Биохимия тканей и жидкостей полостей рта: учебное пособие / Вавилова Т.П. - 2-е изд., испр. и доп. - 2008. - 208 с. : ил.
|
|
|
|
ГЛАВА 2 ХРЯЩЕВАЯ ТКАНЬ
Хрящевая ткань является особым видом соединительной ткани и в сформированном организме выполняет опорную функцию. В челюстно-лицевой области хрящ входит в состав ушной раковины, слуховой трубы, носа, суставного диска височно-нижнечелюстного сустава, а также обеспечивает связь между мелкими костями черепа.
В зависимости от состава, метаболической активности и способности к регенерации различают три типа хрящевой ткани - гиалино- вый, эластический и волокнистый.
Гиалиновый хрящ формируется первым на эмбриональной стадии развития, и в определённых условиях из него образуются остальные два вида хряща. Эта хрящевая ткань определяется в составе реберных хрящей, хрящевого остова носа и образует хрящи, покрывающие поверхности суставов. Он обладает более высокой метаболической активностью по сравнению с эластическим и волокнистым типами и содержит большое количество углеводов и липидов. Это позволяет осуществлять активный синтез белков и дифференцировку хондрогенных клеток для обновления и регенерации гиалинового хряща. С возрастом в гиалиновом хряще происходит гипертрофия и апоптоз клеток с последующим обызвествлением внеклеточного матрикса.
Эластический хрящ имеет сходное строение с гиалиновым хрящом. Из такой хрящевой ткани сформированы, например, ушные раковины, слуховая труба и некоторые хрящи гортани. Для этого типа хряща характерно присутствие в хрящевом матриксе сети эластических волокон, содержится малое количество липидов, углеводов и хондроитинсульфатов. Ввиду низкой метаболической активности эластический хрящ не обызвествляется и практически не регенерируется.
Волокнистый хрящ по своей структуре занимает промежуточное положение между сухожилием и гиалиновым хрящом. Характерной особенностью волокнистого хряща является наличие в межклеточном матриксе большого количества коллагеновых волокон, преимущественно I типа, которые располагаются параллельно друг другу, а клетки в виде цепочки между ними. Волокнистый хрящ благодаря своему особому строению может испытывать значительные механические нагрузки как при сжатии, так и растяжении.
Хрящевой компонент височно-нижнечелюстного сустава представлен в виде диска волокнистого хряща, который располагается на поверхности суставного отростка нижней челюсти и отделяет его от суставной ямки височной кости. Так как волокнистый хрящ не имеет надхрящницы, то питание клеток хряща осуществляется через синовиальную жидкость. Состав синовиальной жидкости зависит от транссудации метаболитов из кровеносных сосудов синовиальной оболочки в суставную полость. Синовиальная жидкость содержит низкомолекулярные компоненты - ионы Na+, K+, мочевую кислоту, мочевину, глюкозу, которые близки в количественном соотношении к плазме крови. Однако содержание белков в синовиальной жидкости в 4 раза выше, чем в плазме крови. Помимо гликопротеинов, иммуноглобулинов синовиальная жидкость богата гликозаминогликанами, среди кото- рых первое место занимает гиалуроновая кислота, присутствующая в виде натриевой соли.
2.1. СТРУКТУРА И СВОЙСТВА ХРЯЩЕВОЙ ТКАНИ
Хрящевая ткань, подобно любой другой ткани, содержит клетки (хондробласты, хондроциты), которые погружены в большой межкле- точный матрикс. В процессе морфогенеза хондрогенные клетки дифференцируются в хондробласты. Хондробласты начинают синтезировать и секретировать в хрящевой матрикс протеогликаны, которые стимулируют дифференцировку хондроцитов.
Межклеточный матрикс хрящевой ткани обеспечивает её сложную микроархитектонику и состоит из коллагенов, протеогликанов, а также неколлагеновых белков - в основном гликопротеинов. Коллагеновые волокна переплетены в трёхмерную сеть, которая связывает остальные компоненты матрикса.
В цитоплазме хондробластов содержится большое количество гликогена и липидов. Распад этих макромолекул в реакциях окисли- тельного фосфорилирования сопровождается образованием молекул АТФ, необходимых для синтеза белков. Синтезируемые в гранулярной эндоплазматической сети и комплексе Гольджи протеогликаны и гликопротеины упаковываются в везикулы и выделяются в межклеточный матрикс.
Упругость хрящевого матрикса определяется количеством воды. Для протеогликанов характерна высокая степень связывания воды, чем и обусловлены их размеры. Хрящевой матрикс содержит до 75%
воды, которая связана с протеогликанами. Высокая степень гидратации обусловливает большие размеры межклеточного матрикса и позволяет осуществлять питание клеток. Высушенный агрекан после связывания воды может увеличиться в объёме в 50 раз, однако ввиду обусловленных коллагеновой сетью ограничений набухание хряща не превышает 20 % от максимально возможного значения.
При сжатии хряща вода вместе с ионами вытесняется из областей вокруг сульфатированных и карбоксильных групп протеогликана, группы сближаются, и силы отталкивания между их отрицательными зарядами препятствуют дальнейшему сжатию ткани. После снятия нагрузки происходит электростатическое притяжение катионов (Na+, К+, Са2+) с последующим притоком воды в межклеточный матрикс (рис. 2.1).
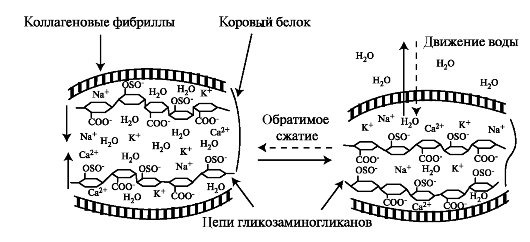
Рис. 2.1. Связывание воды протеогликанами в матриксе хряща. Вытеснение воды при его сжатии и восстановление структуры после снятия нагрузки.
Коллагеновые белки хрящевой ткани
Прочность хрящевой ткани определяют коллагеновые белки, которые представлены коллагенами II, VI, IX, XII, XIV типов и погружены в макромолекулярные агрегаты протеогликанов. На долю коллагенов II типа приходится около 80-90% всех коллагеновых белков хряща. Остальные 15-20% коллагеновых белков - так называемые минорные коллагены IX, XII, XIV типов, которые сшивают фибриллы коллагена II типа и ковалентно связывают гликозаминогликаны. Особенностью матрикса гиалинового и эластического хрящей является присутствие коллагена VI типа.
Коллаген IX типа, обнаруженный в гиалиновом хряще, не только обеспечивает взаимодействие коллагена II типа с протеогликанами, но и регулирует диаметр фибрилл коллагена II типа. С коллагеном IX типа по своей структуре сходен коллаген X типа. Этот тип коллагена синтезируется только гипертрофированными хондроцитами ростовой пластинки и накапливается вокруг клеток. Данное уникальное свойство коллагена X типа предполагает участие этого коллагена в процессах костеобразования.
Неколлагеновые белки хрящевой ткани
Протеогликаны. В целом содержание протеогликанов в хрящевом матриксе достигает 3%-10%. Основным протеогликаном хрящевой ткани является агрекан, который собирается в агрегаты с гиалуроновой кислотой. По форме молекула агрекана напоминает бутылочный ёршик и представлена одной полипептидной цепью (коровый белок) с присоединёнными к ней до 100 цепей хондроитинсульфата и около 30 цепей кератансульфата (рис. 2.2).
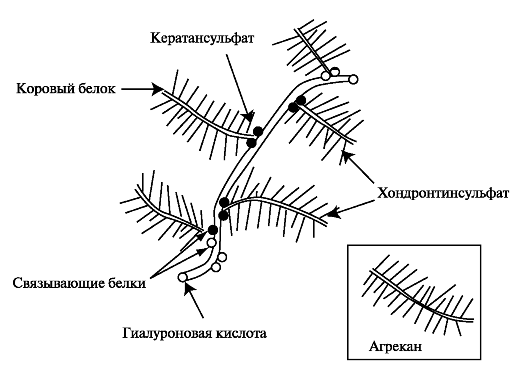
Рис. 2.2. Протеогликановый агрегат хрящевого матрикса. Протеогликановый агрегат состоит из одной молекулы гиалуроновой кислоты и около 100 молекул агрекана.
Таблица 2.1
Неколлагеновые белки хрящевой ткани
Название | Свойства и функции |
Хондрокальцин | Кальций-связывающий белок, являющийся C-про- пептидом коллагена II типа. Белок содержит 3 остатка 7-карбоксиглутаминовой кислоты. Синтезируется гипертрофическими хондробластами и обеспечивает минерализацию хрящевого матрикса |
Gla-белок | В отличие от костной ткани в хряще присутствует высокомолекулярный Gla-белок, который содержит 84 аминокислотных остатка (в кости - 79 аминокислотных остатков) и 5 остатков 7-карбоксиглутаминовой кислоты. Является ингибитором минерализации хрящевой ткани. При нарушении его синтеза под влиянием варфарина образуются очаги минерализации с последующим обызвествлением хрящевого матрикса |
Хондроадерин | Гликопротеин с мол. массой 36 кДа, богатый лейцином. Короткие олигосахаридные цепи, состоящие из сиаловых кислот и гексозаминов, присоединяются к остаткам серина. Хондроадерин связывает коллагены II типа и протеогликаны с хондроцитами и контролирует структурную организацию внеклеточного матрикса хрящевой ткани |
Белок хряща (CILP) | Гликопротеин с мол. массой 92 кДа, содержащий олигосахаридную цепь, связаную с белком N-гликозид- ной связью. Белок синтезируется хондроцитами, участвует в расщеплении протеогликановых агрегатов и необходим для поддержания постоянства структуры хрящевой ткани |
Матрилин-1 | Адгезивный гликопротеин с мол. массой 148 кДа, состоящий из трёх полипептидных цепей, связанных дисульфидными связями. Существуют несколько изоформ этого белка - матрилин -1,-2,-3,-4. В здоровой зрелой хрящевой ткани матрилин не обнаруживается. Он синтезируется в процессе морфогенеза хрящевой ткани и гипертрофическими хондроцитами. Его активность проявляется при ревматическом артрите. При развитии патологического процесса связывает фибриллярные волокна коллагена II типа с протеогликановыми агрегатами и таким образом способствует восстановлению структуры хрящевой ткани |
В структуре корового белка агрекана выделяют N-концевой домен, который обеспечивает связывание агрекана с гиалуроновой кислотой и низкомолекулярными связывающими белками, и С-концевой домен, связывающий агрекан с другими молекулами межклеточного матрикса. Синтез компонентов протеогликановых агрегатов осуществляется хондроцитами, и окончательный процесс их формирования завершается в межклеточном матриксе.
Наряду с большими протеогликанами в хрящевом матриксе приутствуют малые протеогликаны: декорин, бигликан и фибромодулин. Они составляют всего 1-2% от общей массы сухого вещества хряща, однако их роль очень велика. Декорин, связываясь в определённых участках с волокнами коллагена II типа, участвует в процессах фибриллогенеза, а бигликан участвует в формировании белковой матрицы хряща в процессе эмбриогенеза. С ростом эмбриона количество бигликана в хрящевой ткани уменьшается и после рождения этот протеогликан исчезает совсем. Регулирует диаметр коллагена II типа фибромодулин.
Помимо коллагенов и протеогликанов, во внеклеточном матриксе хряща содержатся неорганические соединения и небольшое количество неколлагеновых белков, характерных не только для хряща, но и для других тканей. Они необходимы для связывания протеогликанов с коллагеновыми волокнами, клеток, а также отдельных компонентов хрящевого матрикса в единую сеть. Это адгезивные белки - фибронектин, ламинин и интегрины. Большинство специфических неколлагеновых белков в хрящевом матриксе присутствует только в период морфогенеза, обызвествления хрящевого матрикса или появляются при патологических состояниях (табл. 2.1). Чаще всего это кальцийсвязывающие белки, содержащие остатки 7-карбоксиглутаминовой кислоты, а также гликопротеины, богатые лейцином.
2.2. ФОРМИРОВАНИЕ ХРЯЩЕВОЙ ТКАНИ
На ранней стадии эмбрионального развития хрящевая ткань состоит из недифференцированных клеток, содержащихся в виде аморфной массы. В процессе морфогенеза клетки начинают дифференцироваться, аморфная масса увеличивается и приобретает форму будущего хряща (рис. 2.3).
Во внеклеточном матриксе развивающейся хрящевой ткани количественно и качественно меняется состав протеогликанов, гиалуроновой кислоты, фибронектина и коллагеновых белков. Переход от
Рис. 2.3. Этапы формирования хрящевой ткани.
прехондрогенных мезенхимальных клеток к хондробластам характеризуется сульфатированием гликозаминогликанов, увеличением количества гиалуроновой кислоты и предшествует началу синтеза специфического для хряща большого протеогликана (агрекан). На начальных
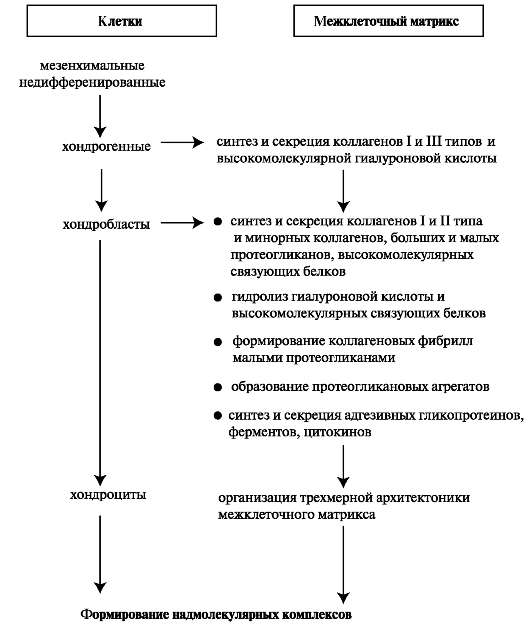
этапах морфогенеза синтезируются высокомолекулярные связующие белки, которые позднее подвергаются ограниченному протеолизу с образованием низкомолекулярных белков. Молекулы агрекана при помощи низкомолекулярных связующих белков связываются с гиалуроновой кислотой и формируются протеогликановые агрегаты. В последующем количество гиалуроновой кислоты снижается, что связано как со снижением синтеза гиалуроновой кислоты, так и с повышением активности гиалуронидазы. Несмотря на снижение количества гиалуроновой кислоты, длина отдельных её молекул, необходимых для формирования протеогликановых агрегатов при хондрогенезе, возрастает. Синтез коллагена II типа хондробластами происходит позднее син- теза протеогликанов. Вначале прехондрогенные клетки синтезируют коллагены I и III типа, поэтому в цитоплазме зрелых хондроцитов обнаруживают коллаген I типа. Далее в процессе хондрогенеза происходит смена компонентов внеклеточного матрикса, контролирующих морфогенез и дифференцировку хондрогенных клеток.
Хрящ как предшественник кости
Все закладки костного скелета проходят три стадии: мезенхимную, хрящевую и костную.
Механизм обызвествления хряща является очень сложным процессом и до конца ещё не изучен. Физиологическому обызвествлению подвержены точки окостенения, продольные перегородки в нижней гипертрофической зоне зачатков хряща, а также прилегающий к кости слой суставного хряща. Вероятной причиной такого развития событий является присутствие на поверхности гипертрофических хондроцитов щелочной фосфатазы. В подверженном обызвествле- нию матриксе образуются так называемые матриксные пузырьки, содержащие фосфатазу. Считают, что эти пузырьки являются, по всей видимости, первичной областью минерализации хряща. Вокруг хондроцитов растёт локальная концентрация фосфатных ионов, что способствует минерализации ткани. Гипертрофические хондроциты синтезируют и выделяют в матрикс хряща белок - хондрокальцин, обладающий способностью связывать кальций. Для подверженных минерализации областей характерны высокие концентрации фосфолипидов. Их присутствие стимулирует образование кристаллов гидроксиапатита в этих местах. В зоне обызвествления хряща происходит частичная деградация протеогликанов. Те из них, которых деградация не коснулась, тормозят обызвествление.
Нарушение индуктивных взаимоотношений, а также изменение (задержка или ускорение) сроков появления и синостезирование центров окостенения в составе отдельных закладок костей, обусловливают формирование структурных дефектов черепа у зародыша человека.
Регенерация хряща
Пересадка хряща в пределах одного и того же вида (так называемые аллогенные трансплантации) обычно не сопровождается возникнове- нием у реципиента симптомов реакции отторжения. Такого эффекта не удается достичь в отношении других тканей, так как трансплантаты этих тканей подвергаются атакам и разрушению клетками иммунной системы. Затруднённый контакт хондроцитов донора с клетками иммунной системы реципиента, в первую очередь, обусловлен наличием в хряще большого количества межклеточного вещества.
Наибольшей регенеративной способностью обладает гиалиновый хрящ, что связано с высокой метаболической активностью хондроцитов, а также присутствием надхрящницы - плотной волокнистой неоформленной соединительной ткани, окружающей хрящ и содержащей большое количество кровеносных сосудов. В наружном слое надхрящницы присутствует коллаген I типа, а внутренний слой сформирован хондрогенными клетками.
Благодаря таким особенностям пересадка хрящевой ткани практикуется в пластической хирургии, например, для реконструкции изуродованного контура носа. При этом аллогенная пересадка одних хондроцитов, без окружающей их ткани, сопровождается отторжением трансплантата.
Регуляция метаболизма хрящевой ткани
Формирование и рост хрящевой ткани регулируется гормонами, факторами роста и цитокинами. Хондробласты являются клеткамимишенями для тироксина, тестостерона и соматотропина, которые стимулируют рост хрящевой ткани. Глюкокортикоиды (кортизол) тормозят пролиферацию и дифференцировку клеток. Определённую роль в регуляции функционального состояния хрящевой ткани выполняют половые гормоны, которые ингибируют высвобождение протеолитических ферментов, разрушающих матрикс хряща. К тому же сам хрящ синтезирует ингибиторы протеиназ, подавляющих активность протеиназ.
Целый ряд факторов роста - ТФР-(3, фактор роста фибробластов, инсулиноподобный фактор роста-1 стимулируют рост и развитие
хрящевой ткани. Связываясь с рецепторами мембран хондроцитов, они активируют синтез коллагенов и протеогликанов и тем самым способствуют поддержанию постоянства хрящевого матрикса.
Нарушение гормональной регуляции сопровождается избыточным или недостаточным синтезом факторов роста, что приводит к разнообразным дефектам в формировании клеток и межклеточного матрикса. Так, ревматоидный артрит, остеоартрит и другие заболевания связаны с повышенным образованием скелетогенных клеток, и хрящевая ткань начинает замещаться на костную. Под влиянием тромбоцитарного фактора роста сами хондроциты начинают синтезировать ИЛ-1α и ИЛ-1(3, накопление которых угнетает синтез протеогликанов и коллагенов II и IX типов. Это способствует гипертрофии хондроцитов и в конечном итоге обызвествлению межклеточного матрикса хрящевой ткани. Деструктивные изменения также связаны с активацией матриксных металлопротеиназ, участвующих в деградации хрящевого матрикса.
Возрастные изменения в хрящевой ткани
При старении в хряще происходят дегенеративные изменения, меняется качественный и количественный состав гликозаминогликанов. Так, цепи хондроитинсульфата в молекуле протеогликана, синтезируемые молодыми хондроцитами, почти в 2 раза длиннее, чем цепи, вырабатываемые более зрелыми клетками. Чем длиннее молекулы хондроитинсульфата в составе протеогликана, тем больше воды структурирует протеогликан. В связи с этим протеогликан старых хондроцитов связывает меньше воды, поэтому хрящевой матрикс пожилых людей становится менее упругим. Изменение микроархитектоники межклеточного матрикса в отдельных случаях является причиной развития остеоартрита. Также в составе протеогликанов, синтезируемых молодыми хондроцитами, содержится большое количество хондроитин-6-сульфата, а у пожилых людей, напротив, в хрящевом матриксе преобладают хондроитин-4-сульфаты. Состояние хрящевого матрикса определяется и длиной цепей гликозаминогликанов. У молодых людей хондроциты синтезируют короткоцепочечный кератансульфат, а с возрастом эти цепи удлиняются. Также наблюдается уменьшение размеров протеогликановых агрегатов за счёт укорочения не только цепей гликозаминогликанов, но и длины корового белка в одной молекуле протеогликана. При старении в хряще увеличивается содержание гиалуроновой кислоты от 0,05 до 6%.
Характерным проявлением дегенеративных изменений хрящевой ткани является её нефизиологическое обызвествление. Обычно оно встречается у пожилых людей и характеризуется первичной дегенерацией суставного хряща с последующим поражением сочленяющихся компонентов сустава. Изменяется структура коллагеновых белков и разрушается система связей между коллагеновыми волокнами. Эти изменения связаны как с хондроцитами, так и с компонентами матрикса. Возникающая гипертрофия хондроцитов приводит к росту массы хряща в области хрящевых полостей. Постепенно исчезает коллаген II типа, который замещается коллагеном X типа, принимающим участие в процессах костеобразования.
Заболевания, связанные с пороками развития хрящевой ткани
В стоматологической практике наиболее часто манипуляции проводят на верхней и нижней челюстях. Существует ряд особенностей их эмбрионального развития, которые связаны с различными путями эволюции этих структур. У зародыша человека на ранних этапах эмбриогенеза в составе верхней и нижней челюстей обнаруживается хрящ.
На 6-7-й неделе внутриутробного развития в мезенхиме нижнечелюстных отростков начинается образование костной ткани. Верхняя челюсть развивается вместе с костями лицевого скелета и подвергается окостенению намного раньше, чем нижнечелюстная кость. К 3-месяч- ному возрасту эмбриона на передней поверхности кости уже отсутствуют места слияния верхней челюсти с костями черепа.
На 10-й неделе эмбриогенеза в составе будущих ветвей нижней челюсти образуются вторичные хрящи. Один из них соответствует мыщелковому отростку, который в середине плодного развития замещается костной тканью по принципу эндохондрального окостенения. Также вторичный хрящ образуется вдоль переднего края венечного отростка, который исчезает перед самым рождением. В месте сращения двух половинок нижней челюсти имеются один или два островка хрящевой ткани, которые окостеневают на последних месяцах внутриутробного развития. На 12-й неделе эмбриогенеза появляется мыщелковый хрящ. На 16-й неделе мыщелок ветви нижней челюсти вступает в контакт с закладкой височной кости. Необходимо отметить, что гипоксия плода, отсутствие или слабое движение зародыша способствует нарушению образования суставных щелей или полному слиянию эпифизов противолежащих закладок костей. Это приводит к деформации отростков нижней челюсти и их сращению с височной костью (анкилоз).