Медицинская паразитология: Учебное пособие / Под ред Н. В. Чебышева. - 2012. - 304 с.: ил.
|
|
|
|
Глава 2. МЕДИЦИНСКАЯ ПРОТОЗООЛОГИЯ
Многочисленные виды одноклеточных организмов в соответствии с современной зоологической классификацией относятся к подцарству простейших. Часть из них ведет паразитический образ жизни.
В настоящее время известно около 70 000 видов простейших, из которых 10 150 видов ведут паразитический образ жизни; более 50 из них являются специфическими паразитами человека и еще десятки видов - факультативными паразитами человека (табл. 2.1).
Таблица 2.1. Подцарство Protozoa (простейшие)
Продолжение
Медицинская протозоология занимается изучением распространения и эпидемиологии паразитарных болезней, имеющих медицинское и социальное значение, а также биологии их возбудителей.
Морфология простейших. Простейшие - типичные эукариоты. Их тело состоит из ядра, цитоплазмы, ограниченной цитоплазматической мембраной. Клетка простейших - одноклеточный организм, выполняющий все функции целостного организма. Простейшие передвигаются с помощью псевдоподий (саркодовые), жгутиков и ундулирующих мембран (жгутиконосцы), ресничек (ресничные инфузории). Пищей простейшим служат органические частицы, в том числе живые организмы, а также растворенные в окружающей среде питательные вещества.
Питание простейших происходит по-разному. Одни заглатывают пищевые частицы ртом, другие поглощают пищевые частицы при помощи псевдоподий (ложноножек), образующихся в любом участке тела. Частица при этом как бы обтекается и оказывается внутри вакуоли в цитоплазме простейшего, где и переваривается (пиноцитоз). У некоторых видов простейших питание происходит путем всасывания питательных соков и растворенных питательных веществ поверхностью тела (эндоосмотически).
Простейшие некоторых видов способны инцистироватъся, т. е. округляться и покрываться плотной оболочкой. Цисты более устойчивы к воздействию неблагоприятных факторов, чем вегетативные формы. При попадании в благоприятные условия простейшие выходят из цисты и начинают размножаться. Размножение происходит бесполым (поперечное, продольное и множественное деление) и половым путями. Простейшие многих видов, ведущие паразитический образ жизни, размножаются последовательно в нескольких хозяевах. Например, малярийный плазмодий проходит цикл развития в теле комара и организме человека.
2.1. Тип Sarcomastigophora
2.1.1. Класс Sarcodina (саркодовые)
2.1.1.1. Отряд Amoebida
В морфологическом отношении амебы более просты, чем жгутиконосцы, от которых они, по-видимому, произошли, утратив свои жгутики. Некоторые амебы имеют эти органеллы на протяжении части своего жизненного цикла. Цитоплазма паразитических видов амеб окружена только обо-
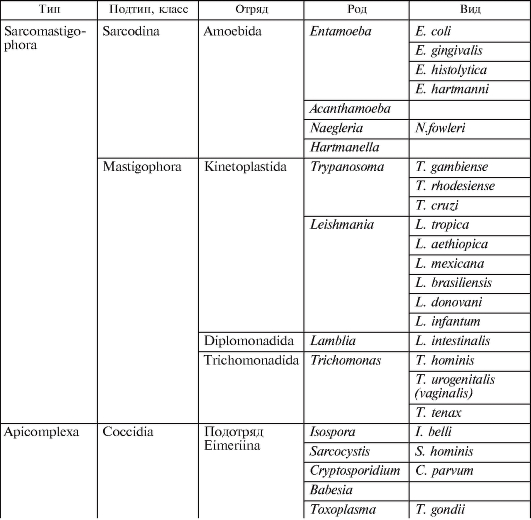
Рис. 2.1. Строение свободноживущих патогенных амеб.
а - неглерия: 1 - вегетативная стадия, 2 - жгутиковая стадия, 3 - циста; б - акантамеба: 1 - вегетативная стадия, 2 - циста.
лочкой, покрытой мукополисахаридным «пушистым слоем», а поддерживающие фибриллы отсутствуют.
Движение и фагоцитоз осуществляются временными структурами - псевдоподиями. Цитоплазматические коллоидные вещества могут изменять свое физическое состояние от эктоплазматического геля до эндоплазматического золя. Пульсирующие движения обеспечиваются сократительными свойствами эктоплазматического геля.
Шесть видов амеб пищеварительного тракта, включая Entamoeba histolytica, являются облигатными паразитами, которые обитают в просвете кишечника человека как анаэробные комменсалы; митохондрии у этих амеб отсутствуют.
Всего насчитывается 8-10 тыс. видов. Из 6 видов амеб, обитающих в толстой кишке, только Entamoeba histolytica является условно-патогенной для человека. Седьмой вид - E. gingivalis - условно-патогенная амеба ротовой полости (рис. 2.1). Из непатогенных амеб чаще всего обнаруживают E. coli (у 40-50 % населения). Цисты чаще всего содержат от 1 до 8 ядер.
Амеба дизентерийная (Entamoeba histolytica). E. histolytica вызывает амебиаз (син.: амебная дизентерия, амебизм) - протозойное антропонозное заболевание, протекающее в виде язвенного амебного колита или абсцессов печени и других органов.
Краткая историческая справка. Возбудителя открыл Л. Ф. Леш (1875) при микроскопии испражнений больного в Санкт-Петербурге. Р. Кох (1883) выделил амебу из испражнений больных и органов умерших людей. Ф. Шаудинн (1903) детально описал ее и назвал Entamoeba histolytica. Заболевание под названием амебной дизентерии впервые описали У. Т. Каунсилмен и Ф. Леффлер (1891).
Этиология. Возбудитель - Entamoeba histolytica - относится к простейшим рода Entamoeba класса Sarcodina. Существует в виде четырехъядерных цист и одноядерных вегетативных форм (трофозоитов) - предцистной, просветной (малая вегетативная, или minuta), большой вегетативной (magna) и тканевой. Морфологически E. histolytica неотличима от непатогенных видов E. dispar и E. moshkovskii (рис. 2.2).
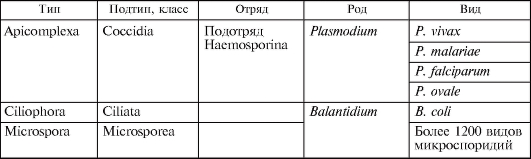
Рис. 2.2. Строение Entamoeba histolytica.
а - малая вегетативная форма: 1 - просветная форма, 2 - предцистная форма; б - зрелая циста; в - большая вегетативная форма (эритрофаг): 3 - поглощенные эритроциты, 4 - эритроцит, 5 - ядро.
Предцистная форма малоподвижна, имеет гомогенную цитоплазму. Просветная форма E. histolytica, обитающая в просвете толстой кишки, крупнее предцистной (10-20 мкм). Обе формы непатогенны и в большинстве случаев вновь трансформируются в цисты по мере продвижения в толстой кишке (рис. 2.3) В некоторых случаях из просветной образуется большая вегетативная форма, а из последней - тканевая. Эти две патогенные формы подвижны, обладают протеолитическими ферментами и протеинами (специфический лектин N-ацетил-галактозамин и др.), определяющими их вирулентность.
Выделяясь с испражнениями во внешнюю среду, вегетативные формы быстро погибают. Цисты достаточно устойчивы: сохраняются в испражнениях до 4 нед, в воде - до 8 мес, но быстро погибают при высушивании.
Эпидемиология. Резервуар и источники инвазии - люди, больные острым или хроническим амебиазом, и бессимптомные цистоносители. В эндемических очагах инвазия в 90 % случаев проявляется в виде продолжительного (до нескольких лет) бессимптомного носительства.
Механизм передачи - фекально-оральный; основные пути передачи - пищевой (особенно с овощами и зеленью), реже водный. Возможны бытовой путь передачи (через руки, загрязненные цистами амеб) и иногда контактный путь (при ротовых и анальных половых контактах).
Амебиаз широко распространен во многих странах. В некоторых тропических и субтропических регионах Центральной и Южной Америки, Африки и Азии пораженность населения амебами достигает 50-80 %. Заболеваемость в основном спорадическая, хотя возможны и водные вспышки. По данным ВОЗ, ежегодно в мире регистрируют 40-50 млн случаев амебного колита и абсцесса печени, из которых 40 000-110 000 заканчиваются летально, что по уровню смертности от протозойных заболеваний ставит амебиаз на 2-е место после малярии.
Патогенез. Выделяют кишечный, внекишечный и кожный амебиаз. После проглатывания человеком цисты преодолевают кислотный барьер желудка, вегетируют в тонкой кишке, последовательно трансформируясь в предцистную, а затем в просветную форму. На этих этапах развития возбу-
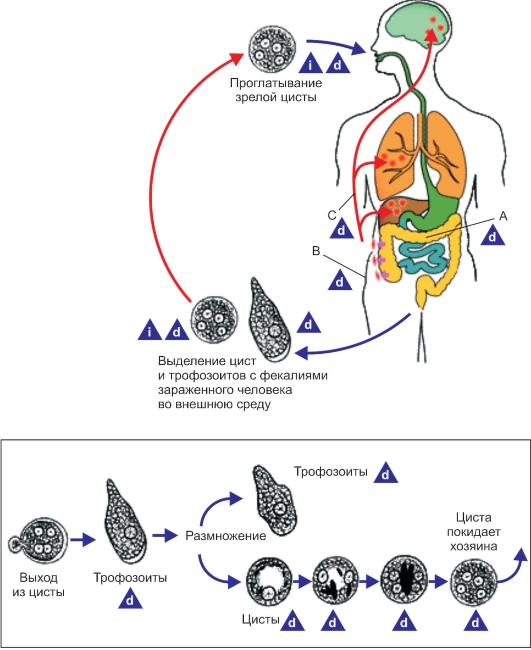
Рис. 2.3. Жизненный цикл Entamoeba histolytica.
А - носительство; В - кишечная стадия заболевания; С - внекишечная стадия заболевания: i - инфекционная стадия; d - диагностическая стадия.
дители непатогенны, инвазия проявляется в виде бессимптомного носительства. Механизмы этих превращений и факторы патогенности амеб окончательно не изучены.
Лектин большой вегетативной формы амебы играет основную роль в процессах адгезии возбудителя к клеткам кишечного эпителия и последую-
щего их лизиса. E. histolytica способны лизировать нейтрофилы, высвобождающиеся при этом медиаторы активизируют диарею и повреждение тканей. Повреждение слизистой оболочки и более глубоких слоев кишечной стенки происходит прежде всего в слепой, ободочной восходящей и ободочной поперечной кишках и сопровождается воспалительной реакцией, типичной для раннего развивающегося амебиаза. В последующем нарастают явления цитолиза эпителия, некроза тканей с образованием язв, нарушений микроциркуляции.
При формировании глубоких язв возможны перфорация кишки и перитонит с последующим развитием спаечного процесса.
Описанные патогенетические механизмы и патоморфологические изменения характерны для кишечной формы амебиаза.
Внекишечный амебиаз обусловлен гематогенной диссеминацией амеб по системам портальной и нижней полой вен и их последующей фиксацией во внутренних органах с развитием абсцессов или язв. Чаще всего абсцессы формируются в правой доле печени, реже в легких, иногда могут быть в головном мозге, почках, поджелудочной железе. Описаны поражения перикарда. Поддиафрагмальный абсцесс печени может осложниться гнойным расплавлением диафрагмы с последующим гнойным плевритом.
Кожный амебиаз возникает при выделении возбудителей с жидкими испражнениями и загрязнении ими кожных покровов промежности, где образуются эрозии и язвы.
Иммунитет. При амебиазе иммунитет определяется активностью макрофагов, выработкой секреторных IgA и лимфокинов в толстой кишке, формированием гуморальных антител, сохраняющихся в организме при реконвалесценции до 1 года и более. Примечательно, однако, то, что приобретенный иммунодефицит не приводит к повышению вероятности инвазивного амебиаза.
Инкубационный период варьируется от 1 нед до 2-3 мес.
Клинические проявления. Кишечный амебиаз развивается постепенно, может проявляться лишь дискомфортом в животе и слабовыраженной диареей. Для легкого течения заболевания характерны кратковременные эпизоды кашицеобразного или жидкого со слизью стула по 2-3 раза в день.
Случаи средней тяжести сначала проявляются диареей с жидким обильным стулом по 3-5 раз в день, при этом появляются умеренные боли в области слепой кишки и восходящего отдела толстой кишки, постепенно нарастает общая слабость, снижается аппетит.
При осмотре больных можно обнаружить метеоризм, болезненность при пальпации в илеоцекальной области, по ходу восходящего и других отделов толстой кишки, утолщение слепой кишки. Сигмовидная кишка может выглядеть как болезненный воспалительный тяж. Печень и селезенка чаще всего не увеличены.
Хроническое течение кишечного амебиаза наблюдается значительно чаще, чем при шигеллезах, и может быть рецидивирующим или непрерывным. Во время сравнительно длительных ремиссий больные чувствуют себя удовлетворительно. При непрерывном течении заболевания появляются прогрессирующая слабость, анемия, трофические нарушения, безбелковые отеки. Из-за дефицита белков и витаминов снижается масса тела больного.
Редкие проявления кишечного амебиаза включают молниеносную форму, некротический колит, токсический мегаколон и амебому. Молниеносная форма встречается у детей раннего возраста, беременных и кормящих женщин, ослабленных лиц с недостаточностью питания. Заболевание отличается выраженным токсикозом, сильными болями в животе, обширными яз-
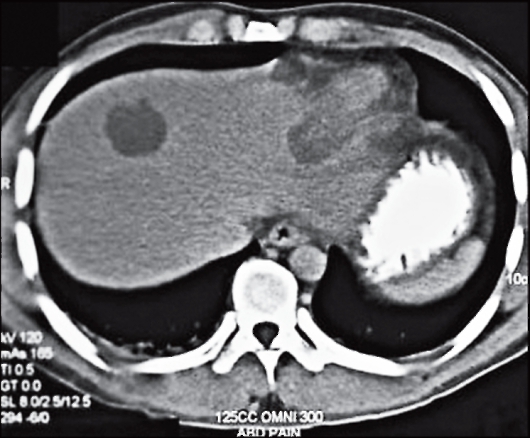
Рис. 2.4. Амебный абсцесс печени. Компьютерная томография показала значительный объем повреждений печени в результате амебного абсцесса.
венными поражениями толстой кишки. Некротический колит характеризуется очень тяжелым состоянием больных, высокой лихорадкой, диареей со стулом в виде мясных помоев, сильными схваткообразными болями в животе, развитием перитонита при расплавлении стенок кишечника с выходом в брюшную полость каловых масс. При перфорации кишки, а также при отсутствии эффекта консервативной антиамебной терапии требуется хирургическое вмешательство.
Внекишечный амебиаз чаще всего проявляется формированием абсцессов печени, реже - легких, головного мозга и других органов.
Амебный абсцесс печени (рис. 2.4) обычно возникает через 1-3 мес после появления симптомов ки-
шечного амебиаза, но иногда спустя несколько месяцев или лет. Он может развиться даже после легкого течения кишечного амебиаза, а в 6-10 % случаев - без предшествовавших поражений толстой кишки.
Абсцесс легкого чаще развивается при распространении абсцесса из верхних отделов печени на диафрагму и далее на легочную ткань.
Абсцесс мозга - редкая форма внекишечного амебиаза.
Кожный амебиаз регистрируют в основном у аборигенов тропических эндемичных зон. Заболевание проявляется образованием эрозий и глубоких малоболезненных язв на ягодицах, в промежности и перианальной области. Перианальные язвы могут вести к последующему формированию свищей.
Диагностика. Кишечный амебиаз дифференцируют от других протозойных заболеваний, шигеллезов, сальмонеллезов и др.
При микроскопии свежевыделенных испражнений (нескольких нативных мазков, а также препаратов, обработанных йодным раствором) можно найти трофозоиты E. histolytica. Обнаружение большой вегетативной формы амебы, содержащей фагоцитированные эритроциты, подтверждает диагноз кишечного амебиаза, тканевую форму выявляют редко. Присутствие в испражнениях просветной предцистной формы и четырехъядерных цист E. histolytica может наблюдаться и при амебном носительстве.
При внекишечном амебиазе редко удается обнаружить амебы в гное абсцесса, поэтому лабораторная диагностика базируется на серологических методах исследования.
С целью диагностики амебных абсцессов используют методы рентгенографии, ультразвукового исследования (УЗИ), компьютерной томографии (КТ), ядерного магнитного резонанса (ЯМР). При необходимости срочного уточнения диагноза можно прибегнуть к аспирационной биопсии абсцесса печени под контролем УЗИ или КТ. В этих случаях полученную желто-коричневую жидкость без запаха направляют в лабораторию для микроскопии, обнаружения антигенов возбудителя, культурального исследования.
Профилактика амебиаза аналогична таковой при кишечных инфекциях. Общие санитарные мероприятия в очаге включают рациональную очистку
и канализацию населенных мест, повышение санитарной грамотности населения, питье только кипяченой воды, мытье овощей с детергентом или вымачивание их в уксусе в течение 10-15 мин перед употреблением. Испражнения больных подвергают дезинфекции (5 % раствор лизола), белье замачивают в 3 % растворе лизола.
Род Acanthamoeba (акантамебы). Акантамебы являются возбудителями акантамебиаза - протозооза, вызываемого различными видами свободноживущих амеб и проявляющегося поражением глаз, кожи и центральной нервной системы.
Этиология. Для человека патогенны 6 видов амеб, относящихся к роду Acanthamoeba.
Жизненный цикл акантамеб (рис. 2.5) включает две стадии: трофозоита и цисту. Трофозоит имеет овальную, треугольную или неправильную форму; его размеры - 10-45 мкм. Он имеет одно ядро с крупной эндосомой, а также экстрануклеарную центросферу. Трофозоиты образуют узкие, нитевидные или шиловидные псевдоподии. Размеры цист - от 7 до 25 мкм. Цисты одноядерные, имеют многослойную оболочку.
Биология развития. Амебы рода Acanthamoeba - аэробы, обитают в почве и теплых пресноводных водоемах, преимущественно в придонном слое. Особенно много их в водоемах, образованных сбросами электростанций и загрязненных сточными водами. Наличие большого количества органических веществ и высокая температура воды (28оС и выше) в этих водоемах
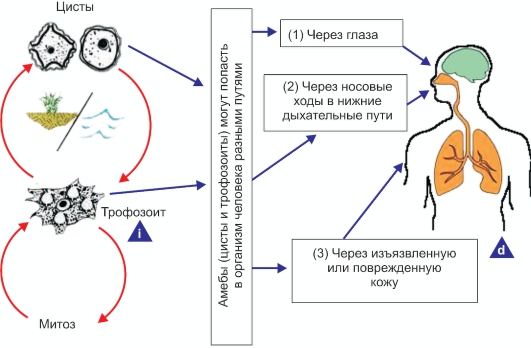
Рис. 2.5. Жизненный цикл Acanthamoeba spp.
i - инфекционная стадия; d - диагностическая стадия; (1) это приводит к острому кератиту; (2) развиваются гранулематозный амебный энцефалит (ГАЭ) и/или генерализованное заболевание у людей с ослабленной иммунной системой; (3) развиваются ГАЭ, генерализованное заболевание или поражение кожи у людей с ослабленной иммунной системой.
способствуют резкому увеличению в них популяций амеб. При понижении температуры воды, изменении рН или подсыхании субстрата акантамебы инцистируются.
Цисты акантамеб устойчивы к высыханию, охлаждению и действию многих антисептиков в стандартных концентрациях. Благодаря небольшим размерам они могут распространяться аэрогенно. Цисты акантамеб выделяли из тканей и экскрементов многих видов рыб, птиц и млекопитающих.
Эпидемиология. Акантамебы - обычно свободноживущие организмы, которые, попадая в организм человека, способны переходить к паразитизму и заканчивать в организме хозяина свой цикл развития, образуя цисты.
Источник инвазии - внешняя среда (контаминированные амебами вода, почва и др.). Человек заражается контактно-бытовым, водным и пищевым путями. Заболеваемость спорадическая, заражение возможно во все сезоны года. Распространены повсеместно. Наиболее часто случаи заболевания регистрируются в странах с тропическим и субтропическим климатом.
Патогенез и клинические проявления. Акантамеб часто обнаруживают в мазках из носоглотки и в фекалиях здоровых людей. Чаще всего развиваются акантамебный кератит и поражения кожи, но в случае попадания амеб в головной мозг гематогенным путем из первичных поражений в роговице глаза или респираторном тракте развивается гранулематозный акантамебный энцефалит. Инкубационный период обычно длится от нескольких недель до нескольких месяцев. В начальном периоде симптомы болезни проявляются в стертой форме. Появляются головные боли, сонливость, судороги, отмечают нарушения психики.
Заболевание постепенно прогрессирует, развивается коматозное состояние с летальным исходом. При патолого-анатомическом исследовании обнаруживают отек полушарий мозга, очаги размягчения с экссудатом на поверхности коры и утолщение мягких оболочек. На разрезах в большинстве участков мозга находят множественные очаги размягчения с геморрагическим некрозом размером от 1,5 до 6,5 см. В некротических массах обнаруживают трофозоиты и цисты акантамеб.
Осложнения. При поражении глаз возможны перфорация роговицы, а при диссеминации возбудителей из первичного очага поражения - формирование амебных абсцессов внутренних органов.
Диагностика. Диагноз акантамебного кератита устанавливают по результатам микроскопического исследования на наличие вегетативных и цистных форм амеб в слезно-мейбомиевой жидкости, смывах и соскобах из язвенных поражений роговицы и склеры.
Иногда прибегают к культивированию акантамеб на среде Робинсона и других средах. В некоторых случаях применяют метод биопробы путем заражения лабораторных животных.
Диагноз акантамебного поражения кожи устанавливают на основании обнаружения амеб и их цист в нативных и окрашенных препаратах, приготовленных из субстрата инфильтратов и биоптатов пораженных тканей.
Наиболее эффективным методом диагностики амебного энцефалита является исследование нативных препаратов спинномозговой жидкости, в которых определяются подвижные трофозоиты.
Профилактика заключается в соблюдении правил гигиены применения контактных линз. Нельзя хранить линзы в водопроводной воде или солевых растворах домашнего приготовления. Их следует хранить лишь в стерильных растворах, специально приготовленных в офтальмологических уч-
реждениях. Эти растворы необходимо менять согласно инструкции по применению контактных линз.
Для предупреждения акантамебного поражения кожи и энцефалита необходимо соблюдать правила личной гигиены и ограничивать контакты с местами обитания акантамеб.
Неглерия (Naegleria fowleri). N. fowleri вызывает неглериоз - протозойное заболевание, проявляющееся поражением кожи, легких, глаз и центральной нервной системы.
Этиология. Неглерия - свободноживущая амеба, жизненный цикл которой включает 3 морфологические формы: амебоидный трофозоит, жгутиковую стадию и цисту. Размеры трофозоитов - 15-40 мкм. Энергичная пульсация сократительной вакуоли отличает неглерию от клеток хозяина. Ядро (5 мкм) имеет эндосому. Псевдоподии прозрачные и широкие. Как и у всех амеб, цитоплазма подразделяется на экто- и эндоплазму, но неглерии имеют пластинчатый комплекс Гольджи, выраженный эндоплазматический ретикулум и сократительную вакуоль. Цисты округлые, с гладкой двойной стенкой, размером 10-20 мкм.
Биология развития. N. fowleri - свободноживущая амеба, которая обитает в пресноводных водоемах (сточные воды, бассейны, термальные источники и др.). При повышении температуры до 35 оС неглерии начинают активно размножаться, и численность их значительно возрастает. Часть амеб при резких колебаниях температуры и изменении рН среды формирует 2 жгутика и активно плавает в толще воды в течение суток, затем вновь переходит в амебоидную форму.
При неблагоприятных условиях амебы легко инцистируются. В отличие от акантамеб цисты неглерий менее устойчивы к высыханию.
Эпидемиология. Чаще всего неглериями заражаются (рис. 2.6) молодые люди и дети, главным образом при купании в открытых водоемах, бассейнах и горячих ваннах. По-видимому, это обусловлено наличием у неглерии жгутиковых стадий развития, плавающих в толще воды, что облегчает контакт человека с амебами.
Цисты неглерий могут проникать также в носовую полость при вдыхании содержащих их аэрозолей. Неглерии распространены повсеместно, но чаще встречаются в районах с тропическим и субтропическим климатом. До 1985 г. в литературе были приведены сведения о 128 случаях неглериоза ЦНС в мире, из которых 50 зарегистрированы в США.
Патогенез и клинические проявления. Заражение человека амебами происходит, по-видимому, при попадании их в ротовую и носовую полости с загрязненной водой. Из носоглотки через обонятельный эпителий амебы проникают в богато васкуляризованное субарахноидальное пространство, откуда распространяются во все отделы мозга. В тканях мозга они локализуются вокруг кровеносных сосудов и интенсивно размножаются. Вследствие этого как в сером, так и в белом веществе мозга возникают кровоизлияния и некроз. Развивается первичный амебный менингоэнцефалит.
Инкубационный период длится 2-3 дня, реже - 7-15 дней. Болезнь начинается внезапно. Сначала во многих случаях возникают нарушения вкусовых или обонятельных ощущений. Появляются головные боли, лихорадка, тошнота, рвота, судороги. На слизистой оболочке глотки нередко образуются язвы. Наблюдаются симптомы менингита и энцефалита. Развивается отек легких. Вскоре наступает кома. В большинстве случаев в пределах 1 нед после появления первых симптомов больные погибают вследствие отека легких и остановки дыхания. N. fowleri, так же как акантамебы, могут вызывать поражения кожи, легких и глаз.
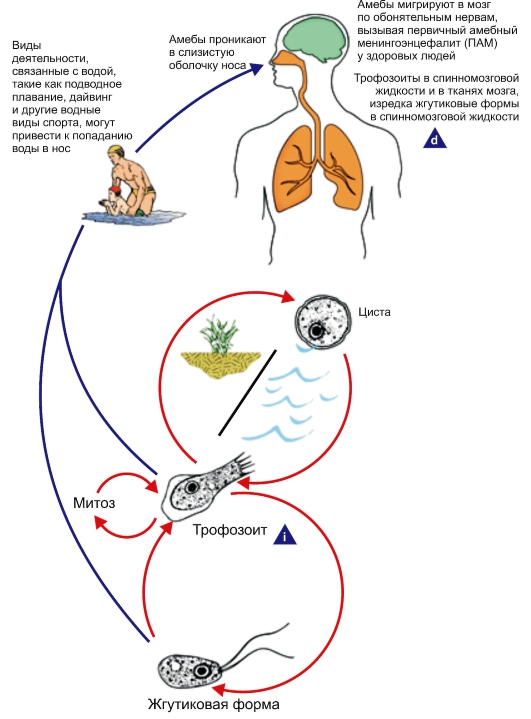
Рис. 2.6. Жизненный цикл Naegleria fowleri.
i - инфекционная стадия; d - диагностическая стадия.
Диагностика. Клиническая диагностика затруднена вследствие сходства симптомов первичного амебного поражения мозга с симптоматикой менингитов и менингоэнцефалитов бактериальной или вирусной этиологии.
Принимаются во внимание данные анамнеза (купание в богатых илом водоемах с теплой водой, контакт со сточными водами и т. д.).
Окончательный диагноз первичного амебного менингоэнцефалита устанавливают микроскопически при обнаружении N. fowleri в осадке спинномозговой жидкости или биоптатах мозга. От окружающих клеток они отличаются подвижностью. Используют также культуральный метод.
Профилактика заключается в соблюдении правил личной гигиены. Особое внимание следует обращать на предотвращение заражения при купании в бассейнах и открытых водоемах, в которых температура воды достигает 35 оС и более.
2.1.2. Класс Mastigophora (жгутиконосцы)
Жгутиконосцы передвигаются с помощью длинных жгутиков, прикрепленных к поверхности клетки. Каждый жгутик отходит от небольшого образования, называемого кинетосомой, которая локализуется в эктоплазме и контролирует движение жгутика. Полагают, что кинетосомы аналогичны центриолям, регулирующим образование митотических веретен у высших организмов. Жгутик состоит из центрального тяжа - аксонемы, окруженной чехлом, который является продолжением клеточной мембраны; аксонему составляют расположенные кольцом 9 периферических фибрилл, окружающих 2 центральные фибриллы. По своему строению эти фибриллы аналогичны таковым ресничек и жгутиков, обнаруживаемых во всем царстве животных, а также у некоторых бактерий, например спирохет.
Передвижение некоторых жгутиконосцев обеспечивается также ундулирующей мембраной, которая состоит из жгутика, расположенного параллельно поверхности клетки у свободного края складки, образованной клеточной мембраной. Эти простейшие передвигаются также благодаря изменениям формы клетки, вызванным сокращениями их пелликулярных фибрилл. Жгутиконосцы - паразиты человека, которые подразделяются на имеющих и не имеющих кинетопласт, представляющий собой сложную органеллу, образующуюся из модифицированной митохондрии.
2.1.2.1. Отряд Kinetoplastida
К данной группе относятся трипаносомы и лейшмании. Эти паразиты передаются кровососущими паразитами-переносчиками, которые одновременно являются промежуточными хозяевами.
В организме позвоночных животных паразиты присутствуют в крови и тканевых жидкостях, а также внутри клеток. Размножение всегда происходит путем бинарного деления. Единственный жгутик отходит от кинетосомы, расположенной рядом с более крупным дисковидным или изогнутым образованием - кинетопластом, однако при исследовании в световом микроскопе эти два образования дифференцировать невозможно. Кинетопласт, который связан с крупной митохондрией, проходящей через большую часть клетки организма, содержит ДНК, которая генетически отличается от ядерной ДНК. В переносчике жгутик может функционировать как орган при-
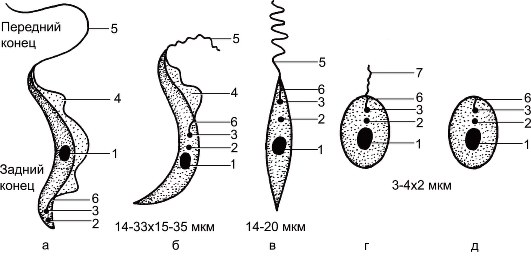
Рис. 2.7. Морфологические формы лейшманий и трипаносом.
а - трипомастигота; б - эпимастигота; в - промастигота; г - сферомастигота (микромастигота); д - амастигота: 1 - ядро; 2 - кинетопласт; 3 - кинетосома; 4 - ундулирующая мембрана; 5 - жгутик; 6 - ризопласт; 7 - рудиментарный жгутик.
крепления. Эти паразиты меняют форму тела в процессе смены фаз жизненного цикла (рис. 2.7).
Амастигота, или амастиготная (безжгутиковая) стадия, соответствующая прежней лейшманиальной стадии, имеет округлую или удлиненную форму; лишена наружного жгутика у Leishmania, Trypanosoma cruzi.
Сферомастигота (микромастигота), или сферомастиготная стадия, имеет округлую форму с рудиментарным свободным жгутиком (у лейшманий).
Промастигота, или промастиготная (переднежгутиковая) стадия, соответствующая прежней лептомонадной стадии, имеет удлиненную форму; кинетопласт лежит впереди ядра, жгутик начинается там же и выходит наружу в переднем конце тела (у Leishmania, Trypanosoma cruzi).
Эпимастигота, или эпимастиготная (бокожгутиковая) стадия, соответствующая бывшей критидиалъной стадии, характеризуется удлиненной формой; кинетопласт лежит рядом с ядром, жгутик начинается там же и выходит наружу сбоку, после чего проходит по поверхности тела или вдоль короткой ундулирующей мембраны (у трипаносом).
Трипомастигота, или трипомастиготная стадия, соответствующая трипаносомной стадии, отличается удлиненной формой; кинетопласт лежит позади ядра, жгутик начинается там же и выходит наружу сбоку, после чего проходит по поверхности тела или вдоль длинной ундулирующей мембраны.
Хотя эта форма сходна с эпимастиготной, ее как важную стадию, свойственную роду Trypanosoma, желательно обозначить специальным термином, который определяет ее структуру, но не связан с родовым названием.
Наряду с полиморфизмом трипаносоматид (трипаносомы и лейшмании) в процессе их жизненных циклов выявлен также полиморфизм на уровне их геномов. Кариотипы трипаносоматид очень изменчивы. Они сильно различаются даже между разными изолятами одного вида.
Кариотип трипаносом не поддается анализу в световом микроскопе, но при применении электрофореза в геле хромосомы могут быть разделены на 4 основных класса: большая ДНК, остающаяся вблизи щели геля; около
5 длинных хромосом; 5-7 хромосом промежуточного размера и от 0 до 100 сателлитных и теломерных мини-хромосом. Вероятно, эволюция кариотипа происходила в направлении увеличения разнообразия антигенной вариации. Одна особь трипаносомы несет до 1000 поверхностных вариантов генов. Такой полиморфизм является одним из важнейших способов уклонения паразитов от защитных механизмов своих хозяев благодаря изменчивости их поверхностных антигенов.
Так, в каждой новой генерации часть трипаносом несет поверхностный антиген, отличающийся от предыдущих. Эта смена антигенов происходит в результате транспозиции и дупликации генов, кодирующих антигенные детерминанты. В результате меняется расположение гена по отношению к промотору.
Изменение поверхностных генов паразита в сторону сближения с антигенами хозяина обеспечивает так называемую молекулярную мимикрию, или связывание антигенов хозяина.
Локализация паразитов в клетках иммунной системы направленно инактивирует лизосомные ферменты макрофага, что обеспечивает их жизнедеятельность и условия для размножения.
Род Trypanosoma (трипаносомы). Размеры трипаносом больше, чем лейшманий. Трипаносомы имеют узкую продолговатую форму (ширина 1,5-3 мкм, длина 15-30 мкм), жгутик и ундулирующую мембрану. В процессе жизненного цикла изменяются морфологически.
Трипаносомозы - группа трансмиссивных тропических болезней, вызываемых простейшими рода Trypanosoma. Для человека патогенны Т. gambiense и Т. rhodesiense, которые вызывают африканский трипаносомоз (сонная болезнь), и Т. cruzi - возбудитель американского трипаносомоза (болезнь Шагаса).
Трипаносомы проходят сложный цикл развития со сменой хозяев, в процессе которого они находятся в морфологически разных стадиях.
Трипаносомы размножаются продольным делением, питаются растворенными веществами.
Жизненный цикл трипаносом осуществляется со сменой двух хозяев, одним из которых являются позвоночные животные и человек, другим - кровососущие членистоногие, служащие переносчиками возбудителя.
Различают африканский и американский трипаносомозы.
Трипаносома гамбийская (Trypanosoma gambiense). T. gambiense вызывает африканский трипаносомоз (сонная болезнь) - облигатно-трансмиссивную инвазию, характеризующуюся лихорадкой, высыпаниями на коже, увеличением лимфатических узлов, появлением местных отеков и поражением центральной нервной системы, приводящим к летаргии, кахексии и летальному исходу.
Африканский трипаносомоз распространен в зоне саванн. Его нозоареал ограничен ареалом переносчика - мухи цеце. Эта болезнь эндемична в 36 странах тропической Африки. Ежегодно регистрируют до 40 тыс. новых случаев.
Известны два типа африканского трипаносомоза - гамбийский, или западноафриканский, и родезийский, или восточноафриканский. Первый вызывает T. gambiense, второй - T. rhodesiense.
Оба возбудителя африканского трипаносомоза относятся к секции Salivaria, т. е. передаются через слюну. Гамбийский тип африканского трипаносомоза - это облигатно-трансмиссивное заболевание, фактически антропоноз, хотя в передаче его возбудителя некоторое участие принимают и сельскохозяйственные животные.
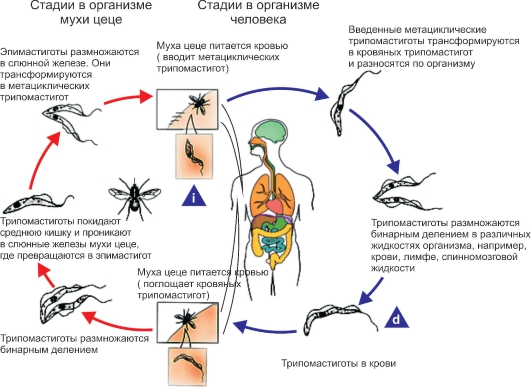
Рис. 2.8. Жизненный цикл Trypanosoma gambiense и Trypanosoma rhodesiense. i - инфекционная стадия; d - диагностическая стадия.
Впервые клинику африканского трипаносомоза описал в 1734 г. английский врач Atkins, наблюдавший эту болезнь у жителей побережья Гвинейского залива (Западная Африка). В 1902 г. P. Ford и J. Dutton нашли в крови человека Т. gambiense. D. Bruce и D. Nabarro установили, что муха Glossina palpalis (цеце) является переносчиком возбудителя болезни.
Этиология. Возбудитель - Trypanosoma gambiense. В крови позвоночных хозяев развиваются полиморфные стадии трипаносом - трипомастиготы и эпимастиготы. (рис. 2.8). Среди них обнаруживаются тонкие трипомастиготные формы длиной 14-39 мкм (в среднем 27 мкм) с хорошо выраженной ундулирующей мембраной и длинной свободной частью жгутика. Их задний конец заострен, кинетопласт находится на расстоянии около 4 мкм от заднего конца тела.
Биология развития. Основным хозяином является человек, дополнительным - свиньи. Переносчиками служат кровососущие мухи рода Glossina, преимущественно G. palpalis. Отличительным признаком мухи цеце является сильно хитинизированный выступающий хоботок, способный прокалывать кожу даже таких животных, как носорог и слон, поэтому любая одежда человека не защитит от мухи цеце. Вторая особенность мухи - великолепная растяжимость стенок кишки, что позволяет ей поглощать количество крови, превышающее массу голодной мухи в десятки раз. Эти особенности обеспечивают надежность передачи возбудителя от донора реципиенту.
Мухи цеце нападают в светлое время суток преимущественно в открытой природе, некоторые антропофильные виды могут залетать в поселки. Кровь пьют и самцы, и самки. Инвазионной стадией для переносчика является трипомастиготная форма. Грипаносомы попадают в организм переносчика при питании кровью инвазированного позвоночного животного или человека. Около 90 % трипаносом, поглощенных мухой цеце, погибают. Остальные размножаются в просвете ее средней и задней кишок.
В первые дни после заражения разнообразные формы трипаносом находятся внутри комка поглощенной крови, окруженного перитрофической мембраной. Они мало отличаются от тех, которые присутствуют в крови человека, но несколько более короткие и имеют слабовыраженную ундулирующую мембрану. Затем трипаносомы выходят в просвет кишечника насекомого.
При попадании в желудок мухи цеце после кровососания трипаносомы к 3-4-му дню изменяются и трансформируются в эпимастиготные формы, становятся более узкими и вытянутыми и интенсивно делятся. Проникнуть в слюнные железы трипаносомы могут и через гемоцель. В слюнных железах трипаносомы претерпевают ряд морфологических изменений, многократно делятся и превращаются в инвазионную для человека и позвоночных стадию - трипомастиготу. Развитие трипаносом в переносчике продолжается в среднем 15-35 дней в зависимости от температуры среды. Эффективное заражение мух происходит при температуре от 24 до 37оС. После заражения муха цеце способна передавать трипаносомы на протяжении всей жизни.
Цикл развития в позвоночном хозяине. Способ заражения африканским трипаносомозом позволяет отнести его возбудителя к секции Salivaria, а заболевание - к «слюнным» (саливарным) трипаносомозам. После проникновения в кожу трипаносомы несколько дней сохраняются в подкожной клетчатке (рис. 2.9), а затем проникают в кровяное русло и лимфу, где происходит их простое бинарное деление (рис. 2.10). Иногда их обнаруживают в сосудистом сплетении мозга в стадии амастиготы, при этом выделяются разные формы трипаносом: тонкие и длинные, короткие, широкие и промежуточные трипомастиготные формы. Инкубационный период сонной болезни длится от нескольких дней до нескольких недель.
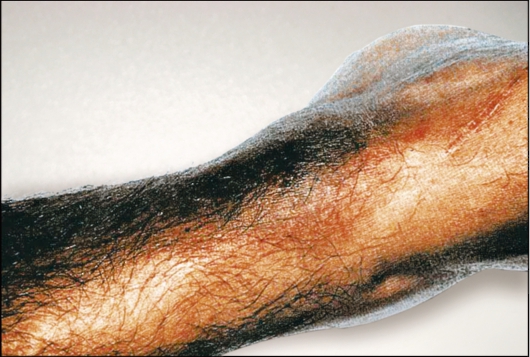
Рис. 2.9. Грипаносомный шанкр - самое раннее клиническое проявление. В шанкре содержится большое количество лимфы с активно делящимися трипаносомами. Шанкр чаще наблюдается при родезийской инфекции, чем при гамбийской.
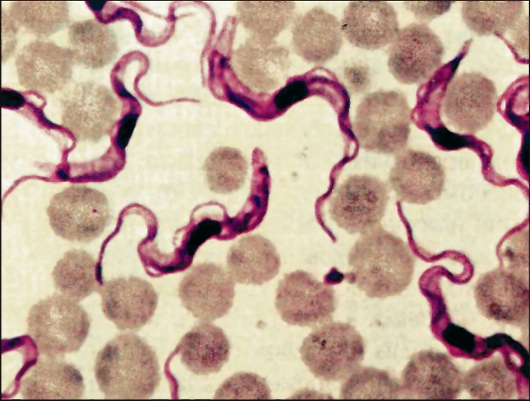
Рис. 2.10. Trypanosoma
gambiense в крови человека (препарат крови, окрашенный по Романовско- му-Гимзе).
Эпидемиология. Гамбийский тип трипаносомоза является преимущественно антропонозом. Основным источником инвазии служит человек, дополнительным - свинья.
Переносчиками служат кровососущие мухи рода Glossina, преимущественно G. palpalis. Эти виды тенелюбивы, активны в светлое время суток. Они обитают в зарослях растительности по берегам рек и ручьев в ряде районов Западной и Центральной Африки. Мухи цеце живородящие. Самка откладывает единственную личинку прямо на поверхность почвы, в расщелины, под корни деревьев. Личинка сразу зарывается в почву и через 5 ч превращается в куколку. Вылет имаго происходит через 3-4 нед после окукливания.
Достаточно одного укуса зараженной мухи, чтобы человек заболел сонной болезнью, поскольку минимальная инвазирующая доза трипаносом составляет 300-400 паразитов, а муха со слюной за один укус выделяет их около 400 тыс. Больной становится источником инвазии примерно с 10-го дня после заражения и остается им на протяжении всего периода болезни, даже в период ремиссии и отсутствия клинических проявлений.
Теоретически возможен механический занос трипаносом в кровь человека кровососущими членистоногими при повторных кровососаниях после питания на больном человеке, так как на хоботке мух, слепней, комаров, клопов и других членистоногих возбудители сохраняют жизнеспособность в течение нескольких часов. Заражение может происходить также при гемотрансфузиях или при недостаточной стерилизации шприцев во время инъекций. Гамбийский тип трипаносомоза встречается в виде очагов в Западной и Центральной Африке между 15о с. ш. и 18о ю. ш.
Летальность от трипаносомоза в Конго в середине прошлого века составляла около 24 %, а в Габоне - 27,7 %, поэтому трипаносомоз для стран тропической Африки представляет серьезную экономическую и социальную проблему.
Заболеваемость носит сезонный характер. Пик приходится на сухой сезон года, когда мухи цеце концентрируются около оставшихся непересохшими водоемов, интенсивно используемых населением для хозяйственных нужд.
Патогенез и клинические проявления. В течении болезни выделяют 2 стадии: гемолимфатическую и менингоэнцефалитическую, или терминальную (сонную болезнь в узком смысле слова).
Гемолимфатическая стадия наступает через 1-3 нед после инвазирования и связана с распространением трипаносом по организму (по лимфатической и кровеносной системе) из места их первичного внедрения.
Заболевание характеризуется длительным течением. В течение 2-3 нед первичное местное поражение спонтанно исчезает, на его месте остается пигментированный рубец. Грипаносомный шанкр возникает главным образом у некоренных жителей Африки.
Одновременно с появлением первичного аффекта на коже туловища и конечностей могут возникнуть так называемые трипаниды, имеющие вид розовых или фиолетовых пятен различной формы диаметром 5-7 см. У африканцев на фоне темной кожи трипаниды заметны слабее, чем у европейцев. На лице, кистях, стопах и в месте эритематозных высыпаний заметны отеки, отмечается болезненность кожи при ее сжатии.
В период развития шанкра или через несколько дней после его исчезновения паразиты появляются в крови и наблюдается лихорадка неправильного типа с подъемом температуры до 38,5оС (редко до 41 оС).
К симптомам гемолимфатической стадии болезни относятся также слабость, потеря массы тела, тахикардия, боли в суставах, гепатоспленомегалия. Нарастают слабость и апатия, являющиеся ранними симптомами поражения ЦНС.
Менингоэнцефалитическая стадия. Спустя несколько месяцев или лет у подавляющего большинства пациентов болезнь переходит во вторую стадию, которая характеризуется поражением ЦНС. Грипаносомы преодолевают гематоэнцефалический барьер и проникают в ЦНС.
Наиболее характерным признаком второй стадии болезни является нарастающая сонливость, которая появляется преимущественно в дневное время, тогда как ночной сон часто бывает прерывистым и беспокойным. Сонливость настолько сильна, что больной может заснуть даже во время приема пищи. Постепенно нарастают и прогрессируют нейропсихические нарушения. При ходьбе больной волочит ноги, выражение его лица угрюмое, нижняя губа отвисает, изо рта течет слюна. Позднее появляются судороги, сменяющиеся параличами.
Диагностика. Предварительный диагноз сонной болезни можно поставить и на основании клинических симптомов, однако неопровержимым подтверждением диагноза сонной болезни служит обнаружение Т. gambiense при лабораторных паразитологических исследованиях.
Для выявления трипаносом проводят исследование пунктатов шанкра, увеличенных лимфатических узлов (до развития в них фиброзных изменений), крови, спинномозговой жидкости. Из полученного субстрата готовят нативные препараты и препараты, окрашенные по Романовскому-Гимзе.
Профилактика и меры борьбы. Комплекс мероприятий по оздоровлению очагов сонной болезни включает выявление и лечение больных, общественную и индивидуальную профилактику населения, борьбу с переносчиками, серологические обследования, прежде всего людей, относящихся к группе риска (охотники, лесорубы, строители дорог и др.). Обследования следует проводить не реже 2 раз в год (перед и после сезона наибольшей опасности заражения).
Иммунитет. Заболевание сонной болезнью не приводит к выработке стойкого иммунитета. Гечение болезни характеризуется периодическими обострениями, что обусловлено изменением морфологии, антигенных осо-
бенностей и численности трипаносом в крови. Численность паразитов в крови хозяина претерпевает периодические колебания от чрезвычайно высокой до очень низкой. Во время высокой паразитемии в крови преобладают тонкие и длинные, а при низком ее уровне - короткие и толстые формы трипомастигот. Колебания численности паразитов в крови хозяина обусловлены защитными реакциями их организма и своеобразным свойством изменять свою антигенную структуру под влиянием этих реакций.
Антигенная изменчивость при сонной болезни, особенно гамбийского типа, - механизм уклонения от воздействия защитных систем хозяина. Антигенная вариабельность обеспечивает возможность хронически рецидивирующего процесса при трипаносомозах. Увеличение численности паразитов в крови стимулирует развитие специфических антител (IgM-ответ хозяина), которые приводят к уничтожению большинства паразитирующей популяции. Те паразиты, которые сохранились (менее чем 1 %), претерпевают антигенную трансформацию, что делает их неуязвимыми для циркулирующих антител, однако по мере увеличения численности нового антигенного варианта возрастает концентрация соответствующих новых специфических антител. Каждый такой повторяющийся цикл занимает несколько дней, заканчиваясь появлением новых антигенных вариантов, резистентных к предшествовавшим вариантам антител. С каждым изменением поверхностных антигенов иммунный механизм позвоночного хозяина активируется, постепенно снижая способность иммунной системы к ответу.
Число антигенов, продуцируемых трипаносомой, неизвестно, но было показано, что одна клетка способна продуцировать до 22 различных специфических для трипаносом антигенов. Материальным субстратом указанных вариаций служат поверхностные антигены гликопротеина (VSG), расположенные на оболочке паразита.
По оценке, многочисленные варианты транскрибируются более чем в 1000 генов, что теоретически возможно для T.b. gambiense. Из этих вариантов только один является генетически доминантным в определенные моменты времени. Экспрессия каждого гена сопровождается перестройкой генов.
Антигенная вариабельность этих паразитов делает получение эффективных вакцин, обеспечивающих длительную защиту, достаточно бесперспективным для контроля данного заболевания.
Трипаносома родезийская (Trypanosoma rhodesiense). T. rhodesiense вызывает африканский трипаносомоз родезийского типа, который во многом сходен с гамбийским типом африканского трипаносомоза, но это зооноз.
Этиология и биология развития. Возбудитель - Т. rhodesiense - по морфологии близок к Т. gambiense. Основными хозяевами Т. rhodesiense служат различные виды антилоп, а также крупный рогатый скот, козы, овцы и реже человек.
Главными переносчиками возбудителя родезийского типа являются мухи цеце группы morsitans (G. morsitans, G. pallidipes и др.). Они обитают в саваннах и саванновых лесах, более светолюбивы и менее влаголюбивы, чем palpalis, более зоофильны и охотнее нападают на крупных копытных и мелких бородавочников, чем на людей.
Эпидемиология. Резервуарами Trypanosoma rhodesiense в природе являются различные виды антилоп и других копытных. В ряде случаев дополнительным резервуаром может стать крупный рогатый скот.
Зоонозная форма сонной болезни распространена в равнинной саванне в отличие от антропонозной, тяготеющей к долинам рек. В естественных условиях саванны Т. rhodesiense циркулирует по цепи антилопа - муха це-
це - антилопа без участия человека. Человек заражается эпизодически при посещении энзоотичных очагов. Относительную редкость заражения людей в дикой природе можно также объяснить выраженной зоофилией переносчика, вследствие чего мухи цеце соответствующих видов неохотно нападают на человека. В этих условиях заболевают представители определенных профессий - охотники, рыболовы, военнослужащие, а также путешественники. Мужчины болеют значительно чаще, чем женщины и дети.
Патогенез и клинические проявления сонной болезни родезийского типа отличаются более острым и тяжелым течением. Инкубационный период короче, чем при гамбийском типе, и составляет 1-2 нед.
В месте укуса возникает первичный аффект - трипаносомный шанкр - в виде фурункула, который исчезает через несколько дней, оставляя иногда небольшой рубец. Трипаносомный шанкр отмечается не у всех больных, чаще у европейцев, чем у африканцев. В период развития шанкра или через несколько дней после его появления паразит появляется в крови, и с этим ассоциируется начало лихорадочного периода. Лихорадка носит неправильный характер, сопровождается головной болью. Смерть больных при отсутствии лечения нередко наступает через 9-12 мес. Гемолимфатическая фаза инвазии выражена слабо. У всех больных обнаруживают трипаносомы в крови, у многих в СМЖ.
Диагностика такая же, как при гамбийском типе.
Профилактика и меры борьбы такие же, как при гамбийском типе.
Трипаносома американская (Trypanosoma cruzi). T. cruzi вызывает американский трипаносомоз (болезнь Шагаса) - трансмиссивную природно-очаговую протозойную болезнь, которая характеризуется наличием острой и хронической фаз. В 1907 г. бразильский врач С. Шагас обнаружил в триатомовых (поцелуйных) клопах, а в 1909 г. выделил из крови больного возбудителя и описал болезнь, названную в честь него болезнью Шагаса.
Этиология. Возбудитель Trypanosoma cruzi отличается от возбудителей африканского трипаносомоза меньшей длиной тела (13-20 мкм) и более крупным кинетопластом трипомастиготных форм. В фиксированных препаратах крови Т. cruzi часто имеет изогнутую форму наподобие букв С или S (С- и S-формы).
Возбудитель американского трипаносомоза относится к секции Stercoralia (лат. stercus- кал, oralis - ротовой), т.е. передается через фекалии клопа-переносчика. Кроме того, для T. cruzi характерна персистенция (лат. persistere - оставаться, упорствовать) - способность паразита сохраняться в организме хозяина в течение всей жизни с развитием резистентности (устойчивости) к реинвазии (повторному заражению). Трипаносомы при этом продолжают медленно размножаться в течение всей жизни хозяина в клетках некоторых тканей.
Биология развития. Цикл развития T. cruzi проходит со сменой хозяев: а) позвоночных животных (более 100 видов) и человека; б) переносчика возбудителя (клопы подсемейства Triatominae) (рис. 2.11).
Цикл развития в переносчике (рис. 2.12). Инвазионной стадией для переносчика, как и для позво-
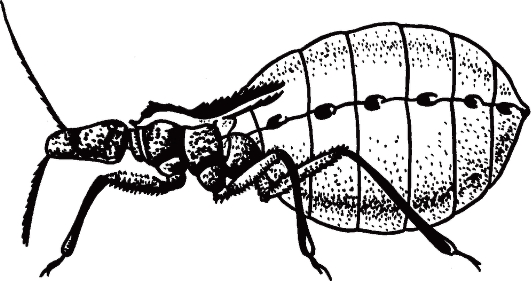
Рис. 2.11. Triatoma infestans (поцелуйный клоп) - специфический переносчик трипаносом, напитавшийся кровью.
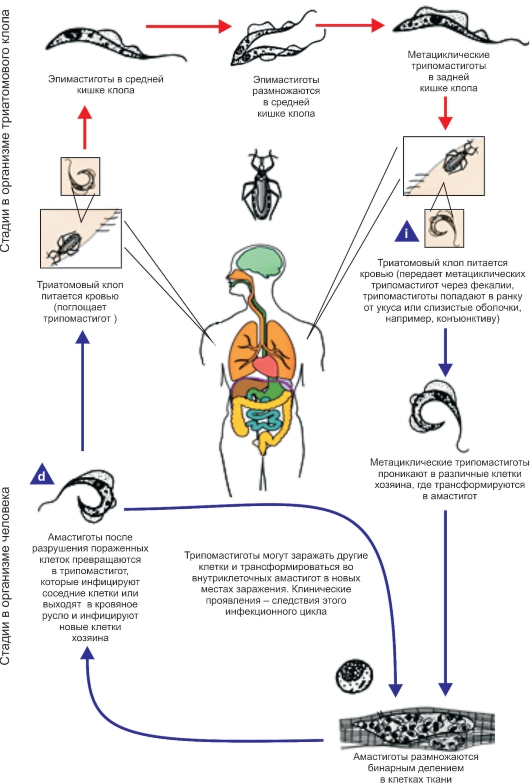
Рис. 2.12. Жизненный цикл Trypanosoma cruzi.
ночного животного и человека, являются трипомастиготы. Поскольку колющий ротовой аппарат в отличие от такового мухи цеце у клопов очень слабый и не может проколоть даже кожу человека, они ищут ссадины или слизистые оболочки конъюнктивы, носовой полости, рта (за что получили название поцелуйных клопов).
Заражение клопов происходит при питании кровью человека или животных, содержащей трипомастиготы.
Попадая в организм триатомовых клопов (переносчики американского трипаносомоза), T. cruzi достигают желудка насекомого, превращаются здесь в эпимастиготы и размножаются в течение нескольких дней. Затем они проходят в заднюю и прямую кишку, где возвращаются к трипомастиготной форме. С этого момента клопы становятся заразными. После или во время засасывания крови клопы опорожняют прямую кишку, и возбудители попадают на кожу человека или слизистые оболочки. Однократно инвазированный клоп сохраняет паразитов до конца жизни (около 2 лет). Трансовариальная передача отсутствует.
Инвазионной стадией для позвоночного хозяина является трипомастиготная форма. Передача инвазии человеку и другим теплокровным происходит не прямо через укус клопа, а путем контаминации экскрементами клопов, содержащими трипаносом, ранки от укуса или слизистых оболочек. В месте укуса формируется шагома - первичный симптом трипонасомоза.
Как правило, дефекация у клопов происходит непосредственно во время кровососания. Укусы клопов вызывают сильный зуд и воспаление, в результате чего паразиты могут быть занесены в ранку при расчесывании. У человека зарегистрированы также случаи врожденного трипаносомоза.
После попадания в организм позвоночного животного (природного резервуара) или человека трипомастиготы некоторое время остаются в периферической крови, но не размножаются.
Затем они проникают в мышечные клетки и клетки эндотелия легких, печени, лимфатических узлов и других органов, однако паразиты скапливаются преимущественно в клетках сердечной мышцы. Внутри клеток трипомастиготы трансформируются в эпимастиготную, промастиготную формы и в конце трансформации превращаются в округлую безжгутиковую форму - амастиготу длиной 2,5-6,5 мкм, содержащую круглое ядро и мелкий овальной формы кинетопласт. Внутри клетки амастиготы размножаются бинарным делением.
Наполненная амастиготами клетка человека или животного увеличивается в размерах и превращается в псевдоцисту, оболочкой которой служит стенка клетки хозяина. Перед разрывом и сразу после разрыва такой псевдоцисты амастигота (минуя промастиготную и эпимастиготную стадии) превращается в трипомастиготу. Трипомастиготы инвазируют соседние клетки, размножаются в стадии амастигот с образованием новых псевдоцист. Таким образом, амастиготы - сугубо внутриклеточная форма паразита. Часть трипомастигот, высвободившихся из псевдоцисты и не попавших в соседние клетки, попадает в кровь, где циркулирует и может попасть оттуда в организм переносчика.
Эпидемиология. Основными переносчиками возбудителя американского трипоносомоза являются летающие клопы Triatoma megistis, Triatoma infestans и др. Эти насекомые отличаются яркой окраской и сравнительно крупными размерами - 15-35 мм в длину. Нападают на человека и животных ночью. Трансовариальная передача трипаносом из поколения в поколение у триатомовых клопов отсутствует.

Рис. 2.13. Основной
резервуар возбудителя в природе - броненосцы Южной и Центральной Америки, имеющие высокий уровень паразитемии.
Передача возбудителя болезни Шагаса происходит по типу специфической контаминации. Грипаносомы, выделенные с фекалиями клопов во время кровососания, проникают в организм человека или животных через поврежденную кожу или слизистые оболочки глаз, носа, полости рта вблизи места укуса. Заражение трипаносомозом возможно также алиментарным путем (в том числе с молоком матери), при гемотрансфузиях.
В настоящее время установлено, что возможна и трансплацентарная передача Т. cruzi, но уровень ее сравнительно невысок: в среднем у больных матерей рождаются 2-4 % инфицированных детей. Механизм протективного действия плаценты полностью не изучен.
Известны синантропные и природные очаги болезни Шагаса. В синантропных очагах, кроме человека, резервуарами возбудителя являются собаки, кошки, свиньи и другие домашние животные. По имеющимся данным, инфицированность собак в синантропных очагах в отдельных районах Бразилии составляет 28,2 %, в Чили - 9 %, кошек в Бразилии - 19,7 %, в Чили - 12 %.
В природных очагах резервуарами возбудителя служат броненосцы (сами не болеют) (рис. 2.13), опоссумы (наиболее важны, так как имеют высокий индекс паразитемии), муравьеды, лисы, обезьяны и др. В Боливии и некоторых районах Перу определенное значение в качестве резервуара Т. cruzi имеют морские свинки, которых население держит дома для употребления в пищу. Естественная зараженность морских свинок достигает 25-60 %.
Болезнь Шагаса широко распространена, ее выявляют практически во всех странах Американского континента от 42о с. ш. до 43о ю. ш. Наиболее часто инфекцию регистрируют в Бразилии, Аргентине, Венесуэле. Она встречается также в Боливии, Гватемале, Гондурасе, Колумбии, Коста-Рике, Панаме, Парагвае, Перу, Сальвадоре, Уругвае, Чили, Эквадоре.
Патогенез и клинические проявления. Т. cruzi паразитируют и размножаются в организме человека и позвоночного хозяина сначала в макрофагах кожи и подкожной клетчатки, затем в регионарных лимфатических узлах, далее - во всех органах.
Наиболее поражаемым органом при болезни Шагаса является сердце. В острой стадии инфекции в миокарде развивается распространенный интерстициальный воспалительный процесс с отеком и разрушением миофибрилл (рис. 2.14).
У некоторых больных, инвазированных Т. cruzi (более часто у детей раннего возраста), развивается острый специфический менингоэнцефалит с мононуклеарной инфильтрацией мягких мозговых оболочек, периваскулярными воспалительными реакциями, иногда в сочетании с геморрагией и пролиферацией глии.
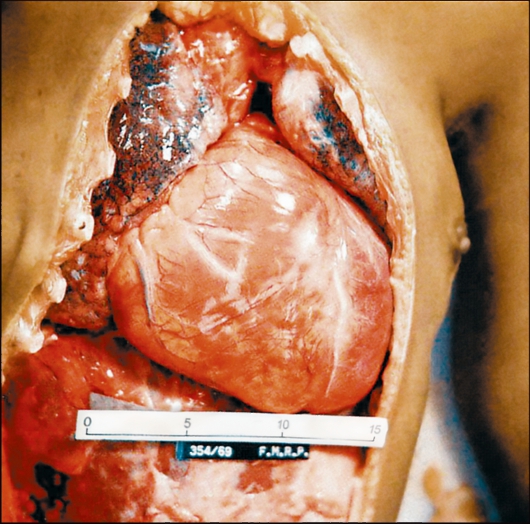
Рис. 2.14. Кардиомегалия при американском трипаносомозе. На снимке видно сильно увеличенное сердце больного, особенно хорошо заметны расширения правого предсердия и обоих желудочков.
Серьезно страдают структуры ганглиев вегетативной нервной системы, что приводит к расстройствам иннервации внутренних органов.
Считается, что инкубационный период при американском трипаносомозе колеблется от 1 до 2 нед. В месте инокуляции паразитов возникает воспалительная реакция - шагома. В случае проникновения паразитов через кожу первичное местное воспаление напоминает ненагнаивающийся фурункул.
Среди общих симптомов необходимо указать на лихорадку постоянного или ремиттирующего типа с повышением температуры тела до 39-40оС, общую аденопатию, гепатоспленомегалию, отеки, иногда макулезные высыпания. Эти клинические симптомы возникают на фоне острого миокардита и раздражения менингеальной оболочки. Такая симптоматика, как правило, наблюдается у детей в эндемичных районах, при этом тяжесть течения увеличивается с уменьшением возраста больного. Примерно 10 % случаев заканчиваются летально в результате прогрессирующего менингоэнцефалита или тяжелого миокардита с сердечной недостаточностью.
После острого периода болезнь переходит в хроническую стадию.
Диагностика. В острой стадии паразитов легко обнаруживают путем микроскопии препаратов периферической крови. Наряду с окрашенными фиксированными препаратами можно исследовать раздавленную каплю крови, при этом подвижные паразиты хорошо видны под микроскопом. В хронической стадии микроскопия малоэффективна.
В целях диагностики прибегают к серологическим реакциям, чаще к реакции связывания комплемента с антигеном из пораженного трипаносомами сердца. Широкое распространение в эндемичных районах получила ксенодиагностика - кормление незараженных триатомовых клопов на больном с последующим исследованием экскрементов насекомых для обнаружения паразитов.
Профилактика. К профилактическим мерам относятся применение стойких контактных инсектицидов для уничтожения клопов-переносчиков, благоустройство жилищ. В связи с наличием бессимптомных носителей в эндемичных районах обязательно обследование доноров серологическими методами и с помощью ксенодиагностики.
Род Leishmania (лейшмании). Простейшие рода Leishmania вызывают лейшманиозы - облигатно-трансмиссивные заболевания.
Жизненный цикл лейшманий (рис. 2.15) протекает со сменой хозяев и включает две морфологические формы - амастиготную (безжгутиковую) и промастиготную (жгутиковую). У теплокровных амастиготы и микромастиготы лейшманий обнаруживают в протоплазме клеток ретикулоэндотелиальной системы, способных к фагоцитозу. Они имеют вид мелких овальных или круглых телец длиной от 2 до 5 мкм (рис. 2.16).
В амастиготной форме лейшмании паразитируют в клетках (макрофагах) природных резервуаров (позвоночные животные) и человека, в промастиготной - обитают в различных частях пищеварительного тракта москитов, которые служат их переносчиками, и в питательных средах. Промастиготы лейшманий имеют удлиненную веретеновидную форму; их длина составляет 10-20 мкм, ширина - 3-5 мкм. Их ядро, протоплазма и кинетопласт
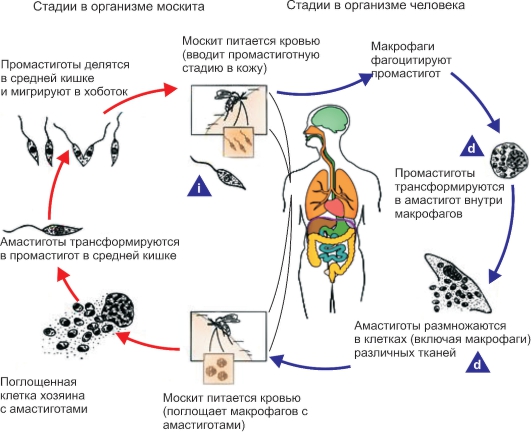
Рис. 2.15. Жизненный цикл Leishmania.
i - инфекционная стадия; d - диагностическая стадия.
Рис. 2.16. Амастигота (лейшманиальная форма) лейшманий в клетках хозяина.
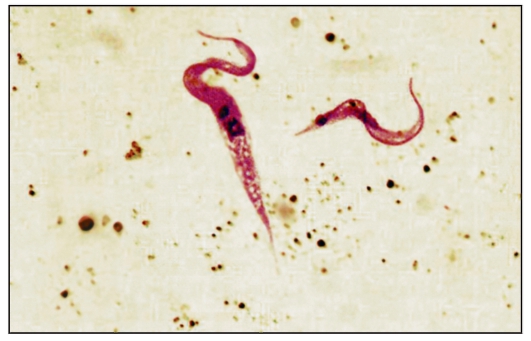
Рис. 2.17. Промастиготы
лейшманий в культуре.
окрашены так же, как и у амастигот. В культурах промастиготы часто представляют собой скопления в виде розеток со жгутиками, обращенными к центру (явление агломерации) (рис. 2.17).
Переносчиками лейшманий являются двукрылые насекомые: в Старом Свете - москиты рода Phlebotomus, в Новом Свете - москиты рода Lutzomyia. Основные природные резервуары - грызуны и представители семейства псовых.
Лейшманиозы распространены в странах с жарким и теплым климатом. Заболевания людей зарегистрированы в 76 странах Азии, Африки, Южной Европы, Центральной и Южной Америки. Во многих странах лейшманиозы наносят существенный социально-экономический ущерб. В России местные случаи заболевания в настоящее время отсутствуют, однако ежегодно регистрируют завозные случаи среди заразившихся при посещении стран ближнего и дальнего зарубежья, эндемичных по лейшманиозам.
Различают три клинические формы лейшманиоза: кожный, слизистокожный и висцеральный лейшманиозы. При кожном лейшманиозе поражаются кожные покровы; при слизисто-кожном - кожа и слизистые оболочки, главным образом верхних дыхательных путей, иногда с разрушением мягких тканей и хрящей; при висцеральном лейшманиозе возбудитель
локализируется в печени, селезенке, костном мозге и лимфатических узлах. В России чаще всего регистрируют кожный и висцеральный лейшманиозы.
Молекулярные и генетические исследования патогенеза лейшманиоза. Патология, возникающая в результате инфекции Leishmania, в значительной мере зависит от генетических факторов хозяина. Чувствительность к Leishmania donovani, Salmonella typhimurium и Mycobacterium bovis контролируется одним и тем же геном на хромосоме 1 у мышей. Этот ген (NRAMP1) кодирует белок-1, ассоциированный с устойчивостью к лейшманиозу у мышей и человека. Слизистый лейшманиоз как осложнение кожного лейшманиоза ассоциирован с аллельными генами, кодирующими цитокины (фактор некроза опухоли). Эти цитокины связываются с одним из двух рецепторов фактора некроза опухоли. Мыши, у которых отсутствовал рецептор, не излечивались от кожных язв, несмотря на то что были способны контролировать размножение паразита. Для заболеваний, при которых клеточный иммунитет играет решающую роль, характерно участие главного комплекса гистосовместимости. В экспериментах на мышах было показано, что различные главные комплексы гистосовместимости были ассоциированы с разной чувствительностью к висцеральному лейшманиозу. Важная роль главного комплекса гистосовместимости в развитии кожного лейшманиоза установлена для человека и подтверждена при анализе генетического сцепления на мышах.
В исследованиях был выявлен локус на хромосоме 1 мыши, который контролирует быстрое размножение Leishmania donovani у этих животных. Несколько групп исследователей выполнили большую работу на иммунологическом и генетическом уровнях и идентифицировали новый ген на хромосоме 1 мыши, который имел локусы lsh, bcg, ity. Этот ген белка-1, ассоциированного с природной устойчивостью макрофагов NRAMP1 (natural resistance-associated macrophage protein-1), локализован на мембране фаголизосом и является транспортером двухвалентных катионов. По-видимому, влияние этого белка на концентрацию Fe+ в вакуоли играет определенную роль в образовании кислородных радикалов в фаголизосоме. Исследования лейшманиоза на мышах также показали, что генетический контроль инфекции, вероятно, является полигенным. В ранних исследованиях было обнаружено, что HLA и локус H1 в дополнение к lsh определяли фенотип чувствительности у мышей. Более поздние исследования подтвердили эту точку зрения. В них было выявлено несколько генетических областей, которые содержат гены, определяющие чувствительность к Leishmania major, вызывающих кожный лейшманиоз у человека. Гены чувствительности до сих пор не идентифицированы.
Лейшмания тропическая (Leishmania tropica). L. tropica - возбудитель кожного лейшманиоза.
Биология развития. Инфекционный процесс начинается, когда промастиготы проникают в организм хозяина со слюной москитов, которые кусают у человека лицо или конечности. Паразиты поглощаются дермальными макрофагами и вскоре превращаются в амастиготы или микромастиготы, размножающиеся поперечным делением, что в конечном счете приводит к разрыву макрофагов.
Москит заражается амастиготами лейшманий при кровососании на инфицированном позвоночном. В кишечнике москита лейшмании переходят в промастиготную стадию, размножаются продольным делением и развиваются в течение 1 нед, превращаясь в инвазионные формы, которые концентрируются в передних отделах кишечника и хоботке москита.
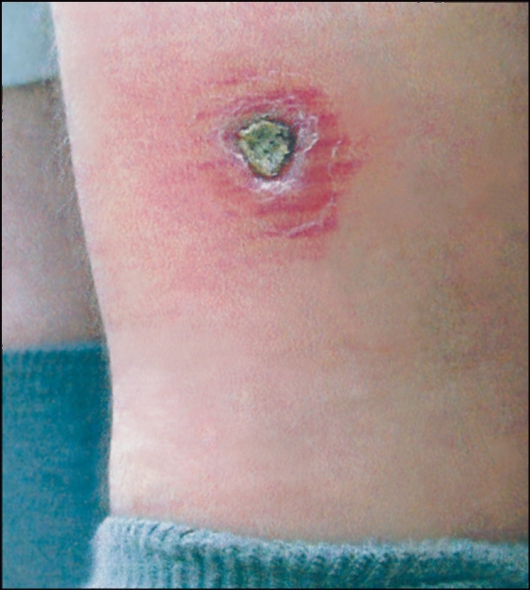
Рис. 2.18. Язва при антропонозном кожном лейшманиозе.
Москиты - мелкие двукрылые насекомые длиной от 1,2 до 3,7 мм. Они распространены во всех частях света в тропической и субтропической зонах между 50о с. ш. и 40о ю. ш. Москиты обитают как в населенных пунктах, так и в природных биотопах. В природных условиях москиты плодятся в норах грызунов, гнездах птиц, пещерах, дуплах деревьев и т. п.
Эпидемиология. Лейшманиозы занимают одно из важнейших мест среди тропических болезней. По данным ВОЗ, лейшманиозы распространены в 88 странах, в 32 странах они подлежат обязательной регистрации. По экспертным оценкам, число больных лейшманиозами в мире составляет 12 млн человек. Ежегодно регистрируют 2 млн новых случаев. Примерно 350 млн человек проживают на эндемичных по лейшманиозам территориях и находятся под угрозой заражения.
Лейшманиозы включены в специальную программу ВОЗ по изучению тропических болезней и борьбе с ними. В некоторых развивающихся странах лейшманиозы могут играть роль фактора, сдерживающего экономическое развитие тех или иных районов.
Кожный лейшманиоз характеризуется поражениями кожи, которые называются лейшманиомами. Вследствие размножения лейшманий в месте введения их москитами появляются специфические гранулемы, состоящие из плазматических клеток, нейтрофилов, лимфоидных элементов. Сосуды в области инфильтрата и за его пределами расширены, отмечаются набухание и пролиферация их эпителия. Процесс развития лейшманиомы состоит из трех стадий: бугорка, изъязвления и рубцевания. Возможны распространение инфекции по лимфатическим сосудам и развитие лимфангитов и лимфаденитов.
Различают антропонозный (АКЛ) и зоонозный (ЗКЛ) кожные лейшманиозы (табл. 2.2).
Антропонозный кожный лейшманиоз (поздноизъязвляющийся, городской) является типичным антропонозом, при котором источником возбудителя служит больной человек. Болеют большей частью жители городов
(рис. 2.18).
Этиология. Возбудитель - Leishmanial tropica minor.
Эпидемиология. Источник инвазии - больной человек; дополнительный резервуар - больная собака. Основной переносчик - Ph. sergenti, но в разных регионах переносчиками могут быть и другие виды москитов.
Инкубационный период варьируется от нескольких месяцев до 2- 5 лет, поэтому заболевание регистрируют круглогодично. Оно распространено преимущественно в городах и поселках городского типа, но встречается и в сельской местности. Среди местного населения чаще болеют дети, среди приезжих - люди всех возрастов. АКЛ распространен в Средиземноморье, странах Ближнего и Среднего Востока, Центральной Азии и Закавказья.
Таблица 2.2. Особенности двух типов кожного лейшманиоза
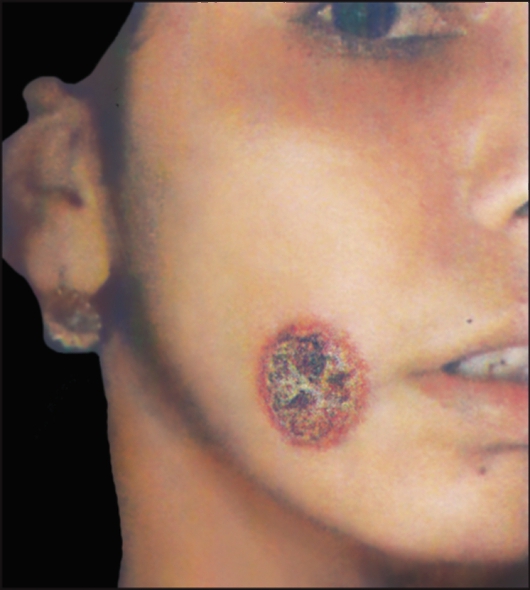
Рис. 2.19. Кожный лейшманиоз. Простая сухая язва на щеке.
Патогенез и клинические проявления. Инкубационный период колеблется от 2-4 мес до 1-2 лет. Возможно его увеличение до 4- 5 лет. После завершения инкубационного периода в месте укуса зараженными москитами (чаще на лице, верхних конечностях) появляются малозаметные единичные, реже множественные бугорки - лейшманиомы. Они проходят 3 стадии: красного или бурого бугорка (стадия пролиферации), сухой язвы (стадия деструкции) и рубца (стадия репарации) (рис. 2.19).
Под отпавшей или снятой коркой видна кровоточащая эрозия или неглубокая, часто кратерообразная язва с гладким или мелкозернистым дном, покрытым гнойным налетом. Через 2-4 мес после формирования язв постепенно начинается процесс их рубцевания,
который заканчивается в среднем через 1 год с момента появления бугорка. Отсюда происходят местные народные названия заболевания - «годовик», «солек», «иыл-ярасы». В некоторых случаях заболевание затягивается на 2года и более.
После перенесенного АКЛ примерно в 10 % случаев развивается вялотекущий хронический туберкулоидный кожный лейшманиоз (рецидивный кожный лейшманиоз), клинически напоминающий туберкулезную волчанку, который может длиться десятилетиями. Люди, перенесшие АКЛ, приобретают иммунитет к этой форме лейшманиоза, но могут заболеть ЗКЛ.
Диагностика. Лейшмании могут быть обнаружены в окрашенных по Ро- мановскому-Гимзе мазках, приготовленных из содержимого язвы, или получены путем культивирования при комнатной температуре на среде NNN- агаре или в культуре тканей.
Профилактика. Наряду с общими профилактическими мероприятиями, включающими борьбу с переносчиками - москитами и грызунами, проводят вакцинацию с использованием препарата L-тропина. Вакцинация приводит к образованию язвы с развитием длительного иммунитета. Подобная вакцинация не защищает от висцерального лейшманиоза, против которого еще не имеется эффективной вакцины.
Зоонозный кожный лейшманиоз (пустынно-сельский лейшманиоз, мокнущий кожный лейшманиоз, пендинская язва) (рис. 2.20) - остронекротизирующееся заболевание.
Этиология. Возбудитель - L. major. Отличается от возбудителя антропонозного подтипа кожного лейшманиоза рядом биологических и серологических особенностей.
Эпидемиология. На значительной части ареала L. major основным резервуаром возбудителя является большая песчанка (Rhhombomys opimus). Установлена естественная зараженность краснохвостой и полуденной песчанок, тонкопалого суслика и других грызунов, а также ежей и некоторых хищных животных (ласка). Переносчики - москиты нескольких видов рода Phle-
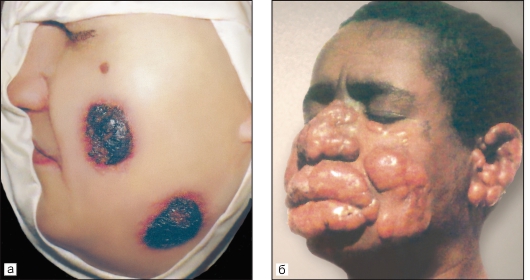
Рис. 2.20. Зоонозный кожный лейшманиоз.
а - пендинская язва; б - диффузная лепроматоидная форма кожного лейшманиоза у больного из Эфиопии.
botomus, главным образом Ph. papatasii, которые становятся заразными через 6-8 дней после кровососания на грызунах.
Человек заражается через укус инвазированного москита. ЗКЛ распространен в странах Северной и Западной (возможно, и в других районах) Африки, Азии (Индия, Пакистан, Иран, Саудовская Аравия, Йемен и большинство других стран Западной Азии). Встречается в Туркменистане и Узбекистане.
Патогенез и клинические проявления. Патологическая картина близка к таковой антропонозного лейшманиоза, но формирование изъязвления и рубцевание первичной лейшманиомы происходят ускоренными темпами.
Инкубационный период в среднем составляет 2-3 нед, но может быть и более длительным - до 3 мес. Различают те же клинические варианты, что и при АКЛ.
Лейшманиомы чаще локализуются на открытых частях тела; нижних и верхних конечностях, лице. Через 2-4, иногда через 5-6 мес начинаются эпителизация и рубцевание язвы. С появления папулы до формирования рубца проходит не более 6-7 мес.
Весь процесс от момента появления папулы или бугорка до полного рубцевания продолжается от 2 до 5-6 мес, т. е. он значительно короче, чем при АКЛ.
После перенесенного заболевания развивается стойкий пожизненный иммунитет как к зоозной, так и антропонозной формам кожного лейшманиоза. Повторные заболевания возникают очень редко.
При локализации язв на суставных сгибах или при множественных поражениях кожный лейшманиоз часто приводит к временной нетрудоспособности. Если обширные инфильтраты и изъязвления образуются на лице, особенно на носу и губах, то остаются косметические дефекты.
Диагностика кожного лейшманиоза основана на анамнестических, клинических и лабораторных данных. Существенное значение имеет пребывание больного в эндемичном по лейшманиозу районе в сезон передачи. В неэндемичных районах (Россия) для подтверждения диагноза необходимы лабораторные исследования, при этом решающую роль играет паразитологический диагноз - обнаружение возбудителя в материале, взятом из кожных поражений больного.
Материал для микроскопического исследования берут из нераспавшегося бугорка или краевого инфильтрата язвы.
Профилактика. Противоэпидемические и профилактические мероприятия в очагах ЗКЛ значительно сложнее и менее эффективны, чем при антропонозном лейшманиозе, и зависят от структуры очага, вида преобладающего резервуара инфекции, состояния природного биоценоза в данной местности. Основа всех мероприятий - широкое использование всех способов истребления диких пустынных грызунов. Борьбу с москитами проводят по тем же принципам, что и при АКЛ. Делают прививки живой культуры L. major. Вакцинацию проводят в осенне-зимний сезон (но не позднее чем за 3 мес до выезда в эндемичный по ЗКЛ очаг), в результате развивается стойкий пожизненный иммунитет.
Высокоэффективной мерой профилактики была лейшманизация - искусственное заражение (прививка) вирулентным штаммом L. major. Этот метод был предложен и изучен русским паразитологом Е. И. Марциновским в начале XX в.
Весьма эффективной мерой профилактики лейшманиозов является защита от нападения москитов. Для этого в вечернее время непосредственно перед заходом солнца и в течение всей ночи целесообразно использовать специальные отпугивающие москитов вещества - репелленты, а также пологи из мелкоячеистой сетки.
Лейшмания мексиканская (Leishmania mexicana). L. mexicana - возбудитель мексиканского кожного лейшманиоза.
Этиология. Возбудители кожного лейшманиоза Нового Света относятся к комплексу L. mexicana, включающему 5 подвидов лейшманий.
Мексиканская форма лейшманиоза встречается на юге Мексики (полуостров Юкатан), в Гватемале и сопредельных государствах. Это зооноз, природные очаги которого связаны с ландшафтами влажных тропических лесов. При заболевании чаще появляется одна лейшманиома, преимущественно на коже уха, которая заживает без осложнений, однако нередки случаи (около 40 %) хронического течения болезни с глубокими язвами и разрушением хрящевой ткани ушей, носа, гортани.
Эпидемиология. Большинство форм этого заболевания являются природно-очаговыми зоонозами. Источниками и резервуарами возбудителей могут быть грызуны, сумчатые, многие дикие и домашние животные. Основные переносчики - москиты из родов Lutzomyia и Psychodopygus, многие виды которых в своих биотопах нападают на человека в дневные часы во время производственной деятельности. Болезнь распространена преимущественно в сельских районах, в городах встречается как исключение. Регистрируется во всех странах Латинской Америки (возможно, за исключением Чили), в южных районах США (Техас).
В Бразилии (бассейн Амазонки) выделена L. mexicana amazonensis, поражающая преимущественно диких животных (крысы, мыши, опоссумы, лисы, паки), обитающих в лесах, на берегах рек и в заболоченных местностях. Человек включается в эпидемический процесс крайне редко. В случае заражения заболевание у человека протекает очень тяжело, в 30 % случаев не
поддается лечению, в форме диффузного кожного лейшманиоза приводит к обезображиванию.
Патогенез и клинические проявления. Патогенез во многом сходен с таковым кожного лейшманиоза Старого Света. Отмечаются более глубокое поражение кожи (вплоть до гиподермы) и сравнительно частое распространение патологического процесса на слизистые оболочки (до подслизистой основы) носа, рта, глотки, гортани, реже половых органов. Иммунитет нестойкий и ненапряженный. Инкубационный период длится от 2-3 нед до 1-3 мес.
Важнейшей особенностью кожного лейшманиоза Нового Света является нередкое вовлечение в патологический процесс слизистых оболочек. Как правило, слизистые оболочки поражаются через 1-2 года после развития язв на коже. Язвенно-некротические изменения слизистых оболочек приводят к глубокой деформации носа, ушей, носовой части глотки, дыхательных путей, половых органов, уродующей и инвалидизирующей больных.
Диагностика и профилактика. Принципы диагностики и профилактики такие же, как и при кожном лейшманиозе Старого Света.
Лейшмания бразильская (Leishmania brasiliensis). Этот вид вызывает бразильский слизисто-кожный лейшманиоз - эспундию (espundio).
Слизисто-кожный американский лейшманиоз имеет несколько нозологических форм, возбудители которых относятся к комплексу L. brasiliensis. Наиболее тяжелая форма - бразильский лейшманиоз (эспундия), при которой в 80 % случаев на коже в месте введения возбудителя, кроме язв, появляются обширные поражения слизистых оболочек носоглотки, гортани, а также хрящей, мягких тканей и даже костей.
Этиология. Возбудитель - L. brasiliensis. Переносчиками являются более 12 видов москитов рода Lutzomya, но наиболее часто встречается Lu. wilcomei.
Эпидемиология. Слизисто-кожный лейшманиоз - эспундия - встречается преимущественно в Южной Америке. Случаи подобного заболевания известны в некоторых странах Азии и Африки (Судан, Сомали, Кения, Индия). Распространение заболевания связано с климатическими условиями, временем года и характером местности. Высокие температура и влажность воздуха являются необходимыми условиями возникновения заболеваний. Эспундия чаще отмечается в осеннее дождливое время. Имеет значение высота местности (не более 2000 м над уровнем моря). Заболевание чаще наблюдается в сельской, лесистой местности и связано с плотностью популяции москитов. Слизисто-кожная форма лейшманиоза часто возникает у людей, работающих в лесах, особенно собирающих смолистые вещества для изготовления жевательной резины, поэтому эспундию называют еще болезнью «жвачки».
Переносчиками заболевания являются москиты, природными резервуарами-носителями - грызуны и, возможно, собаки. В 1946 г. Kiri наблюдал экспериментальную эспундию после заражения обезьян кала-азаром суданского типа. Из всех экспериментально инфицированных животных только у обезьян удалось воспроизвести поражения ротовой и носовой полости.
Патогенез. По микроскопическому характеру кожных поражений заболевание может быть аналогично восточной язве. Паразиты могут проникать через циркулирующие в крови макрофаги в нос, рот и мягкое небо, где они размножаются в макрофагах хрящевых или соединительных тканей, вызывая деструктивное воспаление. Процесс может распространяться на глотку и гортань, иногда поражаются также наружные половые органы.
Клинические проявления. При классической эспундии, встречающейся в Бразилии, Перу, Чили, Эквадоре, Боливии, Парагвае, первоначальные папулопустулезные кожные поражения появляются на лице, ушах и голенях.
Поражения слизистых оболочек или сопровождают кожные поражения, или развиваются через несколько лет. В слизистой оболочке носовой полости наблюдаются застойные явления, в дальнейшем происходит ее изъязвление. При внедрении паразитов в губы, мягкое небо, зев здесь могут происходить разрушения, приводящие к тяжелым страданиям и деформациям. Нос обычно утолщается, деформируется, загибается книзу, а верхняя губа в результате отека и деформации заметно выступает вперед и вверх («нос тапира»). Длительность заболевания - от 4 мес до 4 лет.
Диагностика и профилактика. Принципы диагностики и профилактики такие же, как и при кожном лейшманиозе.
Лейшмания висцеральная (Leishmania donovani). Вызывает висцеральный лейшманиоз («черная болезнь», лихорадка дум-дум, кала-азар).
Этиология. Возбудитель - Leishmania donovani (существуют индийский и средиземноморский, или детский, варианты возбудителя), в организме человека паразитирует внутриклеточно в стадии амастиготы (безжгутиковой), в организме переносчика - в стадии промастиготы (жгутиковой).
Кала-азар (в переводе с санскрита - «черная болезнь») поражает взрослых и лишь в 5-6 % случаев - детей и подростков. Заболевания среди диких и домашних животных неизвестны. Резервуаром возбудителя и источником заражения москитов является больной человек. Передача возбудителя происходит непосредственно от больного человека здоровому через укус москита.
Эпидемиология. Кала-азар - антропоноз. Источник заражения - больной человек, у которого возбудитель присутствует в коже при развитии посткалаазарного кожного лейшманоида. Наибольшую заболеваемость регистрируют среди детей 5-9 лет. Второй по пораженности группой являются подростки.
Переносчик - москит Phlebotomus (Euphlebotomus) argentipes. Кроме Индии, кала-азар встречается в Бангладеш, Непале и, возможно, в Пакистане. Висцеральный лейшманиоз, по клинике сходный с индийским кала-азаром, распространен в северо-восточной части Китая, где переносчиком возбудителя служат Ph. chinensis и Ph. longidudus. Антропонозный висцеральный лейшманиоз, вызываемый L. donovani, встречается также на Африканском континенте - в Кении, Судане, Уганде и Эфиопии, где переносчиком выступает Ph. martini, и на Аравийском полуострове - на юго-западе Саудовской Аравии и в горных районах Йемена (переносчики - Ph. arabicus и Ph. orientalis).
Клинические проявления. Инкубационный период при кала-азаре (висцеральном лейшманиозе) длится от 20 дней до 3-5 мес. Известны случаи его увеличения до 2 лет. Болезнь развивается медленно. Одним из основных симптомов болезни является лихорадка. Чаще всего температура тела больных повышается постепенно, достигая 38-39 оС. Кожный покров может приобретать темный цвет (индийский кала-азар), быть восковидным или сохраняться бледным. Потемнение кожи объясняется гипофункцией надпочечников, что связано с поражением их коркового слоя лейшманиями.
Лимфатические узлы могут быть увеличены, но без выраженного периаденита.
Внутриклеточное паразитирование лейшманий обусловливает развитие печеночно-селезеночного синдрома. Селезенка значительно увеличивается в течение первых 3-6 мес болезни, происходит также увеличение печени. Гепатоспленомегалия выражена у всех больных висцеральным лейшманиозом и при сильном похудении приводит к заметному расширению вен на коже живота.
В некоторых странах и регионах с жарким климатом (Индия, Судан, Восточная Африка, Китай) у 5-10 % больных спустя 1-2 года после видимого выздоровления наблюдается развитие посткалаазарных кожных лейшманоидов, которые могут сохраняться несколько лет. Лейшманоиды являются источником заражения москитов лейшманиями, а сами люди, имеющие кожные лейшманоиды, служат резервуарами инфекции кала-азар.
Диагностика. Можно прибегнуть к реакции связывания комплемента. Разработан иммунолюминесцентный метод, который используют в ранней диагностике до появления основных признаков болезни. L. donovani могут быть обнаружены в окрашенных препаратах из пунктата костного мозга, лимфатических узлов, селезенки и печени. При посеве инвазированной крови или пунктата на специальные среды (NNN-агар) или выращивании в культуре ткани могут быть получены жгутиковые формы лейшманий.
Профилактика и меры борьбы предусматривают активное выявление больных и своевременное их лечение; обязательное лечение лиц с посткалаазарным кожным лейшманоидом; борьбу с москитами: уничтожение мест их выплода в населенных пунктах и их окрестностях; поддержание должного санитарного порядка на территории населенных пунктов; обработку помещений эффективными инсектицидами; применение защитных пологов и сеток, обработанных инсектицидами.
Генетика кала-азара. Кала-азар обнаруживают в определенных семьях и этнических группах, что предполагает наличие наследственного компонента этого заболевания. Основной генетический локус, отвечающий за калаазар, пока не идентифицирован. Тестирование кандидатных генов выявило сцепление с полиморфизмом белка-1, ассоциированного с природной устойчивостью (natural resistance-associated macrophage protein-1, NRAMP1) макрофагов (в хромосомном сегменте 2q35). Среди 169 пораженных детей из 63 семей эфиопско-суданской популяции был проведен анализ геномного сцепления, который выявил локус в хромосомной области 2q22-q23, контролирующий чувствительность к кала-азару. Полиморфизм в гене IL4, как было обнаружено, влияет на чувствительность к кала-азару в суданских семьях, и полиморфизм по гену IFNGR1 был специфически связан с чувствительностью к так называемому дермальному лейшманиозу, возникающему после кала-азара.
2.1.2.2. Отряд Trichomonadida
Из многих видов рода Trichomonas паразитами человека являются Т. hominis (трихомонада кишечная), трихомонада ротовая Т. tenax (Т. elongata) и Т. vaginalis (трихомонада мочеполовая). Все указанные виды трихомонад существуют только в стадии трофозоита и морфологически сходны. Самой крупной из них является трихомонада мочеполовая. Размеры паразита 14- 30 мкм, на переднем конце имеются 5 жгутиков и ундулирующая мембрана, доходящая только до середины тела. Как влагалищные паразиты Т. vaginalis впервые были выделены Доннэ в 1837 г.
Трихомонада урогенитальная [Trichomonas vaginalis (urogenitalis)]. Возбудитель мочеполового трихомоноза (трихомониаза). Т. vaginalis имеет эллипсовидное, ововидное или сфероподобное тело длиной 7,1 (4-13) мкм, шириной 4,7 (2-9) мкм с 5 жгутиками, по краю тела располагается ундулирующая мембрана, доходящая примерно до его половины. Ядро одно, расположено в передней части тела. Под влиянием окружающей среды или после этиотропной терапии может сформироваться псевдоциста округлой
формы, но истинной цистной стенки не имеется. После лечения эти формы обычно неподвижны или малоподвижны, лишены жгутиков и ундулирующей мембраны, что в значительной степени может затруднять диагностику. Размножается паразит простым делением.
Биология развития. Заражение происходит при половом контакте с больным трихомонозом человеком или носителем трихомонад. Пропагативной стадией (стадией распространения) является трофозоит, поскольку трихомонады не образуют цист. Дети иногда заражаются от матери во время родов или через руки, белье и во время туалета половых органов.
Эпидемиология. Трихомонада мочеполовая передается при половом контакте. Хотя возбудитель сохраняет жизнеспособность в течение 24 ч в моче, сперме, а также в воде и может выживать в течение нескольких часов во влажном чистом белье, передача инвазии бытовым путем происходит редко. Примерно 5 % детей, родившихся от инфицированных матерей, заражаются трихомонозом. Мочеполовая трихомонада распространена повсеместно. По оценкам, ежегодно инфицируются около 3 млн женщин в США и 180 млн - в мире. Статистика РФ дает аналогичные сведения. Среди взрослых девственниц зарегистрирована нулевая заболеваемость; она достигает 70 % среди проституток, лиц с другими венерическими болезнями и половых партнеров инфицированных больных. Хотя чаще заболевают женщины в возрасте от 16 до 35 лет, отмечаются случаи трихомоноза в возрастных группах 30-40 и 40-50 лет.
Патогенез. Долгое время считалось, что Т. vaginalis является комменсалом мочеполовых органов человека. Основанием для подобной точки зрения было наблюдение, которое свидетельствовало, что у мужчин заболевание довольно часто протекает торпидно, бессимптомно. Между тем сейчас установлено, что у мужчин трихомоноз встречается не реже, чем у женщин, и обусловливает развитие воспалительного процесса в уретре, предстательной железе и других органах.
Трихомонады, попадая в уретру и цервикальный канал, постепенно распространяются по поверхности слизистых оболочек, затем проникают в субэпителиальную соединительную ткань, что приводит к развитию воспалительного процесса. Фермент гиалуронидаза, вырабатываемый Т. vaginalis, способствует разрыхлению тканей и попаданию в них метаболитов бактерий сопутствующей флоры.
Было также установлено, что Т. vaginalis способны фагоцитировать гонококки, хламидии и другие микроорганизмы, которые могут сохранять жизнеспособность, становясь недоступными для антибиотиков. В связи с этим при лизисе трихомонад под действием антипротозойных препаратов фагоцитированные микроорганизмы высвобождаются из паразитарных клеток, что может способствовать поддержанию хронического воспалительного процесса в урогенитальных органах.
Клинические проявления. Длительность инкубационного периода трихомоноза составляет от 3 дней до 3-4 нед (у большинства больных не более 1 нед). Первыми признаками заболевания при остром трихомонадном поражении влагалища являются обильные, жидкие, часто пенистые, желтоватые выделения с примесью крови, которые нередко имеют неприятный запах. Больные жалуются на боли в области наружных половых органов и влагалища, зуд и ощущение жжения. При гинекологическом осмотре можно обнаружить гиперемию влагалища и шейки матки, опрелость или петехии в промежности. Скопления в заднем своде влагалища жидких, серовато-желтых выделений на фоне кровоточивости слизистой оболочки часто называют «клубничной маткой».
Иногда появляются боли внизу живота, в области поясницы, при мочеиспускании и половом контакте. В отдельных случаях на слизистой оболочке половых губ обнаруживают множественные болезненные поверхностные язвы.
В воспалительный процесс вовлекаются преддверие влагалища и само влагалище, уретра, парауретральные протоки, шейка матки, матка и ее придатки, большие вестибулярные железы, мочевой пузырь, почечная лоханка.
У мужчин поражаются предстательная железа и мочеиспускательный канал. Чаще всего болезнь протекает бессимптомно, однако может иметь картину персистирующего или рецидивирующего неспецифического уретрита. Примерно в 5 % случаев трихомонады вызывают негонококковый уретрит у мужчин.
Диагностика. Диагноз устанавливают только при обнаружении трихомонад путем лабораторного исследования. Основной метод - паразитологический, предусматривающий микроскопическое исследование мазков, окрашенных по методу Папаниколау. Материалом для исследования служат отделяемое из уретры, цервикального канала, влагалища, секрет простаты, сперма, содержимое парауретральных ходов, бартолиновой и скиновой желез, моча. Используют также иммунологические методы для выявления специфических антител и ПЦР.
Профилактика включает выявление и лечение больных и их постоянных половых партнеров, использование презервативов.
Трихомонада кишечная (Trichomonas hominis). Возбудитель кишечного трихомоноза. T. hominis - условно-патогенные жгутиковые формы длиной от 8-9 мкм, шириной 5 мкм. Их движение чрезвычайно энергичное, толчкообразное, поступательное и вращательное вокруг продольной оси тела за счет пучка жгутиков. Этот паразит также существует только в вегетативной форме и локализуется в толстой кишке человека.
Клинические проявления. Размножение кишечных трихомонад усиливается при пищевом рационе, богатом клетчаткой и другими углеводами, а также при различных заболеваниях, сопровождающихся разжижением содержимого толстой кишки. Под действием ряда факторов кишечные трихомонады могут приобретать патогенные свойства и вызывать поражения кишечника в виде колита и энтерита. Число дефекаций в виде диареи достигает 8 раз всутки. Фекалии жидкие, водянистые или кашицеобразные, часто с примесью слизи, но без крови.
Усиленное размножение трихомонад в изъязвлениях кишечной стенки, обусловленных дизентерийной амебой или патогенными бактериями, замедляет их заживление. Трихомонады обнаруживали и в других органах.
Диагностика. Диагноз устанавливают только при обнаружении трихомонад путем лабораторного исследования. Основной метод - паразитологический, предусматривающий микроскопическое исследование нативных мазков свежевыделенных фекалий и мазков со слизистой оболочки прямой кишки, содержимого печеночных абсцессов, окрашенных по Гейденгайну. В кале больного обычно содержится большое количество трихомонад.
Дополнительный метод - культуральный (посев фекалий больного на среду Павловой, Трассела-Джонсона).
Профилактика включает соблюдение правил личной гигиены, защиту воды и почвы от загрязнения фекалиями и др.
Трихомонада ротовая (легочная) [Trichomonas tenax (elongata)]. Возбудитель ротового трихомоноза. Т. tenax (elongata) морфологически напоминает Т. vaginalis. Это довольно мелкий жгутиконосец длиной 4-13 мкм, шириной 2-9 мкм. Подобно E. gingivalis этого паразита обнаруживали в гнойных выделениях из миндалин и в тонзиллярных криптах.
Из ротовой полости трихомонады нередко проникают в лакуны небных миндалин, где их выявляют в больших количествах при хронических тонзиллитах. Их часто обнаруживают при остеомиелитах челюстей и гайморитах, а при гастритах и раке желудка они встречаются в желудочном содержимом. При заболевании легких ротовую трихомонаду можно обнаружить в мокроте 17-20 % больных.
Единственным источником распространения T. tenax является человек.
Диагностика. Диагноз устанавливают только при обнаружении трихомонад путем лабораторного исследования.
Паразитологический метод предусматривает микроскопическое исследование постоянных окрашенных препаратов мазков со слизистой оболочки зева, соскобов с десен, мокроты и др.
При культуральном методе производят посев на среду Симича и др.
Профилактика включает тщательный уход за зубами и ротовой полостью, соблюдение общих правил личной гигиены при питании и питье воды. Необходимо выявлять больных среди работников детских учреждений, в сфере общественного питания и направлять их на лечение.
2.1.2.3. Отряд Diplomonadida
Простейшие этого отряда обладают двойным набором всех органоидов и характеризуются билатеральной симметрией.
Они имеют 2 ядра, некоторые свободноживущие - 2 цитостома. Происхождение этих жгутиконосцев, видимо, связано с не доведенным до конца продольным делением.
Из числа паразитических дипломонад наибольший интерес представляет род Lamblia. Известно около 40 видов лямблий - паразитов млекопитающих: собак, кошек, волков, белок, мышей и др., включая человека. Лямблии имеют характерную грушевидную форму с расширенным передним и суженным задним концом. Спинная сторона тела выпуклая, на брюшинной стороне отчетливо видна впадина - присасывательный диск, ограниченный опорными фибриллами. Это органоид прикрепления к поверхности кишечника.
Лямблия кишечная (Lamblia intestinalis) - возбудитель лямблиоза.
Этиология. Лямблии (L. intestinalis) - представители одной из ранних ветвей филогенетического дерева эукариотов, но имеют особенности, свойственные прокариотам (отсутствие митохондрий, интронов в генах и др.).
Этот возбудитель впервые был обнаружен в фекалиях человека, больного диареей, и описан Антони ван Левенгуком в 1684 г.; в 1859 г. его подробно описал Д. Ф. Лямбль, который наблюдал этого представителя жгутиковых простейших в фекалиях детей с диареей в клинике Праги.
Лямблия по форме напоминает грушу, разрезанную пополам, имеет тело длиной 10-18 мкм, 2 ядра и 4 пары жгутиков. По средней линии вдоль всего тела проходят два тонких аксостиля. В расширенной части тела расположены два присасывательных диска, с помощью которых паразит прикрепляется к ворсинкам кишечника. Питаются лямблии веществами с поверхности клеток кишечного эпителия. Лямблии обитают в тонкой кишке, иногда проникают в желудок и желчный пузырь.
Биологияразвития (рис. 2.21). Существуют вегетативные формы лямблий и цисты, которые из них образуются. Из одной цисты при заглатывании ее новым хозяином образуется 2 трофозоита. Вегетативная форма имеет длину 10-18 мкм, ширину 8-10 мкм. Дорсальная сторона тела выпуклая, вентральная уплощена, и на передней расширенной стороне имеются присасы-
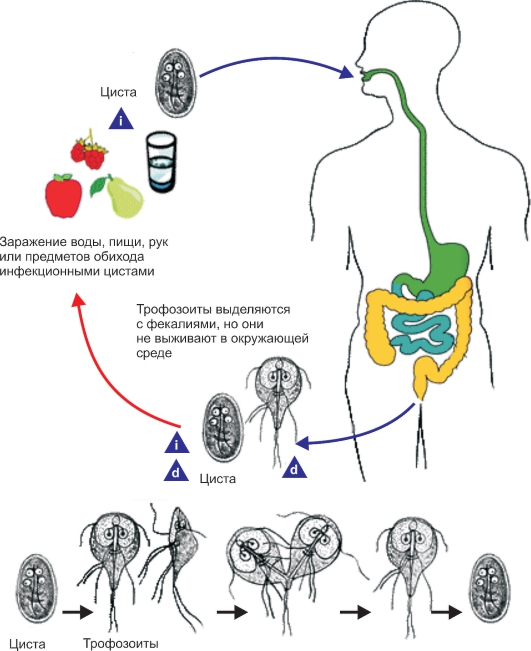
Рис. 2.21. Жизненный цикл Lamblia intestinalis. i - инфекционная стадия; d - диагностическая стадия.
вательные диски. Захватывая с помощью диска микроворсинки щеточной каемки, лямблия удерживается на поверхности слизистой оболочки. Она «откачивает» раствор питательных веществ из промежутков между ворсинками. У человека максимум численности лямблий приходится на верхние 2,5 м тонкой кишки. Здесь же наиболее высока интенсивность контактного пищеварения и всасывается большая часть углеводов, белков, жиров, витами-
нов, минеральных солей и микроэлементов. Лямблии способны поглощать питательные вещества и различные ферменты непосредственно из щеточной каемки, а следовательно, вмешиваться в процесс мембранного пищеварения и нарушать его. В более поздние периоды лямблии перемещаются из проксимальных в средние или дистальные отделы тонкой кишки.
Большинство исследователей отрицают возможность паразитирования лямблий в желчных путях, желчном пузыре. Концентрированная желчь оказывает губительное действие не только на лямблий, но и на другие простейшие.
Образование цист происходит в дистальном отделе тонкой кишки и в ободочной кишке и длится 12-14 ч. Здесь под влиянием неблагоприятных для них условий лямблии инцистируются. Вначале они теряют подвижность, на поверхности их тела появляются псевдоподиеобразные выпячивания цитоплазмы, жгутики отбрасываются. Тело приобретает овальную форму, происходит деление ядер. Цисты, покрытые плотной оболочкой, имеют округлую или овальную форму. На переднем конце видны 4 ядра, тесно прилегающие друг к другу, аксонемы и серповидно изогнутые фибриллы, длина которых 8-12 мкм, ширина 7-10 мкм. Как правило, из кишечника хозяина наружу выходят только цисты. Вегетативные стадии могут попадать во внешнюю среду лишь при очень сильных кишечных расстройствах.
Размножение лямблий происходит путем продольного деления. Сначала делятся ядра, потом присасывательный диск и кинетосомы. У дочерних особей жгутики формируются заново. Цитокинез начинается с расширенного переднего конца тела.
Эпидемиология. Лямблиоз распространен во всем мире. В большинстве стран, в том числе в России, случаи лямблиоза (жиардиаза) подлежат обязательной регистрации и статистическому учету. Во всем мире клинические формы лямблиоза обнаруживают примерно у 500 тыс. больных в год. В Российской Федерации ежегодно регистрируют более 100 тыс. больных, из них до 90 тыс. детей.
Лямблиоз относится к контагиозным протозоозам. Факторами передачи возбудителя являются грязные руки, вода, пища, содержащие цисты лямблий. Насекомые (мухи, тараканы, мучные хрущаки, навозные жуки) также могут способствовать распространению цист лямблий. Механизм передачи инвазии гео-оральный. Заражающая доза составляет 10-100 цист.
Период выделения цист у человека начинается в среднем на 9-12-е сутки после заражения и может длиться многие месяцы. Возможно бессимптомное носительство.
Частота лямблиоза у детей в возрасте до 9 лет в 2-3 раза превышает таковую у взрослых. Дети начинают заражаться с 3-месячного возраста.
Патогенез. Лямблии размножаются в кишечнике человека в огромных количествах, что не может быть безразличным для организма хозяина. В течение жизни они многократно прикрепляются к стенке кишки и открепляются от нее, что вызывает механическое раздражение, а также воздействует на нервные окончания стенки кишки и может привести к патологическим рефлекторным реакциям со стороны органов пищеварения. Происходят усиление митотических процессов и частая смена эпителия с заменой зрелых и функционально полноценных клеток молодыми, функционально незрелыми. Это приводит к нарушению всасывания пищевых веществ, в первую очередь жиров и жирорастворимых витаминов, а также углеводов и белков.
Длительное паразитирование лямблий в организме человека вызывает нарушение функций печени и кишечника.
Клинические проявления. Острый период лямблиоза характеризуется диареей, тошнотой, анорексией, резкими болями в эпигастрии и мезогастрии,
вздутием кишечника. Часты жалобы на головные боли, уменьшение массы тела, повышенную утомляемость.
Диагностика. Диагноз устанавливают путем микроскопического исследования фекалий и дуоденального содержимого. В дуоденальном соке обнаруживают вегетативные формы. В плотных оформленных фекалиях обнаруживают только цисты, а в жидких наряду с цистами можно найти и вегетативные формы.
Профилактика. Основными мерами профилактики лямблиоза являются предотвращение фекального загрязнения внешней среды, продуктов питания, воды, соблюдение правил личной гигиены, уничтожение механических переносчиков (мух и тараканов).
2.2. Тип Apicomplexa
Род Toxoplasma. Этот род представлен одним видом - T. gondii.
Токсоплазма (Toxoplasma gondii). T. gondii вызывает токсоплазмоз - широко распространенное заболевание. Заражение человека в основном происходит алиментарным путем при употреблении пищи, зараженной токсоплазмами, или при контакте с инфицированными кошками.
Биология развития (рис. 2.22). Возбудитель токсоплазмоза - облигатный внутриклеточный паразит. Доказана возможность внутриядерного паразитизма токсоплазмы. Она была обнаружена в 1908 г. независимо друг от друга Ш. Николем и А. Мансо в Тунисе у грызунов гонди и А. Сплендоре в Бразилии у кроликов. Родовое обозначение токсоплазмы отражает полулунную форму бесполой стадии паразита (греч. toxon - лук с натянутой тетевой, plasma - форма), видовое - название грызунов гонди.
С общебиологической точки зрения T. gondii характеризуется признаками, позволяющими рассматривать ее как паразита с очень глубокими приспособлениями. Он обнаружен на всех континентах и на всех географических широтах, может паразитировать и размножаться в сотнях видов млекопитающих и птиц, поражать самые разнообразные ткани и клетки хозяев.
В 1965 г. Хатчисон впервые экспериментально доказал, что в передачу T. gondii вовлечены кошки. В 1970 г. ученые Англии, Дании и США почти одновременно и независимо друг от друга обнаружили в фекалиях токсоплазмозных кошек ооцисты, очень похожие на таковые у кокцидий. Тем самым была доказана принадлежность токсоплазмы к кокцидиям, и вскоре был точно определен жизненный цикл паразита, состоящий из двух фаз: кишечной и внекишечной, или тканевой.
Кишечная фаза жизненного цикла токсоплазмы включает развитие в клетках слизистой оболочки кишечника окончательных хозяев, которыми являются домашняя кошка и другие представители кошачьих (дикая кошка, рысь, бенгальский тигр, оцелот, снежный барс, ягуарунди, эйр).
Полный цикл развития T. gondii может проходить только в организме представителей семейства кошачьих. Жизненный цикл токсоплазмы включает 4 основных этапа развития: шизогонию, эндодиогению (внутреннее почкование), гаметогонию, спорогонию. Все они проходят в разной экологической среде: шизогония, гаметогония и начало спорогинии протекают только в кишечнике представителей кошачьих (окончательные хозяева токсоплазмы), спорогония завершается во внешней среде, а эндодиогения проходит в клетках тканей промежуточного хозяина (в том числе человека) и в клетках основных хозяев - кошачьих.
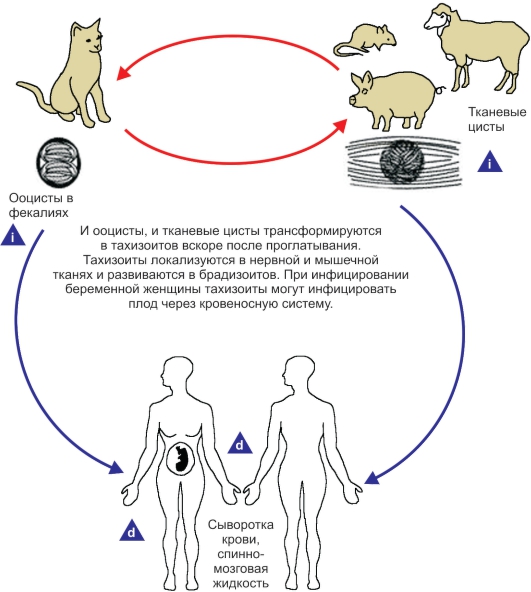
Рис. 2.22. Жизненный цикл Toxoplasma gondii.
i - инвазионная стадия; d - диагностическая стадия: 1) серологический метод диагностики или 2) прямое обнаружение паразита в периферической крови, амниотической жидкости или тканях.
Кишечная фаза развития токсоплазмы в организме окончательного хозяина. Кишечная стадия развития начинается при заражении (пероральном) кошачьих - основных хозяев паразита - как ооцистами со спорозоитами, так и вегетативными стадиями - эндозоитами и цистозоитами, заглатываемыми с тканями промежуточных хозяев. Цистозоиты попадают в кишечник в тканевых цистах, оболочка которых под действием протеолитических ферментов быстро разрушается. Эндозоиты и освободившиеся от оболочки цистозоиты проникают в клетки слизистой оболочки кишечника и путем бесполого размножения - эндодиогении и шизогонии - интенсивно размножаются.
Рис. 2.23. Ультраструктура оокинеты токсоплазмы и малярийного плазмодия.
п - проток роптрий; пм - поверхностная мембрана; пк - полярное кольцо; в - воротник; к - кольцо; мт - микротрубочки; р - роптрии.
Примерно через 2 сут в результате многократно повторяющихся циклов бесполого размножения (шизогонии) образуется особый тип шизонтов (мерозоиты), которые дают начало следующей стадии развития паразита - гаметогонии.
При попадании в кишечник кошки зрелых ооцист токсоплазмы, освободившихся от оболочек, спорозоиты проникают в клетки реснитчатого эпителия кишечника и также начинают размножаться путем шизогонии. В результате бесполого размножения из одного шизонта образуется от 4 до 30 мерозоитов.
Развитие микрогаметоцитов сопровождается рядом последовательных делений яйца. Развитие макрогаметоцита происходит без деления ядра. Оплодотворение, т. е. слияние макро- и микрогамет, происходит в клетке эпителия, в результате чего образуется зигота, которая формирует плотную оболочку и превращается в оокинету (рис. 2.23), а затем в ооцисту. Ооцисты имеют оваль-
ную форму и диаметр от 9-11 до 10-14 мкм. Некоторое время ооцисты остаются в клетках эпителия, но затем выпадают в просвет кишечника, и токсоплазма вступает в следующий этап развития - спорогонию, которая продолжается в фекалиях и во внешней среде.
При достаточных влажности, температуре и доступе кислорода через несколько дней внутри ооцисты формируются две спороцисты с четырьмя банановидными спорозоитами в каждой.
Внекишечная (тканевая) фаза развития токсоплазмы в организме промежуточных хозяев. В клетках различных тканей промежуточных хозяев, в том числе человека, происходит бесполое размножение токсоплазм путем эндодиогении, т. е. образования двух дочерних клеток внутри материнской. В 1969-1970 гг. выявлен способ множественного внутреннего почкования, для которого предложен термин «эндополигения». Бесполое размножение этими двумя способами наряду с шизогонией было обнаружено также в кишечнике основного хозяина паразита - кошки.
Тканевая фаза развития токсоплазмы начинается при попадании в кишечник животных и человека (промежуточных хозяев) либо половых стадий паразита - ооцист со спорозоитами, либо бесполых стадий (эндозоитов и цистозоитов) с тканями инвазированных животных. В тонком отделе кишечника под влиянием протеолитических ферментов высвободившиеся из ооцист спорозоиты либо высвободившиеся из цист цистозоиты или эндозоиты проникают в эпителиальные клетки слизистой оболочки кишечника, где начинается их бесполое размножение - эндодиогения и эндополигения.
В результате размножения развиваются эндозоиты. Через 2-10 ч после внедрения в клетку спорозоита (эндозоита) из разрушенной клетки хозяина
выходит 12-24-32 дочерних эндозоита. Вновь образовавшиеся эндозоиты активно внедряются в соседние клетки.
Постепенно вокруг скоплений эндозоитов образуется истинная паразитарная оболочка, и токсоплазма переходит в новую стадию - истинную тканевую цисту. В образование сложной оболочки цисты вовлечены сами паразиты, и это наблюдается при хроническом токсоплазмозе. Такие оболочки непроницаемы для антител и обеспечивают жизнеспособность паразита в течение многих лет, а иногда и пожизненно. Цисты, как правило, находятся внутри клетки, хотя доказана и внеклеточная их локализация. Диаметр цист составляет от 50-70 до 100-200 мкм. С формированием цисты эндозоиты в ней превращаются в новую стадию - цистозоиты. В зрелой цисте может присутствовать несколько тысяч цистозоитов.
Биологическое назначение тканевых цист очень велико. Прежде всего цисты обеспечивают выживание паразита в иммунном организме и тем самым повышают вероятность заражения токсоплазмозом как окончательного, так и новых особей промежуточных хозяев. Образование цистной стадии является важным этапом в жизненном цикле токсоплазмы, так как цистозоиты значительно устойчивее к внешним факторам, чем эндозоиты.
Таким образом, из описания жизненного цикла токсоплазмы следует, что промежуточные хозяева (дикие и сельскохозяйственные животные, а также человек) являются носителями вегетативных (тканевых) стадий паразита, т. е. эндозоитов в цистах. Именно с ними при диагностике токсоплазмоза приходится иметь дело врачам, ветеринарам и паразитологам.
Первично токсоплазма - паразит кошачьих, в организме которых она способна без участия других хозяев завершить как кишечную, так и внекишечную (тканевую) фазы развития. Тем самым кошачьи могут одновременно выполнять функции промежуточных и окончательных хозяев. Между тем токсоплазма - не моноксенный паразит. В его жизненный цикл вовлечены промежуточные хозяева, хотя их участие и необязательно; поэтому для токсоплазмы характерна факультативная гетерогенность, причем эндозоитами и цистозоитами - стадиями из промежуточных хозяев - могут заражаться не только окончательные хозяева, но и новые промежуточные хозяева (плотоядные животные и человек). В данном случае имеет место своего рода пассирование или перевивка без участия окончательного хозяина и без выхода токсоплазмы во внешнюю среду.
У многих животных (мыши, крысы, морские свинки, хомяки, кролики, собаки, овцы, свиньи) и человека отмечена трансплацентарная передача возбудителя в стадии эндозоита, что свидетельствует о существовании врожденного токсоплазмоза.
Эпидемиология. Токсоплазмоз - первично природно-очаговая инвазия, т. е. зооноз диких животных [Засухин Д. Н., 1952; Jirovec, 1952]. В настоящее время, однако, токсоплазмоз с эпидемиологической точки зрения следует расценивать как зооноз сельскохозяйственных и домашних животных. Человек вовлекается в циркуляцию возбудителя, как правило, в населенном пункте, т. е. в синантропном очаге токсоплазмоза. Есть основания считать, что наиболее распространенным фактором передачи возбудителя человеку является мясо инвазированных сельскохозяйственных животных. Гео-оральный механизм передачи инвазии человеку реализуется, по-видимому, гораздо реже, однако это не должно преуменьшать эпидемиологическую значимость кошек.
Клинические проявления. В соответствии с Международной статистической классификацией болезней и проблем, связанных со здоровьем, принятой ВОЗ в 1998 г., выделяют следующие нозологические формы: токсоплазмоз с вовлечением глаз, токсоплазмоз с гепатитом, токсоплазмоз с менин-
гоэнцефалитом, токсоплазмоз с пневмонией, пневмонитом, токсоплазмоз с вовлечением других органов, миокардит при токсоплазмозе и миозит при токсоплазмозе, а также врожденный токсоплазмоз.
Токсоплазмоз с вовлечением глаз протекает по типу катаракты. Он может также сочетаться с поражением ЦНС и сердца. Поражение глаз носит хронический характер с рецидивами, постепенно развиваются очаги пигментной дегенерации, атрофические очаги на сетчатке глаза, атрофия диска зрительного нерва, приводящие к прогрессирующему ухудшению зрения и слепоте.
Токсоплазмоз с гепатитом характеризуется увеличением печени (основной симптом), которая при пальпации может быть болезненной, однако значительных нарушений функции печени, как правило, не наблюдается. Нередко регистрируют и увеличение селезенки.
Токсоплазмоз с менингоэнцефалитом проявляется симптомами общей интоксикации, высокой температурой тела, сильной головной болью, нарушением сознания, судорогами. Важное диагностическое значение имеет исследование ликвора, в котором можно обнаружить токсоплазмы.
Токсоплазмоз с пневмонией, пневмонитом обычно развивается в острой стадии заболевания при генерализации инфекции. Пневмония при этом чаще всего двусторонняя, интерстициальная, характеризуется затяжным течением. После угасания острого процесса в легких остаются мелкие рассеянные кальцификаты.
Миокардит при токсоплазмозе диагностируют, когда доминирующим симптомом заболевания является поражение сердца. Между тем следует подчеркнуть, что клиническая картина существенно не отличается от картины миокардитов другой этиологии.
Миозит при токсоплазмозе характеризуется болями в мышцах. При рентгенологическом обследовании в них обнаруживают кальцификаты.
По характеру течения инфекции выделяют острую, хроническую и латентную формы. При острой форме после продромального периода (до 2 нед), во время которого отмечают слабость, повышенную утомляемость, мышечные боли, наиболее характерным симптомом является увеличение лимфатических узлов (в шейной, затылочной, подчелюстной и подмышечной областях), возможно повышение температуры тела. Могут наблюдаться образование кальцификатов, увеличение печени и селезенки, миокардиты и пневмонии, а также тяжелые поражения ЦНС (энцефалит, менингоэнцефалит). Инкубационный период длится от 3 до 14 дней. Лечение токсоплазмоза в острой форме наиболее эффективно.
Хроническая форма токсоплазмоза чаще всего протекает бессимптомно, но возможны слабость и быстрая утомляемость, иногда головные боли, а также субфебрильная температура.
Для хронического приобретенного токсоплазмоза характерно длительное течение с периодическими обострениями. Заболевание протекает нетяжело, за исключением нейротоксоплазмоза. Лечение хронического токсоплазмоза целесообразно проводить в периоды обострения.
При латентной форме инфекция протекает скрытно, без клинических симптомов.
Врожденный токсоплазмоз. Трансплацентарное заражение плода происходит только при свежем инфицировании матери во время беременности. Врожденный токсоплазмоз может иметь острое течение и затем переходить в хроническую или латентную форму. Острая форма крайне тяжелая (судороги, параличи, тяжелые поражения мозга), характеризуется высокой летальностью, в том числе внутриутробной (самопроизвольный выкидыш, мертворождение).
Хроническая форма врожденного токсоплазмоза характеризуется волнообразной лихорадкой с прогрессирующим поражением ЦНС (гидроцефалия, эпилепсия и др.), глаз (хориоретинит) и других органов (резидуальный врожденный токсоплазмоз). Клиническая картина врожденного токсоплазмоза зависит от сроков беременности на момент заражения и массивности инвазии. Возможно и латентное течение врожденного токсоплазмоза без клинических проявлений.
Токсоплазмоз и беременность. Актуальность проблемы токсоплазмоза обусловливают серьезные последствия первичного заражения женщин в период органогенеза, в ранние сроки беременности (гибель плода, уродства и т. д.). Все женщины, планирующие беременность, и беременные (желательно в ранние сроки) должны быть обследованы на наличие в сыворотке крови антител к токсоплазме.
Лабораторная диагностика заболевания, перенесенного в прошлом, или обнаружение острой инфекции T. gondii у беременной женщины предусматривает применение серологических методов. Сероконверсию обычно оценивают путем определения IgG или к антигенам токсоплазмы в парных сыворотках, взятых с интервалом 2-3 нед.
Токсоплазмоз у детей. Внутриутробный токсоплазмоз является результатом первичной инфекции у матери, протекающей с клиническими симптомами или бессимптомно. Признаки внутриутробного токсоплазмоза у новорожденных при первичном заражении во второй половине беременности, проявляющиеся в первые месяцы жизни, чаще всего неврологические. Появление последствий или рецидив возможны в более поздние сроки развития ребенка (хориоретиниты, ретинопатия недоношенных или субклиническая симптоматика).
Пути заражения. Основной путь - пероральный. Человек заражается ооцистами при употреблении овощей, ягод, сырой воды, при контакте с кошками и почвой, цистами либо тахизоитами - при употреблении непрожаренного мяса и сырого молока.
При контактном пути заражение происходит через слизистые оболочки и поврежденную кожу; такой путь возможен при тесном контакте с больными животными.
Трансплацентарный (конгенитальный) путь предполагает внутриутробное заражение плода через плаценту. Источником инфекции является беременная женщина со свежей инфекцией, когда имеет место паразитемия и токсоплазмы через плаценту, где формируется первичный очаг, гематогенным путем попадают в плод.
Трансплантационный путь заражения реализуется при пересадке органов от донора с токсоплазмозом. Также доказана передача возбудителя при переливании крови или лейкоцитной массы.
Заболеваемость населения токсоплазмозом в различных странах часто зависит от степени употребления полусырых мясных блюд, предусмотренных кулинарной практикой (до 90 % во Франции, 45-80 % в Голландии, 18-20 % в США).
Диагностика включает применение паразитологических и иммунологических методов. Для обнаружения токсоплазм проводят микроскопические исследования, реакцию прямой иммунофлюоресценции и биопробы на белых мышах. Разработаны метод иммуноблоттинга с IgМ, IgG, IgA для выявления белков возбудителя и полимеразная цепная реакция. Для диагностики внутриутробного токсоплазмоза используют методы кордоцентеза и амниоцентеза. Между тем эти методики имеют ограниченное применение в практической медицине, поскольку требуют больших денежных затрат, специальных оборудования и подготовки персонала.
В подавляющем большинстве случаев прибегают к серологическим тестам. Серодиагностика токсоплазмоза основана на обнаружении Ig классов G,
М, А, Е.
Профилактика. Теоретически наиболее радикальные пути профилактики токсоплазмоза человека - элиминация и надежная санация окончательных хозяев паразита, т. е. кошек. В этом смысле профилактика токсоплазмоза близка к профилактике бешенства. Нет сомнения в том, что полное уничтожение беспризорных кошек и надежный ветеринарный надзор за домашними кошками - залог если не полного оздоровления синантропных очагов токсоплазмоза, то во всяком случае - снижения пораженности населения в них в десятки и тысячи раз.
Род Plasmodium. Малярийные плазмодии вызывают малярию - острое протозойное заболевание человека с трансмиссивным механизмом заражения, характеризующееся выраженными симптомами интоксикации, циклическим течением с чередованием приступов лихорадки и периодов апирексии, увеличением селезенки и печени, развитием гемолитической анемии при прогредиентном течении, рецидивами.
Историческая справка. Изучение малярии (одной из древнейших болезней человека) неразрывно связано с историей развития человеческой цивилизации. Предполагается, что малярия стала распространяться на Земле (из Африканского региона Средиземноморья) около 10 000 лет назад в связи с интенсивным развитием земледелия, торговли, освоением новых земель. В старинных египетских папирусах, древней китайской литературе и канонах (Charaka и Sushrutha) классической древнеиндийской медицины (Ayurveda) до нашего времени сохранились описания клинической картины и эпидемий малярии, и уже тогда высказывались предположения о возможной связи болезни с укусами комаров. Позже (VI-V вв. до н. э.) врачи Древней Греции Гиппократ и Эмпедокл подробно описали клинику малярии. Гиппократу принадлежит заслуга в том, что он выделил малярию из группы лихорадочных заболеваний и предложил различать 3 формы болезни: «quotidian» (ежедневные приступы), «tertian» (приступы через день) и «quartan» (приступы через 2 дня).
Эпоха научных открытий в изучении малярии началась в 1640 г., когда испанский врач-конкистадор Хуан дель Вего впервые для лечения больных малярией использовал настой коры хинного дерева, ранее использовавшийся индейцами Перу и Эквадора как противолихорадочное средство. Своим названием малярия обязана итальянскому естествоиспытателю Д. Ланчизи (1717), который связывал заражение людей с «ядовитыми» испарениями болот (итал. mal aria - дурной воздух). В 1880 г. французский врач A. Лаверан, работая в Алжире, подробно описал морфологию возбудителя малярии. В 1897 г. английским военным врачом Р. Россом в Индии был установлен трансмиссивный механизм передачи малярии.
В настоящее время малярия является одной из серьезнейших проблем здравоохранения для более 100 стран Африки, Азии и Южной Америки, около половины населения Земли живут в условиях риска заражения малярией. Практически во всех странах Европы и Северной Америки ежегодно регистрируют сотни завозных случаев малярии среди людей, прибывших из регионов ее распространения; растет число случаев так называемой «аэропортной» малярии. По данным ВОЗ, ежегодно в мире малярией заболевают 200-250 млн человек, не менее 80 % всех случаев малярии регистрируют в странах Африки, расположенных к югу от Сахары. Каждый год от малярии умирают от 1 до 2 млн человек, в основном детей в возрасте до 5 лет. Социальные и экономические потери только в Африке оценивают в 2 млрд долл. США в год. С 1998 г. под эгидой ВОЗ, Всемирного банка и
ЮНИСЕФ реализуется научнопрактическая программа (Roll Back Malaria Initiative) по контролю за малярией (в основном в развивающихся странах). Программа рассчитана до 2010-2015 гг. Активно ведутся разработки по созданию эффективной противомалярийной вакцины, однако для этого потребуется как минимум еще 10-15 лет. Поиск, разработка и совершенствование препаратов для лечения малярии являются одними из приоритетных направлений деятельности ВОЗ, различных фармацевтических компаний, научно-исследовательских институтов во всем мире. В последние годы в России в результате роста миграционных процессов, интенсивного развития международного туризма отмечено увеличение числа завозных случаев малярии.
Этиология. Название болезни «малярия» фактически обобщает четыре отдельных протозойных заболевания, вызываемых соответственно четырьмя видами возбудителей. Возбудители малярии относятся к подцарству Protozoa, типу Apicomplexa, роду Plasmodium, который подразделяется на два подрода: Plasmodium и Laverania (табл. 2.3).
Для каждой из четырех форм малярии характерны свои клинические, патогенетические и эпидемиологические особенности. Важнейшее место занимает малярия falciparum, возбудитель которой относится к особому подроду (Laverania). Только малярия falciparum может протекать злокачественно, приводя к летальному исходу, на ее долю приходится 80-90 % от всех случаев малярии в мире.
Эпидемиология. При малярии возможны различные механизмы передачи инфекции.
♦ Трансмиссивный механизм (при укусе комара). Этот механизм является основным, обеспечивающим существование плазмодиев как биологического вида. Источник инфекции - человек (больной малярией или паразитоноситель), в крови которого имеются зрелые гаметоциты (мужские и женские половые клетки паразита) (рис. 2.24). Переносчики малярии - только женские особи комаров рода Anopheles.
В желудке комара, куда вместе с кровью попадают мужские и женские гаметоциты, находящиеся внутри эритроцитов, происходит их дальнейшее созревание (после лизиса эритроцитов), слияние и многократное деление с образованием спорозоитов, которые накапливаются в слюнных железах комара. Бесполые формы паразита (трофозоиты, шизонты), попав в желудок комара, погибают.
Таким образом, в организме человека происходит бесполое развитие паразитов (шизогония) с образованием и накоплением гаметоцитов, в организме комара - половое развитие (спорогония), слияние мужских и женских гамет с дальнейшим развитием и образованием спорозоитов.
♦ Вертикальный механизм передачи (от матери плоду или от матери новорожденному, в процессе родов - парентеральный механизм). При вертикальной передаче плод редко заражается через плаценту. Чаще заражение происходит во время родов при попадании в кровоток новорожденного не-
Таблица 2.3. Возбудители и формы малярии
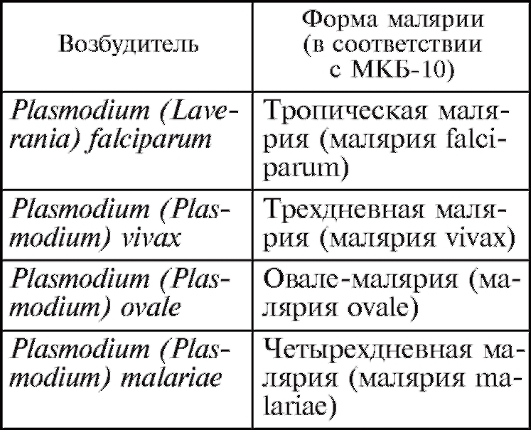
Рис. 2.24. Эритроциты, пораженные малярийным плазмодием.
которого количества материнской крови, в эритроцитах которой находятся бесполые формы паразита.
♦ Парентеральный механизм заражения приводит к развитию так называемой шизонтной малярии. Он наблюдается при гемотрансфузиях и реже при нарушениях асептики при инъекциях (например, среди наркоманов, использующих один шприц). В случае заражения при переливании крови источником инфекции является донор-паразитоноситель, часто имеющий субпатентную паразитемию (количество паразитов менее 5 в 1 мкл крови). В связи с этим в эндемичных по малярии регионах мира для контроля донорской крови необходимо использовать наряду с паразитологическими методами (определение паразита в препаратах толстой капли и мазках крови) и серологические (иммунологические) методы лабораторной диагностики малярии - реакцию непрямой иммунофлюоресценции (РНИФ), иммуноферментный анализ (ИФА) и др. Поскольку при парентеральном заражении обычно вводится небольшое количество паразитов (особенно при инъекциях), инкубационный период может длиться до 3 мес (при массивном заражении инкубационный период, наоборот, может быть и очень коротким - несколько дней), что важно знать при диагностике малярии у больных, перенесших хирургическую операцию, наркоманов.
Для распространения малярии в определенном регионе (стране, крае, области) необходимы следующие условия.
♦ Источник инфекции (больной малярией или паразитоноситель).
♦ Наличие эффективного переносчика (комары рода Anopheles). Восприимчивость к малярийным паразитам - главное качество конкретного вида комаров из этого рода. Численность комаров рода Anopheles среди популяций других видов не столь высока, как немалярийных комаров, и они в редких случаях серьезно беспокоят своими укусами. Между тем и малочисленные виды при прочих благоприятных условиях (близость мест вы-
плода комаров к жилищу людей) могут играть достаточно существенную роль. Более 70 видов комаров рода Anopheles (среди более 200 известных видов) могут служить эффективными переносчиками малярии.
♦ Благоприятные климатические условия (среднесуточная температура воздуха выше 16 оС и наличие мест для выплода комаров: водоемы, резервуары для воды, ирригационные сооружения и др.). Минимальная среднесуточная температура воздуха, необходимая для развития в организме комара P. vivax, - 16 оС, P. falciparum - 18 оС, при более низкой температуре спорогонии не происходит. Продолжительность спорогонии тем меньше, чем выше температура, но до определенного уровня, так как среднесуточная температура 30 оС и выше неблагоприятна для спорогонии. При оптимальной среднесуточной температуре (25-26 оС) спорогония P. vivax длится 8-9 дней, P. falciparum - 10-11 дней.
Весь ареал распространения малярии на земном шаре (от 45о с. ш. и 40о ю. ш. до 64о с. ш. и 45о ю. ш. в разные годы) занимает малярия vivax. Ареал малярии falciparum и малярии malariae несколько меньше вследствие необходимости в более высокой температуре для эффективной спорогонии, ареал малярии ovale расположен в двух не связанных территориально регионах - тропической Африке и государствах западной части Тихого океана (Индонезия, Вьетнам, Филиппины, Новая Гвинея и др.). В горных странах очаги малярии могут формироваться до высоты 1000 м в зоне умеренного климата и до 1500-2500 м в зоне субтропиков и тропиков, причем на больших высотах (1000-1500 м и выше) встречаются очаги только малярии vivax.
Малярия отличается выраженной сезонностью. В условиях умеренного и субтропического климата малярийный сезон делится на периоды эффективной заражаемости комаров, передачи инфекции и массовых проявлений заболевания. Начало периода эффективной заражаемости комаров (при наличии источников инфекции - больных, паразитоносителей) совпадает с моментом устойчивого повышения среднесуточной температуры до 16 оС. Начало периода передачи инфекции связано с завершением спорогонии в организме комара, что зависит от конкретных среднесуточных температур данного года. В Московском регионе длительность периода передачи малярии vivax может достигать 1,5-2 мес и более, до первых осенних заморозков. Границы периода массовых проявлений менее определенны. В очагах, где передается только трехдневная малярия, период массовой заболеваемости может начинаться задолго до начала периода передачи. Наблюдаемые случаи представляют собой первичные проявления малярии vivax с длительной инкубацией (3- 10 мес) за счет заражения в прошлом сезоне и сохранения в печени гипнозоитов (без первичных проявлений с короткой инкубацией), а также отдаленные экзоэритроцитарные рецидивы (после серии приступов малярии с короткой инкубацией в прошлом сезоне без адекватной противорецидивной терапии).
Восприимчивость к малярии всеобщая. Исход заражения после попадания возбудителя в кровоток и клиническое течение болезни зависят от индивидуального иммунологического статуса, активности действия факторов неспецифической врожденной резистентности, напряженности постинфекционного иммунитета, а у новорожденных - от уровня специфических антител класса G, полученных от матери. Исключение составляют коренные жители Западной Африки и Новой Гвинеи, в большинстве своем невосприимчивые к заражению P. vivax, что связано с генетически детерминированным отсутствием у них эритроцитарных изоангигенов системы Даффи, выполняющих функцию рецепторов для мерозоитов P. vivax. Соответственно в этом регионе значительно реже, чем в других регионах тропической Африки, регистрируют случаи малярии vivax.
Относительной устойчивостью к заражению всеми видами плазмодиев обладают лица, являющиеся носителями аномального гемоглобина (при талассемии, серповидно-клеточной анемии, носительстве гемоглобинов Е и С и др.), имеющие нарушения строения цитоскелета эритроцитов (при наследственном сфероцитозе, юго-восточном овалоцитозе, наследственном эллиптоцитозе) или дефицит глюкозо-6-фосфатдегидрогеназы эритроцитов. При заражении малярией они болеют легко, численность паразитов в крови сохраняется на сравнительно низком уровне, случаи злокачественного течения (церебральной формы малярии falciparum) практически отсутствуют. Вместе с тем у лиц с дефицитом глюкозо-6-фосфатдегидрогеназы возникает риск острого гемолиза при использовании ряда противомалярийных препаратов (примахин, хинин и др.). Механизмы естественной устойчивости к различным формам малярии во многом еще не ясны, их изучение продолжается.
Определенной устойчивостью к заражению всеми формами малярии обладают также новорожденные. Это объясняется наличием пассивного иммунитета за счет антител класса G, получаемых от гипериммунной матери (в очагах с высокой заболеваемостью малярией); поддержанием специфического иммунитета после рождения за счет антител класса А, получаемых с грудным молоком; наличием у новорожденного фетального гемоглобина, малопригодного для развития малярийного паразита.
После первых 3-6 мес жизни у новорожденных значительно возрастает риск развития тяжелых, злокачественных форм малярии falciparum (замена эритроцитов, содержащих фетальный гемоглобин, эритроцитами, содержащими нормальный гемоглобин; перевод на смешанное питание, т. е. поступление в пищу парааминобензойной кислоты, необходимой для развития паразита, которая отсутствует в материнском молоке).
Иммунитет при малярии нестерильный, видо- и штаммоспецифический, нестойкий и непродолжительный. Для поддержания защитного уровня антител необходима постоянная антигенная стимуляция в виде повторных заражений малярией. Иммунитет к P. malariae и P. vivax формируется раньше и сохраняется дольше, чем к P. falciparum. Противомалярийный иммунитет включает клеточный и гуморальный ответы. Началом иммунных процессов, которые стимулируют синтез антител, является фагоцитирование малярийных паразитов макрофагами. Это проявляется гиперплазией гистиофагоцитарной системы селезенки, печени, костного мозга.
Генетические варианты, связанные с изменением свойств эритроцитов и обеспечивающие устойчивость к возбудителям малярии. Малярия является направляющей силой эволюции, которая привела к отсутствию антигенов Даффи, появлению разных форм гемоглобинопатий (талассемия, серповидно-клеточная анемия и др.), дефицита глюкозо-6-фосфатдегидрогеназы, овалоцитоза и других менделевских болезней человечества, обеспечивающих устойчивость к малярии. Широкое распространение ряда генетических аномалий среди населения регионов, высокоэндемичных по малярии, можно рассматривать как результат длительного взаимодействия популяций возбудителей и их хозяев. Наибольшее влияние возбудителей малярии испытали представители негроидной расы, проживающие в тропическом поясе Земли, у которых эта инфекция играла роль основного фактора генетического отбора.
Серповидно-клеточные анемии. Это группа генетических заболеваний, возникающих у гомо- и гетерозигот в результате точечной мутации в гене HbB, ответственном за продукцию β-цепи гемоглобина человека.
Эта мутация приводит к пониженной растворимости гемоглобина и повышению его полимеризации, что в свою очередь обусловливает изменение
формы эритроцитов, которые становятся серповидными. Такие эритроциты теряют эластичность, закупоривают мелкие сосуды и гемолизируются.
Гемоглобин S. Мутация HbS в 6-м кодоне (ГАГ вместо ГТС с заменой глутаминовой кислоты на валин) приводит к полимеризации гемоглобина, вызывающей серповидно-клеточную анемию у гомозигот. У гетерозигот гемоглобин S в 90 % случаев защищает от летального исхода тропической малярии. Гомозиготность является летальной, а гетерозиготность - нелетальной. Мутация HbS весьма широко распространена в некоторых районах Африки. Мутантная β-цепь менее эффективна в предотвращении генерации кислородных радикалов внутри эритроцитов самой клеткой или паразитами. Предполагают, что эта мутация появилась от 2000 до 3000 лет назад.
Гемоглобин С. Происходит мутация в гене HbB, при которой глутаминовая кислота или валин заменяются на лизин в 6-м положении. Аллель HbC в гомозиготном состоянии обеспечивает защиту на 90 %, в гетерозиготном - на 30 %. Эта мутация у носителей не сопровождается тяжелыми клиническими проявлениями по сравнению с мутацией HbS.
Гемоглобин Е. Происходит мутация в гене HbB, при которой глутаминовая кислота заменяется на лизин в 26-м положении. Эта гемоглобинопатия может обеспечивать защиту от трехдневной малярии. У гомозигот по HbE анемия протекает бессимптомно. Носительство гемоглобина Е обычно встречается в странах Юго-Восточной Азии, его имеют до 50 % населения. Предполагают, что эта мутация возникла относительно недавно и быстро распространилась в популяции.
Талассемии. Это класс анемий, вызываемых аномалиями в генах, кодирующих продукцию гемоглобина, при которых происходят утрата, уменьшение или замена (например, на γ или δ) α- или β-цепей в молекуле гемоглобина в результате делеции или других перестроек копий глобиновых генов на хромосомах 11 и 16.
К настоящему времени описано более 300 подобных мутаций, приводящих к самым разнообразным клиническим проявлениям. Наличие талассемии в гомозиготном состоянии приводит к тяжелой болезни или гибели. В гетерозиготном состоянии инфицированный малярийным плазмодием человек является практически здоровым. Защитный механизм талассемии неизвестен. В Европе высокая частота талассемий обнаружена в регионах, прилегающих к Средиземному морю.
Дефицит глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах. Дефицит Г-6-ФД - патология, связанная с мутациями в гене G6PD на Х-хромосоме и снижающая способность эритроцитов препятствовать окислению.
Ген Г-6-ФД локализован в области Хq28-хромосомы и содержит 13 экзонов. Описано более 300 различных мутаций в этом гене, приводящих к значительному полиморфизму заболеваний. В результате разрушения гемоглобина паразитом высвобождаются протеиды и железо, участвующие в окислительном процессе, токсичном для плазмодия. Дефицит Г-6-ФД способствует окислению, что приводит к снижению частоты тяжелых клинических проявлений тропической малярии у гетерозиготных женщин и гомозиготных мужчин как в странах Востока, так и в Западной Африке примерно на 50 %. Это одна из распространенных наследственных болезней человека: данную мутацию имеют около 100 млн человек в мире. Наибольшее распространение заболевание получило в странах Средиземноморья, Ближнего и Среднего Востока, северных регионов Африки и Юго-Восточной Азии.
Отсутствие антигенов Даффи в эритроцитах. Единственной аномалией, защищающей от малярии и не вызывающей патологию, является отсутст-
вие антигенов Даффи в эритроцитах жителей Западной и Центральной Африки. Эта мутация делает ее носителей невосприимчивыми к трехдневной малярии, так как P. vivax не могут проникать в эритроциты, не имеющие антигенов Даффи, выполняющих роль рецепторов для плазмодия данного вида. В Западной и Центральной Африке частота такой аномалии составляет 97 %. Только в этих регионах земного шара встречаются гомозиготы по данной мутации.
Овалоцитоз. Эта эритроцитарная патология связана с делецией в 27-й паре нуклеотидов гена SLC4A1. В норме данный ген кодирует синтез белка мембраны эритроцитов, который осуществляет обмен анионов. Указанная аномалия проявляется только в гетерозиготном состоянии. Мутация в гене SLC4A1 ассоциируется с механизмом защиты от малярии, в том числе церебральной. Этот механизм еще не ясен, но, возможно, связан со снижением клеточной адгезии на эндотелии или с ингибирующим влиянием мутации на рост паразитов. Овалоцитоз встречается в Юго-Восточной Азии.
Генетически обусловленная недостаточность мембранных эритроцитарных белков - гликофоринов А, В, С. Эти белки выполняют роль рецепторов для связывания с паразитом. Их генетическая недостаточность делает эритроциты относительно устойчивыми к инвазии P. falciparum.
Gerbich (резус-отрицательная группа крови). Данная мутация, вызванная делецией в экзоне 3 гена GYPS, также приводит к снижению инвазии P. falciparum. Она часто встречается в Папуа-Новой Гвинее.
Генетические варианты, связанные с патогенезом малярии. Наиболее изученной является генетика чувствительности/устойчивости к P. falciparum. В некоторых районах Африки до 70 % случаев тяжелой малярии сопровождается комой, которая приводит к смерти 15-30 % заболевших. Клеточная адгезия - основной фактор в патогенезе малярии. На мембране паразита расположен мембранный белок-1 (PFEMP-1) (лиганд), закодированный в генном семействе var. Каждый паразит содержит много различных копий гена, и путем переключения экспрессии между копиями он может вызвать значительную антигенную изменчивость.
У человека на мембране эндотелия, тромбоцитов, макрофагов, эритроцитов имеются различные молекулы, которые служат связывающими рецепторами для различных форм мембранных белков PFEMP-1 паразита и обеспечивают слипание (адгезию) пораженных плазмодием клеток хозяина между собой и с эндотелием сосудов. Известны гены, участвующие в синтезе этих белков-рецепторов, - CD36, ICAM-1, CR1. Эти гены отвечают за синтез соответствующих белков - CD36, ICAM-1, CR1.
Исследования в Гамбии и Кении показали, что гомозиготы по аллелю с нонсенс-мутацией в гене CD36 (CD36+ 1264 G) восприимчивы к церебральной малярии, а гетерозиготность ассоциируется с защитой от тяжелой малярии. Недостаточность CD36 довольно распространена в Африке. ICAM Kilifi, который является вариантом ICAM, чаще обнаруживают у кенийских детей с тяжелой малярией.
Полиморфизм по CR1 и его недостаточность также ассоциируются с устойчивостью к тяжелой малярии.
Присутствие инфицированных P. falciparum эритроцитов ведет к локальному скоплению паразитов и высвобождению продуктов их метаболизма, которые стимулируют Т-лимфоциты к синтезу цитокинов (TNF-α и IL-1 и IL-6), способствующих иммунной активации. TNF-α усиливает экспрессию молекул адгезии на эндотелии, увеличивая таким образом прилипание инфицированных эритроцитов. Поскольку у больных неинфицированные эритроциты слипаются с инфицированными, значительная агрегация эрит-
роцитов в капиллярах мозга вызывает локальный тромбоз и местное воспаление. По-видимому, продукты, высвобождающиеся из воспалительных инфильтратов, вызывают разрушение эндотелия и просачивание плазмы и эритроцитов в ткани мозга. Такие точечные геморрагии наблюдаются в тканях мозга после смерти от церебральной малярии. На основании этого гипотетического механизма патогенеза было выбрано несколько кандидатных генов, которые включали гены, кодирующие TNF-α, iNOS и ICAM-1. По этим генам был описан полиморфизм, связанный с увеличенной или сниженной чувствительностью к малярии.
Стадии развития малярийных паразитов. Жизненный цикл всех возбудителей малярии (рис. 2.25) включает двух хозяев: человека (шизогония - бесполый цикл развития) и комаров рода Anopheles (спорогония - половой цикл развития).
В ходе шизогонии у всех видов малярийных паразитов традиционно выделяют 3 стадии: экзоэритроцитарную шизогонию (ЭЭШ), эритроцитарную шизогонию (ЭШ) и гаметогонию. Кроме того, в жизненных циклах P. vivax и P. ovale выделяют отдельную стадию («спячку») вследствие возможного внедрения в организм человека при укусе комара спорозоитов морфологически неоднородной группы - тахиспорозоитов и брадиспорозоитов или только брадиспорозоитов. В этих случаях брадиспорозоиты (гипнозоиты) длительно сохраняются в гепатоцитах в неактивном состоянии до начала ЭЭШ.
Экзоэритроцитарная шизогония. Внедренные со слюной комара в организм человека спорозоиты очень быстро (в течение 15-30 мин) попадают с кровотоком в печень, где активно проникают в гепатоциты, не повреждая их. Спорозоиты P. falciparum, P. malariae и тахиспорозоиты P. vivax и P. ovale немедленно начинают ЭЭШ с образованием большого количества экзоэритроцитарных мерозоитов (до 40 000 из одного спорозоита при малярии falciparum). Гепатоциты разрушаются, и мерозоиты снова попадают в кровоток с последующим быстрым (в течение 15-30 мин) внедрением в эритроциты. Длительность ЭЭШ при малярии falciparum обычно составляет 6 дней, при малярии vivax - 8, при малярии ovale - 9, при малярии malariae - 15 дней.
Стадия «спячки». При малярии vivax и малярии ovale брадиспорозоиты, внедрившиеся в гепатоциты, превращаются в неактивные формы - гипнозоиты, которые могут оставаться без деления несколько месяцев или даже лет до последующей реактивации (деление и образование мерозоитов). Таким образом, с гипнозоитами связаны характерные только для этих форм малярии длительная инкубация (до 3-10 мес и более) и возникновение отдаленных экзоэритроцитарных рецидивов.
Эритроцитарная шизогония. После внедрения мерозоитов в эритроциты малярийные паразиты многократно (циклически) последовательно проходят стадии трофозоита (питающаяся одноядерная клетка), шизонта (делящаяся многоядерная клетка) и морулы (сформировавшиеся паразиты, находящиеся внутри эритроцита). В последующем после разрушения эритроцитов в плазму крови попадают мерозоиты. Наибольшее количество дочерних мерозоитов образуется при тропической малярии - до 40 в одном эритроците. Стадия ЭШ имеет строго определенную длительность: 48 ч при малярии falciparum, малярии vivax и малярии ovale и 72 ч при малярии malariae.
Патогенез. Особенности цикла ЭШ и основные патогенетические механизмы развития тяжелых и осложненных форм малярии falciparum включают:
• скопление (секвестрацию) инвазированных эритроцитов, содержащих взрослые трофозоиты (со стадии амебовидного трофозоита), шизонты
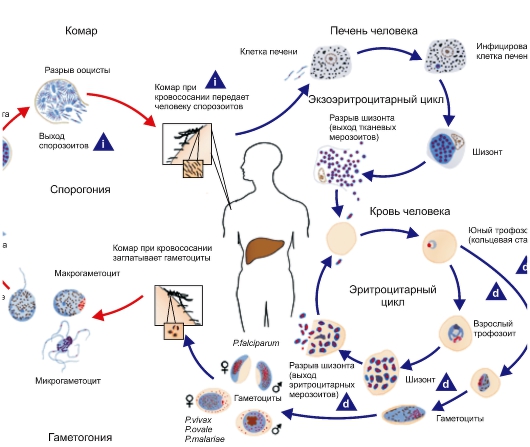
Рис. 2.25. Жизненный цикл малярийного плазмодия, i - инвазионная стадия; d - диагностическая стадия.
в сосудах внутренних органов, преимущественно головного мозга, а также почек, печени, кишечника, костного мозга, плаценты и др.;
• формирование «розеток», состоящих из инвазированных и непораженных эритроцитов;
• развитие нарушений микроциркуляции, гипоксии тканей, метаболического ацидоза (значительное накопление молочной кислоты);
• активацию МФС (преимущественно Th-1-иммунный ответ) с повышенным синтезом α-фактора некроза опухоли, γ-интерферона, интер- лейкина-1 и других цитокинов, повреждающих эндотелий сосудов и вызывающих адгезию эритроцитов к эндотелию кровеносных сосудов. В последние годы рассматривается особая роль повышенного синтеза оксида азота (NO) клетками эндотелия сосудов головного мозга в развитии церебральной формы малярии falciparum.
Важным патофизиологическим механизмом в развитии тяжелых форм малярии falciparum по сравнению с другими формами малярии является гипогликемия, усугубляющая микроциркуляторные и метаболические нарушения (метаболический ацидоз) у больных, особенно у детей и беременных. В развитии гипогликемии при малярии falciparum выделяют три основных фактора: снижение гликогенеза в печени, утилизация глюкозы паразитами и стимуляция секреции инсулина. В то же время гипогликемия может быть следствием гиперинсулинемии, развивающейся после назначения хинина для купирования приступов малярии falciparum.
Как следствие длительной персистенции паразита (без адекватной терапии) при малярии malariae возможно развитие нефротического синдрома в результате действия иммунного механизма (отложение иммунных комплексов, содержащих антигены паразита, на базальной мембране почечных клубочков).
Необходимо отметить, что основные клинические проявления всех форм малярии (интоксикация, увеличение печени и селезенки, анемия) связаны именно со стадией эритроцитарной шизогонии (многократное бесполое размножение паразитов в эритроцитах), и чем больше количество паразитов у больного в 1 мкл крови, определяемое при микроскопическом исследовании толстой капли, тем тяжелее протекает малярия. В связи с этим при лабораторной диагностике малярии важно определить не только вид малярийного плазмодия, но и уровень паразитемии. Формы малярии можно распределить в порядке убывания максимального уровня паразитемии следующим образом: малярия falciparum (до 100 тыс. паразитов и более в 1 мкл), - малярия vivax (до 20 тыс. в 1 мкл, редко больше), - малярия ovale и малярия malariae (до 10-15 тыс. в 1 мкл). При малярии falciparum, протекающей с высоким уровнем паразитемии (100 тыс. и более в 1 мкл), значительно возрастает риск развития тяжелых фатальных осложнений, что определяет тактику интенсивной (парентеральной) противомалярийной терапии.
Возникновение лихорадочных пароксизмов при малярии обусловлено гемолизом эритроцитов, выходом мерозоитов в плазму, разрушением части из них (другая часть мерозоитов снова внедряется в эритроциты), активацией МФС и повышенным синтезом интерлейкина-1, 6, α-фактора некроза опухоли и других эндогенных пирогенов (провоспалительных цитокинов), оказывающих действие на центр терморегуляции гипоталамуса.
При наличии в крови одной генерации плазмодиев с первых дней болезни возникают регулярно чередующиеся пароксизмы. Часто при малярии falciparum и малярии vivax (в гиперэндемичных регионах с интенсивной передачей малярии) у неиммунных лиц наблюдается инициальная (начальная) лихорадка, связанная с развитием в эритроцитах больных сразу не-
скольких генераций возбудителей с разным по времени окончанием цикла развития, что приводит к наслоению приступов, сглаживанию картины апирексии, искажению типичного пароксизма. В процессе развития болезни, нарастания факторов специфической и неспецифической защиты (к концу 1-й недели - на 2-й неделе) часть генераций погибает и остается одна-две ведущие генерации паразитов, при этом типичные пароксизмы наблюдаются через день (или каждый день).
Увеличение печени и селезенки при всех формах малярии связано с их значительным кровенаполнением, отеком, гиперплазией МФС.
Малярия, как правило, приводит к гемолитической гипохромной анемии, в патогенезе которой имеет значение ряд факторов:
• внутрисосудистый гемолиз инфицированных эритроцитов;
• фагоцитоз клетками ретикулоэндотелия селезенки как инфицированных, так и неинфицированных эритроцитов;
• секвестрация (накопление) эритроцитов, содержащих зрелые паразиты, в костном мозге, угнетение кроветворения;
• иммунный механизм (разрушение непораженных эритроцитов в результате адсорбции иммунных комплексов, содержащих компонент С3 комплемента, на мембране эритроцитов).
Стадия гаметогонии является своего рода «ответвлением» стадии ЭШ. Часть мерозоитов (генетически детерминированный процесс) вместо того, чтобы после внедрения в эритроцит снова повторить бесполый цикл развития, превращаются в половые формы - гаметоциты (мужские и женские).
Особенности стадии гаметогонии при малярии falciparum состоят в следующем.
• Гаметоциты появляются в периферической крови не ранее 10-12-го дня болезни.
• Накапливаясь в течение болезни, гаметоциты могут длительно циркулировать в кровотоке (до 4-6 нед и более).
При других формах малярии (vivax, ovale, malariae) гаметоциты могут определяться в периферической крови с первых дней болезни и быстро (в пределах нескольких часов - нескольких дней) погибают.
Установлена связь между P. falciparum и вирусной инфекцией Эпштей- на-Барр в генезисе лимфомы Беркитта - самого распространенного вида рака в Экваториальной Африке. Вирус Эпштейна-Барр - потенциально онкогенный вирус, приводящий к хромосомным транслокациям в пораженных клетках, что в дальнейшем может привести к развитию лимфомы. Доказано, что антигены P. falciparum активируют вирусную репликацию, пролиферацию В-клеток, в частности В-клеток, латентно индуцированных вирусом Эпштейна-Барр, что и вызывает развитие лимфомы.
Клинические проявления. Клиническое течение малярии зависит от состояния иммунитета больного и вида возбудителя. Необходимо отметить, что малярия vivax, малярия ovale и малярия malariae протекают доброкачественно и почти никогда не заканчиваются летально, в то время как тропическая малярия при позднем или неадекватном лечении часто приводит к смерти.
Основу клинической картины любой формы малярии составляет малярийный пароксизм (приступ), включающий последовательные фазы разной длительности: озноб (1-3 ч и более), жар (5-8 ч и более) и потоотделение. Общая продолжительность малярийного пароксизма может колебаться от 6-8 до 12-14 ч и более.
Малярия vivax и малярия ovale. Существенных различий в клинических проявлениях этих форм малярии не отмечается. Заболевание развивается
после короткой (12-17 дней) или (реже) длительной (до 3-10 мес и более) инкубации. За 1-2 сут или за несколько часов до появления лихорадки может отмечаться продромальный период (недомогание, познабливание, головная боль), который чаще наблюдается у неиммунных лиц. Возможен период инициальной лихорадки неправильного типа продолжительностью 2- 6 дней и более. Отсутствие типичных пароксизмов в этот период может быть причиной постановки неправильного диагноза.
Сформировавшиеся типичные малярийные пароксизмы обычно начинаются в первой половине дня с озноба и быстрого повышения температуры тела до 39-40 оС, а в дальнейшем - до 41 оС. Стадия «озноба» длится от 15-30 мин до 2-3 ч и более. Затем наступает следующий период малярийного пароксизма - жар. Кожный покров становится горячим, гиперемированным, некоторые больные в этот период возбуждены, появляются тахикардия, олигурия, снижается АД. Жар сохраняется до 4-6 ч и более. В дальнейшем температура тела начинает снижаться, жар сменяется потоотделением разной степени. Продолжительность этой фазы - 1-2 ч, после чего больной обычно на короткое время засыпает. Следующий пароксизм развивается через день. Через 3-5 дней после начала заболевания отмечаются гепато- и спленомегалия, через 10-14 дней - анемия, которые, как правило, выражены умеренно. Если больному не проводят специфическую терапию, приступы повторяются в течение 2-4 нед и более, постепенно становясь более легкими, и затем самопроизвольно прекращаются.
В отсутствие специфической терапии (или при неадекватной терапии) через 1-2 мес после серии малярийных пароксизмов могут развиться ранние рецидивы, обусловленные активизацией эритроцитарной шизогонии, а через 6-8 мес и более - поздние рецидивы (экзоэритроцитарные). Рецидивы развиваются обычно при высоком уровне паразитемии вследствие частичного формирования иммунитета и повышения пирогенного порога. Редким осложнением малярии vivax в настоящее время является разрыв селезенки.
Малярия malariae. Инкубационный период обычно составляет от 3 до 5- 6 нед. Заболевание начинается остро в дневные часы, сразу устанавливается строгая периодичность приступов - через два дня на третий. Пароксизмы при малярии malariae отличаются наиболее длительным ознобом по сравнению с другими формами малярии. Длительность пароксизма - до 13 ч и более. Анемия, сплено- и гепатомегалия развиваются более медленно, не ранее чем через 1-2 нед. При отсутствии лечения клинические проявления малярии malariae купируются самостоятельно после 8-14 приступов. Через 2- 6 нед возможно развитие рецидивов. После перенесенной малярии malariae (при неадекватном лечении) возможна длительная паразитемия (несколько десятков лет) в отсутствие клинических проявлений болезни вследствие продолжающейся эритроцитарной шизогонии на очень низком уровне (субпатентном). По этой причине в эндемичных районах значительно возрастает риск заражения этой формой малярии при переливании крови, хирургических вмешательствах. В эндемичных районах (тропическая Африка) также существует риск развития нефротического синдрома у больных, перенесших малярию malariae, при длительно сохраняющейся паразитемии или повторных заражениях. При адекватной терапии прогноз благоприятный.
Малярия falciparum (рис. 2.26). Инкубационный период составляет 7- 16 дней. Это самая злокачественная форма малярии: при отсутствии адекватной своевременной терапии заболевание может принять опасное (фатальное) для жизни течение. В продромальном периоде (от нескольких часов до одного-двух дней) могут отмечаться головная боль, слабость, легкий озноб, суб-
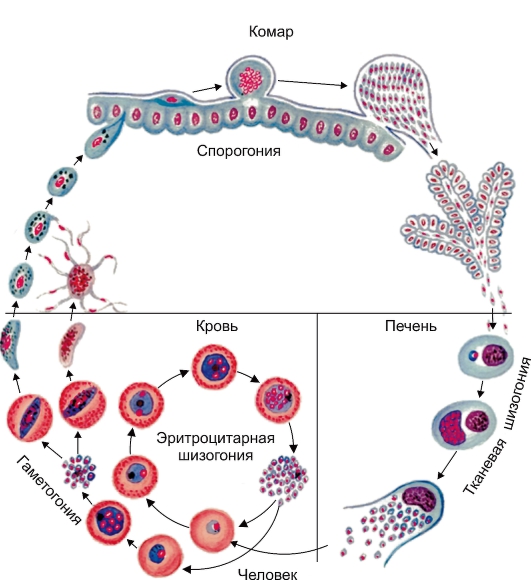
Рис. 2.26. Стадии жизненного цикла P. falciparum в мазке крови.
фебрильная температура, снижение аппетита, диарея. Для малярии falciparum у неиммунных лиц характерна инициальная лихорадка с колебаниями температуры тела от субфебрильной до фебрильной в течение дня, возможна постоянная лихорадка. Через несколько дней у коренных жителей эндемичных регионов (иммунных лиц) или через 1-2 нед у впервые инфицированных (неиммунных лиц) после начала лихорадочного периода при благоприятном течении малярии falciparum начинаются типичные пароксизмы. Длительность малярийного пароксизма - не менее 12-24 ч с быстрым повышением температуры тела до 39-41 оС. Больных беспокоят головная боль, слабость, сильный озноб, тошнота, рвота. Крайне неблагоприятным прогностическим признаком малярии falciparum является сохраняющаяся ежедневная высокая лихорадка без периодов апирексии с нарастающей головной болью. Развитие сплено- и гепатомегалии наблюдается через 3-4 дня.
Осложнения малярии. К ним относятся церебральная форма, гемолитическая анемия, инфекционно-токсический шок (алгид), гемоглобинурийная лихорадка (острый гемолиз), нефротический синдром, острая почечная недостаточность, отек легких (респираторный дистресс-синдром).
Церебральная форма - наиболее распространенное осложнение при тяжелом течении малярии falciparum. В настоящее время церебральная форма развивается в 10 % всех случаев малярии falciparum в мире, и 60-80 % всех летальных исходов болезни связано именно с данным осложнением. Церебральная форма может развиться в первые дни заболевания, но чаще регистрируется на 2-й неделе при отсутствии специфической или неадекватно проводимой терапии. Летальный исход может наступить в пределах 1-2 сут.
Различают I, II и III стадии энцефалопатии (сомнолентность, сопор и кома). Длительность и выраженность каждой стадии могут варьироваться, поэтому у ряда больных можно не заметить переход одной стадии в другую. Энцефалопатия I стадии характеризуется возбуждением или апатией, спутанностью сознания и сонливостью, дезориентацией в пространстве, значительным снижением всех реакций на болевые, тактильные и звуковые раздражители, возможно повышение сухожильных рефлексов. Для энцефалопатии II стадии характерно развитие сопора, кожный покров бледный с землисто-желтоватым оттенком, возможна иктеричность склер, слизистых оболочек, наблюдаются частое поверхностное дыхание, гипотензия, тахикардия, судороги (тонические и клонические), сухожильный рефлекс значительно повышен, появляются патологические рефлексы. В III стадии энцефалопатии сознание отсутствует, больной не реагирует на внешние раздражители, сухожильный и брюшные рефлексы отсутствуют, зрачки чаще расширены, могут наблюдаться патологические рефлексы, менингеальные симптомы (ригидность мышц затылка, симптом Кернига и др.). Температура тела в I стадии энцефалопатии интермиттирующая, во II или в III стадии - неправильного типа или постоянная (40- 41 оС). В крови, помимо большого количества кольцевидных форм, могут быть обнаружены паразиты и в других стадиях развития (взрослые трофозоиты, шизонты), что характерно для синдрома злокачественной малярии falciparum. На высоте комы резко увеличена СОЭ, отмечаются нейтрофильный лейкоцитоз со сдвигом в палочкоядерный лейкоцитоз, выраженная гипохромная анемия.
Анемия при всех формах малярии характеризуется как гемолитическая, гипохромная. Степень анемии зависит от вида паразита, а также от интенсивности и длительности инфекции. Тяжесть малярии у коренных жителей тропических стран часто усугубляется дефицитом железа и фолиевой кислоты в пищевом рационе. Уже после первых приступов малярии возможно развитие анемии, которая при тропической малярии более выражена, чем при других формах.
Инфекционно-токсический шок (ИТШ) с развитием синдрома диссеминированного внутрисосудистого свертывания (ДВС) - осложнение малярии falciparum, протекающей с высокой паразитемией. Характерно развитие острой надпочечниковой недостаточности. Течение ИТШ в условиях жаркого климата сопровождается гиповолемией.
Острая почечная недостаточность обычно наблюдается при злокачественном, осложненном течении малярии falciparum. Часто развиваются олигурия и анурия с нарастанием в крови креатинина, мочевины; анализ мочи показывает выраженную протеинурию, цилиндрурию, пиурию, микрогематурию.
Нефротический синдром - характерное осложнение малярии malariae - отличается медленным, неуклонно прогрессирующим течением, сопровож-
дается отеками, артериальной гипертензией, протеинурией, развитием почечной недостаточности.
Гемоглобинурийная лихорадка (острый гемолиз до 20-50 % всех эритроцитов) при малярии falciparum обычно наблюдается у коренных жителей эндемичных регионов, часто при дефиците в эритроцитах глюкозо-6-фос- фатдегидрогеназы. В последние годы обсуждается аутоиммунный характер развития острого гемолиза, связанный с длительным и частым приемом противомалярийных препаратов хинина и примахина. Отмечается высокая лихорадка (при незначительной паразитемии), моча приобретает черный цвет, при анализе крови обнаруживают анемию, лейкоцитоз, увеличение СОЭ, быстро прогрессирует почечная недостаточность, что при отсутствии адекватной терапии приводит к летальному исходу.
Рецидивы малярии. Уровень паразитемии во время рецидива обычно ниже, чем при первичных проявлениях заболевания. Вследствие повышения в ходе инфекции пирогенного порога клинические проявления во время рецидива обычно появляются при более высокой паразитемии. Рецидивы протекают, как правило, доброкачественно с умеренно выраженным токсическим синдромом и правильным чередованием малярийных пароксизмов от начала рецидива; число пароксизмов значительно меньше, чем при первичных проявлениях заболевания. По времени наступления выделяют ранние рецидивы (в пределах 2 мес после первичных проявлений малярии) и поздние (после 2 мес). По происхождению рецидивы подразделяют на эритроцитарные (все формы малярии) и экзоэритроцитарные (только при малярии vivax и малярии ovale).
Диагностика. В диагностике малярии учитывают следующие факторы.
♦ Острое начало болезни, выраженные симптомы интоксикации, циклическое течение с чередованием приступов лихорадки и периодов апирексии, увеличение печени и селезенки, развитие прогрессирующей гемолитической анемии.
♦ Данные эпидемиологического анамнеза (пребывание в местности, неблагополучной по малярии, переливание крови, наркомания).
♦ Данные лабораторных исследований:
• гемограмма (снижение уровня гемоглобина, лейкопения, лимфомоноцитоз, увеличение СОЭ);
• микроскопическое исследование толстой капли крови с просмотром не менее 100 полей зрения в случаях низкой паразитемии [обнаружение плазмодиев и определение уровня паразитемии в 1 мкл крови (100 полей зрения ≈ 0,2 мкл крови] (табл. 2.4). Это необходимо: 1) для определения интенсивности специфической противомалярийной терапии (при высоком уровне паразитемии у больных тропической малярией предпочтительно парентеральное введение препаратов); 2) для контроля эффективности специфической терапии.
Таблица 2.4. Степени паразитемии при малярии

Уровень паразитемии можно оценивать также по количеству паразитов на 100 лейкоцитов в толстой капле крови и по проценту пораженных эритроцитов (в данном случае для определения количества паразитов в 1 мкл необходимо знать общее количество лейкоцитов и эритроцитов в 1 мкл у больного);
• микроскопическое исследование мазка крови для определения вида плазмодия. Окраску толстой капли и мазка крови проводят по методу Романовского-Гимзы.
В результате скопления инвазированных эритроцитов, содержащих взрослые трофозоиты и шизонты, в сосудах внутренних органов при исследовании препарата толстой капли крови, взятой у больного нетяжелой малярией falciparum, в эритроцитах определяются только молодые (юные) трофозоиты в стадии кольца. Обнаружение в периферической крови инвазированных эритроцитов, содержащих взрослые стадии паразита (взрослые или амебовидные трофозоиты, шизонты), является неблагоприятным лабораторным признаком, указывающим на тяжелое (осложненное) течение малярии falciparum.
У лиц, впервые контактировавших (неиммунных) с данной инфекцией, и детей младшего возраста первые приступы могут протекать при очень низкой паразитемии, иногда не выявляемой при микроскопии, что требует повторного исследования крови (толстой капли) через 6-12 ч, но не позднее чем через 24 ч.
Вспомогательные методы (экспресс-диагностика):
• серологические (определение специфических антител) - РНИФ, ИФА, РНГА (используют при отрицательном результате микроскопии крови для обследования доноров или уточнения диагноза);
• биохимические (или иммуноферментные), направленные на определение специфических антигенов (ферментов) малярийных паразитов (HRP-2-тест; ParaSight F-тест, pLDH-тест и др.);
• ПЦР-диагностика (определение в крови ДНК малярийных плазмодиев).
В эндемичных очагах нередко диагностируют смешанные формы малярии - одновременное заражение двумя-тремя видами паразитов (малярия falciparum и малярия vivax; малярия falciparum, малярия vivax и малярия malariae и др.).
Дифференциальный диагноз. Дифференциально-диагностическое исследование при малярии проводят с учетом остроты клинических проявлений болезни и ее длительности. В первую очередь малярию дифференцируют от заболеваний, протекающих с длительной лихорадкой, увеличением печени, селезенки, возможным развитием анемии: брюшным тифом и паратифами, бруцеллезом, лептоспирозом, сепсисом, лимфогранулематозом. В неэндемичных регионах в первые 5 сут заболевания часто ставят диагноз гриппа (или других ОРВИ).
В тропических странах Южной Америки, Африки, Юго-Восточной Азии проводят дифференциальную диагностику с геморрагическими вирусными лихорадками (желтая лихорадка, лихорадка денге и др.).
При церебральной форме малярии falciparum необходимо проводить дифференциальный диагноз с энцефалопатиями (комой), развивающимися при декомпенсированном сахарном диабете, печеночной и почечной недостаточности, а также с отеком головного мозга при менингите или менингоэнцефалите бактериальной или вирусной этиологии.
Больных малярией госпитализируют в инфекционные больницы (отделения). В тропических странах (с высоким уровнем заболеваемости) госпи-
тализации (в основном) подлежат больные малярией только по клиническим показаниям (тяжелое, осложненное течение), беременные и дети.
Профилактика. Профилактические мероприятия в очаге предусматривают своевременное выявление и лечение больных и паразитоносителей (источники инфекции), а также борьбу с переносчиками малярии. Эффективных вакцин для активной иммунизации против малярии пока нет.
Индивидуальная профилактика малярии при пребывании в эндемичном очаге направлена на предупреждение заражения и малярийного приступа. Профилактика заражения заключается в принятии мер защиты от укусов комаров (использование репеллентов, сеток на окнах и дверях, надкроватных пологов, одежды, закрывающей руки и ноги лиц, находящихся на открытом воздухе в вечернее и ночное время). В соответствии с рекомендациями ВОЗ профилактика малярийного приступа состоит в приеме противомалярийных препаратов, ее рекомендуется проводить только неиммунным лицам, выезжающим в очаги с высоким риском заражения малярией и отсутствием доступной медицинской помощи (удаленность медицинских учреждений, невозможность быстрого исследования крови на малярию).
Необходимость использования, длительность и кратность приема препаратов определяют только в ходе консультации с врачом-инфекционистом. Важно выявить противопоказания к приему химиопрепаратов, наличие тяжелых сопутствующих заболеваний. Беременные неиммунные женщины и дети раннего возраста не должны посещать регионы, эндемичные по малярии.
Учитывая высокую резистентность P. falciparum к хлорохину, ВОЗ в настоящее время рекомендует для профилактики малярии falciparum прием мефлохина (по 250 мг 1 раз в неделю за 2 нед до выезда в эндемичный регион и в течение 4 нед после возращения). Использование других препаратов (доксициклин, хлорохин в сочетании с прогуанилом, атовакин в сочетании с прогуанилом, примахин и др.) определяет врач-инфекционист с учетом эпидемической обстановки в регионе пребывания и других указанных выше факторов.
2.3. Тип Ciliophora (инфузории)
Органоидами движения инфузорий служат многочисленные реснички. Ядерный аппарат состоит из двух ядер - макронуклеуса и микронуклеуса. Среди инфузорий встречаются свободноживущие пресноводные и почвенные организмы, комменсалы и паразиты животных. У человека паразитирует только один вид - Balantidium coli, способный вызывать заболевание - балантидиаз.
Балантидий (Balantidium coli). Этот организм является возбудителем балантидиаза - кишечного зоонозного протозойного заболевания, характеризующегося язвенным поражением толстой кишки и симптомами общей интоксикации, изнурительным поносом и истощением.
Историческая справка. Впервые сообщение о заболевании человека балантидиазом было представлено шведским врачом П. Мальмстеном в 1857 г., обнаружившим балантидиев в кале больных, страдавших поносом. Н. С. Соловьев установил, что паразит способен проникать в стенку толстой кишки и приводить к развитию патологического процесса. Walker (1913) выявил возможность бессимптомного носительства, а также роль свиней как резервуара возбудителя.
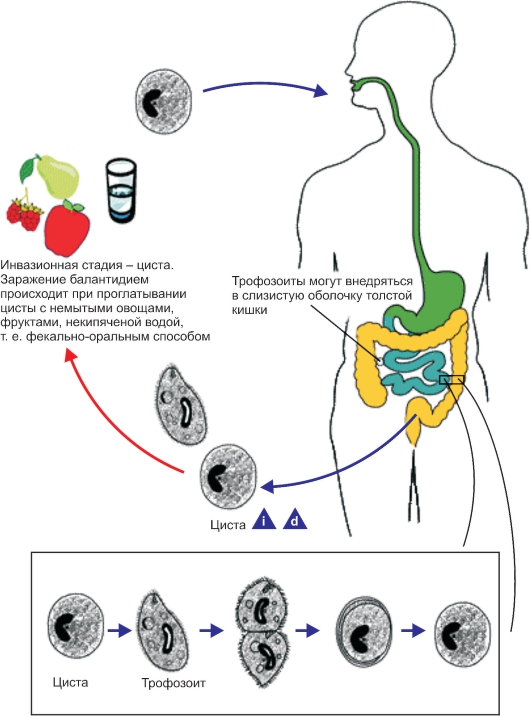
Рис. 2.27. Жизненный цикл Balantidium coli.
i - инвазионная стадия; d - диагностическая стадия.
Географическое распространение. Балантидии встречаются повсеместно, однако очаги болезни чаще регистрируют в регионах с теплым влажным климатом, особенно там, где развито свиноводство.
Локализация. Балантидий паразитирует в толстой кишке, особенно часто в слепой кишке.
Морфология, биология развития (рис. 2.27). Балантидий - самое крупное простейшее среди паразитов человека. Он существует в виде цисты и вегетативной формы.
Вегетативные формы. Балантидий имеет яйцевидное тело длиной 30- 200 мкм, шириной 20-110 мкм. Тело покрыто продольными рядами коротких ресничек, колебания которых обеспечивают вращательно-поступательное движение возбудителя. На переднем конце тела имеется небольшое углубление в виде щели - цитостом (клеточный рот), ведущий в короткий цитофаринкс (клеточную глотку), который заканчивается в цитоплазме. По краю ротовой щели и глотки располагаются особо сильно развитые реснички, направляющие пищу в глубину тела паразита. На заднем конце тела находится анальная пора, или цитопрокт (цитопиг).
Оболочка тела представляет собой пелликулу. Под пелликулой лежит тонкий слой прозрачной эктоплазмы.
В зернистой эндоплазме находится ядерный аппарат, типичный для инфузорий, - бобовидный, расположенный в центре макронуклеус и рядом с ним один маленький микронуклеус, который часто не виден, так как покрывается макронуклеусом. В эндоплазме находятся многочисленные пищевые вакуоли, содержащие бактерии, грибы, зерна крахмала и т. п., иногда эритроциты и лейкоциты в разных стадиях переваривания. В передней и задней частях тела расположены сократительные вакуоли.
Вегетативные формы балантидиев размножаются путем поперечного деления (митоз). В определенные периоды возможен половой процесс - конъюгация.
Балантидий питается разнообразным содержимым толстой кишки (бактерии, грибы, зерна крахмала и т. д.).
Цисты. Цистообразование происходит в нижних отделах толстой кишки.
Вегетативные формы паразита образуют вокруг себя двухслойную оболочку, под которой исчезает ресничный покров. Образующиеся цисты имеют округлую форму, их диаметр составляет 30-70 мкм. В окрашенных препаратах хорошо виден макронуклеус. С калом выходят цисты, которые, попадая в кишечник нового или того же хозяина, дают начало новому поколению балантидиев. Цистообразование в кишечнике человека и выделение цист у больных балантидиазом наблюдаются редко.
Строение балантидиев изучают на препаратах, окрашенных железным гематоксилином Гейденгайна.
Эпидемиология. Зараженность людей Balantidium coli колеблется от 1-3
до 28 %.
Случаи балантидиаза регистрируют преимущественно у жителей сельской местности, где развито свиноводство. Их доля от общего числа инфицированных составляет 91,3 %.
Группы риска. К ним относятся:
• рабочие свиноводческих ферм, которые заражаются при уходе за животными, уборке помещений;
• работники колбасного производства, заготовщики кишечного сырья;
• пациенты психиатрических больниц.
Способ заражения. Заражение происходит фекалъно-оралъным способом - при заглатывании Balantidium coli с водой, овощами, фруктами, загрязненными фекалиями инфицированных балантидиями свиней.
Инвазионная форма - циста. Цисты сохраняют жизнеспособность во внешней среде в течение нескольких месяцев: в свинарниках - до 104 сут, в почве -до 244 сут, в 10 % растворе формалина - 4 ч,в моче -до 10 сут. Высыхание среды, в которой находятся цисты, губительно для них.
Возможно заражение вегетативными формами. Вегетативные формы чувствительны к неблагоприятным условиям среды и быстро в ней погибают, в фекалиях могут сохраняться до 5-6 ч.
Источники инфекции. Балантидиаз - зооноз. Основной источник инфекции - домашние и дикие свинъи, которые почти поголовно заражены балантидиями и постоянно выделяют с фекалиями цисты этих паразитов. У взрослых свиней балантидии, находясь в просвете кишечника, не внедряются в ткань кишечной стенки и не вызывают болезненных явлений. У поросят в возрасте 1-2 мес, когда происходит первичное заражение их балантидиями от свиноматок, могут наблюдаться тяжелые патологические состояния на фоне различных эпизоотий, приводя к гибели 70-90 % молодняка. Животные вместе с фекалиями выбрасывают цисты, заражая окружающую среду.
Balantidium coli обнаружены у крыс, собак, обезьян и других животных. Человек, зараженный балантидиями, не имеет существенного значения в распространении инфекции, так как цисты в кишечнике человека образуются редко, а выделившиеся с фекалиями вегетативные формы во внешней среде быстро погибают.
Патогенез. Патологические изменения происходят преимущественно в слепой, сигмовидной и прямой кишках. Сначала на слизистой оболочке появляются участки отека и гиперемии, затем образуются эрозии. При проникновении балантидиев внутрь кишечной стенки возникают кровоизлияния, очаги некроза. Образующиеся язвы имеют округлые или неправильные очертания, изрезанные и утолщенные края, неровное дно, покрытое некротическими массами, белыми рыхлыми налетами, иногда гноем.
Возможны перфорация, перитонит, септицемия и в некоторых случаях летальный исход.
Клинические проявления. Балантидий часто живет в просвете кишечника, не оказывая какого-либо вредного влияния на организм человека. Такие лица - типичные носители. Клинические проявления варьируются от легких субклинических до крайне тяжелых.
Инкубационный период длится от 5 до 30 дней, чаще 10-15 дней. При остром начале для заболевания характерны лихорадка, интоксикация, резкая слабость, головная боль, диспепсические расстройства - снижение аппетита, тошнота, рвота. Одновременно появляются признаки поражения кишечника - боли в животе, метеоризм, водянистый стул до 20 раз в сутки с примесью слизи и крови и гнилостным запахом. При вовлечении в патологический процесс прямой кишки отмечаются тенезмы.
Длительность острой формы - 2-3 мес, но часто заболевание принимает затяжное или хроническое течение. Хроническая инвазия может быть рецидивирующей или непрерывной. Для хронической рецидивирующей формы характерны эпизоды неоформленного кашицеобразного стула, чередующиеся с запорами, и длительное течение до нескольких лет.
Диагностика. Основной метод диагностики - паразитологический (микроскопическое исследование мазка свежевыделенных фекалий больного на наличие вегетативных форм и цист паразита). Цисты в фекалиях человека обнаруживают редко.
Возможно паразитологическое исследование материала, взятого из-под края язвы при ректороманоскопии.
Микроскопическое исследование мазков при отрицательном результате повторяют многократно на протяжении 10-12 дней.
Культуральный метод заключается в посеве фекалий больного на среду Павловой и др. Балантидии на различных питательных средах живут недолго из-за отсутствия при культивировании полового процесса - конъюгации.
Эндоскопические методы (ректороманоскопия, фиброколоноскопия) позволяют обнаружить типичные изменения стенки кишечника и получить биопсийный материал из пораженных участков с целью выявления вегетативных форм балантидиев.
Профилактика. Профилактика балантидиаза состоит в соблюдении правил личной гигиены, санитарно-гигиенических норм при уходе за свиньями, обеззараживании их фекалий. Важное значение имеют своевременные выявление и лечение больных.
2.4. Тип Microspora (микроспоридии)
Микроспоридии - условно-патогенные СПИД-ассоциированные простейшие типа Microspora класса Microsporea. Описано 143 рода и более 1200 видов микроспоридий. Патогенные для человека виды представлены родами Encephalitozoon, Nosema, Branchiola.
Микроспоридии - древнейшие, очень мелкие, наиболее примитивные одноклеточные эукариотические облигатные внутриклеточные паразиты. Они не имеют митохондрий, аппарата Гольджи и лизосом. Отсутствие жгутиков, центриолей и наличие хитина в стенке споры сближают их с грибами. Вызывают микроспоридиоз в виде хронической диареи, гнойно-воспалительных заболеваний, кератита, диссеминированной инфекции у иммунодефицитных лиц.
Биология развития. Круг хозяев микроспоридий необычайно широк: от одноклеточных до позвоночных, включая человека. Животные и человек выделяют споры с калом и мочой. Расселение микроспоридий происходит при помощи мелких спор (0,6-4 мкм). Они содержат одноили двуядерный амебовидный зародыш и аппарат экстузии (выбрасывания), который состоит из полярной трубки, поляропласта, полярного диска и задней вакуоли.
Споры микроспоридий могут проникать в организм хозяина различными способами: перорально, через респираторный тракт, контактным путем (при поражении глаз). Наиболее часто наблюдается зоооральный механизм передачи.
Споры, попавшие в кишечник хозяина, подвергаются действию пищеварительных ферментов, в результате чего в них начинает проникать жидкость. За счет быстрого увеличения объема поляропласта в споре создается высокое давление. Вследствие этого полярная трубка выбрасывается, выворачиваясь наизнанку и пробивает стенку клетки хозяина; этот процесс напоминает выстрел. По каналу полярной трубки в цитоплазму клетки хозяина впрыскивается амебовидный зародыш микроспоры (спороплазма, или планонт). Он растет, претерпевает ряд морфологических преобразований и превращается в мерозоит.
Внутриклеточное размножение большинства микроспоридий происходит бесполым путем повторных делений надвое (мерогония), множественным делением (шизогония), спорообразованием (спорогония). Меронты первой генерации размножаются множественным делением, формируя одноили
двуядерные мерозоиты, которые дают начало меронтам второй генерации. При контакте с клеткой выбрасывается и спороплазма, попадая внутрь клетки. Подобное развитие происходит или при прямом контакте с цитоплазмой клетки-хозяина, или внутри паразитоформной вакуоли (например, Е. intestinalis). В обоих случаях в результате спорогонии созревают споры. Вокруг споры формируется плотная стенка, обеспечивающая устойчивость к окружающей среде. Споры, заполнившие клетку, разрушают ее и выходят во внешнюю среду или в межклеточное пространство. Созревшие клетки вновь инфицируют новые клетки.
Патогенез, клинические проявления и эпидемиология микроспоридиозов. Микроспоридии часто присутствуют в тканях хозяина, не вызывая воспалительной реакции, или приводят к развитию локальных гранулематозных процессов. В этих случаях инвазия протекает в форме бессимптомного паразитоносительства, и лишь при развитии иммунодефицитов она переходит в острую форму. У больных СПИДом некоторые микроспоридийные инфекции заканчиваются летально. С начала эпидемии СПИДа число выявляемых больных микроспоридиозами за короткое время возросло почти в 20 раз. Ведущую роль среди возбудителей оппортунистических микроспоридиозов занимает Enterocytozoon bieneusi.
Различные нозологические формы микроспоридиозов имеют специфические особенности.
Диагностика. Подозрение на микроспоридиоз может возникнуть при развитии у больных СПИДом хронически протекающей диареи, кератоконъюнктивитов, поражений дыхательных путей, почек и печени, если их этиология не была установлена, а исследования на другие виды простейших, вирусы и бактерии дали отрицательные результаты.
Прижизненный диагноз микроспоридиоза у больных СПИДом ставят главным образом при развитии диссеминированной формы заболевания. Для подтверждения диагноза исследуют мазки фекалий, смешанные с 10 % формалином в соотношении 1:3 и окрашенные трихромовым красителем. При подозрении на диссеминированную инфекцию, особенно на фоне кератоконъюнктивита, исследуют также смывы с роговицы, мокроту, осадок мочи, биоптаты слизистой оболочки мочевого пузыря и двенадцатиперстной кишки. При исследовании окрашенных мазков с иммерсией определяются овоидные споры розовато-красного цвета размером 2-4 мкм. Большинство же бактерий окрашиваются в зеленый цвет - цвет фоновой окраски.
Профилактика. Профилактика микроспоридиозов состоит в соблюдении правил личной гигиены, санитарно-гигиенических норм при уходе за животными, обеззараживании их фекалий. Важное значение имеют своевременные выявление и лечение больных.
СИТУАЦИОННЫЕ ЗАДАЧИ ПО ТЕМЕ «МЕДИЦИНСКАЯ ПРОТОЗООЛОГИЯ»
1. Больной обратился в лечебно-диагностическое учреждение с жалобой на наличие крови в фекалиях. При эндоскопическом обследовании кишечника были обнаружены язвы. В результате копрологического анализа фекалий больного были обнаружены трофозоиты Entamoeba histolytica. Какие существуют вегетативные формы трофозоита? Какая из них является патогенной? Какие изменения происходят в эритроците под действием этого возбудителя?
2. Назовите непатогенную амебу с локализацией в кишечнике, которую обнаруживают у 40-50 % населения. Сколько ядер содержат цисты данной амебы? Является ли она гематофагом?
3. Свободноживущие амебы, паразитизм которых не является обязательным. Обитают в почве и теплых стоячих водоемах. Заражение происходит при купании. Амебы проникают в носоглотку. Назовите эти амебы. Какие органы они поражают? Какие заболевания они вызывают?
4. Женщина обратилась в женскую консультацию для профилактического осмотра, во время которого были сделаны мазки из влагалища, в результате чего был обнаружен паразит. Назовите этого паразита. Где он локализуется, помимо влагалища, у женщин? Где локализуется этот паразит у мужчин?
5. К педиатру обратились родители ребенка. В последнее время у него наблюдается кишечное расстройство. При микроскопическом исследовании фекалий обнаружены грушевидные трофозоиты длиной 10-18 мкм с двумя ядрами. Диагноз? Возможно ли бессимптомное носительство? Профилактика?
6. При дуоденальном зондировании в отделяемой жидкости был обнаружен грушевидный трофозоит с билатеральной симметрией, двойным набором органелл и присасывательным диском на уплощенной стороне. Что это за паразит? Какое заболевание он вызывает? В каких двух формах существует этот паразит?
7. Больной обратился к врачу с жалобой на слабость, сонливость, частые головные боли. При опросе врач выяснил, что больной был в странах Африки примерно 4 года назад, и заподозрил заражение паразитом. Что это за паразит? Какое заболевание он вызывает? Какие типы этой болезни существуют?
8. Больной обратился к врачу с повышенной температурой, увеличенными лимфатическими узлами, печенью и селезенкой. При опросе больной предположил, что, возможно, во время поездки в Африку его укусила муха. При исследовании мазка крови были обнаружены паразиты с веретенообразными клетками длиной 15-30 мкм, с ядром в центре, кинетопластом на заднем конце тела, вблизи которого начинается жгутик. Что это за возбудитель и какую болезнь он вызывает?
9. Заболевание, которое распространено в тропиках, субтропиках. Заражение происходит трансмиссивно (инокуляция) через укус москитов, в слюнных железах которых находятся промастиготы. В месте укуса образуется медленно растущий бугорок, который затем начинает изъязвляться. Язва сухая и локализуется в основном на коже верхней части тела, лице, руках. Что это за заболевание, какой паразит является его возбудителем? Какие типы различают?
10. Больной обратился к дерматологу с жалобой на поражения кожи ног. При осмотре дерматолог обнаружил мокнущие язвы на нижних конечностях. После микроскопического исследования отделяемого язв было обнаружено небольшое количество промастиготных форм возбудителя. Диагноз? К какому типу относится это заболевание? Какие типы существуют, помимо этого, и в чем их отличия?
11. Заболевание, при котором поражаются клетки ретикулоэндотелиальной системы (печень, селезенка, костный мозг, лимфатические узлы и желудочно-кишечный тракт). Инкубационный период от 20 дней до 3-5 мес. Возбудитель попадает в кровь после укуса москита рода Phlebotomus. Диагноз? Название паразита? Какие существуют варианты данного возбудителя?
12. В районную поликлинику обратился больной с кровавым поносом и общим истощением. При составлении анамнеза было обнаружено, что он разводит свиней. Предположительный диагноз? Необходимые исследования? Рекомендации по профилактике?
13. В детскую инфекционную больницу по скорой помощи поступил мальчик с симптомами менингоэнцефалита, увеличенными лимфатическими узлами, печенью, селезенкой. Предположительный диагноз? Какой самый эффективный метод диагностики необходимо использовать?
14. У женщины произошел выкидыш. При исследовании абортивного материала были обнаружены паразиты, имеющие форму апельсиновой дольки или полумесяца, длиной 4-7 мкм, шириной 2-4 мкм. Что явилось причиной гибели плода?
15. К кардиологу обратился мужчина средних лет с жалобами на боли в сердце и повышенную усталость, апатию и сонливость. Ранее он никогда не жаловался на свое здоровье, вел здоровый образ жизни, в прошлом профессионально занимался спортом, вредных привычек не имел. При опросе врач выяснил, что
3 мес назад пациент ездил на отдых в Мексику, где его покусали насекомые. При обследовании были обнаружены расширение границ сердца, уменьшение сердечного выброса, увеличение печени и селезенки. Ваш предположительный диагноз? Необходимые исследования для подтверждения диагноза?
16. К врачу обратился больной с жалобами на озноб и температуру, которая «скачет» от нормальной до 41 оС, сопровождаясь сильным ознобом и потоотделением. Такие приступы длятся 7-8 ч с интервалом 72 ч. Предположительный диагноз? Необходимые исследования?
17. Спорозоиты, попавшие в кровь человека при укусе комаром, проникают в клетки печени, где превращаются в трофозоитов (кольцевидный, юный, полувзрослый, взрослый), потом шизонтов, которые делятся в процессе шизогонии с образованием мерозоитов. Когда клетки печени лопаются, из нее в кровь выходит мерозоит. Какая эта стадия малярии? В каком хозяине она проходит?
18. Микро- и макрогаметоциты (незрелые половые клетки) попадают в желудок, где образуются микро- и макрогаметы (зрелые половые клетки). В результате слияния гамет образуется зигота (червеобразная оокинета), которая внедряется в стенку желудка, обращенную в полость тела, и превращается в ооцисту. В ооцисте формируются спорозоиты. Когда ооциста лопается, спорозоиты попадают в полость тела, затем в слюнные железы и становятся инвазионными. Какая это стадия малярии и в каком хозяине она проходит?
19. При этом заболевании происходит завершение спорогонии, т. е. формирование зрелой ооцисты, в которой находятся 2 спороцисты с четырьмя банановидными спорозоитами. Предположительный диагноз? Где эта стадия проходит? Что с ней происходит дальше?
20. Больной обратился к врачу с головной болью в области лба, затем появились тошнота, рвота, лихорадка и ригидность затылочных мышц. Из анамнеза выяснилось, что он недавно приехал из США, где несколько дней купался в пресной воде. Предположительный диагноз? Необходимые исследования?
21. Мужчина 45 лет, страдающий хроническим простатитом, обратился к урологу для профилактического осмотра. Уролог произвел забор биологического материала из уретры, и при посеве мазка на флору был обнаружен возбудитель. Какой это возбудитель? Как называется заболевание? Предложите возможные варианты попадания этого возбудителя в организм человека.
22. К отоларингологу обратился молодой мужчина с жалобой на образование язв в носовой полости и дыхательных путях. При опросе больного выяснилось, что он примерно 2 мес назад путешествовал по странам Южной Америки, где было большое количество насекомых, которые неоднократно кусали его, но молодой человек не мог предположить, что эти насекомые могут быть возбудителем какого-либо заболевания. При микроскопическом исследовании отделяемого язв был обнаружен возбудитель. Что это за возбудитель? Предположительный диагноз?
23. Молодая замужняя женщина забеременела. Какого заболевания ей необходимо опасаться и какие меры профилактики нужно применять, если недавно она приобрела кошку?
24. При микроскопическом исследовании мазка крови были обнаружены эритроциты с амебовидным паразитом внутри, с хорошо развитыми ложноножками. Обнаружены лентовидные формы. Размер эритроцитов не изменен. Предположительный диагноз?
25. К гастроэнтерологу обратился мужчина, страдающий хроническим энтеритом (воспаление слизистой оболочки тонкой кишки) с жалобой на то, что обычное лечение в домашних условиях не принесло никаких результатов, поэтому мужчина предположил, что, возможно, причиной обострения энтерита является какой-то паразит. При микроскопическом исследовании жидких фекалий больного были обнаружены вегетативные формы возбудителя (бобовидные). Предположительный диагноз? Возможный вариант попадания возбудителя в организм больного? Меры профилактики?