Медицинская паразитология: Учебное пособие / Под ред Н. В. Чебышева. - 2012. - 304 с.: ил.
|
|
|
|
Глава 1. НЕКОТОРЫЕ ВОПРОСЫ ОБЩЕЙ ПАРАЗИТОЛОГИИ
1.1. Паразитизм как явление
В различных биоценозах организмы связаны между собой межвидовыми и внутривидовыми биотическими взаимодействиями. Наибольшее значение для медицины имеет паразитизм - форма взаимоотношений между организмами разных видов, при которой один организм (паразит) использует другого (хозяина) как источник питания и временную или постоянную среду обитания, нанося ему определенный вред. Паразит физиологически и экологически зависит от организма хозяина в течение определенной части своего жизненного цикла. Высокий репродуктивный потенциал паразита приводит к тому, что величина популяции паразита обычно значительно превышает численность популяции хозяина, и этот признак отличает паразитизм от хищничества.
Паразитический образ жизни могут вести самые разнообразные организмы. Все вирусы являются паразитами, их изучает отдельная наука - вирусология. Паразитические прокариоты изучает микробиология, паразитические грибы - микология, паразитизм в растительном мире - фитопатология,па- разитов-животных, или зоопаразитов, - паразитология. В свою очередь паразитология включает следующие разделы: медицинскую протозоологию, изучающую паразитические формы простейших; медицинскую гельминтологию, изучающую паразитических червей, и медицинскую арахноэнтомологию, изучающую опасных для человека членистоногих.
На долю зоопаразитов приходится 6-7 % от общего числа известных видов животных, однако среди первично-примитивных форм паразитизм встречается более часто, чем среди высокоорганизованных организмов.
Паразиты в экосистемах являются консументами 2-го и 3-го порядков и играют существенную роль в биотическом круговороте веществ. Самые патогенные из них, вызывающие гибель большого числа особей хозяев, выступают как стабилизаторы численности хозяев, избыток которой мог бы привести к нарушению экологического баланса. Вместе с тем наиболее тяжелое течение паразитарных заболеваний обычно наблюдается у особей с ослабленным иммунитетом, имеющих наследственные дефекты или врожденную предрасположенность к аллергическим реакциям. Гибель именно этих организмов оказывает на генетическую структуру популяций хозяина благотворное влияние, убирая из его аллелофонда аллели, снижающие жизнеспособность. Таким образом, взаимоотношения между популяциями хозяев и паразитов в условиях конкретных биогеоценозов способствуют их устойчивости и одновременно выступают как фактор естественного отбора, снижая неспецифический генетический груз популяции хозяина.
В связи с социальностью человека паразитизм как фактор естественного отбора в настоящее время практически не имеет значения в человеческих популяциях, однако целенаправленная борьба человека с паразитами, несомненно, является важным фактором эволюции самих паразитов.
1.1.1. Формы паразитизма
Формы паразитизма могут быть весьма разнообразными. Истинный паразитизм является эволюционно-закономерной формой взаимоотношений между двумя организмами, когда другая форма существования для паразита невозможна, при этом истинный паразитизм может проявляться как облигатный, т. е. обязательный и постоянный для данного вида организмов, и как факультативный, когда жизненный цикл паразита может включать и свободный образ жизни, а при попадании его в другой организм он паразитирует в этом организме-хозяине. Примером истинного облигатного паразитизма может служить присутствие малярийных плазмодиев в крови, сосальщиков - в печени хозяина, аскариды - в кишечнике, чесоточного зудня - в кожном покрове и т. п. К факультативному паразитизму можно отнести внедрение личинок угрицы кишечной в организм человека через кожный покров и их миграцию в кишечник, хотя они могут развиваться при благоприятных условиях в почве. Кроме того, существует ложный паразитизм, представляющий собой случайное явление для данного вида, при этом ложный паразит некоторое время сохраняет жизнеспособность в организме хозяина и наносит ему вред, но обычным для него является независимый образ жизни. Примером ложного паразитизма является попадание пиявок в носоглотку человека во время купания. Такой ложный паразитизм пиявок может привести к смерти хозяина в результате закупорки дыхательных путей или кровотечения.
По времени контакта паразита и хозяина различают паразитизм постоянный, когда паразит проходит на теле хозяина или внутри него весь свой жизненный цикл, и временный, если паразит использует тело хозяина только для питания или размножения.
Постоянные паразиты подразделяются на стационарных и периодических. Стационарные паразиты всю жизнь проводят на теле хозяина или внутри него. В качестве примеров можно назвать вшей, чесоточного клеща, трихинеллу и др. Периодические паразиты часть своего жизненного цикла проводят в паразитическом состоянии, остальное время обитают свободно. Типичным паразитом такого рода является угрица кишечная.
Нередко паразитический образ жизни ведут только личинки, в то время как половозрелые формы являются свободноживущими. Паразитизм такого рода называют ларвальным (личиночным). Примеры - вольфартова муха, оводы и др. Противоположное явление, когда паразитом служит половозрелая форма, а личинка обитает в открытой природе, называют имагинальным паразитизмом. К паразитам этого типа относят, например, анкилостомид, личинки которых живут в почве, а взрослые стадии - в двенадцатиперстной кишке человека.
Наибольшее медицинское значение имеет классификация паразитизма по локализации паразитов в организме хозяина. По этому принципу различают эктопаразитизм, когда паразиты (эктопаразиты) находятся на поверхности тела хозяина, не внедряясь в его ткани или органы, и эндопаразитизм, когда паразиты (эндопаразиты) обитают в тканях или органах хозяина. К эктопаразитам относят кровососущих насекомых и клещей, а к эндопаразитам - всех паразитических простейших, гельминтов и некоторых мелких членистоногих (например, чесоточного зудня, личинок вольфартовой мухи, песчаную блоху и др.).
Любой вариант классификации паразитизма не дает возможности строго разграничить формы этого сложного экологического явления. Отсутствие
четких границ между разными формами паразитизма отражает объективную ситуацию - эволюцию этого экологического феномена.
Многие виды на протяжении жизненного цикла могут быть по отношению к разным хозяевам и ларвальными, и имагинальными паразитами. Так, сосальщики на начальных этапах развития ведут свободный образ жизни. Позже их личинки обитают в промежуточном хозяине, затем вновь образуются свободноживущие личинки, которые, обнаружив второго промежуточного или окончательного хозяина, паразитируют у него в половозрелой стадии.
В процессе жизнедеятельности паразиты нередко мигрируют в организме хозяина и способны, таким образом, сначала обитать в полостных органах, а затем перемещаться в ткани внутренней среды. Таковы трихинелла и свиной цепень. Возможен переход от эктопаразитизма к паразитированию в тканях внутренней среды. К таким паразитам относятся, например, личинки вольфартовой мухи.
Своеобразной экологической группой паразитов являются сверхпаразиты. В качестве среды обитания и источника питания они используют другие паразитические организмы. Обычно сверхпаразиты более мелкие и характеризуются более низкой организацией, чем паразиты. Они могут поражать как простейших, так и многоклеточных паразитов. Сверхпаразитизм - широко распространенное явление. Среди сверхпаразитов, обитающих в паразитах человека, известно несколько видов микроспоридий, относящихся к классу споровиков и встречающихся в цитоплазме балантидия, в клетках паренхимы цепней и в гонадах аскарид.
Сверхпаразиты имеют огромное экологическое значение, выполняя функции стабилизаторов численности популяций паразитов. Медицинское значение сверхпаразитов еще не изучено, но не исключено, что и в популяциях человека они могут выполнять роль факторов, сдерживающих численность паразитов.
Любой подход к классификации паразитизма не позволяет строго разграничить формы этого сложного экологического явления, так как сама его эволюция предопределила отсутствие четких границ между его различными вариантами.
1.1.2. Происхождение паразитизма
Происхождение паразитизма отличается многообразием. Даже один тип паразитизма, например эктопаразитизм, в разных группах животных мог возникнуть разными путями. Можно выделить следующие главные пути возникновения паразито-хозяинных отношений.
Большая часть эктопаразитов происходит от хищников. Комары, москиты и другие кровососущие насекомые мало чем отличаются от обыкновенных хищников. Клопы демонстрируют дальнейший переход к паразитизму, так как их контакт с телом хозяина во время питания становится более длительным. У некоторых клещей (например, Ixodes) мы наблюдаем еще более длительный контакт с хозяином, который в еще большей степени развит у блох, у которых только личинки и куколки живут на свободе, а половозрелые особи большую часть жизни проводят на хозяине. От этих длительных, но все же периодических паразитов остается лишь один шаг до постоянных, остающихся в течение всей жизни и во всех стадиях развития на хозяине. Необходимо только, чтобы и яйца, как это можно наблю-
дать у вшей, не выбрасывались во внешнюю среду, а откладывались и развивались здесь же, на хозяине.
В основе еще одного пути возникновения эктопаразитизма лежит сидячий образ жизни, когда малоподвижные животные прикрепляются не к обычному субстрату (дну водоема, почве, растениям), а к другому организму.
В появлении эктопаразитизма несомненную роль сыграл также постепенный переход мелких хищников от полифагии к монофагии, т. е. все большее их специализирование в смысле характера пищи.
Происхождение эндопаразитизма в отдельных случаях также можно связать с предшествующим ему эктопаразитизмом. Примером могут служить некоторые клещи-пухоеды, которые затем мигрировали с перьев птиц в подклювный мешок и стали питаться кровью.
В некоторых случаях путь к эндопаразитизму лежал через изменение инстинкта откладки яиц. Вместо откладки яиц на гниющем материале они могли случайно попасть и развиваться на язвах и ранах животных, где условия оказались более благоприятными. Такое явление можно проследить у личинок вольфартовой мухи и оводов.
Между тем большинство случаев внутреннего паразитизма, а именно случаи кишечного паразитизма, представляют собой вторичное явление, развившееся в результате случайного заноса в пищеварительную систему яиц или покоящихся стадий свободноживущих организмов.
Таким образом, можно говорить о нескольких путях перехода к паразитическому образу жизни от свободного, однако их многообразие свидетельствует о вторичном происхождении явления паразитизма, так как при всем многообразии его форм каждая из них у паразита обязательно имеет свободноживущую стадию, свидетельствующую о свободном образе жизни предков.
1.2. Особенности взаимоотношений в системе паразит-хозяин
1.2.1. Пути проникновения паразитов в организм хозяина
Хозяин, являясь хорошей экологической нишей для паразита, должен обладать уникальными физиологическими особенностями, максимально подходящими для существования паразита, быть полноценным источником питательных веществ для него и представлять как минимум один способ выхода инвазионной формы паразита из организма для передачи другим хозяевам.
Активный паразит должен обладать соответствующими механизмами, обеспечивающими его передачу (или его потомства) новым хозяевам. В этом отношении эктопаразиты имеют определенные преимущества, так как либо являются в той или иной степени свободноживущими, либо могут легко передаваться при контакте одного хозяина с другим (например, человеческая вошь). Процесс распространения эндопаразитов в определенной степени затруднен. Хотя эти паразиты в ходе эволюции приобрели способность поражать практически все ткани и органы хозяина, возможные пути их распространения ограничены.
При специфической локализации паразита (возбудителя) на слизистой оболочке дыхательных путей он выводится с выдыхаемым воздухом. В связи с этим заражение, т. е. внедрение в восприимчивый организм, происходит при вдыхании загрязненного (контаминированного) воздуха, в результате чего возбудитель вновь локализуется в дыхательных путях нового организма. Такой механизм передачи возбудителей инфекционных и паразитарных болезней называют аспирационным (воздушно-капельным, аэрогенным, респираторным).
Локализация паразита (возбудителя) преимущественно в кишечнике, печени или поджелудочной железе определяет его выведение из зараженного организма с экскретами (фекалиями, рвотными массами). Проникновение в восприимчивый организм в этом случае происходит чаще всего через рот, главным образом при заглатывании загрязненной воды или пищи либо с грязных рук, после чего паразит вновь локализуется в пищеварительном тракте нового организма. Такой механизм передачи возбудителей кишечных инфекций и инвазий называют пероральным (фекально-оральным).
Специфическая локализация паразита (возбудителя) преимущественно на наружных покровах - коже и ее придатках, слизистых оболочках, имеющих выход во внешнюю среду, определяет возможность перехода его на наружные покровы восприимчивого организма при соприкосновении (контакте) с источником, поэтому такой механизм передачи возбудителей болезней называют контактным.
При специфической локализации возбудителя (паразита) преимущественно в кровеносной системе (в крови или лимфе) или других внутренних органах он выводится из зараженного организма через укус кровососущего членистоногого (насекомого или клеща) и вводится в кровеносную систему восприимчивого организма при новом кровососании. Такой способ передачи возбудителей болезней непосредственно в кровеносную систему называют трансмиссивным. Существует ряд заболеваний, при которых передача возбудителя болезни иным способом (нетрансмиссивным) невозможна. Эту группу заболеваний называют облигатно-трансмиссивными. К ним можно отнести малярию, лейшманиозы, желтую лихорадку, японский энцефалит и др. В то же время ряд заболеваний, помимо трансмиссивного пути передачи, может распространяться и иным путем, например воздушно-капельным, контактным, алиментарным и т. д. К группе факультативно-трансмиссивных болезней относят такие особо опасные инфекции, как таежный клещевой энцефалит, чума, туляремия, сибирская язва, бруцеллез и др. В свою очередь трансмиссивная передача может осуществляться посредством двух механизмов:
• инокуляции, когда возбудитель проникает в кровь хозяина через ротовой аппарат членистоногого непосредственно при кровососании;
• контаминации, когда возбудитель выделяется членистоногим с фекалиями или иным путем на тело хозяина, а затем попадает в кровь через повреждения на коже (раны, расчесы и т. п.).
Если же паразит (возбудитель) в какой-либо стадии развития сам не покидает организм хозяина и его передача другому организму возможна только при поедании первого хозяина, такой способ передачи (заражения) называется алиментарным.
Некоторые паразиты внедряются в организм хозяина в стадии свободноживущих личинок через поврежденную или неповрежденную кожу или слизистые оболочки. В этом случае способ заражения называют перкутанным (т. е. через кожу).
Возбудители ряда заболеваний могут передаваться «по вертикали» от матери плоду, иногда многократно (например, при токсоплазмозе у грызунов). В этом случае передача возбудителя будет трансплацентарной.
Еще более редки случаи трансфузионного заражения при оказании акушерско-хирургической помощи, гемотрансфузии (переливании крови) или трансплантации органов.
1.2.2. Адаптации паразитов
к паразитическому образу жизни
Переход к паразитическому образу жизни сопровождается появлением у паразитов ряда адаптаций (приспособлений), облегчающих их существование, развитие и размножение в специфических условиях организма хозяина. Разнообразие форм паразитизма, различное систематическое положение паразитов (их принадлежность к разным отрядам, классам и типам), а также обитание их в разных органах и системах хозяина обусловливают многообразие этих адаптаций.
Между тем некоторые приспособления паразитов универсальны. К ним в первую очередь относятся особенности половой системы и как следствие - высокая плодовитость. Возможность оставить потомство, которое попадет в благоприятную среду - организм хозяина, у паразитов очень низка. В связи с этим интенсивность размножения паразитов по сравнению со свободноживущими формами гораздо более велика. Это достигается разными способами.
Некоторые паразиты из типа простейших приобретают способность к множественному делению - шизогонии, когда из одного паразита может образоваться более 1000 дочерних особей, или к спорогонии, в результате которой из одной особи могут образоваться десятки тысяч организмов следующего поколения.
Для многоклеточных характерны высокая сильная степень развития половой системы и образование огромного количества половых продуктов. Этому способствуют первичный гермафродитизм плоских червей, изначально высокая плодовитость круглых червей и основной массы членистоногих. Нередко высокая интенсивность полового размножения дополняется размножением личиночных стадий жизненного цикла. Этим особенно отличаются сосальщики, личинки которых размножаются партеногенетически, а у некоторых ленточных червей - внутренним или наружным почкованием.
Практически у всех эктопаразитов и паразитов, обитающих в полостных органах, имеются адаптации для прикрепления к телу хозяина. Они встречаются у простейших (коноид у споровиков, присасывательные диски у лямблий), гельминтов (присоски, шипики, крючья, ботрии у плоских червей, хитинизированный ротовой аппарат у ряда круглых червей) и паразитических членистоногих (хелицеры и педипальпы - своеобразные конечности).
Эндопаразиты, обитающие в полостных органах, имеют покровы, обладающие антиферментными свойствами, быстро регенерирующие либо вообще непроницаемые для ферментов хозяина. Паразиты, живущие в тканях, часто в них инкапсулируются.
Паразиты, питающиеся кровью, имеют слюнные железы с антикоагулянтной слюной (у круглых червей, кольчатых червей, членистоногих), колющесосущий ротовой аппарат, а также сильно растяжимый хитиновый покров (у членистоногих), сильно разветвленную пищеварительную трубку (у со-
сальщиков, кольчатых червей и членистоногих) и обладают консервантными свойствами ферментов пищеварительной системы (у кольчатых червей и членистоногих).
Эндопаразиты, активно отыскивающие хозяина, имеют органы ориентации в среде, используемые для поиска хозяина (светочувствительные глазки, термо- и хеморецепторы), и органы передвижения.
Передний конец тела паразитов, внедряющихся в организм хозяина, снабжен органами проникновения - специализированными железами, колющими стилетами и т. д. Это относится даже к некоторым простейшим, способным проникать в ткани хозяина через неповрежденные покровы.
Все паразиты, развивающиеся со сменой хозяев, используют в качестве таковых виды, связанные между собой непосредственными пищевыми взаимоотношениями или обитающие с ними в одной среде. Большинство промежуточных хозяев являются источником питания для основных. Другой распространенный путь попадания паразита в организм хозяина - использование многочисленных переносчиков, которые обеспечивают не только постоянную циркуляцию паразитов в экологических системах, но и их широкое расселение.
Высшей степенью адаптации паразитов к хозяевам является часто наблюдаемая полная зависимость паразита от жизнедеятельности хозяев, при этом паразит нередко вызывает у хозяина такие реакции, которые обеспечивают максимальную вероятность заражения последнего. Так, самки остриц, откладывая яйца в области анального отверстия, вызывают зуд. Расчесывание зудящих мест способствует распространению яиц этого паразита через руки на окружающие предметы. Таким же образом обеспечивается расселение чесоточного клеща. Зуд в пораженной конечности, прекращающийся от соприкосновения с водой, способствует циркуляции в природе такого паразита, как ришта. Высокая температура и обильное потоотделение у лиц с паразитарными заболеваниями, распространяющимися через кровососущих членистоногих, нередко привлекают переносчиков с больших расстояний и также оказываются полезными для паразитов.
Особенности жизнедеятельности паразитов часто синхронизированы с образом жизни хозяев. Так, откладка яиц шистосомами происходит обычно в самое жаркое время суток, когда наиболее вероятен контакт хозяев с водой, куда для развития должны попасть яйца этих паразитов. В это же время в поверхностных слоях воды скапливаются в поисках хозяев церкарии этих шистосом. Таким образом облегчается циркуляция паразита сразу в двух стадиях его жизненного цикла. Если в циркуляцию паразита вовлечены несколько хозяев, то наблюдаются взаимные адаптации, оказывающиеся выгодными паразитам и обеспечивающие их эффективное развитие. Так, выход микрофилярий в кровеносные сосуды человека происходит в вечерние и ночные часы, соответствующие периоду максимальной активности кровососущих насекомых, являющихся их переносчиками.
Нередко паразиты модифицируют поведение одних хозяев таким образом, что в результате облегчается их попадание к другим. Например, рыбы, пораженные личинками ленточных червей, плавают в основном у поверхности воды и чаще вылавливаются рыбаками и хищными животными. Ленточные черви, использующие в качестве промежуточных хозяев копытных животных, снижают их жизнеспособность, и, таким образом, хищники поедают их в первую очередь. Сосальщики, заражающие травоядных животных и человека при случайном проглатывании насекомых, вызывают обездвиживание последних и плотное прикрепление к растениям, облегчающее их попадание в пищеварительный тракт хозяина.
Одновременно с перечисленными признаками несомненными адаптациями к паразитизму являются также свойства паразитов переживать неблагоприятные условия внешней среды. Большинство простейших, заражение которыми происходит без участия переносчиков, во внешней среде способны инцистироваться. Яйца большинства гельминтов обладают феноменальной устойчивостью к неблагоприятным воздействиям. Инкапсулированные личинки трихинелл переносят не только промораживание, кипячение, но и многократное прохождение через пищеварительную систему рыб, земноводных, птиц, насекомых и ракообразных, не теряя жизнеспособности.
Для большинства паразитов, попавших в организм окончательного хозяина, существует комплекс условий, являющийся сигналом к началу активной жизнедеятельности. У млекопитающих он часто неспецифичен: это температура тела около 37оС, водная среда и высокая ее кислотность, а также наличие ферментов желудочного сока. Такие условия характерны для желудка любого млекопитающего, поэтому цисты, яйца и другие инвазионные стадии паразитов у разных млекопитающих могут, попадая в желудок человека, начинать развиваться. Некоторые из них проходят лишь часть цикла и, не находя специфических условий, гибнут, успевая, однако, привести к тяжелым последствиям.
Многие паразиты в ходе эволюции выработали механизмы, позволяющие им ослаблять неблагоприятное влияние иммунитета хозяина, поэтому длительные и повторные инвазии возможны только в случае снижения иммунитета хозяина.
Многие простейшие обитают внутри клеток, что делает их малодоступными для антител хозяина. Кроме того, такие паразиты способны размножаться и расселяться в организме хозяина, не выходя даже за пределы клеток, потому что клетки хозяина, в которых они находятся, нередко сохраняют способность к делению и перемещению.
Преимущества некоторым паразитам дает и локализация в тканевой жидкости, где концентрация антител обычно в 5 раз ниже, чем в плазме крови.
На паразитов, обитающих в просвете кишечника, не действуют ни антитела плазмы крови, ни механизмы клеточного иммунитета. Некоторые взрослые гельминты покрыты толстой кутикулой, которая в неповрежденном виде почти не вызывает защитных реакций со стороны хозяина.
Некоторые паразиты прибегают к очень своеобразному средству защиты - антигенной маскировке. Они синтезируют поверхностные антигены, настолько сходные с белками хозяина, что организм не распознает их как чужеродные. Другие паразиты заимствуют антигены хозяина, включая антигены групп крови, и, таким образом, также не воспринимаются хозяином как чужеродный материал.
Ряд паразитов находятся в тканях внутренней среды в инкапсулированном состоянии. В состав стенки капсулы входят как компоненты хозяина, так и паразита. В неповрежденном виде стенка такой капсулы почти непроницаема, поэтому через нее не выходят антигены паразита и не проникают антитела хозяина.
Паразитические простейшие способны менять антигенную структуру своей оболочки, причем разными путями. Это может быть либо естественный отбор, приводящий к возникновению популяций паразитов с новыми антигенными свойствами, как в случаях с малярийным плазмодием, либо, как у трипаносом, поочередная активация разных, но функционально сходных и родственных по происхождению генов, постоянно меняющих антигенную конституцию организма.
Указанные особенности паразитов, общие для многих из них, не состоящих в родстве, возникли в разных группах независимо друг от друга, иллюстрируя конвергентный характер эволюции организмов разных видов, классов и типов, адаптирующихся к сходным условиям.
1.2.3. Факторы восприимчивости организма хозяина к паразиту
С медицинской точки зрения патогенность - это способность возбудителя проникать в макроорганизм, размножаться и вызывать в нем комплекс патологических изменений. Патогенность - генотипический признак, т. е. закрепленный в геноме и передающийся по наследству. Этот признак свойствен виду и практически не зависит от воздействия факторов окружающей среды. Степень фенотипической экспрессии патогенности определяется вирулентностью (от лат. virulentus - ядовитый). Вирулентность - фенотипический признак, который зависит от условий окружающей среды, подвержен изменчивости и свойствен отдельным штаммам. Различные факторы генетической и негенетической природы обусловливают разную чувствительность организма хозяина к паразиту.
Среди негенетических факторов выделяют возраст, питание, гормональный статус, сопутствующие заболевания и особенности их лечения. Изучение распределения паразитов в популяциях хозяина показало, что оно зависит от многих факторов. Одним из них является возраст хозяина. Ряд паразитов чаще встречается у взрослых хозяев. Действительно, у взрослых организмов больше шансов для соприкосновения со многими паразитами, в результате чего они могут быть инвазированы. Например, влагалищная трихомонада поражает только половозрелых людей потому, что передается только половым путем.
Человек заражается дифиллоботриозом и описторхозом, поедая рыбу, прошедшую недостаточную термическую обработку. Такой путь заражения маловероятен для ребенка. Восточно-африканский трипаносомоз чаще встречается у людей среднего возраста - охотников, путешественников, членов геолого-разведочных партий в необжитых саваннах Африки. Эта закономерность часто проявляется и у промежуточных хозяев: взрослые крупные рыбы имеют больше возможностей стать носителями метацеркарий сосальщиков или плероцеркоидов ленточных червей, чем мелкие молодые особи.
Другие паразиты чаще встречаются у детей. Во-первых, это связано с незрелостью иммунной системы детей, а во-вторых, - с не отработанными еще навыками личной гигиены, поэтому для детей характерен особый спектр паразитарных заболеваний, при заражении которыми большое значение имеет состояние иммунитета, а инвазия происходит просто при проглатывании цист, яиц или личинок без участия промежуточных хозяев. К таким заболеваниям относятся лямблиоз, энтеробиоз, трихоцефалез, гименолепидоз, аскаридоз. Более частому заражению детей способствует их тесный и продолжительный контакт друг с другом в детских учреждениях. У детей с нарушенным белковым питанием более тяжело протекают амебиаз, стронгилоидоз и пневмоцистоз, в то время как тропическая малярия - легче, причем такие дети почти никогда не умирают от ее церебральных форм.
Вероятность заражения также часто зависит от профессии. Так, балантидиазом чаще заражаются работники свиноферм, тениозом и тениаринхо-
зом - работники мясокомбинатов, анкилостомидозами в умеренных широтах - шахтеры, а в тропиках - работники сельского хозяйства. Дифиллоботриозом чаще заражаются рыбаки, а альвеококкозом - охотники и лица, занимающиеся обработкой мехового сырья.
Лица с тяжелыми формами злокачественных опухолей, как правило, не заражаются висцеральным лейшманиозом. Железодефицитные анемии практически обеспечивают защиту человека от малярии, в то время как лечение препаратами железа усугубляет тяжелое течение этого заболевания.
Злокачественные опухоли толстой кишки и женской половой системы утяжеляют течение амебиаза и трихомоноза.
Запоры и все нарушения перистальтики кишечника способствуют утяжелению стронгилоидоза и аутоинвазии паразита.
Поражение периферической нервной системы усугубляет течение чесотки. Все иммунодефицитные состояния (СПИД, лечение кортикостероидными гормонами и иммунодепрессантами) приводят к утяжелению течения большинства инвазионных заболеваний. Например, криптоспоридиоз - это острое непродолжительное заболевание, заканчивающееся спонтанным выздоровлением, но у ВИЧ-инфицированных оно протекает в тяжелой форме и при отсутствии адекватной терапии заканчивается летально. У иммунокомпетентных лиц латентно протекающий токсоплазмоз нередко на фоне ВИЧ-инфекции реактивируется и поражает легкие, ЦНС, лимфатические узлы, миокард. В отличие от классического средиземноморского висцерального лейшманиоза, который еще называют детским, поскольку его регистрируют преимущественно у детей, висцеральный лейшманиоз у взрослых ВИЧ-инфицированных приобретает злокачественный характер и сопровождается резистентностью к специфическим препаратам, вследствие чего продолжительность жизни больного сокращается.
Острое течение паразитозов наблюдается и у беременных. У детей с нарушенным белковым питанием тяжелее протекают амебиаз, пневмоцистоз. Различные иммунодефицитные состояния приводят к тяжелым формам лямблиоза с длительным течением, в то время как у иммунокомпетентных лиц возможно спонтанное выздоровление.
Острое течение болезни может развиваться у человека при заражении его недостаточно адаптированными к нему паразитами животных, например возбудителем африканского трипаносомоза родезийского типа, типичного зооноза. T.b. rhodesiense вызывает острую инфекцию, нередко гибель наступает в пределах 1 мес после появления клинических симптомов. Другой возбудитель африканской сонной болезни - T.b. gambiense - хорошо адаптирован к организму человека и вызывает заболевание, характеризующееся длительным бессимптомным периодом и многолетним хроническим течением, предполагается даже возможность «здорового носительства» этого паразита у человека. Гамбийская форма сонной болезни - типичный антропоноз. Только недавно было доказано, что домашние свиньи могут тоже заражаться этим видом трипаносом, однако роль свиней в сохранении возбудителя невелика. Возможно, что возбудитель только начинает адаптироваться к этим животным, находящимся в тесном контакте с основным хозяином паразита - человеком. Сходное объяснение неодинаковой патогенности для человека существует и для разных возбудителей шистосомозов - тропических гельминтозов человека.
У неиммунных лиц, приезжающих в страны тропической зоны, многие тропические болезни протекают в более тяжелой форме, чем у коренных жителей.
1.2.4. Некоторые аспекты генетической устойчивости организма хозяина к паразитарным инвазиям
Паразитарные болезни являются многофакторными и зависят от генетического полиморфизма хозяина, окружающей среды, генетической вариабельности паразитов. При изучении генетических аспектов устойчивости организма хозяина к паразитам необходимо учитывать генетически обусловленный полиморфизм иммунных реакций в разных стадиях инвазии. Другими важными аспектами являются изучение патогенеза заболевания и выявление генных локусов, ассоциированных с устойчивостью и снижением патогенных реакций организма.
Огромное значение в восприимчивости человека к паразитарным заболеваниям имеет его генетическая конституция. Например, лица с группой крови II(A) наиболее восприимчивы к лямблиозу.
Роль генетики была впервые оценена на экспериментальных моделях, в которых изменения окружающей среды можно проконтролировать и измерить. Исследования на животных позволили открыть самый интересный ген NRAMP1, который, по-видимому, играет важную роль в формировании врожденного иммунитета против внутриклеточных патогенов.
Исследования в области генетики человека и изучение чувствительности к паразитарным заболеваниям начались с наблюдения значительного преобладания мутантных аллелей некоего гена на территории, высокоэндемичной по малярии. Появилась гипотеза, в соответствии с которой эти аллели защищали от тяжелой малярии. Это наблюдение было затем подтверждено результатами исследований на контрольных популяциях. Благодаря применению подобных стратегий было продемонстрировано, что определенные гаплотипы HLA (human lymphocyte antigens - антигены лимфоцитов человека) и определенные аллели TNF-a (tumor necrosis factor - фактор некроза опухоли) также модифицировали восприимчивость хозяина к малярии.
В недавних исследованиях на популяции инфицированных шистосомами были использованы преимущества новых методов эпидемиологии и генетики, которые позволяют осуществить интегрированную и одновременную оценку роли окружающей среды и хозяинспецифических факторов в контроле инфицирования и заболевания. Эта работа позволила открыть два главных локуса, один из которых контролировал уровень инфекции, а другой - развитие болезни.
Согласно давно утвержденному постулату (правило Фаренгольца), специализация паразита и хозяина происходит в определенной степени синхронно, поддерживая симбиотические взаимоотношения в системе пара- зит-хозин.
Паразит, вызывающий малярию человека, Plasmodium falciparum, является древней формой, дивергировавшей от паразита шимпанзе P. reichenowi около 5-7 млн лет назад, приблизительно в то время, когда дивергировали человек и шимпанзе.
Виды Schistosoma mansoni, S. japonicum и S. haematobium вызывают паразитарное заболевание шистосомоз, который является одной из основных проблем общественного здравоохранения, если учесть, что в мире поражены более 200 млн человек. Подобно малярийным паразитам, шистосомы как члены группы, которая дивергировала от многоклеточных, также представляют собой древние формы.
В эпидемиологии паразитарных болезней уже давно дискутируется вопрос: каким образом большинство лиц популяции, живущей в районе, эндемичном по данному (или нескольким) паразитарному заболеванию, может быть инфицировано, но при этом лишь небольшая часть данной популяции будет иметь клинические проявления болезни и только у немногих инфекция окажется угрожающей для жизни? Наблюдаемые явления - наиболее веское подтверждение эволюции успешных взаимоотношений в системе паразит-хозяин, которые также предполагают естественную вариабельность внутри популяций, повышающую в некоторой степени риск наряду с защитой.
В случае филярий или шистосом лица из эндемичных районов будут инфицироваться в течение жизни в результате длительной экспозиции и невозможности приобрести защитный иммунитет. Иммунитет хозяина обычно вырабатывается медленно и почти не бывает полным.
Что касается такого вирулентного паразита, как P. falciparum, распространенного в районах Африки к югу от Сахары, то и в этом случае тяжелые заболевания и смертельные исходы наблюдаются редко, несмотря на большую популяцию хозяев, стабильную трансмиссию и широкую эндемичность. В подобном окружении большинство детей инфицируются после приобретения пассивного иммунитета, переданного матерью, но тяжесть инфекции частично контролируется иммунным ответом хозяина, ведущим к хронической асимптоматической паразитемии и мутациям, когда большинство детей являются носителями паразитов. Это не означает, что внедрение смертельно опасного паразита P. falciparum остается без последствий, так как в Африке в результате его внедрения ежегодно умирают около 1 млн детей.
Паразиты тесно связаны с иммунными и эндокринными сигналами, необходимыми для их собственного развития. Рост и репродукция S. mansoni зависят от цитокинов хозяина. Стероидные и тиреоидные гормоны хозяина влияют на рост, метаболизм и созревание паразита in vitro.
Эти паразиты успешно эволюционировали благодаря «разумному» поддержанию ими инфекции их переносчиков и хозяев-млекопитающих для выживания. Выживание паразитов постоянно находится под угрозой функционального иммунного ответа переносчиков и хозяев. Иммунологическое окружение приводит к развитию сложных механизмов для уклонения от иммунитета. Способность избежать влияния адаптационного гуморального и клеточного иммунитета хозяина (промежуточного и окончательного) различается между внеклеточными паразитами (гельминтами) и простейшими и в определенной степени диктуется их репродуктивными особенностями и клеточными циклами.
Механизмы защиты внеклеточных паразитов нацелены в первую очередь против гуморальных эффекторных механизмов (система комплемента - complement lysis), тогда как механизмы внутриклеточных простейших нацелены на выработку устойчивости к токсичным метаболитам и ферментам лизосом. Самые простые способы уклонения - это те, при которых паразит избегает антител хозяина, принимая внутриклеточный образ жизни (Toxoplasma gondii, виды Leishmania, Trypanosoma cruzi), или при которых жизненные стадии протекают в клетках печени и крови, например, в случае малярии.
Сложность и уровень уклонения включают, например, клональные антигенные вариации поверхностных белков красных кровяных клеток, выработанных паразитом [например, мембранный белок-1 эритроцита, вырабатываемый Plasmodium falciparum (Pf EMP1)].
Ген семейства Var, который кодирует Pf EMP1, особенно вариабелен по нуклеотидной последовательности. Из 14 хромосом генома малярийного плазмодия 4 содержат по крайней мере 1 член этого семейства генов. Поверхностные антигены являются важным механизмом уклонения у внеклеточных паразитов и включают трансмембранные антигены поверхности лейкоцитов и тканеспецифичные трансплантационные антигены, идентифицированные у S. japоnicum.
Иммунная система хозяина может быть «обманута» и, следовательно, иммунной атаки можно избежать путем молекулярной мимикрии - явления, при котором паразит имеет общие антигены с хозяином и пытается сопротивляться иммунным реакциям или ингибировать их.
Конвергентная эволюция тропомиозинов 1 и 2 S. mansoni и их промежуточного хозяина Biomphalaria glabrata, которые имеют ~ 63 % гомологию, является, как предполагают, одной из форм молекулярной мимикрии. Тропомиозин принадлежит к семейству белков, связанных с сократительной активностью актина и миозина. Он повсеместно экспрессируется у беспозвоночных и позвоночных, но существует много изоформ, которые различаются структурно и функционально. Показана относительно высокая степень гомологии и функционального сходства между тропомиозином филогенетически отдаленных видов, включая гельминтов (S. mansoni, O. volvulus, Brugia pahangi).
В плане клинической иммунологии интерес представляет высококонсервативный мышечный белок тропомиозин как кросс-реактивный белок между многими общими аллергенами, включая клещей, креветок и насекомых. Предполагается, что «общая аллергия» к насекомым может развиваться у людей, которые раньше были сенсибилизированы одним или несколькими насекомыми, и что аллергенное сходство, возможно, распространяется на других членистоногих, не являющихся насекомыми.
Особое внимание было уделено гомологичным антигенам у домашних тараканов (Blatta germanica и Periplaneta аmericana) и клещей домашней пыли (Dermatophagoides pteronyssinus и D. farinae), поскольку они играют очень важную роль в заболевании аллергией.
В то время как врожденный иммунитет представляет собой самую древнюю систему защиты человека от патогенных микроорганизмов и, по-видимому, является основным и консервативным оружием у паразитов, при анализе сравнительной и функциональной геномики врожденной иммунной системы Anopheles gambiae, одного из видов комаров - промежуточных хозяев малярийных плазмодиев, многие компоненты сигнальных путей иммунной системы оказались очень консервативными у A. gambiae и их очень дальнего родственника Drosophila, несмотря на дивергенцию этих двух насекомых от общего предка около 250 млн лет назад.
Изучение данных о геномной последовательности P. falciparum, наиболее опасного для жизни из четырех видов Plasmodium, поражающих человека, показало, что геном этого вида состоит из 23 тыс. пар нуклеотидов. Из них значительная часть ассоциируется с иммунным уклонением и взаимодействием в системе паразит-хозяин и почти 2/3 генома, по-видимому, уникальны для Plasmodium. Напротив, геном Schistosoma представлен относительно большим числом генов (≈ 15 000), при этом их существенная часть (≈ 65 %) гомологична известным и высококонсервативным генам.
Примечательно для иммуногенетики выявление многих рецепторов, кодируемых генами паразита, которые являются высогомологичными их хозяину - млекопитающему. К ним относятся инсулиновый, прогестероновый, цитокиновые рецепторы. Гомологии с человеческими цитокиновыми
факторами ингибирования миграции макрофагов (MIF), которые модифицируют активность моноцитов и макрофагов человека, были обнаружены как у P. falciparum, так и у более сложных внеклеточных паразитов Wuchereria bancrofti, Onchocerca уо1уШш и Brugia malayi.
Интересные гомологии в геноме шистосом включают белок Clg комплемента, инсулиноподобный рецептор, инсулиноподобный белок, связывающий факторы роста, и семейство фактора некроза опухоли, так же как гомологии генов, связанных с В- и Т-лимфоцитами, такими как фактор усиления образования пре-В-клеток (PBEF).
Высокая степень гомологии последовательностей и структурные сходства были показаны для лектинов С-типа (C-TLs) человека и гельминтов. Одно из объяснений этого заключается в том, что гормоны хозяина являются ключевым механизмом в поддержании развития и созревания гельминта, включая половое развитие.
Разные формы гемоглобинопатии (талассемии, серповидно-клеточная анемия и др.), а также дефицит эритроцитарного фермента глюкозо-6-фос- фатдегидрогеназы обеспечивают устойчивость к малярии. Так, известно, что в эритроцитах людей, гетерозиготных по гену серповидно-клеточной анемии, развитие малярийных плазмодиев происходит быстрее, что приводит к преждевременному образованию гаметоцитов и способствует ускоренному выведению паразитов из крови.
Большое значение имеют генотипические особенности паразита и хозяи- на. У носителей гемоглобинов S, С, Е редко наблюдается тяжелая клиническая симптоматика тропической малярии. Низкая летальность от тропической малярии отмечена среди лиц с дефицитом глюкозо-6-фосфатдегидро- геназы и носителей генов талассемии. Отсутствие антигена Даффи на эритроцитах коренных жителей западной части Экваториальной Африки делает эту популяцию полностью невосприимчивой к Plasmodium vivax.
Не все рассмотренные примеры можно в настоящее время объяснить. Некоторые известны как эмпирические факты, однако они убеждают в необходимости индивидуальной работы врача с больными, страдающими паразитарными заболеваниями, и делают необходимым дальнейшее изучение факторов восприимчивости человека к паразитам.
Защита хозяина от паразитарной инвазии обеспечивается главным образом иммунными механизмами. Иммунные реакции хозяина возникают в ответ на действие антигенов двух разных типов: входящих в состав организма паразита и выделяемых паразитами в окружающую среду.
Антигены первого типа, кроме входящих в состав покровов, высвобождаются только после гибели паразитов. Они очень многообразны, но у многих, особенно родственных форм, часто бывают сходными, поэтому антитела к этим антигенам обладают слабой специфичностью. Антигены покровов разнообразны и специфичны. Часто они имеют гликопротеиновую природу и на разных этапах жизненного цикла паразитов могут меняться, поэтому выработка иммунитета к ним затруднена.
Антигены второго типа специфичны. Это компоненты слюны кровососущих паразитов, ферменты, выделяемые различными железами гельминтов.
Иммунная защита от многоклеточных паразитов существенно усложняется многоступенчатостью циклов их развития, в которых каждая стадия может вырабатывать свой антигенный комплекс. К тому моменту, когда хозяин приобретает к нему иммунитет, паразит вступает в следующую стадию развития и меняет свой антигенный состав.
Простейшие, обитающие вне клеток, покрываются антителами и в таком виде теряют подвижность, при этом облегчается их захват макрофага-
ми. В некоторых случаях антитела обеспечивают агглютинацию (склеивание) паразитов, которые после этого гибнут. Внутриклеточные паразиты, обитающие в макрофагах, - лейшмании, токсоплазма - в случае активации макрофагов антителами могут перевариваться в месте пребывания. Против многоклеточных паразитов эти механизмы иммунной защиты не действуют.
Антитела не прикрепляются к неповрежденным покровам гельминтов, поэтому иммунитет при гельминтозных заболеваниях частичный (и как следствие нестойкий) и действует в основном против личинок: развитие мигрирующих личинок червей в присутствии антител замедляется или прекращается. Некоторые типы лейкоцитов, в частности эозинофилы, способны прикрепляться к мигрирующим личинкам. Поверхность тела личинок при этом повреждается лизосомальными ферментами, что облегчает контакт тканей с антителами и часто приводит к гибели личинок. Гельминты, прикрепляющиеся к стенке кишки, могут подвергаться воздействию механизмов клеточного иммунитета в слизистой оболочке, при этом вследствие перистальтики кишечника гельминты выбрасываются во внешнюю среду.
При многих паразитарных заболеваниях между хозяином и паразитом устанавливаются компромиссные взаимоотношения: хозяин адаптируется к обитанию в его организме небольшого количества паразитов, а их существование в организме хозяина создает состояние иммунитета, препятствующего выживанию личинок, вновь попадающих в организм больного. Такое состояние называют нестерильным иммунитетом. В сохранении нестерильного иммунитета хозяин заинтересован не только потому, что он препятствует усилению инвазии, но и потому, что в случае гибели паразита нередко возникают серьезные тканевые реакции, способные привести к гибели хозяина. Примером таких реакций являются местные и общие осложнения после гибели личинок филярий в лимфатических узлах и глазах, а также цистицерков свиного цепня в головном мозге. Пока паразиты живы, такие реакции вообще не проявляются, поэтому во многих случаях система паразит - хозяин долгое время остается равновесной.
1.2.5. Специфические ответные реакции хозяина на воздействие паразитов
Одно из свойств паразита - мозаика различных молекул, которые при распознавании хозяином как чужеродные называются иммуногенами (или антигенами). Антигеном является любое вещество, которое при соответствующих условиях способно индуцировать синтез антител и взаимодействовать с ними, образуя комплекс антиген-антитело. Антитела - это гликопротеины, синтезируемые в ответ на антиген и способные реагировать в различной степени с молекулами, имеющими сходное строение с антигенами.
Паразит или любая его часть, узнаваемая хозяином как антигенная, в обычном случае индуцирует клеточные и гуморальные реакции. При многих инвазиях трудно разграничить клеточный и гуморальный ответы, поскольку они развиваются одновременно. Эффективность ответных реакций зависит от природы паразита и стадии инвазии.
Клеточные реакции возникают при участии клеточных механизмов специфической защиты. При клеточных реакциях специализированные клетки мобилизуются, чтобы ограничить распространение или разрушить паразита.
Основная роль в развитии клеточного иммунитета принадлежит Т-лимфоцитам. При распознавании антигена Т-клетки дифференцируются в Т-клетки памяти и Т-клетки эффекторные. Функционирование этих специализированных Т-клеток происходит несколькими способами. Например, Т-клетки памяти возвращаются в состояние «покоя» и служат источником новых антигенспецифических Т-клеток в любой момент, когда тот же самый антиген может вновь проникнуть в организм. Т-клетки эффекторные могут быть функционально разделены на две группы: клетки Т-хелперы (Th) и цитотоксические Т-клетки (Тс). Исходный тип Th-клетки можно дифференцировать на подгруппы клеток, которые различаются по секретируемым цитокинам: клетки Th-1 и Th-2. Большая часть Т-клеточной активности обеспечивает синтез и высвобождение различных химических медиаторов, называемых цитокинами. Цитокины взаимодействуют с разнообразными клетками, необходимыми для ряда иммунологических процессов. Th-1-клетки в типичном случае секретируют интерлейкин-2 (IL-2), у-интерферон (IFN-y) и фактор некроза опухоли (TNF). Эти цитокины поддерживают воспалительный процесс, активируют макрофаги и индуцируют размножение естественных киллеров (NK). Th-2-клетки обычно секретируют несколько цитокинов, среди которых IL-4, IL-5 и IL-10. Они активируют В-клетки и иммунные ответы, которые зависят от гуморальных антител. Как правило, преобладание Th-1 ассоциируется с острым течением инфекции и последующим выздоровлением, Th-2 - с хроническим течением болезни и аллергическими проявлениями. Тh-1-клетки обеспечивают защиту от внутриклеточных простейших, Th-2-клетки необходимы для изгнания кишечных гельминтов.
Гуморальный ответ как таковой необходим для уничтожения внеклеточных паразитов, например локализующихся в крови, жидкостях организма или кишечнике. Главным фактором гуморальных механизмов защиты является выработка специфических антител в ответ на поступление антигенов паразита. В образовании циркулирующих в крови антител участвуют В-клетки. Благодаря их общей глобулярной структуре антитела называют иммуноглобулинами и обозначают как Ig. Описано 5 классов структурно сходных молекул антител - IgA, IgM, IgG, IgD, IgE.
IgA участвуют в развитии иммунных реакций в основном на поверхности слизистой оболочки. IgM относятся к макроглобулинам и синтезируются раньше других иммуноглобулинов. IgG являются преимущественно антитоксинами и антибактериальными веществами, IgD выполняют роль антигенраспознающих рецепторов В-лимфоцитов. IgE - эффекторы аллергии и противопаразитарного иммунитета. С IgE связана реакция гиперчувствительности немедленного типа. Они обладают сродством к тучным клеткам организма. Адсорбируясь на них, эти антитела, как правило, не циркулируют в крови или же находятся в ней в весьма незначительном количестве. В таком случае при проникновении в организм антигенов, к которым уже имеются IgE-антитела, иммунная реакция с их участием протекает не в крови, а на поверхности тучных клеток и приводит к их разрушению. Высвобождающиеся при этом в большом количестве биологически активные вещества, которыми богаты тучные клетки, обусловливают картину реакции немедленного типа, классическим примером которой является анафилактический шок.
Содержание IgM повышается при трипаносомозе и малярии, IgG - при малярии и висцеральном лейшманиозе.
Антитела способны непосредственно нейтрализовать паразитов, препятствуя их прикреплению к новым клеткам, например, при инфекциях, вы-
зываемых различными видами малярийных паразитов. Мерозоиты проникают в эритроциты с помощью специальных рецепторов. Этот процесс ингибируют специфические антитела. Антитела могут также предотвращать распространение инфекции, например, в острой фазе инфекции, вызванной Т. cruzi. Гуморальные антитела могут также реагировать с экскреторносекреторными веществами паразита, образуя иммунные комплексы, некоторые из которых могут связываться, вызывая дисфункцию органа.
Антитела как сами по себе, так и в сочетании с комплементом (термолабильными ферментами крови, синтезируемыми макрофагами) эффективно действуют против внеклеточных паразитов. Комплекс антиген-антитело взаимодействует с системой комплемента, в результате чего паразит может погибнуть. Фагоцитарный и цитотоксический потенциал эффекторных клеток (макрофагов, нейтрофилов, эозинофилов) усиливается антителами, наиболее эффективно при участии комплемента.
Паразитарные инфекции нередко приводят к эозинофилии (повышенное количество эозинофилов в крови). IgA, IgG, IgE могут взаимодействовать с мембранно-связанными антигенами на поверхности паразита. Определенные участки этих иммуноглобулинов взаимодействуют с соответствующими рецепторными участками на поверхности эозинофилов. Это взаимодействие стимулирует эозинофилы к высвобождению лизосомных гидролаз или других цитотоксических факторов, разрушающих паразита.
При некоторых паразитарных заболеваниях вырабатывается стойкий иммунитет (например, при лейшманиозе, трипаносомозе), при гельминтозах (аскаридозе, энтеробиозе) иммунитет относительный, поэтому возможны повторные заражения. Иммунологические показатели изменяются преимущественно в личиночной стадии развития гельминтов. Несмотря на развитие иммунных реакций, гельминт способен длительное время сохраняться в организме вследствие наличия у него выраженных иммуносупрессивных свойств и антигенов, общих с антигенами хозяина, утраты гельминтом рецепторов, обеспечивающих развитие эффекторных иммунных механизмов. Все это ведет к хронизации инвазии.
Паразитарные инвазии сопровождаются образованием больших количеств неспецифических антител, спленомегалией, гепатомегалией.
1.2.6. Неблагоприятное влияние паразита на организм хозяина
Неблагоприятное влияние, оказываемое паразитом на организм хозяина, условно можно рассматривать в четырех широких аспектах:
• ухудшение состояния здоровья разной степени вплоть до гибели хозяина;
• угнетение репродуктивной (воспроизводящей) функции хозяина вплоть до его гибели;
• изменение нормальных поведенческих реакций хозяина;
• парадоксальное воздействие паразита на организм хозяина.
Ухудшение состояния здоровья. В этом аспекте неблагоприятное влияние паразита на организм хозяина включает следующие факторы. Поглощение и нарушение всасывания питательных веществ и витаминов. Для поддержания своей жизнедеятельности, интенсивного роста и размножения гельминты поглощают пищу хозяина, что может привести к истощению организма че-
ловека, особенно при паразитировании крупных видов гельминтов, например бычьего цепня, широкого лентеца. Так, бычий цепень увеличивается в сутки на 7-10 см, поглощая огромное количество питательного материала и создавая пищевой дефицит для организма хозяина. Гельминтозы нередко сопровождаются авитаминозами. При цистицеркозе снижается содержание аскорбиновой кислоты, при дифиллоботриозе - витамина В2, который необходим для роста гельминта и активно им поглощается.
При лямблиозе значительная часть поверхности кишечного эпителия покрыта паразитами, что приводит к нарушению процессов пристеночного пищеварения и усвоению хозяином питательных веществ - жиров, жирорастворимых витаминов и др.
Инфицированные криптоспоридиями клетки кишечного эпителия претерпевают ряд патологических изменений, что приводит к сокращению всасывательной поверхности кишечника и как результат - нарушению всасывания питательных веществ, особенно сахаров.
Токсическое действие на иммунную систему хозяина. Продукты жизнедеятельности паразитов обладают антигенными свойствами, вызывающими иммунологическую активность, аллергию или подавление иммунитета хозяина.
Лямблии могут индуцировать апоптоз эпителиальных клеток тонкой кишки и подавлять синтез IgA, в результате чего нарушается прочность зоны абсорбции и увеличивается проницаемость эпителиального слоя для низкомолекулярных белков, обладающих выраженными аллергенными свойствами. Токсико-аллергические реакции играют ведущую роль в патогенезе американского трипаносомоза. Сильное токсикоподобное действие на ткани животных и человека оказывают, например, экстракты саркоспоридий и метаболиты токсоплазм. Аллергический миокардит является одним из наиболее распространенных органных поражений при трихинеллезе и наиболее частой причиной гибели от этого гельминтоза. Это осложнение возникает также при описторхозе, фасциолезе, миграционном аскаридозе. Развитие миокардита при трихинеллезе совпадает с гибелью личинок в миокарде, деструкцией мышечной ткани и поступлением в ткани специфических антигенов паразита.
Установлено, что паразитарные болезни приводят к разнообразным формам приобретенного иммунодефицита, связанного с выключением ответа Т-клеточного иммунитета на любые антигены, в том числе антигены самого возбудителя (лейшманиозы), и к активации В-системы (малярия, висцеральный лейшманиоз, африканский трипаносомоз).
Повреждение органов и тканей. При амебиазе и балантидиазе происходит внедрение паразитов в ткани толстой кишки с образованием в них язв. Entamoeba histolytica способна лизировать клетки эпителия за счет выделения различных протеиназ (например, цистеинпротеиназы), что играет определенную роль в поражении тканей. Проникновение трипаносом в ткани и сосуды мозга приводит к периваскулярной инфильтрации и менингоэнцефалиту. Патогенное действие плазмодия связано с поражением эритроцитов (блокада окислительного фосфорилирования, энергообмена, нарушение проницаемости мембран для кислорода и углекислого газа, снижение пластического обмена). При висцеральном лейшманиозе поражаются клетки гистофагоцитарной системы с развитием в них некротических процессов и дистрофии, нарушаются функции паренхиматозных органов, увеличиваются их размеры.
Кишечные гельминты повреждают слизистую оболочку кишки своими крючьями, присосками. Механическое действие описторхисов состоит в повреждении стенок желчных и панкреатических протоков и желчного пу-
зыря присосками, а также шипиками, покрывающими поверхность тела молодых гельминтов. При эхинококкозе наблюдается давление растущего пузыря на окружающие ткани, вследствие чего наступает их атрофия. Яйца шистосом вызывают воспалительные изменения стенки мочевого пузыря и кишечника и могут ассоциироваться с канцерогенезом.
Механическое действие гельминтов, иногда очень значительное, может быть связано с особенностями биологии и развития гельминтов в организме хозяина. Например, гибель огромного числа ворсинок наступает при массовом развитии в них цистицеркоидов карликового цепня, причем нередко повреждаются и более глубокие ткани кишечной стенки. При локализации аскарид в просвете кишки они упираются своими острыми концами в ее стенки, повреждают слизистую оболочку, вызывая местную воспалительную реакцию, кровоизлияния. Нарушение целостности тканей печени, легких и других структур хозяина может быть весьма серьезным и в результате миграции личинок некоторых нематод (аскариды, анкилостомы, некатора).
Иммунопатологические последствия паразитарных инвазий. Помимо непосредственного повреждающего действия паразитов и неблагоприятного влияния продуктов их выделения на ткани хозяина, к патологическим последствиям инвазии можно отнести и многие иммунные реакции. Например, при малярии, африканском трипаносомозе и висцеральном лейшманиозе увеличение количества макрофагов в печени и селезенке и их усиленная активность приводят к увеличению размеров указанных органов. Паразитарные инвазии обычно сопровождаются образованием иммунных комплексов, которые могут откладываться в почках, например при нефротическом синдроме в случае четырехдневной малярии, или вызывать другие патологические изменения.
Антитела к антигенам паразита могут перекрестно реагировать с тканями хозяина. Так, хроническая кардиомиопатия, расширение пищевода и ободочной кишки при болезни Шагаса обусловлены действием на нервные ганглии антител и цитотоксических Т-клеток, которые перекрестно реагируют с Т. cruzi. Подобно этому, вызывающая онхоцеркоз, или «речную слепоту», нематода О. vulvulus несет антиген, перекрестно взаимодействующий с белком сетчатки.
Угнетение репродуктивной (воспроизводящей) функции хозяина вплоть до гибели. Снижение репродукции хозяина «выгодно» паразиту, так как хозяин не тратит силы на воспроизводство, что создает избыток энергетических ресурсов в его организме, которые паразит активно использует. Например, малярия является одной из причин не только невынашивания плода, но и повышения смертности самих беременных женщин. Исторически «инфантилизм» обоих полов и импотенция у мужчин ассоциируются с территориями, пораженными малярией.
На мышиных моделях гельминтозов человека было показано, что эти паразиты человека также оказывают выраженное действие на генеративные клетки сперматогенеза хозяина. Генотоксическое действие метаболитов гименолеписов и мигрирующих личинок токсокар на наследственный аппарат клеток конечной стадии сперматогенеза у мышей проявляется увеличением количества сперматозоидов с одноцепочечной (поврежденной) ДНК. В результате увеличивается доля сперматозоидов с денатурированной молекулой ДНК. При гименолепидозе, миграционном аскаридозе и токсокарозе отмечается также снижение активности сперматогенеза за счет пониженного выхода сперматозоидов у зараженных мышей.
Изменение нормальных поведенческих реакций хозяина. Направленная модуляция поведения хозяев, способствующая передаче патогенов, отмечена у
многих паразитов, прежде всего у тех, жизненный цикл которых включает последовательную смену нескольких хозяев. Например, при токсоплазмозе окончательным хозяином является кошка, в клетках кишечника которой образуются ооцисты, достигающие инвазионности через 5 сут после дефекации. Промежуточными хозяевами служат многие млекопитающие, в том числе крысы, в их организме паразит существует в форме псевдоцист. Для завершения цикла кошка должна съесть инфицированного грызуна, однако грызуны избегают мест, загрязненных мочой кошек, реагируя на специфический запах. Инфицированные токсоплазмами крысы не только теряют отрицательный таксис к моче кошек, но и активно бегут на этот запах («сходят с ума»). Таким образом, изменяется поведение зараженных животных вследствие нарушения нервной проводимости. У людей острая инфекция Т. gondii может вызывать психотические симптомы, подобные шизофреническим.
Муравьи, зараженные личиночными стадиями дикроцелиума, вечером не возвращаются в муравейник, подобно здоровым незараженным насекомым, а забираются на вершину травинки, впиваются в нее челюстями и замирают до утра, не реагируя на внешние раздражители. Такие насекомые с неправильным поведением становятся невольной добычей травоядных животных - окончательных хозяев, которые утром выходят на пастбище. Таким образом, завершается цикл развития паразита, который созревает до взрослого состояния уже в организме травоядного.
Паразиты способны изменить поведение млекопитающих в результате поражения их мозга. Возможность проникновения паразитов в центральную нервную систему существует при заражении нематодозами (аскаридозом, трихинеллезом, филяриозом). На фоне такой патологии возможно развитие различных изменений психики и неврологической патологии. Поражение мозга личинками токсокар может приводить к спутанности сознания и нарушению познавательных способностей.
Парадоксальное воздействие паразита на организм хозяина. В некоторых случаях, кроме ожидаемого патогенного действия паразита на своего хозяина, наблюдаются парадоксальные примеры паразито-хозяинных отношений. Известно, что гельминты стимулируют развитие иммунного ответа Th2-типа и одновременно способны вызывать иммуносупрессию, однако эти свойства гельминтов могут косвенно способствовать снижению выраженности аллергических реакций и даже купировать приступы бронхиальной астмы. Обследование 520 детей в Габоне показало, что дети, больные кишечным шистосомозом, на 70 % меньше подвержены аллергическим реакциям на антигены клещей домашней пыли. Результаты этого наблюдения послужили основанием для попытки использовать разные стадии гельминтов, а возможно, и отдельные молекулы, полученные из паразитов, в целях создания лекарственных препаратов для подавления аллергических, воспалительных и аутоиммунных реакций организма. В основе этого парадоксального использования гельминтов лежит способность паразитов модулировать иммунный ответ хозяина.
1.2.7. Механизмы защиты паразитов от воздействия со стороны хозяина
В процессе паразитирования в организме человека у некоторых возбудителей протозойных инфекций вырабатываются механизмы защиты от воздействия со стороны хозяина.
Антигенная изменчивость. У паразитов вырабатываются различные механизмы, позволяющие избежать воздействия иммунного ответа хозяина. Наиболее ярким примером служит механизм антигенных вариаций у возбудителей африканского трипаносомоза. Антигенная вариабельность делает возможным хронически рецидивирующий процесс при трипаносомозах. Увеличение численности паразитов в крови стимулирует развитие специфических антител, которые приводят к уничтожению большей части паразитирующей популяции. Паразиты, которые сохранились (менее 1 %), претерпевают антигенную трансформацию, что делает их неуязвимыми для циркулирующих антител, однако по мере увеличения численности нового антигенного варианта возрастает концентрация соответствующих новых специфических антител. Каждый такой повторяющийся цикл занимает несколько дней, завершаясь появлением новых антигенных вариантов, резистентных к предшествовавшим вариантам антител. С каждым изменением поверхностных антигенов иммунологический механизм позвоночного хозяина активируется, постепенно снижая способность иммунной системы к ответу.
Число антигенов, продуцируемых трипаносомой, неизвестно, но было показано, что одна клетка способна продуцировать до 22 различных специфических для трипаносом антител. Материальным субстратом указанных вариаций служат поверхностные антигены - гликопротеины (VSG), располагающиеся на оболочке паразита. По оценке, большое число вариантов транскрибируется более чем в 1000 генов, что теоретически возможно для T.b. gambiense. Из этих вариантов только один является генетически доминантным в определенные моменты. Экспрессия каждого гена сопровождается перестройкой генов. Антигенная вариабельность этих паразитов делает создание эффективных вакцин, обеспечивающих длительную защиту, бесперспективным для контроля этого заболевания. В организме переносчика (муха цеце) у трипаносом наблюдается аналогичный дрейф.
К настоящему времени получены изоляты лямблий с разными вариантами поверхностных антигенов. Антигенная изменчивость поверхностных богатых цистеином белков трофозоитов лямблий объясняет хроническое течение лямблиоза и позволяет Lamblia intestinalis эффективно колонизировать слизистую оболочку кишечника и существовать там длительное время, несмотря на чувствительность паразита к антителоопосредованному иммунитету. Изменение поверхностных антигенов наблюдали на 22-24-й день после экспериментального заражения людей. Возможно, механизм антигенной вариабельности связан с процессингом и конформационными изменениями поверхностных белков. Изменения могут происходить спонтанно, и селекция в отношении различных вариаций определяется физиологическими и иммунологическими факторами хозяина.
Малярийный плазмодий характеризуется большим числом (более 1000) антигенов, состав которых специфичен для разных его популяций, поэтому антигены плазмодиев малочувствительны к ранее выработанным антителам. Одновременное присутствие в крови паразита, отличающегося антигенным составом, затрудняет накопление необходимого количества специфических антител, которое может обеспечить быстрое освобождение организма от возбудителя. Формирующаяся в процессе каждого цикла эритроцитарной шизогонии новая популяция паразитов, отличающаяся от предыдущих по структуре поверхностных антигенов, резко снижает эффективность гуморального иммунитета.
Антигенная изменчивость поверхностных белков в период линьки известна и для личинок аскарид при миграции в организме.
Молекулярная мимикрия. В отличие от постоянной смены поверхностных антигенов для сопротивления иммунному прессу хозяина, что свойственно паразитическим простейшим, гельминты используют другую стратегию защиты от воздействия хозяина. Взрослый гельминт покрывает свою поверхность антигенами хозяина, извлекаемыми из жидких сред его организма. Наиболее детально этот процесс изучен у взрослых шистосом, которые совершенно не подвержены воздействию иммунитета хозяина. Это связано с тем, что в процессе созревания и превращения во взрослого паразита шистосома трансформирует свою наружную мембрану и включает в нее большое число антигенов, сывороточных белков и гликолипидов человека. Этот процесс сопровождается одновременным снижением продукции собственных антигенов. Кроме того, многие гельминты способны синтезировать и продуцировать на поверхности кутикулы белки, подобные антигенам хозяина, не идентифицируемые в качестве «чужого» иммунной системой человека. Например, цестодам и их личиночным стадиям подобный механизм позволяет выживать в организме хозяина.
Протеиндисульфидизомераза, продуцируемая микро- и макрофиляриями Onchocerca volvulus - возбудителем онхоцеркоза, приводящего к необратимой слепоте, идентична белку, входящему в состав сетчатки глаза и роговицы. У лентецов имеется антиген, аналогичный человеческому антигену группы крови В, а у бычьего цепня - антигену группы крови А.
Трипаносомы также способны синтезировать поверхностные антигены, настолько сходные с белками хозяина, что организм не распознает их как чужеродные.
Иммуносупрессия. Подавление иммунной системы хозяина позволяет выжить возбудителям в его организме. Это касается как гуморального, так и клеточного ответа. Среди множества физиологических факторов, вызывающих недостаточность иммунной системы, главенствующим следует признать воздействие патогенов, среди которых гельминтам принадлежит ведущая роль. Гельминты могут нарушать физиологию иммунной системы хозяина, продуцируя растворимые химические соединения, оказывающие токсическое действие на лимфоциты. Подавление иммунного ответа в основном происходит путем инактивации макрофагов.
Например, при малярии в макрофагах накапливается пигмент гемозоин - продукт расщепления гемоглобина, подавляющий различные функции этих клеток. Личинки трихинелл продуцируют лимфоцитотоксические факторы, а шистосомы и возбудитель американского трипаносомоза - ферменты, разрушающие антитела IgG. Возбудители малярии, висцерального лейшманиоза способны снижать продукцию интерлейкинов и одновременно - способность Т-хелперов продуцировать лимфокины, необходимые для роста и дифференциации В-лимфоцитов. Это в свою очередь нарушает процесс образования специфических антител. Entamoeba histolytica могут продуцировать специальные пептиды, которые способствуют выживанию трофозоитов амеб в организме человека за счет угнетения движения моноцитов и макрофагов. Синтез Е. histolytica нейтральной цистеинпротеиназы способствует расщеплению IgA и IgG человека, что в конечном счете обеспечивает их эффективную защиту от неспецифических и специфических факторов резистентности макроорганизма. Существенное значение в развитии хронических форм лямблиоза имеет способность лямблий вырабатывать IgA-протеазы, которые разрушают IgA хозяина и другие протеазы.
Растворимые антигены паразитов, выделяемые ими в огромных количествах, могут подавлять иммунный ответ хозяина путем так называемого иммунного отвлечения. Например, растворимые антигены P. falciparum,
по-видимому, нейтрализуют циркулирующие антитела, создавая своего рода «дымовую завесу», защищающую от них паразитов.
Доказано, что результатом иммуносупрессии, вызванной трипаносомозом, малярией, онхоцеркозом, является снижение иммунного ответа на вакцинацию таких больных столбнячным анатоксином, менингококковой полисахаридной вакциной. В 90-е годы XX в. было показано, что не только аскаридоз, но и токсокароз и в меньшей степени энтеробиоз отрицательно влияют на развитие иммунитета после ревакцинации против дифтерии и вакцинации против кори. Дегельминтизация способствовала восстановлению нормальной иммунологической реактивности у детей и в дальнейшем - развитию напряженного поствакцинального иммунитета после прививок. Как результат приобретенного паразитарного иммунодефицита следует рассматривать отсутствие эффекта специфической терапии на фоне кишечных гельминтозов при туберкулезе и кожном лейшманиозе, поэтому эффективность специфической терапии у таких больных отмечалась только после дегельминтизации. Присутствие тканевых паразитов вызывает столь выраженную иммуносупрессию, что не происходит отторжения кожных аллотрансплантатов у мышей, инвазированных трихинеллами.
Изучение иммунного статуса у детей, больных энтеробиозом, показало значимое снижение а-интерферона в сыворотке крови. Подавление неспецифической резистентности организма в результате паразитирования остриц можно объяснить тем, что среди больных энтеробиозом было в 5,7 раза больше «истинно часто болеющих детей» по сравнению с детьми без энтеробиоза в тех же детских коллективах.
Снижение вирулентности возбудителя. Это означает уклонение от защитных реакций хозяина, которое приводит к развитию затяжных латентных форм инфекций. С точки зрения вероятности выживания возбудителя и паразитарной системы микроорганизм должен «варьировать вирулентность» таким образом, чтобы обеспечить в организме хозяина - макроорганизма высокую численность паразита, гарантирующую возможность его передачи от одного хозяина другому. Факторы патогенности паразита направлены не на поражение хозяина, а на взаимную адаптацию, совместную эволюцию и сохранение паразита.
Способность паразитов противостоять иммунной атаке со стороны хозяина. Внутриклеточная локализация некоторых простейших (малярийного плазмодия, лейшманий, изоспор и др.), инцистирование, инкапсуляция паразитов обеспечивают защиту от антител хозяина. Например, непроницаемая для антител оболочка тканевых цист токсоплазм способствует выживанию паразита в иммунном организме в течение многих лет и тем самым повышает вероятность заражения токсоплазмозом как окончательного, так и новых особей промежуточных хозяев. Инкапсуляция личинок трихинелл в мышцах также защищает их от иммунного воздействия со стороны хозяина. Половозрелые особи О. volvulus, локализованные в коже, индуцируют организм-хозяин к «окружению» их коллагеновыми узелками.
Известны многочисленные примеры простых физических способов защиты у паразитов: нематоды имеют толстую внеклеточную кутикулу, которая защищает их от токсичных метаболитов организма-хозяина; тегумент шистосомул утолщается по мере их превращения в половозрелых особей, также обеспечивая защиту; «свободная» поверхностная оболочка многих нематод может «сползать» под влиянием иммунного ответа; ленточные черви предотвращают иммунные реакции, секретируя ингибитор эластазы, который препятствует привлечению к ним нейтрофилов. Многие гельминты обладают способностью предохранять себя от высокоактивных метаболитов
кислорода, образуемых в клетках иммунной системы. У некоторых нематод и трематод выработался механизм повреждения антител путем секреции протеаз, расщепляющих иммуноглобулины.
Простейшие, паразитирующие внутри макрофагов, различными способами избегают уничтожения от лизосомных ферментов макрофагов.
Представленные примеры свидетельствуют о чрезвычайной сложности взаимодействия в системе паразит-хозяин. Они призваны продемонстрировать физиологическую неоднозначность такого взаимодействия. Теоретическая возможность направленного использования некоторых свойств паразитов на благо человека позволяет в совершенно ином свете представить перспективы взаимоотношений в системе паразит-хозяин.
1.3. Жизненные циклы паразитов
Разнообразные жизненные циклы паразитов можно разделить на две группы: прямые (простые) и непрямые (сложные). Жизненные циклы первой группы протекают без смены хозяев. Кроме эктопаразитов, прямые (простые) жизненные циклы характерны для простейших, обитающих в полостях кишечника (дизентерийная амеба, лямблия, трихомонада, балантидий и др.), и для геогельминтов, распространяющихся через почву (аскарида, власоглав, острица, и др.).
Гораздо большее количество паразитов имеют сложные (непрямые) жизненные циклы, которые включают одного или нескольких промежуточных (дополнительных) хозяев. К таким хозяевам относятся различные виды позвоночных и беспозвоночных животных, в организме которых паразит (возбудитель) развивается, претерпевает различные изменения и/или размножается бесполым путем. Таким образом, промежуточный хозяин будет являться источником инвазии для следующего хозяина только тогда, когда произойдут необходимые биологические изменения паразита.
Любой непрямой (сложный) жизненный цикл характеризуется наличием основного (окончательного, дефинитивного) хозяина. Им считают тот организм, в котором взрослый паразит завершает свой жизненный цикл, достигает половой зрелости и размножается половым путем.
Если один из пары хозяев, участвующих в непрямом цикле, имеет меньшие размеры и обладает более активной подвижностью, то его обозначают термином «переносчик» («вектор») инвазии (инфекции). Данный термин применяют в основном для кровососущих членистоногих и не используют для обозначения животных, ведущих малоподвижный образ жизни и активно не нападающих (например, моллюски). Большое число поражающих человека простейших и гельминтов с непрямым жизненным циклом, а также обширная группа вирусов и бактерий часто распространяются кровососущими членистоногими. В этом случае заболевания называют трансмиссивными (например, малярия, лейшманиозы, вухерериоз, онхоцеркоз, таежный энцефалит, сыпной тиф и др.). В организме таких специфических (истинных) переносчиков паразит (возбудитель), как правило, претерпевает некоторые изменения и/или размножается. Иногда в жизненный цикл вовлекаются такие виды животных, в организме которых паразит не изменяется, не растет, не размножается. Их не следует считать промежуточными хозяевами или истинными (специфическими) переносчиками. Когда такую роль играют членистоногие, их называют механическими переносчиками. Типичным примером может служить пассивный перенос цист простейших, яиц
гельминтов и бактерий из фекалий на пищевые продукты мухами, тараканами и другими членистоногими.
Когда паразит (возбудитель) долгое время находится в организме беспозвоночного или позвоночного животного, при этом может размножаться, но не наносит существенного вреда хозяину, последнего называют резервуарным хозяином (резервуаром). Таким образом, переносчики иногда тоже могут являться промежуточными хозяевами или резервуарами. Паразитарные и инфекционные болезни, возбудители которых сохраняются в природе животными-резервуарами, относящимися к позвоночным, называют зоонозными (зоонозами), например японский энцефалит, туляремию. В большинстве случаев, если человек заражается зоонозными болезнями, он становится неспецифическим (случайным) хозяином. В этих условиях нередко паразит не может завершить свое развитие в организме человека, что приводит к необычным клиническим проявлениям и затрудняет диагностику болезни. Если паразит (возбудитель) сохраняется только в организме человека, вызываемые им заболевания называются антропонозными (антропонозами), например малярия. Если паразит (возбудитель) может циркулировать попеременно и в организме человека, и в организме позвоночного животного, заболевание следует считать антропозоонозным (антропозоонозом), например болезнь Шагаса (американский трипаносомоз).
Характерной особенностью паразитизма является специфичность паразита, т. е. соответствие определенного вида паразита определенному хозяину. Степень специфичности паразитов может быть различна: от строгой для определенного подвида до форм, встречающихся у десятков различных видов хозяев. Примерами специфических паразитов человека являются малярийные плазмодии, острица детская и др. Источником инвазии этими паразитами всегда является человек. Такие специфические паразиты человека вызывают заболевания, называемые антропонозными.
Ряд других паразитов, встречающихся у человека, могут поражать также и человекообразных обезьян. Таковы, например, вши, вухерерия Банкрофта и др. Источником инвазии ими в абсолютном большинстве случае также является человек.
Многие паразиты обладают меньшей специфичностью, чаще встречаясь у домашних и диких животных, но могут поражать и человека. К таким паразитам относятся печеночный сосальщик, широкий лентец, вольфартова муха и многие другие. Источником заражения человека в этом случае являются обычно животные. Заболевания, вызываемые этими паразитами, называют зоонозными.
Деление инфекционных и паразитарных заболеваний на антропо- и зоонозные имеет огромное эпидемиологическое значение в связи с разными подходами к их профилактике. Для профилактики антропонозных болезней в первую очередь необходимо выявление и лечение больных. Полное излечение всех больных с этими заболеваниями должно привести к полному исчезновению этих паразитов как биологических видов. В то же время профилактика зоонозных заболеваний значительно сложнее. Для ее успешного проведения необходимы мероприятия не только по оздоровлению человека, но и других хозяев, что значительно труднее, особенно в отношении диких животных.
У одного и того же вида паразитов специфичность может быть выражена в разной степени в разных стадиях жизненного цикла. Изменение специфичности паразитов к хозяевам на протяжении жизненного цикла обеспечивает им широкую экологическую пластичность, позволяющую выживать в меняющихся условиях, и открывает дальнейшие эволюционные перспективы.
Учет этой особенности паразитов необходим для индвидуальной профилактики заражения соответствующими заболеваниями. Действительно, для предотвращения заражения лейшманиозами, трипаносомозами или малярией оказывается достаточным предохранение от укусов определенным видом кровососущих насекомых, в то время как для индивидуальной профилактики, например, токсоплазмоза необходим сложный комплекс мероприятий.
1.4. Природная очаговость паразитарных болезней
Учение академика Е. Н. Павловского (1939) о природной очаговости болезней относится к числу выдающихся достижений биологии и паразитологии. Оно возникло на основе многолетних комплексных исследований трансмиссивных и паразитарных болезней в разных районах России и стран зарубежья.
По Е. Н. Павловскому (рис. 1.1), явление природной очаговости трансмиссивных болезней состоит в том, что независимо от человека на территории определенных географических ландшафтов могут существовать очаги заболеваний, к возбудителям которых человек восприимчив.
Такие очаги сформировались в процессе длительной эволюции биоценозов с включением в их состав трех основных звеньев:
• популяции возбудителей болезни;
• популяции диких животных - природных резервуарных хозяев (доноры и реципиенты);
• популяции кровососущих членистоногих - переносчиков возбудителей болезни.
Следует иметь в виду, что каждая популяция как природных резервуаров (диких животных), так и переносчиков (членистоногих) занимает определенную территорию со специфическим географическим ландшафтом, в силу чего и каждый очаг инфекции (инвазии) занимает определенную территорию.
В связи с этим для существования природного очага заболевания наряду с тремя названными выше звеньями (возбудитель, природный резервуар и переносчик) важнейшее значение имеет и четвертое звено:
• природный ландшафт (тайга, смешанные леса, степи, полупустыни, пустыни, различные водоемы и т. д.).
В пределах одного и того же географического ландшафта могут существовать природные очаги нескольких болезней, которые носят название сопряженных. Это важно знать при проведении вакцинации.
При благоприятных условиях внешней среды циркуляция возбудителей между переносчиками и животными - природными резервуарами может происходить неопределенно долгое время. В одних случаях заражение животных приводит к их заболеванию, в других отмечается бессимптомное носительство.
По своему происхождению природно-очаговые болезни являются типичными зоонозами, т. е. циркуляция возбудителя происходит только между дикими позвоночными животными, но возможно существование очагов и для антропозоонозных инфекций.
Популяция возбудителя особенно тесно связана с определенными популяциями позвоночных и беспозвоночных животных, образуя так называемую паразитарную систему.

Рис. 1.1. Е. Н. Павловский - основоположник учения о природной очаговости.
Связь в паразитарной системе может строиться по типу паразит - хозяин (двухчленная система) или по типу паразит - хозяин - переносчик (трехчленная система). И та и другая может быть простой или сложной паразитарной системой. Если популяция возбудителя существует за счет популяции хозяев одного вида - это простая двух- и трехчленная паразитарная система. Если же система существует за счет популяций нескольких видов хозяев, то это уже сложная паразитарная система.
Возбудители большинства классических природно-очаговых болезней чаще всего образуют сложные паразитарные системы (энцефалиты клещевой и японский, спирохетозы и риккетсиозы клещевые и др.), но всегда объединяющим звеном во всякой паразитарной системе является паразит - возбудитель заболевания.
По Е. Н. Павловскому, природные очаги трансмиссивных болезней бывают моновекторными, если в
передаче возбудителя участвует один вид переносчиков (вшиные возвратный и сыпной тифы), и поливекторными, если передача одного и того же вида возбудителя происходит через переносчиков двух, трех и более видов членистоногих. Очагов таких болезней большинство (энцефалиты - таежный, или ранневесенний, и японский, или летне-осенний; спирохетоз - клещевой возвратный тиф; риккетсиоз - клещевой сыпной тиф североазиатский и др.).
Учение о природной очаговости указывает на неодинаковую эпидемиологическую значимость всей территории природного очага болезни вследствие концентрации инфицированных переносчиков только в определенных микростациях. Такой очаг становится диффузным.
В связи с общехозяйственной или целенаправленной деятельностью человека и расширением урбанизированных территорий человечество создало условия для массового распространения так называемых синантропных животных (тараканы, клопы, крысы, домовые мыши, некоторые клещи и другие членистоногие). В результате человечество столкнулось с небывалым явлением формирования антропогенных очагов болезней, которые иногда могут стать даже более опасными, чем природные очаги.
В силу хозяйственной деятельности человека возможна иррадиация (распространение) старого очага болезни в новые места при наличии в них благоприятных условий для обитания переносчиков и животных - доноров возбудителя (строительство водохранилищ, рисовые поля и т. п.).
Между тем не исключена деструкция (разрушение) природных очагов при выпадении из состава биоценоза его сочленов, принимающих участие в циркуляции возбудителя (при осушении болот и озер, вырубке лесов).
В некоторых природных очагах может просходить экологическая сукцессия (смена одних биоценозов другими) при появлении в них новых компонентов биоценоза, способных включиться в цепь циркуляции возбудителя. Например, акклиматизация ондатры в природных очагах туляремии привела к включению этого животного в цепь циркуляции возбудителя заболевания.
Е. Н. Павловский (1946) выделяет особую группу очагов - антропоургические очаги, возникновение и существование которых связано с каким-либо видом деятельности человека и также со способностью многих видов членистоногих - инокуляторов (кровососы комары, клещи, москиты, которые переносят вирусы, риккетсии, спирохеты и других возбудителей заболеваний) переходить к синантропному образу жизни. Такие членистоногиепереносчики обитают и размножаются в населенных пунктах как сельского, так и городского типов. Антропоургические очаги возникли вторично; в циркуляцию возбудителя болезни, кроме диких животных, включаются домашние животные, в том числе птицы, и человек, поэтому такие очаги нередко становятся весьма напряженными. Так, крупные вспышки японского энцефалита отмечены в Токио, Сеуле, Сингапуре и других крупных населенных пунктах Юго-Восточной Азии.
Антропоургический характер могут приобретать также очаги клещевого возвратного тифа, кожного лейшманиоза, трипаносомоза и др.
Устойчивость природных очагов некоторых болезней объясняется прежде всего непрерывным обменом возбудителями между переносчиками и животными - природными резервуарами (донорами и реципиентами), но циркуляция возбудителей заболеваний (вирусы, риккетсии, спирохеты, простейшие) в периферической крови теплокровных животных - природных резервуаров чаще всего ограничена во времени и длится несколько дней.
Между тем возбудители таких заболеваний, как клещевой энцефалит, клещевой возвратный тиф и др., в кишечнике переносчиков-клещей интенсивно размножаются, совершают трансцеломическую миграцию и с гемолимфой заносятся в различные органы, в том числе в яичники и слюнные железы. В результате инфицированная самка откладывает инфицированные яйца, т. е. происходит трансовариалышя передача возбудителя потомству переносчика, при этом возбудители по ходу дальнейшего метаморфоза клеща от личинки к нимфе и далее - к имаго не утрачиваются, т. е. происходит трансфазовая передача возбудителя.
Кроме того, клещи длительно сохраняют возбудителей в своем организме. Е. Н. Павловским (1951) прослежена длительность спирохетоносительства у клещей-орнитодорин до 14 лет и более.
Таким образом, в природных очагах клещи служат основным звеном в эпидемической цепи, являясь не только переносчиками, но и стойкими природными хранителями (резервуарами) возбудителей.
Учение о природной очаговости подробно рассматривает способы передачи возбудителей болезней переносчиками, что важно для познания возможных путей заражения человека той или иной болезнью и для ее профилактики.
Как уже указывалось, по способу передачи возбудителя членистоногимпереносчиком от инфицированного позвоночного-донора позвоночномуреципиенту природно-очаговые болезни делят на 2 типа:
• облигатно-трансмиссивные, при которых передача возбудителя от позвоночного-донора позвоночному-реципиенту осуществляется только через кровососущего членистоногого при кровососании;
• факультативно-трансмиссивные природно-очаговые заболевания, при которых участие кровососущего членистоногого (переносчика) в передаче возбудителя возможно, но не обязательно. Иными словами, наряду с трансмиссивным (через кровососа) существуют и другие способы передачи возбудителя от позвоночного-донора позвоночному-реципиенту и человеку (например, пероральный, алиментарный, контактный и др.).
В ходе изучения природной очаговости чумы, туляремии, клещевого энцефалита, кожного и висцерального лейшманиозов и других инфекций и инвазий выяснилось, что каждый природный очаг - явление индивидуальное, существующее в природе в единственном числе, причем границы природного очага в принципе могут быть установлены на местности и проведены на карте.
В настоящее время, по данным разных источников, на территории России известно более 40 болезней человека, очаги которых могут самостоятельно существовать в природе независимо от хозяйственной деятельности человека. Носителями их возбудителей являются около 600 видов позвоночных животных. Наземные позвоночные животные (млекопитающие, птицы, рептилии и в некоторых случаях земноводные) являются прокормителями многих сотен видов кровососущих членистоногих, среди которых установлены многие десятки видов хранителей и переносчиков возбудителей болезней.
Возбудителями различных природно-очаговых болезней могут быть вирусы, спирохеты, риккетсии, разнообразные бактерии, простейшие, гельминты, паразитические грибки. Число таких болезней из года в год увеличивается. Еще совсем недавно специалисты говорили о существовании нескольких десятков, максимум - сотни природно-очаговых инфекций и инвазий. Сейчас ясно, что на самом деле их значительно больше. Так, только в международном каталоге арбовирусов (т. е. вирусов, передаваемых членистоногими) зарегистрировано около 300 вирусов, причем медицинское значение 70 из них доказано или очень вероятно и более 60 - возможно.
Крупные эпидемии совершенно неизвестных ранее тяжелых лихорадочных природно-очаговых заболеваний в последние десятилетия возникали в Африке и Южной Америке (аргентинская и боливийская геморрагические лихорадки, лихорадка Ласса и др.). Подтверждается существование природных очагов болезней, возбудители которых сами по себе известны уже достаточно давно.
Таким образом, роль членистоногих в распространении возбудителей болезней можно представить в виде схемы (схема 1.1).
Из болезней вирусной этиологии, кроме клещевого и японского энцефалитов, природная очаговость установлена для энцефалита Западного Нила (распространен в Экваториальной и Восточной Африке), австралийского энцефалита (энцефалит долины Муррея), энцефалита Сент-Луис, лошадиного энцефалита, желтой лихорадки джунглей, лихорадки денге, кьясанурской лесной болезни Индии и др. Некоторые болезни вирусной этиологии встречаются и на территории нашей страны: омская геморрагическая лихорадка, японский и таежный энцефалиты, крымская геморрагическая лихорадка, лихорадка паппатачи, бешенство и др.
Среди риккетсиозов природная очаговость присуща лихорадкам цуцугамуши и Скалистых гор Америки, клещевым сыпным тифам Азии и Африки, Ку-лихорадке и другим трансмиссивным риккетсиозам.
Среди спирохетозов типичными природно-очаговыми облигатно-трансмиссивными заболеваниями являются клещевой возвратный тиф (возбуди-
Схема 1.1. Болезни, передаваемые членистоногими
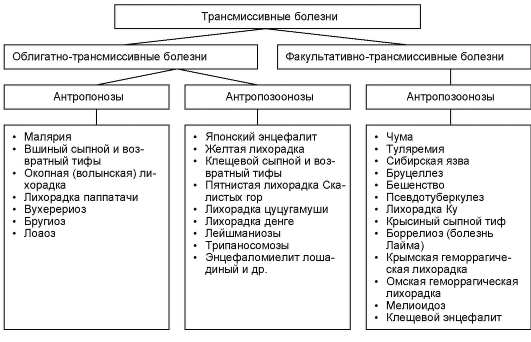
тель - спирохета Обермейера), клещевые боррелиозы, из которых наибольшее эпидемическое значение имеет так называемый поселковый спирохетоз.
Кроме туляремии и чумы, бактериальную этиологию в нашей стране имеют такие заболевания, как псевдотуберкулез, бруцеллез, иерсиниоз идр.
Протозойные трансмиссивные инвазии, характеризующиеся резко выраженной природной очаговостью, встречаются в тропических и субтропических странах. К ним относятся лейшманиозы, трипаносомозы и др.
Природная очаговость распространяется и на некоторые гельминтозы: описторхоз, парагонимоз, дикроцелиоз, альвеококкоз, дифиллоботриоз, трихинеллез, филяриатозы.
В последние годы природно-очаговыми стали считать отдельные микозы - эндемические заболевания, возникающие при дефиците микроэлементов в почве и растениях.
Учение о природной очаговости обосновывает связь между природными и антропоургическими очагами болезней, знание которых важно для эпидемиологической и эпизоотологической оценки, особенно на вновь осваиваемых территориях, и обеспечения возможных профилактических мероприятий.
Е. Н. Павловский указывал, что мероприятия по обезвреживанию и последующей ликвидации природного очага должны быть направлены на нарушение непрерывной циркуляции возбудителя болезни любыми способами, влияющими на ее этапы.
Система этих мероприятий состоит в следующем:
• снижение численности и истребление животных - доноров возбудителя;
• прямая и косвенная борьба с переносчиками на основе знаний об их биологии и экологии;
• уничтожение переносчиков у сельскохозяйственных и домашних животных;
• рациональные хозяйственные мероприятия, исключающие рост численности переносчиков;
• защитные меры против нападения переносчиков: применение репеллентов, специальных костюмов и др.;
• специфическая профилактика путем прививок моновакцинами, а в сопряженных очагах - поливакцинами.
Учение Е. Н. Павловского дает ключи профилактической медицине и ветеринарии не только к изучению природно-очаговых инфекций и инвазий, но и к планомерному, сознательному устранению природных факторов, отрицательно влияющих на здоровье человека или сельскохозяйственных животных. Оно распространилось за пределы нашей страны и на его основе плодотворно ведутся работы во многих зарубежных странах.