Хирургические болезни и травмы в общей врачебной практике: учеб. пособие. - 2008. - 624 с. : ил.
|
|
|
|
ГЛАВА 20 ОБЩИЕ ВОПРОСЫ РЕАНИМАТОЛОГИИ
С.А. Сумин, М.В. Руденко, Н.Н. Богословская
20.1. ВОПРОСЫ ТЕРМИНОЛОГИИ
Терминальное состояние определяется как пограничное состояние между жизнью и смертью, когда в силу различных причин происходит столь выраженное нарушение функционирования основных жизненных систем, что сам организм пострадавшего или больного человека не в состоянии справиться с этими нарушениями и без вмешательства извне неизбежно заканчивается смертью. Причины, приводящие к развитию терминального состояния, многообразны и могут быть по характеру как острыми, внезапными (утопление, поражение электрическим током и др.), так и сравнительно постепенными (тяжелые, длительные заболевания в финальной стадии).
Реаниматология - наука об оживлении (re - вновь, аттаге - оживлять), изучающая вопросы этиологии, патогенеза и лечения терминальных состояний, а также постреанимационной болезни.
Реанимация - это непосредственно процесс оживления организма при проведении специальных реанимационных мероприятий (Неговский В.А.,1975). В настоящее время в большинстве стран принят термин «сердечно-легочная реанимация» (cardiopulmonary resuscitation - CPR), или «сердечно-легочная и церебральная реанимация» (cardiopulmonary-cerebral resuscitation Сафар П., 1984).
Любое терминальное состояние, вне зависимости от первопричины характеризуется критическим уровнем расстройств основ жизнедеятельности организма: дыхания, ССС, метаболизма и т.д., вплоть до полной остановки работы сердца. В его развитии выделяют следующие стадии: преагональное состояние, терминальную паузу (отмечается не всегда), агонию и клиническую смерть. Наступающая вслед за клинической смертью биологическая смерть представляет собой необратимое состояние, когда оживление организма как целого уже невозможно.
Преагональное состояние. Сознание резко угнетено или отсутствует. Кожные покровы бледные или цианотичные. АД прогрессивно снижается вплоть до нуля, пульс на периферических артериях отсутствует, но еще сохранен на сонных и бедренных артериях. На первоначальных этапах отмечается тахикардия, с последующим переходом в брадикардию. Дыхание быстро переходит из тахи- в брадиформу. Нарушаются стволовые рефлексы, могут появиться патологические. Тяжесть состояния быстро усугубляется нарастающим кислородным голоданием и тяжелыми метаболическими нарушениями. Особо следует подчеркнуть центральный генез вышеуказанных нарушений.
Терминальная пауза бывает не всегда. Клинически проявляется остановкой дыхания и преходящими периодами асистолии от 1-2 до 10-15 с.
Агония. Этот этап является предшественником смерти и характеризуется последними проявлениями жизнедеятельности организма. В этом периоде умирания прекращается регуляторная функция высших отделов головного мозга и управление процессами жизнедеятельности, начинает осуществляться на примитивном уровне под контролем бульбарных центров. Это может вызвать кратковременную активацию жизнедеятельности: некоторый подъем АД, кратковременное появление синусового ритма, иногда отмечаются проблески сознания, однако обеспечить полноценность дыхания и работы сердца эти процессы не могут, и очень быстро наступает следующий этап - этап клинической смерти.
Клиническая смерть - обратимый этап умирания, переходный период между жизнью и смертью. На данном этапе прекращается деятельность сердца и дыхания, полностью исчезают все внешние признаки жизнедеятельности организма, но гипоксия еще не вызвала необратимых изменений в органах и системах, наиболее к ней чувствительных. Данный период, за исключением редких и казуистических случаев, в среднем продолжается не более 3-4 мин, максимум 5-6 мин (при исходно пониженной или нормальной температуре тела).
Биологическая смерть наступает следом за клинической и характеризуется тем, что на фоне ишемических повреждений наступают необратимые изменения органов и систем. Ее диагностика осуществляется на основании наличия признаков клинической смерти с последующим присоединением ранних, а затем и поздних признаков биологической смерти. К ранним признакам биологической смерти относятся высыхание и помутнение роговицы и симптом «кошачьего глаза» (чтобы обнаружить данный симптом, нужно сдавить глазное яблоко; симптом считается положительным, если зрачок деформируется и вытягивается в длину). К поздним признакам биологической смерти относятся трупные пятна и трупное окоченение.
«Мозговая (социальная) смерть» - данный диагноз появился в медицине с развитием реаниматологии. Иногда в практике врачей-реаниматологов встречаются случаи, когда во время проведения реанимационных мероприятий удается восстановить деятельность сердечно-сосудистой системы (ССС) у больных, находившихся в состоянии клинической смерти более 5-6 мин, но у этих пациентов уже наступили необратимые изменения в коре головного мозга. Функцию дыхания в данных ситуациях можно поддерживать только методом ИВЛ. Все функциональные и объективные способы исследования подтверждают смерть мозга. По сути дела пациент превращается в «сердечно-легочный» препарат. Развивается так называемое «стойкое вегетативное состояние» (Зильбер А.П., 1995, 1998), при котором пациент может находиться в отделении интенсивной терапии в течение длительного времени (нескольких лет) и существовать только на уровне вегетативных функций.
20.2. СЕРДЕЧНО-ЛЕГОЧНАЯ РЕАНИМАЦИЯ
Показания для СЛР
Основными показаниями для проведения СЛР являются остановка кровообращения и дыхания.
Остановка кровообращеия
Возможны три вида остановки кровообращения: асистолия (остановка сердца), фибрилляция желудочков и атония миокарда (рис. 20-1). После остановки сердца прекращается кровообращение, и жизненно важные органы не получают кислород.
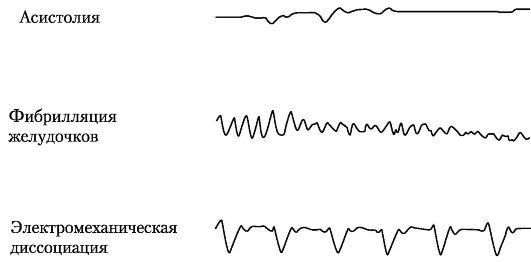 Рис. 20-1. Виды остановки кровообращения
Рис. 20-1. Виды остановки кровообращения
Асистолия характеризуется прекращением сокращений предсердий и желудочков. Ее условно можно подразделить на внезапную и наступающую после предшествующих нарушений ритма. Внезапная асистолия на фоне полного благополучия и без всяких предшествующих нарушений ритма свидетельствует о внезапном прекращении электрической возбудимости сердца в виде «короткого замыкания», чаще всего в результате острой ишемии, связанной с ишемической болезнью сердца (ИБС). Асистолия, наступающая после длительного периода (2-3 мин) фибрилляции желудочков (ФЖ), возникает вследствие истощения запасов высокоэргических фосфатов (аденозинтрифосфорной кислоты - АТФ; креатинфосфата) в миокарде. Возникновение асистолии возможно на фоне развития полной блокады проводимости между синусовым узлом и предсердиями, при отсутствии образования импульсов в других очагах автоматизма.
Данное осложнение может возникать рефлекторно в результате раздражения блуждающих нервов при исходно повышенном их тонусе, особенно на фоне заболеваний, сопровождающихся развитием гипоксии или гиперкапнии.
Предрасполагают к возникновению асистолии лабильная нервная система, эндокринные заболевания, истощение, тяжелая интоксикация и т.д. К сожалению, в хирургической практике иногда наблюдаются случаи внезапной гибели больных от асистолии на фоне проведения таких относительно малоболезненных
и выполняемых по всем правилам манипуляций, как бронхоскопия, экстракция зуба и т.д.
Асистолия может возникнуть внезапно у детей в связи с повышенной физиологической чувствительностью их сердца к вагусной импульсации и у здоровых людей, особенно ваготоников, при физическом или психическом перенапряжении. На ЭКГ при асистолии исчезают желудочковые комплексы.
Фибрилляция желудочков характеризуется внезапным появлением дискоординации в сокращениях миокарда, быстро приводящей к остановке сердца и кровообращения. Причиной ее возникновения является появление нарушений проведения возбуждения внутри проводящей системы желудочков или предсердий. Клиническими предвестниками фибрилляции желудочков может быть появление их трепетания или приступ пароксизмальной тахикардии, и хотя при последнем виде нарушений координация сокращений миокарда сохраняется, высокая частота сокращений может стать причиной неэффективности насосной функции сердца с последующим быстрым летальным исходом.
К факторам риска возникновения фибрилляции желудочков относятся различные неблагоприятные экзо- и эндогенные воздействия на миокард: гипоксия, нарушения водно-электролитного и кислотно-щелочного состояния, общее охлаждение организма, эндогенная интоксикация, наличие ИБС, механические раздражения сердца при различных диагностических и лечебных манипуляциях и т.д.
В развитии фибрилляции желудочков выделяют 4 стадии:
А - трепетание желудочков, продолжающееся 2 с, при котором происходят координированные сокращения, а на ЭКГ регистрируются высокоамплитудные ритмичные волны с частотой 250-300 в минуту;
Б - судорожная стадия (1 мин), при которой происходят хаотичные некоординированные сокращения отдельных участков миокарда с появлением на ЭКГ высокоамплитудных волн с частотой до 600 в минуту;
В - стадия мерцания желудочков (мелковолновая ФЖ) продолжительностью около 3 мин. Беспорядочное возбуждение отдельных групп кардиомиоцитов проявляется на ЭКГ хаотичными низкоамплитудными волнами с частотой более 1000 в минуту;
Г - атоническая стадия - затухающее возбуждение отдельных участков миокарда; на ЭКГ нарастает продолжительность и снижается амплитуда волн при их частоте менее 400 в минуту.
Атония миокарда («неэффективное сердце») характеризуется потерей мышечного тонуса. Она является завершающей стадией любого вида остановки сердечной деятельности. Причиной ее возникновения может быть истощение компенсаторных возможностей сердца (прежде всего АТФ, см. выше) на фоне таких грозных состояний, как массивная кровопотеря, длительная гипоксия, шоковые состояния любой этиологии, эндогенная интоксикация и т.д. Предвестником атонии миокарда является появление на ЭКГ признаков электромеханической диссоциации - видоизмененных желудочковых комплексов.
Остановка дыхания
Нарушения функции внешнего дыхания вызывают расстройства газообмена в легких, которые клинически проявляются тремя основными синдромами: гипок-
сией, гиперкапнией и гипокапнией и могут завершиться развитием апноэ (остановкой дыхательных движений).
Основные причины нарушения внешнего дыхания можно разделить на легочные и внелегочные.
К внелегочным причинам относят:
• нарушение центральной регуляции дыхания: а) острые сосудистые расстройства (тромбоэмболии в церебральные сосуды, инсульты, отек головного мозга); б) травмы головного мозга; в) интоксикации лекарственными препаратами, действующими на дыхательный центр (наркотические препараты, барбитураты и т.д.); г) инфекционные, воспалительные и опухолевые процессы, приводящие к поражению ствола головного мозга; д) коматозные состояния, приводящие к гипоксии мозга;
• поражение костно-мышечного каркаса грудной клетки и плевры: а) периферический и центральный параличи дыхательной мускулатуры; б) спонтанный пневмоторакс; в) дегенеративно-дистрофические изменения дыхательных мышц; г) полиомиелит, столбняк; д) травмы спинного мозга; е) последствия воздействия ФОС и миорелаксантов;
• нарушение транспорта кислорода при больших кровопотерях, острой недостаточности кровообращения и отравлениях «кровяными ядами» (окись углерода, метгемоглобинобразователи).
Легочные причины:
• обструктивные расстройства: а) закупорка дыхательных путей инородными телами и мокротой, рвотными массами, околоплодными водами; б) механическое препятствие доступу воздуха при сдавлении извне (повешение, удушение); в) аллергический бронхо- и ларингоспазм; г) опухолевые процессы дыхательных путей; д) нарушение акта глотания, паралич языка с его западением; е) отечно-воспалительные заболевания бронхиального дерева; ж) повышение тонуса гладкой мускулатуры бронхиол, нарушение опорных структур мелких бронхов, снижение тонуса крупных бронхов;
• поражение респираторных структур: а) инфильтрация, деструкция, дистрофия легочной ткани, б) пневмосклероз;
• уменьшение функционирующей легочной паренхимы: а) недоразвитие легких; б) сдавление и ателектаз легкого; в) большое количество жидкости в плевральной полости; г) тромбоэмболия легочной артерии.
Когда имеет место первичная остановка дыхания, сердце и легкие продолжают оксигенировать кровь несколько минут, и кислород продолжает поступать в мозг и другие органы. Такие пациенты некоторое время сохраняют признаки наличия кровообращения. В случае остановки дыхания или его неадекватности дыхательная реанимация является жизнеспасающим мероприятием и может предупредить остановку сердца.
Признаки клинической смерти
К признакам клинической смерти относятся: кома, апноэ, асистолия. Следует особо подчеркнуть, что данная триада признаков касается раннего периода клинической смерти (когда с момента асистолии прошло несколько минут), и не распространяется на те случаи, когда уже имеются отчетливо выраженные признаки биологической смерти (см. выше). Чем короче период между констатацией клини-
ческой смерти и началом проведения реанимационных мероприятий, тем больше шансов на жизнь у больного, поэтому диагностику и лечение следует проводить параллельно.
Кому диагностируютс на основании отсутствия сознания и по расширенным зрачкам, не реагирующим на свет. Для определения уровня нарушения сознания можно использовать шкалу Глазго (табл. 20-1).
Таблица 20-1. Оценка тяжести комы по шкале Глазго
 Оценка
состояния сознания производится путем суммарного подсчета баллов из
каждой подгруппы. 15 баллов соответствуют состоянию ясного сознания,
13-14 - оглушению, 9-12 - сопору, 4-8 - коме, 3 - смерти мозга.
Оценка
состояния сознания производится путем суммарного подсчета баллов из
каждой подгруппы. 15 баллов соответствуют состоянию ясного сознания,
13-14 - оглушению, 9-12 - сопору, 4-8 - коме, 3 - смерти мозга.
Апноэ регистрируют визуально, по отсутствию дыхательных движений грудной клетки, не стоит тратить время на прикладывание ко рту и носу зеркала или ваты, ниток, ведь реаниматолог довольно часто не знает истинную продолжительность клинической смерти у пациента. Очень важно сразу же определить, имеется обтурация верхних дыхательных путей у пострадавшего, или нет. Это довольно легко диагностируется при первой попытке проведения ИВЛ. Если она проводится по всем правилам (см. ниже), а воздух в легкие не поступает, это указывает на наличие обтурации.
Асистолия регистрируется по отсутствию пульса на сонных артериях. На определение пульса на лучевых артериях тратить время не нужно. Желательно перед определением пульса провести пострадавшему несколько искусственных вдохов.
20.3. СПОСОБЫ ВОССТАНОВЛЕНИЯ ПРОХОДИМОСТИ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Начиная с 1960 г. во многих странах мира начали интенсивно изучать и разрабатывать методы оживления организма. В последующие десятилетия были созданы различные схемы (алгоритмы) оказания реанимационной помощи при терминальных состояниях. В 2000 г. состоялась первая Всемирная научная конференция по сердечно-легочной реанимации и оказанию неотложной сердечно-сосудистой помощи, на которой впервые были выработаны единые международные рекомендации в области оживления организма (Guidelines 2000 for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care).
Далее в данном разделе будут изложены основные положения и рекомендации, принятые на этой конференции, а также дополнения, внесенные в последующие годы.
С практической точки зрения, сердечно-легочную реанимацию (СЛР) можно подразделить на два этапа.
1. Basic Life Support - основные реанимационные мероприятия (базовая СЛР, или первичный реанимационный комплекс), которые могут проводить непрофессиональные спасатели (обученные добровольцы, пожарные и др.), а также должны проводить медицинские работники.
2. Advanced Cardiovascular Life Support - специализированные реанимационные мероприятия (специализированная или расширенная СЛР), которые должен выполнять обученный и оснащенный соответствующим оборудованием и медикаментами медицинский персонал (служба скорой медицинской помощи, врачи отделений реанимации и интенсивной терапии).
Базовая СЛР - это обеспечение проходимости дыхательных путей (Airway), проведение искусственного дыхания (Breathing) и непрямого массажа сердца (Circulation) (приемы АВС). По существу базовая СЛР является начальным этапом оживления, когда спасатель нередко оказывается один на один с пострадавшим и вынужден проводить реанимационные мероприятия «пустыми руками».
Специализированная СЛР подразумевает последовательное выполнение тех же приемов, однако с использованием реанимационного оборудования, медикаментов, что и делает ее существенно более эффективной.
Результативность реанимационных мероприятий во многом определяется четкой последовательностью проведения приемов АВС; отступление от которой чревато переходом клинической смерти в биологическую. При возможности перед началом проведения реанимационных мероприятий следует засечь время.
Выживаемость пострадавших, находящихся в терминальном состоянии, зависит от возможно раннего выполнения действий в определенной последовательности - «цепи выживания» (Chain of Survival), состоящей из следующих звеньев:
• раннее распознавание остановки кровообращения (дыхания) и вызов скорой медицинской помощи или реанимационной бригады для проведения специализированной СЛР;
• раннее проведение базовой СЛР;
• раннее проведение электрической дефибрилляции;
• раннее проведение специализированной СЛР.
У взрослых людей внезапная смерть нетравматического генеза в основном имеет кардиальное происхождение, при этом основным терминальным сердеч-
ным ритмом является фибрилляция желудочков (в 80% случаев). По этой причине наиболее значимым и определяющим фактором выживания у взрослых является временной промежуток, прошедший с момента падения артериального давления до восстановления эффективного сердечного ритма и давления, в соответствии с международными рекомендациями - до момента выполнения электрической дефибрилляции как ведущего звена в «цепи выживания». В дополнение к этому раннее начало проведения окружающими СЛР увеличивает шансы пострадавшего.
Последовательность основных реанимационных мероприятий
• Констатация отсутствия сознания у пострадавшего. Стойкая утрата сознания пострадавшим является достаточно универсальным клиническим проявлением различной по этиологии тяжелой патологии. Необходимо убедиться в том, что у пострадавшего стойко утрачено сознание (с помощью громкого словесного обращения, легкого встряхивания пострадавшего за плечи). Если сознание не возвращается, необходимо по возможности вызвать скорую медицинскую помощь (во многих странах этот пункт выполняется при установлении у пострадавшего отсутствия дыхания).
• Восстановление и обеспечение проходимости дыхательных путей. Если пострадавший без сознания, спасателю необходимо оценить проходимость его дыхательных путей и эффективность дыхания. Для этого пострадавший должен находиться в положении лежа на спине.
Положение пострадавшего. Для проведения реанимационных мероприятий и повышения их эффективности пострадавший должен находиться в положении на спине на твердой, плоской поверхности. Если пострадавший лежит вниз лицом, его необходимо аккуратно и бережно повернуть на спину таким образом, чтобы при повороте голова, плечи и туловище составляли как бы единое целое, без выкручивания (профилактика нанесения дополнительной травмы при, возможно, имеющихся повреждениях).
Положение спасателя. Спасатель должен расположиться по отношению к пострадавшему таким образом, чтобы он мог проводить и искусственное дыхание, и непрямой массаж сердца (желательно с правой стороны от пострадавшего).
Восстановление проходимости дыхательных путей. При отсутствии сознания у пострадавшего его мышечный тонус снижен и язык, и надгортанник могут вызвать обструкцию гортани. Западение корня языка является наиболее частой причиной нарушения проходимости дыхательных путей у пострадавших без сознания (рис. 20-2 а). Во время попытки вдоха пострадавшим язык и надгортанник могут вызвать обструкцию при создании разряжения, создается клапанный тип обструкции. Так как язык анатомически связан с нижней челюстью, то выдвижение последней вперед сопровождается смещением языка от задней стенки глотки и открытием дыхательных путей (рис. 20-2 б). В случае отсутствия данных за травму головы или шеи используется прием «запрокидывание головы - выдвижение нижней челюсти». При этом необходимо удалить изо рта видимые инородные тела (сгустки крови, рвотные массы, зубные протезы). Удалить жидкость изо рта можно достаточно быстро с помощью указательного пальца, обернутого любой тканью (платок, салфетка). При подозрении на наличие инородных тел, расположенных глубже, можно использовать щипцы или прием Геймлиха (см.
раздел 20.4.3. Инородные тела верхних дыхательных путей). Если невозможно восстановить проходимость дыхательных путей всеми описанными способами, возможно проведение коникотомии (крикотиреотомии) (техника ее проведения описана в разделе 20.4.3).
Прием «запрокидывание головы - выдвижение нижней челюсти». Одной рукой, расположенной в области лба пострадавшего, запрокидывают голову последнего, одновременно с этим второй рукой поднимают подбородок пострадавшего (выдвигается нижняя челюсть), что завершает этот прием. В этом случае голову удерживают в запрокинутом положении с приподнятым подбородком и почти сомкнутыми зубами. Необходимо приоткрыть рот пострадавшего для облегчения его спонтанного дыхания и приготовиться к дыханию «ото рта ко рту». Этот прием (ранее описываемый как «тройной прием» Питера-Сафара) является методом выбора при восстановлении проходимости дыхательных путей у пострадавших без подозрения на травму шейного отдела позвоночника.
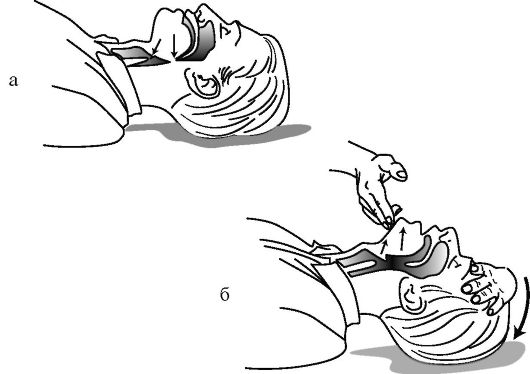 Рис. 20-2. Восстановление проходимости дыхательных путей (а, б)
Рис. 20-2. Восстановление проходимости дыхательных путей (а, б)
Прием «только выдвижение нижней челюсти». Этот ограниченный прием, осуществляемый без запрокидывания головы, должен быть освоен как непрофессиональными спасателями, так и профессионалами. Прием выдвижения челюсти без запрокидывания головы пострадавшего является наиболее безопасным начальным действием при подозрении на травму шейного отдела позвоночника (ныряльщики, падение с высоты, повешенные, некоторые виды автотравмы), так как выполняется без разгибания шеи (рис. 20-3). Необходимо внимательно фиксировать голову без ее поворотов в стороны и сгибания в шейном отделе, так как в подобной ситуации создается реальная угроза усугубления повреждения спинного мозга.
Если у пострадавшего без сознания после обеспечения проходимости дыхательных путей восстанавливается дыхание и есть признаки кровообращения (пульс,
 Рис. 20-3. Прием выдвижения челюсти без запрокидывания головы
Рис. 20-3. Прием выдвижения челюсти без запрокидывания головы
нормальное дыхание, кашель или движения), ему можно придать так называемое «восстановительное положение» (recovery position) или устойчивое положение на правом боку (рис. 20-4).
 Рис. 20-4. Устойчивое положение на правом боку
Рис. 20-4. Устойчивое положение на правом боку
Восстановительное положение (устойчивое положение на правом боку).
Восстановительное положение используется для поддержания пострадавших без сознания (на период ожидания прибытия скорой медицинской помощи), но сохраняющих дыхание и признаки кровообращения при отсутствии подозрений на травмы внутренних органов и повреждения конечностей. Положение пострадавшего на спине чревато повторным нарушением дыхания и опасностью аспирации, например желудочным содержимым. Положение пострадавшего на животе ухудшает его самостоятельное дыхание, так как ограничивает подвижность диафрагмы и снижает податливость легочной ткани и грудной клетки.
Таким образом, восстановительное положение является компромиссным, сводящим к минимуму риск развития вышеописанных осложнений и одновременно позволяющим обеспечить наблюдение за пострадавшим.
Оценка эффективности дыхания пострадавшего. Оценить наличие и эффективность самостоятельного дыхания пострадавшего можно, расположив ухо около
рта и носа пострадавшего, одновременно наблюдая за экскурсией его грудной клетки, слушая и ощущая движение выдыхаемого воздуха (рис. 20-5). Проводить оценку дыхания следует быстро, не более 10 с!
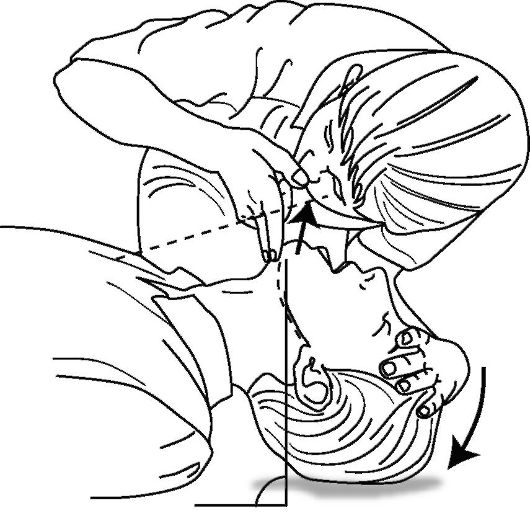 Рис. 20-5. Оценка эффективности дыхания пострадавшего
Рис. 20-5. Оценка эффективности дыхания пострадавшего
Если грудная клетка не расправляется и не спадается, и воздух не выдыхается - пострадавший не дышит.
В том случае если пострадавший не дышит или его дыхание неадекватно (агонального типа), или нет уверенности в эффективности дыхания пострадавшего, необходимо начать проведение искусственного дыхания.
Искусственное дыхание
Дыхание «ото рта ко рту». Данный тип искусственного дыхания является быстрым, эффективным путем доставки кислорода и замены дыхания пострадавшего. Выдыхаемый спасателем воздух содержит достаточно кислорода для поддержания минимальных потребностей пострадавшего (приблизительно 16-17% кислорода поступает пострадавшему, при этом парциальное напряжение О2 в альвеолярном воздухе может достигать 80 мм рт.ст.).
Сразу после восстановления проходимости дыхательных путей спасатель должен двумя пальцами руки, фиксирующей голову пострадавшего в запрокинутом положении, закрыть его носовые ходы, сделать глубокий вдох, после чего охватить своими губами рот пострадавшего и выполнить медленный (продолжительностью не менее 2 с) выдох в пострадавшего (рис. 20-6). Рекомендуемый уменьшенный дыхательный объем у большинства взрослых составляет приблизительно 6-7 мл/ кг (500-600 мл) с частотой 10-12 дыхательных циклов в минуту (1 цикл каждые 4-5 с) и обеспечивает эффективную оксигенацию крови. С самого начала СЛР рекомендуется выполнить от 2 до 5 вдохов подряд.
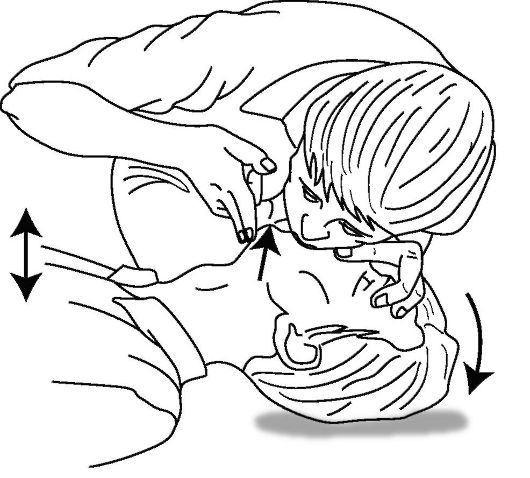 Рис. 20-6. Искусственное дыхание «ото рта ко рту»
Рис. 20-6. Искусственное дыхание «ото рта ко рту»
Следует избегать больших дыхательных объемов, приводящих, с одной стороны, к растяжению желудка, с другой - к повышению внутригрудного давления и снижению венозного возврата к сердцу.
Основным критерием при этом остаются экскурсии грудной клетки, без раздувания эпигастральной области (свидетельство попадания воздуха в желудок). Последнее может вызвать серьезные осложнения, такие, как регургитация и аспирация желудочного содержимого, пневмония. Кроме того, повышающееся давление в желудке приводит к опущению диафрагмы, ограничению экскурсии легких, уменьшению податливости дыхательной системы. Попадание воздуха в желудок происходит при превышении давления в пищеводе над давлением открытия нижнего пищеводного сфинктера. Вероятность попадания воздуха в желудок увеличивается при остановке сердца, когда нижний пищеводный сфинктер релаксируется. Кроме того, существуют факторы, способствующие попаданию воздуха в пищевод и желудок: короткий период вдоха, большой дыхательный объем, высокое пиковое давление на вдохе.
Таким образом, уменьшить риск попадания воздуха в желудок при дыхании ото рта ко рту можно, выполняя медленный вдох с рекомендуемым дыхательным объемом, руководствуясь визуальной оценкой экскурсий грудной клетки при каждом вдохе.
Метод дыхания «ото рта к носу» менее предпочтителен, так как является еще более трудоемким и менее эффективным из-за повышенного сопротивления на вдохе через носовые ходы. Может быть альтернативным методом при невозможности (травма) дыхания ото рта ко рту.
К существенным недостаткам метода дыхания «ото рта ко рту» нужно отнести опасность инфицирования человека, проводящего дыхательную реанимацию (ВИЧ-инфекция, вирусы гепатита В и С, цитомегаловирус, патогенные бактерии).
Однако польза своевременного оказания помощи при остановке дыхания и кровообращения намного превышает риск вторичного инфицирования спасателя или больного, этот риск будет еще меньше, если во время проведения СЛР или обучения ее основным способам следовать простым мерам профилактики инфекций. Обезопасить себя от возможного контактного инфицирования можно с помощью устройств, позволяющих защитить спасателя как от непосредственного контакта с тканями пострадавшего, так и от выдыхаемого им воздуха. К ним относятся различные простейшие одноразового использования лицевые маски с клапаном однонаправленного (нереверсивного типа) потока воздуха («Ключ жизни» и др.), рекомендуемые в основном для непрофессиональных спасателей, S-образный воздуховод, ротоносовая маска с лицевым обтуратором, пищеводно-трахеальный обтуратор и др. профессиональное оборудование. На бытовом уровне воздуховод всегда можно найти в автомобильной аптечке.
Дополнительными и эффективными способами восстановления и поддержания проходимости дыхательных путей является использование ларингеальной маски, комбинированной трахеально-пищеводной трубки (комбитьюб) и интубация трахеи. В частности, конструкция ларингеальной маски (рис. 20-7) позволяет устанавливать ее «вслепую» (рис. 20-8), достаточно надежно разобщать дыхательные пути от глотки и пищевода (рис. 20-9), проводить искусственное дыхание, а также осуществлять туалет трахеобронхиального дерева через ее просвет.
Интубация трахеи предусматривает восстановление проходимости дыхательных путей путем введения интубационной трубки в просвет трахеи. Данная методика может быть выполнена через рот или нос под контролем прямой ларингоскопии или вслепую. Интубация трахеи является наиболее эффективным методом поддержания проходимости верхних дыхательных путей и надежным методом профилактики аспирации. Чаще всего используется оротрахеальная интубация трахеи под контролем прямой ларингоскопии, другие методы используются при невозможности выполнения первой. Выполняя прямую ларингоскопию левой рукой, спасатель вводит клинок ларингоскопа по средней линии, оттесняя им язык влево и вверх. Продвигая изогнутый клинок вперед, конец его подводят к основанию надгортанника, а затем производят движение ларингоскопа вперед и вверх (рис. 20-10 а). При выполнении данных манипуляций открываются голосовая щель и вход в трахею. Под контролем зрения правой рукой спасатель вводит эндотрахеальную трубку в голосовую щель и продвигает ее до исчезновения ман-
 Рис. 20-7. Ларингеальная маска
Рис. 20-7. Ларингеальная маска
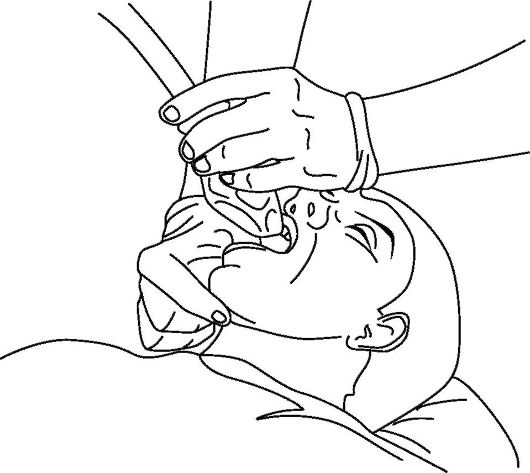 Рис. 20-8. Установка и положение ларингеальной маски
Рис. 20-8. Установка и положение ларингеальной маски
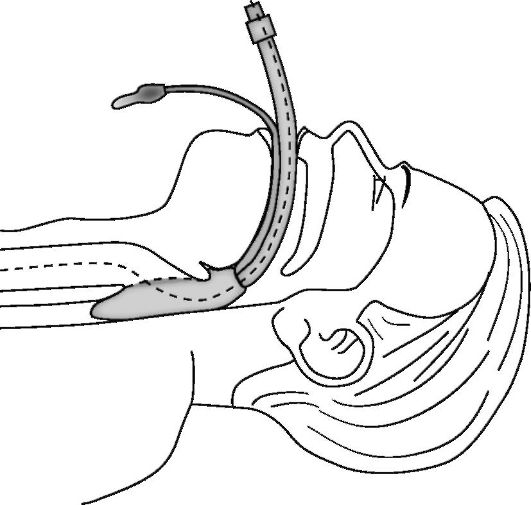 Рис. 20-9. Установка и положение ларингеальной маски
Рис. 20-9. Установка и положение ларингеальной маски
жетки за голосовыми связками (рис. 20-10 б). Раздувают герметичную манжету и соединяют интубационную трубку с мешком «Амбу» или аппаратом ИВЛ.
Необходимо убедиться в правильном положении интубационной трубки.
Об этом свидетельствуют: равномерная экскурсия грудной клетки и аускультация дыхательных шумов равномерно над всей поверхностью грудной клетки (в верхних и нижних отделах легких, справа и слева). После того как спасатель убедился в правильном положении интубационной трубки, последнюю надежно фиксируют для предупреждения ее дислокации во время проведения реанимационных мероприятий и/или транспортировки пострадавшего в стационар.
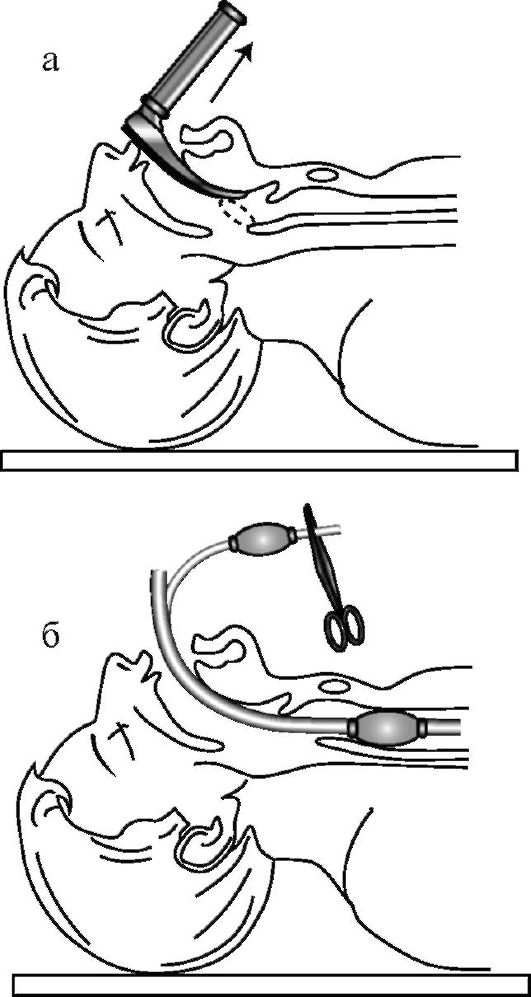 Рис. 20-10. Установка и положение ларингеальной маски (а, б)
Рис. 20-10. Установка и положение ларингеальной маски (а, б)
Типичные ошибки и осложнения при проведении искусственного дыхания
Самая распространенная ошибка - это отсутствие герметичности в «контуре» спасатель (реаниматор) - пострадавший. Начинающий врач, впервые оказавшийся в качестве реаниматора, иногда при проведении дыхания ото рта ко рту забывает плотно зажать нос у пострадавшего. На это будет указывать отсутствие экскурсий грудной клетки. Второй наиболее распространенной ошибкой является неустраненное западение корня языка у пострадавшего, которое может сделать невозможным проведение дальнейшего пособия, и воздух вместо легких начнет поступать в желудок, на что будет указывать появление и нарастание выпячивания в эпигастральной области.
Наиболее частым осложнением при выполнении искусственного дыхания является одновременное поступление воздуха в дыхательные пути и желудок. Это, как правило, связано либо с избыточным дыхательным объемом, либо со слишком быстрым (менее 1,5-2 с) вдохом. Раздувание желудка может вызвать регургитацию с последующим затеканием желудочного содержимого в верхние дыхательные пути. Попытка освободить желудок от воздуха с помощью ручной компрессии в эпигастральной области в положении пострадавшего на спине только провоцирует регургитацию при полном желудке. Если раздувание желудка все же произошло, необходимо быстро повернуть больного на любой бок и плавно, но с достаточным усилием нажать на эпигастральную область. Вышеуказанное пособие нужнл проводить только в положении больного на боку и при наличии наготове отсоса.
Оценка кровообращения. Начиная с первых рекомендаций по оживлению от 1968 г. «золотым стандартом» установления работы сердца было определение пульса на крупных артериях. По стандарту СЛР, отсутствие пульса на сонной артерии указывает на остановку сердца (тратя на это не более 10-15 с!) и требует начала массажа сердца (рис. 20-11).
Существует два метода массажа сердца: открытый и закрытый (непрямой, наружный). Методику проведения открытого массажа сердца мы здесь не рассматриваем, так как он возможен только при вскрытой грудной клетке, в частности, во время кардио-торакальных операций.
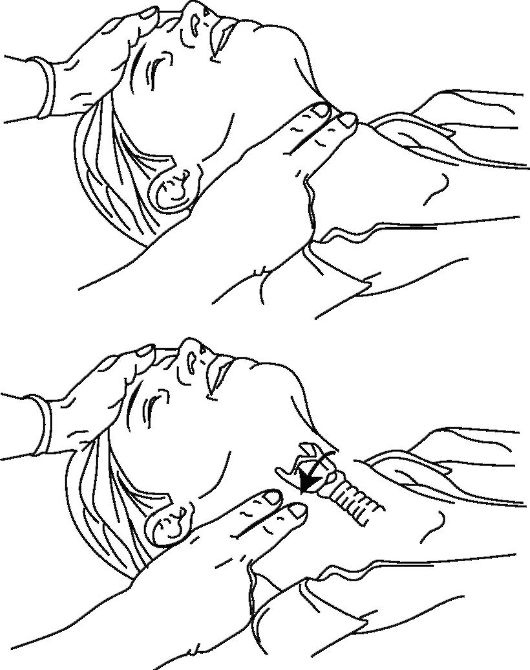 Рис. 20-11. Ориентиры определения каротидного пульса
Рис. 20-11. Ориентиры определения каротидного пульса
Методика непрямого массажа грудной клетки:
• пострадавший должен находиться в горизонтальном положении на спине, на твердом и ровном основании; его голова не должна быть выше уровня груди, так как это ухудшит мозговое кровообращение при проведении компрессий грудной клетки; до начала непрямого массажа сердца с целью увеличения центрального объема крови следует приподнять ноги пострадавшего; поясной ремень расстегнуть для профилактики травмы печени, снять стесняющую одежду;
• спасатель может находиться с любой стороны от пострадавшего; положение рук на грудине - два поперечно расположенных пальца руки вверх от основания мечевидного отростка (рис. 20-12 а), далее обе кисти рук параллельны друг другу, одна на другой («в замке») располагаются в нижней трети грудины; пальцы рук приподняты и не касаются грудной клетки;
• глубина компрессий грудной клетки в среднем 4-5 см, с частотой приблизительно 100 в минуту; для поддержания желаемого ритма спасателю рекомендуется вести вслух счет: «один и два и три и четыре...» до 10, далее до 15 без соединительного союза «и»;
• эффективный мозговой и коронарный кровоток, помимо рекомендуемой частоты, обеспечивается продолжительностью фазы компрессии и фазы расслабления грудной клетки в соотношении 1:1; необходимо придерживаться правильного положения рук в течение всего цикла из 30 компрессий, не отрывая и не меняя их положения во время пауз для искусственного дыхания;
• последовательное соотношение компрессий с дыхательными циклами 30:2 (независимо от числа спасателей); после интубации трахеи и раздувания манжеты - соотношение без изменений.
Для максимально эффективного непрямого массажа и уменьшения возможности вероятного травмирования грудной клетки первое нажатие на грудную клетку следует провести плавно, стараясь определить ее эластичность. Не делайте толчкообразных движений - это верный путь вызвать травму грудной клетки! Спасатель должен расположиться относительно пострадавшего таким образом, чтобы между его руками, полностью выпрямленными в локтевых суставах, и грудной клеткой пострадавшего был прямой угол (рис. 20-12 б). При проведении массажа должна использоваться не сила рук, а масса туловища спасателя. Это даст существенную экономию сил и увеличит эффективность массажа. Если все делается правильно, в такт с компрессией грудной клетки, должен появляться синхронный пульс на сонных и бедренных артериях.
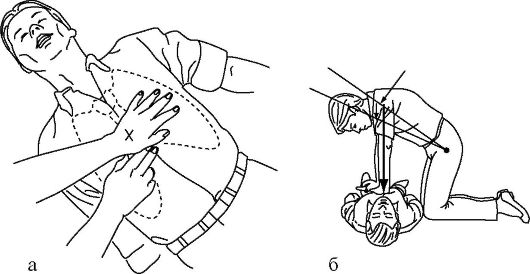 Рис. 20-12. Методика непрямого массажа грудной клетки (а, б)
Рис. 20-12. Методика непрямого массажа грудной клетки (а, б)
Контроль эффективности непрямого массажа сердца и искусственного дыхания (каждые 1-3 мин в течение 5 с) определяется следующими критериями:
• появление пульсового толчка на сонной или бедренной артерии;
• сужение зрачков с появлением реакции на свет;
• изменение цвета кожи (становится менее бледной и цианотичной);
• возможно появление самостоятельного дыхания.
Для обеспечения и поддержания более высокого уровня коронарного и мозгового кровотока у пострадавшего, согласно новым поправкам и предложениям Международной согласительной конференции в области сердечно-легочной реанимации от 2005 г., рекомендуется увеличить число компрессий грудной клетки за один цикл до 30 и придерживаться соотношения массаж - дыхание как 30:2 независимо от числа спасателей.
Эти рекомендации распространяются как на непрофессионалов, так и на профессиональных спасателей при проведении базовой СЛР у взрослых.
Если дыхательные пути защищены интубационной трубкой с раздутой манжетой, обеспечивающей герметичность дыхательного тракта (квалифицированная
СЛР), компрессии грудной клетки могут быть постоянными и независимыми от дыхательных циклов, без пауз для искусственных вдохов, с частотой дыхания 10-12 в минуту у взрослых, 12-20 - у детей. В этом случае эффективность СЛР возрастает.
Типичные ошибки и осложнения при проведении непрямого массажа сердца
Наиболее распространенная ошибка - недостаточная интенсивность сжатия грудной клетки. Ее причиной может быть проведение реанимационного пособия на мягкой поверхности, или сама по себе слабая интенсивность компрессий грудной клетки. Объективный показатель - отсутствие синхронной пульсации на крупных артериях. Перерывы во время проведения массажа сердца более 5-10 с (например, для проведения лечебных или диагностических мероприятий) также крайне нежелательны.
Самым частым осложнением при проведении непрямого массажа сердца являются переломы костного каркаса грудной клетки. Возникновение данного осложнения наиболее типично у лиц пожилого возраста и нехарактерно для пациентов детского возраста. Переломы ребер сами по себе могут вызвать различные механические повреждения легких, но это, к счастью, бывает довольно редко. Чаще повреждение каркаса грудной клетки сопровождается нарушением ее присасывающих свойств для венозного возврата из большого круга в правое предсердие, что вносит дополнительные трудности в процесс реанимации. Во избежание данного осложнения используйте рекомендации, изложенные выше. Если все же возникло повреждение грудной клетки, продолжайте проводить реанимационное пособие в полном объеме.
Лекарственные средства, применяемые при специализированной (расширенной) СЛР
Лекарственные средства в ходе реанимационных мероприятий применяются с целью:
• оптимизации сердечного выброса и сосудистого тонуса;
• нормализации нарушений ритма и электрической нестабильности сердца. Адреналин. Показан при ФЖ, асистолии, симптоматической брадикардии.
Главным образом используется адренэргическое действие адреналина в период остановки кровообращения для увеличения миокардиального и мозгового кровотока при проведении СЛР. Кроме того, повышает возбудимость и сократимость миокарда, однако данный положительный эффект воздействия на сердце имеет оборотную сторону - при передозировке адреналина резко возрастают работа сердца и его потребность в кислороде, что само по себе может вызвать субэндокардиальную ишемию, спровоцировать фибрилляцию. Рекомендуемая доза - 1 мл 0,1% раствора (1 мг). Кратность введения - каждые 3-5 мин СЛР, до получения клинического эффекта.
Для более быстрой доставки препарата в центральный кровоток при его введении (без предварительного разведения) в периферическую вену (желательно кубитальные вены) каждую дозу адреналина необходимо сопровождать введением 20 мл физиологического раствора.
Норадреналин. Адреномиметик с более выраженным, чем у адреналина сосудосуживающим действием и меньшим стимулирующим влиянием на миокард. Показан при тяжелой артериальной гипотензии (без гиповолемии) и низком периферичес-
ком сосудистом сопротивлении. Рекомендуемая доза норадреналина гидротартрата - 2 мл 0,2% раствора, разведенного в 400 мл физиологического раствора.
Вазопрессин. Являясь естественным антидиуретическим гормоном, в больших дозах, значительно превышающих антидиуретический эффект, вазопрессин действует как неадренэргический периферический вазоконстриктор. На сегодняшний день вазопрессин рассматривается как возможная альтернатива адреналину при терапии рефрактерной к электрической дефибрилляции ФЖ у взрослых. Кроме того, может быть эффективен у больных при асистолии или желудочковой тахикардии без пульса.
Атропин. Показан при лечении симптоматической синусовой брадикардии, при асистолии в сочетании с адреналином. Атропин «подтвердил» свою эффективность при лечении гемодинамически значимых брадиаритмий. В соответствии с рекомендациями Международной конференции 2000 г. при развитии остановки кровообращения через асистолию или электромеханическую диссоциацию предлагается введение атропина взрослым каждые 3-5 мин по 1 мг внутривенно до общей дозы не более 0,4 мг/кг.
Амиодарон (кордарон). Считается препаратом выбора у пациентов с ФЖ и ЖТ, рефрактерными к трем начальным разрядам дефибриллятора. Стартовой дозой являются 300 мг, разведенные в 20 мл 5% глюкозы, введенные внутривенно болюсом. Возможно дополнительное введение 150 мг (в таком же разведении), если ФЖ/ЖТ повторяются, вплоть до достижения максимальной суточной дозы - 2 г амиодарона.
Лидокаин. Наиболее эффективен для предупреждения или купирования частой желудочковой экстрасистолии - грозного предвестника возникновения ФЖ, а также при развившейся ФЖ. Рекомендуемая первоначальная доза 1-1,5 мг/кг (80-120 мг). При рефрактерной ФЖ или желудочковой тахикардии через 3-5 мин можно вводить половинную дозу.
Лидокаин в настоящее время может рассматриваться как альтернатива амиодарону только при его недоступности, но не должен (!) вводиться вместе с ним. При сочетанном введении упомянутых антиаритмиков существует реальная угроза как потенцирования сердечной слабости, так и проявления аритмогенного действия.
Сульфат магния. Гипомагниемия вызывает рефрактерную фибрилляцию желудочков и препятствует восполнению запасов внутриклеточного калия. Сульфат магния рекомендуется при рефрактерной ФЖ, особенно если подозревается гипомагниемия у пациентов, длительное время получавших тиазидные и петлевые (некалийсберегающие) диуретики. При проведении реанимационных мероприятий 1-2 г сульфата магния, разведенного в 100 мл 5% глюкозы, вводят в/в за 1-2 мин.
Гидрокарбонат натрия. Метаболический ацидоз в условиях остановки кровообращения является неизбежным следствием гипоксии. Правильно проведенная искусственная вентиляция легких оказывает более эффективное воздействие на КЩС, чем использование буферных растворов. Вторым обстоятельством, ограничивающим применение гидрокарбоната натрия в условиях остановленного кровообращения, является отсутствие адекватной перфузии легких при СЛР и поэтому нарушенной элиминации углекислоты. В этих условиях сода будет только способствовать нарастанию внутриклеточного ацидоза. Гидрокарбонат натрия показан либо после восстановления сердечной деятельности, либо через 10- 15 мин проводимых реанимационных мероприятий. Начальная доза - 1 ммоль/кг
(2 мл 4% раствора соды на 1 кг), в последующем через каждые 10 мин вводят половину расчетной дозы под контролем газов крови.
Хлористый кальций. Раньше считалось, что данный препарат при проведении СЛР увеличивает амплитуду сердечных сокращений и оказывает стимулирующий эффект на сердце, однако исследования последних лет это не подтвердили. Применение хлористого кальция ограничено редкими исключениями (исходная гипокальциемия, гиперкалиемия, передозировка антагонистов кальция).
Пути введения лекарственных средств при СЛР
Распространенное мнение, что оптимальным методом введения лекарственных средств при проведении СЛР является внутрисердечный путь, за последние годы претерпело изменения. Внутрисердечные пункции всегда несут в себе риск повреждения проводящей системы сердца и коронарных сосудов или интрамурального введения лекарственных средств. В подобной ситуации предпочтение отдают внутривенному пути введения лекарственных препаратов при остановке кровообращения. Наиболее эффективное и быстрое поступление лекарственных веществ в кровоток обеспечивает центральный венозный доступ, однако проведение катетеризации центральных вен требует времени и значительного опыта у врача; кроме того, этому доступу присущи достаточно тяжелые осложнения. Обеспечить периферический доступ обычно легче, однако при этом лекарственное средство сравнительно медленно поступает в центральный кровоток. Для ускорения поступления лекарственного средства в центральное русло рекомендуют, во-первых, катетеризировать одну из кубитальных вен, во-вторых, вводить лекарственное средство болюсом без разведения с последующим «продвижением» его 20 мл физиологического раствора.
Исследования последних лет показали, что эндотрахеальное введение лекарственных средств через интубационную трубку обладает по эффективности близким действием к внутривенному доступу. Более того, если интубация трахеи выполнена раньше, чем установлен венозный катетер, то адреналин, лидокаин и атропин можно вводить эндотрахеально, при этом дозу для взрослых увеличивают в 2-2,5 раза (по сравнению с начальной дозой для в/в введения), а для детей - в 10 раз. Кроме того, эндотрахеальное введение лекарственных средств требует их разведения (до 10 мл физиологического раствора каждое введение).
Электрическая дефибрилляция
Основоположниками электрической дефибрилляции можно по праву считать швейцарских ученых Prevost и Betelli, которые в самом конце XIX века открыли этот эффект при изучении аритмогенеза, вызванного электрическим стимулом.
Основная цель дефибрилляционного шока состоит в восстановлении синхронизации сокращений сердечных волокон, нарушенной в результате желудочковой тахикардии или фибрилляции. Экспериментальные и клинические исследования последних лет показали, что наиболее значимой детерминантой, определяющей выживаемость пациентов после внезапной смерти, является время, прошедшее с момента остановки кровообращения до проведения электрической дефибрилляции.
Проведение возможно ранней дефибрилляции крайне необходимо для спасения пострадавших после остановки кровообращения в результате фибрилляции желудочков (ФЖ), которая является наиболее частым начальным ритмом (80%)
при внезапной остановке кровообращения. Вероятность успешной дефибрилляции уменьшается со временем, так как ФЖ имеет тенденцию к переходу в асистолию в течение нескольких минут. Многие взрослые с ФЖ могут быть спасены без неврологических последствий, если дефибрилляция выполнена в течение первых 6-10 мин после внезапной остановки кровообращения, особенно если проводилась СЛР.
В Рекомендациях 2005 г. содержатся следующие новые подходы, основанные на исследованиях последних лет:
• если на догоспитальном этапе бригадой «скорой» с самого начала фибрилляция не регистрируется, то вначале необходимо предварительно в течение приблизительно 2 мин провести базовую СЛР (5 циклов массаж: дыхание 30:2) и лишь затем при наличии дефибриллятора выполнить дефибрилляцию;
• показано, что выполнение одного разряда дефибриллятора с последующим без паузы проведением базовой СЛР в течение 2 мин (до момента оценки ритма) более эффективно, чем ранее рекомендованная 3-кратная серия дефибрилляций;
• рекомендуемая величина разряда при дефибрилляции у взрослых аппаратом с монофазной формой импульса - 360 Дж., двухфазной - 150-200 Дж. При отсутствии эффекта после первого разряда последующие попытки дефибрилляции (после обязательных 2-минутных циклов СЛР -массаж: дыхание) проводятся аналогичными по величине разрядами;
• при проведении дефибрилляции у детей в возрасте от 1 до 8 лет рекомендуется, во-первых, использовать детские электроды, во-вторых, выбирать величину первого разряда - 2 Дж/кг, при последующих попытках - 4 Дж/кг. Детям до 1 года проводить дефибрилляцию не рекомендуется.
Методика дефибрилляции
Электроды наружного дефибриллятора следует располагать на передней поверх-ности грудной клетки: один электрод - справа во втором межреберье под ключицей, другой - в проекции верхушки сердца. Во избежание ожога кожи и улучшения электропроводности необходимо, во-первых, смазывать электроды специальным токопроводным гелем (при его отсутствии физиологическим раствором или водой), во-вторых, плотно прижимать электроды к грудной клетке (приблизительно с усилием в 10 кг). Рекомендуемые параметры дефибрилляции у взрослых: первая попытка - 200 Дж, при неудаче - 300 Дж, затем - 360 Дж.
Помощники должны приостановить реанимационные мероприятия, не касаться пациента и металлических предметов, которые контактируют с пациентом.
Промежуток времени между попытками должен быть минимален и требуется лишь для оценки эффекта дефибрилляции и набора, в случае необходимости, следующего разряда.
У пациента с имплантированным водителем ритма при проведении дефибрилляции один из электродов располагается не менее чем в 10 см от водителя ритма, а другой в проекции верхушки сердца.
Типичные ошибки при проведении дефибрилляции:
• позднее проведение электрической дефибрилляции;
• отсутствие СЛР при подготовке к дефибрилляции;
• плохой контакт между электродами и тканями;
• неправильно выбранная величина энергии разряда.
Прекардиальный удар
Однократный прекардиальный удар (наносится удар кулаком с расстояния 30 см в области нижней трети грудины) может производиться только профессионалами при отсутствии дефибриллятора, если установлена ФЖ (фиксируется на мониторе либо клиническая ситуация, оцененная профессионалом, соответствует классическому описанию ФЖ). При эффективности данного метода появляется пульс на сонной артерии. При внезапной остановке кровообращения, продолжающейся более 30 с, прекардиальный удар неэффективен!
Универсальный алгоритм действий при внезапной смерти взрослых (по Guidelines 2000 for CPR and ECc)
Основные реанимационные мероприятия (базовая СЛР):
• убедиться в отсутствии сознания у пострадавшего;
• обратиться за помощью;
• восстановить проходимость дыхательных путей;
• проверить дыхание;
• выполнить от 2-5 вдохов ИВЛ (при необходимости);
• проверить наличие кровообращения;
• начать непрямой массаж сердца (при отсутствии признаков кровообращения).
Нанести прекардиальный удар (по показаниям и при невозможности проведения дефибрилляции) или (см. ниже).
Подсоединить дефибриллятор/монитор. Оценить ритм сердца.
В случае ФЖ или желудочковой тахикардии без пульса:
• выполнить 3 попытки дефибрилляции (если необходимо);
• возобновить СЛР в течение 1 мин и вновь оценить ритм сердца;
• повторить попытку дефибрилляции.
При отсутствии эффекта начать специализированную (расширенную) СЛР (интубация трахеи, венозный доступ, медикаменты).
При отсутствии эффекта проанализировать и устранить возможные причины.
• Гиповолемия.
• Гипоксия.
• Гипер/гипокалиемия.
• Гипотермия.
• Ацидоз.
• «Таблетки» (наркотики, отравление).
• Тампонада сердца.
• Тромбоз коронарный.
• Тромбоэмболия легочной артерии.
• Пневмоторакс напряженный.
Особенности проведения СЛР у детей
У детей причины внезапного прекращения дыхания и кровообращения весьма разнородны, включая синдром внезапной младенческой смерти, асфиксию, утопление, травмы, инородные тела в дыхательных путях, поражение электричес-
ким током, сепсис и др. В связи с чем, в отличие от взрослых, трудно определить ведущий фактор («золотой стандарт»), от которого бы зависела выживаемость при развитии терминального состояния.
Реанимационные мероприятия у младенцев и детей отличаются от таковых у взрослых. Несмотря на наличие множества сходных моментов в методологии проведения СЛР у детей и взрослых, поддержание жизни у детей, как правило, начинается с другой отправной точки. Как уже отмечалось выше, у взрослых последовательность действий основана на симптомах, большинство из которых имеют кардиальную природу. В итоге создается клиническая ситуация, обычно требующая для достижения эффекта проведения экстренной дефибрилляции. У детей первичная причина обычно носит респираторный характер, которая, если своевременно не распознается, быстро приводит к фатальной остановке сердечной деятельности. Первичная же остановка сердца у детей встречается редко.
В связи с анатомо-физиологическими особенностями пациентов педиатрического периода жизни для оптимизации методики реанимационной помощи выделяют несколько возрастных границ. Это новорожденные, младенцы в возрасте до 1 года, дети от 1 до 8 лет, дети и подростки старше 8 лет.
Наиболее частая причина обструкции дыхательных путей у детей без сознания - это язык. Простые приемы разгибания головы и подъема подбородка или выведения нижней челюсти обеспечивают проходимость дыхательных путей ребенка. Если причиной тяжелого состояния ребенка является травма, то рекомендуется поддерживать проходимость дыхательных путей только за счет выведения нижней челюсти.
Особенность проведения искусственного дыхания у маленьких детей (в возрасте до 1 года) заключается в том, что, учитывая анатомические особенности - небольшое пространство между носом и ртом ребенка - спасатель проводит дыхание «ото рта ко рту и носу» ребенка одновременно. Однако, как свидетельствуют последние исследования, при проведении базовой СЛР у младенцев предпочтительным является метод дыхания «ото рта к носу». У детей в возрасте от 1 до 8 лет рекомендуется метод дыхания «ото рта ко рту».
Выраженная брадикардия или асистолия является наиболее частым видом ритма, связанным с остановкой сердца у детей и младенцев. Оценка кровообращения у детей традиционно начинается с проверки пульса. У младенцев оценивают пульс на плечевой артерии, у детей - на сонной. Проверку пульса проводят не дольше 10 с, и, если он не прощупывается или его частота у младенцев менее 60 ударов в минуту, необходимо немедленно начать наружный массаж сердца.
Особенности непрямого массажа сердца у детей: новорожденным массаж проводят ногтевыми фалангами больших пальцев, предварительно охватив спинку кистями обеих рук, у младенцев - одним или двумя пальцами, у детей от 1 до 8 лет - одной рукой. У детей до 1 года при проведении СЛР рекомендуется придерживаться частоты компрессий более 100 в мин (2 компрессии за 1 с), в возрасте от 1 года до 8 лет - не менее 100 в мин, при соотношении с дыхательными циклами 5:1. У детей старше 8 лет следует придерживаться рекомендаций для взрослых.
Верхняя условная возрастная граница 8 лет для детей была предложена в связи с особенностями методики проведения непрямого массажа сердца. Тем не менее дети могут иметь различную массу тела, поэтому нельзя категорично говорить об определенной верхней возрастной границе. Спасатель должен самостоятельно определить эффективность реанимационных мероприятий и применить наиболее подходящую методику.
Рекомендуемая начальная доза адреналина составляет 0,01 мг/кг или 0,1 мл/ кг на физиологическом растворе, введенная внутривенно или внутрикостно. Последние исследования доказывают преимущество использования у детей высоких доз адреналина при ареактивной асистолии. Если нет ответа на первичную дозу, рекомендуется через 3-5 мин или повторить такую же дозу или ввести адреналин в высокой дозе - 0,1 мг/кг 0,1 мл/кг на физиологическом растворе.
Атропин является препаратом парасимпатической блокады, обладающим противовагусным действием. Для лечения брадикардии применяется в дозе 0,02 мг/кг. Атропин является обязательным препаратом, используемым во время остановки сердца, особенно, если она происходила через брадикардию вагусной природы.
ПОКАЗАНИЯ, ПРОТИВОПОКАЗАНИЯ И СРОКИ ПРОВЕДЕНИЯ РЕАНИМАЦИОННОГО ПОСОБИЯ
Показанием к проведению реанимационного пособия является наличие у больного преагонального, агонального состояний или клинической смерти.
Действия медицинских работников при оказании реанимационной помощи пострадавшим в нашей стране регламентированы приказом Минздрава РФ от 04.03.2003 ? 73 «ОБ УТВЕРЖДЕНИИ ИНСТРУКЦИИ ПО ОПРЕДЕЛЕНИЮ КРИТЕРИЕВ И ПОРЯДКА ОПРЕДЕЛЕНИЯ МОМЕНТА СМЕРТИ ЧЕЛОВЕКА, ПРЕКРАЩЕНИЯ РЕАНИМАЦИОННЫХ МЕРОПРИЯТИЙ».
Приказ зарегистрирован в Минюсте РФ 4 апреля 2003 г. Регистрационный ? 4379.
Приложение к приказу Министерства здравоохранения Российской Федерации
от 04.03.03 ? 73.
ИНСТРУКЦИЯ ПО ОПРЕДЕЛЕНИЮ КРИТЕРИЕВ И ПОРЯДКА ОПРЕДЕЛЕНИЯ МОМЕНТА СМЕРТИ ЧЕЛОВЕКА, ПРЕКРАЩЕНИЯ РЕАНИМАЦИОННЫХ МЕРОПРИЯТИЙ.
I. Общие сведения.
Смерть человека наступает в результате гибели организма как целого. В процессе умирания выделяют стадии: агонию, клиническую смерть, смерть мозга и биологическую смерть.
Агония характеризуется прогрессивным угасанием внешних признаков жизнедеятельности организма (сознания, кровообращения, дыхания, двигательной активности).
При клинической смерти патологические изменения во всех органах и системах носят полностью обратимый характер.
Смерть мозга проявляется развитием необратимых изменений в головном мозге, а в других органах и системах частично или полностью обратимых.
Биологическая смерть выражается посмертными изменениями во всех органах и системах, которые носят постоянный, необратимый, трупный характер.
Посмертные изменения имеют функциональные, инструментальные, биологические и трупные признаки.
Функциональные признаки.
• Отсутствие сознания.
• Отсутствие дыхания, пульса, артериального давления.
• Отсутствие рефлекторных ответов на все виды раздражителей.
Инструментальные признаки.
• Электроэнцефалографические.
• Ангиографические. Биологические признаки.
• Максимальное расширение зрачков.
• Бледность и/или цианоз, и/или мраморность (пятнистость) кожных покровов.
• Снижение температуры тела. Трупные изменения.
• Ранние признаки.
• Поздние признаки.
II. Констатация смерти человека.
Констатация смерти человека наступает при смерти мозга или биологической смерти человека (необратимой гибели человека).
Биологическая смерть устанавливается на основании наличия трупных изменений (ранние признаки, поздние признаки).
Диагноз «смерть мозга» устанавливается в учреждениях здравоохранения, имеющих необходимые условия для констатации смерти мозга.
Смерть человека на основании смерти мозга устанавливается в соответствии с Инструкцией по констатации смерти человека на основании диагноза смерти мозга, утвержденной приказом Министерства здравоохранения Российской Федерации от 20.12.2001 ? 460 «Об утверждении Инструкции по констатации смерти человека на основании диагноза смерти мозга» (приказ зарегистрирован Министерством юстиции Российской Федерации 17 января 2002 г. ? 3170).
III. Прекращение реанимационных мероприятий.
Реанимационные мероприятия прекращаются только при признании этих мер абсолютно бесперспективными или констатации биологической смерти, а именно:
• при констатации смерти человека на основании смерти головного мозга, в том числе на фоне неэффективного применения полного комплекса мероприятий, направленных на поддержание жизни;
• при неэффективности реанимационных мероприятий, направленных на восстановление жизненно важных функций в течение 30 мин.
Реанимационные мероприятия не проводятся.
• При наличии признаков биологической смерти.
• При наступлении состояния клинической смерти на фоне прогрессирования достоверно установленных неизлечимых заболеваний или неизлечимых последствий острой травмы, несовместимой с жизнью.
Примечание. Данная инструкция не определяет условий отказа применения реанимационных мероприятий или их прекращения у новорожденных детей и детей до 5 лет.
Прогноз после проведения СЛР.
Благоприятный исход СЛР в условиях стационара в настоящее время колеблется от 22 до 57%, частота выписки выживших пациентов составляет 5-29%, из этого числа 50% уходят с неврологическим дефицитом. Исход СЛР на догоспитальном этапе на порядок ниже (Г. Балтопулос, 1999). Ведущим осложнением у лиц, перенесших состояние клинической смерти, является развитие постреанимационной болезни.
В заключение данной главы необходимо отметить следующее: успешное оживление пострадавшего человека возможно лишь при непременном сочетании трех равнозначно важных условий:
• желать помочь;
• знать, как это сделать;
• уметь.
20.4. НЕОТЛОЖНАЯ МЕДИЦИНСКАЯ ПОМОЩЬ БОЛЬНЫМ ПРИ ОСТРЫХ НАРУШЕНИЯХ ДЫХАНИЯ
20.4.1. ЛАРИНГОСПАЗМ
Этиология. Механическое или химическое раздражение дыхательных путей.
Патогенез. В основе синдрома лежит рефлекторный спазм поперечно-полосатой мускулатуры, регулирующей работу голосовой щели.
Клиника. На фоне относительного благополучия, у пострадавшего внезапно возникает стридорозное дыхание, быстро появляются признаки острой дыхательной недостаточности (ОДН) I степени, в течение нескольких минут переходящие в ОДН II-III степени; это сопровождается потерей сознания, нарушением работы сердечно-сосудистой системы и развитием коматозного состояния. Смерть наступает от асфиксии.
Неотложная помощь. При полном ларингоспазме патогенетически обоснованным методом лечения является общая кураризация больного с последующей интубацией трахеи и переводом на ИВЛ. В настоящее время кроме миорелаксантов нет других препаратов, способных быстро (в течение нескольких десятков с - 1 мин) снять спазм поперечно-полосатой мускулатуры. Проведение вспомогательной вентиляции при помощи любой дыхательной аппаратуры на фоне полного ларингоспазма неэффективно, однако при частичном ларингоспазме ее нужно проводить любым доступным способом.
При отсутствии возможности провести немедленный перевод больного на ИВЛ с использованием миорелаксантов показано проведение экстренной коникотомии (см. раздел 20.4.3. Инородные тела верхних дыхательных путей). Трахеостомия в данной ситуации из-за сложности и продолжительности оперативного вмешательства (3-5 мин) не показана. После устранения ларингоспазма и перевода больного на ИВЛ проводят неспецифическая антигипоксическая терапия.
20.4.2. БРОНХИОЛОСПАЗМ
Бронхиолоспазм является синонимом анафилактического и анафилактоидного варианта астматического статуса.
Астматические состояния
Астматическое состояние определяется как синдром, характеризующийся остро возникающим приступом удушья. Удушье определяется как крайняя степень
выраженности одышки, сопровождающееся мучительным чувством нехватки воздуха, страхом смерти.
Этиология. Данное состояние может развиться остро при заболеваниях верхних дыхательных путей (инородные тела, опухоли гортани, трахеи, бронхов, приступ бронхиальной астмы) и при заболеваниях ССС (пороки сердца, ОИМ, перикардиты).
Патогенез обусловлен обструкцией дыхательных путей и нарушением диффузии кислорода в кровь.
В развитии астматических состояний при заболеваниях сердечно-сосудистой системы в основном лежат отек слизистой оболочки бронхов в результате скопления в ней интерстициальной жидкости и сдавление мелких бронхов отечной и интерстициальной тканью.
В развитии бронхиальной обструкции принимают участие следующие механизмы: спазм гладкой мускулатуры бронхиол, дискриния и гиперкриния, воспалительный отек слизистой оболочки бронхов, дискинезия трахеи и крупных бронхов, экспираторный коллапс мелких бронхов, склеротические изменения в стенке бронхов.
В зависимости от причин, вызвавших астматическое состояние, выделяют сердечную астму, астматический статус на фоне бронхиальной астмы и смешанный вариант.
Приступ бронхиальной астмы
Приступ бронхиальной астмы характеризуется развитием выраженной экспираторной одышки, сопровождающейся чувством нехватки воздуха и нарушениями газового состава крови (гипоксией и при затяжном течении гиперкапнией).
Клиническая картина приступа бронхиальной астмы складывается из трех периодов: 1) период предвестников; 2) период разгара; 3) период обратного развития. Период предвестников индивидуален у каждого пациента и может проявляться в течение от нескольких минут до нескольких суток в виде головной боли, сенной лихорадки, крапивницы, чувства затруднения дыхания и прочее. В период разгара у больного появляется кашель с трудноотделяемой вязкой мокротой, затем отхождение мокроты прекращается; одышка экспираторного характера, сопровождающаяся чувством нехватки воздуха; сердцебиение, могут появляться перебои в работе сердца. Пациент занимает вынужденное положение с фиксированным плечевым поясом, вдох удлинен, могут наблюдаться «дистанционные хрипы», в акте дыхания принимает участие вспомогательная мускулатура, грудная клетка эмфизематозная, перкуторно коробочный звук над легкими, дыхание жесткое, выслушивается большое количество сухих свистящих и жужжащих хрипов, тахикардия, АД нормальное или имеется тенденция к повышению. В период обратного развития улучшается отхождение мокроты, уменьшается одышка, укорачивается выдох, нормализуется аускультативная картина в легких, хотя при обострении бронхиальной астмы жесткое дыхание и хрипы могут сохранятся еще длительное время.
Неотложная помощь
Ингаляции кислорода через носовой катетер или маску - 2-6 л/мин. Ведущими препаратами для купирования приступа удушья являются адреномиметики. Лечение следует начинать с подкожного введения адреналина.
Адреналин является стимулятором α1- β1- и β2- адренергических рецепторов. Он вызывает расслабление мускулатуры бронхиол с последующим их расширением, что является положительным эффектом на фоне бронхиолоспазма, но, в то же время, воздействуя на βl-адренорецепторы сердца, вызывает тахикардию, усиление сердечного выброса и возможное ухудшение снабжения миокарда кислородом. Применяют «тестирующие» дозы, зависящие от массы больного: при массе меньше 60 кг 0,3 мл, при массе от 60 до 80 кг 0,4 мл, при массе более 80 кг 0,5 мл 0,1% раствора адреналина гидрохлорида. При отсутствии эффекта подкожную инъекцию в первоначальной дозе можно повторить через 15-30 мин (Ч.Г. Скоггин, 1986; В.Д. Малышев, 1996). Не рекомендуется превышать данные дозы, так как избыточное накопление продуктов полураспада адреналина может вызвать возникновение парадоксальной бронхиолконстрикции. Введение адреналина не рекомендуется пожилым больным; лицам, страдающим ИБС, гипертонической болезнью (ГБ), паркинсонизмом, токсическим зобом в связи с возможным повышением АД, тахикардией, усилением тремора, возбуждением, иногда усугублением ишемии миокарда.
Помимо адреналина можно назначать один из β-адреностимуляторов. Алупент (астмопент, орципреналин) - применяется в виде дозированного аэрозоля начиная с одной ингаляции, при необходимости через 5 мин делают повторную. Действие начинается через 1-2 мин, полное купирование приступа происходит через 15-20 мин, продолжительность действия - около 3 ч. Возможно использовать п/к или в/м введение 1 мл 0,05% раствора алупента или в/в капельное введение (1 мл 0,05% раствора алупента в 300 мл 5% глюкозы со скоростью 30 капель в минуту). Алупент является частично селективным β2-адреностимулятором, поэтому в течение суток можно пользоваться алупентом 3-4 раза во избежание тахикардии, экстрасистолий.
Сальбутамол (вентолин, асмалин, алопрол) - применяется дозированный аэрозоль, первоначально 1-2 вдоха; при отсутствии эффекта через 5 мин можно сделать еще 1-2 вдоха. Допустимая суточная доза - 6-10 разовых ингаляционных доз (частично селективный β2-адреностимулятор). Бронхиолдилатирующее действие препарата начинается через 1-5 мин, максимум эффекта наступает через 30 мин, продолжительность действия - 3 ч.
Тербуталин (бриканил) - применяется в виде дозированного аэрозоля: 1-2 вдоха или в/м 0,5 мл 0,05% раствора до 4 раз в день. Бронхорасширяющее действие отмечается через 1-5 мин, максимум - через 45 мин, длительность действия - не менее 5 ч. Значительного изменения ЧСС и АД после ингаляций тербуталина нет (селективный β2-адреностимулятор).
Ипрадол - применяется в виде дозированного аэрозоля: 1-2 вдоха или в/в капельно 2 мл 1% раствора (селективный β2-адреностимулятор).
Беротек (фенотерол) - применяется в виде дозированного аэрозоля: 1-2 вдоха. Начало бронхиолдилатирующего действия через 1-5 мин, максимум действия - через 45 мин, продолжительность действия - 5-6 ч (даже до 7-8 ч). Ю.Б. Белоусов, 2000 г. рассматривает беротек как препарат выбора в связи с достаточной длительностью действия (частично селективный β2-адреностимулятор).
Беродуал - применяется в виде дозированного аэрозоля: 1-2 вдоха, при необходимости препарат можно ингалировать до 3-4 раз в день (сочетание β2-адреностимулятора и холинолитика ипратропиума бромида, являющегося производным атропина). Препарат обладает выраженным бронхиолдилатирующим эффектом.
Дитек - применяется для купирования приступа бронхиальной астмы легкой и средней степени тяжести (1-2 вдоха аэрозоля), при отсутствии эффекта ингаляцию можно повторить через 5 мин в той же дозе (комбинированный дозированный аэрозоль, состоящий из фенотерола (беротека) и стабилизатора тучных клеток - интала).
Если через 15-30 мин не наступает улучшения, то повторяют введение β-адренергических веществ.
Если спустя еще 15-30 мин не наступает улучшения, то налаживают в/в капельное вливание эуфиллина в дозе 0,6 мг/кг в 1 ч больным, получавшим ранее теофиллин; в дозе 3-5 мг/кг на протяжении 20 мин лицам, не получавшим теофиллин, а затем переходят на поддерживающие дозы (0,6 мг/кг в 1 ч).
Отсутствие улучшения в течение 1-2 ч после начала введения эуфиллина требует дополнительного введения атропина в ингаляциях (больным с умеренным кашлем) или кортикостероидов в/в (100 мг гидрокортизона или эквивалентное количество другого препарата).
20.4.3. ИНОРОДНЫЕ ТЕЛА ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Инородные тела верхних дыхательных путей вызывают клинику ОДН различной степени тяжести. Данное патологическое состояние наиболее часто встречается у детей и психически больных.
Наиболее частой причиной развития обструкции дыхательных путей у взрослых в сознании - это попадание инородного тела во время еды. Кусок пищи может вызвать частичную или полную обструкцию. При этом своевременное установление истинной причины острых дыхательных расстройств является ключевым моментом, определяющим исход подобной экстремальной ситуации. Дифференцировать попадание инородного тела в дыхательные пути необходимо с обмороком, инсультом, сердечным приступом, приступом бронхиальной астмы. На Западе случаи аспирации в ресторанах, ошибочно принимаемые за сердечный приступ, даже получили название «коронарный синдром кафе».
Наиболее частой «внутренней» причиной обструкции верхних дыхательных путей у пострадавших находящихся без сознания является западение корня языка и закрытие надгортанника. «Внешними» причинами обструкции могут служить инородные тела, сгустки крови при травме головы и лица, рвотные массы, которые порой труднее диагностировать, особенно если пациент без сознания.
Тяжесть клинической картины зависит от величины инородного тела. Клинические симптомы, возникающие при этом, будут являться характерными признаками ОДН: возникает приступ удушья, сопровождающийся сильным кашлем, осиплостью голоса, афонией, болями в горле или груди. Одышка носит инспираторный характер. Частичная обструкция может протекать с удовлетворительным и нарушенным газообменом. В первом случае у пострадавшего сохраняется способность к форсированному кашлю, без явных признаков гипоксии, во втором отмечается слабый, неэффективный кашель, шумное дыхание, появление цианоза. Подобную частичную обструкцию в плане оказания помощи необходимо приравнивать к полной обструкции.
При полной обструкции человек не способен говорить, дышать и кашлять. В этом случае поза пострадавшего бывает достаточно красноречива для окружаю-
щих (рис. 20-13). Неоказание экстренной помощи приводит к быстрому падению оксигенации крови, утрате сознания с последующей остановкой кровообращения и заканчивается летальным исходом в течение нескольких минут.
Неотложная помощь. Среди применяемых сегодня методик оказания реанимационной помощи при попадании инородного тела в дыхательные пути больному, находящемуся в сознании, наряду с нанесением ударов ладонью в области спины пострадавшего на уровне лопаток (рис. 20-14 а), компрессией грудной клетки, наиболее популярным считается прием Геймлиха (Неimlich maneuver), известный также как «поддиафрагмальное абдоминальное сжатие» или «абдоминальное сжатие» (рис. 20-14 б). Сущность приема заключается в следующем: абдоминальное сжатие сопровождается повышением внутрибрюшного давления и подъемом диафрагмы, приводящим к повышению давления в дыхательных путях и усилению выхода воздуха их легких, создается как бы искусственный кашель, что и способствует удалению инородного тела.
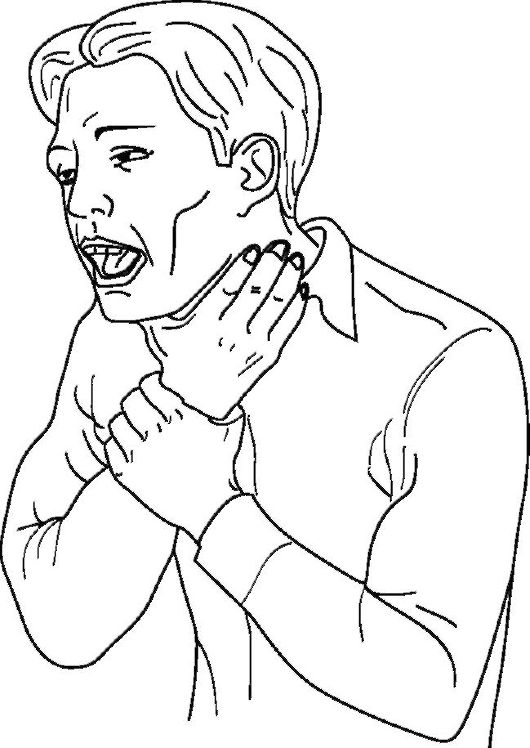 Рис. 20-13. Поза пострадавшего при полной обструкции дыхательных путей
Рис. 20-13. Поза пострадавшего при полной обструкции дыхательных путей
Прием Геймлиха проводится следующим образом: спасатель должен находиться по отношению к сидящему или стоящему пострадавшему со стороны спины. Охватить пострадавшего под его руками и сомкнуть свои руки таким образом, чтобы одна кисть, собранная в кулак, располагалась по средней линии между мечевидным отростком и пупком, а кисть второй руки охватывала первую (см. рис 20-14 б). После чего начать проводить быстрые абдоминальные сжатия (по направлению к себе и несколько вверх) до тех пор, пока или не будет удалено инородное тело или пока пострадавший не потеряет сознание.
При нарушенном сознании или его отсутствии необходимо проверить наличие инородного тела в ротоглотке с помощью указательного пальца (рис. 20-15), провести приемы по восстановлению проходимости дыхательных путей (тройной
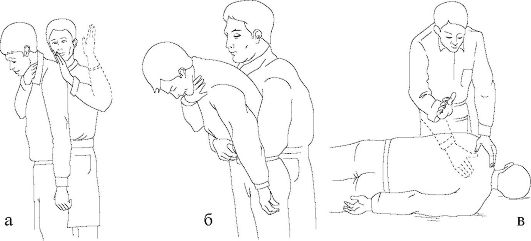 Рис. 20-14. Удар по спине. Компрессия живота. Удар по спине при нарушенном сознании
Рис. 20-14. Удар по спине. Компрессия живота. Удар по спине при нарушенном сознании
прием Питера Сахара), осуществить попытку искусственного дыхания, в случае неудачи провести удары (до 5 ударов) по спине (см. рис. 20-14 в).
При не эффективности выполнить прием Геймлиха (5-6 коротких толчков по направлению к позвоночнику и голове) так, как это показано на рис. 20-16, следует вновь проверить наличие инородного тела в ротоглотке и провести искусственное дыхание. Если инородное тело удалено, то необходимо продолжить искусственное дыхание до восстановления самостоятельного.
Даже при правильном проведении этого приема возможны осложнения, чаще связанные с регургитацией и аспирацией желудочного содержимого, реже с повреждением внутренних органов.
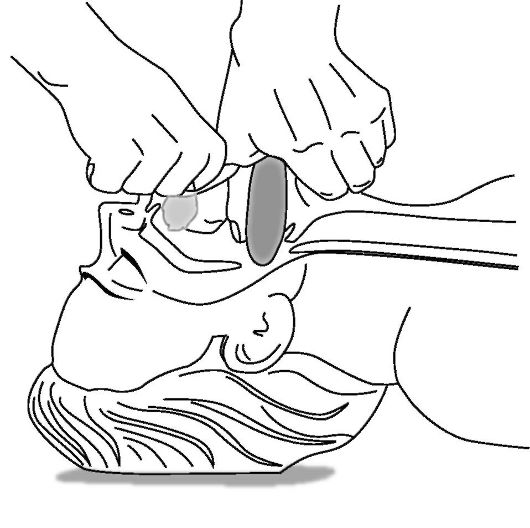 Рис. 20-15. Контроль наличия инородного тела в ротоглотке
Рис. 20-15. Контроль наличия инородного тела в ротоглотке
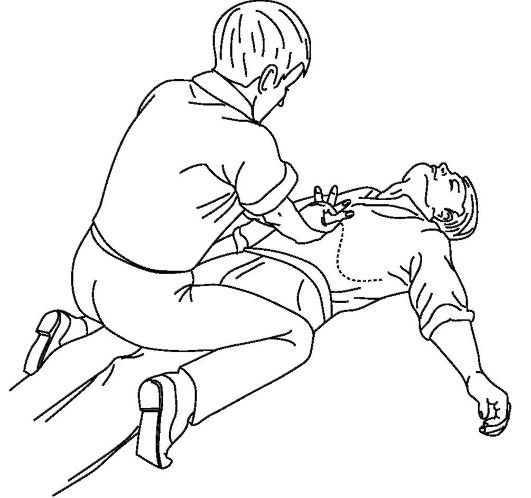 Рис. 20-16. Вариант приема Геймлиха при утрате пострадавшим сознания
Рис. 20-16. Вариант приема Геймлиха при утрате пострадавшим сознания
В случае неудачи при выполнении приема Геймлиха показана экстренная коникотомия с последующим удалением инородного тела эндоскопическим или хирургическим методом. Трахеостомия, даже в опытных руках, требует определенного времени, в то время как коникотомия может быть выполнена в течение нескольких десятков секунд.
Методика коникотомии (крикотиреотомии)
Пострадавшего укладывают на спину, под лопатки подкладывают валик (10-15 см), голову запрокидывают назад. Пальпаторно определяют перстневидно-щитовидную связку, расположенную между нижним краем щитовидного и верхним краем перстневидного хряща (рис. 20-17). Над связкой делают небольшой (до 1,5 см) поперечный разрез кожи (рис. 20-18), в разрез вводят указательный палец, пальпируют перстневидно-щитовидную связку и скальпелем, введенным по ногтю, рассекают ее. В образовавшееся отверстие в трахее вводят любую полую трубку и фиксируют ее на коже. Сегодня в арсенале врачей, занимающихся оказанием экстренной помощи, имеется специальное устройство - коникотом, состоящий из троакара и пластиковой канюли, которая проводится в трахею по троакару как по проводнику после прокола перстневидно-щитовидной связки. Применение коникотома значительно ускоряет и упрощает всю процедуру.
При отсутствии возможности выполнения коникотомии и обструкции дыхательных путей на уровне гортани, восстановление проходимости дыхательных путей может быть обеспечено за счет пункции крикотиреоидной связки и оставления в трахее 2-3 игл большого (2-2,5 мм) внутреннего диаметра (Чен Г. и др.,
1996) (рис. 20-19).
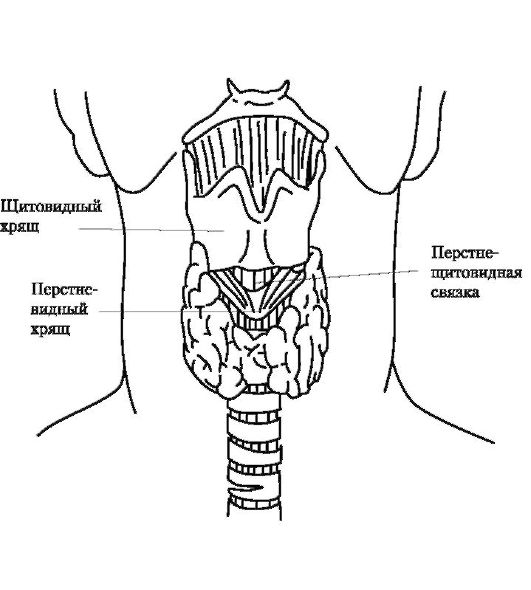 Рис. 20-17. Анатомические особенности расположения перстневиднощитовидной связки
Рис. 20-17. Анатомические особенности расположения перстневиднощитовидной связки
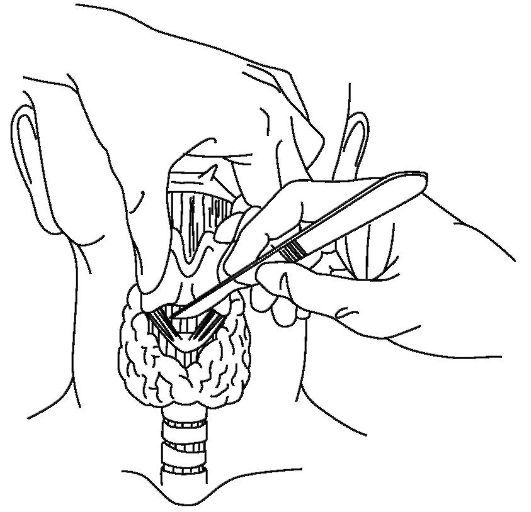 Рис. 20-18. Место разреза перстневиднощитовидной связки при проведении коникотомии
Рис. 20-18. Место разреза перстневиднощитовидной связки при проведении коникотомии
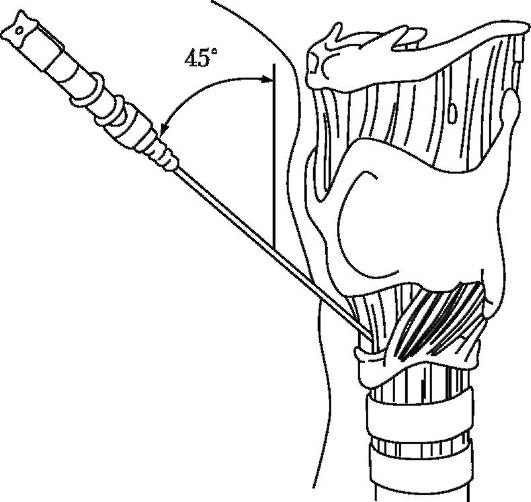 Рис. 20-19. Место пункции крикотиреоидной связки
Рис. 20-19. Место пункции крикотиреоидной связки
20.4.4. УТОПЛЕНИЕ
Утопление - острое патологическое состояние, развивающееся при случайном или преднамеренном погружении в жидкость, с последующим развитием признаков ОДН и ОСН, причиной возникновения которых является попадание жидкости в дыхательные пути.
Различают три вида утопления в воде.
• Истинное (мокрое).
• Асфиксическое (сухое).
• Смерть в воде (синкопальный тип утопления).
Этиология. Истинное утопление. В его основе лежит попадание воды в альвеолы. В зависимости от того, в какой воде произошло утопление (пресной или морской), будет различный патогенез. Пресная вода, в силуразности осмотического градиента с кровью, быстро покидает альвеолы и проникает в сосудистое русло (рис. 20-20 а). Это приводит к увеличению ОЦК и гемодилюции, отеку легких, гемолизу эритроцитов, уменьшению концентрации ионов натрия, хлора и кальция плазмы, а также белков плазмы. При утоплении в морской воде в результате разности осмотического градиента между кровью и морской водой, причем здесь отмечается явное преобладание градиента морской воды над кровью, часть плазмы выходит из сосудистого русла (ем. рис. 20-20 б). В связи с этим уменьшается масса циркулирующей крови (до 45 мл/кг), увеличивается гематокрит (В.А. Неговский, 1977).
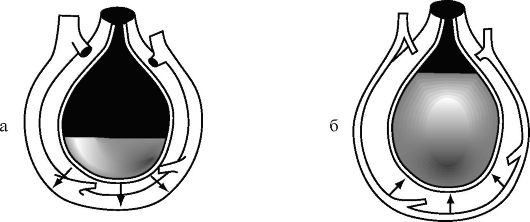 Рис. 20-20. Патогенез утопления в пресной (а) и морской (б) воде
Рис. 20-20. Патогенез утопления в пресной (а) и морской (б) воде
Асфиксическое утопление возникает без аспирации воды. В основе данной патологии лежит рефлекторный ларингоспазм. Голосовая щель не пропускает воду, но она же не пропускает и воздух. Смерть наступает от механической асфиксии.
Синкопальный тип утопления (смерть в воде) наступает в результате рефлекторной остановки сердечной деятельности и дыхания. Наиболее частый вариант данного типа утопления отмечается при внезапном погружении пострадавшего в холодную воду.
Клиника. При истинном утоплении выделяют 3 периода: начальный, агональный и клинической смерти. Состояние сознания зависит от периода утопления и его вида. Нарушение дыхания возможно от шумного до агонального. Наблюдаются цианоз, озноб, гусиная кожа. При утоплении в пресной воде отмечаются клиника отека легких, артериальная и венозная гипертензия, тахикардия, аритмия. Из верхних дыхательных путей может выделяться пена, иногда с розовым оттенком, в результате гемолиза эритроцитов. При утоплении в морской воде более характерны артериальная гипотензия, брадикардия.
Неотложная помощь. Вне зависимости от того, в какой воде поизошло утопление, при остановке дыхания и сердечной деятельности пострадавшему необхо-
димо проводить комплекс реанимационных мероприятий. Перед проведением искусственного дыхания следует освободить верхние дыхательные пути (ВДП) от воды и инородных тел (речной песок, водоросли, ил и т.д.). Оптимальным способом освобождения ВДП, особенно у детей, является подъем пострадавшего за ноги. При невозможности выполнить данное пособие рекомендуется уложить пострадавшего животом на согнутое колено человека, оказывающего реанимационную помощь, и дождаться вытекания жидкости из ВДП (рис. 20-21). Данная процедура должна занимать не более 5-10 с, после чего необходимо приступить к реанимационному пособию (см. раздел 20.3. Сердечно-легочная реанимация).
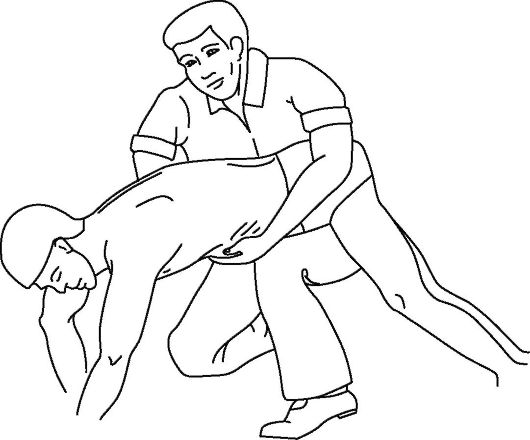 Рис. 20-21. Положение пострадавшего на согнутом колене
Рис. 20-21. Положение пострадавшего на согнутом колене
В условиях стационара лечение носит синдромный характер и складывается из следующих направлений.
• Проведение комплекса реанимационных мероприятий и перевод больного на ИВЛ (по показаниям).
• Санация трахеобронхиального дерева, терапия бронхиолоспазма, отека легких.
• Купирование ОССН.
• Коррекция КЩС и электролитов.
• Профилактика пневмонии и почечной недостаточности.
20.4.5. ТРОМБОЭМБОЛИЯ ЛЕГОЧНОЙ АРТЕРИИ
Тромбоэмболия легочной артерии (ТЭЛА) - определяется как синдром острой дыхательной и сердечной недостаточностей, возникающий при попадании тромба или эмбола в систему легочных артерий.
Этиология
Тромбоз глубоких вен голени - причина ТЭЛА у 5% пациентов.
Тромбоз в системе нижней полой вены является причиной ТЭЛА, согласно данным В.Б. Яковлева (1995), у 83,6% больных.
Заболеваниями сердечно-сосудистой системы, чрезвычайно предрасполагающими к развитию тромбов и эмболий в легочной артерии, являются:
• ревматизм, особенно в активной фазе, с наличием митрального стеноза и мерцательной аритмии;
• инфекционный эндокардит;
• гипертоническая болезнь;
• ишемическая болезнь сердца (обычно трансмуральный или субэндокардиальный инфаркт миокарда);
• тяжело протекающие формы неревматических миокардитов;
• кардиомиопатии.
Злокачественные новообразования часто приводят к развитию рецидивирующих тромбофлебитов верхних и нижних конечностей (паранеопластический синдром), что может являться источником ТЭЛА. Наиболее часто это бывает при раке поджелудочной железы, легких, желудка.
Генерализованный септический процесс в ряде случаев осложняется тромбозом, который обычно является проявлением гиперкоагуляционной фазы синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдрома), что может послужить причиной тромбоэмболии легчной артерии (ТЭЛА).
Тромбофилические состояния - это повышенная склонность организма к внутрисосудистому тромбообразованию, что обусловлено врожденным или приобретенным нарушением регуляторных механизмов системы гемостаза.
Антифосфолипидный синдром - симптомокомплекс, в основе которого лежит развитие аутоиммунных реакций и появление антител к фосфолипидам, присутствующим на мембранах тромбоцитов, клеток эндотелия, нервной ткани, что может привести к тромбозам различной локализации.
Факторы риска (А. Н. Окороков, 2000):
• длительный постельный режим и сердечная недостаточность (в связи с замедлением тока крови и развитием венозного застоя);
• массивная диуретическая терапия (обильный диурез приводит к дегидратации, увеличению показателей гематокрита и вязкости крови);
• полицитемия и некоторые виды гемобластозов (в связи с большим содержанием в крови эритроцитов и тромбоцитов, что приводит к гиперагрегации этих клеток и формированию тромбов);
• длительный прием гормональных контрацептивов (они повышают свертываемость крови);
• системные заболевания соединительной ткани и системные васкулиты (при этих заболеваниях наблюдается повышение свертываемости крови и агрегации тромбоцитов);
• сахарный диабет;
• гиперлипидемия;
• варикозное расширение вен (создаются условия для стаза венозной крови и формирования тромбов);
• нефротический синдром;
• постоянный катетер в центральной вене;
• инсульты и травмы спинного мозга;
• злокачественные новообразования и химиотерапия по поводу рака.
Патогенез. Механическая закупорка общего ствола легочной артерии массивным тромбом или эмболом вызывает каскад патологических рефлекторных реакций.
• Мгновенно наступает генерализованный артериолоспазм в малом круге кровообращения и коллапс сосудов большого круга. Клинически это проявляется падением АД и быстрым нарастанием артериальной гипертензии малого круга (увеличивается ЦВД).
• Генерализованный артериолоспазм сопровождается тотальным бронхиолоспазмом, что вызывает развитие ОДН.
• Быстро формируется правожелудочковая недостаточность, возникающая в результате работы правого желудочка против высокого сопротивления в малом круге.
• Формируется малый выброс левого желудочка в связи с катастрофическим уменьшением поступления в него крови из легких. Падение ударного объема левого желудочка вызывает развитие рефлекторного артериолоспазма в системе микроциркуляции и нарушение кровоснабжения самого сердца, что может спровоцировать появление фатальных нарушений ритма или развитие ОИМ. Данные патологические изменения быстро приводят к формированию острой тотальной сердечной недостаточности.
• Массивное поступление из мест ишемии в кровоток большого количества биологически активных веществ: гистамина, серотонина, некоторых простагландинов повышает проницаемость клеточных мембран и способствует возникновению интероцептивных болей.
• В результате полной закупорки легочной артерии развивается инфаркт легкого, что усугубляет ОДН.
Анатомические варианты ТЭЛА по локализации (В. С. Савельев и соавт., 1990)
Проксимальный уровень эмболической окклюзии:
• сегментарные артерии;
• долевые и промежуточные артерии;
• главные легочные артерии и легочный ствол. Сторона поражения:
• левая;
• правая;
• двустороннее.
Клинические формы ТЭЛА
• Молниеносная. Смерть наступает в течение нескольких минут.
• Острая (быстрая). Смерть может наступить в течение 10-30 мин.
• Подострая. Смерть может наступить в течение нескольких часов, суток.
• Хроническая. Характеризуется прогрессирующей правожелудочковой недостаточностью.
• Рецидивирующая.
• Стертая.
Клиническая картина
В клинической картине первое место занимает внезапно появляющаяся одышка как в состоянии покоя, так и после незначительной физической нагрузки. По характеру одышка «тихая», число дыханий от 24 до 72 в 1 мин. Она может сопровождаться мучительным, непродуктивным кашлем. Чаще жалобы на кашель появляются уже на стадии инфаркта легкого; в это время кашель сопровождается болями в грудной клетке и отхождением кровавой мокроты (кровохарканье наблюдается не более чем у 25-30% больных). Широко распространенное мнение, что кровохарканье является неотъемлемым признаком ранней стадии ТЭЛА, не всегда соответствует истине. Е.М. Тареев (1951) в первые 3 дня кровохарканье отмечал у 10-12%, П.М. Злочевский (1978) данный синдром встречал у 19% больных. Следует подчеркнуть, что кровохарканье более характерно для 6-9 дня заболевания, а не для 1-2 суток. Кровохарканье обусловлено кровоизлиянием в альвеолы вследствие градиента между низким давлением в легочных артериях дистальнее эмбола и нормальным - в концевых ветвях бронхиальных артерий.
Практически сразу появляется компенсаторная тахикардия, пульс приобретает нитевидный характер, причем у каждого четвертого больного может возникнуть мерцательная аритмия. Происходит быстрое падение АД. Циркуляторный шок развивается у 20-58% больных и обычно связан с массивной легочной окклюзией, что считается одним из частых признаков ТЭЛА.
В зависимости от локализации тромба болевой синдром может иметь характер ангинозоподобного, легочно-плеврального, абдоминального или смешанного. При эмболии основного ствола легочной артерии возникают рецидивирующие загрудинные боли, обусловленные раздражением нервных аппаратов, заложенных в стенке легочной артерии. В некоторых случаях массивной ТЭЛА резкая боль с широкой иррадиацией напоминает таковую при расслаивающей аневризме аорты. Продолжительность боли может варьировать от нескольких минут до нескольких часов. Иногда наблюдаются боли стенокардитического характера, сопровождающиеся ЭКГ-признаками ишемии миокарда в связи с уменьшением коронарного кровотока вследствие снижения ударного и минутного объемов. Определенное значение имеет и повышение АД в полостях правого сердца, что нарушает отток крови по коронарным венам. Могут наблюдаться резкие боли в правом подреберье, сочетающиеся с парезом кишечника, икотой, симптомами раздражения брюшины, связанные с острым застойным набуханием печени при правожелудочковой недостаточности или развитием массивных инфарктов правого легкого. При развитии в последующие дни инфаркта легкого отмечаются острые боли в грудной клетке, усиливающиеся при дыхании и кашле, они сопровождаются шумом трения плевры.
При массивной или субмассивной ТЭЛА в первые минуты формируется острое легочное сердце, характеризующееся следующими симптомами: набухание шейных вен, патологическая пульсация в эпигастральной области и во втором межреберье слева от грудины; расширение правой границы сердца, акцент и раздвоение II тона над легочной артерией, систолический шум над мечевидным отростком, повышение ЦВД, болезненное набухание печени и положительный симптом Плеша (надавливание на болезненную печень вызывает набухание шейных вен). Кожные покровы приобретают бледную окраску (возможен пепельный оттенок), на ощупь влажные, холодные. На фоне малого выброса возникают син-
дромы поражения ЦНС: неадекватность поведения, психомоторное возбуждение. Церебральные расстройства при ТЭЛА могут проявляться в двух вариантах:
• синкопальном (по типу глубокого обморока) с рвотой, судорогами, брадикардией;
• коматозном.
Кроме того, могут наблюдаться психомоторное возбуждение, гемипарезы, полиневриты, менингеальные симптомы.
Частый симптом ТЭЛА - повышение температуры тела, возникающее обычно с первых часов заболевания. У большинства больных отмечается субфебрильная температура без ознобов, у меньшей части больных - фебрильная. Общая длительность лихорадочного периода составляет от 2 до 12 суток.
Диагностика ТЭЛА
При подозрении на ТЭЛА врач должен подтвердить наличие эмболии, определить ее локализацию, оценить состояние гемодинамики малого и большого круга, устранить угрозу жизни, назначить адекватное лечение. Помощь в диагностике могут оказать селективная ангиопульмонография, спиральная компьютерная томография с контрастированием сосудов, вентиляционно-перфузионное сканирование легких, рентгенография органов грудной клетки, электрокардиография, определение Д-димера в крови и диагностика тромбоза глубоких вен. Убедительных лабораторных данных, подтверждающих данную патологию, в настоящее время нет.
Селективная ангиопульмонография является наиболее информативным методом в диагностике ТЭЛА; характерны следующие ангиопульмонографические признаки:
• увеличение диаметра легочной артерии;
• полное (при окклюзии главной правой или левой ветви легочной артерии) или частичное (при окклюзии сегментарных артерий) отсутствие контрастирования сосудов легкого на стороне поражения;
• «размытый», или «пятнистый», характер контрастирования сосудов при множественной, но не полной обтурации долевых, а также сегментарных артерий;
• дефекты наполнения в просвете сосудов при наличии единичных пристеночных тромбов;
• деформация легочного рисунка в виде расширения и извитости сегментарных и долевых сосудов при множественном поражении мелких ветвей.
Ангиографическое исследование в обязательном порядке должно включать как зондирование правых отделов сердца, так и ретроградную илиокавографию, позволяющую уточнить источники эмболии, которыми чаще всего являются флотирующие тромбы в подвздошной и нижней полой венах.
Спиральная компьютерная томография с контрастированием сосудов. При помощи данного метода можно визуализировать тромбы в легочной артерии и обнаружить другие заболевания легких, например опухоли, сосудистые аномалии и т.д.
Вентиляционно-перфузионное сканирование легких. Для ТЭЛА характерно наличие дефекта перфузии при сохраненной вентиляции пораженных сегментов легких.
В зависимости от выраженности дефектов перфузии легочной ткани различают высокую (> 80%), среднюю (20-79%) и низкую (< 19%) вероятность наличия ТЭЛА.
Рентгенологические данные. На ранних стадиях ТЭЛА рентгенологические методы исследования могут быть недостаточно информативными. Наиболее характерными признаками ТЭЛА являются: выбухание легочного конуса (проявляется сглаживанием талии сердца или выступанием второй дуги за левый контур) и расширение тени сердца вправо за счет правого предсердия; увеличение контуров ветви легочной артерии с последующим обрывом хода сосуда (при массивной ТЭЛА); резкое расширение корня легкого, его обрубленность, деформация; локальное просветление легочного поля на ограниченном участке (симптом Вестермарка); высокое стояние купола диафрагмы (в связи с рефлекторным сморщиванием легкого в ответ на эмболию) на стороне поражения; расширение тени верхней полой и непарной вен, верхняя полая вена считается расширенной при увеличении расстояния между линией остистых отростков и правым контуром средостения более 3 см. После появления инфаркта легкого выявляется инфильтрация легочной ткани (иногда в виде треугольной тени), чаще расположенная субплеврально. Типичная картина инфаркта легкого обнаруживается не ранее второго дня и лишь у 10% больных. Кроме этого, нужно знать следующее: для получения качественного снимка необходимо исследование больного на стационарном рентгенологическом аппарате с задержкой дыхания. Передвижные аппараты, как правило, затрудняют получение высококачественного снимка. Исходя из этого, врач должен однозначно решить вопрос: нужно ли больному, находящемуся в тяжелом состоянии, рентгенологическое исследование.
ЭКГ. Отмечаются неспецифические признаки перегрузки правых отделов сердца: картина SI, QIII, ТIII, которая состоит из глубокого зубца S в I стандартном отведении, глубокого зубца Q и инверсии зубца Т в III отведении. Наблюдается увеличение зубца R в III отведении и смещение переходной зоны влево (в V4-V6), расщепление комплекса QRS в V1-V2, а также признаки блокады правой ножки пучка Гиса, однако данный симптом может и отсутствовать.
Определение Д-димера в крови. Основой данного метода исследования является наличие эндогенного фибринолиза, сопровождающегося разрушением фибрина с образованием Д-димеров (в норме уровень Д-димеров менее 500 мкг/л). Чувствительность повышения Д-димера при диагностике ТЭЛА достигает 99%, но специфичность равна 53%, поскольку данный Д-димер повышается и при многих других заболеваниях: ОИМ, кровотечениях, после хирургических операций и т.д.
Лабораторные данные неспецифичны. Может наблюдаться нейтрофильный лейкоцитоз с палочкоядерным сдвигом, лимфопения, относительный моноцитоз, увеличение СОЭ; повышение содержания лактатдегидрогеназы; возможна умеренная гипербилирубинемия; увеличение содержания серомукоида, гаптоглобина, фибрина; гиперкоагуляция.
Принципы интенсивной терапии ТЭЛА
Исходя из патогенеза, принципы интенсивной терапии должны содержать следующие направления.
• Поддержание жизни в первые минуты.
• Устранение патологических рефлекторных реакций.
• Ликвидация тромба.
• Купирование коллапса.
• Снижение давления в малом круге кровообращения.
• Оксигенотерапия.
Поддержание жизни в первые минуты включает в себя комплекс реанимационных мероприятий (см. раздел 20.3. Сердечно-легочная реанимация).
Устранение патологических рефлекторных реакций включает борьбу со страхом, болью. С этой целью используют:
• проведение обезболивания наркотическими анальгетиками или методом нейролептанальгезии (НЛА), которые снижают страх и боль, уменьшают гиперкатехоламинемию, улучшают реологические свойства крови;
• гепарин применяется не только как антикоагулянт, но и как антисеротониновый препарат;
• для купирования артериоло- и бронхиолоспазма используются препараты группы ксантинов, атропин, преднизолон или его аналоги.
Купирование коллапса. При систолическом АД менее 90 мм рт.ст. и наличии признаков низкого сердечного выброса в/в струйно следует начать введение коллоидных растворов до повышения систолического АД выше 90 мм рт.ст. Цель - за счет увеличения ОЦК увеличить наполнение сердца и, следовательно, нормализовать сердечный выброс.
Если после в/в 500 мл коллоидного раствора артериальная гипотензия не купируется, к инфузионной терапии следует добавить введение добутамина со скоростью 10 мкг/кг/мин. При отсутствии в течение 5-10 мин подъема АД, следует увеличить скорость введения добутамина до 40 мкг/кг/мин.
Если же и после этого систолическое АД остается менее 90 мм рт.ст., добутамин следует заменить на допамин или норадреналин. Если через 30-60 мин систолическое АД остается менее 90 мм рт.ст. и диагноз ТЭЛА четко установлен, при отсутствии противопоказаний следует начать тромболитическую терапию (Спригингс Д., Чамберс Дж., 2006).
Ликвидация тромба может осуществляться консервативным и оперативным путем, однако последний путь (оперативный), несмотря на многократные попытки его использовать, широкого распространения не получил в связи с большими техническими трудностями и высоким уровнем послеоперационной летальности.
Консервативное патогенетическое лечение имеет два направления.
Тромболитическая терапия.
Прекращение дальнейшего тромбообразования.
Тромболитическая терапия (ТЛТ) показана при наличии массивной или субмассивной ТЭЛА. Необходимо соответствующее лабораторное обеспечение. Критериями для проведения тромболизиса являются сохранение систолического АД менее 90 мм рт.ст. после проведенной терапии коллоидными растворами (см. выше), наличие характерных клинических признаков ТЭЛА, наличие факторов риска тромбоэмболии и отсутствие другого вероятного заболевания. Оптимальным методом тромболитической терапии является введение тромболитиков через катетер, введенный в легочную артерию и под контролем электроннооптического преобразователя, подведенного непосредственно к тромбу. Возможно введение тромболитиков в центральную или периферическую вену. В настоящее время препаратами выбора при проведении тромболитической терапии считаются стрептокиназа и альтеплаза.
При лечении стрептокиназой в течение первых 30 мин в/в вводят 250 000 ЕД, растворенных в изотоническом растворе хлорида натрия или глюкозы. В последующие 12-72 ч продолжают вводить данный препарат со скоростью 100 000 ЕД в час. Для купирования возможных аллергических реакций с первой дозой стрептокиназы рекомендуется в/в ввести 60-90 мг преднизолона.
При лечении альтеплазой в течение первых 1-2 мин в/в вводят 10 мг, затем в последующие 2 ч 90 мг (максимальная общая доза - 1,5 мг/кг у пациентов с массой тела менее 65 кг).
Тромболитическая терапия стрептокиназой или альтеплазой должна осуществляться под постоянным контролем параметров свертывающей системы крови. Через 3-4 ч после прекращения введения данных препаратов следует определить тромбиновое время (ТВ) или активированное частичное тромбопластиновое время (АЧТВ). Если ТВ/АЧТВ увеличилось меньше, чем в 2 раза, следует возобновить введение гепарина.
Антикоагулянтная терапия. Используются прямые антикоагулянты: нефракционированный гепарин (НФГ), низкомолекулярные гепарины (НМГ) и непрямые антикоагулянты (в первую очередь - варфарин).
Прямые антикоагулянты (НФГ). Гепарин следует применять при обоснованном подозрении на развитие ТЭЛА. Его использование предотвращает развитие продолженного тромбоза в легочно-артериальном русле, под его влиянием происходит фиксация границ тромботической окклюзии в магистральных венах и улучшается микроциркуляция (В.С. Савельев и соавт., 2001).
Лечение НФГ следует проводить путем длительной непрерывной интравенозной инфузии; скорость введения регулируется по АЧТВ, которое поддерживают на уровне 1,5-2,5 Ч контроль (Спригингс Д., Чамберс Дж., 2006).
Инфузионное введение нефракционного гепарина натрия
(Цит. по Drug and Therapeutics Bulletin 1992; 30: 77 - 80). Нагрузочная доза 5 000-10 000 ЕД (100 ЕД/кг) в/в в течение 5 мин. Инфузия 25 000 ЕД, разведенные солевым раствором до 50 мл (500 ЕД/мл). Начните введение со скоростью 1 400 ЕД/ч (2,8 мл/ч), используя дозатор. Определите активированное частичное тромбопластиновое время (АЧТВ) через 6 ч.
Отрегулируйте дозу следующим образом:
Коэффициент АЧТВ (цель 1,5-2,5хконтроль) - Действие.
7,0 - Приостановите введение на 30-60 мин, затем уменьшите скорость введения на 500 ЕД/ч.
5,1-7,0 - Повторно определите АЧТВ через 4 ч, затем уменьшите скорость введения на 500 ЕД/ч.
4,1-5,0 - Повторно определите АЧТВ через 4 ч, затем уменьшите скорость введения на 300 ЕД/ч.
3,1-4,0 - Повторно определите АЧТВ через 10 ч, затем уменьшите скорость введения на 100 ЕД/ч.
2,6-3,0 - Повторно определите АЧТВ через 10 ч, затем уменьшите скорость введения на 50 ЕД/ч.
1,5-2,5 - Повторно определите АЧТВ через 10 ч, затем не меняйте скорость введения
1,2-2,4 - Повторно определите АЧТВ через 10 ч, затем увеличьте скорость введения на 200 ЕД/ч
< 1,2 - Повторно определите АЧТВ через 10 ч, затем увеличьте скорость введения на 400 ЕД/ч и повторно определите АЧТВ через 4 ч
После каждого изменения скорости введения подождите 10 ч до следующей оценки АЧТВ, кроме АЧТВ >5 или <1,2, когда повторная оценка необходима через 4 ч.
При стабильной скорости введения оценивайте АЧТВ ежедневно.
Гепарин натрия может вызвать иммунноопосредованную тромбоцитопению, которая часто осложняется тромбозом: оценивайте содержание тромбоцитов ежедневно при применении гепарина более 5 дней и немедленно отмените гепарин при появлении тромбоцитопении.
При отсутствии возможности постоянного инфузионного введения НФГ существуют методики дробного внутривенного или п/к введение гепарина.
Начальную дозу обычного НФГ определяют следующим образом: массу тела больного умножают на 450 ЕД, затем полученное число делят на число инъекций препарата. Так, при дробном в/в введении гепарина число инъекций - 8 (с периодичностью 3 ч каждая), при п/к введении - 3 (с периодичностью 12 ч).
Для достижения максимально быстрого антикоагулянтного эффекта необходимо сначала болюсно ввести 5 000 ЕД гепарина.
Дозу гепарина подбирают индивидуально на основании лабораторного определения активированного частично тромбопластинового времени (АЧТВ) и тромбинового времени (ТВ). Анализ проводят непосредственно перед каждой очередной инъекцией в 1-е сутки терапии. При достижении терапевтического эффекта исследования гемостаза осуществляют ежедневно. Значения этих показателей должны быть в 1,5-2 раза больше по сравнению с нормой (цит. по В.С. Савельев и соавт., 2001).
Прямые антикоагулянты. Низкомолекулярные гепарины (НМГ), например надропарин кальция (фраксипарин), обладают выраженным терапевтическим эффектом. В сравнительном аспекте с НФГ дают меньшую частоту геморрагических осложнений, оказывают более продолжительное действие, отмечается простота в применении (2 инъекции в 1 сутки). НМГ вводят подкожно, контроль АЧТВ не требуется.
Рекомендуемые дозы НМГ прямых антикоагулянтов для лечения развившейся ТЭЛА.
Гепарин натрия (НФГ) - 450 ЕД/кг в/в или п/к в сутки.
Эноксапарин (клексан) (НМГ) - 1 мг/кг п/к 2 раза в сутки.
Дальтепарин (фрагмин) (НМГ) - 100 МЕ/кг п/к 2 раза в сутки.
Надропарин кальция (фраксипарин) (НМГ) - 85 МЕ п/к 2 раза в сутки.
Обязательным дополнением к гепаринотерапии, особенно в первые дни, является применение препаратов низкомолекулярных декстранов (реополиглюкин, реомакродекс), в дозе 10 мл/кг в сутки (цит. по А.В. Покровский, С.В. Сапелкин,
2004).
Непрямые антикоагулянты. Во время терапии гепарином назначается варфарин их следует принимать одновременно в течение 3-4 дней: в этот период ежедневно оценивается АЧТВ и международное нормализованное отношение (МНО).
Варфарин обычно принимают в течение 3-6 месяцев после первого эпизода ТЭЛА (необходимо поддерживать МНО на уровне 2,0-3,0). При рецидивирующей тромбоэмболии может быть показана пожизненная терапия.
Введение гепарина может быть прекращено через 5 дней при условии достижения МНО более 2,0.
Снижение давления в малом круге кровообращения. При отсутствии клиники шока при ТЭЛА эффективными средствами снижения давления в ЛА являются нитровазодилататоры. При развитии острого или подострого легочного сердца на догоспитальном этапе рекомендуется назначение препаратов нитроглицерина в/в или перорально в короткодействующих формах под контролем АД.
Кроме того, вводится внутривенно капельно эуфиллин - 10 мл 2,4% раствора на 200 мл изотонического раствора натрия хлорида. Эуфиллин снижает давление в легочной артерии, вызывает бронходилатирующий эффект. Эуфиллин вводят под контролем артериального давления. При уровне систолического артериального давления ниже 100 мм рт.ст. от введения нитратов и эуфиллина следует воздержаться.
При развитии инфаркт пневмонии - антибактериальная терапия: парентеральные цефалоспорины третьего поколения [цефотаксим (клафоран) 4-8 г/сутки, цефтриаксон (лонгацеф) 2-4 г/сутки] + парентеральные макролиды (спирамицин 1,5-3 г/сутки, эритромицин 1-2 г/сутки) или макролиды внутрь [азитромицин (сумамед) 500 мг/сутки]. Альтернативные средства - парентеральные фторхинолоны [ципрофлоксацин (ципробай) 0,5-1,0 г/сутки, пефлоксацин (абактал) 0,8-1,2 г/сутки)]; цефтазидим (фортум, мироцеф) 2-6 г/сутки) + аминогликозиды (амикацин 10-15 мг/кг/сутки, гентамицин 240 мг/сутки).
Ингаляции увлажненного кислорода проводят через носовые катетеры со скоростью 2-7 л/минуту.
Объем неотложной помощи при подозрении на ТЭЛА
• Окажите реанимационное пособие при его необходимости.
• Последовательно, в/в струйно, введите 10-20 тысяч ЕД гепарина, 10 мл 2,4% раствора эуфиллина, 90-120 мг преднизолона.
• При необходимости введите наркотики, анальгетики, мезатон, норадреналин.
• Запишите ЭКГ, при возможности, если позволяет состояние больного, сделайте рентгенографию органов грудной клетки.
• При подтверждении диагноза начните антикоагулянтную терапию.
• Перевод и дальнейшее лечение в отделении интенсивной терапии и реанимации.
Профилактика ТЭЛА заключается в своевременной диагностике и лечении тромбофлебита вен нижних конечностей, расширении постельного режима в послеоперационном периоде и у больных с сердечной патологией.
В последние годы с целью профилактики ТЭЛА имплантируют зонтичный фильтр в инфраренальный отдел нижней полой вены. Эта операция показана: при эмбологенных тромбозах илеокавального сегмента, когда невозможно выполнить эмболэктомию; при повторной эмболии в систему легочной артерии у больных с неизвестным источником эмболии; при массивной ТЭЛА.
20.4.6. АСПИРАЦИОННЫЙ ПНЕВМОНИТ
Аспирационный пневмонит (синдром Мендельсона) - патологический синдром, возникающий в результате аспирации желудочного содержимого в дыхательные пути и проявляющийся развитием признаков ОДН с последующим присоединением инфекционного компонента.
Этиология. Наиболее часто данный синдром встречается в анестезиологической практике, когда больному проводят общее обезболивание на фоне полного желудка. Однако данное патологическое состояние может развиться и при несостоятельности кардиального жома (у беременных на сроке 20-23 недели), при тяжелом алкогольном опьянении, различных коматозных состояниях в сочетании с рвотой или самопроизвольной аспирацией желудочного содержимого. Аспирационные пневмониты наиболее часто вызывают Е. coli, Fusobacterium, Peptostreptococcus, Pseudomonas aeruginosa, Enterobacteriae, Staphylococcus aureus.
Патогенез. Возможны два варианта возникновения данного синдрома. В первом случае в дыхательные пути попадают довольно крупные частицы непереваренной пищи с желудочным соком, как правило, нейтральной или слабокислой реакции. Происходит механическая закупорка дыхательных путей на уровне средних бронхов и возникает клиника ОДН I-III ст. При втором варианте в дыхательные пути аспирируется кислый желудочный сок, возможно даже без примеси пищи, это вызывает химический ожог слизистой трахеи и бронхов, с последующим быстрым развитием отека слизистой; в конечном итоге формируется бронхиальная обструкция, и затем в течение 1-2 суток появляются симптомы бронхопневмонии и выраженной интоксикации. Аспирационные пневмониты часто осложняются абсцессом легких. Кроме того, на вторые сутки развивается пневмония. Клинические проявления соответствуют другим бактериальным пневмониям, однако отличаются более выраженным синдромом интоксикации и высокой летальностью.
Клиническая картина. Вне зависимости от варианта патогенеза у больных наблюдается три этапа протекания данного синдрома.
В результате рефлекторного бронхиолоспазма возникает ОДН I-III степени с возможным летальным исходом от удушья.
Если больной не погибает на первом этапе, то через несколько минут в результате частичного самопроизвольного купирования бронхиолоспазма отмечается некоторое клиническое улучшение.
В патогенезе возникновения третьего этапа лежит быстрое появление и нарастание отека и воспаления бронхов, что вызывает нарастание признаков ОДН.
Следует помнить о частом присоединении респираторного дистресссиндрома взрослых, что значительно ухудшает прогноз у данной категории больных.
Неотложная помощь
• Срочная санация ротовой полости и носоглотки, интубация трахеи, перевод на ИВЛ, аспирационная санация трахеи и бронхов.
• Проведение ИВЛ, используя гипервентиляцию (минутный объем дыхания (МОД) - 15-20 л) с ингаляцией 100% кислорода.
• Аспирация желудочного содержимого. Введение 0,5% бикарбоната натрия или 0,9% хлорида натрия по 10-15 мл с последующей аспирацией до полного очищения дыхательных путей.
• Санационная бронхоскопия.
• На первоначальном этапе целесообразно назначение глюкокортикостероидов (ГКС) (преднизолон 60-90 мг в/в), эуфиллина 2,4% - 15-20 мл для устранения синдрома бронхиальной обструкции и уменьшения отека бронхов.
• Гепаринотерапия: 5 000 ЕД п/к 4 раза в сутки.
• Антибактериальная терапия должна включать цефалоспорины третьего поколения [клафоран - 2 г каждые 6 ч в/в (максимальная доза 12 г/сутки); лонгацеф - 2 г в/в в сутки (максимальная доза 4 г/сутки); фортум - 2 г в/в в сутки (максимальная доза 4 г/сутки)] в сочетании с аминогликозидами третьегочетвертого поколений (амикацин 15 мг/кг в/в, в/м, каждые 12 ч; тобрамицин 5 мг/кг в/в, в/м, каждые 8 ч).
Альтернативные препараты: фторхинолоны [ципробай - 200-400 мг в/в каждые 12 ч; таривид - 400 мг в/в каждые 12 ч; пефлоксацин (абактал) - 400 мг в/в каждые 12 ч] или карбапенемы (тиенам - 1-2 г в/в, в/м через 6-8 ч).
20.4.7. СТРАНГУЛЯЦИОННАЯ АСФИКСИЯ
Странгуляционная асфиксия (повешение) характеризуется как синдром острой дыхательной и сердечно-сосудистой недостаточности, возникающий в результате механического пережатия шеи.
Этиология. Наиболее частые причины - суицидальные попытки или несчастные случаи, связанные с механическим пережатием шеи.
Патогенез складывается из четырех основных компонентов.
• Механическое сдавление шеи петлей в результате смещения и прижатия языка к задней стенке глотки блокирует проходимость верхних дыхательных путей, что вызывает развитие ОДН, последовательно протекающей в четыре стадии продолжительностью от нескольких с до нескольких минут. Для первой стадии характерны попытки провести глубокий форсированный вдох с участием вспомогательных мышц. Быстро появляются и нарастают цианоз кожных покровов, артериальная и венозная гипертензия, тахикардия. При второй стадии больной теряет сознание, появляются судороги, непроизвольное мочеиспускание. АД снижается, дыхание становится аритмичным, урежается. В третьей стадии наступает остановка дыхания, в четвертой - смерть.
• Пережатие вен шеи на фоне сохраненной проходимости артерий сопровождается быстрым переполнением венозной кровью сосудов головного мозга, в результате чего повышается внутричерепное давление.
• Механическая травма каротидного синуса приводит к рефлекторным нарушениям со стороны ССС.
• Возможно механическое повреждение шейного отдела позвоночника и спинного мозга.
Клиническая картина. При осмотре обращает на себя внимание нарушение жизненно важных функций организма. Состояние сознания - от спутанного до полного отсутствия; кожные покровы бледные, акроцианоз. Характерен судорожный синдром с выраженным напряжением мышц спины и конечностей; непроизвольное моче- и калоотделение. Отмечается также расширение зрачков, отсутствие их реакции на свет, нистагм. На внутренней поверхности век и склер часто отмечаются мелкоточечные кровоизлияния. Нарушения со стороны ССС наиболее часто возможны по двум вариантам: тахикардия до 160-180 в 1 мин и артериальная гипертензия до 200 мм рт.ст. и более или менее выраженная гипотензия в сочетании с брадикардией, что является неблагоприятным диагностическим признаком (летальность в данной подгруппе в 3 раза выше).
Неотложная помощь. Отдаленные результаты лечения во многом зависят от своевременности и правильности оказания медицинской помощи на догоспитальном уровне. Идеальным вариантом лечения является использование миорелаксантов с последующей интубацией трахеи и проведением аппаратной ИВЛ на месте происшествия. При отсутствии на этапе скорой помощи возможности осуществить данное пособие, на первый план выходит купирование судорожного синдрома.
Оптимальным средством для этой цели является в/в введение 2-4 мл реланиума на 10-20 мл изотонического раствора хлорида натрия. Данная доза позволяет купировать судорожный синдром в 70-80% случаев. При необходимости через 5-10 мин можно повторить введение реланиума. В остальном терапия на догоспитальном этапе носит симптоматический характер. Проведение патогенетической терапии (введение спазмолитиков, диуретиков, раствора соды) целесообразно начинать на догоспитальном этапе, если время эвакуации пострадавшего будет превышать 30-40 мин.
Примечание. Введение дыхательных аналептиков при данной патологии нецелесообразно, так как они повышают потребность клеток головного мозга в кислороде, что может углубить его ишемию и вызвать или усилить имеющийся судорожный синдром.
Стационар. Принципы лечения
• Купирование судорожного синдрома.
• Проведение ИВЛ по показаниям (наличие ОДН II-III степени).
• Купирование отека головного мозга.
• Коррекция КЩС и электролитного состояния.
• Профилактика гипостатических осложнений.
• Антибиотикотерапия.
• При наличии гипоксической энцефалопатии показано проведение гипербарической оксигенации (ГБО).
• Симптоматическая терапия.