Акушерство. Клинические лекции : учебное пособие / Под ред. проф. О.В. Макарова. - 2007. - 640 с. :
|
|
|
|
ЛЕКЦИЯ 17 ПОСЛЕРОДОВЫЕ ЗАБОЛЕВАНИЯ
Послеродовые заболевания - это заболевания, возникающие в послеродовом периоде (от момента родов до конца 6-й недели после родов) и связанные с беременностью и родами.
Различают гнойно-воспалительные послеродовые заболевания и заболевания, не обусловленные инфекционным агентом (послеродовый гестоз, кровотечения, психозы).
Основную группу заболеваний в этом периоде составляют ГСИ. Они возникают в результате проникновения микробов через раневые поверхности, образовавшиеся во время родов, или активации условно-патогенной микрофлоры вследствие ослабления защитных сил организма.
Возбудителями послеродовых заболеваний особенно часто становятся энтеробактерии, стафилококки, протеи, неспорообразующие анаэробы и их ассоциации, а в последнее время - условно-патогенная грамотрицательная микрофлора (эшерихии, протей, клебсиеллы). Инфекционные осложнения отмечаются у 1-8% родильниц.
Основные возбудители послеродовых гнойно-септических осложнений
Аэробы
• Стрептококки групп А, В.
• Энтерококки.
• Грамотрицательные бактерии:
• Escherichia coli;
- Klebsiella;
- Proteus sp.;
- Staphylococcus aureus;
- Staphylococcus epiderm;
- Gardnerella vaginalis. Анаэробы
• Peptococcus sp.
• Peptostreptococcus sp.
• Bacteroides fragilis
• Prevotella sp.
• Clostridium sp.
• Fusobacterium sp.
• Mobiluncus sp. Другие
• Mycoplasma sp.,
• Chlamydia trachomatis,
• Neisseria gonorroeae.
Послеродовую инфекцию следует заподозрить, если в течение первых 10 сут после родов (за исключением первых 24 ч) температура тела на протяжении 2 сут подряд достигает 38 °С при измерении температуры не менее четырех раз в сутки.
Обследование лихорадящих больных:
• анамнез;
• анализ течения родов;
• клинический анализ крови;
• общий анализ и посев мочи;
• посев отделяемого из полости матки. Гнойно-воспалительные послеродовые заболевания в зависимости от
распространения патологического процесса разделяют на четыре этапа.
Первый этап - инфекция ограничена областью родовой раны: послеродовая язва на промежности, стенке влагалища и шейке матки, лохиометра.
Второй этап - инфекция распространяется за пределы раны, но остается локализованной: эндометрит, параметрит, отграниченный тромбофлебит (метротромбофлебит, тазовый тромбофлебит, тромбофлебит вен ног), аднексит, пельвиоперитонит.
Третий этап - инфекция по клиническим проявлениям сходна с генерализованной: разлитой послеродовый перитонит, прогрессирующий тромбофлебит.
Четвертый этап - генерализованная инфекция: сепсис без видимых метастазов, сепсис с метастазами, септический шок.
К этой группе послеродовых заболеваний относится также мастит.
лохиометра
Лохиометра (lochiometra) - лихорадочное заболевание, развивающееся в результате задержки в матке выделений (лохий).
Это заболевание возникает на 5-9-й день после родов, как правило, с явлениями эндометрита, вследствие закрытия цервикального канала задержавшимися плодными оболочками, сгустками крови или резкого перегиба матки при ее плохой сократительной способности. Начало заболевания острое, сопровождается повышением температуры тела до 39-40 °С, тахикардией, нередко ознобом. Выделения из матки прекращаются. Температура держится 1-2 дня. При бимануальном акушерском исследовании стенки матки неравномерно утолщены за счет чрезмерного растяжения области плацентарной площадки. Диагноз подтверждается также с помощью УЗИ.
Лечение состоит в применении спазмолитиков (но-шпа, папаверин и др.) с последующим введением через 15-20 мин сокращающих матку средств. При отсутствии эффекта от медикаментозной терапии производят инструментальное опорожнение матки кюреткой или вакуум-аспирацию. Параллельно осуществляют дезинтоксикационную терапию. Прогноз благоприятен. При несвоевременном лечении возможно развитие эндометрита. Профилактика состоит в правильном ведении родов и послеродового периода.
послеродовые язвы
Послеродовая язва промежности
Частота расхождения швов промежности - до 0,5% (Ramin и соавт.,
1992).
Послеродовые язвы представляют собой инфицированные раны промежности, слизистой оболочки влагалища, шейки матки. Границы их четкие, слегка отечные, с воспалительной гиперемией и инфильтрацией окружающих тканей. Дно язвы покрыто грязно-серым или серожелтым налетом с участками некроза.
Клиника заболевания определяется в основном местными проявлениями: локальной болезненностью, зудом, связанным с раздражением кожи отделяемым из раны, иногда дизурическими явлениями.
Лечение заключается в назначении антибактериальной терапии, местном применении антисептических и противовоспалительных средств. Рана обрабатывается перекисью водорода, гипертоническим раствором хлорида натрия. Хорошие результаты дает применение ферментов (трипсин, химотрипсин) для удаления некротических и фибринозных налетов и ускорения регенерации и эпителизации.
Протокол предоперационной подготовки к наложению вторичных швов при расхождении швов промежности (Ramin и Gilstrap, 1994)
• Антибактериальная терапия (внутривенно или внутримышечно).
• Удаление швов, полное раскрытие раны.
• Седативная и обезболивающая терапия по показаниям.
• Обработка раны:
- аппликации на рану 2% геля лидокаина;
- удаление всех некротизированных тканей;
- обработка антисептическими растворами (перманганат калия, повидон-йод, гипертонические растворы и др.);
- мазевые аппликации (левомиколь и др.);
- протеолитические ферменты.
• Механическая подготовка кишечника перед хирургическим вмешательством, особенно при восстановлении разрывов промежности III степени.
послеродовый эндометрит
Послеродовый эндометрит (метроэндометрит, эндомиометрит) представляет собой воспаление слизистой оболочки матки, к которому обычно присоединяется в той или иной степени воспаление ее мышечного слоя. Частота заболевания составляет от 36,3 до 59,5% всех послеродовых инфекций. Основные возбудители - грамотрицательная микрофлора и анаэробы, которые высеваются почти у 90% больных.
Факторы риска послеродового эндометрита
• Кесарево сечение.
• Длительный безводный промежуток.
• Затяжные роды.
• Частые влагалищные исследования.
•  Прямая КТГ.
Прямая КТГ.
• Низкий социально-экономический статус.
• Анемия.
• Ожирение.
• Мекониальные воды.
• Многоплодие.
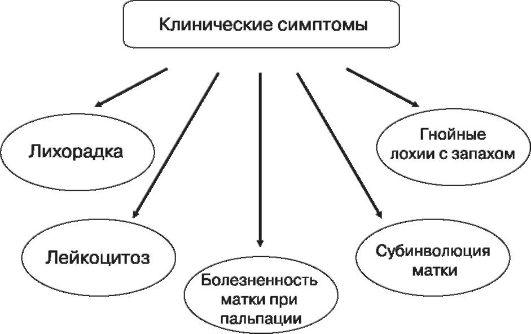
По клиническим проявлениям различают четыре формы эндометрита: классическую, абортивную, стертую и эндометрит после кесарева сечения.
Эндометрит классической, или типичной, формы начинается на 3-5-е сутки после родов, проявляется симптомами общей интоксикации, увеличением размеров матки, чувствительностью ее при пальпации. Выделения из цервикального канала мутные, с характерным зловонным запахом, умеренные или обильные. Заболевание, вызванное анаэробной флорой, отличается ранним началом, тяжелым течением, более выраженными признаками общей интоксикации организма.
Для абортивной формы эндометрита характерно появление симптомов заболевания на 2-4-е сутки послеродового периода. Особенность этой формы - быстрое уменьшение и исчезновение симптомов благодаря интенсивной терапии.
Эндометрит стертой формы начинается сравнительно поздно - на 5-7-е сутки после родов, характеризуется затяжным, без четкой клинической симптоматики течением. Эту форму отличают рецидивирующее течение, запоздалые диагностика и лечение, в последующем возможна генерализация инфекции.
Эндометрит после операции кесарева сечения начинается на 1-5-е сутки. Для него характерны как общие признаки интоксикации, так и местные проявления. При тяжелом течении заболевания реакция со стороны организма и клинические проявления могут соответствовать таковым при перитоните, что обусловлено выраженными нарушениями гомеостаза. Вовремя начатые интенсивная терапия и коррекция предотвращают дальнейшее развитие патологического процесса и генерализацию инфекции.
 Поскольку
стертые и абортивные формы эндометрита в последнее время превалируют
над классической, только комплексное обследование всех органов и систем
(дыхание, кровообращение, иммунитет, выделительная функция почек,
кислотно-щелочное состояние, водно-электролитный баланс и т.д.) дает
необходимую информацию о состоянии больной и позволяет адекватно
подобрать необходимые методы и компоненты специфической и общей терапии.
Поскольку
стертые и абортивные формы эндометрита в последнее время превалируют
над классической, только комплексное обследование всех органов и систем
(дыхание, кровообращение, иммунитет, выделительная функция почек,
кислотно-щелочное состояние, водно-электролитный баланс и т.д.) дает
необходимую информацию о состоянии больной и позволяет адекватно
подобрать необходимые методы и компоненты специфической и общей терапии.
У больных с послеродовым эндометритом в анализах крови наблюдается увеличение СОЭ, повышение количества лейкоцитов со сдвигом формулы влево.
Качественное и количественное бактериологическое исследование содержимого полости матки позволяет подобрать наиболее рациональный антибактериальный препарат.
Большое диагностическое значение имеет срочное гистологическое исследование последа. При наличии в нем воспалительных изменений (базального децидуита) следует учитывать возможность развития эндометрита.
Коагулограмма отражает повышенную готовность организма к возникновению ДВС-синдрома (увеличенное содержание фибриногена - более 5 г/л, снижение фибринолитической активности крови - менее
10%).
При цитохимическом исследовании лейкоцитов крови выявляются повышенные уровни щелочной фосфатазы и увеличенные показатели НСТ-теста (реакция восстановления нитросинего тетразолия).
При допплерографическом исследовании органов малого таза наблюдаются усиление интенсивности кровоснабжения, ускорение кровотока в артериях малого таза, застой и затрудненный отток крови в венах. Температура в полости матки несколько повышена - 37,5 °С и более.
При ультразвуковом исследовании матки определяется нарушение ее сократительной активности, о чем свидетельствует отсутствие разницы при измерении размеров тела и полости матки в динамике послеродового периода. При эндометрите полость матки можно визуализировать в течение 2 нед после родов.
Гистероскопия в послеродовом периоде позволяет видеть непосредственно внутреннюю поверхность матки и практически не имеет противопоказаний для выполнения. При исследовании наблюдаются три вида поражения полости матки: 1) истинный эндометрит - на стенках матки белесоватый налет как следствие воспалительного процесса, причем выраженность этого налета и площадь поражения полости матки зависят от продолжительности и тяжести процесса; 2) эндометрит с некрозом децидуальной ткани - эндометрий в виде структур черного цвета, тяжей и несколько выбухающий над поверхностью стенки матки; 3) эндометрит с задержкой частей плаценты - наблюдается ткань в виде бугристых структур синеватого оттенка с четкими контурами, резко выделяющаяся на фоне матки.
Своевременное и комплексное лечение послеродового эндометрита - основное условие, определяющее предупреждение дальнейшего распространения патологического процесса. Интенсивная терапия заболевания заключается как в общем воздействии на организм, так и в местном лечении. Адекватное местное лечение - важнейший момент, который позволяет ликвидировать очаг инфекции в организме и по возможности сохранить матку. Обязательно удаление из полости матки морфологического субстрата, на котором развивается воспаление. Этим субстратом являются остатки плацентарной ткани либо (в большинстве случаев) децидуальная ткань с различной степенью некроза и лейкоцитарной инфильтрацией. Удаление патологических включений из полости матки производится путем бережного кюретажа или вакуум-аспирации с последующим промыванием дезинфецирущим раствором. После этих манипуляций должны быть созданы условия для свободного оттока отделяемого из полости матки.
Еще один из методов местной терапии послеродового эндометрита - промывное дренирование. В матку вводится катетер, через который производится промывание и орошение ее полости и стенок растворами антисептиков, антибиотиков и т.д. При необходимости применяют аспирационно-промывное дренирование с помощью двухпросветного или двойного катетера. Один из них (приточный) вводится до дна матки, другой (дренажный) - на 6-7 см от внутреннего зева. Через приточный катетер подается охлажденный до температуры 4 °С раствор фурацилина со скоростью 10 мл в минуту.
Кроме местного лечения очага инфекции, необходима интенсивная общая терапия.
Обязательный компонент ее - применение антибактериальных средств, лучше при условии определения возбудителя в содержимом полости матки, а также с учетом чувствительности выделенной микрофлоры к антибиотикам.
Так как в последнее время послеродовый эндометрит вызывается полимикробной аэробной и анаэробной флорой, целесообразно лечение препаратами широкого спектра действия. Необходимо учитывать тот факт, что даже у одной больной в процессе лечения чувствительность возбудителей заболевания к антибиотикам может меняться, поэтому нельзя применять один препарат в течение длительного времени (более 7-8 дней), а при отсутствии положительного эффекта в течение 3-4 дней его также необходимо заменить.
В настоящее время для лечения послеродового эндометрита наиболее часто используют следующие антибиотики: ампициллин - по 1 г 4-6 раз в сутки внутримышечно; оксациллин - по 0,5-1 г 4-6 раз в сутки внутримышечно (до 6 г в сутки); клафоран - по 1 г 2 раза в сутки внутримышечно или внутривенно (до 4 г в сутки); кефзол - по 0,5-1 г 3-4 раза (до 6 г в сутки) внутримышечно или внутривенно; цефазолин - по 1-2 г 4 раза внутримышечно или внутривенно; амикацин - по 0,5 г каждые 8 ч внутримышечно или внутривенно (до 1,5 г в сутки); гентамицин - по 80 мг внутримышечно или внутривенно каждые 8-12 ч (до 240 мг в сутки). Весьма эффективно применение клиндамицина (далацин-С, клеоцин) по 300 мг 2-3 раза в сутки внутримышечно или внутривенно в суточной дозе 600-900 мг, при необходимости дозу можно увеличивать до 2400 мг в сутки.
Кроме антибиотиков, для комплексной антибактериальной терапии необходимы и другие препараты. Хорошей переносимостью и относительно слабой токсичностью обладает метронидазол (метрожил) - по 500 мг 2-3 раза в сутки внутривенно. Перорально можно использовать трихопол (флажил) - по 0,25 г 3 раза в день или тинидазол - в суточной дозе 2 г однократно. Заслуживает внимания лизоцим - фермент, который, кроме антибактериальной активности, обладает способностью стимулировать неспецифические факторы защиты организма. Применяется лизоцим в дозе 100-250 мг внутримышечно дважды в сутки. При непереносимости антибиотиков или при сочетанной мочеполовой инфекции целесообразно назначение препаратов нитрофуранового ряда - фурагина, фурадонина, фуразолидона - по 0,1-0,2 г 3 раза в сутки в таблетках или 300-500 мл 1% раствора фурагина (солафура) внутривенно капельно медленно 1-2 раза в сутки.
При послеродовом эндометрите большое значение имеет также адекватная дезинтоксикационная инфузионная терапия, которую необходимо проводить дифференцированно, с учетом степени нарушения коллоидно-онкотического состояния крови. Объем вводимой жидкости при ненарушенной выделительной функции почек должен составлять 30 мл на 1 кг массы тела в сутки. При повышении температуры тела на один градус необходимо добавлять 5 мл на 1 кг веса в сутки.
Следовательно, общий объем вводимой за сутки жидкости при нормальной функции почек (не менее 60 мл в час) должен составлять 2500-3000 мл. При осложнениях или генерализации процесса количество жидкости может быть увеличено до 5000-6000 мл. Показано вве-
дение 5%, 10%, 20% растворов глюкозы объемом 1000-1500 мл с одновременным добавлением инсулина из расчета 1 ЕД на 4 г сухого вещества глюкозы. Введение глюкозы способствует нормализации энергетического баланса организма.
Белковые препараты необходимо назначать из расчета 1-1,5 г нативного белка на 1 кг массы тела больной. Альбумин вводится внутривенно капельно в виде 5%, 10%, 20% раствора по 200-500 мл, плазма крови - по 200-250 мл, аминопептид или интралипид - по 500 мл. При нарастании явлений интоксикации следует проводить коррекцию минерального обмена. Обычно вводится раствор калия, количество которого зависит от содержания его в крови. В качестве инфузионных сред можно использовать физиологический раствор, раствор Рингера, ацесоль, хлосоль. Гемосорбция, лимфосорбция, плазмаферез, форсированный диурез под контролем электролитного баланса с соответствующим восполнением дефицита калия и натрия также способствуют дезинтоксикации.
Так как послеродовые гнойно-септические осложнения развиваются на фоне недостаточности иммунной системы, обязательно применяют стимуляторы защитных сил организма - тималин, тимоген, тактивин, спленин и т.д.
Важный момент в развитии послеродовых заболеваний - нарушение свертывающей системы крови, что в свою очередь составляет одно из основных звеньев в патогенезе ДВС-синдрома. Поэтому для лечения и профилактики коагулопатий в комплекс проводимой терапии необходимо включать гепарин внутривенно путем непрерывной перфузии в суточной дозе 20 000-30 000 ЕД или по 5 000 ЕД с интервалами 4-6 ч. Бывает вполне достаточно подкожного введения минимальных доз гепарина по 2500-3000 ЕД через 4-6 ч под контролем времени свертывания крови, в последнее время используют низкомолекулярный гепарин: фраксипарин, клексан 1 или 2 раза в сутки.
Поскольку при послеродовом эндометрите в крови увеличивается содержание гистамина и гистаминоподобных веществ, рекомендуется применение десенсибилизирующих препаратов - димедрола, супрастина, пипольфена, тавегила, фенкарола.
Гидрокортизон, преднизолон и другие гормональные препараты применяются только по показаниям при генерализации воспалительного процесса.
Один из важных моментов комплексного лечения - использование витаминов А, С, К и группы В. Вначале их вводят парентерально, а затем можно и внутрь. Введению аскорбиновой кислоты должно предшество-
вать введение унитиола - 5% раствор по 5-10 мл. Аскорбиновая кислота после введения довольно быстро метаболизируется и образует дикетогулоновую и дигидроаскорбиновую кислоты, которые обладают выраженным токсическим свойством. Унитиол способствует пролонгированию действия аскорбиновой кислоты. Кроме того, унитиол связывает тиоловые яды, образуя нетоксичные соединения, выводимые с мочой. Связывание и удаление из организма ядов способствует нормализации метаболических процессов организма и восстановлению его ферментных систем. Своевременное и полноценное комплексное лечение послеродового эндометрита - основа профилактики распространенных генерализованных форм заболеваний у родильниц.
При распространении инфекции за пределы матки (рис. 103, см. вклейку) наступает следующий этап в развитии послеродовых гнойновоспалительных заболеваний с появлением местных процессов в малом тазу и образованием инфильтратов и опухолей воспалительного генеза.
В случае распространения инфекции по маточной трубе развивается сальпингит, а при вовлечении в процесс яичника - оофорит. Послеродовые септические сальпингоофориты возникают чаще всего с одной стороны. При запаивании обоих концов маточной трубы патологическое отделяемое может накапливаться в ее просвете с образованием в последующем гидроили пиосальпинкса. Далее могут возникать тубоовариальные абсцессы. При вовлечении в патологический процесс придатков ухудшается общее состояние больной, появляется лихорадка, усиливаются боли в нижних отделах живота, имеют место симптомы раздражения брюшины, особенно при образовании пиосальпинксов.
Иногда в воспалительный процесс вовлекается тазовая брюшина, и тогда развивается послеродовый пельвиоперитонит. При этом выпот в брюшной полости может быть серозным, серозно-фибринозным, но чаще всего он гнойный. При пельвиоперитоните явления общей интоксикации и симптомы раздражения брюшины более выражены.
Для пельвиоперитонита характерна следующая клиническая картина: высокая температура, резкая тахикардия, тошнота и рвота, задержка газов и стула, положительные симптомы раздражения брюшины. Налицо все признаки общего перитонита. Но благодаря строению брюшины процесс постепенно локализуется, образуются спайки, ограничивающие распространение воспаления, уменьшаются явления интоксикации, нормализуется функция кишечника, и при вагинальном исследовании можно установить наличие выпота в брюшной полости.
При распространении воспалительного процесса на околоматочную клетчатку развивается параметрит.
параметрит
Параметрит (parametritis) - воспаление околоматочной клетчатки (параметрия). Возбудители параметрита - кишечная палочка, клебсиелла, протей, меньшую роль играют стрептококки, золотистый стафилококк, неспорообразующие анаэробы (бактероиды, пептококки, пептострептококки), гонококки. Нередко микрофлора носит ассоциированный характер.
В послеродовом периоде инфекция проникает в клетчатку чаще всего из разрывов шейки матки и верхней трети влагалища, редко из плацентарной площадки. Боковые разрывы шейки матки III степени после родов или позднего выкидыша (нераспознанные и неушитые или неправильно ушитые) иногда осложняются гематомой между листками широкой связки матки. Последующее инфицирование такой гематомы вовлекает в патологический процесс околоматочную клетчатку с развитием параметрита. Гнойный параметрит может формироваться при послеродовом тромбофлебите вен параметрия в результате гнойного расплавления инфицированных тромбов. В некоторых случаях параметрит возникает при перфорации матки во время искусственного аборта. Хронический параметрит часто наступает после воздействия на организм неспецифических факторов, например холода. Предрасполагающими к развитию параметрита факторами вне беременности могут быть: расширение канала шейки матки; диагностическое выскабливание; операции на шейке матки; введение внутриматочной спирали, осложненное травматизацией стенок матки; удаление интралигаментарно расположенной опухоли. Микробы могут попадать в параметральную клетчатку различными путями, но чаще всего - по лимфатическим сосудам из матки.
В течении параметрита различают три стадии: инфильтрации, экссудации и уплотнения экссудата. В начальной стадии воспаления отмечаются расширение сосудов, периваскулярный отек и мелкоклеточная инфильтрация клетчатки. В стадии экссудации происходит массивный выход из сосудистого русла лейкоцитов и других форменных элементов крови, инфильтрат доходит до стенок таза. Воспалительный экссудат
богат фибриногеном. При превращении фибриногена в фибрин инфильтрат приобретает значительную плотность. Воспалительный процесс может локализоваться в пределах параметрия. Этому способствуют выпадение фибрина и блокада лимфатических путей в очаге воспаления, образование грануляционного вала вокруг него, наличие в клетчатке таза фиброзных образований, разграничивающих ее на отделы. При тяжелой инфекции перечисленных защитных приспособлений оказывается недостаточно, и инфекция распространяется на соседние органы и ткани. Если экссудат нагнаивается, возникает гнойный параметрит, который может сопровождаться прорывом гноя, чаще в прямую кишку или мочевой пузырь.
В зависимости от топографии клетчатки малого таза параметриты делятся на передние, боковые и задние. Наиболее часто встречаются боковые параметриты (70-75%), при которых воспалительный процесс сверху ограничивается верхним отделом широкой связки, снизу - нижним отделом кардинальных связок, сбоку - стенкой малого таза. При переднем параметрите инфильтрат определяется спереди от матки и сглаживает передний свод. Он может распространяться на предпузырную клетчатку и переднюю брюшную стенку. Задний параметрит представляет собой воспаление клетчатки между маткой и прямой кишкой. Инфильтрат плотно окутывает прямую кишку, нередко вызывая сужение ее просвета.
Воспаление всей клетчатки малого таза носит название пельвиоцеллюлита (pelviocellulitis).
По клиническому течению параметрит разделяют на острый, подострый и хронический.
Различают параметрит как отдельную форму заболевания (первичный параметрит) и как реактивное воспаление клетчатки при тромбофлебитах, аднекситах (вторичный параметрит).
Параметрит начинается на 10-12-й день после родов с озноба и повышения температуры до 38-39 °С и более, возможны слабость, головная боль. Внизу живота, в левой или правой подвздошной области (соответственно локализации процесса) возникают постепенно усиливающиеся боли. Они носят постоянный характер и иррадиируют в крестец и поясницу. Иногда боль внизу живота является наиболее ранним симптомом параметрита и предшествует появлению инфильтрата.
Сначала местные симптомы мало выражены, при влагалищном исследовании определяется пастозность в области воспаления. Спустя 2-3 дня отчетливо пальпируется инфильтрат тестоватой, а затем плотной консистенции. Он умеренно болезнен, неподвижен. При боковом параметрите инфильтрат располагается рядом с боковой поверхностью матки и переходит на боковую поверхность стенки таза. При этом происходит сглаживание бокового свода влагалища, и слизистая оболочка под инфильтратом быстро теряет подвижность. Матка отдельно от инфильтрата не пальпируется и смещена при одностороннем параметрите в противоположную сторону, а при двустороннем - кверху и кпереди. Продолжительность данной стадии - 5-10 дней.
Инфильтрат может выходить за пределы параметрия. При распространении кпереди он прощупывается снаружи над пупартовой связкой. Благодаря внебрюшинному расположению инфильтрата верхние пальпаторная и перкуторная границы его совпадают. При перкуссии верхнепередних остей подвздошных костей на стороне поражения отмечается приглушение тона (симптом Гентера). При переходе воспаления на околопузырную клетчатку инфильтрат порой распространяется по задней поверхности брюшной стенки, принимая форму треугольника с вершиной, обращенной к пупку. Из верхнего отдела параметрия инфильтрат порой продвигается позади брюшины вплоть до почечной области. При его локализации на поверхности поясничной мышцы (парапсоит) больная принимает щадящее положение: на спине с отведенной и согнутой ногой.
Течение параметрита различное. Лихорадочный период с небольшими периодами нормализации температуры продолжается 1-2 нед. Инфильтрат постепенно рассасывается, если же нет, то наблюдается его нагноение, и образуется абсцесс (на 3-4-й неделе заболевания). Температура тела поднимается до 39 °С и выше, отмечаются значительные колебания между утренней и вечерней температурой, характерны повторные ознобы, выражены явления интоксикации. При влагалищном исследовании в инфильтрате обнаруживают участки размягчения, свидетельствующие о его нагноении. Образовавшийся абсцесс может самопроизвольно вскрыться во влагалище, прямую кишку или мочевой пузырь, реже в брюшную полость или полость матки. В крови значительно нарастает лейкоцитоз, увеличивается сдвиг нейтрофилов влево, резко повышается СОЭ. При угрожающем прорыве в мочевой пузырь возникают частые позывы к мочеиспусканию, в прямую кишку - тенез-
мы, поносы. Если гнойник не вскрыт, гной прокладывает себе путь над пупартовой связкой, через седалищное отверстие между сосудами на ягодицу, под пупартовой связкой на бедро, в околопочечную область. На месте угрожающего прорыва гнойника сначала отмечается выпячивание, а затем покраснение кожи и флюктуация. При подостром параметрите клинические проявления менее выражены, чем при остром.
При развитии хронического параметрита у больной возникают жалобы на периодические тупые, ноющие боли внизу живота. При влагалищном исследовании определяют укорочение сводов и неправильное положение матки за счет спаечного процесса. Встречаются стертые формы параметрита, характеризующиеся невыраженностью, а иногда и отсутствием клинических симптомов.
Диагноз ставится на основании жалоб, данных анамнеза, клинической картины и лабораторных исследований. Тщательно выполненные влагалищное и ректальное исследования в большинстве случаев позволяют установить наличие заболевания. Гнойный параметрит диагностируют с помощью пункции заднего свода влагалища; высокорасположенные и недоступные для пункции абсцессы параметрия - путем ультразвукового сканирования.
Нагноение параметрального инфильтрата и прорыв гнойника в мочевой пузырь выявляют на основании исследования мочи и цистоскопии. Прорыв гнойника в прямую кишку устанавливают, обнаружив гной в каловых массах, а также используя ректоскопию.
Дифференциальный диагноз проводят с ретроцервикальным эндометриозом, пельвиоперитонитом, пиосальпинксом и пиоваром, гематомой параметрия, тромбофлебитом вен параметрия. Иногда дифференциальный диагноз труден, так как некоторые из этих заболеваний предшествуют параметриту или сочетаются с ним. Важный дифференциально-диагностическим признак параметрита - притупление перкуторного тона над верхней передней подвздошной остью на стороне поражения.
В ответ на проникновение возбудителей инфекции в начальной стадии болезни наступает расширение кровеносных и лимфатических сосудов. Появляется отек, имеющий тенденцию к нарастанию. В дальнейшем образуется воспалительный инфильтрат, окруженный валом грануляционной ткани, который является преградой для распространения возбудителей инфекции из первичного очага. В последующем возможно полное рассасывание инфильтрата, образование абсцесса, развитие фиброзных и рубцовых изменений.
Лечат острый параметрит с учетом причины и особенностей заболевания, обусловившего его развитие. Основу составляют общеукрепляющие, антибактериальные, десенсибилизирующие, дезинтоксикационные и симптоматические средства, а также физиотерапевтические процедуры. Иногда приходится прибегать к хирургическому вмешательству. Лечение проводится в стационарных условиях. Вначале обычно применяют антибиотики широкого спектра действия, а после определения чувствительности микробной флоры к антибиотикам назначают более эффективные препараты. При недостаточной эффективности терапии или отсутствии результатов через 5-7 дней антибиотик заменяют.
При тяжелом течении процесса и отсутствии результата от использования одного антибиотика прибегают к их сочетанию, что позволяет создать широкий антимикробный спектр действия.
При тяжелых формах заболевания предпочтительнее применять антибактериальные препараты, комплексно влияющие на аэробную и анаэробную инфекцию.
Для предупреждения развития дисбактериоза, кандидоза назначают нистатин (по 250 000 ЕД 4 раза в день) или леворин (по 200 000 ЕД 4 раза в день), дифлюкан 150 мг однократно и др.
Инфузионная терапия при параметрите направлена на коррекцию метаболических нарушений, борьбу с интоксикацией. Для повышения резистентности организма назначают гамма-глобулин, иммуностимуляторы, используют УФО крови и внутрисосудистую гелий-неоновую лазеротерапию.
При параметрите стафилококковой этиологии для повышения специфической иммунологической реактивности используют антистафилококковый гамма-глобулин, антистафилококковую плазму, адсорбированный стафилококковый анатоксин.
Применяют также препараты протеолитических ферментов (трипсин и химотрипсин), супрастин, димедрол, дипразин. При сильных болях показаны анальгезирующие и седативные средства.
При образовании в параметрии абсцесса проводят оперативное лечение. В случае нагноения инфильтрата с целью уточнения характера экссудата делают его пункцию через свод влагалища в месте наиболее низкого расположения гнойника. При появлении гноя его удаляют шприцем, полость промывают антисептическим препаратом или протеолитическим ферментом (химопсин, химотрипсин), а затем вводят ан-
тибиотики. При выпячивании заднего свода, а иногда и задней стенки влагалища показано срочное вскрытие свода с введением дренажа. Операцию чаще выполняют трансвагинальным путем, реже трансабдоминальным или прямокишечным. Пункцию абсцесса выполняют толстой длинной иглой на шприце. После получения гноя по ходу иглы (не извлекая ее) скальпелем рассекают стенку влагалища и капсулу абсцесса (задняя кольпотомия). Образовавшееся отверстие расширяют и в полость абсцесса вводят резиновую дренажную трубку с боковыми отверстиями (лучше Т-образную).
Лечение подострого параметрита проводят аналогично. При хроническом параметрите назначают фибринолитическую терапию, свечи с лидазой, ЛФК; показаны лазеротерапия, УФО аутокрови, вибротерапия, акупунктура, ручной массаж, бальнеотерапия. Больным хроническим параметритом рекомендовано санаторно-курортное лечение.
Прогноз при ранней диагностике и своевременном рациональном лечении благоприятный. При развитии хронического параметрита отмечается нарушение локальной гемодинамики и функции органов таза.
Профилактика параметрита заключается в предупреждении инфекционно-воспалительных осложнений после абортов и родов, а также гинекологических заболеваний; в борьбе с внебольничными абортами; в рациональном ведении родов и послеродового периода; в своевременном лечении послеродового и послеабортного эндометрита.
тромбоэмболические осложнения
Тромбофлебит (thrombophlebitis) - заболевание вен, характеризующееся воспалением венозной стенки и тромбозом. Вначале может возникать воспаление венозной стенки (флебит), а затем тромбоз, либо, наоборот, - тромбоз и вслед за ним воспаление вены (флеботромбоз).
Роль инфекции в развитии тромбофлебита сложная. Некоторые исследователи считают, что возбудитель инфекции влияет непосредственно на стенку вены, попадая в нее либо с током крови, либо из близлежащего воспалительного очага. Другие рассматривают действие инфекции как общетоксическое, поражающее всю сосудистую систему, нарушающее функцию свертывающей и противосвертывающей системы крови. Если в гнойный процесс вовлекаются питающие венозную стенку сосуды (vasa vasorum), может произойти гнойное расплавление вены.
Острый тромбофлебит - одно из наиболее серьезных осложнений послеродового периода. Возникновению его у родильниц способствуют затяжные и осложненные роды, травмы родовых путей, акушерские операции, постгеморрагическая анемия, послеродовый метроэндометрит, гиперкоагуляция, варикозная болезнь, ожирение, гестоз.
В развитии тромбофлебита важное значение имеют изменение внутренней поверхности сосудистой стенки, повышение свертываемости крови, замедление тока крови, а также рефлекторный спазм сосудов, способствующий замедлению кровотока и повреждению сосудистой стенки. После родов предпосылки к тромбозу следующие: повышение свертываемости крови ко времени родов, развитие застойных явлений в обширной сосудистой сети малого таза, замедление тока крови в венах нижних конечностей. Опасность тромбоза возрастает при сердечно-сосудистых заболеваниях, варикозном расширении вен, ожирении, анемии, позднем гестозе, после затяжных родов и оперативных вмешательств.
Патогенез тромбофлебита различен. У большинства больных острый тромбофлебит не есть следствие гнойного воспаления венозной стенки; он возникает из-за воздействия комплекса факторов, среди которых ведущее значение имеет венозный застой в сочетании с тромботическим состоянием системы гемостаза - гиперкоагуляцией, гипофибринолизом и усилением адгезивно-агрегационных свойств форменных элементов крови. Сравнительно редко в клинической практике наблюдаются случаи истинного септического тромбофлебита, формирующегося на фоне гнойного воспаления вены с последующим тромбообразованием или вследствие вторичного инфицирования венозного тромба и гнойного его расплавления.
Флебит - воспаление стенки вены, которое чаще развивается при общей или местной гнойной инфекции. При понижении реактивности организма, замедлении кровотока, повреждении венозной стенки, изменении состава крови и повышении ее свертываемости создаются благоприятные условия для оседания микробов на внутренней поверхности сосуда, что ведет к ее воспалению (эндофлебит). Поражение венозной стенки воспалительным процессом может происходить и другим путем, когда инфекция переходит из расположенного рядом воспалительного очага на наружную стенку вены (перифлебит). В обоих случаях в воспалительный процесс вовлекается вся венозная стенка. Раздражение, вызванное травмой, микробами, циркулирующими в кро-
ви, оказывает влияние на нервные окончания, заложенные в стенках сосудов, вследствие чего возникает спазм вен. В свою очередь это приводит к замедлению тока крови и образованию тромба. В таких случаях возникает тромбофлебит. Тромб также раздражает нервные окончания венозной стенки, что способствует спазму основного ствола и коллатералей. Спазм и тромбоз вен влекут за собой повышение венозного давления не только в венах, но и в капиллярах, приводящего к увеличению проницаемости капилляров и к отеку конечности.
Послеродовые тромбофлебиты делятся на тромбофлебиты поверхностных и глубоких вен. Последние в свою очередь подразделяются на: метротромбофлебиты; тромбофлебиты вен таза; тромбофлебиты вен ног (подвздошно-бедренные, бедренные, глубоких вен голени и пр.).
По клиническому течению следует различать острую, подострую и хроническую стадии тромбофлебита, по характеру процесса - гнойный и негнойный тромбофлебит. Кроме того, выделяют первичные и рецидивирующие, распространенные и ограниченные (сегментарные) тромбофлебиты.
Тромбофлебиты чаще всего развиваются на 2-3-й неделе после родов, реже - на 5-6-й день; нередко им предшествует длительный субфебрилитет.
К клиническим предвестникам тромбофлебита (точнее, образования тромба) относятся ступенеобразное учащение пульса («лестничный» пульс), стойкое учащение его, болевые ощущения в нижних конечностях: боли в икроножных мышцах при вставании, ходьбе, при дорсальной флексии стопы, спонтанные боли по ходу вены, боли при надавливании на икроножные мышцы, подошву стопы, по обе стороны ахиллова сухожилия, а также положительная проба с манжеткой. Ценны результаты определения коагулирующих и антикоагулирующих свойств крови (в частности, выявление фибриногена В), а также тромбоэластография. В клинической картине различных форм отграниченного тромбофлебита имеется много общего. Состояние больных обычно удовлетворительное. Температура держится в пределах 37-38,5 °С, пульс учащен (нередко до 100 ударов в минуту и более). В начале заболевания наблюдается однократный озноб. В крови чаще всего обнаруживается незначительный лейкоцитоз, умеренный сдвиг лейкоцитарной формулы влево, сравнительно небольшое повышение
СОЭ.
Тромбофлебит поверхностных вен характеризуется яркой клинической симптоматикой и нетруден для диагностики. Как правило, он раз-
вивается на почве варикозного расширения вен нижних конечностей. В ряде случаев это заболевание - следствие введения лекарственных средств в вены стопы. При поверхностном тромбофлебите определяется шнуровидный тяж по ходу подкожной вены, в зоне которого видна полоса гиперемии и отмечается резкая болезненность при пальпации. Процесс чаще развивается в большой подкожной вене и очень редко поражает малую подкожную вену. Длительность заболевания - от 2 до 4 нед. Иногда образуется значительный перифокальный инфильтрат вследствие вовлечения в воспалительный процесс окружающей вену подкожной жировой клетчатки. В ряде случаев наблюдается большой отек мягких тканей в области лодыжек. Если отек значительный и распространяется на голень и бедро, то следует заподозрить сопут-ствующий тромбоз глубоких вен.
Прогрессирование эндомиометрита нередко вызывает метротромбофлебит. Диагностика его часто затруднена. Следует обращать внимание на учащение пульса, субинволюцию матки, длительные обильные кровянистые выделения из половых путей. Иногда при бимануальном акушерском исследовании обнаруживается фасетчатая поверхность матки или на ней определяются характерные извитые тяжи.
Тромбофлебит вен таза выявляется обычно через 2 нед после родов. При влагалищном исследовании определяется плохо сократившаяся матка. При поражении вен нижней венозной системы они нередко прощупываются в основании широкой связки и на боковой стенке таза в виде болезненных плотных и извитых тяжей.
При переходе процесса на клетчатку, окружающую вены, образуются небольшие инфильтраты (вторичный параметрит). При поражении вен яичникового сплетения (верхней венозной системы) имеется повышенная опасность эмболии. При влагалищном исследовании в области придатков определяется небольшой инфильтрат, напоминающий воспалительно измененные придатки.
Развитие подвздошно-бедренного (илеофеморального) венозного тромбоза у родильниц имеет свои особенности. Первично вовлекаются в процесс мелкие ветви внутренней подвздошной вены, что на начальных этапах является следствием физиологического тромбоза вен плацентарной площадки. Далее тромбоз постепенно распространяется на ствол внутренней подвздошной вены и через ее устье - в общую подвздошную вену. Этот период наиболее опасен в отношении возникновения тромбоэмболии легочной артерии, так как в общей подвздош-
ной вене, диаметр которой значительно больше, чем внутренней, образуется флотирующий (плавающий) тромб, представляющий собой потенциальный эмбол. Если эмболии не произошло, наступает тромботическая окклюзия общей подвздошной вены с блокадой кровотока в ней, и процесс распространяется на весь подвздошно-бедренный венозный сегмент. Период распространения тромбоза на общую подвздошную вену протекает латентно из-за отсутствия выраженных нарушений кровотока в магистральных венах таза. На этом этапе клиническая симптоматика неспецифична и характеризуется необъяснимой лихорадкой и тахикардией (признак Малера), нередко - выраженными болями в нижних отделах живота и крестцовой области, иногда наблюдаются дизурические явления. Если в послеродовом периоде возникает пневмония (в особенности плевропневмония), то необходимо исключить ее эмболический генез. По мере распространения тромбоза на подвздошнобедренный сегмент появляются боли и болезненность при пальпации по ходу сосудов нижних конечностей, развивается быстро нарастающий отек ноги, который захватывает всю нижнюю конечность от стопы до паховой складки. У некоторых больных отмечается отек ягодицы, наружных половых органов. Кожа на пораженной конечности цианотична. Цианоз может распространяться на ягодичную область, нижние отделы живота, иногда ограничивается областью голени. Усиление рисунка подкожных вен на бедре и особенно в паховой области - очень важный симптом острого илеофеморального венозного тромбоза.
При остром тромбофлебите глубоких вен бедра в первые дни заболевания возникает сильная боль, температура повышается до 39-40 °С, быстро развивается отек конечности. На бедре по ходу сосудистого пучка отмечается резкая болезненность. На голени боли появляются в проекции глубоких вен (в области икроножных мышц). Окружность бедра пораженной конечности больше, чем окружность здоровой конечности, на 8-15 см. Кожа на больной конечности блестящая, чаще с цианотичным мраморным оттенком, при надавливании пальцем на передней поверхности голени остаются ямки. Конечность на ощупь холоднее по сравнению со здоровой. Температура кожи в области стопы и пальцев на 1,5- 2 °С ниже. Пульс на артериях пораженной конечности отсутствует или значительно ослаблен, что объясняется спазмом магистральных артерий. Регионарные лимфатические узлы увеличены. Вследствие нарушения кровообращения развивается коллатеральная венозная сеть в подвздошной, паховой области и на бедре. В некоторых случаях един-
ственный симптом острого тромбоза глубоких вен голени - боль в икроножных мышцах. Иногда отмечается умеренный отек в области лодыжек. Наиболее выраженный признак острого тромбоза глубоких вен голени - симптом Хоманса, выявляемый следующим образом. Больная лежит на спине, ноги полусогнуты в коленных суставах. Производят тыльное сгибание стопы в голеностопном суставе. Боль в икроножных мышцах, которую при этом ощущает больная, свидетельствует о тромбозе глубоких вен голени, имеющем тенденцию к распространению в проксимальном направлении.
Заболевание продолжается от 3 нед до 2,5 мес и более. Если в процесс вовлекаются бедренная вена и подвздошный сегмент, развивается клинический симптомокомплекс илеофеморального тромбоза.
Острый тромбофлебит как глубоких, так и поверхностных вен может перейти в гнойный, при этом возникают множественные абсцессы и флегмоны по ходу пораженных вен. Гнойный тромбофлебит является чаще осложнением гнойного процесса и характеризуется высокой температурой; ознобом; тяжелым общим состоянием; гиперемией кожи, болезненностью и очагами размягчения (флюктуация) по ходу вены. Если не наступает полного излечения, тромбофлебит чаще из острой стадии переходит в подострую или, минуя подострую, - в хроническую стадию.
Подострый тромбофлебит - переходная стадия от острого процесса к хроническому. Течение: боли постепенно утихают, температура снижается до субфебрильной или нормальной, значительно уменьшается отечность конечности. При тромбофлебите глубоких вен по ходу сосудистого пучка пальпаторной болезненности не отмечается. Уплотнения и инфильтраты определяются по ходу вен на небольшом протяжении или совсем не выявляются. При полной нагрузке на больную конечность наблюдается небольшая болезненность. При хождении и стоянии отек может увеличиваться. Длительность процесса в среднем 1,5-2 мес, а иногда - 4-6 мес. Продолжительность тромбофлебита глубоких вен нижних конечностей составляет в среднем 4-6 нед. Лихорадочный период длится от нескольких дней до 2-3 нед. Лихорадка обычно сменяется субфебрилитетом. Развитие тромбофлебита на другой ноге является обострением заболевания, ее поражение чаще происходит через 10-12 дней.
После перенесенного тромбофлебита нередко возникают осложнения (посттромбофлебитический синдром - хроническая венозная не-
достаточность в 20-40% случаев). Боли в пораженных конечностях обычно появляются вследствие сдавления нервных стволов или распространения на них воспалительного процесса. Одно из наиболее тяжелых осложнений при тромбофлебите крупных вен - эмболия сосудов различных органов, нередко вызывающая инфаркты соответствующей локализации.
После перенесенного тромбофлебита иногда развивается хроническая венозная недостаточность, которая протекает длительно - от нескольких месяцев до 1-2 лет и более. По ходу пораженных вен определяются плотные прерывистые шнуры в виде четок на отдельных участках, безболезненные или несколько болезненные при пальпации. После длительной ходьбы, особенно при поражении глубоких вен, появляются небольшая отечность голени и стопы, напряжение и пастозность мягких тканей. Резкие движения в конечностях вызывают болезненные ощущения. При хронической венозной недостаточности возникают частые обострения тромбофлебита, в основном при варикозном расширении вен, когда наблюдаются трофические расстройства, сухость и шелушение кожных покровов в области голеней, варикозные язвы.
Диагноз ставят на основании анамнеза и тщательного клинического обследования родильницы (осмотр, пальпация, определение пульсации на периферических сосудах, сравнительное измерение окружности конечностей и т.д.). Помимо клинических признаков, большое значение имеют дистальная флебография, антеградная и ретроградная илеокавография, допплерометрическое исследование кровотока, а также исследование с меченым фибриногеном. Косвенная оценка активности тромбообразования может быть произведена путем анализа состояния системы гемостаза. Наиболее информативные тесты - тромбоэластограмма, коагулограмма. Сегментарная окклюзия венозной магистрали на коротком протяжении или флотирующий тромб выявляются только с помощью рентгеноконтрастного метода исследования. При необходимости используют лучевые способы диагностики: флебографию, термографию, радиоизотопное исследование.
Острый тромбофлебит глубоких вен конечностей, сопровождающийся отсутствием или ослаблением пульсации на периферических сосудах, следует дифференцировать с тромбоэмболией и тромбозом артерий - острой артериальной непроходимостью. Закупорка тромбом магистрального венозного ствола приводит к рефлекторному спазму ближайшей артерии, что клинически иногда напоминает артериальную
непроходимость. При эмболии артерий явления непроходимости наступают сразу, а при тромбофлебите только к концу 1-х суток появляются отек конечности и цианоз кожи, в то время как при артериальной непроходимости наблюдается бледность кожи. Иногда при тромбофлебите спастические изменения артерии выражены слабо.
Подострый тромбофлебит глубоких вен голени может иметь некоторое сходство с начальной стадией облитерирующего эндартериита. В отличие от тромбофлебита, эндартериит характеризуется перемежающейся хромотой, трофическими расстройствами на стопе. Эндартериит развивается постепенно. Болезнь Рейно также имеет некоторое сходство с тромбофлебитом. Для нее свойственны симметричное поражение кожи, цикличность болевых приступов. Эти симптомы отсутствуют при тромбофлебите.
Тромбофлебит поверхностных вен следует дифференцировать с мигрирующим тромбофлебитом и лимфангитом. При мигрирующем тромбофлебите процесс развивается одновременно на двух конечностях, быстро возникают тромбы, узелки на свежих участках. При лимфангите имеет место гиперемия кожи в виде полосы по ходу лимфатических сосудов, но уплотнений по ходу поверхностных вен, наблюдаемых при тромбофлебите, не отмечается.
Особенности морфогенеза тромбофлебита зависят от взаимоотношения процессов воспаления и тромбоза. Эндофлебит в сочетании с тромбозом называют эндотромбофлебитом. Тромбофлебит, развивающийся на основе перифлебита, именуется перитромбофлебитом.
При эндотромбофлебите стенка вены гиперемирована, отечна, внутренний ее слой умеренно инфильтрирован полиморфно-ядерными лейкоцитами. Эндотелиальный слой стенки отсутствует, к ней прилежат тромботические массы, в ряде случаев внутренние слои стенки расплавлены, ее структурные элементы в этих местах не прослеживаются, непосредственно к некротизированным тканям прилежит тромб, содержащий большое число лейкоцитов.
При перитромбофлебите в первую очередь поражаются наружная оболочка стенки вены и vasa vasorum. Стенка вены утолщена, серо-желтого цвета, с участками кровоизлияний и лейкоцитарной инфильтрации. Стенки vasa vasorum, вокруг которых отмечается наиболее интенсивная инфильтрация, подвергаются некрозу, просвет их тромбируется. Это ведет к развитию дистрофических и некротических изменений стенки вены.
При благоприятном течении острого тромбофлебита происходит резорбция некротических масс, исчезают полиморфно-ядерные лейкоциты, вместо них появляются макрофаги, лимфоциты, плазматические клетки, фибробласты. Развивается рыхлая молодая грануляционная ткань. Затем следуют канализация или организация тромба, созревание грануляционной ткани и превращение ее в грубоволокнистую соединительную ткань.
Исходом тромбофлебита является склероз венозной стенки и тромба. Степень восстановления просвета вены зависит от величины тромба. После завершения организации тромб нередко облитерирует просвет вены. В соединительной ткани, замещающей тромб, обнаруживаются щели и каналы. От их объема в определенной мере зависит степень восстановления просвета.
Перифлебит, развивающийся при тромбофлебите, может быть причиной склероза соединительной ткани, окружающей сосудисто-нервный пучок, что приводит к развитию нейротрофических расстройств.
Лечение тромбофлебитов во всех стадиях - обязательно комплексное. Используют консервативные и хирургические методы. Выбор метода зависит от локализации, характера (эмбологенный, неэмбологенный) и протяженности тромбоза.
Консервативные методы являются основными при лечении острых тромбозов и тромбофлебитов. При сегментарном тромбозе магистральных вен проводят хирургическое лечение. При обнаружении эмбологенной формы тромбоза показано оперативное вмешательство, направленное на профилактику тромбоэмболии легочной артерии (тромбэктомия, перевязка вен, имплантация кавафильтра).
Главный компонент комплексного консервативного лечения - применение антитромботических средств. Активная стадия венозного тромбоза, продолжающаяся в среднем 2-3 нед, характеризуется тромботическим состоянием системы гемостаза: значительной гиперкоагуляцией, выраженным торможением фибринолиза и резким повышением агрегационной способности тромбоцитов. В связи с этим при лечении острого венозного тромбоза необходимо устранить тромботический сдвиг во всех трех основных звеньях гемостаза.
Успех лекарственной терапии тромбозов достигается при сочетанном использовании антикоагулянтных, тромболитических средств и препаратов, изменяющих микроциркуляцию и агрегацию форменных элементов крови.
Рекомендуемые средства профилактики и лечения тромбозов включают:
• антикоагулянты прямого и непрямого действия - дикумарин, фенилин, синкумар, гепарин, фраксипарин, клексан и др.;
• тромболитические средства - трипсин, химотрипсин, стрептокиназа, тромболитин (комплексный препарат трипсина и гепарина), фибринолизин;
• препараты, улучшающие микроциркуляцию и уменьшающие агрегацию форменных элементов крови, - трентал, никотиновая кислота.
Комплексное лечение острого поверхностного тромбофлебита включает: эластическую компрессию нижней конечности, ее возвышенное положение, местное применение холода, троксевазиновой или гепаринсодержащей мази, внутривенное введение троксевазина по 5 мл в течение пяти дней с переходом на пероральный прием этого же препарата (1 капсула 3 раза в день), назначение бутадиона в дозе 5 г 3 раза в день в течение 10 дней. На протяжении всего периода лечения необходим тщательный контроль за динамикой процесса в поверхностных венах.
Если, несмотря на консервативную терапию, тромбофлебит распространяется в проксимальном направлении, следует совместно с хирургом решить вопрос о необходимости оперативного лечения.
При остром тромбофлебите поверхностных и глубоких вен нижних конечностей хороший клинический эффект дает лечение, которое начато в течение первых трех дней от начала заболевания. Если же оно начато в более поздние сроки, отмечается длительное сохранение отека, реканализация затягивается надолго.
Сроки активизации больных тромбофлебитом зависят главным образом от тяжести заболевания. При тромбофлебите поверхностных вен лечебная физкультура показана со 2-3-го дня, при тромбофлебите глубоких вен - с 5-10-го дня, когда уменьшается местная воспалительная реакция, снижается температура тела и прекращаются боли. Занятия проводят 1-2 раза в день, их продолжительность - 7-10 мин. Начинают с упражнений на здоровой ноге, через 1-3 дня вводят упражнения для больной ноги.
Комплексная сочетанная терапия должна осуществляться под контролем коагулограммы, что позволяет дозировать препараты и избежать осложнений.
Методами хирургического лечения являются: перевязка вен, разрезы по ходу вен с раскрытием венозного ложа и иссечением пораженного участка - венэктомия, эмболэктомия, тромбэктомия, пересадка и пластические операции на венах. При гнойном восходящем тромбофлебите перевязка вены производится значительно выше тромба.
При необходимости флебэктомию выполняют спустя 5-10 дней от начала лечения, т.е. после ликвидации воспалительных явлений (перифлебита). Консервативное лечение с применением протеолитических ферментов в этих случаях служит предоперационной подготовкой к радикальному лечению.
Лечение послеродовых тромбофлебитов осуществляют в отделении акушерского стационара, специализирующегося на лечении воспалительных заболеваний у беременных, рожениц и родильниц, а также в гинекологических и хирургических отделениях.
У больных с тромбофлебитом поверхностных вен прогноз обычно благоприятный. Менее благоприятный прогноз у больных с невосстановленным венозным кровотоком. У них развивается хроническая венозная недостаточность с выраженным отечно-болевым синдромом, трофическими язвами, в связи с чем может наступить стойкая утрата трудоспособности.
Прогрессирующий тромбофлебит является формой третьего этапа послеродовой инфекции. При этом процесс не ограничивается воспалением венозной стенки и образованием тромба, а распространяется дальше по протяжению вены. В результате распада тромбов могут возникнуть эмболии и инфаркты легких. При своевременной и адекватной антибактериальной терапии метастатические очаги, как правило, не развиваются.
Клиническая картина эмболии легких определяется механической закупоркой ветвей легочной артерии, резким рефлекторным спазмом ее незатронутых разветвлений, спазмом бронхов и возникшей коронарной недостаточностью.
Эмболия крупных ветвей легочной артерии проявляется резкой слабостью, бледностью, снижением артериального давления, тахикардией, болями в грудной клетке. Острая эмболия главного ствола легочной артерии, как правило, приводит к смерти.
При эмболии небольших ветвей наблюдаются одышка, боли при дыхании (на выдохе), учащение пульса. Нередко в легких развиваются инфаркты, преимущественно в нижних долях. Наиболее постоянные признаки инфаркта - боли при дыхании, притупление перкуторного звука,
ослабленное дыхание с бронхиальным оттенком, мелкопузырчатые хрипы по периферии инфарктного очага. Иногда появляется примесь крови в мокроте. Повышается температура, отмечается лейкоцитоз.
Лечение заключается в немедленном внутривенном введении морфина, спазмолитических средств, ингаляции кислорода, в инфузии в легочную артерию стрептокиназы, урокиназы с гепарином или во внутривенном введении стрептодеказы (иммобилизированный фермент - стрептокиназа). Все чаще делаются попытки применять хирургический метод лечения эмболии легочных артерий, но ввиду того, что это осложнение развивается очень быстро, чаще со смертельным исходом, операции в специализированных лечебных учреждениях производят редко.
Прогноз при эмболии крупных ветвей легочной артерии неблагоприятный, а при эмболии мелких и небольших ветвей в случаях правильного и своевременного лечения в большинстве случаев благоприятный.
К мерам общей неспецифической профилактики относятся: своевременная и полноценная коррекция нарушений гемогидробаланса, предупреждение дыхательных расстройств, борьба с метеоризмом, лечебная физкультура и ранняя активизация больных. Женщинам, имеющим факторы риска, в особенности тем, которые в прошлом перенесли острый венозный тромбоз или страдают варикозным расширением вен нижних конечностей, показано применение специальных профилактических мер. Для устранения расстройств венозного оттока рекомендуют постоянную компрессию нижних конечностей с помощью эластических бинтов или чулок, обеспечение возвышенного положения ног в постели. Эффективным средством улучшения периферической гемодинамики является прерывистая пневматическая компрессия или электростимуляция икроножных мышц, имитирующая действие мышечно-венозной «помпы» голени.
Важную роль в профилактике послеродовых тромбофлебитов у больных с повышенным риском развития тромбоза играет использование медикаментозных средств, влияющих на систему гемостаза и реологические свойства крови. Опасность возникновения послеродового тромбофлебита может быть значительно уменьшена подкожным введением препаратов гепарина (5-7 дней). Создаваемая при этом легкая гипокоагуляция не вызывает геморрагических осложнений. Широко применяют с целью профилактики никотиновую кислоту, аспирин.
Профилактика тромбофлебита состоит в правильном и своевременном лечении тех заболеваний, которые могут им осложняться. Следует
не допускать обезвоживания организма в предоперационном и послеоперационном периодах, поощрять активные движения больных в послеоперационном периоде, бережно относиться к тканям во время операции, своевременно назначать антикоагулянты и средства, улучшающие функцию сердечно-сосудистой системы.
перитонит
Перитонит - одно из наиболее тяжелых осложнений послеродового периода. В большинстве случаев источником заболеваний в акушерско-гинекологической практике является матка. Ее роль в качестве входных ворот для инфекции определяется наличием в полости сгустков крови, децидуальной ткани, которые служат прекрасной питательной средой для роста микроорганизмов. Кроме того, матка имеет большую поверхность для резорбции бактериальных и тканевых токсинов, а особенности ее кровообращения способствуют поступлению бактериальной флоры и токсинов в кровь. Сопровождающий беременность иммунодефицит, изменения гормонального гомеостаза содействуют развитию перитонита. Основное значение в патогенезе заболевания имеет интоксикация, обусловленная нарушением метаболических процессов в тканях, их распадом, что приводит к расстройству функции сердечнососудистой и дыхательной систем. В дальнейшем развиваются гиповолемия, депонирование и секвестрация крови в сосудах брюшной и грудной полостей, паралич (парез) кишечника. Скопление в петлях кишечника жидкости и газов приводит к его перерастяжению, нарушению микроциркуляции, ишемии кишечной стенки, что повышает проницаемость ее для микроорганизмов и токсинов.
Чаще всего при перитоните обнаруживают смешанную микробную флору. Однако ведущее значение имеют кишечная палочка, стафилококк, синегнойная палочка и протей. В последнее время возросла роль анаэробных неспорообразующих бактерий, относящихся к группе эндогенных условно-патогенных микроорганизмов, вегетирующих преимущественно на слизистых оболочках и обладающих полирезистентностью к антибиотикам и другим антибактериальным препаратам.
Токсины, всасываясь в кровь, вызывают глубокие изменения в организме. В результате появляется циркуляторная гипоксия, которая сопровождается нарушением окислительно-восстановительных процессов,
преобладанием анаэробной фазы с накоплением недоокисленных продуктов обмена. Интоксикация способствует снижению обезвреживающей функции печени. Нередко печеночная недостаточность сочетается и с почечной.
Катаболические процессы при перитоните и анаболические реакции, направленные на синтез необходимых белковых структур, сопровождаются большими затратами белка. Снижение коллоидно-онкотического давления приводит к потере жидкости в сосудистом русле и увеличению вязкости крови и концентрации мочевины. В дальнейшем осмотическая гипотония во внеклеточном секторе сопровождается угнетением выделения антидиуретического гормона и уменьшением реабсорбции воды. Появляется тенденция к усиленному выделению калия, который из клеток перемещается непосредственно в зону патологического процесса. Калий высвобождается также в результате разрушения клеточных элементов. В экссудате брюшной полости отмечается повышение содержания калия, а в сосудистом русле - дефицит его, что усиливает парез кишечника, вызывает брадикардию, аритмию, нарушение внутрисердечной проводимости и сократительной способности миокарда. При развитии почечной недостаточности в результате расстройства экскреции калия почками наблюдается гиперкалиемия.
Повышенная активность протеолитических ферментов, нарушения микроциркуляции приводят к внутрисосудистому свертыванию крови с развитием коагулопатии потребления.
Перитониты классифицируют по этиологическому признаку, по клиническому течению, по характеру экссудата (серозный, серознофибринозный, гнойный, геморрагический и т.д.), по распространенности (местный, общий).
Наиболее приемлемой можно считать классификацию, отражающую динамическое течение заболевания: I фаза - реактивная, II - токсическая, Ш - терминальная.
Реактивная фаза (стадия) перитонита характеризуется подъемом температуры до 37,8-38 °С и выше на 2-3-е сутки, периодическими ознобами, тахикардией до 120-140 ударов в минуту, очень часто пульс не соответствует температуре. Артериальное давление почти всегда в пределах нормы, но при перитоните, вызванном грамотрицательной флорой, - пониженное. Язык может оставаться влажным, рвота - отсутствовать. Ведущий симптом - парез кишечника. Проведение обычных лечебных мероприятий, направленных на нормализацию функции ки-
шечника, дает частичный и кратковременный эффект. Через 2 ч перистальтика исчезает и снова появляется вздутие живота. Живот принимает участие в акте дыхания, при пальпации умеренно болезненный, напряжение мышц передней брюшной стенки и симптомы раздражения брюшины слабо выражены. В брюшной полости при перкуссии определяется выпот. При влагалищном исследовании пальпация матки и придатков затруднена. Задний свод напряженный и болезненный. Выделения из матки кровянистые или гноевидные. При ректальном исследовании определяется нависание и болезненность передней стенки прямой кишки. Иногда имеет место промокание повязки, что часто наблюдается перед эвентрацией. Продолжительность этой стадии перитонита составляет 2-3 сут.
Токсическая фаза перитонита связана с нарастающей интоксикацией. Ухудшается общее состояние больной, нарушаются обменные процессы, изменяется электролитный баланс, развивается гипопротеинемия, нарушается деятельность ферментативных систем, увеличивается лейкоцитоз. Пульс учащается до 130-140 ударов в минуту, артериальное давление снижается; нарастают одышка, цианоз; появляется возбуждение, после которого развивается адинамия. Все симптомы, характерные для предыдущей, реактивной, стадии, выражены резче. Токсическая стадия кратковременная и продолжается менее суток.
Терминальная фаза характеризуется более глубокими изменениями. Преобладают симптомы поражения ЦНС: заторможенность, адинамия. Общее состояние тяжелое, больные вялые. Нарушается моторная функция кишечника, симптомы раздражения брюшины выражены весьма слабо. Перистальтика прослушивается, наблюдается угнетение активности ферментов. Уменьшается количество выделяемой мочи до 300-400 мл в сутки, наблюдаются другие симптомы полиорганной недостаточности.
Таким образом, чем больше времени проходит от начала заболевания, тем больше явлений и последствий катастрофы в брюшной полости. Это обстоятельство делает чрезвычайно важной раннюю диагностику перитонита, поскольку адекватная терапия приносит положительный результат только тогда, когда она начинается в реактивную фазу.
Клиническое течение перитонита отличается разнообразием и во многом зависит от причины, которая его вызвала. В настоящее время выделяются три формы клинического течения перитонита. Первой является ранний перитонит, возникающий в результате инфицирования
брюшины во время операции, чаще всего произведенной на фоне хориоамнионита, при длительном безводном промежутке. Клинические признаки перитонита могут обнаруживаться уже на 1-2-е сутки после операции. Симптомы раздражения брюшины (боль, «мышечная защита», синдром Щеткина-Блюмберга) не выражены. Наблюдаются парез кишечника, симптомы интоксикации (лихорадка, тахикардия, тахипноэ, сухость слизистых оболочек). В анализах крови прослеживаются лейкоцитоз, палочкоядерный сдвиг. Необходимо постоянное наблюдение за больной с обязательным началом лечебных мероприятий.
Вторая клиническая форма - перитонит, развивающийся вследствие длительного пареза кишечника у больной с послеоперационным эндометритом. В этом случае инфицирование брюшины происходит вследствие нарушения барьерной функции кишечника при упорном парезе его и динамической непроходимости. Состояние больных остается относительно удовлетворительным. Температура тела - в пределах 37,4-37,6 °С, тахикардия составляет 90-100 ударов в минуту, рано появляются признаки пареза кишечника. Боли в животе не выражены, периодически возникают тошнота и рвота. Живот может оставаться мягким, признаков раздражения брюшины нет. После проведенных лечебных мероприятий больная отмечает улучшение самочувствия, прекращается рвота, начинают отходить газы и каловые массы, но через 3-4 ч ситуация меняется. Возобновляется вздутие живота, вновь появляется рвота, но уже более обильная и с примесью зеленоватых масс. Опять возникают затруднения с отхождением газов. В анализах нарастает лейкоцитоз, отмечается сдвиг лейкоцитарной формулы влево. Процесс прогрессирует и, несмотря на проводимую консервативную терапию, с 4-го дня состояние больной ухудшается, нарастают симптомы интоксикации.
Дифференциальная диагностика обычного послеоперационного пареза кишечника и развивающегося перитонита остается довольно сложной. Необходимо тщательно наблюдать за больной, оценивать в динамике общее состояние, пульс, артериальное давление, диурез, данные пальпации и аускультации брюшной полости, клинический и биохимический анализы крови и т.д. Очень важный момент в дифференциальной диагностике - отсутствие улучшения состояния женщины, несмотря на проводимое лечение.
Третьей клинической формой является перитонит, развивающийся в результате несостоятельности швов на матке. Чаще всего это бывает
связано с инфекцией, реже - с техническими погрешностями в процессе операции. В результате инфекционный субстрат попадает в брюшную полость, и в клинической картине преобладает местная симптоматика. При неправильном ушивании раны на матке клинические симптомы заболевания появляются быстро, признаки перитонита наблюдаются буквально с первых суток. Состояние больной ухудшается, ее беспокоят боли в нижних отделах живота, которые более выражены при пальпации. Весьма характерно уменьшение количества выделений из матки. Четко выражены общие симптомы интоксикации: рвота, тахикардия, лихорадка, тахипноэ. Перкуторно определяется наличие экссудата в брюшной полости, причем количество его постепенно нарастает. При инфицировании швов и последующей их несостоятельности заболевание развивается значительно позднее - на 4-9-е сутки после операции, причем клинические проявления перитонита зависят от иммунной и эндокринной систем организма. Состояние больной может оставаться удовлетворительным, пульс на уровне 90-100 ударов в минуту, температура тела повышается довольно рано и держится в пределах 38-39°С даже на фоне проводимого лечения. Парез кишечника вначале незначительный, симптомы раздражения брюшины на первых порах отсутствуют. Это в большей степени связано с тем, что кесарево сечение в настоящее время производится обычно поперечным разрезом в нижнем сегменте, и симптоматика со стороны брюшной полости при данной разновидности перитонита чаще всего стертая. Накопление экссудата и инфильтрация происходят забрюшинно. При влагалищном исследовании определяется сниженный тонус шейки матки, цервикалъный канал свободно проходим. При пальпации шва выявляется его несостоятельность, в забрюшинном пространстве - отечность тканей с инфильтрацией, наличие экссудата. На гнойный очаг в дальнейшем начинает реагировать и брюшная полость, развивается перитонит. Живот мягкий, несколько вздут. Шум перистальтики вначале прослушивается, затем исчезает. При попадании содержимого в брюшную полость клиническая картина становится отчетливой. Продолжает ухудшаться общее состояние, нарастает интоксикация, повторяется рвота, может появляться жидкий стул. Передняя брюшная стенка напряжена, четко определяются признаки раздражения брюшины.
Вышеперечисленные формы клинического проявления перитонита встречаются наиболее часто. Однако акушерский перитонит отличается от хирургического, и на фоне проводимого комплексного лечения кли-
ническая картина заболевания порой затушевывается, а его распознавание возможно лишь при появлении возвратной симптоматики. Только тщательная оценка всех факторов и симптомов в совокупности и в динамике позволяет правильно и своевременно поставить диагноз и начать лечение. Важно всегда помнить, что стертая клиническая картина довольно часто характерна для акушерских перитонитов.
Лечение при постановке диагноза «перитонит» должно быть оперативным независимо от стадии течения заболевания; терапия - комплексной и направленной на восстановление всех функций жизненно важных органов и систем.
В течение 2-4 ч проводится предоперационная подготовка, объем которой зависит от состояния больной. Вводятся дезинтоксикационные препараты, белки, корригируются ОЦК, водно-электролитные нарушения, восполняется энергетический дефицит, вводятся сердечные препараты.
Под общей анестезией производится оперативное лечение. Брюшная полость вскрывается продольным разрезом, что важно для последующей ее санации и дренирования. Основная цель операции - удаление источника инфекции, что достигается экстирпацией инфицированной матки с трубами. При неполноценности послеоперационного шва на матке гистерэктомия особенно важна. В то же время при нарушении барьерной функции кишечника особое значение имеет качественное дренирование брюшной полости.
При экстирпации матки у больной после кесарева сечения в нижнем сегменте поперечным разрезом целесообразно вскрыть не передний, а задний свод влагалища, что обусловлено техническими трудностями при переднем доступе в результате инфильтрирования клетчатки мочевого пузыря. Особенностью операции является характер перитонизации, который заключается в наложении двух кисетных швов на каждый параметрий с захватом боковой стенки влагалища и оставлением его открытым в брюшную полость, в результате чего создаются хорошие условия для оттока воспалительного экссудата. Во время операции брюшная полость дренируется через переднюю брюшную стенку и влагалище двумя или более дренажными трубками, которые ежедневно подтягиваются. Передняя брюшная стенка ушивается наглухо.
Особое внимание накануне и во время операции необходимо уделить функциональному состоянию желудочно-кишечного тракта, поскольку перитонит после кесарева сечения относится к послеоперацион-
ным осложнениям и протекает в неблагоприятных условиях, которые в той или иной степени определяются атонией кишечника. Для восстановления функции кишечника по ходу операции может возникнуть необходимость его опорожнения, создания декомпрессии.
Интенсивная терапия перитонита складывается из множества компонентов. Основа комплексного лечения - инфузионно-трансфузионная терапия методом управляемой гемодилюции с использованием кровезаменителей направленного действия и растворов со сбалансированным ионным составом под обязательным контролем показателей коллоидноосмотического состояния. Коррекция водно-электролитных нарушений осуществляется введением препаратов калия, кальция, раствора Рингера-Локка, полиионных растворов, 4% натрия бикарбоната. Из белковых препаратов вводят 5%, 10%, 20% раствор альбумина - до 500 мл, протеин, плазму. Необходимо вводить 10% раствор глюкозы - до 1000 мл с соответствующим количеством инсулина. Для борьбы с интоксикацией и для улучшения микроциркуляции широко применяются крахмал, реополиглюкин, трентал (100 мг в 250 мл изотонического раствора хлорида натрия, вводится медленно), внутримышечные инъекции - 5-10 мл 5% раствора унитиола. Необходимо проводить мероприятия, направленные на устранение нарушений микроциркуляции и ДВС-синдрома. С этой целью применяют гепарин - по 500 ЕД на 1 кг массы тела в сутки, низкомолекулярные гепарины, никотиновую кислоту - 3 мг/кг, эуфиллин - 10 мг/кг, реополиглюкин - 15 мл/кг, контрикал - 100 ЕД/кг. Для улучшения тканевого метаболизма и функции паренхиматозных органов назначают глутаминовую кислоту, коферментные препараты - кокарбоксилазу, фолиевую кислоту. Оправданно и применение ингибиторов протеаз, которые тормозят эстеразную активность эндогенных и экзогенных протеиназ.
Антибактериальная терапия проводится одновременно 2-3 препаратами. Заменяют антибиотики через 10 дней с учетом чувствительности к ним микрофлоры. Для внутривенного и внутримышечного применения предпочитают антибиотики широкого спектра действия (ампициллин - по 1 г 6 раз в сутки, цефалоспорины - до 8 г в сутки, диклоксациллин - по 1 г 6 раз в сутки и т.д.). Процесс, вызванный грамотрицательной флорой, лечат аминогликозидами. При перитоните, вызванном анаэробной флорой, целесообразна гипербарическая оксигенация, которая оказывает мощное антигипоксическое, антипаретическое и детоксикационное действие. Анаэробные неклостридиальные
микроорганизмы чувствительны к небольшой группе препаратов (клиндамицин, линкомицин, рифампицин, левомицетин, метронидазол, тинидазол).
При развитии легочной недостаточности применяют ИВЛ смесью 50% кислорода и воздуха в режиме умеренной гипервентиляции с положительным давлением в конце выдоха 5 см вод. ст.
Лечение гепаторенального синдрома включает все методы детоксикации: гемосорбцию, гемодиализ, плазмаферез, перитонеальный диализ.
Продолжать восстановление функции кишечника необходимо всеми доступными методами, в том числе и изложенными выше. С этой целью используются назогастральное зондирование, длительная перидуральная блокада, внутривенное введение церукала по 2 мл 3 раза в сутки, что способствует эвакуации содержимого желудка в тонкий кишечник, ганглиоблокаторы (бензогексоний). Прозерин следует применять в тот период, когда желудок и кишечник достигают физиологической подготовленности (через 36-48 ч после операции). Широко используются седативные, болеутоляющие, десенсибилизирующие, общеукрепляющие, иммуностимулирующие, анаболические средства.
Таким образом, тактика ведения больной зависит от формы перитонита, тяжести состояния женщины, возникающих расстройств гемодинамики, водно-электролитного, белкового обмена, расстройств микроциркуляции, поражения внутренних органов. Только комплексная интенсивная терапия перитонита, направленная на различные механизмы его развития, может привести к благоприятному исходу.
септический шок
Септический шок - клинический синдром, осложняющий течение различных инфекционных заболеваний. Он представляет собой фазово развивающийся патологический процесс адаптивного характера, возникающий вследствие нарушений нейрогуморальной регуляции и характеризующийся острым снижением обмена веществ и энергообразования в результате расстройства микроциркуляции в тканях и органах с нарушением их функции и структуры. В акушерской практике он может осложнять течение послеродовых и послеабортных септических заболеваний, хориоамнионита, мастита, пиелонефрита и др. Как правило,
протекает на фоне генерализации септического процесса в результате эндо- и экзотоксемии, а также вследствие патологий вирусной, грибковой и другой этиологии.
Септический шок встречается у 3-15% больных с послеродовыми и послеабортными септическими заболеваниями. По частоте возникновения он стоит на третьем месте после геморрагического и кардиального шока, а по летальности - на первом. При септическом шоке погибают от 20 до 80% больных.
Чаще всего септический шок вызывают грамотрицательные микроорганизмы: кишечная палочка, протей, клебсиелла, синегнойная палочка, различные их сочетания. При разрушении этих бактерий выделяется эндотоксин - ведущий патогенетический фактор развития шока.
Септический процесс, вызванный грамположительной флорой (энтерококком, стафилококком, стрептококком), реже осложняется шоком. Активным началом при данном виде инфекции являются экзотоксины (компоненты оболочки - мукопептиды и стафилококковый протеин А), вырабатываемые живыми микроорганизмами. Причиной развития шока может быть анаэробная флора, в первую очередь Cl. perfringens, а также риккетсии, вирусы (вирус герпеса, цитомегаловирусы), простейшие и грибы.
Для возникновения шока, кроме инфекции, необходимо сочетание еще двух факторов: снижения общей резистентности организма больной и наличия возможности для массивного проникновения возбудителя или его токсинов в кровоток.
В акушерско-гинекологической клинике очагом инфекции в подавляющем большинстве случаев является матка (послеродовые и послеабортные септические заболевания, хориоамнионит в родах). Развитию шока при этом способствуют: наличие в матке сгустков крови и остатков плодного яйца, которые служат питательной средой для микробов; особенности кровообращения беременной матки, облегчающие поступление бактерий в кровеносное русло; изменение гормонального гомеостаза; состояние физиологического транзиторного иммунодефицита; гиперлипидемия; аллергизация беременных. Септический шок может осложнять течение гнойного послеродового мастита, а также пиелонефрита беременных при нарушении пассажа мочи.
В механизме развития септического шока основная роль принадлежит острому расстройству гемодинамики и нарушению свертывания крови. Эндотоксины оказывают прямое токсическое действие на эндо-
телий капилляров, вызывая его повреждение. Это приводит к активации внешнего прокоагулянтного звена системы гемостаза за счет выброса тканевого тромбопластина и активации системы комплемента. Важным звеном реализации биологического эффекта эндотоксина в организме являются лейкоциты. Попадая в кровяное русло, эндотоксины вызывают количественное и качественное изменение лейкоцитов. Вначале отмечается лейкопения (в основном за счет падения содержания нейтрофилов), которая в дальнейшем сменяется лейкоцитозом (за счет нейтрофилии) и замедлением хемотаксиса лейкоцитов под влиянием эндотоксина. Эндотоксин придает лейкоцитам высокую прокоагулянтную активность. Связываясь со специфическими рецепторами на поверхности тромбоцитов, он вызывает избирательное освобождение серотонина и тромбоцитарного фосфолипида - тромбоцитарного фактора III. При эндотоксемии наблюдается тромбоцитопения. Помимо прямого влияния эндотоксина на мембрану тромбоцитов, существует еще и опосредованное, обусловленное взаимодействием эндотоксина с системой иммуноглобулинов и комплемента. Активированный комплемент вызывает лейкотоксию лимфоцитов, повреждение мембраны тромбоцитов, выделение тромбоцитарного фактора III и последующее развитие ДВС-синдрома, гемолиз эритроцитов и выделение в кровоток эритроцитарного тромбопластина. Компоненты активированной системы комплекса С3а и С5а - анафилотоксины - действуют на тучные клетки и способствуют выходу гистамина, серотонина и других вазоактивных веществ, которые вместе с эндотоксином увеличивают сосудистую проницаемость и активируют калликреиновую систему. Эндотоксин вызывает стимуляцию альфа-адренорецепторов, в результате чего происходит спазм артериол. Все это ухудшает реологические свойства крови, усугубляет нарушение микроциркуляции и способствует прогрессированию ДВС-синдрома, имеющего иммунотоксическую природу. К гипоксии клеток, обусловленной расстройством микроциркуляции, присоединяется непосредственное действие эндотоксина на клеточные мембраны с нарушением трансмембранного транспорта ионов и торможением синтеза АТФ, результатом чего становится угнетение процессов окислительного фосфорилирования, нарушение метаболического контроля, при котором прогрессирующее расстройство межуточного обмена обусловливают глубокие физиологические нарушения.
Первичные расстройства при септическом шоке касаются периферического кровообращения. Вазоактивные вещества вызывают вазопле-
гию в капиллярной системе, что приводит к резкому снижению периферического сопротивления. Повышение минутного объема сердца за счет тахикардии, а также регионарное артериовенозное шунтирование в органах и тканях не могут полностью компенсировать возникшее нарушение капиллярного кровообращения. Уменьшается (обычно умеренно) АД. Развивается гипердинамическая фаза септического шока, при которой, несмотря на достаточно высокий периферический кровоток, капиллярная перфузия снижена. Ее снижение и прямое повреждающее действие бактериальных токсинов на клеточном уровне нарушают усвоение кислорода и энергетических веществ. Параллельно с возникновением микроциркуляторных расстройств наступает гиперактивация свертывающей системы гомеостаза с развитием ДВС-синдрома. Это ведет к нарушению обменных процессов в тканях с образованием недоокисленных продуктов.
Основными триггерными механизмами возникновения ДВС-синдрома являются; активация фактора XII (Хагемана); повреждение эндотелия сосудов эндо- и экзотоксинами с выделением тканевого тромбопластина; взаимодействие их с тромбоцитами, агрегация последних; высвобождение АДФ, серотонина, гистамина, тромбоцитарных факторов III и IV; гемолиз эритроцитов и высвобождение эритроцитарного тромбопластина; воздействие эндотоксина на систему комплемента и калликреин-кининовую систему. Усугублению ДВС-синдрома при септическом шоке способствуют стаз, особенно в системе микроциркуляции, ацидоз, повышение вязкости крови.
Избирательный спазм венул и прогрессирование ДВС-синдрома вызывают стаз крови в системе микроциркуляции. Повышение проницаемости сосудов ведет к выходу жидкой части крови, а затем и форменных элементов в интерстициальное пространство. Эти патофизиологические изменения способствуют значительному уменьшению ОЦК - наступает гиповолемия. Приток крови к сердцу значительно уменьшается. Минутный его объем, несмотря на резкую тахикардию, не может компенсировать нарастающее нарушение периферической гемодинамики. Ухудшение коронарного кровотока, повреждающее действие токсинов и тканевых метаболитов, снижение реакции миокарда на адренергическую стимуляцию и отек мышечных элементов приводят к нарушению сердечной деятельности. Наступает стойкое снижение АД. Развивается гиподинамическая фаза септического шока.
Наибольшему повреждающему действию при септическом шоке подвержены легкие, печень, почки, мозг, желудочно-кишечный тракт, кожа.
При наличии гнойной инфекции в организме легкие работают с повышенной нагрузкой и большим напряжением. Нарушение микроциркуляции с артериовенозным сбросом крови и развитие интерстициального отека приводят к нарушению соотношения между вентиляцией и перфузией легочной ткани. Усугубление тканевого ацидоза, микротромбоз легочных сосудов, недостаточная продукция сурфактанта ведут к развитию интраальвеолярного отека легких, микроателектазированию и формированию гиалиновых мембран. В результате происходящих изменений септический шок осложняется острой дыхательной недостаточностью, при которой наступает глубокое нарушение кислородного обеспечения организма.
Уменьшение ОЦК и гемомикроциркуляторные расстройства приводят к снижению перфузии почечной ткани, перераспределению почечного кровотока с уменьшением кровоснабжения коркового слоя. Происходит нарушение клубочковой фильтрации, изменение осмолярности мочи - формируется «шоковая почка», развивается острая почечная недостаточность. Олигоанурия приводит к патологическим сдвигам водно-электролитного баланса, задержке шлаков в организме.
Определенная роль в поддержании ДВС-синдрома принадлежит печени. Нарушаются гликоген- и белоксинтезирующая ее функция, липидный обмен, повышается продукция молочной кислоты. Вследствие патологии спланхнологического кровотока образуются центрилобулярные некрозы.
Таким образом, расстройства гемодинамики, развитие и усугубление ДВС-синдрома в сочетании с токсическим действием инфекта приводят к несоответствию энергетических запасов органов и тканей возможностям доставки кислорода и энергетических субстратов. Развиваются глубокие метаболические нарушения, способствующие повреждению жизненно важных органов. В результате формирования «шоковых легких, печени, почек», развития сердечной недостаточности могут наступить гомеостатическое истощение и гибель организма. Процесс этот недлительный. Некротические изменения порой возникают через 6-8 ч от начала функциональных расстройств.
Клинические проявления септического шока зависят от типа инфекции, тяжести основного заболевания, продолжительности шокового
состояния и проводимых лечебных мероприятий. Предшествующие соматические заболевания, патология беременности, величина кровопотери и степень гидратации перед наступлением шока также оказывают влияние на его клиническое течение.
Большое значение имеют факторы, на фоне которых наиболее часто развивается септический шок. К ним относятся послеродовые и послеабортные инфекции, хориоамнионит, оперативные вмешательства на тазовых органах, пиелонефрит, септический эндокардит, мастит, диабет. Возможно возникновение септического шока при применении больших доз антибиотиков, способных вызвать распад массивного количества микроорганизмов и высвобождение эндотоксина.
Быстрота развития и тяжесть состояния больной являются отличительными особенностями септического шока. Функциональные и структурные повреждения клеток, тканей и органов вследствие гемодинамических нарушений происходят очень быстро, а иногда молниеносно.
Септический шок наступает остро, чаще всего после операций или манипуляций в очаге инфекции, создающих условия для «прорыва» микроорганизмов или их токсинов в кровеносное русло больной.
Наиболее характерные признаки токсического шока: высокая температура тела и озноб, причем внезапное изменение температуры тела чаще свидетельствует о возникновении шока; падение АД без предшествующей кровопотери или не соответствующее ей; выраженная тахикардия до 120-140 ударов в 1 минуту на фоне падения АД; шоковый индекс (отношение пульса к систолическому давлению) свыше 1 и часто более 1,5; теплая и сухая кожа с акроцианозом при гипердинамическом синдроме («теплая» гипотензия) или холодная и влажная кожа при гиподинамическом синдроме («холодная» гипотензия); олигурия или анурия; раннее появление выраженной одышки от 30 до 60 дыханий в 1 мин; начальный респираторный алкалоз, переходящий в метаболический ацидоз; нарушение свертывания крови (коагулопатия потребления) с возможным развитием геморрагического синдрома; иногда петехиальные кровоизлияния на коже лица и туловища; рано проявляющиеся нарушения со стороны ЦНС (эйфория, возбуждение, дезориентация, бред, галлюцинации, вялость, адинамия и др.); боли непостоянного характера различной локализации - в эпигастральной области, в нижних отделах живота, в конечностях, пояснице, грудной клетке, головные боли; нарушение функции печени. В случае присоединения печеночной недостаточности
кожа приобретает желтушный оттенок. Акроцианоз, петехиальная сыпь на груди, животе, на сгибательных поверхностях конечностей появляются в более поздние сроки.
Септический шок не всегда с самого начала проявляется ярко выраженными клиническими признаками: падением АД, уменьшением ОЦК или малым сердечным выбросом. Наблюдая больную с высокой температурой тела, можно отметить определенные продромальные симптомы, возникающие за несколько часов до наступления шока: значительное повышение температуры тела, тахикардию, учащение дыхания без озноба, резкую бледность и похолодание кожи, чувство тревоги и страха, реже возбуждение. Неврологические симптомы, наблюдаемые иногда задолго до гемодинамических нарушений, свидетельствуют об усилении интоксикации.
Динамика септического шока (его фазное развитие) определяется степенью нарушения важнейших функций организма. Согласно классификации шока по тяжести (исключая терминальные состояния), различают I, II и III его степени или соответственно легкий шок, шок средней тяжести и тяжелый.
При шоке легкой степени общее состояние близко к удовлетворительному, сознание сохранено. Больная малоконтактна. Кожа и слизистые бледные. Температура тела нормальная или несколько снижена. Реакция зрачков на свет сохранена. Пульс ритмичный, учащен. Одышка. Рефлексы ослаблены. Систолическое АД равно 100-90 мм рт.ст., диастолическое - около 60 мм рт.ст.
При шоке средней тяжести (II степени) сознание сохранено, но затуманено. Реакция зрачков на свет слабая. Кожа бледная, холодная. Взгляд неподвижен. Дыхание учащено, ослаблено. Пульс частый, слабого наполнения. Систолическое АД равно 85-75 мм рт.ст., диастолическое - около 50 мм рт.ст.
При тяжелой степени шока (III степень) сознание спутано. Реакции зрачков на свет нет. Пульс частый, нитевидный. Кожа бледная или цианотичная, липкий пот. Систолическое АД - 70 мм рт.ст. и ниже, диастолическое - около 30 мм рт.ст. Дыхание ослабленное или периоди-ческое.
В целях дополнительной оценки тяжести шока определяют отношение частоты пульса к величине систолического АД - «шоковый индекс» (индекс Альговера). В норме он равен 0,5-0,6, при шоке I степени - 0,7-0,8, II степени - 0,9-1,2, при шоке III степени - 1,3 и выше.
Клиническое течение септического шока независимо от грампринадлежности бактериальной флоры условно подразделяют на две фазы: раннюю, или «теплую», и позднюю, или «холодную».
Ранняя фаза характеризуется увеличением минутного и ударного объема сердца и снижением общего периферического сопротивления сосудов, что соответствует гипердинамическому синдрому. После сильного озноба с повышением температуры тела до 39-40 °С падает АД. В редких случаях лихорадка и озноб незначительны или отсутствуют. Снижение АД может быть резко выраженным (коллапс) или незначительным в течение 30 мин и более («теплая» гипотензия). В некоторых случаях АД остается нормальным («теплая» нормотензия). Наблюдается умеренная или выраженная тахикардия (140 и более ударов в 1 мин). Иногда появляются желудочковые экстрасистолы или мерцательная аритмия. Одновременно с наступлением гипотензии температура тела снижается до субфебрильных или нормальных величин. В некоторых случаях она продолжает снижаться до 35-34 °С. Кожа у таких больных теплая и сухая, гиперемирована, слизистые оболочки и ногтевые ложа цианотичны. Возникает мучительная боль в икроножных мышцах и мышцах спины, парестезия, кожная гиперестезия. Рвота - от однократной до неукротимой. Диурез не изменен. Отмечаются слуховые или зрительные галлюцинации, фотофобия, головная боль. Иногда обнаруживается ригидность мышц затылка. Сознание больных - от ясного до спутанного. Наблюдается возбуждение, реже адинамия, которая прогрессирует в последующие часы. Некоторые больные не предъявляют никаких жалоб, несмотря на значительное снижение АД. Ранняя стадия длится от нескольких минут до 1-2 сут, в среднем 5-8 ч. При грамотрицательной инфекции ее продолжительность значительно меньше. Иногда она остается незамеченной. В некоторых случаях кратковременность периода гипотензии и стертость клинических признаков приводят к запоздалой диагностике септического шока. Септический коллапс развивается не у всех больных, но является наряду с аритмией основной причиной смерти в ранней стадии процесса.
Поздняя стадия септического шока характеризуется генерализованным спазмом сосудов с нарушением микроциркуляции и органного кровотока, функциональными и структурными повреждениями отдельных органов. Минутный и ударный объем сердца уменьшен, общее периферическое сопротивление значительно повышено, причем в наибольшей степени у больных с шоком, вызванным грамотри-
цательными бактериями. Клинически это соответствует гиподинамическому синдрому («холодная» фаза септического шока). Происходит более резкое и выраженное падение АД (иногда ниже критических цифр). Тахикардия усиливается и может перейти в брадикардию. Температура снижена. Пульсовое давление малое. ЦВД повышается, что свидетельствует о развитии сердечной слабости (обычно смешанного типа). У 30% больных развивается отек легких. Дыхание частое, поверхностное. Кожа бледная, покрыта холодным липким потом, в области нижних конечностей и особенно коленных чашечек имеет мраморно-цианотичный рисунок. Развивается олигурия, которая прогрессирующе нарастает. У всех больных обнаруживается ДВСсиндром различной степени выраженности, вплоть до коагулопатии потребления. В некоторых случаях наблюдается желтушность кожи. Выраженная желтуха - прогностически неблагоприятный признак. Важная особенность состоит в том, что при септическом шоке не повышается фибринолитическая активность крови. Нарушение кровотока в надпочечниках и присоединение ДВС-синдрома способны вызвать двусторонний некроз коркового вещества или кровоизлияние в надпочечники (синдром Уотерхауза-Фридериксена). Наблюдавшиеся ранее возбуждение и беспокойство могут усиливаться и затем смениться адинамией и затемнением сознания. У некоторых больных наблюдается ригидность мышц затылка и симптомы раздражения менингеальных оболочек. Острые стрессовые язвы встречаются на фоне ДВС-синдрома в 25-50% случаев.
Неэффективность терапии и тяжесть повреждений органов в дальнейшем обусловливают развитие рефрактерной фазы шока и смерть больной. В прежние годы наибольшая смертность от септического шока наблюдалась в первые 24 ч, в настоящее время большинство больных переживают острый период, однако часть из них погибают через несколько дней в результате сочетанных осложнений или, что реже, от суперинфекции.
Септический шок имеет два типа течения. При первом типе вся клиническая картина может укладываться в относительно небольшой промежуток времени: все фазы шока развиваются в течение 12-24 ч. При втором типе септический шок протекает более длительно.
Диагноз шока не ставится на основании какого-либо одного признака. Только совокупность определенных симптомов помогает установить, а в ряде случаев только предположить наличие шока.
Септический шок представляет смертельную опасность для больной, поэтому важна его ранняя диагностика. Фактор времени при данном виде шока играет решающую роль, так как необратимые изменения в организме наступают рано: в пределах 6-12 ч.
Диагноз ставится главным образом на основании следующих клинических проявлений: наличие септического очага в организме; высокая лихорадка с частыми ознобами, сменяющаяся резким снижением температуры тела; падение АД, не соответствующее кровопотере; тахикардия; тахипноэ; расстройство сознания; боли в животе, грудной клетке, конечностях, пояснице, головная боль; снижение диуреза вплоть до анурии; петехиальная сыпь, некроз участков кожи; несоответствие незначительных местных изменений в очаге инфекции тяжести общего состояния больной.
Клиническая картина септического шока неотделима от развития ДВС-синдрома. Несомненным клиническим признаком последнего являются кровоточивость в одном или нескольких местах (в месте укола, из матки, из поврежденных при операции тканей), наличие пурпуры, кровоподтеков, глубокие нарушения микроциркуляции в органах и тканях, приводящие к поражению легких, почек, печени, мозга, кожных покровов и др. Точная диагностика ДВС-синдрома возможна при своевременной лабораторной оценке системы гемостаза. Это выполняется по возможности быстро и на основании полученных данных проводится коррекция, медикаментозная терапия и определяется тактика ведения больной. Методы исследования, дающие результаты через 12-24 ч, не имеют практической ценности.
Для особого наблюдения следует выделять больных с высокой степенью риска развития септического шока. К таким больным относятся беременные, роженицы и родильницы, у которых имеет место острое проявление инфекции: быстрое развитие выраженной температурной реакции, наличие повторяющихся ознобов, патологических симптомов со стороны ЦНС и рвоты. В этой группе больных наряду с лечением основного заболевания необходимо тщательно и регулярно проводить: измерение АД и подсчет пульса каждые 30 мин; измерение температуры тела каждые 3 ч; определение почасового диуреза; бактериоскопическое и бактериологическое исследование отделяемого из очага поражения для идентификации возбудителя и определения его чувствительности к антибиотикам (при выявлении грамотрицательной флоры велика опасность развития септического шока); клинический анализ крови с обяза-
тельным подсчетом числа тромбоцитов; исследование коагулограммы для выявления ДВС-синдрома, его формы (острая, хроническая) и фазы (гиперкоагуляция, коагулопатия потребления).
Состояние системы гемостаза позволяет оценить время свертывания крови. Важен контроль за динамикой содержания фибриногена и тромбоцитов. Снижение их концентрации прогностически неблагоприятно, поскольку отражает процесс их утилизации во время внутрисосудистого свертывания крови. Тесты с этанолом и протамина сульфатом характеризуют уровень растворимого фибрина в крови и могут быть использованы для скрининга оценки степени выраженности ДВС-синдрома.
Из биохимических исследований важны определение уровня электролитов и мочевины в сыворотке крови, содержания лактата в артериальной крови, величины рН и изучение кислотно-основного гомеокинеза.
В развитии септического шока выделяют четыре стадии изменений на тканевом уровне:
I - гемодинамическая (стадия обратимых изменений), характеризуется изменением тонуса сосудов и кровенаполнения;
II - стадия гемореологических нарушений, характеризуется стазом и сладжированием эритроцитов, изменением стенок микрососудов;
III - ДВС-синдром (декомпенсированный шок);
IV - стадия органных нарушений.
В легких наблюдаются следующие изменения: полнокровие, агрегация и сладж эритроцитов в межальвеолярных капиллярах и венулах; интерстициальный отек междольковой, периваскулярной и перибронхиальной тканей без распространения на альвеолы; скопления сидерофагов в субплевральных и внутриальвеолярных периваскулярных кровоизлияниях; множественные эритроцитарные, глобулярные, реже фибриновые микротромбы; мегакариоцитарная и жировая эмболия. Наряду с циркуляторными расстройствами в легких постоянно встречаются мелкоочаговые ателектазы, «гиалиновые мембраны».
Патогномоничным для септического шока является распространенный тромбоз капилляров с последующим кортикальным некрозом почек. Нарушение микроциркуляции в почках связано с закупоркой сосудов микроциркуляции и последующим шунтированием почечного кровотока.
Для септического шока характерны кровоизлияния и очаги некроза в передней доле гипофиза, диэнцефальной области, корковом веществе надпочечников. Спазм и микротромбоз в сосудах кишечника и желудка
приводят к образованию эрозий и язв слизистой оболочки, а в тяжелых случаях - к псевдомембранозному энтероколиту.
Лечение септического шока должно носить срочный характер. Если в течение нескольких часов шок ликвидировать не удается, то в более поздний период сделать это почти невозможно. Интенсивная терапия осуществляется акушером-гинекологом совместно с реаниматологом, а при необходимости с нефрологом, урологом и гематологом-коагулологом.
Многообразие патофизиологических сдвигов обусловливает многоплановость лечения септического шока, которое проводится комплексно и направлено на купирование микроциркуляторных изменений и восстановление эффективного объема циркулирующей крови и адекватной перфузии в жизненно важных органах; интенсивную терапию заболевания, на фоне которого развился септический шок (борьба с инфекцией и ликвидация ее очагов); коррекцию метаболических нарушений. Так как септический шок может осложнять течение различных заболеваний, его лечение должно быть индивидуальным для каждой конкретной больной.
Лечебные мероприятия проводят при постоянном наблюдении за температурой тела, состоянием кожных покровов, частотой дыхания и пульса, показателями АД и ЦВД, гематокрита, ЭКГ, почасовым диурезом, кислотно-основным и электролитным составом плазмы, протеинограммой, содержанием азотистых шлаков и билирубина в крови, коагулограммой. Желательно определять ОЦК и величину сердечного выброса.
Основными неотложными мероприятиями при септическом шоке являются внутривенная катетеризация для немедленного проведения инфузионной терапии, введение носового или эндотрахеального катетера для тщательного туалета трахеобронхиального дерева, катетеризация мочевого пузыря для контроля за диурезом.
Важнейший компонент реанимации при септическом шоке - инфузионная терапия. Ее цель - восполнение ОЦК, нормализация реологических свойств крови, микроциркуляции, дезинтоксикация и коррекция метаболических нарушений. В качестве инфузионных сред на первых этапах лечения используют производные крахмала, декстраны. Эти препараты улучшают реологические свойства крови и микроциркуляцию, повышают ОЦК за счет привлечения межтканевой жидкости, адсорбируют и выводят из организма токсины. Суточный объем инфузии зависит главным образом от дефицита ОЦК и потери жидкости организмом. Гиперволемия не менее, если не более, опасна, чем гиповоле-
мия, в связи с большой ее ролью в развитии интерстициального отека легких и синдрома «шокового легкого». Передозировка крупномолекулярных декстранов может привести к блокированию ретикулоэндотелиальной системы, низкомолекулярных декстранов - вызвать осмотический нефроз.
В профилактике и лечении «шокового легкого» для устранения интерстициального отека большое значение имеет повышение коллоидноосмотического давления крови. С этой целью проводят инфузии белковых препаратов: 400 мл 5-10% раствора альбумина, 500 мл протеина. Эффективно переливание свежезамороженной плазмы, которая, кроме поддержания осмотического давления и восстановления ОЦК, способствует ликвидации диспротеинемии и восстановлению свертывающей системы крови.
Использование концентрированных растворов глюкозы в количестве 300-500 мл с адекватными дозами инсулина (на каждые 4 г глюкозы - 1 ЕД инсулина) оказывает осмодиуретическое действие и восстанавливает энергетические затраты.
Если септический шок сочетается с кровотечением, то объем гемотрансфузии должен соответствовать степени кровопотери. Гемотрансфузия осуществляется параллельно с вливанием реологически активных плазмозаменителей или кристаллоидных растворов в режиме гемодилюции.
Скорость проведения и объем инфузионной терапии зависят от ее эффективности и реакции организма больной. При шоке I степени общий объем инфузии составляет 1000-1500 мл; при шоке II степени - 2000-2500 мл; при шоке III степени - 3500-5000 мл. Скорость проведения инфузионной терапии при септическом шоке I степени - 200 мл жидкости в 1 ч, затем медленнее; при шоке II степени - 350 мл в 1 ч, при III степени - 500-600 мл в 1 ч.
Объем коллоидных плазмозамещающих растворов не должен превышать 1/4 общего объема инфузий, остальная часть приходится на кристаллоиды. Для улучшения реологических свойств крови используют гемодилюцию, при этом гематокритное число не должно превышать 30%. О ликвидации гиповолемии, восстановлении ОЦК судят по улучшению окраски кожи, нормализации ЦВД (50-100 мм вод. ст.), почасовому диурезу более 30 мл/ч без применения диуретиков и 60-100 мл при форсированном диурезе, а также по величине ОЦК и сердечного выброса. ЦВД свыше 150 мм вод. ст. свидетельствует об избыточной инфузии. Значе-
ния АД при септическом шоке могут длительное время оставаться относительно низкими. Если АД не ниже 90 мм рт. ст. при нормализации микроциркуляции, то нет необходимости форсировать его подъем.
На фоне восполнения ОЦК и улучшения реологических свойств крови для коррекции гемодинамики и восстановления тканевого кровотока необходимо обязательное применение сердечных и вазоактивных средств. Внутривенно вместе с 20 мл 40% раствора глюкозы вводят 0,5-1 мл 0,06% раствора коргликона или 0,5-1 мл 0,05% раствора строфантина либо 1-2 мл 0,02% раствора изоланида. После ликвидации гиповолемии используют 0,5% раствор курантила, который из-за возможного понижения системного АД следует вводить медленно в количестве 2-4 мл. Курантил расширяет коронарные сосуды, повышает толерантность миокарда к гипоксии, тормозит агрегацию тромбоцитов.
В «холодной» гипотензивной фазе, когда выражена периферическая вазоконстрикция, показаны сосудорасширяющие средства. Их назначают (после восполнения ОЦК при обязательном контроле АД) в дозах: 10 мл 2,4% раствора эуфиллина, 2 мл 2 % раствора папаверина, 2-4 мл 2% раствора но-шпы. Применение их также целесообразно при возникновении острой левожелудочковой слабости с развитием отека легких.
β-адреномиметики не нашли широкого применения при выведении больных из состояния септического шока. β-адреноблокаторы ввиду отрицательного ино- и хронотропного их влияния на сердце используются ограниченно, а классический α-стимулятор норадреналин - в исключительных случаях, так как он, повышая АД, значительно увеличивает периферическое сопротивление, что ухудшает работу сердца и усиливает спазм сосудов почек. Перед назначением вазоактивных препаратов должен быть откорректирован метаболический ацидоз, так как на его фоне их активность значительно снижается.
Ликвидации метаболического ацидоза способствует внутривенное капельное введение 3% раствора гидрокарбоната натрия под контролем показателей кислотно-основного состояния крови. Нарушение обмена электролитов, в основном натрий-калиевого баланса, компенсируется введением раствора хлорида кальция (антагонист калия) и хлорида натрия. Коррекция ионного баланса проводится под контролем содержания К, Na+ и хлоридов крови.
Для выведения больной из состояния шока эффективно использование высоких доз кортикостероидов. Одномоментно вводят до 500 мг гидрокортизона или до 120 мг преднизолона либо до 16 мг дексаметазо-
на. Через 2-3-4 ч введение препарата повторяют. Такие дозировки применяют в течение 1-2 дней, поэтому не следует опасаться отрицательного влияния кортикостероидов на функциональную активность надпочечников и иммунные свойства организма. Глюкокортикоиды оптимизируют деятельность сердца, улучшают микроциркуляцию, снижают поступление тканевого тромбопластина, предупреждают нарастание агрегации тромбоцитов, ослабляют действие эндотоксина, стимулируют активность ферментов, участвующих в окислительных процессах, повышают толерантность клеток к недостатку кислорода, способствуют стабилизации мембран, предупреждают развитие «шокового легкого», дают антигистаминный эффект. Отсутствие воздействия значительных доз глюкокортикоидов свидетельствует о далеко зашедших необратимых изменениях в жизненно важных органах и является плохим прогностическим признаком.
Для коррекции нарушений реологических свойств крови широко используют гепарин и его низкомолекулярные аналоги. Несмотря на все положительные свойства препарата, в том числе способность повышать устойчивость организма к тканевой гипоксии и действию бактериальных токсинов, данный антикоагулянт назначается сугубо индивидуально. Как правило, гепаринизацию осуществляют тогда, когда имеется коагулопатия потребления - тромбоцитопения, снижение количества фибриногена, факторов V, VIII, XIII, а также появление в циркуляции продуктов распада фибриногена. Доза гепарина зависит от показателей свертывания крови и обычно не превышает 30 000 ЕД/сут; время коагуляции при этом не должно превышать 15-20 мин.
При септическом шоке быстро развивается метаболический ацидоз. Для его коррекции в состав инфузионной терапии необходимо включать лактасол, рингер-лактат или 4-5% раствор бикарбоната натрия. Количество раствора определяется в зависимости от дефицита оснований (ВЕ).
Септический шок быстро приводит к электролитному дисбалансу. В первые сутки лечения необходимо корригировать недостаток в плазме ионов К , Na+, Ca+, Mg2+. Лечение проводят под контролем лабораторных данных. При этом используют 10-20 мл панангина или 50 мл 4% раствора калия хлорида с 400-500 мл изотонического раствора глюкозы; 10 мл 10% раствора или 100 мл 1% раствора кальция хлорида. Эффективно применение энергетического полиионного раствора следующего состава: к 1 л 25% раствора глюкозы добавляют 3 г калия хлорида, 0,8 г кальция хлорида и 0,4 г магния хлорида. Необходимость в дальней-
шем введении электролитных растворов должна подтверждаться лабораторными данными. Особую осторожность следует проявлять при наличии признаков острой почечной недостаточности
Парентеральное питание обеспечивают применением высококалорийных инфузионных сред, препаратов белков и аминокислот. В сутки больная должна получать не менее 4000 ккал.
Для улучшения окислительно-восстановительных процессов используют растворы глюкозы с адекватным количеством инсулина и витаминами: 1-2 мл 6% раствора витамина В1, 1-2 мл 5% раствора витамина В6, 400-500 мкг витамина B12, 100-200 мг кокарбоксилазы, 5-10 мл 5% раствора аскорбиновой кислоты. Для улучшения функции печени показан холина хлорид в количестве 200 мл в виде 1% раствора, 10-20 мл эссенциале. С целью активизации метаболических процессов внутримышечно применяют ретаболил по 50 мг каждые 3-4 дня или неробол по 5 мг 3-4 раза в сутки.
В улучшении функции паренхиматозных органов и тканевого метаболизма важную роль играют ингибиторы протеолитических ферментов (трасилол, контрикал, гордокс), поскольку они подавляют клеточные протеазы, оказывающие повреждающее действие при шоковых состояниях; дают антитромбопластиновый эффект, который заключается в подавлении контактного активирования при повреждении эндотелия сосудов; улучшают перфузию за счет регуляции сосудистой проницаемости. Их нужно назначать как можно раньше с профилактической и лечебной целью.
Из десенсибилизирующих препаратов можно применять димедрол (1-2 мл 1% раствора), пипольфен (1-2 мл 2,5% раствора), супрастин (1-2 мл 2% раствора). Однако все они тормозят фагоцитарную активность и образование антител. Поэтому предпочтение следует отдавать глюконату кальция, который вводят по 50 мг 3-4 раза в сутки.
На фоне гиперкапнии, гипокалиемии, нарушений ритма сердца и применения сердечных гликозидов нельзя назначать эуфиллин и препараты кальция, так как их быстрое внутривенное введение может вызвать повышение возбудимости миокарда и возникновение фибрилляции. Обязательна для всех больных оксигенотерапия. Введение кислорода необходимо начинать с первых минут лечения, используя для этого любой из имеющихся способов. Абсолютным показанием к ИВЛ является падение парциального давления кислорода (Ро2) ниже 60-70 мм рт. ст. при ингаляции 100% кислорода через маску.
Одна из составных частей комплекса лечения - антибиотикотерапия. Рекомендуются высокие начальные дозы антибиотиков для быстрого достижения их соответствующей концентрации в крови. Поскольку в начале лечения инфекционный агент, вызвавший септический шок, неизвестен, назначают 2-3 антибиотика с учетом их действия не только на грамположительную и грамотрицательную, но и на анаэробную флору. Не менее двух антибиотиков вводят внутривенно, перфузии продолжительны. Доза препаратов должна быть скорригирована в зависимости от функционального состояния почек. При нормальном и высоком диурезе употребляют максимальные количества антибиотиков.
Хороший эффект дает назначение антибиотиков группы цефалоспоринов (до 6 г) с гентамицина сульфатом (до 160 мг) или канамицина сульфатом (до 10 г). Не менее эффективно назначение больших доз оксациллина натриевой соли (до 6 г в сутки) с одним из аминогликозидов (мономицином), а также сочетание ампициллина (4-6 г в сутки) с гентамицина сульфатом (240 мг) или с канамицином (2 г в сутки). Одновременно применяют метронидазол (200-400 мг). При использовании цефалоспоринов широкого спектра действия - цефуроксима (по 0,75 г 3 раза в сутки) или клафорана (по 1 г 3 раза в сутки) - две дозы вводят внутривенно, а одну - внутримышечно. Цефалоспорины чаще комбинируют с гентамицина сульфатом (по 160-240 мг в сутки внутримышечно). В течение 4-5 сут назначают препараты с анаэробным действием (метрагил), после чего в течение 3-4 дней перорально вводят метронидазол (по 0,5 г 3 раза в сутки). Антибиотиками резерва являются защищенные пенициллины (аугментин), карбапенемы, фторхинолоны.
При назначении больших доз антибиотиков и сульфаниламидов вследствие гибели микробов усиливается интоксикация и может развиться коллапс. Поэтому в таких случаях необходимо проводить дезинтоксикационную терапию и следить за диурезом
Если внутримышечное и внутривенное введение лекарственных препаратов оказывается малоэффективным, их вводят внутриартериально, чтобы они поступали прямо к очагу воспаления. Хорошо зарекомендовала себя эндолимфатическая и внутрикостная антибиотикотерапия.
Улучшению обменных и стимуляции регенеративных процессов способствует применение экстракорпорального УФО крови больных, экстракорпоральной гемосорбции, гипербарической оксигенации, плазмафереза и др.
Борьба с инфекцией включает в себя ликвидацию ее очага. Наиболее радикальный способ ликвидации - удаление основного очага инфекции, т.е. матки, опорожнение гнойников и их широкое дренирование. Для получения желаемого эффекта важна своевременность хирургического вмешательства. Оно должно быть последовательным этапом в лечении больных с септическим шоком, а не крайней мерой или операцией отчаяния. По мнению большинства отечественных и зарубежных авторов, к операции следует прибегать при безуспешности интенсивной консервативной терапии, проводимой в течение 4-6 ч, а в некоторых случаях - сразу же после купирования явлений сосудистого коллапса. Хирургическое вмешательство выполняется независимо от состояния больной, и чем раньше, тем лучше отдаленные результаты. Отсрочка операции на 24 ч в большинстве случаев приводит к летальному исходу. Промедление с радикальным удалением септического очага может стоить жизни пациентке.
Операцией выбора считается экстирпация матки с удалением маточных труб, дренирование параметриев и брюшной полости. В отдельных случаях у больных, находящихся в крайне тяжелом состоянии, при отсутствии макроскопически выраженных изменений в тканях матки допустима надвлагалищная ее ампутация. Удаление маточных труб и дренирование брюшной полости обязательны во всех случаях. Хирургическое удаление очагов инфекции любой локализации у больных септическим шоком должно производиться быстро и технически правильно. Перед операцией необходимо устранить дефицит ОЦК, провести коррекцию водно-электролитных нарушений и кислотно-основного состояния. Гипертермию устраняют с помощью фармакологических и физических средств. Премедикацию подбирают в соответствии с состоянием больной. Количество наркотических средств рассчитывают индивидуально во избежание чрезмерного углубления наркоза.
Лечение септического шока при гестационном пиелонефрите начинается с создания лучших условий для пассажа мочи путем катетеризации мочеточников. При редко встречающихся случаях апостематозного пиелонефрита или карбункула почки операция осуществляется урологом: от декапсуляции, вскрытия и дренирования абсцессов до нефрэктомии.
Если септический шок возникает в результате перитонита, то после удаления матки, дренирования брюшной полости и декомпрессии кишечника показан перитонеальный диализ.
Дефицит определенных звеньев иммунной системы является критерием выбора иммунных препаратов, а показатели иммунного ответа - критерием их эффективности. Положительный результат наблюдается при использовании антистафилококкового гамма-глобулина и гипериммунной антистафилококковой плазмы.
Критерии эффективности комплексной терапии септического шока - улучшение сознания больной, исчезновение цианоза, потепление и розовая окраска кожных покровов, уменьшение тахикардии и одышки, нормализация ЦВД и АД, увеличение диуреза, ликвидация тромбоцитопении и нормализация свертывающей системы крови. Целенаправленная антибактериальная, дезинтоксикационная и гемостимулируюшая терапия, восполнение энергетических ресурсов и повышение собственных защитных сил организма, нормализация кислотно-основного состояния и электролитного гомеостаза должны продолжаться до полной ликвидации инфекционного процесса. После выписки из стационара больная в течение 5 лет нуждается в диспансерном наблюдении с целью своевременного выявления и лечения возможных отдаленных последствий перенесенного септического шока: хронической почечной недостаточности, синдрома Шихана, диэнцефального синдрома по типу Иценко-Кушинга, диабета, синдрома Уотерхауса-Фридериксена.
сепсис
Сепсис (греч. sepsis - гниение) - общее неспецифическое инфекционное заболевание, возникающее в условиях нарушенной реактивности организма при постоянном или периодическом поступлении из очага инфекции микроорганизмов и их токсинов в кровеносное русло с образованием в ряде случаев гнойных метастазов. Сепсис не сопровождается какими-либо специфическими изменениями, однако наблюдается комплекс нарушений, сочетание которых характерно для этого заболевания. Оно протекает с изменением реактивности организма, которая приобретает аллергический характер.
С патогенетической точки зрения сепсис представляет собой сложный комплекс клинических и патологоанатомических явлений, кото-
рые обусловлены: реактивными свойствами макроорганизма; характером возбудителя инфекции; состоянием септического очага. Важную роль в возникновении заболевания играют состояние макроорганизма, его иммунной системы, эндокринного статуса, возрастные особенности и др. Физиологический транзиторный иммунодефицит у женщин во время беременности и в ранние сроки после родов, связанный с вынашиванием плода, обусловливает повышенную их чувствительность к бактериальной инфекции.
Чаще всего послеродовые гнойно-септические заболевания вызваны золотистым стафилококком, несколько реже - грамотрицательной микрофлорой, еще немного реже - анаэробными бактериями и стрептококками. В 1/3 случаев сепсис обусловлен микробными ассоциациями, в первую очередь сочетанием стафилококка или стрептококка с кишечной палочкой. В последнее время все в большем числе случаев причиной сепсиса становится грамотрицательная аэробная (кишечная палочка) и анаэробная (бактероиды, пептококки, пептострептококки и др.) микрофлора - за счет госпитальных штаммов микроорганизмов.
Сепсис всегда является вторичным процессом. В его возникновении существенную роль играет первичный очаг инфекции (как правило, послеродовая или послеабортная матка) и первичное заболевание - эндометрит. В некоторых случаях сепсис развивается, минуя стадию эндометрита, на фоне перитонита или после гнойного мастита. Формирование сепсиса связано с проникновением микробов и их токсинов в кровяное русло (непосредственно или через лимфатические пути). Из первичного септического очага микробы перманентно или периодически поступают в кровь, обусловливая бактериемию. Наличие первичного очага сопряжено с сенсибилизацией организма и изменением его реактивности.
Фазами единого септического процесса, нередко переходящими одна в другую, являются септицемия (сепсис без гнойных метастазов), септикопиемия (сепсис с метастазами) и смешанная форма сепсиса.
Септицемией называют наличие в кровеносном русле и во всем организме бактерий и их токсинов, которые в течение длительного времени периодически (волнообразно) поступают в общий кровоток из раны или из нарушенных зон микроциркуляции, где резко замедлен кровоток.
Септикопиемия - преимущественно токсическая фаза сепсиса, в основе которой лежит интоксикация организма микробными токсинами, продуктами распада микробных тел и пораженных тканей.
К наиболее частым возбудителям сепсиса у человека имеется достаточно высокий иммунитет, закрепленный в филогенезе и созревающий в онтогенезе. Поэтому в подавляющем большинстве случаев попавшие в кровь микроорганизмы не вызывают гнойной инфекции. Прорыву иммунитета может способствовать ряд причин. Основная из них - массивная микробная обсемененность очага. Очаг с критическим уровнем инфекта - мощный источник сенсибилизации и интоксикации организма. Важное значение имеет вирулентность возбудителя, склонность к генерализации инфекционного процесса. Возбудители циклических инфекций не вызывают сепсиса (микобактерии, бледные спирохеты). Сепсис, вызванный стафилококком, обладающим способностью свертывать фибрин и оседать в тканях, часто сопровождается образованием гнойных метастатических очагов. Стрептококк, наделенный фибринолитической активностью, редко приводит к метастазированию. Сепсис, вызванный грамположительной флорой, чаще сопровождается возникновением гнойных метастазов, дает меньшую летальность, чем вызванный грамотрицательной флорой, при которой более выражена интоксикация. Скорость развития и тяжесть процесса зависят также от диссеминации микрофлоры из очага. При гематогенном распространении в кровеносное русло проникает одномоментно большое число бактерий и их токсинов. При лимфогенной диссеминации часть бактерий и продуктов их жизнедеятельности задерживается в лимфатических узлах.
Наконец, наиболее существенным фактором является реактивность организма. Интоксикация продуктами жизнедеятельности возбудителя и веществами, образующимися в результате ферментативного распада и нарушения метаболизма тканей, способствует формированию патологической реактивности организма.
Характер иммунной защиты определяет тип реакции организма при сепсисе: нормергический - преобладают явления воспаления; гиперергический - бурное острое начало с преобладанием деструктивно-дегенеративных изменений; анергический - характерно вялое течение.
Иммунодефицитное состояние может иметь место до появления первичного септического очага или образоваться вследствие интоксикации и бактериальной агрессии из очага. По мере развития инфекционная аллергическая реакция утрачивает свою специфичность и становится полиаллергической; ее вызывает любой аллерген, в том числе лекарственное средство. При понижении (гипергия) или отсутствии
(анергия) реактивности организма возникает иммунологическая толерантность к возбудителю. При таких состояниях даже незначительная инвазия микробов и их токсинов обусловливает сепсис и приводит к смертельному исходу вследствие беспрепятственного размножения возбудителя.
Гибель большого числа лейкоцитов в очаге воспаления и в крови приводит к повышенному образованию протеаз. Из-за гиперферментемии происходит общая интоксикация организма. Протеолитические ферменты высокой активности могут вызывать очаговый некроз различных органов и тканей. Участки некроза, обсеменяясь микробами и распадаясь, превращаются в метастатические гнойные очаги. Активизация общего протеолиза ведет к активизации свертывающей и фибринолитической систем крови с возникновением вторичного фибринолиза и ДВС-синдрома, что способствует генерализации гнойного процесса. Часто возбудители сепсиса депонируются в микроциркуляторном русле, обусловливая образование множественных очагов инфекции и формируя нарушение микроциркуляции с ухудшением реологических свойств крови. В результате активируются катаболические процессы, угнетается белоксинтетическая функция печени, что приводит к гипопротеинемии, снижению, угнетению иммунологической защиты и репаративных процессов.
Нарушения энергетического и электролитного обмена выражаются в гиперкатаболизме с развитием метаболического ацидоза. Глубокие изменения претерпевает углеводный обмен. Снижается толерантность к глюкозе и возникает резистентность к инсулину, что проявляется относительной инсулиновой недостаточностью и гипергликемией.
Интоксикация обусловливает нарушение сердечной деятельности. Поражаются легочная паренхима и система сурфактанта. Развивается сердечная и дыхательная недостаточность, приводящая к тяжелой гипоксии. Почки перестают справляться с элиминацией бактериальных токсинов, продуктов дезинтеграции тканей и нарушенного метаболизма. Расстраивается реабсорбционная способность почек. Повышается потеря воды и солей. Развиваются тяжелые нарушения водно-электролитного баланса и почечная недостаточность. У большинства больных обнаруживаются признаки инфекционного или иммунного гломерулонефрита, острого интерстициального нефрита, вплоть до гнойного пиелонефрита.
Акушерско-гинекологический сепсис может развиться при занесении микробов из окружающей среды (в основном госпитальных штаммов) или вследствие активизации собственной патогенной или условно-патогенной микрофлоры. Послеродовый и послеабортный сепсис преимущественно раневой.
Первичный септический очаг в большинстве случаев локализуется в матке, внутри которой после родов и абортов образуется обширная раневая поверхность. Плацентарная площадка снабжена многочисленными кровеносными и лимфатическими сосудами. При кесаревом сечении очаг инфекции порой образуется в месте рассечения матки и передней брюшной стенки. Септический очаг способен сформироваться вследствие инфицирования разрывов мягких тканей родовых путей. Сепсис экзогенного происхождения нередко развивается при послеродовых гнойно-септических заболеваниях, которые в свою очередь могут возникать при попадании микрофлоры из внегенитальных очагов (при гнойном отите, фарингите, аппендиците и др.).
К факторам, способствующим развитию акушерского сепсиса, относятся: эндокринные заболевания; кольпит; экстрагенитальные очаги инфекции; гестоз; кровотечения во время беременности, в родах и в послеродовом периоде; сахарный диабет; ожирение; амниотомия; амниоцентез; хирургическая коррекция истмико-цервикальной недостаточности; преждевременное излитие околоплодных вод; длительный безводный период; затяжные роды; многократные влагалищные исследования; акушерские операции; родовые травмы; задержка частей последа в матке; субинволюция матки и лохиометра в послеродовом периоде и др.
По клиническому течению заболевания различают молниеносный, острый, подострый, хронический и рецидивирующий сепсис. Как особая форма хронического сепсиса выделяется sepsis lenta.
По бактериологическому признаку различают сепсис: стафилококковый, стрептококковый, гонококковый, колибациллярный, псевдомонозный, анаэробный, грибковый, смешанный и др. По источнику инфекции выделяют следующие виды сепсиса: раневой, при внутренних болезнях (ангина, пневмония, мастит), послеоперационный и криптогенный. По локализации первичного очага сепсис может быть гинекологическим, урологическим, отогенным и др.
По времени развития сепсис бывает ранним, развившимся до истечения 10-14 дней с момента повреждения, и поздним, развившимся
позже 2 нед с момента повреждения. Наконец, по характеру реакции организма могут быть нормергическая, гиперергическая и анергическая формы сепсиса.
Специфических патогномоничных симптомов при сепсисе нет. В ряде случаев гнойная инфекция дает клиническую картину, близкую к таковой при сепсисе. Клиническая картина определяется в основном тремя моментами: клиническим течением сепсиса (молниеносный, острый, хронический, рецидивирующий, с метастазами, без метастазов); прогрессирующей декомпенсацией функции всех органов и систем; комплексом симптомов в результате нарушения этих функций.
При молниеносном сепсисе заболевание развивается бурно, приводя к появлению комплекса симптомов буквально за несколько часов, максимум через 1-2 дня. При остром сепсисе требуется несколько дней для развертывания полной картины общей гнойной инфекции. При подострой форме симптоматика не бывает яркой, процесс идет медленно, несколько недель.
Хрониосепсис характеризуется вялым течением и наличием малозаметных изменений, которые наблюдаются месяцами. Рецидивирующий сепсис отличается сменой периодов обострений, когда вся симптоматика ярко выражена, и периодов ремиссий, когда нет сколько-нибудь заметной клинической картины. Sepsis lenta - хроническая форма стрептококкового сепсиса, протекает обычно в форме рецидивирующей болезни с повторными волнами метастазирования. Сепсис с метастазами характеризуется развитием множества гнойников в различных тканях и органах, что сопровождается обострением симптоматики. Сепсис без метастазов обычно проявляется более тяжело и стабильно. При этой форме не наблюдается ремиссий и вся симптоматика резко выражена.
Сепсис после родов или абортов протекает в виде септицемии или (в последнее время чаще) септикопиемии. Сепсис может развиваться молниеносно или иметь длительное течение. Многие клиницисты сепсис с молниеносным течением рассматривают как септический шок.
Клиническая картина септицемии характеризуется ранним началом (на 2-3-и сутки после родов). Септикопиемия чаще всего развивается как следующий этап генерализации инфекции. Сепсис с метастазами формируется, как правило, после периода первичного инфицирования (первичного очага) и септицемии; а затем наступает септикопиемия, чаще - на 10-17-й день после родов. Степень выраженности отдельных
симптомов, характерных для сепсиса, различна. В то же время симптомы всех его форм и фаз почти одинаковы. Они делятся на общие и местные, относящиеся к проявлениям со стороны первичного очага.
Наиболее частыми признаками нарушения деятельности нервной системы являются головная боль, раздражительность, бессонница, угнетение нервной системы, помрачение или даже потеря (в тяжелых случаях) сознания. Постоянно повышена температура, которая при сепсисе без метастазов обычно держится в пределах 39-41 °С, а с метастазами колеблется более значительно. Важный симптом - сильные ознобы и проливные поты. Характерно снижение массы тела, прогрессирующее ухудшение общего состояния на фоне неадекватного лечения. Иногда наблюдаются геморрагическая сыпь на коже, бледность кожных покровов с желтушным оттенком, цианоз губ и ногтей.
Со стороны сердечно-сосудистой системы обычно отмечаются: резкое учащение пульса (120-130 ударов в мин), уменьшение его наполнения; снижение артериального и венозного давления; ухудшение сердечной деятельности; повышение ЦВД; признаки перегрузки правых отделов сердца на ЭКГ; трофические и сосудистые расстройства (пролежни, тромбофлебиты, отеки, тромбозы). Быстро прогрессирует анемия, значительно увеличивается СОЭ (до 40-65 мм/ч), нарастает лейкоцитоз, имеют место сдвиг лейкоцитарной формулы влево, резкое уменьшение лимфоцитов, снижение тромбина в крови до 45-50%, а у ряда больных - лейкопения, бактериемия. Заметно страдают функции паренхиматозных органов. Нарушается функция почек. Снижается относительная плотность мочи, в осадке появляются белок и форменные элементы. Дыхание ослаблено, тахипноэ (26-30 дыханий в 1 мин). Расстраивается функция печени, нередко с развитием желтухи и явлениями гепатита, обнаруживается спленомегалия. Характерны ухудшение или отсутствие аппетита, сухой обложенный язык, упорные септические поносы, тошнота, рвота.
В последнее время клиническая картина септицемии неоднородна. Она характеризуется наличием выраженной интоксикации с тахикардией и гипотензией, обменными нарушениями. Наряду со стойким повышением температуры тела до 39-41 °С и частыми ознобами наблюдаются клинические формы с постепенным повышением температуры, единичными приступами озноба, значительными перепадами температуры тела в течение суток. Для больных септицемией свойственно относительно быстрое снижение температуры тела и
улучшение общего состояния на фоне интенсивной адекватной комплексной терапии.
Наиболее важными клиническими признаками септикопиемии являются: одновременное множественное поражение ряда органов и систем; наличие у больных нескольких гнойных очагов; высокая степень интоксикации; длительное упорное течение заболевания.
Септикопиемия характеризуется более поздним началом, тяжелыми проявлениями интоксикации, чередованием ухудшения состояния с короткими ремиссиями. Наряду с общей интоксикацией имеет место синдром полиорганной и полисистемной недостаточности (матка, легкие, печень, почки, сердце, мозговые оболочки, мозг). Множественность поражения - наиболее характерное проявление септикопиемии. При развитии новых гнойных метастазов отмечается ухудшение гемограммы, при ремиссии процесса - улучшение показателей крови.
Сепсис вызывает резкие метаболические нарушения и изменяет динамические связи, регулирующие метаболизм в мышцах, печени, жировой ткани, что формирует синдром полиорганной полисистемной недостаточности. По тяжести этого синдрома можно судить о степени компенсации процесса у конкретной больной в данный момент времени. Выделяют ряд вариантов патофизиологического состояния синдрома.
Состояние А - нормальный стрессовый ответ, наблюдаемый при компенсированном сепсисе: увеличивается ЧСС, сердечный индекс более 4 л/мин, повышается индекс потребления кислорода. Это симпатический адаптационный ответ. Метаболических нарушений нет. Дыхательная недостаточность выражена минимально.
Состояние В характеризуется симпатической адаптацией и гипердинамическим ответом (повышение частоты сердечных сокращений и сердечного индекса), которые уже не способны удовлетворить потребности периферических тканей. Потребление кислорода снижается, уменьшается артериовенозная разница по кислороду, возникает метаболический ацидоз. Развиваются компенсаторная одышка и респираторный алкалоз.
При состоянии С появляется дыхательная недостаточность, организм уже не может самостоятельно регулировать метаболические процессы, вследствие чего возникает респираторный ацидоз. Наконец, при состоянии D формируется первичная сердечная недостаточность со снижением сердечного индекса, артериальной гипотонией и ацидозом.
Высокий сердечный выброс отражает симпатическую адаптацию к снижению общего периферического сопротивления, что является необходимым условием выживания. В норме величина сердечного выброса составляет 5,6 л/мин. При сепсисе у больных в состоянии А и особенно в состоянии В величина сердечного выброса превышает 8 л/мин. Такой уровень работы сердца сохраняется длительное время, что резко увеличивает энергетические потребности миокарда. Поэтому при сепсисе нередки: сердечная недостаточность, синдром низкого сердечного выброса, характерный для финальных стадий сепсиса.
В редких случаях после родов наблюдается латентная септицемия - хрониосепсис. Клинические симптомы этой формы - субфебрилитет, общая слабость, головная боль, головокружение, сонливость, повышенное потоотделение, иногда жидкий стул. В крови наблюдается умеренный лейкоцитоз, увеличение СОЭ. В большинстве случаев из крови высевается стафилококк. Решающее значение в развитии хронического септического процесса принадлежит снижению иммунологической активности.
Диагноз сепсиса ставят на основании клинической картины, тщательного обследования больной и результатов лабораторных исследований. При этом необходимо учитывать следующие данные: темп развития болезни; прогрессирование ухудшения общего состояния; большую выраженность общих проявлений по сравнению с незначительными местными изменениями в первичном очаге (послеоперационная рана, эндометрит, мастит и др.); высокую лихорадку гектического или постоянного характера с ознобами и проливными потами; тяжелое состояние больной даже на фоне активного лечения; нарушение деятельности сердечно-сосудистой системы; расхождение частоты пульса и температуры (частый пульс при небольшом повышении температуры); прогрессирующую потерю массы тела; наличие септической раны; прогрессирующую анемизацию; значительное увеличение СОЭ при незначительном лейкоцитозе; нейтрофилез со сдвигом лейкоцитарной формулы влево, лимфопению; нарушение функции почек (низкая относительная плотность мочи, в осадке - белок, цилиндры, форменные элементы); иктеричность кожи, склер и увеличение печени; периодические поносы; рано развивающиеся трофические нарушения (пролежни); бактериемию (высеваемость из крови микроорганизмов составляет 75-80%, отрицательные результаты не исключают диагноза сепсиса); септические кровотечения. Специфических лабораторных тестов для выявления сепси-
са не существует. Бактериемию же на фоне лечения антибиотиками удается определить лишь у 15-29% больных.
Дифференциальный диагноз сепсиса необходимо проводить с острой гнойной интоксикацией, гнойно-резорбтивной лихорадкой, тифом, милиарным туберкулезом, бруцеллезом, тяжелыми формами малярии. На сепсис указывают полиморфизм возбудителя, неопределенность инкубационного периода и местных специфических изменений. При гнойной интоксикации и гнойно-резорбтивной лихорадке симптоматика полностью зависит от местного очага. Его вскрытие или удаление приводит к полной и быстрой ликвидации общих симптомов. В то же время при сепсисе вскрытие гнойников хотя и улучшает общее состояние больной, но общие септические симптомы сохраняются.
При макроскопическом исследовании отмечаются дряблость паренхиматозных органов, умеренное их полнокровие или, наоборот, бледность. Селезенка резко увеличена, с обильным соскобом пульпы. Лимфоузлы, миндалины, пейеровы бляшки набухшие. На слизистой органов желудочно-кишечного тракта нередки многочисленные кровоизлияния, эрозии, изъязвления. Надпочечники увеличены, корковый слой их расширен. Слизистые и серозные оболочки полнокровны, с кровоизлияниями. При микроскопическом исследовании в паренхиматозных органах наблюдаются явления белковой и жировой дистрофии, очаги некробиоза и некроза клеток. В селезенке, лимфоузлах и лимфоидном аппарате кишечника имеют место скопление и активизация иммунокомпетентных клеток (лейкоцитов, макрофагов, плазматических клеток, гистиоцитов). Для капилляров коркового слоя надпочечников характерны полнокровие и стаз. Часть клеток коры в состоянии цитолиза. Вилочковая железа претерпевает инволюцию. Изменения в эндокринных органах зависят от фазы развития процесса (компенсация или декомпенсация).
Метастатические абсцессы формируются периваскулярно, около сосудов, содержащих септический эмбол, сопровождаются явлениями гнойного васкулита, периваскулита и капиллярита. В зоне септических инфарктов (в легких, почках, селезенке) ясно различимы эмболы в артерии и скопление микрофлоры в некротизированной расплавленной лейкоцитами ткани. Некоторые особенности различных видов сепсиса зависят от типа возбудителя. Для стафилококкового сепсиса характерно наличие множества метастатических абсцессов желтого цвета, до 5-6 см в диаметре, локализованных под плеврой в легких, под капсулой почек, в сердце, мышцах, головном мозге и других органах.
Кроме того, возникают септические инфаркты, гнойные серозиты, диффузные воспалительные процессы в паренхиматозных органах и метастатические подкожные абсцессы.
Стрептококковый сепсис нередко проявляется в виде молниеносной формы септицемии. Он характеризуется резкими дистрофическими изменениями органов, гиперплазией пульпы селезенки, язвенным эндокардитом с преимущественным поражением митрального и аортального клапанов. Среди тромботических и некротических масс, покрывающих язвенный дефект, определяются колонии стрептококков. Рубцевание язв сопровождается сморщиванием клапанов и формированием порока.
Синегнойный сепсис - результат суперинфекции у ослабленных больных. Протекает в виде острой или подострой септикопиемии с прогрессирующими нагноительно-деструктивными процессами в первичном септическом очаге. В некротизированной ткани очага образуется фибрин, развиваются некротические васкулиты, лимфадениты и лимфангиты. Метастатические очаги - мелкие, зеленоватые, окружены красноватым ободком. При гистологическом исследовании становится ясно: они представляют собой очаг некроза, окруженный тонким демаркационным валом и зоной кровоизлияний. В центре очага находятся скопления грамотрицательных палочек.
При сепсисе, обусловленном протейной инфекцией, рана покрыта вялыми бледными водянистыми грануляциями с неприятным запахом. Метастатические очаги в мозге, легких, почках, подкожной клетчатке имеют центральные участки некроза.
Колисепсис обычно протекает по типу септицемии. Его особенности - парез кишечника, геморрагическая сыпь на коже, истощение, диффузные капилляростазы, пролиферативно-инфильтративные процессы в межуточной ткани органов.
Анаэробный сепсис характеризуется желтушной окраской кожи с бронзовым оттенком, образованием метастатических очагов в подкожной жировой клетчатке; наблюдаются явления гемолиза, миолиза, воспалительные и дегенеративно-некротические изменения во внутренних органах.
При грибковом сепсисе чаще отмечается септикопиемия с абсцессами в легких, головном мозге и других органах. При аспергиллезе имеют место аспергилломы - опухолевидные образования в легких, состоящие из плотных сплетений грибка.
К хроническим формам сепсиса относят стафилококковый сепсис и sepsis lenta. Хронический стафилококковый сепсис протекает обычно в форме рецидивирующей болезни с повторными волнами метастазирования, отличается временной разнотипностью очагов. Sepsis lenta - хроническая форма стрептококкового сепсиса с наличием полипозно-язвенного эндокардита митрального и аортального клапанов, резкого увеличения (в 2-3 раза) селезенки. В органах и нервной системе наблюдаются васкулиты с явлениями альтеративного воспаления, множественный тромбоз и эмболии, нередко с развитием инфарктов и некроза.
При сепсисе, возникающем в условиях массивной антибиотикотерапии, течение заболевания волнообразное, пролонгированное. Уменьшается количество гнойных метастазов и степень дистрофических изменений в органах. Значительно снижается выраженность альтеративного и экссудативного компонентов воспаления в стенке сосудов, преобладают продуктивные процессы, приводящие к склерозированию.
Общие принципы лечения сепсиса предусматривают борьбу с инфекцией и интоксикацией, активизацию защитных сил организма, нормализацию нарушенных функций отдельных органов и систем, воздействие на очаг инфекции.
Основа успеха комплексной терапии сепсиса - ликвидация очага инфекции. При наличии первичного очага в матке необходимо придерживаться активной тактики. При септикопиемии, если на фоне комплексной интенсивной терапии состояние больной не улучшается в течение 2-3 суток, производят гистерэктомию с удалением маточных труб. Экстирпация матки показана при перитоните после кесарева сечения, неэффективной консервативной терапии септического шока, некротическом эндометрите. При кровотечении из матки гистерэктомию выполняют немедленно. В стадии септикопиемии удаление матки не всегда дает выраженный эффект, так как возникшие вторичные очаги поддерживают септический процесс. Однако без удаления матки выздоровление при этой форме сепсиса сомнительно.
Если первичный очаг представляет собой мастит, гнойник промежности, постинъекционный абсцесс, показано хирургическое вмешательство с эвакуацией гноя, иссечением некротизированной ткани. При тяжелом рецидивирующем мастите с интоксикацией, недостаточной эффективностью интенсивной терапии следует прекратить лактацию путем назначения парлодела или сочетанным применением эстрогенов с андрогенами.
Выбор антибактериальных средств определяется характером и чувствительностью микрофлоры. Наряду с антибиотиками целесообразно назначать метронидазол.
При отсутствии условий для быстрой идентификации возбудителя и определения его чувствительности к антибиотикам назначают препараты, воздействующие как на грамположительную, так и на грамотрицательную микрофлору. При этом необходимо учитывать, что среди госпитальной инфекции в последнее время преобладает грамотрицательная флора. Следует принимать во внимание особенности первичного очага инфекции. Если заболевание началось с послеродового эндометрита, применяют антибиотики, воздействующие на кишечную палочку и протей. При первичном очаге в молочной железе (мастит) антибиотиками выбора считают препараты, эффективные против госпитальных штаммов золотистого стафилококка. У больных с тяжелым и затяжным течением сепсиса высока вероятность анаэробной инфекции.
При антибиотикотерапии сепсиса, как и других тяжелых проявлений бактериальной инфекции, необходимо учитывать возрастание частоты выделения антибиотикоустойчивых штаммов возбудителей заболевания.
Антибиотикотерапия сепсиса имеет ряд особенностей. Обычно средства назначаются в максимальных дозах, как правило, показана комбинация двух и более антибиотиков (с разным спектром действия) с одним из химических антисептиков. Антибактериальная терапия должна проводиться под контролем чувствительности микрофлоры. Для этого посевы крови повторяют каждые 5-7 дней. Всегда сочетают местный (внутриматочный, внутрибрюшинный) и общие (внутримышечный, внутривенный, внутриартериальный) пути введения антибиотиков. Продолжительность курса антибиотикотерапии определяется состоянием больной. Лечение продолжают до полного клинического выздоровления и двух отрицательных посевов крови. При использовании ударных доз антибиотиков чаще и быстрее происходит аллергизация, развиваются дисбактериоз и кандидоз, появляются токсические реакции (нефро-, гепато- и ототоксический эффект). В результате дисбактериоза создаются условия для возникновения суперинфекций. Из них большое значение имеет суперинфекция, вызванная протеем, синегнойной палочкой, стафилококками, грибами (Candida albicans).
Важный компонент комплексной терапии сепсиса - адекватная инфузионно-трансфузионная терапия, осуществляемая с целью дезинток-
сикации, поддержания ОЦК, устранения анемии, гипопротеинемии, коррекции нарушений водно-электролитного, коллоидно-осмотического, энергетического баланса со стимуляцией диуреза. Для ликвидации острой гипопротеинемии и гипоальбуминемии, развившихся вследствие «септического аутоканнибализма», применяют растворы плазмы, протеина и альбумина; для повышения коллоидно-осмотического давления - растворы крахмала и декстранов, которые улучшают реологические свойства крови; из кристаллоидов - 10% раствор глюкозы с инсулином и калием, лактосол, раствор Рингера, 4% раствор гидрокарбоната натрия. В зависимости от конкретных нарушений электролитного баланса с целью коррекции добавляют рассчитанное количество недостающих катионов и анионов.
Инфузионно-трансфузионная терапия при сепсисе имеет существенные особенности. Она проводится под контролем функции почек и коллоидно-осмотического давления крови (не ниже 14 мм рт.ст.). Сочетанное снижение коллоидно-онкотического давления и осмолярности у больных сепсисом создает условия для развития интерстициального отека легких, миокарда и мозга. Поэтому при проведении инфузионной терапии, особенно растворами кристаллоидов, нужна большая осторожность.
Общеукрепляющая терапия включает: хороший уход, полноценное питание с большим содержанием витаминов, применение анаболических стероидных гормонов, дополнительную витаминотерапию, парентеральное питание.
При остром сепсисе показаны средства пассивной иммунизации (противостафилококковая антиколибациллярная плазма, противостафилококковый гамма-глобулин, лейкоцитная масса от иммунизированных доноров или реконвалесцентов). Средства активной иммунизации (анатоксины, аутовакцины) применяют при хроническом сепсисе или в период выздоровления при остром сепсисе.
Терапию глюкокортикоидами используют при недостаточности коры надпочечников, возникновении аллергических реакций, склонности к гипотензии, для профилактики септического шока, при осложнении сепсиса бактериально-токсическим шоком (в 1-е сутки назначают преднизолон - до 500-800 мг, а затем по 150-250 мг в течение 2-3 дней). Учитывая высокий уровень кининогенов при сепсисе и роль кининов в нарушении микроциркуляции, в комплексную терапию сепсиса включают ингибиторы протеолиза (гордокс - 20 000-30 000 ЕД в сутки или
контрикал - 40 000-60 000 АТРЕ в сутки). В комплекс лечения больных входят также сердечные гликозиды, гепарин (до 20 000 ЕД в сутки), антипиретики, антиагреганты (дипиридамол, ксантинола никотинат), салуретики. При лечении сердечно-легочной недостаточности эффективны сеансы гипербарической оксигенации, периодическая вспомогательная вентиляция легких, кислородотерапия, при необходимости - искусственная вентиляция легких в связи с нарастающей легочной недостаточностью.
В комплексное лечение необходимо включать десенсибилизирующие антигистаминные препараты - супрастин, димедрол, дипразин. Они предупреждают развитие циркуляторного коллапса, септического и анафилактического шока. Показаны седативные средства - валериана, пустырник и др. В симптоматическую терапию должны входить обезболивающие и спазмолитические препараты.
При возникновении эмпиемы легких или плевры, карбункула почки, абсцесса печени, гнойного менингоэнцефалита, септического эндокардита больные нуждаются в специализированной помощи, которая осуществляется совместно со смежными специалистами в специализированном отделении многопрофильной больницы, где обеспечена возможность участия последних. Лечение в этих случаях проводят по принципам общей гнойной хирургии, т.е. вскрывают и дренируют гнойники на фоне общего лечения. Прогноз при сепсисе, несмотря на применяемую комплексную терапию, остается весьма серьезным. При развитии таких осложнений, как септический шок и(или) синдром полиорганной полисистемной недостаточности, прогноз значительно ухудшается.
Профилактика акушерско-гинекологического сепсиса заключается в предупреждении послеродовых заболеваний и внебольничных абортов.
В женской консультации выявляют беременных, относящихся к группе высокого риска возникновения послеродовых инфекционных заболеваний, или уже заболевших, и проводят соответствующие профилактические и лечебные мероприятия. В родах необходимы предупреждение преждевременного излития околоплодных вод, развития длительного безводного периода, ограничение числа влагалищных исследований, особенно при отсутствии плодного пузыря, ранняя полноценная обработка разрывов мягких тканей родовых путей. При высоком риске инфицирования после проведения акушерских операций
назначают профилактические курсы антибактериальной терапии. Эффективной профилактикой является своевременное хирургическое лечение гнойных заболеваний.
Анаэробной инфекцией называется своеобразно протекающий патологический процесс, вызываемый анаэробными клостридиями. Для анаэробного сепсиса характерны отсутствие воспалительной реакции, прогрессирование отека, газообразование, омертвение тканей, тяжелая интоксикация, обусловленная бактериальными токсинами и продуктами распада тканей.
Это заболевание встречается почти исключительно при криминальных вмешательствах во время беременности. Возбудители его - клостридии, из которых наибольшее значение имеют: Clostridium perfringens, Cl.oedematiens, Cl.septicus, Cl. hystoliticus. Последняя клостридия - тканерасплавляющий анаэроб - редко самостоятельно вызывает газовую гангрену, а в сочетании с другими приводит к быстрому расплавлению тканей и тяжелой интоксикации.
Основная предпосылка для развития анаэробной инфекции - наличие мертвых и омертвевающих тканей. Попавшие в рану анаэробы начинают быстро размножаться и выделять токсины. Токсическое влияние быстро размножающихся анаэробов приводит к повреждению и последующей гибели здоровых тканей, которые таким образом тоже превращаются в питательную среду.
Инфекция может быть ограничена плодным яйцом или маткой. При распространении ее на стенку матки развивается гангрена мышечных волокон с последующим разрушением омертвевшей ткани. Богатство мышц гликогеном делает их особенно благоприятной средой для анаэробов. Чаще всего поражаются отдельные участки стенки матки, реже - весь миометрий. При гангрене матки, распространяющейся до серозного покрова, в брюшной полости образуется серозно-кровянистый выпот и развиваются явления перитонита.
В воздействии анаэробных микробов на ткани выделяют две фазы: 1) токсический отек; 2) газообразование, гангрена мышц и соединительной ткани.
При воздействии токсинов стенки сосудов в ране становятся проходимыми для плазмы и части форменных элементов. Это приводит к развитию отека, который быстро увеличивается в связи со спазмом сосудов, вызванным токсинами. Отек есть реакция тканей на влияние микробных токсинов. Нарастание отека, а также образование газа вызы-
вают повышение внутритканевого давления, сдавление лимфатических и кровеносных сосудов, нарушение кровообращения и развитие ишемии, результат которой - гибель тканей (некроз). В мертвых тканях бурно размножаются анаэробы, процесс быстро прогрессирует.
Общая анаэробная инфекция проявляется главным образом токсемией. Распространение анаэробной инфекции при анаэробном сепсисе происходит сначала по лимфатическим путям, а затем уже микробы проникают в кровеносное русло. Бурное течение патологического процесса ведет организм к гибели, если быстро не принять соответствующие меры.
Клинически выделяют две формы анаэробной инфекции: молниеносную, которая развивается в течение нескольких часов, протекает бурно и заканчивается летально, и острую, к которой относятся все остальные случаи анаэробной газовой инфекции.
В соответствии с патологоанатомической классификацией выделяют следующие формы анаэробной гангрены: эмфизематозную (классическую), отечную (токсическую), смешанную, некротическую, флегмонозную и тканерасплавляющую.
Инкубационный период продолжается от 1 до 7 дней. Чем раньше развивается анаэробная инфекция, тем обычно тяжелее ее течение.
Клиническая картина характеризуется проявлением местных и общих симптомов. Боли в области локализации очага инфекции, учащение пульса, отек (увеличение объема матки), повышение температуры тела, изменение психики больной (беспокойство, возбуждение или, наоборот, угнетение) - самые ранние признаки анаэробной инфекции. При местных формах (инфекция ограничена содержимым матки или стенкой матки) наблюдается лихорадка и другие проявления послеродового заболевания. Характерны выделение из полости матки газа (без запаха) или отхождение тканей, пронизанных пузырьками газа, боль и крепитация при пальпации матки, обнаружение газа при рентгенологическом ее исследовании.
Гнилостный запах лохий, их малиновый цвет указывают на прогрессирование анаэробной инфекции. Уменьшение содержания экссудата - неблагоприятный прогностический признак. Наоборот, увеличение количества отделяемого, его серозный характер расцениваются как показатель остановки развития анаэробного процесса. Переход серозного экссудата в гнойный свидетельствует о присоединении вторичной гнойной инфекции.
Сочетание триады таких симптомов, как боль, высокая температура, увеличение объема матки, относят к ранним симптомам анаэробной инфекции; однако в тяжелых случаях указанная триада иногда отсутствует (в частности, болевой симптом). Патология прогрессирует быстро. Общее состояние больной ухудшается. Развитие анаэробной инфекции сопровождается выраженной интоксикацией и обезвоживанием организма. Это проявляется сухостью кожи и слизистых оболочек, их иктеричностью, учащением пульса, увеличением содержания лейкоцитов с относительной или абсолютной лимфопенией, моноцитопенией и токсической зернистостью нейтрофилов. Появляются юные нейтрофилы, плазматические клетки, весьма возрастает количество палочкоядерных лейкоцитов. Отмечается значительное снижение общего белка (до 38-40 г/л), повышение уровня трансаминаз и общего билирубина. Последние показатели в сочетании с увеличением размеров печени свидетельствуют о развитии печеночной недостаточности.
Заболевание в начальной стадии протекает с явлениями тяжелой интоксикации или септического шока. Характерна триада признаков, зависящих в первую очередь от происходящего при газовой инфекции распада эритроцитов и развития гемолитической анемии. В крови наблюдается гемоглобинемия, гипербилирубинемия, в моче - гемоглобинурия. Эти изменения клинически проявляются в виде триады Нюренберга: бронзовая или шафрановая окраска кожных покровов; темный цвет мочи (цвет мясных помоев); темно-коричневый цвет плазмы крови (лаковая кровь). В данной стадии заболевание нередко заканчивается летальным исходом. После начальной стадии наступает следующая - острая почечная недостаточность. Развивается нефрит с образованием гемоглобиновых цилиндров. Количество мочи резко уменьшается вплоть до анурии. Больная может погибнуть не только в олигурической фазе, но и в полиурической в результате развившегося ацидоза. Длительность заболевания - от 1-2 дней до нескольких недель. Смертность в настоящее время остается очень высокой.
Анаэробная инфекция может развиться как вторичная. В подобных случаях заболевание формируется незаметно, без характерных симптомов. В клинической картине нередко преобладают симптомы, обусловленные действием других микробов. Вторичная анаэробная инфекция - более грозное осложнение, чем первичная, и характеризуется более высокой летальностью.
Своевременное распознавание анаэробной инфекции - весьма важный фактор, ибо от него зависит эффективность лечебных мероприятий. Тщательное наблюдение за больной, изучение клинических и лабораторных данных позволяют своевременно заподозрить анаэробную инфекцию. Ранним симптомам ее необходимо уделять самое серьезное внимание. Присутствие газа, определяемого пальпаторно (крепитация при пальпации матки), делает диагноз бесспорным. Образуется газ в начальном периоде заболевания, как правило, в глубоких тканях и трудно выявляется клинически. Для обнаружения его, а также отека мягких тканей используют УЗИ или рентгенологический метод. Бактериологическое исследование для срочной диагностики значения не имеет, так как продолжается в течение нескольких суток, но его результаты могут быть использованы для коррекции специфической терапии. Бактериоскопия мазков-отпечатков, окрашенных по Граму, позволяет убедиться в наличии крупных грамположительных палочек, что служит ориентировочным признаком для диагностики при соответствующей клинической картине.
Характерны желтушная окраска кожи с бронзовым оттенком, метастатические очаги в подкожной клетчатке. Наблюдаются явления гемолиза, миолиза, воспалительные и дегенеративно-некротические изменения во внутренних органах. В первичном очаге происходят прогрессирующие деструктивно-некротические процессы.
В соответствии с патологоанатомической картиной различают ряд форм анаэробной гангрены.
Эмфизематозная форма характеризуется преобладанием в тканях газа над отеком, основным возбудителем ее является Cl. perfringens.
Отечная форма отличается резким токсикозом, преобладанием отека тканей над газообразованием, возбудитель - Cl. oedematiens.
Смешанная форма вызывается ассоциациями токсических и газообразующих анаэробов. Отек и эмфизема развиваются параллельно.
Некротическая форма характеризуется распадом тканей. Наиболее часто возбудителем ее является Cl. sporogenes. Эта форма встречается реже предыдущих.
Флегмонозная форма протекает обычно в комбинации с нагноением и имеет тенденцию к быстрому распространению. Эмфизема и отек выражены слабее.
Тканерасплавляющая форма встречается редко, протекает исключительно бурно и тяжело.
Скопление микробов, распад ткани и образование пузырьков газа в паренхиматозных органах (обнаруживаемые на вскрытии) происходят в агональном периоде или после смерти больной.
Учитывая высокую контагиозность клостридиальной инфекции, больных, у которых выявлено заболевание или подозревается анаэробная инфекция, следует изолировать в отдельном помещении со строгим противоэпидемическим режимом.
Комплексное лечение больных анаэробной инфекцией имеет следующие задачи: остановить распространение процесса; купировать всасывание токсинов и ликвидировать имеющуюся интоксикацию; нормализовать нарушенные функции органов и систем; активизировать иммунобиологические силы.
Все применяемые при лечении анаэробной инфекции мероприятия делят на три группы: специфические, хирургические, неспецифические. Специфическое лечение состоит в применении смеси антигангренозных сывороток. Наряду с внутривенным обязательно внутримышечное введение 5-8 доз антигангренозной сыворотки для создания в организме депо антител. При необходимости сыворотку вводят повторно. Когда установлен возбудитель заболевания, вводят только одноименную сыворотку. Перед ее введением делают пробу на индивидуальную чувствительность к белку. При отрицательной внутрикожной пробе вводят 0,1 мл сыворотки подкожно, а при отрицательной реакции через 30 мин вводят лечебную дозу сыворотки внутривенно капельно или внутримышечно.
Хирургическое лечение заключается в ранней экстренной радикальной операции. Оптимальный объем операции - экстирпация матки с трубами. Выскабливание матки или вакуум-экстракцию можно использовать лишь в том случае, если инфекция ограничена содержимым матки. При этом высока вероятность септического шока.
Неспецифическая терапия включает энергичную дезинтоксикацию обильным (до 4 л в сутки) введением жидкостей (полиионные растворы, раствор глюкозы), переливание кровезаменителей дезинтоксикационного действия и нормализующих микроциркуляцию, белковых кровезаменителей, обильное питье.
Эффективно использование в комплексной терапии гипербарической оксигенации, плазмафереза и других методов детоксикации.
Успех лечения определяется ранней диагностикой заболевания, использованием комплекса хирургических и терапевтических средств и
безукоризненным уходом за больной. Прогноз сомнительный. Профилактика заключается в борьбе с криминальными вмешательствами во время беременности. Специфические методы профилактики (введение противогангренозной сыворотки и антигангренозных бактериофагов) в акушерско-гинекологической практике не используются.
МАСТИТ
Мастит - воспаление паренхимы и интерстиция молочной железы. Это заболевание - одно из наиболее частых осложнений послеродового периода. Частота возникновения послеродовых маститов составляет 1,5-6% по отношению к числу родов. Две трети различных случаев гнойно-воспалительных процессов в послеродовом периоде приходится на долю мастита. Увеличение частоты возникновения маститов объясняется изменением видового состава возбудителей гнойной инфекции, их антигенных свойств и антибиотикорезистентностью.
Обычно мастит развивается с одной стороны. Двусторонний процесс встречается редко. Из всех случаев маститов 70% приходится на первородящих, 27% - на повторнородящих, 3% - на многорожавших. Возрастание заболеваемости маститом у женщин старше 30 лет обусловлено увеличением количества первых родов в этом возрасте.
Возбудителем мастита чаще всего является стафилококк. У 82% больных при посеве гноя стафилококк выделяется в чистом виде, у 11% - в ассоциациях с E.coli и стрептококком, у 3,4% выявляется E.coli в монокультуре, у 2,4% - стрептококк, редко встречаются протей, грибы. Источник инфекции - носители возбудителей и больные со стертыми формами гнойно-воспалительных заболеваний из числа окружающих лиц, от которых микробы распространяются через предметы ухода, белье и т.д. Важную роль в возникновении мастита играет госпитальная инфекция.
Чаще всего входные ворота для инфекции - трещины сосков. Возможно интраканаликулярное распространение возбудителей при кормлении грудью и сцеживании молока. Реже происходит распространение инфекции гематогенным и лимфогенным путем из эндогенных очагов. Способствовать возникновению и развитию заболевания могут наличие сопутствующей экстрагенитальной патологии, снижение иммунореактивности организма, осложненные роды, особенно первые, различная патология в послеродовом периоде.
Маститу во многих случаях предшествует нарушение оттока молока с развитием лактостаза, что наблюдается при недостаточности млечных протоков у первородящих, аномалиях развития сосков, нарушениях функции молочной железы. При наличии микробов молоко в расширенных молочных ходах сворачивается, стенки протоков отекают, что еще больше способствует застою молока. Все эти моменты являются факторами, способствующими попаданию микробов в ткань молочной железы и обусловливающими начало и развитие мастита
В зависимости от локализации воспалительного процесса выделяют следующие виды мастита: паренхиматозный, характеризующийся преимущественным поражением паренхимы молочной железы; интерстициальный, с преимущественным поражением интерстициальных отделов; галактофорит - воспаление молочных протоков; ареолит - воспаление желез околососкового кружка.
Различают острые и хронические маститы. Для практических целей наиболее приемлема клиническая классификация острых маститов с учетом течения воспалительного процесса: серозный (начинающийся), инфильтративный, гнойный и гангренозный. В свою очередь гнойный мастит может быть инфильтративно-гнойным (диффузный, узловой), абсцедирующим (фурункулез ареолы, абсцесс ареолы, абсцесс в толще железы, абсцесс позади железы - ретромаммарный) и флегмонозным (гнойно-некротический).
В группе хронических маститов различают гнойную и негнойную формы. Хронический гнойный мастит встречается довольно редко, чаще всего он - следствие неправильно леченного острого мастита. Характеризуется образованием мелких абсцессов с выраженной индурацией окружающих тканей. В редких случаях возможно развитие первично-хронического мастита. К негнойной форме хронического мастита относят плазмоклеточный перидуктальный мастит, при котором определяются инфильтраты, имеющие большое число блуждающих плазматических клеток вокруг млечных протоков.
Клиническая картина мастита в различных фазах имеет свои особенности. Для типичной клинической формы серозного мастита характерно острое начало обычно на 2-3-4-й неделе послеродового периода, т. е. после выписки родильницы из стационара. Температура тела быстро повышается до 38-39 °С, сопровождается познабливанием или ознобом. Развиваются общая слабость, разбитость, возникает головная боль, боль в молочной железе. Во время осмотра отмечается едва заметное увеличе-
ние молочной железы при полном сохранении ее контуров. Кожа не изменена. При сравнительной пальпации можно отметить несколько большую упругость и диффузную болезненность пораженной молочной железы. В этой фазе особенно опасен застой молока, который приводит к венозному стазу и способствует быстрому переходу серозного мастита во вторую фазу. Острый застой молока часто предшествует воспалительному процессу. Нагрубание молочных желез, протекающее с повышением температуры, следует считать серозной формой мастита.
При неадекватной терапии начинающийся мастит в течение 2-3 дней переходит в острую инфильтративную форму. Появляются ознобы, в железе образуется резко болезненный инфильтрат с неясными границами, вся железа значительно увеличивается, кожа над ней краснеет, СОЭ повышается до 30-40 мм/ч, лейкоцитоз нарастает до 10-20х109/л. Усиливаются чувство напряжения и боль в молочной железе, появляются головная боль, бессонница, слабость, потеря аппетита. Подмышечные лимфатические узлы увеличиваются и становятся болезненными. При пальпации инфильтрата обычно не удается заметить очаги размягчения, флюктуации.
Если общая и местная терапия не останавливает процесс и не способствует его обратному развитию, возникает абсцедирующая форма мастита. Все клинические признаки прогрессируют: СОЭ достигает 50-60 мм/ч, количество лейкоцитов - 15-16х109/л, гемоглобин снижается до 80-90 г/л, усиливается озноб, продолжается лихорадка. Наблюдается гиперемия кожи молочной железы, расширение подкожных вен, появляется лимфаденит. При нагноении инфильтрата определяется флюктуация.
Для флегмонозной формы характерны резкое ухудшение общего состояния, повышение температуры до 38-40 °С, ознобы. Усиливаются симптомы интоксикации. Появляются сухость губ и языка, бессонница, головная боль. Молочная железа увеличена, кожа ее гиперемирована, с участками цианоза. Наблюдаются резкое расширение подкожной венозной сети, лимфангит и лимфаденит. При пальпации железа пастозная, определяется несколько участков флюктуации. Лейкоцитоз достигает 17-18х109/л, содержание гемоглобина падает до 70 г/л, СОЭ нарастает до 60-70 мм/ч. Лейкоцитарная формула - со сдвигом влево, отмечаются эозинофилия, лимфопения.
Гангренозная форма мастита возникает при несвоевременном обращении за медицинской помощью либо при длительном амбулаторном
лечении без адекватного контроля за общим состоянием больной и распространением процесса. При гангренозном мастите общее состояние очень тяжелое, температура достигает 40 °С, пульс 110-120 ударов в минуту, слабого наполнения. Кожа бледная, язык и губы сухие. Больная жалуется на слабость, головную боль, бессонницу, отсутствие аппетита. Молочная железа увеличена, болезненна, отечна. Кожа над ней от бледно-зеленого до синюшно-багрового цвета, в некоторых местах с пузырями и участками некроза. Сосок втянутый, молока нет, причем почти всегда и в здоровой железе. Регионарные лимфоузлы увеличены, при пальпации болезненны. Лейкоцитоз составляет 20-25х109/л, в формуле - резкий сдвиг влево, имеет место токсическая зернистость нейтрофилов. Гемоглобин снижается до 40-60 г/л, СОЭ повышается до 70 мм/ч.
В современных условиях для послеродового лактационного мастита характерны следующие особенности: более позднее начало, чаще после выписки из родильного стационара (иногда первые признаки заболевания появляются через 4 нед после родов); преобладание инфильтративно-гнойных маститов, протекающих в виде диффузных или узловых форм; затяжное и длительное течение гнойных форм заболевания; увеличение числа стертых субклинических форм мастита, при которых клинические проявления заболевания не соответствуют истинной тяжести процесса.
Диагностика основывается на оценке жалоб больной, особенностях клиники и лабораторных данных. Общий анализ крови характеризуется лейкоцитозом, нейтрофильным сдвигом, ускорением СОЭ, анемией. Бактериологическое исследование молока и гноя производится до антибактериальной терапии, а также в процессе и после окончания курса лечения. Идентифицируется возбудитель, определяется его чувствительность к антибиотикам. При цитологическом исследовании отмечается значительное увеличение числа лейкоцитов в единице объема молока (более 20 в поле зрения).
При УЗИ наблюдается гомогенная масса инфильтрата в определенном участке исследуемой молочной железы. При формировании гнойного мастита появляется очаг разрежения, вокруг которого тень инфильтрата усиливается. В последующем на этом месте визуализируется полость с неровными краями, перемычками.
Дифференциальная диагностика серозной формы мастита и лактостаза проводится на основании клинической картины заболевания. Для
лактостаза характерно однократное повышение температуры до 38 °С при общем удовлетворительном состоянии; молочная железа равномерно нагрубает во всех отделах; после сцеживания температура быстро нормализуется; лактация не страдает. Патогномоничным признаком мастита является высевание микроорганизмов из молока. При массивном высевании микробов лактостаз необходимо рассматривать как субклиническую стадию мастита и проводить лечение, как при серозном мастите. В фазе серозного воспаления ткань железы пропитана серозной жидкостью, отмечается скопление лейкоцитов вокруг сосудов. При прогрессировании воспалительного процесса серозное пропитывание сменяется диффузной гнойной инфильтрацией паренхимы молочной железы с мелкими очагами гнойного расплавления, которые в последующем сливаются, образуя абсцессы. Наиболее частая локализация гнойников - интрамаммарная, субареолярная. Иногда при гнойном мастите в результате вовлечения в воспалительный процесс сосудов и тромбирования их наступает некроз отдельных участков железы, развивается гангренозная форма мастита. После опорожнения гнойника и удаления секвестров ткани начинается процесс пролиферации, образуется грануляционная ткань, а затем происходит рубцевание.
В основе хронического гнойного мастита лежит образование мелких абсцессов с выраженной индурацией окружающих тканей. При плазмоклеточном мастите выделяются инфильтраты с большим количеством блуждающих плазматических клеток вокруг млечных протоков.
Особенности гнойного процесса железистых органов - незначительная способность к отграничению и стремительное распространение с вовлечением в воспалительный очаг большого количества железистой ткани. У части больных развивается гнойная инфильтрация паренхимы железы (апостематозный мастит), что быстро приводит к некрозу пораженных участков железы и образованию больших секвестров. Иногда наблюдается гнилостное поражение молочной железы, сопровождающееся септической реакцией.
Лечение проводят с учетом формы мастита. Его следует начинать как можно раньше, с появлением первых признаков заболевания. При отсутствии гнойного воспаления рекомендуется комплексное консервативное лечение, при гнойных маститах - оперативное вмешательство. При появлении признаков застоя молока железе создают состояние покоя, придают возвышенное положение с помощью поддерживающего, но не сдавливающего ее бюстгальтера. Для улучшения опорожнения
железы используют молокоотсос, назначают окситоцин 1 мл (5 ЕД). Предварительно за 20-30 мин перед инъекцией окситоцина рекомендуется ввести 1-2 мл 2% раствора но-шпы внутримышечно.
При развитии мастита грудное вскармливание временно прекращают. Показания к подавлению лактации у больных маститом при его тяжелом течении и резистентности к проводимой терапии следующие: быстро прогрессирующий процесс - переход серозной стадии в инфильтративную в течение 1-3 дней на фоне активного комплексного лечения; гнойный мастит с тенденцией образования новых очагов после хирургического вмешательства; вялотекущий, резистентный к терапии гнойный мастит (после хирургического лечения); флегмонозный и гангренозный мастит; мастит на фоне заболеваний других органов и систем. Для подавления лактации используют препарат, ингибирующий секрецию пролактина, - парлодел (бромокриптин). При неустоявшейся лактации его применяют в течение 4-5 дней по 1 таблетке 2 раза в день; при развившейся лактации лечение проводят в течение 7-14 дней.
Основной компонент в комплексной терапии послеродового мастита - антибиотики. При гнойном мастите их назначение сочетается со своевременным хирургическим вмешательством. В таких случаях целесообразно использовать цефалоспорины, сочетание синтетических антибиотиков с метронидазолом.
Упорная резистентность гнойного мастита позволяет предполагать наличие анаэробной микрофлоры и применять метронидазол в сочетании с вышеперечисленными антибиотиками. Повысить эффективность лечения можно сочетанным использованием антибиотиков и поливалентного стафилококкового бактериофага. В комплексной терапии мастита важное место занимают средства, повышающие специфическую иммунологическую реактивность и неспецифическую защиту организма. Эффективен антистафилококковый гамма-глобулин по 5 мл (100 ME) через день внутримышечно, на курс - 3 инъекции. Применяют антистафилококковую плазму (по 100-200 мл внутривенно), адсорбированный стафилококковый анатоксин (по 1 мл с интервалом 3 дня, на курс 3 инъекций).
Инфузионную терапию проводят всем больным при наличии интоксикации. В комплексной терапии используют антигистаминные препараты - супрастин, димедрол, дипразин; анаболические стероидные гормоны - ретаболил, неробол. При резистентных к терапии формах,
склонности к гипотонии и угрозе развития септического шока показаны глюкокортикоиды.
Физические методы лечения применяют дифференцированно. При серозном мастите используют микроволновую терапию дециметрового или сантиметрового диапазона, ультразвук, УФО; при инфильтративном мастите - те же физические методы, но с увеличением тепловой нагрузки. После хирургического лечения гнойного мастита назначают внутрисосудистую УФО- и лазеротерапию, электрическое поле УВЧ в слаботепловой дозе.
При гнойном мастите показано оперативное лечение. Операция должна выполняться в операционной в стационарных условиях. Необходимо производить широкое вскрытие гнойного очага с минимальным травмированием молочных протоков. Наиболее часто применяют радиальный разрез - от границы околососкового кружка к периферии, а затем тупым путем разрушают перемычки между пораженными дольками, эвакуируют гной, удаляют некротические ткани, в рану вводят тампон и дренаж. При флегмонозном и гангренозном мастите иссекают и удаляют некротизированные ткани. Прогноз при своевременном адекватном лечении благоприятный.
Профилактика заключается в строгом соблюдении санитарно-гигиенических и санитарно-противоэпидемических мероприятий в акушерском стационаре, в систематической борьбе со стафилококковой инфекцией, в осуществлении целенаправленных мер для предупреждения мастита.
В послеродовом периоде необходимо следующее: ежедневный гигиенический душ и смена белья; занятия гимнастикой; раннее вставание; мытье рук и туалет молочных желез перед кормлением; прием воздушных ванн в течение 10-15 мин после каждого кормления; ношение бюстгальтера, приподнимающего, но не сдавливающего молочные железы; проведение профилактических мероприятий против мастита у родильниц группы высокого риска; обучение родильниц правилам и технике грудного вскармливания; профилактика, своевременное распознавание и рациональное лечение трещин сосков и лактостаза. Для лечения трещин сосков используют 14% спиртовой раствор бриллиантового зеленого, 1-5% линимент синтомицина, 0,2% фурацилиновую мазь, мазь каланхоэ, 2% раствор хлорофиллипта в масле, цигерол, настойку календулы. Эффективно применение токов Д'Арсонваля, УФО. В процессе лечения на 2-4 дня отлучают ребенка от груди (искусственное вскармливание).