Общая хирургия: учебник / Петров С.В. - 3-е изд., перераб. и доп. - 2010. - 768 с. : ил.
|
|
|
|
ГЛАВА 15 ОСНОВЫ ТРАНСПЛАНТОЛОГИИ
Развитие медицины и хирургии в частности привело к тому, что подавляющее большинство заболеваний либо излечимо полностью, либо возможно достижение длительной ремиссии. Однако есть па- тологические процессы, на определённой стадии которых ни терапевтическими, ни обычными хирургическими методами восстановить нормальные функции органа невозможно. В этой связи встаёт вопрос о замене, пересадке органа из одного организма в другой. Этой проблемой занимается такая наука, как трансплантология.
Основные понятия
Терминология
Трансплантология (англ. transplantation - пересадка) - наука, изучающая теоретические предпосылки и практические возможности замещения отдельных органов и тканей органами или тканями, взятыми из другого организма.
Донор - человек, у которого забирают (удаляют) орган, который в последующем будет пересажен в другой организм.
Реципиент - человек, в организм которого имплантируют донор- ский орган.
Трансплантация - операция по замещению органа или тканей пациента соответствующими структурами, удалёнными из другого организма.
Трансплантация состоит из двух этапов: забора органа из организма донора и имплантации его в организм реципиента. Трансплантация органов и (или) тканей может быть осуществлена только в том случае, когда другие медицинские средства не могут гарантировать сохранения жизни реципиента или восстановления его здоровья. Объектами трансплантации могут быть сердце, почки, лёгкое, печень, костный мозг и другие органы; их перечень утверждён Министерством здравоохранения Российской Федерации совместно с Российской академией медицинских наук. В этот перечень не включены органы, их части и ткани, имеющие отношение к воспроизводству
человека (яйцеклетка, сперма, яичники или эмбрионы), а также кровь и её компоненты.
Классификация трансплантаций
По типу трансплантатов
Все операции трансплантации разделяют на пересадку органов или комплексов органов (трансплантация сердца, почки, печени, поджелудочной железы, комплекса «сердце-лёгкие») и пересадку тканей и клеточных культур (пересадка костного мозга, культуры β-клеток поджелудочной железы, эндокринных желёз и др.).
По типу доноров
В зависимости от взаимоотношения между донором и реципиентом выделяют следующие виды трансплантаций.
Аутотрансплантация - пересадка органа в пределах одного организма (донор и реципиент - одно и то же лицо). Например, у пациента поражено устье почечной артерии, обычная реконструкция невозможна, а наложение обходных шунтов связано с высоким риском осложнений (при короткой артерии, раннем её делении, атеросклерозе аорты). Почку можно удалить, осуществить экстракорпоральную (иногда микрохирургическую) реконструкцию артерии и пере- садить почку на подвздошные сосуды.
Изотрансплантация - пересадку осуществляют между двумя генетически идентичными организмами (однояйцовыми близнецами). Подобные операции редки, так как количество однояйцовых близнецов невелико, кроме того, они часто страдают схожими хроническими заболеваниями.
Аллотрансплантация (гомотрансплантация) - пересадка между организмами одного и того же вида (от человека человеку), имеющими разный генотип. Это наиболее часто используемый вид трансплантации. Возможен забор органов у родственников реципиента, а также у других людей.
Ксенотрансплантация (гетеротрансплантация) - орган или ткань пересаживают от представителя одного вида другому, например, от животного человеку. Метод получил крайне ограниченное применение (использование ксенокожи - кожи свиньи, клеточной культуры β-клеток поджелудочной железы свиньи).
По месту имплантации органа
Все трансплантации делят на два вида: орто- и гетеротопические.
Ортотопическая трансплантация. Донорский орган имплантируют на то же место, где находился соответствующий орган реципиента. Таким образом осуществляют пересадку сердца, лёгких, печени.
Гетеротопическая трансплантация. Донорский орган имплантируют не на место нахождения органа реципиента, а в другую область. Причём неработающий орган реципиента может быть удалён, а может и находиться на своём обычном месте. Гетеротопическую трансплантацию выполняют при пересадке почки, органной пересадке поджелудочной железы. Почку, например, пересаживают на подвздошные сосуды.
Операции по пересадке органов достаточно сложны, для них необходимо специальное оборудование. Но в современной трансплантологии вопросы технического выполнения операции, анестезиоло- гического и реанимационного обеспечения принципиально решены. Постоянное совершенствование медицинских технологий в целях трансплантологии значительно расширило практику трансплантации и увеличило потребность в донорских органах. В этой области медицины как ни в одной другой остро стоят вопросы морально-этического и правового порядка.
Проблемы донорства
Проблема донорства - одна из важнейших в современной трансплантологии. Для подбора наиболее иммунологически совместимого донора каждому реципиенту необходимо достаточное количество доноров, отвечающих соответствующим требованиям по качеству органов, используемых для пересадки.
Выделяют две основные группы доноров: живые доноры и нежизнеспособные доноры (в данном случае речь идёт только об аллотрансплантации, составляющей основную массу всех операций по пересадке органов).
Живые доноры
У живого донора могут быть изъяты для трансплантации парный орган, часть органа и ткань, отсутствие которых не влекут за собой необратимого расстройства здоровья.
Для осуществления подобной трансплантации необходимо соблюдение следующих условий:
• донор свободно и сознательно в письменной форме даёт согласие на изъятие своих органов и тканей;
• донор предупреждён о возможных осложнениях для его здоровья в связи с предстоящим оперативным вмешательством;
• донор прошёл всестороннее медицинское обследование и имеет заключение консилиума врачей-специалистов для изъятия у него органов и (или) тканей;
• изъятие у живого донора органов возможно, если он находится с реципиентом в генетической связи, за исключением случаев пересадки костного мозга.
Нежизнеспособные доноры
Ключевые понятия, необходимые для понимания правовых и клинических аспектов органного трупного донорства и порядка действия персонала, следующие:
• потенциальный донор;
• смерть мозга;
• биологическая смерть;
• презумпция согласия.
Потенциальный донор - пациент, признанный умершим на основании диагноза смерти мозга или в результате необратимой остановки сердечной деятельности. К этой категории доноров относят больных с констатированной смертью мозга или установленной биологической смертью. Разграничение этих понятий объясняется принципиально различным подходом к операции изъятия донорских органов.
Доноры, забор органов у которых осуществляют
при работающем сердце после констатации смерти мозга
Смерть мозга наступает при полном и необратимом прекращении всех функций головного мозга (отсутствии кровообращения в нём), регистрируемом при работающем сердце и ИВЛ. Основные причины смерти мозга:
• тяжелая черепно-мозговая травма;
• нарушения мозгового кровообращения различного генеза;
• асфиксия различного генеза;
• внезапная остановка сердечной деятельности с последующим её восстановлением - постреанимационная болезнь.
Диагноз смерти мозга устанавливает комиссия врачей в составе реаниматолога-анестезиолога, невропатолога, могут быть включены специалисты по дополнительным методам исследований (все с опытом работы по специальности не менее 5 лет). Протокол установления смерти составляет заведующий реанимационным отделением, при его отсутствии - ответственный дежурный врач учреждения. В состав комиссии не включают специалистов, принимающих участие в заборе и трансплантации органов. «Инструкция по констатации смерти человека на основании диагноза смерти мозга» не распространяется на установление смерти мозга у детей.
Диагноз смерти мозга может быть достоверно установлен на основании клинических тестов и дополнительных методов обследования (электроэнцефалографии, ангиографии магистральных сосудов головного мозга).
При смерти мозга к моменту изъятия кровообращение в органах сохраняется, что улучшает их качество и результаты операции пересадки. Изъятие при бьющемся сердце донора даёт возможность пе- ресаживать реципиентам сердце, печень, лёгкие и т.д., т.е. органы, обладающие низкой толерантностью к ишемии.
Доноры, изъятие органов и тканей у которых осуществляют после констатации смерти
Биологическую смерть устанавливают на основании наличия трупных изменений (ранние признаки, поздние признаки). Органы и ткани могут быть изъяты у трупа для трансплантации, если существуют бесспорные доказательства факта смерти, зафиксированного консилиумом врачей-специалистов.
Для констатации биологической смерти назначают комиссию в составе заведующего реанимационным отделением (при его отсутствии - ответственного дежурного врача), реаниматолога и судебно-медицинского эксперта.
При биологической смерти изъятие органов проводят при неработающем сердце донора. Доноров с необратимой остановкой сердечной деятельности называют «асистолическими донорами». В таком случае возможен забор таких резистентных к ишемии органов, как почки. Эк- спериментальные и клинические данные свидетельствуют об относительной резистентности почек к тепловой ишемии в течение 10-60 мин.
В настоящий момент во всём мире доноры с «небьющимся сердцем» составляют не более 1-6% всех доноров. В России работа с такой категорией доноров становится ежедневной практикой. Боль-
шинство донорских почек, полученных реципиентами за последние 5 лет в Москве и Санкт-Петербурге, получены от асистолических доноров.
Правовые аспекты
Деятельность медицинских учреждений, связанная с забором и трансплантацией органов и тканей человека, осуществляется в соответствии со следующими документами:
• «Основы законодательства РФ об охране здоровья граждан».
• Закон РФ «О трансплантации органов и (или) тканей человека».
• Федеральный закон ?91 «О внесении дополнений в Закон РФ «О трансплантации органов и тканей человека».
• Приказ МЗ РФ ?189 от 10.08.1993 «О дальнейшем развитии и совершенствовании трансплантологической помощи населению РФ».
• Приказ МЗМП РФ ?58 от 13.03.1995 «О дополнении к приказу
?189».
• Приказ МЗ и РАМН ?460 от 17.02.2002, вводящий в действие «Инструкцию по констатации смерти мозга человека на основании смерти мозга». Приказ зарегистрирован Министерством юстиции РФ -
?3170, 17.01.2002.
• «Инструкция по определению критериев и порядка определения момента смерти человека, прекращения жизни человека, прекращения реанимационных мероприятий», введённая приказом МЗ ?73 от 04.03.2003, зарегистрированным в Минюсте РФ 04.04.2003.
Основные положения закона о трансплантации:
• органы могут быть изъяты из тела умершего человека только в целях трансплантации;
• изъятие может производиться, когда нет предварительных сведений об отказе или возражениях изъятия органов от умершего или его родственников;
• врачи, удостоверяющие факт смерти мозга потенциального донора, не должны непосредственно участвовать в изъятии органов у донора или иметь отношение к лечению потенциальных реципиентов;
• медицинским работникам запрещается любое участие в операциях по пересадке органов, если у них есть основания полагать, что используемые органы стали объектом коммерческой сделки;
• тело и части тела не могут служить объектом коммерческих сделок.
Организация донорской службы
В крупных городах существуют центры трансплантации (например, в Москве - Научно-исследовательский институт трансплантологии и искусственных органов), при них организованы центры за- бора органов. Такие центры могут быть созданы и при крупных многопрофильных стационарах.
Представители центров забора контролируют ситуацию в реанимационных отделениях региона, оценивая возможность использования находящихся в критическом состоянии пациентов для забора органов. При констатации смерти мозга пациента переводят в центр трансплантации, где осуществляют изъятие органов для пересадки, или на место выезжает специальная бригада, выполняющая изъятие органов в стационаре, где находится пострадавший.
Учитывая большую потребность в органах для пересадки, а также дефицит доноров, наблюдаемый во всех экономически развитых странах, после констатации смерти мозга обычно осуществляют комплексное изъятие органов для их максимального использования (мультиорганный забор). Правила изъятия органов:
• изъятие органов осуществляют при строжайшем соблюдении всех правил асептики;
• орган изымают вместе с сосудами и протоками с максимально возможным их сохранением для удобства наложения анастомозов (почечные сосуды выкраивают вместе с участком стенки аорты и нижней полой вены и т.д.);
• после изъятия орган перфузируют специальным раствором (в настоящее время для этого используют раствор Евро-Коллинз при температуре 6-10 ?С);
• после изъятия орган сразу же имплантируют (если параллельно в двух операционных идут операции по забору органа у донора и доступ или удаление собственного органа у реципиента) или помещают в специальные герметичные пакеты с раствором Евро-Коллинз и хранят при температуре 4-6 ?С.
Проблемы совместимости
Проблему совместимости донора и реципиента считают важнейшей для обеспечения нормального функционирования транспланта- та в организме реципиента.
Совместимость донора и реципиента
В настоящее время подбор донора осуществляют по двум основным системам антигенов: АВ0 (антигены эритроцитов) и HLA (анти- гены лейкоцитов, получившие название антигенов гистосовместимости) - см. главу 6.
Совместимость по системе АВ0
При трансплантации органов оптимально совпадение группы крови донора и реципиента по системе АВ0. Допустимо также несовпадение по системе АВ0, но по следующим правилам (напоминают правило Оттенберга при гемотрансфузии):
• если у реципиента группа крови 0(I), возможна пересадка только от донора с группой 0(I);
• если у реципиента группа крови A(II), возможна пересадка только от донора с группой A(II);
• если у реципиента группа крови В(III), возможна пересадка от донора с группой 0(I) и В(Ш);
• если у реципиента группа крови АВ(IV), возможна пересадка от донора с группой A(II), В(III) и AB(IV).
Совместимость по резус-фактору между донором и реципиентом учитывают индивидуально для трансплантации сердца и комплекса «сердце-лёгкие» при проведении искусственного кровообращения и использовании гемотрансфузии.
Совместимость по системе HLA
Совместимость по антигенам HLA считают определяющей при подборе донора. Комплекс генов, контролирующих синтез основных антигенов гистосовместимости, расположен в VI хромосоме. Полиморфизм антигенов HLA весьма широк. В трансплантологии основное значение имеют локусы А, В и DR.
В настоящее время идентифицировано 24 аллеля локуса HLA-A, 52 аллеля локуса HLA-B и 20 аллелей локуса HLA-DR. Комбинации генов могут быть крайне разнообразными, и совпадение одновременно во всех трёх указанных локусах практически невозможно.
После определения генотипа (типирования) производят соответствующую запись, например «HLA-A5 (антиген кодируется 5 сублокусом локуса А VI хромосомы), А10, В12, В35, DRw6» и т.д.
Отторжение в раннем послеоперационном периоде обычно связано с несовместимостью по HLA-DR, а в отдалённые сроки - по HLA-A и HLA-B. При полном совпадении HLA-A и HLA-B вероятность приживления донорской почки, например, в течение 2 лет составляет около 90%, при совпадении наполовину - 65-85%.
Перекрёстное типирование
В присутствии комплемента проводят тестирование нескольких взятых в разное время проб сыворотки реципиента с лимфоцитами донора. Положительным считают результат, когда выявляют цитотоксичность сыворотки реципиента по отношению к лимфоцитам донора. Если хотя бы в одном случае перекрёстного типирования выявлена гибель лимфоцитов донора, трансплантацию не проводят.
Подбор донора к реципиенту
В
В настоящее время в Европе действует несколько банков с данными о реципиентах (Евротрансплантат и др.).
При появлении донора, у которого планируют изъятие органов, проводят его типирование по системам АВ0 и HLA, после чего выбирают, с каким реципиентом он наиболее совместим. Реципиента вызывают в центр трансплантации, где находится донор или куда доставляют в специальном контейнере донорскую почку, и выполняют операцию.
Пересадку почки обычно проводят при совместимости по системе АВ0, совпадении 2-4 антигенов по системе HLA и отрицательном результате перекрёстной пробы.
Понятие об отторжении органа
Несмотря на предпринимаемые меры по подбору каждому реципиенту наиболее генетически близкого донора, добиться полной идентичности генотипа невозможно, у реципиентов после операций может возникнуть реакция отторжения.
Отторжение - воспалительное поражение пересаженного органа (трансплантата), вызванное специфической реакцией иммунной системы реципиента на трансплантационные антигены донора.
Отторжение происходит тем реже, чем более совместимы реципиент и донор.
Выделяют сверхострое (на операционном столе), раннее острое (в течение 1 нед), острое (в течение 3 мес) и хроническое (отсроченное во времени) отторжение. Клинически отторжение проявляется ухуд- шением функций пересаженного органа и его морфологическими изменениями (по данным биопсии). Резкое ухудшение состояния реципиента, связанное с повышением активности иммунной системы по отношению к трансплантированному органу, получило название «криз отторжения».
Для профилактики и лечения кризов отторжения больным после трансплантации назначают иммуносупрессивную терапию.
Основы иммуносупрессии
Для снижения активности иммунной системы и профилактики отторжения органов после операций трансплантации всем больным проводят фармакологическую иммуносупрессию. При неосложнён- ном течении используют относительно небольшие дозы препаратов по специальным схемам. При развитии криза отторжения дозы иммунодепрессантов значительно увеличивают, изменяют их комбинацию. Следует помнить о том, что иммунодепрессия приводит к значительному увеличению риска инфекционных послеоперационных осложнений. Поэтому в отделениях трансплантации особенно тщательно нужно соблюдать меры асептики.
Для иммуносупрессии в основном используют следующие препараты.
Циклоспорин - циклический полипептидный антибиотик грибкового происхождения. Подавляет транскрипцию гена интерлейкина-2, необходимого для пролиферации Т-лимфоцитов, и блокирует Т-интерферон. В целом иммунодепрессивное действие избирательное. Применение циклоспорина обеспечивает хорошую приживляемость трансплантата при относительно низкой вероятности инфекционных осложнений.
Отрицательный эффект применения препарата - нефротоксичность, но его положительные свойства позволяют применять циклоспорин в качестве основного иммунодепрессанта и при трансплантации почки.
Сиролимус - макролидный антибиотик, структурно родствен так- ролимусу. Подавляет регуляторную киназу («мишень сиролимуса») и уменьшает клеточную пролиферацию в цикле деления клеток. Действует на гемопоэтические и негемопоэтические клетки. Применяют в базовой иммуносупрессии в качестве основного или дополнительного компонента. Нет необходимости постоянного контроля концентрации препарата в крови. Возможные осложнения применения пре- парата: гиперлипидемия, тромботическая микроангиопатия, анемия, лейкопения, тромбоцитопения.
Азатиоприн. В печени превращается в меркаптопурин, подавляющий синтез нуклеиновых кислот и деление клеток. Применяют в сочетании с другими препаратами для лечения кризов отторжения. Возможно развитие лейко- и тромбоцитопении.
Преднизолон. Стероидный гормон, оказывающий мощное неспе- цифическое депрессивное действие на клеточный и гуморальный иммунитет. В чистом виде не используют, входит в состав схем иммунодепрессии. В высоких дозах применяют при кризах отторжения.
Ортоклон. Содержит антитела к CD3+-лимфоцитам. Применяют для лечения кризов отторжения в комплексе с другими препаратами.
Антилимфоцитарный глобулин и антилимфоцитарные сыворотки. Были введены в клиническую практику в
Кроме перечисленных препаратов, используют и другие средства: ингибиторы кальциневрина, моноклональные и поликлональные антитела, гуманизированные анти-ТАС антитела и пр.
Частные виды трансплантаций
В настоящее время выполняют органные трансплантации почки, сердца, лёгких, печени и поджелудочной железы, а также пересадку ткани эндокринных желёз и клеточных культур. Наиболее важными представляются пересадки почки и сердца. Трансплантация почки - самая распространённая операция. Трансплантация сердца - вершина трансплантологии, да и хирургии вообще.
Пересадка почки
Пересадка почки - самая частая операция в трансплантологии. Она детально разработана и даёт хорошие результаты.
История
В эксперименте на животных впервые почку пересадили Каррель и Ульман в
В
В
В России в
В настоящее время в России ежегодно пересаживают около 500 почек (в Европе - около 10 000).
Показания
Показанием к трансплантации почки считают терминальную стадию хронической почечной недостаточности (III стадии), когда необходим постоянный гемодиализ. Причины развития почечной недостаточности могут быть различными: хронический гломерулонефрит, хронический пиелонефрит, поликистоз почек, мочекаменная болезнь с исходом в гидронефроз и т.д.
Особенности трансплантации
Так как почка - парный орган, возможна пересадка как от живого родственного донора, так и от нежизнеспособного донора. В последнем случае забор почки можно осуществлять при констатации смерти мозга на работающем сердце или сразу после фактической гибели донора и остановки сердца.
После забора почка, сохраняемая в растворе Евро-Коллинз при температуре 4-6 ?С, может быть трансплантирована в течение 36 ч.
При трансплантации почки проводят подбор донора на основании результатов типирования по антигенам системы HLA, совместимости по AB0 и перекрёстной пробе. После операции назначают тра- диционную иммуносупрессивную терапию.
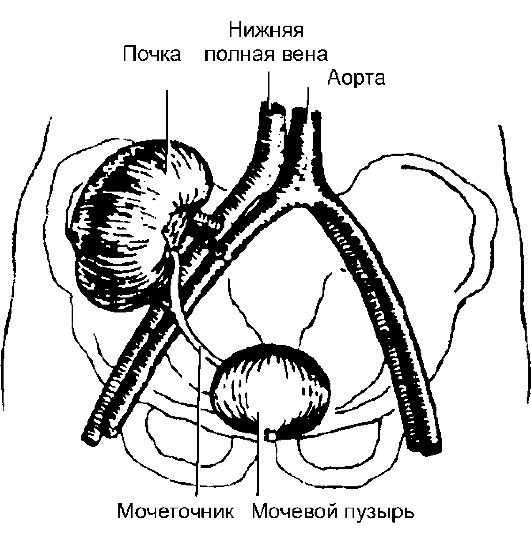
Рис. 15-1. Техника трансплантации почки
Трансплантацию почки осуществляют гетеротопически - на подвздошные сосуды (рис. 15-1). При этом обычно формируют анастомоз с наружными подвздошными артерией и веной по типу «конец в бок» и накладывают неоуретероцистоанастомоз (соустье между мочеточником донорской почки и мочевым пузырём реципиента). Собственные нефункционирующие почки предварительно удаляют лишь в случае развития в них инфекционного процесса (при поликистозе, гидронефрозе).
После операции почка начинает функционировать практически сразу, но в некоторых случаях отмечают олигурию, возможны кризы отторжения, в связи с чем проводят сеансы вспомогательного гемодиализа.
При отторжении донорской почки возможны повторные пересадки. В течение 1 года функционирует более 85% трансплантированных почек. В течение 2 лет - более 75%. Есть наблюдения за пациентами в течение 20 лет после пересадки почки с сохранением её функций.
Пересадка сердца
Пересадка сердца - самый драматичный и впечатляющий раздел трансплантологии. Длительное время вокруг этой проблемы вели острые дискуссии и споры: как человек будет жить с чужим сердцем и как с мо- ральной точки зрения выглядит изъятие только что работавшего сердца?
История
В экспериментах на животных пересадка сердца, как и комплекса «сердце-лёгкие», головы и почек, в 50-х годах XX века была разработана российским учёным Владимиром Петровичем Демиховым.
Первая пересадка сердца была выполнена 3 декабря
В России первая пересадка сердца была выполнена А.В. Вишневским в
После
длительного перерыва подобные операции были возобновлены в России.
Первая успешная трансплантация сердца в НИИТиИО была выполнена 12 марта
В настоящее время в мире проводят тысячи трансплантаций сердца, многие пациенты живы 10-15, а некоторые и 20 лет после операции.
Показания
Показанием к трансплантации сердца считают резкое снижение сократительной способности миокарда с развитием сердечной недо- статочности в результате ишемической болезни сердца (кардиосклероз, постинфарктный кардиосклероз и аневризма сердца, кардиомиопатия), врождённых и приобретённых пороков сердца.
Особенности трансплантации сердца
Сердце пересаживают в ортотопическую позицию. Изъятие донорского сердца выполняют после констатации у донора смерти мозга. Обычно операции по забору и имплантации сердца проводят практически одновременно.
После удаления сердца реципиента кровообращение осуществляется с помощью аппарата искусственного кровообращения.
При удалении сердца сохраняют задние стенки предсердий с впадающими в них полыми и лёгочными венами. При имплантации до- норского сердца накладывают анастомозы с задними стенками обоих предсердий, лёгочной артерией и аортой. После этого сердце запускают с помощью электрического разряда (дефибрилляция).
При пересадке сердца обязательно соблюдение правил совместимости донора и реципиента. Проводят иммунодепрессию в послеоперационном периоде (циклоспорин, азатиоприн, преднизолон).
Наряду с пересадкой донорского сердца интенсивно разрабатывают проблему искусственного сердца. Проведён ряд операций, позволяющих временно заменить функции сердца искусственным ап-
паратом. В последующем таким пациентам необходима трансплантация донорского сердца.
Возможно, что уже в ближайшем будущем искусственное сердце будет имплантировано в грудную клетку пациента и сможет длительно обеспечивать кровообращение во всём организме.
Пересадка других органов Трансплантация лёгких
Трансплантацию лёгких проводят при хронических заболеваниях лёгких с поражением всей их паренхимы и формированием предельной дыхательной недостаточности, заболеваниях и аномалиях лёгоч- ных сосудов.
Пересадку лёгких выполняют в трёх видах:
• Пересадка одного лёгкого. При этом накладывают анастомозы с лёгочной артерией, лёгочными венами и бронхом.
• Пересадка обоих лёгких. Формируют анастомозы с основным стволом лёгочной артерии, левым предсердием и трахеей.
• Пересадка комплекса «сердце-лёгкие» - самая распространён- ная операция в трансплантации лёгких. Накладывают анастомозы с задней стенкой правого предсердия, аортой и трахеей. Изъятие органов, подбор совместимого донора и иммунодепрессию проводят по тем же принципам, что и при пересадке сердца.
Трансплантация печени
Операцию по трансплантации печени в настоящее время считают наиболее сложной как в техническом отношении, так и в плане реа- нимационно-анестезиологического обеспечения. Само оперативное вмешательство длится порой 10-12 ч (трансплантация сердца - 2- 3 ч). За время операции переливают до 10-12 л крови и кровезамещающих растворов.
Изъятие органа выполняют только при работающем сердце (после констатации смерти мозга донора).
Печень пересаживают в ортотопическую позицию. При заборе органа у донора печень удаляют вместе с участком нижней полой вены, а также с воротной веной и печёночной артерией, а также общим жёлчным протоком. При имплантации печени накладывают анастомозы между нижними полыми венами, печёночными артериями и воротными венами донора и реципиента, а также формируют холе-
дохоеюноанастомоз (общий жёлчный проток донорской печени соединяют с тощей кишкой реципиента).
Трансплантацию печени осуществляют после подбора донора по обычному алгоритму определения совместимости. После операции назначают обычную схему иммуносупрессии.
Показанием к трансплантации печени считают различные формы цирроза, первичный рак печени, склерозирующий холангит, атрезию желчевыводящих путей и некоторые другие заболевания.
Трансплантация поджелудочной железы
Органную трансплантацию поджелудочной железы осуществляют в качестве одного из способов лечения сахарного диабета, особенно осложнённого диабетической ангиопатией, невропатией, нефропатией, ретинопатией. Происходит замещение эндокринной функции железы (экзокринная может быть успешно замещена принимаемыми внутрь ферментными препаратами).
Впервые пересадку поджелудочной железы в
Изъятие поджелудочной железы можно проводить и непосредственно после остановки сердца. Возможна как ортотопическая (с сохранением экзокринной функции), так и гетеротопическая (с прекращением экзокринной функции) трансплантация. Для прекращения экзокринной функции используют различные вещества, вводимые в протоковую систему и вызывающие окклюзию и облитерацию протоков.
При органной трансплантации необходимо соблюдать принцип иммунологической совместимости и проводить иммунодепрессию. Можно осуществлять пересадку фрагментов железы от живых доноров.
Довольно часто при диабете, осложнённом диабетической нефропатией и хронической почечной недостаточностью, одновременно выполняют пересадку почки и поджелудочной железы.
Трансплантация кишечника
Операции по трансплантации кишечника осуществляют редко, что во многом связано с большим количеством лимфоидной ткани в ки- шечнике и высоким риском отторжения. В то же время, проведено несколько десятков таких операций. Показаниями были злокачественные новообразования и синдром «короткой кишки».
Трансплантация эндокринных орагнов
Свободную пересадку эндокринных желёз и их фрагментов использовали давно. Но достижение их стойкого функционирования стало возможным после начала пересадок желёз на сосудистой ножке. Показаниями к таким операциям считают недостаточный синтез соответствующих гормонов в результате удаления железы, её гипофункцию.
В клинике используют пересадку яичка, паращитовидных желёз, фрагментов щитовидной железы, надпочечников.
Пересадка тканей и клеточных культур
Наряду с органными трансплантациями широко распространена пересадка тканей и клеточных культур. Возможности тканевой трансплантации увеличиваются с каждым годом. Ниже представлены лишь наиболее распространённые методики.
Пересадка костного мозга
Пересадку костного мозга широко используют при лечении болезней системы крови, для коррекции нарушений при лучевой бо- лезни, при массивной химиотерапии по поводу онкологических заболеваний и др.
Пересадка культуры клеток надпочечников, β-клеток поджелудочной железы, селезёнки и др.
Забор соответствующего органа осуществляют у погибшего плода человека, а иногда и у животных (у свиньи). Клетки плода на опреде- лённом этапе развития практически лишены антигенных свойств, что имеет большое значение. После специальной обработки клетки высаживают на питательную среду, формируется культура клеток. Полученную культуру пересаживают в прямую мышцу живота, вводят в селезёночную или почечную артерию. В результате отмечают длительную функциональную активность пересаженных клеток. В иммуносупрессии нет необходимости.
Свободная трансплантация островковых клеток поджелудочной железы - наиболее безопасный (по сравнению с органной трансплан- тацией) и рациональный способ введения в организм пациента ткани, секретирующей инсулин.
Пересадка ткани селезёнки
Обычно используют аутотрансплантацию: после спленэктомии (по поводу разрыва селезёнки и др.) селезёнку отмывают, измельчают по специальной методике и вводят в сформированный карман из большого сальника. Через несколько месяцев в месте введения формируется спленоид - ткань селезёнки, выполняющая соответствующие функции. Возможна также пересадка культуры клеток селезёнки.
При гнойно-септических и аутоиммунных состояниях в настоящее время широко используют методику экстракорпорального подключения донорской селезёнки. Метод спленоперфузии заключается в изъятии селезёнки, канюляции её сосудов, временной консервации и клиническом использовании. Забор селезёнки осуществляют у взрослых здоровых свиней, канюлируют заднюю ветвь селезёночной артерии. Артериальную канюлю заполняют стерильным физиологическим раствором с гепарином натрия, после чего подготовленную селезёнку помещают в стерильный пакет с физиологическим раствором. Пакет укладывают в контейнер со льдом на дне.
Для проведения спленоперфузии больному канюлируют две периферические вены, обычно кубитальные, и кровь пациента пропускают через ксеноселезёнку. Длительность сеанса спленоперфузии 45 мин. Общий объём перфузируемой крови 700-900 мл. Курс лечения составляет 2-3 сеанса.