Травматология и ортопедия: учебник / [Н. В. Корнилов]; под ред. Н. В. Корнилова. - 3-е изд., доп. и перераб. - 2011. - 592 с.: ил.
|
|
|
|
Деформирующий артроз
Деформирующий артроз (остеоартроз) - полиэтиологичное дегенеративно-дистрофическое заболевание, характеризующееся первичным поражением суставного хряща с последующим вовлечением в патологический процесс подлежащей кости, а также синовиальной оболочки, связок, капсулы, мышц, сопровождающееся формированием остеофитов и проявляющееся болью и ограничением движений в суставе.
Остеоартроз - наиболее распространенное поражение суставов. Деформирующими артрозами болеют 10-12 % людей, причем обычно с возрастом число их резко увеличивается. У детей и подростков деформирующий артроз - следствие травмы или перенесенного заболевания опорно-двигательного аппарата. Прогрессирование деформирующего артроза в течение нескольких лет приводит к инвалидности.
Артрозы крупных суставов у мужчин и у женщин встречаются одинаково часто, за исключением артроза дистальных межфаланговых суставов кисти, который поражает женщин в 10 раз чаще. Кстати, локализация артроза в межфаланговых суставах была впервые описана в 1802 г. В. Геберденом. Краевые костные разрастания мелких суставов кисти названы "узелками Гебердена".
Деформирующие артрозы по причине их развития делятся на первичные и вторичные. В большинстве случаев деформирующий артроз развивается без видимой причины - это так называемый первичный, или идиопатический, остеоартроз. В его возникновении определяющую роль играют генетические факторы. Среди факторов, приводящих к вторичному деформирующему артрозу, наиболее значимыми считаются:
1) биомеханические (травмы сустава, ударно-толчковые и скручивающие нагрузки высокой интенсивности, аномалии развития опорно-двигательной системы (дисплазии), статические деформации скелета, первичный асептический некроз костной ткани, ожирение);
2) воспалительные (острые и хронические артриты различной этиологии, гемофилия);
3) метаболические (подагра, гемохроматоз, хондрокальциноз);
4) эндокринные (сахарный диабет, акромегалия, дисбаланс половых гормонов, гипо- и гиперпаратиреоидизм);
5) ишемические (варикозная болезнь нижних конечностей, облитерирую-щий эндартериит, атеросклероз сосудов нижних конечностей).
В патогенезе деформирующего артроза можно выделить три частично перекрывающие друг друга стадии:
1) альтерация межклеточного матрикса - макроскопически представлена размягчением и поверхностным разволокнением хряща;
2) репаративный ответ хондроцитов - макроскопически увеличиваются площадь и глубина разволокнения;
3) срыв компенсаторных реакций - трещины достигают уровня субхонд-ральной кости, отрываются поверхностные слои хряща, он истончается.
В основе патогенеза дегенеративно-дистрофического процесса в суставах лежит нарушение микроциркуляции в субхондральном слое, так как суставной хрящ не имеет собственной сосудистой сети, а питание его осуществляется осмотическим путем из кости и внутрисуставной жидкости. Нарушение кровоснабжения, связанное с появлением стаза и как следствие гипоксии окружающих тканей, ведет к изменению окислительных процессов в хрящевой ткани. При этом вторично снижается общее количество белково-саха-ридных комплексов и одного из главных его компонентов - протеогликанов, как основного вещества, обеспечивающего стабильную структуру коллаге-новой ткани хряща. Одновременно снижается гидрофильность суставного хряща.
Уменьшение эластичности и прочности суставного хряща, связанное с нарушением метаболизма, ведет к снижению его устойчивости к механическим нагрузкам (первыми поражаются наиболее нагружаемые части сустава). Компенсаторно возрастает пролиферация, анаболическая и катаболическая активность хондроцитов. Однако со временем происходит декомпенсация репаративных реакций, характеризующаяся прогрессирующей потерей суставного хряща и резким снижением количества и активности хондроцитов. Макроскопически увеличивается площадь разволокнения хряща, появляются трещины. По мере их углубления происходит отрыв поверхностных слоев, что приводит к снижению толщины хряща. Этому способствует и ферментная деградация матрикса.
Уменьшение эластичности и прочности суставного хряща повышает нагрузки на субхондральный слой кости, в результате чего происходит его склерозирование, формируются краевые костно-хрящевые разрастания (остеофиты), которые появляются по периферии суставных поверхностей компенсаторно для увеличения площади опоры. В метафизарной и субхондральной зоне могут образовываться кистоподобные костные полости. Ремоделирование костной ткани в сочетании с потерей суставного хряща изменяет форму сустава и приводит к его деформации и нестабильности.
В синовиальной оболочке развивается комплекс клеточных и сосудистых реакций по типу гиперчувствительности замедленного типа. Процесс сопровождается накоплением в полости сустава экссудата и нарушением реологических свойств, а следовательно, и функций синовиальной жидкости: локомоторной (любрикация, шокабсорбция), трофической (питание хряща) и метаболической (антиоксидантная и антипротеиназная активность). Со временем происходит дистрофия капсулы сустава, связок и мышц. Уменьшение использования сустава и ограничение амплитуды движений ведет к мышечной атрофии.
Клиническая картина. Боль в области суставов при деформирующем артрозе вначале имеет ноющий характер, постепенно усиливается с нагрузкой. Интенсивность боли увеличивается с нарастанием тяжести заболевания, она становится более продолжительной.
Характерны жалобы на хромоту, необходимость в дополнительной опоре при ходьбе, затруднения при подъеме или спуске по лестнице, а также при подъеме со стула или кресла (при поражении суставов нижних конечностей). Во время движений в суставе слышна крепитация. Скованность или ограничение амплитуды движений (контрактуры) со временем прогрессируют, вплоть до фиброзного анкилоза. Позднее появляются деформация сустава и увеличение его. Периодически могут развиваться синовиты.
Среди отечественных ортопедов наибольшее распространение получила классификация деформирующего артроза, предложенная Н. С. Косинской (1961), согласно которой в течение патологического процесса различают три клинико-рентгенологические стадии. Общими рентгенологическими признаками являются:
I стадия (рис. 220, а) - неравномерное сужение суставной щели по сравнению со здоровым суставом и легкий остеосклероз;
II стадия (рис. 220, б) - появление краевых костных разрастаний (остеофитов), сужение суставной щели в 2-3 раза больше нормы, выраженный субхон-дральный склероз;
III стадия (рис. 220, в) - почти полное исчезновение суставной щели, расширение суставных поверхностей за счет обширных краевых костных разрастаний, деформация сустава, склерозирование суставных поверхностей, не-
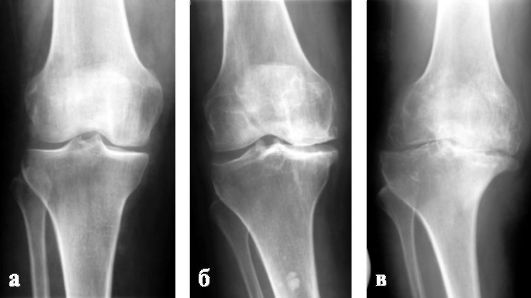
Рис. 220. Деформирующий артроз правого коленного сустава: а - I стадия; б - II стадия; в - III стадия - суставная щель резко сужена
редко их фрагментация и субхондральный очаговый некроз в виде кистозных просветлений или полостей.
Более детальное клинико-рентгенологическое описание в зависимости от локализации деформирующего артроза приведено ниже в соответствующих разделах.
Течение деформирующего артроза длительное, хроническое, прогрессирующее. Оно характеризуется обострением процесса и периодом ремиссии.
Консервативное лечение деформирующего артроза необходимо рассматривать как патогенетически обоснованную систему лечебных мероприятий, воздействующую как на патологический процесс в тканях сустава, так и на весь организм в целом. Цель консервативного лечения - стабилизация дегенеративно-дистрофического процесса и перевод его в фазу клинической компенсации.
Задачами неоперативного лечения являются:
1) уменьшение болевого синдрома;
2) улучшение функции сустава;
3) уменьшение признаков синовита;
4) замедление прогрессирования.
План лечения должен быть индивидуализирован с учетом имеющихся у пациента сопутствующих заболеваний.
Комплекс лечения составляет немедикаментозная и медикаментозная терапия, показанная при I-II стадии деформирующего артроза.
Немедикаментозное лечение заключается в разгрузке пораженного сустава, ограничении длительных статических нагрузок, ношении обуви с хорошо амортизирующей подошвой, назначении постельного режима в период обострения, использовании дополнительной опоры на трость или костыли при ходьбе на большие расстояния, снижении массы тела (диетотерапия). При наличии нестабильности сустава показано использование ортезов. Обязательны занятия ЛФК, в том числе в бассейне. Ускоряют процесс укрепления мышц элект-ромиостимуляция, массаж, гидромассаж мышц бедра и голени. Физиотерапевтические процедуры активизируют местное кровообращение, устраняют спазм мышц, а также оказывают умеренное анальгетическое действие. Широко используют озокеритовые и парафиновые аппликации, криотерапию, лазеротерапию, магнитотерапию, УВЧ, ультразвук, индуктотермию, синусоидальные модулированные токи, микроволновую терапию, электрофорез лекарственных препаратов (анальгин, новокаин, натрия салицилат, химотрипсин), фонофорез гидрокортизона, сероводородные, серные и радоновые ванны и т. д.
Препаратом выбора для терапии первой ступени является парацетамол ("Ацетаминофен"), оказывающий преимущественно анальгетическое и анти-пиретическое действие, по 0,5-1 г per os до 4 раз в сутки. Его эффективность сопоставима с эффективностью нестероидных противовоспалительных препаратов (НПВП), однако частота развития побочных эффектов значительно ниже.
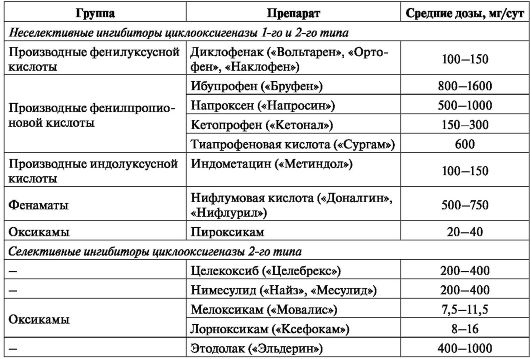
При неэффективности парацетамола показано применение НПВП (табл. 16). Клиническая эффективность всех НПВП примерно одинакова, раз-
личие состоит в основном в индивидуальной реакции пациента на препарат, поэтому его выбор является эмпирическим. Так как интенсивность боли может варьировать день ото дня, равно как и в течение дня, целесообразным является прием препаратов "по необходимости", в случае же выраженного постоянного болевого синдрома предпочтение следует отдавать формам с пролонгированным действием.
Применение селективных НПВП показано у пациентов с высоким риском развития побочных эффектов со стороны желудочно-кишечного тракта (ЖКТ). Факторами риска развития побочных эффектов со стороны ЖКТ являются возраст больше 65 лет, язвенная болезнь или кровотечение из верхних отделов ЖКТ в анамнезе, сопутствующий пероральный прием глюкокорти-костероидов или антикоагулянтов, курение, алкоголизм. Не следует назначать одновременно два или более НПВП, даже из разных групп, так как при этом значительно повышается вероятность осложнений без соответствующего усиления противоболевой эффективности. Исключение составляют случаи, когда необходимо применять ацетилсалициловую кислоту ("Аспирин") с кардио-протективной целью, при этом его суточная доза не должна превышать 325 мг. Ректальные формы НПВП не снижают частоту эрозивного гастрита и кровотечений, но реже вызывают диспепсические явления.
В дополнение к системному приему парацетамола или НПВП эффективно местное использование средств с анальгезирующим и раздражающим действием, а также НПВП для наружного применения в форме мазей и гелей.
Таблица 16. Нестероидные противовоспалительные препараты,
наиболее часто применяемые для лечения деформирующего артроза
Высокоэффективной группой лекарственных препаратов, вводимых внут-рисуставно, являются высокомолекулярные производные гиалуроновой кис-лоты-гиалуронаты, такие как "Synvisc", "Osteonil", "Fermathron" и ряд других. Они восстанавливают нарушенные реологические свойства синовиальной жидкости, а также ее антиоксидантную и антипротеазную активность, нормализуют синтез гиалуроновой кислоты, улучшают трофику хряща и снижают чувствительность болевых рецепторов.
В комплекс лечебных мероприятий целесообразно включать лекарственные средства, улучшающие периферическое кровообращение и микроциркуляцию: пентоксифиллин ("Трентал", "Агапурин", "Пентилин"), дипиридамол ("Курантил"), дротаверин ("Но-шпа"), а также витаминные препараты: тиамин (В^, пиридоксин (В6), цианокобаламин (В12), никотиновую кислоту, аскорбиновую кислоту.
Внутрисуставное введение глюкокортикостероидных препаратов при деформирующем артрозе следует использовать только в крайних случаях, лишь как метод выбора для купирования синовита, устойчивого к парентеральной терапии НПВП в адекватных дозах, но не более 2-3 инъекций в течение календарного года с промежутком между каждой инъекцией не менее 4 мес. Это связано с тем, что глюкокортикостероиды вызывают прогрессирующую деструкцию суставного хряща, а также вторичный асептический субхондраль-ный некроз кости.
При III стадии эффективность неоперативного лечения низкая. У таких больных деформации, как правило, прогрессируют, боли усиливаются, функция сустава резко нарушается; все это служит показанием к оперативному лечению.
Профилактика первичных артрозов, связанных с возрастом, профессиональными вредностями, заключается в общегигиенических мерах против раннего одряхления, соблюдении здорового образа жизни, исключении вредных воздействий окружающей среды.
Профилактика вторичного артроза связана с качественным и своевременным лечением основных заболеваний, приводящих к развитию патологических процессов в суставах.
КОКСАРТРОЗ
Коксартроз - самое тяжелое по течению и последствиям дегенеративно -дистрофическое заболевание опорно-двигательного аппарата, приводящее больных к длительной потере трудоспособности и стойкой инвалидности. Дегенеративные изменения в тазобедренном суставе возникают наиболее часто по сравнению с другими крупными суставами в связи с тем, что он несет наибольшую функциональную нагрузку. Коксартрозом заболевают, как правило, в трудоспособном возрасте. Симптомы деформирующего артроза тазобедренного сустава обычно нарастают постепенно и находятся в прямой зависимости от возраста, массы тела, конституции, образа жизни.
Клиническая картина зависит от стадии коксартроза и проявляется следующими типичными признаками.
I стадия. Боли имеют небольшую интенсивность, возникают после большой функциональной нагрузки, быстро проходят во время отдыха. При продолжительной ходьбе появляется хромота. Ходьба в пределах 2 км, как правило, болевых ощущений в суставе не вызывает. Однако больные отмечают некоторое ограничение функции сустава при ходьбе по лестнице. Трудоспособность не нарушается. Амплитуда движений в тазобедренном суставе снижается на 10-15°.
II стадия. Умеренные и значительные боли в области тазобедренного сустава возникают при любом напряжении суставной капсулы - при вставании, в начале ходьбы, при резком изменении положения тела. Боли проецируются в области паховой складки, иррадиируют в коленный сустав, усиливаются при напряжении окружающих мышц (приводящих, сгибателей, разгибателей). Из-за постоянно повышенного тонуса мышц боли не стихают в покое (ночные боли). Больные вынуждены ходить с тростью, заметно прихрамывая на больную ногу, через 500-800 м вынуждены отдыхать из-за появления (усиления) болей. Развиваются мышечные контрактуры (приводящие, сгибательные, ротационные), резко ограничивающие функцию сустава. Амплитуда движений в суставе снижается на 20-35°. В связи с нарушением трудоспособности больные становятся инвалидами III группы.
III стадия характеризуется постоянными мучительными болями, не стихающими в покое и резко усиливающимися при малейших движениях в суставе. Ходьба возможна только с костылями в пределах нескольких метров. Усиливается хромота за счет функционального укорочения конечности (сгибательная контрактура). Контрактуры фиксируют бедро в порочном положении (приведение, сгибание, наружная ротация). В суставе возможны лишь качательные движения. Больные являются инвалидами I-II группы, нуждаются в постоянной помощи.
Рентгенологическая картина коксартроза зависит от этиологических факторов и стадии патологического процесса. При деформирующем артрозе дис-пластической этиологии определяют состояние крыши и самой вертлужной впадины, угол вертикального отклонения, шеечно-диафизарный угол, угол Виберга, линию Шентона, угол вертикального соответствия, соотношение центров вертлужной впадины и головки бедра, положение головки бедренной кости относительно наружного края вертлужной впадины. При болезни Пертеса определяют состояние крыши и самой вертлужной впадины, шеечно-диафизарный угол, характер деформации головки бедренной кости. При посттравматическом коксартрозе оценивают жизнеспособность головки бедра и степень компенсации поврежденного дна вертлужной впадины.
I стадия. Обнаруживаются небольшие костные разрастания вокруг наружного и внутреннего края суставной поверхности вертлужной впадины, участки оссификации хрящевой губы и поперечной связки вертлужной впадины (эффект углубления впадины); усиление рисунка субхондральной пластинки в наиболее нагружаемых участках дна, впадины и головки бедра, небольшие
краевые разрастания, "заостряющие" переход головки бедра в шейку, сужение рентгеновской суставной щели в верхненаружных отделах.
II стадия. Краевые разрастания вертлужной впадины выходят за пределы хрящевой дуги, формируют "навесы", "клювы", "обхваты" головки бедренной кости. При гиперпластической форме коксартроза костно-хрящевые разрастания в области нижнего края впадины "выталкивают" головку бедренной кости, что проявляется ее латерализацией и подвывихом. Деформация и краевые разрастания головки бедренной кости нарушают конгруэнтность суставных поверхностей, "укорачивают" шейку бедренной кости, нарушают центрацию головки во впадине. Выражено неравномерное сужение суставной щели с явлениями склерозирования субхондральных участков дна вертлужной впадины и головки бедра.
III стадия. Обширные обезображивающие костные разрастания краев вертлужной впадины охватывают головку и шейку бедра вплоть до вертельной области. "Расплющивание" и подвывих головки бедра очень сильно деформируют суставную щель, которая в верхненаружном отделе практически не определяется. Наличие полиформных зон склероза кистозных перерождений костной ткани тазовых костей вокруг вертлужной впадины, головки и шейки бедренной кости (рис. 221) свидетельствует о полной деструкции тазобедренного сустава.
Основой профилактики поздних стадий деформирующего артроза тазобедренного сустава являются раннее выявление начальных признаков коксартроза (с обязательным учетом факторов риска в анамнезе) и раннее лечение с коррекцией опорно-двигательного режима, профессионально-трудовой нагрузки,
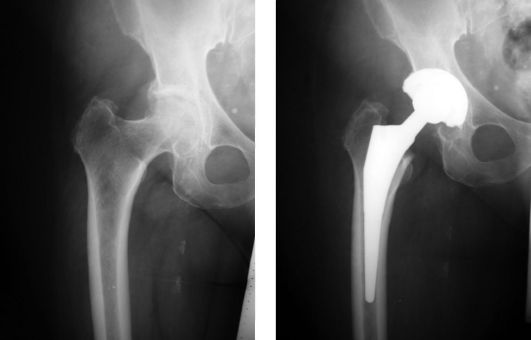
Рис. 221. Тотальное эндопротезирование тазобедренного сустава при коксартрозе III стадии
социальных и психологических мероприятий в зависимости от динамики патологического процесса.
Лечение. Принципы неоперативного лечения коксартроза изложены в разделе, посвященном деформирующему артрозу.
Все пациенты с коксартрозом обязательно должны проходить каждые 6 мес. клинико-рентгенологическое обследование. Прогрессирование патологического процесса является показанием к оперативному лечению. При дис-пластическом коксартрозе операцию проводят уже при II стадии процесса. Своевременная и качественно выполненная операция является также профилактическим средством, эффективно разрывающим патогенетические звенья вторичных патологических изменений не только в пораженном суставе, но и в других суставах конечности, а также в позвоночнике и тазе, при этом улучшается психический статус больного, который вновь может себя полностью обслуживать, полезно трудиться, вести активный образ жизни.
При коксартрозе, протекающем без нарушения конгруэнтности суставных поверхностей, предпочтение отдают внесуставным операциям, в частности различным видам остеотомии проксимального отдела бедренной кости, которые изменяют биомеханику нагрузок в тазобедренном суставе (рис. 222).
Наиболее эффективные результаты восстановления утраченной опороспо-собности и подвижности в патологически измененном суставе обеспечиваются тотальным эндопротезированием (см. рис. 221), особенно при двустороннем поражении. В настоящее время за рубежом и в нашей стране разработаны разнообразные типы эндопротезов тазобедренного сустава. Конструктивно они состоят из вертлужного и бедренного компонентов, которые могут фиксироваться к костям с использованием костного цемента (полиметилметак-рилата) или без него. Бесцементные конструкции эндопротезов используются у больных моложе 60 лет, с хорошим состоянием костной ткани и конусовидной формой костномозговой полости проксимального отдела бедренной кости. Эндопротезы цементной фиксации применяются у больных старше 60-65 лет, при наличии признаков остеопороза и широкой (17 мм и более) костномозговой полости. Иногда используют гибридную фиксацию, когда один из компонентов применяется без использования костного цемента (как правило, вертлужный), а другой (бедренный) фиксируется при помощи поли-метилметакрилата. В качестве пар трения в настоящее время наиболее часто используются металл-полиэтилен, керамика-полиэтилен, керамика-керамика и металл-металл. Ежегодно в мире замена пораженного сустава на искусственный осуществляется более чем 500 тыс. больных. В связи с организацией артрологических центров в различных регионах страны и разработкой новых конструкций эндопротезов, совершенствованием методов их установки результаты эндопротезирования улучшаются, а контингент оперированных неуклонно растет.
Показанием к имплантации тотального эндопротеза тазобедренного сустава является коксартроз II-III стадии.
Противопоказаниями к полной замене тазобедренного сустава являются сопутствующие тяжелые хронические заболевания сердечно-сосудистой систе-
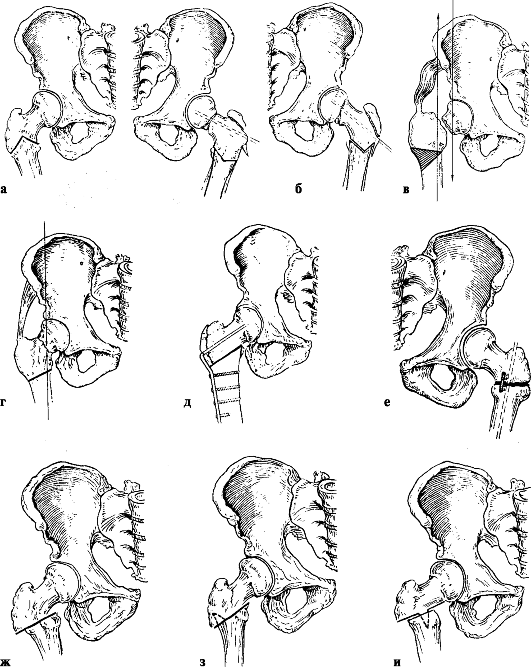
Рис. 222. Методы остеотомии вертельной области: а - по Репке; б - по Крюку; в, г - по Пауэлсу; д - с углообразной пластикой; е - с интрамедуллярным остеосинтезом и деротационным стопором по Мовшовичу; ж-и - по Мак-Мюррею (ж - типичная; з, и - со стопорными шипами)
мы, легких, почек; воспалительный процесс в области тазобедренного сустава; очаги хронической инфекции (тонзиллит, отит, кариес зубов и т. д.), гемипарез на стороне планируемой операции, психические заболевания в стадии декомпенсации.
Трудоспособность пациентов после эндопротезирования находится в прямой связи с состоянием статико-динамической функции и требованиями, предъявляемыми к организму больного профессиональным трудом.
Легкое нарушение статико-динамической функции ограничивает трудоспособность больных, выполняющих тяжелую физическую работу. При умеренном нарушении статико-динамической функции ограничены все виды профессиональной деятельности. При выраженном нарушении опорно-двигательной функции конечности больные становятся нетрудоспособными в обычных производственных условиях.
Трудоспособными следует признавать больных после одностороннего эндопротезирования тазобедренного сустава при легком нарушении статико-динамической функции, занятых в профессиях умственного и легкого физического труда без длительного пребывания на ногах.
Ограниченно трудоспособными следует признавать:
- лиц с эндопротезом одного тазобедренного сустава, при легком нарушении статико-динамической функции, занятых в профессиях умеренного или тяжелого физического труда или трудовая деятельность которых требует постоянного пребывания на ногах, в неблагоприятной позе;
- лиц с легким нарушением опорно-двигательной функции при наличии рентгенологически выявляемого остеолиза;
- лиц с эндопротезами одного или обоих тазобедренных суставов при умеренном нарушении опорно-двигательной функции.
Нетрудоспособными при первичном освидетельствовании следует признать пациентов, имеющих выраженное нарушение функции неоперированной конечности или распространенное поражение опорно-двигательной системы.
При переосвидетельствовании нетрудоспособными следует признать больных с одно- и двусторонними эндопротезами тазобедренных суставов с выраженными нарушениями опорно-двигательного аппарата, а также с послеоперационными осложнениями (нестабильность бедренного или тазового компонентов эндопротеза, остеомиелит, состояние после удаления эндопро-теза).
Сохранение трудоспособности и активного образа жизни после эндопротезирования у пациентов в значительной степени связано с созданием оптимальных условий труда и быта. Образ жизни больных должен быть "подчинен" ограниченным возможностям их опорно-двигательной функции. Превышение допустимых нагрузок (двигательных или статических) на искусственный сустав приведет к преждевременной его несостоятельности.
В первый год с момента имплантации требуют замены около 0,7 % эндопро-тезов тазобедренного сустава, а затем в течение каждого последующего года и до 10 лет - 2,2 %, в дальнейшем частота ревизий возрастает еще больше. Причинами необходимости ревизионных вмешательств являются развитие ранней
и поздней хирургической инфекции, износ компонентов эндопротеза, асептическое расшатывание эндопротеза (т. е. нарушение прочности его фиксации к костям) и остеолиз, рецидивирующие вывихи в искусственном суставе. Следует отметить, что функциональные исходы ревизионного эндопротезирования значительно уступают первичному.
Основной причиной, заставляющей больного обратиться к врачу после эндопротезирования, является болевой синдром, возникающий в покое или чаще при нагрузке. При сборе анамнеза и объективном обследовании следует уделять пристальное внимание другим возможным источникам болей, таким как поясничный остеохондроз, новообразования костей таза, заболевания мягких тканей. При асептическом расшатывании боли обычно глубокие, усиливающиеся в течение дня, при повышенной нагрузке, а также при ротационных движениях и ослабевающие в покое. В случаях расшатывания бедренного компонента они локализуются в паху с иррадиацией по передней поверхности бедра и в область коленного сустава, а при расшатывании вертлужного - в паху и в ягодице. Уменьшаются опороспособность конечности и объем движений, повышается утомляемость мышц.
О наличии инфекционного осложнения свидетельствуют повышение местной и общей температуры тела, ночная потливость и ознобы, эритема, спазм мышц, а также данные лабораторных обследований (повышение СОЭ, лейкоцитоз со сдвигом формулы влево). Диагноз подтверждается при микроскопическом (количество лейкоцитов, процентное содержание полиморфноядерных нейтрофилов) и микробиологическом исследовании тканей или синовиальной жидкости, полученных посредством аспирации.
Обязательным является рентгенографическое обследование в прямой, боковой и косой проекциях, предпочтительнее с анализом снимков, выполненных в динамике. При регулярном диспансерном обследовании больных еще до появления клинической симптоматики можно выявить рентгенологические признаки асептического расшатывания эндопротеза: проседание компонента или изменение его ориентации, появление вокруг имплантата зоны повышенной рентгенопрозрачности (остеолиза) шириной более 2 мм, постепенно увеличивающейся, децентрацию головки эндопротеза и изменение расстояния от ее центра до верхнего и нижнего контуров вертлужного компонента, растрескивание цемента. Бесспорным рентгенологическим признаком расшатывания является наличие миграции компонентов эндопротеза: вертлужного - если по сравнению со старым рентгеновским снимком расстояние по вертикали от его наружного "плеча" до верхушки большого вертела увеличивалось на 2 мм и более; бедренного - если определяется сплошной участок повышенной рентгенопрозрачности шириной не менее 2 мм на протяжении трех или более зон. Показатель до 2 мм может быть обусловлен ошибкой измерения, поэтому такие больные подлежат дальнейшему наблюдению с периодичностью 1 раз в 6 месяцев.
Вследствие высокой технической сложности, необходимости использования специальных конструкций эндопротезов и комплексного дорогостоящего материально-технического обеспечения операции ревизионного эндопротези-
рования должны проводиться только в специализированных ортопедических центрах.
Истинная профилактика вторичного коксартроза заключается в раннем выявлении первичного поражения тазобедренного сустава (врожденного или приобретенного характера) и своевременном качественном лечении.
ГОНАРТРОЗ
Гонартроз является частым патологическим процессом опорно-двигательной системы, поражая от 8 % до 20 % жителей. У женщин деформирующий артроз коленного сустава развивается в два раза чаще, чем у мужчин.
Клинические признаки. Вначале больных начинают беспокоить боли различной интенсивности в коленном суставе после физической нагрузки, ходьбы, при спуске по лестнице, вставании со стула, усиливающиеся в сырую и холодную погоду. В дальнейшем болевой синдром нарастает, периодически развиваются синовиты. При движении в суставе определяется хруст. Болезненна пальпация в проекции суставной щели, при смещении надколенника. Прогрессивно уменьшается амплитуда движений и нарастает деформация нижней конечности. Сокращается дистанция ходьбы, появляется необходимость в дополнительной опоре на трость. На поздней стадии заболевания характерны сгибательно-разгибательная контрактура, нестабильность коленного сустава и варусная или вальгусная деформация нижней конечности.
Рентгенологические признаки: неравномерное сужение суставной щели (как правило, дегенеративно-дистрофический процесс начинает развиваться изолировано во внутреннем или наружном отделе сустава, распространяясь затем на весь сустав), склерозирование субхондральной кости, краевые остеофиты, кистозное перерождение и деформация эпифизов бедренной и болыпеберцо-вой костей (рис. 220).
На / стадии при рентгенографии определяется незначительное сужение суставной щели по сравнению со здоровым суставом и легкий остеосклероз. Клинически заболевание проявляется болью, возникающей при ходьбе, особенно при спуске и подъеме по лестнице, которая проходит в состоянии покоя, иногда боль может появляться после долгого пребывания на ногах, движения в суставе, как правило, не ограничены.
При II стадии на рентгенограмме сужение суставной щели в 2-3 раза превышает норму (контралатеральный сустав), субхондральный склероз более выражен, по краям суставной щели и (или) в зоне межмыщелкового возвышения появляются костные разрастания. Клинически - умеренный болевой синдром, развивается ограничение движений в суставе, гипотрофия мышц, хромота.
При III стадии клиническая картина характеризуется стойкими сгибатель-но-разгибательными контрактурами, резко выраженными болями и хромотой, вальгусной или варусной деформацией конечности, нестабильностью сустава и атрофией мышц бедра и голени. При рентгенографии выявляется значительная деформация и склерозирование суставных поверхностей эпифизов с зонами субхондрального некроза и локального остеопороза, суставная щель почти
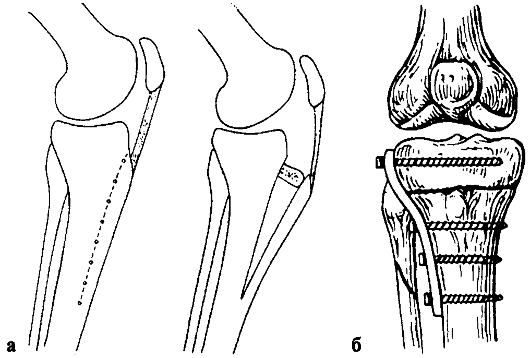
Рис. 223. Корригирующая остеотомия: а - нейтрализация бугристости болынеберцовой кости; б - вальгизирующая подмыщелковая остеотомия большеберцовой кости
полностью отсутствует, определяются обширные костные разрастания и свободные суставные тела.
Раннее неоперативное лечение позволяет ликвидировать воспалительно-болевой синдром и замедлить развитие дегенеративных изменений в суставе. Однако только постоянные лечебно-профилактические мероприятия могут сохранить рабочую функцию сустава, а следовательно, и активную жизнь больным.
Принципы неоперативного лечения гонартроза изложены в разделе, посвященном деформирующему артрозу.
Из немедикаментозных методов наиболее эффективна ЛФК, направленная на восстановление функции четырехглавой мышцы бедра и сохранение оптимальной амплитуды движений в коленном суставе. Занятия ЛФК необходимо проводить ежедневно как с помощью методиста, так и самостоятельно в домашних условиях.
Упражнения необходимо выполнять в положении разгрузки коленного сустава - сидя и лежа. Основные типы упражнений:
1) изометрические - (без движения в коленном суставе), например подъем и удержание на весу прямой ноги, разогнутой в коленном суставе, со стопой в положении наружной ротации, в том числе с сопротивлением (мешочек с песком на голеностопном суставе);
2) изотонические - сгибание и разгибание в коленном суставе свободно свисающей голени, в том числе с сопротивлением, имитация езды на велосипеде поднятыми вверх ногами, занятия на велотренажере;
3) упражнения, направленные на растяжение мышц нижней конечности, преимущественно сгибателей голени (укладки с грузами).
Показаны и общеукрепляющие (аэробические) упражнения (занятия в бассейне, дозированная ходьба), интенсивность которых определяется увеличе-
нием частоты сердечных сокращений на 60-80 % от состояния покоя. Упражнения для мышц больной ноги чередуют с упражнениями для мышц здоровой ноги и верхних конечностей, дыхательной гимнастикой.
Целесообразно выполнение самомассажа мышц бедра и голени в домашних условиях до 2-3 раз в день после обучения у методиста поликлиники. Полезно применение вибромассажеров.
Оперативное лечение показано при неэффективности комплексной немедикаментозной и медикаментозной терапии деформирующего артроза коленного сустава. При деформирующем артрозе I-II стадии и нормальной оси конечности показано выполнение артроскопии коленного сустава, включающей лаваж (обильное промывание) сустава, рациональная резекция нестабильных, отслоенных фрагментов хряща и дегенеративно-измененных участков менисков, экономное удаление остеофитов, а также свободных внутрисуставных тел. Артроскопия позволяет купировать болевой синдром и улучшить функцию сустава на некоторое время, в среднем на 1-2 года, у 70-80 % больных.
При деформирующем артрозе II стадии с преимущественным поражением внутреннего отдела коленного сустава и варусной деформацией конечности показана корригирующая вальгизирующая подмыщелковая остеотомия боль-шеберцовой кости (рис. 223, б), а при преимущественном поражении наружного отдела коленного сустава и валыусной деформации конечности - вари-зирующая надмыщелковая остеотомия бедренной кости. Целью остеотомии является достижение равномерного распределения механической нагрузки по всему суставу. При правильно выполненной остеотомии наблюдается регресс чрезмерного субхондрального склероза и восстановление высоты суставной щели (за счет пролиферации фиброзного хряща), что клинически сопровождается уменьшением болевого синдрома и сохранением достаточной амплитуды движений в среднем в течение 10 лет у 80 % пациентов. Противопоказаниями к остеотомии являются вовлечение в патологический процесс соседнего отдела сустава, нестабильность коленного сустава, варусная или вальгусная деформация, превышающая 15°, ограничение разгибания более 15°, ограничение сгибания более 90°, возраст старше 60 лет. Первым этапом перед выполнением корригирующей остеотомии может быть артроскопия коленного сустава.
При дегенеративно-дистрофическом поражении преимущественно бедрен-но-надколенникового сочленения применяется вентрализация бугристости большеберцовой кости (рис. 223, а).
Эффективным хирургическим методом, позволяющим ликвидировать болевой синдром, восстановить опороспособность конечности и подвижность в коленном суставе, является эндопротезирование (рис. 224). Преимущества эндопротезирования коленного сустава перед другими видами оперативного лечения заключаются в возможности быстрой активизации больных, ранней нагрузке на оперированную конечность и восстановлении движений в суставе, а также в хороших предсказуемых отдаленных результатах. Продолжительность функционирования современных моделей эндопротезов коленного сустава составляет более 95 % через 15 лет и около 90 % через 20 лет после операции. Конструктивно их разделяют на тотальные, с помощью которых
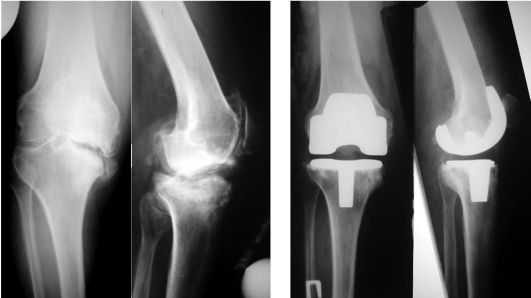
Рис. 224. Тотальное эндопротезирование коленного сустава при гонартрозе III стадии
замещают суставные поверхности бедренно-большеберцового и бедренно-надколенникового сочленения (рис. 225, б), и на одномыщелковые, предназначенные для замены внутреннего или наружного отдела бедренно-болыпеберцового сочленения (рис. 225, а). Тотальные эндопротезы коленного сустава состоят из бедренного и болmiеберцового компонентов, а также эндопротеза надколенника, которые фиксируются к костям, как правило, с использованием костного цемента (полиметилметакрилата). В качестве пары трения чаще всего используется сочетание кобальтохромового стального сплава и высокомолекулярного полиэтилена.
Одномыщелковое эндопротезирование показано при деформирующем артрозе II-III стадии с преимущественным поражением либо внутреннего, либо наружного отдела коленного сустава у пациентов старше 55 лет с интактным связочным аппаратом и варусными или вальгусными деформациями, не превышающими 15°.
Тотальное эндопротезирование показано при выраженных патологических изменениях во всех отделах коленного сустава с сопутствующим стойким болевым синдромом, угловыми деформациями, сгибательными и (или) разгиба-тельными контрактурами, вызывающими нарушение статико-динамической функции и не поддающимися консервативному лечению, преимущественно у пациентов старше 60 лет.
Абсолютными противопоказаниями к эндопротезированию являются острый инфекционный процесс любой локализации; тромбофлебит в стадии обострения; отсутствие активного разгибания в коленном суставе вследствие несостоятельности разгибательного аппарата или выраженной дисфункции мышц. К относительным противопоказаниям относят остеомиелит мыщелков бедренной или большеберцовой костей, а также гнойный артрит в анамнезе (рекомендуется оперировать больных не ранее чем через 12 мес. после
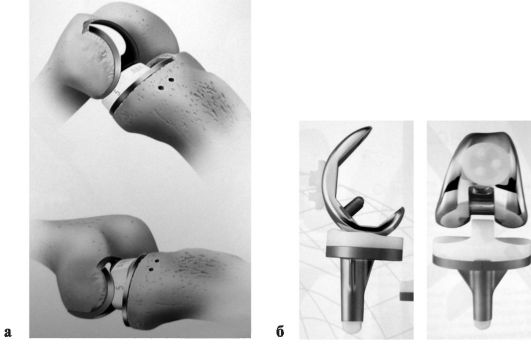
Рис. 225. Эндопротезы коленного сустава: а - одномыщелковый эндопротез внутреннего отдела коленного сустава; б - тотальный эндопротез коленного сустава
купирования воспаления, проведя перед этим специальное обследование и подготовку), очаги хронической инфекции, трофические язвы голени, грубые, обширные посттравматические рубцы, спаянные с подлежащей костью в области коленного сустава, первичный артродез коленного сустава в функционально выгодном положении, хронические заболевания внутренних органов в стадии декомпенсации, выраженный атеросклероз сосудов нижних конечностей, психические заболевания.
После эндопротезирования коленного сустава обязательна антибиоти-копрофилактика, а также нефармакологическая (ранняя мобилизация пациента, возвышенное положение нижних конечностей при нахождении в постели, ношение эластических чулок или эластическое бинтование обеих нижних конечностей от кончиков пальцев до верхней трети бедра) и медикаментозная (нефракционированный или низкомолекулярный гепарин в течение 7- 10 дней, затем за 2 дня до его отмены переход на непрямые антикоагулянты (варфарин, фенилин) в течение 7 дней) профилактика тромбоза глубоких вен и тромбоэмболии легочной артерии.
Со вторых суток после операции возможна ходьба с дополнительной опорой на костыли и дозированной нагрузкой на оперированную конечность, с постепенным увеличением ее до полной в течение 2 недель и дальнейшим использованием трости в течение еще 4-6 недель. Занятия лечебной физкультурой начинают на 1-2-е сутки после операции. После снятия швов на 12-14-е сутки, программа реабилитации направлена на укрепление ослабленных групп мышц бедра и голени, достижение полной амплитуды движений в коленном
суставе, восстановление привычных двигательных стереотипов и тренировку выносливости. На этом этапе кроме лечебной гимнастики могут использоваться и другие средства функциональной терапии: электромиостимуляция, гидрокинезотерапия, механотерапия, сухой и подводный массаж.
Динамическое амбулаторное наблюдение за пациентами и контрольная рентгенография коленного сустава в прямой и боковой проекциях осуществляются через 3,6 и 12 месяцев после операции, затем ежегодно в течение первых 5 лет и далее 1 раз в 5 лет.
Рентгенологические признаки нестабильности ("расшатывания") компонентов эндопротеза, т. е. нарушения прочности их фиксации к бедренной, большеберцовой костям и надколеннику:
- прогрессирование размера и протяженности рентгенопрозрачных линейных участков костной ткани на границе имплантат/кость;
- появление зон остеолиза;
- изменение положения компонентов, включая их миграцию;
- переломы цементной мантии;
- компенсаторная реакция костной ткани (склерозирование) около вершины ножки компонента.
Износ полиэтилена большеберцового вкладыша можно выявить при рентгенографии коленного сустава в прямой проекции с нагрузкой - по ассимет-ричному сужению суставной щели бедренно-надколенникового сочленения, а надколенникового компонента - в боковой проекции по уменьшению промежутка между пателлярным и бедренным компонентом в сравнении с предыдущими наблюдениями. Признаки износа полиэтилена как правило сочетаются с наличием зон остеолиза вблизи компонентов эндопротеза.
В разные сроки после эндопротезирования у пациентов могут развиться боли, сопровождающиеся нарушением функции коленного сустава. Выявление причин этого состояния надо начинать с тщательного сбора анамнеза и внимательного клинического осмотра пациента. Дополнительную информацию можно получить при лабораторном и рентгенологическом обследовании. И только после установки правильного диагноза следует обоснованно применять соответствующие методы консервативного или хирургического лечения. В настоящее время частота ревизионных хирургических вмешательств составляет 5-8 % от числа первичных тотальных замещений коленного сустава. Причины болевого синдрома после тотального эндопротезирования весьма разнообразны, их можно разделить на две группы: внесуставные и внутрисуставные.
Внесуставные источники боли: 1) нейрогенные:
- дегенеративно-дистрофические заболевания поясничного отдела по-звонончника, приводящие к стенозу спинномозгового канала или поясничной радикулопатии;
- неврома;
- рефлекторная симпатическая дистрофия (комплексный региональный болевой синдром 1 типа) - жгучая, выраженная боль без четкой локализации, усиливающаяся при движениях и охлаждении), припухлость
околосуставных мягких тканей, изменения кожи (гиперчувствительность, цианотичность или потемнение, атрофия), тугоподвижность и в последующем стойкая контрактура сустава;
2) сосудистая патология (облитерирующий эндартериит, атеросклероз, варикозная болезнь);
3) ипсилатеральный коксартроз;
4) бурсит гусиной лапки;
5) тендинит сухожилия четырехглавой мышцы или связки надколенника;
6) усталостные переломы надколенника или большеберцовой кости;
7) околопротезные переломы бедренной и большеберцовой костей;
8) гетеротопическая оссификация четырехглавой мышцы бедра. Внутрисуставные источники боли:
1) инфекция;
2) нестабильность (неустойчивость) коленного сустава в положении разгибания или сгибания;
3) нарушение пространственной ориентации компонентов эндопротеза:
- во фронтальной плоскости (варусная/вальгусная установка);
- в сагиттальной плоскости (избыточное сгибание/разгибание компонентов);
- ротационные нарушения;
4) остеолиз и асептическая нестабильность компонентов эндопротеза;
5) механический износ, перелом компонентов эндопротеза;
6) ущемление (импинджмент) мягких тканей:
- синдром щелкающего надколенника;
- ущемление сухожилия подколенной мышцы;
- ущемление капсулы сустава из-за выступания компонентов эндопротеза за костные спилы;
7) рубцово-спаечный процесс в полости коленного сустава (артрофиброз);
8) нарушение нормального функционирования разгибательного аппарата коленного сустава:
- нестабильность надколенника (подвывихи и вывихи);
- разрыв сухожилия четырехглавой мышцы бедра или связки надколенника;
- перелом надколенника;
- боль в переднем отделе коленного сустава.
При проведении дифференциальной диагностики вероятных причин болевого синдрома после тотального эндопротезирования коленного сустава, в первую очередь, следует исключать инфекционные осложнения, частота которых составляет 0,5-2 %. Следует помнить, что хроническое течение инфекционного процесса более характерно, чем острое, и внимательно относиться к таким признакам как беспричинная постоянная боль, отек, эритема, гипертермия, наличие отделяемого из раны, заживление раны вторичным натяжением в анамнезе. Чаще инфицирование развивается на поздних сроках от одного и более года после операции вследствие гематогенного распространения микроорганизмов, поэтому независимо от времени, прошедшего после
эндопротезирования, при любых простудных и воспалительных заболеваниях, сопровождаемых лихорадкой, а также стоматологических вмешательствах и других операциях, необходимо профилактическое применение антибиотиков широкого спектра действия.
Ранняя диагностика инфекционного осложнения крайне важна, так как она зачастую позволяет сохранить эндопротез, предотвратить необратимую потерю функции сустава и необходимость повторных многократных операций. Для инфекционного воспаления характерно острое начало болей, их преобладание в покое и ночью, в отличие асептической нестабильности эндопротеза, при которой болевой синдром развивается постепенно и превалирует при нагрузке на конечность. Объективное обследование обычно выявляет повышение температуры, отек и гиперемию коленного сустава, болезненность и ограничение движений, иногда наличие выделений. При лабораторном обследовании определяется лейкоцитоз со сдвигом формулы крови влево, значительное повышение СОЭ и уровня С-реактивного белка. Рентгенологическое обследование может демонстрировать как нормальное, так и патологическое расположение компонентов эндопротеза с резорбцией окружающей кости; кроме этого, может отмечаться периостальная реакция и газ в мягких тканях или в полости сустава. В комплексе диагностических мероприятий дополнительную информацию можно получить при выполнении тепловизионного и радиоизотопного исследования. Обязательным является микроскопическое и микробиологическое исследование синовиальной жидкости. Если при микроскопии количество белых клеток крови превышает 2500 на мм3, а доля полиморфонуклеарных лейкоцитов составляет более 60 %, это свидетельствует о наличии инфекции (чувствительность - 98 %, специфичность - 95 %). Ложноотрицательные результаты микробиологического исследования могут быть обусловлены приемом антибактериальных препаратов, поэтому он должен быть прекращен за 2 недели до исследования. Если при первичном исследовании синовиальной жидкости получены отрицательные результаты, в то время как клинические данные свидетельствуют об инфекционном процессе, анализ должен быть повторен через 2-4 недели, во время которых запрещена терапия антибиотиками. Тем не менее в 20 % наблюдений результаты посевов являются ложноотрица-тельными. Высокой диагностической ценностью обладает количественная по-лимеразная цепная реакция, позволяющая не только выявить наличие ДНК микроорганизмов в пунктате, но и установить ее концентрацию.
Во время составления плана лечения инфекционного осложнения необходимо учитывать все составляющие процесса: общее состояние пациента, время диагностики воспаления, микрофлору, состояние мягких тканей, положение компонентов эндопротеза. Повторные пункции сустава и парентеральная антибиотикотерапия приемлемы только при диагностике воспаления в течение первых 48 ч и высокой чувствительности микрофлоры к назначенному антибиотику или при наличии абсолютных противопоказаний к ревизионному вмешательству. В противном случае необходима активная хирургическая тактика: если воспаление развилось остро, но прошло более 2 суток и отсутствуют рентгенологические признаки нестабильности компонентов с вовлечением
в патологический процесс кости, то можно сохранить эндопротез, ограничившись артротомией, ревизией, синовэктомией и удалением всех нежизнеспособных тканей с последующим длительным дренированием полости сустава. Обязательным элементом операции является замена полиэтиленового вкладыша эндопротеза на новый. В остальных клинических ситуациях показано двухэтапное хирургическое лечение. Первый этап - тщательная санация сустава, удаление эндопротеза с остатками цемента и установка временного имп-лантата (цементного спейсера), насыщенного термоустойчивыми антибиотиками (гентамицин, ванкомицин или тобрамицин). Затем в течение 6-8 недель проведение парентеральной терапии антибиотиками с учетом чувствительности интраоперационно определенной микрофлоры и после купирования воспаления, подтвержденного клинически и лабораторно, - второй этап, заключающийся в реэндопротезировании коленного сустава. После первого этапа хирургического лечения рекомендуется ходьба с дополнительной опорой на костыли и частичной нагрузкой на нижнюю конечность, после второго этапа сроки осевой разгрузки зависят от объема и вида костной пластики, а также особенностей фиксации эндопротеза и устанавливаются индивидуально.
В случае неудовлетворительных функциональных результатов реэндопро-тезирования и повторных гнойных воспалениях показано артродезирование коленного сустава, а при тяжелом хроническом остеомиелите костей, формирующих коленный сустав, и генерализации инфекции (сепсисе) - ампутация конечности.
Следует отметить, что ревизионное эндопротезирование коленного сустава является технически сложным и дорогостоящим видом медицинской помощи, требующим наличия специальных имплантатов, инструментария, оборудования, и поэтому, также как повторное замещение тазобедренного сустава, должно выполняться в специализированных ортопедических центрах.
ДЕФОРМИРУЮЩИЙ АРТРОЗ ГОЛЕНОСТОПНОГО СУСТАВА
Причины. Переломы лодыжек с неустраненными подвывихами, вывихи стопы (особенно открытые), переломы таранной кости, огнестрельные ранения, хронические травмы (у спортсменов, артистов балета), выраженные деформации проксимальных сегментов конечностей и др.
Признаки. Для I стадии характерно появление небольшой отечности и болей в суставе во второй половине рабочего дня, после обычных бытовых нагрузок. Боли локализуются по передней поверхности, вдоль линии сустава с переходом на боковые поверхности под лодыжки.
Во II стадии боли становятся постоянными, появляются синовит, хруст при движениях, ограничение подвижности ("заклинивание"). На рентгенограмме определяются костные разрастания по краям суставных поверхностей большеберцовой кости, лодыжек, таранной кости (рис. 226).
При III стадии возможны только качательные движения в суставе, который деформирован, резко отечен вместе с дистальным отделом голени. На рентге-
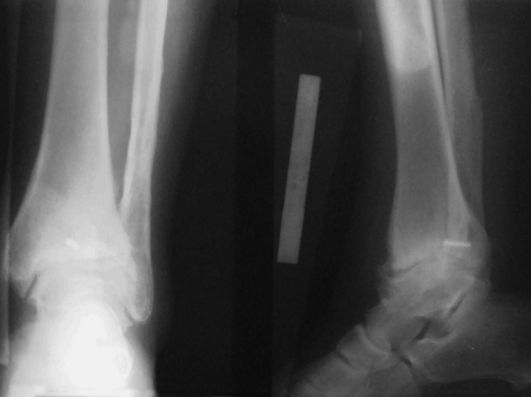
Рис. 226. Деформирующий артроз голеностопного сустава
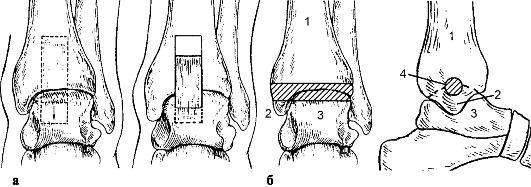
Рис. 227. Артродез голеностопного сустава: а - по Кемпбеллу; б - по С. Д. Яковлеву: 1 - болыпеберцовая кость; 2 - медиальная лодыжка; 3 - таранная кость; 4 - костный аутоили аллотрансплантат, введенный в проделанный сверлом канал
нограмме отмечаются массивные костные разрастания и свободные фрагменты, резкое сужение суставной щели вплоть до полного ее исчезновения.
Лечение. В начальных стадиях лечение проводят амбулаторно. Так же как и при других локализациях артроза, лечебные средства применяют для улучшения кровообращения в околосуставных тканях, устранения болевого синдрома, восстановления достаточной подвижности в суставе и предупреждения контрактур.
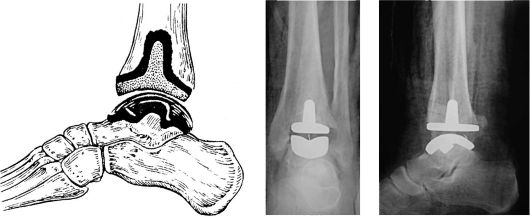
Рис. 228. Эндопротезирование голеностопного сустава
Активно используют массаж, ЛФК, тепловые процедуры, электрофорез новокаина и калия йодида, лития, фонофорез кортикостероидов, диадинамоте-рапию, магнитотерапию, лазеротерапию.
В поздних стадиях при выраженном болевом синдроме показан артродез голеностопного сустава (рис. 227): фиксация конечности аппаратом - до 10- 12 нед., в случае использовании гипсовой повязки продолжительность иммобилизации должна быть не менее 4 мес. Возможно также эндопротезирование голеностопного сустава (рис. 228).
ДЕФОРМИРУЮЩИЕ АРТРОЗЫ СУСТАВОВ ВЕРХНЕЙ
КОНЕЧНОСТИ
Причины. В плечевом суставе дегенеративно-дистрофические процессы возникают после ушибов, вывихов, внутрисуставных переломов. В связи с острым болевым синдромом резко ограничены отведение, сгибание и ротация плеча.
Боли в плече могут быть рефлекторного происхождения (болезни сердца, остеохондрозы, поражение надостной мышцы и др.). Для деформирующего артроза характерны тупые, ноющие, давящие, ломящие боли различной интенсивности с иррадиацией в предплечье и кисть. Типичны ночные боли. Рентгенография позволяет уточнить диагноз (рис. 229).
Для лечения используют те же средства, что и при артрозах других локализаций. Необходимо создать плечу покой на отводящей шине, постепенно увеличивая отведение. В тяжелых стадиях показано оперативное лечение (рис. 230).
Упорный характер заболевания ведет к длительной нетрудоспособности больных (до года и дольше).
На развитие артроза локтевого сустава указывает появление в отдаленном посттравматическом периоде болевых ощущений в области прикрепления сухожилий к надмыщелкам плечевой кости, в проекции локтевого нерва при крайних положениях конечности при сгибании и разгибании. Постепенно
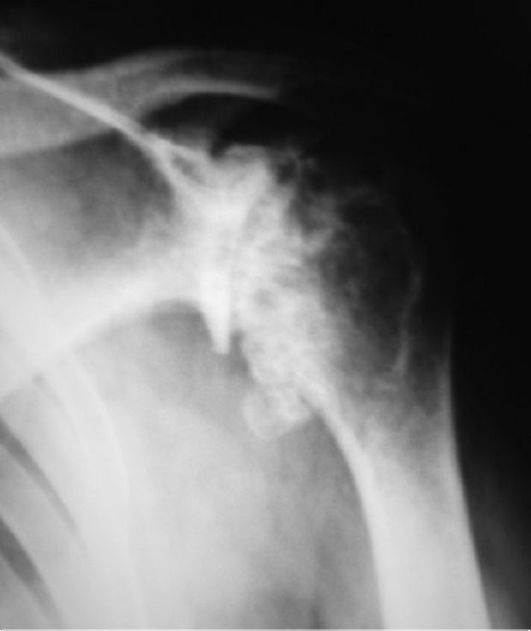
Рис. 229. Деформирующий артроз плечевого сустава
развивается сгибательная контрактура, вначале рефлекторно-болевого характера, затем - артрогенного.
Диагноз уточняют после рентгенографии (рис. 231).
При лечении следует избегать насильственных действий и форсированных приемов увеличения амплитуды движений.
Неоперативное лечение эффективно при I-II стадии и включает НПВП, глю-козаминогликаны, ЛФК, физиотерапию, массаж. Из оперативных методов лечения наиболее перспективно эндопротезирование (рис. 232), так как артродези-рование резко ограничивает функцию верхней конечности.
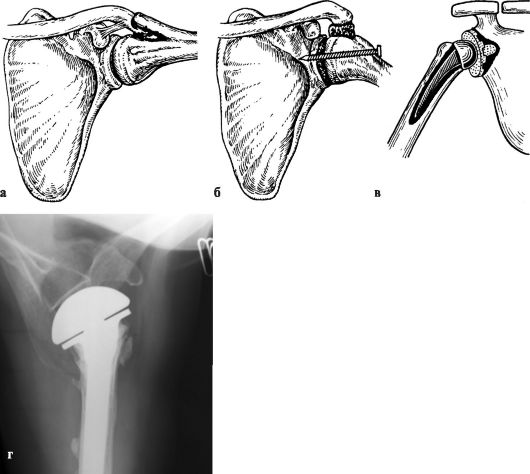
Рис. 230. Артродез плечевого сустава по Гохту (а), по Мовшовичу (б), тотальное эндопротезирование плечевого сустава (в) и однополюсное эндопротезирование плечевого сустава (г)
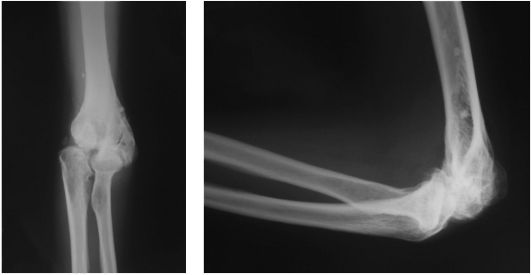
Рис. 231. Посттравматический деформирующий артроз локтевого сустава
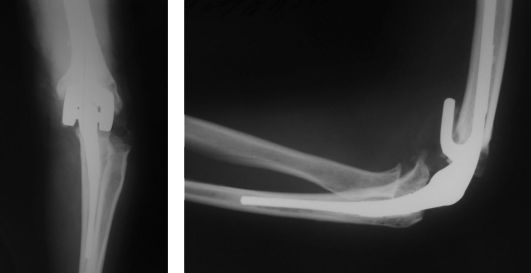
Рис. 232. Эндопротезирование локтевого сустава
Причинами дегенеративно-дистрофического поражения лучезапястного сустава являются ушибы, ранения, переломы сочленяющихся костей, вывихи и подвывихи кисти, контрактуры Дюпюитрена, туннельные синдромы запястья.
В клинической картине преобладают болевой синдром и нарушение рабочей функции кисти и пальцев.
Лечение в I-II стадиях неоперативное. Из оперативных вмешательств предпочтение отдают артродезу (рис. 233, а) и эндопротезированию (рис. 233, б).
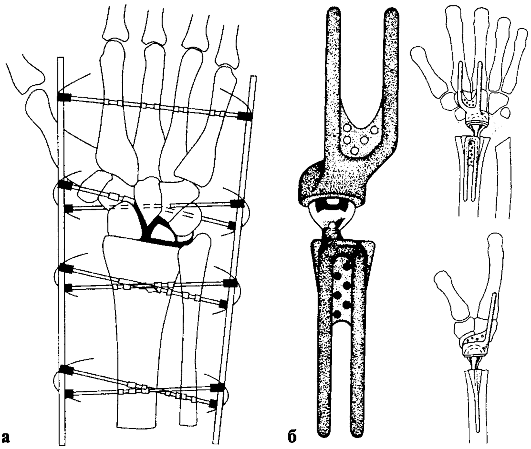
Рис. 233. Артродез (а) и эндопротезирование (б) лучезапястного сустава
АСЕПТИЧЕСКИЙ НЕКРОЗ ГОЛОВКИ БЕДРЕННОЙ КОСТИ
Асептический некроз (остеонекроз, аваскулярный некроз) головки бедренной кости - мультифакториальное заболевание, заключающееся в нарушении микроциркуляции и последующем омертвении участка костной ткани, расположенного субхондрально в наиболее нагружаемом верхненаружном сегменте головки бедренной кости, приводящем к его коллапсу, нарушению целостности покрывающего эту зону гиалинового хряща и развитию вторичного деформирующего артроза.
Страдают асептическим некрозом чаще всего мужчины в возрасте от 25 до 45 лет. У 50 % больных отмечается двустороннее поражение тазобедренных суставов, причем у 15 % из них развивается асептический некроз другой локализации (мыщелки бедренной кости, головка плечевой кости). Заболевание характеризуется быстрым прогрессированием и без должного лечения приводит к выраженному нарушению статико-динамической функции сустава и как следствие - к стойкой утрате трудоспособности.
К локальному нарушению микроциркуляции и развитию зоны некроза кости может приводить ряд причин, наиболее частыми из которых являются первые три:
1) повреждение сосудов, питающих головку бедренной кости при переломах шейки бедра или вывихах тазобедренного сустава;
2) эмболизация сосудов каплями жира, кровяными сгустками, пузырьками азота (кессонная болезнь), серповидными эритроцитами;
3) тромбоз при коагулопатиях (тромбофилия, гипофибринолиз) или сосудистых заболеваниях;
4) окклюзия сосудов из-за внешнего сдавления вследствие дислокации, выпота в суставе, повышенного внутрикостного давления, гипертрофии клеток костного мозга;
5) повреждения сосудистой стенки цитотоксическими агентами.
Различают идиопатический аспетический некроз, который развивается спонтанно, без видимых причин, и вторичный, который ассоциирован со следующими патологическими состояниями: длительная системная терапия глюкокортикостероидами, избыточное употребление алкоголя, системная красная волчанка и другие заболевания соединительной ткани, хроническая почечная недостаточность, трансплантация органов, серповидно-клеточная анемия и другие гемоглобинопатии, коагулопатии, кессонная болезнь, хронические заболевания печени, воспалительные заболевания кишечника, панкреатит, гиперлипидемия, подагра, беременность, лучевая болезнь, атеросклероз и другие заболевания сосудов, курение, синдром Кушинга, аллергические реакции и гиперчувствительность, саркоидоз, химиотерапия и интоксикация химическими веществами, опухоли. У 65 % пациентов с асептическим некрозом головки бедренной кости в анамнезе имеется терапия глюкокортикостероидами или хронический алкоголизм, в то время как идиопатический остеонекроз выявляется только у 15-20 % больных. Существенным предрасполагающим фактором являются индивидуальные особенности сосудистой анатомии, в частности бедных коллатералями латеральных сосудов эпифиза бедренной кости, снабжающих верхненаружный сегмент головки.
Пусковым фактором патогенеза является резкое снижение или прекращение микроциркуляции в сегментарном участке эпифиза кости, приводящее к его инфаркту, т. е. гибели клеток костного мозга, стромы и остеоцитов. Вокруг области некроза появляется намного его превосходящая зона отека. В костной ткани начинаются репаративные процессы. Однако из-за дискоординации спазма и пареза сосудов, замедления тока крови, изменения ее реологических свойств и агрегации форменных элементов возникает патологический очаг кровообращения, который сопровождается сбросом поступающей артериальной крови в венозную систему диафиза. Эти изменения существенно угнетают репарацию, делая ее неэффективной, в результате чего омертвлению подвергаются новые участки и наступает декомпенсация. Под действием механической нагрузки в субхондральной кости происходят микропереломы, приводящие к снижению ее прочности. Гиалиновый хрящ без подлежащей механической опоры быстро подвергается прогрессирующей необратимой дегенерации. Нарушение поверхностной структуры головки бедра приводит к изменению механической нагрузки, передаваемой на гиалиновый хрящ вертлужной впадины, и развитию в нем патологических изменений. Следует отметить, что если зона остеонекроза ограничена по площади и находится в медиальной, менее нагружаемой части головки бедренной кости, то она может подвергаться спонтанному восстановлению. Сроки развития коллапса головки бедренной кости колеблются от нескольких недель до нескольких лет.
Первое клиническое проявление - боли, чаще всего локализующиеся в паховой области, реже в области бедра, коленного сустава, пояснично-крестцо-вого отдела позвоночника.
Вначале боли носят периодический характер, исчезая после отдыха, а затем становятся постоянными, интенсивность их постепенно нарастает, усиливаясь при незначительной физической нагрузке. На поздней стадии заболевания боли могут наблюдаться в ночное время. У некоторых пациентов начало заболевания бывает внезапным. Боли не сопровождаются повышением температуры тела, припухлостью мягких тканей в области сустава.
Зачастую в остром периоде больные не могут ни стоять, ни ходить в течение нескольких дней, затем, как правило, наступает облегчение с возвращением пациента к обычной двигательной активности. В течение нескольких месяцев, а иногда и лет, может сохраняться нормальная амплитуда движений в суставе. В первую очередь возникает ограничение ротационных движений и отведения, затем появляется ограничение движений в сагиттальной плоскости и в конечном итоге формируется стойкая сгибательно-приводящая контрактура и функциональное укорочение конечности. Характерны прогрессирующая гипотрофия мягких тканей бедра, уплощение ягодичной области на стороне поражения. Быстропрогрессирующее течение остеонекроза со значительным разрушением головки, ранним развитием деформирующего артроза, нарушением функции сустава и потерей профессиональной трудоспособности чаще всего встречается при двусторонних поражениях. При одностороннем процессе основные симптомы, как правило, развиваются медленнее.
Изменения лабораторных показателей неспецифичны.
Обязательно выполнение рентгенографии тазобедренного сустава в двух проекциях. При отсутствии патологических изменений показана МРТ, которая является наиболее чувствительным методом диагностики асептического некроза и позволяет выявить дорентгенологические изменения у 90 % больных.
Ранним рентгенологическим признаком является изменение плотности костной ткани в отдельных участках головки бедра: обычно можно видеть очень нежную линию пониженной плотности под субхондральным слоем головки, которая дублирует контур головки и напоминает скорлупу яйца. Иногда можно выявить очаговые участки разрежения и наряду с ними - островки или линии уплотнения.
После появления импрессионного перелома (в субхондральной зоне чаще верхненаружного сегмента головки) на рентгенограмме обозначается треугольный или дискообразный участок некроза и выявляются изменения контуров головки, причем ее деформация чаще всего начинается на латеральном крае с легкой импрессии. Очаг некроза выявляется в виде плотной тени, окруженной светлой остеолитической зоной, за которой следует более плотная зона, соответствующая зоне склероза. В последующем наступают вторичные изменения, характерные для деформирующего артроза: клювовидные костные разрастания, седловидная деформация головки, кистовидные образования, сужение суставной щели.
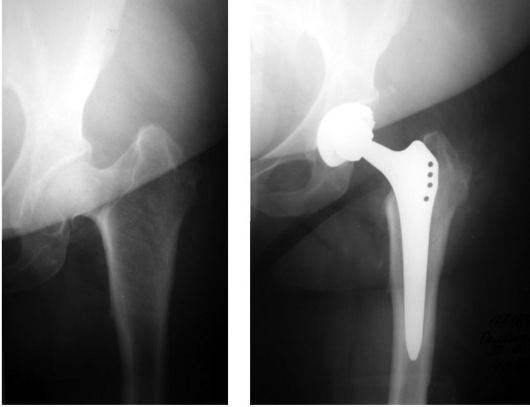
Рис. 234. Тотальное эндопротезирование тазобедренного сустава при асептическом некрозе головки бедренной кости
Дифференциальную диагностику чаще приходится проводить с коксарт-розом, туберкулезным кокситом, остеохондрозом пояснично-крестцового отдела позвоночника.
Неоперативное лечение является симптоматическим и показано при невозможности выполнения хирургического вмешательства. Оно включает длительное (до 6 месяцев) ограничение осевой нагрузки на пораженную конечность, прием НПВП, физиотерапию (переменное электромагнитное поле). При вторичном асептическом некрозе важно устранить или скорректировать действие основного повреждающего фактора.
Если коллапс головки бедренной кости еще не произошел, то для его профилактики выполняется хирургическая декомпрессия зоны остеонекроза посредством удаления 1-2 цилиндрических столбиков кости 8-10 мм в диаметре, с последующим замещением этого участка костными аллоили ауто-трансплантатами, в последнем случае, как свободными, так и на питающей сосудистой ножке. Для разгрузки пораженного участка головки также применяются корригирующие остеотомии проксимального отдела бедренной кости. При развитии коллапса головки бедренной кости показано тотальное эндопротезирование тазобедренного сустава (рис. 234).
ЮНОШЕСКИЙ ЭПИФИЗЕОЛИЗ ГОЛОВКИ БЕДРЕННОЙ КОСТИ
Юношеский эпифизеолиз бедренной кости (соскальзывание проксимального эпифиза бедренной кости) обусловлен медленным смещением эпифиза,
т. е. головки бедренной кости, по линии зоны роста кзади и книзу. Он может быть вызван заболеванием и травмой у подростков.
Разрушение росткового эпифизарного хряща чаще наблюдается при переломах головки бедренной кости у мальчиков и девочек (одинаково часто) 11- 14 лет.
Причиной этого патологического состояния, помимо травмы, являются эндокринные расстройства, нарушения секреции половых желез и передней доли гипофиза. Факторами риска являются ожирение, половое недоразвитие, расстройства функции эндокринной системы, микрогенитосомия, гипогона-дизм, крипторхизм, сахарный диабет.
Признаки. Появляются повышенная усталость и расстройства походки, боли при длительном стоянии и ходьбе в паховой области с иррадиацией в коленный сустав, избыточное отведение и наружная ротация бедра, заметная при ходьбе и особенно в положении лежа на спине (наружное отклонение стопы). Порочное положение усиливается при сгибании бедра. Выявляются укорочение конечности до 3 см, ограничение внутренней ротации (до полного исчезновения) и увеличение разгибания бедра (переразгибание). Слабоположителен симптом Тренделенбурга.
Рентгенологические признаки (рис. 235). В I стадии (предсоскальзывания) отмечаются патологические изменения в ростковых хрящевых пластинках эпифиза головки бедра и апофизов малого и большого вертелов, гиперостоз в области медиальных отделов шейки бедренной кости.
Во II стадии определяется смещение эпифиза в заднемедиальном направлении, эпицервикальный угол уменьшается до 60°.
В III стадии смещение эпифиза увеличивается, эпицервикальный угол меньше 60°, нарушается форма тазобедренного сустава, уменьшается шеечно-диафизарный угол (менее 120°).
В IV стадии возникает полное отделение эпифиза от шейки бедренной кости по типу перелома, шеечно-диафизарный угол уменьшается до 90-75°, вы-
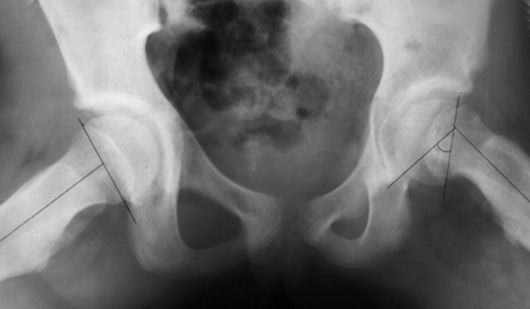
Рис. 235. Юношеский эпифизеолиз головки бедренной кости
являются ранние признаки консолидации головки и шейки бедренной кости в порочном положении.
В V стадии определяется полное сращение головки и шейки бедренной кости в порочном положении.
Основной метод лечения хирургический. При I стадии для предотвращения возможности смещения эпифиза осуществляют внесуставной эпифизео-дез с трансоссальным введением спиц в шейку бедренной кости и эпифиз. При II стадии в шейку и головку бедренной кости вводят 2-3 спицы и аутоили аллотрансплантаты, перекрывающие ростковую зону.
При III стадии производят межвертельную углообразную или шаровидную деторсионно-ротационную вальгизирующую остеотомию с металлоостеосин-тезом.
В IV стадии операция состоит в закрытой репозиции смещенного эпифиза в сочетании с чресшеечной фиксацией последнего спицами Ноулиса, введением аутоили аллотрансплантата после туннелизации шейки и головки.
При V стадии осуществляют эпифизеодез с корригирующей остеотомией проксимального конца бедренной кости для устранения порочного положения конечности.
Послеоперационное ведение больного строго индивидуально.
В случае острого эпифизеолиза лечение начинают со скелетного вытяжения бедра в положении сгибания (не более 30°), отведения и внутренней ротации (в течение 2 нед.). После репозиции шейки бедренной кости и эпифиза и центрации головки в вертлужной впадине продолжение лечения может быть различным: скелетное вытяжение до 8 нед., иммобилизация тазобедренной гипсовой повязкой до 3 мес, оперативная внесуставная фиксация шейки и эпифиза бедренной кости пучком спиц, шурупами, костным трансплантатом.
После операции назначают строгий постельный режим до 3 нед., затем расширенный постельный режим до 6 нед. Ходьбу без опоры на оперированную ногу разрешают через 11/2 мес, без костылей - через 3 мес.
Раннее выявление эпифизеолиза, раннее оперативное лечение и грамотно проведенная реабилитация являются надежной профилактикой коксартроза у взрослых пациентов.