Эндокринология : учебник. И.И. Дедов - 2009. - 432 с.: ил.
|
|
|
|
ГЛАВА 3 ЗАБОЛЕВАНИЯ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
3.1. АНАТОМИЯ И ФИЗИОЛОГИЯ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Щитовидная железа (ЩЖ) является самой крупной эндокринной железой человеческого организма, имеющей только внутрисекреторную функцию. Ее масса у взрослого человека составляет около 15-20 г. ЩЖ состоит из двух долей и перешейка, располагающихся на передней поверхности трахеи и по ее бокам (рис. 3.1). Иногда от перешейка отходит дополнительная пирамидальная доля. ЩЖ развивается из выпячивания середины дна первичной глотки. Ее закладка происходит на 15 неделе внутриутробного развития, к 18-20 неделе она начинает продуцировать тиреоидные гормоны. При нарушениях эмбриогенеза ЩЖ могут развиваться различные аномалии ее расположения. К ним относятся кисты щитоязычного протока, язычная ЩЖ, а также срединные и боковые остатки тиреоидной ткани.
ЩЖ состоит из клеток двух разных видов: фолликулярных и парафолликулярных (С-клетки). Фолликулярные клетки, продуцирующие тироксин (Т4) и трийодтиронин (Т3), формируют в железе многочисленные фолликулы, каждый из которых состоит из центральной полости, заполненной коллоидом, главной составляющей которого является белок тиреоглобулин, окруженной одним слоем кубовидных эпителиальных клеток (рис. 3.2). Парафолликулярные клетки (С- клетки) продуцируют белковый гормон кальцитонин.
Т4 и Т3 синтезируются из аминокислоты тирозина. Кроме того, существует биологически неактивный реверсивный трийодтиронин (рТ3), который образуется при дейодировании внутреннего кольца Т4 (рис. 3.3).
Необходимым структурным компонентом тиреоидных гормонов является йод. Этот микроэлемент практически полностью всасывается в кишечнике, откуда в ионизированной форме поступает в плазму крови. Перенос йода внутрь тироцита энергозависим и осуществляется сопряженно с обратной транспортировкой натрия натрий-йодидным симпортером (NIS). В клетках ион йода окисляется, после чего
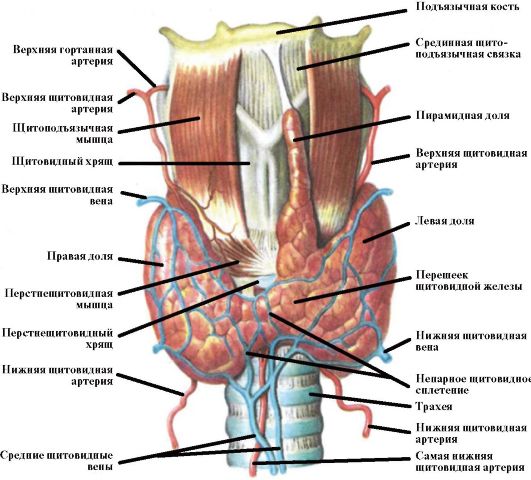 Рис. 3.1. Щитовидная железа
Рис. 3.1. Щитовидная железа
подвергается органификации, присоединяясь к остаткам молекул аминокислоты тирозина, которые присутствуют в тиреоглобулине,
синтезируемом фолликулярными клетками. После этого тиреоглобулин изменяет свою структуру таким образом, что тирозильные остатки сближаются друг с другом, облегчая реакцию конденсации между ними. Йодирование тирозильных остатков и реакция конденсации происходят при участии тиреоидной пероксидазы
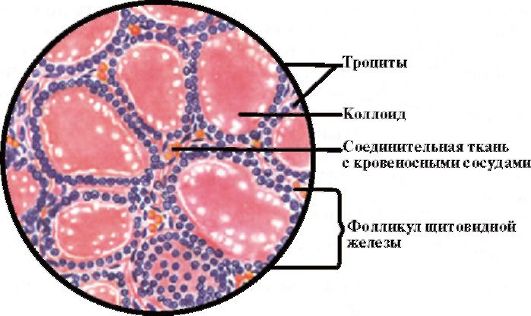 Рис. 3.2. Гистологическое строение щитовидной железы
Рис. 3.2. Гистологическое строение щитовидной железы
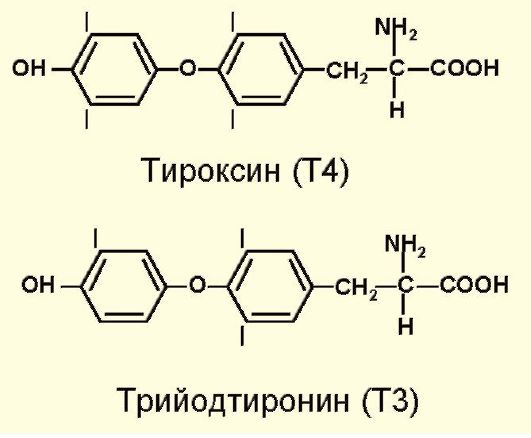 Рис. 3.3. Структура гормонов щитовидной железы
Рис. 3.3. Структура гормонов щитовидной железы
(ТПО), локализованной в микросомальной фракции фолликулярных клеток. Далее содержащий связанные йодтиронины тиреоглобулин транспортируется через апикальную мембрану и откладывается в коллоидной полости фолликула, после чего вновь поступает в тироциты, перемещается к их базальной мембране, высвобождает йодтиронины, которые выделяются в кровь. Попав в кровь, Т4 и Т3 разносятся по организму в основ-
ном в связанном с белками плазмы (тироксинсвязывающий глобулин, преальбумин (транстиретин), альбумин) виде. Период полужизни в крови для Т4 равен 7-9 дням, для Т3 - 2 дням.
Свободные йодтиронины относительно легко проникают сквозь мембрану клеток. Внутриклеточные эффекты тиреоидных гормонов тесно связаны с процессами их метаболизма (в первую очередь с механизмами дейодирования). Самым важным из таких превращений является конверсия Т4 в более активный Т3 . Поскольку с рецепторами тиреоидных гормонов непосредственно взаимодействует преимущественно Т3 , а не Т4, последний принято рассматривать как прогормон, а Т3 - как истинный гормон. Т3 , воздействуя на специфические ядерные рецепторы, которые присутствуют в большинстве клеток, приводит к изменению экспрессии различных генов, что проявляется физиологическими эффектами тиреоидных гормонов, главным из которых является регуляция и поддержание основного обмена. Лишь 5- 10 % циркулирующего в крови Т3 синтезируется непосредственно ЩЖ; его большая часть образуется в результате дейодирования Т4 в периферических тканях. Превращение (конверсия) Т4 в Т3 катализируется различными дейодиназами, обладающими тканевой специфичностью.
Функция ЩЖ регулируется аденогипофизом по принципу отрицательной обратной связи. Тиреотропный гормон (ТТГ) гипофиза стимулирует продукцию тиреоидных гормонов, которые подавляют продукцию ТТГ (рис. 3.4).
Эффекты тиреоидных гормонов многообразны. Они обеспечивают поддержание основного обмена в большинстве клеток, регулируя
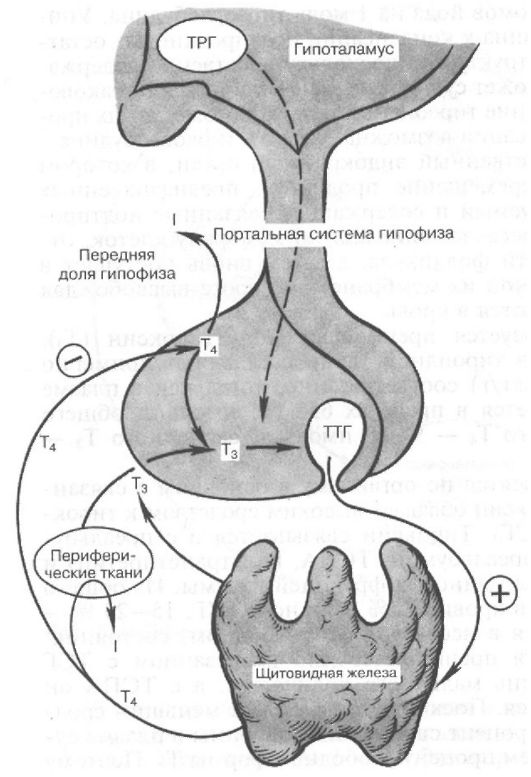 Рис. 3.4. Регуляция секреции тиреоидных гормонов
Рис. 3.4. Регуляция секреции тиреоидных гормонов
их метаболическую активность, а также процессы пролиферации и апоптоза. Нормальный уровень тиреоидных гормонов необходим для функционирования всех без исключения систем организма, а при нарушениях функции ЩЖ патологические изменения носят полисистемный характер. Тиреоидные гормоны необходимы для формирования нервной и других систем плода и новорожденного. Дефицит тироксина в этот период приводит к значительным неврологическим нарушениям. В целом эффект тиреоидных гормонов традиционно описывается как калоригенный: под их действием
происходит повышение основного обмена за счет роста потребления кислорода и увеличения теплопродукции тканей.
3.2. МЕТОДЫ ОБСЛЕДОВАНИЯ ПАЦИЕНТОВ С ЗАБОЛЕВАНИЯМИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
3.2.1 Физикальные методы
Клиническаядиагностика заболеваний ЩЖ подразумеваетвыявление у пациента симптомов тиреотоксикоза, гипотиреоза, а также изменений структуры ЩЖ, которые могут протекать на фоне ее нормальной, сниженной и повышенной функции. В диагностике заболеваний ЩЖ важное место занимают данные пальпации. У подавляющего числа людей ЩЖ в норме достаточно хорошо пальпируется. Пальпация может быть затруднена у тучных пациентов и у мужчин с выраженной мускулатурой шеи. Прощупывание ЩЖ осуществляется во время проглатывания слюны, когда гортань вместе с ЩЖ сначала поднимается вверх, а затем опускается вниз. В этот момент ЩЖ перекатывается через пальцы и ощущается как мягко-эластичный валик. Врач во время пальпации может стоять лицом к лицу пациента (при этом пальпация осуществляется двумя большими пальцами) или находиться сзади (пациент при этом сидит) и пальпировать ЩЖ двумя указательными и средними пальцами (рис. 3.5).
Следует иметь в виду, что пальпация ЩЖ является недостаточно точным методом оценки размеров и структуры ЩЖ - вероятность ошибочного заключения достигает 30 % и более. Тем не менее показанием для использования более точных методов оценки функции ЩЖ,
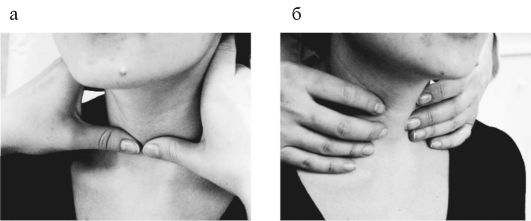 Рис. 3.5. Методы пальпации щитовидной железы
Рис. 3.5. Методы пальпации щитовидной железы
таких как УЗИ, являются именно результаты пальпации. В настоящее время наиболее распространена классификация, предложенная ВОЗ для оценки размеров эндемического зоба при эпидемиологических исследованиях (табл. 3.1). Эта классификация исходит из того, что размеры долей ЩЖ в норме соответствуют по размеру дистальной фаланги большого пальца пациента. Если по данным пальпации доля ЩЖ превышает этот размер, но сама железа не видна при осмотре - говорят о зобе I степени. Если железа видна при осмотре - говорят о зобе II степени (видимый зоб). Достоинствами этой классификации являются ее простота и доступность, а также возможность сравнить данные о распространенности зоба в разных регионах. Следует иметь в виду, что эта классификация создавалась преимущественно для эпидемиологической оценки распространенности эндемического зоба.
Табл. 3.1. Классификация зоба (ВОЗ, 2001)
 3.2.2. Лабораторные методы
3.2.2. Лабораторные методы
Основным методом оценки функции ЩЖ является определение уровня ТТГ. Без определения уровня ТТГ по современным представлениям оценка функции ЩЖ в большинстве случаев некорректна. При обнаружении повышенного уровня ТТГ исследование дополняется определением уровня Т4, при сниженном уровня ТТГ - Т4 и Т3 (рис. 3.6). Часто практикуемое назначение сразу трех гормональных тестов (ТТГ, Т4 и Т3) для диагностики заболеваний ЩЖ (или контроля эффективности их лечения) является явно избыточным и значительно повышает стоимость обследования.
Продукция ТТГ гипофизом и Т4 ЩЖ находятся в отрицательной логарифмической зависимости. Другими словами, при минималь-
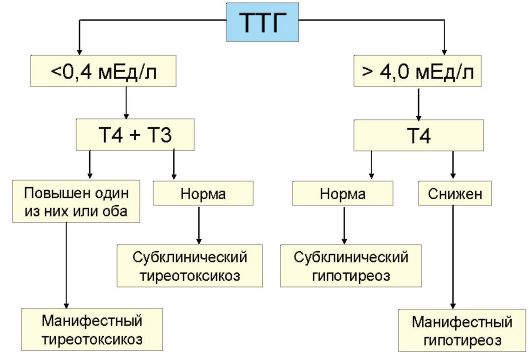 Рис. 3.6. Оценка функции щитовидной железы
Рис. 3.6. Оценка функции щитовидной железы
ном изменении уровня продукции тиреоидных гормонов происходит многократное противоположное изменение уровня ТТГ. Эта закономерность лежит в основе выделения так называемых субклинических нарушений функции ЩЖ, под которыми подразумевают изолированное изменение уровня ТТГ при нормальном уровне тиреоидных гормонов. Субклинический гипотиреоз (минимальная недостаточность ЩЖ) - это изолированное повышение уровня ТТГ при нормальном уровне Т4, а субклинический тиреотоксикоз - снижение уровня ТТГ при нормальном уровне Т4 и Т3. В последнем случае, то есть при обнаружении сниженного уровня ТТГ, как указывалось, необходимо определение обоих тиреоидных гормонов (Т4 и Т3), поскольку возможны ситуации, когда снижение ТТГ сопровождается нормальным уровнем Т4, но повышенным Т3 (Т3-тиреотоксикоз), что чаще встречается при многоузловом токсическом зобе у пожилых пациентов. Важно отметить, что факт наличия или отсутствия клинических симптомов для диагностики субклинического нарушения функции ЩЖ не имеет значения: эти феномены имеют исключительно лабораторные критерии диагностики. Под явным или манифестным гипотиреозом подразумевают ситуацию, когда наряду с повышенным уровнем ТТГ определяется снижение уровня Т4, а под явным или манифестным тиреотоксикозом - ситуацию, когда наряду со сниженным уровнем ТТГ повышена концентрация в крови Т4 и Т3 (рис. 3.6).
Современные методы гормонального исследования позволяют определять общие фракции Т4 и Т3 (свободный гормон + связанный) и отдельно уровень свободных Т4 и Т3 . Определение последних за редким исключением (пациенты реанимационных отделений) имеет значительно большее диагностическое значение. Во-первых, это связано с тем, что именно свободные тиреоидные гормоны обладают биологической активностью, а во-вторых, на их концентрации не отражаются колебания уровня связывающих белков, которые происходят при целом ряде заболеваний и состояний.
Определение уровня тиреоглобулина используется для мониторинга пациентов, получивших комплексную терапию (тиреоидэктомия + терапия 131I) по поводу высокодифференцированного рака ЩЖ. У пациентов, которым была проведена полная аблация тиреоидной ткани, появление (повышение) уровня тиреоглобулина в крови может свидетельствовать о рецидиве опухоли.
Для диагностики аутоиммунных заболеваний ЩЖ используется определение уровня различных аутоантител. К классическим антителам относятся антитела к тиреоглобулину (АТ-ТГ) и антитела к тиреоидной пероксидазе (АТ-ТПО). Эти антитела являются суррогатным маркером любой аутоиммунной патологии ЩЖ, то есть определение их уровня не позволяет дифференцировать многочисленные аутоиммунные заболевания ЩЖ. Они определяются примерно у 70-90 % пациентов с аутоиммунным тиреоидитом, у 75 % пациентов с болезнью Грейвса и не менее чем у 10 % здоровых людей без нарушения функции ЩЖ. Более специфичным исследованием является определение антител к рецептору ТТГ (АТ-рТТГ), которые определяются в большинстве случаев болезни Грейвса.
Определение уровня кальцитонина используется для диагностики медуллярного рака ЩЖ (рак, происходящий из С-клеток), при этом может оцениваться его базальный уровень и его динамика после введения таких стимуляторов, как пентагастрин и глюконат кальция.
Определение экскреции йода с мочой используется в рамках эпидемиологических исследований для оценки выраженности йодного дефицита в той или иной местности. В клинической практике, то есть для диагностики каких-либо заболеваний это исследование не используется. Исключение составляют йодиндуцированные заболевания ЩЖ, при которых для подтверждения факта поступления в организм избытка йода может быть оценен уровень йодурии, который в данном случае будет значительно повышен.
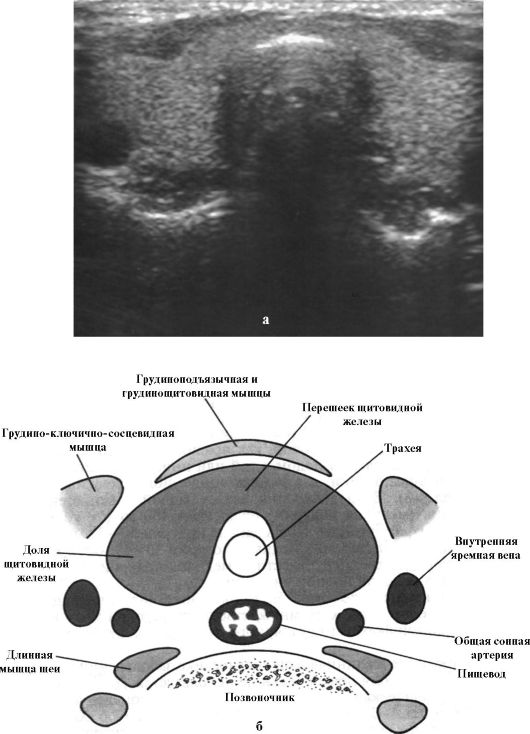 Рис. 3.7. Поперечный срез ЩЖ на мониторе ультразвукового аппарата (а) и на схеме (б)
Рис. 3.7. Поперечный срез ЩЖ на мониторе ультразвукового аппарата (а) и на схеме (б)
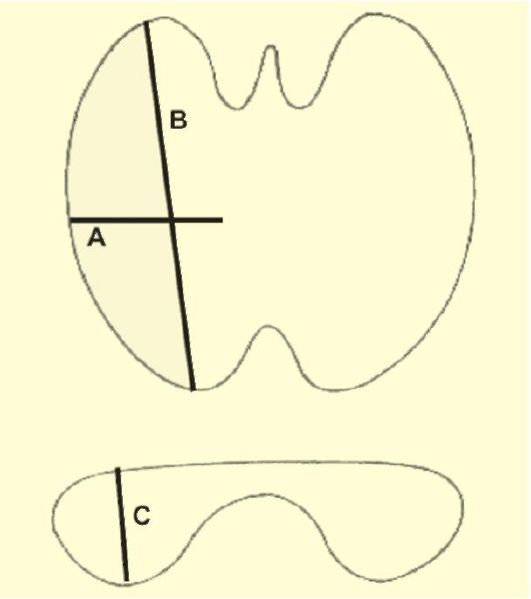 Рис. 3.8. Определение
объема ЩЖ при помощи УЗИ. Объем железы равен сумме объемов ее долей,
которые рассчитываются по формуле: A ? B ? C ? 0,479
Рис. 3.8. Определение
объема ЩЖ при помощи УЗИ. Объем железы равен сумме объемов ее долей,
которые рассчитываются по формуле: A ? B ? C ? 0,479
3.2.3. Инструментальные методы
К инструментальным методам обследования пациентов с заболеваниями ЩЖ относятся УЗИ, сцинтиграфия, пункционная биопсия, компьютерная и магнитнорезонансная томография, а также ряд других методов. Наиболее простым, информативным, безопасным и неинвазивным методом исследования ЩЖ является УЗИ, позволяющее достаточно точно определить размеры долей, наличие и размер узловых образований, особенностей эхоструктуры (рис. 3.7 а, б). Ультразвуковой контроль существенно повышает информативность пункционной биопсии ЩЖ.
Особенности эхоструктуры как самой ЩЖ, так и обнаруженных в ней узловых образований в сочетании с данными других методов исследований могут иметь важное диагностическое значение, тем не менее, само по себе УЗИ не позволяет устанавливать морфологическую структуру выявленных изменений. Важным вопросом, на который позволяет ответить УЗИ, является оценка объема ЩЖ. Для расчета объема доли ЩЖ определяют ее наибольшие размеры в трех проекциях. Произведение полученных результатов умножают на коэффициент эллипсоидности (0,479) (рис. 3.8).
У взрослых женщин объем ЩЖ в норме не превышает 18 мл, у взрослых мужчин - 25 мл. Таким образом, зобом или патологическим увеличением ЩЖ следует считать превышение ее объема у женщин более 18 мл, а у мужчин - более 25 мл по данным УЗИ (табл. 3.2). Единые подходы к оценке объема ЩЖ у детей в настоящее время отсутствуют. Наиболее просто использовать ориентировочные возрастные нормативы; в эпидемиологических исследованиях, как правило, принято использование нормативов, в которых учитывается площадь поверхности тела ребенка.
Табл. 3.2. Оценка объема щитовидной железы с учетом возраста
 Если гормональное исследование оценивает функцию ЩЖ, а пальпация и УЗИ - ее структуру, то сцинтиграфия ЩЖ позволяет
получить ее морфофункциональную характеристику, в частности, оценить
два основных параметра: захват радиофармпрепарата и его распределение в
ЩЖ. Собственно для оценки размера, выявления структурных изменений
(наличие узлов) и функции ЩЖ сцинтиграфия малоинформативна. Для
сцинтиграфии ЩЖ наиболее часто используется изотоп технеция 99mТс-пертехнетат (99mТс),
который представляет собой моновалентный анион, подобно йодиду активно
захватывающийся ЩЖ, но в отличие от йода не подвергающийся
органификации. Короткий период полураспада 99тТс (6 ч) наряду с незначительным поглощением изотопа ЩЖ значительно уменьшает дозу облучения. 99тТс
вводят внутривенно и производят исследование практически сразу после
введения изотопа. Основными показаниями к проведению сцинтиграфии с 99mТс являются:
Если гормональное исследование оценивает функцию ЩЖ, а пальпация и УЗИ - ее структуру, то сцинтиграфия ЩЖ позволяет
получить ее морфофункциональную характеристику, в частности, оценить
два основных параметра: захват радиофармпрепарата и его распределение в
ЩЖ. Собственно для оценки размера, выявления структурных изменений
(наличие узлов) и функции ЩЖ сцинтиграфия малоинформативна. Для
сцинтиграфии ЩЖ наиболее часто используется изотоп технеция 99mТс-пертехнетат (99mТс),
который представляет собой моновалентный анион, подобно йодиду активно
захватывающийся ЩЖ, но в отличие от йода не подвергающийся
органификации. Короткий период полураспада 99тТс (6 ч) наряду с незначительным поглощением изотопа ЩЖ значительно уменьшает дозу облучения. 99тТс
вводят внутривенно и производят исследование практически сразу после
введения изотопа. Основными показаниями к проведению сцинтиграфии с 99mТс являются:
• дифференциальная диагностика различных патогенетических вариантов тиреотоксикоза: истинной гиперфункции ЩЖ (болезнь Грейвса, функциональная автономия ЩЖ) и деструктивного тиреотоксикоза (послеродовый тиреоидит, подострый тиреоидит, амиодарон-индуцированный тиреотоксикоз 2 типа). В первом случае при сцинтиграфии будет определяться повышение захвата 99тТс (рис. 3.9 а), а во втором - его снижение или полное отсутствие (рис. 3.9 б);
• диагностика компенсированной (на фоне эутиреоза) и декомпенсированной (при тиреотоксикозе) функциональной автономии ЩЖ. По этому показанию исследование чаще всего проводится при узловом и многоузловом зобе.
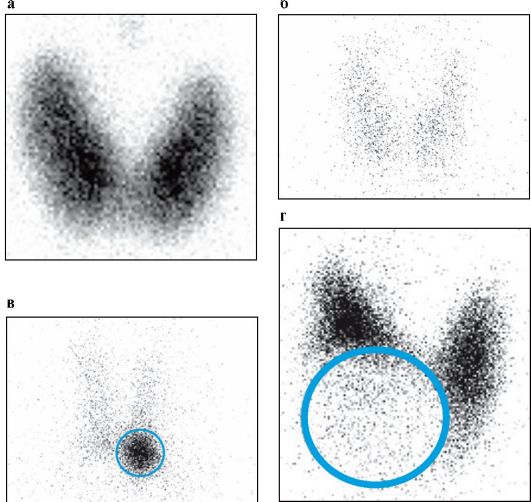 Рис. 3.9. Сцинтиграфия ЩЖ с 99mТс. Обведенные участки соответствуют
Рис. 3.9. Сцинтиграфия ЩЖ с 99mТс. Обведенные участки соответствуют
узловым образованиям, выявленным при УЗИ:
а - диффузное усиление захвата 99mТс при болезни Грейвса; б - диффузное снижение захвата 99mТс при деструктивном тиреотоксикозе (подострый тиреоидит);
в - «горячий» узел левой доли ЩЖ в сочетании со снижением захвата 99mТс оставшейся ЩЖ (узловой токсический зоб);
г - «холодный» узел правой доли ЩЖ (узловой эутиреоидный коллоидный пролиферирующий зоб)
При диагностике функциональной автономии ЩЖ выделяют несколько сцинтиграфических характеристик узловых образований. «Горячий», или автономно функционирующий узел, диагностиру-
ется в тех случаях, когда область ЩЖ, определяемая при УЗИ как узел, накапливает больше изотопа, чем нормальная ткань (рис. 3.9 в). Накопление изотопа в ткани, окружающей узел, может быть либо сниженным, либо полностью подавленным; при этом визуализируется только гиперфункционирующий узел. «Теплые» узлы имеют такой же уровень накопления изотопа, как и окружающая ткань. «Холодные» узлы определяются как дефекты накопления изотопа на сцинтиграмме (рис. 3.9 г). В функциональном отношении они имеют нормальную или пониженную активность. Сцинтиграфия ЩЖ не позволяет сделать заключение о морфологии узловых образований: наиболее ценна в этом плане тонкоигольная биопсия. «Холодные» узлы оказываются злокачественными опухолями примерно в 5-8 % случаев, «горячие» узлы - исключительно редко.
Наряду с 99тТс для сцинтиграфии ЩЖ используется два изотопа йода: 131I и 123I. Из-за относительно большой лучевой нагрузки и достаточно большого периода полураспада использование 131I ограничивается ситуациями, когда на основании показателей его захвата и элиминации из ЩЖ рассчитывается лечебная доза этого же изотопа (терапия 131I токсического зоба и рака ЩЖ). Кроме того, он может применяться для визуализации функционирующих, не потерявших способность захватывать йод, метастазов высокодифференцированного рака ЩЖ. С этой целью значительно удобнее использовать 123I, поскольку сцинтиграфию в данном случае можно проводить спустя небольшой период времени после введения изотопа.
Поскольку в отличие от 99тТс изотопы йода подвергаются органификации, они незаменимы для этиологической диагностики врожденного гипотиреоза, связанного с дефектами органификации йода. Кроме того, изотопы йода могут использоваться для визуализации эктопированной ткани ЩЖ.
Тонкоигольная аспирационная биопсия (ТАБ) ЩЖ показана при всех пальпируемых узловых образованиях, а также при образованиях, превышающих (по данным УЗИ) в диаметре 1 см. При узловых образованиях меньшего размера ТАБ может быть показана в том случае, если имеются подозрительные на рак ЩЖ эхографические признаки. Основное назначение ТАБ - дифференциальная диагностика заболеваний, протекающих с узловым зобом. Проведение ТАБ под ультразвуковым контролем значительно повышает информативность исследования, особенно в случае кистозных и небольших по диаметру узловых образований. Следует отметить, что за ТАБ следует цитологическое, а не гистологическое исследование, то есть изучение разрозненных групп клеток, а не среза ЩЖ.
Из дополнительных методов исследования в диагностике заболеваний ЩЖ могут использоваться МРТ и КТ. Показания для них ограничиваются достаточно редкими случаями, когда необходимо визуализировать крупный загрудинный зоб, сдавливающий органы средостенья. В данном случае значительно более информативна МРТ. Кроме того, она может использоваться для диагностики и оценки эффективности лечения эндокринной офтальмопатии. Среди инструментальных методов исследования не потеряла своего значения рентгенография органов шеи (трахеи, пищевода) и загрудинного пространства с контрастированием пищевода барием. Данное исследование показано при подозрении на смещение трахеи при зобе значительного размера.
3.3. КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Общепринятая классификация заболеваний ЩЖ отсутствует. Наиболее простой принцип, который мог бы лечь в основу такой классификации - функциональный (синдромальный), т.е. В зависимости от функции ЩЖ (гипертиреоз, гипотиреоз, эутиреоз). В таблице 3.3. представлен сокращенный вариант такой классификации.
Предваряя обсуждение классификации необходимо рассмотреть ряд терминологических вопросов. Под термином тиреотоксикоз подразумевается клинический синдром, обусловленный избытком тиреоидных гормонов в организме, при этом патогенетически он подразделяется на три варианта:
♦ Гипертиреоз - гиперпродукция тиреоидных гормонов ЩЖ (болезнь Грейвса, многоузловой токсический зоб)
♦ Деструктивный (тиреолитический) тиреотоксикоз, который представляет собой типовую патологическую реакцию ЩЖ на ряд внешних и внутренних факторов, заключающуюся в массированной деструкции тиреоидных фолликулов с выходом их содержимого (тиреоидных гормонов) в кровеносное русло. При этом варианте гиперфункция ЩЖ отсутствует. Заболевания, протекающие с деструктивным тиреотоксикозом, например подострый и послеродовый тиреоидиты, сопровождаются значительно менее выраженным тиреотоксикозом, чем обусловленные гиперфункцией ЩЖ (болезнь Грейвса). Кроме того, они, как правило, имеют хороший прогноз.
♦ Медикаментозный тиреотоксикоз, связанный с передозировкой препаратов тиреоидных гормонов.
Табл. 3.3. Функциональная (синдромальная) классификация заболеваний щитовидной железы
 ЩЖ относится к гипофиззависимым железам, недостаточность которых подразделяется на первичную и вторичную. Под первичным гипотиреозом подразумевают дефицит тиреоидных гормонов в организме, обусловленный патологией (разрушением, удалением) самой ЩЖ, а под вторичным гипотиреозом -
дефицит тиреоидных гормонов, обусловленный снижением (отсутствием)
трофических и секреторных эффектов ТТГ на ЩЖ (гипоталамо-гипофизарный
гипотиреоз).
ЩЖ относится к гипофиззависимым железам, недостаточность которых подразделяется на первичную и вторичную. Под первичным гипотиреозом подразумевают дефицит тиреоидных гормонов в организме, обусловленный патологией (разрушением, удалением) самой ЩЖ, а под вторичным гипотиреозом -
дефицит тиреоидных гормонов, обусловленный снижением (отсутствием)
трофических и секреторных эффектов ТТГ на ЩЖ (гипоталамо-гипофизарный
гипотиреоз).
Под зобом (струмой), как указывалось, подразумевается увеличение объема ЩЖ выше установленных нормативов (18 мл - у женщин, 25 мл - у мужчин). По макроскопической характеристике он подразделяется на диффузный (увеличена вся ЩЖ), узловой, многоузловой (два и более узловых образования) и смешанный (сочетание
общего увеличения ЩЖ с наличием одного или нескольких узловых образований). По функциональному состоянию ЩЖ зоб бывает эутиреоидным, токсическим и протекающим со снижением функции ЩЖ.
Несмотря на всю простоту и логику классификации заболеваний ЩЖ, которая приведена в табл. 3.3, она имеет ряд недостатков. Основной из них заключается в том, что при большинстве заболеваний функция ЩЖ не является постоянной. Это относится ко всем заболеваниям ЩЖ, протекающим с деструктивным тиреотоксикозом. При хроническом аутоиммунном тиреоидите той или иной длительности эутиреоидная фаза может закончиться субклиническим, а затем явным гипотиреозом. При многоузловом зобе в регионах йодного дефицита по мере нарастания функциональной автономии тироцитов эутиреоз постепенно сменяется тиреотоксикозом. В связи с этим, в настоящее время целесообразнее подразделять заболевания ЩЖ в зависимости от их этиологии (табл. 3.4).
К первой группе относится достаточно много аутоиммунных заболеваний ЩЖ. По своей общей популяционной распространенности они занимают первое место в ряду другой аутоиммунной патологии человека. Еще чаще встречаются доброкачественные гиперпластические процессы ЩЖ, к которым относятся различные формы коллоидного пролиферирующего зоба. Наиболее часто формированию зоба способствуют различные зобогенные факторы, самым распространенным среди которых является дефицит поступления йода в организм и ЩЖ. Здесь следует отметить уникальную особенность тиреоидной патологии в целом: спектр, распространенность и прогноз большинства заболеваний ЩЖ будет во многом зависеть о того, в регионе с каким потреблением йода (недостаточным, нормальным, избыточным) проживает пациент.
Табл. 3.4. Этиологическая классификация заболеваний ЩЖ
 * Эту группу заболеваний можно более академично обозначить, как доброкачественные гиперпластические процессы в ЩЖ.
* Эту группу заболеваний можно более академично обозначить, как доброкачественные гиперпластические процессы в ЩЖ.
Инфекционные тиреопатии, за исключением подострого тиреоидита, этиология которого до конца не выяснена, встречаются относительно редко, как и в целом инфекционные заболевания всех эндокринных желез. К отдельным категориям заболеваний ЩЖ относятся опухоли, которые значительно отличаются по морфологии и прогнозу, и врожденные (наследственные) заболевания, для части которых на сегодняшний день уже известна непосредственная причина развития.
3.4. БОЛЕЗНЬ ГРЕЙВСА
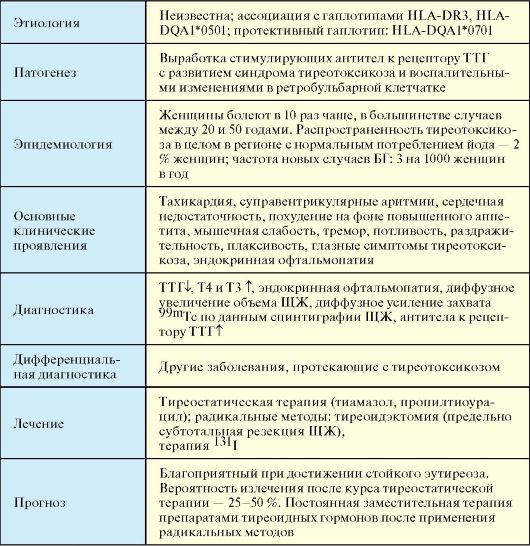
Болезнь Грейвса (БГ, болезнь Базедова, диффузный токсический зоб) - системное аутоиммунное заболевание, развивающееся вследствие выработки антител к рецептору тиреоторопного гормона (ТТГ), клинически проявляющееся поражением ЩЖ с развитием синдрома тиреотоксикоза в сочетании с экстратиреоидной патологией: эндокринной офтальмопатией, претибиальной микседемой, акропатией (табл. 3.5). Впервые заболевание было описано в 1825 г. Калебом Парри, в 1835 г. - Робертом Грейвсом, а в 1840 г. - Карлом фон Базедовым.
Табл. 3.5. Болезнь Грейвса
 В России в качестве синонима термина БГ до последнего времени традиционно используется термин диффузный токсический зоб, который не лишен ряда существенных недостатков. Во-первых, он характеризует лишь макроскопическое (диффузный зоб) и функциональное (токсический) изменение
ЩЖ, которое не является облигатным для БГ: с одной стороны, увеличения
железы может не быть, с другой, он может быть не диффузным. Кроме того,
диффузное увеличение ЩЖ в сочетании с тиреотоксикозом может иметь место
при других ее заболеваниях. Использование более широкого термина
«болезнь», а не просто токсический зоб, более оправдано, поскольку он в
большей мере подчеркивает системность аутоиммунного процесса. Кроме
того, во всем мире традиционно используется и узнается именно термин БГ,
а в немецко-говорящих странах - болезнь Базедова.
В России в качестве синонима термина БГ до последнего времени традиционно используется термин диффузный токсический зоб, который не лишен ряда существенных недостатков. Во-первых, он характеризует лишь макроскопическое (диффузный зоб) и функциональное (токсический) изменение
ЩЖ, которое не является облигатным для БГ: с одной стороны, увеличения
железы может не быть, с другой, он может быть не диффузным. Кроме того,
диффузное увеличение ЩЖ в сочетании с тиреотоксикозом может иметь место
при других ее заболеваниях. Использование более широкого термина
«болезнь», а не просто токсический зоб, более оправдано, поскольку он в
большей мере подчеркивает системность аутоиммунного процесса. Кроме
того, во всем мире традиционно используется и узнается именно термин БГ,
а в немецко-говорящих странах - болезнь Базедова.
Этиология
БГ является мультифакторным заболеванием, при котором генетические особенности иммунного реагирования реализуются на фоне действия факторов окружающей среды. Наряду с этнически ассоциированной генетической предрасположенностью (носительство гаплотипов HLA-B8, -DR3 и -DQA1*0501 у европейцев), в патогенезе БГ определенное значение придается психосоциальным и средовым факторам. Эмоциональные стрессорные и экзогенные факторы, такие как курение, могут способствовать реализации генетической предрасположенности к БГ. Курение повышает риск развития БГ в 1,9 раза, а развития эндокринной офтальмопатии при уже имеющейся БГ - в 7,7 раза. БГ в ряде случаев сочетается с другими аутоиммунными эндокринными заболеваниями (сахарный диабет 1 типа, первичный гипокортицизм); такое сочетание принято обозначать как аутоиммунный полигландулярный синдром II типа (см. п. 9.1.2).
В результате нарушения иммунологической толерантности, аутореактивные лимфоциты (CD4+ и CD8+ T-лимфоциты, В-лимфоциты) при участии адгезивных молекул (ICAM-1, ICAM-2, Е-селектин, VCAM-1, LFA-1, LFA-3, CD44) инфильтрируют паренхиму ЩЖ, где распознают ряд антигенов, которые презентируются дендридными клетками, макрофагами и В-лимфоцитами. В дальнейшем цитокины и сигнальные молекулы инициируют антигенспецифическую стимуляцию В-лимфоцитов, в результате чего начинается продукция специфических иммуноглобулинов против различных компонентов тироцитов. В патогенезе БГ основное значение придается образованию стимулирующих антител к рецептору ТТГ (АТ-рТТГ) (рис. 3.10).
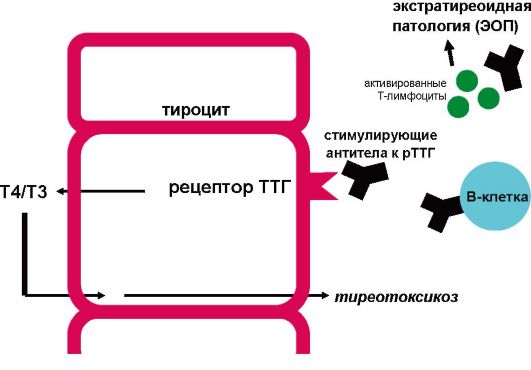 Рис. 3.10. Этиология и патогенез болезни Грейвса
Рис. 3.10. Этиология и патогенез болезни Грейвса
В отличие от большинства других аутоиммунных заболеваний при БГ происходит не разрушение, а стимуляция органа-мишени. В данном случае аутоантитела вырабатываются к фрагменту рецептора ТТГ, который находится на мембране тироцитов. В результате взаимодействия с антителом этот рецептор приходит в активное состояние, запуская пострецепторный каскад синтеза тиреоидных гормонов (тиреотоксикоз) и, кроме того, стимулируя гипертрофию тироцитов (увеличение ЩЖ). По не вполне понятным причинам сенсибилизированные к антигенам ЩЖ Т-лимфоциты инфильтрируют и вызывают иммунное воспаление в ряде других структур, таких как ретробульбарная клетчатка (эндокринная офтальмопатия), клетчатка передней поверхности голени (претибиальная микседема).
Патогенез
Клинически наиболее значимым синдромом, развивающимся при БГ вследствие гиперстимуляции ЩЖ антителами к рецептору ТТГ, является тиреотоксикоз. Патогенез изменений со стороны органов и систем, развивающихся при тиреотоксикозе, заключается в значительном повышении уровня основного обмена, которое со временем приводит к дистрофическим изменениям. Самыми чувствительными к тиреотоксикозу структурами, в которых наиболее
высока плотность рецепторов к тиреоидным гормонам, являются сердечно-сосудистая (особенно миокард предсердий) и нервная системы.
Эпидемиология
В регионах с нормальным потреблением йода БГ является наиболее частым заболеванием в нозологической структуре синдрома тиреотоксикоза (если не принимать в расчет заболевания, протекающие с транзиторным тиреотоксикозом, такие как послеродовый тиреоидит и др.). В регионах различной выраженности йодного дефицита по распространенности в популяции с БГ конкурирует функциональная автономия ЩЖ (см. п. 3.9.2). Распространенность тиреотоксикоза в целом в регионе с нормальным потреблением йода достигает 2 % среди женщин; частота новых случаев БГ - 3 на 1000 женщин в год. Женщины болеют в 8-10 раз чаще, в большинстве случаев между 30 и 50 годами. Заболеваемость БГ одинакова среди представителей европейской и азиатской расы, но ниже среди негроидной расы. У детей и пожилых людей заболевание встречается достаточно редко.
Клинические проявления
Для БГ, в большинстве случаев, характерен относительно короткий анамнез: первые симптомы обычно появляются за 4-6 месяцев до обращения к врачу и постановки диагноза. Как правило, ключевые жалобы связаны с изменениями со стороны сердечно-сосудистой системы, так называемым катаболическим синдромом и эндокринной офтальмопатией (см. п. 3.5).
Основным симптомом со стороны сердечно-сосудистой системы является тахикардия и достаточно выраженные ощущения сердцебиений. Тиреотоксикоз сопровождается дилатацией резистивных артериол и децентрализацией кровообращения. С одной стороны это приводит к тому, что пациенты могут ощущать сердцебиения не только в грудной клетке, но и голове, руках, животе. С другой стороны, гиперкинетическое состояние сердца (высокая ЧСС) в сочетании с децентрализацией кровообращения приводит к повышению пульсового давления (разница между систолическим и диастолическим АД). ЧСС в покое при синусовой тахикардии, обусловленной тиреотоксикозом, может достигать 120-130 ударов в минуту.
При длительно существующем тиреотоксикозе, особенно у пожилых пациентов, развиваются выраженные дистрофические изменения в миокарде, частым проявлением которых являются суправен-
трикулярные нарушения ритма, а именно фибрилляция (мерцание) предсердий. Это осложнение тиреотоксикоза достаточно редко развивается у пациентов моложе 50 лет. Дальнейшее прогрессирование миокардиодистрофии приводит к развитию изменений миокарда желудочков и застойной сердечной недостаточности.
Как правило, выражен катаболический синдром, проявляющийся прогрессирующим похудением (порой на 10-15 кг и более, особенно у лиц с исходным избытком веса) на фоне нарастающей слабости и повышенного аппетита. Кожа больных горячая, иногда имеется выраженный гипергидроз. Характерно чувство жара, пациенты не мерзнут при достаточно низкой температуре в помещении. У некоторых пациентов (особенно в пожилом возрасте) может быть выявлен вечерний субфебрилитет.
Изменения со стороны нервной системы характеризуются психической лабильностью: эпизоды агрессивности, возбуждения, хаотичной непродуктивной деятельности сменяются плаксивостью, астенией (раздражительная слабость). Многие пациенты некритичны к своему состоянию и пытаются сохранить активный образ жизни на фоне достаточно тяжелого соматического состояния. Длительно существующий тиреотоксикоз сопровождается стойкими изменениями психики и личности пациента. Частым, но неспецифичным симптомом тиреотоксикоза является мелкий тремор: мелкая дрожь пальцев вытянутых рук выявляется у большинства пациентов. При тяжелом тиретоксикозе тремор может определяться во всем теле и даже затруднять речь пациента.
Для тиреотоксикоза характерны мышечная слабость и уменьшение объема мускулатуры, особенно проксимальных мышц рук и ног. Иногда развивается достаточно выраженная миопатия. Весьма редким осложнением (возможно проявлением БГ) является тиреотоксический гипокалиемический периодический паралич, который проявляется периодически возникающими резкими приступами мышечной слабости. При лабораторном исследовании выявляется гипокалиемия, повышение уровня КФК. Чаще встречается у представителей азиатской расы.
Интенсификация костной резорбции приводит к развитию синдрома остеопении, а сам тиреотоксикоз рассматривается как один из наиболее важных факторов риска остеопороза. Частыми жалобами пациентов являются выпадение волос, ломкость ногтей.
Изменения со стороны желудочно-кишечного тракта развиваются достаточно редко. У пожилых пациентов в ряде случаев может быть
диарея. При длительно существующем тяжелом тиреотоксикозе могут развиваться дистрофические изменения в печени (тиреотоксический гепатоз).
Нарушения менструального цикла встречаются достаточно редко. В отличие от гипотиреоза, тиреотоксикоз умеренной выраженности может не сопровождаться снижением фертильности и не исключает возможности наступления беременности. Антитела к рецептору ТТГ проникают через плаценту, в связи с чем у детей, рожденных (1 %) от женщин с БГ (иногда спустя годы после проведенного радикального лечения), может развиться транзиторный неонатальный тиреотоксикоз. У мужчин тиреотоксикоз достаточно часто сопровождается эректильной дисфункцией.
При тяжелом тиреотоксикозе у ряда пациентов выражены симптомы тиреогенной (относительной) надпочечниковой недостаточности, которую необходимо дифференцировать от истинной. К уже перечисленным симптомам добавляются гиперпигментация кожи, открытых частей тела (симптом Еллинека), артериальная гипотензия.
В большинстве случаев при БГ происходит увеличение размеров ЩЖ, которое, как правило, имеет диффузный характер. Нередко железа увеличена значительно. В ряде случаев над ЩЖ можно выслушать систолический шум. Тем не менее зоб не является облигатным симптомом БГ, поскольку он отсутствует не менее чем у 25-30 % пациентов.
Ключевое значение в диагностике БГ имеют изменения со стороны глаз, которые обсуждаются в п 3.5 и являются своеобразной «визит-
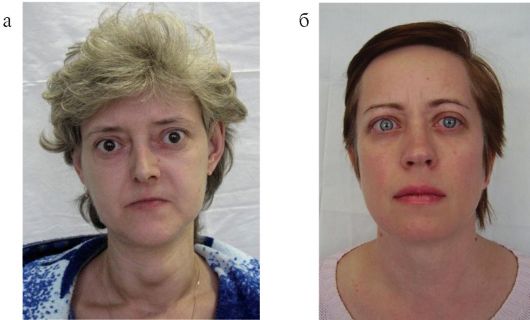 Рис. 3.11. Внешний вид пациентов с болезнью Грейвса (а, б)
Рис. 3.11. Внешний вид пациентов с болезнью Грейвса (а, б)
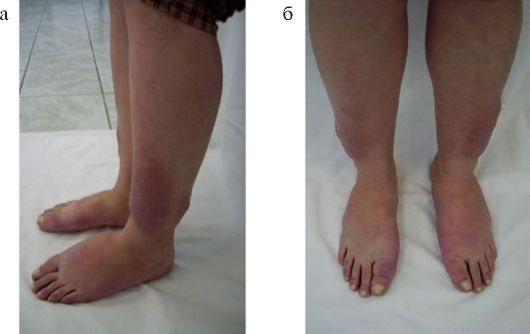 Рис. 3.12. Претибиальная микседема (а, б)
Рис. 3.12. Претибиальная микседема (а, б)
ной карточкой» БГ, т.е. их обнаружение у пациента с тиреотоксикозом практически однозначно свидетельствует именно о БГ, а не о другом заболевании. Очень часто благодаря наличию выраженной офтальмопатии в сочетании с симптомами тиреотоксикоза диагноз БГ очевиден уже при осмотре пациента (рис. 3.11).
Другим редким (менее 1 % случаев), ассоциированным с БГ, заболеванием является претибиальная микседема (рис. 3.12). Патогенез поражения клетчатки претибиальной области, вероятно, аналогичен таковому при ЭОП (см. п. 3.5). Кожа передней поверхности голени становится отечной, уплотненной, пурпурно-красного цвета («апельсиновая корка»), часто сопровождается эритемой и зудом.
Клиническая картина тиреотоксикоза может иметь отклонения от классического варианта. Так, если у молодых БГ характеризуется развернутой клинической картиной, у пожилых пациентов ее течение зачастую олигоили даже моносимптомное (нарушение ритма сердца, субфебрилитет). При так называемом «апатическом» варианте течения БГ, который встречается у пожилых пациентов, клинические проявления включают потерю аппетита, депрессию, гиподинамию.
Весьма редким осложнением БГ (крайне редко других заболеваний, протекающих с тиреотоксикозом) является тиреотоксический криз, патогенез которого не вполне понятен, т.к. криз может развиваться и без запредельного повышения уровня тиреоидных гормонов в крови. Причиной тиреотоксического криза могут оказаться
сопутствующие БГ острые инфекционные заболевания, проведение оперативного вмешательства или терапии радиоактивным йодом на фоне выраженного тиреотоксикоза, отмена тиреостатической терапии, введение пациенту контрастного йодсодержащего препарата. Клинические проявления тиреотоксического криза включают резкое утяжеление симптомов тиреотоксикоза, гипертермию, спутанность сознания, тошноту, рвоту, иногда диарею. Регистрируется синусовая тахикардия свыше 120 уд/мин. Нередко отмечается мерцательная аритмия, высокое пульсовое давление с последующей выраженной гипотонией. В клинической картине может доминировать сердечная недостаточность, респираторный дистресс-синдром. Нередко выражены проявления относительной надпочечниковой недостаточности в виде гиперпигментации кожи. Кожные покровы могут быть желтушны вследствие развития токсического гепатоза. При лабораторном исследовании может выявляться лейкоцитоз (даже при отсутствии сопутствующей инфекции), умеренная гиперкальциемия, повышение уровня щелочной фосфатазы. Смертность при тиреотоксическом кризе достигает 30-50 %.
Диагностика
К диагностическим критериям БГ относят:
1. Лабораторно подтвержденный тиреотоксикоз (ТТГ↓, Т4 и/или Т3 ↑).
2. Эндокринную офтальмопатию (60-80 % случаев).
3. Диффузное увеличение объема ЩЖ (60-70 %).
4. Диффузное усиление захвата 99mTc по данным сцинтиграфии ЩЖ.
5. Повышенный уровень антител к рецептору ТТГ.
На первом этапе диагностики БГ необходимо подтвердить, что имеющаяся у пациента клиническая симптоматика (тахикардия, похудение, тремор) обусловлена синдромом тиреотоксикоза. С этой целью проводят гормональное исследование, которое обнаруживает снижение или даже полное подавление уровня ТТГ и повышение уровней Т4 и/или Т3. Дальнейшая диагностика направлена на дифференцировку БГ от других заболеваний, протекающих с тиреотоксикозом. При наличии клинически выраженной ЭОП диагноз БГ практически очевиден. В ряде случаев при отсутствии явной ЭОП имеет смысл осуществить ее активный поиск при помощи инструментальных методов (УЗИ и МРТ-орбит).
УЗИ при БГ, как правило, обнаруживает диффузное увеличение ЩЖ и характерную для всех ее аутоиммунных заболеваний гипоэхоген-
ность. Определение объема ЩЖ помимо всего необходимо для выбора метода лечения, так как прогноз консервативной тиреостатической терапии при зобе большого размера достаточно плохой. Проведение сцинтиграфии ЩЖ в типичных случаях (тиреотоксикоз, ЭОП, диффузный зоб, молодой возраст пациента) не обязательно. В менее очевидных ситуациях этот метод позволяет дифференцировать БГ от заболеваний, протекающих с деструктивным тиреотоксикозом (послеродовый, подострый тиреоидиты и проч.) или от функциональной автономии ЩЖ (многоузловой токсический зоб с «горячими» узлами).
При БГ не менее чем у 70-80 % пациентов определяются циркулирующие антитела к тиреоидной пероксидазе (АТ-ТПО) и тиреоглобулину (АТ-ТГ), тем не менее, они неспецифичны для этого заболевания и встречаются при любой другой аутоиммунной патологии ЩЖ (аутоиммунный тиреоидит, послеродовый тиреоидит). В ряде случаев повышение уровня АТ-ТПО можно расценивать как косвенный диагностический признак БГ, когда речь идет о ее дифференциальной диагностики от неаутоиммунных заболеваний, протекающих с тиреотоксикозом (функциональная автономия ЩЖ). Достаточно специфическим тестом для диагностики и дифференциальной диагностики БГ является определение уровня антител к рецептору ТТГ, которым при этом заболевании придается основное патогенетическое значение. Тем не менее следует учесть, что в ряде случаев эти антитела не выявляются у пациентов с явной БГ, что связано с несовершенством относительно недавно появившихся тест-систем.
Дифференциальная диагностика
Дифференциальная диагностика БГ и заболеваний со схожей симптоматикой, протекающих с нормальной функцией ЩЖ (мерцание предсердий на фоне атеросклеротического кардиосклероза), проста в силу доступности гормональных исследований, которые оценивают функцию ЩЖ. Основные сложности возникают в дифференциальной диагностике БГ и других заболеваний, протекающих с тиреотоксикозом. В этом плане, как указывалось, большую помощь в диагностике БГ может оказать наличие эндокринной офтальмопатии, которая не встречается при других заболеваниях.
При подостром тиреоидите, а также других заболеваниях, протекающих с деструктивным тиреотоксикозом (послеродовый, «молчащий» и цитокининдуцированный тиреоидиты, амиодарониндуцированный тиреотоксикоз 2 типа), при сцинтиграфии ЩЖ определяется снижение или даже полное отсутствие захвата радиофармпрепарата.
Кроме того, подострый тиреоидит характеризует яркая клиническая картина (болевой синдром) и повышение СОЭ. Функциональная автономия ЩЖ, клинически чаще всего представленная многоузловым токсическим зобом манифестирует в пожилом возрасте (чаще после 50-60 лет); при сцинтиграфии ЩЖ выявляются «горячие» узлы, отсутствуют признаки аутоиммунной патологии (АТ-ТПО, АТ-ТГ,
АТ-рТТГ).
Определенные сложности могут возникать при диагностике БГ у беременных женщин. В норме во время беременности, которая сопровождается гиперстимуляцией ЩЖ преимущественно за счет хорионического гонадотропина, у многих женщин (около 30 %) происходит снижение уровня ТТГ ниже нормы, а у некоторых (2 %) наряду с этим происходит некоторое повышение уровня свободного Т4. Дифференцировать эту ситуацию (транзиторный гестационный гипертиреоз) от БГ позволяет отсутствие ЭОП и большинства типичных симптомов тиреотоксикоза, а также постепенная нормализация измененных показателей по данным динамического наблюдения. Следует заметить, что во время беременности у всех женщин уровень общего Т4 существенно превышает норму, что связано с повышением под действием избытка эстрогенов уровня ТСГ. В связи с этим для оценки функции ЩЖ во время беременности должен использоваться уровень свободного Т4 и ТТГ. Артифицициальный (прием пациентом больших доз препаратов тиреоидных гормонов) тиреотоксикоз от БГ отличает снижение накопления РФП по данным сцинтиграфии и отсутствие повышение уровня тиреоглобулина, свойственное большинству заболеваний, сопровождающихся гиперфункцией ЩЖ.
Лечение
Существует три метода лечения БГ (консервативное лечение тиреостатическими препаратами, хирургическое лечение и терапия 131I), при этом ни один из них не является этиотропным. В разных странах удельный вес использования указанных методов лечения традиционно отличается. Так, в Европейских странах и в РФ в качестве первичного метода лечения наиболее принята консервативная терапия тиреостатиками, в США подавляющее большинство пациентов получает терапию 131I.
Консервативная терапия осуществляется при помощи препаратов тиомочевины, к которым относится тиамазол (мерказолил, тирозол,
метизол) и пропилтиоурацила (ПТУ, пропицил). Механизм действия обоих препаратов заключается в том, что они активно накапливаются в ЩЖ и блокируют синтез тиреоидных гормонов благодаря ингибированию тиреоидной пероксидазы, которая осуществляет присоединение йода к остаткам тирозина в тиреоглобулине. Существуют достаточно противоречивые данные о том, что тиамазол параллельно оказывает некое иммуномодулирующее действие, которое в ряде случаев способствует ремиссии заболевания.
Тиреостатическая терапия может назначаться либо в плане подготовки пациента к другим методам лечения (операция), которые проводятся на фоне эутиреоза, либо в виде курса тиреостатической терапии продолжительностью 12-18 месяцев. Следует подчеркнуть, что на фоне приема тиреостатических препаратов постепенное достижение эутиреоидного состояния может быть достигнуто практически у всех пациентов: случаи резистентности к тиреостатикам являются казуистикой.
Длительную (12-18 месяцев) консервативную терапию имеет смысл планировать далеко не у всех пациентов. В первую очередь, речь идет о пациентах с умеренным увеличением объема ЩЖ (до 35-40 мл); при зобе больших размеров после отмены тиреостатиков неминуемо разовьется тиреотоксикоз. Кроме того, консервативную терапию не следует планировать у пациентов с тяжелыми осложнениями тиреотоксикоза (мерцательная аритмия, выраженный остеопороз и др.). Практически бесперспективно и небезопасно для пациента назначение повторных курсов лечения при развитии рецидива тиреотоксикоза спустя 12-18 месяцев тиреостатической терапии.
Если пациенту планируется проведение курса тиреостатической терапии, тионамиды в начале назначаются в относительно больших дозах: 30-40 мг тиамазола (на 1-2 приема) или ПТУ - 300-400 мг (на 3 приема). На фоне такой терапии спустя 4-6 недель у 80-90 % пациентов с тиреотоксикозом средней тяжести удается достичь эутиреоидного состояния, первым признаком которого является нормализация уровня свободного Т4 и Т3. Уровень ТТГ может еще долго оставаться сниженным. На период до достижения эутиреоза, а зачастую и на более длительный срок, большинству пациентов целесообразно назначение бета-адреноблокаторов (пропранолол - 120-180 мг/сут, атенолол - 50-100 мг/сут), которые достаточно быстро купируют многие сердечно-сосудистые симптомы тиреотоксикоза. После
нормализации уровня свободного Т4 доза тиреостатика снижается до поддерживающей (5-15 мг тиамазола в день). В дальнейшем возможно два варианта тиреостатической терапии. Первый вариант (схема «блокируй») подразумевает назначение небольшой (5-10 мг/сут тиамазола) одного только тиреостатического препарата. При втором варианте (схема «блокируй и замещай») - совместно с относительно большей дозой тиреостатика (10-20 мг тиамазола) назначается левотироксин (L-T4), который предотвращает развитие у пациента медикаментозного гипотиреоза. Критерием адекватности терапии является стойкое поддержание нормального уровня Т4 и ТТГ (последний может приходить в норму на протяжении нескольких месяцев от начала лечения).
Поддерживающая терапия продолжается от 12 до 18 месяцев. На протяжении всего лечения у пациента необходимо проводить определение уровня лейкоцитов и тромбоцитов. Редким, но грозным осложнением тионамидов (как тиамазола, так и ПТУ) является агранулоцитоз, очень редко - изолированная тромбоцитопения. После окончания курса лечения препараты отменяются; наиболее часто рецидив развивается в течение первого года после прекращения терапии. Вероятность развития рецидива даже среди пациентов с небольшим исходным увеличением ЩЖ достаточно высока и достигает 70-75 %. В случае развития рецидива тиреотоксикоза, а также если пациент исходно не соответствует критериям, делающим проведение длительной тиреостатической терапии целесообразным, ему показано радикальное лечение: операция или терапия 131I.
Целью оперативного лечения, равно как и терапии 131I является удаление практически всей ЩЖ, с одной стороны обеспечивающее развитие послеоперационного гипотиреоза (который достаточно легко компенсируется), а с другой - исключающее любую возможность рецидива тиреотоксикоза. С этой целью рекомендуется проведение тиреоидэктомии или предельно субтотальной резекции ЩЖ (с оставлением тиреоидного остатка не более 2 мл), которая с функциональной точки зрения тождественна тиреоидэктомии (в том и другом случае исходом является гипотиреоз).
В большинстве стран мира основная часть пациентов с БГ, равно как и с другими формами токсического зоба, в качестве основного метода радикального лечения получает терапию радиоактивным 131I. Это связано с тем, что метод эффективен, неинвазивен, относительно
недорог, лишен тех осложнений, которые могут развиться во время операции на ЩЖ. Единственными противопоказаниями к лечению 131I являются беременность и грудное вскармливание. В значимых количествах 131I накапливается только в ЩЖ; после попадания в нее он начинает распадаться с выделением бета-частиц, которые имеют длину пробега около 1-1,5 мм, что обеспечивает локальную лучевую деструкцию тироцитов. Существенное преимущество заключается в том, что лечение 131I можно проводить без предварительной подготовки тиреостатиками. При БГ, когда целью лечения является разрушение ЩЖ, терапевтическая активность с учетом объема ЩЖ, максимального захвата и времени полувыведения 131I из ЩЖ рассчитывается исходя из предполагаемой поглощенной дозы в 200-300 Грей. При эмпирическом подходе пациенту без предварительных дозиметрических исследований при зобе небольшого размера назначается около 10 мКи, при зобе большего размера - 15-30 мКи. Гипотиреоз обычно развивается в течение 4-6 месяцев после введения 131I.
Общая схема лечения БГ представлена на рис. 3.13. Такой подход к лечению этого заболевания наиболее принят в странах Европы и в РФ. Наряду с перечисленными факторами выбор варианта лечения БГ могут определять как индивидуальные особенности пациента
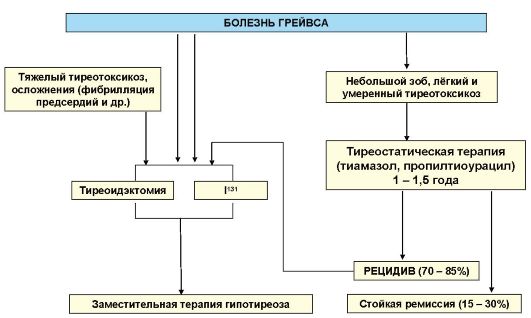 Рис. 3.13. Схема лечения болезни Грейвса
Рис. 3.13. Схема лечения болезни Грейвса
(очень крупный зоб, сопутствующая патология, планирование беременности), так и социальные факторы.
Особенность лечения БГ во время беременности заключается в том, что тиреостатик (предпочтение отдается ПТУ, который хуже проникает через плаценту) назначается в минимально необходимой дозе (только по схеме «блокируй), которая необходима для поддержания уровня свободного Т4 на верхней границе нормы или несколько выше нее. Обычно по мере увеличения сроков беременности потребность в тиреостатике уменьшается и большинство женщин после 25-30 недели препарат вообще не принимает. Тем не менее у большинства из них после родов (обычно через 3-6 месяцев) развивается рецидив заболевания.
Лечение тиреотоксического криза подразумевает интенсивные мероприятия с назначение больших доз тиреостатиков. Предпочтение отдается ПТУ в дозе 200-300 мг каждые 6 часов, при невозможности самостоятельного приема пациентом - через назогастральный зонд. Кроме того, назначаются β-адреноблокаторы (пропранолол: 160-480 мг в день per os или в в/в из расчета 2-5 мг/час), глюкокортикоиды (гидрокортизон: 50-100 мг каждые 4 часа или преднизолон (60 мг/сут), дезинтоксикационную терапию (физиологический раствор, 10 % раствор глюкозы) под контролем гемодинамики. Эффективным методом лечения тиреотоксического криза является плазмаферез.
Прогноз
При отсутствии лечения неблагоприятный и определяется постепенным развитием фибрилляции предсердий, сердечной недостаточности, истощения (марантический тиреотоксикоз). В случае нормализации функции ЩЖ прогноз тиреотоксической кардиомиопатии благоприятный - у большинства пациентов происходит регресс кардиомегалии и восстанавливается синусовый ритм. Вероятность рецидива тиреотоксикоза после 12-18-месячного курса тиреостатической терапии - 70-75 % пациентов.
3.5. ЭНДОКРИННАЯ ОФТАЛЬМОПАТИЯ
Эндокринная офтальмопатия (ЭОП, офтальмопатия Грейвса, аутоиммунная офтальмопатия) - аутоиммунное заболевание, патогенетически связанное с болезнью Грейвса, характеризующееся отеком и лимфоцитарной инфильтрацией, а в дальнейшем фиброзными изменениями ретробульбарной клетчатки и глазодвигательных мышц.
Табл. 3.6. Эндокринная офтальмопатия
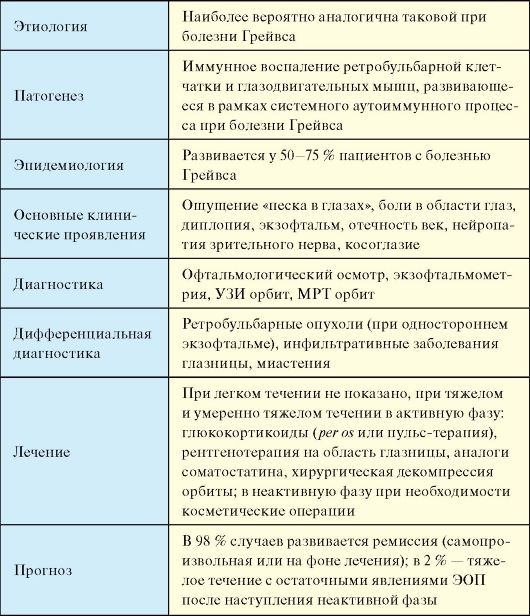 В
95 % случаев ЭОП сочетается с болезнью Грейвса и является неотъемлемым
компонентом этого системного аутоиммунного заболевания (его «визитной
карточкой»), при этом ЭОП может манифестировать раньше тиреотоксикоза.
Примерно в 5 % случаев ЭОП сочетается с аутоиммунным тиреоидитом, а в
оставшихся 5 % - является изолированным заболеванием, т.е. единственным
компонентом аутоиммунно-
В
95 % случаев ЭОП сочетается с болезнью Грейвса и является неотъемлемым
компонентом этого системного аутоиммунного заболевания (его «визитной
карточкой»), при этом ЭОП может манифестировать раньше тиреотоксикоза.
Примерно в 5 % случаев ЭОП сочетается с аутоиммунным тиреоидитом, а в
оставшихся 5 % - является изолированным заболеванием, т.е. единственным
компонентом аутоиммунно-
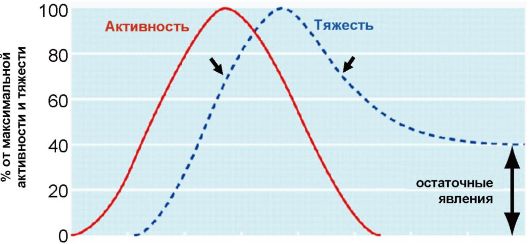 Рис. 3.14. Стадии развития эндокринной офтальмопатии
Рис. 3.14. Стадии развития эндокринной офтальмопатии
го процесса, развивающегося при БГ. По не вполне понятной причине в 5-10 % случаев ЭОП носит односторонний характер (табл. 3.6).
Этиология
Согласно одной из достаточно распространенных теорий, вследствие развивающегося при БГ аутоиммунного процесса по не вполне понятной причине преадипоциты ретробульбарной клетчатки дифференцируются в адипоциты, экспрессирущие рецептор к ТТГ. Вслед за этим происходит инфильтрация этой клетчатки сенсибилизированными к рецептору ТТГ Т-лифоцитами, инициирующими развитие иммунного воспаления. В ответ на воздействие провоспалительных цитокинов адипоциты ретробульбарной клетчатки начинают в избытке продуцировать кислые гликозаминогликаны. Последние обладают выраженными гидрофильными свойствами, что способствует развитию отека и увеличению объема ретробульбарной клетчатки. В дальнейшем интенсивность воспалительных изменений спадает, и развиваются фиброзные изменения той или иной степени выраженности.
Патогенез
В развитии ЭОП выделяют две основные фазы (рис. 3.14). В первой фазе активного воспаления происходят воспалительные изменения в ретробульбарной клетчатке. Эти изменения сопровождаются увеличением ее объема, что приводит к развитию экзофтальма, а в тяжелых случаях - к сдавлению зрительного нерва (нейропатия зрительного нерва) (рис. 3.15).
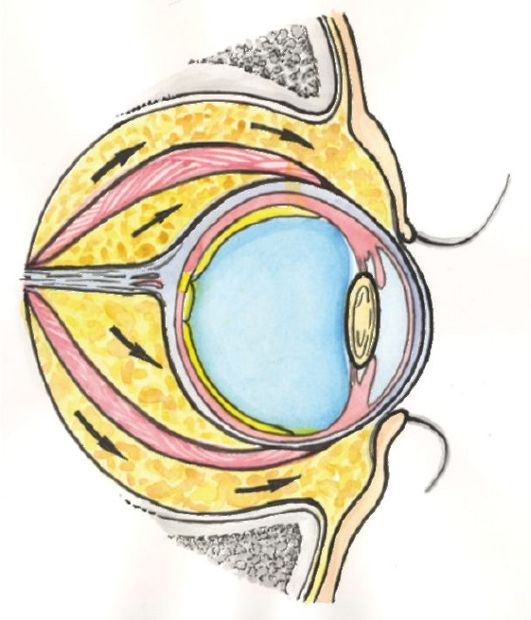 Рис. 3.15. Патогенез экзофтальма и компрессии зрительного нерва при эндокринной офтальмопатии
Рис. 3.15. Патогенез экзофтальма и компрессии зрительного нерва при эндокринной офтальмопатии
Воспалительные изменения в глазодвигательных мышцах развиваются неравномерно, что приводит к тому, что при определенном угле зрения (при взгляде вверх или в сторону) у пациента появляется диплопия. При тяжелых изменениях со стороны глазодвигательных мышц может развиться стойкое косоглазие с постоянной диплопией. Опасным осложнением тяжелой ЭОП является выраженный экзофтальм, приводящий к невозможности полного закрывания глаз, с последующими изменениями роговицы, вплоть до ее изъязвления.
Во второй неактивной фазе ЭОП происходит постепенное
стихание воспалительного процесса в структурах глазницы. В случае легкой ЭОП процесс заканчивается полной ремиссией, при тяжелой ЭОП развиваются фиброзные изменения, приводящие к стойкому экзофтальму, стойкой ретракции верхнего века, косоглазию с диплопией, а также вторичным изменениям со стороны глазного яблока, таким как катаракта. Использование противовоспалительных средств, таких как глюкокортикоиды, в неактивной фазе ЭОП неэффективно. Факторами риска развития и прогрессирования ЭОП являются курение и нарушение функции ЩЖ (как гипотиреоз, так и тиреотоксикоз).
Эпидемиология
ЭОП развивается у 50-75 % пациентов с болезнью Грейвса. Вполне вероятно, что ЭОП той или иной выраженности, включая минимальные изменения в ретробульбарных тканях, которые можно выявить только при помощи специальных методов (МРТ), развивается у всех пациентов с БГ. Частота новых случаев собственно ЭОП по некоторым данным составляет 16 случаев на 100 000 населения в год для женщин и 2,9 случая на 100 000 в год для мужчин.
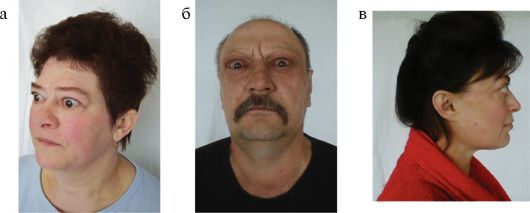 Рис. 3.16. Пациенты с эндокринной офтальмопатией (а, б, в)
Рис. 3.16. Пациенты с эндокринной офтальмопатией (а, б, в)
Клинические проявления
При ЭОП может развиваться несколько групп симптомов. Сразу следует оговориться, что так называемые глазные симптомы тиреотоксикоза, приведенные в таблице 3.7, в полной мере не являются проявлениями ЭОП, а могут развиваться при тиреотоксикозе любого генеза. Их патогенез связывают с нарушением вегетативной иннервации глазного яблока. Этим симптомам придавали большое значение в прошлом, когда прямая оценка функции ЩЖ при помощи гормонального исследования представляла существенные сложности. В дальнейшем стало очевидно, что многие глазные симптомы, например мелкий тремор век закрытых глаз, могут встречаться и при отсутствии тиреотоксикоза у здоровых людей.
Табл. 3.7. Глазные симптомы тиреотоксикоза
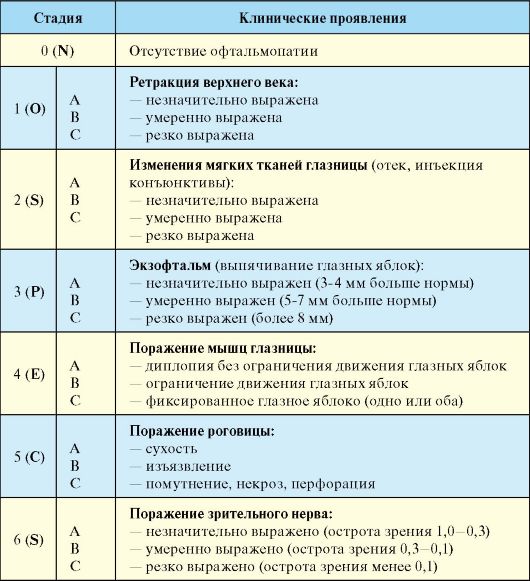
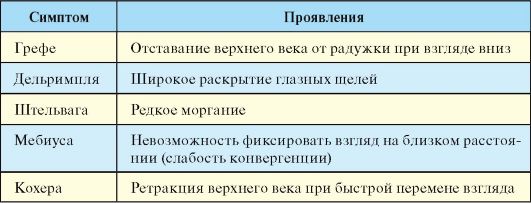 Табл. 3.8. Классификация эндокринной офтальмопатии NOSPECS
Табл. 3.8. Классификация эндокринной офтальмопатии NOSPECS
 Собственно
для ЭОП характерны две группы симптомов: первые связанны с изменением
мягких тканей орбиты, а вторые - с изменением глазодвигательных мышц. В
результате изменения ретробульбарных и частично периорбитальных тканей развивается экзофтальм с сопутствующей ему ретракцией верхнего века (рис. 3.16).
Собственно
для ЭОП характерны две группы симптомов: первые связанны с изменением
мягких тканей орбиты, а вторые - с изменением глазодвигательных мышц. В
результате изменения ретробульбарных и частично периорбитальных тканей развивается экзофтальм с сопутствующей ему ретракцией верхнего века (рис. 3.16).
Первыми симптомами ЭОП очень часто оказываются ощущение «песка» в глазах, слезотечение и светобоязнь. Основными мышечными
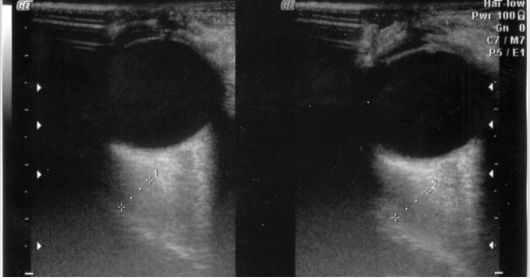 Рис. 3.17. Утолщение глазодвигательных мышц орбит при эндокринной офтальмопатии по данным УЗИ
Рис. 3.17. Утолщение глазодвигательных мышц орбит при эндокринной офтальмопатии по данным УЗИ
симптомами являются двоение при взгляде в какую-то сторону или вверх, невозможность отведения глаз в одну из сторон, а в тяжелых случаях - косоглазие. Тяжесть офтальмопатии принято классифицировать по международной классификации NOSPECS (табл. 3.8). Чаще всего ЭОП имеет достаточно легкое течение, не требующее активных лечебных мероприятий; на тяжелую ЭОП с развитием изменений, угрожающих зрению, приходится не более 1-1,5 % случаев.
Диагностика
Основное, но не абсолютное значение имеет сопутствующая БГ, значительно реже аутоиммунный тиреоидит. В этом случае наличие у пациента характерного двустороннего процесса практически верифицирует диагноз. Реже приходится проводить УЗИ орбит, которое позволяет выявить характерное утолщение глазодвигательных мышц (рис. 3.17).
В ряде случаев это исследование проводится с целью активной диагностики клинически невыраженной ЭОП, выявление которой позволяет установить диагноз БГ, в тех случаях, когда последнюю сложно дифференцировать от других заболеваний, протекающих с тиреотоксикозом. С этой целью может быть предпринята МРТ, которая является более дорогим, но более информативным исследованием. Важным показанием для нее является выявление у пациента одностороннего экзофтальма (особенно при отсутствии воспалительных изменений и других глазных симптомов) с целью исключения ретробульбарной опухоли.
Важным вопросом диагностики ЭОП, ответ на который необходим для решения вопроса о назначении лечения, является установление активности ЭОП. Для этого, как правило, используются данные клинической картины и анамнеза (наблюдения в динамике). Их суммирует шкала клинической активности ЭОП, представленная в табл. 3.9.
Табл. 3.9. Шкала клинической активности ЭОП
 Дифференциальная диагностика
Дифференциальная диагностика
ЭОП необходимо дифференцировать от ретробульбарных опухолей (особенно при одностороннем экзофтальме), инфильтративных заболеваний глазницы, миастении, нейропатии зрительного нерва другого генеза.
Лечение
При выборе тактики лечения следует исходить из того, что воспалительный процесс при ЭОП склонен к самопроизвольной ремиссии, другими словами, активная фаза ЭОП, рано или поздно, всегда заканчивается. Подходы к лечению ЭОП, как указывалось, определяются тяжестью заболевания и его активностью (табл. 3.10).
Табл. 3.10. Лечение эндокринной офтальмопатии
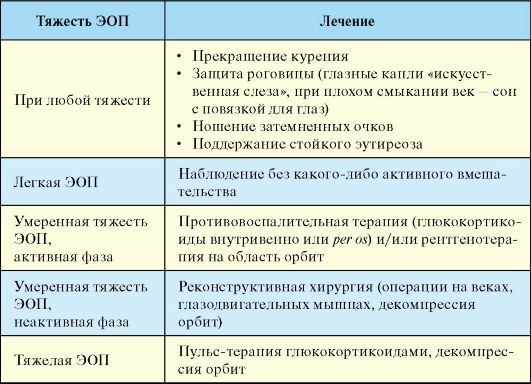 В
большинстве случаев ЭОП какой-либо активной терапии не требуется
вообще, поскольку чаще всего речь идет о достаточно легком течении
заболевания, которое склонно к самопроизвольной ремиссии без каких-либо
остаточных явлений. Тем не менее пациенту должны быть даны рекомендации
по прекращению курения, использованию глазных капель. Важным условием
ремиссии ЭОП является стойкое поддержание эутиреоза. В случае умеренной и
тяжелой ЭОП наиболее часто используемым методом, подтвердившим свою
эффективность и относительную безопасность, является пульс-терапия
метилпреднизолоном (1 г в/в, ежедневно, на протяжении 5 дней, далее при
необходимости проводится повторный курс через 1-2 недели). Альтернативой
может быть пероральный прием преднизолона, который сопровождается
несколько большим риском развития побочных эффектов. Основной проблемой
терапии глюкокортикоидами является достаточно часто развивающиеся
рецидивы ЭОП после прекращения лечения. Другим методом лечения является
рентгенотерапия на область орбит, которую часто комбинируют с терапией
глюкокор-
В
большинстве случаев ЭОП какой-либо активной терапии не требуется
вообще, поскольку чаще всего речь идет о достаточно легком течении
заболевания, которое склонно к самопроизвольной ремиссии без каких-либо
остаточных явлений. Тем не менее пациенту должны быть даны рекомендации
по прекращению курения, использованию глазных капель. Важным условием
ремиссии ЭОП является стойкое поддержание эутиреоза. В случае умеренной и
тяжелой ЭОП наиболее часто используемым методом, подтвердившим свою
эффективность и относительную безопасность, является пульс-терапия
метилпреднизолоном (1 г в/в, ежедневно, на протяжении 5 дней, далее при
необходимости проводится повторный курс через 1-2 недели). Альтернативой
может быть пероральный прием преднизолона, который сопровождается
несколько большим риском развития побочных эффектов. Основной проблемой
терапии глюкокортикоидами является достаточно часто развивающиеся
рецидивы ЭОП после прекращения лечения. Другим методом лечения является
рентгенотерапия на область орбит, которую часто комбинируют с терапией
глюкокор-
тикоидами. При тяжелой ЭОП, особенно при развитии нейропатии зрительного нерва, может быть показано оперативное вмешательство по декомпрессии орбит. В неактивной фазе ЭОП при выраженных косметических и зрительных нарушениях также может быть показано оперативное лечение.
Прогноз
В подавляющем большинстве случаев благоприятный: развивается самопроизвольная или индуцированная противовоспалительной терапией ремиссия. Примерно в 1-2 % случаев ЭОП характеризуется тяжелым течением, которое завершается выраженными остаточными явлениями в неактивной фазе.
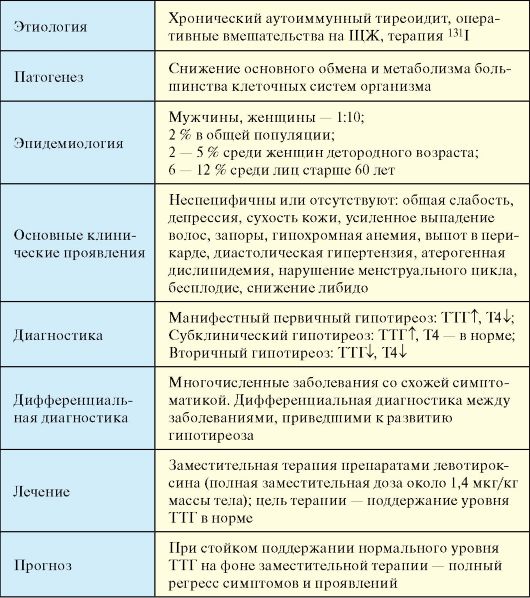
3.6. ГИПОТИРЕОЗ
Гипотиреоз - клинический синдром, развивающийся вследствие дефицита тиреоидных гормонов. По патогенезу гипотиреоз может быть первичным (вследствие патологии самой ЩЖ) и вторичным (вследствие дефицита ТТГ) (табл. 3.11), при этом более 99 % случаев приходится на первичный приобретенный гипотиреоз. Распространенность гипотиреоза в общей популяции составляет порядка 2 %, а в отдельных возрастных группах (женщины пожилого возраста) может достигать 6-8 %.
Табл. 3.11. Этиология гипотиреоза
 3.6.1. Приобретенный гипотиреоз
3.6.1. Приобретенный гипотиреоз
Является одним из наиболее распространенных эндокринных заболеваний (табл. 3.12). Основной причиной стойкого первичного гипотиреоза является хронический аутоиммунный тиреоидит (АИТ), далее по распространенности следует ятрогенный гипотиреоз, развивающийся в исходе хирургических операций на ЩЖ или терапии радиоактивным 131I.
Табл. 3.12. Первичный приобретенный гипотиреоз
 Этиология
Этиология
Наибольшее клиническое значение имеет гипотиреоз, развившийся в результате хронического аутоиммунного тиреоидита (АИТ) (см. п. 3.7.1.1), а также ятрогенный гипотиреоз (послеоперационный, в исходе терапии радиоактивным 131I). На ятрогенный гипотиреоз приходится не менее 1/3 всех случаев гипотиреоза. При указанных заболеваниях гипотиреоз в большинстве случаев носит стойкий необратимый характер. Наряду с этим при многих заболеваниях ЩЖ (деструктивные тиреоидиты), а также при воздействии ряда веществ (большие дозы йода, тиреостатики) может развиваться транзиторный гипотиреоз, который самолимитируется либо в процессе естественного течения этих заболеваний, либо по прекращении воздействия вызвавшего его фактора (отмена тиреостатика). В ряде случаев генез первичного гипотиреоза остается неясным (идиопатический гипотиреоз).
Одной из причин первичного гипотиреоза может быть тяжелый йодный дефицит. Легкий и умеренный йодный дефицит к гипотиреозу у взрослых в обычных условиях привести не может, поэтому проблема йододефицитного гипотиреоза у взрослых для Российской Федерации неактуальна (см. п. 3.9). У новорожденных вследствие умеренного, а иногда даже и легкого йодного дефицита, вследствие сочетания низкого содержания йода в ЩЖ и высокого уровня обмена тиреоидных гормонов может развиться транзиторная неонатальная гипертиротропинемия (см. п. 3.6.2). У беременных женщин в условиях йодного дефицита может развиться относительная гестационная гипотироксинемия (см. п. 3.9.3). Тем не менее два последних феномена не следует отождествлять с синдромом гипотиреоза в полной мере.
Причиной относительно редко встречающегося вторичного гипотиреоза, как правило, являются различные деструктивные процессы в гипоталамо-гипофизарной области. Чаще всего речь идет о макроаденомах гипофиза и супраселлярных структур, а также оперативных вмешательствах по поводу этих заболеваний.
Патогенез
При дефиците тиреоидных гормонов развиваются изменения всех без исключения органов и систем. Поскольку основной функцией тиреоидных гормонов является поддержание основного обмена (клеточного дыхания), при их дефиците происходит снижение потребления кислорода тканями, а также снижение расходования энер-
гии и утилизации энергетических субстратов. По этой же причине при гипотиреозе происходит уменьшение выработки целого ряда энергозависимых клеточных ферментов, обеспечивающих их нормальное функционирование. Универсальным изменением, которое обнаруживается при тяжелом гипотиреозе, является муцинозный отек (микседема), наиболее выраженный в соединительнотканных структурах. Микседема развивается вследствие избыточного скопления в интерстициальных тканях гиалуроновой кислоты и других гликозаминогликанов, которые в силу своей гидрофильности задерживают избыток воды.
Эпидемиология
Эпидемиологию гипотиреоза во многом определяет тот факт, что его наиболее частой причиной является АИТ. Во-первых, АИТ, как и большинство других заболеваний ЩЖ, в 10 и более раз чаще встречается у женщин. Во-вторых, это заболевание характеризуется длительным течением и приводит к гипотиреозу спустя многие годы и десятилетия от его начала. В связи с этим гипотиреоз наиболее распространен среди женщин в возрасте старше 50-60 лет. Если в общей популяции распространенность гипотиреоза составляет около 1 %, среди женщин детородного возраста - 2 %, то среди женщин старше 60 лет этот показатель в некоторых популяциях может достигать 10-12 % и более.
Клинические проявления
Клиническая картина гипотиреоза определяется его этиологией, возрастом пациента, а также скоростью развития дефицита тиреоидных гормонов.
Основными проблемами клинической диагностики гипотиреоза являются:
• отсутствие специфичных (встречающихся только при гипотиреозе) симптомов;
• высокая распространенность сходных с гипотиреозом симптомов в общей популяции, которые связаны с другими хроническими соматическими и психическими заболеваниями. Примерно у 15 % взрослых людей с нормальной функцией ЩЖ можно выявить до нескольких симптомов, характерных для гипотиреоза;
• отсутствие прямой зависимости между степенью дефицита тиреоидных гормонов и выраженностью клинических проявлений (в одних случаях симптомы могут полностью отсутствовать при явном гипотиреозе, в других они значительно выражены уже при субклиническом гипотиреозе).
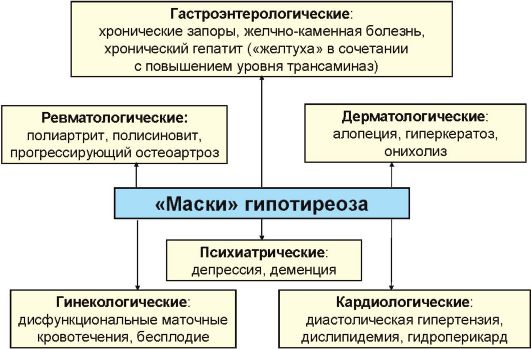 Рис. 3.18. «Маски» гипотиреоза
Рис. 3.18. «Маски» гипотиреоза
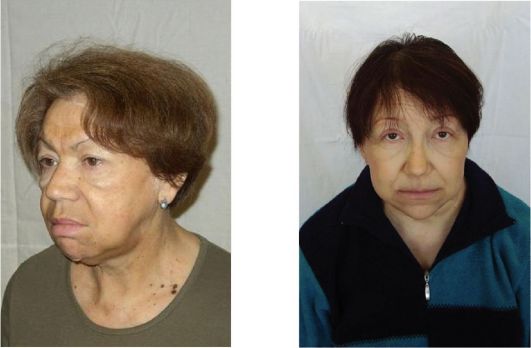 Рис. 3.19. Внешний вид больной гипотиреозом (а, б)
Рис. 3.19. Внешний вид больной гипотиреозом (а, б)
Как указывалось, клиническая картина гипотиреоза в целом характеризуется полисистемностью, но у отдельных пациентов доминируют жалобы и симптомы со стороны какой-то одной системы, в связи с чем у пациента нередко диагностируются заболевания-«маски» (рис.
3.18).
При выраженном и длительно существующем гипотиреозе у пациента формируется достаточно характерный «микседематозный» внешний вид, который характеризуется общей и периорбитальной отечностью. Лицо одутловато, бледно-желтушного оттенка, взгляд отчужден, мимика бедна (маскообразное лицо) (рис. 3.19).
Кроме того, отмечается поредение и потускнение волос, их усиленное выпадение. В целом пациенты апатичны, замедлены или даже заторможены. Для тяжелого гипотиреоза весьма характерно замедление речи; иногда кажется, что у больного что-то во рту (язык заплетается). Отечность слизистой гортани проявляется низким или даже хриплым тембром голоса. Пациент может спотыкаться на произнесении отдельных слов, после чего, приложив определенные усилия, произносит их более внятно. Классически при гипотиреозе описывается отечность языка, на котором можно увидеть отпечатки зубов. Отечность слизистой евстахиевой трубы может проявиться некоторым снижением слуха. Частой жалобой является сухость кожи.
Среди изменений со стороны нервной системы следует указать на снижение памяти и интеллекта, сонливость, депрессию. У детей старше 3 лет и у взрослых изменения со стороны нервной системы не являются необратимыми и полностью купируются на фоне заместительной терапии. В противоположность этому врожденный гипотиреоз при отсутствии заместительной терапии приводит к необратимым нервно-психическим и физическим нарушениям (см. п. 3.6.2). Со стороны периферической нервной системы изменения развиваются редко, хотя у некоторых пациентов явления микседемы провоцируют развитие туннельных синдромов (синдром карпального канала).
Общее снижение уровня основного обмена проявляется некоторой склонностью пациентов с гипотиреозом к прибавке веса, при этом собственно гипотиреоз никогда не приводит к развитию выраженного ожирения. При крайне тяжелом гипотиреозе может развиваться гипотермия. Пациенты часто предъявляют жалобы за зябкость (все время мерзнут). В генезе этого симптома наряду со снижением основного обмена имеет значение характерная для гипотиреоза централизация кровообращения.
Наиболее частыми изменениями со стороны сердечно-сосудистой системы является склонность к брадикардии, легкая диастолическая артериальная гипертензия и формирование выпота в полости перикарда. У большинства пациентов с гипотиреозом развивается атерогенная дислипидемия.
Со стороны пищеварительной системы часто встречающимся симптомом являются запоры. Кроме того, может развиваться дискинезия желчных путей, гепатомегалия; характерно некоторое снижение аппетита. При выраженном гипотиреозе может развиваться гипохромная анемия. В некоторых случаях гипотиреоз в исходе АИТ сочетается с другим аутоиммунным заболеванием - В12-дефицитной анемией.
Очень часто, особенно у женщин, на первый план выходят изменения со стороны половой системы. При гипотиреозе могут происходить различные нарушения менструального цикла: от аменореи до дисфункциональных маточных кровотечений. Как у мужчин, так и у женщин происходит снижение либидо. В патогенезе изменений со стороны половой системы определенное значение имеет вторичная гиперпролактинемия (см. п. 2.4). Выраженный гипотиреоз практически всегда сопровождается бесплодием, но менее явный дефицит тиреоидных гормонов у части женщин (около 2 % среди всех беременных) может не препятствовать наступлению беременности, которая в данном случае сопровождается высоким риском ее прерывания или рождения ребенка с нарушением развития нервной системы.
При длительно существующем гипотиреозе гиперстимуляция тиреотрофов гипофиза может закончиться формированием вторичной аденомы. После компенсации гипотиреоза на фоне заместительной терапии в результате уменьшения объема гипофиза может произойти формирование «пустого» турецкого седла (см. п. 2.9).
Наиболее тяжелым, но в настоящее время крайне редко встречающимся осложнением гипотиреоза является гипотиреоидная (микседематозная) кома. Гипотиреоидная кома, как правило, развивается у пожилых пациентов с длительно недиагностированным гипотиреозом, тяжелыми сопутствующими заболеваниями при низкой социальном статусе и отсутствии ухода. Провоцируют развитие гипотиреоидной комы интеркуррентные заболевания (чаще инфекционные), охлаждение, травмы, назначение препаратов, угнетающих ЦНС. Клинически гипотиреоидная кома проявляется гипотермией, гиповентиляцией с гиперкапнией, гиперволемией, гипонатриемией, брадикардией, артериальной гипотензией, ост-
рой задержкой мочи, динамической кишечной непроходимостью, гипогликемией, сердечной недостаточностью, прогрессирующим торможением ЦНС. Летальность при микседематозной коме достигает 80 %.
Диагностика
Диагностика гипотиреоза, то есть доказательство факта снижения функции ЩЖ, достаточно проста. Она подразумевает определение уровня ТТГ и Т4, при этом обнаружение изолированного повышения ТТГ свидетельствует о субклиническом гипотиреозе, а одновременное повышение уровня ТТГ и снижение уровня Т4 - о явном или манифестном гипотиреозе. Значительно большую проблему представляет собой определение показаний для проведения этого исследования, поскольку неспецифичность клинической картины гипотиреоза, определяет тот факт, что даже «явные симптомы» могут не найти подтверждения при гормональном исследовании, наряду с этим, в ряде случаев гипотиреоз, даже сопровождающийся значительным повышением уровня ТТГ и снижением Т4, иногда протекает бессимптомно. Если говорить о субклиническом гипотиреозе, то он в подавляющем большинстве случаев вообще не имеет проявлений, которые бы позволили его заподозрить. При сопоставлении этих фактов возникает закономерный вопрос о целесообразности скринингового определения функции ЩЖ с целью диагностики гипотиреоза, которое поддерживают многие рекомендации. Группы риска по развитию гипотиреоза, то есть, по сути, показания для оценки функции ЩЖ, вне зависимости от наличия или отсутствия каких-либо симптомов, представлены в табл. 3.13.
Табл. 3.13. Группы риска по развитию гипотиреоза
 Дифференциальная диагностика
Дифференциальная диагностика
Если проблема неспецифичности или полного отсутствия симптомов гипотиреоза решается проведением гормонального исследования (уровень ТТГ), нередко возникает вопрос о дифференциальной диагностике заболеваний, вызвавших гипотиреоз. Причина гипотиреоза очевидна при ятрогенном гипотиреозе (оперативное вмешательство, терапия 131I). При спонтанно же развившемся гипотиреозе может возникнуть вопрос о том, какой вариант аутоиммунного тиреоидита (см. п. 3.7.1) явился его причиной. Это особенно важно в связи с тем, что при хроническом варианте АИТ гипотиреоз необратим и пациент должен получать заместительную терапию пожизненно, в то время как гипотиреоз, являющийся фазой деструктивных тиреоидитов (послеродовый, безболевой, цитокининдуцированный) заканчивается восстановлением функции ЩЖ.
Проблема дифференциальной диагностикой первичного и вторичного гипотиреоза не возникает, поскольку вторичный гипотиреоз
практически никогда не бывает изолированным, а сочетается с вторичной недостаточностью других эндокринных желез (гипокортицизм, гипогонадизм). Кроме того, как правило, очевиден этиологический фактор (макроаденома гипофиза, операции или облучение гипоталамо-гипофизарной области). Следует заметить, что в ряде случаев вторичный гипотиреоз протекает не с пониженным (ТТГ↓, T4↓), а с нормальным уровнем ТТГ, то есть ситуация, в которой при неоднократных исследованиях наряду со сниженным Т4 определяется нормальный уровень ТТГ, требует исключения вторичного гипотиреоза.
Лечение
Манифестный гипотиреоз (ТТГ↑, Т4↓) является абсолютным показанием для назначения заместительной терапии левотироксином (L-T4) вне зависимости от каких-либо дополнительных факторов (возраст, сопутствующая патология). Отличаться может лишь вариант начала лечения (исходная доза и скорость ее повышения). Вопрос о целесообразности лечения субклинического гипотиреоза (ТТГ↑, Т4 - в норме) остается спорным. Абсолютным показанием для заместительной терапии при субклиническом гипотиреозе является его выявление у беременной женщины, либо же планирование беременности в ближайшем будущем.
У молодых пациентов без сопутствующей патологии L-T4 может быть сразу назначен в полной заместительной дозе, которая исходно рассчитывается, исходя из веса пациента (1,6 мкг/кг массы тела). Для женщин доза L-T4 в среднем составляет 100 мкг, для мужчин - 150 мкг в день. Препарат принимается один раз в день, утром за 30 минут до завтрака. Контрольным параметром, по которому оценивают качество компенсации гипотиреоза, является уровень ТТГ. Если он исходно был значительно повышен, то его нормализация может продолжаться до 4-6 месяцев (первое контрольное исследование обычно делается через 2-3 месяца). После того, как достигнута компенсация гипотиреоза (нормальный уровень ТТГ), этот параметр оценивается с интервалом в один год.
Компенсированный гипотиреоз не является противопоказанием для планирования беременности (с ее наступлением доза L-T4 должна быть увеличена примерно из расчета 2,3 мкг/кг веса).
Принципы заместительной терапии вторичного гипотиреоза аналогичны, за исключением того, что оценка качества его компенсации происходит по уровню Т4. Лечение гипотиреодной комы подразумева-
ет интенсивные мероприятия, включающие назначение препаратов тиреоидных гормонов, глюкокортикоидов, коррекцию гемодинамических и электролитных расстройств.
Прогноз
Качество жизни пациентов с компенсированным гипотиреозом, как правило, значительно не страдает: пациент не имеет никаких ограничений, за исключением необходимости ежедневного приема L-T4.
3.6.2. Врожденный гипотиреоз
Врожденный гипотиреоз (ВГ) - гетерогенная группа заболеваний, проявляющаяся врожденным дефицитом тиреоидных гормонов, развивающимся вследствие дисгенезии ЩЖ или гипоталамо-гипофизарной системы, а также вследствие врожденных дефектов синтеза тиреоидных гормонов и различных экзогенных воздействий (медикаменты, материнские блокирующие антитела и прочее). Другими словами, термином ВГ обозначается гипотиреоз любого генеза, который манифестирует и диагностируется при рождении (табл. 3.14).
Табл. 3.14. Врожденный гипотиреоз
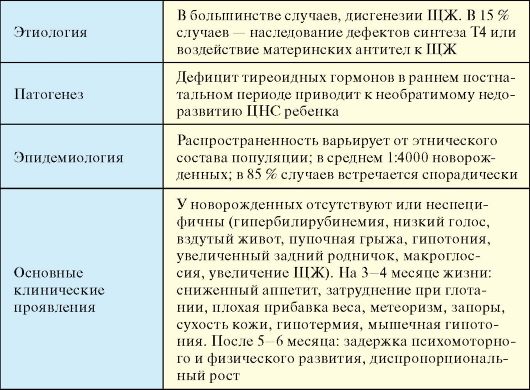 Окончание табл. 3.14
Окончание табл. 3.14
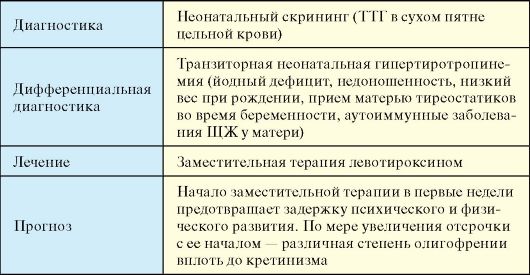 Этиология
Этиология
ВГ примерно в 85 % случаев является спорадическим и в подавляющем большинстве случаев развивается вследствие дисгенезии ЩЖ (табл. 3.15). Примерно в 15 % случаев причиной ВГ является наследование дефектов синтеза Т4 или воздействие материнских антител к ЩЖ (блокирующие антитела, циркулирующие у женщин с аутоиммунной патологией ЩЖ). Казуистически редко с частотой 1:25000 - 1:100000 встречается вторичный ВГ. Для отдельных форм ВГ в настоящее время известны генетические мутации, приводящие к его развитию.
Патогенез
Внутриутробное развитие плода, у которого по тем или иным причинам не функционирует или отсутствует ЩЖ, осуществляется за счет материнских тиреоидных гормонов, проникающих через плаценту. После рождения уровень материнских тиреоидных гормонов в крови у плода быстро падает. В неонатальном периоде, особенно раннем, тиреоидные гормоны критически необходимы для развития ЦНС новорожденного, особенно для продолжающихся процессов миелинизации нейронов коры головного мозга. При дефиците тиреоидных гормонов в этот период формируется необратимое недоразвитие коры головного мозга ребенка, клинически проявляющееся различной степенью умственной отсталости вплоть до кретинизма. При своевременном начале заместительной терапии (в идеале первая неделя жизни)
развитие ЦНС практически соответствует норме. Наряду с развитием патологии ЦНС при несвоевременно компенсированном ВГ страдает формирование скелета и других внутренних органов.
Табл. 3.15. Основные причины врожденного гипотиреоза и заболеваемость его отдельными формами
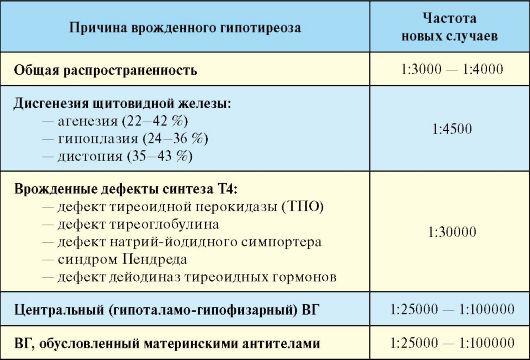 Эпидемиология
Эпидемиология
Распространенность ВГ составляет около 1:3000 - 1:5000 новорожденных, и он является наиболее часто предотвратимым среди заболеваний, приводящих к психической ретардации.
Клинические проявления
Клинические симптомы в большинстве случаев не помогают в ранней диагностике ВГ. Только в 5 % случаев ВГ может быть сразу заподозрен у новорожденных на основании данных клинической картины. К ранним симптомам относятся пролонгированная гипербилирубинемия (> 7 дней), низкий голос, вздутый живот, пупочная грыжа, гипотония, увеличенный задний родничок, макроглоссия и увеличение ЩЖ. Если лечение не начато, в дальнейшем, на 3-4 месяце жизни, появляются такие симптомы, как сниженный аппетит,
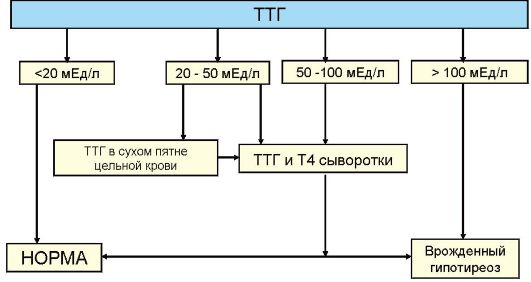 Рис. 3.21. Схема неонатального скрининга врожденного гипотиреоза
Рис. 3.21. Схема неонатального скрининга врожденного гипотиреоза
затруднение при глотании, плохая прибавка массы тела, метеоризм, запоры, сухость и бледность кожи, гипотермия, мышечная гипотония. После 5-6 месяца на первый план выступает задержка психомоторного и физического развития ребенка, а также диспропорциональный рост: широкая запавшая переносица, гипертелоризм, позднее закрытие родничков (рис. 3.20).
Диагностика
В основе диагностики ВГ лежит неонатальный скрининг. Стоимость скрининга и стоимость лечения ребенка-инвалида в поздно диагностируемых случаях ВГ соотносится как 1:7 - 1:11. Наиболее принятый вариант скрининга подразумевает определение уровня ТТГ в высушенных пятнах крови на фильтровальной бумаге, взятой на 4-5 день жизни ребенка, когда происходит снижение уровня ТТГ, который в раннем неонатальном периоде и в норме значительно повышен (рис. 3.21).
Проведение скрининга на более ранних сроках приводит к увеличению числа ложноположительных результатов. В том случае,
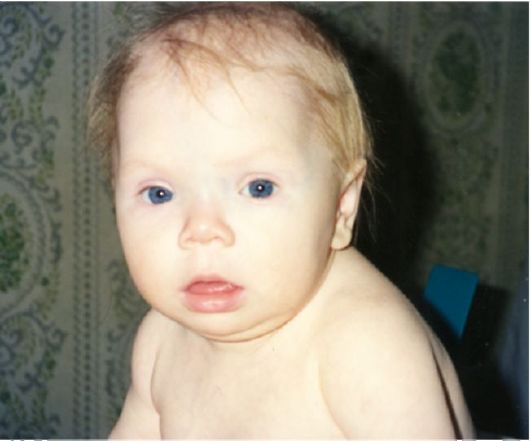 Рис. 3.20. Ребенок с врожденным гипотиреозом (девочка 3 лет, 4 месяцев)
Рис. 3.20. Ребенок с врожденным гипотиреозом (девочка 3 лет, 4 месяцев)
если уровень ТТГ по данным неонатального скрининга превышает 100 мЕд/л, диагноз ВГ не вызывает сомнений, и ребенку показано назначение заместительной терапии L-T4. При исходном уровне ТТГ 20-50 мЕд/л проводится повторное определение его уровня в сухом пятне цельной крови; если он повторно превышает 20 мЕд/л проводится определение ТТГ и свободного Т4 в сыворотке крови. Определение этиологии ВГ в неонатальном периоде не является первоочередной задачей в силу ургентной необходимости проведения заместительной терапии, которая позволит сохранить приемлемый уровень развития интеллекта.
Дифференциальная диагностика
ВГ необходимо дифференцировать от транзиторной гипертиротропинемии, под которой подразумевают преходящее повышение уровня ТТГ, выявляемое при неонатальном скриниге на ВГ. В случае если наряду с этим имеет место транзиторное снижение уровня Т4, говорят о транзиторном гипотиреозе. Причинами транзиторной гипертиротропинемии могут быть: йодный дефицит, недоношенность, низкий вес при рождении, внутриутробная гипотрофия, внутриутробные инфекции, прием матерью тиреостатиков во время беременности, аутоиммунные заболевания ЩЖ у матери. Наиболее частой и изученной причиной транзиторной неонатальной гипертиротропинемии является дефицит йода (п. 3.9). По мере утяжеления йодного дефицита увеличивается доля детей, у которых при скрининге на ВГ выявляется транзиторная гипертиротропинемия. Дифференциальная диагностика осуществляется по описанному выше алгоритму (см. рис. 3.21).
Лечение
Целью заместительной терапии является скорейшая нормализация уровня Т4 в крови, а в дальнейшем подбор дозы L-T4, которая обеспечит стойкое поддержание нормального уровня Т4 и ТТГ. Рекомендуемая начальная доза L-T4 составляет 10-15 мкг на кг массы тела в день. В дальнейшем необходимо проведение регулярных контрольных обследований для подбора адекватной дозы L-T4.
Прогноз
В первую очередь зависит от времени начала заместительной терапии L-T4. Если это происходит на первой-второй неделе жизни - нарушения психического и физического развития практически полностью предотвращаются. Далее по мере увеличения времени от рождения ребенка до назначения заместительной терапии увеличивается риск развития и тяжесть олигофрении вплоть до тяжелейших форм.
3.7. ТИРЕОИДИТЫ
Термин «тиреоидит» объединяет гетерогенную группу воспалительных заболеваний ЩЖ. Наиболее часто встречаются различные варианты аутоиммунного тиреоидита.
3.7.1. Аутоиммунный тиреоидит
Аутоиммунный тиреоидит (АИТ) - гетерогенная группа воспалительных заболеваний ЩЖ аутоиммунной этиологии, в основе патогенеза которых лежит различной выраженности деструкция фолликулов и фолликулярных клеток ЩЖ.
3.7.1.1. Хронический аутоиммунный тиреоидит
Хронический аутоиммунный тиреоидит (тиреоидит Хашимото, лимфоцитарный тиреоидит) - хроническое воспалительное заболевание ЩЖ аутоиммунного генеза, при котором в результате хронически прогрессирующей лимфоидной инфильтрации происходит постепенная деструкция паренхимы ЩЖ с возможным исходом в первичный гипотиреоз (табл. 3.16). Впервые заболевание было описано японским хирургом Н. Hashimoto в 1912 г. Он наблюдал несколько случаев увеличения ЩЖ, обусловленного лимфоидной инфильтрацией (лимфоматозный зоб), в связи с чем термином тиреоидит Хашимото обозначают гипертрофический вариант АИТ, хотя очень часто его распространяют на хронический АИТ в целом.
Этиология
Заболевание развивается на фоне генетически детерминированного дефекта иммунного ответа, приводящего к Т-лимфоцитарной агрессии против собственных тиреоцитов, заканчивающейся их разрушением. Гистологически при этом определяются лимфоцитарная и плазмоцитарная инфильтрация, онкоцитарная трансформация тиреоцитов (образование клеток Гюртле-Ашкенази), разрушение фолликулов. АИТ имеет тенденцию проявляться в виде семейных форм. У пациентов с повышенной частотой обнаруживаются гаплотипы HLA-DR3, DR5, В8. В 50 % случаев у родственников пациентов с АИТ обнаруживаются циркулирующие антитела к ЩЖ. Кроме того, наблюдается сочетание АИТ у одного и того же пациента или в пределах одной семьи с другими аутоиммунными заболеваниями - пернициозной анемией, аутоиммунным первичным гипокортицизмом, хроническим аутоиммунным гепатитом, сахарным диабетом 1 типа, витилиго, ревматоидным артритом и др.
Табл. 3.16. Хронический аутоиммунный тиреоидит
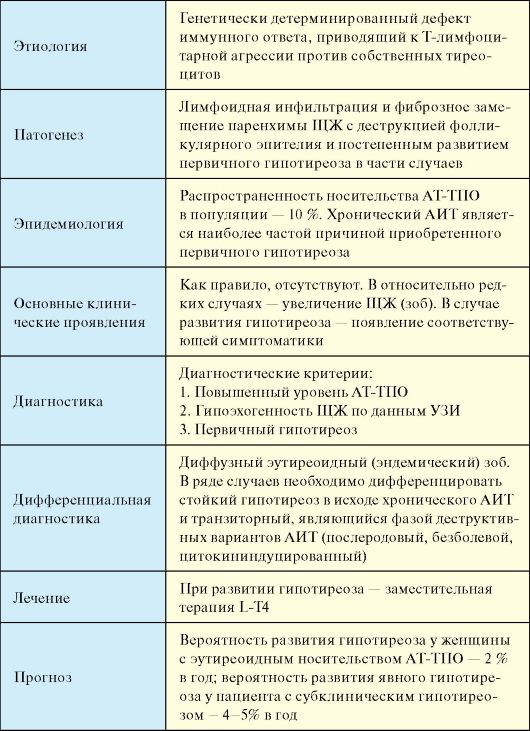
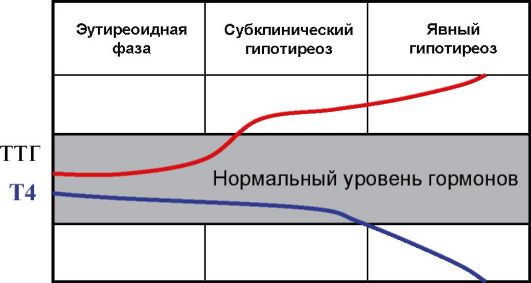 Рис. 3.22. Динамика функции щитовидной железы при хроническом АИТ
Рис. 3.22. Динамика функции щитовидной железы при хроническом АИТ
Патогенез
Патологическое значение для организма АИТ практически исчерпывается тем, что он является фактором риска развития гипотиреоза. Факт носительства антител к ЩЖ, которые являются маркерами АИТ, в популяции многократно превышает распространенность гипотиреоза, свидетельствует о том, что в большинстве случаев заболевание не приводит к развитию гипотиреоза, то есть выраженность замещения паренхимы ЩЖ лимфоидной и фиброзной тканью не превышает некий критический уровень. Остаются непонятными различие в скорости прогрессирования процесса у отдельных пациентов, а также причины увеличения ЩЖ в одних случаях (гипертрофическая форма) и ее значительное уменьшение в других (атрофическая форма).
Прогрессирование АИТ от эутиреоидной фазы к гипотиреозу представлено на рис. 3.22. Эутиреоидная фаза, как указывалось, может продолжаться многие годы или десятилетия, или даже на протяжении всей жизни. Далее в случае прогрессирования процесса, а именно постепенного усиления лимфоцитарной инфильтрации ЩЖ и деструкции ее фолликулярного эпителия, число клеток, продуцирующих тиреоидные гормоны, уменьшается. В этих условиях, для того чтобы обеспечить организм достаточным количеством тиреоидных гормонов, повышается продукция ТТГ, который гиперстимулирует ЩЖ. За счет этой гиперстимуляции на протяжении неопределенного времени (иногда десятков лет) удается сохранять продукции Т4 на нормальном уровне. Это фаза субклинического гипотиреоза (ТТГТ, Т4 - в норме). При дальнейшем разрушении ЩЖ число функционирующих тироцитов падает ниже критического
уровня, концентрация Т4 в крови снижается и манифестирует гипотиреоз (фаза явного гипотиреоза).
Эпидемиология
Распространенность собственно АИТ оценить трудно, поскольку в эутиреоидной фазе он практически не имеет точных диагностических критериев. Распространенность в общей популяции носительства антител к тиреоидной пероксидазе (АТ-ТПО) составляет порядка 10 % и варьирует в зависимости от ее этнического состава. Распространенность как носительства АТ-ТПО, так и гипотиреоза в исходе АИТ примерно в 10 раз выше у женщин по сравнению с мужчинами. АИТ является причиной примерно 70-80 % всех случаев первичного гипотиреоза, распространенность которого оставляет порядка 2 % в общей популяции и достигает 10-12 % среди женщин пожилого возраста.
Клинические проявления
В эутиреоидной фазе и фазе субклинического гипотиреоза отсутствуют. В отдельных, относительно редких случаях, на первый план еще в эутиреоидной фазе выступает увеличение объема ЩЖ (зоб), которое достаточно редко достигает значительных степеней. При развитии гипотиреоза у пациента начинают нарастать соответствующие симптомы (см. п. 3.6.1).
Диагностика
К критериям, сочетание которых позволяет установить диагноз АИТ, относят:
• повышение уровня циркулирующих антител к ЩЖ (более информативно определение АТ-ТПО);
• обнаружение типичные ультразвуковые признаки АИТ (гипоэхогенность ЩЖ); (рис. 3.23)
• первичный гипотиреоз (субклинический или манифестный).
При отсутствии хотя бы одного из перечисленных критериев диагноз АИТ носит вероятностный характер, поскольку само по себе повышение уровня АТ-ТПО или гипоэхогенность ЩЖ по данным УЗИ еще не свидетельствует об АИТ и не позволяет установить этот диагноз. Таким образом, диагностика АИТ в эутиреоидной фазе (до манифестации гипотиреоза) достаточно сложна. При этом реальной практической необходимости в установлении диагноза АИТ в фазе эутиреоза, как правило, нет, поскольку лечение (заместительная терапия L-T4) показано пациенту только в гипотиреоидную фазу.
Дифференциальная диагностика
В регионах йодного дефицита может возникнуть необходимость дифференциальной диагностики простого эндемического зоба и гипертрофической формы АИТ в фазе эутиреоза. При этом следует учесть, что умеренное повышение уровня АТ-ТПО встречается и при эндемическом зобе, кроме того, возможно развитие АИТ на фоне предсуществующего зоба (струмит). В гипотиреоидной фазе АИТ может понадобиться дифференциальная диагностика между необратимым гипотиреозом в исходе хронического АИТ и транзиторным гипотиреозом, который является одной из фаз деструктивных вариантов АИТ (послеродовый, молчащий, цитокининдуцированный). Вывод о стойком характере гипотиреоза делается в случае если при попытке временной отмены заместительной терапии спустя примерно год от ее начала у пациента происходит повышение уровня ТТГ и снижение уровня Т4.
Лечение
Специфическое лечение не разработано, и на сегодняшний день отсутствуют эффективные и безопасные методы воздействия на аутоиммунный процесс, развивающийся в ЩЖ, которые могли бы предотвратить прогрессирование АИТ до гипотиреоза. При развитии гипотиреоза показана заместительная терапия левотироксином (см. п. 3.6.1).
Прогноз
АИТ и носительство АТ-ТПО следует рассматривать как факторы риска развития гипотиреоза в будущем. Вероятность развития гипотиреоза у женщины с повышенным уровнем АТ-ТПО и нормальным
 Рис. 3.23. Гипертрофическая
форма аутоиммунного тиреоидита (эхограмма щитовидной железы). Железа
увеличена за счет перешейка, паренхима смешанной эхогенности с
гипоэхогенными участками инфильтрации
Рис. 3.23. Гипертрофическая
форма аутоиммунного тиреоидита (эхограмма щитовидной железы). Железа
увеличена за счет перешейка, паренхима смешанной эхогенности с
гипоэхогенными участками инфильтрации
уровнем ТТГ составляет около 2 % в год, вероятность развития явного гипотиреоза у женщины с субклиническим гипотиреозом (ТТГТ, Т4 - в норма) и повышенным уровнем АТ-ТПО составляет 4,5 % в год.
У женщин, которые являются носительницами АТ-ТПО без нарушения ее функции, при наступлении беременности повышается риск развития гипотиреоза и так называемой относительной гестационной гипотироксинемии (см. п. 3.9.3). В связи с этим у таких женщин необходим контроль функции ЩЖ на ранних сроках беременности, а при необходимости и на более поздних сроках.
3.7.1.2. Послеродовый, безболевой и цитокин-индуцированный тиреоидит
Эти варианты АИТ объединяет фазность происходящих в ЩЖ железе изменений, связанных с аутоиммунной агрессией: при наиболее типичной течении фаза деструктивного тиреотоксикоза сменяется фазой транзиторного гипотиреоза, после чего в большинстве случаев происходит восстановление функции ЩЖ табл. 3.17. Наиболее изучен и чаще всего встречается послеродовый тиреоидит.
Этиология
Сходна с таковой при хроническом АИТ, поскольку все варианты деструктивного АИТ развиваются у носителей АТ-ТПО, а в ЩЖ при этом выявляется лимфоцитарная инфильтрация и формирование лимфоидных фолликулов. В качестве причины послеродового тиреоидита рассматривается избыточная реактивация иммунной системы после естественной гестационной иммуносупрессии (феномен рикошета), которая у предрасположенных лиц (носительницы АТТПО) приводит к деструктивному АИТ. Провоцирующие факторы для безболевого («молчащего») тиреоидита неизвестны; этот вариант деструктивного АИТ, по сути, является полным аналогом послеродового, но развивается вне связи с беременностью. Причиной развития цитокин-индуцированного тиреоидита является назначение пациенту по поводу различных заболеваний (гепатит С, заболевания крови) препаратов интерферона, при этом четкой временной связи между развитием тиреоидита и продолжительностью терапии интерферонами не прослеживается: тиреоидит может развиться как в начале лечения, так и спустя месяцы.
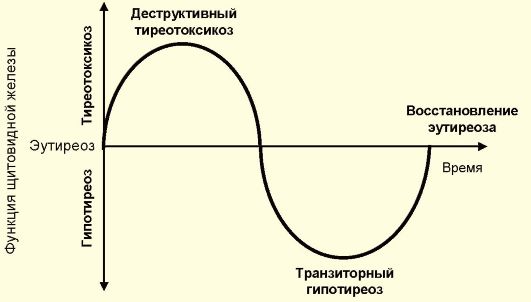 Рис. 3.24. Естественное течение деструктивного тиреотоксикоза
Рис. 3.24. Естественное течение деструктивного тиреотоксикоза
Патогенез
При всех деструктивных АИТ заболевание проходит несколько фаз (рис. 3.24). Тиреотоксическая фаза, судя по всему, является следствием антителозависимой атаки комплемента на тироциты, в результате которой происходит высвобождение готовых тиреоидных гормонов в кровеносное русло. Если деструкция ЩЖ была достаточно выраженной, наступает вторая фаза - гипотиреоидная, которая обычно продолжается не более года. В дальнейшем чаще всего происходит восстановление функции ЩЖ, хотя в ряде случаев гипотиреоз остается стойким. При всех трех вариантах деструктивного АИТ процесс может иметь монофазный характер (только тиреотоксическая или только гипотиреоидная фаза).
Эпидемиология
Послеродовый тиреоидит развивается в послеродовом периоде у 5-9 % всех женщин, при этом он строго ассоциирован с носительством АТ-ТПО. Он развивается у 50 % носительниц АТ-ТПО, при этом, как указывалось, распространенность носительства АТ-ТПО среди женщин достигает 10 %. Послеродовый тиреоидит развивается у 25 % женщин с сахарным диабетом 1 типа.
Табл. 3.17. Послеродовый, безболевой и цитокин-индуцированный тиреоидит
 Распространенность безболевого (молчащего)
тиреоидита неизвестна. Как и послеродовый тиреоидит, он ассоциирован с
носительством АТ-ТПО и в силу доброкачественности течения чаще всего
остается недиагностированным. Цитокин-индуцированный тиреоидит, как
и два обсуждавшихся выше, чаще развивается у женщин (в 4 раза) и
ассоциирован с носительством АТ-ТПО. Риск его развития у носителей
АТ-ТПО, получающих препараты интерферонов, составляет около 20 %.
Зависимость между временем начала, продолжительностью и схемой терапии
интерферонами отсутствует. При развитии цитокининдуцированного
тиреоидита отмена или изменение схемы терапии интерферонами на
естественном течении заболевания, видимо, не отражается.
Распространенность безболевого (молчащего)
тиреоидита неизвестна. Как и послеродовый тиреоидит, он ассоциирован с
носительством АТ-ТПО и в силу доброкачественности течения чаще всего
остается недиагностированным. Цитокин-индуцированный тиреоидит, как
и два обсуждавшихся выше, чаще развивается у женщин (в 4 раза) и
ассоциирован с носительством АТ-ТПО. Риск его развития у носителей
АТ-ТПО, получающих препараты интерферонов, составляет около 20 %.
Зависимость между временем начала, продолжительностью и схемой терапии
интерферонами отсутствует. При развитии цитокининдуцированного
тиреоидита отмена или изменение схемы терапии интерферонами на
естественном течении заболевания, видимо, не отражается.
Клинические проявления
При всех трех деструктивных АИТ симптоматика нарушения функции ЩЖ выражены весьма умеренно, либо вообще отсутствуют. ЩЖ не увеличена если тиреоидит не развился на фоне предсуществующего зоба, безболезненна при пальпации. Эндокринная офтальмопатия никогда не развивается. Послеродовый тиреоидит, как правило, манифестирует легким тиреотоксикозом примерно на 14 неделе после родов. В большинстве случаев неспецифичные симптомы в виде утомляемости, общей слабости, некоторого снижения веса связываются с недавними родами. В отдельных случаях тиреотоксикоз выражен значительно и ситуация требует дифференциальной диагностики с болезнью Грейвса. Гипотиреодная фаза развивается примерно на 19 неделе после родов, при этом о тяжелом гипотиреозе речи, как правило, не идет. В ряде случаев с гипотиреоидной фазой послеродового тиреоидита ассоциирована с послеродовой депрессией.
Безболевой (молчащий) тиреоидит диагностируется при легком, часто субклиническом тиреотоксикозе, который, в свою очередь, выявляется при нецеленаправленном гормональном исследовании. Диагноз гипотиреоидной фазы безболевого тиреоидита может устанавливаться ретроспективно, при динамическом наблюдении пациентов с субклиническим гипотиреозом, который заканчивается нормализацией функции ЩЖ.
Цитокин-индуцированный тиреоидит также, как правило, не сопровождается тяжелым тиреотоксикозом или гипотиреозом и чаще всего диагностируется при плановом гормональном исследовании, которое входит в алгоритм наблюдения пациентов, получающих препараты интерферонов.
Диагностика
В основе диагностики лежат анамнестические указания на недавние роды (аборт) или получение пациентом терапии препаратами интерферона. В указанных ситуациях нарушение функции ЩЖ в подавляющем большинстве связано соответственно с послеродовым и цитокин-индуцированным тиреоидитом. Безболевой тиреоидит следует подозревать у пациентов с легким, часто субклиническим тиреотоксикозом, у которых отсутствуют клинические проявления и эндокринная офтальмопатия. Для тиреотоксической фазы всех трех тиреоидитов характерно снижение накопления радиофармпрепарата по данным сцинтиграфии ЩЖ. При УЗИ выявляются неспецифическая для всех аутоиммунных заболевания сниженная эхогенность паренхимы.
Дифференциальная диагностика
Тиреотоксическую фазу всех трех тиреоидитов необходимо дифференцировать от болезни Грейвса. Следует заметить, что последняя достаточно часто манифестирует (рецидивирует) именно в послеродовом периоде и может быть индуцирована назначением препаратов интерферона. Важнейшим дифференциально-диагностическим методом, который позволяет отличить болезнь Грейвса от тиреотоксической фазы деструктивных АИТ, является сцинтиграфия ЩЖ, которая при болезни Грейвса позволяет выявить диффузное усиление захвата 99mTc, а при деструктивных тиреоидитах - снижение или отсутствие его захвата (рис. 3.25).
Определенные сложности могут возникнуть при дифференциальной диагностике болезни Грейвса и послеродового тиреоидита у кормящих женщин, которым противопоказано проведение сцинтиграфии ЩЖ. В этой ситуации помогает динамическое наблюдение: в случае послеродового тиреоидита происходит постепенное снижение уровня тиреоидных гормонов в крови.
Гипотиреоидную фазу деструктивных тиреоидитов необходимо дифференцировать от стойкого гипотиреоза в исходе хронического АИТ. В этом плане помогает анамнез (недавние роды, терапия интерфероном) и динамическое наблюдение с попыткой отмены назначенной заместительной терапии.
Лечение
В тиреотоксическую фазу назначение тиростатиков (тиамазол) не показано, поскольку гиперфункции ЩЖ при деструктивном тирео-
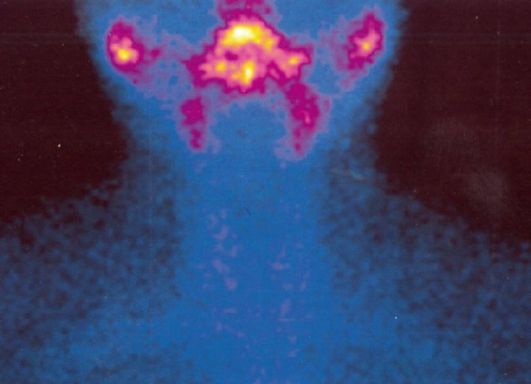 Рис. 3.25. Сцинтиграфия щитовидной железы при послеродовом тиреоидите: резкое снижение захвата 99mTc в сочетании с усиленным захватом слюнными железами
Рис. 3.25. Сцинтиграфия щитовидной железы при послеродовом тиреоидите: резкое снижение захвата 99mTc в сочетании с усиленным захватом слюнными железами
токсикозе отсутствуют. При выраженной сердечно-сосудистой симптоматике назначают β-адреноблокаторы. При гипотиреоидной фазе назначают заместительную терапию левотироксином. Спустя примерно год делают попытку его отмены: в случае, если гипотиреоз был транзиторным, у пациента сохранится эутиреоз, при стойком гипотиреозе произойдет повышение уровня ТТГ и снижение Т4.
Прогноз
У женщин с послеродовым тиреоидитом вероятность его повторения после следующей беременности составляет 70 %. Примерно у 25-30 % женщин, перенесших послеродовый тиреоидит, в дальнейшем развивается хронический вариант АИТ с исходом в стойкий гипотиреоз.
3.7.2. Подострый тиреоидит
Подострый тиреоидит (тиреоидит Де Кервена, гранулематозный тиреоидит) - воспалительное заболевание ЩЖ, предположительно вирусной этиологии, при котором деструктивный тиреотоксикоз сочетается с болевым синдромом в области шеи и симптоматикой острого инфекционного заболевания (табл. 3.18).
Этиология
Предположительно вирусная, поскольку во время заболевания у части пациентов обнаруживается повышение уровня антител к вирусам
гриппа, эпидемического паротита, аденовирусам. Кроме того, подострый тиреоидит часто развивается после инфекций верхних дыхательных путей, гриппа, эпидемического паротита, кори. Доказана генетическая предрасположенность к развитию заболевания. Среди пациентов с подострым тиреоидитом в 30 раз чаще встречаются носители антигена HLA-Bw35.
Табл. 3.18. Подострый тиреоидит
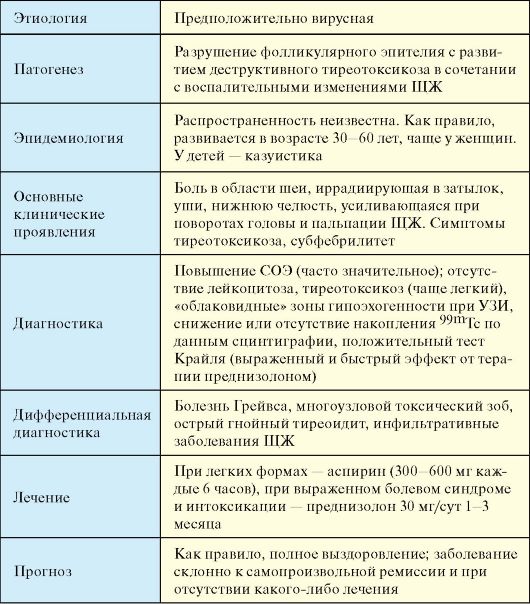 Патогенез
Патогенез
Если придерживаться вирусной теории патогенеза подострого тиреоидита, наиболее вероятно, что внедрение вируса в тиреоцит вызывает разрушение последнего с попаданием фолликулярного содержимого в кровеносное русло (деструктивный тиреотоксикоз). Тканевая реакция на внедрение вируса гистологически проявляется фокальной гранулематозной инфильтрацией гистиоцитами и гигантскими клетками. По окончании вирусной инфекции происходит восстановление функции ЩЖ, в ряде случаев после короткой гипотиреоидной фазы.
Эпидемиология
Заболевают в основном люди в возрасте от 30 до 60 лет, при этом женщины в 5 и более раз чаще, чем мужчины; у детей заболевание встречается казуистически редко. В структуре заболеваний, протекающих с тиреотоксикозом, подострый тиреоидит встречается в 10-20 раз реже болезни Грейвса. Можно предположить несколько большую заболеваемость, учитывая тот факт, что подострый тиреоидит может иметь очень легкое течение, маскирующееся под другую патологию (ангина, ОРВИ) с последующей самопроизвольной ремиссией.
Клинические проявления
Клиническая картина представлена тремя группами симптомов: болевой синдром в области шеи, тиреотоксикоз (легкий или умеренный) и симптоматика острого инфекционного заболевания (интоксикация, потливость, субфебрилитет). Типичным для подострого тиреоидита является довольно внезапное появление диффузных болей в области шеи. Шейные движения, глотание и различные раздражения области ЩЖ весьма неприятны и болезненны. Боль часто иррадиирует в затылок, уши и нижнюю челюсть. При пальпации ЩЖ болезненная, плотная, умеренно увеличена; болезненность может быть локальной или диффузной в зависимости от степени вовлечения железы в воспалительный процесс. Характерны переменная интенсивность и переходящая (блуждающая) боль из области одной доли в другую, а также выраженные общие явления: тахикардия, астенизация, потеря массы тела.
Повышение температуры (субфебрилитет или легкая лихорадка) встречается примерно у 40 % пациентов. Нередко боль в области шеи является единственным клиническим проявлением подострого тиреоидита, при этом тиреотоксикоз у пациента может вообще отсутствовать.
Диагностика
Увеличение СОЭ - одно из наиболее типичных проявлений подострого тиреоидита, при этом она может быть увеличена значительно (более 50-70 мм/час). Лейкоцитоз, свойственный бактериальным инфекциям отсутствует, может определяться умеренный лимфоцитоз. Как и при других заболеваниях, протекающих с деструктивным тиреотоксикозом, уровень тиреоидных гормонов повышен умеренно; часто встречается субклинический тиреотоксикоз, нередко - эутиреоидное течение заболевания.
По данным УЗИ, для подострого тиреоидита характерны нечетко ограниченные гипоэхогенные ареалы, реже диффузная гипоэхогенность. При сцинтиграфии выявляется снижение захвата 99mTc.
Важное диагностическое значение имеют результаты лечения преднизолоном (диагностика ex juvantibus), начальный этап которого известен как тест Крайля. Последний считается положительным, если в первые 12-48 часов после назначения препарата в дозе около 30 мг/сут у пациента происходит значительное уменьшение или исчезновение болей в области шеи, улучшение общего самочувствия и появление заметной тенденции к снижению СОЭ.
Дифференциальная диагностика
Проводится с заболеваниями, при которых тиреотоксикоз обусловлен гиперфункцией ЩЖ (болезнь Грейвса, многоузловой токсический зоб); подострый тиреоидит отличает снижение накопления 99mTc по данным сцинтиграфии, отсутствие эндокринной офтальмопатии. При очень редко встречающемся остром гнойном тиреоидите наряду с болезненностью в области шеи выявляется лейкоцитоз, отсутствует тиреотоксикоз, при УЗИ выявляется жидкостная полость (абсцесс), при пункционной биопсии которой получается гнойное содержимое. Тест Крайля оказывается положительным практически только при подостром тиреоидите.
Лечение
В случае легкого подострого тиреоидита, при котором определяется лишь некоторая болезненность в области шеи и отсутствует интоксикация, лечение вообще может не потребоваться, и заболевание заканчивается самопроизвольно. При легком болевом синдроме могут назначаться нестероидные противовоспалительные препараты (аспирин - 300-600 мг каждые 6 часов). При выраженном болевом синдроме (большинство пациентов) назначается преднизолон в суточной дозе порядка 30 мг с ее постепенным уменьшением и отменой
на протяжении 2-3 месяцев в зависимости от тяжести заболевания. В ряде случаев после окончания лечения, а иногда, спустя несколько месяцев, происходит рецидив заболевания (иногда не один), лечение которого аналогично. При достаточно редко встречающемся при подостром тиреоидите транзиторном гипотиреозе показана временная заместительная терапия левотироксином.
Прогноз
В целом заболевание склонно к самопроизвольному разрешению, то есть в случае, когда лечение по каким-то причинам не назначается, подострый тиреоидит все равно постепенно разрешается, заканчиваясь полным выздоровлением. В подавляющем большинстве случаев, подострый тиреоидит не рецидивирует и заканчивается полным выздоровлением.
3.7.3. Редкие тиреоидиты
К редким тиреоидитам относят острый гнойный тиреоидит, фиброзирующий тиреоидит Риделя, а также специфические тиреоидиты (туберкулезный, сифилитический, грибковый, актиномикозный и прочие). Большинство из них встречаются казуистически редко
(табл. 3.19).
Табл. 3.19. Редкие тиреоидиты
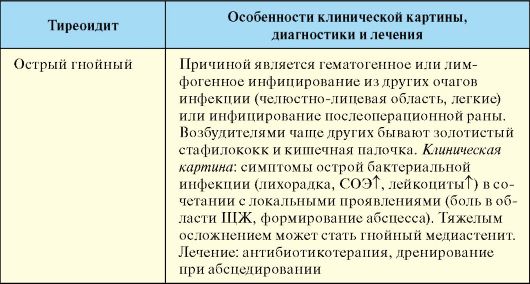 Окончание табл. 3.19
Окончание табл. 3.19
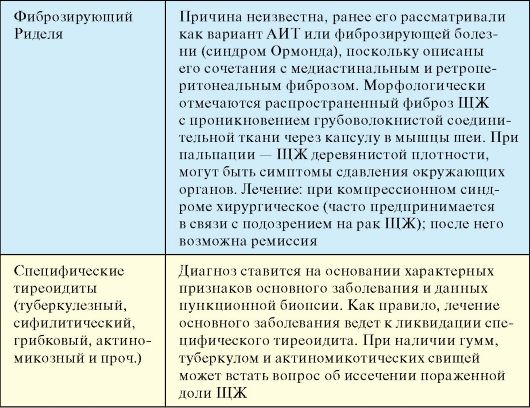 3.8. УЗЛОВОЙ И МНОГОУЗЛОВОЙ ЭУТИРЕОИДНЫЙ ЗОБ
3.8. УЗЛОВОЙ И МНОГОУЗЛОВОЙ ЭУТИРЕОИДНЫЙ ЗОБ
Узловой зоб - собирательное клиническое понятие, объединяющее различные по морфологии объемные образования ЩЖ, выявляемые с помощью пальпации и инструментальных методов диагностики (прежде всего УЗИ). Термин «многоузловой зоб» целесообразно использовать при обнаружении в ЩЖ двух и более узловых образований. Клиническое понятие «узловой (многоузловой) зоб» объединяет следующие наиболее частые нозологические (морфологические) формы:
- узловой коллоидный в разной степени пролиферирующий зоб;
- фолликулярные аденомы;
- злокачественные опухоли ЩЖ (см. п. 3.11).
Кроме того, формирование так называемых псевдоузлов (воспалительный инфильтрат и другие узлоподобные изменения) может происходить при хроническом АИТ, а также при подостром тиреоидите и ряде других заболеваний ЩЖ. При большинстве заболеваний ЩЖ, протекающих с образованием узлов, возможно развитие кистозных изменений; истинные кисты ЩЖ практически не встречаются. Многоузловой зоб может быть представлен разными по морфологии заболеваниями ЩЖ, например один узел - аденома, другой - коллоидный зоб. Узловой (многоузловой) зоб относится к наиболее распространенной патологии ЩЖ, при этом наиболее часто (около 90 %) узловые образования ЩЖ представляют собой узловой коллоидный пролиферирующий зоб, который не является опухолью ЩЖ (табл. 3.20).
Этиология
Этиология большинства опухолей ЩЖ неизвестна. Часть токсических аденом обусловлено мутациями гена рецептора ТТГ и α-субъединицы G-белка каскада аденилатциклазы (см. п. 3.9.2.2). Ряд наследуемых и соматических мутаций обнаруживаются при раке ЩЖ, в первую очередь при медуллярном (см. п. 3.11). Причина развития узлового коллоидного пролиферирующего зоба неизвестна. Учитывая увеличение его распространенности с возрастом, которая у лиц пожилого возраста и по данным аутопсий достигает 40-60 %, узловой коллоидный зоб часто рассматривается как возрастная трансформация ЩЖ. Предрасполагает к развитию коллоидного зоба йодный дефицит, тем не менее его распространенность значительна и в регионах с нормальным потреблением йода. Наиболее вероятно, коллоидный пролиферирующий зоб является патологией всей ЩЖ, поскольку вероятность развития новых узловых образований у пациентов с исходно обнаруженным солитарным узлом, достигает 50-80 %. В регионах йодного дефицита при узловом (чаще многоузловом) зобе может формироваться функциональная автономия ЩЖ с развитием тиреотоксикоза (см.
п. 3.9.2.2).
Табл. 3.20. Узловой и многоузловой эутиреоидный зоб
 Окончание табл. 3.20
Окончание табл. 3.20
 Патогенез
Патогенез
При опухолях ЩЖ происходит активная пролиферация пула опухолевых клеток, постепенно формирующих узел. Фолликулярная аденома является доброкачественной опухолью из фолликулярного эпителия, чаще происходит из А-клеток. Среди фолликулярных аденом выделяют трабекулярную (эмбриональную), микрофолликулярную (фетальную), макрофолликулярную (простую). Реже аденома происходит из В-клеток (онкоцитома). Патологическое значение фолликулярной аденомы при достижении больших размеров ограничивается потенциальной возможностью развития компрессионного синдрома. Она не может подвергаться злокачественному перерождению, но тем не менее показания к оперативному лечению определяются сложностью дифференциальной диагностики с высокодифференцированным раком ЩЖ.
Наиболее часто встречающийся узловой коллоидный в разной степени пролиферирующий зоб не является опухолевым заболеванием. При цитологическом исследовании он не отличается по строению от диффузного эутиреоидного (эндемического) зоба (см. п. 3.9.2.1); по данным гистологического исследования его отличает наличие капсулы. Основными звеньями его патогенеза являются избыточное накоп-
ление коллоида в полости фолликулов и пролиферация тироцитов. Последняя носит полифокальный характер, вследствие чего зобные изменения могут быть выявлены за пределами узла, что определяет высокую вероятность появления в ЩЖ пациентов с солитарными образованиями новых узлов. Патологическое значение узлового коллоидного пролиферирующего зоба определяется:
• относительно небольшим риском значительного увеличения ЩЖ со сдавлением окружающих органов и/или формированием косметического дефекта;
• в регионах йодного дефицита риском развития функциональной автономии ЩЖ и тиреотоксикоза (см. п. 3.9.2.2).
Эпидемиология
При пальпации выявляется не менее чем у 5 % в общей популяции; по данным УЗИ в отдельных группах населения распространенность узлового зоба может достигать 50 % и более. С возрастом распространенность увеличивается; у женщин узловой зоб встречается в 5-10 раз чаще. Частота новых случаев пальпируемых узловых образований составляет около 0,1 % популяции в год. В структуре узлового зоба на коллоидный пролиферирующий зоб приходится 85-90 %, на аденомы - 5-8 %; на злокачественные опухоли - 1-5 %.
Клинические проявления
В подавляющем большинстве случаев отсутствуют. При крупных узловых образованиях возможен косметический дефект на шее, компрессионный синдром, обусловленный сдавлением трахеи. В регионах йодного дефицита при узловом (многоузловом) зобе может формироваться функциональная автономия ЩЖ с развитием тиреотоксикоза.
Диагностика
Методом первичной диагностики узлового зоба является пальпация ЩЖ. При обнаружении узлового образования пациенту показано УЗИ ЩЖ, которое позволит точно оценить размер самого узла и объем ЩЖ. Существует ряд характерных ультрасонографических признаков различных заболеваний, протекающих с узловым зобом, но их диагностическая чувствительность и специфичность невысока. В связи с этим при выявлении пальпируемого узлового образования и превышающего по данным УЗИ 1 см в диаметре показано проведение тонкоигольной аспирационной биопсии (ТАБ). Проведение ТАБ при случайно выявленных образованиях меньшего размера целесообразно только при подозрении на злокачественную опухоль ЩЖ по
данным УЗИ. Проведение ТАБ под контролем УЗИ существенно увеличивает информативность исследования, особенно в случае узловых образований с кистозным компонентом, при которых ультразвуковой контроль позволяет локально пропунктировать пристеночный солидный компонент кистозного узла. По цитологическому исследованию пунктата узлового образования ЩЖ могут быть даны заключения, представленные в табл. 3.21.
Табл. 3.21. Заключения по цитологическому исследованию пунктата узловых образований ЩЖ
 Цитологическое
исследование не позволяет дифференцировать фолликулярную аденому
(аденому из клеток Гюртле-Ашкенази) от высокодифференцированного
фолликулярного рака (рака из клеток Гюртле-Ашкенази). Это может быть
выполнено только при гистологическом исследовании удаленной ЩЖ, при этом
фолликулярный рак отличает инвазия опухоли в капсулу и сосуды.
Цитологическое
исследование не позволяет дифференцировать фолликулярную аденому
(аденому из клеток Гюртле-Ашкенази) от высокодифференцированного
фолликулярного рака (рака из клеток Гюртле-Ашкенази). Это может быть
выполнено только при гистологическом исследовании удаленной ЩЖ, при этом
фолликулярный рак отличает инвазия опухоли в капсулу и сосуды.
Для оценки функции ЩЖ показано определение уровня ТТГ. Сцинтиграфия ЩЖ позволяет охарактеризовать функциональную активность узлового образования («горячий», «холодный») и является основным методом диагностики функциональной автономии ЩЖ (см. п. 3.9.2.2). При крупном, особенно загрудинно расположенном зобе с целью диагностики смещения и риска компрессии трахеи проводится рентгенография грудной клетки с контрастированным барием пищеводом (рис. 3.26).
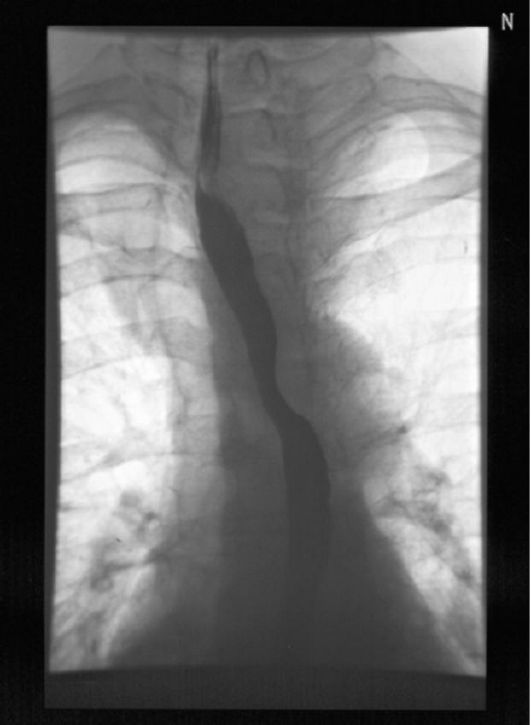 Рис. 3.26. Рентгенография
грудной клетки с контрастированным барием пищеводом. Определяется
выраженная девиация и компрессия пищевода большим загрудинно
расположенным зобом
Рис. 3.26. Рентгенография
грудной клетки с контрастированным барием пищеводом. Определяется
выраженная девиация и компрессия пищевода большим загрудинно
расположенным зобом
Более детальная топическая диагностика загрудинного зоба с оценкой его размеров и взаимоотношения с окружающими органами возможна при МРТ.
Дифференциальная диагностика
Проводится между заболеваниями, проявляющимися узловым зобом. В ее основе лежит ТАБ, а также результаты УЗИ, сцинтиграфии и гормонального исследования.
Лечение
Подавляющее большинство коллоидных пролиферирующих узловых образований без нарушения функции ЩЖ имеет небольшой размер, не представляющий угрозу компрессии или косметическую проблему. Их патологическое значение для организма зачастую сомнительно. Особенно это касается мелких, случайно выявленных узлов. Таким образом, при выявлении узлового (многоузлового) пролиферирующего зоба активное медикаментозное и, тем более инвазивное вмешательство (операция, склеротерапия и т.д.), в большинстве случаев не показано. Динамическое наблюдение таких пациентов подразумевает периодическую (раз в 1-2 года) оценку функции ЩЖ и УЗИ. Показания к хирургическому лечению при узловом (многоузловом) коллоидном пролиферирующем зобе ограничиваются случаями значительного увеличения размера ЩЖ с косметическим дефектом или компрессионным синдромом, при этом альтернативным методом лечения в таких случаях является терапия 131I. При узловом коллоидном пролиферирующем зобе с кистозным компонентом ТАБ может рассматриваться как лечебная манипуляция, поскольку она позволяет эвакуировать содержимое кисты.
Лечение опухолей ЩЖ - оперативное, а при высокодифференцированном раке ЩЖ после тиреоидэктомии проводится терапия 131I (см. п. 3.11). В случае если по данным ТАБ пациенту устанавливается
диагноз фолликулярной неоплазии, которая представлена солитарным узловым образованием проводится гемитиреоидэктомия с удалением перешейка. В том случае, если образование оказывается аденомой, лечение на этом заканчивается, а если фолликулярным раком ЩЖ - при повторном вмешательстве удаляется противоположная доля ЩЖ, после чего рассматривается вопрос о терапии 131I.
Прогноз
Чаще всего узловой коллоидный эутиреоидный зоб, не являющийся опухолевым заболеванием, не имеет патологического и прогностического значения для пациента. Риск значительного увеличения ЩЖ с развитием компрессионного синдрома весьма низок. В регионах йодного дефицита прогноз может определяться развитием тиреотоксикоза вследствие формирования функциональной автономии ЩЖ. Прогноз при злокачественных опухолях ЩЖ определяется их морфологией.
3.9. ЙОДОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ
К йододефицитным заболеваниям (ЙДЗ) относятся все патологические состояния, развивающиеся в популяции вследствие йодного дефицита, которые могут быть предотвращены при нормализации потребления йода (табл. 3.22). Этот термин подчеркивает тот факт, что заболевания ЩЖ являются далеко не единственным и не самым тяжелым последствием дефицита йода. Минимальная физиологическая потребность в йоде варьирует в зависимости от возраста и физиологического состояния организма (табл. 3.23).
3.9.1. Эпидемиология йододефицитных заболеваний
Дефицит йода является естественным экологическим феноменом, поскольку плодородная почва, а также растительная и животная пища содержат очень мало этого микроэлемента. В связи с этим ЙДЗ являются серьезной проблемой здравоохранения во многих регионах мира. Согласно данным ВОЗ, около 1570 млн. человек (30 % населения земного шара) имеют риск развития ЙДЗ, в том числе более 500 млн. людей проживает в регионах с тяжелым дефицитом йода и высокой распространенностью эндемического зоба.
Табл. 3.22. Спектр йододефицитной патологии
 Табл. 3.23. Нормы потребления йода (ВОЗ, 2005)
Табл. 3.23. Нормы потребления йода (ВОЗ, 2005)
 Основным
показателем напряженности йодного дефицита в популяции является уровень
экскреции йода с мочой в репрезентативной группе населения,
проживающего в том или ином регионе. Репрезентативной группой принято
считать детей младшего школьного возраста (7-12 лет), при этом само
обследование обычно про-
Основным
показателем напряженности йодного дефицита в популяции является уровень
экскреции йода с мочой в репрезентативной группе населения,
проживающего в том или ином регионе. Репрезентативной группой принято
считать детей младшего школьного возраста (7-12 лет), при этом само
обследование обычно про-
водится непосредственно в школах, что предопределяет случайность отбора и репрезентативность выборки. После определения уровня экскреции йода в индивидуальных порциях мочи рассчитывается интегральный показатель - медиана йодурии (табл. 3.24). Косвенным и менее надежным показателем выраженности йодного дефицита является распространенность увеличения ЩЖ (зоба) в этой же группе детей.
Табл. 3.24. Эпидемиологические критерии оценки тяжести йодного дефицита в зависимости от уровня йода в моче
 В
соответствии с этими критериями по данным за 2006 года йодный дефицит
преимущественно легкой, реже умеренной тяжести определялся на всей
территории Российской Федерации, Украины, а также многих стран Западной и
Восточной Европы (Франция, Испания, Бельгия, Италия). Спектр ЙДЗ
существенно отличается в регионах с разной выраженностью йодного
дефицита и варьирует от тяжелых степеней нарушения психического развития
до некоторого увеличения распространенности эутиреоидного зоба (табл.
3.25).
В
соответствии с этими критериями по данным за 2006 года йодный дефицит
преимущественно легкой, реже умеренной тяжести определялся на всей
территории Российской Федерации, Украины, а также многих стран Западной и
Восточной Европы (Франция, Испания, Бельгия, Италия). Спектр ЙДЗ
существенно отличается в регионах с разной выраженностью йодного
дефицита и варьирует от тяжелых степеней нарушения психического развития
до некоторого увеличения распространенности эутиреоидного зоба (табл.
3.25).
Табл. 3.25. Преимущественный спектр ЙДЗ при различной выраженности йодного дефицита
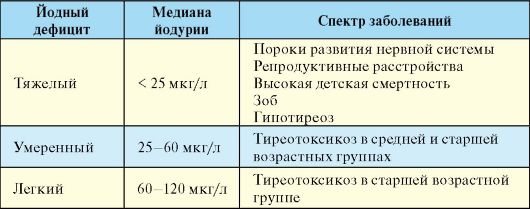 Благодаря
массовой йодной профилактике йодный дефицит ликвидирован в Польше,
Великобритании, ФРГ, странах Скандинавии, Великобритании, Китае,
Туркмении, Армении, странах Южной Америки. Поскольку основным методом
йодной профилактики является йодирование пищевой поваренной соли,
основным критерием ликвидации йодного дефицита в том или ином регионе
является число домашних хозяйств, потребляющих йодированную соль. О
ликвидации йодного дефицита можно говорить в ситуации, когда их доля
превышает 90 %.
Благодаря
массовой йодной профилактике йодный дефицит ликвидирован в Польше,
Великобритании, ФРГ, странах Скандинавии, Великобритании, Китае,
Туркмении, Армении, странах Южной Америки. Поскольку основным методом
йодной профилактики является йодирование пищевой поваренной соли,
основным критерием ликвидации йодного дефицита в том или ином регионе
является число домашних хозяйств, потребляющих йодированную соль. О
ликвидации йодного дефицита можно говорить в ситуации, когда их доля
превышает 90 %.
3.9.2. Йододефицитные заболевания щитовидной железы 3.9.2.1. Диффузный эутиреоидный зоб
Этиология
Наиболее частой причиной увеличения ЩЖ (зоба) является йодный дефицит. Зоб, выявляемый в регионах йодного дефицита, обозначается термином эндемический, в а в регионах с нормальным потреблением йода - спорадический. Достаточно редко эндемический зоб связан не с дефицитом йода, а с действием других зобогенных факторов (флавоноиды, тиоцианаты). Этиология спорадического зоба малоизучена и, судя по всему, гетерогенна. В части случаев он связан с врожденными дефектами ферментных систем, участвующих в синтезе тиреоидных гормонов.
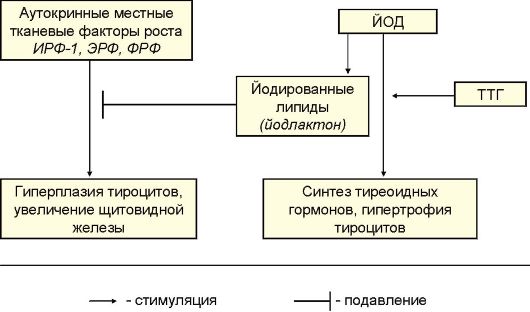 Рис. 3.27. Патогенез йододефицитного зоба
Рис. 3.27. Патогенез йододефицитного зоба
Патогенез
Наиболее изучен патогенез йододефицитного зоба (рис. 3.27). При снижении содержания йода в клетках ЩЖ, в них снижается содержание йодированных липидов, таких как йодлактоны (табл. 3.26).
Эти соединения оказывают блокирующее влияние на продукцию местных тканевых факторов роста (эпидермальный и инсулиноподобный ростовой фактор 1, фактор роста фибробластов). В результате при йодном дефиците происходит интенсификация продукции этих веществ тироцитами, следствием которой является их гиперплазия. Дополнительное влияние на увеличение ЩЖ указывает стимуляция ТТГ, которая несколько возрастает при тенденции к снижению уровня тиреоидных гормонов крови.
Диффузный эутиреоидный зоб небольшого размера далеко не всегда с уверенностью можно трактовать как явную патологию, или, по крайней мере, как ситуацию, требующей агрессивной лечебной тактики. Это связано с тем, что нормативы объема ЩЖ, особенно у детей, являются предметом дискуссий.
Эпидемиология
Распространенность зависит от выраженности йодного дефицита. Так, если в регионах легкого йодного дефицита распространенность эутиреоидного зоба составляет порядка 10 % населения, то при тяжелом йодном дефиците она может достигать 100 %. В отдельных регионах дополнительное, но, как правило, не определяющее значение могут иметь некоторые зобогены (тапиока и маниока, содержащие тиоцианаты, которые употребляют в пищу в ряде африканских стран).
Клинические проявления
Как правило, отсутствуют за исключением относительно редких случаев значительного увеличения ЩЖ с компрессионным синдромом. Иногда пациенты предъявляют жалобы на неприятное ощущение в области шеи, хотя, с другой стороны, такого рода жалобы достаточно редко связаны непосредственно с патологией ЩЖ. Видимый зоб может стать косметической проблемой, в связи с которой пациенту обращаются к эндокринологу.
Диагностика
Пациентам, у которых при пальпации ЩЖ обнаружен зоб, показано УЗИ ЩЖ для оценки ее объема, а также определение уровня ТТГ для исключения нарушения ее функции. В норме объем ЩЖ у женщин не превышает 18 мл, а у мужчин - 25 мл. При диффузном эутиреоидном
зобе железа увеличена за счет обеих долей, при этом у пациента определяется нормальный уровень ТТГ.
Табл. 3.26. Диффузный эутиреоидный зоб
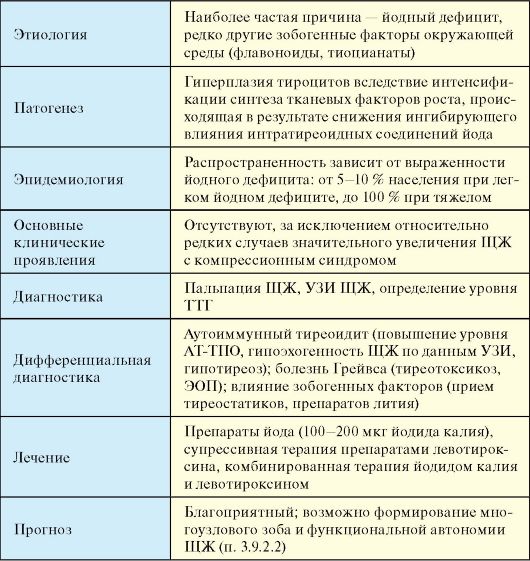 Дифференциальная диагностика
Дифференциальная диагностика
Хронический АИТ нередко протекает с увеличение объема ЩЖ (зоб Хашимото), при этом УЗИ позволяет выявить характерное изменение ее эхогенности, в сыворотке определяются АТ-ТПО, а при гормональном исследовании - гипофункция ЩЖ. Последняя не является
обязательным признаком, но очень ценна для диагностики. Многие заболевания, протекающие с увеличением объема ЩЖ, сопровождаются нарушением ее функции (болезнь Грейвса). В ряде случаев увеличение ЩЖ обусловлено приемом зобогенных препаратов (препараты лития, амиодарон, тиреостатики).
Лечение
Небольшое увеличение ЩЖ без нарушения ее функции, особенно у лиц пожилого возраста, не всегда требует терапии. Более активное лечение показано молодым пациентам. В регионах эндемичным по дефициту йода на первом этапе пациенту принято назначать препараты йода в физиологических дозах (100-200 мкг в день), на фоне приема которых осуществляется динамическая оценка объема ЩЖ. Обычно в пределах полугода объем ЩЖ существенно уменьшается или нормализуется. Если этого не происходит, обсуждается назначение пациенту супрессивной терапии препаратами левотироксина (L- T4), возможно в комбинации с препаратами йодида калия. Ее целью является поддержание несколько пониженного или низконормального уровня ТТГ, в связи с чем препарат назначается в дозе 75-150 мкг в сутки (рис. 3.28).
На фоне такой терапии уменьшение объема ЩЖ происходит у большинства пациентов. После этого обсуждается перевод пациента на монотерапию препаратами йодида калия, поскольку целесообразность длительной супрессивной терапии L-T4 сомнительна.
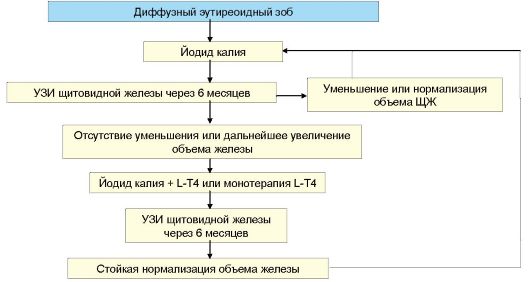 Рис. 3.28. Лечение диффузного эутиреоидного зоба
Рис. 3.28. Лечение диффузного эутиреоидного зоба
Прогноз
Благоприятный, в большинстве случаев указанные лечебные мероприятия позволяют нормализовать объем ЩЖ. В регионах легкого йодного дефицита диффузный эутиреоидный зоб даже при отсутствии лечения весьма редко достигает значительных степеней и приводит к компрессионному синдрому; у части пациентов формируются узловые образования, а в дальнейшем может развиться функциональная автономия ЩЖ (гл. 3.9.2.2).
3.9.2.2. Функциональная автономия щитовидной железы
Функциональная автономия (ФА) ЩЖ - это независимое от регулирующих влияний гипофиза продукция тиреоидных гормонов при отсутствии внешних стимуляторов.
Этиология
Причиной развития ФА является хроническая гиперстимуляция ЩЖ, происходящая в условиях йодного дефицита легкой и умеренной тяжести. Основной этиологической подоплекой развития ФА является микрогетерогенность тироцитов, у которых существенно отличается пролиферативный потенциал (табл. 3.27).
Табл. 3.27. Функциональная автономия щитовидной железы
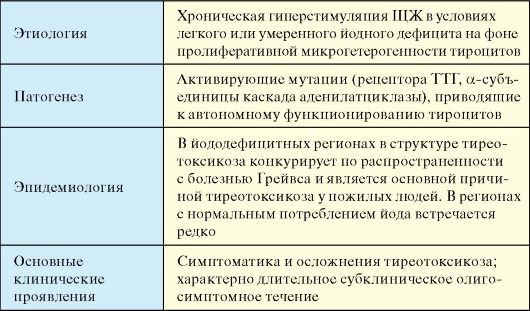 Окончание табл. 3.27
Окончание табл. 3.27
 Патогенез
Патогенез
Этапы патогенеза ФА ЩЖ представлены на рис. 3.29. В условиях легкого и умеренного йодного дефицита ЩЖ находится в состоянии хронической гиперстимуляции, поскольку должна обеспечивать организм тиреоидными гормонами при недостаточном поступлении необходимого субстрата для их синтеза извне. Вследствие этого на 1-м этапе, преимущественно вследствие гипертрофии тироцитов (рис. 3.27) происходит диффузное увеличение ЩЖ (диффузный эутиреоидный зоб). В силу того, что тироциты обладают разным пролиферативным потенциалом, в дальнейшем часть из них делится более активно, в результате чего формируются узловые образования (многоузловой эутиреоидный зоб). На следующем этапе часть клеток ЩЖ (при этом не всегда составляющая узловые образования) приобретает свойства автономного функционирования, то есть начинает производить тиреоидные гормоны независимо от каких-либо регуляторных влияний. Считается, что причиной этого является развитие активирующих соматических мутаций делящихся клеток, в генетическом аппарате которых запаздывают репаративные процессы. Среди активирующих мутаций к настоящему времени описана мутация гена рецептора ТТГ, результатом которой является конформационное изменение рецептора в стойкое активное состояние, а также мутация, приводящая в активное состояние α-субъединицу пострецепторного аденилатциклазного каскада. Результатом обеих мутаций является стойкая активация синтеза тиреоидных гормонов в измененных тиреоцитах. В результате
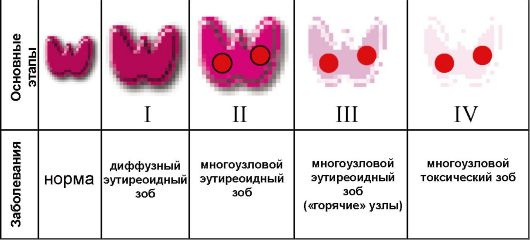 Рис. 3.29. Патогенез функциональной автономии щитовидной железы (этапы естественного течения йододефицитного зоба)
Рис. 3.29. Патогенез функциональной автономии щитовидной железы (этапы естественного течения йододефицитного зоба)
этих процессов в ЩЖ сначала формируются «горячие узлы», а когда количество автономных клеток превысит некий пороговый уровень, развивается субклинический, а затем манифестный тиреотоксикоз со всей его симптоматикой.
Весь процесс формирования ФА занимает многие годы, а чаще десятилетия, в связи с чем она манифестирует у лиц пожилого возраста, чаще старше 60 лет. Патогенетической особенностью тиреотоксикоза при функциональной автономии в отличие от БГ является длительное субклиническое течение, предшествующее постепенной, олигосимптомной манифестации явного тиреотоксикоза.
Эпидемиология
В йододефицитных регионах ФА ЩЖ является конкурирующей с БГ по распространенности причиной тиреотоксикоза. В регионах с нормальным потреблением йода встречается весьма редко. Особенности патогенеза предопределяют тот факт, что ФА встречается преимущественно у лиц пожилого возраста. Среди пожилых людей в йододефицитных регионах ФА является основной и клинически наиболее значимой причиной тиреотоксикоза.
Клинические проявления
Определяются синдромом тиреотоксикоза и его осложнениями. В целом симптоматика сходна с таковой при болезни Грейвса. Основными отличиями является отсутствие (в связи с принципиальной невозможностью развития) эндокринной офтальмопатии, а также
олигоили даже моносимптомное течение заболевания и развитие в пожилом возрасте. Многие пациенты указывают, что в прошлом у них выявлялись узловые образования ЩЖ без нарушения ее функции. На первый план могут выступать такие симптомы, как снижение аппетита, похудение, мышечная слабость, субфебрилитет. Нередко ФА манифестирует нарушениями ритма сердца (фибрилляция предсердий), которые патогенетически связаны с длительно, порой на протяжении десяти лет и более, существующим субклиническим тиреотоксикозом.
Диагностика
При гормональном исследовании выявляется субклинический или манифестный тиреотоксикоз, при УЗИ ЩЖ - чаще многоузловой, реже узловой зоб. По результатам сцинтиграфии ЩЖ выделяют три варианта функциональной автономии: унифокальную (узловой токсический зоб; см. рис. 3.9 в), мультифокальную (многоузловой токсический зоб; рис. 3.30 а) и диссеминированную (рис. 3.30 б).
Первый и второй варианты отличаются числом «горячих» узловых образований. В последнем случае, который встречается относительно редко, клинически значимые узлы ЩЖ отсутствуют, либо зона гипераккумуляции 99mTc не соответствует узловым образованиям, выявляемым при УЗИ. Этот вариант ФА бывает трудно дифференцировать с болезнью Грейвса.
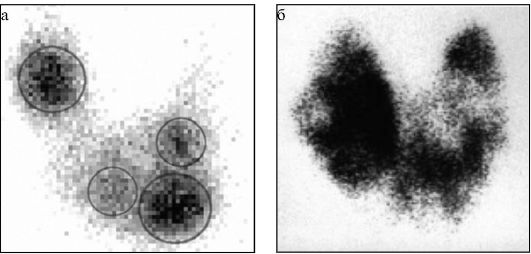 Рис. 3.30. Сцинтиграфия
ЩЖ при функциональной автономии: а) мультифокальная автономия
(многоузловой токсический зоб); б) диссеминированная автономия
Рис. 3.30. Сцинтиграфия
ЩЖ при функциональной автономии: а) мультифокальная автономия
(многоузловой токсический зоб); б) диссеминированная автономия
Дифференциальная диагностика
Наиболее часто возникает необходимость в дифференциальной диагностике ФА и болезни Грейвса (БГ), поскольку заболевания, протекающие с деструктивным тиреотоксикозом, достаточно просто отличить по данным сцинтиграфии ЩЖ. Принципы дифференциальной диагностики ФА и БГ представлены в табл. 3.28.
Табл. 3.28. Дифференциальная диагностика функциональной автономии щитовидной железы и болезни Грейвса
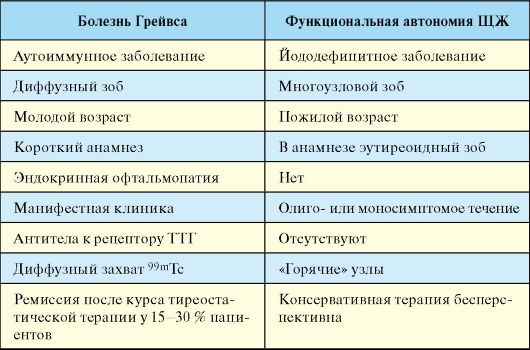 Лечение
Лечение
При компенсированной функциональной автономии («горячие» узлы при нормальном уровне ТТГ) у пожилых пациентов наиболее оправдана тактика активного наблюдения. При манифестировавшем тиреотоксикозе тиреостатическая терапия может использоваться только для временной блокады ЩЖ и достижения эутиреоза, поскольку отмена тиреостатиков, вне зависимости от того, как долго они использовались, приведет к возврату тиреотоксикоза. Методом выбора лечения ФА является терапия 131I. В качестве альтернативы может рассматриваться тиреоидэктомия после достижения эутиреоза на фоне приема тиреостатиков (тиамазол, пропилтиоурацил).
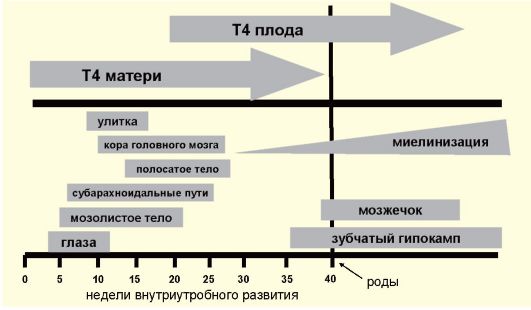 Рис. 3.31. Основные этапы развития центральной нервной системы и продукция тироксина щитовидной железой матери и плода
Рис. 3.31. Основные этапы развития центральной нервной системы и продукция тироксина щитовидной железой матери и плода
Прогноз
Вследствие длительного субклинического течения тиреотоксикоза при ФА у многих пациентов уже на момент диагностики могут выявляться такие осложнения, как фибрилляция предсердий и остеопороз, которые предопределяют прогноз. После радикального лечения (терапия 131I) при условии поддержания стойкого эутиреоза на фоне заместительной терапии препаратами тиреоидных гормонов качество жизни пациентов страдает незначительно.
3.9.3. Нарушения психического и физического развития, связанные с дефицитом йода
Этиология
Тиреоидные гормоны необходимы для адекватного развития большинства структур центральной нервной системы, а их дефицит на начальных этапах ее формирования в зависимости от выраженности может приводить к тяжелой психической ретардации (неврологический кретинизм), а также к менее грубым нарушениям (пограничное снижение интеллекта) (табл. 3.29).
Патогенез
ЩЖ у плода начинает производить Т4 только на 15-18 неделе внутриутробного развития, следовательно, развитие нервной и других
систем плода как минимум до этого строка обеспечивается за счет тиреоидных гормонов матери (рис. 3.31). В связи с этим продукция Т4 у женщины буквально с первых недель беременности возрастает примерно на 40 %.
При тяжелом йодном дефиците уровень Т4 у женщины может быть снижен еще до наступления беременности, в случае наступления которой дефицит Т4 окажется столь выражен, что приведет к тяжелейшим нарушениям развития, которое обозначается термином неврологический кретинизм. Нарушение психического развития при этом связано не с недостаточностью продукции собственного Т4 у плода, а с его тяжелым дефицитом в первой половине беременности. В связи с этим в отличие микседематозного кретинизма, который связан с нарушением развития у плода собственной ЩЖ (см. п. 3.6.2) и развивается постнатально, при неврологическом кретинизме у новорожденных отсутствует нарушение функции ЩЖ. Кроме того, при неврологическом кретинизме, в отличие от врожденного гипотиреоза, терапия препаратами тиреоидных гормонов неэффективна, поскольку развивающиеся на начальных этапах эмбриогенеза неврологические нарушения необратимы.
При легком йодном дефиците уровень тиреоидных гормонов у женщины вне беременности остается в норме, поскольку ЩЖ в обычном состоянии довольно легко его компенсирует. Но во время беременности потребность в тиреоидных гормонах значительно возрастает, вследствие чего продукция Т4 может не достигать необходимого уровня, хотя и не выходит за рамки референсных значений для этого гормона. Этот феномен обозначается термином относительная гестационная гипотироксинемия. Ее результатом могут стать пограничные нарушения интеллектуального развития, не достигающие уровня тяжелой олигофрении.
Табл. 3.29. Нарушения психического и физического развития, связанные с дефицитом йода
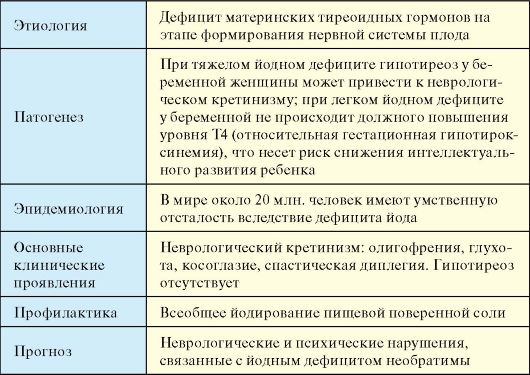 Эпидемиология
Эпидемиология
В мире около 20 млн человек имеет умственную отсталость вследствие дефицита йода. Оценить вклад легкого йодного дефицита в распространенность пограничного снижения интеллектуального развития достаточно сложно, тем не менее в регионах умеренного и легкого йодного дефицита индекс интеллектуального развития (IQ) детей и подростков примерно на 10 % ниже, чем в регионах с нормальным потреблением йода.
Клинические проявления
Основными проявлениями неврологического кретинизма являются олигофрения, глухота, спастическая диплегия или тетраплегия, а также косоглазие. Гипотиреоз отсутствует. Поскольку пациент часто продолжает проживать в условиях йодного дефицита, у него формируется зоб.
Диагностика
Неврологический кретинизм диагностируется на основании типичных клинических проявлений у пациентов, проживающих и рожденных в регионах тяжелого йодного дефицита.
Дифференциальная диагностика
Проводится с неврологическим кретинизмом, при котором имеются другие причины олигофрении.
Профилактика
Основным методом массовой йодной профилактики, который показал свою эффективность и рекомендован ВОЗ, является йодирование пищевой поваренной соли. В качестве индивидуальной йодной профилактики беременным и кормящим женщинам рекомендуется дополнительный прием физиологических доз йода (йодид калия 150-200 мкг/сут).
Прогноз
Неврологические и психические нарушения любой степени выраженности, связанные с йодным дефицитом, необратимы.
3.10. АМИОДАРОН-ИНДУЦИРОВАННЫЕ ТИРЕОПАТИИ
Амиодарон (кордарон) широко используется как эффективное противоаритмическое средство и во многих ситуациях является препаратом выбора, при этом достаточно часто вызывает ряд изменений метаболизма тиреоидных гормонов и патологию ЩЖ (табл. 3.30).
Этиология
Амиодарон содержит большое количество йода (39 % веса) и является бензофурановым производным, которое по структуре похоже на молекулу Т4. При приеме амиодарона в организм ежедневно поступает 7-21 г йода (физиологическая потребность в йоде около 200 мкг). Амиодарон в больших количествах накапливается в жировой ткани и печени; период его полувыведения составляет в среднем 53 дня и более, в связи с чем амиодарон-индуцированные тиреопатии могут возникать спустя долгое время после отмены препарата.
Патогенез
Амиодарон вмешивается в обмен и регуляцию тиреоидных гормонов на всех уровнях. Ингибируя дейодиназу 2 типа, он нарушает конверсию Т4 в Т3 в тиротропоцитах гипофиза, в результате чего происходит снижение чувствительности гипофиза к тиреоидным гормонам. В связи с этим у многих пациентов, получающих амиодарон, особенно в начале терапии, определяется некоторое повышение уровня ТТГ при нормальном уровне тиреоидных гормонов (эутиреоидная гипертиротропинемия). Наибольшую клиническую проблему представляет амиодарон-индуцированный тиреотоксикоз, при этом существует два варианта этого заболевания.
Табл. 3.30. Амиодарон-индуцированные тиреопатии
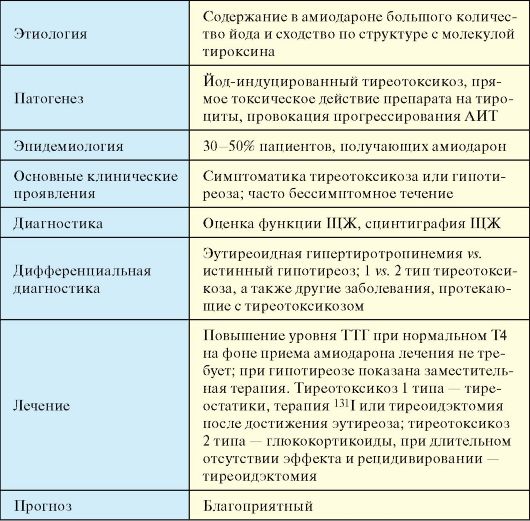 Амиодарон-индуцированный тиреотоксикоз 1 типа (АмИТ-1)
развивается вследствие поступления в организм избытка йода, то есть по
сути дела, речь идет о йод-индуцированном тиреотоксикозе. Он возникает
на фоне предсуществующего многоузлового зоба и функциональной автономии
ЩЖ или же речь идет об индукции манифестации БГ. Амиодарон-индуцированный тиреотоксикоз 2 типа (АмИТ-2)
встречается значительно чаще и обусловлен прямым токсическим действием
амиодарона на тироциты, в результате чего развивается специфический
тиреоидит с деструктивным тиреотоксикозом и присущей ему фазностью
течения. Наконец, в результате приема амиодарона может развиться гипотиреоз; поскольку
он чаще всего встречается у женщин с предсуществующим носительством
АТ-ТПО, речь, судя по всему, идет об индукции избытком йода
прогрессирования АИТ.
Амиодарон-индуцированный тиреотоксикоз 1 типа (АмИТ-1)
развивается вследствие поступления в организм избытка йода, то есть по
сути дела, речь идет о йод-индуцированном тиреотоксикозе. Он возникает
на фоне предсуществующего многоузлового зоба и функциональной автономии
ЩЖ или же речь идет об индукции манифестации БГ. Амиодарон-индуцированный тиреотоксикоз 2 типа (АмИТ-2)
встречается значительно чаще и обусловлен прямым токсическим действием
амиодарона на тироциты, в результате чего развивается специфический
тиреоидит с деструктивным тиреотоксикозом и присущей ему фазностью
течения. Наконец, в результате приема амиодарона может развиться гипотиреоз; поскольку
он чаще всего встречается у женщин с предсуществующим носительством
АТ-ТПО, речь, судя по всему, идет об индукции избытком йода
прогрессирования АИТ.
Эпидемиология
Те или иные изменения со стороны ЩЖ рано или поздно возникают у 30-50 % пациентов, получавших амиодарон. Чаще всего речь идет об эутиреоидной гипертиротропинемии, которая не требует активных лечебных мероприятий. В регионах с нормальным и высоким потреблением йода относительно часто встречается амиодарон-индуцированный гипотиреоз, в йододефицитных регионах - амиодарониндуцированный тиреотоксикоз.
Клинические проявления
Определяются функциональным состоянием ЩЖ. Гипотиреоз чаще всего не имеет каких-либо специфических клинических проявлений и устанавливается в процессе динамической оценки функции ЩЖ на фоне приема амиодарона. АмИТ-2 чаще всего имеет достаточно бедную клиническую симптоматику, в связи с тем, что на фоне приема амиодарона стирается сердечно-сосудистая симптоматика тиреотоксикоза. Здесь на первый план чаще выходят такие симптомы, как похудение и мышечная слабость. У 80 % пациентов, получающих амиодарон, вне зависимости от функции ЩЖ снижен аппетит. Клиническая картина реже встречающегося АмИТ-1 более яркая.
Диагностика
У пациентов, получающих амиодарон, оценку функции ЩЖ необходимо проводить каждые 6 месяцев. В процессе этого чаще всего и обнаруживаются те или иные изменения функции ЩЖ. Амиодарон-индуцированные тиреопатии могут развиться и через год после отмены
препарата, что требует внимательного изучения анамнеза у любого пациента с тиреотоксикозом. Особое внимание в этом плане следует обращать на пожилых пациентов с аритмиями сердца. При выявлении у пациента тиреотоксикоза ему показано проведение сцинтиграфии ЩЖ, что позволит дифференцировать АмИТ-1 и АмИТ-2 (табл. 3.29). Кроме того, характерной особенностью последнего является значительное повышение уровня свободного Т4 - часто более 60-80 пмоль/л (норма 11-21 пмоль/л) при парадоксально бедной клинической картине. Уровень свободного Т3 при этом вследствие нарушения конверсии из Т4 повышается весьма умеренно.
Дифференциальная диагностика
На фоне приема амиодарона часто встречается эутиреоидная гипертиротропинемия, для которой характерно некоторое повышение уровня ТТГ при нормальном Т4. При индуцированном амиодароном гипотиреозе происходит значительное снижение Т4, требующее назначения заместительной терапии. Дифференциальная диагностика АмИТ-1 и АмИТ-2 базируется на данных сцинтиграфии ЩЖ (табл. 3.31).
Табл. 3.31. Дифференциальная диагностика типов амиодарон-индуцированного тиреотоксикоза
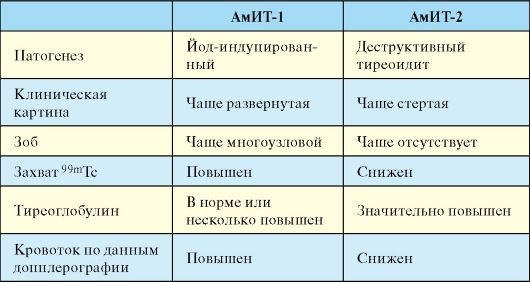 Лечение
Лечение
Эутиреоидная гипертиротропинемия лечения не требует. При манифестном гипотиреозе (ТТГ↑, Т4↓) показана заместительная терапия L-T4. Амиодарон желательно отменить. Тем не менее в ряде ситуаций
это сделать невозможно, так как отмена препарата может спровоцировать развитие желудочковой аритмии, по поводу которой исходно он назначался. В последнем случае, как правило, необходима более радикальная тактика (терапия 131I, тиреоидэктомия). Следует заметить, что отмена амиодарона в ближайшее время не отражается на клиническом течении заболевания ЩЖ, поскольку препарат имеет очень большой период полувыведения и накапливается в организме в очень больших количествах (особенно у пациентов с ожирением). Подходы к лечению АмИТ-1 зависят от конкретной клинической ситуации, но в любом случае на начальном этапе назначаются тиреостатические препараты (тиамазол 30-40 мг/сут), на фоне которых достигается эутиреоз. В дальнейшем пациенту может быть предпринята терапия 131I или тиреоидэктомия. Лечение АмИТ-2 зачастую представляет сложную задачу. Поскольку речь идет о деструктивном тиреотоксикозе, тиростатическая терапия неэффективна и не показана. Назначаются глюкокортикоиды (преднизолон 30-60 мг/сут per os) на протяжении 8-12 недель с постепенным снижением дозы и отменой на фоне достижения эутиреоидного состояния. У части пациентов при этом развивается рецидив тиреотоксикоза. В том случае, если АмИТ-2 приобретает хронически рецидивирующий характер, что сопровождается одновременным усугублением тиреотоксической кардиомиопатии и развитием медикаментозного синдрома Кушинга на фоне больших доз преднизолона, пациенту показана тиреоидэктомия. Тем не менее у большинства пациентов АмИТ-2 заканчивается единственным эпизодом, за которым, как и при большинстве деструктивных тиреоидитов, может последовать транзиторная гипотиреодная фаза, требующая временного назначения заместительной терапии L-T4.
Прогноз
В большинстве случаев благоприятный, особенно в ситуации, когда терапия амиодароном может быть полностью отменена. АмИТ-1 встречается относительно редко, и его прогноз не отличается от такового при БГ и многоузловом токсическом зобе. АмИТ-2 чаще всего заканчивается единственным эпизодом; наиболее благоприятен прогноз (необходимость проведения тиреоидэктомии) в случае его хронического рецидивирования.
3.11. РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Злокачественная опухоль ЩЖ, происходящая из клеток тиреоидного эпителия (фолликулярные, парафолликулярные). Рак ЩЖ (РЩЖ) является относительно редким заболеванием. В подавляющем большинстве случаев речь идет о высокодифференцированном раке ЩЖ (ВДРЩЖ), комплексное лечение которого даже на относительно поздних стадиях обеспечивает высокую выживаемость и приемлемое качество жизни пациентов.
Этиология
В большинстве случаев неизвестна. Особо обсуждается радиационный фактор. Доза внешнего облучения, которая индуцирует развитие РЩЖ, точно неизвестна. Доказательные данные о том, что диагностические и терапевтические дозы 131I могут индуцировать РЩЖ, отсутствуют. Наиболее вероятно, внешнее облучение также может способствовать индукции рака ЩЖ (как правило, папиллярного), преимущественно у детей и лиц моложе 20 лет. После аварии на Чернобыльской атомной станции заболеваемость раком ЩЖ у детей с 1985 по 1993 год возросла в 34 раза. Тем не менее в соседних регионах Польши, где была налажена массовая йодная профилактика, этого не произошло. В связи с этим выброс радиоактивного йода, наиболее вероятно, способен оказать канцерогенное действие преимущественно на фоне йодного дефицита за счет активного поглощения изотопа обедненной йодом ЩЖ.
Йодный дефицит или избыточное потребление йода не приводят к увеличению абсолютной заболеваемости РЩЖ, тем не менее в регионах с нормальным йодным потреблением несколько реже встречается относительно более агрессивный фолликулярный РЩЖ.
Причиной медуллярного рака (МРЩЖ) в рамках синдрома множественных эндокринных неоплазий 2 типа (МЭН-2: МРЩЖ + феохромоцитома; см. п. 9.2) является мутация в RET-протоонкогене на длинном плече хромосомы 10. Аналогичные мутации обнаруживаются в ряде случаев папиллярного РЩЖ (5-30 %), особенно радиационно-индуцированного. Кроме того, при ВДРЩЖ выявлены мутации супрессора опухолей р53, гиперэкспрессия ras-онкогенов и ряд других генетических изменений. МРЩЖ встречается в трех основных формах: спорадический (75 %), изолированный семейный (5 %), семейный в рамках МЭН-2 (20 %).
Патогенез
Клетки ВДРЩЖ (папиллярный и фолликулярный), как и нормальные тироциты, характеризуются способностью к захвату йода. Для него характерен медленный рост и достаточно позднее метастазирование. На отдаленном этапе опухолевой прогрессии клетки метастазов могут терять дифференцировку и способность к захвату йода. Редко встречающийся медуллярный РЩЖ происходит из С-клеток, продуцирующих кальцитонин; этот рак характеризуется ранним метастазированием и плохим прогнозом. Наихудший прогноз имеет казуистически редко встречающийся недифференцированный анапластический РЩЖ (табл. 3.32).
Табл. 3.32. Рак щитовидной железы
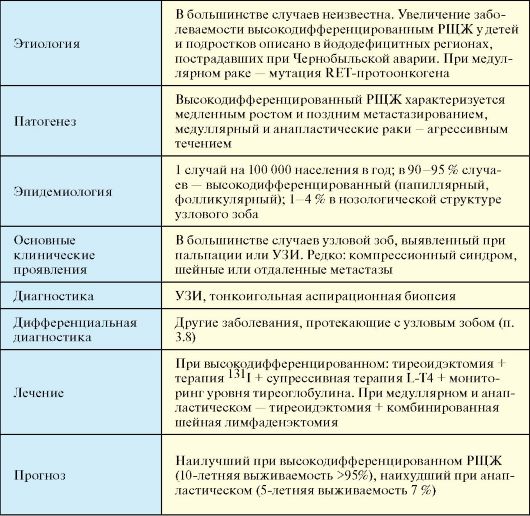 Эпидемиология
Эпидемиология
В целом РЩЖ является относительно редким заболеванием. На него приходится менее 1 % раков всех локализаций и менее 0,5 % смертей от рака. Частота новых случаев РЩЖ составляет 0,5-10 случаев на 100 000 населения в год. В США ежегодно диагностируется 18 000 случаев РЩЖ, от которого каждый год умирает 1200 человек. В большинстве случаев РЩЖ диагностируется при обследовании пациентов с узловым зобом (п. 3.8). Как указывалось, в этиологической структуре узлового зоба на РЩЖ приходится 1-4 % случаев. Распространенность папиллярных микрокарцином (диаметр <1 см), являющихся случайными находками при плановом гистологическом исследовании ткани ЩЖ, удаленной по поводу других заболеваний, достигает 10-20 % случаев, при этом клиническое значение таких опухолей ограничено. РЩЖ, как правило, выявляется в возрасте 40-50 лет, редко у детей и подростков. В целом у женщин встречается чаще (2:1 - 3:1), но в пожилом и старческом возрасте относительная доля мужчин несколько выше (табл. 3.33).
Табл. 3.33. Эпидемиология РЩЖ
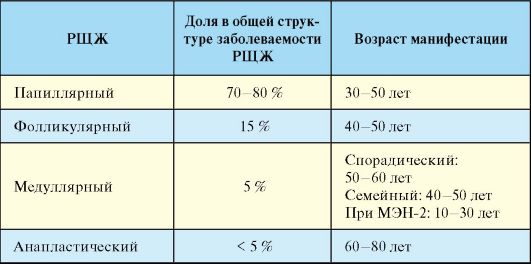 Клинические проявления
Клинические проявления
В настоящее время подавляющее большинство РЩЖ диагностируется при ТАБ в рамках обследования пациентов с узловым зобом, который выявляется при пальпации или при УЗИ ЩЖ. Особенности отдельных гистологических вариантов РЩЖ представлены в табл. 3.34.
Табл. 3.34. Особенности клинической картины отдельных гистологических вариантов РЩЖ
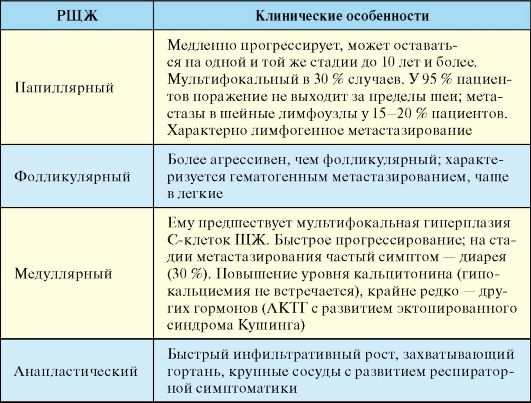 При
изучении анамнеза и клинической картины пациентов, проходящих
обследование по поводу узлового зоба, следует обращать внимание на
следующие признаки, которые повышают вероятность того, что обнаруженный
узел ЩЖ является раком:
При
изучении анамнеза и клинической картины пациентов, проходящих
обследование по поводу узлового зоба, следует обращать внимание на
следующие признаки, которые повышают вероятность того, что обнаруженный
узел ЩЖ является раком:
• облучение головы и шеи в анамнезе;
• медуллярный рак или МЭН-2 у родственников;
• возраст моложе 20 или старше 70 лет;
• мужской пол;
• быстрый рост узлового образования;
• плотная или твердая консистенция узла;
• шейная лимфаденопатия;
• несмещаемость узлового образования;
• постоянная охриплость, дисфония, дисфагия или одышка.
Весьма редко РЩЖ, особенно высокодифференцированный, манифестирует отдаленными метастазами; в ряде случаев в начале
выявляется шейная лимфаденопатия, после чего при УЗИ обнаруживается РЩЖ.
Диагностика
Основными методами первичной диагностики РЩЖ является тонкоигольная аспирационная биопсия (ТАБ) (см. п. 3.8) и УЗИ ЩЖ. Большинство раков ЩЖ имеет достаточно четкие цитологические критерии диагностики. Исключение составляет фолликулярный рак, который по цитологической картине невозможно отличить от фолликулярной аденомы. Диагностика МРЩЖ, кроме ТАБ, базируется на определении уровня кальцитонина как базального, так и стимулированного (на фоне введения пентагастрина, глюконата кальция). При МРЩЖ на фоне введения этих стимуляторов происходит значительное повышение уровня кальцитонина. Функция ЩЖ при РЩЖ в подавляющем большинстве случаев не нарушена.
Дифференциальная диагностика
См. п. 3.8.
Лечение
Лечение ВДРЩЖ базируется на четырех основных принципах (рис. 3.32):
1. Тиреоидэктомия с удалением, в зависимости от распространенности процесса, того или иного объема шейной клетчатки с лимфатическими узлами.
2. После тиреоидэктомии - терапия радиоактивным 131I, направленная на ликвидацию всех клеток ЩЖ (нормальных, опухолевых) и потенциально возможных метастазов.
3. Супрессивная терапия L-T4, направленная на поддержание сниженного уровня ТТГ, который является стимулятором роста и пролиферации тироцитов (нормальных и опухолевых).
4. Динамическая оценка основного маркера рецидива высокодифференцированного РЩЖ - тиреоглобулина, который продуцируется как нормальными, так и опухолевыми клетками. Наряду с оценкой уровня тиреоглобулина периодически пациенту проводится сцинтиграфия всего тела с 123I или 131I, которая позволяет визуализировать йоднакапливающую ткань (метастазы); исследование проводится после предварительной отмены L-T4 на фоне повышенного уровня ТТГ, который стимулирует захват йода клетками опухоли. О рецидиве опухоли свидетельствуют повышение уровня тиреоглобулина и появление данных за местный рецидив, или отдаленные метастазы по результатам сцинтиграфии.
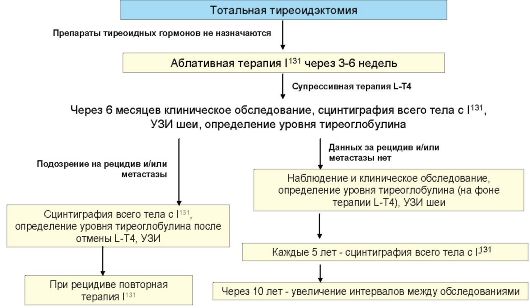 Рис. 3.32. Алгоритм лечения и наблюдения пациентов с высокодифференцированным раком щитовидной железы
Рис. 3.32. Алгоритм лечения и наблюдения пациентов с высокодифференцированным раком щитовидной железы
При МРЩЖ показано проведение экстирпации ЩЖ с проведением комбинированной шейной лимфаденэктомии. При выявлении у членов семей больных семейной формой МРЩЖ или МЭН-2 характерной мутации RET протоонкогена в ряде случаев рассматривается вопрос о профилактической тиреоидэктомии, даже при отсутствии данных за МРЩЖ. При выявлении анапластического рака показана операция аналогичного объема.
Прогноз
При высокодифференцированном РЩЖ - хороший. Даже в случае наличия отдаленных метастазов, которые накапливают 131I, проведение систематического лечения (тиреоидэктомия + терапия 131I + супрессивная терапия L-T4) обеспечивает более чем 95 % 10-летнюю выживаемость. Наихудший прогноз при анапластическиом раке: средняя продолжительность жизни с момента диагностики - 6 месяцев, 5-летняя выживаемость - 7 %.