Биохимия тканей и жидкостей полостей рта: учебное пособие / Вавилова Т.П. - 2-е изд., испр. и доп. - 2008. - 208 с. : ил.
|
|
|
|
ГЛАВА 5 БИОХИМИЯ КОСТНОЙ ТКАНИ
Зубы располагаются в костных лунках - отдельных ячейках альвеолярных отростков верхней и нижней челюстей. Костная ткань - разновидность соединительной ткани, развивающаяся из мезодермы и состоящая из клеток, межклеточного неминерализованного органического матрикса (остеоид) и основного минерализованного межклеточного вещества.
5.1. ОРГАНИЗАЦИЯ И СТРОЕНИЕ КОСТНОЙ ТКАНИ АЛЬВЕОЛЯРНЫХ ОТРОСТКОВ
Поверхность кости альвеолярного отростка покрыта надкостницей (периост), образованной преимущественно плотной волокнистой соединительной тканью, в которой различают 2 слоя: наружный - волокнистый и внутренний - остеогенный, содержащий остеобласты. Из остеогенного слоя надкостницы в кость проходят сосуды и нервы. Толстые пучки прободающих коллагеновых волокон связывают кость с надкостницей. Надкостница осуществляет не только трофическую функцию, но и участвует в росте и регенерации кости. Вследствие этого костная ткань альвеолярных отростков обладает высокой регенеративной способностью не только в физиологических условиях, при ортодонтических воздействиях, но и после повреждения (переломы).
Минерализованный матрикс организован в трабекулы - структурно-функциональные единицы губчатой костной ткани. В лакунах минерализованного матрикса и по поверхности трабекул располагаются клетки костной ткани - остеоциты, остеобласты, остеокласты.
В организме постоянно происходят процессы обновления костной ткани путём сопряженного по времени костеобразования и рассасы- вания (резорбция) кости. В этих процессах активно участвуют различные клетки костной ткани.
Клеточный состав костной ткани
Клетки занимают всего лишь 1-5% общего объёма костной ткани скелета взрослого человека. Различают 4 типа клеток костной ткани.
Мезенхимальные недифференцированные клетки кости находятся главным образом в составе внутреннего слоя надкостницы, покрывающей поверхность кости снаружи - периоста, а также в составе эндоста, выстилающего контуры всех внутренних полостей кости, внутренние поверхности кости. Их называют выстилающими, или контурными, клетками. Из этих клеток могут образовываться новые клетки кости - остеобласты и остеокласты. В соответствии с этой их функцией их также называют остеогенными клетками.
Остеобласты - клетки, находящиеся в зонах костеобразования на внешних и внутренних поверхностях кости. Остеобласты содержат достаточно большое количество гликогена и глюкозы. С возрастом это количество уменьшается в 2-3 раза. Синтез АТФ на 60% связан с реакциями гликолиза. По мере старения остеобластов реакции гликолиза активируются. В клетках протекают реакции цитратного цикла, и наибольшей активностью обладает цитратсинтаза. Синтезируемый цитрат используется в дальнейшем на связывание Ca2+, необходимого для процессов минерализации. Поскольку функцией остеобластов является создание органического межклеточного матрикса кости, эти клетки содержат большое количество РНК, необходимых для синтеза белков. Остеобласты активно синтезируют и выделяют во внеклеточное пространство значительное количество глицерофосфолипидов, которые способны связывать Ca2+ и участвовать в процессах минерализации. Клетки сообщаются между собой через десмосомы, которые позволяют проходить Ca2+ и цАМФ. Остеобласты синтезируют и выделяют в окружающую среду фибриллы коллагена, протеогликаны и гликозаминогликаны. Они также обеспечивают непрерывный рост кристаллов гидроксиапатитов и выступают в качестве посредников при связывании минеральных кристаллов с белковой матрицей. По мере старения остеобласты превращаются в остеоциты.
Остеоциты - древовидные клетки костной ткани, включенные в органический межклеточный матрикс, которые контактируют друг с другом через отростки. Остеоциты взаимодействуют и с другими клетками костной ткани: остеокластами и остеобластами, а также с мезенхимальными клетками кости.
Остеокласты - клетки, выполняющие функцию разрушения кости; образуются из макрофагов. Они осуществляют непрерывный управляемый процесс реконструкции и обновления костной ткани, обеспечивая необходимый рост и развитие скелета, структуру, прочность и упругость костей.
Межклеточное и основное вещество костной ткани
Межклеточное вещество представлено органическим межклеточным матриксом, построенным из коллагеновых волокон (90-95%) и основным минерализованным веществом (5-10%). Коллагеновые волокна в основном расположены параллельно направлению уровня наиболее вероятных механических нагрузок на кость и обеспечивают упругость и эластичность кости.
Основное вещество межклеточного матрикса состоит главным образом из внеклеточной жидкости, гликопротеинов и протеогликанов, участвующих в перемещении и распределении неорганических ионов. Минеральные вещества, размещённые в составе основного вещества в органическом матриксе кости представлены кристаллами, главным образом гидроксиапатитом Ca10(PO4)6(OH)2. Соотношение кальций/фосфор в норме составляет 1,3-2,0. Кроме того, в кости обнаружены ионы Mg2+, Na+, K+, SO42-, HCO3-, гидроксильные и другие ионы, которые могут принимать участие в образовании кристаллов. Минерализация кости связана с особенностями гликопротеинов костной ткани и активностью остеобластов.
Основными белками внеклеточного матрикса костной ткани являются коллагеновые белки I типа, которые составляют около 90% органического матрикса кости. Наряду с коллагеном I типа присутствуют следы других типов коллагена, таких как V, XI, XII. Не исключено, что эти типы коллагена принадлежат другим тканям, которые и находятся в костной ткани, но не входят в состав костного матрикса. Например, коллаген V типа обычно обнаруживается в сосудах, которые пронизывают кость. Коллаген XI типа находится в хрящевой ткани и может соответствовать остаткам кальцифицированного хряща. Источником коллагена XII типа могут быть «заготовки» коллагеновых фибрилл. В костной ткани коллаген I типа содержит производные моносахаридов, имеет меньшее количество поперечных связей, чем в других видах соединительной ткани, и эти связи формируются посредством аллизина. Ещё одним возможным отличием является то, что N-концевой пропептид коллагена I типа фосфорилирован и этот пептид частично сохраняется в минерализованном матриксе.
Неколлагеновые белки костной ткани. В костной ткани содержится около 10% неколлагеновых белков. Они представлены гликопротеинами и протеогликанами (рис. 5.1).
Из общего количества неколлагеновых белков 10% приходится на долю протеогликанов. Вначале синтезируется большой хондроитин-
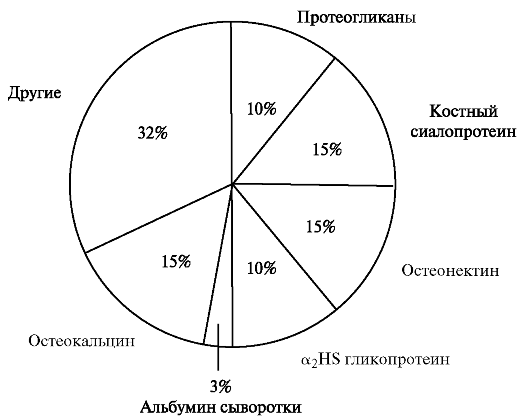
Рис. 5.1. Содержание неколлагеновых белков в межклеточном матриксе костной ткани [по Gehron R. P., 1992].
содержащий протеогликан, который по мере формирования костной ткани разрушается и замещается двумя малыми протеогликанами: декорином и бигликаном. Малые протеогликаны внедряются в мине- рализованный матрикс. Декорин и бигликан активируют процессы дифференцировки и пролиферации клеток, а также вовлечены в регуляцию отложения минералов, морфологию кристалла и объединение элементов органического матрикса. Первым синтезируется бигликан, содержащий дерматансульфат; он влияет на процессы клеточной пролиферации. В фазу минерализации появляется бигликан, связаный с хондроитинсульфатом. Декорин синтезируется позднее, чем бигликан, в стадию отложения белков для формирования межклеточного матрикса; он остаётся и в фазе минерализации. Предполагают, что декорин «отшлифовывает» молекулы коллагена и регулирует диаметр фибрилл. В ходе формирования кости оба белка продуцируются остеобластами, но когда эти клетки становятся остеоцитами, они синтезируют только бигликан.
Из костного матрикса в небольших количествах были выделены и другие типы малых протеогликанов, которые выступают в качестве
рецепторов и облегчают связывание факторов роста с клеткой. Эти типы молекул находятся в мембране или прикрепляются к клеточной мембране посредством фосфоинозитоловых связей.
В костной ткани также присутствует гиалуроновая кислота. Вероятно, она играет важную роль в морфогенезе этой ткани.
Помимо протеогликанов в кости определяется большое количество разнообразных белков, относящихся к гликопротеинам (табл. 5.1).
Как правило, эти белки синтезируются остеобластами и способны связывать фосфаты или кальций; таким образом они принимают участие в формировании минерализованного матрикса. Связываясь с клет- ками, коллагенами и протеогликанами, они обеспечивают образование надмолекулярных комплексов матрикса костной ткани (рис. 5.2).
В остеоиде присутствуют протеогликаны: фибромодулин, бигликан, декорин, коллагеновые белки и морфогенетический белок кости. В минерализованном матриксе замурованы остеоциты, которые связаны с коллагенами. На коллагенах фиксированы гидроксиапатиты, остеокальцин, остеоадерин. В минерализованном межклеточном
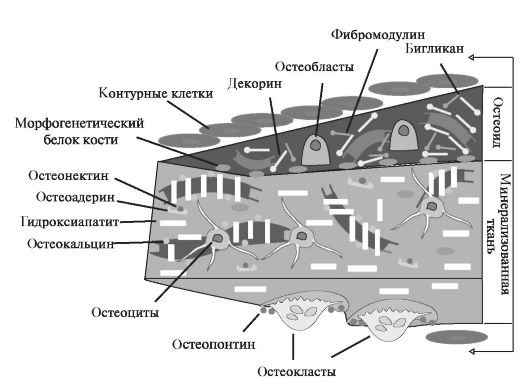
Рис. 5.2. Участие различных белков в образовании матрикса костной ткани.
Таблица 5.1
Неколлагеновые белки костной ткани
Белок | Свойства и функции |
Остеонектин | Гликофосфопротеин, способный связывать Са2+ |
Щелочная фосфатаза | Отщепляет фосфат от органических соединений при щелочных значениях pH среды |
Тромбоспондин | Белок с мол. массой 145 кДа, состоящий из трех идентичных субъединиц, связанных друг с другом дисульфидными связями. Каждая субъединица имеет несколько различных доменов, которые придают белку способность связываться с другими белками костного матрикса - гепарансодержащими протеогликанами, фибронектином, ламинином, коллагеном I и V типов и остеонектином. В N-кон- цевой области тромбоспондина содержится последовательность аминокислот, обеспечивающая прикрепление клеток. На связывание тромбоспондина с рецепторами на поверхности клетки влияет кон- центрация Ca2+. В костной ткани тромбоспондин синтезируется остеобластами |
Фибронектин | Связывается с поверхностью клеток, фибрином, гепарином, бактериями, коллагеном. В костной ткани фибронектин синтезируется на ранних стадиях остеогенеза и сохраняется в минерализован- ном матриксе |
Остеопонтин | Гликофосфопротеин, содержащий N- и О-связанные олигосахариды; участвует в адгезии клеток |
Костный кислый гликопротеин-75 | Белок с мол. массой 75 кДа, содержит сиаловые кислоты и остатки фосфата. Способен связывать ионы Са2+, присущ кости, дентину и хрящевой ростковой пластинке. Ингибирует процессы резорбции костной ткани |
Костный сиалопротеин | Адгезивный гликопротеин, содержащий до 50% углеводов |
Матриксный Gla-белок | Белок, содержащий 5 остатков 7-карбоксиглутами- новой кислоты; способен связываться с гидроксиапатитом. Появляется на ранних стадиях развития костной ткани; белок обнаружен также в лёгких, сердце, почках, хряще |
Остеокальцин | Белок, синтезируемый остеобластами и содержащий 3 остатка 7-карбоксиглутаминовой кислоты. Связывается с гидроксиапатитом; локализуется во внеклеточном матриксе костной ткани |
Протеин S | Белок, содержащий остатки 7-карбоксиглутами- новой кислоты; синтезируется главным образом в печени. До сих пор не установлено, какой тип клеток в костной ткани ответственен за синтез этого белка. Предполагается об его участии в метаболизме костной ткани. При дефиците обнаруживаются изменения костного скелета |
матриксе остеоадерин связывается с остеонектином, а остеокальцин с коллагеном. Морфогенетический белок кости располагается в приграничной зоне между минерализованным и неминерализованным матриксом. Остеопонтин регулирует активность остеокластов.
Свойства и функции белков костной ткани представлены в табл. 5.1.
5.2. ФИЗИОЛОГИЧЕСКАЯ РЕГЕНЕРАЦИЯ КОСТНОЙ ТКАНИ
В процессе жизнедеятельности кость постоянно обновляется, то есть разрушается и восстанавливается. При этом в ней происходят два противоположно направленных процесса - резорбция и восстановление. Соотношение этих процессов называется ремоделированием костной ткани.
Известно, что каждые 30 лет костная ткань изменяется почти полностью. В норме кость «растет» до 20-летнего возраста, достигая пика костной массы. В этот период прирост костной массы составляет до 8% в год. Далее до 30-35-летнего возраста идет период более или менее устойчивого состояния. Затем начинается естественное постепенное снижение костной массы, составляющее обычно не более 0,3-0,5% в год. После наступления менопаузы у женщин отмечается максимальная скорость потери костной ткани, которая достигает 2-5% в год и продолжается в таком темпе до 60-70 лет. В итоге женщины теряют от 30 до 50% костной ткани. У мужчин эти потери обычно составляют 15-30%.
Процесс ремоделирования костной ткани происходит в несколько этапов (рис. 5.3). На первом этапе участок костной ткани, подле-
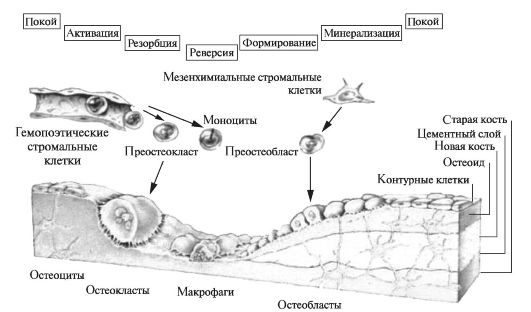
Рис. 5.3. Стадии ремоделирования костной ткани [по Martin R.B., 2000, с изменениями].
жащий резорбции запускают остеоциты. Для активации процесса необходимо участие паратиреоидного гормона, инсулиноподобного фактора роста, интерлейкинов-1 и -6, простагландинов, кальцитриола, фактора некроза опухоли. Тормозится этот этап ремоделирования эстрогенами. На данном этапе поверхностные контурные клетки изменяют свою форму, превращаясь при этом из плоских округлых клеток в кубические.
Остеобласты и Т-лимфоциты секретируют лиганды рецепторов активатора фактора нуклеации каппа В (RANKL) и до определённого момента молекулы RANKL могут оставаться связанными с поверхностью остеобластов или стромальных клеток.
Из стволовой клетки костного мозга образуются предшественники остеокластов. Они имеют мембранные рецепторы, называемые рецепторами активатора фактора нуклеации каппа В (RANK). На следующем этапе RANK-лиганды (RANKL) связываются с RANK- рецепторами, что сопровождается слиянием нескольких предшественников остеокластов в одну крупную структуру и формируются зрелые многоядерные остеокласты.
Образующийся активный остеокласт создаёт на своей поверхности гофрированный край и зрелые остеокласты начинают резорбировать
костную ткань (рис. 5.4). На стороне прилегания остеокласта к разрушаемой поверхности различают две зоны. Первая зона - наиболее обширная, называемая щеточной каемкой, или гофрированным краем. Гофрированный край - это скрученная спиралью мембрана с множественными цитоплазматическими складками, которые обращены в сторону резорбции на костной поверхности. Через мембрану остеокласта освобождаются лизосомы, содержащие большое количество гидролитических ферментов (катепсины К, D, B, кислая фосфатаза, эстераза, гликозидазы и др). В свою очередь, катепсин К активирует матриксную металлопротеиназу-9, которая участвует в деградации коллагена и протеогликанов межклеточного матрикса. В этот период в остеокластах растёт активность карбоангидразы. Ионы НСО3- обме- ниваются на Cl-, которые накапливаются в гофрированном крае; туда же переносятся ионы H+. Секреция H+ осуществляется за счёт очень активной в остеокластах Н+/К+-АТФазы. Развивающийся ацидоз способствует активации лизосомных ферментов и способствует разруше- нию минерального компонента.
Вторая зона окружает первую и как бы герметизирует область действия гидролитических ферментов. Она свободна от органелл и назы-
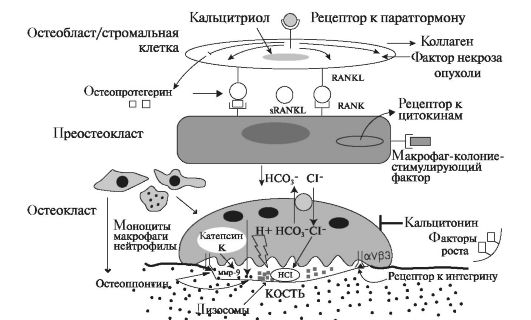
Рис. 5.4. Активация преостеокласта RANKL и формирование активным остеобластом гофрированной каймы, приводящей к резорбции костной ткани [по Edwards P. A., 2005, с изменениями].
вается чистой зоной, поэтому костная резорбция происходит только под гофрированным краем в замкнутом пространстве.
На стадии образования остеокластов из предшественников процесс может блокироваться белком остеопротегерином, который, свободно перемещаясь, способен связывать RANKL и таким образом предотвращать взаимодействие RANKL с RANK-рецепторами (см. рис. 5.4). Остеопротегерин - гликопротеин с мол. массой 60-120 кДа, относящийся к семейству рецепторов ФНО. Ингибируя связывание RANK с RANK-лигандом, остеопротегерин тем самым подавляет мобилизацию, пролиферацию и активацию остеокластов, поэтому увеличение синтеза RANKL приводит к резорбции костной ткани и, следовательно, к потере костной массы.
Характер ремоделирования костной ткани во многом определяется балансом между продукцией RANKL и остеопротегерина. Недифференцированные стромальные клетки костного мозга в большей степени синтезируют RANKL и в меньшей степени остеопротегерин. Возникающий дисбаланс системы RANKL/остеопротегерин при увеличении RANKL приводит к резорбции кости. Данное явление наблюдается при постменопаузальном остеопорозе, болезни Педжета, костных потерях при метастазах рака и ревматоидном артрите.
Зрелые остеокласты начинают активно поглощать кость, а завершают разрушение органической матрицы межклеточного вещества кости макрофаги. Резорбция длится около двух недель. Затем остеокласты в соответствии с генетической программой умирают. Апоптоз остеокластов может задерживаться при недостатке эстрогенов. На последнем этапе в зону разрушения прибывают плюрипотентные стволовые клетки, которые дифференцируются в остеобласты. В дальнейшем остеобласты синтезируют и минерализуют матрикс в соответствии с новыми условиями статической и динамической нагрузки на кость.
Существует большое число факторов, стимулирующих развитие и функции остеобластов (рис. 5.5). Вовлечение в процесс перестройки кости остеобластов стимулируется различными факторами роста - ТФР-(3, морфогенетическим белком кости, инсулиноподобным фактором роста, фактором роста фибробластов, тромбоцитов, колониестимулирующим и гормонами - паратирином, кальцитриолом, а также связывающим фактором ядра α-1 и тормозится белком лептином. Лептин - белок с мол. массой 16 кДа образуется преимущественно в адипоцитах; своё действие реализует через повышение синтеза цитокинов, факторов роста эпителия и кератиноцитов.
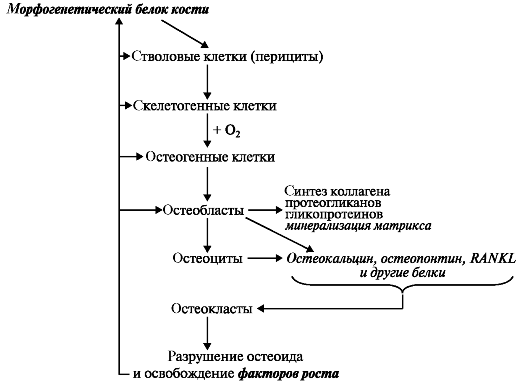
Рис. 5.5. Ремоделирование костной ткани.
Активные секретирующие остеобласты создают слои остеоида - неминерализованного матрикса кости и медленно восполняют полость резорбции. При этом они секретируют не только различные факторы роста, а также белки межклеточного матрикса - остеопонтин, остеокальцин и другие. Когда образующийся остеоид достигает диаметра 6?10-6м, он начинает минерализоваться. Скорость процесса минерализации зависит от содержания кальция, фосфора и ряда микроэлементов. Процесс минерализации управляется остеобластами и тормозится пирофосфатом.
Образование кристаллов минерального остова кости индуцирует коллаген. Формирование минеральной кристаллической решётки начинается в зоне, находящейся между коллагеновыми фибриллами. Затем они, в свою очередь, становятся центрами для отложения в пространстве между коллагеновыми волокнами (рис. 5.6).
Формирование кости происходит только в непосредственной близости от остеобластов, причём минерализация начинается в хряще,
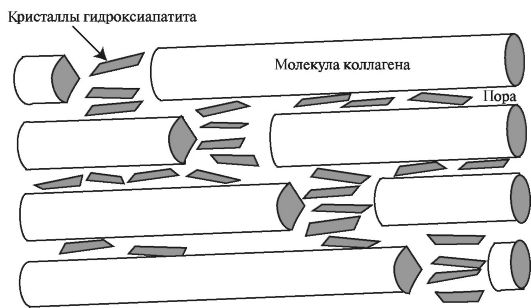
Рис. 5.6. Отложение кристаллов гидроксиапатита на коллагеновых волокнах.
который состоит из коллагена, находящегося в протеогликановом матриксе. Протеогликаны повышают растяжимость коллагеновой сети. В зоне кальцификации происходит разрушение комплексов белок-полисахарид в результате гидролиза белкового матрикса лизосомальными ферментами клеток кости. По мере роста кристаллы вытесняют не только протеогликаны, но и воду. Плотная, полностью минерализованная кость, практически обезвожена; коллаген составляет 20% массы и 40% объема такой ткани; остальное приходится на долю минеральной части.
Начало минерализации характеризуется усиленным поглощением остеобластами молекул O2, активацией окислительно-восстановительных процессов и окислительного фосфорилирования. В митохондриях накапливаются ионы Ca2+ и PO43-. Начинается синтез коллагеновых и неколлагеновых белков, которые затем после посттрансляционной модификации секретируются из клетки. Формируются различные везикулы, в составе которых переносится коллаген, протеогликаны и гликопротеины. От остеобластов отпочковываются особые образования, называемые матриксными пузырьками, или мембранными везикулами. Они содержат в большой концентрации ионы Ca2+, которая превышает в 25-50 раз содержание их в остеобластах, а также глицерофосфолипиды и ферменты - щелочную фосфатазу, пирофосфатазу,
аденозинтрифосфатазу и аденозинмонофосфатазу. Ионы Ca2+ в мембранных везикулах связаны преимущественно с отрицательно заряженым фосфатидилсерином. В межклеточном матриксе мембранные везикулы разрушаются с освобождением ионов Ca2+, пирофосфатов, органических соединений, связанных с остатками фосфорной кислоты. Присутствующие в мембранных везикулах фосфогидролазы, и в первую очередь щелочная фосфатаза, отщепляют фосфат от органических соединений, а пирофосфат гидролизуется пирофосфатазой; ионы Ca2+ соединяются с PO43- , что приводит к появлению аморфного фосфата кальция.
Одновременно происходит частичное разрушение протеогликанов, связанных с коллагеном I типа. Освобождающиеся фрагменты протеогликанов, заряженные отрицательно, начинают связывать ионы Ca2+. Некоторое число ионов Ca2+ и PO43 образуют пары и триплеты, которые связываются с коллагеновыми и неколлагеновыми белками, формирующими матрицу, что сопровождается образованием кластеров, или ядер. Из белков костной ткани наиболее активно связывают ионы Ca2+ и PO43 остеонектин и матриксные Gla-белки. Коллаген костной ткани связывает ионы РО43 через ε-аминогруппу лизина с образованием фосфоамидной связи.
На образовавшемся ядре возникают спиралевидые структуры, рост которых идет по обычному принципу добавления новых ионов. Шаг такой спирали равен высоте одной структурной единицы кристалла. Формирование одного кристалла приводит к появлению других кристаллов; этот процесс называется эпитаксисом, или эпитаксической нуклеацией.
Рост кристалла высоко чувствителен к присутствию других ионов и молекул, которые ингибируют кристаллизацию. Концентрация этих молекул может быть небольшой, и они оказывают влияние не только на скорость, но на форму и направление роста кристаллов. Предполагают, что такие соединения адсорбируются на поверхности кристалла и тормозят адсорбцию других ионов. Такими веществами являются, например, гексаметафосфат натрия, который тормозит преципитацию карбоната кальция. Пирофосфаты, полифосфаты и полифосфонаты также тормозят рост кристаллов гидроксиапатита.
Через несколько месяцев, после того как полость резорбции восполнится костной тканью, плотность новой кости увеличивается. Остеобласты начинают превращаться в контурные клетки, которые участвуют в непрерывном выведении кальция из кости. Некоторые
из остеобластов превращаются в остеоциты. Остеоциты остаются в кости; они связаны друг с другом длинными клеточными отростками и способны воспринимать механические воздействия на кость.
По мере дифференцировки и старения клеток меняется характер и интенсивность обменных процессов. С возрастом в 2-3 раза уменьшается количество гликогена; освобождающаяся глюкоза в молодых клетках на 60% используется в реакциях анаэробного гликолиза, а в старых на 85%. Синтезированные молекулы АТФ необходимы для жизнеобеспечения и минерализации костных клеток. В остеоцитах остаются лишь следы гликогена, и основным поставщиком молекул АТФ является только гликолиз, за счёт которого поддерживается постоянство органического и минерального состава в уже минерализованных отделах костной ткани.
5.3. РЕГУЛЯЦИЯ МЕТАБОЛИЗМА В КОСТНОЙ ТКАНИ
Ремоделирование костной ткани регулируется системными (гормоны) и местными факторами, которые обеспечивают взаимодейс- твие между остеобластами и остеокластами (табл. 5.2).
Системные факторы
Образование кости в известной степени зависит от числа и активности остеобластов. На процесс образования остеобластов влияют
Таблица 5.2
Факторы, регулирующие процессы ремоделирования кости
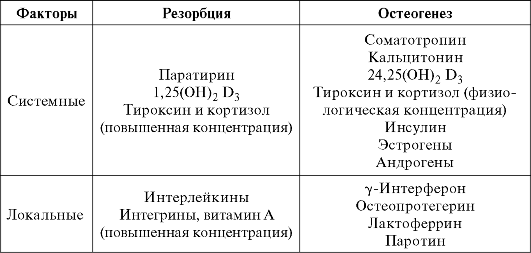
соматотропин (гормон роста), эстрогены, 24,25(ОН)2D3, которые стимулируют деление остеобластов и превращение преостеобластов в остеобласты. Глюкокортикоиды, напротив, подавляют деление остеобластов.
Паратирин (паратгормон) синтезируется в паращитовидных железах. Молекула паратирина состоит из одной полипептидной цепи, содержащей 84 аминокислотных остатков. Синтез паратирина стимулирует адреналин, поэтому в условиях острого и хронического стресса количество этого гормона увеличивается. Паратирины активирует пролиферацию клеток-предшественников остеобластов, продлевает время их полужизни и ингибирует апоптоз остеобластов. В костной ткани рецепторы для паратирина присутствуют в мембранах остеобластов и остеоцитов. Остеокласты лишены рецепторов для данного гормона. Гормон связывается с рецепторами остеобластов и активирует аденилатциклазу, что сопровождается увеличением количества 3'5' цАМФ. Такое повышение содержания цАМФ способствует интенсивному поступлению ионов Ca2+ из внеклеточной жидкости. Поступивший кальций образует комплекс с кальмодулином и далее происходит активация кальцийзависимой протеинкиназы с последующим фос- форилированием белков. Связываясь с остеобластами, паратирин вызывает синтез остеокласт-активирующего фактора - RANKL, способного связываться с преостеокластами.
Введение больших доз паратирина приводит к гибели остеобластов и остеоцитов, что сопровождается увеличением зоны резорбции, повышением уровня кальция и фосфатов в крови и моче с одновре- менным повышением экскреции гидроксипролина вследствие разрушения коллагеновых белков.
Рецепторы к паратирину располагаются и в почечных канальцах. В проксимальных отделах почечных канальцев гормон ингибирует реабсорбцию фосфата и стимулирует образование 1,25(ОН)2D3. В дистальных отделах почечных канальцев паратирин усиливает реабсорбцию Ca2+. Таким образом, паратирин обеспечивает повышение уровня кальция и снижение фосфатов в плазме крови.
Паротин - гликопротеин, выделяемый околоушными и поднижне- челюстными слюнными железами. Белок состоит из α-, β-, и γ-субъединиц. Активным началом паротина является γ-субъединица, которая оказывает влияние на мезенхимные ткани - хрящ, трубчатые кости, дентин зуба. Паротин усиливает пролиферацию хондрогенных клеток, стимулирует синтез нуклеиновых кислот и ДНК в одонтобластах, про-
цессы минерализации дентина и костей. Эти процессы сопровождаются понижением содержания кальция и глюкозы в плазме крови.
Кальцитонин - полипептид, состоящий из 32 аминокислотных остат- ков. Секретируется парафолликулярными К-клетками щитовидной железы или С-клетками паращитовидных желёз в виде высокомолекулярного белка-предшественника. Секреция кальцитонина возрастает при увеличении концентрации ионов Са2+ и уменьшается при понижении концентрации ионов Са2+ в крови. Она также зависит от уровня эстрогенов. При недостатке эстрогенов секреция кальцитонина снижается. Это вызывает усиление мобилизации кальция в костной ткани и способствует развитию остеопороза. Кальцитонин связывается с специфическими рецепторами остеокластов и клеток почечных канальцев, что сопровождается активацией аденилатциклазы и повышением образования цАМФ. Кальцитонин влияет на транспорт ионов Ca2+ через клеточные мембраны. Он стимулирует поглощение ионов Ca2+ митохондриями и тем самым задерживает отток ионов Ca2+ из клетки. Этот зависит от количества АТФ и соотношения ионов Na+ и K+ в клетке. Кальцитонин угнетает распад коллагена, что проявляется уменьшением экскреции с мочой гидроксипролина. В клетках почечных канальцев кальцитонин ингибирует гидроксилирование 25(ОН)D3.
Таким образом, кальцитонин подавляет активность остеокластов и ингибирует освобождение ионов Ca2+ из костной ткани, а также уменьшает реабсорбцию ионов Ca2+ в почках. В результате тормозится резорбция костной ткани, стимулируются процессы минерализации, что проявляется понижением уровня кальция и фосфора в плазме крови.
Йодсодержащие гормоны щитовидной железы - тироксин (Т4) и трийодтиронин (Т3) обеспечивают оптимальный рост костной ткани. Тиреоидные гормоны способны стимулировать секрецию гормонов роста. Они повышают как синтез мРНК инсулиноподобного фактора роста 1 (ИФР-1), так и продукцию самого ИФР-1 в печени. При гипертиреозе подавляется дифференцировка остеогенных клеток и синтез белка в этих клетках, снижается активность щелочной фосфатазы. За счёт усиленной секреции остеокальцина активируется хемотаксис остеокластов, что ведёт к резорбции костной ткани.
Половые стероидные гормоны участвуют в процессах ремоделирования костной ткани. Воздействие эстрогенов на костную ткань проявляется в активации остеобластов (прямое и опосредованное действие), угнетении остеокластов. Они также способствуют всасыванию ионов Ca2+ в желудочно-кишечном тракте и его отложению в костной ткани.
Женские половые гормоны стимулируют продукцию кальцитонина щитовидной железой и снижают чувствительность костной ткани к паратирину. Они также вытесняют на конкурентной основе кортикостероиды из их рецепторов в костной ткани. Андрогены, оказывая анаболическое действие на костную ткань, стимулируют биосинтез белка в остеобластах, а также ароматизируются в жировой ткани в эстрогены.
В условиях дефицита половых стероидов, который имеет место в менопаузе, процессы костной резорбции начинают преобладать над процессами ремоделирования костной ткани, что и приводит к раз- витию остеопении и остеопороза.
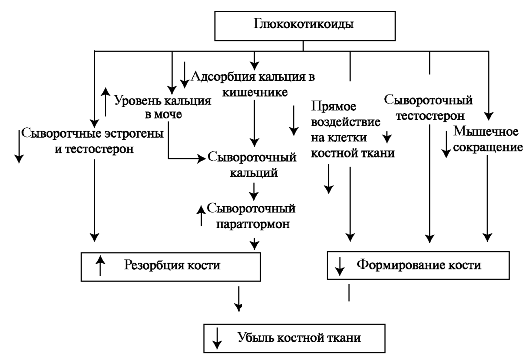
Глюкокортикоиды синтезируются в коре надпочечников. Основной глюкокортикоид человека - кортизол. Глюкокортикоиды скоординировано действуют на разные ткани и разные процессы - как анаболические, так и катаболические. В костной ткани кортизол тормозит синтез коллагена I типа, некоторых неколлагеновых белков, протеогликанов и остеопонтина. Глюкокортикоиды также уменьшают количество тучных клеток, являющихся местом образования гиа- луроновой кислоты. Под влиянием глюкокортикоидов ускоряется распад белков. Глюкокортикоиды подавляют всасывание ионов Ca2+ в кишечнике, что сопровождается снижением его в сыворотке крови. Это понижение приводит к выбросу паратирина, который стимулирует образование остеокластов и резорбцию кости (рис. 5.7). Кроме того, кортизол в мышцах и костях стимулирует распад белков, что также нарушает формирование костной ткани. В конечном итоге действия глюкокортикоидов приводят к убыли костной ткани.
Витамин D3 (холекальциферол) поступает с пищей, а также образуется из предшественника 7-дегидрохолестерола под влиянием ультрафиолетовых лучей. В печени холекальциферол превращается в 25(ОН)D3, а в почках происходит дальнейшее гидроксилирование 25(ОН)D3 и образуются 2 гидроксилированных метаболита - 1,25(ОН)2D3 и 24,25(ОН)2D3. Метаболиты витамина D3 регулируют хондрогенез и остеогенез уже в процессе эмбрионального развития. В отсутствии витамина D3 невозможна минерализация органического матрикса, при этом не образуется сосудистая сеть, а метафизарная кость не способна сформироваться должным образом. 1,25(ОН)2D3 связывается с хондробластами, находящимся в активном состоянии, а 24,25(ОН)2D3 - с клетками в состоянии покоя. 1,25(ОН)2D3 регулирует зоны роста через образование комплекса с ядерным рецептором для этого витамина. Также показано, что 1,25(ОН)2D3 способен связы-
Рис. 5.7. Схема влияния глюкокортикоидов на обменные процессы, приводящие к убыли костной ткани
ваться с мембранно-ядерным рецептором, что приводит к активации фосфолипазы С и образованию инозитол-3-фосфата. Кроме того, образующийся комплекс активируется фосфолипазой А2. Из осво- бождающейся арахидоновой кислоты синтезируется простагландин Е2, который также влияет на ответ хондробластов при их связывании с 1,25(ОН)2D3. Напротив, после связывания 24,25(ОН)2D3 со своим мембранно-связывающимся рецептором, активируется фосфолипаза С, а затем протеинкиназа С.
В хрящевой зоне роста эпифизов костной ткани 24,25(ОН)2D3 стимулирует дифференцировку и пролиферацию прехондробластов, которые содержат специфические рецепторы к данному метаболиту. Метаболиты витамина D3 оказывают влияние на формирование и функциональное состояние височно-нижнечелюстного сустава.
Витамин А. При недостатке и избыточном поступлении витамина А в организм детей нарушается рост костей и происходит их деформация. Вероятно, эти явления обусловлены деполимеризацией и гидролизом хондроитинсульфата, входящего в состав хряща.
Витамин С. При недостатке аскорбиновой кислоты в мезенхемаль- ных клетках не происходит гидроксилирование остатков лизина и пролина, что приводит к нарушению образования зрелого коллагена. Образующийся незрелый коллаген не способен связывать ионы Ca2+ и таким образом нарушаются процессы минерализации.
Витамин Е. При дефиците витамина Е в печени не образуется 25(ОН)D3 - предшественник активных форм витамина D3. Дефицит витамина Е также может привести к снижению уровня магния в костной ткани.
Локальные факторы
Простагландины ускоряют выход ионов Ca2+ из кости. Экзогенные простагландины увеличивают генерацию остеокластов, которые раз- рушают кость. Оказывают катаболическое воздействие на обмен белков в костной ткани и ингибирует их синтез.
Лактоферрин - железосодержащий гликопротеин, в физиологической концентрации стимулирует пролиферацию и дифференцировку остеобластов, а также ингибирует остеокластогенез. Митогенный эффект лактоферрина на остеобластоподобные клетки осуществляется через специфические рецепторы. Образовавшийся комплекс путём эндоцитоза поступает в клетку, и лактоферрин фосфорилирует митоген - активирующие протеинкиназы. Таким образом, лактоферрин выполняет роль фактора роста кости и её здоровья. Может применяться в качестве анаболического фактора при остеопорозе.
Цитокины - низкомолекулярные полипептиды, обусловливающие взаимодействие клеток иммунной системы. Они обеспечивают ответную реакцию на внедрение чужеродных тел, иммунное повреждение, а также воспаления, репарации и регенерации. Они представлены пятью большими группами белков, одной из которых являются интерлейкины.
Интерлейкины (ИЛ) - белки (от ИЛ-1 до ИЛ-18), синтезируемые в основном Т-клетками лимфоцитов, а также мононуклеарными фагоцитами. Функции ИЛ связаны с активностью других физиологически активных пептидов и гормонов. В физиологической концентрации подавляют рост, дифференцировку и продолжительность жизни клеток. Cнижают продукцию коллагеназы, адгезию эндотелиальных клеток к нейтрофилам и эозинофилам, продукцию NO и, как следс- твие, наблюдается уменьшение деградации хрящевой ткани и резорбция кости.
Процесс резорбции костной ткани может активироваться при ацидозе и большими количествами интегринов, ИЛ и витамина A, но тормозится эстрогенами, кальцитонином, интерфероном и морфогенетическим белком кости.
Маркёры метаболизма костной ткани
Биохимические маркёры дают информацию о патогенезе заболеваний скелета и о фазах ремоделирования костной ткани. Различают биохимические маркёры формирования и резорбции кости, характе- ризующие функции остеобластов и остеокластов.
Прогностическая значимость определения маркёров метаболизма костной ткани:
• проведённый скрининг с использованием данных маркёров позволяет определить пациентов с высоким риском развития остеопороза; •высокие уровни маркёров резорбции костей могут быть связаны с
• увеличением риска переломов; повышение уровня маркёров метаболизма костной ткани у пациентов с остеопорозом более чем в 3 раза по сравнению с показателями нормы предполагает иную костную патологию, включая злокачественную; •маркёры резорбции могут быть использованы в качестве дополнительных критериев при решении вопроса о назначении специальной терапии при лечении костной патологии. Маркёры резорбции кости. Во время обновления костной ткани коллаген I типа, который составляет более 90% органического матрикса кости и синтезируется непосредственно в костях, деградирует, а небольшие пептидные фрагменты попадают в кровь или выделяются почками. Продукции деградации коллагена можно определять как в моче, так и в сыворотке крови. Эти маркёры можно использовать при терапии препаратами, снижающими резорбцию костей, у пациентов с болезнями, связанными с нарушениями метаболизма костной ткани. В качестве критериев резорбции костной ткани выступают продукты деградации коллагена I типа: N- и С-телопептиды и тартрат-резистентная кислая фосфатаза. При первичном остеопорозе и болезни Педжета происходит отчетливое повышение С-концевого телопептида коллагена I типа и количество этого маркёра увеличивается в сыворотке крови в 2 раза.
Распад коллагена - единственный источник свободного гидроксипролина в организме. Преобладающая часть гидроксипролина
катаболизируется, а часть выделяется с мочой, главным образом, в составе небольших пептидов (ди- и трипептидов). Поэтому содержание гидроксипролина в крови и моче отражает баланс скорости катаболизма коллагена. У взрослого человека в сутки экскретируется 15-50 мг гидроксипролина, в молодом возрасте до 200 мг, а при некоторых болезнях, связанных с поражением коллагена, например: гиперпаратироидизме, болезни Педжета и наследственной гипергидроксипролинемии, причиной которой является дефект фермента гидроксипролиноксидазы, количество в крови и выделяемого с мочой гидроксипролина увеличивается.
Остекласты секретируют тартрат-резистентную кислую фосфатазу. При возрастании активности остеокластов происходит увеличение содержания тартрат-резистентной кислой фосфатазы и она попадает в повышенном количестве в кровоток. В плазме крови активность этого фермента возрастает при болезни Педжета, онкологических заболеваниях с метастазами в кость. Определение активности этого фермента особенно полезно при мониторинге лечения остеопороза и онкологических заболеваний, сопровождающихся поражением костной ткани.
Маркёры формирования кости. Формирование костной ткани оценивают по количеству остеокальцина, костного изофермента щелочной фосфатазы и остеопротегерина. Измерение количества сывороточного остеокальцина позволяет определять риск развития остеопороза у женщин, проводить мониторинг костного метаболизма во время менопаузы и гормональной заместительной терапии. Рахит у детей раннего возраста сопровождается снижением в крови содержания остеокальцина и степень снижения его концентрации зависит от выраженности рахитического процесса. У больных с гиперкортицизмом и пациентов, получающих преднизолон, значительно снижено содержание остеокальцина в крови, что отражает подавление процессов костеобразования.
Изофермент щелочной фосфатазы присутствует на клеточной поверхности остеобластов. При увеличенном синтезе фермента клетками костной ткани повышается его количество в плазме крови, поэтому определение активности щелочной фосфатазы, особенно костного изофермента, является информативным показателем костного ремоделирования.
Остеопротегерин выступает в качестве рецептора ФНО. Связываясь с преостеокластами, он ингибирует мобилизацию, пролиферацию и активацию остеокластов.
5.4. РЕАКЦИЯ КОСТНОЙ ТКАНИ НА ДЕНТАЛЬНЫЕ
ИМПЛАНТАТЫ
При различных формах адентии альтернативой съёмному протезированию являются внутрикостные дентальные имплантаты. Реакцию костной ткани на имплантат можно рассматривать как частный случай репаративной регенерации.
Различают три вида соединения дентальных имплантатов с костной тканью:
• прямое приживление - остеоинтеграция;
• фиброзно-оссальная интеграция, когда вокруг дентального имплантата образуется слой фиброзной ткани толщиной около 100 мкм;
• периодонтальное соединение (самый редкий вид), образующееся в случае периодонтального связочно-подобного сращения с периимплантационными коллагеновыми волокнами или (в некоторых случаях) цементирование внутрикостного дентального имплантата.
Считают, что в процессе остеоинтеграции после постановки дентальных имплантатов образуется тонкая зона из протеогликанов, которая лишена коллагена. Зона склеивания дентального имплантата с костью обеспечивается двойным слоем протеогликанов, включающим молекулы декорина.
При фиброзно-оссальной интеграции в соединении имплантата с костной тканью также участвуют многочисленные компоненты внеклеточного матрикса. За устойчивость имплантата в его капсуле отвечают коллагены I и III типа, а фибронектин играет основную роль в связывании элементов соединительной ткани с имплантатами.
Однако через какой-то период времени под действием механической нагрузки растёт активность коллагеназы, катепсина К и кислой фосфатазы. Это приводит к убыли костной ткани в периимплантационной области и происходит дезинтеграция дентального имплантата. Ранняя дезинтеграция внутрикостных дентальных имплантатов происходит на фоне сниженного количества в кости фибронектина, Gla-белка, тканевого ингибитора матриксных металлопротеиназ (ТИМП-1).
Установлено, что белковый спектр костной ткани верхних и нижних челюстей различен. Для нижней челюсти по сравнению с верхней характерно более низкое содержание фибронектина и Gla-белков, и наиболее часто дезинтеграция дентальных имплантатов наблюдается именно на нижней челюсти.