Биохимия тканей и жидкостей полостей рта: учебное пособие / Вавилова Т.П. - 2-е изд., испр. и доп. - 2008. - 208 с. : ил.
|
|
|
|
ГЛАВА 3 МИНЕРАЛИЗОВАННЫЕ ТКАНИ
Минерализованные ткани, к которым относятся костная ткань, дентин, клеточный и бесклеточный цемент и эмаль зуба, характери- зуются высоким содержанием минерального компонента, главной составной частью которого являются фосфорнокислые соли кальция.
3.1. ХИМИЧЕСКИЙ СОСТАВ МИНЕРАЛИЗОВАННЫХ ТКАНЕЙ
Образование и распад минерального компонента в этих тканях тесно связан с обменом кальция и фосфора в организме. В межклеточном матриксе минерализованных тканей происходит депонирование кальция, который выполняет также структурную функцию. В клетках кальций исполняет роль вторичного посредника в механизмах внутриклеточного переноса сигналов.
Особенностью всех минерализованных тканей, за исключением эмали и бесклеточного цемента, является малое количество клеток с длинными отростками, а большой межклеточный матрикс заполнен минералами. В белках матрикса формируются центры кристаллизации для формирования кристаллов минерального компонента - апатитов. Эмаль и бесклеточный цемент зубов образуются из эктодермы, а остальные минерализованные ткани из стволовых клеток мезодермы. Насыщенность минеральными соединениями зависит от вида твёрдой ткани, топографической локализацией внутри ткани, возраста и экологических условий.
Все минерализованные ткани различаются по содержанию воды, минеральных и органических соединений (табл. 3.1).
В эмали по сравнению с другими твёрдыми тканями определяется наиболее высокая концентрация кальция и фосфатов, и количество этих минералов снижается в направлении от поверхности к эмалеводентинной границе. В дентине, наряду с ионами кальция и фосфатов, определяется достаточно высокая концентрация магния и натрия. Наименьшее количество кальция и фосфатов присутствует в костной ткани и цементе (табл. 3.2).
В состав твёрдых тканей зубов и костей входят соли HPO42-, или PO43-. Ортофосфаты кальция могут быть в форме однозамещен-
Таблица 3.1
Процентное распределение воды, неорганических и органических веществ
в минерализованных тканях
Ткань | Вещества, % | ||
минеральные | органические | вода | |
Эмаль | 95 | 1,2 | 3,8 |
Дентин | 70 | 20 | 10 |
Цемент | 65 | 25 | 10 |
Кость | 45 | 30 | 25 |
Таблица 3.2
Химический состав минерализованных тканей
Ткань | Химические элементы, в % от сухой массы | |||||
Са2+ | ро43- | Mg2+ | К+ | Na+ | Cl- | |
Эмаль | 32-39 | 16-18 | 0,25-0,56 | 0,05-0,3 | 0,25-0,9 | 0,2-0,3 |
Дентин | 26-28 | 12-13 | 0,8-1,0 | 0,02-0,04 | 0,6-0,8 | 0,3-0,5 |
Цемент | 21-24 | 10-12 | 0,4-0,7 | 0,15-0,2 | 0,6-0,8 | 0,03-0,08 |
Кость | 22-24 | 11 | 03 | 0,2 | 0,8 | 0,01 |
ных (H2PO4-), двузамещенных (HPO42-) или фосфат ионов (PO43-). Пирофосфаты встречаются только в зубных камнях и костной ткани. В растворах ион пирофосфата оказывает существенный эффект на кристаллизацию некоторых ортофосфатов кальция, что выражается в регуляции величины кристаллов.
Характеристика кристаллов
Большинство фосфорно-кальциевых солей кристаллизуются с образованием кристаллов разной величины и формы в зависимости от входящих элементов (табл. 3.3). Кристаллы присутствуют не только в минерализованных тканях, но и способны образовываться в других тканях в виде патологических образований.
Расположение атомов и молекул в кристалле можно исследовать при помощи рентгеноструктурного анализа кристаллических реше- ток. Как правило, частички располагаются в кристалле симметрично; их называют элементарными ячейками кристалла. Сеточка, образуемая ячейками, называется матрицей кристалла. Имеется 7 разных
Таблица 3.3
Кристаллические образования, присутствующие в различных тканях
категорий ячеек кристаллов и соответственно 7 типов кристаллов: триклинные, моноклинные, орторомбические, тригональные, тетрагональные, гексагональные и кубические.
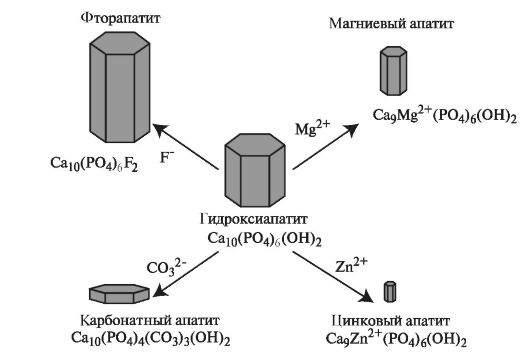
В минерализованных тканях животного мира преобладают апатиты. Они имеют общую формулу Ca10(PO4)6 X2, где X представлен анионами фтора или гидроксильной группой (OH-).
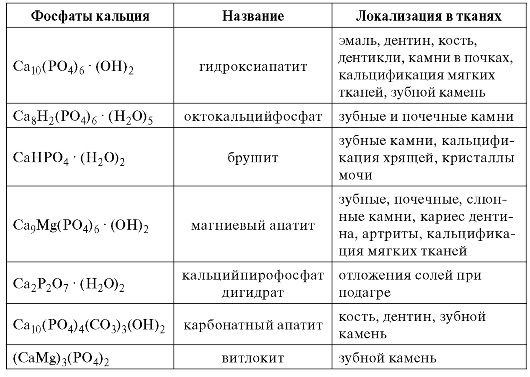
Гидроксиапатит (гидроксилапатит) - основной кристалл мине- рализованных тканей; составляет 95-97% в эмали зуба, 70-75% в дентине и 60-70% в костной ткани. Формула гидроксиапатита - Са10(PO4)6(ОН)2. В этом случае молярное соотношение Са/Р (кальциево-фосфатный коэффициент) равно 1,67. Решётка гидроксиапатита имеет гексагональную структуру (рис. 3.1, А). Гидроксильные группы расположены вдоль гексагональной оси, тогда как фосфатные группы, имеющие наибольшие размеры по сравнению с ионами кальция и гидроксилами, распределяются как равнобедренные треугольники вокруг гексагональной оси. Между кристаллами имеются микропространства, заполненные водой (рис. 3.1, Б). Гидроксиапатиты являются
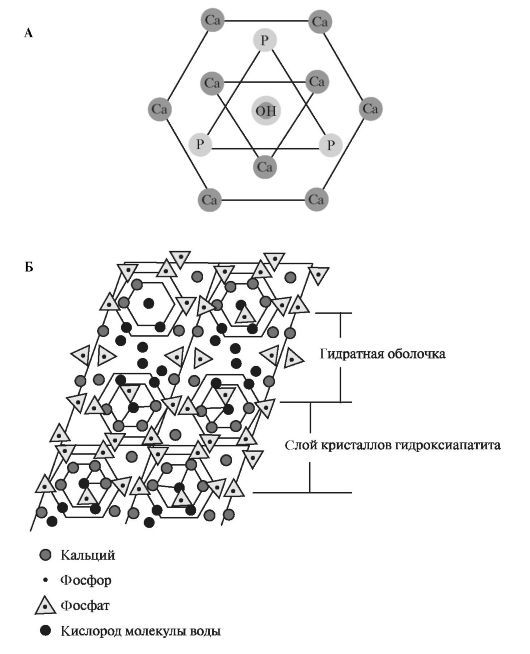
Рис. 3.1. Гидроксиапатит:
А - гексагональная форма молекулы гидроксиапатита; Б - расположение
кристаллов гидроксиапатита в эмали зуба.
довольно устойчивыми соединениями и имеют очень стабильную ионную решётку, в которой ионы плотно упакованы и удерживаются за счёт электростатических сил. Сила связи прямо пропорциональна величине заряда ионов и обратно пропорциональна квадрату расстояния между ними. Гидроксиапатит электронейтрален. Если в структуре гидроксиапатита содержится 8 ионов кальция, то кристалл приобретает отрицательный заряд. Он может заряжаться и положительно, если количество ионов кальция достигает 12. Такие кристаллы обладают реакционной способностью, возникает поверхностная электро- химическая неуравновешенность и они становятся неустойчивыми.
• Гидроксиапатиты легко обмениваются с окружающей средой, в результате чего в их составе могут появляться другие ионы (табл. 3.4). Наиболее часто встречаются следующие варианты обмена ионов: Са2+ замещается катионами Sr2+, Ba2+, Mo2+, реже Mg2+, Pb2+.
Катионы Ca2+ поверхностного слоя кристаллов, могут на короткое
время замещаться катионами К+, Na+.
• PO43- обменивается с НРО42-, СО32-.
• ОН - замещается анионами галогенов Cl-, F-, I-, Br-.
Элементы кристаллической решётки апатитов могут обмениваться с ионами раствора, окружающего кристалл и изменяться за счёт ионов, находящихся в этом растворе. В живых системах это свойство апатитов делает их высокочувствительными к ионному составу крови и межклеточной жидкости. В свою очередь, ионный состав крови и межклеточной жидкости зависит от характера пищи и потребляемой воды. Сам процесс обмена элементов кристаллической решётки протекает в несколько этапов с разной скоростью.
Обмен ионов в кристаллической решётке гидроксиапатита изменяет его свойства, в том числе прочность, и существенно влияет на размеры кристаллов (рис. 3.2).
Некоторые ионы (К+, Cl-) в течение несколькольких минут путём диффузии из окружающей биологической жидкости заходят в гидрат-
Таблица 3.4
Замещаемые и замещающие ионы и молекулы в составе апатитов
Замещаемые ионы | Замещающие ионы |
РО43- | AsO32-, НРО42-, СО2 |
Са2+ | Sr2+, Ba2+, Pb2+, Na+, K+, Mg2+, H2O |
ОН- | F-, Cl-, Br-, I-, H2O |
2ОН | СO32-, O2- |
Рис. 3.2. Размеры кристаллов различных апатитов [Edwards P. A., 2005].
ный слой гидроксиапатита, а затем также легко его покидают. Другие ионы (Na+, F-) легко проникают в гидратную оболочку и, не задерживаясь, встраиваются в поверхностные слои криста лла. Проникновение ионов Са2+, PO43-, СО32-, Sr2+, F- в поверхность кристаллов гидроксиапатита из гидратного слоя происходит очень медленно, в течение нескольких часов. Только немногие ионы: Са2+, PO43-, СО32-, Sr2+, F- встраиваются вглубь ионной решётки. Это может продолжаться от нескольких дней до нескольких месяцев. Преимущественным фак- тором, определяющим возможность замены, является размер атома. Схожесть в зарядах имеет второстепенное значение. Такой принцип замены носит название изоморфного замещения. Тем не менее, в ходе такого замещения поддерживается общее распределение зарядов по
принципу: Сa10х(HPO4)х(PO4)6х(OH)2х, где 0<х<1. Потеря Ca2+ частич- -+ но компенсируется потерей OH и частично H , присоединённых к
фосфату.
В кислой среде ионы кальция способны замещаться протонами по
схеме:

Это замещение несовершенно, поскольку протоны во много раз меньше катиона кальция.
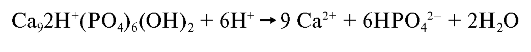
Такое замещение приводит к разрушению кристалла гидроксиапатита в кислой среде.
Фторапатиты Ca10(PO4)6F2 наиболее стабильные из всех апатитов. Они широко распространены в природе и прежде всего как почвенные минералы. Кристаллы фторапатита имеют гексагональную форму. В водной среде реакция взаимодействия фтора с фосфатами кальция зависит от концентрации фтора. Если она сравнительно невысока (до 500 мг/л), то образуются кристаллы фторапатита:
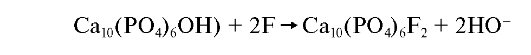
Фтор резко уменьшает растворимость гидроксиапатитов в кислой среде.
При высоких концентрациях фтора (>2 г/л) кристаллы не образуются:
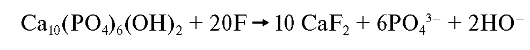
Заболевание, развивающееся при избыточной концентрации фтора в воде и почве, зубах и костях в период формирования костного скелета и зубных зачатков назывется флюорозом.
Карбонатный апатит содержит в своем составе несколько процентов карбоната или гидрокарбоната. Процесс минерализации биологических апатитов в значительной степени определяется присутствием и локализацией карбонатных ионов в кристаллической решётке. Карбонатные радикалы СО32- могут замещать как ОН- (А-узел), так и РО43- (В-узел) в решётке гидроксиапатита. Например, около 4% апатита эмали зуба составляют карбонатные группы, которые замещают как фосфатные, так и гидроксильные ионы в пропорции 9:1 соответственно. Подобная ситуация характерна и для других гидроксиапатитов естественного происхождения. Условно химическая формула карбонированного гидроксиапатита может быть записана в виде Ca10[(PO4)6-x(CO3)x][(OH)2-2y(CO3)y], где х характеризует В-замещение, а у - А-замещение. Для гидроксиапатита эмали зуба x=0,039, y=0,001. Карбонат уменьшает кристалличность апатита и делает его
более аморфным и хрупким. Чаще всего фосфат-анионы апатитов замещаются ионами НСО3- по схеме:
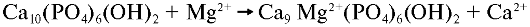
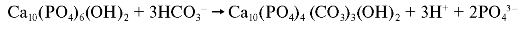
Интенсивность замены зависит от числа образующихся гидрокарбонатов. В организме постоянно происходят реакции декарбоксилирования, и образующиеся молекулы СО2 взаимодействуют с молекулами Н2O. Анионы НСО3- образуются в реакции, катализируемой карбоангидразой, и замещают фосфат-анионы.
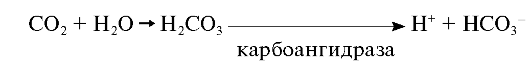
Карбонатные апатиты более характерны для костной ткани. В тканях зуба они образуются в непосредственной близости от эма- лево-дентинной границы за счёт продукции анионов НСО3- одонтобластами. Возможно образование молекул НСО3- за счёт активного метаболизма аэробной микрофлоры зубного налёта. Образующееся количество НСО3- в этих участках может превышать PO43-, что способствует образованию карбонатного апатита в поверхностных слоях эмали. Накопление карбонатапатита свыше 3-4% от общей массы гидроксиапатита повышает кариесвосприимчивость эмали. С возрастом количество карбонатных апатитов увеличивается.
Стронциевый апатит. В кристаллической решётке апатитов Sr2+ может вытеснять или заменять вакантные места для Ca2+.
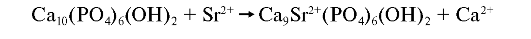
Это приводит к нарушению структуры кристаллов. В Забайкалье, вдоль берегов небольшой реки Уров, описано заболевание, получившее название «уровская» болезнь. Оно сопровождается поражением костного скелета, уменьшением конечностей у людей и у животных. В местности, загрязненной радионуклидами, неблагоприятное значение стронциевого апатита для организма человека связано с возможностью депонирования радиоактивного стронция.
Магниевый апатит образуется при замещении Ca2+ на ионы Mg2+.
Органические вещества минерализованных тканей в основном представлены белками, а также углеводами и липидами.
3.2. БЕЛКИ МЕЖКЛЕТОЧНОГО МАТРИКСА
МИНЕРАЛИЗОВАННЫХ ТКАНЕЙ МЕЗЕНХИМНОГО
ПРОИСХОЖДЕНИЯ
Белки минерализованных тканей составляют основу для прикрепления минералов и определяют процессы минерализации. Особенностью всех белков минерализованных тканей является наличие остатков фосфосерина, глутамата и аспартата, которые способны связывать Ca2+ и таким образом участвовать в образовании кристаллов апатита на начальном этапе. Второй особенностью является присутствие углеводов и последовательности аминокислотных остатков арг-гли-асп в первичной структуре белков, что обеспечивает их связывание с клетками или с белками, формирующими межклеточный матрикс.
Часть белков встречается в межклеточном матриксе большинства минерализованных тканей. Это белки адгезии, кальций-связывающие белки, протеолитические ферменты, факторы роста. Другие белки со специальными свойствами присущи только данной ткани и связаны с определёнными процессами, характерными для этого типа ткани.
Остеонектин - гликопротеин, присутствующий в большом количестве в минерализованной ткани. Белок синтезируется остеобластами, фибробластами, одонтобластами и в небольшом количестве хондроцитами и эндотелиальными клетками. В N-концевой области остеонектина располагается большое количество отрицательно заряженных аминокислот. В сформированной α-спирали на N-концевой области имеется до 12 участков связывания Ca2+, входящего в состав гидроксиапатита. Через углеводный компонент остеонектин связывается с коллагеном I типа. Таким образом, остеонектин обеспечивает взаимодействие компонентов матрикса. Он также регулирует пролиферацию клеток и принимает участие во многих процессах на этапе развития и созревания минерализованных тканей.
Остеопонтин - белок с мол. массой ~32 000 кДа, содержит несколько повторов, богатых аспарагиновой кислотой, которые придают остеопонтину способность связываться с кристаллами гидроксиапатита.
В средней части молекулы содержится последовательность RGD (аргглу-асп), ответственная за прикрепление клеток. Этот белок играет ключевую роль в построении минерализованного матрикса, взаимодействии клеток и матрикса и транспорте неорганических ионов.
Костный сиалопротеин - специфичный белок минерализованных тканей с мол. массой ~70 кДа, на 50% состоящий из углеводов (из них 12% составляет сиаловая кислота). Большинство углеводов представлены О-связанными олигосахаридами, которые содержатся в N-кон- цевой области белка. Этот белок подвергается в реакциях сульфатирования тирозина различным модификациям. В составе костного сиалопротеина определяется до 30% фосфорилированных остатков серина и повторяющихся последовательностей глутаминовой кислоты, которые участвуют в связывании Ca2+. Костный сиалопротеин выявлен в костях, дентине, цементе, гипертрофированных хондроци- тах и остеокластах. Данный белок отвечает за прикрепление клеток и участвует в минерализации матрикса.
Костный кислый гликопротеин-75 - белок с мол. массой 75 кДа, по своему составу на 30% гомологичный остеопонтину. Присутствие большого количества остатков глутаминовой (30%), фосфорной (8%) и сиаловых (7%) кислот обеспечивает его способность связывать Ca2+. Белок обнаружен в костной ткани, дентине и хрящевой ростовой пластинке и не определяется в неминерализованных тканях. Костный кислый гликопротеин-75 ингибирует процессы резорбции в минерализованных тканях.
Gla-белки. Отличительной особенностью семейства Gla-белков является присутствие в их первичной структуре остатков 7-кар- боксиглутаминовой кислоты. Они различаются по мол. массе и количеству остатков 7-карбоксиглутаминовой кислоты. Образование 7-карбоксиглутаминовой кислоты происходит в процессе посттрансляционной модификации в витамин К-зависимой реакции карбоксилирования остатков глутаминовой кислоты. Наличие дополнительной карбоксильной группы в 7-карбоксиглутаминовой кислоте обеспечивает лёгкое связывание и отдачу ионов Ca2+.
К Gla-белкам относят остеокальцин и матриксный Gla-белок.
Остеокальцин (костный глутаминовый белок) - белок с мол. массой 6 кДа. Состоит из 49 аминокислотных остатков, из которых 3 представлены 7-карбоксиглутаминовой кислотой. Белок присутствует в костной ткани и дентине зуба. Синтезируется в виде предшественника (рис. 3.3).
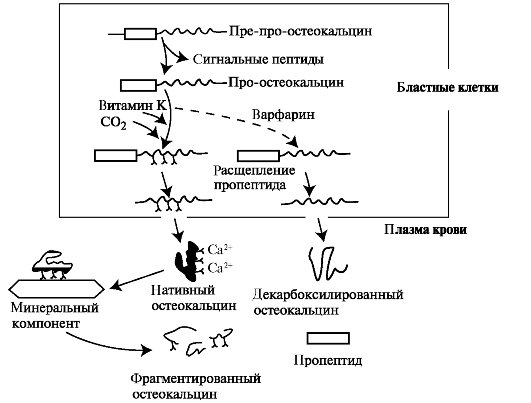
Рис. 3.3. Образование активной формы остеокальцина.
После отщепления сигнального пептида образуется про-остеокальцин, который далее подвергается посттрансляционной модификации. Вначале остатки глутаминовой кислоты окисляются, а затем происходит присоединение молекул СО2 при участии витамин К-зависимой глутаматкарбоксилазы (рис. 3.4). Активность этого фермента снижается в присутствии варфарина - антагониста витамина К.
Нативный остеокальцин связывает Ca2+, идущие на образование кристаллов гидроксиапатита. В плазме крови содержится как нативный остеокальцин, так и его фрагменты.
Матриксный Gla-белок содержит 5 остатков 7-карбоксиглутами- новой кислоты и способен связываться с гидроксиапатитом. Белок обнаружен в пульпе зуба, легких, сердце, почках, хряще и появляется на ранних стадиях развития костной ткани.
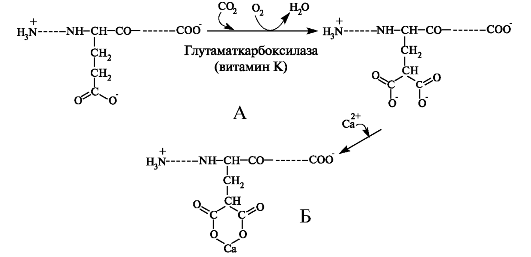
Рис. 3.4. Посттрансляционная модификация остатков глутаминовой кислоты в молекуле про-остеокальцина. А - гидроксилирование глутаминовой кислоты; Б - связывание ионов кальция 7-карбоксиглутаминовой кислотой.
Протеин S содержит остатки 7-карбоксиглутаминовой кислоты и синтезируется главным образом в печени. Определяется в костной ткани, а при его дефиците обнаруживают изменения костного скелета.