Акушерство. Клинические лекции : учебное пособие / Под ред. проф. О.В. Макарова. - 2007. - 640 с. :
|
|
|
|
ЛЕКЦИЯ 5 ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА
В настоящее время большое внимание уделяется антенатальному периоду развития плода. Своевременная диагностика нарушений жизнедеятельности плода и правильная пренатальная профилактика являются важными факторами снижения перинатальной смертности и осложнений неонатального периода.
Пренатальная диагностика - это комплекс методов получения информации о плоде.
История пренатальной диагностики исчисляется с 1818 г., когда швейцарский врач Мейер, проводя осмотр беременной, впервые выслышал сердечные тоны плода обычным терапевтическим стетоскопом. Однако первое официальное сообщение о возможности выслушивания сердцебиения и двигательной активности плода было сделано только через четыре года французским врачом Керджерадом в Парижской медицинской академии.
В 1827 г. в Дублине ирландский врач Джон Фергюсон представил технику выслушивания сердцебиения плода стетоскопом. А в 1833 г. Эвори Кеннеди опубликовал монографию «Аускультативные наблюдения в акушерстве», где он определил критерии ЧСС здорового плода (от 100 до 160 уд/мин), которые до сих пор используются в акушерстве.
На Х Международном медицинском конгрессе в 1891 г. впервые представлена фонокардиограмма (ФКГ) плода, а в 1906 г. немецкий исследователь Кремер продемонстрировал первую ЭКГ плода, снятую при помощи абдоминального и влагалищного электродов. Это сообщение было воспринято как интересный казуистический случай, и на определенный промежуток времени о нем забыли. Только с начала 1950-х годов ФКГ и ЭКГ плода получили широкое распространение. Однако данные методы имели ряд существенных недостатков. Так, при проведении прямой ЭКГ один электрод необходимо вводить толстой пункционной иглой через брюшную стенку и закреплять на ягодице плода. Инвазивность метода снизила его популярность. При проведении непрямой ЭКГ, при которой электроды закрепляются на передней брюшной стенке, невозможно записать зубец Р и, следовательно, определить различные виды нарушения атриовентрикулярной проводимости. В настоя-
щее время с появлением более информативных и неинвазивных методов исследования плода использование ЭКГ и ФКГ ограничено.
С середины 1950-х годов широкое распространение получает КТГ плода - одновременная регистрация частоты сердечных тонов, его двигательной активности и тонуса матки. В тот же период развития пренатальной диагностики становится популярным медико-генетическое консультирование беременных с целью формирования групп повышенного генетического риска возникновения врожденных наследственных заболеваний плода. Генетика начинает активно искать подходы к получению информации о генетическом статусе плода. Эти подходы начинают реализовываться с появлением возможности производить инвазивные диагностические манипуляции.
Первая инвазивная манипуляция с целью получения плодного материала была произведена в 1956 г. в Великобритании. Для диагностики эритробластоза при резус-несовместимости матери и плода без визуального контроля осуществлен трансабдоминальный амниоцентез - пункция амниотической полости через переднюю брюшную стенку (ранее амниоцентез выполнялся трансвагинальным путем с целью прерывания беременности). С этого момента началась разработка методик культивирования клеток амниотической жидкости для последующего цитогенетического анализа.
В 1958 г. Donnald делает первое сообщение о применении в акушерстве ультразвукового сканирования. Принцип его основан на способности волны акустических колебаний ультразвукового диапазона отражаться от границы двух сред с различным акустическим сопротивлением.
В 1962 г. Sailing предложил новый метод визуального контроля состояния плода - амниоскопию, трансцервикальный осмотр нижнего полюса плодного пузыря.
В 1967 г. освоена методика культивирования клеток амниотической жидкости и произведен первый диагностический амниоцентез для пренатальной диагностики хромосомной патологии плода.
В начале 1970-х годов в США разработан и предложен к применению новый диагностический метод визуального контроля за плодом - фетоскопия, осмотр плода через оптическую систему специально приспособленного эндоскопа малого диаметра. А в Великобритании, Италии и Китае тогда же получила распространение новая инвазивная диагностическая процедура - биопсия хориона для пренатальной диагностики врожденных наследственных заболеваний.
С 1976 г. начинают проводиться биохимические исследования амниотической жидкости для определения зрелости легких плода и диагностики обменных заболеваний.
В 1977 г. Фиджеральд и Друмм сообщают о применении в акушерстве допплерометрии - исследования кровотока в артериях пуповины и аорте плода.
В начале 1980-х годов в США и Великобритании при выполнении фетоскопии получена кровь из пуповины плода с целью определения кариотипа плода. В 1983 г. Даффос произвел первый кордоцентез (пункцию вены пуповины) под визуальным контролем УЗИ. Этот метод широко использовался в странах Средиземноморья с целью пренатальной профилактики талассемии - генетически детерминированной гемоглобинопатии. В дальнейшем кордоцентез стал самой актуальной инвазивной диагностической процедурой; он применялся для получения наиболее информативной биологической ткани плода и последующей диагностики хромосомной патологии, некоторых биохимических заболеваний, инфицированности, а также для определения группы крови плода, переливания крови при гемолитической болезни плода.
В 1986 г. Мейлин и Куржак вводят в акушерскую практику новый метод двухмерной цветной допплеркардиографии.
В настоящее время к наиболее распространенным современным методам оценки состояния плода относятся следующие.
1. Ультразвуковое исследование с применением черно-белой и цветной допплерографии.
2. Кардиомониторное исследование сердечной деятельности плода с одновременной регистрацией его двигательной активности и тонуса матки.
3. Методы визуального контроля:
• амниоскопия;
• фетоскопия.
4. Инвазивные диагностические процедуры:
• амниоцентез;
• биопсия хориона;
• кордоцентез.
5. Определение концентрации основных гормонов беременности и факторов материнской сыворотки (эстрогены, ПЛ, ХГ, АФП и т.д.).
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
В 1958 г. Доннальд делает первое сообщение о применении ультразвукового сканирования в акушерстве. Принцип основан на способности волны акустических колебаний ультразвукового диапазона отражаться от границы двух сред с различным акустическим сопротивлением. Все современные УЗ-приборы работают в режиме реального масштаба времени, т.е. непосредственного отображения информации, получаемой с УЗ-датчика, на экран дисплея. Картина, получаемая на экране дисплея, является масштабным изображением ультразвукового среза рассматриваемой зоны.
УЗИ в пренатальной диагностике занимает в настоящее время ведущее место, так как практически 70% основной информации о плоде можно получить с его помощью. Метод неинвазивен (т.е. неоперативный) и безопасен, о чем свидетельствует официальное сообщение Американского института ультразвука в медицине, сделанное в 1979 г. на основании анализа многочисленных проспективных исследований биологических эффектов ультразвука в медицине.
Проведение фето- и плацентометрии, определение количества околоплодных вод, а также оценка биофизической активности плода позволяют получить важную информацию как о состоянии плода, так и наличии ряда акушерских осложнений.
Таблица 10
УЗИ в I триместре
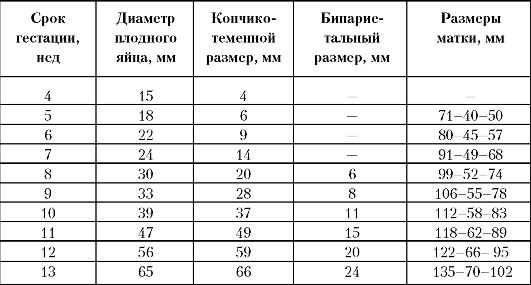 При
проведении УЗИ в I триместре (табл. 10) необходимо уделять большое
внимание анатомическому строению матки, состоянию придатков, развитию и
динамическому изменению желточного мешка.
При
проведении УЗИ в I триместре (табл. 10) необходимо уделять большое
внимание анатомическому строению матки, состоянию придатков, развитию и
динамическому изменению желточного мешка.
Аномалии развития матки и новообразования (чаще всего миомы) наиболее четко дифференцируются именно в I триместре, и их диагностика крайне важна для прогноза течения беременности и выбора оптимальной тактики ведения. Определение состояния шейки матки при исследовании в динамике позволяет вовремя диагностировать истмико-цервикальную недостаточность.
Объем информации, которую получают о плоде в ранние сроки беременности, довольно обширен: плодное яйцо в полости матки наблюдается с 2-3-й нед, визуализация тельца эмбриона и регистрация его сердцебиения возможна с 4-5-й нед, головка, как отдельное анатомическое образование, лоцируется с 8-й нед, после 12-й нед доступны для осмотра структуры головного мозга, позвоночник, лицо, грудная клетка, идентифицируются конечности, а в некоторых случаях _ кисти и стопы плода.
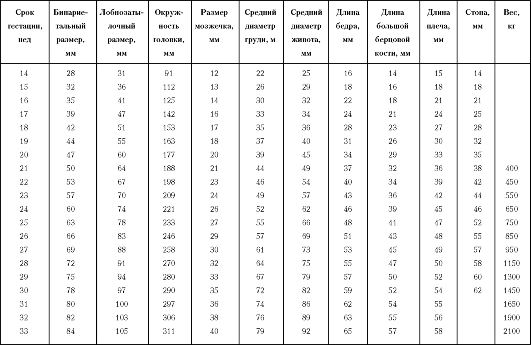
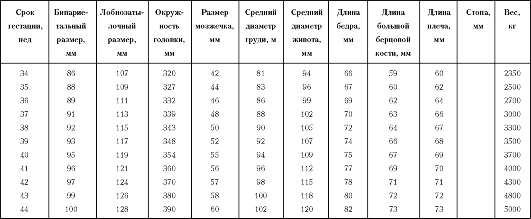
С увеличением срока беременности оценивают локализацию и структуру плаценты, количество и состав околоплодных вод, тонус миометрия. С начала II триместра беременности доступны измерению практически все фетометрические параметры (бипариетальный и лобно-затылочный размер головки, средний размер грудной клетки и живота, длина трубчатых костей и др.). Соответствие размеров плода сроку беременности проводится по фетометрическим таблицам, специфичным для конкретной популяции.
Размеры органов
Размеры сердца плода отражены в табл. 11, 12.
Таблица 11
Размеры сердца плода в разные сроки беременности
Измеряемый параметр | Размер, мм | Колебания размеров, мм | |
17 нед беременности | 40 нед беременности | ||
Левый желудочек* | 4 | 16 | +1,7 |
Правый желудочек* | 4 | 19 | +1,8 |
Левое предсердие** | 4 | 16 | +1,9 |
Правое предсердие** | 6 | 16 | +1,5 |
Дуга аорты | 2,4 | 10 | +1,3 |
Примечание: *Измерение производят перпендикулярно межжелудочковой перегородке в конце диастолы в момент, предшествующий закрытию атриовентрикулярного клапана.
** Измеряется наибольший внутренний диаметр в конце систолы сразу после закрытия атриовентрикулярного клапана.
Таблица 12
Отношения размеров сердца во II и III триместрах
Анатомические области | Отношение |
Поперечный внутренний диаметр правого и левого желудочков | 0,85 : 1,3 |
Поперечный внутренний диаметр правого и левого предсердий | 1 : 1 |
Толщина межжелудочковой перегородки к левой стенке левого желудочка | 1 : 1 |
Внутренние диаметры аорты и легочной артерии (в области клапанов) | 1 : 1 |
Размеры печени плода отражены в табл. 13
После 20 нед беременности измеряется так называемая «длинная ось» печени. Длинная ось определяется при продвижении УЗ-датчика параллельно брюшной аорте вправо до выведения максимального размера печени. Таким образом, длинная ось - это расстояние от правой половины диафрагмы до нижнего края печени.
Таблица 13
Размеры печени плода
Срок гестации, нед | Длина «длинной оси» печени, мм | |
Средний размер | Вариабельность | |
20 | 27,3 | 20,9-33,7 |
25 | 33,6 | 28,3-38,9 |
30 | 38,7 | 33,7-43,7 |
35 | 47,8 | 38,7-56,9 |
40 | 49,0 | |
41 и более | 49,3 | 46,9-51,7 |
Особого рассмотрения заслуживает пренатальная диагностика врожденных наследственных заболеваний (ВНЗ) и пороков развития плода (табл. 14, 15), которая возникла и успешно развивается на стыке двух дисциплин - генетики и ультразвуковой диагностики.
Таблица 14
Частота встречаемости врожденной и наследственной патологии
Генные болезни (1%) | |
Муковисцидоз | 1:2000 |
Фенилкетонурия | 1:3000 |
Ахондроплазия | 1:10 000 |
Миопатия Дюшена | 1:10 000 |
Поликистоз почек | 1: 11000 |
Гемофилия А | 1:20 000 |
Несовершенный остеогенез | 1:50 000 |
Хромосомные болезни (0,5%) | |
Трисомия 21 (синдром Дауна) | 1:700 |
Трисомия 18 (синдром Эдвардса) | 1:7000 |
Трисомия 13 (Синдром Патау) | 1: 8000 |
Врожденные пороки развития (2%) | |
Пороки ЦНС | 1:700 |
Расщепление губы и(или) нёба | 1:1000 |
Таблица 15
Риск рождения новорожденного с синдромом Дауна
Возраст матери Дауна, % | Риск синдрома аберраций, % | Риск хромосомных болезней |
20 | 0,09 (1/1667) | 0,2 (1/526) |
25 | 0,1 (1/1250) | 0,3 (1/476) |
30 | 0,15 (1/952) | 0,4 (1/385) |
35 | 0,4 (1/375) | 1,5 (1/202) |
36 | 0,5 (1/289) | 1,6 (1/163) |
37 | 0,6 (1/224) | 2,1 (1/129) |
38 | 1,1 (1/173) | 2,9 (1/103) |
39 | 1,4 (1/136) | 3,0 (1/82) |
40 | 1,8 (1/106) | 3,5 (1/65) |
41 | 2,1 (1/82) | 4,5 (1/51) |
42 | 2,5 (1/63) | 4,7 (1/40) |
43 | 3,8 (1/49) | 8,0 (1/32) |
44 | 3,4 (1/38) | 7,1 (1/25) |
45 | 5,9 (1/30) | 7,6 (1/20) |
Основную информацию по выявлению ВНЗ плода дает УЗИ во II триместре беременности в сроки от 16 до 28 нед, когда сформированы и доступны подробному исследованию практически все органы и системы плода и «включаются» синдромологические особенности врожденного или наследственного заболевания, именуемые термином «стигмы дизэмбриогенеза». К стигмам (или, как их еще называют, «маркерам» ВНЗ) относятся, например, шейная складка, низкое расположение ушных раковин, уплощенный профиль лица, гипер- и гипотелоризм и т.д.
Антенатальные проявления ВНЗ плода на первый взгляд могут быть незначительными, например в виде многоводия или асимметрии развития плода, и задача специалиста УЗ-диагностики состоит в умении распознавания дополнительных фенотипических особенностях плода как маркеров ВНЗ. Выявление комплекса специфических маркеров ВНЗ - показание для дополнительного исследования плода с целью диагностики некурабельной патологии.
Фетометрическая таблица
 УЗИ-критерии трисомии 21 (синдром Дауна).
УЗИ-критерии трисомии 21 (синдром Дауна).
• Утолщение шейной складки.
• Укорочение бедренной кости.
• Порок сердца.
• Гипертелоризм.
УЗИ-критерии трисомии 18 (синдром Эдвардса).
• Многоводие.
• Микрогнатия.
• СЗРП.
• Деформация пальцев рук.
• Деформация стоп.
• Укорочение I пальца стопы.
• Единственная артерия пуповины.
• Омфалоцеле.
Важным моментом комплексного синдромологического исследования плода является умение проводить дифференциальную диагностику между маркерами ВНЗ и конституциональными наследственно обусловленными особенностями развития. Фенотипические особенности развития плода, сходные с фенотипическими особенностями родителей, как правило, не выражены в сроки до 28 нед и наиболее сильно проявляются после 32 нед. Точность диагностики так называемых ультразвуковых стигм, или маркеров ВНЗ, при соответствующей квалификации специалиста достигает 70-80%. До 27 нед возможно диагностировать до 95% всех видов пороков развития плода и даже такую патологию, как отслойка сетчатки глаза.
Один из важных вопросов пренатальной диагностики - определение состояния плода при доношенной беременности перед родами. Поэтому большое внимание при УЗИ необходимо уделять поведенческим реакциям плода (в том числе общей двигательной активности, мышечному тонусу, дыхательным движениям, моторике желудочно-кишечного тракта и т.д.) как диагностическим критериям гипоксического состояния. Особого внимания требует объем околоплодных вод (рис. 44, 45).
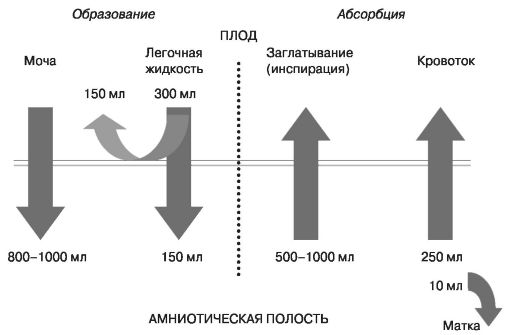 Рис. 44. Физиология обмена околоплодных вод (при доношенной беременности)
Рис. 44. Физиология обмена околоплодных вод (при доношенной беременности)
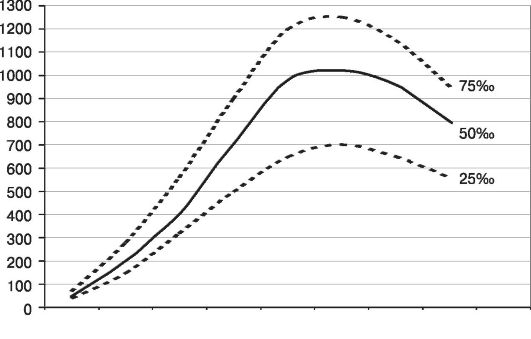 Рис. 45. Динамика увеличения объема околоплодных вод
Рис. 45. Динамика увеличения объема околоплодных вод
Основные причины многоводия
• Инфицирование.
• Трансфузионный синдром (плод-реципиент).
• Порок развития плода.
• Сахарный диабет.
• Изосерологическая несовместимость. Основные причины маловодия
• Хроническая гипоксия плода.
• Амнионит.
• Пороки развития плода.
• Разрыв плодных оболочек.
Говоря об оценке поведенческих реакций плода, необходимо отметить, что новорожденный в нормальном физиологическом состоянии спит около 90% времени. Описаны две стадии сна у новорожденных: тихий сон и REM («rapid eye movements») сон. Тихий сон характеризуется тонической активностью мускулатуры, отсутствием двигательной активности, типичными ЭЭГ, сердечным ритмом и типом дыхания. REM-сон (стадия II) характеризуется движениями конечностей или генерализованными потягивающимися движениями, типичными ЭЭГ, ЧСС и дыхательными движениями.
Допплерометрия
В 1977 г. Фиджеральд и Друмм сообщают о применении в акушерстве допплерометрии (рис. 46, см. вклейку) - исследования кровотока в артериях пуповины и аорте плода. Регистрация кривых скоростей кровотока плода основана на эффекте Допплера, открытом в 1842 г. (разница частот акустических волн ультразвукового диапазона, излучаемых пьезоэлектрическим датчиком и отраженных от движущихся частиц). Простота применения и неинвазивность метода, возможность длительного применения как во время беременности, так и в родах быстро завоевывают симпатии практических акушеров.
По степени изменения параметров кровотока, измеряемых при помощи данного метода, можно на ранних стадиях предположить различные нарушения роста и развития плода. Для оценки кривых скоростей кровотока наиболее часто используются параметры, значения которых не зависят от угла наклона ультразвукового луча к исследуемому сосуду: индекс резистентности (ИР), пульсационный индекс (ПИ) и систолодиастолическое отношение (СДО).
В 1986 г. Мейлин и Куржак применяют в акушерской практике новый метод двухмерной цветной допплеркардиографии. Цветное допплеровское картирование позволяет быстро и точно осуществлять поиск даже самых мелких сосудов плода и производить качественную регистрацию кривых скоростей кровотока.
Кардиотокография
Это одновременная регистрация ЧСС, двигательной активности плода и тонуса матки. Кардиотокограф автоматически расчитывает ЧСС в 1 мин и регистрирует на графике в виде кривой.
Сердечный ритм может быть условно подразделен на три основных параметра: базальный ритм (БР), вариабельность сердечного ритма и периодические изменения.
БР - это средняя величина между мгновенными значениями ЧСС за 10 мин при отсутствии стрессорного воздействия на плод. Частота БР - результат параллельного воздействия на собственный автономный сердечный ритм симпатической и парасимпатической нервных систем.
Нормальный БР составляет 120-160 уд/мин. при головном предлежании плода и 110-180 - при тазовом. Патологический вариант БР - синусоидальный ритм (рис. 47), который наблюдается как антенатально, так и в родах, и обычно связан с тяжелой степенью анемии или гипоксии плода.
Тахикардия - определяется ЧСС более 160 (180) уд/мин. Причины возникновения тахикардии.
1. Легкая степень гипоксии плода.
2. Лихорадка матери.
3. Амнионит.
4. Гипертиреоидизм матери.
5. Анемия плода.
6. Лекарственные препараты (β-симпатомиметики, парасимпатолитики (атропин).
Брадикардия - определяется ЧСС менее 120 (110) уд/мин. Причины возникновения брадикардии.
1. Средняя и тяжелая степени гипоксии плода.
2. Блокада проводящей системы сердца при: а) врожденных пороках сердца; б) коллагенозах.
3. Лекарственные препараты (β-блокаторы).
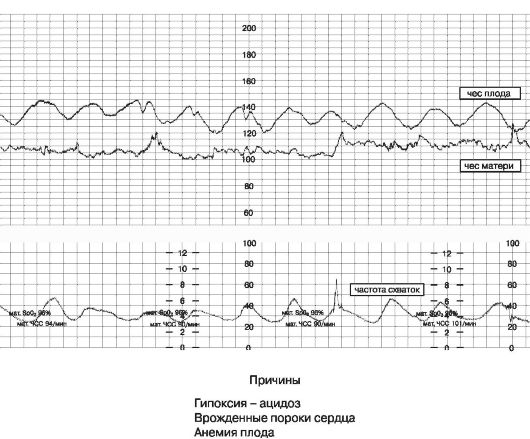
Рис. 47. Синусоидальный базальный ритм
Вариабельность сердечного ритма. Интервалы между двумя последующими сердечными сокращениями хорошо оксигенированного плода не бывает одинаковыми. Таким образом, при графической регистрации мгновенной ЧСС БР представляется нерегулярным (извилистая кривая). Эта нерегулярность сердечного ритма определяется термином «вариабельность».
Вариабельность сердечного ритма характеризуется амплитудой и частотой.
Амплитуда - величина отклонений от БР. Нормальная амплитуда составляет 6-25 уд/мин. За отсутствие вариабельности ритма принимается амплитуда менее 5 уд/мин («монотонный» ритм, рис. 48) и менее 2 уд/мин («немой» ритм).
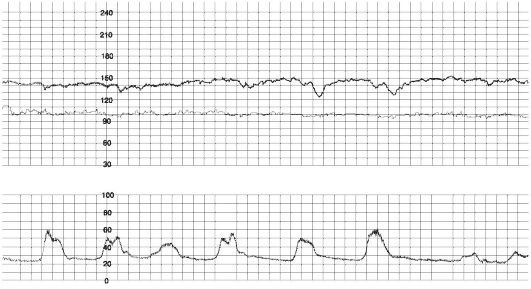 Рис. 48. Монотонный сердечный ритм
Рис. 48. Монотонный сердечный ритм
БР с амплитудой более 25 уд/мин называется «сальтаторным» и свидетельствует о сдавлении пуповины плодом или обвитии вокруг шеи и/или туловища.
Частота - это количество осцилляции в 1 мин. Норма = 7-12.
Вариабельность ритма обусловлена взаимодействием ЦНС, симпатической и парасимпатической нервных систем и собственной иннервации сердца. Изменение вариабельности может быть вызвано нарушением в одной или нескольких системах.
Причины снижения вариабельности БР.
1. Гипоксия - ацидоз.
2. Врожденные аномалии сердечно-сосудистой системы.
3. Недоношенность.
4. Тахикардия.
5. Цикл сна плода.
6. Действие медикаментов (депрессанты, наркотические анальгетики, барбитураты, транквилизаторы, седативные и антигистаминные препараты, парасимпатолитики, общие анестетики).
Периодические изменения ритма сердца обычно связаны с сокращениями матки и движением плода и включают децелерации разных типов (урежение ритма) и акцелерации (учащение ритма).
Акцелерации - это медленные ускорения сердечного ритма. В норме за 30 мин исследования должно быть не менее двух акцелераций амплитудой не менее 15 уд/мин и продолжительностью не менее 15 с.
Децелерации - это медленные замедления ритма. По степени тяжести различают: легкие - до 15 уд/мин; средней тяжести - 16-45 уд/мин; тяжелые децелерации - более 45 уд/мин. При развитии регулярной родовой деятельности возможно возникновение ранних (dip I), поздних (dip II) и вариабельных (dip III) децелераций.
Термин «децелерации» был введен Hon, а термин dips - CaldeyroBarcia.
Ранние децелерации (рис. 49.) - рефлекторная реакция ЧСС плода на сдавление головки во время схватки, обусловленная центральной ваготонией при повышении внутричерепного давления. По форме отражают кривую сокращения матки с той же длительностью и амплитудой. В норме могут возникать при открытии акушерского зева на 4-7 см.
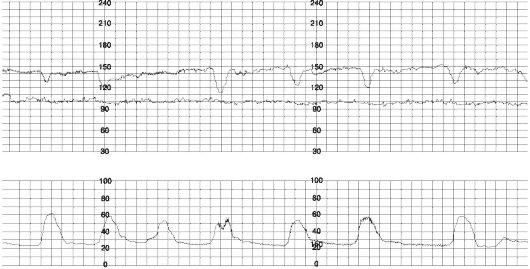 Рис. 49. Ранние децелерации
Рис. 49. Ранние децелерации
Поздние децелерации (рис 50) отражают нарушение кровообращения в межворсинчатом пространстве при сокращении матки. Урежение ритма начинается через 30-60 с после начала схватки и продолжается обычно более 30 с. Максимальный пик урежения ритма (перигей) - через 30-60 с после пика схватки или после ее окончания.
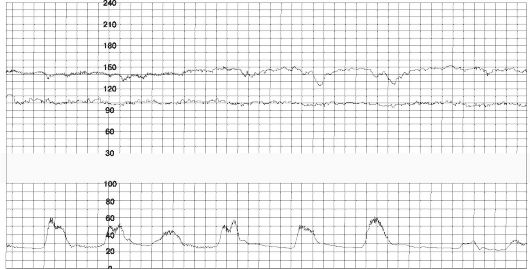 Рис. 50. Поздние децелерации
Рис. 50. Поздние децелерации
Причины возникновения поздних децелерации, вероятно, заключаются в следующем. Известно, что фетоплацентарная недостаточность (ФПН) характеризуется постепенным уменьшением передачи кислорода и питательных веществ к плоду. Было предположено, что пассаж питательных веществ является первой функцией, которая нарушается при ФПН (развитие ЗВУР), за чем следует снижение респираторной функции плаценты (развитие гипоксии плода). Персистирующая гипоксия ведет к развитию анаэробного метаболизма и ацидоза плода. В тех случаях, когда сокращения матки вызывают повышение внутриматочного давления более чем на 30 мм рт.ст., оксигенированная кровь прекращает поступать из открытых межворсинчатых пространств. В связи с этим РО2 в крови плода падает, но при наличии у него нормального кислородного запаса - не ниже критического уровня 17-18 мм рт.ст. Следовательно, у таких плодов не будут возникать периодические поздние децелерации. Если же у плода сниженный кислородный резерв, то сокращения вызывают падение РО2 и поздние децелерации. Поздние децелерации могут обусловливаться двумя механизмами. Автономный рефлекторный механизм наблюдается у плодов с ранней гипоксией. Второй механизм включает прямую миокардиальную депрессию, обычно следующую за первым механизмом, когда гипоксия плода достаточно выражена и становится причиной метаболического ацидоза.
Вариабельные децелерации (рис. 51) возникают вне зависимости от сокращений миометрия и связаны с патологией пуповины (в 50% - с обвитием пуповины вокруг шеи и/или туловища). При отсутствии других нарушений ритма вариабельные децелерации не свидетельствуют о страдании плода.
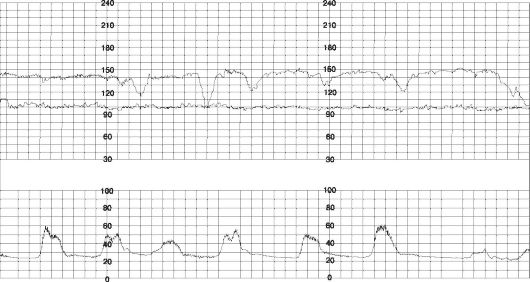 Рис. 51. Вариабельные децелерации
Рис. 51. Вариабельные децелерации
В настоящее время в антенатальной диагностике с использованием метода КТГ применяются следующие тесты.
1. Нестрессовый тест (НСТ).
2. Контрактильный тест:
а) окситоциновый тест (ОТ);
б) маммарный тест (МТ).
Когда появился метод КТГ, было отмечено: появление глубоких децелераций до развития родовой деятельности или в I периоде родов грозит неблагоприятным исходом для плода. В связи с этим возникло желание путем индуцирования тонуса матки (на 30 мм рт.ст.) в антенатальном периоде исследовать состояние маточно-плацентарного кровотока и резервные возможности плода в отношении кислородного голодания. Использовали ОТ: внутривенно капельно вводили окситоцин в дозе 0,5 мЕД/мин с удвоением скорости введения через 15-20 мин до появления схваток продолжительностью 40-50 с через 5-6 мин. Другой
способ индукции сокращений - МТ, механическое давление сосков беременной в течение 10 мин до появления тонуса миометрия.
Положительный ОТ означает появление «персистирующих поздних децелераций» и до настоящего времени считается достоверным тестом для определения ФПН - состояния, сопровождающего 2/3 случаев перинатальной смертности.
В большинстве случаев беременностей высокого риска возможно применение ОТ с 32-й нед гестации. При тяжелом СЗРП, прогрессирующей гипертензии и при маловодии требуется более раннее начало тестирования. Однако контрактильный тест в ряде случаев небезопасен и противопоказан беременным с данными о перенесенном кесареве сечении в анамнезе, признаками угрожающих преждевременных родов, при предлежании и отслойке плаценты, многоводии.
При МТ (Huddleston, 1984) адекватная маточная активность достигается в 80-100% случаев.
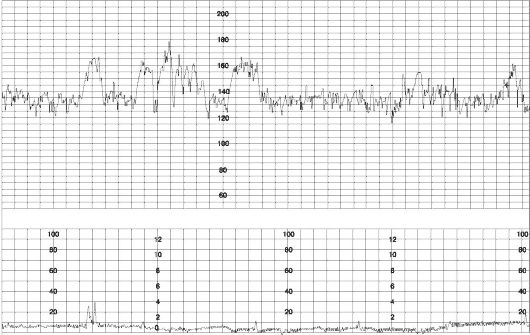 Рис. 52. Реактивный НСТ
Рис. 52. Реактивный НСТ
Нестрессовый тест
В конце 1960-х годов была установлена взаимосвязь между наличием акцелераций сердечного ритма в антенатальном периоде и благоприятным перинатальным исходом при применении длительного кардиомониторинга - НСТ. При наличии акцелераций НСТ считается реактивным и указывает на удовлетворительное состояние плода (рис. 52). Отсутствие акцелераций (нереактивный НСТ) указывает на страдание плода, если только плод не находится в состоянии сна или под действием медикаментов. В настоящее время НСТ используется в качестве рутинного пренатального скрининга беременных высокого риска, а также как важный компонент биофизического профиля плода.
БИОФИЗИЧЕСКИЙ ПРОФИЛЬ ПЛОДА
Manning и соавт. (1980) объединили данные, полученные при проведении УЗИ и НСТ, и создали так называемую балльную систему биофизического профиля (БФП) плода. Manning оценивает нормальные параметры БФП в 2 балла, а патологические - в 0 баллов. Некоторые исследователи дополнили понятие БФП и предложили несколько модификаций системы его оценки. Так, у Vintzileos (1985) система 3-бал- льная, 1 балл означает пограничное состояние; автор ввел в БФП шестой компонент - степень зрелости плаценты: 2 балла соответствуют 0, I, II степени зрелости, 1 балл - неясной степени зрелости при расположении плаценты на задней стенке; 0 баллов - III степени зрелости, связанной с более высокой частотой патологического сердечного ритма и отслойки плаценты в родах. По данным ряда авторов, при изъятии НСТ из схемы определения БФП прогностическая ценность 8-балльной шкалы соответствует таковой 10-балльной шкалы.
БФП - отражает степень риска для плода, выявляемую на основе комплексной оценки маркеров как острого, так и длительно текущего страдания плода. Гипоксемическая стимуляция рецепторов дуги аорты вызывает глубокое перераспределение сердечного выброса. Кровоток к мозгу, сердцу, надпочечникам и плаценте увеличивается, а к другим органам - уменьшается. Во второй половине беременности почки и легкие плода становятся основным источником продукции околоплодных вод, и снижение кровотока в этих органах неминуемо приводит к уменьшению такой продукции и развитию маловодия.
ИНВАЗИВНЫЕ ДИАГНОСТИЧЕСКИЕ ПРОЦЕДУРЫ
Амниоцентез - пункция амниотической полости для аспирации амниотической жидкости.
Первая инвазивная манипуляция с целью получения плодного материала произведена в 1956 г. в Великобритании - трансабдоминальный амниоцентез, т.е. пункция амниотической полости через переднюю брюшную стенку (ранее амниоцентез выполнялся трансвагинальным путем для прерывания беременности). Процедура производится трансабдоминальным или трансвагинальным способом (пункция переднего свода влагалища). Применяется с 11-12 нед беременности и вплоть до родов с целью цитогенетической диагностики хромосомной патологии плода; диагностики эритробластоза, наследственных заболеваний обмена; при необходимости проведения иммуноферментного анализа амниотической жидкости на АФП при подозрении на наличие свищевых дефектов нервной трубки; с целью оценки зрелости легочной ткани на основании анализа соотношения лецитин - сфингомиелин, определения уровня фосфатидилглицерола и других биохимических компонентов околоплодных вод, а также для диагностики степени выраженности гипоксии плода на основании уровня кислотности.
Биопсия хориона проводится в I триместре беременности. Существуют две методики проведения биопсии: трансабдоминальная и трансцервикальная.
Кордоцентез
В 1983 г. Даффос производит первый кордоцентез (пункцию вены пуповины) под визуальным контролем УЗИ. Наиболее часто кордоцентез применяется с 18-й нед беременности, однако при наличии УЗ-сканеров с высокой разрешающей способностью кордоцентез можно выполнять с 12-й нед беременности.
Риск осложнений (прерывание беременности, инфицирование, кровотечение и смерть плода) при проведении инвазивных процедур составляет 0,5-2,5%.
методы визуального контроля
Амниоскопия - трансцервикальный осмотр плодного пузыря, применяется для визуальной качественной оценки околоплодных вод при доношенной беременности и (при необходимости) в более ранние сроки.
В цервикальный канал вводится амниоскоп с мандреном, мандрен удаляется, после чего подключается осветительная система и подводится оптический окуляр. При неосложненном течении беременности в предлежащей части плодного пузыря определяется достаточное количество светлых прозрачных опалесцирующих околоплодных вод с наличием белой сыровидной смазки.
Обнаружение хлопьев мекония, зеленоватая окраска вод и оболочек могут указывать на гипоксическое состояние плода; примесь коричневого мекония - на наличие резус-конфликтной беременности, гемолитической болезни плода, а также на открытые дефекты желудочно-кишечного тракта.
Основным осложнением амниоскопии является разрыв плодного пузыря, излитие околоплодных вод. В настоящее время амниоскопия применяется как вспомогательный метод для уточнения диагноза.
Фетоскопия - метод, позволяющий осуществить непосредственный визуальный осмотр плода. Фетоскопию производят специальным эндоскопическим прибором в сроки от 16 до 22 нед беременности. По сущности технического выполнения исследования фетоскопия идентична лапароскопии и гистероскопии.
Есть два способа введения фетоскопа - трансабдоминальный и трансвагинальный. Перед фетоскопией обязательно с помощью прицельного УЗИ определяют положение плода в матке, расположение и состояние плаценты и состояние миометрия. Фетоскопия противопоказана при: расположении плаценты по передней стенке матки, предлежании плаценты, наличии множественной миомы матки с преимущественным расположением миоматозных узлов по передней стенке, выраженном варикозе миометрия передней стенки матки.
Риск прерывания беременности при проведении фетоскопии составляет 3-8%. Существенный недостаток метода - опасность развития у женщины осложнения в виде внутрибрюшного кровотечения и эмболии околоплодными водами. В связи с этим фетоскопия применяется в настоящее время в редких случаях, в основном для диагностики кож-
ных заболеваний плода, при отсутствии лабораторных методов диагностики, а также при узкоспецифических наследственных заболеваниях, требующих визуальной диагностики.
Оценка концентрации плацентарных гормонов и факторов материнской сыворотки крови
В течение десятилетий врачи пытались определить состояние плода посредством мониторинга уровней содержания различных гормонов плаценты или фетоплацентарного комплекса.
Хорионический гонадотропин человека
Предполагается, что ХГ человека секретируется синцитиотрофобластом. Скорость секреции ХГ быстро увеличивается в первые несколько недель беременности, при этом максимальные его уровни (около 100 ЕД/мл) в крови и моче матери достигаются к 10-й неделе гестации. После чего содержание ХГ как в плазме, так и в моче матери постепенно уменьшается, достигая минимума приблизительно к 120-му дню гестации. Затем концентрация ХГ в плазме сохраняется на уровне около 20 ЕД/мл.
Подъемы уровня ХГ обнаруживаются у женщин с многоплодной беременностью и пузырным заносом или хориокарциномой. Позднее в течение беременности увеличение количества ХГ также может наблюдаться у женщин с Rh-изоиммунизацией, при пороках развития плода и сахарном диабете. В последних двух случаях отмечается повторное появление цитотрофобласта в плаценте на более поздних сроках беременности.
Физиологическая роль ХГ при беременности не определена полностью. Вероятно, ХГ дает лютеотропный эффект, т.е. поддерживает функцию желтого тела. Возможно также, что ХГ индуцирует секрецию тестостерона яичками плода до начала секреции ЛГ гипофизом плода. Некоторые исследователи отметили роль ХГ в иммунологической защите трофобласта.
Плацентарный лактоген
ПЛ также секретируется синцитиотрофобластом; секреция ПЛ может начаться в день или за день до нидации. Однако динамика секреции ПЛ отличается от таковой ХГ. Концентрация в материнской крови нарастает медленно и, по-видимому, параллельно плацентарной массе.
Максимальные уровни достигаются после 32 нед гестации и затем остаются относительно постоянными. Скорость секреции ПЛ у беременных превышает таковую всех других белковых гормонов у женщин и у мужчин и составляет 1 г и более в поздние сроки нормально протекающей беременности. Гормон имеет как лактогенные, так и соматотропные свойства. Однако его потенциальная способность содействовать росту составляет около 1/100 способности гипофизарного гормона роста.
Небольшое количество ПЛ попадает в циркуляцию крови плода. ПЛ является антагонистом инсулина и может быть отчасти ответственным за развитие сахарного диабета у беременных, которые не знали о наличии этого заболевания до беременности или которым не требовалась инсулинотерапия после того, как беременность была прервана (гестационный диабет). Однако прямого доказательства такому предположению не найдено. Были описаны явно нормально протекающие беременности, при которых не обнаруживался ПЛ ни в материнской крови, ни в плаценте.
Поскольку ПЛ секретируется трофобластом и поскольку скорость секреции ПЛ в основном пропорциональна увеличению массы плаценты, измерение уровней ПЛ проводилось с целью определения функции плаценты и (косвенно) состояния плода.
При беременностях высокого риска, особенно осложненных гипертензией, имеется значительная корреляция между уровнями ПЛ и исходом для новорожденного. Эта корреляция не выше, чем между исходом и уровнями эстриола (Е3).
Эстриол
Определение эстриола в плазме и моче матери использовалось и до сих пор используется в некоторых институтах в качестве мониторинга состояния плода, поскольку Е3 формируется в плаценте первично из С19-стероидов. При гипоксии у плода, по-видимому, происходит снижение секреции гипофизарного АКТГ, скорости секреции дигидроэпиандростерона сульфата (ДГЭА-С) надпочечниками и, как следствие, скорости секреции Е3. Если имеет место беременность высокого риска, то при уменьшении содержания Е3 или при небольшом его количестве прогнозируют ожидаемое поражение плода. После смерти плода отмечается значительное падение уровней Е3 в плазме и моче матери. Однако при некоторых беременностях с несомненным риском для плода содержание эстрадиола может не снижаться (например: беременности с
поражением плода при резус-иммунизации; беременности, осложненные сахарным диабетом). В подобных случаях количество Е3 в плазме и моче матери порой бывает выше, чем при нормальной беременности в те же сроки.
Вернемся к основному вопросу: является ли измерение уровня Е3 в плазме и моче матери показателем состояния плода, способным повлиять на выбор идеального времени родоразрешения? Обычно выбирать приходится между недоношенностью и ухудшением состояния плода. К сожалению, рядом авторов отмечено: измерение содержания Е3 в плазме и моче матери не дает значимой информации сверх получаемой при клиническом обследовании беременной. Клиническая оценка осуществляется путем определения скорости роста плода по клиническим и сонографическим критериям, путем систематического измерения артериального давления и оценки функции почек у беременной. Плод подвергается риску при прогрессировании гипертензии, у беременных с диабетом, у которых не контролируется метаболизм карбогидратов, а также в случае отсутствия соответствующего увеличения бипариетального размера головки. У одной и той же пациентки и у разных беременных уровни содержания Е3 широко варьируют, поэтому выбор срока родов на основании их определения без учета других факторов может принести больше вреда, чем пользы. Многие исследователи не разделяют такую точку зрения. Их возражения сводятся к тому, что определение уровней Е3 может иметь ценность, если рассматривать их в контексте полной информации, имеющейся в распоряжении врача о беременности, при которой существует риск для плода. Однако в одном проспективном контролируемом исследовании данные о Е3 не сыграли роли в снижении перинатальной смертности и заболеваемости.
Альфа-фетопротеин - специфичный для плода гликопротеид, размерами 70 000 дальтон, продуцируется в ранние сроки гестации. Функциональная роль неизвестна. Синтезируется в желточном мешке, желудочно-кишечном тракте и печени плода. Максимальная концентрация наблюдается как в плазме плода, так и в амниотической жидкости в 12-14 нед гестации. Соотношение концентрации АФП в сыворотке крови плода и в амниотической жидкости составляет 150/1-200/1.
Исследование уровня АФП в сыворотке матери первоначально использовалось для определения дефектов невральной трубки. В настоящее время скрининг АФП успешно применяется в диагностике другой разнообразной генетической патологии и акушерских осложнений. Так,
взаимосвязь между хромосомными патологиями плода и низким уровнем АФП установлена окончательно. Последний изменяется также при угрозе преждевременных родов и прогнозирует СДР плода.
Эмбриология и эпидемиология дефектов невральной трубки
Невральная трубка, являющаяся предшественником ЦНС, закрывается между 22-м и 28-м днем после зачатия. Недостаточное закрытие цефалической порции трубки часто ведет к анэнцефалии - врожденному отсутствию свода черепа и передней части черепной коробки. Эта аномалия неизбежно приводит к смерти живорожденных анэнцефалов в течение 1-2 дней. Недостаточное закрытие каудальной части невральной трубки вызывает SPINAE BIFIDA; уровень дефекта определяется стадией развития плода, на которой произошло недостаточное закрытие каудального конца невральной трубки. Дети со SPINAE BIFIDA имеют обычно моторный паралич и недостаточную чувствительность ниже уровня дефекта, дисфункцию мочевого пузыря и хронические заболевания почек, а 75% таких детей - гидроцефалию. Частота встречаемости дефекта составляет 1-2 на 1 тыс. живорожденных. Каждый год рождаются примерно 6 тыс. детей с дефектами невральной трубки. Последние чаще всего наблюдаются у детей-первенцев, чаще у девочек, чем у мальчиков. Половая пропорция для анэнцефалов - 0,45, а для новорожденных со SPINAE BIFIDA - 0,67.
Частота дефектов невральной трубки наиболее высока у кавказских народов. 90-95% детей с такими дефектами рождаются от родителей, не имеющих потомства с данным пороком или какого-либо фактора риска. В подобных семьях риск рождения второго пораженного ребенка - 1,5-3%. Значительное количество дефектов невральной трубки сочетается с хромосомной патологией, поражением одного гена и синдромом амниотических перетяжек. Некоторые факторы окружающей среды могут увеличивать риск развития дефектов невральной трубки. При инсулинзависимом диабете имеет место 2% риск развития дефектов невральной трубки и анэнцефалии; назначение противосудорожных препаратов сочетается с 1-2% частотой дефектов невральной трубки. Дефицит фолиевой кислоты, возможно, также способствует формированию дефекта. Однако вероятно, что особо важную роль в его развитии играют генетическая предрасположенность и дефицит витаминов.
АФП проникает в амниотические воды с мочой плода и секретом желудочно-кишечного тракта, а также путем транссудации из плодовых
сосудов в плацентарные. Как АФП попадает в материнскую сыворотку, точно не известно, но вполне возможно - посредством диффузии из плодовых сосудов в плаценту и затем в материнскую циркуляцию.
Комплексная оценка основных гормонов и факторов материнской сыворотки позволяет предположить с высокой степенью достоверности некоторые пороки развития плода.
В течение десятилетий врачи пытались определить состояние плода посредством мониторинга уровней различных гормонов фетоплацентарного комплекса. Однако теперь показано: по абсолютным концентрациям гормонов часто нельзя судить об истинном состоянии плода; для точной диагностики и прогноза необходимы серийные исследования. Некоторыми авторами отмечено: измерения содержания гормонов матери не дают более значимой информации, чем получаемая при клиническом обследовании беременной. Поэтому в настоящее время методики определения количества основных гормонов беременности вытесняются более дешевыми и высокопрогностичными неинвазивными диагностическими методами.
интранатальная оценка состояния плода
Основными методами интранатальной диагностики являются КТГс интерпретацией децелераций и характера БР, а также оценка кислотнощелочного состояния крови плода. Комплексная оценка состояния плода в родах во многом определяет время и метод родоразрешения.
Тактика ведения родов при ацидозе
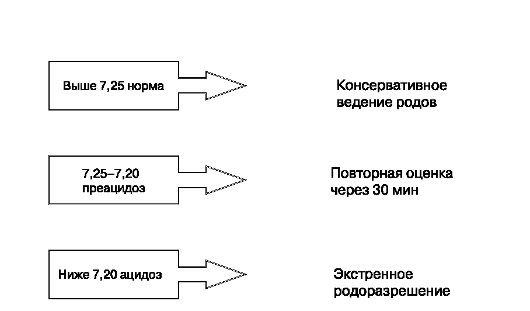 В
заключение следует сказать, что пренатальная диагностика имеет большой
арсенал методов, позволяющих с высокой точностью оценить состояние
плода, исключить большинство наследственных заболеваний и прогнозировать
постнатальный исход. На современном этапе развития акушерства
использование инструментальных методов оценки состояния плода,
применяемых в большинстве клиник рутинно, является неотъемлемой частью
повседневной практической работы акушера-гинеколога.
В
заключение следует сказать, что пренатальная диагностика имеет большой
арсенал методов, позволяющих с высокой точностью оценить состояние
плода, исключить большинство наследственных заболеваний и прогнозировать
постнатальный исход. На современном этапе развития акушерства
использование инструментальных методов оценки состояния плода,
применяемых в большинстве клиник рутинно, является неотъемлемой частью
повседневной практической работы акушера-гинеколога.