Акушерство: учебник для вузов / Савельева Г.М., Шалина Р.И., Сичинава Л.Г., Панина О.Б., Курцер М.А. - М. 2009. - 656 c
|
|
|
|
ГЛАВА 32. ПАТОЛОГИЯ ПЛОДА И НОВОРОЖДЕННОГО
ГИПОКСИЯ ПЛОДА И АСФИКСИЯ НОВОРОЖДЕННОГО
Термин "гипоксия плода" предложен ВОЗ для обозначения кислородной недостаточности. В некоторых странах используют также термины "дистресс плода" и "асфиксия плода".
Под асфиксией в общеклинической практике подразумевают удушье, т.е. недостаток кислорода и накопление углекислого газа в организме (гиперкапния), нередко приводящие к остановке сердца. Термин "асфиксия" применительно к состоянию плода и новорожденного является условным, так как кислородная недостаточность в этих случаях не всегда сопровождается выраженными нарушениями сердечной деятельности и гиперкапнией.
В нашей стране при кислородной недостаточности во внутриутробном периоде используют термин "гипоксия плода". Для характеристики состояния новорожденных, родившихся с явлениями кислородной недостаточности, применяют термин "асфиксия".
В различные периоды беременности и родов кислородная недостаточность обусловливает неодинаковые последствия для эмбриона, плода и новорожденного. В период органогенеза выраженная гипоксия может сопровождаться нарушением развития эмбриона вплоть до его гибели. Кислородное голодание в период фетогенеза может приводить к задержке роста плода, поражению его ЦНС. Кислородная недостаточность в зависимости от ее степени приводит к асфиксии, нарушению адаптации новорожденного в постнатальном периоде, мертворождению и смерти новорожденных в раннем неонатальном периоде.
Гипоксия плода - недостаточное снабжение кислородом тканей и органов плода или неадекватная утилизация кислорода. Гипоксию плода различают по длительности, интенсивности и механизму развития.
В зависимости от длительности выделяют хроническую и острую гипоксию плода.
Хроническая гипоксия плода развивается при длительном недостаточном снабжении плода кислородом вследствие экстрагенитальных заболеваний матери, осложненного течения беременности (гестоз, длительная угроза прерывания, перенашивание, матери и плода, инфицирование плода) иммунная несовместимость крови. Гипоксия плода также может стать следствием курения, употребления алкоголя, наркомании.
Острая гипоксия плода, как правило, возникает в родах (аномалии родовой деятельности, обвитие пуповины, выпадение или прижатие петель пуповины, абсолютная короткость пуповины, истинный узел пуповины), реже наблюдается во время беременности при состояниях, угрожающих жизни матери (преждевременная отслойка нормально расположенной и предлежащей плаценты, разрыв матки). Нередко наблюдается сочетание острой и хронической гипоксии, что является крайне неблагоприятным прогностическим фактором для плода.
По интенсивности различают функциональную гипоксию (легкая форма), проявляющуюся гемодинамическими нарушениями; метаболическую гипоксию - более глубокую, но с обратимыми изменениями метаболизма; деструктивную (тяжелая форма), сопровождающуюся необратимыми изменениями на клеточном уровне.
В зависимости от механизма развития гипоксия может быть гипоксической, циркуляторной, гемической, тканевой.
Гипоксическая гипоксия плода является следствием нарушения доставки кислорода в маточно-плацентарный кровоток; при затрудненном прохождении кислорода через морфологически и функционально измененную плаценту, что наблюдается гораздо чаще; при пониженном рО2 в крови матери.
Циркуляторная гипоксия плода - снижение доставки кислорода к тканям при нормальном насыщении, напряжении и содержании кислорода в артериальной крови.
Гемический тип гипоксии может наблюдаться при анемии у плода (например, при гемолитической болезни плода).
Тканевая гипоксия заключается в неспособности клеток плода усваивать кислород вследствие дисфункции ферментных систем, катализирующих окислительные процессы в тканях, несмотря на нормальное содержание и насыщение крови кислородом. Развитие первичной тканевой гипоксии у плода иногда возможно при отравлении матери сильными ядами. Чаще тканевая гипоксия бывает вторичной при тяжелой и длительной кислородной недостаточности плода любого генеза.
В чистом виде тот или иной тип гипоксии у плода встречается редко, чаще в клинической практике наблюдается их сочетание.
Патогенез. Устойчивость плода к гипоксии определяется большим минутным объемом сердца, достигающим 198 мл/кг (у новорожденного 85 мл/кг, у взрослого человека 70 мл/кг); увеличением ЧСС до 150-160 в минуту; значительной кислородной емкостью крови плода (в среднем 23%); фетальным гемоглобином. Фетальный гемоглобин быстро присоединяет кислород и легко отдает его тканям (повышенное сродство к кислороду), что при большой скорости кровотока обеспечивает получение тканями плода достаточного количества кислорода в единицу времени. Фетальный гемоглобин составляет 70% всего гемоглобина в эритроцитах плода.
Защитным фактором от кислородной недостаточности являются особенности строения сердечно-сосудистой системы плода - три артериовенозных шунта: венозный, или аранциев, проток; межпредсердное овальное отверстие; артериальный, или боталлов, проток. В результате артериовенозных коммуникаций почти все органы плода получают смешанную кровь. Смешение потоков крови в желудочках сердца плода приводит к более медленному снижению рО2, чем у взрослого, в случае развития гипоксии. Плод в большей мере, чем новорожденный, использует анаэробный гликолиз, который обеспечивается значительными запасами гликогена, энергетических и пластических продуктов обмена в жизненно важных органах. Развивающийся при этом метаболический ацидоз повышает устойчивость плода к кислородному голоданию.
Под влиянием дефицита кислорода на начальных стадиях гипоксии усиливаются функции мозгового и коркового слоев надпочечников плода, выработка катехоламинов и других вазоактивных веществ, которые вызывают тахикардию и повышение тонуса периферических сосудов. Вследствие этого происходят централизация и перераспределение кровотока: увеличивается минутный объем сердца, усиливается кровообращение в головном мозге, надпочечниках, плаценте и снижается кровоток в легких, почках, кишечнике, селезенке, коже, что приводит к ишемии этих органов. При ишемии кишечника у плода возможны раскрытие анального сфинктера и выход мекония в околоплодные воды.
В дальнейшем длительная тяжелая гипоксия приводит к резкому угнетению большинства функциональных систем плода и в первую очередь надпочечников, что сопровождается снижением уровня кортизола и катехоламинов в крови. Происходят угнетение жизненно важных центров плода, уменьшение ЧСС, снижение АД.
Одновременно с изменениями макрогемодинамики происходят выраженные нарушения в системе микроциркуляции. Снижение тонуса артериол и прекапилляров вызывает расширение сосудов и увеличение объема сосудистого русла, что в сочетании с уменьшением минутного объема серд-ца приводит к замедлению кровотока вплоть до стаза. В условиях ацидоза и снижения скорости кровотока повышаются вязкость крови, агрегационная активность клеток крови и коагуляционный потенциал с развитием ДВС-синдрома, уменьшением газообмена в тканях плода. В последние годы в патогенезе перечисленных нарушений большая роль отводится универсальному регулятору сосудистого тонуса - оксиду азота, который вырабатывается клетками эндотелия (в том числе в амнионе, пуповине). Оксид азота, являясь вазодилататором, снижает агрегацию тромбоцитов и предотвращает их адгезию к сосудистой стенке.
Нарушение трофики сосудистой стенки приводит к повышению ее проницаемости и выходу жидкой части крови и форменных элементов из сосудистого русла. Результатом этих изменений становятся гиповолемия, гемоконцентрация, отек тканей, диапедезные, а иногда и массивные кровоизлияния в жизненно важные органы плода.
Под влиянием кислородной недостаточности происходят значительные изменения параметров метаболизма, результатом чего является усиление накопления в организме плода недоокисленных продуктов обмена, т.е. патологический метаболический или респираторно-метаболический ацидоз.
При длительной и тяжелой гипоксии плода параллельно происходит активация перекисного окисления липидов с высвобождением токсичных радикалов, которые наряду с недоокисленными продуктами обмена угнетают ферментативные реакции, снижают активность дыхательных ферментов, нарушают структурно-функциональные свойства клеточных мембран, повышая их проницаемость. Наиболее значительны изменения баланса ионов калия, которые выходят из клеточного пространства, обусловливая гиперкалиемию. Гиперкалиемия совместно с гипоксией и ацидозом играет важную роль в перевозбуждении парасимпатической нервной системы и развитии брадикардии у плода.
Вследствие выраженных изменений макро- и микрогемодинамики, метаболизма в тканях жизненно важных органов плода могут развиваться ишемия и некрозы, особенно в ЦНС и надпочечниках.
Клиническая картина. К клиническим проявлениям гипоксии внутриутробного плода относятся изменения его двигательной активности, ощущаемые беременной.
В начальной стадии внутриутробной гипоксии женщина отмечает учащение и усиление двигательной активности плода. При прогрессирующей или длительной гипоксии движения плода ослабляются вплоть до их прекращения. Уменьшение числа движений плода до 3 и менее в течение 1 ч указывает на внутриутробное страдание плода и служит показанием к срочному дополнительному обследованию.
Косвенным признаком хронической гипоксии плода может служить уменьшение высоты стояния дна матки, указывающее на задержку роста плода, и маловодие.
Диагностика гипоксии плода основывается на оценке его функционального состояния с использованием дополнительных методов (кардиотокография, эхография, допплерометрия кровотока в системе мать-плацента-плод, определение биофизического профиля плода, кислотно-основное состояние пуповинной крови плода, полученной путем кордоцентеза).
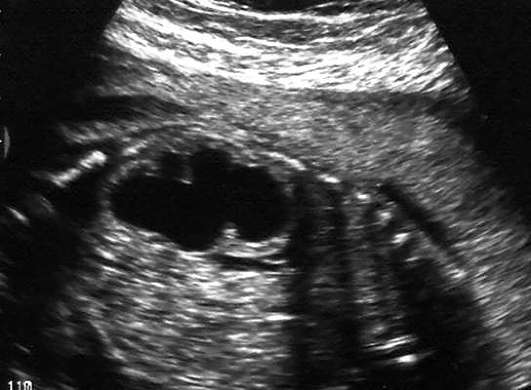
При кардиотокографии к начальным признакам гипоксии плода относятся тахикардия (до 180 в минуту) или умеренная брадикардия (до 100 в минуту), снижение вариабельности сердечного ритма, кратковременная (до 50% записи) монотонность ритма, ослабление реакции на функциональные пробы. Кардиотокограмма при этом оценивается в 5-7 баллами (рис. 32.1).
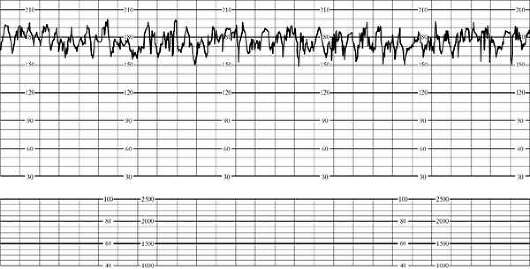
При выраженном страдании плода наблюдаются значительная брадикардия (ниже 100 в минуту) или тахикардия (более 180 в минуту), монотонность ритма (более 50% записи), парадоксальная реакция на функциональные пробы (поздние децелерации в ответ на шевеление плода при нестрессовом тесте) или ее отсутствие. О выраженной гипоксии плода свидетельствует оценка кардиотокограммы 4 балла и менее (рис. 32.2).
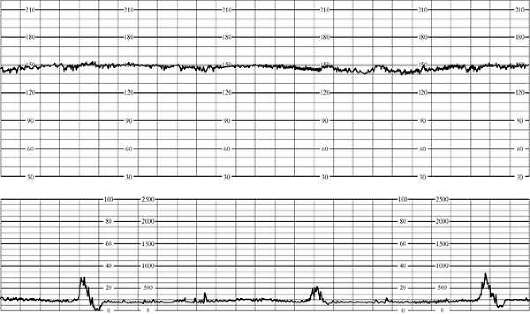
При патологическом нестрессовом тесте целесообразно исследование биофизического профиля. Наблюдается снижение дыхательной активности плода вплоть до прекращения его дыхательных движений, при прогрессирующей гипоксии движения и тонус плода отсутствуют.
Суммарная оценка биофизического профиля 6-7 баллов указывает на сомнительное состояние плода, в связи с чем требуется повторное обследование. Оценка 5 баллов и менее свидетельствует о выраженной гипоксии внутриутробного плода.
В диагностике гипоксии плода важное значение придают допплерометрической оценке кровотока в системе мать-плацента-плод. Допплерометрия позволяет раньше, чем кардиотокография, диагностировать хроническую внутриутробную гипоксию, что является основанием для тщательного наблюдения за состоянием плода и своевременного проведения лечебных мероприятий.
Снижение диастолической скорости кровотока в артерии пуповины (систоло-диастолическое отношение более 3,0) свидетельствует об увеличении сосудистого сопротивления плаценты, что четко коррелирует с гипоксемией, гиперкапнией и ацидемией плода.
Гемодинамические нарушения плодового кровотока (в аорте, в средней мозговой артерии, в почечных артериях плода) свидетельствуют о нарушении центральной гемодинамики в ответ на уменьшение плацентарной перфузии. Увеличение диастолической скорости кровотока в головном мозге плода (систоло-диастолическое отношение в средней мозговой артерии плода менее 2,8) при гипоксии указывает на сохранение церебрального кровотока плода за счет путем вазодилатации. Компенсаторный механизм поддержания нормального кровоснабжения головного мозга при сниженной плацентарной перфузии носит название "охранный круг кровообращения".
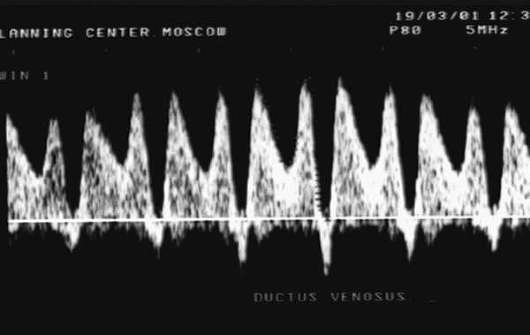
Крайне неблагоприятным прогностическим признаком для плода является так называемое критическое состояние кровотока, когда выявляют нулевой или отрицательный кровоток в артерии пуповины, регургитацию крови через трикуспидальный клапан, отсутствие диастолического кровотока в аорте плода, повышение диастолической скорости кровотока в средней мозговой артерии. По мере прогрессирования гипоксии возникают нарушения венозного кровотока у плода (венозный проток, печеночные вены) - снижение скорости кровотока в фазу поздней диастолы вплоть до нулевых или отрицательных значений (рис. 32.3).
Амниоскопия при головном предлежании нередко позволяет обнаружить окрашивание околоплодных вод меконием, что указывает на гипоксию плода.
Заслуживает внимания диагностика гипоксии плода по плодовой крови, полученной с помощью кордоцентеза (снижение pH, увеличение BE).
Диагностика гипоксии плода в родах основывается на оценке его сердечной деятельности, дыхательной и двигательной активности, КОС крови, взятию из предлежащей части и данных оценки околоплодных вод.
Помимо аускультации сердечных тонов плода, наиболее доступным и точным методом выявления гипоксии плода в родах является кардиотокография.
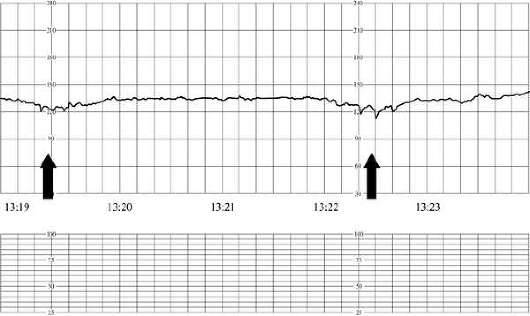
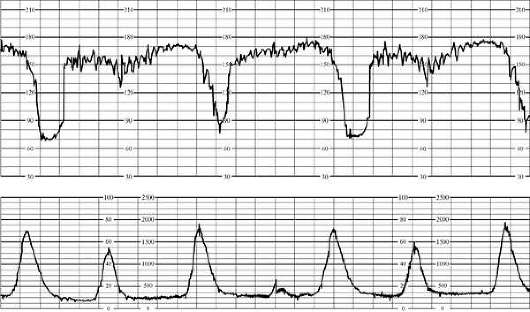
В первом периоде родов к начальным признакам гипоксии плода относятся периодическая монотонность сердечного ритма или брадикардия до 100 в минуту как при головном, так и при тазовом предлежании. Реакция на схватку проявляется кратковременными поздними децелерациями. Во втором периоде родов начальными признаками гипоксии служат брадикардия до 90 в минуту или тахикардия до 180 в минуту, периодическая монотонность ритма. В ответ на потугу возникают поздние децелерации до 60 в минуту (рис. 32.4), которые не восстанавливаются.
Признаком выраженной гипоксии плода в первом периоде ро-дов является брадикардия до 80 в минуту при головном предлежании, брадикардия ниже 80 в ми-нуту или тахикардия до 200 в ми-нуту при тазовом предлежании. Независимо от предлежания плода между схватками могут регистрироваться стойкая монотонность ритма и/или аритмия. В ответ на схватку нередко возникают длительные поздние W-образные децелерации при головном предлежании и комбинация акцелераций с децелерациями до 80 в минуту при тазовом предлежании.
В периоде изгнания к признакам выраженной гипоксии плода относятся появление на кардиотокограмме брадикардии до 80 в минуту или тахикардии более 190 в минуту; стойкая монотонность ритма и аритмия, длительные поздние децелерации в ответ на потугу до 50 в минуту как при головном, так и при тазовом предлежании. При головном предлежании W-образные децелерации до 50 в минуту могут наблюдаться вне схватки.
Дыхательной или двигательная активность плода (при УЗИ) в активную фазу родов является дополнительным признаком гипоксии плода. Выявление эпизодических дыхательных движений, появляющихся, как правило, в латентную фазу родов, не имеет прогностического значения и требует динамического наблюдения за состоянием плода. Регулярная выраженная дыхательная активность плода как в первом, так и во втором периоде родов представляет собой угрозу аспирации околоплодных вод, что в дальнейшем может привести к развитию аспирационного синдрома у новорожденного. Наиболее неблагоприятны дыхательные движения, сопровождающиеся выраженной амплитудой движения диафрагмы и преобладанием вдоха над выдохом - "удушье" (gasping).
Большое значение в выявлении гипоксии плода имеет исследование КОС крови, полученной из предлежащей части (проба Залинга). О гипоксии плода в первом периоде родов свидетельствует рН ниже 7,2, во втором периоде родов - ниже 7,14.
В последние годы во время родов применяют пульсовую оксиметрию. При гипоксии плода она позволяет выявить снижение сатурации кислорода в тканях.
О гипоксии плода в родах можно судить по окраске и густоте околоплодных вод при головном предлежании плода. Предложенная с этой целью оценочная шкала (табл. ) позволяет прогнозировать мекониальную аспирацию.
Окрашивание околоплодных вод меконием при головном предлежании всегда указывает на гипоксию плода. Наиболее неблагоприятное прогностическое значение имеют густые зеленые, желтовато-коричневые околоплодные воды, а также нарастание их густоты в процессе родов.
Лечение. Во время беременности терапия хронической гипоксии плода должна быть комплексной, направленной на лечение основного заболевания/осложнения у женщины и нормализацию плацентарного кровообращения. Назначают постельный режим, при котором улучшается кровоснабжение матки; токолитики (b-адреномиметики) - бриканил, гинипрал; препараты, улучшающие реологические свойства крови (трентал, курантил, актовегин), антикоагулянты (гепарин, фраксипарин).
При хронической гипоксии плода целесообразно применять мембраностабилизаторы (эссенциале-форте, липостабил) и антиоксиданты (витамин Е, аскорбиновая кислота, глутаминовая кислота).
При неэффективности комплексной терапии, сокращающихся симптомах выраженной хронической гипоксии плода, а также при острой гипоксии плода показано экстренное родоразрешение - кесарево сечение.
Профилактика гипоксии плода должна основываться на ранней диагностике осложнений беременности и родов и их лечении, выборе адекватных срока и метода родоразрешения.
Асфиксия новорожденных обусловлена кислородной недостаточностью. Асфиксия проявляется сразу после рождения отсутствием или неэффективностью дыхания, нарушением кровообращения и угнетением нервно-рефлекторной деятельности ЦНС.
Причиной асфиксии новорожденного может быть острая или хроническая гипоксия плода, развивающаяся как антенатально, так и во время родов. Асфиксия новорожденных может быть следствием аспирации молока во время кормления.
Тяжесть асфиксии новорожденного определяют по состоянию дыхательной, сердечно-сосудистой системы и ЦНС в соответствии со шкалой Апгар, применяемой через 1 и 5 мин после рождения (см. главу "Методы обследования в акушерстве и перинатологии).
Различают легкую, среднетяжелую и тяжелую асфиксию новорожденных. Оценка по шкале Апгар 6-7 баллов через 1 мин после рождения соответствует легкой асфиксии новорожденного, 4-5 баллов - асфиксии средней тяжести, 0-3 балла - тяжелой асфиксии.
Оценка по шкале Апгар через 5 мин после рождения отражает эффективность или неэффективность реанимационных мероприятий.
При сохранении низкой оценки через 5 мин, оценку состояния ребенка по шкале Апгар целесообразно проводить также на 10-й, 15-й и 20-й минутах жизни пока оценка не достигнет 7 баллов или первичная реанимация будет прекращена из-за ее неэффективности. При реанимационных меро-приятиях, включающих ИВЛ, оценка по шкале Апгар учитывает наличие или отсутствие попытки самостоятельного дыхания (0 или 1 балл соответственно).
Помимо оценки состояния новорожденного по шкале Апгар, у всех детей, родившихся в асфиксии, необходимо определить кислотно-основное состояние, которое в большой мере отражает тяжесть асфиксии.
При легкой асфиксии рН крови из вены пуповины составляет ‹ 7,2;
ВЕ $ - 10 мэкв/л. При тяжелой асфиксии изменение кислотно-основного состояния крови более выражено: рН ‹ 7,0 и ВЕ > -15 мэкв/л.
Лечение. Первичная реанимация ребенка, родившегося в асфиксии, проводится в родильном зале неонатологом-реаниматологом. Первую помощь ребенку, родившемуся в асфиксии, должен уметь оказать акушер.
Начало лечебных мероприятий зависит от признаков живорожденности, к которым относятся самостоятельное дыхание, сердцебиение, пульсация пуповины, произвольные движения мышц. При отсутствии всех этих признаков живорожденности плод считается мертворожденным и реанимации не подлежит. Если у ребенка отмечается хотя бы один из признаков живорожденности, ребенку необходимо оказать первичную медицинскую помощь.
Новорожденным, родившимся в асфиксии, оказывают помощь в соответствии с Приложением 1 к Приказу МЗ РФ № 372 "Первичная и реанимационная помощь новорожденному в родильном зале".
Объем и последовательность реанимационных мероприятий зависят от степени нарушения дыхания и сердечной деятельности новорожденного.
Оказание первичной помощи ребенку, родившемуся в асфиксии, начинают с восстановления свободной проходимости дыхательных путей. При аспирации околоплодных вод, особенно с примесью мекония, необходима интубация трахеи с последующей санацией трахеобронхиального дерева. Диаметр интубационной трубки определяется массой тела новорожденного: до 1000 г - 2,5 мм, от 1000 до 2500 г - 3 мм, более 2500 кг - 3,5 мм.
При отсутствии самостоятельного дыхания или его неадекватности (судорожное, нерегулярное, поверхностное) приступают к ИВЛ.
ИВЛ можно проводить саморасправляющимся мешком (мешок Амбу) через лицевую маску или интубационную трубку. Первые 2 вдоха при масочной ИВЛ выполняют с максимальным давлением в конце вдоха - 30 см вод.ст., а при последующих вдохах давление поддерживают в пределах 15 см вод.ст. при здоровых легких и 20 см вод.ст. при аспирации мекония или синдроме дыхательных расстройств.
При ЧСС ниже 80 в минуту и масочной ИВЛ проводят непрямой массаж сердца, положив ребенка на твердую поверхность. Непрямой массаж сердца можно выполнить с помощью II и III пальцев одной кисти или с помощью больших пальцев обеих кистей, обхватывая кистями грудную клетку новорожденного. Частота массажных движений должна составлять 2 в секунду. Если сердечная деятельность не восстанавливается или сохраняется брадикардия, необходимо внутривенное (внутрисердечное) введение 0,1% раствора адреналина в дозе 0,1 мг/кг.
Реанимацию в родильном зале прекращают, если отмечаются адекватное самостоятельное дыхание, нормальные ЧСС и цвет кожных покровов. Если через 20 мин после рождения при проведении адекватных реанимационных мероприятий сердечная деятельность не восстанавливается, констатируют смерть.
Реанимация в родильном зале является лишь первым этапом оказания помощи детям, родившимся в асфиксии. Дальнейшее наблюдение и лечение проводят в отделении (палате) интенсивной терапии, куда ребенка переводят сразу по окончании реанимационных мероприятий. При неадекватном самостоятельном дыхании, шоке, судорогах и центральном цианозе новорожденного доставляют в отделение (палату) интенсивной терапии с продолжающейся ИВЛ, начатой в родильном зале. В дальнейшем комплексное лечение проводится по общим принципам интенсивной терапии новорожденных в зависимости от варианта патологии.
Постгипоксические поражения ЦНС. Гипоксия плода и асфиксия новорожденного могут приводить к перинатальным поражениям ЦНС, в первую очередь к гипоксически-ишемическим и гипоксически-геморрагическим поражениям головного мозга.
При легких поражениях ЦНС у ребенка определяется негрубая и непостоянная неврологическая симптоматика (повышенная нервно-рефлекторная возбудимость).
При поражениях ЦНС средней тяжести преобладают симптомы общего угнетения; может развиться гипертензионный синдром. При общем угнетении мышечный тонус снижен или повышен, возможна его асимметрия в верхних и нижних конечностях; отмечается угнетение многих врожденных безусловных рефлексов; новорожденные вяло сосут, часто срыгивают. Локальная неврологическая симптоматика, как правило, отсутствует. При гипертензионном синдроме нарастает двигательное беспокойство с выбуханием родничков, мелкоамплитудным тремором, симптомом Грефе и "заходящего солнца", горизонтальным нистагмом; возможны кратковременные приступы клонических судорог.
Дети с тяжелым поражением ЦНС рождаются в состоянии гипоксемического шока с выраженными нарушениями гемодинамики; оценка по шкале Апгар при рождении не превышает 3 баллов. После первичной реанимации у ребенка сохраняются сердечно-сосудистые и дыхательные расстройства, резкое угнетение ЦНС. Дети находятся в коматозном состоянии, малоподвижны, слабо стонут, возможны частые судорожные припадки с преобладанием тонического компонента, очаговая сиптоматика. Тяжесть клинической картины обусловлена генерализованным отеком мозга и/или внутричерепными кровоизлияниями.
Наиболее частыми проявлениями постгипоксического перинатального поражения ЦНС, особенно у недоношенных, служат пери/интра- вентрикулярные кровоизлияния и перивентрикулярная лейкомаляция.
Пери/интравентрикулярные кровоизлияния. Кровоизлияния у новорожденных сначала развиваются в слое субэпендимального герминального матрикса (источник церебральных нейробластов), расположенного вентролатерально к боковому желудочку. Кровоизлияние в герминальный матрикс может наступать сразу после рождения, но чаще происходит в первые 4 дня жизни. На месте кровоизлияния в герминальном матриксе может образоваться киста. Кровоизлияние способно распространиться по всей желудочковой системе мозга.
Клиническое обследование новорожденных, особенно глубоко недоношенных, в первые часы и дни не всегда позволяет выявить четкую картину неврологического дефекта.
В диагностике перинатальных поражений ЦНС важную роль играет нейросонография.
По данным нейросонографии выделяют 4 степени пери/интравентрикулярных кровоизлияний:
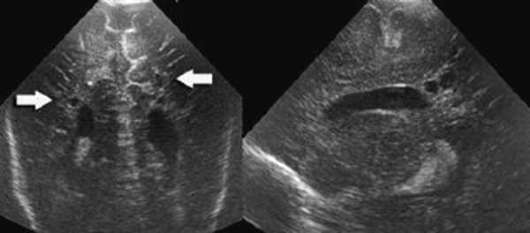
- I степень - изолированное субэпендимальное кровоизлияние (рис. 32.5);
-
II степень - внутрижелудочковые кровоизлияния без расширения желудочков мозга;
- III степень - внутрижелудочковые кровоизлияния с расширением желудочков мозга;
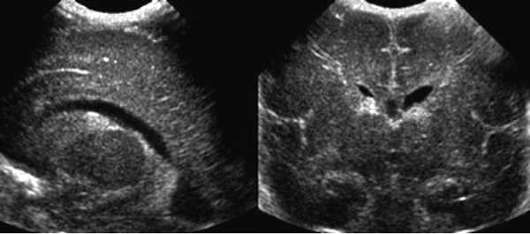
- IV степень - внутрижелудочковые кровоизлияния с вентрикуломегалией и паренхиматозным кровоизлиянием (рис. 32.6).
Под перивентрикулярной лейкомаляцией понимают билатеральный ишемический инфаркт белого вещества, прилежащего к боковым желудочкам головного мозга. Привентрикулярная лейкомаляция особенно часто возникает у недоношенных новорожденных.
Факторами риска развития перивентрикулярной лейкомаляции являются ацидоз, эпизоды гипотензии (среднее АД ниже 30 мм рт.ст.), гиповолемия, резкое снижение АД, эпизоды брадикардии.
В клинической картине в неонатальном периоде на первый план выступают общие симптомы угнетения ЦНС, которые проявляются мышечной гипотонией, преимущественно в нижних конечностей.
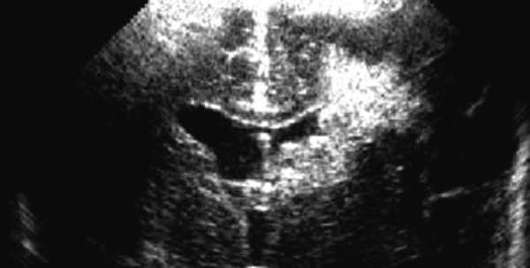
Диагноз устанавливают при нейросонографии (рис. 32.7). Пора-жение белого вещества может быть фокальным, с эволюцией в множественные кистозные полости через 1-2 нед. Размеры, число и локализация кист служат важным прогностическим критерием.
Отдаленные последствия перивентрикулярной лейкомаляции - спастическая диплегия, преимущественно нижних конечностей. В тяжелых случаях поражение нижних конечностей сочетается с поражением верхних конечностей и умственной отсталостью; могут отмечаться нарушения зрения.
ЗАДЕРЖКА РОСТА ПЛОДА, ГИПОТРОФИЯ НОВОРОЖДЕННОГО
Под задержкой роста плода (ЗРП) понимают несоответствие размеров плода предполагаемому сроку беременности.
ЗРП наряду с хронической гипоксией, является одним из основных клинических признаков хронической плацентарной недостаточности любого генеза (см. раздел "Плацентарная недостаточность", в главе 23). Помимо этого, патология плода (врожденные аномалии развития), влияя на формирование плаценты и на компенсаторно-приспособительные механизмы в системе мать-плацента-плод, может служить причиной хронической плацентарной недостаточности, и в следствие этого, - ЗРП.
Выделяют две основные формы ЗРП, которые по данным УЗИ характеризуются различными соотношениями показателей фетометрии: симметричная и асимметричная.
Симметричная форма ЗРП, как правило, развивается в ранние сроки беременности (первая половина) и может быть обусловлена врожденной патологией, в том числе наследственными заболеваниями и хромосомными аберрациями (трисомии по 18-й, 21-й, 13-й паре хромосом, моносомии), инфекционными заболеваниями (краснуха, токсоплазмоз, герпес, сифилис, цитомегаловирусная инфекция). Причинами симметричной формы ЗРП могут быть курение, алкоголизм, наркомания, а также недостаточное и неполноценное питание матери.
Асимметричная форма ЗРП развивается в более поздние сроки (III триместр) и, как правило, обусловлена либо экстрагенитальной патологией у матери (гипертоническая болезнь, бронхиальная астма, аутоиммунные заболевания), либо хронической плацентарной недостаточностью на фоне осложнений беременности (гестоз, многоплодная беременность, длительная угроза прерывания и т.д.).
Диагностика ЗРП возможна с помощью наружного акушерского обследования (измерение и пальпация) и УЗИ. Скрининговым методом диагностики ЗРП является определение высоты стояния дна матки, отставание которой от срока беременности на 2 см и более дает основание заподозрить нарушение роста плода. Более объективную информацию дает ультразвуковая фетометрия, которая позволяет установить диагноз, определить форму и степень ЗРП.
Симметричная задержка роста, при которой отмечается пропорциональное уменьшение всех фетометрических показателей (головка, живот, длина бедра), встречается у 10-30% беременных с ЗРП. Правильная диагностика данной формы ЗРП возможна при точном знании срока беременности или при динамической эхографии, когда выявляется отставание прироста фетометрических показателей.
Симметричное отставание фетометрических показателей не всегда позволяет с уверенностью установить диагноз ЗРП, так как маленькие размеры плода могут быть обусловлены конституциональными особенностями родителей, т.е. генетически детерминированы.
Асимметричная форма ЗРП проявляется отставанием размеров туловища (живота) при нормальных размерах головки и бедра и наблюдается у 70-90% беременных с ЗРП. Диагностика асимметричной формы ЗРП не представляет затруднений при ультразвуковой фетометрии.
На основании результатов фетометрии при УЗИ, помимо формы, можно определить степень ЗРП. При I степени показатели фетометрии отстают от нормы на 2 нед, при II степени - на 3-4 нед, при III - более чем на 4 нед. Тяжесть асимметричной формы ЗРП коррелирует с проявлениями хронической плацентарной недостаточности: преждевременным созреванием плаценты, уменьшением ее толщины, а также маловодием.
При ЗРП независимо от ее формы для определения компенсаторных возможностей плода необходима оценка его функционального состояния. ЗРП (обычно асимметричная форма) нередко сочетается с гипоксией, которая выявляется при кардиотокографии, допплерометрии плодово-плацентарного и плодового кровотока, изучении биофизического профиля плода.
При выраженной ЗРП (II-III степени) на кардиотокограммах могут наблюдаться снижение вариабельности сердечного ритма, ареактивный нестрессовый тест; при допплерометрии отмечаются нарушения кровотока в артерии пуповины, аорте, средней мозговой артерии, венозном протоке. Биофизический профиль плода включает в себя угнетение двигательной, дыхательной активности, мышечного тонуса (см. главу "Гипоксия плода").
Тактика ведения беременности и родов. Лечение ЗРП зависит от ее этиологии, срока беременности, формы и выраженности ЗРП и направлено на коррекцию нарушений в системе мать-плацента-плод (см. главу "Плацентарная недостаточность").
Для оценки темпов роста и функционального состояния плода на фоне терапии необходимы повторные УЗИ (через 7-14 дней) с допплерометрией кровотока в системе мать-плацента-плод (каждые 3-5 дней), кардиомониторное наблюдение (ежедневно).
Если под влиянием терапии рост плода нормализуется, его функциональное состояние находится в пределах нормы, то родоразрешение проводят не ранее 37 нед после подтверждения зрелости легких плода. При неэффективности лечения (отсутствие роста плода в течение 2 нед) или ухудшении состояния плода необходимо досрочное родоразрешение независимо от срока.
Гестации. Показанием к кесареву сечению является ЗРП III степени, срок родоразрешения определяется функциональным состоянием плода. При ЗРП II степени показания к абдоминальному родоразрешению определяются состоянием плода и сопутствующей акушерской патологией.
После рождения плода с ЗРП следует взвесить и внимательно осмотреть плаценту с целью выявления инфарктов, отложений фибрина, артериовенозных пороков, определения места прикрепления пуповины. Плаценту отправляют в лабораторию патоморфологии для установления причины ЗРП.
Гипотрофия новорожденных является следствием многочисленных нарушений во внутриутробном периоде. Новорожденный имеет клинические признаки пониженного питания: дефициты массы тела по отношению к его длине (при асимметричной форме), уменьшение толщины подкожного жирового слоя, морщинистую кожу, снижение тургора, сухость и бледность кожных покровов.
Степень гипотрофии новорожденных определяют по массо-ростовому показателю (отношение массы тела ребенка в граммах к длине тела в сантиметрах) соответственно гестационной норме. При гипотрофии новорожденного I степени и гестационном сроке более 37 нед массо-ростовой показатель составляет от 55 до 60, при II степени - от 50 до 55, при III степени - менее 50. Для нормотрофичного доношенного ребенка этот показатель составляет 60 и более. При определении степени гипотрофии у детей из двойни следует учитывать, что массо-ростовой показатель у них меньше, чем у новорожденных аналогичного гестационного возраста при одноплодной беременности.
У новорожденных с гипотрофией адаптация в раннем неонатальном периоде нередко нарушена. Возможны нарушения терморегуляции, гипо-гликемия, гипокальциемия (особенно в 1-е сутки жизни), гипербилирубинемия, замедленное восстановление массы тела и др.
В то же время у недоношенных детей с гипотрофией реже развивается респираторный дистресс-синдром, чем у нормотрофичных недоношенных. Это обусловлено более ранним образованием альвеолярного сурфактанта, которое стимулируется высоким уровнем эндогенных стероидов при хронической гипоксии плода.
Детей с симметричной гипотрофией необходимо обследовать для выявления внутриутробной инфекции (гепатоспленомегалия, высыпания на коже и слизистых оболочках, аномалии сердечно-сосудистой и нервной системы) или врожденных пороков развития.
Дети, родившиеся с гипотрофией, в дальнейшем нередко отстают в росте, у них отмечают задержку костного возраста, неврологические расстройства различной выраженности, нарушения полового созревания и др. Прогноз наиболее неблагоприятен у детей с симметричной гипотрофией, сопровождающейся врожденной инфекцией или аномалиями развития.
ВНУТРИУТРОБНЫЕ ИНФЕКЦИИ
Внутриутробное инфицирование плода не всегда сопровождается развитием инфекционного заболевания, что объясняется мобилизацией иммунитета и защитных механизмов в системе мать-плацента-плод.
Выделяют вирусные заболевания эмбриона и плода и заболевания, вызванные бактериальной флорой.
Для обозначения инфекций со сходными клиническими проявлениями используют аббревиатуру TORCH: Т - токсоплазмоз, О - другие (other) инфекции (сифилис, хламидиоз, энтеровирусные инфекции, гепатиты А и В, гонорея, листериоз), R - краснуха (rubella), С - цитомегаловирусная инфекция (cytomegalia), Н - герпесвирусная инфекция (herpes).
Значительное место среди многообразных возбудителей внутриутробной инфекции занимают грамотрицательные аэробные бактерии, неспорообразующие анаэробы, микоплазмы, стрептококки группы В, дрожжеподобные грибы.
Тяжесть и клинические проявления внутриутробной инфекции зависят от вида возбудителя, его вирулентности, массивности обсеменения иммунного статуса организма беременной, срока гестации, а также путей проникновения возбудителя в организм.
Внутриутробная инфекция, развившаяся в первые 3 мес гестации, может стать причиной инфекционных эмбриопатий, врожденных пороков развития плода, первичной плацентарной недостаточности, неразвивающейся беременности, самопроизвольного выкидыша. Более неблагоприятны в отношении эмбриопатий микроорганизмы с внутриклеточным циклом развития (вирусы), обладающие высоким тропизмом к эмбриональным тканям.
При внутриутробной инфекции, развившейся после 3-го мес гестации, возникают инфекционные фетопатии с задержкой роста плода, формированием вторичной плацентарной недостаточности, возникновением дизэмбриогенетических стигм, собственно инфекционным поражением плода. Инфекция, как правило, генерализованная, сопровождается нарушением маточно-плацентарного кровообращения, дистрофическими, некробиотическими реакциями, нарушением формообразовательных процессов с избыточным разрастанием соединительной ткани (глиоз мозга, эндокардиальный фиброэластоз). Воспалительные изменения у плода могут вызвать сужение или обтурацию существующих анатомических каналов и отверстий с последующим развитием аномалий (гидроцефалия, гидронефроз).
Во второй половине фетального периода (с 6-7-го мес) благодаря становлению клеточного и гуморального иммунитета плод приобретает способность специфически реагировать на внедрение возбудителей инфекции.
В качестве симптомов внутриутробной инфекции в раннем неонатальном периоде выявляют гипотрофию, гепатоспленомегалию, желтуху, сыпь, дыхательные расстройства, сердечно-сосудистую недостаточность и тяжелые неврологические нарушения.
Для диагностики внутриутробного инфицирования используют бактериологические и иммунологические методы. К ним относится обнаружение в посевах микроорганизмов более 5-102 КОЕ/мл. Более современным и специфичным является метод молекулярной гибридизации, суть которого заключается в идентификации фрагментов ДНК или РНК клеток возбудителя. Посевы и соскобы берут у беременных из влагалища и цервикального канала.
Для диагностики внутриутробного инфицирования высокочувствителен ELISA - метод определения моноклональных антител с помощью тест-системы в жидкостях и средах организма матери и плода (кровь плода, полученная с помощью кордоцентеза). Высокий титр антител в сочетании с выделенным антигеном (возбудителем) свидетельствует об инфицированности плода и элементов плодного яйца.
Эхографические признаки внутриутробной инфекции включают в себя многоводие, утолщение и несвоевременное созревание плаценты, гиперэхогенность кишечника, пиелоэктазию, газ в желчном пузыре плода, гепатомегалию с увеличением живота плода.
Общие принципы профилактики и лечения внутриутробной инфекции состоят в этиотропной противомикробной терапии; профилактике (лечении) фетоплацентарной недостаточности; коррекции и профилактике нарушений микробиоценозов организма беременной (бифидумбактерин, ацилакт или лактобактерин внутрь или вагинально в критические сроки беременности или в сочетании с курсами антибактериальной или противовирусной терапии).
Вирусные инфекции. Краснуха. Наибольшую опасность для эмбриона представляет вирус краснухи. Риск заражения краснухой существует при отсутствии в крови женщины антител к антигену вируса.
При заболевании краснухой в первые 2 мес беременности вероятность инфицирования эмбриона достигает 80%, а возникновения уродств - 25%. Поражение эмбриона вирусом может закончиться его гибелью (эмбриотоксический эффект) или возникновением врожденных пороков сердца, глухоты, катаракты, микроофтальмии, хориоретинита и микроцефалии. Инфицирование плода в более поздние сроки может сопровождаться появлением у новорожденного типичных кожных высыпаний.
Высокий риск возникновения эмбриопатий при заболевании краснухой или контакте с больным краснухой в первые 3 мес беременности требует ее прерывания.
По рекомендации ВОЗ женщинам детородного возраста вне беременности исследуют кровь на антитела к вирусу краснухи. Оптимальной мерой профилактики считается иммунизация вакциной краснухи девочек и женщин детородного возраста, не имеющих антител к вирусу краснухи.
Цитомегаловирус является наиболее распространенным вирусом, передающимся плоду во внутриутробном периоде.
При цитомегалии отмечается высокий риск прерывания беременности, самопроизвольного выкидыша, неразвивающейся беременности, преждевременных родов, антенатальной гибели плода, аномалий развития, многоводия. Ультразвуковыми маркерами инфицирования плода могут быть микроцефалия, кальцификаты в головном мозге, вентрикуломегалия, гиперэхогенность кишечника. В I и II триместрах беременности вероятность инфицирования эмбриона/плода наименьшая, к концу беременности она достигает 40%.
Выделение цитомегаловируса у беременной не означает острого заболевания. Часто формируется бессимптомное вирусоносительство или субклиническая хроническая инфекция. У серопозитивных беременных возможны обострение и реактивация процесса с развитием внутриутробной инфекции. Наивысший риск внутриутробного поражения плода связан с первичной цитомегаловирусной инфекцией, которая возникает у 1-4% беременных. При хронической или латентной инфекции у беременных показано сероиммунологическое обследование 1 раз в 1,5-2 мес.
Лечение во время беременности заключается в проведении курсов пассивной иммунизации противоцитомегаловирусным иммуноглобулином (во 2-й половине беременности). По показаниям назначают специфический противовирусный препарат (ацикловир), а также виферон, который оказывает иммуномодулирующее и антиоксидантное действие.
Вопрос о прерывании беременности решается индивидуально в зависимости от выявленной у плода патологии.
Ранними проявлениями у новорожденного являются желтуха, гепато-, спленомегалия, геморрагический синдром. У новорожденных с врожденной цитомегаловирусной инфекцией вирус обнаруживают в моче, слюне, спинномозговой жидкости. Летальность при врожденной цитомегаловирусной инфекции достигает 20-30%; у 90% выживших детей отмечаются поздние осложнения в виде потери слуха, задержки умственного и физического развития, хориоретинита, атрофии зрительного нерва, нарушение роста зубов и т.д.
Эффективной специфической противовирусной терапии у детей, как и у взрослых, не существует. Для снижения виремии рекомендуют специфический антицитомегаловирусный иммуноглобулин.
Вирус простого герпеса. Инфицирование плода происходит восходящим (из шейки матки) и трансплацентарным (гематогенным) путем. Инфекционные поражения плаценты и плода, формирование врожденных пороков развития, антенатальная гибель плода при герпетической инфекции возможны в любом сроке гестации. Интранатально при хроническом герпесе инфицируются 0,5-1% плодов; при остром генитальном герпесе и обострении хронического риск инфицирования плода в родах достигает 40%. Возможно и постнатальное поражение новорожденных при герпетических проявлениях у матери.
При первичном инфицировании женщины в ранние сроки беременности необходимо ставить вопрос о ее прерывании. При возникновении заболевания в более поздние сроки или при инфицировании до беременности проводят динамический ультразвуковой контроль развития и состояния плода. Курсовая терапия, включает в себя противовирусные препараты (во 2-й половине беременности) (ацикловир) и иммуномодуляторы. Проведение противовирусной терапии в I триместре беременности нежелательно.
Метод родоразрешения при герпетической инфекции зависит от наличия или отсутствия поражения половых органов к моменту родов. При герпетическом поражении половых органов в конце беременности рекомендуется родоразрешение путем кесарева сечения.
У новорожденных возможны локализованные герпетические поражения кожи или глаз (офтальмогерпес). Диссеминированный процесс может проявляться признаками сепсиса. Везикулярные элементы на слизистых оболочках и коже являются важным диагностическим критерием заболевания. Для диагностики исследуют содержимое везикул. При всех клинических формах неонатальной герпетической инфекции назначают ацикловир и иммуномодуляторы.
Вирусные гепатиты. Беременные с легкими формами гепатита А находятся под амбулаторным наблюдением акушера-гинеколога и инфекциониста.
Тератогенность вируса гепатита А не доказана. Риск передачи вируса плоду незначителен, но установлена возможность вертикальной передачи инфекции во время родов.
При контакте беременной с больным гепатитом А необходимо ввести ей g-глобулин с профилактической целью.
Передача вируса гепатита A новорожденному возможна, если мать находится в инкубационном периоде или в остром периоде заболевания во время родов, а также при переливании инфицированной крови.
Гепатит В передается через инфицированные препараты крови, слюну, выделения из влагалища. Маркером гепатита В является HbsAg, обнаруживаемый при исследовании материнской крови. При гепатите В отмечается повышенная частота самопроизвольных абортов, задержки роста плода и преждевременных родов. Риск инфицирования плода значительно выше, если женщина перенесла острый гепатит в III триместре беременности. Трансплацентарная передача гепатита В наблюдается редко, плод чаще заражается во время родов. Возможно также заражение новорожденного гепатитом В при грудном вскармливании.
При HBs-Ag-позитивной крови у матери всем новорожденным, так же, как и родившимся у здоровых матерей, проводится вакцинация в первые 12 ч после рождения. Если мать перенесла гепатит В во время беременности, новорожденному дополнительно вводят специфический иммуноглобулин.
Новорожденных, родившихся у матерей - носительниц вируса гепатита В, не изолируют. Новорожденные с подтвержденным гепатитом В должны быть изолированы.
Гепатит С (ни А, ни В). Носительство антител к вирусу гепатита С отмечается у 1,5-5,2% беременных. Пути передачи инфекции к плоду такие же, как при гепатите В, но чаще бывает вертикальная передача вируса. Методы профилактики не разработаны.
Профилактика заражения персонала вирусным гепатитом заключается в использовании двух пар перчаток при приеме родов и выполнении хирургических операций.
Грипп. Вирус гриппа может проникать через плаценту. При тяжелом гриппе у беременных возможны самопроизвольное прерывание беременности, аномалии развития, гибель плода, рождение недоношенных и функционально незрелых детей.
Во время вспышек гриппа беременных целесообразно иммунизировать поливалентной убитой вакциной.
Парвовирусная инфекция может проявляться кожной сыпью, болями в горле, артралгиями, транзиторной апластической анемией, субфебрилитетом. Риск прерывания беременности при отсутствии антител к парвовирусу наиболее высок до в сроки 20 нед. Заражение плода происходит в фазу вирусемии.
В ранние сроки беременности при парвовирусной инфекции возможны самопроизвольные аборты, в поздние сроки - внутриутробная гибель плода, а также развитие неиммунной водянки плода как проявления тяжелой формы гемолитической анемии. В большинстве наблюдений при серологически подтвержденной инфекции у матери повреждающего действия на плод не отмечается, что можно объяснить нейтрализацией вируса антителами.
Специфической терапии парвовирусной инфекции не существует, для профилактики тяжелых осложнений применяют иммуноглобулин.
Коксаки-вирусная инфекция в I триместре беременности может приводить к формированию пороков развития желудочно-кишечного тракта и мочеполовой системы, ЦНС. При инфицировании в поздние сроки беременности у новорожденного возможны лихорадка, рвота, гипотония, кожные высыпания, судороги.
ВИЧ-инфекция. У ВИЧ-инфицированных женщин часто происходят преждевременные роды и бывает задержка роста плода. Вирус может передаваться внутриутробно или при грудном вскармливании. Кесарево сечение не уменьшает риск инфицирования новорожденных.
У детей, инфицированных ВИЧ, отмечаются кожные проявления в виде бактериальной, грибковой и вирусной экзантем.
В настоящее время для лечения приобретенного иммунодефицита применяют зидовудин. У серопозитивных беременных этот препарат предотвращает передачу вируса плоду. Кормление ребенка грудью не рекомендуется.
Бактериальные инфекции. При бактериальном инфицировании плодного яйца в ранние сроки эмбрион обычно погибает и беременность заканчивается самопроизвольным выкидышем; тератогенный эффект отсутствует. При инфицировании в поздние сроки беременности повышен риск преждевременных родов.
Бактериальное инфицирование плода может происходить трансплацентарно при очагах фокальной инфекции в организме матери (тонзиллит, гайморит, кариес, пародонтоз, пиелонефрит и др.) и восходящим путем при преждевременном излитии околоплодных вод. Развитию восходящей инфекции способствуют кольпиты, цервициты, биопсия хориона, амниоцентез, кордоцентез, фетоскопия, частые влагалищные исследования во время родов.
Внутриутробная бактериальная инфекция может проявляться симптомами хориоамнионита (повышение температуры тела, озноб, тахикардия, гноевидные выделения из половых путей, лейкоцитоз и др.) и сопровождаться нарушениями состояния плода.
Стрептококковая инфекция. Эта инфекция передается, как правило, восходящим путем, происходит преимущественно интранатальное инфицирование плода. Тяжелые формы внутриутробной инфекции (пневмония, менингит, сепсис) наблюдаются редко. Лечение состоит в проведении антибиотикотерапии матери в соответствии с чувствительностью возбудителя.
Листериоз. Антенатальное заражение листериозом в ранние сроки беременности (трансплацентарно) приводит к гибели плода и самопроизвольному аборту. На более поздних сроках беременности инфекция проявляется сепсисом с возникновением специфических гранулем в органах и тканях плода.
У новорожденных врожденный листериоз проявляется аспирационной пневмонией, часто поражаются орган слуха, ЦНС и печень. Возможны высыпания на коже, слизистых оболочках глотки, зева, конъюнктиве. Возбудитель инфекции можно обнаружить в содержимом кожных папул, меконии, моче и спинномозговой жидкости.
Лечение беременной состоит в проведении курсов антибактериальной терапии (ампициллин). Антибиотикотерапия показана также новорожденным, у которых при рождении диагностирован врожденный листериоз.
Урогенитальные микоплазмозы (заболевания, вызываемые M. hominis и Ur. urealyticum). С этими инфекциями связаны невынашивание беременности, задержка роста плода, хориоамнионит, плацентит, многоводие.
Инфицирование новорожденных микоплазмами и уреаплазмами происходит редко (1-3%). Наиболее часто возникают пневмония, менингит, острая гидроцефалия, генерализованная инфекция.
В отношении микоплазменной инфекции эффективны гентамицин и линкомицин.
Урогенитальный хламидиоз. Неблагоприятное влияние хламидиоза на плод вызывает хроническую гипоксию и задержку его роста. У новорожденных хламидиоз проявляется конъюнктивитом и пневмонией, а также фарингитом, отитом, вульвовагинитом, уретритом. Возможно развитие генерализованной инфекции и специфического миокардита, описаны случаи хламидийного менингита и энцефалита.
Проводят этиотропную антибактериальную терапию, препаратом выбора является эритромицин. Эффективны также вильпрафен, доксициклин, клиндамицин.
Гонорея. Инфицирование плода происходит преимущественно восходящим путем. Беременность может осложниться спонтанным септическим абортом, преждевременными родами, преждевременным излитием вод, хориоамнионитом, задержкой роста плода.
Гонорея проявляется у новорожденных гнойным конъюнктивитом (гонобленнорея). В раннем неонатальном периоде возможны патологическая потеря массы тела, нарушение адаптационных реакций, затянувшаяся конъюгационная желтуха, генерализованная гонококковая инфекция.
Лечение гонореи состоит в назначении антибиотиков пенициллинового ряда.
Врожденный сифилис. Заражение плода происходит внутриутробно трансплацентарно, гематогенным путем, чаще во второй половине беременности.
Ультразвуковые признаки внутриутробного сифилиса плацентомегалия, асцит и неиммунная водянка плода, задержка роста плода.
У новорожденных возможны везикулезно-буллезные высыпания на ладонях и подошвах, желтуха, геморрагический синдром, лимфаденопатия, миокардит, нефроз. Однако, как правило, признаки врожденного сифилиса проявляются значительно позже - через 3-4 нед после рождения.
Лечение матери (до 16 нед беременности) предотвращает врожденный сифилис у ребенка. Терапия в более поздние сроки беременности устраняет инфекцию у матери, но у ребенка при рождении могут наблюдаться признаки врожденного сифилиса.
Лечение беременной, больной сифилисом, проводят в соответствии с общепринятыми принципами и методами с обязательным привлечением венеролога.
Протозойные инфекции. Врожденный токсоплазмоз. Заболевание у плода может развиться только при заражении матери во время беременности. Токсоплазмоз чаще возникает у женщин, тесно контактирующих с животными (овцы, кошки), а также при употреблении сырого или недостаточно термически обработанного мяса. Клинические проявления у беременных разнообразные: увеличение лимфатических узлов, печени и селезенки, миокардит, пневмония и др.
Токсоплазмоз может сопровождаться угрозой прерывания беременности, задержкой роста плода, эндометритом. Инфекция передается трансплацентарно. Прогноз для плода зависит от сроков инфицирования беременной. В ранние сроки беременности инфицирование эмбриона нередко заканчивается его гибелью. Возможны аномалии развития: анэнцефалия, анофтальмия, микроцефалия, расщепление верхней губы, челюсти и неба (волчья пасть) и др. При заражении в более поздние сроки беременности у новорожденного отмечают триаду симптомов: гидроцефалию, хориоретинит и менингоэнцефалит с внутримозговыми петрификатами. Если заражение произошло незадолго до родов, то у плода возникают симптомы висцерального генерализованного токсоплазмоза: гепатоспленомегалия, интерстициальная пневмония, миокардит и энцефалит.
При УЗИ внутриутробное поражение фетоплацентарного комплекса при токсоплазмозе проявляется плацентомегалией, неиммунной водянкой плода, гепатоспленомегалией, внутримозговыми петрификатами, гидроцефалией.
Лечение врожденного токсоплазмоза заключаются в назначении беременной сульфаниламидных (сульфадимезин) и антипротозойных препаратов (хлоридин). В ранние сроки беременности хлоридин противопоказан в связи с опасностью тератогенного воздей-ствия на плод.
ВРОЖДЕННЫЕ АНОМАЛИИ РАЗВИТИЯ ПЛОДА
Термином "врожденные аномалии" или "врожденные пороки" обозначают любую врожденную функциональную или структурную патологию, которая выявляется у плода и новорожденного. Пороки развития могут проявляться в более поздние периоды. В зависимости от этиологии различают наследственные (генетические), экзогенные и мультифакторные врожденные аномалии развития плода.
К наследственным относятся врожденные пороки развития, возникающие вследствие генных мутаций, которые выражаются в виде эмбрионального дизморфогенеза, или хромосомных и геномных мутаций (хромосомные болезни). Происходят стойкие изменения наследственных структур в половых клетках (мутации могут быть унаследованы от одного или обоих родителей) и реже - в зиготе. В зависимости от времени воздействия тератогенного фактора врожденные пороки развития бывают следствием гаметопатий, бластопатий, эмбриопатий и фетопатий.
Под мультифакторными подразумевают пороки развития, возникающие в результате комбинированного воздействия генетических и экзогенных факторов.
Генетически обусловленные формы (генные и хромосомные) составляют около 25-30%, экзогенные (тератогенные) - 2-5%, мультифакторные -
30-40%, формы неясной этиологии - 25-50% случаев врожденных аномалий развития.
Наследственные аномалии развития плода делят на хромосомные (наиболее часто встречающиеся), моногенные и полигенные.
В основе хромосомных болезней лежат хромосомные (изменения числа или структуры хромосом) или геномные (полиплоидии) мутации. Каждому заболеванию присущи типичные кариотип и фенотип.
Практически все хромосомные аномалии (кроме сбалансированных) ведут к врожденным порокам развития. Тяжелые формы (полиплоидии, полные трисомии по аутосомам), как правило, становятся причиной самопроизвольного прерывания беременности в I триместре.
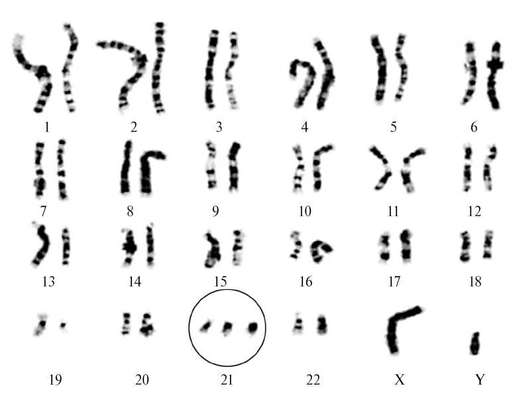
Синдром Дауна (трисомия 21) - наиболее изученная хромосомная патология, встречается с частотой 1:600 живорожденных. Цитогенетические варианты синдрома Дауна разнообразны. 94-95% случаев составляет простая полная трисомия 21 как следствие нерасхождения хромосом в мейозе (рис. 32.8). Около 2% детей с синдромом Дауна имеют мозаичные формы (47+21/46), 4% больных - транслокационную форму трисомии.
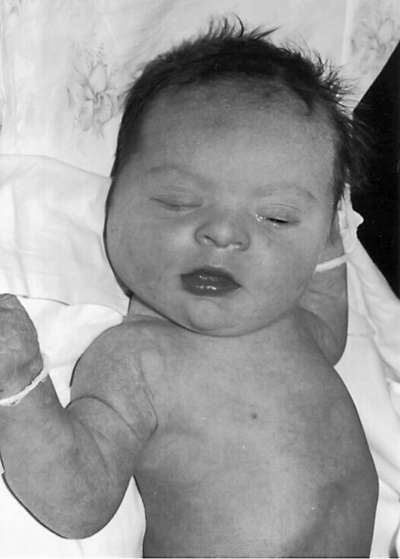
Дети с синдромом Дауна имеют специфический фенотип монголоидный разрез глаз, круглое уплощенное лицо, плоскую спинку носа, эпикант, крупный (обычно высунутый) язык, брахицефалию, деформированные и низко расположенные ушные раковины, избыток кожи на шее (рис. 32.9). Часто встречаются пороки сердца, желудочно-кишечного тракта, клинодактилия, четырехпальцевая (обезьянья) складка на ладони, две кожные складки вместо трех на мизинце. Отмечается задержка физического и умственного развития.
Частота синдрома Патау (трисомия 13) составляет 1:7000 живорожденных. У 80-85% больных встречается простая полная трисомия 13 как следствие нерасхождения хромосом в мейозе у одного из родителей (чаще у матери), остальные случаи обусловлены в основном передачей дополнительной хромосомы (ее длинного плеча) в робертсоновских транслокациях типа D/13, G/13.
Синдром Патау включает в себя нарушения формирования головного мозга, глазных яблок, костей мозговой и лицевой частей черепа. Типичные признаки синдрома Патау - расщелина губы или неба, микрофтальмия, полидактилия, врожденные пороки сердца (рис. 32.10). В связи с тяжелыми врожденными пороками развития большинство детей с синдромом Патау умирают в первые недели или месяцы жизни.
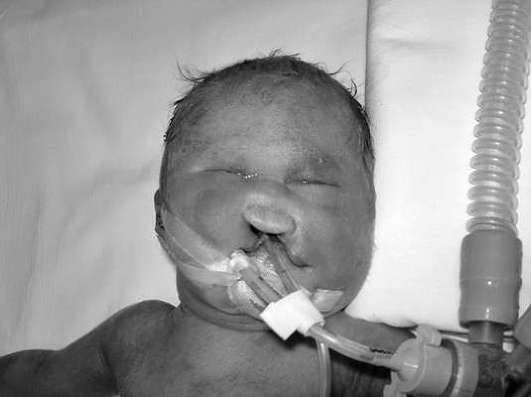
Синдром Эдвардса (трисомия 18) почти всегда обусловлен простой трисомной формой. Частота синдрома Эдвардса составляет 1:5000-1:7000 живорожденных. Новорожденные с синдромом Эдвардса имеют выраженную гипотрофию и множественные пороки развития лицевого черепа, сердца, костной системы, половых органов. Дети с синдромом Эдвардса, как правило, умирают в раннем возрасте.
Синдром Тернера (моносомия 45Х0) - единственная форма моносомий у живорожденных. Синдром Тернера обусловлен отсутствием одной Х-хромосомы у плодов женского пола. Частота составляет 2,5-5,5; 10 000 живорожденных женского пола. Наряду с истинной моносомией встречаются другие хромосомные аномалии по половым хромосомам (делеция короткого или длинного плеча Х-хромосомы, изохромосомы, кольцевые хромосомы, а также различные варианты мозаицизма).
Клинически синдром Тернера проявляется гипогонадизмом, врожденными пороками развития, низким ростом. Отмечаются отсутствие гонад, гипоплазия матки и маточных труб, первичная аменорея, у 25% больных встречаются пороки сердца и почек. Внешний вид больных достаточно характерен, хотя и не всегда. У новорожденных и детей грудного возраста короткая шея с избытком кожи и крыловидными складками, лимфатический отек стоп, голеней, кистей рук и предплечий (рис. 32.11). В дальнейшем проявляются отставание в росте, в развитии вторичных половых признаков, костные дисплазии, антимонголоидный разрез глаз, птоз, в 90% наблюдений - бесплодие. Часто бывает задержка психического и интеллектуального развития.

Моногенные заболевания обусловлены мутациями или отсутствием отдельного гена. Мутации могут захватывать один или оба аллеля. Клинические проявления возникают в результате отсутствия генетической информации или реализации дефектной. Моногенные заболевания исследуются в полном соответствии с законами Менделя (аутосомное или сцепленное с
Х-хромосомой). Известно около 5000 моногенных заболеваний, более половины наследуется по аутосомно-доминантному типу.
К этой группе заболеваний относятся:
- нейрофиброматоз (болезнь Реклингхаузена), при котором наиболее тяжело поражается нервная система;
- миотоническая дистрофия с миотонией, мышечной слабостью, катарактой, сердечной аритмией, нарушенной толерантностью к глюкозе, умственной отсталостью;
- синдром Марфана - наследственная болезнь соединительной ткани. Наиболее специфическими признаками являются нарушения скелета, вывих хрусталика, сердечно-сосудистые изменения, эктазия твердой мозговой оболочки;
- синдром Элерса-Данло - врожденная гиперрастяжимость соединительной ткани в связи с нарушением синтеза коллагена, обусловленным мутациями в разных коллагеновых генах;
- фенилкетонурия, связанная с недостаточностью печеночного фермента фенилаланингидроксилазы, локус которой расположен в длинном плече хромосомы 12. Дети с фенилкетонурией рождаются здоровыми, но в первые же недели после рождения в связи с поступлением фенилаланина в организм с молоком матери развиваются клинические проявления заболевания: повышенная возбудимость, гиперрефлексия, повышенный тонус мышц, судорожные эпилептиформные припадки; от ребенка исходит "мышиный" запах. Позже развиваются умственная отсталость, микроцефалия;
- муковисцидоз (кистозный фиброз), в основе которого лежит нарушение транспорта ионов хлора и натрия через клеточные мембраны (ген муковисцидоза локализован в хромосоме 7), что приводит к избыточному выведению хлоридов. Отмечается гиперсекреция густой слизи в клетках эндокринной части поджелудочной железы, эпителии бронхов, слизистой оболочке желудочно-кишечного тракта;
- адреногенитальный синдром (врожденная гиперплазия коры надпочечников) относится к группе наследственных нарушений синтеза стероидных гормонов. Наиболее распространенная форма врожденной гиперплазии коры надпочечников - дефицит 21-гидроксилазы, ген локализован в коротком плече хромосомы 6;
- миопатия Дюшенна, вызванная мутацией в гене, ответственном за синтез белка дистрофина (ген расположен в локусе Xq21). Заболевание проявляется прогрессирующей мышечной слабостью, дистрофией и некрозом отдельных мышечных волокон;
- гемофилия А - заболевание, сцепленное с Х-хромосомой, ген расположен в локусе Xq28, мутация гена обусловливает дефицит фактора VIII. Клинические проявления состоят в нарушении гемостаза, увеличении времени свертывания.
Полигенные болезни обусловлены взаимодействием определенных комбинаций аллелей разных локусов и экзогенных факторов. Заболевания контролируются сразу несколькими генами, не подчиняются законам Менделя и не соответствуют классическим типам аутосомно-доминантного, аутосомно-рецессивного наследования и наследования, сцепленного с Х-хромосомой. Проявление признака во многом зависит от экзогенных факторов.
Генетический риск полигенных болезней в большой степени зависит от семейной предрасположенности и от тяжести заболевания у родителей. Генетический риск полигенных болезней рассчитывают с помощью таблиц эмпирического риска. Определить прогноз нередко сложно.
К полигенным болезным относятся врожденные пороки развития, не обусловленные хромосомной патологией. С клинической точки зрения различают изолированные (локализованные в одном органе), системные (в пределах одной системы органов) и множественные (в органах двух систем или более) врожденные пороки развития.
Наиболее часто встречаются пороки развития ЦНС.
Анэнцефалия - отсутствие полушарий мозга и свода черепа (рис. 32.12). Данная патология встречается с частотой 1:1000 новорожденных. Акрания (отсутствие свода черепа при наличии мозговой ткани) встречается гораздо реже.
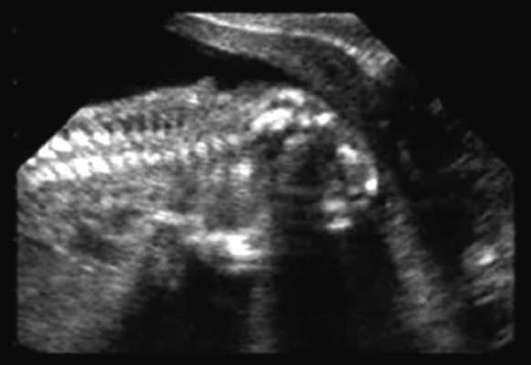
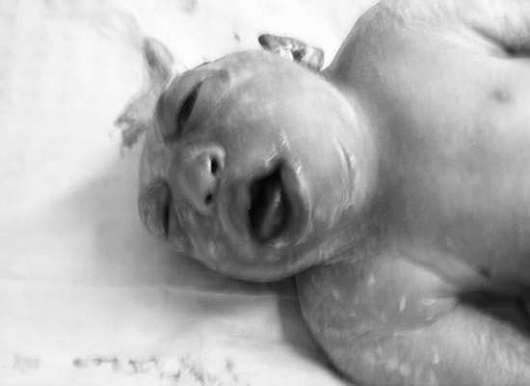
Анэнцефалия часто сочетается с расщелиной губы и неба, аномалиями ушей и носа, пороками сердца, патологией желудочно-кишечного тракта и мочеполовой системы. Анэнцефалия и акрания относятся к летальным порокам развития, поэтому женщине рекомендуется прерывание беременности.
Цефалоцеле развивается в результате незакрытия нервной трубки, возникает на стадии 4 нед внутриутробной жизни и представляет собой выход мозговых оболочек через дефект костей черепа. Когда в состав грыжевого мешка входит мозговая ткань, аномалия носит название энцефалоцеле. Частота порока составляет 1:2000 живорожденных.
Цефалоцеле нередко связано с патологией хромосом (трисомия 13, 18, несбалансированные транслокации), входит в состав многих генетических синдромов.
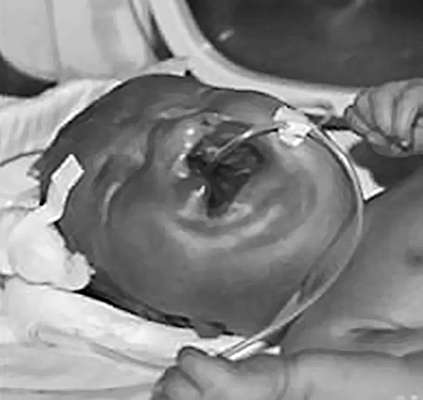
Спинномозговая грыжа (spina bifida) - аномалия позвоночного столба в результате нарушения закрытия нервной трубки. Порок развития, при котором через дефект позвоночника выходят только оболочки спинного мозга, называют менингоцеле. Если грыжевой мешок содержит нервную ткань, то образование называется менингомиелоцеле. Поясничный и крестцовый отделы позвоночника - наиболее частая локализация дефектов. Различают spina bifida cystica (с образованием грыжевого мешка) (рис. 32.13) и spina bifida occulta, которая не сопровождается грыжевым выпячиванием. Частота варьирует в зависимости от географического региона и составляет от 0,5:1000 до 4:1000 новорожденных.
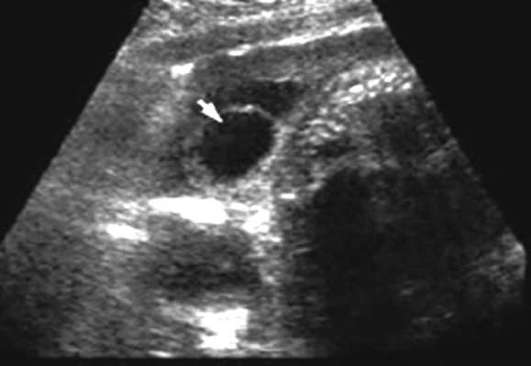
Дефекты нервной трубки (анэнцефалия, цефалоцеле, spina bifida) - мультифакторные аномалии, которые могут формироваться на 4-6-й неделе эмбрионального развития в результате гипертермии у матери, диабета, при воздействии на плод в ранние сроки ряда тератогенных агентов (вальпроиевая кислота, аминоптерин, метотрексат), при хромосомных аномалиях (трисомии 13, 18, триплоидия, тетраплоидии, делеции, несбалансированные транслокации), а также сочетается более чем с 40 синдромами множественных пороков развития.
При выявлении дефектов нервной трубки до достижения плодом жизнеспособности пациентке следует предложить прерывание беременности.
Для профилактики дефектов нервной трубки рекомендуют принимать фолиевую кислоту по 4 мг/сут за 3 мес до наступления беременности с последующим приемом до 6-7 нед.
Гидроцефалия - увеличение желудочков мозга с одновременным нарастанием внутричерепного давления, сопровождающееся увеличением головы. Изолированное увеличение желудочков без увеличения головы обозначают термином "вентрикуломегалия". Частота гидроцефалии 0,1:1000-2,5:1000 новорожденных.
Гидроцефалия и вентрикуломегалия, как правило, развиваются во II-III триместрах беременности в результате нарушения оттока спинномозговой жидкости, что приводит к повышению внутричерепного давления. Реже причиной гидроцефалии бывают повышенная продукция спинномозговой жидкости (папилломы сосудистых сплетений).
Гидроцефалия сопровождает многие хромосомные, моногенные заболевания, синдром множественных пороков развития, скелетных дисплазий.
При диагностике данного порока развития до жизнеспособности плода показано прерывание беременности. При отсутствии у плода хромосомной патологии и выраженных сочетанных аномалий возможно пролонгирование беременности с ультразвуковым наблюдением за нарастанием гидроцефалии.
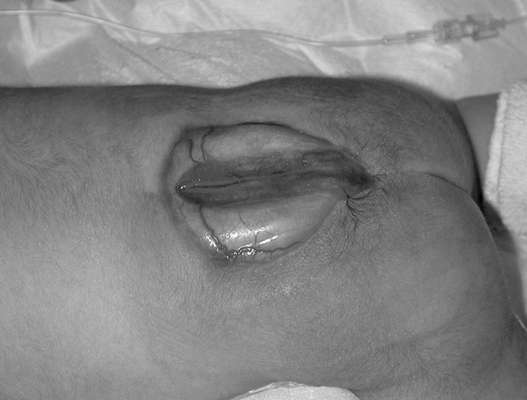
Аномалии лицевых структур. Расщелина лица формируется между 4-й и 10-й неделей гестации при неполном слиянии фронтоназальных структур с парными максиллярными и мандибулярными бугорками. Выделяют изолированную расщелину губы или в сочетании с расщелиной неба (наиболее частая аномалия лицевых структур) (рис. 32.14), а также изолированную расщелину неба (редкая аномалия). Расщелина может располагаться посередине, быть одноили двусторонней. Частота составляет 1:800 живорожденных.
Расщелины лица нередко сочетаются с другими аномалиями развития. Возникновение расщелин лица связывают с экзогенными факторами (алкоголь, фенитоин, триметадион, метотрексат), а также с инсулинзависимым сахарным диабетом у матери.
Диагностика расщелин лица возможна при УЗИ с конца I триместра беременности. Трехмерное изображение помогает уточнить диагноз. Пренатальное обследование должно включать кариотипирование и тщательное исследование (анатомия лица, мозга, сердца, скелета).
Прием фолиевой кислоты за несколько месяцев до наступления беременности снижает риск возникновения расщелин лица.
Аномалии органов грудной клетки. Врожденная диафрагмальная грыжа возникает в результате замедления закрытия плевроперитонеального канала. Дефект диафрагмы приводит к перемещению органов брюшной полости (желудок, кишечник, печень, селезенка) в грудную полость со смещением средостения и сдавлением легких (легочная гипоплазия).
Диафрагмальная грыжа нередко сочетается с пороками сердца, а также с хромосомными (трисомия 13, 18) и генными аномалиями.
Ультразвуковая диагностика возможна с конца I триместра беременности. Пренатальное обследование должно включать кариотипирование плода.
При нормальном кариотипе плода, отсутствии сочетанных аномалий беременность пролонгируют. Возможна внутриутробная хирургическая коррекция этого порока (не позднее II триместра).
Течение неонатального периода у детей с врожденной диафрагмальной грыжей зависит от выраженности гипоплазии легких и вторичной легочной гипертензии.
Врожденный кистозно-аденоматозный порок развития легких - гамартома легких, которая представляет собой кистозное, солидное или смешанное образование в грудной клетке плода, иногда сопровождающееся водянкой плода; нередко сочетается с пороками сердца, кистозными изменениями почек, расщелиной верхнего неба и вентрикуломегалией.
Если порок представлен большим кистами, возможно внутриутробное инвазивное вмешательство - торакоамниотическое шунтирование для предупреждения гипоплазии легких. Нередко требуется хирургическая коррекция в неонатальном периоде.
Легочная секвестрация представляет собой часть легкого, которая развивается вне связи с воздухоносными путями и относится к редким порокам развития. Секвестрированная часть легкого обычно имеет собственное кровоснабжение от сосуда, отходящего непосредственно от аорты. Наиболее часто легочная секвестрация сочетается с неиммунной водянкой.
При УЗИ легочная секвестрация визуализируется как солидное образование вблизи диафрагмы. Цветовое допплеровское картирование способствует идентификации кровоснабжения секвестрированного легкого.
Оперативное лечение ребенка после рождения заключается в сегментэктомии или лобэктомии пораженного легкого.
Пороки сердца. Частота врожденных пороков сердца у новорожденных составляет 0,5-1%. К врожденным порокам сердца, диагностика которых в большинстве наблюдений возможна уже во внутриутробном периоде, относятся единственный желудочек, эктопия сердца, дефекты межпредсердной и межжелудочковой перегородок, гипопластический синдром левых отделов сердца, предсердно-желудочковый канал, аномалия Эбштейна, тетрада Фалло, транспозиция магистральных сосудов, артериальный ствол, стеноз и коарктация аорты, стеноз и атрезия легочной артерии, опухоли сердца. Врожденные пороки сердца нередко сочетаются с другими пороками, а также с хромосомными (трисомии) и моногенными заболеваниями.
Риск врожденных пороков сердца у плода повышен при декомпенсированном сахарном диабете, системной красной волчанке, фенилкетонурии, врожденных пороках сердца у матери. 2% всех врожденных пороков сердца связано с вирусом краснухи, алкоголем, триметадионом.
Наиболее информативным методом антенатальной диагностики врожденных пороков сердца плода является эхокардиографическое исследование, начиная со II триместра беременности. При выявлении врожденного порока сердца проводят кариотипирование плода. При сочетанных пороках и генетических аномалиях показано прерывание беременности в любом сроке. При нормальном кариотипе плода тактика ведения беременной определяется возможностью хирургической коррекции порока сердца у ребенка. Курабельность порока определяет детский кардиохирург до и после рождения ребенка.
Пороки развития желудочно-кишечного тракта. К врожденным порокам желудочно-кишечного тракта относятся атрезия пищевода, атрезия двенадцатиперстной кишки, атрезия и стеноз тонкой и толстой кишки, атрезия ануса, мекониевый перитонит.
Атрезия двенадцатиперстной кишки является наиболее частым врожденным обструктивным поражением тонкой кишки, частота данной аномалии составляет 1:10 000 живорожденных. У 30-40% плодов с атрезией двенадцатиперстной кишки диагностируются трисомия 21 и сочетанные аномалии (врожденные пороки сердца и мочевой системы, другие аномалии желудочно-кишечного тракта, дефекты позвоночника).
Диагностика порока возможна во II и III триместрах беременности. Основные ультразвуковые признаки атрезии двенадцатиперстной кишки: многоводие и классический признак "double bubble" в брюшной полости плода (рис. 32.15). Изображение "двойного пузыря" обусловлено расширением желудка и проксимального отдела двенадцатиперстной кишки.
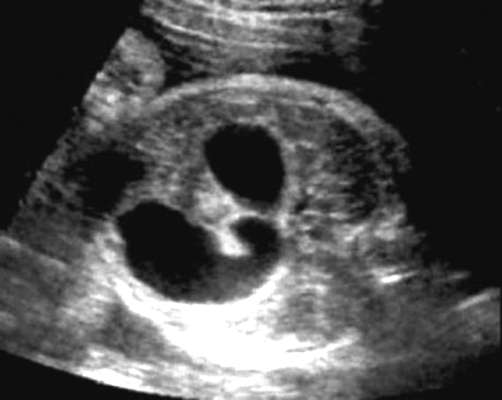
При подозрении на атрезию двенадцатиперстной кишки показаны кариотипирование плода и тщательное изучение всей ультразвуковой анатомии плода, включая эхокардиографическое исследование. При нормальном кариотипе и изолированной аномалии возможно пролонгирование беременности с последующей хирургической коррекцией порока развития у новорожденного.
Пороки развития передней брюшной стенки. Гастрошизис - параумбиликальный дефект передней брюшной стенки плода с эвентрацией органов брюшной полости (чаще кишечника). Как правило, дефект располагается справа от пупка, грыжевые органы свободно "плавают" в амниотической жидкости. Частота составляет 1:10 000 живорожденных.
В 10-30% наблюдений гастрошизис сочетается с атрезией и стенозом кишечника, врожденными пороками сердца и мочевой системы, гидроцефалией, мало- и многоводием.
Ультразвуковая диагностика гастрошизиса не представляет трудности, диагноз, как правило, устанавливают во II триместре беременности (рис. 32.16). Частота хромосомных аномалий при изолированном гастрошизисе не превышает общепопуляционную, поэтому кариотипирование плода можно не проводить.
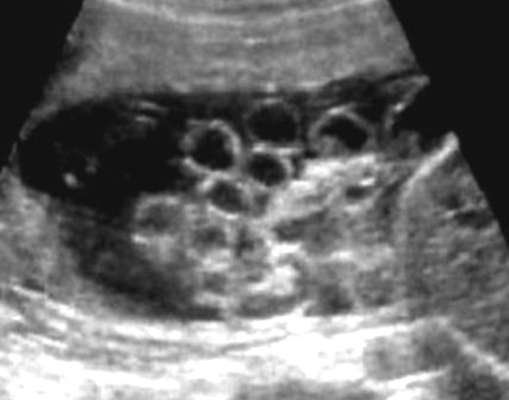
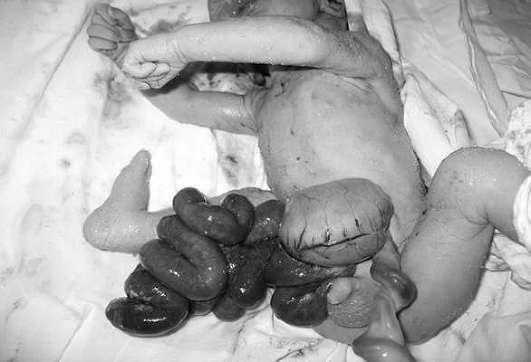
Во избежание развития ишемических изменений и инфицирования кишечника ребенка переводят в хирургический стационар в ближайшие часы после рождения. Обычно операция проводится в первые 24 ч после рождения. Общий прогноз для новорожденного с изолированным гастрошизисом благоприятный - после хирургической коррекции выживает более 90% детей.
Омфалоцеле - пупочная грыжа - является результатом невозвращения органов брюшной полости из амниотической полости через пупочное кольцо. Размеры грыжевого образования определяются содержимым грыжевого мешка, в который могут входить любые органы брюшной полости. В отличие от гастрошизиса, омфалоцеле покрыто амниоперитонеальной мембраной, по боковой поверхности которой проходят сосуды пуповины. Частота порока составляет 1:3000-1:6000 живорожденных.
Омфалоцеле наиболее часто сочетается с врожденными пороками сердца, с пороками ЦНС, мочеполовой системы, диафрагмальной грыжей, скелетными дисплазиями, единственной артерией пуповины, хромосомными дефектами (трисомии 13, 18).
В большинстве наблюдений омфалоцеле выявляется при УЗИ во II триместре беременности. При обнаружении омфалоцеле показано кариотипирование плода, поскольку при данном пороке развития высока частота хромосомных аберраций.
После рождения ребенок нуждается в срочном переводе в хирургическое отделение для оперативного лечения, которое обычно проводят в первые 24-48 ч после рождения. Успех оперативного лечения зависит от размеров грыжевого мешка, степени гипоплазии стенок брюшной полости.
Пороки развития мочеполовой системы. Агенезия почек - отсутствие обеих почек.
Ультразвуковая диагностика агенезии почек возможна с 13 нед гестации. При эхографии почки плода не визуализируются, отсутствует мочевой пузырь, отмечается выраженное маловодие, нередко бывает симметричная форма задержки роста плода. Для дифференциальной диагностики агенезии и гипоплазии почек целесообразно использовать цветовое допплеровское картирование: при агенезии почек нет почечных артерий.
При выявлении этого порока рекомендуют прерывание беременности в любом сроке.
Обструктивная уропатия. Возможна обструкция мочевых путей плода на уровне лоханочно-мочеточникового соустья (высокая), на уровне мочеточников, на уровне пузырно-мочеточникового соустья, на уровне уретры (низкая). Наиболее частой причиной обструктивной уропатии является высокая обструкция, она составляет 50% всех врожденных аномалий мочевых путей.
Ультразвуковая диагностика высокой обструкции основывается на выявлении расширенной почечной лоханки (рис. 32.17). Степень гидронефроза зависит от выраженности обструкции и ее продолжительности: чем раньше формируется обструкция, тем более высок риск поражения почечной паренхимы. При более низкой обструкции, в зависимости от уровня, наряду с гидронефрозом определяются расширенные мочеточники и мочевой пузырь, выраженное маловодие.
При недоношенной беременности у плодов с выраженной обструктивной уропатией возможна внутриутробная хирургическая коррекция с целью предупреждения дисплазии и фиброза почечной паренхимы (лоханочно-амниотическое или пузырно-амниотическое шунтирование).
В неонатальном периоде необходимо повторить УЗИ для подтверждения пренатального диагноза и оценки мочевых путей у новорожденного. При подтвержденной выраженной обструкции мочевых путей показана хирургическая коррекция.
Поликистозная болезнь почек инфантильного типа проявляется двусторонним увеличением почек в результате замещения паренхимы гиперплазированными и расширенными собирательными канальцами. Это летальный порок развития, его частота составляет 3:1000 новорожденных.
Основными эхографическими признаками порока являются увеличенные гиперэхогенные почки, отсутствие мочевого пузыря, маловодие. Типичная эхографическая картина в ряде случаев может не проявляться до III триместра беременности.
Прогноз для жизни крайне неблагоприятен в связи с развитием почечной недостаточности. Акушерская тактика заключается в прерывании беременности в любом сроке.
Мультикистозная дисплазия почек - замещение почечной паренхимы несообщающимися кистами; мочеточник и лоханка нередко атрезированы или отсутствуют. В большинстве случаев процесс односторонний.
Кистозная дисплазия почек может наблюдаться при различных хромосомных и генных нарушениях, поэтому необходимо кариотипирование плода.
Эхографическая диагностика возможна со второй половины беременности. При мультикистозной дисплазии почка увеличена, представлена множественными кистами с анэхогенным содержимым. Размеры кист достигают к доношенной беременности 3-4 см. При двустороннем поражении мочевой пузырь не визуализируется, отмечается маловодие.
Двусторонняя кистозная дисплазия почек является летальным пороком развития; при этом пороке показано прерывание беременности. При одностороннем поражении, нормальном кариотипе плода, отсутствии сопутствующих аномалий беременность пролонгируют.
Пороки развития костной системы. Среди врожденных пороков развития костной системы наиболее часто встречаются амелия (аплазия всех конечностей), фокомелия (недоразвитие проксимальных отделов конечностей), полидактилия (увеличение числа пальцев), синдактилия (сращения пальцев), остеохондродисплазии (аномалии роста и развития хрящей и костей). При некоторых формах скелетных дисплазий вследствие недоразвития ребер и уменьшения размеров грудной клетки развивается вторичная легочная гипоплазия.
Ахондроплазия - одна из наиболее частых нелетальных скелетных дисплазий, представляет собой остеохондродисплазию с дефектами трубчатых костей и аксиального скелета. Это наиболее часто встречающаяся причина карликовости (рост взрослого человека при ахондроплазии 106-140 см). Частота 2:10 000 новорожденных.
Ультразвуковая диагностика возможна во II триместре беременности. Ахондроплазию можно заподозрить при значительном отставании темпов роста бедренных костей. Классическая эхографическая картина включает резкое укорочение конечностей, малые размеры грудной клетки, макроцефалию и седловидный нос.
Прогноз для жизни относительно благоприятный при отсутствии гипоплазии легких. Интеллектуальное развитие может быть нормальным, но повышен риск неврологических нарушений в связи с компрессией спинного мозга на уровне большого затылочного отверстия.
Полидактилия - увеличение числа пальцев на кистях и стопах. Частота полидактилии 1:2000 родов.
Полидактилия может наблюдаться при многих хромосомных и генных заболеваниях и скелетных дисплазиях. При обнаружении полидактилии, особенно в сочетании с другими аномалиями, показано кариотипирование плода.
Ультразвуковая диагностика возможна со второй половины беременности.
При изолированной полидактилии у плода (отсутствие других пороков развития, нормальный кариотип) беременность пролонгируют. После рождения ребенка проводится хирургическая коррекция порока (см. главу "Методы обследования в акушерстве и перинатологии).
ИЗОСЕРОЛОГИЧЕСКАЯ НЕСОВМЕСТИМОСТЬ КРОВИ МАТЕРИ И ПЛОДА. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ ПЛОДА И НОВОРОЖДЕННОГО
Причиной изосерологической несовместимости крови матери и плода является различие антигенных факторов эритроцитов по системе резус: кровь матери резус-отрицательная, плода - резус-положительная. Выявление у женщин с резус-отрицательной кровью антирезус-антител указывает на сенсибилизацию к резус-фактору, вследствие которой возможно развитие гемолитической болезни плода и новорожденного (синоним - эритробластоз).
Резус-фактор - система аллогенных эритроцитарных антигенов человека, дифференциация которого начинается в ранние сроки внутриутробного развития (с 6-8 нед гестации).
Белковый фактор в эритроцитах, обладающий антигенными свойствами, был впервые обнаружен американскими учеными К. Ландштейнером и А. Винером в 1940 г. В эксперименте они показали, что эритроциты обезьян (макака-резус), введенные кроликам, вызывали у кроликов выработку антител.
В настоящее время выделяют 6 основных резус-антигенов Rh (Dd, Cc, Ee). Каждый генный комплекс состоит из трех антигенных детерминант: D или отсутствие D, С или с, Е или е в различных комбинациях. Существование антигена d не подтверждено, так как не известен ген, отвечающий за синтез этого антигена. Несмотря на это, символ d применяется в иммуногематологии для обозначения отсутствия антигена D на эритроцитах при описании фенотипов.
Другими изосерологическими системами крови, с которыми может быть связан иммунный конфликт, являются системы Келл-Челлано, Даффи, Кидд, MNSs, Лютеран.
Наибольшее практическое значение имеет антиген Rh0(D) - основной антиген системы резус. Он содержится на эритроцитах 85% людей, проживающих в Европе. На основании присутсвия на эритроцитах антигена Rh0(D) выделяют резус-положительный тип крови. Кровь людей, эритроциты которых лишены этого антигена, относят к резус-отрицательному типу.
Люди с резус-положительной кровью могут быть гомозиготными (DD) и гетерозиготными (Dd). Если отец гомозиготен (DD) (40-45% всех мужчин с резус-положительной кровью), то доминантный ген D всегда передается плоду. Следовательно, у женщины с резус-отрицательной кровью (dd) плод будет всегда резус-положительным в. Если отец гетерозиготен (Dd) (55-60% всех резус-положительных мужчин), то плод будет резус-положительным в 50% случаев, так как возможно наследование и доминантного, и рецессивного гена.
Определение гетерозиготности отца представляет определенные трудности, его нельзя внедрить в рутинную практику. Беременность у женщины с резус-отрицательной кровью от мужчины с резус-положительной кровью следует вести как беременность плодом с резус-положительной кровью.
Изоиммунизация может также развиться и в результате несовме-стимости крови матери и плода по системе АВ0, когда у матери 0 (I) группа крови, а у плода любая другая. Антигены А и В плода могут проникать во время беременности в кровоток матери, приводя к выработке иммунных a- и b-антител соответственно и развитию у плода реакции антиген-антитело (Аa, Вb). Групповая несовместимость крови матери и плода хотя и встречается чаще, гемолитическая болезнь плода и новорожденного при этом протекают легче и, как правило, не требуют интенсивной терапии. 95% всех клинически значимых случаев гемолитической болезни плода обусловлены несовместимостью по резус фактору, 5% - по системе АВ0.
Патогенез гемолитической болезни плода. Иммунизация женщин с резус-отрицательной кровью происходит при беременности плодом с резус-положительной кровью или после попадания резус-положительной крови в организм женщины (путь введения значения не имеет). Сенсибилизация может наступать после искусственного и самопроизвольного аборта, внематочной беременности. Наиболее часто трансплацентарная трансфузия наблюдается во время родов, особенно при оперативных вмешательствах (ручное отделение плаценты, кесарево сечение). Резус-иммунизации в процессе беременности способствует нарушение целостности ворсин хориона, вследствие чего эритроциты плода попадают в кровоток матери (гестоз, угроза прерывания беременности, преждевременная отслойка плаценты, экстрагенитальная патология, проведение инвазивных процедур - биопсии хориона, амниоцентеза, кордоцентеза).
Первичным ответом организма матери на попадание в кровоток резус-антигенов является выработка IgM-антител ("полные" антитела) с большой молекулярной массой. Они не проникают через плацентарный барьер и не имеют значения в развитии гемолитической болезни плода. При повторном попадании резус-антигенов в сенсибилизированный организм матери происходит быстрая и массивная продукция IgG ("неполные" антитела), которые вследствие низкой молекулярной массы легко проникают через плаценту и становятся причиной развития гемолитической болезни плода.
Выработанные иммунные антитела, проникая из кровотока беременной к плоду, вступают в реакцию с эритроцитами плода (реакция антиген-антитело). При этом происходит гемолиз эритроцитов плода с образованием непрямого токсичного билирубина. Разрушение эритроцитов является основной причиной развивающейся у плода анемии, а накопление непрямого билирубина приводит к развитию желтухи.
В результате развившейся гемолитической анемии стимулируется синтез эритропоэтина. Когда образование в костном мозге эритроцитов не может компенсировать их разрушение, возникает экстрамедуллярное кроветворение в печени, селезёнке, надпочечниках, почках, плаценте и слизистой оболочке кишечника плода. Это приводит к обструкции портальной и пуповинной вен, портальной гипертензии, нарушению белоксинтезирующей функции печени - гипопротеинемии. Снижается коллоидно-осмотическое давление крови, результатом чего становятся асцит и генерализованные отеки у плода. Тяжесть состояния плода обусловлена также прогрессирующей тканевой гипоксией, нарастанием ацидоза.
Поскольку непрямой билирубин хорошо растворяется в липидах, он поражает в первую очередь ядра клеток головного мозга, что в периоде новорожденности способствует развитию билирубиновой энцефалопатии и ядерной желтухи.
Таким образом, анемия и желтуха являются основными симптомами гемолитической болезни плода. При тяжелых формах заболевания возможно развитие водянки у плода вплоть до анасарки.
Диагностика резус-сенсибилизации у матери основывается на данных анамнеза, определении титра резус-антител в периферической крови, диагностика гемолитической болезни плода - на данных ультразвуковой фето- и плацентометрии, исследования околоплодных вод и плодовой крови, оценки состояния плода.
Гемотрансфузии без учета резус-принадлежности, самопроизвольное прерывание беременности, антенатальная гибель плода в предыдущих беременностях или рождение ребенка с гемолитической болезни плода в анамнезе женщины с резус-отрицательной кровью прогностически неблагоприятны и указывают на высокий риск заболевания плода при данной беременности.
У пациенток с резус-отрицательной кровью начиная с ранних сроков (6-12 нед) исследуют кровь на резус-антитела и определяют их титр в динамике (1 раз в месяц на протяжении всей беременности).
Титр антител соответствует наибольшему разведению сыворотки, при котором она еще способна агглютинировать резус-положительные эритроциты (титр антител может быть равен 1:2, 1:4, 1:8, 1:16 и т.д.). Абсолютная величина титра антител в крови матери при определении тяжести заболевания плода не имеет решающего значения (возможно рождение детей с резус-отрицательной кровью у резус-сенсибилизированных женщин).
Титр антител в течение беременности может нарастать, оставаться без изменений, снижаться. Иногда бывают скачкообразные изменения титра (чередующиеся повышение и понижение). Прогностически неблагоприятно нарастание титра антител в динамике, а также его скачкообразные изменения.
Большое значение в диагностике гемолитической болезни плода имеет УЗИ с фето- и плацентометрией, позволяющее выявить изменения как плаценты, так и плода. С целью определения первых признаков гемолитической болезни плода УЗИ целесообразно производить с 18-20 нед. До этого срока ультразвуковые признаки этой патологии, как правило, не определяются. В дальнейшем УЗИ проводят в 24-26, 30-32, 34-36 нед и непосредственно перед родоразрешением. У каждой беременной сроки повторных исследований устанавливают индивидуально. При необходимости интервал между исследованиями сокращают до 1-2 нед, а при тяжелых формах гемолитической болезни плода УЗИ проводят каждые 1-3 дня.
Одним из ранних ультразвуковых признаков гемолитической болезни плода является увеличение толщины плаценты на 0,5-1,0 см по сравнению с нормой. На наличие гемолитической болезни плода указывают также увеличение печени, селезенки плода и многоводие. Дополнительным ультразвуковым критерием тяжести заболевания плода может служить расширение вены пуповины (более 10 мм).
Наиболее точно при УЗИ диагностируют отечную форму гемолитической болезни, критериями которой являются выраженная плацентомегалия (до 6,0-8,0 см), гепатоспленомегалия, асцит, многоводие (рис. 32.18). К патологическим ультразвуковым признакам при выраженной водянке плода относятся также кардиомегалия и перикардиальный выпот, гидроторакс, повышенная эхогенность кишечника вследствие отека его стенки, отек подкожной клетчатки головы, туловища и конечностей.
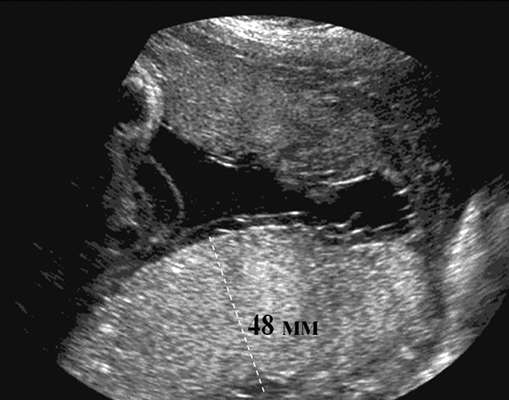
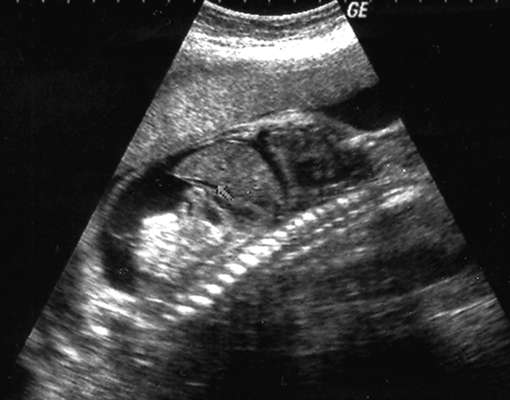
В настоящее время доказана обратная корреляционная связь между максимальной скоростью кровотока в средней мозговой артерии и уровнем гемоглобина у плода. Высокая максимальная скорость кровотока в средней мозговой артерии объясняется увеличением сердечного выброса, обусловленного анемией и снижением вязкости крови при гемолитической болезни (рис. 32.19). Это стало основанием для использования максимальной скорости кровотока в средней мозговой артерии плода в качестве дополнительного критерия при диагностике гемолитической болезни плода и позволяет снизить частоту применения инвазивных диагностических процедур (амниоцентез, кордоцентез) (рис. 32.20).
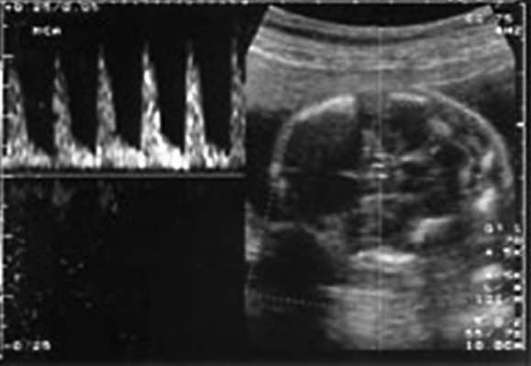
Посокльку гипербилирубинемия - один из основных признаков гемолитической болезни плода определяют оптическую плотность билирубина в околоплодных водах. Она повышается по мере увеличения концентрации билирубина, выделяемого почками плода.
Амниоцентез для определения оптической плотности билирубина в околоплодных водах можно проводить как в условиях стационара, так и амбулаторно. Показания к амниоцентезу: отягощенный акушерский анамнез (анте-, интраили постнатальная гибель детей от тяжелых форм гемолитической болезни); наличие детей, перенесших заменное переливание крови в связи с гемолитической болезнью; обнаружение ультразвуковых маркеров гемолитической болезни плода; титр антител в крови матери 1:16 и выше.
Оптическую плотность билирубина в околоплодных водах можно определять, используя фотоэлектроколориметр или, предпочтительнее, спектрофотометр.
Применяя ФЭК с длиной волны 450 нм, околоплодные воды можно исследовать с 34-35 нед гестации. Оптическая плотность билирубина менее 0,1 отн.ед. свидетельствует об отсутствии заболевания плода. Оптическая плотность билирубина повышается при развитии гемолитической болезни: значения 0,1-0,15 указывают на легкое заболевание, 0,15-0,2 - на среднетяжелую, более 0,2 с большой вероятностью позволяет предположить тяжелую гемолитическую болезнь плода.
Более точно и в более ранние сроки беременности (начиная с 24 нед) оценить тяжесть гемолитической болезни плода возможно при исследовании оптической плотности билирубина в амниотической жидкости при различных длинах волн света (от 300 до 700 нм) с помощью спектрофотометра. Полученные значения интерпретируют по шкале Лили, которая делится на зоны: 1, 2А, 2В, 2С, 3 (рис. 32.21).
Если значение оптическая плотность билирубина соответствует зоне 1, плод следует считать здоровым или резус-отрицательным, повторный амниоцентез необходим через месяц. Если значения находятся в зоне 2А, то амниоцентез повторяют через 4 нед. При соответствии зоне 2В эту процедуру производят через 1-2 нед. Показатели в пределах зоны 2С создают показания к диагностическому кордоцентезу. Если значение соответствует 3-й зоне шкалы Лили, то при сроке гестации до 34 нед показаны кордоцентез и внутриутробное переливание крови, после 34 нед - родоразрешение.
В последние годы исследование околоплодных вод в силу своей инвазивности утрачивает свое первостепенное значение, так как по диагно-стической значимости сопоставимо с показателем максимальной систолической скорости кровотока в средней мозговой артерии, определяемой при УЗИ (неинвазивный метод). Наиболее точным методом выявления и определения тяжести гемолитической болезни плода является исследование плодовой крови, полученной путем кордоцентеза (пункция пуповины). Кордоцентез проводится начиная с 24 нед беременности (методику см. в главе "Методы обследования в акушерстве и перинатологии").
Показаниями к кордоцентезу являются соответствие оптической плотности билирубина зоне 3 или 2С шкалы Лили, ультразвуковые маркеры гемолитической болезни плода, титр антител 1:32 и выше, отягощенный анамнез (анте-, интраили постнатальная смерть детей от тяжелых форм гемолитической болезни; рождение детей, перенесших заменное переливание крови в связи с гемолитической болезнью).
Исследование плодовой крови включает определение группы, резус-принадлежности, уровней гемоглобина, гематокрита и билирубина, непрямую пробу Кумбса.
При выявлении резус-отрицательной крови у плода и, следовательно, отсутствии возможности развития гемолитической болезни дальнейшее наблюдение за беременной проводится так же, как за неиммунизированной пациенткой. При резус-положительной крови плода и отсутствии данных за гемолитическую болезнь плода (уровень гемо-глобина и гематокрит соответствуют гестационной норме) повторный кордоцентез проводят через 4 нед или раньше при появлении ультразвуковых признаков гемолитической болезни. Сниженные показатели гемоглобина и гематокрита (на 15% и более), свидетельствующие о заболевании плода, требуют терапии внутриутробного плода.
Гемолитическая болезнь плода нередко сопровождается гипоксией, поэтому необходима оценка состояния плода при кардиотокографии.
На кардиотокограммах отмечаются характерные для гипоксии плода изменения, выраженность которых увеличивается по мере нарастания тяжести гемолитической болезни. Интерпретацию кардиотокограмм производят согласно шкале оценки сердечной деятельности плода в модификации Г.М. Савельевой и соавт. (см. "Методы обследования в акушерстве и перинатологии"). Кривая синусоидального типа свидетельствует об отечной форме гемолитической болезни и крайне тяжелом состоянии плода (рис. 32.22).
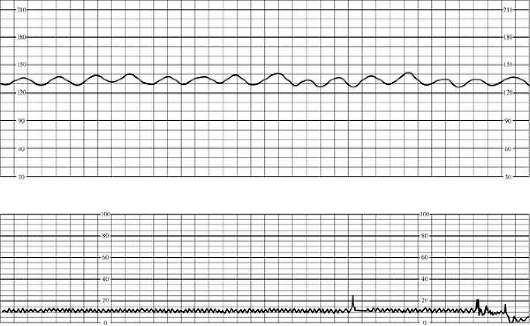
При признаках хронической гипоксии мониторинг необходимо проводить ежедневно с целью раннего выявления ухудшения состояния плода.
В большинстве случаев ультразвуковая фето- и плацентометрия, оценка скорости кровотока в средней мозговой артерии плода, результаты амниоцентеза и кордоцентеза позволяют выработать правильную тактику ведения пациентки. План ведения зависит от срока беременности, состояния плода и возможностей перинатальной службы в данном учреждении (внутриматочные гемотрансфузии и выхаживание недоношенных детей).
В последние годы разработан и начинает использоваться в практике метод, позволяющий исследовать фетальные эритроциты в периферической крови матери с целью диагностики резус-принадлежности крови плода. Установленная в ранние сроки беременности резус-отрицательная принадлежность крови плода (точность диагностики до 100%) позволяет избежать необоснованных инвазивных диагностических вмешательств.
Лечение гемолитической болезни плода состоит во внутрисосудистой гемотрансфузии плоду. Внутриутробное переливание крови повышает уровень гемоглобина и гематокрита, снижает риск развития отечной формы гемолитической болезни плода и позволяет пролонгировать беременность. Кроме того, переливание плоду отмытых эритроцитов способствует ослаблению иммунного ответа организма беременной путем снижения относительного количества резус-положительных эритроцитов и поддержать гематокрит плода на уровне выше критического.
Для внутрисосудистой гемотрансфузии проводят кордоцентез и берут кровь плода для определения предтрансфузионного гематокрита. После получения пробы крови плода рассчитывают объем трансфузии с учетом уровней гематокрита плода, донорской крови и срока беременности. Для внутриутробного переливания крови используется эритроцитная масса [отмытые эритроциты 0(I) группы резус-отрицательной крови], скорость введения не должна превышать 1-2 мл/мин.
По окончании гемотрансфузии берут контрольную пробу крови плода для определения посттрансфузионного гематокрита и гемоглобина с целью оценки эффективности процедуры.
Необходимость повторных гемотрансфузий определяется сроком беременности и уровнем постоперационного гематокрита. Принимают во внимание, что при гемолитической болезни скорость снижения гематокрита составляет в среднем 1% в сутки.
Внутриутробные переливания крови можно проводить неоднократно до 32-34 нед беременности, после этого срока решают вопрос о досрочном родоразрешении.
Тактика ведения родов. Способ родоразрешения беременных с резус-сенсибилизацией зависит от состояния плода, срока беременности, паритета и подготовленности родовых путей.
При отсутствии клинических признаков тяжелой формы заболевания плода, сроке беременности, близком к доношенному (более 36 нед), и зрелой шейке матки роды ведут через естественные родовые пути. Если заболевание плода тяжелое, то предпочтительнее оперативное родоразрешение, так как оно позволяет избежать дополнительной травматизации плода во время родов.
Гемолитическая болезнь новорожденных. Диагностика. Сразу после рождения ребенка у женщин с резус-отрицательной кровью или резус-сенсибилизацией необходимо определить резус-принадлежность и группу крови новорожденного и содержание гемоглобина и билирубина в крови, взятой из пуповины.
В раннем неонатальном периоде выделяют три основные клинические формы гемолитической болезни новорожденного:
- гемолитическая анемия без желтухи и водянки;
- гемолитическая анемия с желтухой;
- гемолитическая анемия с желтухой и водянкой.
Гемолитическая анемия без желтухи и водянки - наиболее легкая форма заболевания. У детей при рождении отмечается бледность кожных покровов, в крови снижен уровень гемоглобина (менее 140 г/л). Желтуха отсутствует или проявляется на 2-3-и сутки, выражена незначительно и исчезает к 7-10-му дню.
Гемолитическая анемия с желтухой встречается наиболее часто и сопровождается желтушным окрашиванием кожных покровов и слизистых оболочек при рождении или вскоре после рождения (в отличие от физиологической желтухи, которая проявляется на 2-3-и сутки). Отмечаются увеличение печени и селезенки; наряду со снижением гемоглобина в периферической крови новорожденного наблюдается гипербилирубинемия.
Без лечения в ближайшие 2-3 дня желтуха нарастает, общее состояние ухудшается, появляются симптомы билирубиновой интоксикации (вялость, снижение врожденных безусловных рефлексов, приступы апноэ). Возможно развитие билирубиновой энцефалопатии (ядерной желтухи): беспокойство, повышение тонуса разгибательной мускулатуры, тонические судороги, симптом "заходящего солнца".
Гемолитическая анемия с желтухой и водянкой - наиболее тяжелая форма заболевания, она нередко заканчивается внутриутробной гибелью плода или смертью новорожденного. При этой форме наблюдаются выраженная анемия и тромбоцитопения, генерализованные отеки, скопление жидкости в серозных полостях (асцит, гидроперикард, гидроторакс) и геморрагический синдром. Печень, селезенка резко увеличены и уплотнены вследствие очагов экстрамедуллярного кроветворения.
Гемолитическая болезнь новорожденного классифицируется также по степени тяжести в зависимости от выраженности гемолиза (табл. 32.2).
Клинические признаки | Степень тяжести гемолитической болезни | ||
легкая | средняя | тяжелая | |
Анемия (гемоглобин в пуповинной крови) | >150 г/л (>5 г%) | 149-100 г/л (15,1-10,0 г%) | ‹100 г/л (‹10 г%) |
Желтуха (билирубин в пуповинной крови) | ‹85,5 мкмоль/л (‹5,0 мг%) | 85,6-136,8 мкмоль/л (5,1-8,0 мг%) | >136,9 мкмоль/л (>8,0 мг%) |
Отечный синдром | Пастозность подкожной клетчатки | Пастозность и асцит | Универсальный отёк |
Лечение. Легкая форма гемолитической болезни новорожденного требует ежедневного контроля уровня гемоглобина, гематокрита и билирубина. По показаниям проводится коррекция анемии резус-отрицательной эритроцитной массой, соответствующей группе крови новорожденного. Эритроцитную массу следует переливать через катетер, введенный в центральную или периферическую вену, с помощью шприцевого насоса со скоростью 10-12 мл/ч, желательно под контролем АД, ЧСС и диуреза.
Показана также инфузионная терапия, направленная на дезинтоксикацию организма новорожденного, повышение билирубинсвязывающей способности альбумина крови и коррекцию метаболических нарушений. В состав инфузионных сред включаются 10% раствор глюкозы, 5% раствор альбумина по 8-10 мл/кг, плазму по 10-15 мл/кг. Общий объем вводимой жидкости должен составлять 100-150% физиологической потребности новорожденного.
Параллельно проводят фототерапию, которая направлена на разрушение в коже новорожденного непрямого билирубина до его водорастворимых дериватов. Для светолечения используют лампы дневного или синего света с длиной волны 460-480 нм. Фототерапия проводится в кювезе в непрерывном или импульсном режиме.
Лечение детей с гемолитической болезни новорожденного средней тяжести, помимо указанных инфузионной терапии и фототерапии, включает также внутрижелудочное капельное (со скоростью 10-12 мл/ч) введение жидкости для предотвращения холестаза и абсорбции билирубина, экскретируемого в кишечник. Общий объем жидкости должен составлять 60-70 мл/кг (плазма 10-15 мл/кг, 25% раствор сульфата магния 5-8 мл/кг, 4% раствор хлорида калия 5-8 мл/кг, 5% раствор глюкозы до полного объема).
Основным методом лечения гипербилирубинемии у новорожденного является заменное переливание крови (ЗПК).
ЗПК бывает ранним (в 1-2-е сутки после рождения) и поздним (с 3-х суток после рождения). Раннее ЗПК проводится с целью выведения из кровотока новорожденного билирубина и заблокированных антителами эритроцитов, повышение уровня гемоглобина. Целью позднего ЗПК является в основном предупреждение билирубиновой интоксикации.
Показания к раннему ЗПК содержание общего билирубина в пуповинной крови более 100 мкмоль/л; почасовой прирост билирубина более 10 мкмоль/л на фоне проводимой интенсивного лечения и фототерапии для доношенного и зрелого ребенка; - почасовой прирост 8 мкмоль/л для недоношенного ребенка.
Показаниями к позднему ЗПК являются абсолютные цифры общего билирубина более 308-340 мкмоль/л у доношенного ребенка и более 272-290 мкмоль/л у недоношенного ребенка с массой тела более 2000 г.
При гемолитической болезни, вызванной резус-конфликтом, для ЗПК используется одногруппная резус-отрицательная кровь или смесь резус-отрицательной эритроцитной массы и одногруппной с ребенком плазмы. При несовместимости по групповым факторам переливают эритроцитную массу 0(I) группы (соответственно резус-принадлежности ребенка) и одногруппной плазмы.
Ребенка прикладывают к груди после уменьшения желтухи и снижения билирубина при общем удовлетворительном состоянии, как правило, с 5-6-го дня после рождения. Антитела, содержащиеся в молоке, не проникают через кишечную стенку из-за крупнодисперсности и не оказывают вредного влияния на уровень гемоглобина.
Основным методом лечения новорожденных с отечной формой гемолитической болезни плода является немедленное восполнение ОЦК и уровня гемоглобина в целях борьбы с выраженной гипоксией и анемией. В связи с сердечно-сосудистой недостаточностью первое ЗПК можно провести "малым" объемом из расчета 60-70 мл/кг чистой эритроцитной массы.
При выраженной дыхательной недостаточности, обусловленной отеком легких, показана ИВЛ до купирования легочной недостаточности. При выраженном асците проводят лапароцентез под контролем УЗИ (фото). Для предупреждения гипотонии у новорожденного асцитическую жидкость следует выводить медленно. В связи с выраженной сердечной недостаточностью, обусловленной дистрофией миокарда, показаны терапия сердечными гликозидами по общепринятой методике, ранняя профилактика холестаза.
Проведение фототерапии при отечной форме заболевания ограничено, так как в первые дни жизни наблюдается накопление большого количества прямого билирубина и возможно такое осложнение, как "синдром бронзового младенца".
Профилактика резус-сенсибилизации заключается в своевременном проведении:
- любого переливания крови с учетом резус-принадлежности крови пациента и донора;
- сохранении первой беременности у женщин с резус-отрицательной кровью;
- специфической профилактики у женщин с резус-отрицательной кровью без явлений сенсибилизации путем введения антирезус-иммуно-глобулина после любого прерывания беременности (роды резус-положительным плодом, аборты, внематочная беременность).
Для специфической профилактики резус-сенсибилизации используют антирезус-иммуноглобулин (специфические антитела). Эффект антирезус-иммуноглобулина обусловлен торможением иммунного ответа в результате связывания имеющихся в организме матери антигенов.
Препарат вводят по одной дозе (300 мкг) внутримышечно однократно: родильнице - не позже чем через 72 ч после родов (желательно в течение первых 2 ч) непосредственно или после искусственного прерывания беременности или операции по поводу внематочной. После кесарева сечения, ручного отделения плаценты, а также при отслойке плаценты дозу препарата необходимо удвоить (600 мкг).
Очень важна также антенатальная профилактика резус-сенсибилизации всем беременным с резус-отрицательной кровью без резус-антител в сыворотке крови. Это обусловлено тем, что трансплацентарный переход эритроцитов плода в материнский кровоток отмечается с 28 нед беременности и сенсибилизация может начаться до родоразрешения. В 28 нед беременности все неиммунизированные беременные с резус-отрицательной кровью при условии, что отец плода резус-положительный, должны получать профилактически 300 мкг анти-Rh0(D)-иммуноглобулина ГиперРОУ С/Д, который не проходит через плаценту и специально разработан для антенатальной профилактики резус-сенсибилизации. Антенатальная профилактика проводится также после инвазивных процедур (биопсия хориона, амниоцентез, кордоцентез) независимо от срока беременности. При рождении ребенка с резус-положительной кровью антирезус-гаммаглобулин вводят повторно в течение первых 72 ч после родов.
Женщинам с резус-сенсибилизацией и чрезвычайно отягощенным анамнезом (гибель детей от гемолитической болезни) необходимо знать о возможности наступления беременности плодом с резус-отрицательной кровью с помощью экстракорпорального оплодотворения. При ЭКО в процессе преимплантационной диагностики отбираются и переносятся в матку именно те эмбрионы, которые наследуют материнскую резус-отрицательную кровь. При этом обязательным условием является гетерозиготность отца по резус-фактору (Dd), когда в 50% возможно ожидать, что плод будет с резус-отрицательной кровью.
РОДОВЫЕ ТРАВМЫ
Под родовой травмой подразумевают механическое повреждение плода (нарушение целостности тканей и органов), возникающее при прохождении через родовые пути. Различают родовые повреждения центральной и периферической нервной системы, мягких тканей и костей плода. Внутричерепные кровоизлияния могут также возникать на фоне хронической и острой гипоксии, особенно у недоношенных детей.
Причиной родовой травмы у новорожденного могут быть быстрые, стремительные и затяжные роды, крупная масса плода, сужение размеров таза, влагалищные родоразрешающие операции (наложение щипцов, вакуум-экстракция, поворот плода и извлечение его за ножку) при отсутствии необходимых условий или нарушении техники.
Хроническая и острая гипоксия плода повышают вероятность родовой травмы.
Повреждения ЦНС (головного и спинного мозга). Травматические повреждения головного мозга (кровоизлияния) возникают относительно редко, чаще их причиной является гипоксия. Различают эпидуральные, субдуральные, субарахноидальные и внутримозговые кровоизлияния, которые нередко сопровождаются повреждением костей черепа, твердой мозговой оболочки и ее производных (венозные синусы, намет мозжечка и др.). Эпидуральные кровоизлияния локализуются на внутренней поверхности черепа между костью и надкостницей, субдуральные кровоизлияния - между твердой и мягкой мозговыми оболочками, субарахноидальные кровоизлияния - между паутинной оболочкой и поверхностью полушарий головного мозга.
Вне зависимости от генеза клиническая картина у новорожденных зависит от локализации и размеров кровоизлияния, а также от сопутствующих повреждений.
В остром периоде родовой травмы ЦНС наблюдается возбуждение (беспокойный крик, учащение дыхания и тахикардия, судороги, тремор конечностей, общее беспокойство). Помимо общемозговых симптомов, нередко наблюдается очаговая симптоматика. Период возбуждения может сменяться угнетением с общей вялостью, снижением мышечного тонуса, адинамией, слабым криком, отсутствием сосания, понижением АД, бледностью кожных покровов.
Наиболее выраженная клиническая картина у ребенка наблюдается при разрыве намета мозжечка, что связано с частым развитием внутримозжечковых гематом, а также компрессией ствола головного мозга. У детей с данным видом родовой травмы отмечаются признаки грубой внутричерепной гипертензии, гипорефлексия, гипотония, тонические судороги, опистотонус, сосудистый коллапс, нарушения дыхания, кома. Прогноз для жизни крайне неблагоприятен.
Большое значение в диагностике повреждений головного мозга имеет нейросонография, которая позволяет выявлять различные изменения ЦНС, а также спинномозговая пункция. При микроскопии спинномозговой жидкости выявляются измененные и неизмененные эритроциты, смешанный нейтрофильно-лейкоцитарный цитоз, повышенный уровень белка, макрофаги.
Травматические повреждения спинного мозга особенно часто возникают в шейном отделе из-за нефизиологического вытяжения головы и шеи плода во время оказания ручного пособия при головном и особенно при тазовом предлежании плода. Грубая тяга и ротация головки, использование метода Кристеллера приводят к увеличению расстояния между основанием черепа и шейными позвонками, повреждению сосудов вертебробазилярной системы, каудального отдела ствола, шейных сегментов спинного мозга, корешков.
Смерть новорожденного в результате повреждения спинного мозга может наступить на фоне острой дыхательной и сердечно-сосудистой недостаточности. У выживших детей натальная спинальная травма может проявляться парезами и параличами конечностей.
Диагноз травмы спинного мозга подтверждается рентгенологически и при компьютерной томографии.
Родовые повреждения периферической нервной системы. Паралич (парез) лицевого нерва обычно наступает при его сдавлении акушерскими щипцами или костями таза матери (узкий таз), при переломе височной кости или костей основания черепа. Паралич чаще возникает у детей, рожденных в лицевом предлежании. Асимметрия лица особенно видна при плаче или крике новорожденного. В большинстве случаев парезы лицевого нерва самостоятельно проходят в течение 1-го месяца жизни.
Повреждение плечевого сплетения у новорожденных, как правило, связаны с чрезмерной тягой за головку плода, неправильным наложением акушерских щипцов, с нарушением техники оказания ручного пособия при тазовом предлежании плода и др. Повреждение плечевого сплетения может ограничиваться мелкими кровоизлияниями и отеком вокруг нервного ствола, но бывает и полный разрыв нервов. Поражение плечевого сплетения чаще одностороннее. Клиническая картина зависит от локализации повреждения: верхний паралич - 5-6-й шейный сегмент (паралич Эрба-Дюшенна), нижний паралич - 7-8-й шейный и 1-2-й грудной сегменты (паралич Дежерина-Клюмпке). Общий паралич плечевого сплетения (сочетанный паралич всех компонентов плечевого сплетения) встречается редко.
Лечение травм плечевого сплетения заключается в ранней иммобилизации конечности в физиологическом положении на 3-6 нед.
Родовая травма мягких тканей и костей. Кефалогематома является результатом кровоизлияния под надкостницу, которое возникает вследствие длительного нахождения головки плода в одной из плоскостей малого таза, а также при наложении акушерских щипцов или вакуум-экстрактора. При пальпации головки новорожденного определяется флюктуация в области кефалогематомы, у ее основания определяется плотный валик.
В большинстве случаев специального лечения не требуется, так как кефалогематома постепенно рассасывается. При очень больших кровоизлияниях возникает необходимость хирургического вмешательства (опорожнение гематомы).
Перелом ключицы является наиболее частым видом родовой травмы. Клинически перелом ключицы проявляется беспокойством ребенка при пеленании, над местом перелома отмечается припухлость, при пальпации можно выявить крепитацию костных отломков. Однако нередко перелом ключицы остается недиагностированным и распознается на 5-7-й день, когда образуется костная мозоль. Диагноз уточняют с помощью рентгенографии. Фиксированное положение руки с поврежденной стороны способствует более быстрому сращению ключицы. К концу 2-й недели жизни ребенка ключица, как правило, срастается.
Перелом плечевой кости чаще всего происходит в верхней и средней третях диафиза и может быть полным и поднадкостничным. Пальпаторно в месте перелома определяются припухлость, деформация конечности, крепитация костных отломков.
Характер перелома уточняется при рентгенографии. При отсутствии смещения отломков ограничиваются мягкой повязкой, а при смещении производят репозицию отломков и фиксируют конечность в гипсовой торакобрахиальной повязке.
Перелом бедренной кости происходит обычно при извлечении плода за тазовый конец или при неправильном оказании ручного пособия при тазовом предлежании. Чаще повреждается средняя часть диафиза. Клинически это проявляется вынужденным положением конечности, при смещении отломков бедро деформировано и ощущается крепитация костных отломков. Лечение зависит от вида перелома, который уточняют с помощью рентгенографии. При отсутствии смещения костных отломков ногу новорожденного фиксируют в гипсовой лонгете. При смещении отломков требуются их репозиция и фиксация конечности путем вытяжения. Бедренная кость обычно срастается в течение 16-18 дней.
ДЫХАТЕЛЬНЫЕ РАССТРОЙСТВА У НОВОРОЖДЕННЫХ
Синдром дыхательных расстройств новорожденного проявляется в первую очередь дыхательной недостаточностью.
Наиболее часто синдром дыхательных расстройств наблюдается у недоношенных детей, что связано с незрелостью системы сурфактанта (созревание системы сурфактанта завершается к 35-36 нед) и его дефицитом к моменту рождения. Недостаток сурфактанта - поверхностно активного вещества, синтезируемого альвеолоцитами 2-го типа, - приводит к спадению альвеол на выдохе и в результате, к снижению площади газообмена в легких, гипо-ксемии и гиперкапнии. Незрелость системы сурфактанта приводит к развитию гиалиновых мембран, отечно-геморрагического синдрома и др.
Гипоксия плода как патогенетический фактор синдрома дыхательных расстройств имеет не меньшее значение, чем гестационный возраст к моменту рождения. Гипоксия может приводить к вазоконстрикции и гипоперфузии легких, инактивации альвеолярного сурфактанта.
Одной из причин синдрома дыхательных расстройств является аспирация околоплодных вод, мекония и крови, которые вызывают обструкцию дыхательных путей и повреждают сурфактантную систему легких, в результате чего у новорожденных развивается дыхательная недостаточность.
Развитию синдрома дыхательных расстройств способствуют задержка резорбции фетальной жидкости из дыхательных путей новорожденных, персистирующие фетальные коммуникации, а также пневмония.
Острое развитие дыхательной недостаточности в первые часы и дни после рождения может быть обусловлено пороками развития верхних дыхательных путей и легких (атрезия хоан, пищеводно-трахеальные свищи, долевая эмфизема, агенезия и гипоплазия легких, поликистоз, диафрагмальная грыжа).
Наиболее частые проявления синдрома дыхательных расстройств - пневмопатии (ателектазы легких, болезнь гиалиновых мембран, отечно-геморрагический синдром, аспирационный синдром) и пневмонии.
Ателектаз легких - сохранение в течение 48 ч после рождения участков нерасправившейся или вторично спавшейся после первого вдоха легочной ткани. Основными причинами ателектазов являются недоразвитие дыхательного центра, снижение его возбудимости, незрелость легочной ткани, нарушение образования сурфактанта, в связи с чем наиболее часто эта патология отмечается у недоношенных детей. Различают рассеянные (мелкие) и обширные (сегментарные и полисегментарные) ателектазы. Сегментарные ателектазы наблюдаются у более зрелых детей.
Болезнь гиалиновых мембран - представляет собой отложение однородного или глыбчатого гиалиноподобного вещества на внутренней поверхности альвеол, альвеолярных ходов и респираторных бронхиол; чаще наблюдается у недоношенных и незрелых детей. Важными патогенетическими факторами являются незрелость легких, гипоксия, гиперкапния, повышенная проницаемость капилляров, нарушение свертывания крови. Патогенез гиалиновых мембран связан также с нарушением синтеза сурфактанта.
Заболевание проявляется через 1-2 ч после рождения постепенно усиливающимися нарушениями дыхания. Типичным рентгенологическим признаком заболевания является "нодозно-ретикулярная сетка"; в наиболее тяжелых случаях на рентгенограмме наблюдаются гомогенные затемнения легочных полей различной интенсивности, делающие неразличимыми контуры сердца, больших сосудов и диафрагмы.
Отечно-геморрагический синдром остается одной из самых тяжелых пневмопатий новорожденных. Избыточное накопление жидкости в тканях легких связано с повышенной проницаемостью капилляров вследствие гипоксемии, ацидоза, гипопротеинемии, гиперпрогестеронемии, застойного полнокровия вследствие сердечной недостаточности.
При этой форме пневмопатии наблюдается выраженный синдром дыхательных расстройств: одышка с втяжением податливых мест грудной клетки, апноэ; нарушения функций сердечно-сосудистой системы: аритмия, цианоз, бледность кожных покровов; возникают или усиливаются судороги, нарушаются сосание и глотание. Рентгенологические детали легочных структур выглядят расплывчатыми, воздухоносность легочной ткани снижается, особенно в прикорневых и корневых отделах. При значительной отечности все легкое становится гомогенно затемненным.
Аспирационный синдром чаще развивается у более зрелых и достаточно крупных новорожденных. Массивная аспирация с обтурацией просвета бронхов может быть причиной тяжелой асфиксии в первые часы после рождения. При менее интенсивной аспирации развиваются макрофагальная реакция эпителия бронхов и асептический лейкоцитарный альвеолит. Инфицирование аспирационных масс нередко сопровождается развитием бактериальной пневмонии.
На рентгенограмме видны сливные очаги уплотненной легочной ткани, напоминающие воспалительную инфильтрацию легких; возможно образование обтурационных ателектазов легких.
Пневмонии новорожденных. По времени возникновения выделяют внутриутробные и постнатальные пневмонии.
Истинные внутриутробные пневмонии встречаются редко, преимущественно при специфических внутриутробных инфекциях (листериоз, цитомегалия); чаще пневмонии (в том числе проявившиеся в первые 2 сут после рождения) развиваются после рождения. У детей с пневмопатиями вероятность развития пневмонии повышена.
В этиологии пневмонии имеют значение различные микроорганизмы, вирусы, пневмоцисты, грибы и микоплазмы; в большинстве случаев пневмония имеет смешанную этиологию. В последние годы в этиологии пневмонии возросла доля клебсиелл, кишечной палочки, протея и других грамотрицательных микроорганизмов.
Инфекционный агент может попадать в организм новорожденного трансплацентарно, при аспирации околоплодных вод, воздушно-капельным путем. При пневмонии у новорожденных формируется порочный круг: дыхательная недостаточность вызывает нарушения гомеостаза, которые в свою очередь отрицательно влияют на функцию внешнего дыхания. Пневмония у новорожденных сопровождаются физикальными изменениями в легких, гипертермией, лейкоцитозом, а также гипоксией, гиперкапнией, дыхательным или смешанным ацидозом.
Выраженность дыхательной недостаточности при различных формах пневмопатий и пневмонии оценивают по шкале Сильвермана, на основании которой делают вывод о наличии и динамике синдрома дыхательных расстройств и объеме респираторной помощи.
Оценка 1-3 балла указывает на легкую дыхательную недостаточность, 4-5 баллов - на среднетяжелую, 6 баллов и более - на тяжелую.
С момента появления первых симптомов дыхательных расстройств новорожденному под контролем газового состава крови начинают проводить оксигенотерапию для обеспечения адекватного снабжения тканей кислородом (в кювезе, с помощью маски, носового катетера). При неэффективности оксигенотерапии и при тяжелом синдроме дыхательных расстройств показаны интубация трахеи и проведение аппаратной ИВЛ.
В комплексе терапевтических мероприятий, помимо инфузионной терапии, по показаниям используют препараты сурфактанта (экзосурф, куросурф).
Профилактика синдрома дыхательных расстройств новорожденных путем назначения глюкокортикоидных препаратов беременным с угрозой преждевременных родов (см. главу 18 "Невынашивание беременности").
ГНОЙНО-СЕПТИЧЕСКИЕ ЗАБОЛЕВАНИЯ НОВОРОЖДЕННЫХ
Анатомо-физиологические особенности, сниженная иммунная реактивность обусловливают высокую восприимчивость новорожденных к гнойно-воспалительным инфекциям. Инфицирование может наступить как во внутриутробном периоде, так и сразу после рождения.
У новорожденных грань между локальными и генерализованными формами гнойной инфекции в значительной мере условна, так как возможен быстрый переход местного воспалительного процесса в генерализованную инфекцию.
К локальным формам относятся гнойно-воспалительные заболевания кожи и слизистых оболочек.
Кожа новорожденных подвергается инфицированию наиболее часто. Различные клинические формы поражения при этом объединяют под названием пиодермии. Пиодермии развиваются под воздействием гноеродных микроорганизмов (стафилококки, стрептококки, гонококки, протей, кишечная палочка, синегнойная палочка и др.).
Везикулопустулез - поверхностная стафилодермия новорожденных - встречается наиболее часто. Процесс локализуется в устьях экзокринных потовых желез. Возникновению заболевания могут способствовать перегревание, повышенная потливость, мацерация. Фолликулярные пустулы размером с просяное зерно или горошину располагаются по всему кожному покрову, чаще локализуются на спине, в складках, на коже шеи, груди, в области ягодиц и на волосистой части головы. Лечение местное (бриллиантовая зелень, метилвиолет, 2% раствор перманганата калия). Антибактериальная терапия, как правило, не проводится.
Псевдофурункулез - заболевание мерокринных потовых желез у детей грудного возраста (множественные абсцессы потовых желез, псевдофурункулез Фингера). Развитию заболевания способствуют недоношенность, иммунодефицитные состояния, искусственное вскармливание, дефекты ухода, повышенная потливость. Высыпания чаще всего располагаются на затылке, спине, ягодицах, бедрах, возможно распространение на кожу груди и живота. Заболевание сопровождается нарушением общего состояния с повышением температуры тела. Местное лечение осуществляют 2% спиртовыми или водными растворами анилиновых красителей, присыпками из окиси цинка (10 %) с тальком. По показаниям назначают антибиотики (с учетом данных антибиотикограммы) и иммунозаместительную терапию.
Эпидемическая пузырчатка новорожденных (пемфигоид новорожденных) - наиболее контагиозная форма стафилодермии. Это генерализованное гнойное поражение кожи у детей первых дней жизни проявляется множественной диссеминированной полиморфной сыпью на коже туловища, конечностей, крупных складок. Процесс может распространяться на слизистые оболочки рта, носа, глаз и гениталий, сопровождается гипертермией, снижением аппетита, диареей, реактивными изменениями в крови и моче. Возможны тяжелые септические осложнения.
Наиболее тяжелой формой эпидемической пузырчатки новорожденных является эксфолиативный дерматит новорожденных (болезнь Риттера). Возникает эритродермия с множественными пузырями, обширными эрозивными поверхностями. Заболевание начинается с покраснения кожи вокруг рта или пупка. В течение 1-2 дней эритема распространяется по всему телу, вскоре происходит лоскутная отслойка эпидермиса. Лишенные эпидермиса участки кожи напоминают ожог II степени. Общее состояние большинства больных детей тяжелое из-за септического течения заболевания.
Лечение местное, как при везикулопустулезе, а также общее - антибиотикотерапия с учетом чувствительности микроорганизмов.
Флегмона новорожденных - воспаление подкожной клетчатки, наблюдаемое в 1-й месяц после жизни, относится к тяжелым гнойно-воспалительным заболеваниям кожи, часто приводит к развитию сепсиса. Входными воротами инфекции служат кожа или пупочная рана. Заболевание начинается остро с повышением температуры тела до 39-40°С. На коже появляется ограниченный болезненный участок покраснения и уплотнения, чаще в крестцово-копчиковой области, на груди и шее. По мере прогрессирования заболевания площадь воспалительного очага быстро увеличивается, в центре возникает участок размягчения с образованием в дальнейшем свища. Новорожденному требуется экстренное хирургическое лечение в условиях педиатрического стационара.
Гнойный мастит может возникнуть у детей с физиологическим нагрубанием молочных желез, особенно при пиодермии. У большинства детей увеличение железы одностороннее с гиперемией, отеком, нередко размягчением в центре. Заболевание может осложниться флегмоной. Лечение местное, общее (антибиотикотерапия), по показаниям - хирургическое.
Омфалит (воспаление тканей в области пупочной ямки) чаще возникает в период заживления пупочной ранки в результате ее инфицирования. В области пупочной ямки появляются гиперемия кожи и припухлость тестоватой консистенции, которые распространяются на окружающие ткани. Из пупка выделяется гной. Чаще процесс остается отграниченным, но возможно развитие флегмоны передней брюшной стенки. Гнойное расплавление тканей по ходу пупочных сосудов может приводить к образованию гнойников в отдаленных от пупка местах. Лечение местное и общее (антибиотикотерапия).
Конъюнктивит - воспаление слизистой оболочки глаза жизни, которое чаще вызывается бактериями, реже - вирусами. Глаз краснеет, появляются слизисто-гнойное отделяемое, отечность, мелкие кровоизлияния под конъюнктиву. Показано местное лечение - 20% раствор сульфацила натрия (глазные капли) или закладывание за нижнее веко тетрациклина гидрохлорида 1%.
Конъюнктивит гонорейный (гонобленнорея) возникает на 2-3-й день после рождения. Заражение происходит через родовые пути матери, больной гонореей. Клинически проявляется выраженным отеком век новорожденного, гиперемией, отечностью, кровоточивостью конъюнктивы. В дальнейшем появляется обильное гнойное отделяемое желто-зеленого цвета (при бактериологическом исследовании в мазках обнаруживается гонококк). Возможна мацерация эпителия роговицы с возникновением тяжелых язв. Местное лечение и системную антибактериальную терапию проводят в условиях педиатрического стационара. В настоящее время гонобленнорея встречается редко в связи с обязательным проведением профилактических мероприятий.
К генерализованным формам гнойно-септических заболеваний относится сепсис новорожденных - общее тяжелое инфекционное заболевание, которое становится следствием активизации очага инфекции в организме и представляет собой не нозологическую форму, а фазу или стадию инфекционного процесса. Новорожденные предрасположены к сепсису, что связано с незрелостью ряда органов и система, слабостью иммунобиологических и ферментативных реакций, повышенной сосудистой проницаемостью, склонностью к генерализации патологических процессов.
Сепсис чаще вызывают стафилококки и стрептококки, кишечная палочка, клебсиелла, реже - пневмококки, менингококки, палочка Пфейффера, синегнойная палочка, сальмонеллы, плесневые грибы. Заражение может произойти как внутриутробно (инфекционные гнойные заболевания матери, аспирация инфицированных околоплодных вод), так и после рождения ребенка (больные мать, персонал, загрязненные предметы ухода и питание). Чаще всего входными воротами инфекции у новорожденных становится пупочная ранка. В зависимости от входных ворот инфекции говорят о пупочном, отогенном, кожном сепсисе и др.
Наиболее часто встречается пупочный сепсис. Среди возбудителей наибольшее значение имеют стафилококки и кишечная палочка. Первичный септический очаг редко бывает одиночным - чаще очаги встречаются в разных сочетаниях: в пупочных артериях и ямке или в пупочной вене и артериях. При пальпации иногда определяют утолщенные пупочные артерии и/или вены. При тромбофлебите наблюдается вздутый и напряженный живот с расширенными венозными сосудами, идущими вверх от пупка, пастозная и блестящая поверхность кожи, увеличение печень и селезенки.
Септический процесс может протекать по типу септицемии или септикопиемии. Септицемия наблюдается в основном у недоношенных и ослабленных доношенных детей и сопровождается выраженными явлениями интоксикации без видимых локальных гнойно-воспалительных очагов. При септикопиемии образуются пиемические очаги (абсцесс, флегмона, деструктивная пневмония, гнойный менингит, остеомиелит и др.).
Любое подозрение на сепсис требует экстренного перевода новорожденного в инфекционное отделение педиатрического стационара.