Онкология: модульный практикум. Учебное пособие. / Давыдов М.И., Ведьшер Л.З., Поляков Б.И., Ганцев Ж.Х., Петерсон С.Б. - 2008.-320 c.
|
|
|
|
МОДУЛЬ 5 ОПУХОЛИ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА
В структуре заболеваемости злокачественные опухоли пищеварительного тракта составляют около 25% у женщин и 30% у мужчин.
Цель изучения модуля: приобретение практических умений, необходимых для ранней диагностики злокачественных опухолей пищевода, желудка, печени, внепечёночных желчных протоков, поджелудочной железы, двенадцатиперстной, ободочной и прямой кишки.
5.1. РАК ПИЩЕВОДА
Проблема диагностики и лечения новообразований пищевода представляет большой интерес. В структуре онкологической заболеваемости в России рак пищевода составляет 3%, причём мужчины болеют чаще женщин примерно в 3 раза. Самая высокая заболеваемость раком пищевода отмечена в Иране (более 150 на 100 тыс. населения) и других странах Каспийского пояса, центральном и северном районе Китая. Кроме того, много случаев заболевания регистрируют в Южной Америке и некоторых регионах Африки. Большая частота рака пищевода обусловлена особенностями быта и диеты местного населения.
Показатели смертности от рака пищевода близки к показателям заболеваемости, в 2003 году смертность на первом году заболевания составила 66,7%, причиной этого выступает крайне неблагоприятный прогноз заболевания, так пятилетняя выживаемость колеблется от 5% в Европе до 10% в США и не имеет тенденции к улучшению.
С точки зрения дифференциальной диагностики важно установить частоту рака по отношению к доброкачественным заболеваниям пищевода. Согласно данным статистики, 20% приходится на воспалительные заболевания, доброкачественные опухоли и травматические повреждения пищевода, 80% - на злокачественные опухоли. В настоящее время удовлетворительное решение вопроса диагностики рака пищевода в раннем периоде тормозится не столько сложностью современных методов обследования больных, сколько недостаточным опытом врачей и оснащённостью медицинских практических
учреждений современными аппаратами, позволяющими при использовании рациональных методик обеспечить точную диагностику на всех этапах контакта больного с врачом.
Общая цель практического занятия
• На основе знания анатомии, нормальной и патологической физиологии пищевода, типичных для рака этой локализации клинических проявлений, данных лабораторных и инструментальных методов исследования студент должен уметь:
- сформулировать предварительный диагноз заболевания;
- провести дифференциальную диагностику рака пищевода;
- определить топический и клинический диагноз заболевания.
• На основе знаний о современных возможностях в лечении рака пищевода кратко сформулировать план лечения и определить возможный прогноз.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Анатомия и физиология
Пищевод начинается на уровне перстневидного хряща (IV шейный позвонок), его длина составляет в среднем
Пищевод имеет четыре оболочки:
• внутренняя слизистая оболочка выстлана многослойным плоским неороговевающим эпителием;
• подслизистая оболочка;
• двухслойная мышечная оболочка из наружного слоя продольных мышечных волокон и внутренних циркулярных;
• наружная адвентициальная оболочка.
В верхнюю треть пищевода кровь поступает из нижней щитовидной артерии, в среднюю из пищеводной ветви аорты, в нижнюю из левой желудочной артерии. Кровоотток осуществляют от верхней трети пищевода нижняя щитовидная вена, от средней трети непарная вена, от нижней трети непарная и левая желудочная вены.
Анатомически пищевод делят на шейный и внутригрудной отделы.
• Шейный отдел берёт начало от уровня перстневидного хряща до уровня яремной вырезки. Шейные и надключичные лимфатические узлы - регионарные лимфатические узлы для этого отдела пищевода.
• Внутригрудной отдел подразделяют на верхний грудной, начиная от уровня яремной вырезки до уровня бифуркации трахеи, средний грудной, занимающий верхнюю половину дистанции между бифуркацией трахеи и пищеводно-желудочным переходом, и нижний грудной отдел, расположенный в нижней половине этого расстояния. Медиастинальные и околожелудочные лимфатические узлы - регионарные лимфатические узлы для внутригрудного отдела пищевода.
Факторы риска и предопухолевые заболевания
К предрасполагающим факторам относят употребление очень горячей, острой, грубой пищи, недостаток витаминов (ретинола и рибофлавина) и некоторых микроэлементов (меди, цинка и железа). Немаловажные факторы риска - курение и употребление крепких спиртных напитков. Предрасполагающими факторами также признаны тилоз (врождённый гиперкератоз ладоней и стоп) и синдром Пламмера-Винсона (железодефицитная анемия, атрофия слизистых, гипохлоргидрия и дисфагия).
К предраковым заболеваниям относят эзофагит, рубцовые стриктуры, язвы, полипы, пищевод Баррета, синдром Пламмера-Винсона, липомы, ахалазию и др.
• Пищевод Баррета - облигатный предрак, патологическое состояние, характеризующееся замещением эпителия пищевода железистым с формированием структур соответствующих слизистой оболочке желудка. Особое место среди предраковых изменений занимает дисплазия, нарастающая вплоть до появления рака in situ.
• Синдром Пламмера-Винсона часто встречают в районах, эндемичных по раку пищевода (на побережье Каспийского и Аральского морей, в районах Заполярья). Клинически он проявляется анемией, ахлоргидрией, атрофией слизистых оболочек с последующим появлением гиперкератических участков неороговевающего плоского эпителия полости рта, глотки и пищевода. Это может быть вызвано недостатком содержания железа и витаминов при однообразном питании.
• Пептические язвы пищевода обычно сочетаются с язвенной болезнью желудка и двенадцатиперстной кишки. Язвы, локализующиеся в нижней трети пищевода, возникают вследствие недостаточности кардиального жома желудка или грыжи пищеводного отверстия диафрагмы. По некоторым данным, пептические язвы пищевода возникают вследствие образования эктопированным желудочным эпителием нижних отделов пищевода агрессивного желудочного сока. В клинике превалируют следующие симптомы: боль за грудиной, усиливающаяся во время еды, возможна дисфагия вследствие эзофагоспазма, изжога, отрыжка и срыгивание.
• Полипы - образования, исходящие из-под слизистого слоя, покрытые железистым эпителием. Папилломы - гиперпластические разрастания покровного эпителия и подлежащей соединительной ткани. И при полипах, и при папилломах клиника связана в основном с осложнениями этих образований (ущемление, изъязвление, кровотечение и явления дисфагии).
• Эзофагиты. Острый эзофагит развивается вследствие раздражения слизистой оболочки пищевода пищей и химическими веществами, может наблюдаться при острых инфекционных заболеваниях, острых фарингитах, гастритах. Подострые эзофагиты возникают при повторяющихся воздействиях вышеперечисленных факторов. Хроническим эзофагитам способствуют заболевания носоглотки, желудка, хронические инфекционные болезни, но наиболее часто хронические эзофагиты выступают следствием рефлюкса желудочного содержимого. Застойные эзофагиты - следствие рубцовых стриктур и ахалазии пищевода.
• Липомы, фибромы и лейомиомы озлокачествляются редко, но могут суживать просвет пищевода, что приводит к повышенной травматизации слизистой оболочки в этой области.
• Неспецифический гранулематозный регионарный стенозирующий эзофагит, протекающий по типу болезни Крона.
• Системная склеродермия, красная волчанка с вовлечением в процесс пищевода.
• Ахалазия пищевода - нервно-мышечное заболевание пищевода, в основе которого лежит нарушение рефлекторного раскрытия кардии во время акта глотания. Термин «ахалазия» сменил ранее употреблявшееся название кардиоспазм, идиопатическое или кардиотоническое расширение пищевода.
Гистологическое строение опухолей пищевода
В 89-92% случаев рак пищевода имеет плоскоклеточное строение различной степени дифференцировки. Железистое строение встречают в 7-10% случаев, как правило, аденокарцинома развивается из пищевода Баррета. На злокачественные опухоли другого строения (диморфную, карциноид, мелкоклеточную) приходиться менее 1%.
Рак пищевода возникает наиболее часто в местах физиологических сужений (устье пищевода, область дуги аорты и левого бронха, пищеводное отверстие диафрагмы). По статистике, частота возникновения опухолей в пищеводе следующая: среднегрудной отдел пищевода - 60%; нижнегрудной отдел и абдоминальная его часть - 30% и в 10% - верхний и шейный отделы.
Различают язвенный, бородавчато-папиломатозный и инфильтрирующий типы роста опухоли пищевода.
•
Язвенный тип роста в ранней стадии заболевания представляет
узелок в толще слизистой оболочки, который относительно быстро
подвергается изъязвлению, а затем целиком превращается в язву. Для этого
типа роста характерен быстрый раковый лимфангиит по стенкам пищевода
(микроскопически опухолевые клетки находят в 5-
• Бородавчато-папилломатозный (узелковый) тип роста - бородавчатые разрастания, похожие на цветную капусту. Между отдельными узелками неправильной округлой формы имеются глубокие щели. Опухоль легко травмируется, подвергается распаду. Экзофитный компонент опухоли довольно быстро приводит к дисфагии.
• Инфильтрирующий тип роста - опухоль развивается в глубоких слоях слизистой, почти сразу поражая подслизистый слой, распространяясь главным образом по окружности пищевода. Опухоли этого типа растут сравнительно медленно, поздно дают метастазы и чаще оказываются операбельными.
Классификация по системе TNM
• T - первичная опухоль.
- Тх - недостаточно данных для оценки первичной опухоли.
- Т0 - первичная опухоль не определяется.
- Tin situ - преинвазивная карцинома.
- Т1 - опухоль инфильтрирует стенку пищевода до подслизистого слоя.
- Т2 - опухоль инфильтрирует мышечную оболочку.
- Т3 - опухоль инфильтрирует все слои стенки, включая адвентициальный.
- Т4 - опухоль распространяется на соседние структуры.
• N - регионарные лимфатические узлы. Для шейного отдела пищевода регионарными считают лимфатические узлы шеи, включая надключичные; для грудного отдела - лимфатические узлы средостения и околожелудочные, исключая чревные лимфатические узлы.
- Nx - недостаточно данных для оценки состояния регионарных лимфатических узлов.
- N0 - регионарные метастазы не определяются.
- N1 - поражение регионарных лимфатических узлов метастазами.
• М - отдалённые метастазы.
- Мх - недостаточно данных.
- М0 - нет отдалённых метастазов.
- Μ1 - отдалённые метастазы:
■ для опухолей нижнегрудного отдела: M1a - метастазы в брюшных лимфатических узлах, М1b - другие отдалённые метастазы;
■ для опухолей верхнегрудного отдела: M1a - метастазы в шейных лимфатических узлах, М1b - другие отдалённые метастазы;
■ для опухолей среднего отдела: М1b - метастазы в не регионарных лимфатических узлах или другие отдалённые мета- стазы.
Рак пищевода можно сгруппировать по стадиям согласно Международной классификации по системе TNM (табл. 5-1).
Клиническая картина
• В клинической картине рака пищевода можно выделить первичные (местные симптомы), вторичные и общие симптомы. Первичные симптомы.
- Дисфагия - прогрессивное и непрерывное нарастание симптомов затруднения прохождения пищи. Явления дисфагии наступают задолго до истинного (механического) сужения просвета пищевода и связаны со спазмом при раздражении изъязвлённого участка пищевода (даже при опухолях небольшого размера). Дисфагию, как первый повод обращения к
Таблица 5-1. Стадии рака пищевода согласно Международной классификации по системе TNM
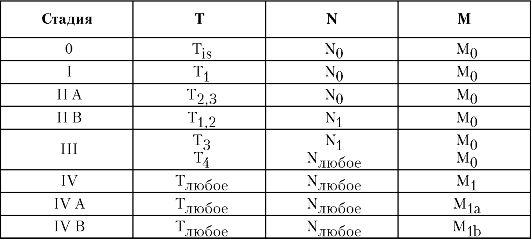
врачу, наблюдают у 70-95% пациентов. Выделяют несколько степеней дисфагии:
■ I степень - затруднено прохождение по пищеводу твёрдой пищи;
■ II степень - полужидкой пищи;
■ III степень - жидкости;
■ IV степень - полное закрытие просвета пищевода.
- Чувство полноты за грудиной при приёме пищи.
- Усиление слюноотделения.
- Пищеводная рвота.
- Дурной и стойкий запах изо рта.
- Боль перемежающаяся, в основном связанная с явлениями спазма при раздражении стенки пищевода при сопутствую- щем опухоли эзофагите.
• Вторичные симптомы связаны с распространением опухоли на соседние органы и ткани.
- Боли носят постоянный характер и связаны с явлениями медиастинита.
- Парез или паралич гортани при прорастании возвратного или блуждающего нервов.
- Изменения в клинической картине при пищеводно-бронхиальных или пищеводно-трахеальных свищах.
• Общие симптомы (анемия, слабость, похудание) выступают следствием опухолевой интоксикации организма и стеноза пищевода.
Течение опухолевого процесса иногда осложняется распадом опухоли, кровотечением и медиастинитом.
Диагностика
При осмотре и пальпации оценивают состояние кожных покровов, подкожной клетчатки, лимфатических узлов, наличие или отсутствие болезненности в эпигастральной области и правом подреберье. Оценивают аускультативный симптом - «запаздывание шума второго глотательного движения».
Рентгенологическое исследование - один из наиболее важных методов инструментального обследования пищевода. Выполняют обзорную рентгенографию, контрастное исследование, двойное контрастирование, томографию, электрорентгенокинематографию.
Наряду с пищеводом необходимо исследовать желудок и лёгкие с обязательной томографией средостения.
Рентгенологическая
семиотика поражения пищевода зависит от макроскопического вида
опухоли, степени сужения пищевода, подвижности стенок. Результаты
рентгенологического исследования во многом влияют на выбор доступа при
планировании хирургического лечения. Так, если граница опухоли ниже
дуги аорты на
При рентгенологическом исследовании пищевода выясняют: степень сужения просвета и его супрастенотическое расширение; ригидность стенок и нарушение рельефа слизистой оболочки; про- тяжённость опухолевого поражения и локализацию согласно сегментарному делению (трахеальный, аортальный, бронхиальный, ретроперикардиальный, над- и поддиафрагмальный); степень выраженности околопищеводного компонента.
Рентгенологические признаки поражения пищевода:
• деформация, неровности контуров (дефекты или выбухания);
• сужения и расширения;
• исчезновение складок;
• сегментарное расширение (при изъязвлении).
Также важное место в диагностике опухолей пищевода занимают эндоскопические методы исследования пищевода, желудка и тра- хеобронхиального дерева. Определяют уровень и протяжённость опухолевого поражения, проксимальную границу его от резцов и распространение на смежные структуры. Чрезвычайно важна и информативна процедура окраски слизистой оболочки 2% раство-
ром Люголя, что позволяет выявить отсевы опухоли на слизистой. Глубину опухолевой инвазии стенки пищевода, возможное внеорганное распространение и поражение околопищеводных и околожелудочных лимфатических узлов позволяет определить эндоскопическая сонография.
УЗИ печени, перикардиальных и забрюшинных лимфатических узлов производят обязательно. При наличии аппаратуры во время мониторной лапароскопии выполняют УЗИ печени. В ряде случаев целесообразно выполнение медиастиноскопии по обычной методике или же левосторонним парастернальным доступом.
Дифференциальная диагностика
Дифференциальную диагностику рака пищевода проводят в зависимости от локализации опухоли:
• при опухоли в шейном отделе пищевода - с опухолями щитовидной железы, метастатическими опухолями, опухолями гортани, дивертикулом Циркеля;
• при новообразовании в грудном отделе - с внутригрудинным зобом, опухолями заднего средостения, аневризмой аорты, с медиастинальным абсцессом, сегментарным сужением пищевода, со сдавлением пищевода лимфатическими узлами, изменён- ными вследствие туберкулёзного процесса или же при лимфогранулематозе.
Следует помнить, что при длительном существовании ахалазии пищевода, вследствие привыкания больного к определённой симптоматике, легко пропустить начало развития опухоли.
Лечение
При раке пищевода используют хирургическое, лучевое и комбинированное лечение. Химиотерапия малоэффективна из-за отсутс- твия препаратов, влияющих на опухоли пищевода, хотя в последнее время изучают возможности проведения полихимиотерапии как компонента комплексного лечения.
Поскольку рак пищевода в большинстве случаев выявляют в поздних стадиях у пожилых пациентов с отягощённым анамнезом, радикальное хирургическое лечение выполняют сравнительно редко - 10-39% больных. В среднем в Москве радикальное хирургическое лечение оказывают в 3,8-4,1% случаев, резектабельными оказываются опухоли у 22-37% больных.
Хирургическое
лечение осуществляют в вариантах паллиативной или радикальной
операций. Паллиативные операции производят при появлении выраженной
дисфагии и нерезектабельном или неопера- бельном раке пищевода.
Выполняют один из видов гастростомии или же обходные анастомозы.
Определённый уровень комфортности обеспечивает гастростомия
антиперистальтическим стеблем из большой кривизны желудка. В некоторых
случаях (опухоль не более
Хирургическое лечение в самостоятельном варианте применяют при Т1, если есть метастазы в регионарных лимфоузлах или инвазия опухоли за пределы слизистой оболочки оправдано комбинированное лечение с применением лучевой терапии и/или химиотерапии.
В настоящее время лучевая терапия - ведущий метод лечения рака пищевода. Её применяют как в самостоятельном варианте по радикальной программе, так и в комбинации с другими методами у 80-85% пациентов. Противопоказания к лучевой терапии: распад опухоли, угроза кровотечения, прорастание в трахею и бронхи, медиастинальные свищи. При облучении по радикальной программе к зоне опухолевого поражения подводят не менее 70 Гр, к зонам возможного субклинического распространения опухоли - 40-45 Гр. Методики облучения - статическое (многопольное), либо подвижным пучком. Всё активней внедряют внутриполостное контактное облучение опухоли в сочетании с дистанционным облучением, используют классическое фракционирование или схему динамического фракционирования.
Лучевую терапию начинают не позже чем через месяц после операции. Адьювантную химиотерапию можно начинать через 1-
3 мес после операции. Используют препараты платины, блеомицин, метотрексат, проспидина хлорид.
При невозможности выполнения оперативного вмешательства возможно проведение симптоматического лечения. Основная задача - восстановление энтерального питания, что даёт шанс провести химиолучевое лечение. В настоящий момент появилась возможность выполнения эндоскопических вмешательств: реканализация просвета пищевода электроили лазерокоагуляцией опухоли; транстуморальная интубация пищевода; установка под рентгентелевизионным контролем различных стентов.
Прогноз при раке пищевода зависит от стадии заболевания. Пятилетняя выживаемость больных после операции по поводу внут- риэпителиального рака - 100%, при T1N0M0 - 75-85%. Прогноз при III стадии, независимо от вида проводимого лечения, всегда сомнителен. Без лечения практически все больные, независимо от стадии опухолевого процесса, умирают в течение года.
ТЕСТОВЫЕ ЗАДАНИЯ
Выберите один правильный ответ
1. Что характерно для эпидемиологии рака пищевода?
A. Женщины болеют чаще, чем мужчины.
Б. Частота рака выше в возрастной группе 30-40 лет.
B. Частота рака выше среди коренных жителей Средней Азии. Г. Частота рака выше среди коренных жителей Севера.
Д. Частота плоскоклеточного рака выше, чем железистого.
2. Что служит для врача сигнальным (опорным) клиническим проявлением, позволяющим заподозрить рак пищевода?
A. Нарушение функции пищевода - дисфагия.
Б. Патологические выделения - гиперсаливация.
B. Болевые ощущения при прохождении пищевого комка. Г. Акрокератоз базекса.
3. У 65-летней женщины развилась очаговая десквамация кожного эпителия мочек уха и ладоней, спустя месяц появилась постепенно прогрессирующая дисфагия. Наиболее вероятный диагноз.
А. Акрокератоз базекса.
Б. Рак пищевода. В. Ахалазия. Г. Дивертикул. Д. Кардиоспазм.
4. Аденокарцинома дистальной части пищевода и кардии оптимально излечивается при помощи.
A. Лучевой терапии.
Б. Полихимиотерапии.
B. Еюностомии для питания.
Г. Проксимальной субтотальной резекции желудка и нижней трети пищевода.
Д. Реканализации пластиковой трубкой.
5. С чем связаны проблемы раннего распространения рака пищевода на средостение и несостоятельности пищеводных анастомозов?
A. С тонким слоем слизистой оболочки. Б. С отсутствием подслизистого слоя.
B. Со слабой васкуляризацией.
Г. С отсутствием серозного покрова.
6. Каким путём лучше выявляют рентгенологически «малые формы» рака пищевода?
A. Рентгенологическим исследованием с «густым» раствором бария.
Б. Дыхательной полирентгенографией пищевода.
B. Бронхоскопией.
Г. Эксфолиативной цитодиагностикой. Д. Эзофагоскопией с браш-биопсией.
7. Каким путём лучше оценить распространённость процесса при стенозе рака пищевода?
А. Рентгенологическое исследование с жидким раствором бария. Б. Дыхательная полирентгенография пищевода.
В. Бронхоскопия.
Г. Эксфолиативная цитодиагностика. Д. Эзофагоскопия с браш-биопсией.
8. С помощью какого метода можно судить о подвижности пищевода?
A. Рентгенологического исследования с «густым» раствором бария.
Б. Рентгенологического исследования с «жидким» раствором бария.
B. Дыхательной полирентгенографии пищевода. Г. Эксфолиативной цитодиагностики.
Д. Эзофагоскопии с браш-биопсией.
9. Каким путём можно исключить трахеоэзофагеальный свищ?
A. Рентгенологическим исследованием с «густым» раствором бария.
Б. Рентгенологическим исследованием с «жидким» раствором бария.
B. Дыхательной полирентгенографией пищевода. Г. Бронхоскопией.
Д. Эзофагоскопией с браш-биопсией.
10. Каким путём может быть получена морфологическая верификация состояния слизистой пищевода?
A. Рентгенологическим исследованием с «густым» раствором бария.
Б. Рентгенологическим исследованием с «жидким» раствором бария.
B. Дыхательной полирентгенографией пищевода. Г. Бронхоскопией.
Д. Эзофагоскопией с браш-биопсией.
11. При помощи чего оптимально излечивают аденокарциному дистальной части пищевода и кардии?
A. Лучевой терапии.
Б. Полихимиотерапии.
B. Еюностомии для питания.
Г. Проксимальной субтотальной резекции желудка и нижней трети пищевода.
Д. Реканализации пластиковой трубкой.
СИТУАЦИОННАЯ ЗАДАЧА
Больной 76 лет, в течение последнего года постепенно нарастали симптомы дисфагии, появились осиплость голоса, одышка. При осмотре: больной истощён, тургор снижен. Кожные покровы бледные, сухие, язык сухой, обложен коричневым налётом. Пульс ритмичный, частота сердечных сокращений 90 в минуту, артериальное давление 110/60 мм рт.ст. Живот мягкий и безболезненный. При рентгенологическом и эндоскопическом исследованиях определяют полный стеноз пищеводно-желудочного перехода. При гистологическом исследовании биоптата поставлен диагноз аденокарцинома.
Вопросы
• Какие исследования следует провести данному больному?
• Какова тактика ведения данного больного?
• Каков прогноз?
ЭТАЛОНЫ ОТВЕТОВ
Тестовые задания
1. Д; 2. А; 3. А; 4. В; 5. Б; 6. А; 7. А; 8. В;
Ситуационная задача
• Больному необходимо выполнить: рентгенографию и КТ органов грудной клетки, УЗИ органов брюшной полости и печени.
• Хирургическое лечение.
• Плохой.
5.2. РАК ЖЕЛУДКА
Рак желудка - вторая по частоте форма злокачественных новообразований. Ежегодно в мире регистрируют 798 тыс. (9,9%) новых случаев и 628 тыс. (12,1%) смертей от этого заболевания. Около 40% случаев регистрируют в Китае, где рак желудка выступает наиболее часто встречающейся формой опухоли, эта тенденция характерна для всех стран Восточной Азии. Высока заболеваемость в Японии (77,9 у мужчин и 33,3 у женщин на 100 тыс. населения), Восточной Европе и тропической части Южной Африки. Возрастно-половые показатели заболеваемости свидетельствуют о постоянном нарастании её с воз-
растом, особенно после 50 лет, и примерно одинаковом риске как для мужчин, так и для женщин.
В России по частоте обнаружения рак желудка устойчиво занимает второе место, уступая только раку лёгкого, в 2006 году заболеваемость составила в среднем 19,1 на 100 тыс. населения. Заболеваемость и смертность от рака желудка достоверно снижаются во всех возрастных группах, по 2-7% в год. Но во всём мире он остаётся второй по частоте причиной смерти от злокачественных новообразований. К сожалению, динамика показателей выживаемости за последние 30 лет остаётся весьма скромной. Только в 20% случаев диагноз ставится на ранней стадии опухоли, а в 30% случаев выявляют признаки поражения регионарных лимфатических узлов. На долю метастатического поражения желудка при опухолях иной локализации приходится около 35% случаев рака желудка. Общая пятилетняя выживаемость для рака желудка равна 15-25%, в то время как тот же показатель для рака на ранней стадии составляет 55%. В случае изолированного поражения регионарных лимфатических узлов пятилетняя выживаемость снижается на 20%.
За последние несколько десятилетий отмечают смещение зоны преимущественной локализации рака желудка в сторону прокси- мальной его части, следовательно, учащаются случаи рака кардиального отдела желудка и пищеводно-желудочного перехода.
Общая цель практического занятия
На основе знаний анатомии, физиологии желудка, представления об этиологии и патогенезе, клинике рака желудка студент должен знать методику обследования больных, способы диагностики данного заболевания, основы построения клинического диагноза, проведения дифференциальной диагностики и определять методы лечения для каждого больного.
В результате подготовки к занятию студент должен повторить и знать методику собирания жалоб, анамнеза заболевания и жизни, методику клинического обследования больного, включающих:
• анализ жалоб и анамнестических данных;
• оценку методов объективного, клинического и инструментального исследования;
• правильную трактовку лабораторных данных, данных рентгенологического и радиоизотопного исследования, цитологических и морфологических показателей;
• построение развёрнутого клинического диагноза и умение его обосновать;
• проведение дифференциальной диагностики;
• выбор и обоснование метода лечения, в том числе паллиативного и симптоматического;
• умение формировать группу «повышенного риска», проводить целенаправленную диспансеризацию, профилактические осмотры;
• определение места и задач врача общего профиля в структуре онкологической помощи;
• ознакомление с разновидностями просветительской работы, направленной на раннюю диагностику.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Этиология
С учётом морфологического строения и факторов риска выделяют диффузный и кишечный типы рака желудка.
• Диффузный тип связан с наследственными факторами, чаще возникает в проксимальном отделе и теле желудка и, по-видимому, развивается, минуя кишечную метаплазию и дисплазию.
• Кишечный тип встречают у молодых людей, он возникает в дистальном отделе желудка и сопряжён с Helicobacter pylori.
Патогенез
Рак желудка в настоящее время рассматривают как результат длительного, многоступенчатого и многофакторного процесса. Известно, что рак желудка практически не возникает на фоне нормальной сли- зистой оболочки, как правило, ему предшествуют самые различные изменения её клеток, развивающиеся при хронических заболеваниях желудка. В связи с этим в настоящее время выделяют предраковые заболевания и изменения состояния желудка.
• Основными предраковыми заболеваниями желудка считают атрофический гастрит, язвенную болезнь, аденоматозные и гиперпластические полипы. Говоря о предопухолевых и фоновых заболеваниях, можно отметить, что опасны не сами по себе заболевания, а диспластические изменения слизистой оболочки, при которых наиболее высок риск развития рака желудка.
- Атрофический гастрит с поражением тела и антрального отдела желудка, вызванный Helicobacter pylori, - фактор риска рака желудка.
- По данным ретроспективных исследований болезнь Аддисона-Бирмера (В12-дефицитная анемия на фоне аутоиммунного гастрита) повышает риск развития опухоли в 3-18 раз.
- Болезнь Менетрие (гипертрофический гастрит) также сопряжена с повышенным риском рака желудка.
- Резекция желудка по поводу язвенной болезни повышает риск рака, особенно при пониженной кислотности и рефлюксе желчи. Рак желудка возникает через 15-20 лет после резекции и вызван дисплазией слизистой оболочки и повышением уровня гастрина.
- Аденоматозные полипы возникают в антральном отделе, они часто бывают одиночными и крупными, в 40-60% случаев одновременно выявляют и рак.
- Гиперпластические полипы - самый частый тип полипов желудка (более 75% случаев), обычно находят много мелких полипов. В 8% случаев одновременно выявляют рак желудка.
• К предраковым изменениям относят гистологически доказанную дисплазию эпителия и кишечную метаплазию, которые возникают на фоне предраковых заболеваний, что свидетельствует о развитии процессов, идущих в сторону злокачественной опухоли. В широком смысле слова дисплазией называют отклонения от нормальной структуры клеток и ткани в направлении неопластического развития. Фоном для дисплазии всегда служит атрофия и нередко метаплазия слизистой оболочки желудка, при этом степень тяжести дисплазии обычно коррелирует с выраженностью гастрита. Судить о наличии и тяжести дисплазии можно только по множественным биоптатам. По одному биоптату нельзя решить, имеется ли дисплазия, или уже рак. Более того, исследование одного кусочка бесполезно и даже вредно, потому что может дать клиницисту ложную информацию о состоянии слизистой оболочки желудка. Выделяют четыре степени дисплазии:
- I степень - слабая;
- II степень - умеренная;
- III степень - выраженная или тяжёлая;
- IV степень - рак in situ.
Анатомическое строение
В желудке различают три отдела, самый верхний - кардиальный отдел, среднему отделу соответствует тело желудка, а нижний отдел включает всю оставшуюся часть желудка - антральный отдел и привратник (для них в целом иногда применяют наименование - пилороантральный отдел). Границы между отделами условно проведены через точки, разделяющие желудок на три равные части. Для уточнения локализации опухоли различают также малую и большую кри- визны, переднюю и заднюю стенки в каждом отделе желудка.
Кровоснабжение желудок получает из системы чревной артерии. Лимфатическая система представлена большой сетью мелких внут- риорганных лимфатических сосудов, которые, постепенно укрупняясь в направлении поверхности органа, впадают в соответствующие регионарные лимфатические коллекторы. Различают четыре бассейна лимфооттока от желудка.
• Лимфатический коллектор, расположенный в толще желудочно-ободочной связки, ближе к большой кривизне и двенадцатиперстной кишке, принимает лимфу от нижней трети желудка в области большой кривизны.
• Лимфатический коллектор, находящийся в клетчатке области дистальной части малой кривизны, в толще печёночно-двенадца- типерстной связки и воротах печени. В этот коллектор оттекает лимфа из нижней трети желудка, прилежащей к малой кривизне и соседних участков средней трети желудка.
• Основной лимфатический коллектор включает в себя лимфатические узлы, расположенные в малом сальнике, по ходу левых желудочных сосудов, по верхнему краю поджелудочной железы и в области её хвоста, а также околопищеводные узлы выше и ниже диафрагмы. Этот коллектор собирает лимфу от средней трети желудка по малой кривизне, прилегающих отделов передней и задней стенок, кардии, медиальной части верхней трети желудка и абдоминального сегмента пищевода.
• Лимфатический коллектор охватывает лимфатические узлы, расположенные в латеральной части желудочноободочной связки, узлы по ходу коротких артерий желудка, в воротах селезёнки и узлы самой селезёнки. В этот коллектор оттекает лимфа от верхней трети желудка в области большой кривизны.
Необходимо также отметить, что между желудком и печенью имеются сложные лимфовенозные коммуникации, проходящие больше в верхней части малого сальника, что обусловливает раннее метастазирование рака желудка в печень.
Патологическая анатомия
Макроскопическая картина рака желудка зависит от длительности заболевания, степени некробиотических изменений и гис- тологической структуры опухоли. Течение болезни определяется локализацией опухоли: распространением её по желудочной стенке, наличием или отсутствием перехода процесса на соседние органы и интенсивностью метастазирования.
Макроскопически различают экзофитный, эндофитный (инфильтративный) и смешанный типы роста рака желудка.
•
Экзофитный рак (полиповидный, грибовидный, блюдцеобразный,
бляшковидный) имеет вид полипа, бляшки или гриба с чёткими границами.
При изъязвлении такой опухоли она принимает вид блюдца. Раковая
инфильтрация обычно не распространяется от видимого края опухоли более
чем на 2-
•
Эндофитный (инфильтративный) рак желудка отличается наиболее
злокачественным течением, эти опухоли не вдаются в просвет органа и не
имеют чётких границ. Они стелятся по стенке желудка, главным образом в
подслизистом слое. Складки слизистой при этом расправляются и
сглаживаются. Раковая инфильтрация распространяется на расстояние 5-
• При смешанном типе сочетаются признаки экзо- и эндофитного рака.
Следует отметить, что рак желудка начинает развиваться с небольшого участка слизистой оболочки, а затем прорастает всю толщу стенки, а также распространяется вдоль стенки по всем направлениям, но преимущественно в сторону кардии, что связано с особенностями лимфообращения в стенке желудка: в норме лимфа оттекает в поперечном и краниальном направлениях. При прорастании серозной оболочки опухоль может распространяться (врастать) на соседние органы: печень, поджелудочную железу, поперечную ободочную кишку и селезёнку.
Рак желудка метастазирует преимущественно лимфогенным
путём, но возможны также гематогенный, контактный и имплантационный пути распространения опухоли. Нередко встречают различные комбинации всех путей распространения опухоли. Различают регионарное и отдалённое метастазирование, к регионарным относят метастазы в регионарные лимфатические узлы. Поражение регионарных лимфатических узлов при раке желудка отмечают в 45-65%, и оно может иметь место даже при небольших опухолях. Вероятность поражения лимфатических узлов возрастает по мере увеличения инфильтрации стенки желудка. Частота вовлечения в процесс каждого из бассейнов лимфооттока зависит от локализации опухоли в желудке и от анатомического строения его лимфатической системы. При магистральном типе лимфогенное метастазирование идёт по ограниченному руслу к лимфатическим узлам строго определённого бассейна. При рассыпном и смешанном типах строгой закономерности нет.
Наиболее клинически значимые отдалённые лимфогенные метастазы - метастаз Вирхова (в лимфатические узлы левой надключичной области), метастаз сестры Мери Жозеф (в пупок - ретроградный метастаз по лимфатическим сосудам круглой связки печени), метастаз Шнитцлера (в параректальной клетчатке таза - дугласовом пространстве), метастазы Крукенберга (в яичниках).
Гематогенно рак желудка чаще всего метастазирует в печень. Реже гематогенные метастазы обнаруживают в лёгких, костях и надпочеч- никах.
Международная гистологическая классификация
Рак желудка согласно Международной гистологической классификации, принятой ВОЗ в 1977 году, подразделяют на следующие типы.
• Высоко, умеренно и низкодифференцированную аденокарциному:
- папиллярную;
- тубулярную;
- муцинозную;
- перстневидноклеточную.
• Железисто-плоскоклеточный рак.
• Плоскоклеточный рак.
• Недифференцированный рак.
• Неклассифицируемый рак.
Классификация по системе TNM (2007)
• T - первичная опухоль.
- Тх - оценка первичной опухоли невозможна.
- Т0 - первичная опухоль не обнаружена.
- Tis - рак in situ.
- Т1 - опухоль поражает собственную пластинку слизистой оболочки и подслизистый слой.
- Т2 - опухоль проникает в мышечную пластинку слизистой оболочки или субсерозную оболочку:
- T2a - опухоль прорастает в мышечную пластинку слизистой;
- T2b - опухоль поражает субсерозную оболочку.
- Т3 - опухоль проникает в серозную оболочку (висцеральную брюшину).
• - Т4 - опухоль проникает в прилегающие органы и ткани. N - поражение регионарных лимфатических узлов.
- Nx - состояние регионарных лимфоузлов оценить невозможно.
- N0 - метастазов в регионарных лимфоузлах нет.
- N1 - поражено от 1 до 6 регионарных лимфоузлов.
- N2 - поражено от 7 до 15 регионарных лимфоузлов.
• - N3 - поражено более 15 регионарных лимфоузлов. M - отдалённые метастазы.
- Мх - наличие отдалённых метастазов оценить невозможно.
- М0 - отдалённых метастазов нет.
- М1 - наличие отдалённых метастазов.
Рак желудка можно сгруппировать по стадиям согласно Международной классификации по системе TNM (табл. 5-2).
Клиническое течение
При всём многообразии клинических проявлений у рака желудка на ранних этапах течения нет патогномоничных симптомов. Они возникают лишь в далеко зашедших стадиях развития опухоли, когда радикальное лечение чаще всего невозможно. Как правило, рак желудка маскируется симптомами предшествующих хронических заболеваний. Особенно часто это наблюдают при ранних стадиях опухолевого процесса. Часто опухоль растёт бессимптомно вплоть до поздней стадии, когда пропадает аппетит, появляются быстрая насыщаемость, отвращение к мясу, дисфагия и слабость. Боль в
Таблица 5-2. Стадии рака желудка согласно Международной классификации по системе TNM
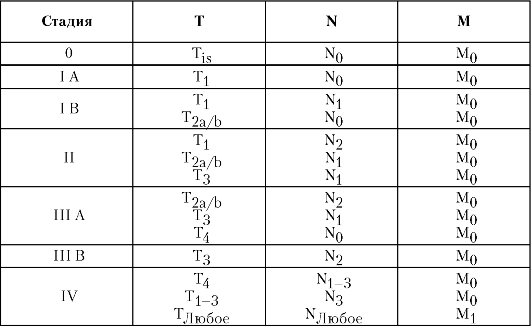
эпигастральной области отмечают в 60% случаев, снижение веса - в 50%, тошнота и рвота в 40%, анемия - в 40%, у 30% больных пальпируют объёмное образование в брюшной полости. Боль в животе напоминает язвенную болезнь, она постоянная, ноющая и поначалу может уменьшаться при приёме антацидных средств. Рвота кровью и мелена возникают у 25% больных.
Клиническая картина рака желудка разнообразна и складывается из следующих групп симптомов:
• общие симптомы, как следствие общего воздействия опухоли на организм больного (снижение аппетита и массы тела, появление немотивированной общей слабости, недомогания);
• местные симптомы, непосредственно связанные с поражением самого желудка (боли, чаще не связанные с приёмом пищи, тошнота, отрыжка, ощущение переполнения и тяжести в эпигастральной области);
• симптомы, обусловленные осложнениями, присоединившимися в течение опухолевого процесса (скрытые и острые желудочные кровотечения в результате разрыва кровеносного сосуда или некроза и распада опухоли, анемия, дисфагия).
Клинические проявления рака желудка зависят от локализации опухоли. Рак нижней трети желудка наиболее ярко проявляется диспепсическими расстройствами, нарушением эвакуации пищи из желудка и болью. Рак средней трети долгое время может протекать без явно выраженных признаков на фоне хронического кровотечения с развитием анемии. На первый план при этой локализации чаще выступают расстройства общего характера. При распространении опухоли на поджелудочную железу может присоединяться болевой синдром. Клиническая картина опухолей верхней трети желудка чрезвычайно разнообразна. Часто развитие этих опухолей протекает практически бессимптомно, иногда они проявляются болями в области сердца. Боль может появиться лишь при рас- пространении опухоли на соседние анатомические образования. При раке кардиального отдела желудка возможно развитие такого серьёзного симп-тома, как дисфагия (затруднение прохождения пищи по пищеводу), которая приводит к белковому голоданию, гиповолемии, следствием которых является нарастание общих симптомов заболевания.
Для постановки диагноза необходим индивидуальный подход при оценке каждого симптома. Своевременное распознавание этих симптомов особенно важно не только для хирурга, но и для терапевта, к которому прежде всего обращаются пациенты. Часто от правильности его действий, его онкологической настороженности в конечном итоге зависит судьба больного. Малейшие отклонения в течении хронического заболевания желудка, появление новых, даже незначительных, жалоб должны служить поводом для специального обследования.
Клинический осмотр больного с подозрением на опухоль желудка включает в себя оценку общего состояния и кожных покровов, пальпацию и перкуссию живота. Пальпаторно определяемое в эпигастральной области опухолевое образование выступает важным местным признаком рака желудка. Пальпаторно опухоль желудка на ранних стадиях чаще всего не определяется, а наличие пальпируемой опухоли соответствует поздним стадиям развития опухоле- вого процесса, но в то же время не является абсолютным признаком неоперабельности, так у 80-87% больных с пальпируемой опухолью удаётся произвести радикальную операцию, правда, с небольшими шансами на длительное выздоровление.
Обследование нельзя считать законченным, если пальпаторно не обследованы области, обычно поражаемые отдалёнными метастазами (левая надключичная область, область пупка, область малого таза
и яичника). Обследование больного обязательно должно заканчиваться ректальным исследованием для мужчин и ректовагинальным для женщин.
Диагностика
В основном для диагностики рака желудка используют рентгенологический и эндоскопический методы. Последний позволяет не только визуально обнаружить опухоль, но и получить материал для морфологического исследования. Каждый из методов имеет свои пределы диагностических возможностей, поэтому для выявления заболевания необходимо их сочетание, поскольку без морфологической верификации диагноза основную диагностическую задачу нельзя считать решённой.
Часто рентгенологическое исследование предшествует применению других специальных методов диагностики, поэтому пра- вильность заключения во многом определяет дальнейшую тактику. Рентгенологическая картина при раке желудка зависит от характера роста, локализации и размера опухоли. Согласно данным некоторых авторов, в начальных стадиях рака рентгенологический метод по информативности уступает эндоскопическому, но в настоящее время при использовании современной аппаратуры и метода одномоментного двойного контрастирования возможности рентгенологического исследования значительно расширились, и диагноз раннего рака желудка устанавливают у 82,5% больных.
Основные рентгенологические признаки рака желудка:
• наличие дефекта наполнения;
• потеря эластичности и растяжимости желудочной стенки в районе опухоли, что ведёт к отсутствию или уменьшению перистальтики;
• изменение рельефа в месте расположения опухоли. Эзофагогастроскопия позволяет определить макроскопическую
форму роста опухоли, её внутриорганную распространённость, а также получить материал для последующего морфологического исследования (цитологического и гистологического). Эндоскопический метод исследования желудка практически не имеет противопоказаний, и в настоящее время получил самое широкое распространение. В эндоскопической диагностике рака желудка выделяют ранние и поздние его формы. Ранний рак поражает только слизистую оболочку и подслизистый слой, не проникая в мышечный слой стенки желудка, имеет площадь поражения 1-3 см2. В настоящее время
для диагностики ранних раков и определения степени (глубины) их инвазии в стенку полого органа всё шире применяют метод эндосонографии, при которой ультразвуковой датчик через биопсийный канал эндоскопа подводят непосредственно к выявленному образованию. В норме все пять слоёв стенки желудка чётко дифференцируются. При раке за счёт инфильтрации стенки желудка опухолевыми клетками дифференциация отдельных слоёв её исчезает, и можно определить глубину поражения, а также констатировать распространение процесса на соседние органы.
КТ органов брюшной полости помогает оценить стадию заболевания.
Лапароскопия позволяет выявить местно распространённый процесс, отдалённые метастазы, канцероматоз брюшины и отказаться от попытки немедленной радиальной операции.
Дифференциальная диагностика
Дифференциальную диагностику рака желудка проводят с полипами, язвой, лейомиомой, лейомиосаркомой, параганглиомой, лим- фомой, карциноидом, липомой, фиброзной гистиоцитомой, а также с метастазами других опухолей.
Лечение
Лечение рака желудка включает в себя хирургическое лечение, химиотерапию и лучевую терапию.
• По поводу рака желудка проводят радикальные и паллиативные операции.
-
При радикальной операции хирург удаляет часть или весь желудок с
опухолью вместе со связочным аппаратом и реги- онарными лимфатическими
узлами, расположенными в них. Показание для выполнения радикальной
операции - морфологически верифицированный рак желудка I, II, IIIA
стадий. Рассчитывать на наиболее полное излечение при применении
хирургического метода можно лишь у больных раком желудка на ранних
стадиях, имеющих опухоль до
на ранних стадиях заболевания японские исследователи предложили расширить объём операции и производить наряду с резекцией желудка или гастрэктомией широкое удаление лимфатических коллекторов из всех зон возможного лимфогенного метастазирования верхнего отдела брюшной полос- ти. Топографическая зона, являющаяся объектом расширенной лимфодиссекции (объём лимфодиссекции D 2) верхних отделов забрюшинного пространства, занимает область от селезёнки до ворот печени, от диафрагмы до верхнего края поджелудочной железы. Таким образом, при расширенной лимфодиссекции, выполняемой при операциях по поводу рака желудка, удаётся соблюсти принципы онкологической абластики и удалить поражённый орган с окружающей его клетчаткой. Морфологические исследования показали, что в макроскопически интактных лимфоузлах метастазы выявляют почти в 60%. При этом почти в 50% наблюдений метастазы локализовались в тех группах лимфоузлов, которые при стан- дартных операциях не удалялись. Основные операции - субтотальная резекция желудка (дистальная - при раке выходного отдела и проксимальная - при раке проксимального отдела желудка), гастрэктомия и комбинированная.
■ Субтотальную резекцию желудка выполняют только по поводу экзофитных опухолей, расположенных в дистальном или проксимальном отделах желудка и не распространяющихся за их пределы. Если производится субтотальная резекция желудка, то большинство онкологов считает, что необходимо проводить операцию типа Бальфура, при ней удаляют полностью желудок, большой и малый сальники (объём лимфодиссекции D 1) и формируют впередиободочный желудочно-кишечный анастомоз на длинной приводящей петле с соустьем. Во-первых, здесь можно максимально отойти от видимого края опухоли, и, во-вторых, при возникновении рецидива в культе желудка или анастомозе провести повторную операцию значительно легче, чем при других типах операций - Гофмейстер-Финстерер, на короткой петле, и тем более Бильрот-1.
■ Гастрэктомию проводят при расположении экзофитной опухоли в теле желудка, при тотальном поражении, при инфильтративных опухолях любой локализации, а также
при мультицентрической форме роста. Самым важным и ответственным этапом хирургической операции на желудке выступает формирование пищеводно-кишечных или желудочно-кишечных соустий. Для улучшения непосредственных результатов операций были разработаны новые модификации пищеводно-кишечных анастомозов после гастрэктомий, ведутся поиски путей снижения частоты послеоперационных гнойно-воспалительных процессов. Всё это наряду с применением адекватного парентерального питания в предоперационном и послеоперационном периодах позволило значительно снизить частоту несостоятельности швов анастомозов после гастрэктомии и послеоперационную летальность.
• ■ В последнее время всё шире применяют комбинированные операции: резекция гастропанкреатодуоденальная, печени и других органов при местно распространённом раке желудка, прорастающем в поджелудочную железу, печень и другие органы. Примерно 30-50% радикальных операций являются комбинированными. В клиниках, где непосредственные результаты оперативного лечения рака удовлетворительные, надо расширять показания к комбинированным операциям, что позволит уменьшить частоту пробных лапаротомий и повысит радикальность выполняемой операции. - Паллиативные операции показаны при кровотечении, стенозе привратника, изъязвлении, распаде и инфицировании опухоли. В этих целях бывает достаточно ограниченной резекции желудка или формирования обходного гастроэнтероанастомоза. Конечно, выполнение паллиативных операций существенно не продлевает жизнь больных, но избавляет их от страданий и тягостных ощущений, улучшает качество жизни, создаёт лучшие условия для последующей химиотерапии. Химиотерапию как самостоятельный метод лечения применяют при неоперабельных формах рака желудка (III B и IV стадиях). Эффективность отдельных препаратов (фторурацил, тегафур) при раке желудка составляет 20-25%. В настоящее время предпочтение отдают комбинированной химиотерапии, наиболее часто используют комбинацию таких противоопухолевых препаратов, как фторурацил, митомицин (схема FAM-I) и цисплатин, этопозид (схема ЕАР). При распространённом процессе
и тяжёлом общем состоянии применение противоопухолевых препаратов бесперспективно, в таких случаях проводят симп- томатическое лечение, направленное на уменьшение страданий больного. Возможно применение адъювантной химиотерапии с целью улучшения отдалённых результатов, но к назначению её также следует подходить в индивидуальном порядке, имея в виду низкую эффективность препаратов и высокую токсичность.
• Лучевая терапия. При неоперабельном раке желудка сочетание облучения (40 Гр за мес) и химиотерапия (фторурацил) показало увеличение выживаемости по сравнению с одной лучевой терапией. Интраоперационное облучение позволяет подвести высокую дозу к зоне резекции или остаточной опухоли, отведя из поля облучения печень и кишечник. В отдельных случаях интраоперационное облучение даёт хороший эффект, особенно в сочетании с обычным дистанционным облучением и химиотерапией.
Прогноз
Выявлено три неблагоприятных фактора прогноза: прорастание серозного слоя, метастазы в лимфатические узлы и наличие опухолевых клеток по краю резекции. Если ни одного из них нет, то пятилет- няя выживаемость составляет 60%, при всех трёх - лишь 5%. Также для прогноза существенное значение имеют: стадия опухолевого процесса, клиническая и эндоскопическая классификации, степень дифференцировки и плоидность опухолевых клеток.
• Стадия опухолевого процесса. По данным многофакторного анализа, основное значение имеют стадия, глубина инвазии и метастазы в лимфатические узлы. Решающую роль играет количество поражённых лимфатических узлов, так при метастазах в 1-3 лимфатических узла прогноз такой же, как и в отсутствие лимфогенных метастазов. По данным японских авторов, пятилетняя выживаемость при I стадии заболевания составляет 98%,
при II - 85%, при III - 52%.
• Клиническая классификация. Выживаемость выше при поверхностном раке, ниже при экзофитном раке и крайне низка при эндофитном раке желудка.
• Эндоскопическая классификация. Выживаемость выше при 2-м типе (плоской опухоли), ниже при 3-м типе (раке с изъявлением) и ещё ниже при 1-м типе (полиповидном раке).
• Дифференцировка. Низкая дифференцировка опухоли ухудшает прогноз.
• Плоидность опухолевых клеток (по данным проточной цитофлуометрии). При диплоидных опухолях медиана безрецидивного периода составляет 18 мес, а при анеуплоидных лишь 5 мес. Диплоидные опухоли чаще встречают у женщин.
ТЕСТОВЫЕ ЗАДАНИЯ
Выберите один правильный ответ
1. Что характерно для рака кардиального отдела желудка?
A. Дисфагия.
Б. Шум «плеска» натощак.
B. Срыгивание.
Г. Гиперсаливация. Д. Загрудинные боли.
2. Что характерно для рака антрального отдела желудка?
A. Тухлая отрыжка.
Б. Рвота съеденной пищей.
B. Чувство тяжести в эпигастрии.
Г. Облегчение после вызванной рвоты. Д. Все ответы верны.
3. Что относят к рентгенологическим признакам язвенно-инфильтративной формы рака желудка?
A. Сглаженность складок вокруг язвенного дефекта. Б. Выход контуров ниши за пределы контура желудка.
B. Отсутствие перистальтики в зоне, прилегающей к нише. Г. Приподнятый валик вокруг ниши.
Д. Все ответы верны.
4. Что включает первичная профилактика рака желудка?
A. Снижение потребления солёных и копчёных продуктов. Б. Принятие пищи не спеша.
B. Увеличение потребления зелёных овощей и фруктов.
Г. Отказ от крепких спиртных напитков или хотя бы сопровождение их принятия «содовой» или минеральной водой. Д. Всё перечисленное.
5. Что относят к ранним макроскопическим формам рака желудка?
A. Язвенно-инфильтративную. Б. Полиповидную.
B. Поверхностно распространяющуюся и диффузную. Г. Инфильтративную типа скирр.
Д. Блюдцеобразную.
6. Какая функция страдает в первую очередь при опухолевом поражении дна или свода желудка?
A. Моторно-эвакуаторная. Б. Резервуарная.
B. Секреторная.
Г. Бактерицидная (барьерная). Д. Кроветворная.
7. Какая функция страдает в первую очередь при опухолевом поражении пилороантрального отдела желудка?
А. Моторно-эвакуаторная. Б. Резервуарная.
8. Секреторная.
Г. Бактерицидная (барьерная). Д. Кроветворная.
8. При поражении какого отдела с большей частотой встречают немотивированную анемию?
A. Кардиального отдела желудка. Б. Дна и тела желудка.
B. Малой кривизны желудка. Г. Выходного отдела желудка. Д. Большой кривизны желудка.
9. При поражении какого отдела с большей частотой встречают дисфагию?
A. Кардиального отдела желудка. Б. Дна и тела желудка.
B. Малой кривизны желудка. Г. Выходного отдела желудка. Д. Большой кривизны желудка.
10. При поражении какого отдела с большей частотой встречают тошноту и рвоту?
A. Кардиального отдела желудка. Б. Дна и тела желудка.
B. Малой кривизны желудка. Г. Выходного отдела желудка. Д. Большой кривизны желудка.
11. В каком возрасте наиболее часто развивается рак желудка?
A. До 20 лет.
Б. От 21 года до 50 лет.
B. От 51 года до 70 лет. Г. Старше 70 лет.
Д. Одинаково во всех возрастных группах.
12. Что влияет на уровень заболеваемости раком желудка?
A. Пищевой фактор и режим питания.
Б. Почвенно-климатическая обусловленность.
B. Местные изменения слизистой оболочки желудка. Г. Фоновые заболевания, наследственный фактор.
Д. Все перечисленные факторы.
13. Чем характеризуются предраковые состояния слизистой оболочки желудка?
A. Наличием атипичных клеток. Б. Степенью дисплазии клеток.
B. Наличием хронического атрофического гастрита.
Г. Наличием кишечной метаплазии очагового характера.
14. Что наиболее часто перерождается в рак?
A. Гиперпластические полипы. Б. Аденоматозные полипы.
B. Аденопапилломатозные полипы. Г. Папиллярные аденомы.
Д. Все полипы, независимо от их гистологического строения, обладают одинаковым индексом малигнизации.
СИТУАЦИОННЫЕ ЗАДАЧИ
Задача ? 1. Больной 60 лет предъявляет жалобы на снижение аппетита, похудание, изжогу. Данные обследования.
• Рентгенография лёгких: патологии не обнаружено.
• ЭГДС: на фоне атрофического гастрита имеется хронический язвенный дефект с каллёзными краями, расположенный в области тела желудка.
• Электрокардиография: ритм синусовый, 65 в минуту. Нагрузка на правое предсердие.
• Клинический анализ крови:
- гемоглобин - 100 г/л;
- эритроциты - 4,0х1012/л;
- цветовой показатель - 0,9;
- тромбоциты - 240х109/л;
- лейкоциты - 8,2х109/л (палочкоядерные - 1 %,сенментоядерные - 61%, эозинофилы - 7%, лимфоциты - 8%, моноциты - 13%);
- СОЭ - 30 мм/ч.
- Анализ мочи: плотность 1003 г/л; реакция среды нейтральная, лейкоцитов 0-3 в поле зрения.
Вопросы
• Предположительный диагноз?
• Что необходимо выполнить для уточнения морфологического диагноза до начала лечения?
• Какое стандартное рентгеновское исследование необходимо выполнить для уточнения степени распространённости процесса в органе?
• Какой основной метод лечения указанной патологии?
• Какая операция будет считаться минимально допустимой при выборе хирургической тактики лечения?
Задача ? 2. Больной 46 лет предъявляет жалобы на изжогу, чувство тяжести в желудке, отрыжку после еды, периодические срыгивания принятой пищей. Данные обследования.
• Рентгенография лёгких: патологии не обнаружено.
• ЭГДС: в пилорическом отделе желудка имеется язва, суживающая просвет привратника до
• ЭКГ: ритм синусовый, 65 в мин. Нагрузка на правое предсердие.
• Клинический анализ крови:
- гемоглобин - 100 г/л;
- эритроциты - 4,0х1012/л;
- цветовой показатель - 0,9;
- тромбоциты - 240х109/л;
- лейкоциты - 8,2х109/л (палочкоядерные - 1 %, сен ментоядерные - 61%, эозинофилы - 7%, лимфоциты - 8%, моноциты - 13%);
- СОЭ - 30 мм/ч.
• Анализ мочи: плотность - 1003 г/л, реакция среды - нейтральная, лейкоцитов 0-3 в поле зрения.
Вопросы
• С какими заболеваниями следует провести дифференциальную диагностику?
• Что необходимо выполнить для уточнения морфологического диагноза до начала лечения?
• Какое стандартное рентгеновское исследование необходимо выполнить для уточнения степени распространённости процесса в органе?
• Какой основной метод лечения указанной патологии?
• Какая операция будет считаться минимально допустимой при выборе хирургической тактики лечения?
Задача ? 3. Больной 50 лет предъявляет жалобы на снижение аппетита, похудание, изжогу, затруднение прохождения пищи. Данные обследования.
• Рентгенография лёгких: патологии не обнаружено.
•
ЭГДС: на фоне атрофического гастрита имеется хронический язвенный
дефект с каллёзными краями, расположенный в области кардии желудка
размером до
• ЭКГ: ритм синусовый, 65 в минуту. Нагрузка на правое предсердие.
• Клинический анализ крови:
- гемоглобин - 100 г/л;
- эритроциты - 4,0х1012/л;
- цветовой показатель - 0,9;
- тромбоциты - 240х109/л;
- лейкоциты - 8,2х109/л (палочкоядерные - 1 %, сен ментоядерные - 61%, эозинофилы - 7%, лимфоциты - 8%, моноциты - 13%);
- СОЭ - 30 мм/ч.
• Анализ мочи: плотность - 1003 г/л; реакция среды - нейтральная, лейкоциты - 0-3 в поле зрения.
Вопросы
• Каков предположительный диагноз?
• Что необходимо выполнить для уточнения морфологического диагноза до начала лечения?
• Какое стандартное рентгеновское исследование необходимо выполнить для уточнения степени распространённости процесса в органе?
• Какой основной метод лечения указанной патологии?
• Какая операция будет считаться минимально допустимой при выборе хирургической тактики лечения?
ЭТАЛОНЫ ОТВЕТОВ
Тестовые задания
1. А; 2. Д; 3. Д; 4. Д; 5. Б; 6. Д; 7. А; 8. Б; 9. А;
Ситуационные задачи
Задача ? 1
1. Рак желудка.
2. Биопсию из области язвы.
3. Рентгеноскопию желудка.
4. Хирургический.
5. Гастрэктомия.
Задача ? 2
1. Рак желудка, язвенная болезнь.
2. Биопсию из области язвы.
3. Рентгеноскопию желудка.
4. Хирургический.
5. Субтотальная резекция желудка.
Задача ? 3
1. Рак желудка.
2. Биопсию из области язвы.
3. Рентгеноскопию пищевода и желудка.
4. Хирургический.
5. Гастрэктомия, резекция нижней трети пищевода.
5.3. ОПУХОЛИ ПЕЧЕНИ И БИЛИОПАНКРЕАТОДУОДЕНАЛЬНОЙ ЗОНЫ
ПЕРВИЧНЫЙ РАК ПЕЧЕНИ
Проблема диагностики и лечения первичного рака печени - одна из актуальнейших задач современной клинической онкологии. Повышение уровня заболеваемости раком печени и высокий уровень смертности выводит проблему поиска новых решений в лечении этого тяжёлого контингента больных в разряд первоочередных. Гепатоцеллюлярный рак по частоте составляет около 85% всех злокачественных опухолей печени. Примерно 5-10% первичного рака печени приходится на рак желчных протоков, а оставшаяся часть - на более редкие новообразования: гемангиосаркому, гепатобластому и мезенхимальные опухоли.
Общая цель практического занятия
На основе знаний анатомии и нормальной и патологической физиологии печени студент должен уметь сформулировать этиоло- гию первичного рака печени и симптомокомплекс в зависимости от локализации опухоли и распространённости опухолевого процесса. На основе клинических проявлений заболевания, а также данных инструментальной и лабораторной диагностики, студент должен сформулировать предварительный диагноз заболевания и провести дифференциальную диагностику с другими очаговыми поражениями печени. В зависимости от локализации опухоли и распространён- ности опухолевого процесса студент должен сформулировать план лечения больного и определить клинический прогноз. Студент должен иметь представление о методах хирургического лечения, локальных методах опухолевой деструкции и основах химиотерапии при первичном раке печени.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Эпидемиология
Гепатоцеллюлярный рак занимает пятое место у мужчин и восьмое место у женщин среди всех злокачественных новообразований в мире, ежегодно регистрируют более 500 тыс. новых случаев гепатоцеллюлярного рака, причём подавляющее большинство наблюдают в странах с высоким уровнем заболеваемости вирусным гепатитом.
В России уровень заболеваемости гепатоцеллюлярным раком составляет 4,9% у мужчин и 2,2% у женщин, но этот показатель значительно варьирует в зависимости от региона, самый низкий пока- затель заболеваемости отмечают в центральном регионе России, он составляет 3,5% у мужчин и 1,6 % у женщин. В восточных регионах страны этот показатель возрастает до 17,2%.
Холангиоцеллюлярный рак - редкая форма рака, не превышающая по уровню заболеваемости 1-2% от всех опухолей. Исключение составляют регионы, эндемичные по гельминтозам, паразитирующим во внутрипечёночных желчных протоках. Эти гельминты часто встречаются в прибрежных районах на территории России, Казахстана, Украины, Китая, Таиланда и др.
Факторы риска
• К факторам риска развития гепатоцеллюлярного рака относят гепатиты B, C, D, злоупотребление алкоголем, тирозинемию и др.
- Гепатит B занимает третье место после курения и характера питания среди всех канцерогенных влияний на человека. Вирусным гепатитом B заражено около 200 млн человек. Хроническими носителями этого вируса являются до 90% населения Юго-Западной Африки и Юго-Восточной Азии. Риск возникновения гепатоцеллюлярного рака при хроническом носительстве вирусного гепатита B в 150-200 раз выше, чем у здоровых людей.
- Гепатит С. Среди больных вирусным гепатитом C, у которых прогрессирование инфекции дошло до стадии цирроза, пока- затели частоты возникновения гепатоцеллюлярного рака достигают 75%. В ряде стран Западной Европы, где в целом заболеваемость первичным раком печени низкая, с вирусом гепатита C связано до 50% случаев гепатоцеллюлярного рака.
- Прямой связи гепатита D с заболеваемостью первичным раком печени не выявлено, однако присоединение данного вируса к гепатиту B или C вызывает значительно более тяжёлое течение заболевания.
- Алкогольный цирроз печени наблюдают, по данным ряда авторов, у 12-42% больных гепатоцеллюлярным раком.
- У лиц, употреблявших в пищу афлотоксины (токсические продукты жизнедеятельности плесневых грибов Aspergillus flavus), содержащиеся в заплесневевшей муке, кукурузе, рисе, соевых и бобах риск возникновения гепатоцеллюлярного рака в 3-4 раза выше, чем в общей популяции.
- Квашиоркор - заболевание, распространённое в африканских странах. Оно возникает у детей раннего возраста в результате белкового голодания. При квашиоркоре развивается белковая и жировая дистрофия печени, вплоть до некрозов печёночной ткани, что создаёт условия для развития первичного рака печени.
- Тирозинемия. Накопление тирозина ведёт к выраженным изменениям в печени и возникновению рака в детском возрасте. Гепатоцеллюлярный рак наблюдают у 37% больных.
- α-1-Антитрипсиндефицит - заболевание, приводящее к усилению активности трипсина.
• К факторам риска развития холангиоцеллюлярного рака относят гельминтозы, холангит, болезнь Кароли, гепатолитиаз и канцерогенные факторы.
- Гельминтозы, вызываемые гельминтами класса трематод (Opisthorchis felineus, Opisthorchis viverrini, Clonorchis sinensis), паразитирующими во внутрипечёночных желчных протоках. Люди заражаются гельминтами при употреблении в пищу сырой или недостаточно термически обработанной рыбы. Роль индикатора злокачественного роста принадлежит вторичным желчным кислотам. При описторхозе превращение первичных желчных кислот во вторичные происходит во внутрипечёночных желчных протоках.
- Первичный склерозирующий холангит - аутоиммунное заболевание, приводящее к мультифокальным стриктурам желчных протоков, что в 8-10% процентах случаев приводит к развитию холангиокарциномы.
- Болезнь Кароли - врождённое расширение внутрипечёноч- ных желчных протоков. У лиц, страдающих этим заболеванием, вероятность развития холангиоцеллюлярного рака возрастает до 7%.
- Гепатолитиаз - заболевание, при котором образуются внут- рипечёночные пигментные камни, что в свою очередь приводит к развитию холангита и образованию стриктур желчных протоков. Примерно у 10% больных гепатолитиазом развивается холангиокарцинома.
- Канцерогенные факторы. Ряд радионуклидных и химических канцерогенов (торий, радон, нитрозамины, асбест, диоксин) ассоциируется с повышенным риском развития рака печени.
Анатомия и физиология печени
Печень - самая крупная железа в организме человека, вес её колеблется от 1,5 до
Печень - орган
пищеварения, кровообращения и обмена веществ. Углеводный, жировой,
белковый, водный, минеральный, пигмент- ный и витаминный обмены в
организме тесно связаны с функцией печени. В ней осуществляются
специфические, защитные, ферментативные и выделительные функции. Она
участвует в процессе гемолиза, совершающегося в селезёнке и кровяном
русле, что заканчивается желчеобразованием (специфической функцией
печени). В сутки у человека образуется 800-1000 мл желчи. Часть её
скапливается в желчном пузыре, имеющем длину 12-
Анатомическая классификация первичного рака печени
Макроскопически первичный рак печени представлен тремя разными формами: массивной, узловой и диффузной.
• Массивная форма представлена одним крупным узлом (простая массивная форма) или крупным узлом с метастазами по периферии (массивная форма с сателлитами).
• При узловой форме рака в печени обычно находят несколько сравнительно одинаковых по размеру опухолевых узлов.
• Диффузная форма встречается реже и представлена опухолью в виде неравномерной инфильтрации паренхимы печени.
Гистологическая классификация первичного рака печени
Первичный рак печени по гистологическому строению подразделяют на гепатоцеллюлярный рак, холангиоцеллюлярный рак и смешанный гепатохолангиоцеллюлярный рак.
• Гепатоцеллюлярный рак по строению различают:
- трабекулярный, состоящий из более крупных клеток, чем нормальные гепатоциты, с обильной эозинофильной цито- плазмой, при этом клетки формируют двух-, трёх- или многорядные трабекулы и тяжи;
- железистый;
- псевдожелезистый (ацинарный);
- компактный (солидный, при этом иногда светлоклеточный);
- скиррозный;
- низкодифференцированный с признаками анаплазии и гигантскими многоядерными клетками.
• Холангиоцеллюлярный рак - злокачественная опухоль печени, представленная клетками, напоминающими эпителий желчных протоков. Железистоплоскоклеточный и плоскоклеточный рак - редко встречающиеся формы холангиоцеллюлярного рака печени, источником их развития считают метаплазированный эпителий желчных протоков.
• Смешанный гепатохолангиоцеллюлярный рак содержит явные элементы как гепатоцеллюлярного рака, так и холангиоцеллюлярного рака. Для строения опухоли характерна продукция желчи и признаки секреции слизи. Такие опухоли встречаются редко.
Классификация первичного рака печени по системе TNM
• Классификация по системе TNM применима только для первичного гепатоцеллюлярного и холангиоцеллюлярного рака. Т - первичная опухоль.
- Тх - недостаточно данных для оценки первичной опухоли.
- T0 - первичная опухоль не определяется.
- T1 - солитарная опухоль до
- T2 - солитарная опухоль до
- T3 - солитарная опухоль более
- T4 - множественные опухоли в обеих долях или опухоль, поражающая основную ветвь портальной или печёночной вены, или опухоль с распространением на соседние органы, кроме желчного пузыря, или опухоль, прорастающая висцеральную брюшину.
• N - регионарные лимфатические узлы (регионарными лимфатическими узлами печени считают узлы ворот печени, расположенные в гепатодуоденальной связке).
- Nx - недостаточно данных для оценки регионарных лимфатических узлов.
- N0 - лимфоузлы ворот печени и гепатодуоденальной связки не поражены.
- N1 - имеется поражение лимфатических узлов ворот печени или гепатодуоденальной связки метастазами.
• М - отдалённые метастазы.
- Мх - недостаточно данных для определения отдалённых метастазов.
- M0 - нет данных за наличие отдалённых метастазов.
- M1 - наличие отдалённых метастазов.
Первичный рак печени можно сгруппировать по стадиям согласно Международной классификации по системе TNM (табл. 5-3).
Таблица 5-3. Стадии первичного рака печени согласно Международной классификации по системе TNM
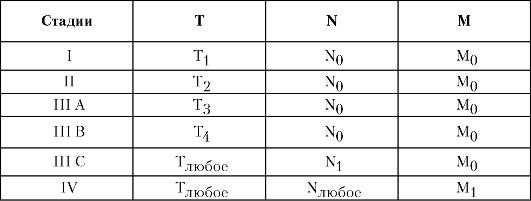
Диагностика
• Для диагностики первичного рака печени применяют УЗИ, КТ, ангиографию, иммуногистохимические и другие методы исследования. УЗИ позволяет диагностировать большинство случаев очагового поражения печени. Под его контролем возможно выполнить чрескожную пункционную аспирационную цитобиопсию опухоли печени с последующим цитологическим исследованием
полученного материала, что позволяет в 76,5% решить вопрос о наличии опухолевого процесса в печени.
• КТ обладает большей чувствительностью и специфичностью, чем УЗИ, особенно при диагностике опухолей диаметром менее
• Ангиография выявляет патологические изменения печени в 95,2%. Проводя такое исследование при подозрении на неопластический процесс в печени, возможно чётко локализовать анатомическую область поражения (доля, сегмент), выяснить характер поражения (доброкачественное, злокачественное) и предположить гистологический вариант строения опухоли.
• Иммуногистохимические и молекулярно-биологические методы диагностики у больных с гепатоцеллюлярным раком печени в последнее время приобрели большое значение. Применяют реакцию на выявление эмбриоспецифического α-фетопротеина (АФП), получившую название реакции Абелева-Татаринова. Суть заключается в том, что у здоровых людей и лиц, больных различными неонкологическими заболеваниями печени, АФП в сыворотке крови отсутствуют, а при гепатоцеллюлярном раке печени его удаётся обнаружить у 75-80% обследованных.
Лечение
Для лечения первичного рака печени используют локальные методы опухолевой деструкции, химиотерапию и хирургические методы.
• Локальные методы опухолевой деструкции: алкоголизация, радиочастотная термоаблация и интраартериальная химиоэмболизация.
- Алкоголизация
(абляция этанолом). К числу региональных методов лекарственного
лечения относят чрескожную абляцию этанолом или 50% уксусной кислотой,
выполняемую под контролем УЗИ или КТ. Локальная деструкция опухоли
может быть использована в лечении опухолей, не превышающих в диаметре
- Радиочастотная термоабляция. Высокочастотная деструкция, разработанная в Италии в
- Внутриартериальная химиоэмболизация - региональная лекарственная терапия, которая применима при опухолях более крупного размера, чем подлежащие абляции, но связана с большим риском осложнений. Сам по себе факт эмболизации лишает или по меньшей мере ограничивает кровоснабжение опухолевых клеток. Дополнение эмболизации воздействием цитостатика в виде суспензии в жировом рентгенконтрастном веществе, создаёт условия для длительного цитостатического действия на опухоль, теоретически без системных токсических эффектов. Для химиоэмболизации при первичном раке печени применяют доксорубицин, иногда в комбинации с митомицином или цисплатином. Наиболее серьёзные ослож-
нения - печёночная недостаточность, инфаркты, абсцессы печени и билиарный некроз наблюдают в 3-4% случаев.
• Системная химиотерапия. Очевидно, что при всех возможностях хирургического и регионального лекарственного лечения остаётся большая группа больных гепатоцеллюлярным раком, для которых по степени распространения опухоли и другим показателям «методом выбора» остаются попытки системной химиотерапии. В качестве монохимиотерапевтических агентов наибольшую противоопухолевую активность проявляют эпирубицин (17% ответа), цисплатин (17%), доксорубицин (11-32%), митоксантрон (27%) и гемцитабин (36%).
• Хирургическое лечение первичного рака печени проводят методом резекции и трансплантации.
- В настоящее время резекция печени остаётся методом выбора в лечении первичного рака печени. Абсолютные противопоказания к резекции печени: генерализация опухолевого процесса на обе половины печени, множественные метастазы в лимфатических узлах и органах (лёгкие, поджелудочная железа, сердце), выраженный цирроз печени, поражение опухолевыми узлами кавальных и портальных ворот печени, нижней полой вены, тяжёлое общее состояние больного. Относительные противопоказания к резекции печени: одиночные метастазы в регионарных лимфатических узлах, лёгком. Хирург может удалить до 70% поражённой печени при условии отсутствия цирроза, и в течении 2-6 нед после операции печень регенерирует. Резекция обеспечивает получение отличных результатов в случае одиночных узлов при хорошо сохранённой функции печени. Пятилетняя выживаемость после резекции печени различна в разных странах и колеблется от 27% до 49%. Послеоперационные осложнения после резекции печени при раке варьируют в пределах от 6% до 52%, по данным отечественных и зарубежных клиник. Специфическими осложнениями принято считать кровотечение из культи печени, желчные перитониты, желчные свищи, поддиафрагмальные абсцессы, секвестрацию участков печени и печёночную недостаточность. Процент летальности колеблется в различных пределах - 3,45-21,8%.
- Трансплантация печени показана пациентам с декомпенсированным циррозом печени или на ранних стадиях развития
опухоли с многоузловым ростом (3 узла диаметром не более
МЕТАСТАТИЧЕСКИЙ РАК ПЕЧЕНИ
Метастатическое поражение печени встречают в клинической практике значительно чаще, чем первичное. Установлено, что у каж- дого третьего онкологического больного независимо от локализации первичной опухоли встречают метастазы в печени. При локализации опухоли в зонах, дренируемых воротной веной, печень становится первым и часто единственным, органом-мишенью для возможного метастазирования. В первую очередь печень поражают метастазы рака органов желудочно-кишечного тракта (ЖКТ). У 60% онкологических больных с опухолями желудка и толстой кишки на аутопсиях обнаруживают метастатическое поражение печени.
Лечение больных с метастатическим поражением печени - трудная задача. Оно включает хирургический подход, химиотерапию, иммунотерапию и выбирается в зависимости от общего состояния больного, возраста, гистологической характеристики первичной опухоли, размеров, анатомической локализации и соотношения с соседними органами, количества опухолевых узлов в паренхиме, от состояния паренхимы в целом, наличия цирроза, вирусного гепати- та B, C и др.
Основным методом лечения, дающим шанс на существенное продление жизни при метастатическом поражении печени у больных колоректальным раком, является хирургическое удаление новообразований. Пятилетняя выживаемость при хирургическом лечении изолированных метастазов колоректального рака в печени, по данным Российского Онкологического Научного Центра
им. Н.Н. Блохина, составляет 37,5%. Пятилетней выживаемости среди больных, получавших химиотерапию или симптоматическое лечение, у больных с солитарными и единичными метастазами в печени, не было. Целесообразность хирургической тактики при метастатических опухолях печени других первичных локализаций выступает объектом изучения. В результате проведённого в Российском Онкологическом Научном Центре им. Н.Н. Блохина сравнительного анализа отдалённых результатов хирургического и лекарственного лечения в зависимости от локализации первичной опухоли, определена тактика лечения больных с метастазами не колоректальных опухолей в печень. Показано выполнение резекции печени по поводу метастазов сразу же при их выявления больным с локализацией первичной опухоли в почке, надпочечнике, желудке, желчном пузыре, при нейроэндокринных опухолях. Больным с лока- лизацией первичной опухоли в яичниках, яичке, молочной железе, показано выполнение резекции печени по поводу метастазов в плане комбинированной терапии после проведения лекарственного лечения. Больным с локализацией первичной опухоли в поджелудочной железе, фатеровом сосочке, лёгком, а также с меланомой кожи выполнение резекции печени по поводу метастазов не показано.
ТЕСТОВЫЕ ЗАДАНИЯ
Выберите один или несколько правильных ответов
1. Какие факторы способствуют развитию первичного рака печени?
A. Гепатиты. Б. Цирроз.
B. Паразитарные заболевания.
Г. Длительный приём гормональных контрацептивов.
Д. Курение.
Е. Пожилой возраст.
Ж. Всё перечисленное.
2. Микроскопические формы первичного рака печени (1 ответ).
A. Гепатоцеллюлярный рак.
Б. Холангиоцеллюлярный рак.
B. Лимфосаркома.
Г. Липосаркома. Д. Ангиосаркома;
Е. Злокачественная фиброзная гистиоцитома. Ж. Всё перечисленное.
3. Пути метастазирования при первичном раке печени (1 ответ).
A. Гематогенный путь. Б. Лимфогенный путь.
B. Имплантационный путь. Г. Всё перечисленное.
4. Куда наиболее часто метастазирует первичный рак печени (3 о т вета)?
A. Печень. Б. Кости.
B. Лимфоузлы ворот печени. Г. Головной мозг.
Д. Лёгкие. Е. Почки.
Ж. Всё перечисленное.
5. Какие методы наиболее часто применяют для диагностики и оценки распространённости опухолевого поражения печени (5 ответов)?
A. УЗИ брюшной полости. Б. КТ брюшной полости.
B. Сканирование костей скелета. Г. Пункционная биопсия опухоли.
Д. Определение опухолевых маркёров.
Е. Рентгенологическое исследование лёгких.
Ж. КТ головного мозга.
6. Уровень каких опухолевых маркёров наиболее часто повышен при первичном раке печени (1 ответ)?
A. РЭА.
Б. СА 19-9.
B. СА
Е. ХГЧ.
Ж. Всё перечисленное.
7. Уровень каких опухолевых маркёров наиболее часто повышен при колоректальном метастатическом раке печени (1 ответ)?
А. РЭА. Б. СА 19-9.
В. СА
Ж. Всё перечисленное.
8. Какой метод морфологической верификации опухоли печени наиболее доступен (1 ответ)?
A. Лапароскопическая биопсия. Б. Биопсия под контролем УЗИ.
B. Интраоперационная биопсия.
9. Клинические признаки первичного рака печени (1 ответ).
A. Гепатомегалия. Б. Боль.
B. Похудание.
Г. Понижение аппетита.
Д. Общая слабость.
Е. Повышение температуры.
Ж. Асцит.
З. Желтуха.
И. Всё перечисленное.
10. Больным показано выполнение резекции печени по поводу метастазов (4 ответа).
A. Рака толстой кишки. Б. Рака желудка.
B. Рака поджелудочной железы. Г. Рака лёгкого.
Д. Меланомы. Е. Почки.
Ж. Нейроэндокринных опухолей.
11. Какой объём операции при опухолевом поражении печени наиболее онкологически оправдан при солитарном поражении печени (1 ответ)?
A. Гемигепатэктомия.
Б. Сегментарная резекция печени.
B. Околоопухолевая резекция печени.
12. Эмболизация правой ветви воротной вены при опухолевом поражении правой доли печени приводит к (1 ответ).
A. Увеличению правой доли печени. Б. Увеличению левой доли печени.
B. Уменьшению опухоли.
13. Эмболизация правой печёночной артерии при опухолевом поражении правой доли печени приводит к (1 ответ).
A. Увеличению правой доли печени. Б. Увеличению левой доли печени.
B. Уменьшению опухоли.
14. Какие методы локального воздействия на опухоль наиболее целесообразно применять в клинической практике (2 ответа)?
A. Алкоголизация. Б. Криодеструкция.
B. Радиочастотная термоаблация.
Г. «Вылущивание» опухолевых очагов.
15. После радикальной операции на печени при колоректальном метастатическом поражении пациенты нуждаются в (1 ответ).
A. Только динамическом наблюдении. Б. Адьювантной химиотерапии.
B. Лучевой терапии.
16. После радикальной операции на печени по поводу первичного рака пациенты нуждаются в (1 ответ):
A. Только динамическом наблюдении. Б. Адьювантной химиотерапии.
B. Лучевой терапии.
СИТУАЦИОННЫЕ ЗАДАЧИ
Задача ? 1. Больной
И., 36 лет. В течение 4 лет болен вирусным гепатитом С. При
обследовании в правой доле печени, на фоне цирротических изменений
определяется объёмное образование до
Вопрос
• Определите диагностическую и лечебную тактику, назовите возможные варианты заболеваний.
Задача ? 2. Больной
А., 45 лет. 2 года назад перенёс резекцию сигмовидной кишки по поводу
рака. При настоящем обследовании в проекции 5 и 8 сегментов печени
определяется 2 опухолевых очага, максимальным размером до
Вопрос
• Определите диагностическую и лечебную тактику.
Задача ? 3. Больной
А., 68 лет. 2 года назад перенёс переднюю резекцию прямой кишки по
поводу рака. При настоящем обследовании в проекции 2 и 5-8 сегментов
печени определяется два опухолевых очага, максимальным размером до
Вопрос
• Определите диагностическую и лечебную тактику.
ЭТАЛОНЫ ОТВЕТОВ
Тестовые задания
1. А, Б, В, Г; 2. Ж;
Ситуационные задачи
Задача ? 1
Предположительный клинический диагноз - первичный рак печени. Для определения лечебной тактики (хирургическое или лекарственное лечение) показано дополнительное обследование: УЗИ или КТ брюшной полости, рентгеновское исследование легких, пункционная биопсия очага в печени, определение уровня опухолевых маркеров - АФП, РЭА, определение функциональной сохраннос-
ти паренхимы печени с помощью радиоизотопных диагностических методов. При отсутствии других проявлений заболевания возможно выполнение операции в объеме правосторонней гемигепатэктомии.
Задача ? 2
Предположительный клинический диагноз - колоректальное метастатическое поражение печени. Диагностические задачи - уточ- нение морфологической природы опухоли и распространенности опухолевого процесса. Необходимо выполнить пункционную аспирационную биопсию очага в печени, УЗИ или КТ брюшной полости, рентгеновское исследование легких, колоноскопию и определить уровень опухолевого маркера РЭА. При отсутствии других проявлений заболевания возможно выполнение операции в объеме правосторонней гемигепатэктомии.
Задача ? 3
Предположительный клинический диагноз - колоректальное метастатическое поражение печени. Диагностические задачи - уточ- нение морфологической природы опухоли и распространенности опухолевого процесса. Необходимо выполнить пункционную аспирационную биопсию очага в печени, УЗИ или КТ брюшной полости, рентгеновское исследование легких, колоноскопию и определить уровень опухолевого маркера РЭА. При отсутствии других проявлений заболевания возможно выполнение операции в объеме правосто- ронней гемигепатэктомии с резекцией или радиочастотной термоаблацией очага во втором сегменте печени.
СПИСОК ЛИТЕРАТУРЫ
1. Патютко Ю.И. Хирургическое лечение злокачественных опухолей печени. - М.: Практическая медицина, 2005.
2. Давыдов М.И. Энциклопедия клинической онкологии. - М.,
2004.
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ БИЛИОПАНКРЕАТОДУОДЕНАЛЬНОЙ ЗОНЫ
Опухоли органов билиопанкреатодуоденальной зоны составляют около 15% среди злокачественных новообразований ЖКТ. В последние годы отмечают рост заболеваемости, особенно в странах,
где имеет место «западный тип» жизни и увеличение средней продолжительности жизни. К органам билиопанкреатодуоденальной зоны относят: желчный пузырь, внепечёночные желчные протоки, поджелудочную железу, большой дуоденальный сосочек и двенад- цатиперстную кишку. Наиболее часто встречают опухоли поджелудочной железы (более 60%), затем большого дуоденального сосочка (15-18%), внепечёночных желчных протоков (10%) и двенадцатиперстной кишки (5%).
Факторы риска
• При раке поджелудочной железы основные факторы риска - табакокурение, длительное употребление кофе, пищи богатой животными жирами, алкоголя, наличие хронического панкреатита, сахарного диабета, перенесённая операция холецистэктомии по поводу желчекаменной болезни в анамнезе, профессиональные токсические воздействия.
• При раке большого дуоденального сосочка - гиперпластические полипы, аденомы, железисто-кистозная гиперплазия и аденомиоз.
• При раке внепечёночных желчных протоков - желчекаменная болезнь, первичный склерозирующий холангит, врождённая дилатация желчных протоков, бактериальная и паразитарная инфекция.
• При раке двенадцатиперстной кишки - диета, богатая животными жирами и белками, диффузные полипозы кишечника (семейный, ювенильный), вилёзные и тубулярные аденомы, глютеновая энтеропатия.
Патологическая анатомия
Наиболее часто рак поджелудочной железы развивается в головке (59-87%), реже в теле и хвосте. Различают экзокринные и эндокринные злокачественные опухоли поджелудочной железы.
• Экзокринные злокачественные опухоли поджелудочной железы:
- протоковая аденокарцинома (микроскопические формы: муцинозная некистозная, перстневидно-клеточная, железисто-плоскоклеточная, недифференцированная, смешанная протоково-эндокринная);
- гигантоклеточная опухоль;
- серозная цистаденокарцинома;
- муцинозная цистаденокарцинома (неинвазивная и инвазивная);
- внутрипротоковая паппилярно-муцинозная карцинома (неинвазивная и инвазивная);
- ацинарноклеточный рак;
- панкреатобластома;
- солидная псевдопаппилярная карцинома;
- смешанная карцинома.
• Эндокринные опухоли поджелудочной железы:
- нейроэндокринная опухоль (карциноид);
- инсулинома;
- гастринома;
- глюкагонома;
- соматостатинома.
В гистологической структуре опухолей поджелудочной железы преобладает протоковая аденокарцинома, которую встречают в 75- 85% случаев. Именно для этой формы характерно крайне агрессивное течение, проявляющееся ранним лимфогенным метастазированием, распространением опухоли по межтканевым и внутритканевым щелям и периневрально. Главный лимфогенный путь опухолевой диссеминации при раке головки поджелудочной железы - поражение лимфатических узлов вокруг головки поджелудочной железы. Далее метастазирование может осуществляться в парааортальные лимфатические узлы или лимфатические узлы вокруг верхних брыжеечных сосудов и чревного ствола. Основной путь метастазирования при локализации опухоли в теле и хвосте поджелудочной железы - лимфатические узлы, прилежащие к дистальным отделам поджелудочной железы, включая лимфатические узлы ворот селезёнки, далее лимфатические узлы вокруг чревного ствола, корня брыжейки и парааортальные лимфатические узлы.
Опухоли большого дуоденального сосочка представлены аденокарциномой различной степени дифференцировки, они имеют экзофитную (вдающиеся в просвет кишки и склонные к изъязвлению) и эндофитную (имеют вид плотного инфильтрата или язвы) формы роста. Для протоковой аденокарциномы характерен периневральный путь распространения, отдалённые метастазы в печень, лёгкие, по брюшине и в отдалённые лимфатические узлы (средостения, периферические).
Также аденокарцинома преобладает среди опухолей внепечёноч- ных желчных протоков, значительно реже встречают низкодифференцированный и плоскоклеточный рак. Различают узловую, папил- лярную и диффузно-инфильтративную формы.
Более 80% опухолей двенадцатиперстной кишки представлены аденокарциномой, реже встречают низкодифференцированный рак, нейроэндокринные опухоли, лимфосаркомы, лейомиосаркомы, фибросаркомы, нейрофибросаркомы.
Классификация по Международной системе TNM
Среди опухолей билиопанкреатодуоденальной зоны преобладает рак поджелудочной железы, поэтому мы ниже приводим его класси- фикацию по системе TNM.
• Т - первичная опухоль.
- Тх - недостаточно данных для оценки первичной опухоли.
- Т0 - первичная опухоль не определяется.
- Tis - преинвазивная карцинома (carcinoma in situ).
- Т1 - опухоль ограничена поджелудочной железой, до
- Т2 - опухоль ограничена поджелудочной железой более
- Т3 - опухоль распространяется за пределы поджелудочной железы, но не вовлекает чревный ствол или верхнюю брыжеечную артерию.
- Т4 - опухоль распространяется на чревный ствол или верхнюю брыжеечную артерию.
• N - регионарные лимфатические узлы.
- Nx - недостаточно данных для оценки регионарных лимфатических узлов.
- N0 - нет признаков метастатического поражения регионарных лимфатических узлов.
- N1 - регионарные лимфатические узлы поражены метастазами.
• М - отдалённые метастазы.
- Мх - недостаточно данных для определения отдалённых метастазов.
- М0 - нет признаков отдалённых метастазов.
- М1 - имеются отдалённые метастазы.
Таблица 5-4. Стадии рака билиопанкреатодуоденальной зоны согласно Международной классификации по системе TNM
Рак поджелудочной железы можно сгруппировать по стадиям согласно Международной классификации по системе TNM (табл. 5-4).
Клиническая картина
Клиническая картина опухолей билиопанкреатодуоденальной зоны зависит от локализации опухоли. Общие симптомы - слабость, похудание, тяжесть в эпигастральной области или правом подреберье, тошнота, расстройства стула, которые часто расценивают как проявления язвенной болезни желудка или двенадцатиперстной кишки.
Наиболее часто диагноз рака внепечёночных желчных протоков, головки поджелудочной железы, большого дуоденального соска и нисходящего отдела двенадцатиперстной кишки устанавливают после выявления механической желтухи, причина которой нарушение оттока желчи. Среди симптомов, сопровождающих желтуху, - пожелтение кожи и слизистых оболочек, зуд, тёмная моча, светлый кал, увеличение жёлчного пузыря (симптом Курвуазье). В анализах крови отмечают повышение билирубина, за счёт прямой фракции, ЩФ, холестерина. Если механическая желтуха обусловлена опухолевым поражением, то она спонтанно не купируется, а постоянно нарастает. Однако при экзофитной форме рака большого дуоденального сосочка, возможна ремитирующая желтуха, связанная с распадом опухоли. Механическая желтуха требует немедленных лечебных мероприятий для её купирования. Раньше единственным способом
для разгрузки жёлчных протоков была полостная операция с созданием обходного соустья между жёлчными протоками и кишечником. В настоящее время, в связи с развитием рентгеноэндохирургии предпочтение отдают чрескожной гепатохолангиостомии, эндоскопическому транспапилярному и лапароскопическому дренированию. При запущенных формах опухолей данной локализации возможна клиническая картина высокой кишечной непроходимости и дуоденального кровотечения.
Для дистальных локализаций рака поджелудочной железы характерно длительное бессимптомное течение заболевания. Первые кли- нические симптомы возникают достаточно поздно и, зачастую, при далеко зашедшем опухолевом процессе. Большинство больных отмечают болевой симптом, который начинается с чувства тяжести и постепенно усиливается, приобретая постоянный ноющий характер. Боль локализуется в мезогастрии, может приобретать опоясываю- щий характер, иррадиировать в спину.
Диагностика
При подозрении на опухоль билиопанкреатодуоденальной зоны необходимо комплексное обследование, включающее иммунохимическое исследование уровня опухолевых маркёров и инструментальные методы диагностики.
• Иммунохимическая диагностика опухолей поджелудочной железы основана на определении в крови двух антигенов: СА 19- 9 и РЭА. Повышение уровня карбогидратного антигена СА 19-9 отмечают у 75-85% больных. Однако чувствительность и специфичность теста на уровень РЭА меньше, чем СА 19-9, и составляет 40-60%.
• Инструментальные методы диагностики условно подразделяют на неинвазивные (УЗИ, КТ и МРТ, позитронно-эмиссионная томография, эндоскопическое и рентгенографическое исследование, эндоскопическая ретроградная холангиопанкреатография, эндоскопическое УЗИ) и инвазивные (ангиография, лапароскопия, пункционная биопсия).
- УЗИ - широкодоступный и достаточно информативный метод. Позволяет выявлять опухоли размером более
- КТ и МРТ с внутривенным контрастированием в настоящее время выступают методами выбора в диагностике рака билиопанкреатодуоденальной зоны. С помощью этих методов можно оценить состояние внепечёночных желчных протоков, двенадцатиперстной кишки, поджелудочной железы, регионарных и юкстарегионарных лимфатических узлов, выявить метастатическое поражения печени и брюшины, провести дифференциальную диагностику между опухолевыми и воспалительными изменениями. При КТ имеется возможность трёхмерной реконструкции, позволяющей наглядно передать взаимоотношения патологического очага с прилежащими сосудами.
- Позитронно-эмиссионная томография - наиболее чувствительный метод визуализации метастазов в лимфатические узлы и другие органы (печень, лёгкие, кости).
- Дуоденоскопия позволяет выявить опухоли двенадцатиперстной кишки и большого дуоденального сосочка, выполнить прицельную биопсию. А при опухолях головки поджелудочной железы оценить прорастание двенадцатиперстной кишки, так же выявить угрозу дуоденального стеноза и кровотечения.
- Эндоскопическая
ретроградная холангиопанкреатография - высокоинформативный метод
диагностики рака под- желудочной железы и внепечёночных желчных
протоков. На сегодняшний момент эта методика - эталон дооперационной
дифференциальной диагностики рака и воспали- тельных изменений.
Признаки рака по эндоскопической ретроградной холангиопанкреатографии:
неравномерное сужение главного панкреатического протока на протяжении
не менее
- Эндоскопическое УЗИ - один из самых высокочувствительных методов, позволяющих выявить местную распространён- ность рака билиопанкреатодуоденальной зоны.
- Ангиографическое исследование устанавливает особенности сосудистой анатомии и определяет степень вовлечения в опухолевый процесс крупных сосудов.
- С целью уточнения распространённости опухолевого процесса выполняют диагностическую лапароскопию, однако этот метод обычно не позволяет оценить местную распространён- ность опухоли и выявить метастазы в забрюшинных лимфатических узлах.
- Пункционная биопсия необходима для морфологической верификации опухоли, чувствительность метода составляет
57-98%.
Лечение
Лечение рака билиопанкреатодуоденальной зоны осуществляют с помощью хирургического метода, лучевой и химиотерапии.
• Хирургический метод лечения больных раком билиопанкреатодуоденальной зоны включает в себя паллиативные, радикальные операции и криохирургию.
- Паллиативные операции выполняют при нерезектабельности опухолевого процесса (распространение опухоли внеорганно на магистральные сосуды, выявление отдалённых метастазов). С целью устранения механической желтухи, высокой тонкокишечной непроходимости проводят паллиативные операции, заключающиеся в формировании обходных анастомозов (холецисто-, холедохоили гепатикоэнтероанастомоза, гастроэнтероанастомоза, а так же межкишечного соустья по
Брауну).
- Радикальные операции проводят в зависимости от локализации опухолевого процесса. При опухоли в головке под- желудочной железы, дистальном отделе холедоха, большом дуоденальном сосочке и двенадцатиперстной кишке проводят гастропанкреатодуоденальную резекцию (операция Whipple), которая включает: резекцию холедоха, выходного отдела желудка с прилежащими малым и правой половиной большого сальника, удаление головки поджелудочной железы, желчного пузыря и всей двенадцатиперстной кишки. В удаляемый комплекс входит прилежащая к головке поджелудочной железы клетчатка и фасциально-клетчаточные футляры общей и собственной печёночной артерии, верхней брыжеечной и воротной вен, содержащие лимфоузлы, лимфатические сосуды и нервные сплетения. При раке проксимального отдела внепечёночных желчных протоков (опухоль Клатскина)
объём и характер операции зависит от локализации и распро- странённости опухолевого процесса. Если опухоль не распространяется на долевые желчные протоки, то осуществляют резекцию общего желчного протока с формированием бигепатикоэнтероанастомоза. При вовлечении одного из долевых протоков проводят резекцию внепечёночных желчных протоков, гемигепатэктомию со стороны опухолевого поражения и удаление первого сегмента. Далее оставшийся долевой проток имплантируют в тонкую кишку. Во всех случаях проводят адекватную лимфо- и невродиссекцию. При локализации опухоли в теле и хвосте поджелудочной железы выполняют дистальную субтотальную резекцию, которая включает резекцию дистальных отделов железы, при которой поджелудочная железа пересекается справа от верхней брыжеечной или воротной вены с пересечением селезёночной артерии около устья, селезёночной вены непосредственно у конфлюенса воротной вены. Эта операция дополняется спленэктомией, удалением лимфатических узлов следующих групп: вокруг чревного ствола, в воротах селезёнки, вдоль селезёночной артерии и по нижнему краю тела и хвоста железы. Панкреатэктомию выполняют при мультицентрическом поражении поджелудочной железы и распространении опухоли головки на тело и хвост. Отдалённые результаты хирургического лечения больных протоковым раком поджелудочной железы остаются неудовлетворительными. Большинство лиц, перенёсших операции, умирают в первый год после операции. К концу второго года в живых остаётся не более 20% оперированных, три года переживают единичные больные. Подавляющее большинство оперированных умирают от прогрессирования рака поджелудочной железы, поэтому для улучшения выживаемости больных раком поджелудочной железы проводят комбинированное лечение, которое заключается в применении хирургического метода и химиотерапии или радиотерапии в различных режимах. Возможно использование всех трёх методов лечения. В плане комбинированного лечения после хирургического удаления опухоли проксимального отдела холедоха возможно проведение внутрипротоковой, дистанционной (узким полем) или сочетанной лучевой терапии. После радикальных операций выполненных по поводу эндокринных,
пограничных и доброкачественных опухолей поджелудочной железы, опухолей дистального отдела холедоха, двенадцати- перстной кишки и большого дуоденального сосочка проводят динамическое наблюдение больных. Только при выявлении прогрессирования опухолевого процесса назначают химиотерапевтическое лечение. - При опухоли тела и хвоста поджелудочной железы используют криохирургический метод. Криовоздействие выполняют прямым контактным способом - наложение криоапликатора (апликационный или перфорационный) непосредственно на опухоль. У большинства больных криодеструкция опухоли обусловливает умеренно выраженный анальгезирующий эффект.
• Лучевую терапию проводят больным с местно распространён- ным нерезектабельным раком поджелудочной железы, внепечё- ночных желчных протоков. Трудность лучевого лечения данных опухолей связана в основном с особенностями анатомического расположения органов билиопанкреатодуоденальной зоны и близостью жизненно важных органов с малой толерантностью к лучевому воздействию. Наиболее целесообразно применение продольной методики тормозным облучением бетатрона или линейного ускорителя. Можно проводить сочетанную радиотерапию. Данные методики позволяют при сравнительно небольших объёмах облучаемых тканей включать в зону достаточно однородного облучения патологически изменённый орган и прилежащие лимфатические узлы. Топометрическое планирование лучевой терапии проводят с помощью компьютерной разметки. Лучевая терапия больных местно распространённым раком поджелудочной железы чаще всего осуществляют пролонгированным курсом в режиме мелкого фракционирования дозы 5 раз в неделю до суммарной очаговой дозы (СОД) 50-90 Гр. Для лечения местно распространённого рака внепечёночных желчных протоков предпочитают сочетанную лучевую терапию (внутрипротоковая и дистанционная). Внутрипротоковую радиотерапию проводят радиоактивным источником 192 Ir по 4-5 Гр, до СОД 28-48 Гр, далее лечение дополняется дистанционной лучевой терапией в СОД 25-30 Гр.
• Химиотерапия. Единого стандарта лечения больных диссеминированными формами рака билиопанкреатодуоденальной зоны не существует из-за резистентности данных опухолей к химиоте-
рапии. Тем не менее лекарственное лечение больных сопровождается объективным эффектом, а это даёт надежду на реальное продление жизни. Лечение проводят только после купирования механической желтухи любым методом. Для лечения применяют различные противоопухолевые препараты: фторурацил, митомицин, доксорубицин, иринотекан, паклитаксел, доцетаксел, гемцитабин, причём возможна комбинация препаратов.
ТЕСТОВЫЕ ЗАДАНИЯ
Выберите один или несколько правильных ответов
1. Какие факторы способствуют развитию рака поджелудочной железы (5 ответов)?
A. Гепатиты. Б. Диабет.
B. Хронический панкреатит. Г. Желчекаменная болезнь. Д. Курение.
Е. Пожилой возраст. Ж. Всё перечисленное.
2. Какие существуют гистологические разновидности опухолей поджелудочной железы (4 ответа)?
A. Аденокарцинома. Б. Инсулинома.
B. Гастринома.
Г. Плоскоклеточный рак.
Д. Саркома.
Е. Всё перечисленное.
3. Рак поджелудочной железы наиболее часто даёт метастазы в... (2 ответа).
A. Печень; Б. Почки;
B. Лёгкие; Г. Кости;
Д. Головной мозг;
Е. Всё перечисленное.
4. Наиболее характерный симптом рака головки поджелудочной железы (1 ответ).
A. Боль.
Б. Интоксикация.
B. Кишечная непроходимость. Г. Потеря веса.
Д. Желтуха.
Е. Всё перечисленное.
5. Наиболее характерный симптом рака тела и хвоста поджелудочной железы (1 ответ).
A. Боль.
Б. Интоксикация.
B. Кишечная непроходимость. Г. Потеря веса.
Д. Желтуха.
Е. Всё перечисленное.
6. Положительный симптом Курвуазье (увеличение желчного пузыря, вызванное застоем желчи) характерен для (1 ответ).
A. Рака головки поджелудочной железы.
Б. Рака тела и хвоста поджелудочной железы.
B. Рака желчного пузыря.
7. Повышение уровня прямого билирубина крови характерно для (1 ответ).
А. Механической желтухи. Б. Паренхиматозной желтухи.
8. Гемолитической желтухи. Г. Всё перечисленное.
8. Специализированными методами обследования, предназначенными для выявления опухоли поджелудочной железы, служат (5 от в е тов).
A. УЗИ. Б. КТ.
B. МРТ.
Г. Ретроградная холангиопанкреатография.
Д. Целиакография.
Е. Обзорная рентгенография.
9. При раке поджелудочной железы целесообразно определение опухолевых маркёров (2 ответа).
A. РЭА. Б. АФП.
B. СА 19-
Д. СА 125.
Е. ХГЧ.
Ж. Всё перечисленное.
10. Для предоперационной билиарной декомпрессии, вызванной раком поджелудочной железы, наиболее оправдано выполнение (1 ответ).
A. Обходных анастомозов.
Б. Чреспечёночной холангиостомии.
B. Холецистостомии.
Д. Папиллосфинктеротомии. Е. Всё перечисленное.
11. При раке головки поджелудочной железы выполняется (1 ответ).
A. Резекция поджелудочной железы.
Б. Гастропанкреатодуоденальная резекция.
B. Криодеструкция опухоли. Г. Всё перечисленное.
12. При раке тела и хвоста поджелудочной железы выполняется (2 ответа).
A. Дистальная субтотальная резекция поджелудочной железы. Б. Гастропанкреатодуоденальная резекция.
B. Криодеструкция опухоли.
13. После радикального удаления опухоли поджелудочной железы больным показано (2 ответа).
A. Динамическое наблюдение. Б. Лучевая терапия.
B. Химиотерапия.
Г. Всё перечисленное.
СИТУАЦИОННЫЕ ЗАДАЧИ
Задача ? 1. Больной 57 лет. Считает себя больным около 3 мес, когда впервые появились жалобы на слабость, потерю веса, боли в эпигастрии, а около 3 нед назад присоединилась желтуха. Уровень общего билирубина крови 315 ммоль/л (прямой билирубин - 295 ммоль/л). При УЗИ отмечают расширение холедоха и внутрипечёночных желчных протоков.
Вопрос
• Определите диагностическую и лечебную тактику, назовите возможные варианты заболеваний.
Задача ? 2. Больной
47 лет. В анамнезе - хронический панкреатит. Настоящее обострение
началось около 2 мес назад, когда впервые появились жалобы на слабость,
потерю веса, боли в эпигастрии опоясывающего характера с иррадиацией в
спину. При УЗИ определяют объёмное образование в проекции хвоста
поджелудочной железы, без чётких контуров, диаметром до
Вопрос
• Определите диагностическую и лечебную тактику, назовите возможные варианты заболеваний.
Задача ? 3 Больной
47 лет. Около 2 мес назад впервые появились жалобы на слабость, потерю
веса, боли в эпигастрии опоясывающего характера с иррадиацией в спину.
При УЗИ определяют объёмное образование в проекции хвоста
поджелудочной железы, диаметром до
Вопрос
• Определите диагностическую и лечебную тактику, назовите возможные варианты заболеваний.
ЭТАЛОНЫ ОТВЕТОВ
Тестовые задания
1. Б, В, Г, Д, Е; 2. А, Б, В, Г; 3. А, В; 4. Д; 5. А; 6. А; 7. А; 8. А, Б, В, Г, Д; 9. А, В; 10. Б; 11. Б; 12. А, В; 13. Б, В.
Ситуационные задачи
Задача ? 1
Явления механической желтухи возможны при опухолевых процессах дистального отдела холедоха, головки поджелудочной железы, фатерова соска, двенадцатипёрстной кишки. На первом этапе лечения следует провести декомпрессию желчных протоков. Методами декомпрессии являются чрескожная чреспеченочная гепатохолангиостомия, эндоскопическое ретроградное транспапиллярное дренирование, лапароскопическая холецистотомия. Вторым этапом для уточнения распространенности опухолевого процесса нужно провести УЗИ брюшной полости, КТ или МРТ с внутривенным контрастированием брюшной полости, обзорную рентгенографию органов грудной клетки, провести верификацию опухолевого процесса. В дальнейшем нужно решать вопрос о радикальной операции в объёме гастропанкреатодуоденальной резекции.
Задача ? 2
Основной причиной данного патологического процесса является опухолевое поражение. Больному с целью уточнения диагноза следует провести УЗИ брюшной полости, КТ или МРТ с внутривенным контрастированием брюшной полости, обзорную рентгенографию органов грудной клетки, провести верификацию опухолевого процесса (пункционная биопсия). В дальнейшем нужно решать вопрос о радикальной операции в объёме дистальной субтотальной резекции поджелудочной железы.
Задача ? 3
Основной причиной данного патологического процесса является опухолевое поражение поджелудочной железы с синхронным мета- стазом в печени. Больному с целью уточнения диагноза и распро- странённости процесса следует провести УЗИ брюшной полости, КТ или МРТ с внутривенным контрастированием брюшной полости, обзорную рентгенографию органов грудной клетки, провести верификацию опухолевого процесса (пункционная биопсия). Если диагностирована нейроэндокринная опухоль поджелудочной железы с метастазом в печень, то следует провести одномоментное хирургическое вмешательство на поджелудочной железе и печени, а если верифицирована аденокарцинома поджелудочной железы с метастазом в печени, то больному показана химиотерапия.
5.4. РАК ТОЛСТОЙ КИШКИ
Общая цель практического занятия
На основе знаний клинических проявлений рака интерпретировать полученные результаты обследования, построить клинический диагноз, провести дифференциальную диагностику, выбрать и обосновать методы лечения.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Эпидемиология
Колоректальный рак занимает второе место среди злокачественных опухолей органов пищеварительного тракта. Статистика последних лет свидетельствует об увеличении числа больных раком этой локализации во всем мире. По данным ВОЗ, в мире ежегодно фиксируют более 500 тыс. случаев колоректального рака. Заболеваемость раком ободочной и прямой кишки в 2004 году составила 12,3 и 11,6 у мужчин и 10,3 и 7,7 у женщин на 100 тыс. населения. На долю больных старше 55 лет приходится 84,5% заболеваний данной локализации. Прирост заболеваемости отмечают во всех экономически развитых странах Северной Америки и Европы, в то же время менее выражен в Азии и сельских общинах Африки (разница до 10-20 раз). Частота поражения различных отделов ободочной и прямой кишки не одинаковы. В слепой и восходящей ободочной кишке опухоли встречают в 24,5%, в поперечно-ободочной кишке 9%, в сигмовидной - 21 %, ректосигмоидный переход - 7%, в прямой кишке - 38% случаев. В ряде стран, например в США, отмечают значительную заболеваемость колоректальным раком - 34,1 на 100 тыс. населения.
Факторы риска и предраковые заболевания
Наблюдают значительно более высокий уровень заболеваемости в тех группах населения, пища которых насыщена животными жирами, белками, легко усваиваемыми углеводами и есть недостаток волокнистой клетчатки. Считают, что возникновение колоректального рака связано также с изменением секреции желчи, состава желчных кислот и кишечной флоры под влиянием отдельных компонентов пищи. Одной из причин возникновения колоректального рака выступают некоторые химические соединения (асбест, афлотоксины).
К предраковым заболеваниям ободочной кишки относят:
• диффузный семейный полипоз (риск озлокачествления 75-100%);
• наследственный не связанный с полипозом колоректальный рак;
• неспецифический язвенный колит (5-50%);
• больные с синдромами Пейтца-Егерса, Гарднера (5-50%);
• болезнь Крона (5-50%);
• одиночные и групповые полипы, частота малигнизации зависит от размеров и локализации (1-42%);
• больные, ранее оперированные по поводу рака толстой кишки
(15-20%);
• лица в возрасте старше 50 лет. Профилактика
Профилактика рака ободочной кишки сводится к своевременному выявлению и лечению предраковых заболеваний, что делает необходимым знание их клинических проявлений. Раннее выявление колорек- тального рака затруднено, и в этом плане существенную помощь могут оказать мероприятия, направленные на формирование «групп риска», охватывающих больных с предопухолевыми заболеваниями и доброкачественными опухолями ободочной кишки, и организация тщательного наблюдения за ними с использованием современных диагностических средств (рентгенологический, эндоскопический контроль).
Анатомия и физиология
Толстая
кишка состоит из отделов, отличающихся функциональными особенностями и
строением: слепая кишка, восходящая, печёночный угол,
поперечноободочная кишка, селезёночный угол, нисходящая и сигмовидная
кишка. Наиболее уязвимыми местами ободочной кишки выступают места её
физиологического сужения, где, как известно, чаще всего возникает рак.
Продольный мышечный слой ободочной кишки распределяется неравномерно и
концентрируется в виде трёх параллельных друг другу полос шириной до
Кровоснабжение ободочной кишки обеспечивает верхняя и нижняя брыжеечные артерии. Верхнеампулярный отдел прямой
кишки кровоснабжается из бассейна нижней брыжеечной артерии, остальные отделы из бассейна внутренних подвздошных артерий. Лимфатическая система начинается капиллярами, расположенными по криптам слизистой оболочки кишки в мышечном и серозном слое, образуя выносящие лимфатические сосуды брыжеечного края кишки, где они впадают в лимфатические узлы. Околокишечные лимфоузлы расположены вдоль артериальных аркад, промежуточ- ные между корнем брыжейки и кишечной стенкой, забрюшинные в забрюшинной клетчатке.
Патологическая анатомия
Из злокачественных опухолей, локализующихся в ободочной, кишке, рак составляет 98-99%, саркомы (в основном лимфосаркомы) - 1-2%. По форме роста опухоли различают экзофитную, характерную для правых отделов, и эндофитную (инфильтрирующую, язвенную), которую чаще встречают в левых отделах ободочной кишки.
По гистологическому строению различают аденокарциному (60- 70%), солидный рак (10-12%) и слизистый рак (12-15%).
Отдалённые метастазы наиболее вероятно обнаружить в печени, лёгких, надпочечниках, яичнике, канцероматоз брюшины. При раке толстой кишки встречают первично множественные опухоли, которые располагаются на разных участках кишки.
Классификация по Международной системе TNM
• При оценке Т, N и М категорий используют следующие методы: физический осмотр;
- методы визуализации;
- эндоскопию;
- хирургическое исследование.
• Классификация TNM применима только для рака, при этом необходимо гистологическое подтверждение диагноза. T - первичная опухоль.
- Tx - недостаточно данных для оценки первичной опухоли.
- T0 - первичная опухоль не определяется.
- Tis - интраэпителиальная или с инвазией слизистой оболочки. Tis включает раковые клетки до базальной мембраны (интраэпителиальное распространение) или в слизистом слое без распространения в подслизистый слой.
- T1 - опухоль инфильтрирует стенку кишки до подслизистой оболочкой.
- Т2 - опухоль инфильтрирует мышечный слой стенки кишки.
- Т3 - опухоль инфильтрирует субсерозную оболочку или ткань ободочной и прямой кишки.
- Т4 - опухоль прорастает висцеральную брюшину или непосредственно распространяется на соседние органы и структуры путём прорастания серозной оболочки, например, врастание опухоли слепой кишки в сигмовидную. Прорастание опухоли в другие органы или структуры, определяемое макроскопически, классифицируется Т4. Однако если нет микроскопического подтверждения, то Т3.
• N - регионарные лимфатические узлы.
- Nx - недостаточно данных для оценки регионарных лимфатических узлов.
- N0 - нет признаков метастатического поражения регионарных лимфатических узлов.
- N1 - метастазы в 1-3 регионарных лимфатических узлах.
- N2 - метастазы в4и более регионарных лимфатических узлах.
• М - отдалённые метастазы.
- Mx - недостаточно данных для оценки отдалённых метастазов.
• - M0 - нет признаков отдалённых метастазов. M1 - наличие отдалённых метастазов.
Таблица 5-5. Стадии рака согласно Международной классификации по системе TNM
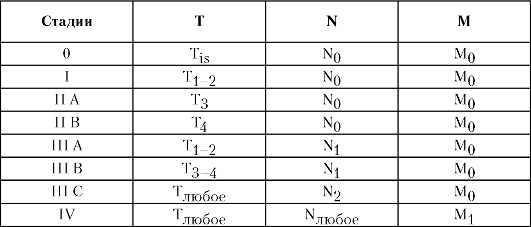
Рак ободочной и прямой кишки можно сгруппировать по стадиям согласно Международной классификации по системе TNM (табл. 5-5).
Клиническая картина
Характерных признаков, на основании которых можно в начальном периоде выявить рак ободочной кишки, не существует. Жалобы возникают лишь с того времени, когда появились нарушения деятельности кишечника или общие симптомы заболевания. Уже при развитом раке следующие клинические признаки отмечаются в разных сочетаниях: потеря аппетита, тошнота, отрыжка, неприятные ощущения во рту, вздутие и чувство тяжести, боли в животе, неустойчивый стул, нарушение кишечной проходимости (более характерное для рака левой половины), патологические выделения из заднего прохода (кровь, слизь, гной). Иногда происходит нарушение общего состояния при отсутствии заметных симптомов со стороны кишки, что выражено анемией, слабостью и повышением температуры. Пальпаторно определение опухоли хотя и не выступает ранним симптомом, но нередко служит основным поводом для постановки диагноза. Осложнения рака ободочной кишки - кишечная непроходимость, кровотечение, абсцесс, флегмона и перфорация кишечной стенки.
Особенности течения рака ободочной кишки и его осложнения позволили выделить токсикоанемическую, энтероколитическую, диспепсическую, обтурационную, псевдовоспалительную и опухолевую клинические формы.
• Токсикоанемическая форма характерна для поражения правой половины ободочной кишки. На первое место выступают симптомы общих расстройств: недомогание, слабость, быстрая утомляемость, потеря трудоспособности, повышение температуры, бледность кожных покровов и прогрессирующая анемия.
• Энтероколитической форме присущи неустойчивый стул, чувство распирания и вздутия кишечника, урчание в животе, различные расстройства акта дефекации, наличие патологических выделений, болевые ощущения в животе.
• Диспепсическая форма отличается более частыми болями в животе, потерей аппетита, неприятными ощущениями во рту, отрыжкой, тошнотой, эпизодической рвотой, чувством вздутия и тяжести в эпигастральной области.
• Обтурационная форма характеризуется ранними проявлениями кишечной непроходимости, которой предшествует боль по типу кишечной колики.
• Псевдовоспалительная форма проявляется повышенной температурой, может симулировать различные воспалительные заболевания брюшной полости (аппендицит, холецистит).
• Опухолевой форме свойственна пальпаторно определяемая опухоль при отсутствии других проявлений заболевания.
Диагностика
Клиническое обследование больного сводится к общему осмотру, пальпации живота, анализам на скрытое кровотечение и тщатель- ному рентгенологическому обследованию ЖКТ. Особую ценность представляет исследование толстой кишки с помощью бариевой клизмы с одновременной инсуфляцией воздухом (двойное контрастирование) и колонофиброскопией. Обследование необходимо начинать с ректороманоскопии. В настоящее время с появлением и совершенствованием эндоскопических методов обязательным считают морфологическую оценку опухоли.
В качестве уточняющих распространённость опухолевого процесса методов используют УЗИ органов брюшной полости, экскреторную урографию, КТ, МРТ, лапароскопию. Также в качестве допол- нительных методов диагностики применяют определение уровня экспрессии в сыворотке крови РЭА, СА 19-9.
Дифференциальная диагностика
Дифференциальную диагностику рака ободочной и прямой кишки проводят с полипозом, туберкулёзом, инвагинацией кишки, актиномикозом, неспецифическим язвенным колитом и заболеваниями желчного пузыря и правой почки (табл. 5-6).
Лечение
Своевременное выявление и адекватное лечение предопухолевых заболеваний ободочной кишки - профилактика рака этой локали- зации. Неспецифические язвенные колиты в большинстве случаев подвергают консервативному лечению сульфаниламидными препаратами, антибиотиками, витаминотерапией, гормонами. Полипы ободочной кишки подлежат эндоскопическому удалению или оперативному лечению.
Таблица 5-6. Дифференциальная диагностика рака ободочной и прямой кишки

Основной метод лечения рака ободочной кишки - хирургический. Объём оперативного вмешательства зависит от локализации опухо- ли. Типовые операции: правосторонняя или левосторонняя гемиколэктомия, резекция поперечноободочной и сигмовидной кишки, при прорастании опухолью соседних органов выполняют комбинированные операции, при распространённом процессе проводят паллиативные операции.
• Операция по Хартманну. Он в 1921 году описал новую методику операции, которая выступила современным вариантом выведения сигмовидной кишки по Микуличу. Суть этого нового метода состоит в том, что уже при первой операции производят резекцию патологически изменённого участка сигмовидной кишки (опухоль, дивертикулит), центральный конец кишки через особое отверстие в брюшной стенке, в форме искусственного заднепроходного отверстия подшивают к брюшной стенке, а нижний конец кишки после вворачивания слизистой ушивают и погружают в малый таз. Этот метод можно применять в следующих случаях:
- при раке сигмовидной кишки с непроходимостью от сужения просвета кишки;
- при обширном местном раке сигмовидной кишки;
- при раке сигмовидной кишки с обширными метастазами;
- при перфорации сигмовидной кишки с распадающейся опухолью или дивертикулом;
- при резекции сигмовидной кишки, когда возникает значительные технические трудности в связи с наложением анас- томоза;
- когда показана брюшинно-промежностная ампутация прямой кишки, но преклонный возраст и тяжёлое общее состояние больного не позволяют её произвести;
- если состояние больного становится очень тяжёлым в ходе запланированной передней резекции или брюшинно-промеж- ностной ампутации прямой кишки, вмешательство можно закончить по методу Hartmann.
• Резекцию толстой кишки чаще всего производят с целью радикального удаления карциномы толстой кишки. Удаляют опре- делённый участок толстой кишки, между остающимися верхней и нижней петлями накладывают анастомоз благодаря которому и восстанавливают непрерывность кишечного тракта. При кар-
циноме размеры резекции определяют так, чтобы выше и ниже опухоли можно было удалить по крайней мере
- Правосторонняя гемиколэктомия (от греческого hemi - половина). К этому вмешательству прибегают, когда опухоль локализуется на правой стороне толстой кишки (на слепой, восходя- щей, в печёночном изгибе). Пересекается а. ileocolica и правая, а иногда и средняя артерии толстой кишки. Непрерывность кишки восстанавливают наложением илеотрансверзостомии.
- Резекция поперечноободочной кишки служит для радикального удаления опухоли поперечноободочной кишки. Рассекают только среднюю артерию толстой кишки. Непрерывность кишечного тракта восстанавливают путём наложения анас-
томоза между центральной и дистальной культями поперечноободочной кишки. Если наложение такого анастомоза сопряжено с трудностями, приходится мобилизовать также оба кишечных изгиба.
- Резекция селезёночного изгиба. Производят в тех случаях, когда опухоль кишки расположена в области селезё- ночного изгиба. Разрезают левую артерию толстой кишки. Непрерывность кишечного тракта восстанавливается наложением трансверзосигмоидеостомии после завершения резекции.
- Резекцию сигмовидной кишки производят при опухолях сигмовидной кишки. Пересекают артерии сигмовидной кишки. Непрерывность кишечного тракта восстанавливают наложением анастомоза между верхней и нижней культями сигмовидной кишки, если это наталкивается на значительные трудности, то мобилизуют селезёночный изгиб и нисходящую часть кишки.
- Левостороннюю гемиколэктомию применяют при опухолях на левой стороне толстой кишки, когда метастазы в лимфатические узлы окружат место отхождения нижней брыжеечной артерии, в результате чего приходится пересекать этот сосудистый ствол у его основания. Непрерывность кишки восстанавливают трансверзоректостомией. После такой обширной резекции наложение анастомоза возможно, если произведена широкая мобилизация печёночного изгиба и восходящей кишки.
• Паллиативные операции производят при невозможности радикального лечения в виду распространённости процесса, при наличии осложнений, у ослабленных и пожилых больных. К ним можно отнести наложение илеотрансверзоанастомоза и выведение стомы на различных уровнях ободочной кишки выше опухоли.
При лечении больных с IV стадией рака используют химиотерапию с производными платины, фторурацилом или его производными в комбинации с кальцием фолиатом, которая даёт положительный эффект в 15-30% случаев. Из новых цитостатиков оказались эффективны ралтитрексид и иринотекан. В последнее время всё более активное применение получает таргетная терапия (воздействие на факторы роста опухоли) - бевацизумаб.
Методика лучевой терапии, применяемая как в предоперационном, так и в паллиативном варианте при раке прямой кишки игра- ет значительную роль. Результаты лечения улучшаются на фоне одномоментной с γ-терапией гипертермии опухоли. Летальность после операций по поводу рака ободочной кишки, выполненных в плановом порядке, составляет 2-5%. При осложнённом течении рака летальность достигает 40%. Наиболее грозное осложнение в послеоперационном периоде - перитонит. Результаты пятилетней выживаемости радикально оперированных больных по поводу рака правой и левой половины ободочной кишки приблизительно одинаковы и составляют около 59%. Имеется зависимость отдалённых результатов хирургического лечения от гистологической структуры опухоли. Так, более 5 лет прожили 68,7% больных с аденокарциномой, 45,6% с солидным раком, 30% с низко дифференцированным раком.
Паллиативные резекции толстой кишки, произведённые с целью профилактики кишечной непроходимости при наличии отдалённых метастазов, а также обходные анастомозы и колостомы, позволяют продлить жизнь до 5 лет у 15% оперированных больных.
СИТУАЦИОННЫЕ ЗАДАЧИ
Задача ? 1. Больной 60 лет предъявляет жалобы на слабость, снижение аппетита, субфебрильную температуру, неустойчивый стул, периодические боли в правой половине живота. Данные обследования.
• Рентгенография лёгких без патологии.
• ЭКГ: ритм синусовый, 85 в минуту, нагрузка на правое предсердие.
• Клинический анализ крови:
- гемоглобин - 60 г/л;
- эритроциты - 4,0х1012/л;
- цветовой показатель - 0,9;
- тромбоциты - 240х109/л;
- лейкоциты - 8,2х109/л (палочкоядерные - 1 % , сегментоядерные - 61%, эозинофилы - 7%, лимфоциты - 8%, моноциты - 13%);
- СОЭ - 30мм/ч.
• Анализ мочи: плотность - 1003 г/л, реакция среды - нейтральная, лейкоциты - 0-3 в поле зрения.
• ЭГДС без патологии.
• УЗИ брюшной полости: диффузные изменения печени.
Вопросы
• Каков предположительный диагноз?
• Что необходимо выполнить для уточнения диагноза до начала лечения?
• Как называется данная форма течения указанной патологии?
• Каков основной метод лечения указанной патологии?
• Какая операция будет считаться минимально-допустимой при выборе хирургической тактики лечения?
Задача ? 2. Больной 46 лет предъявляет жалобы на неустойчивый стул, периодические боли в левой половине живота, периодическое ощущение вздутия, чередование поносов и запоров. Отмечает следы крови в кале. Данные обследования.
• Рентгенография: патологии не обнаружено.
• ЭКГ: ритм синусовый, 85 в мин, нагрузка на правое предсердие.
• Клинический анализ крови:
- гемоглобин - 100 г/л;
- эритроциты - 4,0х1012/л;
- цветовой показатель - 0,9;
- тромбоциты - 240х109/л;
- лейкоциты - 8,2х109/л (палочкоядерные - 1 % , сегментоядерные - 61%, эозинофилы - 7%, лимфоциты - 8%, моноциты - 13%);
- СОЭ - 30 мм/ч.
• Анализ мочи: плотность - 1003 г/л, реакция среды - нейтральная, лейкоцитов - 0-3 в поле зрения.
• ЭГДС: без патологии.
• УЗИ брюшной полости: диффузные изменения печени. Вопросы
• Каков предположительный диагноз?
• Что необходимо выполнить для уточнения диагноза до начала лечения?
• Как называется данная форма течения указанной патологии?
• Каков основной метод лечения указанной патологии?
• Какая операция будет считаться минимально-допустимой при выборе хирургической тактики лечения?
Задача ? 3. Больной 56 лет предъявляет жалобы на неустойчивый стул, периодические боли в животе, периодическое ощущение
вздутия. При пальпации брюшной стенки определяется инфильтрат на границе эпи- и мезогастрия, смещаемый, безболезненный. Данные обследования.
• Рентгенография: патологии не обнаружено.
• ЭКГ: ритм синусовый, 85 в мин, нагрузка на правое предсердие.
• Клинический анализ крови:
- гемоглобин - 130 г/л;
- эритроциты - 4,0х1012/л;
- цветовой показатель - 0,9;
- тромбоциты - 240х109/л;
- лейкоциты - 8,2х109/л (палочкоядерные - 1 % , сегментоядерные - 61%, эозинофилы - 7%, лимфоциты - 8%, моноциты - 13%);
- СОЭ - 30 мм/ч.
• Анализ мочи: плотность - 1003 г/л, реакция среды - нейтральная, лейкоцитов - 0-3 в поле зрения.
• ЭГДС: без патологии.
• УЗИ брюшной полости: диффузные изменения печени. Вопросы
• Каков предположительный диагноз?
• Что необходимо выполнить для уточнения диагноза до начала лечения?
• Какое рентгеновское исследование может дополнить клиническую картину?
• Каков основной метод лечения указанной патологии?
• Какая операция будет считаться минимально-допустимой при выборе хирургической тактики лечения?
Задача ? 4. Больной 48 лет предъявляет жалобы на частые ложные позывы к дефекации, выделение крови и слизи с калом, склонность к запорам. Данные обследования.
• Рентгенография: патологии не обнаружено.
• ЭКГ: ритм синусовый, 85 в минуту, нагрузка на правое предсердие.
• Клинический анализ крови:
- гемоглобин - 120 г/л;
- эритроциты - 4,0х1012/л;
- цветовой показатель - 0,9;
- тромбоциты - 240х109/л;
- лейкоциты - 8,2х109/л (палочкоядерные - 1 % , сегментоядерные - 61%, эозинофилы - 7%, лимфоциты - 8%, моноциты - 13%);
- СОЭ - 30 мм/ч.
• Анализ мочи: плотность - 1003 г/л, реакция среды - нейтральная, лейкоцитов - 0-3 в поле зрения.
• ЭГДС: без патологии.
• УЗИ брюшной полости: диффузные изменения печени. Вопросы
• Каков предположительный диагноз?
• Что необходимо выполнить для уточнения диагноза до начала лечения?
• Какое общепринятое амбулаторное исследование может помочь установить диагноз?
• Каков основной метод лечения указанной патологии?
• Каким видам хирургических вмешательств следует отдать предпочтение при не осложнённом течении указанной патологии?
ЭТАЛОНЫ ОТВЕТОВ
Задача ? 1
1. Рак правой половины толстой кишки.
2. Колоноскопия.
3. Токсико-анемическая форма.
4. Хирургический.
5. Правосторонняя гемиколэктомия.
Задача ? 2
1. Рак левой половины толстой кишки.
2. Колоноскопия.
3. Энтероколитическая форма.
4. Хирургический.
5. Левосторонняя гемиколэктомия.
Задача ? 3
1. Рак поперечной ободочной кишки.
2. Колоноскопия.
3. Рентгенография с барием.
4. Хирургический.
5. Резекция поперечной ободочной кишки.
Задача ? 4
1. Рак прямой кишки.
2. Ректоскопия.
3. Пальцевое исследование прямой кишки.
4. Лучевой и хирургический.
5. Органосохраняющим с восстановлением непрерывности кишки.
СПИСОК ЛИТЕРАТУРЫ
1. Патютко Ю.И., Котельников А.Г. Хирургия рака органов билиопанкреатодуоденальной зоны. - М.: Медицина, 2007.
2. Давыдов М.И. Энциклопедия клинической онкологии. - М.,
2004.
3. Данилов М.В., Федоров В.Д. Хирургия поджелудочной железы - М.: Медицина, 1995.