Онкология: модульный практикум. Учебное пособие. / Давыдов М.И., Ведьшер Л.З., Поляков Б.И., Ганцев Ж.Х., Петерсон С.Б. - 2008.-320 c.
|
|
|
|
МОДУЛЬ 1 ОБЩИЕ ВОПРОСЫ ОНКОЛОГИИ
Цель изучения модуля: ознакомление с механизмами канцерогенеза и метастазирования, с общими принципами диагностики и лечения в онкологии; анализ причин высокой смертности от онкологических заболеваний в Российской Федерации (РФ); выработка практических навыков профилактики и ранней диагностики злокачественных опухолей.
Проблема онкологических заболеваний остаётся приоритетной для современного общества. Судя по нынешним темпам роста насе- ления Земли, за 30 лет, с 1985 по 2015 год, оно может увеличиться с 4,8 до 7,5 млрд человек, в основном за счёт жителей развивающихся стран. Основной прирост численности ожидается в возрастной группе старше 45 лет. В то же время злокачественные опухоли в 75% случаев возникают у лиц старше 55 лет. По прогнозам Всемирной организации здравоохранения (ВОЗ), за период с 1999 по 2020 год заболеваемость злокачественными новообразованиями и смертность от них во всём мире возрастёт в 2 раза: с 10 до 20 млн новых случаев в год и с 6 до 12 млн регистрируемых смертей соответственно. Учитывая, что в развитых странах наблюдается тенденция к снижению этих показателей (как за счёт профилактики, в первую очередь борьбы с курением, так и за счёт совершенствования методов ранней диагностики и лечения), становится ясным, что основной их прирост придётся на развивающиеся страны, к которым сегодня следует отнести и Россию. К сожалению, в России нам следует ожидать серьёзного увеличения как заболеваемости раком, так и смертности от злокачественных опухолей. Этот прогноз подтверждают и данные об основных причинах, вызывающих онкологические заболевания.
1.1. ЗАБОЛЕВАЕМОСТЬ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ И СМЕРТНОСТЬ ОТ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ В РОССИИ
Как и в развитых странах Европы и Америки, в России отмечается рост заболеваемости злокачественными новообразованиями (табл. 1-1).
Таблица 1-1. Онкологическая заболеваемость и смертность от злокачественных опухолей в России
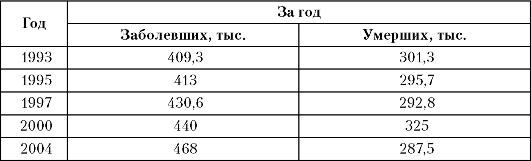
В настоящее время около 1,5% населения России находится на учёте по поводу онкологических заболеваний, а на протяжении пред- стоящей жизни каждый 4-й житель России может заболеть раком. В 2004 году в России от различных причин умерли 2,3 млн человек, из них:
• от болезней системы кровообращения - 56,1%;
• от травм и несчастных случаев - 14,3%;
• от злокачественных опухолей - 12,6%.
Более чем у 90% больных злокачественные опухоли диагностируют в возрасте старше 40 лет. Заболеваемость среди мужчин выше, чем среди женщин (в 2004 году она составила 268,9 и 195,4 на 100 000 населения, соответственно). В структуре заболеваемости злокачественными новообразованиями в Европе, Америке и России лидируют рак лёгкого у мужчин и рак молочной железы (РМЖ) у женщин
(табл. 1-2).
Следует подчеркнуть, что в России с 1994 года наметилась тенденция к снижению заболеваемости раком лёгкого, а частота РМЖ продолжает расти. За последние 5 лет как среди мужчин, так и среди женщин увеличилась (от 20 до 52%) в основном распространённость злокачественных опухолей кожи, в том числе меланомы, рака почки, щитовидной железы и толстой кишки. Кроме того, у женщин распро- странённость рака тела матки (РТМ) увеличилась на 15,1%, а рака предстательной железы у мужчин - на 41,9%. С 1995 года в США рак предстательной железы у мужчин старше 50 лет вышел на первое место по распространённости, обогнав все остальные злокачественные опухоли. В России среди мужчин старше 50 лет в настоящее время рак предстательной железы занимает четвёртое место. За
Таблица 1-2. Структура заболеваемости злокачественными новообразованиями в России в 2004 году, в процентах от общего числа онкологических заболеваний
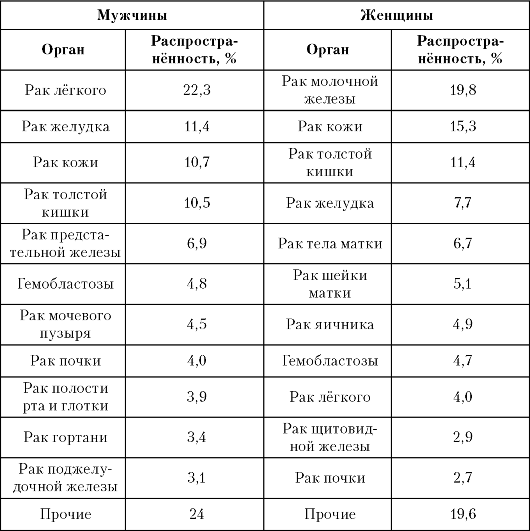
последние годы как среди мужчин, так и среди женщин снизилась заболеваемость раком пищевода, желудка, губы, печени, лёгкого, гортани.
1.2. МЕХАНИЗМЫ КАНЦЕРОГЕНЕЗА И ОПУХОЛЕВАЯ ПРОГРЕССИЯ
Опухоли могут быть доброкачественными и злокачественными. Первые состоят из однотипных, медленно делящихся клеток, существенно не отличающихся по морфологии от нормальных и не способных к инвазивному росту и метастазированию. Многие доброкачественные опухоли сохраняют эти черты на протяжении всей жизни человека, не перерождаясь в соответствующие злокачественные опухоли. Например, липома подкожной клетчатки и миома матки трансформируются в саркому крайне редко. Вместе с тем доброкачественные опухоли могут быть и этапом развития рака или саркомы. Так, диффузный полипоз кишечника почти в 100% случаев переходит в рак. Во многих случаях этап сохранения опухолью характеристик доброкачественного тканевого разрастания (предрак) может быть не столь очевиден, как при полипозе, но в том или ином виде такой этап, занимающий различный промежуток времени, существует. Малигнизацию связывают с повторными изменениями в генетическом аппарате опухолевых клеток, существенно более склонных к мутациям, чем нормальные клетки. В результате мутаций возникают новые клоны клеток, характеризующиеся резким клеточным полиморфизмом, атипией, способностью к прорастанию в прилежащие органы и росту в виде метастатических очагов в других органах и тканях.
Клинический опыт показывает, что любое злокачественное новообразование развивается на фоне предшествующих ему предраковых изменений. Предрак - это микроскопические, мультицентрически возникающие, частью множественные очаги невоспалительного атипического разрастания незрелого эпителия с наклонностью к инфильтративному росту, но ещё без разрушения ткани. В зависимости от вероятности развития злокачественной опухоли предраковые заболевания делят на облигатные и факультативные. Облигатный предрак - заболевание, на почве которого всегда или чаще всего воз- никает злокачественная опухоль; факультативный - заболевание, при котором рак развивается относительно редко, но, безусловно, чаще, чем у здоровых людей. При предраковых заболеваниях вероятность развития рака тем выше, чем более выражена пролиферация клеток новообразования. Структурный атипизм клеток при подобных состояниях называют дисплазией. Выделяют три степени дисплазии: слабую, умеренную и выраженную. При дисплазии III степени
в тканях обнаруживают изолированные клетки злокачественной опухоли или их скопления, не прорастающие базальную мембрану. Такое состояние называют рак in situ.
Известно более 100 видов рака. Это заболевание поражает почти все ткани организма, но при этом у всех видов рака есть общие черты.
С современной точки зрения, рак - генетическое заболевание (заболевание генома клетки!), вызванное изменениями в протоонкогенах (или в генах-супрессорах онкогенов) и приводящее к нарушению системы внутриклеточной передачи сигналов на молекулярном уровне.
Мутации в генах и изменение их функций могут происходить по различным причинам. Ведущими факторами риска развития рака являются особенности питания и курение (табл. 1-3).
Некоторые компоненты питания определяют развитие ряда злокачественных опухолей. С продуктами питания в организм поступают как вещества, способствующие канцерогенезу (табл. 1-4), так и тормозящие его (табл. 1-5).
Курение, жевание табака - вредные привычки, которые более чем в 50% случаев способствуют развитию рака у мужчин. В табачном дыме содержатся канцерогены (полициклический ароматичес-
Таблица 1-3. Факторы, влияющие на заболеваемость раком
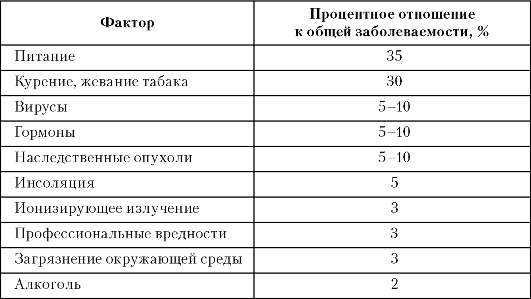
Таблица 1-4. Генотоксические канцерогены, активаторы онкогенов и коканцерогены продуктов питания

Таблица 1-5. Ингибиторы канцерогенеза (антиоксидантные вещества, блокаторы реакции нитрозирования)

кий углеводород 3,4-бенспирен), радиоактивные вещества (полоний 210), а также никотин, синильная кислота, аммиак, угарный газ, свинец, триоксид мышьяка, никель, хром, кадмий. При длительном действии этих веществ на организм развивается рак в первую очередь тех органов, на эпителий которых табачный дым оказывает прямое пагубное воздействие. Это губа, слизистые оболочки полости рта и глотки, гортань, трахея, бронхи, пищевод. В выведении метаболитов
табачного дыма участвуют почки, поджелудочная железа и другие органы, поэтому у курильщиков значительно чаще, чем у некурящих, развиваются злокачественные опухоли этих органов.
Вирусы и рак. Эпидемиологические и экспериментальные данные подтверждают важную роль ряда вирусов в развитии злокачественных опухолей у человека (табл. 1-6).
Таблица 1-6. Вирусы, ассоциированные с развитием злокачественных опухолей у человека
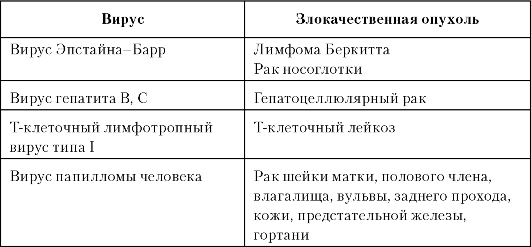
Латентный период (от момента внедрения дезоксирибонуклеиновой кислоты [ДНК] или рибонуклеиновой кислоты [РНК] вируса в геном клетки до возникновения злокачественной опухоли) является длительным и составляет от 20 до 60 лет. Инфицирование вирусом, по-видимому, - необходимое, но не достаточное условие возникновения злокачественной опухоли. Эпидемиологическими исследованиями доказано, что распространённость тех или иных злокачественных опухолей соответствует регионам наибольшего обсеменения соответствующими вирусами. Так, для вируса Эпстайна-Барр и вируса гепатита В это Центральная и Южная Африка, Юго-Восточная Азия; для T-клеточного лимфотропного вируса типа I (HTLV-I) - некоторые острова Японии и бассейн Карибского моря. В России не выявлено регионов обсеменения HTLV-I, и Т-клеточный лейкоз в нашей стране встречается крайне редко.
Экспериментально наиболее изучен вирус папилломы человека (ВПЧ). Идентифицировано более 100 его типов. Твёрдо установлен тот факт, что определённые типы ВПЧ могут инфицировать строго определённые типы эпителия и вызывать при этом характерные нарушения. Так, при раке шейки матки (РШМ) ген Е6 вируса инфицирует и размножается только в клетках базального слоя эпителия, и в этих клетках отмечается высокий процент мутаций гена р53. Экспериментальным подтверждением того, что ВПЧ играет важную роль в развитии рака, служит обнаружение вирусной ДНК в 90% случаев интраэпителиального и раннего РШМ. У больных РШМ отмечаются раннее начало половой жизни, частая смена половых партнёров. Это согласуется с тем, что инфицированность ВПЧ у девочек составляет менее 1%, с началом половой жизни вырастает до 10%, а при наличии нескольких половых партнёров - до 30%. Определённые типы ВПЧ ассоциированы с определёнными видами злокачественных новообразований:
• типы 5, 8 - рак кожи;
• типы 16, 18, реже 31, 33 - РШМ;
• тип 16 - рак предстательной железы;
• типы 31, 33 - рак гортани.
Гормонально-метаболические нарушения служат патогенетическим фактором развития рака органов женской репродуктивной системы (молочной железы, тела матки, яичников), поджелудочной, предстательной желёз и других органов. К таким нарушениям отно- сятся длительная гиперэстрогенизация, гормональные срывы при искусственном прерывании беременности (женщина, сделавшая 4 аборта и более, находится в группе риска развития рака органов репродуктивной системы), гиперандрогенемия (риск развития рака поджелудочной и предстательной желёз).
Около 20% больных онкологическими заболеваниями отмечают в анамнезе наличие родственников, имеющих то или иное злокачественное новообразование. Однако наследственные формы злокачест- венных опухолей составляют лишь от 5 до 10% всех онкологических заболеваний. При наследственных формах рака, в отличие от спорадических, отмечают:
• наличие двух или более родственников первой степени родства, больных той же формой рака;
• наличие больных раком в нескольких поколениях;
• возникновение первично-множественных злокачественных опухолей;
• начало заболевания в более раннем возрасте;
• лучшую выживаемость.
Следует подчеркнуть, что мутации генов и передача их следующему поколению создаёт лишь предрасположенность к заболеванию. Вклад генетических и средовых факторов в развитие разных форм рака неодинаков. Так, при РМЖ, яичников, тела матки, меланоме кожи роль генетических факторов составляет 50-60%, а при РШМ - только 3%. Создание канцер регистра семейных форм злокачественных опухолей позволит своевременно диагностировать опухоли и, следовательно, добиться лучших результатов лечения.
Длительная инсоляция влияет в первую очередь на развитие злокачественных опухолей кожи (рак и меланома). Высокая рас- пространённость этих опухолей отмечается у жителей северных регионов, подвергшихся избыточному воздействию солнечных лучей на отдыхе в районе экватора или переехавших в такие районы на постоянное место жительства. Повышенная инсоляция также имеет значение для реализации гемобластозов, РМЖ и других опухолей.
Ионизирующее излучение, несомненно, влияет на генетический аппарат клетки, вызывая мутации генов с последующим развитием рака. Это доказано клиническими исследованиями в Японии (изучение последствий атомных бомбардировок Хиросимы и Нагасаки) и изучением последствий аварии на Чернобыльской АЭС. Лица, подвергшиеся ионизирующему излучению, имеют повышенный риск развития гемобластозов, рака щитовидной железы и других опухолей.
Профессиональные раки - злокачественные опухоли, возникающие при длительном действии канцерогенов, связанном с профессиональной деятельностью человека. Выявление таких профессиональных вредностей - предмет исследования эпидемиологов-онкологов.
Загрязнение окружающей среды - воздуха, почвы, воды - связано с жизнедеятельностью человека. Загрязнение воздуха продуктами неполного сгорания автомобильного топлива, выбросами фабрик и заводов приводит к повышению концентрации в атмосфере полициклических углеводородов, которые вызывают в верхних дыхательных путях и лёгких хронические воспалительные процессы, метаплазию эпителия, а затем и рак.
Алкоголь отрицательно воздействует в первую очередь на слизис- тые оболочки полости рта, глотки, пищевода. Так, рак пищевода на севере Франции, где пьют крепкие спиртные напитки (кальвадос), встречается значительно чаще, чем на юге, жители которого употребляют столовые виноградные вина.
Повреждения, затрагивающие потенциальные онкогены, могут быть двух типов:
• в половых клетках: в этом случае они наследуются и можно говорить о наследуемых семейных формах рака;
• в соматических клетках: в этом случае они не наследуются и определяют трансформацию именно той клетки, которая их приобретает.
Чаще всего причиной рака становятся соматические мутации. Каждый индивидуальный случай возникает в результате накопления нескольких мутаций. Клетки нашего организма по своим свойствам разделены на категории и типы. Дифференцированные клетки составляют около 200 категорий.
Рак представляет собой болезнь делящихся клеток. Считается, что большинство опухолей происходит из трансформированных стволовых клеток, способных к пролиферации.
Все наши 1013-1014 клеток находятся под строгим контролем и зависят друг от друга. Это хорошо организованное сообщество, где каждая клетка знает, что ей «позволено», а что нет. Каждый вид клеток образует популяцию, состоящую из определённого количества клеток. Клетки обмениваются информацией и регулируют скорость деления соседних клеток.
Опухолевая клетка выходит из-под этого контроля (опухолевая трансформация) и начинает жить по своей собственной про- грамме, безудержно размножаясь и игнорируя сигналы из окружения. Она образует множество себе подобных клеток, которые приобретают способность отрываться от своего первоначального места, мигрировать в другие части тела и размножаться там в виде метастатических очагов. Эти клетки становятся всё агрессивнее, и когда они поражают жизненно важные системы и органы, организм погибает.
Канцерогенез - сложный многостадийный процесс, для реализации которого необходимо несколько последовательных генетических событий. Злокачественная опухоль развивается в результате клональной экспансии клеток, которые приобретают преимущество
в росте над нормальными вследствие одного или нескольких изменений в геноме. Канцерогенез представляет собой многоступенчатый процесс накопления мутаций и других генетических изменений, приводящих к нарушениям регуляции клеточного цикла, апоптоза, дифференцировки, морфогенетических реакций клетки и противоопухолевого иммунитета.
В результате гистологических и цитологических исследований и наблюдений за больными с доброкачественными опухолями и пролиферативными, диспластическими нарушениями, такими, как, например, аденоматозные полипы толстой кишки и дисплазия шейки матки, было показано, что на их фоне с высокой вероятностью развивается интраэпителиальный, а затем и инвазивный рак.
Процесс появления и отбора новых клонов опухолевых клеток лежит в основе явления опухолевой прогрессии, ведущей к усилению злокачественных свойств опухолевых клеток. Прогрессия включает автономизацию роста и возникновение метастатической активности. Однако для развития злокачественных опухолей необходимы дополнительные генетические изменения в соматических клетках. Вероятность возникновения в одной клетке нескольких генетических изменений тем выше, чем больше уровень генетической нестабильности клетки, т.е. при нарушении работы систем, поддерживающих целостность генома, такая вероятность многократно возрастает.
Пролиферация является необходимым компонентом канцерогенеза. Она может быть результатом генетических изменений в клетке или быть связанной с другими физиологическими и патологическими процессами и предшествовать изменениям генома.
Открытие феномена индивидуальной чувствительности к канцерогенным воздействиям, обусловленной наследственными особенностями организма, способствовало пониманию процесса канцерогенеза как результата взаимодействия эндогенных и экзогенных факторов.
Наследуемые генетические изменения, с высокой вероятностью приводящие к развитию рака, обычно выражаются в мутациях одного аллеля гена супрессора. Идентифицирован ряд генов супрессоров, врождённые мутации которых приводят к развитию семейных форм злокачественных опухолей. В то же время население гетерогенно по предрасположенности к развитию рака, что определяется генами, ответственными за репарацию ДНК, метаболизм канцерогенных веществ, их активацию и детоксикацию. Неблагоприятный фенотип
встречается у 30-50% населения. Важную роль в метаболизме канцерогенных веществ играют ферменты системы цитохрома Р450, которые активируют путём преобразования целый ряд канцерогенных веществ. Очевидно, что канцерогенез - многоступенчатый процесс накопления мутаций и других генетических изменений. Мутации, ведущие к генетической нестабильности, являются неотъемлемым этапом опухолевой прогрессии. Генетическая нестабильность опухолевых клеток базируется на уменьшении точности воспроизведения генетического материала, нарушениях механизмов репарации ДНК и изменениях регуляции клеточного цикла в повреждённых клетках. Вместе с уходом от апоптоза, позволяющим генетически измененным клеткам выживать, это делает популяции опухолевых клеток изменчивыми, создает основу для постоянного возникновения и отбора всё более и более злокачественных вариантов. Таким образом, генети- ческая нестабильность выступает двигателем неуклонной опухолевой прогрессии.
Таким образом, процесс канцерогенеза является результатом воздействия на организм множества различных факторов, как экзогенных, так и эндогенных. Переход от одной стадии заболевания к другой (последующей или предыдущей) происходит также в результате взаимодействия этих факторов, которые могут как способствовать, так и противодействовать этому.
Вероятностные процессы имеют статистический характер. Концепция вероятностно-статистической причинности чрезвычайно важна для правильного понимания, трактовки и оценки научных фактов, касающихся причин болезней. Отсутствие строгой причинно-следственной связи между причинным фактором и болезнью, когда болезнь не всегда развивается под воздействием этого фактора, часто приводит к ошибочному отрицанию его этиологической роли в заболевании.
Для практической эпидемиологии знания о вероятностно-статистических этиологических факторах опухолей человека чрезвычайно важны, прежде всего в вопросах профилактики, так как манипуляция этими факторами может привести к значительному снижению заболеваемости раком.
Приобретение совокупности перечисленных свойств обусловлено нарушениями в сигнальных путях, контролирующих реакцию клетки на экзогенные и эндогенные регулирующие факторы. Ключевую роль в возникновении этих свойств играют изменения регуляции
клеточного цикла, апоптоза, миграции и некоторых других базовых процессов жизнедеятельности клетки.
В настоящее время известно немногим более 100 различных протоонкогенов, изменения структуры или гиперэкспрессия которых приводит к продукции онкобелков.
Исследования последних лет позволили идентифицировать сигнальные пути, контролируемые большинством этих генов. Выяснилось, что несколько генов могут регулировать активность одного и того же сигнального пути, но на разных его этапах. Оказалось также, что некоторые сигнальные пути вовлечены в регуляцию сразу нескольких важнейших физиологических процессов. На продуктах некоторых опухолевых супрессоров и протоонкогенов пересекаются различные сигнальные пути. Отсюда становится понятной частая встречаемость изменений генов р53 и RAS в самых разных новооб- разованиях - их мутации позволяют за один шаг преодолеть сразу несколько важных этапов опухолевой прогрессии и придать опухолевой клетке сразу несколько необходимых свойств. В то же время для ряда новообразований, в первую очередь для лейкозов, характерны генетические изменения, встречающиеся только при конкретном заболевании. К таким изменениям относятся, прежде всего, хромосомные транслокации, перемещающие протоонкогены и/или опухолевые супрессоры в другое место генома.
В основе различных онкологических заболеваний лежат сходные молекулярные процессы, т.е. вовлечены родственные группы генов и белков. Среди потенциальных онкогенов имеется ограниченное число ключевых генов, аномалии в которых должны встречаться при большинстве неоплазий.
Вышеизложенное даёт надежду, что бурно развивающиеся в последние годы методы таргетной (воздействующей на определенную «мишень» - механизм, характерный только для опухолевых клеток) и генотерапии позволят в обозримом будущем решать вопросы лечения и предотвращения онкологических заболеваний на принципиально новом уровне.
Известно,
что опухолевый рост в большинстве случаев достаточно медленный.
Среднее время удвоения солидных новообразований составляет около 90
дней. Чтобы достичь клинической фазы (
птомным течением. Этот период составляет 3/4 общей продолжительности существования опухоли. Клинический период проявля- ется не только многочисленными и разнообразными симптомами заболеваний неопухолевой природы, но и характерными признаками, позволяющими предположить наличие опухоли. Существует пять клинических феноменов, являющихся патогенетической основой наиболее ярких симптомов рака различных органов.
• Феномен обтурации наблюдается при раке большинства полых и некоторых паренхиматозных органов.
• Феномен деструкции чаще встречается при экзофитных и изъяз- влённых опухолях и проявляется кровотечением.
• Феномен компрессии отражает давление опухоли на нервные стволы, окружающие ткани и органы. Проявляется он двояко: болевыми ощущениями и нарушением функций органов.
• Феномен интоксикации возникает в результате нарушения белкового, углеводного и минерального обмена, нарушений ферментного и гормонального баланса. Проявляется общей слабостью, похуданием, снижением аппетита.
•
Феномен опухолевидного образования: наличие видимого или
пальпируемого объёмного образования. Надо иметь в виду, что после 40
удвоений средний вес опухоли составляет 1-
Злокачественные опухоли метастазируют в регионарные лимфатические узлы, а также в самые различные органы и ткани. Знание путей оттока лимфы важно при обследовании больных и планировании лечения. В ряде случаев одновременно с удалением первичной опухоли считается обязательным проводить операции на зонах регионарного метастазирования. Такой же подход используется при лучевой терапии, если она является основным методом лечения: планируют облучение не только первичного очага, но и регионарных лимфатических узлов. Различные опухоли имеют особенности метастазирования в отдалённые органы и ткани. Например, РМЖ наиболее часто даёт метастазы в кости; рак яичка, почки - в лёгкие; рак толстой кишки - в печень и т.д. В большинстве случаев возникают множественные метастазы различных размеров, сохраняющие морфологическую структуру и биологические характеристики первичной опухоли. Чаще всего метастазы возникают в лёгких, печени,
костях, головном мозге. Особенности отдалённого метастазирования каждой опухоли важно знать при составлении заключения, что опухоль локализованная. Это необходимо при планировании объёма лечения для каждого конкретного пациента. Срок развития метастазов может быть различным. Например, метастазы рака почки в основном проявляются в течение первого года с момента установления диагноза и операции, а при РМЖ - в течение 2-5 лет, а иногда и через 10-15 лет после обнаружения новообразования.
Кроме симптомов, связанных с местным распространением и метастазированием опухоли, необходимо отметить и паранеопластические синдромы.
Самым частым результатом паранеопластических процессов являются эндокринные синдромы, возникающие из-за эктопической выработки гормонов. Многие опухоли продуцируют сразу несколько гормонов, что проявляется разнообразными симптомами. Наиболее распространены эктопическая секреция гормона роста при раке желудка и лёгкого, адренокортикотропного гормона при атипичных карциномах и мелкоклеточном раке лёгкого, серотонина - при карциноидных опухолях, тимомах, медуллярном раке щитовидной железы.
Среди гематологических паранеопластических синдромов при злокачественных опухолях могут встречаться эритроцитоз, аплазия эритроцитов, аутоиммунная или микроангиопатическая гемолитическая анемия, лейкоцитоз, тромбоцитоз, тромбоцитопения, а также нарушения в системе свёртывания крови (первичный острый или хронический синдром диссеминированного внутрисосудистого свёртывания крови [ДВС-синдром], синдром коагулопатии или повышенной свёртываемости крови при парапротеинемиях).
• Эритроцитоз может наблюдаться при раке почки и гепатоцеллюлярном раке.
• Аутоиммуннная гемолитическая анемия чаще всего бывает вызвана синтезом иммуноглобулинов клетками лимфомы или при хроническом лимфолейкозе.
• Микроангиопатическая гемолитическая анемия - характерный синдром при муцинпродуцирующих аденокарциномах желудка.
• Лейкоцитоз наблюдается при злокачественных опухолях желудка, лёгкого, поджелудочной железы, меланоме, опухолях центральной нервной системы, болезни Ходжкина и при крупноклеточной лимфоме. Этот же синдром характерен для инфекционных
и прочих воспалительных процессов, что необходимо учитывать при дифференциальной диагностике онкологических заболева- ний с заболеваниями неопухолевой природы.
• Тромбоцитоз наблюдается примерно у трети больных онкологическими заболеваниями.
• Тромбоцитопения встречается при лимфомах, солидных опухолях, болезни Ходжкина, а также может быть обусловлена побочными эффектами химиотерапии.
• ДВС-синдром наиболее часто встречается при муцинпродуцирующих аденокарциномах поджелудочной железы, желудка, лёгкого, предстательной железы и толстой кишки. Для этих заболеваний характерны также тромбофлебиты, артериальные эмболии и тромбоэмболия лёгочной артерии, эндокардит, циркуляция ингибиторов свёртывания крови и патологических белков, способных вызывать геморрагические осложнения. Один из самых ранних объективно выявляемых симптомов - увеличение протромбинового времени в сочетании с увеличением количества продуктов распада фибрина и снижением концентрации фибриногена. Активное лечение ДВС-синдрома позволяет составить благоприятный прогноз для большинства больных.
Паранеопластические синдромы с признаками поражения центральной нервной системы выявляются достаточно редко: лимбичес- кий энцефалит (при мелкоклеточном раке лёгкого), миелопатия (при лимфомах и раке лёгкого), миастения (при раке лёгкого и яичников), дерматомиозит (при раке молочной железы и матки).
1.3. ПРОБЛЕМЫ ДИАГНОСТИКИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
К основным принципам диагностики опухолей относятся комплексность исследования и обязательное морфологическое подтверж- дение диагноза.
Комплексность исследования подразумевает изучение жалоб больного и анамнеза заболевания, применение всех необходимых объективных методов исследования, направленных на выявление первичного опухолевого очага, зон регионарного и отдаленного метастазирования.
Морфологическое подтверждение диагноза осуществляется путём гистологического (биопсия, трепанобиопсия) или цитологи-
ческого исследования. Материалом для цитологического исследования могут служить мазки, отпечатки, пунктат опухоли, жидкости из полостей и протоков, промывные воды, мокрота, моча.
Все злокачественные опухоли классифицируют по единой системе TNM, которая позволяет оценить стадию опухолевого процесса и результаты лечения у каждого конкретного больного.
Критерий Т характеризует первичный опухолевый очаг (T0 - нет данных за наличие первичной опухоли; Tis - преинвазивный рак; T1, T2, T3, T4 - различные степени увеличения и/или распространён- ности опухоли).
Критерий N показывает состояние регионарных лимфатических узлов (Nx - состояние лимфатических узлов оценить невозможно; N0 -метастазы в регионарные лимфатические узлы отсутствуют; N1, N2, N3 - возрастающие степени вовлечённости регионарных лимфатических узлов в патологический процесс).
Критерий М показывает наличие либо отсутствие отдалённых метастазов (Мх - наличие отдалённых метастазов оценить невозможно; М0 - отдалённые метастазы отсутствуют; М1 - наличие отдалённых метастазов).
Сложность для диагностики может представлять синдром метастазов злокачественных опухолей из неустановленного первичного очага. У больных с этим синдромом обнаруживают метастазы злокачественного новообразования в лимфатические узлы, кости, головной мозг, лёгкие, печень и в другие внутренние органы, а первичный очаг опухоли выявить не удаётся.
Оценка качества диагностики злокачественных опухолей и онкологической помощи населению проводится по ряду параметров, среди которых основными служат процент поздней диагностики, летальность на первом году после установления диагноза и процент морфологического подтверждения диагноза (табл. 1-7).
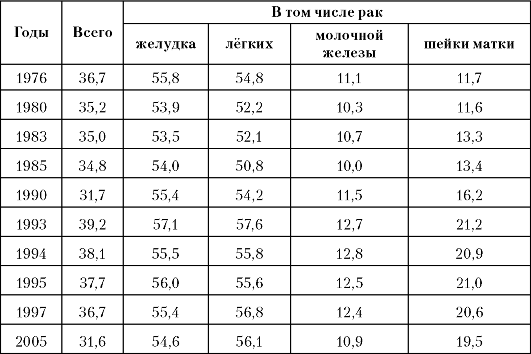
Анализ приведённых данных показывает, что в России почти у 50% больных диагноз устанавливают на поздних стадиях заболева- ния, а для наиболее распространённых опухолей процент поздней диагностики превышает 65-70%. Это является причиной высокой летальности на первом году после установления диагноза при многих локализациях злокачественных опухолей. Причём этот показатель за последние 20 лет не приобрёл тенденции к снижению, а при РШМ даже значительно вырос (табл. 1-8).
Таблица 1-7. Показатели состояния онкологической помощи населению России в 2005 году
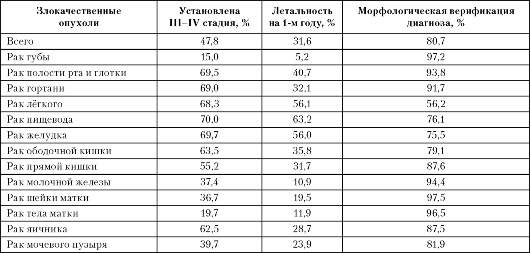
Таблица 1-8. Динамика показателей летальности на 1-м году с момента установления диагноза с 1976 по
Причины поздней диагностики злокачественных опухолей в России:
• отсутствие национальной противораковой программы;
• недостаточная онкологическая подготовка практических врачей;
• низкая информированность населения об онкологических заболеваниях;
• недостаточно широкое применение цитологических и морфологических методов в практическом здравоохранении.
Морфологическая верификация диагноза составляет около 80%. У остальных 20% больных диагноз морфологически не подтверждается, а это служит причиной врачебных ошибок и обращений больных к различным «знахарям».
Таким образом, в диагностике злокачественных опухолей проблема ранней диагностики крайне актуальна. Важно отметить, что своевременная диагностика злокачественных опухолей принципиально возможна. В целом по России диагностика локальных форм
РМЖ (T1-2N0M0) осуществляется только у 30%. В то же время в Президентском медицинском центре при правильной организации обследования и активном поиске локальные формы РМЖ обнаруживают у 70% больных.
В XXI веке получает развитие ДНК-диагностика рака. В отличие от опухолевых маркёров, которые представляют собой продукты жизнедеятельности клетки, при ДНК-диагностике определяют собственную ДНК организма, но с дефектами. Материалами для ДНК-диагностики могут служить кровь и естественные выделения человека: моча (при раке почки, мочевого пузыря), кал (при раке толстой кишки), мокрота (при раке лёгкого), слюна (при раке полости рта и глотки, слюнных желёз). То есть в ближайшем будущем анализ крови, мочи будет включать не только биохимический, цитологический, но и генетический анализ.
1.4. МЕТОДЫ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
В начале XX века в распоряжении врачей для лечения опухолей были только скальпель и лучевая терапия. В середине столетия началось использование методов лекарственной терапии (химиотерапия, гормонотерапия). В конце XX века стали активно разрабатывать методы биотерапии рака, криогенного и лазерного лечения, фотодинамической терапии.
Хирургический метод
Хирургический метод играет одну из ведущих ролей в лечении злокачественных опухолей. Благодаря успехам анестезиологии тех- ника хирургических вмешательств достигла значительных вершин: стало возможным проведение расширенных и комбинированных (с резекцией нескольких органов) операций. В последнее десятилетие активно внедряются операции по поводу опухолевых поражениий головного мозга, позвоночника, средостения. Российский онкологический научный центр им. Н.Н. Блохина (РОНЦ им. Н.Н. Блохина) имеет опыт более 100 нефрэктомий у больных раком почки с одновременным удалением тромба из нижней полой вены. Расширяются показания для хирургического лечения онкологических больных, страдающих сопутствующей патологией сердца. У этой группы
больных предварительно или одновременно выполняют коронарные шунтирования и операции по поводу злокачественной опухоли. Перспективы дальнейшего развития хирургии в онкологии связаны, с одной стороны, с разработкой органосохраняющих операций при опухолях, чувствительных к лекарственным и лучевым методам лечения, и, с другой стороны, с хирургической реабилитацией онкологических больных после калечащих операций.
Органосохраняющие операции сегодня выполняют при РМЖ и злокачественных опухолях костей. Всё более широко в онкологии применяют эндопротезирование и пластику молочных желёз. Разрабатываются методы эндо- и эктопротезирования после калечащих оперативных вмешательств.
Лучевая терапия
Лучевая терапия в виде основного, комбинированного или паллиативного лечения применяется почти у 70% онкологических больных. Перспективы повышения эффективности противоопухолевого действия ионизирующего излучения связаны с использованием экспериментальных разработок по управлению радиочувствительностью нормальных и опухолевых клеток. Оригинальными способами радиомодификации являются облучение крупными фракциями, с фракционированием суточной дозы, с применением гипотермии, терморадиотерапии, гипергликемии, гипоксирадиотерапии, а также контактные (внутритканевые, внутриполостные) методы лучевой терапии.
Лекарственные методы
Лекарственные методы (химиотерапия, гормонотерапия, иммунотерапия) лечения злокачественных опухолей в последние годы развиваются особенно интенсивно. В арсенале онкологов имеется более 100 противоопухолевых препаратов, гормонов, антигормонов, ингибиторов ферментов и препаратов, тормозящих ангиогенез в опухоли. Ряд опухолей (некоторые гемобластозы, злокачественные опухоли яичка, хорионкарцинома) в настоящее время могут быть излечены только лекарственными методами. Так, одна из самых агрессивных злокачественных опухолей у женщин - хорионкарцинома матки - ещё недавно приводила к гибели всех заболевших. А сегодня более 80% женщин, заболевших хорионкарциномой матки и имеющих отдалённые метастазы в лёгкие, после проведённого лекарственно-
го лечения (полихимиотерапии) не имеют признаков болезни при наблюдении свыше 5 лет. Следует подчеркнуть, что через 3 года после окончания полихимиотерапии возможны беременность и роды. И сегодня РОНЦ им. Н.Н. Блохина располагает сведениями более чем о 150 здоровых детях, родившихся после излечения их матерей от хорионкарциномы.
Существует также группа онкологических заболеваний (РМЖ, мелкоклеточный рак лёгкого, остеогенная саркома, саркома Юинга, опухоль Вильмса, рак яичников и др.), которые требуют обязательного включения в план лечения противоопухолевых лекарственных средств.
Большинство опухолей человека пока малочувствительны к лекарственным методам лечения. Однако исследования последних лет расширяют возможности лекарственной терапии и у этой группы больных за счёт использования новых противоопухолевых препаратов и разработки новых схем лечения. Уже сегодня сформированы понятия о биотерапии и таргетной терапии рака (применение вакцин, цитокинов, факторов роста, ингибиторов ферментов, моноклональных антител, средств, нарушающих ангиогенез в опухоли, генноинжинерная терапия), которые получают дальнейшее развитие. Для расширения возможностей лекарственного лечения злокачественных новообразований важно изучать также и механизмы лекарственной устойчивости. Преодоление лекарственной устойчивости путём подавления в опухолевых клетках синтеза специальных защитных белков и нормализации процесса апоптоза повысит эффективность лекарственной терапии опухолей.
Методы физического воздействия
Методы физического воздействия на опухоль стали активно разрабатывать в последние годы. Доказана перспективность крио- генного лечения опухолей кожи, губы, слизистых оболочек полости рта. Продолжается изучение возможностей лазерной терапии. Накапливается опыт практического применения фотодинамической терапии. Всё шире применяется радиотермоаблация опухолей и воздействие на них сфокусированным высокоинтенсивным ультразвуком.
1.5. ПРОФИЛАКТИКА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
Одно из приоритетных направлений в современной онкологии - первичная профилактика злокачественных опухолей, направленная на снижение заболеваемости.
Следует различать индивидуальные и государственные мероприятия по профилактике злокачественных опухолей.
Индивидуальная профилактика
Индивидуальная профилактика предусматривает информированность населения о раке и соблюдение ряда правил.
Исходя из факторов риска возникновения злокачественных опухолей, каждый человек должен помнить:
• о рациональном питании. Следует исключить из ежедневного рациона соления и маринованные продукты, так как они содержат нитриты и нитраты. Для приготовления продуктов впрок вместо консервирования рекомендуется использовать быстрое замораживание. Именно это сыграло роль в снижении заболеваемости раком желудка в США. Следует ограничить приём животных жиров, копчёных и жареных пищевых продуктов, увеличить и разнообразить потребление свежих овощей и фруктов. В периоды дефицита свежих овощей и фруктов целесообразно регулярно принимать синтетические витамины. Клиническими наблюдениями показано, что приём витаминов А и Е уменьшает частоту метаплазии эпителия желудка по кишечному типу, оказывает лечебное действие при предопухолевых изменениях слизистых оболочек, в частности, полости рта;
• о вреде активного и пассивного курения. Отказ от курения снижает риск возникновения рака на 30%;
• о эндокринно-метаболических нарушениях. При ожирении и многократных абортах увеличивается риск развития рака органов репродуктивной системы;
• о существовании наследственных форм рака. При «семейных формах» рака необходима своевременная консультация родственников пробанда у врача-специалиста;
• о вреде чрезмерного солнечного облучения;
• о необходимости соблюдения гигиены полости рта и половых органов;
• о вреде чрезмерного употребления крепких спиртных напитков. Слабоалкогольные напитки и напитки средней крепости, например столовые виноградные вина, не оказывают столь пагубного воздействия.
Массовая профилактика
Государственные мероприятия по первичной профилактике рака состоят в контроле над содержанием канцерогенных и радиоактивных веществ в питьевой воде, пищевых продуктах, воздухе и почве. Государство должно решать экологические проблемы путём разработки и применения фильтров на предприятиях, загрязняющих атмосферу, увеличения КПД двигателей внутреннего сгорания на автомобильном транспорте, использования экологически чистого топлива, устранения профессиональных вредностей на производствах и т.д.
Диагностированные на ранних стадиях, злокачественные опухоли большинства органов в настоящее время могут быть излечены у
70-100% больных.
Основой ранней диагностики злокачественных опухолей является скрининг. Цель скрининга - снижение смертности от данной патологии путём активного раннего выявления и лечения доклинических форм рака. Любая скрининговая программа должна отвечать нескольким обязательным требованиям.
• Исследуемая патология должна быть социально значимой, т.е. с высокой заболеваемостью и смертностью.
• Скрининговый метод должен отличаться высокой чувствительностью. Специфичность имеет меньшее значение.
• Методика должна быть доступна широким слоям населения.
• Желательны минимальные цена и инвазивность процедуры.
• Результатом скрининга должно стать снижение смертности от данной патологии.
С учётом этих требований выбрано несколько онкологических заболеваний, для диагностики которых целесообразно создание скрининговых программ. К ним относятся рак молочной железы, шейки матки, желудка, толстой и прямой кишки, предстательной железы, лёгкого.
Однако существуют некоторые объективные критерии, препятствующие широкому распространению скрининга для диагностики этих форм патологии.
В Российской Федерации существует утверждённая программа скрининговой диагностики РМЖ. Скрининговым методом служит маммография. Согласно данной программе всем женщинам в возрасте от 40 до 60 лет 1 раз в 2 года проводится маммографическое исследование в одной проекции. Однако следует отметить некоторые недочёты этой программы. Проведённые в разных странах рандомизированные исследования показали, что оптимальный для проведения маммографического скрининга возраст - 50-69 лет, так как максимальное число заболевших приходится на возраст 60-64 лет. Кроме того, целесообразно проводить маммографическое исследование ежегодно и в двух проекциях. В возрастной группе от 40 до 49 лет маммографию можно проводить 1 раз в 2 года. Необходимость проведения скрининга в старшей возрастной категории (70 лет и более) весьма спорна. Результаты исследований показали, что в возрастной группе 50-69 лет в результате скрининга достигнуто снижение смертности от РМЖ на 25%. Ультразвуковое исследование (УЗИ) молочных желёз в качестве скринингового метода не используют и применяют лишь для уточнения диагноза. Самообследование как скрининговый метод изучалось в разных странах, однако не было выявлено снижения смертности в опытных группах по сравнению с контрольными. Таким образом, самообследование нельзя считать эффективным скрининговым методом, и женщинам, практикующим самообследование, необходимо дать те же рекомендации по регулярной маммографии, что и всем остальным. Благодаря развитию скрининга в США диагностика локальных форм РМЖ (Tis-2N0M0) осуществляется практически у 90% женщин, а в России - только у
30%.
Скрининг РШМ первоначально получил распространение в скандинавских странах в 60-е годы XX века. Цитологическое исследование мазка с поверхности шейки матки и из цервикального канала (так называемый тест по Папаниколау, Пап-мазок) приводит к достоверному снижению смертности от этой формы рака. На эффективность скрининга влияет величина интервала между тестами. Исследования показали, что оптимальная частота исследования составляет 1 раз в 3 года: это приводит к снижению смертности на 90%. Увеличение частоты исследования до 1 раза в год даёт прирост к этой величине всего в 1%. Необходимо иметь в виду, что пятилетняя выживаемость при распространённом РШМ не превышает 13%, в то время как для локализованных форм она составляет 88%. Таким
образом, кольпоцитодиагностика, снижающая смертность от РШМ, должна быть обязательным компонентом системы государственных профилактических мероприятий.
Скрининг рака желудка с помощью эзофагогастродуоденоскопии (ЭГДС) - эффективный метод снижения смертности от данной патологии, однако такие результаты получены только в Японии. В этой стране показатель пятилетней выживаемости больных ранней стадией рака желудка, выявленной при скрининге, достиг почти 100%. Выживаемость по другим стадиям превышает 40%, в то время как во всех остальных развитых странах она не превышает 20%. Однако необходимо отметить, что повторить подобные результаты не удалось пока ни в одной другой стране. В настоящее время происходит внедрение скрининга рака желудка в США, однако результаты исследования пока не получены.
Скрининг рака толстой и прямой кишки проводят методом выявления скрытой крови в кале. Эффективность такого скрининга под- тверждена многими рандомизированными исследованиями и приводит к снижению смертности от рака данной локализации на 33% при ежегодном исследовании у лиц старше 50 лет. В настоящее время проводятся исследования по вопросу использования колоноскопии в качестве скринингового метода, однако результаты пока не опубликованы. Тем не менее уже сегодня многие страховые компании в США отказываются продлевать контракт с людьми старше 50 лет, не прошедшими колоноскопию.
Для скрининга рака лёгкого ранее применяли рентгенографию (флюорография) грудной клетки и цитологическое исследование мокроты. Было проведено несколько рандомизированных исследований, которые не выявили снижения смертности от рака лёгкого в опытных группах. Таким образом, флюорография, проводимая в РФ в декретированных группах, является важной лишь с точки зрения контроля над ситуацией с туберкулёзом в стране и не приводит к увеличению показателя ранней диагностики рака лёгкого. В настоящее время проводится апробация в качестве скрининга метода низкодозовой спиральной компьютерной томографии (КТ). Благодаря использованию этого метода рак лёгкого в исследуемой группе населения в Японии диагностирован на ранних стадиях у 80% больных. Однако немаловажным аспектом является стоимость такого метода.
Выявление простатического специфического антигена (ПСА) в крови у мужчин старше 50 лет повсеместно используют в качестве скринингового метода диагностики рака предстательной железы. С середины 80-х годов XX века в США и в Европе благодаря внедрению этого метода резко увеличилась заболеваемость раком предстательной железы, однако убедительных данных о снижении смертности не получено. Рост заболеваемости можно объяснить выявлением в результате скрининга латентных форм рака, которые клинически никак не проявляются, не прогрессируют и не приводят к смерти. Такой рак не влияет на продолжительность и качество жизни больного, а агрессивное лечение даже может его ухудшить. Исходя из этого, многие специалисты придерживаются так называемой тактики выжидания, когда пациенты регулярно обследуются, а лечение начинают только в случае прогрессирования заболевания.
Таким образом, доказана эффективность скрининга:
• РМЖ с помощью маммографии у женщин 50-69 лет;
• предрака и РШМ с помощью кольпоцитодиагностики;
• предрака и рака толстой и прямой кишки с помощью теста на скрытую кровь.
На стадии изучения находится эффективность скрининга:
• рака предстательной железы с помощью теста на ПСА;
• РМЖ у женщин моложе 50 лет;
• рака желудка с помощью ЭГДС;
• рака лёгкого с помощью спиральной КТ;
• некоторые другие методы.
Доказана неэффективность самообследования молочных желёз и рентгеновского исследования органов грудной клетки в качестве скрининговых методов диагностики рака соответствующих локализаций.
Кроме создания скрининговых программ, для повышения качества ранней диагностики и снижения смертности от онкологических заболеваний необходимо обеспечить подготовку специалистов, участвующих в программах, широкий охват населения (в том числе путём персонального приглашения), пропаганду в СМИ, а также мониторинг всех этапов программы с оценкой её эффективности. При проведении национального скрининга минимально эффективным считается вовлечение в скрининговое исследование 60% целевой популяции. В скандинавских странах при проведении скрининга рака молочной
железы и шейки матки охвачено до 90% населения и более. В России эта цифра пока составляет, к сожалению, не более 20%.
Важную роль в своевременной диагностике злокачественных опухолей играет «онкологическая настороженность» населения и грамотность врачей, в первую очередь первичного звена. Необходима широкая пропаганда знаний, касающихся проведения профилактических осмотров и ранней симптоматики злокачественных заболеваний. К сожалению, профессиональные навыки медицинского персонала часто оказываются недостаточными, что является причиной значительного числа запущенных стадий заболевания, диагнос- тированных впервые. Немаловажный вклад в позднюю диагностику и неудовлетворительные результаты лечения вносит широкое распространение в последние годы альтернативных методов лечения, так как они не всегда осуществляются специалистами-онкологами, а в некоторых случаях лечение проводят даже лица без высшего медицинского образования.
1.6. ПРОГНОЗ ИЗЛЕЧЕНИЯ ДЛЯ БОЛЬНЫХ ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
Возможность излечения больных злокачественными опухолями определяется факторами прогноза. В качестве таких факторов выступают размер первичной опухоли, наличие регионарных и отдалённых метастазов, гистологическая степень злокачественности, молекулярно-генетическая характеристика опухоли.
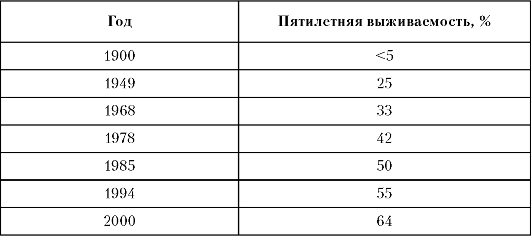
На протяжении XX столетия в экспериментальной и клинической онкологии достигнуты значительные успехи, это отражают показате- ли излечения больных злокачественными опухолями (табл. 1-9).
В странах Западной Европы и США показатели пятилетней выживаемости к 2006 году достигли 65% (среди всех больных злокачественными опухолями). В России этот показатель в 2005 году составил лишь 50,4%, что объясняется в основном более высоким в нашей стране процентом больных на III-IV стадиях опухолевого процесса.
Следует подчеркнуть, что рак - диагноз, а не приговор. Рак - хроническое, а не фатальное заболевание. Длительное течение рака даёт врачам возможность своевременной диагностики злокачественной опухоли и излечения 70-100% больных. В 2004 году в России проживало более 1,15 млн человек, которым 5 лет назад и более было проведено лечение от рака.
Таблица 1-9. Динамика выживаемости больных раком (шведский регистр)
1.7. ДЕОНТОЛОГИЯ В ОНКОЛОГИИ
Важную проблему в онкологии представляет осведомлённость больных о своём диагнозе и выбор правильного метода лечения в соответствии с ним.
Нужно ли сообщать больному онкологическим заболеванием правдивый диагноз?
В большинстве стран цивилизованного мира больные со злокачественными опухолями получают от врача правдивую информацию о своей болезни и её прогнозе. В нашей стране ещё несколько лет назад считалось недопустимой для врача ошибкой назвать больному раком его истинный диагноз. И сегодня ещё многие врачи придерживаются тактики сокрытия диагноза от больного. Однако с правовой точки зрения это неправильно, так как не только лишает больного возможности уладить все бытовые вопросы и правильно распорядиться своим имуществом, но и не позволяет выбрать наиболее приемлемый способ лечения. Совершенно очевидно, что сегодняшнее общество живёт в прагматичном мире, и каждый член этого общества должен быть правильно ориентирован не только в своём правовом и материально-финансовом статусе, но и в состоянии своего здоровья.
Сегодня многие онкологи придерживаются такой точки зрения: если больной хочет знать свой настоящий диагноз, врач должен правдиво информировать его об этом. Как правило, больные хотят знать если не всю правду, то хотя бы ту её часть, которая даёт надежду на
выздоровление. У многих молчание врача даже вызывает обострён- ную подозрительность, рождающую единственный вопрос: «Как же может быть так, что у меня ничего страшного, если меня лечат онкологи?». Именно поэтому врачи РОНЦ им. Н.Н. Блохина рекомендуют во взаимоотношениях с больными придерживаться тактики, ориентированной на правду.
Важно правдиво информировать больного и не скрывать диагноз, а наоборот, доказать с помощью научных фактов надёжность и состоятельность благоприятного прогноза. В целом это будет способствовать формированию у населения правильного отношения к онкологии.
Другой существенный этический момент - право больного на самостоятельный выбор оптимального метода лечения. Нередко таким методом может быть калечащая операция. В этом случае задача врача - обеспечить больного наиболее полной и достоверной информацией о возможном прогнозе его заболевания в зависимости от выбора метода лечения. В своих взаимоотношениях с больным врачу недопустимо настаивать, а следует только рекомендовать кон- кретный метод лечения. Право окончательного выбора должно принадлежать только больному.
ТЕСТОВЫЕ ЗАДАНИЯ
Выберите один правильный ответ
1. Как изменяется смертность от онкологических заболеваний в России за последние 20 лет?
A. Снижается за счёт уменьшения количества больных. Б. Стабилизировалась.
B. Снижается за счёт повышения качества лечения больных онкологическими заболеваниями.
Г. Растёт за счёт увеличения числа больных.
Д. Растёт за счёт увеличения удельного веса запущенных форм.
2. Что можно отнести к особенностям доброкачественных опухолей?
А. Склонность к метастазированию. Б. Способность к инвазивному росту.
В. Существенное отличие опухолевых клеток по структуре от нормальных.
Г. Медленный рост.
Д. 100% вероятность перерождения в злокачественную опухоль.
3. Какое заболевание обязательно приводит к развитию злокачественной опухоли?
A. Факультативный предрак. Б. Облигатный предрак.
B. Дисплазия.
Г. Доброкачественная опухоль. Д. Рак in situ.
4. Что представляет собой рак с современной точки зрения?
A. Генетическое заболевание. Б. Инфекционное заболевание.
B. Воспалительное заболевание.
Г. Заболевание, возникающее после травмы. Д. Вариант нормы.
5. Как называют многоступенчатый процесс накопления мутаций и других генетических изменений, приводящих к нарушениям регуляции клеточного цикла, апоптоза, дифференцировки, морфогенетических реакций клетки, противоопухолевого иммунитета?
A. Облигатный предрак.
Б. Факультативный предрак.
B. Канцерогенез. Г. Дисплазия.
Д. Клеточная атипия.
6. Что выступает двигателем неуклонной опухолевой прогрессии?
A. Потеря опухолевыми клетками способности к апоптозу. Б. Пролиферация опухолевых клеток.
B. Генетическая нестабильность опухолевых клеток. Г. Нарушение дифференцировки опухолевых клеток. Д. Микроокружение опухолевых клеток.
7. Как называется лекарственное воздействие на определённые механизмы, существующие в опухолевых клетках?
А. Химиотерапия. Б. Гормонотерапия.
В. Таргетная терапия. Г. Лучевая терапия.
Д. Комбинированная терапия.
8. Как называется применение различных методов лечения, имеющих как местное, так и системное действие?
A. Комбинированная терапия. Б. Комплексная терапия.
B. Полихимиотерапия.
Г. Сочетанная лучевая терапия. Д. Химио-гормонотерапия.
9. Какова средняя продолжительность латентного периода развития солидных опухолей?
A. 3-6 мес. Б. 1-2 года.
B. 3-5 лет. Г. 6-10 лет.
Д. Более 10 лет.
10. Что служит для большинства форм рака первым этапом метастазирования?
A. Лёгкие. Б. Печень.
B. Регионарные лимфатические узлы. Г. Кости.
Д. Головной мозг.
11. Что не относится к основным путям отдалённого метастазирования злокачественных опухолей?
A. Лёгкие. Б. Печень.
B. Почки. Г. Кости.
Д. Головной мозг.
12. В результате чего возникают гормональные паранеопластические синдромы?
A. Эктопической выработки гормонов клетками опухоли. Б. Развития рака щитовидной железы.
B. Метастатического поражения надпочечников.
Г. Прорастания опухоли желудка в поджелудочную железу. Д. Воздействия генов-супрессоров на гипофиз.
13. Что характеризует критерий N в TNM-классификации злокачественных опухолей?
A. Размер первичной опухоли.
Б. Состояние регионарных лимфатических узлов.
B. Наличие/отсутствие отдалённых метастазов. Г. Степень злокачественности опухоли.
Д. Гистологическую структуру опухоли.
14. Что характеризует критерий T в TNM-классификации злокачественных опухолей?
A. Размер первичной опухоли.
Б. Состояние регионарных лимфатических узлов.
B. Наличие/отсутствие отдалённых метастазов. Г. Степень злокачественности опухоли.
Д. Гистологическую структуру опухоли.
15. Что характеризует критерий M в TNM-классификации злокачественных опухолей?
A. Размер первичной опухоли.
Б. Состояние регионарных лимфатических узлов.
B. Наличие/отсутствие отдалённых метастазов. Г. Степень злокачественности опухоли.
Д. Гистологическую структуру опухоли.
16. Что должно стать результатом любой скрининговой программы в онкологии?
A. Повышение качества ранней диагностики онкологических заболеваний.
Б. Снижение заболеваемости злокачественными новообразованиями.
B. Снижение смертности от злокачественных опухолей.
Г. Повышение качества жизни больных.
Д. Снижение затрат на лечение онкологических заболеваний.
17. Когда целесообразно проводить женщинам маммографическое исследование в качестве скринингового метода диагностики рака молочной железы?
A. При рождении.
Б. В возрасте 10-29 лет.
B. В возрасте 30-49 лет. Г. В возрасте 50-69 лет. Д. Старше 70 лет.
18. Что должно быть скрининговым методом диагностики рака молочной железы?
A. Маммография.
Б. Самобследование молочных желёз.
B. УЗИ молочных желёз.
Г. Компьютерная томография молочных желёз. Д. Осмотр маммологом.
19. Что должно быть скрининговым методом диагностики рака шейки матки?
A. Осмотр гинеколога.
Б. Кольпоцитодиагностика.
B. Трансабдоминальное УЗИ органов малого таза. Г. Трансвагинальное УЗИ органов малого таза. Д. Раздельное диагностическое выскабливание.
20. Использование рентгенографии грудной клетки в качестве скринингового метода диагностики рака лёгких?
A. Целесообразно.
Б. Целесообразно в группах повышенного риска.
B. Целесообразно у лиц старше 50 лет. Г. Целесообразно у курильщиков.
Д. Нецелесообразно.
21. Что является необходимым компонентом постановки диагноза при онкологических заболеваниях?
А. Рентгенография органов грудной клетки.
Б. УЗИ органов брюшной полости. В. Радиоизотопное исследование костей скелета. Г. Морфологическая верификация диагноза. Д. Осмотр онколога.
22. Какое воздействие на человека в настоящее время не доказано как канцерогенное?
A. Курение.
Б. Употребления жирной пищи.
B. Ультрафиолетовое излучение. Г. Ионизирующая радиация.
Д. Мобильные телефоны.
СИТУАЦИОННЫЕ ЗАДАЧИ
Задача ? 1. К гинекологу на контрольное обследование пришла женщина 52 лет без специфических жалоб. При гинекологическом осмотре врач не обнаружил какой-либо выраженной патологии.
Вопросы
• Какие манипуляции с данной пациенткой должен произвести врач?
• На какие дополнительные исследования он должен её направить?
Задача ? 2. К
хирургу обратилась женщина 47 лет с жалобами на увеличение подмышечных
лимфатических узлов справа. При осмотре в правой аксиллярной области
обнаружены единичные плотные лимфатические узлы с ограниченной
подвижностью, размером до 1-
Вопросы
• Правильная ли тактика выбрана хирургом?
• Какие дополнительные исследования вы порекомендуете?
• Какие онкологические заболевания могут проявляться поражением аксиллярных лимфатических узлов?
ЭТАЛОНЫ ОТВЕТОВ
Тестовые задания
1. Б, Д;
Ситуационные задачи
Задача ? 1
• Необходимо взять мазки с поверхности шейки матки и из цервикального канала и направить их на цитологическое исследование; необходимо произвести осмотр молочных желёз и регионарных лимфатических узлов.
• В случае отсутствия признаков поражения молочных желёз пациентку необходимо направить на скрининговую маммографию. В случае обнаружения признаков патологии в молочных железах пациентка должна быть направлена к маммологу либо к онкологу.
Задача ? 2
• Тактика неверна.
• Необходимо провести дополнительные исследования.
A. УЗИ регионарных лимфатических узлов.
Б. Осмотр кожи правой верхней конечности, груди, живота, спины (для исключения меланомы кожи, рака кожи).
B. Рентгенографию органов грудной клетки для исключения рака легких.
Г. Пункцию пораженных лимфатических узлов с последующим цитологическим исследованием пунктата.
Д. В случае неинформативности пункции - биопсию пораженных лимфатических узлов с гистологическим исследованием полученного материала.
• Поражением аксиллярных лимфатических узлов могут проявляться следующие заболевания: РМЖ; неэпителиальные опухоли молочной железы; меланома кожи передней грудной и брюшной стенок, спины, правой верхней конечности; плоскоклеточный рак кожи передней грудной и брюшной стенок, спины, правой верхней конечности; лимфопролиферативные заболевания; рак лёгких; опухоли мягких тканей передней грудной и брюшной стенок, спины, правой верхней конечности.
СПИСОК ЛИТЕРАТУРЫ
1. Ганцев Ш.Х. Руководство к практическим занятиям по онкологии - М.: МИА, 2007.
2. ДавыдовМ.И. и др. Основы современной онкологии, учебник для студентов медицинских высших учебных заведений / М.И. Давыдов, Л.В. Демидов, Б.И. Поляков - М.: Эра, 2002. - С. 19-47; 182-197.
3. Качкато Д. Онкология. Серия зарубежных практических руководств по медицине - М.: «Практика»,
4. Комаров И.Г., Комов Д.В. Метастазы злокачественных опухолей без выявленного первичного очага. - М.,
5. Минимальные клинические рекомендации Европейского Общества Клинической Онкологии. - М.: ESMO,
6. Организация онкологической службы в России. Часть 2 / Под редакцией В.И. Чиссова, В.В. Старинского, Б.Н. Ковалева. М.: ФГУ МНИОИ им. П.А. Герцена Росмедтехнологии, 2007. - 663 с.
7. Руководство по химиотерапии опухолевых заболеваний / Под общ. ред. Н.И. Переводчиковой. - М., 2005. - С. 21-36, 36-56, 66-72,
648-657.
8. СакаеваД.Д., Лазарева Д.Н. Клиническая фармакология в онкологии - М.,
9. Шайн А.А. Онкология. - Тюмень, 2004.
10. Энциклопедия клинической онкологии / Под общ. ред. М.И. Давыдова - М.: 000 «РЛС-2004», 2004. - С. 17-34, 34-60, 60-89, 90-102, 126-133, 692-696, 850-868.
11. Ozols R.F. at al. Успехи клинической онкологии 2006: наиболее значимые достижения в лечении, профилактике и скрининге онкологических заболеваний - сообщение Американского общества кли- нической онкологии // Journal of Clinical Oncology (Русское издание). - 2007. - ? 2 - С. 165-182.
12. www.scsml.ru. Сайт Центральной научной медицинской библиотеки ГУ ВПО ММА им. И.М. Сеченова
13. www.cancer.gov. Сайт национального противоракового института США