Внутренние болезни: учебник. - 6-е изд., перераб. и доп. / В. И. Маколкин, С. И. Овчаренко, В. А. Сулимов. - 2012. - 768 с. : ил.
|
|
|
|
Глава 3. БОЛЕЗНИ ОРГАНОВ ПИЩЕВАРЕНИЯ
ХРОНИЧЕСКИЙ ГАСТРИТ
Хронический гастрит (ХГ) - заболевание желудка, характеризуется хроническим воспалительным процессом слизистой оболочки, выражающимся в уменьшении количества железистых клеток, нарушении физиологической регенерации, дисплазии слизистой оболочки (при прогрессировании - развитии атрофии и кишечной метаплазии), расстройстве секреторной, моторной и нередко инкреторной функций желудка.
Статистические исследования показывают, что примерно 50% трудоспособного населения развитых стран страдает ХГ.
Среди заболеваний органов пищеварения ХГ занимает первое место (около 35%), а среди всех заболеваний желудка ХГ встречается в 80-85% случаев, часто выступая предшественником таких заболеваний, как язвенная болезнь и рак желудка.
Классификация
В настоящее время пользуются классификацией ХГ, которая содержит основные положения так называемой Сиднейской системы (1990, 1994), которую в полной мере можно назвать этиопатогенетической. Согласно этой системе выделяют:
• аутоиммунный - фундальный гастрит (ХГ типа А);
• ассоциированный с Helicobacter pylori - антральный гастрит (ХГ типа В);
• химически обусловленный (ХГ типа C), в том числе рефлюкс-гастрит, алкоголь, НПВС;
• смешанный гастрит (ХГ типа А+В);
• особые формы ХГ (лимфоцитарный, эозинофильный, гранулематозный, гиперпластический);
• идиопатический ХГ (с невыясненной этиологией и патогенезом).
Из числа всех ХГ 70% приходится на гастриты, ассоциированные с HP, 15- 18% - на аутоиммунные ХГ. В группе ХГ типа С на долю рефлюкс-гастрита приходится менее 5%, а около 10% - на ХГ, ассоциируемые с НПВС. На особые формы ХГ приходится около 1% ХГ, в связи с чем их называют редкими.
Этиология
ХГ - полиэтиологическое заболевание. В настоящее время к наиболее вероятным причинам, вызывающим ХГ, относят следующие:
• инфицирование слизистой оболочки желудка Helicobacter pylori;
• генетический фактор, приводящий к образованию аутоантител к обкладочным клеткам;
• повреждающее действие дуоденального содержимого (желчных кислот, лизолецитина) на слизистую оболочку желудка при рефлюксе его содержимого после резекции желудка и органосберегающих операций.
Кроме этого выделяют 2 большие группы факторов - экзогенных и эндогенных; не являясь этиологическими, они могут приводить к обострению заболевания.
• К экзогенным факторам относят:
- нарушение питания (нарушение ритма приема пищи, переедание, недостаточное пережевывание пищи, злоупотребление грубой, острой, горячей пищей, неполноценное питание);
- курение и алкоголь;
- профессиональные вредности (заглатывание металлической, хлопковой пыли, паров, щелочей и кислот);
- длительный прием некоторых лекарственных средств (НПВС, глюкокортикоиды, препараты наперстянки).
• К эндогенным факторам относятся:
- хронические инфекции (полости рта и носоглотки, неспецифические заболевания органов дыхания и туберкулез, хронический холецистит и пр.);
- заболевания эндокринной системы (болезнь Аддисона, гипотиреоз, диффузный токсический зоб, болезнь Иценко-Кушинга, сахарный диабет);
- нарушение обмена веществ (ожирение, дефицит железа, подагра);
- заболевания, приводящие к тканевой гипоксии (сердечная и легочная недостаточность и пр.);
- аутоинтоксикация (уремия).
Среди экзогенных факторов главное место отводят алиментарным нарушениям и приему лекарственных препаратов, среди эндогенных - воспалительным заболеваниям органов брюшной полости, эндокринным расстройствам и метаболическим нарушениям.
Патогенез
Представления о том, что ХГ служит результатом перенесенного острого гастрита, не получили убедительного подтверждения. Считают, что ХГ - самостоятельное заболевание, с самого начала характеризующееся хроническим течением.
Под влиянием различных этиологических факторов (и при участии сопутствующих) происходит ряд функциональных и морфологических изменений желудка, что проявляется секреторными и моторными нарушениями, находящими свое отражение в клинической картине болезни. Предполагают, что первоначально возникают функциональные расстройства секреции и моторики желудка. В дальнейшем к ним присоединяются органические расстройства. Так, например, избыток ионов водорода при гиперсекреции соляной кислоты угнетает активность сульфатазы (фермент, ответственный за поддержание нормальных соотношений компонентов желудочного сока), результатом чего выступают дальнейшее подавление желудочной секреции и повреждение эпителиальных структур слизистой оболочки желудка с последующим нарушением физиологической регенерации.
Нарушение физиологической регенерации железистого эпителия служит ведущим звеном в развитии всех форм ХГ, кроме поверхностной, при которой этих нарушений нет или они незначительны. При всех остальных формах ХГ нарушение физиологической регенерации выражается в преобладании процессов пролиферации клеток эпителия над дифференциацией. Эпителий не стареет, а лишь теряет свойственные ему морфологические и функциональные признаки за счет вытеснения дифференцированных клеток более молодыми, незрелыми. Нарушение камбиального слоя эпителиальных клеток изменяет процессы репаративной регенерации. При ХГ не только уменьшается количество железистых клеток, но и происходит перестройка железистого аппарата; в слизистой оболочке появляются островки желез, аналогичные по своему строению кишечным железам. Все это приводит к снижению секреции соляной кислоты. Кроме структурных изменений, в слизистой оболочке появляется клеточная инфильтрация (неспецифическое воспаление).
При ХГ типа А в развитии атрофии слизистой оболочки принимают участие аутоиммунные процессы: образующиеся аутоантитела к обкладочным клеткам желудочных желез приводят к их гибели.
При гастрите типа В основной причиной возникновения болезни служит Helicobacter pylori. Заражение осуществляется фекально-оральным и оральнооральным путями. Инфицирование происходит в детском, подростковом, а также молодом (до 20 лет) возрасте. Цитотоксин, вырабатывающийся большинством штаммов H. pylori, и аммиак, образующийся при расщеплении мочевины уреазой, приводят к гибели эпителиальных клеток. Воспалительная реакция, развивающаяся в слизистой оболочки в ответ на внедрение H. pylori, сама по себе способствует нарушению целостности желудочного эпителия. Бактериальные ферменты нарушают целостность мембран эпителиальных клеток и снижают их резистентность к повреждающим факторам. Нарушается защитная функция желудочной слизи. Гастрит типа В развивается в молодом возрасте и встречается в 4 раза чаще, чем гастрит типа А.
Моторно-эвакуаторные нарушения, в результате которых содержимое двенадцатиперстной кишки (секрет поджелудочной железы и желчные кислоты) попадает в желудок, также участвуют в повреждении слизистой оболочки. Этот механизм - главный в развитии рефлюкс-гастрита, так называемого гастрита типа С, так же как прием НПВС и злоупотребление алкоголем.
Кроме того, в слизистой оболочке желудка происходит раскрытие шунтов между артериями и венами. Шунтирование в подслизистом слое способствует развитию ишемии, которая приводит к повреждению слизистой оболочки желудка и ее желез, нарушению регенераторных процессов. Первоначально изменения слизистой оболочки локализуются в антральном отделе (по типу поверхностного гастрита), затем они распространяются по направлению к фундальному отделу и становятся со временем диффузными. Кроме того, эти изменения распространяются и «вглубь», приобретая постепенно атрофический характер.
При ХГ изменяется также клеточный состав стромы слизистой оболочки желудка, увеличивается количество плазматических и уменьшается количество тучных клеток. Очевидно, с этим связаны усиление синтеза иммуноглобулинов (плазматические клетки) и уменьшение выработки эндогенного гистамина (тучные клетки).
Развивающаяся структурная перестройка служит основой морфологических изменений, способствующих длительному хроническому процессу в желудке (рис. 3-1).
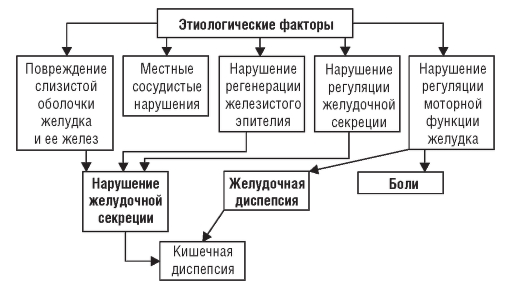
Рис. 3-1. Патогенез хронического гастрита
Клиническая картина
ХГ типа А обнаруживают преимущественно в среднем и пожилом возрасте, а наиболее часто встречающаяся форма ХГ - хеликобактерная (тип В) - развивается в молодом возрасте. Секреторная функция при ХГ типа В не нарушена или даже повышена в начале заболевания. При развитии гипоацидности у этих больных не наблюдают гастринемии, что служит существенным отличием ХГ
типа В от ХГ типа А. Основные отличительные признаки ХГ типа А и типа В представлены в табл. 3-1.
Таблица 3-1. Характеристика ХГ типа А (аутоиммунного) и ХГ типа В (хеликобактерного)
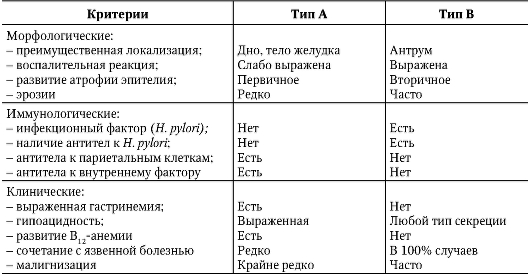
При ХГ типа А при рентгенологическом исследовании отмечается угнетение моторики («вялый» желудок), тогда как при ХГ типа В - усиление моторики («раздраженный» желудок).
В зависимости от вовлечения в патологический процесс фундального или антрального отдела клиническая картина ХГ меняется. Так, при развитии процесса только в фундальном отделе отмечают ранние, умеренной интенсивности разлитые боли в эпигастральной области; фундальный гастрит создает предпосылку для образования язвы желудка. При изменении слизистой оболочки антрального отдела центральное место в клинической картине занимают поздние боли, локализующиеся в пилородуоденальной области, и синдром «ацидизма»; чаще встречается у лиц молодого возраста и предрасполагает к развитию язвы двенадцатиперстной кишки.
Клиническую картину распространенного ХГ составляют следующие основные синдромы:
• желудочная диспепсия;
• боли в эпигастральной области;
• кишечная диспепсия;
• астеноневротический синдром.
Реже встречаются анемический синдром, проявления полигиповитаминоза и гипокортицизма.
В тяжелых случаях ХГ типа А нередко развивается В12-дефицитная анемия и выявляются характерные клинические признаки: бледность кожи, глоссит, неврологические нарушения и др.
При обострении ХГ клинические проявления выражены ярко:
• синдром желудочной диспепсии (у 90% больных) включает «кислую» диспепсию (изжога, «раннее» ощущение голода, кислая отрыжка, кислый
вкус во рту) и «дисмоторную» диспепсию (тяжесть, чувство распирания в эпигастральной области после еды, отрыжка, срыгивание, тошнота, рвота, снижение аппетита, неприятный вкус во рту);
• боли в эпигастральной области неинтенсивного характера;
• симптомы «кишечной» диспепсии встречаются менее чем у половины больных (20-40%) и проявляются метеоризмом, урчанием и переливанием в животе, нарушением стула (запор, понос, неустойчивый стул);
• астеноневротический синдром выражен практически у всех больных при обострении ХГ, о чем свидетельствуют раздражительность, неустойчивость настроения, мнительность, канцерофобия, быстрая утомляемость, плохой сон.
Клиническая картина гастрита с секреторной недостаточностью отличается от проявлений ХГ с сохраненной или повышенной секреторной функцией.
Хронический гастрит с выраженной секреторной недостаточностью
Этот вариант ХГ встречается чаще у лиц зрелого и пожилого возраста. На первом этапе диагностического поиска:
• делают предположение о заболевании желудка на основании жалоб на боли в эпигастральной области и симптомы желудочной диспепсии;
• уточняют вариант течения: хронический, доброкачественный (большая длительность заболевания, сохраненная работоспособность, нерезко выраженное нарушение общего состояния);
• устанавливают отсутствие определенной закономерности в течении заболевания (нет сезонности обострений);
• выявляют возможные причины обострения:
- экзогенные (нарушение питания, бытовые и промышленные интоксикации;
- эндогенные (проявление патологии других внутренних органов, могут быть получены сведения о длительно существующей железодефицитной анемии, заболеваниях эндокринной системы и пр.);
• делают предположение о состоянии секреторной функции: отрыжка тухлым, тошнота, рвота, анорексия при маловыраженных болях встречаются у больных при гастрите с секреторной недостаточностью;
• определяют фазу течения болезни:
- при жалобах, связанных только с патологией желудка (боли, чувство тяжести в эпигастральной области и проявления желудочной диспепсии), предполагают, что процесс в фазе компенсации;
- при появлении общих нарушений (похудание, астеноневротический синдром), жалоб, свидетельствующих о нарушении функции поджелудочной железы, кишечника (понос, чередующийся с запором, вздутие живота, урчание, переливание и др.), следует думать о стадии декомпенсации.
Для больных ХГ с выраженной секреторной недостаточностью характерной жалобой служит понос (диарея).
Причинами «гастрогенной» диареи могут быть:
• недостаточное измельчение поступающей в желудок пищи;
• резкое нарушение переваривания клетчатки;
• ускоренное опорожнение желудка в связи с нарушением замыкательного рефлекса привратника;
• выпадение бактерицидной функции желудка;
• недостаточность поджелудочной железы.
Больных могут беспокоить резкая слабость и головокружение после приема богатой углеводами пищи - проявление демпинг-синдрома, обусловленного быстрым поступлением пищи в двенадцатиперстную кишку при сниженной секреторной способности желудка.
Слабость, адинамия, снижение массы тела, сочетающиеся с жалобами на потемнение кожных покровов, могут быть проявлением гипокортицизма.
Данные, полученные на первом этапе, имеют существенное значение для постановки предварительного диагноза. Однако, учитывая их малую специфичность, достоверность этого этапа для постановки окончательного диагноза относительно невысока.
Получаемая на втором этапе диагностического поиска информация малоспецифична для данного заболевания. На этом этапе можно выявить разлитую болезненность в эпигастральной области при обострении процесса; в этой же области может быть незначительная мышечная защита.
Установленная при пальпации передней брюшной стенки болезненность в точке желчного пузыря, головки поджелудочной железы и зонах, характерных для ее поражения, болезненность при пальпации по ходу толстой кишки, спастически сокращенные участки кишечника отражают вовлечение этих органов в воспалительный процесс. Патологические изменения других органов пищеварительной системы при ХГ выявляют часто.
Обнаруженное при пальпации эпигастральной области «опухолевое образование» делает предполагаемый диагноз ХГ как самостоятельного заболевания, менее вероятным.
При физикальном исследовании могут быть выявлены симптомы полигиповитаминоза (В и С): сухость кожи, покраснение и разрыхленность десен, утолщение языка, сохранение отпечатков зубов на боковой поверхности языка, атрофия и сглаженность его сосочков, ангулярный стоматит и пр. Отмечается выраженная бледность кожи и слизистых оболочек при сопутствующей анемии; могут быть выявлены потемнение кожи в области ладонных складок, сосков, снижение АД - косвенное указание на гипокортицизм.
Постановка окончательного диагноза возможна только с учетом данных третьего этапа диагностического поиска.
Комплекс лабораторно-инструментальных исследований позволяет:
• выявить характер нарушения желудочной секреции;
• определить характер и глубину поражения слизистой оболочки;
• уточнить или выявить осложнения ХГ.
Характер нарушений желудочной секреции определяют по данным фракционного исследования желудочного сока тонким зондом. Главный признак данного варианта гастрита - секреторная недостаточность желудка, приобретает достаточную надежность лишь при проведении гистаминовой стимуляции. Исследование проводят следующим образом. Утром натощак, после удаления содержимого желудка, в течение часа изучают базальную секре-
цию. После получения базального секрета вводят гистамин 0,008 мг на 1 кг массы тела - субмаксимальный гистаминовый тест. Максимальный гистаминовый тест - 0,025 мг на 1 кг массы тела гистамина, применяют редко, так как возможны побочные явления, хотя за 30 мин до введения гистамина предварительно вводят антигистаминный препарат. На протяжении следующего часа собирают отделяющийся сок. Все исследование длится 2 ч.
Очень важно, что базальное и стимулированное гистамином сокоотделение исследуют за равные отрезки времени.
Проведение гистаминовой стимуляции у пожилых требует осторожности, даже при субмаксимальной стимуляции за 30 мин до введения гистамина подкожно вводят антигистаминный препарат (общее действие гистамина смягчается, способность возбуждать секрецию желудка при этом не снижается).
Существуют противопоказания к проведению стимуляции гистамином:
• значительные органические изменения сердечно-сосудистой системы;
• склонность к аллергическим реакциям;
• недавнее кровотечение из пищеварительного тракта;
• подозрение на феохромоцитому.
В таких случаях рекомендуют пользоваться пентагастрином для возбуждения секреторного ответа. Пентагастрин лишен общего действия и обладает исключительно сильной сокогонной способностью.
В лабораторных условиях изменяют объем желудочного сока во все фазы секреции (тощаковая порция, за час до стимуляции - базальная секреция и стимулированная - в течение часа после стимуляции), исследуют общую кислотность, свободную соляную кислоту, кислотную продукцию и пепсин.
О количестве вырабатываемой соляной кислоты судят в основном по показателям общей кислотности и затем на их основе вычисляют по формуле величину кислотной продукции (дебит соляной кислоты).
Ацидограмма (исследование рН желудочного сока в базальную и стимулированную фазы) и электрофореграмма желудочного сока проводятся только в специализированных отделениях и широкого распространения до настоящего времени не нашли.
Кислотность желудочного сока может выражаться в условных титрационных единицах или ммоль/ч. Для более точного учета выработки соляной кислоты желудком в фазе базальной секреции или при оценке субмаксимальной (максимальной) секреции вычисляют так называемый дебит-час, выражаемый в ммоль. Средние нормальные показатели базальной кислотной продукции составляют 1-4 ммоль, субмаксимальной - 6,5-12 ммоль, максимальной - 16-24 ммоль. Для здоровых лиц соотношение базальной кислотной продукции к субмаксимальной считают равным 1\3, а максимальной - 1\6.
При ХГ с секреторной недостаточностью происходит сближение уровней базальной и субмаксимальной кислотообразующей продукции, соотношение их становится 1+1,8 (1+2); снижается общая кислотность, как в базальную, так и в стимулированную фазу до 30-20 титрационных единиц. Свободную соляную кислоту в желудочном соке после стимуляции гистамином не обнаруживают; отмечают уменьшение объема желудочного сока во всех исследуемых порциях; снижается уровень пепсина до 10-20 г/л (содержание пепсина в желудочном
соке не полностью коррелирует с нарушением кислотообразования и обычно снижается медленнее).
Свободная соляная кислота может определяться при ХГ с нерезко выраженной секреторной недостаточностью, но уровень ее значительно снижен.
В ацидограмме при ХГ с резко выраженной секреторной недостаточностью рН базальной фазы 6,0, стимулированной фазы - также 6,0; при нерезком снижении секреции - рН базальной фазы 2,1-5,0, а стимулированной фазы -
2,1.
Характер изменений слизистой оболочки желудка выявляют при проведении фиброгастродуоденоскопии (ФГДС). При ХГ с секреторной недостаточностью отмечают бледность и истонченность слизистой оболочки желудка, при обострении процесса на поверхности слизистой оболочки видны кровоизлияния.
ФГДС должна сочетаться с множественной ступенчатой и прицельной биопсией (4-6 биоптатов по малой и большой кривизне, а также из передней и задней стенок тела желудка).
При ФГДС могут быть выявлены эрозии (эрозивный гастрит), уточнен характер осложнений. Это главный метод диагностики опухолей желудка (полипы, рак желудка), и в подобных случаях диагноз ХГ отвергают именно на этом этапе обследования.
Однако ФГДС не является абсолютно точным методом. При его применении возможны диагностические ошибки; не выявляются изменения моторной функции желудка; невозможно обнаружить опухоли с эндофитным ростом (скирр). В связи с этим эндоскопическое исследование обязательно проводят в сочетании с полноценным рентгенологическим обследованием.
При рентгеноскопии желудка выявляют нарушения его эвакуаторной и моторной функций. У больных ХГ с секреторной недостаточностью отмечают усиленную моторику и ускорение эвакуации взвеси сульфата бария. Рентгеноскопия желудка также важна для отграничения ХГ от рака.
Локальное отсутствие сократимости желудка очень подозрительно на опухолевый процесс с инфильтративным, эндофитным ростом.
Окончательная диагностика гастрита возможна только с учетом данных биопсии и морфологической оценки изменений слизистой оболочки желудка.
Данные биопсии при ХГ с нечетко выраженной секреторной недостаточностью свидетельствуют об умеренно выраженном атрофическом гастрите с поражением желез, часто без их атрофии. При ХГ с резко выраженной секреторной недостаточностью в биоптате обнаруживают атрофию желез и явления кишечной метаплазии.
Клинический и биохимический анализ крови, исследование кала помогают установить вовлеченность в патологический процесс других органов и систем. Так, при поражении поджелудочной железы в крови может быть увеличен уровень амилазы, ингибитора трипсина, а в кале - нейтрального жира. Повторное исследование кала на скрытую кровь в случае отрицательного ответа позволяет отвергнуть предположение о кровотечении. Положительная реакция Вебера настораживает в отношении кровоточащего полипа, эрозивного гастрита, язвы или рака желудка.
Язвенная болезнь желудка, полипоз и рак желудка - характерные осложнения ХГ с секреторной недостаточностью. Диагноз гипокортицизма, поставленный на предыдущих этапах обследования, основан на снижении уровня глюкокортикоидных гормонов в крови. Снижение уровня железа, небольшой процент насыщения железом трансферрина, определяемые при биохимическом анализе крови, по современным представлениям служат причинами развития гастрита с секреторной недостаточностью.
Хронический гастрит с нормальной или повышенной секреторной функцией желудка
Этот вариант ХГ встречается чаще у лиц молодого возраста.
На первом этапе диагностического поиска вне обострения больные могут не предъявлять жалоб.
При обострении преобладают болевой и (или) диспепсический синдромы. Боли, как правило, четко связаны с приемом пищи:
• чаще они возникают непосредственно или спустя 20-30 мин после еды;
• реже встречаются «голодные» или поздние боли;
• ранние и поздние боли могут сочетаться, что указывает на поражение как тела, так и выходного отдела желудка.
Обычно боли умеренные, иногда они сводятся лишь к чувству давления и тяжести в подложечной области. «Поздние» боли отличаются большей интенсивностью, но почти никогда не достигают по интенсивности язвенных болей.
При сочетании с выраженной кишечной дискинезией, часто развивающейся при этой форме ХГ, боли могут приобретать разлитой характер, распространяясь на весь живот. Больные часто жалуются на запор. Возникновение запора объясняется воздействием кислого содержимого желудка на моторную функцию кишечника, а также гипертонусом блуждающего нерва.
Диспепсический синдром проявляется отрыжкой воздухом, кислым; изжогой; тошнотой; иногда срыгиванием; неприятным вкусом во рту и пр. Типичен для ХГ с сохраненной и особенно с повышенной секрецией - синдром ацидизма. Он обусловлен не столько повышенной кислотообразующей функцией желудка, сколько забросом желудочного содержимого в пищевод. Синдром проявляется, прежде всего, изжогой. Иногда изжога настолько мучительна, что становится главной жалобой больных.
Выражен неврастенический синдром: повышенная раздражительность, изменчивость настроения, плохой сон, быстрая утомляемость.
Такое сочетание эпигастральных болей, желудочной диспепсии с выраженным синдромом ацидизма у больных с соответствующим анамнезом при подозрении на ХГ позволяет предположить сохраненную или повышенную желудочную секрецию.
В анамнезе больных удается установить нарушение ритма и качества питания, злоупотребление алкоголем и другие экзогенные причины. Погрешности в диете (употребление тяжелой, непривычной острой или соленой пищи, особенно в избыточном количестве и в сочетании с алкогольными напитками) часто служат причиной обострения заболевания.
Течение ХГ с сохраненной и особенно с повышенной секреторной функцией характеризуется чередованием обострений и ремиссий, но без выраженной сезонности.
На втором этапе диагностического поиска физикальное исследование дает мало опорных данных для диагностики.
Пальпация эпигастральной области выявляет умеренную разлитую болезненность, вне обострения живот безболезненный.
При обострении иногда отмечается болезненность по ходу толстой кишки и в проекции желчного пузыря, обусловленная выраженной дискинезией. Воспалительные поражения кишечника и желчевыделительной системы не свойственны этому варианту ХГ (если они наблюдаются, то их следует рассматривать как самостоятельные заболевания). Выражены симптомы усиления функции парасимпатического отдела вегетативной нервной системы: красный дермографизм, холодные влажные кисти и стопы, гипергидроз, акроцианоз, гипотония.
На третьем этапе диагностического поиска исследуют желудочную секрецию. При этом выявляют повышение тощаковой и базальной секреции, общей кислотности: в стимулированную фазу ее показатели равны 80-100 титрационным единицам и более, базальной кислотной продукции - 1,5- 5,5 ммоль и выше, уровня пепсина - 2,1-4,5 г/л и выше. Анализ ацидограммы (если определяют рН желудочного сока) показывает следующие изменения: при нормацидном состоянии рН базальной фазы 1,6-2,0; стимулированной - 1,2-2,0; при гиперацидном состоянии - соответственно 1,5 и 1,2.
При рентгенологическом исследовании пищеварительного тракта в желудке обнаруживают грубые ригидные складки, спазм привратника. Спастические явления прослеживаются и при прохождении сульфата бария по толстой кишке.
ФГДС, проведенная в стадии обострения процесса, выявляет отек слизистой оболочки, очаги гиперемии, плотную фиксацию слизи на складках слизистой оболочки желудка при поверхностном гастрите. При гипертрофическом гастрите отмечают бархатистость или зернистость слизистой оболочки, утолщение складок, выраженную гиперемию.
Значение ФГДС велико в дифференциации данного клинического варианта ХГ и язвенной болезни двенадцатиперстной кишки. Обнаружение язвенной «ниши», рубца или рубцовой деформации луковицы двенадцатиперстной кишки исключает ХГ как нозологически самостоятельную патологию.
Морфологические исследования биоптата слизистой оболочки выявляют при поверхностном гастрите дистрофические изменения поверхностного (ямочного) эпителия, а при более глубоком поражении желудка - вовлечение в процесс желез. Клетки желез, преимущественно главных и париетальных, гиперплазируются, подвергаются вакуолизации и другим изменениям.
Диагностика
Для постановки диагноза ХГ принимают во внимание:
• клиническую симптоматику (преимущественно субъективные данные):
- преобладание диспепсических синдромов при обострении, сочетающихся с неинтенсивными болями в эпигастральной области;
- длительное течение;
- связь обострений с нарушением диеты;
• изменение секреторной функции желудка;
• изменение слизистой оболочки желудка (по данным рентгеноскопии, ФГДС, гастробиопсии).
В настоящее время основное значение в диагностике ХГ отводят морфологическому изучению структуры, степени выраженности и распространенности патологического процесса в слизистой оболочке желудка (при проведении повторных исследований - динамике патологических изменений). Так, ХГ с нейтрофильной инфильтрацией эпителия и стромы почти всегда служит реакцией на инфицирование H. pylori; нередко при этом имеются эрозии и язвы. ХГ типа А (аутоиммунный) характеризуется лимфоцитарной инфильтрацией желез и их разрушением.
Большое значение в диагностике ХГ придают выявлению H. pylori. Все методы обнаружения H. pylori можно условно разделить на инвазивные и неинвазивные.
• Инвазивные тесты: для этих исследований необходимо проведение ФГДС, во время которой забирают 4 биоптата (по 2 из антрального отдела и тела желудка). Применяют 3 метода выявления H. pylori:
- бактериологический - состоит в выращивании бактерий на селективной питательной среде;
- морфологический - заключается в обнаружении H. pylori в биоптатах, обработанных определенным способом (гистологический метод, золотой стандарт выявления H. pylori);
- биохимический (уреазный тест) - состоит в обнаружении аммиака в среде, содержащей мочевину и биоптат слизистой оболочки (уреаза H. pylori превращает мочевину в аммиак).
• Неинвазивные методы:
- обнаружение в сыворотке крови антител к H. pylori;
- дыхательный тест (пациент принимает внутрь раствор, содержащий меченую [13С] или [14С]мочевину; в присутствии H. pylori выдыхаемый воздух содержит СО2 с меченым изотопом углерода (13С или 14С); этот тест успешно контролирует эрадикацию (удаление) H. pylori.
Формулировка развернутого клинического диагноза учитывает:
• морфологическую и гастроскопическую характеристику ХГ:
- поверхностный;
- с поражением желез без атрофии;
- атрофический;
- гипертрофический;
- эрозивный;
- другие особые формы гастрита;
• состояние желудочной секреции:
- повышенная;
- сохраненная;
- сниженная:
незначительно;
умеренно;
выраженно;
• фазу течения:
- обострение;
- стихающее обострение;
- ремиссия;
• наличие выраженных моторных нарушений (желчного пузыря, кишечника и пр.);
• осложнения (кровотечение и пр.). Примечания
• Морфологическая характеристика гастрита указывается на основании результатов биопсии.
• Для выявления H. pylori наиболее перспективен экспресс-метод его определения в биоптате слизистой оболочки непосредственно во время гастроскопии.
Лечение
ХГ обычно лечат амбулаторно, госпитализация показана при выраженном обострении, необходимости проведения сложных исследований и дифференциальной диагностики. Комплекс лечебных мероприятий зависит от типа гастрита, секреторной функции желудка, фазы заболевания. Лечебные мероприятия включают определенный диетический режим, фармакотерапию, физиотерапевтическое и санаторно-курортное лечение. Задачи терапии при ХГ различных типов отличаются друг от друга.
• При ХГ типа А предусмотрена:
- заместительная терапия;
- минимизация моторных нарушений.
• При гастрите типа В предусмотрены:
- эрадикация H. pylori;
- снижение кислотопродукции;
- «защита» слизистой оболочки желудка.
• При гастрите типа С предусмотрены:
- назначение синтетических простагландинов;
- «защита» слизистой оболочки желудка;
- снижение кислотопродукции.
Диетотерапия - неотъемлемый компонент лечения любого типа ХГ и предусматривает частое дробное питание (5-6 раз в день), пища не должна быть горячей.
• При отсутствии атрофии слизистой оболочки и повышенной секреции исключают блюда и продукты, раздражающие слизистую оболочку желудка (соленые, копченые блюда, маринады, острые приправы, наваристые бульоны).
• При наличии атрофии слизистой оболочки и снижении секреторной функции желудка показана диета, предусматривающая механическое щажение в сочетании с химической стимуляцией секреторной активности желудка: рацион содержит мясные, рыбные и овощные супы, крепкие бульоны, нежирное мясо и рыбу, овощи, фрукты, соки.
• После наступления ремиссии рекомендуют полноценное питание с исключением трудно перевариваемых продуктов, а также продуктов, усиливающих бродильные процессы (цельное молоко, свежие изделия из теста, виноград и пр.).
Заместительная терапия секреторной недостаточности желудка предусматривает назначение препаратов, усиливающих секрецию соляной кислоты (настойка травы горькой полыни, настой корня одуванчика, сок подорожника или плантаглюцид по 0,5-1 г 3 раза в сутки). При отсутствии соляной кислоты в желудочном содержимом прибегают к заместительной терапии - натуральный желудочный сок, 3% раствор соляной кислоты, таблетки ацидин-пепсина. Ранее применявшиеся «стимуляторы» репаративных и регенеративных процессов (ретаболил, масло облепихи, карнитин, витамин U) в настоящее время не используются.
При резко сниженной секреции и кислотности желудочного сока следует назначать хлоридные и хлоридно-гидрокарбонатные натриевые воды достаточной минерализации (Ессентуки № 4, № 7 и др.). Если снижение секреции сопровождается воспалением слизистой оболочки желудка, то предпочтительны воды невысокой минерализации, содержащие, кроме ионов натрия, значительное количество ионов кальция (Славяновская, Смирновская, Миргородская и др.). Больные с пониженной секрецией желудочного сока должны пить воду небольшими глотками за 10-15 мин до еды.
Коррекция нарушений моторной функции желудка (дисмоторной дискинезии) предусматривает назначение препаратов, повышающих тонус привратника и внутрижелудочного давления (так называемых прокинетиков), что предотвращает заброс в желудок содержимого двенадцатиперстной кишки: метоклопрамид или домперидон (мотилиум*) по 10 мг 3 раза в день за 30 мин до еды (в течение 2-3 нед), а также сульпирид (эглонил*) в инъекциях (2 мл 5% раствора 1-2 раза в день) или внутрь (по 50-100 мг 2-3 раза в день).
Для защиты слизистой оболочки применяют обволакивающие препараты: отвар семян льна, белую глину*, смекту* (препарат природного происхождения) по 3 г 3 раза в день, растворяя содержимое пакетика в 1/2 стакана воды.
Для коррекции возможных нарушений кишечного пищеварения при
гастрите типа А применяют ферментные препараты - панкреатин (фестал, дигестал, панзинорм форте, мезим форте).
Снижение кислотопродукции при гастрите типа В достигается назначением 5 основных групп препаратов:
• невсасывающиеся антациды (алмагель, фосфалюгель) лишены многих побочных эффектов всасывающихся антацидных средств (гидрокарбонат натрия, карбонат кальция и др.); антациды принимают через 1-2 ч после еды 3-4 раза в сутки или за 30-60 мин до еды, а также на ночь;
• блокаторы Н2-рецепторов гистамина - ранитидин (зантак, ранисан*) по 150 мг 2 раза в сутки внутрь или внутримышечно, фамотидин (квамател*) по 20 мг 2 раза в сутки внутрь или внутримышечно - эти препараты обладают мощным антисекреторным действием;
• селективные м1-холинолитики - пирензепин (гастроцепин*) внутрь по 25-50 мг/сут (утром и вечером за 30 мин до еды);
• неселективные м-холинолитики (атропин, метацин*, платифиллин) дают незначительный антисекреторный эффект, действуют непродолжительно, часто оказывают побочные эффекты (сухость во рту, тахикардия, нару-
шение мочеиспускания), в связи с чем в настоящее время их используют крайне редко;
• ингибиторы Н+, К+-АТФазы - омепразол по 20 мг 2 раза в сутки, лансопразол по 15, 30 мг/сут, рабепразол (париет*) 20 мг/сут, эзомепразол (нексиум*) по 20, 40 мг/сут - оказывают высокоселективное тормозящее действие на кислотообразующую функцию желудка.
При гастрите типа В (А+В) проводят эрадикацию Н. pylori. Показания к эрадикации:
• ХГ с кишечной метаплазией слизистой оболочки;
• ХГ с атрофией слизистой оболочки;
• ХГ с эрозиями.
Применяют однонедельную трехкомпонентную схему (терапия первой линии) или четырехкомпонентную схему (терапия второй линии при неэффективности предыдущего трехкомпонентного курса).
• Трехкомпонентная схема состоит из одного кислотоподавляющего препарата (ингибитора Н+, К+-АТФазы или блокатора Н2-рецепторов) и двух антимикробных препаратов, например:
- омепразол по 20 мг 2 раза в сутки;
- амоксициллин по 1000 мг 2 раза в сутки;
- кларитромицин по 250 мг 2 раза в сутки; или
- омепразол по 20 мг 2 раза в сутки;
- тинидазол по 500 мг 2 раза в сутки;
- кларитромицин по 250 мг 2 раза в сутки.
Последняя комбинация выпускается в виде таблеток под наименованием пилобакт*.
Для оценки эффективности эрадикационной терапии Н. pylori необходимо выдержать по меньшей мере 4-недельный интервал после курса антихеликобактерной терапии. При проведении диагностических мероприятий в более ранние сроки можно получить ложноотрицательные результаты.
• При неэффективности терапии назначают резервную четырехкомпонентную схему лечения (терапия второй линии), состоящую из одного ингибитора Н+, К+-АТФазы + препарата солей висмута + двух антимикробных препаратов, например:
- омепразол по 20 мг 2 раза в сутки (утром и вечером, но не позже 20 ч, с обязательным интервалом в 12 ч);
- коллоидный висмута трикалия дицитрат (де-нол*) по 120 мг 3 раза за 30 мин до еды и 4-й раз спустя 2 ч после еды перед сном;
- метронидазол по 250 мг 4 раза в день после еды или тинидазол 500 мг 2 раза в сутки после еды;
- амоксициллин или тетрациклин по 500 мг 4 раза в сутки.
Уже через месяц после эрадикации H. pylori исчезает нейтрофильная инфильтрация эпителия, а в более поздние сроки - и мононуклеарная инфильтрация.
Случаи самопроизвольного излечения от инфекции H. pylori у взрослых не описаны - она характеризуется пожизненным течением, поэтому прогноз определяется эффективностью антихеликобактерного лечения.
Физиотерапия широко применяется в комплексном лечении больных ХГ. Для купирования болевого синдрома используют электрофорез с прокаином (новокаином*), платифиллином, озокеритовые и парафиновые аппликации.
В период ремиссии больным ХГ показано санаторно-курортное лечение. При ХГ с сохраненной и повышенной секрецией соляной кислоты рекомендуют гидрокарбонатные минеральные воды, при ХГ с секреторной недостаточностью - хлоридные и натриевые воды.
Прогноз
При нормальной или повышенной секреторной функции желудка прогноз удовлетворительный. Если секреторная функция снижена, то прогноз ухудшается вследствие возможности развития рака желудка (особенно при гистаминоустойчивой ахилии). В связи с этим больных ХГ с выраженной секреторной недостаточностью ставят на диспансерный учет, им регулярно (1-2 раза в год) проводят ФГДС или рентгенологическое исследование желудка.
Профилактика
При ХГ профилактика состоит в рациональном питании и соблюдении режима питания, а также в борьбе с употреблением алкогольных напитков и курением. Необходимо следить за состоянием полости рта, носоглотки, своевременно лечить другие заболевания органов брюшной полости, устранять профессиональные вредности и глистно-протозойные инвазии.
Профилактика обострения ХГ должна предусматривать противорецидивное лечение тех больных, у которых заболевание имеет тенденцию к рецидивированию.
В проведении вторичной профилактики большое значение имеет диспансеризация больных ХГ. Она включает комплексное обследование и противорецидивное профилактическое лечение 1-2 раза в год.
ЯЗВЕННАЯ БОЛЕЗНЬ
Язвенная болезнь (ЯБ) - хроническое, рецидивирующее заболевание, склонное к прогрессированию, морфологическим субстратом которого служит рецидивирующая язва желудка или двенадцатиперстной кишки, возникающая, как правило, на фоне гастрита, вызванного инфекцией Helicobacter pylori.
Заболевание возникает вследствие расстройств нейрогуморальной и эндокринной регуляции секреторных и моторных процессов, а также нарушений защитных механизмов слизистой оболочки этих органов.
Язвенная болезнь встречается у людей любого возраста, но чаще в возрасте 30-40 лет, ею болеют около 8% взрослого населения. Городское население страдает ЯБ чаще по сравнению с сельским, мужчины болеют в 6-7 раз чаще женщин (особенно ЯБ двенадцатиперстной кишки).
Следует строго разделять ЯБ и симптоматические язвы - изъязвления слизистой оболочки желудка и двенадцатиперстной кишки, встречающиеся при различных заболеваниях и состояниях. Таковы язвы при эндокринной пато-
логии, стрессах, острых и хронических нарушениях кровообращения, приеме
НПВС. Этиология
Причины развития заболевания остаются недостаточно изученными. В настоящее время считают, что ее возникновению способствуют следующие факторы:
• длительное или часто повторяющееся нервно-эмоциональное перенапряжение (стресс);
• генетическая предрасположенность, в том числе стойкое повышение кислотности желудочного сока конституционального характера;
• другие наследственно-конституциональные особенности (0 группа крови; НЬЛ-ВЗ-антиген; снижение активности антитрипсина);
• наличие хронического гастрита, дуоденита (ассоциированных с H. pylori), функциональных нарушений желудка и двенадцатиперстной кишки (предъязвенное состояние);
• нарушение режима питания;
• курение и употребление крепких спиртных напитков;
• употребление некоторых лекарственных препаратов, обладающих ульцерогенными свойствами (ацетилсалициловая кислота, фенилбутазон, индометацин и пр.).
Патогенез
Механизм развития ЯБ до сих пор изучен недостаточно. Повреждение слизистой оболочки с образованием язв, эрозий и воспаления связывают с преобладанием факторов агрессии над факторами защиты слизистой оболочки желудка и (или) двенадцатиперстной кишки. К местным факторам защиты относят секрецию слизи, способность к быстрой регенерации покровного эпителия, хорошее кровоснабжение слизистой оболочки, локальный синтез простагландинов и др. К агрессивным факторам причисляют соляную кислоту, пепсин, желчные кислоты. Однако нормальная слизистая оболочка желудка и двенадцатиперстной кишки устойчива к воздействию агрессивных факторов желудочного и дуоденального содержимого в нормальных (обычных) концентрациях.
В последние годы доказана роль инфекции Н. pylori в патогенезе ЯБ.
Так, благодаря особенностям строения и функционирования слизистой оболочки желудка часть людей генетически невосприимчивы к Н. pylori. У этой категории людей Н. pylori, попадая в организм, не способна к адгезии (прилипанию) на эпителий и поэтому не повреждает его. У других лиц (у которых впоследствии развивается ЯБ) Н. pylori, попадая в организм, расселяются преимущественно в антральном отделе желудка, что приводит к развитию активного хронического воспаления (нейтрофильная инфильтрация эпителия и собственной пластинки слизистой оболочки, а также мононуклеарная инфильтрация).
Цитокины клеток воспалительного инфильтрата играют существенную роль в повреждении слизистой оболочки. При адгезии Н. pylori к эпителиальным клеткам последние отвечают продукцией целого ряда цитокинов (в первую очередь ИЛ-8). В очаг воспаления мигрируют лейкоциты и макрофаги, секретиру-
ющие ФНО-а и у-интерферон, что привлекает очередные клетки, участвующие в воспалении. Метаболиты активных форм кислорода, вырабатываемого нейтрофилами, также повреждают слизистую оболочку. Заселение слизистой оболочки двенадцатиперстной кишки и желудка возможно после формирования в ней очагов желудочной метаплазии в ответ на кислотную агрессию. Н. pylori тесно связан с факторами агрессии при ЯБ. Предполагается, что Н. pylori непосредственно, а также опосредованно через цитокины воспалительного инфильтрата приводит к дисгармонии взаимоотношений G-клеток (продуцирующих гастрин) и Д-клеток (продуцирующих соматостатин и играющих роль в функционировании париетальных клеток). Гипергастринемия приводит к увеличению числа париетальных клеток и повышению продукции соляной кислоты. Роль Н. pylori в развитии ЯБ подтверждается тем, что успешная эрадикация этого микроорганизма обусловливает резкое снижение частоты рецидивов (не более 5%), тогда как при отсутствии успешной эрадикации рецидивы ЯБ в течение года возникают в 50-80% случаев.
Одновременно развивается своеобразное нарушение моторики желудка, при котором происходит ранний сброс кислого желудочного содержимого в двенадцатиперстную кишку, что приводит к «закислению» содержимого луковицы двенадцатиперстной кишки.
Таким образом, Н. pylori являются главной причиной, поддерживающей обострение в гастродуоденальной области.
Н. pylori находят в 100% случаев при локализации язвы в антропилородуоденальной зоне и в 70% случаев - при язве тела желудка.
В зависимости от локализации язвенного дефекта различают некоторые патогенетические особенности язвенной болезни. Так, в развитии язвенной болезни с локализацией язвенного дефекта в теле желудка существенная роль принадлежит снижению местных защитных механизмов слизистого барьера в результате воспаления слизистой оболочки, нарушения муцинообразования, регенерации покровно-ямочного эпителия, ухудшения кровотока и локального синтеза простагландинов. Кроме этого существенную роль играет дуоденогастральный рефлюкс с регургитацией желчных кислот и изолецитинов, разрушающих слизистый барьер и обусловливающих ретродиффузию ионов Н+ и образование язвенного дефекта под воздействием пепсина.
Язвообразование в пилородуоденальной зоне слизистой оболочки связывают с длительной гиперхлоргидрией и пептическим протеолизом, обусловленным гиперваготонией, гипергастринемией и гиперплазией главных желез желудка, а также гастродуоденальной дисмоторикой. Кроме этого играет роль и неэффективная нейтрализация содержимого желудка мукоидными субстанциями и щелочным компонентом двенадцатиперстной кишки, длительным закислением пилородуоденальной среды. Приблизительная схема патогенеза ЯБ представлена на рис. 3-2.
Классификация
Язвенную болезнь подразделяют:
• по клинико-морфологическим признакам:
- язвенная болезнь желудка;
- язвенная болезнь двенадцатиперстной кишки;
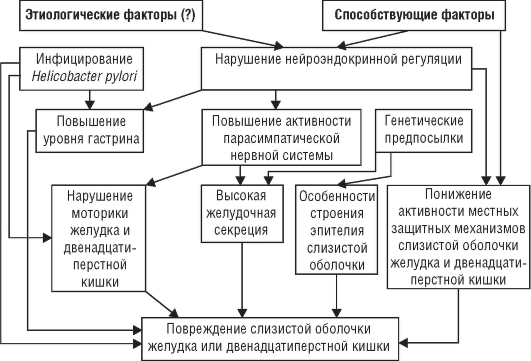
Рис. 3-2. Патогенез язвенной болезни
• по форме заболевания:
- впервые выявленная;
- рецидивирующая;
• по локализации выделяют поражение:
- кардиальной части;
- малой кривизны желудка;
- препилорического отдела желудка;
- луковицы двенадцатиперстной кишки;
- внелуковичного отдела (постбульбарные язвы);
• по фазам течения:
- обострение;
- стихающее обострение;
- ремиссия;
• по тяжести течения:
- доброкачественное (язвенный дефект небольшой и неглубокий, рецидивы редки, осложнений нет; консервативное лечение дает четкий эффект приблизительно через месяц);
- затяжное (стабильное течение, характерны неполный эффект лечения, большие сроки его; возможны рецидивы в течение первого года);
- прогрессирующее (характеризуется минимальным эффектом от лечения, развитием осложнений; рецидивы часты);
• по наличию осложнений:
- осложненная;
- неосложненная.
Осложнения язвенной болезни проявляются кровотечением, пенетрацией, перфорацией, малигнизацией, стенозом привратника и луковицы, перивисцеритами.
Клиническая картина
Клинические проявления ЯБ отличаются многообразием и зависят от фазы течения (обострения или ремиссии), клинико-морфологического варианта (ЯБ желудка или двенадцатиперстной кишки) и наличия осложнений.
При обострении ЯБ независимо от ее клинического варианта выражены следующие основные синдромы:
• болевой (имеет определенные закономерности в зависимости от локализации язвы);
• желудочной диспепсии;
• кишечной диспепсии;
• астеновегетативный;
• локальных изменений;
• осложнений.
Язвенная болезнь желудка
Язвенная болезнь желудка встречается, как правило, у людей зрелого возраста, чаще у мужчин. Дефект локализуется преимущественно на желудочной дорожке малой кривизны или в антральном отделе, но может обнаруживаться в кардиальном и пилорическом отделах.
На первом этапе диагностического поиска выявляют жалобы, связанные с проявлением самой язвенной болезни, с наличием осложнений, вовлечением в процесс других органов пищеварительной системы.
При обострении ЯБ желудка ведущая жалоба на боль в верхней половине эпигастральной области. Хотя локализация боли не имеет абсолютного значения, считают, что при язвах кардиальной части и язвах на задней стенке желудка боли локализуются за грудиной, могут иррадиировать в левое плечо (напоминают боли при стенокардии).
Для язв малой кривизны желудка характерен четкий ритм болей: возникают через 15-60 мин после еды, особенно при погрешности диеты. Сразу после приема пищи боли возникают при локализации язвы в кардиальной части или на задней стенке желудка.
О язве антрального отдела желудка свидетельствуют «голодные», ночные, поздние (через 2-3 ч после еды) боли, напоминающие боли при ЯБ двенадцатиперстной кишки. При язвах пилорического отдела боли интенсивные, не связанные с приемом пищи.
Присоединение болей опоясывающего характера или иррадиация их в спину, интенсивный характер предполагают на последующих этапах диагностического поиска исследование поджелудочной железы (реактивный панкреатит, пенетрация в поджелудочную железу).
Синдром желудочной диспепсии выражен в меньшей степени, проявляется отрыжкой воздухом, пищей, срыгиванием; тошнота и рвота часто отмечаются при язвах канала привратника.
Рвота - нередкая жалоба при ЯБ, рвотные массы состоят преимущественно из примесей пищи. Частая рвота, усиливающаяся к вечеру, содержащая давно съеденную пищу, сочетающаяся с чувством переполнения желудка, похуданием, заставляет заподозрить стеноз выходного отдела желудка.
Кишечный и астеновегетативный синдромы менее выражены при ЯБ желудка, чем при ЯБ двенадцатиперстной кишки. Часть больных жалуются на запор, сочетающийся с болями по ходу толстой кишки и вздутием живота.
Наклонность к кровотечениям характерна для язвы антрального отдела желудка у молодых; кровотечения у пожилых пациентов настораживают в отношении малигнизации (развитие язвы-рака желудка).
На этом этапе обследования оценивают эффективность проводившегося ранее лечения, выясняют частоту рецидивов, т.е. уточняют характер течения процесса - доброкачественный или прогрессирующий.
На втором этапе диагностического поиска выявляют:
• симптомы локальных изменений;
• осложнения;
• вовлечение в процесс других отделов пищеварительной системы. Физические признаки ЯБ при неосложненном течении немногочисленны.
Как правило, отмечают умеренную локальную мышечную защиту в эпигастрии и точечную болезненность в различных отделах этой области. При кардиальных язвах точечная болезненность возникает под мечевидным отростком; при язвах пилорической части - в пилородуоденальной зоне.
Разлитая болезненность в эпигастральной области при одновременном наличии локальной болезненности - признак обострения ХГ (ХГ сопутствует ЯБ) или перигастрита (осложнение ЯБ). При физикальном исследовании могут быть получены данные о развитии других осложнений. Так, появление шума плеска спустя 5-6 ч после приема жидкости свидетельствует о развитии стеноза привратника.
Бледность и влажность кожных покровов, субфебрильная температура тела, тахикардия, снижение АД, исчезновение болезненности в эпигастральной области при пальпации живота служат признаками язвенного кровотечения.
Третий этап диагностического поиска позволяет:
• определить характер нарушения желудочной секреции;
• уточнить характер и локализацию язвенного поражения;
• выявить или уточнить осложнения.
Исследование желудочной секреции выявляет ее нарушения в сторону понижения или умеренного повышения, т.е. характерного нарушения секреции при ЯБ желудка не существует.
Рентгенологическое исследование желудка позволяет обнаружить главный признак ЯБ - «нишу» примерно у 3/4 больных. Поверхностные язвы, не сопровождающиеся воспалительной реакцией окружающей слизистой оболочки, могут рентгенологически не выявляться.
При отсутствии прямого рентгенологического признака («ниши») принимают во внимание косвенные признаки: «пальцевое» втяжение, задержку сульфата бария в желудке свыше 6 ч после его приема, локальную болезненность при пальпации во время исследования. При рентгенологическом исследовании
могут быть выявлены рубцовое сужение привратника, опухоль желудка (полипы, рак и др.).
Наиболее ценную информацию о «нише», ее локализации, глубине, характере (наличие каллезной язвы) и для уточнения осложнений (малигнизация, пенетрация, кровотечение и пр.) дают результаты ФГДС.
ФГДС в сочетании с прицельной биопсией облегчает выявление малигнизации язвы.
При наличии анемии и положительной реакции Вебера при исследовании кала можно с уверенностью говорить о рецидивирующих кровотечениях.
Язвенная болезнь двенадцатиперстной кишки
Язвенная болезнь двенадцатиперстной кишки встречается преимущественно у молодых мужчин; у женщин отмечен рост заболеваемости в период климакса.
В подавляющем большинстве случаев дефект локализуется в луковице двенадцатиперстной кишки, чаще на задней стенке; встречаются так называемые «целующиеся» язвы, поражающие как заднюю, так и переднюю стенку луковицы.
На первом этапе диагностического поиска по совокупности жалоб можно с большой вероятностью предположить возможность обострения ЯБ двенадцатиперстной кишки.
Самый главный симптом - боли, возникающие через 1,5-3 ч после приема пищи (так называемые поздние боли), часто натощак (голодные боли) и ночью (ночные боли); проходят после приема пищи и щелочей. Отчетливо проявляется сезонность болей (обострение весной и осенью).
Структура болевого синдрома может быть представлена следующим образом: голод - боль - пища - облегчение - голод - боль и т.д. Четкой локализации болей не отмечено: они могут быть в подложечной области, правом верхнем квадранте живота, около пупка и т.д.
Изменение характера боли указывает на возможность развития осложнения: при пенетрации в поджелудочную железу появляются боли в левом верхнем квадранте живота, иррадиируют в позвоночник. Для пенетрации язвы в желчный пузырь характерны доминирующие боли в правом подреберье с иррадиацией под правую лопатку, в спину.
Второй важный симптом - рвота, возникает обычно на высоте болей, особенно при осложненных формах заболевания. Рвота, как правило, приносит облегчение (уменьшаются боли).
Ранним и наиболее частым симптомом является изжога (симптом «ацидизма»). Отрыжка кислым реже беспокоит больных, возникает обычно после приема пищи.
Характерен запор, обусловленный изменением моторики кишечника, патогномоничным для ЯБ двенадцатиперстной кишки.
Отличает данное заболевание также выраженность астеновегетативных проявлений (повышенная раздражительность, нарушение сна, снижение работоспособности и пр.).
Ha втором этапе диагностического поиска данные менее информативны. При физическом обследовании выявляют симптомы:
• вегетативной дисфункции (повышенная потливость, красный и белый дермографизм, дисгидроз);
• локальной болезненности и напряжения мышц в эпигастральной области и пилородуоденальной зоне;
• усиления моторной функции желудка и толстой кишки (гиперперистальтика, спастическое состояние);
• вовлечения в процесс других органов пищеварительной системы (поджелудочная железа, желчный пузырь).
Данные третьего этапа диагностического поиска позволяют:
• поставить окончательный диагноз;
• уточнить развитие осложнений;
• обнаружить вовлечение в патологический процесс других органов.
Для ЯБ двенадцатиперстной кишки характерно повышение секреторной функции желудка. При исследовании желудочного сока выявляют повышение базальной и стимулированной секреции соляной кислоты и пепсина в 1,5-2 раза по сравнению с показателями секреции у здоровых людей.
Прямым признаком ЯБ служит обнаружение «ниши», которая наиболее часто локализуется в луковице двенадцатиперстной кишки, реже вне луковицы (постбульбарная). Основные методы ее диагностики - рентгенологический и эндоскопический (ФГДС).
Рентгенологическое исследование выявляет:
• прямые признаки:
- «ниша» с радиарной конвергенцией складок;
- типичная деформация луковицы;
• косвенные признаки:
- спазм привратника;
- дискинезия луковицы, повышение тонуса и усиление перистальтики двенадцатиперстной кишки;
- зубчатость контуров слизистой оболочки луковицы;
- гиперсекреция желудка.
Стеноз луковицы и степень его выраженности также обнаруживают рентгенологически.
Для диагностики постбульбарных язв используют рентгеноконтрастную дуоденографию, проводят ее при гипотонии двенадцатиперстной кишки.
При ФГДС непосредственно выявляют язвенные дефекты слизистой оболочки.
Клинический анализ крови помогает при наличии анемии заподозрить массивное или рецидивирующее кровотечение.
Серийное исследование кала на скрытую кровь помогает выявить скрытое кровотечение.
Диагностика
Для постановки правильного диагноза необходимо учитывать следующие признаки .
• Основные:
- характерные жалобы и типичный язвенный анамнез;
- обнаружение язвенного дефекта при ФГДС;
- выявление симптома «ниши» при рентгенологическом исследовании.
• Дополнительные:
- локальные симптомы (болевые точки, локальное мышечное напряжение в эпигастральной области);
- изменения базальной и стимулированной секреции;
- «косвенные» симптомы при рентгенологическом исследовании;
- скрытые кровотечения из пищеварительного тракта. Формулировка развернутого клинического диагноза учитывает:
• клинический вариант:
- ЯБ желудка или двенадцатиперстной кишки;
• форму заболевания:
- впервые выявленное;
- рецидивирующее;
• локализацию язвы:
- малая кривизна, антральный отдел, канал привратника;
- внелуковичная язва и сочетанные язвы (на основании данных эндоскопического и рентгенологического исследований);
• фазу течения:
- обострение;
- стихающее обострение;
- ремиссия;
• наличие осложнений:
- желудочно-кишечное кровотечение; перфорация; пенетрация, стенозирование, перивисцерит, развитие рака, реактивный панкреатит.
Лечение
Консервативное лечение ЯБ всегда комплексное, дифференцированное с учетом факторов, способствующих заболеванию, с учетом патогенеза, локализации язвенного дефекта, характера клинических проявлений, степени нарушения функций гастродуоденальной системы, осложнений и сопутствующих заболеваний.
В период обострения больных необходимо госпитализировать как можно раньше, так как установлено, что при одной и той же методике лечения длительность ремиссий выше у больных, лечившихся в стационаре. Лечение в стационаре должно проводиться до полного рубцевания язвы. Однако к этому времени все еще сохраняются гастрит и дуоденит, в связи с чем следует продолжить лечение еще в течение 3 мес в амбулаторных условиях.
Противоязвенный курс включает в себя:
• устранение факторов, способствующих рецидиву болезни;
• лечебное питание;
• лекарственную терапию;
• физические методы лечения (физиолечение, гипербарическая оксигенация, иглорефлексотерапия, лазеротерапия, магнитотерапия).
Устранение факторов, способствующих рецидиву болезни, предусматривает организацию регулярного питания, оптимизацию условий труда и быта, категорическое запрещение курения и употребления алкоголя, запрещение приема лекарственных препаратов, обладающих ульцерогенным эффектом.
Лечебное питание обеспечивают назначением диеты, содержащей физиологическую норму белка, жира, углеводов и витаминов. Предусматривают соблюдение принципов механического, термического и химического щажения.
Лекарственная терапия имеет своей целью:
- эрадикацию Н. pylori;
- подавление избыточной продукции соляной кислоты и пепсина или их нейтрализацию и адсорбцию;
- восстановление моторно-эвакуаторной функции желудка и двенадцатиперстной кишки;
- защиту слизистой оболочки желудка и двенадцатиперстной кишки;
- стимуляцию процессов регенерации клеточных элементов слизистой оболочки и купирование воспалительно-дистрофических изменений в ней.
Физические методы лечения - тепловые процедуры применяют в период стихания обострения (аппликации парафина*, озокерита) при неосложненном течении заболевания и отсутствии признаков скрытого кровотечения. При длительно не рубцующихся язвах, особенно у больных пожилого и старческого возраста, в комплексной терапии применяют гипербарическую оксигенацию (ГБО), позволяющую уменьшить гипоксию слизистой оболочки выраженного органа. Наконец, описан положительный опыт применения облучения язвенного дефекта лазером (через фиброгастроскоп), 7-10 сеансов облучения в существенной степени укорачивают сроки рубцевания.
Медикаментозное лечение
• Эрадикация Н. pylori достигается проведением однонедельного курса «трехкомпонентной» схемы (терапия первой линии):
- омепразол по 20 мг 2 раза в сутки;
- амоксициллин по 1000 мг 2 раза в сутки;
- кларитромицин по 250 мг 2 раза в сутки; или
- омепразол по 20 мг 2 раза в сутки;
- тинидазол по 500 мг 2 раза в сутки;
- кларитромицин по 250 мг 2 раза в сутки; или
- ранитидина висмута цитрат (пилорид) по 400 мг 2 раза в день в конце еды;
- кларитромицин по 250 мг, или тетрациклин по 500 мг, или амоксициллин по 1000 мг 2 раза в день;
- тинидазол по 500 мг 2 раза в день вместе с едой.
• При неэффективности эрадикации назначают на 7 дней резервную четырехкомпонентную схему лечения (терапия второй линии), состоящую из одного ингибитора Н+, К+-АТФазы, препарата солей висмута, двух антимикробных препаратов, например:
- омепразол по 20 мг 2 раза в сутки (утром и вечером, но не позже 20 ч, с обязательным интервалом в 12 ч);
- коллоидный висмута трикалия дицитрат (де-нол*) по 120 мг 3 раза за 30 мин до еды и 4-й раз спустя 2 ч после еды перед сном;
- метронидазол по 250 мг 4 раза в день после еды или тинидазол 500 мг 2 раза в сутки после еды;
- амоксициллин или тетрациклин по 500 мг 4 раза в сутки после еды.
• После окончания комбинированной эрадикационной терапии следует продолжить лечение еще в течение 5 нед при ЯБ двенадцатиперстной кишки и 7 нед при ЯБ желудка с использованием одного из следующих препаратов:
- ранитидин по 300 мг в 19-20 ч, или фамотидин по 40 мг в 19-20 ч, или ранитидина висмута цитрат (пилорид) по 400 мг утром и вечером.
• Подавление избыточной секреции желудка достигается с помощью селективных м-холиноблокаторов - пирензепин (гастроцепин*) в суточной дозе 75-100 мг (по 25-50 мг утром за 30 мин до завтрака и 50 мг перед сном).
• Для снижения секреции используют также блокаторы Н2-рецепторов (фамотидин, ранитидин). Эти препараты, блокируя Н2-рецепторы, находящиеся в обкладочных клетках желудка, тормозят базальную и стимулированную гистамином и пентагастрином секрецию соляной кислоты. Используют также ингибитор Н+, К+-АТФазы - омепразол, применяемый 2 раза в день по 20 мг. При лечении антисекреторными препаратами (омепразолом, фамотидином, ранитидином и в меньшей степени пирензепином) в слизистой оболочке желудка развивается гиперплазия гастрин- и гистаминобразующих клеток. В связи с этим необходимы постепенная отмена данных препаратов после рубцевания язвы и обязательное сочетание их приема с нерастворимыми антацидами: алмагель*, фосфалюгель*, сималдрат (гелусил*), которые принимают только в межпищеварительный период (через 1,5-2 ч после еды и на ночь) до наступления полной ремиссии.
• Для нормализации моторно-эвакуаторной функции желудка и двенадцатиперстной кишки назначают метоклопрамид (церукал*) по 10 мг 3-4 раза в день или сульпирид (эглонил*) по 50 мг 3 раза в день или домперидон по 10 мг.
• Для защиты слизистой оболочки желудка и двенадцатиперстной кишки применяют коллоидный субцитрат висмута (де-нол*), который, соединяясь с белками, освобождающимися в язвенном и эрозивном дефектах, образует вокруг них нерастворимый преципитат, покрывающий слизистую оболочку белково-висмутовой пленкой. Де-нол* назначают по 1-2 таблетки за 30 мин до еды 3-4 раза в день. Другой препарат, образующий на поверхности слизистой оболочки защитный слой, резистентный к деструктивному действию соляной кислоты и пепсина, - сукральфат по 1 таблетке 3 раза в день за 30-40 мин до еды и 4-й раз перед сном. Де-нол* и сукральфат* особенно показаны больным, которые не могут самостоятельно прекратить курение, поскольку курение в несколько раз снижает эффективность блокаторов Н2-рецепторов.
• В клиническую практику в последние годы введены новые препараты - синтетические аналоги простагландинов. Синтетический аналог простагландина Е1 - риопростил* - обладает выраженным антисекреторным
эффектом, высокоэффективен также энпростил* (аналог простагландина Е2).
В ряде случаев возникает необходимость в хирургическом лечении. Оперативное лечение показано больным ЯБ с частыми рецидивами при непрерывной терапии поддерживающими дозами противоязвенных препаратов.
Операция показана в случаях пенетрации, перфорации язвы, стеноза пилородуоденального отдела с выраженными эвакуаторными нарушениями и при профузном желудочно-кишечном кровотечении.
В период ремиссии ЯБ необходимо:
• исключение ульцерогенных факторов (прекращение курения, употребление алкоголя, крепкого чая и кофе, лекарственных препаратов - НПВС);
• соблюдение режима труда и отдыха, диеты;
• санаторно-курортное лечение;
• диспансерное наблюдение с проведением поддерживающей терапии. Непрерывная поддерживающая терапия проводится в течение нескольких
месяцев (и даже лет) антисекреторным препаратом в половинной дозе (например, принимать ежедневно вечером ранитидин по 150 мг или фамотидин по
20 мг).
Показания для непрерывной поддерживающей терапии:
• неэффективность проведенной эрадикационной терапии;
• осложнения (кровотечение или перфорация в анамнезе);
• наличие сопутствующих заболеваний, требующих приема НПВС;
• сопутствующий эрозивно-язвенный рефлюкс-эзофагит;
• возраст старше 60 лет в случае ежегодного обострения ЯБ, несмотря на адекватную терапию.
Прогноз
Для неосложненных форм ЯБ прогноз благоприятный, ухудшается при часто рецидивирующих формах, серьезный при осложнениях.
Профилактика
В целях профилактики ЯБ рекомендовано устранение нервного напряжения, отрицательных эмоций, интоксикаций; прекращение курения, злоупотребления алкоголем; нормализация питания; соответствующее трудоустройство, активная лекарственная терапия хеликобактерной инфекции у больных ХГ.
Профилактическая терапия «по требованию» назначается при появлении симптомов, характерных для обострения ЯБ и включает в себя:
• прием одного из антисекреторных препаратов (ранитидин, фамотидин, омепразол) в полной суточной дозе в течение 2-3 дней, а затем в половинной дозе - в течение 2 нед.
ЗАБОЛЕВАНИЯ КИШЕЧНИКА
Заболевания кишечника довольно распространены, однако их истинная встречаемость точно неизвестна, так как поражение кишечника может быть как самостоятельной патологией, так и сопутствовать другим заболеваниям
пищеварительного тракта (например, хроническому гастриту, хроническому панкреатиту). Точный учет частоты заболеваний кишечника затруднен еще и потому, что на различные патологические воздействия кишечник реагирует достаточно однотипной реакцией - диареей (поносом) или запором. Между тем, эти симптомы могут быть проявлением сугубо функциональных расстройств кишечника, определяться характером питания пациента или же быть следствием приема некоторых лекарственных средств.
В настоящее время нет единого подхода к классификации и диагностике заболеваний кишечника. Одни и те же страдания часто обозначаются различными терминами. В качестве самостоятельного диагноза могут фигурировать отдельные симптомы (запор, диарея), синдромы - синдром недостаточности всасывания (синдром мальабсорбции), синдром недостаточности пищеварения (синдром мальдигестии), синдром избыточного роста бактерий в тонкой кишке, кишечная лимфэктазия, а также определенные нозологические формы (БК, НЯК).
В наибольшей степени терминологическое разнообразие наблюдают при обозначении заболеваний тонкой кишки. Фигурируют термины, обозначающие как нозологические формы - болезнь Уиппла, кишечная лимфэктазия, так и синдромы - нарушенное всасывание (мальабсорбция) различных субстанций - мальтозы, сахарозы-изомальтозы, глиадина (фракция глютена - белка пшеничной муки), синдром «короткой кишки», неинфекционная диарея (секреторная, осмотическая), дисбактериоз кишечника, тонкокишечная диарея (инфекционная или неинфекционная). В отечественной литературе также используют термин «хронический энтерит», по существу обозначающий группу состояний, протекающих с многолетним нарушением кишечного пищеварения и всасывания (этот термин можно рассматривать как групповое понятие). При хроническом энтерите (ХЭ) основными клиническими признаками выступают синдромы нарушенного всасывания (мальабсорбция) и нарушенного кишечного пищеварения (мальдигестия), обусловливающие появление основного признака ХЭ - хронической тонкокишечной диареи.
Используемый в отечественной литературе термин «хронический колит» также трактуют чрезмерно широко и включают в него не только собственно воспалительные заболевания толстой кишки, но и ферментопатии, функциональную патологию, дисбактериоз, диспепсию (бродильную или гнилостную), неинфекционную диарею. Существование хронического неспецифического (неязвенного) колита признают не все авторы, относя его к СРК. Истинными же заболеваниями толстого кишечника рассматривают НЯК и гранулематозное поражение толстой кишки (БК). Все это чрезвычайно затрудняет работу врача и не способствует единому подходу к заболеваниям кишечника.
В данном разделе учебника представлены хроническая диарея (ХЭ), НЯК,
БК и СРК.
ХРОНИЧЕСКАЯ ДИАРЕЯ (ХРОНИЧЕСКИЙ ЭНТЕРИТ)
Хронический энтерит (ХЭ) - хроническое воспалительно-дистрофическое поражение тонкой кишки, приводящее к морфологическим изменениям слизистой оболочки и нарушению моторной, секреторной, всасывательной и
других функций тонкой кишки. Основным проявлением заболевания служит хроническая диарея.
Для заболевания характерны воспалительные изменения слизистой оболочки (отек, нерезко выраженная инфильтрация слизистой оболочки лимфоцитами и плазматическими клетками, эрозии) с последующим развитием атрофических процессов. Одновременно поражаются кровеносные капилляры и лимфатические сосуды кишки, а также внутристеночные нервные сплетения. Дистрофические изменения обнаруживаются также в чревном сплетении и пограничных симпатических стволах.
Этиология
Причины развития ХЭ весьма разнообразны:
• наследственно-конституциональный фактор: врожденный дефицит ферментов (в частности, участвующих в расщеплении различных углеводов);
• алиментарные нарушения, безрежимное питание, алкоголизм;
• ранее перенесенные кишечные инфекции;
• интоксикация лекарственными и химическими веществами;
• воздействие проникающей радиации (как правило, ХЭ такой этиологии наблюдают при рентгеновском облучении или лучевой терапии по поводу опухолей различного происхождения);
• заболевания ЖКТ - вторичные энтериты.
Патогенез
В кишечнике развивается ряд патологических процессов, степень выраженности которых зависит от особенностей ведущего этиологического фактора. Так, нарушения моторики тонкой кишки и снижение барьерной функции стенки кишки (вследствие снижения продукции иммуноглобулинов и лизоцима, а также нарушения целостности эпителия) опосредованно приводят к нарушению переваривания (синдром мальдигестии) и всасывания (синдром мальабсорбции в узком смысле слова). Оба эти синдрома обычно объединяют термином «мальабсорбция» (в широком понимании). Существенную роль в развитии синдрома нарушенного всасывания играет дисбактериоз - появление в тонкой кишке условно-патогенной или сапрофитной флоры и обильного ее роста (содержание бактерий в 1 мл составляет 105-107 и более). Часть бактерий вызывают гидролиз желчных кислот и препятствуют их конъюгированию. Продукты гидролиза желчных кислот оказывают токсическое действие на слизистую оболочку кишки. Кроме того, недостаток желчных кислот препятствует образованию мицелл (соединение жирных кислот и моноглицеридов с желчными кислотами), что нарушает всасывание жиров. Кишечная флора может усиленно поглощать витамин В12, приводя к дефициту его в организме. Нарушается также выделение собственных ферментов, что приводит к расстройству всасывания углеводов и белков. Воспалительные изменения стенки кишечника обусловливают также экссудацию жидкой части крови и электролитов в просвет кишечника (синдром экссудативной энтеропатии). Отмечают также нарушение двигательной активности кишки (повышение). Все перечисленное обуслов-
ливает диарею - частый (более 2-3 раз в сутки) обильный (более 250 г/сут) кашицеобразный или жидкий стул. Отличительный признак диареи - увеличение содержания воды в кале (более 85%).
Классификация
Как уже сказано выше, общепринятой классификации болезней кишечника (в том числе тонкой кишки) не существует. Суммируя имеющиеся данные, можно предположить следующую классификацию:
• по этиологии (рассмотрена выше);
• по клиническому течению:
- легкое течение;
- средней тяжести;
- тяжелое;
• по характеру функциональных нарушений тонкой кишки:
- синдром недостаточности пищеварения;
- синдром недостаточности всасывания;
- синдром экссудативной энтеропатии;
• по течению:
- фаза ремиссии;
- фаза обострения.
Клиническая картина
На первом этапе диагностического поиска, прежде всего, удается выявить особенности начала заболевания, а также проявления основных синдромов. Медленное, постепенное начало более характерно для ХЭ алиментарной этиологии. Сведения о профессиональных вредностях, злоупотреблении лекарственными средствами (особенно слабительными на фоне постоянного запора), эпизодах лучевой терапии, непереносимости отдельных видов пищи должны помочь в установлении этиологии заболевания.
Наиболее часто больные жалуются на расстройство функции опорожнения, что проявляется преимущественно в виде диареи. Диарея (понос) характеризуется частым опорожнением кишечника и выделением неоформленных каловых масс. Диарея при ХЭ обладает всеми свойствами так называемой тонкокишечной диареи: стул обычно бывает 2-3 раза в день, обильный, так как нарушение переваривания и всасывания в тонкой кишке приводит к значительному увеличению количества непереваренной пищи, поступающей в толстую кишку. Поскольку резервуарная функция толстой кишки сохранена, дефекация происходит лишь несколько раз в день, но с выделением большого количества кала. Отсутствие воспалительных изменений в левой половине толстой кишки и прямой кишке исключает тенезмы, а также наличие в испражнениях крови. При ХЭ позывы к дефекации возникают спустя 20-30 мин после приема пищи и сопровождаются сильным урчанием и переливанием в животе. Часто пациенты отмечают непереносимость молока. Вызывают обострение также прием острой пищи, переедание, пища, содержащая большое количество жиров и углеводов. Больные обращают внимание на своеобразный желтоватый (золотистый) цвет
каловых масс, обусловленный присутствием в них невосстановленного билирубина и большого количества жира.
Дискинетический синдром проявляется также болями. При поражении тонкой кишки боли чаще локализуются возле пупка, носят тупой, распирающий характер, не иррадиируют, появляются через 3-4 ч после приема пищи, сопровождаются вздутием, переливанием в животе, затихают после согревания живота.
У больных ХЭ часто отмечается метеоризм - вздутие живота вследствие повышенного газообразования. Для преобладания бродильных процессов типично отхождение большого количества газов без запаха. При длительном течении ХЭ, особенно тяжелой формы, астеноневротический синдром выражен ярко: больные отмечают слабость, повышенную физическую и умственную утомляемость.
При поражении тонкой кишки, вследствие нарушения всасывания продуктов расщепления белков, витаминов, липидов, снижается масса тела, тогда как для поражения толстой кишки этот симптом не характерен. Однако и в последнем случае возможно снижение массы тела вследствие добровольного отказа больного от приема пищи из-за боязни болей и расстройства функции кишечника. Таким образом, после первого этапа складывается впечатление о заболевании кишечника.
На втором этапе диагностического поиска объем информации меньше. Однако эта информация также имеет значение для постановки диагноза, так как необнаружение ряда симптомов при несомненном предположении о наличии ХЭ будет указывать на более легкое течение заболевания, отсутствие осложнений. Данные второго этапа будут во многом определяться вовлечением в патологический процесс кишечника, а также реакцией со стороны остальных органов пищеварительной системы. ХЭ, выступая в части случаев осложнением ряда заболеваний, способствует поражению печени, желчных путей, желудка, поджелудочной железы.
При тяжелом поражении тонкой кишки появляются признаки синдрома мальабсорбции: снижение массы тела, трофические изменения кожи (сухость, шелушение, истончение) и ее дериватов (выпадение волос, ломкость ногтей). Гиповитаминоз В2 проявляется хейлитом, ангулярным стоматитом; гиповитаминоз РР - глосситом, гиповитаминоз С - кровоточивостью десен.
При нарушении всасывания в кишечнике кальция возникают патологическая хрупкость костей, а также признаки гипопаратиреоидизма (положительные симптомы Хвостека и Труссо, в тяжелых случаях - судороги).
При развитии надпочечниковой недостаточности появляются признаки аддисонизма - гиперпигментация кожи, особенно кожных складок ладоней, слизистой оболочки рта, артериальная и мышечная гипотензия. Нарушение функции половых желез у мужчин проявляется импотенцией, у женщин - аменореей. Однако эти эндокринные нарушения возникают лишь при тяжелом течении ХЭ, когда синдром мальабсорбции резко выражен.
При пальпации живота отмечаются болезненность в области пупка - в зоне Поргеса (болезненность при пальпации живота и сильном давлении несколько левее и выше пупка), симптом Герца (шум плеска при пальпации слепой кишки
вследствие быстрого пассажа химуса по тонкой кишке и поступления непереваренного и невсосавшегося жидкого содержимого и кишечного газа в слепую кишку).
На третьем этапе диагностического поиска, прежде всего, необходимо подтвердить предположение о поражении кишечника. Этому помогают результаты исследования кала, эндоскопии и рентгенологического метода.
Анализ кала предусматривает микроскопию, химическое и бактериологическое исследование. На основании результатов этих исследований выделяют типичные копрологические синдромы.
• Синдром недостаточности переваривания в тонкой кишке:
- жидкий желтый кал щелочной реакции;
- большое количество мышечных волокон, немного соединительной ткани, нейтрального жира и йодофильной микрофлоры;
- значительное количество жирных кислот и мыл;
- очень большое содержание крахмала и перевариваемой клетчатки.
• Синдром ускоренной эвакуации из тонкой кишки:
- жидкий желтый или светло-коричневый кал слабощелочной реакции;
- значительное количество мышечных волокон, жирных кислот и мыл, немного соединительной ткани;
- очень много нейтрального жира, крахмала и перевариваемой клетчатки. Определенное значение имеет исследование бактериальной микрофлоры
кала для выявления дисбактериоза, наличие которого способствует развитию энтерита и в дальнейшем поддерживает его хроническое течение. У больных ХЭ снижено число бифидо- и лактобактерий, увеличено число гемолитических и лактозонегативных эшерихий, патогенного стафилококка, протея, гемолитического стрептококка. Восстановление нормальной бактериальной флоры в кишечнике служит хорошим критерием успешного лечения.
При ХЭ с преимущественным поражением тонкой кишки концентрация энтерокиназы и щелочной фосфатазы (ферменты, участвующие в процессе всасывания белка и жирных кислот) значительно повышается во всех ее отделах и в кале.
Повышение концентрации ферментов в тонкой кишке объясняется компенсаторным увеличением выработки их и усиленной десквамацией кишечного эпителия, содержащего эти ферменты. Увеличение количества ферментов в кале обусловлено усилением моторики кишечника и нарушением процессов дезактивации ферментов в дистальных отделах кишечника вследствие активации бактериальной флоры.
Для выявления синдрома нарушения всасывания используют тест с D-ксилозой и витамином В12 (тест Шиллинга). Для проведения теста с D-ксилозой внутрь дают 5 г D-ксилозы - моносахарида, всасывающегося из верхнего отдела тонкой кишки без предварительного расщепления. При нарушении всасывания только в верхних отделах тонкой кишки выделение D-ксилозы с мочой снижается в первые 2 ч, при более обширных поражениях в течение 5 ч. Если же выделение D-ксилозы нарушено только в первые 2 ч, а в течение последующих 5 ч протекает нормально, то нарушение всасывания в верхней части тонкой кишки компенсируется всасыванием в ее дистальном отделе.
При поражении слизистой оболочки тонкой кишки нарушается всасывание витамина B12*. Тест Шиллинга состоит в следующем: больному внутрь дают витамин В12*, меченный радиоактивным кобальтом, через 2 ч витамин B12* вводят парентерально, затем определяют количество витамина В12*, выделенного с мочой за сутки. В норме выделяется 10% введенного количества, выделение же менее 3% указывает на нарушение всасывания.
При рентгенологическом исследовании (контрастное вещество вводят в тонкую кишку через зонд) выявляются нарушение моторики, изменение рельефа слизистой оболочки.
В настоящее время используют так называемую «энтерокапсулу» - компьютерное устройство длиной 2-3 см, которое пациент проглатывает и в течение всего прохождения через кишечник капсула передает на экран компьютера изображение слизистой оболочки того или иного участка кишечника. Перспективы получения информации с помощью такого исследования весьма велики.
Морфологическое исследование биоптатов слизистой оболочки возможно при получении материала с помощью специального биопсийного зонда, вводимого в полость тонкой кишки. При микроскопии выявляют выраженную в различной степени атрофию ворсинок.
Биохимическое и общеклиническое исследование крови в выраженных случаях обострения выявляет острофазовые неспецифические показатели (увеличение СОЭ, увеличение содержания фибриногена и а2-глобулина, появление СРБ). Кроме того, при ХЭ наблюдается дистрофически-анемический синдром (железодефицитная или В12-фолиеводефицитная анемия, гипопротеинемия и гипоальбуминемия, гипохолестеринемия). При вовлечении в патологический процесс других органов системы пищеварения (печень, желчные пути, поджелудочная железа) лабораторно-инструментальные исследования помогают обнаружить соответствующие изменения.
Течение
На основании информации, полученной на всех этапах диагностического поиска, выделяют три степени тяжести ХЭ.
• Легкое течение: в клинической картине преобладают «кишечные» симптомы, масса тела снижена не более чем на 5-7 кг, общие симптомы отсутствуют.
• Средней тяжести: наряду с типичными «кишечными» симптомами имеется развернутый синдром мальабсорбции (гиповитаминоз, значительное снижение массы тела).
• Тяжелое течение: выраженный синдром мальабсорбции. В патологический процесс вовлечены другие органы.
Осложнения
К числу осложнений ХЭ относят в основном осложнения, связанные с реакцией других органов пищеварения, а также обусловленные снижением иммунобиологической реактивности организма:
• хронический холецистит;
• жировая дистрофия печени, хронический персистирующий гепатит
(ХПГеп);
• хронический панкреатит;
• хронический гастрит с секреторной недостаточностью;
• инфекция мочевыводящих путей (пиелиты, циститы).
Диагностика
Распознавание болезни основано на выявлении следующих признаков:
• характерные «кишечные» симптомы;
• патологические изменения кала (в период обострения):
- характерные изменения копрограммы;
- измененная микрофлора (дисбактериоз);
- увеличение выделения с калом ферментов;
• синдром мальабсорбции (выраженный в разной степени).
Диагноз ХЭ поставить достаточно трудно, так как синдром хронической диспепсии и мальабсорбции встречается при других поражениях тонкой кишки.
Дифференциальная диагностика
Своеобразной редкой формой ХЭ выступает регионарный илеит (БК), протекающий с преимущественным прогрессирующим поражением подвздошной кишки, повышением температуры тела, выраженной диспротеинемией, острофазовыми показателями крови, поражением других органов (артрит, узловатая эритема, ириты) и своеобразной эндоскопической картиной.
Глютеновая и дисахаридная энтеропатии - заболевания, вызванные наследственным дефицитом ферментов, расщепляющих глютен - белок, содержащийся в пшенице, ржи, ячмене, и фермента дисахаридазы, содержащегося в слизистой оболочке тонкой кишки. Заболевания эти начинаются в детском возрасте, при глютеновой энтеропатии преобладает стеаторея, а при дисахаридной энтеропатии - полифекалия с кислой реакцией каловых масс.
Болезнь Уиппла (интестинальная липодистрофия) - редкое заболевание, вызванное Tropheryma whippelii, возникающее в среднем возрасте и проявляющееся поносом, обильным стулом со стеатореей, полиартралгиями, лимфоаденопатией, умеренной лихорадкой. В большинстве случаев диагноз устанавливают при морфологическом исследовании биоптатов тонкой кишки.
Лечение
Лечебные мероприятия строят по патогенетическому принципу и предусматривают воздействия на различные звенья патологического процесса, которые определяют клиническую картину. Коррекция метаболических нарушений - белковых, жирового баланса и других видов обмена - наиболее важный аспект терапевтических назначений.
В период обострения больного следует госпитализировать. Назначают полноценную диету, содержащую нормальное количество углеводов, жиров и увеличенное количество белка (130-140 г). Исключают тугоплавкие жиры животного происхождения, ограничивают продукты, содержащие большое количество клетчатки. В период обострения пища должна быть механически щадящая (жидкая или кашицеобразная).
Для борьбы с дисбактериозом антибиотики не применяют из-за опасности его усиления. Без результатов микробиологического исследования предпочтительно назначение эубиотиков (называемых также «пробиотики»), обладающих широким спектром антибактериального и противогрибкового действия, но не влияющих на нормальную микрофлору:
• линекс* по 1-2 капсулы 3 раза в день;
• бифиформ* по 1-2 капсулы 2 раза в день;
• лактобактерин* по 5 доз 2 раза в день.
При определении флоры (стафилококк, синегнойная палочка) назначают антибиотики (эритромицин), а также нитрофураны.
При поносе показан прием лоперамида (по 1 таблетке под язык после каждого акта дефекации). Используют также отвары из плодов черемухи, коры дуба, гранатовых корок.
Широко используют ферментные препараты (панзинорм*, мезим-форте*, панкреатин в больших дозах).
Витаминотерапия обязательно проводится больным с ХЭ, так как у них нарушен эндогенный синтез витаминов. В первую очередь назначают витамины группы В* (В2, B6, никотиновая кислота).
При тяжелом синдроме мальабсорбции парентерально вводят белковые препараты и растворы электролитов.
Прогноз
При легком течении ХЭ больные сохраняют трудоспособность, но им не рекомендуются работы, связанные с нерегулярным питанием. При тяжелом течении показан перевод на инвалидность.
Профилактика
Рациональное питание, предупреждение токсических (бытовых и производственных) воздействий, своевременное лечение заболеваний органов пищеварения .
НЕСПЕЦИФИЧЕСКИЙ ЯЗВЕННЫЙ КОЛИТ
Неспецифический язвенный колит (НЯК) - хроническое рецидивирующее заболевание кишечника неизвестной этиологии, характеризующееся диффузным воспалением слизистой оболочки прямой и ободочной кишки. НЯК в иностранной литературе и в последнее время в России называют язвенным колитом.
В ранней стадии НЯК проявляется нарушением целостности эпителия и сосудистой реакцией, позднее присоединяются изъязвления слизистой оболочки, не распространяющиеся глубоко в стенку кишки. В выраженной стадии слизистая оболочка отечна, с многочисленными небольшими или обширными язвами неправильной формы. В слизистой оболочке развиваются псевдополипы, что связано с регенерацией эпителия. При хронизации процесса репаративносклеротические изменения начинают преобладать, происходит рубцевание язв,
образуются обширные зоны рубцовой ткани, приводящие к резкой деформации и укорочению кишки, просвет ее сужается.
НЯК болеют люди всех возрастных групп (чаще в возрасте 20-40 и 60- 70 лет), мужчины и женщины болеют одинаково часто. Заболеваемость - 50- 80 на 100 тыс. населения. Чаще болеют жители Северной Америки и северной части Европы.
Этиология
Точных сведений о причине развития болезни в настоящее время нет. Предполагается наследственная предрасположенность (связь заболевания с носительством антигенов HLA-DR27 и B27), при которой инфекционные факторы (в том числе дисбактериоз) и иммунные реакции запускают воспалительный процесс.
Патогенез
Основными патогенетическими механизмами являются изменение иммунологической реактивности, дисбактериоз и своеобразие нервно-вегетативных реакций организма (рис. 3-3).
Дисбактериоз и, в частности, увеличение количества Escherichia coli и Yersinia оказывают местное токсическое и аллергизирующее влияние. Особенности нервно-вегетативных реакций вызывают дисфункцию вегетативной и гормональной регуляции, а также изменение проницаемости слизистой оболочки
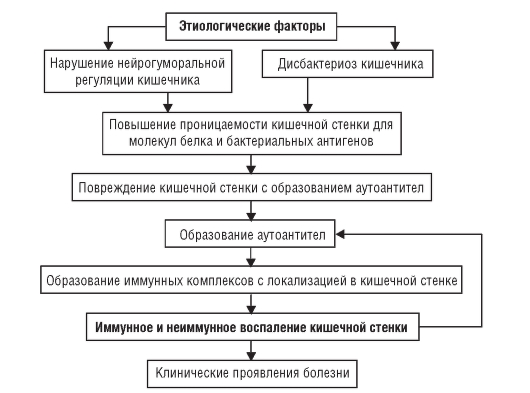
Рис. 3-3. Патогенез неспецифического язвенного колита
толстой кишки. В результате облегчается проникновение веществ, обладающих антигенными свойствами. Известно, что антигены некоторых штаммов E. coli индуцируют синтез антител к ткани кишечника. Цитопатогенное действие противотолстокишечных антител сочетается с действием протеолитических и иных продуктов метаболизма микрофлоры кишечника и вызывает иммунное и неиммунное воспаление стенки кишечника.
Иммунные механизмы обусловливают вовлечение в патологический процесс других органов и систем (внекишечные поражения), к которым относятся поражения кожи, органа зрения, полости рта, опорно-двигательного аппарата, системы крови.
Классификация
В настоящее время общепринятой классификации НЯК нет. Для практических целей выделяют 3 основные формы: острую, хроническую и рецидивирующую. В пределах каждой клинической формы встречаются легкие, среднетяжелые и тяжелые варианты течения болезни.
• Острая (молниеносная) форма встречается редко, отличается тяжестью общих и местных проявлений, ранним развитием осложнений. Процесс развивается бурно, как правило, захватывает всю толстую кишку.
• Хроническая форма характеризуется непрерывным, длительным, истощающим течением, с постепенным нарастанием симптоматики.
• Рецидивирующая форма встречается наиболее часто. Для нее характерны ремиссии продолжительностью 3-6 мес и более, сменяющиеся обострениями различной выраженности. Одна клиническая форма может переходить в другую.
НЯК всегда поражает прямую кишку и, прогрессируя, распространяется проксимально. В связи с этим выделяют проколит, левосторонний колит, тотальный колит. Тяжесть заболевания обусловлена степенью воспаления и топографией патологического процесса толстой кишки. Наиболее часто наблюдается проктосигмоидит (67%), тотальный колит встречается у 16% больных, изолированный проктит - у 5%.
Клиническая картина
Проявления болезни обусловлены обширностью и выраженностью поражения толстой кишки и внекишечными проявлениями, однако на первом месте стоят «кишечные» симптомы.
На первом этапе диагностического поиска выявляют жалобы на диарею, жидкий или кашицеобразный стул, наличие в нем крови, слизи и гноя.
Выделяют несколько вариантов начала заболевания.
• Постепенное появление поноса; через несколько дней в жидких испражнениях обнаруживают слизь, кровь.
• Болезнь дебютирует ректальными кровотечениями при оформленном или кашицеобразном стуле. Потеря крови при дефекации в первые дни обычно незначительная.
• Появление диареи с кровью и слизью, болью, интоксикацией.
При развернутой картине болезни дискинетический и язвенно-геморрагический синдромы проявляются в виде частого жидкого стула с примесью крови и гноя, иногда слизи, что служит основным симптомом. Стул до 20 раз в сутки, а при тяжелом течении число дефекаций достигает 40 и более, преимущественно ночью и утром. Больные тяжелой формой НЯК нередко страдают недержанием кала, что связано с поражением наружного сфинктера заднего прохода и общей слабостью. Примесь крови в стуле бывает значительной, иногда выделения из толстой кишки состоят из одной крови. В период обострения больные в день теряют 100-300 мл крови.
Количество слизи в испражнениях зависит от сохранности слизистой оболочки кишки. При тотальном глубоком поражении слизистой оболочки слизь в испражнениях отсутствует.
В период обострения испражнения представляют собой зловонную гнойнослизистую жидкость с примесью крови. Во время ремиссии понос может полностью прекратиться, но чаще стул кашицеобразный, 3-4 раза в день, с незначительным включением слизи и крови.
Обязательный симптом тотального НЯК - схваткообразные боли. Больные не всегда могут точно определить локализацию боли, лишь приблизительно указывая зону основного поражения. Чаще всего это область сигмовидной ободочной и прямой кишки, реже - область пупка и слепой кишки. Типично усиление болей перед дефекацией и ослабление после опорожнения кишечника. Прием пищи также усиливает боль и диарею, так что иногда больные отказываются от еды.
Поражение прямой и сигмовидной ободочной кишки приводит к тенезмам. Позывы на дефекацию носят резко императивный характер. Больные нередко отмечают чувство неполного опорожнения прямой кишки.
При неспецифическом язвенном проктите и проктосигмоидите некоторые больные отмечают запор по 2-3 дня, чередование поноса с запором, которое носит спастический характер.
Практически все больные жалуются на слабость, похудание. В период ремиссии состояние улучшается, увеличивается масса тела. С каждым рецидивом слабость и похудание прогрессируют. При проктите и проктосигмоидите масса тела обычно не снижается, аппетит сохранен, слабость умеренная.
При молниеносной форме бурно нарастают явления интоксикации: тошнота, рвота, высокая температура тела, слабость вплоть до адинамии. Похудание быстро достигает степени кахексии. Развиваются синдром органных поражений и астеноневротический синдром в виде резкого изменения психики (больные становятся обидчивыми, плаксивыми, утрачивают чувство юмора).
Неэффективность противодизентерийной терапии в дебюте, дальнейшее прогрессирование заболевания, вовлечение других органов и систем позволяют заподозрить тяжелое поражение кишечника, в том числе НЯК, опухоль, туберкулез и т.д.
На втором этапе диагностического поиска выявляют клинические признаки дистрофическо-анемического и дискинетического синдромов, местных и системных осложнений.
При остром течении и тотальном поражении кишечника больные впадают в прострацию, истощены, обезвожены. Наблюдается сухость кожи и слизистых оболочек, резко снижен тургор. Кожные покровы бледные, температура тела 39-40 °С и выше. Отмечаются тахикардия, артериальная гипотензия, уменьшение диуреза. Печень и селезенка нередко увеличены. Пальпируется болезненная урчащая толстая кишка с уплотненными стенками. Кожа вокруг заднего прохода мацерирована, слизистая оболочка прямой кишки пролабирует.
Острая форма часто сопровождается осложнениями. Наибольшую опасность представляет перфорация, возможны множественные перфорации. Перфорации, возникшие на фоне тяжелой интоксикации, резких болей в животе, часто протекают атипично, без бурного начала, без острых болей. Не сразу возникает мышечная защита. В связи с этим наличие перфорации можно предполагать на основании только общего ухудшения состояния больного в сочетании с учащением пульса, падением АД.
Для острой токсической дилатации толстой кишки характерны резкое расширение и вздутие отдельных сегментов, чаще поперечной ободочной кишки. Участок кишки резко растягивается жидкостью и газами, что может закончиться прободением и перитонитом. При этом осложнении частота дефекации уменьшается, стул теряет каловый характер, увеличивается выделение крови, гноя и слизи. Определяются высокая лихорадка, значительная тахикардия, коллапс. Живот вздут, пальпация по ходу вздутых участков толстой кишки резко болезненна. Перистальтика вялая или отсутствует.
При хронической форме НЯК в клинической картине преобладают проявления гиповитаминоза, анемии, эндокринных расстройств (дистрофическианемический синдром).
На втором этапе выявляется также ряд патологических изменений других органов и систем (синдром органных поражений). Типичным проявлением кожных изменений НЯК служит узловатая эритема: появляются единичные или множественные узлы, чаще на разгибательной поверхности голеней. При тяжелых формах болезни встречаются гангренозная пиодермия и массивные изъязвления кожи нижних конечностей.
Для тяжелых форм НЯК характерны также поражение слизистой оболочки рта, афтозный стоматит, глоссит и гингивит. Обычно отмечается изъязвление края или нижней поверхности языка, реже десен. Боли при приеме пищи настолько сильны, что больные отказываются от пищи. Возможен язвенный эзофагит.
При НЯК могут возникать ириты, конъюнктивиты и блефариты. Отмечается четкая зависимость выраженности глазных симптомов от формы и фазы болезни.
НЯК может осложниться полиартритом. Обычно поражаются голеностопные и коленные суставы с небольшим ограничением движений и нерезкими болями. Артриты возникают одновременно с НЯК и исчезают при ремиссии, не оставляя деформации. У некоторых больных развиваются спондилиты.
Сравнительно часто НЯК осложняется сужением просвета кишки, что проявляется картиной толстокишечной непроходимости.
При пальцевом исследовании прямой кишки можно выявить осложнения, которые при НЯК возникают часто (перианальные абсцессы, анальные трещи-
ны, парапроктит, флегмона клетчатки параректального пространства, прямокишечные и ректовагинальные свищи).
На третьем этапе выявление характерных изменений слизистой оболочки толстой кишки позволяет поставить окончательный диагноз.
Для постановки диагноза НЯК (с учетом постоянного поражения прямой кишки) достаточно ректороманоскопии. В начале болезни наблюдаются отек и контактная гиперчувствительность слизистой оболочки. Малейшее механическое раздражение ведет к кровотечению (контактная кровоточивость). Слизистая оболочка гиперемирована, отечна, покрыта слизью, под которой отмечается «зернистость» с точечными и мелкими изъязвлениями. Позднее под слизистой оболочкой образуются характерные просовидные абсцессы; после их вскрытия остаются мелкие язвы, которые в дальнейшем сливаются.
При тяжелой острой форме возможно полное разрушение слизистой оболочки и глубжележащих слоев; внутренняя поверхность становится более гладкой, стенка хрупкой, легко рвется.
Стиханию клинических проявлений соответствует эндоскопическая картина в виде частичной эпителизации, уменьшения размеров язв, появления псевдополипов. В период ремиссии происходит полная эпителизация, слизистая оболочка гладкая, со стертым сосудистым рисунком, могут выявляться мелкие псевдополипы.
Для определения степени и характера поражения толстой кишки, выявления ряда осложнений следует проводить ирригоскопию.
Рентгенологическая картина в ранние стадии НЯК при неглубоких морфологических изменениях скудна и неспецифична. После длительного лечения при рентгенологическом исследовании выявляют отсутствие гаустрации, ригидность, равномерные атрофию и сужение кишки, ее укорочение. Кишка имеет вид «водопроводной трубы». В фазу обострения можно выявить изменение рельефа: широкие поперечные валики с краевыми зубцами, псевдополипоз. Этот метод может обнаружить стриктуру кишки и возможную малигнизацию.
При токсической дилатации толстой кишки, в связи с опасностью ирригоскопии (провокация перфорации), диагностическое значение приобретает обзорная рентгенография: на снимках видны растянутые (от 10 см и более) сегменты кишки. При подозрении на перфорацию следует чаще прибегать к обзорной рентгеноскопии брюшной полости для обнаружения «свободного» газа.
Фиброколоноскопия позволяет точно определить характер изменений на всем протяжении толстой кишки, а также выявить поражение илеоцекального клапана (баугиниева заслонка) и терминального отдела тонкой кишки.
При хроническом течении НЯК и в фазе ремиссии в диагностике помогают эндомикроскопическое исследование и биопсия слизистой оболочки.
Лабораторное исследование крови позволяет определять степень и характер анемии. При массивном кишечном кровотечении возникает острая постгеморрагическая анемия. Постоянная ежедневная, даже «скрытая» кровопотеря также приводит к дефициту железа в организме и развитию анемии.
У некоторых больных развивается приобретенная аутоиммунная гемолитическая анемия (с положительной реакцией Кумбса, ретикулоцитозом и неконъюгированной гипербилирубинемией). При тотальном НЯК с вовлечением
тонкой кишки возникает дефицит фолиевой кислоты и витамина B12, в генезе которого определенную роль играет дисбактериоз.
Для острого НЯК и рецидивов характерны повышение СОЭ и небольшой лейкоцитоз со сдвигом лейкоцитарной формулы влево. Важным является определение СОЭ в динамике, так как количество лейкоцитов часто остается нормальным даже в тяжелых случаях, что связывают с гипокортицизмом и приемом сульфаниламидов. Нечасто возникающий высокий лейкоцитоз почти всегда служит сигналом тяжелого осложнения.
Биохимическое исследование крови помогает установить степень нарушения белкового и электролитного обмена, а также выявить поражение печени и почек.
Копрологическое исследование отражает степень воспалительно-деструктивного процесса. Микроскопически обнаруживают скопления лейкоцитов, эритроциты, большие скопления клеток кишечного эпителия. Резко положительная реакция на растворимый белок в кале (проба Трибуле) свидетельствует также о воспалении кишечной стенки.
Бактериологическое исследование кала в дебюте НЯК помогает исключить острую дизентерию. Определение характера и степени дисбактериоза необходимо для проведения антибактериальной терапии. Показательными для нарушенного биоценоза кишечника служат количественные сдвиги облигатной микрофлоры: отсутствие роста бифидобактерий в разведении 10-7 и резкое изменение количества кишечной палочки. Дисбактериоз проявляется также высоким представительством кишечной палочки со слабовыраженными ферментативными свойствами (более 10%), лактозонегативных энтеробактерий (более 5%), появлением микроорганизмов рода протея, грибов рода кандида, гемолизирующих эшерихий, стафилококка.
Диагностика
Распознавание НЯК основано на выявлении следующих признаков:
• «характерных» изменений стула: частый, неоформленный стул с примесью крови и гноя;
• патологических изменений при копрологическом исследовании: скудные неоформленные испражнения, кровь, слизь, гной в кале, стул типа «малинового желе»; резко положительная реакция на растворимый белок;
• «специфических» изменений слизистой оболочки: контактная кровоточивость, отсутствие сосудистого рисунка, просовидные абсцессы, язвы различной величины и формы, псевдополипы;
• «типичных» изменений кишки при ирригоскопии: укорочение, сужение, отсутствие гаустрации, кишка в виде «водопроводной трубы».
На основании данных, полученных на всех трех этапах диагностического поиска, выработаны критерии тяжести НЯК (табл. 3-2).
Дифференциальная диагностика
В силу того что клиническая картина НЯК сходна с проявлениями других поражений кишечника, его приходится дифференцировать от ряда заболеваний.
Прежде всего, НЯК дифференцируют от острой инфекционной диареи. НЯК протекает тяжелее, быстро возникают осложнения, введение антибиотиков не
Таблица 3-2. Клинико-лабораторные критерии тяжести неспецифического язвенного колита
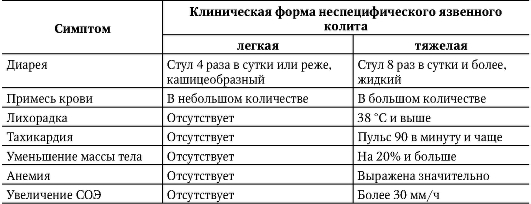
улучшает состояния, как при бактериальной дизентерии, а усугубляет его. При бактериальной дизентерии, в отличие от НЯК, ректороманоскопия не выявляет обширных язвенных полей, диффузной кровоточивости, псевдополипоза. Диарея, возбудителем которой служит Clostridium difficili (псевдомембранозный колит), обусловлена приемом антибиотиков, возникает остро, с лихорадкой, кровавой диареей. В диагностике псевдомембранозного колита (ПМК), ишемического колита вследствие нарушения мезентериального кровоснабжения, дивертикулита ведущая роль принадлежит эндоскопическому исследованию.
НЯК следует дифференцировать также от БК (терминальный илеит), при которой отмечают боли в илеоцекальной области, понос, сменяющийся запором (без примеси крови), лихорадку, анемию. Поперечная и нисходящая ободочная кишка интактны, поэтому не наблюдаются понос и выраженные кровотечения. В ряде случаев в патологический процесс вовлекается сигмовидная, ободочная и прямая кишка, и тогда дифференцировать НЯК можно только по данным эндоскопического исследования, а также микроскопии биоптата слизистой оболочки.
При хронических формах НЯК, когда ведущими симптомами служат кашицеобразный стул и выделение крови из прямой кишки, дифференциальную диагностику проводят с новообразованием прямой и толстой кишки. Окончательный диагноз ставят с учетом результатов эндоскопии.
Формулировка развернутого клинического диагноза строится по следующей схеме:
• клиническая форма;
• степень вовлечения отделов толстой кишки;
• степень тяжести;
• фаза заболевания;
• осложнения.
Лечение
Объем лечебных мероприятий зависит от тяжести течения болезни, фазы (обострение или ремиссия) и наличия или отсутствия осложнений. Комплексное лечение предусматривает борьбу с воспалительным процессом, воздействие
на моторику и микрофлору кишечника, коррекцию обменных нарушений, создание психического и физического покоя.
Общие мероприятия включают диету, создание физического и психического покоя. Больные с НЯК легкого течения в госпитализации не нуждаются.
Пища должна быть достаточно калорийной и включать 110-120 г белка в сутки, в период обострения больного переводят на диету № 4 (механически щадящая пища с исключением сырых и вареных овощей, фруктов, молока), при стихании обострения пища может быть непротертой.
В период ремиссии некоторые больные не переносят определенные продукты, которые следует исключить из рациона, это касается молока, винограда, изюма, кваса, пива.
Больные НЯК эмоционально лабильны, тревожны. Большая роль принадлежит доверительным взаимоотношениям врача и больного. При необходимости назначают седативные препараты или, главным образом, антидепрессанты.
Больные с тяжелым течением болезни нуждаются в неотложной госпитализации и строгом постельном режиме. Назначают парентеральное питание (путем катетеризации подключичной вены вводят различные растворы - ами- нопептид*, альвезин, липофундин* или интралипид*, глюкозу* вместе с электролитами и витаминами комплекса В*).
Из противовоспалительных препаратов (если нет показаний к хирургическому лечению) назначают глюкокортикоиды, особенно если одновременно имеются внекишечные проявления болезни. Преднизолон вначале вводят внутривенно (в дозе эквивалентной 40 мг преднизолона), при недостаточном эффекте добавляют цитостатики (азатиоприн внутрь по 2,5 мг/кг в сутки). Затем переходят на прием преднизолона внутрь (1 мг/кг массы тела); при достижении эффекта дозу постепенно снижают. При лихорадке, клинических симптомах септического состояния назначают антибактериальную терапию ципрофлоксацин внутривенно по 500 мг каждые 8 ч до стихания симптомов.
При НЯК средней тяжести в периоде обострения больных необходимо госпитализировать. Назначают преднизолон 40-60 мг/сут (снижая дозу в зависимости от клинической картины на 5-10 мг в неделю) и месалазин внутрь по 4,0 г/сут, снижая дозу при достижении ремиссии приблизительно на 1 мг в неделю.
Исчезновение симптомов, нормализация эндоскопической картины и лабораторных показателей свидетельствуют об эффективности лечения. Эффективность сульфасалазина и месалазина оценивают на 14-21-й день терапии, глюкокортикоидов - на 7-21-й день, азатиоприна - через 2-3 мес.
В фазе ремиссии, для которой характерно отсутствие жалоб, лихорадки, анемии и других патологических показателей, обычно назначают на длительное время прием сульфасалазина по 2-3 г/сут без существенных ограничений в диете или месалазин 1,0-1,5 г/сут. Если рентгенологические, эндоскопические данные нормальны в течение длительного времени (не менее 2 лет), то можно на несколько месяцев полностью отменить прием сульфасалазина.
В периоды обострения или же при сохранении ряда симптомов в периоде улучшения состояния при частом стуле используют антидиарейные препараты - реасек3 (ломотил3) по 20-30 мг в день, желательно сочетание его со
спазмолитиками; следует применять также вяжущие средства (отвар коры дуба, плодов черники, черемухи).
Лицам с длительностью НЯК более 10 лет следует проводить колоноскопию 1-2 раза в год (опасность малигнизации).
Борьба с осложнениями включает в себя консервативное лечение острой токсической дилатации толстой кишки. Для этого необходимо ограничить прием пищи и полностью отменить холинолитики и опиаты. Требуется полноценная коррекция электролитного обмена, особенно калиевого, а также восполнение потери жидкости и белка. Проводят гемотрансфузии, как правило, прямое переливание крови. Назначают антибиотики широкого спектра действия. Осторожно проводят декомпрессию желудка с помощью зонда. Клизмы противопоказаны. Необходимо соблюдать осторожность с газоотводной трубкой (опасность перфорации сигмовидной и ободочной кишки).
Применение сульфасалазина позволило ограничить прием глюкокортикоидов и проводить длительные курсы поддерживающей терапии. Считается, что действующим эффектом обладает 5-аминосалициловая кислота; клинические наблюдения позволяют считать, что и сам сульфасалазин, как комплексный препарат, обладает противовоспалительным эффектом. Сульфасалазин обладает как дозозависимыми побочными эффектами (тошнота, рвота, головная боль, алопеция), так и дозонезависимыми (агранулоцитоз, гемолитическая анемия, гепатит, панкреатит, фиброз легких).
Применение при НЯК блокатора ФНО-а - инфликсимаба не получило однозначной оценки.
При неэффективности консервативных мероприятий выполняют тотальную колэктомию с наложением илеостомы (одномоментно).
В случае перфорации толстой кишки ушивание не производят. Показана гемиили тотальная колэктомия с наложением илеостомы.
Показания к оперативному лечению:
• обоснованное подозрение на перфорацию;
• острая токсическая дилатация толстой кишки, не поддающаяся терапии в течение 24 ч;
• профузное кишечное кровотечение;
• неэффективность комплексной интенсивной терапии при острой тяжелой форме в течение 7-10 дней;
• неэффективность комплексной терапии рецидивирующего НЯК;
• развитие стриктур с явлениями частичной кишечной непроходимости;
• малигнизация.
У больных с илеостомой в дальнейшем необходимо стремиться к осуществлению реконструктивных и восстановительных операций (илеоректальный анастомоз, создание искусственной ампулы и т.д.).
Прогноз
Прогноз при НЯК зависит от клинической формы заболевания, распространенности процесса и тяжести его течения. При тяжелом течении НЯК прогноз неблагоприятный вследствие развития различных осложнений. Комплексная терапия может смягчить проявления болезни, однако полной и длительной ремиссии обычно не наступает.
Профилактика
Специфические профилактические меры неизвестны. Профилактика сводится к предупреждению обострений, что достигается упорным лечением. Больных ставят на диспансерный учет, чтобы своевременно выявить начинающееся обострение или осложнение.
БОЛЕЗНЬ КРОНА
Болезнь Крона (БК) - хроническое рецидивирующее заболевание неясной этиологии, характеризующееся гранулематозным воспалением с сегментарным поражением разных отделов пищеварительного тракта. Патологический процесс при БК локализуется преимущественно в кишечнике, хотя могут поражаться все отделы ЖКТ, включая пищевод, желудок, ротовую полость. Выделяют БК с поражением подвздошной кишки (терминальный илеит) - 30-35%; илеоцекального отдела - около 40%; толстой кишки, включая аноректальную зону, - 20%; тонкой кишки - 10%. В 5% случаев болезнь может дебютировать с поражением пищевода, желудка, двенадцатиперстной кишки или перианальной области.
Неспецифическое иммунное воспаление распространяется на всю толщу кишечной стенки, имеет регионарный характер: зоны воспалительной инфильтрации клеточными элементами (лимфоциты, плазматические клетки, в меньшей степени - нейтрофилы) чередуются с относительно неизмененными участками кишки. В слизистой оболочке, в зоне инфильтрации образуются глубокие язвы, развиваются абсцессы и свищи с последующим рубцеванием и сужением просвета кишки. Протяженность поражения пищеварительного тракта при БК весьма различна: от 3-5 см до 1 м и более.
Распространенность БК в разных регионах мира колеблется в широких пределах - 20-150 случаев на 100 000 населения. Отмечено, что БК страдают чаще люди трудоспособного возраста (20-50 лет) обоего пола. У родственников первой линии пациентов с БК риск развития данного заболевания в 10 раз выше, чем в популяции.
Этиология
Причины развития болезни неизвестны. Предполагают этиологическую роль бактерий, вирусов, пищевых аллергенов, генетических факторов (семейный характер болезни отмечен в 5% случаев). Отмечено, что БК ассоциируется с антигеном гистосовместимости HLA-B27.
Патогенез
Точные представления о механизмах развития болезни отсутствуют. В настоящее время рабочей гипотезой служит предположение о нарушении иммунного ответа организма на кишечную микрофлору у генетически предрасположенных лиц. Предполагают, что органы иммуногенеза вырабатывают аутоантитела к клеткам слизистой оболочки кишечника, а также сенсибилизированные лимфоциты, обладающие повреждающим действием. Отмечено, что кишечной ми-
крофлоре принадлежит важная роль, так как при БК выявляются значительные нарушения микробиоценоза кишечника. Характерно уменьшение количества бифидобактерий при одновременном увеличении числа энтеробактерий и появлении энтеробактерий с признаками патогенности.
В развитии воспалительного процесса придают большое значение провоспалительным цитокинам, в особенности фактору некроза опухоли-а (ФНО-а), который синтезируется разными типами клеток (макрофагами, Т-лимфоцитами, клетками эндотелия). При воспалении ФНО-а ведет себя как активный провоспалительный агент. Биологические реакции, связанные с его гиперпродукцией, весьма обширны (в частности, индукция синтеза свободных кислородных радикалов, увеличение сосудистой проницаемости, торможение апоптоза воспалительных клеток, индукция синтеза ИЛ-1, ИЛ-2 и др.). Одни из самых мощных индукторов ФНО-а - бактериальные липополисахариды, которые при БК в избытке присутствуют в просвете толстой кишки, поэтому нарушение состава микрофлоры может быть причиной повышения уровня этого цитокина. Кроме того, ФНО-а участвует в формировании воспалительной гранулемы.
Воспалительный процесс при БК начинается в подслизистом слое и распространяется на все слои кишечной стенки. В подслизистом слое на фоне диффузной инфильтрации лимфоцитами и плазматическими клетками отмечается гиперплазия лимфоидных фолликулов, которые могут изъязвляться. Язвы при БК имеют удлиненную щелевидную форму и глубоко проникают в подслизистый и мышечные слои, образуя свищи и абсцессы. Наличие свищей, стриктур и кишечного стаза способствует развитию дисбактериоза. Распространенное поражение тонкой кишки вызывает тяжелый синдром нарушения всасывания (мальабсорбция). Снижение всасывания железа, витамина B12 и фолиевой кислоты вызывает анемию, чему способствуют и повторные кровопотери.
Возникновение воспалительного процесса и изъязвлений в кишечнике приводит также к интоксикации, профузным поносам, потере массы тела, нарушениям электролитного обмена.
Клиническая картина
Клинические проявления и характер течения заболевания определяются тяжестью морфологических изменений, анатомической локализацией и протяженностью патологического процесса, наличием осложнений и внекишечных поражений.
К проявлению собственно кишечных поражений относят боль в животе, диарею, синдром недостаточного всасывания, поражения аноректальной области (свищи, трещины, абсцессы), ректальные кровотечения (редко). К внекишечным признакам относят лихорадку, анемию, снижение массы тела, артрит, узловатую эритему, афтозный стоматит, поражения глаз (ирит, увеит, эписклерит), вторичную аменорею у женщин. Однако, несмотря на значительную вариабельность клинических проявлений при БК, в 90% случаев доминируют боль в животе, диарея, снижение массы тела.
На первом этапе диагностического поиска обращают на себя внимание боли в животе, которые бывают практически у всех больных, они носят чаще тупой или схваткообразный характер (при поражении толстой кишки). Мак-
симальная выраженность болей отмечается при вовлечении в процесс тонкой кишки.
Причины болей разнообразны:
• вовлечение в патологический процесс брюшины;
• повышение давления в просвете кишки в результате повышенного газообразования и увеличения объема кишечного содержимого вследствие нарушения всасывания;
• наличие осложнений (частичная кишечная непроходимость, свищи, абсцессы).
Больные также предъявляют жалобы на диарею, имеющую достаточно упорный характер. Частота стула достигает 4-6 раз в сутки, масса испражнений - более 200 г в сутки, кал разжиженный или водянистый. Диарея возникает после каждого приема пищи, но может быть и ночью. Объем стула зависит от локализации патологического процесса в кишечнике: при поражении высоких отделов тонкой кишки объем кала оказывается большим, нежели при дистальной локализации воспалительного процесса. Тенезмы отмечаются лишь при вовлечении в процесс аноректальной области. Ректальные кровотечения, обычно необильные, отмечаются у половины больных.
В период обострения отмечается лихорадка, сочетающаяся с общей слабостью и уменьшением массы тела. Температура тела может повышаться до 39 °С. В ряде случаев повышение температуры «опережает» местные кишечные симптомы, такая ситуация может продолжаться в течение длительного времени, что создает большие диагностические трудности. Другое частое внекишечное проявление болезни - боли в крупных суставах (артралгии).
Таким образом, при сборе анамнеза выявляют кишечные симптомы и системные (внекишечные) проявления. Эти признаки не позволяют еще сформулировать определенную диагностическую концепцию, однако направление диагностического поиска можно определить. Гораздо сложнее, когда в клинической картине доминируют «общие» признаки: лихорадка, уменьшение массы тела, артралгии, артрит.
На втором этапе диагностического поиска уточняют симптомы со стороны ЖКТ в виде болезненности при пальпации живота (преимущественно вокруг пупка), урчания, болезненного уплотнения терминального отдела подвздошной кишки, болезненности, урчания и «шума плеска» при пальпации слепой кишки. Отмечают уменьшение массы тела, особенно при длительном течении болезни. Снижение массы тела обусловлено, прежде всего, синдромом нарушенного всасывания.
Синдром нарушенного всасывания имеет сложный патогенез и обусловлен рядом факторов:
• уменьшением всасывающей поверхности кишки из-за воспалительного процесса слизистой оболочки;
• дефицитом кишечных ферментов (дисахаридазы, лактазы);
• снижением активности панкреатических ферментов;
• нарушением всасывания желчных кислот, что приводит к блокированию всасывания воды и электролитов.
Кроме того, снижение массы тела связано с уменьшением приема пищи вследствие анорексии (особенно в период обострения болезни).
В 25% случаев можно обнаружить перианальные поражения: отек кожи вокруг анального сфинктера, трещины и изъязвления сфинктера, свищи и периректальные абсцессы. При этом наружные анальные поражения превалируют над поражением слизистой оболочки прямой кишки, в отличие от НЯК, при котором эти соотношения обратные.
При осмотре могут быть выявлены внекишечные проявления в виде артрита крупных суставов (дефигурация сустава), узловатой эритемы, поражения глаз. При тяжелом течении болезни и выраженном синдроме нарушенного всасывания отмечают симптомы гиповитаминоза и дефицита железа: сухость кожи, выпадение волос, ломкость ногтей, хейлит, глоссит, кровоточивость десен.
На третьем этапе диагностического поиска необходимо убедиться в характере и обширности поражения кишечника, а также оценить выраженность обменных расстройств и внекишечных поражений.
Для постановки окончательного диагноза прежде всего необходимо выполнить эндоскопию (колоноскопию), позволяющую осмотреть слизистую оболочку всей толстой кишки и терминального отдела подвздошной. Выявляются отечность слизистой оболочки, исчезновение сосудистого рисунка, небольшие афтозные язвы с последующим образованием глубоких щелевидных трещин, изменяющих рельеф слизистой оболочки по типу «булыжной мостовой», возможно появление стриктур кишки. Биопсия слизистой оболочки кишки выявляет характерные морфологические изменения в виде гранулем туберкулоидного и саркоидного типов, содержащие многоядерные гигантские клетки Пирогова-Лангханса. Аналогичные изменения слизистой оболочки выявляются и при фиброгастродуоденоскопии (в случаях поражения верхних отделов ЖКТ).
Рентгенологическое исследование кишечника (ирригоскопия, энтероскопия) в выраженных случаях болезни демонстрирует сегментарность поражения кишечника с наличием неизмененных участков кишки между пораженными сегментами. В области поражения отмечают волнистый или неровный контур кишки, продольные язвы, образующие рельеф «булыжной мостовой», псевдодивертикулы (представляющие собой глубокие язвы, проникающие в результате фиброзных изменений в кишечную стенку - «симптом шнура»).
Лабораторное исследование крови позволяет определить степень и характер анемии (железодефицитная, В12-дефицитная). Для рецидива болезни характерны повышение СОЭ, иногда достигающее значительных величин (50-60 мм/ч). Биохимическое исследование крови отражает нарушения белкового, жирового и электролитного обмена (гипоальбуминемия, гиполипидемия, гипогликемия, гипокальциемия), обусловленные выраженностью синдрома нарушенного всасывания.
Для выявления нарушения всасывания используют также тест с D-ксилозой и цианокобаламином (тест Шиллинга). Более детально на этих тестах авторы останавливались при описании ХЭ. Анализ кала предусматривает микроскопию, химическое и бактериологическое исследование. Недостаточность переваривания и всасывания в тонкой кишке проявляется большим количеством мышечных волокон, значительным количеством жирных кислот и мыл; определяется небольшое количество соединительной ткани, нейтрального жира и
йодофильной флоры. Степень изменений копрограммы обусловлена тяжестью болезни и ее фазой (ремиссия-обострение).
При вовлечении в патологический процесс других органов системы пищеварения (печень, желчные пути, поджелудочная железа) лабораторно-инструментальным исследованием можно обнаружить соответствующие изменения.
Осложнения
Большинство осложнений БК - хирургическая проблема: кишечная непроходимость, перфорация кишки с развитием абсцессов и перитонита, кишечные кровотечения, формирование энтеро-энтеральных, кишечно-кожных, кишечно-пузырных и ректовагинальных свищей.
Диагностика
Распознавание болезни в развитой форме при наличии болей и типичных кишечных симптомов, увеличенной СОЭ не представляет сложностей и основывается на сочетании эндоскопических, рентгенологических и морфологических данных, свидетельствующих о наличии очагового, асимметричного, трансмурального и гранулематозного воспаления. Однако достаточно часто возникают ситуации, когда в течение длительного периода доминируют общие симптомы: лихорадка, снижение массы тела, признаки гиповитаминоза, неспецифические лабораторные показатели при отсутствии местных кишечных признаков. Это существенно затрудняет своевременную диагностику, заставляя врача предполагать совершенно иное заболевание. Во всяком случае в круг диагностического поиска при БК включается большое количество заболеваний, имеющих сходные черты с БК. Прежде всего, это злокачественные образования, хронические инфекции, системные заболевания (диффузные заболевания соединительной ткани). Несмотря на совершенство методов исследования, диагноз БК ставят спустя 1-2 года после появления первых симптомов. Если доминируют «кишечные» симптомы, то диагностировать болезнь можно значительно раньше. При наличии «кишечных» симптомов дифференциальная диагностика проводится с кишечными инфекциями (дизентерия, сальмонеллез), НЯК, хроническим неязвенным колитом, ХЭ, раком толстой кишки. В любом случае при наличии «кишечных» симптомов у больного БК должна включаться в круг диагностического поиска.
Формулировка развернутого клинического диагноза строится по следующей схеме:
• клиническая форма (с учетом преимущественного поражения тех или иных отделов желудочно-кишечного тракта);
• степень тяжести поражения кишечника (с учетом данных эндоскопии);
• фаза заболевания (ремиссия-обострение);
• внекишечные поражения;
• осложнения.
Лечение
При лечении БК следует учитывать локализацию процесса, активность и продолжительность заболевания, возраст и общее состояние больного.
Диета, приближаясь к нормальной, не должна содержать плохо переносимые продукты. При поражении тонкой кишки с наличием стеатореи и непереносимости жиров рекомендуют диету с высоким содержанием белка и ограничением жира, лактулозы и грубоволокнистых продуктов. Этиологическая терапия БК невозможна, так как этиология и патогенез болезни неизвестны. Тем не менее к препаратам первого ряда относят сульфасалазин, глюкокортикоиды и метронидазол.
При обострении легкой и средней тяжести в случае локализации процесса в подвздошной и толстой кишке показан прием месалазина 3-4 г/сут внутрь с постепенным снижением дозы при достижении ремиссии (приблизительно 1 г в неделю) или же назначают сульфасалазин внутрь 3-6 г/сут, а затем по 2-4 г/сут в течение 6-8 нед с постепенным переходом на поддерживающую дозу (половина лечебной), которая сохраняется не менее 1 года. Препарат принимают вместе с пищей, что предупреждает раздражение желудка. Возможно применение метронидазола внутрь по 10 мг/кг в сутки, однако длительно этот препарат назначать не следует из-за опасности развития периферической полиневропатии.
При обострениях средней тяжести и тяжелых используют глюкокортикоиды внутрь - преднизолон по 40-60 мг/сут сроком до 4 нед с последующим снижением дозы (по 5 мг каждую неделю). Поддерживающая доза может составлять 5-10 мг в течение 6 мес и более.
Более 50% пациентов, получавших глюкокортикоиды в фазе обострения, становятся гормонозависимыми или гормонорезистентными. Добавление к глюкокортикоидам азатиоприна (внутрь 2,5 мг/кг в сутки) или метотрексата парентерально (25 мг в неделю) эффективность лечения повышается.
При диарее назначают антидиарейные препараты (лоперамид, реасек), ферментные препараты. Гипоальбуминемия корригируется введением плазмы, растворов альбумина и аминокислот, при электролитных нарушениях вводят растворы калия, кальция.
По достижении ремиссии активную терапию в полной дозе медикаментов прекращают и переходят на поддерживающие дозы (сульфасалазин или месалазин (более 3 г/сут), возможно применение цитостатиков (азатиоприн или метотрексат) в сочетании с небольшими дозами глюкокортикоидов).
Проводится заместительная терапия, включающая цианокобаламин, фолиевую кислоту, микроэлементы. Антидиарейные препараты (лоперамид, реасек) назначают при необходимости. Продолжительность ремиссии БК различна, в среднем она составляет 2 года.
Прогноз
Зависит от распространенности поражения, выраженности синдрома нарушенного всасывания и осложнений. Комплексная терапия может существенно смягчить проявления болезни, однако длительная ремиссия обычно не наступает. Хирургические вмешательства при патологии аноректальной области улучшают состояние больных. При адекватном лечении больные могут «сосуществовать» со своим заболеванием и вести полноценную жизнь. При развитии осложнений прогноз неблагоприятный.
Профилактика
Специфических методов профилактики не существует. Профилактика сводится к предупреждению обострений, что достигается упорным лечением. Больных ставят на диспансерный учет, чтобы своевременно выявить начинающееся обострение или осложнение.
СИНДРОМ РАЗДРАЖЕННОГО КИШЕЧНИКА
Синдром раздраженного кишечника (СРК) - устойчивая совокупность функциональных расстройств, проявляющаяся болью и (или) чувством дискомфорта в животе, которые проходят после дефекации, и сопровождающаяся изменением частоты и консистенции стула. Эти расстройства должны продолжаться не менее 12 нед на протяжении последних 12 мес.
Заболевание широко распространено, по данным мировой статистики, СРК страдает 15-20% населения, женщины болеют в 2-4 раза чаще, чем мужчины. Наибольшая распространенность заболевания отмечается среди лиц 30-40 лет. Первое появление симптомов заболевания в пожилом возрасте считается маловероятным, поэтому диагноз СРК в подобных случаях сомнителен.
Этиология
В развитии болезни имеет значение наследственная предрасположенность (симптомы СРК у однояйцовых близнецов встречаются чаще, чем у двуяйцовых). Большое внимание уделяют психоэмоциональному стрессу (в анамнезе таких больных часто отмечаются так называемые жизненные стрессовые ситуации, состояние тревоги или же эпизоды депрессии).
Патогенез
В патогенезе важное место отводят различным нарушениям двигательной функции кишечника. Эти нарушения, хотя и не являются специфичными для СРК и встречаются при других заболеваниях кишечника, все же считаются основной причиной возникновения болей и нарушения стула. У больных с СРК отмечают также снижение порога чувствительности прямой кишки (висцеральная гипералгезия). Висцеральная гипералгезия проявляется снижением порога восприятия боли, а также более интенсивным ощущением боли при нормальном ее восприятии. У части больных с СРК отмечают изменения толстой кишки в виде уменьшения его емкости («короткий» кишечник) либо в виде увеличения емкости (наличие дополнительной петли в области сигмы).
Классификация
В Рекомендациях Международных рабочих совещаний (Рим, 1988, 1998) выделяют 3 формы заболевания:
• с преобладанием болей и метеоризма;
• с преобладанием диареи;
• с преобладанием запора.
Для СРК характерны следующие симптомы:
1. Частота стула менее 3 раз в неделю.
2. Частота стула более 3 раз в день.
3. Твердый или комковатый стул.
4. Жидкий (кашицеобразный) стул.
5. Напряжение при акте дефекации.
6. Неотложные (императивные) позывы на дефекацию.
7. Ощущение неполного опорожнения кишечника.
8. Выделение слизи при дефекации.
9. Вздутие живота.
Для варианта СРК с преобладанием диареи характерно сочетание признаков 2, 4, 6 и отсутствие признаков 1, 3, 5.
Для варианта СРК с преобладанием запора характерно сочетание признаков 1, 3, 5 при отсутствии признаков 2, 4, 6.
Клиническая картина
На первом этапе диагностического поиска опрос больного позволяет с большой вероятностью предположить у пациента наличие СРК.
Боли локализуются обычно в подвздошных областях, они могут быть ноющими, тупыми или схваткообразными, не иррадиируют, усиливаются после приема пищи и уменьшаются после отхождения газов или дефекации. Ночью боли, как правило, не возникают. У женщин боли могут усиливаться во время менструаций.
При преобладании запоров боли могут быть постоянными и зависят от спастического сокращения сигмовидной кишки. Нарушение двигательной функции толстой кишки обусловливает изменение характера стула в виде «овечьего» кала или «орешков». Для нормализации функции кишечника больные часто прибегают к приему слабительных или применению очистительных клизм.
Диарея у пациентов с СРК имеет ряд особенностей: она отсутствует ночью и возникает либо рано утром (при пробуждении больного) - так называемый «симптом будильника» или после приема пищи («гастроколитический» рефлекс - старая терминология). Позывы на дефекацию носят часто императивный характер, что объясняется усилением двигательной функции кишечника и повышенным газообразованием. Такие больные плохо переносят легко бродящие продукты (молоко, черный хлеб, мороженое, виноград), тогда как кисломолочные продукты переносятся хорошо, точно так же как и вареное мясо, каши (особенно гречневая). Частота стула, как правило, не превышает 2-5 раз в день. Позывы на дефекацию возникают с небольшими интервалами в течение короткого времени. При первом акте дефекации стул может быть оформленным, при последующих - кашицеобразным и жидким. Общая масса выделенного кала обычно не превышает 200 г.
Достаточно часто встречаются внекишечные симптомы в виде наклонности к сердцебиениям, частым головным болям (типа мигрени), общей повышенной возбудимости, неудовлетворенностью дыханием (гипервентиляционный синдром). Кишечные нарушения часто сочетаются с синдромом раздраженного
мочевого пузыря (до 30%), неязвенной диспепсии (изменение аппетита, отрыжка, изжога), сексуальными нарушениями.
На втором этапе диагностического поиска выявляют мало признаков, значимых для диагноза. Тем не менее, можно обнаружить непостоянную болезненность по ходу спазмированной толстой кишки, «шум плеска» и урчание в области слепой кишки. Отмечают симптомы вегетативной дисфункции - холодные кисти и стопы, повышенное потоотделение, выраженный дермографизм, наклонность к тахиили брадикардии, часто гипотонию.
Данные третьего этапа диагностического поиска нужны, прежде всего, для исключения других заболеваний ЖКТ, так как диагноз СРК является «диагнозом исключения». Этому помогают исследования кала, эндоскопия и рентгенологическое исследование.
Анализ кала предусматривает микроскопию, химическое исследование (определение в суточном кале аммиака и органических кислот), бактериологическое исследование. На основании этих исследований выделяют типичные копрологические синдромы при СРК.
• Синдром бродильной диспепсии:
- кашицеобразный кал кислой реакции;
- незначительное количество мыл и жирных кислот;
- очень много крахмала, перевариваемой клетчатки и йодофильной флоры;
- содержание органических кислот в суточном количестве кала увеличено.
• Синдром гнилостной диспепсии:
- кашицеобразный темно-коричневый кал щелочной реакции с гнилостным запахом;
- в кале содержание обычных ингредиентов не превышает норму;
- резко увеличено содержание аммиака в суточном количестве кала. Исследование бактериальной флоры кала выявляет часто дисбактериоз -
уменьшение количества бифидо- и лактобактерий, увеличение количества гемолитических и лактозонегативных эшерихий, патогенного стафилококка, протея, гемолитического стафилококка.
Определение суточной потери жира позволяет исключить внешнесекреторную недостаточность поджелудочной железы при хроническом панкреатите. Для выявления скрытой лактозной недостаточности прибегают к тесту с нагрузкой лактозой.
При эндоскопическом исследовании различных отделов толстой кишки прежде всего исключают воспалительные заболевания (НЯК, БК), а также опухоли, полипы, дивертикулы. Слизистая оболочка толстой кишки обычно не изменена.
При рентгенологическом исследовании обнаруживают типичные признаки дискинезии: неравномерное наполнение и опорожнение, чередование спастически сокращенных и дилатированных участков кишечника, избыточную секрецию в просвет кишечника.
Данные ультразвукового исследования (по показаниям выполняют компьютерную томографию брюшной полости) позволяют исключить желчнокамен-
ную болезнь, наличие кист и кальцинатов в поджелудочной железе, объемных образований в органах брюшной полости, способных обусловить симптомы кишечных расстройств.
Биохимическое и клиническое исследование крови не обнаруживает какихлибо изменений.
Диагностика
Распознавание болезни основано на выявлении типичных симптомов (указанных выше) и исключении «органических» поражений кишечника, а также других заболеваний ЖКТ, сопровождаемых кишечными расстройствами.
Существенно, что клинические критерии, укладывающиеся в рамки Римских критериев СРК, не являются специфичными и могут встречаться при многих органических заболеваниях (опухолях кишечника, БК, НЯК, хроническом панкреатите). В то же время можно отметить ряд признаков, при наличии которых диагноз СРК становится весьма вероятным. К ним относят следующие:
• длительное течение заболевания (как правило, многолетнее) без заметного прогрессирования;
• многообразие имеющихся жалоб, обусловленных вегетативными дисфункциями;
• изменчивый характер жалоб;
• связь ухудшения самочувствия с психоэмоциональными факторами;
• отсутствие болей и кишечных расстройств (диареи) в ночное время;
• обязательное отсутствие так называемых «симптомов тревоги» - примесей крови в кале, лихорадки, необъяснимого похудания, анемии, увеличения СОЭ и др.
Необходимо также исключить следующие заболевания.
• Кишечную диспепсию, как изолированный признак, наблюдают при различных алиментарных перегрузках, чаще всего при перегрузке углеводами, реже - белковой пищей. В первом случае отмечается диарея, во втором - запор. Вне пищевых нарушений жалоб может и не быть. Причины диареи - размножение йодофильной флоры, что возможно и на фоне обычного питания. При эндоскопии изменений слизистой оболочки не отмечают. При исследовании кала обнаруживают типичные копрологические синдромы бродильной или гнилостной диспепсии без признаков воспаления или повышенного выделения ферментов. Рентгенологически обнаруживают признаки дискинезии толстой кишки. Общее состояние пациента не меняется. Нормализация питания быстро приводит к улучшению состояния.
• Опухоли кишечника следует исключить при первом обращении больного к врачу. При локализации опухоли в правой половине толстой кишки в клинической картине доминирует железодефицитная анемия, а «кишечные» симптомы выражены мало. В связи с этим всем больным среднего и пожилого возраста с железодефицитной анемией следует проводить колоноскопию. Локализация опухоли в левой половине толстой кишки обусловливает упорные запоры (иногда прерываемые эпизодами диареи). Слабительные средства, клизмы сначала способствуют опорожнению ки-
шечника, а в дальнейшем становятся малоэффективными. Эти симптомы должны привлечь внимание врача (диагноз устанавливают после эндоскопического исследования).
• ХЭ, НЯК и БК (см. соответствующие разделы данной главы).
Следует еще раз напомнить, что диагноз СРК ставят после исключения целого ряда заболеваний и состояний, сопровождающихся нарушением деятельности кишечника.
Лечение
Лечение больных СРК должно быть комплексным и содержать:
• общие мероприятия, включающие «образование больного», для правильного понимания им существа имеющихся у него симптомов;
• диетические мероприятия;
• лекарственную терапию (в зависимости от преобладания диареи или запора).
Необходимо объяснить больному доброкачественность его страдания, демонстрируя ему данные лабораторных и инструментальных исследований, свидетельствующих об отсутствии у него тяжелых заболеваний (и, прежде всего, опухолей кишечника и других отделов желудочно-кишечного тракта).
Диетические рекомендации в настоящее время подвергли существенному пересмотру, тем не менее следует подробно расспросить больного о переносимости тех или иных продуктов для того, чтобы дать определенные советы. Так, при диарее необходимо исключить легкобродящие углеводы, грубую клетчатку; напротив, при запоре оправданы пищевые добавки - пшеничные отруби, семя льна.
• При СРК с преобладанием диареи назначают:
- регуляторы моторики: лоперамид в дозе 0,002 г по 2 таблетки 1 раз в день (под язык) до стабилизации стула (1-3 дня и более);
- смекта* по 1 пакетику 3 раза в день перед едой, до оформления стула;
- один из пробиотиков: бифиформ* 1-2 капсулы 2 раза в день (2 нед), линекс* по 1-2 капсулы 3 раза в день (4 нед), лактобактерин* по 5 доз 2 раза в день (4 нед);
- пребиотик: хилак-форте* по 60 капель 3 раза в день (4 нед).
• При СРК с преобладанием запора назначают:
- мукофальк* по 1-2 чайные ложки на ночь (в течение 2 нед) или макрогол 4000 по 10-20 г (1-2 пакетика) на ночь;
- лактулоза по 10-30 мл.
• При СРК с преобладанием болей применяют:
- спазмолитик миотропного ряда - мебеверин по 0,2 г 2 раза в день;
- пинаверия бромид по 0,05 г 3 раза в день.
Важным компонентом лечения больных СРК служит применение психотропных средств, что вызвано частой связью симптомов СРК с психотравмирующей ситуацией, повышенным уровнем тревоги и депрессии, которые обнаруживают у 40-60% пациентов. Чаще всего назначают тианептин (коаксил*) по 1 таблетке 3 раза в день на срок не менее 4-6 мес. Препарат весьма эффективен, хорошо переносится и не имеет побочных эффектов.
Прогноз
СРК не имеет тенденции к прогрессированию, что делает прогноз благоприятным, хотя полной ликвидации симптомов может и не быть.
ХРОНИЧЕСКИЙ ГЕПАТИТ
Хронический гепатит (ХГеп) - диффузный полиэтиологический воспалительный процесс в печени, продолжающийся более 6 мес и не имеющий тенденции к улучшению. Морфологически хронический гепатит характеризуется некрозами печеночных клеток (от единичных до массивных), инфильтрацией ткани печени иммунокомпетентными клетками и полиморфно-ядерными лейкоцитами или дистрофией гепатоцитов и расширением портальных трактов за счет воспалительной инфильтрации в основном лимфоцитами и плазматическими клетками, фиброзом портальных трактов при сохранении дольковой структуры печени.
Хронический воспалительный процесс в печени может быть как самостоятельным в нозологическом отношении заболеванием, так и реакцией печеночной ткани на внепеченочные заболевания и очаговые поражения печени, т.е. быть неспецифическим реактивным гепатитом. К этой группе примыкает хронический гранулематозный гепатит. Морфологические изменения печени при неспецифическом реактивном гепатите не имеют тенденции к прогрессированию, его течение целиком зависит от динамики основного заболевания.
Классификация
В основе применявшихся до настоящего времени классификаций хронического гепатита лежало разделение гепатита по морфологическому признаку с одновременной прогностической оценкой, т.е. определением тенденции прогрессирования в цирроз печени (Акапулько, 1974).
Все хронические гепатиты безотносительно к этиологии подразделялись на:
• хронический персистирующий гепатит (ХПГеп);
• хронический активный гепатит (ХАГеп);
• хронический лобулярный гепатит (ХЛГеп).
При ХПГеп биопсия выявляла расширение и умеренное склерозирование портальных полей без нарушения дольковой архитектоники, инфильтрацию портальных трактов, умеренную дистрофию гепатоцитов без некроза. Этот вариант хронического гепатита не трансформируется в цирроз печени.
ХАГеп характеризуется обширными и сливающимися (мостовидными) некрозами, значительными дистрофическими изменениями гепатоцитов, выраженной инфильтрацией портальных трактов с распространением воспалительных инфильтратов в паренхиму, фиброзированием портальных трактов, проникающим в дольку. Этот вариант переходит в цирроз печени.
ХЛГеп характеризуется мелкими некрозами и внутридольковой инфильтрацией. Изменения более выражены, чем при хроническом персистирующем, но не достигают степени ХАГеп.
Появление современной дифференцированной этиотропной терапии потребовало сделать акценты на этиологических аспектах.
Классификацию, подразделяющую хронические гепатиты на персистирующий, активный и лобулярный, предложено заменить новым подходом (ЛосАнджелес, 1994).
Хронический гепатит предлагают оценивать по следующим критериям:
• по этиологии;
• по клинической картине;
• по гистологическим изменениям (т.е. по выраженности некрозов и воспаления);
• по стадии хронизации (т.е. по распространенности фиброза). Этиология
Выделяют 3 основных этиологических типа ХГеп:
• вирусный;
• аутоиммунный;
• лекарственный.
Выделена и 4-я группа - криптогенный хронический гепатит, т.е. гепатит неуточненной этиологии.
Авторы Лос-анджелесской классификации исключили алкогольный, наследственный, токсический хронический гепатит, поскольку, по их мнению, не доказаны механизмы хронизации и прогрессирования этих гепатитов.
Отечественные авторы к этиологическим факторам ХГеп относят и алкоголь, выделяя наряду с острым и хронический алкогольный гепатит, полагая, что алкогольный гиалин служит основным звеном хронизации.
В группе вирусных гепатитов выделяют следующие этиологические факторы:
• вирус гепатита В - НВV;
• вирус гепатита D - HDV;
• вирус гепатита С - HCV;
• неопределенные (негепатотропные) или неизвестные вирусы.
Основной массив в полиэтиологической группе хронических гепатитов составляют гепатиты вирусной этиологии, среди них чаще всего встречается гепатит, вызванный вирусом В (HBV). Полагают, что 5% населения Земли страдает хроническим вирусным гепатитом В, эта нозология занимает девятое место в ряду причин смерти. Такая высокая распространенность обусловлена высокой заболеваемостью острым вирусным гепатитом В. У 3% лиц, перенесших желтушную форму острого вирусного гепатита В, болезнь переходит в хроническую форму, причем чаще у мужчин. Носителями HBV являются 300-370 млн человек, в Западной Европе носители составляют 0,2-1%, в России - 7%. В последние годы быстрыми темпами растет заболеваемость хроническим вирусным гепатитом С. При этом отмечаются значительные географические различия: хроническим вирусным гепатитом С больны 0,4% населения Европы и 15% населения Центральной Африки. В структуре этиологических факторов хронических гепатитов возросло значение алкоголя и генетически детермини-
рованных заболеваний печени (болезнь Вильсона-Коновалова, гемохроматоз, неалкогольный стеатогепатит).
Пути передачи HBV, HCV, HDV идентичны. Это преимущественно парентеральный и половой пути для HBV и HDV и парентеральный («шприцевой», «посттрансфузионный») для HCV. Вирусы гепатита А (HAV) и гепатита Е (HEV) не бывают причиной хронических гепатитов.
Хронический аутоиммунный гепатит (ХАИГ) был описан в 1950 г. Вальденстремом и имеет много названий, отражающих различные особенности заболевания (ювенильный цирроз, гепатит молодых женщин, гиперу-глобулинемический гепатит, люпоидный гепатит).
Этиология этого гепатита не известна, но ясно, что ХАИГ - заболевание, обусловленное нарушением регуляции иммунитета, дефектом супрессорных Т-клеток и продукцией аутоантител к антигенам гепатоцитов.
Список лекарств, вызывающих при определенных условиях поражение печени, весьма велик. Рассматривают 2 основных механизма повреждения печени: прямое и непрямое патологическое воздействие.
На реакцию лекарственной гепатотоксичности влияют пол, возраст, наличие ожирения, злоупотребление алкоголем, дефицит белка в пищевом рационе. К поражению предрасполагает прием одновременно нескольких лекарств (полипрагмазия), частые повторные курсы такого лечения.
Алкоголь вызывает разнообразный ряд повреждений печени: острый и хронический гепатит, жировую дистрофию печени, фиброз и цирроз печени. Характер поражения во многом зависит от дозы и длительности алкоголизации.
Отечественные морфологи и клиницисты убедительно показали механизмы хронизации гепатита при хронической алкогольной интоксикации. Алкоголь и особенно его метаболит - ацетальдегид имеют гепатотоксический эффект, разрушая клеточные мембраны гепатоцитов, повреждая микротрубочки цитоскелета и запуская процесс перекисного окисления липидов. Ацетальдегид также может образовывать комплексы с белками клеток печени (неоантигены) и нарушать репаративные процессы в ядре.
Гистологическая оценка любого ХГеп основывается на определении выраженности некроза и воспаления. Наибольшее распространение получила градация с использованием индекса гистологической активности по Кноделю. Портальное воспаление оценивается от 0 до 4 баллов, внутридольковая дегенерация и очаговые некрозы - 0-4 балла, перипортальные некрозы, мостовидные некрозы от 0 до 10 баллов. Высокой активности соответствуют 13-18 баллов, минимальной - 1-3. Степени активности заменили ранее используемые понятия ХАГеп, ХПГеп, ХЛГеп. При этом портальное воспаление и внутридольковая дегенерация соответствуют морфологии ХПГеп, очаговые некрозы - ХЛГеп, а перипортальные и мостовидные некрозы - морфологии ХАГеп.
Патогенез
Возбудитель хронического гепатита HBV - крупный ДНК-содержащий вирус. На наружной его поверхности находится поверхностный антиген - MsAg, ядерными антигенами являются McAg и MeAg. Ядро вируса содержит ДНК HBV (HBV-DNA) и ДНК-полимеразу (DNA-P). Все эти вирусные компоненты
и антитела к его антигенам являются специфическими маркерами данной инфекции.
В своем развитии HBV проходит две фазы: фазу репликации и фазу интеграции. В фазу репликации геном вируса и клетки автономны (в эту фазу возможна полная элиминация вируса из организма). Повреждение гепатоцитов обусловлено не самим вирусом, а иммунокомпетентными клетками, распознающими его антигены. HBcAg и НВе-Ag обладают сильными иммуногенными свойствами, а HBsAg - слабыми иммуногенными свойствами.
В фазу репликации HBV, когда синтезируются HBcAg и HBeAg, сила иммунных реакций достаточно высока, в результате чего происходит некроз гепатоцитов.
В фазу интеграции HBV происходит встраивание генома вируса в область клеточного генома (элиминация вируса в эту фазу невозможна). В большинстве случаев формируется состояние иммунологической толерантности к HBsAg, что приводит к купированию активности процесса (в ряде случаев может происходить регресс хронического гепатита вплоть до формирования «здорового» носительства HBsAg).
Хроническому вирусному гепатиту В не всегда предшествует распознаваемая острая форма гепатита В. Хронизация зависит от продолжающейся репликации вируса и состояния иммунной системы больного. HBV не оказывает прямого повреждающего действия на гепатоцит, и лизис инфицированных гепатоцитов служит следствием иммунного ответа больного.
Нарушение гуморального и клеточного иммунитета определяет исход гепатита В.
У пациентов с хроническим вирусным гепатитом В отмечают неполноценный клеточно-опосредованный иммунный ответ на вирусную инфекцию. В случае если ответ слишком слабый, то иммунное поражение гепатоцитов или отсутствует, или весьма незначительное, но при этом продолжается репликация вируса на фоне нормально функционирующей печени. Как правило, это здоровые носители HBV. У больных с выраженным клеточно-опосредованным иммунным ответом происходит некроз гепатоцитов, но при этом ответ недостаточен для полной элиминации вируса, и развивается хронический вирусный гепатит В. Недостаточность лизиса гепатоцитов связана с цитотоксическими лимфоцитами, дефектом регуляции Т-супрессоров, наличием блокирующих антител на мембране гепатоцитов.
Вирус гепатита С, как полагают, вызывает прямое цитотоксическое действие: существует корреляция между тяжестью заболевания и уровнем вирусемии. Иммунный ответ на HCV слабый.
Длительное сохранение (персистирование) вируса в организме больного объясняется недостаточной силой иммунной реакции в ответ на появление антигенов вируса в организме (вероятно, имеется недостаточная продукция противовирусных антител). Даже отсутствие антител к HCV в ряде случаев не исключает диагноз хронического гепатита, вызванного вирусом С. В целом, антитела к HCV образуются медленно, что занимает в среднем 20 нед от момента инфицирования. У некоторых больных для образования антител требуется около года.
Кроме того, вирус, повреждая мембрану гепатоцита, высвобождает мембранный липопротеид, входящий в структуру специфического печеночного антигена. Этот антиген, воздействуя на Т-лимфоциты, приводит к образованию «агрессивных» форм этих клеток. Однако эти клетки функционально неполноценны, и «атака» ими гепатоцитов, ставших для организма чужеродными (вследствие воздействия на них вируса), хотя и приводит к гибели последних, но не обеспечивает полной элиминации вируса из организма.
Аутоиммунные реакции развиваются вследствие того, что под воздействием самых различных патогенных факторов гепатоцит приобретает новые антигенные детерминанты (становится аутоантигенным), что обусловливает ответную реакцию иммунной системы в виде продукции аутоантител. Имеющийся генетический дефект иммунной системы («слабость» Т-супрессоров) обусловливает неконтролируемую продукцию аутоантител, реакция антиген-антитело на поверхности гепатоцитов вызывает их гибель, формирующиеся иммунные комплексы (сначала циркулирующие, а затем - фиксированные в микроциркуляторном русле) обусловливают наряду с поражением гепатоцитов вовлечение в патологический процесс других органов и систем.
Гуморальные и клеточные иммунные реакции и поражение гепатоцитов обусловливают морфологические признак хронического гепатита - гистиолимфоцитарную инфильтрацию портальных трактов, дистрофические и некротические изменения гепатоцитов и эпителия желчных ходов.
Патогенез хронического гепатита представлен на рис. 3-4.
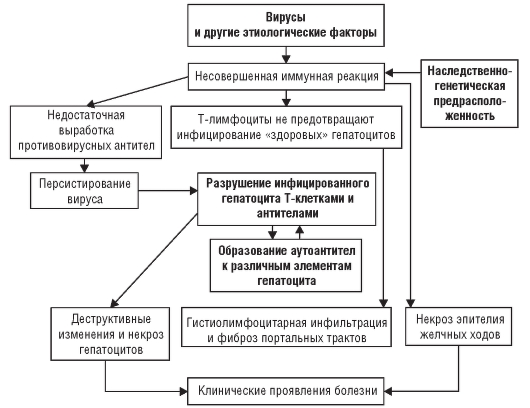
Рис. 3-4. Патогенез хронического гепатита
Клиническая картина
Проявления хронического гепатита весьма разнообразны и зависят от этиологии, степени активности и хронизации, функционального состояния печени.
Клиническая картина включает следующие клинико-лабораторные синдромы:
• болевой;
• цитолитический;
• печеночно-клеточной недостаточности;
• иммуновоспалительный;
• холестатический;
• астенический;
• диспептический.
• Боли при хроническом гепатите возникают при увеличении объема печени и растяжении ее фиброзной капсулы. Этот вариант болей не зависит от характера пищи и чаще всего ощущается больными как тяжесть в правом подреберье. Боль также может возникать при развитии очагов некроза вблизи крупных сосудов, желчных протоков и фиброзной капсулы, такие боли сопровождаются желтухой, повышением температуры тела и активности трансаминаз в крови.
• Цитолитический синдром неотделим от синдрома печеночно-клеточной недостаточности и является следствием гибели (лизиса) гепатоцитов или их дистрофии, что сопровождается нарушением функции печеночных клеток, нарушением проницаемости клеточных мембран. В кровь поступают продукты гибели клеток, что клинически проявляется снижением ряда функций печени. Клинические признаки: желтуха, повышение температуры тела, снижение массы тела. Утрата способности печени разлагать эстрогены и вазоактивные вещества приводит к повышению их концентрации в крови и появлению телеангиэктазий на коже груди и плечевого пояса, печеночных ладоней (пятнистая эритема тенора и гипотенора ладоней), гинекомастии и женскому типу оволосения у мужчин, происходит изменение ногтей («белые» ногти), появляется красный «лакированный печеночный» язык. Лабораторные признаки синдрома: повышение активности в крови индикаторных ферментов: АЛТ, АСТ, ЛДГ общей и «печеночных» фракций ЛДГ - ЛДГ-4 и ЛДГ-5. В крови повышается активность специфических печеночных ферментов: сорбитдегидрогеназы, альдолазы, фруктозо-1-фосфатальдолазы. Повышается уровень билирубина (прямой и непрямой фракции). Возрастает в крови концентрация витамина В12 и железа.
• Снижение синтетической функции печени приводит к падению концентрации в сыворотке крови альбуминов, холестерина, фермента холинэстеразы, протромбина, V и VIII факторов свертывания крови (что приводит к геморрагиям). Снижение превращения в печени токсичных продуктов (аммиака, фенолов и др.) в нетоксичные приводит к интоксикации, появлению «печеночного» запаха. Печеночная недостаточность с умеренными лабораторными проявлениями определяется как «малая печеночная недостаточность».
• Иммуновоспалительный (мезенхимально-воспалительный) синдром клинически проявляется лихорадкой, артралгиями, васкулитами с локализацией в коже, легких, почках, кишечнике, лимфаденопатией, спленомегалией. Лабораторными проявлениями служат:
- повышение уровня у-глобулинов, а1-глобулинов, уровня иммуноглобулинов класса G, М, А, гиперпротеинемией, появлением патологических результатов «осадочных» проб;
- обнаружение в крови антител к гладкомышечным клеткам, митохондриям, ДНК, появление LE-клеток;
- снижение титра комплемента.
• Холестатический синдром обусловлен внутрипеченочным холестазом и повышением концентрации в крови и накоплением в тканях компонентов желчи. Клинические признаки синдрома:
- кожный зуд, от слабого до упорного, нестерпимого;
- желтуха;
- бурая пигментация кожи;
- ксантелазмы и ксантомы.
• Потемнение мочи и осветление кала не характерны для внутрипеченочного холестаза. Лабораторные признаки синдрома:
- повышение в крови активности экскреторных ферментов (щелочной фосфатазы, у-глутамилтранспептидазы, 5-нуклеотидазы);
- повышение в сыворотке крови содержания холестерина, р-липопротеинов, фосфолипидов, желчных кислот.
• Астенический синдром отражает степень снижения функции печени и интоксикации. Клинические проявления: слабость, утомляемость (от ограничения физической нагрузки до невозможности самообслуживания), снижение настроения, апатия, ипохондрия.
• Диспептический синдром обусловлен снижением желчесинтетической функции печени, интоксикацией и проявляется кишечной диспепсией (бродильной, гнилостной) и дисмоторной желудочной диспепсией (тошнота, рвота, снижение аппетита, анорексия).
В настоящее время в связи с имеющимися возможностями проведения этиотропной терапии важнейшая задача диагностики - этиологическая верификация хронического гепатита.
Хронический вирусный гепатит В
Хронический вирусный гепатит В в своих клинических проявлениях зависит от уровня репликации вируса. Высокий уровень репликации HBV отмечают у 20-30% всех больных хроническим вирусным гепатитом В, он сопровождается яркой клинической картиной с четко выраженными клинико-лабораторными синдромами:
• астеническим;
• диспептическим;
• цитолитическим с проявлениями «малой печеночной недостаточности». Иммуновоспалительный синдром отражает реакцию на инфекцию HBV. Больные хроническим вирусным гепатитом В в период репликации (в активную фазу гепатита) предъявляют жалобы на общую слабость, легко возникаю-
щую утомляемость, их беспокоят неопределенные боли в правом подреберье и верхней половине живота. Внимательный расспрос выявляет снижение аппетита, плохую переносимость жирной пищи, алкоголя. Эти диспептические расстройства обычно не достигают значительной выраженности.
В период репликации наблюдают повышение температуры тела, обычно до субфебрильных цифр, «ревматические» жалобы: нерезко выраженные боли в суставах и мышцах, головная боль.
На первом этапе диагностического поиска можно выявить связь настоящего заболевания с перенесенным ранее острым вирусным гепатитом. У незначительной части пациентов хронический вирусный гепатит В может манифестировать непосредственно после острого гепатита. У значительной части заболевших такой связи установить не удается. Важно выявить «факторы риска»: гемотрансфузию, вливание компонентов крови, частые инъекции, прививки, операции, контакт с инфекционными больными, работу с кровью.
Примерно в трети случаев от общего числа больных хронический вирусный гепатит В начинается как острый, с желудочно-кишечных симптомов, артралгий и даже с лихорадки и желтухи. Заболевание остается клинически выраженным до периода нормализации трансаминаз и снижения репликации вируса до низкого уровня.
У 2/3 больных заболевание начинается незаметно с разнообразной, неопределенной и малозначительной, по мнению пациентов, симптоматики. В анамнезе иногда можно выявить причину обострения: прием глюкокортикоидов, инсоляцию, возможна и спонтанная реактивация вируса.
Хронический вирусный гепатит В часто протекает как «немая» болезнь, клинические симптомы зачастую не имеют прямой корреляции с тяжестью поражения печени и поэтому жалобы могут практически отсутствовать.
Второй этап диагностического поиска позволяет выявить гепатомегалию, спленомегалию. Печень умеренно плотная, край заострен, чувствителен или даже болезнен при пальпации. Увеличение селезенки незначительное. Гепатоспленомегалию обнаруживают у 1/4-1/5 больных. В 70% случаев на втором этапе диагностического поиска каких-либо отклонений от нормы не определяют. Клинические признаки печеночно-клеточной недостаточности не выявляются.
Третий этап диагностического поиска имеет решающее значение для постановки диагноза хронического вирусного гепатита В. Данные этого этапа позволяют:
• подтвердить этиологию;
• определить уровень репликации вируса;
• определить степень активности процесса;
• выявить характер морфологических изменений в печени;
• определить состояние других органов и систем, что является важным при решении вопроса о противовирусной терапии.
При клиническом анализе крови у больных хроническим вирусным гепатитом В гематологических изменений обычно не выявляют. Биохимические и вирусологические исследования могу оказать существенную помощь.
Повышение активности АЛТ и АСТ отмечают у всех больных, степень повышения прямо коррелирует с уровнем репликации вируса. Гиперферментемия не бывает высокой. Электрофорез белков сыворотки выявляет умеренное повышение у-глобулинов. Могут быть обнаружены антитела к гладкой мускулатуре, правда, в низких титрах. Уровень билирубина отражает степень цитолиза.
Для определения маркеров вирусного гепатита применяют радиоиммунные и иммуноферментные методы.
Маркером вирусного гепатита В в клинических условиях служит HBsAg.
Для фазы репликации, когда контагиозность высокая, характерно выявление в крови HBeAg, HBV-ДНК, ДНК-полимеразы. Для фазы интеграции, когда контагиозность низкая, характерно выявление анти-HBe. Обнаружение в крови HBsAg и HBeAg свидетельствует об активном вирусном гепатите. Тест на HBV- ДНК может быть положительным даже при появлении анти-HBe. При переходе из HBeAg-положительного статуса в HBeAg-отрицательный может наблюдаться обострение хронического вирусного гепатита В с повышением активности АЛТ, АСТ и морфологической картиной лобулярного гепатита. Сероконверсия может быть спонтанной или произойти при противовирусной терапии.
Возможна и спонтанная реактивация вируса при HBeAg-отрицательном статусе. Реактивацию диагностируют по появлению в крови анти-HBcIgM.
Вирусологические исследования могут выявить суперинфицирование HDV, а также HAV и HCV. Все это сопровождается серьезным прогрессированием хронического вирусного гепатита В.
Диагностическая значимость радионуклидных исследований при хроническом вирусном гепатите В не велика, и эти методы, как правило, не используют.
УЗИ позволяет определить размеры печени, селезенки, диаметр и состояние сосудистой и протоковой системы, но в диагностике хронического вирусного гепатита В большого значения УЗИ не имеет.
Пункционная биопсия печени позволяет поставить морфологический диагноз. Проведение пункционной биопсии печени и гистологическое исследование биоптата позволяет также уточнить этиологию гепатопатии, определить степень активности (воспаления), степень фиброза, определить начальные признаки цирроза печени и объективно оценить результаты лечения.
К постоянным дифференциально-диагностическим признакам хронического вирусного гепатита В относят наличие HBsAg в виде матово-стекловидных гепатоцитов, а также обнаружение HBeAg с помощью иммунопероксидазной реакции («песочные» ядра).
Многие больные хроническим вирусным гепатитом В остаются в стабильном компенсированном состоянии. Прогноз зависит от морфологического состояния печени. Пожилой возраст, наличие мостовидных некрозов, персистирование в сыворотке HBV-ДНК, суперинфекция HDV и HCV указывают на неблагоприятный прогноз.
Хронический вирусный гепатит С
Хронический вирусный гепатит С - вялотекущее заболевание, характеризуется скудной клинической картиной.
На первом этапе диагностического поиска выясняют, что ведущим служит астенический синдром, при этом главным симптомом выступает слабость,
не носящая значительной степени. Больных беспокоят также плохое самочувствие, снижение трудоспособности. Диспептические жалобы, если и предъявляются больными, то не обусловлены самим хроническим вирусным гепатитом С, а являются следствием сопутствующих заболеваний. Значительная часть больных жалоб не предъявляет, у них болезнь протекает совершенно бессимптомно, и диагноз можно заподозрить при скрининговом исследовании на анти-HCV.
В анамнезе могут быть выявлены факторы риска: гемотрансфузии (HCV выступает причиной более чем 90% посттрансфузионного гепатита), внутривенное введение наркотиков, гомосексуализм. Факторы риска могут отсутствовать или скрываться. Острый вирусный гепатит обычно остается нераспознанным, отсутствуют и клинические признаки, позволяющие заподозрить и прогнозировать хронизацию гепатита. У 60-80% больных, перенесших острый вирусный гепатит С, развивается хронический гепатит. Если пациент наблюдался в медицинском учреждении, и имеются результаты биохимических и вирусологических исследований, то можно выявить, что заболевание протекало медленно, при этом эпизоды гипертрансаминаземии чередовались с нормальной активностью ферментов в крови, гиперферментемия, как правило, отражает пики вирусемии.
На втором этапе диагностического поиска при хроническом вирусном гепатите С физикальное исследование может выявить умеренное увеличение печени и ее умеренное уплотнение с заострением печеночного края. Реже определяют незначительное увеличение селезенки. Желтуха, как правило, отсутствует. Кожные внепеченочные знаки, а также проявления геморрагического синдрома также отсутствуют.
Третий этап диагностического поиска наиболее важен. Для хронического вирусного гепатита С характерны колебания активности АЛТ, АСТ в сыворотке крови. Лабораторные показатели холестаза и иммуновоспалительного синдрома не изменяются, то же касается уровня билирубина, у-глобулинов, альбумина.
Важнейший момент исследования - определение антител к HCV и РНК HCV. Более чем у 90% больных хроническим вирусным гепатитом С тест на анти-HCV оказывается положительным. Показателем репликации HCV служит выявление РНК HCV в сыворотке.
При решении вопроса о проведении противовирусной терапии необходимо провести определение генотипа HCV. Это связано с тем, что генотип в значительной мере определяет успешность лечения интерфероном. Генотип вируса 1в связывают с более тяжелым течением, плохим ответом на противовирусное лечение и возможностью гепатоцеллюлярной карциномы. Для IV генотипа характерна резистентность к противовирусной терапии.
Важным моментом в решении о начале терапии и оценке эффективности терапии служит и определение степени виремии.
Из вышеизложенного вытекает, что характерных клинических признаков хронического вирусного гепатита С не существует, в связи с чем важнейшее место в диагностике имеет пункционная биопсия.
При наличии в крови РНК HCV биопсия печени практически всегда выявляет изменения. Высокий уровень виремии сопровождается высоким индексом гистологической активности и высокой гиперферментемией.
Гистологическая картина не является нозологически специфичной, но имеет ряд особенностей, к которым относят жировую дистрофию гепатоцитов, лимфоидные фолликулы, расположенные интралобулярно и в портальных трактах, активацию синусоидальных клеток и поражение желчных протоков.
Хронический аутоиммунный гепатит
Хронический аутоиммунный гепатит (ХАИГ) имеет ряд отличительных особенностей:
• чрезвычайную выраженность аутоиммунных процессов;
• высокий индекс гистологической активности (воспаления) - хронический активный гепатит;
• системный характер аутоиммунного процесса.
Существующее значительное количество синонимов и определений ХАИГ основано на каком-либо отличительном факторе клинической картины, морфологии, лабораторных исследований.
ХАИГ полностью соответствует основным критериям аутоиммунного заболевания:
• невозможность выявления этиологического фактора;
• значительное увеличение СОЭ;
• гипер-у-глобулинемия;
• лимфоплазмоцитарная инфильтрация печени;
• дефекты иммунной системы;
• появление в крови аутоантител;
• положительный терапевтический эффект от глюкокортикоидов.
При некоторых заболеваниях печени (хронический вирусный гепатит С, Д, первичный билиарный цирроз) также находят циркулирующие антитела, но только при ХАИГ неизвестной этиологии отмечена более яркая и своеобразная клиническая картина, полностью соответствующая аутоиммунному заболеванию.
Своеобразие ХАИГ, отличие от других хронических гепатитов состоят в следующем:
• системный характер аутоиммунного процесса реализуется в разнообразных внепеченочных проявлениях - артралгии, пурпуре, нодозной эритеме, легочных инфильтратах, плевритах, волчаночноподобном нефрите, гемолитической анемии;
• ХАИГ протекает одновременно с другими аутоиммунными заболеваниями - тиреоидитом Хасимото, сахарным диабетом, НЯК;
• основные клинико-лабораторные синдромы, наблюдаемые при хронических заболеваниях печени (цитолитический, печеночно-клеточной недостаточности, иммуновоспалительный и др.) имеют высокую степень выраженности.
ХАИГ возникает чаще у женщин, первый пик заболеваемости приходится на возраст 10-30 лет, второй пик - на период менопаузы.
Первый этап диагностического поиска дает важную информацию о дебюте болезни и ее течении. Жалобы больных зависят от варианта начала ХАИГ и темпа прогрессирования болезни.
• Приблизительно у 10% пациентов болезнь начинается внезапно с развития симптоматики, трудно отличимой от острого вирусного гепатита. Быстро нарастают слабость, диспептические явления, анорексия, появляется желтуха, темнеет моча, обесцвечивается кал, в крови - значительное повышение билирубина (до 10 нормальных величин и более), гиперферментемия. Больных госпитализируют в инфекционный стационар, где отмечают отсутствие типичной динамики желтухи и констатируют наличие признаков хронического поражения печени.
• Заболевание может начинаться с внепеченочных проявлений и какоголибо аутоиммунного заболевания (гемолитической анемии, тромбоцитопенической пурпуры, ревматоидного артрита, лимфаденопатии и т.д.). При обследовании выявляют преимущественное поражение печени. Если патологию печени рассматривают как реактивный гепатит, больную длительно лечат от СКВ, ревматоидного артрита (РА), васкулита, миокардита.
• У части больных отмечают малозаметное начало с жалобами на слабость, повышенную утомляемость, неопределенные боли в правом подреберье, вздутие живота, снижение аппетита, субфебрильную температуру тела. К правильному диагнозу приводят выявление гепатоспленомегалии, внепеченочных знаков, повышение уровня билирубина, АЛТ, АСТ, у-глобулинов.
Важным моментом первого этапа служат исключение злоупотребления алкоголем, наркомании, чрезмерного приема лекарств, контактов с кровью, а также оценка проводившегося ранее лечения.
Результаты второго этапа диагностического поиска зависят от характера поражения печени (активность воспаления, степень фиброза) и вовлечения тех или иных органов.
Второй этап диагностического поиска подтверждает, что для ХАИГ особенно характерно сочетание признаков тяжелого поражения печени и аномалий иммунной системы.
Часто встречаются кожные внепеченочные знаки - яркие, крупные сосудистые звездочки на лице, в области шеи, на груди, яркая пальмарная эритема. Желтуха часто носит эпизодический характер. Наблюдают кровоточивость десен, появление легко возникающих кровоподтеков. Выявляют признаки, обусловленные эндокринными изменениями, - синевато-багровые стрии на коже бедер, живота. Лицо может иметь кушингоидный вид даже без приема глюкокортикоидов, также наблюдаются угри, гирсутизм. Развитие аутоиммунного тиреоидита может сопровождаться симптомами тиреотоксикоза или гипотиреоза. Обнаруживают изменения кожи, являющиеся следствием васкулита, - аллергический капиллярит, узловатую эритему, «бабочку» на лице.
Несмотря на частые артралгии, визуально суставы изменяются незначительно - дефигурация обратима и обусловлена периартикулярным отеком. В процесс вовлекаются преимущественно крупные суставы нижних и верхних конечностей. Лимфаденопатия обычно генерализованная и часто сочетается с умеренной спленомегалией (без портальной гипертензии).
Физическое исследование уже на ранних стадиях определяет увеличение печени, заостренный, умеренно плотный край ее выступает на 4-5 см, край и
поверхность органа могут быть неровными. Появление асцита свидетельствует о циррозе печени.
Третий этап диагностического поиска - решающий в диагностике
ХАИГ.
Клинический анализ крови демонстрирует резкое увеличение СОЭ (до 40-60 мм/ч). Часто наблюдают лейкопению и тромбоцитопению, не обусловленную гиперспленизмом. Как правило, выявляют незначительную нормохромную анемию.
Биохимические исследования свидетельствуют о выраженности цитолитического и иммуновоспалительного синдромов. Активность в сыворотке АЛТ и АСТ очень высокая и нередко превышает 10 норм, уровень билирубина повышен как за счет прямой, так и частично непрямой фракции и колеблется от 2 до 10 мг% (34-170 ммоль/л). Электрофорез белков сыворотки выявляет значительное, более чем в 2 раза, повышение уровня у-глобулинов.
В биоптате печени при ХАИГ наблюдают резко выраженное поражение паренхимы с распространенными перипортальными очаговыми некрозами, интенсивной инфильтрацией преимущественно плазматическими клетками, фиброз печени. В большинстве случаев уже при первой биопсии находят картину цирроза печени, обычно макронодулярного типа.
Особенно важна дифференциальная диагностика вирусного и аутоиммунного гепатита (табл. 3-3), так как их этиотропная терапия принципиально различна.
Хронический алкогольный гепатит
Хронический алкогольный гепатит, наряду с острым алкогольным гепатитом, жировой дистрофией печени и циррозом печени, служит локальным проявлением системного действия алкоголя на организм больного.
Клиническая картина хронического алкогольного гепатита складывается из клинических и лабораторных проявлений алкоголизации (часто алкоголизма) и симптомов поражения печени.
Больные предъявляют жалобы на тяжесть в правом подреберье постоянного характера, чувство переполнения в эпигастральной области, тошноту, снижение аппетита, вздутие живота после еды, плохую переносимость жирной пищи.
Диспептические жалобы в основном обусловлены алкогольным хроническим гастритом и панкреатитом. У части больных жалобы отсутствуют.
При проведении первого этапа диагностического поиска следует помнить, что пациенты могут скрывать злоупотребление алкоголем; здесь очень важен так называемый объективный алкогольный анамнез, т.е. сведения, полученные от родственников.
На втором этапе диагностического поиска выявляют как стигматы алкоголизма, так и признаки поражения печени. К первым относятся контрактура Дюпюитрена, гипертрофия околоушных слюнных желез, полиневропатия с парестезиями, нарушением чувствительности в конечностях. Следует обратить внимание на одутловатость и гиперемию лица, гипергидроз, тахикардию, измененное поведение - эйфорию, фамильярность или депрессию. У мужчин часто наблюдают гиперэстрогенемию (женский тип оволосения, пальмарная эритема, гинекомастия) при отсутствии цирроза печени.
Таблица 3-3. Признаки хронического аутоиммунного и вирусных гепатитов В и С
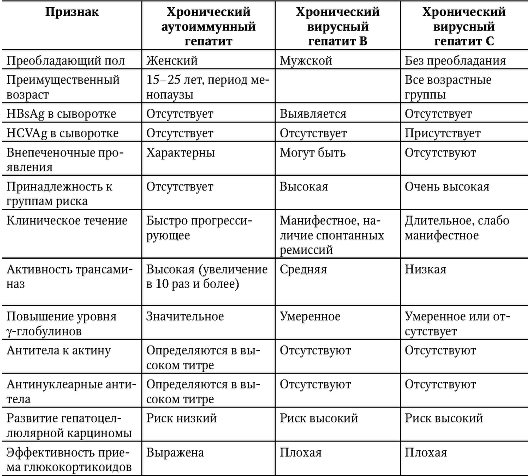
При объективном физическом обследовании в 80-100% случаев удается обнаружить гепатомегалию. Спленомегалию выявляют редко (примерно у 15% пациентов). Пальпация позволяет выявить «заинтересованность» желудка, поджелудочной железы, кишечника.
Третий этап диагностического поиска позволяет уточнить этиологию и определить характер поражения печени. Биохимические маркеры алкоголизма - повышение активности ГГТП, высокий уровень IgA, повышение активности АСТ, превышающее повышение АЛТ в 2 раза. Хронический алкогольный гепатит протекает с умеренным повышением трансаминаз.
Клинический анализ крови демонстрирует макроцитоз. В отличие от других хронических гепатитов, при алкогольном гепатите наблюдают лейкоцитоз.
Хронический алкогольный гепатит протекает с нарушением липидного обмена, у больных повышена в крови концентрация холестерина и триглицеридов.
Биопсия печени подтверждает этиологию, определяет морфологический статус печени. Для алкогольного гепатита характерны резко выраженная жировая дистрофия, мелкие очаги некроза, значительный фиброз, наличие в гепатоцитах алкогольного гиалина.
Неалкогольный стеатогепатит
Неалкогольный стеатогепатит - заболевание, при котором морфологические изменения печени, активность в крови АЛТ, АСТ, ГГТП аналогичны алкогольному гепатиту, но больные не употребляют этанол в гепатотоксичных дозах. Неалкогольный стеатогепатит составляет 9-10% больных хроническим гепатитом, что подтверждается результатами пункционной биопсии печени. Этиологические факторы - ожирение, сахарный диабет II типа, гиперлипидемия, прием амиодарона, глюкокортикоидов, тетрациклина, НПВС.
Основным звеном патогенеза служит накопление в гепатоците свободных жирных кислот, которые являются высокоактивными субстратами перекисного окисления липидов (ПОЛ), что ведет к «окислительному стрессу» с повреждением мембран гепатоцитов и некрозу. По клинической картине и результатам биохимических исследований неалкогольный стеатогепатит не отличается от хронического алкогольного гепатита, только отсутствует употребление алкоголя в дозах, приводящих к печеночному и цитолитическому поражению. Объективизировать этиологию помогают лабораторные маркеры хронической алкогольной интоксикации:
• повышение активности в крови ГГТП;
• повышение содержания в крови IgA;
• увеличение среднего объема эритроцитов;
• повышение в крови активности АСТ, превышающее АЛТ;
• повышение содержания в крови трансферрина.
Хронический холестатический гепатит
Хронический холестатический гепатит - полиэтиологический вариант хронического гепатита с внутрипеченочным холестазом, т.е. уменьшением или прекращением тока желчи вследствие либо нарушения экскреторной способности гепатоцитов, либо поражения холангиол. Внутрипеченочный холестаз сопровождается регургитацией составных компонентов желчи в кровотоке.
В международной классификации хронический холестатический гепатит не выделен. При этом гистологическая картина его заметно отличается от картины, характерной для хронических гепатитов. К основным морфологическим признакам внутрипеченочного (гепатоцитарного) холестаза относят:
• накопление зерен желчных пигментов в гепатоцитах у билиарного полюса клетки;
• укрупнение гранул пигмента и появление их в желчных капиллярах;
• концентрация желчи в расширенных желчных капиллярах в виде сгустков (желчные тромбы).
Клиническая картина хронического холестатического гепатита отличается выраженностью синдрома холестаза.
На первом этапе диагностического поиска выявляют основной клинический симптом холестаза - кожный зуд (наблюдается у всех больных). Он не купируется симптоматическими препаратами, носит мучительный характер, служит нередко причиной бессонницы и депрессии, зуд часто за месяцы и даже годы предшествует желтухе, заставляя длительно лечиться у дерматолога. Желтуха может развиваться медленно, не сопровождается похуданием.
При длительном холестазе возможно появление жалоб, связанных с нарушением всасывания в кишечнике жирорастворимых витаминов A, D, E, K: расстройство сумеречного зрения, кровоточивость десен и кожи, боли в костях и пр.
На этом же этапе имеется возможность уточнить этиологические факторы:
• длительный прием лекарственных препаратов - хлорпромазина (амина- зина*), сульфаниламидных, противодиабетических препаратов, а также диуретиков, антибиотиков, контрацептивов и прочее, вызывающих аллергический холестаз, а также метилтестостерона, анаболических стероидов, вызывающих простой неаллергический холестаз, непереносимость их;
• токсическое воздействие (алкоголь, ядохимикаты и прочие токсичные вещества);
• вирусный гепатит;
• эндокринные изменения (прием гормональных препаратов, пероральных контрацептивов, эндокринные заболевания). Последние 4 мес беременности могут протекать с холестазом.
В ряде случаев этиология может остаться неизвестной (так называемый идиопатический холестаз). Это не исключает предположения о первичном холестазе. Тщательно выясняют наличие заболеваний, которые могли бы привести к вторичному холестазу, возникающему при обструкции внепеченочных желчных путей (желчнокаменная болезнь, опухоли гепатобилиарной системы, хронический панкреатит и др.). В таких случаях диагноз хронического холестатического гепатита маловероятен. На последующих этапах производят уточняющие исследования.
На втором этапе диагностического поиска выявляют другие проявления холестаза: желтуху, пигментацию кожи (чаще генерализованную), ксантелазмы и ксантомы (приподнятые светло-желтые узловатые мягкие образования - отложения липидов в коже). Обнаруживают расчесы кожи.
«Печеночные ладони», сосудистые звездочки не характерны для хронического холестатического гепатита: единичные внепеченочные знаки встречаются у небольшого числа больных.
Печень увеличена незначительно, плотная, с гладким краем. У части больных наблюдают незначительное увеличение селезенки (в фазе обострения).
Наибольшее значение в диагностике имеет третий этап диагностического поиска.
При подозрении на вторичный холестаз основным в диагностике становятся инструментальные методы исследования, позволяющие отвергнуть (или установить) существование причин, приводящих к внепеченочному холестазу.
Биохимическое исследование крови выявляет:
• повышение активности щелочной фосфатазы, ГГТП;
• гиперхолестеринемию, повышение уровня фосфолипидов, р-липопротеидов, желчных кислот;
• гипербилирубинемию (в основном за счет связанного билирубина);
• умеренное повышение уровня аминотрансфераз как проявление поражения гепатоцитов.
Иммунологическое исследование крови позволяет обнаружить митохондриальные антитела, которые служат характерным серологическим маркером
внутрипеченочного холестаза. В моче - уменьшенное содержание уробилина, могут встретиться желчные пигменты.
Биохимические и ферментативные тесты дифференциально-диагностического значения в разграничении внепеченочного и внутрипеченочного холестаза не имеют. Основная роль принадлежит инструментальным методам.
Всем больным с желтухой неясного происхождения, прежде всего, необходимо проводить эхографию печени, желчного пузыря и поджелудочной железы для исключения патологических изменений в этих органах, которые могут послужить причиной внепеченочного холестаза.
УЗИ - наиболее применяемый и важный метод диагностики. Расширение внутрипеченочных желчных протоков свидетельствует об обструкции крупного протока (вторичный, подпеченочный холестаз). УЗИ не позволяет уточнить состояние дистального отдела желчных путей, поэтому в план обследования при вторичном холестазе включают компьютерную томографию (КТ), магнитнорезонансную томографию (МРТ).
Ретроградная панкреатохолангиография или чрескожная гепатохолеграфия: эти методы позволяют установить уровень обтурации желчных протоков. Разрешающая способность сцинтиграфии желчных путей с радиофармпрепаратами уступает другим методам визуализации.
При нерасширенных желчных протоках для уточнения характера процесса производят пункционную биопсию печени или лапароскопию с биопсией.
Следует отметить, что прижизненное морфологическое исследование печени имеет для диагностики холестаза второстепенное значение, поскольку констатируемые при световой микроскопии изменения (накопление компонентов желчи в гепатоцитах, желчных ходах и др.) появляются значительно позже биохимических и клинических признаков.
Кроме того, пункционная биопсия печени противопоказана при наклонности к кровоточивости, что нередко отмечается у больных с холестазом.
Исключение причин внепеченочного холестаза достаточно для диагностики первичного внутрипеченочного холестаза.
Диагностика
Ведущий фактор диагностики хронических гепатитов - результат морфологического изучения биоптата.
Важные данные гистологического исследования должны дополняться другими характеристиками, т.е. учитывать клиническую картину заболевания, показатели лабораторных исследований - гематологического, биохимического, вирусологического.
Критерии диагноза хронического гепатита:
• дистрофические изменения и некроз гепатоцитов, воспалительные инфильтраты портальных трактов, фиброз без нарушения дольковой структуры (архитектоники) печени;
• лабораторные проявления цитолитического, иммуновоспалительного и холестатического синдромов;
• гепатомегалия, спленомегалия, «внепеченочные» знаки;
• подтвержденные этиологические факторы (HBV, HCV, высокая концентрация антител к гладкой мускулатуре, ДНК, к митохондриям печени и почек).
Формулировка развернутого клинического диагноза учитывает:
• этиологическую характеристику;
• индекс гистологической активности;
• гистологическую оценку степени фиброза;
• клиническую активность.
Лечение
Лечебные мероприятия при хроническом гепатите имеют следующие задачи:
• ликвидацию воздействия этиологического фактора;
• снижение активности воспалительного процесса;
• улучшение функционального состояния печени.
Все лечебные воздействия преследуют главную цель - предотвратить развитие цирроза печени и гепатоцеллюлярной карциномы. Характер проводимой терапии зависит:
• от этиологии;
• варианта течения и результатов предшествующей терапии;
• гистологической и клинической активности;
• преобладания каких-либо клинико-биохимических синдромов;
• сопутствующих заболеваний.
Больным ХГ противопоказаны вакцинации, инсоляция, какое-либо активное физиотерапевтическое лечение, тяжелая физическая нагрузка. Следует избегать переохлаждения, перегревания. Необходимо полностью исключить употребление алкоголя.
Режим физической нагрузки определяется степенью клинико-биохимической и гистологической активности. Постельный режим показан при выраженном цитолитическом и иммуновоспалительном синдроме.
В России при хроническом гепатите принято назначать диету № 5, суточный рацион которой содержит белков 100 г, жиров - 80 г, углеводов - 450-600 г, что составляет 3000-3500 ккал. Исключают жирные сорта мяса, острые блюда, соленые, копченые и жареные продукты.
Лечение хронического гепатита В
Лечение хронического гепатита В включает использование противовирусных интерферонов и аналогов нуклеотидов. Интерферон-альфа-2 применяют либо ежедневно по 5 МЕ в виде подкожных инъекций, либо по 10 МЕ в виде подкожных инъекций 3 раза в неделю. Курс лечения составляет 4-6 мес.
Применяют также пэгинтерферон альфа-2а - препарат интерферона пролонгированного действия, инъекции проводят 1 раз в неделю.
Из антивирусных лекарственных средств используют ламивудин по 100 мг в сутки не менее 12 мес.
К прогностическим факторам хорошего ответа на терапию интерфероном относят высокую активность АЛТ, низкую виремию, высокий индекс гистоло-
гической активности, женский пол, небольшую длительность болезни (менее 5 лет), отсутствие суперинфекции HCV, HDV, ВИЧ. Хороший ответ на терапию при этом (исчезновение HBeAg и HBV-ДНК, уменьшение воспаления и гепатоцеллюлярного некроза) приближается к 50%.
Лечение интерфероном сопровождается значительным количеством побочных эффектов. Это гриппоподобный синдром, миалгии, головная боль, уменьшение массы тела, миелосупрессия, диарея, алопеция, тревожность, депрессия.
Лечение хронического гепатита С
В настоящее время мировым стандартом в лечении HCV-инфекции является комбинированная терапия интерфероном с рибавирином. Важно отметить, что противовирусный эффект рибавирина при HCV-инфекции реализуется только в присутствии интерферона. Комбинированную терапию хронической HCV-инфекции, вызванной HCV генотипа I, проводят при низком уровне виремии в течение 24 нед, при высоком уровне - 48 нед. При хронической HCV- инфекции, вызванной HCV генотипов II или III, лечение продолжают 24 нед (более продолжительные курсы необходимы только при циррозе печени). Дозы препаратов зависят от генотипа и массы тела больного. Возможно включение в терапию третьего противовирусного препарата - римантадина. Рибавирин назначают по 600-1200 мг/сут на тот же срок.
Цель противовирусной терапии хронического вирусного гепатита:
• элиминация или прекращение репликации вируса;
• купирование или уменьшение степени активности воспаления;
• предупреждение прогрессирования гепатита с развитием отдаленных его последствий, включая цирроз печени и печеночно-клеточный рак.
Даже если не происходит полной элиминации вируса, проведение курса приводит к улучшению морфологических проявлений.
Противопоказания к назначению интерферона-альфа-2: печеночноклеточная недостаточность, лейкопения, тромбоцитопения, психическая патология.
Эффект лечения проявляется в нормализации АЛТ, исчезновении РНК-HCV из крови и снижении активности процесса в печени, однако результаты лечения все же нельзя назвать удовлетворительными.
Лечение хронического аутоиммунного гепатита
Медикаментозная терапия глюкокортикоидами продлевает жизнь при этом тяжелом заболевании. Лечение требует длительного курса глюкокортикоидов. Обычная начальная доза преднизолона 30-40 мг/сут, длительность назначения данной дозы определяется динамикой лабораторных показателей и клинических симптомов. При достижении эффекта дозу очень медленно снижают до 10-15 мг, такое количество препарата необходимо принимать не менее 2-3 лет после наступления ремиссии.
При недостаточной эффективности преднизолона, рецидивировании гепатита на фоне уменьшения дозы, а также при развитии осложнений глюкокортикоидной терапии проводят комбинированное лечение преднизолоном и азатиоприном. К преднизолону в суточной дозе 30 мг добавляют азатиоприн в дозе 50 мг, длительность приема азатиоприна составляет от нескольких меся-
цев до 1-2 лет (в комбинации с преднизолоном). Монотерапию азатиоприном в настоящее время не используют. Начинать и отменять иммуносупрессивную терапию следует только в условиях стационара. Длительная иммуносупрессивная терапия способствует наступлению ремиссии у большинства больных с хроническим аутоиммунным гепатитом.
Лечение хронического алкогольного гепатита
При хроническом алкогольном гепатите проводят лечение так называемыми гепатопротекторами (средствами, влияющими на обменные процессы в гепатоците, уменьшающими ПОЛ и стабилизирующими биологические мембраны). Используют эссенциальные фосфолипиды - эссенциале форте Н* по 6-8 капсул в день в течение 2-3 мес или растительные флавоноиды - силимар*, хо- фитол* по 6-9 таблеток в сутки в течение 2 мес. Применяют также тиоктовую кислоту (липоевую кислоту*, липамид*) по 0,025-0,05 г 3 раза в день в течение 1 мес.
При холестатическом синдроме помимо препаратов, воздействующих на обмен печеночных клеток, и средств, оказывающих иммунодепрессивное и противовоспалительное действие (при активности процесса), назначают вещества, непосредственно устраняющие синдром внутрипеченочного холестаза. Это препараты урсодезоксихолевой кислоты - урсофальк*, принимают его по 250-500 мг на ночь.
Прогноз
Наименее благоприятный прогноз при хроническом аутоиммунном гепатите. При вирусных гепатитах продолжающаяся репликация вируса приводит также к циррозу печени.
Профилактика
• Исключение вирусной инфекции (HCV).
• Вакцинация от гепатита В.
• Отказ от употребления алкоголя.
• Нормализация жирового и углеводного обмена.
• Исключение приема гепатотоксичных лекарственных препаратов.
ЦИРРОЗ ПЕЧЕНИ
Цирроз печени - хроническое прогрессирующее диффузное полиэтиологическое заболевание с поражением гепатоцитов, фиброзом и перестройкой архитектоники печени, приводящей к образованию структурно-аномальных регенераторных узлов, портальной гипертензии и к развитию печеночной недостаточности.
Цирроз печени - завершающая стадия воспалительно-некротических и дегенеративно-некротических процессов в паренхиме или желчевыводящей системе печени, характеризующихся регенераторной, фибротической и сосудистой перестройкой.
Смертность от цирроза печени занимает 4-5 место в структуре общей смертности населения, и ее показатели в разных странах составляют 15-30 на 100 000 населения.
Классификация
В настоящее время рекомендовано использовать классификацию, основанную на этиологическом и морфологическом принципах (ВОЗ, 1978).
• В этиологии цирроза печени различают следующие факторы:
- вирусный гепатит В, В + Д, С;
- хроническая алкогольная интоксикация;
- метаболические нарушения (гемохроматоз, болезнь Вильсона, недостаточность а1-антитрипсина и др.);
- длительный внутри- и подпеченочный холестаз;
- интоксикации, токсические воздействия лекарств;
- недоедание, белково-витаминный дефицит;
- нарушение венозного оттока (констриктивный перикардит, веноокклюзионная болезнь, сердечная недостаточность);
- хронический аутоиммунный гепатит;
- криптогенный цирроз печени.
• Морфологически выделяют:
- мелкоузловой (характерны мелкие узлы регенерации, почти одинаковые по размеру, диаметром менее 3 мм и перегородки одинаковой ширины; в основном соответствует портальному циррозу прежних классификаций);
- крупноузловой (свойственны узлы и септы разных размеров, превышающие 3 мм, часто состоят из многих долек и содержат беспорядочно расположенные портальные тракты; соответствует постнекротическому циррозу прежних классификаций);
- смешанный цирроз печени (диагностируют, когда количество мелких и крупных узлов приблизительно одинаково).
• По степени функциональных нарушений и портальной гипертензии различают:
- компенсированный цирроз печени;
- декомпенсированный цирроз печени.
Этиология
Цирроз печени - полиэтиологическое заболевание. Более половины всех циррозов печени в Европе связано с хроническим злоупотреблением алкоголя. Количество циррозов печени вирусной этиологии зависит от региона. До четверти всех циррозов печени относят к криптогенным, т.е. неизвестной этиологии, однако успехи вирусологии и иммунологии позволяют сокращать эту группу. Часть криптогенных циррозов печени, особенно у женщин, выступает следствием хронического аутоиммунного гепатита, другая - следствием атаки неизвестным вирусом или тщательно скрываемым злоупотреблением алкоголем.
Патогенез
Патологической регенерации и деформации дольковой архитектуры печени предшествуют либо мелкоочаговые, либо крупноочаговые некрозы паренхимы, либо прогрессирующее активное фиброзообразование в области деструкции портальных и перипортальных желчных протоков. Некроз гепатоцитов или желчных протоков под воздействием различных этиологических причин - пусковой момент цирроза печени. Некротический процесс вызывает активную реакцию соединительной ткани, что, в свою очередь, приводит к некрозу ранее интактных гепатоцитов. Некроз служит стимулом регенерации клеток, которая протекает в виде концентрического увеличения сохранившегося участка паренхимы. Упорядоченному регенераторному процессу с восстановлением нормальной структуры дольки мешает образование фиброзных септ в местах некроза. Возникают участки паренхимы, полностью или частично окруженные соединительнотканными прослойками, т.е. псевдодольки. Важнейшим условием образования псевдодолек служит развитие фиброзных септ между центральными венами и портальными трактами. Часто такие септы образуются на месте мостовидных некрозов. Образование фиброзных септ препятствует восстановлению нормальной структуры. Играют роль и воспалительные инфильтраты, распространяющиеся из портальных полей до центральных зон долек. В рубцующихся зонах нарушается сосудистый и лимфатический аппарат печени. Узлы-регенераты снабжаются кровью преимущественно из печеночной артерии, а ветви воротной вены образуют в септах анастомозы с печеночными венами, и поэтому портальная кровь недостаточно контактирует с гепатоцитами. Развивающаяся фиброзная ткань механически сдавливает венозные сосуды. Эти процессы приводят к нарушению печеночной гемодинамики - развитию портальной гипертензии, затруднению снабжения гепатоцитов портальной кровью и развитию внутрипеченочного окольного кровоснабжения. Вышеописанные процессы, способствуя нарушению печеночной гемодинамики и развитию портальной гипертензии, приводят к повторным некрозам, замыкая порочный круг: некроз - воспаление - неофибриллогенез - нарушение кровоснабжения гепатоцитов - некроз. В развитии портальной гипертензии наибольшее значение имеет сдавление разветвлений воротной вены узлами регенерирующих гепатоцитов или разросшейся фиброзной тканью. Уменьшение количества гепатоцитов и внутрипеченочный шунтовой кровоток приводят к снижению функциональной способности печени и обусловливают эндотоксемию, бактериемию.
Портальная гипертензия приводит к развитию портокавального шунтирования, асцита и спленомегалии.
Между бассейном воротной вены и системным венозным кровотоком при повышении давления в v. portae до 25-30 мм рт.ст. развиваются коллатерали (портокавальные анастомозы). Из них наибольшее клиническое значение имеют анастомозы в нижней трети пищевода и кардиальной части желудка, поскольку кровотечение из варикозно расширенных вен этой области - одно из самых тяжелых осложнений цирроза печени, приводящее к летальному исходу.
В развитии асцита ведущую роль играет внутрипеченочный портальный блок вследствие механического препятствия току портальной крови из-за нарушения архитектоники и в известной мере повышения притока артериальной крови. Повышение синусоидального давления приводит к увеличению образования лимфы - до 15-20 л (при норме 8-9 л). Такое количество не может быть удалено, часть жидкости просачивается в полость брюшины, формируя асцит. Так как значительная часть плазмы депонируется в брюшной полости, объем циркулирующей плазмы снижается. При этом из-за снижения альбуминов печени и скопления белка в асцитической жидкости, снижается и онкотическое давление плазмы. Все это вызывает активацию РААС, стимулируется секреция антидиуретического гормона и происходит задержка натрия и воды. К повышению уровня альдостерона приводят усиление его продукции вследствие гиповолемии и снижение деградации гормона в печени. При этом снижается почечный кровоток.
Спленомегалия также развивается вследствие портальной гипертензии. Помимо венозного застоя увеличению селезенки способствуют иммунные реакции и разрастание соединительной ткани.
Гиперспленизм - это чрезмерная интенсификация и извращение функции селезенки по элиминации «состарившихся» форменных элементов крови. В крови при этом снижается количество тромбоцитов, лейкоцитов, эритроцитов.
Портальная гипертензия ведет также к значительному отеку слизистой оболочки желудка и кишечника, что приводит к нарушению всасывания, экссудативной энтеропатии и образованию «гепатогенных» язв желудка и двенадцатиперстной кишки.
Прохождение с портальной венозной кровью в обход паренхимы печени ряда биологически активных веществ и гормонов (в частности, альдостерона, эстрогенов, инсулина, гастрина, гистамина и др.) приводит к эндокринным и метаболическим расстройствам.
Серьезным последствием портальной гипертензии служит «портокавальная», т.е. экзогенная, энцефалопатия, которая может закончиться развитием комы.
Помимо «шунтовой» комы при циррозе печени возможно развитие и собственно печеночной или эндогенной комы. Этот вид комы - проявление гепатоцеллюлярной недостаточности. При циррозе печени обычно развивается смешанная кома вследствие обеих названных причин.
Клиническая картина
Симптоматика цирроза печени зависит от этиологии, выраженности цирротического процесса, степени нарушения функции печени, стадии портальной гипертензии и активности воспалительного процесса.
При циррозе печени, как и при гепатитах, выделяют следующие синдромы:
• астенический;
• болевой;
• диспептический;
• цитолитический;
• иммуновоспалительный;
• синдром гиперспленизма;
• холестатический;
• геморрагический.
Наличие и выраженность всех этих синдромов при различных циррозах печени колеблются в больших пределах, что будет показано при описании клинической картины различных форм цирроза.
Общим признаком, с той или иной частотой встречающимся при различных формах цирроза печени на определенной стадии его развития, служит синдром портальной гипертензии. Этот синдром - важнейшее отличие цирроза печени от хронических гепатитов.
Из ранних симптомов портальной гипертензии (до появления асцита) наблюдают:
• метеоризм («ветер предшествует дождю»);
• диспептические расстройства (снижение аппетита, тошнота).
Другие клинические проявления развиваются позднее. Это спленомегалия, асцит, варикозное расширение вен пищевода, желудка, геморроидальных вен. Нередко больные узнают о болезни после проведения УЗИ, когда выявляют расширение портальной и селезеночной вен и умеренную (не пальпируемую) спленомегалию.
При циррозе печени в большей степени, чем при хроническом гепатите, выражен синдром печеночно-клеточной недостаточности, проявляющийся внепеченочными признаками, геморрагиями, желтухой, печеночной энцефалопатией.
Заболевание в своем развитии проходит ряд определенных стадий.
• В начальной (компенсированной) стадии цирроза печени, нередко протекающей латентно, без признаков печеночной недостаточности, портальная гипертензия не выражена. Внепеченочные признаки болезни выражены слабо или отсутствуют, лабораторные показатели изменены незначительно или находятся в пределах нормы. Вместе с тем при морфологическом исследовании биоптатов печени обнаруживается характерная для цирроза печени картина. Клинически начальная стадия компенсированного цирроза печени - это гепатомегалия и спленомегалия, расширение диаметра v. portae при УЗИ.
• В стадии декомпенсации внепеченочные признаки выражены ярко, что сочетается с отчетливыми изменениями лабораторных исследований и явными признаками портальной гипертензии. Больные приобретают «типичный» вид: пониженного питания, атрофия мышц, телеангиэктазии, пальмарная эритема, увеличенная бугристая или сморщенная печень, спленомегалия, асцит, «голова медузы», желтуха, геморрагии, отеки. В этой стадии (декомпенсированной), наряду с портальной гипертензией, выраженными внепеченочными признаками являются клинико-лабораторные проявления печеночной недостаточности и гиперспленизма.
В клинической картине цирроза печени (вне зависимости от его этиологии и формы) принято выделять активность цирротического процесса, что морфологически выражается в лимфогистиоцитарной инфильтрации портальных трактов, увеличении количества некрозов гепатоцитов, усилении цитолитического
и иммуновоспалительного синдромов, появлении признаков печеночной недостаточности. Поскольку проведение чрескожной пункции показано, главным образом, только на начальной стадии болезни, нецелесообразно на поздних развернутых стадиях и противопоказано при декомпенсации цирроза печени, активность определяют по ряду признаков, к которым относятся:
• усиление выраженности «внепеченочных знаков»;
• усиление желтухи (гипербилирубинемия за счет конъюгированной фракции);
• повышение активности в сыворотке крови трансаминаз;
• увеличение содержания у-глобулинов в крови и положительные «осадочные» пробы.
Не очень четкие понятия «декомпенсация», «субкомпенсация», «компенсация» в настоящее время заменены на степени тяжести, определяемые по классам А, В, С, которые, в свою очередь, определяются количеством баллов (табл. 3-4).
Таблица 3-4. Степень тяжести цирроза печени по Чайлд-Пью (Child-Pugh)
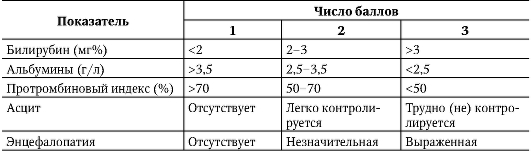
Сумма баллов по всем показателям:
• класс А - от 5 до 7;
• класс В - от 8 до 10;
• класс С - от 11 и более.
Клиническая картина цирроза печени эволюционирует в зависимости от развития осложнений:
• кровотечений из варикозно расширенных вен пищевода и желудка;
• печеночной энцефалопатии, прекомы и комы;
• вторичной инфекции (главным образом, пневмонии и асцит-перитонит);
• гепаторенального синдрома;
• трансформации в цирроз-рак;
• тромбоза воротной вены;
• образования конкрементов в желчных путях.
Кровотечение из вен пищевода и желудка возникает в период портального гипертонического криза, что приводит к разрыву тонкостенных венозных сосудов. Разрыв может произойти и в результате эрозии вен желудочным рефлюктантом. Варикозное расширение вен пищевода находят у 60% больных цирроза печени, а 25% погибает от кровотечения из них. Острая кровопотеря приводит к появлению гипоксических некрозов печени и к развитию эндогенной комы. Наличие крови в кишечнике, ее бактериальное разложение вносит и экзогенный компонент. Кровотечение из вен пищевода проявляется рвотой
алой кровью или «кофейной гущей», обычно больной теряет 1,5-2 л крови. В ряде случаев первым симптомом служит мелена.
Печеночная энцефалопатия - результат токсического влияния на центральную нервную систему продуктов метаболизма азотистых соединений, в норме инактивируемых печенью (аммиак, производные фенола и индола, меркаптаны). В генезе энцефалопатии также участвует накопление в ЦНС ложных нейротрансмиттеров, сходных по структуре с истинными, но в 50 раз менее эффективных. Свой «вклад» вносит повышение концентрации оксимаслянных кислот (β и γ).
Непосредственными причинами печеночной энцефалопатии могут быть: желудочно-кишечные кровотечения, инфекции, в том числе и суперинфекции HAV, HBV, HCV, HDV, диуретики, седативные средства, анальгетики, а также прогрессирование цирроза печени и развитие гепатоцеллюлярной карциномы.
Выделяют следующие стадии печеночной энцефалопатии:
• субклиническая, когда нарушения можно выявить только при психомоторных тестах - «тестах линий и чисел»;
• I стадия - отмечаются легкая несобранность, беспокойство, нарушение ритма сна, объективно наблюдаются легкий тремор, нарушения координации;
• во II стадии больные сонливы, дезориентированы, неадекватны, двигательные нарушения включают дизартрию, астериксис (хлопающий, «порхающий» тремор верхних конечностей);
• в III стадии больной впадает в сопор, полностью дезориентирован; неврологическое обследование определяет гиперрефлексию, патологические рефлексы;
• IV стадия - кома, ответ на болевые раздражители отсутствует.
При печеночной коме наблюдаются: нервно-психические нарушения, усиление желтухи, печеночный запах, лихорадка, геморрагический диатез, непостоянными симптомами могут быть: уменьшение в размерах печени и усиление болей в правом подреберье.
Гепаторенальный синдром провоцируется остро нарастающей гиповолемией - кровотечением, рвотой, диареей, избыточным диурезом, удалением большого объема асцитической жидкости при абдоминальном парацентезе. В основе синдрома лежит почечная вазоконстрикция, главным образом в наружном слое корковой зоны почек, что ведет к снижению почечного кровотока и гломерулярной фильтрации, к снижению экскреции натрия при сохранении способности к канальцевой реабсорбции.
Мелкоузловой цирроз печени
Мелкоузловой цирроз печени - часто встречающаяся форма цирроза печени (до 40% всех циррозов печени). Объем получаемой информации на каждом этапе диагностического поиска зависит от степени портальной гипертензии и этиологии цирроза.
На первом этапе диагностического поиска в состоянии компенсации жалоб может не быть. При нарастании портальной гипертензии ведущими выступают симптомы желудочной и кишечной диспепсии (потеря аппетита, тошнота, рвота, плохая переносимость пищи, диарея) и астении (слабость, повышенная
утомляемость, снижение работоспособности). Частый и стойкий симптом - чувство тяжести и боли в правом подреберье вследствие гепатомегалии.
При декомпенсации цирроза больной в качестве первых проявлений болезни может отмечать увеличение живота, носовые кровотечения. Кровотечения из вен пищевода как драматический дебют болезни наблюдается нередко. Возможны нарушения сна, резкая раздражительность - проявления «шунтовой» печеночной энцефалопатии.
Этиологический фактор (если цирроз алкогольный) на первом этапе на основании анамнестических данных уточнить бывает трудно, так как больные часто скрывают злоупотребление алкоголем. У части больных в анамнезе перенесенный острый вирусный гепатит, бывшая ранее белково-витаминная недостаточность и др.
На втором этапе диагностического поиска уже в стадии компенсации могут обнаруживаться «печеночные» знаки: сосудистые звездочки, пальмарная эритема, гинекомастия, отсутствие или снижение оволосения в подмышечных впадинах, у мужчин - на груди, лице. Ногти часто белые и ровные.
При подозрении на алкогольный генез цирроза печени следует обращать внимание на возможные соматические и неврологические проявления алкоголизма, контрактуру Дюпюитрена, увеличение околоушных желез, атрофию мышц, миопатию и полиневриты. Возможны проявления алкогольного панкреатита, болезненность в характерных зонах (подробнее см. раздел «Хронический панкреатит»). Обнаружение перечисленных признаков делает алкогольный генез болезни весьма вероятным.
Один из наиболее частых объективных симптомов - увеличение печени; край ее заостренный, поверхность ровная, консистенция плотная. Увеличенная селезенка на этой стадии пальпируется у половины больных.
В стадии декомпенсации выявляют: желтуху (степень выраженности различна в зависимости от активности цирроза), значительное похудание, развитые венозные коллатерали на груди и передней брюшной стенке, нередко - пупочную грыжу, отеки нижних конечностей, спленомегалию, асцит. Селезенка увеличена больше, чем печень.
На третьем этапе диагностического поиска клинический анализ крови выявляет анемию, чаще гипохромную, возможно сочетание с лейкопенией и тромбоцитопенией. Микроцитарная анемия - результат возможных кровотечений и (или) синдрома гиперспленизма.
При биохимическом исследовании крови в стадии компенсации обнаруживают незначительные отклонения в функциональных пробах печени: гиперпротеинемию, небольшое повышение билирубина (у части больных). В стадии декомпенсации - выраженную диспротеинемию (гипоальбуминемию, гиперу-глобулинемию, положительные осадочные реакции), снижение содержания протромбина и холестерина, повышение билирубина, умеренное повышение активности аминотрансфераз.
Иммунологические нарушения выражены незначительно. У отдельных больных отчетливо повышено содержание IgA (чаще при хроническом алкоголизме).
Для выявления варикозно расширенных вен пищевода производят рентгенологическое исследование, эзофагогастродуоденоскопию. Ректоскопия выявляет варикозно расширенные геморроидальные вены.
Обследование включает УЗИ органов брюшной полости. Определяют размер и структуру печени. Печень обычно увеличена, эхогенность повышена, структура органа однородна. Диаметр воротной вены и селезеночной вены увеличен. Размеры селезенки превышают норму.
Лапароскопию проводят при неясном диагнозе, главным образом для исключения онкологической патологии. На ранних стадиях при лапароскопии можно обнаружить увеличенную печень с картиной мелкоузлового цирроза, симптомы портальной гипертензии, на поздних стадиях - картину смешанного (крупно- и мелкоузлового) цирроза. Биопсию следует проводить только на ранних стадиях процесса при дифференциальной диагностике гепатита и цирроза.
Морфологическое изучение биоптата печени при циррозе алкогольного генеза выявляет:
• жировую дистрофию гепатоцитов;
• образование ложных долек;
• обширное развитие фиброза.
Признаками алкогольной этиологии цирроза печени служат тельца Маллори (скопления гиалина в центре долек) и очаговая инфильтрация нейтрофилами портальных трактов.
Крупноузловой цирроз печени
Крупноузловой цирроз печени составляет до трети всех циррозов печени и бывает, как правило, вирусной этиологии. Весьма часто хронический аутоиммунный гепатит трансформируется в эту форму цирроза печени. Заболевание значительно чаще встречается у лиц молодого и среднего возраста. Для этой формы цирроза характерно быстрое, клинически выраженное прогрессирование. В клинической картине на первый план выступают проявления цитолитического синдрома и печеночно-клеточной недостаточности, признаки портальной гипертензии присоединяются на терминальной стадии.
Симптоматика в период обострения заболевания напоминает острый вирусный гепатит или хронический гепатит высокой активности. Характерны желтуха, лихорадка, астенический, диспептический и цитолитический синдромы.
На первом этапе диагностического поиска главными признаками являются желтуха, боли в животе (в правом подреберье и подложечной области), повышение температуры тела, диспептические расстройства, слабость. Степень выраженности жалоб прямо коррелирует с активностью процесса, при стихании некроза и воспаления они ослабевают (но полностью не исчезают). Это позволяет уже на данном этапе обследования больного судить об активности процесса.
В случае развития цирроза как исхода хронического аутоиммунного гепатита остается характерная для последнего полиорганность поражения, с чем связано и разнообразие жалоб (артралгии, геморрагические высыпания и др.).
На этом же этапе уточняют этиологию цирроза: у подавляющего большинства больных устанавливают связь с перенесенным вирусным гепатитом В или С, гепатотропными ядами, отмечают лекарственную непереносимость.
Выявляют характерные особенности развития цирроза:
• прогрессирующее течение;
• печеночная недостаточность развивается значительно раньше признаков портальной гипертензии.
На втором этапе диагностического поиска даже в стадии компенсации внепеченочные признаки выражены в большей степени, нежели у больных мелкоузловым циррозом печени.
В стадии декомпенсации цирроза печени отмечается выраженная желтуха, другие «печеночные» знаки по-прежнему очень яркие.
При высокой активности процесса возможны полисерозиты, иногда преходящий асцит. На поздней стадии асцит представляет постоянный признак болезни.
Печень и селезенка увеличены незначительно. Печень имеет острый и болезненный край, неровную поверхность. Болезненность при пальпации печени усиливается в период обострения.
Данные третьего этапа диагностического поиска по результатам клинического и биохимического анализа крови выявляют признаки выраженного печеночного цитолиза и функциональной недостаточности гепатоцитов: значительное повышение уровня билирубина (преимущественно за счет связанного), 5-10-кратное повышение уровня аминотрансфераз, ЛДГ и ее 4-5-й фракций, снижение содержания холестерина и протромбина, диспротеинемию (резкое увеличение количества у-глобулинов и значительное понижение альбуминов, изменение осадочных проб, особенно тимоловой). Клинический анализ крови выявляет увеличение СОЭ, «сдвиг» влево в лейкоцитарной формуле, лейкоцитоза обычно не бывает, явления гиперспленизма наблюдаются реже, чем при мелкоузловом циррозе печени.
Вирусную природу цирроза печени подтверждает или выявляет обнаружение при серологическом исследовании крови маркеров вирусной инфекции.
Варикозное расширение вен пищевода, желудка и геморроидальных вен выявляют при рентгенологическом исследовании пищеварительного тракта, эзофагогастродуоденоскопии и ректороманоскопии.
УЗИ выявляет увеличение или на терминальной стадии уменьшение размеров печени, повышенную эхогенность и неравномерную структуру органа. Селезенка увеличена незначительно.
Лапароскопия помогает обнаружить крупноузловое поражение печени.
Билиарные циррозы
Билиарные циррозы встречаются у 5-10% больных циррозами печени. Различают первичный (истинный) билиарный цирроз и вторичный билиарный цирроз. Первичный билиарный цирроз поражает почти исключительно женщин, вторичный встречается и у мужчин.
В основе первичного билиарного цирроза лежит внутрипеченочный холестаз, а в основе вторичного - внепеченочный (подпеченочный) холестаз (редко - длительное нарушение оттока желчи на уровне крупных внутрипеченочных желчных протоков). Вторичный билиарный цирроз чаще всего развивается при «доброкачественной» обструкции (камень, стриктура), поскольку «злокачественная» обструкция (карцинома) приводит к смерти раньше, чем
успевает развиться цирроз. Этиология первичного билиарного цирроза неизвестна, это аутоиммунное заболевание связано с появлением антител к структурам эпителия желчных протоков.
При первичном билиарном циррозе в печени последовательно протекает ряд стадий:
• лимфоплазмоцитарная инфильтрация портальных полей;
• разрушение эпителия желчных протоков;
• пролиферация мелких желчных ходов и протоков;
• замещение портальных полей рубцовой тканью, очаговые и мостовидные некрозы;
• соединительнотканные септы, «ложные» дольки.
Клинические особенности билиарного цирроза состоят в доминировании холестатического синдрома, позднем проявлении и небольшой выраженности синдромов портальной гипертензии и печеночно-клеточной недостаточности.
На первом этапе диагностического поиска выявляют основные жалобы, характерные для длительного холестаза: желтуху, кожный зуд, кровоточивость, боли в костях (особенно в спине и ребрах), диарею. Асцит наблюдается лишь в поздней стадии болезни. Уже на этапе анализа анамнестических данных складывается мнение о первичном или вторичном билиарном циррозе.
Для первичного билиарного цирроза характерен предшествующий хронический гепатит с холестатическим синдромом, для вторичного - указания на имевшуюся ранее патологию желчевыводящих путей. При вторичном билиарном циррозе, наряду с симптомами холестаза, отмечают симптомы холангита - боли в правом подреберье, лихорадка с ознобами; при наличии ЖКБ - приступы желчной колики, «атаки» панкреатита в анамнезе.
На втором этапе диагностического поиска отчетливо проявляются симптомы длительного холестаза: желтуха, диффузная «бурая» гиперпигментация кожи, ее утолщение, огрубение, сухость, множественные следы расчесов, ксантелазмы, ксантомы на локтях, подошвах, ягодицах. Болезненность при поколачивании по костям, пальцы в виде барабанных палочек - результат остеомаляции и субпериостальных новообразований костной ткани при длительном холестазе.
Сосудистые звездочки встречаются реже и выражены слабее, чем при других видах цирроза печени. Печень всегда увеличена, плотная, может достигать огромных размеров. Селезенка также увеличена, но незначительно.
Проявления портальной гипертензии отмечают только на поздней стадии болезни. Асцит при билиарном циррозе - поздний симптом.
На третьем этапе диагностического поиска выявляют:
• лабораторные признаки холестаза;
• иммунные нарушения, характерные для первичного билиарного цирроза;
• проявления портальной гипертензии;
• осложнения;
• причины внепеченочного холестаза;
• морфологические признаки цирроза. Лабораторные признаки холестаза выражены резко:
• гипербилирубинемия достигает высоких цифр, в 5-10 раз превышая норму, преимущественно увеличивается содержание связанного билирубина;
• значительно возрастает уровень общих липидов, фосфолипидов и холестерина (содержание триглицеридов не увеличивается), у-глобулинов и β-липопротеидов;
• повышается активность щелочной фосфатазы, ГГТП в сыворотке крови. Биохимические признаки цитолиза гепатоцитов с печеночно-клеточной
недостаточностью появляются (и прогрессируют) лишь на поздних стадиях процесса. В начальном периоде билиарного цирроза подъем активности аминотрансфераз выражен слабо.
При первичном билиарном циррозе закономерно выявляют изменение иммунологических показателей: повышение титра IgG и IgM (больше IgM), резкую гипер-у-глобулинемию, повышение СОЭ (при вторичном билиарном циррозе СОЭ также повышена, но как результат неиммунного воспаления). Весьма специфично для первичного билиарного цирроза появление антимитохондриальных антител в высоком титре.
С помощью иммуноферментного анализа выделены подтипы антимитохондриальных антител: анти-М-8 характерны для наиболее прогрессирующих форм заболевания, анти-М-9 - для доброкачественных форм заболевания.
Рентгеноскопия пищеварительного тракта и ЭФГДС позволяют выявить расширение вен пищевода. Эти методы исследования помогают обнаружить язвы желудка и двенадцатиперстной кишки, как проявление осложнений билиарного цирроза. Такое осложнение, как остеомаляция, выявляют при рентгенологическом исследовании костей. Рентгенологические проявления билиарной остеопатии - деминерализация костей, полосы просветления, выявляемые особенно часто в костях таза и лопаток, сдавление и деформация позвонков.
Инструментальные методы исследования (УЗИ, ФГДС, эндоскопическая ретроградная холангиопанкреатография, лапароскопия) позволяют в большинстве случаев выявить причины внепеченочного холестаза.
В случае подозрения на опухолевый процесс производят также МРТ, ангиографию печени и целиакографию. Методы позволяют оценить структуру печени, селезенки, поджелудочной железы и исключить или подтвердить наличие опухоли.
Гистологические признаки цирроза определяют по данным биоптата печени, полученного при лапароскопии или чрескожной пункции.
Диагноз первичного билиарного цирроза подтверждают следующие признаки:
• деструктивные изменения междольковых желчных протоков;
• отсутствие междольковых протоков более чем в половине портальных трактов;
• холестаз преимущественно на периферии дольки;
• расширение, инфильтрация и фиброз портальных полей.
При вторичном билиарном циррозе морфологическими критериями служат:
• расширение внутрипеченочных желчных ходов;
• некрозы в периферических частях печеночных долек с образованием желчных «озер»;
• нормальное дольковое строение в отдельных участках печени.
Биопсия печени при вторичном билиарном циррозе чревата желчным перитонитом.
Диагностика
Распознавание цирроза печени основано на выявлении:
• клинических проявлений ведущих симптомов:
- цитолитического;
- печеночно-клеточной недостаточности;
- портальной гипертензии;
- холестатического;
• лабораторно-инструментального подтверждения наличия указанных синдромов;
• этиологических факторов;
• морфологических признаков цирроза печени на начальной, доклинической (при отсутствии основных синдромов) стадии болезни.
Дифференциальная диагностика
Трудности в диагностике цирроза печени обусловлены сходством клинической картины болезни с проявлениями хронического гепатита, а также ряда других заболеваний.
От хронического гепатита цирроз печени отличают следующие признаки:
• резкое нарушение архитектоники органа (по данным морфологического исследования);
• развитие портальной гипертензии (асцит, спленомегалия, венозные коллатерали, кровотечения из пищеварительного тракта);
• глубокие дистрофические и некробиотические изменения паренхимы органа, обусловливающие большую выраженность функциональных сдвигов, печеночную недостаточность.
Заболевания, требующие проведения дифференциальной диагностики с циррозом печени:
• Цирроз-рак и первичный рак печени. При этой патологии асцит быстро развивается вследствие тромбоза воротной вены и ее ветвей, метастазов в перипортальные лимфатические узлы, локализующиеся в области ворот печени, и карциноматоза брюшины. Отграничить эти процессы от цирроза позволяют обнаружение а-фетопротеина, результаты данных лапароскопии и МРТ.
• Констриктивный перикардит, сопровождающийся увеличением печени и асцитом. Решающее значение в диагностике перикардита имеют данные рентгенокимографии и эхографии сердца.
• Доброкачественный сублейкемический миелоз (миелофиброз, остеомиелосклероз), проявляющийся увеличением печени и особенно селезенки. Диагностическое значение имеют данные трепанобиопсии, выявляющие характерные изменения.
• Альвеолярный эхинококкоз, проявляющийся не только увеличением печени, но также селезенки и изменением функциональных печеночных проб. При эхинококкозе обнаруживают специфические антитела при ре-
акции латекс-агглютинации; печень отличается необыкновенной плотностью и характерными изменениями при УЗИ и МРТ.
• Амилоидоз, гемохроматоз и болезнь Вильсона, сопровождающиеся гепатолиенальным синдромом, изменениями белкового обмена, обмена железа и меди. Достоверная диагностика этих заболеваний основана на характерных для каждого из них симптомах, определении амилоида в тканях, трансферрина и церулоплазмина в крови.
Формулировка развернутого клинического диагноза учитывает следующие пункты:
• этиология (вирусный, алкогольный, криптогенный и др.);
• морфология:
- микронодулярный (мелкоузловой);
- макронодулярный (крупноузловой);
- смешанный;
• класс тяжести по Чайлд-Пью;
• другие синдромы (указывают при их клинической выраженности):
- портальная гипертензия (конкретно - асцит, варикозное расширение вен нижней трети пищевода III степени и т.д.);
- холестаз;
- гиперспленизм (анемия, тромбоцитопения, лейкопения);
• активность цирроза (оценивают активность трансаминаз - I, II, III степень);
• осложнения.
Лечение
Тактика лечения цирроза печени определяется этиологией, активностью патологического процесса, основными клиническими проявлениями и степенью функциональных расстройств. Для подбора адекватной терапии важно учитывать стадию течения.
Всем больным циррозом печени показано соблюдение ряда правил.
• Исключение профессиональных и бытовых вредностей, полный отказ от алкоголя.
• Соблюдение благоприятного для лечения режима труда, отдыха и питания. В компенсированной стадии цирроза печени больные могут выполнять работы, не связанные с тяжелой физической нагрузкой, длительной ходьбой или стоянием, следует избегать воздействия высокой или низкой температуры, инсоляции. При портальной гипертензии следует избегать любых физических усилий, вызывающих повышение внутрибрюшного давления. При выраженной активности и декомпенсации процесса показаны постельный режим и стационарное лечение.
• Всем больным показано соблюдение диеты (стол № 5). В случае выявления симптомов печеночной недостаточности следует исключать или ограничивать белок до уровня, при котором исчезают признаки интоксикации. Поваренную соль ограничивают, а при развитии асцита - исключают из рациона.
• Необходимы лечебные мероприятия, направленные на нормализацию процессов пищеварения и всасывания (прием пищеварительных ферментов, не содержащих желчь, - мезим*, панкреатин, креон*), устранение кишечного дисбактериоза (пробиотики, эубиотики), санацию хронических воспалительных процессов органов брюшной полости и других сопутствующих острых и хронических заболеваний (при этом следует избегать гепатотоксичных антибиотиков).
• Запрещение проведения физиотерапевтических процедур, вакцинаций, приема гепатотоксичных препаратов, в том числе психотропных и снотворных средств.
Такое подробное описание мероприятий базисной терапии объясняется тем, что строгое ее соблюдение играет важную роль в лечении ряда больных циррозом печени.
Решающую роль играет этиотропная терапия.
При циррозе печени, вызванном HBV, показана терапия интерфероном. При наличии противопоказаний (главные - класс С по Чайлд-Пью, почечная недостаточность и др.) показана терапия ламивудином. Уменьшение виремии благоприятно сказывается на прогнозе. При циррозе печени, вызванном HCV, показана терапия интерфероном и рибавирином. При плохой переносимости и противопоказаниях от медикаментозной терапии отказываются.
При алкогольных циррозах печени проводят лечение эссенциальными фосфолипидами (эссенциале форте Н*), флавоноидами (препараты плодов расторопши пятнистой - карсил*, силимар*, экстракт листьев артишока - хофитол*).
Помимо этиотропной терапии, больные компенсированным неактивным или с минимальной активностью циррозом печени в другой лекарственной терапии не нуждаются. Им показано лишь соблюдение правильного образа жизни.
Больные декомпенсированным неактивным или с минимальной активностью циррозом печени нуждаются в строгом соблюдении режима и диеты, лекарственную терапию проводят патогенетическими и симптоматическими средствами. К ним относят дезинтоксикационные средства (внутривенное капельное введение 200-300 мл 5% раствора глюкозы*), эссенциале* по 2 капсулы 3 раза в день или препараты плодов расторопши пятнистой (карсил*, легалон*, силимар*), экстракт листьев артишока (хофитол*) по 2 таблетки 3 раза в день на протяжении 2 мес 2-3 курса в год.
Декомпенсированный цирроз печени с признаками портальной гипертензии (кроме вышеперечисленных мероприятий) нуждается в лечении отечноасцитического синдрома. Лечение асцита требует осмотрительности из-за многочисленных побочных реакций диуретической терапии. Уменьшение и особенно устранение асцита способствуют снижению портального давления и служат профилактикой портокавальной энцефалопатии и кровотечений из варикозных вен пищевода.
Следует помнить, что резорбтивная способность брюшины не превышает 400 мл/сут, и потеря большего количества жидкости приводит к обезвоживанию тканей, гипокалиемии и метаболическому алкалозу.
Первый этап - применение диеты с резким ограничением соли - до 1,5 г натрия хлорида в сутки, но даже если пищу готовить без добавления соли, в ней будет содержаться ее 3-4 г. Поэтому следует исключить продукты, изначально содержащие натрий (колбасы, консервы, сыры, морепродукты). Количество вводимой жидкости должно составлять 800-1500 мл. Если на фоне гипонатриевой диеты не снижается масса тела на 300-400 г, и нет спонтанного диуреза, то назначают антагонисты альдостерона - спиронолактон (верошпирон*) 75-150 мг/сут. При отсутствии эффекта к спиронолактону добавляют фуросемид, далее - этакриновую кислоту (урегит*) и триампур* (гидрохлоротиазид + триамтерен). При резистентном (неконтролируемом) асците, угрозе разрыва тканей живота, дыхательной и сердечной недостаточности вследствие асцита проводят парацентез тонкой иглой с извлечением 3-4 л асцитической жидкости. Выведение больших объемов противопоказано из-за потерь электролитов и белка, ведущих к печеночной недостаточности.
Консервативное лечение портальной гипертензии предусматривает также прием лекарственных препаратов, снижающих портальное давление. Для этого используют пролонгированные нитраты в обычных терапевтических дозах и р-адреноблокаторы в дозах, снижающих ЧСС в покое на 25%. Такое лечение проводят в течение длительного времени (месяцы, годы), оно обязательно для больных с наличием в анамнезе кровотечения из расширенных вен пищевода.
Медикаментозная терапия асцита включает, помимо вышеописанного, введение белковых препаратов: нативную концентрированную плазму и 20% раствор альбумина. Они способствуют повышению коллоидно-осмотического давления плазмы и содержания альбумина.
Для декомпрессии портальной системы показана операция - наложение портокавальных сосудистых анастомозов, в тактику входит наложение внутрипеченочного шунта. Показания к операции - варикозно расширенные вены пищевода у больных, перенесших кровотечение, а также высокая портальная гипертензия. Оперативное лечение (спленэктомия) производят также больным с наличием синдрома гиперспленизма.
При билиарном циррозе печени лечение холестаза проводят аналогично таковому при хроническом холестатическом гепатите (см. выше).
Борьба с осложнениями предусматривает следующие мероприятия.
• Остановка пищеводно-желудочного кровотечения включает:
- переливание свежезаготовленной крови дробно в объеме 100-200 мл, при необходимости повторно капельно;
- парентеральное введение менадиона натрия бисульфит (викасол*), хлорида кальция, аминокапроновой кислоты;
- внутривенное введение питуитрина*9 или вазопрессина* в 100-200 мл 5% раствора глюкозы* (препарат снижает давление в воротной вене);
- обтурационное тампонирование пищевода зондом с баллоном, желудочная гипотермия; при отсутствии эффекта производят эндоскопическое склерозирование вен, обширные трансабдоминальные операции по перевязке вен сопровождаются очень высокой летальностью;
- для предупреждения постгеморрагической комы показаны удаление крови из кишечника назначением: осмотических слабительных, препа-
ратов на основе лактулозы (дюфалак*), промывание желудка и откачивание содержимого через зонд;
- прием антибиотиков, не всасывающихся в кишечнике (канамицин, стрептомицин) внутрь(антибиотики подавляют микрофлору кишечника, что значительно снижает бактериальный внутрикишечный протеолиз с образованием аммиака, индола, скатола и др.);
- парентеральное введение жидкости (в том числе полиглюкина*) до 2 л/сут.
Борьба с пищеводно-желудочным кровотечением не всегда заканчивается успешно, несмотря на весь комплекс мероприятий в 20-40% случаев наступает смертельный исход.
• Лечение печеночной комы требует введения всех препаратов внутривенно:
- для обезвреживания уже поступившего в кровь аммиака и других метаболитов - глутаминовой кислоты, орнитина;
- для улучшения обмена печеночных клеток - эссенциале*, витаминов группы В* и С*, тиоктовой (липоевой*) кислоты, препаратов калия, которые вводят в 5% растворе глюкозы* внутривенно капельно (за сутки - до 2-3 л);
- постоянно контролируют электролитный баланс, кислотно-основное состояние и своевременно регулируют его введением электролитов и буферных смесей: при развитии метаболического ацидоза вводят 200- 600 мл 4% раствора гидрокарбоната натрия, а при выраженном метаболическом алкалозе вводят препараты калия до 10 г/сут;
- антибиотики (мономицин*, канамицин, стрептомицин) вводят через желудочный зонд для подавления жизнедеятельности кишечной микрофлоры.
Однако, несмотря на интенсивное лечение, печеночная кома при циррозе печени чаще всего заканчивается летальным исходом. Профилактика комы сводится к проведению лечебных мероприятий, предотвращающих развитие желудочно-кишечных кровотечений, инфекций, интоксикации; требуется осторожность в назначении диуретиков, седативных и снотворных препаратов.
К факторам плохого прогноза печеночной энцефалопатии относят: продолжающееся желудочно-кишечное кровотечение, высокую степень портальной гипертензии («резистентный» асцит, варикозное расширение вен пищевода III-IV степени), длительность цирроза печени более 5 лет, степень тяжести цирроза класса С и отсутствие положительного клинического эффекта в первую неделю лечения.
Прогноз
Сформировавшийся цирроз печени является необратимым состоянием, однако этиотропная терапия, правильный образ жизни, успешное воздействие на активность процесса, проведение всего комплекса лечебных мероприятий могут способствовать тому, что цирроз печени длительное время остается компенсированным. Накапливается опыт по применению препаратов ингибиторов фиброгенеза (колхицин).
Профилактика
Мероприятиями профилактики являются устранение или ограничение действия этиологических факторов (снижение употребления алкоголя, вакцинация от гепатита В, снижение риска гепатита С), своевременное распознавание и лечение хронического гепатита и жировой дистрофии печени. При наличии цирроза необходимо проводить мероприятия, направленные на прекращение прогрессирования процесса и профилактику осложнений.
ХРОНИЧЕСКИЙ ХОЛЕЦИСТИТ
Хронический холецистит - воспаление желчного пузыря, преимущественно бактериального происхождения, иногда возникающее вторично при дискинезии желчных путей и желчных камнях или паразитарных инвазиях. В данном разделе будет рассмотрен хронический бескаменный холецистит. Хронический калькулезный холецистит рассматривают в курсе хирургических болезней.
Хронический бескаменный холецистит - одно из распространенных заболеваний желчевыводящих путей, встречается во всех возрастных группах, но преимущественно страдают лица среднего возраста (от 40 до 60 лет). Заболеваемость составляет 6-7 случаев на 1000 населения. Женщины болеют чаще мужчин в 3-4 раза.
Этиология
Основную роль в развитии хронического холецистита играет условнопатогенная микрофлора. Наиболее частый возбудитель - кишечная палочка (у 40% больных), несколько реже - стафилококки и энтерококки (по 15%), стрептококки (у 10% больных). У трети больных обнаруживают смешанную микрофлору. Очень редко (примерно в 2% случаев) высевают протей и дрожжевые грибы. Этиологическая роль лямблий сомнительна. Несмотря на довольно высокую частоту обнаружения лямблий в дуоденальном содержимом, в настоящее время считают, что лямблиоз наслаивается на воспалительный процесс в желчном пузыре.
Для развития хронического холецистита недостаточно только инфицирования желчи. Предрасполагают к нему застой желчи и повреждение стенок желчного пузыря.
• Застою желчи способствуют:
- нарушение режима питания (ритма, качества и количества употребляемой пищи);
- психоэмоциональные факторы;
- гиподинамия;
- иннервационные нарушения различного генеза;
- запор;
- беременность;
- нарушения обмена, приводящие к изменению состава желчи (ожирение, атеросклероз, сахарный диабет и пр.);
- органические нарушения путей оттока желчи.
Повреждение стенок желчного пузыря возможно в результате:
- раздражения слизистой оболочки желчного пузыря желчью с измененными физико-химическими качествами;
- травматизации конкрементами (камни могут образоваться в желчном пузыре без предшествующего воспаления);
- раздражения слизистой оболочки панкреатическими ферментами, затекающими в общий желчный проток;
- травм желчного пузыря.
Патогенез
Инфекция попадает в желчный пузырь тремя путями: восходящим, гематогенным и лимфогенным.
• Восходящим путем инфекция проникает из кишечника. Этому способствуют гипо- и ахлоргидрия, нарушение функции сфинктера Одди, экскреторная недостаточность поджелудочной железы.
• Гематогенным путем инфекция может проникнуть в желчный пузырь из большого круга кровообращения по почечной артерии (чаще при хроническом тонзиллите и других поражениях рото- и носоглотки) или из кишечника по воротной вене. Способствует этому нарушение барьерной функции печени.
• Лимфогенным путем инфекция попадает в желчный пузырь при аппендиците, воспалительных заболеваниях женской половой сферы, пневмонии и нагноительных процессах в легких.
Благоприятные условия для развития попавшей в желчный пузырь инфекции создает застой желчи, обусловленный воздействием перечисленных причин. Застой желчи изменяет холатохолестериновый индекс (снижение уровня желчных кислот и увеличение концентрации холестерина), что способствует образованию холестериновых камней (рис. 3-5).
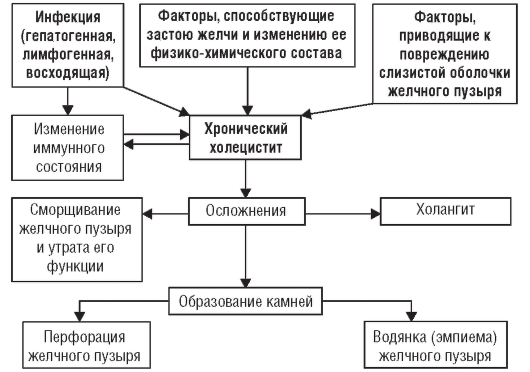
Рис. 3-5. Патогенез хронического бескаменного холецистита
В патогенезе хронического бескаменного холецистита имеют значение также факторы, приводящие к повреждению стенок желчного пузыря с травматизацией его слизистой оболочки, нарушением кровообращения и развитием воспаления. У ряда больных хроническим холециститом первично происходит повреждение слизистой оболочки желчного пузыря при нарушенном оттоке желчи, а инфекция присоединяется вторично.
Длительный воспалительный процесс, хронический очаг инфекции отрицательно влияют на иммунобиологическое состояние больных, снижают реактивность организма.
Больным хроническим холециститом свойственны специфическая и неспецифическая сенсибилизация к различным факторам внешней и внутренней среды, развитие аллергических реакций. В результате создается порочный круг: воспаление в желчном пузыре способствует поступлению в кровь микробных антигенов, что приводит к сенсибилизации, которая поддерживает хроническое течение холецистита и способствует его рецидивированию.
Если морфологические изменения развиваются только в слизистой оболочке желчного пузыря и носят катаральный характер, то функция желчного пузыря долгое время остается достаточно сохранной. Если же воспалительный процесс захватывает всю стенку желчного пузыря, то происходят утолщение и склероз стенки, сморщивание пузыря, утрачиваются его функции и развивается перихолецистит. Воспалительный процесс из желчного пузыря может распространиться на желчные ходы и привести к холангиту.
Помимо катарального воспаления, при холецистите может возникать флегмонозный или даже гангренозный процесс. В тяжелых случаях в стенке желчного пузыря образуются мелкие абсцессы, очаги некроза, изъязвления, которые могут вызвать перфорацию или развитие эмпиемы.
Длительный воспалительный процесс при нарушении оттока желчи, помимо образования камней, может привести к образованию воспалительных «пробок».
Эти «пробки», закупоривая пузырный проток, способствуют развитию водянки желчного пузыря и при бескаменной форме холецистита. Основные звенья патогенеза представлены на рис. 3-5.
Таким образом, при хроническом бескаменном холецистите могут развиваться следующие осложнения:
• перихолецистит;
• холангит;
• перфорация желчного пузыря;
• водянка;
• эмпиема желчного пузыря;
• образование камней.
Вследствие чрезвычайно тесной анатомической и физиологической связи желчного пузыря с близлежащими органами у больных хроническим холециститом поражаются печень (гепатит), поджелудочная железа (панкреатит), желудок и двенадцатиперстная кишка (гастрит, дуоденит).
Классификация
Общепринятой классификации хронического бескаменного холецистита не существует. Ниже, в несколько упрощенном виде приведена классификация, предложенная A.M. Ногаллером (1979).
• По степени тяжести:
- легкая форма;
- средней тяжести;
- тяжелая форма.
• По стадиям заболевания:
- обострения;
- стихающего обострения;
- ремиссии (стойкой и нестойкой).
• По наличию осложнений:
- неосложненный;
- осложненный.
• По характеру течения:
- рецидивирующий;
- монотонный;
- перемежающийся.
Легкая форма характеризуется нерезко выраженным болевым синдромом и редкими (1-2 раза в год), непродолжительными (не более 2-3 нед) обострениями. Боли локализованные, длятся 10-30 мин, проходят, как правило, самостоятельно. Диспептические явления редки. Функция печени не нарушена. Обострения чаще обусловлены нарушением режима питания, перенапряжением, острой интеркуррентной инфекцией (грипп, дизентерия и др.).
Для хронического холецистита средней тяжести характерен болевой синдром. Боли стойкие, с характерной иррадиацией, связаны с нерезким нарушением диеты, небольшим физическим и психическим переутомлением. Диспептические явления выражены, часто бывает рвота. Обострения возникают 5-6 раз в год, носят затяжной характер. Могут быть изменены функциональные пробы печени. Возможны осложнения (холелитиаз).
При тяжелой форме резко выражены болевой и диспептический синдромы. Частые (1-2 раза в месяц и чаще) и продолжительные желчные колики. Лекарственная терапия малоэффективна. Функция печени нарушена. Осложнения развиваются часто.
При обострении воспалительного процесса в желчном пузыре, помимо выраженных субъективных ощущений (боль, диспептический синдром), отчетливо проявляются острофазовые показатели (лейкоцитоз со сдвигом лейкоцитарной формулы влево, повышение СОЭ, увеличение содержания а2-глобулинов, положительный СРБ) и изменения биохимических констант (повышение уровня билирубина, преимущественно за счет связанного, может повышаться уровень аминотрансфераз). Печень может быть увеличена.
При стихающем обострении все указанные явления выражены в меньшей степени.
В период ремиссии клинические симптомы исчезают или значительно уменьшаются, все признаки воспаления отсутствуют.
Хронический холецистит может протекать без осложнений. При длительном течении или тяжелой форме заболевания развиваются осложнения.
При рецидивирующем холецистите период обострения сменяется полной или относительной ремиссией (все клинические симптомы полностью исчезают или значительно уменьшаются).
Для монотонного течения заболевания характерно отсутствие ремиссий. Больные постоянно испытывают боль, чувство тяжести в правом подреберье или эпигастральной области, жалуются на диспептические расстройства.
При перемежающемся хроническом холецистите на фоне постоянно выраженных клинических симптомов периодически отмечаются обострения той или иной степени тяжести с повышением температуры тела или типичной желчной коликой.
Клиническая картина
Проявления болезни определяются наличием следующих синдромов:
• болевого;
• диспептического;
• воспалительного (при обострении);
• нарушением функции кишечника (кишечный дискинетический синдром);
• нарушением липидного обмена (по клинико-лабораторным данным);
• холестатического (при закупорке общего желчного протока);
• вовлечением в процесс других органов и систем.
На первом этапе диагностического поиска выявляют:
• болевой синдром, уточняют его характеристику;
• диспептический синдром и его проявления;
• симптомы, отражающие вовлечение в патологический процесс других органов и систем;
• факторы, приведшие к развитию заболевания и его обострению;
• характер течения заболевания.
Боли при хроническом бескаменном холецистите имеют ряд особенностей:
• локализуются главным образом в правом подреберье, реже - в подложечной области;
• иррадиируют в правую лопатку, реже в правую половину грудной клетки, ключицу, поясницу;
• по характеру, как правило, тупые;
• могут беспокоить постоянно или возникают нечасто;
• продолжительность болей от нескольких минут и часов до нескольких дней;
• обусловлены нарушением диеты, волнением, охлаждением, инфекцией, физическим напряжением, возникают, как правило, после приема жирной жареной пищи, употребления обильного количества пищи.
Боли, появляющиеся при физической нагрузке или после нее, при тряской езде, больше характерны для желчнокаменной болезни (калькулезного холецистита).
У больных вне обострения при легком течении хронического холецистита болей может не быть. При обострении характер боли становится похожим на приступ острого холецистита, интенсивность резко выражена.
Диспептические явления часто наблюдаются при хроническом холецистите. Больные жалуются на тошноту, пустую отрыжку, чувство горечи во рту, рвоту, изменение аппетита, плохую переносимость некоторых видов пищи (жиры, алкоголь, продукты, содержащие уксус и др.). Рвота при холецистите не приносит облегчения. Кроме того:
• сильные и стойкие боли в эпигастральной области могут свидетельствовать о наличии сопутствующих патологических изменений в желудке;
• боли около пупка или в нижней части живота, сопровождающиеся поносом или запором, свидетельствуют о хроническом колите;
• боли в левом подреберье или опоясывающие - о хроническом панкреатите.
Больного может беспокоить повышение температуры тела, связанное, как правило, с развитием воспаления желчного пузыря.
Фебрильная температура тела с жалобами на кожный зуд даже при отсутствии желтухи характерна для холангита.
При изучении анамнеза выявляют факторы, способствующие развитию заболевания или обострения (наличие в семье больных с патологией желчных путей, нарушение режима питания и погрешности в диете, перенесенные вирусный гепатит, дизентерия, заболевания желудка, кишечника и др.).
Определяют характер течения: монотонный, постоянный или волнообразный, рецидивирующий хронический бескаменный холецистит.
Ha первом этапе может сложиться достаточно убедительное впечатление о вовлечении в патологический процесс желчевыводящих путей. Характер заболевания, его нозологическую принадлежность определяют только по данным, полученным на последующих этапах обследования.
На втором этапе диагностического поиска обнаруживают симптомы поражения желчного пузыря и вовлечения в процесс других органов.
При обследовании больного необходимо обратить внимание на зоны кожной гиперестезии, преимущественно в правом подреберье и под правой лопаткой (характерный симптом хронического холецистита). В тяжелых случаях зоны кожной гиперестезии более обширны. При дискинезии желчных путей гиперестезия выражена слабо или отсутствует.
Поверхностная пальпация живота позволяет установить степень напряжения мышц брюшной стенки (при обострении хронического холецистита повышается резистентность брюшной стенки в правом подреберье) и область наибольшей болезненности - правое подреберье.
Основное место в физикальном обследовании больного занимают глубокая пальпация и выявление болевых точек.
Характерным пальпаторным симптомом при воспалительном поражении желчного пузыря служит болезненность в области проекции желчного пузыря при вдохе (симптом Кера).
Болезненность при поколачивании по правому подреберью (симптом Лепене), по реберной дуге справа (симптом Грекова-Ортнера) и при надавливании на диафрагмальный нерв между ножками грудиноключично-сосцевидной мышцы (симптом Георгиевского-Мюсси или френикус-симптом) также относят к признакам, встречающимся чаще при обострении воспалительного процесса в желчном пузыре.
При неосложненном течении хронического холецистита желчный пузырь не пальпируется. Если же при пальпации желчный пузырь определяется, то это свидетельствует об осложнениях (водянка, эмпиема желчного пузыря). Увеличенный желчный пузырь может определяться при сдавлении общего желчного протока увеличенной головкой поджелудочной железы (хронический панкреатит, рак головки железы) или же при воспалительных (опухолевых) изменениях фатерова (дуоденального) соска, также обусловливающих нарушение оттока по общему желчному протоку.
При физикальном обследовании брюшной полости можно получить данные, свидетельствующие о вовлечении в процесс печени (увеличение ее размеров, изменение консистенции), поджелудочной железы (болезненность характерных зон и точек), желудка, толстой кишки.
Выявление экстрасистол (особенно у лиц молодого возраста) может быть свидетельством холецистокардиального синдрома.
При закупорке (слизистой пробкой или камнем) общего желчного протока может наблюдаться выраженная желтушность кожных покровов и слизистых оболочек. Субиктеричность склер, небольшая желтушность выявляются при обострении хронического бескаменного холецистита без закупорки желчных путей.
Решающее значение для уточнения характера поражения желчного пузыря принадлежит третьему этапу диагностического поиска. На этом этапе:
• уточняют степень выраженности (активности) воспалительного процесса в желчном пузыре;
• выявляют нарушения липидного и пигментного обменов;
• уточняют степень вовлечения в патологический процесс печени, поджелудочной железы и других органов;
• выявляют функциональное состояние желчного пузыря (моторная, эвакуаторная, концентрационная функции);
• определяют наличие (или отсутствие) камней, развитие осложнений;
• ставят окончательный клинический диагноз.
Клинический анализ крови вне обострения патологии не выявляет; при обострении - лейкоцитоз со сдвигом лейкоцитарной формулы влево, повышение СОЭ. При биохимическом исследовании крови обнаруживают повышение других острофазовых показателей (содержание α2-глобулинов, уровень фибриногена). Биохимическое исследование крови позволяет выявить нарушение липидного обмена: увеличение содержания холестерина, триглицеридов.
Признаки холестаза - повышение концентрации холестерина, связанного билирубина, активности щелочной фосфатазы и ГГТП - характерны для обструкции общего желчного протока (слизистой пробкой или камнем).
При вовлечении в патологический процесс печени незначительно повышен уровень АСТ, АЛТ, при поражении поджелудочной железы выявляют стеато- и креаторею, в крови повышено содержание амилазы.
О выраженности воспалительного процесса в желчном пузыре можно судить по данным визуального осмотра желчи, полученной при дуоденальном зондировании. Порция «В» (пузырная желчь) при воспалении бывает мутной, с хлопьями и слизью. При микроскопическом исследовании этой порции в большом
количестве обнаруживают лейкоциты и десквамированный эпителий. Диагностическая значимость лейкоцитов в желчи невелика. Основное значение дуоденального зондирования состоит в установлении характера сократительной (эвакуаторной и моторной) функции желчного пузыря, определении концентрационной функции.
Отсутствие порции «В» свидетельствует о нарушении сократительной функции желчного пузыря (наблюдается не только при органических поражениях, но и при функциональных изменениях).
Получение пузырной желчи в количестве более 50-60 мл указывает на застойные явления в желчном пузыре и косвенно свидетельствует о его двигательных расстройствах.
Большое количество кристаллов холестерина, билирубината кальция может косвенно свидетельствовать о снижении стабильности коллоидного раствора желчи и указывать на предрасположенность к холелитиазу на фоне застоя инфицированной желчи. Обнаружение большого количества эозинофилов при микроскопическом исследовании желчи может косвенно указывать на паразитарную инвазию.
Большую диагностическую значимость по сравнению с традиционным дуоденальным зондированием придают непрерывному фракционному зондированию (проводится в специализированных стационарах), которое позволяет с большей достоверностью судить об изменениях в желчных путях и пузыре.
При бактериологическом исследовании желчи возбудитель обнаруживают менее чем у 50% больных. Этиологическое значение микроба подтверждается нарастанием титра антител в сыворотке крови к высеянному из желчи возбудителю.
Более детально изучить функциональное состояние желчного пузыря и желчных путей позволяет сочетание дуоденального зондирования с рентгенологическими методами обследования, среди которых главное место принадлежит пероральной холецистографии. У больных хроническим бескаменным холециститом в 1,5-2 раза медленнее происходит опорожнение желчного пузыря (неизмененный желчный пузырь контрастируется до 90 мин, при холецистите - дольше). Затруднение смещаемости желчного пузыря, неровные контуры и неправильная форма, изменение обычного расположения его служат основными рентгенологическими признаками перихолецистита. При хроническом холецистите иногда выявляются расширение общего желчного протока, задержка в нем контрастного вещества и рефлюкс в печеночный проток. Холецистограмма может быть не изменена, но это не исключает наличия холецистита, холангита или дискинезии желчных путей.
У ряда больных желчный пузырь при холецистографии может не контрастироваться, что бывает в следующих случаях: при непроходимости желчных протоков вследствие наличия камней или воспалительного процесса; переполнении желчного пузыря камнями; при ослаблении концентрационной способности желчного пузыря.
Иногда отсутствие тени желчного пузыря не связано с его патологией, а отражает нарушение всасывания контрастного вещества в кишечнике (при энтерите, усиленной перистальтике), иначе говоря, «отключенный» желчный
пузырь при холецистографии еще не дает полного основания считать его патологически измененным.
Во всех случаях «отключенного» желчного пузыря производят внутривенную холеграфию. Холеграфия выявляет патологические изменения в общем желчном, пузырном и печеночных протоках, а также в большом сосочке двенадцатиперстной кишки (фатеров сосок). При холеграфии легче проследить процесс заполнения желчного пузыря контрастным веществом.
Отсутствие наполнения желчного пузыря при внутривенном введении контрастного вещества свидетельствует о значительных изменениях в желчевыделительной системе.
При наличии сморщенного атрофического желчного пузыря, заполнении его полости камнями, закупорке пузырного протока тень желчного пузыря может отсутствовать и при холеграфии, но выявляются общий желчный и печеночные протоки.
Отсутствие контрастирования желчного пузыря и протоков при внутривенной холеграфии наблюдается при желтухе, нарушении экскреторной функции печени, снижении тонуса сфинктера Одди и в некоторых других случаях.
Другие рентгенологические методы (чрескожное контрастирование желчных путей с помощью пункции печени, лапароскопическая холецистохолангиография, холангиография на операционном столе) проводятся во время операции или в предоперационном периоде при обтурационной желтухе неясного генеза.
Этим же больным проводят ФГДС, которая позволяет осмотреть большой сосочек двенадцатиперстной кишки и оценить его состояние. С помощью этого метода проводится и ретроградная панкреатохолангиография.
При тяжелых заболеваниях желчного пузыря и желчных путей, когда диагноз не удается поставить по данным клинических, лабораторных и рентгенологических методов исследования, производят лапароскопию. Она позволяет осмотреть желчный пузырь, печень и определить патологию.
Метод ультразвуковой диагностики имеет большое значение для оценки формы желчного пузыря, состояния его стенок, наличия камней и спаек. После приема желчегонных средств можно судить о сократительной функции желчного пузыря. С помощью эхографии также выявляют расширенный желчный пузырь при патологии большого сосочка двенадцатиперстной кишки, головки поджелудочной железы.
Компьютерная томография не имеет существенных преимуществ по сравнению с УЗИ в диагностике конкрементов желчного пузыря, однако более точно, чем УЗИ, определяет кальцификацию конкрементов. Это важно в отборе больных для проведения литолитической терапии препаратами желчных кислот.
Диагностика
Диагноз хронического холецистита ставят на основании следующих признаков :
• характерный болевой синдром в сочетании с диспептическими расстройствами;
• признаки вовлечения в процесс желчного пузыря (болевые точки, зоны кожной гиперестезии);
• данные лабораторных и инструментальных методов исследования, указывающие на патологию желчного пузыря и отсутствие камней.
Большая вариабельность клинической картины хронического холецистита, присоединение осложнений, вовлечение в патологический процесс других органов и систем делают диагностику его достаточно сложной.
Хронический бескаменный холецистит необходимо дифференцировать от желчнокаменной болезни и дискинезий желчного пузыря и желчных путей.
• Для желчнокаменной болезни характерны следующие признаки:
- особенности болей: приступообразные, интенсивные, с транзиторной желтухой, типа печеночной колики;
- чаще болеют лица пожилого возраста, среди которых преобладают женщины с ожирением и другими обменными заболеваниями (сахарный диабет, мочекаменная болезнь, артрозы), отягощенный семейный анамнез;
- особенности дуоденального содержимого: большое количество кристаллов холестерина, билирубината кальция, «песок», холатохолестериновый индекс менее 10;
- выявление камней при рентгенологическом и (или) ультразвуковом обследовании.
• Для дискинезий желчного пузыря характерны следующие признаки:
- связь болей с волнениями и нервно-психической нагрузкой;
- болевые точки и зоны кожной гиперестезии, характерные для воспаления желчного пузыря, отсутствуют или выражены нерезко;
- при дуоденальном зондировании отмечается лабильность пузырного рефлекса; воспалительные элементы в желчи, как правило, отсутствуют;
- при холецистографии отсутствуют признаки перихолецистита. Дискинезия желчного пузыря (нарушение его моторики) может протекать
по гипотоническому и гипертоническому типу.
Дифференциация различных моторных нарушений желчного пузыря и желчевыводящих путей возможна на основании клинических признаков, данных дуоденального зондирования, результатов рентгенологического исследования (холецистография).
• Клинические признаки:
- при гипертоническом типе дискинезии боли схваткообразные, кратковременные, отмечается связь болей с нарушением диеты; периодически возникают приступы желчной колики; может быть преходящая желтуха; в промежутках между приступами болей, как правило, не бывает;
- для гипотонического типа дискинезии характерны постоянные боли, которые сопровождаются чувством распирания в правом подреберье; периодически все эти явления усиливаются; боли нарастают при надавливании на желчный пузырь; приступы желчной колики крайне редки.
• Дуоденальное зондирование:
- при гипертонической дискинезии увеличено время выделения порции «А» (гипертония пузырного протока), уменьшено время выделения порции «В» (гиперкинезия желчного пузыря) при сохраненном объеме желчного пузыря или удлиненное, прерывистое выделение желчи («гипертония желчного пузыря»); исследование часто сопровождается болями в правом подреберье;
- при гипотонической дискинезии желчь порции «В» выделяется в большом количестве и долго, часто возникает повторный рефлекс на опорожнение желчного пузыря.
• Холецистография:
- при гипертонической дискинезии тень пузыря округлая; опорожнение замедлено («застойный гипертонический желчный пузырь») или ускорено («гиперкинетический желчный пузырь»);
- для гипокинетической дискинезии характерен увеличенный пузырь продолговатой формы с замедленным опорожнением, несмотря на неоднократный прием желчегонных средств (например, яичных желтков).
Дискинезии желчного пузыря и желчных путей могут быть самостоятельной нозологической формой (так называемые первичные дискинезии), однако чаще они развиваются при хронических холециститах и желчнокаменной болезни (вторичные дискинезии).
Хронический холецистит редко остается изолированным заболеванием в течение длительного времени. Часто в патологический процесс вовлекаются остальные органы пищеварения (прежде всего печень). При формировании диагностической концепции необходимо уточнить характер их поражения.
Вместе с тем заболевания органов пищеварения нередко предшествуют развитию хронического холецистита, имеют сходные клинические синдромы и затрудняют раннюю диагностику хронического холецистита.
Формулировка развернутого клинического диагноза учитывает:
• стадию болезни:
- обострение;
- стихающее обострение;
- ремиссию;
• степень тяжести течения:
- легкую;
- средней тяжести;
- тяжелую;
• характер течения:
- рецидивирующий;
- монотонный;
- перемежающийся;
• состояние функции желчного пузыря:
- сохраненную функцию;
- нефункционирующий или «отключенный» желчный пузырь;
- дискинезию - гипокинетический или гиперкинетический тип;
• осложнения;
• состояние других органов и систем (хронический гепатит, хронический панкреатит и пр.).
При обнаружении конкрементов в желчном пузыре целесообразно говорить о желчнокаменной болезни и указывать осложнения, связанные с миграцией камней.
Лечение
Лечение хронического холецистита определяется фазой течения процесса - обострение или ремиссия.
В фазе обострения следует уменьшить объем и калорийность пищи с последующим постепенным увеличением суточной калорийности. Рекомендуют частое дробное питание в одни и те же часы, что способствует лучшему оттоку желчи. Исключают жареные, соленые и копченые блюда, яичные желтки, экстрактивные вещества мяса и рыбы.
Для устранения болей используют парентеральное введение дротаверина (но-шпа*), бенциклана (галидор*), папаверина, метоклопрамида. При выраженных болях используют метамизол натрия (баралгин*) по 5,0 мл внутривенно или внутримышечно. При стихании болей переходят на прием перечисленных препаратов внутрь. Как правило, боли купируются в первые 1-2 нед от начала лечения, обычно терапия этими препаратами не превышает 3-4 нед.
Боли при хроническом холецистите зависят не только от выраженных дискинетических расстройств желчного пузыря, сфинктеров билиарного тракта, но и от интенсивности воспалительного процесса в желчевыводящих путях. В связи с этим раннее применение антибактериальной терапии оказывается весьма эффективным. Так как определение чувствительности высеваемой из желчи микрофлоры к антибиотикам, как правило, невыполнимо, целесообразно в такой ситуации назначать антибиотики широкого спектра действия, не подвергающиеся в печени существенной биотрансформации. Исходя из этого внутрь назначают антибиотики, приникающие в желчь в очень высоких концентрациях: эритромицин по 0,25 г 6 раз в сутки, рифампицин по 0,15 г 3 раза в сутки, линкомицин внутрь по 0,5 г 3 раза в сутки за 1-2 ч до еды.
Антибиотики, проникающие в желчь в достаточно высоких концентрациях: доксициклин по 0,05-0,1 г 2 раза в сутки, метациклин в дозе 0,3 г 2-3 раза в сутки. Лечение антибактериальными средствами проводят 8-10 дней. После 2-4-дневного перерыва целесообразно повторить лечение этими препаратами еще 7-8 дней.
В случае обнаружения паразитарной инвазии проводят соответствующую терапию. Так, при лямблиозе назначают метронидазол по 0,25 г 3 раза в сутки после еды в течение 7 дней или фуразолидон по 0,15 г 3-4 раза в сутки.
Назначение антибактериальных препаратов не исключает необходимости проведения комплексного лечения с использованием спазмолитических, желчегонных препаратов, а также физиотерапевтических процедур.
Спазмолитики устраняют спазм желчных путей, облегчают отток желчи и тем самым ликвидируют болевой синдром. В случае редких болевых приступов эти препараты применяют эпизодически. При длительных болях рекомендуется прием препаратов в течение 2-4 нед. Используют преимущественно мио-
тропные спазмолитики: дротаверин (но-шпа*) по 2,0 мл внутримышечно или внутрь по 0,04 г 2-3 раза в сутки, бенциклан (галидор*) 2,5% раствор внутримышечно или внутрь по 0,1-0,2 г 2-3 раза в сутки.
Применение желчегонных препаратов противопоказано в период обострения при выраженных воспалительных процессах в желчном пузыре и желчных протоках. Их назначают при стихании воспалительного процесса или в межприступный период.
Желчегонные препараты - холеретики (средства, стимулирующие образование желчи) - используют в фазу ремиссии у больных с признаками гипертонической дискинезии желчного пузыря. Используют препараты, содержащие желчь или желчные кислоты, - аллохол* по 1 таблетке 3 раза в день после еды, холензим* по 1 таблетке 3 раза в день до еды; ряд синтетических веществ - осальмид (оксафенамид*) по 0,25 г 3 раза в день, никодин* по 0,5 г 3 раза в день до еды; препараты растительного происхождения - сумма флавоноидов цветков бессмертника песчаного (фламин*) по 0,05 г 3 раза в день за 30 мин до еды, отвар кукурузных рыльцев 10 г на 200 мл воды по 1/4 стакана 3-4 раза в день за 15 мин до еды.
Если же имеется гипотоническая дискинезия желчного пузыря, то назначают холекинетики (препараты, усиливающие мышечное сокращение желчного пузыря и тем самым способствующие выделению желчи в кишечник). Такой подход обусловлен тем, что у многих больных хроническим бескаменным холециститом в фазе обратного развития воспалительного процесса наблюдается растяжение желчного пузыря с повышением тонуса сфинктера Люткенса, что и приводит к застою желчи в желчном пузыре. К холекинетикам относится сорбитол 10% раствор по 50-100 мл 2-3 раза в день за 30 мин до еды в течение 1-2 мес, сульфат магния 25% раствор по 1 столовой ложке натощак в течение 10 дней, карловарская соль по 1 чайной ложке на стакан воды за 30 мин до еды.
Курс лечения желчегонными средствами после обострения хронического холецистита составляет 10-30 дней в зависимости от получаемого эффекта. После такой терапии остаточные явления обострения ликвидируются.
В фазе стихающего обострения хронического холецистита на область правого подреберья рекомендуют грелку, горячие припарки из овса или льняного семени, аппликации парафина*, озокерита, торфа, назначают диатермию, индуктотермию.
Больным с холестериновыми камнями проводят лекарственное растворение камней с помощью препаратов хенодезоксихолевой (хенофальк) и урсодезоксихолевой кислот (урсофальк*). Урсофальк* назначают в течение нескольких месяцев в суточной дозе от 10 мг/кг до 12-15 мг/кг (по 2-5 капсул или 10-25 мг суспензии соответственно). Хенофальк внутрь перед сном, не разжевывая по 15 мг/кг в сутки, курс от 3 мес до 2 лет. Лекарственное растворение камней можно проводить, если диаметр камней не более 10-15 мм, желчный пузырь наполнен камнями не более чем на 1/3, сохранены функция желчного пузыря и проходимость общего и пузырного протоков.
Два-три раза в неделю больным при наличии гипотонической дискинезии проводится лечебное дуоденальное зондирование или тюбаж без зонда с сульфатом магния по 1/2 столовой ложки на 0,5 стакана воды или с минеральной водой. Сульфат магнезию не применяют при гиперкинетической дискинезии.
Лечебное дуоденальное зондирование показано при отсутствии камней в желчном пузыре.
При бескаменных холециститах иногда приходится прибегать к операции, что показано:
• при упорном течении заболевания с сохраненной функцией желчного пузыря, но имеющимися спайками, деформацией, перихолециститом;
• при «отключении» желчного пузыря или резко деформированном пузыре даже при отсутствии резких болей;
• в случае присоединения трудно поддающегося терапии хронического панкреатита, холангита.
В фазе ремиссии лечение включает соблюдение диеты, прием желчегонных препаратов, занятия ЛФК (утренняя гимнастика и дозированная ходьба), прием маломинерализованных щелочных вод, санаторно-курортное лечение на бальнеологических курортах с минеральными водами.
Прогноз
При нечастых обострениях прогноз удовлетворительный. Он значительно ухудшается при частых обострениях с признаками активности воспалительного процесса, выраженном болевом синдроме и развитии реактивного панкреатита.
Профилактика
С профилактической целью рекомендуют рациональное питание, активный образ жизни, физкультуру. Необходимо своевременное и рациональное лечение острого холецистита, заболеваний пищеварительного тракта, очаговой инфекции, интоксикаций, аллергий, невротических и обменных нарушений.
ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
Хронический панкреатит (ХП) - воспалительное заболевание поджелудочной железы различной этиологии, фазово-прогрессирующего течения, финальной стадией которого являются склероз паренхимы, деформация, облитерация протоков, утрата внешнесекреторной и эндокринной функции железы.
В начальной стадии заболевание морфологически проявляется воспалением, отеком, очагами некроза паренхимы и протоков. Развитие соединительной ткани приводит к деформации протоковой системы, сегментарному и диффузному склерозу, изменению плотности и формы железы.
Заболеваемость ХП за последние 30 лет возросла в 2-3 раза и составляет 49,5-73,4 на 100 000 населения. При ХП возможность развития рака поджелудочной железы возрастает в 5 раз. Ранние осложнения ХП возникают у 30% больных, поздние у 70%, все это ведет к инвалидизации и летальности. За 20 лет течения ХП умирают 50% заболевших.
Этиология
Среди разнообразных причин ХП преобладают главные - алкогольная интоксикация, заболевания билиарного тракта, патология зоны большого дуоденального сосочка (БДС).
Употребление алкоголя в индустриально развитых странах в 50-80% служит причиной ХП. Опасной дозой, т.е. приводящей к воспалению поджелудочной железы, считают ежедневный прием 40-80 мл этанола. Ежедневная доза 96% этилового спирта* в размере 150-200 мл в течение 10 лет приводит к ХП 90% пьющих.
Заболевания желчевыводящей системы, главным образом ЖКБ, как этиологический фактор встречается в 25-50% случаев ХП, возникающие при ЖКБ и другой билиарной патологии, называют билиарнозависимыми. Процент выявляемости ЖКБ зависит от диагностических возможностей УЗИ.
Воспаление поджелудочной железы, возникающее при патологии большого дуоденального сосочка, встречается примерно у 10% больных.
Такое же количество заболевших ХП имеют другие этиологические причины.
Патогенез
По патогенезу выделяют 2 основных варианта ХП - кальцифицирующий и обструктивный.
• По кальцифицирующему варианту развиваются следующие ХП:
- алкогольный;
- тропический;
- наследственный;
- при гиперпаратиреозе;
- идиопатический (ювенильный и старческий).
Прием алкоголя приводит к поступлению по кровеносной системе в поджелудочную железу алкоголя и его деривата ацетальдегида. Ацетальдегид, токсичность которого в 100 раз превышает токсичность этанола, нарушает проницаемость протоков и поступление в протоки межтканевой жидкости, что ведет к возрастанию внутрипротоковой концентрации белка и его преципитации. Алкоголь блокирует механизм, препятствующий осаждению кальция в образовавшиеся белковые пробки, возникают кальцинаты, усугубляющие обструкцию протоков. Выше обструкции происходят повышение давления, повреждение эпителия, поступление панкреатического сока в паренхиму поджелудочной железы.
• По обструктивному варианту возникают панкреатиты:
- при желчнокаменной болезни;
- стенозе большого дуоденального сосочка;
- травматическом повреждении;
- аномалиях главного панкреатического протока.
В дебюте процесса - нарушение оттока панкреатического сока в связи с препятствием в дистальном отделе главного панкреатического протока. Чаще всего это желчный конкремент, обтурирующий фатерову ампулу и вызывающий, раздражая слизистую протока, спазм сфинктера Одди. Вследствие обтурации происходит повышение давления в протоках поджелудочной железы и билиарного тракта; при этом, не имея выхода в двенадцатиперстную кишку, желчь забрасывается в вирсунгов проток. Происходят внутрипротоковая активация панкреатических ферментов (протеолитических и липолитических), повреждения эпителия протоков и паренхимы железы. Такой механизм возникновения присущ всем панкреатитам, входящим в группу обструктивных.
Хроническое воздействие ацетальдегида приводит к дегенерации клеток, продуцирующих гидрокарбонаты, жидкую часть сока, что увеличивает вязкость и потенцирует образование белковых пробок.
Высокое давление в зонах, расположенных выше пробок и кальцинатов, служит одной из причин атрофии ацинарных клеток и развития соединительной ткани.
Алкоголь приводит к жировой дистрофии ацинарных клеток, окислительному стрессу и локальным некрозам с последующим склерозом. Основные звенья хронического панкреатита представлены на рис. 3-6.
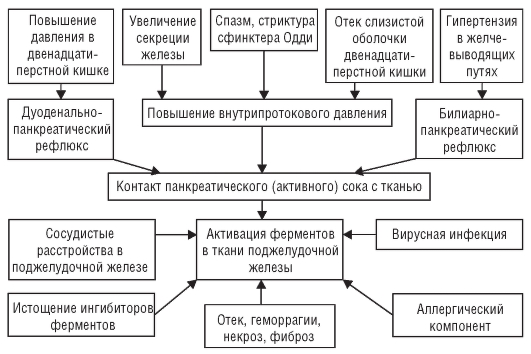
Рис. 3-6. Патогенез хронического панкреатита
Классификация
В настоящее время существует немалое количество классификаций, в основе которых лежат различные подходы. Поскольку промежуточное морфологическое исследование поджелудочной железы возможно только при проведении операции (операционная биопсия) и чревато осложнениями, в основе классификации лежат клиническая картина, результаты инструментальных исследований, этиологический и патогенетические подходы.
По морфологическим признакам выделяют:
• интерстициально-отечный;
• паренхиматозный;
• фиброзно-склеротический (индуративный);
• гиперпластический (псевдотуморозный);
• кистозный.
Определяя позицию в данной классификации, используют результаты УЗИ, КТ, не прибегая к морфологическому исследованию.
Достаточно широко в Западной Европе используют этиологическо-патогенетическую классификацию, выделяя токсико-метаболический ХП (алкогольный, никотиновый, гиперкальцемический, медикаментозный и др.), идиопатический ХП, обструктивный, аутоиммунный, генетический.
О сложности выявления этиологического фактора свидетельствуют данные о том, что более 85 лекарственных препаратов, включая сульфасалазин, тетрациклин, глюкокортикоиды, осмотические диуретики (натрийуретики), вызывают ХП.
Трудности классификации обусловлены отсутствием так называемых чистых форм болезни, при которых было бы отчетливое доминирование какоголибо синдрома (симптома) на всем протяжении болезни. Тщательный анализ каждой клинической ситуации показывает, что практически у всех больных на одном этапе развития болезни преобладают какие-то одни симптомы, в то время как при длительном течении клиническая картина может существенно отличаться от начальных периодов ее развития.
Клиническая картина
Проявления хронического панкреатита при различных формах болезни (как, впрочем, и в различные фазы течения болезни: обострение или ремиссия) складываются из 3 основных синдромов:
1) воспалительно-деструктивного;
2) нарушения внешней секреции;
3) нарушения внутренней секреции.
• Воспалительно-деструктивный синдром (обусловленный некрозом ткани поджелудочной железы, ее отеком и воспалительной реакцией) включает следующие симптомы:
- боль, имеющую четкие особенности;
- панкреатическую гиперферментемию и гиперамилазурию;
- симптомы интоксикации (лихорадка, артралгии, общая слабость, снижение аппетита);
- желтуху (обусловленную сдавлением протока поджелудочной железы ее увеличенной головкой или неспецифическим реактивным гепатитом);
- повышение неспецифических острофазовых показателей;
- воспалительные изменения поджелудочной железы, выявляемые при УЗИ, КТ, МРТ, позитронно-эмиссионной томографии и других исследованиях.
• Синдром нарушения внешней секреции:
- уменьшение количества панкреатического сока и снижение содержания в нем ферментов обусловлены уменьшением ацинарной ткани и обструкцией панкреатических протоков, включает: стеаторею, креаторею, гипопротеинемию, гипохолестеринемию, гипокальциемию;
- полигиповитаминоз;
- симптомы кишечной диспепсии;
- дистрофические изменения кожи и ногтей;
- снижение массы тела.
• Синдром нарушения внутренней секреции, вследствие уменьшения количества островков Лангерганса:
- снижение секреции инсулина;
- нарушение толерантности к глюкозе;
- сахарный диабет.
На первом этапе диагностического поиска часто выявляют факторы, способствующие развитию хронического панкреатита, при этом особое значение придают заболеваниям желчных путей (чаще у женщин), желудка и двенадцатиперстной кишки, а также злоупотреблению алкоголем в сочетании с нерациональным питанием (чаще у мужчин).
Наиболее частая жалоба - на боль различного характера. Локализация боли, ее иррадиация зависят от местонахождения очага поражения в железе. При поражении хвоста железы боль возникает в левом подреберье, левом эпигастрии, слева от пупка. Если поражено тело поджелудочной железы, боли появляются в эпигастрии, над пупком. При поражении головки железы боли возникают в пилородуоденальной зоне, треугольнике Шоффара, правом подреберье. При тотальном поражении железы боли «охватывают» всю верхнюю часть живота. Иррадиация болей при хроническом панкреатите весьма разнообразна, что объясняется особенностями иннервации железы. Чаще всего боли иррадиируют влево, в спину, в лопатку, реже в плечо.
Причиной болей служит реакция рецепторов протоков поджелудочной железы при повышении в них давления. В связи с этим все причины, увеличивающие препятствие оттоку секрета и объем панкреатического сока железы, вызывают боль, поэтому, как правило, боли возникают после приема жирных, жареных и острых блюд. Желчегонные средства, стимулируя секрецию, также служат причиной усиления болей при хроническом панкреатите.
В возникновении боли играет роль воздействие компонентов воспаления на рецепторный аппарат поджелудочной железы, а также ишемия участков паренхимы вследствие отека и фиброза. Болевые ощущения возникают при растяжении капсулы железы в результате увеличения органа или при распространении воспаления на брюшину.
Боль при хроническом панкреатите усиливается в положении больного на спине и прямо зависит от степени наполнения желудка. Все средства, снижающие секреторную функцию железы (голод, блокаторы Н2-гистаминовых рецепторов, ингибиторы H+, К+-АТФазы, антациды, октреотид), снижающие спазм сфинктера Одди и нормализующие тонус двенадцатиперстной кишки (спазмолитики, метоклопрамид, домперидон), тормозящие процесс самоактивации ферментов и отек железы (ингибиторы протеолитических ферментов, мочегонные - ингибиторы карбоангидразы), уменьшают боль.
Боли чаще всего протекают по трем вариантам:
• вариант I - приступообразные боли, возникающие после приема алкоголя, жирной, жареной, копченой пищи. Локализуются в верхних отделах живота, иррадиируют в спину и носят опоясывающий характер;
• вариант II - постоянные, ноющие боли, усиливающиеся после погрешности в питании;
• сочетание I и II вариантов.
При хроническом рецидивирующем панкреатите острые, режущие боли, напоминающие картину острого панкреатита, сменяются «светлыми» периодами, когда боли могут полностью исчезнуть и возобновляются при нарушении диеты, алкогольном эксцессе. При хроническом болевом панкреатите боль не интенсивна, но практически никогда не исчезает, лишь несколько ослабевает или усиливается в периоды обострения или ремиссии.
Боли при хроническом панкреатите могут носить голодный характер, усиливаться по ночам, но в отличие от болей при язвенной болезни после приема пищи они не исчезают, а становятся только глуше. В происхождении этих болей определенную роль играет дуоденит.
Боли чаще бывают при ХП, вызванные заболеваниями желчевыводящей системы, нежели при панкреатите алкогольной этиологии.
Таким образом, боли при хроническом панкреатите достаточно своеобразны и отличаются от болей при других заболеваниях пищеварительного тракта, поэтому появление подобных жалоб у пациентов, страдающих патологией органов пищеварения, должно вызвать у врача мысль о возможности возникновения панкреатита. Ситуация упрощается, если боли возникают у пациента впервые.
У больных хроническим панкреатитом часто наблюдаются симптомы желудочной диспепсии: снижение или отсутствие аппетита, тошнота, чувство быстрого насыщения; эти симптомы часто сопровождают обострения хронического панкреатита и сочетаются с болями. Тошнота бывает постоянной и весьма тягостной, так что больные значительно сокращают прием пищи или же отказываются от нее. У части больных бывает рвота, не приносящая облегчения. При обострении больные жалуются не только на отсутствие или резкое снижение аппетита, но и на боязнь принимать пищу, в особенности при усилении и учащении болей.
В период обострения могут наблюдаться явления гиперинсулинизма. Поступающий в избыточном количестве в кровь инсулин из лизированных при воспалении и аутолизе р-клеток вызывает гипогликемию и обусловленную ею симптоматику: слабость, приступы голода вплоть до «волчьего», чувство страха, неуверенности, злобы, тремор конечностей, потливость, тахикардию. Эти явления быстро проходят при приеме сахара или внутривенном введении глюкозы.
При прогрессирующем течении хронического панкреатита развивается снижение внешнесекреторной функции, что проявляется симптомами кишечной диспепсии: стеатореей, креатореей, амилореей. Клинически - это бродильная или гнилостная кишечная диспепсия. Чаще возникают жалобы на частый, неоформленный стул. Иногда эта симптоматика может быть единственным проявлением болезни.
Выраженная экзокринная недостаточность наблюдается при первичном латентном течении ХП или же в терминальной стадии течения хронического болевого панкреатита. Снижение секреции панкреатических ферментов резко нарушает процессы тонкокишечного пищеварения. При дефиците липазы нарушается гидролиз жиров, которые начинают выводиться с калом в виде нейтрального жира. Нарушается также переваривание углеводов и белков, что способствует усилению бродильных и гнилостных процессов в кишечнике, уси-
лению метеоризма и поносов. Стул бывает 3-4 раза в сутки и более, кашицеобразный, светлый, блестящий, масляного вида, по поверхности воды в унитазе плавают капельки жира. Такой стул, хотя и считается «классическим» панкреатическим, характерен для позднего проявления синдрома экзокринной недостаточности.
При псевдотуморозной форме хронического панкреатита синдром кишечной диспепсии весьма выражен, так как обусловлен прекращением поступления желчи и панкреатического сока в кишечник вследствие фиброзирования или гипертрофии тканей в головке железы, что и приводит к сдавлению общего желчного протока и протока поджелудочной железы.
Жалобы на появление желтухи, кожный зуд, потемнение мочи и обесцвечивание кала при псевдотуморозном хроническом панкреатите также обусловлены обтурационной (подпеченочной или механической) желтухой, развивающейся вследствие сдавления дистальной части общего желчного протока пролиферирующей тканью головки поджелудочной железы, а также вследствие развития реактивного гепатита.
При хроническом панкреатите больных беспокоит запор. К запору приводит ряд причин:
• диета, бедная клетчаткой и жиром;
• прием спазмолитиков, алмагеля*, препаратов висмута, панкреатина и других ферментных препаратов.
Имеют значение повышение тонуса блуждающего нерва (при болях, гипогликемии) и нарушение иннервации толстой кишки.
Более половины больных хроническим панкреатитом отмечают снижение массы тела, обусловленное уменьшением количества употребляемой пищи вследствие резкого снижения аппетита, чрезмерных ограничений в диете, а также внешнесекреторной недостаточности железы.
Во время обострения хронического панкреатита больные предъявляют целый комплекс жалоб, объединяемых в «астенический синдром», - повышенную утомляемость, слабость, раздражительность, чрезмерную фиксированность на собственных болезненных ощущениях.
На втором этапе диагностического поиска можно обнаружить проявления основных синдромов, их выраженность, состояние других органов и систем.
При относительно коротком сроке заболевания, а также в случае легкого течения при внешнем осмотре какие-либо патологические изменения не обнаруживают. Однако при выраженности синдрома недостаточной внешней секреции отмечают дефицит массы тела, снижение тургора кожи, кожные проявления гиповитаминоза (сухость кожи, ломкость волос и ногтей, заеды в углах рта). Может отмечаться выраженная в большей или меньшей степени желтушность склер, слизистых оболочек и кожи. Однако эти симптомы не играют самостоятельной роли, но при последующей постановке диагноза хронического панкреатита указывают на тяжесть течения болезни.
Результаты физикального обследования пищеварительного тракта зависят от формы и фазы хронического панкреатита. Однако при всех клинических вариантах болезни забрюшинное расположение железы, тесные анатомические «соседства» желудка, двенадцатиперстной кишки, печени, кишечника определяют низкую диагностическую ценность данных пальпации.
При обострении хронического панкреатита часто описывают следующие физические признаки.
• На коже груди и живота могут находиться «рубиновые капельки». Этот неспецифический феномен чаще обнаруживают при длительном течении ХП. Есть мнение, что в основе лежит токсический эффект протеолитических ферментов на сосуды.
• Болезненность при пальпации проекции поджелудочной железы на переднюю брюшную стенку. При поражении хвоста железы болезненность локализуется в точке Мейо-Робсона, тела железы - над пупком (выше его на 2-3 см), головки - в треугольнике Шоффара.
• Симптом поворота: при положении больного на спине пальпация в точке Мейо-Робсона вызывает болезненность. Руку врача от поджелудочной железы во время пальпации отделяют кишечник и желудок. Когда больной поворачивается на левый бок, желудок и кишечник, смещаясь, создают дополнительную «подушку», и боли при пальпации в том же месте, обусловленные панкреатитом, уменьшаются, тогда как боли, вызванные поражением желудка и кишечника, - усиливаются.
• Положительный симптом натяжения брыжейки: больной лежит на левом боку, переднюю брюшную стенку врач прижимает рукой, при резком отведении руки брыжейка резко натягивается, что сопровождается заметным усилением болей.
• Поколачивание сзади слева вдоль длинной оси железы приводит к усилению болей - «симптом хвоста», обусловлен воспалением хвоста поджелудочной железы. Симптом аналогичен симптому Пастернацкого, который тоже положителен при обострении хронического пиелонефрита.
• Положительный френикус-симптом слева.
Обострение хронического рецидивирующего панкреатита сопровождается также мышечной защитой, положительным симптомом Кача, т.е. повышением тактильной чувствительности в зоне проекции поджелудочной железы на переднюю брюшную стенку и резчайшей разлитой болезненностью при пальпации верхней половины живота.
На основании всех признаков можно вынести лишь предварительное диагностическое заключение; в дальнейшем требуется лабораторно-инструментальное подтверждение диагноза.
Обострение хронического панкреатита может сопровождаться увеличением печени, что обусловлено развитием реактивного неспецифического гепатита; а при длительном течении болезни вследствие развития жировой дистрофии печени отмечается постоянное увеличение печени (в особенности если лечение хронического панкреатита проводится нерегулярно). Увеличенная головка поджелудочной железы при псевдотуморозном хроническом панкреатите может сдавливать общий желчный проток, приводя к появлению симптома Курвуазье.
Достаточно часто при обострении хронического панкреатита определяется спазмированная, болезненная при пальпации толстая кишка (в особенности поперечный ее отдел).
Третий этап диагностического поиска - решающий в диагностике хронического панкреатита. Объем лабораторно-инструментальных исследований зависит от технической оснащенности лечебного учреждения и возможности больного перенести ряд инвазивных исследований.
При обострении хронического панкреатита (в особенности хронического рецидивирующего) выявляются острофазовые показатели в виде увеличения СОЭ, а2-глобулинов, появления СРБ, нейтрофильного сдвига в лейкоцитарной формуле крови. Эти показатели неспецифичны и отражают активность любого воспалительного процесса. Важным аспектом диагностики служит гиперферментемия - повышение активности панкреатических ферментов в крови и моче. Увеличение их содержания в крови при обострении чаще всего выступает следствием «феномена уклонения ферментов» - поступления ферментов из протоков железы в кровь при повышении внутрипротокового давления. К гиперферментемии приводят также и некроз клеток железы, и «пропотевание» внутриклеточных ферментов из клетки в межклеточное пространство при нарушении проницаемости оболочки клетки.
Поступив в кровь, фермент поджелудочной железы амилаза выделяется с мочой. Колебание уровня фермента в крови соответственно изменяет содержание фермента в моче. При обострении хронического панкреатита уровень панкреатических ферментов в крови обычно повышается в 1,5-2,5 раза. При обострении хронического панкреатита, как и при остром панкреатите, содержание амилазы и трипсина в крови, как правило, значительно (в 3-5 раз) превышает норму.
Диагностической ценностью (как признак обострения) обладают только повышенные показатели активности ферментов. Нормальные и даже низкие показатели активности ферментов поджелудочной железы в крови не дают основания исключить хронический панкреатит. Низкая активность панкреатических ферментов в крови не является свидетельством снижения внешнесекреторной функции железы. В клинической практике наиболее часто определяют содержание амилазы в крови и моче. В основе лабораторного определения лежит способность амилазы расщеплять крахмал. Методики доступны и широко используются. Отмечают высокую диагностическую ценность активности липазы, хотя ее определение связано с техническими трудностями. Активность трипсина, определяемого радиоиммунным методом, по диагностической значимости уступает активности амилазы вследствие нахождения в крови большого количества ингибиторов протеаз.
Повышение уровня амилазы в крови происходит при поражении и других органов, например при воспалении печени и слюнных желез. В таких случаях только определение органоспецифических изоферментов позволяет выяснить происхождение ферментов.
Выраженность гиперферментемии и активности ферментов в моче нарастает параллельно таким признакам, как отек и увеличение поджелудочной железы, выявленным при УЗИ.
Для определения внешнесекреторной функции поджелудочной железы применяют прямые методы - исследование панкреатического сока, и косвенные методы - исследование кала. Обнаружение в кале нейтрального жира (стеа-
торея) и мышечных волокон (креаторея) свидетельствует о функциональной недостаточности железы, при этом в кале не обнаруживаются элементы воспаления. При сдавлении общего желчного протока увеличенной головкой железы (псевдотуморозная форма хронического панкреатита) кал ахоличен, стеркобилин не определяется.
Исследование дуоденального содержимого осуществляют с помощью двухканального зонда до и после стимуляции панкреатической секреции секретином (приводит к секреции сока поджелудочной железы, богатого бикарбонатами) и панкреозимином (приводит к усилению секреции ферментов). Секретинпанкреозиминовый тест считают золотым стандартом диагностики нарушений внешнесекреторной функции поджелудочной железы. По мере увеличения длительности заболевания внешнесекреторная недостаточность прогрессирует: объем секреции снижен, имеется тенденция к понижению концентрации бикарбонатов, концентрация ферментов также снижается. Может наблюдаться так называемый диспанкреатизм, когда секреция одного фермента повышена, а других понижена или мало изменена. Это можно расценивать как умеренное снижение функции железы, хотя клиническая оценка такого явления затруднена, особенно если учитывать возможность адаптации железы к предшествующему пищевому режиму.
В последние годы частое применение находит метод определения ферментов в кале (трипсина, химотрипсина, эластазы-1, липазы) благодаря своей неинвазивности. Наибольшее значение имеет определение эластазы-1 в кале иммуноферментным методом. Чувствительность и специфичность эластазного теста приближаются к таковым секретин-панкреозиминового теста.
Определение степени внутрисекреторной недостаточности поджелудочной железы имеет существенное диагностическое значение, так как при выраженном поражении железы патологический процесс приводит к изменению островкового аппарата, инсулиновой недостаточности и возникновению явного сахарного диабета. Двух- и трехкратное определение уровня повышенной глюкозы натощак в капиллярной крови выше 5,55 ммоль/л служит основанием для диагностики сахарного диабета.
Сахарный диабет при хроническом панкреатите имеет ряд особенностей. При этой форме диабета одновременно с уменьшением секреции инсулина р-клетками происходит снижение секреции глюкагона а-клетками. Это, видимо, одна из причин того, что реже бывают явления кетоацидоза, реже возникает инсулинорезистентность. В то же время чаще возникают явления гипогликемии, особенно при обострении, когда гиперинсулинизм сочетается с уменьшением пищевого рациона. Микроангиопатия и полиневропатия развиваются и при сахарном диабете такой этиологии.
Для выявления нарушения углеводного обмена используют тест толерантности к глюкозе, в процессе которого концентрацию глюкозы определяют натощак и через 60 и 120 мин после приема сахара. Уровень инсулина, С-пептида и глюкагона в крови исследуют радиоиммунным методом, что позволяет непосредственно оценить функцию р-клеток островкового аппарата поджелудочной железы.
Ультразвуковое исследование выявляет различные изменения в зависимости от формы и фазы хронического панкреатита. В фазу обострения хронического рецидивирующего панкреатита УЗИ выявляет увеличение поджелудочной железы, неровность контуров, понижение ультразвукового сопротивления (отек железы). При обострении хронического безболевого панкреатита железа может быть нормальной или слегка увеличенной, с неровными контурами. Структура железы при ХП в фазу обострения неоднородна. Участки повышенной эхогенности (фиброз железы) чередуются с участками пониженной эхогенности (отек). В фазу ремиссии хронического панкреатита орган увеличен или уменьшен, структура его неоднородна, определяются зоны фиброза, т.е. зоны повышенной эхогенности. Значение имеют выявление расширенного протока и его деформация.
УЗИ позволяет выявить также кисту и кальцификацию железы. По данным УЗИ трудно дифференцировать склеротические изменения от рака поджелудочной железы. При отсутствии четких данных УЗИ и неясности диагноза, при подозрении на опухоль железы используют другие методы исследования.
Томография (КТ и МРТ) позволяет обнаружить при ХП изменение размеров органа, неровность контуров, изменение характера окружающей железу жировой клетчатки, неоднородность структуры паренхимы, деформацию протоков, состояние лимфатических узлов. Выявляют очаговые или диффузные обызвествления, кисты. Данные методы с достаточной степенью достоверности помогают дифференцировать хронический панкреатит от рака.
Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) выявляет характерные для хронического панкреатита диффузные изменения протока поджелудочной железы, выражающиеся в чередовании расширений и сужений (цепочка «озер»), извилистости и неровности стенок, изменений боковых ответвлений, эвакуации контрастного вещества из главного панкреатического протока.
Проведение ЭРХПГ чревато осложнениями, кроме того, по данным этого исследования не всегда можно дифференцировать хронический панкреатит от рака поджелудочной железы.
Ограниченное значение в диагностике хронического панкреатита имеют внутривенная холецистохолангиография, ирригоскопия, обзорная рентгенография. Высокую диагностическую ценность имеют использование КТ с введением контрастного препарата, эндоскопическое УЗИ, ПЭТ, сцинтиграфия с введением гранулоцитов, меченных радиоактивным технецием.
Осложнения
Осложнения хронического панкреатита разделяют на ранние и поздние. Ранние осложнения
• «Подпеченочная» желтуха. Причиной «подпеченочной» желтухи служат отек головки поджелудочной железы и сдавление общего желчного протока. Желтуха с ликвидацией отека проходит. Появление жидкости в брюшной полости при хроническом панкреатите может быть обусловлено сдавлением портальной вены увеличенной поджелудочной железой или
псевдокистой, разрывом псевдокисты с воздействием на брюшину панкреатических ферментов. Это осложнение встречается довольно редко.
• Абсцесс поджелудочной железы.
• Кисты и псевдокисты. Ложные кисты (псевдокисты), в отличие от истинных кист, имеют соединение с протоком железы (шейка псевдокисты). Заподозрить развитие псевдокисты можно, если при хроническом панкреатите появляются симптомы нарушения билиарной проходимости, стеноза привратника, непроходимости кишечника, портальной гипертензии. Даже при пальпации в эпигастральной области опухоли эластичной консистенции диагноз псевдокисты требует проведения УЗИ, КТ, ангиографии.
• Асцит.
• Плеврит, пневмонит. Развитие плеврита, чаще левостороннего, реже двустороннего, возможно при выраженном обострении хронического рецидивирующего панкреатита. Высокая концентрация амилазы в плевральной жидкости позволяет подтвердить «панкреатическую» природу плеврита.
• Артрит. Поражение суставов наблюдается при тяжелом обострении хронического рецидивирующего панкреатита и проявляется либо артралгией при неизмененных суставах, либо полиартритом мелких или крупных суставов. При стихании обострения полностью исчезают и суставные симптомы.
• Желудочно-кишечное кровотечение. Кровотечение при хроническом панкреатите вызывают несколько причин:
- сдавление увеличенной поджелудочной железой воротной и селезеночной вен вызывает варикозное расширение вен пищевода и желудка;
- разрыв псевдокисты;
- возникающие при обострении хронического рецидивирующего панкреатита эрозии и изъязвления слизистой оболочки пищеварительного тракта при развивающемся нарушении свертывающей системы крови. Чаще обнаруживают скрытое кровотечение, приводящее к хронической железодефицитной анемии.
• Кальцификация поджелудочной железы возникает чаще при длительно текущем алкогольном панкреатите. Она усугубляет течение хронического панкреатита и, как правило, сочетается с тяжелой стеатореей и сахарным диабетом. Диагноз ставят по данным УЗИ и по прицельным рентгеновским снимкам поджелудочной железы в двух проекциях.
Поздние осложнения
• Мальабсорбция возникает из-за нарушения процессов энтерального пищеварения: дефицит панкреатических ферментов приводит к снижению в первую очередь гидролиза жиров, а также белков и крахмала. Это ведет к уменьшению поступления из пищеварительного тракта энергетических и пластических субстанций, в том числе и кальция.
• Мальдигестия.
• Остеопороз.
• Перипанкреатит.
• «Подпеченочная» желтуха. Причиной «подпеченочной» желтухи при длительном течении ХП выступает сдавление общего желчного протока кистой или соединительной тканью при псевдотуморозном варианте ХП или при перипанкреатите.
Диагностика
• На первом и втором этапах диагностического поиска предположение о диагнозе ХП позволяют сделать:
- типичный характер болей;
- клинические признаки внешнесекреторной недостаточности;
- болезненность при пальпации в «панкреатических точках».
• Третий этап позволяет выявить:
- панкреатический цитолитический синдром - повышение активности панкреатических ферментов в крови и моче;
- снижение внешнесекреторной функции поджелудочной железы:
лабораторные признаки нарушения расщепления жиров, крахмала, белков - стеаторея, амилорея, креаторея;
уменьшение количества эластазы-1 в кале;
- снижение внутрисекреторной функции:
нарушение толерантности к глюкозе;
сахарный диабет;
- подтвердить ХП, визуализировав патологический процесс.
В зависимости от состояния больного, клинической картины обследование следует начинать с простых, но достаточно информативных тестов. При обострении ХП в первую очередь исследуют панкреатические ферменты крови и мочи. Целесообразно провести УЗИ поджелудочной железы и смежных с ней органов, прежде всего печени и желчных путей. Дальнейшие этапы в зависимости от полученных результатов предусматривают ЭРХПГ, КТ, МРТ, ПЭТ.
Опухоль часто развивается на фоне длительно существующего хронического панкреатита.
Схема формулировки диагноза «хронический панкреатит»:
• морфологический вариант;
• этиология;
• клинический вариант;
• стадия (обострение, ремиссия);
• осложнения;
• состояние внешнесекреторной функции;
• состояние инкреторной функции.
Пример: хронический алкогольный паренхиматозный панкреатит с постоянными болями, в стадии обострения, киста хвоста поджелудочной железы, нарушение толерантности к глюкозе.
Лечение
При хроническом панкреатите необходимо воздействовать на этиологические факторы и патогенетические механизмы. Необходимо учитывать фазу обо-
стрения и ремиссии, а также клиническую форму болезни. Устранение причин, приводящих к развитию болезни, предусматривает санацию желчевыводящих путей (при необходимости холецистэктомию), лечение заболеваний желудка и двенадцатиперстной кишки, отказ от приема алкоголя, нормализацию питания (достаточное содержание белка в диете).
При выраженном обострении ХП больным показана госпитализация.
Основные задачи лечения в этот период.
• Подавление секреции поджелудочной железы.
• Снижение кислотопродукции:
- голод;
- эвакуация желудочного содержимого постоянным зондом;
- блокаторы Н2-гистаминовых рецепторов (ранитидин, фамотидин);
- ингибиторы H+, К+-АТФазы (омепразол, рабепразол, эзомепразол);
- антациды (алмагель*, маалокс*).
• Прямое супрессивное воздействие на секрецию поджелудочной железы:
- соматостатин (синтетическое производное гормона - октреотид);
- панкреатические ферменты: панкреатин (креон*);
- мочегонные - ингибиторы карбоангидразы.
• Прекращение процесса аутоактивации ферментов:
- фторурацил;
- ингибиторы протеолитических ферментов: апротинин (трасилол*, гордокс*).
• Ликвидация ферментной интоксикации.
В фазе обострения нередко необходимо восстанавливать баланс жидкости и электролитов, нарушенный вследствие рвоты, диареи, аспирации желудочного содержимого. Внутривенно вводят смеси незаменимых аминокислот в сочетании с хлоридом натрия.
Рекомендации по лечению ХП в период ремиссии
• Отказ от употребления алкоголя.
• Предупреждение миграции желчных камней.
• Купирование болей (НПВС, спазмолитики, трамадол, антидепрессанты). В фазу ремиссии патогенетическая терапия предусматривает нормализацию
желудочной секреции, устранение дискинезии желчных путей, а также стимуляцию репаративных процессов в поджелудочной железе.
С целью стимуляции репаративных процессов и усиления продукции эндогенных ингибиторов протеаз показана механически и химически умеренно щадящая диета с ограничением жиров и повышенным содержанием белка. Увеличение содержания белка достигается добавлением мяса, рыбы, творога и сыра с низким содержанием жира.
Химическое щажение состоит в исключении острых блюд, жареного, бульонов, ограничении поваренной соли. Исключают грубую клетчатку (капусту, сырые яблоки, апельсины). Для уменьшения секреторной функции поджелудочной железы ограничивают жиры.
При внешнесекреторной недостаточности используют препараты экстрактов поджелудочной железы (оптимальным являются капсулы, содержащие микрогранулы или микротаблетки панкреатина, покрытые оболочкой,
растворимой в тонкой кишке). Назначают панкреатин внутрь по 20 000 ЕД 4-6 раз в сутки в начале каждого приема пищи.
Ферментные препараты должны отвечать ряду требований:
• оптимальному составу ферментов физиологической пропорции;
• кислотоустойчивости;
• равномерному и быстрому перемешиванию с пищей;
• быстрому и 100% высвобождению ферментов в двенадцатиперстной кишке;
• безопасности.
При тяжелой витаминной недостаточности дополнительно назначают жирорастворимые витамины (А*, Д\ Е*, К*), а также группы В*.
При умеренной внутрисекреторной недостаточности и сахарном диабете легкого течения ограничивают углеводы. Если нормализации гликемии не происходит, то назначают препараты инсулина.
Прогноз
При исключении этиологических факторов, адекватном лечении, компенсации внешне- и внутрисекреторной недостаточности поджелудочной железы прогноз может быть благоприятным. Однако при длительном течении болезни трудоспособность больных снижается, возникает необходимость хирургического лечения.
Профилактика
Предупреждение болезни предусматривает, прежде всего, полный отказ от алкоголя, своевременное лечение заболеваний желчных путей, желудка и двенадцатиперстной кишки, кишечника, правильное питание.