Внутренние болезни: учебник. - 6-е изд., перераб. и доп. / В. И. Маколкин, С. И. Овчаренко, В. А. Сулимов. - 2012. - 768 с. : ил.
|
|
|
|
Глава 2. БОЛЕЗНИ ОРГАНОВ КРОВООБРАЩЕНИЯ
ОСТРАЯ РЕВМАТИЧЕСКАЯ ЛИХОРАДКА (РЕВМАТИЗМ)
Острая ревматическая лихорадка (ОРЛ) - системное воспалительное заболевание соединительной ткани с преимущественной локализацией процесса в сердечно-сосудистой системе, развивающееся у предрасположенных к нему лиц, главным образом молодого возраста, в связи с инфекцией р-гемолитическим стрептококком группы А.
Это определение болезни (В.А. Насонова, 1989) подчеркивает:
• преимущественное поражение сердечно-сосудистой системы;
• роль патологической наследственности;
• значение стрептококковой инфекции.
Сущность болезни заключается в поражении всех оболочек сердца, главным образом миокарда и эндокарда, с возникновением деформации клапанного аппарата (порока сердца) и последующим развитием сердечной недостаточности. Поражение других органов и систем при ревматизме имеет второстепенное значение и не определяет его тяжести и прогноза.
Пик заболеваемости приходится на детский и юношеский возраст (5-15 лет) и не зависит от пола. Первичная атака ревматизма может быть у лиц в возрасте 20-30 лет, однако после 30 лет первичный ревматизм практически не встречается. После 40 лет ревматизмом не заболевают. Можно тем не менее встретить больного и старше 60 лет, страдающего ревматическим пороком сердца, однако из этого не следует, что он заболел впервые в этом возрасте; ревматическая атака у него была в молодом возрасте.
Заболеваемость ОРЛ в России составляет 2,7 случая на 100 000 населения, ревматическими пороками сердца - 9,7 случая на 100 000 населения.
Этиология
Отмечено, что заболевшие ревматизмом 2-4 нед до начала болезни перенесли ангину, обострение хронического тонзиллита, а в крови у них определялось повышенное количество стрептококкового антигена и противострептококковых
антител. Такая связь с предшествующей стрептококковой инфекцией особенно выражена при остром течении заболевания, сопровождающемся полиартритом.
В развитии ОРЛ имеют значение социальные факторы (неблагоприятные бытовые условия, недостаточное питание), а также генетическая предрасположенность, которая состоит в гипериммунном ответе на антигены стрептококка, склонности заболевших к аутоиммунным и иммунокомплексным процессам.
Патогенез
В ответ на попадание в организм стрептококковой инфекции вырабатываются противострептококковые антитела и образуются иммунные комплексы (антигены стрептококка + антитела к ним + комплемент), циркулирующие в крови и оседающие в микроциркуляторном русле. Повреждающее действие на миокард и соединительную ткань оказывают также токсины и ферменты стрептококка (рис. 2-1).
Вследствие генетически обусловленного дефекта иммунной системы из организма больных недостаточно полно и быстро элиминируются стрептококковые антигены и иммунные комплексы. Ткани таких больных обладают повышенной склонностью фиксировать эти иммунные комплексы. Кроме того, важны перекрестно реагирующие антитела, которые, появляясь в ответ на присутствие антигенов стрептококка, способны реагировать с тканевыми, в том числе кардиальными антигенами организма. В ответ развивается воспаление на иммунной основе (по типу гиперчувствительности немедленного типа - ГНТ), при этом факторами, реализующими воспалительный процесс, служат лизосомные ферменты нейтрофилов, фагоцитирующих иммунные комплексы и разрушаю-
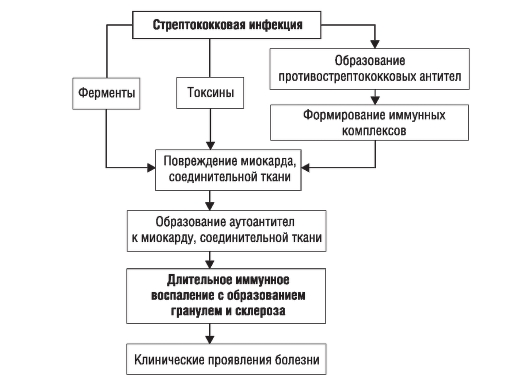
Рис. 2-1. Общая схема патогенеза ревматизма
щихся при этом. Этот воспалительный процесс локализуется в соединительной ткани преимущественно сердечно-сосудистой системы и изменяет антигенные свойства ее и миокарда. В результате развиваются аутоиммунные процессы по типу ГЗТ, и в крови больных обнаруживаются лимфоциты, реагирующие с миоцитами. Этим клеткам придают большое значение в происхождении органных поражений (прежде всего сердца). В крови выявляют также противомиокардиальные антитела, но они имеют меньшее значение в развитии поражения
сердца.
Системный воспалительный процесс при ревматизме проявляется характерными фазовыми изменениями соединительной ткани (мукоидное набухание - фибриноидные изменения - фибриноидный некроз) и клеточных реакций (инфильтрация лимфоцитами и плазмоцитами, образование ревматической, или Ашоффа-Талалаева гранулемы). Эти клеточные реакции выступают морфологическим выражением иммунных нарушений. Патологический процесс завершается склерозированием. Патогенез ОРЛ представлен на рис. 2-1.
Другим морфологическим субстратом поражения сердца при ОРЛ служит неспецифическая воспалительная реакция, по существу аналогичная таковой в суставах и серозных оболочках. Она выражена в отеке межмышечной соединительной ткани, выпотевании фибрина, инфильтрации клеточными элементами, преимущественно нейтрофилами и лимфоцитами.
Так как патологический процесс имеет аутоиммунный характер, то и заболевание течет волнообразно, обостряясь под влиянием инфекции или неспецифических факторов (переохлаждение, физическое напряжение, эмоциональный стресс и др.).
При поражении сердца воспалительный процесс распространяется на эндокард и миокард (эндомиокардит или ревмокардит), либо на все оболочки сердца (панкардит), либо поражает только миокард (при первой, значительно реже при второй атаке). Морфологические изменения обнаруживают, прежде всего, в миокарде, поэтому именно миокардит в ранние сроки определяет клиническую картину. Воспалительные изменения в эндокарде (вальвулит, бородавчатый эндокардит), поражение сухожильных нитей и фиброзного кольца клинически выявляют в более поздние сроки атаки ревматизма - спустя 6-8 нед.
Отмечена определенная закономерность поражения клапанов сердца: чаще всего поражается митральный, затем аортальный и трехстворчатый клапаны. Клапан легочной артерии при ревматизме практически никогда не пора жается.
Различные пороки сердца возникают в разные сроки после атаки ОЛР: недостаточность митрального клапана - спустя 6 мес после начала атаки (недостаточность клапана аорты немного раньше), митральный стеноз - через 2 года после атаки; в еще более поздние сроки формируется стеноз устья аорты.
Классификация
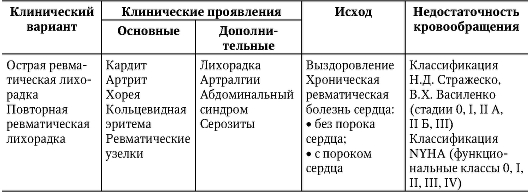
В настоящее время принята классификация ревматической лихорадки (Ассоциация ревматологов России, 2003), отражающая клинические варианты, основные и дополнительные клинические проявления, исходы и функциональное состояние сердечно-сосудистой системы (табл. 2-1).
Таблица 2-1. Классификация ревматической лихорадки
Клиническая картина
Все проявления болезни целесообразно разделить на сердечные и внесердечные и описывать клиническую картину болезни с этих позиций.
Следует иметь в виду, что клиническая картина болезни более отчетлива при первой его атаке, пока порок еще не сформирован. При рецидивах ОРЛ, когда уже сформировался порок сердца, а тем более при наличии сердечной недостаточности, клиническую симптоматику активного ревматического процесса выявить труднее, так как она обусловлена сочетанием порока сердца и нарушением кровообращения. В связи с этим ниже представлена клиническая картина первичной атаки ОРЛ.
На первом этапе диагностического поиска определяют связь болезни с перенесенной инфекцией. В типичных случаях спустя 2-4 нед после ангины или острого респираторного заболевания повышается температура тела (в 90% случаев), иногда до 38-40 °С, с суточными колебаниями 1-2 °С и сильным потом (как правило, без озноба). При повторных атаках ОРЛ рецидив болезни часто развивается вне связи с перенесенной инфекцией (имеют значение неспецифические факторы: переохлаждение, физическая перегрузка, оперативное вмешательство).
В настоящее время наиболее частым, а у большинства больных единственным признаком ревматизма служит поражение сердца - ревмокардит - одновременное поражение миокарда и эндокарда. Попытки дифференцировать миокардит и эндокардит не увенчались успехом.
У взрослых ревмокардит протекает легко. Больные предъявляют жалобы на слабые боли или неприятные ощущения в области сердца, легкую одышку при нагрузке, значительно реже отмечают перебои или сердцебиения. Эти симптомы не являются специфичными для ревматического поражения сердца и могут наблюдаться при других заболеваниях. Природу таких жалоб уточняют на последующих этапах диагностического поиска.
Ревмокардит у некоторых больных молодого возраста (чаще у детей) может протекать тяжело: с самого начала болезни возникают сердцебиения, сильная одышка при нагрузке и в покое, постоянные боли в области сердца. Могут появляться симптомы сердечной недостаточности в большом круге кровообращения в виде отеков и тяжести в области правого подреберья (за счет увеличения
печени). Все эти симптомы указывают на диффузный миокардит тяжелого течения.
Перикардит, так же как внесердечные проявления болезни, в настоящее время встречается редко, обычно при остром течении у детей и лиц молодого возраста.
При развитии сухого перикардита больные отмечают лишь постоянные боли в области сердца. Экссудативный перикардит, который характеризуется накоплением в сердечной сумке серозно-фибринозного экссудата, имеет свою клиническую картину: боли исчезают в связи с разъединением воспаленных листков перикарда накапливающимся экссудатом. Возникает одышка, которая усиливается при горизонтальном положении больного. Вследствие затруднения притока крови к правым отделам сердца появляются застойные явления в большом круге кровообращения (отеки, тяжесть в правом подреберье вследствие увеличения печени).
Изменения опорно-двигательного аппарата проявляются в виде ревматического полиартрита. Больные отмечают быстро нарастающую боль в крупных суставах (коленных, локтевых, плечевых, голеностопных, лучезапястных), невозможность активных движений, увеличение суставов в объеме.
Особенность ревматического полиартрита в быстром и полном обратном его развитии при назначении противоревматических препаратов. Иногда поражение суставов манифестирует лишь полиартралгией - болями в суставах без развития артрита (в 10% случаев).
Ревматические поражения легких в виде пневмонии или плеврита наблюдают крайне редко, их субъективные симптомы такие же, как и при обычных поражениях (см. «Острая пневмония», «Плеврит»).
Ревматические поражения почек крайне редки, их обнаруживают лишь на третьем этапе диагностического поиска (при исследовании мочи).
Ревматические поражения нервной системы встречают исключительно редко, преимущественно у детей. Жалобы не отличаются от жалоб при энцефалите, менингоэнцефалите, церебральном васкулите иной этиологии. Заслуживает внимания лишь «малая хорея», встречающаяся у детей (преимущественно у девочек) и проявляющаяся сочетанием эмоциональной лабильности и насильственных гиперкинезов верхней части туловища, верхних конечностей и мимической мускулатуры.
Абдоминальный синдром (перитонит) встречается почти исключительно у детей и подростков с первичной ОРЛ. Характеризуется внезапным возникновением наряду с лихорадкой, диффузных или локализованных схваткообразных болей, сопровождающихся тошнотой, реже рвотой, задержкой или учащением стула. Ревматический перитонит не оставляет стойких изменений и не рецидивирует.
Таким образом, на первом этапе диагностического поиска при первой атаке ОРЛ наиболее часты жалобы, связанные с поражением сердца, реже с вовлечением в патологический процесс суставов, а также жалобы общего порядка (повышенная утомляемость, потливость, повышение температуры тела).
На втором этапе диагностического поиска наибольшее значение имеет обнаружение признаков поражения сердца.
При первой атаке ОРЛ сердце обычно не увеличено (лишь изредка отмечается умеренное его увеличение), при аускультации выявляют приглушенный
I тон, иногда появление III тона, мягкий систолический шум над верхушкой. Эта симптоматика - не проявление поражения клапанного аппарата; она обусловлена изменениями миокарда (ревматический миокардит). Однако нарастание интенсивности шума, большая продолжительность его и стойкость могут указывать на формирование недостаточности митрального клапана. Уверенно судить о формировании порока можно спустя 6 мес после начала атаки при сохранении приведенной аускультативной картины.
В случае поражения клапана аорты может выслушиваться, а в дальнейшем нарастать по интенсивности и продолжительности протодиастолический шум в точке Боткина, при этом звучность II тона может сохраняться. Лишь спустя много лет, после формирования выраженной недостаточности клапана аорты, вместе с протодиастолическим шумом определяют ослабление (отсутствие)
II тона во втором межреберье справа.
При более редко встречающемся сухом перикардите появляются характерные симптомы (подробнее см. «Перикардит») в виде шума трения перикарда, а при наличии выпота в полости перикарда - глухость тонов в сочетании со значительным расширением границ сердца во все стороны и симптомами сердечной недостаточности в большом круге кровообращения.
У больных полиартритом отмечают деформацию суставов за счет воспаления синовиальной оболочки и околосуставных тканей, болезненность при пальпации сустава. Все эти изменения бесследно исчезают после проведения противоревматической терапии.
Поражение периартикулярных тканей проявляется в виде ревматических узелков, которые располагаются в области пораженных суставов, на предплечьях и голенях, над костными выступами. Это мелкие (величиной с горошину), плотные безболезненные образования, исчезающие под влиянием лечения. В настоящее время эти образования почти не встречаются.
Кольцевидная эритема - признак, патогномоничный для ревматизма и представленный образованием розовых незудящих кольцевидных элементов, располагающиеся преимущественно на коже внутренней поверхности рук, ног, живота, шеи и туловища. Эритему регистрируют исключительно редко (1-2% больных). Иногда наблюдается также узловатая эритема.
Ревматические пневмонии и плевриты имеют те же физические признаки, что и аналогичные заболевания банальной этиологии.
В целом внесердечные поражения в настоящее время наблюдают крайне редко, обычно у лиц молодого возраста при остром течении болезни (при наличии высокой активности - III степени). Они нерезко выражены, быстро поддаются обратному развитию при проведении противоревматической терапии.
На третьем этапе диагностического поиска данные лабораторноинструментального исследования позволяют установить активность патологического процесса и уточнить поражение сердца и других органов. При активном ревматическом процессе лабораторные исследования выявляют неспецифические острофазовые и измененные иммунологические показатели.
К острофазовым показателям относят нейтрофилез со сдвигом лейкоцитарной формулы влево (лейкоцитоз до 12-15х109/л отмечают лишь при III степени активности процесса, что обычно сочетается с ревматическим полиартритом); увеличение содержания α2-глобулинов, сменяющееся повышением концен-
трации у-глобулинов; повышение содержания фибриногена, СРБ; увеличение СОЭ. В большинстве случаев изменение биохимических показателей происходит параллельно СОЭ, которая служит основным лабораторным признаком активности ревматизма.
Повышаются титры противострептококковых антител (антигиалуронидазы и антистрептокиназы более 1\300, антистрептолизина-О более 1\250) в 70-80% случаев. Повышение концентрации этих антител отражает реакцию организма на воздействие стрептококка и поэтому часто возникает при любой стрептококковой инфекции. Диагностическое значение имеют значительно повышенные титры антител.
Все лабораторные показатели у больных с активным ревматическим процессом и сердечной недостаточностью вследствие порока сердца изменены нерезко или соответствуют норме. При уменьшении выраженности сердечной недостаточности после применения мочегонных средств можно определить лабораторные признаки активности.
При электрокардиографическом исследовании иногда обнаруживают нарушения ритма и проводимости, преходящую предсердно-желудочковую блокаду (чаще I (удлинение интервала P-Q), реже - II степени), экстрасистолию, предсердно-желудочковый ритм. У ряда больных регистрируют изменения зубца Т в виде снижения его амплитуды вплоть до образования отрицательных зубцов (преимущественно в грудных отведениях).
Указанные нарушения ритма и проводимости нестойкие, в процессе противоревматической терапии быстро исчезают. Иногда они исчезают самостоятельно. В подобных случаях ЭКГ отражает не столько поражение миокарда, сколько изменение функционального состояния его нервного аппарата в связи с повышением тонуса блуждающего нерва. После назначения атропина изменения на ЭКГ исчезают. Если изменения на ЭКГ стойкие и остаются после ликвидации ревматической атаки, то следует думать об органическом поражении миокарда. При развитии ревмокардита на фоне уже имеющегося порока сердца на ЭКГ отражаются изменения, свойственные данному клапанному поражению (синдромы гипертрофии миокарда предсердий и желудочков, выраженные в различной степени).
При ФКГ уточняют данные аускультации: ослабление I тона, появление III тона, систолический шум. В случае формирования порока сердца на ФКГ появляются изменения, соответствующие характеру клапанного поражения. Развитие ревмокардита на фоне порока сердца на ФКГ манифестирует характерными признаками этого порока.
Рентгенологически при первой атаке ревматизма какие-либо изменения обнаружить не удается. Лишь при тяжелом ревмокардите у детей и лиц молодого возраста можно определить увеличение сердца за счет дилатации левого желудочка.
При развитии ревмокардита на фоне уже имеющегося порока сердца рентгенологическая картина будет соответствовать конкретному пороку.
При ЭхоКГ во время первичной атаки какие-либо характерные изменения отсутствуют. Лишь при тяжелом течении ревмокардита с признаками сердечной недостаточности на эхокардиограмме (ЭхоКГ) обнаруживают признаки, указывающие на снижение сократительной функции миокарда и расширение
полостей сердца. Если ревмокардит развивается на фоне порока сердца, то обнаруживают признаки, свойственные этому поражению. Следует отметить, что примерно у 7-10% детей после перенесенного ревмокардита формируется пролапс митрального клапана.
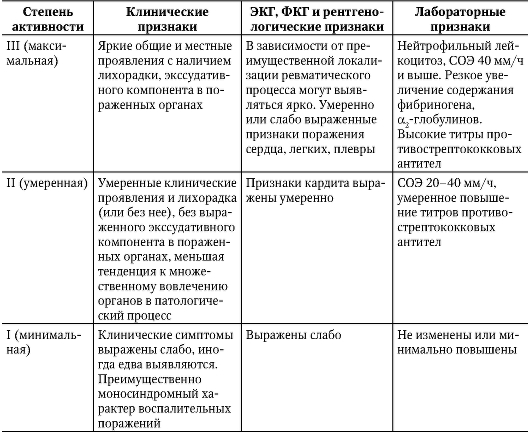
Данные, полученные на всех трех этапах диагностического поиска, лежат в основе определения степени активности ревматического процесса (табл. 2-2).
Таблица 2-2. Клинико-лабораторная характеристика активности ревматического процесса
Диагностика
Диагностика первичного ревматизма представляет большие трудности, так как его такие наиболее распространенные симптомы, как полиартрит и поражение сердца, неспецифичны. В настоящее время во всем мире наибольшее распространение получили большие и малые критерии ревматизма Американской ассоциации кардиологов (1992) и модифицированные Ассоциацией ревматологов России в 2003 г. (табл. 2-3).
Свидетельства связи со стрептококковой инфекцией:
• повышенный титр противострептококковых антител (антистрептолизина-О, антигиалуронидазы и др.);
• недавно перенесенная скарлатина.
Таблица 2-3. Большие и малые критерии ревматизма
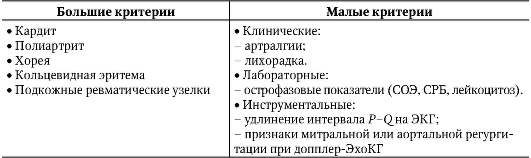
Сочетание двух больших или одного большого и двух малых критериев указывает на большую вероятность ОРЛ лишь в случаях тщательно документированной предшествующей стрептококковой инфекции (недавно перенесенная скарлатина, высевание из носоглотки стрептококков группы А, повышенные титры противострептококковых антител - антистрептолизина-О, антигиалуронидазы, антистрептокиназы).
Дифференциальная диагностика
Диагностика активного ревматического процесса у больных с ранее сформировавшимся пороком сердца не представляет особых трудностей. Первичный ревматизм, протекающий без ярких клинических признаков, весьма сходен с другими заболеваниями, что заставляет проводить дифференциальную диагностику в первую очередь с инфекционно-аллергическим миокардитом.
Для первичного ревмокардита, в отличие от инфекционно-аллергического миокардита, характерны:
• связь заболевания с носоглоточной стрептококковой инфекцией;
• латентный период с момента окончания предшествующего инфекционного заболевания до первых клинических признаков ОРЛ, составляющий 2-4 нед;
• преимущественное возникновение болезни в детском и юношеском возрасте;
• обнаружение полиартрита или острых артралгий в качестве начальных симптомов болезни;
• отсутствие жалоб на нарушения со стороны сердца или их констатация лишь при целенаправленном сборе анамнеза;
• частое обнаружение объективных симптомов поражения сердца;
• четкая корреляция выраженности клинических признаков ревматизма с лабораторными показателями активности ревматического процесса.
При ревмокардите отсутствует хронологическая связь с нестрептококковыми инфекциями, стрессовыми воздействиями; латентный период всегда присутствует и не укорочен.
Инфекционно-аллергический миокардит отмечают у лиц молодого, среднего, пожилого возраста; он характеризуется постепенным началом, отсутствием суставного синдрома в начале болезни; лабораторные признаки активности могут отсутствовать при наличии выраженных признаков кардита; отмечаются астенизация и вегетативная дисфункция.
Первичный ревмокардит следует дифференцировать от так называемых функциональных заболеваний сердца (см. «Нейроциркуляторная дистония»). Общими для обоих заболеваний служат «кардиальные» жалобы, связь ухудшения состояния с перенесенной инфекцией, субфебрилитет, молодой возраст.
Углубленный анализ симптомов показывает, что при первичном ревмокардите, в отличие от НЦД, нет связи начала болезни с разнообразными стрессорными воздействиями, отсутствуют астеноневротические «кардиальные» жалобы (ощущение остановки, замирания сердца), так называемый респираторный синдром (чувство нехватки воздуха, неудовлетворенность вдохом) и вегетативно-сосудистые кризы. В то же время при НЦД есть длительный анамнез, и больные попадают в поле зрения врача во время очередного обострения болезни. При этом не выявляются признаки поражения миокарда (увеличение размеров, глухость I тона, систолический шум, трехчленный ритм в сочетании с тахикардией), нет и лабораторных острофазовых показателей, а также измененных иммунологических показателей. Эффект седативной терапии и применения р-адреноблокаторов отчетливо выражен.
Если в клинической картине первичного ревматизма доминирует поражение суставов (выраженный полиартрит), то дифференциальную диагностику необходимо проводить с реактивными артритами (развивающимися в ответ на кишечную или урогенитальную неспецифическую инфекцию), а также с СКВ. Основу отличия ревматизма от этих заболеваний составляют такие признаки, как эпидемиологический анамнез, частое сочетание полиартрита с поражением сердца, быстрая динамика клинической симптоматики под влиянием противоревматической терапии.
Иногда ОРЛ необходимо дифференцировать от антифосфолипидного синдрома, который может манифестировать поражением клапанного аппарата и развитием хореи, при этом следует учитывать анамнестические данные и результаты определения антифосфолипидных антител.
Распознавание активного ревматического процесса у больных со сформированным пороком сердца (возвратного ревмокардита) основано на тех же диагностических критериях, но данные физикального обследования, а также инструментальные и рентгенологические показатели в гораздо большей степени будут обусловлены существующим пороком сердца, а не активным ревматическим процессом. В связи с этим при диагностике рецидива болезни следует ориентироваться на связь ухудшения состояния больного (возникновение или нарастание симптомов сердечной недостаточности) с перенесенным инфекционным заболеванием, существование артралгий, субфебрильной температуры тела и лабораторных показателей активности ревматического процесса (острофазовых и иммунологических).
Возвратный (рецидивирующий) ревмокардит на фоне того или иного порока сердца в сочетании с сердечной недостаточностью следует дифференцировать от инфекционно-аллергического (неспецифического) миокардита тяжелого течения. Основным при этом считают отсутствие «ревматического» анамнеза, признаков клапанного порока сердца и лабораторных показателей активности при миокардите.
Формулировку развернутого клинического диагноза осуществляют в соответствии с классификацией и номенклатурой ревматизма. Она должна включать следующие пункты:
• активность (степень активности) процесса или ремиссия;
• характер поражения сердца;
• существование (отсутствие) поражения других органов и систем;
• характер течения;
• состояние кровообращения.
Лечение
В настоящее время лечение ревматизма проводят в три этапа:
• лечение в активной фазе в стационаре;
• продолжение лечения больного после выписки в кардиоревматологических кабинетах поликлиники;
• последующее многолетнее диспансерное наблюдение и профилактическое лечение в поликлинике.
Лечебные мероприятия включают:
• борьбу со стрептококковой инфекцией;
• подавление активного ревматического процесса (воспаление на иммунной основе);
• коррекцию иммунологических нарушений.
На первом этапе (стационарном) рекомендовано соблюдение постельного режима в течение 2-3 нед, питание с ограничением хлорида натрия (поваренной соли) и достаточным количеством полноценных белков (не менее 1,0-1,5 г на 1 кг массы тела).
Этиотропную терапию осуществляют бензилпенициллином, оказывающим бактерицидное действие на гемолитические стрептококки группы А. Бензилпенициллин назначают в дозе 1,5-4 млн ЕД в течение 10 дней. Вместо бензилпенициллина можно использовать полисинтетические пенициллины (ампициллин, оксациллин и пр.). При индивидуальной непереносимости пенициллинов применяют макролиды: спирамицин по 6 млн МЕ в 2 приема в течение 10 дней; азитромицин в дозе 0,5 г 1 раз в день в течение 3 дней; рокситромицин по 0,3 г в 2 приема в течение 10 дней.
Активный ревматический процесс купируют различными НПВС. Преимущество отдают диклофенаку - наиболее эффективному средству, оказывающему наименее выраженное побочное действие. Суточная доза этого препарата составляет 100 мг. Его следует принимать до полной ликвидации активности ревматического процесса.
При высокой активности (III степень), тяжелом первичном ревмокардите с признаками сердечной недостаточности (что чаще встречается у лиц молодого возраста) или признаками полисерозита показаны глюкокортикоидные препараты (преднизолон в дозе 1,0-1,5 мг/кг массы тела). По достижении клинического эффекта (обычно - через 2 нед) дозу постепенно снижают с последующим назначением НПВС.
При вялотекущем процессе большего эффекта достигают от проведения иммуносупрессивной терапии (коррекция иммунного гомеостаза) с помощью
аминохинолиновых производных - гидроксихлорохина и хлорохина. Эти препараты назначают по 0,2 и 0,25 г соответственно, 1-2 раза в сутки в течение длительного времени (не менее одного года). Спустя год дозу можно уменьшить в 2 раза.
На втором этапе (поликлиническом) медикаментозное лечение следует продолжать в тех же дозах, которые больной принимал при выписке из стационара. Длительность приема противовоспалительных препаратов при остром течении обычно составляет 1 мес, при подостром - 2 мес. Как было отмечено ранее, аминохинолиновые препараты принимают длительно (1-2 года).
Поликлинический этап также предусматривает проведение после перенесенной атаки ОРЛ обязательной антибиотикопрофилактики. Назначают пенициллин пролонгированного действия - бензатина бензилпенициллин в дозе 2,4 млн ЕД внутримышечно 1 раз в 3 нед: для больных, перенесших ОРЛ без отчетливого кардита, - не менее 5 лет или до достижения возраста 18 лет; для больных с излеченным ревмокардитом без порока сердца - не менее 10 лет или до достижения возраста 25 лет; для больных со сформированным пороком сердца, в том числе и оперированным, - пожизненно.
В задачу третьего этапа входит пребывание детей и подростков в местном ревматологическом санатории, а у взрослых - направление на реабилитацию в кардиологический санаторий.
При хроническом тонзиллите хирургическое лечение проводят только при неэффективности консервативного, а также в случаях, если обострение тонзиллита приводит к рецидиву ОРЛ.
Больным с сердечной недостаточностью проводят соответствующую терапию ингибиторами АПФ, мочегонными средствами, р-адреноблокаторами (см. «Сердечная недостаточность»).
Больных, перенесших ОРЛ, ставят на диспансерный учет не только с целью проведения противорецидивного лечения, но и для своевременной диагностики рецидива ОРЛ, а при прогрессировании клапанного порока - для направления в кардиохирургический стационар.
Прогноз
Непосредственная угроза для жизни при ОРЛ возникает крайне редко. Прогноз определяет выраженность порока сердца и состояние сократительной функции миокарда.
Профилактика
Первичная профилактика состоит из комплекса общественных и индивидуальных мер, направленных на предупреждение первичной заболеваемости (повышение жизненного уровня, пропаганда здорового образа жизни, в частности закаливания, улучшение жилищных условий, борьба со скученностью в детских садах, школах, общественных учреждениях).
Важным фактором служит раннее и эффективное лечение ангин и других острых стрептококковых заболеваний верхних дыхательных путей. Это достигается назначением пролонгированных форм пенициллина. При непереносимости бензилпенициллина можно назначать эритромицин в течение 10 дней.
Любое лечение ангины должно продолжаться не менее 10 дней, что приводит к полному излечению стрептококковой инфекции.
Профилактика рецидива ревматической лихорадки (вторичная профилактика) должна назначаться в стационаре сразу после окончания 10-дневного лечения пенициллинами (макролидами). Классический режим - применение бензатина бензилпенициллина по 2,4 млн ЕД внутримышечно 1 раз в 3-4 нед. Чем меньше возраст больного при первой атаке, тем больше вероятность рецидива. После пятилетнего наблюдения частота рецидивов, как правило, снижается с возрастом. Больные, у которых во время предыдущих атак было установлено минимальное поражение сердца, должны получать противорецидивную профилактику минимум до достижения возраста 40 лет. Пациентам, перенесшим операцию на сердце по поводу ревматического порока сердца, вторичную профилактику проводят пожизненно.
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Инфекционный эндокардит (ИЭ) - полипозно-язвенное поражение клапанного аппарата сердца или пристеночного эндокарда (реже эндотелия аорты или крупной артерии), вызванное различными патогенными микроорганизмами или грибами и сопровождающееся тромбоэмболиями, а также системным поражением сосудов и внутренних органов на фоне измененной реактивности организма.
Термин «инфекционный эндокардит» в настоящее время вытеснил ранее использовавшиеся термины «бактериальный эндокардит», «затяжной септический эндокардит», так как лучше отражает причину заболевания, вызываемого самыми различными микроорганизмами - бактериальными агентами, риккетсиями, вирусами и грибами.
Наиболее часто заболевают ИЭ лица в возрасте 20-50 лет, мужчины несколько чаще, чем женщины. Особенность «современного» ИЭ состоит в высокой частоте возникновения заболевания в пожилом и старческом возрасте (более 20% всех случаев), увеличении числа больных с первичной формой болезни (более 50%), возникновении новых клинических вариантов течения и в значительном изменении свойств возбудителя.
Этиология
Среди возбудителей, наиболее часто вызывающих ИЭ, обнаруживают кокковую микрофлору - стрептококки (зеленящий стрептококк ранее выделяли в 90% случаев), стафилококки (золотистый, белый) и энтерококки. Значительно реже причиной болезни бывает грамотрицательная микрофлора - кишечная палочка, синегнойная палочка, протей и клебсиелла. В последние годы большую роль стали играть патогенные грибы, протей, сарцины, бруцеллы, вирусы. У ряда больных истинного возбудителя заболевания не обнаруживают (частота получения отрицательного результата при посеве крови колеблется в пределах 20-50%). Обнаружение возбудителя зависит от многих факторов: качества бактериологического исследования, длительности предшествующей антибактериальной терапии и особенностей возбудителя.
Источники инфекции и бактериемии при ИЭ могут быть самыми разными.
• Операции в полости рта.
• Операции и диагностические процедуры на органах мочеполовой системы.
• Инфекционное поражение кожи.
• Оперативное вмешательство на сердечно-сосудистой системе (в том числе протезирование клапанов).
• Длительное пребывание катетера в вене.
• Частые внутривенные вливания и эндоскопические методы исследования.
• Хронический гемодиализ (артериовенозный шунт).
• Наркомания (внутривенное введение наркотиков).
ИЭ может развиться на интактных клапанах (первичный эндокардит), а также на фоне ранее существовавших (врожденных и приобретенных) изменений сердца и его клапанного аппарата (вторичный ИЭ).
Имеет значение в развитии ИЭ и ряд медицинских манипуляций (оперативные вмешательства в полости рта, катетеризация мочевого пузыря, ректороманоскопия, установка внутривенного катетера). Наконец, имеет также значение ряд состояний, сопровождающихся снижением иммунитета: сахарный диабет, токсикомания (в том числе алкоголизм), ВИЧ-инфекция, лечение мощными иммунодепрессантами. В настоящее время приобрел большое значение ИЭ наркоманов.
Патогенез
Механизм развития заболевания сложен и изучен недостаточно, но основные моменты развития ИЭ не вызывают сомнения (рис. 2-2). При существовании в организме очага инфекции под влиянием различных эндогенных и экзогенных факторов, изменяющих реактивность и иммунный статус организма, развивается бактериемия.
Микроорганизмы из крови попадают на клапаны сердца, где в дальнейшем формируют вторичный очаг инфекции. Их фиксации и размножению на эндокарде, приводящем к образованию вторичного септического очага, способствуют дополнительные факторы. Вероятно, имеет значение предшествующее изменение ткани и поверхности клапана, а также присутствие на нем тромботических масс (часто - с развитием абактериального эндокардита), образующихся под влиянием прямого повреждающего действия струи крови, движущейся с большой скоростью или под большим давлением (в условиях имеющегося порока сердца). Деформация клапанов вследствие большого градиента давления, узости отверстия и изменения скорости кровотока создает условия, способствующие внедрению инфекционных агентов в эндокард с образованием инфекционного очага.
При поражении ранее интактного клапана происходят изменения, нарушающие нормальные свойства отдельных участков этого клапана в виде отечности, экссудативных или пролиферативных процессов («интерстициальный вальвулит» - доклиническая фаза). Подобная ситуация возможна и при повреждении интимы крупных сосудов.
Происходит снижение иммунитета (в основном клеточного) с развитием вторичных иммунных нарушений (наряду с бактериальными антигенами существуют и антигены тканевого происхождения, что приводит к образованию
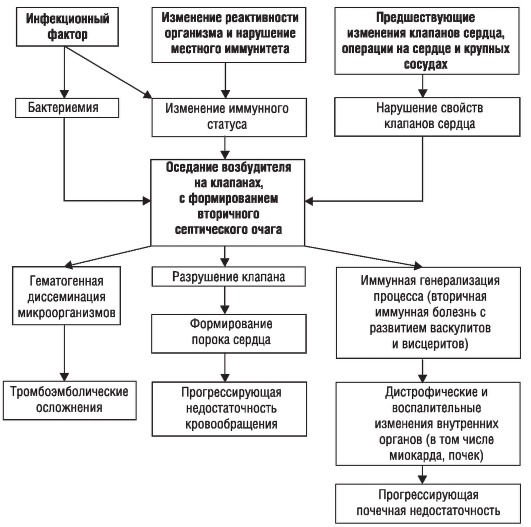
Рис. 2-2. Патогенез инфекционного эндокардита
иммунных комплексов, которые циркулируют в крови и оседают на различные органы и ткани). Патогенез представлен на рис. 2-2.
Классификация
• I. По клиническому течению:
- острый (заболевание длится не более 1-1,5 мес);
- подострый (заболевание длится 3-4 мес);
- затяжной (заболевание длится многие месяцы).
• II. По клинико-морфологической форме:
- первичный (на интактном сердце) - более 50%;
- вторичный на фоне:
ревматических пороков сердца; пролапса митрального клапана; - врожденных пороков сердца;
ГКМП;
постинфарктной аневризмы; артериовенозных аневризм;
оперированного сердца и сосудов;
шунтов при хроническом гемодиализе.
В клинической картине заболевания принято выделять группы симптомов, обусловленных различными патогенетическими механизмами.
• Симптомы, обусловленные инфекционно-токсическим воздействием, протекают с интоксикацией различной степени выраженности и с повышением температуры тела. Рост бактерий сопровождает формирование вегетаций с разрушением клапанов (развитие порока сердца). Происходит также генерализация процесса за счет гематогенного распространения инфекции. Отрыв фрагментов клапанных микробных вегетаций способствует заносу инфицированных эмболов в различные участки сосудистого русла и усугубляет септические проявления. Одновременно эмболы, попадая с током крови в различные органы, вызывают развитие тромбоэмболических осложнений, проявляющихся симптомами инфаркта почки, миокарда, селезенки, сосудов глаз, кожи и др.
• Симптомы, обусловленные иммуновоспалительными механизмами, связаны с иммунной генерализацией процесса. Микроорганизмы, фиксированные на клапанах, вызывают длительную аутосенсибилизацию и гиперергическое повреждение органов и тканей организма. В этой стадии выявляют циркулирующие в крови и фиксированные в тканях (сердце, почки, печень, сосуды) иммунные комплексы. Иммунные и аутоиммунные нарушения обусловливают развитие васкулитов и висцеритов (иммунокомплексный нефрит, миокардит, гепатит, капиллярит и др.). В ряде случаев иммунные нарушения, называемые вторичными, могут развиваться с самого начала болезни, по существу в продромальный период.
• При дальнейшем прогрессировании болезни могут развиваться дистрофические изменения органов с их функциональной недостаточностью (наибольшее значение имеют сердечная и почечная недостаточность, часто приводящая к смерти больных).
Клиническая картина
Проявления ИЭ весьма разнообразны и могут быть представлены в виде ряда синдромов.
• Синдром воспалительных изменений и септицемии (лихорадка, озноб, геморрагические высыпания, изменение острофазовых показателей крови: лейкоцитоз со сдвигом влево, увеличение СОЭ, СРБ, повышение содержания фибриногена, а2-глобулинов, положительная гемокультура).
• Интоксикационный синдром (общая слабость, выраженная потливость, головные боли, миалгии и артралгии, снижение аппетита, бледность кожного покрова с желтушным оттенком).
• Синдром клапанных поражений (формирование порока сердца, чаще аортального или митрального, прежде не измененных клапанов или присоединение новых поражений клапанов к ранее существовавшим).
• Синдром лабораторных иммунных нарушений (циркулирующие в крови иммунные комплексы, фиксированные иммунокомплексные депозиты в почках, миокарде и сосудах; гипергаммаглобулинемия; РФ; противотканевые антитела).
• Синдром тромбоэмболических осложнений (очаговый нефрит, ИМ, селезенки, кишечника, тромбоэмболии в мозг, сетчатку глаза, сосуды нижних конечностей и т.д.).
• Синдром иммунных поражений органов и систем (диффузный гломерулонефрит, миокардит, гепатит, васкулит и др.).
Степень выраженности указанных синдромов различна. Она определяется не только периодом болезни, но и характером течения ИЭ, на который влияет вид возбудителя. Стафилококковый эндокардит характеризуется высокой активностью процесса, тяжелым общим состоянием, гектической лихорадкой, развитием гнойных осложнений. Грибковые эндокардиты, как правило, сопровождаются эмболической окклюзией крупных артерий, особенно нижних конечностей. «Классическая» картина заболевания характерна для ИЭ, вызванного зеленящим стрептококком.
На первом этапе диагностического поиска обращают внимание на жалобы, обусловленные инфекцией и интоксикацией, тромбоэмболическими осложнениями, поражением сердца, вовлечением в патологический процесс других органов и систем.
Наиболее существенным для последующего диагноза следует считать одновременное наличие жалоб, указывающих на инфекционный процесс и поражение сердца.
В анамнезе обычно выявляют указания на перенесенный в прошлом ревматизм, наличие приобретенного или врожденного порока сердца, а также эпизоды «немотивированной» длительной лихорадки или субфебрилитета. Начало заболевания часто связано с острой инфекцией или обострением хронической инфекции, а также с рядом врачебных манипуляций (экстракция зубов, аборты, тонзиллэктомия, катетеризация мочевого пузыря, сосудов, операции на сердце и т.д.). Особенно характерно сочетание повышения температуры тела с ознобами и потливостью. Степень повышения температуры тела может быть различной: при остром течении отмечают повышение до 39 °С, тогда как при подостром и затяжном течении температура может быть субфебрильной. Вместе с тем у больных, длительно болеющих и имеющих сердечную или почечную недостаточность, при рецидивах болезни и несомненной активности процесса температура тела может быть нормальной.
Кроме того, можно выявить жалобы, обусловленные и сердечной недостаточностью (на фоне длительно существовавшего порока сердца), а также жалобы, связанные с тромбоэмболическими осложнениями (в особенности тромбоэмболии мелких мезентериальных сосудов, почечных артерий и селезенки).
В анамнезе больных могут быть эпизоды длительного лечения антибиотиками (это бывает при рецидиве ИЭ у больных, ранее уже подвергавшихся лечению).
В случае типичного течения болезни уже на этом этапе можно заподозрить ИЭ. У ряда больных на первом этапе характер заболевания (ИЭ или какое-то иное заболевание) остается неясным и может быть установлен в дальнейшем лишь с учетом результатов последующих этапов диагностического поиска.
На втором этапе диагностического поиска наибольшее значение для постановки правильного диагноза имеет обнаружение:
• поражения клапанов сердца (возникновение патогномоничных для ИЭ симптомов аортальной или митральной недостаточности и дополнительных шумов, а также изменение аускультативной картины ранее существовавших пороков сердца);
• поражения кожи и слизистых оболочек: цвет кожного покрова типа «кофе с молоком», геморрагии, положительные симптомы Гехта (щипка) и Кончаловского-Румпеля-Лееде (жгута), а также узелки Ослера - болезненные гиперемированные плотные узелки на ладонной поверхности и кончиках пальцев, признак Лукина-Либмана (пятна Лукина) - геморрагия на переходной складке конъюнктив;
• весьма типичный симптом ИЭ - снижение массы тела, иногда значительное, на 15-20 кг;
• увеличения селезенки и печени (спленомегалию часто обнаруживают при ИЭ и почти никогда - при ревматизме).
Пальцы в виде «барабанных палочек» - симптом, не имеющий в настоящее время большого диагностического значения, так как его регистрируют чрезвычайно редко (ранее - в 30-50% случаев). Тем не менее его обнаружение - лишний довод в пользу постановки диагноза ИЭ.
При пороке сердца (в особенности при вторичных ИЭ) можно обнаружить признаки хронической сердечной недостаточности. Другая причина их появления - развитие миокардита, что проявляется глухостью сердечных тонов, систолическим шумом, относительной недостаточностью митрального клапана и дилатацией полостей сердца.
В редких случаях развивается перикардит (нерезкий шум трения перикарда, обусловленный фибринозными наложениями).
При физическом обследовании можно выявить повышение АД, вызывающее подозрение на развитие диффузного гломерулонефрита. У части больных выявляют нарушения ЦНС (парезы, гиперкинезы, патологические рефлексы и др.) как проявление васкулитов или эмболии в мозговые сосуды. При исследовании органов дыхания можно выявить инфарктную пневмонию.
С учетом выявленных симптомов на этом этапе поиска диагноз ИЭ представляется весьма вероятным, особенно при характерном анамнезе. У лиц, не имеющих характерного анамнеза, выявленных симптомов также бывает достаточно, чтобы заподозрить ИЭ.
На втором этапе наиболее частой диагностической ошибкой служит оценка того или иного синдрома в качестве проявлений самостоятельного заболевания: например, при выраженных изменениях в анализе мочи ставят диагноз гломерулонефрита (как самостоятельного заболевания) и пр. Естественно, это возможно при недостаточном учете всей клинической картины и отсутствии связи ведущего синдрома с другими проявлениями болезни.
На третьем этапе диагностического поиска проводят исследования, подтверждающие предварительный диагноз ИЭ и позволяющие сформулировать окончательный развернутый диагноз.
• Лабораторно-инструментальные исследования предусматривают:
- повторные попытки обнаружения возбудителя болезни при многократных посевах крови;
- подтверждение и (или) установление воспалительного характера патологического процесса (выявление острофазовых показателей крови);
- обнаружение иммунологических изменений;
- уточнение характера поражения различных органов и систем;
- получение прямых диагностических признаков инфекционного поражения эндокарда.
• Получение положительной гемокультуры - наиболее важный диагностический признак ИЭ. Для подтверждения диагноза требуется не менее 2-3 анализов. Единичная положительная гемокультура должна интерпретироваться с большой осторожностью вследствие возможности случайного загрязнения. Большое значение имеют техника забора и посева крови, время посева (желательно на высоте лихорадки), использование обогащенных сред. Отрицательная гемокультура не исключает ИЭ. Переоценивать роль посевов крови нельзя, так как имеет значение только положительный результат в сопоставлении с клинической картиной.
• В клиническом анализе крови наиболее важным для диагностики является повышение СОЭ до 50 мм/ч и более. В дебюте ИЭ выявляют лейкоцитоз со сдвигом лейкоцитарной формулы влево, позже могут обнаруживаться лейкопения и гипохромная анемия.
• При биохимическом анализе крови выявляют увеличение содержания фибриногена, а2-глобулинов и резкое увеличение уровня у-глобулинов - до 30-40%. Кроме гипергаммаглобулинемии, показателями иммунологических изменений служат обнаружение ЦИК, снижение титра комплемента, появление ревматоидного (антиглобулинового) фактора, усиление реакции бластной трансформации лимфоцитов с фитогемагглютинином и бактериальными антигенами, выявление противотканевых антител. Как правило, при ИЭ в отличие от ревматизма титры антистрептолизина-О и антигиалуронидазы соответствуют норме.
• Анализ мочи позволяет обнаружить гломерулонефрит, манифестирующий протеинурией, цилиндрурией и гематурией. При высокой протеинурии можно предположить развитие амилоидоза (редко встречающееся осложнение ИЭ). Повышение содержания билирубина, трансаминаз указывает на поражение печени.
• Рентгенологическое, электро- и фонокардиографическое исследование помогает уточнить характер клапанного поражения сердца.
• Прямой признак ИЭ - вегетации на клапанах сердца, которые можно обнаружить во время ЭхоКГ (особенно при использовании чреспищеводной регистрации с помощью специального датчика).
Таким образом, на заключительном этапе диагностического поиска у большинства больных можно с уверенностью диагностировать ИЭ. В некоторых случаях для установления окончательного диагноза требуется динамическое наблюдение.
Диагностика
Распознавание ИЭ при развитой клинической картине заболевания не представляет существенных трудностей.
В современной клинической практике применяют критерии, разработанные в 1994 г. D. Durack и модифицированные в 2000 г.
• Большие критерии:
- положительный посев крови:
положительная гемокультура: типичные для ИЭ возбудители в двух посевах крови - зеленящие стрептококки, Streptococcus bovis, микроорганизмы группы HACEK, Staphylococcus aureus или внебольничные энтерококки при отсутствии первичного очага;
или микроорганизмы, которые могут вызвать ИЭ: по крайней мере, два положительных посева крови, взятой с интервалом более 12 ч, или все три посева, или большинство из более чем четырех посевов крови (первый и последний образцы взяты с интервалом, по крайней мере, 1 ч);
Или однократный положительный посев крови на Coxiella burnetii или титр IgG антител 1 фазы >1\800;
- признаки поражения эндокарда:
эхокардиографические признаки ИЭ - вегетации, абсцесс или частичный отрыв искусственного клапана;
возникновение регургитации.
• Малые критерии.
- предрасположенность: заболевания сердца, предрасполагающие к развитию ИЭ, внутривенная наркомания;
- лихорадка >38 °С;
- сосудистые нарушения: артериальные эмболии, септический инфаркт легкого, микотические аневризмы, внутричерепное кровотечение, кровоизлияния в конъюнктиву;
- иммунологические нарушения: гломерулонефрит, узелки Ослера, пятна Рота, РФ;
- бактериологические изменения: положительный посев крови, не соответствующий большим критериям, или серологические признаки инфицирования возможным возбудителем ИЭ.
ИЭ диагностируют при обнаружении двух больших, одного большого и трех малых или пяти малых критериев.
Диагноз ИЭ возможен при обнаружении одного большого и одного малого или трех малых критериев.
Трудности диагностики обусловлены стертым и атипичным течением ИЭ. Если вторичный септический очаг локализован не в сердце, а в интиме крупных артерий, то исчезает такой важный диагностический признак, как формирование порока сердца. С учетом этого необходимо оценивать комплекс других диагностически значимых симптомов ИЭ.
Определенные сложности возникают в диагностике на ранних этапах, особенно при первичном ИЭ, начало которого очень напоминает другие заболевания.
Следует помнить о разнообразных вариантах начала ИЭ.
• Типичное постепенное начало заболевания (субфебрильная температура тела, слабость, недомогание, головная боль, артралгии). В таких случаях ИЭ следует дифференцировать от ревматизма; при развитии аортальной недостаточности - от висцерального сифилиса.
• Начало болезни по типу острого инфекционного заболевания: высокая температура тела с проливным потом и ознобом. Следует проводить дифференциальную диагностику с гриппом, брюшным тифом, малярией и другими инфекциями.
• Болезнь начинается с развития тромбоэмболии (наиболее часто в мозг, селезенку, почки). ИЭ необходимо дифференцировать от инсульта. Наиболее часто ИЭ проявляется тромбоэмболиями в мозг у пожилых людей. Дифференциальную диагностику проводят с почечной коликой при эмболии в почки.
• При возникновении симптомов острого гломерулонефрита (ОГН) в начале заболевания (гематурия, протеинурия, отеки, гипертензия) необходим учет диагностически значимых симптомов ИЭ (шум регургитации, данные ЭхоКГ, положительная гемокультура и др.).
• Гематологическая маска ИЭ, выражающаяся в анемии, увеличении селезенки, требует проведения дифференциальной диагностики с целым рядом болезней системы крови.
ИЭ наркоманов характеризуется:
• наиболее частым поражением трикуспидального клапана;
• наиболее распространенными возбудителями - белым и золотистым стафилококком, реже - грамотрицательной микрофлорой;
• картиной прогрессирующей правожелудочковой недостаточности;
• тромбоэмболией легочной артерии;
• рецидивирующим течением.
Некоторые признаки ИЭ (особенно вторичного) схожи с таковыми ОРЛ. Признаки, позволяющие дифференцировать ИЭ и ОРЛ (О.М. Буткевич и др., 1993):
• ознобы;
• увеличение селезенки;
• положительная гемокультура;
• лихорадка выше 38 °С;
• узелки Ослера и кожный васкулит;
• вегетации на клапанах;
• анемия;
• повышение активности щелочной фосфатазы нейтрофилов. Формулировка развернутого клинического диагноза должна отражать:
• клинико-морфологическую форму ИЭ (первичный или вторичный);
• этиологию (если удается повторно получить положительную гемокультуру);
• характер клапанного поражения;
• наиболее важные органные поражения с указанием выраженности функциональных расстройств (сердечная, почечная недостаточность, анемия и пр.);
• осложнения (тромбоэмболии и пр.).
Лечение
При лечении больных ИЭ следует руководствоваться рядом правил:
• использовать антибиотики, активные в отношении потенциальных и установленных возбудителей;
• применять бактерицидные антибиотики, так как в вегетациях микроорганизмы находятся в низкой метаболической активности;
• использовать антибиотики, обладающие синергизмом;
• вводить антибиотики парентерально для получения более высоких и предсказуемых сывороточных концентраций;
• антимикробная терапия должна быть длительной для обеспечения стерилизации вегетаций клапанов;
• антибиотическую терапию следует начинать как можно раньше. Следует различать эмпирическую антибиотикотерапию ИЭ и антибиотико-
терапию ИЭ установленной этиологии (известна бактериальная микрофлора).
• Эмпирическая антибиотическая терапия ИЭ
- ИЭ подострого течения:
бензилпенициллин по 12-24 млн ЕД/сут в равных дозах каждые 4 ч в течение 4 нед;
или ампициллин 175 мг/кг в сутки внутривенно в равных дозах каждые 4 ч в течение 4 нед + гентамицин 3 мг/кг в сутки внутривенно или внутримышечно в 2-3 введения в течение 2 нед;
или ванкомицин по 15 мг/кг внутривенно каждые 12 ч в течение 4-6 нед + гентамицин 3 мг/кг внутривенно или внутримышечно в 2-3 дозах в течение 2 нед.
• При ИЭ установленной этиологии (зеленящий стрептококк с различной вирулентностью) используют также бензилпенициллин в высоких дозах в сочетании с гентамицином или антибиотики группы цефалоспоринов III поколения (цефриаксон), аминогликозидов (тобрамицин); препараты вводят, как правило, внутривенно или внутримышечно (не менее 4 нед).
- При ИЭ нестрептококковой этиологии целесообразно применять комбинированную терапию: бензилпенициллин чаще всего комбинируют с аминогликозидами (гентамицином). Гентамицин применяют в дозе 240-320 мг/сут (по 3-5 мг/кг) в виде курсового лечения: препарат вводят в течение 8 дней, затем 5-7 дней перерыв, повторное введение препарата в течение 8 дней, снова перерыв, при необходимости проводят третий курс. Цель прерывистого лечения - предупреждение нефротоксического, гепатотоксического действия препарата. У больных пожилого и старческого возраста суточная доза не должна превышать 240 мг. Вместо гентамицина может быть применен препарат этой же группы - сизомицин (по 2 мг/кг). Все препараты этой группы противопоказаны при почечной недостаточности и заболеваниях слухового нерва. Тем не менее комбинация бензилпенициллина с аминогликозидами - одна из наиболее эффективных при лечении ИЭ.
- При ИЭ стафилококковой этиологии весьма эффективны полусинтетические пенициллины, устойчивые к ферменту пенициллиназе, продуцируемой стафилококком. Наиболее часто используют оксациллин (10- 20 г/сут), а также ампициллин, ампициллин + оксациллин по 10-16 г/сут. Эти препараты сочетают с гентамицином. При отсутствии эффекта от лечения следует назначать антибиотики цефалоспоринового ряда: цефотаксим по 6-8 г внутривенно или внутримышечно равными дозами каждые 6-8 ч (в течение 6 нед) в сочетании с амикацином (по 1-1,5 г
внутримышечно равными дозами каждые 8-12 ч в течение 14 дней с интервалом 14 дней); цефалотин в дозе 8-12 г внутривенно или внутримышечно равными дозами каждые 6 ч в течение 6 нед.
- При энтерококковой инфекции - бензилпенициллин 20-30 млн ЕД внутривенно или внутримышечно каждые 4 ч в течение 6 нед в сочетании со стрептомицином по 1 г внутримышечно равными дозами каждые 12 ч в течение 4 нед. При недостаточном эффекте от данной комбинации препаратов назначают ампициллин по 8-12 г внутримышечно равными дозами каждые 6 ч в течение 6 нед с гентамицином в обычных дозах.
- Лечение грибкового ИЭ проводят амфотерицином (по 30-55 мг/сут). Курс - не менее 40-50 дней. Используют также флуконазол.
- В качестве антибиотиков резерва используют доксициклин и фузидовую кислоту (по 2-3 г/сут).
К основным антибиотикам, применяемым при ИЭ, относят также рифампицин (в дозе 600-1200 мг в капсулах и внутривенно), действующий на стафилококки и стрептококки. Препарат оказывает сенсибилизирующее действие, поэтому всегда лучше проводить один длительный курс лечения, чем повторные короткие курсы. Чаще применяется как резервный препарат при неэффективности других антибиотиков. Отмену антибиотиков производят сразу, без постепенного уменьшения дозы. После отмены антибактериальных препаратов при хорошем самочувствии и благополучных лабораторных показателях больного наблюдают в стационаре еще 7-10 дней для исключения развития ранних рецидивов. Если в процессе лечения развивается резистентность микроорганизмов к проводимой терапии (что проявляется возвратом симптомов: вновь повышается температура тела, появляются ознобы, слабость, повышается СОЭ), то следует резко повысить дозу применяемых антибиотиков либо сменить препарат.
Следует отметить, что существует ряд факторов, обусловливающих резистентность к проводимой антибиотикотерапии. Это позднее начало лечения (в связи с трудностями диагностики); особая вирулентность микрофлоры; наличие микробных ассоциаций (патологический процесс вызывается не одним микроорганизмом); пожилой возраст больных; поражение нескольких клапанов одновременно; эндокардит трехстворчатого клапана; ИЭ, развивающийся у больных, имеющих протезы клапанов или подвергающихся гемодиализу.
Глюкокортикоиды применяют в настоящее время для лечения ИЭ нечасто. Следует отметить, что при лечении ИЭ глюкокортикоиды показаны при резко выраженных иммунных сдвигах: высоком уровне ЦИК в крови, концентрации IgM и IgА, васкулите, артрите, миокардите, а также в случае высокой аллергической чувствительности к антибиотикам. Назначают обычно небольшие дозы (15-20 мг преднизолона в сутки). Лечение глюкокортикоидами необходимо проводить обязательно в сочетании с антибиотиками и заканчивать его за 1 нед до отмены антибиотиков.
Из препаратов иммунотерапии применяют противостафилококковый иммуноглобулин человека в сочетании с антибактериальной терапией (5 вливаний на курс), что может обеспечить при стафилококковом ИЭ наступление стойкой ремиссии, которую иногда не удается получить при применении одних антибиотиков. В ряде случаев эффективны сеансы плазмафереза, во время которых удаляют из крови различные иммунные комплексы.
В случае необходимости назначают симптоматическое лечение:
• при сердечной недостаточности - мочегонные средства и ингибиторы АПФ;
• при тромбоэмболии - фибринолитики и антикоагулянты, хирургическое удаление эмбола;
• при анемии - препараты железа;
• при кахексии - анаболические стероиды;
• при повышении АД - антигипертензивные препараты и т.д.
В последние годы применяют хирургическое лечение ИЭ, показаниями к которому служат:
• устойчивость к антибиотикам различных групп в течение 3-4 нед;
• прогрессирующая сердечная недостаточность вследствие клапанной деструкции (но не миокардита);
• выделение возбудителей, устойчивых к антибактериальной терапии (грибы, синегнойная палочка и др.);
• эндокардит протеза;
• абсцессы миокарда, клапанного кольца, внутрисердечные гнойные фистулы;
• крупные (более 10 мм), рыхлые, подвижные вегетации на клапанах или хордах, угрожающие развитием тромбоэмболий, обнаруживаемые с помощью чреспищеводной ЭхоКГ;
• повторяющиеся эмболии.
Операция состоит в замене пораженного клапана протезом (при непрерывной антибиотикотерапии). Летальность при неотложной замене аортального клапана довольно высока (около 30%), тогда как при плановой операции она значительно ниже (9%).
Исходы и эволюция инфекционного эндокардита
• Ближайшие исходы:
- полное выздоровление (с формированием порока сердца или реже без
него) - 70-80%;
- смерть на ранних этапах болезни от прогрессирования инфекции - 10%;
- летальные эмболии - 10-20%;
- переход в хроническое течение, возможны рецидивы болезни:
V ранние рецидивы - наиболее опасны, возникают в течение первых 1-3 мес (отмечают в 10-15% случаев);
V поздние рецидивы - возникают в более продолжительные сроки, обычно - после ремиссии патологического процесса.
• Отдаленные исходы:
- смерть при прогрессировании сердечной недостаточности (60-65%);
- формирование хронического нефрита и смерть от прогрессирующей почечной недостаточности (10-15%).
Прогноз
Раннее начало лечения антибиотиками в оптимальных дозах может полностью подавить воспалительный процесс. Так, выздоровление от ИЭ, вызванного зеленящим стрептококком, отмечают у 80-90% больных. Однако при других
возбудителях прогноз хуже. Так, при стафилококковом и особенно грибковом ИЭ летальность достигает 70-90%, поэтому если говорить об отдаленных результатах лечения, то полное выздоровление отмечается лишь у 1/3 больных. Прогноз при аортальной локализации эндокардита хуже, чем при митральной. При врожденных пороках ближайший и отдаленный прогноз лучше, чем при приобретенных.
Профилактика
У больных пороками сердца и другими заболеваниями, которые могут осложняться ИЭ, необходима тщательная санация инфекционных очагов, раннее и энергичное лечение любой интеркуррентной инфекции. Следует профилактически использовать лечение антибиотиками короткими курсами у лиц с повышенным риском развития ИЭ (экстракция зубов, снятие зубных камней, тонзиллэктомия, удаление катетера после урологических операций, ФГДС, колоноскопия и пр.).
Согласно международным рекомендациям существует схема профилактических мер при разных инвазивных вмешательствах.
• При манипуляциях в полости рта (зубы, миндалины, придаточные пазухи носа), фибробронхоскопии, эзофагоскопии:
- при отсутствии аллергических реакций к бензилпенициллину назначают внутрь амоксициллин по 2,0 г за 1 ч до предполагаемого вмешательства; если прием внутрь по каким-либо причинам невозможен, то амоксициллин или ампициллин вводят внутривенно в дозе 2,0 г за 0,5-1 ч до предполагаемого вмешательства;
- при наличии аллергических реакций к бензилпенициллину за 1 ч до предполагаемого вмешательства назначают внутрь клиндамицин в дозе 600 мг или азитромицин, кларитромицин в дозе 500 мг).
• При манипуляциях в урогенитальной области или фиброгастроскопии (колоноскопии):
- при отсутствии аллергических реакций к бензилпенициллину:
в группе больных высокого риска - ампициллин или амоксициллин по 2,0 г внутривенно + гентамицин в дозе 1,5 мг/кг внутривенно за 0,5-1 ч до вмешательства, через 6 ч после вмешательства - ампициллин или амоксициллин по 2,0 г внутрь;
в группе больных умеренного риска - ампициллин или амоксициллин 2,0 г внутривенно за 0,5-1 ч до вмешательства (или амоксициллин 2,0 г внутрь);
- при аллергической реакции к бензилпенициллину:
в группе больных высокого риска - ванкомицин по 1,0 г более чем за 1-2 ч до процедуры + гентамицин по 1,5 мг/кг внутримышечно;
в группе больных умеренного риска - ванкомицин по 1,0 г более чем за 1-2 ч до процедуры без гентамицина.
НЕРЕВМАТИЧЕСКИЙ МИОКАРДИТ
Миокардит - острое, подострое или хроническое воспалительное поражение миокарда преимущественно инфекционной и (или) иммунной этиологии,
которое может манифестировать общевоспалительными, кардиальными симптомами (кардиалгия, ишемия, сердечная недостаточность, аритмия, внезапная смерть) или протекать латентно.
Для миокардита характерна большая вариабельность клинической картины; нередко он сочетается с перикардитом (так называемый миоперикардит), возможно также одновременное вовлечение в воспалительный процесс эндокарда. Для удобства разграничения ревматического и иных вариантов миокардита используется термин «неревматический миокардит».
Миокардит, сопровождающийся расширением полостей сердца и сократительной дисфункцией миокарда, включен в Американскую классификацию первичных кардиомиопатий (2006) под названием «воспалительная кардиомиопатия». Этот термин был предложен с целью выделения среди больных с выраженной дилатацией камер сердца (ДКМП), тех, у кого в основе заболевания лежит воспалительный процесс, подлежащий специфическому лечению (в отличие от больных с генетической ДКМП).
Миокардит может быть самостоятельным состоянием или компонентом другого заболевания (например, системной склеродермии, СКВ, ИЭ, системного васкулита и др.).
Эпидемиология
Истинная распространенность миокардита неизвестна в связи с трудностями верификации диагноза. По некоторым данным, частота постановки диагноза «миокардит» в кардиологических стационарах составляет около 1%, при аутопсии у молодых лиц, погибших внезапно или в результате травм - 3-10%, в инфекционных стационарах - 10-20%, в ревматологических отделениях -
30-40%.
Классификация
Классификация миокардитов, предложенная в 2002 г. Н.Р. Палеевым, Ф.Н. Палеевым и М.А. Гуревичем, построена в основном по этиологическому принципу и представлена в несколько измененном виде.
• Инфекционный и инфекционно-иммунный.
• Аутоиммунный:
- ревматический;
- при диффузных болезнях соединительной ткани (СКВ, ревматоидный артрит, дерматомиозит и др.);
- при васкулитах (узелковый периартериит, болезнь Такаясу, болезнь Кавасаки и др.);
- при ИЭ;
- при других аутоиммунных заболеваниях (саркоидоз и др.);
- гиперсенситивный (аллергический), в том числе лекарственный.
• Токсический (уремический, тиреотоксический, алкогольный).
• Радиационный.
• Ожоговый.
• Трансплантационный.
• Неизвестной этиологии (гигантоклеточный, Абрамова-Фидлера и др.).
В качестве этиологического агента инфекционного миокардита могут выступать бактерии (бруцеллы, клостридии, коринебактерии дифтерии, гонококки, гемофильная палочка, легионеллы, менингококки, микобактерии, микоплазмы, стрептококки, стафилококки), риккетсии (лихорадка скалистых гор, Кулихорадка, лихорадка цуцугамуши, сыпной тиф), спирохеты (боррелии, лептоспиры, бледные трепонемы), простейшие (амебы, лейшмании, токсоплазмы, трипаносомы, вызывающие болезнь Шагаса), грибы и гельминты.
Наиболее часто причиной развития инфекционного миокардита становятся аденовирусы, энтеровирусы (Коксаки группы В, ECHO), вирусы герпетической группы (цитомегаловирус, вирус Эпстайна-Барр, вирус герпеса 6 типа, герпес зостер), ВИЧ, вирусы гриппа и парагриппа, парвовирус В19, а также вирусы гепатита В, С, эпидемического паротита, полиомиелита, бешенства, краснухи, кори и др. Возможно развитие микст-инфекции (двумя вирусами, вирусом и бактерией и др.).
Миокардит при инфекционных заболеваниях может не иметь большого клинического значения, развиваться в рамках полиорганного поражения (сыпной тиф, бруцеллез, боррелиоз, сифилис, ВИЧ-инфекция, инфекция вирусом гепатита С, цитомегаловирусом) или выходить на первый план в клинической картине и определять прогноз (миокардит при дифтерии, энтеровирусная инфекция, другие вирусные миокардиты и болезнь Шагаса).
При инфекционном (особенно вирусном) миокардите типично развитие аутоиммунных реакций, в связи с чем разграничить инфекционный и инфекционно-иммунный миокардит бывает затруднительно.
По течению выделяют три варианта миокардита:
• острый - острое начало, выраженные клинические признаки, повышение температуры тела, значительные изменения лабораторных (острофазовых) показателей;
• подострый - постепенное начало, затяжное течение (от месяца до полугода), меньшая степень выраженности острофазовых показателей;
• хронический - длительное течение (более полугода), чередование обострений и ремиссий.
По тяжести течения выделяют следующие варианты миокардита:
• легкий - слабо выраженный, протекает с минимальными симптомами;
• средней тяжести - умеренно выраженный, симптомы более отчетливые, возможны незначительно выраженные признаки сердечной недостаточности);
• тяжелый - ярко выраженный, с признаками тяжелой сердечной недостаточности;
• фульминантный (молниеносный), при котором крайне тяжелая сердечная недостаточность, требующая немедленной госпитализации в отделение интенсивной терапии и реанимации, развивается в считанные часы от начала заболевания и нередко заканчивается летально.
По распространенности поражения выделяют следующие варианты миокардита:
• очаговый - обычно не приводит к развитию сердечной недостаточности, может манифестировать только нарушениями ритма и проводимости, представляет значительные трудности для диагностики;
• диффузный.
Этиология
Из представленной классификации вытекает чрезвычайное разнообразие факторов, приводящих к развитию миокардита. Наиболее часто (до 50% случаев) причиной развития миокардита служат инфекционные заболевания, особенно вирусные.
Патогенез
Различные этиологические факторы вызывают повреждение миокарда и высвобождение (демаскирование или обнажение) его антигенов. Иммунокомпетентная система обусловливает выработку противомиокардиальных антител, которые участвуют в образовании иммунных комплексов, приводящих к дальнейшему повреждению миокарда. Наряду с этим развивается реакция замедленного типа, в результате которой Т-лимфоциты становятся агрессивными по отношению к миокарду. Таким образом, его повреждение происходит посредством нижеперечисленных механизмов:
• прямое миокардиоцитолитическое действие вследствие миокардиальной инвазии и репликации возбудителя;
• клеточное повреждение циркулирующими токсинами;
• неспецифическое клеточное повреждение в результате генерализованного воспаления;
• клеточное повреждение вследствие продукции специфическими клетками или гуморальной иммунной системой факторов в ответ на действие агента.
Эти механизмы влияют на сроки возникновения миокардита (ранний или отдаленный период развития инфекционного заболевания.
Клиническая картина
Клиническая картина миокардита очень многообразна и в значительной степени определяется не только этиологическим фактором, но и реактивностью организма, а также генетически запрограммированными особенностями иммунного ответа. При адекватной реакции организма на воздействие инфекционного агента миокардит может ограничиться инфекционной фазой и закончиться полным выздоровлением. При неспособности иммунной системы полностью элиминировать возбудителя возникает его длительная персистенция в миокарде, сопровождающаяся аутоиммунными реакциями, что ведет к хроническому и, как правило, диффузному воспалению, при котором установить связь заболевания с перенесенной инфекцией или воздействием иного этиологического фактора бывает непросто.
На первом этапе диагностического поиска наибольшее значение имеет определение жалоб, указывающих на возможное поражение сердца и их связи с перенесенной инфекцией. Заболевание встречается чаще в возрасте 20-40 лет, но может развиваться в любом возрасте, в том числе у пожилых больных, - в сочетании с другими заболеваниями сердца (ИБС, ГБ), что затрудняет диагностику. Вместе с тем появление симптомов миокардита у пожилых пациентов может трактоваться как ИБС без достаточных оснований.
Больные миокардитом нередко предъявляют жалобы на различного рода болевые ощущения в области сердца. Существенный признак (как правило) - это неангинозный их характер: боли длительные, не связаны с физической нагрузкой, носят самый разнообразный характер (колющие, ноющие, тупые, жгучие), при невысокой интенсивности могут описываться больным как неприятные ощущения, дискомфорт в области сердца. Однако могут встречаться и типичные ангинозные боли, обусловленные вовлечением в воспалительный процесс мелких (интрамиокардиальных) сосудов. Возможны интенсивные боли в области сердца (особенно при сопутствующем воспалении листков перикарда), которые могут потребовать введения наркотических анальгетиков и становятся источником диагностических ошибок - состояние расценивается как ИМ.
Ощущение сердцебиения, перебоев - типичны для миокардита и могут быть единственным его клиническим проявлением; их появление вместе с другими признаками указывает на «заинтересованность» сердца и направляет диагностический поиск по правильному пути. Большую роль для постановки правильного диагноза играют симптомы сердечной недостаточности, выраженные в различной степени: одышка при нагрузке или в покое, тяжесть в области правого подреберья вследствие увеличения печени, отеки ног, «застойный» кашель, уменьшение выделения мочи. Сами по себе эти симптомы не свидетельствуют о миокардите, так как встречаются при различных заболеваниях сердца, но их наличие и сочетание с другими симптомами указывают на тяжесть поражения сердечной мышцы. Повышенная утомляемость, слабость, субфебрилитет достаточно часто наблюдаются у больных миокардитами, однако они в значительно большей степени обусловлены постинфекционной астенией.
Таким образом, перечисленные симптомы возникают при многих заболеваниях сердечно-сосудистой системы и их нельзя рассматривать в качестве обязательных клинических признаков миокардита, но их следует учитывать при обращении больного к врачу, особенно после перенесенного острого респираторного, кишечного или неясного лихорадочного заболевания.
Анамнез заболевания зачастую имеет решающее значение в постановке диагноза миокардита. Помимо связи кардиальных симптомов в дебюте болезни (и их обострения при хроническом течении заболевания) с перенесенной инфекцией, необходимо учитывать остроту развития болезни, которая нехарактерна для большинства других заболеваний сердца. Вместе с тем возможно длительное хроническое течение как маломанифестного, латентного, так и тяжелого миокардита в отсутствие острого начала и четкой связи заболевания с инфекцией, что создает значительные трудности в дифференциальной диагностике. При подозрении на хронический миокардит диагностическое значение имеет эффективность иммуносупрессивной, противовоспалительной и (или) противовирусной (антибактериальной) терапии в анамнезе.
Необходимо тщательно выяснять семейный анамнез (наличие неопределенных «заболеваний сердца», необъяснимой сердечной недостаточности у относительно молодых родственников), сведения о хронических инфекционных заболеваниях любой локализации, о частоте и тяжести течения банальных «простудных» заболеваний и ОРВИ. Особого внимания требуют ангины и хронический тонзиллит в анамнезе, поскольку, далеко не всегда приводя к развитию ОРЛ, они нередко индуцируют неревматический аутоиммунный мио-
кардит. Имеет значение постоянный профессиональный контакт пациента с инфекционными возбудителями (врачи, особенно участковые, инфекционного и хирургического профиля, сотрудники бактериологических и вирусологических лабораторий, медицинские сестры). Наконец, при сборе анамнеза необходимо обращать внимание на признаки системного иммунного поражения, на сведения о поражении других органов и систем, которые в сочетании с миокардитом могут составлять характерную картину того или иного инфекционного или системного заболевания.
Объем важной для постановки диагноза информации, которую можно получить при миокардите на втором этапе диагностического поиска, зависит от тяжести заболевания.
Наиболее значимым для диагноза тяжелого миокардита считают обнаружение следующих симптомов: приглушение I тона, ритм галопа, систолический шум на верхушке сердца, нарушения ритма (преимущественно экстрасистолии), а также расширение границ сердца. При значительной дилатации камер сердца может появляться видимая пульсация в прекардиальной области, при сопутствующем перикардите может выслушиваться шум трения перикарда. Однако и эти симптомы не имеют специфического диагностического значения, так как встречаются при других заболеваниях, сопровождающихся поражением миокарда со снижением его сократительной функции. Можно также обнаружить симптомы сердечной недостаточности в виде акроцианоза, желтушности кожного покрова (в результате тяжелого застойного поражения печени или сочетанного инфекционного гепатита), положения ортопноэ, отеков, набухания шейных вен, одышки, мелкопузырчатых незвонких (застойных) хрипов в нижних отделах легких, увеличения печени. Естественно, что симптомы сердечной недостаточности отражают снижение сократительной функции миокарда, и, если подтвердится диагноз миокардита тяжелого течения, они будут указывать на значительную тяжесть его течения и распространенность поражения миокарда (диффузный миокардит).
Однако на этом этапе можно не обнаружить признаков сердечной недостаточности. Тогда следует предположить легкое течение миокардита (в подобных случаях диагноз будет основываться на анамнестических данных и результатах лабораторно-инструментальных методов исследования) или наличии другого заболевания, протекающего с жалобами, сходными с предъявляемыми больными миокардитом (например, НЦД).
Следует помнить, что увеличение сердца, признаки сердечной недостаточности могут появляться не только при миокардите, но и при другой группе заболеваний (например, при клапанных пороках сердца, ИБС с развитием аневризмы сердца, болезнях «накопления» с вовлечением в процесс миокарда, идиопатической кардиомиопатии). В связи с этим поиск симптомов, отвергающих или подтверждающих наличие этих заболеваний, весьма важен (естественно, что полученные данные надо сопоставлять с анамнезом, а в дальнейшем и с данными лабораторно-инструментальных методов исследования).
На втором этапе диагностического поиска можно обнаружить симптомы заболевания, ставшего причиной развития миокардита (например, СКВ, ИЭ и др.). Их определение при несомненных признаках поражения миокарда будет свидетельствовать об этиологии миокардита.
На третьем этапе диагностического поиска возможно обнаружение трех групп симптомов:
• подтверждающих или исключающих поражение миокарда;
• указывающих на остроту воспалительного процесса (неспецифического или на иммунной основе);
• уточняющих диагноз заболевания, которое может привести к развитию миокардита.
Результаты лабораторного исследования обладают различной чувствительностью и специфичностью в диагностике разных по этиологии форм миокардита и должны оцениваться в комплексе с другими данными. Лабораторные показатели по значению можно разделить на несколько групп.
• Показатели, позволяющие доказать воспалительно-некротическое поражение миокарда:
- обнаружение в крови сердечного тропонина I и Т, повышения активности МВ-КФК, КФК, ЛДГ (с нарушением соотношения фракций: ЛДГ- 1 > ЛДГ-2), АСТ и АЛТ (характерно лишь для тяжелого, как правило, острого миокардита);
- повышение титра антикардиальных антител (к различным антигенам сердца) класса IgM (характерно для острого процесса) и IgG, которое может возникать и нарастать спустя некоторое время с начала болезни;
- положительная реакция торможения миграции лейкоцитов в присутствии антигена миокарда.
• Показатели, позволяющие доказать существование перенесенного или активного инфекционного заболевания:
- обнаружение в крови генома кардиотропных вирусов и некоторых других возбудителей (методом ПЦР);
- в редких случаях септического миокардита - положительная гемокультура, повышение уровня прокальцитонина крови;
- обнаружение повышенного титра противовирусных или противобактериальных антител (класса IgM или IgG);
- острофазовые показатели:
увеличение числа нейтрофильных лейкоцитов со сдвигом лейкоцитарной формулы влево (эозинофилия, особенно выраженная (более 1500 клеток в 1 мл) заставляет думать о гиперсенситивном (эозинофильном) варианте миокардита как о самостоятельном заболевании либо в рамках системного процесса);
увеличение СОЭ;
обнаружение СРБ;
диспротеинемия (увеличение содержания а2-глобулинов и фибриногена);
• Показатели, позволяющие доказать иммунные нарушения, которые сами по себе недостаточно специфичны, но могут отражать активность болезни:
- уменьшение количества Т-лимфоцитов в периферической крови;
- повышение содержания в крови Ig классов А и G;
- обнаружение повышенного титра циркулирующих иммунных комплексов (ЦИК);
- повышение концентрации ИЛ-6, ФНО-а и ряда других медиаторов воспаления;
- присутствие в крови РФ в повышенном титре, антител к ДНК, кардиолипину, в редких случаях - антинуклеарного фактора (АНФ).
• Показатели, отражающие выраженность сердечной недостаточности и связанных с застойными явлениями нарушений функций печени и почек:
- повышение содержания предсердного натрийуретического фактора;
- лабораторные признаки синдрома холестаза, печеночно-клеточной и почечной недостаточности.
• Показатели, позволяющие подтвердить существование фонового заболевания, способствовавшего развитию миокардита.
В целом для неревматического миокардита весьма характерно отсутствие или незначительность лабораторных изменений. Стойкое повышение острофазовых показателей в сочетании с лихорадкой требует исключения бактериального миокардита.
С учетом данных всех этапов диагностического поиска диагноз миокардита можно поставить с достаточной убедительностью. Иногда, однако, необходимо использовать и другие методы исследования, включенные в дополнительную схему. К этим методам следует прибегать далеко не во всех случаях.
Методы исследования центральной гемодинамики не являются существенными и обязательными для диагностики миокардита. Выявляя ту или иную степень нарушения насосной функции сердца, они объективизируют выраженность сердечной недостаточности. Наряду с этим динамические изменения показателей центральной гемодинамики в процессе лечения позволяют оценить эффективность проводимой терапии.
ЭКГ, а также суточное мониторирование ЭКГ по Холтеру обязательны в диагностике миокардита. Значение полученных данных может быть различным.
• Отсутствие каких-либо изменений на ЭКГ и по данным холтеровского мониторирования делает диагноз миокардита проблематичным.
• Изменения конечной части желудочкового комплекса (ST и Т) чаще неспецифичны (отрицательные, сглаженные или двухфазные зубцы Т преимущественно в левых грудных отведениях, редко напоминающие коронарные), но при одновременном развитии перикардита возможно появление подъема сегмента ST, который нередко расценивают как признак острейшей фазы ИМ; кроме того, может развиваться типичная «ишемическая» депрессия сегмента ST, связанная с поражением мелких коронарных артерий.
• Весьма характерны для миокардита нарушения ритма самого разнообразного характера, которые могут быть единственным проявлением болезни; при активном процессе аритмии нередко носят политопный характер (желудочковая и наджелудочковая экстрасистолия, МА, трепетание предсердий (ТП), ЖТ, рецидивирующая предсердная тахикардия и др.) и отличаются устойчивостью к антиаритмической терапии.
• Типичны также нарушения проводимости, возникающие нередко на разных уровнях, - предсердно-желудочковая блокада, синусовая брадикардия, полная блокада левой ножки пучка Гиса (чаще развивается при тяжелом остром миокардите; при хроническом миокардите может носить преходящий характер) и др.
• При миокардите отмечают динамичность ЭКГ-изменений, почти полностью исчезающих после выздоровления. В то же время на протяжении суток (часов) у больных миокардитом на ЭКГ отсутствуют динамические сдвиги в отличие от ЭКГ больных НЦД, при которых ЭКГ-показатели характеризуются неустойчивостью даже в период регистрации. Лекарственные тесты (калиевая проба, проба с р-адреноблокаторами) нормализуют измененную ЭКГ у больных НЦД; при миокардите пробы оказываются отрицательными.
• При хроническом течении миокардита (обычно тяжелого или средней тяжести) изменения на ЭКГ достаточно стойкие и обусловлены развитием миокардитического кардиосклероза. Это относится не только к интервалу S-Т и зубцу Т, но и к нарушениям предсердно-желудочковой и (или) внутрижелудочковой проводимости и нарушениям ритма. Признаком значительного уменьшения массы рабочего миокарда желудочков может быть снижение или полное исчезновение зубцов R в грудных отведениях (с формированием комплексов QS).
• Сходные изменения на ЭКГ могут наблюдаться и при других заболеваниях сердца (ИБС, приобретенные пороки сердца и ГБ). Вопрос о соответствии изменений на ЭКГ тому или иному заболеванию решают на основании совокупности прочих симптомов, обнаруживаемых на всех трех этапах диагностического поиска.
Рентгенологическое исследование, проведенное у больных миокардитом, позволяет уточнить степень общего увеличения сердца и его отдельных камер. При тяжелых диффузных миокардитах увеличены все отделы сердца, имеются признаки нарушения кровообращения в малом круге в виде усиления легочного рисунка и расширения корней легких. Для миокардитов более легкого течения характерно минимальное увеличение только левого желудочка либо нормальные размеры камер сердца. Рентгенологическое исследование позволяет исключить в качестве причины увеличения сердца экссудативный перикардит, при котором обнаруживают своеобразную круглую тень сердца при отсутствии пульсации по ее наружному контуру, а также констриктивный перикардит, для которого характерны, хотя и не обязательны, отложения кальция в листках перикарда.
ЭхоКГ при миокардитах нередко имеет большую диагностическую ценность.
• При наличии увеличенного сердца данные ЭхоКГ позволяют исключить в качестве причины кардиомегалии клапанные пороки, постинфарктную аневризму сердца, экссудативный перикардит, ГКМП. Выявление значительного утолщения стенок левого желудочка со снижением его сократительной функции требует исключения болезней накопления (амилоидоз, болезнь Фабри и др.) и противоречит диагнозу миокардита.
• Исследование позволяет более точно определить выраженность дилатации различных камер сердца (в первую очередь левого желудочка). Наиболее важными факторами в оценке ремоделирования левого желудочка и его сократимости служат конечный диастолический размер, диастолический и систолический объемы, фракция выброса (процент крови, который выбрасывается желудочком за одну систолу), систолическое давление
в легочной артерии. При значительной дилатации желудочков выявляют также относительную недостаточность митрального и трикуспидального клапанов. С целью определения показаний к ресинхронизирующей терапии проводят ультразвуковую оценку наличия и выраженности межжелудочковой и внутрижелудочковой диссинхронии (неодновременности сокращения различных сегментов).
• При тяжелом миокардите обнаруживают признаки тотальной гипокинезии миокарда (в отличие от локальных зон гипокинезии при ИБС).
• У больных МА, а также выраженным падением сократимости левого желудочка могут быть выявлены внутрисердечные тромбы (как в предсердиях, так и в желудочках).
• При ЭхоКГ можно обнаружить признаки некомпактного миокарда (он расположен кнутри от компактного слоя, имеет рыхлую губчатую структуру, предрасполагает к внутрисердечному тромбозу). Заболевание это, как правило, генетически обусловлено, нередко сочетается с другими аномалиями сердца и приводит к значительному падению сократимости желудочков сердца; его обнаружение ставит под сомнение диагноз миокардита.
• Эхокардиографические изменения, характерные для тяжелого миокардита, трудно дифференцировать от первичной (генетической) ДКМП. Такая дифференциация возможна при учете всей клинической картины болезни, и в первую очередь данных анамнеза.
• ЭхоКГ, в отличие от большинства других инструментальных исследований, можно проводить повторно неограниченное число раз, что позволяет объективно оценить состояние в динамике (например, при тяжелом остром миокардите можно отметить развитие выраженного отека стенок левого желудочка с его последующим регрессом).
• При нетяжелом миокардите при ЭхоКГ не обнаруживают изменений размеров и сократимости камер сердца. Возможно определение минимальных признаков поражения миокарда и перикарда (субклиническая клапанная регургитация, уплотнение листков перикарда, небольшое количество жидкости в полости перикарда и др.).
Комплекс лабораторных обследований, ЭКГ, холтеровского мониторирования и ЭхоКГ является обязательным в диагностике миокардита; однако нередко этих методов оказывается недостаточно. Для верификации диагноза дополнительно используют различные методы (рентгенография, УЗИ, КТ) и определяют очаги хронической инфекции внекардиальной локализации, в первую очередь - поражения ЛОР-органов. Консультация оториноларинголога с проведением посева с миндалин (или из зева) обязательна при обследовании больных с подозрением на миокардит.
Радионуклидные методы (сцинтиграфия миокарда) позволяют доказать наличие очагов кардиосклероза у больных с тяжелым течением миокардита. Отсутствие крупноочагового кардиосклероза при правильно проведенной сцинтиграфии - важный довод против ИБС. Для миокардита весьма характерно диффузное, неравномерное распределение радиофармпрепарата в миокарде, что свидетельствует о некоронарогенном поражении; эти изменения выявляются при исследовании в покое и могут усиливаться при нагрузке, что свиде-
тельствует о воспалительном поражении интрамиокардиальных сосудов (миокардиальный васкулит). Обнаружение очаговых изменений перфузии также не исключает миокардита. Предложена методика томосцинтиграфии миокарда с аутолейкоцитами, меченными 99Тс-ГМПАО, которая достаточно эффективно выявляет зоны активного воспаления, однако выполнение ее достаточно трудоемко.
МРТ миокарда с гадолинием рассматривают как наиболее точный метод неинвазивного выявления очагов активного воспаления в миокарде (характерно выявления зон отсроченного накопления гадолиния); однако отсутствие изменений по данным МРТ не исключает диагноза миокардита. Косвенными признаками миоперикардита служат утолщение листков перикарда, наличие небольшого количества жидкости в его полости. МРТ позволяет также провести дифференциальную диагностику с целым рядом заболеваний сердца (сложные пороки развития, ИМ, некомпактный миокард, амилоидоз, ГКМП, аритмогенная дисплазия правого желудочка и др.).
Сходные изменения могут быть выявлены при проведении МСКТ с внутривенным контрастированием. Этот метод позволяет также выявить включения кальция при констриктивном перикардите, внутрисердечный тромбоз и, что очень важно, признаки атеросклеротического или воспалительного (в рамках системных васкулитов) поражения коронарных артерий и аорты.
С целью исключения коронарного атеросклероза как причины необъяснимой сердечной недостаточности, болей в области сердца, нарушений ритма в ряде случаев (когда неинвазивные методики не дают достаточной информации) проводят коронарографию.
Наконец, золотым стандартом диагностики миокардита служит эндомиокардиальная биопсия. Диагностическая ценность этого метода при миокардите весьма высока (хотя можно получить и весьма неопределенные данные при очаговом миокардите); его широкое применение ограничено инвазивным характером процедуры, небезопасностью ее выполнения недостаточно опытными специалистами и необходимостью высококвалифицированного и разностороннего морфологического исследования полученного материала.
Эндомиокардиальная биопсия состоит во введении в полость правого (через подключичную либо бедренную вену), реже - левого желудочка (через бедренную артерию) специального инструмента - биотома - с целью получения кусочков эндокарда и миокарда под контролем рентгеноскопии, ЭхоКГ или МРТ. Оптимален забор 5-6 кусочков из различных участков сердца; проводят гистологический, электронно-микроскопический, иммуногистохимический и вирусологический (с применением ПЦР-диагностики) анализ полученного материала.
Для постановки диагноза миокардита применяют Далласские критерии. • Активный миокардит:
- инфильтрат (диффузный или локальный);
- количественный подсчет иммуногистохимическим методом (не менее 14 инфильтрирующих лимфоцитов на 1 мм2 (главным образом, CD45+ Т-лимфоцитов или активированных Т-лимфоцитов) и до 4 макрофагов);
- некроз или дегенерация кардиомиоцитов;
- фиброз (его развитие не считают обязательным).
• Пограничный миокардит:
- инфильтрат (не менее 14 лимфоцитов и до 4 макрофагов на 1 мм2);
- некроз и дегенерация обычно не выражены;
- учитывают фиброз.
• Отсутствие миокардита:
- инфильтрирующих клеток нет или их количество не превышает 14 на 1 мм2.
Исследование биоптатов позволяет определить геном кардиотропных вирусов, диагностировать особые формы миокардита (гигантоклеточный, эозинофильный, гранулематозный и др.), а также провести дифференциальную диагностику с другими некоронарогенными заболеваниями миокарда и определить показания к специфическому лечению.
Диагностика
Для установления диагноза тяжелого острого миокардита используют критерии Нью-Йоркской классификации хронической сердечной недостаточности (NYHA).
• Существование инфекции, доказанной лабораторно или клинически (включая выделение возбудителя, динамику титров противомикробных или антивирусных антител, наличие острофазовых показателей - увеличение СОЭ, появление СРБ).
• Признаки поражения миокарда:
- большие признаки:
патологические изменения на ЭКГ (нарушения реполяризации, ритма и проводимости);
повышение концентрации кардиоселективных ферментов и белков
(КФК, МВ-КФК, ЛДГ, тропонин Т);
увеличение размеров сердца по данным рентгенографии или ЭхоКГ;
кардиогенный шок;
- малые признаки:
тахикардия (иногда брадикардия);
ослабление первого тона;
ритм галопа.
Диагноз миокардита правомочен при сочетании предшествующей инфекции с одним большим и двумя малыми признаками.
По ведущему клиническому симптому (синдрому) выделяют клинические варианты миокардита:
• декомпенсационный;
• аритмический;
• псевдокоронарный;
• псевдоклапанный;
• тромбоэмболический;
• смешанный;
• малосимптомный.
Все перечисленные симптомы миокардита могут быть выражены в различной степени либо полностью отсутствовать, что дает основание выделить лег-
кую, среднетяжелую и тяжелую формы заболевания. По результатам многолетнего наблюдения за больными с миокардитами Н.Р. Палеев и соавт. выделяют как наиболее типичные следующие варианты течения миокардита:
• Острый миокардит легкого течения.
• Острый миокардит тяжелого течения.
• Миокардит (подострый) рецидивирующего течения.
• Миокардит (подострый) с нарастающей дилатацией полостей.
• Хронический миокардит. Выделяют особые формы миокардита:
• Эозинофильный (гиперсенситивный, аллергический) миокардит -
нередко развивается в ответ на воздействие аллергена (чаще всего лекарственного препарата), характеризуется высоким уровнем эозинофилов в крови, сопутствующими эозинофильными поражениями других органов (кожи, легких, сосудов), обнаружением эозинофильных инфильтратов в миокарде и эндокарде, выраженным положительным эффектом глюкокортикоидной терапии. Кроме того, у ряда больных выраженная эозинофилия крови отсутствует, однако наличие иммунных заболеваний других органов, высокие титры антикардиальных антител, повышение неспецифических иммунных маркеров в крови в сочетании с отсутствием признаков вирусной инфекции также создают условия для эффективности глюкокортикоидной терапии.
• Гигантоклеточный - клинически отличается от других форм крайней тяжестью течения; диагноз может быть поставлен только с помощью эндомиокардиальной биопсии и требует проведения агрессивной иммуносупрессивной терапии, которая далеко не всегда бывает эффективна. В ряде случаев гистологическую картину гигантоклеточного миокардита выявляют при миокардите Абрамова-Фидлера.
• Миокардит Абрамова-Фидлера - диагностируют клинически на основании крайне тяжелого течения заболевания, которое в достаточно ранние сроки заканчивается летально. Столь тяжелое поражение сердца с быстрым (в течение 4 мес) развитием его дилатации и смертью было описано в 1897 г. С.С. Абрамовым (при морфологическом исследовании миокарда были выявлены тяжелая дистрофия кардиомиоцитов и некроз) и в 1899 г. А. Фидлером (который наблюдал инфильтраты в миокарде и выделил тяжелый миокардит в отдельную форму). Причины болезни остаются неизвестными, хотя предполагают прямое вирусное повреждение миокарда в сочетании с неадекватным иммунным ответом у предрасположенных к этому, как правило, молодых пациентов. Причиной смерти могут быть прогрессирующая сердечная недостаточность, тяжелые, опасные для жизни расстройства ритма и проводимости, эмболии разной локализации, источником которых служат внутрисердечные (межтрабекулярные) тромбы. Смерть может наступить внезапно.
Дифференциальная диагностика
В зависимости от варианта течения миокардита проводят дифференциальную диагностику с различными заболеваниями.
• При легком (латентном, маломанифестном) миокардите, который протекает без сердечной недостаточности, дифференциальную диагностику про-
водят с НЦД, так называемыми идиопатическими либо генетически детерминированными нарушениями ритма и проводимости сердца (при различных каналопатиях, аритмогенной дисплазии правого желудочка и др.). Постепенно прогрессирующий характер аритмий, присоединение признаков сердечной недостаточности у относительно молодых лиц требуют исключения врожденных миопатий и различных генетически детерминированных заболеваний миокарда, которые не всегда могут быть отнесены к определенному виду кардиомиопатии (гипертрофической, рестриктивной, дилатационной).
• Острый миоперикардит с интенсивными болями в области сердца, подъемом сегмента ST и появлением отрицательного зубца Т на ЭКГ, повышением уровня тропонина крови требует дифференциальной диагностики с ИМ, стресс-индуцированной кардиомиопатией.
• Псевдоклапанный вариант миокардита (с развитием вальвулита, вторичной дисфункций клапанов, как правило, по типу недостаточности), а также развитие острого миокардита в сочетании с упорной лихорадкой; после стрептококковой инфекции может потребовать дифференциальной диагностики с ревмокардитом, ИЭ.
• Миокардит тяжелого течения наиболее сложно дифференцировать от первичной, генетически детерминированной ДКМП. В этом случае необходимо обращать внимания на отягощенный семейный анамнез, возраст дебюта заболевания и его связь с перенесенной инфекцией, остроту развития симптомов, скорость прогрессирования, наличие маркеров вирусной инфекции и иммунного воспаления, сведения об эффективности противовирусной, антибактериальной, иммуносупрессивной терапии в анамнезе. В ряде случаев помощь в диагностике ДКМП может оказать генетическое исследование, однако наиболее значимым методом исключения активного миокардита служит эндомиокардиальная биопсия.
Формулировка клинического диагноза включает следующие пункты:
• этиологический фактор (если он известен);
• клинико-патогенетический вариант (инфекционный, инфекционноиммунный, токсический и пр.);
• тяжесть течения (легкий, средней тяжести, тяжелый);
• характер течения (острое, подострое, хроническое);
• наличие осложнений: сердечная недостаточность, тромбоэмболический синдром, нарушения ритма и проводимости, относительная недостаточность митрального и (или) трикуспидального клапана и пр.
Лечение
Лечение миокардита, особенно тяжелого и среднетяжелого, а также хронического, представляет собой довольно сложную задачу в связи с недостаточной изученностью этиологии и механизмов развития заболевания, невозможностью во многих случаях проведения эндомиокардиальной биопсии, тяжестью заболевания, отсутствием крупных исследований по изучению эффективности различных видов терапии.
В ряде случаев острый миокардит заканчивается спонтанным выздоровлением, однако предсказать такой исход довольно трудно.
При назначении лечения больным миокардитом учитывают:
• этиологический фактор;
• патогенетические механизмы;
• выраженность синдрома поражения миокарда (в частности, наличие сердечной недостаточности и нарушений ритма и проводимости).
Воздействие на этиологический фактор (если он известен) предусматривает следующие мероприятия.
• Больным с инфекционными и инфекционно-токсическими миокардитами (миокардиты, возникающие во время инфекции или вскоре после ее исчезновения) обычно назначают антибиотики, чаще всего бензилпенициллин в дозе 1,5-2,0 млн ЕД/сут или полусинтетические пенициллины в течение 10-14 дней. Подавление очаговой инфекции (обычно верхних дыхательных путей, бронхолегочного аппарата) способствует благоприятному исходу заболевания.
• При остром миокардите неизвестной этиологии, протекающем с лихорадкой, выраженными общевоспалительными изменениями, проводят комбинированную терапию антибиотиками широкого спектра действия.
• При установленной вирусной этиологии миокардита (в том числе при обнаружении вирусного генома в биоптатах миокарда) этиотропная терапия зависит от типа вируса: обнаружение энтеро- и аденовирусов подразумевает назначение интерферона бета; вирусов герпеса 1 и 2 типа - ацикловира; вируса герпеса 6 типа, цитомегаловируса, вируса Эпстайна-Барр - ганцикловира, парвовируса В19 - внутривенное введение иммуноглобулина в суммарной дозе 0,2-2,0 г/кг массы тела. Иммуноглобулин можно использовать и при лечении других вирусных миокардитов, поскольку он обладает одновременно противовирусным и иммуномодулирующим действием. В ряде случаев эффективность противовирусной терапии недостаточно высока, однако попытки ее проведения всегда оправданы. При хроническом миокардите, особенно тяжелого и среднетяжелого течения, элиминация вируса из миокарда приводит, по-видимому, к улучшению функционального состояния миокарда (уменьшению размеров камер, повышению сократимости миокарда), а длительная персистенция вируса ухудшает прогноз.
• Лечение заболевания, на фоне которого развился миокардит (например, СКВ), является обязательным, так как миокардит по существу - составная часть этого заболевания.
• Устранение воздействия различных внешних патогенных факторов рассматривают и как лучшее средство профилактики болезни и предупреждения его рецидивов при хроническом течении.
Патогенетическая терапия предусматривает следующие мероприятия.
• Назначение иммуносупрессивного и противовоспалительного лечения. Безусловное показание к иммуносупрессивному лечению являются эозинофильный (гиперсенситивный), гигантоклеточный миокардит, миокардит при диффузных болезнях соединительной ткани и системных васкулитах, а также миокардит с выраженными (в том числе системными) иммунными нарушениями при отсутствии маркеров вирусной инфекции. Предполагают, что вирус не только не выявлен в крови, но для исключения
персистенции вируса в миокарде проведена эндомиокардиальная биопсия, но на практике это возможно далеко не всегда. До некоторой степени об участии вирусов в развитии заболевания можно судить по концентрации противовирусных антител в крови.
• При миокардите тяжелого и среднетяжелого течения преднизолон назначают в дозе 1 мг/кг в сутки; одновременно возможно назначение азатиоприна по 2 мг/кг или циклоспорина по 5 мг/кг. Через неделю начинают постепенное снижение дозы преднизолона до поддерживающей (по 5 мг/сут); общая длительность лечения составляет не менее полугода. Возможен и более мягкий режим глюкокортикоидной терапии - назначение преднизолона в стартовой дозе 30-40 мг/сут с постепенным снижением через 1-2 мес. При легком течении миокардита стартовая доза преднизолона может составлять 20 мг/сут. Кроме того, используют (в качестве монотерапии при легком течении миокардита либо дополнительно к глюкокортикоидам - при тяжелом и среднетяжелом течении) препараты аминохинолиновых производных - гидроксихлорохин и хлорохин (по 1-2 таблетке в дозе 0,25 г или 0,2 г 1-2 раза в день в течение 6 мес и более.
• В ситуации, когда миокардит протекает с выраженными иммунными нарушениями (в частности, значительно повышен титр антикардиальных антител) и одновременно обнаруживают маркеры вирусной инфекции, противовирусное лечение может предшествовать иммуносупрессивному либо (при тяжелом остром миокардите) его проводят одновременно.
• Для воздействия на неспецифический компонент воспаления при острых миокардитах (или обострении хронических) любой тяжести назначают НПВС в общепринятых дозах. Наиболее часто используют индометацин (по 0,025 г 3-4 раза в сутки), диклофенак (по 100-150 мг/сут), а также мелоксикам (по 7,5-15 мг/сут) или целекоксиб (по 100-200 мг/сут в течение 4-8 нед). При миокардитах тяжелого течения НПВС можно комбинировать с преднизолоном.
• Эффективность средств, воздействующих на отдельные звенья патогенеза (например, препарата, представленного моноклональными антителами к ФНО-а, - инфликсимаба) при миокардитах практически не изучена. Применение средств, улучшающих метаболические процессы в миокарде (триметазидин в дозе 75 мг/сут и др.) играет лишь вспомогательную роль в лечебном комплексе.
• В качестве метода эффективного удаления избыточного количества антикардиальных антител рекомендовано проведение иммуносорбции.
Воздействие на синдром поражения миокарда предусматривает лечение сердечной недостаточности, нарушений ритма и проводимости, а также тромбоэмболического синдрома.
• Лечение больных с сердечной недостаточностью проводится согласно общепринятым принципам (постельный режим, ограничение поваренной соли, ингибиторы АПФ, р-адреноблокаторы, мочегонные препараты, при необходимости - сердечные гликозиды). Эффект сердечных гликозидов в этих случаях не так ярко выражен, как при сердечной недостаточности, обусловленной гемодинамической перегрузкой тех или иных отделов сердца. У больных миокардитом быстрее возникают явления гликозидной
интоксикации, эктопические аритмии, нарушения проводимости, в связи с чем следует быть особенно внимательным при назначении этих средств. Мочегонные препараты назначают с учетом стадии сердечной недостаточности (подробнее о принципах и тактике лечения сердечными гликозидами и мочегонными средствами см. «Сердечная недостаточность»).
• Возможности назначения антиаритмических препаратов при тяжелом течении миокардита также ограничены: повышенный риск развития проаритмического эффекта делает нецелесообразным назначение антиаритмиков I класса и требует осторожности при назначении амиодарона. В то же время амиодарон и антагонисты кальция, а также р-адреноблокаторы могут значимо снижать сердечный выброс у больных с исходно низкой фракцией выброса. Для снижения выраженности синусовой тахикардии, которая развивается при сердечной недостаточности, может с успехом использоваться ивабрадин по 10-15 мг/сут.
• Тромбоэмболический синдром регистрируют у больных с тяжелым течением миокардита (чаще всего - при миокардите типа Абрамова-Фидлера). Указания на эпизоды тромбоэмболии в анамнезе и внутрисердечный тромбоз (доказанный с помощью ЭхоКГ, МРТ или МСКТ сердца) - показания к применению непрямых антикоагулянтов (особенно при низкой фракции выброса левого желудочка). Обнаружение у больных миокардитом тяжелой сердечной недостаточности и МА (любой формы), как правило, тоже служит показанием к их назначению.
При миокардитах тяжелого и особенно фульминантного течения может возникнуть необходимость в активной инотропной поддержке миокарда (внутривенное введение добутамина, допамина, левосимендана), искусственном замещении функции жизненно важных органов - проведении искусственной вентиляции легких, ультрафильтрации, гемодиализа, а также во временном использовании систем вспомогательного кровообращения. От своевременности проведения этих мероприятий нередко зависит жизнь больного.
Возможности хирургического лечения миокардита ограничены, что вытекает из особенностей самого заболевания (активный воспалительный процесс, как правило, диффузно поражающий мышцу сердца). Хирургическое вмешательство может быть направлено на устранение необратимых последствий миокардита (имплантация постоянного электрокардиостимулятора, кардиоресинхронизирующего устройства, ИКД, протезирование клапанов сердца, в ряде случаев - реконструктивные операции на сердце). Радикальным методом хирургического лечения крайне тяжелого миокардита, который применяется при полной неэффективности лекарственной терапии и вспомогательных хирургических методик, служит трансплантация сердца (при сохранении персистенции вируса в миокарде предпочтительна полная анатомическая пересадка сердца). При этом не исключен рецидив заболевания в пересаженном сердце.
Прогноз
При миокардитах легкого и среднего течения прогноз обычно благоприятен. Он значительно серьезнее при миокардите тяжелого течения, а при миокардите типа Абрамова-Фидлера неблагоприятный.
Профилактика
Профилактика миокардитов включает мероприятия по предупреждению инфекций (санитарно-гигиенические, эпидемиологические), рациональное лечение инфекционных процессов, санацию хронических очагов инфекции, рациональное и строго обоснованное применение антибиотиков, сывороток и вакцин .
ПЕРИКАРДИТ
Среди различных заболеваний перикарда основное место принадлежит воспалительным поражениям - собственно перикардитам. Другие заболевания (кисты, новообразования) регистрируют реже.
Перикардит - воспалительное заболевание околосердечной сумки и наружной оболочки сердца, являющееся чаще всего местным проявлением какоголибо общего заболевания (туберкулез, ревматизм, диффузные заболевания соединительной ткани) или сопутствующее заболевание миокарда и эндокарда.
Классификация
В настоящее время различные формы патологического процесса в перикарде подразделяют на основе клинико-морфологических признаков (Е.Е. Гогин,
1979) .
• Перикардиты:
- острые формы:
сухой или фибринозный;
выпотной или экссудативный (серозно-фибринозный и геморрагический), протекающий с тампонадой сердца или без тампонады;
гнойный и гнилостный;
- хронические формы:
выпотной;
экссудативно-адгезивный;
адгезивный (бессимптомный, с функциональными нарушениями сердечной деятельности, отложением извести, экстраперикардиальными сращениями, а также констриктивный).
• Накопление в полости перикарда содержимого невоспалительного происхождения (гидро-, гемо-, пневмо- и хилоперикард).
• Новообразования:
- солитарные, диссеминированные, осложненные перикардитом.
• Кисты (постоянного объема, увеличивающиеся).
Этиология
Причины, ведущие к развитию болезни, весьма разнообразны.
• Вирусная инфекция (грипп А и В, Коксаки А и В, ECHO).
• Бактериальная инфекция (пневмококки, стрептококки, менингококки, кишечная палочка, другая микрофлора).
• Туберкулез, паразитарная инвазия (редко).
• Системные заболевания соединительной ткани (наиболее часто при ревматоидном артрите, СКВ).
• Аллергические заболевания (сывороточная болезнь, лекарственная аллергия).
• Метаболические факторы (уремия, микседема, подагра).
• Массивная рентгенотерапия (лучевое поражение).
• ИМ (в раннем и отдаленном периоде).
• Операции на сердце и перикарде.
Из представленной классификации следует, что:
• перикардит может быть самостоятельным заболеванием с определенной клинической картиной;
• перикардит может быть частью другого заболевания, и клиническая картина будет складываться из признаков, присущих этому заболеванию (например, ревматоидному артриту или СКВ), и симптомов самого перикардита;
• выраженность симптомов перикардита может варьировать: так, в клинической картине могут доминировать симптомы перикардита или перикардит будет не более как одним из прочих синдромов болезни, ни в коей мере не определяющих прогноз и особенности лечебной тактики.
Патогенез
Механизмы развития болезни неоднородны и обусловлены следующими факторами :
• непосредственным токсическим воздействием на перикард, например, при метаболическом или лучевом поражении;
• гематогенным или лимфогенным распространением инфекции;
• непосредственным воздействием патологического процесса на перикард (например, прорастание опухоли легкого или средостения, распространение гнойного процесса с плевры или прорыв в полость перикарда абсцесса легкого, влияние субэпикардиального некроза миокарда на перикард при
ИМ);
• аллергическим механизмом (по типу аутоагрессии - «антительный» или иммунокомплексный механизм повреждения перикарда, иммунное воспаление по механизму ГЗТ) - перикардиты при аллергических и системных заболеваниях соединительной ткани, перикардиты с невыясненной этиологией (так называемые идиопатические, хотя роль вирусной инфекции в данном случае не отрицается).
Основные механизмы патогенеза перикардита представлены на рис. 2-3.
Таким образом, существует два основных пути повреждения перикарда - непосредственное воздействие патогенного агента и развитие иммунного воспаления.
Клиническая картина
Клиническая картина заболевания складывается из ряда синдромов:
• синдром поражения перикарда (сухой, выпотной, слипчивый перикард) с острым или хроническим (рецидивирующим) течением;
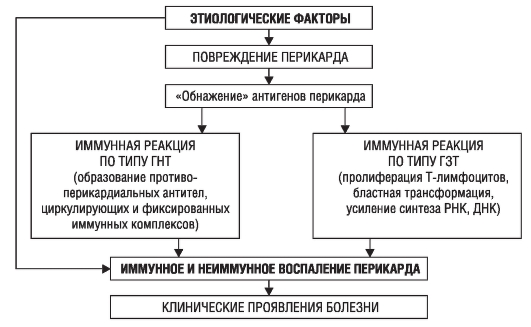
Рис. 2-3. Патогенез перикардита
• синдром острофазных показателей (отражает реакцию организма на воспалительный процесс; наблюдается при остром течении болезни, чаще при сухом или выпотном перикардите);
• синдром иммунных нарушений (при иммунном генезе поражения перикарда);
• признаки другого заболевания (являющегося фоном для поражения перикарда, например ИМ, СКВ, опухоль легкого и др.).
Сухой перикардит
На первом этапе диагностического поиска выявляют жалобы больного на боль в области сердца, повышение температуры тела, одышку, нарушение общего самочувствия. Боль при сухом перикардите имеет наибольшее диагностическое значение и в отличие от болей при других заболеваниях сердца (в частности, ИБС) имеет ряд особенностей:
• локализуется в области верхушки сердца, в низу грудины, непосредственно не связана с физической нагрузкой и не купируется нитроглицерином;
• иррадиирует в шею, левую лопатку, эпигастральную область, однако это не является абсолютным признаком;
• интенсивность болей колеблется в широких пределах (от незначительной до мучительной);
• усиливаются боли при дыхании и ослабевают в положении сидя с некоторым наклоном тела вперед.
Симптомы общего характера, повышение температуры тела указывают лишь на переносимую (или перенесенную ранее) инфекцию. Естественно, что на первом этапе диагностического поиска могут быть выявлены также жалобы, обусловленные заболеванием, приведшим к развитию перикардита (на-
пример, боли в суставах при ревматоидном артрите со всеми характерными признаками; кашель с выделением мокроты, похудание при опухоли легкого и пр.).
На втором этапе диагностического поиска наиболее существенным признаком является обнаружение шума трения перикарда. Шум имеет ряд особенностей:
• может быть преходящим, как в первые дни после ИМ, или существовать длительное время (при уремическом перикардите);
• может быть грубым и громким, даже определяться при пальпации, или мягким;
• воспринимается как скребущий, усиливающийся при надавливании стетоскопом на прекардиальную область, чаще всего локализуется в области левого края грудины, в нижней ее части;
• может состоять из трех компонентов: первый - непосредственно перед I тоном, другой - в систоле, третий - в начале и середине диастолы (чаще всего шум определяется в систоле).
Основные задачи диагностического поиска на третьем этапе:
• выявление критериев, позволяющих установить (или подтвердить) вовлечение перикарда в патологический процесс;
• установление этиологии заболевания, а также степени активности патологического процесса;
• уточнение характера заболевания, приведшего к развитию перикардита (если перикардит является составной частью какого-то иного заболевания).
ЭКГ имеет большое значение, так как позволяет дифференцировать боли при остром перикардите от болей, обусловленных ИМ. При перикардите отмечаются:
• чаще во всех трех стандартных отведениях (и в ряде грудных) подъем сегмента ST;
• отсутствие дискордантности в изменениях сегмента ST;
• отсутствие патологического зубца Q, что позволяет исключить ИМ. Лабораторные исследования имеют относительное значение для диагноза и показывают обычно изменения двоякого рода:
• преходящий подъем активности кардиоспецифических ферментов (МВфракции КФК, «сердечных» фракций ЛДГ (ЛДГ-1 и ЛДГ-2), умеренное увеличение активности ACT и АЛТ);
• чаще обнаруживают изменения лабораторных показателей, имеющих отношение к фоновому заболеванию, обусловливающему развитие острого перикардита (например, изменения, связанные с СКВ или ИМ, острой пневмонией или вирусной инфекцией).
Сами по себе эти лабораторные изменения не имеют значения для диагноза перикардита, но демонстрируют активность основного заболевания.
Диагностика
Клиническая картина сухого перикардита складываются из трех симптомов: боль характерной локализации, шум трения перикарда, изменения на ЭКГ.
Экссудативный перикардит
На первом этапе диагностического поиска больные предъявляют жалобы, сходные с теми, что наблюдаются при сухом перикардите. Можно выделить характерные особенности экссудативного перикардита:
• достаточно острая боль при сухом перикардите, постепенно ослабевает и становится тупой (иногда больные испытывают чувство тяжести в области
сердца);
• одышка при физической нагрузке, которая становится слабее в положении сидя при наклоне туловища вперед, при этом экссудат скапливается в нижних отделах перикарда;
• сухой кашель, а иногда и рвота вследствие давления экссудата на трахею, бронхи и диафрагмальный нерв.
Эти симптомы не патогномоничны для выпотного перикардита и становятся объяснимыми при обнаружении выпота в полости перикарда. Вместе с тем скорость возникновения симптомов определяется таковой увеличения объема выпота: при медленном образовании жидкости больной может не предъявлять никаких жалоб.
Если экссудативный перикардит развивается на фоне инфекции, то могут наблюдаться такие неспецифические симптомы, как повышение температуры тела, потливость и пр.
На втором этапе диагностического поиска наиболее существенным считают поиск признаков присутствия жидкости в полости перикарда:
• расширение границ сердечной тупости во все стороны (это наблюдается, если количество жидкости превышает 300-500 мл), при этом может отмечаться тенденция к увеличению площади абсолютной тупости, имеющая диагностическое значение (этот симптом не выражен при наличии значительной эмфиземы легких);
• в большинстве случаев верхушечный толчок и другие пульсации в прекардиальной области не определяются;
• тоны сердца глухие и сочетаются с шумом трения перикарда: если удается проследить эволюцию перикардита от сухого до выпотного, то можно наблюдать ослабление шума трения перикарда;
• появляется так называемый парадоксальный пульс - ослабление его наполнения на высоте вдоха;
• вследствие повышения венозного давления отмечается набухание шейных вен, особенно заметное при горизонтальном положении больного; одновременно наблюдается одутловатость лица.
На третьем этапе диагностического поиска существенное значение для установления диагноза имеют электрокардиографическое, рентгенологическое и ЭхоКГ.
ЭКГ отражает изменения, сходные с наблюдаемыми при сухом перикардите: подъем сегмента ST с последующей инверсией зубца Т и отсутствием патологического зубца Q часто отмечается сниженный вольтаж комплекса QRS, по мере рассасывания экссудата вольтаж возрастает.
При рентгенологическом исследовании грудной клетки обнаруживают:
• расширение тени сердца, приближающейся по форме к треугольной и сочетающейся с чистыми легочными полями (подобная картина позволяет
дифференцировать изменения сердца при выпотном перикардите с кардиомегалией при развитии сердечной недостаточности);
• уменьшение пульсации по внешнему контуру сердечной тени, указывающее на возможность образования перикардиального выпота (признак ненадежен, так как может возникать и при снижении сократительной функции сердца, расширенного вследствие других заболеваний).
ЭхоКГ позволяет определить даже небольшое количество жидкости в полости перикарда: появляются «эхо-пространства» между неподвижным перикардом и колеблющимся при сокращениях сердца эпикардом. Другой признак - указание на наличие жидкости над передней и задней стенками сердца (при больших выпотах) или только над задней стенкой (при меньшем количестве жидкости).
Из дополнительных инструментальных методов, позволяющих выявить наличие жидкости в полости перикарда, применяют ангиокардиографию. При введении контрастного вещества в полость правого сердца четко контурируемые правые отделы сердца отделены пространством от внешнего контура сердца вследствие наличия жидкости в полости перикарда. Радионуклидный метод исследования также расширяет возможности подтверждения выпотного перикардита. Радиоизотопный препарат (технеций (99тТс) сестамиби) вводят в локтевую вену, после чего проводят сканирование сердца с помощью специального счетчика и записывающего устройства. При наличии жидкости в полости перикарда между легкими и тенью сердца, а также между сердцем и печенью определяют пространство, свободное от изотопа. Оба метода в настоящее время практически не используют в связи с большей точностью и неинвазивным характером ЭхоКГ.
Лабораторное исследование включает, прежде всего, анализ перикардиального выпота.
Следует знать, что для перикардиального парацентеза существуют определенные показания:
• симптомы тампонады сердца (значительное расширение тени, резкое повышение венозного давления, снижение АД, парадоксальный пульс);
• подозрение на присутствие гноя в полости перикарда;
• подозрение на опухолевое поражение перикарда. Первые два показания считают абсолютными.
Если перикардиальная жидкость имеет воспалительное происхождение, то относительная плотность ее 1,018-1,020, содержание белка превышает 30 г/л, реакция Ривальты положительная. Среди лейкоцитов могут преобладать нейтрофилы (если перикардит возникает после перенесенной пневмонии или другой инфекции) или лимфоциты (при хроническом течении болезни туберкулезной этиологии, а также при неизвестной этиологии - идиопатический перикардит). В экссудате при опухолевых перикардитах удается обнаружить атипические клетки. Если перикардит выступает «спутником» лимфогранулематоза, то можно выявить клетки Березовского-Штернберга. При микроскопии так называемого холестеринового выпота видны кристаллы холестерина, детрит и отдельные клеточные элементы в стадии жирового перерождения. Бактериологическое исследование жидкости неэффективно для обнаружения флоры.
Другую группу лабораторных данных относят к признакам основного заболевания, приведшего к развитию перикардита (например, обнаружение LE-клеток, антител к ДНК и РНК при СКВ или РФ при ревматоидном артрите).
Критериями активности текущего воспалительного процесса (любого генеза) служат неспецифические острофазовые показатели (увеличение СОЭ, содержания α2-глобулинов, фибриногена, СРВ и изменение лейкоцитарной формулы).
Диагностика
Выпотной перикардит диагностируют на основании следующих признаков:
• расширение границ сердца с резким ослаблением пульсации его контура;
• отсутствие верхушечного толчка (или расположение его в пределах сердечной тупости);
• глухость сердечных тонов, иногда в сочетании с шумом трения перикарда;
• парадоксальный пульс (симптом необязателен);
• повышение венозного давления;
• изменения на ЭКГ, эхокардиографические признаки присутствия жидкости в полости перикарда.
Констриктивный перикардит
Констриктивный (слипчивый) перикардит чаще диагностируют у мужчин в возрасте 20-50 лет, чем у женщин (2-5\1). Зачастую он служит исходом выпотного перикардита. Нередко констриктивный перикардит возникает без фазы накопления жидкого выпота или после его рассасывания. Наиболее выраженные рубцовые изменения перикарда с последующим отложением извести развиваются как исход гнойного или туберкулезного перикардита, а также гемоперикарда или геморрагического перикардита любой этиологии. Менее выраженные изменения перикарда наблюдают при ревматических панкардитах. Утолщение перикарда (часто до 1 см) с отложением извести формирует ригидную оболочку вокруг сердца, препятствующую диастолическому расслаблению желудочков. Рубцовые процессы могут также распространяться на устья полых вен и фиброзную оболочку печени. В начале диастолы желудочки быстро наполняются кровью, но к концу ее приток крови в правый желудочек резко нарушается. Все это ведет к падению давления в яремных венах во время быстрого наполнения желудочков и значительному его подъему в конце диастолы. Давление в венах большого круга резко повышается, что способствует увеличению печени, асциту и отекам.
На первом этапе диагностического поиска при незначительных изменениях перикарда жалобы больных могут быть неспецифическими (слабость, повышенная утомляемость); иногда отмечают тяжесть в области правого подреберья за счет застоя крови в печени. Обычно не представляется возможным при расспросе выявить ранее перенесенный острый перикардит. При длительном течении болезни этиологию процесса не удается установить, при длительности до года этиология определяется более точно.
При выраженной констрикции и повышении венозного давления жалобы больных становятся более определенными:
• возникновение асцита (характерно, что отеки появляются вслед за асцитом, а не предшествуют ему, как при правожелудочковой недостаточности);
• одутловатость и чувство набухания лица в горизонтальном положении тела;
• уменьшение выделения мочи.
На втором этапе диагностического поиска наиболее существенным признаком считают обнаружение застойных явлений в большом круге кровообращения:
• набухание яремных вен, особенно выраженное в горизонтальном положении больного, при этом отмечается резкое спадение вен в начальный период диастолы желудочков;
• асцит различной степени выраженности;
• увеличение печени, а при длительном течении болезни - увеличение селезенки;
• желтушность кожного покрова вследствие выраженного венозного застоя в печени (иногда с формированием циркуляторного цирроза печени);
• при длительном течении болезни развивается кахексия верхней половины тела, контрастирующая с асцитом и отеками нижних конечностей.
Кроме этих диагностически важных симптомов, можно обнаружить другие, которые не считают обязательными, но их существование также обусловлено поражением сердца и особенностями гемодинамики:
• парадоксальный пульс (при вдохе наполнение пульса на лучевой артерии уменьшается);
• МА (распространение склеротического процесса на субэпикардиальные слои миокарда и особенно на область синусно-предсердного узла, лежащего возле устья верхней полой вены);
• трехчленный ритм (за счет возникновения дополнительного тона в диастоле).
Размеры сердца обычно не увеличены, шумы отсутствуют, но это не считают обязательным, так как при констриктивном перикардите, развивающемся у больных ревматизмом или хроническими диффузными заболеваниями соединительной ткани, могут формироваться клапанные пороки с увеличением полостей сердца и измененной звуковой картиной.
При быстром развитии констрикции асцит и гепатомегалия развиваются быстро, однако асцит менее выражен и не сопровождается кахексией.
На третьем этапе диагностического поиска можно получить большое количество данных, подтверждающих первоначальную диагностическую концепцию.
Рентгенологическое исследование является наиболее значимым. Оно помогает выявить обызвествление перикарда и отсутствие застойных явлений в легких, что весьма существенно для дифференциации причин, обусловливающих выраженные застойные явления в большом круге кровообращения. Однако надо помнить, что изолированная кальцификация перикарда может не сопровождаться констриктивным синдромом, а констриктивный синдром может быть и без признаков кальцификации перикарда.
Размеры сердца у больных с констриктивным перикардитом, как правило, не увеличены, что имеет значение при дифференциальной диагностике кон-
стриктивного перикардита и других заболеваний сердца, ведущих к выраженной правожелудочковой недостаточности.
У пожилых пациентов размеры сердца могут быть увеличены (вследствие, например, АГ или в случаях развития констриктивного перикардита на фоне ревматического порока сердца; однако последнее сочетание считают редким).
Сердце может быть увеличено также в случае сочетания перикардита с тяжелым миокардитом (естественно, что такое заключение делается ретроспективно, так как с момента острого перикардита и миокардита до выявления констриктивного синдрома проходит много времени). Существенным фактором надо признать, что сердце у таких больных увеличено тотально в отличие от больных с пороками сердца, у которых отмечается изолированное (или преимущественное) увеличение отдельных камер сердца.
ЭКГ отражает неспецифические признаки, во многом сходные с наблюдаемыми у больных с выпотом в полость перикарда.
• Снижение вольтажа комплекса QRS и признаки нарушения внутрижелудочковой проводимости.
• Увеличение и зазубренность зубца Рп. Зубец Pv, сходен с P-mitrale, так как присутствует увеличенная вторая негативная фаза зубца.
• Уплощение или инверсия зубца Т в различных отведениях. Лабораторные исследования при констриктивном перикардите проводят
с целью:
• установления этиологии заболевания, что оказывается возможным нечасто;
• определения вовлечения в патологический процесс печени (вследствие хронического застоя крови или утолщения фиброзной оболочки) и существования, а также выраженности ее функциональных изменений (прежде всего, следует обращать внимание на степень снижения концентрации альбумина в крови, повышение активности сывороточных ферментов ACT и АЛТ, снижение содержания протромбина и активности холинэстеразы, а также повышение концентрации билирубина).
Диагностика
Констриктивный перикардит распознают на основании следующих признаков .
• Повышение венозного давления (обычно более 240 мм вод.ст.) при отсутствии признаков поражения сердца (в виде кардиомегалии, органических шумов, ИБС, АГ).
• Асцит и увеличение печени.
• Отсутствие пульсации по контуру сердца.
• Обнаружение обызвествления перикарда.
• Недостаточное диастолическое расслабление желудочков. Развернутый клинический диагноз перикардита формулируют с учетом следующих компонентов:
• этиологии перикардита (если имеются точные сведения);
• клинико-морфологической формы (сухой, выпотной, слипчивый);
• характера течения (острый, рецидивирующий, хронический);
• наличия осложнений или синдромов, определяющих тяжесть заболевания (МА, асцит, отеки, гепатомегалия, псевдоцирроз печени Пика и др.).
При обследовании больного прежде всего следует определить форму поражения перикарда, а затем на основании тех или иных симптомов установить этиологию заболевания. В ряде случаев установить этиологию не удается при самом тщательном анализе клинической картины. В таких случаях говорят об идиопатическом перикардите (все же можно предположить вирусную или туберкулезную природу, хотя это трудно доказать определенно).
Лечение
Лечебные мероприятия при перикардитах проводят с учетом:
• этиологии процесса (если ее удается установить);
• механизмов патогенеза;
• клинико-морфологической формы (сухой, выпотной, слипчивый);
• выраженности тех или иных синдромов, определяющих тяжесть заболевания.
Воздействие на этиологические факторы предусматривает следующие мероприятия.
• Лечение основного заболевания, на фоне которого развился перикардит. Учитывая, что перикардит может явиться частью какого-либо другого заболевания, необходимо проводить терапию, направленную на борьбу с этим заболеванием (например, глюкокортикоидная терапия СКВ, терапия коллоидным золотом или цитостатиками ревматоидного артрита, цитостатические препараты при распространении лимфогранулематозного процесса на листки перикарда). В то же время при перикардите в остром периоде ИМ (эпистенокардитический перикардит), равно как при перикардите в терминальной стадии хронической почечной недостаточности, не требуется каких-то специальных мер.
• Воздействие на инфекцию, грибковые и паразитарные патогенные факторы. Если в происхождении перикардита отчетливо доказана роль инфекции (например, при пневмонии, экссудативном плеврите), необходим курс антибиотикотерапии. При неспецифических перикардитах, в частности пара- и постпневмонических, целесообразно назначать антибиотики из группы пенициллина (бензилпенициллин по 2-3 млн ЕД/сут в сочетании со стрептомицином в дозе 0,5 г или полусинтетическими пенициллинами (оксациллин, ампициллин). При перикардитах туберкулезной этиологии следует длительно проводить антибактериальную терапию стрептомицином в сочетании со фтивазидом и другими противотуберкулезными препаратами (аминосалициловая кислота, метазид и др.). Недостаточный эффект антибиотиков служит основанием для перехода к другим препаратам - из группы цефалоспоринов, а также к рифампицину и др. Препараты назначают в адекватных дозах и на достаточный срок. Если доказана роль грибковых или паразитарных агентов в происхождении заболевания, то следует использовать соответствующие препараты.
• Устранение профессиональных и прочих внешних патогенных факторов предусматривает также и профилактику обострений болезни при наклонности к хронизации.
Воздействие на механизмы патогенеза предусматривает, прежде всего, иммуносупрессивную терапию.
• Учитывая, что в большинстве случаев перикардиты имеют аллергический патогенез, особенно при экссудативных формах любой этиологии (естественно, кроме опухолевых и протекающих с нагноением), целесообразно проводить иммуносупрессивную терапию глюкокортикоидами (преднизолон в дозе 20-30 мг/сут).
• Преднизолон показан и при перикардитах туберкулезной этиологии в обязательном сочетании с противотуберкулезными препаратами (если обратное развитие процесса задерживается). Преднизолон служит и средством лечения основного заболевания (СКВ, склеродермия, дерматомиозит и пр.).
• Целесообразно использование преднизолона (в дозе 15-20 мг) в сочетании с НПВС (индометацин, диклофенак). При перикардите, служащем составной частью постинфарктного синдрома, применение преднизолона в сочетании с НПВС считают наиболее оптимальной комбинацией.
• В сочетании с НПВС преднизолон применяют при идиопатических рецидивирующих (обычно доброкачественно текущих) перикардитах. При каждом рецидиве курс сочетанной терапии дает положительный эффект.
Состояние больного может определять выраженность отдельных синдромов: болевого, отечно-асцитического, тампонады сердца выраженными сращениями листков перикарда. В связи с этим необходимо проведение специальных мероприятий:
• при сильных болях в области сердца - прием ненаркотических анальгетиков;
• отечно-асцитический синдром при развитии констриктивного перикардита или выпота в полость перикарда лечат мочегонными средствами (фуросемид, этакриновая кислота) и конкурентами альдостерона (спиронолактон);
• рекомендовано ограничение приема поваренной соли (не более 2 г/сут);
• при симптомах тампонады сердца рекомендованы срочное проведение пункции полости перикарда и извлечение жидкости;
• развитие симптомов констрикции (повышение венозного давления в яремных венах более 70-78 мм вод.ст.) служит показанием к операции перикардэктомии.
После операции также необходимо проведение этиотропного и патогенетического лечения. Учитывая, что в большинстве случаев констрикция развивается при перикардите туберкулезной этиологии, целесообразно длительное применение противотуберкулезных препаратов, иногда - в сочетании с малыми дозами глюкокортикоидов.
Прогноз
Наиболее неблагоприятен прогноз при гнойных и опухолевых перикардитах. Своевременное лечение сухого или выпотного перикардита полностью ликвидирует симптомы заболевания. Прогноз констриктивного перикардита существенно улучшается после успешно проведенной перикардэктомии.
Профилактика
Своевременное лечение заболеваний, приводящих к вовлечению в патологический процесс перикарда, существенно уменьшает вероятность развития перикардита .
НАРУШЕНИЯ СЕРДЕЧНОГО РИТМА И ПРОВОДИМОСТИ
Нарушения сердечного ритма и проводимости (аритмии) включают все нарушения, при которых изменяется ритмическая деятельность сердца. Клиническое значение аритмий весьма многообразно: одни аритмии практически не имеют клинического значения, ряд других ухудшает самочувствие и состояние больного, некоторые могут даже явиться причиной смерти.
Этиология
Аритмии возникают при многих патологических состояниях:
• заболеваниях сердечно-сосудистой системы (ИБС, ГБ, пороки сердца, миокардиты, кардиомиопатии, врожденные, генетически обусловленные нарушения в проводящей системе сердца и др.);
• некардиальной патологии, в условиях которой сердце подвергается патологическим нервно-рефлекторным воздействиям или страдает в результате нарушений гуморальной регуляции, электролитного баланса, кислотно-основного равновесия, эндокринных расстройств;
• физических и химических воздействиях (алкоголь, травма, гипоксия, гипо- и гипертермия, лекарственные средства, особенно препараты дигиталиса, мочегонные средства, симпатомиметики);
• в тех случаях, когда с помощью современных методов исследования причину аритмии установить не удается, ее называют идиопатической.
Патогенез
В основе развития аритмий лежат три электрофизиологических механизма:
• эктопический автоматизм;
• круговая циркуляция волны возбуждения (re-entry);
• триггерный механизм.
Эктопическая активность миокарда возникает в случаях, если достижение пороговой величины внутриклеточного потенциала происходит раньше срока.
Круговая циркуляция волны возбуждения по миокарду возникает при наличии анатомического или функционального невозбудимого препятствия в определенном участке миокарда; импульс, распространяющийся по проводящей системе, достигает блокированной зоны ретроградным путем и, при условии растормаживания ее к этому моменту, проходит через нее.
При мало изученном триггерном механизме в основе возникновения аритмий лежит наличие ранних или поздних постдеполяризаций.
Эти механизмы могут приводить к выходу отдельных участков миокарда изпод контроля синусового узла. Единичные циклы возбуждения или круговой
циркуляции становятся причиной экстрасистолии. При ПТ, трепетании и мерцании предсердий (желудочков) и ряде других нарушений ритма отмечается длительный период деятельности эктопического очага автоматизма или циркуляции волны возбуждения по миокарду, которые нередко не могут спонтанно закончиться и требуют терапевтического вмешательства. Патология синусового узла и окружающей его ткани способствует появлению эктопических аритмий.
При клинической оценке каждой аритмии следует попытаться ответить на следующие вопросы.
• Какова причина аритмии? Это важно с точки зрения проведения этиотропной терапии, кроме того, иногда аритмия является единственным очевидным клиническим проявлением (маркером) какого-либо заболевания, установить природу которого можно при дальнейшем углубленном исследовании (безболевая форма ИБС, миокардит, маломанифестная форма гипертиреоза и т.д.).
• В какой степени аритмия обусловливает общую клиническую картину (например, прогрессирование недостаточности кровообращения при недавно возникшей постоянной форме МА или синкопальные состояния на фоне полной предсердно-желудочковой блокады)? Это помогает оценить важность именно антиаритмической терапии в комплексе терапевтических мероприятий у данного больного.
• Не является ли данное нарушение ритма предвестником другой, более грозной аритмии (например, частая групповая желудочковая экстрасистолия (ЖЭ), могущая предвещать фибрилляцию желудочков и смерть больного)?
Классификация
В практических целях удобно пользоваться классификацией В.Н. Орлова (1983) с небольшими изменениями (А.Н. Окороков, 1997).
А. Аритмии, обусловленные нарушением автоматизма синусового узла.
- Синусовая тахикардия.
- Синусовая брадикардия.
- Синусовая аритмия.
- Остановка синусового узла.
- Асистолия предсердий.
- СССУ.
Б. Эктопические комплексы или ритмы.
- I. Пассивные.
Предсердные.
Из предсердно-желудочкового соединения.
Миграция суправентрикулярного водителя ритма.
Желудочковые.
- II. Активные.
Экстрасистолия:
V предсердная;
V из предсердно-желудочкового соединения;
V желудочковая.
Парасистолия.
Пароксизмальная и непароксизмальная тахикардия:
V предсердная форма;
V из предсердно-желудочкового соединения;
V желудочковая форма. В. Мерцание и трепетание.
- Мерцание предсердий.
- ТП.
- Трепетание и мерцание желудочков. Г. Нарушение функции проводимости.
- Синоаурикулярная блокада.
- Внутрипредсердная блокада.
- Предсердно-желудочковая блокада.
- Блокада ножек пучка Гиса и ветвей левой ножки.
Д. Синдромы преждевременного возбуждения желудочков.
Далее будет рассмотрена клиническая картина, диагностика и принципы лечения наиболее распространенных аритмий: экстрасистолии, ПТ, МА, предсердно-желудочковой блокады, а также СССУ.
ЭКСТРАСИСТОЛИЯ
Экстрасистолия - наиболее распространенная разновидность аритмий. Ее патогенетическая основа - усиление автоматизма отдельных участков миокарда. Возможен и механизм re-entry, а также триггерный механизм.
В зависимости от места возникновения экстрасистолии делят на предсердные, предсердно-желудочковые и желудочковые.
Суправентрикулярные (предсердные и предсердно-желудочковые) и желудочковые экстрасистолии могут встречаться как при органических поражениях миокарда, так и при отсутствии заболеваний сердца.
Клиническая картина
На первом этапе диагностического поиска у больного с несомненной экстрасистолией можно не выявить никаких жалоб, и экстрасистолия будет диагностирована на последующих этапах исследования. Большинство больных предъявляет жалобы, которые могут быть обусловлены:
• наличием экстрасистолии - жалобы на ощущения перебоев в работе сердца, «замирания» в груди, сильных толчков в грудную клетку, «качелей» или «воздушной ямы» и др.;
• заболеванием сердца;
• заболеванием других органов и систем, обусловливающим возникновение экстрасистолии рефлекторного характера;
• невротическими расстройствами.
Анализ анамнестических данных позволяет установить давность экстрасистолии и определить ее источник: предсердия, желудочки, предсердножелудочковое соединение (по данным предыдущих ЭКГ), основное заболевание сердечно-сосудистой системы (ИБС, пороки сердца и пр.), являющееся
причиной экстрасистолии, проводившееся лечение и его эффективность, а также осложнения терапии.
На втором этапе диагностического поиска определяют признаки основного заболевания, а также саму экстрасистолию. В момент обследования экстрасистолия может не определяться, в таком случае необходимо провести «провоцирующие» ее появление тесты (изменение положения тела, глубокое дыхание, физическая нагрузка). Топику экстрасистолы при осмотре определить нельзя, хотя при длинной компенсаторной паузе можно предположить наличие ЖЭ. Однако в ряде случаев физическое исследование не выявляет несомненную экстрасистолию, и тогда она может быть зарегистрирована на ЭКГ, особенно в условиях суточного мониторирования.
На третьем этапе диагностического поиска идентифицируют экстрасистолию. Возможны три ситуации:
• обычное ЭКГ-исследование сразу выявляет экстрасистолы;
• для обнаружения экстрасистолии необходимы провоцирующие пробы;
• если эти пробы оказываются отрицательными, то следует провести длительное кардиомониторное наблюдение с автоматической регистрацией ЭКГ (холтеровское мониторирование).
В настоящее время для длительной (многомесячной) регистрации ЭКГ используют имплантируемое устройство (так называемый петлевой рекордер). Подробное описание электрокардиографической картины экстрасистолии и других аритмий описано в руководствах по ЭКГ.
Кроме того, на третьем этапе диагностического поиска необходимо получить более подробные данные о характере заболевания, могущего играть роль в этиологии экстрасистолии: активности воспалительного поражения миокарда (в том числе и ревматического характера), признаках гипертиреоза, выраженности ишемии миокарда и т.д. Очень важно установить наличие нарушений внутрисердечной проводимости (длина интервала PQ, ширина комплекса QRS, продолжительность интервала QT), так как это может ограничить возможности последующей антиаритмической терапии.
Весьма существенно оценить состояние миокарда, в частности его сократительной функции, поскольку плохое состояние сердечной мышцы делает наличие экстрасистолии прогностически более серьезным.
После проведения расспроса и осмотра больного, а также получив данные дополнительных исследований, необходимо дать общую клиническую оценку экстрасистолии в рамках ответа на 3 вопроса, приведенные в начале данного раздела.
Что касается этиологии экстрасистолии, то причиной ее развития могут быть практически все перечисленные состояния. При этом следует учитывать, что иногда экстрасистолия является единственным «стигматом» вялотекущего ревмокардита или другого воспалительного поражения миокарда, она может указывать на эндокринную миокардиодистрофию (дизовариальную, климактерическую и др.), может быть следствием неумеренного приема мочегонных (вызывающих гипокалиемию) лицами, использующими эти медикаменты для снижения массы тела и т.д.
Нередко (примерно в половине случаев) причину экстрасистолии установить не удается. При этом возможно:
• существование органического поражения миокарда (например, при постмиокардитическом или атеросклеротическом кардиосклерозе) или иного (воспалительного, дистрофического) процесса, выявление которых современными методами диагностики невозможно (в таких случаях может иметь диагностическое значение пункционная биопсия миокарда, однако она применяется редко ввиду своей небезопасности);
• функциональная этиология экстрасистолии в рамках психовегетативных нарушений, которые очень часто сопровождаются патологией сердечного ритма.
На функциональную этиологию аритмии, помимо отсутствия видимых органических изменений, могут указывать следующие факторы.
• Конституциональные особенности, в частности, признаки синдрома мезенхимальной дисплазии: астеническая конституция, пролапс митрального клапана и добавочные внутрисердечные хорды, СССУ, гипермобильность суставов, плоскостопие, удлинение и изгибы желчного пузыря, спланхноптоз и т.д. Этиология поражения вегетативной нервной системы при этом неясна; одной из возможных причин сопутствующих вегетативных расстройств могут быть изменения периневрия, относящегося к мезенхимальным структурам организма. При этом пролапс митрального клапана и дополнительные хорды сами могут провоцировать локальное возбуждение миокарда.
• Общие признаки вегетативной дистонии (влажные ладони, стопы, подмышки, лабильность ЧСС и АД, выраженный дермографизм и др.).
• Эмоциональная лабильность.
• Возникновение экстрасистол в покое, часто при отходе ко сну или, напротив, при эмоциональном возбуждении.
Чаще функциональные экстрасистолы регистрируют у лиц молодого возраста, но функциональную этиологию аритмий нельзя исключить и у лиц более старших возрастных групп.
В повседневной клинической практике при наличии экстрасистолии, развившейся без видимых причин у лиц без выраженной психовегетативной симптоматики, если в анамнезе есть указания на частые простуды, в качестве диагноза основного заболевания ставят миокардитический кардиосклероз. Об атеросклеротическом кардиосклерозе чаще говорят у пожилых больных; при наличии экстрасистолии на фоне НЦД последнюю считают основной патологией. При этом следует учитывать известную условность такой диагностики. В связи с этим при отсутствии сколько-нибудь отягощенного анамнеза у лиц молодого и среднего возраста без видимых психоэмоциональных и вегетативных отклонений часто диагностируют идиопатическую экстрасистолию (нередко слово «идиопатическая» опускают).
Особого влияния на состояние больного (исключая тягостность субъективных ощущений) экстрасистолия сама по себе не оказывает, хотя очень частая экстрасистолия может несколько ухудшать гемодинамику.
Вместе с тем прогностическое значение экстрасистол может быть весьма серьезным; при этом надо учитывать не только характер экстрасистолии, но и состояние миокарда.
Для прогностической оценки характера желудочковой экстрасистолии используют классификацию Лауна-Вольфа (1971):
• 0 - отсутствие экстрасистол;
• 1 - редкие, монотопные (до 10 в час);
• 2 - частые, монотопные (в настоящее время признают угрожающим уже более 10 в час);
• 3 - политопные;
• 4А - спаренные;
• 4Б - залповые («пробежки» ЖТ из трех комплексов и более);
• 5 - ранние «R на Г».
Экстрасистолами, имеющими серьезное прогностическое значение, признают экстрасистолы высоких градаций (со 2 по 5), наличие которых свидетельствует о перевозбуждении миокарда (2-3 градации) и опасности возникновения тахиаритмий по типу re-entry (4-5 градации), т.е. желудочковой пароксизмальной тахикардии (ЖПТ) с резким ухудшением гемодинамики или фибрилляции желудочков (смерть больного). Опасность этого в несколько раз увеличивается при плохом состоянии миокарда (в частности, при снижении фракции выброса менее 35%).
Весьма удобна в практическом отношении классификация Биггера (1984), согласно которой в зависимости от риска внезапной смерти выделяют:
• доброкачественные желудочковые аритмии - нет обмороков в анамнезе; заболевание сердца, как правило, отсутствует (включая постинфарктный рубец и гипертрофию миокарда), частота ЖЭ 1-10 в час, ЖТ отсутствует;
• злокачественные - обмороки или остановка сердца в анамнезе, имеется заболевание сердца, частота ЖЭ 10-100 в час и более, часто обнаруживают устойчивые пароксизмы ЖТ;
• потенциально злокачественные - отличаются от злокачественных отсутствием обмороков и остановки сердца в анамнезе, а также наличием вместо устойчивой ЖТ неустойчивой ЖТ (часто).
Для предсердной экстрасистолии подобной классификации нет. Однако, как и при желудочковой экстрасистолии, частая, политопная, групповая и ранняя («Р на Г») предсердная эстрасистолии могут предвещать фибрилляцию предсердий (МА), особенно у больных с плохим состоянием предсердий (при пороках сердца, ИБС, тиреотоксикозе).
Лечение
При лечении экстрасистолии необходимо учитывать следующие основные положения.
• Антиаритмическое лечение - ответственное лечебное мероприятие. Известно, что сами антиаритмические препараты в ряде случаев могут оказывать аритмогенный эффект; кроме того, они вызывают нарушения внутрисердечной проводимости.
- Известно, что у больных с плохим состоянием миокарда (в частности, в ближайшие месяцы после перенесенного ИМ) летальность в группе лиц, получавших антиаритмические препараты I класса, оказывалась выше, чем у больных, которым такая терапия не проводилась (много-
центровые рандомизированные исследования CAST-I, CAST-II и др.), вследствие увеличения частоты развития жизнеугрожающих желудочковых аритмий (тахикардии типа «пируэт» и др.). В настоящее время противопоказано применение любых антиаритмических препаратов I класса у больных с плохим состоянием миокарда: перенесенным ИМ; низкой сократительной способностью миокарда (фракция выброса менее 40%) у лиц с патологией сердечной мышцы (миокардиты, кардиомиопатии и др.); при гипертрофии миокарда (толщина задней стенки левого желудочка и (или) межжелудочковой перегородки >14 мм) у лиц с АГ. Антиаритмики I класса также противопоказаны при нестабильной стенокардии, остром коронарном синдроме, ИМ.
• Больных ИБС с желудочковой экстрасистолией высоких градаций (ранняя, политопная, групповая, аллоритмическая, просто частая) следует лечить активно и упорно, особенно если экстрасистолия обнаружена впервые (используют антиаритмические препараты II и III классов).
• Столь же упорное лечение проводят при частой, групповой, политопной и ранней предсердной экстрасистолии, особенно при пороках сердца, так как экстрасистолия может быть предвестником МА.
• Не требует лечения редкая экстрасистолия, особенно если она носит преимущественно функциональный характер. Можно попытаться ликвидировать ее нормализацией режима труда, отдыха, питания.
• При неприятных субъективных ощущениях даже «безобидную» экстрасистолию необходимо пытаться устранить. Не следует назначать сразу антиаритмические средства, а надо попробовать сначала нормализовать ритм общегигиеническими мероприятиями, затем при необходимости - этиотропной терапией, учащая или урежая ритм (при вагоили симпатикотонии). В последующем назначают средства, оказывающие антиаритмическое действие и эффективные при лечении основного заболевания (например, р-адреноблокаторы, спиронолактоны). Только при отсутствии эффекта надо прибегать к собственно антиаритмической терапии.
• При очень тягостной для больного экстрасистолии можно сразу провести активное антиаритмическое лечение, а затем поэтапно применить весь цикл терапевтических мероприятий, указанных в предыдущем пункте.
• При лечении любой экстрасистолии, как правило, используют седативные средства.
• При достижении положительного эффекта у больных с экстрасистолией, потенциально опасной в отношении возможности перехода в фибрилляцию желудочков или предсердий, антиаритмическая терапия должна быть продолжена на неопределенно долгий срок.
• При других видах экстрасистолии можно ограничиться курсовой терапией. В случае рецидива аритмии приходится возобновлять лечение или назначать его профилактически (в предменструальном периоде, в дни резкой смены погоды, перед эмоциональной нагрузкой и т.д.).
- Наилучшим способом подбора препарата служит его назначение в условиях суточного мониторирования ЭКГ (на фоне короткого пробного курса лечения и до него, на 2-3 сут). Препарат считают эффективным, если удается снизить количество монотопных экстрасистол не менее
чем на 75%, парных - не менее чем на 80%, ранних и «пробежек» тахикардии (3-15 комплексов) - на 90%, а при продолжительности более 15 комплексов - на 100%.
- Можно подбирать препарат и в условиях «острого лекарственного теста» - однократного приема препарата в дозе, равной половине суточной, с проведением короткого мониторирования ЭКГ (непрерывная запись в течение 15-30 мин со скоростью 2-5 мм/с) перед приемом препарата и спустя 1 и 2 ч. Хорошие результаты подбора препарата в таких условиях нередко не подтверждаются при его длительном приеме.
- Нередко препарат назначают эмпирически. При этом следует учитывать, что независимо от места возникновения экстрасистол один из самых действенных антиаритмических препаратов - амиодарон (по 0,6 г/сут с последующим снижением дозы), соталол (в дозе 80-160 мг/сут, редко - больше), пропафенон (по 600-900 мг/сут), этацизин* (в дозе до 0,2 г/сут), аймалин (в дозе до 0,3 г/сут), а также дизопирамид (в дозе до 0,6 г/сут) и аллапинин* (по 75-150 мг/сут). Последние можно применять при экстрасистолии на фоне брадикардии, так как они обладают холинолитическим (дизопирамид) и симпатомиметическим (аллапинин*) свойствами.
- При желудочковой экстрасистолии, кроме вышеперечисленных препаратов, может оказать действие прокаинамид в суточной дозе 2-4 г до 4-6 раз в сутки, морацизин (по 0,6-0,8 г/сут), фенитоин (по 0,117 г 3-4 раза в сутки). Фенитоин особенно эффективен при экстрасистолии, обусловленной гипердигитализацией. Его можно применять при брадикардии и на фоне нарушений внутрисердечной проводимости. Также используют мексилетин (по 0,6 г/сут).
- Преимущественно при наджелудочковой экстрасистолии используют хинидин (по 0,2 г 3-5 раз в сутки), а также р-адреноблокаторы (например, пропранолол по 0,01-0,02 г 3-4 раза в сутки, метопролол по 25-50 мг 2 раза в сутки, верапамил по 40-80 мг 3-4 раза в сутки).
- Остро развившаяся желудочковая экстрасистолия неблагоприятного характера требует парентерального введения лекарственных препаратов, так как непосредственно угрожает возникновением фибрилляции желудочков:
лидокаин - однократно в дозе 80-100 мг внутривенно, а затем по 100 мг/ч внутривенно капельно в изотоническом растворе хлорида натрия в течение суток и дольше;
амиодарон в дозе 300-450 мг внутривенно струйно в течение 3 мин с последующим внутривенным капельным введением в дозе 300 мг на 5% растворе декстрозы в течение 1-2 ч (при необходимости выполняют повторное введение);
возможно также введение 10% раствора прокаинамида в дозе 5 мл 3-4 раза в сутки внутримышечно.
• Наилучшими (по эффективности и безопасности) для устранения наиболее опасных экстрасистол (желудочковая экстрасистолия высоких градаций), особенно на фоне ИБС, являются препараты III класса - амиодарон, соталол. «Чистые» антиаритмические препараты III класса (без
р-блокирующей активности) обладают выраженным аритмогенным эффектом. Иногда хороший антиаритмический эффект при предсердной экстрасистолии могут оказывать препараты наперстянки, однако они могут и усиливать экстрасистолию, поэтому при дигиталисной терапии необходим тщательный контроль. Лечение тем или иным препаратом лучше начинать с малых доз, убедившись в течение нескольких ближайших суток (с помощью ЭКГ-контроля) в отсутствии побочных действий (аритмогенный эффект, ухудшение внутрисердечной проводимости и др.), дозу можно увеличить до полной суточной. При отсутствии эффекта продолжить подбор препаратов (лучше в условиях тестирования). Неэффективность одного из представителей антиаритмических препаратов определенного класса (особенно I и III классов) не означает неэффективности других препаратов того же класса и не исключает их тестирования.
• Можно использовать комбинации антиаритмических препаратов, поскольку при этом происходит взаимопотенцирование антиаритмических свойств. Лучше комбинировать препараты различных классов - I и II классов, I и IV классов, при этом доза каждого препарата снижается наполовину. Проведение комбинированной антиаритмической терапии небезопасно, имеет ряд особенностей и требует клинического опыта.
- По своей клинической важности целесообразна комбинация малых доз амиодарона (по 200-300 мг/сут) с р-адреноблокаторами (например, пропранолол в дозе 20-30 мг/сут). Такая комбинация эффективна для предупреждения внезапной смерти у больных с жизнеугрожающей желудочковой экстрасистолией, могущей перейти в фибрилляцию желудочков; при ее применении следует тщательно следить за частотой ритма и предсердно-желудочковой проводимостью. Другой пример удачной комбинации - назначение аллапинина, учащающего синусовый ритм (по 50 мг/сут), одновременно с урежающим ритм соталолом (по 80-120 мг/сут).
• В ряде случаев медикаментозно-резистентных аритмий можно попытаться провести экстракорпоральную очистку крови - гемосорбцию или плазмаферез, основанную на удалении из крови аритмогенных субстанций.
- Метод достаточно безопасен, но дает лишь временный эффект, в связи с чем должен применяться в тех случаях, когда этого эффекта оказывается достаточно (при серьезных обострениях аритмии, подготовке к хирургическому лечению и т.п.).
• При медикаментозно-резистентной, особенно частой (свыше 10-15 тыс. в сутки) и монотопной экстрасистолии, возможно применение радиочастотной или криоаблации (катетерным методом) экстрасистолического очага (или очагов) с предварительным его (их) выявлением с помощью современных методик (электрофизиологическое исследование, электроанатомическое картирование).
Прогноз
Зависит от основного заболевания и типа аритмии. Особенно опасна желудочковая экстрасистолия высоких градаций у больных ИБС и на фоне плохого
состояния миокарда. Легче остальных протекают наджелудочковые экстрасистолии. Экстрасистолия покоя более благоприятна, чем возникающая при физическом напряжении на фоне органических заболеваний сердечно-сосудистой системы.
Профилактика
Основные профилактические мероприятия сводятся к активному лечению основного заболевания, приведшего к экстрасистолии, рекомендациям по нормализации режима труда и отдыха, отказу от курения, приема алкоголя, крепких кофе и чая.
ПАРОКСИЗМАЛЬНАЯ ТАХИКАРДИЯ
Пароксизмальная тахикардия (ПТ) - нарушение ритма эктопического характера, клинически характеризующееся учащением работы сердца, с внезапным началом и внезапным окончанием. Как и экстрасистолия, ПТ может быть суправентрикулярного (предсердного и предсердно-желудочкового) и желудочкового происхождения.
В основе развития суправентрикулярных ПТ (СВПТ) в большинстве случаев лежат механизм re-entry (синусовая, предсердная и предсердно-желудочковая узловая реципрокная тахикардия), а также триггерный механизм и повышение автоматизма (эктопические предсердные и предсердно-желудочковые тахикардии).
Минимальная продолжительность СВПТ составляет три сердечных цикла (такие эпизоды носят названия пробежек СВПТ). Приступ длится обычно от нескольких минут до нескольких суток и способен спонтанно купироваться. Устойчивые (до года) СВПТ встречаются очень редко.
Часть нормальных анатомических структур, которые участвуют в формировании круга re-entry при СВПТ, идентифицированы. К ним относят межпредсердный пучок Бахмана, «быстрый» передний (с ретроградным проведением) и «медленный» задний (с антероградным проведением) предсердно-желудочковые узловые входы (их пересечение ведет к прекращению предсердно-желудочковой-узловой СВПТ). Предполагают наличие «медленного» α-, «быстрого» β- и, возможно, γ-пути в составе предсердно-желудочкового соединения.
СВПТ в 2/3-3/4 всех случаев развивается у людей с отсутствием какойлибо известной патологии сердца. Возникновение СВПТ возможно при ИБС, ГБ, заболеваниях миокарда, а также при синдроме преждевременного возбуждения желудочков (Вольфа-Паркинсона-Уайта, Клерка-Леви-Кристеско), характеризующемся наличием врожденной аномалии - шунтовых предсердножелудочковых путей (пучки Кента, Джеймса, Махейма), могущим носить семейный характер.
ЖПТ лишь изредка наблюдается у молодых людей без видимой сердечной патологии. Обычно ЖПТ появляется при ИБС; возможна также различная патология миокарда, в частности аритмогенная дисплазия сердца (чаще правого желудочка), синдром удлиненного интервала QT (врожденный и приобретен-
ный), синдром Бругада (генетически обусловленный дефект Na-каналов), тиреотоксикоз, дигиталисная интоксикация и др.
Основная причина гемодинамических нарушений при ПТ - укорочение диастолы, имеет значение также десинхронизация деятельности предсердий и желудочков (при ЖПТ). В результате уменьшается минутный объем сердца, снижается АД, ухудшается перфузия жизненно важных органов. Развивается застой крови в большом и малом круге кровообращения. Данные нарушения особенно резко выражены при ЖПТ. При СВПТ гемодинамические нарушения более заметны в случае ее предсердно-желудочкового происхождения.
Клиническая картина
На первом этапе диагностического поиска можно получить достаточно много информации для диагностики ПТ. Приступы сердцебиения начинаются и заканчиваются внезапно. При частоте сердечных сокращений (ЧСС) более 150 в минуту весьма вероятна ПТ. Если число сердечных сокращений менее 150 в минуту, то ПТ маловероятна.
Во время приступа ПТ может возникнуть одышка, как следствие нарушения кровообращения в малом круге. При ЖПТ и СВПТ, развивающихся на фоне органического поражения сердца, могут возникнуть острая левожелудочковая недостаточность и аритмогенный шок - резкое снижение АД. Приступ болей в области сердца часто обусловлен нарушением коронарного кровообращения, и при органических изменениях коронарных артерий может развиться ИМ (чаще при ЖПТ). Головокружение, обмороки - следствие нарушения церебрального кровотока. Во время приступа ПТ нередко отмечают выраженные вегетативные симптомы (дрожь, потливость, тошнота, частое мочеиспускание); чаще эти явления наблюдаются при СВПТ.
Указание больного на исчезновение приступа при глубоком вдохе, натуживании, кашле и других рефлекторных пробах (см. ниже) свидетельствует о наджелудочковом характере ПТ.
Следует учитывать наличие или отсутствие заболеваний сердечнососудистой системы или других органов, изменение в их течении (ухудшение), совпавшее по времени с приступами ПТ (например, ЖПТ, впервые развившаяся у больного ИБС, может стать наиболее ранним проявлением ИМ). Необходимо также выяснить, проводилось ли ранее лечение, каковы были его эффект и переносимость.
На втором этапе диагностического поиска при исследовании в момент приступа необходимо:
• провести ряд рефлекторных проб с целью прекращения пароксизма (см. ниже); купирование приступа свидетельствует о СВПТ, отсутствие эффекта не исключает СВПТ;
• провести физическое обследование и исследовать сердечно-сосудистую систему с целью возможного выяснения генеза ПТ и дифференциации СВПТ и ЖПТ: при ЧСС более 200 наиболее вероятна СВПТ; меняющаяся громкость тонов сердца и наполнения пульса более характерны для ЖПТ; вегетативные признаки (дрожь, потливость) - для СВПТ; при ЖПТ часто-
та пульса на лучевой артерии выше, чем частота венозного пульса (сосуды шеи), так как венозный пульс соответствует нормальному (не учащенному) ритму предсердий; при СВПТ частота венозного и артериального пульса одинакова;
• выявить возможные признаки сердечной недостаточности.
При исследовании вне приступа необходимо попытаться выявить возможные признаки того или иного заболевания сердечно-сосудистой системы, могущие служить причиной приступов ПТ.
На третьем этапе диагностического поиска, помимо исследований, проводимых для выявления заболевания сердечно-сосудистой системы, регистрируют ЭКГ во время приступа (для идентификации ПТ). При этом обращают внимание на могущие иметь место признаки ишемии миокарда или развивающиеся очаговые изменения (наличие негативного зубца Г).
Сразу после приступа ПТ необходимо выполнить ряд лабораторных исследований (определение содержания в крови сердечного тропонина, трансаминаз, ЛДГ, КФК, количества лейкоцитов и СОЭ) с целью выявления возможного повреждения миокарда в результате приступа ПТ.
При указаниях на частые приступы сердцебиения, которые, однако, никогда не были зарегистрированы на ЭКГ, необходимо суточное мониторирование ЭКГ, во время которого могут быть зафиксированы эпизоды ПТ и другие аритмии.
Затем необходимо проведение электростимуляции предсердий (реже желудочков) для уточнения диагноза и подбора терапии (см. ниже).
При СВПТ используют метод чреспищеводной электрокардиостимуляции сердца (ЧПЭСС). Он необходим для провоцирования приступа в тех случаях, когда ранее не удавалось зарегистрировать приступ (в том числе и при суточном мониторировании ЭКГ). Возможность вызвать приступ ПТ, идентичность при этом ощущений больного с таковыми при спонтанно развившихся приступах сердцебиения указывают на наличие СВПТ. Кроме самого факта успешной провокации приступа, ЧПЭСС используют и для уточнения механизма ПТ (выявление дополнительных путей проведения, их рефрактерного периода и др.), что входит в программу электрофизиологического исследования (ЭФИ). Для более точного определения функционально-анатомических особенностей СВПТ при подготовке к хирургическому лечению используют внутрисердечную стимуляцию сердца.
Весьма существенна выявляемая при электрической стимуляции сердца возможность купировать приступ ПТ, спровоцированной стимуляцией в другом режиме - одиночным или двойным стимулом, синхронизированным с фазой сердечного цикла (программированная стимуляция) или сверхчастой стимуляцией.
При ЖПТ эти методы используют реже из-за опасности спровоцировать при электрической стимуляции желудочков их фибрилляцию.
Лечение
В связи с тем что для ПТ не характерно затяжное течение, лечение сводится к купированию приступа ПТ и последующему подбору поддерживающей анти-
аритмической терапии. При лечении ПТ следует соблюдать следующие принципы:
• При СВПТ (или неидентифицированном характере приступа) медикаментозной терапии должно предшествовать механическое раздражение блуждающего нерва:
- глубокое дыхание;
- проба Вальсальвы;
- массаж каротидного синуса, лучше правого (нельзя массировать оба синуса одновременно);
- надавливание на глазные яблоки;
- вызывание рвоты, глотание кусков твердой пищи, холодной воды;
- опускание лица в холодную воду (рефлекс «ныряющей собаки»);
- присаживание на корточки;
- при низком АД - внутривенное введение 1% раствора фенилэфрина в дозе 0,2-0,3 мл.
• При неэффективной стимуляции блуждающего нерва применяют медикаментозные средства.
А. При СВПТ:
• до прихода врача больной может сам попытаться купировать приступ приемом пропранолола в дозе 10-20 мг в сочетании с феназепамом* в дозе 1 мг или клоназепамом в дозе 2 мг. Таблетки следует разжевать и рассосать. Их применение можно дополнить приемом 60-80 капель валокордина*;
при отсутствии расширения комплекса QRS (должно быть известно ранее) можно применить вместо р-адреноблокаторов этацизин* в дозе 50-100 мг пропафенон (в дозе 300 мг), аллапинин* (по 25- 50 мг), прокаинамид (в дозе 0,5-1,0 г). После этого могут оказаться эффективными повторные вагусные пробы;
• от назначения верапамила при неизвестной этиологии ПТ (когда нельзя исключить синдром преждевременного возбуждения желудочков) лучше воздержаться, так как он может ускорить проведение по дополнительному пути, что может оказаться опасным в случае возникновения при синдроме Вольфа-Паркинсона-Уайта (WPW- синдром) МА (ввиду резкого увеличения числа желудочковых сокращений с опасностью перехода в фибрилляцию желудочков);
• затем применяют парентеральное внутривенное введение одного из следующих препаратов:
V трифосаденин (АТФ, натрия аденозинтрифосфат) - высокоэффективен при предсердно-желудочковой узловой реципрокной ПТ, при остальных ПТ ведет к урежению ЧСС; противопоказан при СССУ и бронхиальной астме, а также спастической стенокардии; препарат вводят струйно в дозе 5-10 мг (0,5-1,0 мл 1% раствора) только при условии мониторирования ЭКГ, так как возможен «выход» из ПТ через остановку синусового узла на 3-5 с и более, а также длительная пауза на фоне синусовой реципрокной тахикардии, после чего ПТ возобновляется;
V верапамил в дозе 5-10 мг (по 2,0-4,0 мл 2,5% раствора) струйно медленно под контролем АД и частоты ритма; противопоказан больным с WPW-синдромом;
V прокаинамид в дозе 1000 мг (по 10,0 мл 10% раствора) внутривенно струйно медленно или (лучше) капельно под контролем АД, а при необходимости - одновременно с фенилэфрином в дозе 0,3- 0,5 мл;
V пропранолол в дозе 5-10 мг (по 5-10 мл 0,1% раствора струйно в течение 5-10 мин под контролем АД и ЧСС) противопоказан при гипотонии и бронхоспазме;
V пропафенон (по 1 мг/кг внутривенно струйно в течение 3-6 мин); дизопирамид (1% раствор ритмилена в дозе 15,0 мл в 10,0 мл изотонического раствора натрия хлорида); 2,5% раствор морацизина в дозе 6,0 мл на изотоническом растворе натрия хлорида внутривенно струйно в течение 3 мин;
• после введения антиаритмического препарата, в случае отсутствия восстановления синусового ритма, следует повторить вагусные пробы;
• при отсутствии эффекта от первого введения препарата могут быть применены другой препарат первого ряда, ЧПЭСС либо использованы препараты второго ряда:
V нибентан в дозе 10-15 мг капельно (новый отечественный антиаритмический препарат III класса, высокоэффективный, но большая частота развития серьезных желудочковых аритмий делает целесообразным его использование у больных СВПТ лишь при резистентности к препаратам первого ряда);
V амиодарон в дозе 300 мг (струйно в течение 5 мин или капельно) - эффект бывает отсрочен до нескольких часов;
• особым показанием к применению амиодарона служит развитие пароксизма СВПТ у больных WPW-синдромом и другими вариантами синдрома предвозбуждения желудочков (в случае, если пароксизм не требует экстренного купирования), так как эти препараты блокируют как антероградное, так и ретроградное проведение по дополнительным путям;
• с успехом могут использоваться также прокаинамид (новокаинамид*), трифосаденин, пропранолол; антероградное проведение по дополнительным путям блокируется внутривенным введением 50 мг аймалина;
• после испытания 1-2 препаратов дальнейший поиск эффективных препаратов следует прекратить и перейти к ЧПЭСС либо (при технической невозможности ее выполнения или неэффективности) - к электроимпульсной терапии (ЭИТ) - кардиоверсии. ЭИТ осуществляют путем трансторакального нанесения мощного электрического разряда (100-400 Дж или 3,5-7,0 кВ). Антиаритмический эффект основан на одновременном возбуждении кардиальных структур, что приводит к исчезновению функциональной гетерогенности в миокарде, в том числе и механизма re-entry. Процедуру проводят под общим обезболиванием;
• при тяжелых гемодинамических или коронарных нарушениях купирование приступа ПТ начинают сразу с применения ЭИТ или электрокардиостимуляции. ЧПЭСС (программированную или сверхчастую стимуляцию) следует использовать и в случае непереносимости антиаритмических препаратов, «выходе» из приступа с развитием серьезных нарушений проводимости (в результате СССУ и существующих предсердно-желудочковых блокад);
• ЧПЭСС может быть методом выбора и во всех остальных случаях, особенно когда установлен реципрокный характер СВПТ либо в анамнезе имеется успешный опыт применения ЧПЭСС;
• при неэффективности ЭИТ и электрокардиостимуляции используют парную электрическую стимуляцию сердца, которая не купирует приступ, но позволяет уменьшить число сердечных сокращений примерно в 2 раза в течение всего времени стимуляции. Нередко через несколько часов парной стимуляции после отключения стимулятора восстанавливается синусовый ритм.
Б. При ЖПТ применяют:
• при выраженной гемодинамической нестабильности («аритмогенный шок», отек легких) - экстренную ЭИТ, при ее неэффективности - повторение на фоне струйного внутривенного введения лидокаина (50-75 мг), амиодарона (300-450 мг), тозилата бретилия (по 5-10 мг/кг), при отсутствии эффекта - желудочковую электростимуляцию (частая, фазосинхронная и, наконец, парная);
• при отсутствии резких нарушений гемодинамики (в частности, гипотонии) - лидокаин в дозе 80-100 мг внутривенно струйно или 10% раствор прокаинамида в дозе 10 мл внутривенно струйно, медленно (под контролем АД) или амиодарон в дозе 300-450 мг внутривенно струйно, далее - по 300 мг капельно в течение 1-2 ч. Некоторые формы ЖПТ эффективно купируются трифосаденином, р-адреноблокаторами или верапамилом. При отсутствии эффекта применяют
ЭИТ.
• Вторичная профилактика:
- при часто повторяющихся приступах ПТ или редких, но тяжелых приступах, кроме общих мероприятий, этиотропной и седативной терапии, назначают антиаритмические препараты;
- при СВПТ можно использовать р-адреноблокаторы, верапамил по 120- 360 мг/сут (при отсутствии WPW-синдрома), соталол по 80-320 мг/сут, аллапинин* (по 75-100 мг/сут), пропафенон (по 600-900 мг/сут), этацизин* (по 150 мг/сут), дизопирамид* (по 600-900 мг/сут) и амиодарон (по 200-400 мг/сут);
- оптимальным служит не эмпирический подбор препаратов, а их назначение в условиях тестирования с применением ЧПЭСС по следующей методике: после того, как доказана возможность вызвать с ее помощью СВПТ, назначают тестируемый препарат в полной суточной дозе на 2-3 суток, затем повторяют ЧПЭСС. При отсутствии возникновения СВПТ препарат считают эффективным и начинают тестирование следующего медикамента;
- в случае ЖПТ обычно назначают наиболее действенные и безопасные препараты - амиодарон в поддерживающей суточной дозе 200-400 мг (возможно в комбинации с р-адреноблокаторами), соталол по 80- 320 мг/сут.
Весьма эффективный метод лечения ПТ - кардиохирургическое вмешательство, основанное на деструкции аритмогенных зон миокарда или дополнительных проводящих путей.
В настоящее время хирургические методы лечения применяют при СВПТ в случае:
• неэффективности медикаментозной терапии;
• ее плохой переносимости;
• невозможности ее назначения по тем или иным противопоказаниям.
Более широкие показания к хирургическому лечению WPW-синдрома. Отмечена тенденция к более частому использованию хирургических методов лечения, чтобы избежать длительного превентивного приема препаратов (не гарантирующего к тому же отсутствия рецидивов СВПТ).
Наиболее часто используют радиочастотную деструкцию (аблацию) аритмогенной зоны или дополнительных проводящих путей (эффективность 80- 100%). Кроме того, возможна аблация предсердно-желудочкового соединения с установкой электрокардиостимулятора (ЭКС) в режиме стимуляции желудочков.
При ЖПТ хирургическое лечение показано в случае:
• гемодинамически значимой продолжительной мономорфной ЖТ, резистентной к медикаментозной терапии;
• ЖТ, обусловленной доказанным при ЭФИ механизмом re-entry в системе ножек пучка Гиса.
Наконец, возможно использование имплантируемого кардиовертера-дефибриллятора (ИКД), что абсолютно показано при:
• клинической смерти, обусловленной фибрилляцией желудочков, развивающейся из ЖТ, не связанной с преходящей причиной;
• спонтанных пароксизмах устойчивой ЖТ;
• синкопальных атаках неясного генеза в сочетании с ЖТ или фибрилляцией желудочков (индуцируемой ЭФИ) и неэффективностью или невозможностью использования антиаритмических препаратов;
• неустойчивой ЖТ, воспроизводимой при ЭФИ, некупируемой прокаинамидом (новокаинамидом*), сочетающейся с постинфарктным кардиосклерозом и дисфункцией левого желудочка.
Круг относительных показаний еще более широк. Имплантация ИКД - наиболее эффективный метод предупреждения внезапной смерти; к сожалению, в нашей стране ее широкое использование сдерживает высокая стоимость аппарата.
Прогноз
Приступы СВПТ опасности для жизни, как правило, не представляют. Однако длительные приступы при наличии изменений коронарных артерий способствуют ухудшению коронарного кровообращения и развитию очагов некроза в
миокарде. Наиболее плохой прогноз при ЖПТ на фоне органической патологии сердца вследствие возможности перехода тахикардии в мерцание желудочков.
Профилактика
Включает лечение основного заболевания, а также назначение препаратов, предупреждающих развитие приступа тахикардии.
МЕРЦАТЕЛЬНАЯ АРИТМИЯ
Мерцательная аритмия (МА), в основе которой лежит фибрилляция предсердий (ФП), бывает пароксизмальной (до 7 сут) и постоянной (более 7 сут). По международным рекомендациям с 2001 г. постоянная форма МА делится на персистирующую форму (возможно купирование или спонтанное прекращение МА с достаточно длительным сохранением синусового ритма) и собственно постоянную (permanent) форму (купирование МА невозможно или же рецидив наступает очень быстро). Эта классификация не лишена недостатков.
Как правило, МА осложняет органические заболевания сердца: АГ, ИБС, приобретенные и врожденные пороки сердца, миокардиты и постмиокардитический кардиосклероз, кардиомиопатии, тиреотоксикоз, алкогольную и другие миокардиодистрофии, синдром преждевременного возбуждения желудочков и др. Доказана возможность генетической предрасположенности к МА. Иногда МА возникает и без видимой патологии со стороны сердца и других органов и систем (идиопатическая МА).
Патогенез МА объясняют с помощью теории re-entry (microreentry с ведущим кругом возбуждения и не более десятью «дочерними» кругами). При множественных волнах кругового движения возбуждения по предсердиям возникают фибрилляция или мерцание предсердий. У части больных выявляются постоянные эктопические очаги в устьях легочных вен, «запускающие» фибрилляцию предсердий. Частота волн мерцания - ff, находится в пределах 350-600 в 1 мин. Большая часть волн мерцания вследствие их множественности не может распространяться на желудочки.
При наличии одной волны циркуляции возникает ТП, которое встречается в 15-30 раз реже, чем МА. В основе его лежит механизм macro-reentry. Частота предсердного ритма при ТП составляет 200-350 в 1 мин. Волны трепетания могут распространяться на желудочки через предсердно-желудочковую систему с правильным коэффициентом проведения либо нерегулярно, поэтому и желудочковый ритм может быть правильным и неправильным.
Отрицательные последствия МА:
• прекращение активной сократительной деятельности предсердий и уменьшение количества крови, перемещающейся из предсердий в желудочки во время диастолы (примерно на 20-30%), что приводит к соответствующему снижению ударного выброса желудочков и ухудшению гемодинамики;
• тромбообразование в предсердиях и тромбоэмболии в системе большого (чаще) и (или) малого круга кровообращения (20-40% случаев);
• снижение коронарного кровотока;
• склонность к тахикардии (отсюда углубление гемодинамических расстройств);
• дефицит пульса (непродуктивная работа сердца при резко укороченной диастоле, когда систола желудочков не сопровождается выбросом крови на периферию).
Длительное существование МА может ухудшать функциональные свойства миокарда, с чем связано возникновение аритмогенной кардиомиопатии (расширение камер сердца с усугублением снижения сократительной способности).
Кроме того, возможно так называемое «электрическое ремоделирование» в миокарде предсердий с увеличением рефрактерности и закреплением процесса re-entry, делающего фибрилляцию предсердий необратимой.
Клиническая картина
Для клинической картины МА характерны:
• неприятные ощущения, вызванные беспорядочной работой сердца;
• симптомы, обусловленные прогрессированием расстройств гемодинамики и коронарного кровообращения (степень гемодинамических расстройств определяется исходным состоянием миокарда, степенью клапанного поражения при пороке сердца и т.д.);
• симптомы основного заболевания, на фоне которого развилась МА;
• особенности самой МА:
постоянная или пароксизмальная форма;
пароксизмальная форма может протекать с наличием симптомов вегетативной дисфункции (дрожь, слабость, полиурия, тошнота и др.) или без них;
• иногда можно выделить два патогенетических варианта:
катехоламинзависимый (чаще страдают женщины, приступы МА возникают днем при физической и эмоциональной нагрузке, после употребления алкоголя, как правило, сопровождаются вегетативной симптоматикой);
вагусиндуцированный (чаще страдают мужчины, характерно возникновение МА ночью, во время брадикардии, вегетативная «окраска» менее выражена).
На первом этапе диагностического поиска при постоянной форме МА можно не выявить жалоб или жалобы обусловлены:
• недостаточностью кровообращения;
• основным заболеванием (порок сердца, ИБС, диффузный токсический зоб, миокардит, идиопатическая кардиомиопатия и пр.);
• аритмичной работой сердца (чувством неправильного сердцебиения).
В анамнезе выясняют все, относящееся к основному заболеванию, а также факты, обусловленные самой МА (давность и обстоятельства появления МА, изменение состояния больного при возникновении МА).
Существенное значение для последующего лечения имеет выяснение попыток ликвидации МА в прошлом (с помощью лекарственных препаратов или ЭИТ), в случае успеха - длительность удерживания нормального синусового ритма.
При пароксизмальной форме МА больные предъявляют жалобы на беспорядочное сердцебиение (приступ МА или ТП с неправильным коэффициентом
проведения), однако у части больных может быть ритмичное сердцебиение, являющееся проявлением ТП с правильным коэффициентом проведения.
Во время приступа может появиться целый ряд жалоб: одышка, тяжесть в правом подреберье (признаки недостаточности кровообращения), сжимающие боли за грудиной (приступ стенокардии), головные боли и головокружение (следствие нарушения церебрального кровотока), симптомы вегетативной дисфункции.
На втором этапе диагностического поиска должны быть выявлены:
• симптомы основного заболевания, вызвавшего МА;
• симптомы самой МА (беспорядочная работа сердца, меняющаяся громкость тонов, неравномерность пульса, дефицит его).
На третьем этапе диагностического поиска обязательно проведение ЭКГ, выявляющей МА и характер волн ff: при крупноволновом мерцании более вероятен порок сердца, при мелковолновом - кардиосклероз.
Целесообразно проведение суточного мониторирования ЭКГ, которое выявляет:
• суточные (циркадные) особенности ритма, в том числе при физической нагрузке;
• нередкое наличие одновременной желудочковой экстрасистолии;
• паузы (периоды асистолии) в работе сердца;
• частотозависимую депрессию сегмента ST (указание на ишемию миокарда).
У больных с недоказанной электрокардиографически МА (при приступообразной форме) суточное мониторирование ЭКГ позволяет зафиксировать короткие эпизоды МА в течение суток.
Иногда у больных с жалобами на приступы беспорядочного сердцебиения, но при отсутствии указаний на МА на ЭКГ, в том числе и в период холтеровского мониторирования, проводят ЧПЭСС с целью индуцирования МА. Сама возможность ее индукции и особенно ощущаемое при этом чувство знакомого больному сердцебиения подтверждают предположение о наличии у больного приступообразной формы МА. Метод ЧПЭСС можно использовать в дальнейшем при подборе антиаритмической терапии. Недостатком подобного тестирования у больных МА служит невозможность прервать МА с помощью кардиостимуляции - иногда индуцированный пароксизм МА затягивается, и лишь повторным введением антиаритмических препаратов его удается купировать.
Затем необходимы исследования, подтверждающие характер основного заболевания и уточняющие его особенности. Очень важно УЗИ сердца (размеры предсердий, особенно левого). Весьма целесообразна чреспищеводная ЭхоКГ, обнаруживающая тромбообразование в предсердиях (угроза тромбоэмболий).
Лечение
При МА лечение решает три основные задачи:
• лечение основного заболевания;
• воздействие на МА, зависящее от того, постоянной или приступообразной она является;
• предупреждение тромбоэмболических осложнений (при постоянной форме МА).
Лечение основного заболевания особенно важно при тиреотоксикозе, наличие которого непосредственно провоцирует появление и поддержание МА (после устранения тиреотоксикоза достаточно часто МА спонтанно исчезает). Важными являются лечение текущего миокардита, нормализация АД, хирургическая коррекция порока сердца, хотя эти мероприятия играют положительную роль скорее в стабилизации восстановленного ритма и сами по себе, как правило, не приводят к устранению МА. В ряде случаев (кардиосклероз неясного генеза) лечение основного заболевания практически невозможно.
При пароксизмальной форме МА перед врачом стоят 2 задачи:
• купирование пароксизма МА;
• проведение превентивной антиаритмической терапии. Купирование пароксизма мерцательной аритмии
Первый в жизни больного пароксизм МА всегда служит показанием к восстановлению синусового ритма. В остальных случаях тоже, как правило, следует проводить активные попытки восстановления ритма в первые двое суток (когда риск «нормализационных» тромбоэмболий остается минимальным). Сразу следует отказаться от купирования МА:
• при наличии у больного частых (до нескольких раз в неделю, в день) пароксизмов, которые рецидивируют, несмотря на поддерживающую антиаритмическую терапию;
• удовлетворительно переносятся и купируются самостоятельно;
• при опасных реакциях на антиаритмики в анамнезе и нежелательности ЭИТ (в пожилом возрасте, при непереносимости наркоза и др.).
Если приступ МА затягивается, показана урежающая ритм терапия в сочетании с инъекциями гепарина натрия. ЧПЭСС для купирования пароксизма МА (в отличие от ТП) неэффективна.
В течение первых 2 суток купирование МА проводят по следующим принципам:
• с профилактической целью перед купированием внутривенно струйно вводят гепарин натрия 5000 Ед;
• при сохранении МА - повторные инъекции гепарина натрия в дозе 5000 Ед 4 раза в день подкожно под контролем АЧТВ или надропарина кальция по 0,6 г 2 раза в день подкожно);
• экстренная электрическая кардиоверсия показана при выраженной гемодинамической нестабильности (коллапс, отек легких, нарушения сознания); ЭИТ проводится также при наличии противопоказаний к медикаментозной терапии;
• медикаментозное восстановление синусового ритма.
Первое в жизни больного введение любого антиаритмического препарата должно проводиться под постоянным мониторным контролем с возможностью экстренной дефибрилляции (в блоке интенсивной терапии). При отсутствии монитора необходимы повторные записи ЭКГ (до и после введения). Если в анамнезе был успешный опыт применения какого-либо препарата для купирования МА, ему отдают предпочтение.
Для купирования приступа используют амиодарон по 300-450 мг внутривенно капельно, прокаинамид по 1000 мг внутривенно медленно, лучше капельно; новый отечественный препарат нибентан* (антиаритмический препарат
III класса) в дозе 10-15 мг внутривенно капельно (под постоянным мониторным контролем ЭКГ ввиду возможных желудочковых аритмий); ибутилид (по 1 мг/кг внутривенно медленно); пропафенон (по 2 мг/кг внутривенно в течение 5 мин).
Нередко приступ пытаются купировать приемом внутрь хинидина по 0,2 г через каждые 2 ч под контролем ЭКГ (не следует с этой целью принимать пролонгированные формы типа хинидина-дурулес* , предназначенные для поддерживающей терапии).
При сохранении МА к концу вторых суток должен ставиться вопрос о проведении ЭИТ. При первом в жизни больного пароксизме, редких пароксизмах (1 в несколько месяцев) и отсутствии противопоказаний к проведению наркоза отказ от ЭИТ служит ошибкой.
Частые, но нетяжелые приступы МА больной должен пытаться купировать сам, например приемом хинидина (в дозе 0,4 г внутрь, а спустя 2 ч - еще 0,2 г) или пропафенона в дозе 0,3 г, затем - по 0,15 г. Если это не помогает и в то же время известно, что обычно приступ заканчивается сам, следует рекомендовать больному во время приступа принимать пропранолол по 0,01-0,02 г 3-4 раза в сутки, седативные средства для уменьшения тягостного чувства сердцебиения. Если такой приступ затягивается, то при предшествующем длительном упорном течении и инкурабельности приступов следует воспользоваться этим случаем для «перевода» МА в постоянную форму (с этой целью назначают сердечные гликозиды и седативные средства).
Принципы купирования приступа ТП аналогичны. Однако, как было сказано, при ТП возможно использование ЧПЭСС, с которого целесообразно начинать попытки восстановления синусового ритма.
Медикаментозная профилактика пароксизмов ТП проводится также по принципам лечения пароксизмальной формы МА. Однако при пароксизмальной форме ТП гораздо большее значение приобретает интервенционная методика лечения - аблация так называемого «перешейка» в правом предсердии (при типичной форме ТП). Этот метод, обладая высокой эффективностью (более 90%), достаточно надежно предупреждает рецидивы ТП и сегодня признается предпочтительным при этом виде аритмии.
Профилактика
После успешного купирования МА (ТП) или спонтанного восстановления синусового ритма должна быть начата (скорректирована) поддерживающая антиаритмическая терапия. После первого в жизни больного пароксизма, с учетом высокой вероятности сохранения фактора, вызвавшего МА (и условий к рецидивам МА) показан курс лечения в течение как минимум 3-4 нед. Затем (при отсутствии рецидивов) можно продолжить наблюдение за больным без терапии; при возобновлении МА в ходе лечения следует сменить терапию и продолжать ее постоянно. После повторного эпизода МА поддерживающую терапию следует проводить не менее 1-1,5 лет (при отсутствии рецидивов МА). Подбор эффективного антиаритмического препарата проводится эмпирически или тестированием препаратов с помощью ЧПЭСС, как это описано выше.
С целью предупреждения приступов МА и ТП назначают какой-либо из следующих препаратов: амиодарон (по 0,6 г/сут с последующим уменьшением дозы), этацизин (до 0,2 г/сут), пропафенон (по 450-600 мг/сут), аллапинин* (по 75-100 мг/сут), дизопирамид (по 0,3-0,6 г/сут), хинидин (по 0,6-1,0 г/сут), дофетилид (по 500-1000 мкг/сут), флекаинид (по 200 мг/сут), соталол (по 80-160 мг/сут), дронедарон* (по 200-400 мг/сут).
Возможны комбинации указанных препаратов с антиаритмическими препаратами II или IV классов.
Кроме собственно антиаритмической терапии, при профилактике приступов МА используют следующие возможности:
• коррекцию вегетативного статуса с учетом патогенетического варианта МА - назначение стабилизатора вегетативных реакций клоназепама в дозе 0,5-1 мг на ночь, дополнительно 0,5 мг утром;
• коррекцию психических расстройств, провоцирующих и сопровождающих МА;
• у больных с умеренной дилатацией предсердий, без пороков сердца, с ишемическим и алкогольным генезом МА, с сопутствующей гиперлипидемией - использование гемосорбции или плазмафереза в случае высокой значимости антиаритмического эффекта в ближайшие месяцы (например, перед операцией);
• при подтверждении так называемого «эктопического» (индуцируемого экстрасистолами из устьев легочных вен) варианта МА - аблацию аритмогенных зон (эффективность процедуры около 60-80%, в последующем нередко продолжается антиаритмическая терапия с хорошим эффектом); наиболее серьезное осложнение процедуры - стеноз легочной вены - развивается редко (в некоторых центрах нет осложнений совсем);
• неэффективность превентивной медикаментозной терапии при частых, плохо переносимых пароксизмах МА и отсутствии возможности аблации эктопических зон в устьях легочных вен служат основанием для проведения аблации предсердно-желудочкового соединения (создание искусственной полной предсердно-желудочковой блокады) с одновременной установкой ЭКС.
При постоянной форме МА лечение может быть радикальным (устранение МА) или консервативным (урежение желудочкового ритма, терапия расстройств гемодинамики и пр.).
Устранение постоянной формы МА не показано (ввиду быстро наступающего рецидива) при:
• сроке ее существования свыше 3 лет;
• cor bovinum;
• недостаточности кровообращения III степени;
• частых и непредотвращаемых медикаментами приступах МА, перед ее переходом в постоянную форму;
• гипертиреозе;
• перед хирургической коррекцией порока сердца.
Постоянная форма МА может быть устранена (всегда только в условиях стационара) медикаментозно и с помощью ЭИТ.
Медикаментозное лечение МА менее эффективно, чем ЭИТ, и чаще дает осложнения. Наиболее часто с целью фармакологической кардиоверсии ис-
пользуют хинидин. В больших (и небезопасных) дозах у больных с недавней МА хинидин может давать достаточно хороший эффект (75-80%). С увеличением продолжительности данного эпизода МА эффект хинидина снижается, составляя менее 50%. Разнообразные осложнения (токсическое действие на сердце, органы пищеварения, зрения, слуховой нерв, систему кроветворения) встречаются у 40% больных.
Хинидин назначают в нарастающих дозах - от 0,6 г до 3-4 г/сут (необходим постоянный контроль ЭКГ, так как одной из опасностей лечения хинидином служит кардиотоксический эффект, вплоть до остановки сердца). Предлагают также восстановление ритма с помощью амиодарона, пропафенона, других антиаритмических препаратов, но все они уступают электрической кардиоверсии. Лишь немного уступает по результативности ЭИТ при постоянной форме МА введение нибентана, однако, как уже сказано, этот отечественный препарат нередко вызывает желудочковые аритмии и должен применяться с осторожностью.
ЭИТ эффективна у 90-95% больных, занимает 30-40 мин, осложнения при ее проведении редки. Однако ее проведение требует известных навыков. В настоящее время пользуются обоими методами, но более предпочтительным является ЭИТ.
Независимо от метода устранения МА при восстановлении ритма должны соблюдаться некоторые определенные принципы.
• Попытке восстановления синусового ритма должен предшествовать период лечения основного заболевания (стабилизация гемодинамики, нормализация АД и т.д.).
• Перед проведением ЭИТ всем больным необходима чреспищеводная ЭхоКГ, позволяющая визуализировать наличие или отсутствие тромба в предсердиях. При отсутствии тромба возможно проведение ЭИТ (при этом больному назначают антикоагулянтную терапию - если он не получал ее ранее). При наличии тромба больному также назначают антикоагулянтную терапию. Спустя несколько недель (не менее 3) повторяют чреспищеводную ЭхоКГ. При лизировании тромба возможно проведение ЭИТ. При сохранении тромба ЭИТ не проводят ввиду реальной угрозы «нормализационной» тромбоэмболии (возникает в 1,5-2% случаев), связанной с фрагментацией (разламыванием) тромба после восстановления функции предсердий и заносом фрагментов тромба в сосуды большого и (реже) малого круга кровообращения.
• При отсутствии возможности проведения чреспищеводной ЭхоКГ антикоагулянтная подготовка (при впервые назначенных антикоагулянтах) должна продолжаться не менее 3 нед (как это делали до недавнего времени). При этом следует помнить о сохранении угрозы «нормализационной» тромбоэмболии.
В настоящее время кроме ЭИТ и медикаментозной терапии для устранения постоянной МА, рефрактерной к медикаментозной терапии и сопровождающейся симптомами хронической сердечной недостаточности, ишемией миокарда и тяжелой субъективной симптоматикой, используют радиочастотную (или крио) аблацию эктопических центров в области устьев легочных вен (см. выше). Эффективность метода (стойкое прекращение МА) колеблется
в пределах 60-80%. При наличии внутрипредсердного тромбоза аблацию не проводят.
После восстановления ритма больному продолжают антикоагулянтную терапию с учетом постепенного восстановления сократительной функции предсердий, возможности рецидива МА и наличия коротких, незамечаемых больным, эпизодов МА, которые могут способствовать тромбообразованию в предсердиях. Кроме того, проводят длительную профилактическую антиаритмическую терапию, используя следующие препараты: амиодарон по 200-400 мг/сут, хинидин по 600 мг/сут, дизопирамид* в дозе 200-600 мг/сут, этацизин* по 150 мг/сут, пропафенон по 450-900 мг/сут, дофетилид по 500-1000 мкг/сут, дронедарон* по 200-400 мг/сут.
При невозможности восстановления ритма или отсутствии показаний для его восстановления с целью урежения желудочкового ритма и уменьшения признаков сердечной недостаточности применяют терапию препаратами дигиталиса. Дополнительно назначают р-адреноблокаторы в небольших дозах или антагонисты кальция (верапамил, дилтиазем). Лечение препаратами дигиталиса при тахиаритмической форме МА наиболее целесообразно, поскольку он урежает желудочковый ритм благодаря двум механизмам:
• учащению волн ff, приводящих к затруднению их проведения на желудочки;
• непосредственному торможению предсердно-желудочковой проводимости (наступает позднее).
Сочетание обоих механизмов дает уникальный брадикардитический эффект; к этому следует добавить кардиотоническое действие дигиталиса; р-адреноблокаторы и верапамил действуют лишь на предсердно-желудочковую проводимость и используются как дополнительные средства при недостаточном урежении ритма на фоне препаратов наперстянки или для снижения их дозировки (предупреждения перенасыщения). Кроме того, препараты дигиталиса, урежая ритм, не вызывают резкой аритмии (чередования коротких и длинных сердечных циклов, тягостное для больного), что, напротив, характерно для р-адрено блокаторов.
Вместе с тем препараты дигиталиса, хорошо урежая ритм в состоянии покоя, хуже контролируют его при физической нагрузке. В этом отношении лучше действуют р-адреноблокаторы. В целом, очевидны достоинства комбинации сердечных гликозидов и р-адреноблокаторов (или верапамила). Кроме того, при наличии желудочковой экстрасистолии на фоне МА рациональна комбинация сердечных гликозидов с соталолом (соталексом*) или амиодароном.
Следует подчеркнуть, что терапию, урежающую ритм, при постоянной форме МА проводят практически пожизненно.
В ряде случаев при постоянной форме МА показана имплантация ЭКС:
• наличие у больного периодов асистолии >=3с,илиэпизодовбрадикардиис частотой ритма =<35 в минуту, или полной предсердно-желудочковой блокады (синдром Фредерика), что выявляют обычно при холтеровском мониторировании ЭКГ (при отмене урежающих ритм препаратов);
• возникновение перечисленных нарушений на фоне приема препаратов при необходимости проводить урежающую ритм терапию или подавлять сопутствующую желудочковую эктопию; в таких случаях становится труд-
ным или невозможным адекватный медикаментозный контроль ритма
сердца;
• при некорригируемой медикаментами тахиаритмии проводят деструкцию предсердно-желудочкового узла (радиочастотную аблацию) с одновременной имплантацией ЭКС и навязыванием ритма посредством желудочкового электрода.
Хирургическая модификация (модуляция) предсердно-желудочкового соединения, т.е. создание искусственной неполной предсердно-желудочковой блокады, а также операции типа «коридор» или «лабиринт» широкого применения пока не получили.
Тактика ведения больных с постоянной формой ТП такая же, как и при МА. Обычно ТП легко устраняют с помощью ЭИТ или ЧПЭСС (типичное ТП), после которой у многих больных синусовый ритм может сохраняться в течение длительного времени. Иногда эффект бывает нестойким, и быстро возобновляется исходная аритмия. В таких случаях назначают консервативное лечение.
При стойком, не поддающемся изменению под влиянием препаратов дигиталиса и р-адреноблокаторов, коэффициенте проведения 2\1 (следствием чего служит стойкая тахикардия) или частой смене коэффициента проведения, субъективно тягостных для больного с постоянной формой ТП, надо попытаться дигитализацией или стимуляцией предсердий перевести трепетание в МА, но это удается не всегда. В части случаев возникшая МА быстро сменяется ТП. У таких больных можно попытаться создать искусственным путем (радиочастотная аблация) полную поперечную блокаду с одновременной имплантацией искусственного водителя ритма, стимулирующего желудочки.
В последние годы с успехом (свыше 90% эффективности) применяют катетерную радиочастотную аблацию определенных зон правого предсердия (перешейка и др.), аномальное проведение через которые лежит в основе механизма macroreentry, приводящего к появлению ТП. Этот метод, вероятно, станет основным при терапии ТП.
Профилактика тромбоэмболических осложнений у больных мерцательной аритмией и трепетанием предсердий
Образование внутрипредсердных тромбов, связанное с выпадением сократительной функции предсердий, замедлением внутрипредсердного кровотока, а также, вероятно, протромботическими изменениями в крови - одно из самых серьезных осложнений МА, поскольку угрожает тромбоэмболиями в жизненно важные органы (мозг, почки, селезенку, легкие, артерии нижних конечностей и др.). При ТП риск тромбообразования несколько меньше в связи с сохранением упорядоченного (хотя и частого) сокращения предсердий, однако профилактику тромбоэмболий проводят по тем же принципам, что и при МА.
О принципах назначения антикоагулянтов при плановом восстановлении синусового ритма (медикаментозном, с помощью ЭИТ или радиочастотной аблации) сказано выше. Важно помнить, что принципы профилактики тромбоэмболических осложнений едины как для постоянной, так и для пароксизмальной формы МА. Агрессивность антитромботической терапии определяется соотношением риска тромбоэмболий, с одной стороны, и геморрагических осложнений - с другой.
Наличие клапанного порока сердца (в первую очередь митрального стеноза), протезированных клапанов сердца в сочетании с МА, а также доказанный с помощью чреспищеводной ЭхоКГ внутрисердечный тромбоз делают показания к назначению непрямых антикоагулянтов абсолютными.
У больных с неклапанной этиологией МА, согласно международным рекомендациям по лечению МА (2010), выбор антитромботической терапии проводят по следующим принципам.
• Для оценки риска тромбоэмболий при МА применяется балльная шкала CHADS2: наличие у пациента сердечной недостаточности, АГ, диабета, а также возраст старше 75 лет оценивают в 1 балл (каждый признак), эпизоды тромбоэмболии в головной мозг в анамнезе (с развитием инсульта или транзиторной ишемической атаки) - в 2 балла. При сумме баллов 2 и выше риск тромбоэмболий высок, что требует постоянной терапии непрямыми антикоагулянтами с поддержанием международного нормализованного отношения (МНО) в диапазоне 2,0-3,0. МНО отражает активность плазменных факторов свертывания, оно обратно более традиционному протромбиновому индексу (ПТИ) и рассчитывается с учетом индекса чувствительности реактива, который используют в конкретной лаборатории. Значения МНО, таким образом, не зависят от лаборатории, в которой выполнено исследование.
• При наличии у пациента 1 балла по шкале CHADS2 (Cardiac failure, Hypertension, Age, Diabetes, Stroke - шкала для определения риска сосудистого заболевания) оценивают дополнительные факторы риска - наличие сосудистых заболеваний в анамнезе (ИМ, сочетание атеросклероза аорты и периферических артерий), возраст 65-74 года, женский пол склоняют выбор в пользу непрямых антикоагулянтов.
• Пациентам моложе 65 лет с единственным фактором риска или больным моложе 75 лет без факторов риска профилактику тромбоэмболий проводят с помощью ацетилсалициловой кислоты в дозе 100-300 мг/сут (предпочтительно использование специальных лекарственных форм, покрытых оболочкой, растворяющейся в кишечнике, - аспирина-кардио*, тромбо-
АСС* и др.).
Кроме того, следует учитывать наличие таких факторов, как тиреотоксикоз, выраженная дилатация предсердий, выявление при ЭхоКГ признаков так называемого некомпактного миокарда (двуслойного миокарда), которые также повышают риск тромбообразования.
При редких (один раз в несколько месяцев или лет) пароксизмах МА или ТП у больных без факторов риска антитромботическая терапия может назначаться лишь на несколько дней при развитии очередного пароксизма аритмии (ацетилсалициловая кислота в дозе 0,5 г в сочетании с прямыми антикоагулянтами). То же касается пациентов с высоким риском геморрагических осложнений, имеющих не более одного фактора риска тромбоэмболий.
Одновременно учитывают противопоказания (абсолютные и относительные) к назначению антитромботических препаратов: язвенная болезнь желудка и двенадцатиперстной кишки в фазе обострения или нестойкой ремиссии (ФГДС проводят в обязательном порядке), неспецифический язвенный колит, болезнь Крона (БК) или геморрой в фазе обострения, злокачественные опухо-
ли, лейкозы, геморрагические диатезы, кровоизлияние в мозг или в сетчатку в анамнезе, подозрение на расслаивающуюся аневризму аорты.
С осторожностью следует назначать антикоагулянты больным с плохо корригируемой АГ, печеночной и почечной недостаточностью, хронической алкогольной интоксикацией, геморрагическими осложнениями антикоагулянтной и антиагрегантной терапии в анамнезе, а также пациентам с любым тяжелым заболеванием (особенно при неясном диагнозе).
У больных старше 75 лет одновременно с повышением риска развития тромбоэмболий (особенно у женщин) возрастает риск развития геморрагических осложнений терапии, в связи с чем МНО необходимо поддерживать на уровне 2,0.
Лечение антикоагулянтами или антиагрегантами при МА и ТП проводят пожизненно.
При высоком риске как тромбоэмболических, так и геморрагических осложнений альтернативой назначению непрямых антикоагулянтов может стать имплантация в ушко левого предсердия специального устройства, которое закрывает его (подобно зонтику) и препятствует выходу тромбов в системный кровоток. Риск тромбоэмболий также значительно снижается в том случае, если во время операции на открытом сердце (как правило, это протезирование митрального клапана) проведены ушивание или полная резекция ушка левого предсердия.
Прогноз
Прогноз при пароксизмальной форме МА зависит от частоты возникновения и длительности приступов, которые на фоне органического поражения сердца могут привести к появлению признаков нарушения кровообращения (вплоть до приступа сердечной астмы). Короткие пароксизмы мерцания прогностически не являются неблагоприятными. При постоянной форме МА прогноз обусловливается влиянием аритмии на кровообращение: у ряда лиц нарушения гемодинамики не происходит и они могут выполнять физическую работу, однако чаще развивается выраженная в различной степени сердечная недостаточность.
Большую опасность представляют тромбоэмболические осложнения, в связи с чем необходимо обязательное соблюдение рекомендаций по их антикоагулянтной профилактике, приведенных выше.
Первичная профилактика МА сводится, помимо соблюдения режима труда и отдыха, отказа от алкоголя и курения, к назначению антиаритмических препаратов при упорной предсердной экстрасистолии у больных с увеличенным левым предсердием (при пороках сердца, ИБС, кардиомиопатиях и др.). При пороках сердца следует своевременно решать вопрос о хирургическом лечении.
ПРЕДСЕРДНО-ЖЕЛУДОЧКОВАЯ БЛОКАДА Этиология
Предсердно-желудочковая блокада возникает у больных с воспалительными, дегенеративными и инфильтративными заболеваниями миокарда, при ИМ
или кардиосклерозе, при болезни Ленегра и болезни Лева (прогрессирующий склероз и обызвествление кольца митрального клапана, мембранозной части межжелудочковой перегородки, основания клапана аорты). Определенную роль играет повышение тонуса блуждающего нерва (рефлекторное и медикаментозное).
Патогенез
Ухудшение предсердно-желудочковой проводимости может происходить на уровне предсердно-желудочкового узла и ствола предсердно-желудочкового пучка (пучка Гиса) (интранодальный блок) и ниже его, в системе ножек пучка Гиса (инфранодальный блок).
При интранодальном блоке может происходить простое замедление предсердно-желудочковой проводимости (неполная предсердно-желудочковая блокада I степени); в более далеко зашедших случаях не все импульсы доходят до желудочков (неполная предсердно-желудочковая блокада II степени).
При предсердно-желудочковой блокаде II степени наблюдают следующие изменения ЭКГ:
• тип Мобитц I - прогрессирование парабиотического торможения в предсердно-желудочковой системе с нарастающим удлинением интервала PQ и, наконец, блокировкой очередного импульса и отсутствием возбуждения желудочков (выпадение желудочкового комплекса QRS), затем следует пауза, в течение которой проводимость в предсердно-желудочковой системе улучшается, величина интервала PQ возвращается к норме, а затем цикл повторяется (периоды Самойлова-Венкебаха);
• тип Мобитц II - после проведения одного импульса через предсердножелудочковую систему последняя «погружается» в состояние торможения, так что следующий импульс (или два следующих импульса) не проходит к желудочкам - неполная предсердно-желудочковая блокада с коэффициентом проведения 2\1 или 3\1. Наконец, возможна полная предсердножелудочковая блокада III степени, которая, однако, при интранодальном блоке наблюдается нечасто и бывает, как правило, нестойкой.
При инфранодальном блоке синусовый импульс проходит через предсердия, предсердно-желудочковую систему (предсердно-желудочковый узел и ствол пучка Гиса) и блокируется в системе ножек пучка Гиса.
В момент возникновения полной предсердно-желудочковой блокады может наступить остановка сердца (преавтоматическая пауза) до тех пор, пока функцию водителя ритма не возьмет на себя какой-либо центр автоматизма третьего порядка, лежащий ниже места блока, - гетеротопный водитель ритма.
Если преавтоматическая пауза затягивается, больной может погибнуть. Чем ниже располагается гетеротопный водитель ритма, тем медленнее идиовентрикулярный ритм (от 50 до 30-25, при его локализации в нижних отделах желудочков).
Редкий ритм влечет за собой гемодинамические расстройства, снижение перфузии жизненно важных органов. Кроме того, при полной предсердножелудочковой блокаде возможна одновременная активация не одного, а нескольких центров желудочкового автоматизма; интерференция их деятельно-
сти может привести к фибрилляции желудочков и смерти больного. Возможна остановка одиночного водителя ритма, что приводит к асистолии и даже к смерти больного. В обоих случаях возникает картина так называемого синдрома Морганьи-Адамса-Стокса (соответственно гипердинамического и гиподинамического характера).
Клиническая картина
При предсердно-желудочковой блокаде I и II степени с периодами Самойлова-Венкебаха никаких клинических проявлений обычно не наблюдается. Врач должен, однако, следить за больным и его ЭКГ, так как возможны углубление блокады и переход ее в полную блокаду.
На первом этапе диагностического поиска при полной предсердножелудочковой блокаде (и неполной блокаде II степени с коэффициентом проведения 2\1, 3\1) выявляют жалобы на редкое сердцебиение, головокружение, слабость, головные боли, иногда приступы стенокардии, одышку. Эти жалобы обусловлены нарушением кровоснабжения мозга и сердца. Больные могут отмечать эпизоды потери сознания (синдром Морганьи-АдамсаСтокса).
В анамнезе следует выявлять признаки основного заболевания, а также все относящиеся к предсердно-желудочковой блокаде: давность появления редкого пульса, прямые признаки блокады (ранее регистрировавшиеся ЭКГ), проводившееся лечение и его эффективность.
На втором этапе, кроме данных, обусловленных основным заболеванием, выявляют симптомы, обусловленные самой предсердно-желудочковой блокадой:
• при аускультации определяют брадикардию с правильным или неправильным ритмом; «пушечные» тоны сердца (при совпадении предсердных сокращений с желудочковыми);
• возможен резкий подъем систолического АД (иногда до 200-300 мм рт.ст.) при атеросклерозе аорты, связанный с увеличением ударного выброса, объясняемым большой диастолической паузой и гемодинамическим «ударом» (не компенсируемым растяжением аорты вследствие потери ею эластических свойств).
Может наблюдаться сердечная недостаточность, обусловленная как основным заболеванием, так и самой предсердно-желудочковой блокадой (обычно сердечная недостаточность развивается при значительном снижении ЧСС - ниже 30 в минуту).
Окончательный диагноз предсердно-желудочковой блокады ставят на третьем этапе, после проведения ЭКГ. Суточное мониторирование ЭКГ позволяет:
• оценить максимальную степень предсердно-желудочковой блокады, брадикардии;
• зафиксировать эпизоды преходящей предсердно-желудочковой блокады, оценить их связь с приемом медикаментов, временем суток, другими факторами;
• уточнить показания к установке ЭКС.
Весьма важно выявление желудочковой эктопии (экстрасистолии), которая может стать предшественником фибрилляции желудочков.
Кроме ЭКГ проводят лабораторно-инструментальные исследования, позволяющие уточнить диагноз основного заболевания.
Наиболее серьезным осложнением полной предсердно-желудочковой блокады служит синдром Морганьи-Адамса-Стокса: внезапная потеря сознания, остановка сердечной деятельности и дыхания, цианоз, судороги. На ЭКГ отмечается фибрилляция желудочков или асистолия. Приступ может закончиться спонтанным восстановлением ритма или смертью больного. Приступу Морганьи-Адамса-Стокса может предшествовать желудочковая экстрасистолия на фоне полной предсердно-желудочковой блокады или прогрессирующее замедление идиовентрикулярного ритма.
Лечение
Возможно консервативное (медикаментозное) и хирургическое (имплантация ЭКС) лечение.
При консервативном лечении применяют холинолитики (атропин, белла- донна*), р-адреномиметики (норэпинефрин, эфедрин), нифедипин, теофиллин. Холинолитики и симпатомиметики могут улучшать предсердно-желудочковую проводимость, учащать идиовентрикулярный ритм, однако действие их обычно слабое и недостаточно эффективное, в связи с чем в настоящее время их используют на этапе перед имплантацией ЭКС.
Необходима также этиотропная терапия, если есть основание предполагать, что блокада вызвана каким-либо заболеванием сердца (чаще миокардит, ИМ).
Учащающая стимуляция сердца с помощью ЭКС может быть временной (путем трансвенозного введения электрода в сердце) или постоянной (установка ЭКС на длительный срок с подшиванием аппарата в мышечном ложе или подкожной клетчатке и фиксацией электродов в сердце).
Во всех современных стимуляторах предусмотрен режим работы «по требованию» (включение ЭКС при возникновении асистолии или снижении ЧСС ниже заданного предела), это очень важно, если учесть возможность спонтанного восстановления ритма и нежелательность интерференции двух ритмов - собственного и стимулятора, что чревато возникновением серьезных осложнений вплоть до фибрилляции желудочков. Предпочтительна имплантация двухкамерного стимулятора с расположением электродов в правом предсердии и желудочке, что обеспечивает сохранность естественной последовательности сокращения камер сердца и сохранность гемодинамики.
Предсердно-желудочковая блокада I степени, даже остро возникшая, не требует специальной терапии. Проводят лечение основного заболевания и более осторожно назначают медикаменты, угнетающие предсердно-желудочковую проводимость (контроль ЭКГ).
Предсердно-желудочковая блокада II степени типа Мобитц I (с периодами Самойлова-Венкебаха) требует в случае острого развития назначения прежде всего этиотропной терапии. С целью профилактики ее дальнейшего углубления возможно применение холинолитиков и симпатомиметиков: атропин по 8-10 капель 0,1% раствора 4-6 раз в сутки, изопреналин по 2,5 мг
4-6 раз в сутки. В случаях остро возникшей блокады можно назначать преднизолон 20-30 мг/сут и более. Иногда эти средства устраняют и периоды Самойлова-Венкебаха при остро возникшей блокаде. При хроническом течении специальной терапии не требуется, показано наблюдение.
«Свежая» предсердно-желудочковая блокада II степени типа Мобитц II требует срочной госпитализации ввиду вероятных нарушений гемодинамики и опасности прогрессирования (перехода в полную блокаду); может встать вопрос об имплантации ЭКС. Хроническое течение таких блокад встречается редко, чаще вскоре развивается полная предсердно-желудочковая блокада, в связи с чем, не дожидаясь ее появления, больным имплантируют ЭКС.
При предсердно-желудочковой блокаде III степени, обнаруженной впервые, необходима госпитализация и, как правило, срочная имплантация
ЭКС.
Полная предсердно-желудочковая блокада на уровне АВ-системы (интранодальная) с относительно частым ритмом из ствола пучка Гиса нередко проходит сама (при ИМ, интоксикации сердечными гликозидами). В случае ее сохранения показано внутривенное введение р-адреномиметиков: изопреналин (изадрин*), эфедрина. Атропин обычно неэффективен. В острых случаях назначают преднизолон по 20-30 мг/сут и более внутрь (или внутривенно 90- 180-300 мг и более). Вопрос об имплантации постоянного ЭКС решают индивидуально.
При остро возникшей блокаде возможна временная (трансвенозная) установка наружного ЭКС. Временную стимуляцию налаживают и при угрозе возникновения полной предсердно-желудочковой блокады (прогрессирующая предсердно-желудочковая блокада; предсердно-желудочковая блокада III степени с ЧСС менее 40 в минуту; предсердно-желудочковая блокада II степени типа Мобитц II; предсердно-желудочковая блокада II степени типа Мобитц I при переднем ИМ; остро развившаяся двухпучковая блокада).
Асимптомная хроническая предсердно-желудочковая блокада III степени с ЧСС выше 40 в минуту служит относительным показанием к установке постоянного ЭКС, однако пытаться устранять ее медикаментозно не следует, так как ее неизбежный возврат может сопровождаться длительной преавтоматической паузой.
Следует отметить, что выраженная дисфункция миокарда с застойной сердечной недостаточностью, некорригированные пороки сердца служат относительным противопоказанием к установке постоянного ЭКС, который сам по себе способствует развитию сократительной дисфункции миокарда (синдром кардиостимулятора). Это связано с нарушением естественной последовательности возбуждения при работе ЭКС (с развитием систолы желудочков при открытых предсердно-желудочковых клапанах и ретроградным забросом крови).
Среди других проявлений синдрома - быстро возникающая усталость при физической нагрузке, обусловленные низким минутным объемом неврологические расстройства (головные боли, головокружения), аритмии, ощущение пульсации. Путем перепрограммирования ЭКС часть симптомов устраняют.
При инфранодальной блокаде с целью учащения ритма используют р-адреномиметики: изопреналин (изадрин*) по 2,5 мг 5-6 раз в день.
Имплантацию ЭКС производят по следующим показаниям:
• приступы Морганьи-Адамса-Стокса;
• снижение ЧСС ниже 40 в минуту;
• наличие периодов асистолии >=3 с, даже одиночных (выявляются обычно при холтеровском мониторировании ЭКГ);
• прогрессирующие нарушения гемодинамики или коронарного кровообращения;
• признаки активации конкурентных идиовентрикулярных центров;
• высокое систолическое АД, приводящее к тягостной субъективной симптоматике (сильные головные боли);
• расширение комплекса QRS - более 0,14 с;
• бифасцикулярная блокада, обусловленная сочетанием полной блокады правой ножки пучка Гиса и задней ветви левой ножки пучка Гиса;
• предсердно-желудочковая блокада II или III степени с нарушениями ритма, требующими назначения антиаритмиков, которое ввиду предсердножелудочковой блокады невозможно.
В реальной клинической практике всем больным с предсердно-желудочковой блокадой II степени типа Мобитц II и предсердно-желудочковой блокадой III степени имплантируют ЭКС.
Приступы Морганьи-Адамса-Стокса служат показанием к реанимационным мероприятиям: непрямой массаж сердца, искусственное дыхание, срочная дефибрилляция или стимуляция сердца (в зависимости от причины приступа) с последующим внутривенным введением 5% раствора гидрокарбоната натрия, изопреналина (изадрин), установкой пейсмекера и т.д.
Прогноз
При предсердно-желудочковой блокаде I степени прогноз благоприятный. При предсердно-желудочковой блокаде степени прогноз при своевременной диагностике и установке ЭКС относительно благоприятен и определяется основным заболеванием.
Профилактика
Основное направление профилактики - активное лечение заболевания, приводящего к нарушению проводимости.
СИНДРОМ СЛАБОСТИ СИНУСОВОГО УЗЛА
Понятие «синдром слабости синусового узла» (СССУ) впервые введено в 1965 г. американским кардиологом B. Lown.
СССУ объединяет в себе целый ряд нарушений сердечного ритма, патогенетически обусловленных:
• снижением функциональной способности синусового узла с брадикардией или брадиаритмией;
• наличием сопутствующих эктопических аритмий. СССУ может быть вызван:
• органическим поражением синусового узла и окружающих его тканей;
• угнетением активности синусового узла, обусловленным нарушением регуляции его деятельности, к чему приводят обычно нарушения вегетативного тонуса с превалированием вагусных реакций; при этом обычно говорят о вегетативной дисфункции синусового узла (ВДСУ).
Этиология
Органическое поражение синусового узла бывает обусловлено склеротическими и фибротическими процессами, в основе которых лежат:
• ИБС (атеросклеротический и постинфарктный кардиосклероз, ишемическая миокардиодистрофия);
• миокардиты и постмиокардитический кардиосклероз;
• кардиомиопатии;
• миокардиодистрофии (эндокринные, алкогольная, токсические);
• болезни накопления (амилоидоз, гемохроматоз);
• идиопатическая дегенеративная болезнь с заменой миокарда предсердий фиброзной тканью.
Возможно и повреждение ткани синусового узла во время кардиохирургических операций. Острое развитие СССУ может быть проявлением тромбоза или эмболии артерии синусового узла.
ВДСУ возникает при психовегетативных нарушениях, нередко в рамках НЦД у больных, конституционально стигматизированных - в частности, при синдроме мезенхимальной дисплазии (см. выше).
Патогенез
Угнетение функции синусового узла или нарушение синоатриальной проводимости приводит к брадикардии, остановкам ритмической деятельности синусового узла (периодам асистолии). Уже одно это (при значительной выраженности брадикардии) приводит к гипоперфузии тканей (кардиальной, церебральной, почечной и т.д.) с симптомами их недостаточности. Кроме того, нередко на фоне брадиаритмии активизируются гетеротопные очаги автоматизма, что приводит к экстрасистолии, возникновению так называемых «заместительных» ритмов (предсердному, предсердно-желудочковому, идиовентрикулярному), миграции водителя ритма по предсердиям. Иногда эта активация приводит к появлению тахиаритмий - приступов МА или ТП, ПТ. В этих случаях говорят о синдроме брадикардии-тахикардии. Наконец, на смену брадиаритмии может приходить постоянная форма МА.
СССУ может возникать в любом возрасте. ВДСУ чаще встречается у подростков и в юности, органическое поражение синусового узла более свойственно людям среднего, пожилого и старческого возраста.
Можно выделить следующие клинические варианты СССУ:
• минимальные клинические проявления (на ЭКГ не выявляются длительные паузы и тахиаритмии, течение относительно благоприятное);
• брадиаритмический вариант (появляются клинические симптомы, перечисленные выше и обусловленные гипокинетическим состоянием кровообращения, вплоть до приступов Морганьи-Адамса-Стокса);
• тахи-брадиаритмический вариант:
- с преобладанием тахиаритмий (преимущественно наджелудочковых) и наличием пауз «на входе» в тахикардию и «на выходе» из нее;
- с одинаковой выраженностью тахи- и брадиаритмий (тахиаритмии приобретают затяжной характер в связи с опасностью их купирования);
• с исходом в постоянную форму МА, которая носит характер замещающего ритма (не всегда характерна брадисистолия при МА, СССУ выявляется по данным анамнеза).
По мере прогрессирования СССУ у больных с его органическим поражением один вариант может сменяться другим: первый - вторым - четвертым, второй - третьим - четвертым. При ВДСУ прогрессирования клинических проявлений обычно не происходит.
Клиническая картина
На первом этапе диагностического поиска уточняют варианты клинического течения, что характеризуются соответствующей клинической картиной.
• Для I варианта СССУ обычно характерны клинические проявления психовегетативных расстройств; сам СССУ у этих больных не дает клинической симптоматики. Отмечающиеся у таких больных слабость, обмороки, неприятные ощущения в области сердца связаны с вегетативной дисрегуляцией (вазовагальными реакциями) и устраняются соответствующей терапией. Как при этом, так и при других вариантах обращают внимание на семейный анамнез (аналогичная симптоматика и конституциональные особенности).
• При II варианте СССУ жалобы в основном обусловлены органной гипоперфузией: церебральной (астения, слабость, головокружение, снижение памяти, ощущение дурноты и «обмороки»), кардиальной (одышка и другие признаки хронической сердечной недостаточности, стенокардия), гастроинтестинальной (вздутие живота, запор), почечной (олигурия), периферической (тяжесть в ногах, боли в икрах). Сама брадиаритмия обычно не ощущается. При асистолии характерны эпизоды «провалов в памяти», «проглатывания слов» и далее вплоть до эпизодов полной потери сознания на фоне асистолии (синдром Морганьи-Адамса-Стокса) с падением, ушибами, травмами.
• При III варианте течения СССУ к указанным жалобам и особенностям анамнеза присоединяются указания на приступы сердцебиения. Для III А варианта типичны лишь жалобы на эти приступы, однако больные могут указывать (иногда при направленном опросе) на чувство «замирания» в груди, потемнения в глазах при «входе» в приступ или сразу после его окончания. Иногда они прямо говорят о чувстве остановки сердца в этих обстоятельствах. При III Б варианте одна (брадиаритмическая) тягостная симптоматика сменяется другой (тахиаритмической).
• IV вариант СССУ характеризуется жалобами и анамнезом, свойственными МА; указание на брадиаритмию до появления МА бывает далеко не всегда.
Как и при других аритмиях, следует расспрашивать больного о динамике заболевания, лечении, его эффективности и переносимости. Иногда больные
прямо указывают на рекомендации предыдущих врачей имплантировать ЭКС. Всегда достаточно тщательно расспрашивают о заболеваниях сердца в анамнезе, перенесенных инфекциях (дифтерии, гриппе, ангинах и т.п.).
На втором этапе диагностического поиска, как правило, выявляются брадиаритмия той или иной степени выраженности, нередко экстрасистолия; в какой-то момент возможна фиксация приступа тахикардии. Естественно, при осмотре особое внимание обращают на признаки заболевания, могущего быть фоном для развития СССУ.
В целом, результаты второго этапа обследования дают немного информации. К попыткам спровоцировать в целях диагностики быстрое усугубление брадиаритмии (проба Вальсальвы, массаж каротидного синуса) не следует прибегать - это небезопасно для больного.
Третий этап диагностического поиска, как правило, является решающим для верификации диагноза и определения терапевтической тактики. Уже обычная ЭКГ может выявить характерные признаки СССУ. Нередко обнаруживают нарушения внутрисердечной проводимости - предсердно-желудочковую блокаду, блокаду ножек пучка Гиса, что объясняют при воспалительнодегенеративных процессах антигенно-тканевой однородностью всей проводящей системы с иммунным поражением на всем ее протяжении, а при ИБС - единством васкуляризации синусового и предсердно-желудочкового узла.
Однако наиболее информативно суточное мониторирование ЭКГ, при котором обычно фиксируют «набор» сочетаний нарушения ритма и проводимости, характерный для СССУ.
Диагностически информативны:
• постоянная синусовая брадикардия с ЧСС менее 45-50 в минуту;
• интервалы между синусовыми P более 2,0-2,5 с (синусовые паузы), в том числе после экстрасистолы, приступа тахикардии;
• повторные эпизоды СА-блокады II степени.
Одновременно могут фиксироваться «замещающие» ритмы, миграция водителя ритма, эпизоды тахиаритмий. Важно соотнести периоды особенно выраженной брадиаритмии (в частности, паузы более 3 с) с жалобами больного на потемнение в глазах, дурноту.
Иногда, при отсутствии на суточном мониторировании ЭКГ признаков СССУ, у больных с обмороками неясного генеза признаки дисфункции синусового узла выявляются лишь с помощью петлевого рекордера (многомесячная регистрация ЭКГ).
После выявления ЭКГ-признаков СССУ следует исключить (или подтвердить) их вегетативную обусловленность. Самым простым, но и малоинформативным тестом служит физическая нагрузка с неадекватным (менее 90 в минуту) учащением ЧСС; можно попытаться участить ритм введением ваголитика - атропина (у здоровых людей ритм учащается на 30% и более).
Более информативной, однако, служит ЧПЭСС, с помощью которой проводят ЭФИ функции синусового узла. Учитывают время восстановления функции синусового узла (ВВФСУ) после отключения кардиостимулятора вслед за периодом навязанной стимулятором тахикардии (обычно около 150 сердечных сокращений в минуту). ВВФСУ не должно превышать 1500 мс. Более информативно корригированное ВВФСУ (разница между ВВФСУ и средним
интервалом RR до стимуляции), которое не должно превышать 560-540 мс. С помощью ЧПЭСС можно определить также время синоатриальной проводимости.
Весьма информативны для исключения органической природы СССУ результаты пробы с медикаментозной денервацией. После обычной ЧПЭСС больному вводят внутривенно пропранолол в дозе 0,2 мг/кг массы тела со скоростью 1 мл/мин и спустя 10 мин - атропин в дозе 0,04 мг/кг массы тела за 2 мин. Полная вегетативная блокада наступает спустя 2 мин и удерживается 30 мин. Частота синусового ритма в это время отражает степень автоматизма синусового узла вне вегетативных влияний. В эти полчаса повторяют ЧПЭСС; при нормализации ВВФСУ и корригировании ВВФСУ очевидна вегетативная природа СССУ в рамках ВДСУ, что делает прогноз более благоприятным и дает возможность отказаться от имплантации ЭКС.
Как и при всех нарушениях ритма и проводимости, при СССУ на третьем этапе диагностического поиска проводят весь комплекс лабораторноинструментальных исследований, направленный на выявление характера и особенностей основного заболевания.
Лечение
Терапия СССУ может быть консервативной и хирургической.
При I варианте течения СССУ лечение должно быть направлено у большинства больных на нормализацию состояния нервной системы, особенно вегетативного тонуса. Назначают (непостоянно) седативные средства, вегетотропные препараты (эффективен клоназепам по 0,5-1 мг 1-2 раза в сутки); иногда достаточно назначения препарата белладонны по 1 драже 3 раза в день. Специальной учащающей ритм терапии, как правило, не требуется.
При II варианте течения СССУ учащение ритма необходимо. При маломанифестных, начальных формах, когда брадиаритмия не достигает критических значений, назначают атропин в каплях 4-5 раз в день, изопреналин (изадрин*) в таблетках (по 2,5 мг 4-6 раз в день), аминофиллин (эуфиллин*) по 0,15 г 2 раза в сутки (лучше теофиллин (теопэк*)), нифедипин (коринфар*) 30-40 мг/сут, используя их тахикардитический эффект. При выраженной клинической симптоматике, особенно церебральной («обмороки» в момент асистолии), тем более при приступах Морганьи-Адамса-Стокса, показана имплантация ЭКС. Показанием к этому служат также наличие на ЭКГ пауз >2,5-3 с, а при ЧПЭСС - продолжительность ВВФСУ >3500 мс, корригированное ВВФСУ >2300 мс. Более оправдана предсердная электростимуляция (при сохранении предсердножелудочковой проводимости), а при невозможности ее осуществления - двухкамерная или желудочковая.
При III варианте течения СССУ показана имплантация ЭКС. Консервативная терапия у таких больных малоэффективна, тем более что средства, учащающие ритм (теофиллин (теопэк), нифедипин, изопреналин (изадрин*), белладонна), могут спровоцировать усугубление тахиаритмий, и напротив, антиаритмическая терапия может усугублять брадикардию. Иногда до имплантации ЭКС такую сочетанную терапию назначают (в качестве антиаритмических препаратов применяют аллапинин или дизопирамид, учащающие синусовый
ритм), используя небольшие («половинные») дозы, однако эффект ее, как было указано, оказывается недостаточным.
При IV типе течения СССУ (постоянная форма МА) восстановление синусового ритма не показано, если известно, что МА развилась на фоне предшествующего СССУ - рецидив МА при этом неизбежен в ближайшее время. В случае если сведений о характере ритма до появления МА нет (что бывает гораздо чаще) и наличие СССУ становится очевидным уже после устранения МА, проводят терапию антиаритмическими препаратами в малых дозах, избегая назначения антиадренергических средств (амиодарон, соталол), одновременно назначая малые дозы теофиллина, нифедипина. Обычно вскоре МА рецидивирует. Ее лечение проводят обычными средствами, избегая назначения амиодарона, соталола (возможность, хотя и минимальная, ненужного восстановления синусового ритма). Обязательно назначение антикоагулянтов.
Предсказать эволюцию СССУ до устранения МА (не имея анамнестических данных) очень трудно. Наличие у больных с предшествующим СССУ редкого желудочкового ритма на фоне МА (ввиду предполагаемого «содружественного» поражения предсердно-желудочкового узла, плохо пропускающего предсердные волны к желудочкам) на деле наблюдают редко. Вообще же появление МА на фоне СССУ до известной степени может рассматриваться как мера «самоизлечения», освобождающая больного от необходимости имплантации ЭКС, хотя, конечно, с возникновением МА развиваются и все свойственные ей отрицательные клинические проявления.
Терапия основного заболевания при СССУ, конечно, необходима, но к обратной динамике симптоматики СССУ она не приводит.
Прогноз при СССУ благоприятен при I варианте течения, при II-IV вариантах прогноз серьезен, особенно при тяжелом поражении сердца.
Имплантация ЭКС улучшает качество жизни, предупреждает внезапную смерть от асистолии или фибрилляции желудочков, однако в целом прогноз определяется основным заболеванием.
Первичная профилактика СССУ - своевременное и адекватное лечение заболеваний, предрасполагающих к его развитию.
ПРИОБРЕТЕННЫЕ ПОРОКИ СЕРДЦА
Порок сердца - давнее, сохранившееся до настоящего времени обозначение врожденного или приобретенного морфологического изменения клапанного аппарата, перегородок сердца и отходящих от него крупных сосудов. В данной главе будут рассмотрены приобретенные пороки сердца - состояния, развившиеся в течение жизни больного в результате заболеваний или травматических повреждений сердца.
Сущность заболевания состоит в том, что в результате укорочения створок клапана (недостаточность) или сужения отверстия (стеноз), часто сочетающихся с изменениями подклапанного аппарата (укорочение и деформация сухожильных хорд и сосочковых мышц), возникают расстройства внутрисердечной гемодинамики с последующим развитием компенсаторной гиперфункции и гипертрофии соответствующих камер сердца. В дальнейшем в результате нарушения сократительной функции миокарда возникают расстройства в том
или ином круге кровообращения. Таким образом, при прогрессировании клапанного поражения пороки сердца закономерно проходят несколько стадий. В связи с этим клиническая картина болезни при одном и том же пороке сердца у разных больных будет существенно различаться.
Наиболее часто встречаются пороки митрального клапана (50-70%, по данным различных авторов), несколько реже - аортального (8-27%).
Изолированные пороки трехстворчатого клапана встречаются не чаще чем в 1% случаев, однако в комбинации с пороками других клапанов поражение данного клапана отмечено примерно у половины больных.
Характер поражения клапана (недостаточность или стеноз отверстия) накладывает отпечаток на течение болезни. Причины развития приобретенных пороков сердца весьма разнообразны, однако наиболее частой из них является ОРЛ у лиц молодого возраста, а также дегенеративные изменения ткани клапана и подклапанного аппарата с включением солей кальция (преимущественно у лиц пожилого возраста).
Название порока включает название пораженного клапана и отражает характеристику самого порока (недостаточность или стеноз отверстия). Перед названием порока указывают его происхождение (этиология), после названия - осложнения и стадию сердечной недостаточности (если она развивается).
В клинической картине заболевания выделяют 2 группы симптомов:
• прямые признаки порока, обусловленные нарушением функционирования клапанного аппарата (так называемые клапанные признаки);
• косвенные признаки порока, обусловленные компенсаторной гипертрофией и дилатацией соответствующих камер сердца, а также нарушением кровообращения в различных сосудистых областях.
Прямые (клапанные) признаки выступают критериями наличия того или иного порока сердца. Их обнаружение позволяет поставить диагноз поражения клапана. Наличие косвенных признаков указывает на тяжесть поражения клапана и степень расстройства гемодинамики. Однако наличие лишь косвенных признаков не дает оснований для постановки диагноза порока сердца.
ПОРОКИ МИТРАЛЬНОГО КЛАПАНА Недостаточность митрального клапана
Недостаточность митрального клапана (митральная недостаточность) - патологическое состояние, при котором створки двустворчатого клапана не закрывают полностью митральное отверстие, и во время систолы желудочков происходит обратный ток крови из левого желудочка в левое предсердие (так называемая митральная регургитация). Это возможно в двух ситуациях.
Во время систолы желудочков происходит неполное смыкание створок митрального клапана вследствие органического их изменения в виде укорочения, сморщивания, что часто сочетается с отложением солей кальция в ткань клапана, а также вследствие укорочения сухожильных хорд. В этом случае говорят о клапанной недостаточности.
Митральная регургитация возникает вследствие нарушения слаженного функционирования митрального «комплекса» (фиброзное кольцо, сухожиль-
ные хорды, сосочковые мышцы) при неизмененных створках клапана. В этом случае говорят об относительной митральной недостаточности.
Относительная митральная недостаточность возникает вследствие разнообразных причин:
• при расширении полости левого желудочка створки митрального клапана не могут полностью закрыть предсердно-желудочковое отверстие;
• створки митрального клапана во время систолы левого желудочка могут прогибаться в полость левого предсердия - синдром пролабирования митрального клапана;
• при дисфункции сосочков мышц в результате их ишемии, кардиосклероза;
• вследствие разрыва сухожильных хорд, соединяющих клапаны с сосочковыми мышцами;
• при кальцинозе клапанного фиброзного кольца, затрудняющем его сужение во время систолы желудочков.
Изолированная митральная недостаточность встречается редко. Значительно чаще она комбинируется со стенозом левого предсердно-желудочкового отверстия (митральным стенозом).
Этиология
Митральная недостаточность может быть вызвана:
• ОРЛ;
• ИЭ;
• дегенеративными изменениями ткани клапана с отложением солей кальция;
• диффузными заболеваниями соединительной ткани (ревматоидный полиартрит, СКВ, склеродермия);
• травматическим отрывом створки клапана.
В последние годы роль ОРЛ как причины развития митральной недостаточности неуклонно падает. Так, по данным Европейского исследования по порокам сердца (2001), ревматическое происхождение митральной недостаточности отмечено в 14,2%, тогда как дегенеративный кальциноз был причиной в 61,3% случаев.
Патогенез
Неполное смыкание створок митрального клапана приводит к возврату части крови из левого желудочка в левое предсердие во время систолы желудочков. В левом предсердии накапливается большее количество крови, в результате чего развивается его дилатация. В левый желудочек также поступает увеличенное количество крови, что обусловливает его дилатацию и компенсаторную гипертрофию. Дополнительное растяжение кровью предсердия ведет к повышению давления в его полости и гипертрофии миокарда. Порок длительное время компенсируется за счет работы мощного левого желудочка. В дальнейшем при ослаблении сократительной функции левого желудочка в полости левого предсердия повышается давление, ретроградно передающееся на легочные вены, капилляры, артериолы. Возникает так называемая венозная («пассивная») легочная гипертензия, приводящая к умеренной гиперфункции и гипертрофии правого желудочка. С ростом давления в малом круге кровообращения и раз-
витием дистрофических изменений в миокарде правого желудочка снижается его сократительная функция, и возникают застойные явления в большом круге кровообращения.
Клиническая картина
Наличие и выраженность признаков определяют клиническую картину порока .
• Прямые или «клапанные» признаки, обусловленные нарушением функции митрального клапана.
• Косвенные или «левосердечные» признаки, обусловленные компенсаторной гиперфункцией левого желудочка и левого предсердия с последующим развитием дилатации и гипертрофии.
• Признаки «пассивной» легочной гипертензии.
• Признаки застойных явлений в большом круге кровообращения.
На первом этапе диагностического поиска в период компенсации порока у больного может не быть никаких жалоб. Больные могут выполнять большую физическую нагрузку, и порок у них часто обнаруживают совершенно случайно (например, во время профилактического осмотра).
При снижении сократительной функции левого желудочка, принимающего участие в компенсации порока и развитии легочной гипертензии, больные жалуются на одышку при физической нагрузке и на сердцебиение. Нарастание застойных явлений в малом круге кровообращения может вызвать приступы сердечной астмы, а также одышку в покое.
У некоторых больных при развитии хронических застойных явлений в легких появляется кашель, сухой или с небольшим количеством мокроты, часто с примесью крови (кровохарканье). При нарастании правожелудочковой недостаточности отмечаются отеки и боль в правом подреберье вследствие увеличения печени и растяжения ее капсулы.
Часто у больных наблюдаются боли в области сердца. Характер болей различен: ноющие, колющие, давящие; связь их с физической нагрузкой не всегда удается обнаружить.
При достаточном количестве жалоб можно сделать вывод лишь о наличии нарушения кровообращения в малом круге, однако о причине этих нарушений (т.е. о наличии порока) можно судить только на следующем этапе диагностического поиска.
На втором этапе диагностического поиска следует, прежде всего, выявить прямые признаки, на основании которых можно поставить диагноз митральной недостаточности: систолический шум над верхушкой сердца в сочетании с ослаблением I тона. Эти симптомы непосредственно связаны с нарушением функционирования митрального клапана: ослабление (иногда полное отсутствие) I тона объясняется отсутствием «периода замкнутых клапанов»: систолический шум возникает вследствие прохождения обратной волны крови (волна регургитации) из левого желудочка в левое предсердие через относительно узкое отверстие между неплотно сомкнутыми створками митрального клапана. Интенсивность систолического шума варьирует в широких пределах и обусловлена обычно выраженностью дефекта клапана. Тембр шума различный: мягкий, дующий или грубый, что может сочетаться с пальпаторно ощутимым
систолическим дрожанием на верхушке. Лучше всего выслушивается шум в области верхушки сердца и более отчетливо в положении больного на левом боку при задержке дыхания в фазе выдоха, а также после физической нагрузки. После приема нитроглицерина шум ослабевает. Систолический шум может занимать часть систолы или всю систолу (пансистолический шум).
При аускультации в случаях резко выраженной митральной недостаточности над верхушкой сердца можно услышать III тон, который появляется вследствие колебаний стенок левого желудочка при поступлении увеличенного количества крови из левого предсердия. Этот III тон всегда сочетается со значительным ослаблением I тона и выраженным систолическим шумом. Иногда III тон может выслушиваться у молодых здоровых людей, но в этом случае I тон звучный, а при наличии систолического шума (обычно функционального происхождения) он нерезко выражен, короткий, мягкого тембра и обычно исчезает при физической нагрузке.
Иногда III тон принимают за «тон открытия митрального клапана» при стенозе митрального отверстия, однако тон открытия митрального клапана обязательно сочетается с усилением I тона и диастолическим шумом (т.е. клапанными признаками митрального стеноза). При незначительно выраженной недостаточности митрального клапана III тон не выслушивается.
На втором этапе диагностического поиска также определяют косвенные признаки, указывающие на выраженность порока сердца и нарушение кровообращения в различных сосудах. К ним относят гипертрофию и дилатацию левого желудочка и левого предсердия, признаки легочной гипертензии и застойных явлений в большом круге кровообращения. Степень увеличения левого желудочка и левого предсердия соответствует степени митральной регургитации. Увеличение левых отделов сердца может быть выявлено при осмотре и пальпации области сердца: смещение верхушечного толчка влево (при значительной дилатации левого желудочка) и вниз, а также при перкуссии (смещение левой границы латерально за счет расширения левого желудочка, а верхней границы вверх за счет дилатации левого предсердия).
При снижении сократительной способности левого желудочка и развитии легочной гипертензии выявляют соответствующие симптомы: акцент II тона над легочной артерией в сочетании с его расщеплением (это объясняется небольшим запаздыванием легочного компонента тона, а также более ранним закрытием аортального клапана вследствие того, что левый желудочек опорожняется через два отверстия). Легочная гипертензия приводит к развитию компенсаторной гиперфункции и гипертрофии правого желудочка, что может обусловить появление пульсации в эпигастральной области (усиливается на высоте вдоха). При выраженных нарушениях кровообращения в малом круге может отмечаться акроцианоз вплоть до развития типичного facies mitralis.
В случае снижения сократительной функции правого желудочка обнаруживают признаки застоя в большом круге кровообращения: увеличение печени, набухание шейных вен, отеки на стопах и голенях. Пульс и АД обычно не изменены.
На третьем этапе диагностического поиска уточняют прямые и косвенные признаки.
ФКГ дает подробную характеристику систолического шума и измененных тонов. Систолический шум возникает вместе с начальными осцилляциями I тона и
занимает всю систолу или большую ее часть, амплитуда кривой шума тем больше, чем более выражена недостаточность клапана. При записи с верхушки сердца в выраженных случаях порока амплитуда I тона значительно уменьшается, I тон может полностью сливаться с систолическим шумом. Интервал QI тон может оказаться увеличенным до 0,07-0,08 с в результате увеличения давления в левом предсердии и некоторого запаздывания закрытия створок митрального клапана.
Лучше записывается III тон с верхушки сердца - в виде 2-4 редких осцилляций. Следует подчеркнуть, что интервал между записью II и III тонов не менее 0,12 с. Это очень важный признак для дифференциации III тона и тона открытия, наблюдаемого при митральном стенозе.
На ЭКГ при данном пороке выявляют весьма различные признаки в зависимости от выраженности клапанного дефекта и степени повышения давления в малом круге кровообращения.
При незначительно и умеренно выраженном пороке ЭКГ может остаться неизмененной. В более выраженных случаях наблюдают признаки гипертрофии левого предсердия:
• появление двухвершинного зубца Р в отведениях I, aVL, V4-V6, причем вторая вершина, отражающая возбуждение левого предсердия, превышает первую, обусловленную возбуждением правого предсердия;
• в отведении V1 резко увеличивается по продолжительности и амплитуде вторая (негативная) фаза зубца Р;
• по мере увеличения степени гипертрофии зубец Р удлиняется и превышает
0,10 с.
Признаки гипертрофии левого желудочка:
• увеличение амплитуды зубца R в отведениях V4-V6 и зубца S в отведениях V -V ;
• в отведениях V4-V6, реже в V1 и aVL сегмент ST снижается, а зубец Т изменяет свою форму (его амплитуда снижается, затем он становится изоэлектричным и, наконец, двухфазным и негативным).
При развитии выраженной легочной гипертензии на ЭКГ появляются признаки гипертрофии правого желудочка в виде увеличения амплитуды зубца R в отведениях V1-V2, и ЭКГ становится характерной для гипертрофии обоих желудочков.
ЭхоКГ выявляет увеличение полости левого предсердия и левого желудочка. Этот метод также выявляет кальциноз митрального клапана. При допплерЭхоКГ определяют прямые признаки порока - заброс струи крови из левого желудочка в левое предсердие во время систолы желудочков. По величине струи регургитации выделяют 4 степени выраженности порока.
• I степень - незначительная - длина струи регургитации до 4 мм (от основания створок митрального клапана).
• II степень - умеренная, струя регургитации равна 4-6 мм.
• III степень - средняя, струя регургитации равна 6-9 мм.
• IV степень - выраженная, струя регургитации более 9 мм.
Наконец, этот метод выявляет величину трансмитрального градиента давления.
При рентгенологическом обследовании обнаруживают увеличение левого предсердия (смещение контрастированного пищевода предсердием по дуге
большого радиуса, выбухание третьей дуги на левом контуре сердца), а также левого желудочка (закругление четвертой дуги на левом контуре сердца, уменьшение ретрокардиального пространства). В случае развития легочной гипертензии отмечается расширение корней легких с нечеткими контурами, сосудами, прослеживаемыми до периферии легочных полей. Увеличение правого желудочка как реакции на повышение давления в легочной артерии выражено обычно нерезко, так как легочная гипертензия при данном пороке не достигает больших степеней.
Течение
Течение недостаточности митрального клапана отличается большим разнообразием. Ни при одном другом пороке не бывает такой вариабельности клинической картины: часть больных, страдающих пороком на протяжении многих лет, переносят большую физическую нагрузку, а другая часть больных страдают выраженной одышкой и тяжелой правожелудочковой недостаточностью. При умеренно выраженной регургитации и отсутствии серьезного поражения миокарда в результате повторных атак ОРЛ больные могут длительное время оставаться трудоспособными. Резко выраженная митральная недостаточность быстро приводит к развитию сердечной недостаточности. В течение порока можно выделить три периода.
• Первый период: компенсация «клапанного» дефекта усиленной работой левого предсердия и левого желудочка. Это длительный период хорошего самочувствия больных и отсутствия симптомов сердечной недостаточности.
• Второй период: развитие «пассивной» (венозной) легочной гипертензии вследствие снижения сократительной функции левых отделов сердца. В этот период появляются характерные симптомы нарушения кровообращения в малом круге в виде одышки (при нагрузке и в покое), кашля, иногда кровохарканья и приступов сердечной астмы. Этот период длится относительно недолго, так как застойные явления в малом круге кровообращения быстро прогрессируют и правый желудочек не успевает приспособиться к новым условиям функционирования.
• Третий период: правожелудочковая недостаточность со всеми характерными симптомами в виде увеличения печени, отеков, повышения венозного давления.
Осложнения
Основные осложнения порока связаны с развитием легочной гипертензии и дилатацией левого предсердия. К ним относятся:
• кровохарканье и отек легких;
• нарушения сердечного ритма в виде фибрилляции предсердий (МА) и суправентрикулярной экстрасистолии;
• тромбоэмболические осложнения (тромбоз левого предсердия с эмболией в почки, мезентериальные сосуды и сосуды головного мозга).
Диагностика
Диагноз митральной недостаточности может быть поставлен при обнаружении прямых (клапанных) признаков порока, подкрепляемых косвенными (при
этом аускультативные симптомы - наиболее важные). Увеличение левого желудочка и левого предсердия - менее яркие симптомы, особенно в начальной стадии порока; они становятся выраженными лишь при прогрессировании порока и длительном его существовании. Значительную помощь оказывает допплеровская ЭхоКГ.
Дифференциальная диагностика
При дифференциальной диагностике митральной недостаточности необходимо иметь в виду следующее.
• У здоровых может выслушиваться функциональный систолический шум над верхушкой сердца, но чаще он определяется над основанием. В отличие от больных с пороком сердца у таких лиц не изменены тоны сердца, нет косвенных признаков порока (увеличение левого предсердия и левого желудочка), шум мягкого тембра изменчив по интенсивности. На ФКГ амплитуда шума невелика, шум начинается позднее, чем при пороке сердца, менее продолжителен, I тон имеет нормальную амплитуду.
• При «митрализации» в течение заболеваний, сопровождающихся резким расширением полости левого желудочка и растяжением фиброзного кольца митрального отверстия (ГБ, постинфарктная аневризма левого желудочка, диффузный миокардит тяжелого течения, ДКМП и пр.), над верхушкой выслушивается систолический шум, обусловленный относительной митральной недостаточностью. Однако, в отличие от порока сердца, при этих заболеваниях отмечают умеренное увеличение левого предсердия, не соответствующее гораздо большей степени увеличения левого желудочка. Кроме того, дифференциации помогает анализ всей клинической картины.
• Систолический шум на верхушке сердца может выявляться при синдроме пролапса митрального клапана. Этот синдром состоит в выбухании створок клапана в полость левого предсердия, что обусловливает регургитацию крови. В отличие от митральной недостаточности, при пролапсе I тон не изменен, в период систолы определяется добавочный тон (мезосистолический щелчок), систолический шум приходится на вторую половину систолы, что отчетливо выявляется на ФКГ; шум этот регистрируется между мезосистолическим щелчком и II тоном. При переходе больного в вертикальное положение или после приема нитроглицерина шум усиливается, в то время как прием р-адреноблокаторов приводит к ослаблению шума. ЭхоКГ окончательно разрешает диагностические трудности, выявляя пролапс митрального клапана.
• Систолический шум над верхушкой сердца может выслушиваться и при других пороках (стеноз устья аорты, трикуспидальная недостаточность).
Лечение
Специальных методов консервативного лечения больных с данным пороком сердца не существует. При развивающейся сердечной недостаточности, а также нарушении сердечного ритма лечение проводят согласно общепринятым методам.
Хирургическое лечение (протезирование митрального клапана) показано при недостаточности митрального клапана III и IV степеней (даже при удовлет-
ворительном состоянии больного), а также при признаках дисфункции левого желудочка (падение сердечного выброса, конечном систолическом размере более 45 мм).
Митральный стеноз
Стеноз левого предсердно-желудочкового отверстия (митральный стеноз) - патологическое состояние, характеризующееся уменьшением площади отверстия митрального клапана в 2-14 раз, что создает препятствие движению крови из левого предсердия в левый желудочек. Митральный стеноз может наблюдаться изолированно или в сочетании с митральной недостаточностью, а также с пороками других клапанов (аортального, трехстворчатого).
Этиология
Чаще всего митральный стеноз выступает следствием ОРЛ. Достаточно часто в анамнезе больных (до 30-50% случаев) не наблюдают явных ревматических «атак», тем не менее сомнений в ревматическом происхождении порока не должно быть.
В последние годы увеличилось количество больных, митральный стеноз у которых служит следствием дегенеративного изменения клапанного аппарата с включением в него солей кальция. Так, по данным Европейского исследования пороков сердца (2001), доля ревматического происхождения митрального стеноза составила 85,4%, митральный стеноз был дегенеративным в 12,5% (причем это ранее не было известным). Две трети больных данным пороком составляют женщины.
Изолированный митральный стеноз регистрируют в 40% случаев среди всех пациентов с ревматическим пороком сердца. В остальных случаях он сочетается с недостаточностью митрального клапана и поражением других клапанов.
Патогенез
Площадь отверстия митрального клапана в норме составляет около 4,5-6 см2. Когда развивается митральный стеноз, кровоток через митральный клапан из левого предсердия в левый желудочек уменьшается и сердечный выброс падает.
При уменьшении площади митрального отверстия давление в левом предсердии увеличивается, чтобы облегчить изгнание крови. Когда площадь митрального отверстия достигает 1 см2, давление в левом предсердии возрастает до 25 мм рт.ст. (в норме не более 5 мм рт.ст.). Подъем давления в левом предсердии ведет к повышению давления в легочных венах и капиллярах. Развивается «пассивная» (венозная) легочная гипертензия, при которой давление в легочной артерии обычно не превышает 50-60 мм рт.ст., поэтому гипертрофия правого желудочка выражена нерезко. Однако у части больных (преимущественно молодых), имеющих «чистый» митральный стеноз, отмечают иной тип легочной гипертензии. В ответ на прогрессирующий рост давления в левом предсердии (часто более 25 мм рт.ст.) и легочных венах возникает активный спазм легочных артериол (рефлекс Китаева). В результате этого давление в легочной артерии возрастает непропорционально повышению давления в левом предсердии - развивается так называемая активная, или легочная, АГ. Легоч-
ные капилляры вследствие спазма легочных артериол как бы «предохранены» от переполнения протекающей кровью, однако это ведет к тому, что в легочной артерии давление возрастает значительно и может в 2-3 раза превышать давление в аорте. В ответ на значительный подъем давления в легочной артерии развивается выраженная гипертрофия правого желудочка. В дальнейшем при снижении его сократительной функции наблюдаются застойные явления в большом круге кровообращения.
Клиническая картина
Клиническую картину заболевания определяют наличие и выраженность следующих признаков:
• прямые («клапанные») признаки, обусловленные нарушением функции митрального клапана. К прямым относят также «левопредсердные» признаки, отражающие реакцию левого предсердия на затруднение кровотока в митральном отверстии;
• косвенные признаки:
- «легочные», обусловленные наличием легочной гипертензии;
- «правожелудочковые», обусловленные реакцией правого сердца на наличие легочной гипертензии;
• признаки застойных явлений в большом круге кровообращения.
На первом этапе диагностического поиска можно не получить значимой для диагноза информации; как правило, компенсация порока обусловлена усиленной работой левого предсердия. Больные не предъявляют никаких жалоб, могут справляться с достаточной физической нагрузкой, внешне производят впечатление вполне здоровых людей.
При повышении давления в малом круге кровообращения (особенно при «пассивной» легочной гипертензии) можно выявить жалобы на одышку при физической нагрузке. Увеличенный приток крови к сердцу при физической нагрузке приводит к переполнению легочных капилляров кровью (митральный стеноз препятствует нормальному оттоку крови из малого круга) и затрудняет нормальный газообмен. При резком подъеме давления в капиллярах возможно развитие приступа сердечной астмы (резкая одышка с выделением пенистой мокроты). У некоторых больных в таких случаях отмечается кашель, сухой или с выделением небольшого количества слизистой мокроты, часто с примесью крови (кровохарканье).
При развитии высокой легочной гипертензии больные предъявляют жалобы на быстро возникающую слабость, повышенную утомляемость. Это обусловлено отсутствием возрастания минутного объема сердца при физической нагрузке (так называемая фиксация минутного объема). Отмечают также усиленные сердцебиения при физической нагрузке.
Значительно реже наблюдаются разнообразные болевые ощущения в области сердца, не имеющие диагностического значения. Чаще всего это ноющие или колющие боли, связи их с физической нагрузкой не отмечено.
При развитии нарушений сердечного ритма (экстрасистолия, фибрилляция предсердий) больные предъявляют жалобы на перебои, приступы сердцебиений.
На основании указанных жалоб больного может возникнуть лишь предположение о пороке сердца, сопровождающемся нарушением легочного крово-
обращения (особенно если речь идет о больном молодого возраста с указаниями в анамнезе на перенесенную ОРЛ).
На втором этапе диагностического поиска следует, прежде всего, выявить прямые признаки, на основании которых можно поставить диагноз митрального стеноза. К ним относятся определяемые при аускультации усиление I тона, диастолический шум, тон открытия митрального клапана. Шум прямо связан с затруднением кровотока через суженный митральный клапан; усиленный I тон обусловлен быстрым сокращением недостаточно наполненного левого желудочка; «тон открытия митрального клапана» объясняют резким движением уплотненных створок митрального клапана в начале диастолы.
При выраженном стенозировании выслушивается шум, занимающий всю диастолу и усиливающийся в пресистоле. В начале диастолы (протодиастола) шум обусловлен усиленным кровотоком через митральное отверстие вследствие увеличенного градиента давления «левое предсердие-левый желудочек», в конце диастолы усиление кровотока объясняется активной систолой левого предсердия.
При развитии фибрилляции предсердий и выпадении активной систолы предсердий пресистолический шум исчезает.
Для умеренного митрального стеноза характерно наличие шума только в начале диастолы (протодиастолический) или в конце ее (пресистолический). Лучше выслушивается «митральная мелодия» над верхушкой сердца; звуковые симптомы значительно усиливаются при положении больного на левом боку с задержкой дыхания в фазе выдоха. Надо иметь в виду, что в этом случае эпицентр шума смещается латерально, поэтому следует искать место наилучшего звучания, а не ограничиваться традиционными местами аускультации. Диастолический шум усиливается при ускорении кровотока через митральное отверстие, что достигается с помощью специальных приемов: подъем нижних конечностей или физическая нагрузка, увеличивающие приток крови к сердцу. Прием нитроглицерина или вдыхание амилнитрита также усиливают диастолический шум, так как эти препараты уменьшают спазм легочных артериол, что способствует увеличению притока крови в левое предсердие.
Диастолический шум имеет эквивалент в виде пальпаторно определяемого «кошачьего мурлыканья» (диастолическое дрожание) над верхушкой сердца.
«Левопредсердные» признаки проявляют себя в виде смещения верхней границы относительной тупости сердца вверх (за счет расширения ушка левого предсердия).
Косвенные признаки («легочные») позволяют диагностировать легочную гипертензию. К ним относят цианоз; акцент II тона над легочной артерией; диастолический шум по левому краю грудины, обусловленный относительной недостаточностью клапана легочной артерии (шум Стилла). Если легочная гипертензия существует продолжительное время, то выявляют «правожелудочковые» признаки: пульсацию в эпигастрии за счет правого желудочка, «сердечный горб», пульсацию в третьем-четвертом межреберьях слева от грудины, при перкуссии правую границу относительной тупости определяют латеральнее (за счет правого предсердия, смещаемого расширенным правым желудочком).
При развитии одного из осложнений - фибрилляции предсердий - во время исследования пульса выявляют соответствующие изменения.
АД обычно не изменено, однако при резко выраженном митральном стенозе отмечается тенденция к гипотензии.
При развитии правожелудочковой недостаточности можно выявить соответствующие симптомы в виде увеличения печени, набухания шейных вен, отеков нижних конечностей.
На третьем этапе диагностического поиска уточняют прямые и косвенные признаки.
«Клапанные» признаки могут быть уточнены с помощью ЭхоКГ, выявляющего изменения движения створок митрального клапана, их утолщение, а также увеличение размеров левого предсердия.
Метод также позволяет определить величину градиента «левое предсердиелевый желудочек», что важно для определения выраженности митрального стеноза. При «легком» митральном стенозе (площадь митрального отверстия >1,5 см2) трансмитральный градиент менее 5 мм рт.ст., при «умеренном» митральном стенозе (площадь митрального отверстия 1,0-1,5 см2) трансмитральный градиент равен 5-10 мм рт.ст., при «тяжелом» (митральное отверстие <1,0 см2) трансмитральный градиент - более 10 мм рт.ст.
Рентгенологическое исследование помогает определить выраженность изменений сосудов малого круга, обусловленных развитием легочной гипертензии. При «пассивной» (венозной) гипертензии отмечают расширение корней легких в виде гомогенной ткани с нерезкими контурами. Иногда от корней в разные стороны отходят линейные тени, прослеживающиеся до периферии легочных полей. При «активной» легочной АГ отмечают выбухание дуги легочной артерии в сочетании с расширением ее ветвей. Это проявляется расширением тени корней с четкими контурами. Мелкие ветви легочной артерии сужены, поэтому наблюдается как бы внезапный обрыв расширенных ветвей вместо постепенного их перехода в более мелкие ветви - симптом «ампутации» корней. При значительной легочной гипертензии развивается аневризма легочной артерии. Рентгенологическое исследование выявляет также увеличение правого желудочка и левого предсердия (контрастированный пищевод отклоняется по дуге малого радиуса).
ЭКГ при митральном стенозе выявляет синдром гипертрофии левого предсердия, аналогичный наблюдаемому при митральной недостаточности. По мере прогрессирования легочной гипертензии появляются признаки гипертрофии правого желудочка:
• отклонение электрической оси сердца вправо в сочетании с депрессией сегмента ST и изменением зубца Т в отведениях II, III, aVF в виде двухфазности (±) или негативности;
• в правых грудных отведениях возрастает зубец R (R/S >1,0), а в левых грудных отведениях возрастает зубец S (R/S <1,0).
ФКГ при митральном стенозе детализирует аускультативные данные: при регистрации ФКГ в области верхушки сердца выявляют увеличение амплитуды I тона, а также добавочный тон в диастоле - тон открытия митрального клапана. Длительность интервала от начала II тона до тона открытия составляет 0,08-0,12 с. Этот интервал (II-QS) укорачивается при прогрессировании стеноза. Другой интервал (Q-I тон) удлиняется по мере роста давления в левом предсердии и достигает 0,08-0,12 с. По мере возрастания степени стеноза, а также
снижения сократительной функции левого предсердия пресистолический шум исчезает, уступая место прото- и мезодиастолическому.
Течение
Характер изменений клинических проявлений митрального стеноза соответствует эволюции гемодинамических расстройств.
• Первый период: компенсация клапанного дефекта осуществляется за счет усиленной работы левого предсердия. В этих случаях порок часто выявляют случайно (во время профилактических осмотров или при обращении к врачу по какому-либо иному поводу). Больные не предъявляют жалоб, однако при обследовании выявляют «клапанные» признаки и несколько менее отчетливо «левопредсердные». Косвенных симптомов («легочных» и «правожелудочковых») не наблюдается, так как нарушений в малом круге кровообращения еще нет.
• Второй период: легочная гипертензия и гиперфункция правого желудочка. Больные предъявляют жалобы на одышку, сердцебиения. При значительной физической нагрузке в результате быстрого повышения давления в легочных капиллярах появляются приступы сильной одышки, кровохарканье и даже отек легких. В этой стадии клиническая картина митрального стеноза наиболее ярко выражена.
• Третий период: правожелудочковая недостаточность с застойными явлениями в большом круге кровообращения. Снижение давления в легочной артерии вследствие правожелудочковой недостаточности приводит к некоторому изменению субъективных ощущений; одышка уменьшается, но появляются жалобы, связанные с застоем в большом круге кровообращения (тяжесть в правом подреберье, отеки, олигурия). Значительное расширение полости правого желудочка при легочной гипертензии может привести к появлению относительной недостаточности трехстворчатого клапана. В подобных случаях отмечают расширение сердца вправо (за счет дилатации правого предсердия), набухание шейных вен, у основания мечевидного отростка выслушивают самостоятельный систолический шум, усиливающийся на высоте вдоха (симптом Риверо-Корвальо). При значительной недостаточности трехстворчатого клапана отмечается пульсация печени.
Осложнения
При митральном стенозе осложнения определяются:
• нарушением кровообращения в малом круге;
• дилатацией некоторых отделов сердца.
К первой группе осложнений относят кровохарканье и сердечную астму. Вторую группу осложнений составляют фибрилляция или ТП, тромбоэмболические осложнения, медиастинальный синдром. Фибрилляция или ТП - следствие развития дистрофических и склеротических процессов в миокарде левого предсердия. Присоединение нарушений ритма ухудшает состояние компенсации, так как из сердечного цикла выпадает активная систола предсердий. - Тромбоэмболические осложнения связаны с образованием тромбов в левом ушке, чему способствует фибрилляция предсердий. Эмболы по-
падают в сосуды головного мозга, в мезентериальные сосуды, сосуды почек, нижних конечностей.
- Тромбоэмболические явления в сосудах малого круга кровообращения - следствие флеботромбоза вен нижних конечностей, чему способствуют застойные явления в большом круге кровообращения и малая физическая активность больных.
- Значительное расширение в размерах левого предсердия может привести к сдавлению расположенных вблизи образований:
сдавление левого возвратного нерва вызывает паралич голосовой связки и осиплость голоса;
сдавление левой подключичной артерии обусловливает различие в наполнении пульса на левой и правой руке;
давление на симпатический нерв может стать причиной анизокории.
Диагностика
Диагноз митрального стеноза может быть поставлен при обнаружении прямых («клапанных») признаков порока, подкрепленных «левопредсердными» признаками. Аускультативные симптомы наиболее важные, именно они позволяют поставить правильный диагноз. Косвенные симптомы («легочные» и «правожелудочковые») не являются обязательными признаками митрального стеноза. Их наличие указывает лишь на существование легочной гипертензии и ее выраженность. Существенную помощь оказывает грамотно проведенное ЭхоКГ.
Трудности в диагностике митрального стеноза возникают в следующих случаях:
• На ранних стадиях течения, когда косвенные симптомы отсутствуют, порок часто не распознается. Такие лица не производят впечатления больных людей, не предъявляют жалоб, поэтому врач ограничивается аускультацией лишь в положении больного стоя. Подозрение на митральный стеноз возникает, если при аускультации (даже при вертикальном положении больного) выявляют усиленный I тон и добавочный тон в диастоле (тон открытия). Эта аускультативная картина заставляет применить весь комплекс приемов, способствующих лучшему выслушиванию диастолического шума (физическая нагрузка, положение больного на левом боку с задержкой дыхания в фазе выдоха, лекарственные пробы).
• При сочетании митрального стеноза с АГ любого происхождения симптоматика в большей степени определяется именно гипертензией (головные боли, головокружения, шум в ушах). Кроме того, при АГ изменяются аускультативные симптомы: уменьшается интенсивность диастолического шума, появляется акцент II тона во втором межреберье справа от грудины. Развивается гипертрофия левого желудочка, выявляемая физическими и инструментальными методами исследования. Подозрение на наличие митрального стеноза возникает при выслушивании усиленного I тона и тона открытия митрального клапана. Диагноз устанавливают при последующей тщательной аускультации с соблюдением всех необходимых правил, а также при ЭхоКГ.
• При недостаточности клапана аорты в небольшом числе случаев диастолический аортальный шум выслушивают только над верхушкой серд-
ца. Однако в отличие от митрального стеноза при аортальной недостаточности не определяется тон открытия, сам шум имеет более нежный тембр (никогда не бывает «рокочущим»), всегда начинается после II тона (тогда как при митральном стенозе - после тона открытия), сочетается с ослаблением II тона. В случае значительного увеличения левого желудочка у больных с аортальной недостаточностью отмечают весьма умеренное увеличение левого предсердия (или оно не изменено).
• У больных с митральным стенозом может наблюдаться патология органов дыхания: хронические неспецифические заболевания с развитием пневмосклероза и эмфиземы легких. В таких случаях одышку, увеличение правых отделов сердца, симптомы правожелудочковой недостаточности расценивают как проявление хронического легочного сердца. Выраженная эмфизема легких затрудняет выслушивание сердца, однако аускультация с соблюдением указанных приемов обеспечивает выявление необходимых симптомов порока.
• Митральный стеноз, осложненный фибрилляцией предсердий, приходится дифференцировать от атеросклеротического кардиосклероза,
также протекающего с нарушениями ритма. Однако в последнем случае одновременно имеются и другие проявления атеросклероза: поражение периферических сосудов, сосудов мозга и аорты, кроме того, отсутствует увеличение левого предсердия и, что самое главное, нет прямых («клапанных») признаков порока.
• Наиболее трудно дифференцировать митральный стеноз от миксомы левого предсердия - доброкачественной опухоли, периодически закрывающей левое предсердно-желудочковое отверстие, что приводит к появлению аускультативной картины, почти неотличимой от митрального стеноза. Однако при миксоме наблюдается резкое изменение аускультативных данных после перемены положения тела. Окончательный диагноз устанавливают с учетом данных ЭхоКГ.
Лечение
Специфических методов консервативного лечения нет. При сердечной недостаточности, а также активной ревматической «атаке» лечение проводят согласно общепринятым принципам.
Митральный стеноз может быть ликвидирован оперативным путем. Операция показана больным с выраженным митральным стенозом («чистым» или преобладающим) при наличии симптомов, ограничивающих физическую активность (одышка при физической нагрузке, начальные и более выраженные признаки правожелудочковой недостаточности). Комиссуротомию следует делать по жизненным показаниям, если у больного имеется выраженная легочная гипертензия с приступами сердечной астмы, кровохарканьем и развитием в ряде случаев отека легкого.
Сочетание митральной недостаточности и митрального стеноза
Существует 3 различных варианта сочетания митральной недостаточности и митрального стеноза.
• Площадь митрального отверстия больше 2 см2 - преобладает митральная регургитация.
• Площадь митрального отверстия 1,5-2 см2 - оба порока выражены в равной степени. Эта ситуация не является частой.
• Площадь митрального клапана менее 1,5 см2 и даже 1 см2 - преобладает митральный стеноз.
В случае преобладания митральной недостаточности выражены признаки увеличения левого желудочка и левого предсердия (при рентгенологическом, ЭхоКГ- и ЭКГ-исследовании). Доминируют «клапанные» признаки митральной недостаточности. Лишь при тщательном выслушивании больного в положении на левом боку с задержкой дыхания в фазе выдоха определяют короткий протодиастолический шум, указывающий на одновременное наличие митрального стеноза.
При равной выраженности обоих пороков отчетливо определяется «синдром регургитации»: систолический шум типичен по локализации, верхушечный толчок усилен, смещен влево и вниз, рентгенологически выявляют увеличение левого желудочка; систолическое расширение левого предсердия. На ЭКГ синдром гипертрофии левого желудочка выражен отчетливо. Наряду с этим выявляют симптомы митрального стеноза в виде длительного протодиастолического шума с типичным тембром и графической конфигурацией на ФКГ; I тон в преобладающем большинстве случаев ослаблен.
Для больных данной группы характерно частое возникновение МА. Легочная гипертензия обычно не выражена.
Если преобладает митральный стеноз, то у больных выражены почти все прямые («клапанные») признаки порока, а также симптомы легочной гипертензии и гипертрофии правого желудочка. Однако в клинической картине имеются признаки, не укладывающиеся полностью в картину митрального стеноза. К ним относятся систолический шум над верхушкой (умеренно выраженный), отсутствие хлопающего I тона. При рентгенологическом обследовании определяют умеренно выраженные признаки увеличения левого желудочка. На ЭКГ - картина гипертрофии обоих желудочков.
Для определения показаний к хирургическому лечению и выбора операции (митральная комиссуротомия или протезирование клапана) проводят инвазивные исследования: зондирование сердца с определением градиента давления «левое предсердие-левый желудочек» и конечного диастолического давления в левом желудочке. Градиент давления увеличен при митральном стенозе, тогда как при митральной недостаточности выявляют увеличение конечного диастолического давления в левом желудочке.
ПОРОКИ АОРТАЛЬНОГО КЛАПАНА Стеноз устья аорты
Стеноз устья аорты (аортальный стеноз - АС) - патологическое состояние, при котором имеется препятствие на пути тока крови из левого желудочка в аорту. Различают 3 формы стеноза устья аорты: клапанный, подклапанный, надклапанный.
• Клапанный стеноз устья аорты обусловлен сращением створок аортального клапана.
• При подклапанном (субаортальном) стенозе клапаны аорты интактны, а препятствие кровотоку создается за счет выраженной гипертрофии выходного отдела левого желудочка. Этот тип порока относится к группе идиопатических кардиомиопатий и рассматривается в соответствующем разделе.
• Наиболее редкая форма порока - надклапанный стеноз, при котором сужение создается циркулярным тяжем или мембраной, располагающейся дистальнее устья коронарных артерий.
Стеноз устья аорты (в данном разделе будет рассматриваться клапанная его форма) может наблюдаться в изолированном виде или в сочетании с аортальной недостаточностью, а также с пороками других клапанов (преимущественно митрального).
Этиология
Стеноз устья аорты у взрослых пациентов может быть обусловлен:
• ОРЛ (ревматизмом);
• врожденным поражением;
• дегенеративными изменениями ткани клапана с включением солей кальция (чаще встречается у лиц старше 60 лет).
Иногда вызывает значительные затруднения решение вопроса об этиологии изолированного стеноза устья аорты с обызвествлением створок клапанов в пожилом возрасте. Длительное течение порока (даже ревматического по происхождению) с последующим кальцинозом створок и наслоением атеросклеротических изменений не позволяет нередко даже при микроскопии выяснить истинную природу поражения. Если стеноз устья аорты сочетается с поражением митрального клапана, то это всегда указывает на его ревматическую этиологию. Тем не менее в последние десятилетия в числе причин стеноза устья аорты доминирует дегенеративный кальциноз (81,9%, по данным Европейского исследования клапанных пороков сердца, 2001), тогда как ОРЛ - всего лишь в 11,2%, а врожденное поражение отмечено в 5,4% случаев.
Патогенез
Стеноз устья аорты создает значительные препятствия для кровотока из левого желудочка в аорту. В связи с этим значительно повышается давление в полости левого желудочка, что приводит к гипертрофии этого отдела сердца. Ни при каком ином приобретенном пороке сердца не развивается столь выраженной гипертрофии миокарда, как при стенозе устья аорты.
В компенсации аортального стеноза принимает участие мощный левый желудочек, поэтому порок длительное время протекает без расстройств кровообращения, при этом показатели сердечного выброса остаются нормальными даже при физической нагрузке (за счет более интенсивной систолы левого предсердия, обеспечивающей хорошее наполнение левого желудочка). При ослаблении сократительной функции левого желудочка развивается его дилатация, что приводит к гемодинамической перегрузке левого предсердия. Повышенное давление из левого предсердия ретроградно передается на легочные
вены и другие сосуды малого круга кровообращения (развивается пассивная легочная гипертензия). Значительной гипертрофии правого желудочка обычно не наблюдают. В дальнейшем появляются застойные явления в большом круге кровообращения.
Клиническая картина
Характерны наличие и выраженность следующих признаков:
• прямые («клапанные») признаки, обусловленные нарушением кровотока через устье аорты;
• косвенные признаки:
- «левожелудочковые», обусловленные компенсаторной гипертрофией;
- «сосудистые», обусловленные снижением сердечного выброса и нарушением кровотока в различных сосудистых областях;
• признаки застойных явлений в малом и большом круге кровообращения.
На первом этапе диагностического поиска в стадии компенсации порока можно не получить никакой важной для диагноза информации: больные не предъявляют жалоб и могут выдержать большую физическую нагрузку, не производя впечатления больных людей. При более выраженном стенозе возможны жалобы, обусловленные нарушением кровотока в разных сосудистых областях: головокружения, головные боли, наклонность к обморокам, чувство дурноты (при ухудшении мозгового кровообращения), сжимающие и давящие боли за грудиной (следствие снижения коронарного кровотока и повышения потребности гипертрофированного миокарда в кислороде).
Все эти жалобы обычно появляются при физической нагрузке различной интенсивности, когда необходимо повышенное кровоснабжение функционирующих органов, но наличие стеноза препятствует увеличению сердечного выброса.
При снижении сократительной функции левого желудочка появляется одышка при физической нагрузке, могут развиться приступы сердечной астмы. Застоем в большом круге кровообращения объясняют жалобы на уменьшение количества мочи, отеки ног, тяжесть в правом подреберье (вследствие увеличения печени).
При возникновении указанных жалоб у лиц молодого возраста можно предположить наличие порока сердца, а у лиц среднего и пожилого возраста - скорее ИБС, тем более, если заболевание проявляется сжимающими и давящими болями в области сердца. Церебральные жалобы позволяют предположить наличие АГ или атеросклероза сосудов головного мозга. Если же у больных в анамнезе были четкие указания на перенесенную ревматическую атаку, то первые симптомы порока обычно возникают через много лет (до 10-15 и более) после нее (в отличие от митрального порока).
На втором этапе диагностического поиска следует, прежде всего, выявить прямые признаки, на основании которых можно поставить диагноз стеноза устья аорты. К ним относится определяемый при аускультации систолический шум во втором межреберье справа от грудины, а также в точке Боткина в сочетании с ослаблением (или исчезновением) II тона; I тон также ослаблен. Систолический шум связан с затруднением кровотока через устье аорты, ослабление II тона обусловлено малой подвижностью ригидных (часто с отложени-
ем солей кальция), сращенных между собой створок клапана аорты. Систолический шум интенсивный, имеет грубый (скребущий или «рокочущий») тембр, хорошо проводится на сосуды шеи. Шум лучше слышен при положении больного на правом боку и задержке дыхания в фазе выдоха, а также после приема нитроглицерина. В области максимальной интенсивности шума тоны наиболее ослаблены.
При умеренно выраженном стенозе в точке Боткина или на верхушке сердца может выслушиваться добавочный тон в систоле - так называемый систолический щелчок (тон «изгнания»). Этот признак указывает на сохранившуюся подвижность створок клапана аорты. Интенсивный шум имеет свой эквивалент в виде систолического дрожания.
Косвенные признаки («левожелудочковые») позволяют судить о степени выраженности стеноза устья аорты. При выраженном стенозе можно определить усиление верхушечного толчка. В периоде компенсации он обычно не смещен или незначительно смещен влево. По мере развития сердечной недостаточности верхушечный толчок увеличивается по площади и смещается влево и вниз, что отражает дилатацию левого желудочка. При перкуссии левая граница сердца смещается кнаружи. Степень увеличения сердца, определяемая перкуторно, прямо зависит от стадии порока: чем больше увеличено сердце, тем более выражен порок и более выражено снижение сократительной функции левого желудочка.
«Сосудистые» симптомы обусловлены снижением сердечного выброса, что выражается в бледности кожных покровов, снижении систолического АД, малом медленном пульсе. Чем выраженнее порок, тем значительнее изменены АД и пульс. Однако у части больных может быть АГ как следствие включения ренин-ангиотензинового механизма в связи с уменьшением почечного кровотока в условиях сниженного сердечного выброса.
При развитии правожелудочковой недостаточности можно выявить соответствующие симптомы в виде увеличения печени, набухания шейных вен, цианоза, отеков нижних конечностей.
После второго этапа диагностического поиска диагноз стеноза устья аорты может быть поставлен с большой уверенностью.
На третьем этапе диагностического поиска уточняют прямые и косвенные признаки порока, а также исключают ряд заболеваний, сходных по своей симптоматике со стенозом устья аорты.
При рентгенологическом исследовании в периоде компенсации порока размеры сердца не увеличены или же незначительно увеличен левый желудочек. С развитием сердечной недостаточности происходит увеличение левого желудочка, затем левого предсердия и, наконец, правого желудочка. Изменения аорты выражаются в постстенотическом расширении ее начальной части. Сильные вихревые движения крови вызывают выбухание стенки аорты, при этом часто наблюдаемые повреждения эластических элементов стенки аорты усиливают аневризматическое выпячивание. В месте расширения аорты выявляют усиленную пульсацию. Она может быть обнаружена и при пальпации в яремной ямке. Отложение извести в ткань клапана можно обнаружить при рентгенографии.
Изменения сосудов малого круга в виде признаков венозной легочной гипертензии выявляют лишь при развитии сердечной недостаточности.
При электрокардиографическом исследовании определяют различной степени выраженности синдром гипертрофии левого желудочка: при умеренно выраженном стенозе и в начальных стадиях болезни ЭКГ может быть не изменена или на ней отмечаются начальные признаки гипертрофии в виде увеличения амплитуды комплекса QRS в отведениях V5-V6. При выраженном пороке появляются изменения конечной части желудочкового комплекса в виде депрессии сегмента ST и негативного зубца Т в отведениях V5, V6, I, aVL. В далеко зашедших случаях на ЭКГ определяют полную блокаду левой ножки пучка Гиса.
При ЭхоКГ обнаруживают утолщение миокарда (задней стенки и межжелудочковой перегородки), деформацию створок клапана аорты и нарушение их подвижности. При дегенеративных изменениях клапана аорты выявляют кальциноз створок, часто сочетающийся с кальцинозом аортального кольца.
ЭхоКГ и допплеровский метод позволяют оценить степень тяжести стеноза устья аорты.
• При легкой выраженности порока (площадь аортального клапана >1,5 см2) средний градиент давления между левым желудочком и аортой <25 мм рт.ст.
• При умеренном стенозе (площадь аортального клапана 1,0-1,5 см2) градиент составляет 25-40 мм рт.ст.
• При тяжелом стенозе (площадь аортального клапана <1,5 см2) градиент составляет >40 мм рт.ст.
ФКГ уточняет данные аускультации, выявляя уменьшение амплитуды II тона, а также I тона и систолический шум ромбовидной формы. Систолический шум начинается через небольшой интервал после I тона и заканчивается до начала II тона. Если максимальная амплитуда шума регистрируется во второй половине систолы, то стеноз устья аорты выражен значительно. Аортальный компонент II тона ослаблен, чего не наблюдается при стенозе устья аорты атеросклеротического происхождения. При выраженном пороке регистрируют парадоксальное расщепление II тона: легочный компонент появляется раньше аортального, интервал между ними на высоте вдоха уменьшается. У части больных на ФКГ регистрируют IV тон сердца - признак гемодинамической перегрузки левого желудочка.
Коронароангиографию проводят лишь при показаниях к хирургическому лечению порока. Цель этого исследования - выяснение состояния коронарного русла, так как у пожилых пациентов, помимо вмешательства на клапане аорты, может возникнуть необходимость в операции на коронарных артериях (стентирование или шунтирование коронарных артерий).
Течение
Динамика клинических проявлений стеноза устья аорты соответствует эволюции гемодинамических расстройств.
• Первый период - компенсация порока усиленной работой левого желудочка. В этих случаях порок иногда выявляют случайно, так как такие больные не предъявляют жалоб. Однако при выраженном стенозе могут быть жалобы, связанные со сниженным сердечным выбросом и нарушением кровотока в отдельных сосудистых областях. У всех больных определяются «клапанные» признаки порока, наличие и выраженность «ле-
вожелудочковых» и «сосудистых» признаков обусловливаются степенью стенозирования устья аорты.
• Второй период - нарушения сократительной функции левого желудочка. Проявляется приступами одышки (часто по ночам в виде сердечной астмы) или приступами стенокардии, также часто возникающими по ночам.
• Третий период - правожелудочковой недостаточности с развитием застойных явлений в большом круге кровообращения. В этот период одышка может несколько уменьшаться за счет «перемещения» застойных явлений в большой круг. Обычно период сердечной недостаточности длится относительно короткое время (1-2 года). Устойчивость нарушений кровообращения - весьма характерный признак данного порока.
Осложнения
Все осложнения порока связаны с нарушением сократительной функции левого желудочка и относительной недостаточностью коронарного кровообращения (в условиях повышенной потребности гипертрофированного миокарда в кислороде). Развивающаяся левожелудочковая недостаточность, по сути, является этапом в развитии порока. Коронарная недостаточность может обусловить развитие ИМ. Нарушения ритма нетипичны для стеноза устья аорты, однако иногда может развиться фибрилляция предсердий.
Часть больных со стенозом устья аорты умирают внезапно. Это больные с бессимптомным течением, а также лица с приступами стенокардии, обмороками, левожелудочковой недостаточностью и выраженными признаками гипертрофии левого желудочка или блокады левой ножки пучка Гиса на
ЭКГ.
Стеноз устья аорты - порок, на фоне которого может развиться ИЭ. Диагностика
Диагноз стеноза устья аорты может быть поставлен при обнаружении прямых («клапанных») признаков. Левожелудочковые и сосудистые признаки не обязательны для постановки диагноза, однако их наличие и степень выраженности указывают на выраженность стенозирования устья аорты.
Трудности в диагностике обусловлены возможностью бессимптомного течения порока сердца и схожестью симптоматики стеноза устья аорты с другими заболеваниями. Они усугубляются еще тем обстоятельством, что при данном пороке косвенные симптомы наблюдаются лишь у 25% больных, а у остальных отсутствуют либо нерезко выражены. В связи с этим врач, не выявляя гипертрофии левого желудочка, изменений пульса и АД, не склонен считать больным человека, не предъявляющего никаких жалоб, несмотря на наличие у него систолического шума и ослабления II тона во втором межреберье справа от грудины и в точке Боткина.
Можно выделить ряд типичных ситуаций, при которых диагностика порока проводится несвоевременно.
• В начальных стадиях порок сердца не диагностируют, так как больные не предъявляют жалоб и не производят впечатления больных людей. Систолический шум во втором межреберье расценивают как функциональный,
а на ослабление II тона не обращают внимания. Однако функциональный систолический шум имеет мягкий, дующий тембр, занимает лишь середину систолы. Второй тон не ослаблен. Шум обычно проводится к верхушке сердца. Возможная причина такого шума - систолическая вибрация растянутого корня аорты.
• У лиц среднего возраста шум расценивают как выражение атеросклероза аорты и диагноз порока сердца не ставится. Ослабление II тона (а тем более его отсутствие) помогает поставить правильный диагноз.
• При сильных загрудинных болях и изменениях на ЭКГ в виде появления негативных зубцов Т в левых грудных отведениях у лиц среднего и пожилого возраста ставят диагноз ИБС (стенокардия покоя или напряжения). Однако стенокардия у таких больных - лишь один из симптомов, а не главное проявление болезни. Обнаружение прямых («клапанных») признаков позволяет правильно интерпретировать жалобы больных. Развивающиеся у больных со стенозом устья аорты мелкоочаговые ИМ также следует расценивать как осложнение порока сердца, но не как самостоятельное заболевание (ИБС).
• У части больных со стенозом устья аорты может наблюдаться АГ, что в сочетании с «сосудистыми» признаками (головные боли, головокружения, наклонность к обморокам) можно расценить как проявление ГБ. Основой дифференциации служит правильный учет первичных симптомов порока (данные аускультации и ЭхоКГ).
• В стадии тотальной сердечной недостаточности яркие симптомы правожелудочковой недостаточности, признаки относительной недостаточности митрального и трехстворчатого клапанов, значительное увеличение сердца, фибрилляция предсердий настолько впечатляют врача, что он не обращает внимания на грубый систолический шум и резкое ослабление II тона. Между тем учет анамнестических данных, анализ особенностей систолического шума, очень часто наблюдаемый на ЭКГ синдром гипертрофии левого желудочка или блокады левой ножки пучка Гиса, позволяют правильно диагностировать стеноз устья аорты.
Лечение
Больных с сердечной недостаточностью, развивающейся при стенозе устья аорты, лечат по общепринятым принципам.
При выраженном ангинальном болевом синдроме следует назначать пролонгированные р-адреноблокаторы в небольших дозах, оказывающие антиангинальный эффект. Они сокращают конечный систолический и конечный диастолический объем левого желудочка, вследствие чего потребность миокарда в кислороде уменьшается, улучшается его сократительная функция.
Кроме этих препаратов антиангинальным действием обладает верапамил.
Хирургическое лечение (имплантация искусственного клапана) показано больным с выраженными признаками заболевания (особенно если в V5-V6 имеется негативный зубец Т), а также определяется градиент давления «левый желудочек-аорта», равный 50 мм рт.ст. и более, давление в левом желудочке 200 мм рт.ст. и выше или если площадь аортального отверстия 0,75 см2 и менее.
Аортальная недостаточность
Недостаточность клапана аорты (аортальная недостаточность) - патологическое состояние, при котором в период диастолы створки клапана не закрывают полностью просвет аорты, и вследствие этого происходит обратный ток крови из аорты в левый желудочек (так называемая аортальная регургитация). При данном пороке имеется дефект створок клапана в виде их укорочения и сморщивания, что иногда сочетается с перфорацией створок. Поражение клапана может сочетаться с поражением корня аорты и расширением клапанного кольца, что усугубляет аортальную регургитацию. Встречается также неполное смыкание клапана (при анатомической целостности) вследствие резкого расширения аортального клапанного кольца (атеросклероз аорты, стойкая высокая АГ, воспалительные изменения аорты).
Этиология
Недостаточность клапана аорты может быть вызвана:
• ОРЛ (ревматизмом);
• ИЭ;
• сифилитическим аортитом;
• дегенеративными изменениями ткани клапана с включением солей кальция;
• тупой травмой грудной клетки;
• диффузными заболеваниями соединительной ткани (болезнь Бехтерева, ревматоидный полиартрит, системная склеродермия, дерматомиозит);
• врожденными поражениями (двустворчатый клапан, сочетание недостаточности клапана аорты с другими врожденными пороками).
По данным Европейского исследования пороков сердца (2001), дегенеративный кальциноз как причина аортальной недостаточности отмечен в 50,3%, ревматизм - в 15,2%, ИЭ - в 7,5%, врожденное поражение - в 15,2%.
Патогенез
Основные гемодинамические сдвиги вызваны значительным обратным током крови из аорты в левый желудочек («аортальная регургитация») в период его диастолы в результате неполного смыкания створок клапана аорты. Объем возвращающейся крови зависит в основном от площади незакрытой части аортального отверстия. Для сохранения нормальной гемодинамики систолический выброс увеличивается на такое же количество крови, какое возвращается в левый желудочек во время его диастолы. Вследствие такой гемодинамической перегрузки происходят дилатация и гипертрофия левого желудочка.
Более полноценному кровоснабжению органов и тканей способствуют следующие компенсаторные механизмы: тахикардия, снижение периферического сосудистого сопротивления, удлинение систолы и укорочение фазы изометрического сокращения. Компенсация длится долгое время за счет мощного левого желудочка. При снижении сократительной функции последнего возникает гиперфункция левого предсердия. Если давление в полости левого предсердия превысит 25 мм рт.ст., то возникает легочная гипертензия (венозная, «пассивная») с реакцией правых отделов сердца. В дальнейшем возможно развитие правожелудочковой недостаточности.
Клиническая картина
Определяют клиническую картину наличие и выраженность следующих признаков:
• прямые («клапанные») признаки, обусловленные нарушением функционирования клапана аорты;
• косвенные признаки:
- левожелудочковые, обусловленные компенсаторной гиперфункцией и гипертрофией левого желудочка;
- сосудистые, обусловленные нарушением кровотока в различных сосудистых областях вследствие увеличения сердечного выброса и резкого колебания давления в артериальном русле;
• признаки застойных явлений в малом и большом круге кровообращения.
На первом этапе диагностического поиска в стадии компенсации порока больные не предъявляют жалоб и активно к врачу не обращаются. Выявить порок сердца можно случайно при обращении больного к врачу совершенно по другому поводу. При выраженном пороке и значительных изменениях гемодинамики (даже до развития сердечной недостаточности) часть больных предъявляют жалобы, обусловленные значительным выбросом крови из левого желудочка и резкими колебаниями давления в артериальной системе. К ним относятся ощущение усиленной пульсации сосудов шеи, сердцебиения, усиливающиеся при физической нагрузке, когда выброс сердца еще более увеличивается. У некоторых больных могут появиться боли в грудной клетке типа стенокардии, головокружения, дурнота, наклонность к обморокам, которые, как и у больных со стенозом устья аорты, зависят от нарушения мозгового и коронарного кровотока. Эти явления наблюдаются при выраженном дефекте клапана, когда большая часть крови из аорты попадает опять в левый желудочек и в артериальной системе во время диастолы давление значительно падает.
Одышка развивается лишь при снижении сократительной функции левого желудочка вначале при физической нагрузке, а затем в покое, принимая характер приступов сердечной астмы.
Указанная симптоматика лишь привлекает внимание врача к неблагополучию в сердечно-сосудистой системе, не давая четких опорных пунктов для диагностики порока. Как и при других поражениях клапана, диагноз порока сердца может быть поставлен после второго этапа диагностического поиска.
На втором этапе диагностического поиска следует, прежде всего, выявить прямые признаки, на основании которых можно поставить диагноз недостаточности клапана аорты. К ним относится диастолический шум, обусловленный обратным током крови из аорты в левый желудочек. Этот шум имеет ряд характерных особенностей: он возникает сразу после II тона, постепенно уменьшаясь в своей интенсивности к концу диастолы. Шум отличается мягким, дующим тембром, длительность его различна и зависит от выраженности поражения клапана. Шум грубого тембра наблюдается как исключение.
Лучше всего шум выслушивается в третьем-четвертом межреберьях у левого края грудины, т.е. по току крови из аорты в левый желудочек. Такую локализацию шума отмечают при пороке ревматического происхождения. При сифилитическом пороке шум более грубого тембра и лучше выслушивается во
втором межреберье справа от грудины (в «классической» точке выслушивания клапана аорты). По-видимому, это обусловлено лучшим проведением шума в данную область вследствие значительного уплотнения стенки аорты.
Диастолический шум выслушивают лучше в горизонтальном положении больного при задержке дыхания в фазе выдоха. Однако в начальных стадиях болезни при нерезком дефекте клапана приходится использовать специальные приемы: больного выслушивают в коленно-локтевом положении или в положении сидя с наклоном вперед. Эпицентр шума в этих случаях расположен в точке Боткина.
Второй главный признак - ослабление или полное исчезновение II тона в результате сморщивания створок клапана аорты. Степень ослабления звучности II тона пропорциональна выраженности дефекта клапана. Однако этот признак не всегда характерен для порока сердца сифилитического происхождения, при котором створки могут быть поражены нерезко, а регургитация обусловлена резким расширением корня аорты. Уплотненная стенка аорты хорошо проводит звук, возникающий при закрытии умеренно измененных клапанов. Кроме этих патогномоничных признаков, часто отмечают и другие, но не обязательные аускультативные признаки. К ним относятся ослабление I тона вследствие отсутствия периода замкнутых клапанов во время систолы левого желудочка, а также систолический шум во втором межреберье справа от грудины. Этот шум обусловлен относительным стенозом устья аорты (ширина устья нормальная, однако сердечный выброс значительно увеличен) или сопутствующим клапанным стенозированием. Систолический шум проводится на сонные артерии и в яремную ямку.
Косвенные признаки («левожелудочковые») появляются при достаточно выраженном пороке. Они служат реакцией левого желудочка на измененную внутрисердечную гемодинамику и выражаются в усиленном и разлитом верхушечном толчке, смещенном влево и вниз, смещении влево левой границы сердца.
«Сосудистые» признаки достаточно разнообразны. К ним относится бледность кожных покровов, обусловленная быстрым оттоком крови из мелких артериол. Пульсация сонных артерий («пляска каротид»), подключичных артерий, пульсация в яремной ямке, височных и плечевых артерий обнаруживаются при выраженном дефекте клапанов. Сюда же относится и так называемый капиллярный пульс: синхронное с пульсом изменение в интенсивности окраски ногтевого ложа и участка гиперемии на коже лба, вызванного путем трения кожи. В действительности это пульсируют не капилляры, а мельчайшие артериолы.
К «сосудистым» симптомам относится изменение АД и пульса. При выраженном пороке систолическое давление повышается, а диастолическое снижается, так что амплитуда пульсового давления возрастает. Пульс высокий и скорый, что зависит от быстрого подъема давления в артериальной системе и такого же быстрого его снижения. При выслушивании периферических артерий выявляют ряд характерных симптомов: двойной тон Траубе и двойной шум Виноградова-Дюрозье (значительно реже). Шум появляется, если фонендоскопом надавливать на выслушиваемую артерию, создавая тем самым условия стеноза. Появление тонов над периферическими артериями объясняется сильными колебаниями стенки артерии.
При развитии легочной гипертензии и правожелудочковой недостаточности обнаруживают соответствующие симптомы.
На третьем этапе диагностического поиска уточняют прямые и косвенные признаки, а также исключают ряд заболеваний, сходных по своей симптоматике с аортальной недостаточностью, окончательно решают вопрос об этиологии порока.
При рентгенологическом исследовании в период компенсации порока размеры сердца незначительно увеличены. При выраженной аортальной недостаточности сердце значительно расширено за счет дилатации левого желудочка. Тень аорты обычно диффузно расширена, амплитуда ее пульсации, как и пульсации левого желудочка, увеличена.
При развитии сердечной недостаточности появляются признаки легочной гипертензии, а в дальнейшем - увеличение правого желудочка.
ЭхоКГ выявляет расширение полости левого желудочка и корня аорты, нарушение движения створок клапана. При допплеровской ЭхоКГ выявляют струю регургитации из аорты в левый желудочек. В зависимости от длины струи регургитации выделяют 3 степени недостаточности аорты (I степень - длина струи не более 5 мм от створок аортального клапана; II степень - 5-10 мм; III степень - более 10 мм, струя регургитации продолжается дальше створок митрального клапана к верхушке левого желудочка).
Эффективная площадь регургитационного отверстия при легкой степени тяжести аортальной регургитации <0,10 см2; при средней степени тяжести - 0,10-0,219 см2; при тяжелой степени >0,30 см2.
Данные электрокардиограммы имеют большое значение как в оценке тяжести порока, так и в определении выраженности изменений миокарда. При нерезком пороке ЭКГ может быть неизмененной. Если порок выраженный, на ЭКГ обнаруживают признаки гипертрофии левого желудочка, которые отличаются от таковых на ЭКГ больных со стенозом устья аорты. Эти признаки состоят в следующем: увеличивается амплитуда зубца R в отведениях V5-V6 и S в отведениях V1-V2, появляются высокие заостренные зубцы Т в отведениях V5-V6. При развитии сердечной недостаточности отмечают характерные изменения конечной части желудочкового комплекса в виде депрессии сегмента ST в отведениях V5-V6, в этих же отведениях зубец Т становится двухфазным или негативным.
На ФКГ выявляют типичные признаки: диастолический шум, начинающийся вслед за II тоном и убывающий по интенсивности. Часто регистрируют усиление III и IV тонов, обусловленное объемной гемодинамической перегрузкой левого желудочка. Амплитуда II тона снижена, в ряде случаев регистрируют «сопутствующий» систолический шум, убывающий по интенсивности и занимающий не более половины (реже двух третей) систолы.
Течение
Клинические проявления порока отличаются значительным разнообразием. Сердечная недостаточность может отсутствовать длительное время, однако, возникнув, симптомы декомпенсации держатся стойко и, несмотря на интенсивное лечение, почти никогда полностью не исчезают.
Причина сердечной недостаточности - дистрофия миокарда в условиях длительной гемодинамической перегрузки, а также повреждение его повторными ревматическими «атаками».
Условно выделяют 3 периода течения порока.
• Первый период - усиленная работа левого желудочка.
• Второй период - нарушение сократительной функции левого желудочка и более или менее острое развитие легочной гипертензии. В этот период возникают приступы сердечной астмы, может наступить смерть.
• Третий период - развитие правожелудочковой недостаточности, может уменьшиться одышка за счет снижения давления в легочной артерии. Период сердечной недостаточности у больных с аортальным пороком длится недолго (2-3 года) в отличие от больных митральными пороками.
Осложнения
У больных аортальной недостаточностью осложнений, типичных только для этого порока, не отмечено. Развивающаяся левожелудочковая недостаточность служит этапом в развитии порока, так же как и коронарная недостаточность. Нарушения ритма сердца (в частности, фибрилляция предсердий) наблюдаются нечасто и обычно лишь в стадии тотальной сердечной недостаточности.
Недостаточность клапана аорты - порок сердца, на фоне которого может развиться ИЭ.
Диагностика
Диагноз порока ставят на основании прямых («клапанных») признаков. Признаки увеличения левого желудочка, выявляемые различными методами, а также симптомы, обусловленные увеличенным сердечным выбросом и колебанием давления в артериальном русле, не являются обязательными. Их наличие и степень выраженности указывают лишь на степень поражения клапанного аппарата. Существенную помощь оказывает ЭхоКГ.
Трудности в диагностике обусловливаются схожестью симптоматики аортальной недостаточности и других болезней сердца и возможностью бессимптомного течения порока.
В начальных стадиях при незначительной выраженности повреждений клапана можно не выявить порок, так как типичный диастолический шум небольшой интенсивности локализуется на ограниченной площади (точка Боткина), ослабления II тона может не быть. Кроме того, пациенты не предъявляют никаких жалоб, а аускультацию, к сожалению, часто проводят недостаточно тщательно.
Иногда диастолический шум выслушивают только на верхушке сердца, на основании чего делают заключение о наличии у больного митрального стеноза. Однако, в отличие от этого порока, при аортальной недостаточности нет тона открытия митрального клапана, не определяется увеличение левого предсердия. Кроме того, шум при недостаточности клапана аорты имеет мягкий тембр («дующий»), в то время как при митральном стенозе диастолический шум более грубого тембра («рокочущий»). Громкость I тона не имеет большого значения в подобной дифференциации, так как при аортальной недостаточности он может быть усилен (так называемый тон «изгнания»). Наконец, у части больных с тяжелой недостаточностью клапана аорты над верхушкой сердца может определяться пресистолическое усиление диастолического шума. Для дифференциа-
ции от митрального стеноза учитывают наличие тона открытия митрального клапана, увеличения левого предсердия, данные ЭхоКГ.
У больных митральным стенозом с высокой легочной гипертензией по левому краю грудины может выслушиваться диастолический шум относительной недостаточности клапана легочной артерии (шум Грэма Стилла), который может быть принят за шум аортальной недостаточности. Отличие состоит в отсутствии ослабления II тона во втором межреберье справа, резком усилении II тона во втором межреберье слева от грудины, наличии сопутствующего систолического шума (шум изгнания). Кроме того, при шуме Грэма Стилла имеется яркая картина митрального стеноза, а при рентгенологическом исследовании выявляют аневризматическое расширение легочной артерии.
Относительная аортальная недостаточность (не являющаяся пороком сердца в истинном смысле слова) наблюдается при расширении атеросклеротической аорты или высокой АГ. Она сопровождается усиленным II тоном во втором межреберье справа от грудины.
Гипердиагностика аортальной недостаточности основана на переоценке диагностической значимости периферических («сосудистых») симптомов: пульс, АД, пульсация периферических артерий. Высокий скорый пульс, понижение диастолического давления, усиление пульсации периферических артерий наблюдают при состояниях, характеризующихся увеличением выброса крови и снижением периферического сопротивления (анемия, тиреотоксикоз, лихорадочное состояние). Однако внимательная аускультация, не выявляющая типичного диастолического шума, позволяет отвергнуть предположение о наличии порока сердца.
Лечение
При сердечной недостаточности, развивающейся при пороке сердца, проводят лечение общепринятыми методами.
Пролонгированные нитраты в небольших дозах, антагонисты ионов кальция (верапамил) назначают при выраженном сердечном болевом синдроме. При выраженном гиперкинетическом типе кровообращения (при условии достаточной сократительной функции миокарда) могут быть назначены небольшие дозы р-адреноблокаторов, уменьшающих ощущение усиленной пульсации.
Замена пораженного клапана протезом показана больным с увеличенным левым желудочком (при наличии выраженных признаков его гипертрофии на ЭКГ), снижении диастолического давления ниже 40 мм рт.ст., даже если у таких больных нет субъективных ощущений.
Эхокардиографические критерии (даже при хорошем самочувствии больного):
• регургитация >50% ударного объема;
• снижение сократительной функции левого желудочка (фракция выброса <40-50%);
• конечный диастолический размер левого желудочка >70 мм;
• конечный систолический размер левого желудочка >50 мм.
Сочетание стеноза устья аорты и аортальной недостаточности
Многие больные со стенозом устья аорты имеют легкую, клинически не значимую недостаточность клапана аорты. С другой стороны, у многих боль-
ных с аортальной регургитацией выявляют легкий, клинически малозначимый стеноз устья аорты. Однако при наличии значительного стеноза устья аорты и аортальной недостаточности определяются систолический градиент между левым желудочком и аортой, равный 25 мм рт.ст., и, кроме того, значительная регургитация через аортальный клапан в левый желудочек. Такое сочетанное поражение имеет течение, сходное с таковым при изолированном стенозе устья аорты.
У этих больных определяют типичный систолический и ранний диастолический шумы. Записанный графически пульс сонной артерии обычно нормален, в отличие от такового при изолированном стенозе устья аорты. При рентгенологическом и ЭхоКГ может определяться кальцификация клапана. На ЭКГ обнаруживают выраженные признаки гипертрофии левого желудочка, на ЭхоКГ - признаки стеноза устья аорты.
Преобладание аортальной недостаточности при сочетанном поражении определяют на основании выраженности периферических сосудистых симптомов: снижения диастолического давления, высокого скорого пульса.
Более точные сведения о преобладании того или иного поражения можно получить при измерении давления в аорте и левом желудочке и по данным
ЭхоКГ.
ПОРОКИ ТРЕХСТВОРЧАТОГО КЛАПАНА
Среди пороков трехстворчатого (трикуспидального) клапана недостаточность клапана диагностируется наиболее часто, однако в изолированном виде встречается крайне редко: обычно недостаточность трехстворчатого клапана сочетается с пороками митрального или аортального клапана.
Недостаточность трехстворчатого клапана
Различают органическую (клапанную) и относительную недостаточность трехстворчатого клапана.
• При органической недостаточности выявляются морфологические изменения клапанного аппарата: створок, хорд, сосочковых мышц. Однако, в отличие от пороков митрального и аортального клапанов, обызвествление створок клапана и подклапанные сращения обычно отсут ствуют.
• Относительная недостаточность не проявляется морфологическими изменениями клапанов. Створки клапана не полностью перекрывают правое предсердно-желудочковое отверстие, так как сухожильное кольцо (место прикрепления створок клапана) резко растянуто. Это наблюдается при значительном расширении правого желудочка и увеличении его полости у больных с правожелудочковой недостаточностью.
Этиология
Наиболее частая причина трикуспидальной недостаточности - ревматизм, значительно реже - ИЭ. Врожденная недостаточность трехстворчатого клапана в изолированном виде не встречается и обычно комбинируется с другими аномалиями клапанного аппарата.
Патогенез
Во время систолы правого желудочка возникает обратный ток крови из его полости в правое предсердие. Эта кровь вместе с кровью, поступающей из полых вен и коронарного синуса, переполняет правое предсердие, вызывая его дилатацию. В период систолы предсердий увеличенный объем крови поступает в правый желудочек, обусловливая его дальнейшие дилатацию и гипертрофию. В правое предсердие впадают полые вены, поэтому застой крови в его полости сразу передается на систему полых вен. При резко выраженной слабости правого предсердия (фибрилляция предсердий) оно представляет вместе с полыми венами как бы один резервуар, растягивающийся при систоле желудочков, а во время диастолы опорожняющийся далеко не полностью.
Снижение сократительной функции правого желудочка приводит к резкому уменьшению количества крови, поступающей в легочную артерию, тем самым уменьшая застой крови в сосудах малого круга, обычно обусловленный декомпенсированным митральным или аортальным пороком сердца. С другой стороны, недостаточность трехстворчатого клапана способствует прогрессированию признаков застоя в большом круге кровообращения.
Клиническая картина
Проявления трикуспидальной недостаточности зависят от наличия клапанных признаков порока, обусловленных ретроградным током крови из желудочка в предсердие, а также симптомов застоя в большом круге кровообращения.
На первом этапе диагностического поиска жалобы больных нехарактерны для данного порока. Они связаны с основным пороком сердца (митральным или аортальным) и значительным застоем в большом и малом круге кровообращения. Больные жалуются на одышку, однако умеренную, так как застой в малом круге с появлением трикуспидальной недостаточности уменьшается, а часть крови депонируется в правых отделах сердца и печени. Физическая активность больных ограничена в основном не усилением одышки, а резкой слабостью. Нередки боли в правом подреберье и эпигастрии, тошнота, снижение аппетита. Присоединение асцита обусловливает чувство тяжести и боли по всему животу. Таким образом, на первом этапе можно составить представление лишь о выраженных расстройствах кровообращения.
На втором этапе диагностического поиска можно выявить прямые («клапанные») признаки порока: систолический шум, наиболее четко выслушиваемый у мечевидного отростка грудины. Он резко усиливается при выслушивании на высоте вдоха с задержкой дыхания, что объясняется увеличением объема регургитации и ускорением кровотока через правые отделы сердца. Регургитация крови в правое предсердие обусловливает появление положительного венного пульса и систолической пульсации печени. Кроме этих симптомов, обязательно определяются прямые и косвенные признаки основного порока сердца, на фоне которого развилась трикуспидальная недостаточность. Пульс, АД без особенностей. Венозное давление, как правило, повышено. Внешний вид больного определяется наличием выраженной недостаточности кровообращения. При длительно существующей трикуспидальной недостаточности и развитии гепатомегалии возможно появление небольшой желтушности кожных покровов.
Таким образом, на втором этапе можно поставить диагноз трикуспидальной недостаточности, а также диагноз основного порока сердца.
На третьем этапе диагностического поиска подтверждаются прямые и косвенные признаки митрального или аортального порока сердца. Сам порок трикуспидального клапана также вносит свою «долю» в результаты инструментальных исследований. Рентгенологически обнаруживают значительное увеличение правого желудочка и правого предсердия, расширение верхней полой вены. Застой в малом круге кровообращения может быть выражен нерезко. На ЭКГ появляются признаки значительной дилатации правого желудочка в виде полифазного комплекса rSr в отведении V1 и глубокого зубца S в последующих грудных отведениях. На ФКГ с мечевидного отростка регистрируется систолический шум, начинающийся сразу после I тона. ЭхоКГ выявляет различной степени увеличение правого желудочка, а допплеровская ЭхоКГ - выраженность регургитации. Флебография (кривая пульса яремной вены) позволяет обнаружить высокую волну «а» в пресистоле, если сохраняется синусовый ритм.
Диагностика
Диагноз недостаточности трехстворчатого клапана основан на обнаружении систолического шума у основания мечевидного отростка (с усилением на высоте вдоха), положительного венного пульса, систолической пульсации печени. Такие симптомы, как увеличение правого желудочка и правого предсердия (на рентгенограмме), синдром гипертрофии правого желудочка на ЭКГ, повышение венозного давления, не патогномоничны для порока и могут наблюдаться и при его отсутствии.
Следует признать характерным для данного порока такое сочетание симптомов, как заметное увеличение правых отделов сердца и отсутствие значительного застоя в малом круге.
Некоторые симптомы могут отсутствовать (положительный венный пульс, систолическая пульсация печени). В этих случаях единственным надежным признаком порока служит характерный систолический шум.
При распознавании трикуспидальной недостаточности вызывает определенные затруднения дифференциация органической и относительной ее форм.
• Относительная недостаточность выявляется у больных с митральным стенозом и высокой легочной гипертензией. Если митральный стеноз не сопровождается высокой легочной гипертензией, то трикуспидальная недостаточность чаще бывает органической. Имеет значение динамика систолического шума у мечевидного отростка во время лечения. Усиление шума при улучшении состояния больного может свидетельствовать об органическом поражении клапана, а ослабление шума, сочетающееся с улучшением состояния больного - об относительной недостаточности. Считается также, что более громкий и грубый шум скорее обусловлен органическим поражением клапана.
• Трикуспидальная недостаточность, выявляемая у больных с митральным или аортальным пороком при значительном увеличении сердца, симптомах выраженной правожелудочковой недостаточности, фибрилляции предсердий, чаще всего является относительной.
• Трикуспидальную недостаточность иногда приходится дифференцировать от слипчивого перикардита, при котором наблюдается выраженный застой в большом круге кровообращения. Однако слипчивый перикардит почти никогда не сочетается с пороками других клапанов, аускультативная симптоматика бедная, сердце не так увеличено, как при пороках.
• Поставить правильный диагноз помогают данные рентгенографии и ЭхоКГ, обнаруживающих обызвествление листков перикарда.
• При «чистом» митральном стенозе над верхушкой сердца может выслушиваться систолический шум, обусловленный относительной трикуспидальной недостаточностью. Эта ситуация возникает вследствие того, что при выраженной гипертрофии правого желудочка всю переднюю поверхность сердца образует именно этот отдел, а левый желудочек смещается назад. В результате такой ротации сердца смещаются точки наилучшего выслушивания клапанов: митрального - к средней или задней подмышечной линии, трехстворчатого - к левой срединно-ключичной линии. В подобных случаях систолический шум дифференцируют от шума при недостаточности митрального клапана: при относительной трикуспидальной недостаточности шум усиливается на высоте вдоха, а при митральной недостаточности - на высоте выдоха в положении больного на левом боку.
Лечение
Больным с трикуспидальной недостаточностью проводят лечение согласно общим принципам терапии сердечной недостаточности. Назначают мочегонные и особенно антагонисты альдостерона - спиронолактон.
Трикуспидальный стеноз
Стеноз правого предсердно-желудочкового отверстия (трикуспидальный стеноз) - патологическое состояние, характеризующееся уменьшением площади правого предсердно-желудочкового отверстия, что создает препятствие движению крови из правого предсердия в правый желудочек. Изолированно трикуспидальный стеноз не встречается, он всегда сочетается с пороками других клапанов.
Этиология
Наиболее частая причина трикуспидального стеноза - ревматизм. Врожденное поражение встречается крайне редко и всегда сочетается с другими аномалиями клапанов и перегородок сердца.
Патогенез
Вследствие неполного опорожнения правого предсердия через суженное отверстие при нормальном притоке крови из полых вен, объем крови в правом предсердии возрастает, давление также увеличивается. В результате возрастает градиент давления «правое предсердие-правый желудочек», что способствует прохождению крови через суженное предсердно-желудочковое отверстие в начале диастолы желудочков.
Расширение предсердия вызывает более сильное его сокращение и увеличение тока крови в правый желудочек в конце диастолы. Расширение правого
предсердия сочетается с гипертрофией его стенки, однако эти компенсаторные механизмы несовершенны и кратковременны. С увеличением давления в правом предсердии повышается давление во всей венозной системе: рано увеличивается печень, появляется асцит, в дальнейшем развивается фиброз печени.
Клиническая картина
Проявления трикуспидального стеноза зависят от наличия клапанных признаков порока, обусловленных нарушением функции трикуспидального клапана, признаков дилатации правого предсердия, а также симптомов застоя в большом круге кровообращения.
На первом этапе диагностического поиска жалобы не являются характерными для данного порока, так как они связаны с основным пороком (митральным или аортальным) и значительным застоем в большом круге кровообращения. Больные жалуются на быструю утомляемость и тяжесть или боли в правом подреберье, вызванные увеличенной печенью. Для трикуспидального стеноза характерно отсутствие жалоб, обусловленных застоем кровообращения в малом круге (одышка, кровохарканье, приступы отека легких), так как в правый желудочек и соответственно в легочную артерию попадает мало крови.
Таким образом, на первом этапе можно составить представление лишь о выраженных расстройствах кровообращения.
Ha втором этапе диагностического поиска можно выявить прямые («клапанные») признаки порока: диастолический шум у мечевидного отростка или у места прикрепления V ребра к грудине слева. Шум этот появляется или усиливается при задержке дыхания на высоте вдоха, что нехарактерно для диастолического шума, обусловленного митральным стенозом. На высоте вдоха часто появляется тон открытия трехстворчатого клапана (тон открытия митрального клапана не зависит от фазы дыхания и никогда не появляется на высоте вдоха, если отсутствует на высоте выдоха). Диастолический шум при синусовом ритме занимает преимущественно конец диастолы (пресистолический шум), а при фибрилляции предсердий - начало диастолы (протодиастолический шум). Все эти признаки позволяют дифференцировать аускультативную картину при трикуспидальном и митральном стенозе.
Застой крови в правом предсердии обусловливает раннее увеличение печени, набухание шейных вен, отеки. Отмечается выраженный пресистолический венный пульс на яремных венах, а также пресистолический печеночный пульс. Граница относительной тупости сердца резко смещена вправо. Кроме этих признаков, обязательно выявляются прямые и косвенные симптомы «основного» порока сердца, на фоне которого развился трикуспидальный стеноз. Пульс, АД без особенностей. Венозное давление, как правило, повышено. При длительном существовании трикуспидального порока и развитии гепатомегалии возможно появление небольшой желтушности кожных покровов.
Таким образом, на втором этапе можно поставить диагноз трикуспидального стеноза, а также диагноз основного порока сердца.
Ha третьем этапе диагностического поиска подтверждаются прямые и косвенные признаки митрального или аортального порока сердца. Сам трикуспидальный стеноз вносит свою «долю» в результаты инструментального исследования. Рентгенологически выявляется значительное увеличение правого
предсердия, верхней полой вены, в то время как правый желудочек увеличен значительно меньше, чем при трикуспидальной недостаточности. Признаки легочной гипертензии отсутствуют.
На ЭКГ при сохраненном синусовом ритме отмечается высокий острый зубец P в отведениях II, III, aVF и правых грудных. Изменения желудочкового комплекса обусловлены особенностями компенсаторной гипертрофии вследствие основного порока сердца. На ФКГ регистрируется высокочастотный убывающий диастолический шум (иногда с пресистолическим усилением) у мечевидного отростка или в месте прикрепления V ребра к грудине. Иногда в этой же области регистрируется тон открытия трикуспидального клапана.
ЭхоКГ помогает выявить диагностически важный признак - конкордантное движение створок трехстворчатого клапана в диастолу (этот признак обнаруживается не часто в связи с трудностью визуализации задней створки клапана). Чаще отмечается резкое уменьшение скорости движения передней створки в фазу диастолы.
Диагностика
Распознавание порока основано на обнаружении диастолического шума у мечевидного отростка, усиливающегося на высоте вдоха, часто в сочетании с там же выявляемым тоном открытия трехстворчатого клапана. При наличии синусового ритма диагноз подтверждается пресистолической пульсацией яремных вен и увеличенной печени. Другие симптомы: увеличение правого предсердия, измененные зубцы P во II, III, aVF и правых грудных отведениях, повышение венозного давления, увеличение печени, отеки не патогномоничны для порока.
Лечение
Наличие трикуспидального стеноза служит показанием для имплантации искусственного клапана . Если по каким-либо причинам оперативное лечение не производится, следует использовать достаточные дозы мочегонных средств и антагонистов альдостерона - спиронолактона (верошпирон).
Прогноз
Прогноз определяется типом основного клапанного дефекта и его выраженностью, а также развивающейся сердечной недостаточностью. При нерезко выраженном пороке сердца и отсутствии (или незначительно выраженной) сердечной недостаточности прогноз вполне удовлетворителен, больной длительное время трудоспособен. Существенно ухудшается прогноз при выраженных изменениях клапана и нарастающей сердечной недостаточности, а также возникающих осложнениях, особенно нарушениях ритма сердца. После внедрения оперативных методов лечения (митральная комиссуротомия, протезирование клапана) прогноз улучшился, так как при своевременной и адекватно выполненной операции восстанавливаются гемодинамические характеристики, как внутрисердечные, так и внесердечные. Больных с пороком сердца (в том числе и после операции на сердце) необходимо ставить на диспансерный учет и наблюдение.
Профилактика
Предупреждение приобретенных пороков сердца сводится к первичной и вторичной профилактике рецидивов ОРЛ (ревматизма).
КАРДИОМИОПАТИИ
С середины XIX в. представления о том, что такое «кардиомиопатии», неоднократно менялись в связи с накоплением все новых и новых знаний о причинах их возникновения (в том числе и генетических), их патогенезе, клинических вариантах течения, характере морфологических и электрофизиологических изменений миокарда и др.
В 1968 г. ВОЗ определяла кардиомиопатии как «заболевания различной и часто неизвестной этиологии, преобладающими чертами которых являются кардиомегалия и сердечная недостаточность». В 1980 г. ВОЗ дала определение кардиомиопатиям как «заболеваниям мышцы сердца неизвестной причины». В одном из последних определений ВОЗ, опубликованном в 1995 г., под кардиомиопатиями понимались «заболевания миокарда, связанные с нарушением функции сердца».
В 2006 г. группой экспертов Американской ассоциации сердца (АНА) было предложено последнее из ныне существующих определений кардиомиопатий: «Кардиомиопатии представляют собой гетерогенную группу заболеваний миокарда, связанных с механической и (или) электрической дисфункцией, которая обычно (но не всегда) проявляется неадекватной гипертрофией или дилатацией. Кардиомиопатии вызываются различными причинами, часто носящими генетический характер, и могут как изолированно поражать только сердце, так и быть частью генерализованного системного заболевания, они часто приводят к сердечно-сосудистой смерти или к инвалидизации, обусловленной прогрессирующей сердечной недостаточностью».
Соответственно изменениям представлений о том, что такое кардиомиопатии, изменялась и их классификация.
В 1995 г. ВОЗ предложила «функциональную классификацию» кардиомиопатий, которая используется и в настоящее время, согласно которой выделяют:
• ДКМП;
• ГКМП;
• РКМП;
• аритмогенную правожелудочковую кардиомиопатию (дисплазию). Согласно последней классификации экспертов Американской ассоциации
сердца (АНА) от 2006 г., все кардиомиопатии предлагается подразделять на первичные и вторичные.
• Под первичными кардиомиопатиями понимают такие их варианты, при которых поражение ограничивается исключительно (или преимущественно) мышцей сердца. Они относительно малочисленны и могут быть генетически обусловленными, смешанными, т.е. генетическими и негенетическими либо приобретенными (рис. 2-4).
• Под вторичными кардиомиопатиями понимают такие их варианты, при которых вовлечение миокарда в патологический процесс происходит в рамках большого спектра часто встречающихся генерализованных системных (мультиорганных) заболеваний (табл. 2-4). При этом необходимо отметить, что из данной классификации исключены такие варианты

Рис. 2-4. Первичные кардиомиопатии
поражения и дисфункции миокарда, которые служат прямым следствием какого-либо другого сердечно-сосудистого заболевания (например, ГБ, врожденных заболеваний сердца, ИБС, клапанных пороков сердца и др.). Таким образом, в настоящее время считают неоправданным использовать такие термины, как «ишемическая кардиомиопатия», «ГКМП», которые ранее также относили к специфическим кардиомиопатиям.
Таблица 2-4. Вторичные кардиомиопатии

ГИПЕРТРОФИЧЕСКАЯ КАРДИОМИОПАТИЯ
Гипертрофическая кардиомиопатия (ГКМП) - наиболее часто встречающаяся кардиомиопатия. Это генетически детерминированное заболевание сердца, характеризующееся значительной гипертрофией миокарда левого желудочка, равной или превышающей 15 мм по данным ультразвукового исследования сердца. При этом отсутствуют какие-либо заболевания сердечно-сосудистой системы, способные вызвать такую выраженную гипертрофию миокарда (АГ, аортальный порок сердца и др.).
Для ГКМП характерны сохранение сократительной функции миокарда левого желудочка (нередко даже ее повышение), отсутствие расширения его полости и наличие выраженного нарушения диастолической функции миокарда левого желудочка.
Гипертрофия миокарда может быть симметричной (увеличение толщины стенок всего левого желудочка) либо асимметричной (увеличение толщины
одной лишь стенки). В ряде случаев наблюдается только изолированная гипертрофия верхней части межжелудочковой перегородки непосредственно под фиброзным кольцом клапана аорты.
В зависимости от наличия или отсутствия градиента давления в выходном тракте левого желудочка различают обструктивную (сужающую выходную часть левого желудочка) и необструктивную ГКМП. Обструкция выходного тракта может локализоваться как под аортальным клапаном (субаортальная обструкция), так и на уровне середины полости левого желудочка.
Встречаемость ГКМП в популяции составляет 1\500 человек, чаще в молодом возрасте; средний возраст больных в момент диагностики около 30 лет. Однако заболевание может быть выявлено и значительно позднее - в возрасте 50-60 лет, в единичных случаях ГКМП выявляют у лиц старше 70 лет, что является казуистикой. Позднее выявление заболевания связано с нерезкой выраженностью гипертрофии миокарда и отсутствием значительных изменений внутрисердечной гемодинамики. Коронарный атеросклероз встречается у 15-25% больных.
Этиология
ГКМП - генетически обусловленное заболевание, передающееся по аутосомно-доминантному принципу. ГКМП вызывается мутацией одного из 10 генов, каждый из которых кодирует определенные белковые структуры саркомеров, состоящих из тонких и толстых филаментов, обладающих сократительной, структурной и регуляторной функциями. Наиболее часто ГКМП вызывается мутациями в 3 генах, кодирующих р-миозин тяжелых цепей (ген локализован в хромосоме 14), сердечный тропонин С (ген локализован в хромосоме 1) и миозинсвязывающий белок С (ген локализован в хромосоме 11). Мутации в 7 других генах, ответственных за регуляторный и эссенциальный миозин легких цепей, титин, а-тропомиозин, а-актин, сердечный тропонин I и а-миозин тяжелых цепей встречаются значительно реже.
Необходимо отметить отсутствие прямых параллелей между характером мутации и клиническими (фенотипическими) проявлениями ГКМП. Далеко не все лица, имеющие данные мутации будут иметь клинические проявления ГКМП, а также признаки гипертрофии миокарда на ЭКГ и по данным ультразвукового исследования сердца. В то же время известно, что выживаемость больных ГКМП, возникающей вследствие мутации гена тяжелой цепи р-миозина, существенно ниже, нежели при мутации гена тропонина Т (в этой ситуации болезнь проявляется в более позднем возрасте).
Тем не менее пробанды больного ГКМП должны быть информированы о наследственном характере заболевания и об аутосомно-доминантном принципе его передачи. Более того, родственники первой линии должны быть тщательно обследованы клинически с использованием ЭКГ и УЗИ сердца.
Наиболее точный метод подтверждения ГКМП - анализ ДНК, позволяющий выявить непосредственно мутации в генах. Однако в настоящее время, в связи со сложностью и высокой стоимостью этой методики, она пока широкого распространения не получила.
Патогенез
При ГКМП отмечается 2 основных патологических механизма - нарушение диастолической функции сердца и у части больных - обструкция выходного
тракта левого желудочка. В период диастолы в желудочки, вследствие плохой их растяжимости, поступает недостаточное количество крови, что приводит к быстрому подъему конечного диастолического давления. В этих условиях компенсаторно развиваются гиперфункция, гипертрофия, а затем и дилатация левого предсердия, а при его декомпенсации - легочная гипертензия («пассивного» типа).
Обструкция выходного отдела левого желудочка, развивающаяся во время систолы желудочков, обусловлена двумя факторами: утолщением межжелудочковой перегородки (миокардиальный) и нарушением движения передней створки митрального клапана. Сосочковая мышца укорочена, створка клапана утолщена и прикрывает пути оттока крови из левого желудочка вследствие парадоксального движения: в период систолы она приближается к межжелудочковой перегородке и соприкасается с ней. Именно поэтому субаортальная обструкция нередко сочетается с митральной регургитацией, т.е. с недостаточностью митрального клапана. Вследствие обструкции левого желудочка в период систолы желудочков возникает градиент давления между полостью левого желудочка и восходящей частью аорты.
С патофизиологической и прогностической точки зрения значимым является градиент давления в состоянии покоя, превышающий 30 мм рт.ст. У одних больных с ГКМП градиент давления может повышаться только при физических нагрузках, а в покое быть нормальным. У других больных градиент давления повышен постоянно, в том числе и в покое, что прогностически менее благоприятно. В зависимости от характера и степени повышения градиента давления больных с ГКМП подразделяют на:
• пациентов с постоянной обструкцией выходного отдела, у которых градиент давления постоянно, в том числе в покое, превышает 30 мм рт.ст. (2,7 м/с при допплеровском ультразвуковом исследовании);
• пациентов с латентной обструкцией выходного отдела, у которых в покое градиент давления составляет менее 30 мм рт.ст., а во время проведения провокационных проб с физической (тредмилтест, велоэргометрия) либо фармакологической (добутамин) нагрузкой градиент давления превышает 30 мм рт.ст.;
• пациентов без обструкции выходного отдела, у которых и в покое, и во время проведения провокационных проб с физической либо фармакологической нагрузкой градиент давления не превышает 30 мм рт.ст.
При этом необходимо учитывать, что градиент давления у одного и того же больного может варьировать в широких пределах в зависимости от различных физиологических условий (покой, физическая нагрузка, прием пищи, алкоголя и др.).
Постоянно существующий градиент давления приводит к чрезмерному напряжению миокарда левого желудочка, возникновению его ишемии, гибели кардиомиоцитов и замещению их фиброзной тканью. В результате, помимо выраженных нарушений диастолической функции вследствие ригидности гипертрофированного миокарда левого желудочка, развивается и систолическая дисфункция миокарда левого желудочка, что в конечном итоге приводит к возникновению хронической сердечной недостаточности.
Клиническая картина
Для ГКМП характерны следующие варианты клинического течения:
• стабильное состояние больных на протяжении длительного времени, при этом около 25% больных ГКМП имеют нормальную продолжительность жизни;
• внезапная сердечная смерть вследствие фатальных желудочковых аритмий (желудочковая тахикардия, фибрилляция желудочков), риск которой у больных ГКМП достаточно высок;
• прогрессирование клинических проявлений заболевания при сохраненной систолической функции левого желудочка: одышка при физических нагрузках, боли в области сердца ангинозного или атипичного характера, нарушения сознания (обмороки, предобморочные состояния, головокружения);
• возникновение и прогрессирование хронической сердечной недостаточности вплоть до терминальной (IV функциональный класс по NYHA) стадии, сопровождающейся систолической дисфункцией и ремоделированием левого желудочка сердца;
• возникновение фибрилляции предсердий и характерных для нее осложнений (ишемический инсульт и другие системные тромбоэмболии);
• возникновение ИЭ, который осложняет течение ГКМП у 5-9% больных (при этом характерно атипичное течение ИЭ с более частым поражением митрального, чем аортального клапана).
Для больных с ГКМП характерно чрезвычайное разнообразие симптомов, что служит причиной ошибочной диагностики. Нередко им ставят диагноз ревматического порока сердца и ИБС в результате сходства жалоб (боли в области сердца и за грудиной) и данных исследования (интенсивный систолический шум).
В типичных случаях клиническую картину составляют:
• жалобы на одышку при физических нагрузках и снижение толерантности к ним, боли в области сердца как ангинозного, так и другого характера, эпизоды головокружения, пресинкопальные либо синкопальные состояния;
• признаки гипертрофии миокарда желудочков (преимущественно левого);
• признаки нарушения диастолической функции желудочков;
• признаки обструкции выходного тракта левого желудочка (не у всех больных);
• нарушения ритма сердца (чаще всего фибрилляция предсердий). Следует учитывать определенную стадийность течения ГКМП. Вначале,
когда градиент давления в выходном тракте левого желудочка не превышает 25-30 мм рт.ст., жалобы обычно отсутствуют. При возрастании градиента давления до 35-40 мм рт.ст. появляются жалобы на снижение толерантности к физическим нагрузкам. Когда градиент давления достигает 45-50 мм рт.ст. у больного с ГКМП появляются жалобы на одышку, сердцебиения, стенокардию, обморочные состояния. При очень высоком градиенте давления (>=80 мм рт.ст.) нарастают гемодинамические, цереброваскулярные и аритмические расстройства.
В связи со сказанным, информация, получаемая на различных этапах диагностического поиска, может быть весьма различной.
Так, на первом этапе диагностического поиска может не быть никаких жалоб. При выраженных расстройствах сердечной гемодинамики больные предъявляют следующие жалобы:
• на одышку при физической нагрузке, обычно умеренно выраженную, но иногда и тяжелую (в первую очередь она обусловлена диастолической дисфункцией левого желудочка, проявляющейся в нарушении его диастолического расслабления вследствие повышенной жесткости миокарда и, как следствие, приводящей к снижению наполнения левого желудочка в период диастолы, что, в свою очередь, приводит к повышению давления в левом предсердии и конечно-диастолического давления в левом желудочке, застою крови в легких, появлению одышки и снижению толерантности к физическим нагрузкам);
• на боли в области сердца как типичного ангинозного характера, так и нетипичного:
- типичные ангинозные боли за грудиной сжимающего характера, возникающие при физической нагрузке и реже в покое, являются проявлениями ишемии миокарда, возникающей как следствие диспропорции между увеличенной потребностью гипертрофированного миокарда в кислороде и сниженным кровотоком в миокарде левого желудочка вследствие его плохого диастолического расслабления;
- помимо этого в развитии ишемии миокарда определенную роль может играть и гипертрофия медии мелких интрамуральных коронарных артерий, приводящая к сужению их просвета при отсутствии атеросклеротического поражения;
- наконец, у лиц старше 40 лет, имеющих факторы риска развития ИБС, нельзя исключить сочетание увеличения коронарного атеросклероза и
ГКМП;
• головокружение, головные боли, наклонность к обморочным состояниям
- следствие внезапного снижения сердечного выброса или пароксизмов аритмий, также уменьшающих выброс из левого желудочка и приводящих к временному нарушению церебрального кровообращения;
• нарушения ритма сердца, чаще всего пароксизмы мерцания предсердий, желудочковая экстрасистолия, ПТ.
Указанная симптоматика отмечается у больных с выраженной ГКМП. При нерезкой гипертрофии миокарда, незначительном снижении диастолической функции и отсутствии обструкции выходного отдела левого желудочка жалоб может не быть, и тогда ГКМП диагностируют случайно. Однако у части больных с достаточно выраженными изменениями сердца симптоматика бывает неопределенной: боли в области сердца ноющие, колющие, достаточно длительные.
При нарушениях ритма сердца появляются жалобы на перебои, головокружения, обморочные состояния, преходящую одышку. В анамнезе не удается связать появление симптомов заболевания с интоксикациями, перенесенной инфекцией, злоупотреблением алкоголем или какими-либо иными патогенными воздействиями.
Ha втором этапе диагностического поиска наиболее существенным служит обнаружение систолического шума, измененного пульса и смещенного верхушечного толчка.
Аускультативно обнаруживают следующие особенности:
• максимум звучания систолического шума (шум изгнания) определяется в точке Боткина и на верхушке сердца;
• систолический шум в большинстве случаев усиливается при резком вставании больного, а также при проведении пробы Вальсальвы;
• II тон всегда сохранен;
• шум не проводится на сосуды шеи.
Пульс примерно у 1/3 больных высокий, скорый, что объясняется отсутствием сужения на путях оттока из левого желудочка в самом начале систолы, но затем, за счет сокращения мощной мускулатуры, появляется «функциональное» сужение путей оттока, что и приводит к преждевременному снижению пульсовой волны.
Верхушечный толчок в 34% случаев имеет «двойной» характер: вначале при пальпации ощущается удар от сокращения левого предсердия, затем от сокращения левого желудочка. Эти свойства верхушечного толчка лучше выявляются в положении больного лежа на левом боку.
На третьем этапе диагностического поиска наибольшее значение имеют данные ЭхоКГ:
• гипертрофия стенки миокарда левого желудочка, превышающая 15 мм, при отсутствии других видимых причин, способных ее вызвать (АГ, клапанные пороки сердца);
• асимметричная гипертрофия межжелудочковой перегородки, более выраженная в верхней трети;
• систолическое движение передней створки митрального клапана, направленное вперед;
• соприкосновение передней створки митрального клапана с межжелудочковой перегородкой в диастолу;
• малый размер полости левого желудочка.
К неспецифическим признакам относят увеличение размеров левого предсердия, гипертрофию задней стенки левого желудочка, уменьшение средней скорости диастолического прикрытия передней створки митрального клапана.
Изменения ЭКГ зависят от выраженности гипертрофии левого желудочка. При незначительной гипертрофии на ЭКГ не обнаруживается каких-либо специфических изменений. При достаточно развитой гипертрофии левого желудочка на ЭКГ могут появляться ее признаки. Изолированная гипертрофия межжелудочковой перегородки обусловливает появление зубца Qувеличенной амплитуды в левых грудных отведениях (V5-V6), что осложняет дифференциальную диагностику с очаговыми изменениями вследствие перенесенного ИМ. Однако зубец 0 неширокий, что позволяет исключить перенесенный ИМ. В процессе эволюции кардиомиопатии и развития гемодинамической перегрузки левого предсердия на ЭКГ могут появляться признаки синдрома гипертрофии левого предсердия: уширение зубца P более 0,10 с, увеличение амплитуды зубца Р, появление двухфазного зубца P в отведении V1 с увеличенной по амплитуде и продолжительности второй фазой.
Для всех форм ГКМП общим симптомом служит частое развитие пароксизмов фибрилляции предсердий и желудочковых аритмий (экстрасистолия и ПТ). При суточном мониторировании (холтеровское мониторирование) ЭКГ эти нарушения ритма сердца хорошо документируются. Наджелудочковые аритмии выявляют у 25-50% больных, у 25% - обнаруживают желудочковую тахикардию.
При рентгенологическом обследовании в развитой стадии болезни могут определяться увеличение левого желудочка и левого предсердия, расширение восходящей части аорты. Увеличение левого желудочка коррелирует с высотой давления в левом желудочке.
На ФКГ амплитуды I и II тонов сохранены (и даже увеличены), что отличает ГКМП от стеноза устья аорты, обусловленного сращением створок клапана (приобретенный порок), а также выявляется систолический шум различной степени выраженности.
Кривая каротидного пульса, в отличие от нормы, двухвершинная, с дополнительной волной на подъеме. Такая типичная картина наблюдается лишь при градиенте давления «левый желудочек-аорта», равном 30 мм рт.ст. При большей степени стеноза вследствие резкого сужения путей оттока на каротидной сфигмограмме определяют только одну пологую вершину.
Инвазивные методы исследования (зондирование левых отделов сердца, контрастная ангиография) в настоящее время не обязательны, так как ЭхоКГ дает вполне достоверную для постановки диагноза информацию. Она позволяет выявить все признаки, характерные для ГКМП.
Сканирование сердца (с радиоизотопом таллия) помогает обнаружить утолщение межжелудочковой перегородки и свободной стенки левого желудочка.
Поскольку у 15-25% больных диагностируют коронарный атеросклероз, то у немолодых лиц с приступами типичных ангинозных болей следует проводить коронарографию, так как эти симптомы, как уже упоминалось, при ГКМП обычно обусловлены самим заболеванием.
Диагностика
Диагноз основан на выявлении типичных клинических проявлений и данных инструментальных методов исследования (в основном УЗИ и ЭКГ).
Для ГКМП наиболее характерны последовательно обнаруживаемые следующие симптомы:
• систолический шум с эпицентром по левому краю грудины в сочетании с сохраненным II тоном; сохранение I и II тонов на ФКГ в сочетании с мезосистолическим шумом;
• выраженная гипертрофия левого желудочка по данным ЭКГ;
• типичные признаки, обнаруживаемые при ЭхоКГ.
В диагностически трудных случаях показаны коронарография и МСКТ сердца с контрастированием. Диагностические сложности обусловлены тем, что отдельно взятые симптомы ГКМП могут встречаться при самых разнообразных заболеваниях. Поэтому окончательный диагноз ГКМП возможен лишь при обязательном исключении следующих заболеваний: стеноза устья аорты (клапанного), недостаточности митрального клапана, ИБС, ГБ.
Лечение
В задачи лечения больных с ГКМП входят:
• обеспечение симптоматического улучшения и продления жизни пациентам путем воздействия на основные нарушения гемодинамики;
• лечение возможной стенокардии, тромбоэмболических и неврологических осложнений;
• уменьшение выраженности гипертрофии миокарда;
• профилактика и лечение аритмий, сердечной недостаточности, предотвращение внезапной смерти.
Вопрос о целесообразности лечения всех пациентов остается дискуссионным. Больным с неотягощенным семейным анамнезом, без выраженных проявлений гипертрофии левого желудочка (по данным ЭКГ и ЭхоКГ), жизнеопасных аритмий показано диспансерное наблюдение с систематическим проведением ЭКГ и ЭхоКГ. Им необходимо избегать значительной физической активности.
Современные возможности лечения больных ГКМП включают медикаментозную терапию (р-адреноблокаторы, блокаторы Са-каналов, антиаритмические препараты, препараты, применяемые для лечения сердечной недостаточности, профилактики тромбоэмболических осложнений и др.), хирургическое лечение у больных с выраженной обструкцией выходного тракта левого желудочка (септальная миэктомия, алкогольная аблация межжелудочковой перегородки) и использование имплантируемых устройств (ИКД и двухкамерные кардиостимуляторы).
Медикаментозное лечение
Препаратами первого ряда в лечении больных с ГКМП выступают р-адреноблокаторы, которые снижают градиент давления (возникающий или усиливающийся при физической нагрузке) и потребность миокарда в кислороде, удлиняют время диастолического наполнения и улучшают наполнение желудочков. Эти препараты могут быть признаны патогенетическими, так как обладают еще и антиангинальным и антиишемическим действиями. Могут использоваться различные р-адреноблокаторы как короткого, так и длительного действия: пропранолол в дозе 40-200 мг/сут, метопролол (метопролол тартрат) в дозе 100-200 мг/сут, бисопролол в дозе 5-10 мг/сут.
У ряда больных, у которых р-адреноблокаторы оказались не эффективны либо их назначение невозможно (выраженная бронхообструкция), могут назначаться антагонисты кальция короткого действия - верапамил в дозе 120-360 мг/сут. Они улучшают расслабление миокарда левого желудочка, увеличивают его наполнение в период диастолы, кроме того, их применение обусловлено отрицательным инотропным действием на миокард желудочков, что приводит к антиангинальному и антиишемическому эффекту.
При наличии нарушений желудочкового ритма и недостаточной антиаритмической эффективности р-адреноблокаторов назначают амиодарон (кордарон) в дозе 600-800 мг/сут в 1-ю нед, затем по 200-400 мг/сут (под контролем холтеровского мониторирования).
При развитии сердечной недостаточности назначают мочегонные препараты (гидрохлоротиазид, фуросемид, торасемид) и антагонисты альдостерона: верошпирон*, спиронолактон (альдактон*) в необходимых дозах.
При обструктивной ГКМП следует избегать применения сердечных гликозидов, нитратов, симпатомиметиков. Хирургическое лечение
Оно показано примерно 5% всех больных с ГКМП, при наличии выраженной обструкции выходного отдела левого желудочка, когда пиковый градиент давления, по данным допплеровского ультразвукового исследования, превышает 50 мм рт.ст. в покое и сохраняется выраженная клиническая симптоматика (синкопальные состояния, одышка, стенокардия, сердечная недостаточность), несмотря на максимально возможную медикаментозную терапию.
• При выполнении септальной миэктомии резецируют небольшой участок миокарда (5-10 г) проксимального отдела межжелудочковой перегородки, начиная от основания аортального фиброзного кольца до дистального края створок митрального клапана. При этом расширяют выходной отдел левого желудочка, устраняют его обструкцию и одновременно ликвидируют относительную недостаточность митрального клапана и митральную регургитацию, что приводит к уменьшению конечно-диастолического давления в левом желудочке и уменьшению застоя в легких. Операционная летальность при выполнении данного хирургического вмешательства невелика, составляет 1-3%.
• Чрескожная транслюминальная алкогольная аблация миокарда межжелудочковой перегородки была предложена в 1995 г. в качестве альтернативы септальной миэктомии. Показания к ее применению такие же, как и для септальной миэктомии. В основе этого метода лежит создание окклюзии одной из септальных ветвей передней межжелудочковой коронарной артерии, кровоснабжающей те отделы межжелудочковой перегородки, которые ответственны за возникновение обструкции выходного отдела левого желудочка и градиента давления. С этой целью в выбранную септальную артерию, используя технику чрескожных коронарных вмешательств (ЧКВ), вводят небольшое (1,0-3,0 мл) количество этанола. Это приводит к возникновению искусственного некроза, т.е. ИМ участка межжелудочковой перегородки, ответственного за формирование обструкции выходного отдела левого желудочка. В результате степень гипертрофии межжелудочковой перегородки уменьшается, выходные отделы левого желудочка расширяются, и градиент давления снижается. Операционная летальность примерно такая же, как и при миэктомии (1-4%), однако у 5-30% больных требуется имплантация кардиостимулятора в связи с развитием предсердно-желудочковой блокады II-III степени.
• Еще один метод хирургического лечения больных с ГКМП - имплантация двухкамерного (предсердно-желудочкового) электрокардиостимулятора. При осуществлении электрической стимуляции из верхушки правого желудочка изменяется нормальная последовательность сокращения различных отделов сердца: первоначально происходят активация и сокращение верхушки сердца и лишь затем с определенной задержкой - активация и сокращение базальных отделов левого желудочка. У части больных с обструкцией выходного отдела левого желудочка это может сопровождаться уменьшением амплитуды движения базальных отделов межжелудочковой перегородки и приводить к уменьшению гради-
ента давления. При этом необходима очень тщательная индивидуальная настройка кардиостимулятора, включающая в себя поиск оптимального значения предсердно-желудочковой задержки. Имплантация двухкамерного кардиостимулятора не является методом первого выбора в лечении больных с ГКМП. Его используют достаточно редко у избранных больных старше 65 лет, с выраженной клинической симптоматикой, резистентных к медикаментозной терапии, у которых невозможно выполнить миэктомию либо чрескожную транслюминальную алкогольную аблацию миокарда межжелудочковой перегородки.
Профилактика внезапной сердечной смерти
Среди всех больных с ГКМП имеется относительно небольшая группа пациентов, характеризующаяся высоким риском внезапной сердечной смерти, обусловленной желудочковыми тахиаритмиями (фибрилляция желудочков, желудочковая тахикардия). К ней относятся следующие пациенты с ГКМП:
• переносившие ранее остановку кровообращения;
• имевшие ранее эпизоды спонтанно возникающей и устойчивой (длительностью более 30 с) желудочковой тахикардии;
• имеющие среди близких родственников лиц, страдавших ГКМП и умерших внезапно;
• страдающие необъяснимыми эпизодами потери сознания (синкопальные состояния), в особенности если это молодые люди, а синкопальные состояния возникают у них повторно и во время физических нагрузок;
• имеющие во время 24-часового холтеровского мониторирования ЭКГ зарегистрированные эпизоды неустойчивой желудочковой тахикардии (3 последовательных желудочковых экстрасистол и более) с частотой более 120 в минуту;
• лица, у которых в ответ на физическую нагрузку, выполняемую в вертикальном положении, развивается артериальная гипотензия, в особенности молодые больные с ГКМП (моложе 50 лет);
• имеющие чрезвычайно резко выраженную гипертрофию миокарда левого желудочка, превышающую 30 мм, особенно молодые пациенты.
По современным представлениям таким больным с ГКМП, имеющим высокий риск внезапной сердечной смерти, в целях ее первичной профилактики показана имплантация кардиовертера-дефибриллятора. Еще более она показана с целью вторичной профилактики внезапной сердечной смерти у больных с ГКМП, уже однажды переносивших остановку кровообращения либо эпизоды спонтанно возникающей и устойчивой желудочковой тахикардии.
Прогноз
Годовая летальность составляет 3-8%, причем внезапная смерть возникает в 50% подобных случаев. Пожилые больные умирают от прогрессирующей сердечной недостаточности, а молодые - внезапной смертью вследствие развития пароксизмов желудочковой тахикардии либо фибрилляции желудочков, реже вследствие ИМ (который может возникнуть и при малоизмененных коронарных артериях). Нарастание обструкции выходного отдела левого желудочка либо снижение его наполнения во время физической нагрузки также могут быть причиной внезапной смерти.
Профилактика
Мероприятия первичной профилактики неизвестны.
АРИТМОГЕННАЯ ПРАВОЖЕЛУДОЧКОВАЯ КАРДИОМИОПАТИЯ
Правожелудочковая аритмогенная кардиомиопатия (АПЖК) - генетически обусловленная первичная кардиомиопатия, которая была описана относительно недавно (около 20 лет назад). Распространенность АПЖК точно не известна, считают, что она встречается с частотой 1\1000-1\10 000 населения, обычно у молодых лиц.
АПЖК характеризуется преимущественным поражением правого желудочка, которое проявляется прогрессирующей гибелью кардиомиоцитов миокарда правого желудочка и замещением их жировой либо фиброзно-жировой тканью, что приводит к возникновению как региональных, так и глобальных нарушений. Возможно вовлечение в патологический процесс также и левого желудочка, в то время как поражение межжелудочковой перегородки относительно редкое.
АПЖК - одна из основных причин внезапной сердечной смерти у лиц моложе 35 лет и лежит в основе 25% смертей у молодых спортсменов.
АПЖК - наследственное заболевание, при этом около 30% случаев наследуются по аутосомно-доминантному принципу с неполной пенетрантностью. На сегодняшний день возникновение аутосомно-доминантного варианта АПЖК связывают с мутациями в следующих генах:
• в генах хромосомы 14 - q23, q24;
• в генах, ответственных за рианодиновые рецепторы RyR2, которые контролируют выход кальция в цитоплазму кардиомиоцитов; они также ответственны за возникновение семейной катехоламинергической полиморфной желудочковой тахикардии (КПЖТ);
• в генах хромосомы 17, ответственных за синтез белков, участвующих в формировании цитосклелета (десмоплакин, плакофиллин-2);
• в генах, контролирующих функцию трансформирующего фактора роста р, который играет определенную роль в процессах воспаления.
Рецессивная форма АПЖК, сочетающаяся с болезнью Наксоса (поражение кожи в виде пальмоплантарной кератодермы и волос в виде «шерстяных волос»), связана с двумя базовыми парными делециями плакоглобина и десмоплакина. Плакоглобин, являясь белковой молекулой межклеточной адгезии, играет важную роль в осуществлении межклеточных соединений и принимает участие в процессе апоптоза.
Клиническая картина
Обычно первыми клиническими проявлениями АПЖК служат желудочковые аритмии, возникающие чаще всего при физических нагрузках и выявляемые в основном у подростков или молодых людей, реже в детском возрасте. У 29% больных АПЖК они проявляются синкопальными состояниями (обмороками), а у 7-23% больных - остановкой кровообращения.
Наиболее частой желудочковой аритмией, встречающейся у больных АПЖК в 70-92% случаев, является мономорфная желудочковая тахикардия с
ЭКГ-картиной блокады левой ножки пучка Гиса. Однако могут наблюдаться и другие желудочковые аритмии, начиная от бессимптомной желудочковой экстрасистолии до полиморфной желудочковой тахикардии с тяжелыми гемодинамическими расстройствами.
При невысокой ЧСС больные могут ощущать лишь чувство сердцебиения. При частоте желудочковой тахикардии свыше 150-160 в минуту, помимо ощущения сердцебиения, нередко возникают головокружения, обмороки, падение АД (аритмогенный коллапс). Приступ желудочковой тахикардии с очень высокой частотой (200 в минуту и более) может трансформироваться в фибрилляцию желудочков и закончиться внезапной сердечной (аритмической) смертью.
Так же как у больных с ГКМП, АПЖК может приводить к развитию хронической сердечной недостаточности, однако чаще она приводит к возникновению внезапной сердечной смерти.
Стратификация риска внезапной сердечной смерти
Наиболее угрожаемыми больными АПЖК в отношении возникновения внезапной сердечной смерти являются пациенты, имеющие:
• отчетливое увеличение размеров правого желудочка;
• сниженную фракцию выброса правого желудочка (<40%);
• наличие гипоили акинезии >3 сегментов либо аневризматического выбухания >2 сегментов миокарда правого желудочка;
• возможность индукции устойчивых желудочковых аритмий с помощью программированной стимуляции сердца во время внутрисердечного ЭФИ.
Лечение
Основная задача в лечении больных с АПЖК - профилактика внезапной сердечной смерти.
Среди лекарственных средств наибольшая эффективность была отмечена у антиаритмического препарата III класса - соталола, в связи с чем он может рассматриваться как препарат первого выбора для профилактики рецидивов желудочковой тахикардии у больных АПЖК.
Однако наиболее надежно профилактика внезапной сердечной смерти у больных АПЖК высокого риска (см. выше) может осуществляться с помощью имплантации кардиовертеров-дефибрилляторов. Имплантация таких устройств показана больным с АПЖК с доказанными эпизодами устойчивой желудочковой тахикардии, особенно если они сопровождаются расстройствами гемодинамики, а также у лиц, однажды уже переносивших остановку кровообращения вследствие желудочковой тахикардии или фибрилляции желудочков с успешной реанимацией.
У больных АПЖК, у которых профилактика внезапной сердечной смерти осуществляется достаточно надежно с помощью ИКД, продолжительность жизни близка к обычной.
Прогноз
Больные с АПЖК не должны принимать участие в спортивных соревнованиях. У здоровых лиц, а также у ближайших родственников больных АПЖК, за-
нимающихся спортивными занятиями, необходимо исключать наличие АПЖК с помощью ЭхоКГ, ЭКГ в 12 отведениях, а при показаниях - с помощью специальных электрофизиологических методов исследования.
Профилактика
Профилактики не существует.
НЕКОМПАКТНЫЙ МИОКАРД ЛЕВОГО ЖЕЛУДОЧКА
Некомпактный миокард левого желудочка (НКМЛЖ) - недавно описанная первичная генетически обусловленная кардиомиопатия, которая характеризуется выраженным губчатым строением внутренней части миокарда левого желудочка, обращенного к его полости. НКМЛЖ возникает вследствие нарушений эмбриогенеза, локализуется в основном в области верхушки левого желудочка и представляет собой глубокие межтрабекулярные углубления, соединяющиеся с полостью левого желудочка. Имеются описания как семейных, так и спорадических случаев НКМЛЖ. НКМЛЖ может быть как единственной патологией, так и сочетаться с другими врожденными аномалиями сердца. Возникновение изолированной формы НКМЛЖ связывают с мутацией гена G4.5, кодирующего синтез таффазина, при этом наследование сцеплено с Х-хромосомой. При сочетании НКМЛЖ с другими врожденными заболевания сердца описаны мутации гена а-дистробревина и транскрипционного фактора NKX2.5.
Клиническая картина
Клиническая картина и естественное течение НКМЛЖ изучены мало. Они включают в себя клинические проявления хронической сердечной недостаточности с систолической дисфункцией левого желудочка, тромбоэмболический синдром, нарушения сердечного ритма и внезапную сердечную смерть.
Диагностика
Диагностика НКМЛЖ базируется на данных двухмерной ЭхоКГ, МРТ, либо рентгеновской томографии сердца, либо на вентрикулографии левого желудочка.
Лечение
Лечение симптоматическое, включает в себя лечение хронической сердечной недостаточности, нарушений ритма сердца и профилактику тромбоэмболических осложнений.
Прогноз
Не определен.
Профилактика
Профилактики не существует.
БОЛЕЗНЬ ПРОВОДЯЩЕЙ СИСТЕМЫ СЕРДЦА (БОЛЕЗНЬ ЛЕНЕГРА)
Болезнь Ленегра - это генетически обусловленная первичная кардиомиопатия, представляющая собой прогрессирующее заболевание проводящей системы сердца, которое характеризуется возникновением и прогрессирующим
развитием нарушений проводимости на уровне системы Гис-Пуркинье. Это приводит расширению комплекса 0RS на ЭКГ, возникновению брадикардии, длительных пауз в работе сердца, что может привести к возникновению синкопальных состояний. Характерен аутосомно-доминантный тип наследования. Данных о характере генетических изменений нет.
Клиническая картина
Клиническими проявлениями болезни Ленегра являются симптомы, характерные для брадиаритмий:
• перебои в работе сердца, редкий пульс;
• синкопальные (обмороки) или пресинкопальные (предобморочные) состояния;
• неврологические симптомы: резкое головокружение, шум в ушах, снижение памяти, нарушения сна;
• симптомы хронической сердечной недостаточности: одышка, снижение толерантности к физическим нагрузкам, периферические отеки, гепатомегалия;
• симптомы коронарной недостаточности: приступы стенокардии.
Диагностика
Диагностика основывается на данных регистрации ЭКГ в покое в 12 отведениях и на результатах холтеровского мониторирования ЭКГ.
Лечение
Основное лечение - это имплантация постоянного кардиостимулятора у больных, имеющих показания для выполнения данного вмешательства (см. главу «Нарушения ритма и проводимости сердца»). Кроме того, по показаниям проводят терапию хронической сердечной недостаточности и других сопутствующих заболеваний.
Прогноз
При своевременной имплантации постоянного кардиостимулятора прогноз хороший .
Профилактика
Профилактики не существует.
ИОННЫЕ КАНАЛОПАТИИ («ЭЛЕКТРИЧЕСКИЕ БОЛЕЗНИ МИОКАРДА»)
Существует целый ряд редких первичных, наследственно обусловленных кардиомиопатий (число которых постоянно увеличивается), проявляющихся преимущественно нарушениями ритма сердца. Эти заболевания сердца получили еще название «электрических болезней миокарда», поскольку они обусловлены мутациями в генах, кодирующих синтез белков клеточных мембран, ответственных за трансмембранные ионные токи Na+ и К+. Эти ионные каналопатии включают в себя синдром длинного интервала Q-T, синдром короткого интервала Q-T, синдром Бругада и КПЖТ.
Синдром длинного интервала Q-T
Синдром длинного интервала Q-T (LQTS) представляет наследственное заболевание, характеризующееся увеличением длительности периода реполяризации желудочков сердца, что проявляется удлинением интервала Q-T на ЭКГ и нередко сопровождается развитием опасных для жизни желудочковых аритмий, в частности полиморфной желудочковой тахикардией типа «пируэт» (torsades de pointes). Синдром длинного интервала Q-T (LQTS) - наиболее часто встречающийся вариант «электрических болезней миокарда».
Этиология
К настоящему времени установлены мутации в 8 генах, кодирующих синтез определенных субъединиц ионных каналов кардиомиоцитов, приводящих к возникновению синдрома длинного интервала Q-T. Пять мутаций генов касаются калиевых каналов мембраны кардиомиоцитов (KCNQ1, KCNH2, KCNE1, KCNE2, KCNJ2), 1 мутация касается натриевых каналов мембраны кардиомиоцитов (SCN5A), 1 мутация касается кальциевых каналов кардиомиоцитов (CACNA1C) и 1 мутация относится к белку анкерину (ANKB), который участвует в прикреплении ионных каналов к мембранам кардиомиоцитов.
В настоящее время выделяют 8 генетически обусловленных вариантов синдрома удлиненного интервала Q-T. При типе LQTS1(синдром ДжеруэллаЛанге-Нилсена) и LQTS2 изменения касаются 2 генов - KCNQ1 и KCNE1, ответственных за синтез структур ионных каналов, обеспечивающих медленный (IKs) и быстрый компонент калиевого тока задержанного выпрямления (IKr). Тип LQTS3 обусловлен изменениями гена SCN5A, кодирующего Na+ токи в кардиомиоцитах. Типы LQTS5 и LQTS6 являются достаточно редкими вариантами синдрома удлиненного интервала Q-T, при которых изменения касаются также калиевых токов IKs и IKr. Тип LQTS7 (синдром Андерсена) связан с изменениями калиевого тока Kir2.1, а тип LQTS8 (синдром Тимоти) - c нарушениями кальциевого тока Са1.2.
Описаны два типа наследования синдрома длинного интервала Q-T: более редкая аутосомно-рецессивная форма, сочетающаяся с врожденной глухотой (синдром Джеруэлла-Ланге-Нилсена), обусловленная мутациями в 2 генах (KCNQ1 и KCNE1) и чаще встречающаяся аутосомно-доминантная форма (синдром Романо-Варда), связанная с мутациями во всех 8 генах.
Клиническая картина
Одним из наиболее характерных кинических проявлений синдрома длинного интервала Q-T являются обморочные состояния, которые обычно впервые возникают в молодом возрасте (5-15 лет). Наиболее грозное клиническое проявление синдрома длинного интервала Q-T - внезапная сердечная смерть, обусловленная развитием фатальных желудочковых тахиаритмий (полиморфная желудочковая тахикардия типа «пируэт», фибрилляция желудочков). При этом отмечают определенную корреляцию между генотипом и фенотипом у больных с синдромом длинного интервала Q-T. Для больных с синдромом длинного интервала Q-T типа LQTS2 специфическим механизмом запуска этих нарушений ритма служат резкие звуковые раздражители, особенно во время сна или отдыха. При синдроме длинного интервала Q-T типа LQTS1 (синдром
Джеруэлла-Ланге-Нилсена) 97% всех внезапных смертей связано с физическими или эмоциональными нагрузками, в то время как при синдроме длинного интервала Q-T LQTS2 и LQTS3 50% всех смертей происходит в покое.
Диагностика
Диагноз длинного интервала 0-T устанавливают на основе регистрации ЭКГ в покое в 12 отведениях и измерении корригированного интервала 0-T (Q-Tc). Обычно величину корригированного интервала Q-Tc автоматически рассчитывает электрокардиограф, регистрирующий ЭКГ. Поскольку величина корригированного интервала Q-Tc прямо зависит от ЧСС, для ее расчета используют формулу Базетта:
Q-T = К х V(R-R),
где Q-T - корригированный интервал, (R-R) - величина интервала в секундах; К - константа, равная для мужчин 0,37, для женщин - 0,40, для детей - 0,38. В диапазоне физиологических частот сердечного ритма (от 60 до 100 в минуту) нормальные значения величины интервала Q-Tc не должны превышать 0,42 с.
Наибольшая вероятность возникновения фатальных желудочковых аритмий у больных с синдромом длинного интервала Q-T наблюдается при увеличении корригированного интервала Q-Tc свыше 600 мс.
Стратификация риска
Стратификация риска базируется в основном на наличии в анамнезе синкопальных состояний, эпизодов полиморфной желудочковой тахикардии типа torsades de pointes и остановок кровообращения.
Лечение
Основная задача лечебных мероприятий - профилактика внезапной сердечной смерти.
Все больные с синдромом удлиненного интервала Q-T должны ограничивать физические нагрузки, в особенности избегать спортивных соревнований. Это положение обязательно для всех больных, имеющих вариант LQTS1. Для лиц, имеющих вариант LQTS3, с определенной осторожностью возможно выполнение некоторых физических нагрузок, исключающих спортивные соревнования.
Крайне важно информировать больных с синдромом удлиненного интервала Q-T, что они должны избегать приема лекарств, способных вызвать удлинение периода Q-T (многие антибиотики, антидепрессанты и др.).
В качестве медикаментозной терапии профилактики внезапной сердечной смерти могут использоваться р-адреноблокаторы. Однако они не способны обеспечить полную защиту и для больных, имевших в анамнезе остановку кровообращения, риск внезапной сердечной смерти остается очень высоким.
Именно поэтому тем больным, у которых, несмотря на прием адекватной дозы р-адреноблокаторов, продолжают возникать обморочные состояния, может выполняться левосторонная симпатэктомия, приводящая к симпатической денервации сердца.
Однако наиболее эффективным способом предупреждения внезапной сердечной смерти у больных с синдромом удлиненного интервала Q-T является имплантация кардиовертеров-дефибрилляторов. Их применение рекоменду-
ется у лиц, перенесших остановку кровообращения, также у детей при наличии синдрома Джеруэлла-Ланге-Нилсена, сопровождающегося клиническими проявлениями заболевания.
Профилактика
Профилактики возникновения синдрома длинного интервала Q-T не существует.
Синдром Бругада
Синдром Бругада - вариант ионной каналопатии, описанный братьями Brugada в 1992 г., относящийся к первичным генетически обусловленным кардиомиопатиям («электрические болезни миокарда»), при которых существует высокая вероятность внезапной сердечной смерти.
В основе заболевания лежит мутация, приводящая к нарушению функции а-субъединицы №+-каналов кардиомиоцитов, кодируемых геном SCN5 (этот же ген ответствен за возникновение синдрома LQTS3). Сообщается также и о мутации в хромосоме 3, однако конкретный ген пока еще не идентифицирован.
Семейные формы синдрома Бругада передаются по аутосомно-доминантному типу наследования.
Клиническая картина
Клинически синдром Бругада характеризуется возникновением синкопальных и пресинкопальных состояний, также развитием внезапной сердечной смерти. Наиболее часто последняя наблюдается у молодых мужчин возрасте 30-40 лет, проживающих в Юго-Восточной Азии (Япония, Тайланд, Филиппины, Камбоджа). Частота остановки кровообращения в течение 3 лет составляет 30% как у лиц с клиническими проявлениями заболевания, так и без них. Причиной внезапной сердечной смерти у больных с синдромом Бругада являются полиморфные желудочковые тахикардии с высокой частотой возбуждения желудочков сердца, возникающие в покое либо во время сна (рис. 2-5).
Диагностика
Диагностика синдрома Бругада основана на характерных изменениях ЭКГ, проявляющихся возникновением преходящей блокады правой ножки пучка Гиса и подъемом сегмента S-T на ЭКГ в отведениях V1-V3 (рис. 2-6).
Лечение
Лечение больных с синдромом Бругада сводится к профилактике внезапной сердечной смерти. К сожалению, ни один из лекарственных препаратов не оказался эффективным для предупреждения внезапной сердечной смерти у больных с синдромом Бругада. Наилучшим методом профилактики внезапной смерти у больных с синдромом Бругада, имевших в анамнезе обморочные состояния либо остановку кровообращения, а также больных без клинических проявлений заболевания, служит имплантация кардиовертера-дефибриллятора.
Профилактика
Профилактики возникновения синдрома Бругада не существует.
Рис. 2-5. Фрагмент холтеровского мониторирования ЭКГ во время возникновения эпизода полиморфной (а) и мономорфной (б) желудочковой тахикардии у больного с синдромом Бругада
Рис. 2-6. ЭКГ больного с синдромом Бругада
Катехоламинергическая полиморфная желудочковая тахикардия
Катехоламинергическая полиморфная желудочковая тахикардия (КПЖТ) - одна из форм ионных каналопатий, относящихся к первичными генетически обусловленным кардиомиопатиям («электрические болезни миокарда).
Причиной возникновения КПЖТ считают возникновение мутации в гене рианодиновых рецепторов сердца человека (hRyR2), расположенном на хромосоме lq42-q43. Рианодиновые рецепторы hRyR2 - ключевой белок, регулирующий высвобождение Са2+ из саркоплазматического ретикулума и сопряжение процессов возбуждения и сокращения в кардиомиоцитах. Заболевание передается по аутосомно-доминантному принципу наследования.
Клиническая картина
Клиническая картина КПЖТ проявляется возникновением обмороков либо предобморочных состояний, выраженных головокружений на фоне приступов сердцебиений. Однако наиболее серьезным клиническим проявлением КПЖТ служит развитие внезапной сердечной смерти. Для больных с КПЖТ характерно возникновение желудочковой аритмии под влиянием адренергической стимуляции при отсутствии каких-либо структурных изменений сердца. Пациенты, страдающие КПЖТ, чаще всего оказываются на приеме у кардиолога в связи с развитием у них синкопальных состояний, при этом примерно у 30% пациентов в семейном анамнезе отмечаются случаи обмороков и внезапной сердечной смерти.
Диагностика
ЭКГ в 12 отведениях, зарегистрированная в покое, может быть неизмененной, за исключением синусовой брадикардии и выраженной волны U у некоторых больных. Во время приступа аритмии на ЭКГ регистрируется картина, свойственная полиморфной желудочковой тахикардии, для которой характерно наличие тахикардии с широкими комплексами QRS и высокой частотой возбуждений желудочков, а также чередование направленности комплексов QRS (рис. 2-7).

Рис. 2-7. Полиморфная желудочковая тахикардия
Синдром короткого интервала Q-T
Синдром короткого интервала Q-T (SQTS) - представляет собой одну из форм ионных каналопатий, относящихся к первичным генетически обусловленным кардиомиопатиям («электрические болезни миокарда»). Этот синдром был описан недавно, в 2000 г., и характеризуется высокой вероятностью внезапной сердечной смерти вследствие жизнеугрожающих желудочковых тахиаритмий (желудочковая тахикардия, фибрилляция желудочков) у лиц без какой-либо органической патологии сердца. Синдром короткого интервала Q-T обусловлен мутациями в генах, контролирующих входящие внутрь клеток калиевые токи IK, Iks, Ikl. В основе синдрома SQT1 лежит мутация в гене KCNH2, синдром SQT2 обусловлен мутацией гена KCNQ1, синдром SQT3 связан с мутацией в гене KCNJ2.
Клиническая картина
Клиническая картина синдрома короткого интервала Q-T складывается из обморочных состояний и развития внезапной сердечной смерти (вследствие внезапно возникающих желудочковых тахиаритмий) при отсутствии какоголибо органического заболевания сердца.
Диагностика
Диагностика синдрома короткого интервала Q-T основана на ЭКГпризнаках, основными из которых служат укорочение корригированного интервала Q-T менее 330 мс (0,33 с), а также выявление высоких заостренных зубцов Т, схожих по морфологии с зубцами Т, регистрирующимися при гиперкалиемии .
Лечение
Лечение больных с синдромом короткого интервала Q-T, у которых возникали синкопальные состояния либо были зарегистрированы эпизоды желудочковых тахиаримтий, сводится к имплантации кардиовертера-дефибриллятора. Медикаментозных способов предупреждения внезапной сердечной (аритмической) смерти у этой категории больных на сегодняшний день не существует.
Профилактика
Профилактики возникновения синдрома короткого интервала Q-T не существует.
ДИЛАТАЦИОННАЯ КАРДИОМИОПАТИЯ
Дилатационная кардиомиопатия (ДКМП) относится к первичным кардиомиопатиям, имеющим смешанное происхождение, т.е. она может быть как генетически обусловленной, так и развиваться под влиянием других, негенетических факторов.
ДКМП характеризуется выраженным расширением камер сердца, преимущественно левого и правого желудочков, в сочетании со снижением их сократительной функции и отсутствием гипертрофии миокарда.
Заболеваемость составляет 1 случай на 2500 человек, при этом болезнь в 2-3 раза чаще встречается у мужчин среднего возраста (30-50 лет).
С течением времени ДКМП приводит к снижению сократительной функции левого и правого желудочков, развитию прогрессирующей сердечной недостаточности, возникновению наджелудочковых (МА) и желудочковых нарушений ритма, нарушений проводимости сердца, возникновению тромбов в полостях сердца с развитием тромбоэмболических осложнений и в конечном итоге - к смерти либо вследствие фатальных желудочковых аритмий (внезапная сердечная смерть), либо вследствие насосной дисфункции сердца.
Примерно у 30% больных отмечена семейная (генетически обусловленная) форма заболевания, при которой преобладает аутосомно-доминантный тип наследования, реже встречаются аутосомно-рецессивные и Х-сцепленные формы ДКМП. Некоторые мутации, приводящие к развитию ДКМП касаются генов, кодирующих синтез таких сократительных белков, как кардиальный а-актин, а-тропомиозин, сердечные тропонины Т и I, тяжелые цепи а- и р-миозина, миозинсвязывающий протеин С и др. При Х-сцепленных формах ДКМП выявляют мутации генов, ответственных за синтез дистрофина, десмина, кавеолина, а- и р-саркогликана.
Существуют и другие причиной развития ДКМП: вирусные инфекции, нередко вызывающие миокардиты (вирусы Коксаки, гепатита С, герпеса, цитомегаловирусы, аденовирусы, парвовирусы, ВИЧ), бактериальные инфекции, риккетсии, микобактерии и паразиты (например болезнь Шагаса, возникающая вследствие инфицирования Trypanosoma cruzi).
Помимо этого к причинам, вызывающим ДКМП, следует отнести ряд интоксикаций: чрезмерное употребление алкоголя (алкогольная форма ДКМП), интоксикации рядом металлов (кобальт, свинец, ртуть, мышьяк), применение химиотерапевтических препаратов (доксорубицин и др.).
ДКМП может развиваться у больных аутоиммунными заболеваниями, в том числе при системных заболеваниях соединительной ткани. Однако примерно в половине случаев этиология ДКМП остается неизвестной (идиопатическая форма).
Патогенез
В результате воздействия этиологических факторов возникает повреждение кардиомиоцитов с уменьшением количества нормально функционирующих мышечных элементов. Это приводит к возникновению и прогрессированию сердечной недостаточности, проявляющейся в значительном снижении сократительной способности миокарда, т.е. развивается систолическая дисфункция желудочков сердца с быстрым развитием дилатации всех его камер. Прогрессирование патологического процесса приводит к критическому снижению насосной функции сердца, повышению конечно-диастолического давления в желудочках, развитию миогенной дилатации полостей сердца с формированием относительной недостаточности митрального и трехстворчатого клапанов. Одновременно происходящая активация нейрогормональных систем регуляции кровообращения (симпатоадреналовой, РААС) приводит к еще большему повреждению сохранившихся кардиомиоцитов (см. раздел «Хроническая сердечная недостаточность»), снижению ударного и минутного объемов сердца, повышению периферического сопротивления и к развитию застойной сердечной недостаточности в малом, а в дальнейшем и в большом круге кровообращения
Нарушается активность свертывающей и противосвертывающей систем крови с развитием внутрисердечных тромбов и последующих системных тромбоэмболий.
Клиническая картина
Заболевание чаще возникает у лиц молодого и среднего возраста. Специфических признаков заболевания нет.
Клиническая картина полиморфна и складывается из:
• симптомов хронической сердечной недостаточности;
• нарушений ритма и проводимости сердца;
• тромбоэмболических осложнений.
Все эти явления развиваются по мере прогрессирования заболевания, поэтому распознавание ДКМП на ранних стадиях представляет значительные трудности. На ранних этапах выявляют лишь начальные признаки сердечной недостаточности (одышку при выраженных физических нагрузках, снижение работоспособности, повышенную утомляемость).
На первом этапе диагностического поиска в ранней стадии заболевания симптомы могут не выявляться. При снижении сократительной функции миокарда появляются жалобы на повышенную утомляемость, одышку при физической нагрузке, а затем в покое. По ночам беспокоит сухой кашель (эквивалент сердечной астмы), позже - типичные приступы удушья. У 10% больных наблюдают характерные ангинозные боли. При развитии застойных явлений в большом круге кровообращения появляются тяжесть в правом подреберье (вследствие увеличения печени), отеки ног.
На втором этапе диагностического поиска наиболее важный признак - значительное увеличение сердца (признаки клапанного порока сердца или АГ отсутствуют). Обнаружение на ранних стадиях болезни кардиомегалии в большей или меньшей степени может быть случайным во время профилактического осмотра или обращения больного к врачу по поводу сердечных жалоб. Кардиомегалия проявляется расширением сердца в обе стороны, определяемым перкуторно, а также смещением верхушечного толчка влево и вниз. В тяжелых случаях при аускультации сердца I тон на верхушке ослаблен, выслушиваются ритм галопа, тахикардия, шумы относительной недостаточности митрального и (или) трехстворчатого клапанов. В 20% случаев развивается МА. АД обычно нормальное или слегка повышено (вследствие сердечной недостаточности).
Остальные симптомы появляются только при развитии сердечной недостаточности и служат ее выражением (холодные цианотичные конечности, набухание шейных вен, отеки, увеличение печени, застойные хрипы в нижних отделах легких, увеличение числа дыханий в минуту).
На третьем этапе диагностического поиска (при отсутствии признаков почечно-печеночной недостаточности при далеко зашедших стадиях хронической сердечной недостаточности) лабораторно никаких изменений выявить не удается.
Инструментальные методы исследования позволяют обнаружить:
• рентгенологические признаки кардиомегалии и застоя в малом круге кровообращения;
• на ЭКГ могут регистрироваться нарушения ритма и проводимости;
• основная диагностически значимая информация может быть получена с помощью ультразвукового исследования сердца.
• ЭхоКГ оказывает существенную помощь в диагностике, выявляя:
- дилатацию желудочков со снижением сердечного выброса;
- снижение движения стенок желудочков;
- парадоксальное движение межжелудочковой перегородки во время систолы;
- в допплеровском режиме можно обнаружить относительную недостаточность митрального и трехстворчатого клапанов.
• Ультразвуковыми диагностическими критериями ДКМП считают снижение фракции выброса левого желудочка менее 45% и увеличение конечнодиастолического размера левого желудочка более 117% от надлежащего (рассчитывают на основании возраста и площади поверхности тела больного).
• Рентгенологически обнаруживают значительное увеличение желудочков (часто в сочетании с умеренным увеличением левого предсердия). Развивающиеся вследствие левожелудочковой недостаточности нарушения в малом круге кровообращения проявляются усилением легочного сосудистого рисунка, а также появлением транссудата в плевральных (чаще в правой) полостях.
• На ЭКГ не отмечают каких-либо характерных изменений или сдвиги носят неспецифический характер. К ним относят признаки гипертрофии левого желудочка и левого предсердия; нарушения проводимости в виде блокады передней ветви левой ножки предсердно-желудочкового пучка (пучка Гиса) или полной блокады левой ножки (15% случаев); уплощение зубца Т в левых грудных отведениях; мерцание предсердий. Некоторые сложности возникают при появлении патологических зубцов Q в грудных отведениях, что заставляет заподозрить перенесенный ранее ИМ. При морфологическом исследовании миокарда в таких случаях обнаруживают множество мелких рубчиков (не являющихся следствием коронарного атеросклероза).
• ФКГ подтверждает аускультативные данные в виде ритма галопа, довольно частого обнаружения систолического шума (вследствие относительной недостаточности митрального или трехстворчатого клапана). При застойных явлениях в малом круге кровообращения выявляют акцент II тона.
• Дополнительные инструментальные исследования не являются обязательными для постановки диагноза, однако их результаты позволяют детализировать степень расстройств гемодинамики и характер морфологических изменений миокарда.
• Исследование показателей центральной гемодинамики выявляет низкий минутный и ударный объем (минутный и ударный индексы), повышение давления в легочной артерии.
• Ангиокардиографически обнаруживают те же изменения, что и на ЭхоКГ.
• Биопсия миокарда позволяет проводить дифференциальный диагноз ДКМП со вторичными кардиомиопатиями, протекающими с выраженной кардиомегалией. При вторичных кардиомиопатиях в биоптатах можно обнаружить признаки миокардита, васкулита, болезней накопления (гемохроматоза, амилоидоза) и др.:
- при тяжелых диффузных миокардитах обнаруживается клеточная инфильтрация стромы в сочетании с дистрофическими и некротическими изменениями кардиомиоцитов;
- при первичном амилоидозе, протекающем с поражением сердца (так называемый кардиопатический вариант первичного амилоидоза), наблюдается значительное отложение амилоида в интерстициальной ткани миокарда, сочетающееся с атрофией мышечных волокон;
- при гемохроматозе (заболевание, обусловленное нарушением обмена железа) в миокарде находят отложения железосодержащего пигмента, наблюдают различной степени дистрофию и атрофию мышечных волокон, разрастание соединительной ткани.
Диагностика
Ключевой момент в диагностике ДКМП - исключение других причин развитиях сердечной недостаточности.
Распознавание ДКМП представляет существенные трудности, так как значительное увеличение сердца с отсутствием или наличием сердечной недостаточности встречается с большей или меньшей частотой при других заболеваниях сердца. Среди этих заболеваний - диффузные миокардиты тяжелого течения, ИБС (постинфарктный кардиосклероз с развитием аневризмы сердца), приобретенные пороки сердца в стадии тотальной сердечной недостаточности, ГБ далеко зашедших стадий, болезни накопления (гемохроматоз, первичный амилоидоз с преимущественным поражением сердца).
Лечение
Основное лечение ДКПМ - борьба с развивающейся застойной сердечной недостаточностью, что осуществляется по общим принципам (см. раздел «Хроническая сердечная недостаточность»).
Прежде всего, это касается общих мероприятий, касающихся ограничения физической активности, употребляемого количества жидкости до 1,5 л и поваренной соли до 1-2 г/сут.
Высокоэффективны ингибиторы АПФ: каптоприл в дозе 25-100 мг/сут, эналаприл 2,5-20 мг/сут, рамиприл 1,25-10 мг/сут, периндоприл по 4-8 мг/сут, лизиноприл 10-20 мг/сут. При назначении этих препаратов следует учитывать величину АД, так как они снижают его. Для того чтобы избежать возникновения гипотонии, лечение начинают с небольших доз и, убедившись в отсутствии выраженного гипотензивного эффекта, дозу препарата увеличивают.
В комплексную медикаментозную терапию хронической сердечной недостаточности целесообразно включать (при их переносимости) р-адреноблокаторы. С этой целью могут использоваться как селективные р-адреноблокаторы (метопролол, бисопролол, небиволол), так и неселективные (карведилол). При этом начальная доза р-адреноблокатора должна быть очень низкой с последующим постепенным ее увеличение до достижения максимально переносимой либо так называемой «целевой» дозы (см. раздел «Хроническая сердечная недостаточность»).
Больным с признаками задержки жидкости в огранизме (застой в легких, периферические отеки, гепатомегалия, асцит, анасарка) должны назначать мо-
чегонные препараты. Преимущество отдают петлевым диуретикам - фуросемиду, торасемиду. Доза препарата и частота приема колеблются в зависимости от стадии недостаточности кровообращения. Рекомендуют начинать лечение с небольших доз: фуросемид 20-40 мг утром натощак 1-3 раза в неделю.
Дигоксин назначают при сочетании клинической картины выраженной сердечной недостаточности (II-IV класс NYHA) и МА в обычных дозах (при этом следует иметь в виду, что при ДКМП может быстро развиться дигиталисная интоксикация, поэтому контроль приема препарата должен быть строгим).
При ДКМП можно проводить трансплантацию сердца. Основные показания - тяжелая застойная сердечная недостаточность и отсутствие эффекта от лекарственной терапии.
РЕСТРИКТИВНАЯ КАРДИОМИОПАТИЯ
Рестриктивная кардиомиопатия (РКМП) - это редкая форма заболевания сердца, которая приводит к развитию хронической сердечной недостаточности и характеризуется уменьшенным (либо нормальным) объемом обоих желудочков, неизмененным клапанным аппаратом, нормальной толщиной стенок левого желудочка и нормальной (либо почти нормальной) его фракцией выброса при одновременном нарушении процесса диастолического наполнения левого желудочка по рестриктивному типу и при увеличении объемов обоих предсердий.
РКМП относится к первичным кардиомиопатиям, имеющим смешанное происхождение. Этиология ее неизвестна, описаны как спорадические, так и семейные формы этого заболевания.
Раньше к РКМП относили эндомиокардиальный фиброз и гиперэозинофильный эндокардит Леффлера. В настоящее время поражение сердца при этих заболеваниях, так же как и при многих других, рассматривают как вторичные кардиомиопатии (см. классификацию кардиомиопатий).
Патогенез
При РКМП нарушены диастолическое наполнение желудочков в виде укорочения времени изометрического расслабления желудочков и уменьшение позднего наполнения желудочков (в период систолы предсердий). Эти нарушения, а также часто развивающаяся недостаточность трехстворчатого клапана обусловливают нарастание сердечной недостаточности (часто при малых размерах сердца).
Клиническая картина
Проявления болезни чрезвычайно полиморфны, они определяются симптомами нарушения кровообращения в малом или большом круге (в зависимости от преимущественного поражения правого или левого желудочка).
На первом этапе диагностического поиска не всегда можно получить необходимую информацию для постановки диагноза, так как жалобы или отсутствуют, или обусловлены застойными явлениями в малом или большом круге кровообращения.
На втором этапе диагностического поиска могут выявляться симптомы застойной недостаточности сердца разной степени выраженности. Большее значение имеет обнаружение увеличения сердца, мягкого позднего систоличе-
ского шума и громкого раннего III тона (обусловленного быстрым наполнением желудочков во время диастолы). Может обнаруживаться симптом Куссмауля - увеличение набухания яремных вен на фазе глубокого вдоха.
На третьем этапе диагностического поиска обычно не обнаруживают признаки увеличения сердца при рентгенологическом исследовании. На ЭКГ отмечают неспецифические изменения зубца Т, блокаду левой (реже - правой) ножки пучка Гиса. При ЭхоКГ отмечают уменьшение полости левого желудочка, укорочение времени изоволюмического расслабления (признаки нарушения диастолической функции левого желудочка). При допплеровской ЭхоКГ отмечают увеличение пика раннего наполнения, уменьшение пика позднего предсердного наполнения желудочков и увеличение отношения раннего наполнения к позднему. Кроме того, выявляют быстрое движение передней створки митрального клапана во время диастолы и быстрое раннее движение задней стенки левого желудочка наружу.
При исследовании параметров центральной гемодинамики определяют повышенное давление заполнения в обоих желудочках, причем конечное давление в левом превышает аналогичный показатель в правом желудочке.
При вентрикулографии наблюдают усиленно сокращающийся левый желудочек или оба желудочка, гладкие контуры их стенок, иногда с дефектом заполнения в области верхушки, отражающим ее облитерацию. В некоторых случаях определяются вдавления в области сосочковых мышц. Отмечаются признаки недостаточности митрального или трехстворчатого клапана.
Диагностика
Распознавание РКМП чрезвычайно трудно. С уверенностью о данной патологии можно говорить при исключении синдромально сходных заболеваний, прежде всего констриктивного перикардита с признаками нарушения кровообращения в большом круге, а также пороков сердца (митрально-трикуспидальный порок). Предположение о РКМП может возникнуть при обнаружении умеренного увеличения сердца (иногда - нормальных величин сердца) в сочетании с признаками сердечной недостаточности, которые нельзя объяснить никакими иными причинами. Из этого следует, что необходимо провести ряд дополнительных методов исследования. Ранние стадии болезни могут быть выявлены при зондировании сердца и обнаружении повышенного конечного диастолического давления в левом желудочке. В настоящее время с помощью допплерографии можно выявить нарушения, возникающие в период диастолы. Обнаруживают увеличение пика раннего наполнения, уменьшение пика позднего наполнения, увеличение отношения раннего наполнения к позднему. Помощь в установлении диагноза оказывает также и ангиокардиография.
Лечение
Лечение, как правило, симптоматическое и направлено на уменьшение застойных явлений в малом и большом круге кровообращения. Используют в небольших дозах диуретики (гидрохлоротиазид в дозе 50 мг/сут), вазодилататоры (изосорбида динитрат и изосорбида мононитрат по 20-60 мг в сутки), непрямые антикоагулянты. Диуретики и периферические вазодилататоры в больших дозах могут ухудшить состояние. Сердечные гликозиды не применя-
ют. Выраженные стадии сердечной недостаточности - показание к трансплантации сердца.
Прогноз
Летальность в течение 2 лет составляет 35-50%. РКМП может осложниться тромбоэмболией, аритмиями, прогрессированием сердечной недостаточности.
ПРИОБРЕТЕННЫЕ ПЕРВИЧНЫЕ КАРДИОМИОПАТИИ Миокардит (воспалительная кардиомиопатия)
Согласно существующей сегодня классификации кардиомиопатий (см. ранее), к первичным кардиомиопатиям приобретенного характера, при которых преимущественно либо изолированно поражается мышца сердца, относится воспалительная кардиомиопатия, синонимом которой служит миокардит.
Миокардит - это острое или хроническое воспалительное поражение миокарда. Может быть вызвано широким спектром инфекционных агентов (вирусы, бактерии, грибы, паразиты и др.), токсинов, лекарственных препаратов (антибиотики, сульфаниламиды, противовоспалительные и противосудорожные препараты и т.д.). Персистирующий процесс воспаления, протекающий в миокарде, приводит к некрозу кардиомиоцитов, разрушению их цитоскелета, замещением миокарда фиброзной тканью и в конечном итоге заканчивается развитием ДКМП с выраженной систолической дисфункцией левого желудочка.
Клинические варианты миокардитов, их клиническая картина, диагностические критерии, а также возможность лечения подробно рассматриваются в разделе «Неревматический миокардит» данного учебника.
Стресс-индуцируемая кардиомиопатия (кардиомиопатия «tako-tsubo»)
Стресс-индуцируемая кардиомиопатия (кардиомиопатия «тако-тсубо») - относительно недавно выявленный вариант первичной приобретенной кардиомиопатии, которая впервые была описана в Японии. По-японски «такотсубо» называется «ловушка для осьминогов» (рис. 2-8), по своей форме очень напоминающая форму левого желудочка, которую он принимает у больных с этим синдромом. Кардиомиопатия «тако-тсубо» характеризуется остро возникающей, но быстрообратимой систолической дисфункцией левого желудочка, которая провоцируется выраженным психоэмоциональным стрессом при отсутствии атеросклеротических поражений коронарных артерий. Наиболее часто стресс-индуцируемой кардиомиопатией страдают пожилые женщины без коронарного атеросклероза. На рисунке 2-9 представлена вентрикулограмма больного стресс-индуцируемой кардиомиопатией.
Точная причина возникновения стресс-индуцируемой кардиомиопатии не установлена.
Клиническая картина
Клиническая картина напоминает ОКСпST (см. раздел «Острые коронарные синдромы») .
Рис. 2-8. «Ловушка для осьминогов»
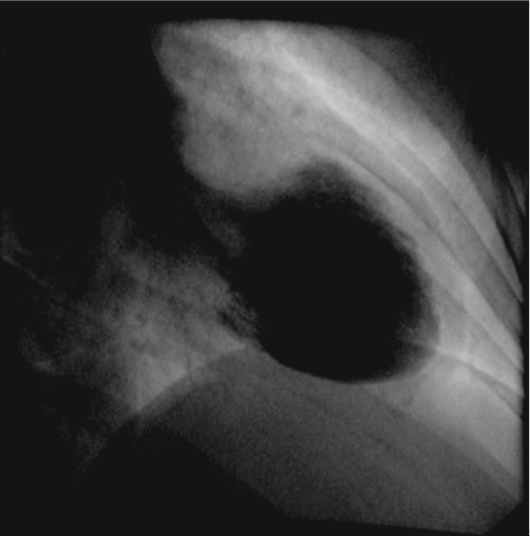
Рис. 2-9. Вентрикулограмма левого желудочка сердца у больного со стресс-индуциро ванной кардиомиопатией («тако-тсубо»)
Диагностика
Инструментальная диагностика базируется на данных ЭхоКГ, выполненной на фоне болевого синдрома и изменений ЭКГ, которые напоминают таковые при ОКСпST (см. раздел «Острые коронарные синдромы»). Поскольку возникающая при стресс-индуцируемой кардиомиопатии зона оглушенного миокарда обычно захватывает верхушку левого желудочка, то при ЭхоКГ и при рентгеноконтрастной вентрикулографии выявляют ее парадоксальное движение, так называемое «баллонирование» верхушки левого желудочка с одновременно выраженным гиперкинезом базальных отделов левого желудочка.
Лечение
Основа медикаментозной терапии - р-адреноблокаторы. В остальном терапия симптоматическая (антикоагулянты, антитромбоцитарные препараты).
Профилактика
Профилактика стресс-индуцируемой кардиомиопатии не изучена.
Послеродовая кардиомиопатия
Послеродовая кардиомиопатия - редкая форма приобретенных кардиомиопатий, которая проявляется дилатацией и систолической дисфункцией левого желудочка с развитием клинической картины хронической сердечной недостаточности.
Причины ее возникновения не установлены, однако известно, что клинически она проявляется в III триместре беременности либо в первые 5 мес после родов.
Наиболее часто послеродовая кардиомиопатия возникает у полных повторнородящих старше 30 лет, у которых отмечалась преэклампсия.
У половины женщин с послеродовой кардиомиопатией в течение первых 6 мес от начала заболевания отмечают полное или почти полное выздоровление. Однако возможно прогрессирование заболевания с исходом в терминальную стадию хронической сердечной недостаточности.
Вторичные кардиомиопатии
При вторичных кардиомиопатиях вовлечение миокарда в патологический процесс происходит в рамках большого спектра часто встречающихся генерализованных системных (мультиорганных) заболеваний.
Клиническая картина и клиническое течение вторичных кардиомиопатий, их диагностические критерии, способы диагностики и лечения во многом будут зависеть от того конкретного заболевания, которое привело к поражению миокарда.
НЕЙРОЦИРКУЛЯТОРНАЯ ДИСТОНИЯ
Нейроциркуляторная дистония (НЦД) - заболевание структурно-функциональной природы, проявляющееся разными сердечно-сосудистыми, респираторными и вегетативными расстройствами, астенизацией, плохой переносимостью стрессовых ситуаций и физических нагрузок. Заболевание течет волнообразно, однако имеет хороший жизненный прогноз, так как при нем не развиваются кардиомегалия и сердечная недостаточность.
Термин «структурно-функциональное» заболевание означает, что болезнь проявляется в основном функциональными расстройствами, но при этом обязательно есть морфологический субстрат в виде патологии субклеточных структур. Эти изменения выявляют лишь при электронно-микроскопическом исследовании, тогда как при обычной световой микроскопии, а тем более макроскопически, никаких изменений не выявляется (Д.С. Саркисов, 1997).
В большинстве случаев НЦД выступает самостоятельной нозологической единицей. Однако в части случаев НЦД следует рассматривать как синдром, если ее признаки встречаются при каком-то другом заболевании (например, при АГ, заболеваниях щитовидной железы, тонкой кишки, расстройствах, вызванных воздействием токов сверхвысокой частоты, а также при заболеваниях прочих органов и систем).
НЦД - очень распространенное заболевание, в общей структуре сердечнососудистых заболеваний эта патология составляет 32-50%. Встречается у людей самого разного возраста (преимущественно у женщин), однако дебют болезни чаще наблюдается у молодых лиц.
Этиология
Причины развития болезни точно не установлены. НЦД - полиэтиологическое заболевание. Многочисленность и переплетение различных причин создают значительные трудности в выявлении ведущих. В настоящее время можно говорить лишь о вероятной причине болезни. Среди этиологических факторов выделяют предрасполагающие и вызывающие, причем их разграничение достаточно сложно и может быть только условным.
Предрасполагающими факторами служат наследственно-конституциональные особенности организма, особенности личности; неблагоприятные социально-экономические условия; периоды гормональной перестройки организма.
Вызывающие факторы - это психогенные (острые и хронические психоэмоциональные стрессы, ятрогения), физические и химические (переутомление, гиперинсоляция, ионизирующая радиация, вибрация, гиподинамия, хронические интоксикации, злоупотребление алкоголем), дисгормональные (периоды гормональной перестройки, беременность, аборт, дизовариальные расстройства), инфекция (хронический тонзиллит, хроническая инфекция верхних дыхательных путей, острые или рецидивирующие респираторные заболевания). Однако во время болезни предрасполагающие факторы могут стать пусковыми. В периоды обострений болезни эти факторы могут быть различными у одного и того же больного.
Патогенез
Различные внешние и внутренние воздействия ведут к нарушению на любом уровне сложной нейрогормонально-метаболической регуляции сердечнососудистой системы, причем ведущим звеном становится поражение гипоталамических структур, осуществляющих координаторно-интегративную роль. Патологическое влияние на эти структуры может осуществляться двояким путем: через кору головного мозга (в результате расстройств высшей нервной деятельности) и вследствие непосредственного воздействия различных патогенных факторов. Существенную роль играет и наследственно-конституциональный фактор в виде функциональной недостаточности регулирующих структур мозга или чрезмерной их реактивности.
Нарушения регуляции проявляются, прежде всего, дисфункцией симпатикоадреналовой и холинергической систем и изменением чувствительности соответствующих периферических рецепторов. Расстройства гомеостаза выражаются также в нарушении гистамин-серотониновой, калликреин-кининовой систем, водно-электролитного обмена, кислотно-основного состояния, углеводного обмена. Резко нарушается кислородное обеспечение физической нагрузки, что приводит к снижению напряжения кислорода в тканях, в результате чего энергообеспечение организма происходит в основном за счет анаэробных
механизмов. При физической нагрузке быстро возникают ацидотические сдвиги за счет увеличения в крови уровня лактата.
В тканях, особенно в миокарде, активизируются так называемые тканевые гормоны (гистамин, серотонин и др.), приводящие к расстройству метаболизма и развитию дистрофии. Также при НЦД возникают нарушения микроциркуляции.
Расстройство нейрогормонально-метаболической регуляции сердечнососудистой системы реализуется в неадекватном реагировании ее на обычные и тем более сверхсильные раздражители. Это выражается в неадекватности тахикардии, колебании тонуса сосудов, неадекватной нагрузке росту минутного объема сердца, регионарных спазмах сосудов.
Расстройства регуляции в покое могут оставаться бессимптомными, однако различные нагрузки (физическая нагрузка, гипервентиляция, ортостатическое положение, введение симпатомиметических средств) четко указывают на «дефекты» функционирования сердечно-сосудистой системы.
Классификация
Общепринятой классификации в настоящее время нет. Рабочая классификация НЦД, учитывающая этиологические формы, особенности клинических проявлений и степень тяжести заболевания, представлена в табл. 2-5.
Таблица 2-5. Рабочая классификация нейроциркуляторной дистонии

Клиническая картина
Из классификации вытекает, что клиническая картина болезни чрезвычайно полиморфна, выраженность симптоматики очень вариабельна. С другой стороны, симптомы НЦД напоминают признаки других заболеваний сердечнососудистой системы, что в ряде случаев затрудняет ее распознавание.
На первом этапе диагностического поиска выявляют наиболее важную для диагноза информацию. Жалобы больных чрезвычайно разнообразны. Больные жалуются на боли разнообразного характера в области сердца: ноющие, колющие, жгучие, распирающие. Продолжительность их весьма разнообразна: от мгновенных («прокалывающих») до монотонных, длящихся часами и сутками. Боли могут иррадиировать в левую руку и лопатку. Обычно преобладает прекардиальная или верхушечная локализация, однако часто боли локализуются чуть ниже левой подключичной области или парастернально, а иногда загрудинно.
Часто отмечается «миграция» болей. Наиболее часто возникновение болей связывают с переутомлением, волнением, изменениями погоды, приемом алкоголя. У женщин боли иногда возникают в предменструальный период.
Ряд больных связывают появление боли с переноской тяжести в левой руке. Боли могут появляться ночью во время кошмарных сновидений, а также во время вегетативных пароксизмов, сопровождающихся сердцебиением и повышением АД.
Особого внимания требует связь болевых ощущений с физической нагрузкой. Эта связь прослеживается у многих лиц, однако она иная, чем при стенокардии. В частности, боли возникают обычно не во время, а после физического напряжения или длительной ходьбы. Когда больной заявляет, что боль появляется при ходьбе, обычно оказывается, что болевые ощущения не возникают, а усиливаются; как правило, боль не требует остановки и не прекращается сразу после нее.
Болям в области сердца при НЦД обычно сопутствуют тревога, беспокойство, снижение настроения, слабость. Приступообразная и сильная боль сопровождается страхом и вегетативными нарушениями (нехватка воздуха, сердцебиение, потливость, чувство внутренней дрожи). Слабая и умеренная боль не требует приема лекарственных средств и проходит самостоятельно. Однако при сильной боли больные охотно принимают лекарственные препараты: большинство предпочитают валокордин, поскольку прием нитроглицерина не купирует боли (в этом существенное отличие болей при НЦД от болей при ИБС).
Часть больных предъявляют жалобы на учащенное поверхностное дыхание (больные неверно называют это одышкой), чувство затрудненного вдоха, желание периодически глубоко вдыхать воздух («тоскливый вздох»).
Стертая форма дыхательных расстройств проявляется чувством «комка» в горле или «сдавлением» горла, больной не может находиться в душных помещениях, возникает потребность постоянно открывать окна, выходить на улицу. Эти ощущения сами по себе довольно тягостные, нередко сопровождаются головокружением, сердцебиениями, чувством тревоги, боязнью задохнуться, умереть. Врач далеко не всегда правильно трактует эти нарушения, расценивая их как сердечную или легочную недостаточность либо даже как бронхиальную астму.
Больные предъявляют жалобы на сердцебиение, ощущение усиленных сокращений сердца, иногда сопровождающиеся чувством пульсации сосудов шеи, головы, появляющиеся в момент нагрузки или волнения, а иногда в покое, ночью, что мешает сну. Сердцебиение провоцируется волнением, физическим усилием, приемом пищи, длительным пребыванием в вертикальном положении, гипервентиляцией.
У многих больных отмечается астенический синдром в виде чувства физической слабости, постоянной усталости, что сопровождается снижением настроения. Отмечается снижение физической работоспособности.
Периферические сосудистые нарушения проявляются головной болью, «мельканием мушек» перед глазами, головокружениями, чувством похолодания конечностей. Больные могут сообщить об отмечающихся ранее колебаниях АД.
Больные НЦД плохо переносят резкие перепады температуры окружающей среды; они плохо чувствуют себя в холодных помещениях, зябнут. Жару переносят тоже плохо, она вызывает обострение субфебрилитета от нескольких дней до многих месяцев. Обычно это следует за какой-либо инфекцией, чаще
всего острым респираторным заболеванием или гриппом, и совпадает с обострением основных жалоб. Температура тела не превышает 37,2-37,7 °С и не сопровождается появлением острофазовых лабораторных показателей.
Вегетативно-сосудистые кризы (так называемые «панические атаки») проявляются по ночам дрожью, ознобом, головокружением, потливостью, чувством недостатка воздуха, дурноты, безотчетным страхом. Такие состояния длятся от 20-30 мин до 2-3 ч и нередко заканчиваются частым обильным мочеиспусканием, иногда жидким стулом. Они купируются самостоятельно или после приема лекарственных препаратов (обычно седативных). После криза остаются чувство слабости, тревоги, боли в области сердца. Кризы могут повторяться от 1-3 раз в неделю до 1-2 раз в месяц, иногда бывают реже.
Больные отмечают снижение умственной работоспособности, быструю утомляемость. Часть из них предъявляют жалобы на различные диспептические явления: рвоту, обусловленную расстройствами моторной функции желудка или истерического происхождения, отрыжку воздухом, икоту. У некоторых больных развивается анорексия, они теряют массу тела. Могут быть боли в животе разнообразной локализации и выраженности.
Болезнь начинается по-разному: у половины больных бурно, с большим числом симптомов, так что они могут довольно определенно назвать время ее начала; у остальных симптоматика нарастает постепенно, медленно, и больные не в состоянии указать точное время начала заболевания. Острота начала болезни зависит во многом от пускового фактора, а также от ведущего клинического синдрома. Например, при переутомлении и хронической психической травме заболевание начинается постепенно, тогда как после острого психического стресса возможно острое начало.
Больные могут сообщить, что ранее им ставили самые различные диагнозы. Так, в юношеском возрасте начало заболевания рассматривалось как проявление «ревмокардита» или «порока сердца». В последующем наиболее часто диагностировали «инфекционно-аллергический миокардит», а в дальнейшем - ИБС и даже ИМ и ГБ. Тем не менее при расспросе выявляют достаточно доброкачественное течение болезни с периодическими ремиссиями и обострениями. Обнаруживают также различные проявления болезни в тот или иной период: могут доминировать боли в области сердца или респираторные расстройства, в другой период - астеноневротический синдром или вегетативные кризы.
Таким образом, на первом этапе диагностического поиска можно получить самые разнообразные сведения, характерные для НЦД.
На втором этапе диагностического поиска отмечают весьма скудные данные физического обследования больного.
Внешний вид больных НЦД очень разный: некоторые напоминают страдающих тиреотоксикозом (блестящие глаза, тревожность, тремор пальцев), другие, напротив, унылы, с тусклым взором, адинамичны. Часто отмечают повышенную потливость ладоней, подмышечных впадин, «пятнистую» гиперемию кожи лица, верхней половины грудной клетки (особенно у женщин), усиленный смешанный дермографизм. Конечности у таких больных холодные, иногда бледные, синюшные.
Можно отметить частое поверхностное дыхание, больные преимущественно дышат ртом (в связи с чем у них сохнут слизистые оболочки верхних ды-
хательных путей). Многие женщины с НЦД не могут сделать форсированный выдох.
При осмотре области сердца и крупных сосудов обнаруживается усиленная пульсация сонных артерий как проявление гиперкинетического состояния кровообращения. Пальпаторно в прекардиальной области, особенно в третьем-четвертом межреберье по срединно-ключичной линии и слева по окологрудинной линии, определяют участки болезненности межреберных мышц (в 50% случаев), как правило, в периоды обострения болезни. Эта гипералгезия, вероятно, обусловливается реперкуссивными влияниями, исходящими из раздраженных вегетативных образований сердца.
Размеры сердца у больных НЦД не изменены. При аускультации сердца нередко у левого края грудины и на основании его выслушивают дополнительный тон в систоле (в начале ее - тон изгнания, а в конце - систолический щелчок). Наиболее частым аускультативным признаком служит систолический шум (приблизительно в 70% случаев). Этот шум слабый или умеренный, максимум звучания в третьем-четвертом межреберье у левого края грудины; нередко шум распространяется на сосуды шеи.
Основными причинами шума выступают гиперкинетическое состояние кровообращения и ускорение тока крови, у части больных шум обусловлен пролапсом митрального клапана. Отмечается выраженная лабильность пульса: легкость возникновения тахикардии при эмоциях и незначительных физических нагрузках, при ортостатическом положении и учащенном дыхании. У многих больных разница пульса в горизонтальном и вертикальном положении может составлять 100-200% от исходного. АД очень лабильное, поэтому на результаты его однократного измерения не следует полагаться. Очень часто при первом измерении обнаруживают некоторое повышение верхней границы нормы, но уже через 2-3 мин давление возвращается в пределы нормального. Часто определяют асимметрию АД на правой и левой руке.
Патологических изменений других органов и систем при физическом исследовании выявить не удается.
Таким образом, данные второго этапа, не выявляя каких-либо типичных признаков НЦД тем не менее позволяют отвергнуть ряд диагностических предположений (например, пороки сердца, легочную и сердечную недостаточность).
Основной задачей третьего этапа диагностического поиска является исключение заболеваний, имеющих сходную симптоматику с НЦД.
• При общеклиническом и биохимическом исследовании крови не получают острофазовых показателей и показателей измененной иммунологической реактивности. Это позволяет исключить воспалительные заболевания сердца, и прежде всего ревмокардит.
• При рентгенологическом обследовании выявляют нормальные размеры камер сердца и крупных сосудов, что исключает клапанные поражения.
• Большое значение придают электрокардиографии. При записи ЭКГ в состоянии покоя у больных НЦД в 30-50% случаев регистрируют изменения конечной части желудочкового комплекса в виде снижения амплитуды зубца Т, его сглаженности и даже негативизации. Измененные зубцы Т
обнаруживают чаще в правых грудных отведениях, иногда во всех грудных отведениях («синдром тотальной негативности Т»). Редко (5-8% случаев) отмечают суправентрикулярную экстрасистолию, а также расстройства автоматизма. Расстройства ритма обусловлены преимущественно различными эмоциональными факторами. Изменения зубца Т у больных НЦД весьма лабильны: даже в процессе регистрации ЭКГ можно наблюдать изменения его полярности. Эти сдвиги конечной части желудочкового комплекса могут быть объяснены изменениями нейрогуморальной регуляции сердца (преобладание адренергических влияний). Стойкие изменения ЭКГ объясняются развивающейся со временем миокардиодистрофией. Учитывая, что изменения зубца Т наблюдают при многих органических заболеваниях сердца, необходимо провести ряд функциональных тестов, позволяющих понять природу этих изменений.
- Проба с дозированной физической нагрузкой (велоэргометрия) обнаруживает реверсию негативного зубца Т при отсутствии признаков ишемии миокарда (горизонтальная или косонисходящая депрессия сегмента ST величиной 1 мм и более), что позволяет исключить ИБС. При проведении этой пробы выявляют характерный для НЦД признак - снижение толерантности к физической нагрузке. Больной НЦД в состоянии выполнить значительно меньшую нагрузку, чем здоровый человек того же пола и возраста. Толерантность к физической нагрузке определяет тяжесть течения болезни.
- Для дифференциации природы измененного зубца Т проводят лекарственные тесты - калиевый и с р-адреноблокаторами. После приема 6 г хлорида калия или 60-80 мг пропранолола регистрируют ЭКГ через 40 мин и 1,2 ч. При НЦД зубец Т становится положительным, в случаях же органического поражения сердца (миокардит, гипертрофия миокарда, ИБС), обусловливающего негативный зубец Т, положительной динамики не наблюдается.
- Показательны при НЦД физиологические пробы с гипервентиляцией и ортостатическая. При регистрации после гипервентиляции (серия форсированных быстрых вдохов и выдохов в течение 30-45 с) или сразу после 10-15-минутного пребывания обследуемого в вертикальном положении у больных с НЦД на ранее не измененной ЭКГ появляются негативные зубцы Т, быстро становящиеся позитивными. При органических заболеваниях сердца пробы с гипервентиляцией и ортостатическим положением отрицательные.
• При регистрации ФКГ появляется дополнительный тон в систоле, а также нерезко выраженный систолический шум. Эти изменения могут зависеть от наблюдающегося нередко при НЦД пролапса створки митрального клапана в полость левого предсердия - в связи с нарушением тонуса сосочковой мышцы (вследствие измененной регуляции координированного сокращения различных отделов сердца). На ФКГ отсутствуют признаки того или иного порока сердца, что учитывают при проведении дифференциальной диагностики.
• При ЭхоКГ необходимо исключить клапанный порок сердца. При наличии пролапса митрального клапана на эхокардиограмме определяются
характерные признаки последнего (у больных НЦД пролапс обнаруживается в 17-20% случаев), точно так же нередко выявляют дополнительные хорды в полости левого желудочка. Не все лабораторно-инструментальные исследования обязательны для постановки диагноза НЦД, но их данные помогают понять патогенез отдельных проявлений болезни.
• Исследование функции внешнего дыхания обнаруживает увеличение минутного объема дыхания, снижение жизненной емкости легких; форсированная жизненная емкость также снижается. Признаки бронхиальной обструкции не обнаруживаются. У больных НЦД отмечается пониженное усвоение кислорода, что объясняет сниженную толерантность к физической нагрузке.
• Исследование функции симпатико-адреналовой системы выявляет повышение ее активности: в ответ на физическую нагрузку неадекватно повышается уровень адреналина, норадреналина, их предшественников и метаболитов. Эти нарушения обусловливают также неадекватное увеличение содержания молочной кислоты в периферической крови. Подобные изменения метаболизма углеводов хорошо объясняют снижение физической работоспособности больных НЦД.
• При исследовании параметров центральной гемодинамики различными методами (с помощью радиоизотопов, ЭхоКГ) обнаруживают гиперкинетическое состояние кровообращения: увеличение минутного объема сердца в сочетании с умеренным понижением периферического сосудистого сопротивления. Могут регистрироваться неизмененные параметры гемодинамики, однако при проведении исследования после дозированной физической нагрузки также наблюдается неадекватный прирост минутного объема (гиперкинетический тип реакции аппарата кровообращения на нагрузку).
• При исследовании психического статуса можно выявить признаки депрессии, выраженной в различной степени.
Течение
Тяжесть течения НЦД определяется комплексом различных параметров: выраженность тахикардии, частота вегетативно-сосудистых кризов, болевой синдром, толерантность к физической нагрузке.
• Легкое течение: сохраненная трудоспособность, незначительное снижение толерантности к физической нагрузке (по данным велоэргометрического исследования), умеренно выраженный болевой синдром, возникающий только после значительных психоэмоциональных и физических нагрузок, отсутствие вегетативно-сосудистых пароксизмов; неадекватная тахикардия развивается в ответ на эмоции и физические нагрузки; респираторные нарушения выражены слабо или отсутствуют. ЭКГ изменена незначительно. Потребности в лекарственной терапии обычно нет.
• Среднетяжелое течение: длительно существуют множественные симптомы, снижена или временно утрачена трудоспособность, существует необходимость проведения лекарственной терапии. Болевой синдром обычно стойкий, возможны вегетативно-сосудистые пароксизмы. Тахикардия
возникает спонтанно, достигая 100-120 в минуту. Физическая работоспособность (по данным велоэргометрического исследования) снижена более чем на 50%.
• Тяжелое течение характеризуется стойкостью множественных проявлений болезни. Выражены болевой синдром, респираторные нарушения, частые вегетативно-сосудистые кризы. Резко снижена физическая работоспособность; трудоспособность резко снижена или утрачена.
Диагностика
Распознавание болезни основывается:
• на выявлении симптомов, достаточно часто встречающихся при данном заболевании;
• исключении заболеваний, имеющих сходную симптоматику. При постановке диагноза НЦД учитывают следующее:
• множественность и полиморфность жалоб больного, преимущественно касающихся сердечно-сосудистых нарушений;
• длительный анамнез, указывающий на волнообразное течение болезни, усиление всей симптоматики во время обострения;
• доброкачественность течения (сердечная недостаточность и кардиомегалия не развиваются);
• диссоциацию между данными первого и второго этапа диагностического поиска (при многочисленных жалобах больного его непосредственное обследование позволяет обнаружить небольшое количество неспецифических симптомов).
Учитывая, что симптоматика НЦД напоминает многие заболевания, выделяют исключающие диагноз НЦД признаки:
• увеличение сердца;
• диастолические шумы;
• ЭКГ-признаки крупноочаговых изменений:
- блокада левой ножки предсердно-желудочкового пучка или блокада правой ножки, развившаяся в период заболевания;
- предсердно-желудочковая блокада II-III степени;
- ЖПТ;
- постоянная МА;
- горизонтальная или нисходящая депрессия сегмента ST на 2 мм и более, возникающая при велоэргометрическом исследовании или в момент приступа болей в области сердца либо за грудиной;
• острофазовые показатели и показатели изменений иммунологической реактивности, если они не связаны с какими-либо сопутствующими заболеваниями;
• застойная сердечная недостаточность.
Дифференциальная диагностика
Дифференцируют НЦД от целого ряда заболеваний.
• ИБС исключают, если жалобы больных и результаты инструментального исследования не характерны для данной патологии. Так, при ИБС типичные сжимающие загрудинные боли появляются во время физической
нагрузки, купируются нитроглицерином, а при проведении велоэргометрической пробы или теста частой предсердной стимуляции отмечают типичную ишемическую депрессию сегмента ST.
• Неспецифический (инфекционно-аллергический) миокардит исключают при отсутствии характерных для этого заболевания признаков (увеличение размеров сердца, признаки снижения сократительной функции миокарда, нарушения ритма и проводимости, неспецифические изменения зубца Т). Кроме того, для миокардита не характерны вегетативно-сосудистые кризы, а также полиморфизм симптомов.
• ОРЛ и ревматические пороки исключают при отсутствии прямых признаков порока (выявляют с помощью аускультации и ЭхоКГ). При НЦД отсутствуют острофазовые показатели, показатели нарушений иммунной реактивности, суставной синдром, присущие активной фазе ревматизма.
• Кардиомиопатии (без заметной кардиомегалии и застойной сердечной недостаточности) исключают после проведения ЭхоКГ.
Формулировка развернутого клинического диагноза учитывает рубрики, указанные в рабочей классификации НЦД:
• этиологическая форма заболевания (если это возможно выявить);
• ведущие клинические синдромы;
• тяжесть течения.
Лечение
Все лечебные мероприятия при НЦД предусматривают:
• воздействие на этиологические факторы;
• воздействие на звенья патогенеза;
• общеукрепляющие мероприятия;
• воздействие на этиологические факторы:
- учитывая, что в развитии НЦД играют роль многочисленные факторы внешней среды, следует стремиться к нормализации образа жизни и исключению влияния на организм патогенных факторов. При легких формах заболевания это дает хороший эффект;
- определенное значение имеет ятрогения: категорические врачебные заключения о наличии у больных тех или иных заболеваний (например, ИБС, миокардита, порока сердца и пр.) способствуют закреплению симптоматики. Больной перестает верить в выздоровление, посещает разных врачей, подвергается многочисленным обследованиям;
- проведение рациональной психотерапии имеет существенное значение в осознании больным существа болезни, в убеждении благоприятного исхода ее;
• воздействие на звенья патогенеза:
- нормализация корково-гипоталамических и гипоталамо-висцеральных взаимосвязей:
первая задача решается с помощью индивидуально подобранной терапии, включающей седативные, транквилизирующие препараты, а также небольшие дозы антидепрессантов. Такой подбор целесо-
образно проводить терапевту и психоневрологу. При легких формах болезни лечение дает стойкий положительный эффект; - снижение активности симпатико-адреналовой системы и уменьшение клинических эффектов гиперкатехоламинемии:
активность симпатико-адреналовой системы снижают назначением р-адреноблокаторов: метопролола, бетаксолола, бисопролола. Эти средства особенно эффективны при вегетативно-сосудистых кризах симпатико-адреналового типа, а также при болевом синдроме и проявлениях гиперкинетического состояния кровообращения. Ликвидируются тахикардия, неприятные ощущения в области сердца; повышенное АД нормализуется. Под влиянием р-адреноблокаторов существенно повышается толерантность к физической нагрузке. Эти препараты нормализуют и ряд обменных сдвигов, имеющих значение в патогенезе болезни и происхождении ряда симптомов: при физической нагрузке не происходит неадекватного повышения содержания молочной кислоты в крови, чрезмерного возрастания минутного объема сердца, не возникает выраженной тахикардии при пробе с гипервентиляцией. Дозу р-адреноблокатора подбирают индивидуально, с учетом чувствительности к препарату. В периоды улучшения состояния препарат может быть отменен или существенно уменьшают дозу;
кроме р-адреноблокаторов можно назначать верапамил в общепринятых дозах (40-120 мг/сут). Имеется опыт благоприятного действия симпатолитиков центрального действия - стимуляторов 1-имидазо- линовых рецепторов (рилменидин в дозе 0,5-1 мг/сут);
при наличии на ЭКГ-признаков нарушения реполяризации (изменение сегмента ST и зубца Т) можно использовать препараты, улучшающие метаболические процессы (триметазидин);
• общеукрепляющие мероприятия. Из мероприятий общего порядка проводят занятия ЛФК; необходимы правильное трудоустройство, оздоровление образа жизни, в том числе запрещение курения и приема алкоголя. Хороший эффект дает иглорефлексотерапия;
• у части пациентов существенную помощь оказывает назначение антидепрессантов (тианептин).
Прогноз
При НЦД прогноз благоприятный: не развиваются кардиомегалия, сердечная недостаточность или опасные для жизни нарушения ритма и проводимости. НЦД не рассматривают как преморбидное состояние ИБС или ГБ. Больные трудоспособны, и лишь во время обострения трудоспособность может снижаться или временно утрачиваться.
Профилактика
Препятствуют развитию НЦД здоровый образ жизни с достаточными физическими нагрузками, правильное воспитание в семье, борьба с очаговой инфекцией, у женщин - регулирование гормональных нарушений в период климакса.
Необходимо избегать чрезмерных психоэмоциональных перегрузок, запрещаются курение и прием алкоголя.
ГИПЕРТОНИЧЕСКАЯ БОЛЕЗНЬ
Гипертоническая болезнь (ГБ), называемая также эссенциальной гипертензией, - заболевание, характеризующееся уровнем АД >140/90 мм рт.ст., что обусловлено суммой генетических и внешних факторов и не связано с какимилибо самостоятельными поражениями органов и систем (так называемые вторичные гипертензии, при которых АГ выступает одним из проявлений болезни). В основе ГБ лежит срыв нормальной неврогенной и (или) гуморальной регуляции сосудистого тонуса с постепенным формированием органических изменений сердца и сосудистого русла.
ГБ, в отличие от вторичных (симптоматических) гипертензий, характеризуется длительным течением, непостоянством величины АД, стадийностью развития, хорошим эффектом гипотензивной терапии.
ГБ - одно из наиболее распространенных заболеваний сердечнососудистой системы. ГБ страдают в мире 22,9% в развивающихся странах и 37,3% - в развитых. В России лиц с повышенным АД среди женщин - 40,4%, среди мужчин - 37,2%. С возрастом распространенность увеличивается и достигает 50-65% у лиц старше 65 лет. До 50-летнего возраста ГБ чаще бывает у мужчин, после 50 лет - у женщин. Вторичные гипертензии составляют 5-10% всех случаев АГ.
Классификация
Согласно рекомендациям ЕОГ/ВНОК (2003) в настоящее время приняты следующие нормативы АД у здоровых лиц (табл. 2-6).
Таблица 2-6. Величины АД у здоровых лиц

ГБ, согласно рекомендациям экспертов ВОЗ (1978), разделяется на 3 стадии (в основу классификации положены наличие и выраженность поражения внутренних органов):
• I стадия - отсутствуют объективные признаки поражения внутренних органов (так называемых органов-мишеней), имеется лишь повышение АД.
• II стадия - имеется, по крайней мере, один из следующих признаков поражения органов-мишеней:
- гипертрофия левого желудочка (подтвержденная данными рентгенографии, ЭКГ, ЭхоКГ);
- распространенное и локализованное сужение артерий (в частности, артерий глазного дна);
- протеинурия и (или) незначительное повышение концентрации креатинина в плазме крови (106,08-176,8 мкмоль/л при норме 44- 115 мкмоль/л);
- ультразвуковое или радиологическое подтверждение наличия атеросклеротических бляшек (сонные артерии, аорта, подвздошные и бедренные артерии).
• III стадия - наличие комплекса признаков поражения органов-мишеней:
- сердце - стенокардия, ИМ, сердечная недостаточность;
- мозг - преходящее нарушение мозгового кровообращения, энцефалопатия, мозговой инсульт;
- глазное дно - кровоизлияние в сетчатку и экссудаты с отеком диска зрительного нерва и без него;
- почки - повышение концентрация креатинина в плазме, хроническая почечная недостаточность;
- сосуды - расслоение аневризмы, окклюзионное поражение артерий. Эта классификация, широко распространенная в России, удачно дополняется данными другой классификации, предложенной в 2003 г. (ЕОГ/ВНОК) и основанной на учете степени повышения АД, что оказалось весьма удобным при проведении популяционных исследований, а также при определении степени риска развития сердечно-сосудистых осложнений у конкретного больного (особенно если повышение АД было выявлено впервые) (табл. 2-7).
Таблица 2-7. Классификация степени повышения АД
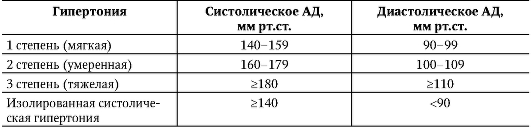
По характеру прогрессирования симптомов, степени поражения органов, стабильности АГ и эффективности лечения выделяют:
• доброкачественную ГБ - медленно прогрессирующую (наиболее частый вариант);
• злокачественную ГБ - систолическое АД >220 мм рт.ст. и диастолическое АД >130 мм рт.ст. в сочетании с быстро развивающимися поражениями органов-мишеней (в частности, с нейроретинопатией); этот вариант встречается в настоящее время редко.
Существует также понятие «обезглавленная АГ», когда систолическое АД =<140 мм рт.ст., а диастолическое АД >=100 мм рт.ст., а также «изолированная систолическая АГ», когда систолическое АД >140 мм и диастолическое АД <90 мм рт.ст. (эта форма чаще встречается у лиц пожилого возраста).
Если ГБ протекает с частыми резкими подъемами АД, то говорят о «ГБ кризового течения».
Этиология
Причины развития ГБ все еще неясны. Среди факторов, способствующих развитию заболевания, выделяют следующие:
• наследственно-конституциональные особенности (возможно, связанные с патологией клеточных мембран);
• нервно-психическую травматизацию (острую или хроническую) - эмоциональный стресс;
• профессиональные вредности (шум, постоянное напряжение зрения, внимания);
• особенности питания (перегрузка поваренной солью, дефицит кальция);
• возрастная перестройка диэнцефально-гипоталамических структур мозга (в период климакса);
• травмы черепа;
• интоксикации (алкоголь, курение);
• нарушение жирового обмена (избыточную массу тела).
В возникновении ГБ велика роль отягощенной наследственности. На ее фоне перечисленные факторы в различных сочетаниях или в отдельности могут играть этиологическую роль.
Патогенез
Как известно, уровень АД определяется соотношением сердечного выброса крови и периферического сосудистого сопротивления. Повышение АД может быть следствием:
• роста периферического сопротивления, обусловленного спазмом периферических сосудов;
• увеличения минутного объема сердца вследствие интенсификации его работы или возрастания внутрисосудистого объема жидкости (обусловленного задержкой натрия в организме);
• сочетания увеличенного минутного объема и повышения периферического сопротивления.
В нормальных условиях рост минутного объема сочетается со снижением периферического сопротивления, в результате чего АД не повышается.
Таким образом, регуляция АД определяется оптимальным соотношением прессорной и депрессорной систем организма.
• К прессорной системе относят:
- симпатико-адреналовую (САС);
- РААС;
- систему антидиуретического гормона (вазопрессин);
- систему простагландина F2a и циклических нуклеотидов;
- эндотелин-1.
• Депрессорная система включает:
- аортокаротидную зону (рефлексы с которой ведут к снижению АД);
- систему депрессорных простагландинов;
- калликреин-кининовую систему (в частности, брадикинин);
- предсердные натрийуретические пептиды;
- эндотелийзависимый релаксирующий фактор (прежде всего оксид азота).
При ГБ имеется рассогласование прессорной и депрессорной систем в виде различных сочетаний повышения активности прессорной и снижения активности депрессорной систем (рис. 2-10).
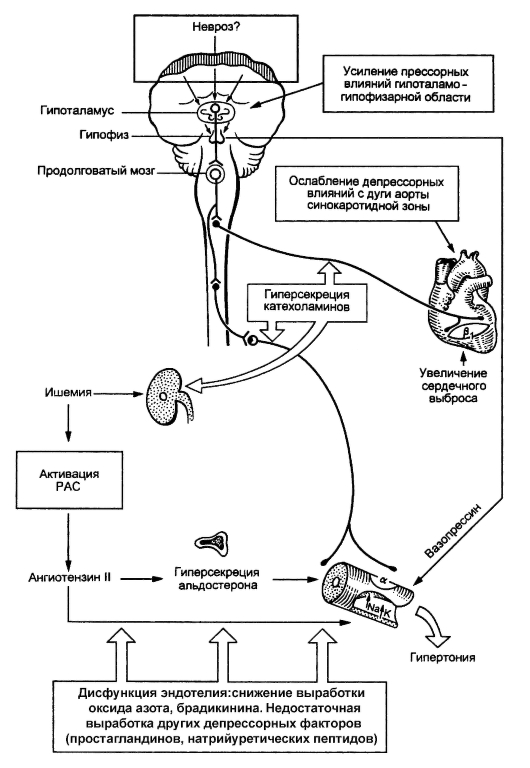
Рис. 2-10. Схематическое изображение патогенеза гипертонической болезни
По не вполне ясным причинам у больных ГБ повышается прессорная активность гипоталамо-гипофизарной зоны, что ведет к гиперпродукции катехоламинов (повышенная активность симпатико-адреналовой системы), о чем свидетельствует повышение суточной экскреции с мочой норадреналина, что еще в большей степени возрастает в условиях физического и эмоционального стресса. Результатом активации симпатико-адреналовой системы являются следующие изменения, обусловливающие рост АД:
• периферическая веноконстрикция сопровождается увеличением притока крови к сердцу и сердечного выброса;
• возрастает число сердечных сокращений, что в сочетании с увеличенным ударным объемом также ведет к увеличению сердечного выброса;
• возрастает общее периферическое сопротивление сосудов за счет активации р1-рецепторов периферических артериол (рис. 2-11).
Существенное место среди прессорных факторов занимает активация РААС. Образуемый печенью ангиотензиноген под влиянием ренина, вырабатываемого почкой, трансформируется в ангиотензин I. Ангиотензин I под влиянием АПФ преобразуется в очень мощный прессорный агент - ангиотензин II.
Повышенная продукция ренина выступает следствием двух причин:
• непосредственного воздействия катехоламинов на клетки, вырабатывающие ренин;
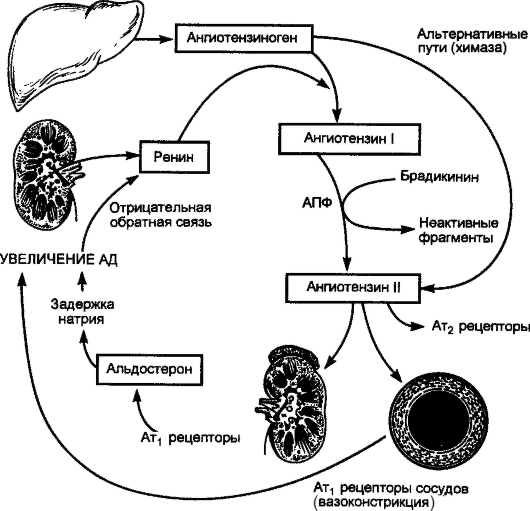
Рис. 2-11. Ренин-ангиотензиновая система при гипертонической болезни (подробное объяснение в тексте)
• ишемии почки, обусловленной спазмом почечных сосудов под влиянием катехоламинов, что ведет к гипертрофии и гиперплазии юкстагломерулярного аппарата (ЮГА), вырабатывающего ренин.
Повышенное содержание ангиотензина II в плазме крови вызывает длительный спазм гладкой мускулатуры периферических артериол и резкое увеличение общего периферического сосудистого сопротивления.
Роль ангиотензина II в патогенезе ГБ исключительно велика, так как кроме прямого прессорного влияния он обусловливает развитие и других патологических процессов - гипертрофию и фиброз миокарда левого желудочка, гипертрофию гладких мышечных волокон сосудов, способствует развитию нефросклероза, повышению реабсорбции натрия и воды, высвобождению катехоламинов из мозгового слоя надпочечников. Весьма существенно, что кроме повышения уровня ангиотензина II в кровяном русле повышается его содержание в тканях, так как существуют так называемые тканевые ренин-ангиотензиновые системы. Наконец, кроме классического пути образования ангиотензина II путем воздействия АПФ на ангиотензин I, существуют так называемые альтернативные пути, когда ангиотензин I превращается в ангиотензин II с помощью других ферментов (например, химазы), а также нерениновый путь образования ангиотензина II.
Ангиотензин II оказывает влияние и на другие прессорные системы:
• вызывая жажду, он ведет к повышенной выработке вазопрессина, обусловливающего спазм сосудов и задержку жидкости в организме;
• активирует выработку альдостерона - гормона коры надпочечников, обусловливающего задержку в организме натрия и воды (увеличение массы циркулирующей крови);
• ангиотензин II также обладает пролиферативным влиянием на клетки гладкой мускулатуры сосудов, обусловливая изменение их структуры (так называемое ремоделирование сосудов), что в еще большей мере ведет к росту общего периферического сосудистого сопротивления.
Длительному спазму артериол способствует повышенное содержание ионов Са2+ в цитозоле гладкомышечных волокон, что связано с наследственно обусловленными особенностями транспорта ионов через полупроницаемые мембраны.
Повышение активности прессорных факторов сочетается с ослаблением депрессорных влияний с дуги аорты и синокаротидной зоны, уменьшением выработки кининов, недостаточной активацией выработки предсердного натрийуретического и эндотелийзависимого релаксирующего факторов (оксида азота), уменьшением выделения простагландинов, обладающих депрессорным влиянием, и простациклина, уменьшением выработки ингибитора ренина - фосфолипидного пептида. Снижение выработки депрессорных факторов связывают с так называемой эндотелиальной дисфункцией, когда под влиянием ряда факторов (в частности, АГ) эндотелий начинает продуцировать преимущественно прессорные факторы.
Большое значение в развитии АГ имеют снижение чувствительности тканей к действию инсулина и связанная с этим гиперинсулинемия.
Следует помнить, что АД становится стабильно повышенным тогда, когда развивается так называемое ремоделирование периферических (резистивных) сосудов - уменьшение просвета сосуда в результате увеличения комплекса
«интима-медиа», что может являться следствием пролиферативного эффекта ангиотензина II.
Независимо от преобладающего нейрогуморального механизма повышения АД, развивается поражение «органов-мишеней» - сердца (гипертрофия и фиброз миокарда с изменением формы левого желудочка - так называемое ремоделирование сердца), сосудов (гипертрофия гладких мышечных волокон с последующим изменением соотношения медиа-просвет сосуда), артериолосклерозом почек (нефроангиосклероз). Именно от состояния этих органов зависят течение и исход ГБ.
Клиническая картина
Проявления ГБ определяются рядом факторов:
• степенью повышения АД (уровень и устойчивость АД);
• стадией развития (состояние органов-мишеней);
• вариантом течения;
• наличием (отсутствием) гипертонических кризов и особенностями их проявлений;
• патогенетическим вариантом.
Как уже упоминалось, выделяют злокачественное и доброкачественное течение болезни. Доброкачественный вариант отмечается у преобладающего числа больных, тогда как злокачественный вариант крайне редок.
• Доброкачественный вариант ГБ характеризуется:
- медленным прогрессированием;
- волнообразным чередованием периодов ухудшения и улучшения;
- медленно развивающимся поражением сердца, сосудов головного мозга, сетчатки глаз и почек;
- эффективностью лекарственной терапии;
- достаточно четкой стадийностью течения;
- развитием осложнений на поздних стадиях болезни.
• Злокачественный вариант характеризуется:
- быстрым прогрессированием болезни;
- стойким повышением АД до очень высоких цифр (>220/130 мм рт.ст.) с самого начала заболевания;
- ранним развитием выраженных изменений сосудов и органов, свойственных обычно конечным стадиям ГБ;
- малой эффективностью терапевтических мероприятий;
- быстрым летальным исходом (через 1-2 года после появления первых симптомов) при отсутствии активного целенаправленного лечения.
При злокачественном варианте ГБ наблюдается тяжелое поражение глазного дна в виде отека сетчатки и дисков зрительных нервов, геморрагии; часто возникают гипертоническая энцефалопатия, нарушение мозгового кровообращения (в том числе и мозговой инсульт), рано развиваются органические изменения в сосудах почек типа артериосклероза и артериолонекроза, что приводит к хронической почечной недостаточности.
Большое значение имеет оценка общего сердечно-сосудистого риска, степень которого зависит от сопутствующих факторов риска, поражения
органов-мишеней и ассоциированных клинических состояний (по сути, ослож нений ГБ).
• Факторы риска
- Основные:
величина пульсового АД (у пожилых);
мужчины старше 55 лет; женщины старше 65 лет;
курение;
дислипидемия (общий ХС >6,5 ммоль/дл (>250 мг/дл), или ХС ЛПНП >4,0 ммоль/л (>155 мг/дл), или ХС ЛПВП <1,0 ммоль/л (40 мг/дл) для мужчин и <1,2 ммоль/л (48 мг/дл) для женщин;
семейный анамнез ранних сердечно-сосудистых заболеваний (у женщин моложе 65 лет, у мужчин моложе 55 лет);
абдоминальное ожирение (окружность талии >102 см для мужчин и >88 см для женщин при отсутствии метаболического синдрома).
- Дополнительные факторы риска, негативно влияющие на прогноз больного ГБ:
нарушение толерантности к глюкозе;
малоподвижный образ жизни;
повышение уровня фибриногена.
• Поражение органов-мишеней
- Гипертрофия левого желудочка (ЭКГ-, ЭхоКГ-признаки).
- Ультразвуковые признаки атеросклеротических бляшек или утолщение стенки артерии (толщина слоя интима-медия >0,9 мм).
- Скорость пульсовой волны от сонной до бедренной артерии >12 м/с.
- Лодыжечно-плечевой индекс <0,9.
- Низкая скорость клубочковой фильтрации <60 мл/мин (MDRD- формула) или низкий клиренс креатинина <60 мл/мин (формула Кокроф та-Гаулта).
- Небольшое повышение уровня креатинина (1,3-1,5 мг/дл для мужчин или 1,2-1,4 мг/дл для женщин).
- Микроальбуминурия:
30-300 мг/сут;
соотношение альбумин\креатинин в моче >22 мг/г для мужчин и >31 мг/г для женщин.
- Сахарный диабет:
глюкоза плазмы натощак >7,0 ммоль/л (126 мг/дл) при повторных измерениях;
глюкоза плазмы после еды или через 2 ч после приема 75 г глюко- зы* >11,0 ммоль/л (198 мг/дл).
• Ассоциированные (сопутствующие) клинические состояния (по существу, ассоциированные состояния являются осложнением ГБ)
- Цереброваскулярные заболевания:
ишемический, геморрагический инсульт;
преходящее нарушение мозгового кровообращения.
- Заболевания сердца:
ИМ, стенокардия, коронарная реваскуляризация, хроническая сердечная недостаточность.
- Поражение почек:
диабетическая нефропатия (при сочетании АГ и сахарного диабета);
почечная недостаточность;
протеинурия (>300 мг/сут).
- Заболевания периферических артерий:
расслаивающаяся аневризма аорты;
клинические признаки поражения периферических артерий.
- Гипертоническая ретинопатия (кровоизлияния или экссудаты, отек диска зрительного нерва).
- Сахарный диабет:
глюкоза крови натощак >126 мг/дл;
глюкоза плазмы крови после еды или через 2 ч после приема 75 г глю- козы* >198 мг/дл.
В зависимости от степени повышения систолического АД, пола, возраста, курения, уровня холестерина у больных ГБ (при отсутствии ИБС) может быть проведена экспресс-оценка уровня риска. Для Российской Федерации по системе стратификации SCORE (Systematic COronary Risk Evaluation - шкала оценки риска смертельного сердечно-сосудистого заболевания в течение десяти лет) оценивается только риск от заболеваний, связанных с атеросклерозом, в течение ближайших 10 лет:
• низкий уровень риска - менее 5%;
• средний уровень риска - 5-9%;
• высокий уровень риска - 10-14%;
• очень высокий уровень риска - >15%.
Систему стратификации SCORE целесообразно использовать как предварительную с последующим уточнением величины риска по методу стратификации, основанному на Фремингемской модели лишь после проведения полного дополнительного (клинико-инструментального и биохимического) обследования больного.
Вероятность развития сердечно-сосудистых осложнений и смерти от них в течение ближайших 10 лет составляет при низком риске <15%, среднем риске - 15-20%, высоком риске - 20-30%, очень высоком риске - >30%.
В таблице 2-8 представлена стратификация риска у больных ГБ при условии полного обследования (включая УЗИ сердца и сосудов).
Различия величин риска (в процентах) в модели SCORE и Фремингемской модели обусловлены тем, что в последней более полно учтены изменения органов, развивающиеся при ГБ, а также наличие сахарного диабета и метаболического синдрома (центральное или андроидное ожирение в сочетании с нарушениями липидного и углеводного обменов).
На первом этапе диагностического поиска полученная информация позволяет выявить сам факт повышения АД или же сделать предположение о возможности АГ, а также предположительно определить стадию развития болезни, оценить эффективность проводимой терапии. Вместе с тем следует помнить, что весьма часто больные, несмотря на несомненное повышение АД, никаких жалоб могут и не предъявлять и даже не знать, что у них повышено АД (согласно международным исследованиям, лишь 35-60% людей знают о наличии у них АГ).
Таблица 2-8. Стратификация риска у больных с гипертонической болезнью
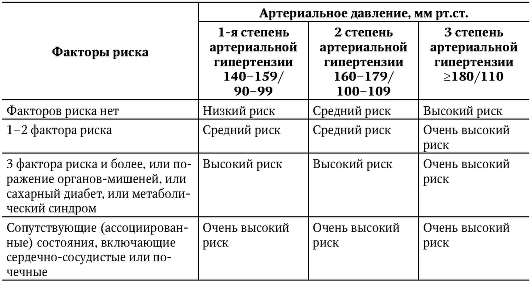
• Появление жалоб на повышенную утомляемость, нервозность, головную боль, плохой сон, снижение работоспособности свидетельствует о выраженности функционального компонента (невротические симптомы), а при длительном существовании болезни - о возможном присоединении атеросклероза сосудов головного мозга. Головная боль - один из симптомов АГ и длительное время может быть единственным (но и необязательным) признаком ГБ.
• Боли в области сердца у больного ГБ имеют разнообразный генез. Их возникновение часто совпадает с резким повышением АД (гипертоническими кризами). Типичные приступы стенокардии у пожилых пациентов при длительной ГБ в большинстве случаев обусловлены развитием ИБС.
• Жалобы больного на ощущение «перебоев» в работе сердца, указание на наличие тех или иных симптомов сердечной недостаточности (одышка, удушье, отеки, увеличение печени) характерны для одного из осложнений ГБ. Появление экстрасистолии на фоне длительного приема мочегонных средств может быть результатом побочного действия салуретиков.
• Стабильно высокое диастолическое давление в сочетании с тяжелым поражением сосудов глазного дна и азотемией, трудно поддающееся лекарственной терапии, необходимо дифференцировать от симптоматической (нефрогенной) гипертензии.
• Раннее развитие церебральных и кардиальных нарушений (мозговой инсульт, ИМ, нарушение зрения), признаков хронической почечной недостаточности при наличии АГ присуще злокачественному течению ГБ. Течение АГ с кризами более характерно для ГБ, нежели для почечной гипертензии, но не позволяет исключить наличие, в частности, симптоматической гипертензии при феохромоцитоме (достоверный диагноз устанавливают после проведения специальных исследований на третьем этапе диагностического поиска).
• Длительное течение ГБ без развития осложнений, эффективность медикаментозной терапии, позволяющей поддерживать АД на уровне нормы, свидетельствуют о доброкачественном течении ГБ.
• Оценку эффективности проводимой ранее терапии осуществляют с целью дальнейшего подбора оптимальной гипотензивной терапии.
На втором этапе диагностического поиска можно выявить следующие факты, необходимые для постановки диагноза:
V основной диагностический критерий - повышение АД;
V гипертрофию миокарда левого желудочка и другие изменения со стороны сердца;
V симптомы заболеваний, сопровождающих АГ;
V осложнения ГБ.
Во многих случаях начало ГБ остается незамеченным, так как ранние подъемы АД, как правило, не сопровождаются субъективной симптоматикой. На I стадии ГБ физическое обследование не выявляет патологии. Повышение АД у пациента часто бывает случайной находкой (при диспансеризации населения, популяционных исследованиях, определении годности к военной службе, обращении к врачу по поводу совершенно иных заболеваний).
• С целью исключения гипердиагностики АГ при изменении АД надо соблюдать следующие правила:
- правильно измерять АД (положение руки, наложение манжеты);
- считать истинными цифрами АД самые низкие при троекратном измерении с короткими интервалами;
- сопоставлять полученные величины АД с нормальными показателями;
- АД необходимо измерять на обеих руках, на ногах, в положении больного лежа и стоя.
• Соблюдение этих правил поможет заподозрить синдром Такаясу (значительный подъем АД на одной руке), коарктацию аорты (АД на руках выше, чем на ногах). Более точные показатели АД можно получить при проведении суточного мониторирования АД с помощью специального прибора-монитора. Больному на плечо накладывают манжетку, соединенную с регистрирующим устройством, прикрепляемым к поясу больного. Спустя сутки прибор снимают, регистрирующее устройство присоединяют к компьютеру, который дает распечатку показателей АД в течение каждого часа (за сутки); отдельно регистрируется систолическое АД, диастолическое АД и среднее АД, а также ЧСС. Определяется доля повышенного АД в процентах отдельно за ночь и день; определяется также ряд других производных показателей. Суточное мониторирование АД проводится также после назначения антигипертензивной терапии для определения ее эффективности.
• Расширение перкуторных границ относительной сердечной тупости влево, усиление верхушечного толчка обусловлены дилатацией и гипертрофией левого желудочка, развитие которой позволяет отнести ГБ как минимум ко II стадии заболевания. Акцент II тона над аортой в значительной степени зависит от величины АД.
• При физическом обследовании больного могут быть выявлены разнообразные симптомы, которые позволят заподозрить симптоматический
характер АГ и наметить пути уточнения диагноза с помощью специальных лабораторно-инструментальных методов обследования на третьем этапе диагностического поиска.
• При обследовании могут быть выявлены осложнения, которые развиваются в III стадии ГБ и связаны с поражением сердца, головного мозга, почек:
- коронарный атеросклероз может сопровождаться нарушением сердечного ритма и проводимости, явлениями хронической сердечной недостаточности (вначале появляется одышка, затем влажные мелкопузырчатые незвонкие хрипы, увеличенная болезненная печень, отеки на ногах):
развиваясь остро (на высоте подъема АД), сердечная недостаточность может проявляться симптомами отека легких;
- у больных ГБ III стадии могут выявляться динамические и органические изменения мозгового кровообращения:
нарушение двигательной функции верхних и нижних конечностей с изменением чувствительности в этих же областях;
нарушение эмоциональной сферы, памяти, сна, речи (различные когнитивные расстройства);
- симптомы почечной недостаточности при адекватной длительной медикаментозной терапии развиваются редко.
Объем информации, получаемой на втором этапе диагностического поиска, во многом зависит от стадии заболевания. Он существенно возрастает при увеличении длительности болезни и стадии болезни. После второго этапа диагноз ГБ становится более достоверным, но окончательный диагноз можно поставить только с учетом данных лабораторно-инструментальных методов исследования.
На третьем этапе диагностического поиска проводят исследования, которые позволяют:
• дать точную оценку состояния сердца, почек, органа зрения, мозгового кровообращения и точно определить стадию ГБ;
• установить первичность повышения АД и отвергнуть существование заболеваний, сопровождающихся симптоматической АГ.
Все исследования, которые проводят на третьем этапе диагностического поиска, можно разделить на две группы - обязательные исследования и исследования по показаниям (специальные методы); кроме того, в ряде случаев выполняют углубленное исследование.
• Обязательные исследования
- ЭКГ не выявляет изменений при I стадии. Во II и III стадиях имеются признаки гипертрофии левого желудочка: отклонение электрической оси сердца влево, увеличение амплитуды комплекса QRS, появление характерной депрессии сегмента ST и снижение амплитуды зубца Т (вплоть до его негативизации) в отведениях V5, V6, I, aVL.
- ЭхоКГ - наиболее точный метод выявления гипертрофии левого желудочка, которую диагностируют более чем у 50% больных ГБ. Наличие гипертрофии левого желудочка - наиболее неблагоприятный признак при ГБ (у таких больных в 4 раза выше риск развития сердечно-
сосудистых «катастроф» - ИМ, инсульта). Более того, риск смерти от сердечно-сосудистых заболеваний в 3 раза выше по сравнению с таковым у больных ГБ без признаков гипертрофии левого желудочка. Кроме того, этот метод выявляет так называемую диастолическую дисфункцию левого желудочка, заключающуюся в нарушении расслабления этой камеры сердца в период диастолы.
- Исследование глазного дна позволяет с достоверностью судить об изменениях сосудов мозга. В I стадии ГБ органических изменений сосудов глазного дна не отмечают. В ряде случаев можно выявить лишь спазм артерий сетчатки. У больных II-III стадии ГБ изменение сосудов глазного дна выражено значительно: сужен просвет артериол, утолщена их стенка, уплотненные артериолы сдавливают вены; развивается склероз артериол, отмечается неравномерность их калибра, присоединяются мелкие и крупные кровоизлияния, возможен отек сетчатки, иногда ее отслойка с потерей зрения. Картина глазного дна позволяет судить о стадии ГБ при любом уровне АД.
- Исследование крови (натощак) - клинический анализ, определение уровня мочевой кислоты, креатинина, общего холестерина (ХС), холестерина ЛПВП, триглицеридов, глюкозы, калия:
изменения клинического анализа крови не характерны для ГБ. В III стадии при развитии хронической почечной недостаточности возможна анемия;
биохимический анализ крови на ранних стадиях ГБ изменений не выявляет. С присоединением атеросклероза возможно повышение уровня холестерина, триглицеридов, липопротеидов низкой и очень низкой плотности, снижение холестерина липопротеидов высокой плотности;
азотемия не является характерной для ГБ, хотя в настоящее время изредка встречается в III стадии болезни, сочетаясь, как правило, с выраженными кардиальными и церебральными изменениями. Выявление азотемии у больных АГ требует дополнительных инструментальных исследований почек, так как она чаще является исходом латентного хронического гломерулонефрита (ХГН) или пиелонефрита, а не ГБ (хотя в последние десятилетия хроническая почечная недостаточность как исход ГБ встречается не так уж и редко).
- Исследование мочи - общий анализ:
у больных с I и II стадиями ГБ при исследовании мочи обычно не обнаруживают выраженных изменений. Периодические изменения в моче (микрогематурия, преходящая альбуминурия) могут появляться при гипертонических кризах. Однако выявление постоянной микроальбуминурии (суточное выделение альбумина до 300 мг) служит неблагоприятным прогностическим показателем, указывающим на вовлечение в патологический процесс почек. В III стадии ГБ возможны умеренная альбуминурия (до 1 г/л) и незначительная гематурия, которые могут наблюдаться годами, не сопровождаясь выраженными нарушениями экскреторной функции почек. Микроальбуминурия - плохой прогностический признак у больных ГБ. Как правило, сохра-
няются нормальная относительная плотность мочи и значительный диапазон ее колебаний в течение суток.
• Дополнительные исследования:
- Рентгенологическое исследование органов грудной клетки при I стадии ГБ не обнаруживает отчетливых изменений сердца и крупных сосудов. Начиная со II стадии отмечают увеличение левого желудочка, в III стадии можно выявить признаки атеросклероза аорты. Однако этот метод обладает невысокой разрешающей способностью.
- Ультразвуковое исследование почек и надпочечников.
- Ультразвуковое исследование брахиоцефальных и почечных артерий.
- Определение скорости пульсовой волны (на участке между сонной и бедренной артериями), наибольшая вероятность осложнений наблюдается при величине >12 м/с.
- Определение лодыжечно-плечевого индекса (рассчитывают с помощью допплерографии сосудов лодыжки и плеча), снижение его величины менее 0,9 свидетельствует об облитерирующем поражении сосудов нижних конечностей и может расцениваться как косвенный признак выраженного атеросклероза.
- Анализ мочи на бактериурию; выявление лейкоцитурии при исследовании мочи может свидетельствовать о присоединении инфекции нижних отделов мочевыводящих путей или обострении простатита у больного ГБ, но может быть и проявлением пиелонефрита. Обнаружение «активных» лейкоцитов, высокая бактериурия помогают дифференциальной диагностике.
- Количественная оценка протеинурии. В III стадии ГБ возможны умеренная альбуминурия (до 1 г/л) и незначительная гематурия, которые могут наблюдаться годами, не сопровождаясь выраженными нарушениями экскреторной функции почек. Как правило, сохраняются нормальная относительная плотность мочи и значительный диапазон ее колебаний в течение суток (проба Зимницкого).
- При злокачественном течении ГБ поражение почек может сопровождаться значительной протеинурией в сочетании с умеренной гематурией и цилиндрурией, а также прогрессирующим ухудшением клубочковой фильтрации и концентрационной функции почек. Выявление злокачественного течения АГ должно ориентировать врача скорее на поиски симптоматической гипертензии, нежели ГБ (в настоящее время злокачественный вариант течения ГБ наблюдается редко).
- Определение микроальбуминурии (обязательно при сахарном диабете); выявление постоянной микроальбуминурии (суточное выделение белка до 300 мг) служит неблагоприятным прогностическим показателем, указывающим на вовлечение в патологический процесс почек.
• Углубленное исследование.
- Осложненная АГ - оценка функционального состояния мозгового кровотока, сердца, почек.
- Выявление вторичных форм АГ - исследование в крови концентрации альдостерона и других кортикостероидов, активности ренина; опреде-
ление катехоламинов и их метаболитов в суточной моче, брюшная аортография; КТ или МРТ надпочечников и головного мозга.
Течение ГБ у ряда больных (от 20 до 33%) осложняется гипертоническими кризами, которые могут возникать на всех стадиях заболевания. Известны случаи, когда гипертонические кризы служат единственным проявлением болезни. В большинстве случаев гипертонический криз развивается при систолическом АД >180 мм рт.ст. и (или) диастолическом АД >120 мм рт.ст.
При гипертоническом кризе подъем АД возникает с различной скоростью, сопровождается характерной клинической симптоматикой, чаще церебрального и кардиального характера. Условно различают 2 типа гипертонических кризов - неосложненные (нежизнеугрожающие) и осложненные (жизнеугрожающие).
• При нежизнеугрожающих (неосложненных) кризах острого поражения органов-мишеней не происходит. В экстренной антигипертензивной терапии нет необходимости, тем не менее запаздывать с лечебными мероприятиями не следует.
• При жизнеугрожающих (осложненных) кризах необходимо немедленно снизить АД (необязательно до нормальных величин) для предотвращения или ограничения потенциально опасного поражения органов-мишеней (инсульта, ИМ, острой сердечной и почечной недостаточности).
В таблице 2-9 представлена сравнительная характеристика типов гипертонических кризов.
Таблица 2-9. Сравнительная характеристика типов гипертонических кризов

И.Н. Бокарев (1995) предложил учитывать быстроту повышения АД и скорость нарастания симптомов при гипертонических кризах:
• быстрые - симптоматика поражения органов развивается в пределах 1 ч;
• медленные - симптоматика поражения органов развивается в течение нескольких часов и даже суток.
Подобное деление, безусловно, целесообразно, однако из этого не следует, что можно затягивать лечебные мероприятия. Гипертонический криз - всегда ургентная ситуация, поскольку не известно, по какому «сценарию» будут развиваться события.
Диагностика
Выявление АГ не представляет каких-либо существенных сложностей, гораздо труднее бывает определить причину повышения АД . В связи с этим на всех этапах диагностического поиска ГБ следует дифференцировать от симптоматических АГ.
• Из анамнеза можно получить сведения о перенесенных заболеваниях почек (гломерулонефрит, пиелонефрит и др.), лечении по поводу эндокринных заболеваний (сахарный диабет, диффузный токсический зоб и др.), что позволяет заподозрить симптоматический характер АГ и делает диагноз ГБ маловероятным.
• Данные физического обследования также могут выявить симптомы, характерные для симптоматической гипертензии. Так, АД на руках бывает выше, чем на ногах у больных с коарктацией аорты. При этой патологии у больного видна или пальпаторно определяется пульсация межреберных артерий, в межлопаточном пространстве в проекции аорты отчетливо прослушивается систолический шум.
• Повышение АД на одной руке при отсутствии пульса или резком ослаблении его на другой часто свидетельствует о симптоматическом характере АГ - болезни Такаясу. Систолический шум, выслушиваемый над брюшной аортой в околопупочной зоне, указывает на возможное сужение почечных артерий, что может быть причиной АГ.
• Обнаруженное при пальпации живота у больного с АГ образование в левом или правом подреберье должно направить дальнейшее обследование на исключение поликистоза, гидронефроза, опухоли почек.
• Грубые изменения со стороны 12 пар черепных нервов и другие симптомы, свидетельствующие о поражении ЦНС, встречаются при органических изменениях ЦНС, сопровождающихся АГ (могут наблюдаться на поздних стадиях ГБ).
Более подробно поражения внутренних органов при различных симптоматических гипертензиях описаны в соответствующих разделах.
В ряде случаев предположение о симптоматической гипертензии может возникнуть только на третьем этапе диагностического поиска. Так, обнаружение асимметрии функции и размеров почек, анатомических дефектов при экскреторной урографии у лиц с ранее диагностируемой ГБ заставляет пересмотреть диагноз и провести дополнительные исследования (по показаниям) для выявления патологии почек или почечных артерий. Диагноз ГБ может быть отвергнут или подтвержден на завершающем этапе дифференциальной диагностики. Однако в части случаев диагноз ГБ остается недостаточно обоснованным, так как сложные методы диагностики, необходимые для исключения симптоматической гипертензии, не всегда могут быть выполнены.
Вместе с тем существует ряд признаков, наличие которых требует полного обследования больного для исключения или выявления симптоматической гипертензии:
• возраст больного - моложе 20 и старше 60 лет (если АГ развилась в этот период жизни);
• остро возникающее и стойкое повышение АД;
• очень высокое АД;
• злокачественное течение АГ;
• наличие симпатико-адреналовых кризов;
• указания на любое заболевание почек в анамнезе, а также на возникновение АГ в период беременности;
• наличие в период обнаружения АГ даже минимальных изменений мочи (незначительной протеинурии и микрогематурии).
Формулировка развернутого клинического диагноза ГБ учитывает:
• стадию течения болезни;
• степень повышения АД (если АГ выявлена впервые или же больной не получает антигипертензивного лечения);
• характер течения (указать злокачественный характер гипертензии);
• наличие или отсутствие кризов;
• степень риска развития сердечно-сосудистых осложнений;
• наличие самих осложнений.
Если у больного ГБ обнаружен ИМ или мозговой инсульт, то при формулировке диагноза эта патология указывается раньше, а затем следует развернутый диагноз ГБ.
Лечение
Перед системой лечебных мероприятий ставят три задачи:
1) устранение факторов, способствующих развитию ГБ (использование так называемых нефармакологических методов лечения);
2) воздействие на основные звенья патогенеза;
3) борьба с осложнениями.
• Нефармакологические методы лечения ГБ включают:
- снижение массы тела;
- ограничение потребления поваренной соли;
- индивидуальные дозированные физические нагрузки;
- отказ от курения табака и употребления алкоголя;
- организация здорового быта, отдыха и нормальной трудовой деятельности с исключением факторов, травмирующих психическую сферу; нормализация сна.
• Воздействие на основные звенья патогенеза достигается назначением лекарственной терапии:
- антигипертензивные препараты, используемые для лечения ГБ в настоящее время, классифицируют следующим образом:
препараты центрального действия - стимуляторы 1-имидозалино- вых рецепторов (моксонидин, рилменидин, клонидин);
препараты, влияющие на рецепторный аппарат:
V блокаторы α1-адренорецепторов (празозин, доксазозин);
V блокаторы β1-адренорецепторов (метопролол, бисопролол, бетаксолол, небиволол);
блокаторы кальциевых каналов клеточной мембраны:
V дигидропиридиновые - нифедипин, фелодипин, амлодипин, лацидипин;
V недигидропиридиновые - верапамил, дилтиазем; диуретики (тиазиды и тизидоподобные препараты, петлевые диуретики, калийсберегающие препараты);
ингибиторы АПФ - каптоприл, эналаприл, лизиноприл, рамиприл, трандолаприл, периндоприл, зофеноприл;
блокаторы рецепторов к ангиотензину II - лозартан, валсартан, ирбесартан, кандесартан, телмисартан.
При назначении гипотензивных средств больному разъясняют необходимость их приема на многие годы или всю жизнь. Прерывистая терапия не допустима. Существует ряд правил проведения антигипертензивной терапии:
• АД снижать постепенно, но до нормы - менее 140/90 мм рт.ст.; если у больного имеется сахарный диабет, то АД следует снижать ниже 130/80 мм рт.ст., если одновременно имеется протеинурия, то АД должно быть менее 125/75 мм рт.ст.;
• комбинированное лечение (2 препарата) имеет преимущество перед монотерапией, так как позволяет применять меньшие дозы препарата и, таким образом, уменьшать возможные побочные действия;
• не менять схему лечения без крайней необходимости;
• использовать препараты длительного действия (так называемые «ретардные» препараты), что позволяет их принимать один или (максимум) два раза в день.
При назначении антигипертензивной терапии следует помнить, что препаратами первого ряда (т.е. назначаемыми в начале лечения) служат практически все вышеперечисленные группы препаратов (за исключением α1-адреноблокаторов и препаратов центрального действия).
Весьма существенно, чтобы эти препараты при длительном приеме не нарушали бы углеводный, липидный и пуриновый обмен (т.е. были бы метаболически нейтральными), не задерживали в организме жидкость, не провоцировали «рикошетную гипертонию», не вызывали патологическую ортостатическую гипотонию, не угнетали активность ЦНС.
Согласно международным (ВОЗ/МОГ) и отечественным рекомендациям по лечению ГБ, следует придерживаться определенных правил при назначении лекарственной терапии.
Тактика ведения больных ГБ зависит не только от величины АД, но и сопутствующих факторов риска, заболеваний, поражений органов-мишеней, а также различных личностных и социально-экономических характеристик.
После стратификации риска конкретного больного следует принимать решение о назначении медикаментов. При этом следует пользоваться следующими правилами:
• очень высокий риск - немедленно начать медикаментозную терапию;
• высокий риск - немедленно начать медикаментозную терапию.
• В Рекомендациях ВНОК (2010) специально выделены характеристики больных с высоким и очень высоким риском:
- систолическое АД >180 мм рт.ст. и (или) диастолическое АД >110 мм рт.ст.;
- систолическое АД >160 мм рт.ст. при низком диастолическом АД (<70 мм рт.ст.);
- сахарный диабет;
- метаболический синдром (сочетание абдоминального ожирения, АГ, нарушений липидного и (или) углеводного обмена);
- >=3 факторов риска;
- поражение органов-мишеней:
гипертрофия левого желудочка по данным ЭКГ или ЭхоКГ;
увеличение жесткости стенки артерии;
умеренное повышение сывороточного креатинина;
уменьшение скорости клубочковой фильтрации или клиренса креатинина;
микроальбуминурия или протеинурия;
- цереброваскулярные болезни (инсульт ишемический, геморрагический, транзиторная ишемическая атака - ТИА);
- ИМ, стенокардия, реваскуляция миокарда, сердечная недостаточность;
- диабетическая нефропатия, хроническая почечная недостаточность;
- заболевание периферических артерий;
- гипертоническая ретинопатия.
• Средний риск - показано наблюдение за АД и факторами риска в течение 3-6 мес, при этом возможны две ситуации:
- если в результате немедикаментозных воздействий АД снижается до величин, когда систолическое АД <140 или диастолическое АД <90 мм рт.ст., следует продолжить наблюдение (естественно, при соблюдении всех немедикаментозных мероприятий);
- если систолическое АД >140 или диастолическое АД >90 мм рт.ст., начинают медикаментозную терапию.
• Низкий риск - рекомендуется активное наблюдение за величиной АД и факторами риска в течение 6-12 мес, при этом возможны две ситуации:
- если систолическое АД >150 или диастолическое АД >90 мм рт.ст., следует начать медикаментозную терапию;
- если систолическое АД <150 или диастолическое АД <90 мм рт.ст., то продолжают наблюдение; если все же в течение ближайших месяцев АД не снижается ниже 140/90 мм рт.ст., то даже при низком риске надо начать прием медикаментов.
При рациональном выборе лекарственного препарата при ГБ необходимо учитывать следующие факторы:
• стоимость лечения и (связанная с этим) доступность препаратов;
• имеющиеся факторы риска сердечно-сосудистых заболеваний у данного больного;
• наличие поражений органов-мишеней, клинических проявлений сердечнососудистых заболеваний, поражений почек и сахарного диабета;
• индивидуальные реакции больного на препараты различных классов;
• вероятность взаимодействия с препаратами, которые больной принимает по другим поводам.
Существуют две стратегии лечения ГБ:
• начиная с одного препарата (режим монотерапии);
• начиная с двух препаратов (режим комбинированной терапии).
У молодых пациентов, особенно при наличии признаков симпатикотонии (тахикардия, высокий сердечный выброс), а также у лиц более старшего возраста при наличии приступов стенокардии следует назначать селективные β1-адреноблокаторы длительного действия: метопролол (метопролол тартрат) (в дозе 50-200 мг/сут), небиволол (в дозе 5-10 мг/сут), бетаксолол (в дозе 10- 40 мг/сут), бисопролол (5-10 мг/сут). При наклонности к брадикардии, недостаточном эффекте или плохой переносимости β1-адреноблокаторов назначают антагонисты кальция пролонгированного действия - амлодипин, фелодипин (в дозе 5-10 мг/сут в 1-2 приема), нифедипин (в дозе 10-20 мг/сут), верапамил (изоптин СР 240*) (240-480 мг в 1-2 приема). Антагонисты кальция, а также диуретики в большей степени показаны больным пожилого и старческого возраста (однако это не исключает назначение препаратов других групп).
Следует отметить, что блокада β1-адренорецепторов может приводить к активации РААС (плазменной и тканевой), что в конечном счете обусловливает задержку натрия и воды. В связи с этим одновременно с β1-адреноблокаторами (или же антагонистами кальция, имеющими в виде побочных действий отеки лодыжек или голеней) назначают небольшие дозы мочегонных препаратов - гидрохлоротиазид в малых дозах (6,25 мг; 12,5 мг ежедневно, иногда и 25 мг) или индапамида (индапамид-ретард* 1,25 мг).
При неэффективности β1-адреноблокаторов или антагонистов кальция, а также при наличии у больного гипертрофии левого желудочка в качестве базисного препарата назначают ингибиторы АПФ (эналаприл в дозе 5-20 мг/сут, лизиноприл в дозе 10-30 мг/сут, периндоприл по 4-8 мг/сут, трандолаприл по 1-2 мг/сут). Одновременно целесообразно добавлять небольшие дозы мочегонных препаратов (тиазиды или тиазидоподобые препараты). Существенно реже в качестве препарата первого выбора применяют блокаторы рецепторов к ангиотензину II - лозартан (50-10 мг/сут), валсартан (40-80-160 мг/сут), моксонидин, рилменидин (агонист 1-имидозолиновых рецепторов). Все сказанное относится к режиму монотерапии. При недостаточной эффективности первоначально назначенного препарата и необходимости дальнейшего увеличения дозы следует применять 2 препарата - β1-адреноблокатор и антагонист кальция, ингибитор АПФ и антагонист кальция. Во всех случаях необходимо назначать небольшие дозы диуретиков (например, гидрохлоротиазид в дозе
12,5 мг).
С 2007 года применяют принципиально новый антигипертензивный препарат, являющийся прямым ингибитором ренина, - алискирен, предотвращающий образование ангиотензина I и ангиотензина II и потенциально всю цепочку органоповреждающего действия ангиотензина II. Алискирен блокирует активный центр, ренина и тот не может осуществлять трансформацию ангиотензиногена в ангиотензин I. Применяют алискирен в дозе 150-300 мг 1 раз в день. Побочных явлений в виде сухого кашля, что бывает при использовании ингибиторов АПФ, не наблюдается.
В настоящее время рекомендуют с самого начала назначать 2 препарата, так как подобная комбинированная терапия при ГБ будет продолжаться неограниченно долго. В связи с этим с начала лечения следует назначать 2 препарата - вначале в малых дозах: например, сочетание ингибитора АПФ периндоприла 2 мг и тиазидоподобного диуретика индапамида в дозе 0,625 мг (торговое на-
звание - нолипрел), а при недостаточной эффективности низкодозовой комбинации составные ее части следует увеличивать вдвое (полнодозовая комбинация - торговое название нолипрел-форте*).
Согласно последним рекомендациям ВНОК (4-й пересмотр, 2010) больным ГБ целесообразно назначать так называемые фиксированные комбинации (в одной таблетке имеется два препарата); это повышает приверженность пациента к лечению (хотя бы еще и потому, что вместо двух таблеток больной принимает всего одну).
Таких фиксированных препаратов достаточно много: например, комбинация антагониста кальция (фелодипина) и β1-адреноблокатора (метопролола) - препарат логимакс*, комбинация бисопролола и гидрохлоротиазида (лодоз*). Широко распространены комбинации ингибитора АПФ (эналаприла) и гидрохлоротиазида в различных дозах, комбинации квинаприла и гидрохлоротиазида. Комбинация дигидропиридинового блокатора медленных кальциевых каналов амлодипина и валсартана (блокатора рецепторов к ангиотензину II); комбинация ингибитора АПФ лизиноприла и недигидропиридинового антагониста кальция амлодипина и пр.
Комбинированное применение двух (а иногда и трех) препаратов оправдано еще и потому, что вследствие существования так называемого «эффекта ускользания», полная доза препарата оказывается недостаточной для антигипертензивного эффекта или же (при несомненной эффективности) сопровождается побочными эффектами. «Эффект ускользания» обусловлен тем, что подавление одного прессорного механизма ведет к активации другого. Это служит еще одним основанием, почему монотерапия в настоящее время уступила место комбинированной терапии. Комбинированная терапия в особенности показана больным с высоким и очень высоким риском.
Как уже было упомянуто, сосуществование с ГБ сопутствующих заболеваний накладывает определенный отпечаток на проводимую терапию: так при одновременном наличии у больного ИБС целесообразно в качестве базисного препарата назначать β1-адреноблокатор; при сахарном диабете - ингибиторы АПФ; при хронической сердечной недостаточности - ингибитор АПФ и диуретик; при суправентрикулярной тахикардии - верапамил; при почечной недостаточности - ингибитор АПФ или антагонист к рецепторам ангиотензина II и петлевой диуретик (фуросемид, торасемид).
При бронхоспастических реакциях (хроническая обструктивная болезнь легких, нетяжелые формы бронхиальной астмы), облитерирующих поражениях сосудов нижних конечностей и сахарном диабете не следует назначать неселективные р-адреноблокаторы 1-го поколения (пропранолол), а также гидрофильный β1-адреноблокатор атенолол (имеющий иные фармакодинамические свойства, нежели жирорастворимые р-адреноблокаторы). Этой категории больным можно назначать высокоселективные Р1-блокаторы 3-го поколения, обладающие вазодилатирующими свойствами за счет одновременной индукции оксида азота (небиволол).
При хорошем эффекте от применения ингибитора АПФ, но одновременном развитии побочных явлений (в виде сухого кашля) рекомендуют вместо него назначать блокатор рецепторов к ангиотензину II - лозартан (25-50 мг/сут) или валсартан (80-100 мг/сут).
Врач не должен стремиться к быстрому снижению АД, особенно у пожилых пациентов. При невысоких цифрах системного АД и выраженных головных болях для улучшения кровообращения в бассейне мозговых артерий дополнительно назначают ксантинола никотинат (теоникол*), вазобрал*, мексидол* и другие подобные препараты. При развитии когнитивных нарушений легкой или средней выраженности следует назначать пирибедил по 50 мг 2-3 раза в день (длительно), пиритинол (энцефабол*) по 200 мг (3 раза в день).
При тенденции к непрогнозируемым колебаниям АД у лиц пожилого возраста (особенно при ортостатической и постпрандиальной гипотонии) целесообразно назначать клоназепам в дозе 0,5-2 мг/сут.
Применение всех антигипертензивных средств при ГБ должно быть длительным, перерывы в лечении ведут к неблагоприятным последствиям (например, к появлению гипертонических кризов).
Повышенная чувствительность или, напротив, толерантность к препарату и возникновение побочных явлений требуют его отмены и подбора другого препарата.
У больных с высоким и очень высоким риском целесообразна комбинация трех или четырех препаратов, например:
• β1-адреноблокатор + диуретик + ингибитор АПФ;
• β1-адреноблокатор + диуретик + антагонист кальция;
• β1-адреноблокатор + диуретик + блокатор рецепторов к ангиотензину II. В этой ситуации мочегонные (например, гидрохлоротиазид) следует применять ежедневно или через день (в больших дозах - 25 мг).
Если у больного имеется тенденция к брадикардии, то вместо β1-адреноблокатора целесообразно назначать дигидропиридиновые антагонисты кальция (не обладающие брадикардитическим эффектом).
Ранее применявшиеся препараты раувольфии, назначаемые изолированно (резерпин, раунатин), а также в комбинациях с другими средствами (адельфан, кристепин, трирезид) в настоящее время не используют. Точно так же при систематической терапии не применяют кальциевые антагонисты короткого действия (нифедипин), а также клонидин (клофелин, катапрессан). Эти препараты используют лишь для купирования гипертонических кризов.
Учитывая, что наиболее грозное осложнение ГБ - гипертонический криз, своевременная терапия его представляется весьма важной.
Главная цель проводимых мероприятий при гипертоническом кризе - быстрое снижение АД: диастолическое АД до уровня примерно 100 мм рт.ст. (если энцефалопатия сопровождается судорогами, то их устраняют до начала антигипертензивного лечения внутривенным введением 10-40 мг диазепама в 5% растворе глюкозы*).
Выбор лекарственных препаратов, последовательность их введения определяются возрастом пациента, а также наличием осложнений (энцефалопатия, отек легких).
• Купирование неосложненного криза:
- прием клонидина (0,15-0,3 мг внутрь, затем по 0,05-0,1 мг каждый час, доводя дозу до 0,7 мг), нифедипина (1-20 мг) или каптоприла (25- 50 мг);
- в случае отсутствия эффекта - клонидин (1 мл 0,01% раствора);
- лечение необходимо начинать немедленно, скорость снижения АД не должна превышать 25% за первые 2 часа с последующим достижением целевого АД в течение нескольких часов (не более 24-48 ч) от начала терапии;
- лечение больного с неосложненным кризом может осуществляться амбулаторно.
• Лечение больных с осложненным гипертоническим кризом проводят в отделении неотложной кардиологии или палате интенсивной терапии:
- АД следует снижать постепенно, во избежание ухудшения кровоснабжения головного мозга, почек, сердца и, как правило, не более чем на 25% за первые 1-2 ч;
- наиболее быстрое снижение АД необходимо при расслаивающейся аневризме аорты (на 25% от исходного за 5-10 мин; оптимальное время достижения целевого уровня систолического АД 100-110 мм рт.ст. составляет 20 мин), а также при выраженной острой левожелудочковой недостаточности (отек легкого).
Используют следующие парентеральные препараты для лечения гипертонического криза:
• вазодилататоры:
- эналаприлат (предпочтителен при острой недостаточности левого желудочка);
- нитроглицерин (предпочтителен при остром коронарном синдроме и острой недостаточности левого желудочка);
- нитропруссид натрия (препарат выбора при гипертонической энцефалопатии, однако следует иметь в виду, что он может повышать внутричерепное давление);
• р-адреноблокторы (пропранолол, очень быстро действующий эсмолол при расслаивающейся аневризме аорты и остром коронарном синдроме);
• антиадренергические средства (фентоламин при подозрении на феохромоцитому);
• нейролептики (дроперидол);
• ганглиоблокаторы: азаметония бромид (пентамин*).
У больных пожилого возраста АД часто бывает нестабильным, что связано с возрастными нарушениями регуляции сосудистого тонуса. При так называемой лабильной АГ пожилых колебания АД отличаются особенно большими размахами, варьируя от 180-200/100 мм рт.ст. до 100-110/60-70 мм рт.ст. Такие колебания АД возникают обычно без видимых причин, от одного раза в сутки до нескольких раз в месяц. Клинически они малосимптомны (в отличие от классических гипертонических кризов) и иногда даже не замечаются больными. Это последнее обстоятельство таит в себе угрозу нарушения мозгового кровообращения, так как, не ощущая резких колебаний АД, больные не прибегают к лечебным мероприятиям. В промежутках между подъемами АД может быть нормальным или умеренно повышенным. Лабильная АГ пожилых встречается практически лишь у женщин, частота ее сравнительно невелика (7-8% всех случаев АГ). Причиной этой своеобразной АГ выступают резкие нарушения вегетативной регуляции сосудистого тонуса. Лечение этой формы АГ - непростая задача, так как антигипертензивная терапия не предотвращает подъемов АД.
Средство выбора - препарат из группы атипичных бензодиазепинов - клоназепам, обладающий вегетостабилизирующими и антипароксизмальными свойствами (назначают по 0,5-1,0 мг 1-2 раза в сутки, начиная с однократного приема на ночь). Эффективность клоназепама у таких больных достигает 80%, прием должен быть длительным.
Прогноз
При неосложненном течении и адекватной терапии больные длительно сохраняют трудоспособность. Соответствующее лечение может привести к длительной стабилизации процесса.
Профилактика
• Первичная профилактика состоит в ограничении длительных воздействий неблагоприятных внешних факторов, способствующих возникновению заболевания, здоровом образе жизни (запрещение курения, ограничение приема алкоголя, достаточная физическая активность).
• Вторичная профилактика включает диспансерное наблюдение и длительную антигипертензивную терапию (при соблюдении рекомендаций в отношении соблюдения здорового образа жизни).
СИМПТОМАТИЧЕСКИЕ АРТЕРИАЛЬНЫЕ ГИПЕРТЕНЗИИ
Симптоматическими (вторичными) называют АГ, причинно связанные с определенными заболеваниями или повреждениями органов (систем), участвующих в регуляции АД.
Симптоматические артериальные гипертензии (САГ) регистрируют у 5-15% всех пациентов с АГ.
Классификация и этиология
Единой классификации САГ не существует. Ниже представлена этиологическая классификация САГ, в которой одновременно указаны основные заболевания, приводящие к развитию вторичных гипертензий. Представленный перечень патологических состояний далеко не исчерпывающий; существует ряд более редких заболеваний (главным образом, болезней почек), которые подробно рассмотрены в соответствующих руководствах.
• Почечные:
- ренопаренхиматозные (ХГН, хронический пиелонефрит, диабетическая нефропатия, поликистоз почек, подагрическая нефропатия и др.);
- вазоренальные (стеноз почечных артерий, фибромускулярная дисплазия почечных артерий и др.).
• Эндокринные:
- надпочечниковые (первичный гиперальдостеронизм, опухоли хромаффинной ткани, синдром Кушинга);
- тиреоидные (тиреотоксикоз, гипотиреоз);
- гипофизарные (болезнь Кушинга, акромегалия);
- гиперпаратиреоз;
- климактерические.
• Гемодинамические (коарктация аорты, васкулиты, в том числе неспецифический аортоартериит, недостаточность аортального клапана).
• Ятрогенные (вызваны приемом некоторых лекарственных препаратов и биологически активных добавок).
• Синдром ночного апноэ.
Возможно сочетание нескольких (чаще двух) заболеваний, потенциально способных привести к АГ (например, диабетический гломерулосклероз и хронический пиелонефрит, атеросклеротический стеноз почечных артерий и диабетический гломерулосклероз, гломерулонефрит при СКВ и вторичный синдром Кушинга в рамках побочного действия глюкокортикоидов, используемых для ее лечения).
Нередко причиной САГ становится применение лекарственных препаратов по назначению врача или самостоятельное. К препаратам, способным повышать АД, относят оральные контрацептивы, глюкокортикоиды, НПВС, симпатомиметики (в том числе капли в нос нафазолин и ксилометазолин при длительном применении), эпоэтин бета, циклоспорин и биологически активные добавки, содержащие эфедру, лакрицу и др.
Патогенез
Механизм развития САГ при каждом заболевании имеет отличительные черты, обусловленные характером и особенностями развития основного патологического состояния. Так, при почечных заболеваниях и реноваскулярных поражениях пусковым фактором служит ишемия почки, а доминирующим механизмом повышения АД - рост активности прессорных и снижение активности депрессорных почечных агентов.
При эндокринных заболеваниях непосредственная причина повышения АД - первично усиленное образование некоторых гормонов. Тип гиперпродуцируемого гормона (альдостерон, другие минералокортикоиды, катехоламины, СТГ, АКТГ и глюкокортикоиды) зависит от характера эндокринного нарушения.
При органических поражениях ЦНС создаются условия для ишемии центров, регулирующих АД, и нарушений центрального механизма его регуляции, вызванных не функциональными (как при ГБ), а органическими изменениями.
При гемодинамических САГ, обусловленных поражением сердца и крупных артериальных сосудов, механизмы повышения АД определяются характером нарушения. Они связаны:
• с нарушением функций депрессорных зон (синокаротидной зоны) и снижением эластичности дуги аорты (при атеросклерозе дуги);
• с переполнением кровью сосудов, расположенных выше места сужения аорты (при ее коарктации), дальнейшим включением почечно-ишемического ренопрессорного механизма, сужением сосудов в ответ на уменьшение сердечного выброса, увеличением ОЦК, вторичным гиперальдостеронизмом и повышением вязкости крови (при застойной сердечной недостаточности);
• с увеличением и ускорением систолического выброса крови в аорту (недостаточность клапана аорты) при усилении ее притока к сердцу (артериовенозные свищи) или увеличением продолжительности диастолы (полная предсердно-желудочковая блокада).
У больных с синдромом ночного апноэ существует несколько патогенетических механизмов повышения АД: гипоксемия, гиперкапнический ацидоз, резкие респираторные усилия и увеличение симпатической активности на фоне микропробуждений. Постоянную АГ отмечают у 40-50% больных с синдромом ночного апноэ. Связь между расстройствами дыхания во сне и АГ также может быть обусловлена существованием одинаковых факторов риска для обоих состояний (например, ожирение).
Клиническая картина
Клиническая картина САГ в большинстве случаев складывается из симптомов, обусловленных повышением АД, и признаков основного заболевания.
Повышением АД можно объяснить головную боль, головокружение, мелькание «мушек» перед глазами, шум и звон в ушах, разнообразные боли в области сердца и другие субъективные ощущения. Обнаруживаемая при физикальном обследовании гипертрофия левого желудочка, акцент II тона над аортой - результат стабильной АГ. Отмечают характерные изменения сосудов глазного дна. При рентгенографии и ЭКГ регистрируют признаки гипертрофии левого желудочка (см. «Гипертоническая болезнь»).
Симптомы основного заболевания:
• могут быть ярко выраженными, при этом характер САГ определяют на основании развернутой клинической картины соответствующего заболевания;
• могут отсутствовать, заболевание манифестирует только повышением
АД.
В последнем случае предположения о симптоматическом характере АГ возникают:
• при развитии АГ у молодых и лиц в возрасте старше 50-55 лет;
• остром развитии и быстрой стабилизации АГ на высоких показателях;
• бессимптомном течении АГ;
• резистентности к гипотензивной терапии (неэффективность трех гипотензивных препаратов и более в оптимальных дозах);
• злокачественном характере течения АГ.
По характеру течения САГ, как и ГБ, разделяют на доброкачественную и злокачественную форму. Синдром злокачественной АГ регистрируют в 13-30% всех САГ.
Различная выраженность симптомов и широкий круг заболеваний, сопровождающихся АГ, обусловливают чрезвычайную вариабельность клинической картины САГ. В связи с этим этапы диагностического поиска будут представлены отдельно для каждой группы заболеваний, выделенных в классификации.
Почечные (нефрогенные) гипертензии. Почечные заболевания - наиболее распространенная причина САГ (70-80% случаев). Последние подразделяют на АГ при заболеваниях паренхимы почек, реноваскулярные (вазоре-
нальные) гипертензии и АГ, связанные с нарушением оттока мочи. Большую часть почечных АГ представляют ренопаренхиматозные и вазоренальные заболевания.
Клиническая картина многочисленных заболеваний, сопровождающихся АГ почечной этиологии, может манифестировать следующими синдромами: АГ и патологическими изменениями мочевого осадка; АГ и лихорадкой; АГ и шумом над почечными артериями; АГ и пальпируемой опухолью брюшной полости; только АГ.
Эти синдромы можно обнаружить на разных этапах диагностического поиска.
В задачу первого этапа диагностического поиска входят:
• сбор сведений о ранее перенесенных заболеваниях почек или мочевыводящих путей;
• целенаправленное определение жалоб, характерных для почечных заболеваний, при которых АГ может выступать в качестве симптома.
Указания на имеющиеся у больного заболевания почек (гломеруло- и пиелонефрит, мочекаменная болезнь и т.д.) и их связь с развитием АГ позволяют сформулировать предварительную диагностическую концепцию.
При отсутствии характерного анамнеза жалобы на изменение цвета, количества мочи, дизурию и возникновение отеков помогают связать повышение АД с поражением почек без определенных предположений о характере поражения почек. Эти сведения необходимо получить на дальнейших этапах обследования больного.
Если пациент предъявляет жалобы на лихорадку, боли в суставах и животе, а также на повышение АД, то можно заподозрить узелковый полиартериит - заболевание, при котором почки - лишь один из органов, вовлеченных в патологический процесс.
Сочетание повышенного АД с лихорадкой характерно для инфекционного поражения мочевыводящих путей (жалобы на дизурию) и возможно при опухолях почек.
На этом этапе в ряде случаев можно получить сведения, указывающие лишь на повышение АД. Следует учитывать возможность существования моносимптомных почечных АГ, поэтому при установлении причины повышения АД возрастает значение последующих этапов обследования больного.
На втором этапе диагностического поиска определяют симптомы, обусловленные повышением АД (описаны ранее) и основным заболеванием.
Присутствие выраженных отеков при соответствующем анамнезе делает предварительный диагноз гломерулонефрита более достоверным. Возникают предположения и об амилоидозе.
При физикальном обследовании больного можно обнаружить систолический шум над брюшной аортой у места отхождения почечных артерий. В этом случае можно предположить реноваскулярный характер АГ. Уточненный диагноз ставят по данным ультразвукового дуплексного сканирования и ангиографии. Следует отметить, что шум над почечными артериями выслушивают лишь у 30-50% больных со стенозом почечных артерий, поэтому его отсутствие не должно быть основанием для прекращения диагностического поиска в этом направлении.
Обнаружение при пальпации живота опухолевого образования у больных АГ позволяет предположить поликистоз почек, гидронефроз или гипернефрому.
Таким образом, на втором этапе диагностического поиска могут возникнуть новые предположения о заболеваниях, обусловивших развитие АГ, а также подтвердиться диагностические концепции первого этапа.
Завершить первые два этапа обследования необходимо формулировкой предварительного диагноза. Это нужно для того, чтобы из огромного количества исследований, выполнение которых предполагают на третьем этапе, выбрать необходимые конкретному больному для установления окончательного диагноза.
На основании оценки обнаруженных синдромов можно высказать следующие предположения о заболеваниях, сопровождающихся АГ почечной этиологии.
Сочетанием АГ с патологическими изменениями мочевого осадка манифестирует:
• хронический и острый гломерулонефрит;
• хронический пиелонефрит.
Сочетание АГ и лихорадки наиболее часто регистрируют при:
• хроническом пиелонефрите;
• поликистозе почек, осложненном пиелонефритом;
• опухолях почки;
• узелковом полиартериите (УП).
Сочетание АГ с пальпируемой опухолью в брюшной полости отмечают:
• при опухоли почек;
• поликистозе;
• гидронефрозе.
Сочетанием АГ с шумом над почечными артериями характеризуется стеноз почечных артерий различного происхождения. Моносимптомная АГ характерна:
• для фибромускулярной гиперплазии почечных артерий (реже - стенозирующего атеросклероза почечных артерий и некоторых форм артериита);
• аномалий развития почечных сосудов и мочевыводящих путей. На третьем этапе диагностического поиска выполняют:
• обязательное обследование всех больных (см. «Гипертоническая болезнь»);
• специальные исследования по показаниям. Исследования по показаниям включают:
• анализ мочи по Нечипоренко, определение суточной потери белка с мочой, количественную оценку бактериурии;
• УЗИ почек;
• радиоизотопное исследование (сцинтиграфию) почек (в том числе с каптоприлом);
• экскреторную урографию;
• КТ почек;
• мультиспиральную КТ-ангиографию почечных артерий;
• прямую инвазивную ангиографию (аортография с исследованием почечного кровотока);
• определение содержания ренина и альдостерона в крови.
Показания к проведению того или иного дополнительного исследования зависят от предварительного диагностического предположения и результатов проведения рутинных (обязательных) методов исследования.
Диагностика почечных САГ заключается в определении заболевания, приводящего к повышению АД, и оценке функций почек, что очень важно для выбора тактики лечения.
Наиболее частая причина развития ренопаренхиматозной АГ - длительно существующий сахарный диабет. В этом случае гипергликемия будет сочетаться с протеинурией (альбуминурией или неселективной протеинурией) и глюкозурией.
При подагрической нефропатии закономерно обнаружение гиперурикемии, микрогематурии, протеинурии и урикозурии.
Нередко патологический процесс в почках многие годы протекает скрыто и сопровождается минимальными и непостоянными изменениями мочи. Небольшая протеинурия приобретает диагностическое значение только при учете суточного количества теряемого с мочой белка: протеинурию более 1 г/сут можно рассматривать как косвенное указание на связь АГ с первичным поражением почек. Нередко так манифестирует ХГН - редкое, но прогностически очень значимое заболевание.
Следует подчеркнуть исключительную значимость тщательного исследования мочевого осадка в диагностике ренопаренхиматозной АГ, так как гипертензии при заболеваниях паренхимы почек практически не имеют типичной ультразвуковой и рентгенологической картины. Для окончательной диагностики в случаях латентно протекающего пиелонефрита, гломерулонефрита или амилоидоза выполняют биопсию почки.
Методы лучевой диагностики приобретают значение для определения урологических заболеваний (нефролитиаз, опухоли или поликистоз почек). Для достоверной диагностики, как правило, достаточно проведения УЗИ и КТ.
Для оценки функций почек (диагностики хронической почечной недостаточности) СКФ определяют с помощью лабораторного анализа клиренса креатинина или расчетных формул (Кокрофта-Гоулта и MDRD), которые приведены в специальных руководствах.
Вазоренальная АГ длительно протекает без патологических изменений мочевого осадка, поэтому для ее обнаружения большое значение имеют методы инструментальной диагностики. Для первичной диагностики применяют ультразвуковое дуплексное сканирование почечных артерий, но результаты его выполнения зависят от конституции пациента и опыта оператора. Более достоверным исследованием, которое в настоящее время становится золотым стандартом диагностики, считают мультиспиральную КТ-ангиографию почечных артерий, позволяющую неинвазивным способом получить информацию об анатомии почечных артерий. Прямую инвазивную ангиографию почечных артерий проводят тогда, когда уже принято решение об эндоваскулярном лечении.
Данные ангиографии трактуют следующим образом:
• у мужчин среднего возраста односторонний стеноз артерии, устья и средней части почечной артерии, сочетающийся с признаками атеросклероза брюшной аорты (неровность контура), характерен для атеросклероза почечной артерии;
• чередование на ангиограмме участков стеноза и дилатации пораженной почечной артерии с локализацией стеноза в ее средней трети, а не в устье (при неизмененной аорте у женщин в возрасте младше 40 лет это свидетельствует о фибромускулярной дисплазии стенки почечной артерии);
• двустороннее поражение почечных артерий от устьев до средней трети, неравномерность контуров аорты и признаки стеноза других ветвей грудной и брюшной аорты характерны для артериита почечных артерий и аорты.
Дополнительные методы диагностики вазоренальной АГ - определение активности ренина плазмы и сцинтиграфия почечных артерий с каптоприлом. Как правило, активность ренина у таких больных повышена в 5-10 раз и более, что обусловлено патогенезом гипертензии, связанным с активацией ренинангиотензинового каскада. Сцинтиграфия с каптоприлом основана на том, что ингибиторы АПФ снижают клубочковую перфузию и кровоток в ишемизированной почке. Таким образом, на ренограммах, выполненных после приема каптоприла, отмечают замедление выведения индикатора со стороны стеноза почечной артерии.
Эндокринные гипертензии. Среди эндокринных заболеваний, сопровождающихся АГ, не рассматривают диффузный токсический зоб, так как диагностика АГ в этом случае не затруднена и имеет преимущественно гемодинамический механизм.
Клиническая картина других эндокринных заболеваний, протекающих с повышением АД, представлена следующими синдромами:
• АГ и симпатико-адреналовые кризы;
• АГ с мышечной слабостью и мочевым синдромом;
• АГ и ожирение;
• АГ и пальпируемая опухоль в брюшной полости (редко). Обнаружение этих синдромов на разных этапах диагностического поиска
позволяет предположительно высказаться об эндокринной этиологии АГ.
На первом этапе диагностического поиска жалобы больного на возникновение гипертонических кризов, сопровождающихся приступами сердцебиения, мышечной дрожью, профузной потливостью, бледностью кожного покрова, головными болями и болями за грудиной, позволяют говорить о феохромоцитоме.
Вне кризов АД может быть нормальным или повышенным. Склонность к обморокам (особенно при подъеме с постели) на фоне постоянно высокого АД также характерна для феохромоцитомы, протекающей без кризов.
Жалобы больного на повышение АД, приступы мышечной слабости, снижение физической выносливости, жажду и обильное мочеиспускание (особенно в ночные часы) создают классическую клиническую картину первичного гиперальдостеронизма (синдром Конна) и позволяют установить возможную причину АГ уже на первом этапе диагностического поиска.
Если больной предъявляет жалобы на увеличение массы тела, совпадающее по времени с развитием АГ (при алиментарном ожирении, как правило, ее повышение происходит задолго до развития АГ), и нарушения в половой сфере (дисменорея - у женщин, угасание либидо - у мужчин), то можно предположить синдром или болезнь Иценко-Кушинга. Предположение подкрепляют обнаружением у больного жажды, полиурии и кожного зуда (признаки нарушений углеводного обмена).
Таким образом, первый этап диагностического поиска очень информативен для диагностики эндокринных заболеваний, сопровождающихся АГ. Сложности возникают при феохромоцитоме, не сопровождающейся кризами, и при гиперальдостеронизме без типичных нейромышечных синдромов. В такой ситуации значение последующих диагностических этапов (особенно третьего) чрезвычайно возрастает.
На втором этапе диагностического поиска физические методы обследования позволяют обнаружить:
• изменения сердечно-сосудистой системы, развивающиеся под влиянием повышения АД;
• преимущественное отложение жира на туловище при относительно худых конечностях, розовые стрии, угри и гипертрихоз, свойственные болезни и синдрому Иценко-Кушинга;
• слабость мышц, вялые параличи и судороги, характерные для синдрома Конна.
Следует подчеркнуть, что, несмотря на избыток альдостерона, у этих больных не бывает отеков.
Иногда у больных феохромоцитомой пальпация живота может спровоцировать гипертонический криз. Использовать этот прием в качестве диагностический пробы следует с большой осторожностью.
Третий этап диагностического поиска приобретает решающее значение, поскольку позволяет:
• поставить окончательный диагноз;
• установить локализацию опухоли;
• уточнить ее характер;
• определить тактику лечения.
Лабораторно-инструментальная диагностика гормонально-активных опухолей надпочечников складывается из двух этапов:
• доказательства существования заболевания, протекающего с избытком гормонов;
• обнаружения опухоли методами топической диагностики.
Очень важно, чтобы эти этапы проводили именно в такой последовательности, а не наоборот. Это связано с тем, что около 5% здоровых людей имеют гормонально-неактивные аденомы надпочечников размером до 2-3 см, которые не требуют лечения. Случайное обнаружение такой аденомы у пациента с АГ может направить врача по ложному следу и стать причиной проведения неоправданного хирургического вмешательства.
При лабораторном обследовании пациента с первичным гиперальдостеронизмом возможно (свыше 50% случаев) обнаружение гипокалиемии (особенно если ранее больной получал хотя бы небольшие дозы тиазидных диуретиков). Гормональная диагностика основана на определении концентрации альдостерона и активности ренина плазмы. Сочетание повышенного содержания альдостерона с низкой (иногда нулевой) активностью ренина свидетельствует в пользу диагноза.
Для обнаружения гиперкортицизма используют один из трех тестов:
• определение суточной экскреции кортизола с мочой;
• малый дексаметазоновый тест (подробные инструкции по проведению можно найти в руководстве по эндокринологии);
• определение концентрации ночного кортизола в слюне.
В силу высокой суточной вариабельности концентрации кортизола в крови, его однократное определение в ней следует считать ошибкой.
Золотым стандартом диагностики катехоламинпродуцирующих опухолей считают определение концентрации в крови или суточной экскреции метилированных производных катехоламинов - метанефринов (метанефрин и норметанефрин). До сих пор иногда выполняют определение суточной экскреции адреналина, норадреналина и ванилилминдальной кислоты с мочой, но этот метод менее чувствителен, поэтому от него следует отказываться. Категорически недопустимым в настоящее время считают проведение провокационных проб (в том числе с гистамином). Это может привести к развитию состояния неуправляемой гемодинамики и гибели больного.
Лишь после подтверждения гиперсекреции того или иного гормона следует проводить топическую диагностику опухоли. Наиболее оптимальный метод - КТ брюшной полости и забрюшинного пространства, позволяющая с высоким разрешением визуализировать надпочечники, определить опухоль, ее гомогенность и плотность.
При подозрении на болезнь Кушинга (кортикотропному гипофизу) выполняют МРТ гипофиза с контрастированием.
В качестве дополнительного метода верификации опухолей коры надпочечников иногда проводят селективную флебографию с раздельной катетеризацией надпочечниковых вен и забором крови с целью определения концентрации альдостерона и кортизола. Это исследование позволяет обнаружить, какой из надпочечников обладает повышенной гормональной активностью (например, при двусторонних опухолях).
Редкая форма феохромоцитомы - параганглиома (феохромоцитома вненадпочечниковой локализации). Для поиска вненадпочечниковой опухоли хромаффинной ткани используют сцинтиграфию всего тела с 131I-метайод- бензил гуанидином.
Гемодинамические гипертензии. Гемодинамические АГ обусловлены поражением сердца и крупных сосудов. Их подразделяют:
• на систолические гипертензии при атеросклерозе, брадикардии, аортальной недостаточности;
• регионарные гипертензии при коарктации аорты;
• гиперкинетический циркуляторный синдром при артериовенозных фистулах;
• ишемические застойные гипертензии при сердечной недостаточности и пороках митрального клапана.
Все гемодинамические АГ связаны непосредственно с заболеваниями сердца и крупных сосудов, изменяющими условия системного кровотока, и способствуют подъему АД. Характерно изолированное или преимущественное повышение систолического АД.
На первом этапе диагностического поиска получают сведения:
• о времени возникновения повышения АД, его характере и субъективных ощущениях;
• различных признаках атеросклероза у лиц пожилого возраста и степени их выраженности (перемежающаяся хромота, резкое снижение памяти и т.д.);
• заболеваниях сердца и крупных сосудов, с которыми можно связать повышение АД;
• признаках застойной сердечной недостаточности;
• характере и эффективности медикаментозного лечения. Возникновение АГ на фоне существующих болезней и ее прогрессирование
в связи с ухудшением течения основного заболевания обычно свидетельствуют о симптоматическом характере гипертензии (АГ - симптом основного заболевания).
На втором этапе диагностического поиска определяют:
• степень повышения АД и его характер;
• заболевания и состояния, определяющие повышение АД;
• симптомы, обусловленные АГ.
У большинства пожилых больных АД не отличается стабильностью, возможны его беспричинные подъемы и внезапные понижения. АГ характеризуется повышением систолического давления при нормальном, а иногда и пониженном диастолическом - так называемая атеросклеротическая гипертензия или возрастная (склеротическая) у пожилых (без явных клинических признаков атеросклероза). В общепринятой классификации АГ по степеням повышения АД, подобную АГ, обозначают как систолическую изолированную АГ. Обнаружение признаков атеросклероза периферических артерий (снижение пульсации на артериях нижних конечностей, их похолодание и др.) делает диагноз атеросклеротической АГ более вероятным. При аускультации сердца можно обнаружить интенсивный систолический шум на аорте и акцент II тона во втором межреберье справа, что свидетельствует об атеросклерозе аорты (иногда обнаруживают атеросклеротический порок сердца). Присоединение к уже существующей систолической АГ довольно стойкого повышения диастолического давления может свидетельствовать о развитии атеросклероза почечных артерий (систолический шум над брюшной аортой у пупка выслушивают не всегда).
Можно определить резкое повышение АД на руках и его снижение на ногах. Сочетание такой АГ с усиленной пульсацией межреберных артерий (при осмотре и пальпации), ослаблением пульсации периферических артерий нижних конечностей и запаздыванием пульсовой волны на бедренных артериях позволяет с достоверностью заподозрить коарктацию аорты. Выслушивают грубый систолический шум у основания сердца над грудным отделом аорты спереди и сзади (в межлопаточной области). Шум иррадиирует по ходу крупных сосудов (сонных, подключичных). Характерная аускультативная картина позволяет на втором этапе с уверенностью диагностировать коарктацию аорты.
При физикальном обследовании можно обнаружить признаки недостаточности аортального клапана, незаращения артериального протока и застойной сердечной недостаточности. Все эти состояния могут приводить к АГ.
На третьем этапе диагностического поиска можно поставить окончательный диагноз.
Повышение концентрации холестерина (чаще - а-холестерина), триглицеридов и ЛПНП в крови отмечают при атеросклерозе. При офтальмоскопии можно определить изменения сосудов глазного дна, развивающиеся при ате-
росклерозе мозговых сосудов. Снижение пульсации сосудов нижних конечностей (иногда - сонных артерий) и изменение формы кривых на реограмме подтверждают атеросклеротическое поражение сосудов.
На третьем этапе диагностического поиска обнаруживают характерные электрокардиографические, рентгенологические и эхокардиографические признаки порока сердца (см. «Пороки сердца»).
Больным с коарктацией аорты ангиографию обычно выполняют для уточнения локализации и протяженности пораженного участка (перед операцией). Если существуют противопоказания к оперативному лечению, то для установления диагноза достаточно данных физикального обследования.
Синдром ночного апноэ. Синдром ночного апноэ - состояние, характеризующееся возникновением храпа, периодическим спадением верхних дыхательных путей на уровне глотки, прекращением легочной вентиляции при сохраняющихся дыхательных усилиях, снижением концентрации кислорода в крови, грубой фрагментацией сна и избыточной дневной сонливостью (Guilleminault C., 1976).
Ha первом этапе диагностического поиска определяют основную жалобу пациентов на интенсивный храп с периодическими остановками дыхания. Нередко для детализации этой жалобы необходимо расспросить близких родственников и членов семьи. Сам пациент может отмечать ночные пробуждения с ощущением задержки дыхания, нехватки воздуха или удушья, дневную сонливость, спонтанные засыпания и чувство усталости в течение дня.
На втором этапе обращают внимание на избыточную массу тела или ожирение, причем чем более выражено последнее, тем, как правило, тяжелее степень дыхательных нарушений. При осмотре можно определить анатомические предпосылки к развитию синдрома ночного апноэ - гиперстеническую конституцию с короткой толстой шеей, деформации носа, макроглоссию, увеличение миндалин, низко расположенное мягкое нёбо и удлиненный нёбный язычок.
На третьем этапе получают наиболее важные для диагностики сведения.
Золотым стандартом диагностики считают полисомнографию - одновременную регистрацию различных функций организма (ЭКГ, степень насыщения крови кислородом, электроэнцефалограмма, определение носоротового потока воздуха и др.) в период ночного сна.
При отсутствии возможности для проведения полисомнографии нарушения дыхания во сне можно заподозрить по данным других более доступных методов исследования - холтеровского мониторирования ЭКГ (преобладание нарушений ритма и проводимости в ночной период, характерный вид синусовой аритмии); мониторирования АД (преимущественно ночной и утренний характер АГ или отсутствие снижения АД ночью), исследования функции внешнего дыхания (существование дискинезии трахеи).
Для оценки состояния глотки и верхних дыхательных путей обязателен осмотр ЛОР-врача.
Лечение
• Этиологическое лечение. При обнаружении АГ, коарктации аорты или гормонально-активных аденом надпочечников ставят вопрос об опера-
тивном вмешательстве (устранение причин, приводящих к развитию АГ). В первую очередь это касается феохромоцитомы, альдостеронпродуцирующей аденомы и аденокарциномы надпочечника, кортикостеромы и, конечно, гипернефроидного рака почки. Для лечения вазоренальной гипертензии с успехом применяют эндоваскулярные вмешательства (баллонная ангиопластика и стентирование). При аденоме гипофиза используют методы активного воздействия с помощью рентгено-, радиотерапии и лечения лазером. В ряде случаев выполняют операции. Медикаментозное лечение основного заболевания (УП, эритремии, застойной сердечной недостаточности, инфекционного поражения мочевыводящих путей и др.) дает положительный эффект и в отношении АГ. • Медикаментозная гипотензивная терапия. Медикаментозное лечение САГ зависит от основного заболевания, вызывающего повышение АД. В подавляющем большинстве случаев эти гипертензии достаточно тяжело поддаются лечению и требуют назначения одновременно 3-4, а иногда и больше гипотензивных препаратов. Тем не менее существуют некоторые специфические принципы лечения отдельных САГ.
- В лечении нефрогенных АГ важную роль играют препараты, обладающие нефропротективным действием (ингибиторы АПФ и блокаторы рецепторов к ангиотензину II). Эти средства обладают антипротеинурическим эффектом и замедляют прогрессирование почечной недостаточности. При уже имеющейся тяжелой почечной недостаточности (концентрация креатинина более 3 ммоль/л) эти препараты следует применять с большой осторожностью и в очень малых дозах, что связано с опасностью усугубления почечной недостаточности.
- Препараты выбора для медикаментозного лечения вазоренальной гипертензии, вызванной односторонним стенозом почечной артерии (например, на этапе подготовке к оперативному лечению), - ингибиторы АПФ. При двустороннем стенозе их применение категорически противопоказано в связи с риском развития острой почечной недостаточности.
- В лечении АГ при первичном гиперальдостеронизме и гиперкортицизме ведущая роль принадлежит антагонисту альдостерона спиронолактону, который назначают в высоких дозах (по 100-400 мг/сут). Для усиления гипотензивного эффекта возможно добавление блокаторов медленных кальциевых каналов (нифедипин, амлодипин).
- Предоперационная подготовка больных с феохромоцитомой предусматривает назначение а-адреноблокаторов (доксазозин), к которым через 3-4 дня добавляют р-адреноблокаторы (метопролол, бисопролол и др.). Категорически недопустимо назначение р-адреноблокаторов без предшествующей блокады а-адренорецепторов, так как в этом случае возможна парадоксальная активация а-адренорецепторов с развитием катехоламинового криза.
Для лечения синдрома ночного апноэ применяют методику СИПАП (CPAP)- терапии - аппаратное поддержание постоянного положительного давления в дыхательных путях во время сна.
Прогноз
Прогноз САГ зависит от течения и исхода заболевания, симптомом которого служит САГ. При своевременном хирургическом лечении опухолей надпочечника прогноз хороший, возможно полное излечение. Несвоевременно диагностированные и нелеченые САГ чреваты развитием ранних и потенциально смертельных осложнений (инсульт, нарушения ритма). Некоторые нефрогенные АГ (например, при поликистозе почек) имеют неуклонно прогрессирующее течение и со временем требуют проведения почечной заместительной терапии (гемодиализ или трансплантация почки).
Профилактика
Профилактика САГ состоит в предупреждении развития основного заболевания и его своевременном лечении.
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Ишемическая болезнь сердца (ИБС) - острое или хроническое заболевание сердца, обусловленное уменьшением или прекращением доставки крови и кислорода к сердечной мышце, возникающее в результате патологических процессов в системе коронарных артерий. Данный термин был предложен группой экспертов по изучению атеросклероза при ВОЗ в 1957 г. и принят в качестве определения ИБС в 1962 г.
Нарушение снабжения миокарда кислородом при ИБС обусловлено несоответствием между потребностями сердечной мыщцы в кислороде и метаболических (энергетических) субстратах и возможностями коронарного кровотока обеспечить эти потребности. Это несоответствие может возникать при сохраняющемся на определенном уровне кровоснабжении миокарда, но резко возросшей потребности в нем; при сохраняющейся потребности, но упавшем кровоснабжении. Особенно выражено несоответствие в случаях снижения уровня кровоснабжения и возрастающей потребности миокарда в притоке крови. Эта ситуация может быть следствием:
• атеросклероза коронарных артерий;
• спазма (неизмененных или малоизмененных) коронарных артерий;
• эмболии коронарных артерий;
• анемии;
• АГ;
• артериальной гипотензии;
• тахиили брадиаритмий.
ИБС широко распространена во многих странах мира, ею болеют преимущественно мужчины в возрасте 40-60 лет, у женщин после 60 лет ИБС встречается с той же частотой, что и у мужчин этого возраста. Из всех причин смерти от сердечно-сосудистых заболеваний на долю ИБС приходится более 50%.
Классификация
В 1979 г. Комитетом экспертов ВОЗ по стандартной клинической терминологии была разработана классификация ИБС, модифицированная в 1984 г. Кардио-
логическим научным центром Российской академии медицинских наук. Эта классификация предусматривает выделение следующих клинических форм ИБС:
• внезапная коронарная смерть (первичная остановка сердца);
• стенокардия (впервые возникшая стенокардия напряжения, стабильная стенокардия напряжения различных (I-IV) функциональных классов, прогрессирующая стенокардия напряжения, стенокардия покоя, спонтанная (особая)стенокардия);
• ИМ (с Q-зубцом (ранее именовавшийся как «трансмуральный», «крупноочаговый») и без Q-зубца (ранее именовавшийся как «мелкоочаговый», «субэндокардиальный»);
• постинфарктный кардиосклероз (старый, перенесенный ранее ИМ);
• нарушения ритма сердца (имеются в виду лишь связанные с ишемией миокарда);
• сердечная недостаточность (связанная с поражением миокарда вследствие ИБС).
Необходимо отметить, что за прошедшие 30 лет со времени создания классификации ИБС, предложенной экспертами ВОЗ в 1979 г., произошли существенные изменения в понимании патогенеза и в возможностях лечения многих клинических форм ИБС. В связи с этим в последние годы появились ряд новых терминов (например, «острый коронарный синдром», «нестабильная стенокардия») и ряд новых классификаций некоторых форм ИБС (например, «универсальное определение ИМ», классификация ИМ 2007 г.). Они не нашли своего отражения в классификации ВОЗ 1979 г. и будут представлены в соответствующих разделах данного учебника.
Главным этиологическим фактором ИБС служит атеросклероз коронарных артерий. Факторы, предрасполагающие к его развитию, следует рассматривать как факторы риска ИБС. Их можно разделить:
• на немодифицируемые, к которым относят мужской пол, возраст и наследственную предрасположенность;
• модифицируемые, наиболее важны:
- дислипидемия (высокая концентрация общего холестерина в крови (>240 мг/дл) и ЛПНП >160 мг/дл, снижение концентрации ЛПВП, повышение содержания триглицеридов);
- АГ;
- курение;
- гиподинамия (физическая детренированность);
- избыточная масса тела и высококалорийное питание;
- сахарный диабет или нарушение толерантности к глюкозе.
СТЕНОКАРДИЯ
Стенокардия (грудная жаба, angina pectoris) - одна из клинических форм ИБС, характеризующаяся возникновением дискомфорта или боли в грудной клетке (чаще всего - за грудиной, но возможна и другая локализация) вследствие ишемии миокарда в результате физических или эмоциональных нагрузок, быстро проходящей после приема нитроглицерина либо после прекращения нагрузок.
По клиническому течению и прогнозу стенокардию можно подразделить на несколько вариантов:
• стабильная стенокардия напряжения различных (I-IV) функциональных классов;
• впервые возникшая стенокардия напряжения;
• прогрессирующая стенокардия напряжения;
• стенокардия покоя;
• спонтанная (особая) стенокардия (вазоспастическая, вариантная, стенокардия Принцметала).
В настоящее время впервые возникшую, прогрессирующую стенокардию напряжения и стенокардию покоя относят к клиническим вариантам нестабильной стенокардии и рассматривают в рамках острого коронарного синдрома без подъема сегмента ST (см. соответствующие разделы учебника).
Стабильная стенокардия напряжения
Стенокардию напряжения считают стабильной, если она возникает у больного в течение не менее 1 мес с более или менее определенной частотой (1-2 приступа в неделю или месяц). У большей части пациентов стенокардия возникает при одних и тех же физических нагрузках и может быть стабильной в течение многих лет. Этот клинический вариант заболевания имеет относительно благоприятный прогноз.
Распространенность стенокардии зависит от возраста и пола. Так, среди населения в возрасте 45-54 года стенокардию напряжения регистрируют у 2-5% мужчин и 0,5-1% женщин, а в возрасте 65-74 года - у 11-20% мужчин и 10-14% женщин. До инфаркта миокарда стенокардию напряжения отмечают у 20% пациентов, после перенесенного инфаркта миокарда - у 50% больных.
Этиология
Причина возникновения стенокардии у подавляющего большинства больных - атеросклероз коронарных артерий. К числу некоронарогенных причин ее развития относят АГ, стеноз устья аорты, ГКМП, анемии, тиреотоксикоз, изменения в свертывающей и противосвертывающей системе крови, а также недостаточное развитие коллатерального кровообращения. Значительно реже приступы стенокардии возникают при неизмененных коронарных артериях.
Патогенез
В большинстве случаев в основе ИБС, в том числе стенокардии, лежит атеросклероз коронарных артерий. Неизмененные коронарные артерии во время максимальной физической нагрузки вследствие снижения сопротивления способны в 5-6 раз увеличивать объем коронарного кровотока. Присутствие атеросклеротических бляшек в коронарных артериях приводит к тому, что во время физических нагрузок не происходит адекватное увеличение коронарного кровотока, в результате чего развивается ишемия миокарда, степень которой зависит от выраженности сужения коронарных артерий и потребности миокарда в кислороде. Сужение коронарных артерий менее чем на 40% мало влияет на способность коронарного кровообращения обеспечивать максимальные физические нагрузки, поэтому не сопровождается развитием ишемии миокарда и не
манифестирует приступами стенокардии. В то же время у больных, имеющих сужение коронарных артерий на 50% и более, физические нагрузки могут приводить к развитию ишемии миокарда и возникновению приступов стенокардии.
Как известно, в норме между доставкой кислорода к кардиомиоцитам и потребностью в нем существует четкое соответствие, обеспечивающее нормальный метаболизм и, следовательно, нормальное функционирование клеток сердца. Коронарный атеросклероз приводит к развитию дисбаланса между доставкой кислорода к кардиомиоцитам и потребностью в нем: возникает нарушение перфузии и ишемия миокарда. Эпизоды ишемии приводят к изменению метаболизма кардиомиоцитов и вызывают кратковременное обратимое нарушение сократительной функции миокарда («оглушенный миокард»). Часто повторяющиеся эпизоды ишемии миокарда могут привести к развитию хронической дисфункции миокарда (гибернирующий миокард), которая также может носить обратимый характер.
Клеточный ацидоз, нарушение ионного равновесия, уменьшение синтеза АТФ сначала приводят к диастолической, а затем и к систолической дисфункции миокарда, а также электрофизиологическим нарушениям, выражающимся в изменениях зубца Т и сегмента ST на ЭКГ, и лишь в дальнейшем возникают боли в грудной клетке. Основным медиатором болевых ощущений, играющим роль в развитии приступа стенокардии, считают аденозин, который высвобождается из клеток ишемизированного миокарда и стимулирует А1-рецепторы, располагающиеся в окончаниях нервных волокон, иннервирующих сердечную мышцу. Эту последовательность изменений называют ишемическим каскадом. Таким образом, стенокардия - его конечный этап, по сути, - «верхушка айсберга», в основании которого лежат возникшие вследствие нарушений перфузии изменения метаболизма миокарда.
Необходимо отметить, что существует и безболевая ишемия миокарда. Отсутствие болевых ощущений во время эпизода ишемии может быть обусловлено ее малой продолжительностью и степенью выраженности, недостаточной для того, чтобы вызвать повреждение окончаний афферентных нервов сердца. В клинической практике безболевую ишемию миокарда чаще всего регистрируют у больных сахарным диабетом (диабетическая полинейропатия), у пожилых пациентов, женщин, лиц с высоким порогом болевой чувствительности, а также при заболеваниях и повреждениях спинного мозга. У больных с безболевой ишемией миокарда нередко возникают так называемые эквиваленты стенокардии в виде приступов одышки и сердцебиения, обусловленных развитием систолической и (или) диастолической дисфункции миокарда либо преходящей митральной регургитации на фоне ишемии миокарда левого желудочка.
Клиническая картина
Основной признак стенокардии - характерный болевой приступ. Первое классическое описание стенокардии дал Геберден в 1772 г. Он писал, что стенокардия - это «...боль в грудной клетке, возникающая во время ходьбы и заставляющая больного остановиться, особенно во время ходьбы вскоре после еды; кажется, что эта боль в случае ее продолжения или усиления способна лишить человека жизни; в момент остановки все неприятные ощущения исчезают. По-
сле того, как боль продолжает возникать в течение нескольких месяцев, она перестает немедленно исчезать при остановке, и в дальнейшем она будет продолжать возникать не только когда человек идет, но и когда лежит...».
Типичной стенокардии свойствен ряд характерных клинических признаков.
Характер, локализация и длительность болевых ощущений. Для типичной стенокардии характерно возникновение давящих, сжимающих, режущих и жгучих болей. Иногда больные воспринимают приступ не как явную боль, а как трудно выразимый дискомфорт, который можно охарактеризовать как тяжесть, сжатие, стеснение, сдавление или тупую боль. Приступ типичной стенокардии нередко также называют ангинозным, по аналогии с латинским названием стенокардии - «angina pectoris».
При типичной стенокардии болевые ощущения локализуются в основном за грудиной. Нередко отмечают иррадиацию боли в нижнюю челюсть, зубы, шею, межлопаточую область, левое (реже - в правое) плечо, предплечье и кисть. Чем тяжелее приступ стенокардии, тем обширнее может быть зона иррадиации боли.
Несмотря на то что интенсивность и длительность ангинозных болей может значительно варьировать у разных больных, типичный приступ стенокардии не продолжается более 15 мин. Чаще всего он длится около 2-5 мин и прерывается после прекращения физической или эмоциональной нагрузки. Если типичный по характеру приступ стенокардии продолжается более 20 мин и его не устраняет прием нитроглицерина, то в первую очередь следует подумать о возможности развития острого коронарного синдрома (инфаркта миокарда) и зарегистрировать ЭКГ.
Провоцирующие факторы. В типичных ситуациях фактором, провоцирующим стенокардию, служит физической или эмоциональное напряжение. После прекращения его воздействия приступ проходит. Если нагрузка (быстрая ходьба, подъем по лестнице) не вызывает загрудинного дискомфорта, то с большой вероятностью можно предполагать, что у больного нет значительного поражения крупных венечных артерий сердца. Для ангинозного приступа также характерно его возникновение на морозе или холодном ветру, что особенно часто происходит утром, при выходе из дома. Охлаждение лица вызывает стимуляцию вазорегуляторных рефлексов, направленных на поддержание температуры тела. В результате возникают вазоконстрикция и системная АГ, что способствует увеличению потребления миокардом кислорода и провоцирует приступ стенокардии.
Эффект от приема нитроглицерина. Обычно сублингвальный прием нитроглицерина в виде одной таблетки или одной дозы спрея быстро (в течение 1-2 мин) и полностью купирует приступ стенокардии. Если больной не имеет опыта применения этого препарата, то в первый раз ему лучше принять нитроглицерин в положении лежа, что позволит избежать возможного резкого снижения АД, обусловленного ортостатической артериальной гипотензией. Пациент может самостоятельно принять две таблетки (две дозы спрея) нитроглицерина с интервалом 10 мин. Если после этого приступ стенокардии не прекращается, то для исключения развивающегося инфаркта миокарда необходимы врачебная помощь и регистрация ЭКГ. Нередко приступ стенокардии
сопровождается вегетативными симптомами: учащением дыхания, бледностью кожного покрова, усилением сухости во рту, повышением АД, возникновением экстрасистолии, тахикардии и позывов к мочеиспусканию.
Стенокардию считают типичной (несомненной), если болевой приступ соответствует всем трем вышеприведенным критериям. Типичный характер болевого синдрома (болевые ощущения, локализация болей, их длительность, провоцирующие факторы, эффективность нитроглицерина) в сочетании с мужским полом и возрастом старше 40 лет позволяют с высокой вероятностью (85-95%) говорить о том, что у больного существуют ИБС и ишемия миокарда на фоне атеросклероза магистральных (субэпикардиальных) коронарных артерий с сужением их просвета более чем на 50%.
Стенокардию считают атипичной (возможной), если клинические характеристики болевого приступа удовлетворяют только двум из трех вышеприведенных критериев. Для подтверждения того, что атипичные боли в области сердца - признак атипичной стенокардии, необходимо объективное подтверждение взаимосвязи ишемии миокарда и болевого приступа на третьем этапе диагностического поиска, при этом вероятность обнаружения ИБС и ишемии миокарда (т.е. объективного подтверждения того, что болевой синдром носит характер стенокардии, хотя и атипичной) у мужчин в возрасте старше 40 лет значительно ниже и составляет от 45 до 65% (табл. 2-10). Чаще всего атипичную стенокардию регистрируют у больных сахарным диабетом, женщин и пожилых больных.
Если болевые ощущения в грудной клетке не соответствуют ни одному из вышеприведенных критериев, то их расцениваются как некардиальные.
Таблица 2-10. Вероятность существования ишемической болезни сердца в зависимости от характера болевого синдрома, пола и возраста больных
Таким образом, типичная стенокардия напряжения - одно из немногих внутренних заболеваний, которое можно с большой долей вероятности диагностировать уже на первом этапе диагностического поиска, тщательно расспросив пациента.
Согласно классификации Канадского общества кардиологов, принятой в 1976 г., стабильную стенокардию напряжения в зависимости от выраженности физических нагрузок, вызывающих ее, можно разделить на четыре функциональных класса.
• I функциональный класс - обычная физическая нагрузка (ходьба, подъем на лестницу) не вызывает стенокардию. Она возникает только во время очень интенсивных, «взрывных» или длительных физических нагрузок.
• II функциональный класс - небольшое ограничение физической активности. Стенокардию вызывают обычная ходьба на расстояние более 500 м, подъем по лестнице более чем на один этаж или в гору, ходьба после приема пищи, при ветре или в холод. Возможно возникновение стенокардии под влиянием эмоционального напряжения.
• III функциональный класс - выраженное ограничение физической активности. Стенокардия возникает при обычной ходьбе на расстояние 200- 400 м либо при подъеме на первый этаж.
• IV функциональный класс - неспособность выполнять любую физическую работу без возникновения стенокардии. Возможны редкие приступы стенокардии покоя.
Основной клинический симптом - болевой приступ (приступ стенокардии) - не считают специфическим только для ИБС. В связи с этим диагноз стенокардии как формы хронической ИБС можно поставить только в тех случаях, когда с учетом всех данных, полученных на различных этапах обследования больного (в основном с помощью объективных методов обследования на третьем этапе диагностического поиска), будет подтверждена связь возникновения болей в грудной клетке с существованием ишемии миокарда.
Вместе с тем клиническая картина стенокардии при ИБС имеет свои особенности, которые обнаруживают уже на первом этапе диагностического поиска. Задача первого этапа диагностического поиска - определение:
• типично протекающей стенокардии;
• других признаков хронической ИБС (нарушения ритма, сердечная недостаточность);
• факторов риска ИБС;
• атипичных кардиальных болей и их оценки с учетом возраста, пола, факторов риска развития ИБС и сопутствующих заболеваний;
• эффективности и характера проводимого медикаментозного лечения;
• заболеваний, манифестирующих стенокардией.
Первый этап диагностического поиска чрезвычайно важен для диагностики стенокардии напряжения. При ее классическом варианте правильно собранная информация о характере болевого синдрома позволяет поставить диагноз более чем в 70% случаев даже без использования инструментальных методов обследования больного.
Все жалобы оценивают с учетом возраста, пола, конституции, психоэмоционального фона и поведения пациента, так что нередко уже при первом общении с больным можно отвергнуть или убедиться в правильности предварительного диагноза ИБС. Так, при классических жалобах в течение последнего года и отсутствии сердечно-сосудистых заболеваний в прошлом у мужчины в возрасте 50-60 лет с очень высокой вероятностью можно диагностировать хроническую
ИБС.
Тем не менее развернутый диагноз с указанием клинического варианта болезни и тяжести поражения коронарных артерий и миокарда можно поставить лишь после выполнения всей основной схемы диагностического поиска, а в некоторых ситуациях (описаны далее) - после проведения дополнительного обследования.
Иногда трудно дифференцировать стенокардию и разнообразные болевые ощущения кардиального и экстракардиального происхождения. Особенности болей при различных заболеваниях описаны в многочисленных руководствах. Следует лишь подчеркнуть, что стабильной стенокардии свойствен постоянный, одинаковый характер болей при каждом приступе, а ее возникновение четко связано с определенными обстоятельствами.
При НЦД и ряде других заболеваний сердечно-сосудистой системы пациент отмечает разнообразный характер болей, их различную локализацию и отсутствие какой-либо закономерности в их возникновении. У больного стенокардией даже при существовании других болей (обусловленных, например, поражением позвоночника) обычно удается выделить характерные ишемические боли.
У больных с такими заболеваниями, как ГБ и сахарный диабет, следует активно определять жалобы, характерные для стенокардии, аритмии и расстройства кровообращения. Сам пациент может и не предъявлять их, если соответствующие явления выражены незначительно или он считает их малосущественными по сравнению с другими.
Больные нередко описывают стенокардию не как боль, а говорят о чувстве дискомфорта в груди в виде тяжести, давления, стеснения или даже жжения и изжоги. У лиц пожилого возраста ощущение боли менее выражено, а клинические признаки чаще представлены затрудненным дыханием и внезапно возникающим чувством нехватки воздуха, сочетающимся с резкой слабостью.
В отдельных случаях отсутствует типичная локализация болей; они возникают лишь в тех местах, куда обычно иррадиируют. Поскольку болевой синдром при стенокардии может протекать атипично, при любых жалобах на боль в грудной клетке, руках, спине, шее, нижней челюсти и эпигастральной области (даже у молодых мужчин) следует выяснить, не соответствуют ли обстоятельства их возникновения и исчезновения закономерностям болевого синдрома при стенокардии. За исключением локализации, в таких случаях боли сохраняют все особенности типичной стенокардии (причина возникновения, продолжительность приступа, эффект нитроглицерина или остановки при ходьбе
и др.).
Таким образом, на первом этапе диагностического поиска оценивают характер, локализацию и продолжительность болевого синдрома, его связь с физическими и эмоциональными нагрузками, эффективность приема нитроглицерина (при исчезновении болей через 5 мин и позднее эффект препарата весьма сомнителен) и других ранее принимаемых лекарственных препаратов (важно не только для диагностики, но и для построения индивидуального плана дальнейшего лечения).
Второй этап диагностического поиска малоинформативен для диагностики стабильной стенокардии напряжения. Каких-либо данных объективного осмотра больного, специфичных для нее, не существует. Нередко при физикальном обследовании можно вообще не обнаружить каких-либо отклонений от нормы (при недавно возникшей стенокардии). Тем не менее у больного со стенокардией второй этап диагностического поиска позволяет уточнить характер поражения сердечно-сосудистой системы (пороки сердца, АГ), существование сопутствующих заболеваний (анемия) и осложнений (сердечная недостаточ-
ность, аритмии). Именно поэтому на втором этапе диагностического поиска, несмотря на его относительно малую информативность у больных со стабильной стенокардией напряжения, следует активно искать симптомы заболеваний, которые могут сопровождаться ишемией миокарда.
Важной для диагностики считают внесердечную локализацию атеросклероза (при поражении аорты - акцент II тона и систолический шум на аорте, при заболевании нижних конечностей - резкое ослабление пульсации артерий), симптомы гипертрофии левого желудочка при нормальном АД и отсутствие каких-либо заболеваний сердечно-сосудистой системы.
На третьем этапе диагностического поиска выполняют инструментальные и лабораторные исследования, позволяющие определить факторы риска ИБС, объективные признаки ишемии миокарда и ее связи с болевыми приступами. Таким образом подтверждают диагноз ИБС и стенокардии как одних из признаков ишемии.
Лабораторные исследования. У всех больных, у которых на основании результатов первого и второго этапа диагностического поиска предполагают существование стабильной стенокардии напряжения, целесообразно проведение:
• клинического анализа крови с оценкой числа эритроцитов, лейкоцитов и концентрации гемоглобина;
• биохимического анализа крови с оценкой липидного спектра (концентрация общего холестерина, ЛПНП, ЛПВП и триглицеридов), содержания глюкозы и креатинина.
У больных с тяжелыми и длительными приступами стенокардии с целью исключения развития инфаркта рекомендовано определение биохимических маркеров некроза миокарда (сердечный тропонин Т или I, активность МВфракции креатинфосфокиназы (см. «Инфаркт миокарда)).
Рентгеноскопия грудной клетки. Это рутинное исследование, проводимое у больных с подозрением на заболевание сердечно-сосудистой системы или органов дыхания, позволяет обнаружить внесердечные признаки атеросклероза аорты. У больных со стенокардией рентгенография органов грудной клетки никакой специфической информации не дает, поэтому ее проведение оправдано при существовании клинических признаков сердечной недостаточности или заболевания органов дыхания.
ЭКГ - один из ведущих неинвазивных методов инструментальной диагностики ИБС, что связано с его простотой, доступностью и легкостью выполнения.
ЭКГ в покое в 12 стандартных отведениях необходимо регистрировать у всех больных с подозрением на стенокардию напряжения. Следует помнить, что вне болевого приступа у многих больных со стенокардий (если они не перенесли ранее инфаркт миокарда) ЭКГ в покое может соответствовать норме. В то же время рубцовые изменения, обнаруженные на ЭКГ в покое, при жалобах на характерные боли в сердце считают важным доводом в пользу диагноза
ИБС (рис. 2-12).
Зарегистрировать обычную ЭКГ в 12 отведениях во время приступа болей в области сердца достаточно трудно, но если это удается, то приносит очень много ценной информации. В первую очередь она позволяет обнаружить и связать
Рис. 2-12. Стандартная ЭКГ в 12 отведениях в покое у больного с ИБС, перенесшего переднебоковой инфаркт миокарда с Q-зубцом, после которого сохранялась стенокардия напряжения (ST-сегмент не изменен)
объективные признаки ишемии миокарда (изменения сегмента ST в виде его депрессии или подъема) с болевыми ощущениями в грудной клетке, т.е. дает возможность объективно диагностировать ИБС и стенокардию как одни из ее клинических признаков. Кроме того, ЭКГ в 12 отведениях, зарегистрированная во время приступа болей в области сердца, позволяет определить вызванные ишемией миокарда преходящие нарушения ритма и проводимости, что имеет существенное значение для стратификации риска и установления прогноза. Именно поэтому по возможности (особенно если больной находится в стационаре) следует стремиться зарегистрировать ЭКГ во время болевого приступа.
Нагрузочные тесты. К ним относят ЭКГ-пробы с физической нагрузкой (тредмил-тест, велоэргометрия), стресс-ЭхоКГ, стресс-сцинтиграфию миокарда с физической нагрузкой или фармакологическими препаратами (добутамин, дипиридамол, трифосаденин) и чреспищеводную электрическую стимуляцию предсердий.
ЭКГ-пробы с физической нагрузкой более чувствительны и специфичны при диагностике ишемии миокарда, чем ЭКГ в покое. Именно поэтому с учетом простоты выполнения, доступности и невысокой стоимости ЭКГ-пробы с физической нагрузкой считают методом выбора для обнаружения индуцируемой ишемии миокарда у больных с подозрением на стабильную стенокардию напряжения.
Наиболее распространенное показание к проведению ЭКГ-проб с физической нагрузкой - возникновение болей в грудной клетке, напоминающих та-
ковые при стенокардии напряжения, у лиц, которые по возрасту, полу и другим факторам риска имеют умеренно высокую или низкую вероятность существования ИБС (см. табл. 2-10). В то же время диагностическая значимость ЭКГпроб с физической нагрузкой у пациентов, имеющих на основании клинической оценки высокую вероятностью ИБС, минимальна: мужчина в возрасте 65 лет с типичными тяжелыми приступами стенокардии напряжения с вероятностью 95% страдает ИБС. Их проведение целесообразно как с точки зрения объективной верификации ишемии миокарда, так и с точки зрения определения прогноза и выбора тактики лечения. Кроме того, проведение ЭКГ-проб с физической нагрузкой желательно при существовании:
• типичного болевого синдрома при отсутствии изменений на ЭКГ, зарегистрированной в покое;
• болей в области сердца атипичного характера;
• нехарактерных для ишемии миокарда изменений на ЭКГ у лиц среднего и пожилого возраста, а также у молодых мужчин с предварительным диагнозом ИБС;
• отсутствии изменений на ЭКГ при подозрении на ИБС.
ЭКГ-пробу с физической нагрузкой считают положительной, если во время ее проведения возникает приступ стенокардии, сопровождающийся горизонтальной или косонисходящей депрессией либо подъемом сегмента ST >1 мм (0,1 мВ), отстоящего на >=60-80 мс от точки окончания комплекса QRS (рис. 2-13).
Если во время ЭКГ-пробы с физической нагрузкой возник типичный приступ стенокардии (служит основанием для ее прекращения), не сопровождающийся характерными для ишемии миокарда изменениями на ЭКГ, то такие результаты теста расценивают как сомнительные. Обычно они требуют проведения других инструментальных методов диагностики ИБС (фармакологических стресс-тестов в сочетании с ЭхоКГ, перфузионной сцинтиграфией миокарда, мультиспиральной КТ с контрастированием коронарных артерий или коронароангиографии).
Важное условие для интерпретации ЭКГ-пробы с физической нагрузкой как отрицательной - отсутствие возникновения приступа стенокардии и вышеописанных изменений на ЭКГ при достижении больным субмаксимальной для него по возрасту ЧСС. Для каждого больного последнюю ориентировочно рассчитывают как 200 минус возраст пациента.
Чувствительность ЭКГ-проб с физической нагрузкой в среднем составляет 68%, а специфичность - 77%.
Основные противопоказания к проведению проб с физической нагрузкой:
• острый ИМ;
• частые приступы стенокардии напряжения и покоя;
• сердечная недостаточность;
• прогностически неблагоприятные нарушения сердечного ритма и проводимости;
• тромбоэмболические осложнения;
• тяжелые формы АГ;
• острые инфекционные заболевания.
При невозможности проведения тредмил-теста или велоэргометрии (заболевания опорно-двигательного аппарата, выраженное ожирение, детрениро-
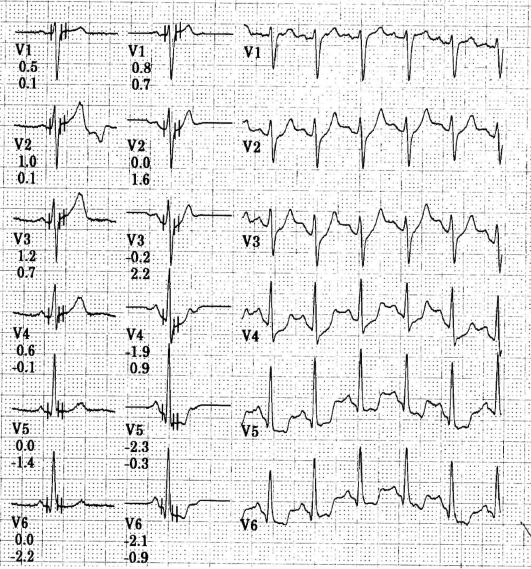
Рис. 2-13. ЭКГ больного ИБС во время пробы с физической нагрузкой (тредмил-тест), сегмент ST резко снижен в отведениях V2-V6. До нагрузки ST-сегмент был не изменен
ванность больного и др.) усиления работы сердца можно достичь с помощью теста частой чреспищеводной электрической стимуляции предсердий (метод не травматичен и достаточно легко выполним).
У больных, изначально имеющих изменения на ЭКГ в покое, которые затрудняют ее интерпретацию при выполнении проб с физической нагрузкой (полная блокада левой ножки пучка Гиса, депрессия сегмента ST >1 мм, синдром WPW, имплантированный кардиостимулятор), можно использовать стресс-ЭхоКГ и перфузионную сцинтиграфию миокарда в сочетании с физическими нагрузками.
Стресс-ЭхоКГ и перфузионную сцинтиграфию миокарда в сочетании с физическими нагрузками также можно применять для обнаружения объективных признаков ишемии миокарда у больных с высокой вероятностью существования ИБС, у которых ЭКГ-пробы с физическим нагрузками не дали однозначных результатов и диагноз остался неясным.
Фармакологические стресс-тесты. Несмотря на то что считают предпочтительным использование в качестве стресса физической нагрузки, так как это позволяет индуцировать ишемию миокарда и более физиологично вызвать бо-
левой приступ, для диагностики ИБС можно применять и фармакологические нагрузочные пробы с различными лекарственными препаратами, способными влиять на коронарное русло и функциональное состояние миокарда.
Так, при существовании исходных изменений конечной части желудочкового комплекса на ЭКГ и необходимости проведения дифференциальной диагностики ИБС и НЦД применяют фармакологические пробы с пропранололом и калия хлоридом. Изменения, полученные на ЭКГ, всегда оценивают с учетом других данных обследования больного.
Использование фармакологических стресс-тестов в сочетании с ЭхоКГ (стресс-ЭхоКГ) или перфузионной сцинтиграфией миокарда (стресс-сцинтиграфия) целесообразно у больных, которые не могут полноценно выполнить тест с физической нагрузкой.
В клинической практике используют два варианта фармакологических стресс-тестов.
• С использованием короткодействующих симпатомиметиков (добутамин), которые вводят внутривенно капельно с постепенным увеличением дозы, что способствует увеличению потребности миокарда в кислороде, действуя аналогично физическим нагрузкам.
• Реже используемая внутривенная инфузия препаратов, расширяющих коронарные артерии (трифосаденин или дипиридамол). Эти средства поразному влияют на зоны миокарда, которые кровоснабжаются нормальными и атеросклеротически стенозированными коронарными артериями. Под влиянием этих препаратов перфузия значительно возрастает или может увеличиться незначительно или даже снизиться (феномен «обкрадывания»).
При существовании у пациента ИБС во время проведения стресс-ЭхоКГ с добутамином или дипиридамолом возникает дисбаланс между доставкой кислорода и потребностью в нем определенного участка миокарда, снабжаемого кровью из ветви пораженной коронарной артерии. Вследствие этого возникают локальные нарушения сократимости и перфузии миокарда, которые обнаруживают либо с помощью УЗИ (стресс-ЭхоКГ), либо с помощью радиоизотопного (перфузионная сцинтиграфия миокарда) исследования. При стресс-ЭхоКГ изменения локальной сократимости могут предшествовать или сочетаться с другими признаками ишемии миокарда (изменения ЭКГ, болевой синдром, нарушения ритма сердца).
Чувствительность ультразвукового стресс-теста с добутамином колеблется от 40 до 100%, а специфичность - от 62 до 100%. Чувствительность ультразвукового стресс-теста с вазодилататорами (трифосаденин, дипиридамол) составляет 56-92%, а специфичность - 87-100%. Чувствительность и специфичность радиоизотопного фармакологического стресс-теста с трифосаденином составляет 83-94% и 64-90% соответственно.
На третьем этапе диагностического поиска у больных со стабильной стенокардией напряжения УЗИ сердца в покое необходимо проводить при выслушивании патологических шумов в сердце, подозрительных в отношении клапанных пороков сердца или ГКМП, клинических признаках хронической сердечной недостаточности, ранее перенесенном ИМ и выраженных изменениях ЭКГ (полная блокада левой ножки пучка Гиса, патологические зубцы Q,
признаки значительной гипертрофии миокарда левого желудочка). УЗИ сердца в покое позволяет оценить сократительную способность миокарда и определить размеры его полостей. Кроме того, при обнаружении порока сердца, дилатационной или обструктивной кардиомиопатии диагноз ИБС становится маловероятным, но у лиц пожилого возраста возможно сочетание этих заболеваний.
Холтеровское 24-часовое амбулаторное мониторирование ЭКГ у больных со стабильной стенокардией напряжения позволяет определить объективные признаки ишемии миокарда, возникающие во время обычной, повседневной активности пациентов, но редко может добавить что-либо существенное к диагностической информации, полученной во время проведения ЭКГ-проб с физической нагрузкой. Тем не менее проведение холтеровского 24-часового амбулаторного мониторирования ЭКГ у больных со стабильной стенокардией напряжения рекомендуют для определения возможных нарушений ритма, связанных с ней, «немой» ишемии миокарда и при подозрении на вазоспастическую стенокардию (стенокардия Принцметала).
С внедрением новых внутривенных контрастных средств и современной МСКТ, позволяющей выполнять до 320 срезов в секунду, роль КТ в диагностике ИБС и атеросклеротического поражения коронарных артерий значительно возрастает. Несмотря на то что чувствительность МСКТ с контрастированием коронарных артерий в диагностике их атеросклеротического поражения достигает 90-95%, а специфичность составляет 93-99%, окончательное место этого метода обследования в иерархии других на сегодняшний день окончательно не определено. В настоящее время считают, что проведение МСКТ рекомендовано больным, у которых на основании клинической оценки определена низкая (менее 10%) вероятность существования ИБС и у которых ЭКГ-пробы с физической нагрузкой, а также ультразвуковые и радиоизотопные стресс-тесты оказались недостаточно информативными для установления диагноза. Помимо этого МСКТ - неинвазивный метод исследования - используют для скрининга населения с целью диагностики начальных стадий ИБС.
Селективная коронарография - золотой стандарт диагностики ИБС. Ее проведение с целью диагностики стабильной стенокардии напряжения рекомендовано:
• при стенокардии напряжения более III функционального класса и отсутствии эффекта от полноценного медикаментозного лечения;
• при возобновлении стенокардии после ранее выполненных операций по реваскуляризации миокарда (аортокоронарное шунтирование, чрескожная транслюминальная ангиопластика);
• при ранее перенесенной остановке кровообращения;
• тяжелых желудочковых аритмиях (эпизоды устойчивой и неустойчивой ЖТ, частой политопной ЖЭ и др.);
• больным, у которых на основании клинической оценки отмечена промежуточная или высокая вероятность существования ИБС, а результаты использования неинвазивных методов исследования оказались недостаточно информативными для установления диагноза либо принесли разноречивую информацию.
Стратификация риска у больных со стабильной стенокардией напряжения
В зависимости от риска смерти в течение ближайшего года, всех больных со стабильной стенокардией напряжения разделяют на пациентов низкого (риск смерти менее 1%), высокого (риск смерти более 2%) и промежуточного риска (риск смерти 1-2%).
Эффективный способ стратификации риска смерти у больных со стабильной стенокардией напряжения - сочетание клинической оценки (тяжесть стенокардии, частота возникновения приступов, изменения на ЭКГ в покое) и результатов ЭКГ-тестов с физической нагрузкой (тредмил-индекс Дьюка). Последний рассчитывают по следующей формуле:
Индекс Дьюка = А-[5хВ]-[4хС], где А - продолжительность физической нагрузки (мин), В - максимальное отклонение сегмента ST (мм), С - индекс стенокардии.
Оценка индекса стенокардии: 0 - стенокардии нет, 1 - стенокардия есть, 2 - стенокардия приводит к остановке исследования.
При тредмил-индексе Дьюка более +5 больного относят к группе низкого риска, при этом его четырехлетняя выживаемость составляет 99%, а ежегодная вероятность смерти - 0,25%. Если величина тредмил-индекса Дьюка находится в диапазоне от +4 до -10, то его относят к группе промежуточного риска, и его четырехлетная выживаемость составляет 95%, а ежегодная вероятность смерти - 1,25%. При величине тредмил-индекса Дьюка менее -10 больного относят к группе высокого риска, его четырехлетняя выживаемость составляет 79%, а ежегодная вероятность смерти - более 5,0%.
Больным, имеющим по результатам стратификации промежуточный и высокий риск смерти, рекомендовано проведение коронароангиографии для решения вопроса о целесообразности выполнения реваскуляризации миокарда.
Следует отметить, что нормальные результаты коронароангиографии свидетельствуют лишь об отсутствии существенного сужения крупных коронарных артерий и их ветвей, при этом могут оставаться не обнаруженными изменения в мелких артериях (четвертого и пятого порядка). Такая ситуация характерна для больных с так называемой ИБС с нормальными коронарными артериями. К этой категории относят пациентов с коронарным синдромом Х и вазоспастической (вариантной) стенокардий (стенокардией Принцметала).
Коронарный синдром Х. Несмотря на то что общепринятого определения этого синдрома не существует, он характеризуется классической триадой признаков: типичными приступами стенокардии, вызываемыми нагрузками; положительными результатами ЭКГ-пробы либо других тестов с физической нагрузкой и неизмененными коронарными артериями (по данным коронароангиографии). Наиболее признанной причиной возникновения коронарного синдрома Х считают возникновение функциональных нарушений коронарного кровообращения на уровне микроциркуляторного русла во время физических или эмоциональных нагрузок. К возможным причинам возникновения болевого синдрома и ишемических изменений на ЭКГ относят эндотелиальную дисфункцию с неполноценной коронарной вазодилатацией и чрезмерно выраженной коронарной вазоконстрикцией во время физических
нагрузок на уровне микроциркуляторного русла. Прогноз относительно благоприятный.
Вазоспастическая (вариантная, спонтанная) стенокардия. Характерный признак этой формы стенокардии - возникновение типичных ангинозных приступов в покое при их отсутствии во время физических и эмоциональных нагрузок. Реже спонтанная стенокардия сочетается со стенокардией напряжения.
Если во время приступа спонтанной стенокардии на ЭКГ регистрируют преходящий подъем сегмента ST, то такую стенокардию называют стенокардией Принцметала .
Чаше всего спонтанные приступы стенокардии возникают ночью или ранним утром, без связи с физической либо эмоциональной нагрузкой, продолжаются от 5 до 15 мин и устраняются приемом нитроглицерина в течение нескольких минут.
В основе спонтанной стенокардии лежит спазм нормальных либо атеросклеротически измененных коронарных артерий. Механизм развития спазма последних до конца не изучен, но существенную роль в его возникновении могут играть гиперактивность гладкомышечных элементов сосудистой стенки и эндотелиальная дисфункция.
В типичных ситуациях приступ вазоспастической стенокардии сопровождается преходящим подъемом сегмента ST на ЭКГ, что отражает возникновение трансмуральной ишемии миокарда, которая исчезает сразу же после прекращения болевого синдрома и не сопровождается последующим повышением концентрации биохимических маркеров некроза миокарда (сердечный тропонин T или I, МВ-фракция КФК), т.е. не заканчивается развитием ИМ.
Вазоспастическая стенокардия может быть спровоцирована курением, холодом, гипервентиляцией, применением наркотических средств (кокаин) и электролитными нарушениями.
Для того чтобы доказать возникновение спазма коронарных артерий и таким образом объективно подтвердить существование вазоспастической стенокардии, используют провокационный тест с введением ацетилхолина (реже - эргоновина) в коронарные артерии во время выполнения коронароангиографии.
Прогноз у больных с вазоспастической стенокардий, возникающей на фоне неизмененных коронарных артерий, относительно благоприятный; риск смерти у них не превышает 0,5% в год. У больных с вазоспастической стенокардией на фоне гемодинамически значимых стенозов коронарных артерий прогноз значительно серьезнее.
Диагностика
При установлении диагноза стабильной стенокардии напряжения учитывают основные и дополнительные диагностические критерии. Основные критерии:
• типичные по характеру болевого синдрома приступы стенокардии напряжения (анамнез, наблюдение);
• достоверные указания на ранее перенесенный ИМ (анамнез, признаки хронической аневризмы сердца или рубцовых изменений на ЭКГ и по данным УЗИ сердца);
• положительные результаты ЭКГ-проб с физической нагрузкой (тредмилтест, велоэргометрия), фармакологических стресс-тестов (стресс-ЭхоКГ, стресс-сцинтиграфия миокарда);
• положительные результаты коронароангиографии (гемодинамически значимые стенозы коронарных артерий).
Дополнительные диагностические критерии:
• признаки хронической сердечной недостаточности;
• нарушения сердечного ритма и проводимости (при отсутствии других заболеваний, вызывающих их).
Формулировка развернутого клинического диагноза должна учитывать:
• констатацию существования ИБС (при условии, что есть объективные доказательства ее наличия);
• определение клинического варианта ИБС (часто у одного больного отмечают сочетание двух или даже трех вариантов; если у больного диагностирована стабильная стенокардия напряжения, то указывают ее функциональный класс в соответствии с классификацией Канадского сердечно-сосудистого общества; 1979);
• характер нарушения ритма и проводимости (если таковые есть);
• при обнаружении хронической сердечной недостаточности - ее тяжесть (по классификации Нью-Йоркской ассоциации сердца и Н.Д. Стражеско- В.Х. Василенко);
• основную локализацию атеросклероза (отсутствие коронарного атеросклероза при убедительных доказательствах по данным коронарографии обязательно отражают в диагнозе);
• при обнаружении - АГ (в том числе ГБ с указанием стадии течения);
• при обнаружении - сахарный диабет;
• другие фоновые и сопутствующие заболевания.
Лечение
Основные цели лечения больных со стабильной стенокардией:
• увеличение продолжительности жизни больных посредством снижения риска развития ИМ и внезапной смерти;
• улучшение качества жизни посредством уменьшения выраженности клинических симптомов заболевания.
Достигнуть подобные цели можно с помощью сочетанного применения:
• мер немедикаментозного воздействия, направленных на коррекцию имеющихся факторов риска ИБС;
• медикаментозного и хирургического лечения.
Учитывая относительно благоприятный прогноз у больных со стабильной стенокардией, для большинства пациентов медикаментозное лечение считают реальной альтернативой интервенционным (баллонная коронарная ангиопластика и стентирование коронарных артерий) и хирургическим методам лечения (коронарное шунтирование и др.).
Применение интервенционных и хирургических методов лечения больных со стабильной стенокардий оправдано у пациентов высокого риска в отношении развития ИМ и внезапной смерти, а также у лиц, у которых полноценное медикаментозное лечение недостаточно эффективно.
Коррекцию факторов риска следует проводить у всех больных и на любом этапе развития заболевания.
Курение - важный фактор риска развития ИБС, поэтому необходимо добиваться стойкого отказа больных от него. Часто для этого требуется участие квалифицированного психолога или психотерапевта. Существенную помощь может оказать применение никотинсодержащих препаратов (никотин) в виде накожных пластырей, жевательных резинок и в форме ингалятора с мундштуком (наиболее предпочтителен, так как моделирует акт курения).
Целесообразно изменить характер питания, ориентируясь на так называемую средиземноморскую диету, основу которой составляют овощи, фрукты, рыба и птица. При гиперлипидемии (липидный профиль необходимо оценивать у всех больных стенокардией) соблюдение жесткой гиполипидемической диеты становится особенно важным. Концентрацию общего холестерина следует поддерживать на уровне ниже 5,0 ммоль/л (192 мг/дл), ЛПНП - менее 2,6 ммоль/л (100 мг/дл). Выбор препаратов для гиполипидемической терапии зависит от липидного профиля, но в большинстве случаев отдают предпочтение средствам из группы статинов (симвастатин, аторвастатин, розувастатин), при этом учитывают их доказанное положительное влияние на прогноз у больных
ИБС.
Больные стенокардией обязательно должны поддерживать посильную физическую активность, поскольку это может способствовать увеличению толерантности к нагрузкам, а также нормализации АД, концентрации липидов, улучшению толерантности к глюкозе и чувствительности к инсулину. Это так же поможет снизить избыточную массу тела.
Особое значение имеет лечение сопутствующей АГ и сахарного диабета, служащих факторами риска развития ИБС. Следует не только стремиться к достижению целевого АД, но и стараться использовать препараты, одновременно обладающие и антигипертензивной, и антиангинальной активностью (Р-адреноблокаторы, блокаторы медленных кальциевых каналов). У больных сахарным диабетом наиболее оправдано использование ингибиторов АПФ, блокаторов медленных кальциевых каналов, а также высокоселективных р-адреноблокаторов с вазодилатирующими свойствами (небиволол)).
Медикаментозное лечение
Можно выделить два основных направления медикаментозного лечения стабильной стенокардии:
• лечение, направленное на предупреждение возникновения ИМ и смерти;
• лечение, направленное на уменьшение ишемии миокарда и выраженности клинических признаков заболевания.
К первому направлению относят применение антитромбоцитарных препаратов, р-адреноблокаторов, статинов и ингибиторов АПФ.
Ко второму направлению относят использование р-адреноблокаторов, нитратов, блокаторов медленных кальциевых каналов и цитопротекторов.
Всем больным стенокардией для купирования возникающих ангинозных приступов следует рекомендовать использование короткодействующих нитратов. Пациенты должны постоянно иметь при себе тот или иной нитросодержащий препарат короткого действия. Традиционно для этой цели применяют таблетки нитроглицерина, но они имеют небольшой размер, нередко крошатся,
и поэтому их использование часто затруднительно (особенно у пожилых пациентов и больных с нарушениями двигательной сферы). Более удобны короткодействующие нитраты в виде дозированных аэрозолей (изосорбида динитрат, изомак), которые распыляют в полости рта. В качестве альтернативы можно использовать изосорбида динитрат в таблетках по 10 мг, которые применяют аналогично нитроглицерину (сублингвально). Следует помнить, что эффект при этом наступает несколько позднее (через 10-15 мин), но и продолжается дольше (до 1,5 ч). Нередко оказывается полезным заблаговременный прием изосорбида динитрата перед планируемой повышенной физической и (или) эмоциональной нагрузкой. Важно объяснять пациентам необходимость своевременной замены упаковки препарата еще до истечения срока его годности, а также опасность многократного бесконтрольного приема нитратов короткого действия, чреватого развитием гипотензии и указывающего на недостаточную эффективность антиангинальной терапии в целом.
Лечение, направленное на предупреждение возникновения инфаркта миокарда и смерти
Все больные стенокардией при отсутствии противопоказаний должны получать ацетилсалициловую кислоту в дозе 75-160 мг/сут (оптимальная доза - 100 мг/сут), что позволяет снизить относительный риск развития ИМ и внезапной смерти минимум на 30%. Основные противопоказания к применению препарата: язвенная болезнь, эрозивный гастрит, дуоденит. В таких случаях возможно использование клопидогрела.
При лечении стенокардии широко применяют р-адреноблокаторы. Улучшение прогноза у них на фоне приема этих средств связано со снижением риска развития ИМ и смерти. Особенно рекомендовано назначение р-адреноблокаторов больным стенокардией, перенесшим ИМ, поскольку показана способность этих препаратов снижать относительный риск развития ИМ и смерти на 30-35%.
При лечении стенокардии предпочтение отдают кардиоселективным р-адреноблокаторам. Наиболее широко применяют такие средства, как метопролол (по 50-200 мг/сут), бисопролол (по 2,5-5 мг/сут), карведилол (по 25- 50 мг/сут), бетаксолол (по 10-40 мг/сут) и др. Существенно реже используют атенолол (по 100-200 мг/сут), при этом адекватной дозой р-адреноблокаторов считают ту, при которой удается добиться снижения ЧСС в покое до 50-60 в минуту.
По прежнему применяют неселективный р-адреноблокатор пропранолол в дозе 40-200 мг/сут, но его обычно хуже переносят больные. Кроме того, препарат требует 3-4-разового приема, что снижает приверженность пациентов к лечению.
Основные побочные реакции на фоне приема р-адреноблокаторов: брадикардия, нарушения предсердно-желудочковой проводимости, артериальная гипотензия, ухудшение переносимости физических нагрузок, бронхоспазм и эректильная дисфункция.
Следует избегать применения р-адреноблокаторов у больных с бронхиальной обструкцией (особенно при плохо контролируемой БА), заболеваниями периферических артерий и сахарным диабетом. В ряде подобных случаев возможно применение таких высокоселективных р-адреноблокаторов, как мето-
пролол и бисопролол, но это следует делать с особой осторожностью. Наиболее безопасно использование препаратов, обладающих способностью к периферической вазодилатации в результате модуляции высвобождения окиси азота, в частности небиволола и карведилола.
Следует обратить внимание на применение р-адреноблокаторов у больных стенокардией с сопутствующей хронической сердечной недостаточностью. В такой ситуации рекомендовано использовать метопролол, бисопролол, карведилол и небиволол.
Лечение β-адреноблокаторами больных стенокардией на фоне хронической сердечной недостаточности следует начинать с применения малых доз и только на фоне адекватного приема ингибиторов АПФ и диуретиков, причем в первое время закономерно ожидать некоторого усугубления симптомов сердечной недостаточности.
Больным стабильной стенокардией с повышенной концентрацией холестерина, ЛПНП и триглицеридов в крови рекомендовано длительное лечение статинами, что позволяет снизить относительный риск развития ИМ и смерти на 20-40%.
Больным со стабильной стенокардией, независимо от существования АГ, сердечной недостаточности и сахарного диабета, рекомендовано длительное лечение одним из двух ингибиторов АПФ - рамиприлом или периндоприлом. Эти препараты также позволяют снизить вероятность развития у них ИМ и смерти на 20%. Этот эффект не считают класс-зависимым, поскольку другие представители ингибиторов АПФ в крупных клинических исследованиях не продемонстрировали такой способности.
Лечение, направленное на уменьшение ишемии миокарда и выраженности клинических признаков заболевания
Для предотвращения приступов стенокардии традиционно используют препараты гемодинамического действия, которые, влияя на параметры центральной гемодинамики, уменьшают потребность миокарда в кислороде или увеличивают его доставку. Применяют средства трех основных групп: р-адрено блокаторы, блокаторы медленных кальциевых каналов и пролонгированные нитраты.
Блокаторы медленных кальциевых каналов используют в лечении стенокардии в тех случаях, когда невозможно применение р-адреноблокаторов либо в сочетании с последними для усиления антиангинального действия. Положительное влияние лечения ими на продолжительность жизни больных стабильной стенокардией не доказано. Наиболее предпочтительны недигидропиридиновые средства - верапамил (по 120-320 мг/сут) и его пролонгированная форма изоптин СР 240, а также дилтиазем (по 120-320 мг/сут).
Для лечения больных со стабильной стенокардией напряжения не следует использовать короткодействующие дигидропиридины (нифедипин) и пролонгированные дигидропиридины второго и третьего поколения (амлодипин, фелодипин и др.).
У больных со стабильной стенокардией напряжения в качестве препаратов, уменьшающих степень ишемии миокарда и выраженность клинических признаков стенокардии, широко используют пролонгированные нитраты. Необходимо помнить, что этот класс антиангинальных средств не влияет на продолжительность жизни больных со стабильной стенокардией. Для этой цели
применяют изосорбида динитрат (по 40-240 мг/сут) и изосорбида мононитрат (по 40-240 мг/сут). Эти препараты лучше переносят больные, они в меньшей степени вызывают головную боль. Использование сустак мите, сустак форте и пентаэритритила тетранитрата не оправдано вследствие низкой эффективности и неудобства применения (многократный прием).
Основные побочные явления лечения нитратами: головная боль, артериальная гипотензия, покраснение кожи, иногда - синкопе. К существенным недостаткам этого класса препаратов следует отнести развитие толерантности, преодолеть которую можно временной отменой этих средств. Избежать развития толерантности к нитратам можно путем рационального дозирования, обеспечивающего «безнитратный промежуток» длительностью не менее 8 ч (обычно - ночью).
При плохой переносимости нитратов возможно назначение молсидомина в дозе 2-24 мг/сут (особенно у больных с сопутствующими заболеваниями легких, легочным сердцем).
Часто в процессе лечения стенокардии не удается достичь успеха с помощью монотерапии. В таких случаях целесообразно применять комбинации антиангинальных средств с различным механизмом действия. Наиболее рациональны следующие комбинации: р-адреноблокаторы + нитраты, р-адреноблокаторы + блокаторы медленных кальциевых каналов (дигидропиридиновые), блокаторы медленных кальциевых каналов + нитраты, р-адреноблокаторы + блокаторы медленных кальциевых каналов + нитраты. Нецелесообразно комбинировать препараты одного класса вследствие неэффективности и резко возрастающего риска развития побочного действия. Следует соблюдать осторожность при комбинации р-адреноблокаторов с верапамилом или дилтиаземом, поскольку резко увеличивается вероятность возникновения нарушений проводимости и дисфункции левого желудочка.
Хотя комбинированную антиангинальную терапию применяют повсеместно, ее эффективность не всегда оказывается достаточной. Ее можно усилить посредством добавления к лечению метаболических препаратов: триметазидина, никорандила или блокатора пейсмекерного ионного тока синусового узла Ir ивабрадина. Триметазидин - цитопротекторный препарат метаболического действия, доказавший свою антиангинальную эффективность. Важнейшее преимущество триметазидина - отсутствие у него какого-либо влияния на гемодинамику. Он также не действует на автоматизм и проводимость, не усугубляет брадикардию. Триметазидин обычно очень хорошо переносят больные. Его назначают в дозе 20 мг 3 раза в день во время приема пищи. В настоящее время используют новую лекарственную форму триметазидина - предуктал МВ*, что дает возможность поддерживать постоянную антиангинальную эффективность средства в течение 24 ч (одна таблетка препарата, которую принимают 2 раза в день, содержит 35 мг триметазидина).
Больным с коронарным синдромом Х рекомендовано применение пролонгированных нитратов, р-адреноблокаторов и блокаторов медленных кальциевых каналов в виде монотерапии либо их сочетания. При гиперлипидемии целесообразно назначение статинов, а при АГ - ингибиторов АПФ. При недостаточной эффективности можно применять метаболические препараты (никорандил, триметазидин).
Лечение больных с вариантной (вазоспастической) стенокардией состоит из исключения провоцирующих факторов (курение, употребление кокаина и др.) и применения таких лекарственных средств, как блокаторы медленных кальциевых каналов (верапамил в дозе до 480 мг/сут, дилтиазем в дозе до 260 мг/сут, нифедипин в дозе до 120 мг/сут) и пролонгированные нитраты.
Реваскуляризация миокарда. В настоящее время существует два метода реваскуляризации миокарда (в том числе у больных со стабильной стенокардией напряжения): хирургический (коронарное шунтирование) и интервенционный (чрескожная коронарная ангиопластика и стентирование коронарных артерий).
Выбор стратегии лечения у больных со стабильной стенокардией напряжения - достаточно сложная задача. Ее следует решать строго индивидуально и учитывать множество факторов: клиническую картину, выраженность и обширность зон ишемии миокарда по данным стресс-тестов, тяжесть, локализацию и распространенность атеросклеротического поражения коронарных артерий по данным коронароангиографии, желание самого пациента и многое другое.
При выборе стратегии лечения больных со стабильной стенокардией необходимо помнить, что последние клинические исследования, сравнившие ближайшие и отдаленные результаты оптимального медикаментозного лечения и реваскуляризации миокарда у больных со стабильной стенокардий напряжения, показали, что пятилетняя выживаемость не зависит от выбранной стратегии, но качество жизни (частота и тяжесть приступов стенокардии) достоверно лучше у пациентов, которым была выполнена реваскуляризация миокарда.
Клинические показания к реваскуляризации миокарда у больных со стабильной стенокардией напряжения:
• неэффективность оптимального медикаментозного лечения, при котором качество жизни не устраивает пациента;
• результаты применения неинвазивных методов обследования, указывающие на то, что в зоне риска находится большой объем миокарда, подвергающийся ишемии;
• высокая вероятность выполнения успешной реваскуляризации миокарда с приемлемым риском ближайшей и отдаленной летальности;
• осознанный выбор пациентом хирургического метода лечения с учетом его полного информирования о возможных рисках вмешательства.
В то же время существуют определенные показания к реваскуляризации миокарда с целью улучшения прогноза развития ИМ. Они связаны в первую очередь с тяжестью, распространенностью и локализацией атеросклеротических поражений коронарных артерий, которые определяют с помощью коронароангиографии.
Чрескожная коронарная ангиопластика и стентирование рекомендованы при:
• выраженном (>=75%) стенозе одной коронарной артерии у больных со стенокардией I-IV функционального класса и неэффективности оптимального медикаментозного лечения;
• выраженном (>=75%) стенозе нескольких коронарных артерии у больных со стенокардией I-IV функционального класса (без сахарного диабета) и неэффективности оптимального медикаментозного лечения.
Коронарное шунтирование рекомендовано:
• при стенокардии I-IV функционального класса у больных с гемодинамически значимым (>50%) стенозом ствола левой коронарной артерии либо его эквивалентом (выраженные (>=75%) стенозы устьев либо проксимальных отделов передней межжелудочковой и огибающей артерии);
• стенокардии I-IV функционального класса и неэффективности оптимального медикаментозного лечения у больных с выраженными (>75%) стенозами всех трех коронарных артерий (передней межжелудочковой, огибающей и правой), особенно их проксимальных отделов, а также при сахарном диабете, дисфункции левого желудочка и объективно доказанной большой зоны ишемии миокарда.
Прогноз
Прогноз зависит от результатов стратификации риска. У большинства больных он относительно благоприятный, но его следует всегда оценивать с осторожностью, так как хроническое течение заболевания может внезапно обостриться, осложниться развитием ИМ, а иногда - внезапной смертью.
Профилактика
Первичная профилактика сводится к профилактике атеросклероза. Вторичная профилактика должна быть направлена на проведение рационального противоатеросклеротического лечения и оптимального купирования болевого синдрома, нарушений ритма и сердечной недостаточности.
ОСТРЫЕ КОРОНАРНЫЕ СИНДРОМЫ
Термин «острые коронарные синдромы» был введен V. Furster и соавт. в 1985 г. В настоящее время под этим термином понимают целый спектр клинических состояний, которые отражают обострение в течении ИБС и включают в себя начальный период в развитии нестабильной стенокардии, ИМ без подъема сегмента ST и ИМ с подъемом сегмента ST.
«Острый коронарный синдром» (ОКС) не является окончательным нозологическим диагнозом, он служит диагнозом первого контакта врача с пациентом, имеющим клиническую и ЭКГ-картину острой коронарной недостаточности. В связи с этим диагноз «острый коронарный синдром» правомочен для врача скорой помощи, врача приемного отделения стационара и для врача отделения неотложной кардиологии в первые часы госпитализации.
В дальнейшем по мере накопления информации (как клинической, так и лабораторно-инструментальной) диагноз «острый коронарный синдром» должен трансформироваться в диагноз «нестабильная стенокардия», «ИМ без подъема сегмента ST», «ИМ с подъемом сегмента ST» или в какой-либо другой нозологический диагноз, отражающий имеющуюся сердечно-сосудистую патологию (рис. 2-14).
В то же время лечение больных с ОКС должно начинаться как можно раньше, до получения всей информации, позволяющей уверенно поставить нозологический диагноз (ИМ с подъемом сегмента ST, ИМ без подъема сегмента ST или нестабильная стенокардия). Более того, нередко, особенно у больных острым ОКСпST, фактор времени служит ключом, влияющим на результаты лечения.
Рис. 2-14. Острые коронарные синдромы.
При этом лечебная тактика, в первую очередь проведение тромболитической терапии, во многом будет зависеть от ЭКГ-варианта острого коронарного синдрома (с подъемом или без подъема сегмента ST).
Эпидемиология
По данным Глобального регистра острых коронарных событий (GRACE) 2002 г. суммарная частота всех острых коронарных синдромов в разных странах колеблется от 1\80 до 1\170 человек населения. Среди всех больных, доставленных в стационар в связи с развитием острого коронарного синдрома, у 42% поводом для госпитализации служил ОКС с подъемом сегмента ST, у остальных - ОКС без подъема сегмента ST. При этом, по данным Euro Heart Survey (2002), 30-33% больных, госпитализированных по поводу ОКС, были выписаны с диагнозом ИМ с зубцом Q, 25% больных - с диагнозом ИМ без зубца Q, у 38-42% больных была диагностирована нестабильная стенокардия.
Классификация
В зависимости от ЭКГ-картины все острые коронарные синдромы подразделяют на: • ОКСпST
- ОКСпST чаще трансформируется в ИМ с подъемом сегмента ST (ИМпST), который заканчивается развитием ИМ с зубцом Q (рис. 2-15). Однако в случае успешного тромболизиса или ЧКВ, выполненного в первый час от начала ОКС с подъемом сегмента ST, ИМ может не возникнуть вообще (прерванный ИМ) либо закончиться развитием ИМ без зубца Q. В более редких случаях ОКС с подъемом сегмента ST может быть проявлением вариантной (вазоспастической) стенокардии Принцметала, перикардита либо, что наиболее благоприятно, отражением одного из синдромов ранней реполяризации желудочков.

Рис. 2-15. Острый коронарный синдром с подъемом сегмента ST. Признаки трансмуральной ишемии миокарда передней стенки левого желудочка: подъем сегмента ST >1 мВ в отведениях I, II, avL, V2-6 депрессия сегмента ST в отведениях III, avF. Патологические зубцы Q и QS пока не сформировались
• ОКСбпST:
- ОКСбпST чаще всего трансформируется в одну из двух нозологических форм ИБС - в нестабильную стенокардию (НС) либо в ИМ без подъема сегмента ST (ИМбпST). Учитывая практически одинаковую клиническую и ЭКГ-картину, дифференциальная диагностика между нестабильной стенокардией и ИМбпST основана в основном на результатах лабораторно-инструментальных методов исследования, в частности определения биохимических маркеров некроза кардиомиоцитов (тропонины I или Т, МВ-КФК). В ряде случаев в результате клинического обследования у больного с первоначальным диагнозом «ОКСбпST» обнаруживают некоронарогенные поражения миокарда.
Этиология
Причиной возникновения острых коронарных синдромов служит атеротромбоз в коронарном бассейне.
Патогенез
• У подавляющего большинства больных в основе ОКС как с подъемом сегмента ST, так и без подъема сегмента ST лежат общие патофизиологические процессы, являющиеся проявлением атеротромбоза в коронарном бассейне вследствие разрыва, трещины или эрозии нестабильной атеросклеротической бляшки. Это повреждение атеросклеротической бляшки приводит к активации тромбоцитов и запускает каскад коагуляции, в результате чего в месте поврежденной атеромы образуется тромб, при этом размеры тромба могут быть различными.
- У больных с ОКС без подъема сегмента ST тромб носит характер пристеночного, не окклюзирующего полностью просвет коронарной артерии и состоящий преимущественно из тромбоцитов, связанных между
собою нитями фибрина, так называемый «белый тромб». Поэтому при возникновении ОКС без подъема сегмента ST развивается ишемия в основном субэндокардиальных зон миокарда левого желудочка, что отражается на ЭКГ в виде депрессии сегмента ST. В последующем в этих зонах субэндокардиальной ишемии миокарда может развиваться некроз, что отражается на ЭКГ формированием характерного негативного равнобедренного зубца Т (так называемого «коронарного»), т.е. формируется ИМ без зубца Q Однако так происходит далеко не всегда, нередко субэндокардиальный некроз миокарда, особенно если он небольшой по объему, может протекать без типичных изменений на ЭКГ, и в таких ситуациях он может быть диагностирован только по повышению уровня биохимических маркеров некроза миокарда (сердечные тропонины I или Т либо МВ-КФК). - У больных с ОКС и с подъемом сегмента ST тромб полностью окклюзирует просвет коронарной артерии, при этом в состав тромба входит большое количество эритроцитов, так называемый «красный тромб». Вследствие этого при возникновении ОКС с подъемом сегмента ST, развивается трансмуральная ишемия обширных зон миокарда левого желудочка, что отражается на ЭКГ в виде подъема сегмента ST. В дальнейшем в этих зонах развивается необратимое повреждение кардиомиоцитов (некроз), что проявляется на ЭКГ появлением патологических зубцов Q или QS, т.е. формируется ИМ с зубцом Q.
• Эти различия в морфологическом характере тромбов диктуют необходимость применения тромболитических препаратов (стрептокиназа, тканевые активаторы плазминогена) у больных ОКС с подъемом сегмента ST. В то же время у больных с ОКС без подъема сегмента ST их применение противопоказано, и акцент в медикаментозной терапии смещается в сторону антитромбоцитарных (ацетилсалициловая кислота, клопидогрел, блокаторы IIb-IIIa рецепторов тромбоцитов) и антитромбиновых препаратов (нефракционированные гепарины, низкомолекулярные гепарины).
• Помимо ключевой роли активации тромбоцитарного звена гемостаза, в патогенезе ОКС без подъема сегмента ST большую роль играют присоединяющиеся элементы спазма, воспаления и микроэмболизации дистального русла коронарной артерии вследствие того, что образующиеся пристеночные тромбоцитарные тромбы непрочные и легко фрагментируются током крови.
Острый коронарный синдром без подъема сегмента ST
Как уже указывалось ранее, острый коронарный синдром без подъема сегмента ST (ОКСбпST) включает две нозологические формы ИБС:
• нестабильную стенокардию;
• ИМ без подъема сегмента ST.
Нестабильная стенокардия
Нестабильная стенокардия - это одна из клинических форм ИБС, характеризующаяся развитием острой ишемии миокарда, тяжесть и продолжительность которой недостаточна для возникновения некроза миокарда. Нестабильная сте-
нокардия проявляется типичными болями в грудной клетке, во время которых на ЭКГ отмечают признаки ишемии миокарда в виде стойкой либо преходящей депрессии сегмента ST, инверсии, сглаженности или псевдонормализации зубца Т, однако в плазме крови отсутствует повышение уровня биохимических маркеров некроза миокарда (сердечных тропонинов I или Т либо МВ-КФК). Необходимо подчеркнуть, что вне приступа болей ЭКГ может быть нормальной.
Эпидемиология
По данным Национального регистра США, в 1999 г. число больных, перенесших ОКСбпST, составило 1 932 000 человек, при этом 953 000 человек были выписаны из стационаров с диагнозом нестабильной стенокардии, а 530 000 человек - с диагнозом ИМ без зубца Q. Национальные регистры ИМ в США (NRMI I, II и III) показали, что за период 1990-1999 гг. произошло относительное увеличение частоты ОКС без подъема сегмента ST с 45 до 63%.
Клиническая картина
Основной жалобой больных с нестабильной стенокардией являются типичные ангинозные боли в грудной клетке, локализующиеся чаще всего в области сердца. Однако уже на первом этапе диагностического поиска можно определить ряд особенностей, заставляющих заподозрить «нестабильность» стенокардии, поэтому в соответствии с клинической картиной нестабильной стенокардии, выделяют следующие ее клинические варианты:
• Впервые возникшая стенокардия напряжения. Под этим термином понимают стенокардию напряжения, возникшую в течение последних 2 мес и имеющую тяжесть не ниже III ФК по классификации Канадского сердечно-сосудистого общества.
• Прогрессирующая стенокардия напряжения, т.е. прогрессирование ранее существовавшей стабильной стенокардии напряжения как минимум на 1 класс (по классификации Канадского сердечно-сосудистого общества) с достижением как минимум III ФК. Ангинозные боли становятся более частыми, более продолжительными, возникают при более низких физических нагрузках.
• Стенокардия покоя, возникшая в течение последних 7 дней, с длительностью приступов до 20-30 мин, в том числе и стенокардия покоя, трансформировавшаяся из стенокардии напряжения.
Все эти варианты клинического течения нестабильной стенокардии могут возникнуть как у пациента, не переносившего ранее ИМ, так и у больного, имевшего в анамнезе ИМ. Все они требуют скорейшей регистрации ЭКГ и решения вопроса о госпитализации. С формальной точки зрения все больные, имеющие ту или иную вышеописанную клиническую картину, должны быть госпитализированы, поскольку у них имеется ОКС без подъема сегмента ST (нестабильная стенокардия). Однако риск смерти и развития ИМ, несомненно, выше у лиц, имевших длительные приступы стенокардии покоя в последние 48 ч, по сравнению с лицами, у которых умеренно выраженная стенокардия напряжения возникла 3-4 нед назад.
• Ранняя постинфарктная стенокардия. Стенокардия напряжения или покоя, возникшая в ближайшие дни после перенесенного ИМ, особенно после успешной тромболитической терапии у больных с ИМ с подъемом
сегмента ST. Данный вариант стенокардии чреват развитием повторного ИМ и требует скорейшего проведения коронароангиографии для решения вопроса о реваскуляризации миокарда. В настоящее время общепринята клиническая классификация нестабильной стенокардии, предложенная E. Braunwald в 1989 г. (табл. 2-10).
Таблица 2-10. Клиническая классификация нестабильной стенокардии
Инфаркт миокарда без подъема сегмента ST
ИМ без подъема сегмента ST - одна из клинических форм ИБС, характеризующаяся развитием острой ишемии миокарда, тяжесть и продолжительность которой достаточны для возникновения его некроза.
ИМбпST, так же как и нестабильная стенокардия, проявляется типичными болями в грудной клетке, во время которых на ЭКГ могут отмечаться признаки ишемии субэндокардиальных слоев миокарда в виде стойкой либо преходящей депрессии сегмента ST, инверсии, сглаженности или псевдонормализации зубца Т. Однако, в отличие от больных с нестабильной стенокардией, у больных с ИМбпST в плазме крови выявляют повышение уровня биохимических маркеров некроза миокарда (тропонинов I или Т либо МВ-КФК), что свидетельствует о возникновении ИМ. Обычно это повреждение (некроз) миокарда локализуется в тех же субэндокардиальных зонах, которые подвергались ишемии. Развитие некроза миокарда отражается на ЭКГ формированием характерного негативного равнобедренного (так называемого «коронарного») зубца Т, т.е. образуется ИМ без зубца Q (ранее он носил название субэндокардиального, мелкоочагового ИМ).
Нестабильная стенокардия и ИМбпST - состояния очень близкие, имеющие общий патогенез и схожую клиническую картину, которая может отличаться только тяжестью (выраженностью) симптомов. Обычно термин ИМбпST используют непродолжительное время, до тех пор, пока не станет ясно, что ОКС закончился развитием ИМ без зубца Q, а не обширным ИМ с зубцом Q, либо нестабильной стенокардией.
Само понятие ИМбпST появилось с широким внедрением в клиническую практику определения сердечных тропонинов. Больные ОКСбпST, имеющие повышенный уровень сердечных тропонинов в плазме крови, имеют более серьезный прогноз, более высокий риск смерти, требуют более активного лечения и наблюдения, нежели больные с нестабильной стенокардией, имеющие нормальный уровень биохимических маркеров некроза миокарда.
Таким образом, для быстрого и правильного разграничения внутри ОКСбпST больных с нестабильной стенокардией и больных с ИМбпST, необходимо определение таких биохимических маркеров некроза миокарда, как сердечные тропонины Т или I. Использование с этой целью других, менее чувствительных биохимических маркеров, в частности МВ-КФК, возможно, но может привести к ошибкам.
На втором этапе диагностического поиска можно и не получить какойлибо существенной информации. Тем не менее важнейшей задачей второго этапа диагностического поиска служит исключение внесердечных причин болевого синдрома (пневмоторакс, пневмония, плевральный выпот), а также некоронарной природы поражения сердечно-сосудистой системы (тромбоэмболия легочной артерии, расслаивающаяся аневризма аорты, перикардит, клапанные поражения сердца и др.).
В клинической оценке больных с ОКСбпST исключительно важен третий этап диагностического поиска, позволяющий осуществить среди них стратификацию риска и на этом основании выбрать оптимальную тактику лечения (медикаментозную, инвазивную либо хирургическую).
• Электрокардиография является основным инструментальным методом диагностики ОКСбпST и должна быть зарегистрирована и оценена квалифицированным специалистом в течение первых 10 мин поступления больного в стационар. Существенную помощь в интерпретации имеющихся изменений ЭКГ может оказать сравнение ее с предыдущими ЭКГ. При наличии соответствующей клинической симптоматики, характерными для ОКСбпST изменениями ЭКГ служат горизонтальная либо косонисходящая депрессия сегмента ST глубиной не менее 1 мм (0,1 мВ) в двух смежных отведениях и более, а также инверсия зубца Т глубиной более 1 мм (0,1 мВ) в отведениях с преобладающим зубцом R (рис. 2-16, 2-17).
• Помимо ЭКГ в покое у больных с ОКСбпST может применяться холтеровское мониторирование ЭКГ. Оно позволяет выявить продолжающиеся эпизоды ишемии миокарда (в том числе и безболевые), а также нарушения ритма сердца (в особенности желудочковые), что может иметь большое значение при стратификации риска этой категории больных.
• Ультразвуковое исследование сердца у больных с ОКСбпST позволяет оценить наличие нарушений локальной сократимости, глобальную сократительную функцию левого желудочка и тем самым помочь в стратификации риска.
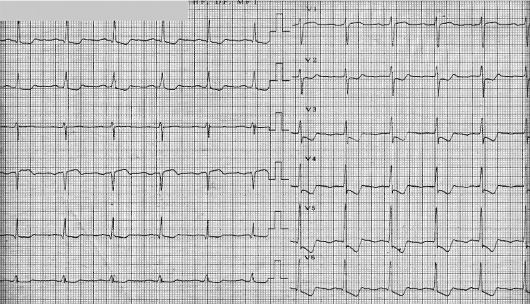
Рис. 2-16. Выраженная ишемия миокарда переднебоковой, верхушечной и перегородочной областей левого желудочка у больного с нестабильной стенокардией: депрессия сегмента ST >1 мВ в отведениях I, II, aVL,V2-V6
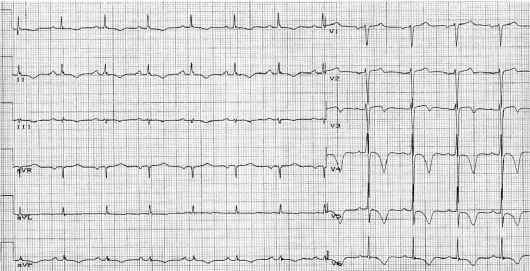
Рис. 2-17. Распространенный передний инфаркт миокарда без зубца Q: глубокие негативные симметричные («коронарные») зубцы Т в отведениях I, II, aVL, V2-V6.
• Наибольшее значение в диагностике ОКСбпST, его варианта (нестабильная стенокардия или ИМбпST), а также для стратификации риска имеют биохимические маркеры некроза миокарда. Наиболее предпочтительным считается определение содержания в крови сердечных тропонинов Т или I, повышение которых представляет собой наиболее надежный критерий некроза миокарда. Сердечные тропонины - белковые комплексы, регулирующие мышечное сокращение, состоят из трех субъ-
единиц: тропонин Т (ТнТ), тропонин С (ТнС), тропонин I (ТнГ). Считается, что ТнI и ТнТ - наиболее чувствительные и специфичные маркеры некроза миокарда. Их уровень повышается в крови уже через 4-6 ч после ИМ по сравнению с нормой и сохраняется повышенным в течение 10- 14 дней.
• Менее специфичным для определения некроза миокарда служит повышение содержания в крови фермента креатинфосфокиназы (КФК) за счет ее МВ изофермента (МВ-КФК). Повышение уровня КФК-МВ в плазме крови регистрируется через 4-6 ч от начала формирования ИМ и сохраняется до 2-3 суток.
При сравнении чувствительности МВ-КФК и сердечных тропонинов у больных с ОКС без подъема сегмента ST оказалось, что у 30% больных с нормальными значениями МВ-КФК уровень сердечных тропонинов был повышенным. Поэтому в настоящее время золотым стандартом биохимического выявления некроза миокарда считают сердечные тропонины Т или I. С практической точки зрения необходимо подчеркнуть, что определение уровня сердечных тропонинов у больных с ОКС без подъема сегмента ST нужно осуществлять как минимум 2 раза с интервалом 6-12 ч, при этом первое определение должно быть выполнено не ранее, чем через 6 ч от начала болевого приступа.
Стратификация риска смерти у больных с острым коронарным синдромом без подъема сегмента ST
Для того чтобы в кратчайшие сроки правильно выбрать тактику лечения больного с ОКСбпST в первые 12-48 ч госпитализации необходимо определить степень риска развития смертельного исхода.
Стратификация риска основана на комплексе демографических, анамнестических, клинических и инструментально-лабораторных показателей.
Для этого существует несколько шкал расчета риска. Наиболее широкое распространение получила шкала GRACE, основанная на данных Глобального регистра острых коронарных событий (2002). Несмотря на то что она несколько более сложна, чем другие шкалы расчета риска, требует специального оборудования (компьютер со специальной встроенной программой либо с выходом в Интернет на сайт www.outcomes.org), она лучше других шкал предсказывает риск госпитальной и 6-месячной смертности у больных ОКСбпST.
Шкала GRACE позволяет оценить риск смерти как в период госпитализации, так и в течение 6 мес после выписки из стационара. Она построена на оценке следующих показателей: возраста, ЧСС, систолического АД, концентрации креатинина плазмы крови, наличии и тяжести острой сердечной недостаточности по классификации Killip (см. раздел «Осложнения ИМ»), имелись или нет остановка кровообращения, отклонения сегмента ST и повышение уровня биохимических маркеров некроза миокарда.
В зависимости от количества баллов, набранных по шкале GRACE, как в период госпитализации, так и в течение 6 мес после выписки из стационара, все пациенты с ОКСбпST могут быть разделены на 3 категории риска смерти:
• больных низкого риска;
• больных промежуточного риска;
• больных высокого риска.
Необходимо отметить, что в Российских национальных рекомендациях по лечению острого коронарного синдрома без стойкого подъема сегмента ST на ЭКГ (2006) есть только 2 градации риска смерти этой категории больных - низкая и высокая.
• У больных, имеющих низкий риск смерти в период госпитализации (<1%), количество баллов по шкале GRACE при поступлении составляет =<108.
• У больных, имеющих промежуточный риск смерти в период госпитализации (1-3%), количество баллов по шкале GRACE при поступлении составляет 109-140.
• У больных, имеющих высокий риск смерти в период госпитализации (>3%), количество баллов по шкале GRACE при поступлении составляет >140.
Стратификация риска по шкале GRACE имеет крайне важное значение для выбора первоначальной тактики лечения больных с ОКСбпST.
К клиническим показателям, позволяющим отнести больных к группе высокого и промежуточного риска, относятся больные, которые, несмотря на полноценное стационарное лечение, имеют рефрактерную стенокардию либо рецидивирующие приступы стенокардии покоя или малых напряжений, сопровождающиеся динамическими изменениями сегмента ST (>0,5 мм) или зубца Т на ЭКГ; а также больные с ранней постинфарктной стенокардией, сахарным диабетом, клиническими признаками острой сердечной недостаточности (отек легких, кардиогенный шок) либо нестабильной гемодинамикой (артериальная гипотензия), жизнеугрожающими нарушениями ритма сердца (желудочковая тахикардия, фибрилляция желудочков). К группе высокого и промежуточного риска относятся также больные, перенесшие ранее операцию коронарного шунтирования или ЧКВ (в последние 6 мес), перенесшие ранее ИМ, имевшие ранее признаки хронической сердечной недостаточности, больные с ранней постинфарктной стенокардией или с явлениями острой левожелудочковой недостаточности (артериальная гипотензия, отек легких, кардиогенный шок).
Лабораторно-инструментальными показателями, позволяющими отнести больных к группе высокого и промежуточного риска служат в первую очередь повышение в плазме крови уровня сердечных тропонинов Т и I или МВ-КФК, снижение фракции выброса левого желудочка менее 40% и нарушение функции почек (скорость клубочковой фильтрации <60 мл/мин в 1,73 м2).
К категории больных низкого риска смерти относят пациентов, у которых отсутствуют повторные приступы стенокардии, признаки сердечной недостаточности, признаки гемодинамической нестабильности, отсутствует повышение уровня МВ-КФК или сердечных тропонинов, нет повторных эпизодов депрессии или подъема сегмента ST при мониторном контроле за ЭКГ, нет жизнеугрожающих нарушений ритма сердца, имеющих нормальную фракцию выброса левого желудочка.
Выбор первоначальной тактики лечения больных с острым коронарным синдромом без подъема сегмента ST
Существуют две первоначальные тактики лечения больных с ОКС без подъема сегмента ST:
• консервативная тактика, подразумевающая на начальном этапе лечения использование только медикаментозных препаратов;
• инвазивная тактика, при которой помимо медикаментозной терапии в первые 72 ч проводится реваскуляризация миокарда с помощью ЧКВ (ангиопластика или стентирование коронарных артерий) либо коронарное шунтирование.
Выбор первоначальной тактики лечения базируется на результатах стратификации риска больных с ОКС без подъема сегмента ST.
У больных высокого и промежуточного риска смерти неоспоримое преимущество имеет первоначальная инвазивная тактика лечения. При этом в зависимости от сроков выполнения вмешательств она подразделяется на срочную инвазивную тактику (вмешательства выполняются в первые 2 ч госпитализации) и раннюю инвазивную тактику (вмешательства выполняются в первые 72 ч госпитализации) лечения.
Срочная инвазивная тактика лечения показана больным с ОКСбпST, у которых, несмотря на интенсивную терапию, сохраняется рефрактерная стенокардия, либо возникают рецидивирующие приступы стенокардии покоя или малых напряжений, сопровождающиеся выраженными изменениями сегмента ST (>2,0 мм) или зубца Т на ЭКГ, либо имеются признаки острой сердечной недостаточности или жизнеугрожающие нарушения ритма сердца.
Ранняя инвазивная тактика лечения показана больным с ОКСбпST, у которых имеется повышение в плазме крови уровня сердечных тропонинов Т и I или МВ-КФК, у которых, несмотря на проводимое лечение, сохраняются приступы стенокардии покоя или малых напряжений, сопровождающиеся умеренно выраженными изменениями сегмента ST (>0,5 мм) или зубца Т на ЭКГ; больные, имеющие сахарный диабет, раннюю постинфарктную стенокардию, снижение фракции выброса левого желудочка менее 40%, нарушение функции почек (скорость клубочковой фильтрации <60 мл/мин в 1,73 м2), перенесшие ранее ИМ либо операцию коронарного шунтирования или ЧКВ (в последние 6 мес) и имеющие высокий либо промежуточный риск смерти по шкале GRACE.
В то же время у больных низкого риска смерти предпочтительнее консервативная (медикаментозная) тактика лечения. В случае выбора первоначальной консервативной тактики лечения, после стабилизации состояния больным низкого риска через 7-10 дней показано проведение нагрузочных тестов (тредмилтест, стресс-ЭхоКГ, сцинтиграфия миокарда с нагрузкой). По их результатам выбирают дальнейшую тактику лечения: рекомендуют продолжение медикаментозной терапии и выбирают ее объем либо рекомендуют проведение в ближайшее время коронароангиографии для решения вопроса о методе реваскуляризации миокарда.
Диагноз
Диагноз нестабильной стенокардии либо ИМ без зубца Q устанавливают в процессе наблюдения и обследования больного с ОКС без подъема сегмента ST в течение первых 24-72 ч госпитализации на основании как клинической картины заболевания, так и результатов лабораторно-инструментальных методов диагностики .
Лечение
Больной с клинической картиной ОКСбпST (или с подозрением на него) должен быть экстренно госпитализирован в кардиологический стационар, имеющий отделение неотложной кардиологии.
Медикаментозное лечение у больных с ОКС без подъема сегмента ST
Медикаментозное лечение больных с ОКСбпST включает в себя комплексное применение нитратов, р-адреноблокаторов, блокаторов Са2+-каналов, антитромбоцитарных препаратов (ацетилсалициловая кислота, клопидогрел, прасугрел, тикагрелор, блокаторы IIb-IIIa рецепторов тромбоцитов), антитромбиновых препаратов (нефракционированные гепарины, низкомолекулярные гепарины, антагонисты Ха-фактора) и статинов.
Купирование болевого синдрома осуществляется приемом нитроглицерина в дозе 0,5 мг под язык (при необходимости возможен прием до 3 таблеток с интервалом 5-10 мин) либо внутривенным введение наркотических или ненаркотических анальгетиков.
• Нитраты. Несмотря на широкое применение нитратов в лечении больных с ОКСбпST, крупные клинические исследования, доказывающие их эффективность по сравнению с плацебо, отсутствуют. Тем не менее клиническое использование нитратов в лечении больных с ОКСбпST является логически обоснованным исходя из их фармакологического действия (уменьшение преднагрузки, снижение потребности миокарда в кислороде и прямое вазодилатирующее действие на коронарные артерии). На начальном этапе лечения больных с ОКСбпST нитраты вводят в виде постоянной внутривенной инфузии через дозаторы лекарственных препаратов в стартовой дозе 5 мг/ч с последующей ее корректировкой в зависимости от величины АД и клинического состояния больного. Длительность внутривенной инфузии нитратов чаще всего не превышает 48 ч, что обычно бывает достаточным для стабилизации состояния пациента. В последующем переходят на прием внутрь (изосорбида мононитрат или изосорбида динитрат) или трансдермальный путь введения нитратов.
• р-Адреноблокаторы. Как ни странно, до настоящего времени не существует прямых доказательств благоприятного влияния р-адреноблокаторов на клинические исходы у больных с ОКСбпST, полученных в плацебоконтролируемых исследованиях. Однако, принимая во внимание не вызывающий сомнения антиангинальный и антиишемический эффект р-адреноблокаторов, их фармакологическое действие, вызывающее замедление ЧСС, уменьшение потребности миокарда в кислороде, снижение риска возникновения фатальных желудочковых аритмий, высокую эффективность их применения у больных ИМ с зубцом Q, здравый смысл говорит о целесообразности использования этих препаратов у больных ОКСбпST. р-Адреноблокаторы как можно раньше назначают всем больным ОКСбпST (при отсутствии абсолютных противопоказаний), при этом преимущество имеют современные р-адреноблокаторы пролонгированного действия (метопролол, бисопролол, карведилол, небиволол). Доза р-адреноблокатора считается оптимальной, если достигнуто урежение ЧСС до 55-60 в минуту.
• Блокаторы медленных кальциевых каналов. В настоящее время общепризнано, что применение коротко- и длительно действующих дигидропи-
ридинов (нифедипин, амлодипин) у больных с ОКСбпST, не получающих р-адреноблокаторы, противопоказано. В то же время верапамил, так же как и дилтиазем, может применяться у этой категории больных, когда имеются абсолютные противопоказания к использованию р-адреноблокаторов. Однако наиболее подходящей «нишей» для клинического применения дилтиазема служит вариантная, вазоспастическая стенокардия Принцметала.
• Антитромбоцитарные препараты. Учитывая патофизиологические механизмы атеротромбоза коронарных артерий, лежащие в основе ОКСбпST, подавление адгезии, активации и агрегации тромбоцитов служит одним из ключевых моментов в лечении этой категории больных. С этой целью в настоящее время используют ацетилсалициловую кислоту, клопидогрел, прасугрел, тикагрелор и блокаторы IIb-IIIa рецепторов тромбоцитов (абциксимаб, эптифибатид, тирофибан и монафрам).
- Ацетилсалициловая кислота (аспирин) блокирует циклооксиге- назу-1 тромбоцитов, нарушая синтез в них тромбоксана А2, и таким образом необратимо подавляет агрегацию тромбоцитов, индуцированную коллагеном, АДФ и тромбином. Ацетилсалициловая кислота была и остается одним из препаратов первого выбора в лечении больных с ОКСбпST, ацетилсалициловая кислота на 50% снижает у таких больных риск смерти и ИМ. Ацетилсалициловая кислота в первоначальной дозе 160-320 мг должна быть назначена как можно раньше всем больным с ОКСбпST либо с подозрением на него. При этом необходимо, чтобы первую дозу ацетилсалициловой кислоты больной разжевал. В последующем суточная доза ацетилсалициловой кислоты составляет 100 мг/сут желательно в кишечно-растворимой форме. Больным, перенесшим ОКСбпST, целесообразно продолжать прием ацетилсалициловой кислоты неопределенно долго (или до появления побочных эффектов).
- Клопидогрел относится к группе тиенопиридов, которые, блокируя Р2Y12-рецепторы тромбоцитов, необратимо подавляют агрегацию тромбоцитов, индуцированную АДФ. Совместное назначение клопидогрела с ацетилсалициловой кислотой значительно сильнее подавляет агрегацию тромбоцитов, нежели использование каждого препарата в отдельности. В связи с этим клопидогрел, так же как и ацетилсалициловая кислота, должен быть назначен всем больным ОКСбпST (при отсутствии явных противопоказаний) как можно раньше в нагрузочной дозе 300 мг с последующим приемом в дозе 75 мг в день на протяжении не менее 12 мес. Добавление к проводимой терапии дополнительно клопидогрела на 20% снижает риск смерти и ИМ у больных с ОКСбпST по сравнению с монотерапией ацетилсалициловой кислотой. Больным с ОКСбпST высокого и промежуточного риска, которым в рамках первоначальной инвазивной тактики лечения планируется выполнение срочных либо ранних ЧКВ, нагрузочная доза клопидогрела должна составлять 600 мг. У больных с ОКСбпST, которым планируется выполнение коронарного шунтирования, клопидогрел должен быть отменен не менее чем за 5 дней до операции.
- Прасугрел (эффиент) - новый тиенопиридин так же, как и клопидогрел, необратимо блокирующий Р2Y12-рецепторы тромбоцитов. Препарат сильнее, чем клопидогрел, подавляет агрегацию тромбоцитов, однако чаще вызывает серьезные геморрагические осложнения. Прасугрел разрешен к применению с середины 2009 г. у больных с ОКСбпST высокого и промежуточного риска, которым в рамках первоначальной инвазивной тактики лечения планируется выполнение срочных либо ранних ЧКВ. Нагрузочная доза прасугрела составляет 60 мг, поддерживающая - 10 мг в день.
- Тикагрелор (бриланта) - новый нетиенопиридиновый блокатор Р2Y12-рецепторов тромбоцитов. В отличие от клопидогрела и прасугрела , тикагрелор обратимо блокирует агрегацию тромбоцитов, что особенно выгодно у больных с ОКСбпST высокого и промежуточного риска, которым по каким-либо причинам невозможно выполнить ЧКВ, и которые являются кандидатами для срочного коронарного шунтирования. Тикагрелор быстрее и сильнее, чем клопидогрел, подавляет агрегацию тромбоцитов, при этом он не увеличивает риск геморрагических осложнений. Тикагрелор разрешен к применению с середины 2010 г. у больных с ОКСбпST как в рамках консервативной, так и инвазивной тактики лечения. Нагрузочная доза тикагрелора* составляет 180 мг, поддерживающая - 90 мг 2 раза в день.
- Блокаторы IIb-IIIa рецепторов тромбоцитов. Механизмом действия этого класса антитромбоцитарных препаратов - блокада гликопротеиновых тромбоцитов, которые располагаются на поверхности их мембраны, и к которым присоединяются нити фибрина, связывая тромбоциты между собой. Таким образом, блокада рецепторов приводит к подавлению общего конечного пути агрегации. Поэтому блокаторы IIb-IIIa рецепторов тромбоцитов на сегодняшний день выступают наиболее мощными антитромбоцитарными препаратами. В настоящее время в клинической практике используют четыре внутривенных блокатора IIb-IIIa рецепторов тромбоцитов: абциксимаб , эптифибатид, тирофибан (в Россию он не поставляется) и отечественный препарат фрамон (монафрам). Их применение у больных с ОКСбпST ограничивается в основном больными промежуточного и высокого риска смерти, которым выполняются ЧКВ (ангиопластика и стентирование коронарных артерий). В то же время эптифибатид и тирофибан* могут использоваться и в рамках комплексной медикаментозной терапии у больных с ОКСбпST промежуточного и высокого риска смерти, если выполнение ЧКВ у них по каким-то причинам невозможно.
• Антикоагулянты (антитромбиновые препараты). Тромбин - один из основных ферментов свертывающей системы крови. Под его влиянием происходит превращение фибриногена в фибрин, активируются агрегация тромбоцитов и XIII фактор, связывающий между собой нити фибрина, стабилизируя, таким образом, тромбоцитарно-фибриновый пристеночный тромб, являющийся морфологической основой острого ОКСбпST. В связи с этим антитромбиновые препараты (нефракционированные гепарины, низкомолекулярные гепарины (НМГ), ингибиторы Ха-фактора,
прямые ингибиторы тромбина) являются одними из ключевых в лечении и должны назначаться всем больных с ОКСбпST.
- Нефракционированный гепарин (НФГ). У больных с ОКСбпST комбинированная терапия НФГ и ацетилсалициловой кислотой по сравнению с монотерапией ацетилсалициловой кислотой позволяет снизить суммарный риск смерти и ИМ в течение первых 7 дней лечения более чем на 50%. При этом необходимо отметить, что такая высокая клиническая эффективность НФГ характерна только в первые 5-7 дней его применения, в последующем она исчезает. С практической точки зрения важно подчеркнуть, что при использовании НФГ в комплексном лечении больных с ОКСбпST последний должен вводиться как минимум в течение 48-72 ч только внутривенно в виде постоянной инфузии через дозаторы лекарственных препаратов под регулярным контролем активированного частичного тромбопластинового времени (АЧТВ). При этом необходимо стремиться к тому, чтобы величина АЧТВ постоянно была в 1,5-2 раза выше первоначальной и составляла примерно 70-100 с, поскольку только при этих значениях АЧТВ достигается адекватная степень антикоагуляции. Первоначально НФГ вводят внутривенно в виде болюса из расчета 60-70 Ед/кг массы тела (но не более 5000 Ед), в период последующей внутривенной инфузии - из расчета 12-15 Ед/кг в час (но не более 1000 Ед/ч). Необходимо подчеркнуть, что при лечении больных с ОКСбпST НФГ не должен вводиться ни в виде внутримышечных, ни в виде подкожных инъекций. Помимо необходимости в постоянной внутривенной инфузии, у НФГ есть и другие относительные недостатки: выраженная вариабельность степени связывания с белками плазмы, что делает ангикоагулянтный эффект НФГ трудно предсказуемым, повышает вероятность кровотечений и требует частого лабораторного контроля, возникновение тромбоцитопении, развитие феномена «рикошета» после окончания введения препарата.
- НМГ. Многих из перечисленных выше недостатков лишены НМГ, которые представляют собой фрагменты НФГ весом от 2000 до 10 000 дальтон, полученные путем его химической либо ферментной деполяризации. НМГ по сравнению с НФГ в меньшей степени влияют на образование тромбина и в большей степени блокируют Xa-фактор. При их не меньшей (далтепарин натрия, надропарин кальция), а у ряда препаратов - и большей эффективности (эноксапарин), чем у НФГ, в плане снижения риска смерти и ИМ у больных с ОКСбпST, важными преимуществами НМГ служит удобство введения (возможность их подкожного введения 2 раза в день). При этом достигается прогнозируемый и достаточный уровень антикоагуляции, отсутствует необходимость в лабораторном контроле, реже развивается тромбоцитопения. В связи со своей наиболее высокой эффективностью, чаще всего в клинической практике для лечения больных с ОКСбпST используется эноксапарин натрия (клексан*, гемапаксан*, ловенокс* ). Он вводится подкожно 2 раза в день в дозе 1 мг/кг массы тела больного на протяжении 5-7 сут (если раньше не было выполнено ЧКВ).
- Ингибиторы Ха-фактора. На сегодняшний день единственным представителем селективных ингибиторов Ха-фактора служит синтетический пентасахарид - фондапаринукс натрия (арикстра*). Селективная блокада Ха-фактора выгоднее и эффективнее с точки зрения подавления каскада коагуляции, поскольку блокада одной молекулы Ха-фактора предупреждает образование 100 молекул тромбина. При одинаковой эффективности с эноксапарином в отношении снижения риска смерти и ИМ у больных с ОКСбпST, фондапаринукс натрия (арикстра) в 2 раза реже вызывает серьезные кровотечения. Он так же, как и НМГ, вводится подкожно, но только 1 раз в день в фиксированной дозе 2,5 мг и не требует лабораторного контроля. Длительность его применения, так же как у НФГ, составляет 5-8 дней.
- Прямые ингибиторы тромбина. Прямые ингибиторы тромбина присоединяются непосредственно к тромбину (фактор IIa), связывают его и таким образом предотвращают превращение фибриногена в фибрин. Существуют 3 прямых ингибитора тромбина: гирудин, агратробан и бивалирудин* , однако ни один из них коммерчески не доступен в РФ. В настоящее время применение бивалирудина рекомендуют в качестве альтернативы НФГ или эноксапарину у больных с ОКСбпST высокого и промежуточного риска, которым планируется выполнение ЧКВ в рамках срочной интервенционной стратегии лечения.
Таким образом, антикоагулянты должны назначаться в дополнение к антитромбоцитарным препаратам всем больным с ОКСбпST. Выбор антикоагулянта (НФГ, НМГ или фондапаринукс натрия, бивалирудин* ) зависит от выбора первоначальной тактики лечения (срочная интервенционная, ранняя интервенционная либо консервативная). В случаях выбора срочной интервенционной тактики лечения как можно быстрее следует начать введение НФГ, либо эноксапарина, либо бивалирудина* . В менее экстренных ситуациях, когда приходится выбирать между ранней интервенционной тактикой лечения и консервативной (медикаментозной) тактикой лечения, в качество антикоагулянтов могут быть использованы фондапаринукс натрия, либо эноксапарин, либо НФГ. При этом фондапаринукс натрия предпочтительнее эноксапарина, а эноксапарин предпочтительнее НФГ.
• Статины. Больным с нестабильной стенокардией вне зависимости от уровня общего холестерина и ХС ЛПНП показано как можно более раннее назначение статинов в высоких дозах (например, 40-80 мг аторвастатина в день).
Прогноз
Прогноз определяется тяжестью коронарной недостаточности, наличием факторов риска и дальнейшей эволюцией острого коронарного синдрома. В 2000 г., согласно данным GRACE, в который было включено 12 000 больных с острыми коронарными синдромами в 14 странах, госпитальная летальность у больных с ОКСбпST составила 6%, в том числе среди больных с нестабильной стенокардией - 3%. В первые 6 мес после выписки из стационара умерло 13% больных с ОКСбпST, в том числе 8% больных с нестабильной стенокардией.
Профилактика
Соответствует принципам первичной и вторичной профилактики ИБС и атеросклероза .
• В качестве первичной профилактики устраняют факторы риска ИБС: отказ от курения, сбалансированная диета, контроль и коррекция АД, уровня глюкозы и холестерина в плазме крови.
• В качестве вторичной профилактики - прием ацетилсалициловой кислоты, р-адреноблокаторов (и других антиангинальных препаратов) в сочетании с гиполипидемическими препаратами (статинами) и ингибиторами
АПФ.
Острый коронарный синдром с подъемом сегмента ST
Острый коронарный синдром с подъемом сегмента ST ОКСпST) характеризуется типичными болями в грудной клетке, во время которых на ЭКГ регистрируют стойкий (более 20 мин) подъем сегмента ST (либо вновь возникшая полная блокада левой ножки пучка Гиса). Стойкий подъем сегмента ST на ЭКГ отражает возникновение обширной трансмуральной ишемии миокарда левого желудочка, обусловленной полной тромботической окклюзией крупной эпикардиально расположенной коронарной артерии. Как правило, в дальнейшем в этих зонах ишемии развивается обширный (часто трансмуральный) некроз миокарда, т.е. ОКСпST трансформируется в ИМ с подъемом сегмента ST (ИМпST). На ЭКГ это проявляется появлением патологических зубцов Q, или QS, т.е. формируется ИМ с зубцом Q. Ранее такой ИМ носил называние крупноочагового (зубец Q на ЭКГ) либо трансмурального (зубец QS на ЭКГ) ИМ. Главной целью лечения больных с ОКСпST является скорейшее, максимально полное и стойкое восстановление кровотока по окклюзированной коронарной артерии. С этой целью используют либо тромболитические препараты, либо ЧКВ (баллонная ангиопластика и стентирование коронарных артерий).
Инфаркт миокарда с подъемом сегмента ST
Вне зависимости от того, о каком ИМ идет речь (ИМпST, ИМбпST, ИМ с зубцом Q, ИМ без зубца Q), под этим термином с точки зрения патоморфологии понимают заболевание, характеризующееся возникновением некроза кардиомиоцитов, развившегося вследствие ишемии миокарда, обусловленной абсолютной или относительной недостаточностью коронарного кровотока. При этом необходимо отметить, что некроз кардиомиоцитов, возникший в результате воспаления (миокардит), токсического воздействия на миокард, сепсиса, инфильтративных заболеваний миокарда, почечной либо сердечной недостаточности, травмы, электрической кардиоверсии, катетерной аблации аритмий и др., не является ИМ.
У мужчин ИМпST встречается чаще, чем у женщин, особенно в молодых возрастных группах. В группе больных в возрасте от 21 года до 50 лет это соотношение равняется 5\1, от 51 года до 60 лет - 2\1. В более поздние возрастные периоды эта разница исчезает за счет увеличения числа инфарктов у женщин.
В последнее время значительно увеличилась заболеваемость ИМпST лиц молодого возраста (мужчин до 40 лет).
Классификация
Существует несколько классификаций ИМ, построенных по различным принципам. Есть классификация, в основу которой положен механизм развития ИМ, есть основанная на клиническом варианте начала и течения ИМ, есть классификация, построенная на обширности поражения миокарда, есть классификация, построенная на патоморфологических изменениях миокарда в зависимости от интервала времени, прошедшего с начала заболевания, есть классификация, учитывающая наличие и отсутствие осложнений в течение ИМ, и т.д.
В 2007 году международным сообществом были приняты новые критерии диагностики ИМ, в которых на первом месте по значимости стоят биохимические маркеры некроза миокарда.
Диагноз ИМ основывается на следующих клинических и лабораторноинструментальных диагностических критериях:
• повышение (с последующим снижением) концентрации в плазме крови биохимических маркеров некроза миокарда (предпочтение имеют сердечные тропонины) до уровня, превышающего величину 99-го перцентиля верхней границы их нормальных значений у здоровых лиц в сочетании с одним из следующих признаков ишемии миокарда:
- клинические признаки ишемии миокарда;
- ЭКГ-признаки вновь возникшей ишемии миокарда (подъем или депрессия сегмента ST, появление блокады левой ножки пучка Гиса);
- возникновение патологического зубца Q на ЭКГ;
- выявление с помощью методов визуализации вновь возникшей потери жизнеспособного миокарда или вновь возникших нарушений локальной сократимости миокарда желудочка сердца.
В 2007 году была принята также новая клиническая классификация ИМ, выделяющая пять типов.
• Тип 1. Спонтанный ИМ, обусловленный его ишемией вследствие эрозии, трещины или разрыва атеросклеротической бляшки коронарной артерии либо диссекции стенки коронарной артерии.
• Тип 2. Вторичный ИМ, обусловленный его ишемией в результате либо возросшей потребности миокарда в кислороде, либо в результате уменьшения его доставки вследствие спазма, эмболии коронарной артерии, анемии, аритмии, гипертонии или гипотонии.
• Тип 3. Внезапная, неожиданная сердечная смерть, включая остановку сердечной деятельности, нередко в сочетании либо с клиническими симптомами, характерными для ишемии миокарда, либо с изменениями ЭКГ в виде предположительно вновь возникшего подъема сегмента ST или вновь возникшей блокады левой ножки пучка Гиса, либо при наличии признаков свежего тромба в коронарной артерии по данным ангиографии или аутопсии, в тех случаях, когда смерть наступила раньше, чем было возможно взять образцы крови, либо в период времени, предшествующий повышению уровня биохимических маркеров некроза миокарда в плазме крови.
• Тип 4а. ИМ, связанный с выполнением ЧКВ. Его диагностируют в тех случаях, когда после выполнения ЧКВ у больных, имеющих изначально нормальный уровень сердечных тропонинов или МВ-КФК в плазме крови, отмечается более чем трехкратное превышение величины 99-го перцентиля верхней границы их нормальных значений.
• Тип 4b. ИМ, связанный с тромбозом стента, подтвержденным с помощью ангиографии или аутопсии.
• Тип 5. ИМ, связанный с выполнением операций коронарного шунтирования. Его диагностируют в тех случаях, когда после выполнения операции коронарного шунтирования у больных, имеющих изначально нормальный уровень сердечных тропонинов или МВ-КФК в плазме крови, отмечается более чем пятикратное превышение величины 99-го перцентиля верхней границы их нормальных значений в сочетании с одним из следующих признаков: вновь появившимися на ЭКГ патологическими зубцами Q либо полной блокадой ножки пучка Гиса; с ангиографически доказанной, вновь возникшей окклюзией коронарного шунта, либо нативной коронарной артерии; либо с выявленными с помощью методов визуализации признаками вновь возникшей потери жизнеспособного миокарда.
В зависимости от характера изменений ЭКГ, все ИМ могут быть разделены на ИМ с зубцом Q и на ИМ без зубца Q. Несмотря на то что четкой взаимосвязи между размерами некроза миокарда (распространенностью, глубиной) и его ЭКГ-проявлениями нет, обычно при ИМ с глубокими зубцами Q и особенно с зубцами QS некроз носит трансмуральный характер, захватывая на определенном участке всю толщину стенки миокарда левого желудочка. При ИМ без образования на ЭКГ патологических зубцов Q или QS некроз миокарда обычно имеет меньший размер. В связи с этим ИМ с зубцами Q и QS на ЭКГ назывались раньше соответственно «крупноочаговым» и «трансмуральными»; ИМ без зубца Q назывались раньше «мелкоочаговыми» или «субэндокардиальными».
В зависимости от локализации ИМ подразделяют на передний, верхушечный, боковой, септальный (перегородочный), нижний (диафрагмальный) и базальный. При обширном некрозе возможны сочетания этих локализаций (переднеперегородочный ИМ, нижнебоковой ИМ и др.).
Указанные локализации относятся к левому желудочку, как наиболее часто страдающему при ИМ. Инфаркт правого желудочка развивается значительно реже, обычно при окклюзии правой коронарной артерии, которая обычно его кровоснабжает.
В зависимости от тех патоморфологических изменений, которые происходят в поврежденном миокарде в различные периоды времени, прошедшие от начала заболевания, выделяют определенные стадии, которые ИМ проходит в своем развитии:
• развивающийся ИМ - это первые 6 ч развития ИМ, когда еще сохраняется какая-то часть жизнеспособного миокарда, и лечебные мероприятия, направленные на восстановления кровотока в окклюзированной коронарной артерии, оказываются наиболее эффективны, поскольку дают шанс на спасение части этого сохранившегося миокарда;
• острый ИМ - это ИМ в интервале времени от 6 ч до 7 дней от начала клинической картины заболевания;
• заживающий (рубцующийся) ИМ - это ИМ в период от 7 до 28 дней заболевания;
• заживший ИМ (постинфарктный кардиосклероз, старый ИМ) - это ИМ, начиная с 29 сут заболевания.
В зависимости от клинического течения выделяют первичный, повторный и рецидивирующий ИМ.
• Первичный ИМ - это впервые развившийся ИМ.
• Под повторным ИМ понимают возникновение новых очагов некроза миокарда в сроки, превышающие 29 дней от начала предыдущего инфаркта. Повторный ИМ может возникать как в бассейне инфарктсвязанной коронарной артерии, так и в бассейнах других коронарных артерий.
• Рецидивирующий ИМ - это вариант болезни, при котором новые участки некроза возникают в первые 4 нед после развития предшествующего ИМ, т.е. до окончания основных процессов рубцевания. В диагностике рецидивирующего ИМ, помимо клинической картины (ангинозный приступ длительностью более 20 мин) и изменений ЭКГ (повторный подъем сегмента ST >1 мм либо 0,1 мВ, не менее чем в 2 смежных отведениях), большое значение имеет повторное определение в плазме крови уровня сердечных тропонинов с интервалом 3-6 ч. Для повторного некроза миокарда характерно повышение уровня сердечных тропонинов во втором анализе >20% по сравнению с предыдущим.
Этиология
Основной причиной ИМ служит атеротромбоз в коронарном бассейне, т.е. образование тромба на месте разрыва, эрозии или трещины, так называемой «нестабильной» атеросклеротической бляшки. «Нестабильная» атеросклеротическая бляшка далеко не всегда бывает гемодинамически значимой, суживающей просвет коронарной артерии на 50% и более. Примерно в 2/3 случаев тромбы в коронарных артериях образуются на «нестабильных» атеросклеротических бляшках, суживающих просвет артерии лишь незначительно либо умеренно. «Нестабильная» атеросклеротическая бляшка характеризуется большим липидным ядром и тонкой фиброзной покрышкой с клеточными элементами воспаления. Те или иные признаки атеросклероза коронарных артерий обнаруживают у пациентов, умерших от ИМ в 90-95% случаев.
Реже причинами ИМ бывают спазмы, эмболии коронарных артерий, тромбоз их при воспалительных поражениях (тромбангиит, ревматический коронарит и т.д.), анемия, АГ либо гипотензия, сдавление устья коронарных артерий расслаивающейся аневризмой аорты и пр.
Патогенез
В патогенезе ИМ ведущая роль принадлежит ишемии, т.е. прекращению притока крови к участку сердечной мышцы. Однако необходимо отметить, что гибель ишемизированных кардиомиоцитов происходит не мгновенно, это процесс, растянутый во времени. Во многом длительность этого процесса зависит от наличия и выраженности коллатерального кровообращения, постоянного
либо прерывистого характера тромботической окклюзии, чувствительности кардиомиоцитов к ишемии и их индивидуальной потребности в кислороде и энергетических субстратах. Обычно кардиомиоциты начинают погибать не ранее, чем через 20-30 мин после развития ишемии. Через 60 мин погибает примерно 20% миокарда, через 3 ч - около 40-50% миокарда, через 6 ч - около 60-80% миокарда, через 12 ч - погибает весь миокард, находившийся в зоне кровоснабжения окклюзированной коронарной артерии. Именно поэтому ключевым фактором, влияющим на эффективность лечения больных с ОКСпST, является фактор времени, а введение тромболитических препаратов либо выполнение первичных ЧКВ целесообразно осуществлять только в первые 12 ч заболевания.
Некроз миокарда проявляется резорбционно-некротическим синдромом (данные лабораторных исследований, повышение температуры тела).
Нарушения электрофизиологических и метаболических процессов в миокарде служат причиной тяжелых нарушений ритма сердца, нередко заканчивающихся фибрилляцией желудочков.
Некроз миокарда приводит к нарушению сократительной способности миокарда левого желудочка и запускает процессы его ремоделирования. Образование очага некроза в миокарде сопровождается изменением размера, формы и толщины стенки левого желудочка, а сохранившийся миокард испытывает повышенную нагрузку и подвергается гипертрофии. Насосная функция миокарда левого желудочка, подвергшегося процессам ремоделирования, ухудшается, что способствует развитию хронической сердечной недостаточности. Максимально выраженный вариант ремоделирования левого желудочка проявляется в виде формирований его хронической аневризмы после перенесенного обширного ИМ.
Если же ишемии и некрозу одномоментно подвергается большой объем миокарда левого желудочка (>50% его массы), что бывает при проксимальной окклюзии передней межжелудочковой артерии или окклюзии ствола левой коронарной артерии, развивается острая левожелудочковая недостаточность - отек легких и (или) кардиогенный шок. Возникающее при кардиогенном шоке снижение коронарного кровотока еще больше способствует снижению насосной функции сердца, АД и усугубляет течение кардиогенного шока. Дальнейшее прогрессирование артериальной гипотензии приводит к резкому снижению кровоснабжения жизненно важных органов, что вызывает нарушение микроциркуляции, тканевую гипоксию, ацидоз, полиорганную недостаточность и заканчивается гибелью больного.
Клиническая картина
Нередко ИМпST развивается внезапно, без каких-либо предвестников. Однако примерно у 15-20% больных перед развитием ИМпST наблюдается период нестабильной стенокардии (см. выше соответствующий раздел учебника).
Клиническая картина ИМпST определяется вариантом его начала, характером течения и развитием тех или иных осложнений.
• Классический (типичный) или ангинозный вариант начала ИМпST наблюдается примерно в 70-80% случаев. Клиническая картина характеризуется типичным интенсивным ангинозным болевым синдромом с локализа-
цией боли за грудиной (реже - в области сердца), часто иррадиирующей в левую руку, плечо, лопатку, нижнюю челюсть и т.д. Боли по характеру обычно носят давящий, сжимающий, жгущий характер. В отличие от стенокардии, боль длительная, более 20 мин, не купируется нитроглицерином, сопровождается холодным потом, страхом смерти.
• Помимо типичной формы начала болезни, выделяют ряд других, атипичных вариантов начала ИМпST:
- астматический - начало болезни проявляется одышкой, удушьем, приступами отека легких; болевой синдром отсутствует либо выражен не резко (этот вариант развивается обычно при повторном ИМ у пожилых больных на фоне уже существовавшей ранее хронической сердечной недостаточности);
- абдоминальный (гастралгический) - боли в животе, чаще в подложечной области, диспептические расстройства, чаще возникает при нижнем (диафрагмальном) ИМ;
- аритмический - заболевание проявляется нарушениями ритма или проводимости, чаще в виде предсердно-желудочковой блокады IIIII степени либо желудочковой тахикардией, при этом болевой синдром отсутствует либо выражен слабо;
- церебральный (цереброваскулярный) - проявляется неврологическими расстройствами: головокружением, обмороками, симптомами, напоминающими клиническую картину инсульта. Чаще встречается у пожилых больных, имеющих поражения интра- и экстракраниальных артерий, перенесших ранее нарушения мозгового кровообращения;
- бессимптомный (безболевой) - симптомы общего недомогания, немотивированной слабости, адинамии; особенно часто встречается у пожилых лиц, у больных сахарным диабетом, перенесших ранее нарушение мозгового кровообращения; часто диагноз ставится ретроспективно, после случайной регистрации ЭКГ.
Осложнения
• В период развивающегося ИМпST более чем у 90% больных возникают различные желудочковые нарушения ритма (обычно желудочковая экстрасистолия), в том числе и тяжелые (желудочковая тахикардия, фибрилляция желудочков), которые могут привести к летальному исходу (внезапная сердечная смерть).
• В период острого ИМпST могут возникать осложнения, большинство которых также может служить причиной смерти больных:
- нарушения ритма и проводимости (ЖПТ, фибрилляция желудочков, предсердно-желудочковые блокады, мерцание и ТП и другие менее грозные нарушения);
- острая левожелудочковая недостаточность - сердечная астма, отек легких, шок (рефлекторный, кардиогенный или аритмический);
- острая аневризма сердца;
- эпистенокардитический перикардит;
- разрывы миокарда как внутренние, так и наружные (в том числе перфорация межжелудочковой перегородки и отрыв сосочковых мышц);
- тромбоэмболические осложнения (в большом и малом круге кровообращения);
- парез желудка и кишечника, эрозивный гастрит с желудочным кровотечением, панкреатит.
• Период заживающего (рубцующегося) ИМпST протекает более благоприятно, но и в его течении возможны осложнения:
- тромбоэндокардит с тромбоэмболическим синдромом (чаще - эмболия мелких сосудов большого круга кровообращения);
- пневмония;
- постинфарктный синдром - синдром Дресслера, синдром передней грудной стенки, синдром плеча - развивается обычно на 2-6-й нед после ИМ, характеризуется перикардитом, плевритом, пневмонитом; иногда в воспалительный процесс вовлекаются синовиальные оболочки суставов (одновременно все симптомы встречаются редко, чаще наблюдается сочетание перикардита с плевритом или пневмонитом; иногда каждый из этих симптомов может встречаться изолированно, затрудняя диагностику постинфарктного синдрома);
- психические изменения (чаще неврозоподобные симптомы);
- хроническая левожелудочковая сердечная недостаточность;
- начало формирования хронической аневризмы сердца;
- правожелудочковая недостаточность развивается редко; при ее наличии следует думать о тромбоэмболии ветвей легочной артерии, разрыве межжелудочковой перегородки и крайне редко - об инфаркте правого желудочка.
• В периоде зажившего ИМпST продолжается ремоделирование левого желудочка, может идти формирование хронической аневризмы, развитие симптомов хронической сердечной недостаточности. Могут также возникнуть новые нарушения ритма сердца (МА). В целом, для данного периода развитие тяжелых осложнений нехарактерно.
На первом этапе диагностического поиска на основании клинической картины, характера ее развития, с учетом предшествующего анамнеза, возраста и пола больного можно:
• заподозрить развитие ИМ;
• высказать предположения о клиническом варианте болезни;
• получить сведения о тех или иных осложнениях.
При наличии длительного приступа нестерпимых болей за грудиной и в области сердца с характерной иррадиацией, не купирующихся нитроглицерином, следует, прежде всего, предположить развитие ИМ, особенно у мужчин старше 40 лет. Надо помнить, что подобная симптоматика иногда может быть обусловлена и другими причинами (неврит, плеврит, миозит и др.).
Остро возникший приступ удушья, особенно у лиц пожилого возраста, прежде всего наводит на мысль об астматическом варианте ИМ и требует обязательной регистрации ЭКГ. Однако острая левожелудочковая недостаточность может быть проявлением иной болезни (аортальный или митральный порок сердца, ГБ). Сердечная астма и отек легких при соответствующей клинической картине ИМ могут быть осложнением, но не вариантом его начала.
Наличие резких болей в эпигастральной области, особенно у больных с хронической ИБС, позволяет заподозрить абдоминальный (гастралгический) вариант ИМ и требует регистрации ЭКГ. Подобная клиническая картина может быть проявлением других заболеваний (обострением язвенной болезни, гастритом, а также холециститом, острым панкреатитом, пищевым отравлением), особенно при наличии симптомов желудочной диспепсии.
Жалобы больного на приступы сердцебиений или резкого урежения ритма, появление аритмий, обмороков могут указывать на начало ИМ или его осложнений. Кроме этого нарушения ритма могут появиться и вне связи с ИМ и быть проявлением НЦД, миокардитического кардиосклероза, хронической ИБС и др.
Интенсивный болевой синдром с атипичной локализацией реже напоминает ИМ, но не исключает его, в связи с чем дальнейшее обследование больного обязательно.
Внезапное немотивированное развитие кардиогенного шока, когда больной заторможен, вял, сознание его спутано, также должно вызвать у врача подозрение в отношении ИМ.
Все сведения, полученные на первом этапе диагностического поиска, должны оцениваться с учетом данных физического и лабораторно-инструментального обследования. Иногда на этом этапе диагностического поиска можно не получить никакой информации, позволяющей поставить диагноз ИМ.
На втором этапе диагностического поиска можно получить сведения:
• косвенно указывающие на развитие ИМ (прямых признаков не существует);
• позволяющие выявить осложнения.
При соответствующем анамнезе такие симптомы, как повышение температуры тела, тахикардия, артериальная гипотензия, особенно развившаяся на фоне предшествующей гипертензии, глухость тонов сердца и кратковременно выслушиваемый шум трения перикарда, позволяют высказаться в пользу диагноза ИМ. Однако сами по себе эти симптомы непатогномоничны для ИМ и могут встречаться при ряде заболеваний (ревматизм, миокардит, перикардит и т.д.).
Физическое исследование помогает выявить симптомы возможных осложнений.
Для кардиогенного шока характерны: холодная кожа серо-бледного цвета, покрытая липким потом (нарушение периферической циркуляции); олигоанурия (уменьшение мочеобразования); нитевидный пульс; уменьшение пульсового давления (менее 20-30 мм рт.ст.); снижение систолического АД (ниже 80 мм рт.ст.).
Могут наблюдаться симптомы острой левожелудочковой недостаточности: одышка, ортопноэ, влажные незвонкие мелкопузырчатые хрипы в легких.
Увеличенная печень, периферические отеки - симптомы недостаточности кровообращения в большом круге.
При физическом обследовании представляется возможным обнаружить брадитахикардию, экстрасистолию, МА, ПТ.
Диагностическое значение всех указанных осложнений невелико, так как они встречаются и при других заболеваниях. Лишь в сочетании с анамнезом и
данными третьего этапа диагностического поиска они значимы при постановке диагноза ИМ.
Большое диагностическое значение приобретает выявление острой аневризмы (патологическая пульсация в прекардиальной области в четвертом межреберье слева от грудины), разрыва межжелудочковой перегородки (интенсивный систолический шум в нижней трети грудины с симптомами быстро нарастающей недостаточности кровообращения в малом и большом круге), разрыва или отрыва сосочковой мышцы (дующий систолический шум на верхушке сердца, иногда определяемый пальпаторно, в сочетании с нарастающим застоем в малом круге кровообращения).
Третий этап диагностического поиска позволяет:
• поставить окончательный диагноз ИМ;
• уточнить его локализацию и распространенность (степень поражения миокарда);
• подтвердить или выявить нарушения ритма и проводимости;
• выявить новые осложнения (аневризма сердца, очаговое поражение почек при тромбоэмболии).
Поставить окончательный диагноз ИМ можно на основании сочетания признаков резорбционно-некротического синдрома и данных ЭКГ.
• Резорбционно-некротический синдром выявляют по результатам общеклинического и биохимического исследований крови: лейкоцитоз со сдвигом лейкоцитарной формулы влево и анэозинофилия (не всегда) с первых часов заболевания; увеличение СОЭ с 3-5-го дня.
- В настоящее время самым информативными методом диагностики ИМ служит определение в плазме крови сердечных тропонинов Т или I. При возникновении некроза миокарда уровень сердечных тропонинов повышается до диагностически значимого уровня не ранее, чем через 6 ч, поэтому для диагностики ИМ рекомендуется 2-кратное определение сердечных тропонинов: при поступлении больного в стационар и повторно через 6-9 ч. Диагностически значимым повышением уровня сердечных тропонинов в плазме крови считают уровень, превышающий 99-й перцентиль значений этого показателя у здоровых лиц, определенный лабораторным методом, у которого коэффициент вариации определений не превышает 10%. Величины 99-го перцентиля нормальных значений для различных лабораторных методов могут быть найдены на веб-сайте Международной федерации клинической химии. Повышенный уровень сердечных тропонинов сохраняется в плазме крови до 7-14 дней после возникновения ИМ.
- Если использование сердечных тропонинов в качестве маркеров некроза миокарда невозможно, допустимо использование с этой целью MB-КФК, хотя чувствительность ее несколько ниже, чем чувствительность сердечных тропонинов. Так же как и в случае с сердечными тропонинами, диагностически значимого уровня в плазме крови MB-КФК достигает через 6-9 ч после возникновения некроза миокарда, однако сохраняет повышенное значение только около 2-3 суток. Аналогично сердечным тропонинам, диагностически значимыми считают уровни
MB-КФК в плазме крови, превышающие 99-й перцентиль значений этого показателя у здоровых лиц.
- Еще одним биохимическим маркером некроза миокарда, используемым для диагностики инфаркта, служит миоглобин. Его преимущество - быстрое повышение концентрации в плазме крови, которая достигает диагностического значения уже через 2 ч после возникновения ангинозного приступа. Однако миоглобин имеет существенный недостаток - при высокой чувствительности он обладает низкой специфичностью.
- Использовавшееся ранее в диагностике ИМ определение в плазме крови уровня аминотрансфераз (АСТ, АЛТ), лактатдегидрогеназы (ЛДГ) и ее изоферментов (ЛДГ-1 и ЛДГ-2) в настоящее время потеряли свое значение и практически не применяются.
• ЭКГ - один из основных методов диагностики ИМпST, который позволяет установить диагноз ИМ, уточнить его локализацию, глубину и обширность поражения, фазу течения; подтвердить или выявить нарушения ритма и проводимости; высказать предположение о развитии аневризмы
сердца.
- У больных с ОКСпST и у больных с ИМпST в период развивающегося ИМ и в начальный период острого ИМ (первые 6-12 ч заболевания) отмечают подъем сегмента ST в так называемых «прямых» отведениях (в этих отведениях в последующем будет формироваться патологический зубец Q) и реципрокное снижение ST в отведениях, при этом изменений комплекса QRS и формирования патологических зубцов Q пока еще не будет. Диагностически значимым считают подъем сегмента ST в точке J в 2 последовательных отведениях и более >0,2 мм (0,2 мВ) для мужчин и >=0,15 мм (0,15 мВ) для женщин в отведениях V2-V3 и >0,1 мм (0,1 мВ) в других отведениях.
- В период острого ИМ в «прямых» отведениях ЭКГ резко снижается амплитуда зубца R и формируется патологический зубец, по амплитуде равный не менее 1/3 зубца R, а по длительности - равный 0,04 с и более (ранее называвшийся «крупноочаговым» ИМ). Либо зубец R исчезает полностью и формируется патологический комплекс QS (ранее называвшийся трансмуральным ИМ; рис. 2-18).
- Последующая эволюция ЭКГ при ИМпST сводится к возвращению сегмента ST к изоэлектрической линии и формированию в «прямых» отведениях отрицательного («коронарного») зубца Т.
- Для распространенного ИМ передней стенки левого желудочка, включая область верхушки, межжелудочковой перегородки и боковой стенки, характерны изменения ЭКГ в отведениях I, II, aVL и с V2 по V6; для инфаркта в области верхушки левого желудочка - в отведениях V3-V4; при поражениях области межжелудочковой перегородки выявляют изменения в отведениях V1-V3; при инфаркте боковой стенки - в отведениях I, aVL и V5, V6; для инфаркта нижней стенки характерны изменения - в отведениях II, III и aVF.
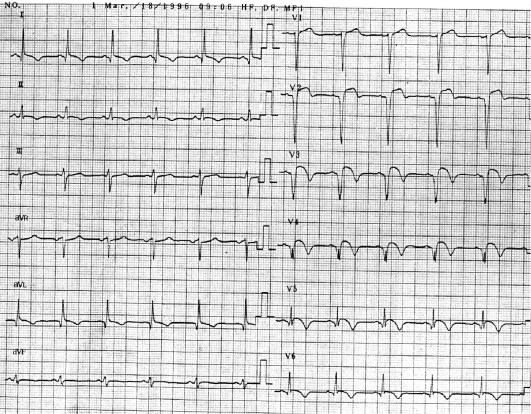
Рис. 2-18. Острый период инфаркта миокарда (3-и сут) у больного с ИМпST (тот же больной, что и на рис. 2-15): ЭКГ-признаки формирования инфаркта миокарда с зубцом Q передней, верхушечной, септальной и боковой областей левого желудочка: появление патологических зубцов Qи QS в отведениях I, aVL, V2-6; сегмент ST снизился по сравнению с рис. 2-18, однако еще не опустился до изолинии. Начало формирования негативных «коронарных» зубцов Т отведениях I, aVL, V2-6
- ЭКГ в 12 стандартных отведениях не является информативной в случае предшествовавшей блокады левой ножки пучка Гиса и при инфаркте правого желудочка.
- На ЭКГ могут выявлять самые разнообразные нарушения ритма, встречающиеся при ИМ. По ЭКГ можно узнать впервые о нарушениях предсердно-желудочковой проводимости и проводимости по ножкам пучка Гиса, определить характер блокады.
- Признаком, позволяющим предположить аневризму, является так называемая «застывшая» ЭКГ - сохранение подъема сегмента ST в сочетании с комплексом QS в «прямых» отведениях, при этом может отмечаться «коронарный» зубец Т.
• Ультразвуковое исследование сердца - важный дополнительный метод исследования у больных с инфарктом. УЗИ позволяет выявить участки нарушения локальной сократимости миокарда левого желудочка (гипокинезия, акинезия), соответствующие зоне поражения, а также состояние
сосочковых мышц и межжелудочковой перегородки, которые также могут поражаться при ИМ. Велико значение УЗИ сердца в оценке глобальной сократимости левого желудочка (величина фракции выброса левого желудочка), в оценке его формы, размеров, в распознавании таких осложнений, как образование тромбов в полостях сердца, разрывов миокарда, возникновении перикардита.
• Рентгеноскопию органов грудной клетки рекомендуется проводить у всех больных с подозрением на ИМ либо с уже установленным диагнозом инфаркта. Для этого обычно используют передвижные рентгеновские установки. Рентгенография органов грудной клетки позволяет уточнить состояние легких, сердца. Особенно велико ее значение в диагностики начальных признаков застоя в малом круге кровообращения, которые еще не проявляются клинически.
В подавляющем большинстве случаев на этом третий этап диагностического поиска заканчивается и формулируется развернутый клинический диагноз. Иногда прибегают к специальным методам диагностики.
• Визуализация ИМ с помощью радиоактивных изотопов. Этот метод применяют, если затруднена диагностика ИМ с помощью ЭКГ, а исследование активности ферментов сыворотки крови невозможно или малоинформативно.
- Пирофосфат, меченный технецием (99mTc-MIBI), начинает накапливаться в зоне некроза спустя 12 ч от начала заболевания, и очаг «свечения» определяется до 2 нед, а при обширных поражениях - 2-3 мес.
- Реже используют радиоактивный талий (T1201), который накапливается в хорошо кровоснабжаемых участках миокарда и не поступает в зону некроза.
• Селективная коронарография в остром периоде ИМ применяется, если планируется выполнение первичной ангиопластики и стентирования коронарных артерий.
Диагностические критерии инфаркта миокарда
Повышение и (или) последующее снижение уровня биохимических маркеров некроза миокарда в крови (предпочтительно сердечных тропонинов), если их концентрация как минимум в одной пробе крови превышает верхнюю границу нормы, принятую в данной лаборатории, и имеется как минимум одно из следующих свидетельств ишемии миокарда:
• клиническая картина ишемии миокарда;
• изменения ЭКГ, указывающие на появление ишемии миокарда (возникновение смещений сегмента ST-T, блокады левой ножки пучка Гиса);
• появление патологических зубцов Q на ЭКГ;
• появление признаков потери жизнеспособного миокарда или нарушений локальной сократимости при использовании методик, позволяющих визуализировать сердце.
Формулировка развернутого клинического диагноза ИМ должна отражать:
• характер течения (первичный, рецидивирующий, повторный);
• глубину некроза (ИМ с зубцом Q, или ИМ без зубца Q);
• локализацию ИМ;
• дату возникновения ИМ;
• осложнения (если они имелись): нарушения ритма и проводимости, острая сердечная недостаточность и др.;
• фоновые заболевания - атеросклероз коронарных артерий (если выполнялась коронароангиография, то указывается его тяжесть, распространенность и локализация), ГБ (при ее наличии) и ее стадия, сахарный диабет и др.
Лечение
Оказание помощи больным с ИМпST складывается из системы организационных и лечебных мероприятий.
• Организационные мероприятия включают:
- раннюю диагностику врачами скорой медицинской помощи, участковыми врачами, терапевтами и врачами общей практики районных поликлиник ОКСпST на основании критериев, приведенных ранее (см. ОКСпST);
- как можно более раннюю госпитализацию бригадой скорой помощи больного с ОКСпST в блок интенсивной кардиологии отделения неотложной кардиологии;
- как можно более раннее начало мероприятий, направленных на восстановление коронарного кровотока: выполнение первичных ЧКВ в течение 90 мин от момента поступления больного в стационар, располагающий такими возможностями, или введение тромболитических препаратов на догоспитальном этапе либо не позднее 30 мин от момента поступления больного в стационар, не располагающий возможностями выполнения первичных ЧКВ;
- пребывание больного в течение острого периода ИМпST в блоке интенсивной кардиологии;
- систему восстановительного лечения (реабилитация).
• Лечебные мероприятия проводятся с учетом стадии ИМпST, выраженности и характера осложнений.
В начальном периоде ИМпST основные лечебные мероприятия направлены на обезболивание, скорейшее полноценное и стойкое восстановление коронарного кровотока в инфаркт-связанной артерии и лечение осложнений, если они возникают.
Купирование болевого синдрома. Обезболивание является одной из важнейших задач начального периода лечения больных с ИМпST. При неэффективности 1-2-кратного приема 0,4 мг нитроглицерина в виде таблеток или спрея, используют внутривенное введение наркотических анальгетиков, среди которых наиболее эффективен 1% раствор морфина (морфина гидрохлорида). Обычно внутривенно струйно (медленно!) вводят 1,0 мл препарата, разведенного в 20,0 мл изотонического раствора натрия хлорида. Вместо морфина могут быть использованы и другие наркотические анальгетики: 1,0 мл 1% раствора тримеперидина (промедола*), 1-2 мл 0,005% раствора фентанила, как в сочетании с транквилизаторами или нейролептиками (2 мл 0,25% раствора дроперидола), так и без них.
Оксигенотерапия через лицевую маску либо носовые катетеры показана больным, имеющим одышку или клинические признаки острой сердечной недостаточности (отек легких, кардиогенный шок).
Восстановление коронарного кровотока и перфузии миокарда. Скорейшее восстановление кровотока в окклюзированной коронарной артерии (реперфузия) служит краеугольной задачей в лечении больных с ИМпST, решение которой влияет как на госпитальную смертность, так и на ближайший и отдаленный прогноз. При этом желательно, чтобы, помимо как можно более быстрого, восстановление коронарного кровотока было полноценным и стойким. Ключевым моментом, влияющим как на эффективность любого реперфузионного вмешательства, так и на его отдаленные результаты, является фактор времени: потеря каждых 30 мин увеличивает риск смерти в стационаре примерно на 1%.
Существует две возможности восстановления коронарного кровотока: тромболитическая терапия, т.е. реперфузия с помощью тромболитических препаратов (стрептокиназа, тканевые активаторы плазминогена), и ЧКВ, т.е. реперфузия с помощью механического разрушения тромботических масс, окклюзирующих коронарную артерию (баллонная ангиопластика и стентирование коронарных артерий).
Попытка восстановления коронарного кровотока с помощью того или другого метода должна быть предпринята у всех больных с ИМпST в первые 12 ч заболевания (при отсутствии противопоказаний). Реперфузионные вмешательства оправданы и после 12 ч от начала заболевания, если имеются клинические и ЭКГ-признаки продолжающейся ишемии миокарда. У стабильных больных, при отсутствии клинических и ЭКГ-признаков продолжающейся ишемии миокарда, проведение ни тромболитической терапии, ни ЧКВ позднее 12 ч от начала заболевания не показано.
В настоящее время методом выбора восстановления коронарного кровотока у больных с ИМпST в первые 12 ч заболевания служит первичное ЧКВ
(рис. 2-19).
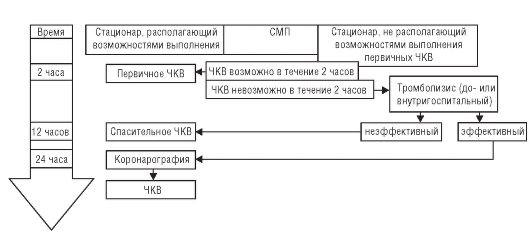
Рис. 2-19. Выбор реперфузионной стратегии лечения больных с инфарктом миокарда с подъемом сегмента ST в первые 12 ч заболевания
Под первичным ЧКВ понимают баллонную ангиопластику со стентированием (либо без него) инфаркт-связанной коронарной артерии, выполненные в первые 12 ч от начала клинической картины ИМпST без предшествующего применения тромболитических либо других препаратов, способных растворять тромбы.
В идеальном случае в первые 12 ч заболевания больной с ИМпST должен быть доставлен в стационар, располагающий возможностями выполнения первичного ЧКВ 24 часа в сутки 7 дней в неделю при условии, что предполагаемые потери времени между первым контактом пациента с врачом и моментом раздувания баллонного катетера в коронарной артерии (т.е. момента восстановления коронарного кровотока) не превысят 2 ч. У больных с обширным ИМпST, диагностированным в первые 2 ч от начала заболевания, потери времени не должны превышать 90 мин.
Однако в реальной жизни далеко не у всех больных с ИМпST возможно выполнение первичного ЧКВ, поскольку, с одной стороны, по различным причинам в первые 12 ч заболевания госпитализируются значительно менее 50% больных, а в первые 6 ч, наиболее благоприятных для лечения, - менее 20% больных с ИМпST. С другой стороны, далеко не все крупные стационары имеют возможность выполнения экстренных ЧКВ 24 часа в сутки 7 дней в неделю.
В связи с этим во всем мире, в том числе и в Российской Федерации, основным способом восстановления коронарного кровотока у больных с ИМпST пока остается тромболитическая терапия. К преимуществам тромболитической терапии относится простота ее проведения, относительно невысокая стоимость, возможность ее проведения как на догоспитальном этапе (существенное, не менее чем на 30 мин (!) сокращение времени до начала реперфузионной терапии), так и в любом стационаре. К ее недостаткам следует отнести недостаточную эффективность (50-80% в зависимости от типа тромболитического препарата и времени, прошедшего от начала заболевания), развитие ранних (5-10% больных) и поздних (30% больных) повторных окклюзий коронарных артерий, возможность тяжелых геморрагических осложнений, включая геморрагический инсульт (у 0,4-0,7% больных).
При отсутствии противопоказаний проведение тромболитической терапии должно быть осуществлено в первые 12 ч от начала клинической картины ИМпST у больных, которым первичное ЧКВ по каким-либо причинам не может быть выполнено в указанные выше интервалы времени.
Принципиально важным является положение, что проведение системного тромболизиса целесообразно только в первые 12 ч от начала клинической картины ИМпST.
В более поздние сроки проведение системного тромболизиса не показано, поскольку эффективность его крайне низкая, и он не оказывает существенного влияния на показатели госпитальной и отдаленной смертности.
В настоящее время наиболее широко используемыми тромболитическими препаратами являются стрептокиназа (самый часто используемый в мире препарат) и тканевые активаторы плазминогена, к которым относятся алтеплаза (t-PA), ретеплаза (rt-PA) и тенектеплаза (nt-PA), проурокиназа (пуролаза).
Преимущество имеют тканевые активаторы плазминогена, поскольку они являются фибринспецифичными тромболитическими препаратами.
При наличии обученного персонала рекомендуется начинать тромболитическую терапию на догоспитальном этапе в условиях бригады скорой помощи, что позволяет значительно (минимум на 30-60 мин) сократить потери времени, связанные с проведением реперфузионных вмешательств.
Показания к проведению системного тромболизиса:
• наличие типичной клинической картины острого коронарного синдрома в сочетании с изменениями ЭКГ в виде подъема сегмента ST >1,0 мм в 2 смежных стандартных отведениях от конечностей либо подъема сегмента ST >2,0 мм в двух смежных грудных отведениях и более;
• впервые выявленная полная блокада левой ножки пучка Гиса в сочетании с типичной клинической картиной.
К абсолютным противопоказаниям к проведению системного тромболизиса относятся:
• геморрагический инсульт или инсульт неизвестного характера любой давности в анамнезе;
• ишемический инсульт в течение последних 6 мес;
• наличие сосудистой патологии головного мозга (артериовенозная мальформация);
• наличие злокачественной опухоли головного мозга или метастазов;
• недавняя травма, в том числе черепно-мозговая, полостная операция, в течение последних 3 нед;
• желудочно-кишечное кровотечение в течение последнего 1 мес;
• известные заболевания, сопровождающиеся кровоточивостью;
• подозрение на расслоение стенки аорты;
• пункции неподдающихся компрессии органов (пункция печени, люмбальная пункция), в том числе сосудов (подключичная вена).
К относительным противопоказаниям к проведению системного тромболизиса относятся:
• транзиторная ишемическая атака в течение последних 6 мес;
• терапия непрямыми антикоагулянтами;
• беременность и 1-я неделя после родов;
• реанимационные мероприятия, сопровождавшиеся травмой грудной клетки;
• неконтролируемая АГ (систолическое АД >180 мм рт.ст.);
• язвенная болезнь желудка и двенадцатиперстной кишки в фазе обострения;
• далеко зашедшие заболевания печени;
• ИЭ.
Стрептокиназу вводят внутривенно капельно в дозе 1,5 Ед, растворенные в 100 мл 0,9% раствора натрия хлорида или 5% глюкозы* в течение 30-60 мин. Предварительно, для снижения вероятности аллергических реакций, целесообразно ввести внутривенно 60-90 мг преднизолона.
Алтеплаза вводится внутривенно в суммарной дозе 100 мг следующим образом: первоначально внутривенно в виде болюса вводят 15 мг препарата, затем в течение следующих 30 мин начинают внутривенное капельное введение ал-
теплазы из расчета 0,75 мг/кг массы тела, в последующие 60 мин продолжают внутривенное капельное введение препарата из расчета 0,5 мг/кг массы тела.
Тенектеплазу вводят внутривенно в виде однократной болюсной инъекции в дозе, рассчитываемой в зависимости от веса больного: при весе 60-70 кг - вводится 35 мг препарата, при весе 70-80 мг - вводится 40 мг тенектеплазы, при весе 80-90 кг - вводят 45 мг препарата, при весе более 90 кг - 50 мг.
Проурокиназа (пуролаза), отечественный препарат, вводится внутривенно (предварительно препарат растворяют в 100-200 мл дистиллированной* воды или изотоническом растворе хлорида натрия) по схеме «болюс + инфузия». Болюс составляет 2 000 000 МЕ; последующая инфузия 4 000 000 МЕ в течение 30-60 мин.
По сравнению со стрептокиназой (тромболитик 1-го поколения), алтеплазой и ретеплазой (тромболитики 2-го поколения), которые требуют внутривенного капельного введения в течение определенного времени, удобство применения тенектеплазы (тромболитик 3-го поколения) состоит в возможности его болюсного внутривенного введения. Это чрезвычайно удобно при проведении догоспитального тромболизиса в условиях бригады скорой медицинской помощи.
Косвенно эффективность тромболитической терапии оценивают по степени снижения интервала S-T (по сравнению с выраженностью первоначального подъема) через 90 мин после начала введения тромболитического препарата. Если интервал S-T снизился на 50% или более по сравнению с первоначальным уровнем, принято считать, что тромболизис оказался эффективным. Еще одним косвенным подтверждением эффективности тромболитической терапии служит появление так называемых реперфузионных аритмий (частая желудочковая экстрасистолия, пробежки медленной желудочковой тахикардии, крайне редко возникает фибрилляция желудочков). Однако необходимо отметить, что далеко не всегда формально эффективная по косвенным признакам тромболитическая терапия приводит к восстановлению коронарного кровотока (по данным коронароангиографии). Реперфузионная эффективность стрептокиназы составляет около 50%, алтеплазы, ретеплазы*9 и тенектеплазы - 75-85%.
При неэффективности тромболитической терапии может рассматриваться вопрос о переводе больного с ИМпST в стационар, имеющий возможность проведения ЧКВ (для того чтобы в течение 12 ч от начала заболевания ему было выполнено так называемое «спасительное» ЧКВ).
В случае эффективного системного тромболизиса больному в течение ближайших 24 ч, но не ранее 3 ч от начала введения тромболитического препарата, целесообразно проведение коронароангиографии и при показаниях - выполнение ЧКВ.
С целью усиления тромболитического эффекта и предупреждения повторного тромбоза коронарной артерии (при эффективном тромболизисе) используют антитромбоцитарные препараты (ацетилсалициловую кислоту и клопидогрел) и антитромбиновые препараты (НФГ, НМГ, ингибиторы Ха-фактора).
Учитывая чрезвычайно важную роль тромбоцитов в патогенезе ОКСпST, подавление адгезии, активации и агрегации тромбоцитов служит одним из ключевых моментов в лечении этой категории больных. Ацетилсалициловая кислота, блокируя циклооксигеназу-1 тромбоцитов, нарушает синтез в них тромбокса-
на А2 и, таким образом, необратимо подавляет агрегацию тромбоцитов, индуцированную коллагеном, АДФ и тромбином.
Ацетилсалициловую кислоту (аспирин) в качестве антиагреганта назначают больному как можно раньше заболевания (еще на догоспитальном этапе). Первую нагрузочную дозу 250 мг больного просят разжевать; затем в дозе 100 мг больной принимает аспирин* внутрь (желательно в кишечнорастворимой форме) один раз в сутки неограниченно долго. Назначение аспирина* одновременно с проведением тромболитической терапии сопровождается снижением 35-дневной смертности на 23%.
Тиенопиридины (клопидогрел). Еще более эффективным является добавление к тромболитической терапии комбинации аспирина* и клопидогрела (как с использованием нагрузочной дозы клопидогрела 300-600 мг, так и без нее). Такая двухкомпонентная антитромбоцитарная терапия приводит к достоверному снижению на 30-й день заболевания частоты серьезных сердечнососудистых осложнений на 20%.
Антитромбиновые препараты (антикоагулянты). Целесообразность применения антикоагулянтов (НФГ, НМГ, ингибиторы Ха-фактора) связана с необходимостью сохранения проходимости и предупреждения повторного тромбоза инфарктсвязанной коронарной артерии после успешного системного тромболизиса; профилактикой формирования пристеночных тромбов в левом желудочке и последующих системных артериальных эмболий, а также профилактикой возможных тромбозов вен нижних конечностей и тромбоэмболий ветвей легочной артерии.
Выбор антикоагулянта зависит от того, проводился ли системный тромболизис или нет, и если проводился, то какой препарат использовали.
Если системный тромболизис проводили с помощью стрептокиназы, препаратом выбора среди антикоагулянтов служит ингибитор Ха-фактора фондапаринукс натрия (арикстра*), первая доза которого 2,5 мг вводится внутривенно в виде болюса, в дальнейшем он вводится подкожно 1 раз в день в дозе 2,5 мг на протяжении 7-8 дней. Помимо фондапаринукса может использоваться НМГ эноксапарин натрия, который первоначально вводят в виде внутривенного болюса в дозе 30 мг, вслед за ним с интервалом в 15 мин следует первая подкожная инъекция из расчета 1 мг/кг массы тела. В дальнейшем эноксапарин натрия вводят подкожно 2 раза в день в дозе 1 мг/кг массы тела на протяжении максимально 8 дней.
В качестве антикоагулянтной терапии может применяться и НФГ, что менее удобно, нежели эноксапарин и фондапаринукс натрия. Принципиально важен путь введения НФГ: его следует назначать исключительно (!) в виде постоянной внутривенной инфузии через дозирующие устройства под контролем АЧТВ. Цель такой терапии - достижение величины АЧТВ в 1,5-2 раза большей по отношению первоначального значения. Для этого первоначально НФГ вводят внутривенно в виде болюса 60 Ед/кг (но не более 4000 Ед), с последующей внутривенной инфузией в дозе 12 Ед/кг в час, но не превышающей 1000 Ед/ч под регулярным (через 3, 6, 12 и 24 ч после начала инфузии) контролем АЧТВ и соответствующей коррекцией дозы НФГ.
Если системный тромболизис проводили с помощью тканевого активатора плазминогена, в качестве антикоагулянтной терапии может быть использован либо эноксапарин, либо нефракционировнный гепарин.
Нитраты. Органические нитраты - препараты, уменьшающие ишемию миокарда. Однако убедительных данных в пользу применения нитратов при неосложненном течении ИМпST нет, поэтому их рутинное применение в таких случаях не показано. Внутривенное введение нитратов может применяться в течение первых 1-2 сут ИМпST при клинических признаках сохраняющейся ишемии миокарда, при высокой АГ, при сердечной недостаточности. Начальная доза препарата составляет 5-10 мкг/мин, при необходимости она увеличивается на 10-15 мкг/мин, пока не будет достигнут требуемый эффект либо систолическое АД не достигнет уровня 100 мм рт.ст.
Применение р-адреноблокаторов на раннем этапе лечения больных с ИМпST (за счет снижения потребности миокарда в кислороде) способствует уменьшению ишемии миокарда, ограничению зоны некроза и вероятности возникновения жизнеугрожающих нарушений ритма, в том числе фибрилляции желудочков. У «стабильных» больных, не имеющих нарушений гемодинамики (артериальной гипотензии, острой левожелудочковой недостаточности), нарушений проводимости сердца, бронхиальной астмы, в первые часы ИМпST возможно внутривенное введение р-адреноблокаторов с последующим переходом на поддерживающий прием внутрь. Однако у большинства больных, после стабилизации их состояния, предпочтительнее сразу назначение р-адреноблокаторов (метопролол, бисопролол, карведилол, пропранолол) внутрь. При этом сначала р-адреноблокаторы назначаются в небольшой дозе с последующем ее увеличение под контролем АД, ЧСС и состояния гемодинамики.
Ингибиторы АПФ следует назначать с первых суток ИМпST, если нет противопоказаний. Могут применяться каптоприл, эналаприл, рамиприл, периндоприл, зофеноприл, трандолаприл и др. Учитывая нестабильность гемодинамики в первые сутки ИМпST, возможность одновременного применения р-адреноблокаторов и нитратов, первоначальные дозы ингибиторов АПФ должны быть небольшими с последующим их увеличением под контролем АД, уровня калия и креатинина плазмы крови до максимально переносимых доз либо до достижения их целевых значений. Если больной не переносит ингибиторы АПФ, можно использовать блокаторы рецепторов ангиотензина II (валсартан, лозартан, телмисартан и др). Особенно эффективны ингибиторы АПФ у больных ИМпST, у которых в ранней фазе заболевания имелось снижение фракции выброса или были признаки сердечной недостаточности.
Осложнения инфаркта миокарда и их лечение
Острая сердечная недостаточность (ОСН) - одно из наиболее грозных осложнений ИМ. Обычно она развивается при резком снижении сократимости миокарда левого желудочка вследствие обширной зоны ишемии или некроза, захватывающей более 40% миокарда левого желудочка. Нередко ОСН развивается на фоне уже имевшейся ранее хронической сердечной недостаточности либо осложняет течение повторных ИМ .
Различают два клинических варианта ОСН:
• застой крови в малом круге кровообращения, т.е. отек легких (интерстициальный либо альвеолярный);
• кардиогенный шок.
Иногда оба эти варианта ОСН сочетаются. Такие больные имеют наихудший прогноз, поскольку летальность у них превышает 80%.
• Отек легких развивается вследствие повышения давления крови в капиллярах малого круга кровообращения. Это приводит к поступлению плазмы крови из внутрисосудистого русла в ткань легких, обусловливая их повышенную гидратацию. Обычно это происходит, когда гидростатическое давление в капиллярах легких повышается до 24-26 мм рт.ст. и начинает превышать величину онкотического давления крови. Различают интерстициальный и альвеолярный отек легких.
- При альвеолярном отеке жидкость, богатая белком, проникает в альвеолы и, перемешиваясь с вдыхаемым воздухом, образует стойкую пену, заполняющую дыхательные пути, резко затрудняет дыхание, ухудшает газообмен, вызывает гипоксию, ацидоз и нередко заканчивается смертью больного.
• В основе кардиогенного шока лежит критическое снижение минутного выброса сердца (сердечный индекс =<1,8 л/мин в 1 м2), сопровождающееся выраженным снижением систолического АД =<90 мм рт.ст. (на протяжении не менее 30 мин), что приводит к развитию тяжелой гипоперфузии всех органов и тканей, проявляющейся акроцианозом, олиго- и анурией (<30 мл мочи в 1 ч), гипоксией и метаболическим ацидозом. Одновременно происходит «централизация» кровообращения, при которой за счет компенсаторных механизмов, в первую очередь за счет периферической вазоконстрикции и спазма артериол в поперечно-полосатой мускулатуре, кишечнике, селезенке, печени и др., поддерживается кровообращение только в жизненно важных органах (в головном мозге, сердце и легких). Если централизация кровообращения оказывается не в состоянии обеспечить адекватную перфузию жизненно важных органов и стабилизацию АД, то длительная периферическая вазоконстрикция приводит к нарушению микроциркуляции, возникновению ДВС-синдрома, развитию ишемических некрозов в почках, кишечнике, печени, других органах. В итоге развивается полиорганная недостаточность, приводящая к смерти больного.
В зависимости от клинической картины и тяжести, ОСН у больных ИМ подразделяется на четыре класса (классификация Killip).
• I класс: умеренная одышка, синусовая тахикардия при отсутствии застойных хрипов в легких.
• II класс: влажные незвонкие мелкопузырчатые хрипы в нижних отделах легких не выше лопаток, захватывающие <50% поверхности легких (интерстициальный отек легких).
• III класс: влажные незвонкие мелкопузырчатые хрипы, захватывающие более 50% поверхности легких (альвеолярный отек легких).
• IV класс: кардиогенный шок.
Для лечения ОСН I-II класса по Killip используют:
• ингаляцию кислорода через лицевую маску либо через носовые катетеры под контролем насыщения крови кислородом;
• внутривенное введение петлевых диуретиков (фуросемид) в дозе 20-40 мг с интервалом 1-4 ч в зависимости от необходимости;
• внутривенную инфузию нитратов (нитроглицерин, изосорбида динитрат) в начальной дозе 3-5 мг/ч при отсутствии артериальной гипотензии;
• ингибиторы АПФ внутрь при отсутствии артериальной гипотензии, гиповолемии и почечной недостаточности.
Лечение больных с ОСН III класса по Killip преследует следующую цель: добиться снижения давления заклинивания в легочной артерии <20 мм рт.ст. и увеличения сердечного индекса >=2,1 л/мин в 1 м2, что осуществляют следующим образом:
• оксигенотерапия, мониторирование насыщения крови кислородом и величины рН;
• при снижении рО2 ниже 50% - неинвазивная (лицевая маска, CIPAP, BiPAP) либо инвазивная (интубация трахеи) вспомогательная вентиляция легких;
• мониторный контроль показателей центральной гемодинамики с помощью плавающего баллонного катетера Swan-Ganz;
• внутривенное введение петлевых диуретиков (фуросемид) в дозе 60-80 мг и больше с интервалом 1-4 ч в зависимости от диуреза;
• наркотические анальгетики: внутривенно морфин (морфина гидрохлорид*) 1% по 1,0 мл на 20,0 мл изотонического раствора натрия хлорида;
• при отсутствии артериальной гипотензии (АД >100 мм рт.ст.) внутривенная инфузия периферических вазодилататоров (нитроглицерина либо изосорбида динитрата в стартовой дозе 3-5 мг/ч с последующей коррекцией) под контролем АД и показателей центральной гемодинамики;
• при наличии артериальной гипотензии (АД =<90ммрт.ст.)внутривенная инфузия инотропных препаратов - добутамина, допамина (начальная доза 2,5 мкг/кг в 1 мин с последующей коррекцией) под контролем АД и показателей центральной гемодинамики;
• скорейшая реваскуляризация миокарда (ЧКВ или коронарное шунтирование).
Лечение больных с ОСН IV класса по Killip преследует такую же цель, как и у больных с ОСН III класса по Killip, что осуществляется следующим образом:
• оксигенотерапия, мониторирование насыщения крови кислородом и величины рН;
• при снижении рО2 ниже 50% - неинвазивная (лицевая маска, CIPAP, BiPAP ) либо инвазивная (интубация трахеи) вспомогательная вентиляция легких;
• мониторный контроль показателей центральной гемодинамики с помощью плавающего баллонного катетера Swan-Ganz;
• внутривенная инфузия инотропных препаратов - добутамина, допамина (начальная доза 2,5 мкг/кг в 1 мин с последующей коррекцией) под контролем АД и показателей центральной гемодинамики;
• внутриаортальная баллонная контрпульсация;
• скорейшая реваскуляризация миокарда (ЧКВ или коронарное шунтирование).
Внутриаортальная баллонная контрпульсация - один из методов вспомогательного кровообращения. Суть его заключается в том, что в нисходящую часть аорты (от уровня отхождения левой подключичной вены до уровня отхождения почечных артерий) пункционным способом через бедренную артерию вводят специальный баллонный катетер, который соединяют со специальным насосом, который синхронно с деятельностью сердца раздувает и сдувает баллонный катетер. В период диастолы баллонный катетер раздувается и перекрывает нисходящую аорту. За счет этого значительно повышается диастолическое давление в восходящей части аорты и в синусах Вальсальвы, что приводит к возрастанию коронарного кровотока, который осуществляется в основном в диастолу. Во время систолы баллонный катетер быстро сдувается, что приводит к уменьшению давления в нисходящей аорте и снижению сопротивления выбросу крови из левого желудочка. Одновременно снижается и потребность миокарда в кислороде. С помощью внутриаортальной баллонной контрпульсации у части больных с кардиогенным шоком удается улучшить гемодинамику, выиграть время и подготовить больного для проведения реваскуляризации миокарда.
Дополнительно из лекарственных препаратов в лечении кардиогенного шока применяют внутривенное введение растворов декстрана (полиглюкина*, реополиглюкина*) (либо других декстранов) и глюкокортикоидов, коррегируют кислотно-основной и электролитный баланс. Однако они влияют на вторичные механизмы патогенеза и не могут ликвидировать шок до тех пор, пока не решена основная задача - восстановление насосной функции сердца.
Механические осложнения (разрывы миокарда и митральная регургитация)
Острый разрыв свободной стенки левого желудочка проявляется внезапно развившимся коллапсом в сочетании с электромеханической диссоциацией, при которой электрическая активность сердца присутствует, а механическая - отсутствует (АД и пульс не определяются). Это осложнение обычно заканчивается смертью в течение нескольких минут и не поддается реанимационным мероприятиям. Крайне редко удается выполнить кардиохирургическое вмешательство .
Подострый разрыв свободной стенки левого желудочка - сам дефект миокарда прикрыт тромбом либо прилежащими тканями; это примерно в 25% дает время для выполнения кардиохирургического вмешательства. Клинически подострый разрыв свободной стенки протекает как рецидив ИМ и сопровождается ангинозными болями, подъемом сегмента ST на ЭКГ, тяжелыми расстройствами гемодинамики в виде выраженной артериальной гипотензии. Ключевым моментом диагностики данного осложнения служит выявление признаков тампонады сердца (что осуществляют с помощью УЗИ).
Разрыв межжелудочковой перегородки проявляется внезапным ухудшением состояния больного, нередко развитием острой левожелудочковой недостаточности в виде кардиогенного шока, появлением грубого систолического шума и данными ультразвукового допплеровского исследования сердца, показывающими наличие, локализацию и размер дефекта межжелудочковой перегородки. Единственный способ спасения больного - хирургическое закрытие дефекта межжелудочковой перегородки, сроки выполнения которого зависят от размера дефекта и тяжести состояния больного.
Митральная регургитация чаще всего развивается на 2-7 день ИМ. Она может быть обусловлена растяжением кольца митрального клапана вследствие расширения и дисфункции левого желудочка либо дисфункцией папиллярной мышцы вследствие ее некроза или отрыва. Остро возникшая митральная регургитация клинически проявляется резким ухудшением состояния больного, развитием острой левожелудочковой недостаточности в виде отека легких, появлением систолического шума на верхушке сердца, проводящегося в левую подмышечную область. При трансторакальной, чреспищеводной и допплеровской ЭхоКГ определяют признаки дисфункции митрального клапана и выраженной митральной регургитации. Обычно больным с ИМ, осложнившимся остро возникшей митральной регургитацией, требуется хирургическое лечение (протезирование митрального клапана либо аннулопластика), сроки выполнения которого зависят от клинического состояния больного.
Нарушения ритма и проводимости (см. раздел учебника «Нарушения ритма и проводимости сердца»). Лечение нарушений ритма и проводимости определяется видом этих нарушений и их влиянием на гемодинамику. Для их устранения могут использоваться различные антиаритмические препараты, ЭИТ (кардиоверсия или дефибрилляция), электрическая стимуляция сердца.
Желудочковая экстрасистолия в остром периоде ИМ специальной антиаритмической терапии (за исключением р-адреноблокаторов) не требует.
Применение лидокаина и других антиаритмических препаратов с целью первичной профилактики развития фибрилляции желудочков не показано.
Для купирования эпизодов желудочковой тахикардии, не сопровождающихся тяжелыми расстройствами гемодинамики, вводят лидокаин в дозе 100-150 мг внутривенно струйно. При приступах желудочковой тахикардии, сопровождающихся резким снижением АД, а также при неэффективности лидокаина, проводят экстренную электрическую кардиоверсию разрядом мощностью 200-300 Дж.
При возникновении фибрилляции желудочков проводят экстренную электрическую дефибрилляцию сердца разрядом 300-360 Дж. Электрическая дефибрилляция - единственный эффективный метод лечения фибрилляции желудочков сердца.
При рецидивировании приступов желудочковой тахикардии или фибрилляции желудочков начинают терапию амиодароном (кордароном*) в суточной дозе 600-800 мг (300-400 мг внутрь и 300-400 мг внутривенно капельно).
Для устранения устойчивой наджелудочковой ПТ внутривенно болюсно вводят аденозинтрифосфат (АТФ*) в дозе 3-5 мл либо внутривенно медленно 10 мг верапамила (изоптина*) в течение 5-10 мин (во избежание падения АД).
При мерцательной аритмии у больных ИМ, за исключением тех случаев, когда мерцание предсердий создает угрозу жизни (в таких случаях сразу проводят ЭИТ), лечение рекомендуется начинать с введения р-адреноблокаторов либо верапамила. Если лекарственные средства неэффективны, то при наджелудочковой и желудочковой тахикардии, а также при трепетании и мерцании предсердий проводят ЭИТ.
Внутрижелудочковые тромбы и системные тромбоэмболии. Образование тромбов в левом желудочке чаще всего бывает у больных обширным
передним ИМ. Обычно это осложнение легко выявляется с помощью ультразвукового исследования сердца. При наличии подвижных тромбов в левом желудочке рекомендуется терапия НМГ с последующим переходом на оральные антикоагулянты (варфарин), длительность приема которых составляет от 3 до 6 мес. При возникновении тромбоэмболии крупных периферических сосудов лечение осуществляют как с помощью лекарственных препаратов, так и хирургическим путем.
Перикардит может осложнить течение трансмурального ИМ. Клинически он проявляется возникновением боли в области сердца, что может симулировать рецидив ИМ. Однако, в отличие от ангинозного характера боли при ИМ, боль при перикардите является острой, она связана с положением тела и дыханием. Диагноз перикардита подтверждается появлением характерного шума трения перикарда. При возникновении перикардита необходимо отменить антикоагулянтную терапию (за исключением случаев, когда их применение абсолютно необходимо) и назначить НПВС (диклофенак, ибупрофен, мелоксикам).
В дальнейшем продолжают терапию ацетилсалициловой кислотой, подобранными индивидуально р-адреноблокаторами, ингибиторами АПФ, статинами, при необходимости - пролонгированными нитратами (изосорбида мононитрат или изосорбида динитрат).
Симптоматическое лечение седативными, снотворными, слабительными средствами проводится по показаниям; дозы препаратов подбирают индивидуально.
В комплексном лечении больных ИМ важно проведение восстановительной терапии - реабилитации больных (ЛФК, гимнастика), как физической, так и психологической. Реабилитационные мероприятия в дальнейшем проводят в санаторно-курортных условиях или в специализированных реабилитационных отделениях.
Прогноз
Прогноз заболевания серьезный, возможно развитие повторного ИМ. С развитием осложнений (при сохранении АГ, хронической сердечной недостаточности) прогноз ухудшается.
Профилактика
Устраняют так называемые факторы риска ИБС, особенно у лиц, в семьях которых есть случаи раннего атеросклероза.
Немедикаментозная и медикаментозная терапия по существу представляют собой вторичную профилактику ОИМ. Рекомендовано категорическое запрещение курения, соблюдение диеты с низким содержанием насыщенных жиров, обогащенной фруктами и овощами. Вторичная профилактика ОИМ заключается в постоянном приеме антиангинальных препаратов, при измененном липидном спектре - гиполипидемических препаратов, при наличии ГБ - антигипертензивных препаратов.
СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Сердечная недостаточность - синдром, выражающийся в неспособности сердечно-сосудистой системы полноценно обеспечивать органы и ткани организма кровью и кислородом в количестве, достаточном для поддержания нормальной жизнедеятельности. В основе сердечной недостаточности лежат нарушение насосной функции одного или обоих желудочков, а также активация нейрогормональных систем организма, и в первую очередь симпатической системы. Это обусловливает высокий риск развития жизнеугрожающих аритмий (в 5 раз больше, чем у пациентов без сердечной недостаточности).
Различают острую и хроническую сердечную недостаточность. Хроническая сердечная недостаточность - финал заболеваний сердечно-сосудистой системы. Смертность пациентов с ее начальными стадиями достигает 10% в год, тогда как у больных с тяжелыми формами заболевания - 40-65%.
Этиология
Хроническая сердечная недостаточность развивается при самых разнообразных заболеваниях, сопровождающихся поражением сердца и нарушением его насосной функции. Причины последнего весьма разнообразны.
• Поражение мышцы сердца, миокардиальная недостаточность:
- первичная (миокардиты, дилатационные кардиомиопатии);
- вторичная (атеросклеротический и постинфарктный кардиосклероз, гипоили гипертиреоз, поражение сердца при диффузных заболеваниях соединительной ткани, токсико-аллергические поражения миокарда).
• Гемодинамическая перегрузка сердечной мышцы:
- давлением (стеноз митрального или трикуспидального отверстий, устья аорты или легочной артерии, гипертензия малого или большого круга кровообращения);
- объемом (недостаточность клапанов сердца, внутрисердечные шунты);
- комбинированная (сложные пороки сердца, сочетание патологических процессов, приводящих к перегрузке давлением и объемом).
• Нарушение диастолического наполнения желудочков (слипчивый перикардит, гипертрофические и рестриктивные кардиомиопатии, болезни накопления миокарда - амилоидоз, гемохроматоз, гликогеноз).
Патогенез
Основной пусковой механизм хронической сердечной недостаточности - снижение сократительной способности миокарда и связанное с этим падение сердечного выброса. Это, в свою очередь, приводит к ухудшению кровоснабжения органов и тканей и включению ряда компенсаторных механизмов, одним из которых служит гиперактивация симпатико-адреналовой системы. Катехоламины (в основном норадреналин) вызывают сужение артериол и венул, что обусловливает увеличение венозного возврата крови к сердцу, возрастание диастолического наполнения пораженного левого желудочка и выравнивание
до нормы сниженного сердечного выброса. Активация симпатико-адреналовой системы, первоначально будучи компенсаторной, в дальнейшем становится одним из факторов, обусловливающих прогрессирование патологических изменений в органах сердечно-сосудистой системы и усугубление признаков сердечной недостаточности. Спазм артериол (в частности, почечных) вызывает активацию РААС и гиперпродукцию мощного вазопрессорного фактора - ангиотензина II. Кроме повышения содержания последнего в крови активируются местные тканевые РААС, в частности в миокарде, что обусловливает прогрессирование его гипертрофии. Ангиотензин II также стимулирует усиление образования альдостерона, что, в свою очередь, повышает реабсорбцию натрия, увеличивает осмолярность плазмы крови и в конечном счете способствует активации продукции АДГ (вазопрессина). Повышение содержания АДГ и альдостерона приводит к прогрессирующей задержке в организме натрия и воды, увеличению ОЦК и венозного давления, что также обусловлено констрикцией венул. Происходит дальнейшее увеличение венозного возврата крови к сердцу, в результате чего дилатация левого желудочка усугубляется. Ангиотензин II и альдостерон, действуя местно в миокарде, приводят к изменению структуры пораженного отдела сердца (левого желудочка), т.е. к так называемому ремоделированию. В миокарде происходит дальнейшая гибель миокардиоцитов и развивается фиброз, что еще больше снижает насосную функцию сердца. Снижение сердечного выброса, а точнее, фракции выброса, приводит к увеличению остаточного систолического объема и росту конечного диастолического давления в полости левого желудочка. Дилатация последнего еще больше усиливается. Это явление, согласно механизму Франка-Старлинга, сначала приводит к усилению сократительной функции миокарда и выравниванию сердечного выброса, но по мере прогрессирования дилатации механизм Франка-Старлинга перестает работать, в связи с чем возрастает давление в вышележащих отделах кровеносного русла - сосудах малого круга кровообращения. Развивается гипертензия малого круга кровообращения по типу пассивной легочной гипертензии.
Среди нейрогормональных нарушений при хронической сердечной недостаточности следует отметить увеличение содержания в крови эндотелина - мощного вазоконстрикторного фактора, секретируемого эндотелием.
Наряду с вазопрессорными факторами увеличивается концентрация предсердного натрийуретического пептида, секретируемого сердцем в кровяное русло, что связано с увеличением напряжения стенок предсердий и повышением давления наполнения соответствующих камер сердца. Предсердный натрийуретический пептид расширяет артерии и способствует экскреции соли и воды, но при хронической сердечной недостаточности выраженность вазодилататорного эффекта снижается вследствие вазоконстрикторного действия ангиотензина II и катехоламинов. Именно поэтому потенциально полезное влияние предсердного натрийуретического пептида на функцию почек ослабевает.
В патогенезе хронической сердечной недостаточности придают значение эндотелиальной дисфункции, выражающейся, в частности, в снижении продукции эндотелием оксида азота - мощного вазодилатирующего фактора.
Таким образом, в патогенезе хронической сердечной недостаточности выделяют кардиальный и экстракардиальный (нейрогормональный) механизм,
при этом пусковым фактором, вероятно, служит изменение напряжения стенки левого (правого) желудочка.
Классификация
В настоящее время используют классификацию недостаточности кровообращения, предложенную Н.Д. Стражеско и В.Х. Василенко. В соответствии с ней выделяют три стадии сердечной недостаточности.
• Стадия I (начальная): скрытая недостаточность кровообращения, манифестирующая возникновением одышки, сердцебиения и утомляемости только при физической нагрузке. В покое эти явления исчезают. Гемодинамика в покое не нарушена.
• Стадия II:
- период А - признаки сердечной недостаточности в покое выражены умеренно, толерантность к физической нагрузке снижена, есть нарушения гемодинамики в большом или малом круге кровообращения умеренной степени выраженности;
- период Б - выраженные признаки сердечной недостаточности в покое, тяжелые гемодинамические нарушения и в большом, и в малом круге кровообращения.
• Стадия III (конечная) - дистрофическая стадия с выраженными нарушениями гемодинамики, обмена веществ и необратимыми изменениями в структуре органов и тканей.
Существует также классификация хронической сердечной недостаточности, предложенная Нью-Йоркской кардиологической ассоциацией (NYHA). В соответствии с ней выделяют четыре функциональных класса, основанных на физической работоспособности больных.
• I класс - при заболевании сердца нет ограничения физической активности.
• II класс - заболевание сердца вызывает небольшое ограничение физической активности.
• III класс - заболевание сердца вызывает значительное ограничение физической активности.
• IV класс - выполнение минимальной физической нагрузки вызывает дискомфорт.
Достоинство этой классификации заключается в том, что она допускает возможность перехода больного в процессе лечения из более высокого класса в более низкий, но в ней не учитывают состояние внутренних органов и выраженность нарушений кровообращения в большом круге. О нарушениях в малом круге можно судить лишь косвенно по степени ограничения физической работоспособности.
Наконец, своего рода синтез отечественной и Нью-Йоркской классификации был предложен в 2005 г. Американской ассоциацией сердца и Американской коллегией кардиологов (AHA/ACC). Эта классификация включает четыре стадии: А и В - предпосылки к развитию хронической сердечной недостаточности, но отсутствие клинических признаков, С и D - клиническая картина хронической сердечной недостаточности.
• А - высокий риск развития хронической сердечной недостаточности при отсутствии структурных изменений сердечной мышцы и клинических симптомов недостаточности (пациенты с АГ, атеросклерозом, сахарным диабетом, ожирением, метаболическим синдромом, отягощенным семейным анамнезом в отношении кардиомиопатий и др.).
• B - существование структурных изменений сердечной мышцы при отсутствии клинических симптомов хронической сердечной недостаточности (пациенты с перенесенным ИМ, гипертрофией левого желудочка, бессимптомным течением клапанных пороков сердца и др.).
• С - существование структурных изменений сердечной мышцы в сочетании с симптомами хронической сердечной недостаточности (диагностированное заболевание сердца + одышка, повышенная утомляемость, сниженная толерантность к физическим нагрузкам).
• D - рефрактерная к лечению хроническая сердечная недостаточность (пациенты с выраженными клиническими признаками недостаточности кровообращения в покое, несмотря на проводимое медикаментозное лечение).
Клиническая картина
Симптомы хронической сердечной недостаточности определяются выраженностью нарушений внутрисердечной гемодинамики, изменениями сердца, степенью нарушений циркуляции в малом и большом круге кровообращения, выраженностью застойных явлений в органах и степенью нарушения их функций. Кроме того, для клинической картины хронической сердечной недостаточности характерно существование симптомов заболевания, послужившего причиной развития сердечной недостаточности. Таким образом, клиническая картина зависит от того, снижение сократительной функции какого отдела сердца преобладает - левого, правого желудочка (левожелудочковая или правожелудочковая недостаточность) или их сочетание (тотальная сердечная недостаточность).
На первом этапе диагностического поиска обнаруживают одышку - учащение дыхания, не соответствующее состоянию и условиям, в которых находится больной (возникновение одышки при различной физической нагрузке или в покое). Одышка - четкий критерий нарушения кровообращения в малом круге; ее динамика соответствует состоянию сократительной функции сердца. Больных может беспокоить сухой, с выделением небольшого количества слизистой мокроты или примесью крови (кровохарканье) кашель, также служащий признаком застойных явлений в малом круге. Иногда тяжелая одышка возникает приступообразно. Подобные приступы называют сердечной астмой.
Больные предъявляют жалобы на сердцебиение, возникающее после физической нагрузки, приема пищи и в горизонтальном положении, т.е. при условиях, способствующих усилению работы сердца.
При развитии нарушений сердечного ритма пациенты жалуются на перебои в работе сердца или его нерегулярную работу.
При возникновении застойных явлений в большом круге кровообращения отмечают жалобы на уменьшение выделения мочи (олигурия) или ее
преимущественное выделение ночью (никтурия). Тяжесть в области правого подреберья обусловлена застойными явлениями в печени и ее постепенным увеличением. При быстром увеличении органа возможны достаточно интенсивные боли в правом подреберье. Застойные явления в большом круге кровообращения вызывают нарушения функционирования ЖКТ, что выражается в снижении аппетита, тошноте, рвоте, метеоризме и склонности к запорам.
В связи с нарушением кровообращения изменяется функциональное состояние ЦНС: характерны быстрая умственная утомляемость, повышенная раздражительность, расстройство сна и депрессивное состояние.
У больных также определяют жалобы, обусловленные основным заболеванием, приведшим к развитию хронической сердечной недостаточности.
На втором этапе диагностического поиска прежде всего определяют признаки фонового заболевания, а также симптомы, выраженность которых будет обусловливать стадию недостаточности кровообращения.
Один из первых признаков сердечной недостаточности - цианоз: синюшная окраска слизистых оболочек и кожи, возникающая при повышенном содержании в крови восстановленного гемоглобина (более 50 г/л), который, в отличие от оксигемоглобина, имеет темную окраску. Просвечивая через кожный покров, темная кровь придает ему синюшный оттенок, особенно в областях с тонкой кожей (губы, щеки, уши и кончики пальцев). Переполнение сосудов малого круга при нарушении сократительной функции левого желудочка и изменении оксигенации крови в легких обусловливают возникновение диффузного (центрального) цианоза. Замедление кровотока и усиление утилизации кислорода тканями (причины развития периферического цианоза) отмечают при преобладании явлений правожелудочковой недостаточности.
В обоих случаях цианозу способствуют увеличение ОЦК (компенсаторный фактор) и содержание гемоглобина.
При прогрессировании хронической сердечной недостаточности и усилении застойных явлений в печени нарушаются ее функции и структура, что может обусловить присоединение к цианозу желтушного оттенка.
Важный симптом хронической сердечной недостаточности - отеки. Задержка жидкости сначала может быть скрытой и выражаться лишь в быстром увеличении массы тела больного и уменьшении выделения мочи. Видимые отеки первоначально возникают на стопах и голенях, а затем развивается распространенный отек подкожной жировой клетчатки и водянка полостей: асцит, гидроторакс и гидроперикард.
Во время обследования органов дыхания при длительном застое обнаруживают эмфизему легких и пневмосклероз (снижение подвижности нижнего легочного края, малая экскурсия грудной клетки). Во время аускультации определяют застойные хрипы (преимущественно в нижних отделах, мелкопузырчатые, влажные, незвонкие) и жесткое дыхание.
Независимо от этиологии хронической сердечной недостаточности, возникает ряд симптомов со стороны сердечно-сосудистой системы, обусловленных снижением сократительной функции миокарда. К ним относят увеличение сердца вследствие миогенной дилатации (иногда - весьма значительное, cor bovinum), глухость сердечных тонов (особенно I тона), ритм галопа, тахикар-
дию, систолические шумы относительной недостаточности митрального и (или) трехстворчатого клапана. Систолическое давление снижается, а диастолическое незначительно повышается. В ряде случаев развивается застойная АГ, уменьшающаяся по мере ослабления симптомов хронической сердечной недостаточности. Застой в большом круге кровообращения также манифестирует набуханием яремных вен, что может быть особенно резко выражено в горизонтальном положении больного (вследствие большего притока крови к сердцу).
При обследовании органов пищеварения обнаруживают увеличенную, слегка болезненную печень, которая со временем становится более плотной и безболезненной. Селезенка обычно не увеличивается, но в редких случаях выраженной недостаточности кровообращения отмечают ее незначительное увеличение (нельзя безапелляционно отвергать и другие причины ее увеличения).
По мере прогрессирования хронической сердечной недостаточности регистрируют усиливающееся снижение массы тела больного - развивается так называемая сердечная кахексия, больной как бы «высыхает». Бросается в глаза резкая атрофия мышц конечностей в сочетании со значительно увеличенным животом (асцит). Возникают трофические изменения кожи в виде ее истончения, сухости и образования пигментации на голенях.
Таким образом, после второго этапа формирование и выраженность сердечной недостаточности становятся несомненными.
На третьем этапе диагностического поиска уточняют выраженность гемодинамических нарушений, степень снижения сократительной функции сердца, а также степень поражения и функциональное состояние различных органов и систем организма. Наконец, уточняют диагноз основного заболевания, обусловившего развитие сердечной недостаточности.
Выраженность гемодинамических сдвигов и сократительную функцию сердца определяют с помощью неинвазивных методов исследований, наибольшее распространение из которых получила ЭхоКГ. Этот метод позволяет определить снижение сердечного выброса (признак систолической сердечной недостаточности), конечный систолический и диастолический объем левого желудочка, скорость циркулярного укорочения сердечных мышечных волокон, а также существование регургитации митрального и (или) трикуспидального клапана. С помощью ЭхоКГ также определяют признаки диастолической сердечной недостаточности (нарушение наполнения сердца в период диастолы, что определяют по изменению соотношения скорости начального и конечного диастолического наполнения левого желудочка).
Величину сердечного выброса также можно установить прямым методом при зондировании полостей сердца. Определяют увеличение ОЦК и замедление скорости кровотока. Венозное давление отчетливо повышается при развитии правожелудочковой недостаточности.
При рентгенологическом исследовании уточняют состояние малого круга кровообращения (существование и выраженность признаков легочной гипертензии) и степень увеличения камер сердца. При развитии сердечной недостаточности, независимо от причины, вызвавшей ее, отмечают расширение границ сердца по сравнению с периодом компенсации. Степень увеличения сердца может быть показателем состояния его сократительной функции: чем
больше увеличено сердце, тем больше снижена его сократительная способность.
При ЭКГ каких-либо характерных изменений обнаружить не удается: ЭКГ демонстрирует изменения, типичные для фонового заболевания.
Лабораторные методы определения концентрации ренина, норадреналина, некоторых электролитов (калия и натрия) и альдостерона в крови, а также кислотно-основного состояния позволяют выяснить степень выраженности гормональных и обменных нарушений в каждом конкретном случае. Тем не менее выполнение этих исследований не считают обязательным при диагностике хронической сердечной недостаточности.
Для определения степени поражения внутренних органов и систем и их функционального состояния используют комплекс инструментально-лабораторных исследований.
Осложнения
При длительном течении хронической сердечной недостаточности возможно развитие осложнений, служащих признаком поражения органов и систем в условиях хронического венозного застоя, недостаточности кровоснабжения и гипоксии. К ним относят:
• нарушения электролитного обмена и кислотно-основного состояния;
• тромбозы и эмболии;
• ДВС-синдром;
• нарушения ритма и проводимости;
• кардиальный цирроз печени с возможным развитием печеночной недостаточности (в последние годы в связи с внедрением в клиническую практику рекомендацией по лечению кардиологических больных регистрируют крайне редко).
Диагностика
Диагностика хронической сердечной недостаточности основана на обнаружении ее характерных симптомов при одновременном определении вызвавшей ее причины. Обычно достаточно проведения первых двух этапов диагностического поиска, и лишь для установления ранних (доклинических) стадий хронической сердечной недостаточности приходится прибегать к помощи инструментальных методов исследования (в частности, к ЭхоКГ). В связи с этим, согласно рекомендациям Европейского и Всероссийского общества кардиологов, диагностика сердечной недостаточности на ранней стадии основана на обнаружении двух клинических симптомов (одышки и отеков) и признаков нарушения сократительной функции сердца (по данным ЭхоКГ). В последние годы важным лабораторным диагностическим критерием хронической сердечной недостаточности считают повышение концентрации мозгового натрийуретического пептида.
Формулировка развернутого клинического диагноза должна учитывать:
• основное (фоновое) заболевание;
• стадию хронической сердечной недостаточности;
• функциональный класс хронической сердечной недостаточности;
• осложнения хронической сердечной недостаточности.
Лечение
Назначают комплекс мероприятий, направленных на создание бытовых условий, способствующих снижению нагрузки на сердечно-сосудистую систему, а также лекарственные средства, призванные воздействовать на миокард и различные звенья патогенеза хронической сердечной недостаточности. Объем проводимых мероприятий определяется стадией заболевания.
Существуют следующие пути достижения поставленных целей при лечении хронической сердечной недостаточности:
• соблюдение определенной диеты;
• соблюдение определенного режима физической активности;
• психологическая реабилитация (организация врачебного контроля, школ для больных хронической сердечной недостаточности);
• медикаментозное лечение;
• хирургические, механические и электрофизиологические методы лечения.
Диета для больных хронической сердечной недостаточностью
При I функциональном классе не следует употреблять соленую пищу (до 3 г соли в день). При II функциональном классе рекомендуют не досаливать пищу (не более 1,5 г соли в день). При III-IV функциональном классе необходимо употреблять продукты с уменьшенным содержанием соли и готовить пищу без соли (по 1 г соли в день).
При тяжелом течении хронической сердечной недостаточности, требующем внутривенного введения диуретиков, рекомендовано ограничение потребления жидкости. В обычных ситуациях максимум приема жидкости составляет 1,5 л.
Пища должна содержать достаточное количество белка и быть легко усваиваемой.
Ожирение ухудшает прогноз, и при индексе массы тела более 25 кг/м2 требуются применение специальных мер и ограничение энергетической ценности пищи. В то же время резкое снижение массы тела (индекс менее 19 кг/м2) свидетельствует о критической активации нейрогормональных систем и требует сочетания коррекции нейрогормональных расстройств (см. раздел «Патогенез») и парентерального питания.
Режим физической активности
При хронической сердечной недостаточности I стадии (I функциональный класс) обычная физическая нагрузка не противопоказана. Допустимо выполнение нетяжелой физической работы и занятия физкультурой без значительного напряжения.
При хронической сердечной недостаточности II функционального класса занятия физкультурой и тяжелая физическая работа исключены. Рекомендованы сокращение продолжительности рабочего дня и введение дополнительного дня отдыха.
Больным с хронической сердечной недостаточностью III стадии (особенно при IV функциональном классе заболевания) рекомендован домашний режим,
а при прогрессировании симптомов - полупостельный режим. Очень важен достаточный сон (не менее 8 ч/сут).
При развитии хронической сердечной недостаточности следует исключить употребление алкоголя, крепкого чая и кофе - средств, возбуждающих работу сердца прямым путем и посредством активации симпатико-адреналовой системы.
Психологическая реабилитация
Заключается в обучении больного и его ближайших родственников приемам контроля течения хронической сердечной недостаточности и методам самопомощи. Больной должен иметь возможность регулярно консультироваться со специалистами для своевременной коррекции своего состояния.
Медикаментозное лечение
Цели медикаментозного лечения:
• разгрузка сердца путем воздействия на нейрогормональные механизмы патогенеза хронической сердечной недостаточности и периферические сосуды;
• нормализация водно-солевого обмена;
• повышение сократимости сердца (инотропная стимуляция);
• воздействие на нарушенные процессы метаболизма в миокарде.
В связи с этим все лекарственные средства для лечения хронической сердечной недостаточности можно разделить на две основные группы.
• Основные препараты - ингибиторы АПФ, р-адреноблокаторы,антагонисты рецепторов к альдостерону, антагонисты к рецепторам ангиотензина II (при непереносимости ингибиторов АПФ), диуретики, сердечные гликозиды.
• Вспомогательные средства - их применение диктуют особые клинические ситуации. Их не используют для лечения собственно недостаточности кровообращения. К ним относят:
- блокаторы медленных кальциевых каналов (при стенокардии и стойкой АГ);
- пролонгированные нитраты (при стенокардии);
- антиаритмические средства (в основном III класса при опасных для жизни желудочковых аритмиях);
- ацетилсалициловую кислоту (для вторичной профилактики после перенесенного ИМ);
- непрямые антикоагулянты (при риске развития тромбоэмболических осложнений, особенно у больных с МА, внутрисердечных тромбах, после операций на сердце);
- глюкокортикоиды (симптоматическое средство при упорной гипотензии);
- цитопротекторы (триметазидин) - для улучшения функционирования кардиомиоцитов при недостаточности, развившейся на почве ИБС.
Важное место в лечении занимает разгрузка сердца путем воздействия на нейрогормональные механизмы патогенеза хронической сердечной недостаточности. С этой целью назначают ингибиторы АПФ, которые препятствуют переходу ангиотензина I в ангиотензин II, который обладает мощным вазопрес-
сорным действием и стимулирует образование альдостерона. Кроме того, ингибиторы АПФ уменьшают избыточный синтез норадреналина и вазопрессина. Особенностью этих препаратов считают их воздействие не только на циркулирующие, но и на локальные органные (тканевые) РААС. Комплекс этих влияний определяет широкий спектр клинических эффектов ингибиторов АПФ: снижение пред- (вследствие расширения венозных сосудов) и постнагрузки (в результате снижения периферического сосудистого сопротивления), ЧСС и АД; блокирование ремоделирования левого желудочка и крупных сосудов; уменьшение гипертрофии и дилатации левого желудочка; диуретическое действие; нормализация и предотвращение возникновения электролитных нарушений; антиаритмические эффекты.
Ингибитор АПФ короткого действия каптоприл назначают в дозе 25,0- 50,0 мг/сут, разделенной на 2-4 приема. Ингибитор АПФ пролонгированного действия (действуют в течение 12-24 ч) эналаприл назначают в дозе 10-20 мг/сут в два приема, рамиприл - в меньших дозах (по 2,5-5 мг/сут в 1-2 приема), лизиноприл - в дозе 10-20 мг/сут, периндоприл - в дозе 4-6 мг/сут. Для достижения терапевтического эффекта ингибиторы АПФ следует использовать не менее 2-4 нед. В дальнейшем препараты принимают постоянно. Стартовая доза ингибиторов АПФ обычно составляет 1/4-1/8 максимальной, что позволяет предотвратить развитие так называемого эффекта первой дозы, заключающегося в возникновении гипотензии. Для предупреждения этого явления следует придерживаться определенных правил: не допускать чрезмерного диуреза перед началом лечения ингибиторами АПФ (за 24 ч отменить диуретики) и начинать с приема малых доз вечером, когда больной находится в горизонтальном положении.
При назначении ингибиторов АПФ могут возникать побочные реакции в виде сухого кашля, вызываемого избыточным образованием брадикинина (при назначении препаратов деградации брадикинина не происходит). В этих случаях, а иногда и с самого начала лечения, назначают блокаторы рецепторов к ангиотензину II - лозартан (по 50-100 мг/сут) и валсартан (по 80-160 мг/сут).
р-Адреноблокаторы следует назначать всем больным, не имеющим противопоказаний к их применению, причем эти препараты применяют не изолированно, а обязательно в сочетании с ингибиторами АПФ. Как доказывают многочисленные исследования, р-адреноблокаторы замедляют прогрессирование болезни, число госпитализаций и улучшают прогноз у декомпенсированных больных. Тяжесть декомпенсации не играет самостоятельной роли в определении противопоказаний к назначению препарата. Используют бисопролол (максимальная доза - 10 мг/сут), карведилол (по 50 мг/сут), метопролол сукцинат (по 200 мг/сут) и небиволол (по 5-7,5 мг/сут). Лечение р-адреноблокаторами начинают после стабилизации состояния больного (без признаков выраженных застойных явлений), при этом первоначальная доза составляет 1/8 максимальной. Дозу удваивают не чаще 1 раза в две недели до достижения оптимально переносимой. Противопоказания к назначению р-адреноблокаторов при хронической сердечной недостаточности: плохо контролируемая БА, брадикардия менее 50 в минуту, гипотензия (систолическое АД менее 85 мм рт.ст.), предсердно-желудочковая блокада II степени и более, а также тяжелый облитерирующий эндартериит.
Нормализации водно-солевого обмена достигают назначением мочегонных препаратов. Диуретики не замедляют прогрессирование хронической сердечной недостаточности и не улучшают прогноз, но существенно повышают качество жизни. Существуют разные группы препаратов, применение которых зависит от выраженности заболевания и индивидуальной реакции больного на них.
На I стадии диуретики не назначают. При хронической сердечной недостаточности НА стадии или при II функциональном классе заболевания (при существовании симптомов застоя) применяют тиазидные средства (гидрохлоротиазид, хлорталидон). Начальная доза составляет 25 мг, максимальная - 75-100 мг. Не следует применять массивную диуретическую терапию (так называемый ударный диурез 1 раз в несколько дней). Правильным будет ежедневное назначение умеренных доз диуретиков (превышение диуреза над принятой жидкостью должно составлять 0,5-1,0 л при снижении массы тела на 1 кг/сут). При достижении эффекта переходят на поддерживающее лечение (диурез должен быть сбалансированным, а масса тела - стабильной), т.е. на ежедневный прием меньших доз препарата.
Если такая мочегонная терапия гидрохлоротиазидом (хлорталидоном) недостаточно эффективна, то следует назначать петлевые диуретики - фуросемид (стартовая доза - 20-40 мг, максимальная - до 200 мг) или торасемид (стартовая доза - 5 мг, максимальная - 20 мг).
При хронической сердечной недостаточности ПБ стадии, сопровождающейся выраженным отечным синдромом и трудно поддающейся лечению, следует использовать фуросемид или торасемид в сочетании с антагонистами альдостерона (спиронолактон). Если такая комбинация мочегонных окажется недостаточно эффективной, то следует сочетать фуросемид с гидрохлоротиазидом (или диакарбом) и теми же антагонистами альдостерона.
При рефракторном отечном синдроме решающим фактором может оказаться дополнение лечения осмотическими диуретиками (маннитол), блокирующими реабсорбцию натрия и воды в проксимальной части канальцев нефрона, снижающими сопротивление почечных сосудов и улучшающими почечный кровоток. Увеличивая «загрузку» натрием нижележащих отделов нефрона, они повышают эффективность других диуретиков (прежде всего, фуросемида и торасемида).
Антагонисты альдостерона заняли особое место в лечении хронической сердечной недостаточности после получения результатов крупных исследований, в которых их назначение в небольших дозах (спиронолактон по 25-50 мг/сут) к стандартному лечению приводило к увеличению продолжительности жизни больных. Это можно объяснить нейтрализацией токсического действия повышенной концентрации альдостерона на сердечную мышцу и, в частности, замедлением прогрессирования фиброза в миокарде, ведущего к развитию жизнеугрожающих аритмий.
Механические способы удаления жидкости (плевральная, перикардиальная пункция, парацентез) применяют лишь по жизненным показаниям.
В настоящее время при лечении хронической сердечной недостаточности применяют сердечные гликозиды, хотя в последнее десятилетие отношение к
ним изменилось. Эти препараты не улучшают прогноз у больных и не замедляют прогрессирование болезни, но уменьшают клинические симптомы.
Сердечные гликозиды обычно назначают больным при хронической сердечной недостаточности НА стадии. Выбор оптимального препарата для лечения конкретного больного - важная задача, основанная на ряде принципов.
• Внутривенное назначение гликозидов (строфантин К, дигоксин, ландыша листьев гликозид) должно быть ограничено лишь случаями обострения хронической сердечной недостаточности, когда эффект необходимо получить немедленно. В остальных случаях лечение лучше начинать с приема внутрь дигоксина или дигитоксина.
• При запущенной хронической сердечной недостаточности и выраженных изменениях ЖКТ целесообразно вводить гликозиды внутривенно, так как принятый внутрь препарат плохо всасывается и усиливает диспептические явления. Так как в дальнейшем предстоит перевод больного на прием препарата внутрь, то лечение рекомендуют начинать с внутривенного введения дигоксина.
• При сочетании хронической сердечной недостаточности с МА и трепетанием предсердий (особенно при тахиаритмиях) дигоксин считают препаратом выбора при отсутствии противопоказаний к его применению. После его назначения и получения терапевтического эффекта следует перевести больного на поддерживающие дозы, которые у пожилых пациентов не должны превышать 1/4-1/2 таблетки в день.
Сердечные гликозиды далеко не во всех случаях позволяют добиться желаемого терапевтического эффекта, особенно у больных с тяжелыми поражениями миокарда (пороки сердца, кардиомиопатии, постинфарктный кардиосклероз). Нередко гликозиды вызывают интоксикацию (тошнота, рвота, потеря аппетита, эктопические аритмии). Их нельзя применять при брадикардии и нарушениях проводимости (особенно предсердно-желудочковой).
Прогрессирование хронической сердечной недостаточности сопровождается усугублением различных видов метаболических нарушений в миокарде. В связи с этим целесообразно проводить оксигенотерапию и назначать средства, корректирующие обмен веществ (анаболические стероиды, триметази-
дин).
Хирургические, механические, электрофизиологические методы:
• если хроническая сердечная недостаточность развивается на фоне ИБС, то оправданной считают реваскуляризацию миокарда (аортокоронарное шунтирование), но выполнение подобной операции не рекомендовано тяжелым больным (при фракции выброса менее 35%);
• коррекция митральной недостаточности (трансплантация искусственного митрального клапана может улучшить клиническую картину);
• ресинхронизирующая терапия - установка определенного вида кардиостимулятора (так называемая трехкамерная стимуляция, когда три электрода устанавливают в различных отделах сердца) позволяет устранить асинхронию в работе желудочков и установить оптимальную для каждого больного предсердно-желудочковую задержку, что позволяет сердцу работать в более правильном временном режиме;
• имплантация кардиовертера-дефибриллятора - устройства, самостоятельно распознающего и устраняющего жизнеугрожающие нарушения сердечного ритма методом ЭИТ.
Прогноз
Возможность излечения основного заболевания (например, эффективное хирургическое лечение порока сердца) значительно улучшает прогноз. Больные с хронической сердечной недостаточностью I стадии трудоспособны, но тяжелый физический труд им противопоказан. При НА стадии трудоспособность ограничена или утрачена, при ПБ - утрачена. Больные с хронической сердечной недостаточностью III стадии нуждаются в постоянном уходе.
Профилактика
Предупреждения развития хронической сердечной недостаточности достигают систематическим лечением заболеваний сердца (в том числе хирургическим), а также медикаментозной и немедикаментозной профилактикой развития сердечно-сосудистых осложнений.