Инфекционные болезни и эпидемиология : учебник / Покровский В. И., Пак С. Г., Брико Н. И., Данилкин Б. К. - 3-е изд., испр. и доп. - 2013. - 1008 с. : ил.
|
|
|
|
Глава 4. Зоонозы
Зоонозы - это инфекции, общие для человека и животных в естественных условиях (ВОЗ, 1991). В отечественной медицинской литературе зоонозами принято считать большую группу инфекционных и инвазивных болезней человека (более 190 нозологических форм), при которых резервуаром и источником инфекции служат различные виды домашних, синантропных и диких млекопитающих и птиц. Именно они обеспечивают существование возбудителя как биологического вида. Организм человека служит для возбудителей зоонозов неспецифическим хозяином, заражение его происходит эпизодически и, как правило, человек становится для них биологическим тупиком. Иногда человек становится источником инфекции, но никогда не служит резервуаром возбудителей зоонозов. Серия инфекционных заболеваний людей заканчивается гибелью возбудителя при самопроизвольном затухании эпидемического процесса.
По этиологии зоонозы разделяют на следующие инфекции:
- бактериальные (бруцеллез, чума, туляремия, кампилобактериоз, лептоспироз, сальмонеллез, сибирская язва, риккетсиозы, хламидиозы, боррелиозы);
- вирусные (геморрагические лихорадки, бешенство);
- прионные (скрепи, губчатая энцефалопатия).
В эпидемиологических целях целесообразно подразделять зоонозы по способности возбудителей циркулировать среди домашних, а также синантропных (бруцеллез, ящур, ку-лихорадка, орнитоз, содоку, трихофития и др.) и диких (туляремия, клещевые риккетсиозы, клещевые боррелиозы, арбовирусные инфекции, обезьянья оспа, бешенство, лихорадка Ласса и др.) животных. Заболевания, резервуаром возбудителя которых становятся дикие животные, называют природно-очаговыми. Очаги заболеваний, связанные с домашними животными или синантропными грызунами, называют антропургическими. Абсолютной грани между природными и антропургическими очагами нет. Так, при заражении домашних животных отдельными арбовирусами создаются временные антропургические очаги природно-очаговых болезней. Антропургические очаги туляремии возникают при миграции зараженных грызунов из мест обитания в населенные пункты, где они контактируют с синантропными грызунами. Возбудитель бруцеллеза может передаваться от сельскохозяйственных животных диким грызунам. При этом создается временный природный очаг бруцеллеза. В современных условиях не только обнаруживают новые природные очаги зоонозных болезней, но и отмечают трансформацию известных очагов при изменяющихся условиях организации хозяйства и образа жизни людей. По механизму передачи зоонозы могут быть классифицированы только при их распространении среди животных. По существу, эпидемический процесс при зоонозах - это механизм заражения людей, оказавшихся в сфере циркуляции возбудителя этих болезней.
У возбудителей зоонозов тропность к отдельным органам и тканям выражена слабее, чем у возбудителей антропонозов, что определяет их политропность и полипатогенность. Это свойство обеспечивает непрерывность циркуляции возбудителя в природе. При этом роль различных животных как резервуаров инфекции неодинакова - выделяют основных и второстепенных хозяев. Наиболее часто возбудитель зоонозов локализуется в крови у животных. По этому принципу выделяют облигатно-трансмиссивные болезни, при которых передача возбудителя осуществляется только через кровососущих переносчиков, и факультативно-трансмиссивные зоонозы. Последние отличает выделение возбудителя также с околоплодной жидкостью и молоком самок.
Нередко отмечают локализацию возбудителей в ЖКТ и на наружных покровах (нетрансмиссивные зоонозы). Возможна и трансовариальная передача возбудителя (у клещей). Заражение людей возбудителями факультативно-трансмиссивных и нетрансмиссивных зоонозов чаще всего происходит при участии самых различных факторов передачи. С фекально-оральным (урино-оральным) механизмом связано заболевание лептоспирозом (через воду), сальмонеллезами, трихинеллезом, сибирской язвой и ботулизмом (с мясом инфицированного при жизни животного), бруцеллезом (с молоком) и др.
Воздушный (аспирационный, ингаляционный) механизм передачи возбудителей характерен лишь для ограниченного количества возбудителей зоонозных инфекций (пситтакоз, орнитоз, чума, пневмоцистоз, кокцидиоидомикоз).
Следует иметь в виду реальную возможность передачи ряда возбудителей, отличающихся повышенной устойчивостью во внешней среде, пылевым путем (туляремия, сибирская язва, ку-лихорадка). Контактный (чрескожный) механизм передачи свойствен бешенству, содоку, столбняку, ящуру, сапу, лейшманиозу и др.
Интенсивность и характер связи людей с эпизоотическими очагами определяют те или иные элементы социальных условий. С социальными и природными условиями связана активность механизма передачи возбудителей среди домашних животных и синантропных грызунов. Например, туляремия в зависимости от бытовой и производственной деятельности человека может оказаться как инфекцией наружных покровов (промысловые вспышки), так и инфекцией дыхательных путей (воздушно-пылевой механизм передачи при обмолотах зерна) или трансмиссивной инфекцией (заражение при укусе человека комарами или клещами). Эпидемический процесс зоонозов носит зависимый характер. Его полностью обусловливает эпизоотический процесс. Для ряда зоонозов (в основном с трансмиссивным механизмом передачи) характерна эндемичность, т.е. распространенность в определенных географических районах, где постоянно обитают специфические переносчики или животные - хранители инфекции в природе. Подъем заболеваемости совпадает с периодом их максимальной биологической активности. Риск заражения многими зоонозами имеет выраженную социальную, бытовую, профессиональную и иную специфику. Заболеваемость сельского населения обычно выше, чем городского. В последние годы под влиянием хозяйственной деятельности человека, изменившихся социальных и экономических условий произошла трансформация эпидемиологических проявлений ряда зоонозных инфекций. Сегодня в городских условиях сложились вполне приемлемые условия для возникновения, распространения и даже укоренения неко-
торых инфекций, общих для человека и животных (бешенство, лептоспироз, эхинококкоз, токсоплазмоз, орнитоз, туляремия и др.). Заражение человека происходит разными путями:
- через укусы и травмы;
- пищевые продукты;
- объекты внешней среды, загрязненные выделениями животных;
- кровососущих переносчиков либо аэрозольно.
В РФ эпидемиологическая и эпизоотологическая обстановка по зоонозам остается напряженной. Ежегодно в стране регистрируют до 30 000 заболеваний ГЛПС, клещевым энцефалитом, клещевым боррелиозом, туляремией и другими природно-очаговыми болезнями. Несмотря на то что многие природноочаговые инфекции отличает ограниченная распространенность, значимость их определяется тяжестью клинического течения и высокой летальностью (в среднем от 3 до 35%, а при бешенстве - 100%), а также большие затраты на лечение и проведение противоэпидемических мероприятий. Только на проведение медицинских и противоэпидемических мероприятий в 1999 г. они составили около 2 млн рублей.
В сложившихся социально-экономических условиях особенности борьбы с заболеваниями, общими для человека и животных, в значительной степени связаны с развитием частного сектора в животноводстве, бесконтрольной миграцией скота, в том числе из неблагополучных регионов. Это затрудняет учет и проведение вакцинопрофилактики животных, создает трудности в осуществлении государственного ветеринарного и санитарно-эпидемиологического надзора. Исключительная стойкость и циклическое возрастание активности обусловливают периодические резкие подъемы заболеваемости. Увеличение масштабов и интенсивности освоения территорий, где располагаются активно действующие природные очаги, приводит к широкому распространению этих заболеваний среди населения.
Профилактика зоонозов в первую очередь основана на своевременном выявлении опасности заражения людей той или иной инфекцией. Эпизоотологические и эпидемиологические особенности инфекции, эффективные средства профилактики и возможности их применения определяют выбор основных мероприятий. В одних случаях это могут быть режимно-ограничительные мероприятия, в других - ветеринарно-санитарные, дератизационные, дезинсекционные, санитарно-противоэпидемические (профилактические), прививочные мероприятия и экстренная профилактика, а также их сочетания. Проблема профилактики зоонозных инфекций - проблема не одной, а нескольких служб и ведомств, прежде всего служб санитарно-эпидемиологического и ветеринарного надзора. Для ее решения необходима общая стратегия.
Основные принципы эпизоотолого-эпидемиологического надзора:
- комплексный (медико-санитарный) подход к организации надзора;
- учет эпизоотологической и эпидемиологической специфики каждой нозологической формы, взятой под наблюдение;
- учет краевых особенностей жизни населения и территории, на которой осуществляют надзор;
- системный и динамичный сбор, анализ и оценка как эпизоотологической, так и эпидемиологической информации;
- постоянный оперативный обмен информацией между медицинской, ветеринарной и другими заинтересованными службами.
Надзор за отдельными зоонозами осуществляют на основании специально разработанной программы для конкретной инфекции на данной территории и в данный период времени, которая должна включать контроль над всеми уровнями эпидемического процесса.
• Отслеживание молекулярно-генетической характеристики циркулирующих штаммов паразита, переносчиков и их изменчивости, а также генетических детерминант иммунного статуса населения.
• Наблюдение за динамикой биологических свойств возбудителя контролируемой инфекции (изменением его вирулентности, токсигенности, ферментативной активности, фаго- и серотиповой характеристики, лекарственной устойчивости, устойчивости в окружающей среде и т.п.).
• Характеристика преобладающих клинических форм, тяжести и исходов заболеваний людей.
• Наблюдение за популяциями возбудителя, его переносчиков и хозяев - структурой популяции паразита, иммунологической структурой населения, обилием и биологической характеристикой популяций членистоногих переносчиков, обсемененностью возбудителем абиотических объектов окружающей среды, динамикой эпизоотического процесса, состоянием природных факторов (метеорологических, водных, почвенных и др.).
• Социологический и санитарно-гигиенический мониторинг, включающий:
◊ слежение за уровнем и тенденцией динамики заболеваемости, летальности и смертности во времени (по годам и месяцам), их территориальным распределением и заболеваемостью отдельных групп населения (городского и сельского, различных возрастных и профессиональных групп);
◊ слежение за динамикой эпидемиологически значимых социальных процессов (естественные демографические сдвиги и миграция населения, направление и характер хозяйственной деятельности, коммунальнобытовые и санитарно-гигиенические условия, организация снабжения пищевыми продуктами, уровень медицинского обслуживания).
САЛЬМОНЕЛЛЕЗ
(SALMONELLESIS)
Сальмонеллез - острая зооантропонозная кишечная инфекция, характеризующаяся поражением органов пищеварения в виде гастрита, гастроэнтерита, энтероколита с развитием синдрома интоксикации и водно-электролитных нарушений, реже - тифоподобным или септикопиемическим течением.
Краткие исторические сведения
Первых представителей рода обнаружил К. Эберт (1880) в пейеровых бляшках, селезенке и лимфатических узлах человека, погибшего от брюшного тифа. Чистую культуру возбудителя заболевания выделил Г. Гаффки (1884). Позднее Д.Е. Сэльмон и Дж. Т. Смит (1885) во время вспышки чумы свиней и А. Гертнер (1888) из говядины и селезенки погибшего человека выделили сходные бактерии. В начале ХХ в. для возбудителей был организован отдельный род в составе семейства Enterobacteriaceae, получивший в честь Сэльмона название Salmonella.
Сальмонеллы представляют собой большую группу бактерий, систематика которых претерпевала значительные изменения по мере совершенствования знаний об их антигенной структуре и биохимических свойствах. В начале 1930-х годов Ф. Кауффманн и П. Уайт предложили разделять сальмонеллы на группы в соответствии с их антигенной структурой; в настоящее время ее применяют для дифференцировки сальмонелл.
Этиология
Возбудители - грамотрицательные подвижные палочки рода Salmonella семейства Enterobacteriaceae.
Несмотря на обилие обнаруживаемых серологических вариантов сальмонелл, основная масса заболеваний сальмонеллезами и случаев носительства у людей обусловлена относительно небольшим числом сероваров (10-12).
Последняя классификация сальмонелл (1992) выделяет 2 вида:
- S. enterica;
- S. bongori.
В свою очередь виды подразделяют на 7 подвидов (подродов), обозначаемых номерами или собственными именами:
- S. enterica (I);
- S. salamae (II);
- S. arizonae (IIIа);
- S. diarizonae (IIIb);
- S. houtenae (IV);
- S. indica (V);
- S. bongori (VI).
Основные возбудители сальмонеллезов входят в состав I и II подродов. Деление на подвиды имеет определенное эпидемиологическое значение, так как естественным резервуаром сальмонелл I подвида служат теплокровные животные, а для представителей остальных подвидов - холоднокровные животные и окружающая среда.
Бактерии растут на обычных питательных средах, обладают сложной антигенной структурой:
- соматический термостабильный О-Аг;
- жгутиковый термолабильный Н-Аг. У многих представителей выявляют:
- поверхностный Vi-Аг;
- капсульный К-Аг;
- слизистый М-Аг.
Некоторые серотипы поддаются фаготипированию. Сальмонеллы способны продуцировать энтеротоксин (экзотоксин) и липополисахарадный комплекс (эндотоксин). Большинство сальмонелл патогенно как для человека, так и для животных и птиц, но в эпидемиологическом отношении наиболее значимы для человека лишь несколько из них. S. typhimurium, S. enteritidis, S.panama, S. infantis, S. newport, S. agona, S. derby, S. london и некоторые другие вызывают 85-91% случаев сальмонеллезов. При этом на долю первых двух приходится 75% всех изолятов, выделяемых в настоящее время от больных людей.
Сальмонеллы длительно сохраняются во внешней среде:
- в воде - до 5 мес;
- в мясе - около 6 мес (в тушках птиц более 1 года);
- в молоке - до 20 дней;
- в кефире - до 1 мес;
- в сливочном масле - до 4 мес;
- в сырах - до 1 года;
- в яичном порошке - от 3 до 9 мес;
- на яичной скорлупе - от 17 до 24 дней;
- в пиве - до 2 мес;
- в почве - до 18 мес.
Экспериментально установлено, что при длительном (свыше 1 мес) хранении куриных яиц в холодильнике S. enterica может проникать внутрь яиц через неповрежденную скорлупу и размножаться в желтке. При 70 °С они погибают в течение 5-10 мин, в толще куска мяса выдерживают кипячение в течение некоторого времени, в процессе варки яиц сохраняют жизнеспособность в белке и желтке в течение 4 мин. В некоторых продуктах (молоко, мясные изделия) сальмонеллы способны не только сохраняться, но и размножаться, не изменяя внешнего вида и вкуса продуктов. Соление и копчение оказывают на них очень слабое влияние, а замораживание даже увеличивает сроки выживания микроорганизмов в продуктах питания. Известны так называемые резидентные (госпитальные) штаммы сальмонелл, отличающиеся множественной устойчивостью к антибиотикам и дезинфектантам.
Эпидемиология
Резервуар и источники инфекции - многие виды сельскохозяйственных и диких животных и птиц. У них болезнь может протекать в виде выраженных форм, а также бессимптомного носительства. Важнейшим источником инфекции при сальмонеллезах служит крупный рогатый скот, а также свиньи, инфицированность которых может достигать 50%. Животные-носители наиболее опасны для людей. У здоровых животных сальмонеллы не вызывают заболевания, при ослаблении же организма сальмонеллы проникают из кишечника в ткани и органы, вследствие чего у них возникают септические заболевания. Заражение человека происходит при уходе за животными, вынужденном забое их на мясокомбинатах и употреблении прижизненно или посмертно инфицированного мяса, а также молока и молочных продуктов. Носительство сальмонелл отмечено у кошек и собак (10%), а также среди синантропных грызунов (до 40%). Сальмонеллез широко распространен среди диких птиц (голуби, скворцы, воробьи, чайки и др.). При этом птицы могут загрязнять пометом и тем самым контаминировать предметы внешней обстановки и пищевые продукты. В последние 30 лет в большинстве стран мира отмечается резкое увеличение числа положительных находок сальмонелл у сельскохозяйственных птиц и в первую очередь кур.
Человек может быть источником некоторых видов сальмонелл (S. typhimurium и S. haifa), особенно в условиях стационаров. Наибольшую опасность человек (больной или носитель) представляет для детей первого года жизни, отличающихся особой восприимчивостью к сальмонеллам. Длительность заразного периода у больных определяет срок и характер болезни. Он может продолжаться у животных месяцами, а у человека - от нескольких дней до 3 нед. Реконвалесцентное носительство у людей иногда может длиться до 1 года.
Механизм передачи - фекально-оральный, основной путь передачи - пищевой, главным образом через продукты животного происхождения. Наиболее значимы мясные блюда, приготовленные из фарша, и мясные салаты, меньшее значение имеют рыбные и растительные продукты. Водный путь передачи играет роль в заражении животных в животноводческих комплексах и на птицефабриках. Контактно-бытовой путь передачи (через зараженные предметы обихода, полотенца, игрушки, горшки, пеленальные столики, манежи, руки медицинского персонала и матерей) играет наибольшую роль в стационарах, особенно в родильных, педиатрических и гериатрических отделениях. Факторами передачи могут оказаться медицинский инструментарий, оборудование (катетеры, эндоскопы и др.) при нарушении режима их стерилизации.
Показана возможность воздушно-пылевого пути распространения сальмонелл в городских условиях при участии диких птиц, загрязняющих своим пометом места обитания и кормления.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, зависит от совокупности многих известных и неизвестных факторов, определяющих исход встречи человека с возбудителем:
- дозы возбудителя;
- его антигенной структуры;
- особенностей биологических свойств;
- индивидуальных особенностей человека;
- его иммунного статуса и др.
Наиболее чувствительны к сальмонеллам дети в первые месяцы жизни (особенно недоношенные), люди преклонного возраста и лица с неблагоприятным преморбидным фоном. Постинфекционный иммунитет носит видо- и типоспецифический характер и сохраняется менее 1 года.
Основные эпидемиологические признаки
Сальмонеллез относят к числу повсеместно распространенных (убиквитарных) инфекций. В последние годы отмечают тенденцию к дальнейшему росту заболеваемости. В отличие от большинства кишечных инфекций сальмонеллезы наиболее широко распространены в крупных благоустроенных городах, в странах, характеризующихся высоким уровнем экономического развития, что позволяет отнести их к группе болезней цивилизации.
Увеличение распространения сальмонеллезов в глобальном масштабе связано с рядом причин, основные из которых:
- интенсификация животноводства на промышленной основе;
- централизация производства пищевых продуктов и изменившиеся способы их реализации;
- увеличение выпуска полуфабрикатов;
- процессы урбанизации;
- активизация миграционных процессов;
- расширение экспорта и импорта пищевых продуктов и кормов;
- интенсивное загрязнение окружающей среды и др. Заболеваемость сальмонеллезом в РФ также имеет тенденцию к дальнейшему увеличению. В 2007 г. показатель заболеваемости - 35,6 на 100 000 населе-
ния (в 2006 г. - 31,9), в том числе у детей до 17 лет - 86,8 на 100 000 населения (в 2006 г. - 73,3). В ряде регионов страны заболеваемость сальмонеллезом в 1,5-3 раза превышает общефедеральные показатели. Высоким остается уровень заболеваемости в Удмуртской Республике, Иркутской области, Красноярском крае, Ханты-Мансийском автономном округе, Еврейской автономной области - от 63 до 123 на 100 000 населения. В 2007 г. заболеваемость сальмонеллезом у детей до 17 лет превысила заболеваемость взрослых в 2,4 раза. Основной удельный вес среди заболевших детей составляют дети от 1 до 2 лет - 28,4%, показатель на 100 000 данной возрастной группы - 231,2. В этиологической структуре сальмонеллеза, как и в предыдущие годы, преобладают сальмонеллы группы D (86%) и прежде всего - сальмонелла энтеритидис.
Основным путем передачи инфекции по-прежнему остается пищевой, преобладающие факторы передачи:
- мясо кур;
- яйцепродукты.
Сальмонеллезы регистрируют в виде эпидемических вспышек и спорадических случаев. Довольно часто даже при тщательном эпидемиологическом расследовании вспышки остаются нерасшифрованными. Их выявление затруднено в крупных городах вследствие сильно развитой инфраструктуры, интенсивной внутригородской миграции населения, широкой сети магазинов и предприятий общественного питания.
Ежегодно в стране регистрируют до 30 крупных вспышек сальмонеллеза пищевого характера с числом пострадавших от 500 до 1500 человек, к причинам которых относят:
- нарушения технологического процесса приготовления блюд;
- правил и сроков хранения продукции;
- мытья и обработки кухонного оборудования и инвентаря;
- несоблюдения требований по содержанию функциональных помещений.
Проявления эпидемического процесса при сальмонеллезах во многом определяет серовар вызвавшего его возбудителя. В последние годы отмечают значительный рост заболеваемости, связанной с распространением бактерий (S. enteritidis) через мясо птицы и яйца, а также продуктов, приготовленных из них. В г. Москве, например, уже в течение длительного времени также наблюдают доминирование S. enteritidis - на ее долю приходится 85-90%. При заносе бактерий в крупные птицеводческие хозяйства они быстро инфицируют часть поголовья за счет способности к трансовариальной передаче. Распространение сальмонеллеза среди кур может происходить за счет вертикального, фекально-орального и аэрозольного (аспирационного) механизмов передачи возбудителя. Контаминация сальмонеллами куриных яиц может происходить эндогенным (трансовариальным) и экзогенным (через поврежденную и неповрежденную скорлупу) путями.
Среди заболевших людей преобладают взрослые (60-70%), хотя самый высокий интенсивный показатель заболеваемости отмечен среди детей раннего возраста. Высокая чувствительность детей раннего возраста к небольшим дозам возбудителя предопределяет возможность передачи его среди них не только пищевым, но и так называемым бытовым путем. Вспышки носят, как правило, взрывной характер. Заболеваемость сальмонеллезами возрастает в теплое время года.
Своеобразной чертой сальмонеллезов стал их антропонозный характер. Чаще всего внутрибольничное распространение сальмонелл связано с контактно-бытовой передачей антибиотикоустойчивых штаммов S. typhimurium или S. haifa. Госпитальные штаммы бактерий отличает множественная устойчивость к антибиотикам и дезинфектантам. Очаги (вспышки) внутрибольничного сальмонеллеза возникают в основном в детских стационарах (соматические и инфекционные больницы, отделения для недоношенных, новорожденных и др.). Вспышки часто отличаются высокой летальностью среди детей раннего возраста и могут продолжаться длительное время.
Патогенез
Сальмонеллы и их токсины, содержащиеся в пищевых продуктах, поступают с пищей в ЖКТ, преодолевают факторы неспецифической защиты ротовой полости и желудка и попадают в просвет тонкой кишки, где происходит адгезия возбудителей к мембранам кишечного эпителия с последующей колонизацией энтероцитов. При дальнейшем продвижении возбудителей по кишечнику с каловыми массами возможна частичная колонизация ими отделов толстой кишки. Адгезированные микроорганизмы выделяют энтеротоксин, активирующий аденилатциклазную систему и выработку циклических нуклеотидов, что служит основной причиной развития секреторной диареи. С помощью факторов проницаемости (гиалуронидазы) возбудители через энтероциты и М-клетки проникают в подслизистый слой кишечной стенки. Взаимодействие бактерий с эпителиальными клетками приводит к дегенеративным изменениям микроворсинок.
Интервенция возбудителей сопровождается частичным разрушением микробных клеток с высвобождением ЛПС-комплекса (эндотоксина). Эндотоксин активирует макрофаги и моноциты, что влечет за собой выброс цитокинов и развитие экссудативного воспаления в слизистой оболочке кишечника. Диарея принимает смешанный секреторно-экссудативный характер.
ЛПС-комплекс (эндотоксин), поступающий в кровоток, играет основную роль в развитии синдрома интоксикации. Под его воздействием происходит активация арахидонового каскада по липооксигеназному и циклооксигеназному путям. Липооксигеназный путь приводит к образованию лейкотриенов, стимулирующих хемотаксис и реакции дегрануляции, усиливающих проницаемость сосудов и, опосредованно, уменьшающих сердечный выброс. Циклооксигеназный путь ведет к образованию простаноидов (тромбоксаны, ПГЕ, ПГF2α и др.). Усиленный синтез простаноидов индуцирует агрегацию тромбоцитов, что влечет за собой тромбообразование в мелких капиллярах. Развивается ДВС-синдром с нарушениями микроциркуляции. Последние обусловливают изменения метаболизма с накоплением кислых продуктов в органах и тканях (метаболический ацидоз). ПГЕ стимулируют секрецию электролитов и жидкости в просвет кишечника, сокращение гладкой мускулатуры и усиление перистальтики, что в конечном счете усугубляет диарею и обезвоживание организма. Следствием дегидратации и интоксикации является нарушение деятельности сердечно-сосудистой системы за счет экстракардиальных механизмов, что проявляется тахикардией и наклонностью к снижению АД. При максимальной выраженности эксикоза возможно развитие клеточной гипергидратации за счет разности осмотических потенциалов между клетками и межклеточным пространством. Клинически состояние проявляется острым
набуханием и отеком мозга. Нарушения микроциркуляции и обезвоживание приводят к дистрофическим процессам в канальцах почек. Развивается ОПН, первым клиническим признаком которой является прогрессирующая олигурия с дальнейшим накоплением азотистых шлаков в крови. Обычно (95-99% случаев) при активном формировании фагоцитарных реакций сальмонеллы не распространяются дальше подслизистого слоя кишечника или регионарных мезентериальных лимфатических узлов, обусловливая развитие гастроинтестинальной (локализованной) формы заболевания. Лишь в некоторых случаях возможно проникновение возбудителей в кровь, при этом наблюдают генерализованную форму сальмонеллеза с тифоподобным или септическим течением. Генерализации инфекции способствует недостаточность клеточного и гуморального иммунитета.
При микроскопическом исследовании стенки кишки обнаруживают изменения в сосудах в виде кровоизлияний в слизистый и подслизистый слои кишечной стенки. В подслизистом слое помимо микроциркуляторных нарушений развиваются лейкоцитарная реакция и отек. При генерализованном инфекционном процессе отмечают полнокровие и дистрофические изменения во всех органах с возможным развитием метастатических очагов размножения сальмонелл.
Клиническая картина
В соответствии с принятой в РФ клинической классификацией сальмонеллезов выделяют следующие формы и варианты течения:
• Гастроинтестинальная (локализованная) форма:
◊ гастритический вариант;
◊ гастроэнтеритический вариант;
◊ гастроэнтероколитический вариант.
• Генерализованная форма:
◊ тифоподобный вариант;
◊ септикопиемический вариант.
• Бактерионосительство:
◊ острое;
◊ хроническое;
◊ транзиторное.
Инкубационный период при всех формах и вариантах заболевания составляет от нескольких часов до 2 дней.
Клиническая картина проявляется интоксикацией, признаками поражения различных отделов ЖКТ и расстройствами водно-электролитного баланса.
Гастроэнтеритический вариант
Вариант заболевания встречается наиболее часто. Заболевание развивается остро, спустя несколько часов после заражения.
В первые часы преобладают признаки интоксикации:
◊ повышение температуры тела;
◊ головная боль;
◊ озноб;
◊ ломота в теле.
В дальнейшем появляются боли в животе (чаще спастического характера) с локализацией в эпигастральной и пупочной областях, тошнота, возникают
многократная рвота и диарея. Вначале испражнения носят каловый характер с примесями непереваренной пищи, но быстро становятся водянистыми, пенистыми, зловонными, иногда с зеленоватым оттенком. Объем испражнений уменьшается по мере нарастания числа дефекаций. Частота рвоты и дефекации может быть различной, однако для оценки степени обезвоженности большее значение имеет не частота, а количество выделенной жидкости. Дефекация не сопровождается тенезмами.
Несмотря на высокую температуру тела, при осмотре отмечают бледность кожного покрова, в более тяжелых случаях развивается цианоз. Язык сухой, обложен налетом. Живот вздут, при его пальпации можно отметить небольшую разлитую болезненность и урчание кишечника. Тоны сердца приглушены, отмечают тахикардию, склонность к снижению АД, пульс мягкого наполнения. Выделение мочи уменьшается. В тяжелых случаях возможно развитие клонических судорог, чаще в мышцах нижних конечностей.
Гастроэнтероколитический вариант
Начало заболевания напоминает гастроэнтеритический вариант, но уже на 2-3-й день болезни уменьшается объем испражнений. В них появляются слизь, иногда кровь. Боли смещаются в подвздошные области, при пальпации живота отмечают спазм и болезненность отделов толстой кишки. Возможны ложные позывы и тенезмы. Таким образом, в динамике заболевания клинические проявления указанного варианта приобретают много сходных черт с одноименным вариантом острой дизентерии.
Гастритический вариант
Наблюдают значительно реже. Характерны острое начало, повторная рвота и боли в эпигастральной области. Как правило, синдром интоксикации выражен слабо, а диарея вообще отсутствует. Течение болезни обычно нетяжелое, кратковременное, благоприятное.
Степень тяжести гастроинтестинальной формы сальмонеллеза определяет выраженность интоксикации и величина водно-электролитных потерь. При оценке степени интоксикации прежде всего учитывают уровень температурной реакции. Температура тела может быть очень высокой, в этих случаях ее подъем обычно сопровождают чувство озноба, головная боль, разбитость, ломота в теле, анорексия. В случаях более легкого течения болезни лихорадка умеренная, даже субфебрильная.
Вместе с тем одним из ведущих условий, определяющих тяжесть заболевания при различных вариантах сальмонеллеза, служит выраженность водноэлектролитных потерь. Клинические признаки, характерные для той или иной степени дегидратации, представлены в сводной таблице в разделе «Холера».
При генерализации процесса может развиться тифоподобный вариант сальмонеллеза, сходный по клинической картине с тифопаратифозными заболеваниями, или септикопиемический вариант. Как правило, генерализованной форме заболевания предшествуют гастроинтестинальные расстройства.
Тифоподобный вариант
Может начинаться с проявлений гастроэнтерита. В дальнейшем через несколько дней на фоне стихания или исчезновения тошноты, рвоты, диареи и абдоминальных болей наблюдают нарастание температурной реакции, лихорадка приобретает постоянный, волнообразный или неправильный характер. Боль-
ные жалуются на головную боль, плохой сон, общую слабость. При осмотре пациента отмечают вялость, адинамию, бледность кожного покрова, в некоторых случаях на коже живота и нижней части груди появляются отдельные розеолезные элементы. Может быть метеоризм, к 3-5-м суткам болезни развивается гепатолиенальный синдром. АД склонно к снижению, выражена относительная брадикардия. В целом клиническая картина заболевания приобретает черты, весьма напоминающие течение брюшного тифа, что затрудняет клиническую дифференциальную диагностику. Тифоподобный вариант сальмонеллеза не исключен и при отсутствии начальных проявлений в виде гастроэнтерита.
Септикопиемический вариант
В начальном периоде заболевания также можно наблюдать проявления гастроэнтерита, в дальнейшем сменяемые длительной ремиттирующей лихорадкой с ознобами и выраженным потоотделением при ее снижении, тахикардией, миалгиями. Развивается гепатоспленомегалия. Течение болезни длительное, торпидное.
Проявляется склонность к формированию вторичных гнойных очагов:
- в легких (плеврит, пневмония);
- сердце (эндокардит);
- подкожной клетчатке и мышцах (абсцессы, флегмоны);
- почках (пиелит, цистит).
Могут также развиться ириты и иридоциклиты.
После перенесенного сальмонеллеза независимо от формы его течения у части реконвалесцентов формируется бактерионосительство. В большинстве случаев выделение сальмонелл заканчивается в течение 1-3 мес (острое бактерионосительство), если оно продолжается более 3 мес, после клинического выздоровления его расценивают как хроническое. При транзиторном бактериовыделении однократный или двукратный высев сальмонелл из испражнений не сопровождается клиническими проявлениями заболевания и образованием значимых титров АТ.
Дифференциальная диагностика
Сальмонеллезы следует отличать от многих заболеваний, сопровождающихся развитием диарейного синдрома:
- шигеллезов;
- эшерихиозов;
- холеры;
- вирусных диарейных инфекций;
- отравлений грибами, солями тяжелых металлов, фосфорорганическими соединениями и др.
Кроме того, в некоторых случаях возникает необходимость в срочной дифференциальной диагностике сальмонеллеза от инфаркта миокарда, острого аппендицита, приступа желчнокаменной болезни, тромбоза мезентериальных сосудов.
Для гастроэнтеритического варианта сальмонеллеза характерно преобладание признаков интоксикации в первые часы заболевания, затем развитие диспепсических признаков:
- тошноты и рвоты;
- спастических болей в животе;
- диареи с водянистым, пенистым зловонным стулом. Гастроэнтероколитический вариант отличают уменьшение объема испражнений со 2-3-го дня болезни, появление в них слизи и, возможно, крови, спазма и болезненности толстой кишки, иногда тенезмов. Сальмонеллезный гастрит, как правило, развивается на фоне общетоксических признаков различной степени выраженности. Тифоподобный и септический варианты генерализованной формы сальмонеллеза легче заподозрить, если они начинаются с проявлений гастроэнтерита. В остальных случаях их дифференциальная диагностика с брюшным тифом и сепсисом крайне затруднительна.
Лабораторная диагностика
Основу составляет выделение возбудителя при посевах рвотных и каловых масс, а в случаях генерализованной формы - крови. Материалом для бактериологического исследования также могут служить промывные воды желудка и кишечника, моча. При септикопиемическом варианте заболевания возможны посевы гноя или экссудата из воспалительных очагов. При вспышках сальмонеллеза проводят бактериологический анализ остатков пищи, подозреваемой на зараженность, а также смывов с посуды. Обязательным будет использование сред обогащения (магниевая среда, селенитовая среда) и нескольких дифференциально-диагностических сред (Эндо, Плоскирева висмут-сульфит агара), достаточно широкого набора биохимических тестов и набора моновалентных адсорбированных O- и Н-сывороток.
В качестве метода серологической диагностики применяют РНГА с комплексными и групповыми сальмонеллезными эритроцитарными диагностикумами. Реакцию ставят с парными сыворотками, взятыми с интервалом 5-7 дней. Минимальный диагностический титр АТ в РНГА - 1:200. К сожалению, серологические методы в большинстве случаев представляют ценность только для ретроспективного подтверждения диагноза.
Более перспективно экспресс-выявление Аг сальмонелл в РКА, РЛА, ИФА
и РИА.
Для установления степени дегидратации и оценки тяжести состояния больного, а также для коррекции проводимого регидратационного лечения определяют гематокрит, вязкость крови, показатели КЩС, электролитного и газового состава крови.
Осложнения и исходы
Наиболее опасным осложнением при сальмонеллезах бывает ИТШ, который сопровождается острым отеком и набуханием головного мозга, острой сердечно-сосудистой недостаточностью, часто на фоне острой надпочечниковой недостаточности и ОПН.
Отек-набухание головного мозга, возникающие на фоне эксикоза, проявляются брадикардией, кратковременной гипертензией, покраснением и цианозом кожного покрова лица и шеи (синдром удавленника), быстро развивающимися парезами мышц, иннервируемых черепными нервами. Затем присоединяется усиливающаяся одышка и, наконец, наступает мозговая кома с потерей сознания.
Выраженная олигурия и анурия является тревожным сигналом возможного наступления ОПН. Эти подозрения усиливаются, если моча по-прежнему не выделяется после восстановления АД. В таких случаях необходимо срочно определить концентрацию азотистых шлаков в крови. В дальнейшем у больных нарастает симптоматика, характерная для уремии.
Острую сердечно-сосудистую недостаточность характеризуют развитие коллапса, снижение температуры тела до нормального или субнормального уровня, появление бледности и цианоза кожного покрова, похолодание конечностей, а в дальнейшем - исчезновение пульса в связи с резким падением АД. Если в процесс вовлечены надпочечники (кровоизлияния в них из-за ДВС-синдрома), коллапс очень резистентен к лечению.
В абсолютном большинстве случаев заболевание заканчивается выздоровлением. Летальные исходы не превышают 0,5-0,6%.
Лечение
Госпитализацию больных осуществляют только при тяжелом или осложненном течении, а также по эпидемиологическим показаниям. Постельный режим назначают при выраженных проявлениях токсикоза и дегидратации.
Если позволяет клиническое состояние больного, лечение необходимо начинать с промывания желудка до чистых промывных вод, сифонных клизм, назначения энтеросорбентов (активированный уголь и др.). Промывание желудка противопоказано при гипертонической болезни с высокими цифрами АД, язвенной болезни желудка и двенадцатиперстной кишки, ишемической болезни сердца с признаками стенокардии, атеросклерозе сосудов головного мозга.
При дегидратации I-II степени показано назначение глюкозо-солевых растворов типа цитроглюкосолан, глюкосолан, регидрон, оралит внутрь с учетом дефицита воды и солей у больного до начала лечения, восполняемых дробным частым питьем (до 1-1,5 л в час) в течение 2-3 ч, и дальнейших потерь жидкости в процессе лечения (следует контролировать каждые 2-4 ч).
При дегидратации III-IV степени изотонические полиионные кристаллоидные растворы вводят внутривенно струйно до момента ликвидации признаков дегидратационного шока, а затем капельно. Основные принципы оральной и внутривенной регидратации изложены в разделе «Холера».
При необходимости проводят дополнительную коррекцию содержания ионов К+ - внутрь в виде растворов калия хлорида или калия цитрата по 1 г 3-4 раза в день (следует контролировать содержание электролитов в крови).
Внутривенное введение макромолекулярных коллоидных препаратов (реополиглюкин, гемодез и др.) с целью дезинтоксикации можно проводить лишь после коррекции водно-электролитных потерь. При выраженном метаболическом ацидозе может потребоваться дополнительное внутривенное введение 4% раствора натрия бикарбоната под контролем показателей КЩС.
Кроме того, для купирования признаков интоксикации при гастроинтестинальной форме сальмонеллеза можно рекомендовать индометацин. Препарат назначают в ранние сроки заболевания по 50 мг троекратно в течение 12 ч.
При гастроинтестинальной форме применение антибиотиков и других этиотропных препаратов в большинстве случаев не показано. Их необходимо применять при генерализованной форме сальмонеллеза (фторхинолоны по 0,2-
0,5 г 2 раза в сутки, цефтриаксон по 1-2 г в сутки парентерально, левомицетин по 0,5 г 4-5 раз в сутки, доксициклин по 0,1 г в сутки и др.). Антибактериальные препараты (чаще всего фторхинолоны) назначают также при выраженном и (или) затянувшемся колитическом синдроме, у лиц с иммуносупрессией или тяжелой соматической патологией. Целесообразно назначение комплексных ферментных препаратов (энзистал, фестал, мексаза и др.), а в периоде реконвалесценции - пробиотиков.
Диета больных в острый период заболевания соответствует столу № 4 по Певзнеру, после прекращения диареи назначают стол № 13.
Эпидемиологический надзор
Ведущее значение в профилактике сальмонеллеза принадлежит сочетанному эпидемиолого-эпизоотологическому надзору, осуществляемому ветеринарной и санитарно-эпидемиологической службами. Ветеринарная служба ведет постоянное наблюдение за заболеваемостью животных, частотой инфицирования кормов и мясопродуктов, осуществляет микробиологический мониторинг за серологической структурой выделяемых сальмонелл и их биологическими свойствами. Санитарно-эпидемиологическая служба проводит наблюдение за заболеваемостью людей, ее тенденциями и особенностями в определенный отрезок времени и на данной территории, осуществляет слежение за серотиповой структурой возбудителя, выделяемого от людей и из пищевых продуктов, изучение биологических свойств сальмонелл. Большое значение имеют разработка надежных методов диагностики и стандартизация процедур учета и уведомления о случаях заболевания, а также контроль за поступающими в реализацию пищевыми продуктами, особенно завезенными из других регионов страны или из-за рубежа. Сочетанный анализ заболеваемости населения и эпизоотического процесса сальмонеллеза среди животных и сельскохозяйственных птиц позволяет осуществлять своевременную эпидемиологическую диагностику, планирование и организационно-методическое обеспечение профилактических и противоэпидемических мероприятий.
Профилактические мероприятия
Основу профилактики сальмонеллеза среди людей составляют ветеринарносанитарные мероприятия, направленные на обеспечение надлежащих условий в процессе убоя скота и птицы, соблюдение режима убоя животных, технологии обработки туш, приготовления и хранения мясных и рыбных блюд. Большое значение имеют регулярный выборочный контроль кормов и кормовых ингредиентов, плановое осуществление дезинфекционных и дератизационных мероприятий на мясоперерабатывающих предприятиях, пищевых и сырьевых складах, холодильниках, вакцинация сельскохозяйственных животных. В общественном питании и личной домашней практике следует строго соблюдать санитарно-гигиенические правила приготовления пищи, раздельной обработки сырого мяса и вареных продуктов, условия и сроки хранения готовой пищи.
Сигналы к проведению специальных противоэпидемических мероприятий: - нарастание числа выделений штаммов сальмонелл одного и того же серовара;
- появление новых или увеличение числа выделений сальмонелл редко встречающихся на данной территории сероваров;
- увеличение доли штаммов, устойчивых к действию антибиотиков;
- возникновение вспышки сальмонеллеза.
Для профилактики ВБИ следует соблюдать все требования санитарногигиенического и противоэпидемического режима в ЛПУ. Лица, впервые поступающие на работу в ДДУ и ЛПУ, на предприятия пищевой промышленности и приравненные к ним учреждения подлежат обязательному бактериологическому обследованию. Средства специфической профилактики отсутствуют.
Мероприятия в эпидемическом очаге
Госпитализацию больных осуществляют по клиническим показаниям. Обязательной госпитализации и диспансерному наблюдению за переболевшими подвергаются только работники пищевых предприятий и лица, к ним приравненные. Выписку из стационара осуществляют после клинического выздоровления и однократного бактериологического исследования кала, проведенного через 2 дня после окончания лечения. Работников пищевой промышленности и лиц, к ним приравненных, выписывают после отрицательных результатов двукратного бактериологического обследования. Лиц, не выделяющих возбудитель, допускают к работе. При установлении бактерионосительства в течение 3 мес этих лиц как хронических носителей сальмонелл отстраняют от работы по специальности на срок не менее 1 года. Детей - хронических носителей сальмонелл не допускают в детские ясли (дома ребенка). Таких детей, посещающих детские сады и общеобразовательные школы, в том числе школы-интернаты, допускают в коллективы, но им запрещают дежурить на пищеблоках.
В отношении лиц, общавшихся с больным сальмонеллезом, в случае оставления больного на дому разобщение не применяют. Работников пищевых и приравненных к ним предприятий, детей, посещающих детские учреждения, а также детей из детских домов и школ-интернатов подвергают однократному бактериологическому обследованию. В случае возникновения внутрибольничного заражения сальмонеллезом больных, а в случае заболевания детей - и матерей, ухаживающих за ними, переводят в инфекционную больницу; при групповых заболеваниях возможна временная организация специального отделения на месте с привлечением для обслуживания больных врача-инфекциониста. Прием новых больных в это отделение до купирования вспышки прекращают. Дезинфекционные мероприятия в отделениях осуществляют как и при других острых кишечных инфекциях, обращая особое внимание на обеззараживание выделений больных, постельных принадлежностей и посуды. Проводят систематическую обработку предметов ухода за больными, ванн, уборочного инвентаря и т.д. В детских отделениях дезинфекции подлежат пеленальные столы после каждого пользования. Единственным средством экстренной профилактики в очаге инфекции в случае возникновения длительных внутрибольничных вспышек сальмонеллезов является лечебный бактериофаг сальмонеллезный групп ABCDE.
ПИЩЕВЫЕ ТОКСИКОИНФЕКЦИИ
ПТИ - острые инфекционные заболевания, вызываемые преимущественно условно-патогенными бактериями, продуцирующими экзотоксины. При попадании микроорганизмов в пищевые продукты в них накапливаются токсины, которые могут вызывать отравления человека.
Краткие исторические сведения
На протяжении многих веков человечеству было известно, что употребление в пищу недоброкачественных продуктов, прежде всего мясных, может приводить к развитию рвоты и поноса. После описания П.Н. Лащенковым (1901) клинической картины стафилококковой пищевой интоксикации было установлено, что заболевания с синдромами диареи и интоксикации могут вызывать условно-патогенные бактерии. В результате работ отечественных исследователей эти заболевания отнесены к группе ПТИ. Несмотря на отсутствие единого мнения среди инфекционистов нашей страны о классификации ПТИ, следует поддержать мнение К.В. Бунина о том, что в эту группу должны быть внесены заболевания, вызываемые как патогенными, так и условно-патогенными микроорганизмами.
Этиология
ПТИ вызывает большая группа бактерий:
- Staphylococcus aureus;
- Proteus vulgaris;
- Bacillus cereus;
- Clostridium perfringens;
- Clostridium difficile;
- Klebsiella;
- Enterobacter;
- Citrobacter, Serratia;
- Enterococcus и др.
Возбудители широко распространены в природе, обладают выраженной устойчивостью, способны размножаться в объектах внешней среды. Все они постоянные представители нормальной микрофлоры кишечника человека и животных. Нередко у заболевших не удается выделить возбудитель, так как клиническую картину ПТИ в основном определяет действие микробных токсических субстанций. Под действием различных факторов внешней среды условно-патогенные микроорганизмы изменяют такие биологические свойства, как вирулентность и устойчивость к антибактериальным препаратам.
Эпидемиология
Источник инфекции - различные животные и люди. Наиболее часто это лица, страдающие гнойными заболеваниями (панариции, ангины, фурункулезы и др.). Среди животных - коровы и овцы, болеющие маститами. Все они выделяют возбудители (обычно стафилококки), попадающие в пищевые продукты в процессе их обработки, где и происходит размножение и накопление
бактерий. Эпидемиологическую опасность представляют как больные, так и носители возбудителей. Период заразности больных небольшой. Относительно сроков бактерионосительства данные противоречивы. Возбудители других токсикоинфекций (C. рerfringens, B. сereus и др.) люди и животные выделяют во внешнюю среду с испражнениями. Резервуаром ряда возбудителей могут быть почва, вода и другие объекты внешней среды, загрязненные испражнениями животных и человека.
Механизм передачи - фекально-оральный, основной путь передачи - пищевой. Для возникновения ПТИ, вызываемых условно-патогенными бактериями, необходима массивная доза возбудителей либо определенное время для его размножения в пищевых продуктах. Чаще всего ПТИ связаны с контаминацией молока, молочных продуктов, рыбных консервов в масле, мясных, рыбных и овощных блюд, а также кондитерских изделий, содержащих крем (торты, пирожные). Основным продуктом, участвующим в передаче клостридий, служит мясо (говядина, свинина, куры и др.). Приготовление некоторых мясных блюд и изделий (медленное охлаждение, многократное подогревание и др.), условия их реализации способствуют прорастанию спор и размножению вегетативных форм.
В эстафетной передаче возбудителя участвуют различные объекты внешней среды:
- вода;
- почва;
- растения;
- предметы быта и ухода за больными.
Продукты, содержащие стафилококковый и другие энтеротоксины, по внешнему виду, запаху и вкусу не отличаются от доброкачественных. Заболевания протекают в виде спорадических случаев и вспышек. Их чаще регистрируют в теплое время года, когда создаются благоприятные условия для размножения возбудителей и накопления их токсинов.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Обычно заболевает большая часть лиц, употреблявших контаминированную пищу. Помимо свойств возбудителя (достаточная доза, высокая вирулентность), для развития заболевания требуется ряд способствующих факторов со стороны как микроорганизма, так и макроорганизма (сниженная сопротивляемость, сопутствующие заболевания и др.).
Более восприимчивы индивидуумы из группы риска:
- новорожденные;
- ослабленные лица;
- пациенты после хирургических вмешательств либо длительно получавшие антибиотики и др.
Основные эпидемиологические признаки
Заболевания, вызываемые условно-патогенными микроорганизмами, распространены повсеместно. Вспышки носят семейный характер или при контаминации пищи на предприятиях общественного питания, заболевания могут быть рассеяны среди населения. Число заболевших определяется количеством лиц, употреблявших контаминированный пищевой продукт, и может суще-
ственно варьировать. В частности, весьма характерны групповые заболевания среди пассажиров морских судов, туристов и членов детских и взрослых организованных коллективов. Вспышки обычно носят взрывной характер. Какихлибо особенностей по социально-возрастному и половому составу не выявлено. Заболевания чаще регистрируют в летнее время. В зависимости от вида пищевого продукта среди заболевших преобладают дети или взрослые. Кроме пищевых, возможны и бытовые вспышки, в большинстве случаев возникающие в больничных условиях.
Вспышки ВБИ, вызываемые C. difficile, связаны с длительным применением антибиотиков. При водных вспышках как следствие фекального загрязнения одновременно с условно-патогенными микроорганизмами выделяют и другие возбудители острых кишечных инфекций.
Патогенез
Общее свойство всех возбудителей ПТИ - это способность вырабатывать различные типы экзотоксинов (энтеротоксинов) и эндотоксинов (ЛПС-комплексов). Именно благодаря особенностям действия этих токсинов отмечают определенное своеобразие в клинических проявлениях ПТИ, обусловленных различными возбудителями. На исключительно важную роль бактериальных токсинов в развитии ПТИ указывает и относительно короткий инкубационный период заболевания.
В зависимости от типов токсины различают по основным механизмам действия. Они могут вызывать гиперсекрецию жидкости в просвет кишечника за счет активации аденилат-гуанилатциклазной системы (энтеротоксины), повреждение клеток и клинические проявления гастроэнтерита (цитотоксины и гемолизины), активацию арахидонового каскада и выработку шокогенных цитокинов, что обусловливает системные проявления заболевания в виде синдрома интоксикации (ЛПС-комплексы и супер-Аг). Вместе с тем синергизм действия токсинов возбудителей обеспечивает сходство патогенетических механизмов ПТИ различной этиологии, клинических проявлений заболеваний и общность основных принципов в подходах к лечебным мероприятиям.
Клиническая картина
Клиническая классификация ПТИ предусматривает выделение тех же вариантов гастроинтестинальной формы и бактерионосительства, что и при сальмонеллезе (см. раздел «Сальмонеллез»). Генерализованная форма ПТИ не развивается.
Инкубационный период длится несколько часов, однако в отдельных случаях он может укорачиваться до 30 мин или, наоборот, удлиняться до 24 ч и более.
Несмотря на полиэтиологичность ПТИ, основные клинические проявления синдрома интоксикации и водно-электролитных нарушений при этих заболеваниях сходны между собой и мало отличимы от таковых при сальмонеллезе. Для заболеваний характерно острое начало с тошноты, повторной рвоты, жидкого стула энтеритного характера от нескольких до 10 раз в сутки и более. Боли в животе и температурная реакция могут быть незначительными, однако в части случаев наблюдают сильные схваткообразные боли в животе,
кратковременное (до 1 сут) повышение температуры тела до 38-39 °С, озноб, общую слабость, недомогание, головную боль. При осмотре больных отмечают бледность кожного покрова, иногда периферический цианоз, похолодание конечностей, болезненность при пальпации в эпигастральной и пупочной областях, изменения частоты пульса и снижение АД. Степень выраженности клинических проявлений дегидратации и деминерализации зависит от объема жидкости, теряемой больными при рвоте и диарее (см. раздел «Сальмонеллез»). Течение заболевания короткое и в большинстве случаев составляет 1-3 дня.
Вместе с тем клинические проявления ПТИ имеют некоторые различия в зависимости от вида возбудителя. Стафилококковой инфекции свойственны короткий инкубационный период и бурное развитие симптомов заболевания.
В клинической картине доминируют признаки гастрита:
- многократная рвота;
- резкие боли в эпигастральной области, напоминающие желудочные колики.
Характер стула может не меняться. Температура тела в большинстве случаев остается нормальной или кратковременно повышается. Выраженное снижение АД, цианоз и судороги можно наблюдать уже в первые часы заболевания, но в целом течение болезни кратковременное и благоприятное, поскольку изменения сердечной деятельности и гемодинамики не соответствуют степени водноэлектролитных расстройств. В случаях ПТИ, вызванных Clostridium perfringens, клиническая картина, сходная с таковой при стафилококковой инфекции, дополняется развитием диареи с характерным жидким кровянистым стулом, температура тела остается нормальной. При ПТИ, вызванных вульгарным протеем, стул приобретает зловонный характер.
Дифференциальная диагностика
ПТИ следует отличать от сальмонеллеза и других острых кишечных инфекций - вирусных гастроэнтеритов, шигеллезов, кампилобактериоза, холеры и других инфекций (см. соответствующие нозологии), а также от хронических заболеваний ЖКТ, хирургической и гинекологической патологии, инфаркта миокарда. Поскольку основные патогенетические механизмы и клинические проявления ПТИ мало отличимы от таковых при сальмонеллезе, в клинической практике часто ставят обобщенный предварительный диагноз ПТИ, а выделение сальмонеллеза из этой общей группы проводят в случае его бактериологического или серологического подтверждения.
Лабораторная диагностика
Основу составляет выделение возбудителя из рвотных масс, промывных вод желудка и испражнений. При высеве возбудителя необходимо изучение его токсигенных свойств. Однако в большинстве случаев выделяемость незначительна, а обнаружение конкретного микроорганизма у больного еще не позволяет считать его виновником заболевания. При этом необходимо доказать его этиологическую роль либо с помощью серологических реакций с аутоштаммом, либо установлением идентичности возбудителей, выделенных из зараженного продукта и от лиц, употреблявших его.
Осложнения и исходы
Редко наблюдают гиповолемический шок, острую сердечно-сосудистую недостаточность, сепсис.
Лечение
Аналогично таковому при сальмонеллезе; показаны промывание желудка, сифонные клизмы, раннее назначение энтеросорбентов (активированный уголь и др.), витаминов. При необходимости проводят регидратационное лечение (см. раздел «Сальмонеллез»). Этиотропное лечение при неосложненном течении ПТИ не показано.
Эпидемиологический надзор
Следует проводить в рамках надзора за кишечными инфекциями и ВБИ.
Профилактические мероприятия
В основе профилактики заболеваний лежит соблюдение санитарно-гигиенического и технологического режима, норм и правил заготовки, приготовления, хранения и реализации пищевых продуктов. Необходимо обеспечить ветеринарно-санитарный контроль над животными, способными контаминировать почву, воду и окружающие предметы возбудителями. Для предупреждения стафилококковых отравлений проводят мероприятия, направленные на уменьшение носительства стафилококков у работников пищевых предприятий (санация носителей стафилококка в носоглотке и на кожном покрове, лечение хронических воспалительных заболеваний миндалин и верхних дыхательных путей). Необходимо отстранение от работы, непосредственно связанной с обработкой пищевых продуктов и их изготовлением, лиц с гнойничковыми заболеваниями кожи, фарингитами, ангинами и другими проявлениями стафилококковой инфекции. Большое значение имеют контроль за соблюдением санитарно-гигиенического режима на пищевых предприятиях и ЛПУ, соблюдение правил личной гигиены, постоянное проведение гигиенического воспитания. Важно правильно хранить пищевые продукты, исключить размножение в них возбудителей ПТИ. Чрезвычайно важны термическая обработка пищевых продуктов и соблюдение сроков их реализации, кипячение молока.
Мероприятия в эпидемическом очаге
Аналогичны таковым при других острых кишечных инфекциях. Диспансерное наблюдение за переболевшими не регламентировано.
БОТУЛИЗМ (BOTULISMUS)
Острое токсико-инфекционное заболевание, связанное с употреблением в пищу продуктов, содержащих специфический белковый нейротоксин микроорганизмов Clostridium botulinum и самих возбудителей. Характерно развитие парезов и параличей мускулатуры в связи с блокадой токсином выделения ацетилхолина в нервных синапсах.
Краткие исторические сведения
Под названиями аллантиазис (от гр. allantiksa - колбаса), ихтиозизм (от гр. ichtis - рыба) заболевание известно с XVIII в., когда были зарегистрированы случаи отравления рыбой и кровяной колбасой. Термин «ботулизм» (от лат. botulus - колбаса) ввел бельгийский бактериолог Э. Ван-Эрменгем (1896), выделивший возбудитель из кишечника погибшего больного. Вместе с тем еще в IX-X вв. в Византии, а несколько позже в Германии наблюдали случаи заболевания, связанные с употреблением кровяной колбасы. В 1818 г. в России описано нервно-паралитическое заболевание, связанное с употреблением в пищу копченой рыбы.
Этиология
Возбудитель - подвижная грамположительная, строго анаэробная спорообразующая бактерия Clostridium botulinum. В мазках имеет вид палочек с закругленными концами, располагающихся беспорядочными скоплениями или небольшими цепочками. В неблагоприятных условиях образует субтерминальные и терминальные споры, в виде которых и сохраняется в окружающей среде. В высушенном состоянии споры могут сохранять жизнеспособность десятилетиями. Известно 8 сероваров ботулизма - A, B, Сα, β, Д, E, F, G, отличающихся по антигенной структуре, однако в патологии человека доминируют серовары А, В, Е и F. На территории РФ в основном встречаются серовары А, В, Е и редко С. Оптимальный рост клостридий и токсинообразование происходят в анаэробных условиях при температуре 28-35 °С, исключение составляет серовар Е, способный продуцировать токсин даже при температуре бытового холодильника (+2-3 °С) и при отсутствии строгих анаэробных условий. Возможны случаи отравления людей и животных сразу несколькими токсинами, продуцируемыми бактериями различных сероваров.
Ботулотоксин - один из самых сильных биологических ядов. Состоит из трех белковых компонентов:
- нейротоксина;
- гемагглютинина;
- нетоксичного белка-протектина.
Нейротропностью обладает только нейротоксин, остальные белки защищают его от неблагоприятных воздействий в организме. Токсин быстро разрушается при кипячении (за 15-20 мин), устойчив к действию пепсина и трипсина, выдерживает высокие концентрации (до 18%) поваренной соли, не разрушается в продуктах, содержащих различные специи.
Присутствие ботулотоксина в пищевых продуктах не изменяет их органолептических свойств.
Вегетативные формы бактерий погибают при 80 °С в течение 30 мин, при кипячении - в течение 5 мин. Споры погибают при кипячении лишь через 4-5 ч, но быстро разрушаются при автоклавировании.
В последнее время появились сообщения о возможности продукции нейротоксинов типов F и Е другими представителями клостридий:
- Cl. barati;
- Cl. butyricum.
Эпидемиология
Резервуар и источники инфекции - почва, дикие и синантропные животные, водоплавающие птицы, рыбы и человек. В различных пробах почвы Clostridium botulinum обнаруживают приблизительно в 10% случаев. Возбудитель ботулизма обитает в кишечнике коров, лошадей, свиней, кроликов, крыс, норок, кур, диких водоплавающих птиц и многих других представителей животного мира. При этом носительство возбудителей обычно не причиняет животным видимого вреда. Больной человек не представляет эпидемиологической опасности для окружающих лиц. Из организма зараженных животных (или человека) бактерии выделяются с фекалиями и попадают в почву, воду, корм скота и т.п. Загрязнение различных элементов внешней среды возможно также при разложении трупов грызунов и птиц, погибших от ботулизма.
Механизм передачи - фекально-оральный. Основная причина заболевания (99% случаев) - употребление в пищу продуктов домашнего консервирования, наиболее часто овощей и грибов, а также колбасы, ветчины, копченой и соленой рыбы, контаминированных клостридиями (пищевой ботулизм). Практически все пищевые продукты, загрязненные почвой или содержимым кишечника животных, птиц, рыб, могут содержать споры возбудителей ботулизма. Однако заболевание может возникнуть только при употреблении продуктов, хранившихся в анаэробных условиях (консервы, приготовленные в домашних условиях). Значительно реже встречают раневой ботулизм и ботулизм новорожденных, возникающий у последних при попадании клостридий в кишечник и продукции ими токсина. При травмах в размозженных, некротизированных тканях, лишенных доступа кислорода, создаются условия, близкие к анаэробным, при которых происходит прорастание спор и аккумуляция ботулотоксина. Токсин хорошо всасывается не только со слизистой оболочки ЖКТ, но и со слизистых оболочек глаз и верхних дыхательных путей, что представляет большую опасность в случае использования аэрозоля токсина в качестве биологического оружия.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. В связи с тем что токсин реализует активность в минимальных дозах, значимых антитоксических иммунных реакций не развивается и антитоксический иммунитет не вырабатывается.
Основные эпидемиологические признаки
Ботулизм регистрируют в виде спорадических и групповых заболеваний. Часто случаи заболевания имеют семейный характер в результате употребления в пищу зараженных продуктов домашнего приготовления. На их долю приходится порядка 38% всех случаев заболевания. Для ботулизма не характерна строго выраженная сезонность. Следует отметить, что ботулизм, обусловленный употреблением продуктов питания, изготовленных в промышленных условиях, практически исчез. В России чаще регистрируют заболевания, связанные с употреблением грибов домашнего приготовления, копченой или вяленой рыбы, в европейских странах - мясных и колбасных изделий, в США - бобовых консервов. Определена связь между типовой структурой возбудителей и характером факторов передачи. Заражение после употребления консервов из мяса теплокровных животных (тушенка, окороки, колбасы и др.) наиболее часто вызывают бактерии типа В, из рыбы - бакте-
рии типов Е и F, консервированных продуктов растительного происхождения (маринованные грибы, овощи, фрукты и др.) - бактерии типов А и В. Если контаминируется твердофазный продукт (колбаса, копченое мясо, рыба), то в нем возможно гнездное образование токсина, поэтому заболевают не все лица, употреблявшие этот продукт. Местные и национальные особенности, традиции и обычаи в питании и способах консервирования пищевых продуктов определяют неодинаковое распространение того или иного типа возбудителя на разных территориях. Выражены также и клинико-эпидемиологические особенности заболеваний, вызванных бактериями разных типов. Возбудитель типа В вызывает интоксикации с относительно низкой летальностью и очаговостью, которые отличают удлиненный инкубационный период, запоздалые сроки госпитализации и начало специфического лечения. В то же время бактерии типа Е вызывают поражения с очень высокой летальностью (30% и выше), доминированием тяжелых клинических форм. В последние годы отмечают тенденцию к росту заболеваемости, смертности и числа вспышек, что объясняется возрастающими темпами и стихийностью консервирования разнообразных видов продуктов в домашних условиях, а также хранением продуктов в вакуумной упаковке. Наиболее часто заболевание регистрируют среди лиц 20-25 лет.
Патогенез
В подавляющем большинстве случаев заражение человека происходит при попадании токсина с пищей в ЖКТ, однако возможны и другие пути заражения (раневой ботулизм, ботулизм новорожденных). Возбудитель серовара Е выделяет протоксин, трансформирующийся в токсическую форму уже в организме человека под воздействием ферментов ЖКТ. Хорошая всасываемость токсина обусловливает его наибольшую концентрацию в крови уже в 1-е сутки. Токсин быстро связывается с мотонейронами передних рогов спинного мозга, клетками периферических ядер двигательных черепных нервов. Вместе с тем дозы токсина, не успевшие связаться с нервной тканью, к 3-4-м суткам полностью выводятся из организма с мочой.
Патогенетические механизмы развития интоксикации остаются еще недостаточно ясными. Известно, что ботулотоксин обратимо нарушает углеводный обмен в нервных клетках, обеспечивающий их энергетический режим. При этом нарушается синтез холинацетилтрансферазы, которая активизирует образование ацетилхолина. В результате ослабевает или исчезает нервно-мышечный импульс, развиваются обратимые (в случае выздоровления) парезы или параличи различных групп мышц. Ботулотоксин оказывает воздействие на парасимпатическую нервную систему, угнетая ее активность, что проявляется мидриазом, сухостью слизистых оболочек и запорами. Одновременная активизация симпатического отдела вегетативной нервной системы, развитие гиперкатехолинемии обусловливает сужение сосудов, повышение АД, головокружение.
Развивается гипоксия всех видов:
- гипоксическая;
- гемическая;
- циркуляторная;
- гистотоксическая.
Многие исследователи квалифицируют ботулизм не как интоксикацию, а как токсикоинфекцию, придавая значение возбудителю. В частности, редко встречающийся длительный инкубационный период (до 10 дней) объясняют прорастанием спор возбудителя в ЖКТ с последующим выделением экзотоксина вегетативными формами, чему способствует угнетение моторно-секреторной деятельности кишечника и создание в нем условий, близких к анаэробным. Кроме того, установлена возможность развития вегетативных форм из спор в гнойных очагах или карманах при ранениях (раневой ботулизм). Эти механизмы поддерживают концентрацию токсина в организме больного в течение длительного времени, что следует учитывать при проведении сывороточного лечения.
Клиническая картина
Инкубационный период
В большинстве случаев бывает коротким и составляет 4-6 ч. Однако в редких случаях он может удлиняться до 7-10 дней. Это вызывает необходимость в течение 10 сут наблюдать за состоянием здоровья всех лиц, употреблявших в пищу продукт, послуживший причиной возникновения 1-го случая заболевания.
Начальный период
Симптоматика болезни может быть нечеткой, похожей на симптоматику ряда других заболеваний, что затрудняет возможности ранней диагностики. По характеру основных клинических проявлений ботулизма в начальный период условно можно выделить следующие варианты.
• При гастроэнтеритическом варианте возникают боли в эпигастральной области схваткообразного характера, возможны однократная или повторная рвота съеденной пищей, боли в животе, послабление стула. Заболевание напоминает проявления ПТИ. Вместе с этим следует учитывать, что при ботулизме диспепсические признаки кратковременны и исчезают к моменту появления неврологической симптоматики, в начальном периоде не бывает выраженного повышения температуры тела. Развивается сильная сухость слизистых оболочек ротовой полости, которую нельзя объяснить незначительной потерей жидкости, она связана с атропиноподобным действием ботулотоксина. Частым симптомом в начальном периоде бывает затруднение прохождения пищи по пищеводу (комок в горле).
• Глазной (офтальмоплегический) вариант проявляется расстройствами зрения - появлением тумана, сетки, мушек перед глазами, теряется четкость контуров предметов, возникает их двоение (диплопия). В некоторых случаях развивается острая дальнозоркость, корригируемая плюсовыми линзами.
• Вариант острой дыхательной недостаточности - это наиболее опасный вариант ботулизма с молниеносным развитием острой дыхательной недостаточности (стеснение или тяжесть в груди, чувство нехватки воздуха, одышка, поверхностное дыхание без втяжения межреберных промежутков, исчезновение кашлевого рефлекса, цианоз, тахикардия, патологические типы дыхания). Смерть пациента может развиться через 3-4 ч.
Период разгара
Клинические проявления ботулизма достаточно характерны и отличаются сочетанием ряда синдромов, связанных с поражением ядер различных череп-
ных нервов. При развитии офтальмоплегического синдрома сохраняются и усиливаются расстройства зрения, описанные в начальном периоде болезни. Можно наблюдать двусторонний блефароптоз, стойкий мидриаз, анизокарию, снижение реакции зрачков на свет, нарушения движения глазных яблок (чаще сходящийся стробизм), вертикальный нистагм. Одновременно у больного возникает синдром нарушения глотания, выражающийся в затруднении проглатывания сначала твердой, а затем и жидкой пищи (при попытке выпить воду она выливается у больного через нос). Последнее обусловлено парезом глотательных мышц. Парез мягкого нёба и надгортанника проявляется гнусавостью голоса, дизартрией, при осмотре ротовой полости обращает на себя внимание нарушение или в более тяжелых случаях полное отсутствие подвижности мягкого нёба и язычка. Отсутствует глоточный рефлекс, движения языка ограничены.
Характерны нарушения фонации, последовательно проходящие 4 стадии. Вначале появляются осиплость голоса или снижение его тембра, вследствие сухости слизистой оболочки голосовых связок. В дальнейшем развивается дизартрия, объясняемая нарушением подвижности языка, вслед за этим может возникнуть гнусавость голоса (парез или паралич небной занавески), и, наконец, наступает полная афония, причиной которой является парез голосовых связок. У больного отсутствует кашлевой толчок, что приводит к приступу удушья при попадании слизи или жидкости в гортань.
В ряде случаев, но не постоянно выявляют нарушения иннервации со стороны лицевого нерва мышц мимической мускулатуры:
- перекос лица;
- невозможность оскала зубов и др.
В разгар заболевания больные жалуются на сильнейшую мышечную слабость; их походка становится неустойчивой (пьяная походка). С первых часов заболевания типична выраженная сухость слизистых оболочек полости рта. Развиваются запоры, связанные с парезом кишечника. Температура тела остается нормальной и лишь изредка повышается до субфебрильных цифр. Характерна тахикардия, в некоторых случаях отмечают небольшую артериальную гипертензию. Сознание и слух полностью сохранены. Характерно отсутствие нарушений со стороны чувствительной сферы.
Расстройства дыхания обусловлены поражением мотонейронов передних рогов шейного и верхнегрудного отделов спинного мозга с угнетением иннервации диафрагмальных и межреберных мышц. Клинические признаки этого состояния описаны выше.
Период реконвалесценции при ботулизме продолжительный, иногда затягивается на несколько месяцев. Медленно регрессируют неврологические расстройства, долго остаются общая слабость, астеновегетативные проявления.
Дифференциальная диагностика
Ботулизм следует отличать от ПТИ, отравлений беленой (атропином), ядовитыми грибами, метиловым спиртом, от бульбарной формы полиомиелита, дифтерии, стволовых энцефалитов. Дифференциальная диагностика заболевания основывается на клинико-эпидемиологических данных.
Особую значимость имеет дифференциальная диагностика заболевания в его начальный период. При ботулизме возможны диспепсические симптомы
(гастроэнтеритический вариант заболевания), однако не бывает выраженного повышения температуры тела. Характерна сильная сухость во рту, часто отмечают затруднения при глотании (комок в горле). При других вариантах начального периода ботулизма быстро развиваются расстройства зрения (глазной вариант) или острая дыхательная недостаточность при нормальной температуре тела. В разгар заболевания характерны значительная мышечная слабость, выраженная сухость слизистых оболочек полости рта, запоры. У больных одновременно развиваются проявления офтальмоплегического синдрома, нарушения глотания, последовательные нарушения фонации (осиплость голоса, дизартрия, гнусавость, афония); в ряде случаев выявляют патологию со стороны лицевого нерва. Нарушений со стороны чувствительной сферы не бывает.
Лабораторная диагностика
В гемограмме при ботулизме отмечают умеренно выраженные лейкоцитоз и СОЭ, лимфопению. Цели бактериологических исследований - обнаружение и идентификация ботулотоксина в крови и выделениях больного, а также в подозреваемых продуктах питания. Выделение возбудителя проводят на втором этапе. В настоящее время нет лабораторных тестов, позволяющих идентифицировать ботулотоксин в биологических средах человека в ранние сроки заболевания. Для этого ставят биологическую пробу на лабораторных животных (белые мыши, морские свинки). В опыт отбирают партию из 5 животных. Первое заражают только исследуемым материалом, остальных животных - исследуемым материалом с введением антитоксической сыворотки различных типов А, В, С и Е. Если в материале имеется токсин, то выживает животное, получившее антисыворотку, которая нейтрализует токсин соответствующего типа.
Для экспресс-индикации токсинов ставят РПГА с антительным диагностикумом (эритроциты, сенсибилизированные антитоксинами соответствующих типов). Современные перспективные методы основаны на индикации Аг в ИФА, РИА или ПЦР. Выявление антитоксических АТ не проводят, поскольку количество токсина, необходимого для их образования, является летальным, следовательно, в течение болезни АТ не образуются.
Выделение возбудителя не дает оснований для подтверждения диагноза, поскольку возможно прорастание спор C. botulinum, которые могут находиться в кишечнике здоровых людей.
Осложнения и исходы
При ботулизме наблюдают фатальное развитие пневмоний, прежде всего вследствие уменьшения у больных объема внешнего дыхания. Вместе с тем превентивное назначение антибиотиков при ботулизме не предотвращает наступления этого осложнения.
Наиболее грозные осложнения, нередко ведущие к летальному исходу, - дыхательные расстройства, которые могут наступить в любой период ботулизма. В начальную стадию их отличают учащение дыхания до 40 в минуту, двигательное беспокойство больного, втягивание межреберных промежутков, паралич диафрагмы, вовлечение в процесс дыхания плечевой мускулатуры. В эту стадию больного необходимо перевести на ИВЛ.
При введении гетерогенной противоботулинической сыворотки может развиться анафилактический шок, а в более поздние сроки (на 10-12-й день после ее использования) - сывороточная болезнь.
За счет нарушения иннервации сердца, гипоксических расстройств развивается кардиомиопатия с расширением границ сердца, глухостью тонов, аритмией, признаками сердечной недостаточности. В последнее время появился ряд сообщений о достаточно часто возникающем миокардите в качестве осложнения ботулизма. По клиническим проявлениям и прогнозу осложнение сходно с миокардитом при дифтерии.
Летальность при ботулизме колеблется от 3 до 30-40%.
Лечение
В связи с угрозой для жизни госпитализация больных необходима во всех случаях, даже при подозрении на ботулизм. Больных направляют в любой стационар, где имеется аппаратура для ИВЛ.
Лечебные мероприятия начинают с промывания желудка толстым зондом. При проведении процедуры необходимо убедиться, что введенный зонд находится в желудке, учитывая то обстоятельство, что при отсутствии глоточного рефлекса зонд может быть введен в дыхательные пути. Промывание желудка целесообразно проводить в течение первых 1-2 дней болезни, когда в желудке еще может оставаться зараженная пища.
Для нейтрализации свободно циркулирующего ботулотоксина на территории РФ применяют поливалентные противоботулинические сыворотки, поскольку токсины различных серотипов возбудителя могут быть нейтрализованы только сыворотками соответствующих гомологичных типов. Разовая первоначальная доза поливалентной сыворотки содержит антитоксины типа А - 10 000 МЕ, типа В - 5000 МЕ, типа Е - 10 000 МЕ, иногда типа С - 10 000 МЕ. Сыворотку вводят внутривенно или внутримышечно после предварительной десенсибилизации (метод Безредки). При введении сыворотки внутривенно капельно необходимо предварительно смешать ее с 250 мл физиологического раствора, подогретого до 37 °С. В большинстве случаев хватает однократного введения вышеуказанных доз сыворотки. Если через 12-24 ч по окончании ее введения у больного прогрессируют нейропаралитические расстройства, введение сыворотки следует повторить в первоначальной дозе. При заведомо известном типе ботулотоксина применяют соответствующую моновалентную сыворотку.
Достаточно хороший клинический эффект дает применение человеческой антитоксической противоботулинической плазмы по 250-300 мл 2-3 раза в сутки, однако ее применение затруднено из-за короткого срока хранения (4-6 мес). Имеются данные об эффективности человеческого поливалентного противоботулинического иммуноглобулина, вводимого внутривенно без проведения предварительной кожной пробы в однократной дозе, содержащей 500 МЕ типа А, 300-600 МЕ типа В и 250-500 МЕ типа Е.
Одновременно с введением противоботулинической сыворотки проводят массивное дезинтоксикационное лечение, включающее внутривенное капельное введение инфузионных растворов. Желательно применение соединений на основе поливинилпирролидона (гемодез, реополиглюкин и др.), хорошо адсорбирующих свободно циркулирующий ботулотоксин и выводящих его через почки с мочой.
В связи с тем что больной не может глотать, его кормление осуществляют через тонкий зонд. Пища должна быть не только полноценной, но и обязательно жидкой, проходимой через зонд. Оставлять зонд до следующего кормления нежелательно, так как при сухих слизистых оболочках возможно быстрое развитие пролежней.
Учитывая токсико-инфекционную природу заболевания и возможность развития вегетативных форм возбудителя из спор, находящихся в ЖКТ, больному назначают антибиотики. Препарат выбора - левомицетин в суточной дозе 2,5 г курсом 5 дней. Альтернативные препараты - ампициллин, тетрациклин, цефалоспорины III поколения в средних лечебных дозах. В комплекс лечения больных входит назначение 3% раствора аденозинтрифосфорной кислоты (АТФ) и кокарбоксилазы, сердечно-сосудистых препаратов, витаминов.
Имеются сообщения о достаточно хорошем лечебном эффекте гипербарической оксигенации на ранних этапах заболевания.
При развитии пневмонии проводят лечение антибиотиками по общепринятым схемам.
При первых признаках наступления дыхательных расстройств больного следует перевести на ИВЛ в условиях отделения реанимации и интенсивной терапии.
При нарушениях глотания применяют зондовое или парентеральное питание. Важна профилактика пролежней, пневмоний, мышечных атрофий.
После исчезновения признаков интоксикации для более быстрого восстановления нервно-мышечного аппарата возможно применение физиотерапевтических процедур, лечебной физкультуры.
Реконвалесцент может быть выписан из стационара при полном восстановлении глотания, фонации и артикуляции.
Эпидемиологический надзор
В основном аналогичен таковому при кишечных инфекциях, включает бактериологический контроль пищевого сырья, применяемого при приготовлении мясных, рыбных и овощных консервов, слежение за соблюдением режима их стерилизации. Систематическому контролю подлежит продажа в торговой сети консервов, их внешний вид (бомбаж) и сроки реализации. Анализ заболеваемости осуществляют с учетом типа возбудителя и вида пищевого продукта. Сохраняется необходимость совершенствования методов лабораторного контроля пищевых продуктов и диагностики заболевания.
Профилактические мероприятия
Профилактика ботулизма основана на строгом соблюдении санитарных и технологических правил консервирования пищевых продуктов. Мясо и рыбу разрешено консервировать только в свежем виде. Овощи и фрукты перед консервированием требуется тщательно обмывать для удаления частиц почвы. Недопустимо также консервирование перезревших фруктов. Необходимо строго соблюдать режим гарантийной стерилизации. Стерилизацию следует осуществлять в автоклавах, так как повышенное давление и высокая температура (120 °С) разрушают не только бактериальные клетки и токсин, но и споры. В домашних условиях продукты растительного происхождения можно заготов-
лять впрок только путем маринования или соления с добавлением достаточного количества кислоты и соли и обязательно в открытой для доступа воздуха таре. Большое значение имеет профилактика ботулизма в торговой сети. Самый важный момент - соблюдение условий хранения скоропортящихся продуктов. В торговую сеть не должны поступать испортившиеся (с бомбажем) и с истекшим сроком реализации консервы. Важную роль играет разъяснительная работа среди населения об опасности ботулизма и правилах консервирования продуктов в домашних условиях.
Мероприятия в эпидемическом очаге
Госпитализацию больного проводят по клиническим показаниям. Выписывать переболевших из стационара рекомендовано не раньше чем через 7-10 дней после клинического выздоровления. При выявлении случаев заболевания подозрительные продукты подлежат изъятию и лабораторному исследованию, а употреблявшие их лица - медицинскому наблюдению в течение 10-12 сут. Целесообразно внутримышечное введение им противоботулинической сыворотки, содержащей по 2000 МЕ к токсинам А, В и Е, а также назначение энтеросорбентов. Активная иммунизация не нашла широкого применения.
БРУЦЕЛЛЕЗ (BRUCELLOSIS)
Бруцеллез - зоонозное инфекционно-аллергическое заболевание, склонное к хронизации, протекающее с преимущественным поражением опорнодвигательного аппарата, сердечно-сосудистой, нервной и половой систем.
Краткие исторические сведения
Заболевание известно более 2000 лет, но его научное изучение началось лишь в середине XIX в., когда бруцеллез был выделен из группы различных лихорадок в отдельную нозологическую форму под названием средиземноморская или мальтийская лихорадка (Дж. Марстон, 1859). Возбудитель бруцеллеза впервые обнаружил Д. Брюс (1886), давший бактерии название Micrococcus melitensis. Позднее Банг и В. Стриболд выделили сходные микроорганизмы (B. abortus) при инфекционных абортах у коров (1897), а Дж. Траум - у свиней (B. suis, 1914). В 1920 г. бактерии объединены в один род, названный в честь Д. Брюса, Brucella, а вызываемое ими заболевание получило название бруцеллез. В 50-60-х годах ХХ столетия были выделены бруцеллы B. neotomae (1957), B. ovis и B. canis (1970). С 1994 г. известен новый вид бруцелл, вы-деляемых у морских млекопитающих, - Br. maris с подвидами Br. pinnipediae и Br. cetaceae, описаны несколько случаев бруцеллеза у человека, вызванного Br. maris.
Основоположники серологических исследований при бруцеллезе - А. Райт и Д. Семпл (1897). РА Райта в дальнейшем приобрела большое значение в лабораторной диагностике заболевания.
Большой вклад в изучение клинической картины, эпидемиологии бруцеллеза и в разработку методов лечения заболевания внесли русские ученые А.А. Крамник, Е.И. Марциновский, А.Ф. Билибин, Г.П. Руднев, Н.Д. Беклемишев, П.А. Вершилова, И.С. Безденежных и др.
Этиология
Возбудители бруцеллеза - бактерии рода Brucella. По современной классификации микроорганизмы, патогенные для человека, отнесены к виду Br. melitensis, в него также включены Br. abortus, Br. suis и Br. canis, ранее считавшиеся самостоятельными видами. Наиболее часто поражения у человека вызывает B. melitensis, представленная 3 биоварами (основные хозяева - овцы и козы). Несколько реже - B. abortus, включающая 9 биоваров (основной хозяин - крупный рогатый скот), и B. suis (4 биовара, основные хозяева - свиньи, зайцы, северные олени). В редких случаях поражения у человека вызывает B. canis (основной хозяин - собаки). Br. ovis и Br. neotomae для человека не патогенны.
Определение видов и биоваров бруцелл на конкретных территориях и в очагах инфекции имеет важное эпидемиологическое и эпизоотологическое значение с точки зрения классификации очагов, оценки степени напряженности эпидемического и эпизоотологического процессов, установления фактов миграции бруцелл с одного вида животных на другой, выявления путей распространения возбудителя, выбора тактики лечения и др.
Бруцеллы представляют собой аэробные и микроаэрофильные мелкие, неподвижные, грамотрицательные микроорганизмы, не образующие спор и капсул. Бактерии отличаются выраженным полиморфизмом: в одном препарате наблюдают кокки и удлиненные палочки. B. melitensis чаще представлены кокковидными формами, B. abortus и B. Suis - палочками с закругленными концами. Растут медленно на питательных средах с добавлением сыворотки или крови, первичное выделение возбудителя может потребовать инкубации до 4 нед. Бруцеллы обладают высокой инвазивностью и могут проникать через неповрежденные слизистые оболочки, способны к реверсии в S-, R- и L-формы, внутри- и внеклеточному существованию.
Основные факторы патогенности бруцелл:
- ЛПС-комплекс (эндотоксин);
- гемолизины;
- аденин и монофосфат гуанина, ингибирующие фагосомальные энзимы и перекисное окисление и обеспечивающие устойчивость бактерий к фагоцитозу.
Бактерии достаточно устойчивы во внешней среде:
- в воде сохраняются свыше 2 мес;
- в сыром мясе - 3 мес;
- в засоленном - до 30 дней;
- в брынзе - 2 мес;
- в шерсти - до 4 мес.
Бруцеллы погибают при нагревании до 60 °С через 30 мин, при кипячении - моментально.
Чувствительны к действию многих дезинфицирующих средств - 2% раствор карболовой кислоты, 3% раствор креолина и лизола, 0,2-1% раствор хлорной извести и хлорамина убивают их в течение нескольких минут.
Эпидемиология
Основной источник и резервуар инфекции - овцы, козы, крупный рогатый скот и свиньи. Отмечены случаи заражения людей бруцеллезом от северных оленей. В редких случаях источником заражения могут быть лошади, верблю-
ды, яки и некоторые другие животные, которые выделяют возбудитель с молоком, мочой, калом, околоплодной жидкостью. Наиболее часто человек заражается бруцеллезом от мелкого скота, возбудитель которого (B. melitensis) вызывает большинство тяжелых форм заболевания. Довольно часто человек заражается B. аbortus от крупного рогатого скота, однако клинически выраженную инфекцию регистрируют в единичных случаях. Течение болезни легкое; больной человек не опасен для окружающих.
Механизм передачи возбудителя разнообразный, чаще всего фекальнооральный. Возможны контактно-бытовой (при попадании возбудителя на поврежденные кожный покров и слизистые оболочки) и аэрогенный механизмы передачи. Алиментарный путь передачи бруцелл возможен при употреблении продуктов, полученных от зараженных животных. Эпидемическое значение пищевых продуктов и сырья животного происхождения определяют массивность обсеменения, вид возбудителя, длительность его сохранения. Наибольшую опасность представляют сырые молочные продукты (молоко, брынза, сыр, кумыс и др.), мясо и сырье (шерсть, каракулевые смушки и кожа) от коз и овец, больных бруцеллезом. Мясо представляет значительно меньшую эпидемиологическую опасность, так как оно употребляется после термической обработки. Однако в ряде случаев при недостаточной термической обработке (национальные особенности приготовления пищи - строганина, шашлык с кровью, сырой фарш и др.) мясо и мясные продукты могут стать причиной заражения бруцеллезом.
Больные животные загрязняют бруцеллами почву, подстилку, корм, воду, становящиеся в свою очередь факторами, обусловливающими заражение человека. Зарегистрированы случаи заражения человека при уборке навоза. Аспирационный путь заражения возможен при ингалировании воздушно-пылевой смеси, содержащей инфицированные фрагменты шерсти, навоза, земли. Этот путь инфицирования возможен при стрижке, сортировке шерсти, вычесывании пуха (разработка, вязание и пр.), а также при уборке помещений и территорий, где содержат животных или обрабатывают сырье от них. При этом бруцеллы могут также проникать через слизистую оболочку конъюнктивы глаз. Возможны случаи лабораторного аэрогенного заражения при работе с культурами бактерий. Известны случаи заражения людей через воду, однако эпидемиологическое значение этого пути передачи невелико. Возможны внутриутробное инфицирование плода и заражение детей при кормлении грудным молоком.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Инфицирующая доза составляет всего от 10 до 100 микробных тел. Постинфекционный иммунитет длится обычно 6-9 мес. Повторные заболевания наблюдают в 2-7% случаев.
Основные эпидемиологические признаки
Бруцеллез - это убиквитарная инфекция, очаги болезни выявлены на всех континентах. При этом для нее характерен выраженный профессиональный характер заболеваемости. Заболевание наиболее распространено в сельской местности среди работников животноводства. Заболеваемость людей тесно связана с эпизоотиями среди крупного рогатого скота, овец и коз. Значительное место в отдельных случаях занимает возможность миграции бруцелл от биологически адаптированного хозяина к другим животным. Миграции способствуют чаще всего совместное содержание или совместный выпас разных видов живот-
ных. Наибольшую опасность представляют миграции B. melitensis на крупный рогатый скот.
Заболевают в основном люди, работающие с животными:
- чабаны;
- пастухи;
- доярки;
- ветеринарные и зоотехнические работники;
- сотрудники бактериологических лабораторий;
- рабочие мясокомбинатов, боен, шерстеперерабатывающих фабрик. Заражение контактным путем носит профессиональный характер, особенно
часто происходит при попадании на кожу околоплодной жидкости (помощь при отелах, ягнении, при уходе за новорожденными телятами, ягнятами). Заражение может произойти при переработке мясного сырья, кожи, шерсти животных, больных бруцеллезом. В таких случаях проникновение бруцелл в организм человека происходит через кожный покров, слизистые оболочки глаза, носа, ротовой полости. При лабораторном обследовании животноводов выявляют 1,5-2% лиц, имеющих АТ к возбудителям бруцеллеза. В России ежегодно регистрируют 400-550 впервые выявленных случаев заболевания. В 2007 г. в 32 субъектах РФ зарегистрировано 296 случаев заболеваний людей бруцеллезом (показатель на 100 000 населения 0,21), что на 29,9% ниже, чем в 2006 г., в том числе у детей до 17 лет - 21 случай (показатель - 0,08), что на 39,4% ниже
2006 г.
Распространенность бруцеллеза неодинакова по регионам, заболевание регистрируют в основном в животноводческих районах. Высокие цифры заболеваемости отмечены в Республиках Тыва, Калмыкия, Карачаево-Черкесия, Дагестан, в Ставропольском крае, Саратовской и Волгоградской областях. Эпизоотии и высокий уровень заболеваемости бруцеллезом сохраняются в странах СНГ, главным образом в Казахстане и среднеазиатских странах, из которых возможно поступление в Россию инфицированного сырья. Сезонность в заболеваемости людей бруцеллезом обусловлена хозяйственной деятельностью человека и, в частности, процессом обслуживания сельскохозяйственных животных. Особого внимания заслуживает время отелов, окотов и абортов, уход за животными в послеродовый период, а также время купки и стрижки овец. Максимальное число заболеваний бруцеллезом козье-овечьего типа приходится на весенне-летний период. При заражении бруцеллезом от крупного рогатого скота сезонность выражена слабее, что объясняется длительным периодом лактации и заражением в основном через молоко и молочные продукты.
Патогенез
Бруцеллы проникают в организм человека через неповрежденные слизистые оболочки (включая конъюнктиву) или поврежденный кожный покров, не оставляя никаких изменений в области входных ворот (рис. 4-1).
Лимфогенная фаза (фаза первичной латенции) соответствует по времени инкубационному периоду. При незавершенном фагоцитозе возбудители заносятся макрофагами по лимфатическим сосудам в регионарные лимфатические узлы и размножаются в них. Продолжительность этого процесса может быть различной и зависит от соотношения активности возбудителей (инфицирующей дозы) и защитных сил организма. При длительном сохранении бруцелл в
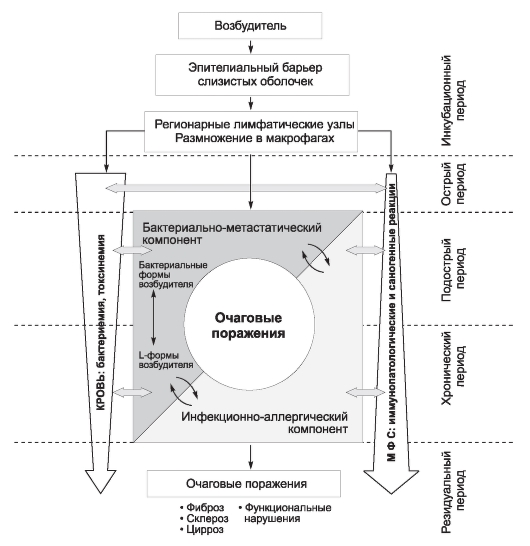
Рис. 4-1. Патогенез бруцеллеза
лимфатических узлах происходит иммунологическая перестройка и сенсибилизация организма, начинается выработка сывороточных АТ, но клинические проявления еще не развиваются.
Вслед за лимфогенной наступает гематогенная фаза (фаза гематогенного заноса), клинически соответствующая периоду острого бруцеллеза.
Развиваются бактериемия и эндотоксинемия, возбудители заносятся в следующие органы:
- печень;
- селезенку;
- костный мозг;
- лимфатические узлы;
- почки;
- легкие.
В патологический процесс могут быть вовлечены практически любые органы или системы организма.
ЛПС-комплекс (эндотоксин) бруцелл и выработка медиаторов воспаления обусловливают развитие клинической симптоматики острого бруцеллеза:
- токсических и токсико-аллергических реакций;
- функциональных нарушений нервной системы (преимущественно вегетативной).
Фаза полиочаговых локализаций соответствует клиническому периоду подострого бруцеллеза. Макрофаги с паразитирующими в них бруцеллами, попавшие в различные органы при гематогенной диссеминации, фиксируются в них. Эти процессы, направленные на уменьшение интенсивности бактериемии, локализацию и фиксацию возбудителей, приводят к развитию в органах продуктивно-воспалительных изменений очагового характера в виде специфических бруцеллезных гранулем. Формирование гранулем клинически проявляется в виде воспалительных реакций со стороны опорно-двигательной, нервной, урогенитальной и других систем. Гранулемы, представляющие собой вторичные полиорганные очаги инфекции, служат постоянным источником повторных волн бактериемии и токсинемии с формированием метастатических органных воспалительных очагов. В связи с нарастающей сенсибилизацией организма развиваются реакции ГЗТ, а иногда и гиперчувствительности немедленного типа (ГНТ). Активизируется гуморальный и нестерильный клеточный иммунитет. В части случаев (8-10%) очаговые поражения формируются рано, на 2-4-й неделе от начала заболевания, т.е. во время периода острого бруцеллеза.
Фаза экзоочаговых обсеменений и реактивно-аллергических изменений соответствует периоду хронического бруцеллеза. Заболевание склонно к длительному течению и хронизации. В основе хронического бруцеллеза лежит длительное сохранение возбудителей в метастатических очагах с эпизодами повторной диссеминации и развитием реактивно-аллергических изменений. Возможно формирование новых воспалительных очагов, связанное в первую очередь с аутоиммунными механизмами.
Вместе с тем нарастает активность гуморального иммунитета, продукции активизированных мононуклеарных фагоцитов, фагоцитоз становится завершенным. Ослабевает патогенетическое значение бактериемии и эндотоксинемии, активности воспалительно-аллергических органных очаговых реакций. Бруцеллезные гранулемы рассасываются, частично нагнаиваются, значительно реже подвергаются фиброзированию и склерозированию с возможным развитием необратимых органических изменений. Более типично развитие функциональных нарушений в различных органах вследствие реактивного воспаления.
Фаза резидуального метаморфоза (фаза исхода и остаточных признаков). Сформировавшиеся при бруцеллезе нарушения функционального, а иногда и необратимого органического характера с развитием стойких рубцовых изменений сохраняются в периоде реконвалесценции и даже после полной санации организма. Функциональные нарушения отличаются скудностью или полным отсутствием объективной симптоматики при обилии субъективных жалоб.
Патоморфологические изменения при бруцеллезе разнообразны. Могут быть выявлены гиперемия слизистой оболочки кишечника, воспаление пейеровых бляшек, очаги некроза в печени, абсцессы печени и селезенки, воспаление желчного пузыря, поджелудочной железы, кишечника.
Клиническая картина
Современная клиническая классификация бруцеллеза основана на принципах, заложенных Г.П. Рудневым в 50-х годах прошлого столетия.
• Острый бруцеллез (длится условно до 1-1,5 мес).
• Подострый бруцеллез с очаговыми поражениями (от 1-1,5 до 4 мес).
◊ Стадии болезни:
- повторная генерализация инфекции; - без повторной генерализации инфекции.
• Хронический бруцеллез (длится свыше 4 мес).
◊ Формы хронического бруцеллеза:
- костно-суставная, или локомоторная (поражение суставов, костей, мягкого скелета);
- нервная, или нейробруцеллез (поражение периферической нервной
системы, ЦНС, психоневроз); - урогенитальная (у мужчин - орхиты, эпидидимиты; у женщин -
оофориты, сальпингиты, эндометрит, дисменорея; у беременных -
аборты, преждевременные роды); - висцеральная (сердечно-сосудистая, легочная, гепатолиенальная); - комбинированная.
• Резидуальный бруцеллез (клиника последствий бруцеллеза).
◊ Функциональные нарушения различных органов и систем.
◊ Необратимые поражения локомоторного аппарата и внутренних органов. Инкубационный период заболевания равен от 1-4 нед до 2-3 мес. Клинические проявления заболевания и их выраженность отличаются большим полиморфизмом.
Острый бруцеллез
Острый бруцеллез в клинически выраженных случаях проявляется как генерализованная инфекция с общетоксическими и аллергическими признаками. Развитие заболевания может быть быстрым, постепенным или стертым. При быстром развитии бруцеллез проявляется подъемом температуры тела до высоких цифр (39 °С и выше) в течение первых 1-2 дней заболевания. Лихорадку ремиттирующего, волнообразного или интермиттирующего характера сопровождает выраженный озноб, завершающийся профузным потоотделением. Лихорадочная реакция обычно продолжается несколько дней, но может удлиняться до 3-4 нед, принимая волнообразный характер. Вместе с тем в большинстве случаев самочувствие больных вследствие умеренной интоксикации остается относительно удовлетворительным даже на фоне высокой температуры тела и достаточно существенных объективных изменений. Эта клиническая особенность, свойственная бруцеллезу, часто бывает причиной затруднений при проведении дифференциальной диагностики заболевания. Больные жалуются на головную боль, эмоциональную неустойчивость, раздражительность, нарушения сна.
Могут быть боли в мышцах и суставах (около 20% случаев), диспепсические симптомы:
- снижение аппетита;
- тошнота;
- рвота;
- боли в животе;
- понос или запор.
При осмотре на высоте лихорадки отмечают гиперемию лица и шеи, бледность кожи туловища и конечностей. В 10-15% случаев возникают быстро проходящая экзантема макулопапулезного, скарлатиноподобного или петехиального характера, кожные капилляриты. Периферические лимфатические узлы, особенно шейные и подмышечные, незначительно увеличиваются в размерах, могут быть несколько болезненными при пальпации. Микрополиаденопатию, которая считалась ранним клиническим признаком бруцеллеза, в последнее время встречают нечасто (не более чем в 20-25% случаев). Иногда в подкожной клетчатке, но чаще в области мышц и сухожилий можно пальпировать болезненные плотные узелки или узлы размером от горошины до мелкого куриного яйца - фиброзиты и целлюлиты, хотя их появление у пациентов более характерно для следующей, подострой формы бруцеллеза. Печень и селезенка увеличиваются к концу 1-й недели заболевания, становятся чувствительными при пальпации.
Постепенное начало болезни отмечают более чем в половине случаев, чаще у пожилых лиц. На протяжении различного времени (от нескольких суток до нескольких недель) больные жалуются на недомогание, разбитость, нарушения сна, снижение работоспособности, боли в суставах, различных группах мышц и пояснице. При обследовании отмечают субфебрилитет, иногда - увеличение периферических лимфатических узлов по типу микрополиаденопатии. В дальнейшем нарастают признаки интоксикации, температура тела становится высокой, появляются ознобы и проливные поты, особенно в ночное время, увеличиваются в размерах печень и селезенка.
Стертое течение острого бруцеллеза не вызывает жалоб со стороны больного. Объективная симптоматика скудная, лишь у некоторых пациентов обнаруживают микрополиаденопатию, увеличение печени и селезенки, функциональные расстройства нервной системы. В таких случаях заболевание может оставаться нераспознанным на этапах острого и подострого бруцеллеза и правильный диагноз ставится иногда уже при хроническом процессе (первичнохронический бруцеллез) на основе полного комплекса данных эпиданамнеза, клинического и лабораторного обследования.
Степень тяжести бруцеллеза во многом зависит от вида возбудителя (его вирулентности). Обычно заболевания, вызванные B. abortus, протекают легче, чем поражения, обусловленные B. melitensis.
Подострый бруцеллез
Подострый бруцеллез начинается с момента появления первых клинических признаков очаговых воспалительных поражений опорно-двигательного аппарата, половой сферы, периферической нервной системы или других органов и систем, что в 10-15% случаев может наблюдаться рано, уже на 2-3-й неделе болезни.
Для подострого бруцеллеза характерны чередование лихорадочных периодов с периодами апирексии, очаговые воспалительные реакции со стороны различных органов и систем, а также аллергические проявления (экзантемы, дерматиты, поверхностные кожные васкулиты и др.). Эпизоды лихорадки продолжаются несколько дней, сменяясь более длительными ремиссиями. Во время лихорадки температурная кривая приобретает неправильный характер, уровень температуры подвержен значительным колебаниям даже в течение суток.
Больные предъявляют многочисленные жалобы, так же как и в остром периоде болезни. Беспокоят диффузные боли в мышцах, костях и суставах, парестезии, угнетенное настроение. Ухудшаются сон и аппетит, развивается мышечная слабость, появляются сухость во рту, жажда, запоры.
При осмотре больных могут обратить на себя внимание проявления аллергических реакций:
- экзантемы;
- дерматиты;
- поверхностные кожные капилляриты.
Довольно часто выявляют фиброзиты и целлюлиты. Со стороны сердечнососудистой системы отмечают относительную брадикардию на высоте лихорадки и небольшую тахикардию в периоды нормальной температуры тела, приглушенность тонов сердца. В тяжелых случаях могут быть обнаружены признаки инфекционно-аллергического миокардита, эндокардита и перикардита. Патологию органов дыхания выявляют редко (катаральные ангины, фарингиты, бронхиты, бронхопневмонии). Изменения органов пищеварения носят функциональный характер, что отражается в жалобах больных. В тяжелых случаях возможно развитие менингизма и вялотекущего серозного менингита.
На фоне общетоксических признаков или без таковых (подострый бруцеллез с повторной генерализацией или без повторной генерализации инфекции) развивается разнообразная очаговая воспалительная симптоматика.
В первую очередь наблюдают поражения опорно-двигательного аппарата:
- артриты и полиартриты;
- синовиты;
- бурситы;
- тендовагиниты и т.д.
Типичны поражения половой сферы - у мужчин орхиты и эпидидимиты, у женщин расстройства менструального цикла, эндометриты, самопроизвольные аборты. Поражения нервной системы могут проявиться в виде невритов, плекситов, ишиорадикулитов.
Хронический бруцеллез
Хронический бруцеллез развивается обычно после 4 мес от начала заболевания.
Для него характерны:
- рецидивирующее течение со слабой или умеренной интоксикацией, преимущественно субфебрильной температурой во время обострений;
- длительные (до 2-3 мес) ремиссии;
- ухудшение состояния, вариабельность клинических проявлений при возникновении новых очаговых поражений реактивно-воспалительного характера.
В клинической картине хронического бруцеллеза наиболее часто проявляются комплексные очаговые поражения со стороны различных органов и систем с доминированием той или иной органной патологии (см. клиническую классификацию бруцеллеза).
Изменения опорно-двигательного аппарата проявляются развитием рецидивирующих, длительно протекающих артритов с частым вовлечением околосуставной клетчатки (периартриты), бурситов, тендовагинитов, периоститов, пери-
хондритов. Типичны фиброзиты и целлюлиты в пояснично-крестцовой области и над локтевыми суставами. Поражения различных отделов позвоночника сопровождаются сильными болями, ограничением движений, деформациями, деструктивными изменениями.
Поражения нервной системы выражаются в виде радикулитов, плекситов, межреберной невралгии, невритов слухового и зрительного нервов, расстройств чувствительности. В редких случаях возможно развитие менингоэнцефалита, диэнцефального синдрома. С изменениями со стороны вегетативной нервной системы связаны гипергидроз, признаки вегетативно-сосудистой дистонии. Часто формируются неврозы и реактивные состояния (трудный характер больных).
Урогенитальная патология проявляется орхитами и эпидидимитами у мужчин, оофоритами, сальпингитами, эндометритами и нарушениями менструального цикла у женщин. Характерны невынашиваемость беременности, дисменорея, бесплодие.
Хронический активный бруцеллез может длиться до 2-3 лет, а при повторном инфицировании - и значительно дольше. Его переход в хроническую неактивную форму характеризуется отсутствием образования свежих очагов и интоксикации, преобладанием функциональных нарушений, длительным сохранением сывороточных АТ и положительной кожно-аллергической пробы Бюрне.
Последствия бруцеллеза (резидуальный бруцеллез)
Последствия перенесенного заболевания (резидуальный бруцеллез) сохраняются при отсутствии возбудителя в организме человека.
В основном характерны нарушения функционального характера вследствие иммуноаллергической перестройки и расстройств вегетативной нервной системы:
- головная боль;
- слабость;
- плохой сон;
- снижение работоспособности;
- потливость;
- раздражительность;
- изменения нервно-психической сферы;
- артралгии;
- иногда субфебрилитет вегетативного генеза.
Вместе с тем тяжелые последствия бруцеллеза могут быть связаны с развитием необратимых фиброзно-рубцовых изменений с вовлечением нервных стволов, сплетений, корешков, что провоцирует появление разнообразных неврологических симптомов. Органические изменения опорно-двигательного аппарата, иногда развивающиеся у перенесших бруцеллез (деформации суставов, анкилозы, контрактуры, атрофия мышц, спондилез), в ряде случаев требуют хирургического лечения и определения группы инвалидности.
Иммунологические реакции отрицательные или проявляются в низких титрах.
Течение заболевания на современном этапе отличает ряд особенностей:
- лихорадочная реакция чаще ограничивается субфебрилитетом;
- поражения опорно-двигательного аппарата проявляются в первую очередь болевыми реакциями, реже - очаговыми воспалительными процессами;
- лимфаденопатия и увеличение селезенки развиваются не более чем в 25% случаев;
- очаговые поражения в 12-15% случаев развиваются рано, уже на 2-3-й неделе болезни;
- органические поражения ЦНС наблюдают редко;
- поражения висцеральных органов при хроническом бруцеллезе преимущественно проявляются нарушениями со стороны сердечно-сосудистой системы;
- резидуальный бруцеллез протекает в основном с функциональными, а не с органическими нарушениями.
Дифференциальная диагностика
Острый бруцеллез дифференцируют от заболеваний, сопровождающихся длительной лихорадкой (тифопаратифозные заболевания, малярия, туберкулез, неспецифические системные заболевания, ВИЧ-инфекция, сепсис, лимфогрануломатоз и др.). При остром бруцеллезе отмечают неправильный характер температурной кривой, появление микрополиаденопатии, ознобов, потливости, увеличение размеров печени и селезенки. В ряде случаев в этот период болезни обнаруживают фиброзиты и целлюлиты. Характерна выраженность клинических симптомов (особенно высокой температуры тела) при достаточно удовлетворительном самочувствии.
При подостром и хроническом бруцеллезе необходимо исключить ревматизм и ревматоидный артрит, туберкулезные очаговые поражения, сифилитические и гонорейные артриты. При этих формах бруцеллеза периоды повышенной температуры тела сменяют эпизоды апирексии, жалобы больных многочисленны и разнообразны (боли в суставах, мышцах, костях, парестезии и др.), характерны очаговые полиорганные проявления и аллергические реакции, фиброзиты и целлюлиты.
Лабораторная диагностика
Изменения гемограммы при бруцеллезе:
- лейкопения;
- относительный лимфоцитоз;
- моноцитоз;
- тромбоцитопения;
- нормальная или умеренно повышенная СОЭ. Изменения ликвора при нейробруцеллезе:
- лимфоцитарный плеоцитоз;
- повышенное количество белка;
- нормальное содержание глюкозы. Бактериологическая диагностика
С целью выделения возбудителя возможны посевы крови, пунктатов лимфатических узлов, спинномозговой жидкости, костного мозга. Вместе с тем бактериологические исследования проводят редко из-за длительности и сложности культивирования возбудителя, а также относительно низкой высеваемости. В связи с высокой контагиозностью бруцелл работу с ними можно проводить только в специально оборудованных (режимных) лабораториях.
Серологические реакции
Широко применяют РА Райта, РСК, РНГА, РИФ, определяющие нарастание титров специфических АТ в парных сыворотках. Минимальный диагностический титр реакций - 1:200. Ценность исследований повышается при клинических признаках бруцеллеза. Реакция Райта наиболее информативна при остром бруцеллезе, при хронической форме заболевания, кроме того, можно выявить неполные АТ в реакции Кумбса. В последнее время с успехом применяют реакцию лизиса бруцелл под воздействием сыворотки крови больного.
Иммунологические реакции
В последнее время для обнаружения Аг бруцелл в биологических средах (в первую очередь в крови) в практику внедряют реакцию агрегатгемагглютинации, РКА и РЛА с антительными диагностикумами, ИФА.
Для получения адекватных результатов рекомендовано одновременное применение 3-4 серологических методов исследования (комплексная серодиагностика).
Внутрикожная аллергическая проба Бюрне (см. рис. 27 доп. илл.) с введением бруцеллина (белковый экстракт бульонной культуры бруцелл) проводится не ранее 20-25 дней от начала болезни, учитывая время, необходимое для нарастания специфической сенсибилизации организма к Аг бруцелл.
Результат оценивается через 24 и повторно через 48 ч после постановки пробы:
- реакция считается положительной при диаметре отека более 3 см;
- развитие гиперемии и болезненность в месте введения бруцеллина при этом не обязательны.
Положительную пробу Бюрне наблюдают при всех формах бруцеллеза, включая латентное течение инфекционного процесса, она годами сохраняется после реконвалесценции. Проба может быть положительной также у лиц, привитых живой противобруцеллезной вакциной, и у сотрудников лабораторий, длительно контактировавших с Аг бруцелл.
При введении бруцеллина происходит дополнительная сенсибилизация организма и может возникнуть выраженная местная реакция (некроз). Во избежание этих осложнений в практику внедряют реакции повреждения нейтрофилов и лейкоцитолиза. Их ставят с кровью больного в пробирке без введения аллергена в организм.
Осложнения и исходы
Тяжелым, но не частым (менее чем в 2% случаев) осложнением бруцеллеза считают развитие вторичного эндокардита. В большинстве случаев, при адекватном и своевременном лечении, бруцеллез заканчивается полным выздоровлением, критерием которого является стойкое отсутствие основных клинических проявлений бруцеллеза в течение последних 2 лет. Вместе с тем хронический бруцеллез может продолжаться годами с обострениями, ремиссиями и рецидивами. При отсутствии лечения летальность может достигать 3%.
Лечение
Режим амбулаторный в легких и стационарный в тяжелых случаях заболевания. Этиотропное лечение эффективно при остром бруцеллезе. Меньший
эффект наблюдают при активации процесса у больных подострыми и хроническими формами.
Особенности этиотропного лечения при бруцеллезе:
- оптимальным считают одновременное назначение двух антибактериальных препаратов, один из которых хотя бы частично проникает через клеточную мембрану;
- длительное курсовое лечение;
- при рецидивах заболевания целесообразно назначение повторных курсов со сменой препаратов;
- при подостром и хроническом бруцеллезе этиотропное лечение проводят в стадиях повторной генерализации.
Применяют одно из следующих сочетаний с учетом противопоказаний (дети до 15 лет, беременность, лактация, эпилепсия).
• Рифампицин (по 600-900 мг в сутки) и доксициклин (по 200 мг в сутки) внутрь непрерывным курсом, длительность не менее 6 нед. При рецидивах курс лечения повторяют.
• Доксициклин (по 100 мг 2 раза в сутки) курсом на 3-6 нед и стрептомицин (по 1 г внутримышечно 2 раза в сутки) в течение 2 нед. Это сочетание эффективнее предыдущего, особенно при спондилите, но применяемые препараты проявляют высокую токсичность. Вместо стрептомицина можно использовать гентамицин по 5 мг/кг в сутки.
• Офлоксацин (по 200-300 мг 2 раза в сутки) внутрь и рифампицин в вышеуказанных дозах. Вместо стрептомицина можно использовать гентамицин по 5 мг/кг в сутки.
Детям до 8 лет можно назначить комбинацию рифампицина и бактрима в возрастных дозах, беременным предпочтительна монотерапия рифампицином. При тяжелых спондилитах обычно рекомендуют схемы:
- доксициклин, рифампицин и гентамицин в течение первых 2-3 нед;
- затем до 6 нед - рифампицин с доксициклином.
Длительность применения препаратов объясняет целесообразность контроля над их приемом больными.
В комплексном лечении бруцеллеза назначают дезинтоксикационные средства по общим принципам их применения, АТФ, метионин, мягкие иммуностимуляторы (дибазол, пентоксил, тималин и др.) под контролем иммунного статуса пациента. Широко используют противовоспалительные средства - нестероидные противовоспалительные препараты (индометацин, бруфен и др.). При болях (невриты, невралгии, боли вегетативного характера) проводят симптоматическое лечение в виде новокаиновых блокад 1% раствором новокаина, внутривенные введения 0,25% раствора новокаина в возрастающих дозах.
Применение глюкокортикоидов следует проводить с большой осторожностью при поражениях ЦНС (менингит, менингоэнцефалит), а также при выраженных воспалительных изменениях (орхиты, невриты и др.).
В период стойкой ремиссии при хронической форме бруцеллеза и на стадии остаточных признаков назначают лечебную физкультуру, физиотерапевтическое и санаторно-курортное лечение (УВЧ, кварц, парафиновые аппликации, родоновые ванны).
Выписку из стационара проводят при полном клиническом выздоровлении или при достижении стойкой ремиссии. После выписки пациенты находятся на диспансерном наблюдении в течение 2 лет, каждые 5-6 мес проводят их
комплексное клинико-лабораторное обследование, при необходимости - повторную госпитализацию.
Эпидемиологический надзор
Основан на результатах оценки эпизоотической и эпидемической обстановки. В связи с этим в организации и проведении противобруцеллезных мероприятий важную роль играют своевременный обмен информацией и совместная деятельность ветеринарной и санитарно-эпидемиологической служб по выявлению заболеваний среди животных и людей и оценке факторов риска их возникновения.
Профилактические мероприятия
Профилактика и борьба с бруцеллезом основаны на проведении комплекса ветеринарно-санитарных и медико-санитарных мероприятий, направленных на снижение и ликвидацию заболеваемости бруцеллезом сельскохозяйственных животных.
Владельцы животных, руководители хозяйств независимо от форм собственности, фермеры, арендаторы и др. в соответствии с Законом РФ «О ветеринарии» обязаны обеспечивать проведение ограничительных, организационнохозяйственных, специальных и санитарных мероприятий по предупреждению заболевания животных бруцеллезом, а также по ликвидации очага инфекции в случае его возникновения с выделением необходимых материально-технических и финансовых средств.
Поголовье животных в неблагополучных зонах необходимо систематически обследовать на бруцеллез с помощью серологических и аллергологических тестов для своевременного выявления и ликвидации больных животных. В качестве вспомогательной меры в эндемичных по бруцеллезу регионах проводят активную иммунопрофилактику бруцеллеза животных введением живой вакцины. Прививкам подлежат постоянные и временные работники животноводства, а также работники мясокомбинатов. Большое значение имеют обезвреживание сырья и продуктов животноводства, кипячение и пастеризация молока и молочных продуктов, другие мероприятия. Особого внимания требуют помещения, где содержится скот. После вывоза навоза или удаления абортированных плодов и последа помещение следует обеззаразить 20% раствором хлорной извести, 2% раствором формальдегида или 5% раствором мыльно-креозоловой смеси. К работе по уходу за животными не допускают подростков, беременных и лиц, страдающих хроническими заболеваниями. Все лица, допущенные к работе с животными, должны быть обеспечены спецодеждой, также необходимо умение пользоваться дезинфицирующими средствами. Большое значение имеет неукоснительное соблюдение правил личной гигиены. При этом проводят систематическое профилактическое обследование персонала, занятого работой с животными (не реже 1 раза в год). Важную роль играет разъяснительная работа об опасности употребления в пищу сырого молока и невыдержанных сыров и брынзы, использования шерсти животных из неблагополучных по бруцеллезу хозяйств. Работникам животноводства (а по показаниям - населению неблагополучных районов) вводят бруцеллезную сухую живую вакцину (накожно в объеме 2 капель или подкожно - 5 мл). Ревакцинацию проводят в половинной дозе через 10-12 мес.
Мероприятия в эпидемическом очаге
Госпитализацию больных осуществляют только по клиническим показаниям, так как больной человек эпидемиологической опасности не представляет. Диспансерное наблюдение за переболевшим проводят в течение 2 лет после клинического выздоровления. Лица, соприкасавшиеся с больными животными, подлежат клинико-лабораторному обследованию, которое повторяют через 3 мес. В качестве экстренной профилактики назначают внутрь в течение 10 дней рифампицин (по 0,3 г 2 раза в день), доксициклин (по 0,2 г 1 раз в день), тетрациклин (по 0,5 г 3 раза в день).
ИЕРСИНИОЗЫ (YERSINIOSES)
Иерсиниозы (кишечный иерсиниоз и псевдотуберкулез) - сапрозооантропонозные инфекционные заболевания, характеризующиеся полиорганностью клинических проявлений с частым поражением ЖКТ, разнообразной токсико-аллергической симптоматикой, склонностью к генерализации, затяжному и хроническому течению с возможным формированием иммунопатологических состояний. Сходство этиологических характеристик, а также патогенеза, патолого-анатомических изменений, эпидемиологии и клинических проявлений позволяет рассматривать псевдотуберкулез и кишечный иерсиниоз как близкие друг другу кишечные инфекции.
Краткие исторические сведения
Возбудитель псевдотуберкулеза (Yersinia pseudotuberculosis) открыт Л. Малассе и В. Виньялем (1883), возбудитель кишечного иерсиниоза (Y. enterocolitica) - Д. Шляйфстейном и М. Колеманом (1939). Свое название бактерии получили в честь швейцарского бактериолога А. Иерсена, открывшего возбудителя чумы (1894). Постановлением Международного комитета по систематике бактерий (1972) все упомянутые микроорганизмы включены в состав рода Yersinia семейства Enterobacteriaceae.
Первые случаи псевдотуберкулеза у человека в виде абсцедирующих мезаденитов описали В. Массхоф и В. Кнапп (1953). В 1959 г. на Дальнем Востоке СССР наблюдали эпидемию заболевания, получившего в то время название дальневосточной скарлатиноподобной лихорадки.
Заболевание проявлялось в виде сочетания нескольких синдромов:
- общетоксического;
- артралгического;
- экзантематозного;
- катарального.
Позднее В.А. Знаменский и А.К. Вишняков из фекалий больных дальневосточной скарлатиноподобной лихорадкой выделили палочки псевдотуберкулеза (1965). Этиологическую роль возбудителя в возникновении дальневосточной скарлатиноподобной лихорадки доказал В.А. Знаменский в опыте по самозаражению.
Первые заболевания людей, вызванные Y. enterocolitica, зарегистрированы в 1962-1963 гг. во Франции, Бельгии, а также Швеции и других Скандинавских странах.
Этиология
Y. pseudotuberculosis и Y. enterocolitica - подвижные (перитрихи) грамотрицательные факультативно-анаэробные споронеобразующие палочки рода Yersinia семейства Enterobacteriaceae. Бактерии неприхотливы к питательным средам, могут расти на так называемых голодных средах (фосфатно-буферный раствор). Оптимальная температура для роста от 22 до 28 °С, размножение иерсиний также может происходить при колебаниях температуры от 2 до 40 °С, что позволяет отнести их к психрофильным бактериям. В холодильниках при 4-6 °С микроорганизмы способны длительно сохраняться и размножаться на пищевых продуктах.
Выраженность патогенных свойств иерсиний подвержена значительным колебаниям в зависимости от вида возбудителя, а также от условий существования бактерий в теплокровных организмах человека и животных или во внешней среде. К факторам патогенности иерсиний относятся поверхностные белки Yop (Yersinia outer proteins, белки наружных мембран), различные токсины (энтеротоксин, ЛПС-комплекс, цитотоксины), иерсиниабактин, токсин YPM и др.
Белки наружных мембран определяют способность возбудителей к адгезии и инвазии (белок Yop1), антифагоцитарную и антибактерицидную активность микроорганизмов (белки-эффекторы YopE, YopH, YopO и др.). Y. pseudotuberculosis обладает значительно более выраженной инвазивной активностью, что обусловливает частые случаи генерализации псевдотуберкулеза и трудности выделения возбудителя из кишечника. У Y. enterocolitica инвазивность, за небольшим исключением (серовар О:9), не выражена.
Энтеротоксин Y. enterocolitica играет ведущую роль в развитии выраженной диареи, энтеротоксин Y. pseudotuberculosis имеет меньшее патогенетическое значение.
Иерсиниабактин определяет способность Y. pseudotuberculosis и биовара 1 Y. enterocolitica к утилизации железа крови теплокровных животных и человека, с чем связано интенсивное размножение возбудителей при иерсиниозах у пациентов, страдающих талассемией, гемохроматозами, гемолитическими анемиями, циррозами печени. С токсином YPM предположительно связана возможность развития иммунопатологических нарушений.
К факторам патогенности относят также жгутики, обусловливающие подвижность микроорганизмов, способность иерсиний к реверсии в S-, R- и L-формы, VW-Аг, регулирующие выработку белков-эффекторов и др.
Бактерии имеют термолабильные жгутиковые Н-Аг, термостабильные полисахаридные соматические О-Аг, а также Аг вирулентности V- и W-, расположенные на наружной мембране. По структуре О-Аг Y. pseudotuberculosis разделяют на 8 сероваров. Большинство штаммов (60-90%) принадлежит к первому серовару (О:1), достаточно распространены также серовары О:3 и О:4. По структуре О-Аг у Y. enterocolitica выделяют около 60 сероваров, большинство известных изолятов принадлежит к сероварам О:3 (15-60%), часть к О:5,27 (10-50%), О:7,8 (5-10%) и О:9 (1-30%).
Кроме того, по биохимическим признакам выделяют биовары иерсиний:
- 1 биовар Y. pseudotuberculosis;
- 6 биоваров Y. enterocolitica.
Неоднородность О-Аг иерсиний определяет их внутривидовые и общие для энтеробактерий антигенные связи с чумной палочкой, а также с сальмонеллами, бруцеллами, шигеллами, холерным вибрионом, протеями, гафниями. Важ-
ную патогенетическую роль играют антигенные связи иерсиний с некоторыми тканевыми Аг человека (щитовидная железа, синовиальные оболочки суставов, эритроциты, печень, почки, селезенка, лимфатические узлы, толстая кишка, червеобразный отросток, вилочковая железа).
Иерсинии устойчивы к замораживанию и оттаиванию, способны длительно существовать в почве и воде. Эти свойства имеют большое эпидемиологическое значение.
Вместе с тем бактерии чувствительны:
- к воздействию солнечных лучей;
- высыханию;
- кипячению;
- действию обычных дезинфектантов.
Эпидемиология
Резервуар и источники инфекции - различные животные, главным образом свиньи, крупный и мелкий рогатый скот, собаки, грызуны и др. Заражение от людей происходит редко и только при участии Y. enterocolitica. При псевдотуберкулезе, как полагают, больной человек не опасен для окружающих. К возбудителям восприимчивы различные сельскохозяйственные, а также домашние животные. Основной резервуар возбудителя и источник заболеваний человека - синантропные и другие грызуны. Они высоковосприимчивы к иерсиниям, распространены практически повсеместно, всегда имеют возможность инфицировать своими выделениями продукты питания, воду и почву, где возбудитель не только сохраняется длительное время, но и при определенных условиях размножается. В популяции мышевидных грызунов реализуется алиментарный путь передачи возбудителя. В местах обитания этих животных в определенных биотопах формируются природные очаги.
Возбудитель псевдотуберкулеза относится к факультативным паразитам, способным обитать и размножаться как в организме теплокровных животных и человека, так и в объектах окружающей среды:
- почве;
- воде;
- растительных субстратах.
Поэтому важным резервуаром Y. pseudotuberculosis также может быть почва. Роль грызунов в распространении псевдотуберкулеза незначительна.
Механизм передачи - фекально-оральный, ведущий путь передачи - пищевой. Передача возбудителей реализуется при употреблении сырых либо неправильно термически обработанных мясных, молочных и овощных продуктов, в том числе хранившихся в холодильнике. Неприхотливость иерсиний к условиям обитания и способность размножаться при низких температурах способствуют накоплению их в продуктах животного и растительного происхождения. Эпидемиологическое обследование большого числа вспышек псевдотуберкулеза позволило установить, что из всех пищевых продуктов наибольшее значение имеют овощи и корнеплоды, затем молочные продукты (творог, сыр) и в значительно меньшей степени фрукты (сухофрукты), хлебобулочные и кондитерские изделия. Наибольшее количество вспышек псевдотуберкулеза произошло после употребления в пищу свежей капусты, моркови, зеленого лука, длительное время хранившихся в овощехранилищах. Низкая температу-
ра, высокая влажность в овощехранилищах служат оптимальными условиями для размножения иерсиний.
Определенная роль в этом принадлежит различным объектам внешней среды - инвентарю, таре, различным емкостям и контейнерам, обсемененность которых всегда имеет место. В некоторых овощехранилищах в апрелемае иерсинии выявляют в 40-50% проб с различных овощей и фруктов, а с моркови, капусты и лука - в 100% случаев. Помимо овощехранилищ, определенная роль принадлежит теплицам, в которых выращивают зелень, огурцы, помидоры, зеленый лук. Второе место занимает водный путь передачи. Он обычно реализуется при употреблении воды из открытых водоемов, инфицированной испражнениями животных. Не исключен и контактно-бытовой путь передачи. Описаны семейные и внутрибольничные вспышки иерсиниоза, при которых источником бактерий стали больные взрослые, обслуживающий персонал больницы или ухаживающие за детьми родители. В единичных случаях отмечали заболевания, связанные с переливанием крови (при иерсиниозе) и применением диагностической аппаратуры (при псевдотуберкулезе).
Естественная восприимчивость людей
Естественная восприимчивость людей, по-видимому, невелика. У практически здоровых лиц инфекционный процесс часто протекает бессимптомно. Манифестные и тяжелые формы возникают в основном у детей с преморбидным фоном, ослабленных, на фоне различных нарушений иммунного статуса.
Основные эпидемиологические признаки
Инфекции регистрируют повсеместно. Заболеваемость в различных регионах РФ варьирует от 3-5 до 100 случаев на 100 000 населения, имеет тенденцию к дальнейшему росту, носит как спорадический, так и вспышечный характер. В 2007 г. в России зарегистрировано 3180 случаев иерсиниоза, что составило 2,2 на 100 000 населения.
Рост заболеваемости в развитых странах связан:
- с нарушением экологического равновесия в природе;
- увеличением численности грызунов;
- ускорением урбанизации;
- созданием больших складов продуктов, особенно овощехранилищ;
- нарушением санитарно-гигиенических норм хранения продуктов питания;
- обеспеченностью населения холодильниками;
- возрастанием доли общественного питания в городах.
В России ежегодно регистрируют 8 000-10 000 случаев псевдотуберкулеза. Его характерной особенностью является вспышечная заболеваемость, на долю которой в крупных городах в отдельные годы приходится до 50% общего числа заболевших. Вспышки возникают в ДДУ и школах, особенно в загородных детских коллективах, значительно реже на предприятиях или в учебных заведениях, имеющих общественные столовые. В последние годы стала преобладать спорадическая заболеваемость. Вспышки псевдотуберкулеза бывают распространенными, когда заболеваемость диффузно поражает население всего города или населенного пункта, и локальными, при которых заболеваемость ограничивается одним коллективом.
Указанное определяется местом инфицирования поступающих пищевых продуктов:
- в первом случае - овощехранилище или центральные холодильники;
- во втором случае - пищеблок одного учреждения.
При псевдотуберкулезе основную роль в заболеваемости людей играют сырые овощи, особенно приготовленные из них салаты при несоблюдении санитарных правил работы, технологии приготовления и хранения готовых продуктов. В редких случаях фактором передачи может быть квашеная капуста и соленые огурцы, а также вторично инфицированные любые пищевые продукты (компоты, молоко, сыр, сливочное масло). Имеют место вспышки, связанные с сухарями, печеньем и другими хлебобулочными изделиями, загрязненными выделениями грызунов.
При иерсиниозе вспышки возникают редко. Имеют место смешанные (псевдотуберкулез-иерсиниоз) вспышки, в большинстве связанные с употреблением в пищу инфицированных овощей. Возможны ВБИ с длительным и вялым течением и внутрисемейные случаи иерсиниоза, обычно ограничивающиеся детьми и ухаживающими за ними родственниками. Заболеваемость регистрируют круглый год, отмечая некоторое увеличение в октябре-ноябре. В последние годы обе инфекции приобрели сходную характеристику сезонности. Обладая значительной устойчивостью к физическим и химическим факторам, широким диапазоном адаптационных свойств, а также психрофильностью, возбудители иерсиниоза и псевдотуберкулеза способны длительно сохраняться в различных продуктах (молоко, молочные и мясные продукты) или находиться на поверхности овощей, фруктов, зелени, хлебобулочных изделий и т.д. Особенностью иерсиниоза в отличие от псевдотуберкулеза будет его скрытый характер с большим числом неманифестных форм и выраженным профессиональным характером инфицирования. Псевдотуберкулез регистрируют во всех возрастных группах, однако в меньшей степени им заболевают дети до 2 лет и взрослые старше 50 лет, что объясняется их меньшей связью с общественным питанием. В то же время иерсиниоз чаще встречают среди детей от 1 года до 4 лет. Заражение их происходит от больных иерсиниозом, и, возможно, носителей, ухаживающих за ними. При псевдотуберкулезе маленькие дети могут заболеть при включении в прикорм овощей и фруктов (соков).
Патогенез
В большинстве случаев заражение возможно лишь при превышении определенной концентрации бактерий (106-107 микробных клеток) в пищевом продукте или воде. При высокой заражающей дозе и инвазивности (серовар О:1 Y. pseudotuberculosis) входными воротами инфекции может стать слизистая оболочка ротоглотки, где развивается катаральный процесс. Известную роль играют кислотный барьер желудка и развитие на его слизистой оболочке катарально-эрозивных изменений (табл. 4-1).
В местах основной колонизации возбудителей (дистальные отделы подвздошной кишки, слепая кишка и начало толстой кишки) происходит интервенция иерсиний через М-клетки в лимфоидные образования кишечника с развитием воспалительных изменений катарального, катарально-геморрагического и даже язвенно-некротического характера. Под влиянием энтеротоксина иерсиний возникает секреторная диарея, связанная с активацией аденилатциклазной системы в эпителии кишечника и накоплением циклических нуклеотидов. В развитии секреторного процесса известную роль играют ПГ. Всасывание в кровь ЛПС-комплекса (эндотоксина) возбудителей обусловливает синдром интоксикации.
Таблица 4-1. Патогенез иерсиниозов
Возникновение диареи секреторно-экссудативного характера, болей в животе, других диспепсических расстройств и общетоксического синдрома связано в первую очередь с образованием медиаторов воспаления, действием цитотоксинов отдельных типов иерсиний, с энтеротоксигенными свойствами штаммов (они выражены, например, у сероваров О:3, 0:5,27, 0:7,8 Y. еnterocolitica) и развитием эндотоксинемии. В таких случаях иерсиниозы протекают в виде локализованной гастроинтестинальной формы.
В дальнейшем развитии инфекционного процесса, как правило, играют роль штаммы Y. enterocolitica серовара 0:9 и особенно - Y. pseudotuberculosis, обладающие солидным инвазивным потенциалом. Последний обусловлен способностью к синтезу инвазинов, цитотоксинов, гиалуронидазы и нейраминидазы. Иерсинии проникают в энтероциты, далее в слизистый и подслизистый слои кишки, лимфоидные образования кишечной стенки. На уровне подслизистого слоя кишечника возбудители вступают во взаимодействие с макрофагами, неспособными к внутриклеточному киллингу (незавершенный фагоцитоз). Вследствие этого бактерии накапливаются в них, стимулируя развитие лейкоцитарной инфильтрации. Размножение в эпителиоцитах и макрофагах сопровождается распадом зараженных клеток, развитием эрозий и язв. Дальнейшее распространение иерсиний приводит к поражению регионарных мезентериальных лимфа-
тических узлов, аппендикса. Характерно формирование очагов гранулематозного воспаления с гиперемией и гиперплазией мезентериальных лимфатических узлов и возможным развитием микроабсцессов. Патогенетические процессы, ведущие к поражению лимфатических образований кишечника и мезентериальных лимфоузлов, обусловливают клинические проявления абдоминальной формы иерсиниозов.
В условиях незавершенного фагоцитоза иерсинии, находящиеся внутри и вне макрофагов, диссеминируют по органам макрофагальной системы, обусловливая формирование мелких некротических очагов или микроабсцессов, а также изменений дистрофического характера. Вторичные внутриорганные очаги размножения возбудителей поддерживают и усиливают бактериемию и токсинемию. Развивается гепатолиенальный синдром. В клиническом аспекте эти механизмы соответствуют генерализованной форме инфекции с проявлениями органных поражений воспалительного и (крайне редко, при иммуносупрессии) септического характера.
В патогенезе иерсиниозов помимо инфекционно-токсических факторов важную роль играют аллергические компоненты, приводящие к проявлениям аллергических реакций замедленного и немедленного типов.
При антигенном сходстве иерсиний с тканевыми Аг человеческого организма (Аг интерстиция миокарда, синовиальных оболочек суставов, эндотелия кишечника и других органов) в ходе инфекционного процесса возможно образование и накопление ауто-АТ, формирование аутоиммунных комплексов, оказывающих повреждающее воздействие на многие органы и ткани. В клинической картине проявляются органные нарушения иммунопатологического генеза.
Они лежат в основе вторично-очаговой формы иерсиниозов, способствуют рецидивирующему и хроническому течению заболевания с длительной персистенцией возбудителя в организме, а в дальнейшем - развитию системных заболеваний соединительной ткани:
- системной красной волчанки;
- ревматоидного артрита;
- узелкового периартериита и др.
При иерсиниозах (в большей степени при псевдотуберкулезе) отмечают транзиторную недостаточность защитных реакций человека на уровне как специфических, так и неспецифических факторов (синтез АТ IgM и IgG, опсоно-фагоцитарная активность, бактериолиз и др.).
Установлены дефекты фагоцитарных потенций полиморфно-ядерных лейкоцитов - снижение активности нейтрофилов в остром периоде болезни и ее нормализация на стадии реконвалесценции. Однако при развитии так называемых вторично-очаговых форм активность нейтрофилов остается низкой.
Особенность иерсиний, обладающих инвазивными свойствами (более всего они присущи холодовым штаммам, выращенным при 4-12 °С), - внутриклеточное паразитирование, в частности в макрофагах, что во многом связано со снижением активности кислородзависимого потенциала фагоцитов.
Выявлены также нарушения со стороны клеточного иммунитета:
- в острой стадии болезни отмечено снижение числа Т-лимфоцитов, некоторое увеличение В-лимфоцитов;
- в период реконвалесценции эти изменения выравниваются.
Однако при развитии вторично-очаговых форм этого выравнивания не происходит. Нельзя забывать о том, что определенный иммуносупрессивный
эффект может быть связан и с назначением некоторых антибиотиков, например левомицетина. При иерсиниозах с массивной дозой возбудителя выявлено истощение Т-независимой зоны лимфатических узлов и селезенки, образование в них больших участков некроза. По-видимому, с этим связано угнетение синтеза IgM и IgG. Последнее в определенной степени может быть объяснено и естественной иммунологической толерантностью организма к некоторым бактериальным Аг вследствие их антигенной общности с тканевыми Аг макроорганизма.
В период реконвалесценции нарастают реакции гуморального и клеточного иммунитета, активность завершенного фагоцитоза. Постинфекционный иммунитет при псевдотуберкулезе стойкий, но типоспецифический.
На основе изучения факторов неспецифической и специфической защиты при иерсиниозах разработан комплекс показателей, позволяющих на ранних сроках болезни прогнозировать ее дальнейшее неблагоприятное течение:
- повышение содержания ЦИК;
- снижение показателей фагоцитарной функции моноцитов и нейтрофилов периферической крови;
- снижение функциональной активности Т-лимфоцитов.
Клиническая картина
Единой общепринятой клинической классификации иерсиниозов до сих пор не существует, хотя к этому и вынуждает многообразие форм и вариантов заболеваний. В РФ предложена клиническая классификация Н.Д. Ющука и
соавт. (2003) (табл. 4-2).
Таблица 4-2. Клиническая классификация иерсиниозов
Инкубационный период при псевдотуберкулезе варьирует от 3 до 18 дней, при кишечном иерсиниозе - в пределах 1-6 сут. В клинических проявлениях иерсиниозов обычно наблюдают сочетание нескольких синдромов. Степень их выраженности неодинакова при разных формах и вариантах заболевания.
Общетоксический синдром проявляется наиболее часто. В начале болезни отмечают повышение температуры тела до 38-40 °С, озноб, головную боль, миалгии, общую слабость, снижение аппетита. Температурная реакция продолжается в течение 7-10 дней, а при генерализованной форме болезни - значительно дольше.
Диспепсический синдром
Боли в животе, тошнота, диарея, рвота вместе с признаками токсикоза составляют клиническую основу гастроинтестинальной формы иерсиниозов. Чаще встречают при поражениях, вызванных Y. еnterocolitica.
Катаральный синдром
Встречают наиболее часто при псевдотуберкулезе (до 80% случаев). Характерны боли в горле, гиперемия слизистой оболочки ротоглотки, пятнистая энантема на слизистых.
Экзантематозный синдром
Чаще наблюдают при псевдотуберкулезе (см. рис. 28 доп. илл.). Проявляется пятнисто-папулезной (мелкоточечной, крупнопятнистой, кольцевидной) сыпью на различных участках кожных покровов. Сыпь обычно появляется на 2-6-й день болезни. Характерно появление сыпи скарлатинозного мелкоточечного характера на лице и шее в виде капюшона, дистальных отделах конечностей в виде носков и перчаток. При кишечном иерсиниозе проявления экзантемы наблюдают реже.
Артралгический (артропатический) синдром
Отмечают боли в суставах кистей, стоп, коленных, локтевых и др. Характерные признаки - отек и ограничение движений в суставах. Наряду с выраженными проявлениями токсикоза и развитием гепатолиенального синдрома эти признаки иерсиниозов чаще встречают при генерализованных поражениях.
Гастроинтестинальная форма
Часто встречающаяся клиническая форма иерсиниозов (более 50% случаев). Она протекает в виде острых проявлений гастроэнтерита или энтероколита, реже гастроэнтероколита и клинически во многом напоминает другие острые кишечные инфекции, прежде всего сальмонеллезы, ПТИ и шигеллезы (см. разделы «Сальмонеллез», «Пищевые токсикоинфекции», «Шигеллезы»). Признаки поражения ЖКТ проявляются более чем в половине случаев, при этом выраженность и длительность диареи более характерна для заболеваний,
вызванных Y. enterocolitica. Интоксикация чаще возникает одновременно с диспепсическим синдромом, но в 1/3 случаев может предшествовать ему.
В 10-20% случаев в начале заболевания отмечают умеренно выраженные признаки катарального воспаления со стороны верхних дыхательных путей. В части случаев возникают дизурические явления (15-17%), артралгии в разгаре болезни, экзантема на 2-6-й день от начала заболевания, жжение в ладонях и подошвах с их последующим крупнопластинчатым шелушением. При псевдотуберкулезе, как уже указывалось выше, кардинальными признаками могут быть своеобразная скарлатиноподобная экзантема и малиновый язык. Сыпь более выражена на сгибательных поверхностях конечностей и в естественных складках кожи. Элементы сыпи исчезают в срок от нескольких часов до 3-4 сут, оставляют после себя мелкочешуйчатое или крупнопластинчатое (на ладонях и подошвах) шелушение.
Приблизительно у половины больных можно наблюдать небольшое увеличение печени и реакцию со стороны периферических лимфатических узлов. В отличие от сальмонеллезов изолированные поражения желудка (острый гастрит) при иерсиниозах практически не отмечают.
При легком течении болезни все клинические проявления могут исчезнуть за 2-3 дня, в тяжелых случаях заболевание приобретает волнообразное течение с высокой температурой тела, развитием обезвоживания, сохранением основных проявлений до 2 нед и более.
Абдоминальная форма
Варианты абдоминальной формы - острый аппендицит, мезентериальный лимфаденит, терминальный илеит могут разворачиваться в виде самостоятельного процесса или вслед за проявлениями диареи. По клиническим признакам они практически не отличаются от аналогичных вариантов острой хирургической патологии брюшной полости другой этиологии.
Вместе с тем варианты абдоминальной формы иерсиниозов отличаются большей выраженностью лихорадки и других проявлений интоксикации с первого дня болезни, а также довольно частым развитием сопутствующей внеабдоминальной симптоматики:
- артралгий и миалгий;
- экзантемы;
- инъекции сосудов склер;
- периферической лимфаденопатии;
- гиперемии мягкого нёба;
- своеобразного малинового языка;
- увеличения печени.
Заболевание продолжается от нескольких дней до 3-4 нед, иногда принимает длительное рецидивирующее течение. Нередко требуется хирургическое вмешательство, проводимое с учетом распространенности и характера воспалительного процесса (от катарального до флегмонозного и гангренозного).
Генерализованная форма
Отличается полисиндромностью проявлений. На фоне развития общетоксического синдрома с высокой лихорадкой часто отмечают выраженные артралгии, сковывающие движения больных (до 60-70% случаев), реже развиваются артриты и периартриты. Могут быть боли при глотании и катараль-
ные изменения со стороны верхних дыхательных путей. Со 2-3-го дня болезни отмечают разнообразную (в том числе скарлатиноподобную) экзантему на туловище и конечностях, захватывающую ладони и подошвы (до 90% случаев). Характерны концентрация сыпи вокруг суставов и ее тенденция к слиянию. Одновременно с экзантемой могут наблюдаться сосудистые вегетативные реакции в виде гиперемии лица и шеи, дистальных отделов конечностей (симптомы капюшона, носков, перчаток), а также отечность кистей и стоп. После исчезновения сыпи на местах ее бывшей локализации возникает мелкочешуйчатое или крупнопластинчатое (на ладонях и подошвах) шелушение кожи.
Диспепсический синдром при генерализованной форме псевдотуберкулеза может отсутствовать или проявляется лишь в начале клинического процесса. В случаях заболевания, вызванного Y. enterocolitica он, как правило, выражен и иногда сохраняется длительно. При этом часто (более 50% случаев) наблюдаются боли в животе различной интенсивности, с преимущественной локализацией в правой подвздошной области. Они возникают после повышения температуры тела. Приблизительно в 25% случаев развиваются тошнота, рвота, неустойчивый стул. Долго сохраняется высокая лихорадка, усиливаются другие признаки интоксикации, развивается гепатолиенальный синдром. Заболевание может принять волнообразное, рецидивирующее или хроническое (в 2-3% случаев) течение. Вышеописанная симптоматика характерна для смешанного варианта генерализованной формы.
При длительной бактериемии вследствие полиорганной диссеминации возбудителей клинические варианты генерализованной формы могут проявиться в виде гепатита, пиелонефрита, мелкоочаговой пневмонии. Изредка (менее 1% случаев) встречается серозный менингит или иерсиниозный сепсис, отличающийся крайне тяжелым течением. Указанные состояния развиваются на фоне стихающей или сохраняющейся вышеописанной симптоматики.
Реактивный иерсиниозный гепатит может протекать в безжелтушной или желтушной форме с коротким (3-4 дня) дожелтушным периодом. Заболевание отличается развитием желтухи на высоте интоксикации, непродолжительностью желтухи и гепатомегалии, благоприятным в большинстве случаев течением с умеренно измененными показателями билирубина, аминотрансфераз, нормальной тимоловой пробой. В отличие от вирусных гепатитов в крови отмечают лейкоцитоз, увеличение СОЭ. На фоне антибактериального лечения гепатит протекает доброкачественно, хронизация не развивается. Однако в редких случаях наблюдают развитие тяжелого гепатита вплоть до образования абсцессов в печени (у детей, диабетиков, при анемиях, циррозах).
Вторично-очаговая форма
В своей основе имеет иммунопатологические реакции, формирующиеся при любой из вышеописанных форм иерсиниозов. У отдельных пациентов начальный этап заболевания может протекать субклинически, но обычно эта форма развивается через 2-3 нед от появления первых клинических признаков болезни, а иногда значительно позже (через несколько месяцев). К общим чертам вариантов этой формы относят также волнообразное течение с развитием вегетососудистых нарушений.
Наиболее частый вариант вторично-очаговой формы - артритический. Он протекает в виде иерсиниозного полиартрита с последовательным вовлечением в процесс крупных и мелких суставов (кистей, стоп), реже моноартрита
(20-25% случаев). Поражения суставов конечностей отличают несимметричность, интенсивные боли даже при малейших движениях, отек в области суставов, возникающий значительно чаще, чем гиперемия кожи над ними, отсутствие деструктивных изменений суставных поверхностей (на рентгенограмме). Одновременно нередко развиваются сакроилеиты и тендовагиниты. Возможны лихорадка и другие проявления токсикоза, изменения гемограммы:
- лейкоцитоз;
- увеличение СОЭ;
- эозинофилия.
Длительность проявлений заболевания - от 1 нед до 2 лет (при затяжном или хроническом течении), чаще - 2-3 мес. Прогноз благоприятный.
Узловатая эритема проявляется как самостоятельный вариант вторичноочаговой формы (10-20% больных) или сопровождает артритический вариант, а также обострения и рецидивы генерализованной формы иерсиниозов. Характерно образование единичных или множественных плотных и болезненных подкожных узлов с типичной локализацией на голенях, бедрах, ягодицах. Элементы округлой формы, размером до 2 см и более, с четкими границами. Кожа над ними вначале ярко гиперемирована, в дальнейшем последовательно приобретает цианотичную и желто-зеленоватую окраску. После рассасывания узлов остается пигментация и иногда шелушение кожи. Заболевание длится от нескольких дней до 2-3 нед, течение благоприятное.
Окулоуретросиновиальный синдром (синдром Рейтера) при иерсиниозах выражается в одновременном сочетании трех синдромов:
- поражений суставов;
- мочевыводящих путей (уретрит, цистит, пиелонефрит);
- глаз (конъюнктивит, склерит, ирит, иридоциклит).
Возможно сочетание двух синдромов из трех, присоединение умеренных общетоксических проявлений.
Иерсиниозные тиреоидит и миокардит протекают доброкачественно и не имеют клинических отличий от аналогичных заболеваний другой этиологии. Длительность миокардита может достигать нескольких месяцев, однако его течение не сопровождается развитием недостаточности кровообращения.
Хронический энтероколит иерсиниозной этиологии чаще развивается с поражением проксимального отдела толстой кишки. Анамнестически ему предшествуют симптомы острых кишечных инфекций или генерализованной формы иерсиниоза. Длительные проявления энтероколита (в течение многих месяцев и даже лет) могут сочетаться с артралгиями и артритами, экзантемой, катаральными признаками со стороны верхних дыхательных путей, субфебрилитетом, астенией, вегетативно-невротическими реакциями и т.д.
В качестве редких вариантов описаны изолированные шейные лимфадениты без предшествующей диареи и других клинических признаков иерсиниозов. Они протекают с болями, покраснением кожи, увеличением лимфатических узлов и нормальной или субфебрильной температурой тела. Редкими проявлениями иерсиниозов могут быть также пиодермиты, остеомиелиты, изъязвления и инфильтрация кожи.
Особенности клинической картины псевдотуберкулеза
Клинические проявления псевдотуберкулеза характеризуются большим разнообразием форм и вариантов. Преимущественно заболевание развивается по
смешанному варианту генерализованной формы. Инкубационный период варьирует от 3 до 18 дней, чаще продолжается 5-7 сут. В начале заболевания возникают лихорадка и другие симптомы токсикоза, артралгии, боли в животе, иногда бывают диарея, тошнота и рвота, катаральные симптомы со стороны верхних дыхательных путей. В части случаев отмечают гиперемию и отечность лица, кистей и стоп, увеличение печени. Через 5-7 дней наступает период разгара, он продолжается от нескольких дней до 1 мес. В это время на фоне доминирующих проявлений интоксикации возникает гиперемия лица, шеи и дистальных отделов конечностей, ладоней и подошв, на туловище и конечностях появляется экзантема, преимущественно скарлатиноподобного характера. Одновременно усиливаются артралгии, резко ограничивающие объем движений в суставах. При развитии артритического синдрома сглаженность контуров суставов и гиперемию кожи над ними отмечают редко. Может проявляться клиническая симптоматика иерсиниозного гепатита или вариантов абдоминальной формы заболевания. Иногда при рецидивах болезни возникает узловатая эритема.
Период реконвалесценции затягивается до 1 мес и более. При длительном течении заболевания выделяют острый (до 1 мес), затяжной (от 1 до 3 мес) и хронический (более 3 мес) псевдотуберкулез. Довольно часто, до 20% случаев, заболевание протекает с обострениями и рецидивами.
Обострения и рецидивы
Рецидивы и обострения иерсиниозов развиваются с частотой от 8 до 55%, переход в подострые и хронические формы - в 3-10% случаев. Ранние рецидивы чаще возникают на 3-й неделе от начала болезни. Причины рецидивов недостаточно изучены, возможно, определенную роль в их формировании играют короткие курсы лечения и ранняя выписка больных. По своим клиническим проявлениям рецидивы практически повторяют начальную симптоматику заболевания, но в стертом варианте.
Дифференциальная диагностика
Представляет серьезные затруднения. Следует иметь в виду возможности развития гастроэнтеритов, колитов и пиелонефритов различной этиологии, гепатитов, дизентерии, ревматизма, глазных, хирургических заболеваний, коллагенозов.
Одно их основных и наиболее частых отличий иерсиниозов, особенно генерализованной формы, - это одновременное сочетание в клинической картине заболевания нескольких синдромов:
- общетоксического;
- диспепсического;
- катарального;
- экзантематозного;
- артралгического (артропатического);
- гепатолиенального.
Гастроинтестинальную форму, клинически во многом сходную с сальмонеллезами, ПТИ, в ряде случаев отличает одновременное развитие у больных длительной и выраженной диареи, дизурических расстройств, артралгий, экзантемы, небольшого увеличения печени.
Проявлениям иерсиниозного аппендицита или терминального илеита, как правило, предшествуют признаки гастроэнтерита и (или) внеабдоминальная симптоматика.
Реактивный иерсиниозный гепатит протекает с более коротким, чем при вирусных гепатитах, периодом желтухи и гепатомегалии, умеренным повышением показателей билирубина и аминотрансфераз, лейкоцитозом, увеличением СОЭ.
Иерсиниозный полиартрит отличают несимметричность поражений суставов и слабо выраженная гиперемия кожи над ними.
Наиболее трудна дифференциальная диагностика таких проявлений иерсиниозов, как узловатая эритема, синдром Рейтера, миокардит, тиреоидит и хронический энтероколит. В таких случаях определенную направленность дифференциальной диагностике придают указания больного на недавно перенесенные диарейные состояния и пищевые отравления
Лабораторная диагностика (табл. 4-3 - 4-5)
Таблица 4-3. Лабораторная диагностика иерсиниозов
Таблица 4-4. Рутинная диагностика иерсиниозов
*ММА им. И.М. Сеченова, НИИЭМ им. Н.Ф. Гамалеи. **ЦНИИ эпидемиологии.
Бактериологический метод
Материалом для посева могут служить:
- фекалии больных;
- глоточные смывы;
- моча;
- мокрота;
- спинномозговая жидкость;
- кровь;
- желчь;
- операционный материал (мезентериальные лимфатические узлы, участки кишечника);
- секционный материал (измененные органы и ткани, содержимое кишечника, сгустки крови).
Возбудителей также можно выделить с объектов внешней среды:
- овощей и фруктов;
- из салатов;
- молока;
- рыбных и молочных продуктов;
- смывов с оборудования и тары.
Исследуемый материал вначале засевают на среды обогащения с целью предварительного подращивания (стандартный фосфатный буферный раствор), затем проводят пересевы на плотные питательные среды Эндо, Левина, Серова и др. Положительные результаты исследования получают в 9-15% случаев при спорадическом характере заболеваний и в 25-50% при вспышках. Низкая эффективность выделения обусловлена незначительным количеством иерсиний в исследуемом материале (особенно в крови) и высокой обсемененностью исследуемых объектов сопутствующей микрофлорой. Бактериологический анализ требует достаточно длительного времени - от 7 до 30 дней.
Иммунологические методы
Перспективны экспресс-методы определения Аг иерсиний (изолированных или в составе иммунных комплексов) в копроэкстрактах, слюне, крови и моче при постановке РКА, РЛА, ИФА, РНИФ. Эффективность РКА повышается при тяжелом течении, обострениях и рецидивах болезни. Частота положительных результатов составляет от 55 до 90% (при гастроинтестинальной форме заболевания).
Серологические методы
С 6-7-го дня болезни применяют РА и РНГА с повторной их постановкой через 5-7 дней. РНГА дает 40-70% позитивных результатов. Минимальный диагностический титр АТ - 1:200. 0днако необходимо учитывать возможность появления АТ в диагностических титрах лишь в поздние сроки, после 21-го дня от начала заболевания, а также недостаточную специфичность реакций. При постановке РА с эталонными живыми культурами иерсиний можно выявить АТ к большему, чем в РНГА, числу сероваров и в большем проценте случаев. Минимальный диагностический титр АТ - не менее 1:160.
Таблица 4-5. Рекомендуемая схема обследования при подозрении на иерсиниоз (ЦНИИ эпидемиологии)
Осложнения и исходы
Многочисленные осложнения включают миокардиты, гепатиты, холециститы и холангиты, панкреатиты, аппендицит, спаечную кишечную непроходимость, перфорации кишечника с перитонитом, кишечные кровотечения, очаговый гломерулонефрит, менингоэнцефалит, абсцессы различных органов и др. Учитывая современные патогенетические данные, многие из указанных осложнений расценивают как отдельные варианты генерализованной, вторично-очаговой или гастроинтестинальной форм заболевания.
Исходы иерсиниозов обычно благоприятные, за исключением септического варианта с летальностью до 50%. Продолжительность заболевания чаще всего не превышает 1,5 мес, однако возможно затяжное, рецидивирующее и хроническое течение болезни длительностью до 3-6 мес и более. 0писаны хронические заболевания опорно-двигательного аппарата и ЖКТ, этиологически связанные с иерсиниозами (чаще с псевдотуберкулезом), которые можно расценивать как резидуальную фазу процесса (Шувалова Е.П., 1995). Возможно развитие хронических коллагенозов и аутоиммунных расстройств. Имеются исследования, подтверждающие участие иерсиний в развитии различных дисфункций щитовидной железы (диффузно-токсический зоб, тиреоидиты и др.).
Лечение
Необходимо проведение стационарного лечения даже легких форм заболевания в связи с возможностью развития осложнений, учащением рецидивирующих форм и хронизации иерсиниозов. При гастроинтестинальной и абдоминальной формах иерсиниозов назначают диету № 2 или 4, при генерализованной форме - № 13 или 15, при иерсиниозном гепатите - № 5 (по Певзнеру).
При проведении этиотропного лечения предпочтительно назначение фторхинолонов. Курс лечения заканчивают не ранее 10-12-го дня после нормализации температуры тела. Назначение препаратов позже 3-го дня болезни не предупреждает развития обострений, рецидивов и хронизации заболевания. При генерализованной форме иерсиниозов предпочтение отдают комбинированному парентеральному введению антибиотиков. В случаях рецидивов необходимо проводить повторные курсы антимикробного лечения со сменой препаратов (табл. 4-6, 4-7).
Из других этиотропных средств иногда применяют ко-тримоксазол (по 2 таблетки 2 раза в день), нитрофурановые препараты (по 0,1 г 4 раза в день), но эти средства менее эффективны, чем антибиотики.
Таблица 4-6. Показания к этиотропному лечению иерсиниозов
*В ряде случаев - повторно несколько курсов.
Таблица 4-7. Выбор антибактериальных средств
Примечание.
Полусинтетические тетрациклины, аминогликозиды и ко-тримоксазол нельзя назначать при желтушных формах.
Дезинтоксикационное лечение с применением кристаллоидных и коллоидных растворов проводят по общепринятым схемам. Назначают регидрон, цитроглюкосолан, квартасоль, 5% раствор глюкозы, реополиглюкин, донорскую свежезамороженную плазму, витамины групп С и В.
При развитии вторично-очаговой формы необходима активная десенсибилизация. При этом этиотропное лечение становится вторичным и назначается в тех случаях, если ранее не проводилось. Показаны антигистаминные средства, нестероидные противовоспалительные препараты. При упорном течении узловатой эритемы и тяжелых проявлениях других вариантов этой формы иерсиниозов рекомендуют преднизолон коротким курсом в течение 4-5 дней по 60-80 мг в сутки.
При полиартритах назначают антиревматические средства, лечебную физкультуру, физиотерапевтические мероприятия. Временное облегчение больным приносит местное введение глюкокортикоидов.
В лечении иерсиниозов также рекомендуют применять антиоксиданты (например, витамин Е), ферменты (хилак-форте), транквилизаторы, сердечнососудистые препараты.
Растет популярность иммунокорректоров (циметидин, метилурацил, пентоксил и др.) и иммуностимуляторов (нормальный человеческий иммуноглобулин, полиглобулин). Учитывая высокую вероятность развития дисбиоза, рекомендуют пробиотики.
Выписку пациентов из стационара проводят при их клиническом выздоровлении, желательно не ранее 20-го дня болезни (учитывая возможность развития рецидивов).
Диспансерное наблюдение за реконвалесцентами осуществляют в течение от 1 до 6 мес в зависимости от клинической формы и тяжести перенесенного заболевания.
Эпидемиологический надзор
Профилактические и противоэпидемические мероприятия при иерсиниозе и псевдотуберкулезе проводят на основании результатов эпидемиологического и эпизоотологического надзора. В сельском очаге наиболее значимыми являются животноводческие хозяйства, в которых должен быть организован постоянный контроль за инфицированностью животных и обсемененностью окружающей среды. В городском антропогенном очаге данные о зараженности грызунов и домашних животных большой роли не играют. Наиболее важным и информативным будет контроль за объектами, перерабатывающими продукцию животноводства, пищеблоками. Помимо систематического анализа заболеваемости людей и животных, необходимо осуществлять периодический бактериологический контроль за обсемененностью иерсиниями овощей, фруктов, инвентаря, тары, оборудования в овощехранилищах и теплицах. Бактериологический контроль на контаминированность возбудителями готовой продукции (яйца, тушки птиц, пастеризованное молоко, мясные продукты и др.) осуществляет санитарноэпидемиологическая служба при плановом обследовании пищевых предприятий. Для профилактики внутрибольничных заражений важно организовать выявление носителей и больных легкими формами болезни, микробиологический мониторинг в стационарах с изучением антибиотикорезистентности выделяемых возбудителей.
Профилактические мероприятия
Основу профилактики составляют целенаправленные санитарно-гигиенические мероприятия. Первостепенное значение имеет предупреждение заражения микроорганизмами овощей, фруктов и корнеплодов, для чего необходимо соблюдение санитарных правил содержания овощехранилищ, температурновлажностного режима хранения овощей. Следует ограничить употребление пищевых продуктов, используемых без термической обработки. Важны также мероприятия, делающие пищу и питьевую воду недоступными для грызунов, птиц и домашних животных. Для этого проводят борьбу с грызунами и осуществляют санитарный надзор за питанием, водоснабжением, соблюдением технологии обработки и хранения пищевых продуктов. Профилактика иерсиниоза у животных предусматривает строгое соблюдение ветеринарно-санитарных и зоогигиенических правил ухода за животными, направленных на создание оптимальных условий содержания и кормления животных и предотвращение их заражения через объекты внешней среды. Существенное значение имеют дератизационные мероприятия на объектах питания, водоснабженения и животноводческих комплексах. Большое значение имеет проведение гигиенического обучения среди населения, особенно среди работников продовольственнопищевых предприятий. Одна из важнейших мер по предупреждению заболеваемости и вспышек псевдотуберкулеза - ежемесячное бактериологическое и серологическое исследование находящихся в овощехранилищах овощей и корнеплодов, а также инвентаря. В случае обнаружения возбудителя псевдотуберкулеза или его Аг на продуктах или оборудовании овощехранилищ следует немедленно запретить употребление в пищу зараженных овощей в сыром виде и разрешить их использование только после термической обработки для приготовления первых и вторых блюд. Питьевую воду следует употреблять только после кипячения. Средства специфической профилактики отсутствуют.
Мероприятия в эпидемическом очаге
Госпитализацию больного проводят по клиническим показаниям. Больных выписывают из стационара после полного клинического выздоровления, не ранее 10-го дня нормальной температуры тела и при нормализации лабораторных показателей. Контрольные однократные исследования перед выпиской целесообразны только при кишечном иерсиниозе. Бактерионосителей лечат амбулаторно без освобождения от работы. Носителей, работающих на пищеблоках, на период амбулаторного лечения переводят на другую работу, не связанную с приготовлением пищи. Дети, перенесшие псевдотуберкулез и иерсиниоз, особенно тяжелых форм, подлежат диспансерному наблюдению участковым педиатром для предотвращения рецидивов, затяжного течения и осложнений. При благоприятном течении наблюдение проводят 21 день. При появлении жалоб, клинических проявлений назначают лабораторное обследование, в случае показаний - госпитализацию и лечение.
Лиц, относящихся к декретированным категориям, перед выпиской подвергают бактериологическому обследованию (1 анализ кала через 2 дня по окончании лечения). При отрицательном результате обследования их сразу допускают к работе. После выписки рекомендуют диспансерное наблюдение всех переболевших сроком не менее 3 мес. При этом в зависимости от органных поражений следует проводить клинические анализы крови, мочи, биохимические исследования (билирубин, холестерин, функциональные пробы печени, АЛТ и АСТ, общий белок и его фракции), РНГА. При необходимости назначают консультации терапевта, ревматолога, гастроэнтеролога и других специалистов. В конце диспансерного наблюдения лицам декретированных категорий проводят 2 контрольных бактериологических анализа кала с интервалом в 2-3 дня.
Методические рекомендации Министерства здравоохранения РФ по иерсиниозам (1995) предусматривают определение показателей, свидетельствующих об угрозе развития рецидивов и хронизации заболеваний.
• Выявление Аг HLA-B27.
• Снижение активности полиморфно-ядерных лейкоцитов в период реконвалесценции.
• Повышение содержания ПГЕ2 и ПГF2α в стадии ранней реконвалесценции.
• Снижение содержания Т- и В-лимфоцитов в период реконвалесценции.
• Длительная циркуляция в крови бактериальных О-Аг и ЦИК.
• Дисбактериоз III и IV степеней.
При обнаружении не менее 2 из вышеперечисленных показателей диспансерное наблюдение реконвалесцентов рекомендовано пролонгировать до 1 года с ежемесячными осмотрами, лабораторными анализами (клинический анализ крови, белок и его фракции) и привлечением для консультаций соответствующих специалистов - ревматолога, гастроэнтеролога и др. В конце диспансерного наблюдения лицам декретированных категорий проводят 2 контрольных бактериологических анализа кала с интервалом в 2-3 дня.
Мероприятия в детских коллективах и семейных очагах. При заболевании ребенка бактериологическому обследованию подлежат все члены семьи. Показано наблюдение (термометрия, осмотр) в течение 7-10 дней. Экстренную профилактику не проводят. При возникновении крупных вспышек в закрытых учреждениях (пионерский лагерь, санаторий, детский сад, интернат) допускается развертывание стационара на месте для больных легкими формами при
условиях обеспечения их квалифицированной медицинской помощью, возможности лабораторного обследования и соблюдения противоэпидемического режима. Выделения больного (фекалии, мочу) дезинфицируют 3-5% раствором хлорной извести с экспозицией не менее 1 ч и только после этого выбрасывают в канализацию или выгребные ямы.
КАМПИЛОБАКТЕРИОЗ
(CAMPYLOBACTERIOSIS)
Кампилобактериоз - острое зооантропонозное инфекционное заболевание, вызываемое патогенными для человека видами бактерий рода Campylobacter. Характеризуется симптомами интоксикации с преимущественным поражением ЖКТ. У детей и ослабленных лиц нередко протекает в виде сепсиса.
Краткие исторические сведения
Впервые возбудители у больных диареями обнаружил Т. Эшерих (1884), их связь с патологией человека установлена Ж.Г. Венсаном (1947). Этиологическую значимость микроорганизмов в развитии энтеритов у людей отметила Э. Кинг. В 1973 г. предложено родовое название микроорганизмов - Campylobacter.
С начала 80-х годов XX в. отечественные и зарубежные исследователи обратили внимание на достаточно высокий уровень диарейных заболеваний населения, вызванных кампилобактерами (в настоящее время в среднем от 5 до 15% среди острых кишечных инфекций у взрослых пациентов и до 30% у детей, особенно первого года жизни).
Этиология
Род Campylobacter включает не менее полутора десятков видов возбудителей, которые могут вызывать заболевания у животных и человека. Наибольшее значение в патологии человека имеют C. jejuni и C. coli, вызывающие подавляющее большинство случаев кампилобактериоза у детей и взрослых, а также C. laridis и C. fetus. С последним видом связано большинство случаев генерализованных и септических форм внекишечного кампилобактериоза. Реже диареи у человека вызывают C. hyointestinalis, C. upsaliensis, C. sputorum. Кампилобактеры - микроаэрофильные грамотрицательные подвижные споронеобразующие бактерии, представлены спиральными (могут иметь один и более витков), S-образными или изогнутыми в виде вибриона клетками с полярно расположенными одним или двумя жгутиками. При культивировании более 48-72 ч образуют кокковидные формы. Бактерии прихотливы к условиям культивирования. Обычно их выращивают на селективных средах, угнетающих рост других патогенных микроорганизмов (средах с кровью животных, дополненных различными ингибиторами роста контаминирующей флоры).
Условия оптимального роста:
- 37-42 °С;
- рН 7;
- атмосфера культивирования должна содержать не менее 10% углекислого газа (СО2).
Основные Аг бактерий - О-Аг и Н-Аг.
Кампилобактеры чувствительны к высушиванию, длительному воздействию прямого солнечного света. В пресной воде при температуре 4 °С выживают в течение нескольких недель, при 25 °С - 4 дня, в почве и помете птиц - до 30 сут. При нагревании до 60 °С бактерии погибают через 1 мин. Кипячение и хлорирование воды вызывает быструю их гибель. Кампилобактеры чувствительны к эритромицину, левомицетину, стрептомицину, канамицину, тетрациклинам, гентамицину, малочувствительны к пенициллину, устойчивы к сульфаниламидам и триметаприму.
Эпидемиология
Резервуар и источник инфекции - дикие и сельскохозяйственные животные и птицы, у которых помимо болезни возможно и носительство. Роль диких животных и птиц в распространении инфекции менее значима, однако установлено, что частота заражения домашних птиц (куры, гуси, утки, индюшки и др.) достигает 25-40% у голубей, 45-83% у грачей и 90% у ворон. Естественными резервуарами возбудителя часто оказываются свиньи, крупный рогатый скот, куры. Наибольшую эпидемиологическую опасность представляют куры, крупный рогатый скот, свиньи и овцы, особенно бессимптомные бактерионосители. Животные и птицы-носители выделяют возбудителей в окружающую среду в течение длительного периода (несколько месяцев и даже лет). Роль больных людей и бактерионосителей менее значима. Длительность выделения кампилобактеров у человека составляет 2-3 нед, в редких случаях может достигать 3 мес.
Механизм передачи - фекально-оральный, основной путь передачи - пищевой (через мясные и молочные продукты, овощи, фрукты), с которым связано большинство групповых заболеваний и крупных вспышек. Наиболее часто пищевой путь передачи реализуется при употреблении в пищу недостаточно хорошо термически обработанных цыплят-бройлеров, а также свинины и продуктов ее переработки (котлеты, студни и т.п.). Роль сырого молока в передаче возбудителя незначительна. Возможен бытовой путь передачи возбудителя, особенно при инфицировании новорожденных, беременных и пожилых. Заболевание может возникнуть при прямом контакте с больными животными, в процессе ухода за ними, во время отелов и ягнения. Инфицирование наступает также при употреблении недостаточно термически обработанного мяса, зараженного прижизненно или при разделке. Большинство вспышек кампилобактериоза в США связано с употреблением пастеризованного молока. Несомненное значение имеет и водный путь передачи инфекции. Разные виды бактерий довольно часто выделяют из воды различных водоемов. Инфицированные или больные женщины могут передавать кампилобактеров плоду трансплацентарно, при родах или в постнатальный период. Описаны случаи развития кампилобактериоза после переливания крови, гемодиализа. Среди животных кампилобактериоз передается половым, алиментарным и контактным путями.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, о чем свидетельствует высокий уровень пораженности кампилобактериозом детей до 2 лет. Клиниче-
ская картина болезни может варьировать от бессимптомного носительства до тяжелых поражений, что во многом определяется состоянием резистентности макроорганизма и прежде всего иммунного статуса. Лица с иммунодефицитами составляют группу риска. Материнские АТ не подавляют колонизацию бактериями кишечника новорожденных. Характер и продолжительность постинфекционного иммунитета при кампилобактериозе недостаточно изучены. Очевидно, иммунитет носит типоспецифический характер.
Основные эпидемиологические признаки
Заболевание распространено повсеместно. Распространение кампилобактериоза вызвано интенсификацией животноводства, возросшей международной и национальной торговлей животными, кормами, продуктами животного происхождения. Кампилобактериоз составляет от 5 до 14% всех регистрируемых случаев кишечных инфекций. Заболеваемость носит спорадический характер. Чаще всего регистрируют семейные очаги кампилобактериоза. В 2007 г. в России зарегистрировано 395 случаев кампилобактериоза (0,28 на 100 000 человек).
Особенности эпидемического и эпизоотического процессов при кампилобактериозе:
- увеличение циркуляции возбудителей среди кур;
- повышение значимости сельскохозяйственных птиц как источника инфекции для людей.
В экономически развитых странах заражение инфекцией связано главным образом с инфицированным куриным мясом, в развивающихся странах - с водой. Заболевание регистрируют в течение всего года, с подъемом заболеваемости в летне-осенние месяцы. Кампилобактерии нередко вызывают диарею путешественников.
Важные социальные факторы, влияющие на распространенность кампилобактериоза:
- санитарно-гигиенические условия жизни;
- национальные привычки;
- характер питания населения.
Кампилобактериозом болеют люди всех возрастов, но наиболее часто дети от 1 года до 7 лет. Увеличивает риск инфицирования грудных детей ранний переход на искусственное вскармливание. Нозокомиальные случаи кампилобактериоза описаны среди новорожденных.
Патогенез
Остается до настоящего времени окончательно не изученным. Возбудитель попадает в организм преимущественно через ЖКТ алиментарным путем, возможно также проникновение через поврежденную кожу (контакт с животными, укусы). После поступления в кишечник бактерии колонизируют эпителий слизистой оболочки тонкой и толстой кишки, провоцируя в месте внедрения развитие воспалительной реакции. Воспаление имеет катаральный или катарально-геморрагический характер с инфильтрацией слизистой оболочки плазмоцитами, лимфоцитами и эозинофилами. Эозинофильная инфильтрация отражает проявления аллергического компонента в патогенезе заболевания. Адгезии препятствуют слизь, выделяемая клетками крипт, и секреторные IgA.
От степени выраженности адгезивных процессов в дальнейшем во многом зависят тяжесть и длительность течения заболевания.
Вслед за этим кампилобактеры при помощи жгутиков повреждают клеточные мембраны и проникают в клетки кишечного эпителия, где могут находиться около 1 нед, повышая свою вирулентность. Токсигенные свойства возбудителей определяют бактериальные энтеротоксин и цитотоксин. Механизм активности энтеротоксина сходен с таковым у холерного экзотоксина (холерогена). Преобладающее влияние энтеротоксина придает клинической картине заболевания общие черты с ПТИ. Обильная рвота и диарея могут приводить к дегидратации, гиповолемическому шоку. Активная выработка цитотоксина во многом определяет развитие заболевания по типу острой дизентерии с преимущественным поражением дистальных отделов толстой кишки.
Возможна генерализация процесса с гематогенной диссеминацией возбудителя в различные органы и ткани с развитием токсинемии и вторичных септических очагов в виде множественных микроабсцессов в различных органах. Трансплацентарное проникновение кампилобактеров у беременных приводит к абортам, преждевременным родам, внутриутробному заражению плода.
Развитие заболевания может пойти по пути хрониосепсиса с формированием вторичных очагов в различных органах (эндокардиты, менингиты, энцефалиты, перитонит и др.). Подобное течение кампилобактериоза наблюдается при иммунодефицитных состояниях, на фоне цирроза печени, алкоголизма, при кахексии, а также у новорожденных и престарелых.
Клиническая картина
Инкубационный период продолжается от нескольких часов до 11 дней, в среднем составляет 2-5 дней.
Гастроинтестинальная форма
Форма преобладает (до 95% случаев) и имеет чаще всего среднетяжелое течение.
Приблизительно у половины больных в первые 1-2 дня болезни появляются неспецифические гриппоподобные симптомы:
- повышение температуры тела до 38 °С и более;
- ознобы;
- головная боль;
- боли в мышцах и суставах.
Вслед за этим или одновременно с лихорадкой появляются черты заболевания, придающие ему характер гастрита, гастроэнтерита, гастроэнтероколита, энтероколита или колита.
В соответствии с вариантом течения клиническая картина болезни может быть очень похожа на гастритический или гастроэнтеритический варианты ПТИ или острую дизентерию. В таких случаях окончательный диагноз ставят только после его подтверждения бактериологическим исследованием.
Развитие энтероколита и колита особенно характерно для больных в Европе и России. На фоне общетоксических признаков или несколько позднее возникают боли в животе, локализованные главным образом в левой подвздошной области или носящие разлитой коликообразный характер. Интенсивность болей различна. Иногда они настолько выражены, что симулируют картину
острого живота. Возможно развитие тошноты и рвоты. Стул обильный, жидкий, каловый, зловонный, зеленого цвета. Частота дефекаций варьирует от нескольких раз до 10 раз в сутки и более. Однако при развитии колитического варианта заболевания, особенно у детей, испражнения быстро становятся скудными, в них появляются слизь и прожилки крови, а примерно у половины больных испражнения приобретают вид ректального плевка. Признаки гемоколита более характерны для кампилобактериоза, вызванного C. jejuni. Спазм и болезненность сигмовидной кишки, тенезмы и ложные позывы появляются нечасто.
В редких случаях развиваются терминальный илеит и мезаденит. Через 1-3 нед после начала диареи могут возникнуть симптомы реактивного артрита или развиться пятнистая, пятнисто-папулезная или уртикарная экзантема. Длительность заболевания варьирует от нескольких дней до 2 нед и более, у 20-25% больных возможны рецидивы.
Генерализованная форма
Основной возбудитель - C. fetus. Наиболее часто проявляется бактериемией, длительной выраженной лихорадкой, но без полиорганной диссеминации возбудителей и развития в органах микроабсцессов. К этому варианту инфекции наиболее восприимчивы пожилые и ослабленные лица, беременные, дети младшего возраста.
Клиническая картина септикопиемии чаще развивается на фоне предшествующих заболеваний - цирроза печени, сахарного диабета, туберкулеза, злокачественных образований, лейкоза и других заболеваний, а также при иммуносупрессивных состояниях. Вторичные септические очаги могут формироваться в легких, печени, головном мозге, почках, миокарде, брюшине, формируя на фоне выраженной интоксикации проявления соответствующих клинических вариантов - менингитов и менингоэнцефалитов, миокардитов и эндокардитов, гепатитов, нефритов при общем тяжелом состоянии больных. В этих случаях заболевание может осложнить развитие ИТШ.
Хроническая форма
По характеру развития напоминает хрониосепсис. Проявляется вялым течением, длительным волнообразным субфебрилитетом, прогрессивным похуданием. Больные жалуются на слабость, плохой аппетит, раздражительность, нарушение сна. Временами появляются боли в животе, тошнота, рвота и жидкий стул, чередующийся с запорами. Течение заболевания могут сопровождать артриты, кератиты, конъюнктивиты, вагиниты и вульвовагиниты.
Субклиническая форма (бактерионосительство)
Данная форма развивается у лиц с полноценным иммунологическим фоном. Характерно выделение возбудителя с испражнениями при отсутствии клинических признаков заболевания, но с нарастанием титров специфических АТ в крови. Длительность бактериовыделения в большинстве случаев не превышает 1 мес.
Дифференциальная диагностика
Гастроинтестинальную форму кампилобактериоза следует отличать от других острых кишечных инфекций (что клинически крайне затруднительно), а также от хирургических заболеваний органов брюшной полости. В части случаев форми-
рованию подозрения на кампилобактериоз помогает возникновение признаков реактивного артрита или экзантемы через 1-3 нед после начала диареи. Генерализованную форму необходимо дифференцировать от септических состояний различной этиологии, менингитов, пневмонии. Хроническая форма заболевания требует дифференциальной диагностики с бруцеллезом, иерсиниозами, токсоплазмозом.
В связи с трудностью клинической дифференциальной диагностики окончательный диагноз кампилобактериоза ставят только после его подтверждения бактериологическим исследованием.
Лабораторная
и инструментальная диагностика
Основу составляет обнаружение бактерий в испражнениях, крови и других биологических жидкостях. Для выделения кампилобактеров применяют селективные питательные среды, подавляющие рост сопутствующей бактериальной флоры. Определяют также специфические АТ в РСК, РНГА, ИФА, РКА и иммунофлюоресцентным методом, однако сроки достоверного нарастания титров АТ при исследовании парных сывороток с интервалами в 10-14 дней снижают диагностическую ценность серологических методов. Перспективной является РКА для обнаружения О-Аг кампилобактерий. При колоноскопии в остром периоде болезни обнаруживают распространенные катаральногеморрагические или эрозивно-геморрагические очаговые поражения слизистой оболочки толстой кишки.
Осложнения и исходы
При кампилобактериозе, протекающем на фоне тяжелых сопутствующих заболеваний, возможны кишечные кровотечения, перитонит, псевдомембранозный колит, токсический мегаколон. В случаях тяжело протекающей генерализованной инфекции осложнения могут быть связаны с формированием абсцессов в различных органах и возможным развитием ИТШ. Летальность при тяжелом течении инфекции может превышать 20%. Прогноз гастроинтестинальной формы заболевания обычно благоприятный.
Лечение
При развитии гастроинтестинальной формы заболевания по типу гастроэнтерита или энтерита обычно ограничиваются назначением спазмолитиков и других симптоматических средств, ферментов. Необходимость этиотропного лечения относительна, поскольку в таких случаях заболевание склонно к самоограничению. Целесообразно применение пробиотиков.
Этиотропное лечение назначают при колитическом варианте гастроинтестинальной формы, генерализованной и хронической формах кампилобактериоза, а также во всех случаях у больных с отягощенным преморбидным фоном. Этиотропное лечение включает назначение эритромицина по 500 мг 4 раза в день (детям - по 40 мг/кг в сутки) или других макролидов (спирамицин, рокситромицин, кларитромицин, азитромицин) в средних терапевтических дозах. Препараты резерва - фторхинолоны (ципрофлоксацин), препараты 2-го ряда -
клиндамицин, гентамицин, доксициклин, а также фуразолидон (при колитическом варианте). Дозы этих препаратов зависят от возраста пациентов, курс лечения не менее 7 дней. В ряде случаев требуются повторные курсы этиотропных средств или смена препаратов при их малой клинической эффективности, что связано с нарастающей резистентностью кампилобактеров к антибиотикам, в частности к эритромицину.
Используют сочетание парентерально назначаемых препаратов:
- макролидов (ровамицин);
- аминогликозидов (нетромицин);
- метрогила.
Эпидемиологический надзор
Направлен на выявление заболеваний людей, непрерывный сбор и анализ данных о случаях инфекции и возбудителях, а также распространение обобщенной информации для оптимизации системы профилактических и противоэпидемических мероприятий. Учитывая, что ведущая роль среди источников инфекции принадлежит птицам и животным, необходимо тесно координировать работу медицинских и ветеринарных служб по организации эпидемиологического и эпизоотологического надзора.
Профилактические мероприятия
Основу профилактики составляют ветеринарно-санитарные мероприятия, направленные на предупреждение инфицированности животных и птиц, проведение истребительных и лечебных мер среди больных животных. Предупреждение распространения болезни начинают с контроля за качеством кормов, соблюдения правил содержания животных и птиц в хозяйствах и фермах. Следующий этап - это ветеринарно-санитарная экспертиза на бойнях и соблюдение санитарно-гигиенических требований к технологии приготовления и хранению молочных продуктов, мяса животных и птицы. Для специфической профилактики кампилобактериоза животных применяют различные вакцины. Средства специфической профилактики для людей отсутствуют. Проводят общие санитарно-противоэпидемические мероприятия, аналогичные таковым при других кишечных инфекциях. В целях профилактики госпитального кампилобактериоза следует проводить бактериологическое обследование всех больных, поступающих в инфекционные стационары с острыми кишечными заболеваниями независимо от диагноза, всем больным соматических стационаров при выявлении у них симптомов дисфункции кишечника.
Мероприятия в эпидемическом очаге
Аналогичны таковым при сальмонеллезе. Работники пищевых предприятий и лица, к ним приравненные, перенесшие кишечный кампилобактериоз, подлежат диспансерному наблюдению в течение 1 мес после выписки из стационара с двукратным бактериологическим обследованием в конце срока наблюдения. Дети раннего возраста (до 2 лет) находятся на диспансерном наблюдении в течение 1 мес с ежедневным осмотром стула. При подозрении на возникновение рецидива болезни назначают повторное лабораторное обследование.
ЛЕПТОСПИРОЗЫ (LEPTOSPIROSES)
Лептоспирозы - острые зоонозные природно-очаговые инфекции, вызванные патогенными представителями рода Leptospira. Характеризуются полиорганностью поражений (преимущественно почек, печени и нервной системы), сопровождаются развитием интоксикации, геморрагического синдрома и нередко желтухи.
Краткие исторические сведения
Первые клинические описания лептоспироза как самостоятельной нозологической формы представили Larrey (1812) во Франции, А. Вейль в Германии (1886) и Н.П. Васильев в России (1888). Заболевание длительное время носило название болезни Вейля-Васильева. Впервые возбудитель заболевания выделен от больных в 1915 г. немецкими врачами (Н.Р. Уленгут и др.) и японскими исследователями (Р. Инада, У. Идо и др.). Термин «лептоспира» (мягкая, нежная спираль) ввел в практику японский микробиолог Ногуши (1917). Позднее стало известно, что возбудитель имеет много сероваров, вызывающих поражения у человека.
Этиология
Возбудители - ДНК- и РНК-содержащие аэробные подвижные спиралевидные бактерии разновидности Leptospira interrogans рода Leptospira, семейства Leptospiraceae. Морфологически все лептоспиры неразличимы. Спирали очень плотно примыкают друг к другу, что придает им вид нитки жемчуга при микроскопии в темном поле. Один или оба конца могут быть изогнуты. Движение винтообразное - сгибательное или вдоль продольной оси. Некоторое время бактерии могут быть неподвижными, напоминая веревку или прихотливо изогнутые петли. В культурах часто можно обнаружить образование клубков из лептоспир. Растут медленно (2-13 нед) на жидких и полужидких средах, дополненных 10-15% кроличьей сыворотки и витаминами В2 и В12. Температурный оптимум 28-30 °С, оптимум рН 7,2-7,4. Плохо окрашиваются по Граму и Романовскому-Гимзе, но хорошо различимы при импрегнации серебром (окрашены в коричневый или черный цвет). Легко выявляются темнопольной микроскопией. У Leptospira interrogans выделяют более 250 патогенных сероваров, объединенных на основании антигенного родства в серологические группы. На территории СНГ выделено 13 серогрупп (27 сероваров), вызывающих поражения у человека и различных животных.
Наиболее часто встречают варианты:
- grippothyphosa;
- icterohaemorrhagica;
- pomona;
- canicola и др.
Для паразитических лептоспир характерна специализация патогенных свойств - каждый серовар циркулирует в популяции определенного вида животного.
Патогенные серовары чувствительны к действию солнечного света и высоких температур (при 45 °С в воде погибают через 45 мин, при 70 °С - через
10 с); высушивание вызывает их немедленную гибель. Выживаемость лептоспир в пресноводных водоемах вариабельна - от нескольких часов до 30 сут (наиболее долго - в чистой воде с рН <7 и низкой минерализацией), в сухой почве сохраняются 2-3 ч, а заболоченной - до 280 сут. При низких температурах они могут сохраняться несколько месяцев, способны переживать зиму во влажной почве и в водоемах, не утрачивая при этом вирулентность. На пищевых продуктах выживают 1-2 дня, не теряют активности при замораживании. Растворы 0,1% хлористоводородной кислоты, 0,5% фенола убивают лептоспир в течение 20 мин, активный хлор в дозе 0,3-0,8 мг/л - через 2 ч.
Эпидемиология
Резервуар и источники инфекции разделяют на 2 группы. Основной природный резервуар 1-й группы:
- грызуны (серые полевки, мыши, крысы);
- насекомоядные (ежи, землеройки). Основной резервуар 2-й группы:
- домашние животные (свиньи, крупный рогатый скот, овцы, козы, лошади, собаки);
- пушные звери клеточного содержания (лисицы, песцы, нутрии), формирующие антропургические (сельскохозяйственные) очаги.
Носительство лептоспир установлено более чем у 100 видов млекопитающих и 6 видов птиц. Период контагиозности источника равен всему периоду заболевания животного. У грызунов болезнь протекает хронически с выделением лептоспир в окружающую среду с мочой. Бактерии каждого серовара поражают главным образом популяции определенных видов животных, и этиологическую структуру заболеваний в каждом очаге в основном определяет преобладающий в нем вид животных - хозяев возбудителя. На территории России крысы выступают носителями варианта icterohaemorrhagica, свиньи - pomona, крупный рогатый скот - grippotyphosa, собаки - canicola. Больной человек эпидемиологического значения не имеет.
Механизм передачи - фекально-оральный, основной путь передачи возбудителя - водный, меньшее значение имеют контактный и пищевой (кормовой). В организм человека и животных лептоспиры проникают через незначительные повреждения кожи и неповрежденные слизистые оболочки полости рта, носа, глаз, ЖКТ и мочеполового тракта. Заражение чаще происходит в период сельскохозяйственных и других работ, а также при пребывании в эндемичном очаге при умывании, купании и заглатывании воды. Случаи заражения иктерогеморрагическим лептоспирозом чаще происходят при употреблении пищи, инфицированной мочой зараженных крыс, а также при контакте с животными-бактерионосителями.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Перенесенное заболевание оставляет прочный, но серовароспецифичный иммунитет. Возможна реинфекция другими сероварами лептоспир.
Основные эпидемиологические признаки
Лептоспироз - один из самых распространенных зоонозов в мире. Он встречается на всех континентах кроме Антарктиды, особенно высока заболеваемость в тропических странах.
Однако уровень заболеваемости во многом зависит от природно-климатических условий:
- наиболее высок в районах с густой речной сетью;
- частыми многократными летними паводками;
- с высокой плотностью поголовья сельскохозяйственных животных. Лептоспироз относят к числу наиболее распространенных природно-
очаговых инфекций в РФ. Ежегодно более чем в 50 субъектах России регистрируют 1200-1500 случаев заболевания. При этом отсутствует выраженная тенденция к снижению заболеваемости. В 2007 г. заболевания лептоспирозом зарегистрированы в 49 субъектах РФ. Всего зарегистрировано 699 случаев лептоспироза, показатель на 100 000 населения - 0,49, в том числе среди детей до 17 лет - 46 случаев и 0,17 соответственно. В эпидпроцесс вовлечены дети всех возрастов, за исключением детей до 1 года. Среди заболевших городские жители составляют 70%. В 2007 г. зарегистрирован 21 случай со смертельным исходом, показатель на 100 000 населения - 0,01, что чаще всего связано с тяжелым клиническим течением. Самые высокие показатели заболеваемости в Республике Мордовии - 10,21 (87 случаев), Удмуртской Республике - 1,69 (26 случаев), Пермском крае - 1,53 (42 случая), Ульяновской области - 1,43 (19 случаев), Кировской области - 1,25 (19 случаев), Краснодарском крае - 2,0 (102 случая).
Заболевания часто имеют профессиональный характер. Чаще заболевают дератизаторы, лица, работающие на заболоченных лугах, работники животноводческих ферм, боен, доярки, пастухи, ветеринары. Известны спорадические случаи и эпидемические вспышки, причем последние чаще связаны с купанием в открытых водоемах, загрязненных выделениями грызунов и других животных. Для лептоспироза характерна выраженная летне-осенняя сезонность (особенно в июле и августе). В последние годы отмечена склонность лептоспироза к урбанизации и распространению инфекции на территории рекреационных зон. При этом в крупных городах формируются антропургические очаги, в которых преимущественную роль в качестве источников инфекции играют собаки. В связи с тем что резкий рост заболеваемости каникулезным (возбудитель - лептоспиры серовара canicola) лептоспирозом отмечается и во многих других странах, его относят к категории возвращающихся инфекций.
Патогенез
Лептоспиры проникают в организм человека через поврежденный кожный покров, а также неповрежденные слизистые оболочки полости рта и ЖКТ, глаз, носа, не вызывая никаких изменений в области входных ворот. В инкубационном периоде при незавершенном фагоцитозе возбудители заносятся макрофагами по лимфатическим сосудам в регионарные лимфатические узлы. После первичного размножения и накопления бактерий в лимфоузлах развивается кратковременная бессимптомная лептоспиремия, возбудители распространяются по органам и тканям системы мононуклеарных фагоцитов, преимущественно накапливаясь в печени и селезенке, почках, легких.
В начальный период болезни (1-я неделя клинических проявлений) нарастают лептоспиремия и токсинемия, происходит распространение возбудителей по новым органам и системам (надпочечники, ЦНС и др.). Лептоспиры обладают разнообразными факторами патогенности.
К ним относят:
- ЛПС-комплекс;
- белки наружной мембраны, предположительно проявляющие антифагоцитарную активность;
- фибронектинсвязывающий белок;
- гликолипопротеины, обладающие цитотоксическими свойствами;
- гемолизины;
- различные ферменты.
Факторы патогенности лептоспир обусловливают развитие васкулитов с отеком и некрозом сосудистого эндотелия, воспалительными инфильтратами и повышением проницаемости сосудистых стенок. В пораженных органах и тканях происходят нарушения гемостаза и микроциркуляции, развиваются дегенеративные и некротические изменения гепатоцитов, эпителия почечных канальцев, поперечно-полосатых мышц, эндотелия капилляров, гемолиз эритроцитов, накапливаются токсичные метаболиты. Возникают лихорадка, ознобы, миалгии. Нарастание концентрации токсических метаболитов (эндогенных пирогенов) обусловливает быстрое прогрессирование симптомов интоксикации.
В разгар заболевания токсинемия, патоморфологические и функциональные изменения в органах достигают максимальной степени. Прогрессирует генерализованный капилляротоксикоз с нарушениями микроциркуляции, повышением проницаемости стенок сосудов, геморрагическими признаками различной степени выраженности (геморрагическая сыпь на коже и слизистых оболочках, мелкие диапедезные органные кровоизлияния, внутренние и наружные кровотечения). Нередко развиваются признаки гемолиза и почечной недостаточности.
Поражения печени обусловлены следующими факторами:
- развитием отека;
- повреждением гепатоцитов подвижными лептоспирами;
- токсическим действием эндотоксина, выделяющегося при гибели бактерий.
Возможны проявления желтухи смешанного генеза, определенная роль в ее происхождении отводится массивному гемолизу эритроцитов. Характерны резкие мышечные боли, развивающиеся вследствие деструктивных процессов, кровоизлияний и гистиолимфоцитарных инфильтратов в скелетной мускулатуре. В тяжелых случаях заболевание могут осложнить менингит, специфический лептоспирозный миокардит, ИТШ.
Формирование иммунитета связано с нарастанием в крови титров специфических АТ (агглютининов, опсонинов, комплементсвязывающих АТ), образованием иммунных комплексов, активацией фагоцитоза. Однако при этом лептоспиры могут еще в течение определенного времени сохраняться в организме. Начиная со 2-й недели болезни возбудитель постепенно депонируется преимущественно в извитых канальцах почек и исчезает из крови и других тканей. Его избирательная концентрация на эпителии и в межклеточном пространстве может привести к тяжелым повреждениям почечных канальцев и нарушению мочеобразования, а в тяжелых случаях - к анурии и уремии. Лептоспиры могут длительно сохраняться в почках и выделяться с мочой в течение 1-2 мес после клинического выздоровления.
После выздоровления формируется стойкий иммунитет лишь по отношению к гомологичному серовару лептоспир.
Клиническая картина
Разнообразие клинических проявлений лептоспироза обусловлено полиморфизмом поражений органов и систем. Единой клинической классификации заболевания до настоящего времени нет. Различают желтушные и безжелтушные формы легкого, среднетяжелого и тяжелого течения. Нередко инфекция протекает субклинически и выявляется лишь при серологическом обследовании пациентов.
Безжелтушная форма
Заболевание отличает цикличность, что позволяет выделить в динамике его развития следующие периоды:
- инкубационный;
- начальный;
- разгара;
- реконвалесценции. Инкубационный период
Варьирует от нескольких дней до 1 мес, чаще продолжается 1-2 нед. Начальный период
Длится около 1 нед, но при тяжелом течении инфекции может быть короче. Характерно острое начало болезни. На фоне выраженного озноба температура тела в течение 1-2 дней достигает высоких цифр - 39-40 °С, в дальнейшем приобретая неправильный характер. Больные жалуются на головную боль, боли в икроножных и иногда брюшных мышцах (особенно при пальпации), слабость, головокружение, бессонницу, жажду, отсутствие аппетита. У части больных бывают сухой кашель, тошнота, рвота, диарея. Быстро нарастают симптомы интоксикации.
При объективном обследовании обращает на себя внимание внешний вид больного. Его лицо становится одутловатым, гиперемированным, с герпетическими высыпаниями на губах и крыльях носа. Наблюдают инъекцию сосудов склер, гиперемию конъюнктив и иногда слизистой оболочки ротоглотки.
С первых дней болезни возможны геморрагические проявления:
- петехиальные элементы на коже;
- геморрагии в местах инъекций;
- кровоизлияния на склерах и конъюнктивах;
- геморрагическое пропитывание герпетических высыпаний.
В более тяжелых случаях появляется микроили макрогематурия, возникают носовые кровотечения. Можно отметить небольшое увеличение периферических лимфатических узлов, брадикардию, снижение АД. Клиническая патология со стороны органов дыхания в начальный период болезни, как правило, отсутствует. В середине 1-й недели болезни у 20-50% больных возникает экзантема кореподобного, уртикарного или петехиального характера, длительность ее проявлений варьирует от нескольких часов до нескольких дней. В это же время у большинства пациентов увеличивается печень, реже селезенка. К концу недели возможно появление желтухи и (или) менингизма, снижение температуры или ее нормализация на короткое время.
Период разгара
Захватывает конец 1-й и 2-ю неделю болезни. Продолжается или вновь возникает лихорадка, сохраняются и нарастают клинические симптомы начального периода.
При тяжелом течении заболевания усиливаются проявления геморрагического синдрома:
- обширные кровоизлияния в подкожную клетчатку, мышцы поясницы и брюшной стенки;
- желудочные, кишечные и маточные кровотечения.
В случае альвеолярного кровоизлияния быстро нарастают признаки острой дыхательной недостаточности:
- одышка;
- кашель с кровянистой мокротой;
- боли в груди;
- влажные хрипы в легких;
- очаговые легочные инфильтраты на рентгенограмме.
Возможно развитие инфекционно-токсического миокардита с признаками сердечно-сосудистой недостаточности:
- усиливается цианоз;
- тоны сердца становятся глухими;
- нарастает артериальная гипотензия;
- брадикардия сменяется тахикардией;
- иногда возникает аритмия.
Нарушения микроциркуляции и геморрагические реакции в слизистой оболочке ЖКТ могут обусловливать возникновение болей по ходу кишечника, тошноты, рвоты и диареи, болей и тяжести в правом подреберье. Язык становится сухим, покрывается бурым налетом. Характерны боли и положительный симптом поколачивания в поясничной области. Моча может приобрести темный или кровянистый оттенок, содержать повышенное количество белка, лейкоцитов, свежих и выщелоченных эритроцитов, цилиндров. В разгаре болезни развивается олигурия, а при тяжелом течении заболевания даже анурия с прогрессирующей почечной недостаточностью.
Нарастают признаки токсической энцефалопатии:
- головная боль;
- бессонница;
- возбуждение и беспокойство больных;
- иногда бред.
У 10-15% больных формируется клиническая картина менингита, чаще серозного, а в редких случаях и менингоэнцефалита.
Желтушная форма
Данная форма (см. рис. 29, 30 доп. илл.) встречается значительно реже (в 10-20% случаев), но отличается более тяжелым течением с выраженными полиорганными поражениями. Темная моча, а вслед за нею иктеричность могут появиться уже на 1-й неделе болезни, в периоде разгара интенсивность желтухи нарастает и соответствует тяжести течения заболевания.
Яркая желтуха шафранового оттенка может сохраняться в течение нескольких недель, сопровождается кожным зудом и геморрагическими проявлениями - кровоизлияниями в кожу и слизистые оболочки. Гепатолиенальный синдром становится четко выраженным, возможна ахолия стула. Характерна высокая и стойкая билирубинемия с умеренным повышением показателей АЛТ, АСТ, ЩФ.
В периоде разгара высокая температура длится около недели, однако возможны и повторные волны лихорадки после короткой апирексии, продолжающиеся еще в течение нескольких дней.
Период реконвалесценции
Начинается с критического снижения температуры и продолжается 3-4 нед. Постепенно регрессируют общетоксические, геморрагические проявления и органные расстройства. У части больных долго сохраняются головные боли, депрессия, раздражительность, беспокойство. Возможно длительное депонирование возбудителя в почках с лептоспирурией в течение 1-3 мес.
Дифференциальная диагностика
В начальный период лептоспироз следует отличать от острых лихорадочных состояний, при развитии органных поражений - от вирусных гепатитов, геморрагических лихорадок (прежде всего от ГЛПС), малярии, иерсиниозов, иногда менингитов, менингоэнцефалитов и сепсиса. При дифференциальнодиагностическом поиске необходимо ориентироваться на острое начало болезни, высокую и иногда двухволновую лихорадку, боли в икроножных мышцах, гиперемию лица с герпетическими высыпаниями, инъекцию склер и гиперемию конъюнктивы, экзантему кореподобного и в дальнейшем петехиального характера, множественные геморрагические высыпания на различных участках тела, боли в пояснице, микро- и макрогематурию, олигоили анурию, увеличение в размерах печени, в части случаев развитие желтухи.
Одновременно следует учитывать данные эпидемиологического анамнеза:
- пребывание больного в эндемичных по лептоспирозу районах;
- купание в природных водоемах, питье сырой воды из них;
- участие в сельскохозяйственных работах.
Лабораторная диагностика
В гемограмме обнаруживают:
- лейкоцитоз;
- выраженный нейтрофильный сдвиг влево;
- значительное нарастание СОЭ.
В разгар болезни уменьшается число эозинофилов, эритроцитов и тромбоцитов, снижается содержание гемоглобина.
Биохимические показатели крови при желтушной форме лептоспироза включают:
- повышение билирубина (с преобладанием связанного);
- повышение мочевины и сывороточного креатинина;
- умеренное повышение показателей аминотрансфераз и ЩФ;
- гипохолестеринемию.
Бактериоскопические и бактериологические методы
При высокой концентрации возбудителей (более 100 в 1 мл) возможно обнаружение живых подвижных лептоспир в крови, ликворе или моче методом микроскопии раздавленной капли в темном поле, а также их выделение при посевах крови, мочи или ликвора на питательные среды. По 3-5 мл свежего биологического материала, взятого непосредственно у постели больного, засевают в каждую из 3-5 чашек Петри с питательной средой. Лептоспиры относят
к медленнорастущим микроорганизмам, поэтому выделение культуры имеет значение только для ретроспективного подтверждения диагноза и более детальной расшифровки этиологии случая или вспышки.
Серологические методы значительно более популярны в клинической практике. Диагноз подтверждают с помощью реакций микроагглютинации и агглютинации-лизиса, а также РСК и РНГА. За минимальный диагностический титр принимают разведение сыворотки крови 1:100. Реакции ставят в парных сыворотках, взятых в период разгара болезни и в стадии реконвалесценции, при этом диагностическое значение имеет четырехкратное нарастание титров АТ.
На основе ПЦР разработаны тест-системы для выявления ДНК патогенных лептоспир. Этот метод целесообразно использовать в целях ранней экспрессдиагностики лептоспирозов. Исследуют сыворотки крови начиная с 1-х и до 10-х суток заболевания, а также для контроля течения инфекции и эффективности лечения. При концентрации лептоспир в исследуемом биоматериале более 100 в 1 мл возможно выявление Аг возбудителей с помощью РИА или
ИФА.
Биологическая проба
Морским свинкам внутривенно, внутрибрюшинно или подкожно вводят 3-5 мл крови, мочи или ликвора больного. После гибели животных лептоспиры обнаруживают в различных органах после окраски гистологических срезов азотнокислым серебром.
Осложнения и исходы
Наиболее частое и опасное осложнение лептоспироза - ОПН с нарастающей азотемией (обусловливает более 60% летальных исходов). При тяжелом течении заболевания это осложнение может развиться уже на 1-й неделе.
Опасные осложнения, обычно характерные для периода разгара болезни (периода органных поражений):
- острая печеночная недостаточность;
- ИТШ;
- кровотечения;
- кровоизлияния в легкие, надпочечники.
Кроме того, могут развиться менингиты, энцефалиты, ириты и иридоциклиты, а также неспецифические осложнения, вызванные патогенной бактериальной флорой:
- пневмонии;
- пролежни;
- абсцессы и др.
Рецидивы лептоспироза возникают приблизительно в 20-30% случаев. Их продолжительность обычно не превышает нескольких дней, высота лихорадки и органные нарушения при этом менее значительны, чем во время основного заболевания.
При рецидивах, иногда и повторных, длительность болезни может затягиваться до 2-3 мес.
Летальные исходы при спорадической заболеваемости составляют 1-2%, при эпидемических вспышках лептоспироза на определенных территориях - до 15-20% и более.
Лечение
Целесообразность госпитализации больных лептоспирозом связана с необходимостью динамического клинико-лабораторного исследования и возможностью развития тяжелых осложнений. Больному назначают постельный режим в течение всего лихорадочного периода. При симптомах почечно-печеночной недостаточности его продлевают. Диета, в основном молочно-растительная, предусматривает ограничения, необходимые при заболеваниях печени и почек.
В этиотропном лечении среднетяжелых и тяжелых форм лептоспироза до последнего времени сохраняет свою эффективность бензилпенициллин, который назначают внутримышечно в суточной дозе 6-12 млн ЕД (18-24 млн ЕД при лептоспирозном менингите). Альтернативно внутривенно можно назначать ампициллин по 500-1000 мг 4 раза в сутки, амоксициллин до 3 г в сутки, эритромицин до 2 г в сутки. При нетяжелом течении заболевания препаратом выбора является доксициклин по 100 мг 2 раза в сутки в течение 7 дней, возможно применение ампициллина, амоксициллина, азитромицина в средних терапевтических дозах.
При тяжелом течении заболевания рекомендуют сочетать этиотропное лечение с введением гетерологичного противолептоспирозного иммуноглобулина после дробной предварительной десенсибилизации по Безредке. В 1-е сутки лечения подкожно вводят 0,1 мл, через 30 мин еще 0,7 мл разведенного (1:10) иммуноглобулина и еще через 30 мин внутримышечно вводят 10-15 мл неразведенного препарата. В последующие 2 дня нативный иммуноглобулин вводят внутримышечно по 5-10 мл. При использовании гетерологичного противолептоспирозного иммуноглобулина всегда следует иметь в виду возможность развития ранних и отсроченных аллергических реакций.
Необходимы проведение дезинтоксикационного лечения, интенсивность которого определяется тяжестью течения заболевания, а также коррекция метаболических и электролитных нарушений. Показаны препараты для улучшения свертываемости крови и повышения резистентности сосудов, анальгетики, витамины.
При начальных проявлениях почечной недостаточности больным можно назначить осмотические диуретики (маннитол, 40% раствор глюкозы). Прогрессирование ОПН служит показанием к проведению гемодиализа. При развитии острой печеночной энцефалопатии лечение проводят, как при вирусных гепатитах с аналогичным осложнением (см. главу 3, раздел «Вирусные гепатиты»).
Выписку больных из стационара осуществляют по клиническим показаниям.
Эпидемиологический надзор
Как и при других зоонозах, профилактические мероприятия при лептоспирозах осуществляют на основе эпидемиологического и эпизоотологического надзора. Он включает в себя как слежение за заболеваемостью людей и животных (грызунов), так и микробиологический мониторинг свойств выделяемых от них и из объектов внешней среды возбудителей. Большое значение имеет обмен информацией между ветеринарной и санитарно-эпидемиологической службами.
Профилактические мероприятия
Включают в себя мероприятия, направленные на профилактику и борьбу с лептоспирозом среди сельскохозяйственных и домашних животных, и профилактику заболеваний людей на территории эпизоотического очага. Значительную часть общих санитарных мероприятий проводят ветеринарная служба и руководство животноводческих ферм и других хозяйств. Организационнометодическое руководство работой по профилактике лептоспироза среди людей осуществляют отделы особо опасных инфекций республиканских, краевых и областных (городских) центров гигиены и эпидемиологии. Особое внимание уделяют охране водоемов от загрязнения их больными животнымилептоспироносителями. Запрещено строительство животноводческих и звероводческих помещений и лагерное содержание свиней и других сельскохозяйственных животных на берегу водоемов без соответствующих правил по охране водоемов. Устанавливают строгий контроль за источниками централизованного водоснабжения, а также местами купания людей, водопоя скота и спуском сточных вод от животноводческих ферм.
Для предупреждения распространения иктерогеморрагического лептоспироза в наиболее заселенных крысами объектах осуществляют дератизационные мероприятия. Их проводят в жилых застройках, на животноводческих фермах, продовольственных складах, зверофермах, предприятиях по переработке животноводческого сырья и продуктов, в шахтах и канализационных сооружениях, а также в открытых станциях городов (свалки, пустыри, парковая зона) и сельской местности, местах массового отдыха, охоты и рыбной ловли.
На неблагополучных по лептоспирозу животноводческих фермах, а также в убойных и субпродуктовых цехах мясокомбинатов, в шахтах, рудниках, на земельных работах персонал должен работать в специальной одежде, предохраняющей от проникновения лептоспир через поврежденный кожный покров и неповрежденные слизистые оболочки:
- халаты (комбинезоны);
- резиновые перчатки;
- сапоги;
- фартуки.
Специфической вакцинации путем введения убитой лептоспирозной вакцины подлежат лица высокого риска заражения (сельскохозяйственные рабочие, животноводы, работники боен и др.). Профилактическую иммунизацию против лептоспироза проводят населению по эпидемическим показаниям, определяемым местными органами здравоохранения в зависимости от эпидемической и эпизоотической ситуации. В очагах лептоспироза медицинские и ветеринарные работники, руководители хозяйств проводят гигиеническое обучение среди населения по мерам профилактики данной инфекции.
Мероприятия в эпидемическом очаге
Все больные с заболеванием или подозрительные на лептоспироз в обязательном порядке подлежат немедленной госпитализации. Разобщение лиц, бывших в контакте с заболевшими, не проводят. Карантин не устанавливают. Лица, переболевшие лептоспирозом, подлежат диспансерному наблюдению в течение 6 мес с обязательным клиническим обследованием окулистом, невропатологом и терапевтом в 1-й месяц после перенесенного заболевания. В после-
дующие месяцы диспансерные наблюдения осуществляют ежемесячно участковыми врачами с привлечением специалистов по профилю клинических проявлений. Снятие с учета проводят при полном клиническом выздоровлении. Для экстренной профилактики лептоспироза лицам, подвергшимся риску заражения, назначают доксициклин (вибрамицин) по схеме - 1 капсула (0,1 г) 1 раз в день курсом на 5 сут. Решение о проведении экстренной химиопрофилактики принимают территориальные управления Роспотребнадзора. В эпидемическом очаге проводят мероприятия по истреблению крыс, дезинфекцию - аналогично таковой при брюшном тифе.
ЧУМА (PESTIS)
Чума - острая, особо опасная природно-очаговая зоонозная трансмиссивная инфекция. Характеризуется тяжелой интоксикацией и развитием серозногеморрагического воспаления с преимущественным поражением кожи, лимфатических узлов, легких, а также возможным развитием сепсиса.
Краткие исторические сведения
В истории человечества нет другой такой инфекционной болезни, которая приводила бы к столь колоссальным опустошениям и смертности среди населения, как чума. С древности сохранились сведения об эпидемиях чумы с большим числом смертельных исходов. Было замечено, что эпидемии развивались вследствие контактов с больными животными. Временами распространение заболевания носило характер пандемий. Известно 3 пандемии чумы. Первая, известная как юстинианова чума, свирепствовала в Египте и Восточно-Римской империи в 527-565 гг. Вторая, названная великой, или черной смертью, в 1345-1350 гг. охватила Крым, Средиземноморье и Западную Европу. Эта самая опустошительная пандемия унесла около 60 млн жизней. Третья пандемия началась в 1895 г. в Гонконге, затем распространилась в Индии, где умерли свыше 12 млн человек.
В самом ее начале были сделаны важные открытия:
- выделен возбудитель (Минх Г.Н., 1878, Йерсен А., Китазато Ш., 1894);
- доказана роль крыс в эпидемиологии чумы, что позволило организовать профилактику заболевания на научной основе.
Начиная с XIV в. чума многократно посещала Россию в виде эпидемий. Работая на вспышках по предотвращению распространения заболевания и лечению больных, большой вклад в изучение чумы внесли российские ученые Д.К. Заболотный, Н.Н. Клодницкий, И.И. Мечников, Н.Ф. Гамалея и др. В XX в. Н.Н. Жуковым-Вережниковым, Е.И. Коробковой и Г.П. Рудневым были разработаны принципы патогенеза, диагностики и лечения больных чумой, создана противочумная вакцина.
Этиология
Возбудитель - Y. pestis рода Yersinia семейства Enterobacteriaceae, грамотрицательная неподвижная факультативно-анаэробная бактерия. Отличается выраженным полиморфизмом, наиболее типичны короткие овоидные палочки, окрашивающиеся биполярно анилиновыми красителями. Хорошо
растет на обычных питательных средах и средах с добавлением стимуляторов роста (гемолизированной крови, сульфита натрия) при оптимальной температуре 26-27 °С. По многим морфологическим, биохимическим признакам, а также по антигенной структуре чумная палочка сходна с возбудителями псевдотуберкулеза, кишечного иерсиниоза, туляремии и пастереллеза, вызывающими тяжелые заболевания у человека и животных. Выделяют 3 биовара возбудителя, различные по вирулентности; в настоящее время заболеваемость чумой в основном обусловливает широко распространенный биовар Orientalis.
Y. pestis содержит более 30 Аг, экзо- и эндотоксины. Видоспецифические АГ чумного микроба:
- капсульный АГ;
- мышиный токсин;
- пестицин;
- фибринолизин;
- плазмокоагулаза.
Их продукцию регулируют плазмиды вирулентности, в том числе дополнительные плазмиды возбудителя (pPst, pFra), отсутствующие у других иерсиний. Большинство остальных АГ - общие с другими патогенными иерсиниями.
Основные факторы вирулентности возбудителя обусловливают возможность его быстрого размножения и распространения в пораженном организме. В организме теплокровных животных и человека Y. pestis образует капсулы, капсульный АГ придает бактериям устойчивость к фагоцитозу. Мышиный токсин обладает р-адреноблокирующим свойством, усиливает действие ЛПСкомплекса. Поверхностные белки-эффекторы Yop обладают антифагоцитарной цитотоксической активностью, V-Аг и W-Аг участвуют в переносе Yop в клетки-мишени и предохраняют бактерии от лизиса в цитоплазме фагоцитов. Быстрому размножению возбудителей способствует выработка ими иерсиниабактина, активизирующего усвоение иерсиниями железа из организма хозяина. Пестицин, фибринолизин, плазмокоагулаза - это основные факторы, обеспечивающие распространение бактерий в организме.
Y. pestis умеренно устойчива во внешней среде. Хорошо переносит низкие температуры, замораживание, при этом в течение многих месяцев может сохраняться в трупах людей и животных, в голодающих блохах и клещах. Высокочувствительна к воздействию солнечных лучей, атмосферного кислорода, высокой температуры (при 58 °С погибает за 30 мин), кислой реакции среды. Дезинфектанты (хлорная известь, хлорамин, карболовая кислота, сулема и др.) в обычных концентрациях убивают возбудитель за 1-5 мин.
Эпидемиология
Основной резервуар и источник инфекции - дикие грызуны (почти 300 видов), распространенные повсеместно. Однако не все виды животных имеют одинаковое значение для сохранения возбудителя. В каждом конкретном природном очаге существуют свои основные хранители инфекции, выполняющие роль основного резервуара инфекции.
Основные источники в природе:
- сурки;
- суслики;
- песчанки;
- полевки;
- тарбаганы;
- пищухи и др.
Основной резервуар инфекции в антропургических (городских, портовых) очагах чумы - это синантропные крысы. К таковым относятся:
- серая крыса, или пасюк, живущая в канализационных трубах больших городов;
- черная крыса, обитающая на судах и в домах;
- александрийская, или египетская, черная крыса.
Собаки совершенно резистентны к возбудителю, но могут инфицировать блох. Увеличивается число сообщений о случаях инфекции у кошек в связи с возможностью передачи возбудителя человеку при пневмонии. Имеются данные о роли верблюдов как источника инфекции для человека. Сохранение чумной инфекции происходит главным образом благодаря передаче возбудителя от больных животных к здоровым. Исключительную роль в этом процессе играют паразитирующие на грызунах блохи. У большинства грызунов развивается острая форма чумы, но при этом быстрая гибель животных приводит к прекращению эпизоотии. Часть грызунов (суслики, сурки, тарбаганы), находясь в спячке, переносят болезнь в латентной форме, а весной следующего года становятся источниками инфекции и способствуют поддержанию природного очага чумы в данной местности.
Больной человек может в определенных условиях стать источником инфекции:
- при развитии легочной чумы;
- в непосредственном контакте с гнойным содержимым чумного бубона;
- в результате заражения блох на больном с чумной септицемией. Трупы умерших от чумы людей часто бывают непосредственной причиной
инфицирования окружающих. Особую опасность представляют больные легочной формой чумы.
Механизм передачи разнообразен, чаще всего трансмиссивный, но возможен и воздушно-капельный (при легочных формах чумы, заражении в лабораторных условиях). Переносчиками возбудителя служат блохи (около 100 видов) и некоторые виды клещей, поддерживающие эпизоотический процесс в природе и передающие возбудитель синантропным грызунам, верблюдам, кошкам и собакам, которые могут переносить на себе зараженных блох к жилью человека. Человек заражается не столько при укусе блохи, сколько после втирания в кожу ее фекалий или масс, срыгиваемых при питании. Бактерии, размножающиеся в кишечнике блохи, выделяют коагулазу, образующую пробку (чумной блок), препятствующую поступлению крови в ее организм. Попытки голодного насекомого к кровососанию сопровождаются срыгиванием зараженных масс на поверхность кожи в месте укуса. Такие блохи голодные и часто пытаются сосать кровь животного. Контагиозность блох сохраняется в среднем около 7 нед, а по некоторым данным - до 1 года.
Возможны контактный (через поврежденную кожу и слизистые оболочки) при разделке туш и обработке шкур убитых зараженных животных (зайцы, лисы, сайгаки, верблюды и др.) и алиментарный (при употреблении в пищу их мяса) пути заражения чумой.
Естественная восприимчивость людей
Естественная восприимчивость людей очень высокая, абсолютная во всех возрастных группах и при любом пути заражения. После перенесенного заболевания развивается относительный иммунитет, не предохраняющий от повторного заражения. Повторные случаи заболевания не бывают редкостью и протекают не менее тяжело, чем первичные.
Основные эпидемиологические признаки
Природные очаги чумы занимают 6-7% суши земного шара и зарегистрированы на всех континентах, исключая Австралию и Антарктиду. Ежегодно в мире регистрируют несколько сотен случаев чумы у людей. В странах СНГ выявлено 43 природных очага чумы общей площадью более 216 млн гектаров, расположенных в равнинных (степных, полупустынных, пустынных) и высокогорных регионах.
В РФ зарегистрировано 12 природных очагов чумы общей площадью свыше 30 млн гектаров, повышенному риску заражения этой болезнью подвергается более 20 тыс. человек:
- в Астраханской области;
- Республиках Кабардино-Балкарской;
- Карачаево-Черкесской;
- Чеченской;
- Дагестан;
- Тыва;
- Алтай и др.
Различают 2 вида природных очагов:
- дикой чумы;
- крысиной чумы.
В природных очагах чума проявляется в виде эпизоотий среди грызунов и зайцеобразных. Заражение от спящих зимой грызунов (сурки, суслики и др.) происходит в теплое время года, в то время как от не спящих зимой грызунов и зайцеобразных (песчанки, полевки, пищухи и др.) заражение имеет 2 сезонных пика, что связано с периодами размножения зверьков. Мужчины болеют чаще, чем женщины, в связи с профессиональной деятельностью и пребыванием в природном очаге чумы (отгонное животноводство, охота). В антропургических очагах роль резервуара инфекции выполняют черная и серая крысы. Эпидемиология бубонной и легочной форм чумы в наиболее важных чертах имеет существенные различия. Для бубонной чумы характерно сравнительно медленное нарастание заболеваний, в то время как легочная чума из-за легкой передачи бактерий может в короткие сроки получать широкое распространение. Больные бубонной формой чумы малоконтагиозны и практически незаразны, так как выделения их не содержат возбудителей, а в материале из вскрывшихся бубонов их мало или нет совсем. При переходе болезни в септическую форму, а также при осложнении бубонной формы вторичной пневмонией, когда возбудитель может передаваться воздушно-капельным путем, развиваются тяжелые эпидемии первичной легочной чумы с очень высокой контагиозностью. Обычно легочная чума следует за бубонной, распространяется вместе с ней и быстро становится ведущей эпидемиологической и клинической формой. В последнее время интенсивно разрабатывается представление о том, что возбудитель чумы может долгое время находиться в почве в некультивируемом состоянии. Пер-
вичное заражение грызунов при этом может происходить при рытье нор на инфицированных участках почв. Данная гипотеза основана как на экспериментальных исследованиях, так и наблюдениях о безрезультатности поисков возбудителя среди грызунов и их блох в межэпизоотические периоды.
Патогенез
Адаптационные механизмы человека (рис. 4-2) практически не приспособлены сопротивляться внедрению и развитию чумной палочки в организме. Это объясняется тем, что Y. pestis очень быстро размножается. Бактерии в большом количестве вырабатывают факторы проницаемости и подавления фагоцитоза, что способствует быстрому и массивному лимфогенному и гематогенному диссеминированию возбудителя, прежде всего в органы мононуклеарно-фагоцитарной системы с ее последующей активизацией. Массивная антигенемия, выброс медиаторов воспаления, в том числе и шокогенных цитокинов, ведет к развитию микроциркуляторных нарушений, ДВС-синдрома с последующим исходом в ИТШ.
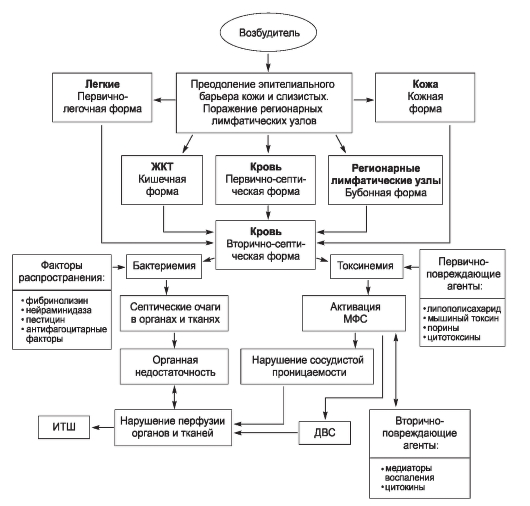
Рис. 4-2. Патогенез чумы
Клиническая картина заболевания во многом определяется местом внедрения возбудителя, проникающего через кожный покров (укусы насекомых, микротравмы кожи при расчесах), слизистые оболочки глаз, дыхательных путей или ЖКТ, альвеолярный эпителий.
Основы патогенеза чумы разработаны Н.Н. Жуковым-Вережниковым в середине ХХ столетия и включают 3 стадии:
- лимфогенный занос возбудителя и его размножение в регионарных лимфоузлах с формированием чумного бубона;
- стадию бактериемии;
- стадию септицемии.
Первая стадия патогенеза соответствует инкубационному периоду заболевания. Происходит первичный контакт возбудителя с фагоцитами в месте входных ворот, его адаптация в организме с выработкой антифагоцитарных факторов и размножением в макрофагах. От места внедрения иерсинии лимфогенно диссеминируют в регионарные лимфатические образования, где кратковременно задерживаются. При этом создаются условия для формирования первичного очага инфекции в лимфатических узлах (чумной бубон), лимфоглоточном кольце, изредка в коже или внутренних органах СМФ.
В начальном периоде (в стадии бактериемии) клинические проявления болезни связаны прежде всего с развитием интоксикации, обусловленной выработкой медиаторов воспаления под воздействием ЛПС-комплекса и других токсинов возбудителя.
В разгаре болезни нарастает бактериемия и развивается сильнейший токсикоз с изменениями реологических свойств крови, нарушениями микроциркуляции и геморрагическими проявлениями (вплоть до геморрагического некроза) в различных органах. Микроциркуляторные нарушения, связанные с действием токсинов возбудителя, а также цитокинов, выделяемых сенсибилизированными макрофагами, нейтрофилами и лимфоцитами, вызывают изменения в сердечной мышце, в сосудах и надпочечниках, что может обусловить развитие острой сердечно-сосудистой недостаточности, тканевой гипоксии, ДВС-синдрома, респираторного дистресс-синдрома. Гипоксия тканей и некробиотические изменения в них приводят к полиорганной недостаточности. Возможен ИТШ, быстрота развития которого усугубляется при нарушении компенсаторных механизмов вследствие р-адреноблокирующего действия мышиного токсина иерсинии.
В первичных очагах инфекции на месте входных ворот развиваются воспалительные, геморрагические и некротические изменения, происходит интенсивное размножение возбудителей. При аэрогенном пути заражения поражаются альвеолы, в них развивается воспалительный процесс с элементами некроза.
Последующая лимфогематогенная диссеминация бактерий сопровождается интенсивным токсикозом и приводит к формированию вторичных очагов инфекции в отдаленных лимфоузлах (вторичные бубоны), висцеральных органах, ЦНС с развитием септико-геморрагических проявлений в различных органах и тканях (септицемии).
В периоде реконвалесценции специфические АТ к основным Аг возбудителя способствуют активизации завершенного фагоцитоза. Антительный ответ при чуме слабый и формируется в поздние сроки заболевания. Нарастают образование иммунных комплексов, реакции клеточного иммунитета, развиваются репаративные процессы.
Клиническая картина
Инкубационный период составляет 3-6 сут (при эпидемиях или септических формах сокращается до 1-2 дней). Максимальный срок инкубации - 9 дней.
Согласно клинической классификации чумы, предложенной Г.П. Рудневым (1936), выделяют:
- преимущественно локальные формы заболевания (кожную, бубонную, кожно-бубонную);
- внутренне-диссеминированные или генерализованные формы (первично-септическую, вторично-септическую);
- внешне-диссеминированные формы (первичную легочную, вторичную легочную, кишечную).
Начальный период проявляется признаками, общими для всех форм чумы. Характерно острое начало болезни с потрясающими повторными ознобами, быстрым нарастанием температуры тела до высоких цифр и развитием выраженной интоксикации, определяющей в дальнейшем тяжесть течения и исход заболевания. Характерны жалобы пациентов на сильную, прогрессирующую головную боль, боли в области крестца, в мышцах и суставах, мучительную жажду. Может быть рвота, нередко кровавая. При развитии инфекционного делирия появляются психомоторное возбуждение, двигательное беспокойство, чрезмерная активность, суетливость, дрожательный тремор. Возникают бред и галлюцинации, дезориентация, больные пытаются бежать (бежит, как чумной). Речь становится невнятной, походка шаткой. В более редких случаях возможны заторможенность, апатия, а слабость достигает такой степени, что больной не может встать с постели. Внешне отмечают гиперемию и одутловатость лица, инъекцию склер. На лице выражение страдания или ужаса (маска чумы). Очень характерными признаками заболевания являются утолщение и обложенность языка густым белым налетом (меловой язык). При тяжелом течении болезни отмечают бледность и цианотичность кожного покрова, заострившиеся черты лица, на коже появляется геморрагическая сыпь. Могут развиться кровоточивость слизистых оболочек, полостные кровотечения, геморрагический отек легких (респираторный дистресс-синдром). Со стороны сердечно-сосудистой системы отмечают выраженную тахикардию (вплоть до эмбриокардии), аритмию и прогрессирующее падение АД. Развивается гепатолиенальный синдром. Даже при локальных формах заболевания характерны тахипноэ, а также олигурия или анурия.
Кожная форма
Первичное поражение кожи в месте входных ворот развивается редко (3-4% случаев). На фоне умеренной интоксикации в месте укуса насекомого (чаще в области стоп и лодыжек) появляется небольшой болезненный участок покраснения с последующей быстрой трансформацией в пузырек с геморрагическим или гнойно-геморрагическим содержимым, локализующийся на отечной подкожной клетчатке и окруженный зоной инфильтрации и гиперемии с багровым оттенком (так называемую фликтену). Иногда процесс на этом заканчивается, но чаще фликтена превращается в дальнейшем в карбункул. После вскрытия пустулы образуется язва с желтоватым дном, склонная к увеличению в размерах, окруженная багровым валом, не имеющим четких границ со здоровой кожей. В дальнейшем нарастают отек и инфильтрация подлежащих тканей, подвижность карбункула ограничивается, дно язвы покрывает черный
струп, после отторжения которого образуются рубцы. Возможно развитие вторичных отдаленных фликтен и карбункулов. Чумной карбункул имеет значительное сходство с сибиреязвенным (см. раздел «Сибирская язва»), но отличается от него резкой болезненностью.
Бубонная форма
Наиболее частая форма чумы. Характерно поражение лимфатических узлов, регионарных по отношению к месту внедрения возбудителя - паховых, реже подмышечных и очень редко шейных. Обычно бубоны бывают одиночными, реже множественными, располагающимися выше по ходу оттока лимфы. На фоне умеренной или выраженной интоксикации возникают нарастающие по интенсивности боли в области будущей локализации бубона. Через 1-2 дня можно пропальпировать резко болезненный лимфатический узел, реже конгломерат из нескольких лимфоузлов. Кожа над ним резко гиперемирована с цианотичным оттенком, напряжена, лоснится.
Сформировавшийся бубон сопровождается признаками периаденита:
- он выбухает из отечной подкожной клетчатки;
- имеет нечеткие контуры;
- малоподвижен.
Вначале бубон имеет твердую консистенцию, затем размягчается и становится пастозным, а в дальнейшем флюктуирующим при пальпации. Зона болезненности в области бубона расширяется, но ее интенсивность уменьшается. Период разгара заболевания продолжается около недели. В периоде реконвалесценции разрешение бубона заканчивается его произвольным вскрытием с истечением гнойно-геморрагического содержимого и образованием фистулы, в дальнейшем длительно заживающей с рубцеванием. При проведении антибактериального лечения лимфатические узлы могут также самостоятельно рассасываться или склерозироваться.
Кожно-бубонная форма
Представляет собой сочетание кожных поражений и изменений со стороны регионарных лимфатических узлов.
Эти локальные формы заболевания могут переходить во вторичный чумной сепсис и вторичную пневмонию. Их клиническая характеристика принципиально не отличается от первично-септической и первично-легочной форм чумы соответственно.
Первично-септическая форма
Возникает после короткого инкубационного периода в 1-2 дня и характеризуется быстрым развитием тяжелой интоксикации, геморрагическими проявлениями (кровоизлияния в кожу и слизистые оболочки, желудочнокишечные, легочные, почечные кровотечения), формированием клинической картины декомпенсированного ИТШ, в части случаев сочетающегося с развитием тяжелого менингита или менингоэнцефалита. При молниеносной форме заболевания его длительность не превышает нескольких часов, при отсутствии лечения летальность достигает 100%.
Первично-легочная форма
Входные ворота инфекции - респираторный тракт, реже конъюнктива или миндалины. Инкубационный период короткий, от нескольких часов до 2 сут. Заболевание начинается остро с проявлений интоксикационного синдрома,
характерного для чумы, при отсутствии физикальной легочной патологии и относительно удовлетворительной сердечно-сосудистой деятельности. На 2-3-й день болезни возбужденное, эйфоричное поведение больных сменяется апатией с гипертермией, выраженными признаками токсической энцефалопатии (вплоть до развития делирия), которые свидетельствуют о тяжелом состоянии пациента.
Нарастают нарушения гемодинамики:
- тахикардия;
- прогрессивное снижение АД;
- развитие цианоза.
Физикальные данные со стороны легких скудные, на рентгенограмме обнаруживают признаки очаговой или долевой пневмонии. В дальнейшем появляется сильный кашель, возникают выраженная одышка, боли в грудной клетке при дыхании. Кашель сопровождается выделением сначала стекловидной, а затем жидкой пенистой кровянистой мокроты. В легких нарастает количество рассеянных сухих и влажных крепитирующих хрипов. Период разгара длится от нескольких часов до 2-3 сут и сменяется терминальной стадией. У больных сначала развивается сопорозное состояние, сопровождающееся усилением одышки и геморрагическими проявлениями в виде петехий или обширных кровоизлияний, а затем кома (тяжелый декомпенсированный шок).
Кишечная форма
На фоне ведущих проявлений синдрома интоксикации у больных возникают резкие боли в животе, многократная рвота и диарея с тенезмами и обильным слизисто-кровянистым или водянистым стулом. Поскольку кишечные проявления можно наблюдать и при других формах заболевания, до последнего времени остается спорным вопрос о существовании кишечной чумы как самостоятельной формы, по-видимому, связанной с энтеральным заражением.
Дифференциальная диагностика
Кожную, бубонную и кожно-бубонную формы чумы следует отличать от туляремии, карбункулов, различных лимфаденопатий, легочные и септические формы - от воспалительных заболеваний легких и сепсиса, в том числе менингококковой этиологии.
При всех формах чумы уже в начальный период настораживают быстро нарастающие признаки тяжелой интоксикации:
- высокая температура тела;
- потрясающий озноб;
- рвота;
- мучительная жажда;
- психомоторное возбуждение;
- бред и галлюцинации.
При осмотре больных привлекают внимание:
- невнятная речь;
- шаткая походка;
- одутловатое гиперемированное лицо с инъекцией склер;
- выражение страдания или ужаса на лице (маска чумы);
- меловой язык.
Быстро нарастают признаки сердечно-сосудистой недостаточности, тахипноэ, прогрессирует олигурия.
Для кожной, бубонной и кожно-бубонной форм чумы характерны:
- резкая болезненность в месте поражения;
- стадийность в развитии карбункула (пустула, язва, черный струп, рубец);
- выраженные признаки периаденита при формировании чумного бу бона.
Легочные и септические формы отличают молниеносное развитие тяжелой интоксикации, выраженных проявлений геморрагического синдрома, декомпенсированного ИТШ. При поражении легких отмечают резкие боли в груди и сильный кашель, отделение стекловидной, а затем жидкой пенистой кровянистой мокроты. Скудные физикальные данные не соответствуют общему крайне тяжелому состоянию.
Лабораторная диагностика
В гемограмме отмечают:
- лейкоцитоз (лейкопению при крайне тяжелом течении болезни);
- нейтрофилию с резким сдвигом влево;
- увеличение СОЭ. Бактериоскопический метод
Быстрый, но ориентировочный метод исследования биоматериала, взятого от больных и умерших. Обнаружение возбудителей в мазках периферической крови свидетельствует о крайне тяжелом течении болезни.
Бактериологический метод
Выделение культуры Y. pestis возможно в условиях специализированных режимных лабораторий для работы с возбудителями особо опасных инфекций. Исследования проводят для подтверждения клинически выраженных случаев заболевания, а также для обследования лиц с повышенной температурой тела, находящихся в очаге инфекции.
Бактериологическому исследованию подвергают материал от больных и умерших:
- пунктаты из бубонов и пустул;
- отделяемое язв;
- мокроту и слизь из ротоглотки;
- кровь;
- испражнения;
- ликвор;
- секционный материал.
Иногда для исследования берут пробы воздуха из помещений, смывы с предметов обихода и одежды больных. Результат исследования может быть получен через 2-3 сут.
Биологическая проба
Проводят пассаж на лабораторных животных (морские свинки, белые мыши), погибающих на 5-7-е сутки после заражения. Серологические методы
Методы (ИФА, РНГА, РНАТ, РТПГА) направлены на выявление АТ к капсульному АГ. Используют для ретроспективной диагностики.
Иммунологические методы
Выявляют капсульный АГ в антительных ИФА и РНГА. Молекулярно-биологический метод
Положительные результаты ПЦР через 5-6 ч после ее постановки свидетельствуют о специфической ДНК чумного микроба и подтверждают предварительный диагноз. Окончательным подтверждением чумной этиологии болезни является выделение и идентификация чистой культуры возбудителя.
Осложнения и исходы
Летальные исходы при бубонной форме чумы в условиях современного лечения не превышают 5-19% случаев. При легочных и септических формах даже на фоне адекватного, но поздно назначенного антибактериального и патогенетического лечения летальность может быть чрезвычайно высокой (50% и более).
Основные причины летального исхода:
- ИТШ;
- декомпенсированный ДВС-синдром;
- сердечно-сосудистая и легочная недостаточность.
Лечение
Срочная госпитализация всех больных чумой и лиц с подозрением на чуму является строго обязательной. Режим и диета строго индивидуальны и определяются тяжестью и клинической формой заболевания.
Этиотропные препараты назначают при первом подозрении на чуму, основываясь на клинико-эпидемиологических данных. Успех лечения зависит от своевременности проведения. Выбор препаратов для этиотропного лечения, их доз и схем применения проводят с учетом клинической формы чумы. Продолжительность этиотропного лечения при локализованных формах болезни составляет 7 дней, при диссеминированных - 10 дней. В соответствии с рекомендациями ВОЗ при локализованных формах чумы лекарственным средством выбора считают стрептомицин, назначаемый в суточной дозе 30 мг/кг (максимально до 2 г в сутки) внутривенно и внутримышечно.
Альтернативные препараты:
- перорально тетрациклин по 500 мг 4 раза в сутки;
- перорально или внутривенно доксициклин по 0,1-0,2 г 2 раза в сутки;
- хлорамфеникол по 0,5-0,75 г 4 раза в сутки;
- рифампицин по 0,3 г 3 раза в сутки.
Имеются сведения об успешном использовании в лечении взрослых больных триметоприм-сульфаметоксазола (по 160/800 мг 4 раза в сутки перорально). Препарат выбора для лечения чумы у беременных - гентамицин, вводимый внутримышечно или внутривенно с интервалами 8 ч, в суточной дозе 3 мг/кг.
Одновременно проводят:
- массивное дезинтоксикационное лечение (свежезамороженная плазма, альбумин, реополиглюкин, гемодез, кристаллоидные растворы внутривенно, методы экстракорпоральной детоксикации);
- форсированый диурез;
- назначают препараты для улучшения микроциркуляции и репарации (трентал в сочетании с солкосерилом, пикамилон);
- сердечные гликозиды;
- сосудистые и дыхательные аналептики;
- жаропонижающие и симптоматические средства.
При необходимости используют кортикостероидные препараты (в случаях надпочечниковой недостаточности), методы экстракорпоральной детоксикации.
Эпидемиологический надзор
Объем, характер и направленность профилактических мероприятий определяет прогноз эпизоотической и эпидемической обстановки по чуме в конкретных природных очагах с учетом данных слежения за движением заболеваемости во всех странах мира. Все страны обязаны сообщать ВОЗ о появлении заболеваний чумой, движении заболеваемости, эпизоотиях среди грызунов и мерах борьбы с инфекцией. В стране разработана и функционирует система паспортизации природных очагов чумы, позволившая провести эпидемиологическое районирование территории.
Профилактические мероприятия
В комплексе мер профилактики и борьбы с чумой решающая роль принадлежит мероприятиям, исключающим завоз инфекции из других стран и предупреждающим возникновение заболеваний в энзоотических очагах. Мероприятия по предотвращению завоза чумы из-за рубежа регламентируют ММСП и соответствующие Санитарные правила по охране территории России от завоза опасных инфекционных болезней. Для профилактики завоза чумы из других стран большое значение имеет строгое соблюдение всеми странами международных санитарных правил. В энзоотических очагах противочумные мероприятия включают наблюдение за видовым составом и численностью грызунов, исследование грызунов и их эктопаразитов на инфицированность чумной палочкой. При выявлении эпизоотии проводят дератизацию и дезинсекционные мероприятия в том или ином объеме. Синантропных грызунов истребляют без выявления среди них больных чумой, если их численность превышает 15% попадаемости в ловушки. Грызунов и эктопаразитов в поле и вокруг населенных пунктов уничтожают противочумные учреждения, а в населенных пунктах - дератизационно-дезинсекционные отделы учреждений Роспотребнадзора.
Показания к проведению профилактической иммунизации населения:
- эпизоотия чумы среди грызунов;
- выявление больных чумой домашних животных;
- возможность завоза инфекции больным человеком.
В зависимости от эпидемической обстановки вакцинацию проводят на строго определенной территории всему населению (поголовно) и выборочно особо угрожаемым контингентам - лицам, имеющим постоянную или временную связь с территориями, где течет эпизоотия (животноводы, агрономы, охотники, заготовители, геологи, археологи и т.д.). Вакцинируют ежегодно сотрудников противочумных учреждений Министерства здравоохранения Рос-
сии. Все ЛПУ должны иметь на случай выявления больного чумой определенный запас медикаментов и средств личной защиты и профилактики, а также схему оповещения персонала и передачи информации по вертикали. Меры по предупреждению заражения людей чумой в энзоотичных районах, лиц, работающих с возбудителями особо опасных инфекций, а также предупреждение выноса инфекции за пределы очагов в другие районы страны осуществляют противочумные и другие учреждения здравоохранения.
Мероприятия в эпидемическом очаге
При появлении больного чумой или подозрительного на эту инфекцию принимают срочные меры для локализации и ликвидации очага. Границы территории, на которой вводят те или иные ограничительные мероприятия (карантин), определяют исходя из конкретной эпидемиологической и эпизоотологической обстановки, возможных действующих факторов передачи инфекции, санитарно-гигиенических условий, интенсивности миграции населения и транспортных связей с другими территориями. Общее руководство всеми мероприятиями в очаге чумы осуществляет Чрезвычайная противоэпидемическая комиссия. При этом строго соблюдают противоэпидемический режим с использованием противочумных костюмов. Карантин вводят решением Чрезвычайной противоэпидемической комиссии, охватывая им всю территорию очага.
Больных чумой и пациентов с подозрением на это заболевание госпитализируют в специально организованные госпитали. Транспортировка больного чумой должна осуществляться в соответствии с действующими санитарными правилами по биологической безопасности. Больных с бубонной чумой размещают по несколько человек в палате, больных легочной формой - только в отдельные палаты. Выписку реконвалесцентов проводят при их полном клиническом и бактериологическом выздоровлении не ранее 15-го дня апирексии после локализованных форм и 30-го дня апирексии после диссеминированных форм чумы. При этом необходимо получить отрицательные результаты бактериологического исследования 2 биоптатов бубонов, взятых с интервалом 5-6 дней и 4 мазков с миндалин и мокроты, взятых с интервалами 3-5 дней. Взятие биоматериала проводят по окончании этиотропного лечения. Диспансерное наблюдение за лицами, перенесшими чуму, устанавливают на срок не менее 3 мес.
После выписки переболевшего из стационара за ним устанавливают медицинское наблюдение в течение 3 мес.
В очаге проводят текущую и заключительную дезинфекцию. Лица, соприкасавшиеся с больными чумой, трупами, зараженными вещами, участвовавшие в вынужденном забое больного животного и т.д., подлежат изоляции и медицинскому наблюдению (6 дней). При легочной чуме проводят индивидуальную изоляцию (в течение 6 дней) и профилактику антибиотиками (стрептомицин, рифампицин и др.) всем лицам, которые могли инфицироваться. Вскрытие умерших от чумы, взятие от них материала и его транспортирование в специализированные лаборатории производят в присутствии специалистов противочумного учреждения или отдела особо опасных инфекций учреждения Роспотребнадзора с соблюдением требований нормативных документов.
ТУЛЯРЕМИЯ (TULAREMIA)
Острое природно-очаговое зоонозное инфекционное заболевание с выраженной интоксикацией и поражением кожного покрова, лимфатических узлов, иногда легких, глаз, ЖКТ.
Краткие исторические сведения
В 1910 г. в районе озера Туляре в Калифорнии Д. Мак-Кой обнаружил у сусликов заболевание, напоминающее по клинической картине бубонную чуму. Вскоре он же и Ч. Чапин выделили от больных животных возбудитель, который был назван Васtеriит tularense (1912). Позже было выяснено, что к данной инфекции восприимчивы и люди. По предложению Э. Френсиса (1921) заболевание получило название «туляремия». Возбудитель был назван Francisella tularensis в честь Фрэнсиса, подробно его изучившего.
Этиология
Возбудитель - бактерии F. tularensis рода Francisella семейства Brucellaceae. Морфологически проявляют выраженный полиморфизм, часто имеют форму мелких коккобацилл. Микроорганизмы неподвижные, грамотрицательные, факультативные анаэробы, растут на желточных или агаровых средах с добавлением кроличьей крови или других питательных веществ. Способны к образованию капсулы в организме теплокровных животных и человека. Из лабораторных животных к заражению чувствительны белые мыши и морские свинки.
У бактерий обнаружены О- и Vi-Аг. Факторы патогенности возбудителя полностью не изучены. К ним относят поверхностные белки, способность бактерий к образованию капсулы, к внутриклеточному размножению в макрофагах, гепатоцитах и эндотелиоцитах при незавершенном фагоцитозе, слабоактивный ЛПС-комплекс (эндотоксин).
У бактерий выделяют 3 подвида:
- подвид tularensis (неарктический, африканский);
- среднеазиатский;
- голарктический (европейско-азиатский). Последний включает 3 биологических варианта:
- японский биовар;
- эритромицин-чувствительный биовар;
- эритромицин-устойчивый биовар.
Внутривидовая дифференциация возбудителя туляремии основывается на различиях подвидов и биоваров по ряду фенотипических признаков:
- биохимической активности;
- составу высших жирных кислот;
- степени патогенности для человека и животных;
- чувствительности к определенным антибиотикам;
- особенностям экологии и ареалу возбудителя.
На территории России распространен голарктический подвид возбудителя с двумя последними биоварами.
Вне организма хозяина возбудитель может сохраняться долго. Так, в воде при 4 °С он сохраняет жизнеспособность 1 мес, во влажной почве, на соломе и зерне при температуре ниже 0 °С - до 6 мес, в шкурах животных, павших от
туляремии, при 8-12 °С - более 1 мес. Бактерии не устойчивы к высокой температуре и дезинфицирующим средствам. Для дезинфекции применяют:
- 5% раствор фенола;
- раствор сулемы 1:1000 (убивает бактерии в течение 2-5 мин);
- 1-2% раствор формалина (уничтожает бактерии за 2 ч);
- 70° этиловый спирт и др.
Для полного обеззараживания трупов инфицированных животных их следует выдерживать не менее 1 сут в дезинфицирующем растворе, после чего подвергать автоклавированию и сжиганию.
Эпидемиология
Резервуар и источник инфекции - многочисленные виды диких грызунов, зайцевидные, птицы, собаки и др. Бактерии выделены от 82 видов диких, а также от домашних животных (овцы, собаки, парнокопытные). Основная роль в поддержании инфекции в природе принадлежит грызунам (водяная крыса, обыкновенная полевка, ондатра и др.). Больной человек не опасен для окружающих.
Механизм передачи - множественный, чаще всего трансмиссивный. Возбудитель сохраняется в природе в цикле клещ-животное, передается сельскохозяйственным животным и птицам клещами и кровососущими насекомыми. Специфические переносчики туляремии - иксодовые клещи. Человек заражается туляремией в результате прямого контакта с животными (снятие шкур, сбор павших грызунов и др.), а также алиментарным путем через инфицированные грызунами пищевые продукты и воду открытых водоисточников. Заражение контактным путем возможно также при купании в контаминированном водоисточнике, переходе его вброд, умывании, полоскании белья. Часто заражение происходит через укус кровососущих переносчиков (клещи, комары, блохи, слепни и другие членистоногие) или контактный - при раздавливании инфицированного насекомого на коже или при попадании его в глаз.
Возможно заражение и респираторным путем (при вдыхании инфицированной пыли от зерна, соломы, овощей), а также при вдыхании капельножидкого аэрозоля, образующегося в процессе мойки и резки свеклы и других кормов, контаминированных выделениями больных туляремией грызунов. Зарегистрированы случаи заболеваний людей на производствах, связанных с переработкой природного сырья (сахарные, крахмалопаточные, спиртовые, пеньковые заводы, элеваторы и т.п.), на мясокомбинатах, при забое овец и крупного рогатого скота, на котором имелись инфицированные клещи, на окраинах городов, расположенных вблизи природных очагов. Известны случаи завоза инфекции при транспортировке продуктов и сырья из неблагополучных по туляремии районов. Контактный и аспирационный механизмы передачи туляремийной инфекции могут быть реализованы в условиях лабораторий.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая (практически 100%).
Основные эпидемиологические признаки
Туляремия - распространенное природно-очаговое заболевание, встречающееся преимущественно в ландшафтах умеренного климатического пояса
Северного полушария. Ежегодно в РФ регистрируют от 100 до 400 спорадических случаев туляремии, от 60 до 75% которых приходится на Северный, Центральный и Западно-Сибирский регионы.
Анализ заболеваемости туляремией показал, что после активной разлитой эпизоотии среди грызунов в 2005 г. и резкого подъема заболеваемости до 880 случаев (показатель на 100 000 населения - 0,6) в 2006 г. при низкой численности мелких млекопитающих заболеваемость туляремией снизилась в 13,1 раза. В 2007 г. произошло постепенное восстановление численности грызунов и заболеваемость туляремией среди населения выросла в 1,6 раза, в том числе среди детей до 17 лет - в 2,3 раза. Зарегистрировано 108 случаев туляремии, показатель на 100 000 населения - 0,08, в том числе среди детей до 17 лет зарегистрировано 26 случаев, показатель на 100 000 - 0,09 (в 2006 г. - 67 случаев, показатель - 0,05, среди детей - 12 случаев, показатель - 0,04). В возрастной структуре заболевших дети до 17 лет составляют 23,4%.
Заболевания туляремией регистрировались в 2007 г. в 28 субъектах РФ. Наибольшее число случаев зарегистрировано в Центральном федеральном округе - 41 случай, показатель на 100 000 населения - 0,11. Наиболее высокая заболеваемость зарегистрирована в Рязанской области - показатель на 100 000 населения - 1,44 (17 случаев), Ханты-Мансийском автономном округе - 1,48 (22 случая), Ленинградской - 0,49 (8 случаев) и Архангельской - 0,4 (5 случаев) областях, Ставропольском крае - 0,26 (7 случаев).
Широкое распространение возбудителя в природе, вовлечение в его циркуляцию большого числа теплокровных животных и членистоногих, обсемененность различных объектов окружающей среды (воды, пищевых продуктов) определяют и характеристику эпидемического процесса.
Выделяют различные типы очагов:
- лесной;
- степной;
- лугово-полевой;
- пойменно-болотный;
- в долине рек и др.
Каждому типу очагов соответствуют свои виды животных и кровососущих членистоногих, принимающих участие в передаче возбудителя. Среди заболевших преобладают взрослые.
Часто заболеваемость связана с профессией:
- охотники;
- рыбаки;
- сельскохозяйственные рабочие и др.
Мужчины болеют в 2-3 раза чаще, чем женщины. Антропургические очаги туляремии возникают при миграции зараженных грызунов из мест обитания в населенные пункты, где они контактируют с синантропными грызунами. Туляремия остается болезнью сельской местности, однако в настоящее время отмечают устойчивое нарастание заболеваемости городского населения. Туляремию регистрируют на протяжении всего года, но более 80% случаев приходится на лето и осень. В последние годы заболеваемость спорадическая. В отдельные годы отмечают локальные трансмиссивные, промысловые, сельскохозяйственные, водные вспышки, реже вспышки других типов. В 1993-1998 гг. вспышки туляремии трансмиссивного характера зарегистрированы среди населения Ростовской области и в Республике Башкортостан, водного - в Смоленской области, про-
мыслового - в Оренбургской области, пищевого (молочного) - в Москве. Трансмиссивные вспышки обусловлены передачей возбудителя инфекции кровососущими двукрылыми и возникают в очагах эпизоотий туляремии среди грызунов. Трансмиссивные вспышки обычно начинаются в июле или июне, достигают максимума в августе и прекращаются в сентябре-октябре. Подъему заболеваемости способствуют сенокос и уборочные работы. Крупная трансмиссивная вспышка туляремии, охватившая свыше 200 человек, зарегистрирована в 1993 г. в Ростовской области. В 2007 г. среди населения Ханты-Мансийского автономного округа зарегистрирована 1 вспышка туляремии с трансмиссивным путем передачи, число пострадавших - 22 человека, из них 3 детей.
Промысловый тип вспышек обычно связан с отловом водяной крысы и ондатры. Промысловые вспышки возникают весной или в начале лета в период половодья, и длительность их зависит от периода заготовки. Заражение происходит при контакте с животными или шкурами. Возбудитель проникает через повреждения на коже, в связи с чем чаще возникают подмышечные бубоны, часто без язв в месте внедрения.
Водные вспышки определяет попадание возбудителей в открытые водоемы. Основным загрязнителем воды служат водяные полевки, обитающие по берегам. Заболевания обычно возникают летом с подъемом в июле. Заболевания связаны с полевыми работами и использованием для питья воды из случайных водоемов, колодцев и др. В 1989-1999 гг. доля изолятов возбудителя туляремии из образцов воды достигла 46% и более, что свидетельствует о важном эпидемиологическом значении водоемов как длительных резервуаров инфекции.
Сельскохозяйственные вспышки возникают при вдыхании воздушно-пылевого аэрозоля при работе с соломой, сеном, зерном, кормами, контаминированными мочой больных грызунов. Преобладают легочная, реже абдоминальная и ангинозно-бубонная формы. Бытовой тип вспышек характеризует заражение в быту (дома, на усадьбе). Заражение также возможно во время подметания пола, при переборке и сушке сельскохозяйственных продуктов, раздаче корма домашним животным, употреблении в пищу контаминированных продуктов.
Патогенез
Бактерии проникают в организм человека через кожу (даже неповрежденную), слизистые оболочки глаз, дыхательных путей и ЖКТ. В инкубационном периоде при контакте возбудителя с клетками СМФ макроорганизма происходит сенсибилизация клеток, адаптация и начальное размножение бактерий, образование ими капсулы, начинаются процессы незавершенного фагоцитоза.
В начальном периоде болезни в области входных ворот, локализация которых во многом определяет клиническую форму заболевания, иногда развивается первичный аффект - участок гранулематозного воспаления в виде последовательно сменяющих друг друга пятен, папул, везикул, пустул и язв. В условиях незавершенного фагоцитоза бактерии заносятся макрофагами по лимфатическим путям в регионарные лимфоузлы, где происходит их размножение и накопление, при частичной гибели бактерий высвобождается ЛПС-комплекс (эндотоксин), усиливающий развитие местного воспалительного процесса. При поступлении в кровь ЛПС-комплекса и токсических медиаторов воспаления (ФНО-α, ИЛ-1 и др.) развивается токсинемия, нарастает сенсибилизация клеток СМФ. Бактериемия при заболевании возникает не всегда.
В разгаре заболевания развитие воспалительного процесса в регионарных лимфоузлах приводит к формированию первичного бубона (воспаленного лимфатического узла). Дальнейшая лимфогенная и, значительно реже, гематогенная внутримакрофагальная диссеминация возбудителя обусловливает возможность формирования вторичных бубонов, токсико-аллергических реакций, развития вторично-генерализованной формы инфекции с поражением различных органов и систем (прежде всего легких, печени и селезенки). Первично-генерализованная форма туляремии в виде тяжелого сепсиса развивается крайне редко, при этом выраженная бактериемия и полиорганная гематогенная диссеминация возбудителей происходят на фоне резкого ослабления лимфатического барьера и отсутствия иммунной перестройки организма. В лимфатических узлах и пораженных внутренних органах образуются специфические гранулемы с центральными участками некроза, скоплением гранулоцитов, эпителиальных и лимфоидных элементов. Формированию гранулем способствует незавершенность фагоцитоза, обусловленная свойствами возбудителя (факторы, препятствующие внутриклеточному киллингу).
В периоде реконвалесценции усиливаются реакции гуморального и клеточного иммунитета, завершенного фагоцитоза, элиминации возбудителей. В органах и тканях развиваются репаративные процессы. Некротизированные участки в первичных бубонах нередко нагнаиваются, и бубоны самопроизвольно вскрываются с последующим длительным заживлением язвы. Вторичные бубоны, как правило, не нагнаиваются. В случае замещения некротизированных участков в лимфатических узлах соединительной тканью нагноение не происходит, бубоны рассасываются или склерозируются. Формируется стойкий постинфекционный иммунитет, но в некоторых случаях он может быть нестерильным, при этом наблюдают затяжное рецидивирующее течение заболевания.
Клиническая картина
В соответствии с методическими рекомендациями МЗ РФ (1999), повторяющими клиническую классификацию академика Г.П. Руднева (1960), выделяют нижеследующие клинические формы туляремии.
• По локализации местного процесса:
◊ гландулярную (бубонную);
◊ ульцерогландулярную (язвенно-бубонную);
◊ окулогландулярную (глазобубонную);
◊ ангинозно-гландулярную (ангинозно-бубонную);
◊ легочную с бронхитическим и пневмоническим вариантами;
◊ желудочно-кишечную (абдоминальную);
◊ генерализованную (тифоидную, септическую).
• По длительности течения:
◊ острую;
◊ затяжную;
◊ рецидивирующую.
• По степени тяжести:
◊ легкую;
◊ среднетяжелую;
◊ тяжелую.
Инкубационный период длится от 1 до 30 дней, чаще всего он равен 3-7 сут. Начальный период болезни длится 2-3 дня и проявляется признаками, общими для всех клинических форм туляремии:
- острым началом с повышением температуры тела до 38-40 °С;
- лихорадкой постоянного характера;
- развитием других симптомов интоксикации:
◊ озноба;
◊ головной боли;
◊ мышечных болей;
◊ потливости (особенно ночной);
◊ общей слабости, анорексии.
При осмотре больных отмечают гиперемию и пастозность лица, а также слизистой оболочки рта и носоглотки, инъекцию склер, гиперемию конъюнктивы. Могут быть сухой кашель, скудные сухие хрипы в легких. Пульс нередко урежен (относительная брадикардия), АД снижено.
Период разгара болезни
Нарастает интоксикация, сохраняется ремиттирующая (наиболее часто), интермиттирующая, постоянная или волнообразная лихорадка (в виде 2-3 волн при затяжном течении заболевания). Чаще всего лихорадка продолжается 2-3 нед, иногда ее длительность варьирует от 1 нед до 2-3 мес. В ряде случаев появляется экзантема различного характера:
- эритематозная;
- макулопапулезная;
- розеолезная;
- везикулезная;
- петехиальная.
Через несколько дней от начала заболевания развивается гепатолиенальный синдром. Развитие различных клинических форм заболевания связано с механизмом заражения и входными воротами инфекции, определяющими локализацию местного процесса.
Гландулярная (бубонная) форма (см. рис. 31 доп. илл.)
Развивается после проникновения возбудителя через кожу в виде регионарного по отношению к воротам инфекции лимфаденита (бубона). Возможно изолированное или сочетанное поражение различных групп лимфатических узлов - подмышечных, паховых, бедренных. Кроме того, при гематогенной диссеминации возбудителей могут формироваться вторичные бубоны. Возникает болезненность, а затем увеличение лимфатических узлов до размеров лесного ореха или мелкого куриного яйца. При этом болевые реакции постепенно уменьшаются и исчезают. Контуры бубона остаются отчетливыми, признаки периаденита незначительны. В динамике заболевания бубоны медленно (иногда в течение нескольких месяцев) рассасываются, нагнаиваются (обычно на 3-4-й неделе болезни) с образованием свища и выделением густого сливкообразного гноя или склерозируются. Эти процессы в различных бубонах происходят не одновременно. Бубонная форма туляремии может приобрести рецидивирующее течение с периодическим возобновлением лимфаденита в местах прежней локализации и умеренными проявлениями интоксикации. В этих случаях заболевание может продолжаться от нескольких месяцев до 2-3 лет.
Ульцерогландулярная (язвенно-бубонная) форма
Развивается преимущественно при трансмиссивном заражении. На фоне слабой или умеренной интоксикации в месте внедрения микроорганизма формируется первичный аффект. В течение нескольких дней последовательно сменяют друг друга пятно, папула, везикула, пустула, а затем неглубокая язва диаметром от 0,2 до 1,5 см с утолщенными приподнятыми краями. Дно язвы покрывается скудным серозно-геморрагическим отделяемым, а затем темной корочкой в форме кокарды. Перифокальный отек окружающих мягких тканей не развивается, болезненность незначительная. Одновременно развивается регионарный лимфаденит (бубон). В последующем рубцевание язвы происходит медленно, с образованием слабозаметного рубца или участка пигментации кожи.
Окулогландулярная (глазобубонная) форма
Встречается редко и возникает в случаях проникновения возбудителя через конъюнктиву при контактном заражении (занос бактерий грязными руками, умывание). При этом происходит поражение (чаще одностороннее) слизистых оболочек глаз в виде конъюнктивита, папулезных, а затем эрозивно-язвенных образований с отделением желтоватого гноя. Поражения роговицы наблюдают редко. Эти клинические проявления сопровождают выраженная интоксикация, значительный отек век, блефароспазм и регионарный лимфаденит с воспалением лимфатических узлов различных групп - околоушных, подчелюстных, переднешейных. Течение заболевания обычно достаточно тяжелое и длительное.
Ангинозно-гландулярная (ангинозно-бубонная) форма
Развивается после проникновения возбудителя с инфицированной пищей или водой, поэтому может сочетаться с абдоминальной формой туляремии. Больные жалуются на умеренные боли в горле, затрудненное глотание. При осмотре миндалины гиперемированы, увеличены и отечны, спаяны с окружающей клетчаткой. На их поверхности, чаще с одной стороны, образуются серовато-белые островчатые или сливные фибринозные налеты, снимаемые с трудом. Выражен отек небных дужек и язычка. В дальнейшем происходит разрушение ткани миндалины с образованием глубоких, медленно заживающих язв с последующим образованием рубца. Туляремийные бубоны возникают в подчелюстной, шейной, иногда в надключичной областях, чаще на стороне пораженной миндалины. Признаки периаденита и гиперемия кожи над лимфоузлами не характерны, болезненность слабая. Длительность заболевания - 1-3 нед, проявления тонзиллита исчезают значительно быстрее, чем лимфаденит.
Легочная форма
Развивается при аэрогенном заражении или вслед за любой другой формой заболевания (вторично-легочная форма). Протекает в виде бронхитического или пневмонического варианта с поражением паратрахеальных, бронхиальных и медиастинальных лимфоузлов и признаками интоксикации. Бронхитический вариант имеет продолжительность 1-2 нед и характеризуется умеренной интоксикацией, развитием трахеита и бронхита. Пневмонический вариант отличается острым началом с высокой лихорадкой, слабостью, адинамией, профузной ночной потливостью, развитием пневмонии различного характера (очагового, сегментарного, лобулярного или диссеминированного). При глу-
боком расположении пневмонических очагов скудные физикальные данные появляются поздно. Течение болезни обычно тяжелое, длительное, ацикличное, зачастую рецидивирующее.
Нередко развиваются разнообразные осложнения:
- плевриты;
- бронхоэктазы;
- абсцессы;
- каверны;
- гангрена легких;
- острая дыхательная недостаточность.
Желудочно-кишечная (абдоминальная) форма
Встречается редко и развивается вследствие поражения лимфатического аппарата кишечника и брюшной полости. Клинически проявляется выраженной интоксикацией, сильными болями в животе, тошнотой, изредка рвотой, анорексией. Иногда в начале заболевания развивается диарея, а впоследствии задержка стула. При пальпации отмечают болезненность около пупка, возможны положительные симптомы раздражения брюшины. Как правило, формируется гепатолиенальный синдром. Пальпировать брыжеечные лимфатические узлы удается редко, их увеличение устанавливают с помощью УЗИ. Возможно образование выпота в брюшную полость с появлением симптомов раздражения брюшины, а в дальнейшем - нагноение и самопроизвольное вскрытие мезентериальных лимфоузлов с развитием перитонита.
Генерализованная форма
Развивается редко как результат других клинических форм заболевания (вторично-генерализованная форма), очень редко как первично-генерализованная форма у иммуносупрессивных лиц или при лабораторном заражении высоковирулентными штаммами туляремийных бактерий. Клинически напоминает тифопаратифозные инфекции или тяжелый сепсис. Высокая лихорадка становится неправильно ремиттирующей, сохраняется долго.
Выражены симптомы интоксикации:
- головная боль;
- ознобы;
- миалгии;
- слабость.
Возможны спутанность сознания, бред, галлюцинации. Пульс лабилен, тоны сердца глухие, АД низкое. В большинстве случаев с первых дней заболевания развивается гепатолиенальный синдром. В дальнейшем возможно появление стойкой экзантемы с локализацией элементов сыпи на симметричных участках тела - предплечьях и кистях рук, голенях и стопах, на шее и лице. Характер сыпи напоминает полиморфную экссудативную эритему. При этой форме возможно развитие вторичных бубонов, обусловленных гематогенным диссеминированием возбудителей, и метастатической специфической пневмонии.
Дифференциальная диагностика
Туляремию следует отличать:
- от лимфаденитов кокковой, туберкулезной и другой этиологии;
- лимфогранулематоза;
- пневмоний (при легочной форме);
- тифопаратифозных заболеваний;
- сепсиса (при генерализованной форме);
- лимфосаркомы;
- фелиноза;
- инфекционного мононуклеоза;
- орнитоза;
- ку-лихорадки;
- в природных очагах - от чумы.
Туляремийный лимфаденит отличают стихание болей при увеличении бубона, слабые или отсутствующие признаки периаденита, медленное рассасывание или склерозирование, а при нагнаивании бубона - сливкообразный характер гноя.
Из признаков заболевания, общих для всех форм туляремии, обращают внимание на высокую длительную лихорадку, относительную брадикардию, гепатолиенальный синдром, возможность появления экзантемы различного характера.
При язвенно-бубонной форме характерно развитие первичного аффекта на месте внедрения возбудителя в виде последовательно сменяющих друг друга пятна, папулы, везикулы, пустулы, язвы. При глазо-бубонной форме туляремии происходит поражение слизистых оболочек глаз в виде конъюнктивита, папулезных, а затем эрозивно-язвенных образований с отделением желтоватого гноя. Ангину при ангинозно-бубонной форме заболевания отличают чаще односторонний характер, умеренные боли в горле, спаянность миндалин с окружающей клетчаткой, трудно снимаемые серовато-белые налеты на их поверхности, а в дальнейшем - образование глубоких язв, медленно заживающих рубцеванием. Поражения мезентериальных лимфатических узлов при абдоминальной форме клинически проявляются сильными болями в животе, тошнотой, изредка рвотой, анорексией. Бронхитический вариант легочной формы туляремии отличает поражение бронхиальных, медиастинальных, паратрахеальных лимфатических узлов, туляремийную пневмонию - довольно тяжелое ацикличное течение, склонность к развитию осложнений (бронхоэктазы, абсцессы, плевриты, каверны, гангрена легких).
Лабораторная диагностика
В первые дни заболевания в периферической крови отмечают изменения гемограммы:
- умеренный лейкоцитоз;
- нейтрофильный сдвиг влево;
- повышение СОЭ.
В дальнейшем лейкоцитоз может сменять лейкопения с лимфоцитозом и моноцитозом.
Серологические методы исследования
В клинической практике широко применяют РА с использованием взвеси убитых бактерий и РНГА. Минимальным диагностическим титром реакций считают разведение сыворотки крови 1:100, исследования проводят с парными сыворотками для исключения перекрестных ложноположительных результатов. ИФА на твердофазном носителе по чувствительности в 10-20 раз
превышает другие методы серологической диагностики туляремии, положительный результат (диагностический титр АТ 1:400) может быть получен на 6-10-й день болезни.
Кожно-аллергическая проба
Проба с тулярином (взвесью вакцинного штамма убитых туляремийных бактерий):
- 0,1 мл препарата вводят внутрикожно в среднюю треть предплечья с внутренней стороны;
- результат реакции учитывают через 24 ч.
Проба высокоспецифична и результативна уже на ранних этапах (на 3-5-й день) болезни. Ее положительный результат выражается в появлении болезненного инфильтрата и гиперемии диаметром не менее 0,5 см.
Одновременно могут возникнуть побочные реакции:
- повышение температуры;
- лимфангит и лимфаденит;
- некроз в месте инъекции.
Следует учитывать, что у лиц, переболевших туляремией, проба может оставаться положительной в течение многих лет.
Реакция лейкоцитолиза с использованием тулярина в качестве АГ и сыворотки крови пациента также отличается строгой специфичностью, но позволяет избежать вышеуказанных нежелательных проявлений, поскольку ставится in vitro.
Бактериологическая диагностика
Имеет второстепенное значение, поскольку малая концентрация возбудителя в крови или биоматериале из тканей снижает вероятность его высева. Выделение возбудителя возможно в первые 7-10 дней заболевания, однако это требует специальных сред и лабораторных животных. Выделение возбудителя, а также постановка биологической пробы с заражением белых мышей или морских свинок пунктатом бубонов, кровью больных, отделяемым конъюнктивы и язв возможны только в специальных режимных лабораториях.
Молекулярно-генетический метод
Выявление ДНК возбудителя в исследуемом биоматериале с помощью ПЦР - ценный метод ранней диагностики туляремии. Реакция положительна уже в начальный лихорадочный период заболевания.
Инструментальные методы диагностики
Рентгенография, УЗИ, биопсия, бронхоскопия и лапароскопия, КТ имеют вспомогательное значение.
Осложнения и исходы
В большинстве случаев развиваются при генерализованной и легочной формах. Наиболее часты вторичные туляремийные пневмонии с тяжелым течением и возможным развитием острой дыхательной недостаточности. Возможно развитие ИТШ. В редких случаях наблюдают менингиты и менингоэнцефалиты, миокардиты, полиартриты и др. Легочная форма может осложниться развитием плеврита, формированием абсцессов и каверн, желудочно-кишечная форма - нагноением и самопроизвольным вскрытием мезентериальных лимфоузлов с развитием перитонита.
Лечение
Госпитализацию больных осуществляют по клиническим показаниям. Этиотропное лечение предусматривает сочетанное применение стрептомицина по 1 г в сутки и гентамицина по 240 мг в сутки внутримышечно. Монотерапию можно проводить доксициклином по 0,2 г в сутки внутрь или парентерально, канамицином по 0,5 г 4 раза в сутки или сизомицином по 0,1 г 3 раза в сутки внутримышечно. Курс лечения антибиотиками продолжают до 5-7-го дня нормальной температуры тела.
Антибиотики 2-го ряда:
- рифампицин;
- левомицетин.
Проводят дезинтоксикационное лечение, показаны антигистаминные и противовоспалительные препараты (салицилаты), витамины, сердечнососудистые средства. Для местного лечения бубонов и кожных язв применяют наложение повязок с тетрациклиновой, стрептомициновой, левомицетиновой мазями, компрессы, физиотерапевтические процедуры (УФО, УВЧ, лазерное облучение, диатермия). При нагноении бубона проводят его вскрытие и дренирование.
Больных выписывают из стационара после клинического выздоровления. Длительно не рассасывающиеся и склерозированные бубоны не являются противопоказанием для выписки. Диспансерное наблюдение за переболевшим осуществляют в течение 6-12 мес при остаточных признаках.
Эпидемиологический и эпизоотологический надзор
Включает постоянное отслеживание заболеваемости людей и животных в природных очагах туляремии, циркуляции возбудителя среди животных и кровососущих членистоногих, контроль за численностью грызунов на территории природных очагов и состоянием иммунитета у людей. Его результаты составляют основу для планирования и осуществления комплекса профилактических и противоэпидемических мероприятий. Эпидемиологический надзор предусматривает эпизоотологическое и эпидемиологическое обследование природных очагов туляремии, обобщение и анализ полученных при этом данных, обусловливающих эпидемические проявления в природных очагах туляремии в виде спорадической, групповой и вспышечной заболеваемости людей. Большое значение имеет установление преобладающих клинических форм, тяжести заболевания, сроков диагностики, эпидемиологических типов заболеваемости.
Профилактические мероприятия
Основу профилактики туляремии составляют мероприятия по обезвреживанию источников возбудителя инфекции, нейтрализации факторов передачи и переносчиков возбудителя, а также вакцинация угрожаемых контингентов населения. Устранение условий заражения людей (общие санитарные и гигиенические мероприятия, включая гигиеническое воспитание) имеет свои особенности при различных типах заболеваемости. При трансмиссивных заражениях через кровососущих применяют репелленты, защитную одежду, ограничивают доступ непривитого населения на неблагополучные территории. Большое значение имеет борьба с грызунами и членистоногими (дератизационные и дезинсекци-
онные мероприятия). Для профилактики алиментарного заражения следует избегать купания в открытых водоемах, а для хозяйственно-питьевых целей следует применять только кипяченую воду. На охоте необходимо дезинфицировать руки после снятия шкурок и потрошения зайцев, ондатр, кротов и водяных крыс. Вакцинацию проводят в плановом порядке (среди населения, проживающего в природных очагах туляремии, и контингентов, подвергающихся риску заражения) и по эпидемиологическим показаниям (внеплановая) при ухудшении эпидемиологической и эпизоотологической ситуации и возникновении угрозы заражения определенных групп населения. Для иммунопрофилактики применяют живую аттенуированную вакцину. Вакцинация обеспечивает формирование стойкого и длительного иммунитета у привитых (5-7 лет и более). Ежегодно в нашей стране вакцинируют более 500 000 и ревакцинируют против туляремии около 1,5 млн человек. Ревакцинацию проводят через 5 лет контингентам, подлежащим плановой вакцинации.
Мероприятия в эпидемическом очаге
Каждый случай заболевания человека туляремией требует подробного эпизоотолого-эпидемиологического обследования очага с выяснением пути заражения. Вопрос о госпитализации больного туляремией, сроках выписки из стационара решает лечащий врач сугубо индивидуально. Больных с абдоминальной, легочной, глазобубонной и ангинозно-бубонной, а также средней тяжести или тяжело протекающие случаи язвенно-бубонной и бубонной форм необходимо госпитализировать по клиническим показаниям. Больных выписывают из стационара после клинического выздоровления. Длительно не рассасывающиеся и склерозированные бубоны не являются противопоказанием для выписки. Разобщение других лиц в очаге не проводят. В качестве меры экстренной профилактики можно провести антибиотикопрофилактику назначением рифампицина по 0,3 г 2 раза в сутки, доксициклина по 0,2 г 1 раз в сутки, тетрациклина по 0,5 г 3 раза в сутки. В жилище больного проводят дезинфекцию. Обеззараживанию подлежат только вещи, загрязненные выделениями больных.
СИБИРСКАЯ ЯЗВА (ANTHRAX)
Сибирская язва - острая зоонозная инфекция, протекающая с выраженной интоксикацией, преимущественно в виде кожной формы с образованием карбункулов, реже генерализованных форм с поражением легких, кишечника, развитием сепсиса.
Краткие исторические сведения
Заболевание известно с древности под различными названиями:
- священный огонь;
- персидский огонь;
- углевик и др.
В России его назвали сибирская язва в связи с преимущественным распространением в Сибири. Идентичность инфекции у животных и человека и возможность ее передачи от больных животных людям доказаны С.С. Андреевским
в опыте самозаражения (1788). Возбудитель заболевания описан Ф. Поллендером, Ф. Брауэллом и К. Давеном (1849-1850). Чистую культуру выделил Р. Кох (1876). Выдающаяся роль в изучении сибирской язвы принадлежит отечественным ученым - И.И. Мечникову, Г.Н. Минху, Н.Ф. Гамалее, А.А. Владимирову, Л.С. Ценковскому и др.
Этиология
Возбудитель - факультативно-анаэробная неподвижная грамположительная спорообразующая капсулированная бактерия В. anthracis рода Bacillus семейства Bacillaceae. Морфологически выглядит как крупная палочка с обрубленными концами. В мазках располагается одиночно, парами или цепочками. В присутствии кислорода образует споры. Сибиреязвенная палочка хорошо растет на мясо-пептонных средах, температурный оптимум для роста 35-37 °С, оптимум рН 7,2-7,6. Антигенная структура возбудителя представлена белковым капсульным и полисахаридным соматическим Аг, АТ к ним не обладают защитными свойствами. Патогенность возбудителя определяет капсула, со свойствами которой связана антифагоцитарная резистентность бактерий, и синтез экзотоксина. В организме теплокровных животных и человека вегетативная форма сибиреязвенной палочки способна выделять сильный экзотоксин белковой природы.
Он состоит из 3 компонентов, или факторов:
- отечного фактора;
- защитного Аг;
- собственно летального фактора.
Протективный Аг не токсичен, проявляет иммуногенные свойства. В клеточных мембранах он образует каналы для проникновения отечного и летального факторов, в комбинации с которыми формирует 2 вида токсинов - отечный и летальный. Комбинированное действие экзотоксина на организм человека проявляется активацией цитокинов с развитием воспалительных реакций и токсинемии, нарушениями процессов тканевого дыхания и свертывающей системы крови, отеком тканей, угнетением активности фагоцитов. Сибиреязвенный экзотоксин чрезвычайно лабилен, он полностью разрушается после получасового нагревания при 60 °С.
Вегетативные формы возбудителя неустойчивы во внешней среде, быстро погибают при нагревании и кипячении, под действием обычных дезинфицирующих средств. Споры очень устойчивы, в воде могут сохраняться несколько лет, в почве - десятки лет, при определенных условиях могут прорастать и вновь образовывать споры, поддерживая существование почвенного очага. Под действием 1% раствора формалина и 10% раствора NaOH споры гибнут через 2 ч, в автоклаве при 110 °С - через 40 мин. После 5-минутного кипячения сохраняют способность вегетировать.
Эпидемиология
Резервуар и источник инфекции - травоядные животные (крупный и мелкий рогатый скот, лошади, верблюды, свиньи и др.). В ряде случаев источниками инфекции могут быть и дикие животные (зайцы, волки, медведи, песцы и др.). Период контагиозности источника равен периоду болезни животных, в течение
которого они выделяют возбудителей с мочой, калом, кровянистыми выделениями. Среди животных важное эпизоотологическое значение имеет алиментарный путь передачи возбудителя - при поедании кормов или питье воды, загрязненных спорами сибирской язвы. Трансмиссивный путь передачи реализуется через укусы мух-жигалок, слепней, переносящих возбудителя от больных животных, зараженных трупов и объектов внешней среды к здоровым животным. Невскрытый труп больного животного заразен в течение 7 дней. Полученное от больного животного сырье (шерсть, шкура и др.) и продукты его переработки представляют опасность в течение многих лет. В почве возбудитель может не только сохраняться, но и при определенных условиях (температура не ниже 12-15 °С, влажность 29-85%, нейтральная или слабощелочная среда и т.д.) прорастать в вегетативную форму. Почвенные очаги сибирской язвы сохраняют потенциальную эпизоотическую и эпидемическую опасность в течение десятилетий. При проведении строительных, гидромелиоративных и других земляных работ, а также с ливневыми и паводковыми водами споры могут быть вынесены на поверхность почвы, создавая возможность заражения животных и людей. Достоверные случаи заражения человека от человека не известны, однако человек может стать источником заражения животных. Больной человек не представляет опасности для здоровых индивидуумов, что можно объяснить особенностями механизма передачи инфекции, реализуемого среди животных или от животного к человеку и невозможного среди людей.
Механизм передачи - разнообразный, наиболее часто контактный. Возбудитель проникает в организм через поврежденный кожный покров, микротравмы слизистых оболочек. Заражение чаще происходит в процессе ухода за больным животным, забое, разделке туш, кулинарной обработке мяса, работе с животным сырьем и изготовлении из него предметов (полушубки, кисточки для бритья и др.). Известны крайне редкие случаи заражения пищевым путем, а также при вдыхании зараженного аэрозоля. Факторами передачи служат инфицированные продукты животноводства, сырье, продукты переработки, контаминированные предметы внешней среды и инвентарь для ухода за животными. Заражение спорами возбудителя через дыхательные пути в прошлом неоднократно отмечали на бумажных и шерстеобрабатывающих предприятиях. Болезнь тряпичников была распространена в России у сборщиков свалочного тряпья, загрязненного выделениями и навозом животных. Трансмиссивным путем заражаются реже через укусы слепней, мух-жигалок, комаров.
Естественная восприимчивость людей
Естественная восприимчивость людей относительно невысокая (заболевает около 20% лиц, подвергшихся риску заражения), но практически всеобщая при воздушно-капельном (пылевом) заражении. У переболевших остается прочный иммунитет, повторные случаи заболеваний крайне редки.
Основные эпидемиологические признаки
Сибирская язва распространена повсеместно. Большинство случаев регистрируют преимущественно в развивающихся странах Азии, Африки и Южной Америки. Заболевания встречают в регионах с развитым животноводством. В России с 1993 по 2000 г. зарегистрирован 281 случай заболевания людей. Заболеваемость сибирской язвой в последние 5 лет имеет тенденцию к снижению. В 2007 г. зарегистрировано 3 случая заболевания сибирской язвой, что на 3 случая меньше, чем в 2006 г. Все заболевшие - жители сельской местности.
В Республике Северная Осетия зарегистрированы 2 случая сибирской язвы с 1 летальным исходом и 1 случай - в Республике Бурятия.
Заражение людей происходит в основном в процессе проведения вынужденного убоя скота, который проводят без уведомления ветеринарных специалистов, при разделке туш и захоронении трупов животных, павших от сибирской язвы (74,1%), при кулинарной обработке инфицированного мяса, при уходе за больными животными, при торговле мясом на рынке. Заражение скота чаще связано с использованием инфицированных кормов и выпасом на зараженной территории в зоне скотомогильников или в местах падежа животных от сибирской язвы. Все заболевшие животные, как правило, не привиты.
На территории страны имеются стойкие стационарно неблагополучные пункты по сибирской язве, создающие постоянную угрозу заражения крупного рогатого скота. Наиболее неблагополучны по сибирской язве Республики Дагестан, Кабардино-Балкарская и Карачаево-Черкесская. Сезонность заболеваемости людей в определенной мере повторяет летне-осенний характер заболеваемости животных. Регистрируют спорадические случаи и групповые заболевания. Основные причины возникновения групповых заболеваний - несоблюдение ветеринарно-санитарных требований в части профилактики сибирской язвы частными владельцами скота, руководителями хозяйств, торгово-закупочными организациями и предприятиями различных форм собственности, занимающимися заготовкой, переработкой и реализацией мяса и мясопродуктов.
Заболевания преобладают в сельской местности среди лиц активного возраста, чаще мужского пола. Различают бытовую и профессиональную заболеваемость сибирской язвой. Заражения в городских условиях связаны с заготовкой, хранением, переработкой животного сырья, с нарушениями технологического режима и правил техники безопасности. Иногда заболевания встречают при проведении земляных работ, известны случаи лабораторного заражения.
Споры возбудителя сибирской язвы могут быть применены в качестве средства биотерроризма, что наглядно продемонстрировали события в США осенью
2001 г.
Патогенез
Возбудитель в виде спор проникает в организм человека через поврежденную кожу, реже через слизистые оболочки дыхательньгх путей или ЖКТ. В месте входных ворот:
- споры вегетируют;
- вегетативные формы бактерий размножаются;
- формируют капсулу и продуцируют компоненты экзотоксина:
◊ протективный Аг;
◊ летальный фактор;
◊ отечный фактор.
Протективный Аг связывается с рецепторами макрофагов и других эукариотических клеток, с отечным и летальным факторами. Образовавшиеся отечный и летальный токсины проникают в цитоплазму клеток. В результате совместного действия токсинов и цитокинов, продуцируемых пораженными клетками, повышается проницаемость сосудов, развиваются гемолиз эритроцитов, выраженный отек и геморрагические изменения окружающих тканей, дистрофические и некробиотические процессы в них. При развитии очага
серозно-геморрагического воспаления с некрозом, захватывающего все слои дермы и подкожную клетчатку, формируется сибиреязвенный карбункул, иногда другие местные проявления в виде пузырей или изменений, напоминающих эризипелоид. По лимфатическим путям подвижные макрофаги заносят возбудитель в ближайшие лимфатические узлы, где продолжается размножение бактерий, накопление токсинов, развивается регионарный лимфаденит. Бактериемию с развитием вторичного септического процесса при кожной форме сибирской язвы наблюдают крайне редко.
При аэрогенном заражении вегетация спор происходит медленно в условиях насыщенности воздухоносных путей кислородом, инкубационный период заболевания значительно удлиняется. Сепсис возникает чаще при проникновении возбудителя через дыхательные пути или ЖКТ, снижении защитных барьеров бронхопульмональных или мезентериальных лимфатических узлов вследствие деструктивных процессов и быстрой, активной гематогенной генерализации инфекции.
Клиническая картина
Инкубационный период
Продолжается в течение нескольких дней, но может удлиняться до 8-14 дней или сокращаться до нескольких часов. Выделяют кожную (локализованную) и генерализованные формы заболевания (легочную, кишечную и септическую).
Кожная форма
Кожная форма встречается наиболее часто (более 95% случаев). Может протекать в виде нескольких разновидностей:
- карбункулезной;
- эдематозной;
- буллезной;
- эризипелоидной.
Наиболее часто развивается карбункулезная разновидность кожной формы (см. рис. 32 доп. илл.). В этих случаях на коже в месте входных ворот инфекции появляется безболезненное красноватое пятно диаметром до нескольких миллиметров. Через несколько часов оно превращается в папулу медно-красного цвета, иногда с багровым оттенком, приподнятую над уровнем кожи. Формирование пятна и папулы сопровождают местный зуд или жжение. Спустя 12-24 ч папула превращается в везикулу диаметром 2-4 мм, наполненную серозным содержимым. Содержимое везикулы быстро становится кровянистым, приобретает темный, а иногда багрово-фиолетовый цвет (pustula maligna). При расчесывании или (реже) самопроизвольно везикула лопается и образуется язвочка с приподнятыми над уровнем кожи краями, дном темнокоричневого цвета и серозно-геморрагическим отделяемым. По ее краям появляются вторичные везикулы (ожерелье), что считается типичным для заболевания. В дальнейшем дочерние везикулы проходят те же стадии развития, что и первичный элемент. При их вскрытии и слиянии размеры язвы увеличиваются.
Через несколько дней, иногда через 1-2 нед вследствие некроза в центре язвы образуется черный струп, который быстро увеличивается в размерах, закрывая все дно язвы, и напоминает сильно обгорелую корку. Болевая чувстви-
тельность в области струпа потеряна (местная анестезия), что является важным дифференциально-диагностическим признаком. Вокруг струпа формируется воспалительный валик багрового цвета, возвышающийся над уровнем здоровой кожи. Внешне струп с валиком напоминает затухающий уголек, что и определило старое русское название (углевик) и современное латинское название болезни (от греч. anthrax - уголь). В целом кожные изменения получили название карбункула. Его размеры варьируют от нескольких миллиметров до 5-10 см.
По периферии карбункула развивается выраженный отек тканей, захватывающий иногда большие участки, особенно в местах с рыхлой подкожной клетчаткой (например, на лице). Кожа над зоной отека бледная, не напряжена, лишена блеска. Характер отека студневидный, при ударе перкуссионным молоточком в его области возникает дрожание тканей (симптом Стефанского). Локализация карбункула и отека на лице весьма опасна, поскольку он может распространиться на верхние дыхательные пути и привести к асфиксии и смерти. Формирование карбункула сопровождает регионарный лимфаденит (а при тяжелом течении болезни и лимфангит).
С самого начала заболевания наблюдают выраженную интоксикацию с высокой температурой тела, головной болью, адинамией, ломотой в пояснице. Лихорадка сохраняется в течение 5-6 дней, после чего температура тела критически снижается. Нормализацию температуры сопровождает обратное развитие общих и местных симптомов. К концу 2-3-й недели струп отторгается, образуется язва с гранулирующим дном и гнойным отделяемым. На протяжении последующих 2-3, а иногда и 4-6 нед язва постепенно заживает с образованием рубца.
Чаще формируется 1 карбункул, при этом заболевание в большинстве случаев протекает в легкой или среднетяжелой форме. В редких случаях число карбункулов может доходить до 10 и более. При развитии их на голове, шее, слизистых оболочках рта и носа заболевание протекает особенно тяжело и может осложниться развитием сибиреязвенного сепсиса.
Эдематозная разновидность кожной формы
Вначале заболевание проявляется лишь развитием отека на фоне выраженной интоксикации, некроз кожи и формирование карбункула больших размеров наблюдают в более поздние сроки болезни. Эдематозный вариант обычно протекает тяжелее, чем другие разновидности кожной формы сибирской язвы.
Буллезная разновидность кожной формы
Отличается образованием пузырей с геморрагическим содержимым в области входных ворот инфекции. После вскрытия пузырей образуются обширные язвы. Последующий некроз в области их дна приводит к развитию карбункула.
Эризипелоидная разновидность кожной формы
Характеризуется образованием множественных пузырей различной величины, наполненных прозрачным серозным содержимым и расположенных на припухшей, покрасневшей и безболезненной коже. После вскрытия пузырей образуются язвы с последующей их трансформацией в струп.
Кожная форма сибирской язвы в большинстве случаев (до 80%) протекает как локализованная инфекция с благоприятным прогнозом.
Легочная форма
Встречается редко, в основном у животноводов при аэрогенном заражении спорами, находившимися на подстилке, корме больных животных и предметах
ухода за ними. В то же время эта форма заболевания может стать основной при применении бактериологического оружия.
Типичны симптомы поражения органов дыхания, поскольку легкие - первые тканевые фильтры на пути оттока лимфы в кровь.
Первая фаза заболевания проявляется гриппоподобными симптомами:
- недомоганием;
- головной болью;
- миалгиями;
- слезотечением;
- насморком;
- кашлем;
- субфебрильной лихорадкой.
Уже с самого начала отмечают выраженную тахикардию, тахипноэ и одышку. Длительность этой фазы составляет от нескольких часов до 2 дней. Во вторую фазу (период разгара) наблюдают бурное нарастание интоксикации и температура тела повышается до 39-41 °С, сопровождаясь сильным ознобом. Нередко возникают боли и стеснение в груди, кашель с обильным выделением кровянистой мокроты, которая свертывается в виде вишневого желе. В легких выслушивают большое количество влажных хрипов. Возможно образование обширных зон притупления перкуторного звука над легкими. На рентгенограмме выявляют признаки пневмонии или плеврита (серозно-геморрагический выпот в плевру).
Прогрессируют проявления геморрагического синдрома:
- кровоточивость десен;
- носовые и органные кровотечения;
- кровоизлияния.
Период разгара заболевания продолжается также не более 1-2 дней. Третья фаза длится не более 12 ч, характеризуется быстрым развитием септического шока, острого респираторного дистресс-синдрома, ОПН и заканчивается летальным исходом в абсолютном большинстве случаев.
Кишечная форма
Кишечная форма сибирской язвы связана с алиментарным путем заражения и протекает в виде 2 вариантов:
- орофарингеального;
- кишечного.
Отличается тяжелым течением и часто неблагоприятным исходом. Орофарингеальный вариант протекает с развитием воспалительных изменений на задней стенке глотки, твердом нёбе, основании языка или миндалинах. Эти изменения похожи на первичный аффект при кожной форме сибирской язвы, сопровождаются развитием выраженного общетоксического синдрома (головная боль, головокружение, озноб, высокая лихорадка), болями и жжением в горле, отеком кожи и подкожной клетчатки шеи, регионарной лимфаденопатией. При кишечном варианте заболевания развивается картина геморрагического гастроэнтероколита. Возникают сильные режущие боли в животе, тошнота, кровавая рвота, жидкий стул. В каловых массах визуально обнаруживают кровь. Живот вздут, болезненный при пальпации, появляются положительные симптомы перитонита.
Летальность при кишечной форме сибирской язвы составляет 30-60%, причины смерти в большинстве случаев - это развитие ИТШ или сепсиса.
Септическая форма
Может протекать в виде первичного сепсиса с короткой инкубацией от нескольких часов до 1-2 сут или вторичного, возникающего как осложнение любых форм заболевания. Септическую форму отличают стремительное нарастание интоксикации, обилие кожных и внутренних кровоизлияний, вовлечение в процесс мозговых оболочек. Частым исходом данной формы является ИТШ.
Дифференциальная диагностика
Кожную форму сибирской язвы необходимо дифференцировать прежде всего от бактериальных карбункулов. Сибиреязвенный карбункул отличают формирование вторичных везикул (ожерелья) по краям язвы, черный струп на ее дне с характерной потерей болевой чувствительности, выраженный студневидный отек по периферии. Формирование отека может предшествовать образованию карбункула (эдематозная форма).
Для генерализованных форм характерно бурное нарастание признаков интоксикации с развитием сердечно-сосудистой недостаточности, геморрагического синдрома, отека легких, олигурии, ИТШ. При различных генерализованных формах констатируют поражения легких (пневмония, плеврит) с обильной кровянистой мокротой (вишневое желе), ЖКТ с кровавой рвотой, жидким стулом с примесью крови.
В некоторых случаях необходимо дифференцировать заболевание от чумы и туляремии (см. соответствующие заболевания).
Лабораторная диагностика
Гемограмма отличается лейкоцитозом, нейтрофилезом со сдвигом формулы влево, снижением количества эозинофилов, увеличением СОЭ.
Бактериологические исследования включают 3 последовательных этапа:
- микроскопию мазков из биологического и патологического материала (отделяемое со дна язвы, кровь, мокрота, кал, моча, биоптаты органов от трупа);
- выделение на питательных средах чистой культуры возбудителя;
- проведение биологической пробы на лабораторных животных. Серологические и иммунологические исследования:
- реакция термопреципитации по Асколи основана на взаимодействии содержимого, взятого из пустул и язв (сибиреязвенный Аг), со специфической преципитирующей сывороткой;
- люминесцентно-серологический анализ (метод флюоресцирующих
АТ);
- выявление специфических АТ и Аг в РНГА и ИФА с антительными и антигенными диагностикумами.
Кожно-аллергическая проба с антраксином становится положительной с конца 1-й недели болезни. При этом на внутренней стороне предплечья в месте введения антраксина образуется гиперемия и инфильтрат диаметром 10 мм и более. Реакцию учитывают через 48 ч после постановки пробы. Положительный результат реакции у лиц, привитых против сибирской язвы, не учитывается, поскольку может сохраняться в течение 12 мес после прививки.
ПЦР-диагностика сибирской язвы внедряется в практику крупных лабораторий. Исследования проводят в специальных лабораториях с соблюдением правил работы с возбудителями особо опасных инфекций.
Осложнения и исходы
Возможно развитие менингоэнцефалита, отека и набухания головного мозга, желудочно-кишечных кровотечений, пареза кишечника, перитонита. Наиболее опасные осложнения при любой форме заболевания - ИТШ, респираторный дистресс-синдром. Указанные осложнения резко ухудшают прогноз заболевания.
Лечение
Больных госпитализируют в инфекционные отделения. Режим пациентов определяется тяжестью заболевания, диета - его формой (при кишечной форме стол № 1 или 4).
При кожной форме сибирской язвы в последнее время рекомендуют назначение фторхинолонов:
- ципрофлоксацина по 500 мг 2 раза в сутки;
- левофлоксацина и др. в средних терапевтических дозах. Альтернативно можно применять доксициклин по 100 мг 2 раза в день. Бен-
зилпенициллин назначают реже в связи с появлением пенициллиноустойчивых штаммов возбудителя. Курс лечения продолжается 7-10 дней, но в случаях заболевания, вызванного применением бактериологического оружия, пролонгируется до 60 дней (учитывается возможность одновременного ингаляционного заражения с длительным прорастанием спор возбудителя в респираторном тракте).
При кожной форме с локализацией местных проявлений на лице или с распространенным отеком, а также при генерализации инфекции ципрофлоксацин или доксициклин назначают в сочетании с одним из препаратов с учетом чувствительности выделенного возбудителя:
- рифампицином;
- кларитромицином;
- клиндамицином;
- ампициллином;
- хлорамфениколом и др.
Препараты вводят внутривенно в высоких дозах.
При генерализованных формах инфекции необходимо раннее парентеральное назначение комбинации трех антибиотиков - ципрофлоксацина с рифампицином и одним из следующих препаратов:
- клиндамицином;
- ванкомицином;
- бензилпенициллином.
При получении устойчивого положительного терапевтического эффекта возможен переход на пероральный прием препаратов. Курс комбинированного антибактериального лечения продолжается не менее 60 дней.
Этиотропное лечение сочетают с внутримышечным введением гетерогенного (полученного из гипериммунной сыворотки лошади) противосибиреяз-
венного иммуноглобулина, оказывающего специфическое антибактериальное и антитоксическое действие. Препарат вводят после дробной десенсибилизации только при отрицательной внутрикожной пробе. Лечебная суточная доза иммуноглобулина, составляющая 30-50 мл при среднетяжелом и тяжелом течении болезни и 75-100 мл при крайне тяжелом течении и сепсисе, вводится в 2-3 приема с интервалами 10-15 мин.
Необходимо интенсивное дезинтоксикационное лечение с внутривенными инфузиями коллоидных и кристаллоидных растворов, а также свежезамороженной плазмы с добавлением преднизолона и одновременным проведением форсированного диуреза. Лечение тяжелых осложнений, в том числе ИТШ, проводят по общепринятым методикам.
При кожной форме сибирской язвы рекомендуют наложение асептических повязок. Хирургические вмешательства противопоказаны, поскольку могут провоцировать генерализацию процесса.
Выписка реконвалесцентов проводится после полного клинического выздоровления, диспансерное наблюдение не регламентировано.
Эпидемиологический надзор
Направлен на выявление групп и времени риска. Как и при других зоонозах, большое значение имеет обмен информацией медицинских и ветеринарных работников. Строгому учету подлежат стационарно неблагополучные пункты (населенный пункт, животноводческая ферма, пастбище, урочище, на территории которых обнаружен эпизоотический очаг независимо от срока давности его возникновения) и почвенные очаги (скотомогильники, биотермические ямы и другие места захоронения трупов животных, павших от сибирской язвы). Осуществляют активное наблюдение за заболеваемостью животных и лиц из групп риска. Проводят регистрацию и учет всех случаев заболевания, расследование причин их возникновения, анализ ситуации, обобщают все данные на федеральном уровне.
Профилактические мероприятия
Включают в себя ветеринарные и медико-санитарные мероприятия. Ветеринарная служба осуществляет выявление, учет, паспортизацию неблагополучных по сибирской язве пунктов, а также плановую иммунизацию животных, контроль за состоянием скотомогильников, пастбищ, животноводческих объектов с соблюдением надлежащих условий при заготовке, хранении, транспортировке и обработке животного сырья.
Комплекс медико-санитарных мероприятий включает контроль за общей санитарной обстановкой в неблагополучных по сибирской язве пунктах, а также при заготовке, хранении, транспортировке и обработке сырья животного происхождения. Выявление больных людей, их госпитализация, проведение мероприятий в очагах инфекции осуществляет медицинская служба. Плановую вакцинопрофилактику проводят среди лиц определенных профессий, подвергающихся повышенному риску заражения сибирской язвой. Это в первую очередь лица, работающие с живыми сибиреязвенными культурами, зооветеринарные работники и другие лица, профессионально занятые передубойным содержанием скота, а также убоем, разделкой туш и снятием шкур, лица, занятые сбором, хра-
нением, транспортировкой и первичной переработкой сырья животного происхождения. Иммунопрофилактику проводят двукратным введением живой вакцины с интервалом 21 день. Ревакцинацию проводят ежегодно. В стране ежегодно проводят прививки против сибирской язвы. В 2007 г. вакцинировано 15 489 человек, что на 20% меньше 2006 г., и ревакцинировано 60 892 человек, что на 10% меньше предыдущего года.
Профилактическую дезинфекцию проводят в стационарно неблагополучных по сибирской язве пунктах, животноводческих хозяйствах, в пунктах убоя скота, на заводах, перерабатывающих продукты и сырье животного происхождения, а также в пунктах его заготовки, хранения и при перевозке всеми видами транспорта. Ее рекомендуют проводить 2 раза в год.
Мероприятия в эпидемическом очаге
Больного госпитализируют в инфекционную больницу (или инфекционное отделение). Для ухода за больными тяжелой формой сибирской язвы выделяют отдельный медицинский персонал. Выздоровевших от кожной формы сибирской язвы выписывают из стационара после эпителизации и рубцевания язв на месте отпавшего струпа. При септической форме выписку проводят после клинического выздоровления. Диспансерное наблюдение за переболевшими не регламентировано.
Трупы людей, умерших от лабораторно подтвержденной сибирской язвы, вскрытию не подвергаются. В случае крайней необходимости вскрытие проводит врач с обязательной дезинфекцией помещения, всех предметов, инструментария, халатов, перчаток, обуви и др. Захоронение трупов людей, умерших от сибирской язвы, проводится на обычном кладбище. В тех случаях, когда труп не вскрывали, до выноса из помещения его укладывают в гроб, выстланный целлофановой пленкой, такой же пленкой плотно закрывают труп сверху для исключения контакта с кожей лица и рук трупа. При захоронении трупа, подвергшегося вскрытию, под целлофановую пленку на дно гроба насыпают слой сухой хлорной извести.
Разобщение контактных лиц не осуществляют. За соприкасавшимися с больным животным или человеком устанавливают медицинское наблюдение до полной ликвидации очага. Экстренная профилактика показана в течение первых 5 дней контакта. Ее проводят людям, соприкасавшимся с материалом, содержащим возбудитель или его споры, принимавшим участие в убое и разделке туш животного, оказавшегося больным сибирской язвой, а также лицам, ухаживавшим за больными животными и принимавшим участие в захоронении их трупов, приготовлявшим или употреблявшим пищу из мяса больного животного. Для этого применяют антибиотики (феноксиметилпенициллин по 1 мг 3 раза в сутки в течение 5 дней, тетрациклин по 0,5 мг 3 раза в день либо другие антибиотики). В очаге проводят дезинфекцию.
КЛЕЩЕВОЙ ЭНЦЕФАЛИТ
(ENCEPHALITIS ACARINA)
Клещевой энцефалит - острая природно-очаговая трансмиссивная вирусная инфекция с поражением различных отделов нервной системы (преимущественно ЦНС), развитием парезов и параличей.
Краткие исторические сведения
В 30-х годах XX столетия отечественные ученые Л.А. Зильбер, Е.Н. Павловский, А.А. Смородинцев, А.Г. Панов, И.И. Рогозин и др. провели глубокие исследования этиологии, эпидемиологии, патоморфологии и клиники заболевания, встречавшегося в таежных районах Дальнего Востока России, разработали методы специфической профилактики и лечения болезни.
Этиология
Возбудитель - РНК-геномный арбовирус рода Flavivirus семейства Flaviviridae. В зависимости от строения протеинов оболочки у вируса определены антигенные варианты, вызывающие различные клинико-эпидемиологические формы заболевания. Специфика антигенных свойств возбудителя позволяет отличать его в серологических реакциях от других арбовирусов. Иммуногенность (индукция образования вируснейтрализующих АТ) и вирулентность возбудителя связаны в первую очередь с оболочечным белком Е. Выделяют 5 основных генотипов вируса с различной степенью вирулентности:
- генотип 1 - дальневосточный вариант;
- генотип 2 - западный (центрально-европейский) вариант;
- генотип 3 - греко-турецкий вариант;
- генотип 4 - восточно-сибирский вариант;
- гентип 5 - урало-сибирский вариант.
Последний генотип, наиболее распространенный, обнаружен на большей части ареала вируса клещевого энцефалита.
Вирус культивируют на куриных эмбрионах и клеточных культурах.
При низких температурах (оптимальный режим - минус 60 °С и ниже) вирус клещевого энцефалита сохраняется длительное время, в лиофилизированном состоянии - в течение многих лет; достаточно долго сохраняется в таких продуктах питания, как молоко или масло, которые иногда могут быть факторами передачи инфекции. При этом пищевой путь передачи облегчается в связи с устойчивостью возбудителя к действию низких концентраций соляной кислоты. Вместе с тем вирус быстро инактивируется при кипячении (через 2-3 мин), нагревании (при 60 °С - через 20 мин) и даже при комнатной температуре. Инактивирующее действие также проявляют УФО, хлорсодержащие препараты, лизол, фенол и другие дезинфицирующие вещества.
Эпидемиология
Резервуар и источник инфекции - большой круг теплокровных животных и птиц. Основной вид, поддерживающий существование вируса в природе, - это иксодовые клещи. Возможность спонтанной зараженности вирусом клещевого энцефалита установлена для 16 видов иксодовых клещей, а также для ряда других видов членистоногих и позвоночных животных. Однако непосредственным источником инфекции для человека чаще всего бывают иксодовые клещи Ixodespersulcatus и Ixodes ricinus - основные переносчики и долговременные хранители инфекции в природных очагах. Для этих клещей характерен сложный цикл развития (имаго-яйцо-личинка-нимфа-имаго), продолжающийся минимум 3 года. При определенных условиях личинки и нимфы впадают в биопаузу, каждая из которых удлиняет цикл развития на 1 год. По ходу
метаморфоза происходит обязательная смена хозяев клещей. Основные прокормители личинок - мелкие млекопитающие, а местами и птицы. Имаго кормится на домашних животных среднего и крупного размера, среди которых наиболее восприимчивы козы. Наиболее широкий круг хозяев имеет нимфальная фаза. Вирус энцефалита передается от одной фазы развития клещей к другой, а также трансовариально. Однако длительное существование популяции вируса только за счет трансовариальной и трансфазовой передачи невозможно. Пополнение осуществляется при регулярном заражении клещей во время их питания на позвоночных животных с виремией. Человек выступает тупиковым хозяином, поскольку не может быть донором для иксодовых клещей.
Механизм передачи - трансмиссивный, переносчики - клещи Ixodes persulcatus и Ixodes ricinus. Клещи заражаются, нападая на больных животных. Человек обычно заражается трансмиссивным или алиментарным путем, через сырое молоко инфицированных коз, овец и коров. Козы способны несколько раз на протяжении жизни болеть клещевым энцефалитом, выделяя вирус с молоком. Одно и то же животное может быть источником инфекции в разные эпидемические периоды.
На людей нападают в основном взрослые особи клещей и лишь в редких случаях нимфы. Клещ начинает инокулировать вирус с первыми же порциями слюны, поэтому иногда даже очень непродолжительное пребывание зараженного переносчика на теле после укуса может привести к инфицированию человека. Известны также случаи заражения людей вследствие проникновения вируса через поврежденную кожу и глаза при раздавливании инфицированного клеща или несоблюдении режима лабораторной работы.
Естественная восприимчивость людей
Независимо от пола и возраста восприимичивость к клещевому энцефалиту высокая, особенно среди лиц, впервые посещающих природный очаг. Перенесенное заболевание оставляет напряженный иммунитет.
Основные эпидемиологические признаки
Клещевой энцефалит относят к природно-очаговым болезням человека. Штаммы центрально-европейского варианта вируса распространены в Европе до территории Сибири. Природные очаги совпадают с ареалом клещей - переносчиков возбудителя в лесных и лесостепных районах России. Помимо природных, известны вторичные, антропургические очаги, расположенные вблизи населенных пунктов и поддерживаемые за счет сельскохозяйственных животных и синантропных грызунов. В стране ежегодно регистрируют 7-10 000 случаев клещевого энцефалита среди людей. В 1996 и 1997 гг. в результате заболевания погибло 166 и 102 человека, летальность составила 1,7 и 1,5% соответственно. Наиболее тревожное положение сложилось в природных очагах Урала и Сибири. Очаги этой болезни встречаются в лесных районах Дальнего Востока, Западной и Восточной Сибири, Приуралья, Северо-Западном и Центральном регионах европейской части России. Основная причина такого положения - практически полное прекращение наземных обработок лесных массивов против клещей акарицидными препаратами из-за запрещения использования ДДТ, а также активное посещение городским населением природных биотопов с целью сбора дикоросов, интенсивным освоением садово-огородных участков.
В 2007 г. было зарегистрировано 3138 случаев, показатель на 100 000 населения - 2,2, в том числе среди детей до 17 лет - 520 случаев, показатель - 1,89. В 2006 г. было зарегистрировано 3510 случаев, показатель на 100 000 населения - 2,44, в том числе среди детей - 592 случаев и 2,0 соответственно. Заболеваемость клещевым энцефалитом зарегистрирована в 46 субъектах РФ. Наибольшее число случаев клещевого энцефалита зарегистрировано в Сибирском федеральном округе - 1650 случаев, показатель на 100 000 населения - 8,4, который в 4 раза выше показателя по стране. Самая высокая заболеваемость клещевым энцефалитом в Красноярском крае - 523 случая, показатель на 100 000 населения - 18,0, Томской области - 307 случаев (показатель - 29,7). От клещевого вирусного энцефалита за 2007 г. умерло 42 человека, в том числе детей до 17 лет - 3. Заболеваемость имеет весенне-летнюю сезонность, связанную с периодом наибольшей активности клещей. Сезонный пик численности I. persulcatus почти повсеместно бывает в последней декаде мая - первой декаде июня. Клещ I. ricinus имеет обычно 2 сезонных пика активности имаго: весной и в конце лета - начале осени. Среди заболевших преобладают взрослые люди, работающие в лесу (лесники, лесозаготовители и др.) или посещающие лесонасаждения. В последние годы клещевой энцефалит перестал быть профессиональным заболеванием. До 20% заболевших составляют дети до 14 лет. В 2007 г. около 75% среди заболевших составили городские жители, чаще не привитые. Увеличение числа заболеваний среди городских жителей, в том числе и среди детей школьного возраста, происходит главным образом за счет населения крупных городов. Горожане заражаются в пригородных лесах, лесопарках, на индивидуальных садово-огородных участках, а также на расстоянии десятков и сотен километров от городов. Число людей, подвергающихся непосредственной опасности заболевания клещевым энцефалитом, чрезвычайно велико. Сельские жители достаточно интенсивно соприкасаются с природными очагами: в России в пределах ареала вируса 70-90% сельчан ежегодно в летнее время бывают в лесу. Каждый 4-8-й из них отмечает укус клещей. Алиментарный путь заражения, нередко сопровождающийся семейно-групповыми заболеваниями, чаще связан с употреблением в пищу сырого козьего молока. Число алиментарных случаев и их доля в структуре заболеваемости увеличиваются, что определяется поголовьем коз, которое в последние годы значительно увеличилось.
Патогенез
При трансмиссивном пути заражения возбудитель проникает в организм человека через кожу (укусы иксодовых клещей, микротравмы), при алиментарном - через слизистые оболочки ЖКТ. В течение инкубационного периода заболевания развиваются первичная репликация вируса в области входных ворот (в эндотелии сосудов кожи и подкожной клетчатки, в эпителиальных клетках и лимфоидных образованиях кишечника), сенсибилизация иммунокомпетентных клеток и первичная виремия, приводящая к образованию вторичных очагов размножения возбудителя в эндотелии кровеносных и лимфатических сосудов и в макрофагах внутренних органов.
В периоде клинических проявлений болезни происходит дальнейшее нарастание виремии и интоксикации. Полагают, что вирус активизирует клеткиэффекторы (лимфоциты, макрофаги, нейтрофилы) с продукцией медиаторов воспаления (цитокинов и др.), вызывая мезенхимально-воспалительную реак-
цию с развитием отека, расширением и полнокровием сосудов, геморрагиями, нарушениями микроциркуляции крови и ликвородинамики.
Лимфогематогенная и периневральная диссеминация возбудителя приводит к поражениям нервной системы с репликацией вируса в нейронах и нейроглии. Процесс захватывает серое вещество в различных отделах головного и спинного мозга (особенно шейно-грудного отдела), в первую очередь двигательные нейроны, корешки периферических нервов, мягкие оболочки мозга. Некробиоз нервных клеток наиболее активен в ретикулярной формации, ядрах черепных нервов, в передних рогах шейного отдела спинного мозга. Клинически указанные повреждения проявляются развитием менингеальной симптоматики, вялых парезов и параличей.
Параллельно с клиническими проявлениями заболевания происходит нарастание напряженности защитных иммунных реакций:
- клеточного иммунитета;
- завершенного фагоцитоза;
- синтеза противовирусных IgM-АТ;
- с 3-й недели болезни и IgG-АТ.
Период реконвалесценции отличается медленной элиминацией возбудителя.
Клиническая картина
Инкубационный период
Варьирует от нескольких дней до 4 нед, в среднем составляет 2 нед. В течении заболевания выделяют 3 периода:
- начальный;
- неврологических расстройств;
- исхода (выздоровление, хронизация или смерть больных). Начальный период
Продолжается в среднем около 1 нед и характеризуется главным образом развитием общетоксических признаков. Продромальные признаки проявляются редко в виде головной боли, нарушений сна, корешковых болей, чувства онемения кожи лица или туловища, психических нарушений. Значительно чаще заболевание начинается и развивается остро с повышением температуры тела до 39-40 °С, ознобами, резкой головной болью, болями в поясничной области и конечностях, в глазных яблоках, гиперестезиями, фотофобией, общей слабостью. Возможно развитие тошноты и повторной рвоты. При осмотре больных отмечают их заторможенность, иногда сонливость, оглушенность, при этом сознание больных сохранено. Разлитая гиперемия захватывает кожу лица, шеи, груди; конъюнктива полнокровна, склеры инъецированы. Слизистые оболочки верхних дыхательных путей также гиперемированы. При развитии одышки в легких нередко выявляют физикальные признаки пневмонии. Тоны сердца приглушены, пульс урежен (относительная брадикардия), АД снижено. На ЭКГ можно выявить признаки нарушения проводимости, дистрофии миокарда, при значительной выраженности которых у больных может развиться картина острой сердечной недостаточности. Язык обложен, часто дрожит при высовывании, живот вздут, перистальтика кишечника ослаблена, стул со склонностью к запорам. Печень и селезенка могут быть увеличены в размерах.
Период неврологических расстройств
Начинается с возникновения неврологических нарушений в виде парестезий, парезов конечностей, эпилептиформных припадков, которые могут развиться уже в первые дни болезни. В соответствии с выраженностью неврологической симптоматики различают лихорадочную, менингеальную, менингоэнцефалитическую, менингоэнцефалополиомиелитическую и полирадикулоневритическую клинические формы заболевания.
Лихорадочная форма
Проявляется общетоксическим синдромом, имеет доброкачественное течение без выраженных поражений нервной системы и заканчивается выздоровлением.
Менингеальная форма
У части больных на фоне высокой лихорадки (30-40 °С) и других признаков общей интоксикации уже с первых дней болезни появляются менингеальные симптомы:
- возбуждение или заторможенность;
- сильная головная боль;
- повторная рвота;
- гиперестезии;
- симптомы Кернига и Брудзинского.
Иногда отмечают диплопию, птоз, повышение сухожильных рефлексов. При исследовании спинномозговой жидкости определяют признаки серозного менингита:
- повышенное давление ликвора;
- лимфоцитарный плеоцитоз;
- небольшое увеличение белка. Течение менингита доброкачественное.
Менингоэнцефалитическая форма
Проявляется более тяжелым течением, нередко с осложнениями и неблагоприятными исходами.
Существует в виде 2 клинических вариантов.
• При диффузном менингоэнцефалите на фоне общетоксических и менингеальных симптомов наблюдают расстройства сна, ранние нарушения сознания вплоть до развития глубокой комы. Возможны психомоторное возбуждение, бред, галлюцинации, утрата ориентации во времени и пространстве. При более тяжелом течении возможно присоединение эпилептиформных припадков, тремора рук и языка, снижение мышечного тонуса, фибриллярных подергиваний мышц лица и конечностей.
• При очаговом менингоэнцефалите в зависимости от зоны поражения ЦНС развиваются спастические парезы конечностей, парезы лицевого, подъязычного и других черепных нервов с проявлениями нарушения функции мимической мускулатуры, птоза, страбизма, диплопии, пареза мягкого нёба, афонии, нарушений глотания. Двигательные нарушения исчезают медленно, в течение месяцев.
Менингоэнцефалополиомиелитическая форма
Отличается ранним (уже к 3-4-му дню болезни) развитием вялых симметричных парезов мышц шеи, туловища, верхних конечностей на фоне фебриль-
ной лихорадки, других общетоксических и менингеальных признаков. Клинические проявления парезов могут нарастать в течение нескольких дней, иногда они развиваются уже на фоне апирексии. Реже в процесс вовлекаются межреберные мышцы, мускулатура диафрагмы и нижних конечностей. Больной не способен удержать голову в вертикальном положении, отсутствуют движения в верхних конечностях. В дальнейшем, через 2-3 нед, развивается выраженная атрофия отдельных групп мышц плечевого пояса, груди, конечностей.
Полирадикулоневритическая форма
Наблюдают редко, составляет лишь несколько процентов от всех случаев заболевания. Наряду с общетоксическими и менингеальными симптомами развивается поражение корешков периферических нервов. Возникают парестезии по ходу нервных стволов (чувство ползания мурашек, покалывание в коже), нарушается чувствительность в дистальных отделах конечностей, могут быть положительными симптомы натяжения (симптомы Лассега и Вассермана).
Двухволновой менингоэнцефалит
Развивается после энтерального заражения. Заболевание описано в 1951- 1954 гг. А.А. Смородинцевым и М.П. Чумаковым в западных районах СССР под названием двухволновой молочной лихорадки. Для этого варианта клещевого энцефалита характерна двухволновая температурная реакция с продолжительностью каждой волны от 2 дней до 1 нед и 1-2-недельными интервалами. Первую волну лихорадки сопровождают общетоксические симптомы, во время второй волны к ним присоединяются менингеальные и общемозговые признаки. Течение этой формы благоприятное, отличается быстрой положительной динамикой и отсутствием остаточных признаков.
Субклиническая форма
Субклиническая форма клещевого энцефалита встречается довольно часто у жителей эндемичных зон. При отсутствии клинических признаков заболевания и указаний на них в анамнезе у лиц этой группы можно выявить АТ к Аг возбудителя, а нередко (до 25% пациентов) и антигенемию. Под воздействием провоцирующих факторов различного характера (травмы, заболевания и т.д.) субклиническая форма может трансформироваться в первично-прогредиентную с медленным развитием клинической картины энцефалита.
Дифференциальная диагностика
Клещевой энцефалит следует отличать от поражений ЦНС разнообразного генеза (опухоли, гнойные процессы, глубокая сосудистая патология), а также от полиомиелита и менингоэнцефалитов различной этиологии.
Уже в начальный период клещевого энцефалита на фоне выраженных общетоксических признаков развиваются характерные психоневрологические нарушения:
- заторможенность;
- сонливость;
- оглушенность при сохраненном сознании;
- дрожание языка.
Отмечают резкую гиперемию лица и верхней половины туловища, относительную брадикардию. В период неврологических расстройств чрезвычайный
полиморфизм неврологических нарушений при многочисленных клинических формах заболевания крайне затрудняет его дифференциальную диагностику. Следует принимать во внимание данные эпидемиологического анамнеза:
- сезонность;
- пребывание в эндемичных районах;
- укусы клещей;
- употребление некипяченого молока;
- вакцинацию против клещевого энцефалита.
Лабораторная диагностика
В начальный период заболевания в гемограмме отмечают нейтрофильный лейкоцитоз, повышение СОЭ. В течение 1-й недели болезни можно выделить вирус из крови или спинномозговой жидкости заражением новорожденных белых мышей. Дальнейшую идентификацию вируса проводят иммунофлюоресцентным методом. Достаточно широкое применение нашли серологические методы:
- ИФА;
- РТГА;
- РСК;
- РНГА;
- РН.
Постановку реакций проводят с парными сыворотками с 2-3-недельным интервалом. Диагностически значимым считают четырехкратное нарастание титров АТ. Возможно выявление Е-Аг вируса в спинномозговой жидкости методом ИФА, а также РНК возбудителя в сыворотке крови и ликворе с помощью ПЦР.
Осложнения и исходы
Осложнениями заболевания могут быть отек и набухание головного мозга, кома, острая дыхательная недостаточность, пневмонии и др. В большинстве случаев заболевание заканчивается выздоровлением. При поражениях продолговатого мозга и центральных отделов ствола мозга возможны летальные исходы. После клинического выздоровления возможна длительная и даже пожизненная персистенция вируса в организме, что может стать причиной медленно прогрессирующего хронического течения заболевания с воспалительными изменениями ликвора, лейкоцитозом и лимфоцитозом, формированием стойких разноплановых неврологических нарушений.
Лечение
Лечение пациентов с клещевым энцефалитом проводят в условиях инфекционных (совместно с наблюдением невропатолога) или неврологических отделений, поскольку больные неконтагиозны. В острый период заболевания независимо от тяжести его течения больным назначают строгий постельный режим с максимальным ограничением раздражителей. В начальных стадиях заболевания для специфического лечения применяют противоэнцефалитный донорский иммуноглобулин. Дозы препарата, кратность его введения в сутки и длительность курса лечения зависят от клинической формы, тяжести и перио-
да болезни, а также массы тела пациента. Разовую дозу 0,1 мл/кг вводят ежедневно от 1 до 3 раз в сутки в течение 3-6 дней. Оценка клинической эффективности иммуноглобулина неоднозначна. В тяжелых случаях заболевания рекомендуют применение донорской иммунной плазмы реконвалесцентов клещевого энцефалита в курсовой дозе до 250 мл. Продолжается изучение эффективности рибавирина и ИФН в лечении клещевого энцефалита.
Параллельно проводят дезинтоксикационное и дегидратационное лечение. При тяжелом и осложненном течении заболевания осуществляют комплекс мероприятий на базе реанимационного отделения.
Эпидемиологический надзор
Как и при других природно-очаговых инфекциях, основу составляет мониторинг за состоянием природных и антропургических очагов, инвентаризация и прогнозирование их активности. Включает наблюдение, оценку и прогнозирование заболеваемости населения, инвалидности и летальности. Проводят предупредительный и текущий санитарный надзор при размещении жилых, производственных и общественных зданий на территории природных очагов клещевого энцефалита. Осуществляют контроль за качеством проводимых акарицидных обработок и профилактической вакцинации населения.
Профилактические мероприятия
Предусматривают создание неблагоприятных экологических условий для клещей в местах их обитания, их уничтожение и предотвращение укусов. Личная профилактика сводится к защите от нападения клещей использованием специальной одежды и репеллентов. Существенного снижения численности клещей можно достигнуть обработкой домашнего скота пестицидами, предусмотренными ветеринарно-зоотехнической службой.
Эффективным методом ограничения численности клещей могут служить лесомелиоративные мероприятия, включающие расчистку и благоустройство лесов:
- удаление сухостоя и валежника;
- проведение санитарных рубок леса;
- скашивание трав;
- разрежение кустарника.
В зонах отдыха и местах расположения оздоровительных учреждений такие лесотехнические мероприятия обязательны. Дератизационные мероприятия направлены на уменьшение численности прокормителей клещей (диких грызунов) и проводятся на расчищенных территориях осенью и весной. Обязательные составные части комплексного плана противоклещевых мероприятий в очагах:
- гигиеническое воспитание;
- внедрение средств защиты среди населения.
Специфическую профилактику проводят инактивированной культуральной вакциной. Она включает троекратную вакцинацию и последующую ревакцинацию через 4, 6 и 12 мес. Вакцинируют лиц, проживающих на эндемичных по клещевому энцефалиту территориях (привитость должна быть не менее 95%) и выезжающих в очаги. Ежегодно в стране вакцинируют от 650 000 до 900 000 и более, а ревакцинируют - от 1,32 до 1,52 млн человек. В 2007 г. вак-
цинировано 914 376 человек, что на 14% больше, чем в 2006 г. (786 551 человек), ревакцинировано 1 524 408 человек, что на 6% больше, чем в 2006 г.
(1 426 269 человек).
Мероприятия в эпидемическом очаге
Больного с подозрением на клещевой энцефалит независимо от тяжести его состояния желательно максимально быстро госпитализировать. Показаниями для этого служат анамнестические данные:
- предшествовавшее заболеванию пребывание в лесу в период активности клещей;
- указание больного на присасывание клещей или употребление в пищу сырого козьего молока;
- внезапное начало заболевания.
Выписку реконвалесцентов из стационара производят через 2-3 нед после нормализации температуры при отсутствии менингеальных симптомов. Переболевшие находятся под диспансерным наблюдением врача-невропатолога от 1 до 3 лет.
Карантин, дератизация, дезинфекция и дезинсекция жилых помещений, как и разобщение больного с окружающими, не проводят.
В случае присасывания клеща невакцинированным показана экстренная профилактика - введение специфического иммуноглобулина:
- детям до 12 лет - 1,5 мл;
- 12-16 лет - 2 мл;
- старше 16 лет - 3 мл.
Введение иммуноглобулина рекомендовано не позднее 4-го дня после присасывания клеща. В случаях повышенного риска заражения (выявлено инфицирование присосавшегося клеща, многократные укусы или одновременное присасывание нескольких клещей) препарат вводят и привитым лицам. В случае нового инфицирования можно повторно назначить препарат через 4-6 нед.
ИКСОДОВЫЕ
КЛЕЩЕВЫЕ БОРРЕЛИОЗЫ
Иксодовые клещевые боррелиозы (системный клещевой боррелиоз, болезнь Лайма, лаймоборрелиоз, лаймский артрит) - природно-очаговые трансмиссивные полиэтиологические заболевания с преимущественным поражением кожи, нервной системы, сердечно-сосудистой системы и опорно-двигательного аппарата, склонные к хронизации.
Краткие исторические сведения
В XIX-ХХ вв. описаны отдельные клинические синдромы - хронический атрофический дерматит, мигрирующая эритема, менингиты, менингоэнцефалиты - и высказано предположение об их связи с укусами инфицированных клещей. Начало изучения заболевания как отдельной нозологической формы, связанной с укусами иксодовых клещей, было положено A. Стиром
(1975), описавшим новую форму артрита в сочетании с мигрирующей эритемой у жителей городка Лайм (Коннектикут, США). Заболевание получило название лаймской болезни. В 1982 г. У. Бургдорфер выделил возбудитель и доказал его спирохетозную природу. В 1984 г. бактерии получили название Borrelia burgdorferi. В настоящее время лаймоборрелиоз включает целую группу заболеваний с разнообразным спектром клинических проявлений, вызванных различными видами боррелий. Э.И. Коренберг (1996) предложил объединить их под общим названием «иксодовые клещевые боррелиозы».
Этиология
Возбудители - грамотрицательные анаэробные подвижные спиралевидные бактерии семейства Spirochaetaceae рода Borrelia. Спирали имеют 3-10 неправильных крупных завитков. В настоящее время установлено, что лаймоборрелиоз могут вызывать В. burgdorferi (самая крупная из боррелий, способна активно передвигаться с помощью жгутиков), B. garinii и B. afzelii. В РФ выделяют все 3 вида.
Различают 3 группы Аг боррелий:
- поверхностные (OspA, OspB, OspD, OspE и OspF);
- жгутиковый;
- цитоплазматический.
Генетический материал боррелий находится не только в хромосоме, но и во множестве циркулярных и линейных плазмид. Набор плазмид, который в значительной мере определяет антигенную структуру возбудителя, подвержен постоянным количественным и качественным изменениям.
Факторы патогенности бактерий:
- соматический термостабильный липополисахаридоподобный Аг;
- жгутиковый Аг;
- белки наружной мембраны;
- порины;
- декоринсвязывающие белки, обеспечивающие адгезию возбудителя к клеткам хозяина.
Патогенные для человека боррелии - облигатные внутриклеточные паразиты - in vitro отличаются медленным ростом на специальных селективных средах, обогащенных аминокислотами, витаминами, альбумином бычьей и кроличьей плазмы и другими веществами, при температурном оптимуме 30-34 °С. Легко окрашиваются анилиновыми красителями, что отличает их от других родов спирохет. Боррелии хорошо сохраняются при низких температурах, чувствительны к формалину, фенолу, этиловому спирту и другим дезинфектантам, а также к УФ-излучению.
Эпидемиология
Резервуар и источник инфекции - многие виды диких и домашних позвоночных животных и птиц (главным образом различные виды диких грызунов, белохвостые олени, лоси и др.). В природных очагах возбудители циркулируют между клещами и дикими животными. Прокормителями клещей выступают более 200 видов диких животных. Поскольку заражение восприимчивых животных происходит не одновременно, в течение всего сезонного периода актив-
ности клещей, они играют наряду с переносчиками, существенную роль как резервуар инфекции в природе. Зараженный человек не является источником инфекции для человека.
Механизм передачи - чаще всего трансмиссивный, путь передачи - через укусы клеща, с его слюной. Основное эпидемиологическое значение имеют клещи Ixodes ricinus, I. persulcatus. Спонтанная инфицированность клещей боррелиями в природных очагах может достигать 70% и более. Общность переносчиков для клещевого боррелиоза, клещевого энцефалита и эрлихиоза нередко обусловливает возникновение случаев смешанной инфекции. У человека клещ присасывается чаще всего в области шеи, груди, подмышечных впадин, паховых складок, т.е. в местах с тонкой кожей и обильным кровоснабжением. У детей частым местом прикрепления клеща бывает волосистая часть головы. Прикрепление и присасывание клеща к телу в большинстве случаев остается незамеченными, так как в состав его слюны входят анестезирующие, сосудорасширяющие и антикоагулирующие вещества. Процесс насыщения кровью самок иксодовых клещей может продолжаться 6-8 дней. В начале питания клещ может передавать боррелии только после попадания бактерий в слюнные железы, т.е. при генерализованной инфекции клеща. Если боррелии находятся только в кишечнике, то они передаются во 2-й фазе питания (позднее 1-2-х суток присасывания). Поэтому раннее удаление клещей предотвращает в ряде случаев инфицирование человека. Возможна передача боррелий через фекалии клеща после их попадания на кожу и последующего втирания при расчесах. Другим возможным путем передачи возбудителей от животного к человеку может быть алиментарный путь, реализующийся при употреблении в пищу сырого молока (преимущественно козьего) или молочных продуктов без термической обработки. Доказанным фактом является возможность инфицирования плода трансплацентарно при боррелиозе беременных.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Постинфекционный иммунитет нестерильный, видоспецифический, через несколько лет после выздоровления возможно повторное заражение. Возбудитель способен длительно циркулировать в организме.
Основные эпидемиологические признаки
Лаймскую болезнь относят к числу наиболее распространенных клещевых инфекций. Природные очаги болезни сходны с клещевым энцефалитом и приурочены главным образом к лесным ландшафтам умеренного климатического пояса, что связано с ареалом клещей - основных переносчиков возбудителя. В РФ клещевой боррелиоз имеет широкое распространение, но судить об уровне заболеваемости можно лишь предположительно. Ежегодно более чем в 60 субъектах Федерации регистрируют 7 000-9 000 заболеваний людей.
Наиболее неблагополучные районы по заболеваемости клещевым боррелиозом:
- Усть-Ордынский Бурятский автономный округ - показатель на 100 000 населения - 57,52 (77 случаев);
- Кировская область - 48,5 (696 случаев);
- Томская область - 32,12 (332 случая);
- Свердловская область - 15,98 (704 случая);
- Пермский край - 17,37 (433 случая).
В 2007 г. зарегистрировано 7247 случаев, показатель на 100 000 населения - 5,09, в том числе среди детей до 17 лет - 767 случаев и 2,79 соответственно. Несмотря на некоторое снижение заболеваемости в 2007 г. по сравнению с 2006 г. - на 2,4%, в том числе среди детей до 17 лет - 6,3%, уровень ее остается высоким. В возрастной структуре заболевших дети составляют 6,8%. Наиболее пораженными оказались дети от 3 до 6 лет, среди которых зарегистрировано 246 случаев заболевших, показатель на 100 000 детей этого возраста - 4,66. В основном болеют городские жители - 79%, заражение происходит чаще всего во время посещения леса, лесопарков, на садово-огородных участках. Весенне-летняя сезонность обусловлена периодом активности клещей (с апреля по октябрь). Среди заболевших преобладают лица активного возраста. Исключительная стойкость, цикличность и активность природных очагов клещевых инфекций обусловливает уровень заболеваемости, а отсутствие специфической профилактики при клещевом боррелиозе в значительной степени осложняет эпидситуацию.
Патогенез
До настоящего времени остается окончательно не изученным.
Боррелии проникают в организм человека при укусе инфицированного клеща с его слюной, обладающей разнообразными специфическими свойствами:
- обезболивающим;
- противовоспалительным;
- сосудорасширяющим;
- гемолитическим;
- нейропаралитическим.
В месте входных ворот уже в инкубационном периоде заболевания происходит внедрение возбудителей и их накопление в макрофагах, лимфоцитах, эндотелиальных клетках. Внутриклеточная интервенция возбудителей облегчается за счет воздействия на клеточные мембраны ферментных систем макроорганизма, активированных под влиянием поверхностных белков боррелий (OspA, OspC).
По общепринятым представлениям, в развитии заболевания условно могут быть выделены 3 последовательные стадии:
- локализованной;
- диссеминированной (генерализованной);
- персистирующей (хронической) инфекции.
Условность такого подразделения объясняется тем, что не всегда достаточно четко можно проследить чередование указанных стадий, тем более что в отдельных случаях возможно даже развитие латентной инфекции.
В стадии локализованной инфекции боррелии остаются в месте входных ворот, где развиваются воспалительно-аллергические изменения кожи, клинически проявляющиеся в виде мигрирующей эритемы. Эритему часто сопровождает регионарный лимфаденит. В половине случаев заболевания уже на этой стадии возникают умеренная бактериемия, сопутствующие проявления интоксикации.
В части случаев при инфицировании боррелиями мигрирующая эритема не развивается, особенностью такой формы заболевания бывает достаточно
быстрое гематогенное, лимфогенное и, возможно, периневральное диссеминирование возбудителя.
При диссеминировании боррелии, как внутриклеточные паразиты, поражают клетки СМФ (в том числе макрофаги и лимфоциты), эндотелиальные клетки. Бактерии способны распространяться в тканях, проникая через эндотелий сосудов и гематоэнцефалический барьер. Вследствие этих процессов развиваются полиорганные поражения, включая различные отделы нервной системы. Внутриклеточная локализация возбудителя препятствует завершенности фагоцитоза и быстрой элиминации бактерий при формировании гуморальных иммунных реакций. Под воздействием микробных продуктов (в том числе и ЛПС-комплекса) происходит выработка различных медиаторов воспаления (ИЛ-1, α-ИФН) и других биологически активных веществ, участвующих в развитии органных воспалительных и дистрофических процессов с иммуноаллергическим компонентом и первоочередным поражением соединительной ткани. Поражение эндотелиальных клеток сопровождается десквамацией эндотелия, развитием продуктивного васкулита и микроциркуляторных нарушений, отягощающих клиническую картину заболевания. Нарушения гемостаза возникают уже в ранний период болезни и сохраняются длительно, даже в течение года после ее начала.
Хроническое течение болезни с поздними рецидивами обусловлено способностью возбудителей к длительной внутриклеточной персистенции в организме (более 10 лет). Механизмы этого состояния окончательно не выяснены, однако могут быть связаны с тропизмом возбудителей к фибробластам, нервной системе, тканям суставов, выраженной изменчивостью поверхностных Аг боррелий, нарушениями различных звеньев иммунной системы. Выявлены повышенная супрессорная активность Т-клеток в первой стадии болезни, снижение активности фагоцитоза, сохраняющееся у части пациентов даже в период реконвалесценции. Слабое антигенное раздражение при медленной репликации боррелий в инфицированном организме приводит к замедленной выработке IgM-АТ и IgG-АТ (максимальное накопление IgM-АТ происходит только через 1-1,5 мес, а IgG-АТ через 1,5-3 мес от начала болезни). Протеины бактерий ингибируют продукцию лимфоцитами медиаторов воспаления и систему комплемента макроорганизма, усиливают выработку противовоспалительных цитокинов. Перечисленные разнообразные патогенетические особенности способствуют уклонению возбудителей от иммунного надзора. Важным патогенетическим звеном может быть формирование аутоиммунных реакций с накоплением специфических иммунных комплексов в коже, суставах и внутренних органах.
Вместе с тем известно, что инфекционный процесс при боррелиозах может спонтанно завершиться выздоровлением и санацией организма на любой стадии развития заболевания. Постинфекционный иммунитет нестерильный, видоспецифический; возможно повторное заражение.
Клиническая картина
Единая клиническая классификация боррелиозов отсутствует. В табл. 4-8 приведена клиническая классификация, отражающая периоды, формы и варианты течения заболеваний с учетом превалирования органной патологии.
Таблица 4-8. Клиническая классификация иксодовых клещевых боррелиозов
Инкубационный период
Варьирует от 5 до 45 дней, составляя в среднем 2-3 нед. Клинически течение боррелиоза разделяют на 3 периода:
- ранний;
- поздний;
- резидуальный.
Кожный вариант локализованной формы ИКБ проявляется развитием мигрирующей эритемы - основного и зачастую единственного патогномоничного признака раннего периода заболевания (см. рис. 33 и 34 доп. илл.). Сначала в месте укуса клеща возникает пятно или папула. Пятно представляет собой участок гомогенной гиперемии овальной или округлой формы, в течение нескольких дней расширяющийся во все стороны до 15-20 см и более в диаметре. Цвет эритемы варьирует от бледно-розового до насыщеннокрасного, края становятся четкими, приподнятыми над уровнем здоровой кожи. У части больных в центре пятна эритема постепенно бледнеет, превращается в кольцевидную, приобретает цианотичный оттенок. В редких атипичных случаях на фоне эритемы возникают мелкие папулы или везикулы с возможной последующей трансформацией в язвочки. В 10-30% случаев эритема сопровождается развитием регионарного лимфаденита. 0бщее состояние и самочувствие пациентов изменяются незначительно. Иногда развитие эритемы сопровождается неприятными ощущениями в области пятна, зудом, легкой болезненностью. Нередко (до 50% случаев) возникают повышение температуры (обычно субфебрилитет), недомогание, головная боль, миалгии.
При лечении антибиотиками эритема сохраняется несколько дней, без лечения - до 1 мес и более, а затем постепенно исчезает, оставляя слабую пигментацию и шелушение. Исчезновение эритемы далеко не всегда свиде-
тельствует о выздоровлении, через некоторое время возможно появление признаков генерализации инфекционного процесса.
Генерализованная форма иксодового клещевого боррелиоза развивается у 10-15% больных приблизительно через 1 мес от начала болезни, как правило, при отсутствии полноценного антибактериального лечения.
Выражены общетоксические признаки:
- лихорадка неправильного типа;
- миалгии и артралгии;
- головная боль;
- слабость.
Характерен полиморфизм клинических проявлений, отражающих поражения различных органов и систем.
В соответствии с преобладающей органной симптоматикой выделяют клинические варианты течения генерализованной формы:
- кожный;
- неврологический;
- суставной;
- кардиальный;
- офтальмологический;
- смешанный.
Поражения кожи могут проявляться в виде вторичных элементов кольцевидной эритемы, удаленных от места входных ворот инфекции, капилляритов, уртикарной сыпи, в редких случаях - доброкачественной лимфоцитомы в виде узелков темно-вишневого цвета, похожих на аналогичные элементы при саркоме Капоши (см. рис. 23 доп. илл.).
Особое внимание привлекают возникающие неврологические нарушения с поражениями различного уровня как ЦНС, так и периферической нервной системы. Можно наблюдать вялотекущий энцефалит с поражением полушарий и ствола головного мозга, различные моно- и полинейропатии, поражения черепных нервов (более часто - неврит лицевого нерва). В редких случаях развиваются серозный менингит, энцефаломиелит с сегментарными радикулоневритическими расстройствами. Может возникнуть лимфоцитарный менингорадикулоневрит, проявляющийся болями в месте укуса клеща, интенсивными корешковыми болями с нарушениями чувствительной и двигательной функций корешков спинальных нервов шейного и грудного отделов спинного мозга и серозным менингитом. Неврологические нарушения сохраняются от нескольких недель до нескольких месяцев.
Суставной вариант проявляется артралгиями с летучими болями в суставах или артритами, тендовагинитами, миозитами.
Поражения сердечно-сосудистой системы развиваются не более чем в 10% случаев и в раннем периоде болезни могут проявляться кардиалгиями, сердцебиениями, артериальной гипертензией. Отмечены нарушения проводимости вплоть до полной атриовентрикулярной блокады. В редких случаях выявляют признаки миокардита или перикардита.
Офтальмологический вариант как доминирующий в клинической картине генерализованной формы иксодового клещевого боррелиоза встречается крайне редко и проявляется симптоматикой поражений различных отделов глаз:
- конъюнктивитов;
- иритов;
- хориоидитов и др.
Кроме того, в различных случаях при этой форме боррелиозов отмечены лимфаденопатия, безжелтушные нетяжелые гепатиты, ангины и бронхиты, орхиты, почечная патология (микрогематурия и протеинурия).
Генерализованная форма раннего периода иксодового клещевого боррелиоза нередко (в 20-30% случаев) может развиться и без предшествующей эритемы (безэритемная, первично-генерализованная форма).
Хроническая форма иксодового клещевого боррелиоза относится к позднему периоду заболевания. Клинические проявления формируются через 1-3 мес после первых двух форм, а у некоторых больных через 6-12 мес и более, считая от начала болезни. Больные предъявляют разнообразные жалобы на слабость, повышенную утомляемость, снижение работоспособности, головную боль. Отмечают повышенную возбудимость или депрессию, нарушения сна, миалгии. Более чем у 1/3 больных возникают нарушения со стороны опорнодвигательного аппарата.
Поражения суставов развиваются по 3 вариантам:
- мигрирующие артралгии различной выраженности без объективных признаков воспаления;
- доброкачественные рецидивирующие артриты с гиперемией, отечностью суставов и резким ограничением движений в них из-за болей;
- хронические прогрессирующие артриты с глубокими изменениями структуры суставов.
Хронические артриты развиваются нечасто (около 10% больных), сопровождаются поражением периартикулярных тканей. Течение болезни становится длительным, рецидивирующим. Кроме суставных проявлений, в поздний период лаймоборрелиоза могут отмечать кожные поражения в виде хронического атрофического акродерматита с истончением эпидермиса кожи кистей и стоп, приобретающей вид папиросной бумаги. Возможны очаговые склеродермоподобные изменения кожи, вовлечение нервной системы (хронический энцефаломиелит, парапарезы, множественный мононеврит, расстройства памяти и др.), приобретающие многолетнее течение. Описаны случаи развития дилатационной кардиомиопатии, кератита. Хронический процесс чаще развивается у больных, перенесших безэритемную форму в раннем периоде иксодового клещевого боррелиоза.
Прогноз благоприятный, несмотря на длительное течение заболевания. Однако в ряде случаев могут возникать необратимые неврологические и суставные поражения, отягощающие прогноз (резидуальные проявления).
Дифференциальная диагностика
В 1-й фазе заболевание следует отличать от лихорадочных состояний, сопровождающихся экзантемой. Клинический диагноз локализованной формы иксодового клещевого боррелиоза может быть установлен при обнаружении первичного аффекта в месте укуса клеща, а затем характерных признаков мигрирующей кольцевидной эритемы - основного патогномоничного проявления боррелиоза. На более поздних стадиях боррелиоз дифференцируют от серозных менингитов различной этиологии, клещевого энцефалита и других заболеваний нервной системы, а также от поражений суставов различной этиологии, протекающих в сочетании с разнообразной кардиальной патологией.
Лабораторная диагностика
В гемограмме отмечают лейкоцитоз, повышение СОЭ. Специфическая лабораторная диагностика может дать ориентировочный результат при выявлении боррелий в биоптатах кожи, а также в крови, спинномозговой жидкости после импрегнации препаратов серебром, а также в клещах, снятых с пациента. Выделение культуры возбудителя при посевах исследуемого материала на сложные жидкие питательные среды в широкой клинической практике не проводят. Применяют серологические методы:
- РНИФ;
- ИФА;
- РНГА.
Реакции ставят в парных сыворотках с интервалом 20-30 дней. Высокие титры АТ (1:80 и выше) появляются поздно, через несколько месяцев от начала болезни. Длительное сохранение высоких титров IgG свидетельствует о продолжающемся инфекционном процессе и развитии хронических форм заболевания. Сходство антигенной структуры боррелий со спирохетами других родов может стать причиной получения ложноположительных результатов серодиагностики.
Лечение
Пациенты с мигрирующей эритемой могут лечиться амбулаторно, в случаях генерализованного и хронического боррелиоза показана госпитализация в инфекционные отделения. Этиотропное лечение проводят при всех формах и вариантах заболевания (при хронической форме - только в периоде обострения). При мигрирующей эритеме препаратом выбора считают доксициклин по 100 мг 2 раза в сутки.
Альтернативные средства:
- цефуроксим по 0,5 г 2 раза в сутки;
- ампициллин, амоксициллин по 1,5-2 г в сутки;
- азитромицин.
Препараты назначают перорально курсом не менее 14-21 дня.
При генерализованной и хронической формах, особенно в случаях поражения ЦНС и проводящей системы сердца, предпочтительно парентеральное введение препаратов:
- цефтриаксона или цефатоксима (клафорана) внутривенно по 2 г 1 раз в сутки;
- бензилпенициллина внутримышечно по 2-4 млн ЕД в сутки (при менингите 16-24 млн ЕД в сутки).
Курс лечения составляет в среднем 2-4 нед.
Широко применяют нестероидные противовоспалительные препараты, десенсибилизирующие, общеукрепляющие средства, витамины, физиотерапевтические процедуры.
Эпидемиологический надзор
Общие принципы остаются слабо разработанными, так как медленное внедрение методов лабораторной диагностики клещевого боррелиоза не позволяет оценить истинное состояние заболеваемости и обеспечить эффективный надзор за этой инфекцией. Сходство эпидемиологии иксодовых клещевых боррелиозов и клещевого энцефалита определяет единые цели, методы и объекты эпидемиологического надзора при этих болезнях.
Профилактические мероприятия
Меры иммунопрофилактики не разработаны.
Большое значение имеет личная профилактика, направленная на предупреждение присасывания клещей:
- ношение защитной одежды;
- применение репеллентов и др.
Исключительно большое значение имеют само- и взаимоосмотры. Их проводят для обнаружения клещей на поверхности одежды и ее складках, а также на открытых поверхностях тела, не снимая одежды через каждые 2 ч нахождения в очаге.
Мероприятия в эпидемическом очаге
Аналогичны таковым при клещевом энцефалите. Госпитализацию больных проводят по клиническим показаниям. Карантин не вводят. Разобщение контактных лиц и дезинфекцию не проводят. Экстренную профилактику антибиотиками осуществляют строго индивидуально в доказанных случаях присасывания инфицированных клещей.
Для экстренной профилактики в России применяют антибиотики различных групп:
- пенициллины;
- тетрациклины;
- макролиды (проявляют эффективность и при лечении манифестных форм болезни).
Антибактериальное лечение в инкубационный период в ранние сроки (до 5 сут после присасывания клеща) позволяет практически у всех пациентов оборвать инфекционный процесс.
ЛЕЙШМАНИОЗЫ (LEISHMANIOSES)
Лейшманиозы - протозойные трансмиссивные заболевания, характеризующиеся преимущественным поражением внутренних органов (висцеральные лейшманиозы) или кожи (кожные лейшманиозы), иногда кожи и слизистых оболочек, главным образом дыхательных путей. Висцеральные лейшманиозы протекают с развитием лихорадки, спленомегалии и анемии.
Краткие исторические сведения
Первые описания возбудителей кожных лейшманиозов представили Cuningham (1884) и Firth (1891). Научное изучение заболеваний началось с обнаружения П.Ф. Боровским (1898) возбудителя кожного лейшманиоза в мазках из грануляций пендинской язвы. П.Ф. Боровский отнес возбудителя к простейшим. Позднее У. Лейшмен и С. Донован (1900-1903) в Индии обнаружили в селезенке больных кала-азаром возбудителей висцерального лейшманиоза - простейших, морфологически идентичных микроорганизму, описанному П.Ф. Боровским. В 1903 г. Р. Росс отнес открытые микроорганизмы в новый род Leishmania. В 1908 г. Ш. Николь выделил лабораторную культуру возбудителей. Работами Е. Сержана, А. Донатье и Л. Парро (1921) установлен транс-
миссивный путь передачи заболеваний через москитов. Природная очаговость заболеваний обоснована исследованиями В.Л. Якимова (1931) и Н.И. Латышева
(1937-1947). Этиология
Возбудители - простейшие рода Leishmanial семейства Trypanosomidae класса Mastigophora. В настоящее время выделяют несколько десятков видов лейшманий, из них около 20 видов способны вызывать поражения у человека. Лейшмании - внутриклеточные паразиты, развивающиеся в макрофагах или клетках ретикулоэндотелиальной системы.
Жизненный цикл лейшманий протекает со сменой хозяев в виде двух стадий:
- безжгутиковой (амастиготной) в организме позвоночного животного или человека;
- жгутиковой (промастиготной) - в организме членистоногого. Размножаются путем продольного деления, морфологически лейшмании
неразличимы. Дерматотропные виды лейшманий (L. tropica major et minor, L. aethiopica и др.) вызывают кожные формы лейшманиоза, L. braziliensis, L. mexicana обусловливают развитие американских кожно-слизистых лейшманиозов. При заражении висцеротропными паразитами (L. donovani, L. infantum, L. chagasi и др.) развивается системное, хронически протекающее заболевание. Большинство видов лейшманий легко культивировать in vitro. В культурах клеток при 37 °С они растут в виде амастигот, имеющих овальную форму, на бесклеточных средах при 22-27 °С - в виде промастигот веретеновидной формы. При окраске по Романовскому-Гимзе цитоплазма возбудителей приобретает серовато-голубой цвет, ядра - красный или красно-фиолетовый. Около ядра располагается кинетопласт (круглое зернышко или короткая палочка, лежащая эксцетрично). Ядро и кинетопласт позволяют отличить лейшмании от других простейших. Лейшмании малочувствительны к антибиотикам, несколько больше - к производным пятивалентной сурьмы.
Эпидемиология
Резервуар и источники инвазии - человек и различные животные. Среди последних наибольшее значение имеют шакалы, лисицы, собаки и грызуны (песчанки - большая, краснохвостая, полуденная, тонкопалый суслик и др.). Заразность длится неопределенно долгое время и равна периоду пребывания возбудителя в крови и изъязвлений кожи хозяина. Длительность кожного лейшманиоза у песчанок обычно составляет около 3 мес, но может достигать 7 мес и более.
Механизм передачи - трансмиссивный, переносчики - москиты родов Phlebotomus и Lutzomyia. Хорошо изучен в качестве переносчика городского лейшманиоза москит P. papatasii, ведущий в большинстве случаев синантропное существование. Основные места выплода москитов в населенных пунктах - подвалы в жилых помещениях и свалки мусора, в природе - гнезда птиц, логова животных, норы грызунов, пещеры, трещины скал. В природных очагах основными переносчиками лейшманий выступают P. papatasii, P. caucasicus, P. sergenti. Москиты активны в сумеречное и ночное время. При кожных формах инвазии москиты заражаются на лейшманиомах - папуле или язве у человека, на утолщенных или изъязвленных участках ушей у песчанок и
других животных. При висцеральных формах лейшманиоза у человека паразиты обычно малодоступны для москитов, поэтому больной редко служит источником инвазии. Исключение составляет индийский кала-азар, при котором лейшмании нередко обнаруживают в крови и кожных поражениях, развивающихся в исходе заболевания. Лейшмании попадают в организм москита при сосании крови зараженного человека или животного, в желудке которого через несколько часов амастиготы превращаются в промастиготы. Заразными москиты становятся через 5-8 сут после попадания зараженной крови в желудок и остаются носителями лейшманий пожизненно.
Развитие москитов реализуется путем полного метаморфоза:
яйцо-личинка-куколка-имаго.
Отмечены случаи передачи лейшманий при гемотрансфузиях.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Иммунитет носит видовой характер. Напряженный постинфекционный иммунитет вырабатывается только после кожного лейшманиоза. Различные состояния, сопровождающиеся иммунодефицитами, существенно снижают резистентность к паразитам.
Основные эпидемиологические признаки
Индийский висцеральный лейшманиоз (кала-азар), вызываемый L. donovani, - антропоноз. Распространен в ряде районов Пакистана, Бангладеш, Непала, Китая и др. Его отличают возникающие время от времени вспышки заболевания. Болеют преимущественно подростки и молодые лица, главным образом проживающие в сельской местности.
Средиземноморско-среднеазиатский висцеральный лейшманиоз, вызываемый L. infantum, - зооноз, резервуар инфекции в природе - шакалы, лисицы, собаки. Распространен в ряде стран Средиземноморья, Ближнего и Среднего Востока, Африки, Казахстане, Средней Азии и Закавказье. Выделяют природные, полусинантропные (сельского типа) и синантропные (городского типа) очаги инвазии. Заражение происходит чаще всего летом, болеют в основном дети от 1 года до 5 лет жизни.
В последние годы в связи с широким распространением ВИЧ-инфекции и сочетанием лейшманиозной и ВИЧ-инфекций произошли существенные изменения в клинических и эпидемиологических проявлениях лейшманиоза. На фоне ВИЧ-инфекции резко увеличивается концентрация лейшманий в крови и кожном покрове больных. Такие больные, заменяя больных собак, начали играть роль источника инвазии для переносчиков. Средиземноморский висцеральный лейшманиоз из типичного зооноза превратился в трансмиссивный антропоноз.
Поддержание циркуляции возбудителя стало возможным в цепи:
больной человек-москит-здоровый человек.
Вместе с тем по мере развития эпидемии ВИЧ-инфекции происходило дальнейшее упрощение схемы развития эпидемического процесса.
Увеличение числа парентеральных наркоманов, инфицированных ВИЧ и лейшманиями, способствовало становлению прямой инъекционной передачи висцерального лейшманиоза.
В этом случае произошло предельное упрощение паразитарной системы висцерального лейшманиоза:
больной человек-здоровый человек.
Фактором передачи служат инфицированные шприцы.
Южноамериканский висцеральный лейшманиоз (висцеральный лейшманиоз Нового Света), вызываемый L. chagasi, близок по своим проявлениям к средиземноморско-среднеазиатскому лейшманиозу. Отмечают в основном спорадическую заболеваемость в ряде стран Центральной и Южной Америки.
Антропонозный кожный лейшманиоз Старого Света (болезнь Боровского), вызываемый L. minor, распространен в Средиземноморье, странах Ближнего и Среднего Востока, в западной части полуострова Индостан, Средней Азии и Закавказье. Заболевание встречается преимущественно в городах и поселках городского типа, где обитают москиты. Среди местного населения чаще болеют дети, среди приезжих - лица всех возрастов. Характерна летне-осенняя сезонность, что связано с активностью переносчиков.
Зоонозный кожный лейшманиоз Старого Света (пендинская язва) вызывается L. major. Основной резервуар инвазии - грызуны (большая и красная песчанка и др.). Распространен в странах Ближнего Востока, Северной и Западной Африки, Азии, в Туркмении и Узбекистане. Эндемичные очаги встречаются главным образом в пустыне и полупустыне, в сельской местности и на окраинах городов. Летняя сезонность заражений определяется периодом активности москитов. Болеют преимущественно дети, среди приезжих возможны вспышки заболеваний среди лиц разного возраста.
Зоонозный кожный лейшманиоз Нового Света (мексиканский, бразильский и перуанский кожные лейшманиозы), вызываемые L. mexicana, L. braziliensis, L. peruviana, L. uta, L. amazoniensis, L. pifanoi, L. venezuelensis, L. garnhami, L. guyanensis, L. panamensis, регистрируют в Центральной и Южной Америке, а также в южных районах США. Природный резервуар возбудителей - грызуны, многочисленные дикие и домашние животные. Заболевания встречают в сельской местности, преимущественно в сезон дождей. Заболевают лица всех возрастов. Обычно заражение происходит в момент работы в лесу, охоты и т.д.
Патогенез
При укусах москитов лейшмании в форме промастигот проникают в организм человека. Их первичное размножение в макрофагах сопровождается трансформацией возбудителей в амастиготы (безжгутиковую форму). При этом в области входных ворот развивается продуктивное воспаление, образуется специфическая гранулема. В ее состав входят макрофаги, содержащие возбудители, ретикулярные, эпителиоидные и гигантские клетки. Образуется первичный аффект в виде папулы. В дальнейшем при висцеральных лейшманиозах она рассасывается без следа или рубцуется.
При кожном лейшманиозе развиваются деструкция кожного покрова в месте бывшего бугорка, изъязвление и затем заживление язвы с образованием рубца. Распространяясь лимфогенным путем к регионарным лимфатическим узлам, лейшмании провоцируют развитие лимфангитов и лимфаденитов, образование ограниченных поражений кожи в виде последовательных лейшманиом. Развитие туберкулоидного или диффузно-инфильтрирующего кожного лейшманиоза во многом обусловлено состоянием реактивности организма (соответственно гиперэргии или гипоэргии).
Наряду с кожными формами заболевания можно наблюдать кожнослизистые формы с изъязвлением слизистых оболочек носоглотки, гортани,
трахеи и последующим образованием полипов или глубоким разрушением мягких тканей и хрящей. Эти формы регистрируют преимущественно в странах Южной Америки.
При висцеральном лейшманиозе первичный аффект образуется реже, в основном у детей. Из места инокуляции возбудители диссеминируют в лимфатические узлы, затем в печень, селезенку, костный мозг, стенку кишечника, иногда в почки, надпочечники и легкие, где попадают в клетки СМФ и размножаются в них. Это обусловливает функциональные и морфологические нарушения в органах ретикулогистиоцитарной системы (системный паразитарный ретикулогистиоцитоз). Развитие ГЗТ способствует разрушению лейшманий, в таких случаях заболевание протекает в субклинической или латентной форме. На фоне снижения реактивности организма или иммуносупрессии лейшмании активно размножаются, вызывая лихорадку и другие проявления интоксикации продуктами метаболизма паразитов, развитие патоморфологических изменений во внутренних органах и их дисфункцию вследствие генерализованного эндотелиоза. В печени гипертрофия звездчатых эндотелиоцитов (купферовских клеток) приводит к сдавлению и атрофии гепатоцитов, формированию интерлобулярного фиброза. Развивается атрофия пульпы селезенки (иногда с некрозами и инфарктами) и зародышевых центров лимфатических узлов. Нарушения костномозгового кроветворения приводят к анемии. Развивается кахексия.
Образующиеся АТ проявляют слабовыраженную защитную активность, так как большая часть лейшманий паразитирует внутриклеточно либо локализована в гранулемах. Отмечают высокие титры ауто-АТ, что указывает на развитие иммунопатологических процессов. Возникают вторичные инфекции, формируются признаки амилоидоза почек, гипохромной анемии.
Иммунитет после перенесенного лейшманиоза носит видовой характер. У реконвалесцентов кожного лейшманиоза Старого Света развивается стойкий гомологичный иммунитет.
Клиническая картина
В соответствии с особенностями клиники, этиологии и эпидемиологии лейшманиозы подразделяют на следующие виды.
• Висцеральные лейшманиозы (кала-азар).
◊ Зоонозные:
- средиземноморско-среднеазиатский (детский кала-азар); - восточноафриканский (лихорадка дум-дум);
- кожно-слизистый лейшманиоз (лейшманиоз Нового Света, носоглоточный лейшманиоз).
◊ Антропонозный:
- индийский, кала-азар взрослых.
• Кожные лейшманиозы.
◊ Зоонозный (сельский тип болезни Боровского, пендинская язва).
◊ Антропонозный (городской тип болезни Боровского, ашхабадская язва, багдадский фурункул, годовик).
◊ Кожный и кожно-слизистый лейшманиоз Нового Света (эспундия, болезнь Бреды).
◊ Эфиопский кожный лейшманиоз.
Висцеральный средиземноморско-азиатский лейшманиоз
Возбудитель заболевания - L. infantum. В РФ встречается в виде спорадических случаев, завозных из среднеазиатских республик СНГ, Казахстана, Азербайджана, Грузии и дальнего зарубежья.
Инкубационный период
Варьирует от 20 дней до 3-5 мес, в редких случаях до 1 года и более. У детей раннего возраста и редко у взрослых задолго до общих проявлений болезни возникает первичный аффект в виде бледно-розовой папулы на месте укуса москита.
Начальный период заболевания
Характерны постепенное развитие слабости, снижение аппетита, адинамия, бледность кожного покрова, небольшое увеличение селезенки. Незначительно повышается температура тела.
Период разгара
Обычно начинается с подъема температуры тела до 39-40 °С. Лихорадка принимает волнообразный или неправильный характер и длится от нескольких дней до нескольких месяцев со сменой эпизодов высокой температуры и ремиссий. В отдельных случаях температура тела в течение первых 2-3 мес бывает субфебрильной или даже нормальной.
При осмотре больных определяют полилимфаденопатию (периферических, перибронхиальных, мезентериальных и других лимфатических узлов), увеличение и уплотнение печени и селезенки (даже в большей степени), безболезненных при пальпации. В случаях развития бронхоаденита возможен кашель, нередки пневмонии вторично-бактериального характера.
По мере течения заболевания состояние больных прогрессивно ухудшается. Развиваются похудание (вплоть до кахексии), гиперспленизм. Поражения костного мозга ведут к прогрессирующей анемии, гранулоцитопении и агранулоцитозу, иногда с некрозом слизистых оболочек полости рта.
Нередко возникают проявления геморрагического синдрома:
- кровоизлияния в кожу и слизистые оболочки;
- кровотечения из носа, ЖКТ.
Фиброзные изменения в печени приводят к портальной гипертензии с отеками и асцитом, чему способствует прогрессирующая гипоальбуминемия.
Вследствие гиперспленизма и высокого стояния диафрагмы сердце несколько смещается вправо, тоны его становятся глухими, развиваются тахикардия и артериальная гипотензия. Эти изменения, наряду с анемией и интоксикацией, приводят к появлению и нарастанию признаков сердечной недостаточности. Возможны диарея, нарушения менструального цикла, импотенция.
Терминальный (кахектический) период
Наблюдают кахексию, падение мышечного тонуса, истончение кожи, развитие безбелковых отеков, резкую анемию.
Заболевание может проявляться в острой, подострой и хронической формах, его общая продолжительность варьирует от нескольких месяцев до 1,5-3 лет.
• Острую форму изредка встречают у маленьких детей. Развивается бурно, без лечения быстро заканчивается летальным исходом.
• Подострую форму встречают более часто. Характерны тяжелые клинические проявления, без лечения через 5-6 мес может наступить летальный исход.
• Хроническая форма развивается наиболее часто, нередко протекает субклинически и латентно.
Висцеральный антропонозный лейшманиоз (индийский кала-азар)
Встречается преимущественно у взрослых лиц и лишь в 5-6% случаев - у детей и подростков. Возбудитель заболевания - L. donovani. В некоторых зонах жаркого климата (Индия, Восточная Африка, Судан) у части больных (5-10% при индийском, до 50% при восточно-африканском лейшманиозе) наряду с поражением внутренних органов через несколько месяцев (до 1 года) после терапевтической ремиссии на коже появляются лейшманоиды. Вначале они представляют собой эритематозные пятна или участки кожи с пониженной пигментацией, в дальнейшем мелкие узелки, папилломы, в которых содержатся лейшмании в течение длительного времени (годами и десятилетиями).
Кожный зоонозный лейшманиоз (пендинская язва, болезнь Боровского)
Возбудитель - L. major. Заболевание встречают в тропических и субтропических странах. Инкубационный период варьирует от 1 нед до 1,5 мес, в среднем составляет 10-20 дней. В месте входных ворот появляется первичная лейшманиома, вначале представляющая собой гладкую папулу розового цвета диаметром 2-3 мм. Размеры бугорка быстро увеличиваются, при этом он иногда напоминает фурункул, но безболезненный или слабоболезненный при пальпации. Через 1-2 нед в центре лейшманиомы начинается некроз, напоминающий головку гнойника, а затем образуется болезненная язва до 10-15 см в диаметре, с подрытыми краями, мощным ободком инфильтрата и обильным серозно-гнойным или сукровичным экссудатом (см. рис. 35 доп. илл.). Вокруг нее часто формируются мелкие вторичные бугорки - бугорки обсеменения, также изъязвляющиеся и при слиянии образующие язвенные поля. Так формируется последовательная лейшманиома. Лейшманиомы чаще локализуются на открытых частях тела, их количество варьирует от единиц до десятков. Образование язв во многих случаях сопровождается развитием безболезненных лимфангитов и лимфаденитов. Через 2-6 мес начинаются эпителизация язв и их рубцевание. Общая длительность заболевания не превышает 6-7 мес.
Диффузный (эфиопский) кожный лейшманиоз
Встречается в Африке (Эфиопия, Кения, Уганда, Танзания), отличается длительным течением, генерализованным характером инфильтративных изменений кожи, напоминающих лепру и практически не рассасывающихся (см. рис. 36 доп. илл.).
Кожные и кожно-слизистые лейшманиозы Нового света
Заболевания не имеют принципиальных патогенетических и клинических различий с кожным зоонозным лейшманиозом Старого Света, отличаясь лишь более глубоким поражением кожи и относительно частым распространением патологического процесса на слизистые оболочки различных отделов дыхательных путей или половых органов.
Кожный антропонозный лейшманиоз
Возбудитель заболевания - L. tropica minor.
Отличается длительным инкубационным периодом в несколько месяцев или даже лет и 2 основными особенностями:
- медленным развитием сухой язвы (3-4 мес) и рубца (до 1-2 лет);
- меньшей выраженностью кожных поражений.
Возможно развитие последовательных лейшманиом с частым рассасыванием образовавшихся новых бугорков или с формированием язв.
Туберкулоидный кожный лейшманиоз. Иногда (до 10% случаев) наблюдают у детей и молодых лиц. Он отличается вялым течением, образованием вокруг рубцов или на них мелких бугорков. Последние могут увеличиваться и сливаться друг с другом. В динамике заболевания они изредка изъязвляются; в последующем язвы заживают с рубцеванием. При рецидивирующей форме заболевание может длиться десятилетиями.
Диффузно-инфильтрирующий лейшманиоз. Характеризуется выраженной инфильтрацией и утолщением кожи с большой зоной распространения вследствие слияния бугорков, близко расположенных друг к другу. Цвет кожи синюшно-красный, поверхность гладкая или бугристая, слегка шелушится. Мелкие изъязвления наблюдают лишь в исключительных случаях; они заживают с образованием едва заметных рубцов. Этот вариант кожного лейшманиоза встречают очень редко у пожилых людей.
Дифференциальная диагностика
Висцеральный лейшманиоз следует отличать от малярии, тифо-паратифозных заболеваний, бруцеллеза, амебиаза, лимфогранулематоза, лейкоза, сепсиса. При установлении диагноза используют данные эпидемиологического анамнеза, свидетельствующие о пребывании больного в эндемических очагах заболевания. При обследовании больного необходимо обратить внимание на длительную лихорадку, полилимфаденопатию, анемию, похудание, гепатолиенальный синдром со значительным увеличением селезенки.
Проявления кожного зоонозного лейшманиоза дифференцируют от похожих местных изменений при лепре, туберкулезе кожи, кожной форме рака, сифилисе, трофических язвах, саркоидозе.
При этом необходимо учесть фазность образования лейшманиомы:
- безболезненная папула;
- некротические изменения;
- язва с подрытыми краями, ободком инфильтрата и серозно-гнойным экссудатом;
- образование рубца.
Лабораторная диагностика
В гемограмме определяют признаки гипохромной анемии, лейкопению, нейтропению и относительный лимфоцитоз, анэозинофилию, тромбоцитопению, значительное повышение СОЭ. Характерны пойкилоцитоз, анизоцитоз, анизохромия, возможен агранулоцитоз. Отмечается гипергаммаглобулинемия.
При кожном лейшманиозе возбудители могут быть обнаружены в материале, полученном из бугорков или язв, при висцеральном - в мазках и толстых каплях крови, окрашенных по Романовскому-Гимзе, значительно чаще (95% положительных результатов) - в мазках пунктатов костного мозга. Культуру возбудителя (промастиготы) можно получить посевом пунктата на среду NNN.
Иногда для обнаружения лейшманий проводят биопсию лимфатических узлов, печени и селезенки.
Широко применяют серологические реакции:
- РСК;
- ИФА;
- РНИФ;
- РЛА;
- а также биологические пробы на хомячках или белых мышах.
В период реконвалесценции положительной становится кожная проба с лейшманином (реакция Монтенегро), применяемая только при эпидемиологических исследованиях.
Осложнения и исходы
Запущенный лейшманиоз могут осложнять пневмонии, гнойно-некротические процессы, нефрит, агранулоцитоз, геморрагический диатез. Прогноз тяжелых и осложненных форм висцерального лейшманиоза при несвоевременном лечении часто неблагоприятный. При легких формах возможно спонтанное выздоровление. В случаях кожного лейшманиоза прогноз для жизни благоприятный, но возможны косметические дефекты.
Лечение
При висцеральном лейшманиозе применяют препараты пятивалентной сурьмы [меглюмина антиманат (глюкантим), стибоглюконат натрия, солюсурьмин, неостибозан] в виде ежедневных внутривенных вливаний в нарастающих дозах, начиная с 0,05 г/кг. Курс лечения составляет 20-30 дней. При недостаточной клинической эффективности препаратов назначают амфотерицин В по 3 мг/кг в сутки в течение 5 дней, препарат вводят медленно внутривенно в 5% растворе глюкозы. Затем дозу препарата повторяют на 14-й и 21-й дни лечения. Патогенетическое лечение и профилактику бактериальных осложнений проводят по общеизвестным схемам.
В случаях кожного лейшманиоза на ранней стадии заболевания проводят обкалывание бугорков растворами мепакрина, мономицина, уротропина, сульфата берберина. Применяют примочки и мази:
- 2% хлориромазин;
- 1% клотримазол и др.
При сформировавшихся язвах прежде всего необходима их очистка и обработка антибиотиками для профилактики гнойной инфекции. С целью этиотропного лечения назначают внутримышечные инъекции мономицина по 250 000 ЕД (детям по 4000-5000 ЕД/кг) 3 раза в сутки, курсовая доза препарата составляет 10 млн ЕД. Можно проводить лечение аминохинолом (по 0,2 г 3 раза в день, на курс - 11-12 г препарата). При множественных поражениях показаны препараты сурьмы, как при висцеральном лейшманиозе. Применяют лазерное облучение язв. Препараты пятивалентной сурьмы и амфотерицин В назначают лишь в тяжелых случаях заболевания.
Препараты выбора:
- антимонил глюконат натрий по 20 мг/кг внутривенно или внутримышечно 1 раз в сутки курсом на 20-30 дней;
- меглумин антимониат (глюкантим) по 20-60 мг/кг глубоко внутримышечно 1 раз в сутки курсом на 20-30 сут.
При рецидиве заболевания или недостаточной эффективности лечения следует провести повторный курс инъекций в течение 40-60 дней. Эффективно дополнительное назначение аллопуринола по 20-30 мг/кг в сутки в 3 приема внутрь.
Альтернативные препараты при рецидивах заболевания и резистентности возбудителя:
- амфотерицин В по 0,5-1 мг/кг внутривенно через день;
- пентамидин внутримышечно 3-4 мг/кг 3 раза в неделю курсом на 5-25 нед.
При отсутствии эффекта химиотерапии дополнительно назначают человеческий рекомбинантный ИФН.
По показаниям проводят спленэктомию.
Эпидемиологический надзор
Включает мероприятия, аналогичные таковым при других болезнях с трансмиссивным механизмом передачи инфекции.
Профилактические мероприятия
Борьбу с животными - носителями лейшманий проводят организованно и в широких масштабах только при зоонозном кожном и висцеральном лейшманиозах. Осуществляют дератизационные мероприятия, благоустройство населенных мест, ликвидацию в них пустырей и свалок, осушение подвальных помещений, обработку инсектицидами жилых, подворных и животноводческих помещений. Рекомендовано применение репеллентов, механических средств защиты от укусов москитов.
После выявления и лечения больных людей обезвреживают источник инвазии. В небольших коллективах проводят химиопрофилактику назначением хлоридина (пириметамина) в течение эпидемического сезона. Иммунопрофилактику зоонозного кожного лейшманиоза проводят живой культурой промастигот вирулентного штамма L. major в межэпидемический период среди лиц, выезжающих в эндемичные очаги, или неиммунных лиц, проживающих в этих очагах.
Мероприятия в эпидемическом очаге
Госпитализацию больных осуществляют только по клиническим показаниям. Дезинфекцию не проводят. В отношении контактных лиц экстренную профилактику и разобщение не проводят.
БЕШЕНСТВО (RABIES)
Бешенство (водобоязнь, гидрофобия) - острая вирусная зоонозная инфекция, возникающая после попадания на поврежденную кожу слюны инфицированных плотоядных животных. Заболевание сопровождается дегенерацией нейронов головного и спинного мозга с развитием своеобразного энцефалита.
Характерны симптомы глубокого расстройства нервной системы (возбужденность, агрессивность, деменция, параличи), приводящие к летальному исходу.
Краткие исторические сведения
Впервые клиническую картину бешенства описал Авл Корнелий Цельс (I в. н.э.), он же назвал это заболевание водобоязнью. До этого было известно, что заболевание возникало у людей после укусов животных.
В 1804 г. немецкий ученый Цинке впервые выявил факт передачи бешенства через слюну в кровь. В 1885 г. Л. Пастер разработал антирабическую вакцину, полностью предохраняющую человека от развития заболевания. С 1906 г. в России начали функционировать пастеровские станции, где делали прививки против бешенства. В XIX-XX вв. В. Бабеш и А. Негри описали специфические эозинофильные включения в нейронах погибших от бешенства животных.
Этиология
Возбудитель - РНК-геномный вирус рода Lissavirus семейства Rhabdoviridae.
Он имеет палочковидную или пулевидную форму, содержит 2 Аг:
- растворимый S-Аг, общий для всех лиссавирусов;
- поверхностный V-Аг, ответственный за развитие противовирусных иммунных реакций.
Вирус образует эозинофильные тельца-включения (тельца Негри, или Бабеша-Негри) в клетках аммонова рога, коры, мозжечка и продолговатого мозга. Известно 2 варианта вируса:
- уличный (дикий), циркулирующий в природе среди животных;
- фиксированный, применяемый для изготовления вакцин против бешенства.
Фиксированный штамм получен Пастером путем многократного пассирования дикого вируса через мозг кроликов, в результате чего вирус приобрел новые свойства:
- утратил патогенность для человека;
- перестал выделяться со слюной;
- инкубационный период сократился с 15-20 до 7 сут и в последующем не изменялся.
Варианты близки по антигенному строению, поэтому вакцинация фиксированным штаммом создает невосприимчивость к уличному вирусу. Вирус культивируют путем внутримозгового заражения лабораторных животных и в культуре клеток. Возбудитель хорошо переносит низкие температуры, но быстро погибает при кипячении, высыхании, под действием УФ-лучей, этанола, 2% растворов хлорамина, лизола и карболовой кислоты.
Эпидемиология
Резервуар и источники инфекции - инфицированные животные (лисы, волки, собаки, кошки, летучие мыши, грызуны, лошади, мелкий и крупный рогатый скот). Вирус выделяется во внешнюю среду со слюной, которая становится заразной за 8-10 дней до начала заболевания.
В России отмечены очаги бешенства 3 типов:
- природные очаги, в которых циркуляция вируса происходит в популяции красной лисицы, передаваясь волкам, енотовидным собакам, барсукам и др.;
- природные полярные, или арктические, очаги, где вирус существует в популяции песцов, передаваясь леммингам и др.;
- антропургические очаги, где вирус циркулирует в популяции бродячих собак, передаваясь кошкам и сельскохозяйственным животным.
Больной человек в естественных условиях эпидемиологической опасности не представляет. Описаны внутрибольничные случаи заражения, связанные с пересадкой роговицы глаза умерших от бешенства людей.
Механизм передачи - контактный, заражение человека обычно происходит при укусах, реже при ослюнении больными бешенством животными. В последние годы доказано, что помимо контактного возможны аэрогенный (в пещерах, населенных летучими мышами, внутрилабораторные заражения), алиментарный и трансплацентарный пути передачи вируса.
Естественная восприимчивость людей
Естественная восприимчивость людей, по-видимому, не всеобщая и во многом определяется тяжестью нанесенных повреждений и локализацией укуса. В среднем при укусах в лицо и шею заведомо бешеными животными бешенство развивается в 90% случаев, при укусах в кисти рук - в 63%, а при укусах в проксимальные отделы рук и ног - лишь в 23% случаев.
Основные эпидемиологические признаки
Бешенство регистрируют на всех континентах, исключая Австралию и Антарктиду. Некоторые островные государства (Великобритания, Мальта, Австралия, Япония, Новая Зеландия) практически свободны от бешенства благодаря строгим карантинным мерам для ввозимых собак, кошек и других животных. В мире ежегодно более 50 000 человек умирают от бешенства, из них около 60% не обращались за медицинской помощью. Заболеваемость бешенством в России имеет неравномерное территориальное распространение. Ежегодно регистрируют от 5 до 12 случаев заболевания бешенством среди людей.
В 2007 г. зарегистрировано 8 случаев заболевания людей бешенством:
- Воронежская область - 2 случая,
- Курская область - 1;
- Мурманская область - 1;
- Чеченская Республика - 1;
- Удмуртская Республика - 1;
- Ростовская область - 1;
- Саратовская область - 1, показатель на 100 000 населения - 0,01. Случаев заболевания детей не зарегистрировано. Среди заболевших в 5 случаях - жители сельской местности. Выделяют природные и антропургические очаги бешенства. Эпизоотии бешенства выявлены на территории 20 субъектов Федерации. В целом около 1/3 случаев заболевания связаны с заражением от диких животных (чаще всего лисы и волки) и более 70% - от домашних животных. За медицинской помощью по поводу укусов животными обращаются 300 000-450 000 человек. В 2007 г. пострадало 418 708 человек, с 3 летальными исходами, показатель на 100 000 населения - 293,9; в том числе детей до
17 лет - 119 927 случаев, с 1 летальным исходом, показатель - 436,5. Всего пострадало людей на 2,5% больше, чем в 2006 г., в том числе детей - на 19%.
В возрастной структуре пострадавших дети составляют 28,64%. Городские жители среди пострадавших составляют 77%.
Среди пострадавших от укусов животных зарегистрированы дети всех возрастов:
- дети до 1 года - 696 случаев, показатель - 47,8;
- от 1 года до 2 лет - 7598 случаев, показатель - 258,98;
- от 3 до 6 лет - 26 212 случаев, показатель - 496,9;
- до 14 лет - 101 310 случаев, показатель - 481,0.
Количество неблагополучных пунктов в стране составило в 2007 г. 4562, а число лабораторно подтвержденных случаев бешенства среди животных - 5503. Помимо огромной социальной значимости, бешенство имеет и серьезное экономическое значение. Экономический ущерб от бешенства животных и смертности людей от этой инфекции определяется затратами на оказание медицинской помощи людям и потерями от заболеваний, падежа и вынужденного забоя сельскохозяйственных животных, а также расходами на борьбу с безнадзорными животными и регуляцию численности диких животных - источников инфекции для человека. Затраты на вакцинацию диких и сельскохозяйственных животных ежегодно превышают 15 млн руб. Ежегодные затраты, связанные с применением импортного антирабического иммуноглобулина человека, составляют десятки миллионов рублей. На ликвидацию очагов бешенства затрачивается около 8-9 млн руб. Ощутимы и другие прямые и косвенные потери.
Заболевания бешенством становятся следствием позднего обращения укушенных за медицинской помощью, нарушения режима во время прививок или незавершенности цикла иммунизации. Жители сельских районов болеют значительно чаще, чем горожане. Среди заболевших практически отсутствуют дети раннего возраста и, напротив, преобладают лица активного возраста. Большинство заболевших мужчины. Летне-осенняя сезонность связана с увеличением контактов с бродячими и дикими животными в это время.
Преобладают повреждения опасной локализации:
- лицо;
- голова;
- пальцы рук и кисти.
Патогенез
Возбудитель проникает в организм человека через поврежденные кожный покров и слизистые оболочки от зараженных животных при укусе или ослюнении. Центростремительно по периневральным пространствам и нервным волокнам вирус бешенства попадает в спинной и головной мозг. Возможны гематогенный и лимфогенный пути распространения возбудителя в организме.
Вирус способен избирательно связываться с ацетилхолиновыми рецепторами, что объясняет селективное поражение различных групп нейронов с последующей репродукцией вируса, что приводит к повышению рефлекторной возбудимости, а затем к развитию параличей. В головном мозге формируются отек, кровоизлияния, дегенеративные и некротические изменения. Процесс захватывает кору головного мозга, мозжечок, зрительный бугор, подбугорную область, ядра черепных нервов. Аналогичные изменения развиваются в сред-
нем мозге, базальных ганглиях и в мосту мозга, в поясничной части спинного мозга. Максимальные поражения наблюдают в области IV желудочка. С изменениями в ЦНС связаны судорожные сокращения дыхательных и глотательных мышц, повышение отделения слюны и пота, дыхательные и сердечнососудистые расстройства. В цитоплазме клеток мозга обнаруживают эозинофильные включения (тельца Бабеша-Негри).
В дальнейшем из ЦНС вирус попадает в различные органы и системы:
- скелетные мышцы;
- сердце;
- легкие;
- печень;
- почки;
- надпочечники.
Проникая в слюнные железы, вирус выделяется со слюной.
Клиническая картина
Инкубационный период
Длительность зависит от места укуса или ослюнения. Если входные ворота инфекции локализуются на лице или голове, инкубационный период укорачивается (в среднем от 2 нед до 1 мес). Наиболее длительным он бывает при поражении нижних конечностей (от 1-3 мес до 1 года).
В клинической картине выделяют 3 периода:
- начальный (депрессивный);
- возбуждения;
- период параличей.
Начальный период (период депрессии)
Характерно постепенное развитие заболевания, что существенно затрудняет диагностику, так как к этому времени факт укуса или ослюнения животным больной часто забывает. Только в некоторых случаях могут появляться предвестники заболевания, выражающиеся тянущими болями, жжением и зудом в месте уже давно зажившей раны. В еще более редких случаях в месте укуса вновь появляются краснота и отечность. Температура тела нормальная или субфебрильная. Обращает на себя внимание изменение психики больного. Он подавлен, замкнут, иногда раздражителен, отказывается от еды, жалуется на общее недомогание, головную боль, плохой сон со сновидениями устрашающего характера. Появляются апатия, угнетенность, чувство страха и тревоги, боязнь смерти. В некоторых случаях больные отмечают чувство стеснения в груди, возможны диспепсические симптомы (чаще запоры).
Период возбуждения (стадия разгара заболевания)
Сменяет через 2-3 сут период депрессии.
Характерны субфебрильная температура тела, общее возбуждение, развитие типичных симптомов:
- гидрофобии;
- аэрофобии;
- акустофобии;
- фотофобии.
Гидрофобия проявляется болезненным спазмом мускулатуры глотки и гортани при попытке выпить воды. Если больному дать стакан воды, он жадно хва-
тает его, но как только подносит ко рту, у него приостанавливается дыхание, он синеет и с криком отбрасывает стакан. Однако эти реакции возникают не во всех случаях бешенства, иногда больной в состоянии пить воду, что уводит врача от правильного диагноза. Впоследствии при формировании стойкого рефлекса аналогичные спазмы возникают при виде и шуме текущей воды и даже при слове вода. Больной страдает от жажды, но даже при воспоминании о воде могут возникнуть мучительные спазмы дыхательной мускулатуры. Аэрофобия, акустофобия, фотофобия - провоцирование пароксизмов даже легким движением воздуха, шумом, ярким светом. Пароксизмы длятся несколько секунд и сопровождаются мучительными судорогами лицевых мышц, выражением ужаса на лице, расширением зрачков. Больной с криком откидывает голову назад, его руки дрожат. Дыхание учащается, становится свистящим, неровным, с глубокими шумными вдохами. Возникает чувство стеснения в груди, в акт дыхания вовлекаются мышцы плечевого пояса. Больной возбужден, агрессивен, кричит и мечется в отчаянии, может ударить, укусить или плюнуть на окружающих. Из-за сильного слюнотечения он постоянно сплевывает.
Приступы возбуждения во второй период болезни учащаются, следуют друг за другом. Больной худеет, отмечают повышенное потоотделение. Развиваются слуховые, зрительные и обонятельные галлюцинации. Сознание, как правило, сохранено и становится спутанным лишь к концу заболевания. Второй период болезни длится 2-3 дня, редко до 6 сут.
Паралитический период
Заключительный период заболевания. Возбуждение сменяет апатия (зловещее успокоение). Снижаются двигательные и чувствительные функции. Приступы судорог, гидрофобия, аэрофобия и другие проявления предыдущего периода могут исчезнуть. Создается впечатление о наступлении улучшения состояния больного. Однако на этом фоне очень быстро нарастает температура до высоких цифр, учащаются сердечные сокращения, падает АД, развиваются параличи конечностей и черепных нервов. Через 12-24 ч наступает смерть от паралича дыхательного и сердечно-сосудистого центров.
Длительность паралитического периода варьирует от 1 до 3 дней.
В качестве вариантов течения выделяют бульбарную форму с выраженными симптомами поражения продолговатого мозга, паралитическую (сразу начинается с параличей, иногда типа Ландри) и мозжечковую с выраженными мозжечковыми расстройствами.
Дифференциальная диагностика
Бешенство следует отличать от полиомиелита, парезов и параличей другой этиологии, столбняка, энцефалитов, ботулизма, истерии и алкогольного делирия. Большое значение в постановке правильного диагноза имеют анамнестические сведения об укусе или ослюнении животным, которое погибло или исчезло.
Наиболее демонстративные клинические признаки заболевания:
- гидрофобия;
- аэрофобия;
- акустофобия;
- фотофобия;
- усиленное слюноотделение.
Лабораторная диагностика
Принципиально возможно при жизни больного выделение вируса из слюны или спинномозговой жидкости, а также постановка реакции флюоресцирующих АТ на отпечатках с роговицы или биоптатах кожи. Однако в клинической практике это трудновыполнимо и диагноз основывают на клинических проявлениях заболевания. Методом ретроспективной диагностики служит гистологическое исследование срезов головного мозга умершего для обнаружения телец Бабеша-Негри. Для выделения вируса используют мышейсосунков, которых заражают интрацеребрально исследуемым материалом и наблюдают не менее 28 дней. Гибель животных через 6-7 дней позволяет предположить вирус бешенства.
Лечение
После появления клинических симптомов спасти больных не удается. Пациентов помещают в затемненную звукоизолированную палату, применяют мероприятия и средства, облегчающие состояние больного. Вводят повторно пантопон, аминазин, димедрол, хлоралгидрат в клизмах, курареподобные препараты. При дыхательных расстройствах показаны трахеотомия и ИВЛ. Этиотропное лечение не разработано.
Эпидемиологический надзор
Включает организацию и проведение эпизоотолого-эпидемиологического надзора, предусматривающего систему сбора, анализа и обмена информацией о случаях бешенства среди животных и людей, противоэпидемических и противоэпизоотических мероприятиях на определенных территориях, которые служат основой для контроля эпидемиологической ситуации. Необходимо обеспечить четкую работу лабораторной службы, обеспечивающую быструю и эффективную диагностику бешенства у животных и людей.
Эпидемиологический надзор - основа любой программы борьбы с бешенством - включает в себя:
- своевременное качественное обследование очага и выявление пострадавших немедленно по получении экстренного извещения;
- проведение регулярного анализа подачи экстренных извещений травматологическими (хирургическими) пунктами и отделениями;
- подготовку врачей-травматологов (хирургов) по оказанию антирабической помощи населению.
Профилактические мероприятия
Включают систематическую плановую борьбу с бешенством среди животных на основе массовых предохранительных прививок, уничтожение бешеных и бродячих собак, правильное содержание домашних животных и кошек, контроль перевозок домашних животных как в масштабах страны, так и на международном уровне. Порядок содержания, регистрации и учета собак и кошек в населенных пунктах определяет местная администрация.
При организации мероприятий по профилактике и борьбе с бешенством следует различать:
- эпизоотический очаг (квартиры, жилые дома, личные подворья граждан, животноводческие помещения, скотобазы, летние лагеря, участки пастбищ, лесных массивов и другие объекты, где обнаружены больные бешенством животные);
- неблагополучный пункт (населенный пункт или часть крупного населенного пункта, отдельная животноводческая ферма, пастбище, лесной массив, на территории которых был выявлен эпизоотический очаг бешенства);
- угрожаемую зону (населенные пункты, животноводческие хозяйства, пастбище, охотничьи угодья и другие территории, где существует угроза заноса бешенства или активизации природных очагов болезни);
- эпидемический очаг (эпизоотический очаг бешенства, в котором возникли заболевания людей).
Важные организационно-хозяйственные мероприятия по профилактике бешенства:
- система учета собак и кошек;
- организация выгулов собак;
- отлов и стерилизация (в крайнем случае, уничтожение) бродячих собак и кошек;
- утилизация трупов животных и пищевых отходов;
- значительное увеличение охвата вакцинацией собак и кошек, особенно в стойких природных очагах инфекции;
- разработка новых правил содержания собак и кошек в населенных пунктах России;
- учет и оптимизация численности диких хищников - резервуара и источника распространения вируса бешенства;
- регуляция численности диких грызунов - прокормителей диких хищников;
- изучение и выявление природных резервуаров вируса бешенства;
- вакцинация диких хищников против бешенства;
- профилактическая вакцинация людей, подверженных повышенному риску заражения бешенством;
- расширение деятельности по гигиеническому воспитанию среди населения;
- составление кадастра бешенства в России.
Необходимо проводить гигиеническое воспитание среди населения о мерах профилактики бешенства у животных и людей. Для предупреждения заражения бешенством среди лиц определенных профессий (собаколовы, сотрудники ветеринарных диагностических лабораторий, охотники и др.) проводят курс профилактической иммунизации, который состоит из 3 внутримышечных введений вакцины в толщу дельтовидной мышцы плеча в дозе 5 мл. Однократную повторную иммунизацию рекомендуют через 1 год и далее каждые 3 года, если человек продолжает пребывать в зоне высокого риска.
При укусах, царапинах и ослюнении животными людей необходимо в течение 10 мин обильно промыть раны водой с мылом, обработать края раны 40-70° спиртом или йодной настойкой, наложить стерильную повязку. Пострадавших немедленно направляют в травматологический пункт (кабинет), а при его отсутствии - в хирургический кабинет для назначения и проведения курса антирабической вакцинации.
Для активной иммунопрофилактики применяют:
- сухую инактивированную культуральную антирабическую вакцину рабивак-Внуково-32;
- сухую инактивированную концентрированную очищенную культуральную антирабическую вакцину;
- антирабический иммуноглобулин.
Существуют подробные схемы лечебно-профилактической иммунизации для каждой вакцины, учитывающие тяжесть укуса и характер контакта с животными (ослюнение, оцарапание и др.), данные о животном и др. Вакцинация против бешенства эффективна лишь при начале курса не позднее 14-го дня от момента укуса. Различают антирабические прививки по безусловным и условным показаниям. По безусловным показаниям прививки проводят при укусах явно бешеных животных, а также при отсутствии сведений об укусившем животном. Прививки по условным показаниям проводят при укусе животным без признаков бешенства и при возможности наблюдать за животным в течение 10 дней.
Конкретные показания к антирабическим прививкам:
- при всех укусах, царапинах, ослюнении кожного покрова и слизистых оболочек, нанесенных явно бешеными, подозрительными на бешенство и неизвестными животными;
- при ранении предметами, загрязненными слюной или мозгом бешеных или подозрительных на бешенство животных (вскрытие трупов, разделка туш и др.);
- при укусах через одежду, если она проколота или разорвана зубами;
- при укусах через тонкую или вязаную одежду;
- при укусах, ослюнении и нанесении царапин здоровым в момент контакта животным, если оно в течение 10 дней наблюдения заболело, погибло или исчезло;
- при укусах дикими грызунами;
- при явном ослюнении или повреждении кожного покрова больным бешенством человеком.
При укусах любой тяжести, нанесенных здоровыми животными, при неблагоприятных данных начинают иммунизацию и 10-дневное ветеринарное наблюдение за животными.
Прививки не проводят:
- при укусах через неповрежденную плотную или многослойную одежду;
- при ранении нехищными птицами;
- при укусах домашними мышами и крысами в местностях, где бешенство не регистрировалось последние 2 года;
- при случайном употреблении молока или не обработанного термически мяса больных бешенством животных;
- если в течение 10 дней после укуса, ослюнения или нанесения царапины животное осталось здоровым;
- при укусе, ослюнении или нанесении царапины животным за 10 дней и более до их заболевания;
- при ослюнении и укусах легкой и средней тяжести, нанесенных здоровыми в момент укуса животными, при благоприятных данных (эпизоотическое благополучие местности, изолированное содержание, укус спровоцирован пострадавшим, собака вакцинирована про-
тив бешенства); однако в этом случае за животными устанавливают 10-дневное ветеринарное наблюдение, с тем чтобы немедленно начать прививки в случае проявления у него признаков бешенства, а также гибели или исчезновения;
- при спровоцированном ослюнении неповрежденного кожного покрова неизвестным домашним животным в местностях, стойко благополучных по бешенству;
- в случаях контакта с больным бешенством человеком, если не было явного ослюнения слизистых оболочек или повреждения кожного покрова.
Лицам, заболевшим гидрофобией, антирабические прививки не проводят.
Защитный уровень АТ формируется не ранее 12-14 дней после прививки, поэтому при подозрении на короткий инкубационный период (обширные поражения мягких тканей, локализация укуса, близкая к головному мозгу) проводят активно-пассивную защиту пострадавшего. В этих случаях помимо вакцины вводят и антирабический иммуноглобулин.
Применяют 2 вида иммуноглобулинов:
- гомологичный (человеческий);
- гетерологичный (лошадиный).
Профилактической вакцинацией против бешенства в 2007 г. было охвачено 21 550 человек, что на 23,6% больше, чем в 2006 г., ревакцинировано - 11 673 человек, что на 1,38% больше, чем в предыдущий года.
Мероприятия в эпидемическом очаге
Больного изолируют в отдельную палату. Обслуживающий персонал должен работать в защитной одежде, исключающей ослюнение кожи и слизистых оболочек. При попадании на них слюны больного показана экстренная профилактика антирабическими препаратами. Проводят текущую и заключительную дезинфекцию. Экстренную профилактику проводят лицам, у которых установлен факт попадания инфицированной вирусом бешенства слюны на кожу или слизистые оболочки, а также контакта с больным или подозреваемым на бешенство животным.
Диспансерное наблюдение за переболевшим не регламентировано, так как случаи выздоровления неизвестны.
ЭРИЗИПЕЛОИД
(ERYSIPELOID)
Эризипелоид - бактериальная зоонозная инфекция с умеренными общетоксическими признаками, поражением кожи и суставов (преимущественно кистей рук).
Краткие исторические сведения
Возбудитель эризипелоида впервые был выделен от мышей (Кох Р., 1878) и свиней (Пастер Л., 1892). Заболевание у человека впервые описал У. Бейкер (1873). А. Розенбах (1909) выделил возбудителя из организма больного человека, определил заболевание как самостоятельную нозологическую форму и дал ему название «эризипелоид» (рожа свиней, эризипелоид Розенбаха).
Этиология
Возбудитель - грамположительная неподвижная неспорообразующая палочка Erysipelothrix rhusiopathiae семейства Corynebacteriaceae. Известно несколько сероваров возбудителя, выделенных у теплокровных животных, птиц, рыб и моллюсков, основными из них считают свиной (suis) и мышиный ( murisepticum), циркулирующие соответственно среди домашних и диких животных. Бактерии неприхотливы и растут на обычных питательных средах.
Основные факторы патогенности возбудителя:
- продукция нейраминидазы и гиалуронидазы при проникновении в кожу;
- капсульные факторы, защищающие бактерии от фагоцитоза и способствующие их длительной персистенции внутри макрофагов.
E. rhusiopathiae высокоустойчив во внешней среде:
- в трупах животных может сохраняться, а иногда и размножаться в течение 3-4 мес;
- в воде - несколько дней.
Соление и копчение мяса не убивают возбудитель, при варке куска мяса толщиной 10 см бактерии погибают только через 2,5 ч. Чувствителен к воздействию 1% раствора хлорной извести, 3% раствора лизола.
Эпидемиология
Резервуар и источники инфекции - многие виды животных (свиньи, овцы, крупный рогатый скот, собаки, куры, утки, грызуны, рыбы, раки и др.), которые сохраняют возбудителя неопределенно долго. Наиболее частый источник - свиньи, у которых заболевание протекает в острой форме. Определенную роль в распространении инфекции могут играть мыши и крысы, загрязняющие мясные туши на мясокомбинатах и в процессе их хранения. Больной человек не представляет опасности для окружающих.
Механизм передачи - контактный. Человек заражается при попадании возбудителя на поврежденную кожу рук. Среди животных реализуется фекальнооральный механизм передачи. Больные животные выделяют возбудитель с мочой и испражнениями, инфицируя окружающую среду и различные предметы. Факторами передачи служат шкура и мясо больных животных, контаминированное возбудителем сено, почва, вода.
Естественная восприимчивость людей
Естественная восприимчивость людей невысокая.
Основные эпидемиологические признаки
Заболевание распространено повсеместно и довольно часто связано с профессией. Чаще болеют мясники, повара, охотники, животноводы, рыбаки, домашние хозяйки. Обычно регистрируют спорадические случаи, хотя описаны и вспышки болезни. Отмечают летне-осеннюю сезонность.
Патогенез
Возбудитель проникает в организм человека через микротравмы кожи, чаще всего пальцев рук. В области ворот инфекции развивается очаг воспаления в дерме с захватом межфаланговых суставов. Генерализованные формы заболе-
вания наблюдают редко, при употреблении контаминированных продуктов. При этом происходит диссеминирование бактерий по лимфатическим и кровеносным сосудам, возникновение распространенных поражений кожи и формирование вторичных очагов инфекции во внутренних органах. В области пораженных участков кожи развивается серозное воспаление с периваскулярной лимфоцитарной инфильтрацией, нарушениями микроциркуляции и оттока лимфы. Механизмы хронизации эризипелоида изучены недостаточно.
Клиническая картина
Инкубационный период
Варьирует от 1 до 7 дней.
Различают следующие клинические формы эризипелоида:
- кожную локализованную;
- кожную распространенную;
- генерализованную (септическую).
Кожная локализованная форма
Наиболее частая форма заболевания. На фоне нормальной или субфебрильной температуры тела и слабых проявлений других признаков интоксикации в месте входных ворот инфекции возникают жжение и зуд, затем появляется эритема. Наиболее часто она локализуется на коже пальцев или кистей рук (см. рис. 37 доп. илл.). Эритема неяркая, с цианотичным оттенком, более бледная в центре и с отеком по периферии. Постепенно увеличиваясь в размерах, она может захватить кожу всего пальца; на фоне эритемы иногда появляются везикулы с серозным или серозно-геморрагическим содержимым. Температура кожи в области пораженного участка нормальная или слегка повышена, болезненные ощущения минимальны. В одной трети случаев развиваются признаки регионарного лимфангита и лимфаденита. Даже при отсутствии специфического лечения в динамике заболевания эритема бледнеет, на ее месте возникает шелушение кожи, исчезает периферический отек. Кожная форма заболевания длится в среднем около 10 дней, рецидивы наблюдают не более чем в 1% случаев.
Кожная распространенная форма
Встречается реже, чем локализованная. Из первичного очага в области пальцев рук эритема может распространиться на кисть или предплечье. При этом формируются более крупные буллезные элементы, развивается выраженная интоксикация. При сосудистой диссеминации возбудителя возможно появление характерных участков эритемы на коже туловища, нижних конечностях. Нередко заболевание принимает рецидивирующее течение.
При кожных формах эризипелоида возможно одновременное развитие эритемы и артритов (чаще регионарных межфаланговых суставов). Артриты проявляются веретенообразной припухлостью суставов, болезненностью, ограничением движений в них. Обычно заболевание длится около 2 нед, но в некоторых случаях может развиться хронический рецидивирующий артрит с деформацией сустава.
Генерализованная (септическая) форма
Наблюдают крайне редко, в мире известны всего около 200 случаев. Характерны высокая и длительная лихорадка, выраженные симптомы интоксика-
ции, развитие гепатолиенального синдрома и появление крупнопятнистой или эритематозной сыпи на различных участках кожи. Возможны артриты, менингит, пневмония, эндокардит и другие вторичные очаговые проявления инфекции. Генерализованная форма эризипелоида в большинстве случаев возникает у больных с тяжелыми соматическими процессами или на фоне выраженной иммуносупрессии. Отмечена определенная связь заболевания с употреблением контаминированных морепродуктов.
Дифференциальная диагностика
Заболевание следует отличать от рожистого воспаления, артритов различной этиологии, панарициев, экссудативной полиморфной эритемы, различных дерматитов, в тяжелых случаях - от сепсиса. Для кожных форм эризипелоида характерны слабые проявления интоксикации, неяркая, с цианотичным оттенком эритема, более бледная в центре с отеком по периферии, наиболее часто локализующаяся на коже пальцев или кистях рук. Возможно одновременное развитие эритемы и артритов регионарных межфаланговых суставов.
Лабораторная диагностика
Возбудитель заболевания может быть выделен из крови при генерализованной инфекции, реже из везикул, образовавшихся при кожной форме на фоне эритемы. Исследуемый материал засевают на желчный, слабощелочной мясопептонный бульоны или на кровяной агар. Применяют серологические методы - РА, РНГА, ИФА, а также биологическую пробу на белых мышах. В большинстве случаев специальные методы исследования при эризипелоиде практически не применяют, а диагноз устанавливают на основе клиникоэпидемиологических данных.
Осложнения и исходы
При генерализованной форме эризипелоида возможны менингиты, пневмонии. Очень часто (до 90% случаев) развивается эндокардит с высокой летальностью (до 40%).
Лечение
В нетяжелых случаях проводят амбулаторное лечение, при генерализованных формах показана госпитализация больных. Основу лечения составляют этиотропные средства. Препарат 1-го ряда - бензилпенициллин (6-12 млн ЕД в сутки и более), препарат 2-го ряда - доксициклин (в 1-е сутки 0,2 г, в последующем по 0,1 г в сутки). В качестве альтернативных средств могут быть использованы макролиды, цефалоспорины 1-го и 2-го поколений. Курс антибактериального лечения составляет 7-10 дней. При генерализованных формах возможно назначение имипенема по 0,5 г 4 раза в сутки, цефтриаксона по 2 г в сутки или ципрофлоксацина по 400 мг 2 раза в сутки внутривенно, курсом от 2 до 4 нед.
По показаниям назначают дезинтоксикационные, антигистаминные, противовоспалительные средства, примочки с антисептиками в области воспалительного очага, физиотерапевтические процедуры. Для профилактики рецидивов проводят внутримышечные инъекции ретарпена или экстенциллина по 2,5 млн ЕД 1 раз в 3 нед курсом на 6-12 мес.
Профилактические мероприятия
Большое значение имеют профилактика эризипелоида среди домашних животных (выявление, изоляция, лечение, вакцинация), контроль за забоем скота, обработкой мяса, снятием шкур, соблюдение мер личной профилактики при уходе за животными, разделке туш и т.д. Меры иммунопрофилактики человека не разработаны.
Мероприятия в эпидемическом очаге
Специальных мероприятий не проводят. При ранении кожи в условиях контакта с заведомо больным животным рекомендованы обработка раны и экстренная профилактика пенициллином.
ЯЩУР (APHTAE EPIZOOTICAE)
Ящур - острая зоонозная антропургическая вирусная инфекция со специфическим везикулезно-эрозивным поражением слизистых оболочек и кожного покрова, а также с синдромом интоксикации.
Краткие исторические сведения
Первое клиническое описание ящура у животных сделал Д. Фракасторо (1546). У человека заболевание стало известно лишь через 200 лет с лишним (1764). Вирусная природа болезни предположена Ф. Леффлером и П. Фрошем (1897) и впоследствии окончательно доказана.
Этиология
Возбудитель заболевания - РНК-геномный вирус рода Aphtovirus семейства Picornaviridae. Выделяют 7 серотипов вируса (А, О, С, САТ1, САТ2, САТ3, Азия), из которых в РФ наиболее распространены типы А и О. Каждый из серотипов включает множество субтипов (вариантов). Вирус отличают высокая вирулентность и тропизм к кожному покрову и слизистым оболочкам. Все типы и варианты возбудителя вызывают заболевания с одинаковой клинической картиной. Культивирование вируса возможно на развивающихся куриных эмбрионах и культурах тканей крупного рогатого скота, овец и свиней.
Вирус ящура устойчив во внешней среде:
- на шерсти животных сохраняется до 4 нед;
- на одежде - до 3,5 нед.
Низкие температуры и высушивание не уничтожают вирус, но он быстро гибнет при нагревании, воздействии УФ-лучей и дезинфицирующих растворов. Особенного внимания заслуживает выживаемость вируса в молоке, мясе, молочных и мясных продуктах. При пастеризации молока вирус теряет жизнеспособность через 30 мин, а при температуре кипения - через 5 мин. При комнатной температуре в засоленных и сохраняемых в рассоле продуктах вирус выживает до 50 дней. Вирус ящура, как и другие мелкие РНК-вирусы, устойчив к жирорастворимым веществам (эфир, хлороформ), к 0,5-1% раствору карболовой кислоты, 2-3% раствору креолина, 13% раствору лизола. В качестве дезинфицирующих средств рекомендуют 1% раствор формалина, 2% раствор щелочей, 1% окись этилена. Вирус отнесен ко 2-й группе патогенности.
Эпидемиология
Резервуар и источники инфекции - дикие и домашние копытные животные. Многие виды грызунов чувствительны к вирусу ящура, но в распространении инфекции они значения не имеют. Птицы резистентны к вирусу ящура, однако их рассматривают как механических распространителей инфекции в процессе миграций. Больные животные (чаще всего крупный рогатый скот) выделяют вирус во внешнюю среду со слюной, молоком, испражнениями, мочой. Заразными могут быть также кровь и мясо забитых животных. Животные заразны на протяжении всей болезни. Человек эпидемиологической опасности не представляет.
Механизм передачи - контактный, при попадании возбудителя на поврежденные кожный покров или слизистые оболочки. Факторами передачи могут служить загрязненные вирусом подстилки, навоз, предметы ухода за животными. Так как вирус ящура устойчив во внешней среде, он может заноситься в хозяйства, находящиеся вдали от неблагополучных районов, с фуражом, водой, предметами ухода за животными, молочными продуктами, овощами, а также шерстью, щетиной, шкурами животных, предназначенными для обработки. Возможен пищевой путь инфицирования через мясные и молочные продукты от больных животных. Нельзя исключить и возможность воздушно-пылевого инфицирования.
Естественная восприимчивость людей
Естественная восприимчивость людей невысокая, постинфекционный иммунитет типоспецифический и сохраняется до полутора лет.
Основные эпидемиологические признаки
Болезнь наблюдают повсеместно. Заболевания среди животных встречают в виде эпизоотий, среди людей регистрируют спорадические случаи. Заболеваемость связана с профессией, чаще болеют работники животноводства (доярки, пастухи и др.), ветеринарный и зоотехнический персонал, рабочие мясокомбинатов, боен, предприятий по переработке животного сырья. В быту чаще болеют дети, обычно заражающиеся через молоко и молочные продукты.
Патогенез
Возбудитель проникает в организм человека через слизистые оболочки ротовой полости, реже дыхательных путей, ЖКТ, конъюнктиву, а также через поврежденный кожный покров. В области входных ворот происходит адгезия вируса на эпителиальных клетках, внедрение и репликация в них с последующей первичной виремией инкубационного периода. Возбудитель обладает прямым цитопатическим действием на пораженные клетки. В начальном периоде заболевания возникает первичный аффект в виде афты - пузырька с прозрачным, а позже мутным содержимым, в котором происходит размножение и накопление вируса. Последующая виремия, развивающаяся в начальном периоде и в периоде разгара заболевания, обусловливает гематогенное диссеминирование возбудителя в организме, инфицирование эпителиоцитов и клеток СМФ, выработку ими медиаторов воспаления, развитие интоксикации. Вирус фиксируется на эпителии слизистых оболочек ротовой полости, носа, уретры, кожного покрова кистей и стоп с формированием вторичных везикул и афт. При недостаточности иммунных защитных реакций возможно распространение инфекции на эпителий желудка, кишечника, половых органов, миокарда.
В периоде реконвалесценции при формировании типоспецифического иммунитета виремия уменьшается и прекращается, происходит заживление афт без образования рубцов.
Патоморфологические изменения при ящуре характеризует развитие участков некрозов кожи и слизистых оболочек, гнойно-некротических процессов в трахее, бронхах, уретре, венозное полнокровие печени, почек и мозга, выраженные нарушения в миокарде.
Клиническая картина
Инкубационный период варьирует от 2 до 12 дней, чаще всего 3-4 сут.
Острое, часто внезапное начало заболевания проявляется ознобом, подъемом температуры тела до высоких цифр, головной болью и миалгиями, особенно в области поясницы. Уже к концу 1-х суток возникают жжение во рту, сильное слюнотечение, иногда боли при мочеиспускании (при поражении уретры) и диарея. При осмотре больного отмечают гиперемию конъюнктив, увеличение и болезненность регионарных лимфатических узлов, резкую гиперемию и отечность слизистой оболочки ротовой полости, на которой располагаются множественные пузырьки (афты) размером 1-3 мм, наполненные прозрачным или мутным содержимым. Наибольшее их число локализуется на краях и кончике языка, который также становится отечным. Приблизительно через 1 сут пузырьки лопаются, на их месте образуются болезненные эрозии. Множественные эрозии могут сливаться между собой с образованием обширных эрозированных участков, что при современном течении заболевания наблюдают редко.
В этих случаях значительно затрудняются жевание, глотание и речь, нарастает слюноотделение вплоть до истечения слюны струей. Больной становится раздражительным, выражение лица страдальческое, губы припухшие, в корочках и язвах, глаза красные. Иногда такие же афты появляются на слизистой оболочке носа, конъюнктивах, коже вокруг рта и носа, в межпальцевых складках, около ногтей, на подошвах. Реже афты развиваются на коже лица и предплечий. Вместе с тем известны случаи легкого течения ящура только с кожными поражениями, например на руках.
У детей заболевание протекает тяжелее, чем у взрослых, часто сопровождается признаками гастроэнтерита.
В редких случаях при алиментарном пути заражения возможно развитие гастроэнтерита с лихорадкой, болями в животе, тошнотой и рвотой, жидким стулом с примесью крови в испражнениях. При аэрогенном заражении воспалительный афтозный процесс развивается на слизистой оболочке трахеи и бронхов.
Через 4-5 дней язвочки эпителизируются, нормализуется температура тела. Выздоровление затягивается на 10-15 сут, а при сочетанных афтозных поражениях слизистых оболочек и кожи - до 1 мес и более. Возможно длительное течение заболевания (до 1-1,5 года) с периодически возникающими повторными везикулезными высыпаниями.
Дифференциальная диагностика
У человека ящур следует отличать от афтозных стоматитов различной этиологии, герпангины, ветряной оспы. Ящур отличают острое начало заболевания с ознобом и высокой лихорадкой, на фоне которых возникают жжение во рту,
сильное слюнотечение, резкая гиперемия и отечность слизистой оболочки рта с локализацией на ней мелких афт с прозрачным или мутным содержимым, при их разрыве образуются эрозии. Глотание и речь затруднены, нарастает слюноотделение. Афты могут появляться также на слизистой оболочке носа, уретры, конъюнктиве, коже вокруг рта и носа, в межпальцевых складках, около ногтей. Следует учитывать данные эпиданамнеза:
- употребление некипяченого молока;
- уход за больными животными;
- контакт с сельскохозяйственной и животноводческой продукцией.
Лабораторная диагностика
Вирус можно выделить из афтозных элементов, крови, слюны, фекалий, но из-за сложности проведения вирусологические исследования в клинической практике не применяют. Основу серологической диагностики составляют ИФА, РСК и РНГА при постановке реакций с парными сыворотками, взятыми с интервалом 7-8 дней. Также возможна постановка биологической пробы втиранием афтозного содержимого, крови, мочи, кала и слюны, взятых от больного ящуром, в подушечки лапок морских свинок. На месте втирания появляются афты. В последнее время методом выбора при лабораторной диагностике ящура признана высокочувствительная и специфичная ПЦР.
Осложнения и исход
Осложнения (пневмонии, миокардит, сепсис и др.) возникают редко, они связаны с возможностью развития вторичной инфекции при проникновении возбудителей через изъязвления на слизистых оболочках и коже.
Лечение
Больных госпитализируют. Этиотропное лечение не разработано, главные лечебные мероприятия направлены на уход за полостью рта и кожным покровом. Применяют средства местного действия, проводят дезинтоксикационное и симптоматическое лечение. Пища больных должна быть полужидкой, нераздражающей, легкоусвояемой. Перед приемом пищи можно дать пациенту 0,1 г анестезина. Применяют 0,5% оксолиновую, 0,5% флореналевую и (или) 50% интерфероновую мазь. Рекомендуют местное лазерное облучение и УФО, ускоряющие эпителизацию эрозий. По показаниям назначают болеутоляющие средства, сердечно-сосудистые, антигистаминные препараты, витамины. В необходимых случаях больного кормят через зонд или парентерально.
Эпидемиологический надзор
Аналогичен таковому при сибирской язве.
Профилактические мероприятия
Основу составляет профилактика заболеваний среди домашних животных (вакцинация, карантинные меры, дезинфекция). Для специфической иммунизации животных используют инактивированные моно- и поливалентные вак-
цины. Больных животных изолируют и лечат. Трупы павших животных сжигают. Необходимо строго соблюдать меры личной гигиены при уходе за животными, запрещать работу с больными животными беременным, подросткам, лицам с микротравмами рук. Запрещено употребление сырых молочных продуктов от больных или подозрительных на ящур животных. Меры иммунопрофилактики людей не разработаны.
Мероприятия в эпидемическом очаге
Не регламентированы. Госпитализация больного обязательна на срок не менее 14 дней.
ЛИСТЕРИОЗ (LISTERIOSIS)
Листериоз - сапрозоонозное инфекционное заболевание, поражающее преимущественно новорожденных, беременных и иммуносупрессивных лиц. Отличается клиническим полиморфизмом с проявлениями от латентной инфекции до тяжелых поражений нервной системы и сепсиса.
Краткие исторические сведения
Возбудитель заболевания впервые выделили Д. Мюррей, Р. Уэбб и М. Стоун (1926) от больных кроликов и морских свинок в питомнике Кембриджского университета. В связи со способностью вызывать выраженный моноцитоз в эксперименте микроорганизм получил видовое название B. monocytogenes. Аналогичный микроорганизм был выделен от диких грызунов в Южной Африке (Пири У., 1927), а несколько позже от человека, больного ангиной с высоким моноцитозом (Нифельдт А., 1929). Позднее К. Берн наблюдал случаи вызванного им заболевания у родильниц и новорожденных (1935). В 1940 г. по предложению У. Пири возбудитель в честь Джозефа Листера был назван Listeria monocytogenes, а болезнь - листериозом.
Этиология
Возбудитель - подвижная неспорообразующая грамположительная палочка Listeria monocytogenes, единственный патогенный для человека представитель рода Listeria. Бактерия имеет жгутики, может образовывать капсулу, трансформироваться в L-формы и паразитировать внутри клеток, обусловливая медленное латентное развитие инфекции. Листерии - микроаэрофилы, неприхотливы и растут на обычных средах с глюкозой даже при комнатной температуре, оптимум для роста - 30-37 °С. Имеют соматический и жгутиковый Аг, при распаде микробных клеток освобождается ЛПС-комплекс (эндотоксин). Известны 16 сероваров возбудителя, из них серовары 4в, 1/2в, 1/2а вызывают 90% всех случаев листериоза у человека.
Факторы патогенности листерий:
- мембранный белок интерналин, обусловливающий проникновение листерии в макрофаги;
- эндотелиоциты;
- фосфолипазы, растворяющие клеточные мембраны.
Основным фактором патогенности считают листериолизин О, разрушающий мембраны фаголизосом.
Бактерии обладают выраженными свойствами сапрофитов и высокоустойчивы во внешней среде. Хорошо переносят низкие температуры, как психрофильные микроорганизмы способны размножаться при 4-6 °С в различных объектах (почве, воде, на растениях, в трупах и пищевых продуктах). Длительно выдерживают 6-20% концентрации поваренной соли. Солнечные лучи их инактивируют в течение 2-15 сут, 2,5% раствор формалина или NaOH - через 20 мин, раствор хлорной извести (100 мг активного хлора в 1 л) - через 1 ч. При 62 °С бактерии погибают через 35 мин, при 100 °С - в течение 5-10 мин. Чувствительны к пенициллину, тетрациклинам, эритромицину, левомицетину, хотя известны и антибиотикоустойчивые штаммы.
Эпидемиология
Резервуар и источники инфекции - многие виды диких и синантропных грызунов, а также различные объекты внешней среды. Возбудитель листериоза выделен более чем от 90 видов диких и домашних животных, птиц, рыб, моллюсков, насекомых и клещей.
Болезнь поражает:
- домашних и сельскохозяйственных животных (свиней, мелкий и крупный рогатый скот, лошадей, кроликов, реже кошек и собак);
- домашнюю и декоративную птицу (гусей, кур, уток, индюшек, голубей, попугаев и канареек).
Листерии найдены у лисиц, норок, енотов, песцов, диких копытных, птиц, в рыбе и продуктах моря, во многих природных средах. Особенно благоприятной средой для их размножения служат поверхностные слои некачественного силоса. Возбудитель выделяется из организма с различными секретами (моча, молоко, кровь, сперма, ликвор, ректальная слизь, околоплодные воды и др.). Период заразности животных длится неопределенно долго. Инфицированный человек может быть источником перинатальной и неонатальной патологии. Родильницы и новорожденные могут выделять возбудитель в течение 10-12 дней после родов.
Механизм передачи разнообразный (фекально-оральный, контактный, воздушно-капельный, трансплацентарный), основной - фекально-оральный. Животные заражаются через воду и корма, инфицированные листериями, от грызунов или их трупов. Определенную роль в поддержании стационарных очагов болезни играют кровососущие насекомые, особенно пастбищные клещи. Заражаясь от грызунов и других больных животных, они способствуют распространению инфекции, передавая бактерии другим животным.
Механизмы заражения людей многообразны. Чаще заражение происходит алиментарным путем через инфицированную воду и пищевые продукты животного происхождения, особенно при отсутствии их надежной термической обработки и длительном хранении в условиях относительно низких температур. Возможно заражение при употреблении в пищу свежих овощей. Установлена возможность аэрогенного заражения, происходящего при обработке животного сырья (шерсти, щетины, кожи, шкур, пера, пуха). Известен контактный путь передачи, осуществляемый через порезы и ссадины на коже при попадании в них различных выделений больных животных. Выявлена возможность передачи
бактерий от человека к человеку, описаны случаи заражения половым путем. Особенно опасен листериоз для беременных в связи с перинатальной передачей возбудителя от матери к ребенку (трансплацентарно или во время родов). Описаны случаи послеродового аэрогенного, контактного и пищевого заражения новорожденных от матери, медицинского персонала или инфицированных ими объектов внешней среды.
Естественная восприимчивость людей
Естественная восприимчивость людей невысокая. Заболевания возникают чаще всего у лиц пожилого возраста, новорожденных, у лиц с иммунодефицитами. Постинфекционный иммунитет выражен слабо.
Основные эпидемиологические признаки
Болезнь имеет все черты сапрозоонозной инфекции, распространена повсеместно. Наиболее часто ее встречают в зонах с умеренным климатом и почвами, богатыми органическими удобрениями. Распространению листериоза способствует широкомасштабная хозяйственная деятельность человека, связанная с внедрением передовой технологии возделывания почвы, строительством животноводческих комплексов, комбикормовых заводов, централизованных предприятий по переработке и реализации сырья животного происхождения, продовольственных складов и хранилищ. В России ежегодно регистрируют 50-80 случаев листериоза, что не отражает действительный уровень заболеваемости. Возможны спорадические и групповые заболевания. К группе риска относят беременных и новорожденных. Профессиональный характер заболеваемость носит среди работников животноводческих и птицеводческих хозяйств, а также цехов первичной переработки на мясо- и птицекомбинатах. Заболеваемость чаще регистрируют в весенне-летний период. В последние десятилетия большинство крупных эпидемических вспышек листериоза с высоким процентом летальных исходов обусловлено потреблением пищевых продуктов, прежде всего сыра, других молочных продуктов и салатов, в меньшей степени - мясных, куриных и рыбных изделий. В качестве ВБИ листериоз наиболее актуален для акушерских стационаров, где имели место спорадические случаи и вспышки листериоза, а беременных и новорожденных относят к группам риска. В последние 10-15 лет наиболее значительный рост числа случаев листериоза отмечается у лиц пожилого возраста на фоне сопутствующих заболеваний, иммуносупрессивного лечения.
Патогенез
Входными воротами инфекции могут быть слизистые оболочки ЖКТ и респираторного тракта, глаз, а также поврежденный кожный покров.
Локализация входных ворот имеет существенное значение для развития разнообразных форм заболевания:
- при пероральном заражении развивается ангинозно-железистая форма;
- через слизистую оболочку глаза - глазожелезистая;
- при трансплацентарном заражении - генерализованный септический процесс с вовлечением ЦНС.
Первичное размножение листерий происходит в месте входных ворот и в регионарных лимфоузлах, вызывая их гиперплазию.
После прорыва возбудителя в кровь развивается бактериемия или сепсис (на фоне выраженного иммунодефицита) с фиксацией листерии в органах, богатых клетками системы мононуклеарных фагоцитов:
- печени;
- селезенке;
- лимфатических узлах;
- миндалинах;
- легких;
- почках и надпочечниках;
- ЦНС.
В местах внутриклеточного размножения бактерий образуются специфические гранулемы. При гибели инфицированных клеток формируются очажки некроза с перифокальными инфильтратами из макрофагов, лимфоцитов, эпителиоидных клеток. Токсинемия, обусловленная циркуляцией в кровотоке токсических продуктов, образовавшихся при гибели клеток, а также ЛПСкомплекса листерий, проявляется развитием общетоксического синдрома. Листерии могут проникать в ЦНС, вызывая менингит, менингоэнцефалит и абсцесс головного мозга, а также в органы урогенитальной системы, где способны длительно существовать в виде хронической бессимптомной инфекции. При беременности листериомы могут длительно сохраняться в почках, скапливаться в плаценте, что приводит в последующем к инфицированию плода с развитием у него и новорожденного своеобразной септико-гранулематозной формы заболевания, сопровождающейся появлением многочисленных абсцессов и гранулем (листериом), напоминающих поражения при милиарном туберкулезе. Внутриклеточное паразитирование возбудителей снижает роль гуморальных факторов иммунитета в патогенезе этой инфекции и определяет высокую значимость клеточного звена иммунитета в полной элиминации листерии из зараженного организма. Возникновению заболевания способствуют иммунодефицитные состояния и опухоли.
У переболевших развивается стойкий постинфекционный иммунитет. В некоторых случаях возникает здоровое носительство листерий.
Клиническая картина
Заболевание может приобретать острое, подострое, хроническое и абортивное течение, обычно склонно к рецидивированию.
Выделяют следующие основные клинические формы листериоза:
- ангинозно-септическую;
- глазожелезистую;
- железистую;
- нервную;
- тифоподобную;
- септико-гранулематозную (у плодов и новорожденных);
- смешанную.
По течению заболевание может быть острым, подострым и хроническим. Известны случаи длительного бессимптомного листериозного носительства.
Инкубационный период варьирует от нескольких дней до 1,5 мес, чаще длится 2-4 нед.
Общие черты острых форм листериоза:
- внезапное начало;
- озноб;
- быстрое (за 1-2 дня) повышение температуры тела до 38-40 °С;
- головная боль;
- раздражительность;
- боль в мышцах.
Болезнь нередко протекает с экзантемой. Сыпь крупнопятнистая или эритематозная, сгущается в области крупных суставов, на лице образует фигуру бабочки. Нередко формируется гепатолиенальный синдром. Клинические формы инфекции зависят от вовлечения в патологический процесс того или иного органа.
Ангинозно-септическая форма
Развивается наиболее часто. Основное клиническое проявление - ангина, которая может быть катаральной, фолликулярной, клинически не отличимой от ангины стрептококковой этиологии, или язвенно-пленчатой. Увеличиваются подчелюстные и шейные лимфоузлы. В периферической крови наблюдают лейкоцитоз и значительное увеличение числа мононуклеаров, СОЭ повышена. Обычно заболевание протекает благоприятно в течение 5-7 дней и заканчивается полным выздоровлением.
При язвенно-пленчатой листериозной ангине температура тела повышается до 38,5-39 °С, возможны кашель и насморк, характерны боли в горле. У больных отмечают яркую гиперемию слизистой оболочки ротоглотки, увеличение и разрыхленность миндалин, образование на них пленчатых налетов или язв, покрытых пленками. Регионарные лимфатические узлы увеличены, болезненные при пальпации. Характерны изменения гемограммы - лейкоцитоз, увеличение СОЭ и особенно повышение количества мононуклеаров (до 70% и более). Длительность заболевания в случаях его благоприятного течения составляет 12-14 дней.
Вместе с тем язвенно-пленчатая и значительно реже фолликулярная листериозная ангины при прогрессировании процесса могут приводить к развитию сепсиса, что наблюдают преимущественно у взрослых. Высокая лихорадка принимает ремиттирующий характер, отмечают гиперемию лица, конъюнктивит, полиморфную сыпь на коже, белый налет на миндалинах. Развивается гепатолиенальный синдром, в некоторых случаях появляются слабо выраженные менингеальные симптомы. В крови сохраняется выраженный моноцитоз. Исход листериозного сепсиса при своевременном и полноценном лечении благоприятный.
Глазожелезистая форма
Встречается редко, обычно она бывает следствием контакта с инфицированными животными. У больных отмечают повышение температуры тела, снижение остроты зрения.
Развиваются односторонний или двусторонний гнойный конъюнктивит с отеком конъюнктивы и многочисленными фолликулами на ней, отек век, сужение глазных щелей, увеличение и небольшая болезненность околоушных и шейных лимфатических узлов. Роговица остается неизмененной. Заболевание протекает длительно, от 1 до 3 мес.
Железистая форма
Протекает с лихорадкой, интоксикацией и увеличением многих групп лимфоузлов:
- подчелюстных;
- шейных;
- подмышечных;
- брюшной полости и др.
Нервная форма
Проявляется в виде листериозного менингита, менингоэнцефалита или абсцесса мозга. Клиническая характеристика этих состояний не имеет существенных отличий от соответствующих нозологических форм иной бактериальной этиологии. Можно наблюдать поражения периферической нервной системы - парезы и параличи отдельных групп мышц, полирадикулоневрит.
Развивается гепатолиенальный синдром. Моноцитоз в периферической крови при нервной форме заболевания отмечают лишь в раннем периоде, в дальнейшем обнаруживают лейкоцитоз и гранулоцитоз. Спинномозговая жидкость иногда может быть гнойной, но обычно остается прозрачной, ликворное давление и содержание белка повышены, цитоз имеет смешанный характер, показатели глюкозы и хлоридов изменяются незначительно. При иммунодефицитных состояниях, включая ВИЧ-инфекцию, нервная и тяжелая генерализованная формы листериоза проявляются как оппортунистические инфекции.
Тифоподобная форма
Характеризуется длительной лихорадкой, выраженной интоксикацией, гепатоспленомегалией, нередко диареей и экзантемой.
Септико-гранулематозная форма
Может развиться у плода и новорожденных. При беременности листериоз нередко протекает в стертой и атипичной формах, а также в виде бессимптомного носительства, и в таких случаях остается нераспознанным. При внутриутробном заражении плода в ранние сроки беременности заболевание характеризуется гранулематозным поражением многих органов и систем, возможна его гибель или тяжелые аномалии развития (гидроцефалия, микрогирия и др.).
Листериоз новорожденных отличает тяжелое течение с летальностью
до 50%.
Заболевание проявляется высокой лихорадкой, расстройствами дыхания и кровообращения:
- диспноэ;
- цианозом;
- глухостью тонов сердца.
Развивается специфическая листериозная пневмония, нередко осложняющаяся гнойным плевритом. Возможны рвота, слизистый стул. Иногда возникает экзантема розеолезно-папулезного характера. Печень и селезенка увеличены, у отдельных больных появляется желтуха. При развитии гнойного менингита чаще всего наблюдают летальный исход. Клинически листериоз новорожденных распознают редко ввиду его сходства с другими внутриутробными инфекциями.
У грудных детей листериоз начинается как ОРВИ с повышения температуры тела, насморка, кашля, затем развиваются мелкоочаговая бронхопневмо-
ния или гнойный плеврит. У части больных отмечают экзантему макулопапулезного характера, увеличение печени, желтуху, менингеальные симптомы, иногда судороги, параличи. Характерный моноцитоз в гемограмме встречают редко.
При выздоровлении после этой формы листериоза у 15-20% детей остаются расстройства со стороны периферической нервной системы и ЦНС.
Хронический листериоз
При хронических формах заболевания листерии могут длительно находиться в организме человека, не вызывая выраженных клинических изменений. Иногда они вызывают легкие гриппоподобные проявления, довольно часто диспепсические расстройства или обострения хронического пиелонефрита. На фоне иммунодефицитных состояний (лечение иммунодепрессантами, лимфогранулематоз и другие онкологические заболевания) может произойти генерализация инфекции, развивается тяжелый листериозный сепсис с поражением печени, почек, ЦНС.
Дифференциальная диагностика
Осложнена в связи с клиническим полиморфизмом листериоза и отсутствием патогномоничных клинических признаков. Заболевание дифференцируют от ангин различной этиологии, инфекционного мононуклеоза, острых респираторных вирусных инфекций, гнойных менингитов, острой фазы ВИЧинфекции, острого токсоплазмоза, заболеваний крови и лимфогранулематоза. Различные клинические формы листериоза в большинстве случаев объединяет преимущественное поражение системы мононуклеарных фагоцитов.
Лабораторная диагностика
Нередко при листериозе, особенно при его ангинозно-септической форме, обращают внимание на большое количество (до 60-70%) моноцитов в периферической крови.
В зависимости от формы заболевания проводят бактериологическое исследование крови, цереброспинальной жидкости, слизи из носоглотки и зева, отделяемого конъюнктивы, пунктатов лимфатических узлов, околоплодных вод, плаценты, а также разнообразного биологического материала, взятого от трупов погибших.
Посевы рекомендовано делать в первые 7-10 сут болезни. Кровь (10 мл) и ликвор (2-5 мл) засевают на 100-150 мл глюкозного, глюкозно-печеночного или глюкозно-глицеринового бульона, инкубируют при 37 °С до 3 нед. При посеве на глюкозо-кровяной агар отбирают типичные колонии (прозрачные или роговидные), дающие гемолиз. Можно также проводить посев на триптозный агар и просматривать чашки под микроскопом при косом освещении - суточные колонии листерий имеют сине-зеленую окраску.
Применяют РА с листериозным диагностикумом, РНГА и РСК с их постановкой в парных сыворотках. Часто регистрируют ложноположительные результаты из-за антигенного родства листерий со стафилококками и другими микроорганизмами. Возможно применение МФА и биологических проб на белых мышах, кератоконъюнктивальной пробы на кроликах.
Осложнения и исходы
При ангинозно-септической форме заболевания возможно развитие эндокардита. При хроническом листериозе обострение заболевания у ослабленных лиц и при иммунодефицитных состояниях может привести к развитию тяжелого генерализованного септического процесса.
Прогноз при железистых формах благоприятный. У беременных листериоз может привести к тяжелым поражениям плода. После листериозных менингоэнцефалитов могут быть стойкие резидуальные признаки со стороны ЦНС.
Лечение
Особенности лечения зависят от клинической формы листериоза. Все больные с тяжелым и среднетяжелым течением листериоза подлежат госпитализации. В этиотропном лечении эффективны тетрациклин по 300 мг 4 раза в сутки (беременным, особенно в I триместре, не назначают!), доксициклин по 100 мг в сутки (в 1-е сутки - 200 мг), эритромицин по 30 мг/кг в сутки внутрь в 4 приема. При менингите и менингоэнцефалите назначают бензилпенициллина натриевую соль по 75 000-100 000 ЕД/кг внутривенно каждые 4 ч. Альтернативные препараты - кларитромицин, ципрофлоксацин. Антибиотики назначают в течение всего лихорадочного периода и последующих 5-7 дней апирексии, при тяжелых формах до 14-21 дня апирексии. Патогенетическое лечение проводят по общепринятым принципам. При глазожелезистой форме местно применяют 20% раствор сульфацила натрия (альбуцида), 1% гидрокортизоновую эмульсию.
Эпидемиологический надзор
Включает:
- анализ заболеваемости животных и людей;
- слежение за инфицированностью возбудителем объектов внешней среды;
- выявление групп риска и факторов, способствующих распространению инфекции как в бытовых, так и больничных условиях;
- регламентирование показателя L. monocytogenes для сырья и продуктов животного происхождения, птицы и рыбы в качестве гигиенического требования к качеству и безопасности пищевых продуктов и внедрение в практику текущего надзора.
В системе надзора для планирования, осуществления и оценки эффективности мероприятий по борьбе с листериозом необходимо шире применять серологические методы исследования.
Профилактические мероприятия
Многообразие источников инфекции и широкие возможности инфицирования населения определяют необходимость осуществления общего комплекса ветеринарно-санитарных и санитарно-гигиенических мероприятий в населенных пунктах, на различных объектах, связанных с животноводством, хранением и переработкой сырья и мясных продуктов. Необходимы также дератизационные мероприятия, защита водоисточников и предприятий общественного питания от грызунов. В хозяйствах (животноводческих комплексах, фермах,
отделениях, стадах), неблагополучных по листериозу, проводят поголовный осмотр животных и отбраковку животных, изоляцию и лечение согласно соответствующим инструктивно-методическим документам. Полученное от больных животных молоко кипятят, кожевенно-меховое сырье обеззараживают. Для профилактики листериоза у беременных рекомендуют полное исключение из рациона питания мягких сыров типа камамбер, рокфор, брынзы, а также продуктов пищевой индустрии быстрого питания типа сосисок хот-дог, гамбургеров и других продуктов, не прошедших длительную термическую обработку перед употреблением. Беременных, работающих в животноводстве, временно переводят на работы вне контакта с животными. Меры специфической профилактики не разработаны.
Мероприятия в эпидемическом очаге
Госпитализацию больных проводят по клиническим и эпидемиологическим показаниям. Выписку из стационара осуществляют после клинического выздоровления и прекращения выделения листерий, устанавливаемого на основе бактериологических исследований. Все переболевшие подлежат диспансерному наблюдению в соответствии с инструктивно-методическими документами. Дезинфекцию проводят по той же схеме, что и при брюшном тифе. В очаге усиливают мероприятия по уничтожению грызунов и защите от них жилых и производственных помещений. Разобщение и экстренную профилактику в отношении контактных лиц не проводят.
ЛИХОРАДКА ЗАПАДНОГО НИЛА
Лихорадка Западного Нила (западно-нильский энцефалит, утиная лихорадка) - острое зоонозное трансмиссивное вирусное заболевание, отличающееся значительным клиническим полиморфизмом и протекающее в виде нейроинфекционной, экзантематозной и гриппоподобной форм.
Краткие исторические сведения
Возбудитель впервые выделен из крови больной женщины в Уганде (1937). В дальнейшем его выделили от больных людей, теплокровных животных и комаров во многих странах Африки, Азии и Европы. Вспышки заболевания зарегистрированы в Израиле (50-е годы ХХ в.), Румынии (1996), южной части России, в частности в Астрахани и Волгограде (1999).
Доказано существование природных очагов заболевания в южных регионах бывшего СССР:
- Армении;
- Туркмении;
- Таджикистане;
- Азербайджане;
- Казахстане;
- Молдавии;
- Астраханской;
- Одесской;
- Омской областях и др.
Этиология
Возбудитель - РНК-геномный вирус рода Flavivirus группы В семейства Flaviviridae. По антигенной структуре и биологическим свойствам близок к вирусам японского энцефалита, лихорадки Денге, желтой лихорадки, клещевого энцефалита. Отнесен ко 2-й группе патогенности. Репликация вируса происходит в цитоплазме пораженных клеток. Вирус лихорадки Западного Нила обладает значительной способностью к изменчивости, что обусловлено несовершенством копирования генетической информации. Штаммы вируса, выделенные в различных странах и в различные годы, не имеют генетического сходства и обладают различной вирулентностью. Хорошо сохраняется в замороженном и высушенном состоянии. Погибает при температуре выше 56 °С в течение 30 мин. Инактивируется эфиром и дезоксихолатом. Обладает гемагглютинирующими свойствами.
Эпидемиология
Резервуар и источники инфекции - дикие и домашние птицы, грызуны, летучие мыши.
Механизм передачи - трансмиссивный, переносчиками заболевания выступают комары, а также аргасовые и иксодовые клещи. В настоящее время вирус лихорадки Западного Нила выделен более чем от 40 видов комаров, входящих не только в род Culex, но и в роды Aedes, Anopheles и др. Зафиксированы отдельные случаи передачи инфекции от человека к человеку через кровь, при пересадке органов и кормлении грудью.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Постинфекционный иммунитет напряженный и стойкий.
Основные эпидемиологические признаки
Заболевание эндемично во многих странах Азии, Европы, Африки. Описаны сотни случаев лихорадки в Израиле и Южной Африке. Значительная африканская эпидемия (около 3000 случаев) отмечена в провинции Кэйп после сильных дождей в 1974 г.
Вспышки наблюдали в Алжире, Азербайджане, Центрально-Африканской Республике, Заире, Египте, Эфиопии, Индии, Нигерии, Пакистане, Сенегале, Судане, Румынии, Чехии.
В 1999 г. на территории Волгоградской области отмечена вспышка лихорадки (заболели 380 человек) с лабораторным подтверждением болезни. В этом же году появились первые сообщения об обнаружении вируса на территории США. За 2003 г. в США было зафиксировано свыше 9000 случаев инфекции. Аг вируса обнаружен у выборочно отловленных комаров рода Culex и клещей. Территория риска для лихорадки Западного Нила - Средиземноморский бассейн, куда прилетают птицы из Африки. Дополнительную роль в сохранении и распространении вируса могут играть синантропные птицы. Вспышки лихорадки Западного Нила в 1999 г. в Нью-Йорке сопровождались массовым падежом ворон и гибелью экзотических птиц в зоопарке. Эпидемии в Израиле в 2000 г. предшествовала эпизоотия среди гусей на фермах. Болезнь имеет отчетливую сезонность - позднее лето и осень. Болеют преимущественно сельские жители, хотя во Франции, где эта болезнь извест-
на под названием утиная лихорадка, заболевают городские жители, приезжающие на охоту в долину Роны. В ареалах болезни заболевают лица любого возраста. Известны случаи лабораторного заражения.
Лихорадку Западного Нила в России в настоящее время регистрируют только в субъектах Южного федерального округа:
- Астраханской;
- Волгоградской;
- Ростовской областях.
В 2007 г. зарегистрировано 115 случаев этого заболевания, в том числе в Волгоградской области - 63 случая с 2 летальными исходами, Астраханской области - 33 случая, в Ростовской области - 19. У всех больных диагноз подтвержден лабораторно.
Патогенез
Остается недостаточно изученным. Вирус проникает в кровь человека при укусе комара. Затем возбудитель гематогенно диссеминирует, вызывая системные поражения лимфоидных тканей (лимфаденопатию). Вирус тропен не только к клеткам ЦНС, но и к эндотелию сосудов. Возможно персистирование вируса в организме человека в течение относительно длительного времени (более 1-2 мес). При проникновении вируса через гематоэнцефалический барьер возможны поражения оболочек и вещества мозга с развитием менингоэнцефалита. Известны случаи латентной инфекции.
Клиническая картина
Инкубационный период длится 2-8 дней, но может затягиваться до 2-3 нед. Клиническая картина заболевания представлена в соответствии с наблюдениями вспышек лихорадки Западного Нила в России (1999). Выделяют нейроинфекционную, гриппоподобную и экзантематозную формы различных степеней тяжести:
- легкой;
- среднетяжелой;
- тяжелой.
Нейроинфекционная форма
Наиболее часто встречаемое поражение. Характерно острое начало с повышением температуры тела до 38-40 °С, ознобом, слабостью, повышенным потоотделением, головными болями, иногда артралгиями и болями в пояснице. Постоянные признаки включают тошноту, повторную рвоту (до 3-5 раз в сутки), не связанную с приемом пищи.
Реже наблюдают значительно выраженные симптомы токсической энцефалопатии :
- мучительную головную боль;
- головокружение;
- психомоторное возбуждение;
- неадекватность поведения;
- галлюцинации;
- тремор.
Часто развиваются клинические проявления менингизма, серозного менингита (до 50% больных), в последние годы участились случаи тяжелых энцефалитов с летальным исходом, что позволяет предположить возникновение новых нейровирулентных штаммов вируса. Продолжительность ремитирующей лихорадки варьирует от 7-10 дней до нескольких недель. После ее снижения по типу ускоренного лизиса в период реконвалесценции постепенно наступает улучшение состояния больных, но длительно сохраняются слабость, бессонница или сонливость, подавленность настроения, ослабление памяти.
Гриппоподобная форма
Протекает с общими инфекционными симптомами:
- умеренной или высокой лихорадкой в течение нескольких дней;
- головной болью;
- болями в глазных яблоках;
- слабостью;
- ознобами;
- миалгиями (особенно мышц шеи и поясницы) и артралгиями. Иногда больные жалуются на кашель, чувство саднения в горле. При осмотре
отмечают гиперемию кожи, признаки конъюнктивита, склерита, яркую гиперемию и зернистость мягкого и твердого нёба, нёбных дужек и задней стенки глотки. Часто отмечают периферическую лимфаденопатию. Тоны сердца приглушены, АД снижено. Патологические изменения в легких, как правило, отсутствуют. Вместе с тем возможны диспепсические симптомы:
- тошнота;
- рвота;
- учащенный жидкий стул;
- реже запоры;
- боли в животе.
Язык суховат, обложен, иногда выявляют увеличение печени и селезенки. В целом эта форма заболевания протекает как острая вирусная инфекция и часто сопровождается признаками менингизма.
Экзантематозная форма
Наблюдают значительно реже, около 5% случаев. Характерно развитие на 2-4-е сутки болезни полиморфной экзантемы (чаще пятнисто-папулезной, иногда розеолоподобной или скарлатиноподобной) на фоне лихорадочной реакции и других общетоксических симптомов, катаральных проявлений и диспепсических расстройств. Сыпь сохраняется от нескольких часов до нескольких дней, исчезает при снижении температуры, не оставляя пигментации. Часто наблюдают полиаденит, при этом лимфатические узлы незначительно увеличены и умеренно болезненны при пальпации. Заболевание продолжается 3-5 дней и заканчивается выздоровлением.
Дифференциальная диагностика
Заболевание следует отличать от ОРВИ, энтеровирусной инфекции, менингитов и менингоэнцефалитов, лептоспироза, респираторного микоплазмоза и орнитоза. Дифференциальная диагностика спорадических случаев крайне затруднительна. В эпидемических очагах диагноз базируется на комплексе клинических, эпидемиологических и специфических лабораторных данных.
Лабораторная диагностика
В гемограмме, как правило, не выявляют патологических изменений. В 30% случаев отмечают лейкопению менее 4×109/л со сдвигом влево. Для серологической диагностики применяют РТГА, РСК, РН, а также ИФА, позволяющий выявить IgM-АТ в плазме крови или цереброспинальной жидкости в ранние сроки заболевания. Возможно проведение биологической пробы на новорожденных белых мышах с последующей идентификацией возбудителя прямым методом иммунофлюоресцирующих АТ. Для обнаружения вирусной РНК разработана ПЦР с обратной транскрипцией. Реакции применяют для лабораторного подтверждения диагноза, а также для сопоставления генома возбудителей, выделенных от больных в различных странах мира.
Осложнения и исходы
При нейроинфекционной форме заболевания могут развиться отек и набухание головного мозга, нарушения мозгового кровообращения. При развитии менингоэнцефалита возможны парезы и параличи, тяжелое течение болезни. Летальность при нейроинфекционной форме заболевания составляет в среднем 4-6%, у пожилых и ослабленных лиц может достигать 10%. В большинстве случаев течение заболевания благоприятное, несмотря на длительную астению в периоде реконвалесценции, выздоровление полное.
Лечение
Проводят патогенетическое и симптоматическое лечение.
Профилактические мероприятия
Включают уничтожение комаров и обезвреживание мест их выплода, применение средств индивидуальной защиты от комаров, засетчивание окон и дверных проемов. Рекомендуют проводить контроль за плотностью популяций синантропных птиц (вороны, галки, воробьи, голуби, чайки и др.). Специфическая профилактика не разработана.
Мероприятия в эпидемическом очаге
Не регламентированы.
КАРЕЛЬСКАЯ ЛИХОРАДКА
Карельская лихорадка (Ockelbo disease, Швеция; Pogosta disease, Финляндия) - природно-очаговое острое вирусное заболевание, характеризующееся лихорадкой, умеренно выраженными признаками общей интоксикации, артралгиями и экзантемой.
Краткие исторические сведения
Впервые заболевание, сопровождающееся лихорадкой, развитием экзантемы и поражением суставов, было зарегистрировано в населенном пункте
Ockelbo (Швеция) в 1960 г. и получило название болезни Окельбо. В последующем аналогичные случаи болезни наблюдали в Финляндии в районе Pogosta (1981) и Карелии (1982), соответственно они получили названия болезни Погоста и Карельской лихорадки. Этиология заболевания установлена в 1982 г. после выделения вируса от комаров во время эпидемической вспышки в районе Edsbyn в Центральной Швеции.
Этиология
РНК-геномный вирус Edsbyn 5/82 рода Alphavirus группы А семейства Togaviridae. По антигенным свойствам близок к вирусу Синдбис, выделенному от комаров в окрестностях Каира в 1952 г.
Оптимальные условия роста:
- температура - 20-30 °С;
- pH 5,8.
Чувствителен к действию органических растворителей (эфир, хлороформ), разрушается детергентами, УФО, при нагревании до 56 °С и выше, обычными дезинфектантами. Вирус отнесен ко 2-й группе патогенности.
Эпидемиология
Резервуар и источники инфекции - предположительно птицы. Механизм передачи - трансмиссивный, переносчики - комары рода Culex.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Постинфекционный иммунитет стойкий, повторные случаи заболевания не зарегистрированы.
Основные эпидемиологические признаки
Природно-очаговая инфекция, регистрируемая в Финляндии, Швеции, Норвегии. В России случаи заболевания отмечены в Карелии. Болеют преимущественно взрослые сельские жители, женщины и мужчины в одинаковой степени. Заболевание чаще наблюдают в летнее время в период активности комаров.
Патогенез
До конца не изучен. В организм человека вирус попадает при укусе зараженного комара, выраженных изменений в области ворот инфекции не наблюдается. Далее происходит гематогенная диссеминация вируса, приводящая к развитию генерализованной экзантемы и поражению суставов. Длительное сохранение отдельных клинических признаков заболевания и IgM-АТ у пациентов, вероятно, свидетельствует о продолжительной персистенции вируса в организме человека (от 2 до 4 лет).
Клиническая картина
Длительность инкубационного периода не установлена, предположительно она варьирует от 3 до 14 дней. Заболевание начинается остро, температура тела
у большинства пациентов субфебрильная, приблизительно у 30% больных - высокая. Симптомы общей интоксикации (слабость, головная боль) выражены слабо и наблюдаются редко (в 8-14% случаев). Часто возникают боли в мышцах, но основной жалобой более 90% больных уже с первых дней заболевания является боль в суставах. Преимущественно поражаются крупные суставы, иногда наблюдается их припухлость. Почти у всех больных выявляется экзантема, она обычно возникает в первые 2-3 дня болезни. Сыпь обильная, отличается стадийностью развития. Сначала появляются дискретные пятна размером до 1 см в диаметре, в дальнейшем на их фоне развиваются папулы, некоторые из них могут трансформироваться в везикулы. Длительность проявлений экзантемы - 5-10 дней, после исчезновения сыпи рубцов на коже не остается. Суставные боли носят пролонгированный характер и продолжаются от 2-3 нед до 3-4 мес, а иногда до 2 лет.
Дифференциальная диагностика
Заболевание следует дифференцировать от ряда острых лихорадочных заболеваний, сопровождающихся развитием экзантем и артритов. Оно встречается у лиц, находившихся в эндемичных зонах Финляндии, Швеции, Норвегии, Карелии. Основные клинические отличия карельской лихорадки - суставные поражения (преимущественно крупных суставов), развивающиеся уже в начальный период и продолжающиеся длительное время, иногда до 1-2 лет, а также экзантема.
Лабораторная диагностика
Принимают во внимание результаты серологических реакций с исследованием парных сывороток крови при 4-кратном нарастании титров АТ.
Осложнения
Не наблюдают.
Лечение
Специфическое лечение не разработано. Применяют анальгетики, нестероидные противовоспалительные средства и антигистаминные препараты.
Профилактические мероприятия
Включают борьбу с комарами и использование средств индивидуальной защиты. Специфическая профилактика не разработана.
Мероприятия в эпидемическом очаге
Не регламентированы.
ХЛАМИДИОЗЫ
Хламидиозы - группа антропонозных и зоонозных инфекций, вызываемых хламидиями. Характеризуются острым или хроническим течением с поражениями внутренних органов, лимфатических узлов, глаз, суставов и воспалительными гранулематозными процессами на слизистых оболочках.
Краткие исторические сведения и этиология
Возбудители относят к роду Chlamydia семейства Chlamydiaceae. В пределах рода Chlamydia ранее были известны 2 вида:
- C. trachomatis;
- C. psittaci.
В 1989 г. описан вид C. pneumoniae, а в 1993 г. - C. pecorum. Хламидии занимают промежуточное положение между бактериями, риккетсиями и вирусами. Их родство с бактериями определяют морфологические свойства возбудителей (мелкие кокковидные грамотрицательные микроорганизмы), в клетках имеются одновременно ДНК и РНК, способность размножаться делением, чувствительность к антибиотикам, способность к образованию спорообразных форм во внешней среде. От прочих бактерий хламидии и риккетсии отличает облигатный внутриклеточный паразитизм.
Эпидемиология
Хламидии широко распространены в природе, помимо человека выявлены более чем у 200 видов млекопитающих и птиц. Источники инфекции - больные и латентные носители. Заражение человека хламидиозами происходит аэрозольным и контактным путями, а при антропонозных хламидиозах также и половым путем. Восприимчивость к заболеваниям высокая, иммунитет слабый.
К антропонозным хламидиозам относят:
- трахому и паратрахому;
- урогенитальный хламидиоз;
- венерическую лимфогранулему.
К зоонозным хламидиозам - орнитоз, генерализованный хламидиоз, атипичные пневмонии, артрит, пиелонефрит и др.
Доказано, что хламидии могут играть роль пускового фактора при развитии коллагенозов:
- узловатой эритемы;
- болезни Рейтера и других поражений суставов.
Многообразие клинических форм хламидиозов и отсутствие у последних характерных патогномоничных симптомов представляют большие сложности для специалистов, изучающих эти заболевания:
- инфекционистов;
- терапевтов;
- гинекологов;
- урологов;
- офтальмологов;
- венерологов.
В соответствии с утвержденной программой в курс инфекционных заболеваний включен орнитоз как одна из нозологических форм хламидиозов.
ОРНИТОЗ (ORNITHOSIS)
Орнитоз (пситаккоз) - острое зоонозное хламидийное заболевание с преимущественным поражением легких и развитием синдрома интоксикации, склонное к затяжному течению с обострениями.
Краткие исторические сведения
Заболевание впервые описал Т. Юргенсен под названием атипичной пневмонии (1876). В 1879 г. Д. Риттер установил его связь с заражением от попугаев. Вспышку инфекции, источником которой стали попугаи, завезенные из Бразилии, наблюдали в 1892 г. в Париже, вследствие чего заболевание получило название пситтакоз, т.е. попугайная болезнь. Позднее было установлено, что источниками инфекции могут быть не только попугаи, но и многие другие виды птиц, в связи с чем заболевание получило название «орнитоз». Возбудителя выделил С.П. Бедсон (1930).
Этиология
Возбудитель - грамотрицательная неподвижная бактерия Chlamydia psittacii рода Chlamydia семейства Chlamydiaceae, облигатно паразитирующая в инфицированных клетках. Хламидии имеют сферическую форму, окрашиваются по Романовскому-Гимзе в фиолетовый цвет. Содержат ДНК и РНК, размножаются только в живых клетках, культивируются в культурах ткани и куриных эмбрионах, а также в организме лабораторных животных (на белых мышах). Обладают термолабильным и термостабильным Аг. Возбудитель сохраняется во внешней среде до 2-3 нед, устойчив к замораживанию, высушиванию, инактивируется при нагревании и под воздействием дезинфектантов в обычных концентрациях. Отнесен ко 2-й группе патогенности.
Эпидемиология
Резервуар и источники инфекции - домашние и дикие птицы. В настоящее время возбудитель орнитоза выделен более чем у 150 видов птиц. Наибольшее эпидемиологическое значение имеют домашние птицы (особенно утки и индюшки), комнатные птицы (попугаи, канарейки и другие мелкие певчие птицы) и особенно городские голуби, зараженность которых варьирует в пределах 30-80%. Птицы выделяют возбудитель с фекалиями и носовым секретом. Больной человек эпидемиологической опасности не представляет. Период контагиозности источника - недели и месяцы.
Механизм передачи - аэрозольный, возможен пылевой и пищевой пути инфицирования.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Постинфекционный иммунитет непродолжительный, возможны повторные случаи заболевания.
Основные эпидемиологические признаки
Заболевание распространено повсеместно. Около 10% всех пневмоний имеет орнитозную природу. Чаще заболевают лица, постоянно контактирующие с птицами (работники птицефабрик, мясокомбинатов, голубеводы, работники зоомагазинов и др.). Бытовые заболевания возникают в течение всего года, профессиональные - в периоды массового забоя птицы, завоза новых партий птиц и т.д. При бытовом инфицировании чаще наблюдают спорадические заболевания, хотя возможны и небольшие (семейные) вспышки. Заболевают преимущественно лица среднего и старшего возраста.
Патогенез
Возбудитель проникает через эпителий слизистых оболочек всех отделов дыхательных путей, включая мелкие бронхи и альвеолы. В эндотелии сосудов, в эпителиальных, лимфоидных и ретикулогистиоцитарных клетках происходят его размножение и накопление. При разрушении пораженных клеток продукты их распада, а также хламидии, бактериальные токсины и продукты жизнедеятельности попадают в кровь. Нарастают интоксикация и аллергизация организма. При орнитозе резко выраженная интоксикация может привести к ИТШ. Хламидии могут проникать в различные органы и системы, прежде всего в легкие, нервную, сердечно-сосудистую системы, печень. В органах развивается воспалительный процесс серозного, а в случаях присоединения условнопатогенной флоры - смешанного характера. Пневмония развивается на фоне катарального трахеобронхита и гиперплазии перибронхиальных лимфатических узлов. Реже воротами инфекции служит слизистая оболочка ЖКТ. В этих случаях заболевание протекает атипично, с выраженной интоксикацией, увеличением печени и селезенки, но без поражения легких.
Хламидии способны к длительной внутриклеточной локализации, что обусловливает возможность рецидивирующего течения заболевания.
Клиническая картина
Инкубационный период
Длится 1-3 нед. Инфекция может протекать в острой или хронической форме.
Острая форма
У некоторых больных на протяжении 1-2 дней может наблюдаться продромальный период с недомоганием, болями в суставах, подташниванием. В большинстве случаев заболевание начинается остро с быстрого повышения температуры до высоких цифр. Лихорадку сопровождают ознобы, повышенное потоотделение, боли в мышцах и суставах, головная боль. Больные жалуются на слабость, боли в горле, нарушения сна и аппетита, запоры. Иногда возможны тошнота и жидкий стул. Лихорадка носит постоянный или ремиттирующий характер и продолжается от 1 до 3 нед.
При осмотре больных обнаруживают гиперемию лица, у части из них имеются признаки конъюнктивита. Язык утолщен, обложен, возможны отпечатки зубов по краям. В большинстве случаев формируется гепатолиенальный синдром. Тоны сердца приглушены, отмечают склонность к брадикардии и сни-
жению АД. Развиваются бессонница, возбуждение, раздражительность и плаксивость, реже заторможенность, апатия, адинамия. Могут выявляться симптомы раздражения мозговых оболочек, в редких случаях развивается серозный менингит.
Первый признак поражения легких - кашель, сначала сухой, затем со слизистой мокротой, он появляется лишь на 3-4-й день болезни. В этот период у больных можно выявить признаки ларингита и трахеобронхита. В дальнейшем при развитии пневмонии отмечается бледность кожного покрова, одышка не выражена, перкуторные изменения звука над легкими определяют редко, при аускультации выслушивают сухие хрипы и только в отдельных случаях единичные - мелкопузырчатые. Однако рентгенологически можно обнаружить интерстициальные изменения или очаги неоднородных инфильтратов, обычно располагающиеся в нижних отделах легких, а также расширение легочных корней, усиление легочного рисунка, иногда - увеличение прикорневых лимфатических узлов. В случае присоединения условно-патогенной флоры пневмония может быть также крупноочаговой и лобарной.
Рассасывание очагов пневмонии происходит медленно, длительно сохраняется астения. Иногда полное выздоровление наступает через 10-15 дней, в других случаях заболевание становится ремиттирующим с последующими рецидивами. Ранние рецидивы развиваются через 2-4 нед после острой фазы, поздние - спустя 3-4 мес. У части больных орнитоз принимает хроническое течение. К редко встречающимся вариантам острой формы орнитоза относят также случаи заболевания без поражения легких, протекающие с умеренной лихорадкой, болями в горле, миалгиями, развитием гепатолиенального синдрома. Известны орнитозные серозные менингиты, иногда сочетающиеся с пневмонией, а также менингоэнцефалиты с развитием полиневритов, парезов и параличей (голосовых складок, нижних конечностей).
Хроническая форма
Развивается у 10-12% больных и протекает в виде хронического бронхита или поражений других органов и систем и может продолжаться несколько лет с периодическими рецидивами.
Генерализованная форма
Заболевание относится к группе зоонозных хламидиозов, развивающихся при инфицировании человека C. psittacii. Имеет общие с орнитозом этиологические, эпидемиологические и патогенетические характеристики.
Инкубационный период варьирует от 1 до 3 нед. Чаще заболевание начинается остро с быстрого повышения температуры тела до высоких цифр, озноба, головной боли, артралгий. Иногда может проявляться продромальный синдром в виде общей слабости, снижения аппетита, головной боли и субфебрилитета. В последующем высокая лихорадка сохраняется в течение нескольких дней, снижается литически. Больные жалуются на сухость во рту, жажду, тошноту, ухудшение аппетита, нарушения сна. В большинстве случаев с первых дней болезни развиваются артралгии в крупных суставах конечностей.
При осмотре больных отмечают бледность кожного покрова (значительно реже кратковременную гиперемию лица и верхней части туловища), конъюнктивит с серозным отделяемым, инъекцию сосудов склер. Тоны сердца приглушены, пульс учащен, лабилен, АД склонно к незначительному повышению. Патология со стороны дыхательной системы отсутствует. Язык густо обложен
белым налетом, размеры печени увеличены, селезенка интактна. Мочеиспускание учащено, повышен суточный диурез, в моче увеличивается содержание белка, лейкоцитов, цилиндров, отмечают гипо- и изостенурию. Больные астенизированы, эмоционально лабильны. Может проявляться неврологическая симптоматика в виде тремора пальцев рук, дрожания языка при высовывании, парестезий в кистях рук, неврита тройничного нерва. Характерно развитие эписклерита на 2-й неделе болезни или позже. Он проявляется чувством жжения, песка в глазах, болью при движении глазных яблок, иногда снижением зрения. Возможны изменения со стороны глазного дна.
Дифференциальная диагностика
Орнитоз следует отличать от гриппа, ОРВИ, различных воспалительных процессов в легких, туберкулеза, бруцеллеза, ку-лихорадки, инфекционного мононуклеоза, микоплазмоза, в некоторых случаях - от серозных менингитов.
В начале заболевания характерны лихорадка с ознобом и повышенным потоотделением, боли в горле, мышцах и суставах. Отмечают конъюнктивит, утолщенный язык с возможными отпечатками зубов по краям, нередко гепатолиенальный синдром, нарушения эмоциональной сферы (возбуждение, раздражительность, плаксивость). С 3-4-го дня болезни развиваются ларингит или бронхит, интерстициальная или мелкоочаговая пневмония со скудными физикальными данными. При подозрении на орнитоз учитывают данные эпидемиологического анамнеза - контакты с птицами (работники птицефабрик, мясокомбинатов, голубеводы, работники зоомагазинов и др.).
Лабораторная диагностика
В гемограмме определяют лейкопению или нормоцитоз, относительный лимфоцитоз и анэозинофилию, СОЭ повышена или нормальна.
Выделение хламидий из крови и патологического материала в широкой практике не проводят. Основу составляют серологические методы - РСК и РТГА с постановкой реакций в парных сыворотках, а также ИФА, РНИФ.
Лечение
Наиболее эффективные этиотропные средства в лечении орнитоза и генерализованной формы хламидиоза - азитромицин и эритромицин в средних терапевтических дозах. Возможно применение антибиотиков тетрациклинового ряда. Длительность курса зависит от клинического эффекта. В качестве средств патогенетического лечения проводят дезинтоксикацию, назначают бронхолитики, витамины, кислород, противовоспалительные, антигистаминные и симптоматические средства.
Эпидемиологический надзор
Включает учет и анализ заболеваемости людей, слежение за эпизоотологической обстановкой среди птиц, контроль за состоянием среды их обитания и содержания.
Профилактические мероприятия
Включают борьбу с орнитозом среди домашних птиц, регулирование численности голубей, ограничение контакта с ними. Важный момент - соблюдение ветеринарно-санитарных правил при ввозе из-за рубежа птиц, перевозке и содержании птиц в птицеводческих хозяйствах, зоопарках. Больных птиц уничтожают, помещение подвергают дезинфекции. Персонал снабжают спецодеждой и дезинфекционными средствами. Специфическая профилактика не разработана.
Мероприятия в эпидемическом очаге
Больных госпитализируют по клиническим и эпидемиологическим показаниям. За лицами, подвергшимся риску заражения, устанавливают медицинское наблюдение сроком на 30 дней. Экстренную профилактику можно проводить в течение 10 сут доксициклином 1 раз в сутки по 0,2 г или тетрациклином 3 раза в сутки по 0,5 г. В очаге проводят заключительную дезинфекцию 5% растворами хлорамина, лизола, осветленного раствора хлорной извести.
КУ-ЛИХОРАДКА (FEBRIS Q)
Ку-лихорадка (болезнь Деррика-Бернета) - острое зоонозное природноочаговое заболевание с развитием ретикулоэндотелиоза, синдрома интоксикации, часто с атипичными пневмониями.
Краткие исторические сведения
Возбудитель заболевания открыли австралийские ученые Э. Деррик, Ф.М. Бернет и М. Фриман в 1937 г. В это же время Э. Деррик, впервые описавший заболевание у фермеров и рабочих мясных фабрик в Австралии, предложил для него название Q-лихорадка (от англ. queri - неясный). Независимо от австралийских исследователей в США Х. Кокс выделил фильтрующийся агент из клещей - переносчиков лихорадки Скалистых Гор (1938). В России заболевание было давно известно под названием термезской или среднеазиатской лихорадки. В 60-х годах XX в. его изучали П.Ф. Здродовский, М.П. Чумаков, Е.Н. Барташевич и др.
Этиология
Возбудители - мелкие грамотрицательные, чаще палочковидные или кокковидные бактерии Coxiella burnetii рода Coxiella. Относят к облигатным внутриклеточным паразитам, которые размножаются в цитоплазме клеток и способны проходить через бактериальные фильтры. Микроорганизмы склонны к полиморфизму и образованию L-форм. Обладают высокой устойчивостью в окружающей среде (в шерсти, хлопке, соломе и т.д.). В молоке выдерживают нагревание до 90 °С в течение 1 ч, в испражнениях клещей, сухих субстратах, стерильном молоке, нехлорированной воде при 4 °С сохраняют жизнеспособ-
ность более 1 года, в мясе - более 1 мес. Резистентны к действию УФО, растворов формалина, фенола и хлорной извести в обычных концентрациях. Высокую устойчивость определяет способность к образованию спорообразных форм. Для возбудителей характерна фазовая изменчивость с образованием форм, аналогичных S- и R-формам бактерий. Свежевыделенные бактерии обладают Аг 1-й фазы, но после длительных пересевов на куриных эмбрионах трансформируются во 2-ю фазу. Эта диссоциация носит обратимый характер, и после заражения животных набор Аг восстанавливается. Бактерии 2-й фазы склонны к спонтанной агглютинации. Агглютинируются нормальной сывороткой и выявляются в РСК. Аг 1-й фазы проявляют большую иммуногенность, и образующиеся АТ реагируют с Аг обеих фаз. Аг 2-й фазы индуцируют образование АТ, реагирующих только с Аг 2-й фазы.
Эпидемиология
Резервуар и источник инфекции - домашние и дикие животные (преимущественно грызуны) и птицы. Хранителями риккетсий в природе выступают клещи (иксодовые, гамазовые и аргасовые), трансовариально передающие инфекцию потомству. Больные животные выделяют возбудитель на протяжении всей болезни, особенно во время отелов и окотов. Человек представляет эпидемическую опасность крайне редко.
Механизм передачи разнообразный. Возбудитель проникает в организм человека через слизистые оболочки ЖКТ, дыхательного тракта или поврежденный кожный покров. Нередко заражение реализуется через контаминированные молоко и молочные продукты, мясо, воду. Возбудитель может передаваться и аэрогенно (при вдыхании пыли высохших испражнений и мочи больных животных, обработке инфицированных шкур, хлопка, шерсти), а также контактным путем (через руки, загрязненные околоплодными водами, абортусами больных животных). При этом ведущим путем передачи коксиелл является аспирационный.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, но во многих случаях заболевание остается малосимптомным. Постинфекционный иммунитет напряженный, хотя известны случаи повторных заболеваний.
Основные эпидемиологические признаки
Ку-лихорадка имеет выраженную очаговость. Выделяют антропургические (заражение от домашних животных и птиц) и природные очаги. Установлено, что природные очаги поддерживают зараженные клещи. Заболевания бывают спорадическими или групповыми. Заболеваемость отчетливо связана с профессией: значительно чаще болеют охотники, животноводы и лица, занятые сбором, хранением и переработкой животного сырья. В природных очагах болезни заражение чаще происходит весной, летом и осенью. В России заболевание встречается в Красноярском и Алтайском краях, на Сахалине, в Читинской области, в ряде регионов Западной и Центральной Сибири и почти на всей территории Европейской части (преимущественно в южных регионах). Ежегодно в стране регистрируют около 500-600 случаев болезни.
Патогенез
В соответствии с механизмами заражения возбудители заносятся в организм через дыхательные пути, ЖКТ или кожный покров без образования первичного аффекта. При последующем возникновении бактериемии коксиеллы поражают органы СМФ, где образуются очаги инфекции с размножением возбудителей в эндотелии сосудов, гистиоцитах и макрофагах, пролиферацией ретикулоэндотелия, периваскулитами и некробиозом клеток. Возможны поражения ЦНС, печени, почек и других органов. Бактериемию сопровождают токсинемия и развитие аллергических реакций. При аэрогенном заражении вследствие выраженной пневмотропности возбудителей развивается инфильтративный процесс в легких. В зависимости от напряженности иммунологических реакций у больных в большинстве случаев происходит элиминация риккетсий и наступает полное выздоровление. Однако вместе с тем возможна длительная персистенция возбудителей в организме, что обусловливает развитие затяжных и хронических форм болезни у некоторых пациентов.
Клиническая картина
Выделяют острую, подострую и хроническую формы ку-лихорадки различной степени тяжести. Наиболее часто встречается острая форма заболевания с поражением легких.
Острая форма
Инкубационный период варьирует от 3 до 30 дней, иногда он затягивается до 3 мес.
Начальный период
Заболевание начинается с внезапного появления озноба, быстрого, в течение 1-2 дней, повышения температуры тела до 39-40 °С, однако при легких формах болезни ее начало может быть постепенным с познабливанием, небольшим недомоганием, субфебрилитетом.
Начальный период длится несколько дней, отмечают ознобы, потливость, выраженную слабость, сильную диффузную головную боль, миалгии и артралгии, нарушения сна. Очень характерны болезненность при движении глазами, ретробульбарные боли, боли в глазных яблоках. При тяжелом течении ку-лихорадки могут быть раздражительность, возбуждение, бессонница, делирий. При остром начале заболевания часто отмечают гиперемию лица и шеи, инъекцию сосудов склер, конъюнктивы и слизистой оболочки ротоглотки, разрыхленность и гипертрофию миндалин, энантему на мягком нёбе. В случаях постепенного начала болезни кожный покров может быть бледным. Изредка (1-5% случаев) возникает экзантема, обычно розеолезного или пятнистопапулезного характера. Патология со стороны органов дыхания в течение первых дней болезни обычно не развивается. Тоны сердца приглушены, характерных изменений пульса не наблюдают.
Период разгара
Сохраняются основные жалобы больных. Высокая температура держится в среднем до 1 нед, но иногда после этого лихорадка затягивается на субфебрильных величинах еще на 7-8 дней, после чего наступает 2-я волна повышения температуры. В подобных случаях общая длительность лихорадки составляет 2-3 нед и более. Типичная температурная кривая не характерна.
Отмечают относительную брадикардию, приглушенность тонов сердца, умеренную артериальную гипотензию. Развиваются клинические признаки со стороны органов дыхания в виде бронхита или трахеита. Однако уже в это время при рентгенологическом обследовании можно обнаружить усиление легочного рисунка и мелкоочаговые конусовидные инфильтраты, локализующиеся преимущественно в нижних отделах легких или прикорневых зонах. Последние иногда сливаются, образуя массивные затемнения легочной ткани, но без формирования полостей. Увеличение перибронхиальных лимфатических узлов создает картину расширения, уплотнения и деформации корней легких. С развитием пневмонии у больных усиливается сухой, а затем влажный кашель с выделением серозно-гнойной мокроты, изредка с примесью крови. Появляется одышка, возможны незначительные боли в грудной клетке, усиливающиеся при поражении плевры.
Физикальные данные по сравнению с рентгенологическими изменениями скудные:
- выявляют участки укорочения перкуторного звука и жесткого дыхания;
- небольшое количество сухих или влажных мелкопузырчатых хрипов в легких.
Течение пневмонии торпидное, рентгенологические изменения исчезают медленно.
В случаях с выраженной интоксикацией возможны тошнота и рвота, резко снижается аппетит. Вследствие поражения вегетативной нервной системы иногда у больных возникают непостоянные боли в животе и метеоризм.
Внешне язык напоминает таковой при брюшном тифе:
- отечный;
- обложен грязно-серым налетом;
- с чистыми краями и кончиком;
- с отпечатками зубов по краям.
Характерно умеренное увеличение печени и селезенки. Период реконвалесценции
Проявляется снижением температуры тела в течение 2-4 дней, улучшением самочувствия и состояния больных, постепенным исчезновением основных клинических признаков заболевания. Для этого периода обычно характерна физическая и психическая астения, нередки вегетативно-сосудистые расстройства.
Помимо острой циклической, ку-лихорадка может проявляться в подострой форме длительностью от 1 до 3 мес или в хронической форме продолжительностью от нескольких месяцев до 1 года и более. В этих случаях заболевание протекает на фоне субфебрилитета с рентгенологически выраженными инфильтративными процессами в легких, иногда с развитием эндокардитов и васкулитов.
Приведенное описание ку-лихорадки дает возможность врачу заподозрить заболевание на основании клинико-эпидемиологических данных. Вместе с тем проявления болезни весьма разнообразны и могут выражаться в виде гриппоподобного, ложнобруцеллезного, ложнотуберкулезного, септического и других клинических вариантов. В этих случаях, особенно при легком течении заболевания, постановка клинического диагноза затруднительна без специальных методов лабораторной диагностики.
Дифференциальная диагностика
Диагностика ку-лихорадки только на основании клинической симптоматики чрезвычайно затруднена в связи с полиморфизмом клинических проявлений. При поражениях легких необходимо дифференцировать заболевание прежде всего с туберкулезом легких, поскольку в ряде случаев инфильтраты при ку-лихорадке могут располагаться в верхних отделах легких и напоминать туберкулезные. В первые дни заболевания пневмония при ку-лихорадке протекает со скудными клиническими проявлениями (отсутствие кашля, мокроты, болей в грудной клетке, одышки, притупления перкуторного звука и влажных хрипов). Однако уже в этот период можно наблюдать значительные изменения в легких при рентгенологическом обследовании. При других формах заболевания его следует отличать от гриппа, брюшного тифа и паратифов, острого и подострого бруцеллеза, безжелтушного лептоспироза и сепсиса. Из клинических проявлений ку-лихорадки диагностическое значение имеют острое начало с быстрым повышением температуры тела, боли в глазных яблоках, гиперемия лица, инъекция сосудов склер, раннее увеличение печени и селезенки, развитие пневмонии преимущественно интерстициального характера.
Лабораторная диагностика
В гемограмме у многих больных выявляют лейкопению с нейтропенией, лимфо- и моноцитоз, умеренное увеличение СОЭ.
Основу специфической диагностики составляют серологические методы:
- РА;
- РСК;
- РНИФ и др.
В практической деятельности преимущественно используют постановку РСК с парными сыворотками крови. Специфичность этой реакции достаточно высокая, однако положительной она становится поздно, диагностические титры АТ (1:16-1:32) появляются не ранее конца 2-й или на 3-й неделе болезни. Более чувствительна РНИФ, при сочетанном применении РСК и РНИФ диагноз удается подтвердить в абсолютном большинстве случаев. Возможно выделение микроорганизма из крови и других клинических материалов и его микробиологическая идентификация, однако этот метод сопряжен с опасностью для персонала. Разработана методика постановки ПЦР.
Осложнения и исходы
Благодаря специфическому этиотропному лечению в настоящее время осложнений практически не наблюдают. При тяжелом течении болезни в отдельных случаях могут развиться эндокардит, плеврит, менингоэнцефалит, пиелонефрит, панкреатит. Процент летальных исходов обычно составляет менее 1%.
Лечение
В качестве средств этиотропного лечения применяют тетрациклины (тетрациклин по 1,2-1,6 г в сутки, доксициклин по 200 мг в сутки) или левомицетин в дозе 2 г в сутки внутрь. Наиболее эффективно парентеральное введение комбинации тетрациклина с левомицетином по 0,9 и 1,5 г в сутки соответственно.
При непереносимости тетрациклинов можно применять рифампицин, эритромицин. Длительность курса лечения определяется клиническим эффектом препаратов и в среднем составляет 8-10 дней. Укорочение курса или снижение доз препаратов способствует возникновению рецидивов. Длительно сохраняющиеся рентгенологические изменения в легких не являются показанием к пролонгированию этиотропного лечения. Одновременно проводят дезинтоксикационное лечение, назначают витамины, антигистаминные и нестероидные противовоспалительные препараты (индометацин, бутадион, ортофен, диклофенак и др.). При отсутствии улучшения можно назначать глюкокортикоидные гормоны, в частности преднизолон (по 30-60 мг в сутки), дексаметазон (по 3-4 мг), длительностью 5-8 дней.
Эпидемиологический и эпизоотологический надзор
Осуществляют в очагах обоих типов. Включают наблюдение за заболеваемостью людей и животных, постоянное отслеживание масштабов циркуляции возбудителя и контроль за соблюдением общих санитарных правил.
Профилактические мероприятия
Основа профилактики ку-лихорадки - ветеринарно-санитарные мероприятия. Разнообразие источников инфекции и путей передачи значительно затрудняет организацию и проведение профилактических мероприятий. Определенное значение имеют противоклещевая обработка пастбищ, охрана животноводческих хозяйств от заноса в них возбудителей. В неблагополучных по ку-лихорадке хозяйствах запрещают ввод в хозяйство и вывод из него животных, употребление мяса вынужденно убитых животных. Молоко из неблагополучных хозяйств можно употреблять только в кипяченом виде. Отелы (окоты) подозрительных на заболевание ку-лихорадкой животных проводят в отдельных помещениях с последующим уничтожением последа, мертворожденного плода и тщательной дезинфекцией помещения и инвентаря. К уходу за больными животными допускают только переболевших либо вакцинированных лиц. Группы риска (животноводы, рабочие мясокомбинатов, ветеринары, рабочие по обработке сырья животноводства и др.) подлежат активной иммунизации живой вакциной.
Мероприятия в эпидемическом очаге
Больного госпитализируют, выписку осуществляют после клинического выздоровления. В очаге проводят текущую и заключительную дезинфекцию с применением хлорсодержащих средств. Экстренную антибиотикопрофилактику среди лиц, бывших в очаге инфекции, проводят назначением 0,2 г доксициклина 1 раз в сутки или 0,3 г рифампицина 2 раза в сутки курсом 10 дней.
БОЛЕЗНЬ КОШАЧЬИХ ЦАРАПИН
Болезнь кошачьих царапин (доброкачественный лимфоретикулез, гранулема Моляре, cat scratch disease) - острое инфекционное заболевание из группы бартонеллезов, возникающее после укусов или царапин кошек. Протекает с
образованием первичного аффекта в виде нагнаивающейся папулы с последующим развитием регионарного лимфаденита и синдрома интоксикации.
Краткие исторические сведения
Р. Дебре и К. Фоше (1932), затем В. Молляре и соавт. (1950) описали доброкачественно протекающую лимфаденопатию, возникавшую после царапин кошек. Трудности выделения возбудителя в течение длительного времени обусловливали разнообразные предположения о вирусной, хламидийной, риккетсиозной этиологии заболевания. В 1995 г. A. Bergmans с сотрудниками методом ПЦР подтвердили ключевую роль в развитии заболевания Bartonella henselae, выделявшуюся ранее из ткани пораженных лимфатических узлов. Сходные данные были получены и другими исследователями.
Этиология
Возбудитель заболевания - Bartonella henselae, мелкая грамотрицательная бактерия - отличается выраженным полиморфизмом, медленным ростом на специальных избирательных питательных средах. Идентифицировано 2 генотипа бартонеллы, но зависимость между генотипом и клиническим течением болезни не установлена. Паразитирует у кошек, собак, грызунов, обезьян. Не выдерживает нагревания, но хорошо сохраняется при низких температурах.
Эпидемиология
Резервуар и источник инфекции - кошки, в отдельных случаях - собаки. Предположительно в распространении инфекции определенное значение могут иметь мелкие грызуны и обезьяны. От человека человеку возбудитель не передается. Сами кошки остаются здоровыми, возбудитель входит в состав нормальной микрофлоры полости рта кошек.
Механизм передачи - контактный. Возбудитель проникает через поврежденную кожу (укусы, царапины или имевшиеся до контакта с кошкой микротравмы). Иногда слюна кошек попадает на конъюнктиву, что ведет к развитию глазных форм болезни.
Естественная восприимчивость людей
Естественная восприимчивость людей не изучена.
Основные эпидемиологические признаки
Заболевание распространено во всех странах, но довольно часто остается нераспознанным, поэтому судить об истинном уровне заболеваемости сложно. Чаще встречается в зимние месяцы. Мужчины болеют несколько чаще, чем женщины. Среди заболевших преобладают дети. Описаны случаи заболеваемости среди ветеринарных и лабораторных работников. Зарегистрированы отдельные семейные вспышки.
Патогенез
Патогенез остается недостаточно изученным. Возбудитель проникает в организм человека через поврежденные кожный покров и слизистые оболочки (царапины, нанесенные когтями кошек, или их укусы). В половине случаев в
месте его внедрения образуются папулы, впоследствии нагнаивающиеся. Из ворот инфекции риккетсии лимфогенно диссеминируют в регионарные лимфатические узлы. Под их воздействием в лимфатических узлах образуются воспалительные инфильтраты с гиперплазией ретикулярных клеток, а в дальнейшем гранулемы, напоминающие бруцеллезные, абсцессы с образованием свищей. Токсины возбудителей и продукты распада тканей обусловливают развитие интоксикации и аллергических реакций. Впоследствии возможно регрессирование воспалительного процесса со склерозированием лимфатических узлов. Гематогенное диссеминирование с формированием гранулем в различных паренхиматозные органах развивается редко, главным образом при иммунодефицитных состояниях. В таких случаях заболевание может проявляться разнообразными системными поражениями, включая эндокардит, бациллярный ангиоматоз и бациллярный пелиозный гепатит.
Клиническая картина
Инкубационный период
Варьирует от 3 до 10-14 дней, но в отдельных случаях может затягиваться до 1,5 мес.
Начальный период
На месте зажившей царапины или укуса часто возникает первичный аффект в виде красноватых папул диаметром от 1 до 5 мм, не причиняющих значительного беспокойства больному и часто остающихся незамеченными.
Период разгара
Позднее, уже при заживлении царапин и укусов, папулы могут превращаться в везикулы и затем нагнаиваться. После спонтанного вскрытия пустул иногда они подсыхают, но чаще изъязвляются, а впоследствии покрываются корочками, после отторжения которых не остается рубцов. Через 2-3 нед после возникновения первичного аффекта развивается регионарный лимфаденит с наиболее типичной локализацией в подмышечных впадинах и на шее, реже в паховых и бедренных областях. Нередко лимфаденит может быть практически единственным проявлением болезни. В 80% случаев отмечают увеличение одного лимфатического узла. Размеры лимфатических узлов обычно от 1 до 5 см, но иногда и до 10 см в диаметре, при пальпации они слегка болезненные, плотные, кожа над ними зачастую гиперемирована. Признаки периаденита не наблюдают. Проявляются симптомы интоксикации в виде повышения температуры тела, недомогания, головной боли, снижения аппетита. Длительность температурной реакции с умеренными проявлениями интоксикации варьирует от 1 до 3 нед, лимфаденит может сохраняться значительно дольше, до нескольких месяцев. В ряде случаев могут возникнуть полиморфная аллергическая сыпь на коже, микрополилимфаденит, увеличиваются печень и селезенка.
Период реконвалесценции
Характеризуется исчезновением признаков интоксикации, постепенным рассасыванием, склерозированием или нагноением лимфатических узлов с последующим их вскрытием.
В 5-10% случаев заболевание также может протекать в виде атипичных форм. Одна из них регистрируется при попадании возбудителя на слизистую оболочку глаза и проявляется в виде одностороннего конъюнктивита с образованием язв и узелков на конъюнктиве и увеличением околоушных и подче-
люстных лимфатических узлов. В редких случаях возникает нейроретинит, обычно односторонний, проявляющийся отеком диска зрительного нерва, образованием пятен звездообразной формы и узелков на сетчатке, ангиоматозными изменениями под ней. При этом полностью сохраняется острота зрения.
Проявления неврологического варианта бартонеллеза еще более редки, но разнообразны:
- радикулиты;
- полиневриты;
- миелит;
- энцефалопатия;
- энцефалит;
- менингит и др.
Они развиваются обычно через 2-3 нед от момента развития лимфаденопатии. При развитии висцерального варианта наблюдают поражение печени и селезенки с длительной лихорадкой, генерализованной лимфаденопатией.
Дифференциальная диагностика
Заболевание следует отличать от туляремии, чумы, бруцеллеза, инфекционного мононуклеоза, лимфом различной этиологии и других заболеваний, сопровождающихся лимфаденопатией. Для болезни кошачьих царапин характерно образование первичного аффекта с последующим развитием синдрома интоксикации и регионарного лимфаденита, чаще всего с увеличением одного лимфатического узла без признаков периаденита.
Большое значение имеют данные эпидемиологического анамнеза:
- контакт с кошками;
- нанесение ими царапин, укусов или ослюнение.
Лабораторная диагностика
У части больных в гемограмме отмечают эозинофилию и повышение СОЭ. Серологическую диагностику проводят с помощью РСК. Постановка кожноаллергических проб с аллергенами, полученными при термоинактивации пунктата лимфоузлов больных. Пробы дают положительный результат у 90% больных, но проявляются лишь на 3-4-й неделе от начала болезни и, кроме того, ограничены возможным риском передачи гемоконтактных инфекций. В последнее время разрабатывают ИФА с антисывороткой и ПЦР. При гистологическом исследовании биоптатов папул и лимфатических узлов можно обнаружить возбудителя.
Осложнения и исходы
Осложнения крайне редки. Известно возникновение серозных менингитов, энцефалитов и энцефаломиелитов.
Лечение
Для лечения неосложненного фелиноза рекомендуют азитромицин в средних терапевтических дозах в течение 5-10 дней.
Применяют альтернативные препараты:
- эритромицин по 500 мг 4 раза в сутки;
- доксициклин по 100 мг 2 раза в сутки;
- ципрофлоксацин по 500 мг 2 раза в сутки;
- хлорамфеникол, офлоксацин в средних терапевтических дозах курсом 10-14 дней.
Эффективность альтернативных препаратов проявляется далеко не всегда и не подтверждена соответствующими исследованиями. Назначают симптоматические средства, витамины, антигистаминные препараты. Показаны нестероидные противовоспалительные препараты (индометацин, вольтарен и др.). При размягчении лимфатического узла делают его разрез или пункцию для удаления гноя.
Профилактические мероприятия
Специфическая профилактика не разработана. Меры личной профилактики сведены к ограничению контакта с кошками. Мероприятия в эпидемическом очаге не регламентированы.
ВИРУСНЫЕ ГЕМОРРАГИЧЕСКИЕ ЛИХОРАДКИ
Общая характеристика
Многочисленная группа опасных и особо опасных острых лихорадочных природно-очаговых заболеваний вирусной этиологии. Характеризуются:
- признаками интоксикации;
- своеобразным поражением мелких кровеносных сосудов (универсальная капилляропатия) с нарушением проницаемости сосудистой стенки;
- геморрагическим синдромом;
- изменениями в ЦНС, периферической нервной системе и внутренних органах.
В табл. 4-9 представлены вирусные геморрагические лихорадки, известные в настоящее время (Ющук Н.Д., Венгеров Ю.Я., 1999).
Общие признаки геморрагических лихорадок включают следующие.
• Этиология. Возбудители - РНК-геномные вирусы четырех семейств - Arenaviridae, Bunyaviridae, Filoviridae и Flaviviridae. Их объединяет тропизм к эндотелию мелких кровеносных сосудов (капилляров, артериол, венул). Некоторые репродуцируют в организме членистоногих-переносчиков и передаются через слюну, половым путем (трансовариально), наследуясь от одного поколения членистоногих другими. В организм человека они попадают при укусах членистоногих. Подобные возбудители известны как арбовирусы (от англ. arthropod-borne - передающиеся через членистоногих). Вторая группа вирусов постоянно циркулирует среди грызунов (крыс, мышей). Они также известны как робовирусы (от англ. rodent-
borne - передающиеся от грызунов). В условиях дикой природы возможна циркуляция некоторых вирусов среди приматов (лихорадки желтая, Денге, Крым-Конго, Рифт-Валли). Большую проблему представляет обнаружение и выделение новых возбудителей геморрагических лихорадок. Лишь за последнее десятилетие описаны венесуэльская, бразильская геморрагические лихорадки, вызванные неизвестными ранее вирусами. РНК-геномные вирусы по сравнению с ДНК-геномными отличает значительно более выраженная мутационная способность, что может лежать в основе появления в природе новых возбудителей геморрагических лихорадок.
• Принадлежность к заболеваниям с природной очаговостью. Заболевания регистрируют в определенных ареалах, ограниченных областями распространения источника или переносчиков возбудителей. Среди природноочаговых вирусных инфекций выделяют эндемичные зоонозы, ареал которых связан с ареалом животных - хозяев и переносчиков (например, клещевой энцефалит), и эндемичные метаксенозы, связанные с ареалом животных, прохождение через организм которых является важным условием распространения болезни (например, желтая лихорадка). Включение человека в циркуляцию возбудителей в природе случайно и выступает тупиком инфекционного процесса, так как человек не способен заразить большое количество переносчиков. Вместе с тем доказана и прямая передача инфекции от человека к человеку (лихорадки КрымКонго, Марбург, Эбола, Ласса, Сабиа). При активизации хозяйственной деятельности человека, особенно связанной с освоением новых территорий, возрастает потенциальная угроза вспышек новых для данной местности инфекционных заболеваний. Несмотря на то что ряд болезней носит экзотический характер, должна существовать настороженность медицинских работников в силу возможного заноса геморрагических лихорадок на территорию РФ.
• Высокие контагиозность и летальность, свойственные некоторым геморрагическим лихорадкам, позволяют отнести их к группам опасных и особо опасных инфекций (лихорадки Эбола, Марбург, Ласса, желтая лихорадка). В последнее время в связи с резко возросшим уровнем международного сотрудничества, большим объемом международных перевозок грузов и людей возрастает и возможность завоза этих заболеваний, способных в силу высокой контагиозности и особой опасности вызвать чрезвычайную эпидемическую ситуацию. Возбудителей вирусных геморрагических лихорадок относят к потенциальным агентам биотерроризма. Профилактические мероприятия по отношению к ним направлены на предупреждение заноса инфекции и строятся на основе Правил по санитарной охране территории РФ.
• Общность патогенеза геморрагических лихорадок. Многие вопросы патогенеза геморрагических лихорадок остаются до сих пор неизученными. В его основе лежит системное деструктивное поражение стенок мелких кровеносных сосудов, обусловленное вазотропным действием вирусов. Большинство авторов выделяют 2 основных направления в развитии механизмов заболевания:
◊ нарушение проницаемости сосудов;
◊ развитие геморрагических проявлений.
Таблица 4-9. Вирусные геморрагические лихорадки
Примечание.
ГЛД - геморрагическая лихорадка Денге;
ГЛПС - геморрагическая лихорадка с почечным синдромом.
Возбудители геморрагических лихорадок имеют разнообразные факторы патогенности, обеспечивающие адгезию, инвазию в различные клетки макроорганизма и репликацию в них. После попадания вируса в организм и его накопления в клетках ретикулогистиоцитарной системы развивается виремия. Возбудитель проникает в макрофаги, моноциты, лимфоциты (лимфобласты), дендритные клетки, эндотелий, гепатоциты, клетки коры надпочечников. Некоторые вирусы способны репродуцироваться в иммунокомпетентных клетках и диссеминировать в их цитоплазме. Установлены основные механизмы вирусного поражения эндотелия сосудов:
◊ иммуноопосредованное (иммунокомплексное);
◊ прямое цитотоксическое в результате репликации вирусов. Активация процессов перекисного окисления в макрофагах приводит к
развитию изменений со стороны свертывающей и противосвертывающей систем крови:
◊ агрегации тромбоцитов (предположительно с внедрением в них вируса);
◊ проявлениям геморрагического синдрома;
◊ повышению активности гистаминовой системы;
◊ нарушению проницаемости сосудов.
Выход из них мелкодисперсных белков (в первую очередь альбуминов) и электролитов обусловливает развитие периваскулярного серозно-геморрагического отека и сгущения крови. Повышению проницаемости сосудов способствуют компоненты калликреин-кининовой системы. Нарушения микроциркуляции и дисбаланс свертывающей и противосвертывающей систем крови создают предпосылки к развитию:
◊ ИТШ;
◊ ДВС-синдрома;
◊ тромбозов;
◊ некрозов;
◊ деструкции клеток;
◊ денатурации белков;
◊ образованию белковых ауто-Аг и иммунных комплексов.
При диссеминировании внутри макрофагов вирусы оседают и вызывают поражения в различных органах и системах - соединительной ткани, почках, надпочечниках, гипоталамусе, печени и т.д. В печени в основном страдают купфферовские клетки, в почках - мальпигиев слой (без развития воспаления). Характерно снижение белково-синтетической функции печени с уменьшением уровня плазменных факторов коагуляции. При серозно-геморрагическом отеке межуточного вещества пирамид со сдавлением канальцев прогрессирует олигурия со снижением клубочковой фильтрации, нарушением канальцевой реабсорбции (изогипостенурия), может развиться ОПН. Поражение клеток коры надпочечников играет важную роль в развитии токсического шока у больных с вирусными геморрагическими лихорадками.
Вирусы геморрагических лихорадок стимулируют выброс многочисленных воспалительных, противовоспалительных и регуляторных медиаторов. Высокая экспрессия биологически активных медиаторов в крови приводит к иммунологическому дисбалансу и прогрессированию заболевания. Огромную роль в развитии указанных поражений играют формирующиеся иммунные комплексы и нейроэндокринные нарушения. В дальнейшем при разрушении
макрофагов, содержащих вирус, усиливаются активация гистамина и образование свободных кислородных радикалов, повреждающих эндотелий.
Проникновение вируса в лимфоциты вызывает нарушение их дифференцировки, что придает иммунопатологии сходство с таковой при СПИДе:
◊ снижается количество Т-лимфоцитов;
◊ нарастают титры ауто-АТ классов IgA и IgG.
Клетки, освободившиеся от вирусов, сохраняют на своих мембранах гликопротеиды (мишени для ауто-АТ), что может привести к подавлению синтеза белка в клетках и их гибели. В результате у больных развивается выраженная иммуносупрессия и высокая виремия. В полиурический период остается сниженной канальцевая реабсорбция, что поддерживается эндокринными нарушениями.
• Развитие геморрагического синдрома. Характерны высыпания и геморрагии на коже и слизистых оболочках, микрокровоизлияния во многих внутренних органах, кровотечения различной локализации. Интенсивность геморрагического синдрома варьирует в зависимости от вида лихорадки.
• Интоксикация характеризуется общими симптомами:
◊ артериальной гипотонией;
◊ брадикардией;
◊ глухостью тонов сердца;
◊ дистрофическими процессами и нарушением проводимости в миокарде (на ЭКГ);
◊ поражением почек;
◊ тромбоцитопенией;
◊ лейкопенией (при ГЛПС - лейкоцитоз).
• Высокая летальность, составляющая при различных геморрагических лихорадках от 5 до 80%.
• Выздоровление вызывает развитие длительной и стойкой невосприимчивости к повторным заражениям (например, после ГЛПС).
В учебнике представлены геморрагические лихорадки в соответствии с программой преподавания инфекционных болезней на лечебных факультетах медицинских вузов России.
ХАНТАВИРУСНЫЕ ИНФЕКЦИИ
В настоящее время род Hantavirus семейства Bunyaviridae включает несколько вирусов (Хантаан, Дубрава, Пуумала, Сеул, Sin Nombre, Проспект Хилл, каньона Муэрто и др.), вызывающих зоонозные эндемичные и природноочаговые робовирусные заболевания у человека. Резервуар вирусов - различные грызуны (возбудитель выделяют из слюны, мочи и фекалий). Среди животных возможны бессимптомное носительство либо эпизоотии. Человек заболевает при прямом контакте с загрязненными объектами, употреблении загрязненных продуктов или вдыхании вирусов.
Основные проявления хантавирусных инфекций:
- ГЛПС;
- хантавирусный легочный синдром (ХЛС).
ГЕМОРРАГИЧЕСКАЯ ЛИХОРАДКА
С ПОЧЕЧНЫМ СИНДРОМОМ
ГЛПС - острая вирусная природно-очаговая зоонозная инфекция с синдромом интоксикации, развитием универсального капилляротоксикоза с геморрагическими проявлениями и поражением почек.
Краткие исторические сведения
Заболевание известно под различными названиями с начала ХХ в. (корейская, дальневосточная, уральская, ярославская, закарпатская, скандинавская и прочие лихорадки). В 1938-1940 гг. на Дальнем Востоке России проведены комплексные исследования, в результате которых предположена вирусная природа заболевания, его основные эпидемиологические и клинические закономерности (А.А. Чумаков, М.П. Смородинцев). Заболевание получило название дальневосточного геморрагического нефрозонефрита. Одновременно в Северной Маньчжурии среди личного состава японской Квантунской армии было зарегистрировано сходное заболевание, получившее название болезни Сонго. Несколько позже случаи заболевания были отмечены в Тульской области, Швеции, Норвегии и Финляндии, Южной Корее (более 2000 больных во время корейскоамериканской войны 1951-1953 гг.). В дальнейшем природные очаги выявлены во многих областях РФ (особенно на Урале и в Среднем Поволжье), на Украине, в Молдавии, Белоруссии, Югославии, Румынии, Венгрии, Чехии, Словакии, Болгарии. В 1976-1978 гг. корейский ученый H.W. Lee выделил возбудитель у полевых мышей (вирус Hantaan - по названию реки в Корее), несколько позже возбудитель был изолирован от больного человека. Общее название для различных вариантов болезни ГЛПС введено по решению научной группы ВОЗ в 1982 г.
Этиология
Возбудители - РНК-геномные вирусы рода Hantavirus семейства Bunyaviridae. В настоящее время известны около 30 сероваров возбудителя ГЛПС, из них на территории России циркулируют 2 генотипа:
- Dobrava-Belgrad;
- Puumala.
Вирусы, выделенные в разных местах от различных грызунов, вызывают заболевания с неодинаковой степенью тяжести. Первые 4 серотипа вызывают у людей заболевания, объединенные названием ГЛПС. Тяжело протекают заболевания, вызванные вирусами 1-го серовара (основной резервуар - полевая мышь), наиболее легко - вызванные вирусами 2-го серовара. Малопатогенными считают вирусы так называемого недифференцированного серовара. Вирусы относительно устойчивы во внешней среде, длительно сохраняются при низких температурах. В сыворотке крови, взятой у больных, сохраняются до 4 сут при 4 °С.
Эпидемиология
Резервуар и источники инфекции - различные виды диких мышевидных грызунов, наиболее часто - полевая мышь (Apodemus agrarius), рыжая полевка (Clethrionomys glareolus), серая (Rattus norvegicus) и черная (R. rattus) крысы. Инфек-
ция у грызунов протекает длительно и бессимптомно. Животные выделяют вирусы ГЛПС с мочой, калом, слюной. Больные люди практически не заразны.
Механизм передачи - разнообразный. Пути передачи - воздушнопылевой, пищевой, контактный (через поврежденную кожу). Передача вируса между грызунами происходит при непосредственном контакте (спаривание, использование одного убежища, создание зимних агрегаций у полевых мышей). Возможно аспирационное заражение (при вдыхании пыли сухих экскрементов) и алиментарное (при поедании трупов зверьков, а также ослюненной инфицированными зверьками или запачканной экскрементами пищи). При заражении людей летом наиболее распространен алиментарный путь (инфицирование продуктов выделениями зараженных грызунов или грязными руками во время еды). Обычны и контактные заражения при отлове зверьков (через укус грызуна) и при попадании свежих экскретов зверьков на ссадины на коже. В холодное время, особенно в помещении, преобладает аспирационный путь заражения (через вдыхание пыли во время уборки помещений, при перевозке сена и соломы и работе с ними на ферме). Циркуляцию возбудителя в популяции грызунов также поддерживают гамазовые клещи, однако трансмиссивной передачи человеку не происходит, так как большинство обитающих на грызунах клещей не нападают на человека.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Постинфекционный иммунитет стойкий. Повторные случаи заболевания возможны при инфицировании вирусом другого серотипа.
Основные эпидемиологические признаки
Заболевание широко распространено в различных странах, в том числе в России. В 1997 г. в РФ отмечен самый высокий за предшествующие 40 лет уровень заболеваемости ГЛПС (20 921 случай). В 2007 г. в РФ зарегистрировано 5138 случаев ГЛПС, показатель на 100 000 населения - 3,61, в том числе среди детей до 17 лет - 271 и 0,99 соответственно. В возрастной структуре заболевших дети составляют 5,3%. Заболевания ГЛПС зарегистрированы в 48 субъектах РФ и занимают одно из первых мест среди всех природно-очаговых болезней человека. За 2007 г. зарегистрировано 29 случаев ГЛПС со смертельным исходом, показатель на 100 000 населения - 0,02. Среди заболевших 57% составляют городские жители. Эпидемически активные природные очаги ГЛПС расположены в основном в умеренных широтах европейской части и на Дальнем Востоке, где основными хозяевами в природе выступают рыжая полевка, а также полевая мышь, восточно-азиатская мышь и серая крыса. Самая высокая заболеваемость отмечается в Приволжском федеральном округе - 11,8 на 100 000 населения (3593 случая), в Центральном федеральном округе - 3,4 (1264 случая). На территории Сибирского федерального округа заболевания ГЛПС не зарегистрированы.
Наибольшее число случаев ГЛПС зарегистрировано:
- в Республике Башкортостан - 1141 случай (показатель на 100 000 населения - 28,1);
- Удмуртской Республике - 382 случая (показатель - 24,7);
- Нижегородской области - 255 случаев (показатель - 7,5);
- Пензенской области - 245 случаев (показатель - 17,4);
- Оренбургской области - 226 случаев (показатель - 10,6).
В эпидемический процесс вовлечены дети всех возрастов, за исключением детей до 1 года. По клиническим признакам можно выделить 2 типа очагов ГЛПС. На Дальнем Востоке заболевание протекает, как правило, с большей долей тяжелых форм, более выраженными инфекционно-токсическими проявлениями, чаще встречающимся и тяжелым геморрагическим синдромом. В европейских очагах преобладают среднетяжелые и легкие формы болезни. Летальность как показатель тяжести течения ГЛПС составляет 1-3% в европейских и 15-20% в дальневосточных районах страны.
Болезнь проявляется в виде спорадических и групповых заболеваний. Описаны семейные вспышки ГЛПС, например, в семье заболели отец, мать и 3 детей после того, как все они во время засолки капусты на зиму ели капустные листья. Наиболее крупная вспышка среди сотрудников одной из лабораторий была связана с воздушно-пылевым путем передачи после размещения в виварии большого количества отловленных грызунов. Заболели 52 сотрудника (86,6% неиммунных лиц, 5 человек, перенесших ранее ГЛПС, не заболели). Наиболее активные очаги заболевания сосредоточены на стыках различных ландшафтов. Заражения в природе возникают при всех видах деятельности человека в лесу и поле, а также при обработке сельскохозяйственных продуктов. Болеют люди всех возрастов, но чаще мужчины в возрасте 20-50 лет (активная деятельность).
Заболеваемость в России отличает летне-осенняя сезонность (после массовой миграции грызунов в жилые помещения), составляя в различных регионах от 0,2 до 90 на 100 000 населения. ГЛПС проявляется в основном в виде спорадических заболеваний, но характерны и эпидемические вспышки.
Патогенез
Основные патогенетические механизмы описаны в общем разделе «Вирусные геморрагические лихорадки». Особенности патогенеза ГЛПС:
- первичная репликация вируса в альвеолярных макрофагах (соответственно основному воздушно-пылевому пути заражения);
- развитие виремии обычно лишь в начальном периоде болезни (в разгаре заболевания при развитии полиорганной патологии вирус из крови больных не выделяется);
- преимущественно иммуноопосредованный механизм поражения различных тканей и органов;
- характерные патоморфологические изменения почек:
◊ увеличение;
◊ кровоизлияния в околопочечную клетчатку и ткань почек;
◊ отек окружающей клетчатки;
◊ поражение нервных окончаний.
Клиническая картина
Инкубационный период
Составляет чаще всего 2-3 нед, но иногда может удлиняться до 45-50 сут. Заболевание отличает строгая цикличность течения с последовательной сменой нескольких периодов.
Период продромальных признаков
Продолжается 2-3 дня, иногда может отсутствовать. Постепенно нарастает температура тела, чаще она остается субфебрильной. Больные жалуются на вялость, быструю утомляемость, головную боль, слабость, недомогание, познабливание, снижение аппетита, боли в конечностях, особенно в коленных суставах, ломоту во всем теле, расстройство сна, першение и слабые царапающие боли в горле. Слизистая оболочка ротоглотки гиперемирована за счет расширения сосудов.
Признаки ангины сопровождает подчелюстной и шейный лимфаденит. В этот период диагноз можно предположить лишь в очаге заболевания с учетом эпидемиологических данных.
Лихорадочный период
Продолжается от 2-3 до 5-8 сут. Начинается с резкого подъема температуры тела до 39-40 °С, сопровождающегося ознобом. Температурная реакция прямо пропорциональна дальнейшей тяжести заболевания. В динамике этого периода высокая температура тела сохраняется постоянно, возможны 2 или даже 3 волны лихорадки по 2-3 дня. Усиливается головная боль, особенно в лобной и височных областях, появляются боли в околопочечной области или пояснице. Больные отмечают общую разбитость, слабость, головокружение, боли в мышцах всего тела. Обычно они апатичны, малоподвижны, на вопросы отвечают неохотно, с замедленной реакцией, стонут.
Большое диагностическое значение имеют жалобы, связанные с расстройством зрения (15-30% случаев):
- болезненность в глазных яблоках при движении;
- светобоязнь;
- расплывчатое изображение предметов (туман перед глазами, мелькание мушек);
- снижение остроты зрения.
Некоторые больные видят все предметы в красном цвете. В ряде случаев может развиться отек радужной оболочки глаза.
С самого начала болезни можно обнаружить симптомы поражения ЖКТ:
- сухость во рту;
- жажду;
- анорексию;
- тошноту;
- рвоту;
- запоры (в редких случаях поносы);
- боли в эпигастральной области.
Иногда боли иррадиируют от почечной капсулы по всему животу.
При осмотре у больного отмечают яркое-красное одутловатое лицо, инъекцию сосудов склер и конъюнктив, набухшие веки, гиперемию в зеве. Кожа сухая и горячая. Тоны сердца приглушены. Отмечают нормокардию, наклонность к гипотонии. Положителен симптом поколачивания в поясничной области (проверять осторожно из-за опасности разрыва почечной капсулы!). Отмечают резкие боли при надавливании в точке пересечения прямой мышцы спины и XII ребра с обеих сторон.
Диурез несколько снижен или нормальный. Удельный вес мочи повышен, в моче обнаруживают эритроциты, лейкоциты. В крови увеличен цветной пока-
затель, количество лейкоцитов снижено или нормально, отмечают тромбоцитопению, степень выраженности которой прямо пропорциональна тяжести заболевания.
Геморрагический период
В различных очагах заболевания частота развития геморрагических проявлений колеблется от отдельных случаев до 70-90% пациентов.
На фоне нормальной, субфебрильной или высокой температуры тела появляется петехиальная или более массивная мелкопятнистая экзантема без определенной локализации. Высыпания не имеют тенденции к слиянию, но могут образовывать различные фигуры, например, группируются в виде полос (удар хлыста). Появление повторных высыпаний чаще совпадает с ухудшением состояния больных. На слизистой оболочке ротоглотки может развиться энантема в виде точечных или более крупных кровоизлияний.
Экзантема и энантема - это предвестники грозных геморрагических проявлений:
- кровотечений из десен, носа;
- почечных кровотечений в виде микрогематурии или массивной макрогематурии;
- желудочно-кишечных кровотечений (особенно опасны!). Возможны кровоизлияния в склеры (симптом красной вишни).
Со стороны сердечно-сосудистой системы отмечают приглушение тонов сердца, брадикардию. Учащение пульса в этот период болезни служит неблагоприятным прогностическим признаком. Усиливается артериальная гипотензия. У тяжелобольных можно наблюдать резкое падение АД, в отдельных случаях - развитие ИТШ.
Иногда у больных отмечают катаральные признаки со стороны верхних дыхательных путей, кровохарканье, легочные кровотечения.
Частые рвотные движения, а также упорная икота указывают на тяжелое течение болезни. Язык суховат, живот умеренно вздут, при его пальпации отмечают локальную или диффузную болезненность. Увеличение печени наблюдают редко (7-25%), у отдельных больных пальпируется мягкий край селезенки.
При среднетяжелом течении болезни наблюдают умеренный, а при тяжелом течении - высокий лейкоцитоз, СОЭ не повышается.
Период органных поражений (олигурический период)
Протекает чаще на фоне нормальной температуры тела и проявлений геморрагического синдрома. В первую очередь обращают на себя внимание признаки нарастающей азотемии:
- усиливаются жажда, рвота (может быть геморрагической);
- вялость;
- заторможенность;
- головная боль;
- развивается упорная бессонница.
У части больных наблюдаются психомоторное возбуждение, иногда делириозное состояние. Выраженные боли в пояснице могут проецироваться на живот, из-за поясничных болей пациенту трудно лежать на спине. Отмечают сухость кожного покрова.
В результате распада тканевых белков в очагах некробиоза и нарушения азотовыделительной функции почек в крови прогрессивно нарастает уровень азотистых шлаков. Развивается олигоили анурия.
Количество выделяемой суточной мочи соответствует тяжести болезни:
- незначительное его снижение при легких формах;
- 300-900 мл в сутки при среднетяжелых;
- менее 300 мл при тяжелых случаях заболевания.
Резко снижается относительная плотность мочи; в дальнейшем у большинства больных развивается изогипостенурия. В моче увеличивается количество белка, обнаруживают свежие эритроциты, гиалиновые и зернистые цилиндры, вакуолизированные клетки почечного эпителия (клетки Дунаевского).
В крови как следствие органных поражений нарастает нейтрофильный лейкоцитоз с палочкоядерным сдвигом, возрастает число моноцитов и плазматических клеток, развивается тромбоцитопения. Начинает повышаться СОЭ.
Длительность периода органных поражений - от 7-10 дней до 1 мес.
Полиурический период
Проявляется прекращением рвоты, постепенным исчезновением болей в пояснице и животе. Развивается полиурия с выделением мочи до 5 л в сутки и более с сохранением изогипостенурии. Нормализуются показатели креатинина и мочевины. Постепенно исчезает брадикардия. Сохраняются сухость во рту, жажда. Выделительная функция почек нормализуется через 1-2 нед, концентрационная функция восстанавливается лишь через 3-5 нед и более.
Период реконвалесценции
Продолжается от 3 до 12 мес. В течение длительного времени остаются выраженная астенизация, патология со стороны почек, особенно в случаях развившегося острого или хронического пиелонефрита. При стойком сохранении (более 6 мес) полиурии, жажды и сухости во рту следует думать о хронической тубулоинтерстициальной нефропатии с нарушением экскреторно-секреторной функции канальцев и повышением суточной экскреции электролитов. Состояние может сохраняться до 10 лет, однако исходов в ХПН не наблюдают.
Описанные клинические этапы заболевания могут не иметь четких переходных границ между собой или проявляться одновременно.
Дифференциальная диагностика
ГЛПС следует отличать от лептоспирозов, гриппа, энтеровирусной инфекции, пиелонефрита и острого гломерулонефрита, различных видов прочих геморрагических лихорадок.
При обследовании больного необходимо обращать внимание на последовательную смену периодов болезни. В лихорадочный период отмечают высокую температуру тела, покраснение и одутловатость лица, инъекцию сосудов склер и конъюнктивы, набухание верхних век и гиперемию зева. Одновременно большинство больных жалуются на мышечные боли, а также боли в пояснице. В этот период положителен симптом поколачивания по поясничной области. В геморрагический период к перечисленным симптомам присоединяется массивная мелкопятнистая сыпь. В более тяжелых случаях экзантема и энантема сменяются геморрагическими проявлениями (кровотечения из десен, носа), моча приобретает красноватый оттенок. В олигурический период температура тела нормализуется, но отчетливо проявляется патология со стороны почек - олигурия или анурия, повышение содержания азотистых шлаков в крови. При исследовании мочи обнаруживают увеличенное количество белка, свежие эритроциты, гиалиновые и зернистые цилиндры. В дифференциальной диагно-
стике могут оказать помощь сведения о прямом или косвенном контакте больного с грызунами.
Лабораторная диагностика
Помимо общих клинических и биохимических анализов, показатели которых рассмотрены выше, применяют РНИФ и ИФА с определением IgM-АТ в сыворотке крови, взятой в максимально ранний период заболевания и затем повторно через 5-7 дней. Подтверждением диагноза будет нарастание титров АТ не менее чем в 4 раза. В крови перенесших ГЛПС АТ (IgG) сохраняются в течение многих лет.
Осложнения и исходы
Обусловлены развитием ИТШ, ОПН, отека легких, острой сердечно-сосудистой недостаточности, органных кровоизлияний и кровотечений, разрывов почки. В редких случаях наблюдают эклампсию с артериальной гипертензией, тоническими и клоническими судорогами, тризмом, потерей сознания, расширением зрачков, замедлением пульса и дыхания. Возможны субарахноидальные кровоизлияния. В Китае (1988) описаны случаи энцефалитов при ГЛПС.
При развитии уремии как терминальной стадии ОПН усиливаются тошнота и рвота, появляется икота, затем прогрессируют сонливость, непроизвольные подергивания отдельных групп мышц (мимических, мышц рук) и другая мозговая симптоматика. Значительно нарастает уровень мочевины и креатинина в крови.
Лечение
Поскольку больные ГЛПС неконтагиозны, они могут быть госпитализированы в любой стационар, оснащенный соответствующей лабораторной службой, позволяющей организовать систематический контроль функции почек. Транспортировку больных проводят на носилках с матрацем с соблюдением максимальной осторожности из-за опасности разрыва почечной капсулы.
Режим строгий постельный, включая первые дни полиурии. Необходимы тщательный уход, туалет полости рта, контроль диуреза и опорожнения кишечника.
Диета № 4 без ограничений белка и соли, с достаточным количеством витаминов, особенно С и группы В. При тяжелом течении временно ограничивают потребление продуктов, содержащих большое количество белка и калия (так как у больных развивается гиперкалиемия). Назначают обильное питье, в том числе минеральных вод (Боржоми, Ессентуки № 4 и др.).
Этиотропное лечение эффективно в первые 3-4 дня болезни. Рекомендован рибавирин внутривенно в индивидуальных дозах в зависимости от массы тела, разведенных до общего объема 100 мл 5% раствором глюкозы. Возможен пероральный прием препарата в суточной дозе 800-1000 мг в течение 5 дней и более.
Патогенетическое лечение проводят с учетом тяжести течения болезни и ведущих клинических синдромов. В легких случаях назначают рутин, аскорбиновую кислоту, кальция глюконат, димедрол, салицилаты до 1,5 г в сутки.
В более тяжелых случаях показано внутривенное введение 5% раствора глюкозы, изотонического раствора натрия хлорида по 500 мл с добавлением 200- 400 мл гемодеза и 10 мл 5% раствора аскорбиновой кислоты. При тяжелом течении заболевания показано внутривенное введение свежезамороженной плазмы, тромбоцитарной массы, альбумина, назначают этамзилат натрия, s-аминокапроновую кислоту, викасол. При нарастании признаков сосудистой недостаточности показаны вливания реополиглюкина (200-400 мл). В период олигурии инфузии изотонического раствора натрия хлорида отменяют, целесообразно дробное парентеральное введение фуросемида.
Характер и объем проводимого инфузионного дезинтоксикационного лечения определяет фильтрационная функция почек:
- общее суточное количество внутривенных растворов не должно превышать объем суточной мочи более чем на 750 мл;
- при выраженной почечной недостаточности - на 500 мл. Показания к применению глюкокортикоидов:
- угроза развития выраженной почечной недостаточности (анурия, многократная рвота);
- олигурия в течение 2 нед и более;
- развитие менингоэнцефалита.
В этих случаях применяют преднизолон парентерально в суточной дозе от 1 до 2 мг/кг курсом 3-6 дней. При развитии ИТШ или острой сосудистой недостаточности суточную дозу преднизолона увеличивают до 10-12 мг/кг.
Показаны антигистаминные препараты, ингибиторы протеаз (трасилол, контрикал внутривенно до 50 000 ЕД), препараты антибрадикининового действия, улучшающие микроциркуляцию (продектин по 0,25 г 4 раза в сутки).
Для улучшения диуреза применяют 5-10 мл 2,4% раствора эуфиллина (добавляют в капельницу). Лазикс малоэффективен, маннитол не показан.
В случае отсутствия клинического эффекта от проводимого лечения в течение 2-4 дней и нарастания признаков ОПН (мочевина более 30 ммоль/л и креатинин более 600 мкмоль/л), а также при развитии почечной эклампсии или менингоэнцефалита больных переводят на гемодиализ.
При выраженных геморрагических проявлениях показаны дицинон, s-аминокапроновая кислота, замещающие дозы крови. При сильных почечных болях применяют промедол, аминазин, димедрол, дроперидол, седуксен в виде литических смесей. В случаях развития сердечно-сосудистой недостаточности внутривенно вводят коргликон, строфантин.
Для профилактики вторичной бактериальной инфекции мочевыводящих путей применяют нитрофураны, нитроксолины (после восстановления диуреза). В полиурический период постепенно отменяют медикаментозное лечение, продолжая внутривенное введение изотонического раствора натрия хлорида.
Выписку больных проводят при клиническом выздоровлении (при этом возможны остаточные полиурия и изогипостенурия).
После выписки реконвалесценты нетрудоспособны в течение 1-4 нед. В дальнейшем их освобождают от тяжелой физической работы, занятий спортом на 6-12 мес.
В восстановительный период рекомендуют полноценное питание, обильное питье (щелочные минеральные воды, настои шиповника и трав с мочегонным действием), применение витаминных препаратов, физиотерапевтических процедур (диатермия, электрофорез), массажа и лечебной физкультуры.
Эпидемиологический надзор
Основные задачи:
- изучение санитарно-эпидемиологического состояния территорий страны;
- выявление и инвентаризация природных очагов;
- установление контингентов населения, соприкасающихся с природными очагами;
- прогнозирование активности природного очага;
- обоснование объемов и сроков проведения профилактических мероприятий, оценка их эффективности.
Профилактические мероприятия
Включают благоустройство лесопарковой территории, барьерной и домовой дератизации на территории природных очагов и гигиеническое воспитание населения. Специфическая профилактика не разработана, хотя получены лабораторные образцы вакцины на основе вируса, циркулирующего на территориях европейской части РФ.
Мероприятия в эпидемическом очаге
Больной ГЛПС не представляет опасности для окружающих и не нуждается в строгой изоляции. Диспансерное наблюдение за переболевшими осуществляют в сроки, определяющиеся степенью тяжести болезни. Карантин не вводят. В очаге проводят текущую и заключительную дезинфекцию.
ХАНТАВИРУСНЫЙ
ЛЕГОЧНЫЙ СИНДРОМ
ХЛС - острая вирусная природно-очаговая зоонозная инфекция, протекающая с выраженной интоксикацией, развитием универсального капилляротоксикоза и преимущественным острым поражением легких и плевры.
Краткие исторические сведения
Предположительно, возбудитель заболевания поражал жителей пустынных областей юго-запада Северной Америки на протяжении многих столетий. Устные истории племени навахо сообщают о заболевании, похожем на ХЛС, поражавшем молодых членов племени после умеренно холодных зим. В этих историях предупреждается об опасности сосуществования человека с грызунами. Сообщается о двух эпидемиях среди индейцев навахо в 1917-1918 и 1934 гг.
Впервые ХЛС описан в 1993 г. у больного с фатальным течением респираторного дистресс-синдрома взрослых неустановленной природы. Как эндемичное заболевание впервые зарегистрирован в США в регионе штатов НьюМексико, Аризона, Колорадо и Юта. Эти штаты имеют между собой прямые границы и на карте образуют 4 прямых угла, поэтому первоначально его стали называть болезнью 4 углов.
Этиология
Возбудитель - РНК-геномный вирус рода Hantavirus семейства Bunyaviridae. В настоящее время у возбудителя ХЛС выделяют по крайней мере несколько подтипов:
- Sin Nombre;
- Bayou;
- Black Creek Canal;
- New York-1;
- Monongahela.
Эпидемиология
Случаи ХЛС зарегистрированы только на Американских континентах (более 2000 случаев в США, Канаде, Аргентине, Чили, Бразилии, Уругвае, Парагвае, Боливии), наибольшее количество случаев заболевания отмечено в США - 416
(ВОЗ, 2006).
Резервуаром и источниками инфекции служат крысы и мыши, наиболее часто - красная полевка (Clethrionomys rutilus), белоногие хомячки (Peromyscus maniculatus, P. leucopus), черная (Rattus rattus) и серая (R. norvegicus) крысы, домовая мышь (Mus musculus), хлопковые крысы (Sigmodon hyspidus) и др. Каждый из подтипов хантавирусов распространен в ареале грызунов одного вида. Инфекция у грызунов протекает в виде бессимптомного носительства, длящегося в течение нескольких недель. Хантавирусы выделяют от грызунов в большинстве государств, даже в тех странах, где ХЛС не зарегистрирован.
Механизм передачи до конца не изучен.
Передача возбудителя от животных к человеку может реализоваться:
- через инфицированные выделения грызунов ингаляционным путем (вдыхание пыли);
- контактным путем при попадании инфицированного материала на конъюнктиву;
- поврежденные кожный покров и слизистые оболочки;
- при укусах грызунов и инфицировании раны их слюной;
- энтерально при поступлении в ЖКТ инфицированных пищевых продуктов или воды.
Членистоногие могут передавать возбудитель только в среде грызунов. Для человека данный путь не имеет практически никакого значения. Хантавирусы не относятся к арбовирусам в отличие от других представителей семейства Bunyaviridae. Передача от больного человека к здоровому считается маловероятной, подобные случаи не зарегистрированы.
Естественная восприимчивость людей
Естественная восприимчивость людей и характеристика постинфекционного иммунитета не определены.
Основные эпидемиологические признаки
Отмечена территориальная приуроченность заболеваний к местам обитания белоногих хомячков.
Для заболеваемости характерна четкая сезонность - наибольшее количество случаев отмечают в весенне-летнее и летне-осеннее время. Преимущественно болеют жители сельской местности (75%). Заболевание чаще встреча-
ют у молодых здоровых мужчин (60%), что, возможно, связано с особенностями их профессиональной деятельности (фермеры, охотники, лесозаготовители, сельскохозяйственные рабочие и т.д.).
Патогенез
Остается до конца не изученным. Хантавирусы проникают в клетки СМФ посредством слияния суперкапсида вириона с клеточной мембраной. После сборки дочерней популяции вирионы транспортируются в секреторных везикулах к плазматической мембране и высвобождаются путем почкования. Виремия, как и при ГЛПС, наблюдается только в начальном периоде заболевания. Ключевым звеном в развитии ХЛС является системное поражение стенок мелких сосудов (капилляров, артериол, венул), однако в отличие от возбудителя ГЛПС вирусы обладают тропностью к эндотелию капилляров легких. Возникающие поражения микроциркуляторного русла сопровождаются выработкой провоспалительных цитокинов ИЛ-1, ИЛ-6, ФНО-α, специфических цитотоксических Т-лимфоцитов CD8, усиливающих проявления ДВС-синдрома и вызывающих плазматическое пропитывание периваскулярной ткани, гемоконцентрацию, гиповолемию, гипоперфузию. Чрезвычайно высокий уровень вирусных Аг в микроциркуляторном русле легочной ткани приводит к развитию цитотоксических иммунных реакций, сопровождающихся повышением проницаемости сосудов. Указанные нарушения лежат в основе быстро прогрессирующего отека легких, развития острого респираторного дистресс-синдрома.
Типичные хантавирусные тельца включений обнаруживают и в эндотелиальных клетках сосудов лимфатических узлов, селезенки и других внутренних органов, включая миокард. В последнем случае это приводит к вторичным выраженным нарушениям сократительной функции сердца вплоть до развития кардиогенного шока.
Клиническая картина
Инкубационный период
Варьирует от 3 дней до 6 нед, чаще составляя 3-5 сут. В развитии заболевания выделяют несколько периодов:
- продромальный;
- кардиопульмональный;
- реконвалесценции.
Продромальный период
Продолжается 3-5 сут (иногда до 7-10 дней).
Характерны неспецифические признаки, близкие к таковым при обычных вирусных инфекциях:
- слабость;
- недомогание;
- миалгии;
- ломота в пояснице.
В начальный период у больных также можно наблюдать повышение температуры тела, озноб, головную боль, головокружение, сухой кашель, тошноту, рвоту, диарею и некоторые другие признаки.
Недомогание, понос и головокружение выявляют приблизительно в половине всех наблюдений. Реже отмечают:
- артралгии;
- боли в пояснице и животе. Кардиопульмональная стадия
Длительность варьирует от 1 до 5 дней. Типичный признак - усиление кашля, вначале сухого, а затем с гнойной мокротой. Появляется постепенно усиливающаяся одышка (тахипноэ более 30 в минуту), возникает чувство нехватки воздуха. Со стороны сердечно-сосудистой системы отмечают признаки выраженных нарушений сократительной способности миокарда и снижения ударного объема. Резко нарастает тахикардия, достигая 120 в минуту и более, снижается наполнение пульса и АД. Больные часто жалуются на обильное потоотделение, боли в груди, головокружение и прогрессирующую слабость. Физикально и рентгенологически выявляют признаки быстро развивающегося отека легких. Незначительные вначале влажные хрипы захватывают все легочные поля.
Могут присоединиться боли в животе. Иногда можно наблюдать анурию, периферические отеки, катаральный ринит и назофарингит, экзантемы, геморрагические проявления, ригидность мышц затылка.
Быстро прогрессирующий некардиогенный отек легких с дыхательной недостаточностью может возникнуть рано, уже в 1-е сутки от начала заболевания.
Период реконвалесценции
Продолжается 1,5-2 нед и характеризуется восстановлением функций организма. Дыхательная недостаточность, гемодинамические нарушения и диурез восстанавливаются быстро, в течение 1-2 дней. Однако на полное восстановление функции легких может потребоваться до 6 мес.
Клиническую картину ХЛС отличает достаточно тяжелое течение. Летальность в США (1993) составляла около 80%, в настоящее время она снизилась до
30-40%.
Дифференциальная диагностика
Достаточно затруднена в связи с тем, что общие признаки ХЛС аналогичны таковым при других, менее тяжелых вирусных заболеваниях.
Помимо клинических проявлений заболевания (лихорадка, недомогание, миалгии, кашель, диспепсические расстройства, а в дальнейшем развитие прогрессирующей одышки, ослабленного дыхания, мелкопузырчатых хрипов в легких, тахикардии), следует учитывать данные эпидемиологического анамнеза:
- присутствие и численность грызунов в помещениях или местах профессиональной деятельности людей;
- контакты с грызунами и их выделениями;
- время года.
Заболевание следует дифференцировать от застойной сердечной недостаточности, кардиогенного отека легких, кардиогенного шока, острого респираторного дистресс-синдрома, лептоспироза, легочной чумы, туляремии, пневмоний различной этиологии, отравлений фосгеном. Течение кардиопульмональной стадии требует дифференциальной диагностики с острым респираторным дистресс-синдромом, пневмонией, хирургической патологией брюшной полости (аппендицит).
Лабораторная диагностика
С помощью твердофазного ИФА и реакции иммуноблота в острый период заболевания можно выявить противовирусные IgM, а позднее - IgG. В качестве метода ранней диагностики предложена ПЦР на обнаружение в сыворотке крови РНК возбудителя. Учитывая скоротечность развития заболевания и высокую летальность, выявление нарастания титров АТ имеет ретроспективный характер.
В гемограмме у больных выявляют нейтрофильный лейкоцитоз (более 10× 109/л) с выраженным сдвигом влево, атипичные лимфоциты (иммунобласты). Достаточно рано развивается и сохраняется на протяжении всего заболевания тромбоцитопения (менее 150×109/л). Увеличиваются показатели протромбинового времени, гематокрита, азота мочевины крови и креатинина, лактатдегидрогеназы, АСТ. В сыворотке крови уменьшаются показатели общего белка, бикарбонатов, нарастают признаки метаболического ацидоза. При рентгенологическом исследовании легких выявляют быстро прогрессирующие инфильтраты, плевральный выпот.
Лечение
На ранних стадиях болезни рекомендовано назначение рибавирина (см. раздел «Геморрагическая лихорадка с почечным синдромом»), в США его часто применяют на протяжении всех этапов заболевания. В кардиопульмональной фазе лечение проводят только в условиях отделения интенсивной терапии. Борьбу с отеком легких осуществляют по общеизвестным принципам. В ряде случаев необходимы интубация и ИВЛ, коррекция КЩС, катетеризация бедренной вены и легочной артерии. Для предотвращения недостаточной перфузии рекомендовано применять вазопрессоры (допамин, добутамин, адреналин). Пациентам с лихорадкой и респираторным дистресс-синдромом для предотвращения развития бактериальной пневмонии и сепсиса назначают антибиотики широкого спектра (цефалоспорины 3-го поколения, аминогликозиды, при дифференцировании с легочной чумой - хлорамфеникол). Изучается методика экстракорпоральной мембранной оксигенации, считающаяся перспективной.
Профилактические мероприятия
Неспецифическую профилактику проводят с учетом неконтагиозности больных. В первую очередь она касается таких групп, как пешие туристы, сельскохозяйственные рабочие, лесорубы, работники водопроводной и канализационной служб, продовольственных складов. Наиболее эффективны меры, обеспечивающие ограничение деятельности населения в местах скопления грызунов. Применяют средства дератизации, ограничение доступа грызунов к воде и пищевым продуктам. При установке ловушек против грызунов рекомендуют использовать 10% хлорную известь как дезинфицирующее средство, а при работе с потенциально инфицированными грызунами - одноразовые перчатки. Перед входом в нежилые помещения необходимо открыть двери и окна с целью проветривания для уменьшения числа циркулирующих вирусных частиц в воздухе. В Европе и Китае ведут разработки вакцины, однако ее создание связано с трудностями изолирования вирусов in vivo и отсутствием модели лабораторных животных для их культивирования.
Мероприятия в эпидемическом очаге не регламентированы.
НАИРОВИРУСНЫЕ ИНФЕКЦИИ
ГЕМОРРАГИЧЕСКАЯ
КРЫМСКАЯ-КОНГО ЛИХОРАДКА
Острая зоонозная природно-очаговая вирусная инфекция с трансмиссивным механизмом передачи, характеризующаяся выраженным геморрагическим синдромом с тромбоцитопенией и двухволновой лихорадкой.
Краткие исторические сведения
Приоритет в описании современной клинической картины болезни по материалам вспышки в Крыму принадлежит военным врачам Приморской армии 4-го Украинского фронта (Колачев и др., 1945). Заболевание было названо Крымской геморрагической лихорадкой. В это же время М.П. Чумаковым с сотрудниками был выделен возбудитель. Позднее в Африке (1967-1969) выделен вирус Конго, сходный по антигенным свойствам с вирусом Крымской геморрагической лихорадки. В настоящее время заболевание зарегистрировано в странах Европы, Средней Азии и в Казахстане, Калмыкии и Дагестане, частично на юге Волгоградской области, в Иране, Ираке, Объединенных Арабских Эмиратах, Индии, Пакистане, странах Африки (Заир, Нигерия, Уганда, Кения, Сенегал, ЮАР и др.).
Этиология
Возбудитель - РНК-геномный вирус рода Nairovirus семейства Bunyaviridae. Вирус малоустойчив в окружающей среде. При кипячении возбудитель инактивируется мгновенно, при 45 °С - через 2 ч. Вирус хорошо сохраняется в замороженном состоянии, чувствителен ко всем известным дезинфектантам. Лиофилизированная культура сохраняется до 2 лет. Для выделения и идентификации вируса наиболее удобно заражать в мозг и брюшную полость новорожденных белых крыс в культуре клеток перевиваемых линий почек поросят.
Эпидемиология
Резервуар и источники инфекции - дикие и домашние животные (коровы, козы, зайцы и др.), более 20 видов иксодовых клещей (наиболее часто пастбищные клещи родов Hyalomma, Dermacentor и др.). Больной человек представляет опасность для окружающих. Вирус обнаруживают в крови и выделениях, содержащих кровь (рвотных массах, а также при кишечных, носовых и маточных кровотечениях).
Механизм передачи - обычно трансмиссивный (переносчики - иксодовые клещи, мокрецы) или контактный; в лабораториях возможен и аэрогенный. При заражении от человека основным является прямой контакт с кровью (взятие крови для исследования, внутривенные вливания, остановка кровотечения, проведение искусственного дыхания рот в рот и т.п.). Отмечены случаи внутрилабораторного заражения персонала во время аварий при центрифугировании вируссодержащего материала, а также в других условиях (заражение вирусом из воздушной среды).
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, продолжительность постинфекционного иммунитета составляет 1-2 года.
Основные эпидемиологические признаки
Болезнь отличает выраженная природная очаговость, регистрируют в виде вспышек и спорадических случаев. Очаги инфекции приурочены преимущественно к полупустынным, степным, лесостепным и припойменным ландшафтам с теплым климатом.
В России заболевание периодически регистрируют в Краснодарском и Ставропольском краях, а также в Астраханской и Ростовской областях. В 2007 г. в РФ зарегистрировано 233 случая Крымской геморрагической лихорадки с 4 летальными исходами (1,7%) в 7 субъектах Южного федерального округа.
Активизация природных очагов Крымской геморрагической лихорадки связана:
- с климатическими условиями (теплая зима, ранняя весна);
- с сокращением посевных площадей сельскохозяйственных культур;
- с восстановлением степной растительности в результате сокращения поголовья овец;
- с увеличением численности зайцев, лисиц и других млекопитающих - прокормителей клещей;
- с активизацией циркуляции вируса в природных биотопах с вовлечением в эпидемический процесс сельскохозяйственных животных и определенных групп населения.
Эффективным профилактическим мероприятием Крымской геморрагической лихорадки является акарицидная обработка скота в хозяйствах и территорий в местах оздоровления и отдыха детей и взрослых в сроки до достижения пика численности клещей, а также применение средств индивидуальной защиты при проведении работ в животноводстве.
Заболеваемость возрастает с мая по октябрь, что связано с периодом активного нападения клещей. Основную роль в передаче вируса человеку играют взрослые особи. Преобладают случаи заражения при уходе за скотом и его выпасе, сельскохозяйственных работах (сенокос, уборка хлопчатника и др.). Чаще болеют мужчины 20-40 лет, в основном животноводы и сельскохозяйственные рабочие. Описаны внутрибольничные вспышки и внутрилабораторные заражения.
Патогенез
Общие черты патогенеза аналогичны другим геморрагическим лихорадкам (см. раздел «Общая характеристика»). Его особенности состоят в поражении клеток гипоталамуса, костного мозга со снижением кроветворения, нарушениях функций печени и почек. В острой стадии заболевания характерно развитие интенсивной виремии, лимфопении, тромбоцитопении. В терминальной стадии развивается печеночная, почечная и острая сердечно-сосудистая недостаточность. Патолого-анатомические изменения преимущественно обусловлены резко выраженным геморрагическим синдромом.
Клиническая картина
Инкубационный период
После укуса инфицированного клеща продолжается 3-7 дней, после контакта с кровью больного или инфицированными тканями может удлиняться до 9-14 сут. Заболевание варьирует от стертых до тяжелых форм.
Начальный период
Продолжается 3-6 дней. Характерны острое начало, высокая температура тела с ознобом, миалгиями и артралгиями, головной болью, болями в животе и пояснице. Часто наблюдают возбуждение, сухость во рту, головокружение, рвоту, диарею. Лицо, шея, плечевой пояс и слизистые оболочки полости рта гиперемированы. АД снижено, отмечают склонность к брадикардии. На 3-5-й день болезни возможен срез на температурной кривой, что обычно совпадает с появлением кровотечений и кровоизлияний.
Разгар болезни
Соответствует последующим 2-6 дням. Клиническими особенностями данного вида лихорадки являются выраженные геморрагические реакции в разных сочетаниях. Степень их выраженности определяет тяжесть и исход заболевания и широко варьирует от петехиальной экзантемы до массивных полостных кровотечений. Резко ухудшается состояние больных. Отмечают подавленность настроения, бледность, акроцианоз, тахикардию, артериальную гипотензию. Нередко возникает увеличение печени, иногда развивается желтуха как гемолитического, так и паренхиматозного характера. В 10-25% случаев возможны возбуждение, менингеальные симптомы, бред, судороги, кома. Почечная патология отступает на второй план, олигурия с признаками азотемии развивается лишь у части больных.
Период реконвалесценции
При доброкачественном течении заболевания продолжается длительное время - от 1-2 мес до 1-2 лет (астения).
Дифференциальная диагностика
В начальный период затруднена. В разгар заболевания Крымскую геморрагическую лихорадку дифференцируют от других инфекций, протекающих с геморрагическим синдромом. Необходимо учитывать, что данное заболевание в РФ встречается в южно-европейских районах, особенно в Краснодарском и Ставропольском краях, а также Астраханской и Ростовской областях, однако возможны завозные случаи заболевания и в других регионах.
Клинические признаки болезни:
- двухволновая лихорадка;
- выраженные геморрагические проявления (от петехиальной экзантемы до обильных полостных кровотечений).
Лабораторная диагностика
Лабораторные исследования проводят в лабораториях с повышенным уровнем биологической защиты. Характерны выраженные лейкопения со сдвигом влево и тромбоцитопения, повышение СОЭ.
В анализе мочи:
- гипоизостенурия;
- микрогематурия.
Специфические методы лабораторной диагностики - это выделение вируса из крови, постановка ИФА для определения его Аг, РСК, реакции торможения непрямой гемагглютинации (РТНГА), НРИФ. Разработана ПЦР.
Осложнения и исходы
Возможны отек легких, пневмонии, тромбофлебит, ОПН, ИТШ, тяжелые желудочно-кишечные кровотечения. Летальность варьирует от 4 до 15-30%.
Лечение
Госпитализация и изоляция больных обязательны. Лечение проводят в соответствии с общими принципами лечения вирусных геморрагических лихорадок (см. раздел «Геморрагическая лихорадка с почечным синдромом»). В ряде случаев отмечен положительный эффект от введения 100-300 мл иммунной сыворотки реконвалесцентов или 5-7 мл гипериммунного иммуноглобулина лошади, а также от применения рибавирина внутривенно и перорально.
Профилактические мероприятия
В природных очагах проводят дератизационные, акарицидные мероприятия; особое внимание уделяют защите людей от клещей. На территории очага в качестве мер личной профилактики рекомендовано ношение защитной одежды, импрегнирование одежды, палаток, спальных мешков репеллентами. По эпидемическим показаниям применяют инактивированную формалином вакцину из мозга зараженных белых мышат или крысят-сосунков.
Мероприятия в эпидемическом очаге
Больного госпитализируют по клиническим показаниям. В стационаре необходимо соблюдение мер личной профилактики. Соблюдают осторожность при проведении инвазивных процедур. В отношении контактных лиц разобщение не проводят. Устанавливают медицинское наблюдение с термометрией в течение 8 сут. Лицам, соприкасавшимся с кровью больного, в качестве экстренной профилактики вводят специфический иммуноглобулин. В очаге проводят дезинфекцию.
ФЛАВИВИРУСНЫЕ ИНФЕКЦИИ ГЕМОРРАГИЧЕСКАЯ ОМСКАЯ ЛИХОРАДКА
Острое зоонозное трансмиссивное природно-очаговое инфекционное заболевание, характеризующееся лихорадкой (часто с повторными волнами), поражением ЦНС, сердечно-сосудистой системы, вегетативной нервной системы и геморрагическими проявлениями.
Краткие исторические сведения
Заболевание впервые описано и выделено в отдельную нозологическую форму во время эпидемии в Омской и Новосибирской областях (1945-1948).
С 1991 г. случаи заболевания у населения не регистрируют, но спорадические эпизоотии среди ондатр отмечают в Омской, Новосибирской, Тюменской, Курганской, Оренбургской и Северо-Казахстанской областях.
Этиология
Возбудитель - РНК-геномный вирус рода Flavivirus семейства Flaviviridae. Он очень близок к вирусу клещевого энцефалита, но не идентичен ему. Вирус высокочувствителен к обработке растворителями жиров. При температуре 4 °С инактивируется через 29 сут, при 37 °С - через 2,5 сут, при 56 °С - через 25 мин, а при 100 °С - через 3 мин. Относительно устойчив к изменениям рН среды. В 50% глицерине вирус сохраняется до 7 мес, в лиофилизированном состоянии - до 2-4 лет.
Эпидемиология
Резервуар и источник инфекции - ондатры (ондатровая болезнь) и широкий круг других грызунов (полевки, бурундуки, водяные крысы и др.). Переносчиками служат пастбищные и иксодовые клещи, блохи, возможно комары. Вирус могут передавать клещи трансовариально и трансфазно. Больной человек опасности для окружающих не представляет.
Механизм передачи - трансмиссивный. Переносчики - гамазовые и иксодовые клещи. Установлено, что основную роль играют клещи Dermacentor pictus и D. marginatus. Есть основание предполагать участие комаров в циркуляции вируса. Возможны контактный (при разделке и обработке тушек ондатр) и воздушно-пылевой (в лабораторных условиях) пути заражения человека.
Естественная восприимчивость людей
Естественная восприимчивость людей изучена слабо. У переболевших формируется стойкий иммунитет.
Основные эпидемиологические признаки
На территории России заболевание встречают в природных очагах Западной Сибири (Омская, Новосибирская, Тюменская, Оренбургская и другие области). В основном регистрируют спорадические случаи. Заболевание чаще регистрируют в сельской местности. В соответствии с периодами активности клещей отмечают 2 пика заболеваемости - в мае и августе-сентябре. Заражение на промысле ондатры возникает в осенне-зимний период. В настоящее время заболевают преимущественно мужчины - охотники и промысловики. Среди персонала, ухаживающего за больными, случаи заражения не отмечены.
Патогенез
В целом изучен недостаточно (аналогичен таковому при других вирусных геморрагических лихорадках). Типичные для геморрагических лихорадок патолого-анатомические изменения в значительной мере касаются ЦНС и вегетативной нервной системы, надпочечников, эндотелия сосудов.
Клиническая картина
Основные признаки и этапы развития заболевания аналогичны таковым при ГЛПС и геморрагической Крымской-Конго лихорадке, хотя имеются некоторые клинические особенности.
Инкубационный период обычно длится не более 3-6 дней.
Экзантема в виде геморрагических и розеолезных элементов непостоянна. Значительно реже развиваются органные кровотечения, обычно они необильные, кратковременные. Вместе с тем часто выявляют патологию со стороны дыхательной системы - это атипичные вирусные мелкоочаговые пневмонии и бронхиты. У большинства больных отмечают нестойкие общемозговые и менингеальные симптомы, но может развиться менингит или менингоэнцефалит. Нарушения функции почек умеренные. Лихорадка держится 4-12 сут, часто наблюдают ее повторные волны.
Дифференциальная диагностика
Заболевание следует отличать от других геморрагических лихорадок, клещевого энцефалита, лептоспирозов. На территории РФ Омская геморрагическая лихорадка встречалась в основном в районах Сибири. При сходстве основных клинических проявлений с другими геморрагическими лихорадками ее часто отличают развитие атипичных мелкоочаговых пневмоний и бронхитов, а также менингеальная симптоматика.
Лабораторная диагностика
Гемограмму отличают повышение содержания гемоглобина и эритроцитов, лейкопения, умеренный нейтрофилез со сдвигом влево, тромбоцитопения, замедленная СОЭ. Отмечают протеинурию, в осадке мочи типично появление вакуолизированных и зернистых клеток эпителия почек и мочевыводящих путей. Методы специфической лабораторной диагностики аналогичны таковым при других геморрагических лихорадках.
Осложнения и исходы
Осложнения нечасты и преимущественно связаны с воздействием вторичной бактериальной флоры. Прогноз заболевания в основном благоприятный, летальность не превышает 1-3%.
Лечение
Специфическое этиотропное лечение не разработано. Патогенетическое и симптоматическое лечение аналогично ГЛПС. Серотерапию не проводят.
Профилактические мероприятия
Аналогичны таковым при геморрагической Крымской-Конго лихорадке. В очагах используют вакцину против клещевого энцефалита (вследствие схожести антигенных характеристик возбудителей развивается стойкий иммунитет против обоих заболеваний). Для специфической профилактики разработа-
на инактивированная вакцина. Прививки показаны рыбакам, пастухам, охотникам, работникам зверопромхозов.
Мероприятия в эпидемическом очаге
Больной Омской геморрагической лихорадкой не представляет опасности для окружающих и не нуждается в строгой изоляции. Карантин не накладывают. Дезинфекцию, дезинсекцию и дератизацию в очаге не проводят. При аварийных случаях в лабораториях (при подозрении на возможное заражение) или в полевых условиях в гиперэндемичных районах при обнаружении присосавшегося клеща проводят пассивную иммунопрофилактику сывороткой крови реконвалесцентов (по 30-50 мл внутримышечно).
ЖЕЛТАЯ ЛИХОРАДКА
Острое облигатно-трансмиссивное заболевание с природной очаговостью из группы вирусных геморрагических лихорадок. Относится к особо опасным инфекциям. Характерно тяжелое течение с высокой лихорадкой, поражениями печени и почек, желтухой, кровотечениями из ЖКТ.
Краткие исторические сведения
Впервые клиническая картина желтой лихорадки была описана во время вспышки в Америке в 1648 г. В XVII-XIX вв. зарегистрированы многочисленные эпидемии в Африке и Южной Америке, вспышки заболевания на юге Европы. Трансмиссивный путь передачи инфекции через комаров Aedes aegypti установил К. Финлей (1881), вирусную этиологию заболевания - У. Рид и Д. Кэррол (1901). Природная очаговость заболевания, роль обезьян в циркуляции возбудителя в очагах установлена исследованиями Стоукса (1928) и Соупера и соавт. (1933). В 1936 г. Ллойд и соавт. разработали эффективную вакцину против желтой лихорадки.
Этиология
Возбудитель - РНК-геномный вирус рода Flavivirus семейства Flaviviridae, имеет 1 серотип и 5 генотипов. Имеет антигенное родство с вирусами японского энцефалита и лихорадки Денге. Патогенен для обезьян, белых мышей и морских свинок. Культивируется в развивающемся курином эмбрионе и культурах тканей. Длительно (более 1 года) сохраняется в замороженном состоянии и при высушивании, но при 60 °С инактивируется в течение 10 мин. Быстро погибает под воздействием УФ-лучей, эфира, хлорсодержащих препаратов в обычных концентрациях. Низкие значения рН среды действуют на него губительно.
Эпидемиология
Резервуар и источники инфекции - различные животные (обезьяны, сумчатые, ежи, возможно грызуны и др.). При отсутствии переносчика больной человек не опасен для окружающих.
Механизм передачи - трансмиссивный. Переносчики - комары родов Haemagogus (на американском континенте) и Aedes, особенно A. aegypti (в Афри-
ке), имеющие тесную связь с жилищем человека. Переносчики размножаются в декоративных водоемах, бочках с водой, других временных резервуарах с водой. Часто нападают на человека. Комары становятся заразными уже через 9-12 дней после кровососания при температуре окружающей среды до 25 °С и через 4 дня при 37 °С. При температуре ниже 18 °С комар теряет способность передавать вирус. В организме комара возбудитель сохраняется в течение всей жизни насекомого, однако трансовариальной передачи возбудителя не происходит. При попадании инфицированной крови на поврежденные кожный покров и слизистую оболочку возможен контактный путь заражения.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая, постинфекционный иммунитет длительный.
Основные эпидемиологические признаки
Желтую лихорадку относят к числу карантинных болезней (особо опасная болезнь), подлежащих международной регистрации. Ежегодно в мире, по данным ВОЗ, регистрируют более 200 000 случаев заболеваний и 30 000 летальных исходов, связанных с желтой лихорадкой, из них 15 000 - это дети до 5 лет жизни. Заболеваемость в настоящее время регистрируют только в тропических районах Африки и Южной Америки (в том числе в странах Карибского бассейна) и Мексике. К эндемичным относят 44 страны. Однако вспышки этого заболевания могут возникать практически на всех территориях, где есть переносчики вируса - от 42° северной до 40° южной широты. В 2007 г. случаи желтой лихорадки регистрировались в Того, Боливии, Бразилии. Распространение вируса из эндемичных районов может реализоваться как через больных лиц, так и с комарами при перевозке грузов.
Различают 2 вида очагов:
- природные (джунглевые);
- городские (антропургические).
Последние чаще проявляются в виде эпидемий. При этом источниками инфекции выступают больные в период виремии. В последние годы желтая лихорадка становится больше городской болезнью и приобретает черты антропоноза (передача осуществляется по цепочке человек-комар-человек). При условиях для распространения возбудителя (вирусоносители, большое количество переносчиков и восприимчивых лиц) желтая лихорадка может принять эпидемический характер. Комар A. aegypti обитает в субтропических районах России, но случаи желтой лихорадки в нашей стране не регистрировались.
Патогенез
Размножение вируса, проникшего в организм при укусе комара, происходит в регионарных лимфатических узлах во время инкубационного периода. В течение первых нескольких дней болезни вирус с кровотоком диссеминирует по всему организму, вызывая поражения сосудистого аппарата печени, почек, селезенки, костного мозга, миокарда, головного мозга и других органов. В них продолжается активная репликация вируса, развиваются выраженные дистрофические, некробиотические, геморрагические и воспалительные изменения. Характерны множественные кровоизлияния в органы ЖКТ, плевру и легкие, а также периваскулярные инфильтраты в головном мозге.
Клиническая картина
Инкубационный период
Длится около 1 нед, изредка до 10 дней. В настоящее время преобладают стертые и легкие формы желтой лихорадки.
При классическом течении (15-20% случаев) заболевание проходит несколько последовательных стадий.
• Фаза гиперемии. Острое начало болезни проявляется быстрым нарастанием температуры тела более 38 °С с ознобом, головной болью, миалгиями, болями в пояснице, тошнотой и рвотой, возбуждением и бредом. В динамике этой фазы болезни указанные признаки сохраняются и усиливаются. При осмотре больных отмечают гиперемию и одутловатость лица, шеи, плечевого пояса, яркую гиперемию сосудов склер и конъюнктив, фотофобию, слезотечение. Характерна гиперемия языка и слизистой оболочки рта. Выраженная тахикардия сохраняется при тяжелом течении болезни или быстро сменяется брадикардией, начальная артериальная гипертензия - гипотензией. Незначительно увеличиваются размеры печени, реже селезенки. Возникают лейкопения, олигурия, альбуминурия. Появляются цианоз, петехии, развиваются симптомы кровоточивости. В конце фазы может быть отмечена иктеричность склер. Длительность фазы гиперемии - 3-4 дня.
• Кратковременная ремиссия. Длится от нескольких часов до 1-2 сут. В это время температура тела обычно снижается (вплоть до нормальных значений), самочувствие и состояние больных несколько улучшаются. В ряде случаев при легких и абортивных формах в дальнейшем постепенно наступает выздоровление. Однако чаще вслед за кратковременной ремиссией вновь возникает высокая лихорадка, которая может держаться до 8-10 сут, считая от начала болезни.
• Период венозного стаза сменяет ремиссию при тяжелом течении болезни. В этот период виремия отсутствует, однако сохраняется лихорадка, отмечают бледность и цианоз кожи, желтушное окрашивание склер, конъюнктив и мягкого нёба. Состояние больного ухудшается, цианоз, как и желтуха, быстро прогрессируют. Возникают распространенные петехии, пурпура, экхимозы. Выражен гепатолиенальный синдром. Характерны рвота кровью, мелена, кровоточивость десен, органные кровотечения. Развиваются олигурия или анурия, азотемия. Возможны ИТШ, энцефалит. ИТШ, почечная и печеночная недостаточность приводят к смерти больных на 7-9-й день болезни.
• Период реконвалесценции в случаях выздоровления протекает длительно. Постинфекционный иммунитет пожизненный.
Дифференциальная диагностика
В РФ желтая лихорадка может встретиться только в виде завозных случаев. При этом необходимо дифференцировать заболевание от лептоспирозов, малярии, риккетсиозов, брюшного тифа, различных геморрагических лихорадок. При клинической дифференциальной диагностике обращают внимание на последовательную смену двух основных фаз в развитии заболевания - гиперемии и венозного стаза - с возможным коротким периодом ремиссии между ними.
Лабораторная диагностика
В начальной стадии заболевания характерны лейкопения, нейтропения с резким сдвигом влево, тромбоцитопения, в разгаре - лейкоцитоз, прогрессирующая тромбоцитопения, повышение гематокрита, азота и калия крови. В моче нарастает количество белка, появляются эритроциты, цилиндры. Отмечают гипербилирубинемию, высокую активность аминотрансфераз (преимущественно АСТ).
В условиях специализированных лабораторий возможны выделение вируса из крови в начальный период, использование биологических методов диагностики (заражение новорожденных мышат). АТ к вирусу определяют с помощью РНГА, РСК, РНИФ, РТНГА, ИФА. Ложноположительные перекрестные серологические реакции возможны при лихорадках Западного Нила и Денге. Разработана ПЦР.
Прогноз
В зависимости от тяжести заболевания летальность варьирует от 5 до 50%.
Лечение
Лечение проводят по тем же принципам, что и ГЛПС, в условиях инфекционных отделений для работы с особо опасными инфекциями. Этиотропное лечение не разработано. Плазма крови реконвалесцентов, применяемая в первые дни болезни, дает слабый лечебный эффект.
Профилактические мероприятия
Направлены на предупреждение заноса возбудителя из-за рубежа и основаны на соблюдении ММСП и Правил по санитарной охране территории. Проводят уничтожение комаров и мест их выплода, защиту от них помещений и использование индивидуальных средств защиты. В очагах инфекции проводят специфическую иммунопрофилактику живой ослабленной вакциной. Ее вводят лицам всех возрастов подкожно в объеме 0,5 мл. Невосприимчивость развивается через 7-10 дней и сохраняется не менее 10 лет. Вакцинацию детей и взрослых проводят перед выездом в эндемичные районы (Южная Африка), где заболевание у вновь прибывших протекает очень тяжело и с высокой летальностью.
В 29 странах Африки и Южной Америки, где заболевание эндемично, вакцинация против желтой лихорадки включена в национальный календарь прививок.
Мероприятия в эпидемическом очаге
Больных госпитализируют в инфекционное отделение. При выявлении больного на судне во время рейса его изолируют в отдельной каюте. Дезинфекцию в очаге не проводят. Любое транспортное средство, прибывшее из стран, неблагополучных по желтой лихорадке, должно иметь сведения о проведенной дезинсекции. Непривитые лица, приехавшие из эндемичных районов, подлежат изоляции с медицинским наблюдением в течение 9 дней. При возникновении вспышки желтой лихорадки немедленно приступают к массовой иммунизации населения.
КЬЯСАНУРСКАЯ ЛЕСНАЯ БОЛЕЗНЬ
Кьясанурская лесная болезнь - острая зоонозная природно-очаговая инфекция с трансмиссивным механизмом передачи - проявляется выраженной интоксикацией, лихорадкой (часто двухфазной), геморрагическим синдромом.
Краткие исторические сведения
Первые случаи заболевания людей описаны в 1956 г. в местности Кьясанур (штат Майсор, Индия) во время эпизоотии у обезьян. Болезнь развивалась через 3-8 дней после посещения леса или контакта с павшими обезьянами. Через год была доказана вирусная природа заболевания. Вирус от больных людей выделялся в течение последних 2 дней инкубационного периода и первых 10 дней болезни. Большая заслуга в открытии и изучении болезни принадлежит Т. Уорку и его сотрудникам по вирусологическому центру в Пуне (Индия).
Этиология
Возбудитель - РНК-геномный вирус рода Flavivirus семейства Flaviviridae. Имеет антигенное сходство с вирусами клещевого энцефалита и Омской геморрагической лихорадки. Быстро инактивируется при нагревании, воздействии УФ-лучей и дезинфектантов.
Эпидемиология
Резервуар и источники инфекции - различные животные (обезьяны и мелкие млекопитающие, особенно дикобразы, белки и крысы). Роль птиц и летучих мышей в качестве хозяев менее значима. Человек не играет существенной роли в передаче вируса.
Механизм передачи - трансмиссивный, переносчики - иксодовые клещи рода Haemaphysalis (особенно Н. spinigera). Роль других видов кровососущих клещей и комаров в циркуляции вируса и заражении людей также не исключена и наиболее вероятна в периоды интенсивных эпизоотий среди обезьян. Клещи могут паразитировать у домашнего скота и распространяться птицами, прилетающими в Индию на зимовку. Описаны случаи внутрилабораторного заражения.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Постинфекционный иммунитет напряженный, типоспецифический.
Основные эпидемиологические признаки
Заболевание имеет выраженную территориальную ограниченность. Природные очаги болезни выявлены в низкогорной зоне тропического леса штата Карнатака в Индии. До настоящего времени остается загадкой исключительно строгая географическая локализация очага болезни. За пределами эндемичных очагов Индии болезнь нигде не обнаружена. Ежегодно в Индии регистрируют несколько десятков больных. Летальность варьирует в разные годы от 1 до 10%. Последняя зарегистрированная вспышка заболевания в 1982-1983 гг. была наибольшей. Заболевание регистрируют преимущественно в холодный период
года - с января по июнь. Чаще болеют взрослые мужчины, посещающие территорию природных очагов.
Патогенез
Патогенез заболевания сходен с таковым при других геморрагических лихорадках.
Клиническая картина
Инкубационный период при кьясанурской лесной болезни составляет 3-7 дней.
Заболевание начинается остро, характерны:
- высокая температура тела;
- озноб;
- головная боль;
- боли в пояснице и конечностях.
Могут наблюдаться боли в глазах, животе, рвота, диарея, гиперестезии. Далее развиваются апатия, заторможенность речи, прострация, помрачение сознания. При осмотре пациентов отмечают гиперемию лица, конъюнктивит, лимфаденопатию.
С 3-4-го дня болезни состояние больных резко ухудшается, развивается геморрагический период с проявлениями, сходными с ГЛПС. Возможны диарея и рвота. На слизистой оболочке мягкого нёба появляются папулы и везикулы. Часто выявляют гепатолиенальный синдром, желтуха не типична.
Лихорадка продолжается 5-12 дней. При нормализации температуры тела довольно быстро исчезают изменения в крови и моче (см. раздел «Геморрагическая лихорадка с почечным синдромом»).
Длительно сохраняются проявления астенизации:
- слабость;
- быстрая утомляемость;
- адинамия;
- головные боли.
Полное восстановление здоровья наступает через 1-2 мес. В период реконвалесценции возможны рецидивы.
Дифференциальная диагностика
Заболевание дифференцируют от других геморрагических лихорадок, менингитов, гриппа, лептоспирозов, сепсиса.
Лабораторная диагностика
Изменения гемограммы:
- лейкопения;
- тромбоцитопения;
- анемия.
Серологическая диагностика - ИФА, РНГА с парными сыворотками. Разработана ПЦР.
Осложнения и исходы
Возможны осложнения в виде обильных внутренних кровотечений, респираторного дистресс-синдрома (альвеолярных кровотечений), судорожного синдрома, серозного менингита, пневмонии. Летальность при Кьясанурской лесной болезни в среднем составляет около 3-10%, при тяжелом течении заболевания увеличивается до 20-30%.
Лечение
Лечение симптоматическое.
Профилактические мероприятия
Защита от нападения клещей. Специфическая вакцинация не разработана.
Мероприятия в эпидемическом очаге
Не регламентированы.
ЛИХОРАДКА ДЕНГЕ И ГЕМОРРАГИЧЕСКАЯ ЛИХОРАДКА ДЕНГЕ
Лихорадка Денге - острая трансмиссивная флавивирусная инфекция доброкачественного течения, проявляется лихорадкой, миалгиями и артралгиями, экзантемой, лимфаденопатией, лейкопенией.
ГЛД (Филиппинская , Тайская, Сингапурская геморрагическая лихорадка, костоломная лихорадка, лихорадка жирафов) - острая вирусная природноочаговая болезнь с трансмиссивным механизмом передачи. Обусловлена повторным инфицированием вирусами Денге. Характерно тяжелое течение с двухволновой лихорадкой, интенсивными мышечными и суставными болями, сыпью, выраженным геморрагическим синдромом.
Краткие исторические сведения
Заболевание известно достаточно давно. В соответствии с основным симптомокомплексом болезнь называли костоломной лихорадкой. Понятие о ГЛД утвердилось лишь в 1954 г. после описания клинической картины заболевания у детей на Филиппинах, а затем и в других странах Юго-Восточной Азии. К этому времени уже были получены доказательства вирусной этиологии болезни (Ашберн П.М., Крейг Ч.Ф., 1907, Сэйбин А., 1944).
Этиология
Возбудитель - РНК-геномный вирус рода Flavivirus семейства Flaviviridae. В настоящее время выделяют 4 антигенных типа и несколько генотипов вируса Денге, имеющих антигенное родство с вирусами желтой лихорадки, японского энцефалита, лихорадки Западного Нила. Вирус термолабилен (при 50 °С за 10 мин инактивируется 90% вирионов), чувствителен к УФО, устойчив к высушиванию. После лиофильного высушивания может сохраняться до 10 лет.
Эпидемиология
Резервуар и источники инфекции - больной человек. Возможными хозяевами инфекции могут быть обезьяны, лемуры, белки, летучие мыши. Человек становится заразным в последние часы (6-18 ч) инкубационного периода и в течение первых 3 дней заболевания. В отсутствие переносчиков не представляет опасности для окружающих.
Механизм передачи - трансмиссивный, основные переносчики - комары Aedes aegypti и A. albopictus. Вирус также могут передавать комары родов Anopheles и Culex. Насосавшийся инфицированной крови комар способен передавать вирус начиная с 4-18-го дня и пожизненно, т.е. 1-3 мес. Трансовариально возбудитель не передается. Попавший с кровью в организм комара вирус размножается, накапливается и попадает в слюнные железы комара, что обеспечивает передачу вируса при очередном кровососании. Комары для своего обитания в городских условиях используют различные контейнеры для воды, емкости из пластика и металла, автомобильные покрышки и т.д. Доказана возможность вертикальной передачи инфекции в последнем триместре беременности, при этом первичная инфекция у новорожденного может протекать как ГЛД.
Естественная восприимчивость людей
Естественная восприимчивость людей к лихорадке Денге высокая, чаще болеют дети и лица, приехавшие в эндемичные районы. Постинфекционный иммунитет типоспецифичный, стойкий и длится несколько лет. Повторные заболевания лихорадкой Денге возможны по истечении этого времени или при инфицировании вирусом иного типа. ГЛД чаще регистрируют у коренных жителей (особенно детей) тропических регионов, где одновременно или последовательно циркулируют несколько серотипов вируса Денге.
Основные эпидемиологические признаки
Болезнь эндемична более чем в 100 странах мира, распространена в ряде стран Юго-Восточной Азии:
- Пакистане;
- Индии;
- Бирме;
- Шри-Ланке;
- Таиланде;
- Вьетнаме;
- Камбодже;
- Лаосе;
- Малайзии;
- Сингапуре.
Заболеваемость совпадает с ареалом распространения основных переносчиков. По данным ВОЗ, в мире ежегодно болеет лихорадкой Денге от 50 до 100 млн человек, ГЛД - 250 000-500 000 человек, из них умирает 25 000 человек. В 2007 г. зарегистрировано более чем 890 000 случаев лихорадки Денге, из них 26 000 - ГЛД. Болезнь наиболее интенсивно проявляется в периоды различных социальных потрясений, сопровождающихся резким ухудшением санитарно-гигиенических условий и появлением большого числа лиц, восприимчивых к инфекции. Эпидемии в городах развиваются бурно, связаны с заносом нового типа (типов) вируса. Болеют преимущественно дети до 14 лет, у взрослых заболевание регистрируют крайне редко.
Патогенез
Предполагают, что ведущее значение в развитии ГЛД имеет последовательное инфицирование различными серотипами вируса. Патогенетические механизмы сходны с другими геморрагическими лихорадками.
Отличительные особенности:
- гиповолемия (до 20%);
- аноксия тканей;
- ацидоз;
- сочетание ДВС-синдрома, печеночных нарушений и тромбоцитопении
(при ГЛД).
Клиническая картина
Классическая доброкачественная форма заболевания (лихорадка Денге) доминирует среди туристов-европейцев. Инкубационный период варьирует в пределах от 1 до 5-15 дней.
Первые признаки болезни:
- высокая лихорадка;
- ретроорбитальная головная боль;
- миалгии в мышцах шеи, спины, поясницы;
- артралгии;
- диспепсические симптомы (анорексия, тошнота, рвота, диарея).
С 3-4-го дня болезни усиливаются озноб и лихорадка, появляется пятнистопапулезная или мелкоточечная сыпь. Экзантема не поражает ладони и подошвы, держится 2-3 сут и чаще исчезает без пигментации и шелушения. Характерен лимфаденит. В крови лейкопения, нейтропения, относительный лимфоцитоз. Показатели гемостаза обычно не нарушены. Температура часто бывает двухволновой с 2-3-дневной апирексией.
Геморрагическая форма заболевания (ГЛД) развивается у жителей ЮгоВосточной Азии в период от 3 мес до 5 лет после перенесенной первичной лихорадки Денге. В первые дни болезни клиническая картина лихорадки Денге и ее геморрагической формы почти не отличается, но затем состояние больного резко ухудшается, возникает повторная рвота, усиливается лихорадка с повышением потоотделения, возникает эмоциональная лабильность. Характерны прогрессирование геморрагического синдрома, сердечно-сосудистой и дыхательной недостаточности. Нередко (около 30% случаев) развивается ИТШ. Часто отмечают клинические проявления двустороннего плеврита. В крови снижен гематокрит (снижение усугубляется при рвоте), тромбоцитопения, значительно снижается протромбиновый индекс, нарастают показатели гипоальбуминемии и метаболического ацидоза.
Дифференциальная диагностика
В остром периоде болезни необходимо исключить грипп, лептоспироз, вирусный гепатит, малярию, желтую лихорадку.
Проводят дифференциальную диагностику с вирусными инфекциями, протекающими с артралгиями.
Лабораторная диагностика
Возможно выделение вируса из крови, определение IgM-АТ и IgG-АТ (преобладают при повторном заболевании) в серологических реакциях, постановка
ПЦР.
Прогноз
Прогноз благоприятный при классической форме заболевания и серьезный при геморрагической форме заболевания (летальность при ГЛД без адекватного лечения достигает 30-50%).
Лечение
Назначают постельный режим, обильное питье (соки и солевые растворы) и жаропонижающие средства. При выраженной гиповолемии и ацидозе, а также при развитии ИТШ жидкости (физиологический раствор, 5% глюкоза, растворы Филипса, плазма и коллоидные растворы при снижении гематокрита) вводят парентерально. Все противошоковые мероприятия аналогичны таковым при лечении ГЛПС. Заместительную терапию прекращают при гематокрите около 40%, нормальном диурезе и хорошем аппетите, не позднее чем через 48 ч после исчезновения симптомов ИТШ.
Профилактические мероприятия
В странах, где нет природных очагов лихорадки Денге, на первый план выступают карантинные мероприятия, направленные на недопущение заноса инфекции с больными и через комаров. Большое значение имеют уничтожение комаров и обезвреживание мест их выплода, использование индивидуальных средств защиты от комаров, засетчивание оконных и дверных проемов. Существенное значение имеет гигиеническое обучение населения. Специфическую иммунопрофилактику проводят введением живой аттенуированной вакцины из вирусов типов 1 и 2.
Мероприятия в эпидемическом очаге
Аналогичны таковым при желтой лихорадке. В случае экстренной профилактики применяют специфический иммуноглобулин или иммуноглобулин из плазмы доноров, проживающих в эндемичных районах.
ФИЛОВИРУСНЫЕ ИНФЕКЦИИ
ЛИХОРАДКА МАРБУРГ
Лихорадка Марбург ( церкопитековая болезнь) - острое зоонозное заболевание из группы вирусных геморрагических лихорадок с тяжелым течением, интоксикацией, выраженными признаками универсального капилляротоксикоза и высокой летальностью. Отнесена к особо опасным вирусным инфекциям Африки.
Краткие исторические сведения
Впервые заболевание зарегистрировано в 1967 г. в Белграде (Югославия), Марбурге и Франкфурте (Германия) у сотрудников вирусологических лабораторий, работавших с зелеными мартышками (Cercopithecus aethiops), импортированными из Уганды. Этот факт обусловил его название - церкопитековая лихорадка. Тогда же в Марбурге Р. Зигерт выделил возбудитель, названный вирусом Марбург.
Позднее случаи заболевания были отмечены в Родезии, Кении, ЮАР. По данным серологических исследований, ареал распространения возбудителя значительно более широк и захватывает ряд других стран Африки - Центрально-Африканскую Республику, Габон, Судан, Заир, Кению, Уганду, Гвинею, Либерию.
Этиология
Возбудитель - РНК-геномный вирус рода Filovirus семейства Filoviridae. Вирус размножается в комарах Aedes aegypti, не патогенен для мышей, но у обезьян вызывает заболевание, по клинической картине напоминающее болезнь Марбург у человека. Как и вирус Эбола, он термостабилен, чувствителен к этиловому спирту, хлороформу. Культивируется на перевиваемых клетках; экспериментальными моделями для изучения вирусов выступают морские свинки, белые мыши-сосунки, зеленые мартышки.
Эпидемиология
Резервуар и источник инфекции до конца не установлены. Наиболее вероятной считают циркуляцию вируса среди зеленых мартышек. Несмотря на то что лихорадка Марбург была впервые передана человеку от африканских зеленых мартышек, выделить вирус Марбург от обезьян, живущих в природе, не удалось. Естественная циркуляция вируса среди разнообразных обезьян, других животных и людей еще недостаточно изучена. АТ к вирусу обнаружены у мартышек, бабуинов, человекообразных обезьян. Высказано предположение, что вирусы Эбола и Марбург - это вирусы растений. Больной человек, по-видимому, представляет опасность для окружающих лиц с периода инкубации, когда вирус уже находится в крови. Контагиозность сохраняется в течение всех периодов болезни. Описаны случаи заражения от реконвалесцентов на 80-й день от начала болезни. Вирус находят в носоглоточной слизи, рвотных массах, фекалиях, крови и во всех выделениях, содержащих кровь, слезной жидкости, сперме.
Доказан парентеральный путь заражения (вирус содержится во всех средах организма), но возможны и другие механизмы передачи - аэрозольный, контактный, пищевой. Чаще всего заражение людей происходит при прямом контакте с кровью и органами обезьян, также через поврежденную кожу (при уколах, порезах), при попадании вируса на конъюнктивы. Не доказана, но и не исключена трансмиссивная передача посредством эктопаразитов. Ряд авторов установили репродукцию вируса Марбург в комарах A. aegypti, на основании чего был сделан вывод о возможной роли комаров подсемейства Culucinae в передаче возбудителя. Вирус сохраняется в комарах Anopheles maculipennis в течение 8 дней, а в клещах Ixodes ricinus - до 15 дней. Есть сведения, указывающие на возможность вертикальной передачи возбудителя.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Иммунитет после заболевания длительный, сведения о повторных заболеваниях отсутствуют.
Основные эпидемиологические признаки
По данным серологических исследований, вирус Марбург имеет почти тот же ареал распространения, что и вирус Эбола:
- Центральная и Западная Экваториальная Африка;
- юг Африки (Центрально-Африканская Республика, Габон, Кения, Судан, Заир, Либерия, Гвинея, Родезия, ЮАР).
С 1967 по 2007 г. зарегистрировано более 50 случаев лихорадки Марбург с летальностью 20-50%. Эпидемиологические проявления этих лихорадок также имеют много сходного. Сезонность и периодичность вспышек не выявлены.
Патогенез
После проникновения вируса в организм и первичной репродукции в клетках системы моноцитарных фагоцитов развивается выраженная и стойкая виремия с лихорадочной реакцией. Гибель инфицированных клеток и очаговые некротические изменения в тканях внутренних органов (печени, почек, надпочечников и др.) без выраженных воспалительных реакций связаны как с прямым цитопатическим действием вируса, так и с иммунными механизмами - цитотоксическим влиянием Т-лимфоцитов и формирующихся ЦИК. Деструктивные и некротические изменения в органах усиливают развитие интоксикации.
На ранних этапах заболевания выявляют нарушения реологических свойств крови и микроциркуляции (стаз, тромбоз капилляров и мелких кровеносных сосудов, повышение их проницаемости), что углубляет патологические изменения в органах и нарушения их функций, приводит к развитию геморрагических проявлений. Результатом патологии надпочечников будет снижение продукции глюкокортикоидов.
Иммуносупрессивное действие вируса обусловливает отсутствие адекватных защитных реакций со стороны клеточной и гуморальной систем иммунитета, что способствует активному размножению и диссеминированию возбудителя.
В тяжелых случаях заболевания ДВС-синдром, гиповолемический шок, отек легких и мозга могут послужить причинами летального исхода.
Клиническая картина
Инкубационный период
Варьирует от 1-2 (при парентеральном заражении) до 17 дней, в среднем составляет 4-9 дней. Начальный период
Продолжается около недели. Заболевание отличается острым началом, проявляется фебрильной лихорадкой, головной болью, выраженными генерализованными миалгиями, прострацией. С первых дней болезни возникают тошнота, рвота и жидкий стул водянистого характера. При осмотре больных часто отмечают признаки фарингита, конъюнктивита, воспалительных поражений половых органов. С первых часов заболевания возможно появление пятнисто-
папулезной сыпи с последующей десквамацией в периоде реконвалесценции. Нередко отмечают геморрагическую сыпь на коже и слизистых оболочках. Разгар заболевания
Возникают кровотечения из десен, тонкой кишки, мочевыводящих путей, влагалища. В рвотных массах могут появляться примеси крови. Параллельно развиваются признаки полиорганных поражений:
- печени;
- почек;
- миокарда и других органов.
При гепатите клинически выраженная желтуха не отмечена. Высокая лихорадка снижается после 8-10-го дня болезни, но может дать 2-й пик к концу 2-й недели от начала заболевания. Диарея длительная, может сохраняться и после нормализации температуры тела, приводя к резкому обезвоживанию.
Период реконвалесценции
В случаях выздоровления затягивается до 1 мес и более. Возможно развитие артритов, конъюнктивита, орхита, снижение слуха. У некоторых больных после болезни развивается алопеция. Возможны рецидивы заболевания, связанные с длительной персистенцией вируса (до 3-4 мес).
Дифференциальная диагностика
Заболевание дифференцируют от лептоспироза, риккетсиозов, малярии, гриппа и др. Дифференциальная диагностика клинически затруднена ввиду отсутствия специфических признаков лихорадки Марбург. Большое значение придают данным эпидемиологического анамнеза о пребывании больного в регионах эндемичного распространения болезни.
Лабораторная диагностика
В гемограмме уже в первые дни болезни отмечают выраженную лейкопению и тромбоцитопению. В качестве специфических методов исследования (возможны только в условиях лабораторий максимального уровня защиты) применяют прямую электронную микроскопию крови больных, вирусологическое исследование биопсийного материала, РНИФ, ИФА, постановку РСК, РИА, иммуноблота. В качестве экспресс-метода применяют ПЦР на выявление РНК вируса.
Осложнения и исходы
Возможно развитие ранних энцефалитов, а также миелитов, орхитов, психических нарушений, снижение интеллекта. При тяжелом течении болезни уже в начальном периоде возможен летальный исход при развитии ИТШ, отеке легких и мозга, нарастании клинических проявлений полиорганной недостаточности.
В тяжелых случаях причинами летального исхода могут послужить ИТШ, гиповолемический шок.
Показатель летальности достигает 30% и более, смерть наступает обычно между 8-17-ми сутками болезни от геморрагических проявлений.
Лечение
Этиотропное лечение отсутствует. Проводят патогенетическое и симптоматическое лечение. Эффективность иммунной плазмы (от реконвалесцентов) не доказана. Применение ИФН и их индукторов малоэффективно.
Эпидемиологический надзор
См. раздел «Лихорадка Эбола».
Профилактические мероприятия
Выявление больных, их изоляция, карантинные мероприятия. Разработан гетерогенный (лошадиный) сывороточный иммуноглобулин для иммунопрофилактики контингентов высокого риска. Более подробно - см. раздел «Лихорадка Эбола».
ЛИХОРАДКА ЭБОЛА
Острое, предположительно зоонозное заболевание из группы вирусных геморрагических лихорадок, протекающее с выраженным геморрагическим синдромом, отличается высоким уровнем летальности. Относится к особо опасным вирусным инфекциям.
Краткие исторические сведения
Впервые заболевание зарегистрировано и описано в районе Эбола (Заир) в 1976 г. В это же время из крови одного из умерших больных выделен возбудитель. Вспышки инфекции в Заире и Судане в 1976-1979 гг., в Заире в 1994- 1995 гг., исчисляемые сотнями заболевших, сопровождались высокой летальностью (от 53 до 88%). В 1996 г. вспышка лихорадки Эбола зарегистрирована в Габоне. Данные ретроспективного серологического скрининга населения позволяют утверждать, что эпидемии заболевания отмечали в 1960-1965 гг. в Нигерии, Сенегале, Эфиопии.
Этиология
Возбудитель - РНК-геномный вирус рода Filovirus семейства Filoviridae. Встречаются 4 штамма вируса - Заир, Судан, Рестон, Кот-д'Ивуар - отличающиеся по антигенной структуре. Четкие различия выявлены между штаммами Заир и Судан по генетическим, биологическим и биохимическим свойствам. В лабораторных условиях культуры возбудителя поддерживают пассажем через печень или кровь обезьян. Вирус Эбола имеет среднюю степень устойчивости во внешней среде.
Эпидемиология
Резервуар и источник инфекции в природе мало изучен, скорее всего, он в основном представлен разнообразными грызунами. Не исключена роль обезьян
как источников инфекции. Больной человек очень опасен для окружающих, известны 5-8 последовательных передач вируса от больного и возникновение внутрибольничных вспышек болезни. Отмечено, что при первых передачах летальность была наивысшей (100%), затем она снижалась. Вирус выявляют в различных органах, тканях и выделениях:
- в крови (7-10 дней);
- слизи носоглотки;
- моче;
- сперме.
Больной представляет высокую опасность в течение 3 нед от начала болезни. В инкубационный период больной вирус не выделяет.
Механизм передачи разнообразный. Политропность вируса, многообразие путей его выделения из организма определяют возможность заражения при контакте с кровью больных, половым и аэрозольным путями, при пользовании общими предметами обихода и совместном питании. Установлено, что заражение при лихорадке Эбола в основном реализуется путем прямого контакта с инфицированным материалом. Заболевание очень контагиозно и передается при попадании вируса на кожу и слизистые оболочки. Наиболее опасна кровь. Наибольшему риску заражения подвергается медицинский персонал при уходе за больными, а также персонал, осуществляющий отлов, транспортировку обезьян и уход за ними в период карантина. Отсутствие заболеваний среди лиц, находившихся с больными в одном помещении, но не имевших с ними тесного контакта, позволило сделать вывод о том, что воздушно-капельная передача маловероятна.
Естественная восприимчивость людей
Естественная восприимчивость людей высокая. Постинфекционный иммунитет стойкий. Повторные случаи заболеваний редки, их частота не превышает 5%.
Основные эпидемиологические признаки
Очаги циркуляции вируса Эбола располагаются в зоне влажных тропических лесов Центральной и Западной Африки:
- Заир;
- Судан;
- Нигерия;
- Либерия;
- Габон;
- Сенегал;
- Кения;
- Камерун;
- Эфиопия;
- Центрально-Африканская Республика.
Вспышки лихорадки Эбола в эндемичных очагах отмечают в основном весной и летом. В городе Нзара (Судане) первичный очаг инфекции возник среди рабочих на хлопчатобумажной фабрике, вскоре болезнь распространилась на членов семей и других лиц, бывших в тесном контакте с больными. Внутрибольничное распространение возникло только в 2 случаях. Другую картину заболеваемость представляла в городе Мариди (Судан) и Заире, где больница
сыграла роль катализатора эпидемического процесса. Больные были доставлены в больницу с лихорадкой неясной этиологии. Внутрибольничное распространение инфекции среди персонала осуществлялось при попадании инфицированного материала (крови и выделений) на поврежденные кожный покров и слизистые оболочки, больных - при различных парентеральных манипуляциях, выполненных плохо обработанными инструментами. Обследование семейных контактов подтвердило эпидемиологическое значение контактов с больными и длительности общения с ними. При кратковременном соприкосновении с больным заболело 23%, а при тесном и длительном (уход за больным) - 81% лиц. Вторичными очагами стали семьи больных, покинувших больницы. Заражение происходило при близком контакте с больными (лечебный уход, совместное проживание, ритуальные обряды у тел умерших). В декабре 1994 г. и июне 1995 г. в Заире возникла вспышка лихорадки Эбола, связанная с употреблением в пищу местными жителями мозга обезьянвирусоносителей. Общее число заболевших превысило 250 человек, летальность составила около 80%. Описаны также случаи внутрилабораторного заражения лихорадкой Эбола при работе с зелеными мартышками. Учитывая колоссальные возможности и скорости международных перемещений, серьезную опасность представляют миграции лиц в начальной стадии болезни и перевозки зараженных животных.
Патогенез
В течение инкубационного периода вирус репродуцируется в регионарных лимфатических узлах, селезенке и других органах системы СМФ. Острое начало заболевания лихорадки совпадает с развитием интенсивной виремии с полиорганной диссеминацией возбудителя. Поражение клеток и тканей различных органов предположительно обусловлено как прямым цитопатическим действием вируса, так и аутоиммунными реакциями. Развитие нарушений микроциркуляции и реологических свойств крови проявляется капилляротоксикозом с геморрагическим синдромом, периваскулярными отеками, ДВСсиндромом. Диссеминированная внутрисосудистая коагуляция представляет собой ведущий синдром, выявляемый гистологически. Патологические изменения в органах в виде очаговых некрозов, рассеянных геморрагий в клинической картине проявляются признаками гепатитов, интерстициальных пневмоний, панкреатитов, орхитов и др. Реакции клеточного и гуморального иммунитета значительно снижены, противовирусные АТ у умерших в ранние сроки болезни обнаруживают редко, у выздоравливающих они появляются поздно.
Клиническая картина
Инкубационный период варьирует от нескольких дней до 2-3 нед. Начало заболевания острое, с повышения температуры тела до 38-39 °С, головной боли, миалгий и артралгий, недомогания, тошноты. В течение первых дней у большинства больных возникают признаки ангины. Воспаление миндалин вызывает ощущение болезненного комка в горле. В разгар заболевания присоединяются неукротимая рвота, боли в животе и диарея геморрагического характера с испражнениями в виде мелены. Быстро развивается геморраги-
ческий синдром с проявлениями кожных кровоизлияний, органных кровотечений, кровавой рвоты. Часто наблюдают признаки энцефалопатии в виде возбуждения и агрессивности больных; в случаях выздоровления они длительно сохраняются и в период реконвалесценции. На 4-6-й день от начала болезни приблизительно у половины больных появляется экзантема сливного характера.
Летальный исход наступает, как правило, в начале 2-й недели болезни. Основные причины летального исхода:
- кровотечения;
- интоксикация;
- ИТШ и гиповолемический шок.
В случаях выздоровления острая фаза заболевания продолжается 2-3 нед. Период реконвалесценции затягивается до 2-3 мес, сопровождается астенизацией, анорексией, снижением массы тела, выпадением волос, иногда развитием психических нарушений.
Дифференциальная диагностика
Представляет значительные сложности в связи с отсутствием специфических клинических признаков и скоротечностью развития заболевания. В РФ заболевание может быть занесено из стран Центральной и Западной Африки.
Лабораторная диагностика
Предусматривает применение ПЦР, ИФА, иммунофлюоресцентных методов, постановку серологических реакций (РН, РСК, РНГА). Методы доступны только в условиях хорошо оснащенных вирусологических лабораторий строгого противоэпидемического режима. В полевых условиях можно применять комплексный диагностикум для РИФ или твердофазные иммуноферментные тест-системы для выявления Аг вирусов Эбола и Марбург, а также АТ к ним.
Осложнения и исходы
Осложнениями можно считать все тяжелые патогенетически обусловленные процессы, ведущие в конечном счете к смерти больных:
- кровотечения;
- ИТШ и гиповолемический шок.
Прогноз заболевания крайне неблагоприятен. В отдельных очагах летальность составляет от 50 до 90%.
Лечение
Проводят в специализированных инфекционных отделениях с режимом строгой изоляции. Применяют методы патогенетического и симптоматического лечения. В большинстве случаев они оказываются малоэффективными. Этиотропное лечение не разработано. В эпидемических очагах может быть получен положительный эффект от применения плазмы реконвалесцентов.
Эпидемиологический надзор
Осуществление Международной системы эпидемиологического надзора за контагиозными геморрагическими лихорадками призвано обеспечить необходимой информацией для своевременного и полного проведения профилактических мероприятий. В связи с трудностью в ряде случаев осуществления полноценной лабораторной диагностики заболеваний важнейшее значение приобретают клинические проявления. С учетом концепции ВОЗ все страны обязаны немедленно уведомлять штаб-квартиру о единичных или групповых тяжелых заболеваниях, для которых характерен синдром острой геморрагической лихорадки.
По определению Комитета экспертов ВОЗ, больной лихорадкой Ласса, Марбург и Эбола - человек с лихорадочным заболеванием, сопровождающимся одним или несколькими из следующих признаков:
- выделение вируса;
- 4-кратное нарастание титров АТ к вирусу через 1-2 нед после забора. При лихорадке Ласса титры IgG при поступлении не менее 1:512 и позитивные титры IgM, при лихорадках Марбург и Эбола - содержание IgM 1:8 и выше, IgG - 1:64 в РИФ.
Профилактические мероприятия
В результате фундаментальных исследований биологических свойств вируса Эбола созданы предпосылки для разработки вакцины и неспецифических защитных препаратов.
Мероприятия в эпидемическом очаге
Больные геморрагическими лихорадками Ласса, Марбург и Эбола подлежат немедленной госпитализации в боксовые отделения с соблюдением строгого режима, рекомендуемого в случаях особо опасных инфекций, таких как чума и оспа. Выздоровевших выписывают не ранее 21-го дня от начала болезни при нормализации состояния больных и 3-кратных отрицательных вирусологических исследованиях. Все предметы обихода больного должны быть строго индивидуальными, маркированными. Их хранят и дезинфицируют в боксе. Для лечения применяют инструменты разового пользования. После употребления их автоклавируют или сжигают. В период текущей дезинфекции применяют 2% раствор фенола [с добавлением 0,5% гидрокарбоната натрия (1:500)], йодоформ (450 г на 1 мл активного йода с добавлением 0,2% натрия нитрата). Выделения больных также обрабатывают соответствующим образом. Обслуживающий персонал должен работать в противочумном костюме 1-го типа. Разработаны специальные пластиковые боксы, в которых с помощью вытяжной системы, снабженной блоком дезактивации, обеспечивается приток воздуха в одном направлении - внутрь бокса. Такие боксы снабжены обычной системой для обеспечения полной безопасности персонала во время медицинских манипуляций. Особую осторожность следует соблюдать при исследованиях крови и других биологических материалов от больных геморрагическими лихорадками и подозрительных на заболевание.
Лиц, находившихся в непосредственном контакте с больным (или лицом, у которого подозревают развитие заболевания), изолируют в бокс и наблюдают в
течение 21 дня. Во всех случаях подозрения на заражение вирусом Эбола вводят специфический иммуноглобулин из сыворотки гипериммунизированных лошадей. Срок действия иммуноглобулина 7-10 дней.
АРЕНАВИРУСНЫЕ ИНФЕКЦИИ
ЛИХОРАДКА ЛАССА
Острое зоонозное заболевание из группы вирусных геморрагических лихорадок с признаками универсального капилляротоксикоза, поражениями печени, почек, ЦНС. Клинически проявляется лихорадкой, геморрагическим синдромом, развитием почечной недостаточности. Относится к особо опасным вирусным инфекциям Африки с высокой летальностью.
Краткие исторические сведения
Заболевание впервые зарегистрировано в 1969 г. в городке Ласса (Нигерия). Три из пяти первых случаев заболевания у медицинских сестер и исследователей закончились летальным исходом. Возбудитель выделен в 1970 г. Лихорадка Ласса широко распространена в Западной Африке (Сьерра-Леоне, Нигерия, Либерия, Гвинея, Сенегал, Мали), некоторых странах Центральной Африки (Центрально-Африканская Республика, Буркина-Фасо). Зарегистрированы завозные случаи инфекции в Европе, США, Японии, Израиле.
Этиология
Возбудитель - РНК-геномный вирус рода Arenavirus семейства Arenaviridae. Имеет сходную антигенную структуру с возбудителями лимфоцитарного хориоменингита, аргентинской и боливийской лихорадок. При электронной микроскопии внутри частиц вируса выявляется около 10 мелких плотных гранул (рибосом), напоминающих песок (лат. arenaceus - песчаный), откуда и дано название семейству вирусов. В настоящее время выделено 4 субтипа вируса Ласса, циркулирующие в разных регионах. Вирус устойчив к воздействию факторов окружающей среды. Инфекционность возбудителя в сыворотке крови или секретах не снижается в течение длительного периода без специальной обработки. Инактивируется жировыми растворителями (эфир, хлороформ и др.).
Эпидемиология
Резервуар и источник инфекции - многососковые африканские крысы Mastomys natalensis (в эпидемических очагах инфицированность может достигать 15-17%) и другие мышевидные грызуны. У грызунов инфекция может протекать пожизненно в виде бессимптомной персистенции вируса. Животные выделяют вирус со слюной и мочой до 14 нед. Источником инфекции может быть также больной человек в течение всей болезни, при этом заразными могут быть все выделения.
Механизм передачи разнообразный. Передача вируса между грызунами реализуется контактным путем - при питье и поедании корма, контаминированного мочой крыс-вирусоносителей. Заражение людей в природных очагах происходит
случайно во время охоты (при сдирании шкурок), при употреблении воды из инфицированных мочой крыс источников, термически необработанного мяса. Заражение может произойти и в домашних условиях при обитании в жилищах грызунов. Вирус проникает через органы дыхания, поврежденную кожу, конъюнктиву, ЖКТ. Больной человек опасен для окружающих на протяжении всего заболевания. Передача вируса среди людей реализуется воздушно-капельным, алиментарным, контактным и половым путями. Возможна и вертикальная передача вируса от беременной к плоду. Зарегистрированы внутрибольничные вспышки лихорадки Ласса. Последние были связаны с фарингитами и поражениями слизистой оболочки верхних дыхательных путей у больных, выделявших большие дозы вируса при кашле. Отмечены также случаи заражения медицинского персонала от инструментария, инфицированного кровью, - при хирургических операциях и вскрытии трупов умерших или проведении экспериментов на животных.
Естественная восприимчивость людей
Лихорадка Ласса - заболевание со средним уровнем контагиозности, но высокой летальностью (до 40% и более). Иммунитет почти не изучен, но у переболевших обнаруживают специфические АТ в течение 5-7 лет.
Основные эпидемиологические признаки
Лихорадка Ласса - природно-очаговая вирусная болезнь. К группам риска относят население, проживающее в Западной Африке. При этом высокая плотность популяции грызунов рода Mastomys делает заболевание эндемичным как в сельских районах, так и в городах. Летальность при лихорадке Ласса варьирует от 18,5 до 60%. Вторичные случаи болезни в эпидемическом отношении обычно менее опасны, чем первично возникшие. В большинстве эндемичных районов ее регистрируют круглогодично. Наиболее высокий уровень заболеваемости приходится на январь-февраль в период миграций грызунов к человеческому жилью. Болезнь могут завозить в неэндемичные страны. В частности, имели место завозы инфекции в Нью-Йорк, Лондон, Гамбург, Японию, Великобританию. Как и другие геморрагические лихорадки, лихорадка Ласса подлежит строгому учету и контролю в международном масштабе.
Патогенез
В соответствии с доминирующими путями передачи входными воротами инфекции в основном выступают слизистые оболочки дыхательного тракта и ЖКТ. В инкубационном периоде вирус размножается в регионарных лимфатических узлах, после чего наступает стойкая и выраженная виремия, сопровождающаяся лихорадкой и диссеминированием возбудителя по органам СМФ. Зараженные вирусом клетки жизненно важных органов становятся мишенями для цитотоксических Т-лимфоцитов. В дальнейшем образование иммунных комплексов и их фиксация на базальных мембранах клеток приводят к развитию тяжелых некротических процессов в печени, селезенке, почках, надпочечниках, миокарде. Воспалительные признаки при этом выражены слабо, изменений в головном мозге не выявляют.
Установлено, что в лихорадочном периоде заболевания выработка вируснейтрализующих АТ носит отсроченный характер. Предположительно, в развитии тяжелого инфекционного процесса с ранним летальным исходом ведущую роль играют нарушения клеточных иммунных реакций.
Клиническая картина
Инкубационный период варьирует в пределах 6-20 дней. Большинство случаев лихорадки Ласса в эндемичных районах протекают в виде стертых или бессимптомных форм. В клинически выраженных случаях заболевание чаще начинается постепенно с невысокой лихорадки, сопровождающейся недомоганием, миалгиями, болями в горле при глотании, признаками конъюнктивита. В течение нескольких дней при нарастании температуры тела до 39-40 °С с ознобом усиливаются слабость, апатия и головная боль, появляются значительные боли в спине, ретростернальной области, животе. Возможны тошнота, рвота и диарея (иногда в виде мелены), кашель, дизурические расстройства и протеинурия, судороги. Иногда наблюдают нарушения зрения.
При осмотре больных обращают на себя внимание выраженная гиперемия лица, шеи, кожи груди, экзантема петехиального, макулопапулезного или эритематозного характера. В части случаев (около 20%) развиваются геморрагические проявления различной локализации. Увеличены периферические лимфатические узлы. Развивается язвенный фарингит. На слизистой оболочке глотки, мягкого нёба, миндалин появляются белые пятна, позднее превращающиеся в язвы с желтым дном и красным ободком; часто язвы локализуются на нёбных дужках. Тоны сердца значительно приглушены, отмечают брадикардию и артериальную гипотензию.
При тяжелом течении заболевания выражены проявления геморрагического синдрома, появляются клинические признаки множественных органных поражений:
- печени;
- легких (пневмонии);
- сердца (миокардит);
- ЦНС (менингит, энцефалит) и др.
Прогностически неблагоприятным считается появление отеков лица и шеи, плевральных, перикардиальных и перитонеальных экссудатов вследствие повышенной проницаемости стенок капилляров. Развиваются ИТШ, ОПН. В этих случаях в начале 2-й недели заболевания часто наблюдают летальные исходы.
При благоприятном течении заболевания острый лихорадочный период может продолжаться до 3 нед, температура тела снижается литически. Выздоровление протекает очень медленно, возможны рецидивы болезни.
Дифференциальная диагностика
Большое клиническое значение в постановке предварительного диагноза придают сочетанию лихорадки, язвенного фарингита, отеков лица и шеи (в разгар болезни), альбуминурии и других изменений в моче. Дифференциальная диагностика затруднена, особенно в ранней фазе развития заболевания.
Лабораторная диагностика
В гемограмме отмечают лейкопению, в дальнейшем она сменяется лейкоцитозом, нейтрофилезом со сдвигом влево и резким увеличением СОЭ (40-80 мм/ч). Характерна тромбоцитопения, уменьшается свертываемость
крови, удлиняется протромбиновое время. В моче выявляют белок, лейкоциты, эритроциты, зернистые цилиндры.
Специальные методы лабораторных исследований включают выделение вируса из глоточных смывов, крови и мочи и его идентификацию. В качестве метода экспресс-диагностики применяют ИФА и РНИФ, выявляющие Аг вируса. Для определения противовирусных АТ используют РНГА, РСК, ИФА. По рекомендации ВОЗ при определении IgG в титрах 1:512 и выше с одновременным выявлением IgM у лихорадящих больных в эндемичных районах ставят предварительный диагноз «лихорадка Ласса». Разработана ПЦР-диагностика.
Осложнения и исходы
К осложнениям относят:
- ИТШ;
- пневмонии;
- миокардиты;
- ОПН;
- делирий;
- увеит;
- орхит;
- глухоту.
При тяжелых формах заболевания летальность составляет 30-50%.
Лечение
Обязательна госпитализация больных в специализированные инфекционные отделения с режимом строгой изоляции. Режим постельный, лечение в основном симптоматическое (см. раздел «Геморрагическая лихорадка с почечным синдромом»). Применение плазмы реконвалесцентов эффективно лишь в некоторых случаях при назначении в 1-ю неделю заболевания. При ее введении в более поздние сроки возможно ухудшение состояния больного. При осложнениях показаны антибиотики, глюкокортикоиды. Разрабатываются этиотропные средства и вакцинные препараты. Применение рибавирина (виразол, рибамидил) в ранней фазе заболевания перорально по 1000 мг в сутки в течение 10 сут или внутривенно в течение 4 дней снижает тяжесть течения и летальность.
Эпидемиологический надзор
См. раздел «Лихорадка Эбола».
Профилактические мероприятия
В основном сведены к борьбе с проникновением в жилища крыс - источников инфекции. Особенно следует защищать предметы обихода и пищевые продукты от загрязнения мочой грызунов или пылью, содержащей их экскременты. Персонал, ухаживающий за больными, забирающий инфицированный материал от больных либо участвующий в хирургических операциях, должен быть обучен уходу за особо заразными больными. Больничные помещения сле-
дует содержать с соблюдением строгого противоэпидемического режима. Для профилактики лихорадки Ласса (в эндемичных регионах) можно использовать рибавирин по 500 мг перорально каждые 6 ч в течение 7 дней. Специфическая профилактика не разработана.
Мероприятия в эпидемическом очаге
При возникновении случаев заболевания важны организационные карантинные мероприятия:
- изоляция больных в боксы;
- ношение персоналом противочумных костюмов;
- госпитализация в изоляторы контактных лиц;
- сжигание вещей (не имеющих ценности) больных;
- сжигание трупов погибших.
Лиц, прибывших из эндемичных районов по лихорадке Ласса, в случае возникновения у них любой лихорадки изолируют в стационары для установления диагноза. В очаге проводят текущую и заключительную дезинфекцию.
АЛЬФА-ВИРУСНЫЕ ИНФЕКЦИИ ЛИХОРАДКА ЧИКУНГУНЬЯ
Острая трансмиссивная болезнь, характеризующаяся лихорадкой, интоксикацией и геморрагическим синдромом.
Краткие исторические сведения
Заболевание впервые описано в Танзании в 1952-1953 гг. Затем его зарегистрировали в Заире, Замбии, ЮАР, Анголе, Таиланде, Бирме, Сингапуре и Индии. Выделенные штаммы вируса мало отличались от африканских изолятов, но заболевания, вызванные азиатскими вариантами, не сопровождаются геморрагическими проявлениями.
Этиология
Возбудитель - РНК-геномный вирус рода Alphavirus семейства Togaviridae. Выделен из крови больных, от комаров Aedes aegypti, A. africanus и Culex fatigans, постельных клопов (обитающих в хижинах больных) и летучих мышей. Вирус малоустойчив во внешней среде, разрушается под воздействием УФ-лучей, термолабилен и чувствителен к дезинфектантам.
Эпидемиология
Резервуар и источники инфекции - больной человек в течение 4-10 первых дней болезни, обезьяны-вирусоносители и, возможно, летучие мыши, грызуны и дикие птицы.
Механизм передачи возбудителя - трансмиссивный, переносчики вируса в Африке - комары A. aegypti и A. africanus, в городских районах Индии и ЮгоВосточной Азии - A. aegypti. Данные о прямой передаче инфекции от человека к человеку отсутствуют.
Естественная восприимчивость людей
Естественная восприимчивость людей не установлена. Продолжительность и напряженность постинфекционного иммунитета не изучены.
Основные эпидемиологические признаки
Заболевание с выраженной природной очаговостью, распространено почти на всей территории тропической Азии, ряде стран Африки (Заир, Замбия, ЮАР, Ангола). В 2005-2006 гг. произошла резкая активация лихорадки Чикунгунья на островах Индийского океана, особенно на Маврикии и Реюньон. Заболело в общей сложности 270 000 человек. Летальность достигла 4,3%, а в Западной Индии (штат Ахмаабад) - 11,9%. Заболевание встречается исключительно среди местных жителей и крайне редко у приезжих. Большинство случаев заболевания регистрируют у молодых людей и подростков. Вспышки возникают в сезон дождей в районах с высоким выплодом комаров A. aegypti. Кроме городских и пригородных вспышек, в ряде стран отмечают также джунглевый тип заболеваний, связанный с комарами, питающимися кровью обезьян.
Патогенез
Патогенетические механизмы сходны с другими геморрагическими лихорадками.
Клиническая картина
Напоминает лихорадку Денге, но заболевание протекает значительно легче. Инкубационный период составляет 3-12 дней. Начало заболевания сопровождают сильные артралгии и боли в позвоночнике, обездвиживающие больного. Согнутые положения в суставах несколько облегчают боли.
Другие симптомы:
- незначительная головная боль;
- анорексия;
- запоры.
Лихорадка двухволновая - волны по несколько дней разделены периодом апирексии в 1-3 дня. На туловище и разгибательных поверхностях конечностей возникает макулопапулезная сыпь, сопровождающаяся зудом. Геморрагические проявления непостоянны. Через 6-10 дней состояние больных нормализуется. Летальные исходы не зарегистрированы.
Дифференциальная диагностика
При сходных клинических признаках с ГЛД заболевание отличают боли в суставах и позвоночнике, приводящие к обездвиженности больного, и отсутствие геморрагических проявлений.
Лабораторная диагностика
Аналогична таковой при лихорадке Денге.
Лечение
Аналогично таковому при лихорадке Денге.
Профилактические мероприятия
Включают борьбу с комарами и меры индивидуальной защиты от них. Средства специфической профилактики не разработаны.
Мероприятия в эпидемическом очаге
Аналогичны таковым при желтой лихорадке и лихорадке Денге.