Инфекционные болезни и эпидемиология : учебник / Покровский В. И., Пак С. Г., Брико Н. И., Данилкин Б. К. - 3-е изд., испр. и доп. - 2013. - 1008 с. : ил.
|
|
|
|
Глава 2. Общая патология инфекционных болезней
ИНФЕКЦИОННЫЙ ПРОЦЕСС И ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ
Проникновение микроорганизмов во внутреннюю среду организма человека приводит к нарушению гомеостаза организма, которое может проявиться комплексом физиологических (адаптационных) и патологических реакций, известных как инфекционный процесс, или инфекция. Спектр этих реакций достаточно широк, его крайние полюсы - клинически выраженные поражения и бессимптомная циркуляция. Термин «инфекция» (от лат. inficio - вносить что-либо вредное и позднелат. infectio - заражение) может определять и сам инфекционный агент, и факт его попадания в организм, но более правильно использовать этот термин для обозначения всей совокупности реакций между возбудителем и хозяином.
По выражению И.И. Мечникова, «...инфекция есть борьба между двумя организмами». Отечественный вирусолог В.Д. Соловьев рассматривал инфекционный процесс как «особого рода экологический взрыв с резким усилением межвидовой борьбы между организмом-хозяином и внедрившимися в него патогенными бактериями». Известные инфекционисты А.Ф. Билибин и Г.П. Руднев (1962) определяли его как сложный комплекс «физиологических защитных и патологических реакций, возникающих в определенных условиях внешней среды в ответ на воздействие патогенных микробов».
Современное научное определение инфекционного процесса дано В.И. Покровским: «Инфекционный процесс - это комплекс взаимных приспособительных реакций в ответ на внедрение и размножение патогенного микроорганизма в макроорганизме, направленных на восстановление нарушенного гомеостаза и биологического равновесия с окружающей средой».
Таким образом, участники инфекционного процесса - микроорганизмвозбудитель заболевания, организм хозяина (человека или животного) и определенные, в том числе социальные, условия внешней среды.
Микроорганизм представляет непосредственную причину инфекционного заболевания, определяет специфичность его клинических проявлений, влияет на течение и исход болезни. Его основные специфические качества:
- патогенность;
- вирулентность;
- токсигенность;
- адгезивность;
- инвазивность, способность к внутриклеточному паразитированию и антигенной мимикрии.
Патогенность - способность возбудителя проникать в организм человека или животного, жить и размножаться в нем, вызывая морфологические и функцио-
нальные нарушения в органах и тканях макроорганизма, проявляющиеся как инфекционное заболевание. Наличие или отсутствие этого признака позволяет разделить все микроорганизмы на патогенные, условно-патогенные и непатогенные (сапрофитные). Различные микроорганизмы могут быть патогенными только для человека (например, брюшнотифозная палочка, шигеллы, менингококк), для человека и животных (бруцеллы, иерсинии) или только для животных. Патогенность определяет комплекс разнообразных свойств микроорганизма, включающий токсигенность возбудителя, адгезивность и инвазивность, наличие или отсутствие капсулы, способность к внутриклеточному паразитированию, антигенной мимикрии и др.
Токсигенность возбудителя - способность синтезировать и выделять экзо- и эндотоксины. Экзотоксины - белки, выделяемые микроорганизмами в процессе жизнедеятельности. Они проявляют специфическое действие, приводящее к избирательным патоморфологическим и патофизиологическим нарушениям в органах и тканях (возбудители дифтерии, столбняка, ботулизма, холеры и др.). Эндотоксины высвобождаются после гибели и разрушения микробной клетки. Бактериальные эндотоксины - структурные компоненты внешней мембраны практически всех грамотрицательных микроорганизмов, биохимически представляющие собой липополисахаридный комплекс (ЛПС-комплекс). Структурно-функциональный анализ молекулы ЛПС-комплекса показал, что биологически активным сайтом (участком), определяющим все основные свойства нативного препарата ЛПС-комплекса, служит липид А. Ему присуща выраженная гетерогенность, что позволяет защитным силам организма его распознать. Действие эндотоксинов малоспецифично, что проявляется сходными клиническими признаками болезни.
Адгезивность и инвазивность микроорганизмов - способность фиксироваться на клеточных мембранах и проникать в клетки и ткани. Этим процессам способствуют лиганд-рецепторные структуры и капсулы возбудителей, которые препятствуют поглощению фагоцитами, а также жгутики и ферменты, повреждающие клеточные мембраны.
Многим патогенным микроорганизмам свойственна способность к внутриклеточному паразитированию, подавлению литических ферментов клетки и размножению в ней. В этих случаях патогенные возбудители избегают действия АТ и неспецифических факторов защиты (комплемента, лизоцима и др.), что существенно влияет на форму, тяжесть, длительность и исход инфекционного заболевания.
Один из важнейших механизмов сохранения возбудителя в организме хозяина - микробная персистенция, заключающаяся в образовании атипичных бесстеночных форм микроорганизма - L-форм, или фильтрующихся форм. При этом наблюдается резкая перестройка обменных процессов, выражающаяся в замедлении или полной потере ферментативных функций, неспособности расти на элективных питательных средах для исходных клеточных структур, утрате чувствительности к антибиотикам.
Антигенная мимикрия - структурное сходство некоторых микробных Аг с различными тканевыми Аг организма человека. При подобном сходстве возбудитель маскируется в организме человека, что способствует его более длительному паразитированию. При этом развивающиеся иммунные реакции направлены не только против микробных Аг, но и сходных с ними тканевых Аг. В результате развиваются аутоиммунные процессы, осложняющие течение болезни.
Вирулентность - качественное проявление патогенности. Признак нестабилен, у одного и того же штамма возбудителя он способен меняться в ходе инфекционного процесса, в том числе под влиянием антимикробного лечения. При определенных особенностях макроорганизма (иммунодефицит, нарушение барьерных защитных механизмов) и условий окружающей среды виновниками развития инфекционного заболевания могут стать условно-патогенные микроорганизмы и даже сапрофиты.
Место внедрения патогенного возбудителя в организм человека называют входными воротами инфекции, от их локализации нередко зависит клиническая картина заболевания. Свойства микроорганизма и пути его передачи обусловливают разнообразие входных ворот.
Ими могут быть:
- кожные покровы (например, для возбудителей сыпного тифа, чумы, сибирской язвы, малярии);
- слизистые оболочки дыхательных путей (в частности, для вируса гриппа и менингококка);
- ЖКТ (например, для возбудителей брюшного тифа, дизентерии);
- половых органов (для возбудителей сифилиса, ВИЧ-инфекции, гонореи).
При различных инфекционных болезнях могут быть одни (холера, грипп) или несколько (бруцеллез, туляремия, чума) входных ворот. На формирование инфекционного процесса и степень выраженности клинических проявлений инфекционного заболевания существенно влияет инфицирующая доза возбудителей.
Из входных ворот возбудитель может диссеминировать преимущественно лимфогенным или гематогенным путем.
При нахождении возбудителя в крови и лимфе применяют следующие термины:
- бактериемия (присутствие в крови бактерий);
- фунгемия (присутствие в крови грибов);
- виремия (вирусы в крови);
- паразитемия (простейшие в крови).
Циркуляцию микробных токсинов определяют термином токсинемия. При одних инфекционных заболеваниях бактериемию и токсинемию наблюдают одновременно (например, при брюшном тифе, менингококковой инфекции), при других развивается преимущественно токсинемия (дизентерия, дифтерия, ботулизм, столбняк). Диссеминируя в организме человека, возбудители могут поражать различные системы, органы, ткани и даже отдельные виды клеток, т.е. проявлять определенную избирательность, тропность. Например, вирусы гриппа тропны к эпителию респираторного тракта, возбудители дизентерии - к эпителию кишечника, малярии - к эритроцитам.
Макроорганизм - активный участник инфекционного процесса, определяющий возможность его возникновения, форму проявления, степень тяжести, длительность и исход. Организм человека обладает разнообразными врожденными или индивидуально приобретенными факторами защиты от агрессии патогенного возбудителя. Защитные факторы макроорганизма помогают предупредить инфекционное заболевание, а в случае его развития - преодолеть инфекционный процесс. Их разделяют на неспецифические и специфические.
Неспецифические факторы защиты весьма многочисленны и разнообразны по механизмам антимикробного действия. Наружными механическими барье-
рами для большинства микроорганизмов служат неповрежденные кожные покровы и слизистые оболочки.
Защитные свойства кожных покровов и слизистых оболочек обеспечивают:
- лизоцим;
- секреты сальных и потовых желез;
- секреторный IgA;
- фагоцитирующие клетки;
- нормальная микрофлора, препятствующая интервенции и колонизации кожи и слизистых оболочек патогенными микроорганизмами.
Чрезвычайно важный барьер при кишечных инфекциях - кислая среда желудка. Механическому удалению возбудителей из организма способствуют реснички респираторного эпителия и моторика тонкого и толстого кишечника. Мощным внутренним барьером на пути проникновения микроорганизмов в ЦНС служит гематоэнцефалический барьер.
К неспецифическим ингибиторам микроорганизмов относят ферменты ЖКТ, крови и других биологических жидкостей организма (бактериолизины, лизоцим, пропердин, гидролазы и др.), а также многие биологически активные вещества [ИФН, лимфокины, простагландины (ПГ) и др.].
Вслед за внешними барьерами универсальные формы защиты макроорганизма составляют фагоцитирующие клетки и система комплемента. Они служат связующими звеньями между неспецифическими защитными факторами и специфическими иммунными реакциями. Фагоциты, представленные гранулоцитами и клетками макрофагально-моноцитарной системы, не только поглощают и уничтожают микроорганизмы, но и представляют микробные Аг иммунокомпетентным клеткам, инициируя иммунный ответ. Компоненты системы комплемента, присоединяясь к молекулам АТ, обеспечивают их лизирующий эффект в отношении клеток, содержащих соответствующие Аг.
Важнейший механизм защиты макроорганизма от воздействия патогенного возбудителя - формирование иммунитета как комплекса гуморальных и клеточных реакций, определяющих иммунный ответ. Иммунитет обусловливает течение и исход инфекционного процесса, служа одним из ведущих механизмов, поддерживающих гомеостаз организма человека.
Гуморальные реакции обусловлены активностью АТ, синтезируемых в ответ на проникновение Аг.
АТ представлены иммуноглобулинами различных классов:
- IgM;
- IgG;
- IgA ;
- IgD ;
- IgE .
В самой ранней стадии иммунного ответа первыми образуются IgM как филогенетически наиболее древние. Они активны в отношении многих бактерий, особенно в реакциях агглютинации (РА) и лизиса. Значимые титры IgG появляются на 7-8-е сутки после действия антигенного стимула. Однако при повторном попадании Аг они образуются уже на 2-3-и сутки, что обусловлено формированием клеток иммунологической памяти в динамике первичного иммунного ответа. При вторичном иммунном ответе титр IgG значительно превосходит титр IgM. В форме мономеров IgA циркулируют в крови и тканевых жидкостях, но особое значение имеют димеры IgA, отвечающие за иммунные
реакции на слизистых оболочках, где они нейтрализуют микроорганизмы и их токсины. Поэтому их еще называют секреторными АТ, поскольку в основном они содержатся не в сыворотке крови, а в секретах ЖКТ, респираторного и полового трактов. Особенно важную роль они играют при кишечных инфекциях и ОРВИ. Защитные функции IgD и IgE окончательно не изучены. Известно, что IgE участвует в развитии аллергических реакций.
Специфичность АТ обусловлена их строгим соответствием Аг возбудителя, послужившего причиной их образования, и взаимодействием с ними. Однако АТ могут реагировать и с Аг других микроорганизмов, имеющих сходную антигенную структуру (общие антигенные детерминанты).
В отличие от гуморальных реакций, реализующихся через циркулирующие в средах организма АТ, клеточные иммунные реакции реализуются через непосредственное участие иммунокомпетентных клеток.
Регуляция иммунного ответа осуществляется на генетическом уровне (гены иммунореактивности).
Окружающая среда как 3-й компонент инфекционного процесса влияет на его возникновение и характер течения, оказывая воздействие как на микро-, так и на макроорганизм. Температура, влажность и запыленность воздуха, солнечная радиация, антагонизм микроорганизмов и другие многочисленные природные факторы внешней среды определяют жизнеспособность патогенных возбудителей и оказывают влияние на реактивность макроорганизма, снижая его устойчивость ко многим инфекциям.
Чрезвычайно важны социальные факторы внешней среды, влияющие на развитие инфекционного процесса:
- ухудшение экологической обстановки и бытовых условий населения;
- неполноценное питание;
- стрессовые ситуации в связи с социально-экономическими и военными конфликтами;
- состояние здравоохранения;
- доступность квалифицированной медицинской помощи и т.д. Формы инфекционного процесса могут быть различными в зависимости от
свойств возбудителя, условий заражения и исходного состояния макроорганизма. До настоящего времени не все из них достаточно изучены и четко охарактеризованы. Основные формы инфекционного процесса могут быть представлены в виде следующей таблицы (табл. 2-1).
Таблица 2-1. Основные формы инфекционного процесса
Транзиторное (бессимптомное, здоровое) носительство - однократное (случайное) обнаружение в организме человека патогенного (или любого другого) микроорганизма в тканях, считающихся стерильными (например, в крови). Факт транзиторного носительства определяют в серии последовательных бак-
териологических анализов. При этом существующие в настоящее время методы обследования не позволяют выявить клинические, патоморфологические и лабораторные признаки заболевания.
Носительство патогенных микроорганизмов возможно на этапе выздоровления от инфекционной болезни (реконвалесцентное носительство). Оно характерно для ряда вирусных и бактериальных инфекций. В зависимости от длительности реконвалесцентное носительство разделяют на острое (до 3 мес после клинического выздоровления) и хроническое (свыше 3 мес). В этих случаях носительство протекает бессимптомно или эпизодически проявляется на субклиническом уровне, но может сопровождаться формированием функциональных и морфологических изменений в организме, развитием иммунных реакций.
Инаппарантная инфекция - одна из форм инфекционного процесса, характеризующаяся отсутствием клинических проявлений болезни, но сопровождающаяся нарастанием титров специфических АТ в результате развития иммунных реакций к Аг возбудителя.
Манифестные формы инфекционного процесса составляют обширную группу инфекционных болезней, вызываемых воздействием на организм человека различных микроорганизмов - бактерий, вирусов, простейших и грибов. Для развития инфекционного заболевания недостаточно только внедрения патогенного возбудителя в организм человека. Макроорганизм должен быть восприимчивым к данной инфекции, отвечать на воздействие возбудителя развитием патофизиологических, морфологических, защитно-приспособительных и компенсаторных реакций, определяющих клинические и другие проявления болезни. При этом микро- и макроорганизм взаимодействуют в определенных, в том числе и социально-экономических, условиях внешней среды, неизбежно влияющих на течение инфекционного заболевания.
Разделение заболеваний на инфекционные и неинфекционные достаточно условно.
В основном оно традиционно базируется на двух критериях, характерных для инфекционного процесса:
- присутствии возбудителя;
- контагиозности (заразности) заболевания.
Но вместе с тем обязательное сочетание этих критериев наблюдают далеко не всегда. Например, возбудитель рожи - β-гемолитический стрептококк группы А - также вызывает развитие неконтагиозных гломерулонефритов, дерматитов, ревматического процесса и других заболеваний, да и саму рожу, как одну из форм стрептококковой инфекции, считают практически неконтагиозной. Поэтому с лечением инфекционных заболеваний сталкиваются не только инфекционисты, но и представители практически всех клинических специальностей. По-видимому, большинство заболеваний человека можно было бы отнести к инфекционным. Создание инфекционной службы, исторически сложившейся как результат развития специализации в медицине, предназначено для оказания квалифицированной помощи инфекционным больным на догоспитальном (на дому), госпитальном (в стационаре) и диспансерном (наблюдение после выписки из стационара) этапах.
Характер, активность и длительность клинических проявлений инфекционного заболевания, обусловливающих степень его тяжести, могут быть чрезвычайно разнообразными.
При типичной манифестной инфекции ясно выражены клинические признаки и общие особенности, характерные для инфекционного заболевания:
- последовательность смены периодов;
- возможность развития обострений, рецидивов и осложнений, острых, фульминантных (молниеносных), затяжных и хронических форм;
- формирование иммунитета.
Степень тяжести манифестных инфекций может быть различной:
- легкой;
- средней;
- тяжелой.
Особую форму заболеваний, известных как медленные инфекции, вызывают прионы .
Для них характерны:
- многомесячный или даже многолетний инкубационный период;
- медленное, но неуклонно прогрессирующее течение;
- комплекс своеобразных поражений отдельных органов и систем;
- развитие онкологической патологии;
- неизбежный летальный исход.
Атипичные манифестные инфекции могут протекать как стертые, латентные и микст-инфекции. Стертая (субклиническая) инфекция представляет вариант манифестной формы, при котором клинические признаки заболевания и смена его периодов выражены нечетко, зачастую минимально, а иммунологические реакции отличаются незавершенностью. Диагностика стертой инфекции вызывает значительные трудности, что способствует пролонгированию инфекционного заболевания в связи с отсутствием своевременного полноценного лечения.
При ослабленном иммунном ответе макроорганизма и выраженной изменчивости возбудителя, длительное время сохраняющегося в организме, инфекционное заболевание может приобрести характер латентной инфекции с хроническим (более 6 мес) течением. На этапах внутриклеточного паразитирования возбудителя клинические проявления заболевания минимальны или полностью отсутствуют, при его диссеминации латентная инфекция клинически может повести себя как острое инфекционное заболевание. Такое течение инфекционного процесса можно наблюдать при герпетической инфекции, ЦМВ-инфекции, туберкулезе и др.
Возможно одновременное возникновение двух инфекционных заболеваний, вызванных разными возбудителями. В таких случаях говорят о смешанной инфекции, или микст-инфекции.
Развитие инфекционного заболевания может быть обусловлено диссеминированием патогенных возбудителей, находившихся ранее в организме человека в виде дремлющего латентного очага инфекции, или активацией условнопатогенной и даже нормальной флоры, населяющей кожу и слизистые оболочки. Такие заболевания известны как эндогенные инфекции (аутоинфекции).
Как правило, они развиваются на фоне иммунодефицитов, связанных с разнообразными причинами:
- тяжелыми соматическими заболеваниями;
- хирургическими вмешательствами;
- применением токсических лекарственных соединений, лучевого и гормонального лечения;
- ВИЧ-инфекцией.
Возможно повторное заражение одним и тем же возбудителем с последующим развитием заболевания (обычно в манифестной форме). Если такое инфицирование произошло после окончания первичного инфекционного процесса, его определяют как реинфекция. От реинфекций и, особенно, смешанных инфекций следует отличать суперинфекции, возникающие при заражении новым инфекционным агентом на фоне уже имеющегося инфекционного заболевания.
ОБЩИЕ ОСОБЕННОСТИ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Общепринятый термин «инфекционные болезни» ввел немецкий врач Кристоф Вильгельм Гуфеланд.
Основные признаки инфекционных болезней:
- специфический возбудитель как непосредственная причина заболевания;
- контагиозность (заразность) или возникновение нескольких (многих) заболеваний, обусловленных общим источником инфекции;
- нередко склонность к широкому эпидемическому распространению;
- цикличность течения (последовательная смена периодов болезни);
- возможность развития обострений и рецидивов, затяжных и хронических форм;
- развитие иммунных реакций к Аг возбудителя;
- возможность развития носительства возбудителя. Возбудители
Специфическими возбудителями инфекционных болезней могут быть:
- бактерии;
- риккетсии;
- хламидии;
- микоплазмы;
- грибы;
- вирусы;
- прионы.
В курсе инфекционных болезней изучают также паразитарные заболевания, вызываемые простейшими и гельминтами. Характеристика свойств возбудителей, позволяющих им быть непосредственной причиной инфекционных и паразитарных заболеваний, приведена выше (см. «Общую часть» в главе 2, раздел «Инфекционный процесс и инфекционные заболевания»).
Контагиозность (заразность) большинства инфекционных и паразитарных заболеваний связана с тем, что больной, выделяя возбудителя во внешнюю среду, становится источником инфекции и представляет опасность для окружающих здоровых лиц. В разные периоды заболевания степень контагиозности инфекционного больного неоднозначна. Например, больные гриппом наиболее контагиозны в первые 3 дня болезни, больные брюшным тифом - в периодах разгара заболевания и ранней реконвалесценции, когда выделение брюшнотифозных палочек с испражнениями достигает максимума. Степень контагиозности зависит не только от периода инфекционной болезни, но также от свойств самого возбудителя (например, заразность при гриппе в целом значительно выше, чем при дизентерии) и путей его передачи.
Чем выше контагиозность заболевания, тем больше его склонность к широкому эпидемическому распространению. Болезни с максимально выраженной контагиозностью, характеризующиеся тяжелым течением и высокой летальностью, объединены в группу особо опасных инфекций.
К таким болезням относят:
- чуму;
- холеру;
- желтую лихорадку;
- лихорадки Ласса, Эбола, Марбурга.
Цикличность течения свойственна большинству инфекционных заболеваний. Она выражается в последовательной смене определенных периодов болезни:
- инкубационного (скрытого);
- продромального (начального);
- периода основных проявлений (разгара болезни);
- угасания симптомов (ранней реконвалесценции);
- выздоровления (реконвалесценции).
Инкубационный период
Скрытый промежуток времени между моментом заражения (проникновения возбудителя в организм) и появлением первых клинических симптомов заболевания. Длительность инкубационного периода различна при разных инфекциях и даже у отдельных больных с одним и тем же инфекционным заболеванием.
Длительность этого периода зависит:
- от вирулентности возбудителя и его инфицирующей дозы;
- локализации входных ворот;
- состояния организма человека перед заболеванием, его иммунного статуса.
Определение сроков карантина, проведение профилактических мероприятий и решение многих других эпидемиологических вопросов проводят с учетом продолжительности инкубационного периода инфекционного заболевания.
Продромальный (начальный) период
Обычно продолжается не более 1-2 дней болезни, его наблюдают не при всех инфекциях.
В продромальном периоде клинические признаки заболевания не имеют четких специфических проявлений и зачастую одинаковы при разных заболеваниях:
- повышение температуры тела;
- головная боль;
- миалгии;
- артралгии;
- недомогание;
- разбитость;
- снижение аппетита и т.д.
Период основных проявлений (разгара) болезни
Этот период характеризуется появлением и (часто) нарастанием наиболее характерных, специфических для конкретного инфекционного заболевания клинических и лабораторных признаков. Степень их выраженности максимальна при манифестных формах инфекции.
По оценке этих признаков можно:
- поставить правильный диагноз;
- оценить тяжесть заболевания;
- предположить ближайший прогноз;
- предупредить развитие неотложных состояний.
Различная диагностическая значимость симптомов позволяет подразделить их на решающие, опорные и наводящие.
• Решающие симптомы характерны именно для конкретной инфекционной болезни (например, пятна Филатова-Коплика-Бельского при кори, геморрагическая звездчатая сыпь с элементами некроза при менингококцемии).
• Опорные симптомы типичны для данного заболевания, но их можно встретить и при некоторых других (желтухи при вирусных гепатитах, менингеальные симптомы при менингитах и т.д.).
• Наводящие симптомы менее специфичны и сходны при ряде инфекционных заболеваний (лихорадка, головная боль, озноб и др.).
Период угасания симптомов (ранней реконвалесценции)
Следует за периодом разгара при благоприятном течении инфекционного заболевания. Характеризуется постепенным исчезновением основных симптомов.
Одно из его первых проявлений - снижение температуры тела. Оно может происходить быстро, в течение нескольких часов (кризис), или постепенно, на протяжении нескольких дней заболевания (лизис).
Период выздоровления (реконвалесценции)
Развивается после угасания основных клинических симптомов. Клиническое выздоровление почти всегда наступает раньше, чем полностью исчезают морфологические нарушения, вызванные заболеванием.
В каждом конкретном случае длительность последних двух периодов инфекционного заболевания различна, что зависит от многих причин:
- формы болезни и ее тяжести;
- эффективности проводимого лечения;
- особенностей иммунологического реагирования организма больного и т.д.
При полном выздоровлении восстанавливаются все функции, нарушенные вследствие инфекционного заболевания, при неполном выздоровлении сохраняются те или иные остаточные явления.
При многих инфекционных заболеваниях также существует возможность развития обострений и рецидивов, затяжных и хронических форм. Причины этих состояний разнообразны и недостаточно изучены.
Они могут быть связаны со специфическими особенностями всех трех компонентов инфекционного процесса:
- возбудителя;
- макроорганизма;
- условий окружающей среды.
Изменчивость возбудителя, формирование у него резистентности к этиотропному лечению, образование L-форм бактерий, способность к внутриклеточному паразитированию, образование ауто-Аг - лишь некоторые свойства микроорганизмов, имеющие значение в пролонгировании и хронизации инфекционного заболевания.
У каждого больного течение инфекционного заболевания имеет индивидуальные особенности.
Они могут быть обусловлены:
- предшествующим физиологическим состоянием важнейших органов и систем (преморбидным фоном) пациента;
- характером питания;
- особенностями формирования неспецифических и специфических защитных реакций;
- проведением в анамнезе вакцинации и т.д.
На состояние макроорганизма и, следовательно, на течение инфекционного заболевания оказывают влияние многочисленные факторы окружающей среды:
- температура;
- влажность;
- уровень радиации и др.
Особое значение имеет влияние социальных факторов на развитие инфекционного заболевания у человека:
- миграция населения;
- характер питания;
- стрессовые ситуации и др.
Неблагоприятное воздействие на макроорганизм оказывают аспекты ухудшающейся экологической обстановки:
- радиация;
- загазованность;
- канцерогенные вещества и т.д.
Ухудшение внешней среды, наиболее заметное в последние десятилетия, оказывает активное влияние на изменчивость микроорганизмов, а также на формирование неблагоприятного преморбидного фона у человека (в частности, иммунодефицитных состояний). В результате типичная клиническая картина и течение многих инфекционных заболеваний существенно меняются.
В практике врачей-инфекционистов укоренились понятия:
- классическое и современное течение инфекционной болезни;
- атипичные, абортивные, стертые формы;
- обострения и рецидивы.
Атипичными формами инфекционного заболевания считают состояния, отличающиеся доминированием в его клинических проявлениях признаков, не свойственных данному заболеванию, или отсутствием типичных симптомов. Например, преобладание менингеальных симптомов (менинготиф) или отсутствие розеолезной экзантемы при брюшном тифе. К атипичным формам относят и абортивное течение, характеризующееся исчезновением клинических проявлений заболевания без развития его типичных признаков. При стертом течении болезни характерные для нее симптомы отсутствуют, а общие клинические проявления выражены слабо и кратковременно.
Обострением инфекционного заболевания считают повторное ухудшение общего состояния больного с нарастанием характерных клинических признаков заболевания после их ослабления или исчезновения. Если основные патогномоничные признаки заболевания вновь развиваются у больного уже после полного исчезновения клинических проявлений болезни, говорят о ее рецидиве.
Помимо обострений и рецидивов, в любой период инфекционной болезни возможно развитие осложнений. Их условно разделяют на специфические (патогенетически связанные с основным заболеванием) и неспецифические.
• Виновником специфических осложнений бывает возбудитель данного инфекционного заболевания. Они развиваются вследствие необычной выраженности типичных клинических и морфологических проявлений болезни (например, острая печеночная энцефалопатия при вирусных гепатитах, перфорация язв подвздошной кишки при брюшном тифе) либо по причине атипичных локализаций тканевых повреждений (например, эндокардит или артрит при сальмонеллезе).
• Неспецифическими считают осложнения, вызванные микроорганизмами другого вида (например, бактериальная пневмония при гриппе).
Самые опасные осложнения инфекционных заболеваний:
- инфекционно-токсический шок (ИТШ);
- острая печеночная энцефалопатия;
- острая почечная недостаточность (ОПН);
- отек мозга;
- отек легких;
- гиповолемический, геморрагический и анафилактический шок.
Они рассмотрены в соответствующих главах специальной части учебника.
Многим инфекционным заболеваниям свойственна возможность развития микробного носительства. Носительство - это своеобразная форма инфекционного процесса, при которой макроорганизм после интервенции возбудителя не способен полностью его элиминировать, а микроорганизм не в состоянии больше поддерживать активность инфекционного заболевания. Механизмы развития носительства до настоящего времени изучены недостаточно, методы эффективной санации хронических носителей до сих пор в большинстве случаев не разработаны. Предполагают, что в основе формирования носительства лежит изменение иммунных реакций, при котором проявляются избирательная толерантность иммунокомпетентных клеток к Аг возбудителя и неспособность мононуклеарных фагоцитов к завершенному фагоцитозу.
Формированию носительства могут способствовать:
- врожденные, генетически обусловленные особенности макроорганизма;
- ослабление защитных реакций вследствие перенесенных ранее и сопутствующих заболеваний;
- пониженная иммуногенность возбудителя (снижение его вирулентности, трансформация в L-формы).
С формированием носительства связывают следующие факторы:
- хронические воспалительные заболевания разных органов и систем;
- гельминтозы;
- дефекты лечения;
- характер течения инфекционного заболевания и т.д. Длительность носительства различных патогенных микроорганизмов может
варьировать чрезвычайно широко - от нескольких дней (транзиторное носительство) до месяцев и лет (хроническое носительство). Иногда (например, при брюшном тифе) носительство может сохраняться пожизненно.
ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ СИНДРОМА ИНТОКСИКАЦИИ, ФОРМИРУЮЩИЕСЯ ПОД ВОЗДЕЙСТВИЕМ ЛИПОПОЛИСАХАРИДНОГО КОМПЛЕКСА
Благодаря многочисленным исследованиям отечественных и зарубежных ученых расшифрованы механизмы последовательных ответных реакций, возникающих в организме человека под воздействием бактериальных эндотоксинов большинства микроорганизмов. Совокупность этих реакций представляет собой активацию или угнетение функционального состояния различных органов и систем организма, что выражается в развитии синдрома интоксикации. С биологических позиций синдром интоксикации - системная ответная реакция организма на воздействие чужеродного агента.
Сопротивление организма человека проникновению эндотоксина во внутреннюю среду начинается с активного уничтожения возбудителя при помощи клеточных (макрофагов, полиморфно-ядерных лейкоцитов и других фагоцитов) и гуморальных (специфических и неспецифических) факторов. Прежде всего происходит распознавание ЛПС и других патоген-ассоциированных молекул (PAMP), осуществляемое при помощи TLR. Без распознавания и обнаружения невозможен защитный ответ макроорганизма. В тех случаях, когда эндотоксину удается проникнуть в кровь, включается система антиэндотоксиновой защиты (рис. 2-1). Она может быть представлена в виде совокупности неспецифических и специфических факторов.
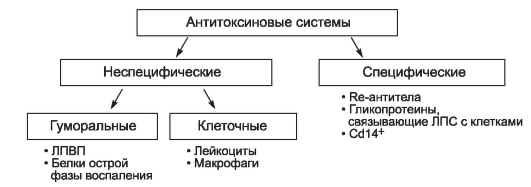
Рис. 2-1. Система антиэндотоксиновой защиты
Неспецифические факторы антиэндотоксиновой защиты включают клеточные (лейкоциты, макрофаги) и гуморальные механизмы. Участие гуморальных факторов в защитных реакциях продолжают изучать, но уже не оспаривают тот факт, что на пути эндотоксина прежде всего встают липопротеины высокой плотности. Обладая уникальной способностью адсорбировать ЛПС-комплекс, они нейтрализуют, а затем выводят эндотоксин из организма человека.
Такими же свойствами обладают белки острой фазы воспаления:
- альбумины;
- преальбумины;
- трансферин;
- гаптоглобин.
Специфические факторы антиэндотоксиновой защиты включают Re-АТ и гликопротеины (LBP), связывающие ЛПС-комплекс с СD14+-клетками. Re-АТ
постоянно присутствуют в крови, так как вырабатываются в ответ на воздействие эндотоксина, поступающего из кишечника. Следовательно, от их первоначальной концентрации, а также от способности их быстрого синтеза в случаях избыточного поступления ЛПС-комплексов зависит сила нейтрализующего антитоксинового эффекта.
Гликопротеин (LBP) из группы белков острой фазы воспаления синтезируют гепатоциты. Его основная функция - опосредование взаимодействия ЛПСкомплекса со специфическими рецепторами клеток миелоидного ряда CD 14+. ЛПС-комплекс и LBP усиливают примиряющее действие липополисахаридов на гранулоциты, опосредуя выработку активных форм кислорода, ФНО и других цитокинов.
Только после преодоления мощных механизмов антиэндотоксиновой защиты ЛПС-комплекс начинает осуществлять свое воздействие на органы и системы макроорганизма. На клеточном уровне основная мишень ЛПС-комплекса - активация арахидонового каскада, становящаяся ведущим повреждающим фактором при эндогенной интоксикации. Известно, что регуляция активности клеток реализуется в том числе и через высвобождение арахидоновой кислоты из фосфолипидов клеточной мембраны. Под действием катализаторов арахидоновая кислота поэтапно расщепляется с образованием ПГ (арахидоновый каскад). Последние через аденилатциклазную систему осуществляют регуляцию функций клеток. Под действием ЛПС-комплекса метаболизм арахидоновой кислоты идет по липооксигеназному и циклооксигеназному путям (рис. 2-2).
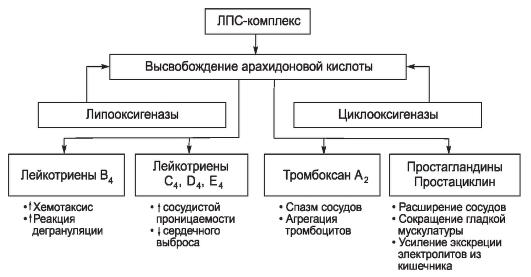
Рис. 2-2. Образование биологически активных веществ из арахидоновой кислоты
Конечный продукт липооксигеназного пути - лейкотриены. Лейкотриен В4 усиливает хемотаксис и реакции дегрануляции, а лейкотриены С4, D4, Е4 увеличивают проницаемость сосудов и снижают сердечный выброс.
При расщеплении арахидоновой кислоты по циклооксигеназному пути образуются простаноиды (промежуточные и конечные формы). Под действием ЛПС-комплекса появляется избыточное количество тромбоксана А2, вызывающего вазоконстрикцию, а также агрегацию тромбоцитов во всем сосудистом русле. Вследствие этого образуются тромбы в мелких сосудах и развиваются
микроциркуляторные нарушения, приводящие к нарушению трофики тканей, задержке в них продуктов метаболизма и развитию ацидоза. Степень нарушения кислотно-щелочного состояния (КЩС) во многом определяет силу интоксикации и тяжесть заболевания.
Развитие микроциркуляторных расстройств вследствие изменений реологических свойств крови - морфологическая основа синдрома интоксикации. В ответ на усиленное образование тромбоксана А2, вызванное ЛПСкомплексом, сосудистая сеть начинает выделять простациклин и антиагрегационные факторы, восстанавливающие реологические свойства крови.
Влияние ЛПС-комплекса на циклооксигеназный путь распада арахидоновой кислоты реализуется через образование большого количества ПГ (и их промежуточных форм).
Их биологическая активность проявляется:
- расширением сосудов [один из основных факторов снижения артериального давления (АД) и даже развития коллапса];
- сокращением гладкой мускулатуры (возбуждение перистальтических волн тонкого и толстого кишечника);
- усилением экскреции электролитов, а вслед за ними и воды в просвет кишечника.
Поступление электролитов и жидкости в просвет кишечника в сочетании с усилением перистальтики клинически проявляется развитием диареи, ведущей к дегидратации.
При этом обезвоживание организма проходит несколько последовательных стадий:
- снижение объема циркулирующей плазмы крови (сгущение крови, возрастание гематокрита);
- уменьшение объема внеклеточной жидкости (клинически это выражается снижением тургора кожи);
- развитие клеточной гипергидратации (острый отек и набухание головного мозга).
Помимо этого, ПГ проявляют пирогенные свойства, их избыточное образование приводит к повышению температуры тела.
Одновременно и во взаимодействии с арахидоновым каскадом ЛПСкомплекс активирует клетки миелоидного ряда, что ведет к образованию широкого спектра эндогенных медиаторов липидной и белковой природы (прежде всего цитокинов), обладающих исключительно высокой фармакологической активностью.
Среди цитокинов ведущее место в реализации биологических эффектов ЛПС-комплекса занимает ФНО. Это один из первых цитокинов, уровень которого возрастает в ответ на воздействие ЛПС-комплекса. Он способствует активизации каскада цитокинов (прежде всего ИЛ-1, ИЛ-6 и др.).
Таким образом, начальная повреждающая фаза синдрома интоксикации, формирующегося под воздействием ЛПС-комплекса, реализуется через активизацию арахидонового и цитокинового каскадов, в результате чего происходит расстройство системы управления клеточными функциями. В подобных ситуациях обеспечение жизнедеятельности организма человека и сохранение его гомеостаза требуют включения вышестоящих регуляторных механизмов. Задачи последних включают создание условий для удаления возбудителяисточника ЛПС-комплексов и восстановление разбалансированных функций
клеточных систем. Эту роль выполняют биологически активные соединения, задействованные в адаптационных механизмах, а также регулирующие системные реакции организма.
Впервые роль глюкокортикоидных гормонов в развитии стресс-синдрома как адекватной адаптационной ответной реакции на повреждение определил канадский биохимик Ханс Селье. На высоте интоксикации происходит активация коры надпочечников, приводящая к усиленному выбросу глюкокортикоидов в кровь. Эти реакции контролируют АД в условиях повышенной проницаемости сосудов и резкого изменения реологических свойств крови (повышенное тромбообразование, нарушения микроциркуляции и трофики органов). При истощении потенциальных и резервных возможностей коры надпочечников развивается острая сердечно-сосудистая недостаточность (коллапс ).
Регуляторная роль ренин-ангиотензин-альдостероновой системы возрастает на высоте эндогенной интоксикации, особенно на фоне обезвоживания организма (диарея при острых кишечных инфекциях). Благодаря ее активации организм пытается сохранить водно-электролитный состав в жидкостных объемах, т.е. сохранить постоянство гомеостаза.
Активация плазменного калликреиногенеза в условиях интоксикации ведет к изменению фазовых структур систол левого и правого желудочков сердца.
На высоте интоксикации усиливается обмен серотонина и гистамина, что напрямую связано с агрегацией тромбоцитов в сосудистом русле и состоянием микроциркуляции.
Происходит интенсивное изучение участия системы катехоламинов в процессе развития интоксикации, а также других систем, участвующих в управлении жизненно важными функциями организма.
Анализируя приведенные данные об известных и изучаемых механизмах развития синдрома интоксикации, следует обратить особое внимание на 2 положения:
- последовательность включения механизмов защиты;
- взаимодействие различных систем управления функциями органов и систем организма.
Именно взаимодействие систем управления, направленное на сохранение и (или) восстановление гомеостаза организма человека, можно определить как синдром адаптации.
Активизация регуляторных механизмов, возникающих в ответ на повреждающее действие ЛПС-комплекса, реализуется через функциональные возможности различных органов и систем. При развитии интоксикации практически все органные клеточные системы вовлекаются в процесс сохранения гомеостаза организма и удаления эндотоксина. На рис. 2-3 представлены системные реакции организма на фоне интоксикации.
На основании общепатологических подходов была разработана концепция медико-биологического значения синдрома интоксикации в развитии инфекционных заболеваний. Синдром интоксикации имеет уникальное значение для клиники инфекционных болезней, поскольку, с одной стороны, представляет универсальный клинический синдромокомплекс, развитие которого типично для большинства инфекционных заболеваний независимо от этиологического фактора, а с другой - степень его выраженности определяет тяжесть и исход болезни. В общепатологическом же плане синдром интоксикации выступает клиническим
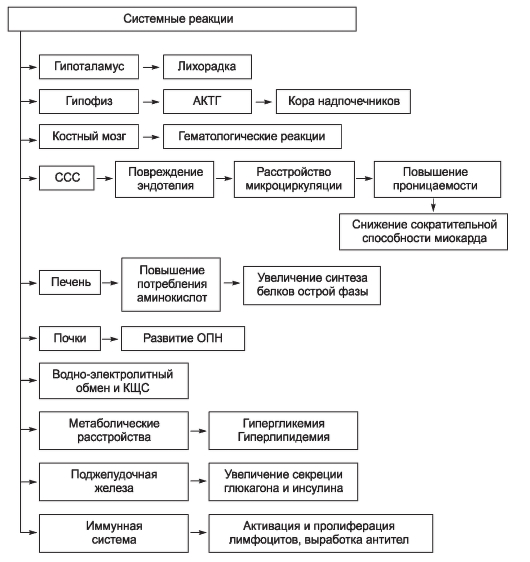
Рис. 2-3. Системные реакции организма в ответ на интоксикацию
эквивалентом срочной адаптации организма в условиях микробной инвазии. Исключительно большое значение для клиники инфекционных заболеваний имеет установление характера сбоя в регуляции адаптационного потенциала организма, что клинически проявляется более тяжелыми формами заболевания, развитием осложнений и, в крайнем случае, летальным исходом.
Необходимо подчеркнуть, что изменения параметров функционального состояния отдельно взятого органа или отдельно взятой клеточной системы при синдроме интоксикации зачастую далеко не всегда свидетельствуют о поражении этого органа или системы. Наоборот, отклонения показателей функционального состояния органа от нормальных могут быть индикатором необходимости в компенсации поврежденных функций или их временной замене (например, тахикардия при обезвоживании).
Об органной патологии следует говорить только в том случае, если инфекционный агент непосредственно поражает ткань органа (например, при ВГА)
или происходит истощение резервных возможностей органа при его тяжелой работе. Патологические изменения и реакции систем органов (положительные или отрицательные) представлены в разделе «Специальная часть».
Крайне неблагоприятный исход инфекционных заболеваний - развитие ИТШ, а при некоторых из них (например, в терминальную стадию холеры, сальмонеллезов) и гиповолемического шока (рис. 2-4).
Клиническая картина шока описана в соответствующих разделах данного учебника. Однако необходимо представить себе, какие механизмы лежат в основе этого состояния, что представляет собой шок с патофизиологических позиций.
По мнению авторов учебника, шок может возникнуть на фоне израсходованных резервов организма, без восстановления которых создаются условия, несовместимые с жизнью. Однако это состояние может быть обратимым, если недостающие резервы пополнить извне.
Вместе с тем известно, что в организме человека, погибшего от шока, в ряде случаев жизненные резервы остаются использованными далеко не полностью. В этой ситуации шок, по-видимому, возникает вследствие отказа системы управления функциями органов и систем. На современном уровне развития биологии и медицины этот патогенетический механизм восстановить крайне трудно в силу еще недостаточных знаний в этой области и, следовательно, отсутствия возможности разработать систему борьбы с указанным состоянием. В этих случаях шок следует считать необратимым.
ПАТОГЕНЕЗ ВИРУСНЫХ ЗАБОЛЕВАНИЙ
Основное отличие вирусов от других инфекционных агентов состоит в механизме их репродукции. Вирусы не способны к самостоятельному размножению. В основе патогенеза вирусных инфекций лежит взаимодействие генома вируса с генетическим аппаратом чувствительной клетки. Некоторые вирусы способны размножаться в самых различных клетках, другие размножаются лишь в клетках определенных тканей. Это связано с тем, что количество специфических рецепторов, обеспечивающих взаимодействие вируса с клетками, в последнем случае ограничено. Весь репликативный цикл вируса осуществляется с использованием метаболических и генетических ресурсов клетки. Поэтому характер развития внутритканевых процессов определяется, с одной стороны, цитопатическим действием вируса на клетки данной ткани и органа, с другой - реакцией внутритканевых и органных систем защиты от вируса. Последние часто носят деструктивный характер, усугубляющий течение заболевания.
Распространение вирусов в организме может носить локальный или системный характер.
Исключая поражения, вызываемые вирусами, распространяющимися по нервной ткани, вирусная инфекция протекает с виремией. Виремия характеризуется степенью вирусной нагрузки, прямо коррелирующей со степенью общего токсикоза, тяжестью состояния пациента.
Виремия приводит к чрезмерной секреции лимфокинов эндотелиальными клетками и повреждению стенок кровеносных сосудов с развитием геморрагий, капиллярного токсикоза, тканевого геморрагического отека легких, почек и других паренхиматозных органов. Для ряда вирусов характерна индукция программированной клеточной гибели, т.е. апоптоза инфицированных клеток.
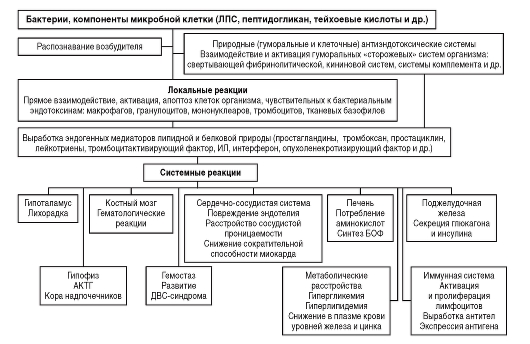
Рис. 2-4. Схема развития интоксикации (Малов В.А., Пак С.Г., 1992)
Многие вирусы поражают иммунокомпетентные клетки. Это чаще проявляется нарушением функций и уменьшением количества Т-хелперов, что приводит к гиперактивации В-клеточного звена иммунитета, но со снижением функциональных возможностей плазматических клеток по синтезу высокоаффинных АТ. Одновременно происходит увеличение содержания и активация Т-супрессоров, а также В-клеток.
Различают латентные формы вирусных инфекций, при которых вирусы длительное время сохраняются в организме без клинических проявлений, но под влиянием неблагоприятных факторов могут реактивироваться и вызвать обострение заболевания (большинство вирусов герпеса), а также развитие медленных инфекций. Последние характеризуются длительным инкубационным периодом (месяцы и годы), в течение которого возбудитель размножается, вызывая явные повреждения тканей. Заболевание заканчивается развитием тяжелых поражений и смертью больного (подострый склерозирующий панэнцефалит, ВИЧ-инфекция и др.).
ОСНОВНЫЕ КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Разделение заболеваний на инфекционные и неинфекционные весьма условно. В подавляющем большинстве случаев заболевание бывает результатом взаимодействия инфекционного агента (бактерий, вирусов и т.д.) и макроорганизма. Вместе с тем многие виды воспалительных поражений легких (пневмонии), сердца (септические эндокардиты), почек (нефриты, пиелонефриты), печени (абсцессы) и других органов формально не относят к разряду инфекционных болезней.
Если в основу разделения этих групп заболеваний положить эпидемиологический фактор, то такие болезни, как столбняк, бруцеллез, ботулизм и многие другие, отнесенные к группе инфекционных, не представляют эпидемической опасности в коллективе. В то же время хронические вирусные гепатиты, лечением которых занимаются в основном терапевты, могут передаваться от человека человеку.
Принимая во внимание изложенные обстоятельства, в данном разделе приведено клиническое описание основных симптомов и синдромов, возникающих при взаимодействии микро- и макроорганизмов в процессе развития заболеваний, независимо от того, относят их к инфекционным или неинфекционным.
Для подавляющего большинства инфекционных болезней характерен общетоксический синдром. Клинически он представляет собой частое сочетание лихорадки с многочисленными другими проявлениями интоксикации.
Лихорадка - любое повышение температуры тела более 37 °С. Ее характер (температурная кривая) весьма типичен при многих инфекционных заболеваниях, что служит важным диагностическим признаком. Она не характерна лишь для немногих манифестных форм инфекционных болезней (например, для холеры и ботулизма). Лихорадка также может отсутствовать при легком, стертом или абортивном течении заболеваний.
Основные критерии лихорадки:
- длительность;
- высота температуры тела;
- характер температурной кривой.
Чаще всего наблюдают острую лихорадку длительностью не более 15 дней. Лихорадку, продолжающуюся от 15 дней до 6 нед, называют подострой, более 6 нед - субхронической и хронической. По высоте температуру тела разделяют на субфебрильную (37-38 °С), умеренную (до 39 °С), высокую (до 40 °С) и гиперпиретическую (свыше 41 °С).
По характеру температурной кривой с учетом разницы между самой высокой и самой низкой температурой за день различают следующие основные типы лихорадки.
• Постоянная лихорадка (febris continua). Характерны колебания между показателями утренней и вечерней температуры, не превышающие 1 °С. Ее наблюдают при брюшном и сыпном тифах, иерсиниозах, крупозной пневмонии.
• Послабляющая, или ремиттирующая, лихорадка (febris remittens). Характерны дневные колебания температуры (не снижающиеся до нормы) в пределах от 1-1,5 °С. Наблюдают при некоторых риккетсиозах, туберкулезе, гнойных заболеваниях и др.
• Перемежающаяся, или интермиттирующая, лихорадка (febris intermittens). Характерны правильные чередования периодов повышения температуры тела, как правило, быстрого и кратковременного (пароксизмы лихорадки), с безлихорадочными периодами (апирексия). При этом ее минимальные показатели в течение 1 сут лежат в пределах нормы. Такой тип лихорадки отмечают при малярии, некоторых септических состояниях, висцеральном лейшманиозе.
• Возвратная лихорадка (febris reccurens). Представлена чередованиями приступов высокой температуры тела с ее быстрым подъемом, критическим падением и периодами апирексии. Лихорадочный приступ и апирексия длятся несколько дней. Данный вид лихорадки характерен для возвратных тифов.
• Гектическая, или истощающая, лихорадка (febris hectica). Характерны резкие повышения температуры тела на 2-4 °С и быстрые ее падения до нормального уровня и ниже, которые повторяются 2-3 раза в течение суток и сопровождаются профузной потливостью. Встречается при сепсисе.
• Волнообразная, или ундулирующая, лихорадка (febris undulans). Характерна температурная кривая со сменой периодов постепенного нарастания температуры до высоких цифр и постепенного ее понижения до субфебрильных или нормальных показателей. Эти периоды длятся несколько дней (бруцеллез, некоторые формы иерсиниозов, рецидивирующий брюшной тиф).
• Неправильная, или атипичная, лихорадка (febris irregularis, sine atypica). Характерны разнообразные и неправильные суточные колебания неопределенной длительности. Наблюдают при многих инфекционных заболеваниях (грипп, дифтерия, столбняк, менингиты, сибирская язва и др.).
• Обратная лихорадка. Иногда встречают при бруцеллезе, септических состояниях. При этом утренние показатели температуры тела превышают вечерние.
В течении лихорадки различают три периода:
- нарастания;
- стабилизации;
- снижения температуры тела.
Выделение этих периодов с их клинической оценкой важно для диагностики инфекционного заболевания и для определения комплекса мероприятий по медицинской помощи больному.
При остром начале заболевания (грипп, сыпной тиф, менингококковый менингит, рожа, лептоспироз и др.) нарастание температуры тела до высоких цифр происходит быстро, в течение 1 сут и даже нескольких часов. Постепенное начало заболевания сопровождается нарастанием лихорадки в течение нескольких суток, как это бывает, например, в случаях классического течения брюшного тифа. Оканчивается лихорадка или очень быстро, через несколько часов (критическое снижение температуры), или медленно, постепенно, в течение нескольких дней (литическое снижение).
В некоторых случаях при тяжелом течении инфекционного заболевания отмечают гипотермию - не повышение, а падение температуры тела ниже нормального уровня. Сочетание гипотермии с нарастающими симптомами интоксикации и гемодинамических расстройств крайне неблагоприятно и свидетельствует о развитии ИТШ.
Лихорадку при инфекционных заболеваниях обычно сопровождают другие проявления интоксикации, связанные с поражениями различных органов и систем. При развитии токсинемии в первую очередь наблюдают признаки поражения ЦНС (головная боль, слабость, недомогание, нарушение сна), либо более выраженные признаки токсической энцефалопатии (возбуждение или апатия, эмоциональная лабильность, чувство тревоги, нарушения сознания различной степени вплоть до глубокой комы).
Интоксикация также приводит к нарушениям сердечно-сосудистой деятельности:
- брадикардии или тахикардии;
- глухости тонов сердца;
- снижению или увеличению АД.
Возникают изменения окраски кожных покровов и слизистых оболочек (иктеричность, цианоз, бледность или гиперемия), сухость слизистых оболочек и жажда, уменьшение количества выделяемой мочи (олигурия, анурия) и многие другие клинические симптомы.
Важные диагностические признаки, выявляемые при осмотре инфекционного больного, представляют изменения кожного покрова и слизистых оболочек - их окраски, эластичности и влажности, различные высыпания на них. Бледность кожных покровов может свидетельствовать о спазме кровеносных сосудов или депонировании крови в брюшной полости (например, при ИТШ). Появление цианоза связано с выраженными нарушениями метаболизма и гипоксией тканей (при менингококцемии, тяжелой форме сальмонеллеза, сепсисе и др.).
Для некоторых инфекционных заболеваний (грипп, сыпной тиф, псевдотуберкулез) характерна гиперемия кожи, преимущественно лица и верхней половины туловища. Вследствие поражения печени или гемолиза эритроцитов можно наблюдать желтушное окрашивание кожи, склер и слизистых оболочек (вирусные гепатиты, лептоспироз).
Сухость кожи и снижение ее эластичности (тургора) свидетельствуют о значительном обезвоживании. Выраженное потоотделение наблюдают при малярии, бруцеллезе, сепсисе, пневмонии. Обычно оно сопровождает этапы критического снижения температуры тела.
Для многих инфекционных заболеваний характерны высыпания на коже (экзантемы).
Элементы сыпи довольно разнообразны:
- розеолы;
- пятна;
- эритема;
- геморрагии;
- папулы;
- везикулы;
- пустулы;
- волдыри.
Позднее первичные элементы сыпи могут сменяться образованием чешуек, пигментных пятен, язв и рубцов. Большое диагностическое значение имеют характер экзантемы, сроки ее появления (день болезни), последовательность (этапность) высыпаний, преимущественная локализация, количество элементов сыпи и последующая динамика их развития.
При некоторых трансмиссивных инфекциях (туляремия, боррелиозы и др.) в месте внедрения возбудителя в кожу развивается первичный аффект - участок воспаления кожных покровов, предшествующий другим клиническим проявлениям болезни.
При осмотре слизистых оболочек можно обнаружить энантему с образованием везикул, эрозий и язв, мелких кровоизлияний (пятна Киари-Авцына на переходной складке конъюнктив у больных сыпным тифом), очагов некроза эпителия (пятна Бельского-Филатова-Коплика на слизистой оболочке щек при кори).
Большое диагностическое значение придают выявленным изменениям слизистых оболочек глаз:
- гиперемии конъюнктив;
- инъекции сосудов склер (грипп, корь, лептоспироз);
- образованию на конъюнктивах фибринозных пленок с резким отеком век (дифтерия глаза, пленчатые аденовирусные конъюнктивиты).
Можно наблюдать изменения цвета слизистых оболочек - иктеричность склер, мягкого нёба, уздечки языка при поражениях печени, цианотичный оттенок слизистых оболочек ротоглотки при дифтерии.
Многие инфекционные заболевания сопровождает лимфаденопатия - увеличение лимфатических узлов. При осмотре и пальпации оценивают их величину, консистенцию, болезненность, подвижность, их спаянность с окружающей клетчаткой и кожей (периаденит). В неясных диагностических случаях проводят пункцию и биопсию лимфатических узлов. Специфические изменения изолированных групп лимфатических узлов, так называемый регионарный лимфаденит, наблюдают при чуме, туляремии, фелинозе (болезнь кошачьих царапин), дифтерии, различного рода ангинах. Регионарными такие изменения называют потому, что они развиваются около входных ворот инфекции и представляют собой место первичной локализации и накопления возбудителя. При вовлечении в процесс 2-3 групп лимфатических узлов и более говорят о генерализованной лимфаденопатии. Она характерна для ВИЧ-инфекции, бруцеллеза, инфекционного мононуклеоза, хламидиоза и т.д.
Некоторым инфекциям свойственно поражение суставов в виде моно-, поли- и периартритов (бруцеллез, иерсиниозы, менингококковая инфекция, боррелиозы).
Катарально-респираторный синдром ярко выражен при ОРВИ и проявляется:
- насморком;
- кашлем;
- чиханьем;
- болями и першением в горле и носоглотке.
При осмотре больных выявляют гиперемию, в ряде случаев отечность слизистых оболочек верхних отделов респираторного тракта, налеты разнообразного характера (рыхлые фолликулярные или лакунарные при ангинах кокковой этиологии, фибринозные локализованные или распространенные при дифтерии и т.д.). Нередко развиваются бронхиты, бронхиолиты и пневмонии; последние при некоторых инфекционных заболеваниях носят специфический характер (ку-лихорадка, легионеллез, микоплазмоз, орнитоз).
Изменения сердечно-сосудистой системы характерны для многих инфекционных заболеваний и часто бывают связаны с развитием интоксикации. Однако при некоторых инфекциях изменения со стороны сердца и сосудов бывают специфическими проявлениями заболевания (дифтерия, геморрагические лихорадки, сыпной тиф, менингококковая инфекция).
Для клинической картины острых кишечных инфекций наиболее типична диарея. Она обычно сочетается с разнообразными диспепсическими расстройствами, существенно различающимися при разных кишечных инфекциях, - болями в животе, тошнотой и рвотой, нарушениями аппетита, а также лихорадкой и другими симптомами общей интоксикации (шигеллезы, сальмонеллезы, эшерихиозы, иерсиниозы, вирусные энтериты и др.). Поскольку характер стула связан с развитием патологических процессов в разных отделах ЖКТ, важную роль в постановке диагноза кишечных инфекций играет осмотр. При поражении тонкой кишки наблюдают энтеритный стул - частый и обильный, жидкий, водянистый, с частицами непереваренной пищи, пенистый, зловонный, зеленоватой или светло-желтой окраски. При патологическом процессе в толстой кишке наблюдают колитический стул - кашицеобразной или полужидкой консистенции, коричневого цвета, частый, объем каловых масс имеет тенденцию к уменьшению с каждой последующей дефекацией. В кале могут быть выявлены патологические примеси в виде слизи или крови. При тяжелом колите испражнения скудны и состоят только из слизи, прожилок или капелек крови, иногда примеси гноя (ректальный плевок). При этом можно наблюдать ложные позывы и болезненные сокращения толстой кишки - тенезмы.
Тифо-паратифозные заболевания может осложнить развитие обильного кишечного кровотечения. В этом случае кал приобретает дегтеобразный вид (мелена ).
Вместе с тем следует учитывать, что характер стула (в первую очередь - его окраска) может быть связан с пищевыми продуктами, употреблявшимися больным (свекла, черника и др.).
Одно их важных проявлений многих инфекционных заболеваний, сопровождающихся циркуляцией возбудителя в крови, - гепатолиенальный синдром. Он выражается в сочетанном увеличении печени и селезенки, что объясняется активными реакциями ретикулогистиоцитарной ткани в указанных органах.
Гепатолиенальный синдром формируется при вирусных гепатитах, бруцеллезе, лептоспирозе, малярии, сыпном тифе, тифо-паратифозных и других
инфекционных заболеваниях, протекающих в генерализованной форме. С помощью перкуссии и пальпации оценивают размеры печени и селезенки, их консистенцию, чувствительность или болезненность органов.
Менингеальный синдром развивается при менингитах различной этиологии. Он обычно сочетается с общими токсическими проявлениями и изменениями спинномозговой жидкости. Умение выявить его признаки чрезвычайно важно для ранней диагностики заболеваний и своевременного начала полноценного лечения, от чего часто зависит судьба больного. Менингеальный синдром включает общемозговые и оболочечные симптомы.
• Общемозговые симптомы - нарастающая по силе головная боль диффузного, распирающего характера, внезапная рвота без предшествующей тошноты и, как правило, не приносящая облегчения больному, а также нарушения сознания различной степени, вплоть до глубокой комы.
• Оболочечные симптомы - слуховая, зрительная и тактильная гиперестезия, болезненность при надавливании на глазные яблоки при закрытых веках, на точки выхода ветвей тройничного нерва и затылочных нервов, при перкуссии черепа.
Наряду с общемозговыми и оболочечными симптомами возникает менингеальная симптоматика в виде ригидности мышц затылка, симптомов Кернига, Брудзинского и др.
• Ригидность мышц затылка выявляют при попытке пассивно пригнуть голову больного, лежащего на спине, к его груди.
• Симптом Кернига выражается в невозможности полного пассивного разгибания в колене предварительно согнутой под прямым углом в тазобедренном суставе ноги больного (проверяют с обеих сторон).
• Верхний симптом Брудзинского определяют у больного, лежащего на спине, одновременно с попыткой выявления ригидности затылочных мышц: при этом одна или обе ноги больного спонтанно сгибаются в коленных и тазобедренных суставах. Такое же самопроизвольное сгибание ног больного в положении его на спине может возникать при надавливании на лонное сочленение или при проверке симптома Кернига (средний и нижний симптомы Брудзинского соответственно).
• Наряду с вышеуказанными основными менингеальными симптомами возможно присутствие и многих других (Гийена, Гордона, симптома подвешивания, или Лессажа, и др.).
• Для детей первого года жизни характерны выбухание и напряжение большого родничка. В более старшем возрасте появляется симптом посадки (треножника): при попытке сесть в постели ребенок отводит руки назад и опирается ими о кровать, поддерживая туловище в вертикальном положении.
Степень выраженности отдельных признаков и менингеального синдрома в целом может быть различной, однако во всех случаях при этом показано проведение люмбальной пункции и исследование спинномозговой жидкости (ликвора).
При отсутствии изменений ликвора у больного с положительными менингеальными симптомами говорят о менингизме. Состояние может развиваться при инфекционных заболеваниях, сопровождающихся выраженными общими токсическими реакциями, например при гриппе.
Наряду с перечисленными основными синдромами при некоторых инфекционных заболеваниях выявляют специфические поражения отдельных органов:
- почек - при геморрагической лихорадке с почечным синдромом (ГЛПС) и лептоспирозах;
- половых органов - при бруцеллезе, эпидемическом паротите и др.
ОСНОВНЫЕ МЕТОДЫ ДИАГНОСТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
Диагностика инфекционных болезней основана на комплексном использовании клинических, лабораторных и инструментальных методов обследования.
Клиническая диагностика
Клинические методы предусматривают:
- выявление жалоб больного;
- анамнестических сведений (анамнез болезни, эпидемиологический анамнез, основные сведения из анамнеза жизни);
- клинический осмотр больного.
Анамнез инфекционной болезни выясняют путем активного опроса больного: детального выявления его жалоб на момент осмотра врачом, времени и характера начала болезни (острого или постепенного), подробного и последовательного описания возникновения отдельных симптомов и их развития в динамике заболевания. При этом нельзя ограничиваться рассказом больного (если позволяет его состояние), анамнестические данные выясняют максимально подробно. Это дает врачу возможность составить предварительное впечатление о вероятном клиническом диагнозе. Старое правило клиницистов гласит: «Анамнез - половина диагноза».
При сборе анамнестических сведений у инфекционных больных особое внимание необходимо обратить на данные эпидемиологического анамнеза. При этом врач преследует цель получить сведения о месте, обстоятельствах и условиях, при которых могло произойти заражение, а также о возможных путях и способах передачи возбудителя инфекции данному больному. Выясняют контакты и частоту общения пациента с другими больными людьми или животными, его пребывание в местах, где могло произойти заражение (в эндемических или эпизоотических очагах). Обращают внимание на возможность укусов насекомых и животных, любые повреждения кожных покровов (травмы, ранения), лечебные парентеральные вмешательства.
При выяснении анамнеза жизни обращают внимание на условия быта, питания, труда и отдыха больного. Исключительно важны сведения о перенесенных ранее заболеваниях, в том числе инфекционных, и проводимом при этом лечении. Необходимо выяснить, сделаны ли больному профилактические прививки (какие и когда), есть ли в анамнезе указания на введение сывороток, иммуноглобулинов, препаратов крови и кровезаменителей, а также возможные реакции на них.
Клинический осмотр больного проводят в определенном порядке в соответствии со схемой истории болезни. Последовательный и детальный осмотр позволяет выявить симптомы и синдромы, характерные для инфекционного заболевания (см. раздел «Основные клинические проявления инфекционных болезней»).
Прежде всего оценивают общее состояние больного:
- сохранность сознания или степень его нарушения;
- возбуждение или заторможенность;
- психические нарушения;
- адекватность поведения.
В соответствии с установленным порядком проводят обследование:
- кожного покрова и слизистых оболочек;
- периферических лимфатических узлов;
- оценивают состояние опорно-двигательного аппарата, дыхательной, сердечно-сосудистой систем, ЖКТ, органов мочевыделения, половых органов, нервной системы.
На основе информации, полученной врачом при выявлении анамнестических сведений, и данных клинического осмотра больного формулируют предварительный диагноз.
В соответствии с диагнозом (с оценкой формы и тяжести заболевания, периода болезни, осложнений и сопутствующих заболеваний) врач определяет:
- место госпитализации больного в инфекционном стационаре, отделение (при необходимости реанимационное), палату или изолированный бокс;
- разрабатывает план лабораторного и инструментального обследования, проведения консультаций специалистов;
- составляет схему лечения больного (режим, диета, медикаментозное лечение).
Все эти данные вносят в историю болезни.
Лабораторная и инструментальная диагностика
Методы лабораторной и инструментальной диагностики подразделяют на общие (например, общие анализы крови и мочи, рентгенография органов грудной клетки) и специфические (специальные), применяемые для подтверждения предполагаемого диагноза инфекционной болезни и оценки тяжести заболевания. Данные специфических исследований необходимы также для контроля над выздоровлением, определения сроков и условий выписки больного.
В зависимости от нозологической формы заболевания, его характера и периода специфическому исследованию могут подлежать:
- кровь;
- фекалии;
- моча;
- мокрота;
- спинномозговая жидкость;
- дуоденальное содержимое;
- смывы со слизистых оболочек;
- пунктаты и биоптаты органов;
- отделяемое язв;
- секционный материал. Лабораторные методы исследования
Бактериологические исследования предусматривают посев на питательные среды различного материала, взятого у больного (кровь, моча, ликвор, испражнения и т.д.), выделение чистой культуры возбудителя, а также определение его свойств, в частности типовой принадлежности и чувствительности к антибиотикам. При вспышках кишечных инфекций бактериологическому исследованию подвергают остатки пищи, с которой может быть связано инфицирование употреблявших ее лиц. Бактериологическое исследование занимает как минимум несколько дней.
Вирусологические исследования предусматривают выделение и идентификацию вирусов. При их проведении используют тканевые культуры, куриные эмбрионы, лабораторных животных. Довольно часто подобные исследования проводят в режимных лабораториях.
Для более быстрой лабораторной диагностики некоторых бактериальных (возвратный тиф, первичный сифилис) и большинства паразитарных (малярии, амебиаза, балантидиаза, лямблиоза, гельминтозов и др.) болезней достаточно применения прямой микроскопии исследуемого материала (окрашеных и нативных мазков, толстой капли крови). Диагностическую ценность микроскопии повышает применение специфических сывороток, меченных флюорохромом (иммунофлюоресцентные методы).
Иммунологические методы основаны на обнаружении Аг возбудителя или АТ к ним.
Аг возбудителя выявляют в испражнениях, сыворотке крови, ликворе, слюне и другом биологическом материале, полученном от больного. Для этого применяют:
- реакции коагглютинации (РКА);
- реакции латекс-агглютинации (РЛА);
- РНГА;
- ИФА и др.
Реакции основаны на применении специальных диагностических препаратов (диагностикумов), представляющих собой носитель (лиофилизированный стафилококк, латексные частицы, эритроциты) с фиксированной на нем высокоактивной сывороткой против того или иного Аг возбудителя. Реакции высокоспецифичные и могут быть использованы как методы экспресс-диагностики в ранние сроки болезни.
АТ в цельной сыворотке крови или ее фракциях, содержащих иммуноглобулины различных классов, можно обнаружить с помощью многих специфических лабораторных методов.
Наиболее популярны из них:
- РА - при бруцеллезе, иерсиниозах, туляремии, некоторых риккетсиозах и других инфекциях;
- РНГА - при многих кишечных инфекциях;
- РТГА - при различных вирусных инфекциях.
При риккетсиозах и некоторых вирусных заболеваниях большое диагностическое значение имеют реакция связывания комплемента (РСК), радиоиммунологический анализ (РИА) и ИФА. Исследования проводят с заведомо известными Аг. Определение принадлежности АТ к различным классам иммуноглобулинов помогает уточнить фазу инфекционного процесса, отличить первичное инфекционное заболевание от повторного (например, сыпной тиф от болезни Брилла- Цинссера), дифференцировать инфекционное заболевание от поствакцинальных реакций.
Вместе с тем методы обнаружения АТ имеют и существенные недостатки. Как правило, положительные результаты реакций могут быть получены не ранее чем на 2-й неделе заболевания, когда титры сывороточных АТ начинают превышать минимальный диагностический уровень. Слабое или отсроченное образование АТ наблюдают у лиц со сниженной активностью иммунной системы, а также при многих инфекционных заболеваниях, возбудители которых проявляют высокую иммуносупрессивную активность (иерсиниозы, брюшной
тиф и др.). Диагностическая ценность реакций возрастает при исследовании парных сывороток, взятых с интервалом 7-10 сут. В этих случаях прослеживают динамику нарастания титров АТ, что наиболее важно при вирусных инфекциях, когда диагностическое значение имеет лишь нарастание титров во 2-й порции сыворотки в 4 раза и более.
В последние годы в практике здравоохранения широко применяют и другие иммунологические методы - определение маркеров вирусных гепатитов (Аг вирусов и АТ к ним), определение иммуноглобулинов разных классов, количественного содержания Т-лимфоцитов, иммуноблоттинг и др.
В настоящее время большое значение для диагностики инфекционных болезней имеет полимеразная цепная реакция (ПЦР), выявляющая минимальное количество нуклеиновых кислот практически любого патогенного возбудителя в различных биологических жидкостях и клеточных элементах макроорганизма.
Кожно-аллергические пробы применяют для аллергологической диагностики бруцеллеза, туляремии, сибирской язвы, токсоплазмоза, орнитоза и других инфекционных заболеваний. Для этого 0,1 мл специфического аллергена (белкового экстракта культуры возбудителя) вводят внутрикожно или наносят на скарифицированную кожу. Пробу считают положительной, если в месте введения аллергена через 24-48 ч появляются гиперемия, отек и инфильтрат, по выраженности которых судят об интенсивности реакции.
Значительное место в практике врача-инфекциониста занимают биохимические методы исследования. Они особенно популярны при инфекционных заболеваниях, сопровождающихся поражениями печени, почек, сердечнососудистой, эндокринной систем и т.д.
Инструментальные методы исследования
Для дифференциальной диагностики некоторых кишечных инфекций и установления характера и глубины поражения слизистой оболочки прямой и сигмовидной кишки издавна практикуют ректороманоскопию. Метод позволяет исследовать состояние слизистой оболочки толстого кишечника на протяжении, но не далее 30 см от заднего прохода. В последнее время ректороманоскопия уступает по диагностической ценности фиброколоноскопии и рентгенологическому исследованию (ирригоскопии), выявляющим патологические изменения на уровне более глубоко расположенных отделов кишечника.
При эхинококкозе и альвеококкозе локализацию и интенсивность очагов поражения можно выявить с помощью сканирования печени. При выявлении очаговых поражений висцеральных органов наиболее популярны методы ультразвукового исследования (УЗИ). Они неоценимы в дифференциальной диагностике заболеваний, сопровождающихся желтухой (вирусных гепатитов, новообразований печени и области ее ворот, камней в желчных протоках и желчном пузыре и др.). С этой целью также применяют лапароскопию и пункционную биопсию печени.
В диагностике инфекционных болезней также применяют рентгенологические методы исследования (особенно исследование легких при ОРВИ), электрокардиографию (ЭКГ) и компьютерную томографию (КТ).
Представленные методы исследования наиболее часто используют в инфекционной практике, однако для диагностики инфекционных заболеваний и особенно дифференциальной диагностики необходимо использовать любые другие методы, применяемые клиницистами.
ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ БОЛЬНЫХ
Успехи в области ранней диагностики и лечения инфекционных болезней, большие достижения в эпидемиологии и улучшение социально-бытовых условий жизни людей позволяют в настоящее время наблюдать и лечить больных некоторыми инфекционными болезнями, подлежавших ранее госпитализации, в амбулаторных условиях (в поликлинике и на дому). К этим болезням относят ПТИ, шигеллезы, ВГА и ряд других. Безусловно, желательна (при согласии больных) их госпитализация с перечисленными заболеваниями по клиническим показаниям - в случаях тяжелого и затяжного течения, осложнений, тяжелых сопутствующих заболеваний.
Вместе с тем общие принципы лечения инфекционных больных в амбулаторных и стационарных условиях остаются едиными.
Режим инфекционных больных
Режим инфекционных больных определяет лечащий врач в соответствии со следующими условиями: степенью тяжести заболевания, сроками инфекционного процесса, выраженностью патологии тех или иных органов и систем, а также возможностью развития осложнений. Предписанный больному режим отмечают в истории болезни.
• Режим I - строго постельный. Больному запрещено садиться и тем более вставать; уход за ним, кормление и все медицинские манипуляции осуществляют при положении больного в постели. При некоторых инфекционных болезнях (брюшной и сыпной тифы и др.) строгий постельный режим назначают на длительное время. Необходимо объяснить больному причины назначения постельного режима, возможные последствия его нарушения и строго следить за его соблюдением.
• Режим II - полупостельный (палатный). Возможно самостоятельное посещение больным туалета, процедурного кабинета, питание в палате, но большую часть времени рекомендовано проводить в постели.
• Режим III - общий. Назначают при хорошем самочувствии и удовлетворительном состоянии больного, если полностью исключена опасность развития осложнений и последствий заболевания. Больному разрешено самостоятельно обслуживать себя, посещать столовую.
Режим инфекционного отделения распространяется и на медицинский персонал, который должен стараться максимально устранить факторы, нарушающие покой больного:
- несдержанный и резкий тон в общении с ним;
- громкие разговоры в палатах и коридорах.
Особенно строго необходимо соблюдать тишину в ночные часы. Тяжесть состояния пациента не следует обсуждать в его присутствии, даже если больной находится в бессознательном состоянии.
Уход за инфекционными больными
Квалифицированный уход за инфекционными больными способствует их выздоровлению, профилактике осложнений, помогает предотвратить заражение окружающих.
Очень важно сохранение ровного, спокойного тона в общении с больными. Следует помнить, что раздражительность и грубость пациента могут быть вызваны не только низким уровнем культуры и моральных принципов, но и своеобразной реакцией на окружающее, сдвигами в психоэмоциональном состоянии, обусловленными длительным и тяжелым инфекционным заболеванием. В то же время следует настойчиво проводить необходимые мероприятия и заставлять больного соблюдать режим инфекционного отделения. Это требует от медицинского работника знания основных принципов медицинской этики и деонтологии, включая особенности субординации, профессионального поведения, внешнего вида, умения применять их в повседневной деятельности.
В инфекционном отделении необходимо систематически проводить влажную уборку помещений с применением дезинфицирующих средств, проветривание палат. Особое внимание уделяют чистоте тела и постели больного. Больных моют в ванне или под душем не реже 1 раза в неделю. Если это противопоказано, ежедневно обтирают кожу больного полотенцем, смоченным теплой водой. Тяжелобольным проводят обработку полости рта и носа, профилактику пролежней и застойных пневмоний, контролируют физиологические отправления.
Питание больных
Питание больных осуществляют с учетом специфики развития инфекционного заболевания. Питание должно быть достаточно калорийным и восполнять все потребности организма в пищевых продуктах, жидкости, витаминах и солях. Инфекционных больных и выздоравливающих кормят не реже 4 раз в день (завтрак, обед, полдник и ужин) в строго определенное время. Тяжелобольным пищу дают небольшими порциями 6-8 раз в день.
Диетическое питание назначает лечащий врач, соблюдение больным диеты контролирует медицинская сестра. Продукты, приносимые посетителями, проверяют в их присутствии и немедленно возвращают, если они не соответствуют предписанной диете. Следует систематически контролировать условия хранения принесенных больному продуктов в прикроватных тумбочках и специально отведенных холодильниках.
В целом питание инфекционных больных осуществляют с применением определенных видов диет, соответствующих выявленной патологии.
Наиболее часто в инфекционных стационарах используют следующие виды диет.
• Диету № 2 назначают при острых кишечных инфекциях в период реконвалесценции на длительный срок. Она предусматривает механическое и термическое щажение ЖКТ. Стол смешанный, все блюда готовят в протертом и рубленом виде. Исключают бобы, фасоль, зеленый горошек.
• Диету № 4 рекомендуют при диареях, сопровождающихся значительным раздражением слизистой оболочки ЖКТ (дизентерии, сальмонеллезах, некоторых формах эшерихиозов и др.). Разрешают мясные бульоны, слизистые супы, вареное мясо в виде котлет и фрикаделек, вареную рыбу, протертые каши, кисели, желе, фруктовые соки, обогащенные витаминами. Исключают продукты, вызывающие бродильные процессы и усиленную перистальтику кишечника: капусту, свеклу, соленья и копчености, пряности, молоко, натуральный кофе.
• Несколько видоизмененную диету № 4 (в инфекционных стационарах ее иногда обозначают как диету № 4abt) предписывают при брюшном тифе и паратифах в течение всего лихорадочного периода и 10-12 дней апирексии. Диета обеспечивает максимальное механическое и химическое щажение кишечника, уменьшение перистальтики и бродильных процессов. Разрешают нежирные бульоны из говядины или курицы, слизистые крупяные супы, протертые каши на воде, мясо в виде фрикаделек, суфле или паровых котлет, отварную рыбу, яйца всмятку, сухари из белого хлеба. С 10-12-го дня апирексии диету дополняют включением белого получерствого хлеба (до 150-200 г/сут). Пища должна быть обогащена витаминами. Рекомендуют кисели, ягодные и фруктовые соки, протертые яблоки. Количество жидкости - 1,5-2 л/сут (чай, клюквенный морс, отвар шиповника). Ограничивают жиры, углеводы, грубую клетчатку.
• Диета № 5а показана в острой стадии вирусных гепатитов и при обострении хронических гепатитов. Для максимального снижения нагрузки на печень ограничивают животные жиры и экстрактивные вещества, исключают жареную пищу. Блюда готовят в основном в протертом виде. Разрешают хлеб вчерашней выпечки, супы овощные, крупяные и из макаронных изделий на овощном или неконцентрированном мясном и рыбном бульонах, молочные и фруктовые супы; нежирное мясо, рыбу и птицу в отварном виде; протертые каши (особенно гречневую) на воде или с добавлением молока; яйца, молоко, масло сливочное и растительное (как добавки в блюда); свежие кисломолочные продукты и творог (суфле); фрукты, ягоды, варенье, мед, кисели, желе, компоты, некрепкий чай. Исключают закуски, грибы, шпинат, щавель, репу, редис, лимон, пряности, какао, шоколад.
• Диету № 5 назначают в период выздоровления при острых вирусных гепатитах или в период ремиссии при хронических гепатитах. В дополнение к продуктам диеты № 5а разрешают вымоченную сельдь, некислую квашеную капусту, овощи и зелень в сыром виде или в виде салатов, винегретов; молоко, сыр, омлеты. Пищу не измельчают.
• Диету № 13 рекомендуют при лихорадочных состояниях. Она включает разнообразную пищу с ограничением грубой клетчатки, молока, острых закусок и пряностей. Количество жидкости - от 1,5-2 до 3 л/сут.
• Диету № 15 (общий стол) назначают при отсутствии показаний к специальной диете. Физиологически полноценная диета с повышенным содержанием витаминов.
При бессознательном состоянии больных или при параличе глотательных мышц (например, при ботулизме, дифтерии) кормление проводят через носовой зонд, вводимый врачом. Используют 100-200 мл подогретой питательной смеси из молока, кефира, бульонов, яиц, фруктовых соков, сливочного масла и др. Через зонд вводят также жидкости и лекарства.
Необходимые тяжелобольному калории частично восполняет парентеральное питание, при котором внутривенно вводят:
- гидролизаты;
- аминокислоты;
- соли;
- витамины;
- 5% раствор глюкозы♠;
- специальные питательные смеси.
При лихорадочных состояниях и при дегидратации инфекционные больные нередко нуждаются в обильном питье (до 2-3 л/сут). Рекомендуют минеральные воды, чай с лимоном, морсы (клюквенный, черносмородиновый и др.), разнообразные фруктовые и ягодные соки. При дегидратации и деминерализации назначают пероральное и внутривенное введение полиионных кристаллоидных изотонических растворов.
Медикаментозное лечение
Комплексное медикаментозное лечение инфекционных больных предусматривает учет этиологии и патогенеза заболевания, тщательный анализ индивидуального состояния больного, его возраста и иммунологических особенностей, периода и тяжести инфекционной болезни, осложнений и сопутствующих заболеваний.
Одно из важнейших направлений комплексного лечения инфекционных больных - этиотропное лечение, т.е. воздействие на возбудителя заболевания. При его проведении применяют антибиотики и химиопрепараты.
При выборе препарата важно использовать определенные правила.
• Возбудитель должен быть чувствительным к применяемому средству.
• Концентрация химиопрепарата (антибиотика) в очаге инфекции должна быть достаточной для подавления жизнедеятельности возбудителя (бактерицидное или бактериостатическое действие).
• Препарат должны вводить таким методом и с таким интервалом, чтобы в очаге инфекции поддерживалась необходимая его концентрация.
• Отрицательное воздействие препарата на макроорганизм должно быть меньше его целебного эффекта.
• Препарат следует вводить столь длительно, сколько требуется для полного подавления жизнедеятельности возбудителя.
• Нельзя в процессе лечения понижать дозу вводимого препарата, несмотря на кажущееся достижение лечебного эффекта.
Основные принципы этиотропного лечения сведены к выделению и идентификации возбудителя инфекционного заболевания, изучению его чувствительности к лекарственным средствам, выбору активного и наименее токсичного этиотропного препарата (или нескольких препаратов при комбинированном лечении), определению его оптимальных доз, метода и длительности применения с учетом возможных побочных явлений. Поскольку крайне важна своевременность проведения лечения, часто его начинают сразу после взятия материала для микробиологического исследования, еще до выделения возбудителя. Вместе с тем целесообразно избегать назначения множества лекарственных средств и лечебных процедур, их объем должен быть ограничен необходимым в каждом конкретном случае минимумом.
В инфекционной практике широко применяют антибиотики. Препараты группы пенициллина (соли бензилпенициллина, феноксиметилпенициллин, бициллин♠, ампициллин, полусинтетические пенициллины - оксациллин, ампициллин, карбенициллин и др.) обладают бактерицидным действием в отношении кокков (возбудители менингококковой инфекции, пневмоний, рожи), а также возбудителей дифтерии, лептоспирозов, сибирской язвы, листериоза. Пенициллины, устойчивые к кислотам и действию β-лактамаз (клоксациллинΨ, диклоксациллинΨ, флуклоксациллинΨ), используют для
перорального применения. Цефалоспорины I-IV поколений отличает выраженное бактерицидное действие в отношении грамположительных (стафилококки и пневмококки), а также большинства грамотрицательных бактерий. Препараты малотоксичны, но вместе с тем иногда могут вызывать нежелательные проявления в виде аллергических и диспептических реакций, геморрагического синдрома, флебитов (при парентеральном введении). Самым широким спектром антимикробного действия обладают карбапенемы (имипенем, меропенем), относящиеся к антибиотикам резерва. Тетрациклин, левомицетин♠, рифампицин применяют в лечении иерсиниозов, риккетсиозов (сыпной тиф, болезнь Брилла-Цинссера, ку-лихорадки и др.), боррелиозов, брюшного тифа и паратифов, бруцеллеза, легионеллеза, а также хламидиозов и микоплазмозов. При устойчивости возбудителей к пенициллину, левомицетину♠ и тетрациклинам применяют аминогликозиды различных поколений - стрептомицин, неомицин, канамицин, мономицин♠ (I поколение), гентамицин, тобрамицин, сизомицин (II поколение), нетилмицин, амикацин (III поколение) и др., однако их спектр действия не захватывает анаэробную флору, а токсичность значительно выше, в связи с чем в настоящее время назначать препараты I поколения внутрь запрещено. Аминогликозиды активны в отношении грамотрицательной флоры, стафилококков, синегнойной палочки (препараты II-III поколений). При кокковых инфекциях, а также коклюше, дифтерии и кампилобактериозе назначают макролиды (эритромицин, олеандомицин и др.). Одним из лучших полусинтетических макролидов по своим фармакологическим свойствам является азитромицин. В случаях грибковых заболеваний активны противогрибковые антибиотики - нистатин, микосептин♠ и др.
Количество новых антибиотиков постоянно растет. На смену многим препаратам природного происхождения приходят полусинтетические антибиотики III и IV поколений, обладающие многочисленными преимуществами. Однако следует помнить, что широкое и необоснованное применение антибиотиков, проведение длительных курсов антибиотикотерапии могут вызвать нежелательные последствия: развитие сенсибилизации с аллергическими реакциями, дисбиозы (дисбактериозы), снижение активности иммунной системы, нарастание устойчивости патогенных штаммов микроорганизмов и многие другие.
Сравнительно новая группа препаратов для этиотропного лечения инфекционных заболеваний - фторхинолоны. Они находят все более широкое применение в случаях тяжелых форм кишечных бактериальных инфекций (брюшной тиф, иерсиниозы), микоплазмозов и хламидиозов.
При проведении этиотропного лечения назначают и другие антимикробные средства, в меньшей степени, чем антибиотики, вызывающие развитие резистентности микроорганизмов. В лечении пневмоний, ангин и некоторых других инфекционных заболеваний могут быть использованы сульфаниламидные препараты, особенно пролонгированного действия. Их назначение в сочетании с антибиотиками нередко дает синергичный терапевтический эффект. Вместе с тем применение сульфаниламидов может вызвать побочные реакции: сенсибилизацию организма, угнетение кроветворения, подавление нормальной микрофлоры, образование камней в органах мочевыделения, раздражающее действие на слизистые оболочки.
Нитрофурановые производные (фуразолидон, фурадонин♠, фурагин♠ и др.) эффективны в лечении многих бактериальных и протозойных заболеваний, в
том числе вызванных устойчивой к антибиотикам флорой. Они нашли применение в лечении лямблиоза, трихомоноза, амебиаза.
Специфические антипаразитарные средства различной химической природы и механизмов действия используют в лечении протозойных заболеваний (малярия, лейшманиозы, амебиаз) и гельминтозов. Широкое применение противопаразитарных препаратов зачастую связано с необходимостью решения двух важных проблем. Обычно чем выше терапевтический эффект лекарственного средства, тем больше возможность побочных токсических реакций, вызываемых им. Кроме того, длительное использование указанных химиопрепаратов в эндемичной зоне приводит к выработке и нарастанию химиорезистентности возбудителей, как это происходит, например, при малярии.
В практику лечения инфекционных заболеваний все шире внедряют противовирусные препараты. Их применяют в этиотропной терапии и профилактике гриппа (амантадин, ремантадин♠), герпетической инфекции (ацикловир и др.), вирусных гепатитов (рибавирин), ВИЧ-инфекции (азидотимидинΨ). Однако клиническая эффективность указанных препаратов во многих случаях остается недостаточно высокой.
При хроническом течении болезни особое значение приобретает приверженность пациентов лечению, то есть строгое соблюдение регулярного приема лекарств, проводимого в некоторых случаях пожизненно (например при ВИЧинфекции). ВИЧ-инфицированные лица, постоянно применяющие антиретровирусную терапию, в течение многих лет сохраняют здоровье и трудоспособность.
В лечении инфекционных болезней используют также препараты специфической иммунотерапии - иммунные сыворотки (см. Приложения, табл. 3), иммуноглобулины и γ-глобулины, плазму иммунизированных доноров. Иммунные сыворотки разделяют на антитоксические и антимикробные. Антитоксические сыворотки представлены противодифтерийной, противостолбнячной, противоботулинической и противогангренозной сыворотками различных типов. Они содержат специфические антитоксические АТ, их применяют для нейтрализации свободно циркулирующих в крови токсинов возбудителей при соответствующих заболеваниях. Клинический эффект от применения антитоксических сывороток наиболее выражен в ранние сроки болезни, поскольку сыворотки не способны нейтрализовать токсины, уже связанные клетками и тканями. Противомикробные сыворотки содержат АТ к патогенным возбудителям, в инфекционной практике их применяют редко (противосибиреязвенный глобулин).
В лечении многих инфекционных заболеваний (грипп, корь, лептоспироз, герпетическая инфекция, сибирская язва и др.) нашли применение иммуноглобулины, имеющие высокую концентрацию АТ, а также плазма иммунизированных доноров (антистафилококковая, антисинегнойная и др.).
В настоящее время убитые вакцины применяют все более ограниченно в связи с возможностью развития побочных реакций на содержащиеся в них балластные вещества, аутоиммунных реакций, иммуносупрессивного эффекта, учащения рецидивов заболевания.
Использование препаратов специфической иммунотерапии требует врачебного контроля и неукоснительного соблюдения правил, изложенных в инструкциях по их применению, поскольку в ряде случаев может привести к развитию осложнений:
- анафилактического шока;
- сывороточной болезни;
- двойной анафилактической реакции.
Анафилактический шок - аллергическая реакция немедленного типа, возникающая у лиц с гиперчувствительностью. Его основные патогенетические механизмы включают образование иммунных комплексов, фиксирующихся на клеточных структурах с их последующим повреждением и высвобождением биологически активных веществ. Последние, действуя на гладкую мускулатуру сосудов и бронхов, приводят к развитию сосудистого паралича с повышением проницаемости стенок сосудов, спазму гладкой мускулатуры органов. При этом уменьшаются объем циркулирующей крови и сердечный выброс. Развиваются тяжелые осложнения в виде острой сосудистой недостаточности, синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдрома), отека мозга и легких, отека гортани с асфиксией, ОПН и (или) острой надпочечниковой недостаточности.
Анафилактический шок возникает внезапно, сразу после парентерального введения лекарственного препарата, и отличается бурным, нередко молниеносным течением.
Клинические признаки анафилактического шока:
- общее беспокойство больного;
- чувство страха;
- головная боль;
- головокружение;
- ощущение жара;
- гиперемия;
- одутловатость лица;
- тошнота и рвота;
- общая слабость.
Возникают чувство давления в груди, боли в сердце. Быстро прогрессирует одышка, дыхание шумное, свистящее, с затрудненными вдохом и выдохом. Могут быть приступы удушья с кашлем. Иногда наблюдают отек Квинке, крапивницу. Одновременно кожные покровы становятся бледными, усиливается потоотделение, падает АД, нарастает тахикардия, нарушается сознание. При более постепенном развитии шокового состояния больные отмечают кожный зуд, онемение губ, языка, лица.
Неотложную помощь при анафилактическом шоке оказывают на месте.
Она включает следующие действия.
• Немедленно прекратить введение лекарственного препарата, вызвавшего анафилактическую реакцию.
• Наложить жгут выше места инъекции.
• Обколоть место инъекции разбавленным адреналином♠ (1 мл 0,1% адреналина♠, разведенного в 5-10 мл изотонического раствора натрия хлорида).
• Приложить лед к месту обкалывания.
• Придать больному горизонтальное положение с немного приподнятыми ногами и повернутой набок головой.
• Положить грелку к ногам.
• Наложить манжету тонометра, записать время, измерить и зарегистрировать показатели АД, пульса, дыхания.
• Ввести внутривенно 0,5-1 мл 0,1% раствора адреналина♠ в 10-20 мл изотонического раствора натрия хлорида и 60 мг преднизолона. Повторять
введение адреналина♠ внутривенно каждые 10-20 мин до выведения больного из шока или при отсутствии эффекта провести его внутривенную капельную инфузию (1-2 мл 0,1% раствора адреналина♠ в 250 мл изотонического раствора глюкозы♠ ).
• При бронхоспазме и отеке легких подкожно ввести 0,5 мл 0,1% раствора атропина сульфата♠, внутримышечно - 1 мл 2,5% раствора дипразина♠, внутривенно - 20 мл 40% раствора глюкозы♠ с 60 мг преднизолона.
• Проводить инфузию с внутривенным капельным введением 400 мл реополиглюкина♠ , 400 мл изотонического раствора натрия хлорида. В капельницу добавить 5 000 единиц действия (ЕД) гепарина в растворе декстрана♠, преднизолон из расчета 10 мг/кг (всю дозу вводят дробно в течение 2 ч), 2 мл 0,25% раствора дроперидола, 1 мл 0,05% раствора строфантина.
• Подкожно ввести 2 мл 10% раствора кофеина, 2 мл 25% раствора кордиамина♠ .
• Постоянно подавать кислород на протяжении всего лечения.
Тяжелое течение анафилактического шока часто определяет необходимость проведения комплекса мероприятий в условиях реанимационного отделения:
- противосудорожного лечения;
- коррекции нарушений водно-электролитного обмена и КЩС;
- интубации или трахеостомии;
- ИВЛ и т.д.
Сывороточная болезнь развивается через 6-12 дней после введения сыворотки. Проявляется лихорадочной реакцией, возникновением пятнистопапулезной сыпи на коже, отеком слизистых оболочек, лимфаденитом.
Двойная анафилактическая реакция протекает в 2 этапа:
- сначала развивается анафилактический шок;
- затем - сывороточная болезнь.
В лечении некоторых инфекций значимое место занимает неспецифическая иммунотерапия. В ее арсенал входят нормальный человеческий иммуноглобулин, иммуностимуляторы и иммуносупрессоры. Их назначают для повышения неспецифической резистентности организма и регуляторного воздействия на иммунную систему. В лечении ряда вирусных инфекций (грипп, вирусные энцефалиты, герпетическая инфекция) применяют ИФН и стимуляторы их выработки.
Также применяют пентоксил♠ , метилурацил♠ и оротат калия, стимулирующие лейкопоэз. Спленин♠ и апилак♠ ускоряют выздоровление после перенесенных тяжелых инфекций.
Иммуномодуляторы левамизол, тималин♠, Т-активин♠, натрия нуклеинат и некоторые липополисахариды (пирогенал♠, продигиозан♠) способствуют регулированию процессов клеточного иммунитета и фагоцитоза.
Необходимо обратить внимание на то, что показания к назначению препаратов указанной группы определяют целым комплексом разнообразных факторов:
- особенностями патогенеза заболевания;
- сроками и тяжестью болезни;
- состоянием неспецифических и специфических факторов защиты организма.
Поэтому применение иммунотропных препаратов рекомендуют только под динамическим иммунологическим контролем.
Патогенетическое лечение направлено на коррекцию нарушений гомеостаза при инфекционном заболевании.
Его методы и средства базируются на детальном изучении патогенетических механизмов:
- интоксикации;
- нарушений водно-электролитного обмена и КЩС;
- изменений реологических свойств крови;
- микроциркуляции;
- иммунного статуса и т.д.
Одно из основных направлений патогенетического лечения инфекционных болезней - применение препаратов, снижающих интоксикацию. Выраженными дезинтоксикационными свойствами обладают коллоидные растворы - гемодез♠, полидез♠, реополиглюкин♠, макродексΨ, желатиноль♠, альбумин и многие другие, вводимые внутривенно капельно в средних дозах от 200 до 400 мл. Менее выражен дезинтоксикационный эффект 5% или 10% раствора глюкозы♠, 0,9% раствора натрия хлорида. При лечении острых кишечных инфекций, сопровождающихся диареей, детоксикация может быть усилена при одновременном назначении внутривенных инфузий и перорального приема нестероидных противовоспалительных препаратов (индометацина) и энтеросорбентов (энтеродеза♠, полисорба♠, активированного угля и др.). Одновременно с детоксикацией для улучшения выделительной способности почек назначают салуретики (фуросемид, лазикс♠ и др.).
При тяжелом течении инфекционных заболеваний применяют методы экстракорпоральной детоксикации:
- гемодиализ;
- гемосорбцию;
- плазмаферез;
- цитоферез.
Незаменимыми препаратами для коррекции дегидратации, КЩС, реологических и микроциркуляторных нарушений служат полиионные кристаллоидные изотонические растворы для внутривенных инфузий (трисоль♠, квартасоль♠, лактасольΨ и др.) и глюкозо-солевые растворы для перорального применения (регидрон♠, оралитΨ, цитроглюкосоланΨ). Их применение одновременно способствует снижению интоксикации, поскольку использование коллоидных растворов в условиях дегидратации противопоказано. Активность разнонаправленного действия указанной группы препаратов (регидратация и детоксикация) потенцируется при острых кишечных инфекциях одновременным назначением ингибиторов биосинтеза простаноидов (индометацина).
Для предотвращения выраженных проявлений воспаления и аллергии при многих инфекционных заболеваниях (энцефалиты, менингиты, инфекционный мононуклеоз, бруцеллез, трихинеллез и др.) назначают антигистаминные препараты и глюкокортикоиды (преднизолон, дексаметазон, гидрокортизон и др.). Гормональные препараты особенно показаны в случаях ИТШ и развития острой недостаточности надпочечников (менингококковая инфекция, дифтерия), а также при анафилактическом шоке.
Инфекционные заболевания, особенно кишечные инфекции, часто осложняет развитие дисбиоза (дисбактериоза), чему немало способствует активное и длительное, но необходимое лечение антибиотиками.
В коррекции дисбиоза нашли широкое применение пробиотики, т.е. бактериальные препараты, восстанавливающие и регулирующие микрофлору кишечника (колибактерин♠, бифидумбактерин♠, лактобактерин♠, бактисубтил♠ и др.), и пребиотики (вещества немикробного происхождения).
Регулирование процессов протеолиза, фибринолиза, деполимеризации в патогенетическом лечении инфекционных заболеваний проводят назначением ферментных препаратов. В последние годы широко применяют трипсин, химотрипсин, фибринолизин, стрептодеказу♠, ε-аминокапроновую кислоту, дезоксирибонуклеазу♠ и др. Особое место занимают ингибиторы протеолиза (контрикал♠, трасилол♠ и их аналоги), рекомендуемые при остром массивном некрозе печени (при тяжелом и осложненном течении острых вирусных гепатитов). Необходимость коррекции нарушений секреции желез ЖКТ объясняет целесообразность применения панкреатина, фестала♠, панзинорма♠, мезима♠, панкурменаΨ и других ферментных препаратов.
Обязательный компонент в лечении инфекционных больных - витаминотерапия. Недостаток витаминов снижает резистентность организма и облегчает развитие инфекционного процесса, часто проявляющегося нарастанием интоксикации, развитием неблагоприятного течения заболевания и осложнений. Назначение инфекционным больным витаминов С и группы В способствует нормализации обменных процессов, снижению интоксикации, оказывает положительное иммуномодулирующее действие.
При инфекционных заболеваниях находит широкое применение симптоматическое лечение - назначение сердечно-сосудистых и спазмолитических препаратов, обезболивающих, жаропонижающих, седативных, снотворных, противосудорожных и др.
При тяжелом течении инфекционных заболеваний и развитии осложнений (ИТШ, тромбогеморрагический синдром, отек головного мозга, острая дыхательная и сердечно-сосудистая недостаточность, судорожный синдром, острая печеночная недостаточность и ОПН) показано интенсивное комплексное патогенетическое лечение с применением вышеперечисленных и специальных методов лечения (ИВЛ, гипербарическая оксигенация и др.). Лечение часто проводят в условиях реанимационных отделений.
По индивидуальным показаниям при инфекционных заболеваниях применяют методы физиотерапии и бальнеотерапии.
После многих инфекционных заболеваний рекомендуют диспансерное наблюдение реконвалесцентов, а также санаторно-курортное лечение.