Инфекционные болезни и эпидемиология : учебник / Покровский В. И., Пак С. Г., Брико Н. И., Данилкин Б. К. - 3-е изд., испр. и доп. - 2013. - 1008 с. : ил.
|
|
|
|
Общая часть. Глава 1. Общая эпидемиология
ЭПИДЕМИОЛОГИЧЕСКИЙ ПОДХОД К ИЗУЧЕНИЮ БОЛЕЗНЕЙ ЧЕЛОВЕКА, ЕГО ВОЗНИКНОВЕНИЕ И СОВЕРШЕНСТВОВАНИЕ
Введение в эпидемиологию (краткая история эпидемиологии)
Эпидемиология (от греч. epi- - над-, demos - народ и logos - наука) - это
фундаментальная медицинская наука, относящаяся к области профилактической медицины и изучающая причины возникновения и особенности распространения заболеваний в обществе с целью применения полученных знаний для решения проблем здравоохранения. Она включает 2 раздела с одной методологией исследования: эпидемиологию инфекционных и эпидемиологию неинфекционных болезней. Эпидемиология относится к древним наукам. Она зародилась в общественном опыте борьбы с эпидемиями еще в древние времена. Повальные болезни с глубочайшей древности представляли собой наиболее тяжелые бедствия человечества. С самого начала становления эпидемиологии как науки предметом ее изучения была заболеваемость в период эпидемий (надорганизменный уровень организации жизни). В этом заключается принципиальное отличие эпидемиологии от клинической медицины, предметом изучения которой служит болезнь как таковая (организменный и суборганизменный уровни организации жизни).
Термином «эпидемия» изначально определяли заболеваемость, явно превышающую привычный, спорадический (рассеянный) уровень либо болезнь, возникающую там, где ее ранее не было. В последующем этот термин стали применять для того, чтобы подчеркнуть инфекционную (заразную) природу повышенной заболеваемости. Однако до основополагающих открытий в области бактериологии в понятие «эпидемия» этого смысла не вкладывали, так как в то время вообще не существовало дифференциации болезней и различные авторы применяли в случае массовых заболеваний обобщающие названия: «чума», «мор», «поветрие», «повальные болезни» и т.п. По мере выделения и обозначения отдельных болезней к категории эпидемий стали относить повышенную заболеваемость с однородными клиническими проявлениями.
История повальных болезней, охватывавших народы на протяжении многих веков, есть не только история неисчислимых бедствий и тяжелейших социальных потрясений, сопровождавшихся огромным количеством уносимых этими болезнями жертв, но это есть также история напряженной работы человеческой мысли, стремящейся познать сущность происходящих при этом явлений и изыскать меры борьбы с ними. Первые описания эпидемий приведены в исторических сочинениях.
Из древних книг, в которых встречаются упоминания о заразных болезнях, можно назвать в хронологическом порядке (приблизительно) следующие:
- египетские папирусы;
- Библия;
- индийские Веды - 4 книги, около 1500 лет до н.э.
Но время их составления установить трудно, так как до VII в. до н.э. они передавались устно. Законы Ману в Индии, изданные приблизительно в 1280 г. до н.э., китайская письменность того же периода. Илиада и Одиссея Гомера, описывающие в поэтической форме события, происходившие за 1000 лет до н.э. Автор дает картину мора, посланного на ахенян разгневанным богом Апполоном. «Отец истории» Геродот описал эпидемии проказы в Персии в V-VI вв. до н.э. Спартанский историк и военачальник Фукидид в «Истории Пелопонесской войны» повествовал о моровом заболевании, известном также как «аттическая чума». По мнению одних авторов, речь идет об эпидемии сыпного тифа, по мнению других - о чуме, натуральной оспе или сочетании заболеваний (430-425 гг. до н.э.). Позже описание сходной эпидемии дал Гален (моровая язва Антонина с 165 по 170 г.). Сохранились описания первой исторически доказанной чумы (Юстинианова чума, 527-565 гг.), эпидемий чумы IV в. («черная смерть») и более поздних времен. Существуют многочисленные исторические описания эпидемий сифилиса, натуральной оспы (сыпных болезней), тифозных лихорадок, холеры. Следует признать, что только натуральная оспа, проказа и чума имеют историю, почти совпадающую с историей человеческой культуры, а история остальных инфекционных болезней - это история в лучшем случае 3-4 столетий, а для большинства немногим более 100 лет.
На раннем этапе развития медицины применяли главным образом клинический подход, своими целями преследовавший выделение инфекционных болезней из общей группы заболеваний человека и их распределение по нозологическим формам. Например, из группы чумы вычленить действительно чуму, из группы тифы - сыпной и брюшной тифы и т.д. Однако одно лишь описание клинической картины не отвечало на основные вопросы: почему возникает болезнь и по какой причине развивается эпидемия? Применение морфологического и функционального подходов позволяло получить данные, лишь частично освещавшие вопрос о причинах формирования повышенной заболеваемости населения. Необходимо было изучить условия (обстоятельства) и общие факторы возникновения эпидемий. Вместе с тем уже на первых этапах развития эпидемиология широко использовала так называемые сопоставления времени и места появления эпидемий, а также характер их проявлений.
В сочинениях Гиппократа (460-377 гг. до н.э.) уже существуют обобщения в отношении признаков эпидемий («Семь книг об эпидемиях»). В них указано на «эпидемическую конституцию мест и лет», т.е. приуроченность эпидемий к определенным местам и временным периодам. Также выделен и 3-й признак проявления эпидемий - неравномерность поражения отдельных социальных групп. При описании эпидемии «черной смерти» отмечено, что «оборванные толпы ранее всех других падают жертвами ангела смерти, затем поражаются люди среднего достатка... Знатные же, полководцы и судьи, пользующиеся всеми удобствами и наслаждениями жизни, редко поражаются болезнью, но при развитии эпидемии и они не остаются пощаженными». Гиппократ искал причины повальных болезней в воздухе и был одним из первых «миазматиков». В книге «О ветрах» он писал: «Когда воздух будет наполнен миазмами такого
рода, которые враждебны природе людей, тогда люди болеют». В эссе «О воздухе, водах и местностях» Гиппократ предположил, что факторы окружающей среды и характеристики хозяев, например характер труда, поведения, обычаи, могут влиять на развитие заболевания. Но это были только первые попытки объяснить и выявить причины повышенной заболеваемости.
Крупнейший после Гиппократа врач античной древности Клавдий Гален (около 138-201 гг.) писал, что наиболее опасные болезни называются моровыми. От этих болезней погибает больше людей, чем от всех других. Вслед за Гиппократом он полагал, что «моровое» состояние воздуха приносит лихорадку, но Гален знал об опасности общения с больными «мором» и нахождения вместе с больным чахоткой, а также вместе с теми, кто выдыхает «гнилостный» воздух. В античном мире было сформулировано 2 обобщающих представления о причинах, условиях и механизмах развития эпидемий, а также об их природе.
• С одной стороны, наблюдения за эпидемиями, периодически возникающими в одних и тех же местах и имеющими характерные признаки, позволили сформулировать гипотезу, объясняющую развитие эпидемий именно в определенных местах и в определенные годы. Причиной поражения людей считали особое болезнетворное начало, имеющее теллурическое (от лат. tellus - земля; буквально «из недр») либо космическое происхождение и получившее название «миазма» (от греч. miasma - скверна). В качестве миазмов рассматривали «все вредные, дурные испарения... из низших мест, болот и вязких рытвин» (Уильям Шекспир «Буря»), а также исходящие от трупов людей, животных и просто от грязи, поднимающиеся в воздух, разносящиеся ветром и проникающие в организм людей при вдохе. Следы миазматической теории можно найти и сегодня в названиях некоторых болезней. Например, латинский перевод названия болезни малярия означает «дурной воздух». Позже появилось учение об «эпидемических конституциях». По этой теории болезни возникают в результате конституциональных изменений организма под воздействием тех или иных экзогенных причин. В Средние века, в период господства астрологических представлений, неравномерную заболеваемость в различных социальных группах связывали с космическими воздействиями. Так, особенности эпидемии «черной смерти» объясняли тем, что «бедные находятся под неограниченным влиянием Сатурна, а люди ?средней крепости тела" подчиняются Луне и Меркурию».
• С другой стороны, наблюдения за отдельными эпидемиями свидетельствовали об их «ползучем» распространении, возникновении очагов в тех местах, куда прибывали больные люди. Можно полагать, что именно на основе подобных наблюдений параллельно миазматической теории развивалась контагиозная (от лат. contagi - прикасаться) гипотеза происхождения эпидемий. Согласно этой теории эпидемии развиваются при передаче от больных людей здоровым некоего болезнетворного «начала». Фукидид предполагал существование некоего животного контагия (contagium animatum), передающего инфекционные болезни. Римский поэт Тит Лукреций Кар в поэме «О природе вещей» прямо указал, что у каждой инфекции есть особые «семена». Другой римлянин, Марк Теренций Варрон, верил в существование мельчайших животных (animalcula quaedam minuta), приносящих эпидемии. Предполагалось, что передача болезни происходит при контакте - совместном нахождении больных и здоровых.
Основываясь на этих предположениях, люди в те времена применяли крайне примитивные и неэффективные, а порой избыточные по современным представлениям меры изоляции и карантина. Для уничтожения миазмов в воздухе разжигали костры, били в колокола, а для предотвращения проникновения их в организм надевали защитные маски. Эмпирические мероприятия по личной гигиене и профилактике были облечены в форму религиозных обрядов и обычаев. В памятниках египетской письменности, в Библии можно найти целый ряд предписаний для населения, направленных на предупреждение болезней. Так, Библия запрещает загрязнять почву внутри лагеря, предписывая определенным способом устраивать кладбища, для отправления естественных надобностей выходить за черту лагеря и испражнения засыпать землей. Имеется предписание не употреблять для питья болотную воду, не есть свинину как часто зараженную трихинеллезом. С большими подробностями представлены в Библии правила по борьбе с инфекционными болезнями, особенно с проказой. Подозрительного по проказе больного осматривает священник, и в случае признания его прокаженным на шею подвешивается звонок, он выселяется за пределы стана, причем вещи больного, не взятые им с собой, сжигаются. Больным проказой запрещалось посещать церкви, мельницы, пекарни, булочные, пользоваться колодцами, другими источниками воды, т.е. находиться в местах скопления народа, производства пищевых продуктов и источников питьевой воды.
Населению запрещалось прикасаться к трупам людей и животных. Лица же, в силу необходимости касавшиеся трупов, должны были на протяжении 7 дней дважды совершить омовение. Жилище умершего в целях дезинфекции окроплялось жертвенной водой и т.д. Сюда же может быть отнесено применение более 3000 лет назад в Китае, а затем и в других странах вариоляции, установление санитарных законов у древних евреев, индусов, китайцев и др. Всякие нарушения правил по общественной и личной гигиене и профилактике считались тяжелым преступлением и вели к жестоким наказаниям. Строительный устав Нерона предписывал очищать улицы и хозяйства от мусора. В Риме уже в I в. были построены водопровод и канализация. В Греции для дезинфекции помещений сжигали серу. Но все эти мероприятия были результатом только предположений. Закономерности распространения эпидемий были еще мало известны. Эпидемиология в тот период делала только первые шаги.
В эпоху Возрождения контагиозная гипотеза получила развитие в трудах современника и школьного товарища Коперника - врача и астронома Джироламо Фракасторо (1478-1553), заметившего, что заразные болезни сходны с брожением, т.е. передаются от одного к другому посредством «живого болезнетворного начала» (contagium vivum). Именно Фракасторо ясно определил материальность болезнетворного начала и ввел в медицину термин «инфекция», благодаря чему эпидемические болезни стали рассматривать как инфекционные, а не как конституциональные. Наиболее полно эта теория была представлена в его книге «О контагии, контагиозных болезнях и лечении» (1546). Богатый материал для своих трудов Фракасторо получил в результате сильного распространения чумы в XIV в. С этого времени в медицинском мире началась ожесточенная борьба между сторонниками учения о контагии и миазматической теории. Наиболее ярким сторонником последней стал английский врач Сайдэнгам, также известный как «английский Гиппократ».
В России уже в XI в. применялась изоляция больных и захоронение умерших от заразных (повальных) болезней на специальных кладбищах, а с XIV в.
начали проводить карантинные и дезинфекционные мероприятия. В летописях указываются первые попытки дезинфекции зараженных вещей окуриванием дымом и замачиванием металлических вещей в уксусе. К зачаткам дезинфекции относятся требования, существовавшие в Италии в XIV-XV в., о проветривании домов, где была чума, в течение 8-10 дней, а также об окуривании их «благовонными веществами». В XIV в. Парижский медицинский факультет во время эпидемии чумы предлагал зажигать повсюду костры из виноградных лоз и зеленых лавровых и других ветвей, а также окуривать дома полынью и ромашкой.
Развитие эпидемиологии в более поздний период связано с именем Данилы Самойловича (1744-1805), который предпринял попытки поиска чумного «контагия» с помощью микроскопа, предложил иммунизацию против чумы материалом из бубона больных, разработал систему карантинных и дезинфекционных мероприятий при чуме. Он принимал личное участие в борьбе с эпидемией чумы в Москве (1771 - 1772). Благодаря своим трудам, переведенным на ряд иностранных языков, он приобрел мировую известность и был избран членом десяти западноевропейских академий. Д. Самойлович всю жизнь посвятил преимущественно изучению чумы, но значение его работ далеко выходит за пределы этой болезни. Они имеют отношение к изучению заразных болезней вообще. Д. Самойлович последовательно придерживался контагионистических позиций. В эти же годы значительный вклад в развитие эпидемиологии инфекционных болезней внесли русские врачи К.О. Ягельский, П.И. Погорецкий, А.Я. Италийский, А.Ф. Шафонский и др. Врач С.С. Андреевский (1760-1818) в опыте самозаражения показал инфекционную природу сибирской язвы и условия передачи ее от животных человеку. В 1786 г. врач Иван Виен издал первое русское руководство по эпидемиологии под названием «Лоймология или описание моровой язвы, ее существа, происшествия, причин, поражения и производства припадков, с показанием образа предохранения и врачевания сея скорби».
По мере накопления знаний о природе заразных болезней постепенно совершенствовались и меры борьбы с ними. Наряду с такими мерами, как изоляция больных, карантины, уже в XVII в. в России вводятся объяснительные извещения о появлении заразных заболеваний, а также начинают проводиться мероприятия по предупреждению заноса инфекций из соседних стран, а в XVIII в. учреждается должность специального пограничного доктора. В 1755 г. Сенатом были учреждены постоянные пограничные карантинные заставы в Киевской и Смоленской губерниях. В указе 1786 г. имеются инструкция об обязанностях должностных лиц пограничного карантина, правила изоляции и карантинизации больных и лиц, соприкасавшихся с ними.
Однако вплоть до XIX в. эпидемиологические исследования носили описательный характер и основывались на эпизодических наблюдениях за отдельными эпидемиями, систематически накапливаемых количественных характеристиках эпидемий не было. Одним из ранних авторов, способствовавших развитию эпидемиологии, был лондонский галантерейщик Джон Гронт, опубликовавший исторический анализ данных смертности в 1662 г. Он первым проанализировал количественные характеристики рождаемости, смертности и заболеваемости с учетом различий между женщинами и мужчинами, высокой детской смертности, различий между городом и селом и сезонных колебаний.
Работа Гронта находилась под спудом до 1855 г., когда составитель обзоров гражданского состояния Уильям Фарр начал систематически собирать и анализировать статистику смертности в Великобритании. Фарр, считающийся отцом современной демографической статистики и надзора, разработал многие основные принципы, применяемые в классификации болезней. Он расширил эпидемиологический анализ данных по заболеваемости и смертности, принимая во внимание влияние рода занятий, социального положения и отношений. Его по праву считают «духовным отцом» продолжающейся и в наши дни деятельности Всемирной организации здравоохранения (ВОЗ) по совершенствованию Международной классификации болезней (МКБ).
Первое эпидемиологическое исследование, ставившее целью описать, объяснить и даже принять меры по устранению выявленных причин заболеваемости, провел английский врач Джон Сноу, позднее получивший имя «отца полевой эпидемиологии». За 20 лет до появления микроскопа Сноу проводил анализ вспышек холеры для выяснения причины их возникновения и разработки программы ее профилактики. Его работа классически иллюстрирует ход событий от описательной эпидемиологии до апробации гипотезы на практике (аналитическая эпидемиология). Использование нескольких подходов (клинического, патогенетического и эпидемиологического) позволило Сноу выяснить истинные причины эпидемии холеры в Лондоне. Клинические проявления болезни, характер и локализация патологического процесса при инфекции позволили ему предположить возможные пути проникновения заразного начала в организм человека. Далее Сноу выяснил место проживания каждого жителя Лондона, умершего от холеры в 1848-1849 и 1853-1854 гг., нанес их на карту и обнаружил существование явной связи между источником питьевой воды и случаями смерти. Он провел статистическое сравнение летальных исходов холеры в районах с разными системами водоснабжения и выяснил, что общее количество случаев смерти и, что еще важнее, показатели смертности были выше там, где водоснабжение осуществляла компания Southwark. Дальнейшее расследование показало, что компания пользовалась водозаборами на Темзе, находившимися ниже Лондона, т.е. ниже стоков городской канализации. Таким образом, из изучения эпидемий с различных позиций родился эпидемиологический подход к изучению заболеваемости.
Еще одним примером показательного эпидемиологического исследования по изучению причин развития различных заболеваний служит изучение эпидемии врожденной краснухи. В 1941 г. австралийский офтальмолог Норман Мак Алистер Грегг обратил внимание на необычно высокий уровень врожденной катаракты в Сиднее и других городах Австралии. На основе совокупности собранных материалов Грегг сформулировал гипотезу причинно-следственной связи врожденной катаракты с краснухой, перенесенной матерью на раннем сроке беременности. Для проверки высказанной гипотезы не были пригодны ни патологические, ни лабораторные исследования больных. Результаты могли дать лишь эпидемиологические методы - сопоставление интересующих исследователя данных в отдельных группах людей и в разные периоды времени. Грегг установил ярко выраженную зависимость между врожденной катарактой у новорожденных и краснухой у их матерей, перенесенной на раннем сроке беременности.
Формирование в XIX в. медицинской статистики, отражающей заболеваемость и смертность населения в количественных показателях, стало суще-
ственным фактором в развитии эпидемиологии. Представилась возможность перейти от качественных эпизодических описаний отдельных эпидемий к систематическому накоплению количественных показателей, характеризующих здоровье населения. Центром развития эпидемиологии в нашей стране в конце ХIХ-начале ХХ в. стала земская медицина. Основным методическим инструментом представителей земской медицины была статистика. С этой точки зрения эпидемиологию иногда образно называют своеобразной «игрой в цифры», которые отражают показатели заболеваемости или другие проявления, характеризующие здоровье населения.
Основы профилактики и борьбы с заразными болезнями преподавались на разных кафедрах медицинского факультета Московского университета задолго до официального учреждения кафедры эпидемиологии. Основоположники клинической медицины С.Г. Зыбелин, М.Я. Мудров, И.Е. Дядьковский, Т.А. Захарьин в своих лекциях выдвигали идеи предупреждения заболеваний. Таким образом, первоначальное преподавание эпидемиологии происходило в неразрывной связи с клиническими дисциплинами. В конце XIX в. основы профилактики и борьбы с эпидемиями излагались уже в самостоятельном учебном курсе, который проводился на объединенной кафедре гигиены, эпидемиологии, медицинской полиции и медицинской статистики Московского университета. Первый заведующий кафедрой проф. Ф.Ф. Эрисман уделял большое внимание не только вопросам гигиены, но и эпидемиологии. В своем фундаментальном труде «Руководство к гигиене» он обобщил известные к тому времени данные по эпидемиологии и объединил группы заразных болезней по способу их распространения, а также дал достаточно подробное описание каждого варианта передачи. Работа Ф.Ф. Эрисмана отражала передовую систему взглядов, господствовавших в медицине накануне великих бактериологических открытий. В 1875 г. он впервые в истории выдвинул идею о возможности ликвидации инфекционных болезней. «История дает нам надежду, что благодаря всеобщему распространению образования, улучшению социальных условий и развитию науки удастся все более и более оттеснить на задний план и наши господствующие эпидемические болезни, а может быть, и вовсе освободить от них род человеческий».
Благодаря работам А. Левенгука, Л. Пастера, Р. Коха, И.И. Мечникова, П. Эрлиха, Д.И. Ивановского, Н.Ф. Гамалеи и многих других ученых инфекционное происхождение эпидемических болезней стало уже не гипотезой, а фактом. Бактериологические открытия последней четверти XIX столетия преобразовали эпидемиологию и изменили ее сущность. Основным методом изучения на первых этапах стали не эпидемиологические сопоставления, а микробиологические исследования, порой в ущерб традиционным подходам. С другой стороны, бактериологические открытия создали научную базу для изучения патогенеза инфекционных болезней, природы невосприимчивости к их возбудителям и закономерностей эпидемического процесса. Преподавание эпидемиологии в этот период переместилось на кафедры микробиологии и инфекционных болезней. Однако уже в 1911 г. по предложению ректора Московского университета на медицинском факультете были созданы эпидемиологические курсы для врачей, а в 1913-1916 гг. функционировал приват-доцентский курс эпидемиологии, который читал санитарный врач А.Я. Раммуль.
На новой научной и методологической основе эпидемиология возродилась в первой половине ХХ в. при участии Д.К. Заболотного (1866-1929), В.А. Баше-
нина (1882-1978), Е.Н. Павловского (1884-1969) и Л.В. Громашевского (1887- 1979). Е.Н. Павловский создал теорию природной очаговости ряда инфекционных болезней, согласно которой обеспечивается стойкое сохранение возбудителя в природе. В.А. Башенин, соавтор открытия безжелтушного лептоспироза, рассматривал эпидемиологию как науку, предназначенную для изучения всех болезней, а не только инфекционной природы. Д.К. Заболотный осуществил много ценных клинических, микробиологических и эпидемиологических исследований, касающихся чумы и холеры, сифилиса и сыпного тифа. В 1911 г. совместно с В.И. Исаевым он открыл, что источником чумной инфекции являются тарбаганы. Его книга «Основы эпидемиологии», изданная в 1927 г., представляет собой первое в мире систематизированное руководство по данной дисциплине. Д.К. Заболотный стал основоположником советской эпидемиологии, инициатором открытия первой в мире кафедры эпидемиологии в Одесском медицинском институте (1920), автором первого отечественного руководства «Основы эпидемиологии». Д.К. Заболотный - создатель школы видных отечественных эпидемиологов, среди которых прежде всего следует назвать Л.В. Громашевского и М.Н. Соловьева. В 1923 г. М.Н. Соловьев учредил курс эпидемиологии в Харькове, а в 1929 г. Л.В. Громашевский организовал кафедру эпидемиологии в Днепропетровске. В 1931 г. открыта кафедра эпидемиологии в Центральном институте усовершенствования врачей и в 1-м ММИ. Первыми заведующими этих кафедр стали Л.В. Громашевский и Н.Н. Клодницкий. Начиная с 1932 г. санитарно-гигиенические факультеты открыли во многих медицинских институтах, в их состав вошли кафедры эпидемиологии. Кроме того, на всех лечебных и педиатрических факультетах читали доцентский курс эпидемиологии. Кафедры эпидемиологии были созданы также в институтах усовершенствования врачей. Включение эпидемиологии в число академических дисциплин само по себе уже представляет факт огромнейшего, принципиального значения. Кафедры эпидемиологии стали центрами подготовки квалифицированных кадров эпидемиологического профиля.
В эти тяжелые годы в общественном опыте борьбы с эпидемиями закладывались основы санитарно-эпидемиологической службы страны. Богатую почву для научных исследований создавали многочисленные эпидемии, развившиеся в период Гражданской войны и послевоенной разрухи.
Архивы свидетельствуют о проведении в 1920-х годах многочисленных съездов и совещаний, на которых активно обсуждали вопросы борьбы с эпидемиями, развития науки, подготовки кадров и комплекса противоэпидемических мероприятий. Для руководства борьбой с эпидемиями создавали чрезвычайные комиссии и противоэпидемические отряды, а затем и санитарно-эпидемиологические станции. Был организован комплекс научно-исследовательских институтов: Институт контроля вакцин и сывороток (1918), Московский институт им. И.И. Мечникова (1919), Центральный институт малярии (1920), также открыты институты в Тифлисе, Петрограде, Минске, Перми, Ставрополе и противочумный институт в Саратове (1919). На государственном уровне был введен принцип обязательности противоэпидемических мероприятий, государственного контроля за санитарным состоянием.
Огромную роль в решении теоретических проблем эпидемиологии инфекционных болезней, создании системы профилактических и противоэпидемических мероприятий сыграли труды отечественных ученых Г.Н. Габричевского, Л.А. Тарасевича, Н.Н. Клодницкого, Н.Ф. Гамалеи, Г.Ф. Вогралика, Т.Е. Бол-
дырева, Е.Н. Павловского, М.Н. Соловьева, Л.В. Громашевского, Е.И. Марциновского, К.И. Скрябина, П.Г. Сергиева, В.А. Башенина, В.Д. Тимакова, А.А. Смородинцева, М.П. Чумакова, И.И. Елкина, И.И. Рогозина, В.Д. Белякова, Б.Л. Черкасского и др. Несомненно, крупное достижение теоретической эпидемиологии - создание стройного учения об эпидемическом процессе Д.К. Заболотным, Л.В. Громашевским, М.Н. Соловьевым и их многочисленными последователями. Л.В. Громашевскому принадлежит честь научного определения таких категорий эпидемиологии, как источник инфекции, механизм передачи инфекции и т.п. Он же сформулировал основные законы эпидемиологии и разработал эпидемиологическую классификацию инфекционных болезней. Л.В. Громашевский - автор первой учебной программы и методики преподавания эпидемиологии в медицинских вузах. В 1941 г. он опубликовал свой классический труд - учебник «Общая эпидемиология», выдержавший 4 издания и переведенный на многие языки народов мира. Эта книга стала настольным руководством, методологическим и методическим пособием для многих поколений не только студентов, но и врачей. Таким образом, эпидемиологию инфекционных болезней можно с полным основанием назвать русской наукой.
Созданная в бывшем Советском Союзе и функционирующая ныне в РФ система эпидемиологического надзора реализуется сетью учреждений государственной санитарно-эпидемиологической службы. Эта система оригинальна, поскольку отечественная эпидемиологическая наука разработала адекватные социально-экономическим условиям страны принципы и технологию сбора, анализа и передачи эпидемиологической информации, что давало возможность объективно и оперативно оценивать эпидемическую ситуацию и своевременно формулировать необходимые управленческие решения. Отечественная система профилактических и противоэпидемических мероприятий на протяжении всей истории обогатилась эффективными методами борьбы с инфекциями и выдержала испытание в трудные для страны времена. Благодаря совместным усилиям работников лечебной и санитарно-эпидемиологической службы, государственной поддержке проводимых мероприятий достигнуты огромные успехи в борьбе с эпидемиями. К значимым достижениям в области борьбы с инфекционными заболеваниями следует отнести ликвидацию оспы, сыпного тифа, полиомиелита. В настоящее время реализуется национальный план действий по ликвидации кори к 2010 г. До спорадического уровня снижена заболеваемость брюшным тифом по большинству инфекций, управляемых средствами специфической профилактики. Развитие микробиологии, вирусологии и иммунологии расширило возможности изучения различных болезней, позволило научно обосновать эпидемиологические особенности и закономерности, способствовало совершенствованию профилактических мероприятий.
В июне 2006 г. РФ впервые председательствовала на саммите «Группы восьми» в г. Санкт-Петербурге. Основываясь на собственном успешном опыте борьбы с инфекциями и осуществлении профилактических мероприятий, направленных на предотвращение негативного воздействия недоброкачественной питьевой воды и продуктов питания на здоровье населения, Россия предложила в качестве одной из приоритетных тем обсуждения лидерами «восьмерки» - противодействие инфекционным болезням наряду с такими приоритетами, как энергетическая безопасность и образование. По инициативе России «Группе восьми» было предложено принять отдельное заявление,
которое объединило бы в себе позицию индустриально развитых демократических государств по всему комплексу проблем, связанных с распространением эпидемий и определило бы дальнейшую глобальную стратегию действий в данной сфере. Российские инициативы подверглись детальному анализу и обсуждению со стороны экспертов стран «Группы восьми» и профильных международных организаций. В результате было подготовлено сбалансированное, комплексное итоговое решение лидеров, в котором четко обозначены причины и угрозы распространения инфекций, основные принципы, в соответствии с которыми необходимо действовать мировому сообществу в целях достижения значимых результатов в борьбе с эпидемиями. В ходе работы саммита были приняты решения:
- по созданию Центра, сотрудничающего с ВОЗ, по гриппу для стран Восточной Европы и Центральной Азии;
- по созданию регионального координационного центра по разработке вакцины против ВИЧ-инфекции для стран Восточной Европы и Центральной Азии;
- по укреплению Глобальной сети по оповещению и реагированию на вспышки инфекционных болезней (GOARN) за счет использования «ударных бригад» и технических экспертов (терминология ВОЗ), созданных путем модернизации российских специализированных противоэпидемических бригад;
- по повышению эффективности международных мер реагирования в чрезвычайных ситуациях (ЧС), включая использование для этих целей команд быстрого реагирования для предупреждения и ликвидации эпидемиологических последствий ЧС, поддержания санитарноэпидемиологического благополучия населения в условиях кризиса систем здравоохранения.
Современные СПЭБ - это мобильные формирования экстренного реагирования и автономного функционирования, которые используют передовые диагностические, информационные технологии и современное оборудование. Они укомплектованы по модульному принципу, имеют высококвалифицированный кадровый состав, способны решать задачи по проведению комплекса мероприятий санитарно-противоэпидемического обеспечения населения при ликвидации последствий разного рода ЧС на территории РФ, стран СНГ, Восточной Европы и Центральной Азии.
Специфика эпидемиологической деятельности
Эпидемиология - одна из быстро развивающихся областей медицины. С одной стороны, в ней появляются новые гипотезы и теории, призванные объяснить вновь накапливаемые факты. С другой стороны, намечается тенденция к расширению границ эпидемиологии и вовлечению в ее сферу новых объектов.
В последние годы в разных странах мира интенсивно развивается популяционный подход в частных медицинских науках:
- онкологии;
- кардиологии;
- эндокринологии;
- психиатрии и др.
Сумму таких подходов стали называть неинфекционной эпидемиологией. Несколько лет назад эпидемиологию неинфекционных болезней рассматривали как некую совокупность методических приемов, заимствованных из традиционного опыта эпидемиологии. Сегодня термин «неинфекционная эпидемиология» прочно вошел в обиход не только за рубежом, но и у нас в стране и ни у кого не вызывает возражений. Эпидемиологический метод, сформировавшийся в недрах эпидемиологии инфекционных болезней, оказался эффективным при изучении закономерностей распространения среди населения болезней неинфекционной природы. Не случайно J. Gordon (1954) назвал эпидемиологию «диагностической дисциплиной общественного здравоохранения». В этой связи эпидемиологические исследования служат инструментом, помогающим принимать управленческие решения в сфере общественного здравоохранения, основанные на научных данных, вскрытых причинно-следственных связях и здравом смысле.
Трудно переоценить вклад, внесенный эпидемиологией в медицинские науки, особенно об инфекционных и профессиональных заболеваниях, а также заболеваниях, вызываемых нарушениями питания. Благодаря эпидемиологическим исследованиям медицина обогащалась знаниями, необходимыми для профилактики заболеваний, еще до того, как появились микробиологические, биохимические или другие научные данные об этиологии ряда заболеваний (холеры, цинги, пеллагры, бери-бери и др.). Эпидемиологический подход, определяющий закономерности распределения заболеваний во времени, территориально и среди различных групп населения, позволяет сконцентрировать профилактические мероприятия в период времени, предшествующий подъему заболеваемости, на территории, где вероятность ее возникновения наиболее высока, и на группах населения, подверженных наибольшему риску заболевания.
Эпидемиологическую информацию следует использовать для укрепления и охраны здоровья общества. Основные цели каждой из существующих на сегодня систем здравоохранения - охрана, укрепление и восстановление здоровья населения с учетом влияющих на него факторов. Новая концепция развития здравоохранения в России также подчеркивает сохранение и восстановление здоровья населения страны.
В современной медицине различают:
- индивидуальное здоровье (здоровье личности, отдельного человека);
- здоровье отдельных групп людей, объединенных каким-либо признаком (возраст, профессия, место проживания и т.д.);
- общественное здоровье - понятие высокого социального уровня, характеризующее состояние здоровья населения страны, региона, определенной административной территории.
Показатели общественного здоровья
• Индекс здоровья населения - это соотношение болевших и неболевших лиц (или доля неболевших лиц за определенный период времени в общей численности населения).
• Потенциал здоровья - это мера количества и качества здоровья, измеряемых комплексом показателей. К ним относят уровень заболеваемости (инфекционной, неинфекционной, онкологической, профессиональной, внутрибольничной) и травматизма.
• Каждую из названных категорий заболеваемости оценивают по тяжести течения и исхода:
◊ заболеваемость с временной утратой трудоспособности;
◊ заболеваемость со стойкой утратой трудоспособности, или инвалидность;
◊ заболеваемость со смертельным исходом, или летальность.
• Наряду с заболеваемостью важнейшими показателями, характеризующими общественное здоровье, являются демографические и медикодемографические коэффициенты:
◊ рождаемость;
◊ смертность;
◊ естественный прирост (убыль) населения;
◊ младенческая смертность;
◊ смертность по причинам и возрастно-половым группам.
В последние годы помимо названных критериев, для оценки здоровья населения используют частоту и характер состояний, предшествующих развитию патологии. Донозологическая диагностика как метод исследования и оценки адаптации организма к негативному воздействию различных факторов среды должна стать основой прогнозирования здоровья населения. Этот метод базируется на изучении иммунного, психического статуса, функционального состояния систем биохимической защиты, состояния сердечно-сосудистой и респираторной систем, желудочно-кишечного тракта (ЖКТ) и др. Для выявления людей с ранними стадиями заболеваний (до обращения за медицинской помощью) предназначены скрининговые исследования. Факторы, оказывающие влияние на состояние здоровья населения, могут быть связаны с образом жизни, состоянием окружающей среды, генотипом популяции и обеспеченностью населения медицинской помощью. Удельный вес влияния образа жизни (курение, употребление алкогольных напитков и наркотиков, злоупотребления лекарственными средствами, характер питания, условий труда, материальнобытовых условий, семейного положения и др.) составляет 49-53%, вклад генетических и биологических факторов - 18-22%, развития здравоохранения (своевременность и качество медицинской помощи, эффективность профилактических мероприятий) - 8-10%, вредного влияния окружающей среды (природно-климатические факторы, состояние атмосферного воздуха, воды, почвы, пищевых продуктов) - 17-20%.
В современных условиях здоровье населения - это один из главных факторов экономического роста и национальной безопасности страны, который во многом определяется санитарно-эпидемиологическим благополучием населения, реальным обеспечением прав граждан на безопасную среду обитания и профилактику заболеваний, гарантом которых выступает санитарно-эпидемиологическая служба.
Основной предмет эпидемиологии как познавательной деятельности - это заболеваемость населения. Ее можно представить как одно из объективных массовых явлений, отражающих влияние неблагоприятных внешних факторов на население. С другой стороны, заболеваемость - статистическая величина, определяемая совокупностью объективных (причинных) и субъективных (качество выявления, диагностики и т.д.) факторов. Изменившиеся технологические возможности позволили как выявлять новые болезни, так и диагностировать легкие формы болезни, бактерионосительство, ранее недоступные для распознавания, а следовательно, и не регистрируемые формы заболеваний.
Показатели заболеваемости различными болезнями образуют сложную упорядоченную структуру. Размерность этого показателя - количество случаев на 100, 1000, 10 000 или 100 000 населения. Эпидемиологический смысл показателя состоит в том, что он отражает частоту заболевания либо риск его развития. Помимо количественной характеристики, показатель заболеваемости может отражать диагноз, время, место, индивидуальную характеристику больного (пол, возраст и др.).
Причинная обусловленность болезней
К основным целям эпидемиологии как познавательной деятельности относится:
- описание заболеваемости населения;
- выявление причин и механизма возникновения, развития и распространения болезней;
- разработка, оценка качества и эффективности мер по снижению заболеваемости и профилактике заболеваний.
Причина болезни - это событие, условие, свойство или комбинация этих факторов, играющих важную роль в возникновении той или иной патологии. В настоящее время при изучении причинно-следственных отношений в медицине исходят из концепции «множественности и сочетанного действия причин», согласно которой многие болезни имеют несколько причин, а отдельная причина может вызывать разные болезни. Поэтому при использовании термина «причина» в большинстве случаев речь идет о комплексе причин, всю совокупность которых можно разбить на 3 большие группы - причины биологические, социальные и природно-климатические.
Причина обязательно скрыта в событиях, предшествующих возникновению и распространению болезни, но не все предшествующие заболеванию события бывают его причинами.
Причину расценивают как достаточную, если она неизбежно вызывает или инициирует болезнь, и как необходимую, если при ее отсутствии развитие болезни невозможно. Достаточная причина редко бывает единичным фактором, она часто объединяет несколько компонентов. Например, курение - один из компонентов достаточной причины развития рака легких. Само по себе курение не считают достаточной причиной для возникновения этой болезни (некоторые люди, курившие на протяжении 50 лет, раком легких не страдают), для этого необходимы и другие факторы, которые по большей части остаются неизвестными. Однако прекращение курения приводит к снижению доли этой патологии в популяции, даже если другие компоненты причины остаются без изменений.
Каждая достаточная причина в качестве компонента включает необходимую причину. Например, при расшифровке вспышки пищевой токсикоинфекции (ПТИ) было установлено, что употребление двух блюд могло привести к возникновению сальмонеллезного гастроэнтерита. В данном случае необходимая причина - присутствие бактерий в обоих блюдах или в одном из них. Причинным следует считать только тот фактор, без которого болезнь не может возникнуть ни при каких обстоятельствах. При отсутствии патогенных микроорганизмов соответствующие болезни не могут развиться даже при особо благоприятных условиях заражения и готовности организма к развитию патологического процесса.
Каждая причина формирует соответствующую часть заболеваемости, которую называют этиологической долей. Это удельный вес (доля) тех случаев болезни, которые могли бы быть предотвращены при отсутствии влияния фактора риска. Чтобы предупреждать возникновение болезней, совсем не обязательно дожидаться выяснения всех составляющих причин. Исключение влияния всего одной составляющей причины вызывает эффект, равный эффекту исключения влияния всех тех достаточных причин, в которые входит данная составляющая.
На первый взгляд менее сложным кажется комплекс причин распространения инфекционных болезней. Например, достоверно известно, что распространение антропонозов невозможно без резервуара (источника) инфекции, соответствующего способа передачи возбудителя (механизма передачи) и восприимчивого коллектива. Другими словами, источник инфекции, механизм передачи и восприимчивый коллектив - это составляющие и необходимые причины.
Будет ли сочетание необходимых причин распространения инфекционных болезней одновременно и достаточной причиной? Ответ - нет, поскольку каждая необходимая причина представляет лишь потенциальную опасность. Для реального процесса распространения инфекций необходимо не просто присутствие трех указанных необходимых причин, но обязательно и неразрывная их связь, которая осуществляется за счет социальных факторов. Социальные факторы могут превратить потенциальную опасность необходимых причин в реальную, они способны резко ухудшить эпидемическую обстановку или снизить заболеваемость до минимальных цифр. Комплекс достаточной причины распространения антропонозов не ограничивается только набором источника инфекции, механизма передачи и восприимчивого коллектива. В него обязательно входят необходимые социальные, иногда природно-климатические факторы, обеспечивающие неразрывную связь необходимых причин. Именно активность социальных факторов в комплексе достаточной причины определяет интенсивность распространения антропонозов.
Болезни неинфекционного генеза обычно вызваны разнообразными по своей природе причинами:
- химическими;
- физическими;
- психогенными;
- генетическими и др.
В то же время один единственный фактор, например курение, может стать непосредственной причиной многих болезней. Эффект от двух или более одновременно действующих причин часто бывает большим, чем это можно было бы ожидать при суммировании эффектов от каждой причины в отдельности. Это взаимодействие можно проиллюстрировать на примере курящих лиц, контактировавших с асбестовой пылью. Риск развития рака легких в этой группе гораздо выше, чем в том случае, когда просто суммируются риск, связанный только с курением, и риск, появляющийся только от вдыхания асбестовой пыли.
На воздействие причинного фактора организм отвечает системой защитных реакций, определяющих возможность клинического проявления болезни. Первичное и основное звено развития болезни - это повреждение. При инфекционной болезни повреждение макроорганизма начинается с изменения строения и
свойств различных молекул в клетках тканей, где размножаются микроорганизмы, при этом клетки могут погибать. Но развитие, течение и исход инфекционной болезни в значительной степени, кроме процессов повреждения, определяет реактивность организма. Инфекционная болезнь развивается в условиях неспособности организма предотвратить нарушения, вызываемые возбудителем. Инфекционную болезнь может вызывать один возбудитель, в таких случаях говорят о моноинфекции. Иногда инфекционное заболевание бывает результатом действия двух или нескольких микроорганизмов (микст-инфекция). С другой стороны, некоторые болезни возникают лишь при условии значительного снижения реактивности макроорганизма, вызванного генетическими или внешними факторами. Так, СПИД развивается у ВИЧ-инфицированных лиц на фоне выраженного иммунодефицита, предрасполагающего к присоединению оппортунистических инфекций.
Причины проявляют свое патологическое влияние на разных уровнях организации жизни:
- суборганизменном (тканевом, органном, молекулярном);
- организменном;
- надорганизменном (уровень общества, населения, популяционный уровень).
Ни одной медицинской науке не под силу изучать проявления на всех уровнях организации жизни, следовательно, ни одна наука не может считать своим предметом весь процесс возникновения и распространения болезни.
Для выявления причин разные науки используют различные направления поиска и специфические исследования:
- морфологические;
- клинические;
- микробиологические;
- гигиенические;
- генетические;
- эпидемиологические и т.д.
Основной предмет эпидемиологии и, соответственно, эпидемиологических исследований - это патология (заболеваемость), которая проявляется на надорганизменном уровне (уровне общества, популяционном уровне). Эпидемиология изучает заболеваемость населения любыми болезнями и независимо от их происхождения, тем более что для многих болезней оно еще далеко не расшифровано.
Термин «фактор риска» обычно используют для обозначения факторов, ассоциирующихся с риском развития болезни, но недостаточными для того, чтобы вызвать ее. Некоторые факторы риска (например, курение) ассоциируются с несколькими болезнями, а некоторые заболевания (например, ишемическая болезнь сердца) - с несколькими факторами риска. С помощью эпидемиологических исследований можно дать количественную оценку относительного значения каждого фактора в возникновении той или иной болезни, а также оценить эффективность проводимых профилактических программ по устранению каждого из этих факторов. Кроме того, эпидемиологический подход наиболее эффективен в установлении причинно-следственных отношений возникновения массовых неинфекционных заболеваний и открывает возможности для поиска средств предупреждения и нейтрализации воздействия на здоровье населения негативных факторов внешней среды.
Выяснение причины болезни предполагает следование определенному набору «принципов установления причинности».
• Причинно-следственная связь однонаправлена: причина → следствие, а не наоборот.
• Обязательное условие - причина всегда предшествует следствию.
• Убедительность ассоциации - подтверждение причины различными данными.
• Последовательность - несколько исследований дают одинаковые результаты.
• Степень выраженности ассоциации - вычисление коэффициента риска.
• Зависимость «доза-ответ» - увеличение действия причинного фактора ассоциируется с увеличением эффекта.
• Доказательство «от противного» - устранение возможной причины приводит к снижению риска заболевания.
Сходство и различие эпидемиологии инфекционных и неинфекционных болезней
Эпидемиологические исследования помогли установить роль курения в развитии рака легких, расшифровать многие генетические заболевания крови, изучить распространенность сердечно-сосудистых и профессиональных заболеваний, разработать профилактические программы при различных хронических заболеваниях и сформировать государственную политику охраны здоровья населения.
Общность целей эпидемиологии инфекционных и неинфекционных заболеваний заключается в выявлении закономерностей возникновения, распространения и прекращения заболеваний человека, а также определении направлений профилактических мероприятий.
Задачи эпидемиологии инфекционных и неинфекционных болезней совпадают:
- определение медицинской и социально-экономической значимости болезни и ее места в структуре патологии населения;
- изучение закономерностей распространения болезни во времени (по годам, месяцам и т.п.), территориально и среди различных (возрастных, половых, профессиональных, бытовых, этнических и др.) групп населения;
- выявление причинно-следственных связей заболеваемости;
- разработка рекомендаций по оптимизации профилактики данной болезни.
В основе эпидемиологии как медико-биологической науки лежат общебиологические закономерности. Биологическую основу процесса формирования заболеваемости составляет спектр различных по характеру и силе причинных факторов во взаимодействии с гетерогенной по степени восприимчивости к ним популяции людей. Различия при инфекционной и неинфекционной патологии касаются преимущественно природы причинных факторов. Все факторы, формирующие заболеваемость и процесс ее распространения, могут быть разделены на биологические, химические и физические. В случае биологического фактора - это микроорганизмы, паразиты и прионы, в случае химического - химическое вещество, физический фактор предусматривает механиче-
ское воздействие, радиацию, температуру и т.д. Воздействие этих факторов осуществляется из источника через воздух, при контакте, через воду и пищу, а восприимчивость зависит во всех случаях от генетических факторов, неспецифической защиты, особенностей биохимических процессов и состояния иммунитета. В одной группе факторов более значимы одни компоненты, в другой группе - другие. Задача эпидемиологического метода - найти причины, которые обеспечивают возникновение и распространение патологических состояний среди населения.
Отмечая общность целей, задач и методов исследования эпидемиологии инфекционных и неинфекционных болезней, необходимо подчеркнуть то принципиальное обстоятельство, что ни цель, ни задачи, ни метод не определяют качественного своеобразия и обособленности каждой науки как самостоятельной отрасли знания. Они определяются только спецификой объекта (предмета познания) исследования. Эпидемиология инфекционных болезней имеет специфический, четко очерченный объект исследования, что определяет ее качественное своеобразие как самостоятельной научной дисциплины. Предмет ее изучения - эпидемический процесс (закономерности возникновения и распространения инфекционных болезней), способы его профилактики и борьбы с ним. Однако эпидемический процесс не может быть предметом изучения только эпидемиологии инфекционных болезней. Эпидемический процесс - это чрезвычайно сложный процесс, в котором участвует население, возбудители инфекционных заболеваний и окружающая среда. Раскрытие причин и механизма развития эпидемического процесса невозможно без таких наук, как клиническая картина инфекционных болезней, микробиология, гигиена, биология, но при этом предметом изучения каждой из них будут отдельные составляющие эпидемического процесса.
Для развития инфекционных болезней характерна возможность и необходимость возникновения новых случаев заболевания. Возбудители инфекционных болезней (живые существа) служат не только специфическим пусковым фактором, но и определяют все стадии и механизмы патогенеза, защитноприспособительные реакции организма человека и исход болезни. При инфекционных болезнях сущность латентной фазы патологического процесса - это инкубация возбудителя в зараженном им организме, т.е. его адаптация к среде обитания, завоевание экологической ниши, размножение, накопление и диссеминация продуктов его жизнедеятельности в макроорганизме. При инфекционных болезнях, в отличие от неинфекционных, обычно формируются специфические иммунные реакции, обеспечивающие освобождение организма от возбудителя. Теоретические основы, позволяющие признать общность объекта исследования эпидемиологии инфекционных и неинфекционных болезней, отсутствуют, так как закономерности их возникновения, распространения и прекращения совершенно иные.
Перед традиционной эпидемиологией инфекционных болезней стоит много нерешенных проблем. Изменившаяся социально-экономическая обстановка и ухудшившаяся экологическая ситуация способствовали эволюции эпидемического процесса многих инфекционных болезней. По данным ВОЗ, ежегодно 2 млрд людей болеют инфекционными заболеваниями, из которых 17 млн умирают. Ежедневно в мире 50 000 смертей обусловлены инфекционными болезнями. Инфекции остаются ведущей причиной смерти и первой причиной преждевременной смерти. Около 50% населения планеты проживает в усло-
виях постоянной угрозы эндемических инфекций. В начале ХХ в. в США начал издаваться справочник «Борьба с инфекционными болезнями человека». В 1-м издании справочника, опубликованном в 1917 г., перечислено всего 38 нозологических форм. В 17-м издании этого же справочника (2000 г.) приведено уже более 500 болезней человека, вызываемых живыми возбудителями - паразитами. Многие болезни, близкие, как казалось, к полной ликвидации (например, малярия, холера, туберкулез), начиная с середины 80-х годов ХХ в. вновь стали представлять высокую эпидемиологическую опасность во многих странах мира. Не случайно в 1997 г. Всемирный день здоровья (7 апреля) проводили под девизом: «Инфекционные болезни наступают - все на борьбу с глобальной опасностью». Ситуацию усугубляет растущая устойчивость микроорганизмов к используемым лекарственным препаратам и дезинфектантам. Из-за устойчивости возбудителей малярии, туберкулеза, менингитов и пневмоний к лекарственным препаратам ежегодно в мире погибают миллионы людей. Широкое бесконтрольное применение антибиотиков вызывает изменение микробного биоценоза человека, снижает его сопротивляемость по отношению к микроорганизмам. Ухудшившаяся экологическая обстановка и большие психоэмоциональные нагрузки привели к значительному увеличению распространенности иммунодефицитов. Следствием этого стали существенное возрастание эпидемиологического значения условно-патогенных микроорганизмов и увеличение частоты заболеваемости оппортунистическими инфекциями (герпетической, ЦМВ-инфекцией, токсоплазмозом, микоплазмозами, криптококкозом, криптоспоридиозом и др.). Все чаще регистрируют необычные комбинации известных инфекций. В клинических и экспериментальных исследованиях накоплено немало фактов по особенностям течения ассоциативных болезней. В одних случаях такие заболевания протекают тяжелее, а в других - более благоприятно. Установлена высокая доля полиэтиологичных инфекций в структуре всех гнойно-септических инфекций в многопрофильных больницах. Следует упомянуть произошедшие существенные изменения эпидемиологических и клинических проявлений инфекционных болезней. Известно, что микроорганизмы эволюционируют, как и вся живая природа, только более быстрыми темпами. Они претерпевают фенотипическую и генетическую трансформацию, влияющую на изменение вирулентности, эффективности защитных механизмов человека и резистентности к обычно применяемым лекарственным препаратам.
Опасность инфекционных болезней связана не только с «реставрацией» хорошо известных, но уже порядком забытых заболеваний, но и с появлением новых, прежде не известных человечеству инфекционных болезней. За последние 35 лет выделен и идентифицирован 41 новый патоген - от смертельно опасного вируса геморрагической лихорадки Эбола до ротавирусов, становящихся, как выяснилось, наиболее распространенными возбудителями диареи у детей. Многие из этих новых инфекций характеризуются тяжелым течением, высокой летальностью, отсутствием надежных методов диагностики и профилактики. В последние годы открыт совершенно новый класс возбудителей, характеризующийся отсутствием носителей генетической информации, но обладающий способностью к репликации. Инфекционный агент белкового происхождения, обозначенный термином «прион» [от англ. proteinaceous infectious (particle) - белковая инфекционная (частица)], вызывает нейродегенеративные заболевания у животных и человека. Изучение прионов и связан-
ных с ними заболеваний - новая проблема, представляющая большой интерес для медицины и ветеринарии. Особую озабоченность вызывает обеспечение безопасности лекарственных препаратов, медицинских изделий и косметических средств, получаемых из органов и тканей крупного рогатого скота, прежде всего в странах с зарегистрированными случаями заболеваний животных. Если ранее основное внимание уделялось острым инфекционным заболеваниям, то в последние годы оно все более смещается в сторону хронических болезней (хронические вирусные гепатиты, ВИЧ-инфекция и др.), которые выступают причиной длительных страданий людей и ложатся тяжким бременем на здравоохранение. Сегодня известно около 40 нозологических форм медленных инфекций человека и животных. Спектр возможных возбудителей болезней у человека (в том числе и хронических инфекций) со временем будет расширяться. Сегодня из 5 000 видов известных в мире вирусов идентифицировано менее 4%. Из 300 000-1 000 000 видов бактерий, существующих на Земле, описано только 2 000, а из всех океанических бактерий - менее 1%.
Среди факторов, способствовавших возникновению новых инфекционных болезней (возбудителей болезни), можно выделить следующие.
• Экологические изменения, обычно ускоряющие появление инфекционной болезни посредством контакта людей с природным резервуаром или хозяином инфекции. Наиболее серьезное экологическое изменение XXI в. - глобальное потепление. Оно неизбежно вызовет рост числа инфекционных заболеваний, распространяющихся посредством переносчиков и воды (холеры, малярии, шистосомоза, африканского трипаносомоза, арбовирусных инфекций, желтой лихорадки и др.), а также изменение границ естественных ареалов этих инфекций.
• Демографические сдвиги и изменения в поведении людей, позволяющие инфекционным агентам, циркулирующим в изолированных сельских районах, проникать в большие человеческие популяции городов и распространяться по всему миру (лихорадка Денге, ВИЧ-инфекция, нетрансмиссивные геморрагические лихорадки Эбола, Марбург, Ласса и др.).
• Международный туризм и коммерция способствуют разносу возбудителей инфекционных болезней по всему миру. Чтобы возбудитель получил возможность циркулировать в новом для него регионе, в последнем должны присутствовать условия, благоприятные для возбудителя:
◊ трансмиссивные переносчики;
◊ восприимчивая популяция людей;
◊ определенные поведенческие стереотипы и др.
• Новые технологии в медицине и производстве продуктов питания и других продуктов биологического происхождения увеличивают риск появления новых болезней или формирования необычных для известных возбудителей путей передачи.
• Создание условий для нетрадиционных путей заражения, формирование техногенных очагов, артифициальные пути инфицирования:
◊ иерсиниозы;
◊ ротавирусный гастроэнтерит;
◊ ВГВ;
◊ ВГС;
◊ вспышки диарей, вызванные токсигенными штаммами кишечной палочки;
◊ криптоспоридиоз;
◊ прионные инфекции;
◊ госпитальные инфекции;
◊ ВИЧ-инфекция и др.
• Микробные адаптации и изменения либо способствуют образованию новых эпидемических вариантов возбудителей инфекционных болезней, либо изменяют патогенез вызываемых ими заболеваний (пенициллиноустойчивые пневмококки, гонококки, метициллинорезистентные стафилококки, мультирезистентные штаммы возбудителя тропической малярии, туберкулеза, токсигенные стрептококки группы А, устойчивые к ванкомицину энтерококки, резистентные к левомицетину и другим препаратам брюшнотифозные бактерии и др.).
Распространение инфекционных болезней, как уже говорилось выше, может представлять серьезную опасность (демографическую, экономическую, снижать обороноспособность) не только для какой-либо одной страны или отдельного региона, но и для всего населения мира.
Национальная безопасность - это историческая задача любого государства. Биологическая безопасность - это требование настоящего времени в мировом масштабе.
Биологическую опасность можно определить как опасность для здоровья и жизни человека, связанную с воздействием на него агентов (патогенов) биологической природы. Биологическая безопасность означает предотвращение ущерба и достижение защищенности каждого человека, общества и государства от потенциальных и реально существующих биологических угроз. Биологические патогены могут быть разделены по своему происхождению на природные (естественные) и искусственно созданные. Ниже перечислены основные источники биологической опасности для населения, животных и растений.
• Естественные резервуары патогенных микроорганизмов (эпидемические цепочки антропонозных и зоонозных болезней, сохранение возбудителей на субстратах окружающей среды).
• Ввоз на территорию РФ патогенных микроорганизмов, ранее здесь не встречавшихся (возбудитель тропической малярии), или возбудителей ранее не известных инфекционных болезней [возбудитель ВГВ, ВГС, вирусного гепатита D (ВГD), легионеллеза, ВИЧ-инфекции и др.].
• Аварии и диверсии на объектах, где проводят работы с патогенными микроорганизмами.
• Лечебно-профилактические учреждения (ЛПУ) - распространение возбудителей ВБИ.
• Биологический терроризм во всех его проявлениях.
Вторая угроза исходит от успехов высоких технологий - генной инженерии и биотехнологии. Организмы, модифицированные при помощи методов генной инженерии, могут представлять большую опасность в результате их диверсионной направленности или непредсказуемости эпидемиологических и экологических последствий при неконтролируемом попадании во внешнюю среду. Манипулирование генами может привести к повышению антигенных свойств подопытных микроорганизмов. Иммунная защита человеческого организма может оказаться неэффективной в связи с формированием новых иммунодоминантных эпитопов.
Необходимо помнить, что для инфекций не существует национальных границ. Поэтому мировое сообщество не должно игнорировать появление или повышение инфекционной заболеваемости где-либо. В борьбе между людьми и патогенными микроорганизмами неусыпная бдительность - это цена выживания.
Инфекционные болезни не прощают бездеятельности или ослабления внимания, они мстят активизацией, ростом заболеваемости и смертности. Примерами служат недавние эпидемии дифтерии и полиомиелита, справиться с которыми стало возможно благодаря огромному напряжению сил и средств, восстановлению утраченного коллективного иммунитета и организации строгого эпидемиологического контроля.
В целом можно говорить о достаточно напряженной эпидемиологической ситуации в нашей стране. Ежегодно регистрируют около 30-40 млн случаев инфекционных заболеваний. Отмечен стремительный рост заболеваемости туберкулезом, в том числе активной формой болезни, в особенности среди контингента исправительных учреждений. Небывалого по своим масштабам размаха достигла заболеваемость сифилисом и другими заболеваниями, передающимися половым путем (ЗППП), произошло значительное омоложение этих инфекций, далеко не редкими стали случаи врожденного сифилиса.
Причина возвращения многих болезней - это неблагоприятное влияние комплекса социально-экономических и экологических факторов, среди них не последнее место занимает и свертывание программ иммунизации населения. К таким факторам в РФ можно отнести неоправданно большое количество противопоказаний для вакцинации детей, отказ и необоснованные отводы от прививок, широкую кампанию в прессе против вакцинации, несоблюдение правил «холодовой цепи». Все это привело к формированию низкой иммунной прослойки населения и росту заболеваемости инфекционными заболеваниями, вполне управляемыми при помощи средств иммунопрофилактики. Страна пережила эпидемию дифтерии, вспышку полиомиелита, повысилась заболеваемость коклюшем и эпидемическим паротитом. Подобное неблагополучие нельзя объяснить только социальными переменами последних лет, так как накопление прослойки невакцинированных детей происходило в течение последних двух десятилетий.
Опыт РФ свидетельствует о том, что нарушения плановой иммунизации в течение лишь нескольких лет ведет к развитию эпидемии на федеральном или региональном уровне. Массовая иммунизация дает положительный эффект даже в условиях неблагоприятной социально-экономической ситуации. Однако массовое применение иммунных препаратов в рамках национальных календарей сделало современное человечество вакцинозависимым. Не только прекращение, но даже сокращение охвата контингентов, подлежащих вакцинации, плановой иммунизацией ведет к эпидемическому возврату болезней, управляемых средствами вакцинопрофилактики. По мнению экспертов ВОЗ, на сегодняшний день существуют все предпосылки (теоретические, организационные, экономические и технологические) для прекращения циркуляции вирусов полиомиелита и кори, что и заложено в качестве долгосрочной цели вакцинопрофилактики первых десятилетий XXI в. Решение этой задачи позволит отменить вакцинацию против инфекций, вызываемых указанными возбудителями. XXI в., по определению ВОЗ, назван веком борьбы и ликвидации некоторых
инфекционных заболеваний. Есть все основания, что в 1-й половине ХХI в. исчезнут такие болезни, как корь, полиомиелит, столбняк новорожденных, врожденная краснуха.
ЭПИДЕМИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
В сфере общественного здравоохранения эпидемиологический подход находит самое разнообразное применение. При осуществлении социальногигиенического мониторинга здоровья населения с помощью эпидемиологических исследований выявляют и оценивают факторы риска разного уровня обобщения. В сложном переплетении причинно-следственных связей задача исследований заключается в поиске элементов (факторов), на которые можно повлиять при современном уровне научных и практических возможностей. В этом смысле целью эпидемиологических исследований становится получение необходимой информации, направленной на улучшение здоровья населения. С другой стороны, каждое клиническое решение должно базироваться на строго доказанных научных фактах. Этот постулат получил название «evidencebased medicine» (буквально «медицина, основанная на фактах» либо, что более точно, «научно обоснованная медицинская практика» или «научно-доказательная медицина»).
Эпидемиологические исследования составляют методическую основу доказательной медицины и служат важным источником получения обоснованных доказательств, необходимых для практической деятельности. Доказательная медицина предусматривает добросовестное, объяснимое и основанное на здравом смысле использование современных достижений для лечения каждого пациента. Любое медицинское вмешательство сопряжено с риском возникновения нежелательных (побочных) реакций как на индивидуальном, так и на популяционном уровне. Целью доказательной медицины является предупреждение риска или ограничение его масштабов на индивидуальном и популяционном уровнях. Такая задача выполнима только на основании эпидемиологического подхода к изучению болезней человека. Однако основная цель внедрения принципов доказательной медицины в практику здравоохранения значительно шире. Она направлена на оптимизацию качества оказания медицинской помощи с точки зрения не только ее безопасности, но и эффективности, стоимости и других значимых факторов. Практика доказательной медицины подразумевает объединение индивидуального профессионализма с лучшим доступным внешним обоснованным доказательством, полученным из систематического исследования. Научно обоснованная (доказательная) медицина делает основной упор не на интуицию, а на беспристрастную, объективную оценку научного факта. С этой целью она приводит стандарты качества информации к общим показателям, с тем чтобы результаты клинического и популяционного исследования могли быть оценены по воспроизводимым, систематизированным критериям. Принцип доказательности относится практически ко всем сферам деятельности медицины, включая профилактику, диагностику, принятие решений о применении того или иного вмешательства, использования аппаратуры и оборудования при проведении лечебных мероприятий, осуществление научных исследований и разработок, организацию и оказание медицинской помощи, экономику здравоохранения. Она затрагивает все спектры вузовского и послевузовского
медицинского и фармацевтического образования, профессионального развития специалистов здравоохранения и медицинской науки.
По мере развития эпидемиология обогащалась отдельными приемами и методами исследования различных проявлений заболеваемости. Постепенно эти подходы оформились в стройную систему в виде методологической основы науки. Сегодня эпидемиология располагает универсальным научным методом, позволяющим изучать любую (инфекционную и неинфекционную) патологию человека на популяционном уровне ее организации и здоровья населения.
Эпидемиологический метод - это совокупность методических приемов, позволяющих оценить структуру заболеваемости населения по группам и нозологическим формам болезни в отношении отдельных заболеваний - по территории, по группам населения и во времени, а также вскрыть конкретные элементы социальных и природных условий, причинно-следственные связи в развитии и проявлении заболеваемости.
Имеются специфические, свойственные только эпидемиологии методы:
- эпидемиологическое обследование;
- эпидемиологический эксперимент.
Эпидемиологический метод представляет совокупность методических приемов, позаимствованных из статистики, социологии, географии, клинической медицины, социальной гигиены, микробиологии и других смежных наук. Интегрируют эту совокупность цели исследования. По мере развития методологии эпидемиологических исследований и успехов в области изучения смежных наук перечень конкретных приемов и способов постоянно совершенствуют и дополняют. Аналогично клинической медицине, где до назначения полноценного лечения больному необходимо диагностировать болезнь с помощью клинических и инструментальных исследований, при изучении заболеваемости населения исследования позволяют поставить эпидемиологический диагноз и на его основе наметить целенаправленный комплекс профилактических и противоэпидемических мероприятий. Распознавание болезни называют клинической диагностикой. Распознавание заболеваемости в популяции людей определяют как эпидемиологическую диагностику.
Эпидемиологическое исследование - это способ изучения эпидемического очага, используемый для установления причин и условий его возникновения, выявления источника инфекции, путей и факторов его передачи, а также лиц, подвергшихся риску заражения. Завершается эпидемиологическое обследование постановкой оперативного эпидемиологического диагноза с целью разработки рекомендаций о характере, объеме и тактике проведения необходимых противоэпидемических мероприятий, направленных на ограничение и ликвидацию очага. Эпидемиологическое обследование должно быть начато в первые 24 ч после получения экстренного извещения об инфекционном заболевании, пищевом, остром профессиональном отравлении, необычной реакции на прививку. Эпидемиологическое обследование - строго специфическая составная часть эпидемиологического метода, представляющая собой один из наиболее существенных разделов деятельности эпидемиолога.
С помощью эпидемиологических методов выявляют конкретные условия и механизмы развития заболеваний в конкретной обстановке. Это методологический фундамент, на котором выстраивается система управления эпидемическим процессом.
По мнению В.Д. Белякова (1989), общий алгоритм эпидемиологической диагностики включает следующие компоненты:
- оценку проявлений эпидемического процесса в зависимости от территории, среди различных групп населения и во времени (обнаружение территорий, групп населения, отдельных коллективов риска и времени риска);
- выявление конкретных условий жизни и деятельности людей, факторов социальной и природной среды (включая качество и эффективность профилактической работы), определяющих проявления эпидемического процесса (формулирование гипотез о факторах риска);
- проверку сформулированных гипотез и расшифровку механизма причинно-следственных связей, приводящих к заболеваемости, достаточных для назначения эффективных в данной обстановке противоэпидемических мероприятий;
- ближайший и (или) отдаленный прогноз заболеваемости, оценку достоверности гипотез о факторах риска по эффекту (экспериментальное доказательство гипотез), определение эпидемиологической, социальной и экономической эффективности мер профилактики (оценка затрат и эффективности).
Методы эпидемиологических исследований, сформированные и успешно используемые при изучении инфекционных болезней, имеют важное, а подчас решающее значение при анализе различных патологических состояний. В современных условиях эпидемиологические методы исследования успешно используют при изучении факторов риска сердечно-сосудистых, онкологических и многих других заболеваний. Итоги эпидемиологических исследований служат совокупной оценкой мер профилактики и результатов их применения. В современных условиях сферы применения эпидемиологических исследований значительно расширились.
Исключительно важная роль эпидемиологических исследований в глобальной стратегии по достижению здоровья для всех была официально признана в резолюции, принятой сессией Всемирной ассамблеи здравоохранения в мае 1988 г. Этот документ призывает государства шире использовать эпидемиологические данные, концепции и методы при осуществлении профилактических программ.
Задача эпидемиологических исследований - это изучение частоты различных заболеваний. Показатели частоты заболеваемости (интенсивные показатели) определяют и вычисляют разными способами, они могут характеризовать либо общее число существующих, либо появление новых случаев болезни среди определенных групп населения. Показатели распространенности демонстрируют, какая доля населения страдает данным заболеванием в определенный момент времени. Показатели заболеваемости, напротив, характеризуют частоту возникновения новых случаев болезни в течение какого-либо периода времени. Основными показателями в эпидемиологии служат показатели заболеваемости (инцидентности), трудопотерь, инвалидизации, смертности, а также болезненности или пораженности (распространенности, превалентности). Между показателями распространенности и заболеваемости существует тесная связь. Возникновение новых случаев заболевания и увеличение продолжительности болезни увеличивают показатели распространенности болезни. Экстенсивные показатели, или показатели структуры (распределе-
ния), позволяют охарактеризовать распределение целого на составляющие его части. Так определяют структуру заболеваемости (смертности и др.) населения по отдельным классам и группам болезней, а отдельных классов (групп) - по нозологическим формам болезней. Структура заболеваемости отдельной нозологической формой болезни может быть выражена по признаку тяжести течения заболеваний, срокам госпитализации, источникам инфекции и т.д. Экстенсивные показатели не дают полного представления о сравнительной значимости анализируемой проблемы в динамике и в разных группах населения и не пригодны для выявления причинно-следственных связей. Стандартизованные показатели вычисляют для исключения влияния различий в сравниваемых группах населения на величину интенсивных показателей в этих группах.
Дизайн эпидемиологических исследований
Дизайн, способы проведения исследований, способы организации исследований, research structures, study design - термины, которые служат синонимами определения «структура».
Под дизайном эпидемиологического исследования понимают все особенности проведения конкретного исследования, предусмотренные его планом (от англ. design - план). Эти особенности выражаются многочисленными терминами, и только их сочетание позволяет отразить все характерные черты исследования.
Многообразие видов и различия в организации и проведении эпидемиологических исследований представлены в табл. 1-1.
Таблица 1-1. Классификация основных терминов, характеризующих отдельные особенности эпидемиологических исследований
Применение метода наблюдений не предусматривает вмешательства в естественный ход событий. Исследователь проводит нужные оценки, не пытаясь изменить ситуацию. К этой подгруппе относят описательные (оценочные) и аналитические исследования.
• Описательное исследование призвано дать характеристику эпидемиологической ситуации (распространенности той или иной болезни) среди наблюдаемого населения и в определенных его группах в конкретных условиях места и времени. Оно часто становится первой ступенью эпидемиологического исследования.
• Следующий шаг - аналитическое исследование, анализирующее взаимосвязь между заболеваемостью (другими показателями, характеризующими состояние здоровья населения) и различными причинными факторами. Не считая описательных, эпидемиологические исследования по своему характеру чаще бывают аналитическими.
Во многих странах описательные исследования предпринимают национальные центры санитарной статистики. Описательные исследования не предусматривают анализа связей между воздействием и результатом. Обычно в них используют статистические данные о смертности, заболеваемости, их распределение по возрасту, полу или этнической принадлежности за определенное время или по разным территориям (странам). Примером описательных исследований могут служить данные о структуре заболеваемости (смертности) за несколько лет в динамике. Эти сведения могут иметь большую ценность при идентификации факторов, обусловивших тенденцию к росту. На этой стадии исследований можно сделать ряд предположений, построить гипотезу о факторах риска.
Экологические, или корреляционные, исследования также часто становятся началом эпидемиологического исследования. В экологическом исследовании объектами анализа бывают популяции или группы людей, живущих в одном
округе, населенном пункте, микрорайоне, а не отдельные лица. Показатели заболеваемости популяций, подверженных воздействию определенных факторов, сравнивают с контрольными данными. Хотя экологические исследования просты в исполнении, и поэтому многих привлекают их результаты, во многих случаях полученные данные трудно интерпретировать, поскольку редко удается их объяснить. В экологических исследованиях обычно используют сведения, собираемые для других целей. При этом информация о различных воздействиях и социально-экономических факторах может отсутствовать. К тому же, поскольку единицей анализа в таких исследованиях служит популяция или группа, невозможно проследить индивидуальные связи между воздействием и эффектом. Одно из преимуществ экологических исследований состоит в том, что при их проведении можно опираться на данные о популяциях с широко варьирующими характеристиками.
Неправильные выводы, сделанные на основании экологических данных, могут дать ошибочные результаты. Связь, наблюдаемая между переменными факторами в группе, может отсутствовать на индивидуальном уровне. Довольно часто при проведении подобных исследований используют методы многофакторного анализа, так как изучаемые признаки могут оказаться под влиянием нескольких факторов. Тем не менее экологические исследования нередко служат плодотворным началом более детальных эпидемиологических исследований.
Поперечные (одномоментные) исследования оценивают пораженность какой-либо болезнью, т.е. при этих исследованиях определяют количество случаев болезни в группе населения в определенный период времени. При этом количественное воздействие и эффект определяют одновременно. Причины выявляемых в исследованиях ассоциаций оценить довольно трудно. Главный вопрос заключается в следующем: предшествует воздействие эффекту или следует после него? Поперечные исследования выполняют без особых трудностей и больших затрат. Они весьма полезны при изучении воздействия факторов, служащих постоянными характеристиками для отдельных лиц (например, этническая принадлежность, социально-экономический статус или группа крови). При расследовании вспышек инфекционных заболеваний поперечные исследования - самый целесообразный первый шаг в анализе причин вспышки.
Исследования типа случай-контроль относительно просты в выполнении, экономичны и чаще предпринимаются для анализа причин болезней, особенно редко встречающихся (рис. 1-1). В исследования включают лиц с изучаемой болезнью и контрольную группу, используемую для сравнения в отношении возможной причины болезни. При этом собирают данные за несколько фиксированных моментов времени. Таким образом, исследования типа случай- контроль, в отличие от поперечных, будут продольными. Их также называют ретроспективными, поскольку исследователь прослеживает ход событий в обратном направлении - от развития болезни до возможной причины ее возникновения. При сравнении частоты возникновения болезней можно рассчитать риск воздействия какого-либо фактора. Весьма трудный этап исследования случай-контроль связан с выбором группы контроля и объективной количественной оценкой экспозиции, имевшей место в прошлом. Анализ экспозиции необходимо проводить в отношении как ведущих факторов риска, так и потенциальных смешивающих факторов.
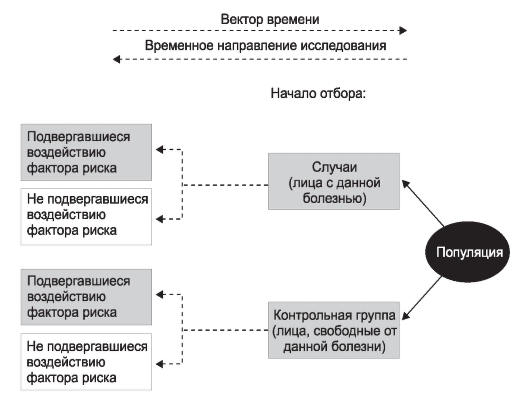
Рис. 1-1. Схема исследования типа случай-контроль
Исследование типа случай-контроль начинают с отбора больных, выборка должна быть репрезентативной в отношении всех больных с данной патологией в определенной популяции. Наибольшие затруднения вызывает составление контрольных групп, поскольку выборка должна отражать распространенность определенного фактора, воздействующего на изучаемую популяцию. Контрольные группы должны быть составлены из тех лиц, которые бы относились к числу больных в случае развития у них рассматриваемой болезни. Это может быть осуществлено путем случайной или направленной выборки из исследуемой группы населения. Для набора группы контроля в ряде случаев используют пациентов с другими заболеваниями. Иногда прибегают к индивидуальному подбору. Для каждого случая отбирают один или несколько контрольных вариантов, сходных по определенным аспектам.
Важный момент исследований типа случай-контроль - это определение начала и продолжительности действия фактора риска на больных и контрольных лиц. Этот момент устанавливают по опросу больного, его родственников или друзей. Для данных целей используют биохимические, иммунологические данные лабораторных исследований и другие показатели.
Основные достоинства метода случай-контроль:
- возможность осуществления в относительно короткие сроки;
- сравнительная дешевизна;
- применимость для изучения редких заболеваний и болезней с длительным латентным периодом;
- возможность изучения нескольких воздействий одновременно.
В то же время эти исследования требуют ретроспективного подхода к их проведению, обычно не позволяют определить частоту заболевания и не пригодны для изучения редких воздействий.
Когортные исследования
Исследования начинают на группе людей (когорте), не пораженных болезнью, распределенных на 2 категории в зависимости от подверженности воздействию фактора, который служит потенциальной причиной болезни (рис. 1-2).
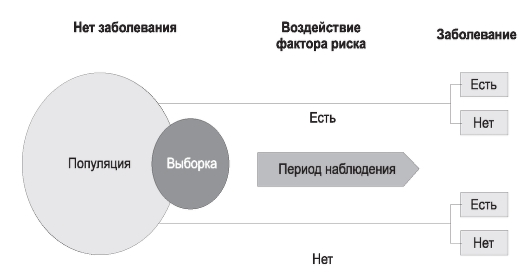
Рис. 1-2. Схема проведения когортного исследования
Когортные исследования называют проспективными, так как они позволяют проследить проявляемость изучаемого фактора на протяжении длительного периода наблюдения. При изучении болезней с длительным латентным периодом это требует больших затрат времени и необходимости большого количества исследуемых лиц. В то же время они могут быть и ретроспективными, с оценкой влияния изучаемого фактора на исторической когорте, т.е. на группе лиц, сформированной на основе информации об экспозиции и заболеваемости, собранной в течение какого-то периода в прошлом.
Ретроспективные когортные исследования обычны при изучении эпидемиологии профессиональных болезней. Группу работников отрасли или предприятия прослеживают через специальные регистры с информацией о случаях заболеваний или смерти. В качестве группы неэкспонированных индивидуумов рассматривают население страны или отдельного региона. Точность такого исследования зависит от полноты регистрации необходимой информации.
Существуют также исследования комбинированного типа, объединяющие характеристики проспективного и ретроспективного исследований.
Когортные исследования полнее информируют о причинах возникновения болезней и позволяют оценить количественно риск их развития (табл. 1-2).
Таблица 1-2. Основные характеристики исследований (когортного, случай-контроль и одномоментного)
Такие исследования достаточно просты, однако масштабны и могут потребовать продолжительного наблюдения, поскольку между воздействием фактора риска и развитием болезни может пройти много времени. Затраты на когортное исследование можно уменьшить, прибегая к дополнительным источникам информации. Поскольку когортные исследования начинают на группе здоровых людей, они позволяют проанализировать несколько эффектов (в отличие от исследований типа случай-контроль). Они служат заменой истинного эпидемиологического эксперимента в тех случаях, когда организация такого эксперимента по каким-либо причинам невозможна. В отличие от метода случай-контроль когортное исследование позволяет определить частоту заболевания; оно пригодно для исследования редких воздействий и дает возможность изучить множественность эффектов одного воздействия (табл. 1-3).
Таблица 1-3. Достоинства и недостатки когортных исследований
Аналитическое исследование обычно носит характер выборочного, при нем обследуют часть населения. Основной принцип формирования выборки - это непредвзятость. Для достижения этой цели формирование изучаемой выборки всегда основывают на принципе случайности.
Существуют индивидуальный, типический, механический и серийный способы выборки.
• При применении индивидуального способа выборки единицы выборочной совокупности включают по жребию или по принципу 1, 3, 5 и т.д.
• Типическая (типологическая) выборка подразумевает разделение всего собираемого материала на какие-либо группы (по определенному признаку). Затем из этих групп проводят случайный отбор единиц наблюдения.
• Механическая выборка подразумевает механическое (без учета какоголибо признака) разделение генеральной совокупности на части, из которых затем отбирают по одной единице наблюдения.
• Серийная (кустовая, гнездовая) выборка включает предварительное разделение генеральной совокупности на серии (гнезда, кусты) с последующим проведением случайного отбора определенных серий (например, детские учреждения, отдельные предприятия и т.д.) и проведением сплошного наблюдения в каждой из них.
Для эпидемиологических исследований на основе информации о малом количестве лиц характерна значительная случайная вариация. Для оценки масштаба исследования, обеспечивающего надежность результатов в различных ситуациях, существуют специальные статистические методы.
Обычно размеры любого исследования ограничивают сугубо практические обстоятельства:
- финансовые затраты;
- временные рамки;
- случаи исследуемого заболевания.
Степень точности результатов выборочного исследования оценивают по критериям их репрезентативности, достоверности, обобщаемости и воспроизводимости.
• Репрезентативность результатов выборочного исследования означает, что они представительны, т.е. правильно отражают характеристику изучаемого признака в генеральной совокупности.
• Достоверность (внутренняя достоверность) отвечает на вопрос, в какой мере полученные средние показатели выборочной группы справедливы в отношении каждого члена (единицы) данной выборки.
• Обобщаемость (внешняя достоверность) показывает, в какой мере результаты данного исследования можно распространить на другие выборочные группы. Внешняя достоверность требует внешнего контроля качества измерений и суждений относительно возможности экстраполяции результатов.
• Воспроизводимость (повторяемость) результата исследования означает вероятность того, что при повторных исследованиях изучаемого явления, сделанных в разное время и на разных территориях, будут получены аналогичные результаты.
Для статистического контроля значимости полученных результатов при выборочном исследовании показателей (или разности двух показателей) вычисляют их стандартную ошибку, или ошибку выборки (среднеквадратичное отклонение), критерий t (критерий Стьюдента, отношение показателя к его стандартной ошибке), критерий однородности F (критерий Фишера), определяют доверительный интервал и доверительные границы и др.
Результаты сравнения заболеваемости в группах, отличающихся по воздействию фактора риска, можно представить в виде нескольких показателей.
• Добавочный (атрибутивный) риск - дополнительная заболеваемость, связанная с воздействием фактора риска. Ее определяют как разность между заболеваемостью лиц, подвергавшихся воздействию фактора риска, и заболеваемостью лиц, не подвергавшихся такому воздействию.
• Относительный риск (коэффициент риска) показывает во сколько раз вероятность заболевания выше у лиц, подвергавшихся воздействию фактора риска, чем у лиц, не подвергавшихся такому воздействию. Его определяют как отношение риска возникновения какой-либо болезни у лиц, подвергающихся воздействию соответствующего фактора, к риску у лиц, не подвергающихся ему. Воздействие фактора риска на группу лиц зависит не только от его силы, но и от распространенности. Для того чтобы оценить фактор риска, необходимо знать, с какой частотой члены рассматриваемой популяции подвергаются его воздействию. Показатель относительного риска более объективно характеризует связь заболеваемости с изучаемым фактором риска, чем показатель абсолютного риска. Он отражает степень связи между воздействием фактора риска и уровнем заболеваемости. Высокий коэффициент риска дает основание с высокой степенью достоверности заподозрить наличие причинной связи между изучаемыми явлениями.
• Популяционный добавочный риск рассчитывают как произведение добавочного риска на распространенность фактора риска в популяции.
Экспериментальные исследования, в отличие от наблюдения, предполагают искусственное воспроизведение явления (его части) или искусственное вмешательство в естественный ход процесса. Искусственное воспроизведение заболеваемости людей в ходе исследований немыслимо. Поэтому под экспери-
ментом в эпидемиологии понимают искусственное вмешательство в процесс за счет устранения гипотетически подозреваемых факторов, вызывающих болезни, а также оценку эффективности какого-либо средства, метода или мероприятия по профилактике или борьбе с данной болезнью. Известны 3 формы экспериментальных исследований:
• рандомизированные контролируемые;
• полевые;
• проводимые на коммунальном уровне.
Рандомизированное контролируемое испытание (или рандомизированное клиническое испытание) - экспериментальное эпидемиологическое исследование, предпринимаемое для оценки новой схемы профилактики или лечения. Представителей какой-либо популяции распределяют методом случайной выборки по группам, обычно называемым группой вмешательства и контрольной группой, и наблюдаемые результаты сравнивают. При этом можно применить двойной слепой метод, при проведении которого ни врачисследователь, ни пациент не знают, получает больной плацебо или лекарственное средство. Согласно современным стандартам ни один новый метод лечения, профилактики или диагностики не может быть признан без обязательной тщательной проверки в ходе рандомизированных контролируемых исследований.
Рандомизация - это случайное распределение пациентов по группам. Случайное распределение пациентов по группам проводится для того, чтобы различия между группами были как можно меньше и эти различия носили случайный, а не преднамеренный характер по всем признакам. Из принципа случайного комплектования групп исходит методология статистического анализа данных - различия групп по определению будут случайными.
Рандомизация проводится разными способами:
- использование таблиц случайных чисел;
- компьютерных программ.
Иногда рандомизацию подменяют псевдорандомизацией. Примеры псевдорандомизации:
- распределение в группы по первой букве имени;
- дате рождения;
- номеру медицинской карты;
- дню недели поступления в клинику и т.д.
Применение псевдорандомизации может повлиять на правильность формирования выборки и, соответственно, на оценку результатов. Главное неблагоприятное следствие псевдорандомизации - это то, что становится известна принадлежность каждого пациента к конкретной группе (основной или контрольной). Таким образом, не выполняется главное условие рандомизации - сокрытие ее результатов. Рандомизация не может выполнить своей главной функции - обеспечения слепого характера исследования. В исследованиях, где меры к сокрытию результатов рандомизации не принимались или сокрытие было недостаточным, оценка эффективности вмешательства завышалась примерно на 25%. Для обеспечения сокрытия принимаются надежные технические меры. Например, после регистрации в испытании пациента, давшего согласие, его данные заносятся в базу данных организатора исследования.
Организация контролируемого экспериментального исследования должна отвечать определенным требованиям, сформулированным ВОЗ.
• Опытная и контрольная группы должны быть равноценны по численности и всем прочим признакам, кроме исследуемого фактора.
• Объем выборки (численность взятого в опыт контингента) должен быть достаточным для того, чтобы в последующем показатели влияния изучаемого фактора были статистически достоверными.
• Участвующие в эксперименте лица не должны быть осведомлены, какая из групп служит опытной, какая - контрольной.
• Применяемые препараты (методы) шифруют (кодируют).
• Объективность проводимого эксперимента должна быть обеспечена четкой стандартизацией способов сбора информации и ее анализом.
Каждое клиническое решение должно базироваться на строго доказанных научных фактах. Клиническое исследование трудно отнести к чистому эксперименту. Объектом исследования служит пациент, который сам определяет свои поступки, а экспериментатором - врач с личным профессиональным опытом, склонностями и подчас ошибочными суждениями. Вот почему в клинических исследованиях всегда заложена опасность систематических ошибок (предвзятости), избежать которых можно лишь следуя четким научным принципам. В наибольшей мере таким принципам отвечают рандомизированные клинические испытания. Клинический опыт и интуиция - необходимые составляющие врачебного искусства. Однако ни один клиницист не может иметь достаточного прямого опыта, чтобы свободно ориентироваться во всем многообразии клинических ситуаций. Индивидуальный врачебный опыт и мнение экспертов не могут иметь достаточной научной основы.
Не отрицая огромной важности личного опыта, научно обоснованная медицинская практика основывается на некоторых положениях.
• В большинстве клинических ситуаций диагноз, прогноз и результаты лечения отдельного больного неопределенны, поэтому их следует рассматривать через вероятности.
• Вероятность исхода для отдельного больного наиболее оптимально оценивается на основании прошлого опыта наблюдений за группами подобных больных.
• В клинические исследования заложены предвзятость и систематические ошибки, поскольку сделаны они экспериментатором (врачом) на объекте наблюдения - человеке (пациенте).
• Любые исследования, включая клинические, подвержены влиянию случайностей. Чтобы избежать заблуждений, клиницисты должны полагаться на наблюдения, основанные на твердых научных принципах, включающих способы уменьшения предвзятости и оценку роли случайности (табл. 1-4).
Специальные методики (метаанализ) обеспечивают возможность суммирования данных, полученных в ходе разных исследований по одной проблеме. В результате такого синтеза можно объективно оценить информацию, основываясь на статистических выкладках и, соответственно, оценить степень полезности различных лечебных, диагностических и профилактических вмешательств. Строгий научный подход к отбору и синтезу информации отличает систематические обзоры от обычных литературных обзоров, страдающих субъективизмом. Авторы подобных обзоров не ставят своей целью анализ и критический разбор всех исследований по проблеме, а скорее, наоборот, подбирают литературные источники таким образом, чтобы подтвердить или опровергнуть определенную точку зрения.
Таблица 1-4. Оптимальные методы исследований применительно к разным клиническим вопросам
К полевым испытаниям, в отличие от клинических, привлекают людей без клинически выраженных заболеваний, но находящихся, как считается, под угрозой. При этом данные собирают в полевых условиях, т.е. среди населения, не находящегося в учреждениях здравоохранения. Такие исследования часто требуют огромных масштабов и финансовых средств. Научные основы контролируемых эпидемиологических экспериментов хорошо разработаны при оценке потенциальной эффективности вакцин. Они служат общими для любых средств профилактики индивидуального применения. При оценке потенциальной эффективности мероприятий, а также дезинфекционных или иных средств, направленных на прекращение передачи инфекции, необходима кустовая выборка. Эффективность вмешательства оценивают по сравнению результатов экспериментальной и контрольной групп.
Другим примером эксперимента служат профилактические мероприятия, проводимые санитарно-эпидемиологической службой. При их осуществлении контрольную группу не выделяют. Эффективность проводимых мероприятий оценивают по наблюдениям и сравнениям с ситуацией в период времени, предшествующий вмешательству в эпидемический процесс.
Ценную информацию можно получить при исследовании материалов естественных экспериментов. Выводы о различных чрезвычайных воздействиях, приводящих к массовой заболеваемости, основаны на анализе и построении заключений об их природе.
Примером служат чрезвычайные происшествия:
- серьезные вспышки заболеваний;
- выбросы в окружающую среду радиоактивных и химических веществ;
- аварии на производстве и т.д.
Ухудшение (улучшение) социально-экономических и экологических условий жизни населения непосредственно влияет на распространенность как инфекционных, так и неинфекционных болезней человека.
Физическое моделирование эпидемического процесса применяют для выяснения различных сторон его развития. Так, распространение возбудите-
лей кишечных инфекций иногда изучают, вводя в организм человека кишечную палочку М-17 или бактериофаг. Это позволяет проследить пути распространения инфекции и источники инфицирования пищевых продуктов, воды и других объектов внешней среды.
Испытания на коммунальном уровне проводят на общинах (больших группах населения, проживающих на определенных территориях), а не на группах специально отобранных лиц. К таким испытаниям целесообразно прибегать для изучения болезней, обусловленных социальной средой. Примером таких состояний служат сердечно-сосудистые заболевания. Недостаток подобных исследований состоит в том, что при их проведении невозможен рандомизированный отбор участников эксперимента. Полученные различия в конце эксперимента оценивают специальными методами, для того чтобы подтвердить их связь с исследуемыми факторами воздействия.
Скрининговые исследования предназначены для выявления людей с заболеваниями в самой ранней их стадии, до обращения за медицинской помощью. Скрининг не служит диагностической процедурой, для диагностики необходимы дополнительные исследования. Людей, имеющих отклонения от нормы, выявленные при скрининговом исследовании, обычно обследуют далее для подтверждения или уточнения предполагаемого диагноза и возможного раннего лечения. Важное требование проведения подобных исследований - применение тестов, быстро воспроизводимых в широком масштабе.
Существуют разные типы скрининговых исследований, с помощью каждого из них преследуют конкретные цели.
• Массовые скрининговые исследования охватывают все население.
• Многопрофильные, или многостадийные, скрининговые исследования предусматривают одномоментное использование разных скрининговых тестов.
• Целенаправленные скрининговые исследования проводят с группой лиц, подверженных специфическим воздействиям (например, рабочих, занятых в литейном производстве свинца), часто применяют в программах охраны окружающей среды и профессиональной гигиены.
• Поисковые, или профилактические, скрининговые исследования распространяются на пациентов, обратившихся к врачу по поводу тех или иных проблем.
Скрининговый тест должен быть дешевым, легко воспроизводимым, приемлемым для населения, надежным и достоверным. Тест считают надежным, если он дает однозначные результаты, достоверным, если он достаточно чувствителен и специфичен, чтобы можно было разделить обследуемых на группы людей, имеющих и не имеющих заболевание. Чувствительность теста определяет количество истинно больных лиц в обследуемой группе населения, выявляемых с его помощью. Специфичность теста определяется количеством истинно здоровых лиц в обследуемой группе населения, выявляемых с его помощью.
Чем чувствительнее тест, тем выше ценность его отрицательного результата, т.е. возрастает уверенность исследователя в том, что отрицательные результаты можно обнаружить только среди здоровых лиц. И наоборот, чем специфичнее тест, тем выше ценность его положительного результата, т.е. тем выше уверенность исследователя в том, что положительные результаты теста обнаруживают только у больных. Наибольшую ценность имеют тесты, обладающие одновременно и высокой чувствительностью, и высокой специфичностью.
Однако такие тесты достаточно редки. Попытки повысить специфичность теста обычно ведут к снижению его чувствительности, а увеличение чувствительности влечет за собой снижение специфичности.
Одна из важных целей большинства эпидемиологических исследований - точная количественная оценка распространенности болезней (или связанных с ними эффектов). Однако такая оценка довольно сложна и существует множество факторов, приводящих к ошибкам. Ошибка может быть либо случайной, либо систематической.
Случайная ошибка - это расхождение, объясняемое исключительно случайностью между результатом наблюдения за выборкой и фактической величиной, присущей всей популяции. Это расхождение приводит к неточности количественной оценки какой-либо ассоциации.
Существует 3 основных источника случайных ошибок:
- индивидуальные биологические различия;
- процесс отбора;
- неточность измерения.
Полностью исключить случайную ошибку невозможно по тем причинам, что возможно исследовать лишь выборку из популяции, где индивидуальных различий избежать нельзя и никакие измерения не бывают абсолютно точными. Случайную ошибку можно уменьшить благодаря тщательной количественной оценке экспозиции и ее эффекта, что максимально повышает точность отдельных количественных оценок. Увеличение масштаба исследований также благоприятно сказывается на результатах. Желаемый масштаб предполагаемого исследования можно определить по стандартной формуле. При этом учитывают соображения материально-технического и финансового обеспечения и находят компромисс между размером выборки и затратами на исследование.
Систематическая ошибка (смещение) возникает в эпидемиологических исследованиях при получении результатов, систематически отличающихся от фактических величин. Существует мнение, что при небольшой систематической ошибке результаты исследования отличаются высокой точностью. Возможные причины систематических ошибок многочисленны и разнообразны. Идентифицировано более 30 типов смещения. Основные из них - смещения в результате отбора и измерения. Очевидным источником ошибок при отборе бывает самоотбор участников исследования, происходящий, если они чувствуют себя нездоровыми либо ощущают особое беспокойство по поводу воздействия того или иного фактора риска. Существенное смещение также наблюдают в тех случаях, когда изучаемые болезни или факторы создают невозможность включения в исследование определенных лиц. Хорошо известен эффект здоровых рабочих. Для выполнения своих обязанностей рабочие должны иметь хорошее здоровье. Некорректно сравнивать состояние здоровья работающего населения и населения в целом, так как работающие лица всегда бывают более здоровыми, чем неработающие.
Смещение в результате измерения возникает в случае неточности отдельных измерений. Источники таких неточностей крайне многочисленны. Например, могут быть неточными измерения биохимических или физиологических показателей в разных лабораториях при исследовании одного и того же показателя. Этот вид смещения можно наблюдать при исследовании опытных и контрольных образцов в разных лабораториях. Поэтому в строго контролируемых опытах желательно проводить исследования в одной лаборатории.
В обычных условиях на организм человека могут одновременно влиять несколько факторов риска разной силы и степени воздействия. Смешивание имеет место в тех случаях, когда эффекты обоих воздействий не разделены, и в результате возникает ошибочный перевес в пользу этиологической роли одной из переменных. Проблемы, чаще всего возникающие по поводу смешивания, заключаются в создании видимости причинно-следственной связи, которой в действительности нет. Необходимо отличать смешивание от модификации эффекта. Модификация эффекта означает, что воздействие изучаемого фактора может быть в отдельных группах (возрастных, половых и т.д.) сильнее, чем в других. Факторы, видоизменяющие характер изучаемой взаимосвязи, называют смешивающими. Они могут усиливать или ослаблять их действие. Например, хорошо известно, что риск развития рака легкого у курильщиков, подверженных воздействию асбеста, примерно в 10 раз превышает соответствующий риск среди некурящих.
Существует несколько методов устранения смешивания (табл. 1-5), которые можно применить на стадии планирования исследования (рандомизация, рестрикция и подбор) или анализа полученных результатов (стратификация, статистическое моделирование).
Таблица 1-5. Методы устранения систематических ошибок
Рандомизация - идеальный метод, обеспечивающий равномерное распределение потенциальных смешивающих факторов по сопоставляемым
группам. Чтобы избежать случайного неравномерного распределения таких переменных, объем выборки должен быть достаточно большим. Метод рестрикции (удаления) применяют для ограничения исследования лицами, имеющими определенные характеристики, т.е. устраняют возможное воздействие других факторов. При использовании метода подбора для устранения смешивания участников исследования выбирают таким образом, чтобы было обеспечено равномерное распределение потенциальных смешивающих переменных в двух сопоставляемых группах. Этот метод нашел широкое применение при исследованиях типа случай-контроль. Он требует больших финансовых затрат и много времени, но представляет особую ценность, так как позволяет устранить индивидуальные несоответствия в сравниваемых группах.
В крупных исследованиях устранение смешивающего эффекта лучше проводить на стадии анализа, а не планирования. Для этого применяют метод, известный как стратификация, предусматривающий количественную оценку степени ассоциаций по четко определенным и однородным категориям (слоям) смешивающей переменной. Если смешивающим фактором служит возраст, то результаты исследования можно оценивать по группам с определенным возрастным диапазоном (10 или 20 лет и т.д.). При анализе одновременного влияния на изучаемые объекты нескольких факторов применяют методы статистического моделирования.
Проведение любого эпидемиологического исследования предполагает следующие этапы:
- формулирование цели;
- организацию исследования;
- сбор и анализ собранной информации;
- заключение и выводы по результатам исследования. Формулирование цели исследования - один из самых трудных разделов
работы, основанный на оценке сложившейся ситуации и изучении данных литературы. На этом этапе выдвигают рабочую гипотезу о факторах риска и возможных причинно-следственных связях.
Организация исследования предполагает составление программы, плана исследования и его содержания, определение объекта и единицы исследования, объема и сроков проведения, сил и средств, оформления в виде соответствующих документов и доведения до сведения исполнителей.
Крайне ответственные моменты - сбор и группировка необходимой для исследования информации, оценка ее достоверности и полноты, а также их проверка. Недостоверность данных может быть вызвана многими причинами: неполными выявлением и учетом больных, ошибками в диагностике и регистрации, фиктивными сведениями и др. Для обеспечения возможности анализа собранных материалов их группируют и сводят в таблицы, представляют в различном графическом отображении. Группировка дает возможность показать структуру совокупности, выделить основные типы и формы явления и выявить взаимосвязь между ними. Группировку можно проводить по качественным (типологическим, атрибутивным) или количественным признакам. Включение сгруппированных данных в таблицы называют статистической сводкой. Графические изображения помогают наглядно представить статистические показатели, выявить тенденцию развития, характер соотношений, особенности пространственного распределения явлений. Собранную и сгруп-
пированную информацию анализируют с использованием арсенала статистических и логических приемов, а также методов машинной обработки.
Заключения и выводы должны быть научно обоснованными и вытекать из проведенных исследований. На данном этапе подтверждают или исключают выдвинутые гипотезы, формулируют диагноз, строят прогнозы, оценивают эффективность программ профилактики.
Общие принципы проведения медико-биологических научных исследований изложены в Хельсинкской декларации и других нормативных документах. В них предписано соблюдение основных принципов медицинской этики. В исследованиях участвуют лица, давшие свободное и добровольное согласие. При этом за ними остается право отказаться от участия в исследовании в любое время. Организаторы исследований должны уважать право человека на личную тайну и соблюдать конфиденциальность. Они обязаны информировать население о том, что и почему они намерены делать, а также сообщать результаты исследований и их значение участникам эксперимента. Согласие на участие в исследовании должно быть не только свободным, но и информированным. В статье 21 Конституции РФ сказано: «Никто не может быть без добровольного согласия подвергнут медицинским, научным и иным опытам».
УЧЕНИЕ ОБ ЭПИДЕМИЧЕСКОМ ПРОЦЕССЕ
Происхождение инфекционных болезней и их классификация
Инфекция (инфекционный процесс) - это взаимодействие возбудителя заболевания с организмом человека или животного, проявляющееся болезнью либо носительством. Основное и важное проявление инфекционного процесса - инфекционная болезнь, которая клинически проявляется нарушением нормальной жизнедеятельности человека вследствие морфологических и функциональных повреждений, вызванных проникновением и размножением в его организме возбудителя заболевания.
Эволюция возбудителей инфекционных поражений человека проходила тремя основными путями.
• Представители 1-й группы достались в наследство от обезьяноподобных предков.
• Микроорганизмы 2-й группы произошли от непатогенных предшественников.
• Микроорганизмы 3-й группы были первичными патогенами синантропных и диких животных, но эволюционно адаптировались к обитанию в организме человека.
Принято считать, что предки большинства возбудителей заразных болезней человека - свободно живущие сапрофитные виды. Доказательством этому служит тот факт, что большинство патогенных микроорганизмов (исключая облигатных паразитов) частично сохранило способность некоторое время жить и размножаться вне организма-хозяина.
Инфекционные болезни возникают при внедрении в организм специфического возбудителя, способного, как всякий живой микроорганизм, сохра-
няться только при непрерывном размножении. Возбудитель существует лишь при перемещении и смене хозяев. В жизненном цикле возбудителей инфекционных болезней наблюдают смену среды обитания. С точки зрения экологии возбудителя и эпидемиологии заболевания среды неравноценны. Наибольшее значение имеет та среда обитания, без которой возбудитель не может существовать как биологический вид. Она известна как специфическая, главная среда обитания, или резервуар. Резервуар инфекции - это совокупность биотических и абиотических объектов, являющихся средой естественной жизнедеятельности паразитического вида и обеспечивающих существование его в природе.
Резервуаром инфекции может служить:
- человек;
- млекопитающие;
- членистоногие;
- растения;
- почва и иные субстраты (или их комбинация).
В них инфекционный агент живет и размножается. Резервуар возбудителя в природе характеризуется совокупностью факторов, обеспечивающих сохранение микроорганизмов как биологического вида не только путем циркуляции среди хозяев (популяций человека, популяции животных), но и путем резервации в межэпидемические или межэпизоотические периоды.
В зависимости от типа резервуара микроорганизмов вызываемые ими инфекционные болезни делят на антропонозы, зоонозы и сапронозы.
• Резервуар возбудителей антропонозов - человеческая популяция. Существование антропонозов обеспечивает непрерывная передача возбудителя от человека к человеку. Животные к возбудителям антропонозов, как правило, не восприимчивы. Характерная черта антропонозов - узкая видовая специализация как возбудителя, так и хозяина инфекции, способная возрастать в ходе сопряженной эволюции.
• Резервуар возбудителей зоонозов - популяции определенных видов животных. Например, чумная палочка циркулирует в природе благодаря существованию эпизоотий среди различных видов грызунов (крыс, сурков, сусликов, тарбаганов, песчанок и др.). Возбудители бруцеллеза существуют в природе благодаря распространению инфекции среди мелкого, крупного рогатого скота и свиней. Возбудители зоонозов способны поражать очень большое число позвоночных, в то же время они являются истинными паразитами для сравнительно небольшого количества видов (непосредственных их хранителей). Так, естественное носительство возбудителей туляремии обнаружено у 64 видов позвоночных, а к возбудителям бруцеллеза оказалось восприимчиво 40 видов диких животных. Высокая экологическая пластичность позволяет возбудителям иметь разных хозяев и легко допускает их смену. Возбудители зоонозов способны в ряде случаев поражать человека. Однако сам человек играет случайную роль в процессе циркуляции и резервации возбудителя, не становясь обязательным условием его существования в природе, т.е. служит биологическим тупиком. В некоторых болезнях человек может оказаться источником инфекции. В результате может возникнуть эпидемическая вспышка с передачей возбудителя от человека к человеку (например, при легочной чуме, желтой лихорадке, лейшманиозах, сонной болезни).
• Резервуар возбудителей сапронозов - внешняя среда. Возбудители сапронозов обитают преимущественно в почве или воде (почвенные и водные сапронозы). Типичные почвенные сапронозы - подкожные микозы (или болезни имплантации), их возбудители попадают в организм человека при различных травмах. К водным сапронозам относят легионеллез, так как естественная среда обитания легионелл - теплые водоемы, где бактерии накапливаются в амебах и водорослях. Они также могут колонизировать резервуары для воды, конденсат кондиционеров и др. Возбудители зоофильных сапронозов (лептоспирозов, псевдотуберкулеза), помимо сапрофитного существования, ведут паразитический образ жизни, причем их связи с животными в той или иной мере случайны. Сапронозные инфекции, будучи самой древней в эволюционном плане группой инфекций, характеризуются отсутствием какой-либо специализации возбудителя к человеку.
Попытки создать рациональную классификацию инфекционных болезней предпринимали давно, при этом широко использовали самые разные подходы и классификационные признаки. В руководстве по МКБ и связанных с заболеваниями проблемам здоровья населения (10-й пересмотр), принятой 43-й Всемирной ассамблеей здравоохранения (1992), выделен 1-й класс заболеваний - «Некоторые инфекционные и паразитарные болезни». В этот класс включен даже неполный перечень острозаразных болезней, а многие инфекционные болезни разбросаны по другим классам классификации. Нозологические формы в этих разделах сгруппированы в зависимости от ведущего синдрома или локализации патологического процесса. Например, многие острые респираторные заболевания, в том числе грипп и другие инфекционные заболевания легких, включены в раздел «Болезни органов дыхания», а такие инфекции, как менингиты, энцефалиты, миелиты, энцефаломиелиты и т.п., составляют подраздел «Воспалительные болезни центральной нервной системы», входящий в раздел «Болезни центральной нервной системы и органов чувств». Указанные моменты затрудняют реальную оценку роли инфекционных заболеваний в современном мире. Это приводит к неправильной стратегии профилактики и тактике лечения, недооценке роли этиотропного противомикробного лечения и мер предотвращения заражения при многих соматических болезнях. Сопоставление доли инфекционных и паразитарных болезней, зарегистрированных как инфекции и заболевания, отнесенные к другим классам болезней, в странах Европы показало, что во всех без исключения странах доля инфекционных заболеваний, учтенных не как инфекционные, значительно превосходит количество зарегистрированных заболеваний в разделе «Инфекционные и паразитарные болезни». Проблема инфекционных и паразитарных болезней наиболее остро стоит в развивающихся странах, но она остается достаточно важной и в странах Западной Европы и Северной Америки. Согласно мнению экспертов ВОЗ, на долю инфекционных и паразитарных болезней в этих странах приходится 50-60% всей заболеваемости населения. Исследования, проведенные в РФ, свидетельствуют о высокой доле инфекционных болезней в структуре общей заболеваемости москвичей (36-49%) и об отсутствии тенденции к ее уменьшению в последние годы. По оценкам Всемирного банка, среди четырех ведущих причин ущерба, наносимого человечеству всеми болезнями и травмами, три относят к инфекционным и паразитарным болезням (диареи,
кишечные гельминтозы и туберкулез). Человечеству еще очень далеко до победы над инфекционными и паразитарными болезнями, остающимися важнейшей причиной гибели людей на Земле.
Впервые последовательно выдержанную классификацию инфекционных болезней, основанную на едином признаке (локализация возбудителя в организме), предложил Л.В. Громашевский. Он считал, что рациональная классификация инфекционных болезней служит не только высшим обобщением достижений науки, но и теоретическим ключом для планирования системы эпидемиологического надзора за инфекционными болезнями вплоть до их искоренения. В соответствии с основной локализацией в организме, определяющей механизм передачи инфекции, все инфекционные болезни Л.В. Громашевский разделил на 4 группы:
- кишечные инфекции;
- инфекции дыхательных путей;
- кровяные инфекции;
- инфекции наружных покровов.
Для практических нужд первоочередное значение имеют и такие не менее важные показатели, как характеристика основных резервуаров возбудителей инфекции (человек, животное, абиотическая среда) и закономерности передачи возбудителей людям от этих резервуаров. Действительно, локализация возбудителя в организме может быть множественной. Для зоонозных инфекций характерно несколько механизмов передачи, причем определить главный из них порой бывает очень сложно. Многие сапронозы вообще не имеют закономерного механизма передачи инфекции. Человек и теплокровное животное становятся биологическим тупиком для возбудителя, поэтому закономерной цепной передачи его от особи к особи не существует. С эпидемиологических позиций данный класс инфекций целесообразно разделить по природным резервуарам (основной среде обитания) возбудителей, определяющим специфику эпидемического проявления разных сапронозных инфекций.
Что касается сапронозов, то они стоят особняком как по экологии возбудителей, так и по эпидемиологическим закономерностям. Средой обитания (резервуаром) этих возбудителей в природе служат почва, водоемы, растения и пр. Закономерного механизма передачи возбудителей от одного заболевшего человека другому нет. Наряду с истинными сапронозами, чьи возбудители не нуждаются в животном (человеческом) организме для своего существования, есть переходная группа инфекций, возбудители которых закономерно обитают как во внешней среде, так и в организме теплокровных. По предложению группы экспертов ВОЗ (1969) их принято называть сапрозоонозами. Качественные различия этих классов столь значительны, что требуют в каждом случае специфических критериев внутренней классификации. Эти критерии не могут быть едиными для антропонозов, зоонозов и сапронозов.
На современном этапе развития эпидемиологической науки наиболее рациональна классификация, предложенная Б.Л. Черкасским (1994). Она отражает не только специфику резервуара возбудителей, но и особенности передачи патогенных микроорганизмов человеку из этих резервуаров (табл. 1-6). Только сочетание экологических и эпидемиологических признаков способно отразить эпидемиологическую специфику каждой инфекционной (паразитарной) болезни.
Таблица 1-6. Эпидемиологическая классификация инфекционных (паразитарных) болезней человека
Продолжение табл. 1-6
Продолжение табл. 1-6
Примечание.
ВГА - вирусный гепатит А. ВГЕ - вирусный гепатит Е. PC - респираторно-синцитиальный.
Определения понятия «эпидемический процесс»
Основоположник учения об эпидемическом процессе - Л.В. Громашевский, впервые детально разработавший теорию общей эпидемиологии, понятие об источнике инфекции, механизме передачи и движущих силах эпидемии. По определению Л.В. Громашевского, существование эпидемического процесса обусловливает чередование пребывания возбудителя в организме хозяина с выходом его во внешнюю среду. Таким образом, эпидемический процесс состоит из 3 элементов:
- инфицированного организма человека или животного, ставшего источником инфекции;
- различных элементов внешней среды, обеспечивающих перенос возбудителя или факторов передачи заразного начала;
- восприимчивого организма человека, в свою очередь становящегося источником инфекции для следующего цикла циркуляции возбудителя (рис. 1-3).
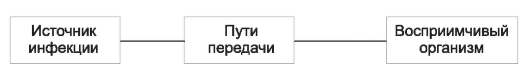
Рис. 1-3. Составные звенья эпидемического процесса
Эти элементы тесно связаны между собой и обеспечивают непрерывность течения эпидемического процесса. При устранении одного из факторов распространение инфекционной болезни прекращается.
Определения эпидемического процесса многочисленны и весьма разнообразны, но их можно свести к общим и частным категориям. К числу первых относят определения, относящиеся к любой инфекции. Например, «процесс взаимодействия между человеческим коллективом и популяцией возбудителя» (Беклемишев В.Н., 1970, Елкин И.И., 1973) или «процесс возникновения и распространения инфекции среди людей» (Беляков В.Д., 1964). Наряду с этими известно определение эпидемического процесса, отражающее его специфику при антропонозах. Эпидемический процесс - непрерывная цепь следующих друг за другом последовательно возникающих одно из другого специфических инфекционных состояний (больные, носители) или эпидемических очагов (Громашевский Л.В., 1941, Елкин И.И., 1960, Жданов В.М., 1961, Безденежных И. С., 1968) (рис. 1-4). Эпидемический очаг - место пребывания источника инфекции с окружающей его территорией в тех пределах, в которых заразное начало способно передаваться от него окружающим лицам, т.е. возможно развитие эпидемического процесса. Пространственные и временные границы эпидемического очага при каждой инфекционной болезни определяют особенности механизма передачи инфекции и конкретные условия природно-социальной среды, обусловливающие возможности и масштабы реализации этого механизма. Однако при зоонозах и сапронозах, когда человек не служит источником инфекции, эпидемический процесс качественно отличен и представляет сумму разрозненных заболеваний, возникающих независимо друг от друга (рис. 1-5). В этих случаях происходит групповое заражение людей от общих источников инфекции (животные, птицы, субстраты внешней среды), так что эпидемический процесс носит не цепной, как при антропонозах,
Рис. 1-4. Эпидемический процесс при антропонозах (Громашевский Л.В., 1965)
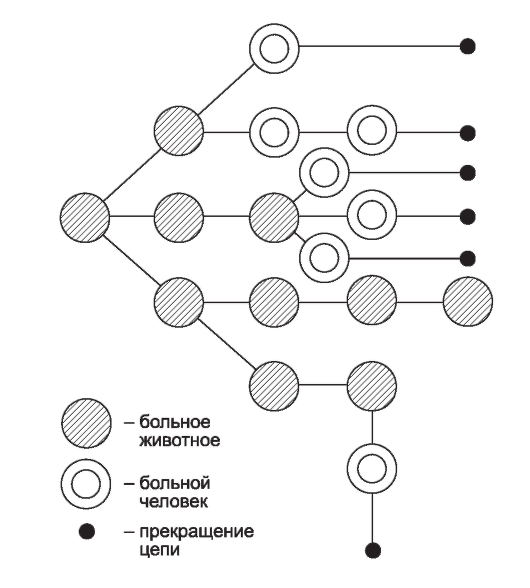
Рис. 1-5. Эпидемический процесс при зоонозах
а веерообразный характер (рис. 1-6). При этом отдельные заражения (группы заражений) от одного источника могут быть разделены значительными отрезками времени, включая длительные межэпидемические периоды, так что эпидемический процесс в той или иной мере дискретен.
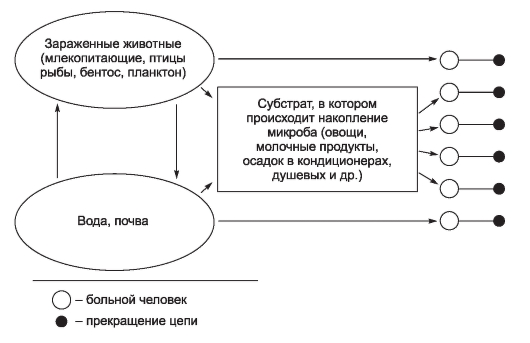
Рис. 1-6. Эпидемический процесс при сапронозах
Определение эпидемического процесса должно характеризовать всю совокупность определяемого явления, а не только его часть. Одно из последних общих определений эпидемического процесса, одинаково справедливое для антропонозов, зоонозов и сапронозов, - это процесс взаимодействия возбудителя-паразита и организма человека на популяционном уровне, проявляющийся при определенных социальных и природных условиях единичными и (или) множественными заболеваниями, а также бессимптомными формами инфекций (Беляков В.Д., Яфаев Р.Х., 1989).
Понятие «эпидемический процесс» применимо к распространению не только антропонозов, но и зоонозов с сапронозами, так как биологической основой процесса при этих болезнях служит паразитарная система, т.е. взаимодействие популяции паразита и хозяина, а при трансмиссивных инфекциях - переносчика. Во время такого взаимодействия при любой инфекции (инвазии) происходит взаимное влияние популяций паразита и хозяина, претерпевающих в результате этого взаимную адаптационную изменчивость.
Паразитарная система как биологическая основа эпидемического процесса
Микроорганизмы, населяющие человека или животное, находятся с ним в различных симбиотических отношениях - от взаимовыгодных (мутуализм) до антагонистических (паразитизм). Е.Н. Павловский (1961) определил парази-
тизм как форму отношений между организмами разных видов, из которых один (паразит) использует другого (хозяина) в качестве источника пищи и постоянного или временного места обитания.
В жизненном цикле паразитов обязательны 2 фазы:
- пребывание (размножение) в организме хозяина;
- смена хозяина.
Без 2-й фазы невозможно существование паразитов как биологических видов, поскольку жизнь индивидуального хозяина всегда ограничена. Паразиты обладают генетической информацией и соответствующими системами питания и защиты, позволяющими им использовать организмы других видов (хозяев) и уклоняться от их защитных механизмов. Паразитический образ жизни характерен для патогенных вирусов, микроорганизмов, простейших, гельминтов, грибов, членистоногих.
Организм хозяина тоже содержит генетическую информацию, дающую ему возможность регулировать свои отношения с паразитирующими видами микроорганизмов. Паразит и хозяин составляют эволюционно сформировавшуюся единую паразитарную систему (Беклемишев В.Н., 1970), в которой отношения между партнерами находятся в состоянии запрограммированного подвижного равновесия (Астафьев Б.А. и др., 1993). Взаимодействие паразита и хозяина на популяционном уровне автоматически включает понятие механизма передачи, реализующего 2-ю фазу паразитизма. Форма реализации функционирования паразитарной системы в определенных условиях социальной и природной среды - эпидемический процесс.
По типу паразитизма возбудителей инфекционных болезней можно разделить на 3 большие группы.
• Облигатные паразиты. Единственной средой их обитания всегда служит определенный хозяин. Независимо от путей передачи такие возбудители отличаются выраженной зависимостью от хозяев.
• Факультативные паразиты, помимо организма хозяина, могут циркулировать и во внешней среде.
• Случайные паразиты - возбудители типичных сапронозов. Для них внешняя среда (почва, вода, растительные и другие органические субстраты) служит нормальной и обычной средой обитания.
Такое деление основано преимущественно на присутствии у микроорганизмов факторов (детерминант) патогенности (вирулентности). Полагают, что безусловные патогены располагают всеми факторами патогенности, позволяющими им вызывать болезнь у практически здоровых людей. В то же время условные патогены полным набором патогенности не располагают, вследствие чего способны вызывать инфекцию лишь при определенных условиях (нарушение целостности наружных покровов, недостаточность иммунитета, при попадании в обычно стерильные полости и др.). Патогенность более широкое понятие, чем паразитизм. В определенных условиях заболевания могут вызывать условно патогенные микроорганизмы и случайные паразиты. Важное значение имеет восприимчивость макроорганизма. Как отметил В.Д. Тимаков, «микроорганизм настолько патогенен, насколько ему позволяет организм человека». В 70-80-е годы XX в. по инициативе ВОЗ были разработаны принципы (критерии) определения потенциальной патогенности микроорганизмов, которые используют в биологии и медицине в первую очередь в интересах проведения противоэпидемических мероприятий.
В качестве основных критериев, характеризующих потенциальную патогенность, выделены:
- вирулентность микроорганизмов;
- механизмы и пути их передачи;
- круг хозяев возбудителей;
- наличие и доступность лечебных препаратов, а также средств специфической и экстренной профилактики болезней.
В этом случае используют комплекс биологических, эпидемиологических и социальных критериев.
Известно, что организация любой системы имеет 2 одинаково необходимых аспекта - структурный и функциональный. Согласно этой классификации паразитарные системы могут быть двучленными (возбудитель-носитель, рис. 1-7), трехчленными (возбудитель-переносчик-носитель, рис. 1-8) и многочленными (рис. 1-9).
Рис. 1-7. Двучленная простая паразитарная система (при кори)
Рис. 1-8. Трехчленная простая паразитарная система (при эпидемическом возвратном тифе)
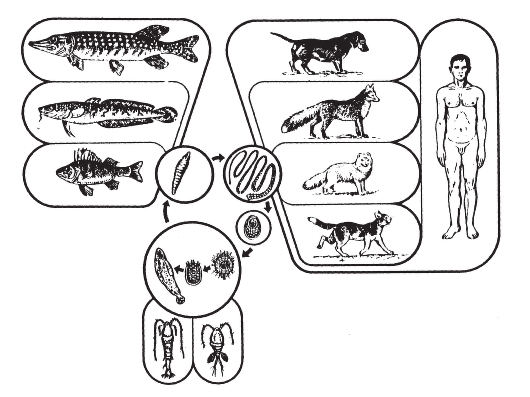
Рис. 1-9. Многочленная паразитарная система (при дифиллоботриозе)
Согласно современным представлениям, известно 3 категории функциональной организации паразитарных систем: замкнутая, полузамкнутая и открытая (табл. 1-7).
Таблица 1-7. Функциональная организация паразитарных систем в зависимости от характера паразитизма микроорганизмов у наземных животных
• Замкнутая паразитарная система характерна для облигатных паразитов, связанных с организмом хозяина (хозяев), будь то теплокровное животное или членистоногое, и не способных к свободному существованию во внешней среде. Замкнутая паразитарная система характеризуется циркуляцией возбудителя только в пределах паразитарной системы и свойственна зоонозам и антропонозам. Ее поддержание обеспечивает непосредственный перенос возбудителя от одного хозяина другому посредством трансмиссивного механизма передачи (желтая лихорадка, лихорадка Денге), при укусах (бешенство), трансфазовой и трансовариальной передачи у членистоногих (японский энцефалит, боррелиозы).
• Полузамкнутая паразитарная система свойственна факультативным паразитам, имеющим 2 типа циркуляции. Один из них связан только с паразитической фазой, когда возбудитель не выходит из паразитарной системы (трансмиссивная передача), и в этом случае паразитарная система функционирует подобно замкнутой. Другой тип циркуляции сопровождается регулярным выходом возбудителя во внешнюю среду и его передачей новому хозяину нетрансмиссивным путем. Специфика полузамкнутой паразитарной системы заключается в сочетании «замкнутой» схемы циркуляции возбудителя внутри паразитарной системы с «открытой» схемой циркуляции, предполагающей выход из паразитической фазы. Полузамкнутая паразитарная система характерна для зоонозов. Например, возбудитель туляремии, входящий в состав двучленной паразитарной системы в пойменно-болотных очагах (передача среди грызунов водным путем) или трехчленной паразитарной системы, - в очагах других типов, где циркуляцию возбудителя поддерживают клещи.
• Открытая паразитарная система свойственна только случайным паразитам теплокровных, поскольку они бывают нормальными обитателями почвы и водоемов, служащих их основной средой обитания. Открытая паразитарная система характерна для сапронозов (клостридиоза, листериоза, легионеллеза). Только спорадически (при случайном попадании в организм теплокровного хозяина) паразит сталкивается с факторами, действующими в любой другой наземной паразитарной системе. Успех взаимодействия паразита с организмом теплокровного хозяина определяет степень его адаптивных возможностей и арсенал средств противодействия защитным механизмам хозяина.
Факторы, обеспечивающие устойчивость паразитарных систем
Устойчивость паразитарных систем очень велика, о чем свидетельствует сам опыт борьбы с инфекционными болезнями. Общеизвестно, что массовая иммунизация людей и домашних животных, а также меры неспецифической профилактики способны свести к минимуму и даже практически ликвидировать заболеваемость в масштабе регионов и контингентов. Однако полная ликвидация возбудителей как видов, а следовательно, и паразитарных систем весьма проблематична и сомнительна даже при антропонозах, не говоря уже о зоонозах или сапронозах. Факторы, обеспечивающие высокую устойчивость паразитарных систем к внешним и внутренним воздействиям, перечислены ниже.
• Гибкость паразитарных систем в структурном отношении, обусловленная экологической пластичностью паразита, т.е. способностью к использованию разных хозяев, замещению одного хозяина другим или изменению по каким-то причинам их видового состава.
• Гетерогенность популяции паразита и хозяина. Гетерогенность возбудителя по признакам вирулентности и антигенной структуры обеспечивает наиболее полную его адаптацию к различным и меняющимся в ходе взаимодействия условиям в организме отдельных хозяев, а по температурной устойчивости и питательным потребностям - к резко отличным от организма абиотическим условиям внешней среды. Гетерогенность популяции хозяина проявляется по признаку его чувствительности к возбудителю.
Например, в популяции основных хозяев возбудителя туляремии, как правило, погибающих от острых инфекций, выявляют субпопуляции, имеющие более низкую чувствительность к микроорганизмам. Для таких особей характерны персистенция возбудителя и длительное его выделение с мочой, что может создать дополнительные возможности для циркуляции и сохранения в очаге.
• Резервация паразита обеспечивает сохранение паразитарной системы в условиях, по каким-либо причинам затрудняющих или временно исключающих активную циркуляцию возбудителя (например, вследствие уменьшения численности хозяев при зоонозных инфекциях или массовой иммунизации населения при некоторых антропонозах).
• Полигостальность паразита обеспечивает устойчивость паразитарных систем за счет интенсивной циркуляции возбудителя в условиях высокой численности и разнообразия хозяев. Полигостальность отличает возбудителей зоонозов и сапронозов, способных использовать в качестве хозяев наиболее многочисленных в конкретной экологической системе животных (грызунов, зоо- и фитопланктон в водоемах и т.п.).
Закономерности формирования эпидемического процесса
К числу основных законов эпидемиологии относится постулат, согласно которому эпидемический процесс возникает и поддерживается только при взаимодействии трех непосредственных элементов - источника инфекции, механизма передачи возбудителя и восприимчивости населения к данному возбудителю. В соответствии с положением, сформулированным Л.В. Громашевским (1965), источник инфекции - это конкретное место пребывания возбудителя в данных условиях. Источник инфекции - первая необходимая предпосылка для возникновения и поддержания эпидемического процесса. «Объект, который служит местом естественного накопления заразного начала и из которого возбудитель может тем или иным путем заражать здоровых людей». Источником инфекции может быть зараженный организм человека (при антропонозах) или животных (при зоонозах). Это положение базируется на признании паразитической природы возбудителей и их эволюционно обусловленной адаптации к паразитированию в организме своего биологического хозяина, служащего для него основной средой обитания. Однако это определение было искусственно сужено оговоркой, что единственное возможное место обитания патогенных микроорганизмов - организм теплокровного хозяина. Применительно к разным группам болезней источник инфекции - объект, служащий местом естественной жизнедеятельности возбудителя, из которого происходит заражение людей, животных или растений (Черкасский Б.Л., 1994).
При антропонозах эпидемиологическая опасность источника инфекции зависит от дозы выделяемого из организма возбудителя, его вирулентности и степени врожденной и приобретенной резистентности организма человека, а характер и сроки контагиозности - от особенностей патогенеза при каждой нозологической форме. Из источников инфекции выделение патогенных микроорганизмов происходит при любой форме течения инфекционного процесса: при ярко выраженном заболевании, стертом и хроническом его течении, а также при различных видах носительства (бессимптомной инфекции) (рис. 1-10). При типичном, а осо-
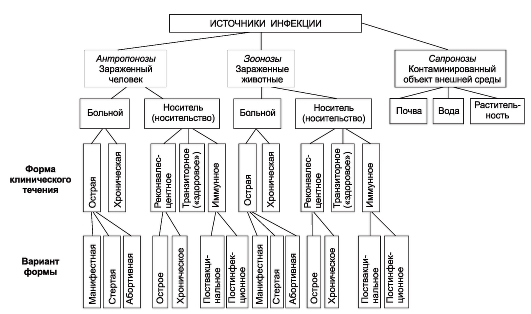
Рис. 1-10. Характеристика источников инфекции
бенно при тяжелом течении инфекционного процесса источник выделяет большее количество микроорганизмов, а иногда и в течение более продолжительного периода времени, чем при стертой или бессимптомной инфекции. При стертой атипичной форме инфекционного процесса источники инфекции могут представлять большую эпидемиологическую опасность. В течение продолжительного времени они могут оставаться невыявленными и беспрепятственно заражать окружающих. С эпидемиологической точки зрения хронические формы болезни следует характеризовать как длительно существующие источники инфекции.
Инфекционным болезням свойственно циклическое течение, т.е. последовательная смена периодов: инкубационного, продромального, разгара болезни, выздоровления (реконвалесценции) либо смерти больного. Как правило, в инкубационном периоде больной не выделяет возбудителей, исключение составляют корь, ВГА, ВГЕ, ВИЧ-инфекция и некоторые другие болезни. В продромальном периоде опасность для окружающих представляют больные корью, коклюшем и ВГА. Контагиозность больных в период разгара инфекции нужно считать общим признаком всех инфекционных болезней. В большинстве случаев именно в этот период количество выделяемых микроорганизмов достигает максимума (дифтерия, брюшной тиф, шигеллезы). При многих инфекциях исчезновение клинических проявлений может наступить раньше освобождения организма от возбудителя (скарлатина, брюшной тиф, холера). В этих случаях человек остается контагиозным и в периоде реконвалесценции. Особый вариант инфекции - носительство патогенных микроорганизмов. Под носительством следует понимать такое состояние организма, при котором выделение во внешнюю среду возбудителей инфекционных заболеваний не сопровождается какими-либо клиническими проявлениями болезни (ВОЗ, 1990). Подавляющее большинство носителей можно разделить на 2 основные группы.
• Первую группу составляют люди, переболевшие каким-либо заболеванием, у которых клиническое выздоровление наступает раньше полного освобождения организма от возбудителя. Подобная категория носителей характерна для холеры, брюшного тифа и паратифов, бактериальной дизентерии, дифтерии, менингококковой инфекции, полиомиелита. Такой род носительства встречают в первые недели у 10-20% переболевших брюшным тифом, 15-25% переболевших дифтерией (носительство переболевших). Постинфекционное носительство, продолжающееся до 2-3 мес, называют острым, более 3 мес - хроническим.
• Кроме носительства, сформировавшегося в связи с развитием болезни, существует здоровое носительство невосприимчивого организма. Так, при менингококковой и стрептококковой инфекциях нарушений состояния здоровья часто не наблюдают, но на слизистой оболочке носоглотки часто обнаруживают возбудителей. Кроме того, выделяют кратковременное (транзиторное) носительство у лиц, иммунизированных вследствие перенесенного ранее заболевания (или вследствие эффективной иммунизации).
Эпидемиологическое значение различных категорий больных (с клинически выраженными и атипичными формами) и носителей зависит не только от особенностей патогенеза болезни, но также от конкретных особенностей обстановки, в которой находится источник инфекции. Например, опасность больного брюшным тифом для окружающих резко возрастает, если он работает на пищевом предприятии или учреждении централизованного водоснабжения, не соблюдая при этом элементарных санитарно-гигиенических правил.
При зоонозах источником инфекции для человека могут быть самые разнообразные больные животные - млекопитающие, птицы, в отдельных случаях рептилии и рыбы. Например, бешенством болеют, а следовательно, могут быть источником вируса волки, лисы, енотовидные собаки, скунсы, при туляремии - зайцы, ондатры и водяные крысы и т.д. Среди сельскохозяйственных и домашних животных при бруцеллезе - коровы, козы и др., при орнитозе - различные птицы, при токсоплазмозе - кошки и т.д. В некоторых случаях человек, заразившийся от животного, сам становится источником инфекции (например, при сальмонеллезах, дерматомикозах, лейшманиозах). Среди млекопитающих особое эпидемиологическое значение имеют грызуны. Служа естественными хранителями многих видов возбудителей, патогенных для человека, грызуны могут жить в непосредственной близости от жилищ людей (полусинантропные) или в самих жилищах (синантропные) и в силу своих экологических особенностей теми или иными путями вступать в контакт с человеком. Эпидемиологическое значение грызунов заключается и в том, что их кровь служит пищей для многих видов кровососущих насекомых (клещей, блох, комаров и москитов). Последние, имея широкий круг хозяев среди позвоночных животных, могут нападать и на человека.
При сапронозах основным источником инфекции являются субстраты внешней среды - почва, вода, растения, реже животные (см. рис. 1-10). Возбудители этих заболеваний, прежде чем вызвать заражение людей, нередко проходят стадию концентрации на объектах окружающей среды для формирования инфицирующей дозы, обеспечивающей преодоление защитных барьеров организма (легионеллы - в испарителях кондиционеров или душевых установках, иерсинии - на гниющих овощах в овощехранилищах и т.п.).
Механизм передачи - вторая необходимая предпосылка для возникновения и поддержания эпидемического процесса.
«Любой паразитический вид, - писал Л.В. Громашевский, - как бы хорошо он не был адаптирован к организму своего биологического хозяина, не может ограничить свою природу только этой формой своего приспособления. Всякий высший организм, служащий хозяином для паразита, рано или поздно погибает. Поэтому ни один паразитический организм не может существовать в природе как вид, если он не сменяет систематически своего индивидуального хозяина». Исходя из изложенного Л.В. Громашевским было предложено понятие механизма передачи. Механизм передачи - эволюционно выработанный способ перемещения возбудителя из одного организма хозяина в другой, обеспечивающий ему поддержание биологического вида (рис. 1-11).
Механизм передачи возбудителя реализуется через 3 стадии:
- стадию выделения из зараженного организма;
- стадию циркуляции во внешней среде;
- стадию внедрения в очередной организм.
Вторая и третья стадии механизма передачи реализуются через факторы передачи.
Факторы передачи - элементы внешней среды, обеспечивающие перенос возбудителя от одного организма к другому. Выделяют 6 таких обобщенных элементов внешней среды:
- воздух;
- пища;
- вода;
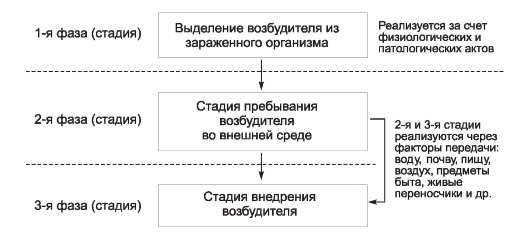
Рис. 1-11. Схема механизма передачи инфекции
- почва;
- предметы обихода, быта и производственной обстановки;
- живые переносчики.
Факторы передачи, на которые возбудитель попадает при реализации первой стадии механизма передачи, называют первичными. Факторы передачи, доставляющие возбудитель в заражающийся организм, называют конечными.
В тех случаях, когда первичный фактор передачи не может выполнять функцию конечного фактора, в механизм передачи включаются промежуточные факторы, доставляющие возбудитель с первичных факторов на конечные.
Пути передачи - это совокупность элементов внешней среды, обеспечивающих перенос возбудителя из одного организма в другой (распространение соответствующей болезни) в конкретных условиях эпидемиологической обстановки.
Способы выведения возбудителя из зараженного организма и внедрения в восприимчивый организм определяет его специфическая локализация в организме хозяина. В свою очередь локализацию определяет механизм передачи возбудителя от зараженного организма в заражающийся, т.е. существует закон соответствия механизма передачи основной (эпидемиологической) локализации возбудителя в организме хозяина. На основе анализа всего разнообразия инфекционных болезней Л.В. Громашевский разделил их на 4 группы в зависимости от локализации возбудителя в организме хозяина и механизма передачи.
Аэрозольный механизм передачи
При локализации возбудителя на слизистых оболочках дыхательных путей его выведение происходит с выдыхаемым воздухом (в том числе при кашле или чихании), где он находится в составе аэрозолей. Установлено, что устойчивость любого аэрозоля, в том числе и бактериального, зависит от нескольких факторов: величины взвешенных частиц, их формы, величины электрического заряда, концентрации. В зависимости от величины частиц аэрозоли разделяют на высокодисперсные (размер частиц 0,5-5 мкм), среднедисперсные (5-25 мкм), низкодисперсные (25-100 мкм), мелкокапельные (100-250 мкм) и крупнокапельные (250-400 мкм). Наиболее контагиозен воздух в зоне, окружающей больного человека примерно на расстоянии до 2,5 м. Дальнейшая судьба капель зависит от их размеров: более крупные оседают, а мелкие могут долго находиться в воздухе во взвешенном состоянии, перемещаться с конвекционными
потоками внутри комнаты и проникать через коридоры и вентиляционные ходы за ее пределы. Заражение восприимчивого организма происходит при вдыхании инфицированного аэрозоля с последующей локализацией возбудителя в дыхательных путях (рис. 1-12). Поэтому такой механизм передачи возбудителей инфекции дыхательных путей называют аэрозольным (воздушнокапельным). Воздушно-капельным путем распространяются вирусы гриппа, кори, ветряной оспы, стрептококки, коклюшная палочка и др.
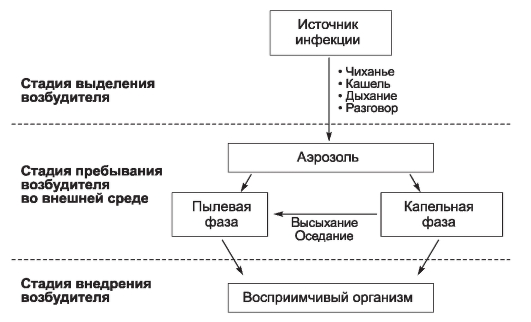
Рис. 1-12. Аэрозольный механизм передачи инфекции
Высохшие капельки, комочки слизи и мокроты, находящиеся на полу и продуктах, могут снова подниматься в воздух. При уборке помещения, движении людей и под влиянием других факторов создается вторичная пылевая фаза аэрозоля. Однако заражение через вдыхаемый воздух с пылью возможно лишь при устойчивости возбудителя к высыханию. Воздушно-пылевую передачу наблюдают при туберкулезе, также она возможна при дифтерии и скарлатине. Важный источник формирования пылевой фазы инфекционного аэрозоля - мокрота (при туберкулезе). Также воздушно-пылевая передача возможна при дополнительной локализации возбудителя в организме, например в корочках на кожных поражениях. В последнем случае большое значение в формировании инфицированной пыли имеет белье. Воздушно-пылевой способ заражения можно наблюдать и при зоонозных инфекциях. Например, при туляремии поселяющиеся в скирдах грызуны загрязняют их своими выделениями; затем во время обмолота в воздух поступает огромное количество пыли, содержащей возбудители заболевания, что может привести к заражению людей, участвующих в обмолоте.
Между капельной и пылевой фазами выделяют промежуточную фазу капельных ядрышек. Капельки после некоторого срока пребывания в воздухе теряют часть своей влаги, естественно испаряющейся с их поверхности. Поверхностный слой капельки уплотняется, бывшая капелька начинает вести себя как твердая частица или пылинка (аэрозоль). Находящиеся в таком состоянии частицы принято называть ядрышками. В центре ядрышка сохраняется
значительная степень влажности, обеспечивающей сохранение более устойчивых возбудителей (дифтерийной палочки, стрептококков, стафилококков). Фекально-оральный механизм передачи
Специфическая локализация возбудителя в кишечнике определяет его выведение из зараженного организма с испражнениями. В дальнейшем он может проникнуть в восприимчивый организм с загрязненной водой или пищей, после чего микроорганизм колонизирует ЖКТ. Поскольку входными воротами для подобных возбудителей служит рот, то такой механизм передачи возбудителей кишечных инфекций называют фекально-оральным. Реализация фекально-орального механизма передачи происходит с помощью конкретных путей передачи (водного, пищевого, контактно-бытового), включающих разнообразные факторы передачи, непосредственно участвующие в переносе возбудителя от его источника к восприимчивым лицам (рис. 1-13).

Рис. 1-13. Фекально-оральный механизм передачи инфекции
Отдельные виды возбудителей с кишечной локализацией характеризуются более узкой органотропностью. Например, холерный вибрион размножается в просвете тонкой кишки, шигеллы - в слизистой оболочке толстой кишки, возбудители брюшного тифа - в лимфатических узлах кишечника с выходом в его просвет через кровь и желчные пути, вирус гепатита А (HAV) - в ткани печени с выходом в просвет кишечника через желчные пути. Энтеровирусы, помимо основной локализации в кишечнике, дополнительно локализуются в верхних дыхательных путях. При одних заболеваниях (холера, шигеллезы) возбудитель остается в пределах кишечника, при других (брюшной тиф, паратифы А и В) микроорганизмы попадают в кровь и диссеминируют по всему организму. В этих случаях первичная локализация возбудителей болезни дополняется их вторичной локализацией и микроорганизмы получают возможность выделять-
ся из организма во внешнюю среду не только через кишечник, но и через другие органы (например, печень, почки). Таким образом, выявлено эпидемиологическое значение не одной, а двух и более локализаций отдельных возбудителей в организме хозяина. Однако, как правило, сохранение биологического вида возбудителя обеспечивает основная локализация возбудителя. В подобных случаях говорят об основной и дополнительных локализациях возбудителя в организме специфического хозяина.
Загрязнение воды патогенными микроорганизмами может происходить многими путями. Наиболее часто - в результате спуска в водоемы неочищенных сточных вод. Особую опасность представляют канализационные стоки инфекционных больниц, ветеринарных лечебниц, а также промышленных предприятий, перерабатывающих животное сырье (мясокомбинатов, боен, кожевенных заводов). Кроме того, фекальное загрязнение водоемов, в частности колодцев, может реализоваться попаданием поверхностных вод в периоды ливневых дождей и таяния снегов. Вода систем централизованного водоснабжения может загрязняться не только в месте ее забора (открытых водоемах), но и в головных сооружениях, а также в водоразводящей периферической сети.
Водоемы также могут быть загрязнены выделениями диких животных, главным образом грызунов или водоплавающих птиц. Таким образом в воду попадают возбудители туляремии, лептоспирозов и кампилобактериозов. Вода, инфицированная патогенными микроорганизмами, становится фактором передачи инфекционных болезней. Причем заболевания, возникающие при водном пути заражения, часто приобретают массовый (эпидемический) характер.
Пищевым продуктам так же, как и воде, принадлежит главная роль в передаче патогенных агентов всех кишечных инфекций (антропонозов и зоонозов). Зараженный пищевой продукт может стать причиной как единичных, так и множественных заболеваний. Заражение пищевых продуктов патогенными микроорганизмами бывает первичным и вторичным.
• Первично зараженными называют продукты, полученные от больного животного.
• Значительно чаще наблюдают вторичное заражение пищевых продуктов, развивающееся после попадания возбудителей в продукты с рук больного человека или носителя, загрязненной посуды или вследствие заноса грызунами. Вторичное заражение пищевых продуктов может произойти в процессе их получения, транспортировки, хранения и реализации, а также во время приготовления пищи.
Реализация контактно-бытового пути передачи в рамках фекальноорального механизма осуществляется посредством обсеменения предметов обихода и труда. Поскольку патогенные микроорганизмы на предметах обычно не размножаются и постепенно погибают, то роль зараженных вещей в их передаче неодинакова. Она зависит от массивности обсеменения, жизнеспособности возбудителей, частоты и характера использования вещей здоровыми людьми. Заметную роль в распространении кишечных инфекций играют посуда, игрушки, белье, полотенца. Эти предметы в случае их совместного использования больными и здоровыми лицами могут быть фактором передачи возбудителя. Сильно загрязненными возбудителями кишечных инфекций могут быть дверные ручки, особенно в туалетах. Патогенные микроорганизмы попадают на них с рук неопрятных больных и носителей, а затем загрязняют руки здоровых людей, создавая возможность их заражения.
Трансмиссивный механизм передачи
Передача возбудителей, циркулирующих в кровотоке больного, реализуется с помощью кровососущих членистоногих. Тип членистоногих (Arthropoda) объединяет более 900 000 видов.
Медицинское значение имеют представители 2 классов:
- Insecta (насекомые);
- Arachnoidae (паукообразные).
Членистоногих, передающих возбудителей инфекционных и инвазионных заболеваний от больных людей или животных здоровым, называют переносчиками. Среди них большое эпидемиологическое значение принадлежит насекомым (вши, блохи, комары, москиты, слепни, мухи-жигалки и др.) и клещам (иксодовые, гамазовые, аргасовые и краснотелковые). Пассивно передавать возбудителей заразных болезней могут и некоторые некровососущие насекомые (мухи, тараканы и др.).
К трансмиссивным инфекциям относятся антропонозы, вызываемые риккетсиями (сыпной тиф), спирохетами (возвратный тиф), простейшими (малярия), и зоонозы (клещевой энцефалит, лихорадка Денге, крымская геморрагическая лихорадка). Возбудители облигатно-трансмиссивных болезней передаются только через переносчиков (малярия, весенне-летний клещевой энцефалит, желтая лихорадка, лейшманиозы, филяриатозы, эпидемический сыпной тиф, японский энцефалит и др.).
Возбудители факультативно-трансмиссивных болезней (туляремия, чума, бруцеллез, сибирская язва, ку-лихорадка и др.) могут передаваться как через переносчиков, так и другими путями:
- аэрозольным;
- контактно-бытовым и т.д.
Передача возбудителей трансмиссивных инфекций включает 3 фазы:
- получение возбудителя переносчиком;
- перенос возбудителя переносчиком;
- введение возбудителя переносчиком реципиенту. Получение возбудителя переносчиком
В организм членистоногого патогенные микроорганизмы могут попадать при кровососании либо при контакте с пораженными участками кожи (кожные формы сибирской язвы и лейшманиоза) или любой зараженной поверхностью, находящейся во внешней среде (мухи).
В зависимости от взаимоотношений переносчика и возбудителя существует 2 способа переноса.
• Механический (неспецифический) перенос - возбудитель не размножается в организме переносчика, а сохраняется лишь ограниченное время на хоботке, конечностях, крыльях и т.д.
• Специфический (биологический) перенос - возбудитель интенсивно размножается или проходит определенные стадии своего развития в организме переносчика.
Введение возбудителя
Перенос возбудителей из организма переносчика в организм человекареципиента реализуется 2 способами.
• Инокуляция - возбудитель активно вводится в организм реципиента со слюной кровососущего переносчика после нарушения целостности кожных покровов реципиента.
• Контаминация - переносчик выделяет возбудителей с экскрементами либо срыгивает на неповрежденную кожу реципиента, затем последний неосознанно втирает микроорганизмы в место укуса переносчика.
Инокуляция и контаминация могут носить специфический или механический характер. Посредством специфической инокуляции комары передают возбудителей малярии; при помощи специфической контаминации вши передают возбудителей эпидемического сыпного тифа, эпидемического возвратного тифа, блохи - чумную палочку.
Примером механической инокуляции может служить передача возбудителей туляремии и сибирской язвы двукрылыми насекомыми (комары, мошки, слепни); механической контаминации - передача возбудителей кишечных инфекций, цист простейших и яиц гельминтов синантропными мухами.
Трансовариальная передача
При трансмиссивных заболеваниях действенна трансовариальная передача, обусловленная способностью возбудителя в ходе циркуляции в организме переносчика проникать с гемолимфой из полости тела в яйцевые клетки. Зараженные яйца не претерпевают каких-либо изменений, продолжают развиваться, сохраняя возбудителей во всех стадиях развития. Так происходит трансовариальная передача возбудителя потомству переносчика. Эпидемиологическая значимость трансовариальной передачи весьма велика. Если она распространяется на несколько поколений переносчиков (т.е. растягивается на несколько лет), то это может привести к длительному существованию природного очага трансмиссивной инфекции. Циркуляция возбудителя в нем поддерживается только за счет трансовариальной передачи возбудителя в популяции переносчика, выполняющей в данном случае и резервуарную функцию по отношению к возбудителю.
Контактный механизм передачи
Возбудители инфекционных болезней, паразитирующие на кожных покровах и слизистых оболочках, передаются контактным прямым или непрямым путем. Прямым путем передаются возбудители гонореи, сифилиса, ВИЧинфекции и других ЗППП. Непрямым путем (через предметы и вещи больного) происходит передача возбудителей трахомы, чесотки, парши и др. К этой же группе относят заболевания, главным образом раневые инфекции (столбняк, газовая гангрена), возбудители которых проникают через поврежденные кожные покровы, но патологический процесс локализуется в глубине тканей. Факторами передачи возбудителей большинства инфекций с контактным механизмом передачи выступают одежда, полотенца, постельное белье, перевязочный материал и т.д. На этих предметах патогенные микроорганизмы не могут длительно сохраняться, поэтому они обладают определенной устойчивостью во внешней среде. Лишь возбудители ЗППП, бешенства и содоку как передающиеся без участия внешней среды обладают крайне низкой устойчивостью. Некоторое своеобразие отличает раневые инфекции, так как обязательное условие развития любой раневой инфекции - это нарушение целостности кожных покровов или слизистых оболочек. Поэтому и эпидемиологические проявления этих инфекций находятся в прямой зависимости от степени развития и характера травматизма среди населения (столбняк).
Разработка теории механизмов передачи стала не только итогом определенного этапа развития науки, но и стимулом к ее дальнейшему развитию. По мере развития микробиологии, всестороннего изучения возбудителей инфекционных болезней и патогенеза вызываемых ими болезней исследователи уточняли те или
иные положения этой теории. В 1950-е годы, помимо сформулированных Л.В. Громашевским четырех основных естественных (горизонтальных) механизмов передачи возбудителя инфекционных болезней, была выделена вертикальная передача возбудителей, под которой подразумевают передачу возбудителя в течение всего пренатального (антенатального, внутриутробного) периода, включающего период развития, протекающий от зачатия до рождения. По многим признакам вертикальная передача принципиально отличается от известных типов механизма передачи. Прежде всего при ней возбудитель передается не просто от человека человеку, а только от беременной плоду. Только при вертикальной передаче формируются врожденные заболевания (болезни пренатального периода, продолжающиеся в постнатальном). Наконец, не известно ни одной инфекционной болезни, передающейся только вертикально. Напротив, информацией о такой передаче дополняют характеристику болезней с известным основным (иным) типом механизма передачи. Все это отличает вертикальную передачу от классических горизонтальных типов механизма передачи. Вероятность вертикальной передачи выше при вирусных инфекциях, имеющих тенденцию к затяжному течению (ВГВ, ВГС, ВГD, ВИЧ-инфекция, ЦМВ-инфекция, герпетическая инфекция), но она возможна и при остро протекающих вирусных, бактериальных и протозойных инфекциях (краснуха, ротавирусная и стафилококковая инфекция, токсоплазмоз). С учетом периодов внутриутробного развития и механизмов заражения, предложенных Н. Sinnecker (1971), выделено 5 вариантов вертикальной передачи возбудителей болезней человека (табл. 1-8).
Таблица 1-8. Типы вертикальной передачи болезней человека (Sinnecker Н., 1971)
Феномен вертикальной передачи определен для различных вирусных инфекций, поражающих людей, животных, птиц, насекомых и членистоногих.
По данным многих авторов, большинство известных вирусов способно преодолевать плацентарный барьер и инфицировать организм плода (ЦМВ, возбудители полиомиелита, оспы, гриппа, лимфоцитарного хориоменингита, орнитоза, вирусы Коксаки, ВПГ и др.). Приблизительно 2/3 передаваемых вертикально микроорганизмов - возбудители антропонозов. Среди них доминируют болезни с аэрозольным механизмом передачи (герпетическая инфекция, ЦМВ-инфекция, ветряная оспа, паротит, корь, краснуха, реовирусная инфекция, пневмоцистная пневмония, инфекционная эритема, микоплазмозы). Среди зоонозов с вертикальной передачей преобладают болезни, возбудители которых проникают в организм человека через ЖКТ (бруцеллез, кампилобактериоз, токсоплазмоз, лимфоцитарный хориоменингит).
Развитие медицины, новых технологий лечения, развертывание сети ЛПУ привели к формированию нового, как бы искусственно созданного, артифициального (от лат. artificium - искусство) пути передачи. Этот тип механизма передачи связан с медицинскими, в первую очередь инвазивными, лечебными и диагностическими процедурами. Артифициальным путем могут передаваться ВБИ. Парентеральное заражение возможно при нарушении санитарнопротивоэпидемического режима в медицинских учреждениях через медицинские инструменты и приборы, при переливании крови, инъекциях и других манипуляциях, сопровождающихся нарушением целостности кожных покровов и слизистых оболочек. Этот путь передачи способствует повышению заболеваемости среди определенных групп населения, особенно среди наркоманов. Иногда возможны случайные заражения необычными путями в научноисследовательских и практических лабораториях, при производстве бактерийных и вирусных препаратов и т.д.
Применительно к зоонозам не следует употреблять тезис о существовании определенного механизма передачи, специфичного для каждой инфекции. При многих природно-очаговых зоонозах множественность механизма передачи встречается достаточно часто. Политропность возбудителей обеспечивает возможность выделения их из организма различными путями, поэтому тип механизма передачи зоонозов можно выявить лишь в ходе эпизоотического процесса. Вместе с тем возбудители зоонозов в организме хозяина локализуются преимущественно в крови. Поэтому наибольшему количеству этих заболеваний свойствен только трансмиссивный (облигатно-трансмиссивный) механизм передачи. С другой стороны, обширная и разнообразная группа факультативно-трансмиссивных инфекций характеризуется несколькими одинаково возможными механизмами передачи (через укусы кровососущих членистоногих, алиментарным путем, через кожные покровы), что лежит в основе функционирования паразитарных систем полузамкнутого типа, предполагающих разные схемы циркуляции возбудителя. В связи с тем что возбудители зоонозов сохраняются за счет пассажа через организм животных, механизм передачи этих возбудителей имеет место лишь при эпизоотическом процессе. В отношении же человека можно говорить лишь о механизме заражения возбудителями зоонозов. Что касается сапронозных инфекций, то закономерного механизма передачи в классическом понимании просто не существует ни среди людей, ни среди животных. Возбудитель инфекции обитает во внешней среде, а заражение теплокровных животных или человека происходит независимо от
общего источника, одновременно служащего фактором передачи, носит эпизодический характер и становится тупиком для возбудителей инфекции.
К примеру, заражение псевдотуберкулезом происходит в результате употребления в пищу инфицированных сырых овощей. Совокупность известных сегодня факторов заставляет признать именно их источниками инфекции в классическом определении. Во-первых, неоднократно установлено регулярное выделение культур Yersinia pseudotuberculosis с только что собранных овощей, а также из почв полей, где эти овощи выращивали. Во-вторых, продемонстрировано возрастание инфицированности овощей в процессе хранения их от осени до весны из-за активного размножения микроорганизмов. В-третьих, при этом показано отсутствие зависимости степени и динамики инфицированности овощей от присутствия и численности грызунов в хранилище. Возможность автономного накопления иерсиний в субстратах внешней среды сегодня не вызывает сомнения.
При широком и повсеместном распространении и постоянном присутствии возбудителя в окружающей человека среде заболеваемость людей и эпидемиологическое проявление инфекции могут закономерно и длительно отсутствовать. При переходе микроорганизмов во внешнюю среду из организма человека или животного и резком изменении условий существования в этой среде патогенные бактерии с помощью различных регуляторных механизмов перестраивают работу своего генетического аппарата, что позволяет им сохранить жизнеспособность. В последние годы появилось достаточно много экспериментальных данных, дающих основание утверждать, что следующая крайняя мера в реакции грамотрицательных бактерий - это переход в состояние анабиоза (спячки), выражающееся во временной потере воспроизводимости бактерии. Они способны длительно существовать во внешней среде в виде клеток со значительно сниженной метаболической активностью, их не обнаруживают традиционными методами лабораторного культивирования на питательных средах. Подобным состояниям покоя с временной потерей воспроизводимости у грамотрицательных бактерий, впервые обнаруженным в лаборатории Р. Коуэлла (Roszak et al., 1984), предложено присвоить название «некультивируемые состояния», а самим бактериям - «некультивируемые формы». Феномен существования жизнеспособных бактерий в некультивируемом состоянии имеет большое значение в инфекционной патологии людей и животных, поскольку установлено, что некультивируемые формы патогенных бактерий сохраняют свои вирулентные свойства.
Поскольку содержание некультивируемых форм в природных образцах весьма незначительно, наиболее перспективным методом их обнаружения служит полимеразная цепная реакция (ПЦР). С помощью ПЦР в настоящее время исследована эпидемическая значимость некультивируемых форм у возбудителей многих сапронозов. Например, доказана способность возбудителя холеры длительно существовать в водоемах эндемичных районов в межэпидемические периоды.
Восприимчивое население - третья предпосылка для возникновения и поддержания эпидемического процесса.
Восприимчивость - способность организма отвечать на внедрение возбудителя рядом специфических патологических реакций. Восприимчивость к инфекционным болезням определяет неодинаковую чувствительность организма разных людей к внедрению различных инфекционных агентов. Она
зависит от состояния организма человека, его возраста, пола, качественной характеристики возбудителя, его дозы и конкретных условий места и времени развития эпидемического процесса.
Восприимчивость принято выражать контагиозным индексом - численным выражением готовности к заболеванию при первичном инфицировании каким-либо определенным возбудителем. Контагиозный индекс показывает степень вероятности заболевания человека после гарантированного заражения. При высоком контагиозном индексе индивидуальная предрасположенность не может оказывать существенного влияния на заболеваемость, при низком индексе заболеваемость больше зависит от предрасположенности человека к заболеванию. Контагиозный индекс выражают десятичной дробью или в процентах. При кори этот показатель приближается к 1 (100%), при дифтерии он составляет 0,2 (20%), при полиомиелите - 0,001-0,03%.
Неоднородность людей по восприимчивости и устойчивости к различным патогенным агентам общеизвестна. Она постоянно проявляется в виде различий в реакции отдельных индивидуумов на воздействие одного и того же агента в одной и той же дозе и при одинаковой длительности воздействия на организм. В подобных случаях возможен ярко выраженный полиморфизм клинических проявлений заболевания - от тяжелейших молниеносных и смертельных форм до легчайших случаев, едва нарушающих общее состояние заболевшего. Например, при холере возможны легкие формы заболевания и бессимптомное носительство, но также и тяжелые состояния, заканчивающиеся летально. При полиомиелите из общего количества заразившихся лишь 1-2% заболевают паралитической формой, у 5-6% наблюдают легкую форму и 92-94% переносят бессимптомную инфекцию.
Для раннего детского возраста характерна пониженная иммунологическая реактивность, обусловленная недостаточным развитием лимфоидной ткани, слабой способностью новорожденных к синтезу иммуноглобулинов, отсутствием плазматических клеток, принимающих участие в синтезе АТ, а также пониженной способностью к воспалительной реакции. Иммунологическую инертность новорожденных учитывают при составлении календаря прививок. В преклонном возрасте иммунологические возможности организма также ослаблены, что обусловлено как снижением общей реактивности организма, так и ослаблением физиологических механизмов, обеспечивающих формирование невосприимчивости.
Естественная восприимчивость - это наследуемое биологическое свойство организма человека. Сущность естественной восприимчивости проявляется в форме закономерных первичных и вторичных патологических и иммунологических состояний и реакций, обусловленных специфическим патогенным действием паразита и физиологической реактивностью зараженного организма, а также видовыми свойствами, присущими человеку. Примерами естественной восприимчивости и невосприимчивости могут служить восприимчивость человека к брюшному тифу, холере, кори, гриппу и полная или частичная невосприимчивость людей к ряду инфекций животных. Для возникновения заболевания в организм должно попасть определенное количество микроорганизмов или их токсинов. Количество микроорганизмов, вызывающее проявление инфекции, - инфицирующая доза (ID). Количество микроорганизмов или токсинов, обусловливающих гибель индивидуума, - летальная доза (LD). Обычно за одну инфицирующую или летальную дозу
принимают количество патогенного начала (микроорганизмов, вирусов, токсинов), вызывающее соответствующий эффект у 50% взятых в опыт животных. В соответствии с этим различают ID50 (доза, приводящая к инфицированию 50% взятых в опыт животных) и LD50 (доза, приводящая к гибели 50% взятых в опыт животных). Величина инфицирующей или летальной дозы зависит от вирулентности микроорганизма и индивидуальной чувствительности макроорганизма, а также условий инфицирования. Например, в опытах на добровольцах установлено, что различные виды шигелл имеют разную инфицирующую дозу. Вирулентные штаммы Shigella dysenteriae вызывают заболевание у взрослых лиц в дозе 10 микробных тел (Levine M. et al., 1973). Минимальная инфицирующая доза Shigella flexneri подсеровара 2a составляет 102 микробных тела. Вирулентность Shigella sonnei еще ниже - минимальная инфицирующая доза составляет 107 микробных тел.
От естественной невосприимчивости следует отличать невосприимчивость, обусловленную иммунными реакциями, развившимися в ответ на внедрение возбудителя в организм, иммунизацию вакцинами либо анатоксинами. Такое состояние известно как активный иммунитет. Активный иммунитет может возникнуть в результате латентной или дробной иммунизации малыми и субинфекционными дозами, не способными вызывать клинически выраженное заболевание. Помимо активного, также выделяют пассивный иммунитет - состояние, развивающееся после введения в организм человека готовых АТ. Пассивный иммунитет также характерен для новорожденных (за счет АТ, полученных от матери).
На течение инфекционного процесса огромное влияние оказывают развивающиеся иммунные реакции и факторы неспецифической резистентности. На фоне приобретенных или врожденных иммунодефицитов непатогенные (точнее, не вызывающие поражения у здорового человека) микроорганизмы (пневмоцисты, токсоплазмы и др.) способны вызывать так называемые оппортунистические инфекции (от англ. opportunity - возможность, удобный случай).
После перенесенных инфекций в большинстве случаев формируется постинфекционный иммунитет, а при введении средств активной иммунизации (вакцин и анатоксинов) - искусственный иммунитет.
При многих инфекционных заболеваниях решающее влияние на течение эпидемического процесса оказывает постинфекционный иммунитет. Прежде всего это относится к заболеваниям, приводящим к формированию стойкого и продолжительного иммунитета. По мнению ВОЗ, вакцинацию можно считать успешной, если не менее чем у 80% лиц в коллективе формируется полноценный иммунитет.
Коллективный иммунитет
Термин определяет способность коллектива противостоять поражающему действию возбудителя инфекции. Иммунологическую структуру населения (коллектива) можно представить, распределив отдельных членов коллектива по уровню восприимчивости к данному возбудителю. Она отражает состояние иммунитета к определенному патогенному агенту, приобретенного в результате перенесенных заболеваний, латентной или активной иммунизации.
В эпидемиологической практике нередко возникает потребность в оценке иммунологической структуры коллектива. Существуют непосредственные
критерии, отражающие состояние специфической иммунологической структуры населения. Некоторые методы (количественные определения АТ, антитоксинов, аллергические кожные пробы и др.) позволяют определить уровень или напряженность, состояние невосприимчивости, т.е. охарактеризовать не только качественную, но и количественную сторону иммунологической структуры коллектива.
Социальные и природные факторы эпидемического процесса
Взаимозависимость элементов эпидемического процесса позволяет рассматривать его как сложное социально-биологическое явление. При этом приоритет в значительной части случаев принадлежит социальным факторам. Социальная среда многообразна по проявлениям и возможностям воздействия на эпидемический процесс. Ее конкретные элементы активируют или тормозят эпидемический процесс, способствуя или препятствуя жизнедеятельности возбудителей инфекций, реализации путей передачи, а также повышают или снижают восприимчивость людей к возбудителю.
Социальные условия, влияющие на развитие эпидемического процесса:
- экономические факторы;
- санитарно-коммунальное благоустройство;
- уровень развития здравоохранения;
- урбанизация;
- особенности питания;
- условия труда и быта;
- национально-религиозные обычаи;
- войны;
- миграция населения;
- стихийные бедствия и др.
В порядке иллюстрации можно рассмотреть влияние ведущих социальных факторов на эпидемический процесс при инфекциях, передающихся разными механизмами передачи (Черкасский Б.Л., 1985).
При инфекциях дыхательных путей к значимым социальным факторам относятся:
- создание крупных городских поселений;
- изменения естественных демографических процессов;
- формирование крупных постоянных (производственных, детских) и временных коллективов;
- удлинение внутригородских транспортных магистралей и увеличение объема внутригородских пассажирских перевозок;
- интенсификация маятниковой миграции населения;
- ускорение передвижения населения из города в город за счет скоростных транспортных средств.
Экологические последствия реализации этих факторов:
- активизация капельного механизма передачи инфекции;
- активизация обмена возбудителями между жителями различных районов города и жителями различных населенных пунктов;
- снижение неспецифической резистентности городского населения к инфекциям.
Все это приводит к следующим изменениям в проявлениях эпидемического процесса:
- сокращение интервалов между периодическими подъемами заболеваемости;
- сдвиг возрастной заболеваемости вправо;
- стирание различий в эпидемиологических особенностях инфекций в крупных городах и мелких населенных пунктах;
- возникновение локальных вспышек в коллективах.
При кишечных инфекциях из социальных факторов значимыми бывают следующие:
- централизация водоснабжения и питания;
- общее благоустройство населенных мест, в том числе централизованное удаление нечистот;
- повышение общей и санитарной культуры населения. Экологические последствия воздействия этих социальных факторов:
- общее улучшение микробиологического качества питьевой воды и пищевых продуктов при сохранении возможности аварий на водопроводной сети, а также возможности централизованного микробного загрязнения пищевых продуктов;
- повышение загрязненности воды открытых водоемов и затруднение процессов ее самоочищения.
Эти разнонаправленные процессы в свою очередь сказываются на эпидемическом процессе в виде снижения значимости водного, пищевого и контактнобытового путей передачи инфекции при возможности локальной активизации составляющих их факторов.
При трансмиссивных инфекциях из социальных факторов урбанизации большую эпидемиологическую значимость приобретают следующие:
- строительство новых и расширение старых городских поселений;
- привлечение горожан к сельскохозяйственным работам. Экологические последствия реализации этих факторов:
- адаптация грызунов и членистоногих к урбанизированной среде и формирование своеобразной городской фауны;
- расширение границ соприкосновения населенных пунктов с природноочаговыми территориями;
- учащение бытовых и производственных контактов городского населения с природой.
Это отражается на эпидемическом процессе в виде образования антропургических очагов инфекции в пределах городской черты и активизации механизма передачи возбудителей. Возрастает также риск заражения городского населения трансмиссивными инфекциями.
Положительные факторы, влияющие на природно-очаговые инфекции (в частности, чуму):
- эпизоотологическое обследование природных очагов с целью определения риска заражения людей;
- вакцинация людей, проживающих в непосредственной близости от природных очагов;
- гигиеническое воспитание и пропаганда здорового образа жизни;
- борьба с носителями и переносчиками инфекции;
- лечение больных.
С другой стороны, неизбежное побочное следствие технического прогресса - это возникновение мест обитания возбудителей инфекционных заболеваний в объектах непосредственного окружения человека. Здесь создаются особые, нередко весьма благоприятные условия существования микроорганизмов - как абиотические (температура, влажность и др.), так и биотические (микрофлора, микрофауна, растительность).
В урбанизированных экологических системах (урбаценозах) возбудители инфекций занимают особое место обитания, часто не свойственное им в природных сообществах (табл. 1-9). На современном уровне знаний, по мнению В.Ю. Литвина (1989), можно выделить несколько основных типов очагов, различающихся условиями существования возбудителей, путями их циркуляции и закономерностями эпидемического проявления инфекций. Техногенные очаги представляют относительно замкнутые системы с автономной циркуляцией занесенных из естественных экологических систем возбудителей инфекций.
В городах водопроводную сеть часто колонизируют многие патогенные и условно-патогенные бактерии - сальмонеллы, шигеллы, энтеротоксигенные кишечные палочки (ЭТКП), вибрионы, клебсиеллы, кампилобактеры, псевдомонады. В душевых установках и системах кондиционирования воздуха обитают легионеллы, термофильные актиномицеты, микобактерии, псевдомонады. Растущее эпидемиологическое значение имеют системы централизованного хранения продуктов общественного питания, где на первое место выходят психрофильные бактерии - иерсинии, листерии, серрации, клебсиеллы и энтеробактеры. Первичное инфицирование овощей иерсиниями может происходить как в городских тепличных хозяйствах, так и на полях выращивания в агрономических центрах, из почвы которых бактерии способны проникать в различные части растений.
Таблица 1-9. Характеристика техногенной очаговости инфекций
По сравнению с природными экологическими системами среда обитания в урбаценозах для патогенных микроорганизмов нередко оказывается более благоприятной. Об этом свидетельствуют несравненно более высокие концентрации возбудителей в кондиционерах и системах охлаждения (легионеллы) или овощехранилищах (иерсинии, листерии) по сравнению с их численностью в почве или природных водоемах. В техногенных очагах (техногенная очаговость) могут формироваться высоковирулентные варианты из достаточно безобидных потенциально патогенных бактерий, широко распространенных в природе, и в этом смысле их можно считать продуктом цивилизации (Прозоровский С.В. и др., 1987).
Ведущие природные факторы эпидемического процесса
Природные факторы - это совокупность абиотических и биотических компонентов внешней среды, оказывающих активизирующее или тормозящее воздействие на эпидемический процесс. Абиотические экологические факторы (температура, инсоляция, радиоактивное излучение, влажность воздуха, состав воды, течение, рельеф местности) - все свойства неживой природы, прямо или косвенно влияющие на паразитарную систему. Биотические экологические факторы - формы воздействия живых существ друг на друга. Каждый организм постоянно испытывает на себе прямое или косвенное влияние других, вступает в связь с представителями как своих, так и других видов - растениями, животными, микроорганизмами. Изменение экологических факторов во времени может происходить с регулярной периодичностью, меняться в связи со временем (например, сезоном), быть нерегулярным или не иметь четкой периодичности (изменения погодных условий в разные годы, явления катастрофического характера - ливни, поднятие грунтовых вод). Также экологические факторы могут действовать на протяжении длительных промежутков времени (например, при похолодании или потеплении климата).
Одним из ведущих экологических факторов, влияющих на эпидемический процесс, можно назвать климат. Под термином «климат» понимают среднее состояние метеорологических явлений на обширных территориях за большой промежуток времени во взаимодействии с земной поверхностью. Степень воздействия климата (температура, влажность, геомагнитные влияния, инсоляция и т.п.) как одного из компонентов географической среды на элементы эпидемического процесса различна.
Особенно выражено влияние экологических факторов при инфекционных болезнях, источником которых бывают животные, а передачу осуществляют переносчики (членистоногие). Полное исчезновение переносчиков, увеличение их активности в определенный сезон (комары, клещи) или уменьшение их количества (вшей - летом, комаров и мух в тропическом климате - в период дождей и т.п.) ярко отражается на степени заражения людей и на ходе эпидемического процесса.
Прямое действие климатических факторов на механизм передачи инфекций обнаруживают при потребности паразита в определенной температуре внешней среды для своего развития. Например, личинки анкилостомид развиваются в почве при температуре не ниже 4-16 °С, плазмодии трехдневной малярии (Plasmodium vivax) в теле комара - при температуре не ниже 16 °С, а
возбудитель тропической малярии (Plasmodium falciparum) - не ниже 17-18 °С. Лишь при этих экологических абиотических условиях почва может стать фактором передачи для анкилостомидоза, а комар - для малярии. Зона распространения некоторых инфекционных болезней ограничена тропическим поясом, отсюда и их название «тропические болезни». Так, хроническая сонная болезнь (гамбийский трипаносомоз) распространена главным образом по побережьям тропических рек в Африке (13°северной широты и 20°южной широты), что обусловлено приспособленностью ее переносчика, мухи цеце (Glossina palpalis), к условиям обитания в этой климатической зоне.
Распространенность желтой лихорадки также строго ограничена, так как ее переносчики - комары родов Aedes (А. aegypti, A. simpsoni, A. africanus) и Haemagogus spegazzini - нормально развиваются при 25-30 °C, причем ночная температура не должна быть ниже 20 °C. В субтропиках (Средняя Азия, Закавказье) регистрируют инфекционные болезни, не встречающиеся в северной умеренной зоне, - амебную дизентерию, лихорадку Денге, флеботомную лихорадку, клещевой возвратный тиф, лейшманиозы.
Действие экологических факторов косвенно реализуется и через изменение инфекционной восприимчивости организма хозяина. Например, известно влияние температуры окружающей среды на характер инфекционного процесса при чуме у грызунов, впадающих в зимнюю спячку, а также изменение чувствительности грызунов к возбудителю туляремии при низких температурах. Экспериментально показано, что температура воздуха, особенно в сочетании с ветром, способна заметно изменить чувствительность больших песчанок к возбудителю чумы, а также темпы репродукции микроорганизмов и рост их численности в организме хозяина.
Длительно господствовало представление об однозначно губительном воздействии на всех паразитов как абиотических, так и биотических (микробная конкуренция, хищничество простейших и т.п.) экологических факторов и невозможности автономного существования возбудителей в окружающей среде (вне организма человека или теплокровных животных).
В настоящее время это предубеждение развеяно многочисленными данными. У патогенных бактерий, способных к обитанию в почвах и водоемах, выявлены психрофильные свойства, холодовые термы, а также реализация прототрофного типа питания. Разные компоненты биотопов способны поддерживать популяции патогенных бактерий в почвенных и водных экологических системах, играя роль их естественных резервуаров. Например, возбудитель холеры может сохраняться в синезеленых водорослях и повышать свою вирулентность при пассаже через простейших, населяющих водоемы. Циркуляция некоторых возбудителей (например, иерсиний) не ограничивается пределами вида популяции хозяина на одном территориальном уровне (к примеру, простейшими): они могут мигрировать и по вертикали - по пищевым цепям сообществ от низших трофических уровней к высшим. Передача возбудителя от низших уровней к высшим, вызывая заражение самых разных организмов, приводит к значительному накоплению биомассы возбудителей и повышает устойчивость бактериальной популяции в окружающей среде.
Наряду с этим отдельные звенья трофических цепей при миграции возбудителей представляют непосредственную эпидемиологическую опасность.
Вмешательство человека во внешнюю среду значительно расширило границы выживания и размножения возбудителя легионеллеза (рис. 1-14). Исполь-
зование различных аппаратов в системе водоснабжения, кондиционирования воздуха и при работе различных гидросооружений может сопровождаться образованием водного аэрозоля, что увеличивает опасность заражения человека легионеллами, если вода заражена ими.
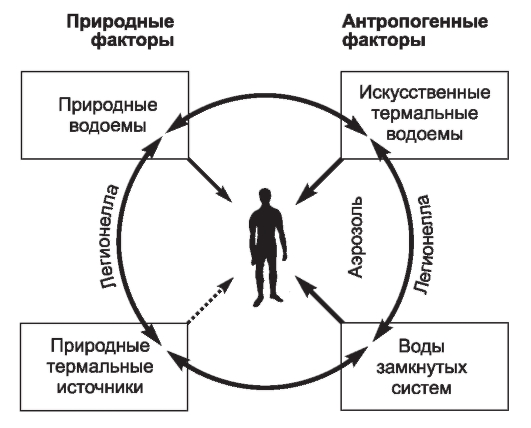
Рис. 1-14. Воздействие легионелл на человека в различных условиях окружающей среды
Развитие учения об эпидемическом процессе в трудах отечественных ученых
Теория природной очаговости
В зависимости от распространения в природе возбудителей инфекционных болезней разделяют на повсеместные (убиквитарные) и эндемичные. Последние регистрируют в определенных территориальных рамках, ограниченных областями распространения источника или переносчиков возбудителей. Иначе такие болезни называют природно-очаговыми. Учение о природной очаговости инфекционных болезней, ставшее неотъемлемой частью медицинской микробиологии, создал Е.Н. Павловский. По мнению Е.Н. Павловского, природный очаг - это участок определенного географического или в известной степени окультуренного ландшафта, в биотопах которого существует биоценоз, т.е. сочетание минимума организмов, находящихся в межвидовых биоценотических связях, за счет которых осуществляется непрерывность перехода возбудителя болезни от больного животного к восприимчивому организму посредством кровососущего переносчика. Природный очаг существует в течение времени непрерывной циркуляции возбудителя между животнымидонорами и реципиентами. Основным критерием объединения заболеваний в природно-очаговые является то, что они возникали в природе, не тронутой или не видоизмененной деятельностью человека (Павловский Е.Н., 1965).
Природные очаги болезни имеют определенную общую структуру, характеризующуюся сочетанием 5 факторов:
- возбудитель болезни;
- животные - доноры возбудителя;
- переносчик (для трансмиссивных инфекций);
- животные - реципиенты возбудителя;
- факторы внешней среды.
Первые 4 компонента в своей совокупности образуют биоценоз определенного вида, отличающийся от биоценоза в обычном зоологическом его понимании тем, что в состав его членов входит и возбудитель болезни. Для подобных случаев предложен особый термин - «биопатоценоз» («патобиоценоз»).
По мнению Е.Н. Павловского, инфекции с природной очаговостью обладают следующими характерными эпидемиологическими особенностями:
- природные резервуары возбудителей среди диких животных (преимущественно грызунов) и птиц, среди которых постоянно существуют эпизоотии;
- распространение возбудителя реализуется через кровососущих членистоногих-переносчиков;
- сезонность заболеваний, обусловленная биологическими циклами животных - природных резервуаров или переносчиков;
- связь с определенной территорией;
- возможность возникновения заболевания человека связана с определенными географическими ландшафтами.
На первом этапе учение Е.Н. Павловского охватывало трансмиссивные инфекции с наземными паразитарными системами замкнутого типа, представленными обязательной триадой возбудитель-переносчик-носитель (рис. 1-15). В последующие годы Е.Н. Павловский и его последователи, во-первых, проводили анализ закономерностей структуры и функционирования природных очагов, путей и схем циркуляции возбудителей, их взаимоотношений с хозяевами и т.п., а во-вторых, проводили описание новых трансмиссивных природно-очаговых болезней.
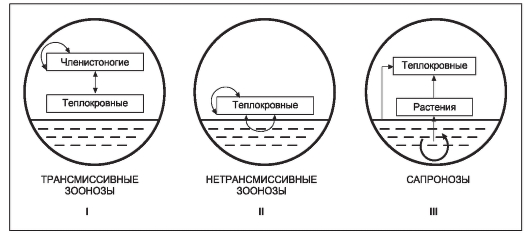
Рис. 1-15. Принципиальная схема циркуляции возбудителей в природных очагах
Второй этап развития учения знаменуется пополнением списка природноочаговых инфекций за счет нетрансмиссивных зоонозов (лептоспироза, эризипелоида, листериоза, бешенства и др.), что привело к значительному расширению не только круга природно-очаговых болезней, но и самого содержания концепции.
Оказалось, что патобиоценоз может включать как 2 компонента паразитарной системы, обеспечивающих циркуляцию возбудителя (теплокровных и членистоногих-переносчиков), так и 1 (лишь теплокровных), причем обе схемы циркуляции можно наблюдать в одном природном очаге. Тем самым было снято первое ограничение - обязательность переносчика как компонента любого природного очага. В общем случае осталось 2 непременных компонента - возбудитель и теплокровный носитель инфекции.
Положения теории природной очаговости можно распространить и на некоторые сапронозы, если резервуаром возбудителей служат абиотические объекты внешней среды. В частности, выделяют почвенные и водные микроорганизмы, естественной экологической системой для которых служит соответствующая среда. Сегодня уже есть немало оснований утверждать, что растения могут быть самостоятельным природным резервуаром многих микроорганизмов (листерий, иерсиний, псевдомонад и др.). Кроме того, при обитании в воде или почве микроорганизмы активно используют для своей жизнедеятельности населяющий их живой мир (различные гидробионты, водоросли и др.). Положения о природной очаговости ряда сапронозов развиты в работах В.И. Терских (1958), Г.П. Сомова (1988), В.Ю. Литвина (1989) и других отечественных ученых.
Сапронозы вносят в концепцию природной очаговости следующие принципиальные положения.
• Единственный и специфический компонент природного очага - популяция возбудителя инфекции.
• Резервуаром возбудителя в природе и источником для человека могут служить почва и вода.
• Формой существования возбудителя в природном очаге может быть не только активная циркуляция, но и автономная резервация в субстратах внешней среды с эпизодическим (случайным) паразитированием в организме разных хозяев. Следовательно, природный очаг сапронозной инфекции - это естественные экологические системы, биоценозы, включающие популяцию возбудителя (Литвин В.Ю., 1989).
Внутренняя регуляция эпидемического процесса
Теория саморегуляции паразитарных систем, разработанная В.Д. Беляковым, акцентирует внимание на внутренних механизмах развития эпидемического процесса, характеризуя явления, свойственные его биологической основе, т.е. паразитарной системе. В соответствии с теорией саморегуляции движущая сила функционирования паразитарной системы эпидемического процесса - взаимообусловленная изменчивость биологических свойств взаимодействующих генотипически и фенотипически гетерогенных популяций паразита и хозяина. Динамику эпидемического процесса во времени теория объясняет фазовой самоперестройкой популяций паразита, происходящей под влиянием изменений в иммунном статусе популяции хозяина. В теории выделены 4 положения, объясняющие эти механизмы: генотипическая и фенотипическая гетерогенность популяций паразита и хозяина по признакам отношения друг к другу; взаимообусловленная изменчивость биологических свойств взаимодействующих популяций; фазовая самоперестройка популяций паразита, определяющая неравномерность развития эпидемического процесса; регулирующая роль социальных и природных условий в фазовых преобразованиях эпидемического процесса. Основные постулаты теории убеждают в ее применимости к инфекциям, отвечающим двум условиям:
• механизм передачи возбудителей должен обеспечивать постоянное массовое распространение возбудителя;
• необходимо формирование иммунитета, способного регулировать взаимодействие популяций паразита и хозяина.
Социально-экологическая концепция
В соответствии с социально-экологической концепцией, разработанной Б.Л. Черкасским, паразитарная система - это один из уровней целостной системы эпидемического процесса. Посредством механизма передачи она связана с природной средой обитания. В совокупности они образуют эпидемиологическую экологическую систему, или экосистемный уровень системы эпидемического процесса. Экосистемный уровень отражает экологию паразита в популяциях биологических хозяев и на объектах окружающей среды, служащих регуляторами жизнедеятельности, гетерогенности и изменчивости структуры популяции паразита. На этом уровне социальные факторы влияют на паразитарную систему извне, играя роль внешних условий ее функционирования.
Эти два условия - предпосылка возникновения и развития эпидемического процесса, т.е. реализации взаимодействия эпидемиологической экологической системы с социальной средой. Например, присутствие природно-очаговой паразитарной системы и населения служит условием (предпосылкой) для возникновения эпидемического процесса.
Эпидемиологическую социально-экологическую систему можно дифференцировать по вертикали на локальную, региональную и глобальную.
• Эпидемический процесс на уровне локальной социально-экологической системы ограничен коллективом - группой лиц, связанных между собой в течение определенного периода времени в хозяйственном, профессиональном, бытовом или ином отношении (детские, семейные коллективы, коллективы предприятий, воинские части), т.е. находящихся в сходных условиях взаимодействия с популяцией возбудителя.
• На уровне региональной социально-экологической системы эпидемический процесс ограничен населением данной административной территории (город, район, область, республика). Она состоит из локальных социально-экологических систем.
• Эпидемический процесс на уровне глобальной социально-экологической системы состоит из региональных эпидемиологических социальноэкологических систем, взаимодействующих с планетарной средой обитания современного сообщества (пандемия).
Социально-экологическая концепция отражает взаимосвязь эпидемического процесса с многообразными природными и социальными условиями жизни общества. Системный подход открывает возможность цельного восприятия как эпидемического процесса, так и системы целенаправленной борьбы и профилактики инфекционных болезней.
Проявления эпидемического процесса
Эндемическая заболеваемость (эндемия) - постоянно регистрируемая на определенной территории заболеваемость конкретными болезнями (в том числе неинфекционными), обусловленная социальными и природными условиями. Экзотическая заболеваемость - заболеваемость болезнями, не свойственными данной местности. Она возникает в результате заноса или завоза
возбудителя с других территорий. Повсеместное распространение по всему земному шару характерно для большинства антропонозных инфекций и ряда зоонозов домашних животных. Территориальная неравномерность распределения заболеваний характерна для зоонозов, резервуаром возбудителя которых служат дикие животные, и ряда антропонозов, зависящих от природных и социальных условий. Территории распространения заболеваний - нозоареалы.
С известной долей условности все инфекционные болезни по особенностям их территориального распространения и типу нозоареала можно объединить в 2 группы - с глобальным и региональным распределением.
• Глобальное распространение характерно для большинства антропонозных инфекций и ряда зоонозов домашних животных.
• Региональное распространение заболеваний свойственно прежде всего природно-очаговым инфекциям.
Зональные нозоареалы - территории распространения болезней человека, эндемичных для вполне определенных зон земного шара. Обычно эти нозоареалы в виде пояса охватывают весь земной шар или большую его часть. Зональное распределение болезней зависит от определенных климатических и ландшафтных зон земного шара. К таким инфекционным болезням относят туляремию, блошиный эндемический тиф, аскаридоз.
В зависимости от интенсивности распространения болезни эпидемический процесс может проявляться в виде спорадической заболеваемости, групповых заболеваний (эпидемических вспышек), эпидемий и пандемий. Принято считать, что главное отличие перечисленных форм заключается в количественной стороне вопроса.
• Единичные, не связанные между собой, неповсеместные и нерегулярные заболевания относят к категории спорадической заболеваемости.
• Групповые заболевания, связанные с одним источником (путями и факторами передачи) инфекции и не выходящие за пределы семьи, коллектива, населенных пунктов, - эпидемическая вспышка.
• Более интенсивное и широкое распространение инфекционной болезни, охватывающее население региона страны или нескольких стран, принято называть эпидемия. Она представляет совокупность эпидемических вспышек, возникающих на больших территориях и наслаивающихся одна на другую. Часто эпидемии разделяют по 4 признакам (временному, территориальному, по интенсивности, механизму развития эпидемического процесса).
◊ По временному признаку выделяют острые (взрывоопасные) и хронические (длительно протекающие) эпидемии. Наиболее типичными острыми эпидемиями бывают эпидемии, развивающиеся при одномоментном заражении. Первый случай заболевания появляется по истечении минимального инкубационного периода болезни, последний - после максимального инкубационного периода болезни. Наибольшее количество заболеваний приходится на средний инкубационный период. Заболевания, возникшие за пределами колебаний инкубационного периода, - результат вторичных заражений.
◊ По территориальному признаку выделяют эпидемии локальные, приуроченные к определенной территории и группе населения, а также распространенные, захватывающие смежные территории и группы населения.
◊ По интенсивности развития эпидемического процесса различают эксплозивные (взрывоопасные) и вяло протекающие эпидемии.
◊ По механизму развития различают 3 группы эпидемий.
- Эпидемии, связанные с веерообразной передачей возбудителя от одного источника или фактора передачи сразу большому количеству людей без последующей передачи возбудителя от заболевшего (зоонозы, сапронозы). Длительность течения этих эпидемий может ограничиваться колебаниями инкубационного периода (от минимума до максимума). Более длительное течение подобных эпидемий происходит, если не устранены условия, приводящие к заражению людей.
- Эпидемии, обусловленные цепной передачей возбудителя от зараженных индивидуумов здоровым (воздушно-капельным путем - при аэрозольных инфекциях, контактно-бытовым - при кишечных).
- Эпидемии, развивающиеся за счет передачи возбудителя от зараженных лиц здоровым через различные факторы (пищу, воду, членистоногих, предметы быта), без непосредственного контакта этих людей.
• Повсеместная эпидемия, интенсивно распространяющаяся во многих странах или даже во всех частях света, - пандемия.
Иногда под спорадической заболеваемостью понимают регулярно наблюдаемый, сложившийся для данной местности уровень заболеваемости, а под эпидемией - заболеваемость, превышающую обычную для данной местности норму.
Для инфекционных болезней характерны колебания уровня заболеваемости в многолетней и годовой (помесячной) динамике.
• Многолетняя динамика определяет эпидемическую тенденцию, цикличность и нерегулярные колебания заболеваемости.
• Годовая динамика включает межсезонный, средний круглогодичный уровень и сезонное повышение заболеваемости.
Инфекционные болезни неодинаково поражают разные социально-возрастные группы населения. Интерпретация этих проявлений зависит от эпидемиологических особенностей болезни. При инфекционных болезнях с активно действующим аэрозольным механизмом передачи основное значение имеет иммунологический фактор, болеют ими преимущественно дети раннего возраста, посещающие организованные коллективы. Зоонозными инфекциями чаще заражаются взрослые люди, в силу своей профессиональной деятельности ухаживающие за животными или занимающиеся переработкой животного сырья. В то же время некоторые кишечные инфекции распространены среди определенных возрастных и профессиональных групп населения, связанных с возможностью заражения через пищу или воду.
СОДЕРЖАНИЕ ПРОТИВОЭПИДЕМИЧЕСКОЙ
ДЕЯТЕЛЬНОСТИ И ОСНОВЫ ЕЕ ОРГАНИЗАЦИИ
Обеспечение санитарно-эпидемиологического благополучия населения по инфекционным болезням осуществляют специалисты разных служб. При этом не последнее место отводят лечебной службе. Врач любой специальности может столкнуться с инфекционной болезнью, причем первичные мероприятия по недопущению дальнейшего распространения болезни (мероприятия в эпидемическом очаге) проводит именно лечащий врач, выявляющий больного и устанавливающий первичный диагноз. Участковые врачи (семейные врачи)
должны хорошо разбираться не только в вопросах диагностики инфекционных болезней, но и в особенностях их эпидемиологии, так как правильное ознакомление с эпидемиологическим анамнезом помогает врачу распознать заболевание в наиболее ранние периоды его возникновения, иногда даже до проявления типичных клинических признаков.
Профилактические и противоэпидемические мероприятия
Противоэпидемические мероприятия можно определить как совокупность обоснованных на данном этапе развития науки рекомендаций, обеспечивающих предупреждение инфекционных заболеваний среди отдельных групп населения, снижение заболеваемости совокупного населения и ликвидацию отдельных инфекций. Противоэпидемические мероприятия проводят при возникновении (выявлении) инфекционной болезни, профилактические - постоянно, независимо от наличия или отсутствия инфекционного больного. Основу профилактики инфекционных болезней в масштабе страны составляют повышение материального благосостояния народа, обеспечение населения благоустроенным жильем, квалифицированной и доступной медицинской помощью, развитие культуры и т.д.
Медицинские аспекты профилактики инфекционных болезней:
- систематический санитарный контроль за водоснабжением населения;
- санитарный и бактериологический контроль за качеством пищевых продуктов, санитарным состоянием предприятий пищевой промышленности и объектов общественного питания, торговли и детских учреждений;
- проведение плановых дезинфекционных, дезинсекционных и дератизационных мероприятий;
- плановая специфическая профилактика среди населения;
- осуществление мер по санитарной охране границ с целью предупреждения заноса на территорию страны инфекционных болезней из-за рубежа и др.
Основы организации противоэпидемической работы
Организационная структура системы противоэпидемической защиты населения включает медицинские и немедицинские силы и средства. Важную роль в обеспечении противоэпидемического режима играют исполнители коммунального направления. Комплекс различных по характеру и направленности мероприятий, связанных с очисткой населенных пунктов, питанием, водоснабжением и т.д., выполняют государственные органы, учреждения и предприятия при активном участии населения. Исполнение многих противоэпидемических мероприятий осуществляют ЛПУ. Работники лечебной сети (поликлиник, амбулаторий, сельских врачебных участков, фельдшерских пунктов и детских учреждений) обеспечивают раннее выявление эпидемического очага на обслуживаемом ими участке. Без выявления инфекционного заболевания информация о эпидемическом очаге не доступна работникам санитарноэпидемиологической службы, поскольку ее деятельность включает диагностическую (эпидемиологическая диагностика), организационную, методическую
и контрольную функции. Сложность управленческой деятельности санитарноэпидемиологических учреждений (СЭУ) заключается в том, что для борьбы с инфекционными заболеваниями необходимо привлечение сил и средств, не подчиненных службе санитарно-эпидемиологического контроля.
История государственного санитарно-эпидемиологического надзора как системы мер, направленных на предупреждение инфекционных заболеваний и улучшение санитарного состояния страны, началась с Декрета Совета народных комиссаров РСФСР «О санитарных органах Республики» от 15.09.1922 г. С этого времени в стране началось создание сети специализированных санитарно-профилактических учреждений - санитарно-эпидемиологических станций. В 1933 г. произошло разделение функций санитарно-эпидемиологической службы - при сохранении санитарно-эпидемиологических станций была организована Государственная санитарная инспекция, осуществлявшая общее руководство санитарно-эпидемиологической работой, а также предупредительный санитарный надзор. В начале 50-х годов Государственная санитарная инспекция была ликвидирована.
Дальнейшее развитие санитарно-эпидемиологическая служба получила в 1963 г., когда постановлением Совета Министров СССР было утверждено новое Положение о Государственном санитарном надзоре в СССР. В 1991 г. с принятием Закона РСФСР «О санитарно-эпидемиологическом благополучии населения» начался качественно новый этап развития санитарно-эпидемиологической службы. Впервые в истории страны на законодательном уровне было введено правовое регулирование деятельности в сфере обеспечения санитарноэпидемиологического благополучия населения. В 1999 г. был принят новый Федеральный закон «О санитарно-эпидемиологическом благополучии населения», который не только уточнил редакцию основных положений закона 1991 г., но и включил в себя ряд принципиальных положений, которые ранее регулировались подзаконными актами. Санитарно-эпидемиологический надзор стал основным средством достижения санитарно-эпидемиологического благополучия, механизмом, с помощью которого решаются насущные проблемы охраны здоровья населения. Государственная инспекция по торговле, качеству товаров и защите прав потребителей (Госторгинспекция) была образована в 1993 г. при Комитете РФ по торговле, с тех пор многократно переходила из подчинения одного органа другому, а в 2000 г. стала структурным подразделением Министерства экономического развития и торговли РФ. Полномочия Госторгинспекции с 1993 г. не изменялись и включали в себя государственный контроль за соблюдением норм и правил торговли и общественного питания, порядком применения цен по отдельным группам товаров, качеством и безопасностью товаров народного потребления, а также деятельность по искоренению злоупотреблений в торговле, общественном питании и недопущению поступлений на потребительский рынок недоброкачественных товаров.
В соответствии с Указом Президента РФ от 09.03.2004 г. № 314 «О системе и структуре Федеральных органов исполнительной власти» в рамках проводимой в стране административной реформы была создана Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека. Федеральной службе передана часть функций Министерства здравоохранения РФ, Министерства экономического развития и торговли РФ, Министерства по антимонопольной политике РФ. Федеральная служба осуществляет свою деятельность согласно Постановлению Правительства РФ от 06.04.2004 г. № 154
«Вопросы Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека» и на основании Положения, утвержденного Постановлением Правительства РФ от 30.06.2004 г. № 322 «Об утверждении Положения о Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека». Федеральная служба - уполномоченный федеральный орган исполнительной власти, осуществляющий функции по контролю и надзору в сфере обеспечения санитарно-эпидемиологического благополучия населения РФ, защиты прав потребителей на потребительском рынке. Правовые основы деятельности Федеральной службы установлены федеральными законами «О санитарно-эпидемиологическом благополучии населения», «О защите прав потребителей», другими нормативными правовыми актами РФ. Федеральная служба осуществляет свою деятельность непосредственно и через свои территориальные органы во взаимодействии с другими федеральными органами исполнительной власти, органами исполнительной власти субъектов РФ и иными организациями.
В Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека образовано 89 территориальных управлений и 90 центров гигиены и эпидемиологии в субъектах РФ. Специалисты Федеральной службы осуществляют санитарно-карантинный контроль в 285 пунктах пропуска, из них на автомобильном транспорте - 102, в аэропортах - 67, морских портах - 64, речных портах -13, на пограничных железнодорожных станциях -39. Помимо территориальных управлений и центров гигиены и эпидемиологии, в подчинении Федеральной службы находится 28 научно-исследовательских институтов, 14 противочумных станций, более 100 организаций дезинфекционного профиля. Всего в органах и организациях Федеральной службы работает около 110 000 специалистов.
Основные функции Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека:
- организация и осуществление государственного санитарноэпидемиологического надзора, в том числе на железнодорожном транспорте, а также надзора на потребительском рынке и в сфере защиты прав потребителей;
- предупреждение, обнаружение, а также пресечение нарушений законодательства РФ в установленных сферах деятельности до внесения соответствующих изменений в Кодекс РФ об административных правонарушениях;
- осуществление лицензирования видов деятельности в соответствии с компетенцией Службы;
- осуществление санитарно-карантинного контроля в пунктах пропуска через государственную границу РФ;
- осуществление государственной регистрации представляющих потенциальную опасность для человека продукции, объектов;
- осуществление санитарно-эпидемиологических расследований, направленных на установление причин и выявление условий возникновения и распространения инфекционных заболеваний и массовых неинфекционных заболеваний (отравлений);
- организация и осуществление мер, направленных на выявление и устранение влияния вредных и опасных факторов среды обитания на здоровье человека.
Организацию деятельности системы государственного санитарно-эпидемиологического надзора осуществляет Главный государственный санитарный врач РФ, а также главные государственные санитарные врачи субъектов РФ, городов, районов, на транспорте (водном, воздушном), главные государственные санитарные врачи федеральных органов исполнительной власти.
Органы и учреждения государственного санитарно-эпидемиологического надзора во взаимодействии с органами и учреждениями здравоохранения:
- разрабатывают целевые комплексные программы профилактических и оздоровительных мероприятий по важнейшим проблемам охраны здоровья населения;
- принимают совместные решения по вопросам профилактики заболеваний;
- изучают состояние здоровья населения и демографическую ситуацию в связи с воздействием неблагоприятных факторов среды обитания человека;
- организуют и контролируют работу по профилактике инфекционных (паразитарных), профессиональных, массовых неинфекционных заболеваний и отравлений людей.
Мероприятия по обеспечению санитарно-эпидемиологического благополучия в войсках и на специальных объектах Министерства обороны, Министерства путей сообщения, Министерства внутренних дел, органов государственной безопасности осуществляют специальные службы этих министерств и ведомств.
В системе борьбы с инфекционными болезнями существенную роль играют амбулаторно-поликлинические учреждения.
В обязанности медицинских работников поликлинического звена (участковых терапевтов и педиатров) входит проведение всего комплекса первичной противоэпидемической работы:
- выявление;
- изоляция;
- госпитализация инфекционных больных и другие мероприятия в очаге;
- диспансерное наблюдение;
- лечение хронических больных.
Мероприятия по борьбе с инфекционными заболеваниями - составная часть комплексного плана амбулаторно-поликлинического учреждения.
План включает санитарно-оздоровительные, лечебно-профилактические и противоэпидемические мероприятия. На основании комплексного плана работы амбулаторно-поликлинического учреждения разрабатывают планы мероприятий на случай возникновения особо опасных инфекций.
В каждом учреждении существует обязательный перечень нормативных документов, средств и инвентаря:
- перечень функциональных обязанностей медицинского персонала при выявлении больного, подозрительного на особо опасные инфекции;
- форма списков лиц, находившихся в контакте;
- памятка о правилах забора материала от больных и доставке его в лабораторию;
- перечень средств экстренной профилактики;
- правила использования дезинфекционных средств, применяемых в очагах инфекции;
- емкости для приготовления дезинфекционных растворов;
- список лиц, выделенных в прививочные и дезинфекционные бригады;
- комплекты противочумных костюмов.
В амбулаторно-поликлиническом учреждении предусмотрены организация и проведение профилактических и противоэпидемических мероприятий (табл. 1-10).
Таблица 1-10. Схема противоэпидемических мероприятий в эпидемическом очаге (участковый врач-терапевт, педиатр)
• Мероприятия в отношении источника инфекции:
◊ своевременное выявление больных и носителей патогенных микроорганизмов;
◊ обеспечение ранней диагностики заболеваний;
◊ учет больных и носителей;
◊ изоляция источника;
◊ лечение в поликлинических условиях;
◊ реабилитационное лечение после выписки из стационара;
◊ санация носителей и больных хроническими формами заболеваний;
◊ проведение бактериологического контроля за полнотой освобождения от возбудителей;
◊ проведение гигиенического воспитания больных и носителей;
◊ обеспечение диспансерного наблюдения за переболевшими, больными хронической формой инфекционного заболевания и хроническими носителями.
• Мероприятия, направленные на прерывание путей передачи (совместно с территориальным центром санитарно-эпидемиологического надзора):
◊ текущая и заключительная дезинфекция в очаге;
◊ отбор проб из объектов внешней среды для лабораторного исследования;
◊ запрещение использования продуктов, воды, одежды и других предметов, предполагаемых в качестве факторов передачи возбудителя.
• Мероприятия, проводимые в отношении лиц, находившихся в контакте с источником инфекции:
◊ активное выявление этих лиц;
◊ их изоляция;
◊ медицинское наблюдение;
◊ лабораторное обследование;
◊ гигиеническое воспитание и пропаганда здорового образа жизни;
◊ специфическая и неспецифическая профилактика. Существенное значение в борьбе с инфекционными болезнями и их профилактике имеют кабинет инфекционных заболеваний (структурное подразделение поликлиники) и кабинет (отделение) профилактики инфекционных заболеваний, организуемый в составе детской городской поликлиники или центральной районной больницы.
Основные задачи этих подразделений:
- обеспечение своевременного и полного выявления инфекционных больных;
- проведение диспансерного наблюдения за реконвалесцентами;
- участие в планировании, организации, контроле за проведением (а иногда и в самом проведении) профилактической иммунизации населения.
Кабинеты инфекционных заболеваний, организованные в целях повышения качества диагностики и лечения инфекционных болезней, диспансерного наблюдения за реконвалесцентами, служат повседневными консультативными центрами для участковых врачей. Возглавляет кабинет врач-инфекционист, прошедший хорошую эпидемиологическую подготовку и квалифицированно пользующийся методом эпидемиологической диагностики, способный руководить профилактической и противоэпидемической работой участковых врачей.
В поликлинике под руководством врача инфекционного кабинета проводят:
- конференции с анализом врачебных ошибок;
- разборы историй болезни пациентов с разными инфекциями;
- обсуждение динамики инфекционной заболеваемости на участке. Кабинет инфекционных заболеваний не только контролирует деятельность
по раннему выявлению и диагностике больных, но и организует работу по повышению квалификации участковых врачей по вопросам диагностики, лечения и специфической профилактики инфекционных болезней.
Большой раздел работы кабинетов составляет систематическое изучение инфекционной заболеваемости как на отдельных врачебных участках, так и на всей территории, обслуживаемой поликлиникой. Врач инфекционного кабинета каждый месяц составляет отчет о движении инфекционной заболеваемости и представляет его в территориальный центр санитарно-эпидемиологического надзора по специальной форме № 85-леч. Сведения о проводимой в поликлиниках профилактической работе, включая и отчет о профилактических прививках, представляют ежеквартально.
Санитарная охрана территории страны от завоза и распространения инфекционных болезней
Составная часть общегосударственной системы обеспечения санитарноэпидемиологического благополучия населения РФ - это санитарная охрана
территории, направленная на предупреждение заноса на территорию страны и распространения инфекционных заболеваний, представляющих опасность для населения, а также на предотвращение ввоза на территорию РФ и реализации на территории страны товаров, химических, биологических и радиоактивных веществ, отходов и иных грузов, представляющих опасность для человека. Развитие политического, экономического и культурного сотрудничества с зарубежными странами приводит к ежегодному росту пассажиропотока и грузовых перевозок, увеличению количества воздушных, морских и автомобильных рейсов, в том числе в неблагополучные по особо опасным инфекциям страны. Ежегодно расширяются объемы железнодорожных перевозок, пассажиров, организованных коллективов, в том числе детей к местам отдыха. Расширилась география выезда туристических групп. В стране находится множество объектов возможного завоза из зарубежных стран возбудителей особо опасных инфекций.
К ним относят:
- плодоовощные объединения;
- склады продовольственных и промышленных товаров;
- мясоперерабатывающие комбинаты;
- таможенные терминалы;
- предприятия по переработке сырья животного происхождения и пищевой промышленности;
- оптовые вещевые и продовольственные рынки.
На вышеперечисленные потенциально опасные объекты возбудители инфекций могут попадать с людьми (больные, бактерионосители), грызунами и членистоногими.
Проблема санитарной охраны территории имеет особую актуальность в связи с тем, что на территории России располагаются крупнейшие международные аэропорты. Таким образом, завоз карантинных и других инфекционных заболеваний, опасных для населения РФ, - это реальная возможность. В связи с сохраняющимся эпидемиологическим неблагополучием в мире по холере, чуме, контагиозным вирусным геморрагическим лихорадкам, птичьему и свиному гриппу, малярии, эпизоотологическим неблагополучием по чуме в сопредельных с РФ государствах, выраженной внутренней и внешней миграцией населения существует реальная угроза завоза и распространения указанных заболеваний на территории нашей страны. Ежегодно регистрируют завозы малярии из стран Африки, Азии и СНГ. Завоз особо опасных инфекций на территорию страны может быть обусловлен в основном мигрантами, беженцами, коммерсантами, прибывающими из стран СНГ, российскими гражданами, работающими по контракту в эндемичных странах.
Сохраняется вероятность эпидемических осложнений в природных очагах чумы, расположенных на территории РФ, а также заноса этой болезни из-за рубежа, прежде всего из сопредельных стран (Монголия, Казахстан, Китай), с которыми имеются тесные коммуникационные связи. Заносы чумы возможны и из других (более 50) стран мира, в которых также имеются эпидемически активные природные и антропоургические очаги этой болезни.
Санитарная охрана территории страны состоит из комплекса мероприятий:
- организационных;
- санитарно-гигиенических;
- противоэпидемических;
- лечебно-профилактических;
- экономических;
- технических и иных.
Одна из составляющих комплекса - это организация санитарно-карантинного контроля в пунктах пропуска через государственную границу РФ, которая в настоящее время осуществляется в 277 из 448 пунктов. Постановлением Главного государственного санитарного врача РФ от 11.05.2007 г. введены в действие международные медико-санитарные правила (ММСП) (2005). В правилах указан перечень инфекционных болезней, требующих проведения мероприятий по санитарной охране территории страны.
Он включает:
- холеру;
- чуму;
- желтую лихорадку;
- вирусные геморрагические лихорадки, Ласса, Марбург, Эбола;
- малярию;
- натуральную оспу;
- полиомиелит;
- тяжелый острый респираторный синдром (ТОРС);
- грипп, вызванный новым подтипом вируса.
Новизна ММСП (2005) состоит в регламентировании на уровне стран - членов ВОЗ мероприятий по оповещению и ответным мерам в отношении ЧС в области общественного здравоохранения, имеющих международное значение, ассоциируемых с инфекционными болезнями, товарами, биологическими, химическими веществами, радиоактивными материалами, отходами, другими грузами.
Цель и задача ММСП - это координирование мероприятий по упреждающему управлению рисками возникновения и распространения ЧС.
Функции национального координатора по ММСП возложены на Федеральную службу по надзору в сфере защиты прав потребителей и благополучия человека. В своей деятельности Роспотребнадзор опирается на эпидемиологическую информацию, получаемую от ВОЗ в виде ежедневного радиотелеграфного бюллетеня, еженедельного эпидемиологического отчета, обзоров и др.
В свою очередь Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека сообщает медицинской службе субъектов федерации сведения о странах, где зарегистрированы карантинные болезни. На основании этой и другой медико-санитарной информации не допускаются к ввозу на территорию страны опасные грузы и товары, ввоз которых запрещен законодательством РФ. Указанное также распространяется на грузы и товары, в отношении которых санитарно-карантинным контролем установлено, что их ввоз создаст угрозу возникновения и распространения инфекционных заболеваний или массовых неинфекционных заболеваний (отравлений). Решения Роспотребнадзора обязательны для всех предприятий и учреждений независимо от их ведомственной принадлежности и формы собственности. Для санитарной охраны территории РФ в пунктах пропуска через государственную границу РФ на основании федерального органа исполнительной власти, уполномоченного осуществлять государственный санитарно-эпидемиологический надзор, введен санитарно-карантинный контроль. В пунктах пропуска через государственную границу РФ в морских и речных портах, аэропортах, автодорожных переходах
карантинный контроль осуществляют центры государственного санитарноэпидемиологического надзора (на железнодорожных переездах - центры санитарно-эпидемиологического надзора Министерства путей сообщения, на военно-морских базах и военных аэродромах - санитарно-эпидемиологические подразделения Министерства обороны РФ). Прибывающие из-за рубежа и выезжающие российские транспортные средства подлежат санитарно-карантинному контролю, предшествующему другим видам контроля.
Он включает посещение и обследование лицами медицинского состава:
- морского и речного судна;
- самолета;
- поезда;
- автодорожного или другого транспортного средства;
- контейнера (контейнеров).
В санитарно-карантинный контроль входят также:
- выявление больных и подозрительных на заболевание карантинной болезнью;
- опрос, а при необходимости и осмотр лиц, пересекающих границу;
- проверка правильности заполнения установленных санитарных документов.
К таким документам относят:
- международное свидетельство о прививках;
- морскую санитарную декларацию;
- санитарную часть генеральной декларации самолета;
- свидетельство о дератизации и т.д.
В случае выявления больного карантинной инфекцией транспортное судно отводят на заблаговременно выделенные и оборудованные санитарные площадки или тупики, затем на судне проводят противоэпидемические мероприятия, соответствующие нозологической форме. При получении информации о выявленных больных срочно оповещают руководителя медицинского учреждения, больного изолируют и госпитализируют для уточнения диагноза и лечения. С 01.05.2008 г. на территории РФ введены в действие Санитарно-эпидемиологические правила СП 3.4.2318-08.
Санитарные правила распространяются на перечень инфекционных (паразитарных) и массовых неинфекционных заболеваний (отравлений).
• На инфекционные болезни, которые могут привести к возникновению ЧС в области санитарно-эпидемиологического благополучия населения, требующие проведения мероприятий по санитарной охране территории
РФ (табл. 1-11).
• На болезни и другие события, требующие принятия решений для оценки и уведомления о выявлении ЧС; на ЧС, связанные с ввозом на территорию РФ товаров и грузов, представляющих риск для здоровья населения.
Санитарные правила устанавливают основные требования к организационным, санитарно-противоэпидемическим (профилактическим) мероприятиям по санитарной охране территории РФ.
В случаях, не предусмотренных в Санитарных правилах, следует руководствоваться ММСП.
Как было указано выше, возникновение и поддержание эпидемического процесса определяют три фактора:
- источник инфекции;
Таблица 1-11. Перечень инфекционных (паразитарных) болезней, требующих проведения мероприятий по санитарной охране территории Российской Федерации
- механизм передачи возбудителя;
- восприимчивость населения.
Устранение одного из факторов неизбежно приводит к прекращению эпидемического процесса и исключает возможность существования инфекционной болезни. Поэтому профилактические и противоэпидемические мероприятия могут быть эффективными в том случае, если они направлены на обезвреживание (нейтрализацию) источника инфекции, разрыв путей передачи возбудителя и повышение невосприимчивости населения (табл. 1-12).
Таблица 1-12. Группировка противоэпидемических мероприятий по их направленности на звенья эпидемического процесса
При антропонозах мероприятия, направленные на источник инфекции, разделяют на диагностические, изоляционные, лечебные и режимно-ограничительные, а при зоонозах - на санитарно-ветеринарные и дератизационные.
Мероприятия, ведущие к разрыву механизма передачи возбудителя, называют санитарно-противоэпидемическими. В самостоятельную группу можно выделить дезинфекционные и дезинсекционные мероприятия.
Мероприятия, направленные на защиту популяции хозяина, представлены в основном прививочными мероприятиями, имеющими целью создание специфической невосприимчивости (иммунитета) к отдельным инфекционным заболеваниям.
Отдельную группу составляют лабораторные исследования, гигиеническое воспитание и пропаганда здорового образа жизни, помогающие каждому из направлений.
Раннее и полное выявление инфекционных больных - это предпосылка своевременно начатого лечения, изоляции и проведения противоэпидемических мероприятий в очаге. Различают пассивное и активное выявление инфекционных больных. В первом случае инициатива обращения за медицинской помощью принадлежит больному или его родственникам.
К методам активного выявления инфекционных больных относят:
- выявление больных по сигналам санитарного актива;
- подворные обходы;
- выявление больных и носителей при различных профилактических осмотрах и обследованиях (группы риска).
Обязательному медицинскому осмотру и лабораторному обследованию подлежат:
- дети перед поступлением в детское дошкольное учреждение (ДДУ);
- взрослые при приеме на работу на пищевые предприятия.
К активному выявлению следует также отнести выявление инфекционных больных при проведении медицинского наблюдения в эпидемических очагах.
Система регистрации инфекционных больных, принятая в нашей стране, позволяет обеспечить:
- своевременную осведомленность СЭУ и органов здравоохранения о выявлении случаев инфекционных заболеваний в целях принятия всех необходимых мер для предотвращения их распространения или возникновения эпидемических вспышек;
- правильный учет инфекционных заболеваний;
- возможность проведения оперативного и ретроспективного эпидемиологического анализа.
Медицинский работник, выявивший инфекционное заболевание, которое подлежит обязательной регистрации и учету, или при подозрении на него обязан информировать об этом местные (территориальные) центры государственного санитарно-эпидемиологического надзора и (или) другие учреждения, осуществляющие их централизованный учет и регистрацию. В 2006 г. пересмотрены и утверждены Росстатом формы государственного и отраслевого статистического наблюдения, касающиеся сведений об инфекционных и паразитарных заболеваниях, профилактических прививках.
Все медицинские данные об инфекционных больных заносят в основную медицинскую документацию, соответствующую специфике ЛПУ:
- медицинскую карту стационарного больного;
- медицинскую карту амбулаторного больного;
- историю развития ребенка;
- медицинскую карту больного венерическим заболеванием и др. В общепринятом порядке на каждый случай заболевания заполняют:
- статистический талон для регистрации заключительных (уточненных) диагнозов;
- талон амбулаторного пациента.
На каждый случай заболевания (подозрения), необычной реакции на прививку, укус, ослюнение животными заполняют экстренное извещение об инфекционном заболевании, пищевом, профессиональном отравлении, необычной реакции на прививку (форма № 58).
Экстренные извещения заполняют врачи или средний медицинский персонал, выявивший или заподозривший заболевание:
- в амбулаторно-поликлинических учреждениях (на приеме);
- при посещении больного на дому и профилактическом осмотре;
- в стационаре;
- по получении информации об изменении диагноза болезни;
- при патолого-анатомическом исследовании;
- в учреждениях судебно-медицинской экспертизы;
- в ДДУ;
- в школах;
- в средних и высших специальных учебных заведениях;
- в санаторно-курортных учреждениях;
- в учреждениях системы социального обеспечения;
- в хозрасчетных лечебных учреждениях;
- врачами, занимающимися частной практикой.
Извещение отсылают в течение 12 ч в территориальный центр санитарноэпидемиологического надзора по месту регистрации заболевания (независимо от места жительства больного). ЛПУ, уточнившее или изменившее диагноз, обязано составить новое экстренное извещение и в течение 24 ч отослать его в центр санитарно-эпидемиологического надзора по месту обнаружения заболевания, указав измененный диагноз, дату его установления, первоначальный диагноз и результаты лабораторного обследования.
Для персонального учета инфекционных больных и последующего контроля полноты и сроков передачи информации в центр санитарно-эпидемиологического надзора сведения из экстренного извещения вносят в специальный журнал учета инфекционных заболеваний (форма № 60).
Эффективность мероприятий в отношении источников инфекции в значительной степени определяет диагностика. Требования к ней с эпидемиологических позиций обусловлены выбором достоверных и ранних методов.
Причины диагностических ошибок связаны:
- с трудностями дифференциальной диагностики клинически сходных инфекционных заболеваний;
- полиморфизмом клинических проявлений многих из них;
- недоучетом эпидемиологических данных;
- недостаточным использованием возможностей лабораторного подтверждения.
Качество диагностики существенно улучшает сочетанное применение различных методов. Например, при кори, эпидемическом паротите, ветряной
оспе, скарлатине и некоторых других заболеваниях диагноз практически всегда устанавливают клинически, с учетом эпидемиологических данных (если они есть). Лабораторные методы диагностики значительного применения при этих инфекциях пока не получили.
При широком наборе методов лабораторной диагностики следует каждому из них дать правильную эпидемиологическую оценку. Например, при брюшном тифе раннюю диагностику заболевания осуществляют методом выделения возбудителя из крови (гемокультура) и серологическими тестами [ Vi-гемагглютинация, иммуноферментный анализ (ИФА), ПЦР]. При ретроспективной постановке диагноза применяют методы более поздней диагностики - выделение возбудителя из испражнений, мочи и желчи. Эти методы используют для подтверждения диагноза и выявления бактерионосителей. Сложность многих лабораторных тестов ограничивает возможность их широкого применения. Именно по этим причинам аденовирусные и энтеровирусные инфекции очень часто не распознают, хотя они встречаются повсеместно.
Меры в отношении источника инфекции в эпидемическом очаге следует рассматривать как эффективные лишь в случае изоляции больного (в соответствии с патогенезом инфекции) до наступления заразного периода и на весь его срок (брюшной и сыпной тиф). Если больного изолируют в начале, разгаре или даже конце заразного периода (вирусный гепатит, корь, ветряная оспа и др.), такие меры оценивают как малоэффективные.
Больного инфекционным заболеванием или носителя обычно изолируют, помещая его в соответствующее ЛПУ вплоть до полного клинического выздоровления или достижения эффективной санации носителя. Сроки и условия изоляции определены специальными инструкциями. При многих инфекционных болезнях допускают изоляцию больного или носителя на дому при соблюдении условий, исключающих возможность передачи инфекции. За своевременную госпитализацию инфекционных больных отвечает участковый врач. Если больной остается дома, лечащий врач должен обеспечить его лечение и эпидемиологическое наблюдение за очагом, проводимое до окончания заразного периода у реконвалесцента. Оставляя больного дома, врач обязан сообщить ему и проживающим с ним лицам, какую эпидемиологическую опасность он представляет и как следует себя вести для предупреждения новых заболеваний. Для некоторых болезней госпитализация обязательна и предусмотрена законодательными документами. Инфекционных больных госпитализируют силами ЛПУ на специальном транспорте, подлежащем дезинфекции.
При зоонозах домашних животных самая радикальная мера - это их уничтожение. В отдельных случаях, если речь идет о высокоценных породах животных, прибегают к лечению или созданию специальных хозяйств для содержания и санации пораженного скота. Наряду с обеззараживанием источников инфекции проводят мероприятия по уничтожению эктопаразитов - переносчиков возбудителей инфекционных заболеваний. При зоонозах такие меры проводит ветеринарная служба, предоставляющая соответствующую информацию санитарно-эпидемиологической службе.
При зоонозах диких животных (природно-очаговых болезнях) основные мероприятия направлены на истребление либо уменьшение плотности популяции (иногда на больших территориях, особенно при обнаружении чумы, бешенства и др.). Эти мероприятия дорогостоящи, их проводят по эпидемиологическим или эпизоотологическим показаниям специализированные учреж-
дения здравоохранения и ветеринарной службы. Хозяйственное освоение территорий (распашка степей, мелиорация, лесонасаждение) часто приводит к ликвидации природных очагов инфекционных болезней.
Режимно-ограничительные мероприятия проводят в отношении лиц, подвергавшихся или подверженных риску заражения. Продолжительность этих мероприятий определяет время опасности заражения лиц, контактирующих с больным или носителем, плюс время максимального инкубационного периода.
Выделяют 3 категории режимно-ограничительных мероприятий:
- усиленное медицинское наблюдение;
- обсервация;
- карантин.
Усиленное медицинское наблюдение направлено на активное выявление инфекционных больных среди лиц, контактировавших с больным (носителем) дома, по месту работы, учебы и т.д. Среди этих лиц в течение максимального инкубационного периода болезни проводят:
- опрос;
- медицинское обследование;
- термометрию;
- лабораторные исследования и др.
Обсервация (наблюдение) - это усиленное медицинское наблюдение за здоровьем людей, находящихся в зоне карантина и намеренных ее покинуть.
Карантин - это комплекс режимно-ограничительных мероприятий в системе противоэпидемического обслуживания населения, предусматривающий административные, медико-санитарные, ветеринарные и иные меры, направленные на предотвращение распространения инфекционных заболеваний, и предполагающий особый режим хозяйственной или иной деятельности, ограничение передвижения населения, транспортных средств, грузов, товаров и животных.
При возникновении очагов особо опасных инфекций осуществляют полную изоляцию контактных лиц, обеспечиваемую вооруженной охраной. При менее опасных инфекциях карантин включает:
- разобщение лиц, бывших в контакте с больным;
- запрещение приема новых детей или перевода детей из группы в группу в организованных коллективах;
- недопущение лиц, общавшихся с больным, в детские коллективы, на пищевые предприятия, ограничение их контакта с другими лицами.
Работников пищевых предприятий, водопроводных сооружений, детских учреждений и лиц, осуществляющих непосредственный уход за больными в лечебных учреждениях, а также детей, посещающих ДДУ, при некоторых инфекциях отстраняют от работы, а детей не допускают в детские учреждения. Сроки разобщения лиц из очагов различны. Например, при брюшном тифе, дизентерии и дифтерии разобщение длится в течение срока, необходимого для бактериологического обследования. При других заболеваниях разобщение проводят на весь срок инкубации, отсчитываемый от момента изоляции больного.
Характер мероприятий по разрыву путей передачи инфекции зависит от особенностей эпидемиологии заболевания и степени устойчивости возбудителя во внешней среде.
Успех обеспечивают общие санитарные мероприятия:
- санитарный контроль за водоснабжением и пищевыми продуктами;
- очистка населенных мест от нечистот;
- борьба с выплодом мух и т.д.
Мероприятия проводят как при инфекционных заболеваниях, так и при их отсутствии. Общие санитарные мероприятия играют решающую роль в профилактике острых кишечных инфекций. Кроме общих санитарных мероприятий, большое значение в пресечении дальнейшей передачи инфекции играют дезинфекция, дезинсекция и дератизация.
При инфекциях дыхательных путей фактором передачи служит воздух, поэтому столь трудны меры по разрушению механизма передачи, особенно в больничных условиях и организованных коллективах. Разработка способов и приборов для дезинфекции воздуха в таких условиях необходима, и такую работу ведут. Для индивидуальной профилактики в очаге инфекции рекомендуют ношение марлевых повязок.
Прерывание механизма передачи при инфекциях наружных покровов осуществляют путем выполнения требований общественной и личной гигиены, улучшения жилищных условий, санитарной обстановки в быту и на производстве. Огромное значение мер по прерыванию механизма передачи ярко проявляется при трансмиссивных заболеваниях, где фактором передачи бывают живые переносчики (вши, комары, клещи и др.).
Мероприятия по повышению невосприимчивости населения сводятся как к общеукрепляющим мерам, повышающим неспецифическую резистентность организма, так и к созданию специфического иммунитета благодаря проведению профилактических прививок.
Направленность мероприятий зависит от особенностей инфекции. Наряду с комплексным подходом к противоэпидемической деятельности решающими будут меры, направленные на уязвимое и доступное звено. Например, при кишечных инфекциях основу профилактики составляет комплекс санитарногигиенических мероприятий, приводящий к прерыванию путей передачи болезней и предупреждению заражения населения. В то же время эти мероприятия малоэффективны при инфекциях дыхательных путей, так как практически невозможно прервать активно действующий аэрозольный механизм передачи возбудителей инфекции. Заболеваемость инфекциями дыхательных путей регулирует иммунологический фактор. В связи с этим решающую роль в профилактике этой группы инфекций играют мероприятия по специфической иммунизации населения, создающие прослойку коллективного иммунитета. Соответственно, те инфекции, для борьбы с которыми разработаны вакцины, называют инфекционными заболеваниями, управляемыми средствами иммунопрофилактики. К таким инфекциям относят многие аэрозольные антропонозы (корь, дифтерия, коклюш, эпидемический паротит и др.). К инфекциям, управляемым санитарно-гигиеническими мероприятиями, относят антропонозы с фекально-оральным механизмом передачи (шигеллезы, брюшной тиф, ВГА, ВГЕ и др.). Однако при полиомиелите устойчивое снижение заболеваемости стало возможным лишь после разработки и широкого использования живой вакцины. Профилактику заболеваемости людей зоонозами домашних животных обеспечивают санитарно-ветеринарными мероприятиями и прививками, а природно-очаговыми инфекциями - режимно-ограничительными и прививочными мероприятиями. Удельный вес отдельных мероприятий разли-
чен и зависит не только от характера инфекции, но и от санитарно-эпидемиологической ситуации их проведения. В настоящее время массовая химиотерапия всего населения эндемичных территорий или отдельных групп населения играет центральную роль в борьбе с такими паразитарными болезнями, как филяриатоз лимфатической системы, онхоцеркоз, шистосомоз, аскаридоз, трихоцефалез. Массовые кампании по дегельминтизации населения, пораженного анкилостомидозами, оказались наиболее экономически оправданным и эффективным средством борьбы с анемией.
При развитии неординарных событий, известных как ЧС, организацию и проведение противоэпидемических мероприятий строят на общих принципах охраны здоровья населения:
- оказывают квалифицированную специализированную медицинскую помощь;
- проводят комплекс мероприятий по предупреждению возникновения и распространения инфекционных заболеваний.
В условиях ЧС система противоэпидемических мероприятий базируется на данных санитарно-эпидемиологической разведки территории населенных пунктов и прилегающих зон. Организацию и проведение санитарно-гигиенических и противоэпидемических мероприятий в районах ЧС возлагают на территориальные центры государственного санитарно-эпидемиологического надзора, работающие в тесном взаимодействии со штабами гражданской обороны ЧС административной территории. Общее руководство мероприятиями в ЧС при возникновении очага особо опасных инфекционных заболеваний или инфекций, на которые распространяются ММСП*, осуществляет санитарно-противоэпидемическая комиссия, создаваемая решением администрации района, области, края или республики в составе РФ. Санитарно-противоэпидемическую комиссию возглавляет глава администрации, заместитель председателя комиссии - руководитель органа здравоохранения региона. В состав санитарно-противоэпидемической комиссии входят представители силовых структур (МВД, МО, ФСБ), Министерства путей сообщения, гражданской авиации, сельского хозяйства, транспорта и другие заинтересованные ведомства.
При выполнении противоэпидемических мероприятий в этих условиях ЛПУ обязаны выполнять определенные действия.
• Осуществлять активное выявление больных с симптомами болезней на всех этапах оказания медицинской помощи населению.
• Организовывать транспортировку специализированным автотранспортом, госпитализацию, клинико-эпидемиологическое и лабораторное обследование и лечение каждого больного.
• Вести учет, осуществлять изоляцию и профилактическое лечение лиц, контактировавших с больными.
• В период действия очага инфекции осуществлять провизорную госпитализацию всех больных с сигнальными симптомами болезней и медицинское наблюдение за контактировавшими с ними лицами в течение всего инкубационного периода.
* Карантинные болезни - чума, холера, желтая лихорадка, контагиозные вирусные геморрагические лихорадки (Ласса, Марбург, Эбола), малярия, а также другие опасные для человека инфекционные болезни, передаваемые комарами (лихорадка Денге, японский энцефалит).
• Проводить вскрытие умерших от пневмоний, лимфаденитов, острых лихорадочных заболеваний невыясненной этиологии и других заболеваний, подозрительных на инфекцию, а также во всех случаях скоропостижной смерти лиц, не обращавшихся за медицинской помощью, с целью установления патолого-анатомического диагноза и забора соответствующего материала для лабораторного исследования.
• Вскрытие подобных трупов, забор секционного материала и его транспортировку в специализированные лаборатории проводить с соблюдением соответствующих требований противоэпидемического режима.
Защита медицинского персонала, работающего с больными или проводящего лабораторные исследования, вскрытие трупов погибших, возможна при повышенном внимании к выполнению всех процедур и постоянном использовании защитной одежды.
Для этого применяют:
- шлем-респиратор;
- бахилы;
- халат;
- фартук;
- перчатки;
- при особо опасных инфекциях противочумный костюм с респиратором по типу «лепесток»;
- защитные очки или пластиковый щиток.
Определенную защиту обеспечивает использование обычной хирургической маски, халата и перчаток.
Успех противоэпидемических мероприятий складывается из качества используемых средств, достаточности объема, своевременности и полноты проводимых мероприятий. Критерием эффективности противоэпидемических мероприятий служит способность изменять уровень, структуру и динамику инфекционной заболеваемости, предотвращать или уменьшать связанный с заболеваемостью ущерб здоровью населения.
Эффективность противоэпидемических мероприятий принято рассматривать в 3 аспектах:
- эпидемиологическом;
- социальном;
- экономическом.
Под эпидемиологическим эффектом противоэпидемических мероприятий понимают количественную характеристику предотвращенных инфекционных заболеваний населения и связанных с заболеваемостью явлений. О степени эпидемиологического эффекта можно судить по изменению заболеваемости инфекционными болезнями населения или отдельных его групп. Выражают эпидемиологический эффект в виде индекса эффективности.
Социальная эффективность противоэпидемических мероприятий связана с предотвращением убыли населения в целом и уменьшением смертности и инвалидности, особенно дееспособного населения.
Экономическая эффективность тесно связана с социальной. Она выражается экономическим эффектом, достигнутым в результате сохранения трудоспособности населения и предотвращения расходов общества на лечение больных, содержание нетрудоспособных, проведение мероприятий в эпидемических очагах и т.д.
Эпидемиологический, социальный и экономический аспекты отдельных мероприятий в деятельности противоэпидемической системы в целом взаимосвязаны. В практической деятельности чаще всего используют понятие эпидемиологической эффективности, подразделяемой в свою очередь на потенциальную и фактическую эффективность противоэпидемических средств и мероприятий.
Потенциальная эффективность - это максимально достижимая на данном этапе развития науки и практики возможность предупреждения, уменьшения или прекращения инфекционной заболеваемости при отсутствии побочного действия или при побочном действии, не превышающем установленные границы. Потенциальную эффективность препарата (рекомендации, мероприятия) количественно выражают в показателе защищенности или индексе эффективности.
Мероприятия по борьбе с инфекционными болезнями могут быть эффективны и результативны в более короткий срок только при систематическом, плановом и комплексном их проведении. Проблемно-тематические и программно-целевые планы ориентированы на конечный результат. В планах подобного типа отчетливо осуществляют принцип специализации кооперирования работ, обеспечивающий наилучшие результаты в достижении конечной цели - снижении и ликвидации инфекционной заболеваемости. К достоинствам программно-целевого подхода относят возможность и целесообразность его использования при решении проблем, имеющих межотраслевой характер. Поскольку для решения эпидемиологических проблем необходимо участие не только противоэпидемической, но и других служб (в зависимости от нозологической формы - лечебной, ветеринарной, коммунальной и др.), а также органов власти и самого населения, то именно программно-целевой подход способен обеспечить оптимальную координацию их деятельности и тем самым наибольшую эффективность противоэпидемической работы.
В зависимости от актуальности проблемы и эффективности средств ее решения постановка целей может значительно варьировать. При этом речь может идти как о ликвидации инфекции в целом (полиомиелит, корь), так и ликвидации той или иной инфекции в определенной группе населения (столбняк новорожденных, врожденная краснуха, врожденный сифилис). В других случаях может быть поставлена задача снижения заболеваемости и смертности [программы ВОЗ по борьбе с малярией и другими паразитарными болезнями, расширенная программа иммунизации (РПИ)] или только смертности (программа борьбы с заболеваниями, сопровождающимися диареей). Функционально-отраслевые планы применяют внутри отдельных учреждений системы противоэпидемической защиты населения, они удобны для определения объема и характера работы конкретного отдела, лаборатории и других структурных подразделений.
Правовые аспекты
противоэпидемической деятельности
Правовые аспекты профилактической и противоэпидемической деятельности в общем виде закреплены в Конституции РФ. Россия - это демократическое и правовое государство (ст. 1), где высшей ценностью служит человек, его права и свободы (ст. 2), которые гарантируются согласно общепризнанным
принципам и нормам международного права (ст. 17). В соответствии с Конституцией РФ (1993, ст. 42) каждый гражданин России имеет право на благоприятную среду обитания и достоверную информацию о ее состоянии. Гражданский кодекс Российской Федерации (гл. 59), Основы законодательства Российской Федерации об охране здоровья населения (1993), Закон РФ «О санитарно-эпидемиологическом благополучии населения России» (1999) и постановление Правительства РФ от 06.04.2004 г. № 154 «Вопросы Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека», Положение, утвержденное постановлением правительства РФ от 30.06.2004 г. № 322 «Об утверждении Положения о Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека» регламентируют права и обязанности граждан и медицинских работников в решении задач санитарно-эпидемиологического благополучия и сохранения здоровья населения. Следует также упомянуть статьи Уголовного кодекса РФ, предусматривающие наказание за нарушение санитарно-эпидемиологического благополучия населения или покушение на его права и свободы в данной сфере. Это касается раздела «Преступления против личности», включающего гл. 16 «Преступления против жизни и здоровья» (ст. 121 «Заражение венерической болезнью» и ст. 122 «Заражение ВИЧ-инфекцией») и гл. 19 «Преступления против конституционных прав и свобод человека и гражданина» (ст. 140 «Отказ в предоставлении гражданам информации»).
Рассмотрение этических и правовых аспектов деятельности по борьбе и профилактике инфекционных и паразитарных болезней должно исходить из обстоятельства, что они, в отличие от соматических болезней, представляют опасность не только для самого больного, но и для окружающих его лиц. Следовательно, обоснованием многих проводимых профилактических и противоэпидемических мероприятий служит общественный интерес. В этом случае государство в лице служб государственного санитарно-эпидемиологического надзора и здравоохранения выполняет по существу полицейские функции, осуществляя принудительное вмешательство в жизнь гражданина в соответствии с правовыми нормами, закрепленными в Конституции и других законах государства. Согласно этим законам права и свободы человека могут быть ограничены в той мере, в которой это необходимо в целях защиты интересов государства и общества. Ст. 34 Основ законодательства Российской Федерации об охране здоровья граждан предусматривает «оказание медицинской помощи (медицинское освидетельствование, госпитализацию, наблюдение и изоляцию) без согласия граждан или их законных представителей в отношении лиц, страдающих заболеваниями, представляющими опасность для окружающих». В этом смысле определенно и оправданно звучит ст. 51 (п. 6) Закона «О санитарно-эпидемиологическом благополучии населения», наделяющая полномочиями главных государственных санитарных врачей и их заместителей «...при угрозе возникновения и распространения инфекционных заболеваний, представляющих опасность для окружающих, выносить мотивированное постановление о госпитализации для обследования или об изоляции больных инфекционными заболеваниями, представляющими опасность для окружающих, и лиц с подозрением на такие заболевания», а также о «.проведении обязательного медицинского осмотра, госпитализации или об изоляции граждан, находившихся в контакте с больными инфекционными заболеваниями, представляющими опасность для окружающих». Этот принцип регламентирует
ст. 33 (п. 1), согласно которой «...больные инфекционными заболеваниями, лица с подозрением на такие заболевания и контактировавшие с больными инфекционными заболеваниями, а также лица, являющиеся носителями возбудителей инфекционных болезней, подлежат лабораторному обследованию и медицинскому наблюдению или лечению в случае, если они представляют опасность для окружающих, обязательной госпитализации или изоляции в порядке, установленном законодательством РФ. Лица, являющиеся носителями возбудителей инфекционных заболеваний, если они могут быть источниками распространения инфекционных заболеваний и в связи с особенностями производства, в котором они заняты, или выполняемой ими работы, при их согласии временно переводятся на другую работу, не связанную с риском распространения инфекционных заболеваний. При невозможности перевода на основании постановлений главных государственных санитарных врачей и их заместителей их временно отстраняют от работы с выплатой пособий по социальному страхованию».
Для лиц, не достигших возраста 15 лет, а также лиц, признанных в установленном законом порядке недееспособными, такое согласие должно быть получено от их законных представителей (родителей, опекунов). В законодательном порядке закреплено и право граждан на отказ от медицинского вмешательства. При этом им разъясняют возможные последствия такого отказа, что оформляют записью в медицинской документации и скрепляют подписью гражданина и медицинского работника. Тем самым реализуется право гражданина на неприкосновенность его личности и свободу волеизъявления в принятии значимых для его жизни решений при осознанной его ответственности за возможные последствия. Так, одним из возможных последствий отказа от профилактических прививок может стать отстранение от выполнения профессиональных обязанностей или посещения ДДУ, школьных и других образовательных учреждений.
ЭПИДЕМИОЛОГИЧЕСКИЙ НАДЗОР
Эпидемиологическая и социально-экономическая значимость инфекционных болезней определяет необходимость непрерывного наблюдения за часто меняющейся эпидемиологической ситуацией (надзор) с целью своевременной разработки соответствующих мероприятий, обеспечивающих ликвидацию, сокращение или сдерживание на определенном уровне распространения инфекционных болезней (контроль). Таким образом, эпидемиологический надзор и эпидемиологический контроль - компоненты общей системы, определяемой как управление эпидемическим процессом. Эти понятия вошли в отечественную эпидемиологию из обихода ВОЗ.
В течение последних десятилетий эпидемиологический надзор составляет теоретическую и научно-практическую основу профилактики и борьбы с инфекционными и паразитарными болезнями. Он прошел длинный путь своего развития: от унификации понятия «эпидемиологический надзор» до оформления в систему, располагающую своей методологией (предмет, цели, задачи и методы). В настоящее время эпидемиологический надзор можно рассматривать как качественный скачок в плане организации борьбы с инфекционными болезнями. Он приобрел статус официально принятой в стране информационной системы
наблюдения за эпидемическим процессом и его детерминантами, четко реагирующей на все возможные изменения в развитии процесса. Прежде всего следует отметить, что система надзора базируется на глубоком понимании эпидемиологических закономерностей, особенностей клинического течения, биологических свойств возбудителя, а также социальных и природных факторов, детерминирующих проявления эпидемического процесса каждой инфекционной болезни. В настоящее время задачу управления эпидемическим процессом (надзор и контроль) в России решают с помощью системы социально-гигиенического мониторинга, обеспечивающего управленческие органы информационноаналитическими материалами о состоянии санитарно-эпидемиологического благополучия населения. В соответствии с постановлением Правительства РФ от 06.10.1994 г. «Об утверждении Положения о социально-гигиеническом мониторинге» были начаты разработка и внедрение в практику федеральной многоуровневой координированной системы социально-гигиенического мониторинга. Новым этапом в его развитии стало принятое Правительством РФ 01.06.2000 г. постановление № 426 «Об утверждении Положения о социально-гигиеническом мониторинге». В нем значительно расширен круг участников мониторинга, поставлены новые цели и задачи, причем не только для удовлетворения сегодняшних запросов мониторинга, но и с далекой перспективой. Согласно упомянутому Положению социально-гигиенический мониторинг - это «государственная система наблюдения, анализа, оценки и прогноза состояния здоровья населения и среды обитания человека, а также определения причинно-следственных связей между состоянием здоровья населения и воздействием факторов среды обитания человека». Эпидемиологический надзор представляет собой информационную систему обеспечения органов здравоохранения сведениями, необходимыми для осуществления мероприятий по профилактике и снижению инфекционной заболеваемости населения. Будучи сугубо информационной системой, эпидемиологический надзор служит основой для разработки стратегии и тактики, рационального планирования, реализации, корректировки и усовершенствования деятельности санитарно-противоэпидемической службы по борьбе с инфекционными болезнями и их профилактике. Основные положения эпидемиологического надзора (сбор, анализ, интерпретация и передача информации о состоянии здоровья населения) можно распространить и на неинфекционные заболевания. Применительно к инфекционным болезням эпидемиологический надзор можно определить как систему постоянного динамического и многоаспектного слежения (наблюдения) за эпидемическим процессом конкретной инфекционной (паразитарной) болезни или за эпидемиологической ситуацией в целом на определенной территории в конкретный период времени в целях рационализации и повышения эффективности профилактических и противоэпидемических мероприятий.
При динамической оценке эпидемиологической ситуации необходимо учитывать как биологические (состояние популяции возбудителя, хозяев, их взаимодействия друг с другом и средой обитания посредством специфического механизма передачи), так и природно-социальные (условия труда, быта и отдыха населения) компоненты эпидемического процесса. Таким образом, объект эпидемиологического надзора - эпидемиологическая ситуация в ее взаимосвязи с социально-экологической средой обитания людей. Эпидемиологический контроль - не что иное, как собственно система профилактических и противоэпидемических мероприятий. Поэтому не следует оценивать эффек-
тивность эпидемиологического надзора по степени его влияния на уровень, структуру и динамику инфекционной заболеваемости. Влияние на эти проявления эпидемического процесса способна оказать только рациональная система профилактики и борьбы. Эффективность эпидемиологического надзора можно оценить лишь по его способности обеспечить информацией, необходимой и достаточной для принятия рациональных управленческих решений и их оптимальной реализации. Влияние системы эпидемиологического надзора на эпидемический процесс может сказаться лишь опосредованно и зависеть от своевременности и целесообразности использования результатов эпидемиологического надзора при планировании, усовершенствовании и реализации профилактических и противоэпидемических мероприятий. Задачи эпидемиологического надзора:
- оценка масштабов, характера распространенности и социальноэкономической значимости инфекционной болезни;
- выявление тенденций и оценка темпов динамики эпидемического процесса данной инфекционной болезни во времени;
- районирование территорий с учетом степени реального и потенциального эпидемиологического неблагополучия по данной инфекционной болезни;
- выявление контингентов населения, подверженных повышенному риску заболевания в силу особенностей их производственно-бытовых или иных условий жизни;
- выявление причин и условий, определяющих наблюдаемый характер проявлений эпидемического процесса данной инфекционной болезни;
- определение адекватной системы профилактических и противоэпидемических мероприятий, планирование последовательности и сроков их реализации;
- контроль масштабов, качества и эффективности осуществляемых профилактических и противоэпидемических мероприятий в целях рациональной их корректировки;
- разработка периодических прогнозов эпидемиологической ситуации. Основные принципы системы эпидемиологического надзора:
- активный и систематический сбор, анализ и оценка необходимой информации;
- разграничение задач и функций федерального, регионального и локального уровней эпидемиологического надзора;
- использование единых для всех субъектов эпидемиологического надзора методологических подходов, сертифицированных критериев и методов оценки влияния биологических, природных и социальных факторов на эпидемический процесс наблюдаемой инфекции;
- унификация способов сбора, накопления, обработки, анализа, передачи и хранения информации (в частности, унификация соответствующих нормативно-методических документов);
- открытость информации для широкого круга пользователей и широкий обмен ею со всеми учреждениями и организациями, заинтересованными в результатах эпидемиологического надзора, а также информирование граждан.
Система эпидемиологического надзора за инфекционными (паразитарными) болезнями имеет многоуровневую иерархическую структуру в соответствии с
иерархической структурой службы государственного санитарно-эпидемиологического надзора страны. Поэтому система эпидемиологического надзора структурируется по уровням на локальный, или местный (уровень городов, сельских и городских районов), региональный (уровень субъектов Федерации) и федеральный (уровень страны в целом) уровни. В соответствии с этим перечень учреждений, задействованных в реализации системы эпидемиологического надзора, на различных уровнях его структуры оказывается разным (табл. 1-13).
Таблица 1-13. Учреждения, задействованные в реализации системы эпидемиологического надзора на разных уровнях его функционирования
Функциональную структуру системы эпидемиологического надзора можно представить в виде последовательной цепи мероприятий:
- наблюдение на месте, сбор и регистрация информации;
- поэтапная передача данных по вертикали, или снизу вверх, т.е. от нижестоящих в вышестоящие уровни (звенья, подсистемы) системы эпидемиологического надзора (районные, областные, краевые, республиканские, федеральный уровни);
- обмен информацией по горизонтали между заинтересованными ведомствами и учреждениями (на уровне районов, областей, краев, республик, страны), а также информирование граждан;
- эпидемиологический анализ и оценка данных по программам, специфичным для каждого уровня эпидемиологического надзора;
- оценка эпидемиологической ситуации, т.е. постановка эпидемиологического диагноза;
- обмен информацией по принципу обратной связи, или сверху вниз, т.е. распространение обобщенной информации от вышестоящих в нижестоящие уровни (звенья, подсистемы) системы эпидемиологического надзора;
- разработка управленческих решений, рекомендаций по планированию, организации и корректировке осуществляемых мероприятий;
- разработка прогноза развития эпидемиологической ситуации.
Объем и степень (глубина) обработки информации определяют масштабы задач, решаемых на каждом уровне эпидемиологического надзора. Степень обработки возрастает по мере повышения уровня эпидемиологического надзора в связи с возрастанием значимости принимаемых на данном уровне управленческих решений. Вертикальная структура системы эпидемиологического надзора обеспечивает централизованный принцип управления системой и координацию работ, постоянное взаимодействие с субъектами надзора, взаимное иерархическое согласование планов и мероприятий, унификацию программно-технологических и технических средств, интеграцию данных локального, регионального и федерального уровней.
Эпидемиологический надзор осуществляют в соответствии с комплексноцелевыми программами, специально разрабатываемыми для каждой нозологической формы инфекционных болезней.
Любая программа эпидемиологического надзора должна определять следующие моменты:
- цель и задачи планируемого надзора; территорию, охватываемую надзором;
- часть или группу (группы) населения, берущуюся под надзор, и длительность предстоящего периода наблюдения;
- характер и объем информации, подлежащей сбору;
- источники получения информации (ЛПУ, клинические, микробиологические, вирусологические, паразитологические лаборатории и др.);
- способы и периодичность сбора первичной информации, частоту (периодичность) анализа информации, методы анализа информации, первичные и окончательные формы таблиц и отчетности, способы представления отчетности.
Программа эпидемиологического надзора должна учитывать необходимость решения этих задач в соответствии с функциями каждого уровня системы государственного санитарно-эпидемиологического надзора (локального, регионального, федерального).
Программы надзора включают взаимосвязанные самостоятельные разделы (подсистемы):
- информационно-аналитический;
- диагностический.
Информационно-аналитическая подсистема - базовый раздел эпидемиологического надзора. В ее рамках учитывают и регистрируют все формы проявления заболеваний, а также прослеживают динамику носительства, заболеваемости, летальности и смертности. Объем необходимых сведений в каждом случае зависит от особенностей эпидемиологии болезни и реальных возможностей противоэпидемической системы для необходимого информационного обеспечения в конкретных условиях места и времени. Различия в задачах надзора при отдельных инфекционных болезнях определяют набор необходимой информации для полноценного изучения эпидемиологической ситуации. Так, наряду с общим для всех программ надзора информационным обеспечением наблюдения за уровнем, структурой и динамикой заболеваемости (смертности) при инфекциях, управляемых средствами иммунопрофилактики, необходимы сведения об иммунном статусе населения (иммунологический контроль) с оценкой напряженности иммунитета в группах риска. В то же время при дифтерии актуально наблюдение за циркуляцией возбудителя среди населения
(бактериологический контроль, включающий данные о структуре, широте циркуляции и биологических свойствах возбудителя). При кори такие сведения не нужны. Эпидемиологический надзор при кишечных инфекциях должен опираться на санитарно-гигиенический контроль внешней среды, соблюдение санитарно-эпидемиологического режима на пищевых объектах и т.д. При зоонозах необходим комплексный многоаспектный эпизоотолого-эпидемиологический надзор, осуществляемый совместно санитарно-эпидемиологической и ветеринарной службами.
Исходным пунктом разработки программы эпидемиологического надзора служит ретроспективный анализ местной эпидемиологической ситуации за предшествующий период. Цель его определяют первоочередные направления эпидемиологического надзора за изучаемой инфекционной болезнью в конкретных условиях. Логическим продолжением ретроспективного эпидемиологического анализа становится оперативный эпидемиологический анализ, т.е. изучение динамики эпидемиологической ситуации для принятия оперативных решений по управлению эпидемическим процессом. Эпидемиологический диагноз - логическая формула, содержащая оценку эпидемиологической ситуации и ее детерминант (причин) на конкретной территории среди определенных групп населения в изучаемый отрезок времени с целью рационализации профилактических и противоэпидемических мероприятий и разработки эпидемиологического прогноза. Большое значение имеет социальноэкономический анализ, позволяющий оценить экономический и социальный урон, наносимый той или иной инфекционной болезнью.
Подобно используемому в клинической практике понятию «донозологическая диагностика» (распознавание пограничных состояний организма между здоровьем и болезнью, нормой и патологией), в эпидемиологической практике существует понятие «предэпидемическая диагностика» - своевременное обнаружение предпосылок и предвестников возможного осложнения эпидемиологической ситуации и разработка на их основе рекомендаций по оперативной коррекции плана профилактических и противоэпидемических мероприятий
(Черкасский Б.Л., 1994).
Предпосылки - природные и социальные явления, усиливающие взаимодействие сочленов паразитарной системы эпидемического процесса, что перестраивает структуры популяции паразита, переносчика и (или) хозяина и активизирует реализацию механизма передачи. Предвестники - признаки начавшейся активизации взаимодействия сочленов паразитарной системы, свидетельствующие о возможности ее перерастания в манифестный эпидемический процесс при благоприятно складывающихся факторах природносоциальной среды.
При каждой инфекционной болезни круг компонентов природной среды и специфику их влияния на эпидемический процесс определяют механизмы передачи возбудителей.
• Например, при инфекциях дыхательных путей, возбудители которых в основном обитают в организме биологического хозяина, природные факторы действуют главным образом на популяцию хозяина (резистентность макроорганизма).
• При кишечных инфекциях, возбудители которых могут длительно находиться во внешней среде, природные факторы влияют как на возбудителей, так и на активность путей передачи инфекции.
Социальные условия жизни населения воздействуют на биологическую основу эпидемического процесса через все 3 его звена, но с разной интенсивностью при разных инфекциях.
• При инфекциях дыхательных путей динамику эпидемического процесса определяет обновление состава коллективов, способствующее заносу возбудителей инфекции, увеличению неиммунной прослойки и активизации механизма передачи.
• При кишечных инфекциях основными предпосылками осложнения эпидемиологической ситуации становятся явления социальной жизни, способные активизировать ведущие пути передачи возбудителя (водный и пищевой).
Предвестниками осложнения эпидемической обстановки при инфекциях дыхательных путей может служить появление источника инфекции в сочетании с увеличением неиммунной прослойки населения, а также изменение пейзажа циркулирующих возбудителей.
• В частности, прогностическим признаком вероятного подъема заболеваемости менингококковой инфекцией может быть увеличение удельного веса носительства менингококков серогруппы А или С у подростков и взрослых, а также резкий рост носительства менингококков серогруппы В среди детей младшего возраста.
• Изменение антигенных характеристик вируса гриппа также может служить прогностическим признаком возможного подъема заболеваемости.
• Неблагополучный фактор в развитии эпидемического процесса при дифтерии и инфекциях, вызываемых стрептококками группы А, - перепланировка в серологической и типовой структурах популяции циркулирующего возбудителя, увеличение его токсигенности.
• Предвестником осложнения эпидемиологической ситуации по кишечным инфекциям могут служить ухудшение бактериологических показателей воды и пищи, изменение свойств циркулирующего возбудителя.
• Основными предпосылками обострения эпидемической обстановки по ЗППП становятся ухудшение социально-экономических и бытовых условий жизни населения, усиление миграционных потоков, в том числе беженцев и переселенцев, неконтролируемый рост проституции, злоупотребление алкогольными напитками значительной частью населения, распространение наркомании и токсикомании, рост сексуального насилия в отношении детей и подростков, а предвестниками - преобладание в структуре клинических форм сифилиса свежих форм болезни, изменение соотношения вторичного рецидивного сифилиса и свежих форм болезни, увеличение территорий с показателями заболеваемости, значительно превышающими среднестатистические по стране.
Качество программы эпидемиологического надзора оценивают на основании следующих критериев:
- простота;
- гибкость;
- приемлемость;
- чувствительность;
- достоверность;
- специфичность;
- репрезентативность;
- оперативность (степень запаздывания);
- стоимость.
Степень простоты планируемой программы эпидемиологического надзора зависит от объема и типа необходимой информации, количества и характера ее источников, методов ее сбора и передачи, количества вовлеченных учреждений и организаций, потребности в обучении вовлекаемого персонала, методов анализа информации, количества пользователей информации, методов передачи им периодических отчетных данных, а также времени, необходимого для реализации программы.
Гибкость программы зависит от возможности быстро приспосабливать ее к меняющейся эпидемиологической ситуации.
Степень приемлемости программы зависит от понимания администрацией, медицинской общественностью и гражданами ее необходимости и полезности для общества в целом и для отдельных индивидов, а также от степени ее соответствия действующим законам и правилам.
Чувствительность программы определяет ее возможность выявлять реальную эпидемиологическую ситуацию и своевременно обнаруживать переход спорадической заболеваемости в эпидемическую. В первую очередь этот показатель зависит от уровня диагностики и регистрации данной болезни на данной территории в наблюдаемый период времени.
Степень достоверности получаемой информации оценивают с помощью показателя отношения количества правильно диагностированных случаев заболеваний к сумме всех (правильно и неправильно) диагностированных случаев. Вполне очевидно, что этот показатель, с одной стороны, зависит от уровня диагностики болезни, а с другой стороны, он окажется разным в условиях спорадической и эпидемической заболеваемости.
Специфичность программы эпидемиологического надзора определяют отношением количества лиц, действительно не заболевших данной болезнью за период наблюдения, к сумме числа случаев с неправильно поставленным диагнозом данной болезни и действительно оставшихся здоровыми.
Степень репрезентативности программы определяют по возможности распространения полученных в ходе ее реализации данных не только на изучаемые период времени, территорию и группу населения, но и на другие сходные периоды, территории и группы.
Оперативность (своевременность, степень запаздывания) программы характеризуется длительностью периодов между различными этапами ее реализации (сбором информации, обработкой, передачей, анализом, отчетностью).
Стоимость программы определяется главным образом величиной расходов на оплату работы персонала (включая заработную плату, расходы на командировки, обучение и т.п.), приобретение и эксплуатацию оборудования, расходные материалы, связь (почтовые и телефонные расходы, компьютерное время и т.п.) и др.
Таким образом, степень надежности результатов эпидемиологического надзора зависит от адекватного выбора источников, характера и объема базовой информации при унификации таких принципиальных моментов, как объем выборочной совокупности, выбор единиц наблюдения, группировка возрастных и иных категорий населения, унификация методов статистической и математической обработки данных. В результате обработки статистических данных могут быть получены сведения об интенсивности эпидемического процесса,
характеристики распределения больных по времени их заболевания, полу, возрасту, роду занятий, месту жительства и некоторым другим показателям, необходимым для планирования и оценки профилактических и противоэпидемических мероприятий.
Сбор и анализ традиционных статистических данных (показатели заболеваемости, смертности, потерь трудоспособности от инфекционных болезней и др.) остаются естественным элементом эпидемиологического метода. Однако они, давая возможность оценить эпидемиологическую ситуацию и ее изменения во времени, по территории и среди различных групп населения, не могут ответить на кардинальный для эпидемиологии вопрос о причинах и условиях, определяющих наблюдающуюся ситуацию и ее динамику. Между тем лишь вскрытие этих причин и условий позволяет указать противоэпидемической практике рациональные пути и способы регуляторного воздействия на эпидемический процесс. В связи с этим возникает потребность в комплексном, системном подходе к сбору и анализу эпидемиологических показателей. В соответствии с социально-экологической концепцией эпидемического процесса (Черкасский Б.Л.) его структура определяет и структуру информационных потоков в системе эпидемиологического надзора, в комплексе характеризующих состояние эпидемического процесса. При разных группах инфекционных болезней эпидемиологический надзор имеет особенности, учитываемые при разработке комплексно-целевых программ. Кроме того, во внимание принимают необходимость проведения эпидемиологического надзора на различных уровнях проявления эпидемического процесса.
В связи с этим система надзора за эпидемиологической ситуацией на наблюдаемой территории в изучаемый период должна предусматривать сбор и анализ следующих показателей.
• На уровне социально-экологической системы:
◊ уровень и тенденция динамики заболеваемости (носительства, временной потери трудоспособности, инвалидности, летальности, смертности и др.) во времени (по годам, месяцам, неделям, дням);
◊ статистический мониторинг - распределение заболеваний по территории и среди отдельных групп населения;
◊ динамика эпидемиологически значимых социальных явлений (естественные демографические сдвиги и миграции населения, направления и характер хозяйственной деятельности);
◊ социально-гигиенический мониторинг - санитарно-гигиенические условия жизни, характер и организация снабжения питьевой водой и пищевыми продуктами, их качество, гигиеническое воспитание населения и др.;
◊ качество и эффективность осуществляемых профилактических и противоэпидемических мероприятий.
• На уровне экологической системы:
◊ микробиологический, вирусологический и паразитологический мониторинг (характеристика паразитарной системы в ее взаимодействии с природной средой) - структура популяции возбудителя (по совокупности характеристик, полученных на популяционном, организменном, клеточном и субклеточном уровнях), а также обсемененность возбудителем абиотических объектов окружающей среды;
◊ иммунологический (серологический) мониторинг - иммунологическая структура населения (по совокупности характеристик, полученных на клеточном и субклеточном уровнях);
◊ энтомолого-микробиологический мониторинг - численность, биологическая характеристика и инфицированность популяций членистоногих-переносчиков;
◊ эпизоотологический мониторинг - динамика эпизоотического процесса (при зоонозах);
◊ экологический мониторинг - состояние природных факторов (метеорологических, водных, почвенных и др.).
• На организменном уровне (клинический мониторинг):
◊ преобладающие клинические формы (в соответствии с принятой классификацией);
◊ тяжесть течения заболеваний (носительство, легкие, среднетяжелые и тяжелые формы);
◊ исходы заболеваний (выздоровление, хронизация, летальность).
• На клеточном уровне (микробиологический, вирусологический, паразитологический и иммунологический мониторинг):
◊ динамика биологических свойств возбудителя наблюдаемой болезни (его вирулентность, токсигенность, ферментативная активность, фаготиповая и серотиповая характеристики, антигенная структура, лекарственная устойчивость, устойчивость в окружающей среде и др.);
◊ состояние иммунитета хозяина.
• На субклеточном (молекулярно-генетическом) уровне (молекулярный мониторинг):
◊ молекулярно-генетическая характеристика циркулирующих штаммов возбудителя и их изменчивость;
◊ генетические детерминанты иммунологического статуса населения. Результаты наблюдения за всеми биолого-экологическими уровнями системы эпидемического процесса (от субклеточного до уровня экологической системы) служат базой для постановки объективного эпидемиологического диагноза. Информация о движении инфекционной заболеваемости распространяется в виде:
- периодических отчетов;
- донесений о вспышках;
- информационных писем;
- бюллетеней;
- методических документов и др.
Аналитические материалы о санитарно-эпидемиологическом состоянии отдельных регионов и по стране в целом публикуются в ежемесячном бюллетене «Здоровье населения и среда обитания», ежегодном Государственном докладе о санитарно-эпидемиологической обстановке в России и др.
В соответствии с Конституцией РФ и законодательными документами в области здравоохранения данные о санитарно-эпидемиологическом благополучии сообщают населению страны через средства массовой информации.
Разрабатываемые и внедряемые в практику здравоохранения комплексноцелевые программы эпидемиологического надзора за отдельными инфекционными болезнями входят в систему государственного санитарно-эпидемиологического надзора. Информационной подсистемой последнего служит
социально-гигиенический мониторинг. Правовой основой для подготовки концепции, организационной структуры и принципов создания и внедрения системы социально-гигиенического мониторинга послужил Закон РФ «О санитарно-эпидемиологическом благополучии населения». В соответствии с этим законом «наблюдение, оценка и прогнозирование состояния здоровья населения в связи с состоянием среды его обитания» определены как ведущие элементы государственного санитарно-эпидемиологического надзора. Создание и внедрение системы социально-гигиенического мониторинга на федеральном и региональном уровнях станут важным этапом развития профилактического направления в деле охраны здоровья населения РФ.
Перед социально-гигиеническим мониторингом стоят следующие задачи:
- формирование государственного фонда информационных ресурсов в области обеспечения санитарно-эпидемиологического благополучия населения;
- выявление причинно-следственных связей на основе системного анализа и оценки риска здоровью населения;
- программно-техническое и лабораторно-диагностическое обеспечение социально-гигиенического мониторинга на основании современных информационно-аналитических технологий и программно-аппаратных комплексов;
- межведомственная координация по обеспечению санитарно-эпидемиологического благополучия населения для принятия решений на уровнях федеральных органов исполнительной власти, органов исполнительной власти субъектов РФ, органов местного самоуправления.
ДЕЗИНФЕКЦИОННЫЕ МЕРОПРИЯТИЯ В СИСТЕМЕ БОРЬБЫ С ИНФЕКЦИОННЫМИ БОЛЕЗНЯМИ
Дезинфекционные мероприятия, направленные на разрыв механизмов и путей передачи (собственно дезинфекция, дезинсекция) и на источники инфекции (дезинфекция при сапронозных инфекциях, в ряде случаев при возникновении госпитальных инфекций, когда источником являются абиотические объекты, дератизация).
Дезинфекция
Дезинфекция (обеззараживание) - процесс уничтожения в окружающей среде или удаления из нее возбудителей инфекционных болезней (микроорганизмов или их токсинов). Указанное отличает ее от стерилизации, при которой уничтожают все микроорганизмы и их споры.
Выделяют 2 вида дезинфекции:
- очаговую;
- профилактическую.
Очаговая дезинфекция
Очаговую дезинфекцию проводят в эпидемических очагах - квартирах, общежитиях, детских учреждениях, ЛПУ и т.д. В зависимости от условий проведения различают текущую (при источнике инфекции) и заключительную (после удаления источника) дезинфекцию.
Текущая дезинфекция
Ее проводят для уничтожения заразного начала сразу после его выведения из организма больного или носителя. Она направлена на постоянное обеззараживание экскрементов, рвотных масс, мокроты, патологического отделяемого, перевязочного материала и других объектов в окружении источника инфекции, которые инфицированы или могли быть инфицированы. Текущую дезинфекцию проводят в течение всего периода, пока больной или носитель служит источником инфекции. Ее проводят проинструктированные лица, ухаживающие за больными (носителями), или медицинские работники (при госпитализации больного) в месте нахождения больного или носителя. В том случае если больной оставлен дома, текущую дезинфекцию организуют медицинские работники, впервые выявившие больного. Дезинфекцию считают своевременной, если ее начинают выполнять не позднее чем через 3 ч с момента выявления больного.
Текущая дезинфекция крайне важна при кишечных инфекционных заболеваниях, так как их возбудители периодически выделяются из организма с экскрементами, легко доступными обеззараживанию.
Подвергают дезинфекции также:
- предметы пользования больного;
- столовую посуду;
- санитарно-техническое оборудование;
- посуду из-под выделений;
- постельное и нательное белье.
Все перечисленные предметы могут быть контаминированы.
Текущая дезинфекция в инфекционном отделении - важнейшее мероприятие соблюдения противоэпидемического режима.
Велико значение текущей дезинфекции и при инфекциях с воздушнопылевым путем передачи, т.е. при высокой устойчивости возбудителя во внешней среде. При инфекциях только с воздушно-капельным путем основная цель текущей дезинфекции - это снижение обсемененности воздуха возбудителями. Этого достигают проветриванием и ультрафиолетовым облучением (УФО) помещения, влажной обработкой поверхностей, обеззараживанием объектов окружения больного.
При проведении текущей дезинфекции на дому население применяет простые методы обеззараживания:
- влажную уборку помещений с использованием моющих средств;
- кипячение посуды в 2% растворе соды в течение 15 мин с момента закипания;
- кипячение белья в 2% растворе любого моющего средства перед стиркой;
- мытье горячей водой с мылом или раствором любого моющего средства предметов ухода, игрушек и т.п.;
- мытье посуды для экскрементов горячей водой снаружи и изнутри.
Заключительная дезинфекция
Ее проводят после госпитализации, выздоровления или смерти больного. Обеззараживанию подвергают:
- помещение;
- экскременты;
- рвотные массы;
- патологическое отделяемое;
- нательное и постельное белье;
- предметы бытовой обстановки;
- объекты, которые могли быть контаминированы возбудителями инфекции.
Задача заключительной дезинфекции - уничтожение патогенных микроорганизмов, оставшихся в очаге на различных предметах внешней среды в жизнеспособном состоянии. По эпидемическим показаниям либо в зависимости от нозоформы ее проводят специалисты дезинфекционной службы через 3-12 ч после удаления из очага источника инфекции. Заключительная дезинфекция важна при инфекциях, вызываемых возбудителями, устойчивыми во внешней среде.
Решение о проведении очаговой дезинфекции, объеме и сроках ее проведения, выборе обеззараживающих средств и режиме их применения, перечне предметов и объектов, подлежащих обработке, зависит от вида заболевания, санитарного состояния очага и регламентированы нормативными документами.
Перечень заболеваний, при которых заключительная дезинфекция обязательна, включает:
- чуму;
- холеру;
- возвратный тиф;
- эпидемический сыпной тиф;
- болезнь Брилла;
- ку-лихорадку (легочную форму);
- брюшной тиф и паратифы;
- сальмонеллезы;
- туберкулез;
- проказу;
- орнитоз;
- дифтерию;
- грибковые заболевания волос, кожи, ногтей и др.
Особенность ряда возбудителей бактериальных инфекций (сибирская язва, столбняк, ботулизм, газовая гангрена) - это способность к образованию спор, очень устойчивых к действию физических и химических факторов. Для их уничтожения следует применять дезинфектанты, обладающие не только бактерицидными, но и спороцидными свойствами. В очагах заболевания либо при подозрении на заболевание ВГА, ВГЕ, полиомиелитом и другими энтеровирусными инфекциями, бактериальной дизентерией, ротавирусной инфекцией, кишечным иерсиниозом, а также острыми кишечными инфекциями неустановленной этиологии заключительную дезинфекцию кроме специалистов дезинфекционных станций могут проводить медицинский персонал лечебнопрофилактических, детских и подростковых учреждений и население (в малонаселенных благоустроенных квартирах или собственных домах) под руководством тех же специалистов дезинфекционных станций. При других инфекциях заключительную дезинфекцию проводят в зависимости от эпидемической ситуации по решению главного государственного санитарного врача конкретной территории.
Профилактическая дезинфекция
В отличие от очаговой профилактическую дезинфекцию проводят без выявления источника, но предполагая его присутствие.
Профилактическую дезинфекцию постоянно проводят:
- на очистных сооружениях;
- на объектах водоснабжения и общественного питания;
- на предприятиях, изготовляющих, перерабатывающих и реализующих пищевые продукты, а также сырье животного происхождения.
Профилактическую дезинфекцию также проводят в местах массового скопления людей (вокзалы, зрелищные учреждения, общественный транспорт, бани, общественные туалеты, плавательные бассейны и т.п.), где предполагают присутствие источника инфекции среди здорового населения. Профилактическая дезинфекция также включает:
- проветривание и влажную уборку помещений;
- мытье рук;
- очистку и хлорирование водопроводной воды;
- пастеризацию молока и т.д. Методы дезинфекции:
- механический;
- физический;
- химический;
- биологический;
- комбинированный.
Механический метод
Механический метод основан на удалении патогенных и условнопатогенных микроорганизмов с предметов, подлежащих обеззараживанию, путем обмывания, встряхивания, подметания, влажного протирания, обработки пылесосом, проветривания, вентиляции, стирки белья. Обеззараженные такими способами предметы становятся менее опасными или безопасными в эпидемиологическом отношении.
Физический метод
Физический метод предполагает использование:
- электроэнергии;
- токов ультравысокой частоты (УВЧ);
- лучистой энергии;
- ультразвука;
- холода (замораживание);
- теплоты (кипячение, сухой и влажный горячий воздух, водяной пар). Высушивание губительно действует на многие микроорганизмы. Сжигание
применяют для уничтожения малоценных предметов, трупов животных, погибших от некоторых инфекционных болезней, и др. Обжигание и прокаливание широко применяют в микробиологической практике для обеззараживания инструментов, лабораторной и аптечной посуды.
Горячую воду (60-100 °С) с моющими средствами применяют при стирке и уборке для механического удаления загрязнения и микроорганизмов. Большинство вегетативных форм последних погибает через 30 мин в воде, нагретой до 60-70 °С. Кипячением при 100 °С в течение 15-45 мин обеззараживают белье, посуду, инструменты, предметы ухода за больными, игрушки и др. Анти-
микробное действие кипячения усиливает добавление в воду 2% натрия гидрокарбоната или мыла.
Радиоактивное излучение убивает все вегетативные формы микроорганизмов и их споры. Его широко применяют для стерилизации, особенно на предприятиях, выпускающих стерильную продукцию и разовые стерильные изделия медицинского назначения. Разработаны рекомендации по применению радиоактивного излучения для дезинфекции сточных вод и сырья животного происхождения.
Солнечный свет губительно действует на большинство микроорганизмов благодаря высушиванию и УФО, но действие его поверхностно, поэтому в практике дезинфекции он играет вспомогательную роль.
Обеззараживание УФ-лучами проводят с помощью специальных бактерицидных ламп в виде настенных, потолочных, переносных и передвижных установок. Они обеззараживают воздух, снижают количество микрофлоры в ЛПУ и детских учреждениях, бактериологических и вирусологических лабораториях, на предприятиях пищевой промышленности, боксах по производству вакцин и сывороток.
Сухой горячий воздух (сухой жар) оказывает бактерицидное, вирулицидное, спороцидное и инсектицидное действие. При сухожаровой обработке, особенно при температуре выше 100 °С, изменяются органические вещества, растительные и животные волокна; при температуре выше 170 °С они обугливаются. Сухой горячий воздух (160-180 °С) применяют в воздушных стерилизаторах и других аппаратах для обеззараживания лабораторной посуды, инструментов и стерилизации изделий из металла, стекла и силиконированной резины, в камерах - для дезинсекции одежды, матрацев, подушек, одеял и других вещей. Горячий воздух по эффективности уступает пару, так как действует поверхностно.
Физическое воздействие на патогенные микроорганизмы осуществляют также в специальных паровых, паровоздушных и пароформалиновых камерах. В паровых камерах дезинфицируют водяным паром при 104-111 и 118-120 °С. Насыщенный водяной пар проявляет выраженное бактерицидное, вирулицидное, фунгицидное и спороцидное действие, особенно при повышенном давлении. При повышении температуры время дезинфекции сокращают.
В пароформалиновых камерах применяют обеззараживание увлажненным горячим воздухом в сочетании с парообразным формальдегидом при 80-97 или 42-59 °С. Действующее начало паровоздушного метода - это увлажненный горячий воздух. По сравнению с сухим горячим воздухом паровоздушная смесь проявляет во много раз большую бактерицидность.
Камерный способ дезинфекции применяют при следующих инфекциях:
- чуме;
- холере;
- возвратном тифе;
- эпидемическом сыпном тифе;
- болезне Брилла;
- ку-лихорадке (легочной форме);
- сибирской язве;
- высококонтагиозных вирусных геморрагических лихорадках;
- брюшном тифе и паратифе;
- туберкулезе;
- проказе;
- дифтерии;
- микозе кожи и ногтей;
- чесотке;
- платяном педикулезе.
В паровых камерах нельзя дезинфицировать меховые, кожаные и некоторые цветные вещи ввиду возможности их порчи при температуре выше 50-60 °С. Для этих целей предназначены пароформалиновые камеры.
Химический метод
Для дезинфекции химическим методом используют препараты, содержащие:
- галоиды;
- кислород;
- фенол;
- поверхностно-активные вещества (ПАВ);
- гуанидины;
- альдегиды;
- спирты.
Химические вещества, применяемые для дезинфекции, должны отвечать следующим требованиям:
- хорошо растворяться в воде;
- уничтожать микроорганизмы в короткие сроки;
- быть активными в присутствии органических веществ;
- быть нетоксичными или малотоксичными для людей и животных;
- не иметь резкого неприятного запаха;
- не быть маркими и не портить обеззараживаемые предметы;
- не терять бактерицидные свойства при хранении как в сухом виде, так и в виде растворов;
- обладать моющим эффектом;
- быть дешевыми и удобными для транспортировки;
- разлагаться во внешней среде.
Окислители
Для бытового применения выпускают моющие, чистящие, отбеливающие и дезодорирующие препараты, проявляющие антимикробный эффект за счет введения в их состав различных дезинфицирующих средств:
- гипохлоритов кальция и натрия;
- циануратов;
- перекисных соединений и др.
Эти препараты предназначены для очистки и обеззараживания санитарнотехнического оборудования (ванны, раковины, унитазы), посуды, белья. Галоидсодержащие соединения
В качестве активно действующего вещества включают:
- хлор;
- бром;
- йод.
Часто используют хлорсодержащие препараты:
- хлорамин;
- хлорную известь;
- гипохлориты кальция и натрия;
- трихлороль.
К средствам на основе дихлоризоциануровой кислоты относят:
- пресепт;
- клорсепт;
- стеринова;
- аквасепт.
Хлор в виде газа или хлорной воды, содержащей до 7% активного хлора, применяют для обеззараживания питьевой и сточных вод. Хлорсодержащие препараты обладают самым широким спектром противомикробной активности, сравнительно быстрым действием, а также недороги. В ряде случаев применение ограничено их способностью вызывать коррозию ряда инструментов, раздражающим действием на слизистые оболочки органов дыхания и глаз, обесцвечиванием тканей и др.
Хлорсодержащие препараты разделяют на 2 большие группы:
- неорганические соединения хлора;
- органические соединения хлора.
Среди 1-й группы препаратов широко распространены гипохлориты кальция, натрия и лития. К препаратам, содержащим гипохлорит кальция, относят хлорную известь, известь белильную термостойкую, нейтральный гипохлорит кальция.
• Хлорная известь содержит 28-35% активного хлора. В виде сухого порошка ее применяют для обеззараживания жидких выделений, остатков пищи, почвы, мусора, оформленных фекалий. При хранении содержание активного хлора снижается на 1-3% ежемесячно. Хлорная известь, содержащая менее 15% активного хлора, не пригодна к использованию.
• Гипохлорит кальция нейтральный содержит 24-64% активного хлора. В воде растворяется лучше и быстрее, чем хлорная известь. Назначения их также схожи - для проведения грубой дезинфекции (выделений больных, выгребных ям, почвы, сточных вод и т.д.).
• Натрия гипохлорит получают двумя способами.
◊ Химическим способом получают гипохлорит натрия 9,5-17% (содержание активного хлора до 19%) марки А (прозрачная зеленовато-желтая жидкость, содержащая 17% активного хлора) и марки В (жидкость от желтого до коричневого цвета, содержащая 9,5-12% активного хлора). Применяют для обеззараживания сточных вод, вод плавательных бассейнов (марка А), выделений, помещений, оборудования, мебели, посуды, игрушек (марка В). Из импортных препаратов, содержащих натрия гипохлорит, следует отметить средство жавель (Франция) в виде таблеток.
◊ Электрохимическим способом (электролиз раствора натрия хлорида) получают гипохлорит натрия (0,5-0,9% активного хлора). Применяют в виде растворов, содержащих 0,125-0,9% активного хлора, для обеззараживания в ЛПУ поверхностей, игрушек, белья, посуды, санитарнотехнического оборудования, предметов ухода за больными с кишечными и капельными инфекциями бактериальной и вирусной этиологии, туберкулезом, дерматомикозами, а также отдельных объектов при сибирской язве. Эти растворы получают путем электролиза раствора натрия хлорида (поваренной соли) в электролизерах, где анодное и катодное пространства разделены диафрагмой. В анодной камере получают анолит, в катодной - католит.
К группе органических хлорсодержащих препаратов относят хлорамины. В анодной камере получают анолит (дезинфекционное средство), в катодной - католит (моющее средство).
• Хлорамин Б и хлорамин ХБ (содержат 21-29% активного хлора). Применяют в виде неактивированных 0,2-5% растворов и активированных аммиаком или аммонийными солями 0,5-4% растворов. Используют для обеззараживания белья, посуды, мокроты, изделий медицинского назначения, помещений, оборудования, мебели, предметов ухода за больными, кожи рук. Неактивированные 0,2-3% растворы применяют при кишечных и капельных инфекциях бактериальной и вирусной этиологии, гриппе и острых респираторных инфекциях, 1-3% растворы - при гепатитах, энтеровирусных инфекциях, 5% растворы - при дерматомикозах, туберкулезе. Активированные 0,5-2,5% растворы - при туберкулезе, 0,5-4% - при сибирской язве. Хлорамины стойки при хранении. Срок хранения сухого порошка - 3 года, рабочих растворов - 15 сут.
• Препарат ДП-2Т (содержит 35-40% активного хлора). Применяют в виде 0,1-3% раствора для обеззараживания поверхностей, оборудования, мебели, белья, посуды, игрушек, изделий медицинского назначения, предметов ухода за больными. Растворы 0,1-5% используют при кишечных и капельных инфекциях бактериальной этиологии, 3-7% раствор - при сибирской язве.
• Натриевая (калиевая) соль дихлоризоциануровой кислоты. Используют в виде 0,05-0,3% раствора в составе композиционных препаратов пресепт, дихлор-1, циареф и других препаратов, а также таблеток аквасепт. Применяют для обеззараживания поверхностей, оборудования, мебели, белья, посуды, выделений и остатков пищи, 0,05-3% растворы - при кишечных и капельных инфекциях бактериальной этиологии, дерматозах. Таблетки аквасепт (содержат 4 мг активного хлора) применяют для обеззараживания питьевой воды, не требующей предварительной очистки, зараженной бактериями (1 таблетка на 1 л воды) и вирусами (2 таблетки на 1 л воды).
• Дихлордиметилгидантоин (содержит 68% активного хлора) входит в состав композиционных препаратов для обеззараживания воды плавательных бассейнов при остаточном активном хлоре 0,3-0,5 мг/л. Препараты сульфохлорантин и сульфохлорантин М представляют композицию на основе дихлордиметилгидантоина, содержат 16% активного хлора и моющие вещества. Применяют 0,1-0,3% растворы для обеззараживания белья, посуды, помещений, оборудования, мебели, игрушек при кишечных и капельных инфекциях бактериальной и вирусной этиологии. При концентрации 0,5% и более требуют использования средств защиты, как и при использовании других хлорсодержащих препаратов.
Галоидсодержащие соединения на основе йода и брома
• Йодонат представляет собой комплекс йода с ПАВ. В виде 4,5% растворов применяют для обеззараживания кожи рук, операционного поля.
• Дибромантин применяют для обеззараживания воды плавательных бассейнов, причем при его использовании вода не пахнет хлором.
Кислородсодержащие средства
В качестве действующего вещества включают кислород в форме перекиси водорода, перекисных соединений, надкислот.
Кроме традиционной перекиси водорода, в ЛПУ применяют комбинированные препараты, содержащие перекисные соединения или перекись водорода с различными добавками:
- ПВК;
- перамин;
- ПФК-1;
- пероксимед;
- виркон;
- перформ и др.
Кислородсодержащие препараты обладают широким спектром антимикробного действия, не имеют резкого запаха, экологичны. Применяют для дезинфекции посуды, белья, предметов ухода за больными, санитарнотехнического оборудования, изделий медицинского назначения при инфекциях бактериальной (в том числе туберкулезной), вирусной и грибковой этиологии. Некоторые препараты обладают спороцидными свойствами. Однако их применение в качестве стерилизующих средств ограничивает выраженное коррозионное действие на металлы.
• Перекись водорода (пергидроль, 30-40% раствор перекиси водорода) применяют в виде 1-6% раствора в комбинации с 0,5% моющих средств для обеззараживания посуды, помещений, оборудования, санитарного транспорта, изделий медицинского назначения, предметов ухода за больными, белья (3%) при кишечных и капельных инфекциях бактериальной и вирусной этиологии, дерматомикозах и сибирской язве (3% с 0,5% моющего средства при 50 °С либо 6-10% раствор). Для предстерилизационной очистки изделий медицинского назначения применяют 0,5% раствор с моющими средствами «Прогресс», «Лотос», «Астра», «Айна». Для стерилизации изделий медицинского назначения из стекла, резины и пластмассы используют 6% раствор.
• Надкислоты - средства, изготовленные на основе надмуравьиной и надуксусной кислот, легко смешиваются с водой и спиртом, обладают сильными окислительными свойствами. Надмуравьиную кислоту в виде рецептуры С-4 (первомур) готовят перед применением для обработки рук хирургов смешиванием пергидроля (30-33%) с муравьиной кислотой (100 или 85%), получая 2,4% раствор. Первомур в концентрации 4,8% применяют для стерилизации лигатурного шовного материала. Растворы первомура оказывают бактерицидное, вирулицидное, фунгицидное и спороцидное действие. Препараты дезоксон-1 и дезоксон-4 в основном применяют для холодной стерилизации предметов ухода за больными, изделий медицинского назначения из пластмассы, стекла, устойчивого к коррозии металла, резины.
Фенолсодержащие средства
В широкой практике для дезинфекции не применяют. Фенол как дезинфектант запрещен для применения из-за высокой токсичности и стойкого запаха. Лизол - раствор крезола в калийном мыле - используют в виде 2% раствора для дезинфекции объектов при чуме и других особо опасных инфекциях.
Катионные поверхностно-активные вещества
Из этой большой группы препаратов свойства дезинфектантов проявляют средства на основе четвертично-аммониевых соединений. Все препараты обладают хорошими моющими свойствами и предназначены для дезинфекции при
бактериальных инфекциях. Многие из них (аламинол, деконекс, денталь ББ, дюльбак, ДТБ/Л, ИД-235, санифект-128, дезэффект, велтолен и др.) разрешены для дезинфекции медицинских инструментов, так как обладают вирулицидной активностью в отношении ВИЧ и вирусов парентеральных гепатитов. Наряду с моющими свойствами важные достоинства препаратов этой группы - отсутствие резкого запаха и низкая токсичность. Поэтому их можно широко применять в помещениях ЛПУ, где длительно находятся больные и медицинский персонал.
Дезинфицирующее средство велтолен обладает широким спектром антимикробной активности в отношении грамположительных и грамотрицательных бактерий, включая микобактерии туберкулеза, возбудителей особо опасных инфекций (чума, холера, сибирская язва), анаэробные инфекции (столбняк, газовая гангрена), дерматофитии, дрожжеподобные грибы рода Candida. Кроме того, велтолен инактивирует ВИЧ, ВПГ, вирусы ВГА, ВГВ, ВГС, гриппа, парагриппа. Велтолен разрешен к применению в концентрации 0,1-1% (по действующему веществу) для дезинфекции и предстерилизационной очистки изделий медицинского назначения из металлов, резины, стекла, пластмассы (включая хирургические и стоматологические инструменты), для дезинфекции поверхностей в помещениях, белья, посуды, предметов ухода за больными и санитарно-технического оборудования в ЛПУ, объектах коммунальной службы, предприятиях общественного питания [Методические указания по применению для целей дезинфекции и предстерилизационной очистки средства велтолен ЗАО «Велт» (Оренбург, Россия) - МУ-148-113, утв. 18.11.1997 г.].
Гуанидины
Действующее начало - сложные органические соединения. Гуанидины активны в отношении грамположительных и грамотрицательных бактерий. Расширение спектра антимикробной активности происходит при сочетании гуанидинов с ПАВ.
На этой основе выпускают препараты:
- демос;
- лизоформин специаль;
- лизетол АФ;
- пливасепты 5%, обладающие широким спектром антимикробного действия;
- хлоргексидина биглюконат 20%.
Применяют 0,5-1% водные и спиртовые растворы для обеззараживания различных объектов, изделий медицинского назначения, предметов ухода за больными, рук медицинского персонала, хирургических инструментов, эндоскопической аппаратуры в ЛПУ. На основе гуанидинов разработан ряд кожных антисептиков. Кроме хлоргексидина биглюконата, пливасепта 5% с ПАВ, пливасепта 5% без ПАВ, разработаны такие, как асептинол С, асептинол спрей, АХД-200 специаль, спитадерм, биотензит дезинфектант. Полимерные производные гуанидина также относят к катионным ПАВ. Это средства бионаг-Д, фосфонаг-Д, во многом отвечающие требованиям, предъявляемым к современным дезинфекционным средствам.
Альдегидсодержащие средства
Группа препаратов, в качестве действующего начала включающих глутаровый или янтарный альдегид. Препараты этой группы обладают широким спектром антимикробного действия. Садекс, глутарал, глутарал-Н, дюльбак рас-
творимый - готовые для работы растворы, т.е. их не разводят водой и применяют только для дезинфекции и стерилизации изделий медицинского назначения, в том числе эндоскопов. Узкое целевое значение имеют препараты колдспор, дезоформ, корзолин Д, секусепт форте, септодор форте. Их применяют только для дезинфекции изделий медицинского назначения, в том числе эндоскопов. Для стерилизации эти средства не применяют. Многоцелевое назначение имеют препараты деконекс 50 ФФ, альдесал, неодишер, септо 2000, бианол. Формалин выпускают в виде 40% раствора. Для обеззараживания одежды, постельных принадлежностей, обуви в пароформалиновых камерах применяют 0,5-5% раствор. Положительные качества альдегидсодержащих препаратов - это отсутствие либо низкая коррозионная активность в отношении металлов, отсутствие резкого запаха (за исключением формалина), широкий спектр антимикробного действия. Высокая антимикробная активность альдегидсодержащих средств позволяет использовать их в качестве дезинфектантов при генеральных уборках в хирургических, процедурных кабинетах и т.д., однако они более токсичны, чем кислородсодержащие средства.
Недостатки этой группы препаратов - необходимость работы с ними в отсутствие пациентов и выраженная способность фиксировать органические загрязнения (кровь, слизь, гной и т.д.), что требует предварительной отмывки изделий медицинского назначения в воде с помощью ватно-марлевых тампонов.
Спирты
Группа препаратов, приготовленных на основе этанола, пропанола, изопропанола, применяемых для дезинфекции поверхностей, инструментов, а также в качестве кожных антисептиков. Спирт этиловый выпускают в виде 90-95° препарата. Для дезинфекции кожных покровов, изделий медицинского назначения и эндоскопов применяют 70°этиловый спирт. Он обладает бактерицидным (не уничтожает микобактерии туберкулеза) и вирулицидным (включая ВИЧ и вирусы гепатитов) действиями, а также свойством фиксировать органические загрязнения на изделиях медицинского назначения.
На основе спиртов разработаны препараты для обеззараживания инструментов в стоматологической практике:
- ИД-220;
- гротанат (ванна для боров).
Последний можно применять для предстерилизационной очистки инструментов и их одновременной дезинфекции.
Кожные антисептики на основе спиртов в сочетании с другими добавками - готовые к применению препараты, за исключением дамисепта, представляющего собой одноразовые салфетки, пропитанные кожным антисептиком стериллиумом, для гигиенической обработки рук. Широкую сферу применения в качестве кожных антисептиков имеют кутасепт Ф, октенидерм и спитадерм, так как их используют для обеззараживания кожи операционного и инъекционного полей, рук хирургов и гигиенической дезинфекции рук медицинского персонала.
Качество и эффективность дезинфекции
На эффективность дезинфекции влияют различные факторы, причем каждый из них может уменьшить активность процесса обеззараживания и даже свести его к нулю:
- физико-химические свойства дезинфектанта (способность воздействовать на микроорганизм, концентрация, растворимость в воде, температура, кислотность и т.д.);
- устойчивость микроорганизмов к различным средствам дезинфекции;
- особенности обрабатываемых объектов (качество материалов, конструктивные особенности, массивность загрязнения органическими веществами);
- массивность микробного обсеменения объектов, подлежащих дезинфекции;
- способы дезинфекционной обработки (крупнокапельное или аэрозольное орошение, протирание или погружение в раствор дезинфектанта);
- время воздействия препарата (экспозиция).
При планировании расхода дезинфицирующих средств для обработки отдельных объектов следует проводить расчет исходя из норм расхода раствора на 1 м2 обрабатываемой площади:
- при протирании - 0,1 л/м2;
- при орошении - 0,3 л/м2;
- для замачивания 1 кг белья - 4 л/м2;
- на 1 комплект столовой посуды - 2 л/м2;
- на 1 кг выделений и остатков добавляют раствор в соотношении 1:2 (по объему).
Средний объем вещей для камерной обработки - 15 кг. Для применения химических средств дезинфекции предложены различные типы распылителей:
- опрыскиватель ручной (ОР-0,5) с производительностью 0,07 л/мин;
- агрегат высокого давления (0,4-0,9 л/мин);
- садовый электроопрыскиватель (ЭОС-3, ЭОС-5, ЭОС-7);
- гидропульт (1,7 л/мин);
- опрыскиватель ранцевый (34 мл за 1 нажатие) и др.
Качество организации работы по заключительной дезинфекции определяют по следующим показателям:
- процент охвата заключительной дезинфекцией эпидемических очагов (не менее 95% очагов, подлежащих дезинфекции);
- выполнение заключительной дезинфекции в эпидемических очагах в течение суток с момента госпитализации или изоляции больного из организованного коллектива (своевременность заключительной дезинфекции не менее 90%);
- процент проведенных камерных дезинфекций (не менее 95%);
- контроль качества заключительной дезинфекции (визуальный и лабораторный - одновременно) не менее чем в 10% организованных коллективов в период от 1 до 3 ч после окончания дезинфекции;
- отбор для контроля качества заключительной дезинфекции в очаге не менее 10 смывов, 2 проб дезинфицирующих средств и растворов, 10 экспресс-проб на остаточное количество дезинфицирующих веществ;
- бактериологический контроль дезинфекционных камер не реже 1 раза в квартал.
При высеве микрофлоры не более чем в 0,5% смывов и неудовлетворительных экспресс-пробах на остаточные дезинфицирующие вещества не более чем
в 0,5% случаев заключительная дезинфекция считается удовлетворительной. При высеве патогенной микрофлоры дезинфекция считается неудовлетворительной. Контроль текущей дезинфекции с применением лабораторных методов обязателен в очагах брюшного тифа, дизентерии, туберкулеза, дифтерии, грибковых заболеваний. Контроль осуществляют специалисты дезинфекционных станций или центров санитарно-эпидемиологического надзора не менее чем в 1% очагов.
Дезинфекция и стерилизация
в лечебно-профилактических учреждениях
Дезинфекционные мероприятия в ЛПУ (больницы, поликлиники, диспансеры и т.д.) проводят для предупреждения распространения ВБИ среди пациентов и персонала.
Ответственность за организацию и проведение дезинфекционных мероприятий (дезинфекция, стерилизация, дезинсекция, дератизация) в ЛПУ несет руководитель учреждения, руководствующийся действующими инструктивнометодическими документами и приказами. Для уменьшения опасности заражения пациентов при физиотерапевтических, бальнеологических процедурах (гидротерапия и т.п.), а также при пребывании в стационаре, посещении поликлиники, где возможна реализация горизонтальных (фекально-орального, воздушно-капельного, контактно-бытового и трансмиссивного) механизмов передачи инфекции, в ЛПУ должны проводить целенаправленную профилактическую, очаговую текущую и заключительную дезинфекции.
При организации дезинфекционных мероприятий в ЛПУ необходимо учитывать специфику стационара и знать объекты, часто и массивно колонизируемые возбудителями ВБИ, их устойчивость к лечебным и дезинфицирующим средствам. Для определения сроков и кратности обработки различных объектов целесообразно использовать данные бактериологического контроля за микробной обсемененностью объектов внешней среды санитарно-показательными микроорганизмами, определить интенсивность их колонизации микроорганизмами после проведенной дезинфекции, учитывая функциональное назначение помещений в отделении, больнице и др. Часто и массивно контаминированы поверхности санитарно-технического оборудования (раковины, краны, унитазы, ванны и др.), холодильники, тумбочки, столы, детские весы, перевязочный материал, постельное и нательное белье, медицинские инструменты, различные изделия медицинского назначения (зонды, катетеры, дренажные трубки, иглы, системы переливания крови и т.д.), а также предметы ухода за больными, кожа рук медицинского персонала и больных. Все эти объекты подлежат обеззараживанию с применением физического и химического методов дезинфекции. Часто проведение дезинфекционных мероприятий в ЛПУ осложняется необходимостью их выполнения в присутствии больных и персонала. Поэтому для этих целей стараются применять дезинфицирующие средства без сильного, неприятного запаха в активных концентрациях, не вызывающих неприятных побочных действий.
При проведении текущей дезинфекции в ЛПУ в присутствии больных запрещено обеззараживание поверхностей орошением растворами дезинфицирующих средств, а также применение средств, проявляющих раздражающее или сенсибилизирующее действие при протирании.
Заключительную дезинфекцию следует проводить в отсутствие больных; при этом персонал, выполняющий обработку, должен использовать средства личной защиты (респиратор, перчатки, фартук). Приготовление растворов дезинфицирующих средств, их хранение, обеззараживание объектов способом погружения следует проводить в специально выделенном и оборудованном помещении.
Для дезинфекции в ЛПУ применяют средства, содержащие в качестве действующих веществ активный кислород (перекисные соединения и др.), хлорсодержащие соединения, ПАВ, реже спирты (этанол, пропанол и др.), а также многокомпонентные дезинфицирующие средства, содержащие разные дезинфицирующие вещества и функциональные добавки (антикоррозионные, дезодорирующие, моющие и др.). Применение дезинфицирующих средств с моющими свойствами позволяет совместить обеззараживание объектов с их мойкой.
Поверхности приборов, оборудования и других объектов в помещениях дезинфицируют протиранием тканевой салфеткой (ветошью), смоченной раствором дезинфицирующего средства. Орошение поверхностей осуществляют с помощью ручного распылителя типов «Росинка», «Квазар», гидропульта и других распылительных устройств (установок). Норма расхода дезинфицирующего средства составляет в среднем 100-300 мл/м2. Воздух в помещениях обеззараживают (УФО) с помощью бактерицидных ламп, аэрозольным методом с помощью специальной распыляющей аппаратуры и применением дезинфицирующих средств, имеющих разрешение на такой способ использования (велтолен, пемос-1).
Предметы ухода за больными (судна, мочеприемники и др.) дезинфицируют погружением в раствор дезинфицирующего средства. Подкладные клеенки, резиновые грелки и др. - протиранием ветошью, смоченной раствором дезинфицирующего средства, или погружением в его раствор с последующим промыванием водой.
Загрязненную (например, кровью) лабораторную посуду обеззараживают погружением в раствор дезинфицирующего средства по режимам, рекомендованным Приказом МЗ СССР № 408 от 12.07.1989 г. для дезинфекции при парентеральных вирусных гепатитах. Затем посуду промывают водой. Обеззараживание нательного и постельного белья проводят в прачечных.
Постельные принадлежности (матрацы, подушки, одеяла), одежду и обувь больного подвергают камерной дезинфекции. Во фтизиатрических стационарах и отделениях, кожно-венерологических диспансерах и специализированных дерматологических больницах дезинфекцию проводят в соответствии с методическими указаниями. В инфекционных стационарах - в соответствии с Приказом МЗ РФ № 916 от 04.08.1993 г.
Обработка большинства изделий медицинского назначения включает 3 основных этапа:
- дезинфекцию;
- предстерилизационную очистку;
- стерилизацию.
Стерилизация - это полное освобождение предмета от микроорганизмов (патогенных и непатогенных, в том числе и их спор) воздействием на него физических или химических агентов.
Стерилизации подвергают все изделия, соприкасающиеся с раневой поверх-
ностью, контактирующие с кровью (собственной кровью пациента или вводимой в него) и инъекционными препаратами, а также изделия, соприкасающиеся в процессе эксплуатации со слизистой оболочкой и способные вызывать ее повреждение.
Цель стерилизации - уничтожение всех микроорганизмов на изделиях медицинского назначения и в лекарственных препаратах, свободных (по условиям их применения) от патогенных и непатогенных микроорганизмов. Изделия медицинского назначения многократного использования стерилизуют в учреждениях, где их применяют, одноразовые изделия - на промышленных предприятиях.
Физические методы стерилизации (табл. 1-14) включают обработку сухим горячим воздухом, паром под давлением, фильтрование (для термолабильных жидкостей), мембранную фильтрацию, радиационный метод.
Таблица 1-14. Дезинфекция физическим методом
При паровом, воздушном и газовом методах изделия обычно стерилизуют в упакованном виде, используя упаковочные материалы, разрешенные к применению в установленном порядке. При применении парового метода также используют стерилизационные коробки без фильтра и с фильтром. При воздушном методе допустима стерилизация инструментов в неупакованном виде.
Паровым методом стерилизуют:
- общие хирургические специальные инструменты;
- детали приборов и аппаратов из металлов, устойчивых к коррозии, и стекла;
- шприцы с пометкой 200 °С;
- хирургическое белье;
- перевязочный и шовный материал (нити хирургические шелковые крученые, нити хирургические капроновые крученые, шнуры хирургические полиэфирные);
- изделия из резины (перчатки, трубки, катетеры, зонды и т.д.), латекса, отдельных видов пластмасс (табл. 1-15).
Таблица 1-15. Стерилизация паровым способом (водяной насыщенный пар под избыточным давлением)
Окончание табл. 1-15
Примечание.
ПВХ - поливинилхлорид.
* Время стерилизационной выдержки, соответствующее значению температуры стерилизации с учетом предельных отклонений температуры в загруженной стерилизационной камере, указано в паспорте на конкретную модель стерилизатора.
** Конкретные виды зарубежных упаковочных материалов однократного применения, рекомендованные для стерилизации паровым методом, а также соответствующие сроки сохранения в них стерильности изделий указаны в методических документах по применению упаковок данных фирм. Срок сохранения стерильности изделий, простерилизованных в стерилизационной коробке без фильтра, в двойной мягкой упаковке - 3 сут, в пергаменте, бумаге мешочной непропитанной, бумаге мешочной влагопрочной, бумаге упаковочной высокопрочной, бумаге крепированной, стерилизационной коробке с фильтром - 20 сут. Кратность использования пергамента, бумаги мешочной непропитанной, бумаги мешочной влагопрочной и бумаги крепированной - 2 раза, бумаги упаковочной высокопрочной - 3 раза.
Воздушным способом стерилизуют хирургические, гинекологические, стоматологические инструменты, детали приборов и аппаратов, в том числе изготовленные из не устойчивых к коррозии металлов, шприцев с пометкой 200 °С, инъекционные иглы, изделия из силиконированной резины. Перед стерилизацией воздушным методом изделия после предстерилизационной очистки обязательно высушивают в сушильном шкафу при температуре 85 °С (табл. 1-16).
Таблица 1-16. Стерилизация воздушным способом (сухой горячий воздух)
* Конкретные виды зарубежных упаковочных материалов однократного применения, рекомендованные для стерилизации воздушным методом, а также сроки сохранения в них стерильности изделий указаны в методических документах по применению упаковок. Срок сохранения стерильности изделий, простерилизованных в бумаге мешочной влагопрочной, бумаге крепированной, - 20 сут. Кратность использования бумаги мешочной влагопрочной, бумаги крепированной - 2 раза, бумаги упаковочной высокопрочной - 3 раза. Изделия, простерилизованные без упаковки, помещают на стерильный стол и используют в течение одной рабочей смены.
В гласперленовых стерилизаторах (стерилизующая среда - нагретые до 190-250 °С стеклянные шарики) стерилизуют инструменты простой конфигурации, полностью состоящие из металла, применяемые в стоматологии (зубные боры, алмазные головки, дрильборы и др.).
Химические методы стерилизации (табл. 1-17) включают газовый метод (газ состоит из окиси этилена и бромистого метила) и погружение в растворы химических стерилизующих агентов. После химической стерилизации изделия необходимо дегазировать (в случае газовой обработки) или тщательно отмыть.
• Газовым методом стерилизуют изделия из различных материалов. В качестве стерилизующих агентов применяют окись этилена, смесь ОБ (смесь
Таблица 1-17. Стерилизация растворами химических средств
Продолжение табл. 1-17
Продолжение табл. 1-17
* Концентрация растворов средств бианол, лизоформин-3000, кодд-спор, гигасепт ФФ приведена соответственно препарату, средства первомур - по суммарному содержанию 30-33% перекиси водорода и 100% муравьиной кислоты, растворов остальных средств - по действующему веществу. ** Допускается использование только медицинской перекиси водорода.
*** Температура раствора в момент погружения в него изделий; в процессе стерилизации указанную температуру не поддерживают.
**** Электрохимически активированные растворы с рН=2-8,4 в зависимости от типа анолита (кислый анолит, нейтральный анолит, нейтральный анолитАНК), вырабатываемые в установках ЭХА-30, СТЭЛ-МТ-1, СТЭЛ-МТ-2, СТЭЛ-4Н-60-01, СТЭЛ-4Н-60-02, СТЭЛ-1-ОАК-120-01, СТЭЛ-ЮН-12001. Анолиты используют без разведения. Конкретные режимы стерилизации приведены в методических указаниях по применению растворов, вырабатываемых конкретными установками.
окиси этилена и бромистого метила), формальдегид, озон. Перед стерилизацией газовым методом изделия после предстерилизационной очистки вытирают чистой салфеткой либо подсушивают при комнатной температуре до исчезновения видимой влаги. Стерилизацию осуществляют при температуре 18-80 °С (в зависимости от типа стерилизатора и вида стерилизуемого изделия) в соответствии с режимами, регламентированными соответствующими методическими документами. • В связи с появлением изделий из термолабильных материалов, снабженных оптическими и прочими устройствами, в медицинской практике начали широко применять стерилизацию с помощью растворов химических средств. Преимущества метода стерилизации растворами включают щадящие температурные режимы обработки термолабильных изделий и возможность их обеззараживания на местах. При стерилизации растворами химических средств применяют стерильные емкости. После стерилизации все манипуляции проводят, строго соблюдая правила асептики. Изделия промывают в стерильной жидкости (питьевая вода, 0,9% раствор натрия хлорида). Промытые стерильные изделия хранят в стерильной коробке не более 3 сут. Выбор адекватного метода стерилизации зависит от особенностей стерилизуемых изделий:
- вида материала;
- необходимости длительного сохранения стерильности;
- оперативности использования и др.
В практике работы ЛПУ широкое распространение получил физический метод стерилизации с использованием насыщенного пара и сухого горячего воздуха (паровые и воздушные стерилизаторы).
На эффективность стерилизации значительно влияет качество предстерилизационной очистки изделий и санитарного состояния помещения, где ее проводят. Предстерилизационную очистку изделий проводят для удаления с них белковых, жировых и механических загрязнений, а также остатков лекарственных препаратов. Ее осуществляют после дезинфекции или одновременно с ней (в зависимости от применяемого средства). Все новые инструменты, еще не применявшиеся для работы с пациентами, должны пройти предстерилизационную обработку с целью удаления промышленной смазки и механических загрязнений.
Предстерилизационную очистку и стерилизацию изделий проводят в централизованных стерилизационных в соответствии с действующими методическими рекомендациями. При отсутствии централизованных стерилизационных эти этапы обработки осуществляет обученный персонал в отделениях стационара в специально выделенных помещениях, обеспечивающих работу в асептических условиях.
Предстерилизационную очистку осуществляют ручным или механизированным (с применением моечных машин или установок) способом.
Очистка медицинского инструментария включает следующие этапы:
- предварительное ополаскивание в проточной воде;
- замачивание в одном из моющих растворов (например, «Биолот», «Астра», «Лотос» и др.);
- промывание каждого инструмента щеткой в моющем растворе;
- ополаскивание под проточной водой;
- ополаскивание дистиллированной водой;
- вакуумную сушку.
Качество предстерилизационной очистки изделий оценивают по отсутствию следующих положительных проб:
- на присутствие крови - постановкой азопирамовой или амидопириновой пробы;
- на остаточное количество щелочных компонентов моющих средств - постановкой фенолфталеиновой пробы.
Срок хранения простерилизованных медицинских изделий:
- в пакетах из полиэтиленовой пленки - 5 лет;
- в биксах без фильтров - 3 сут;
- в двойной бязи - 3 сут;
- в биксах с бактериальными фильтрами - 20 сут;
- в крафт-пакетах и пакетах из пергамента - 20 сут;
- в комбинированных (ламинат и бумага) прозрачных пакетах, закрытых термосшиванием, - 1 год;
- в защитном пакете-футляре из пленки, заполненном изделиями, простерилизованными в упаковке стерикинг, закрытом липкой лентой, - 5 лет.
Обеззараживание рук медицинского персонала, операционного и инъекционного полей пациентов
Для обеззараживания кожных покровов пациентов и рук медицинских работников применяют кожные антисептики.
В соответствии с назначением антисептики подразделяют на следующие группы:
- для гигиенической обработки рук медицинского персонала;
- для обработки рук хирургов (а также операционной сестры, акушерки и других специалистов, участвующих в операции или приеме родов);
- для обработки операционного и инъекционного полей, локтевых сгибов доноров.
Гигиеническая обработка рук медицинского персонала необходима до и после проведения различных манипуляций.
Обработка рук хирургов
Проводят после предварительного мытья рук (кистей и предплечий) с мылом (двукратно намыливая их). Применять щетки для мытья рук не рекомендуют. Антисептик наносят на вытертые насухо стерильной салфеткой руки, тщательно втирая его в кожу кистей и предплечий. Стерильные перчатки надевают после высыхания антисептика.
Обработку операционного и инъекционного полей, локтевых сгибов доноров проводят протиранием стерильным тампоном, смоченным антисептиком.
Перечень антисептиков, режимы и методики применения приведены в табл. 1-18.
Таблица 1-18. Обеззараживание кожи рук медицинского персонала, операционного, инъекционного полей пациентов и др.
Окончание табл. 1-18
Примечание.
Возможно применение других кожных антисептиков, разрешенных к применению в установленном порядке. Для устранения запах хлора следует протереть кожу салфеткой, смоченной стерильным раствором тиосульфата натрия. При видимых загрязнениях кровью на коже рук не следует использовать для обработки спирт этиловый и другие спиртосодержащие антисептики (лизанин, велтосепт, АХД-2000-специаль, хлоргексидина глюконат в 70% этиловом спирте, дезинфицирующие салфетки велтосепт-С, велталекс). Эти антисептики эффективны при отсутствии видимых загрязнений на коже.
Контроль качества и эффективности дезинфекции и стерилизации
Контроль за дезинфекционными и стерилизационными мероприятиями в ЛПУ проводят специалисты центров санитарно-эпидемиологического надзора и дезинфекционных станций одновременно с контролем санитарно-противоэпидемического режима.
Его осуществляют визуально, бактериологическим и химическим методами, а также с помощью специальных приборов и оборудования. Контроль проводят со следующей кратностью:
- в стационарах (диспансерах) инфекционного и хирургического профиля, родовспомогательных, детских, стоматологических учреждениях и подразделениях, станциях (отделениях) переливания крови, станциях (отделениях) скорой медицинской помощи - не реже 1 раза в квартал;
- в стационарах терапевтического профиля, поликлиниках, клинических (иммунологических, серологических, биохимических и т.п.) лабораториях - не реже 2 раз в год;
- за дезинфекционными камерными блоками, дезинфекционными камерами, централизованными стерилизационными, складами и помещениями для централизованного приготовления растворов - не реже 1 раза в квартал.
Особое внимание обращают на правильность выбора средств и методов обеззараживания, эффективность работы моющей, дезинфекционной и стерилизационной аппаратуры, своевременность и объем проведенных мероприятий, правильность условий хранения средств дезинфекции и стерилизации, их приготовления и использования, оснащение мягким и твердым инвентарем, аппаратурой, изделиями медицинского назначения и т.д.
Объекты исследований при проведении бактериологического контроля санитарного состояния помещений централизованных стерилизационных - воздух и поверхности различных предметов (рабочих столов, оборудования, инвентаря, аппаратуры).
Показатели качества дезинфекции:
- высев непатогенной микрофлоры с объектов контроля не более чем в 2% отобранных бактериологических смывов;
- определение заниженных концентраций дезинфицирующих растворов не более чем в 5% отобранных проб;
- выявление неудовлетворительных экспресс-проб на остаточное количество дезинфицирующих веществ не более чем в 2% поставленных проб каждого вида;
- соответствие тестового бактериологического контроля режиму камерной дезинфекции.
Показатели качества предстерилизационной очистки:
- отсутствие положительных проб на остаточное количество крови;
- отсутствие положительных проб на остаточное количество щелочных компонентов синтетических моющих веществ и остатков масляных лекарственных средств.
Контролю подлежит не менее 1% каждого вида изделий, обработанных за сутки. При неудовлетворительных пробах данная партия изделий подлежит повторной обработке до их полной очистки и отмывки.
Показатели качественной работы стерилизаторов:
- отсутствие роста микроорганизмов при посеве всех биологических тестов в питательные среды;
- изменение исходного состояния (цвета, агрегатного состояния) химических индикаторов и отсутствие высева микрофлоры со стерильных изделий.
Дезинсекция
Дезинсекция - это комплекс мероприятий, направленных на уничтожение членистоногих - переносчиков возбудителей инфекционных (паразитарных) болезней и защиту от них человека, помещений и территорий или имеющих другое санитарно-гигиеническое значение.
Выделяют неспецифическую (профилактическую) и истребительную, в том числе и очаговую, дезинсекцию. Профилактические мероприятия направлены на создание неблагоприятных условий для жизни и размножения членистоногих, предупреждение попадания их в помещения и нападения на человека (личная гигиена, гигиена жилищ, осушение болот, очистка и углубление рек и другие гидротехнические работы).
- Очаговая дезинсекция обязательна в очагах трансмиссивных инфекционных (паразитарных) болезней и чесотки, а также при кишечных инфекциях при наличии в очаге мух.
- Профилактическая дезинсекция необходима для предупреждения выплода членистоногих, а также заселения ими жилых и хозяйственных построек.
Борьбу с членистоногими преимущественно проводят силами дезинфекционных станций и специализированных отделений (отделов) ФГУЗ Роспотребнадзора. Режимы и кратность обработки, выбор средств и способов дезинсекции зависят от вида насекомых, их численности, санитарного состояния объекта или очага и регламентированы нормативными документами.
Характер дезинсекционных мероприятий при разных инфекциях зависит от механизма передачи возбудителей, в частности от биологических особенностей переносчиков. Например, при кишечных инфекциях дезинсекционные мероприятия направлены на снижение численности мух - механических переносчиков возбудителей. При инфекциях дыхательных путей дезинсекционные мероприятия не проводят. В то же время защитные и истребительные дезинсекционные мероприятия играют основную роль в борьбе с кровяными инфекциями и их профилактике. При этом учитывают не только вид, экологическую специфику переносчиков и их ареал, но и возможность формирования устойчивости к применяемым дезинсекционным средствам. Например, дезинсекционные мероприятия обязательны при чесотке для уничтожения чесоточного клеща на одежде, белье, постельных принадлежностях и других объектах в окружении больного.
Методы дезинсекции
Для уничтожения насекомых и клещей используют следующие методы дезинсекции:
- механический;
- физический;
- химический;
- биологический;
- комбинированный.
Механический метод
Механический метод предупреждает залет и проникновение членистоногих в помещение. Возможно помещение сеток на окна и двери, а также уничтожение членистоногих разными способами (мухоловками, липкими лентами и др.).
Физический метод
Физический метод широко применяют в виде сухого горячего воздуха в камерах.
Для освобождения хлопчатобумажной, шерстяной одежды и постельных принадлежностей от платяных и головных вшей, а также чесоточного клеща применяют следующие режимы паровоздушной дезинсекции:
- при загрузке 5 комплектов на 1 м2 площади пола камеры (30 кг) вещи обрабатывают при 57-59 °С в течение 30 мин;
- при загрузке 10 комплектов (60 кг) - при 80-85 °С в течение 5 мин. Для обработки кожаной, меховой одежды и обуви применяют воздушный
режим - 4 комплекта (24 кг) обрабатывают 90 мин при 49-51 °С.
В паровую камеру загружают 10-12 комплектов на 1 м2 площади тележки или 50 кг на 1 м2 камеры и обрабатывают при 100 °С в течение 5 мин, при 104- 111 °С и давлении пара 0,2-0,5 кгс/см3 - 10 мин.
Химический метод
Химические вещества, применяемые для уничтожения насекомых (инсектициды), клещей (акарициды), личинок (ларвициды), яиц насекомых и клещей (овоциды), в зависимости от целей и задач дезинсекции могут быть приготовлены в виде порошков (дустов), эмульсий, суспензий, мыл, мазей, растворов, отравленных приманок, аэрозолей, специальных карандашей. Применяют фосфорорганические препараты, карбаматы, пиретроиды и другие группы химических соединений, а также отпугивающие вещества (репелленты).
Учитывая пути проникновения в организм членистоногих, инсектициды разделяют:
- на контактные, проникающие через покровы тела;
- кишечные - через органы пищеварения;
- фумиганты - через трахейную систему. Фосфорорганические вещества
• Карбофос (малатион) применяют 4% дуст и эмульгирующийся 50% концентрат. Для уничтожения личинок мух используют 0,5-1% водную эмульсию; постельных клопов - 1% водную эмульсию; синантропных тараканов и блох - 4% дуст и 1% водную эмульсию; вшей - 0,1-0,15% водную эмульсию; комаров - 0,5-1,5-2% водную эмульсию; иксодовых клещей - 4% дуст и 1,5% водную эмульсию.
• Сульфидофос (байтекс, фентион) применяют 50% концентрат эмульсии, 2% дуст сульфолан, препарат сульфоцин (1% дуста, 0,7% сульфидофоса, 0,3% неопинамина). Для импрегнации белья при борьбе с платяным педикулезом, дезинсекции белья, уничтожения головных вшей у взрослых используют 50% концентрат эмульсии.
• Актеллик применяют 50% концентрат эмульсии, используют для уничтожения блох, тараканов, клопов, мух, имаго, комаров.
Карбаматы
Эти средства относят к производным карбаминовой кислоты. Используют широко пропоксур в составе инсектицидов серии байгон в виде концентрата эмульсии, дуста, приманок, наполнителей аэрозольных баллонов.
Пиретроиды
Инсектициды из этой группы в настоящее время широко используют. Эти средства относят к ядам контактного действия, угнетающим нервно-мышечную систему членистоногих. Их делят на пиретроиды 1-го и 2-го поколения. Инсектициды 2-го поколения обладают более длительным остаточным действием, фотостабильностью, более высокой инсектицидной активностью, отсутствием острой токсичности для млекопитающих. Пиретроиды обладают широким спектром инсектицидной активности, действуют как на различные виды членистоногих, так и на различные стадии метаморфоза. Широко используются препараты биорин, дельтар, медифокс, цифокс, окситокс, зольфак, раптор-мелок и др.
Другие группы химических соединений
• Буру (борная кислота) применяют в виде пищевых приманок для борьбы с тараканами и рыжими домовыми муравьями.
• Бутадион используют в практике медицинской дезинсекции в виде порошка и таблеток. В виде таблеток при педикулезе назначают принимать внутрь, при этом кровь человека становится токсичной для вшей.
• Фторсульфонамиды входят в состав средств алстар, флюрогард и других средств, используемых в виде приманок. Относятся к малоопасным для теплокровных веществам.
• Репелленты (отпугивающие вещества) можно условно назвать средствами дезинсекции. Их наносят без втирания на открытые участки тела; допустимо применение до 2-3 раз в сутки. Кроме того, репелленты применяют и для обработки одежды, сеток, палаток и других предметов.
◊ Сетка репеллентная из хлопчатобумажного сетеполотна (размер ячеек 13×13 мм), обработанная водной эмульсией (диэтил-2,5-диметилбензамид 98%) ДЭКСА-98, защищает от гнуса. Срок защитного действия до 90 сут.
Биологический метод
В качестве биологических средств дезинсекции используют следующие препараты.
• Бактицид (на основе эндотоксина Bacillus thuringiensis) применяют для уничтожения личинок комаров, обрабатывая места их выплода из расчета 0,5-2 кг/га в зависимости от климатической зоны и вида комаров. Остаточное действие сохраняется от 2 до 10 сут.
• Димилин (дифторбензурон) - 25% смачивающийся порошок, который относится к ингибиторам синтеза хитина, размягчает и расслаивает кутикулу. Применяют для обработки субстратов, содержащих личинок синантропных мух (0,2-0,5%) и самок рыжих тараканов (0,5%), а также для обработки водоемов из расчета 10-50 г/га в зависимости от характера водоема и вида насекомых.
• Другая группа средств вызывает гормональные нарушения (аналоги ювенильного гормона). Метопрен вызывает развитие нежизнеспособных личинок комаров.
• В качестве биологического средства уничтожения комаров в местах их выплода используют также хищных рыб, например гамбузию (Gambusia affinis).
Аттрактанты
Вещества природного либо синтетического происхождения, привлекающие членистоногих для их изучения или уничтожения с помощью инсектицидов либо механическим методом (например, использование липкой поверхности).
Основные эпидемиологические критерии качества дезинсектантов:
- соотношение токсической дозы для человека и животных с летальной дозой для членистоногих;
- активность и стадии развития различных видов членистоногих;
- стойкость во внешней среде и др.
Основной критерий качества репеллентов - длительность защиты от укусов членистоногих.
Основной критерий оценки качества проводимых дезинсекционных мероприятий - плотность членистоногих на объектах или территории после обработки либо их полное отсутствие. Насекомых подсчитывают при отлове в контрольных точках с помощью липких лент, а также по числу нападающих на человека кровососущих насекомых за единицу времени. Численность клещей на территории оценивают в расчете на 1 флагочас сбора.
Дератизация
Дератизация - это комплекс мероприятий по борьбе с грызунами - носителями возбудителей инфекционных (паразитарных) болезней, а также причиняющими существенный экономический ущерб. Мероприятия по борьбе с грызунами делят на предупредительные (профилактические) и истребительные.
• Предупредительные мероприятия предусматривают создание условий, препятствующих проникновению, заселению и размножению грызунов в жилых домах и хозяйственных постройках, а также способствующих снижению численности грызунов в открытых станциях путем агротехнических мероприятий.
Различают городскую (поселковую) и полевую дератизацию.
• Городская дератизация. Основные мероприятия направлены на борьбу с синантропными и полусинантропными грызунами. Наиболее эффективна сплошная систематическая дератизация, предусматривающая проведение комплекса предупредительных и истребительных мероприятий в течение всего года на всех объектах населенного пункта и окружающей территории. Дератизация обязательна в очагах заболеваний людей чумой (одновременно с заключительной дезинфекцией), туляремией, лептоспирозами, иерсиниозами, по эпидемиологическим показаниям - при сальмонеллезах и других зоонозных инфекциях. В данных случаях дератизация бывает частью комплекса мероприятий по дезинфекции, дератизации и дезинсекции.
• Полевая дератизация. Основные мероприятия направлены на борьбу с дикими грызунами, главным образом носителями возбудителей природноочаговых инфекций. Обычно при этом дератизацию проводят в комплексе с дезинсекцией с целью уничтожения членистоногих - переносчиков возбудителей природно-очаговых инфекций.
Выбор средств и способов дератизации зависит от особенностей объекта, его специфики, видового состава и численности грызунов, что определяется соответствующими нормативными документами.
Истребительные мероприятия осуществляют с помощью механического, химического и биологического методов.
• Механический метод состоит в вылове грызунов специальными орудиями лова (капканами, ловушками, давилками) и может быть использован как в помещениях, так и в открытых станциях. Он безопасен для людей и сельскохозяйственных животных.
• Химический метод заключается в отравлении грызунов ядовитыми веществами - родентицидами, применяемыми в виде отравленных приманок; опыления ядами нор, ходов, троп и других посещаемых грызунами мест; газации, при которой химические вещества попадают в легкие животных при вдыхании. При использовании родентицидов следует соблюдать меры личной и общественной безопасности, особенно в детских, лечебных, пищевых и приравненных к ним специализированных объектах. В качестве химических средств дератизации используют препараты острого и хронического действия. Яды острого действия в основном используют по эпидемическим показаниям.
◊ Фосфид цинка (14-18% фосфора, 70-80% цинка и другие соединения) добавляют в приманки из зерна, хлеба, каш, белого или серого хлеба (из продуктов, повышающих кислотность содержимого желудка грызунов). Применяют для борьбы с серой и черной крысами, обыкновенной, водяной и рыжей полевками, разными видами песчанок и сусликов. Летальная доза варьирует в пределах 5-100 мг/кг в зависимости от вида грызунов. Яды острого действия запрещено применять в лечебных и детских учреждениях.
• Яды хронического действия (антикоагулянты) более длительно вызывают патологический процесс у грызунов. Родентициды антикоагулянты делятся на средства 1-го и 2-го поколений. Родентициды 1-го поколения кумулируются в организме грызунов после их неоднократного употребления с пищевыми и водными добавками. К этой группе относятся средства зерацид, ратиндан, ратифен и реацид, зоокумарин.
◊ Ратиндан в качестве действующего начала включает 0,5-2% антикоагулянта дифенацина. Предназначен в качестве составляющей части родентицидных приманок для борьбы с серыми, черными крысами, домовыми мышами в жилых и нежилых помещениях, на промышленных и других объектах, складах, в незастроенных частях населенных пунктов.
◊ Ратифен и реацид в качестве действующего начала включают антикоагулянт этилфенацин из группы 1,3-индандионов. Используют для борьбы с крысами в помещениях различного назначения.
◊ Зоокумарин - препарат из группы синтетических антикоагулянтов кумаринового ряда. Представляет собой 0,5-1% дуст либо дуст на тальке или крахмале. Применяют для дератизации в детских лечебных и оздоровительных учреждениях, где другие родентициды неприменимы.
• Антикоагулянты 2-го поколения используют в очень низких концентрациях, летальный исход наступает при малых дозах, практически после 1-й дозы препарата. К средствам этой группы препаратов относят гельдан, родеффакум и родиалон.
◊ Гельдан - родентицидный концентрат в виде геля темно-зеленого цвета. Он содержит 0,1% изоиндана - антикоагулянта индандионового ряда. Оказывает антикоагулирующее действие, изменяет проницаемость стенок кровеносных сосудов, в результате чего возникает кровоточивость, приводящая к гибели грызунов. Средство используют в приготовлении отравленных приманок для борьбы с домовыми мышами, черными и серыми крысами, рыжими, серыми и водяными полевками внутри и вокруг жилых и нежилых помещений.
◊ Зерацид в качестве действующего начала включает 0,02% дифенацин - родентицид антикоагулянтного действия.
◊ Родеффакум и родиалон - антикоагулянты 2-го поколения. Гибель серых и черных крыс наступает на 2-11-е сутки после поедания приманки. Гибель домовых мышей - на 6-12-е сутки после поедания 1-6 доз.
• При газовом методе дератизации применяют сернистый ангидрид, хлорпикрин, углекислый газ (CO2), препараты синильной кислоты, бром, метил. При газации погибают как грызуны, так и их эктопаразиты. Метод применяют в основном на морских судах, в железнодорожных вагонах, отдельно стоящих элеваторах, зерновых складах, холодильниках, мельницах и др. Сначала помещение готовят к газации, затем проводят газацию в течение определенного времени и дегазацию. Категорически запрещено использовать газовый метод в условиях ЛПУ.
• Биологический метод предусматривает использование животных (естественных врагов грызунов) и бактериологических культур, патогенных для грызунов и безопасных для людей.
В эпидемиологической практике качество родентицидов оценивают:
- по величине минимальной летальной дозы для отдельных видов грызунов;
- соотношению ее с токсичной для человека или теплокровных животных дозой;
- скорости наступления токсического эффекта;
- длительности сохранения токсичности в приманках во внешней среде и т.д.
Качество биологических средств борьбы с грызунами определяют по количеству жизнеспособных микроорганизмов, используемых в препарате или единице массы приманки.
Критерии качества дератизации как противоэпидемического мероприятия - доля обработанных объектов от числа объектов, на которых дератизация намечалась, и количество живых грызунов до и после обработки.
Потребность и результативность дератизации оценивают по количеству съеденной грызунами приманки и числу грызунов, попавших в ловушки за единицу времени.
Дезинсекция и дератизация
в лечебно-профилактических учреждениях
Дезинсекция
При проведении дезинсекционных мероприятий в стационарах следует применять инсектициды, не вызывающие аллергических реакций. В присутствии больных запрещено проводить дезинсекцию способом орошения или опыливания.
Обычно используют малолетучие, безопасные и экологически чистые препараты разных типов:
- инсектицидные гели;
- пищевые приманки;
- приманочные станции;
- микрокапсулированные препараты и др. Дезинсекция в борьбе с педикулезом и чесоткой Дезинсекционные мероприятия в борьбе со вшами включают:
- механические (вычесывание частым гребнем, стрижка или сбривание волос);
- физические (кипячение белья, проглаживание горячим утюгом, камерная дезинсекция);
- химические (применение средств для борьбы с эктопаразитами) методы уничтожения насекомых и их яиц (гнид).
Средства для уничтожения яиц вшей должны обладать овоцидным действием.
Препараты для уничтожения головных вшей
• Препараты, действующие губительно на все стадии вшей (овициды):
◊ 30 или 50% эмульгирующийся концентрат карбофоса;
◊ 50% эмульгирующийся концентрат сульфидофоса;
◊ лосьоны лонцид*, нитилон, перфолон;
◊ 20% водно-мыльная суспензия бензилбензоата.
• Препараты, не действующие на яйца (не-овициды):
◊ мыло витар;
◊ мыло антиэнтом.
• Препараты для дезинсекции белья:
◊ овициды:
- 30 или 50% эмульгирующийся концентрат карбофоса; - 50% эмульгирующийся концентрат сульфидофоса*; - дуст бифетрин-П; - средство медифокс-спер.
◊ Не-овициды: - мыло витар.
• Препараты для дезинсекции помещений:
◊ 30 или 50% эмульгирующийся концентрат карбофоса, хлорофоса;
◊ аэрозольные баллоны вираж;
◊ средство медифокс.
Обработку пациентов (больных) и их вещей при платяном или смешанном педикулезе проводят специалисты дезинфекционных отделов Центра государственного санитарно-эпидемиологического надзора и дезинфекционных станций.
При средней и большой пораженности (от 10 особей и более, включая насекомых и яйца) рекомендовано применять инсектициды-педикулициды (табл. 1-19). Обработка педикулицидами детей до 5 лет, беременных и кормящих женщин, людей с заболеваниями и повреждениями волосистых частей тела и головы (микротравмами, дерматитом, экземой и т.п.), проявлениями аллергии на медицинские и косметические средства запрещена.
* Периодически препараты обновляют в соответствии со сроком их годности, указанным в паспорте препарата.
Таблица 1-19. Инсектицидные средства для борьбы с педикулезом (Шандала М.Г. и др., 1999)
После обработки и мытья волос на голове их прополаскивают теплым 5-10% водным раствором уксусной кислоты. При необходимости обработку педикулоцидами повторяют через 7-10 сут. Белье подвергают камерной обработке согласно инструкции. Для профилактики и борьбы с педикулезом в приемном отделении ЛПУ должна быть противопедикулезная укладка.
Содержимое укладки, предназначенной для проведения противопедикулезной обработки:
- клеенчатый или хлопчатобумажный мешок для сбора вещей больного;
- клеенчатая пелерина;
- резиновые перчатки;
- ножницы;
- частый гребень (желательно металлический);
- оцинкованное ведро или лоток для сжигания или обеззараживания волос;
- машинка для стрижки волос;
- спиртовка;
- косынки (2-3 штуки);
- вата;
- столовый уксус или 5-10% уксусная кислота.
Контроль эффективности проводимых противопедикулезных мероприятий осуществляют визуальным осмотром волосистых частей тела (при необходимости волосы на голове расчесывают частым гребнем для вычесывания вшей), белья, одежды, прочих вещей и предметов.
Лечение больных чесоткой направлено на уничтожение возбудителя (чесоточного клеща человека) с использованием скабицидных препаратов, наносимых непосредственно на кожу пациента. Лечение больных и однократную обработку контактных лиц в одном очаге проводят одновременно во избежание реинвазии.
В очаге чесотки в ЛПУ необходимо проведение текущей дезинсекции с применением химических (инсектоакарициды) и физических (паровой, воздушный, кипячение) методов для уничтожения чесоточных клещей на белье, одежде, прочих вещах и предметах. Обработке подлежат полы, стулья, дверные ручки и другие предметы, с которыми мог контактировать больной чесоткой. Обработка необходима в помещениях, где проводят осмотры таких пациентов (скабиозории, приемные отделения ЛПУ, изоляторы, санитарные пропускники).
Современные средства для лечения и профилактики чесотки приведены в табл. 1-20.
Таблица 1-20. Инсектоакарицидные средства для лечения и профилактики чесотки
(Шандала М.Г. и др., 1999)
Дератизация
При дератизации в ЛПУ разрешено применение только препаратов, оказывающих на грызунов хроническое действие. Нельзя раскладывать родентициды в помещениях для приема пищи и палатах стационаров. Возможно применение механических методов борьбы (ловушки, клеевые поверхности), а также других методов, средств и препаратов, разрешенных для этих целей.
Родентицидные приманки следует раскладывать на подложки и в специальные, доступные только для грызунов емкости, исключающие разнос яда грызунами и его попадание на пищевые продукты, медикаменты и т.д. Ядовитые покрытия наносят только на вертикальные поверхности специальных
укрытий. Емкости с приманкой и укрытия должны быть пронумерованы, сданы под расписку администрации ЛПУ. По окончании дератизационных работ емкости с остатками приманки собирают в полиэтиленовые пакеты и удаляют из ЛПУ.
ИММУНОПРОФИЛАКТИКА ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Иммунопрофилактика инфекционных болезней - система мероприятий, осуществляемых в целях предупреждения, ограничения распространения и ликвидации инфекционных болезней путем проведения профилактических прививок. Профилактические прививки - это введение в организм человека медицинских иммунобиологических препаратов для создания специфической невосприимчивости к инфекционным болезням.
История современной вакцинопрофилактики началась 14.05.1796 г., когда английский врач Э. Дженнер (1749-1823) привил против натуральной оспы первого жителя Земли. В настоящее время мировое сообщество рассматривает вакцинацию как самый экономичный и доступный способ борьбы с инфекциями и как средство достижения активного долголетия для всех социальных слоев населения развитых и развивающихся стран. Накопленные данные убедительно свидетельствуют о том, что риск неблагоприятных реакций на введение современных вакцин несоизмеримо ниже, чем при возникновении соответствующей инфекции. Триумфом вакцинации стала ликвидация натуральной оспы во всем мире.
Для некоторых инфекционных болезней иммунизация служит основным и ведущим методом профилактики в силу особенностей механизма передачи возбудителя инфекции и стойкого характера постинфекционного иммунитета. В первую очередь это касается инфекций дыхательных путей, однако при многих болезнях с другим механизмом передачи вакцинация населения - решающее направление их профилактики. Например, полиомиелит и столбняк новорожденных стали управляемыми лишь после получения и широкого применения соответствующих вакцин. Их эффективность позволила в настоящее время поставить задачу их полной ликвидации.
Вакцинация как профилактическая мера показана при острых инфекциях, протекающих циклически и быстро заканчивающихся выработкой иммунитета (корь, дифтерия, столбняк, полиомиелит). Она недостаточно эффективна при затяжных инфекциях (например, бруцеллезе) и бесперспективна при хронических инфекциях (трахома, сифилис, проказа).
Вакцинация детей против туберкулеза приводит к развитию иммунных реакций. Попадая в организм прививаемого вакциной Кальметта-Герена (БЦЖ) ребенка, возбудитель туберкулеза обычно не вызывает тяжелых поражений, развивающихся в результате первичного заражения (туберкулезного менингита, милиарного туберкулеза, казеозной пневмонии, обширных инфильтратов в легких с образованием первичных каверн). Вместе с тем БЦЖ не предохраняет от заражения туберкулезом, т.е. от проникновения микобактерий аэрогенным или алиментарным путем и развития первичной туберкулезной инфекции, сопровождающейся возникновением локальных форм первичного туберкулеза у 7-10% заразившихся. Не снижая интенсивности рас-
пространения инфекции, вакцинация БЦЖ оказывает сравнительно слабое влияние на глобальные результаты борьбы с туберкулезом. Ее следует рассматривать как дополнительный компонент в национальных противотуберкулезных программах. Быстрое выявление заболеваний и эффективное лечение больных остаются наивысшими приоритетами в борьбе с туберкулезом во многих странах с низким уровнем заболеваемости (США, Канада, Бельгия, Дания, Испания, Италия). В этих странах вакцинацию проводят в группах повышенного риска. Заболеваемость в России выросла за последние годы в несколько раз, что не позволяет отказаться от вакцинации в плановом порядке. Прививки БЦЖ, включенные в РПИ, считают обязательными в 150 странах и рекомендованы в 177 странах и территориях.
Важно учитывать длительность иммунитета, вырабатывающегося в естественных условиях. При инфекциях, сопровождающихся формированием длительного или пожизненного иммунитета, после естественной встречи с возбудителем можно ожидать эффекта от вакцинации (корь, полиомиелит, дифтерия и др.), тогда как при инфекциях с кратковременной невосприимчивостью (1-2 года при гриппе А) рассчитывать на вакцинацию как ведущую меру не приходится.
Следует принимать во внимание антигенную стабильность микроорганизмов. При натуральной оспе, кори и многих других инфекциях возбудитель обладает антигенной стабильностью, иммунопрофилактика этих болезней вполне оправдана. С другой стороны, при гриппе, особенно вызываемом вирусами типа А, а также ВИЧ-инфекции антигенная изменчивость возбудителей столь велика, что темпы конструирования вакцин могут отставать от темпов появления новых антигенных вариантов вирусов.
При инфекциях, вызываемых условно-патогенными микроорганизмами, вакцинация не может решить радикально проблему, так как исход встречи макроорганизма и микроорганизма определяется состоянием неспецифических защитных сил организма.
Многолетний опыт осуществления плановой иммунизации населения продемонстрировал несомненную эффективность этого метода борьбы с инфекционными болезнями. Достаточно напомнить, что широкое и целенаправленное применение вакцинопрофилактики натуральной оспы сделало возможным ликвидацию этой инфекции в нашей стране. Эти результаты стали основанием для принятия ВОЗ (1958) решения о создании глобальной программы ликвидации оспы. Идея массовой иммунопрофилактики сформулирована и обоснована в 1950-е годы в СССР. Большая заслуга в этом принадлежит В.М. Жданову, А.А. Смородинцеву, В.Д. Тимакову и М.П. Чумакову. Созданная по предложению нашей страны программа была успешно завершена ликвидацией в мире одной из самых опасных болезней, с древних времен вызывающей опустошительные пандемии.
Плановая иммунизация стала решающим и эффективным мероприятием в борьбе и с такими инфекциями, как дифтерия, коклюш, столбняк, корь и полиомиелит. Значительные успехи в этом направлении были достигнуты в странах Европы, США, Канаде и некоторых других, где заболеваемость дифтерией и столбняком снизилась настолько, что данные инфекции к началу 1970-х годов уже не представляли собой проблемы для здравоохранения. В настоящее время в таких странах практически сведена к нулю заболеваемость этими инфекциями, а также достигнуты весьма впечатляющие успехи
и в борьбе с другими болезнями, причиняющими значительный социальноэкономический ущерб (краснуха, гемофильная и менингококковая инфекции и др.).
Вакцинопрофилактика - это весьма результативное (рентабельное) в экономическом отношении мероприятие. Программа ликвидации оспы стоила 313 млн долларов США, однако ежегодный предотвращенный ущерб составляет 1-2 млрд долларов США. В отсутствие иммунизации каждый год погибало бы 5 млн детей, из них свыше половины от кори, 1,2 и 1,8 млн от столбянка новорожденных и коклюша.
Новое тысячелетие человечество встречает на фоне дальнейшей интенсификации иммунопрофилактики. Борьба с ведущими инфекционными болезнями, включенными в РПИ ВОЗ, уже привела к впечатляющим успехам: в настоящее время этими прививками охвачены более 80% детского населения мира - более 130 млн детей ежегодно, что позволяет предотвратить более 3 млн смертей в год.
Во многих странах мира отсутствуют случаи заболевания дифтерией, эпидемия этой инфекции, возникшая в странах СНГ в связи с низким охватом детского населения прививками, заканчивается. В 1999 г. заболеваемость сократилась наполовину по сравнению с 1998 г. Полиомиелит эндемичен в ряде стран Индийского субконтинента и Африки (Индия, Нигерия, Пакистан, Афганистан). Полная ликвидация полиомиелита, планировавшаяся на 2000 г., произойдет с некоторым опозданием.
Очередная задача - элиминация кори, т.е. ликвидация эндемичных случаев и распространения при заносе инфекции, что практически осуществлено в ряде стран мира. В 2007 г. число стран с заболеваемостью корью менее 1 на 1 млн населения возросло до 29 по сравнению с 19 в 2006 г. Европейское региональное бюро ВОЗ поставило задачу элиминации кори и краснухи и предупреждения врожденной краснушной инфекции к 2010 г.
В большинстве стран был положительно воспринят призыв ВОЗ к массовой вакцинации против ВГВ.
Несмотря на эти успехи, возможности вакцинопрофилактики в мире далеко не исчерпаны - не только в отношении заболеваний, пока не входящих в круг управляемых, но и в отношении таких инфекций, как коклюш, корь, паротит, краснуха. В РФ проводится комплекс организационных и практических мероприятий, направленных на реализацию Программы ликвидации кори к 2010 г., утвержденной Приказом Минздрава России № 270 от 19.08.2002 г. В 2008 г. начался третий этап реализации названной программы. В 2007 г. впервые интенсивный показатель заболеваемости корью на территории России составил 0,1 на 100 000 населения. Зарегистрирован всего 161 случай кори. По сравнению с предыдущим 2006 г. заболеваемость корью в стране снизилась в 6,6 раза (2006 г. - 0,66 на 100 000 населения). Анализ показателей специфического иммунитета выявил, что в целом по стране защищен против кори 81% населения. По результатам оценки напряженности и анализа заболеваемости установлено, что в настоящее время контингентами, определяющими заболеваемость корью, будут подростки и взрослые, среди которых имеется значительное количество лиц, восприимчивых к инфекции, в том числе среди привитых против кори.
В целях повышения охвата прививками взрослого населения и реализации Программы ликвидации кори к 2010 г. иммунизация лиц в возрасте до 35 лет с
2008 г. включена в приоритетный национальный проект в сфере здравоохранения. В рамках этого издано постановление Главного государственного санитарного врача РФ от 28.08.2007 г. № 63 «Об усилении мероприятий по реализации Программы ликвидации кори в Российской Федерации к 2010 г.».
В 2007 г. отмечалось дальнейшее снижение заболеваемости эпидемическим паротитом. Показатели заболеваемости эпидемическим паротитом снизились в 2007 г. по сравнению с 2006 г. на 21,2% и составили 1,3 против 1,65 на 100 000 населения. Из общего числа заболевших 70,5% составляют дети до 17 лет включительно. По сравнению с 2006 г. заболеваемость эпидемическим паротитом в 2007 г. у детей снизилась на 19,9%. Зарегистрировано 1 308 случаев (4,76 на 100 000 детей) против 1 694 (5,94), зарегистрированных в 2006 г.
Заболеваемость краснухой в РФ в 2007 г. сократилась по сравнению с 2006 г. в 4,3 раза и составила 21,65 против 93,13 на 100 000 населения. Зарегистрировано 30 934 против 133 289 случаев в 2006 г.
В нашей стране продолжает снижаться заболеваемость дифтерией. Показатели заболеваемости дифтерией в 2007 г. составили 0,06 на 100 000 населения, что в 2 раза ниже уровня заболеваемости в 2006 г. (0,12 на 100 000 населения). В числе заболевших дети до 17 лет составляют 31,8%. Показатели заболеваемости детей дифтерией в 2007 г. снизились в 2 раза и составили 0,11 против 0,24 на 100 000 детей в 2006 г. Заболевания детей дифтерией в 2007 г. не регистрировались в 50 субъектах РФ.
В 2007 г. заболеваемость коклюшем в нашей стране оставалась на уровне 2006 г. и составила 5,7 на 100 000 населения. В то же время уровень заболеваемости детей в 2007 г. по сравнению с 2006 г. увеличился на 2,5 % и составил соответственно 27,7 против 27,04 на 100 000 детей.
Во всем мире от инфекций, потенциально управляемых методами иммунопрофилактики, ежегодно погибают 12 млн детей. Количество детей, ставших инвалидами, а также расходы на лечение определить невозможно. При этом 7,5 млн детей погибают из-за заболеваний, против которых на сегодняшний день нет эффективных вакцин, но более 4 млн умирают от болезней, полностью предотвратимых с помощью иммунопрофилактики.
Иммунобиологические препараты
К иммунобиологическим препаратам относят биологически активные вещества, вызывающие состояние иммунологической защиты, изменяющие функции иммунной системы либо необходимые для постановки иммунодиагностических реакций.
Для иммунопрофилактики применяют зарегистрированные в соответствии с законодательством РФ отечественные и зарубежные медицинские иммунобиологические препараты. Все препараты, используемые для иммунопрофилактики, подлежат обязательной сертификации.
Бактерийные и вирусные препараты - это вид продукции, к производству и контролю которой предъявляют особо жесткие требования. Все указанное обусловлено прежде всего тем, что обычно эти препараты готовят на основе патогенных или ослабленных микроорганизмов. Это обстоятельство требует соблюдения четко регламентированных условий технологии производства, гарантирующих, с одной стороны, безопасность работающего персонала, с другой - безвредность, эффективность и стандартность препаратов. Государ-
ственным стандартом, определяющим требования к качеству иммунобиологических препаратов, служит Фармакопейная статья, утверждаемая Министерством здравоохранения и социального развития РФ. При ее составлении учитывают требования ВОЗ к вакцинным препаратам. Ответственность за качество выпускаемых препаратов несет предприятие-изготовитель. Препараты должны соответствовать требованиям, изложенным в действующих Санитарных правилах «Производство и контроль медицинских иммунобиологических препаратов для обеспечения их качества». Для этого осуществляют постоянный контроль за их качеством на этапах производства и на конечном этапе (отдел биологического контроля предприятия). Государственный надзор за качеством препаратов осуществляет национальный орган контроля (ГИСК им. Л.А. Тарасевича) путем выборочного контроля выпускаемых серий препарата и систематических инспекционных проверок предприятий. На каждый конкретный препарат выдают сертификат производства, а его выпуск возможен лишь при условии получения предприятием лицензии, выдаваемой Министерством здравоохранения и социального развития РФ.
В соответствии с Национальными требованиями и рекомендациями ВОЗ в страну разрешено ввозить и применять лишь препараты, зарегистрированные в РФ и отвечающие необходимым требованиям. В настоящее время на территории страны зарегистрированы и разрешены к применению многие препараты против кори, краснухи, полиомиелита, гемофильной инфекции, гриппа, менингококковой инфекции, ВГВ и др.
Учитывая механизм действия и природу иммунобиологических препаратов, их разделяют на следующие группы:
- вакцины (живые и убитые), а также другие препараты, приготовленные из микроорганизмов (эубиотики) или их компонентов и дериватов (анатоксинов, аллергенов, фагов);
- иммуноглобулины и иммунные сыворотки;
- иммуномодуляторы эндогенного (иммуноцитокины) и экзогенного (адъюванты) происхождения;
- диагностические препараты.
Все препараты, применяемые для иммунопрофилактики, разделяют на 3 группы:
- создающие активный иммунитет (вакцины и анатоксины);
- обеспечивающие пассивную защиту (сыворотки крови и иммуноглобулины);
- предназначенные для экстренной профилактики или превентивного лечения инфицированных лиц [антирабическая вакцина, анатоксины, бактериофаги и интерфероны (ИФН)].
Вакцины за последнее столетие претерпели большие изменения, пройдя путь от аттенуированных и убитых вакцин времен Пастера до современных, приготовленных методами генной инженерии, и синтетических вакцин.
Живые вакцины - это живые аттенуированные (ослабленные) штаммы бактерий или вирусов, отличающиеся пониженной вирулентностью при выраженной иммуногенности, т.е. способности вызывать формирование активного искусственного иммунитета. Кроме применения аттенуированных штаммов возбудителей, для иммунопрофилактики ряда инфекций широко используют дивергентные штаммы (возбудителей коровьей оспы и микобактерий туберкулеза бычьего типа).
К живым относят вакцины против следующих инфекций:
- туберкулеза;
- туляремии;
- желтой лихорадки;
- натуральной оспы;
- бешенства;
- полиомиелита;
- кори;
- бруцеллеза;
- сибирской язвы;
- чумы;
- ку-лихорадки;
- гриппа;
- эпидемического паротита;
- клещевого энцефалита;
- краснухи.
В группе живых вакцин помимо ранее известных из аттенуированных штаммов (полиомиелит, корь, паротит, туляремия и др.), а также вакцин из дивергентных штаммов микроорганизмов (вируса оспы, микобактерий туберкулеза) появились векторные вакцины, полученные методом генной инженерии (рекомбинантная вакцина против ВГВ и др.).
Убитые вакцины - это штаммы бактерий и вирусов, убитые (инактивированные) нагреванием или химическими веществами (формалином, спиртом, ацетоном и др.). Инактивированные, или убитые, вакцины целесообразно разделять на корпускулярные (цельноклеточные или цельновирионные, субклеточные или субвирионные) и молекулярные. Убитые вакцины обычно менее иммуногенны, чем живые, что определяет необходимость их многократного введения. К убитым вакцинам относят:
- брюшнотифозную;
- холерную;
- коклюшную;
- лептоспирозную;
- вакцину против клещевого энцефалита и др.
Корпускулярные вакцины - наиболее древние и традиционные вакцины. В настоящее время для их получения применяют не только инактивированные цельные микробные клетки или вирусные частицы, но и извлеченные из них надмолекулярные структуры, содержащие защитные антигены (Аг). До недавнего времени вакцины из надмолекулярных комплексов микробной клетки называли химическими вакцинами.
Химические вакцины - разновидность убитых вакцин, однако в них вместо цельной микробной клетки или вируса иммуногенную функцию выполняют извлеченные из них химическим путем растворимые Аг. На практике применяют химические вакцины против брюшного тифа, паратифов А и В.
Следует отметить, что вакцины применяют не только для профилактики, но и для лечения некоторых инфекций, протекающих хронически (в частности, заболеваний, вызываемых стафилококками, бруцеллеза, герпетической инфекции и др.).
Анатоксины в качестве иммунизирующего фактора содержат экзотоксины токсинообразующих бактерий, лишенные токсических свойств в результате
химического или термического воздействия. В процессе получения анатоксины подвергают очистке, концентрации и адсорбции на гидроксиде алюминия или другом адсорбенте. Анатоксины обычно вводят многократно.
В настоящее время применяют анатоксины против следующих инфекций:
- дифтерии;
- столбняка;
- холеры;
- стафилококковой инфекции;
- ботулизма;
- газовой гангрены.
Препараты, содержащие комбинацию Аг, известны как ассоциированные вакцины.
В отечественной практике применяют следующие ассоциированные вакцины:
- АКДС (адсорбированная коклюшно-дифтерийно-столбнячная);
- АДС (дифтерийно-столбнячная);
- вакцину корь-паротит-краснуха;
- дивакцину (брюшной тиф-паратифы А и В, корь-паротит) и др. Многочисленные исследования показали, что одновременное введение
нескольких вакцин не угнетает формирование иммунных реакций к какомулибо из отдельных Аг.
В настоящее время для расширения спектра средств иммунопрофилактики исследуют защитные Аг, представляющие собой Аг, связанные с факторами патогенности бактериальной или вирусной клетки. Такие Аг выявлены у возбудителей коклюша, сибирской язвы, стрептококков, стафилококков, риккетсий и др.
Сыворотки крови (венозная, плацентарная) гипериммунных животных или иммунных людей содержат защитные АТ - иммуноглобулины. После введения в организм реципиента циркулируют в нем от нескольких дней до 4-6 нед, создавая на этот период состояние невосприимчивости к заражению. Из практических соображений различают гомологичные (приготовленные из сыворотки крови человека) и гетерологичные (из крови гипериммунизированных животных) препараты. На практике применяют противостолбнячную, поливалентную противоботулиническую (типов А, В, С и Е), противогангренозные (моновалентные), противодифтерийную, противогриппозные сыворотки, коревой, антирабический, сибиреязвенный иммуноглобулины, иммуноглобулин против клещевого энцефалита, лактоглобулин и др. С момента появления лошадиных противодифтерийной и противостолбнячной сывороток прошло примерно 100 лет. За это время изменились ассортимент и качество иммунных сывороток, а также тактика их использования. На смену гетерологичным неочищенным сывороткам пришли гомологичные очищенные иммуноглобулины целевого назначения, допускающие внутривенное введение. Иммуноглобулины применяют не только в качестве лечебных или профилактических средств, но и для создания принципиально новых иммунобиологических препаратов, таких как антиидиотипические вакцины. Эти вакцины весьма перспективны, так как гомологичны для организма и не содержат микробных или вирусных компонентов.
Бактериофаги - вирусы, паразитирующие внутри бактериальных клеток и вызывающие их лизис. Сохраняются в организме человека в течение нескольких дней. Их применяют для лечения и профилактики ряда инфекционных болезней. Выпускают брюшнотифозный, холерный, стафилококковый, дизен-
терийный и другие бактериофаги, но наиболее эффективны бактериофаги, приготовленные с использованием конкретных штаммов возбудителей.
ИФН - плейотропные цитокины с относительно низкой молекулярной массой (20 000-100 000, реже до 160 000), вызывающие антивирусное состояние клеток, препятствуя проникновению в них различных вирусов. Их синтезируют лимфоциты, макрофаги, клетки костного мозга и вилочковой железы в ответ на стимуляцию некоторыми биологическими и химическими агентами.
В настоящее время разработаны методы генной инженерии для производства ИФН. Таким способом получают реаферон, α-ИФН и γ-ИФН, применяемые в медицинской практике для лечения болезней злокачественного роста, ВГВ, ВГС, герпетической инфекции и других заболеваний.
Конструирование вакцинных препаратов всегда ведут с учетом метода их введения.
Известно несколько способов введения вакцин в организм.
• Подкожный способ применяют для введения убитых и некоторых живых вакцин.
• Внутрикожный - при иммунизации против туберкулеза.
• Накожный - при иммунизации некоторыми живыми вакцинами (против туляремии, бруцеллеза, сибирской язвы и др.).
• Внутримышечно вводят вакцины АКДС,АДС, адсорбированную дифтерийно-столбнячную вакцину с уменьшенной дозой Аг (АДС-М), антидифтерийный анатоксин, иммуноглобулины, антирабические препараты.
• Для быстрого охвата прививками больших коллективов в противоэпидемической практике незаменимы массовые способы вакцинации:
◊ безыгольный (с использованием специальных инъекторов);
◊ пероральный;
◊ аэрозольный (табл. 1-21).
Таблица 1-21. Классификация вакцин по физическим и физико-химическим особенностям препаратов в зависимости от способа их введения
Примечание.
ЖКВ - живая коревая вакцина.
ОПВ - полиомиелитная вакцина для приема per os.
Иммуномодуляторы - вещества, специфически или неспецифически изменяющие выраженность иммунологических реакций. Идея иммуностимуляции представляется весьма привлекательной, так как при соответствующем арсенале оказались бы решенными многие проблемы инфекционной патологии, болезней злокачественного роста, эндокринных расстройств и т.д. Эти препараты объединяет одно свойство - иммуномодуляторы имеют иммунологические точки действия, т.е. мишени среди иммунокомпетентных клеток.
• Эндогенные иммуномодуляторы представлены интерлейкинами (ИЛ), ИФН, пептидами вилочковой железы, миелопептидами костного мозга, факторами некроза опухоли (ФНО), факторами активации моноцитов и др. Эндогенные иммуномодуляторы принимают участие в активации, супрессии или нормализации деятельности иммунной системы. Поэтому вполне естественно, что после открытия каждого из них предпринимали попытки их применения в клинической медицине. Многие препараты используют при лечении различных инфекций, онкологических заболеваний, нарушений иммунного статуса и т.д. Например, α-ИФН и γ-ИФН применяют для лечения ВГВ, ВГС, ВГD, герпетических инфекций и острых респираторных вирусных инфекций (ОРВИ), онкологических болезней и некоторых форм иммунной патологии. Препараты вилочковой железы широко используют для коррекции иммунодефицитных состояний.
• Экзогенные иммуномодуляторы представлены широкой группой химических препаратов и биологически активных веществ, стимулирующих или подавляющих иммунную систему (продигиозан, сальмозан, левамизол).
Иммуномодуляторы относят к числу препаратов, перспективных к применению, в особенности эндогенные иммуномодуляторы, поскольку они наиболее эффективны и относятся к числу естественных для организма веществ и природных лекарственных препаратов.
Прогностическая характеристика вакцин XXI века
Вакцинопрофилактика сохранит свою актуальность и в XXI в. При этом она будет ориентирована не только на ликвидацию ряда инфекций (прежде всего полиомиелита и кори), но и на постепенное расширение количества инфекций, контролируемых с помощью вакцинации. Такая стратегическая задача требует для своего решения нового поколения вакцин.
В настоящее время можно прогнозировать, что вакцины начала XXI в. будут иметь следующие признаки:
- содержать защитные Аг многих возбудителей инфекционных болезней (комбинированные вакцины);
- создавать иммунитет при непарентеральных способах введения (прежде всего после приема внутрь);
- обладать активностью, достаточной для создания защитного иммунитета после 1-2 аппликаций;
- иметь стоимость, приемлемую для стран с различными уровнями экономического развития.
Требования к идеальной вакцине:
- однократное введение в организм;
- создание иммунитета ко многим инфекциям (комплексная вакцина);
- обеспечение пожизненного иммунитета у 100% привитых;
- безопасность и отсутствие побочных действий;
- неинвазивный метод введения;
- стабильность и длительный срок хранения;
- компоненты вакцины (Аг, адъюванты и пр.) должны иметь точно установленную структуру;
- необязательность соблюдения холодовой цепи;
- технология изготовления вакцин должна отвечать современным требованиям и не быть дорогостоящей.
Достоинства комбинированных вакцин включают возможность увеличения количества инфекций, контролируемых с помощью иммунизации, при сохранении количества иммунизаций неизменным либо при его уменьшении, что позволяет сократить частоту посещения ЛПУ, упростить календарь прививок и снизить затраты на вакцинацию за счет уменьшения расходов при транспортировке, хранении и введении препаратов (доля этих расходов составляет 90% общей стоимости вакцинации одного человека).
В настоящее время предметом обсуждения стали две принципиальные конструкции новых комбинированных вакцин.
• Первая представляет инактивированную вакцину, базирующуюся на АКДС, с добавлением инактивированных вирусов полиомиелита, белков HbsAg, полученных с помощью генной инженерии, защитных (Аг) Haemophilus influenzae и т.д.
• Вторая конструкция предполагает создание живой комбинированной вакцины, в которой носителем (вектором) служит БЦЖ.
Интерес к комбинированным вакцинам для перорального применения базируется на признании идеи, что воздействие на иммунную систему через слизистые оболочки позволяет не только создавать невосприимчивость к большинству инфекций, а также значительно снижает риск развития побочных эффектов (аллергических и аутоиммунных болезней).
В настоящее время посредством вакцинации успешно справляются более чем с 40 инфекционными заболеваниями, и это далеко не предел. В ближайшем будущем в практику здравоохранения будут внедрены новые вакцины, которые при их массовом применении позволят спасать ежегодно дополнительно миллионы жизней (700 тыс. от ротавирусной инфекции, 2 млн от других заболеваний, сопровождающихся диареей, 1,2 млн от пневмококковой инфекции и т.д.). Расцвет иммунологии, развитие современных технологий, использование методов генной инженерии делают возможным создание широкого спектра классических и принципиально новых типов вакцин. Одна из важнейших причин детской смертности в эндемичных районах - малярия, борьба с которой посредством ограничения численности комаров-переносчиков и профилактического приема химиотерапевтических средств неэффективна. Поэтому успешная апробация вакцины против тропической малярии стала событием первостепенной важности. И конечно, все человечество с нетерпением ждет появление вакцины против ВИЧ-инфекции.
Проблема совершенствования и создания новых вакцинных препаратов должна предусматривать наряду с повышением их эффективности снижение побочных, нежелательных реакций, использование щадящих путей применения вакцин. Указанного достигают очисткой Аг от примесей и использованием щадящих методов введения вакцин. Этим требованиям наилучшим образом отвечает пероральный (оральный и энтеральный) путь введения вакцин, что
блестяще подтверждает практика применения ОПВ и БЦЖ. Традиционный парентеральный способ иммунизации и форма десятков современных вакцин не пригодны для широкомасштабных программ, охватывающих прививками сотни миллионов детей. Согласно данным ВОЗ, в 1996 г. дети планеты получили 1,4 млрд инъекций, в том числе 240 млн лечебных и 800 млн вакцинальных (профилактика 7 инфекций). В 2005 г. увеличение количества лечебных инъекций произошло до 500-800 млн, а профилактических прививок (против 15 болезней) до 6,7 млрд.
Большое значение имеет разработка новых форм для пероральной или интраназальной иммунизации вакцинами, вводимыми сегодня парентерально. При разработке новых вакцин первостепенной задачей остаются снижение их реактогенности и очистка от посторонних примесей. Создание более дешевой и ареактогенной (бесклеточной) вакцины против коклюша могло бы существенно снизить количество побочных реакций и сделать более доступным широкий охват детского населения.
К настоящему времени полностью расшифрован геном более 20 возбудителей заболеваний, что позволило проводить исследования по созданию около 500 вакцинных препаратов, причем для иммунопрофилактики не только инфекционных болезней. Например, разрабатывают вакцины, призванные снизить частоту развития рака шейки матки и коронарной болезни сердца. Возможными кандидатами для иммунопрофилактики становятся даже ревматизм, рассеянный склероз, шизофрения и сахарный диабет. Эти разработки имеют целью не только создание вакцины против новых заболеваний, но и упрощение технологии их изготовления. Это должно привести к снижению стоимости вакцин - одного из основных препятствий на пути расширения иммунопрофилактики во многих странах мира. Очевидно, что большим эффектом будут обладать вакцины против массовых инфекций, таких, как малярия, лихорадка Денге и кишечные инфекции, поражающие миллионы детей. Сложнее предсказать эффективность вакцин для экономически развитых стран. Для этой цели применяют показатели, учитывающие количество лет предстоящей жизни, потерянных (в случае смерти) или неполноценных (в случае инвалидности) в результате заболевания, не предотвращенного с помощью вакцинопрофилактики.
Новые подходы к созданию вакцин
ДНК-вакцины
Расшифровка генома возбудителя позволяет с помощью новейших технологий генной инженерии создавать вакцины. Первой из них стала вакцина против ВГВ - энджерикс В. Технология их производства включает встраивание в геном микроба-продуцента части генома-возбудителя, кодирующего синтез основных антигенных детерминант. В случае синтеза вакцины против ВГВ S-последовательность, кодирующую HBsAg, встраивают в ДНК (дезоксирибонуклеиновая кислота) дрожжевой клетки, в результате этого производящей вакцинный препарат - поверхностный Аг вируса.
Эти достижения создали перспективу совершенно нового подхода к проблеме - разработке ДНК-вакцин. Идея их создания состоит во встраивании генов микроорганизма, ответственных за синтез микробного Аг, в геном чело-
века. В случае успеха клетки человека начнут синтезировать этот чужеродный для него белок, а иммунная система человека станет вырабатывать к этому белку АТ, нейтрализующие возбудитель при его попадании в организм человека.
Съедобные вакцины
Еще одно направление в создании вакцин захватило воображение многих исследователей. Речь идет о «съедобных» вакцинах - препаратах, вырабатываемых растениями, в геном которых был встроен соответствующий фрагмент генома микроорганизма. В 1992 г. была получена первая такая вакцина: трансгенное табачное растение стало синтезировать HBsAg (поверхностный Аг ВГВ), вызывающий развитие мощного иммунного ответа после иммунизации опытных животных. В настоящее время с обнадеживающими результатами проходят испытания картофельные вакцины против вируса Ньюарк (возбудитель диареи) и вируса ВГВ, а также вакцины против бешенства, выращенные на помидорах.
Интересные результаты получены при изучении на волонтерах эффективности моноклональных АТ к кариесогенному Streptococcus mutans, выращенных на табаке. В этом случае речь идет не об активной, а о пассивной иммунизации. Тот же принцип использован в отношении соевых моноклональных АТ к ВПГ-2. Интравагинальное введение этих АТ мышам предохраняло животных от заражения вирусом.
Антиидиотипические вакцины
Антигенсвязывающие фрагменты молекул иммуноглобулинов содержат участки, представляющие собой слепки с эпитопов Аг. Если получить АТ к этим иммуноглобулинам (идиотипам), то они по своей конфигурации будут подобны эпитопу Аг, что позволит применять их для иммунизации человека. В качестве антиидиотипических получают моноклональные АТ, их использование может иметь преимущество в случае малой иммуногенности Аг или их токсичности.
Вакцины-леденцы
Новые перспективы повышения стабильности вакцин, упрощения их транспортировки и хранения открываются благодаря леденцовой технологии. Дополнительная стоимость таких вакцин на одного полностью иммунизированного ребенка - менее 2 долларов США. Речь идет о способности дисахарида трегалозы сохранять живыми клетки при крайней степени обезвоживания. Трегалоза, как и другие дисахариды, присутствует в тканях многих организмов - от грибов до млекопитающих. Трегалоза обладает способностью при охлаждении насыщенного раствора постепенно переходить в состояние леденца, иммобилизирующее, защищающее и сохраняющее белковые молекулы. При контакте с водой леденец быстро тает, высвобождая белки. Использование подобной технологии для сохранения вакцин позволит прежде всего сократить расходы на их транспортировку и хранение, повысив термостабильность. Но с ее помощью можно создать и новые их формы, например вакцинные иглы, способные после введения в кожу растворяться и высвобождать вакцины с определенной скоростью. Возможно приготовление вакцины в виде быстрорастворимого порошка, содержащего вакцину, для ингаляции или внутрикожных инъекций.
Национальный прививочный календарь и его зарубежные аналоги
Каждая страна пользуется своим национальным календарем профилактических прививок, предусматривающим проведение плановой массовой вакцинации населения. Обязательность таких прививок обычно устанавливает законодательство страны.
В РФ плановая вакцинопрофилактика детей и подростков также предусматривает соблюдение определенных сроков и схем, совокупность которых и составляет национальный календарь прививок. Его построение зависит как от частоты и тяжести инфекций, так и от эффективных и безопасных вакцинных препаратов и их доступности. Также на сроки и схемы вакцинации оказывают влияние возрастные особенности формирования иммунитета и возможность развития побочных реакций, влияние материнских АТ, риск развития поствакцинальных осложнений и др.
Появление в последние годы новых, более совершенных вакцин, изменения в тактике вакцинопрофилактики потребовали совершенствования схемы и сроков прививок. Пересмотр действующего прививочного календаря привел к появлению нового календаря прививок, утвержденного Приказом МЗ РФ № 229 от 27.06.2001 г. и введенного в действие с 01.01.2002 г. (табл. 1-22).
Таблица 1-22. Национальный календарь профилактических прививок
Окончание табл. 1-22
Примечание.
Иммунизацию в рамках национального календаря профилактических прививок проводят вакцинами отечественного и зарубежного производства, зарегистрированными и разрешенными к применению в установленном порядке в соответствии с инструкциями по их применению.
Детям, родившимся от матерей - носителей вируса ВГВ или больных ВГВ в III триместре беременности, вакцинацию против ВГВ проводят по схеме 0-1-2-12 мес. Вакцинацию против ВГВ в 13 лет проводят ранее не привитым.
Вакцинацию против краснухи проводят девочкам в 13 лет, ранее не привитым или получившим только одну прививку.
Ревакцинацию против туберкулеза проводят не инфицированным возбудителем туберкулеза туберкулинотрицательным детям.
Ревакцинацию против туберкулеза в 14 лет проводят не инфицированным возбудителем туберкулеза туберкулинотрицательным детям, не получившим прививку в 7 лет. Применяемые в рамках национального календаря профилактических прививок вакцины (кроме БЦЖ) можно вводить одновременно разными шприцами в разные участки тела или с интервалом 1 мес.
При нарушении срока начала прививок последние проводят по схемам, предусмотренным настоящим календарем и инструкциями по применению препаратов.
В российский календарь обязательных прививок входит 7 вакцин против 10 инфекций. Основное отличие нового календаря прививок РФ от предыдущего - включение в него прививок против краснухи и ВГВ, давно уже применяемых в развитых странах.
На сегодняшний день национальный календарь профилактических прививок включает профилактические прививки против ВГВ, дифтерии, гриппа, коклюша, кори, краснухи, полиомиелита, столбняка, туберкулеза, эпидемического паротита. Указанные профилактические прививки проводят в соответствии с Законами РФ «О санитарно-эпидемиологическом благополучии населения» (1999) и «Об иммунопрофилактике инфекционных болезней» (1998) всем гражданам РФ в сроки, установленные национальным календарем профилактических прививок. Национальный календарь профилактических прививок утверждает федеральный орган исполнительной власти в области здравоохранения. Очень важное изменение в новом календаре - положение о совмещении всех положенных по возрасту ребенку прививок. Указанное соответствует рекомендациям ВОЗ и практикуется во всем мире. Прививки следует проводить строго в сроки, установленные календарем, совмещая указанные для каждого возраста вакцины.
По некоторым позициям календарь прививок в России отличается от календарей прививок в ряде зарубежных стран и календаря, рекомендованного ВОЗ. В большинстве развитых стран (за исключением Франции) массовую вакцинацию БЦЖ не проводят. В календаре РФ не предусмотрена прививка против инфекций, вызываемых Haemophilus influenzae типа b, роль которой в инфекци-
онной патологии детей повсеместно возрастает. Общее правило вакцинации лиц, не привитых в соответствии со сроками, указанными в календаре, - проведение всех необходимых прививок с принятыми интервалами. Пропуск одной прививки из серии (например, АКДС или ОПВ) не влечет за собой повторения всей серии. Вакцинацию продолжают так, как если бы необходимый интервал был сохранен. Новый календарь прямо указывает, что при его нарушении допустимо одновременное проведение всех необходимых прививок разными шприцами в разные участки тела. Минимальный разрыв между прививками составляет 4 нед.
В соответствии с Приказом Минздравсоцразития от 17.01.2006 г. № 27 в национальный календарь профилактических прививок внесены некоторые дополнения.
• Дети от 1 до 17 лет, взрослые от 18 до 35 лет, не привитые ранее, подлежат вакцинации против ВГВ.
• Дети от 5 до 17 лет, девушки от 18 до 25 лет, не болевшие и не привитые ранее, подлежат вакцинации против краснухи.
• Вакцинация инактивированной вакциной против полиомиелита осуществляется среди детей раннего возраста с клиническими признаками иммунодефицитного состояния (частые гнойничковые заболевания), ВИЧ-инфицированных или рожденных от ВИЧ-инфицированных матерей, с установленным диагнозом онкогематологических заболеваний и (или) длительно получающих иммуносупрессивную терапию, детей, находящихся на втором этапе выхаживания и достигших 3-месячного возраста, воспитанников домов ребенка (вне зависимости от состояния здоровья), детей из семей, где имеются больные с иммунодефицитными заболеваниями.
• Дети, посещающие ДДУ, учащиеся 1-4-х классов, медицинские работники, работники образовательных учреждений, взрослые старше 60 лет подлежат вакцинации против гриппа.
Совершенствование тактики вакцинопрофилактики Приказ Минздравсоцразвития России от 30.10.2007 г. № 673 «О внесении изменений в Приказ Минздрава России от 27.06.2001 г. № 229 «О национальном календаре профилактических прививок и календаре профилактических прививок по эпидемическим показаниям».
• Для новорожденных от здоровых матерей предложена схема иммунизации против гепатита B 0-3-6. Аргументами в пользу данной схемы иммунизации являются:
◊ увеличение интервала между вакцинацией БЦЖ и второй прививкой против ВГВ до 3 мес;
◊ уменьшение числа посещений ЛПУ;
◊ возможность применения для второй и третьей вакцинации против ВГВ отечественных препаратов Бубо-Кок и Бубо-М;
◊ сохранение на высоком уровне охвата иммунизацией против гепатита В детей к первому году жизни (не менее 95%).
• В субъектах РФ, в которых показатель заболеваемости туберкулезом ниже 80 на 100 000 населения, вакцинация новорожденных проводится БЦЖ-М вакциной.
• Прививки против гриппа включены в национальный календарь профилактических прививок.
Представление о том, что вакцинопрофилактика - мера, относящаяся только к детскому возрасту, глубоко ошибочно. Не менее важна вакцинопрофилактика отдельных групп взрослого населения, наиболее подверженных риску заражения или заболевания. Недооценку необходимости поддержания иммунитета взрослого населения к дифтерии наглядно продемонстрировала ее последняя эпидемия в России и странах СНГ, когда 2/3 заболевших составили лица старше 14 лет. Вакцинация против дифтерии и столбняка взрослых включена в календарь профилактических прививок практически всех стран, в том числе и России. Прививки против ВГВ предусмотрены среди взрослых лиц, относящихся к группам высокого риска заражения. Вакцинация против краснухи показана всем неиммунным женщинам детородного возраста. Прививки против гриппа в первую очередь рекомендованы лицам старше 60 лет, а также страдающим хроническими заболеваниями легочной и сердечно-сосудистой систем, поскольку инфекция наиболее тяжело протекает среди этих групп. Контингенты взрослых, которым показано проведение других прививок по эпидемическим показаниям, представлены в табл. 1-23.
Таблица 1-23. Календарь профилактических прививок по эпидемическим показаниям
Продолжение табл. 1-23
Продолжение табл. 1-23
Окончание табл. 1-23
Примечание.
Прививки в рамках календаря профилактических прививок по эпидемическим показаниям проводят вакцинами отечественного и зарубежного производства, зарегистрированными и разрешенными к применению в установленном порядке в соответствии с инструкциями по их применению.
Инактивированные вакцины (кроме антирабических), применяемые в рамках календаря профилактических прививок по эпидемическим показаниям, и инактивированные вакцины национального календаря профилактических прививок можно вводить одновременно разными шприцами в разные участки тела.
Профилактические прививки по эпидемическим показаниям проводят гражданам при угрозе возникновения инфекционных болезней, перечень которых устанавливает федеральный орган исполнительной власти в области здравоохранения. Решения о проведении профилактических прививок по эпидемическим показаниям принимают главный государственный санитарный врач РФ и главные государственные санитарные врачи субъектов РФ.
Профилактические прививки проводят с согласия граждан, родителей или иных законных представителей несовершеннолетних и лиц, признанных недееспособными, в государственных, муниципальных или частных организациях здравоохранения либо медицинскими работниками, ведущими частную практику, имеющими лицензии на соответствующие виды деятельности в области иммунопрофилактики. Профилактические прививки проводят гражданам, не имеющим медицинских противопоказаний.
Организация прививочной работы
Для организации прививочной работы первостепенную важность имеет полный и достоверный учет всех детей, проживающих на данной территории, и ведение документации на каждого ребенка, строгий учет лиц, получивших прививки и не привитых в календарные сроки. Не меньшую роль играет обеспечение ЛПУ качественными вакцинными препаратами с соблюдением правил транспортировки и хранения вакцин, а также требования холодовой цепи. Обязательна и отчетность (месячная, квартальная, годовая).
Учет детского населения проводят силами участковой педиатрической службы 2 раза в год (весна-осень); дополнительно в списки вносят вновь прибывших детей и новорожденных. Учет организованных детей проводят непосредственно в коллективах (школах, ДДУ). По завершении переписи населения проводят сверку списков с имеющимися медицинскими формами. При отсутствии последних их оформляют (медицинская карта, история развития ребенка, карта профилактических прививок для организованных детей).
Прививки проводят в медицинских учреждениях государственной, муниципальной и частной систем здравоохранения. Основное подразделение, осуществляющее планирование прививок, учет и отчетность по ним, - прививочный кабинет городской детской поликлиники или ЦРБ. За планирование, проведение прививок, учет и отчетность несут ответственность врач и медицинская сестра, на фельдшерско-акушерском пункте - фельдшер. Прививки также проводят в кабинете ДДУ и здравпунктах предприятий при строгом соблюдении санитарно-гигиенических требований. В определенных ситуациях органы управления здравоохранением могут принять решение о проведении прививок на дому или по месту работы.
Прививочный кабинет включает помещения, где проводят прививки (манипуляционную), и помещения для хранения прививочной картотеки. За полноту и правильность ведения документации несет ответственность персонал кабинета. В последние годы на многих территориях РФ в структуру детской поликлиники и ЦРБ введены центры (кабинеты) иммунопрофилактики, осуществляющие координационную и консультативную функции. Для них выделяют штаты - врача и медицинских сестер, прошедших специальную подготовку. Основная задача этих кабинетов (центров) - увеличение охвата детей прививками.
Поскольку главной причиной неполного охвата прививками детей в положенный срок стали медицинские отводы, в задачу специалистов консультативных центров входят следующие обязанности:
- определение возможности и сроков иммунизации детей с теми или иными патологическими состояниями, не служащими противопоказаниями к прививкам;
- охват прививками максимально возможного числа детей из групп риска, страдающих хроническими патологиями, а также детей с поствакцинальными реакциями без причинения вреда их здоровью;
- обучение врачей-педиатров детских поликлиник города обоснованно устанавливать и своевременно снимать постоянные и длительные медицинские отводы;
- обучение родителей правильному наблюдению и уходу за детьми, наблюдаемыми и прививаемыми в консультативно-диспансерных кабинетах по индивидуальным методикам;
- оказание помощи специалистам практического здравоохранения в организации прививочной работы в детских поликлиниках.
Планирование прививок на следующий год осуществляет персонал прививочного кабинета (сестры-картотетчицы). При этом учитывают всех детей, подлежащих профилактическим прививкам по возрасту и не привитых в срок по различным причинам. Карты профилактических прививок (форма 063у) раскладывают по месяцам года в соответствии со сроками проведения ближайшей вакцинации, эти же формы на детей, не подлежащих вакцинации в текущем году, хранят в отдельной ячейке. Отдельно следует выделить картотеку на организованных детей.
По завершении планирования выполняют подсчет общего числа детей, подлежащих вакцинации в будущем году (организованных и не посещающих детские учреждения), составляют свободный план, направляемый в территориальный центр государственного санитарно-эпидемиологического надзора. Подготовительный период - основа для определения потребности каждого региона в вакцинных препаратах и формирования заявки в вышестоящие учреждения. В настоящее время разработаны специальные компьютерные программы, используемые в некоторых регионах РФ.
Ответственность за организацию и проведение прививок несет руководитель учреждения (главный врач детской поликлиники, территориального центра государственного санитарно-эпидемиологического надзора, ЦРБ, а также лица, занимающиеся частной медицинской практикой, проводящие прививки). За полноту прививок детям в сроки, установленные календарем, несет ответственность в первую очередь медицинский персонал детских поликлиник и организованных детских коллективов. Ответственность за вакцинацию населения по эпидемическим показаниям несет территориальный центр государственного санитарно-эпидемиологического надзора, выполняющий методические и контролирующие функции.
Для обеспечения своевременности вакцинации медицинская сестра в письменной или устной форме приглашает детей, подлежащих прививкам, или их родителей в определенный для этого день. В детском учреждении предварительно информируют родителей о предстоящей прививке. Очень важное направление работы персонала детских поликлиник и ДДУ - учет детей, по тем или иным причинам не получивших прививки в установленные сроки.
Перед вакцинацией в день прививки для исключения острого заболевания проводят врачебный осмотр ребенка с обязательной термометрией. Следует обеспечить наблюдение за привитыми в течение 1-1,5 ч после вакцинации, а также через 1-2 сут. При развитии необычных реакций и осложнений на введение вакцины необходимо проводить тщательный разбор каждого случая и предоставлять документацию установленной формы в ГИСК им. Л.А. Тарасевича.
Техника проведения прививок
Отбор детей на прививку осуществляет врач-педиатр (на фельдшерскоакушерских пунктах - фельдшер). Прививки проводит медицинский работник, обученный правилам организации и техники проведения прививок, а также приемам неотложной помощи в случае развития поствакцинальных реакций и осложнений.
Оснащение прививочного кабинета:
- инструкции по применению вакцин и инструктивно-методические рекомендации;
- холодильник, специально предназначенный только для хранения вакцин; в детских учреждениях вакцины нельзя хранить длительное время, их количество должно соответствовать числу запланированных на текущий момент прививок;
- шкаф для инструментов и медикаментов;
- биксы со стерильным материалом;
- пеленальный столик и (или) медицинская кушетка;
- столы для подготовки препаратов к применению и для хранения документации;
- емкость с дезинфицирующим раствором;
- нашатырный спирт, этиловый спирт, смесь эфира со спиртом или ацетон;
- тонометр, термометры, одноразовые шприцы, электроотсос;
- средства противошоковой терапии:
◊ 0,1% раствор адреналина, мезатона или норадреналина;
◊ преднизолон, дексаметазон или гидрокортизон;
◊ растворы 1% тавегила, 2,5% супрастина, 2,4% эуфиллина, 0,9% натрия хлорида;
◊ сердечные гликозиды (строфантин, коргликон), кордиамин. Перед проведением прививок необходимо тщательно проверить качество
препарата, его маркировку, целостность ампулы (флакона). Вакцины нельзя применять в следующих случаях:
- изменение физических свойств вакцины;
- нарушение целостности ампулы;
- неясная или отсутствующая маркировка на ампуле (флаконе);
- сорбированные вакцины (в частности, АКДС, АДС, АДС-М, против ВГВ), хранившиеся или транспортировавшиеся с нарушением температурного режима, особенно подвергшиеся замораживанию;
- живые вакцины [ЖКВ, живая паротитная вакцина (ЖПВ)], подвергшиеся действию температуры выше 8 °С, БЦЖ - выше 4 °С.
Вскрытие ампул, растворение лиофилизированных вакцин (ЖКВ, ЖПВ и пр.) и вакцинацию осуществляют в соответствии с инструкцией при строгом
соблюдении правил асептики. Обработку места введения вакцины обычно проводят 70°спиртом, если нет других указаний. Например, при постановке реакции Манту или введении вакцины БЦЖ кожу обрабатывают эфиром; при скарификационном способе иммунизации живыми вакцинами - ацетоном или смесью спирта с эфиром (в последнем случае разведенную вакцину наносят на кожу после полного испарения дезинфицирующей жидкости). Препарат во вскрытой ампуле (флаконе) хранению не подлежит.
Инструментарий, применяемый для проведения вакцинации (шприцы, иглы, скарификаторы), должен быть одноразового пользования, его следует приводить в негодность в присутствии прививаемого или его родителя. При проведении процедуры вакцинации следует строго придерживаться соответствующих положений инструкции по применению препарата.
Хранение и транспортировка вакцин
Правила хранения и транспортировки вакцин определяются соответствующими инструкциями по применению. Их соблюдение - непременное условие успеха и безопасности вакцинации, так как только в этом случае можно обеспечить сохранение препаратами требуемых показателей качества и реактогенности.
Температурный режим в процессе транспортировки, складирования и хранения имеет особое значение. Хранение живых вакцин при повышенной температуре приводит к уменьшению количества жизнеспособных микробных клеток, вплоть до их исчезновения, а также к десорбции анатоксинов в сорбированных препаратах. Именно потеря вакцинами своих свойств объясняет более низкую эффективность вакцинации во многих районах (особенно с жарким климатом).
Замораживание сорбированных препаратов также недопустимо, так как приводит к десорбции Аг и, в результате, к значительному снижению иммуногенности (и увеличению числа выраженных реакций). Отрицательная температура не оказывает негативного влияния на живые вакцины, поэтому такая вакцина, как ОПВ, выпускаемая в жидком виде, и живые вакцины, выпускаемые в сухом виде отдельно от растворителя, целесообразно хранить при отрицательной температуре, в том числе в морозильном отделении бытового холодильника. При этом следует помнить, что растворитель замораживанию не подлежит.
Нарушение температурного режима хранения ряда препаратов не только приводит к снижению их эффективности, но и может повысить их реактогенность. Например, хранение сорбированных препаратов при высокой температуре или их замораживание приводит, как было сказано выше, к десорбции Аг. Введение такого препарата с высокой концентрацией растворенных Аг сопровождается быстрым их поступлением в кровоток, что у лиц с высоким содержанием АТ может привести к развитию аллергических реакций.
Хранение при высокой температуре препаратов иммуноглобулинов человека сопровождается агрегацией белков. Введение такого препарата может привести к развитию коллаптоидных состояний. Важно оберегать транспортируемые вакцины от ударов, способных вызвать образование трещин в стенке флаконов и ампул, через которые внутрь проникают микроорганизмы.
РПИ ВОЗ разработана концепция холодовой цепи, т.е. последовательной серии мероприятий, обеспечивающих надлежащий температурный режим хранения, транспортировки вакцин и других иммунобиологических препаратов на всех этапах пути их следования от производителя до вакцинируемого. Особое внимание при этом уделяют температурному режиму на транспорте и во время промежуточных перегрузок, когда чаще всего и происходит его нарушение. Эта концепция принята в России, развитие холодовой цепи предусмотрено Федеральной программой «Вакцинопрофилактика».
В настоящее время за рубежом разработаны термоиндикаторы, меняющие свой цвет при пребывании в тепле в течение времени, достаточного для инактивации вакцины. Есть и индикаторы ударов, сигнализирующие о возможных трещинах ампул. В поликлиниках (или других местах применения вакцин) препараты следует хранить в бытовом холодильнике, ежедневно регистрируя температуру. При этом каждую вакцину следует помещать в отдельную маркированную коробку. Поскольку температура в открытом холодильнике быстро повышается, его не следует открывать без необходимости даже на минуту. Показано что за 10 с температура в холодильнике повышается от 4 до 12 °С (при комнатной температуре 20 °С), причем для снижения температуры до 4 °С требуется 20-30 мин. Не следует держать вакцины на полках дверцы холодильника. На случай отключения электрической энергии в морозильном отделении следует держать замороженные пакеты с хладоносителем.
При хранении растворенного препарата, выпускаемого в сухом виде, необходимо соблюдать как температурный режим, так и допустимую продолжительность хранения, определенную инструкцией по применению. Некоторые препараты, например иммуноглобулин человека, перед употреблением рекомендовано довести до комнатной температуры, заблаговременно (за 2-4 ч) вынув из холодильника.
Проверка физических свойств вакцин перед проведением прививок
При получении поликлиникой новой серии вакцины следует проверить, насколько физические свойства препарата соответствуют требованиям, определенным инструкцией по его применению.
Выборочный контроль
Предварительно проверяют физические свойства ампул (флаконов), содержащихся не менее чем в 2 коробках. При обнаружении 20% и более первичных упаковок, содержимое которых не отвечает требованиям инструкции, весь поступивший препарат этой серии следует вернуть поставщику.
Сплошной контроль
Отсутствие забракованных при предварительном просмотре ампул (флаконов) не исключает контроля физических свойств каждой первичной упаковки перед введением препарата. Это положение относится и к препаратам, выпускаемым в сухом виде (в том числе контролируют время их растворения).
Сплошной контроль физических свойств вакцин перед их введением проводит медицинский работник, осуществляющий вакцинацию.
В этом случае действует то же правило, что и при предварительном контроле: выявление более 20% ампул с измененными физическими свойствами
содержащегося в них препарата требует приостановки применения данной серии, так как свидетельствует о нарушении условий ее хранения и транспортировки.
Ампулы, содержащие неиспользованные остатки инактивированных, а также ЖКВ, ЖПВ, краснушной вакцины и иммуноглобулинов, не подлежат какой-либо обработке. Ампулы, содержащие неиспользованные остатки других живых бактериальных и вирусных вакцин, кипятят в течение 60 мин (сибиреязвенной - 2 ч) или заливают одним из дезинфицирующих растворов либо подвергают уничтожению при автоклавировании. Остаток неиспользованных ампул с препаратами, не подлежащими применению (истечение срока годности, неправильное хранение и т.п.), следует направлять на уничтожение в территориальный центр санитарно-эпидемиологического надзора.
Послепрививочные реакции
Послепрививочные реакции принято подразделять на общие и местные.
• Общие реакции включают такие объективные и субъективные показатели изменения состояния организма, как повышение температуры тела, чувство недомогания, головную боль, расстройство сна, боли в суставах, животе, тошноту, рвоту, кратковременное обморочное состояние и т.п.
• Местные реакции включают реакции, развивающиеся непосредственно в месте введения препарата. При парентеральном способе иммунизации местная реакция может проявиться в виде болезненности в месте введения, развития гиперемии, отека, инфильтрата, а также регионарного лимфаденита. При применении некоторых живых вакцин (БЦЖ, туляремийной и др.) местная реакция характеризуется также развитием специфических элементов. При иммунизации этими препаратами развитие специфической местной реакции необходимо для последующего формирования невосприимчивости к заражению, а интенсивность местной реакции во многом определяет интенсивность и продолжительность общей реакции. При аэрозольной, интраназальной, пероральной иммунизации к местным реакциям следует относить катаральные явления со стороны верхних дыхательных путей и конъюнктивит. Проявления местных реакций достигают максимального развития через 24 ч (при введении сорбированных препаратов - через 24-48 ч) и обычно сохраняются в течение 2-7 сут.
Четкой взаимосвязи между интенсивностью местных и общих реакций обычно не наблюдают. Общие и местные реакции, обусловленные токсическим действием препарата, наиболее выражены после первой прививки, тогда как реакции, имеющие аллергическую природу, чаще развиваются после повторных инъекций. Примером последних могут служить сильные местные реакции после ревакцинации АКДС и анатоксинами, появляющиеся через 12-18 ч и характеризующиеся развитием обширной гиперемии и отека.
Выраженность общей реакции принято оценивать в основном по степени повышения температуры тела (наиболее объективный показатель). Реакцию считают слабой при температуре тела 37-37,5 °С, средней - при 37,5-38,5 °С, сильной - при температуре тела выше 38,5 °С.
Интенсивность местной реакции, развившейся после применения корпускулярных и химических бактериальных вакцин, анатоксинов и сывороточных препаратов, оценивают следующим образом:
- гиперемия без инфильтрата или инфильтрат диаметром 2,5 см - слабая реакция;
- инфильтрат диаметром 2,6-5 см - реакция средней силы;
- инфильтрат диаметром более 5 см, а также инфильтрат с лимфангитом и лимфаденитом - сильная реакция.
В отношении большинства живых бактериальных и вирусных вакцин подобной регламентированной оценки интенсивности местной реакции нет.
Допустимую степень реактогенности большинства препаратов определяют наставления по их применению. В том случае, если частота реакций после применения той или иной серии препарата превышает установленные наставлениями лимиты, прививки данной серией прекращают, а вопрос о ее дальнейшем использовании может быть решен только через ГИСК им. Л.А. Тарасевича.
Противопоказания к вакцинации
За последние 20-30 лет произошли коренные изменения в подходах к вакцинации детей и взрослых. Большинство заболеваний перестало рассматриваться в качестве противопоказаний к прививкам. Более того, именно определенное хроническое заболевание стало считаться показанием для проведения некоторых прививок. Противопоказания к проведению прививок направлены на снижение частоты неблагоприятных событий в поствакцинальном периоде. В настоящее время большинство осложнений вакцинации носит характер индивидуальных реакций, которые часто бывает невозможно связать с предшествующим состоянием привитого лица. Фактически существует очень немного расстройств здоровья, повышающих риск развития поствакцинальных осложнений, именно они и включены в список противопоказаний.
Приказом МЗ РФ № 375 список противопоказаний к вакцинации был существенно сокращен и фактически стал полностью соответствовать рекомендациям ВОЗ (табл. 1-24).
Патологические состояния, служащие основанием для постоянного медицинского отвода от прививок, встречаются редко, их суммарная частота не превышает 1%.
Другая группа состояний (например, острые инфекционные заболевания) требуют лишь отсрочки в проведении иммунизации. Контакт с больным инфекционным заболеванием (возможность нахождения в инкубационном периоде) не считают противопоказанием для проведения прививок, так как показано, что даже на фоне текущего заболевания вакцинальный процесс не утяжеляется, а иммунный ответ на вакцину не снижается. Незначительное повышение температуры тела, легкое недомогание и диарея не служат противопоказаниями для проведения вакцинации. Практический опыт показывает, что от вакцинации достаточно часто отводят детей, не имеющих ни абсолютных, ни временных противопоказаний. Наиболее часто встречающиеся состояния, не являющиеся противопоказаниями к вакцинации, но ложно учитываемые педиатрами, приведены в табл. 1-25.
Таблица 1-24. Перечень медицинских противопоказаний к проведению профилактических прививок
Примечание.
Плановую вакцинацию откладывают до окончания острых проявлений заболевания и обострения хронических заболеваний. При нетяжелых ОРВИ, острых кишечных заболеваниях прививки проводят сразу же после нормализации температуры тела. Как сильную реакцию расценивают подъем температуры тела выше 40 °С, развитие отека в месте введения вакцины, гиперемию диаметром 8 см, развитие анафилактического шока.
Таблица 1-25. Ложные противопоказания к проведению профилактических прививок
По данным НИИ вакцин и сывороток им. И.М. Мечникова, среди детей г. Москвы, обращающихся по поводу плановой вакцинации, 30% страдают заболеваниями нервной системы, 30% - аллергическими болезнями, 5% - патологией почек, 5% - эндокринными расстройствами, 4% - нарушениями функций печени. В настоящее время в институте разработана технология безопасной вакцинации таких детей, позволяющая индуцировать выраженный защитный иммунитет.
Вышеуказанные состояния не являются противопоказаниями для проведения прививок, но предполагают разработку индивидуальных схем и изменения тактики проведения прививок. Основные задачи в отношении лиц с указанными состояниями - это определение срока вакцинации и проведение полноценного лечения основного заболевания с достижением возможно более полной ремиссии. На ее фоне проводят вакцинацию, в том числе и на фоне необходимого поддерживающего лечения. Прививки лиц с хроническими заболеваниями могут осуществлять в центрах иммунопрофилактики. При решении вопроса о вакцинации детей с хроническими заболеваниями учитывают степень иммуносупрессии, поскольку это может препятствовать введению живых вакцин. Детей с первичным иммунодефицитом следует вакцинировать убитыми вакцинами, но результаты вакцинации необходимо контролировать с помощью серологических реакций. Введение живых вакцин, например ОПВ, этим детям может приводить к развитию вакциноассоциированного полиомиелита. В настоящее время в качестве противопоказания к иммунизации против кори (а также паротита и краснухи) фигурирует только первичный иммунодефицит (эти дети обычно защищены от данных инфекций благодаря заместительной терапии иммуноглобулином); а инфицированным ВИЧ детям проводят прививки против кори, паротита и краснухи. После введения иммуноглобулинов, переливания цельной крови, эритроцитарной массы или плазмы вакцинацию живыми вакцинами можно проводить не ранее чем через определенный интервал, в течение которого из организма будут полностью выведены АТ, поступившие с препаратом. В большинстве случаев этот срок составляет 3-6 мес. Вакцинация сама по себе не служит противопоказанием к введению иммуноглобулинов или переливанию крови. Однако при введении их ранее чем через 2 нед после прививки живой вакциной (за исключением ОПВ) содержащиеся в них АТ препятствуют размножению вакцинного штамма и формированию иммунитета.
Поствакцинальные осложнения
В отдельных случаях после иммунизации вакцинами возникают патологические процессы, не свойственные обычному течению вакцинальной реакции и известные как поствакцинальные осложнения. Они обусловливают выраженные, иногда тяжелые нарушения функций организма, подчас угрожающие жизни человека. Выделяют следующие виды поствакцинальных осложнений:
- местные - абсцесс на месте введения, гнойный лимфаденит, тяжелая местная реакция;
- со стороны центральной нервной системы (ЦНС) - острый паралич, энцефалопатия, энцефалит, менингит, судороги;
- прочие - острые реакции гиперчувствительности, анафилактический шок, диссеминированный БЦЖ-ит, остеит и (или) остеомиелит, упорный пронзительный крик, сепсис, синдром токсического шока.
Источники вакцинальных осложнений разделяют на 3 типа.
• Осложнения, связанные с нарушением техники вакцинации, регистрируют сравнительно редко. Нарушения стерильности приводят к развитию гнойного процесса в месте введения. Подкожное введение адсорбированных вакцин может привести к образованию асептических инфильтратов. Введение БЦЖ подкожно обычно приводит к развитию абсцесса, при этом часто происходит вовлечение лимфатических узлов.
• Осложнения, связанные с качеством вакцины, могут быть местными (нестерильность) или общими (токсические). Появляются у некоторых привитых одной серией вакцины. Для исключения подобных осложнений все медицинские иммунобиологические препараты подлежат строгому контролю в процессе их производства и хранения.
• Осложнения вследствие индивидуальной реакции чаще всего имеют характер аллергических или неврологических.
Все случаи осложнений и необычных реакций, развившихся после применения бактерийных, вирусных и сывороточных препаратов, подлежат специальному учету и расследованию. В РФ регистрации и последующему расследованию подлежат заболевания, указанные в табл. 1-26.
Таблица 1-26. Заболевания в поствакцинальном периоде, подлежащие регистрации и последующему расследованию
Примечание.
Выраженные реакции, форма проявления которых указана в соответствующих инструкциях по применению препаратов (местные и температурные реакции, кратковременная специфическая сыпь, легкие катаральные явления у привитых против кори и т.д.), регистрируют в карте профилактических прививок ребенка (ф. 63у) и истории развития (ф. 112у); сильные реакции дополнительно регистрируют в окружном центре санитарноэпидемиологического надзора без передачи информации в вышестоящие органы санитарно-эпидемиологического надзора.
В работе комиссии по расследованию принимают участие эпидемиологи и квалифицированные клиницисты - в зависимости от характера осложнения и возраста заболевшего (например, педиатр и невропатолог - в случае развития поствакцинального энцефалита у ребенка, терапевт и дерматолог - при развитии генерализованной вакцинии у взрослого).
В случае смерти ребенка в результате развившегося осложнения вскрытие и просмотр гистологических препаратов должен осуществлять опытный патологоанатом. Расследование должно быть направлено на выяснение причин и условий, способствовавших возникновению осложнения, правильности назначения вакцинации и техники ее проведения, соблюдения режима в поствакцинальном периоде, своевременности госпитализации, правильности проводимой терапии, степени реактогенности серии препарата, вызвавшего осложнение. По окончании расследования составляют акт, который подписывают все члены комиссии. Акт расследования высылают в МЗ и СР РФ и ГИСК им. Л.А. Тарасевича.
Гражданин, признанный инвалидом вследствие поствакцинального осложнения, имеет право на получение ежемесячной денежной компенсации. Выплаты государственных единовременных пособий и ежемесячных денежных компенсаций проводят за счет средств федерального бюджета органами социальной защиты населения в порядке, установленном Правительством РФ. Выплаты пособий по временной нетрудоспособности проводят из средств государственного социального страхования.
Расширенная программа иммунизации
Успешная реализация программы ВОЗ по ликвидации оспы в мире резко повысила престиж программ вакцинации. Еще в ходе завершения этой программы, в 1974 г., был принят документ, направленный на борьбу с ведущими инфекционными болезнями, - РПИ. Выполняя ее, все страны мира добились впечатляющих успехов в предупреждении шести основных инфекционных болезней: дифтерии, столбняка, туберкулеза, полиомиелита, коклюша и кори. По расчетам ВОЗ (1985), до принятия РПИ в развивающихся странах из 90 млн ежегодно рождавшихся детей до 5 млн погибали от кори, дифтерии и столбняка, туберкулеза и полиомиелита. Кроме того, столько же детей ежегодно становились инвалидами из-за различных осложнений этих инфекций.
При отсутствии вакцинации в рамках РПИ корью болели практически все дети в возрасте до 3 лет; ежегодно из них погибали приблизительно 2,5 млн в возрасте до 2 лет. От столбняка новорожденных, представляющего острую проблему для здравоохранения развивающихся стран, погибали ежегодно более 1 млн детей. Число летальных исходов при коклюше варьировало от 0,5 до 1 млн. Среди детей в возрасте до 5 лет от дифтерии и туберкулеза ежегодно погибали 50-60 и 30 тыс. соответственно. В настоящее время этими прививками охвачено более 80% детского населения на Земле - более 130 млн детей ежегодно.
В ряде стран в течение многих лет отсутствуют случаи заболевания дифтерией. Полиомиелит ликвидирован во всем Западном полушарии (с 1992 г.), Тихоокеанском регионе, Европе. На очереди - элиминация кори, т.е. ликвидация эндемических очагов кори и вторичных случаев при заносе ее в страну.
Активная реализация РПИ началась в 1977 г. после формулирования долгосрочных программ, заключающихся в снижении заболеваемости и смертности от кори, дифтерии, коклюша, столбняка, полиомиелита и туберкулеза путем обеспечения необходимых условий для иммунизации каждого ребенка на земном шаре к 1990 г.
Одновременно были определены в большей степени апробированные подходы к реализации этих целей:
- оказание помощи государствам - членам ВОЗ в разработке национальных программ иммунизации;
- подготовка национальных кадров всех уровней;
- разработка и создание системы хранения и транспортировки вакцин;
- проведение постоянной оценки реализации национальных программ иммунизации и оказание поддержки научным исследованиям, приоритетным в плане повышения эффективности специфической профилактики инфекционных болезней.
Для выполнения РПИ созданы службы иммунизации во многих развивающихся странах и глобальная автоматизированная информационная система эпидемиологического надзора.
Общая формула РПИ на протяжении 20 с лишним лет остается неизменной: массовая иммунизация детей для существенного снижения инфекционной заболеваемости и детской смертности, увеличения ожидаемой продолжительности жизни, обеспечения активного долголетия, глобальной ликвидации некоторых антропонозов. Особое внимание уделено мероприятиям по борьбе с полиомиелитом, корью и столбняком новорожденных. Однако по мере накопления опыта и развития научно-производственной базы тактические цели программы в разные периоды времени корректировались. В реализации программы участвуют практически все страны - члены ВОЗ.
Сегодня представляется возможным рассматривать 3 этапа реализации РПИ.
• Первый этап (РПИ-1). Начало РПИ датируют с мая 1974 г., после принятия ВОЗ резолюции, рекомендующей иммунизировать к 1990 г. не менее 80% детей против шести инфекций (корь, полиомиелит, коклюш, дифтерия, туберкулез, столбняк).
• Второй этап РПИ (РПИ-2) начался после 1990 г. Перечень инфекций, определенный РПИ-1, дополнен ВГВ. Учитывая опыт 1974-1990 гг., признано целесообразным вакцинирование к 2000 г. до 90% детей (впоследствии этот показатель увеличили до 95%). Основываясь на резолюции ВОЗ от мая 1988 г., РПИ ориентирована на ликвидацию паралитического полиомиелита на Земле к 2000 г. и искоренение столбняка новорожденных. Также предусмотрено существенное снижение заболеваемости корью (следует отметить, что в рамках РПИ-1 эффект борьбы с корью оказался недостаточным). На фоне охвата прививками 80% детей зарегистрированы 29 млн больных корью и 1 млн летальных исходов.
• Третий этап (РПИ-3). В ходе подготовки РПИ-3 эксперты ВОЗ пришли к выводу, что существуют все основания (теоретические, организационные, экономические и технологические) определить долгосрочную цель вакцинопрофилактики на первые десятилетия XXI в. - прекращение циркуляции вирусов полиомиелита и кори. Решение этой задачи позволит, по мнению экспертов, отменить вакцинацию против вызываемых указанными вирусами инфекций (освобождение от вакцинозависимости).
С 1994 г. РПИ стала составной частью глобальной Программы вакцин и иммунизации, провозгласившей «Мир, в котором все люди из групп риска защищены против инфекций, предупреждаемых вакцинами».
Итоги реализации РПИ-1
К 1990 г. стало очевидным, что массовая вакцинация детей первых лет жизни позволила существенно снизить заболеваемость дифтерией, коклюшем, столбняком, корью и краснухой на больших территориях. На фоне массовой вакцинации (не менее 80% детей) уменьшилось количество случаев дифтерии (в СССР - на 96,5%, в США - на 99,8%). Практически аналогичные результаты были достигнуты в результате иммунопрофилактики коклюша, столбняка и полиомиелита.
Вместе с тем опыт борьбы с оспой показал, что 80-90% и даже 95% охвата прививками недостаточно для ликвидации инфекции. Оспу удалось ликвидировать лишь после иммунизации 99% населения. Это обстоятельство важно учитывать при решении задачи ликвидации других инфекций.
В 1988 г. Всемирная ассамблея ВОЗ приняла резолюцию о ликвидации полиомиелита во всем мире с полным прекращением циркуляции дикого вируса полиомиелита к 2000 г. Опережающий характер глобальной программы по ликвидации полиомиелита был необходим для привлечения к этой проблеме правительств и органов здравоохранения всех стран.
В программу ликвидации полиомиелита заложено 4 основных принципа:
- достижение высокого (95%) уровня охвата детей прививками против полиомиелита;
- проведение национальных дней иммунизации;
- организация системы эпидемиологического надзора за синдромом острых вялых параличей (ОВП);
- дополнительная подчищающая иммунизация против полиомиелита. Итоги РПИ-2 выявили 2 важные закономерности вакцинопрофилактики
полиомиелита.
• Во-первых, была продемонстрирована возможность искоренения эпидемического паралитического полиомиелита в рамках крупного региона (США). Впоследствии аналогичный эффект зарегистрирован в масштабе всего Южноамериканского континента, где заболевание не регистрируют
с 1994 г.
• Во-вторых, опыт бывшего СССР показал обратимость результатов массовой вакцинопрофилактики полиомиелита и возможность возвращения ликвидированной инфекции там, где плановую иммунизацию прекратили или проводили не в полном объеме (эпидемия паралитического полиомиелита в Чечне). Сходный эффект наблюдали и при эпидемии дифтерии после снижения количества привитых ниже критического уровня.
Анализ ситуации в целом позволяет утверждать, что эпидемия дифтерии в 1990-х годах возникла в результате нарушения плановой иммунизации, а затухание эпидемии последовало после проведения масштабной кампании вакцинопрофилактики. В 1990-1991 гг. охват прививками против дифтерии детей до 1 года достигал только 69%, а в 1992-1994 гг. этот показатель последовательно увеличился до 73, 79 и 88%. Если в 1990 г. против дифтерии были привиты около 15 млн детей и взрослых, то в 1993 г. вакцинировали 20,2 млн, а в 1995 г. - 38,1 млн детей. Всего за 1993-1995 гг. иммунизировали около 96 млн россиян.
Эпидемия паралитического полиомиелита в Чечне началась в конце мая 1995 г. и закончилась в ноябре того же года. Нормализация ситуации связана с массовым применением вакцины на территории республики в 1995 г. Вспышке полиомиелита в Чечне предшествовало полное прекращение вакцинопрофилактики, продолжавшееся 3 года. Следует отметить, что в начале 90-х годов в целом в РФ произошло уменьшение иммунной прослойки по полиомиелиту. За 3 года (1990-1992) вакцинировано соответственно 69, 72 и 69% детей первого года жизни. И только в 1993 и 1994 гг. их число достигло 82 и 88% - уровня, необходимого для предупреждения эпидемии.
Для исправления положения было принято решение о проведении Национальных дней иммунизации двумя турами путем внеочередной вакцинации всех детей от 3 мес до 3 лет, невзирая на предшествующий прививочный анамнез. В 1996-1998 гг. в РФ были привиты более 11 млн детей (охват прививками среди них составил 99,3%). Кроме того, в стране была введена система регистрации ОВП. Эффективный эпидемиологический надзор за полиомиелитом и ОВП основан на лабораторных исследованиях. Он обеспечивает жесткий контроль за диагностикой и регистрацией этих заболеваний, дифференциальную диагностику, проведение вирусологических исследований материала от больных. Система достаточно чувствительна для своевременного выявления циркуляции дикого вируса полиомиелита.
Опыт России свидетельствует, что нарушение плановой иммунизации в течение нескольких лет ведет к развитию эпидемии на федеральном или региональном уровне. Массовая иммунизация дает положительный эффект даже в условиях неблагоприятной социально-экономической ситуации.
Оценка эффективности вакцинопрофилактики
В основу анализа эффективности вакцинопрофилактики положено 3 критерия.
• Показатель охвата прививками (показатель документированной привитости) позволяет косвенно оценить возможное состояние популяционного иммунитета.
• Показатели иммунологической (клинической) и эпидемиологической (полевой) эффективности служат объективными критериями качества вакцинного препарата, а также состояния защищенности коллектива против того или иного инфекционного заболевания. Иммунологическая эффективность отвечает на вопрос «работает ли вакцина?», а эпидемиологическая эффективность - «помогает ли прививка людям?». Если под иммунологической эффективностью вакцины принято понимать способность препарата вызывать формирование иммунитета у привитого, то эффективность иммунизации представляет собой различие в заболеваемости групп привитых и непривитых лиц.
Сбор сведений о привитости осуществляют на уровне педиатрического участка по данным журналов профилактических прививок (форма 064у), карт профилактических прививок (форма 063у), истории развития ребенка (форма 112у) и сертификата о профилактических прививках (форма 156у). Эту информацию передают в территориальные центры государственного санитарно-эпидемиологического надзора, последние анализируют ее по территориям и передают в вышестоящие учреждения. Оценку привитости прово-
дят на основании изучения величины охвата прививками лиц декретированного возраста в соответствии с действующим календарем профилактических прививок, утвержденным Приказом МЗ РФ № 375 от 18.12.1997 г. Нормативными показателями охвата прививками в возрастных группах детей до 3 лет следует считать 95%, в старших возрастных группах - 97-98%.
Опыт борьбы с оспой показал, что 80-90% охвата прививками недостаточно для ликвидации инфекции. Болезнь удалось ликвидировать лишь после вакцинации 99% населения. Это обстоятельство необходимо учитывать при решении задач ликвидации других инфекций.
Оценку иммунологической эффективности осуществляют выборочно среди различных групп населения, прицельно - в индикаторных группах населения (получающих в соответствии с возрастом прививки), а также в группах риска (детские интернаты, дома ребенка и др.).
Для этого используют весь арсенал серологических исследований:
- реакцию непрямой гемагглютинации (РНГА);
- реакцию торможения гемагглютинации (РТГА);
- ИФА и др.
Выбор метода оценки иммунологической эффективности вакцины зависит от характера иммунитета при данной инфекции. Например, для столбняка, дифтерии, кори и паротита методом оценки эффективности вакцины служит определение содержания циркулирующих АТ, а для туберкулеза, туляремии и бруцеллеза - клеточные реакции, например кожно-аллергические пробы на гиперчувствительность замедленного типа (ГЗТ). К сожалению, для большинства случаев невосприимчивости к инфекциям, в основе которых лежат клеточные иммунные реакции, защитный уровень АТ (их содержание, достаточное для защиты организма от заболевания) не установлен.
Изучение иммунологической эффективности вакцин проводят сопоставлением титров специфических АТ в сыворотке крови до и после иммунизации (на разных сроках), а также сравнением этих результатов с данными определения содержания АТ у лиц, получавших плацебо или препарат сравнения.
Необходимость проведения подобных исследований определена неоднозначностью понятий «привит» и «защищен». Имеющийся опыт свидетельствует, что эти понятия далеко не всегда совпадают. Это отмечали разные авторы при дифтерии, кори и эпидемическом паротите. Иммунологическая активность вакцин может отражать ее профилактическую эффективность в том случае, если известен защитный уровень иммунологических показателей при данной инфекции. Защитный уровень АТ устанавливают заранее.
Для каждой инфекции определяют защитный титр АТ.
• Для кори, паротита и гриппа он составляет 1:10, для столбняка - 1:20, для дифтерии - 1:40 в РПГА (реакция пассивной гемагглютинации).
• Для коклюша он равен 0,03 международной единицы (МЕ) на 1 мл, для ВГВ - 0,01 МЕ/мл при применении ИФА и т.д.
При инфекциях с неустановленным защитным уровнем АТ профилактическую эффективность вакцин оценивают по показателям заболеваемости данной инфекцией.
Объективную оценку иммунологической эффективности вакцин можно получить при вакцинации людей, заведомо серонегативных к конкретным Аг. Из таких лиц формируют опытную и контрольную группы. Оценку иммуногенности вакцинного препарата осуществляют на основе определения разницы
в числе серопозитивных лиц в двух группах. Коэффициент иммунологической эффективности определяют по следующей формуле:
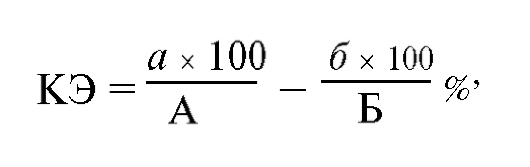
где КЭ - коэффициент иммунологической эффективности; а - число серопозитивных в группе привитых лиц; б - то же в контрольной группе; А - число привитых испытуемым препаратом, у которых исследовали парные сыворотки крови; Б - то же в контрольной группе.
Сформировать группы лиц, серонегативных к Аг возбудителям широко распространенных заболеваний (гриппа, ВГА и др.), подчас бывает довольно сложно. В таких случаях нередко эффективность препаратов оценивают по нарастанию титров специфических АТ до и после вакцинации, как в основной, так и в контрольной группе. Иммунологические сдвиги, возникающие при вакцинации, оценивают также по проценту сероконверсии. Вакцину считают высокоэффективной, если процент сероконверсии составляет 90 и более. Кроме того, большое значение имеет продолжительность поствакцинального защитного иммунитета. Для иммунопрофилактики против желтой лихорадки она составляет 10-15 лет, брюшного тифа (вакцины вианвак и Vi-тифин) - 3 года, ВГВ - не менее 7-10 лет. Опубликованы результаты исследований о сохранении АТ к вирусу краснухи от 9 до 21 года после прививки.
Для оценки и наблюдения за уровнем популяционного иммунитета проводят плановый серологический (иммунологический) контроль. Он позволяет выявить группы людей, наиболее подверженных риску заболевания, оценить степень защищенности лиц, привитых с нарушением схемы иммунизации или не имеющих документов о вакцинации, дать оценку и составить прогноз изменения эпидемиологической ситуации на конкретной территории. Отбор лиц для обследования в целях изучения иммунологической структуры проводят на основе кластерной выборки, рекомендованной ВОЗ. Экстренный серологический контроль проводят в очагах инфекционных заболеваний для выявления неиммунных лиц, контактировавших с источником инфекции и подлежащих срочной активной или пассивной иммунизации. Также его проведение показано среди лиц с неясным прививочным анамнезом, при оценке вакцинального процесса у детей из групп риска развития поствакцинальных осложнений и привитых щадящими методами.
При создании новых вакцин для определения их эффективности применяют контролируемые испытания. Они позволяют предупредить ошибки и субъективизм оценки благодаря использованию метода случайной выборки субъектов исследования и контрольной группы, а также применению двойного слепого метода, когда ни субъекты, ни исследователи не знают конкретных результатов в ходе испытания. Среди исследований эпидемиологической эффективности можно применять как когортные исследования, так и метод случай-контроль. В первом случае методом случайной выборки (рандомизацией) выделяют 2 группы лиц: опытную и контрольную. Обе группы строго идентичны по всем характеристикам, за исключением одного - подверженности воздействию вакцины. В дальнейшем оценку эффективности вакцинации можно осуществлять путем наблюдения за возникающими на протяжении выбранного отрезка времени случаями заболеваний в опытной и контрольной
группах (прогностический подход). С этой целью организуют постоянное медицинское наблюдение за контингентом привитых для своевременного выявления и диагностики всех случаев болезни, вплоть до бессимптомных форм. Срок наблюдения в контролируемом эпидемиологическом опыте должен быть достаточным для определения длительности иммунитета, формирующегося у привитых изучаемой вакциной. При соответствующей документации защитный эффект вакцинации можно оценивать и ретроспективно, т.е. на основе уже имеющейся информации о заболеваемости привитых и непривитых лиц. Метод случай-контроль используют при оценке эффективности вакцинации в группах лиц (на определенных территориях), где зарегистрированы случаи соответствующих заболеваний. Каждый случай (или выборку) заболеваний сопоставляют индивидуально по признаку вакцинации с соответствующими случаями у незаболевших лиц, идентичных по возрасту, полу, условиям проживания и т.д.
Исследования эпидемиологической (полевой) эффективности прививки прямо отвечают на вопрос: помогает ли прививка людям? Оценка эпидемиологической эффективности предусматривает сбор информации об уровне заболеваемости, проявлениях эпидемического процесса во времени, пространстве и среди различных групп населения. Основными критериями оценки эффективности массовой иммунизации служат не только показатели заболеваемости, но и смертности, изменения в характере очаговости, сезонности и цикличности, возрастной структуры болеющих, а также клинического течения соответствующей вакцине инфекционной болезни, учтенные за достаточно длительный период времени до и после проведения прививок. Предусмотрено определение индекса эффективности, коэффициента (показателя) защищенности, коэффициента тяжести клинического течения болезни.
Коэффициент защищенности (Е) определяют по формуле
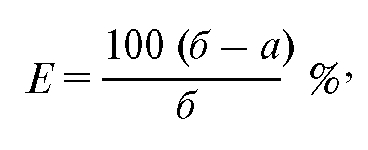
где б - заболеваемость среди лиц, не получивших препарат; a - заболеваемость среди лиц, получивших препарат.
По показателю защищенности можно определить, сколько процентов людей из числа получающих вакцинный препарат защищены от заболевания. Показатель защищенности можно с известной долей достоверности выводить из показателя непосредственного риска, определяемого в когортном эпидемиологическом исследовании.
Индекс эффективности показывает, во сколько раз заболеваемость среди лиц, получивших препарат, ниже заболеваемости среди лиц, не получивших препарат. Его определяют по формуле
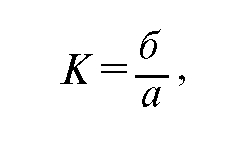
где б - заболеваемость среди лиц, не получивших препарат; a - заболеваемость среди лиц, получивших препарат.
Индекс эффективности вакцинации равен показателю относительного риска. После вычисления коэффициентов эпидемиологической эффективно-
сти того или иного вакцинного препарата следует убедиться, что разница в заболеваемости закономерна. Для этого следует провести соответствующую статистическую обработку полученного материала. Принято считать, что разница в показателях не будет случайной, если уровень значимости p <0,05, т.е. когда вероятность отсутствия разницы в заболеваемости двух наблюдаемых групп не превышает 5%. Для более точной оценки коэффициента эпидемиологической эффективности того или иного препарата следует определить его доверительные границы. При этом коэффициент эпидемиологической эффективности не может быть меньше нижней доверительной границы. Это позволяет утверждать, что при повторных испытаниях данного препарата будут получены аналогичные результаты.
Вакцинация - весьма результативное в экономическом плане мероприятие. Согласно данным специалистов Центра по контролю за инфекционными болезнями (Атланта, США), каждый доллар, вложенный в вакцинацию против кори, дает прибыль, равную 11,9 доллара США. Прибыль при иммунизации против полиомиелита равна 10,3 доллара США, при прививках против краснухи - 7,7 доллара США, против паротита - 6,7 доллара США. Иммунопрофилактика коклюша и инфекции, вызываемой гемофильной палочкой, приносит прибыль, соответственно равную 2,1-3,1 и 3,8 доллара США. На ликвидацию оспы было затрачено 313 млн долларов, величина предотвращенного ущерба ежегодно составляет 1-2 млрд долларов США. Ни одна отрасль народного хозяйства не дает такой впечатляющей отдачи. Все затраты на мероприятия, проведенные под эгидой ВОЗ по ликвидации оспы, окупились в течение 1 мес после провозглашения ее ликвидации.
Федеральная целевая программа
Российской Федерации «Вакцинопрофилактика»
Первая программа вакцинопрофилактики была ориентирована на 1993- 1997 гг.
Она предполагала следующие достижения:
- ликвидацию полиомиелита к 2000 г.;
- снижение заболеваемости дифтерией до единичных случаев к 2000 г.;
- предупреждение летальных исходов к 1995 г.;
- снижение заболеваемости коклюшем до уровня 5 на 100 000 населения к 1997 г.;
- снижение заболеваемости корью до уровня 3 на 100 000 населения к 1997 г. и до единичных случаев - к 2000 г.
Для реализации поставленных целей было предусмотрено решение следующих задач:
- достичь к 1997 г. 95% охвата детей в возрасте 1 года прививками против полиомиелита, дифтерии, столбняка, туберкулеза, детей в возрасте 2 лет - против кори;
- обеспечить современный уровень производства и контроля качества вакцин;
- создать эффективную систему транспортировки и хранения препаратов для вакцинопрофилактики;
- усовершенствовать информационно-аналитическую систему эпидемиологического надзора за инфекционными заболеваниями, управляемы-
ми средствами активной профилактики, а также за поствакцинальными осложнениями;
- провести прикладные исследования по решению оперативных задач вакцинопрофилактики.
В настоящее время развитие вакцинопрофилактики осуществляют в рамках реализации постановления Правительства РФ «О федеральной целевой программе ?Вакцинопрофилактика" и приоритетного национального проекта в сфере здравоохранения», составной частью которого является иммунопрофилактика инфекционных болезней, профилактика и лечение ВИЧ (СПИД), ВГВ
и ВГС.
Основные задачи дополнительной иммунизации населения против ВГВ, краснухи, полиомиелита и гриппа:
- снижение заболеваемости населения гепатитом В до 3 на 100 000 населения к 2009 г.;
- снижение заболеваемости краснухой к 2009 г. в 10 раз и ликвидация синдрома врожденной краснухи;
- снижение заболеваемости гриппом в период эпидемического подъема;
- уменьшение числа осложнений и летальных исходов после перенесенного заболевания;
- предупреждение случаев вакциноассоциированного паралитического полиомиелита (ВАПП), иммунизация инактивированной полиомиелитной вакциной (ИПВ) детей первого года жизни.
Правовые основы иммунопрофилактики
До начала 1990-х годов вакцинопрофилактику регламентировали Конституция РФ и ведомственные документы МЗ РФ. Первым законодательным актом, включающим положения о профилактических прививках, стал Закон РФ «О санитарно-эпидемиологическом благополучии населения», принятый в 1991 г. Затем 12.03.1999 г. Государственная дума приняла новый одноименный Федеральный закон. Ст. 35 гл. 4 «Санитарно-противоэпидемические мероприятия» декларирует, что «профилактические прививки проводятся гражданам для предупреждения возникновения и распространения инфекционных заболеваний».
Профилактическая вакцинация для сохранения здоровья индивидуума и общества в целом с законодательной точки зрения освещена в Основах законодательства РФ об охране здоровья граждан (1993) и Гражданском Кодексе Российской Федерации (1995). Согласно этим документам, каждый гражданин имеет право отказаться от медицинского вмешательства, а значит, и от профилактических прививок. Однако эти же документы предусматривают и оказание медицинской помощи без согласия граждан, если ее проводят в рамках противоэпидемических мероприятий для предупреждения дальнейшего распространения инфекционных заболеваний. В соответствии с Законом РФ от 7.02.1992 г. «О защите прав потребителей» все потребители медицинских услуг, включая профилактические прививки, защищаются от причинения вреда их здоровью и жизни.
В настоящее время принят Закон «Об иммунопрофилактике инфекционных болезней» от 13.09.1998 г., впервые рассматривающий вакцинопрофилактику в качестве одного из направлений государственной политики в области обеспече-
ния национальной безопасности. В области иммунопрофилактики государство гарантирует доступность и бесплатное проведение профилактических прививок, включенных в национальный календарь, и профилактических прививок по эпидемическим показаниям в организациях государственной и муниципальной систем здравоохранения, а также социальную защиту граждан при возникновении поствакцинальных осложнений. При возникновении поствакцинального осложнения помимо бесплатного лечения граждане имеют право на получение государственных единовременных пособий, ежемесячных денежных компенсаций, пособий по временной нетрудоспособности. Перечень поствакцинальных осложнений, дающих право гражданам на получение государственных единовременных пособий, утверждает Правительство РФ.
При осуществлении иммунопрофилактики граждане обязаны выполнять предписания медицинских работников и в письменном виде подтверждать отказ от профилактических прививок. Отказ от прививок может повлечь за собой ряд санкций со стороны государства. Например, отсутствие профилактических прививок влечет запрет для граждан на выезд в страны, пребывание в которых в соответствии с ММСП требует конкретных профилактических прививок. Кроме того, возможен временный отказ в приеме граждан в образовательные и оздоровительные учреждения в случае возникновения или угрозы массовых инфекционных заболеваний, а также отказ в приеме или отстранение граждан от работ, выполнение которых связано с высоким риском заболевания. Как следует из указанного, политика вакцинопрофилактики предусматривает соблюдение интересов общества в целом и отдельных индивидуумов. Вместе с тем при обеспечении санитарно-эпидемиологического благополучия населения, в том числе с помощью вакцинации, интересы отдельных лиц могут входить в противоречие с интересами общества. При выполнении санитарнопротивоэпидемических мероприятий невозможно полностью исключить случаи ограничения прав человека и применения принудительных мер. Противники вакцинации считают, что государство нарушает права людей, подвергая их риску развития поствакцинальных осложнений только ради достижения высокого процента охвата населения прививками. Такую постановку вопроса нельзя считать корректной, так как, проведя массовую вакцинацию, государство предохраняет от инфекций не только общество в целом, но и каждого отдельного человека.
Нарушение правовых и этических принципов вакцинопрофилактики порождает у общественности недовольство и неуверенность в целесообразности вакцинации. Нельзя не отметить отрицательную роль антивакцинальной пропаганды, периодически звучащей в средствах массовой информации и способствующей отказу населения от прививок. Во многих случаях ее поддерживают медицинские работники.
ВНУТРИБОЛЬНИЧНЫЕ ИНФЕКЦИИ Актуальность и значимость проблемы
ВБИ (синонимы: госпитальные , нозокомиальные, больничные инфекции) представляют одну из наиболее актуальных проблем здравоохранения во всех странах мира. Наносимый ими социально-экономический ущерб огромен и трудноопределим. Несмотря на колоссальные достижения в области лечебно-
диагностических технологий, в частности технологий стационарного лечения, проблема ВБИ остается одной из самых острых и приобретает все большую медицинскую и социальную значимость. Согласно данным отечественных и зарубежных исследователей, ВБИ развиваются у 5-20% госпитализированных больных.
Истоки ВБИ уходят корнями в далекое прошлое. Инфекционные заболевания, связанные с различными медицинскими вмешательствами и манипуляциями, возникли после появления людей, занимающихся лечением, а инфекционные заболевания в стационарах - со времени формирования лечебных учреждений и принципов госпитального лечения. Сейчас можно только предположить урон, нанесенный человечеству ВБИ за это время. Достаточно вспомнить слова Н.И. Пирогова: «Если я оглянусь на кладбища, где схоронены зараженные в госпиталях, то не знаю, чему больше удивляться: стоицизму ли хирургов или доверию, которым продолжают пользоваться госпитали у правительства и общества. Можно ли ожидать истинного прогресса, пока врачи и правительство не выступят на новый путь и не примутся общими силами уничтожать источники госпитальных миазм».
Эмпирические наблюдения за роженицами в Вене привели Игнаца Земмельвайса к мысли о связи заболеваний женщин с несоблюдением гигиены врачами при осмотре и приеме родов. Он отметил, что родильная горячка в 5 раз чаще развивалась в отделении, где обучались студенты и вели прием врачи, а не акушерки. Земмельвайс объяснил это тем, что врачи и студенты после работы в анатомическом театре приступают к осмотру больных, недостаточно тщательно вымыв руки. Он также отметил совпадение патологоанатомической картины у родильниц, умерших от горячки, и патологоанатома, порезавшего палец при вскрытии. Не зная природы сепсиса, Земмельвайс предложил для предупреждения горячки перед внутренним обследованием женщин тщательно мыть руки и дезинфицировать их раствором хлорной извести. Заболеваемость после этого резко снизилась. Встретив непонимание коллег, Земмельвайс переехал в Будапешт, где написал монографию об этиологии, сущности и профилактике родильной горячки, принесшую ему всемирную известность (1861), но в полной мере оцененную лишь после его смерти. На памятнике ему выбита лаконичная надпись «Спасителю матерей».
В 1867 г. Джозеф Листер впервые высказал мысль о том, что раневые инфекции, широко распространенные в хирургических отделениях и приводящие к высокой смертности, вызывают живые агенты. Позднее идею экзогенного заражения Листер связал с исследованиями Л. Пастера и разработал стройную, теоретически обоснованную систему мер профилактики раневой инфекции (антисептика с элементами асептики). Он подчеркивал важность уничтожения микроорганизмов на объектах окружающей среды, соприкасающихся с раной, и защиты ее от воздуха. Не зная о стафилококковой и других инфекциях, он предугадал возможность заражения раны контактно-бытовым и аэрогенным путями. Учение Листера заложило фундамент профилактики раневой инфекции.
Изучение ВБИ и разработка мер их профилактики связаны с успехами бактериологии, особенно с экспериментами и обобщениями Л. Пастера и Р. Коха. Открытие пенициллина А. Флемингом положило начало новой эры в истории медицины - эры антибиотиков. Их применение позволило спасти миллионы человеческих жизней, резко снизить летальность от инфекционных болезней. Однако именно применение антибиотиков стало одной из причин, обусловив-
ших рост заболеваемости ВБИ благодаря формированию антибиотикоустойчивых госпитальных штаммов.
В 50-60-е годы ХХ в. остроту проблемы борьбы с ВБИ первыми ощутили экономически развитые страны, где на фоне успехов, достигнутых в борьбе со многими инфекционными и соматическими заболеваниями, отмечали рост заболеваемости ВБИ. Развитие сети стационаров и увеличение объема больничной помощи в развивающихся странах привели к увеличению заболеваемости ВБИ, ставшей глобальной проблемой здравоохранения.
Рост ВБИ в современных условиях порожден комплексом следующих основных факторов.
• Создание крупных больничных комплексов со своеобразной экологией: большой плотностью населения, представленного преимущественно ослабленными контингентами (пациентами) и медицинским персоналом. Постоянное и тесное общение больных между собой, замкнутость окружающей среды (палаты для больных, кабинеты для диагностики и лечебных процедур), своеобразие ее микрофлоры, представленной преимущественно устойчивыми штаммами условно-патогенных микроорганизмов.
• Формирование мощного искусственного (артифициального) механизма передачи возбудителей инфекций, обусловленного инвазивными лечебными и диагностическими процедурами. Существенное значение имеет все более широкое применение сложной техники для диагностики и лечения, требующей особых методов стерилизации.
• Активация естественных механизмов передачи возбудителей инфекционных болезней, особенно воздушно-капельного и контактно-бытового, в условиях тесного общения больных и медицинского персонала в лечебных учреждениях.
• Большое количество источников инфекции в виде пациентов, поступающих в стационар с нераспознанными инфекционными болезнями, а также лиц с ВБИ, осложняющими основное заболевание в стационаре. Важная роль принадлежит медицинскому персоналу (носителям, больным стертыми формами).
• Широкое, подчас бесконтрольное применение антимикробных препаратов. Не всегда достаточно продуманные стратегия и тактика их назначения для лечения и профилактики заболеваний способствуют появлению лекарственной устойчивости микроорганизмов.
• Формирование госпитальных штаммов микроорганизмов, характеризующихся высокой устойчивостью к лекарственным средствам и неблагоприятным факторам окружающей среды (УФО, высушиванию, действию дезинфицирующих препаратов).
• Увеличение количества групп риска, формируемых пациентами, выхаживаемыми и излечиваемыми благодаря достижениям современной медицины.
• Возрастание доли пациентов, находящихся на «двух полюсах жизни», где состояние защитных сил организма снижено. Увеличение доли пожилых лиц среди пациентов отражает изменение возрастной структуры населения. Присутствие в стационарах большого количества детей раннего возраста связано, с одной стороны, со снижением резистентности организма матерей, с другой стороны, с несовершенством иммунитета у новорожденных в целом, особенно у недоношенных детей, новорожденных с дефектами физического и психического развития, редко выживавших в прошлом.
• Общее снижение резистентности организма у населения в силу его эволюционной неподготовленности к стремительно изменяющимся условиям жизни в связи с бурным научно-техническим прогрессом и его теневыми сторонами - загрязнением окружающей среды, экологическим кризисом, изменением условий жизни населения (гиподинамия, стресс, неблагоприятное воздействие на организм шума, вибрации, магнитных полей и др.).
• Медленная психологическая перестройка части медицинских специалистов, по-прежнему рассматривающих многие ВБИ (пневмонию, пиелонефрит, воспалительные заболевания кожи, подкожной клетчатки и др.) как неинфекционную патологию и несвоевременно осуществляющих или вовсе не проводящих необходимые профилактические и противоэпидемические мероприятия.
По определению ВОЗ, «больница - неделимая часть социальной и медицинской организации, функции которой заключаются в обеспечении населения всесторонним медицинским обслуживанием, как лечебным, так и профилактическим, амбулаторным, распространяющимся и на всю семью в домашних условиях; больница является также центром обучения работников здравоохранения и центром биосоциальных исследований». В современном соматическом стационаре сконцентрировано большое количество источников возбудителей инфекции, постоянно выделяющих во внешнюю среду болезнетворные микроорганизмы.
В последние годы отмечено увеличение количества лиц с различными нарушениями в системе иммунитета; для них ВБИ становятся основной причиной заболеваемости и смертности.
Факторы, способствующие возникновению иммунодефицитных состояний у пациентов ЛПУ.
• Основные и сопутствующие, особенно хронические, заболевания (табл. 1-27).
• Применяемые методы лечения, диагностики, лекарственное лечение и др. В настоящее время хорошо изучено иммуносупрессивное действие многих медикаментозных препаратов. К ним относят антибиотики, гормональные препараты, салицилаты, барбитураты, цитостатики и иммунодепрессанты.
• Различные стрессовые ситуации, например инвазивные диагностические процедуры или оперативные вмешательства.
Присоединяющиеся ВБИ перечеркивают усилия, затраченные на проведение сложнейших операций или выхаживание новорожденных. Наслаиваясь на основное заболевание, ВБИ оказывают большое влияние на состояние организма: ведут к удлинению сроков лечения, хронизации процесса, а в тяжелых случаях - к смерти больного.
Длительное время к ВБИ относили только заболевания, возникающие в результате заражения в больнице. Именно эта часть ВБИ, конечно, самая заметная и значительная, привлекала в первую очередь внимание общественности и медицинских работников. Сегодня, согласно определению ВОЗ, к ВБИ относят «любое клинически распознаваемое инфекционное заболевание, поражающее больного в результате его поступления в больницу или обращения в нее за лечебной помощью или сотрудников больницы вследствие их работы в данном учреждении, вне зависимости от появления симптомов заболевания во время пребывания в больнице или после выписки».
Таблица 1-27. Инфекционные и хронические соматические заболевания, сопровождаемые иммунодефицитными состояниями (Семененко Т.А. и др., 1999)
Из этого определения следует, что в понятие ВБИ входят как заболевания пациентов, получавших медицинскую помощь в стационарах и поликлиниках, медико-санитарных частях, здравпунктах, на дому и т.д., так и случаи инфицирования медицинского персонала в процессе их профессиональной деятельности. В определенных стационарах персонал подвергается высокому риску заражения различными инфекционными болезнями, в том числе ВГВ, ВГС, ВИЧ-инфекцией (отделения реанимации и гнойной хирургии, отделения ВИЧ-инфекции и гемодиализа, станции переливания крови и др.). Среди медицинских сестер наиболее подвержены заражению процедурные сестры, а также персонал, осуществляющий предстерилизационную очистку и стерилизацию загрязненного кровью и другими секретами инструментария и оборудования. Установлено, что 63% медицинского персонала гнойных хирургических отделений в течение года заболевают различными формами гнойно-воспалительных инфекций, в родильных домах эта цифра составляет 15%. У 5-7% персонала возможны повторные заболевания.
Исследования, проведенные по программам ВОЗ, позволили установить, что ВБИ развиваются в среднем у 8,4% пациентов. В странах Европы этот показа-
тель составил 7,7%, в западной части Тихого океана - 9%, в регионах ЮгоВосточной Азии и Восточного Средиземноморья - 10-11%, в США - около 5%. Наибольшее число случаев зарегистрировано среди детей до 1 года и лиц старше 65 лет. В США в стационарах ежегодно регистрируют до 2 млн заболеваний, в Германии - 500-700 тыс.; таким образом, количество заболевших людей составляет примерно 1% населения этих стран. По данным О.В. Барояна и Д. Портера (1975), уровень заболеваемости и смертности от ВБИ в 7-8 раз превышает эти показатели при других нозологических формах. Анализ материалов ВОЗ показывает, что в настоящее время только от одной из этих форм (сепсис) в некоторых странах умирают больше людей, чем от брюшного тифа, паратифов, дизентерии, скарлатины, коклюша, дифтерии и полиомиелита, вместе взятых.
Все большее беспокойство эта проблема вызывает в России. Ежегодно, по далеко не полным данным, в РФ регистрируют 50-60 тыс. случаев ВБИ. Явно заниженные данные официальной статистики позволяют предполагать, что реальные показатели заболеваемости ВБИ в России в 30-50 раз выше регистрируемых показателей. Согласно данным выборочных исследований, проведенных с учетом рекомендаций ВОЗ на базе 58 ЛПУ в 8 регионах СНГ, уровень заболеваемости составил 6,7% всех госпитализированных. В абсолютных цифрах предполагаемая ежегодная заболеваемость пациентов в стационарах составляет 2-2,5 млн человек. В детских хирургических стационарах ВБИ выявлены у 21,9% прооперированных больных, во взрослых хирургических стационарах доля послеоперационных гнойно-септических осложнений составляет 12-16%. Актуальность проблемы ВБИ для нашей страны подтверждают и постоянно регистрируемые вспышки заболеваний в ЛПУ. Значительное достижение последних лет - введение в России с 1990 г. регистрации ВБИ в рамках государственной статистической отчетности. Анализ этих материалов позволяет оценить уровень заболеваемости ВБИ в последние годы (в том числе по территориям) и структуру заболеваемости (по нозологическим формам и стационарам разного профиля). Вместе с тем регистрируемый уровень заболеваемости ВБИ в России далеко не полностью отражает истинное положение вещей.
Проблему ВБИ изучают и рассматривают в различных аспектах, в том числе в экономическом и социальном. Экономический ущерб, вызванный ВБИ, складывается из прямых и дополнительных затрат, связанных с увеличением срока пребывания пациента в стационаре, лабораторным обследованием, лечением (антибиотики, иммунопрепараты и др.). По данным американских авторов, стоимость дополнительного пребывания в стационаре из-за ВБИ составляет ежегодно от 5 - 10 млрд долларов США, в Венгрии - 100-180 млн форинтов, в Болгарии - 5-7 млн левов, в Германии - 800 тыс. марок.
По данным Л.П. Зуевой и Р.Х. Яфаева (1989), пребывание больных в травматологическом стационаре при средней продолжительности лечения, равной 21,3±5,4 дня, в случае инфицирования синегнойной палочкой или протеем удлиняется еще на 38,6±8,9 дня. По данным В.В. Шкарина (1978), при ВБИ сроки пребывания больного в стационаре увеличиваются на 14,5 дня.
Социальный аспект ущерба касается нанесения вреда здоровью пострадавшего, вплоть до инвалидности при некоторых нозологических формах, а также увеличения летальности пациентов с ВБИ. По данным ВОЗ, показатель летальности среди госпитализированных с ВБИ в 10 раз превышал таковой у лиц без инфекции. По оценке американских авторов, у 1% больных ВБИ были основной причиной смерти, а у 3% умерших они осложняли течение основного забо-
левания. Это связано с тем, что удельный вес генерализованных форм достаточно велик: внутрибольничная бактериемия ежегодно развивалась примерно у 200 000 больных в госпиталях США (у 5 на 1000 госпитализированных), а летальность составляла 37%.
Анализ внутрибольничных вспышек в родовспомогательных учреждениях нашей страны показал, что летальность среди пострадавших новорожденных составляла в среднем 16,2%, а в отделениях патологии новорожденных достигала иногда 46,6%. По данным В.И. Стручкова и соавт. (1983), до 30-35% хирургических вмешательств осложняется различными формами ВБИ, что определяет свыше 40% послеоперационной летальности. Аналогичные данные о частоте ВБИ приводят и другие отечественные авторы.
Значение проблемы ВБИ для служб здравоохранения всех стран мира, прежде всего экономически развитых, резко возросло в последние 20-30 лет. В этих странах в результате внедрения эпидемиологического надзора за ВБИ отмечена их стабилизация на уровне 5-10%. Осуществление программ по слежению за ВБИ в большинстве стационаров США привело к снижению заболеваемости до 3-3,5%. Однако непрерывное и поступательное развитие современной медицины, по оценкам зарубежных экспертов, вскоре приведет к очередному увеличению заболеваемости ВБИ. В связи с увеличением коечного фонда возрастает заболеваемость ВБИ в развитых странах Африки и Азии. Там, судя по материалам зарубежных и отечественных исследователей, не наблюдают тенденцию к стабилизации и снижению ее уровня.
Возбудители госпитальной инфекции
Обширный перечень возбудителей ВБИ включает представителей различных таксономических групп, относящихся к бактериям, вирусам, простейшим и грибам.
По этиологии ВБИ разделяют на 2 группы:
- вызванные облигатными патогенными микроорганизмами;
- вызванные условно-патогенными микроорганизмами, в том числе входящими в состав нормальной микрофлоры человека.
К 1-й группе относят традиционные (классические) инфекционные заболевания:
- детские инфекции (корь, дифтерия, скарлатина, краснуха, паротит и др.);
- кишечные инфекции (сальмонеллез, шигеллезы и др.);
- ВГВ;
- ВГС и др.
Их возникновение в стационаре может значительно осложнить течение основного заболевания, особенно в условиях детских больниц и родовспомогательных учреждений. На долю этих заболеваний приходится примерно 15% ВБИ. Возникновение и распространение в условиях стационаров инфекционных заболеваний, вызываемых облигатными патогенными микроорганизмами, связано с заносом возбудителя в лечебные учреждения или заражением персонала при работе с инфекционным материалом.
Занос патогенных возбудителей в неинфекционный стационар может произойти в следующих случаях:
- при поступлении в стационар больных, находящихся в инкубационном периоде болезни, или носителей патогенного возбудителя;
- если среди персонала больницы имеются носители возбудителя;
- от посетителей больниц, особенно в период эпидемий гриппа и других ОРВИ, а также через передаваемые пищевые продукты и другие предметы.
При заносе патогенных микроорганизмов в стационаре возникают единичные или множественные случаи инфекционных заболеваний, регистрируемых одномоментно или последовательно, что определяет активность действующего механизма передачи. Эпидемиологические проявления этих болезней, за редким исключением (госпитальный сальмонеллез с воздушно-пылевым инфицированием, аэрогенное заражение бруцеллезом и др.), хорошо известны, и ситуацию в стационарах во многом определяет общая эпидемиологическая обстановка. По мере роста заболеваемости той или иной инфекцией увеличивается и частота заноса заболеваний в стационары. Успех борьбы с ВБИ зависит от грамотного и добросовестного проведения рекомендованных противоэпидемических и профилактических мероприятий.
Ко 2-й группе, составляющей примерно 85% ВБИ, относят заболевания, вызываемые условно-патогенными микроорганизмами. Эта группа представляет совокупность различных по клиническим проявлениям и этиологии инфекционных заболеваний, находящихся в причинно-следственной связи с лечебно-диагностическим процессом. Структуру этих болезней определяют гнойно-воспалительные заболевания, проявляющиеся локальными воспалительными процессами с нагноением или без него и имеющие склонность к генерализации и развитию сепсиса. Отдельные нозологические формы, входящие в группу гнойно-воспалительных заболеваний, включены в МКБ в различные рубрики. Перечень гнойно-воспалительных заболеваний насчитывает более 80 самостоятельных нозологических форм.
Среди возбудителей доминируют:
- стафилококки;
- стрептококки;
- грамотрицательные бактерии (кишечная палочка, клебсиеллы, протей, серрации и др.).
Нередки случаи внутрибольничного заражения псевдомонадами, легионеллами, ротавирусом, ЦМВ и др. (табл. 1-28).
Таблица 1-28. Основные возбудители внутрибольничных инфекций
Примечание.
ВПГ-1 - вирус простого герпеса типа 1.
Вид микроорганизмов зависит от определенных факторов: локализации патологического процесса, профиля стационара, характера и уровня лабораторного обследования и др.
• Патология мочевыводящих путей обусловлена почти исключительно грамотрицательными микроорганизмами.
• При инфекциях нижних дыхательных путей доминируют синегнойная палочка и пневмококки.
• В акушерских стационарах преобладает грамположительная микрофлора (стафилококки, стрептококки), в психиатрических - кишечные инфекции (брюшной тиф, шигеллезы), в гастроэнтерологических - хеликобактериоз, в хирургических отделениях - грамотрицательная микрофлора, стафилококки и т.д.
В последние годы большое внимание уделяют роли неспорообразующих анаэробов в этиологии ВБИ, особенно в хирургических стационарах (пептострептококков, бактероидов и фузобактерий). Из споровых анаэробов наибольший интерес для госпитальной патологии представляет Clostridium difficile - возбудитель псевдомембранозного колита у детей первого года жизни и пожилых людей, обычно развивающегося на фоне длительного лечения антибиотиками.
Следует отметить особенность развития инфекционных процессов в гнойной хирургии, включающего возможность перекрестного инфицирования возбудителями. Например, возможен обмен возбудителями между больными со стафилококковой и синегнойной инфекциями, находящимися в одной палате. В абдоминальной хирургии более чем в 50% наблюдений инфицирование брюшной полости носит полимикробный характер, что также говорит о распространенности перекрестного инфицирования и суперинфицирования в
ЛПУ.
ВБИ обычно вызывают госпитальные штаммы микроорганизмов, обладающие множественной лекарственной устойчивостью, более высокой вирулентностью и резистентностью по отношению к неблагоприятным факторам окружающей среды - высушиванию, действию УФ-лучей и дезинфицирующих препаратов. В растворах некоторых дезинфектантов госпитальные штаммы возбудителей могут не только сохраняться, но и размножаться.
Многие возбудители, например клебсиеллы, псевдомонады и легионеллы, могут размножаться во влажной среде:
- в воде кондиционеров;
- ингаляторах;
- душевых установках;
- жидких лекарственных формах;
- на поверхности умывальных раковин;
- во влажном уборочном инвентаре и др.
Одна из причин неполного учета ВБИ в России - отсутствие в нормативных документах четких определений и критериев выявления этих инфекций. В этой связи представляет несомненный интерес опыт зарубежных стран, в частности США, где были разработаны и ныне действуют принципы и положения определений ВБИ. Многие страны Западной Европы используют эти положения в своей работе, что придает документу ценность как возможному международному стандарту. В основе определения лежит комбинация клинических признаков, а также результатов лабораторных и других видов диагностических исследований. В переч-
не ВБИ представлены определения хирургических раневых инфекций, инфекций крови и мочевыводящих путей, пневмоний. Другие типы инфекций классифицируют исходя из пораженных органов и систем. Инфекции хирургических ран составляют в США примерно 29% ВБИ, инфекции мочеполового тракта - 45%, пневмонии - 19% и содержат наибольшую угрозу летального исхода. По данным литературы, 15% смертельных исходов у госпитализированных больных связано с пневмонией, чаще возникающей в хирургических стационарах, отделениях реанимации и интенсивной терапии. Кожные инфекции, инфекции мягких тканей, ЖКТ, репродуктивного тракта, сердечно-сосудистой системы, костных тканей и комбинированные инфекции встречают редко, они составляют менее 6%. Оценивая социально-экономическую значимость каждой госпитальной инфекции, следует отметить, что раневые инфекции поглощают 42% дополнительных затрат, ими объясняется половина дополнительных сроков пребывания в стационаре от общего количества ВБИ. Пневмонии занимают 2-е место (39% дополнительных расходов). На 3-м месте стоят инфекции мочевого тракта (13% затрат). Инфекции крови составляют 3% затрат.
Эпидемиологические проявления госпитальной инфекции
Эпидемиологические особенности ВБИ последних лет.
• Множественность источников инфекции, доминирование больных как источников инфекции в отделениях гнойной хирургии, ожоговых, урологических, туберкулезных стационарах. Вместе с тем важная роль принадлежит носителям среди медицинского персонала при острых кишечных инфекциях в разных типах стационаров, в том числе в родовспомогательных учреждениях, при инфекциях верхних дыхательных путей и пневмоцистозе - в детских отделениях и отделениях ВИЧ-инфекции.
• Доминирование экзогенных заражений в большинстве ЛПУ при важной роли эндогенного возникновения инфекции в онкологических стационарах, отделениях для ВИЧ-инфицированных и некоторых других типах стационаров.
• Действие в ЛПУ не только естественных механизмов передачи, но и мощного артифициального, искусственно созданного медициной механизма, связанного большей частью с инвазивными и лечебными процедурами.
• Присутствие контингентов и факторов риска, характерных для разных типов стационаров.
Источники возбудителей ВБИ антропонозной природы и некоторых зооантропонозов представлены больными, медицинским персоналом, лицами, привлекаемыми к уходу за пациентами (матерями и другими родственниками) и посетителями.
Роль больных в распространении ВБИ неоднозначна при различных нозологических формах и зависит от типа стационара. Больные становятся основными источниками инфекции при заболеваниях, вызываемых эпидермальным стафилококком или обусловленных грамотрицательными бактериями. С пациентами связаны заносы и дальнейшее распространение классических инфекций, вызываемых безусловно-патогенными микроорганизмами. Больные играют немаловажную роль в распространении ВБИ в отделениях на этапе выхаживания новорожденных, а также в урологических, ожоговых отделениях,
некоторых хирургических стационарах, особенно при доминировании заболеваний, обусловленных грамотрицательными бактериями. Значима их роль в детских инфекционных больницах.
Медицинский персонал часто бывает носителем золотистого стафилококка, возбудителей кишечных инфекций, у части сотрудников выявляют хронические заболевания мочеполового тракта, дыхательной системы и т.д. Периодически нарушая гигиенические требования, медицинские работники могут создавать весьма сложные эпидемиологические ситуации. Уровень культуры медицинского персонала при этом имеет исключительно большое значение, особенно при инфекциях, распространяющихся контактно-бытовым путем. Лица, привлекаемые к уходу за больными, могут быть поставлены на 3-е место по значимости как источники возбудителей ВБИ после больных и медицинского персонала. Роль носителей, навещающих пациентов, в распространении ВБИ весьма ограничена, поскольку больного навещают практически здоровые люди. Имеющиеся среди них носители условно-патогенных бактерий выделяют негоспитальные штаммы. Попытки воспрепятствовать посещению родственников во многих странах не приводят к снижению заболеваемости ВБИ.
Длительное время дискутировали по поводу роли экзогенного и эндогенного возникновения ВБИ. В настоящее время показано несомненное доминирование экзогенных заражений. В большинстве случаев заразное начало проникает в организм пациентов извне. Затем развивается эпидемический процесс, имеющий свою специфику при заболеваниях, вызываемых условно-патогенными микроорганизмами. Долевое участие эндогенно возникших инфекций ничтожно мало. Это в основном осложнения после операций на кишечнике, придаточных пазухах носа, иногда - активизация ранее клинически не проявлявшейся инфекции с длительной персистенцией возбудителя (например, герпетической инфекции).
Полиэтиологичность ВБИ и многообразие источников возбудителей различных нозологических форм предопределяют многообразие механизмов, путей и факторов передачи (рис. 1-16), имеющих свою специфику в стационарах разного профиля. Вместе с тем существуют общие моменты, способствующие или препятствующие распространению возбудителей. В первую очередь это планировка больничных помещений, санитарно-гигиенические условия стационара, процедурных и диагностических кабинетов.
Воздушно-капельный (аэрозольный) путь передачи инфекции играет ведущую роль в распространении стафилококковой и стрептококковой инфекций. Инфицированный воздух обусловливает возникновение вспышек легионеллеза, зарегистрированных в госпиталях ряда стран мира. При этом большую роль в распространении инфекции играли кондиционеры с увлажнителями, вентиляционные системы, реже заболевания были связаны с вдыханием водного или пылевого аэрозоля при физиотерапевтических процедурах или проводившихся недалеко от стационара строительных земляных работах. Следует иметь в виду, что постельные принадлежности (тюфяки, матрасы, одеяла, подушки) также могут стать факторами передачи стафилококков, энтеробактерий и других возбудителей.
Контактно-бытовой путь передачи характерен главным образом для инфекций, вызываемых грамотрицательными бактериями. При этом нужно учитывать возможность интенсивного размножения и накопления этих микроорганизмов во влажной среде, жидких лекарственных формах, сцеженном грудном молоке, на влажных щетках для мытья рук персонала и влажной ветоши.
Факторами передачи инфекции также могут быть:
- контаминированный инструментарий;
- аппаратура для вспомогательного дыхания;
- белье;
- постельные принадлежности;
- поверхности ручек кранов, раковин;
- инфицированные руки персонала.
Бытовая передача реализуется и при стафилококковой инфекции, особенно в случаях, вызванных эпидермальным стафилококком. В последние годы отмечают увеличение внекишечных форм проявления нозокомиального сальмонеллеза, когда госпитальные штаммы Salmonella typhimurium выделяют из гноя, мочи, крови, желчи, экссудатов брюшной и грудной полостей. Доля этих форм составляет до 15% всех регистрируемых. Ведущими путями передачи возбудителя в условиях стационара становятся воздушно-пылевой и контактнобытовой.
Пищевой путь передачи может реализоваться при инфекциях, вызываемых различными этиологическими агентами. У детей, находящихся на грудном вскармливании, возможно заражение стафилококками при кормлении или докорме сцеженным молоком или вскармливании матерью, страдающей маститом. Нарушения технологии приготовления пищевых продуктов и нераспознанные источники инфекции у работников пищевых блоков приводят к возникновению вспышек кишечных инфекций в стационарах.
Однако основное значение в распространении ВБИ играет искусственный, или артифициальный, механизм передачи (см. рис. 1-16). Значение артифициального механизма растет. По данным ВОЗ, около 30% инвазивных вмешательств выполняют необоснованно. Парентеральная передача возбудителей возможна при использовании загрязненных шприцев и игл, а также при введении инфицированных препаратов крови. Важную роль играют невыполнение персоналом правил асептики и антисептики, нарушения режима стерилизации и дезинфекции медицинского инструментария и приборов. Особую опасность таит переливание крови и ее препаратов. В настоящее время кровь доноров
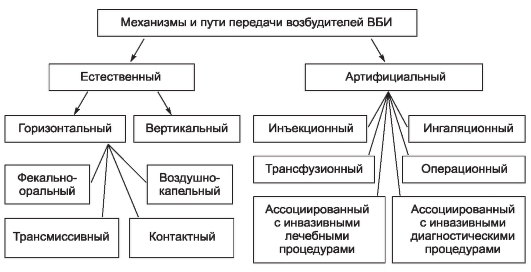
Рис. 1-16. Механизмы и пути передачи возбудителей внутрибольничных инфекций
(ВБИ)
проверяют лишь на сифилис, ВИЧ-инфекцию, ВГВ и ВГС, тогда как круг инфекций, способных передаваться через кровь, значительно более широк - ВГD, ВГG, TTV-инфекция, ЦМВ-инфекция, листериоз, токсоплазмоз и др. Описаны случаи заражения синегнойной и стафилококковой инфекциями в результате переливания крови, инфицированной после ее получения от доноров.
Инвазивные процедуры, ассоциированные с артифициальным механизмом передачи возбудителей ВБИ:
- забор крови (из пальца, вены и при венесекции);
- биопсия (кожи, слизистых оболочек, лимфатических узлов и внутренних органов);
- эндоскопия (бронхо-, гастро-, дуодено-, ириго-, колоно- и цистоскопия);
- зондирование (дуоденальное и др.);
- пункция (люмбальная, стернальная, внутренних органов).
Более всего риску заболевания подвержены больные после обширных хирургических вмешательств с последующей инфузионной терапией (в том числе с применением кровезаменителей), получавшие программный гемодиализ, инфузионное лечение, а также широкий комплекс современных инвазивных лечебно-диагностических исследований (эндоскопические исследования, лапароскопическая хирургия).
Инвазивные лечебные процедуры, способствующие артифициальной передаче возбудителей ВБИ:
- инъекции (подкожные, внутримышечные, внутривенные, интра- и эндолюмбальные, интравентрикулярные);
- лаваж с эндобронхиальным введением препаратов;
- иглоукалывание;
- катетеризация (сосудов, мочевого пузыря);
- оперативные вмешательства;
- трансплантация (органов, тканей, костного мозга);
- внутренняя лазеротерапия;
- стоматологические манипуляции (экстракция зубов, лечение пародонтоза);
- стомии, уход за трахео-, эпицисто-, уро-, гастро-, илио- и колоностомой;
- искусственное оплодотворение;
- трансфузии (крови, плазмы, лейкоцитарной массы и др.);
- введение иммунобиологических препаратов, полученных из крови (иммуноглобулинов, ИФН и др.).
Установлено, что многие хронические инфекции, возникновение которых связано с использованием медицинского имплантируемого материала (катетеры, протезы, искусственные клапаны сердца), обусловлены способностью расти в виде биопленок на этих устройствах или внутри них. Образование биопленок - одна из основных причин выживания бактерий в окружающей среде, поскольку в составе биопленок они защищены от антибактериальных препаратов, включая антибиотики, бактериофаги или фагоциты. Поэтому антибиотики и механизмы естественной защиты макроорганизма бессильны перед такими инфекциями. Биопленки могут быть образованы бактериями одного или нескольких видов и состоять из активно функционирующих и покоящихся клеток.
Обследования, проводимые стационарным больным с различными патологиями, выявляют от 7 до 60% лиц, в крови которых обнаруживают маркеры вышеуказанных инфекций. Особую категорию риска представляет медицинский персонал ЛПУ, чьи обязанности предусматривают выполнение хирургических манипуляций или работу с кровью (хирургические, гематологические, лабораторные, гемодиализные отделения). При обследованиях выявляют, что носителями маркеров вирусных гепатитов, передающихся через кровь, бывают до 15-42% персонала, работающего в этих отделениях. Эти категории лиц составляют и поддерживают мощные резервуары хронических вирусных гепатитов в ЛПУ.
Заражение возможно при диагностических процедурах (пункции, зондировании, бронхо-, гастро-, цисто-, эндоскопии и др.). На современном этапе многие виды аппаратуры весьма трудно надежно обеззараживать [аппараты для гемодиализа, искусственной вентиляции легких (ИВЛ), бронхоскопы, эндоскопы и др.]. Существует реальная опасность заражения ВБИ и при таких редких операциях, как пересадка органов, тканей, костного мозга, а также при широко осуществляемых оперативных вмешательствах, начиная от удаления миндалин, аденоидов и т.д.
Угрозу заражения кровяными инфекциями (ВГВ, ВГС, ВГD, ВГG и TTVинфекция, ВИЧ-инфекция, сифилис, ЦМВ-инфекция и др.) таит использование инструментария, не подвергавшегося надежной стерилизации. Даже при централизованных стерилизационных отделениях возможны нарушения режима работы на отдельных этапах. Грубейшим нарушением противоэпидемического режима при низкой культуре работы медицинского персонала бывает повторное использование одноразового инструментария после проведения дезинфекционно-стерилизационных мероприятий, а также шприцев со сменой только игл.
Вертикальная передача инфекции от беременной плоду во время внутриутробного развития заслуживает упоминания в связи с тем, что в стационарах могут столкнуться с ее последствиями (например, при приеме родов). При этом важно разграничить внутриутробное инфицирование от заражения новорожденных в самом стационаре. Вероятность вертикальной передачи выше при вирусных инфекциях, имеющих склонность к затяжному течению (ВГВ, ВГС, ВГD, ВГG и TTV-инфекция, ВИЧ-инфекция, герпетическая инфекция, ЦМВинфекция и др.), но ее можно наблюдать и при остро протекающих вирусных, бактериальных и протозойных инфекциях (краснуха, ротавирусная и стафилококковая инфекции, токсоплазмоз). При некоторых заболеваниях (ВГВ, краснухе) подобные дети могут представлять высокую эпидемиологическую опасность для пациентов и медицинского персонала.
При этом в каждом типе стационаров важно выявить факторы и контингенты риска, вероятность возникновения ВБИ у которых особенно велика.
Особенности эпидемического процесса гнойно-септической инфекции:
- перманентное течение с вовлечением в него большого количества больных и медицинского персонала;
- эпидемический процесс протекает в замкнутом (больничном) пространстве;
- существует вероятность формирования в одном очаге нескольких механизмов передачи (аэрозольного, контактно-бытового и др.);
- наряду с больными и носителями резервуаром инфекции служит и внешняя среда.
Основные направления надзора и профилактики госпитальной инфекции
Поскольку большинство ВБИ вызывают условно-патогенные микроорганизмы, важно в каждом типе стационара четко определить факторы и контингенты риска. Борьба с госпитальной инфекцией сложна, потому что уровень, структура и динамика ВБИ - следствия взаимодействия многих факторов. Поэтому необходим комплексный подход к профилактике госпитальной инфекции. Традиционно сложившаяся система профилактики и борьбы с инфекциями (воздействие на все 3 звена эпидемического процесса) применима и к ВБИ, но нуждается в коррекции с учетом их общих особенностей, а также особенностей этиологии и эпидемиологических проявлений заболеваний в условиях конкретного типа ЛПУ.
Независимо от профиля лечебного стационара следует выполнять 3 важных требования:
- свести к минимуму возможность заноса инфекции извне;
- исключить возможность внутрибольничного заражения;
- исключить вынос инфекции за пределы ЛПУ.
Выполнить все эти требования достаточно сложно и удается далеко не всегда. Достаточно часто больной поступает в ЛПУ в инкубационном периоде. Иногда госпитализацию инфекционного больного по жизненным показаниям проводят в соматические или реанимационные отделения многопрофильных ЛПУ. Возможна выписка больного или носителя из-за безуспешности лечебных мероприятий.
Большое значение имеет эпидемиологический надзор, предназначенный как для объективной оценки эпидемиологической ситуации в стационаре, так и для прогнозирования и научного обоснования мер борьбы и профилактики, а также передачи и анализа информации для принятия управленческих решений. Эпидемиологический надзор за ВБИ - система постоянного наблюдения за динамикой их эпидемического процесса (заболеваемостью, носительством, летальностью), факторами и условиями, влияющими на их распространение, а также анализ и обобщение полученной информации для разработки научно обоснованной системы мер борьбы и профилактики.
Эпидемиологический надзор включает:
- учет;
- регистрацию заболеваний;
- расшифровку этиологической структуры;
- изучение циркуляции патогенных и условно-патогенных микроорганизмов.
В эту работу входит контроль за здоровьем медицинского персонала (заболеваемостью и носительством).
Эпидемиологический надзор осуществляют в целом по больнице, что предусматривает сбор данных по всем отделениям и всем ВБИ у пациентов. В каждом ЛПУ должна быть создана база данных, позволяющая оценить эпидемиологическую обстановку по ВБИ и своевременно выявить превышение обычных (условно-нормативных, фоновых) значений и изменение отдельных параметров эпидемиологического надзора, требующих принятия управленческих решений.
В РФ регистрация ВБИ введена в 1990 г., однако до настоящего времени их учет остается неполным. Только эпидемиологическое обследование, проведен-
ное с привлечением клиницистов, позволит в каждом конкретном случае решить вопрос, считать ли заболевание внутрибольничным. Существуют пассивные и активные методы выявления ВБИ.
• Пассивный метод базируется на добровольном информировании врачами и медицинскими сестрами больничных эпидемиологов и специалистов Центра государственного санитарно-эпидемиологического надзора о случаях ВБИ. Полученные данные обычно не позволяют составить представление об истинном распространении ВБИ.
• Активный метод несравненно более эффективен. Он предполагает регулярный контакт с врачами, палатными и процедурными сестрами, коллегиальные отношения с медицинскими работниками больницы, сотрудниками всех отделений, главной медицинской сестрой и администрацией больницы.
Выявлению больных ВБИ способствуют следующие методические приемы:
- участие (периодически) в обходах врача-клинициста;
- интервью с врачами и медицинскими сестрами;
- количество использованных шприцев и число выполненных назначений;
- регулярное наблюдение за температурными графиками больных;
- ознакомление с данными о применении антибиотиков для выявления пациентов, получающих антибиотики (информация из аптеки, отделения, заявки на антибиотики, их получение);
- предоперационное бритье.
Составная часть эпидемиологического надзора - слежение за санитарногигиеническим и противоэпидемическим режимами в ЛПУ. В США, странах Европы и Азии работу по профилактике ВБИ называют инфекционным контролем. Контроль за ВБИ осуществляют различные специалисты, в том числе врачи лечебного профиля, эпидемиологи, фармацевты, в то время как во многих странах инфекционный контроль возложен именно на высококвалифицированный сестринский персонал.
Особое значение имеет микробиологический мониторинг за широтой и биологическими свойствами циркулирующих возбудителей, поскольку одной из причин роста заболеваемости ВБИ бывает формирование госпитальных штаммов. Своевременное выявление факта появления и циркуляции госпитальных штаммов в стационаре указывает на надвигающееся осложнение эпидемиологической ситуации и побуждает к проведению соответствующих мероприятий. Этими вопросами должны заниматься подготовленные специалисты. Необходимость такого подхода диктуют громадный объем существующих лекарственных средств и широкое их использование в клинической медицине.
Среди мероприятий, направленных на источник инфекции, можно выделить следующие:
- своевременное выявление и изоляцию больных (при приеме в стационар и во время нахождения в нем) в специальные палаты (боксы) с учетом этиологического фактора;
- эпидемиологическое расследование каждого случая ВБИ.
Тем самым осуществляют профилактику дальнейшего распространения инфекции и заноса в другие ЛПУ.
В последние годы показана нецелесообразность широкого обследования медицинского персонала больниц на носительство условно-патогенной
микрофлоры. В нашей стране принято решение прекратить плановые обследования медицинских работников на носительство золотистого стафилококка, оправданные лишь в особо сложной эпидемической обстановке. Это связано с тем, что ежеквартальная санация препаратами широкого спектра действия приводила к нарушению нормального микробного биоценоза слизистой оболочки носоглотки, играющего важную роль в защите организма от патогенных микроорганизмов. Признано, что целесообразно подвергать сотрудников санации лишь при длительном носительстве (выделении возбудителя одного и того же фаговара дольше 6 мес). При этом рекомендовано применять препараты узкого спектра действия - 2% масляный раствор хлорофиллипта или стафилококковый бактериофаг.
В группу мероприятий, направленных на разрыв механизма передачи, входят архитектурно-планировочные мероприятия, санитарно-гигиенический и дезинфекционный режимы. Архитектурно-планировочные мероприятия направлены на обеспечение строгого разделения гнойных и чистых потоков больных.
Для этого планируют создание достаточного количества помещений и их рациональное размещение.
• Операционный блок должен иметь весь набор производственных, бытовых и вспомогательных помещений и быть максимально изолированным от других помещений стационара. Он должен иметь 2 изолированных непроходных отделения (септическое и асептическое). При размещении операционных отделений друг над другом септическое отделение следует размещать над асептическим.
• Гнойные хирургические отделения следует располагать на верхних этажах зданий для исключения возможности поступления загрязненного воздуха в другие помещения. Желательно выведение гнойного отделения с септическим операционным блоком в отдельно стоящее здание.
В зданиях ЛПУ обычно бывает предусмотрена приточно-вытяжная вентиляция с механическим побуждением. Вентиляция в зданиях должна исключать поступление воздуха из грязных зон (помещений) в чистые. Отделения или группы помещений, между которыми не допускают переток воздуха, изолируют шлюзами. Отделения или группы помещений, имеющие один санитарногигиенический режим, как правило, оборудуют одной централизованной системой приточно-вытяжной вентиляции.
Основные принципы:
- в помещениях с асептическим режимом (чистых операционных, родовых, реанимационных, процедурных, перевязочных и пр.) приток воздуха преобладает над вытяжкой;
- в грязных помещениях (гнойных операционных, помещениях для хранения грязного белья, боксах для работы с инфекционным материалом и т.п.) вытяжка воздуха преобладает над притоком.
Свежий воздух подают через верхнюю зону помещения, при этом приток не менее чем на 20% должен преобладать над вытяжкой. Норма кратности воздухообмена в операционных - не менее 10 раз за 1 ч.
Большое значение в борьбе с ВБИ принадлежит санитарно-гигиеническим мероприятиям:
- соблюдению медицинским персоналом правил личной гигиены;
- тщательной обработке рук;
- дезинфекционному режиму.
В приемном отделении санитарно-гигиенический режим должен исключать занос инфекции в стационар. После осмотра каждого поступающего больного клеенку на кушетке следует протирать дезинфицирующим раствором, больного осматривают на педикулез, он проходит полную санитарную обработку (душ или ванна, при этом выдают обеззараженную мочалку). Поступающего больного переодевают в чистое больничное белье (по разрешению врача он может остаться в своем белье).
Приемные отделения должны иметь:
- средства дезинфекции и дезинсекции;
- мыло;
- мочалки индивидуального пользования;
- посуду для хранения чистых и бывших в употреблении мочалок;
- наконечники для клизм и посуду для их хранения в чистом виде.
В лечебных отделениях стационаров кровать, тумбочку и подставку для подкладного судна протирают дезинфицирующими растворами. Постельные принадлежности после выписки каждого больного обрабатывают в дезинфекционной камере. Гигиеническую ванну больные получают 1 раз в 7-10 дней со сменой белья. После смены белья пол и предметы протирают дезинфицирующими растворами.
Большое значение при переносе инфекции от одного пациента к другому играют руки персонала. По имеющимся данным, в 40% случаев развитие инфекций, вызванных условно-патогенной микрофлорой, связано с присутствием этих микроорганизмов (чаще энтеробактерий) на руках персонала. В связи с этим в любом случае медицинский персонал должен мыть руки до и после выполнения всех манипуляций пациентам, выделенным в группу высокого риска развития ВБИ. Мытье рук и использование перчаток не исключают друг друга. Причем мытье рук после снятия перчаток также необходимо, так как они могут иметь незаметные дефекты, невидимые трещины или повреждения.
Для профилактики ВБИ необходимо соблюдать и другие санитарногигиенические требования:
- не трясти в воздухе и не бросать на пол постельное белье пациентов;
- правильно удалять твердые и жидкие отходы из лечебного отделения;
- неукоснительно соблюдать требования, предъявляемые к дезинфекции предметов ухода и изделий медицинского назначения, предстерилизационной очистке и стерилизации;
- соблюдать режим проветривания помещений;
- осуществлять мытье полов и влажную уборку поверхностей (мебели, оборудования, аппаратуры) в соответствии с требованиями, используя при этом дезинфицирующие средства.
Санитарно-гигиенический режим, его рациональная организация и поддержание - функции руководителей стационара и отделения, в первую очередь старших и главных медицинских сестер. Именно они должны воспитывать у среднего медицинского персонала чувство ответственности за высокое качество выполняемой работы. Они осуществляют контроль за санитарногигиеническим состоянием всех объектов и соблюдением правил асептики и антисептики. Главная медицинская сестра проводит маркетинговые исследования дезинфекционных средств, стерилизационного оборудования и медицинского инструментария, составляет заявки на их приобретение.
Профилактике артифициального механизма передачи способствуют сокращение инвазивной активности, широкое применение неинвазивных методов забора материала для исследования, создание централизованных стерилизационных отделений. Инвазивные вмешательства следует проводить только по абсолютным показаниям. При этом необходимо соблюдать условия, гарантирующие безопасность.
Профилактика артифициальных заражений:
- серьезная аргументированность инвазивных медицинских вмешательств;
- более широкое применение инструментария разового пользования;
- расширение сети ЦСО и усиление контроля за их работой;
- внедрение новых высокочувствительных методов диагностики в ЛПУ и на станциях переливания крови;
- проведение переливаний крови и плазмы только по жизненно важным показаниям;
- внедрение в хирургическую практику малотравматичных технологий (эндохирургия, лазерная хирургия и т.д.);
- обеспечение жесткого контроля за работой эндоскопических подразделений ЛПУ;
- контроль за работой учреждений стоматологического профиля;
- контроль за производством иммунобиологических препаратов, изготовляемых из донорской крови.
За рубежом к катетеризации сосудов относятся как к весьма серьезной операции и проводят ее в маске, перчатках, стерильных халатах. Особо следует выделить роль стерилизационных мероприятий, нарушение которых может приводить к возникновению не только гнойно-воспалительных заболеваний, но и ВГВ, ВГС, ВИЧ-инфекции и др. Следует стремиться к использованию инструментария разового применения (шприцы, системы для переливания крови и др.), также эффективно применение одноразового белья.
Не оправданы ни эпидемиологически, ни экономически плановые обследования объектов окружающей среды. Они дороги и редко бывают эффективными. Рациональны лишь эпизодические целенаправленные исследования для контроля санитарно-гигиенического состояния конкретного объекта и при вспышках ВБИ. В нашей стране в ряде городов до 50-70% микробиологических исследований клинических лабораторий направлено на обследование внешней среды и лишь 30-50% - на пациентов. Поэтому нередко не расшифрованы этиология и причины вспышек заболеваний ВБИ. Это не исключает необходимости бактериологического контроля за стерильностью инструментов, перевязочных средств, растворов, молочных смесей и др.
Профилактику госпитальных инфекций у лиц с иммунодефицитами следует проводить, основываясь на общих подходах: выявление возможных факторов риска развития ВБИ до начала основного лечения.
При этом следует неукоснительно соблюдать общие меры профилактики ВБИ за счет повышения резистентности пациентов, достигаемой следующими путями:
• вакцинацией пациентов с соблюдением соответствующих схем прививок и показаний:
◊ вакцины против Pseudomonas aeruginosa показаны ожоговым больным;
◊ вакцинация против ВГВ показана больным, находящимся на лечении в отделении гемодиализа;
• пассивной иммунизацией с применением соответствующих иммуноглобулинов при контактах с больными ВГА или корью;
• соответствующей диетой;
• применением эубиотиков и бактериофагов;
• проведением Аг-неспецифической иммунопрофилактики (иммуномодуляторы).
Другое важное направление профилактики ВБИ - определение стратегии и тактики использования антибиотиков и химиопрепаратов. В современных условиях проблема лекарственной устойчивости микроорганизмов приобрела глобальный характер. Широкое распространение возбудителей инфекционных заболеваний, устойчивых к действию различных лекарственных препаратов вследствие беспорядочного применения антимикробных средств, приводит к неэффективной химиотерапии больных ВБИ. Полирезистентные микроорганизмы могут стать причиной возникновения тяжелых форм ВБИ. Нерациональная антибиотикотерапия увеличивает сроки пребывания больных в стационарах, приводит к серьезным осложнениям и летальным исходам. Это диктует настоятельную необходимость разработки политики применения антибиотиков для профилактики и лечения ВБИ, направленной на повышение эффективности и безопасности применения химиопрепаратов и снижение возможности формирования лекарственной устойчивости бактерий.
Политика применения антибиотиков предусматривает комплекс организационных и медицинских мероприятий, базирующихся на мониторинге лекарственной устойчивости возбудителей ВБИ с разработкой оптимальных схем эмпирической и целенаправленной антибиотикотерапии в конкретных стационарах (формуляр). Подбор антибиотиков проводят сугубо индивидуально, однако в обычной практике назначают р-лактамные антибиотики (пенициллины или цефалоспорины) с аминогликозидами или без них, а также метронидазол, если предполагают анаэробную инфекцию. Наряду с антибиотиками для поддержания нормальной колонизационной резистентности ЖКТ больным необходимо назначать пробиотики (бифидумбактерин, лактобактерин и др.), а для профилактики кандидоза - противогрибковые препараты (нистатин, флюконазол и др.).
Краеугольный камень профилактики ВБИ в ЛПУ - комплекс дезинфекционно-стерилизационных мероприятий, направленных на уничтожение всех вегетативных и споровых форм микроорганизмов в воздухе функциональных помещений и палатных секций, на объектах в окружении больного, изделиях медицинского назначения.
В настоящее время существует большое количество новых перспективных направлений данного раздела профилактических мероприятий, получивших свое развитие за рубежом и в нашей стране. В первую очередь это связано с использованием новых дезинфицирующих средств и совершенствованием методов дезинфекции и стерилизации.
Среди таких направлений следует отметить увеличение удельного веса применяемых дезинфицирующих препаратов на основе четвертичных аммониевых соединений, катионных ПАВ, солей аминов, производных гуанидинов. Эти средства проявляют высокую бактерицидную активность и, наряду с антимикробным, обладают моющим действием, что дает возможность сочетать дезинфекцию с уборкой помещения и применять их для предстерилизационной очистки изделий медицинского назначения.
В последние годы проводят работы по созданию гласперленовых стерилизаторов для мелких стоматологических инструментов с использованием в качестве стерилизующей среды нагретых стеклянных шариков, а также озоновый и плазменный стерилизаторы. Разработка условий стерилизации изделий в этих аппаратах позволит расширить возможности выбора наиболее подходящих (щадящих в отношении материалов изделий, оптимальных по времени воздействия) методов и режимов стерилизации для конкретных групп изделий медицинского назначения.
Усовершенствование проведения процесса предстерилизационной очистки изделий возможно за счет разработки и внедрения установок, где процесс очистки осуществляется путем обработки изделий моющими или моющедезинфицирующими средствами в сочетании с ультразвуком.
Большое значение имеет разработка новых принципов применения бактерицидных облучателей воздуха в функциональных помещениях ЛПУ в присутствии и в отсутствие пациентов, внедрение в практику отечественных рециркуляторов, принцип действия которых основан на принудительном прокачивании воздуха через аппарат со встроенными УФ-лампами или специальными фильтрами.
Опыт, накопленный у нас в стране и за рубежом, свидетельствует о том, что прогресс в области профилактики ВБИ во многом определяет эффективная организационная работа. В соответствии с Приказом Министерства здравоохранения РФ № 220 от 17.09.1993 в ЛПУ введены должности врачей - клинических эпидемиологов, а в крупных больницах - заместителя главного врача по санитарно-эпидемиологическим вопросам, а также сформулированы новые задачи и даны новые организационные возможности для создания действенной системы профилактики ВБИ. В центрах государственного санитарноэпидемиологического надзора созданы группы (отделения) по контролю за ВБИ. Их основные задачи - методическое руководство работой по профилактике ВБИ, лицензирование ЛПУ, анализ эпидемиологической ситуации по различным ЛПУ, участие в расследовании вспышек и минимальные карательные санкции к руководителям ЛПУ. Существует опыт создания в ЛПУ комиссий по борьбе с ВБИ во главе с заместителем главного врача. В состав комиссии, кроме представителя администрации больницы, входят заведующие отделениями (или врачи лечебных отделений), главная медицинская сестра (или специалист по инфекционному контролю), госпитальный эпидемиолог, лабораторные работники и представители инженерно-технических служб.
На предупреждении ВБИ благоприятно сказываются организационные формы деятельности ЛПУ.
• Организация работы родильных домов по принципу мать-дитя (их преимущество доказано по 12 параметрам). Как показали наблюдения, в родильных домах, работающих по принципу мать-дитя, организм новорожденного колонизируют преимущественно материнские, а не госпитальные штаммы. Кроме того, уменьшается интенсивность циркуляции внутригоспитальных штаммов среди персонала и на объектах внешней среды.
• Создание в акушерских стационарах отделений (палат) дневного пребывания беременных из групп высокого риска с дородовой патологией.
• Изменение соотношения добольничной и больничной помощи в сторону добольничной.
• Проведение диагностических исследований в специализированных центрах.
• Сокращение масштабов госпитализации больных.
• Максимальное сокращение времени пребывания в стационаре. В хирургических больницах при плановых операциях этого можно достичь за счет обследования в поликлинических условиях без дублирования анализов в стационаре.
В родильных домах рекомендовано раннее прикладывание новорожденного к груди для формирования нормального биоценоза и иммунной системы, ранняя выписка (на 2-4-е сутки), прекращение лечения инфекционных больных за счет своевременного перевода их в профильные больницы, разрешение родственникам присутствовать до, во время и после родов. Применение комбинированной антибактериальной профилактики в пред-, интра- и послеоперационном периодах позволяет снизить количество осложнений в среднем на 30%. Однако проведение химио- и антибиотикопрофилактики должно быть осмысленным, его следует осуществлять строго по показаниям.
Особое значение имеет профилактика ВБИ у медицинского персонала. Персонал клиник подвержен риску заражения через кровь более чем 30 инфекциями. Во всем мире ВГВ, ВГС и ВГD рассматривают как профессиональные заболевания медицинских работников, контактирующих с кровью больных. Другая важная проблема - ВИЧ-инфекция. Как отмечали ранее, в отделениях гнойной хирургии и ожоговых отделениях регистрируют повышенную заболеваемость гнойно-воспалительными заболеваниями у медицинского персонала. Можно предупредить заражение персонала, опираясь на комплекс мероприятий: при одних инфекциях (ВГВ, дифтерия) провести вакцинацию, при других (грипп, ОРВИ и т.д.) - повышать неспецифическую резистентность макроорганизма. Однако для большинства инфекций основными мероприятиями остаются соблюдение элементарных гигиенических правил и использование средств индивидуальной защиты (перчаток, защитных очков, халатов, масок и др.) при контакте с кровью и другими биологическими секретами. Важно также весьма осторожно обращаться с острыми медицинскими инструментами (иглами, скальпелями и др.). При микротравме на коже закрывать входные ворота инфекции лейкопластырем или лифузолем, они должны быть в аптечке для медицинского персонала в каждом ЛПУ. Регулярно проводимая диспансеризация медицинских работников способствует выявлению среди них больных и носителей инфекций, что отражается на профилактике как профессиональных заболеваний, так и ВБИ.
Профилактика и снижение заболеваемости, нетрудоспособности и смертности медицинского персонала при ВБИ могут быть достигнуты при реализации следующих целенаправленных мер.
• Выявление и учет ВБИ на основе определения стандартного случая ВБИ в ходе диспансерного наблюдения.
• Определение факторов риска и групп риска среди персонала в различных типах стационаров.
• Проведение эпидемиологического анализа заболеваемости ВБИ и носительства патогенных и условно-патогенных микроорганизмов у медицинского персонала по этиологии, локализации патологического процесса с определением ведущих причин и факторов, обеспечивающих распространение ВБИ.
• Организация специфической профилактики медицинского персонала и др.
В процессе профессиональной деятельности у медицинского персонала, работающего в стационаре или микробиологической лаборатории, может возникнуть необходимость в экстренной профилактике антибиотиками и другими химиопрепаратами. Она может быть связана с аварийными ситуациями и попаданием заразного материала в места возможных входных ворот инфекции, при непреднамеренном (случайном) нарушении режима работы или реальной опасности заражения в процессе обычного ухода за больными и оказания им медицинской помощи. Антимикробные препараты назначают при особо опасных инфекциях (чума, холера), ВИЧ-инфекции и др. Большое значение имеет обучение медицинского персонала вопросам профилактики ВБИ в различных типах стационаров, обучение врачей, среднего звена и младшего персонала. Следует помнить о том, что профилактика ВБИ у персонала - не только сохранение здоровья тех, кто дарует жизнь другим, но и профилактика ВБИ у пациентов.
К настоящему времени накоплено достаточно информации о высокой экономической эффективности внедрения программ профилактики ВБИ. Исследования, проведенные в США, показали, что снижение заболеваемости ВБИ на 0,4% полностью окупает расходы на программу профилактики и предупреждает развитие инфекции более чем у 130 000 больных. Вместе с тем самым большим препятствием в их активном использовании становится человеческий фактор. До тех пор пока сотрудники системы здравоохранения (от санитарки до главного врача) не будут активно заинтересованы в тщательном и повседневном выполнении всех регламентированных простейших мероприятий, не могут быть получены сколько-нибудь значительные результаты в борьбе с ВБИ. Пока еще скрыть ВБИ гораздо проще, чем предотвратить. Важную роль в успешной борьбе с ВБИ играет тесное взаимодействие медицинских работников лечебнопрофилактической и санитарно-эпидемиологической служб.