Инсулин - в норме и при патологии: учебное пособие. - Мкртумян А.М. 2008. - 64 с. : илл.
|
|
|
|
ИНСУЛИН И МЕТАБОЛИЗМ УГЛЕВОДОВ, ЖИРОВ И БЕЛКОВ
При всем разнообразии форм и пищевых источников углеводов в кишечнике всасываются только гексозы, самое большое значение среди которых имеет глюкоза. Глюкоза, в сравнении с жирами и белками, является наиболее предпочтительным и доступным энергетическим веществом. Связано это с легкой усвояемостью, быстрым встраиванием в различные биохимические циклы обмена веществ. Несмотря на то что запасы глюкозы, представленные гликогеном мышц и печени в организме, значительно уступают запасам жиров и белков, именно гликоген печени способен при ферментативном расщеплении быть источником глюкозы, которая в первую очередь потребляется головным мозгом. Суммарно количество гликогена в
организме взрослого человека не превышает 500 г, треть которого приходится на печеночный, а остальное количество - на мышечный. Необходимо отметить, что именно наличие в печени фермента глю- козо-6-фосфатазы обеспечивает отщепление фосфатного остатка с образованием чистой глюкозы. В мышцах и жировой ткани подобного фермента нет, в силу этого конечным этапом гликогенолиза становится образование глюкозо-6-фосфата, который вступает в аэробный или анаэробный гликолиз с образованием молекулы воды и углекислого газа в первом случае, лактата - во втором. Инсулин ингибирует активность глюкозо-6-фосфатазы, в результате чего происходит торможение печеночной продукции глюкозы. Клетки печени свободно проницаемы для глюкозы, а скорость ее поступления в клетку зависит от скорости ее внутриклеточного фосфорилирования, которое осуществляется высокоспецифичной глюкокиназой.
Практически ни одна из клеток организма не содержит свободной глюкозы, а по мере поступления энергетического вещества метаболизирует ее по одному из возможных путей: это может быть простое окисление, синтез гликогена, синтез жирных кислот через ацетилКоА (рис. 5). В качестве альтернативных путей утилизации глюкозы нужно отметить пентозофосфатный и полиоловый пути обмена углеводов. В результате вступления глюкозы в пентозофосфатный цикл, который преимущественно активен в молочных железах, жиро-
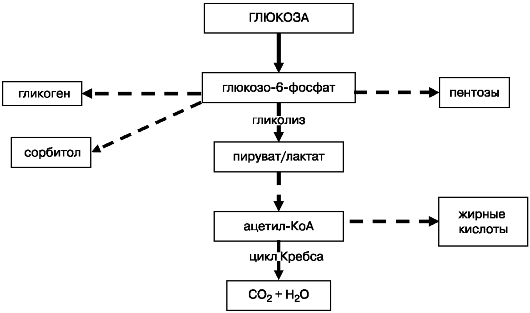 Рис. 5. Основные пути метаболизма глюкозы
Рис. 5. Основные пути метаболизма глюкозы
вой ткани, надпочечниках, печени и эритроцитах, половых железах, происходит синтез промежуточных продуктов, необходимых для последующего образования жирных кислот, холестерина и половых стероидов. Синтезируемая D-рибоза используется для синтеза нуклеиновых кислот и нуклеотидов. Пентозный цикл обеспечивает процессы гидроксилирования, необходимые для синтеза биогенных аминов: катехоламинов, серотонина; стероидных гормонов коры надпочечников. Сорбитоловый, или полиоловый, путь активен в инсулинонезависимых тканях: эндотелии сосудов глаз и почек, нервной ткани. Образование сорбитола происходит и в норме, но значительно активируется во время хронической гипергликемии. Под воздействием фермента альдозоредуктазы происходит образование полигидроксильного спирта сорбита, который под действием сорбитдегидрогеназы преобразуется во фруктозу. Фруктоза и сорбит начинают активно накапливаться в упомянутых тканях в нефизиологичес-
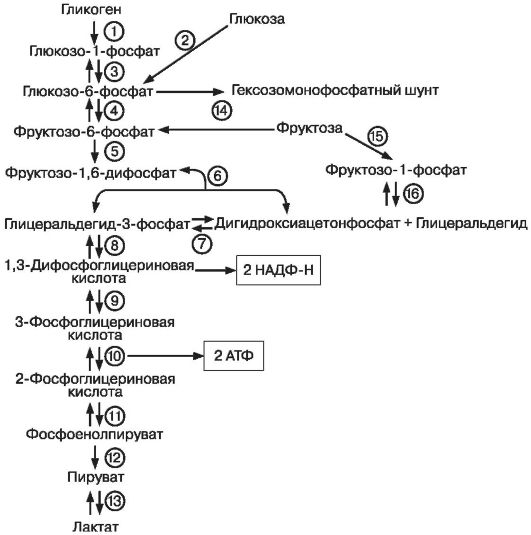 Рис. 6. Первый этап окисления глюкозы (цикл Эмбдена-Мейергофа)
Рис. 6. Первый этап окисления глюкозы (цикл Эмбдена-Мейергофа)
ких количествах, вызывая деформацию клеток, их перерастяжение, сопровождающееся нарушением их функциональной активности. Являясь активными осмотическими веществами, фруктоза и сорбит привлекают на себя воду, вызывают выраженный гиперосмолярный отек и дальнейшие нарушения в заинтересованных тканях.
Центральным путем катаболизма глюкозы является гликолиз, или ее окисление, происходящее в три этапа:
1. Окисление глюкозы до пирувата (цикл Эмбдена-Меергофа).
2. Образование из пирувата ацетил-КоА.
3. Цикл трикарбоновых кислот (цикл Кребса).
Необходимо помнить, что в условиях аэробного гликолиза происходит полное разрушение питательных веществ до образования воды и углекислого газа. При отсутствии кислорода, т.е. в анаэробных условиях, клетка может синтезировать АТФ за счет гликолитического разрушения глюкозы с образованием лактата.
В обоих случаях в ходе гликолиза одна молекула глюкозы, состоящая из 6 атомов углерода, расщепляется ферментативным путем в десяти последовательных реакциях до 2 молекул пирувата, каждая из которых содержит по 3 атома углерода. Эта реакция приводит к образованию двух молекул АТФ и двух молекул НАДФ-Н, из которых в последующем в дыхательной цепи синтезируется 6 молекул АТФ, в сумме КПД первого этапа окисления глюкозы в присутствии кислорода составляет 8 молекул АТФ. В анаэробных условиях НАДФ-Н не поступает на дыхательную цепь внутренней мембраны митохондрий, следовательно, энергетическая составляющая аэробного окисления глюкозы снижается до двух молекул АТФ.
После образования пирувата в аэробных условиях происходит его дальнейшее декарбоксилирование до ацетил-КоА, в результате чего высвобождается молекула НАДФ-Н, дающая 6 молекул АТФ.
Ацетил-КоА входит в цикл трикарбоновых кислот (цикл Кребса), в результате образуется 24 молекулы АТФ (рис. 7). При прохождении в цикле трикарбоновых кислот одной молекулы пирувата происходит образование трех молекул воды и одной молекулы углекислого газа. Суммарно в процессе аэробного гликолиза вырабатывается 38 молекул АТФ.
Модуляторами интенсивности прохождения цикла Кребса являются уровень АДФ, ацетил-КоА, концентрация инсулина, скорость и активность прохождения гликолиза с образованием пирувата, уровень кислорода.
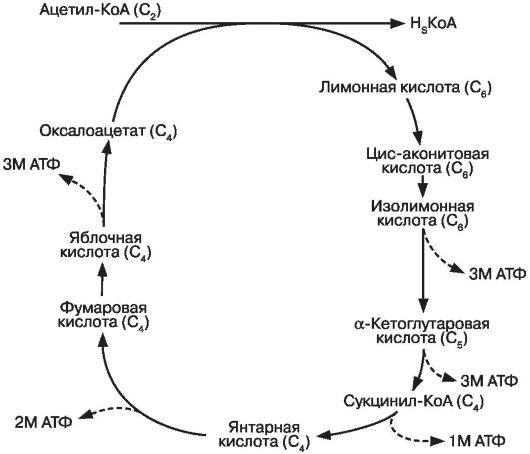 Рис. 7. Третий этап окисления глюкозы. Цикл трикарбоновых кислот
Рис. 7. Третий этап окисления глюкозы. Цикл трикарбоновых кислот
В условиях дефицита инсулина происходит торможение реакций окисления ацетил Ко-А, в силу чего происходит накопление недоокисленных продуктов: β-оксимасляной и ацетоуксусной кислот, а также участников окисления пирувата, что в конечном итоге вызывает развитие ацидоза и снижение рН крови. Важно помнить, что в процессе анаэробного пути превращения глюкозы образуется пируват, который может восстанавливаться до лактата. В этом случае возможно дальнейшее окисление лактата с образованием конечных продуктов метаболизма: углекислого газа и воды. А возможно вступление лактата в цикл Кори, где путем последовательных реакций, проходящих с затратой энергии, синтезируется эндогенная глюкоза. Этот процесс носит название ГЛЮКОНЕОГЕНЕЗА, и до 20% всей глюкозы в организме человека рециркулирует через цикл Кори, особенно активен этот процесс в печени и почках.
Глюкоза может быть получена не только алиментарным путем или в финале цикла Кори. Еще одним путем образования глюкозы может являться гликогенолиз - расщепление гликогена мышц ферментом
гексокиназой и гликогена печени - глюкокиназой. Процесс «отшнуровывания» молекул глюкозы от молекулы гликогена катализируется цАМФ, активность которой стимулируют адреналин и глюкагон, а тормозит инсулин, поддерживающий таким образом постоянство депо гликогена в печени.
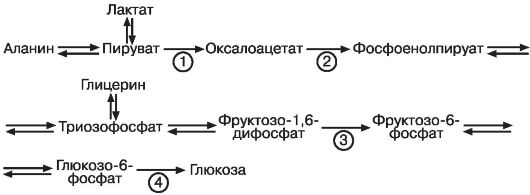 Рис. 8. Цикл Кори (глюконеогенез)
Рис. 8. Цикл Кори (глюконеогенез)
Ограниченность углеводных запасов в организме человека подчеркивает большое значение и важность жировых депо как источников энергетических субстратов, необходимых для поддержания энергетического гомеостаза. Преимущества жиров неоспоримы:
• при их окислении выделяется вдвое больше энергии, чем при окислении такого же количества белков и углеводов;
• жиры связывают гораздо меньше воды и потому являются наиболее компактной формой запасаемого организмом «топлива»;
• жировые депо служат изолирующим слоем, предохраняющим организм от избыточной потери тепла;
• триглицериды, на долю которых приходится до 80% всей запасенной энергии, позволяют человеку обходиться без пищи до нескольких недель;
• фосфолипиды являются основными компонентами клеточных мембран и предшественниками многих биологически активных соединений;
• холестерин служит предшественником многих жизненно важных соединений - желчных кислот, стероидных гормонов.
Несмотря на способность адипоцитов синтезировать холестерин, большинство из них утилизируют «экзогенный» холестерин, лишний раз подтверждая необходимость и важность умеренного употребления жиров с пищей. Поступающие с пищей жиры эмульгируются в кишечнике желчью до небольших капель, содержащих триглицериды, эфиры холестерина, фосфоглицериды, после чего начинают действовать специфические липазы, образуются жирные кислоты, глицерин, ди- и моноглицериды. Именно эти субстраты связываются с желчными кислотами и всасываются эпителиальными клетками тонкой кишки. В кишечнике происходит всасывание до 40% холестерина и порядка 85% триглицеридов, поступающих с пищей. Основные энергетические субстраты, образующиеся при распаде жиров - глицерин и жирные кислоты - встраиваются в окислительные реакции, окисляясь до воды и углекислого газа в присутствии кислорода или до лактата в анаэробных условиях. Глицерин в цикле Кребса дает одну молекулу АТФ в анаэробных условиях и 19 молекул АТФ в аэробных. Жирные кислоты окисляются до ацетил-КоА, метаболизм которой в цикле Кребса дает 24 молекулы АТФ.
В печени происходит спряжение углеводного и жирового путей обмена посредством ацетил-КоА. Так, в процессе окисления глюкозы и по мере накопления образовавшегося ацетил-КоА, не все соединение вступает в цикл Кребса, частично ацетил-КоА встраивается в цепь реакций, направленных на образование жирных кислот с различной длиной цепи, с последующим образованием триглицеридов при взаимодействии с глицерином. В свою очередь, липолиз и образование свободных жирных кислот способно давать в качестве энергетического субстрата ацетил-КоА и собственно глицерин, которые поступают в цикл трикарбоновых кислот (рис. 9). Сопряжение двух путей обмена получило название цикла Рендла. Рендл показал, что при избыточном поступлении в клетки свободных жирных кислот происходит увеличение содержания ацетил-КоА, которое сопровождается снижением активности прохождения цикла Кребса и увеличением накопления в клетках цитрата. Цитрат ингибирует активность фосфофруктокиназы - ключевого фермента в цикле Эмбдена-Меергофа, в результате чего снижается скорость фосфорилирования глюкозы и значительно замедляется утилизация глюкозы клетками. Следствием замедления транспорта и утилизации глюкозы становятся с одной стороны снижение интенсивности
синтеза гликогена в клетках, а с другой - повышение содержания глюкозы в периферической крови. Поскольку мышечная ткань в качестве пластического и энергетического материала может использовать ацетил-КоА «жирового» происхождения, встраивая его в цикл Кребса, циркулирующая глюкоза остается невостребованной. Имеются достоверные данные, подтверждающие наличие прямой корреляции между накоплением липидов в мышцах и формированием инсулинорезистентности.
Инсулин, будучи анаболическим гормоном, стимулирует синтез жирных кислот в печени и жировой ткани, тормозит липолиз и кетогенез, блокирует накопление в клетках триглицеридов и эфиров холестерина. В том случае когда происходит значительное снижение секреции инсулина, ткани организма начинают испытывать энергетический голод в связи с затруднением поглощения глюкозы инсулинозависимыми тканями, активируются процессы липолиза и последующего глюконеогенеза из ацетил-КоА.
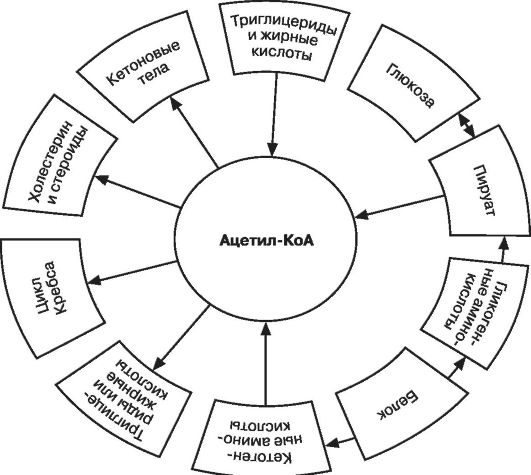 Рис. 9. Участие ацетил-КоА в метаболизме
Рис. 9. Участие ацетил-КоА в метаболизме
Дефицит инсулина, приводящий к торможению окисления предшественников в цикле трикарбоновых кислот, накоплению большого количества потенциальных участников окисления в цикле Кребса, приводит к активации неполного окисления пирувата и ацетил-КоА до ацетоуксусной и β-оксимасляной кислот, массивному накоплению лактата, в результате чего развивается метаболический кетоацидотический ацидоз.
Влияние инсулина на белковый обмен так же актуально, как и в углеводном и жировом обменах. Белки являются не только необходимым компонентом любой из тканей организма, но и одним из главных пластических материалов, обеспечивающих рост и формирование организма. Инсулин обеспечивает положительный азотистый баланс в организме. Являясь анаболическим гормоном, он стимулирует не только активный транспорт аминокислот в клетки периферических тканей, но и непосредственный синтез белка на уровне транскрипции. Под влиянием инсулина, ускоряющего поглощение глюкозы, не только ускоряется синтез белка, но и замедляется его распад. Различают глюкогенные, кетогенные и смешанные аминокислоты. Кетогенная аминокислота - лейцин. Аланин, аргинин, аспарагиновая кислота и глицин, гистидин, пролин, метионин, серин, треонин, триптофан, а также валин являются источником для образования глюкозы (глюкогенные аминокислоты). Остальные аминокислоты могут быть использованы как для кетогенеза, так и для глюконеогенеза.
Рециркуляция обмена глюкозы и лактата между печенью и мышцами может проходить посредством глюкозо-аланинового цикла или челнока (рис. 10). Пируват, полученный в процессе гликолиза из глюкозы в мышцах, подвергается аминированию с образованием аланина, который с током крови поступает в печень, где происходит отщепление аминогруппы и дальнейший синтез глюкозы. Активное отщепление от аланина группы NH2 в процессе глюконеогенеза, осуществляемого в печени, может приводить к накоплению азотистых оснований в организме, развитию интоксикации и смещению рН. Подобные нарушения можно наблюдать у пациентов с манифестацией сахарного диабета типа 1 и лиц с декомпенсацией углеводного обмена.
Регуляторная роль инсулина в сфере белкового обмена очевидна и тесно связана с регуляцией метаболизма жиров и углеводов. Инсулин усиливает синтез белка, оказывает мощные анаболические эффекты на организм в целом и все органы и ткани в частности.
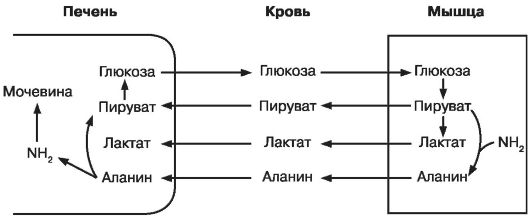 Рис. 10. Взаимосвязь цикла Кори и аланинового цикла
Рис. 10. Взаимосвязь цикла Кори и аланинового цикла
Хорошо известна роль инсулина в регуляции электролитного обмена. Особого внимания заслуживает влияние инсулина на обмен калия и натрия. Инсулин обладает выраженным антинатрийуретическим эффектом, что связано с влиянием гормона на почки. Инсулин снижает экскрецию натрия с мочой, не влияя при этом на скорость клубочковой фильтрации или секрецию альдостерона. Именно этот эффект лежит в основе отеков, появляющихся у части больных сахарным диабетом при назначении им инсулинотерапии. Как правило, подобные отеки проходят через несколько дней самостоятельно и не нуждаются в специфическом лечении.