Клиническая биохимия : учебное пособие. 3-е издание / под ред. В.А. Ткачука. - 2008
|
|
|
|
ГЛАВА 4 БИОХИМИЧЕСКАЯ ДИАГНОСТИКА ПАТОЛОГИЧЕСКИХ ПРОЦЕССОВ И НАСЛЕДСТВЕННЫХ ЗАБОЛЕВАНИЙ
4.1. СЕРДЕЧНО-СОСУДИСТАЯ ПАТОЛОГИЯ
В области сердечно-сосудистой патологии клиническая биохимия достигла наибольших успехов в диагностике инфаркта миокарда. Методы клинической энзимологии и иммунохимии позволяют диагностировать инфаркт миокарда в первые часы его возникновения, выявить клиническое состояние нестабильной стенокардии, провести дифференциальную диагностику тяжелого приступа стенокардии (ишемии) и гибели миоцитов (аноксия), оценить эффективность тромболитической терапии и феномен реперфузии.
В соответствии с рекомендациями ВОЗ диагноз инфаркта миокарда основан на типичной клинической картине приступа болей за грудиной; изменениях показателей ЭКГ; повышении в крови активности кардиоспецифических ферментов (маркеров).
В то же время при повторных инфарктах миокарда, кардиосклерозе и мерцательной аритмии, а также при наличии у больного водителя ритма (пейсмейкера) поставить диагноз инфаркта миокарда по данным ЭКГ значительно труднее. Кроме того, более 25% больных, у которых инфаркт миокарда подтвержден при аутопсии, не имели изменений на ЭКГ. По данным проспективного исследования, проведенного в США, диагноз инфаркта миокарда без исследования кардиоспецифических маркеров гибели миоцитов можно поставить только в 25% случаев.
Среди пациентов, доставляемых в блок интенсивной терапии с болями в сердце, только у 10-15% имеется инфаркт миокарда. Необходимость диагностики инфаркта миокарда в ранние сроки продиктована тем, что тромболитическая терапия в первые 2-6 ч снижает раннюю смертность в среднем на 30%, а терапия, начатая через 7-12 ч, - лишь на 13%. Тромболитическая терапия через 13-24 ч не снижает уровень смертности.
Ранняя постановка диагноза инфаркта миокарда позволяет применить и транслюминальную ангиопластику, да и эффективность консервативного лечения выше, если оно начато возможно раньше.
Необходимо также провести дифференциальную диагностику инфаркта миокарда с нестабильной стенокардией, когда рано начатое лечение может предотвратить инфаркт миокарда.
В последние годы арсенал биохимических маркеров гибели миоцитов пополнился новыми высокоспецифичными тестами, которые позволяют диагностировать инфаркт миокарда в первые часы его возникновения. Это тесты, которые можно применить на первом этапе оказания медицинской помощи, а также определение кардиоспецифических изоферментов и белков-маркеров гибели миоцитов, использующихся в блоке интенсивной терапии медицинских учреждений. В то же время успехи промышленной технологии и выпуск диагностических систем, основанных на принципе «сухой химии», дают возможность определить специфичные маркеры гибели миоцитов уже на первом этапе оказания медицинской помощи. Однако и в этих условиях возможны диагностические ошибки, если четко не представлять патофизиологию инфаркта миокарда и механизмы поступления в кровь органоспецифических и неспецифических белков-маркеров гибели миоцитов.
Локализация в клетке оказывает существенное влияние на скорость выхода маркера из поврежденного миоцита. Цитозольные ферменты высвобождаются быстрее, чем структурированные на внутриклеточных мембранах. В отличие от цитозольных маркеров, для выхода в интерстициальное пространство структурносвязанных белков требуется деструкция внутриклеточного сократительного аппарата, что замедляет процесс появления маркеров в крови; последними высвобождаются митохондриальные ферменты.
При исследовании кардиальных маркеров инфаркта миокарда необходимо принимать во внимание ряд положений, именуемых принципами диагностики инфаркта миокарда. К ним относят: 1) временные интервалы; 2) исследование маркеров поражения миокарда в динамике; 3) органоспецифичность лабораторной диагностики инфаркта миокарда; 4) комплексный характер диагностики; 5) понятие «серая зона».
Практически значимые маркеры гибели миоцитов - каталитическая концентрация в крови КК, ЛДГ, АСТ, гликогенфосфорилазы (ГФ), повышение в крови содержания миоглобина, цепей миозина, тропонинов Ти I. Для поражения только кардиомиоци-тов (но не миоцитов скелетных мышц) специфично определение в крови концентрации изоферментов КК-МВ и ЛДГ1, иммунохимическое определение КК-МВ и ГФ-ВВ, а также соотношения изоформ изофермента КК-МВ и тропонинов.
При диагностике инфаркта миокарда важно учитывать время, прошедшее с момента приступа стенокардии. Это обусловлено тем, что от момента гибели миоцитов до появления в крови маркеров проходит довольно длительный период. Истечение из клеток больших белковых молекул (КК и ЛДГ) может происходить только при нарушении целостности плазматической мембраны миоцитов в результате их гибели при аноксии. Менее крупные молекулы белков-маркеров (миоглобин, тропонин) могут истекать в небольшом количестве из клеток и в условиях длительной гипоксии при выраженном изменении мембраны миоцитов, опережая деструкцию клеток. В первые 4 ч после окклюзии коронарной артерии в зоне максимальной ишемии некротизируется около 60% миоцитов; некроз остальных 40% наступает в течение последующих 20 ч.
Выходя за пределы мембраны миоцита, белковые молекулы попадают в межклеточную жидкость и оттекают от сердца только по лимфатическим путям. Это и определяет довольно длительный промежуток времени (3-6 ч) от момента гибели миоцитов до появления кардиоспецифических маркеров в крови. Прежде всего в крови повышается содержание миоглобина, ГФ-ВВ и тропо-нина, далее - КК и кардиоспецифического изофермента КК-МВ, АСТ; существенно позже возрастает активность ЛДГ и кардиоспецифического изофермента ЛДГ1 (рис. 4.1). Клиническая чувствительность кардиоспецифических маркеров во многом зависит от времени, которое прошло с момента гибели миоцитов. Так, для КК-МВ при определении в крови в первые 3-4 ч после приступа стенокардии клиническая чувствительность (дмагностическая достоверность) составляет только 25-45% и возрастает до 98% в интервале 8-32 ч. В сроки ранее 8 ч определение активности
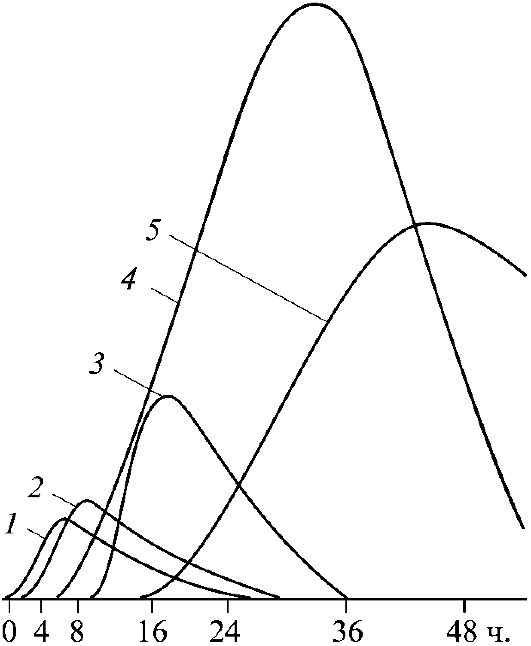 Рис. 4.1. Динамика активности ферментов при инфаркте миокарда. 1 - МВ-2/МВ-1; 2 - ММ-3/ММ-1; 3 - КК-МВ; 4 - КК суммарная; 5 - ЛДГ1/ЛДГ2
Рис. 4.1. Динамика активности ферментов при инфаркте миокарда. 1 - МВ-2/МВ-1; 2 - ММ-3/ММ-1; 3 - КК-МВ; 4 - КК суммарная; 5 - ЛДГ1/ЛДГ2
КК дает ложноотрицательные результаты в 32% случаев, АСТ - в 49%, миоглобина - в 15%. Активность ЛДГ - достоверный маркер гибели миоцитов после 12 ч от начала приступа стенокардии, но она остается повышенной в течение 10-12 дней. Данные об активности кардиоспецифических маркеров в сроки менее 4-6 ч после приступа стенокардии могут приводить к диагностическим ошибкам, когда даже при обширном инфаркте миокарда маркеры гибели миоцитов окажутся не столь информативными. Кроме того, скорость нарастания содержания кардиальных маркеров в крови в значительной степени зависит от длительности ишемии и времени реканализации тромбированной коронарной артерии и реперфузии миокарда после инфаркта.
Вторая особенность выхода в кровь маркеров гибели кардиомиоцитов - характерная динамика нарастания и убывания их концентрации (каталитической концентрации). Это определено постоянным сокращением миокарда, что приводит вначале к быстрой элиминации белков из некротизированного участка миокарда, а затем к полному вымыванию в кровь белков-маркеров. Только при инфаркте миокарда содержание в крови маркеров гибели кардиомиоцитов увеличивается в интервале 8-24 ч. При неосложненном течении инфаркта миокарда далее происходит столь же заметная элиминация белков-маркеров из сосудистого русла. При этом содержание каждого из маркеров «выписывает» дугообразную динамичную кривую с разными временными параметрами. Для большинства маркеров площадь кривой дает представление о величине инфаркта миокарда, отражая количество некротизированной ткани миокарда. Активность в крови КК и КК-МВ повышается уже при гибели 1 г ткани миокарда.
Однократное исследование АСТ, КК или ЛДГ обладает сравнительно низкой клинической специфичностью - 66%, возрастание активности ферментов или содержания белков-маркеров через 3-4 ч повышает органоспецифичность диагностики до 86%, третье измерение позволяет диагностировать инфаркт миокарда при использовании даже столь малоспецифичного теста, как определение АСТ. Динамическое исследование маркеров гибели миоцитов позволяет провести дифференциальную диагностику между инфарктом миокарда и гиперферментемией при массивном поражении поперечнополосатых мышц. В сроки 8-24 ч после приступа стенокардии активность ферментов настолько показательна, что если нет динамичного нарастания их активности в крови, то нет и инфаркта миокарда.
Абсолютно специфических маркеров поражения кардиомиоцитов не найдено. Органоспецифичность при диагностике с помощью изоферментов КК основана только на различии процентного соотношения изоферментов в отдельных органах и тканях, а следовательно, и в сыворотке крови при их поражении.
Значение КК-МВ. Изофермент КК-МВ специфичен для миокарда не потому, что в других тканях такого изофермента нет, а потому, что в кардиомиоцитах его активность составляет 15-42% общей активности КК, в то время как в ткани скелетных мышц его содержание не превышает 4%, да и то только в красных, медленно сокращающихся мышечных волокнах. В этих условиях при поражении миокарда и скелетной мускулатуры активность КК может быть повышена в одинаковой степени, но в процентном отношении активность КК-МВ будет существенно отличаться. При инфаркте миокарда содержание КК-МВ превышает 6% общей активности КК или 12 МЕ/л при температуре 30 °С.
Как при патологии скелетных мышц, так и при гибели кардиомиоцитов в крови повышена активность КК-МВ, но в первом случае ее активность не превысит 6% активности КК, а во втором случае повысится до 12-20%. Целесообразно выражать активность КК-МВ одновременно в единицах на 1 л (МЕ/л) и в процентах от активности КК. Определение активности КК-МВ остается самым популярным тестом в диагностике инфаркта миокарда. При инфаркте миокарда у лиц пожилого возраста активность КК может быть повышена только в малой степени, но при достоверном повышении активности КК-МВ. У таких больных диагностически важно исследовать активность КК-МВ даже при не столь значительном повышении активности КК.
При операциях на сердце (пороки сердца, коронарное шунтирование) активность КК-МВ используют для диагностики послеоперационного инфаркта миокарда. Сразу после операции вследствие гипоксии и повреждения миокарда активность КК-МВ в крови повышается и возвращается к норме в течение 10-12 ч. При развитии инфаркта миокарда активность КК-МВ повышается более значительно и имеет динамику, характерную для инфаркта миокарда.
Значение ЛДГ. Активность ЛДГ1 характерна для миокарда как для ткани с анаэробным типом обмена. В условиях гипертрофии миокарда и хронической гипоксии синтез ЛДГ1 в кар-диомиоцитах начинает увеличиваться. При инфаркте миокарда повышение каталитической концентрации ЛДГ в крови происходит за счет возрастания
содержания изоферментов ЛДГ1 и ЛДГ2 при соотношении ЛДГ1/ЛДГ2 более 1. ЛДГ - цитозольный фермент; достоверное повышение активности ЛДГ в крови при инфаркте миокарда происходит позже, чем КК и АСТ, - в течение 1-х суток поле приступа стенокардии; высокая активность ЛДГ1 сохраняется на протяжении 12-14 дней. Именно снижение активности ЛДГ в крови до нормы используют в качестве теста, который указывает на завершение периода резорбции некротизированной ткани миокарда. Если активность ЛДГ1, определенная прямым методом, при ингибировании субъединицы М антителами превышает 100 МЕ/л, это служит достоверным признаком инфаркта миокарда.
В отличие от субъединицы М и изоферментов ЛДГ3 (ММНН), ЛДГ4 (НМММ) и ЛДГ5 (ММММ) субъединица Н и изофермент ЛДГ1 (НННН) в меньшей степени ЛДГ2 (НННМ), могут в качестве субстрата использовать не только лактат и пируват, но и α-гидроксибутират. Это послужило основой предложения оценивать активность ЛДГ1 в крови, используя в качестве субстрата α-гидроксибутират; при этом изофермент ЛДГ1 именуют α-гидроксибутиратдегидрогеназой (α-ГБДГ). При инфаркте миокарда исследование активности общей ЛДГ и α-ГБДГ дает сходные результаты. Если же активность ЛДГ в крови повышается в результате иного патологического процесса, активность ЛДГ будет существенно выше активности ЛДГ1 и α-ГБДГ при отсутствии характерной для инфаркта миокарда динамики.
При инфаркте миокарда не отмечено достоверной зависимости между активностью КК-МВ и ЛДГ1 во все сроки инфаркта, что происходит в результате существенного различия динамики и сроков повышения в крови активности этих изоферментов.
Молекулы ферментов, попавших в кровь после гибели кардиомиоцитов, - патологические компоненты плазмы крови и поэтому подлежат удалению. В зависимости от размеров молекул маркера некоторые белки, например миоглобин, экскретируются в мочу или их фагоцитируют клетки моноцитарно-макрофагальной системы. Однако перед тем как молекулы КК-МВ и КК-ММ будут фагоцитированы макрофагами, они в крови подвергаются последовательному действию протеаз, в результате чего образуются фрагменты изоферментов КК-МВ и КК-ММ.
В миоцитах изофермент КК-ММ представлен одной формой ММ-3. В крови карбоксипептидаза последовательно отщепляет конечные аминокислотные остатки лизина от каждого из двух мономеров, последовательно образуя изоформы ММ-2 и ММ-1. Определение изоформ КК-ММ и КК-МВ методом ЭФ и расчет их соотношения
позволяют с точностью до 1 ч установить время гибели кардиомиоцитов. Соотношение изоформ ММ и МВ изменяется раньше, чем повышается активность КК-МВ.
Энзимодиагностика инфаркта миокарда в клинико-диагностических лабораториях имеет комплексный характер. Сначала определяют активность АСТ, КК и ЛДГ, затем исследуют активность КК-МВ и ЛДГ1. Комплексный подход к энзимодиагностике обусловлен, во-первых, тем, что при исследовании активности одного фермента можно допустить ошибку; во-вторых, каждый из указанных ферментов отличается по диагностической значимости и динамике (время появления в крови и скорость элиминации из сосудистого русла). Кроме неточностей, которые могут быть допущены на преаналитическом (взятие крови на анализ) и аналитическом этапах, существуют объективные причины, влияющие на результаты определения активности ферментов. Сложности возникают, когда инфаркт миокарда развивается на фоне тяжелых соматических заболеваний, при осложнении инфаркта миокарда кардиогенным шоком, при септицемии.
Несмотря на клиническую специфичность активности КК для инфаркта миокарда (98%), в отдельных случаях повышение активности КК и КК-МВ не удается выявить даже в условиях верификации диагноза инфаркта миокарда по данным ЭКГ. Это происходит в тех случаях, когда инфаркт развивается на фоне почечной недостаточности и накопления уремических токсинов (среднемолекулярные пептиды), у пациентов с циррозом печени и недостаточностью детоксикационной активности гепатоцитов, при септицемии и эндогенной интоксикации, при выраженном метаболическом (или дыхательном) ацидозе. В этих условиях в крови накапливается столь большое количество неспецифических ингибиторов, что активность КК и КК-МВ практически не определяется. В таких случаях определить активность КК удается только после проведения непопулярной в клинической биохимии процедуры разведения сыворотки крови, когда снижение концентрации ингибиторов позволяет проявиться активности фермента.
Присутствие в крови ингибиторов КК и КК-МВ побудило разработать иммунохимический способ определения в крови не каталитической активности, а содержания КК-МВ по молекулярной массе этой формы. Это существенно улучшило чувствительность метода и воспроизводимость результатов. Хотя при неосложненном инфаркте миокарда активность КК-МВ и содержание белка КК-МВ хорошо коррелируют,
определить содержание КК-МВ в крови удается на несколько часов раньше, чем фермент проявляет активность. Достоверное повышение в крови уровня белка КК-МВ отмечено у половины больных уже через 3 ч, а через 6 ч после приступа стенокардии высокий уровень белка отметили у всех больных с клинической картиной инфаркта миокарда. Уже через 90 мин после тромболизиса уровень белка КК-МВ в крови увеличивается в несколько раз. У больных нестабильной стенокардией возрастание содержания белка КК-МВ отмечено чаще, чем повышение активности изофермента. В то же время, несмотря на производство диагностических наборов разными фирмами, вопрос о стандартизации метода определения количества КК-ВМ окончательно не решен.
Значение гликогенфосфорилазы. Среди ферментных и изоферментных маркеров в диагностике инфаркта миокарда клинические биохимики определяют активность ГФ и ее изофермента ГФ-ВВ. ГФ - цитозольный фермент, который катализирует в клетке отщепление глюкозы от гликогена.
В тканях человека присутствуют три изофермента ГФ: ГФ-LL в печени, ГФ-ММ в миоцитах и ГФ-ВВ в ткани мозга. В миокарде человека присутствуют изоферменты ГФ-ВВ и ГФ-ММ, в миоцитах скелетной мускулатуры - только ГФ-ММ. ГФ-ВВ - наиболее чувствительный тест для диагностики инфаркта миокарда в первые 3-4 ч после приступа стенокардии. По диагностической чувствительности в первые часы определение активности ГФ можно сопоставить только с определением в крови массы КК-МВ. У большинства больных уровень ГФ-ВВ достоверно увеличивался уже через 4 ч после приступа стенокардии и при неосложненном инфаркте миокарда возвращался к норме в течение 48 ч.
Значение миоглобина. Среди белков-маркеров инфаркта миокарда наиболее широкое распространение получило определение в крови содержания миоглобина (МГ). МГ - хромопротеин, который в цитозоле всех мышечных клеток транспортирует кислород главным образом к митохондриям. Молекулярная масса МГ всего 18 кД; его свойства близки в миоцитах скелетной мускулатуры и кардиомиоцитах. МГ постоянно присутствует в плазме крови в концентрации ниже 80 нг/мл. При инфаркте миокарда уровень МГ в крови повышается в 10-20 раз.
• Увеличение содержания МГ в крови - наиболее ранний тест для диагностики инфаркта миокарда; повышение уровня МГ в крови удается определить через 3-4 ч после приступа стенокардии. Это первое диагностическое значение МГ.
• Βторая особенность МГ в диагностике инфаркта миокарда состоит в том, что столь малая молекула свободно проходит через фильтрационный барьер почечных телец и быстро оказывается в моче. Это определяет характер изменений содержания МГ в крови: оно быстро повышается и столь же быстро снижается. Только при определении МГ удается диагностировать повторные инфаркты миокарда (рис. 4.2), развивающиеся через несколько часов после первого эпизода гибели кардиомиоцитов. Кроме того, в ряде клинических наблюдений отмечены существенные колебания уровня МГ в крови в 1-е сутки инфаркта миокарда, когда выраженное повышение через несколько часов сменяется столь же выраженным снижением. Β ряде ситуаций уровень МГ в крови остается длительное время постоянно высоким. Это наблюдают при кардиогенном шоке, когда снижение сократительной функции приводит к гипотонии, падению гидростатического давления над почечной мембраной и прекращению
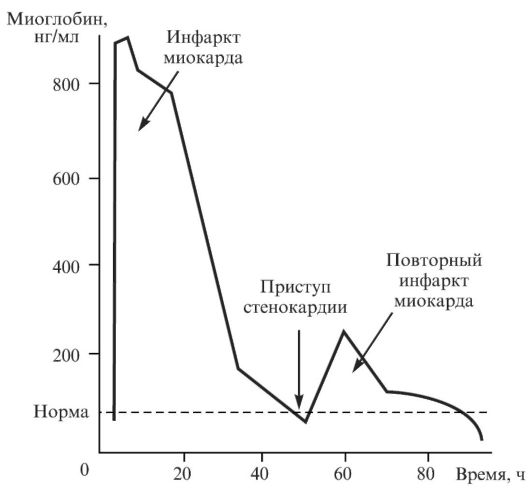 Рис. 4.2. Динамика концентрации миоглобина в крови после повторного приступа стенокардии
Рис. 4.2. Динамика концентрации миоглобина в крови после повторного приступа стенокардии
гломерулярной фильтрации, когда МГ не может быть профильтрован в мочу. При этом наблюдается положительная корреляция между содержанием МГ в крови положительно коррелирует с нарастанием уровня креатинина.
Основная структурная сократительная единица миоцита - саркомер, который образуют упорядоченно расположенные толстые и тонкие волокна. Тонкие содержат волокна актина и тропонин-тропомиозиновый комплекс.
Значение тропонинов. Тропониновый регуляторный комплекс в поперечнополосатых мышцах состоит из трех полипептидов; при диагностике инфаркта миокарда определяют в крови содержание только тропонина Т (Тн Т) и тропонина I (Тн I). Каждый из белков имеет три изоформы, синтез которых кодируют три разных гена. Как специфические маркеры гибели кардиомиоцитов используют миокардиальные изоформы Тн Т и Тн I (сердечный Тн Т и сердечный Тн I).
Определение содержания Тн Т позволяет провести диагностику инфаркта как в ранние, так и в поздние сроки. Содержание Тн Т в крови повышается уже через несколько часов после приступа стенокардии. В ранние сроки инфаркта миокарда клиническая чувствительность определения миоглобина и содержания КК-МВ оказываются выше, чем Тн Т, но с 3-го дня уровень Тн выходит на плато, которое сохраняется при постепенном снижении в течение 5-6 дней. Уровень Тн Т оказывается высоким в те сроки неосложненного инфаркта миокарда, когда уровень миоглобина и активность КК-МВ уже вернулись к норме, а в крови остается только высокая активность ЛДГ1. В ряде случаев при определении Тн Т диагноз инфаркта миокарда можно поставить и в поздние сроки - через 8-10 дней после ангинозных болей. Особенно важно исследовать Тн Т у больных, которые поступили в стационар через 2-3 дня после приступа стенокардии, когда показатели КК и КК-МВ могут уже вернуться к исходному нормальному уровню. Кроме того, по сравнению с КК и КК-МВ содержание Тн Т в крови повышается в большей степени, что характеризует более высокую диагностическую чувствительность определения в крови содержания Тн Т.
Сравнительное исследование Тн Т и Тн I выявило более высокую диагностическую чувствительность Тн I. Так, уровень в крови Тн I при инфаркте миокарда может почти в 100 раз превышать верхнюю границу нормы. При небольшом по размерам инфаркте миокарда уровень Тн I в крови повышается в большей степени, чем активность КК,
Таблица 4.1. Сравнительная характеристика кардиальных маркеров сыворотки крови
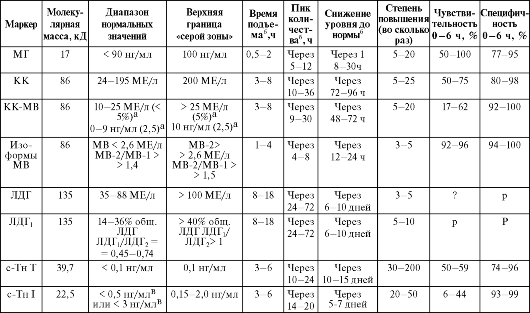 а Процент или соотношение КК-МВ/общ. КК 6 Время от начала болевого приступа в Зависит от метода
а Процент или соотношение КК-МВ/общ. КК 6 Время от начала болевого приступа в Зависит от метода
КК-МВ и ЛДГ1. Определение обеих форм Тн Т и Тн I предпочтительно при диагностике инфаркта миокарда, развивающегося в послеоперационном периоде и после активных реанимационных мероприятий.
Идеального маркера состояния кардиомиоцитов нет (табл. 4.1). В диагностике инфаркта миокарда клинические биохимики стремятся использовать наиболее органоспецифические изоферменты и определять белки-маркеры, содержащие только клетки миокарда. Вместе с тем для диагностики инфаркта миокарда в лабораториях продолжают определять и МГ. Однако при неосложненном инфаркте миокарда динамика содержания в крови неспецифического МГ практически повторяет таковую кардиоспецифического КК-МВ, опережая ее на 4-6 ч. В то же время попытки определять содержание МГ в моче для диагностики инфаркта миокарда успеха не имели.
4.2. БОЛЕЗНИ ПЕЧЕНИ
Несмотря на множество биохимических процессов, протекающих в клетках печени, изменения далеко не всех из них имеют диагностическое значение. Это обусловлено ограниченными методическими возможностями лаборатории, низким уровнем знаний о патофизиологии печени, а также однонаправленными изменениями ряда биохимических тестов.
Доминирующее значение в лабораторной диагностике заболеваний печени имеет определение активности ферментов. Синтезируемые гепатоцитами и клетками эпителия желчных протоков ферменты могут быть разделены на индикаторные, секреторные и экскреторные. К секреторным ферментам относят холестеразу, ее активность в крови при заболеваниях печени понижается вследствие нарушения ее синтеза. К экскреторным ферментам относят ЩФ, ГГТ и ЛАП. Наибольшую группу диагностически важных ферментов представляют индикаторные ферменты, включающие АЛТ, АСТ, ЛДГ и ГлДГ. В табл. 4.2 приведены указанные ферменты и их внутриклеточное распределение.
Широкое распространение в дифференциальной диагностике заболеваний печени получил способ сопоставления степени повышения активности ферментов, имеющих разную локализацию в гепатоците и отражающих разные стороны функциональной активности поражений клетки. Наиболее используемые соотношения ферментов представлены в табл. 4.3.
Таблица 4.2. Ферменты печени
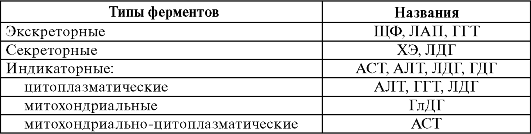 Таблица 4.3. Соотношения ферментов печени
Таблица 4.3. Соотношения ферментов печени
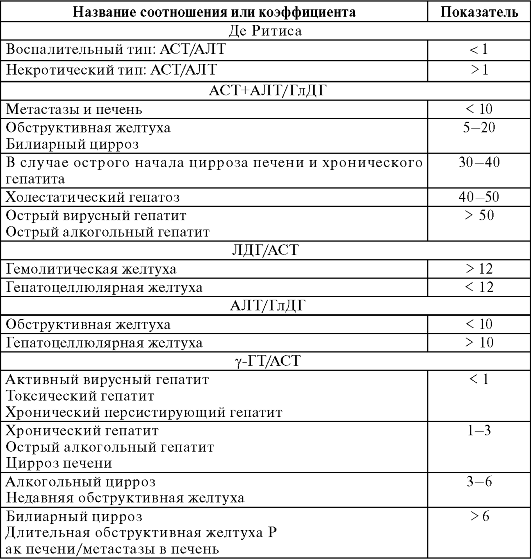 При
заболеваниях печени используют коэффициент Де Ритиса (соотношение
активности АСТ/АЛТ). Соотношение АСТ/АЛТ более 2 характерно для
алкогольного поражения, а менее 1 - для вирусного гепатита,
холестатического синдрома. В большинстве случаев вирусного гепатита
соотношение АСТ/АЛТ оставалось ниже 1. При вирусном гепатите в десятки
раз возрастает активность АЛТ. При остром алкогольном гепатите
активность АСТ выше АЛТ, при этом активность обоих ферментов не
превышает 500-600 МЕ/л. У пациентов с токсическим гепатитом,
инфекционным мононуклеозом, внутрипеченочным холестазом, при циррозе,
метастазах в печень, инфаркте миокарда активность АСТ выше, чем
активность АЛТ. Активность АЛТ и АСТ возрастает при приеме эритромицина,
парааминосалициловой кислоты, диабетическом кетоацидозе, псориазе, ее
также используют для ранней диагностики безжелтушного гепатита.
При
заболеваниях печени используют коэффициент Де Ритиса (соотношение
активности АСТ/АЛТ). Соотношение АСТ/АЛТ более 2 характерно для
алкогольного поражения, а менее 1 - для вирусного гепатита,
холестатического синдрома. В большинстве случаев вирусного гепатита
соотношение АСТ/АЛТ оставалось ниже 1. При вирусном гепатите в десятки
раз возрастает активность АЛТ. При остром алкогольном гепатите
активность АСТ выше АЛТ, при этом активность обоих ферментов не
превышает 500-600 МЕ/л. У пациентов с токсическим гепатитом,
инфекционным мононуклеозом, внутрипеченочным холестазом, при циррозе,
метастазах в печень, инфаркте миокарда активность АСТ выше, чем
активность АЛТ. Активность АЛТ и АСТ возрастает при приеме эритромицина,
парааминосалициловой кислоты, диабетическом кетоацидозе, псориазе, ее
также используют для ранней диагностики безжелтушного гепатита.
В дифференциальной диагностике патологии печени важно исследовать соотношения активности изоферментов ЛДГ. Увеличение относительной активности изофермента ЛДГ5 характерно для поражения гепатоцитов. Гиперферментемию ЛДГ в разной степени наблюдают при остром вирусном, лекарственном и гипоксическом гепатите, сердечной недостаточности, циррозе печени и внепеченочном холестазе, а также при снижении осмотической резистентности эритроцитов и гемолизе. Длительное повышение активности изоферментов ЛДГ5 и ЛДГ4 дает основание предположить наличие метастазов в печень.
В настоящее время в диагностике заболеваний печени все еще оценивают стабильность коллоидных систем по тимоловому и сулемовому тестам. Патологические результаты отражают ранние сроки острого гепатита, токсического поражения печени, обострения хронического гепатита. ЭФ белков сыворотки крови также дает неспецифические данные, но позволяет судить о характере патологического процесса. Процентное содержание альбумина, белков острой фазы и γ-глобулинов помогает в диагностике патологии печени: низкое содержание альбумина и высокий уровень γ-глобулинов характерны для цирроза печени. Повышение содержания в крови γ-глобулинов встречается также при жировой инфильтрации печени, воспалении желчных протоков, малигнизации.
Содержание альбумина в сыворотке крови имеет диагностическое значение при острой и хронической формах гепатита. Во всех случаях острого гепатита уровень альбумина в крови остается нормальным.
Хронический гепатит сопровождается гипоальбуминемией и гипергаммаглобулинемией.
Печень - центральное звено регуляции свертывания крови. Гепатоциты синтезируют фибриноген, многие активаторы и ингибиторы каскада ферментативных реакций. Как острый, так и хронический гепатит нарушает эту регуляцию. К диагностическим тестам заболевания печени относят удлинение протромбинового времени, накопление в крови продуктов разрушения фибриногена. Острое поражение печени сопровождается усилением кровоточивости в условиях гипофибриногенемии.
Нарушение функций печени сопровождается изменением обмена ЛП. Гипертриглицеридемия характерна для разных форм патологии печени. Гиперхолестеринемия чаще возникает при закупорке желчных протоков и обтурационной желтухе. При хроническом гепатите в крови происходит накопление свободного холестерина в результате снижения его этерификации в сосудистом русле. В условиях выраженного холестаза наблюдается формирование холестатической макроформы ЛП - ЛП-Х, составляющей комплекс ЛП с фрагментом плазматической мембраны.
В большинстве случаев заболеваний печени этиологический фактор остается за рамками диагностики и клинические биохимики формируют диагноз, основываясь на принципах синдромальной диагностики.
Основные патологические процессы, формирующие лабораторную диагностику заболевания, следующие синдромы:
• цитолиза;
• внутриклеточного холестаза;
• внутрипеченого и внепеченочного холестаза;
• токсического поражения гепатоцитов;
• недостаточности синтетических процессов в гепатоцитах;
• замедления инактивации токсических соединений;
• воспалительный.
Синдром цитолиза. Патофизиологическая основа синдрома цитолиза - нарушение целостности плазматической мембраны гепатоцитов и их органелл с развитием гиперферментемии. Выраженная гиперферментемия при поступлении в кровь цитозольных ферментов характерна для инфекционного гепатита, лекарственных и токсических повреждений печени, отравлений, декомпенсированных циррозов, перифокального воспаления паренхимы при холангитах. В энзимодиагностике синдрома цитолиза доминирует определение
активности АЛТ, АСТ и ЛДГ. В норме активность как АЛТ, так и АСТ в крови не превышает 24 МЕ/л; в пределах 100 МЕ/л гиперферментемию рассматривают как «серую зону», что может быть связано с реактивными изменениями в гепатоцитах. Активность АЛТ выше 100 МЕ/л свидетельствует о поражении паренхимы печени. Увеличение активности АЛТ в 100-200 раз (до 2-6 тыс. МЕ/л) отражает обширное поражение гепатоцитов при вирусном гепатите и отравлении органическими растворителями.
Синдром внутрипеченочного и внепеченочного холестаза. Синдром внутрипеченочного холестаза определяет нарушение оттока желчи из печени. Увеличение объема гепатоцитов приводит к сдавлению ими желчных протоков, нарушению дренажной функции. Обтурация крупных желчных протоков - причина внепеченочного холестаза; наиболее выражен холестаз при механической желтухе. В табл. 4.4 приведены комбинации лабораторных тестов, наиболее часто используемых для дифференциальной диагностики холестаза.
Таблица 4.4. Диагностика холестаза
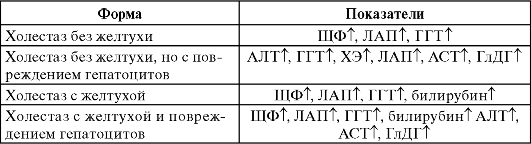 Достоверные
маркеры синдрома внутрипеченочного холестаза - повышение в крови
активности ЩФ, ГГТ и 5-нуклеотидазы. В мембране эпителия желчевыводящих
протоков ферменты расположены близко друг от друга, поэтому при
деструкции мембран их активность в кровотоке повышается одновременно и в
равной степени.
Достоверные
маркеры синдрома внутрипеченочного холестаза - повышение в крови
активности ЩФ, ГГТ и 5-нуклеотидазы. В мембране эпителия желчевыводящих
протоков ферменты расположены близко друг от друга, поэтому при
деструкции мембран их активность в кровотоке повышается одновременно и в
равной степени.
Реактивные изменения в эпителии желчевыводящих путей и плазматических мембран гепатоцитов оценивают на основании активности ЩФ. Активность ЩФ помогает в дифференциальной диагностике внутри- и внепеченочного холестаза. При внепеченочной обструкции (камни желчных протоков, новообразование фатерова сосочка) активность ЩФ повышается в 10 раз и более. Внутрипеченочная обструкция при паренхиматозном поражении (гепатите) сопровожда-
ется повышением активности ЩФ в 2-3 раза. Острый некроз гепатоцитов может и не сопровождаться повышением активности ЩФ, если при этом не происходит сдавления желчных протоков (внутрипеченочный холестаз). Не при всех патологических процессах в печени наблюдают зависимость между активностью ЩФ и гипербилирубинемией. В ранние сроки внутрипеченочного холестаза повышение активности ЩФ - следствие активации ее синтеза; далее ее увеличение связано с деструкцией желчных канальцев при действии желчных кислот.
Синдром внутриклеточного холестаза. Увеличение размеров гепатоцитов и сдавления ими желчных ходов между дольками печени приводят к возникновению синдрома внутриклеточного холестаза с умеренным увеличением в крови активности ЩФ и ГГТ, поражению эпителия желчевыводящих протоков. Повышение в крови содержания желчных кислот - также ранний симптом холестаза.
Частый симптом заболеваний печени, сопровождающихся холестазом, - накопление в крови билирубина. Выраженность гипербилирубинемии недостоверна для дифференциальной диагностики внутри- и внепеченочного холестаза. В то же время гипербилирубинемия имеет прогностическое значение. Повышение уровня билирубина в пять раз характерно для внутрипеченочного холестаза, увеличение концентрации билирубина в 10 раз более характерно для острого гепатита.
Синдром токсического поражения гепатоцитов развивается, например, при алкогольной интоксикации, когда явления цитолиза отсутствуют, но алкоголь нарушает функцию митохондрий.
При острой интоксикации алкоголем развивается синдром токсического поражения субклеточных образований, а нарушения целостности плазматических мембран в гепатоцитах не происходит. Токсическое влияние оказывают метаболиты алкоголя, в частности ацетальдегид, образующийся непосредственно в митохондриях. При этом в клетке нарушается образование макроэргических соединений, в частности АТФ, что оказывает патологическое влияние на процессы детоксикации ядовитых соединений. В остром периоде алкогольного гепатита в крови может доминировать активность АСТ за счет высокой активности не цитоплазматического, а митохондриального изофермента АСТ.
Вовлечение в патологический процесс митохондрий гепатоцитов сопровождается появлением в крови активности ГлДГ. Повышение активности ГлДГ - ранний тест алкогольного гепатита, однако 8-10-кратное повышение активности ГлДГ при умеренной активации АСТ и АЛТ характерно для обструктивной желтухи. Для токсического
влияния алкоголя характерно выраженное повышение в крови активности ГГТ без значительного повышения активности ЩФ.
Синдром недостаточности синтетических процессов проявляется в снижении синтеза гепатоцитами транспортных белков, белков свертывающей системы крови, ХЭ.
ХЭ и ее изоферменты синтезируют гепатоциты. В условиях паренхиматозного поражения синтез ХЭ и ее активность в крови снижены. Чаще снижение в крови ХЭ возникает в результате токсического влияния (цитостатики, инсектициды, фунгициды, фториды). Физиологическое снижение активности ХЭ происходит при беременности. Отмечают редкие случаи генетически обусловленного снижения синтеза ХЭ.
При острой печеночной недостаточности гипогликемия развивается у каждого 4-го пациента. В условиях накопления промежуточных метаболитов и развития резистентности к инсулину возможно возникновение и гипергликемии. При длительном течении печеночной недостаточности возникает гиперинсулинемия (снижение разрушения гормона в печени). В условиях гипоксии и активации анаэробного гликолиза формируется метаболический ацидоз с накоплением в крови молочной кислоты (лактат-ацидоз). Метаболический ацидоз приводит к нарушению соотношения электролитов. Поражение паренхимы печени сопровождается снижением образования креатинина и мочевины. Естественно, что определенный вклад в это вносят неадекватное потребление белка, нарушение пищеварения. Однако основная причина гипокреатининемии - снижение синтеза креатинина в гепатоцитах. У пациентов с гепатитом к гипокреатининемии присоединяется снижение в крови уровня мочевой кислоты.
Синдром замедления инактивации токсических соединений обусловлен ингибированием их гидроксилирования в микросомальном аппарате гепатоцитов, что снижает скорость инактивации в организме многих лекарственных препаратов. В этих условиях даже низкая терапевтическая доза препарата может стать причиной выраженного побочного действия.
Печень служит биологическим барьером эндогенных и экзогенных токсичных соединений, которые в первую очередь поступают из ЖКТ. Оценку детоксикационной функции печени чаще проводят при хронических поражениях, используя нагрузочные тесты с галактозой, фенолтетрабромфталеинсульфоновой кислотой, бромциановым зеленым, мечеными соединениями. Нагрузочные тесты дают возможность диагностировать хронические формы заболевания, оценить
остаточные явления перенесенного гепатита, составить представление о функции печени при циррозе, жировой инфильтрации печени.
В тяжелых ситуациях печеночной комы при остром вирусном гепатите или портальной гипертензии детоксикационную функцию печени оценивают на основании содержания в крови аммиака. Образование аммиака в кишечнике происходит постоянно в результате жизнедеятельности микроорганизмов и дезаминирования аминокислот, образующихся из белков пищи. В условиях массивных кровотечений из желудка или вен пищевода происходит усиленное образование аммиака из альбумина крови.
Воспалительный синдром обусловлен активацией клеток РЭС. Для него характерны увеличение в крови содержания белков острой фазы, диспротеинемия с нарушением соотношения белков сыворотки крови на электрофореграмме, изменение осадочных проб (тимоловой), повышение концентрации иммуноглобулинов.
Несмотря на многообразие описанных нарушений, использование приемов синдромальной диагностики эффективно уже на ранних стадиях заболеваний печени. Естественно, что результаты биохимических исследований в диагностическом процессе не единственны. Одновременно клиницисты используют данные анамнеза и объективного обследования, результаты радионуклидной диагностики, компьютерной томографии и биопсии печени. В то же время дифференциальную диагностику на ранних стадиях заболевания и оценку характера поражения гепатоцитов можно провести только на основании лабораторных исследований, главным образом данных клинической биохимии. Используемые комбинации лабораторных исследований представлены в табл. 4.5.
Таблица 4.5. Диагностика заболеваний печени по ферментам
 4.3. ПАТОЛОГИЯ КОСТНОЙ ТКАНИ
4.3. ПАТОЛОГИЯ КОСТНОЙ ТКАНИ
К основным факторам, регулирующим метаболизм фосфатов и кальция, относят ПТГ, кальцитонин и витамин D. ПТГ и кальцитонин поддерживают постоянство кальция в сосудистом русле и внеклеточной жидкости, влияют на всасывание кальция в кишечнике, реабсорбцию в почках, кишечнике и депонирование в костной ткани. ПТГ регулирует содержание кальция в крови, оказывая влияние на всасывание кальция в кишечнике и почечных канальцах, мобилизацию кальция из костной ткани. Кальцитонин обладает менее значительным влиянием, снижая активность остеокластов, повышает активность остеобластов, приводя к снижению содержания кальция в крови.
Роль ПТГ
ПТГ - полипептид, единственная цепь которого состоит из 84 аминокислотных остатков. Гормон секретируют паращитовидные железы, вероятно, в форме неактивного предшественника, из которого активный гормон образуется путем отщепления полипептидного фрагмента. Активный ПТГ имеет короткий период полужизни, что создает проблемы для анализа: с помощью радиоиммунологического метода измеряют в основном карбокситерминальный фрагмент гормона, который имеет более длительный период полужизни, но биологически неактивен.
При действии на почки ПТГ подавляет реабсорбцию фосфора в проксимальных и дистальных канальцах нефрона, увеличивая его экскрецию и, соответственно, понижая уровень фосфора в крови (гипофосфатемия). Одновременно гормон увеличивает тубулярную реабсорбцию кальция, особенно в дистальных канальцах нефрона. Действие ПТГ вызывает в костной ткани мобилизацию кальция и фосфата, способствуя возникновению остеопороза и гиперкальциемии. Гипокальциемия по механизму отрицательной обратной связи - основной стимул секреции ПТГ, тогда как гиперкальциемия подавляет образование гормона паращитовидными железами. ПТГ увеличивает также абсорбцию кальция и фосфора в кишечнике, стимулируя синтез 1,25-дигидроксихолекальциферола.
Первичный гиперпаратиреоз
В случаях гиперсекреции ПТГ при аденоме паращитовидной железы развивается выраженный остеопороз, при этом отмечены наличие
гиперкальциемии и гипофосфатемии и повышенная экскреция кальция и фосфата с мочой. В этих условиях ингибирована реабсорбция фосфата в канальцах и, следовательно, увеличена его экскреция, повышен клиренс фосфата с возникновением гиперкальциемии в условиях резорбции костной ткани с развитием остеопороза. Подтвердить диагноз можно путем определения концентрации ПТГ в крови. В случаях, когда гипофосфатемия сопровождается гиперкальциемией, диагностически важно даже умеренное повышение содержания гормона.
Следует иметь в виду, что при некоторых формах новообразований легких, почек, яичников происходит эктопическое образование ПТГ клетками опухоли. Среди таких состояний следует дифференцировать форму рахита, резистентную к витамину D. Это редко встречающееся наследственное заболевание, сцепленное с полом, называется синдромом Фанкони. Для последнего характерна высокая экскреция фосфора с мочой одновременно с глюкозурией и аминоацидурией без возникновения ацидоза в крови.
Вторичный гиперпаратиреоз
При хронической почечной недостаточности может происходить активация синтеза ПТГ как компенсаторный механизм при развитии гипокальциемии и гиперфосфатемии. Вторичный гиперпаратиреоз отмечают также при остеомаляции, вызванной значительным снижением абсорбции кальция в кишечнике при увеличенной экскреции.
Гипопаратиреоз
Это патологическое состояние развивается чаще всего как осложнение оперативных вмешательств на щитовидной железе, когда по ошибке удаляют паращитовидные железы. В этом случае уровень кальция в крови бывает настолько низким, что развивается специфическая симптоматика гипокальциемии и гиперфосфатемии (симптомы Хвостека и Труссо), экскреция кальция и фосфора с мочой снижается. Такое состояние требует неотложного внутривенного введения хлорида кальция.
Псевдогипопаратиреоз
В клинической картине псевдогипопаратиреоза изменение в крови содержания фосфата и кальция сходно с первичным гипопаратиреозом, но при этом содержание ПТГ в крови повышено. Это состояние
характерно для генетического заболевания (болезни Олбрайта), связанного с неспособностью клеток почечных канальцев реагировать на гормон.
Роль кальцитонина
Второй гормон, регулирующий обмен фосфора и кальция, - кальцитонин. Пептид, состоящий из одной цепи, насчитывающий 32 аминокислотных остатка, секретирует парафолликулярные клетки латеральных долей щитовидной железы. Этот гормон ингибирует мобилизацию фосфата и кальция, при этом содержание их в крови понижается (гипокальциемия и гипофосфатемия). Действие гормона на почки недостаточно выяснено; предполагают, что кальцитонин повышает тубулярную экскрецию фосфатов. Кроме того, гормон ингибирует стимулирующее влияние ПТГ на синтез 1,25-дигидрок- сихолекальциферола.
РОЛЬ ВИТАМИНА D
Третий фактор, активно влияющий на обмен кальция и фосфора в костной ткани, - витамин D. Синтез витамина D в организме проходит в два этапа гидроксилирования: первый происходит в печени с образованием вещества с ограниченной биологической активностью; второй этап происходит в почках с образованием витамина D3, холекальциферола с максимальной биологической активностью. В тонкой кишке витамин D3 стимулирует абсорбцию фосфора и кальция, в проксимальных отделах тубулярной части нефрона активирует реабсорбцию обоих ионов. Факторы, активирующие синтез витамина D3 в почках, - это снижение содержания фосфора в крови и действие ПТГ.
В условиях дефицита витамина D, обусловленного снижением содержания его жирорастворимых предшественников в пище, недостаточным ультрафиолетовым облучением кожи или мальабсорбцией, в крови отмечают выраженную гипофосфатемию. В ответ на повышение секреции ПТГ увеличиваются абсорбция кальция и фосфата в тонкой кишке и мобилизация минеральных веществ из костной ткани. В течение определенного времени это нормализует содержание кальция в крови, но концентрация фосфора может оставаться сниженной по причине ингибирования его реабсорбции паратиреоидным гормоном.
При хронической почечной недостаточности развивается синдром почечной остеодистрофии - сложное нарушение метаболизма костной ткани и фосфорно-кальциевого гомеостаза. Снижение гломерулярной
фильтрации продуцирует гиперфосфатемию, развивается гипокальциемия при снижении в почках синтеза витамина D и резистентности к его эффектам. Гиперфосфатемия может способствовать развитию гипокальциемии вследствие снижения абсорбции кальция в тонкой кишке, обусловленной формированием нерастворимых апатитов.
МЕТАБОЛИЧЕСКИЕ ЗАБОЛЕВАНИЯ КОСТНОЙ ТКАНИ
Собственно метаболические заболевания костей подразделяют на остеопороз, остеомаляцию, остеодистрофию, несовершенный остеогенез и остеопороз. Заболевания костей также могут развиться на фоне другой патологии, например акромегалии или эктопической кальцификации в стенке сосудов (при атеросклерозе и в норме при образовании «мозгового песка» в эпифизе).
Остеопороз
Остеопороз - наиболее частое метаболическое заболевание костей. Остеопороз типичен для многих заболеваний, характеризуется генерализованной потерей объема костной ткани, превосходящей возрастную и половую норму и приводящей к снижению прочности кости, что обусловливает подверженность переломам (спонтанным или при минимальной травме). Остеопороз следует отличать от остеопении (обусловленная возрастом атрофия костной ткани) и остеомаляции (нарушение минерализации костного матрикса).
К факторам риска остеопороза относят принадлежность к европеоидной или монголоидной расе, семейную предрасположенность, массу тела менее 58 кг, курение и алкоголизм, низкую или чрезмерную физическую активность, раннюю менопаузу, позднее появление менструаций, аменорею и бесплодие, длительную лактацию (более 6 мес), более трех беременностей и родов в репродуктивном возрасте, а также злоупотребление кофе (более пяти чашек в день), дефицит поступления кальция с пищей и длительное парентеральное питание.
Клиническая картина в большинстве случаев развивается постепенно, обычно в течение нескольких лет. В лабораторной диагностике важны определение уровня ЩФ (может транзиторно повышаться после переломов), кальция и фосфатов (обычно в норме). Активность резорбции кости определяют по отношению уровня кальция мочи к уровню креатинина мочи и по отношению содержания гидроксипролина мочи к уровню креатинина мочи. Рентгенологическое исследование позвоночника выявляет снижение плотности кости с подчеркнутостью
кортикальных контуров. Появление на рентгенограмме подобных отклонений возможно лишь при потере не менее 30% костной ткани.
Остеомаляция - патология скелета, возникающая при недостаточной минерализации органического матрикса костей. У детей это рахит (см. ниже), у взрослых нарушения метаболизма кальция, фосфора и витамина D.
Рахит - заболевание раннего детского возраста, возникающее вследствие дефицита витамина D, характеризующееся изменениями костной ткани с развитием деформаций скелета. Все патофизиологические процессы обусловлены гипокальциемией в результате недостаточности витамина D и его метаболитов. Компенсаторно происходят активация паращитовидных желез и гиперпродукция ПТГ, мобилизующего выведение кальция из костей и увеличивающего всасывание солей кальция и фосфатов в кишечнике. Возникают гипофосфатемия, метаболический ацидоз и нарушения остеогенеза.
Остеодистрофии
Деформирующая остеодистрофия (остеит деформирующий, болезнь Педжета) - наследственная болезнь, характеризующаяся деформацией бедренных и большеберцовых костей, позвоночника и черепа с выраженным гиперостозом, утолщением и искривлением костей, повышенной частотой возникновения опухолей. Возникает обычно в возрасте старше 50 лет. Клиническая картина обычно бессимптомна, наиболее частое проявление - боль в кости или суставе. Более редко отмечают костные деформации, головную боль, патологические переломы, повышение температуры тела над пораженной конечностью, сердечную недостаточность с высоким сердечным выбросом и различные неврологические расстройства вследствие сдавления нервной ткани (при поражении черепа наиболее частое из них - глухота). Лабораторно характерно повышение уровня ЩФ и остеокальцина в остеосклеротическую фазу, повышение уровня гидроксипролина в остеолитическую фазу. Содержание кальция и фосфора в сыворотке обычно нормально.
Почечная, или уремическая, остеодистрофия - распространенное повреждение костей, сходное с остеомаляцией, рахитом или фиброзным оститом; отмечают при хронической почечной недостаточности.
Наследственная остеодистрофия Олбрайта обусловлена резистентностью клеток-мишеней к действию ПТГ (псевдогипопаратиреоз). Пациенты с псевдогипопаратиреозом проявляют резистентность и к другим гормонам, действующим через аденилат-циклазную систему
(тиреотропный гормон, глюкагон, ФСГ, ЛГ). У таких пациентов отмечают характерный фенотип, проявляющийся брахидактилией, низкорослостью, подкожными оссификатами. Болезнь Олбрайта часто сочетается с сахарным диабетом, артериальной гипертензией, ожирением, нарушениями менструального цикла (олигоменореей), артериитом, полиартрозом. Также характерны отставание в умственном развитии и судороги (вследствие гипокальциемии).
Несовершенный остеосинтез - наследственное заболевание, вызывающее уменьшение массы костей (вследствие нарушения остеогенеза) и обусловливающее их повышенную ломкость; часто сопровождается голубой окраской склер, аномалиями зубов (несовершенный дентиногенез) и прогрессирующим снижением слуха. УЗИ позволяет выявить тяжелые формы у плода начиная с 16 нед беременности. Возможна диагностика с помощью исследования ДНК в биоптатах ворсин хориона. Лечение симптоматическое и ортопедическое.
Остеопороз и остеосклероз - собирательные и на практике идентичные понятия, характеризующие относительное увеличение содержания костной ткани в составе костей, что приводит к уменьшению объема костномозговых полостей с неизбежным нарушением гемопоэза.
Мраморная болезнь. Известно несколько наследуемых форм: доминантно наследуемая болезнь Альберс-Шенберга и рецессивные - злокачественная, мягкая и летальная формы. Частота всех форм - около 1 : 20000. Клинически остеопетроз при этой патологии проявляется множественными переломами, остеомиелитом, гиперостозом черепа, хроническим ринитом вследствие сужения носовых ходов, гепатоспленомегалией (вызванной компенсаторным экстрамедуллярным кроветворением), параличом лицевого нерва, анемией (вызванной уменьшением объема костного мозга), а лабораторно - повышением уровня ЩФ.
4.4. МАРКЕРЫ ЗЛОКАЧЕСТВЕННОГО РОСТА
Не вызывает сомнения тот факт, что рассчитывать на успех лечения заболеваний раком можно лишь при выявлении злокачественных опухолей на раннем этапе развития, однако вопрос о своевременном выявлении признаков такого рода патологий до сих пор остается открытым.
За последние годы диагностические возможности клинических онкологов значительно расширились в связи с использованием современных инструментальных методов диагностики: ангио- и лимфографии, радионуклидной диагностики, компьютерных
термо- и рентгенотомографов, радиомагнитного резонанса, УЗИ с использованием допплерэффекта, которые позволяют получать цветовое изображение опухоли и судить об особенностях микроциркуляции. Современные иммуноморфологические и цитологические исследования позволяют изучать биоптаты не только самой опухоли, но и различных выделений (мокроты, мочи, асцитической жидкости). В настоящее время комплексная лабораторная биохимическая и иммунологическая диагностика строится на определении опухолевых маркеров, гормонов, биологически активных соединений, изоформ ферментов, а также метаболитов костного ремоделирования в случае метастатического поражения костей.
Начало изучения опухолевых маркеров было весьма обнадеживающим. Уже в конце XIX века в моче больных множественной миеломой были обнаружены специфические белки (иммуноглобулины), получившие название «белки Бенс-Джонса», однако следующего успеха пришлось ждать более 80 лет. Он связан с открытием Г.И. Абелевым и Ю.С. Татариновым α-фетопротеина в крови больных гепатомой. Эти исследования положили начало новому этапу в изучении факторов, ассоциированных с ростом злокачественных опухолей, и в ХХ столетии привели к обнаружению серии различных соединений, получивших название «опухолевые маркеры». Маркеры широко используются клиническими биохимиками для выявления первичной опухоли и ее метастазов. К маркерам злокачественного роста относят вещества различной природы. В их число входит более 200 соединений: антигены, гормоны, ферменты, гликопротеины, липиды, белки, метаболиты, концентрация которых коррелирует с массой опухоли, ее пролиферативной активностью, а в некоторых случаях со степенью злокачественности новообразования. Аномальная экспрессия генома - один из основных механизмов продукции маркеров опухолевыми клетками, который обусловливает синтез эмбриональных, плацентарных и эктопических белков, ферментов, антигенов и гормонов.
В качестве идеальных тестов для ранней диагностики злокачественных опухолей предлагалось множество маркеров, однако решения этой проблемы до настоящего времени не найдено. Сложности обусловлены многообразием требований, предъявляемых к идеальному маркеру. Идеальный опухолевый маркер должен продуцироваться опухолевой клеткой в достаточных количествах, чтобы его можно было определить с помощью современных методов. Он не должен присутствовать у здоровых людей и при доброкачественных опухолях,
маркер должен выявляться на ранних стадиях опухолевого процесса, количество опухолевого маркера должно быть прямо пропорционально объему опухоли, этот маркер должен определяться еще до клинических проявлений опухоли, уровень идеального маркера должен коррелировать с результатами противоопухолевого лечения.
В клинических исследованиях используется ряд достотачно эффективных опухолевых маркеров, которые, однако, не всегда соответствуют всем вышеуказанным критериям в полной мере. Современные биохимические и иммунологические методы позволяют выявить новообразования, когда условное число опухолевых клеток достигает 109-1010, а минимальный уровень секретируемого опухолью маркера - от одного до нескольких фемтомолей (все цифры в пересчете на 1 мл сыворотки крови). Большая эффективность использования опухолевых маркеров в клинике может быть достигнута путем комбинации разных тестов. Следует отметить, что количество предлагаемых маркеров для диагностики и мониторинга злокачественных новообразований постоянно увеличивается, и наступает этап критической их переоценки с целью формирования стратегии и адекватного использования.
4.4.1. ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ ТЕСТИРОВАНИЯ ОПУХОЛЕВЫХ МАРКЕРОВ
Определение концентрации опухолевых маркеров при различных новообразованиях требует знания факторов как in vivo, так и in vitro, влияющих на полученные результаты или искажающих их. Это необходимо в равной степени учитывать не только врачам-лаборантам, но и врачам, непосредственно отвечающим за наблюдение и лечебный процесс конкретного больного. Ниже перечислены основные факторы, влияющие на определение опухолевых маркеров.
In vivo:
• степень экспрессии и синтеза маркера;
• высвобождение маркера опухолевыми клетками;
• прием лекарственных и химиотерапевтических препаратов;
• экскреция из организма;
• масса опухоли;
• распространенность опухоли;
• интенсивность кровоснабжения опухоли;
• режим больного;
• положение тела пациента во время забора образца крови;
• ятрогенное воздействие;
• инструментальные и неинструментальные методы обследования (например, бронхоскопия или биопсия);
• катаболизм опухолевого маркера (например, функциональное состояние печени и почек);
• вредные привычки (курение, прием алкоголя). In vitro:
• условия хранения образцов;
• интервал времени между забором крови и центрифугированием (при отделении сыворотки);
• степень гемолиза и желтушности;
• контакт емкостей для забора образцов крови с кожей;
• загрязнение образца слюной;
• влияние лекарственных препаратов;
• наличие антител к мышиным иммуноглобулинам в крови пациентов (после диагностической иммуносцинтиграфии и иммунотерапии);
• методическая ошибка определения опухолевого маркера. Необходимо учитывать, что большинство циркулирующих в
крови опухолевых маркеров непригодно для скринингового обследования пациентов при отсутствии симптомов, поскольку существует ряд ограничений, связанных с зачастую низкими диагностическими чувствительностью и специфичностью, а также с ограниченностью прогностической ценности. Вместе с тем существует ряд общепризнанных случаев, когда без определения опухолевых маркеров трудно обойтись.
Это, во-первых, оценка эффективности терапии. На ранних этапах изменения концентрации опухолевого маркера могут показать, будет ли успешна выбранная химиотерапия или же (в случае устойчивого роста концентрации) необходима коррекция терапии, вплоть до отмены. Конечно, тестирование опухолевого маркера абсолютно не имеет смысла в тяжелых онкологических случаях.
Во-вторых, мониторинг течения заболевания. Использование опухолевых маркеров для мониторинга течения новообразования нередко позволяет обнаружить метастазы и/или рецидив опухоли на 3-5 мес и более раньше клинических проявлений болезни. У некоторых пациентов тестирование опухолевых маркеров после хирургического удаления первичного очага опухоли может обеспечить более чувствительный мониторинг, чем эндоскопия, ультрасонография или компьютерная томография. Скорость возрастания уровня опухолевого
маркера обычно позволяет в ряде наблюдений сделать заключение
0 природе прогрессирования заболевания, в частности о метастазировании. Знание характера изменений уровня опухолевого маркера позволяет также оптимизировать время последующего детального обследования пациента. При сохранении низкого или нормального уровня опухолевого маркера в течение достаточно длительного времени последующее обследование, включающее инвазивные или дорогостоящие методики, представляется излишним. Наоборот, если уровень опухолевых маркеров возрастает, а информация о прогрессировании заболевания необходима при решении вопроса о тактике лечения, такие исследования показаны.
В-третьих, идентификация резидуальных и рецидивных опухолей. Неадекватное слабое снижение уровня опухолевого маркера или отсутствие снижения вообще свидетельствует о неполном удалении опухоли либо о наличии множественных опухолей (метастазов). Информация такого рода может иметь терапевтическую и прогностическую значимость.
И наконец, в-четвертых, прогнозирование течения опухолевого процесса. Это крайне интенсивно развивающаяся современная область применения опухолевых маркеров, в частности таких, исследование которых связано с прогнозом и соответственно в первую очередь влияет на выбор терапии.
4.4.2. КОЛОРЕКТАЛЬНЫЙ РАК
В европейских странах колоректальным раком (КРР) заболевает
1 из 20 человек. Реже этот вид рака встречается в Африке и некоторых частях Азии. Сейчас в России частота выявления КРР монотонно возрастает.
В настоящее время использование молекулярных методов в диагностике КРР считается очень перспективным и важным направлением исследований, это связано с тем, что события, происходящие на уровне генома, следует считать ключевыми в возникновении и прогрессировании этих новообразований. Существует целый ряд достоверных фактов, свидетельствующих о том, что КРР на ранних стадиях развития может и должен идентифицироваться молекулярными методами. Методы молекулярной диагностики КРР позволяют также назначить адекватное лечение и достаточно точно прогнозировать результат.
КРР развивается в результате последовательных изменений (дисп- лазия/аденома-аденокарцинома), в основе которых лежат генетические
нарушения. Однако механизмы, ответственные за возникновение и накопление в эпителиальной клетке таких нарушений, изучены не до конца. Примером трудностей, стоящих на пути изучения этой проблемы, является тот факт, что имеются различия в частоте возникновения доброкачественных и злокачественных фаз болезни, а именно в последовательности дисплазия/аденома-аденокарцинома. Доказано, что колоректальные аденомы возникают более чем у половины населения к 9-му десятилетию жизни, а КРР развивается только у 5% населения. Следовательно, только единичные из предраковых изменений трансформируются в рак.
Так, наряду с пожилым возрастом и хроническими воспалительными заболеваниями (неспецифический язвенный колит, болезнь Крона или шистосомоз с вовлечением толстой кишки) наличие КРР у кровных родственников - признанный, если не основной, фактор повышенного риска. Причины, которые вызывают развитие КРР у членов одной семьи, могут варьировать от редких аутосомных доминантных синдромов с высокой заболеваемостью КРР (семейный аденоматозный полипоз, синдром наследственного неполипозного КРР) до менее ясных в генетическом отношении состояний, таких, например, как обнаружение аденомы у ближайших кровных родственников (родитель, родной брат или ребенок). Известно, что чем в более молодом возрасте возник КРР, тем выше статистический риск возникновения его у близких родственников. Наследственные синдромы КРР представлены в табл. 4.6 согласно фенотипу и мутациям в соответствующих генах.
Следует отметить, что изучение молекулярных механизмов, лежащих в основе редких наследственных синдромов, способствовало пониманию патогенеза спорадического КРР, который наблюдается значительно чаще в популяции, но в основе которого лежат аналогичные или похожие молекулярные события.
Роль молекулярно-генетических нарушений в возникновении КРР и, в частности, нестабильности генома стала интенсивно изучаться относительно недавно. В 1993 г. у членов семей, больных наследственным неполипозным раком толстой кишки (РТК), была найдена нестабильность микросателлитов (MSI). Это открытие послужило основой гипотезы мутаторного фенотипа возникновения рака, выдвинутой Loeb, согласно которой клетка должна пережить целый ряд мутаций, чтобы стать злокачественной. Но для этого она исходно должна иметь способность мутировать чаще, чем в норме, а это в свою очередь может
Таблица 4.6. Наследственные синдромы КРР
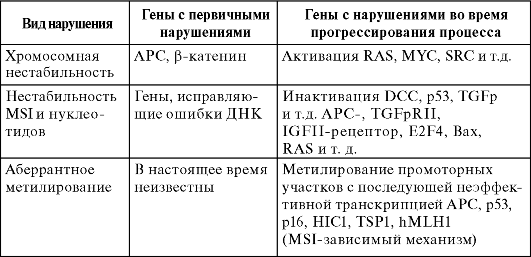
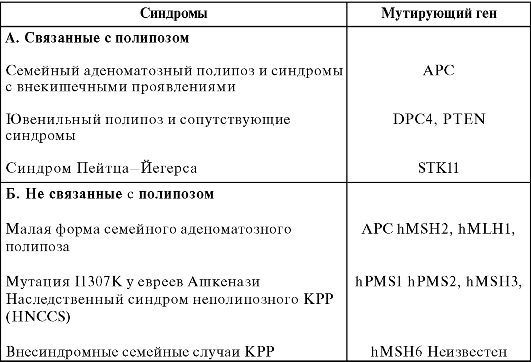 Таблица 4.7. Виды генетических нарушений и молекулярные маркеры при КРР
Таблица 4.7. Виды генетических нарушений и молекулярные маркеры при КРР
 быть связано с инактивацией механизмов, отвечающих в норме за сохранность структуры ДНК.
быть связано с инактивацией механизмов, отвечающих в норме за сохранность структуры ДНК.
Почти во всех случаях РТК отмечается или хромосомная нестабильность, или нестабильность MSI. Фактически между этими двумя нарушениями существует обратная зависимость. Так, злокачественные опухоли, в которых имеется нестабильность MSI, обычно диплоидные и не имеют хромосомных аберраций. Опухоли, в которых имеется хромосомная нестабильность, характеризуются анеуплоидией и часто сопровождаются потерей или появлением добавочных хромосом. Столь частое обнаружение хромосомной нестабильности или нестабильности MSI свидетельствует в данном случае не о том, что это весьма распространенное и неспецифическое явление в процессе возникновения любой злокачественной опухоли, а о том, что нестабильность генома тесно ассоциирована с туморогенезом.
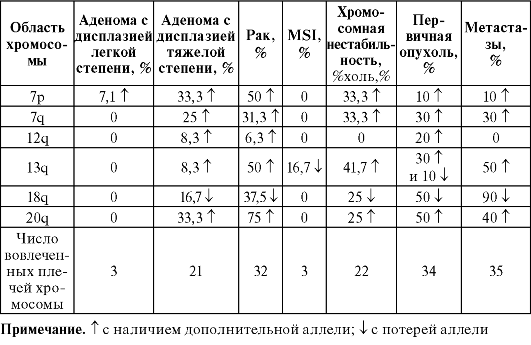
И хромосомная нестабильность, и нестабильность MSI могут быть обнаружены на самых ранних стадиях РТК. Так, используя сравнительную гибридизацию генома для определения среднего числа ошибок при копировании, удалось показать их постепенное увеличение при прогрессировании аденомы с дисплазией легкой степени в аденомы с дисплазией тяжелой степени и последующей трансформацией в рак (табл. 4.8).
Таблица 4.8. Хромосомная нестабильность при возникновении РТК
 У
пациентов с наследственной предрасположенностью вследствие нарушений
гена APC, включающих нарушения последовательности нуклеотидов и
экспрессии гена, возникают опухоли, обычно развивающиеся вследствие
хромосомной нестабильности, которая характеризуется потерей аллелей и
цитогенетическими нарушениями. Опухоли у части пациентов со
спорадической формой КРР возникают таким же путем.
У
пациентов с наследственной предрасположенностью вследствие нарушений
гена APC, включающих нарушения последовательности нуклеотидов и
экспрессии гена, возникают опухоли, обычно развивающиеся вследствие
хромосомной нестабильности, которая характеризуется потерей аллелей и
цитогенетическими нарушениями. Опухоли у части пациентов со
спорадической формой КРР возникают таким же путем.
Напротив, у пациентов с синдромом наследственного неполипозного КРР вследствие мутации в гене, исправляющем ошибки ДНК, возникают опухоли, характеризующиеся нестабильностью MSI и нуклеотидов, выявляемых в виде повторяющихся нуклеотидных последовательностей, некоторые из которых располагаются в кодонах генов. Потеря аллелей наблюдается редко. Такой тип молекулярной патологии также наблюдается примерно в 15% случаев спорадических КРР и часто связан с патолого-анатомическими особенностями, такими, как расположение в проксимальных отделах кишки (восходящей ободочной кишке); низкая дифференцировка клеток опухоли с ослизнением, медуллярным или перстневидно-клеточным компонентом; наличие значительного числа лимфоидных фолликулов с зародышевыми центрами по периферии опухоли; инфильтрация опухоли лимфоцитами.
Неэффективная транскрипция генов в результате аберрантного метилирования последовательностей цитозингуанин (Ц-Г-островки) в промоторных участках генов в настоящее время рассматривается как один из компонентов молекулярного патогенеза третьего подвида КРР.
Использование методов молекулярной диагностики у пациентов имеет большой потенциал как в ранней диагностике и оценке ответа опухоли на терапию, так и в прогнозе заболевания. Как показано в табл. 4.9, при такой диагностике можно использовать различные объекты исследования.
У тех пациентов, у которых уже имеется КРР, молекулярные методы могут быть использованы для идентификации микрометастазов, для более точной оценки стадии опухолевого процесса, в частности выявления микрометастазов в лимфатических узлах, или для оценки возможной гематогенной диссеминации опухолевых клеток в костный мозг.
Кроме того, молекулярная диагностика обладает большим потенциалом для выявления генотипических и фенотипических характеристик опухоли, которые обусловливают целую цепь событий, приводящих к метастазированию клеток, - так называемый метастатический
Таблица 4.9. Использование методов молекулярной диагностики при КРР
 генотип
и фенотип. Маркеры этого типа могли бы указывать на большую вероятность
прогрессирования опухолевого процесса после радикальной операции.
генотип
и фенотип. Маркеры этого типа могли бы указывать на большую вероятность
прогрессирования опухолевого процесса после радикальной операции.
Генетические нарушения, связь которых с прогнозом или ответом на химиотерапию КРР была установлена, включают потери аллелей в 18q, исчезновение экспрессии продукта гена DCC, нарушения в гене p53, потерю аллелей на коротком плече хромосомы 1 и 5, RAS-мутации. Исследования клинической эффективности использования таких молекулярных маркеров были убедительно сформулированы, в настоящее время проводятся и включают в себя репрезентативную популяционную выборку. Для широкого использования в клинической практике исследования молекулярных маркеров должны удовлетворять всем требованиям, предъявляемым к рутинным лабораторным тестам, таким как воспроизводимость, доступность, адекватный контроль качества. Наконец, результаты исследования молекулярных маркеров должны легко интерпретироваться клиницистами и иметь терапевтическое значение.
Сложность и многоступенчатость генетических и биохимических процессов, протекающих в раковых клетках, которые позволяют им метастазировать, обусловливают трудность интерпретации значений таких маркеров. Кроме того, факторы, не связанные с опухолью непосредственно, например качество хирургической техники, значительно влияют на конечный результат. Среди маркерных генов опухоли, прогнозирующих терапевтический ответ, внимание было сосредоточено на p53 и генах, ответственных за апоптоз, которые регулируются p53.
Одной из областей молекулярно-генетического изучения опухолей является выявление молекулярных нарушений, характерных для более позднего развития метахронных опухолей, иногда ошибочно рассматриваемых как рецидив основной опухоли. Такие исследования включают изучение колоректальных аденом в качестве мишени для идентификации маркерного гена из-за их высокой частоты в популяции как предракового изменения по сравнению с низкой частотой выявления злокачественных опухолей. Молекулярный маркер, указывающий на высокую вероятность развития метахронных аденом, особенно аденом, способных трансформироваться в злокачественную опухоль, мог бы быть полезен для определения групп риска с целью последующего колоноскопического скрининга.
Напротив, тех пациентов, у которых метахронные аденомы вряд ли будут прогрессировать, можно исключить из скрининга. Стратегия удаления аденом показала, что она связана с уменьшением частоты КРР и молекулярные маркеры, идентифицирующие пациентов с более высоким риском, могли бы быть полезны.
Исследование проб кала и крови имеет так же большой потенциал. Так, использование весьма простого теста на скрытую кровь в кале позволило снизить смертность от КРР, однако его специфичность остается относительно низкой. Молекулярные тесты на обнаружение в кале фрагментов опухолевой ДНК являются более прогрессивными. Целый ряд исследований показал, что ДНК, содержащая мутации, может быть идентифицирована в кале и крови пациентов, у которых имеются опухоли с этими мутациями. Диагностика опухолей, скрининг и динамическое наблюдение за больными могут существенно улучшиться, если будут преодолены определенные технические трудности и сбалансированы затраты на их проведение.
В настоящее время большое внимание исследователи уделяют изучению перспектив использования молекулярно-генетических маркеров КРР. Ниже дается краткая характериситика опухолевых маркеров, которые уже сейчас наиболее часто используются в клинической практике.
Раково-эмбриональный антиген
Впервые раково-эмбриональный антиген (РЭА) обнаружили в 1965 г. Gold и Freedman при исследовании тканей желудочно-кишечного тракта человека и аденокарциномы толстой кишки. Позже РЭА был выявлен в сыворотке крови больных КРР. Эти первые работы были весьма обнадеживающими. Тогда многим казалось, что найден
высокоспецифический тест для диагностики РТК. Однако в последующем по мере совершенствования методов обнаружения РЭА и накопления клинических данных этот маркер удалось выделить и при других опухолях (раке поджелудочной железы, печени, легкого, щитовидной железы и нейробластоме), а также при неопухолевых заболеваниях (циррозах печени, язвенных колитах, панкреатитах, хронических бронхитах, эмфиземе, вирусном гепатите, дивертикулите, полипах, почечной недостаточности). Поэтому нельзя при выявлении РЭА абсолютно точно утверждать, что у больного данный тип рака. Вместе с тем до сих пор РЭА остается маркером первого выбора при КРР и используется с высокой эффективностью в мониторинге заболевания, но главное внимание при этом уделяют количественным параметрам метода.
У 99% здоровых людей уровень РЭА равен менее 5 нг/мл. При КРР чувствительность теста колеблется от 25 до 80% и зависит от размеров и степени дифференцировки опухоли, а также распространенности процесса. Уровень РЭА коррелирует со стадией опухолевого процесса. Так, по суммированным данным разных авторов, в соответствии со стадиями по классификации Dukes для антигена было характерно нарастание его концентрации: при стадии A - 7,8 нг/мл, B - 30,3 нг/мл, C - 58,1 нг/мл, D - 134,3 нг/мл. При этом частота выявления РЭА (при пороговом значении маркера 5 нг/мл) в группах больных с указанными стадиями нарастала и соответствовала 3, 25, 45 и 65%, а при пороговом значении маркера > 2,5 нг/мл обнаруживалась еще чаще при вышеуказанных Dukes-стадиях и соответствовала 28, 45, 75 и 84%. С учетом того, что при стадии А и В опухолевый маркер повышен только у 3-28% больных, его использование в ранней диагностике КРР проблематично. Высокодифференцированные опухоли активнее продуцируют РЭА.
По данным многих авторов, маркер обладает прогностической значимостью, которая заключается в том, что высокий исходный уровень РЭА в сыворотке крови (более 25 нг/мл) свидетельствует о высоком риске развития раннего рецидива КРР после хирургического удаления опухоли.
Одним из примеров использования РЭА является определение радикальности хирургического вмешательства при КРР. Как правило, после радикального хирургического удаления опухоли уже к концу 6-й недели концентрация антигена становится ниже нормы. Если уровень маркера не падает после удаления первичной опухоли, следует
думать, что у больного есть метастазы. Рекомендуется определять РЭА у больных в послеоперационном периоде через 3 мес на протяжении 2 лет. Регулярный мониторинг больных КРР с включением определения РЭА улучшает показатели 5-летней выживаемости. Адъювантная химиотерапия (5-фторурацил и левамизол) у больных КРР может вызывать преходящее повышение уровня РЭА в сыворотке крови. Не рекомендуется рутинно определять РЭА в мониторинге ответа на терапию, однако никаких альтернативных тестов в оценке ответа на лечение у больных КРР пока нет.
У большинства больных РТК (79,1%) по сравнению с группой контроля (10%) обнаружены IgM- и IgG-антитела к РЭА, что также позволяет использовать этот показатель как диагностический маркер и независимый фактор прогноза. При этом выявление антител к РЭА в сыворотке крови больных КРР ассоциируется с лучшим прогнозом и значительным увеличением показателя 2-летней выживаемости.
Анализ уровня РЭА в смывах толстой кишки до проведения рутинного эндоскопического исследования показал, что этот простой тест может быть полезным в практической медицине для выявления группы пациентов с высоким риском развития КРР.
Применение РЭА в диагностических целях ограничено его низкой специфичностью, обусловленной повышением концентрации антигена в сыворотке крови при неопухолевых заболеваниях, а также влиянием на синтез этого маркера некоторых экзогенных и эндогенных факторов. Поэтому при обследовании больных с опухолями толстой кишки в качестве маркера второго выбора используют CA-19-9 (см. ниже). Особое значение это имеет при РЭА-негативных новообразованиях.
Учитывая низкую чувствительность и специфичность, также не рекомендуется использовать определение РЭА в скрининге КРР. В случае 5-кратного повышения РЭА в сыворотке крови и наличия клинических жалоб у больного следует предполагать КРР.
СА-19-9 и α-фетопротеин
Сравнительный анализ трех опухолевых маркеров (СА-19-9, РЭА и α-фетопротеина) в сыворотке крови больных РТК при различных стадиях опухолевого процесса, у больных с хроническим язвенным колитом и у практически здоровых людей выявил достоверное различие между больными с локализованным РТК и хроническим язвенным колитом по уровню СА-19-9 и РЭА, а также между локализованным и генерализованным РТК по двум вышеуказанным
опухолевым маркерам. Значения опухолевых маркеров при хроническом язвенном колите не превышали таковые в норме. При локализованном процессе уровень СА-19-9 не превышает 1000 ед/мл, РЭА - 20 нг/мл. Показатели α-фетопротеина у больных КРР находятся в пределах нормы и повышаются, как правило, только при генерализации опухолевого процесса, что не позволяет использовать этот маркер в диагностике заболевания. При использовании комплекса СА-19-9+РЭА диагностическая чувствительность составляет 91% и значительно превышает таковую при использовании только одного опухолевого маркера. Присоединение к инструментальным методам диагностики данных по определению опухолевых маркеров (СА-19-9 и РЭА) повышает частоту выявления локализованного КРР на 14%, а при генерализации процесса - на 9%.
Маркеры апоптоза
Для опухолей характерен дисбаланс между процессами пролиферации и апоптоза. Эндотелин-1 - полипептид из 21 аминокислотного остатка - обладает вазоконстрикторной и мито-генной активностью, а также вовлечен в механизмы регуляции апоптоза. В эксперименте показано, что эндотелин-1 является фактором выживания и способен in vitro защищать клетки РТК от FasL-инду- цированного апоптоза.
Частота выявления и уровень растворимого Fas-антигена (sFas) - ингибитора апоптоза - в сыворотке крови больных РТК выше, чем у практически здоровых людей. Отмечена тенденция к повышению содержания sFas в сыворотке крови больных РТК с метастазами в регионарных лимфатических узлах и печени, что позволяет обсуждать роль Fas/FasL-системы как возможную мишень противоопухолевой терапии у больных КРР.
Показано, что высокая активность каспазы-3 коррелирует с высоким риском рецидива РТК, особенно в случаях правосторонней его локализации. Также выявлена корреляция активности каспазы-3 с CD57+ опухольинфильтрирующими клетками.
Важную роль в механизмах регуляции апоптоза при РТК играет bcl-2, который экспрессируется в норме клетками, выстилающими донную часть крипт толстой кишки. Показано, что экспрессия bcl-2 при РТК Dukes B-стадии ассоциируется с лучшей выживаемостью больных и соответственно пациентам, у которых опухоли не экспрессируют bcl-2, целесообразно проводить адъювантную терапию.
Экспрессия иммунореактивного р53 в первичной опухоли при КРР является маркером высокого риска рецидива заболевания после хирургического ее удаления и чаще после 1-го года наблюдения. При этом повышенная экспрессия р53 выявлялась в 47, а РЭА - в 34,4% опухолей. Полагают, что при оценке прогноза КРР необходимо определение обоих маркеров.
Известно, что генетические повреждения отличают первичные карциномы проксимального и дистального отделов толстой кишки. Так, многофакторный анализ экспрессии р53 в первичных КРР чаще выявляет повышенную экспрессию р53 в дистальных (58,5%), чем проксимальных (41,7%) РТК. При этом безрецидивный период меньше в р53+ опухолях (75 и 38%; соответственно р=0,006). Высокий риск рецидива КРР отмечен среди р53+ опухолей при их дистальной локализации. Следовательно, оценка экспрессии р53 при КРР может служить маркером раннего рецидива заболевания и связана с локализацией опухоли в органе.
Доказано, что неудачи химиотерапии КРР связаны с множественной лекарственной резистентностью этих новообразований. Показано, что экспрессия различных изоформ CD44 ассоциируется с агрессивным поведением опухоли и ставит вопрос о том, модулирует ли сигнал от этого рецептора лекарственную чувствительность опухоли. Также доказано, что CD44 индуцирует активацию src-семейства тирозинкиназы LYN и Akt. Способность супрессировать апоптоз может играть решающую роль в развитии опухолей толстой кишки, что связано с экспрессией CD44.
Активаторы и ингибиторы системы плазминогена
В последние годы пристальное внимание исследователей привлекает изучение металлопротеиназ внеклеточного матрикса, которые тесно связаны с процессами инвазии и метастазирования опухолей. При развитии метастазов должна иметь место цепь последовательных событий, приводящих к выходу опухолевых клеток из их первоначального окружения и образованию опухолевых узлов в отдаленных органах и тканях. Предполагается, что для обеспечения процессов инвазии и метастазирования нужна комплексная протеолитическая цепочка, включающая различные протеазы. Считается, что плазмин, уменьшающий уровень внеклеточных матричных гликопротеидов и активирующий некоторые прометаллопротеазы, играет решающую роль в процессах инвазии и метастазирования, при этом
в многоступенчатой цепочке протеаз ключевую позицию занимает сериновая протеаза - активатор плазминогена урокиназного типа (uPA), поскольку она катализирует образование плазмина из его предшественника плазминогена. Важную роль играет также рецептор иРА (Рц-uPA), так как при связывании uPA с рецептором его способность активировать плазминоген увеличивается. С другой стороны, в тканях РТК могут присутствовать ингибиторы uPA - PAI-1 и PAI-2. Показано, что уровень uPA и PAI-1 в КРР выше, чем в гомологичной нормальной ткани и доброкачественных опухолях.
Вопрос о том, является ли uРА при РТК у человека производным самих раковых клеток или элементов окружающей стромы (фибробласты, макрофаги, лейкоциты), долгое время оставался без ответа. В конце концов Harvey и соавт. удалось доказать, что активатор происходит из самих раковых клеток, а не заимствуется ими из элементов стромы, при этом антиген наиболее интенсивно выявляется в апикальной и базальной областях клеток РТК.
Наиболее репрезентативное исследование компонентов системы активации плазминогена в образцах КРР было проведено Fujii и соавт. Они анализировали также экспрессию генов uPA и PAI-1 с использованием метода ПЦР. Экспрессия uPA была обнаружена в 58,8% опухолей. У пациентов с положительными результатами теста на uPA и отрицательными результатами на PAI-1 прогноз 5-летней выживаемости был достоверно хуже. Многофакторный анализ показал, что результаты одновременного определения uPA и PAI-1 в КРР являются независимыми прогностическими показателями.
Выживаемость больных после операций не коррелировала с содержанием uPA в строме опухоли, однако была отмечена закономерность, связанная с его уровнем в эпителии опухоли, т. е. определение уровня uРА вполне может быть тестом для диагностики РТК еще без метастазов, а также риска раннего развития рецидива после операции. Возможно, что протеазы могут быть мишенью лекарственных препаратов, предотвращающих инвазию и метастазирование КРР.
Метастазы в печень - важный фактор, ограничивающий прогноз у больных РТК. Существует корреляционная связь между иРА и печеночными метастазами. Трансдукция гена tPA в клетки РТК может быть полезна с точки зрения противодействия печеночным метастазам.
Наименее изученным в клиническом плане компонентом системы активации плазминогена считается Рц-uPA, который представляет собой мембранно-связанный трехдоменный гликопептид. Этот
рецептор может также существовать в растворимой форме (рРц-uPA) в экстрактах из опухоли, а также в плазме крови как здоровых людей, так и больных раком. Растворимый Рц-uPA в плазме является практически неизмененной молекулой, однако ни точный механизм его высвобождения с поверхности клеток, ни его биологическая функция до конца не изучены. Повышенный уровень рРц-uPA в плазме крови был обнаружен у больных РТК, а концентрация рРц-uPA связана с прогнозом заболевания. Возможно, что Рц-uPA могут вносить весомый вклад в усиление ангиогенеза вокруг опухоли, равно как и в процессы метастазирования по микрососудам.
Таким образом, повышенная экспрессия Рц-uPA, характеризующая инвазивную способностью опухоли in vitro по крайней мере в некоторых субпопуляциях клеток РТК, является частично следствием постоянной активации сигнального каскада, зависящего от митогенактивированных протеинкиназ.
Рецепторы факторов роста
Одной из важных регуляторных систем передачи митогенного сигнала является семейство тирозинкиназных рецепторов - продуктов онкогенов группы c-erbB, в которое входят четыре сходных по структуре трансмембранных рецептора - рецептор эпидер-мального фактора роста (РЭФР или ErbB1), а также ErbB2 (HER2/neu), ErbB3 (HER3) и ErbB4 (HER4). Помимо структуры, эти рецепторы различаются между собой по относительной специфичности и сродству к различным общим лигандам. После активации в результате связывания лигандов и димеризации внутренняя тирозинкиназа рецепторов активируется и приобретает способность фосфорилировать как сам рецептор, так и другие клеточные белки, участвующие в передаче митогенного сигнала.
В аутокринной и паракринной регуляции пролиферации клеток КРР участвуют различные ростовые факторы. В последние годы активно изучается клиническое значение рецепторов факторов роста и их лигандов при КРР, в первую очередь РЭФР, рецептора инсулиноподобного фактора роста типа 1 (РИФР-1), рецептора фактора роста эндотелия сосудов (R-VEGF).
РЭФР - продукт онкогена c-erbB1, представляющий собой трансмембранную тирозинкиназу, - наиболее изученный в клиническом плане маркер данной группы при опухолях различной локализации, но недостаточно исследованный при КРР.
Рецепторы семейства ErbB могут образовывать как гомо-, так и гетеродимеры, при этом во многих случаях наиболее активными являются гетероструктуры с участием второго представителя этого семейства - HER2/neu, не имеющего собственного лиганда. Таким образом, HER2/neu является ключевым звеном передачи митогенных сигналов ЭФР-подобных факторов роста и его блокирование может существенно замедлить или остановить рост опухолей, зависимых от подобных стимулов. Полагают, что повышенная экспрессия HER2/ neu в опухолях, в том числе и при КРР, может служить маркером чувствительности и мишенью для более эффективной биотерапии этих новообразований. Клинические исследования продолжаются, и в литературе представлены предварительные работы, посвященные изучению экспрессии HER2/neu в прогнозе опухолей ЖКТ.
РИФР-1 и РИФР-2 являются потенциальными митогенами и сильными стимуляторами роста опухолевых клеток. Ростостимулирующие эффекты обоих типов РИФР опосредуются, главным образом РИФР-1. Eдиного мнения относительно клинической ценности РИФР-1 при КРР до настоящего времени не существует.
В большинстве исследований показана обратная взаимосвязь между обнаружением рецепторов стероидных гормонов (эндокринный тип регуляции) и РЭФР (ауто- и паракринный тип регуляции) в опухолях.
Блокирование любого из этапов передачи митогенного сигнала факторов роста может в принципе привести к нарушению регуляции пролиферации опухолевых клеток и потенциально к торможению роста опухоли. В эксперименте уже исследовано достаточно большое количество препаратов, влияющих на вышеперечисленные процессы: специфические и неспецифические блокаторы связывания РЭФР с лигандами, ингибиторы тиро-зинкиназы и других киназ, блокаторы связывания SH2-доменов эффекторных белков с активированным рецептором, соединения, подавляющие активацию гена ras, в том числе ингибиторы фарнезилирования. Большинство из них находятся на стадии клинического изучения, хотя некоторые, в частности, герцептин, уже прошли клинические испытания и показали себя достаточно эффективными при некоторых видах опухолей.
Известно, что РТК являются тканями-мишенями стероидных гормонов и в 25-60% случаев сохраняют функциональную способность первичного звена механизма действия одного или нескольких стероидов, а именно рецепторы эстрогенов (РЭ; 40,9%), андрогенов (РА; 15,5%), прогестерона (РП; 32,6%) и глюкокортикоидов (РГ; 59,1%).
Однако только наличие РЭ и РП в опухоли может быть использовано как критерий благоприятного прогноза 10-летней выживаемости больных КРР. При этом чаще РЭ выявляются в РТК у женщин (60,5%), чем у мужчин (39,5%), при локализованной стадии заболевания (63,1%) и поражении опухолью правых отделов толстой кишки (59,4%).
Опухолевые маркеры ангиогенеза
Большой интерес исследователи проявляют в последние годы к изучению ангиогенных факторов в опухоли и в частности к VEGF. Появляется все больше доказательств, что метастазирование на разных этапах опухолевого процесса зависит от степени васкуляризации опухоли.
При гематогенном метастазировании клетки опухоли должны прикрепиться к эндотелиальным клеткам, пройти в просвет сосуда, выжить в циркулирующей крови, остановиться в определенном органе или ткани и образовать там колонию. Высокоангиогенные первичные опухоли, к которым относится и КРР, с высокой внутриопухолевой плотностью сосудов с большой вероятностью могут дать в отдаленном органе ангиогенный клон, который при благоприятных условиях способен образовать метастаз. Большинство исследователей полагают, что высокая степень васкуляризации опухоли является статистически значимым маркером наличия метастазов в регионарных лимфатических узлах. В 77% ранее проведенных исследований обнаружена значимая связь между опухолевым ангиогенезом и развитием отдаленных метастазов. И хотя имеются значительные различия в исследованных группах пациентов и используемых методах оценки ангиогенеза, большинство исследователей продемонстрировали обратную связь между васкуляризацией опухоли и выживаемостью больных КРР. Кроме того, недостаточная васкуляризация и как следствие ее гипоксия увеличивают экспрессию генов, связанных с устойчивостью (Pg-гликопротеина, гидрофолатредуктазы) к химиотерапии и представляют важный фактор неэффективности неоадъювантной лучевой и химиотерапии.
У большинства больных (73,4%) с регионарными метастазами в лимфатических узлах безрецидивный период достоверно выше при отсутствии экспрессии VEGF и низком индексе SPF (S-phase fraction) в опухоли. В дополнение к прогностической значимости VEGF показано, что блокирование VEGF-рецептора-2 ингибирует рост метастазов КРР в печени.
В настоящее время ангиогенной активностью обладают более 200 соединений, и по ингибирующему действию все они могут быть разделены на две группы. В первую входят соединения, влияющие на передачу ангиогенных сигналов эндотелиальными клетками (антагонисты факторов роста эндотелия, ингибиторы продукции ангиогенных факторов, миграции эндотелиальных клеток), а во вторую - соединения, влияющие на пролиферацию эндотелиальных клеток. Наиболее перспективны такие антиангиогенные препараты, как маримастат, батимастат - ингибиторы матриксных металлопротеиназ, SU 6661.
Следует отметить, что за последние годы наши знания о биологических процессах, вовлеченных в формирование новых микрососудов в опухоли, значительно расширились. И хотя прогностические и терапевтические принципы еще только формируются, достижения в понимании патофизиологических механизмов неоангиогенеза в опухоли уже внедряются в клиническую практику.
Ферменты
Одним из наиболее эффективных маркеров лекарственной резистентности и прогноза КРР считается уровень экспрессии тимидилатсинтетазы в опухоли. Фермент необходим для синтеза ДНК и катализирует метилирование дезоксиуридинмонофосфата в дезокситимидинмонофосфат в качестве кофактора 5,10-метилентетра- гидрофолата (5,10-CH2FH4). Известно, что 5-фторурацил (5-ФУ), один из наиболее широко используемых антиметаболитов в лечении гастроинтестинальных опухолей, при введении больному образует 5-фтор-2'-дезоксиуридин-5'-монофосфатные формы, связывающиеся ковалентно с тимидилатсинтетазой, блокируя таким образом процесс синтеза ДНК в опухоли. Изучение показателей экспрессии тимидилатсинтетазы в опухолях больных КРР позволило считать его независимым фактором прогноза у данной категории больных. При этом показатели 10-летней выживаемости были достоверно ниже среди пациентов, в опухоли которых выявлена экспрессия фермента.
На основании ретроспективного многофакторного анализа и высокой степени достоверности результатов по определению в опухолях экспрессии тимидилатсинтетазы считают, что этот маркер может быть использован в клинике как независимый фактор прогноза локального рецидива, отдаленных метастазов, длительности безрецидивного периода и общей выживаемости больных РТК.
Лучший прогноз имели больные ТРК с низкой экспрессией тимидилатсинтетазы в первичной опухоли. При этом исследователи убедительно продемонстрировали, что никакие другие факторы прогноза, в том числе возраст, пол, степень дифференцировки опухоли, экспрессия р53 не могут считаться независимыми маркерами прогноза, в частности, рецидива этого заболевания.
Уровень экспрессии тимидилатсинтетазы при генерализованном или рецидивирующем КРР может быть маркером чувствительности опухоли к 5-ФУ. Чаще наиболее высокие показатели экспрессии фермента обнаруживались в абдоминальных метастазах КРР (82%) по сравнению с метастазами опухоли в печени (47%). Полагают, что это необходимо принимать во внимание при прогнозе чувствительности диссеминированных форм опухоли к 5-ФУ и индивидуально изменять стратегию химиотерапии у пациентов.
Также показано, что экспрессия тимидилатсинтетазы и тимидинфосфорилазы в опухолях нелеченых больных КРР не только имеет прогностическое значение в выборе химиотерапии 5-ФУ вместе с такими маркерами пролиферации, как р53 и Ki-67, но и коррелирует с показателями безрецидивной и общей выживаемости. При этом активность двух указанных ферментов изучали биохимическим методом в свежезамороженных образцах опухоли и сравнивали их экспрессию с помощью иммуногистохимического метода в парафиновых срезах вместе с р53 и Ki-67. Выявлена также значимая корреляционная связь между показателем ферментативной активности тимидинфосфорилазы и связывающей активностью 5-фтор-2'-дезок- сиуридин-5'-монофосфата (метаболит 5-ФУ). Стало известно, что с процессами ангиогенеза и пролиферации при КРР имеют тесную связь активность тимидилатсинтетазы и тимидинфосфорилазы. При этом экспрессия VEGF значительно коррелировала с активностью тимидинфосфорилазы и индексом Ki-67 в опухоли, а также длительностью безрецидивного периода.
При изучении дигидропиримидиндегидрогеназы - первого фермента, который метаболизирует 5-ФУ в 5-фтордигидроурацил, обнаружено, что показатель экспрессии этого фермента в опухоли может быть использован как маркер в оценке чувствительности КРР к 5-ФУ.
Высокая активность индуцированной синтетазы оксида азота может служить маркером более агрессивного течения КРР.
Предложено использовать высокочувствительный и специфичный метод определения теломеразной активности в эпителиальных
клетках КРР, циркулирующих в крови. Активность фермента выявлена в 72% опухолей при стадиях С и D (классификация Dukes) КРР. Полагают, что данный маркер в этом малоинвазивном методе может быть использован в ранней диагностике, прогнозе и мониторинге больных ТРК.
Обнаружено, что повышенная экспрессия CDC25B-фосфатазы в клетках КРР в 43% случаев указывает на плохой прогноз заболевания. Поэтому эти пациенты нуждаются в адъювантной терапии. Полагают, что CDC25B может служить независимым прогностическим маркером и даже контролировать такие факторы, как метастазы в регионарных лимфатических узлах, диаметр первичной опухоли, степень ее дифференцировки, глубину инвазии. Более того, уровень экспрессии CDC25B убедительно указывает на возможный ранний рецидив КРР стадий B и C по Dukes.
В последнее время появились работы, свидетельствующие о возможности использования фермента синтеза простагландинов и эйкозаноидов - циклооксигеназы-2 (СОХ-2), известной также как простагландинэндопероксидсинтетаза, - в качестве маркера ранней диагностики и прогноза КРР. Экспериментальные и клинические данные свидетельствуют о важной роли СОХ-2 в патогенезе КРР. Показаны отсутствие СОХ-2 в эпителии нормальной слизистой оболочки и экспрессия белка в 40% полипов и 80-90% злокачественных опухолей толстой кишки, что является подтверждением участия СОХ-2 в неопластических процессах и в прогрессии КРР. Установлена положительная корреляция между экспрессией СОХ-2 и размером, стадией опухоли по классификации Dukes. Увеличение экспрессии СОХ-2 в РТК стало основой для попыток использования ее ингибиторов, в частности нестероидных противовоспалительных препаратов, в качестве профилактических средств, предотвращающих развитие КРР и малигнизацию полипов толстой кишки. В экспериментах на животных было показано, что ингибиторы СОХ-2 проявляют защитное действие при колоректальном канцерогенезе. Кроме того, эти препараты предотвращали образование новых полипов и способствовали регрессии уже существующих в толстой кишке. С другой стороны, данные некоторых экспериментальных исследований свидетельствуют о том, что противоопухолевое действие нестероидных противовоспалительных препаратов связано также с тем, что они индуцируют апоптоз в клетках РТК и ингибируют ангиогенез в экспериментальных опухолях.
Другие маркеры КРР
Вкратце остановимся на некоторых опухолевых маркерах, применение которых представляется перспективным при КРР.
Уровень экспрессии MUC1 в опухолях может быть использован как маркер в оценке прогрессирования и прогноза КРР.
Циклинзависимый ингибитор киназы P27 (KIP1) может быть использован как маркер выявления ранних стадий КРР. Однако он не может быть использован в качестве маркера раннего прогрессирования этих новообразований.
Также совсем недавно предложено использовать при оценке распространенности РТК новый маркер - TA90-IC, который присутствует в сыворотке крови в форме циркулирующих иммунных комплексов. Основанием для проведения исследования послужил тот факт, что, по данным многих авторов, уровень РЭА повышен только у 70% больных в распространенной стадии болезни. У 86% обследованных больных были выявлены отдаленные метастазы, хотя многие из этих пациентов клинически имели локализованную опухоль без признаков генерализации опухолевого процесса. Анализ уровня вышеуказанных маркеров показал, что концентрация TA90-IC была увеличена у 82,9%, а РЭА - только у 70,2% больных. Комбинация обоих маркеров позволила установить распространенность опухолевого процесса в 93,5% наблюдений. Исследователи считают, что данную работу необходимо продолжить и доказать роль TA90-IC в скрининге и мониторинге прогрессирования КРР.
Необходимо отметить, что наиболее адекватным с клинической точки зрения может быть одновременное определение только небольшого числа взаимодополняющих показателей, способных охарактеризовать пролиферативную активность КРР, ее метастатический потенциал, чувствительность к различным типам центральной и локальной регуляции. Задачей исследователей, работающих в данной области, является выбор оптимального в количественном и качественном отношении сочетания молекулярных маркеров в диагностике, мониторинге и прогнозе КРР.
4.4.3. РАКОВЫЕ ЗАБОЛЕВАНИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ, ЖЕЛУДКА, ПИЩЕВОДА И ПЕЧЕНИ
Поджелудочная железа
В Западной Eвропе рак поджелудочной железы выявляется приблизительно в 10 случаев на 100 тыс. Около 90% всех опухолей
поджелудочной железы составляют аденокарциномы из протоков и только 5% - нейроэндокринные новообразования и ацинарный рак.
Наиболее широко в диагностике рака поджелудочной железы используется маркер CA 19-9. Специфичность его определения варьирует от 76 до 99%, а чувствительность - от 69 до 93%. Однако повышенная концентрация СА 19-9 в сыворотке крови не является специфичной только для аденокарцином поджелудочной железы. Высокий уровень СА 19-9 обнаружен при других заболеваниях ЖКТ (остром и хроническом панкреатите, циррозе печени, воспалении желчных протоков).
Показано, что только 55% больных раком поджелудочной железы при диаметре опухоли менее 3 см имеют повышенный уровень СА 19-9 (> 37 U/ml). Следовательно, использование маркера СА 19-9 в диагностике рака поджелудочной железы, в частности ранних его форм, ограничено, поскольку уровень его повышается и при вышеперечисленных доброкачественных процессах в печени и поджелудочной железе. Рекомендуется определение показателей СА 19-9 для оценки прогноза рака поджелудочной железы, но не для рутинной практики.
В перспективных исследованиях изучается также ряд других маркеров при раке поджелудочной железы: муцины типа СА50, СА242, СА195, DU-PAN 2, CAM 17.1/WGA. Однако в настоящее время СА 19-9 следует считать «золотым стандартом» в диагностике рака поджелудочной железы.
Желудок
Рак желудка - одна из наиболее распространенных форм опухоли в мире. В Западной Eвропе частота его в последнее десятилетие снизилась, тогда как в Азии показатель смертности вырос и приблизительно равен 100 на 100 тыс. В США от рака желудка умирает ежегодно 6 больных на 100 тыс.
Достаточно подробно изучаются при раке желудка три маркера: РЭА, СА 19-9 и СА 72-4, однако наиболее чувствительным и специфичным считается СА 72-4. РЭА и СА 19-9 обладают одинаковой специфичностью, хотя СА 19-9 может быть более чувствительным, чем РЭА, однако ни один из вышеуказанных маркеров не может быть использован в скрининге и ранней диагностике рака желудка.
Рак пищевода
Частота выявления рака пищевода значительно варьирует. Так, в Центральной Азии заболеваемость им составляет 50-100 случаев на 100000, тогда как в Eвропе и США - 2-3 случая на 100 тыс. В 90% рак пищевода представлен плоскоклеточной карциномой и менее чем в 10% - аденокарциномой.
По сравнению с другими опухолями ЖКТ биохимические маркеры рака пищевода исследовались недостаточно. Однако считается, что наилучшими маркерами в диагностике рака пищевода из плоскоклеточного эпителия следует считать SCC и цитокератины (CYFRA 21-1, TPA, TPS), тогда как предпочтение при диагностике аденокарцином пищевода отдают СА 19-9. Вместе с тем опухолевым маркерам в диагностике опухолей пищевода уделяется незначительное внимание ввиду их неспецифичности.
Гепатоцеллюлярная карцинома
Другое название этого заболевания - «злокачественная гепатома». Такой диагноз ставится в Западной Eвропе с частотой 5-10 случаев на 100 тыс., а в Южной Eвропе - менее 5 случаев на 100 тыс. Наиболее часто рак печени выявляется в Китае, где рекомендуется популяционный скрининг эндемического очага этого вида опухоли с целью выявления новообразования.
Основным маркером в диагностике гепатоцеллюлярной карциномы является α-фетопротеин, который при скрининге позволяет выявить опухоли небольшого размера, что способствует увеличению послеоперационной выживаемости у этой категории больных. Однако следует заметить, что роль α-ФП в скрининге гепатоцеллюлярной аденокарциномы не определена проспективными рандомизированными исследованиями. Ввиду очень редкого выявления этих новообразований в Западной Eвропе полагают, что проведения скрининга гепатоцеллюлярной карциномы не требуется. Однако с 1986 г. рекомендуются проведение каждые 6 мес ультрасонографии печени и определение каждые 3 мес концентрации α-ФП у больных, позитивных на поверхностный антиген гепатита В, а также страдающих хроническим активным гепатитом или циррозом печени. Полагают также, что пациентов с персистирующей инфекцией, в частности больных вирусным гепатитом С, также следует считать угрожаемыми по гепатоцеллюлярной аденокарциноме. Доказано, что риск развития этой опухоли при вирусном гепатите С и циррозе печени в 100 раз выше, чем у неинфицированных людей.
Одной из важных проблем при использовании α-ФП в дифференциальной диагностике гепатоцеллюлярной аденокарциномы являются гепатиты и цирроз печени, при которых уровень опухолевого маркера также повышается. Поэтому в дифференциальной диагностике вышеуказанных заболеваний помогает отделение фукозилированного α-ФП от нормального α-ФП путем связывания с лектинами. Определение этих фракций α-ФП помогает в дифференциальной диагностике гепатоцеллюлярной карциномы. Кроме того, при доброкачественных заболеваниях уровень α-ФП может увеличиваться временно, тогда как при гепатоцеллюлярной карциноме он повышен в сыворотке крови постоянно. Поэтому определение α-ФП несколько раз в течение 2-3 нед позволяет исключить ложноположительные его значения. Кроме того, недавно появился новый маркер в диагностике гепатоцеллюлярной аденокарциномы - des-gamma-carboy prothrombin (DCP), также известный как PIVKA II (белок, индуцированный отсутствием витамина К). Сочетание этого маркера с α-ФП позволяет выявить в 86% гепатоцеллюлярную карциному и в 78,3% солитарную опухоль, и в этих случаях один из этих маркеров будет положительным.
4.4.4. НОВООБРАЗОВАНИЯ ОРГАНОВ ЖЕНСКОЙ РЕПРОДУКТИВНОЙ СИСТЕМЫ
Новообразования половых органов у женщин составляют 15% всех опухолей, и они распределяются по частоте убывания в следующем порядке: рак тела матки, яичников и шейки матки. Однако в структуре смертности рак яичников занимает первое место, затем следует рак шейки и тела матки. Так, например, в США ежегодно регистрируются 20 тыс. новых случаев рака яичников и 12 тыс. умерших от этой опухоли. Этиология заболевания неизвестна, однако факторами риска считаются ановуляция, использование некоторых контрацептивов, а также семейная предрасположенность.
Опухоли яичников
Более 90% опухолей яичника имеют эпителиальную природу, т.е. возникают из целомического эпителия. Эпителиальные опухоли яичников классифицируются на основании типа клеток: серозные, муцинозные, эндометриоидные, светлоклеточные, смешанные эпителиальные, недифференцированные, плоскоклеточные. Чаще всего рак яичников развивается из серозных клеток.
Наилучшим маркером при эпителиальном раке яичников является муцин - СА 125. В период менструации уровень маркера у женщин может повышаться до 100 kU/l и выше. Уровень СА 125 повышается почти у 80% больных с эпителиальными опухолями яичников, однако высокие показатели опухолевого маркера обнаруживаются только у половины больных при раке яичников I стадии согласно международной (FIGO) классификации этого заболевания. Недостаточная чувствительность при ранней диагностике, а также выявление повышенных значений СА 125 при различных доброкачественных новообразованиях и других аденокарциномах, не позволяют использовать этот показатель как маркер раннего выявления рака яичников. Наряду с уровнем других маркеров (α-ФП, hCG, hCGb) уровень СА 125 может повышаться при опухолях из герминогенных клеток.
Прогноз рака яичников в основном зависит от стадии болезни. При скрининге СА 125 малочувствителен, и только 50% пациенток с I стадией болезни имеют повышенный уровень маркера, именно поэтому данный маркер не рекомендуют для выявления спорадических случаев заболевания. Однако определение СА 125 в комбинации с мануальным ректовагинальным исследованием органов малого таза и трансвагинальной ультрасонографией может иметь важное значение в раннем выявлении рака яичников.
Мультицентрическое проспективное исследование женщин в постменопаузе с новообразованиями в малом тазу и сравнение трансвагинальной ультрасонографии, мануального исследования органов малого таза и определения СА 125 (пороговое значение СА 125 35 kU/l) показали, что диагноз подтверждается этими методами в 77, 76 и 74% соответственно. Кроме того, с помощью регрессионного анализа показано, что по сравнению с ультрасонографией СА 125 более чувствителен, однако диагностическая ценность уступает таковой мануального исследования. Опухоли не выявляются при комбинации отрицательных результатов трех методов. Определение уровня СА 125 перед операцией может подсказать врачу возможный объем хирургического пособия.
Известно, что традиционными прогностическими факторами у больных раком яичников считаются стадия заболевания, степень дифференцировки и гистологический тип опухоли, размер остаточной опухоли после паллиативной циторедуктивной операции. Вместе с тем многоцентровые исследования показали, что уровень СА 125 в сыворотке крови больных после 1, 2 и 3-го курсов химиотерапии являются одним из самых важных прогностических факторов ран-
него рецидива болезни. Удлиненный период полужизни СА 125 или менее чем 7-кратное снижение уровня опухолевого маркера в ранние месяцы после лечения указывают на плохой исход. Дальнейшие исследования показали, что концентрация СА 125 > 70 kU/l перед третьим курсом химиотерапии является наиболее важным фактором прогноза прогрессирования заболевания в ближайшие 12 мес.
СА 125 при мониторинге больных раком яичников позволяет выявить ранний рецидив. Однако в литературе еще не представлены данные, указывающие на то, что своевременное выявление рецидива болезни может улучшить показатели выживаемости. Увеличение уровня СА 125 свидетельствует о резидуальной болезни в 94,8% случаев, однако почти у половины больных с нормальными значениями маркера также имело место наличие болезни (опухолевых узлов) по данным «second-look»-лапаротомии. Уровни СА 125 увеличены в сыворотке крови 25% больных, которые имеют только микроскопические признаки болезни и у 79% пациенток, диаметр рецидивной опухоли у которых равен более 1 см при лапаротомии.
Рак молочной железы
Рак молочной железы (РМЖ) - одна из основных причин смерти женщин в странах Западной Eвропы, и за время жизни женщины риск возникновения этой опухоли составляет 12,2%, а риск смерти от нее - 3,6%. Известно достаточно много факторов, которые ассоциируются с риском развития РМЖ: генетические и семейные факторы, гормональные (ранняя менархе, поздняя менопауза, поздняя первая беременность) факторы, диета, доброкачественные болезни молочной железы (в основном ассоциированы с атипичной гиперплазией).
В настоящее время известен ряд опухолевых маркеров при РМЖ: МИС-1 (СА 15-3), СEA, онкопротеины, цитокератины. Наиболее широко используют СEA и СА 15-3. Известны и другие члены семейства гена МИС-1: МСА, СА 519, BR27-29, BRMA. Все они имеют примерно одинаковую чувствительность и специфичность, как и СА 15-3. Поэтому использование нескольких маркеров сразу не вносит дополнения к информации, полученной с помощью СА 15-3. Ряд маркеров, такие, как цитокератины (TPA, TPS, CYFRA 21-1) и растворимые онкопротеины (c-erbB-2), в настоящее время интенсивно изучаются и проходят стадию клинической оценки.
Чувствительность опухолевых маркеров у больных с ранним РМЖ очень низкая (15-35%), поэтому их использование в диагностике
зачастую затруднительно. Конечно, полученные низкие значения маркеров отнюдь не исключают наличия первичного и метастатического очагов. С другой стороны, высокие уровни маркера у больных РМЖ почти полностью свидетельствуют о наличии генерализации опухоли и отдельных метастазов.
Высокий уровень СEA, СА 15-3 и других маркеров семейства МИС-1 однозначно связан со стадией РМЖ, размером опухоли и вовлечением в опухолевый процесс регионарных лимфатических узлов. Но пока неясно, являются ли эти маркеры независимыми факторами прогноза. Более того, неизвестно, будет ли использование такого опухолевого маркера как индикатора раннего рецидива болезни приводить к увеличению безрецидивной и общей выживаемости пациенток.
В случае радикального лечения РМЖ серийные определения СEA и СА 15-3 в могут быть показаны также при ранней диагностике рецидива. Эти опухолевые маркеры в пределах 2-18 мес (в среднем 5,2 мес) обнаруживаются у 40-60% больных с рецидивом РМЖ еще до положительного ответа по результатам клиникоинструментальных и радиологических методов (рентгенография грудной клетки, ультрасонография печени, сканирование скелета). Динамическое определение уровня СEA и СА 15-3 считается достаточно чувствительным тестом в ранней диагностике метастазов в кости и печень и, кроме того, снижает частоту проведения у больных как изотопного сканирования, так и радиоизотопных диагностических процедур.
Тканевые маркеры при раке молочной железы
В отличие от классических опухолевых маркеров, определяемых в сыворотке крови, клеточные или тканевые маркеры типируются непосредственно в опухолевой ткани. Большинство из них характеризуют определенные биологические особенности опухоли, специфику ее поведения и регуляции, например гормональную чувствительность или склонность к инвазии и метастазированию. Для некоторых молекулярных маркеров конкретная биологическая функция пока не установлена. Основное значение таких маркеров заключается в том, что они характеризуют биологические особенности каждой конкретной опухоли и помогают при прогнозировании и индивидуализации лекарственного лечения заболевания.
В табл. 4.10 представлены биологически значимые показатели, являющиеся действующими или потенциальными тканевыми маркерами РМЖ.
Таблица 4.10. Основные группы тканевых/клеточных прогностических маркеров при раке молочной железы
 В
общем случае определение молекулярного маркера при РМЖ может иметь три
практических результата: 1) выявление среди больных с ранними стадиями
рака групп риска, требующих дополнительного лечения, а также не
подлежащих адъювантной терапии; 2) определение чувствительности к
определенным видам терапии и индивидуализация схем адъювантного лечения
больных с распространенным процессом; 3) разработка новых препаратов.
В
общем случае определение молекулярного маркера при РМЖ может иметь три
практических результата: 1) выявление среди больных с ранними стадиями
рака групп риска, требующих дополнительного лечения, а также не
подлежащих адъювантной терапии; 2) определение чувствительности к
определенным видам терапии и индивидуализация схем адъювантного лечения
больных с распространенным процессом; 3) разработка новых препаратов.
Одними из первых вошедших в практику лечения больных РМЖ показателей, относящихся к категории клеточных маркеров, были рецепторы стероидных гормонов, в первую очередь рецепторы эстрогенов (РЭ). Несколько позднее в дополнение к ним стали определять также рецепторы прогестерона (РП).
Присутствие РЭ в первичной опухоли молочной железы свидетельствует о ее потенциальной чувствительности к лечебным мероприятиям, направленным на удаление источника эстрогенов из организма или на противодействие их эффектам (овариэктомия, использование антиэстрогенов).
РП представляет интерес как молекулярный маркер РМЖ не только потому, что он является первым звеном реакции клетки на прогестины, определяя чувствительность к соответствующим препаратам, но и потому, что его синтез в клетках РМЖ индуцируется эстрогенами. Таким образом, наличие РП может свидетельствовать о функциональной активности РЭ.
В настоящее время в различных клиниках и лабораториях используется три относительно равнозначных метода определения рецепторного статуса РМЖ: радиолигандный - оценка связывающей способности рецепторов в цитозолях опухолей; иммуноферментный - определение концентрации иммунореактивного рецепторного белка в тех же цитозолях; иммуногистохимический - специфическое окрашивание срезов опухоли с помощью антител к рецепторным белкам. Преимуществом первых двух методов является количественный характер, позволяющий объективизировать критерии оценки рецепторного статуса. Радиолигандный метод позволяет также оценить и функциональную активность рецептора на одной из первых стадий его взаимодействия с гормоном, что делает прогноз гормоночувствительности более надежным, чем при определении иммунореактивных белков.
С другой стороны, иммуногистохимический метод хотя и носит полуколичественный характер, однако имеет важное достоинство, заключающееся в том, что при окрашивании срезов можно четко
определить принадлежность рецепторов именно опухолевым клеткам. При использовании биохимических методов такая возможность отсутствует. Кроме того, этот метод позволяет работать с архивным материалом - парафиновыми блоками и даже готовыми стеклами, что делает его единственно возможным вариантом в тех случаях, когда необходимость исследования рецепторов стероидных гормонов возникла или была осознана через длительное время после операции.
Известно, что гормонально-зависимый вариант РМЖ, когда типируются оба или хотя бы один из рецепторов стероидных гормонов, характеризуется благоприятным течением, а послеоперационный период у таких больных протекает лучше, чем в случае рецепторотрицательных опухолей. Тем не менее в практической клинической работе результаты определения рецепторов стероидных гормонов в основном используют при отборе больных, чувствительных к эндокринной терапии.
Рецепторы факторов роста. В эту группу относят и сами факторы роста - белки и небольшие полипептиды, продуцируемые собственно опухолевыми клетками и другими компонентами опухолевой ткани (фибробластами, инфильтрирующими опухоль макрофагами и лимфоцитами, эндотелиальными клетками) и стимулирующие рост клеток-продуцентов (аутокринный механизм) или соседних клеток (паракринный механизм).
В аутокринной и паракринной регуляции пролиферации клеток РМЖ участвуют различные ростовые факторы: пептиды группы ЭФР (α-трансформирующий фактор роста, амфирегулин и др.), взаимодействующие с общим рецептором, инсулиноподобные факторы роста (ИФР), соматостатин и др. Рецепторы этих ростовых факторов были обнаружены в опухолях больных РМЖ. Наличие в опухоли молочной железы РЭФР, в особенности в отсутствие рецепторов стероидных гормонов, свидетельствует о неблагоприятном прогнозе заболевания даже на ранних стадиях и о резистентности к эндокринной терапии. Eсть данные о том, что наличие рецепторов ИФР и рецепторов соматостатина указывает на более благоприятный прогноз РМЖ.
Тем не менее из-за неоднозначности результатов, полученных разными авторами, ни один из показателей, характеризующих чувствительность РМЖ к ауто- и паракринным регуляторам, пока не вошел в рутинную клиническую практику, как, например, исследование уровня рецепторов стероидных гормонов. Можно ожидать, однако, что в ближайшее время интерес к исследованию РЭФР при РМЖ вновь возрастет, в связи с тем что уже на стадии клинических
испытаний вышли препараты, специфически воздействующие на РЭФР, - моноклональные антитела к рецептору и ингибиторы внутренней тирозинкиназы РЭФР, реализующей первый этап передачи митогенного сигнала.
Следует отметить, что до настоящего времени «золотым стандартом» при исследовании РЭФР считается радиолигандное определение в мембранной фракции тканей с использованием 125I-меченного ЭФР и последующего разделения на гидроксил-апатите.
Определенные успехи в области практического использования маркеров, связанных с РЭФР-зависимой регуляцией роста РМЖ, уже достигнуты после появления препарата герцептина, представляющего собой гуманизированные антитела к HER2/neu - одному из рецепторов семейства ErbB, к которому принадлежит и РЭФР.
Семейство тирозинкиназных рецепторов - продуктов онкогенов группы c-erbB, в которое входят четыре сходных по структуре трансмембранных рецептора, - РЭФР (ErbB-1), ErbB-2 (HER2/neu), ErbB-3 (HER3) и ErbB-4 (HER4) - одна из важнейших регуляторных систем передачи митогенного сигнала.
Помимо структуры, рецепторы семейства ErbB отличаются между собой по относительной специфичности и сродству к различным общим лигандам. Основной особенностью всех рецепторных тирозинкиназ являются трансмембранная локализация и необходимость во взаимодействии с соответствующим лигандом (активирующим фактором) для реализации киназной активности и последующих биологических эффектов. После активации в результате связывания лигандов и димеризации внутренняя тирозинкиназа рецепторов активируется и приобретает способность фосфорилировать как сам рецептор, так и другие клеточные белки, участвующие в передаче митогенного сигнала. Рецепторы семейства ErbB могут образовывать как гомо-, так и гетеродимеры, при этом во многих случаях наиболее активными являются гетероструктуры с участием рецептора HER2/neu, не имеющего собственного лиганда.
Таким образом, HER2/neu - это уникальный представитель рассматриваемого семейства трансмембранных тирозинкиназ, так как, не имея собственного лиганда и не взаимодействуя ни с одним из известных факторов роста, активирующих родственные рецепторы, он является тем не менее ключевым звеном передачи митогенных сигналов всех ЭФР-подобных пептидов и необходим для успешного функционирования всей системы.
Что касается прогностического значения гиперэкспрессии или амплификации гена c-erbB-2, то, несмотря на гигантский материал (к настоящему времени в различных лабораториях мира обследовано уже более 12000 больных РМЖ), единого мнения о прогностической ценности HER2/neu пока нет. Некоторые авторы отмечают его неблагоприятное влияние на безрецидивную выживаемость больных РМЖ без метастазов в лимфатических узлах, другие исследователи не находят достоверной взаимосвязи этих показателей. Опубликованы данные, свидетельствующие о том, что опухоли с амплифицированным геном HER2/neu слабо реагируют на гормональную терапию, но чувствительны к последующей химиотерапии. В настоящее время принято считать также, что больным с HER2/neu-положительными опухолями следует рекомендовать более интенсивные режимы химиотерапии, чем больным с опухолями, не имеющими повышенной экспрессии этого онкогена.
Система активации плазминогена. Способность к метастазированию и инвазии - одно из фундаментальных свойств злокачественных опухолей, важнейшим механизмом которого является разрушение окружающей базальной мембраны и внеклеточного матрикса ассоциированными с опухолью протеазами. Эти протеазы также участвуют в неоангиогенезе, способствуя распространению новых сосудов в опухоли.
Протеолитический каскад активации плазминогена в опухолевой ткани занимает центральное место. Считается, что плазмин, который способен уменьшить уровень внеклеточных матричных гликопротеидов и активировать некоторые прометалло-протеазы, например коллагеназу IV типа, играет решающую роль как в локальном распространении опухоли, так и в формировании метастазов в отдаленных органах и тканях. В многоступенчатой цепочке протеаз, ведущей к разрушению внеклеточного матрикса, ключевую позицию занимает активатор плазминогена урокиназного типа (uPA). Важную роль играет также находящийся на поверхности клеток рецептор uPA, поскольку при связывании с ним способность uPA активировать плазминоген увеличивается. В целом процесс образования плазмина представляет собой циклическую амплификацию, регулируемую по механизму обратной связи.
Помимо uPA, в активации плазминогена участвует также активатор тканевого типа (tPA), однако его роль при развитии опухолей, по-видимому, противоположна и сводится к разрушению опухолевых
клеток и защите окружающих тканей. Активность иРА и tPA подавляется двумя белковыми ингибиторами, принадлежащими к семейству серпинов, - PAI-1 и PAI-2. На основании экспериментальных и клинических данных считается, что при опухолевом росте два ингибитора активаторов плазминогена также играют разную роль: PAI-1 защищает опухолевые клетки от саморазрушения, а PAI-2 тормозит протеолитические процессы во внеклеточном матриксе.
Различные компоненты системы активации плазминогена в ткани РМЖ могут находиться как на самих опухолевых клетках, так и на фибробластах стромы, инфильтрирующих опухоль лимфоцитах и макрофагах, эндотелиальных клетках. В связи с этим можно считать, что процесс активации плазминогена носит преимущественно паракринный характер.
Уровень и соотношение экспрессии компонентов системы активации плазминогена в опухолевой ткани могут служить показателем метастатической и инвазивной активности опухоли, являясь вследствие этого биологически значимым фактором прогноза при злокачественных опухолях или показателем риска малигнизации при доброкачественных новообразованиях. Кроме того, подавление активации плазминогена по урокиназному типу на различных уровнях может стать одним из подходов к разработке новых видов антиметастатической терапии, для эффективного использования которых в клинике необходимо выявлять группы больных, потенциально чувствительных к такому лечению. Разработки подобных препаратов уже достаточно активно ведутся в экспериментальных лабораториях и фармацевтических фирмах, что делает исследование их белков-мишеней в опухолях человека особенно актуальным.
Наиболее адекватным методом оценки уровня экспрессии компонентов системы активации плазминогена считается в настоящее время количественное иммуноферментное определение их концентрации в цитозолях тканей. К сожалению, единые пороговые значения пока не установлены, хотя уже проводятся международные кооперированные исследования в этом направлении.
Фактор роста эндотелия сосудов. В последние годы большое внимание уделяется проблеме неоангиогенеза - формирования новых сосудов - в злокачественных опухолях. В отличие от васкулогенеза ангиогенез - это процесс ответвления новых капиллярных отростков от уже существующих кровеносных сосудов. Уже не вызывает сомнения тот факт, что опухоль не может развиваться и расти без образования
в ней разветвленной сети капилляров, обеспечивающих снабжение клеток кислородом и питательными веществами. Изучение молекулярных механизмов ангиогенеза позволило перейти от микроскопической оценки плотности сосудов в опухолевой ткани к исследованию конкретных молекул, участвующих в регуляции образования и роста новых сосудов. Важнейшим положительным регулятором ангиогенеза, бесспорно, является VEGF, называемый также фактором проницаемости сосудов. Уникальность этого фактора заключается в том, что в отличие от всех других факторов роста он митогенен только по отношению к эндотелиальным клеткам. Доказано, что VEGF играет ключевую роль в неоангиогенезе при РМЖ.
Результаты ряда ретроспективных клинических исследований, опубликованные в самое последнее время, свидетельствуют о том, что экспрессия VEGF при РМЖ имеет, по-видимому, существенное значение для прогноза заболевания, а также влияет на чувствительность опухолей к гормональному и лекарственному лечению. Ero высокий уровень свидетельствует о неблагоприятном прогнозе как при раннем, так и при распространенном РМЖ. Кроме того, в настоящее время активно создаются и исследуются новые препараты с антиангиогенными свойствами, и оценка активности VEGF-зависимого ангиогенеза может стать основой для их целенаправленного применения.
Рак шейки матки
Практически во всем мире рак шейки матки после РМЖ занимает второе место по смертности от опухолевых заболеваний. Основными факторами риска данного заболевания считают социально-экономические, раннее замужество, большое число половых партнеров, а также инфекции, вызванные вирусом папилломы человека (HPV) (типы 16, 18, 31 и 45). Показатели 5-летней выживаемости при данном заболевании составляют около 70%. Однако при выявлении новообразования в ранней стадии 5-летняя выживаемость увеличивается до 90%. Следует отметить, что 90% опухолей шейки матки представлены плоскоклеточным раком, из других гистологических типов - это аденокарцинома и плоскоклеточная карцинома. Очень редко обнаруживаются саркомы или нейроэндокринный рак.
В диагностике плоскоклеточной карциномы шейки матки используется как опухолевый маркер антиген SCCA - белок (молекулярная масса 48 кД) с сильной гомологией семейства ингибиторов протеаз, так называемых серпинов. Чувствительность метода при I стадии заболевания составляет менее 30%, а при IV стадии - 90%. Однако
экспрессия SCCA может увеличиваться и при других плоскоклеточных опухолях (рак легкого, опухоли головы и шеи, рак пищевода и влагалища), при доброкачественных новообразованиях кожи (псориаз, экзема), легких (саркоидоз), печени и почек. В скрининге этот опухолевый маркер не используется.
Для скрининга рака шейки матки предложена во всем мире программа Papanicolau, инструментальные и морфологические диагностические методы, которые позволяют диагностировать преинвазивные опухоли: карциному in situ (CIS) и интраэпителиальную неоплазию шейки матки (CIN). Развитие этих процессов в течение 10-15 лет может предшествовать раку шейки матки. В диагностике ранних стадий SCCA не используется, поскольку уровень опухолевого маркера зависит от объема первичной опухоли, стадии и вовлечения в опухолевый процесс лимфатических узлов. Повышенный уровень SCСА до лечения может служить независимым фактором в оценке метастатического поражения регионарных лимфатических узлов.
Высокие значения маркера до лечения указывают на плохой прогноз у больных плоскоклеточным раком шейки матки. В некоторых исследованиях показано, что SCCA может быть использован как независимый прогностический фактор при раке шейки матки. При аденокарциномах шейки матки как фактор прогноза более полезен CA 125, но не SCCA.
Маркер SCCA определяют для выявления раннего рецидива плоскоклеточной карциномы шейки матки, а также при мониторинге перед неоадъювантной терапией и перед терапией рецидивных опухолей. В этих случаях корреляционная связь составляет 80%, что имеет существенное клиническое значение при отборе больных для последующей лучевой терапии или хирургического лечения.
Рак эндометрия
Рак эндометрия составляет 50% всех злокачественных опухолей урогенитального тракта у женщин, а в 80% случаев обнаруживается при обследовании матки. Выживаемость при I стадии составляет 80%, при IV - 10%. В 60-80% случаев опухоли имеют строение аденокарциномы.
Чаще всего при раке эндометрия повышается опухолевый маркер СА 125: при стадии болезни до 22%, а при III-IV стадии - до 80% уровень маркера выше 35 kU/l. Не существует опухолевого маркера для скрининга с целью раннего выявления рака эндометрия. Морфологическое исследование считается традиционным методом
диагностики рака эндометрия, а образцы тканей получают после выскабливания слизистой оболочки полости матки.
В мониторинге рака эндометрия лучшим маркером считается СА 125. У 60% больных с ранним рецидивом опухоли выявлено повышение в сыворотке крови именно СА 125.
4.4.5. РАК ЛЕГКОГО
В экономически развитых странах мужского населения от злокачественных новообразований рак легкого составляет 21% в структуре общей смертности. Рак легкого представляет прототип опухоли, индуцируемой химическими канцерогенами. Выявлена тесная связь развития рака легкого с курением сигарет, однако не у всех курильщиков развивается рак, а только в 5-10%, что свидетельствует о важной роли генетической предрасположенности у этих пациентов. Почти в 50% случаев при первичной диагностике может быть рекомендовано хирургическое лечение, однако только у 70% из них опухоль является резектабельной.
Основные гистологические типы рака легкого: плоскоклеточный (ПРЛ), аденокарцинома, крупноклеточная карцинома и мелкоклеточный рак легкого (МРЛ). Следует отметить, что МРЛ отличается от других гистологических типов опухолей легкого особенностями клинического течения. Поэтому все злокачественные опухоли легкого разделяют на МРЛ и немелкоклеточный рак легкого (НМРЛ), которые входят в гетерогенную группу опухолей.
При раке легкого наиболее часто исследуются следующие маркеры: нейронспецифическая енолаза (НСE), РЭА, 19 фрагмен цитокератина (CYFRA 21-1), плоскоклеточный раковый антиген (SCC), СА 125, тканевый полипептидный антиген (ТПА).
Нейронспецифическая енолаза впервые была обнаружена в нейронах мозга и периферической нервной системе. НСE представляет собой изофермент цитоплазматического гликолитического фермента енолазы (2-фосфо-Д-глицерат-гидролаза, КФ 4.2.1.11) и состоит из двух практически идентичных полипептидных цепей γ-типа, молекулярная масса каждой равна 39000 Д. В мозге наряду с обнаруживается также изоформа - димер из субъединиц α-типа и гибридный изофермент αγ, обладающие сходным сродством к субстрату - 2-фос- фоглицериновой кислоте. Eнолаза, содержащая эту γ-субъединицу (α-γ и γ-γ) была названа НСE. Изоформы могут синтезироваться глиальными клетками мозга, а также большинством клеток соматических
тканей. Сам фермент синтезируется в центральных и периферических нейронах и злокачественных опухолях нейроэктодермального происхождения (МРЛ, нейробластомы, интестинальные карциноиды).
Показано, что верхняя граница нормы НСE у здоровых людей - 12,5 нг/мл. Учитывая, однако, что концентрация до 20 нг/мл
и более может встречаться и при доброкачественных заболеваниях легких, для клинической диагностики предпочтителен более высокий уровень порогового значения маркера (> 25 нг/мл). Повышение активности HCE в сыворотке крови обнаружено у 40-70% первич-
ных больных МРЛ и у 83-98% пациентов при распространенной стадии заболевания.
По данным, представленным Memorial Sloan Kettering Cancer Center (США), частота увеличения активности НСE в сыворотке крови больных МРЛ зависит от распространенности опухолевого процесса: при I-II стадии чувствительность теста составляет 39%, при III-IV - 87%. Следует отметить, что при анализе диагностической значимости многие авторы выявляют достаточно высокую специфичность по сравнению с другими маркерами. Так, активность при эмфиземе легких повышалась только в исключительных случаях, в отличие от которой концентрация РЭА была увеличена в 7-36% наблюдений. Результаты исследований свидетельствуют о том, что НСE вполне применим в качестве опухолевого маркера выбора как при дифференциальной диагностике, так и при мониторинге эффективности терапии МРЛ.
Вместе с тем обнаружено повышение активности НСE в сыворотке крови больных туберкулезом (27,3%), а также у пациентов, инфицированных вирусом HIV, по сравнению с неинфицированными. Пациенты с альвеолярными инфильтратами или интерстициальными очагами в легких имели также значительно повышенный уровень НСE в сыворотке крови. Полагают, что увеличение НСE в сыворотке крови у больных с доброкачественными заболеваниями легких связано с локальной гипоксией. Представленные результаты следует учитывать при анализе НСE у больных раком легкого и при обструктивных процессах легких.
Необходимо отметить, что, учитывая значительную гетерогенность рака легкого, в частности мелкоклеточного варианта, можно отметить существенную диагностическую и прогностическую значимости НСE по сравнению с другими опухолевыми маркерами.
Раково-эмбриональный антиген, представленный гликопротеином с молекулярной массой около 180 кД, также принадлежит к группе
онкофетальных антигенов, синтезируемых и секретируемых кишечными клетками эмбриона и плода, а также некоторыми злокачественными опухолями (рак молочной железы, желудка, легкого). Впервые РЭА обнаружен у больных раком толстой кишки. В настоящее время РЭА-подобные соединения выявлены также на мембранах клеток в неэмбриональных и нераковых тканях. Eсть все основания полагать, что печень является основным местом метаболизма РЭА. Уровень РЭА в сыворотке крови повышен у 40-80% больных со злокачественными новообразованиями эндодермального происхождения, у 20-30% с другими формами рака и у 10-20% с доброкачественными опухолями. Наибольшая чувствительность РЭА и самые высокие концентрации маркера обнаружены при аденокарциноме и крупноклеточном раке легкого.
Сывороточный антиген плоскоклеточной карциномы - это белок с молекулярной массой 48 кД, который сходен с серпинами (ингибиторами протеаз). Маркер используют в диагностике плоскоклеточного рака в различных органах (рак шейки матки, пищевода, легкого, опухоли головы и шеи). Более чем у 70% больных ПРЛ его уровень повышен. Однако лишь в 26,1% уровень опухолевого маркера повышается в сыворотке крови при аденокарциноме легкого и не обнаруживается при МРЛ. У 87,8% больных с ранним рецидивом ПРЛ отмечается высокий уровень SCC в сыворотке крови. Очень важное практическое значение имеет выявление экспрессии SCC при иммуногистохимическом исследовании опухолей легкого.
Тканевый полипептидный антиген - полидисперсная смесь цитокератинов 8, 18 и 19 (молекулярная масса от 20 до 45 кД), которая способна полимеризоваться в растворе с образованием олигомеров. Активность ТПА зависит от аминокислотной последовательности и положения остатка аргинина. В норме содержится в высокой концентрации в плаценте и эмбриональных тканях. Локализуется ТПА на плазматической мембране и эндоплазматическом ретикулуме опухолевых клеток, продуцируется пролиферирующими клетками и высвобождается в окружающую среду спонтанно. ТПА обнаруживается практически во всех злокачественных опухолях.
Фрагмент цитокератина 19. Значимость цитокератина для дифференциации физиологической и патологической ткани давно была известна в гистопатологии. Цитокератины являются нерастворимыми клеточными белками, более 20 из них в настоящее время хорошо охарактеризованы с помощью моноклональных антител. В отличие
от целой молекулы, фрагменты цитокератина растворимы в сыворотке. В тесте на опухолевый маркер CYFRA 21-1 используются два типа моноклональных антител (Ks 19.1 и BM 19.21) для выявления фрагмента цитокератина 19 с молекулярной массой 30 кД. Верхняя граница нормы у здоровых людей равна 2,3 нг/мл. Тест CYFRA 21-1 обладает хорошей специфичностью по отношению к доброкачественным заболеваниям легких, уровень порогового значения - 3,3 нг/мл. Маркер обладает высокой чувствительностью в диагностике НМРЛ.
Не выявлено связи CYFRA 21-1 с курением. Показано, что уровень CYFRA 21-1 одинаков в сыворотке крови больных с незлокачественными заболеваниями легких, МРЛ и в контрольной группе. В то же время значительно более высокие уровни CYFRA 21-1 отмечены у больных НМРЛ, аденокарциномой и ПРЛ. Представленные данные подтвердили высокую чувствительность и специфичность CYFRA 21-1 в дифференциальной диагностике между злокачественными и незлокачественными заболеваниями легких, так же как и между МРЛ и НМРЛ. Больные с метастазами в лимфатических узлах N2 и N3 имеют наиболее высокий уровень CYFRA 21-1 в сыворотке крови (5,6 нг/мл) (пределы колебания 3,2-11,5 нг/мл) в сравнении с пациентами с N0 и N1 (3,9-10 нг/мл) (Mann-Whitney U-тест; р=0,0373).
При всех видах рака легкого CYFRA 21-1 имеет наиболее высокую чувствительность (57,7%) по сравнению с РЭА (45,3%) и SCC (22,6%). Несмотря на то что при сочетании CYFRA 21-1 и РЭА для диагностики НМРЛ показатели чувствительности и точности повышаются до 75,4 и 78,1% соответственно, однако специфичность снижается до 86,5%.
Японские исследователи (University of Tsukuba) предлагают использовать в целях повышения диагностики и дифференциальной диагностики рака легкого определение уровня CYFRA 21-1 в плевральной жидкости в дополнение к цитологическому исследованию. Это связано с тем, что в плевральной жидкости у больных раком легких выявлено достоверное повышение маркера (в среднем 84,5 нг/мл) по сравнению с больными с доброкачественными опухолями (13,9 нг/мл). Кроме того, уровень CYFRA 21-1 в плевральной жидкости больных ПРЛ значительно отличаются от такового при пневмонии, тогда как РЭА не выявляет таких различий.
При определении CYFRA 21-1 следует помнить о возможном увеличении уровня до 10 нг/мл при прогрессирующих доброкачественных заболеваниях печени и особенно при почечной недостаточности. Загрязнение образца элементами слюны может также
привести к значительному повышению значения CYFRA 21-1. При этом на результат не влияют пол, возраст, курение и беременность. Исследования всех типов солидных опухолей показали, что CYFRA 21-1 является результативным маркером при НМРЛ и ПРЛ.
В заключение рассмотрим некоторые особенности использования в клинике маркеров злокачественного роста на примере рака легкого.
Прежде всего использовать все вышеуказанные маркеры в скрининге бессимптомного рака легкого или у больных с высоким риском развития этого вида опухоли не следует. Первичная диагностика и первичная терапия больных раком легкого основываются на клинических и инструментальных методах обследования (общеклиническое, эндоскопическое, рентгенологическое, интраоперационные находки).
Далее маркер НСE следует считать крайне важным при иммуногистохимической диагностике варианта опухоли. Часто только определение НСE в сыворотке крови помогает подтвердить диагноз МРЛ.
Концентрация SCC в сыворотке крови > 2 mg/l указывает на 95% вероятность обнаружения НМРЛ и 80% - плоскоклеточный рак легкого.
При уровне СА 125 более 100 U/ml и РЭА выше 10 mg/l следует предполагать аденокарциному или крупноклеточный рак легкого.
И наконец, хотя часто концентрация в сыворотке крови CYFRA 21-1, ТРА, HCE, РЭА показывает наличие опухоли, не отмечается
стойкой зависимости между продукцией опухолевых маркеров и гистологическим вариантом опухоли легкого. В большинстве случаев высокий уровень в этом случае указывает на распространенность опухолевого процесса, а следовательно, и прогноз должен быть неутешительным. Однако низкие и средние значения этих маркеров никогда не позволяют полностью исключить какой-либо вариант опухоли или прогрессирование заболевания.
Несмотря на все вышеуказанные ограничения, опухолевые маркеры в первичной диагностике рака легкого могут иметь большое значение в следующих ситуациях.
Во-первых, ассоциированные с опухолью антигены, экспрессирующиеся во время установления первичного диагноза, следует использовать в мониторинге у данного пациента. CYFRA 21-1, РЭА и СА 125 являются высокозначимыми прогностическими факторами при НМРЛ, а HCE - при МРЛ.
Во-вторых, снижение уровня опухолевых маркеров в послеоперационном периоде (~2-3 дня для РЭА, 1 день для НСE, несколько часов
для CYFRA 21-1) дает врачу полезную информацию о радикальности выполненного хирургического вмешательства и эффективности терапии, а стало быть, и о хорошем прогнозе. С другой стороны, медленное снижение уровня маркера в сыворотке крови свидетельствует о нерадикальности проведенной операции и предполагает наличие резидуальных очагов опухоли.
В-третьих, постепенное повышение опухолевого маркера может служить первым признаком рецидива болезни. Такое увеличение может быть обнаружено за 12 мес до клинических признаков рецидива. Для рака легкого НСE может служить критерием дифференциальной диагностики различных гистологических типов опухоли, особенно в тех случаях, когда не удается провести биопсию и подтвердить данными морфологического исследования тип опухоли.
4.5. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ДИАГНОСТИКА
Основной задачей современной молекулярно-генетической диагностики (МГД, ДНК-диагностика) является обнаружение наследственных аномалий для последующего использования в диагностике, составления прогноза и выбора стратегии лечения многих заболеваний. При этом МГД рассматривается значительно шире, чем просто анализ последовательности геномной ДНК человека, поскольку практически всегда дополнительную информацию о наследственном заболевании можно также получить, анализируя состояние и самих хромосом, и РНК, и белков, и метаболитов.
Как и другие методы клинической биохимии, генетическое тестирование применяется для дифференциальной диагностики заболеваний. При ряде заболеваний, например при наследственных формах рака или «ошибках метаболизма», обнаружение мутаций становится не менее важным диагностическим критерием, чем клиническая симптоматика. Однако, безусловно, главным достоинством ДНК-диагностики является возможность определения предрасположенности к определенному заболеванию на пресимптоматической стадии. В ряде случаев это дает возможность путем хирургического вмешательства, лекарственной терапии или изменения стиля жизни пациента предотвратить развитие самой болезни. Кроме того, проведение пренатального ДНК-тестирования позволяет выявлять наследование патологических генов и, соответственно, определять показания для искусственного прерывания беременности.
Необходимо отметить и такое перспективное направление МГД, как фармакогенетика. Точное типирование генотипа пациента позволяет оценивать гены, непосредственно связанные с всасыванием, метаболизмом и действием лекарств, т. е. появляется реальная возможность выявлять больных, особо чувствительных к определенному препарату, и избегать в процессе лечения осложнений, обусловленных непереносимостью данного лекарства. В некоторых случаях генотипирование также позволяет выбрать наиболее адекватное лекарство. Уже сейчас можно с уверенностью утверждать, что по мере развития фармакогенетики лекарственная терапия будет все больше опираться на анализ генотипа пациента.
Таким образом, использование МГД в клинической практике открывает широкие возможности не только для диагностики и оценки генетического риска заболеваний, но и для подбора индивидуальной лекарственной терапии. Можно надеяться, что активное развитие молекулярной генетики человека поставит ДНК-диагностику в один ряд с такими незаменимыми инструментами в арсенале врача-биохимика, как, например, методы определения активности ферментов в крови.
4.5.1. ТИПЫ ГЕНЕТИЧЕСКИХ ПЕРЕСТРОЕК
В популяции обычно встречается несколько вариантов (аллелей) каждого гена. Eсли частота таких вариантов достаточно высока и не может быть объяснена случайным возникновением одинаковых мутаций в разных семьях, то говорят о полиморфизме данного локуса.
Более редкие варианты генов относят к мутациям. Какова же граница между полиморфизмом и мутациями? Принято считать, что к полиморфизму относят варианты генов, встречающиеся в гетерозиготной форме более, а к мутациям менее, чем у 1% популяции. Однако на практике мутантными часто называют аллели, предрасполагающие к той или иной патологии даже в том случае, если их частота в популяции выше 1%. Ниже перечислены типы мутаций, которые могут приводить к патологическим изменениям.
• Миссенс-мутации, или замена нуклеотидов, - самый частый тип мутаций. Замена нуклеотидов в некоторых положениях кодонов не приводит к замене кодируемой аминокислоты; такие мутации называются молчащими или синонимичными. При изменении кодируемой аминокислоты в результате миссенс-мутации функция белка часто меняется. Сохранение функции белка наблюдается в том случае, если
происходящая от мутантного кодона аминокислота принадлежит к тому же структурному классу, что и свойственная норме аминокислота. Максимальное влияние на белок оказывают однонуклеотидные замены, приводящие к образованию стоп-кодона (нонсенс-мутации). Укороченные мРНК и белок часто неактивны и быстро деградируют.
• Делеции и инсерции. Такого рода мутации варьируют по длине от одного до миллионов нуклеотидов и, соответственно, носят название микро- и макроделеции (инсерции). Понятно, то макромутации затрагивают очень большие участки хромосом (с 10 млн пар нуклеотидов), т.е. появляется возможность их обнаружения с помощью цитогенетического анализа. Микромутации затрагивают небольшое количество нуклеотидов, и для их поиска используются методы анализа нуклеотидной последовательности ДНК. Небольшие инсерции и делеции могут не влиять на функцию кодируемого белка. Фатальные последствия обычно наблюдаются, когда количество нуклеотидов инсерции/делеции не кратно трем. При этом происходит сдвиг рамки считывания и синтезируется бессмысленная аминокислотная последовательность. Чаще всего она очень быстро прерывается за счет образования нового стоп-кодона. Классическим примером влияния сдвига рамки на последствия делеции являются два родственных заболевания - миодистрофии Дюшенна и Беккера. Оба вызываются мутациями в гене дистрофина, причем 2/3 этих мутаций - при обоих заболеваниях делеции. Миодистрофия Беккера протекает значительно мягче, чем Дюшенна, однако эта разница не связана с размером делеций. Причиной отличий является то, что в большинстве выявленных случаев миодистрофии Дюшенна делеции приводят к сдвигу рамки считывания, и в результате дистрофин перестает образовываться совсем, в то время как при миодистрофии Беккера мутантный дистрофин сохраняет некоторую активность.
• В ряде случаев мутации затрагивают некодирующие участки ДНК, участвующие в инициации транскрипции данного гена или сплайсинге мРНК. Такие изменения могут также приводить к нарушению структуры, стабильности или нормальной регуляции экспрессии данного белка.
• Нестабильные, или динамические, мутации развиваются обычно в участках, содержащих множественные копии тринуклеотидных повторов. В результате ошибок репликации ДНК или неравного кроссинговера число таких повторов может возрастать либо уменьшаться, вследствие чего такие мутации и назвали динамическими. Eсли число
повторов превышает некоторую пороговую величину, нарушается функция данного или близлежащих генов. Механизмы выключения генов при накоплении тринуклеотидных повторов не совсем ясны. В частности, при синдроме ломкой Х-хромосомы возрастание числа повторов CGG в локусе FRAXA выше 200 ведет к метилированию и инактивации данного гена. Возрастание числа тринуклеотидных повторов лежит также в основе болезни Гентингтона (свыше 35 CAG-повторов в гене Гентингтона) и миотонической дистрофии (свыше 50 повторов в З'-нетранслируемой области гена DMPK, кодирующего протеинкиназу). Характерным признаком этих заболеваний является то, что в одной семье тяжесть заболевания может возрастать в ряду поколений за счет экспансии нуклеотидных повторов.
В общем случае появление мутаций приводит к изменению функции или экспрессии белка. Данное изменение проявляется как увеличением, так и уменьшением, часто вплоть до полной потери, функции или экспрессии белка. В случае функционального увеличения возможно также приобретение белком новых функций.
МУТАЦИИ С ПОТEРEЙ ФУНКЦИИ
Снижение функциональной активности белка в ткани может являться результатом изменения как структуры белка, так и транскрипционной активности данного гена. Например, снижение уровня экспрессии рецептора ЛПНП за счет мутации в промоторной области будет приводить к точно такой же гиперхолестеринемии, которая наблюдалась бы в случае синтеза нормальных количеств функционально неполноценного рецептора, не способного связывать или интернализовать липопротеиды.
Изменение структуры белка, вызванное аминокислотными заменами или нарушение процессинга мРНК в результате мутаций в участках сплайсинга, приводит к появлению аномальных мРНК и белков, подверженных ускоренной деградации, в результате чего общее количество активного белка снижается. Например, три наиболее часто встречающихся дефектных аллеля гена тиопуринметилтрансферазы кодируют быстродеградирующие белки, в результате чего активность фермента резко снижается, что сопровождается повышенной чувствительностью пациентов к тиопуринам. В других случаях, например при а-талассемии, может наблюдаться делеция всего гена, приводящая к полному отсутствию продукта.
Механизмы потери собственно функциональной активности белка могут быть самыми разнообразными. В результате мутаций может
происходить замена аминокислот, играющих ключевую роль в структуре или каталитической активности. В результате мутаций может нарушаться нормальный процессинг или транспорт белка. Например, наиболее частая мутация, вызывающая кистозный фиброз, - делеция фенилаланина в положении 506 гена CFTR - не влияет на синтез или функциональную активность данного белка, но нарушает его внутриклеточный транспорт, в результате чего он не включается в плазматическую мембрану и поэтому теряет способность к функционированию в качестве хлорного канала.
Как правило, мутации с потерей функции приводят к заболеваниям с рецессивным типом наследования. Это связано с тем, что для полноценного функционирования метаболического пути обычно хватает того количества активного белка, которое производится одним нормальным аллелем. И таких заболеваний большинство.
Реже встречаются случаи, когда количества синтезируемого белка становится недостаточно. В этом случае заболевание начнет проявляться даже при наличии одного мутантного аллеля, а наследование становится доминантным. Таких заболеваний известно немного, одним из них является семейная гиперхолестеринемия, вызванная дефектом гена рецептора ЛПНП. Для этого заболевания характерен еще и эффект дозы гена, проявляющийся в том, что семейная гиперхолестеринемия протекает гораздо тяжелее у гомозигот по сравнению с гетерозиготами.
Доминантный тип наследования проявляется и когда мутантный белок не только теряет свою активность, но и препятствует функционированию продукта нормального аллеля у гетерозигот. Эта ситуация вошла в литературу под названием доминантно-негативного эффекта. Такой эффект обнаруживается в случае мультимерных белков, к которым, в частности, относятся коллагены или димерные транскрипционные факторы.
МУТАЦИИ С ПРИОБРEТEНИEМ ФУНКЦИИ
Среди широкого спектра усиливающих функцию мутаций наиболее интересными с точки зрения клинической биохимии являются случаи, когда белок приобретает новую функцию. Вновь приобретенная функция может проявляться на таких уровнях, как взаимодействие фермента с новым субстратом, необратимая активация сигналпередающего белка или ионного канала, нарушение нормального процесса инактивации фермента, аномальная олигомеризация белка или синтез химерного белка.
Хорошим примером приобретения функции служит миссенсмутация Ала366-Сер в гене GNAS1, кодирующем α-субъединицу гетеротримерного GTP-связывающего белка Gs. Этот белок сопрягает 7-домен- ные трансмембранные рецепторы гормонов с аденилатциклазой. Мутация приводит к двоякому изменению свойств белка. Во-первых, ускоряется высвобождение GDP и, соответственно, повышается фракция GTP-связанного (активного) белка ασ, что приводит к конститутивной активации адени-латциклазы. Во-вторых, белок становится термолабильным при 37 °С. В связи с этим во всех органах, за исключением яичка, активность Gs снижается, что приводит к развитию наследственной остеодистрофии Олбрайта. А в яичке, где температура ниже, Gs белок необратимо активируется, что приводит к тестотоксикозу.
Наиболее частой причиной приобретения функции является повышенная экспрессия гена либо нарушение места или времени его экспрессии, что наиболее характерно для злокачественно трансформированных клеток.
Для мутаций с приобретением функции, как правило, характерен доминантный тип наследования. В тех редких случаях, когда мутации с приобретением функции находятся в гомозиготном состоянии, наблюдаются очень тяжелые формы заболеваний, часто с пренатальной летальностью. Примером может служить гомозиготная ахондроплазия - наиболее частая причина карликовости, которая вызывается мутациями в гене FGFR3, кодирующем рецептор фактора роста фибробластов. Делеции участка хромосомы, на котором располагается FGFR3, при других заболеваниях не приводят к аномалиям скелета, характерным для ахондроплазии, что позволяет предположить усиление или приобретение функции при этом заболевании. Ахондроплазия всегда встречается в гетерозиготной форме, поскольку гомозиготность по данному признаку летальна.
ПРИНЦИПЫ ПОИСКА МУТАЦИЙ
Общий подход к поиску мутаций в геномной ДНК человека базируется на ряде принципов.
Использование того или иного метода в ДНК-диагностике зависит от наличия информации о возможном типе мутации у данного пациента. В тех случаях, когда тип мутации неизвестен, применяются скрининговые методы, позволяющие обнаруживать любые отличия в нуклеотидной последовательности мутантного и нормального генов. Eсли же мутация известна, например уже идентифицирована у родственников, для обследования используются другие, более простые
и одновременно более эффективные методы, которые можно назвать методами детекции известных мутаций.
Далее, независимо от направленности (скрининговый или детекционный) выбранного способа обязательно учитывают, что одна группа методов базируется на специфичности нуклеотидного спаривания при образовании двойной цепи ДНК, а другая - на узнавании последовательности ДНК ферментами.
Для первой группы методов в качестве референсной последовательности используются фрагменты последовательности изучаемого гена, соответствующей дикому типу, т. е. наиболее распространенной в популяции. Это может быть как короткий олигонуклеотидный праймер (около 20 нуклеотидов), так и более длинный фрагмент ДНК, используемый для гибридизации. В том случае, если ДНК больного содержит мутацию в участке, перекрываемом пробой, полноценная гибридизация между мутантным аллелем и пробой невозможна. Это приводит либо к отсутствию продукта полимеразной цепной реакции (ПЦР), либо к образованию неполноценного ДНК-дуплекса, содержащего участки неспаренных нуклеотидов, которые обнаруживаются различными химическими или ферментативными способами.
Классическим примером метода, основанного на узнавании последовательности ДНК ферментами, является использование рестриктаз - ферментов, расщепляющих ДНК в участках, содержащих строго индивидуальные последовательности длиной 4-8 нуклеотидов. Появление отклонений в нуклеотидной последовательности в результате мутации может приводить либо к утрате уже существующего сайта расщепления для какой-либо рестриктазы, либо, наоборот, к его появлению. В этой же группе методов используют ферменты ДНК-полимеразы. Эти ферменты синтезируют комплементарную цепь в точном соответствии с последовательностью одноцепочечной матрицы. Используя меченые нуклеотидные блоки, можно определить, в какой последовательности располагаются нуклеотиды в данной матрице. Такой принцип лежит в основе ферментативного секвенирования (определения нуклеотидной последовательности) по методу Сэнгера, а также в его упрощенных вариантах, предназначенных для определения нуклеотидной последовательности коротких участков ДНК (минисеквенирование).
В подавляющем большинстве случаев перед собственно анализом мутаций изучаемый фрагмент генома пациента амплифицируется с помощью ПЦР. Целью ПЦР обычно является простое умножение
числа копий данного фрагмента, что облегчает технически последующий анализ ДНК (рис. 4.3). В большинстве вариантов ПЦР у гетерозигот с одинаковой эффективностью амплифицируются и нормальный, и мутантный аллели, а их дискриминация осуществляется на последующих стадиях. Существует также аллель-специфическая
 Рис. 4.3. Схема полимеразной цепной реакции
Рис. 4.3. Схема полимеразной цепной реакции
ПЦР, при которой используются праймеры, гомологичные нормальному либо мутантному аллелю, что позволяет определить присутствие мутации уже на стадии ПЦР по наличию или отсутствию продукта амплификации.
Другой универсальный метод, широко применяемый для диагностики мутаций, - секвенирование ДНК. Секвенирование применяется как для поиска неизвестных мутаций, так и для подтверждения нарушений, обнаруженных другими методами. Существующие методы позволяют секвенировать непосредственно продукты ПЦР, минуя стадию клонирования ПЦР-фрагмента в бактериях. Достоинством секвенирования являются универсальность и высокая информативность. Главным ограничением данного метода является высокая стоимость, не позволяющая использовать его в качестве основного при поиске мутаций.
Количество существующих методов анализа мутаций чрезвычайно велико, а их описание без преувеличения потребует отдельной книги. Ниже приведены описания лишь тех методов, которые лучше приспособлены к использованию в клинической практике, т.е. отвечающих следующим требованиям: достаточная чувствительность выявления мутаций, хорошая воспроизводимость, невысокая стоимость и возможность автоматизации.
МЕТОДЫ МУТАЦИОННОГО СКРИНИНГА
Методы мутационного скрининга применяются в тех случаях, когда характер мутации неизвестен, а клиническая картина наследственного заболевания позволяет предположить, в каких именно генах могла произойти перестройка. Например, наличие гиперхолестеринемии IIа типа в сочетании с сухожильными ксантомами свидетельствует о наличии семейной гиперхолестеринемии и подсказывает, что мутацию следует искать в генах, связанных с захватом ЛПНП клетками, прежде всего в гене рецептора ЛПНП. Поскольку мутации в этом гене при семейной гиперхолестеринемии очень разнообразны и могут затрагивать всю длину гена, необходимо анализировать большие участки ДНК. Секвенирование такого длинного фрагмента гена слишком дорого, поэтому применяют более простые методы.
АНАЛИЗ МАКРОПЕРЕСТРОЕК ДНК-БЛОТТИНГОМ
Для поиска макроперестроек ДНК используют блоттинг по Саузерну. При этом методе первоначально производят фрагментацию геномной ДНК с помощью рестриктазы, после чего полученные
фрагменты ДНК разделяют по размеру электрофорезом в геле, денатурируют и переносят на нитроцеллюлозную мембрану. ДНК на полученном с геля отпечатке (блоте) инкубируют с меченым фрагментом исследуемого гена, который гибридизуется с теми фрагментами геномной ДНК, которые содержат данный ген. При наличии макроперестроек ДНК, затрагивающих данный ген, набор или размер фрагментов, с которыми гибридизуется меченая проба, будет отличаться от нормы.
 Рис. 4.4. Гетеродуплексный анализ
Рис. 4.4. Гетеродуплексный анализ
ГEТEРОДУПЛEКСНЫЙ АНАЛИЗ Поиск микроделеций/инсерций размером менее 25 пар нуклеотидов, а также однонуклеотидных замен более сложен. Для их анализа часто используются специальные варианты электрофоретических методов. Одним из наиболее простых является гетеродуплексный анализ (рис. 4.4). В этом методе образец, содержащий смесь нормального (референсного) и исследуемого амплифицированного фрагмента ДНК, нагревается для денатурации ДНК, а потом охлаждается с восстановлением двухцепочечной структуры ДНК. Поскольку наличие небольших отличий в нуклеотидной последовательности не препятствует гибридизации, часть образующихся дуплексов состоит из референсной и исследуемой ДНК. В участках референсной и исследуемой ДНК, отличающихся по нуклеотидному составу, нормальное спаривание нуклеотидов невозможно и образуется так называемый мисмэтч. Двухцепочечная ДНК, имеющая в своей структуре мисмэтч, на электрофорезе мигрирует по-другому, чем полностью комплементарный дуплекс, что позволяет после окрашивания ДНК обнаруживать аномально мигрирующие фрагменты.
АНАЛИЗ ПОЛИМОРФИЗМА КОНФОРМАЦИИ ОДНОЦEПОЧEЧНОЙ ДНК
Другим популярным электрофоретическим методом мутационного скрининга является анализ полиморфизма конформации одноцепочечной ДНК (single strand conformation polymorphism - SSCP). Принцип метода основан на том, что если денатурированную нагреванием ДНК резко охладить, будут преимущественно образовываться не двухцепочечные дуплексы, а короткие двухцепочечные участки внутри каждого одноцепочечного фрагмента ДНК (рис. 4.5). Обычно образуется несколько относительно устойчивых вариантов, которые в силу различной пространственной конформации по-разному мигрируют на электрофорезе. Участки внутрицепочечной комплементарности обычно короткие, и любое их изменение в результате даже однонуклеотидной замены обычно приводит к исчезновению данной формы внут-рицепочечного дуплекса. В результате на электрофореграмме изменяются распределение и интенсивность полос одноцепочечной ДНК. Данный метод ничего не говорит о природе отличий в нуклеотидной последовательности, поэтому аномальные образцы необходимо секвенировать.
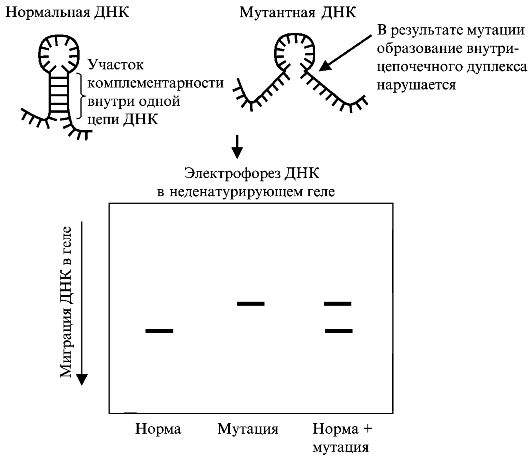 Рис. 4.5. Анализ полиморфизма конформации одноцепочечной ДНК
Рис. 4.5. Анализ полиморфизма конформации одноцепочечной ДНК
ЭЛЕКТРОФОРЕЗ ДΒУХЦЕПОЧЕЧНОИ ДНК Β ГРАДИЕНТЕ ДЕНАТУРАНТА Более воспроизводимым и информативным по сравнению с SSCP является электрофоретический анализ ДНК в градиенте денатуранта (рис. 4.6). Очевидно, что любая нуклеотидная замена приведет к изменению прочности дуплекса ДНК, и он будет денатурировать на одиночные цепи при аномальной температуре или концентрации денатурирующего агента по сравнению с нормальной последовательностью. Β данном методе электрофорез проводят в полиакриламидных гелях, содержащих в нижней части более высокую концентрацию денатуранта, чем в верхней. Β ходе электрофореза нормальный и мутантный фрагменты ДНК денатурируют в разных участках геля. Так как подвижность образующихся одиночных цепей много ниже,
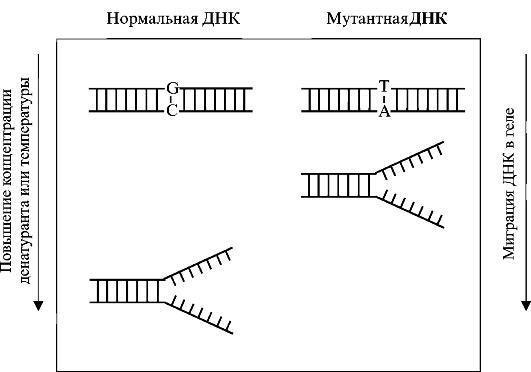 Рис. 4.6. Электрофорез в градиенте денатуранта
Рис. 4.6. Электрофорез в градиенте денатуранта
чем двухцепочечной ДНК (вследствие конформационных особенностей одноцепочечной ДНК), денатурированный фрагмент резко замедляет миграцию, в то время как двухцепочечный продолжает свое движение. Β результате нормальные и мутантные фрагменты ДНК мигрируют в геле на разное расстояние. Иногда в качестве денатуранта используют не химическое вещество, а градиент температуры.
ДЕНАТУРИРУЮЩАЯ ΒЫСОКОЭФФЕКТИΒНАЯ ЖИДКОСТНАЯ
ХРОМАТОГРАФИЯ Различия в прочности нормального и мутантного дуплексов можно также обнаружить с помощью денатурирующей высокоэффективной жидкостной хроматографии. Β этом методе фрагмент ДНК аналогично описанным выше электрофоретическим методам подвергается воздействию градиента денатурирующих агентов, но анализ ДНК проводится хроматографическим методом с использованием спектрофотометрической детекции. Данный метод высокочувствителен и легко автоматизируется, в связи с чем он все шире используется для клинической ДНК-диагностики.
ХИМИЧЕСКОЕ ОБНАРУЖЕНИЕ НЕСПАРЕННЫХ НУКЛЕОТИДОВ Вторая группа методов основана на детекции мутаций с помощью ферментов или химической обработки, специфически разрушающей участки некомплементарного спаривания.
Исследуемый фрагмент ДНК денатурируют, смешивают с контрольным образцом, содержащим нормальную ДНК, и охлаждают для образования дуплексов, некоторые из которых при наличии у пациента мутации будут содержать участки неспаренных оснований. Обработка гетеродуплекса ДНК гидроксиламином или тетроксидом осмия приводит к модификации неспаренных нуклеотидов, содержащих цитозин и тимидин. Последующая обработка пиперидином приводит к расщеплению ДНК по данному нуклеотиду. В результате в нормальных образцах размер ДНК сохраняется, а мутантные содержат набор фрагментов, соответствующих мутациям, затрагивающим нуклеотиды С или Т. Данный метод не получил широкого применения, вероятно, вследствие высокой токсичности применяемых реагентов.
ЗАЩИТА ОТ РНКАЗЫ В другом методе наличие неспаренных нуклеотидов определяется с помощью фермента РНКазы. В этом методе используется меченая РНК-проба, соответствующая нормальной последовательности гена, которая гибридизуется с исследуемым фрагментом ДНК (рис. 4.7). В составе ДНК/РНК-дуплекса РНК устойчива к действию РНКазы, поэтому данный метод называют защитой от РНКазы. Однако в участках, различных по нуклеотидной последовательности между пробой и анализируемым образцом спаривания нуклеотидов не происходит. Образование фрагментов РНК регистрируется с помощью электрофореза. Данный метод является одним из наиболее чувствительных и специфичных для скрининга мутаций, но не получил широкого распространения, видимо, из-за неудобства работы с лабильными РНК-пробами. Существуют и другие методы, основанные на узнавании ферментами неспаренных оснований; пока неясно, насколько широко они будут применяться в клинической диагностике.
СКРИНИНГ МУТАЦИЙ В ДИАГНОСТИКЕ Электрофоретические методы мутационного скрининга обладают неабсолютной чувствительностью, обычно они позволяют обнаруживать лишь около половины мутаций и полиморфизмов в анализируемых фрагментах, и лишь чувствительность денатурирующего
электрофореза приближается к 100%. В сочетании с относительно невысокой стоимостью и возможностью автоматизации это делает данный метод все более популярным.
Еще одна особенность скрининговых методов состоит в том, что при положительных результатах требуется дополнительное секвенирование или рестриктазный анализ, поскольку скрининговые методы не
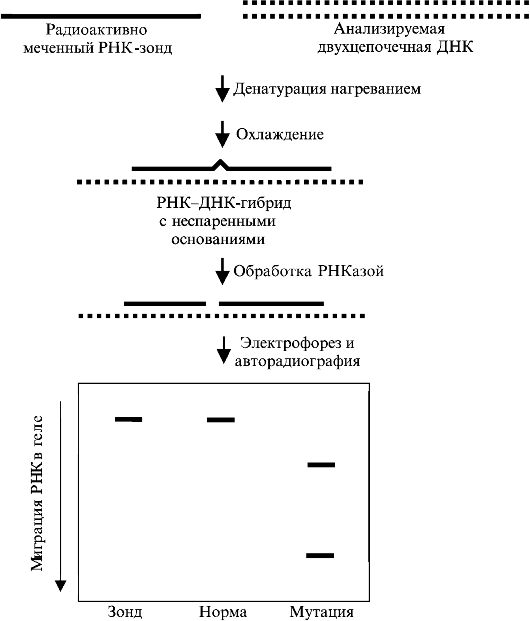 Рис. 4.7. Метод защиты от РНКазы
Рис. 4.7. Метод защиты от РНКазы
дают никакой информации о характере нуклеотидных отличий. При проведении ДНК-диагностики недостаточно обнаружить у пациента отклонение в нуклеотидной последовательности, приводящее к замене кодируемой аминокислоты. Нужно подтвердить, что эта аминокислотная замена функционально значима. Прямой метод заключается в получении рекомбинантного мутантного белка и определении его активности. Этот трудоемкий и дорогостоящий подход используется главным образом в исследовательских целях. На практике чаще ориентируются на тип аминокислотной замены. В том случае, если нормальная и мутантная аминокислоты принадлежат к разным структурным классам, вероятность функциональных изменений в белке более высока. Вероятность нарушения функции белка еще выше, если мутация затрагивает эволюционно консервативные участки гена, т. е. те положения, в которых одна и та же аминокислота присутствует у нескольких видов млекопитающих. Наличие таких участков обычно оказывает влияние на синтез, транспорт или функционирование белка, и любое изменение в них отражается на активности белка. Например, анализ последовательностей гена ЛПНП-рецептора китайского хомячка, кролика, крысы, мыши и Xenopus laevis продемонстрировал соответственно 81, 79, 77, 76 и 70% гомологичность рецептору человека. Доступная через Интернет база данных UMD-LDLR содержит ряд программ для анализа мутаций в гене ЛПНП-рецептора и в том числе дает возможность анализировать консервативность каждого участка гена.
Дополнительную информацию о патогенности мутации можно получить, обследуя родственников больного. В том случае, если эта же мутация присутствует у родственников больного, имеющих признаки данного заболевания (например, повышенный уровень холестерина при семейной гиперхолестеринемии), но отсутствует у здоровых лиц (обычно проводится скрининг более 100 доноров без признаков данного заболевания), вероятность того, что данная мутация является патогенной, очень высока.
В целом, несмотря на неабсолютную чувствительность методов скрининга мутаций, соотношение между информативностью и стоимостью данных методов достаточно высоко, и они широко используются на практике. Следует, однако, иметь в виду, что их отрицательная предсказательная сила невелика. Другими словами, отсутствие каких-либо особенностей образца ДНК при анализе скрининговыми методами не означает, что эта ДНК не содержит мутаций.
МEТОДЫ ДEТEКЦИИ МУТАЦИЙ
В том случае, когда возможные варианты генетических перестроек известны и их не очень много, можно использовать методы, более быстрые и дешевые по сравнению с методами мутационного скрининга. Эти методы основаны либо на проведении ДНК-гибридизации, либо на способности ферментов-рестриктаз распознавать строго определенные нуклеотидные последовательности или ДНК-полимераз синтезировать ДНК, комплементарную матрице (минисеквенирование).
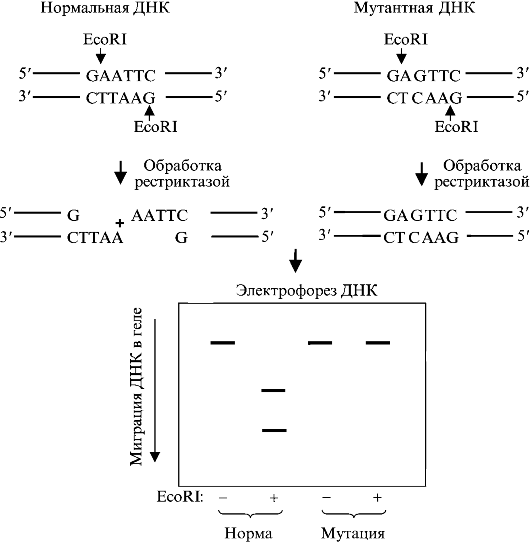 Рис. 4.8. Рестрикционный анализ
Рис. 4.8. Рестрикционный анализ
РEСТРИКЦИОННЫЙ АНАЛИЗ Наиболее простым методом детекции мутаций является рестрикционный анализ (рис. 4.8). Основой данного метода является очень высокая специфичность рестрикционных эндонуклеаз в отношении определенных нуклеотидных последовательностей. Каждый из этих бактериальных ферментов узнает строго индивидуальную последовательность из 4-8 нуклеотидов и разрезает двойную цепь ДНК внутри или рядом с этим участком. Достаточно замены одного нуклеотида, чтобы нарушить рестрикцию данным ферментом. В тех случаях, когда полиморфный нуклеотид входит в состав сайта рестрикции, его можно со 100% надежностью генотипировать с помощью рестриктазы. Нуклеотидные замены чаще всего нарушают существующие сайты рестрикции, но иногда создают новые сайты. Недостатком метода является то, что полиморфные нуклеотиды не всегда лежат в участках узнавания какой-либо рестриктазы. Частичное решение возможно в тех случаях, когда участок, в котором располагается мутация, содержит хотя бы часть нуклеотидов, составляющих сайт рестрикции. Полноценный участок рестрикции можно создать искусственно в ходе ПЦР. Для этого используют праймеры, не полностью соответствующие последовательности нуклеотидов в районе мутации, а содержащие 1-2 некомплементарных нуклеотида, дополняющих сайт рестрикции, в который будет входить и полиморфный нуклеотид. Обычно введение небольшого числа некомплементарных оснований несильно снижает эффективность ПЦР, поэтому после амплификации в продукте появляется новый сайт рестрикции, в котором участвует и полиморфный нуклеотид. Дальнейший рестрикционный анализ проводится так же, как в стандартном методе.
АЛЛEЛЬСПEЦИФИЧEСКАЯ ПЦР В некоторых случаях ПЦР можно использовать не для обогащения исследуемого фрагмента геномной ДНК, а для непосредственного обнаружения мутации (рис. 4.9). В этом варианте один из праймеров гибридизуется с участком ДНК, внутри которого расположен полиморфный нуклеотид. Температуру отжига праймеров подбирают так, чтобы связывание праймера и последующая амплификация проходили только при полном совпадении последовательностей ДНК и праймера. Например, при связывании праймера, соответствующего мутантной последовательности, с нормальной ДНК образуется неспаренный нуклеотид, снижающий прочность связывания праймера с ДНК. При достаточно высокой температуре отжига праймер
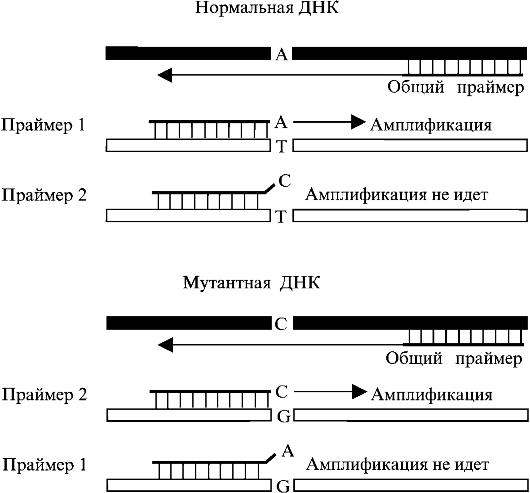 Рис. 4.9. Аллельспецифическая полимеразная цепная реакция
Рис. 4.9. Аллельспецифическая полимеразная цепная реакция
вообще перестает связываться с нормальным аллелем, ПЦР не идет и продукт не накапливается. Обычно параллельно ставят реакцию с праймером, соответствующим нормальному аллелю. Эта реакция служит положительным контролем, показывающим нормальный ход амплификации. Поскольку наличие одного мисмэтча может несильно снижать прочность связывания праймера с ДНК, иногда в последовательность праймера вводят второй мисмэтч с целью еще больше дестабилизировать дуплекс и снизить выход продукта при наличии неспаренного нуклеотида в полиморфном участке.
ПЦР Β РЕАЛЬНОМ ΒРЕМЕНИ
Достоинством описанного выше метода аллельспецифической ПЦР является уменьшение числа стадий в процедуре анализа, поскольку при этом не требуется обработки продукта рестриктазами или применения сложных электрофоретических методов.
Еще больше метод ускоряется при использовании ПЦР в реальном времени (РВ-ПЦР). В этом методе образование продукта отслеживается не с помощью электрофореза, как в стандартном методе ПЦР, а непосредственно в ходе ПЦР по накоплению в реакционной среде двухцепочечной ДНК. Накопление ДНК определяется после каждого цикла полимеризации по увеличению флюоресценции красителя SYBR Green или его аналогов, флюоресценция которых резко усиливается при взаимодействии с двухцепочечной ДНК, но не зависит от присутствия нуклеотидов или праймеров. Приборы для РВ-ПЦР представляют собой комбинацию ПЦР-амплификатора и флюориметра. После завершения амплификации специфичность полученного продукта можно определить с помощью измерения температуры плавления, которая мониторируется по снижению флюоресценции SYBR Green.
ПРОБЫ TAQMAN Существуют и другие способы регистрации продукта ПЦР непосредственно в реакционной смеси без проведения электрофореза. Метод, запатентованный фирмой Hofmann LaRoche, основан на детекции амплифицированной ДНК с помощью олиго-нуклеотидного зонда, гибридизующегося с центральной частью амплифицированной последовательности. На концах олигонук-леотидных проб, получивших название TaqMan, расположены нуклеотиды, меченные двумя разными флюоресцентными красителями, один из которых тушит флюоресценцию другого. В результате тушения уровень флюоресценции второго красителя невелик. Taq-полимераза, достраивающая новую цепь с одного из праймеров, за счет своей экзонуклеазной активности расщепляет TaqMan-пробу, связавшуюся с серединой амплифицируемо-го участка ДНК, в результате чего флюоресцентно меченные нуклеотиды высвобождаются в раствор и эффект тушения исчезает, поскольку он наблюдается только в том случае, когда флюорофоры расположены близко друг от друга. В результате флюоресценция красителя возрастает тем сильнее, чем больше олигонуклеотидной пробы было разрушено ДНК-полимеразой в ходе амплификации, т.е. чем больше продукта образовалось. Этот метод применяется и для анализа мутаций. Для этого используются две TaqMan-пробы, меченные разными парами флюорофоров и отличающиеся по нуклеотидной последовательности в полиморфном участке, одна из которых соответствует дикому типу, другая - мутантному. Деградация проб ДНК-полимеразой
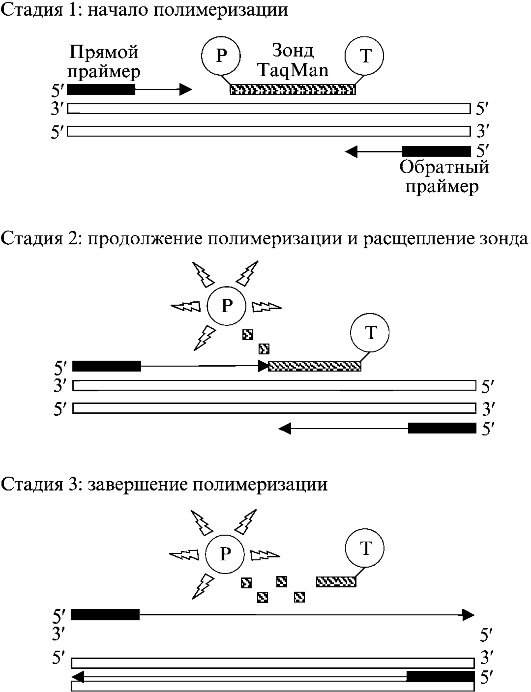 Рис. 4.10. Зонды TaqMan. Р - репортерный краситель, Т - тушитель флюоресценции
Рис. 4.10. Зонды TaqMan. Р - репортерный краситель, Т - тушитель флюоресценции
проводится при температуре, при которой сохраняются только полностью комплементарные комплексы между анализируемым фрагментом и пробами. По увеличению флюоресценции красителей, входящих в состав нормальной или мутантной пробы, можно определить, какие варианты присутствуют в анализируемом образце. Данный метод позволяет надежно различать гетеро- и гомозиготных носителей мутаций.
МОЛEКУЛЯРНЫE БАКЕНЫ Eще один способ детекции мутаций, основанный на эффекте тушения флюоресценции, реализуется в методе молекулярных бакенов (рис. 4.11). Бакеном называется олигонуклеотид, 3'- и 5'-концы которого помечены двумя красителями, один из которых выступает в качестве тушителя. В отличие от проб TaqMan бакены длиннее и содержат около концов короткие комплементарные друг другу участки, которые при обычной температуре отжигаются друг на друга с образованием шпилечной структуры. При этом расположенные на концах олигонуклеотида красители сближаются и происходит тушение флюоресценции одного красителя другим. В середине бакена последовательность нуклеотидов соответствует изучаемому участку ДНК. После денатурации нагреванием, приводящей к плавлению участка шпильки, смесь ДНК с бакенами охлаждается, что дает возможность образования дуплекса бакена с анализируемой ДНК. При дальнейшем охлаждении в свободных бакенах вновь образуются шпильки и флюоресценция снижается. В отличие от этого в бакенах, связавшихся с анализируемой ДНК,
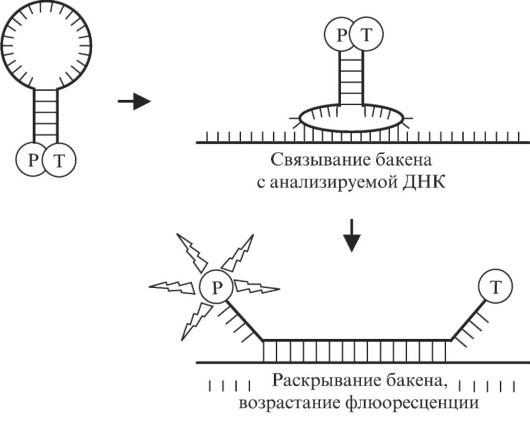 Рис. 4.11. Метод молекулярных бакенов. Р - репортерный краситель, Т - тушитель флюоресценции
Рис. 4.11. Метод молекулярных бакенов. Р - репортерный краситель, Т - тушитель флюоресценции
красители остаются на удалении друг от друга и их флюоресценция сохраняется на высоком уровне. Гибридизация исследуемой ДНК с бакенами, содержащими в центральной части нормальную или мутантную последовательность нуклеотидов, позволяет определить генотип исследуемой ДНК.
ГИБРИДИЗАЦИЯ С АЛЛЕЛЬСПЕЦИФИЧЕСКИМИ
ОЛИГОНУКЛЕОТИДАМИ
Данный метод основан на гибридизации исследуемой ДНК с олигонуклеотидами, гомологичными участку мутации и окружающей его последовательности. Данный метод сущетвует в двух формах. Иногда на твердой основе иммобилизуют анализируемый продукт ПЦР, а меченые олигонуклеотиды добавляют в растворе. Условия отмывки подбираются таким образом, чтобы дуплексы, содержащие неспаренные основания, разрушились. В результате на матрице остаются только олигонуклеотиды, на 100% комплементарные анализируемой ДНК. Добавляя олигонуклеотиды, соответствующие по последовательности нормальному либо мутантному варианту, можно определить, какой именно нуклеотид присутствует в анализируемой ДНК. Во втором варианте данного метода на матрице иммобилизуются олигонуклеотиды, с которыми гибридизуется меченый продукт ПЦР.
Достоинством метода гибридизации с олигонуклеотидами является возможность его миниатюризации, когда широкий набор олигонуклеотидов иммобилизуется на микрочипе, что позволяет одновременно детектировать множество мутаций. Основной сложностью данного метода является необходимость строгого подбора условий гибридизации и отмывки не полностью комплементарной ДНК. Пока неясно, насколько широко этот метод будет применяться в практической ДНК-диагностике.
АЛЛЕЛЬСПЕЦИФИЧЕСКАЯ ЛИГАЗНАЯ РЕАКЦИЯ Эффективным методом обнаружения однонуклеотидных замен и коротких перестроек является лигазная реакция (рис. 4.12). Анализируемая ДНК гибридизуется с двумя олигонуклеотидами, один из которых заканчивается нуклеотидом, комплементарным полиморфному сайту, а второй непосредственно прилегает к нему. После окончания гибридизации фермент ДНК-лигаза сшивает олигонуклеотиды с образованием более длинного фрагмента, который сильно отличается от исходных олигонуклеотидов по подвижности
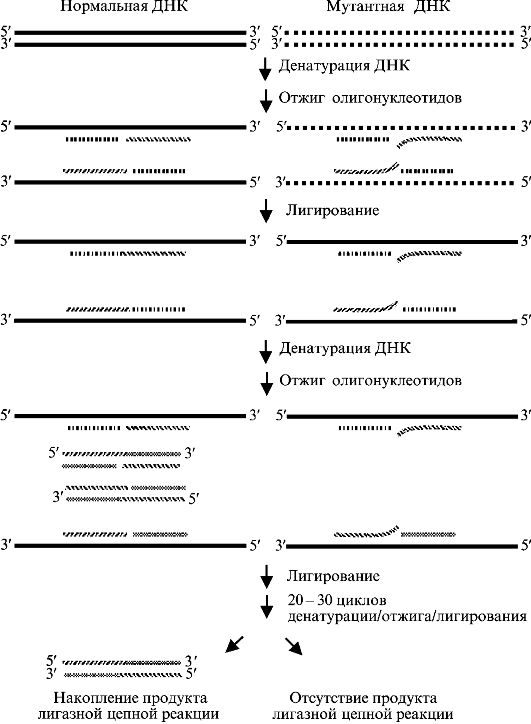 Рис. 4.12. Аллельспецифическая лигазная реакция
Рис. 4.12. Аллельспецифическая лигазная реакция
при электрофорезе. Если же олигонуклеотиды не полностью комплементарны фрагменту ДНК и после гибридизации в полиморфном участке образуется неспаренный нуклеотид, лигаза не сшивает такие олигонуклеотиды и длинный фрагмент не образуется. Таким образом, проводя лигазную реакцию с одной общей и одной из двух аллельспецифических проб, можно генотипировать образец ДНК по данному нуклеотиду.
МИНИСЕКВЕНИРОВАНИЕ
В этом методе ПЦР-продукт гибридизуется с олигонуклеотидом, связывающимся с б'-стороны от участка полиморфизма (рис.4.13). После проведения гибридизации в реакционную смесь добавляется ДНК-полимераза и один из четырех модифицированных нуклеотидов. В этой реакции используются флюоресцентно меченные дидезоксинуклеотиды, в результате чего ДНК-полимераза может достроить лишь один нуклеотид, комплементарный тому, который располагается в анализируемом положении. Поэтому реакция пройдет только в той пробирке, куда добавлен нуклеотид, комплементарный анализируемому. В ряде случаев в реакционной смеси присутствуют все четыре нуклеотида, но меченные разными красителями. Анализ флюоресценции на четырех длинах волн позволяет установить, какой нуклеотид включился и соответственно комплементарный ему анализируемый нуклеотид. Поскольку в данной методике используется тот же принцип, что в ферментативном секвенировании ДНК, его часто называют минисеквенированием.
ПИРОСЕКВЕНИРОВАНИЕ
Известны и другие методы определения мутаций, основанные на активности ДНК-полимеразы. В одном из них, получившем название пиросеквенирования, каждый шаг удлинения цепи ДНК-полимеразой регистрируется по образованию пирофосфата, который мониторируется с помощью сопряженных ферментативных реакций, приводящих в ответ на образование пирофосфата к вспышке хемилюминесценции (рис. 4.14). Данный метод позволяет секвенировать лишь очень короткие участки ДНК, поэтому его основное применение заключается в анализе мутаций. Анализируемый нуклеотид идентифицируется по тому, добавление какого из четырех нуклеотидов (в этом методе используются обычные нуклеотиды) привело к вспышке хемилюминесценции.
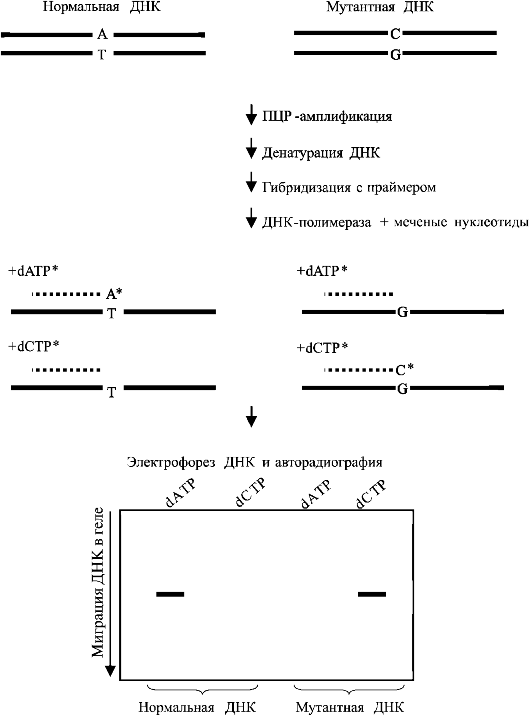 Рис. 4.13. Минисеквенирование
Рис. 4.13. Минисеквенирование
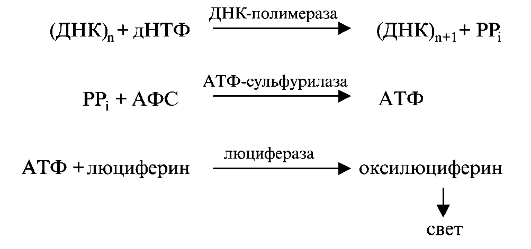 Рис. 4.14. Принцип пиросеквенирования ДНК
Рис. 4.14. Принцип пиросеквенирования ДНК
ДЕТЕКЦИЯ МУТАЦИЙ Β ДИАГНОСТИКЕ При правильном использовании методы детекции определяют наличие или отсутствие мутаций с очень высокой чувствительностью и специфичностью, что позволяет использовать полученную этими методами информацию для принятия очень важных решений, например о необходимости прерывания беременности при проведении пренатальной диагностики.
Существуют два метода пренатальной диагностики. Амниоцентез заключается в отборе около 10 мл амниотической жидкости через брюшную стенку (рис. 4.15). Оптимальный срок
 Рис. 4.15. Амниоцентез
Рис. 4.15. Амниоцентез
проведения - 16-я неделя беременности. Из жидкости центрифугированием выделяют клетки плода и либо сразу анализируют их с помощью ПЦР, либо помещают в культуру. Клетки в культуре делятся, и через какое-то время их хватает для проведения хромосомного анализа, а позднее - биохимического. Второй метод - биопсия ворсин хориона - возможен на более ранних сроках беременности - на 10-12-й неделе (рис. 4.16). Эта процедура заключается в трансабдоминальной или трансцервикальной биопсии ворсин хориона. Клетки хориона можно культивировать либо анализировать сразу, если материала хватает для проведения ДНК-анализа. В случае обнаружения хромосомных аномалий либо мутаций беременность по желанию родителей можно прервать.
Проведение пренатальной диагностики мутаций имеет смысл при наличии надежного метода детекции той мутации, которая присутствует в данной семье. В некоторых случаях можно определить,
 Рис. 4.16. Взятие биопсии хориона
Рис. 4.16. Взятие биопсии хориона
унаследовал ли плод наследственное заболевание, не зная точной локализации мутации, а опираясь на анализ генетического сцепления болезни в данной семье. Однако это не всегда возможно, поскольку для анализа сцепления требуются образцы ДНК нескольких больных родственников и большого количества здоровых членов семьи.
4.5.2. ОСОБЕННОСТИ ПРИМЕНЕНИЯ ДНК-ДИАГНОСТИКИ
Максимальная диагностическая ценность генетического тестирования наблюдается в тех случаях, когда имеется высокая корреляция между наличием генетического дефекта и вероятностью развития патологии, т. е. для болезней с высокой пенетрантностью.
Такие заболевания испытывают постоянное давление естественного отбора, вследствие чего их частота в общей популяции обычно невелика. В связи с этим большинство применяемых генетических тестов связаны с диагностикой редких форм заболеваний. Даже самые частые формы моногенных заболеваний человека, описанные ниже, клинически проявляются не чаще чем у одного человека из нескольких сотен.
Распространенные заболевания человека, такие как гипертензия, диабет, сердечно-сосудистые заболевания, хотя и зависят от генетических факторов, но имеют невысокую пенетрантность, сложную, вариабельную и малоизученную генетическую структуру, поэтому, несмотря на несомненную необходимость поисков генетической предрасположенности к распространенным заболеваниям, результаты таких исследований на практике применяются очень ограниченно.
ФАКТОРЫ ЭФФEКТИВНОСТИ Соотношение информативности результатов ДНК-диагностики и затрат на ее проведение в большой степени определяется генетической сложностью заболевания. В качестве примеров можно привести гемохроматоз, при котором две мутации вызывают практически все клинические случаи среди белого населения, и семейную гиперхолестеринемию, которую могут вызывать более 800 мутаций в гене ЛПНП-рецептора, ни одна из которых не встречается чаще, чем у 1% больных с семейной гиперхолестеринемией. Большинство наследственных заболеваний занимает промежуточное положение в этом диапазоне, приближаясь к семейной гиперхолестеринемии, когда затраты на проведение ДНК-диагностики могут лимитировать ее проведение.
При определенных условиях сложность диагностики и, соответственно, ее стоимость могут снижаться. Это возможно в группах населения, в которых генетическая структура какого-либо заболевания более проста, чем в остальных популяциях. Данный эффект наиболее выражен в популяциях с так называемым эффектом основателя. Этот генетический термин обозначает, что значительная часть популяции унаследовала от одного из своих предков-основателей определенную мутацию. В силу этого чисто случайного события в данной популяции большая часть случаев данного заболевания вызывается именно этой мутацией. Характерный пример, имеющий отношение к генетическому тестированию, - популяция африканеров, жителей Южной Африки североевропейского происхождения. Современные африканеры являются потомками небольшого числа семей из Голландии, переселившихся в XVII-XVIII веке в Африку. Среди африканеров семейная гиперхолестеринемия, ведущая к раннему развитию ИБС, встречается в несколько раз чаще, чем в европейской или американской популяции. Кроме того, подавляющее большинство (>95%) случаев семейной гиперхолестеринемии в южноафриканской белой популяции связано с наличием одной из всего трех мутаций в рецепторе ЛПНП. Такая генетическая однородность резко контрастирует с генетической структурой семейной гиперхолестеринемии в других странах, где описаны многие сотни мутаций, ни одна из которых не встречается чаще чем у 1-2% больных. По-видимому, несколько семей переселенцев (не менее трех) имели мутации, называемые теперь африканерскими, которые и стали основной причиной семейной гиперхолестеринемии у их потомков. С точки зрения практической медицины молекулярно-генетическое тестирование белых жителей Южной Африки на наличие семейной гиперхолестеринемии является достаточно эффективным и относительно недорогим подходом, позволяющим проводить пресимптоматическую диагностику этого заболевания. В отличие от Южной Африки в других странах для постановки такого диагноза требуется гораздо более дорогостоящий арсенал молекулярных методов.
Для других наследственных заболеваний также характерна разница в частоте мутаций между популяциями. Например, миссенс-мутация Цис282~Тир в гене HFE, приводящая к развитию гемохроматоза, довольно часто встречается в европейских популяциях, где частота ее носителей составляет до 10-15%. В отличие от этого в африканских, азиатских популяциях и популяции австралийских аборигенов
эта мутация встречается очень редко. Предполагается, что мутация Цис282-Тир возникла в Eвропе около 2000 лет назад.
Помимо наличия эффекта основателя, второй биологический механизм, упрощающий поиск мутаций даже в генетически открытой популяции, - наличие в генах горячих мутационных точек. Доказано, что вероятность возникновения мутаций отличается в участках генома с разным содержанием GC-нуклеотидов. Известна также последовательность, на которой происходит остановка ДНК-полимеразы а; в таких районах в самых разных генах часто встречаются спорадические делеции. Вследствие этих факторов мутации распределяются не равномерно по длине гена, а концентрируются в определенных участках, что упрощает их поиск.
Таким образом, для эффективной ДНК-диагностики необходима информация о наиболее частых мутациях, приводящих к развитию данного заболевания в популяции, к которой принадлежит пациент.
ФАКТОРЫ ДИАГНОСТИЧEСКОГО ЗНАЧEНИЯ
При ряде наследственных метаболических нарушений наличие заболевания можно заподозрить при проведении биохимического анализа. Например, у больных с семейной гиперхолестеринемией обычно повышен уровень холестерина ЛПНП, а при гемохроматозе увеличено насыщение трансферрина железом. Биохимические параметры подвержены вариабельности у каждого индивидуума. Вследствие этого лицам, например, с повышенным уровнем холестерина ЛПНП рекомендуется проведение повторных анализов с интервалом 3 мес, чтобы убедиться в достоверности обнаруженного метаболического отклонения. В ряде случаев биохимические показатели находятся в так называемой серой зоне, что еще больше затрудняет постановку диагноза. Здесь на помощь может прийти ДНК-диагностика. Наличие мутации показывает усредненную предрасположенность в течение всей жизни к сдвигу данного биохимического параметра в патологическую сторону, так сказать, патологическую готовность. В отличие от биохимического фенотипа генотип не подвержен индивидуальным и популяционным вариациям, свойственным биохимическим параметрам. Таким образом, ДНК-диагностика позволяет подтвердить биохимический диагноз независимым методом, а также исключить наличие других причин данного биохимического нарушения. Очевидно, что максимальная информативность ДНК-диагностики наследственных нарушений метаболизма достигается при ее сочетании с классическими биохимическими методами.
При обсуждении специфичности и чувствительности методов ДНК-диагностики следует сначала определить, о чем идет речь - об определении конкретной мутации или о поиске неизвестного генетического нарушения у пациента. В случае определенной мутации, для которой разработаны надежные методы детекции, чувствительность и специфичность детекции близки к 100%. Для определения диагностической ценности суммарного молекулярно-генетического теста необходимо учитывать чувствительность обнаружения мутаций в сочетании с их пенетрантностью.
Положительная диагностическая ценность теста в значительной степени определяется пенетрантностью мутаций. Например, обнаружение трисомии по 21-й хромосоме либо мутаций, специфичных для миодистрофии Дюшенна или болезни Гентингтона, говорит о том, что у данных индивидуумов с вероятностью, близкой к 100%, имеется или разовьется в дальнейшем соответствующий клинический синдром. Однако столь высокая положительная диагностическая ценность характерна далеко не для всех генетических тестов. При низкой пенетрантности мутации, например у носителей гемохроматозных мутаций, вероятность развития клинических проявлений не превышает нескольких процентов. В подобных случаях обнаружение дефекта свидетельствует лишь о предрасположенности к развитию данного заболевания, которая сильно зависит от наличия дополнительных наследственных факторов и факторов внешней среды.
Чем проще и чем более изучена генетическая структура данного заболевания, тем легче обнаружить мутацию и тем выше чувствительность теста. К сожалению, подавляющее большинство генетических заболеваний вызвано широким спектром мутаций, часто расположенных в разных генах. В сочетании с ограниченными возможностями современных молекулярных методов это снижает чувствительность молекулярно-генетического тестирования. Например, в настоящее время даже в лучших молекулярно-генетических лабораториях, работающих с пациентами с семейной гиперхолестеринемией, мутации удается выявить лишь у половины больных с верифицированным клиническим диагнозом. Другим примером является миодистрофия Дюшенна. При этом заболевании делеции в гене дистрофина удается обнаружить лишь в 70% случаев, а остальным больным требуется дополнительный гистологический анализ мышечного биоптата. В тех случаях, когда тест не способен выявлять все генетические изменения, приводящие к данному заболеванию, его отрицательная предсказательная сила низка.
В определенных ситуациях отрицательная предсказательная сила ДНК-тестов может быть очень высокой. Речь идет о пренатальной и пресимптоматической диагностике в тех случаях, когда известны патогенные мутации, присутствующие у родителей. В такой ситуации высокая точность молекулярных методов позволяет с достаточной надежностью показать не только наличие, но и отсутствие родительских мутаций у плода или ребенка.
Подводя итог, можно сказать, что большинство молекулярно-генетических тестов обладает значительной положительной предсказательной силой, делающей целесообразным их применение в клинике, особенно в случае высокой пенетрантности и патогенности мутаций. В отличие от этого отрицательная предсказательная сила большинства молекулярных тестов невелика, за исключением тех случаев, когда известно, какие мутации были у родителей.
4.5.3. ПРИМЕРЫ ИСПОЛЬЗОВАНИЯ ДНК-ДИАГНОСТИКИ В КЛИНИКЕ
Как известно, классическая медицинская генетика описывает моногенные высокопенетрантные и клинически тяжелые заболевания. Частота таких заболеваний обычно не превышает 1 на 5000 населения. Около тысячи моногенных наследственных заболеваний можно выявлять с помощью анализа ДНК. Список тестов и выполняющих их лабораторий постоянно обновляется в Интернете (http://www.geneclinics.org). В основном ДНК-диагностику сейчас используют при генетическом консультировании и пренатальной диагностике с целью предотвращения рождения детей с патологией.
Однако, помимо классических моногенных случаев, в клинике часто встречаются наследственные заболевания, которые характеризуются достаточно низкой пенетрантностью и относительно мягким течением. Традиционно их относили к моногенным, однако накопившиеся в последнее время данные больше указывают на олигогенный характер этих заболеваний.
Ниже подробно рассмотрено несколько распространенных олигогенных заболеваний человека, таких, как гемохроматоз, наследственные тромбофилии, семейная гиперхолестеринемия, кистозный фиброз и гипертрофическая кардиомиопатия. Гетерозиготные носители мутаций, приводящих к этим заболеваниям, в популяции встречаются с частотой от 1 на 500 до 1 на 20 человек. Вследствие высокой популяционной частоты заболевания этой группы вносят заметный
суммарный вклад в патологию человека, вероятно, превышающий вклад редких наследственных заболеваний. Для всех перечисленных заболеваний ДНК-тестирование дает возможность пресимптоматической диагностики, а для гемохроматоза, тромбофилий и гиперхолестеринемии - и последующей профилактики, как фармакологической, так и путем изменения стиля жизни.
4.5.3.1. Гемохроматоз
Это одно из самых частых генетических нарушений обмена веществ, называемыхтакжеврожденнымиошибкамиметаболизма.Гемохроматоз (ГХ) встречается у 1 из 200-300 лиц в Северной Европе.
Классическая триада - диабет, цирроз и пигментация кожи («бронзовый диабет») - была описана еще в 1865 г., а в 1935 г. был доказан семейный характер этого заболевания. В основе клинических проявлений ГХ лежит биохимический дефект - избыточное накопление железа в паренхимальных клетках печени, поджелудочной железы, сердца и передней доли гипофиза. Предотвратить развитие клинических проявлений можно с помощью очень простого и одновременно эффективного способа - профилактических флеботомий. Промежуточным фенотипом ГХ является повышенное содержание железа в плазме и печени, которое оценивается разными биохимическими тестами, такими, как насыщение трансферрина железом, концентрация ферритина и содержание железа в печени.
Клинические проявления ГХ очень разнообразны. Одним из наиболее частых проявлений является хроническое паренхиматозное поражение печени. Характерным признаком является общее или локальное усиление пигментации кожи. У 30-60% пациентов с развившимся заболеванием имеется сахарный диабет. На ранних стадиях ГХ проявляется неспецифическими симптомами, такими как летаргия, гепатомегалия, артропатия, кардиомиопатия, диабет, гиперпигментация кожи или гипогонадизм. Клинические проявления зависят от генетических и внешних факторов, таких, как содержание железа в диете, донорство крови и физиологические потери крови женщинами при менструациях.
В 1996 г. был идентифицирован ген, ответственный за наиболее частую форму ГХ, который получил название HFE. Этот ген кодирует трансмембранный белок, состоящий из короткого цитоплазматического домена, трансмембранного участка и трех внеклеточных доменов, которые взаимодействуют с β2-микроглобулином на поверхности клетки. Белок HFE связывается на поверхности энтероцита с трансферриновым рецептором и снижает сродство к трансферрину, несущему
железо. При отсутствии функционально активного HFE связывание и последующий эндоцитоз трансферрина увеличиваются, что приводит к накоплению железа внутри клетки, где оно хранится в виде комплекса с ферритином. Среди пациентов кельтского происхождения с клинически выраженным ГХ, около 90% являются гомозиготами по мутации Цис282-Тир в гене HFE, а у большинства оставшихся имеется сочетание Цис282-Тир и другой мутации - ГиСбз-Асп. В результате мутации Цис282-Тир нарушается образование дисульфидной связи в одном из внеклеточных доменов белка HFE, нарушается его конформация и белок остается после синтеза в эндоплазматическом ретикулуме. В результате белок перестает экспрессироваться на поверхности клеток, что приводит к усиленному захвату железа, неадекватному потребностям организма. В большинстве европеоидных популяций частота гетерозиготных носителей аллеля Цис282-Тир составляет около 10%, а у басков и ирландцев, имеющих кельтское происхождение, частота данного полиморфизма может достигать 30%. В отличие от европейцев у монголоидов и негроидов данная мутация почти не встречается. Предполагается, что мутация Цис282-Тир возникла около 2000 лет назад в кельтской популяции и распространилась по Eвропе за счет миграции населения, т. е. причиной высокой частоты данной мутации является эффект основателя.
Существуют и другие заболевания с клинической картиной, напоминающей классический семейный ГХ (также классифицируемый как ГХ 1-го типа), но имеющие другое происхождение. Ювенильный ГХ (2-й тип), так же как ГХ 1-го типа, наследуется по аутосомнорецессивному типу и вызывается мутациями в неизвестном гене. ГХ 3-го типа также является рецессивным заболеванием и связан с мутацией в рецепторе трансферрина. ГХ 4-го и 5-го типов наследуются доминантно и вызываются мутациями в генах ферропортина, транспортирующего железо в кишечнике, и ферритина соответственно. Все эти формы очень редкие, и на сегодняшний день их определение не играет практической роли.
ПEНEТРАНТНОСТЬ
Мутация Цис282~Тир в гене HFE характеризуется высокой пенетрантностью по отношению к промежуточному фенотипу, т. е. биохимическому признаку избытка железа в организме. У 95% мужчин старше 40 лет, являющихся гомозиготами по этой мутации, наблюдается избыток железа и имеются клинические признаки и симптомы. Женщины в пременопаузе имеют пониженный риск в связи с потерей крови при
менструациях. Фенотипический эффект мутации ГиСбз-Асп является менее выраженным. Фиброз или цирроз печени обнаруживается при анализе биопсии у 4-25% гомозиготных носителей аллеля Цис282~Тир. Кроме того, аллель Цис282-Тир предрасполагает к развитию гепатоклеточной карциномы. У мужчин с ГХ и циррозом относительный риск развития гепатоклеточной карциномы выше в 200 раз.
ТЕСТИРОВАНИЕ НА НОСИТЕЛЬСТВО
Наличие перечисленных выше симптомов является показанием для генетического тестирования на ГХ. Однако при этом диагноз ставится во время развернутой клинической картины, когда уже поздно проводить профилактику первичного дефекта. В связи с этим многие исследователи отстаивают необходимость скрининга населения на наличие ГХ. Данное заболевание удовлетворяет многим требованиям, предъявляемым к заболеваниям, подвергающимся скринингу, т.е. встречается достаточно часто, имеет латентную фазу, предшествующую клиническим проявлениям, легко диагностируется биохимическими и генетическими методами и может быть предотвращено с помощью эффективного и недорогого лечения.
Вместе с тем пока массовый скрининг считается преждевременным в связи с неясностями, касающимися главным образом пенетрантности ГХ. Определенно целесообразным является тестирование родственников больных ГХ, у которых следует измерять уровень насыщения трансферрина железом, содержание ферритина и биохимические маркеры печеночной дисфункции, а также определять наличие мутаций в гене HFE по положению 282 и 63.
С технической точки зрения обнаружение этих мутаций не представляет сложности. Обычно используют рестрикционный анализ или различные формы аллельспецифической амплификации или гибридизации.
4.5.3.2. Наследственные тромбофилии
Тромбофилия - склонность к развитию тромбозов, связанная с врожденными и приобретенными нарушениями свертываемости крови и фибринолиза. Наиболее часто тромбофилии проявляются в виде венозных тромбозов и тромбоэмболий, которые встречаются с частотой около 1 на 1000 населения в год.
Существуют семейные формы тромбофилий, описанные еще в 1950-е годы. Первыми идентифицированными причинами наследственных тромбофилий (НТФ) были дефицит антитромбина III,
протеина С и его кофактора протеина S. Позднее были идентифицированы еще две формы НТФ - мутация фактора V свертывания, которая вызывает резистентность фактора V к активированному протеину С, и мутация в гене протромбина G20210А, повышающая уровень протромбина в плазме. Кроме того, умеренная гипергомоцистеинемия, часто связанная с распространенным полиморфизмом в гене MTHFR, также является фактором риска венозного тромбоза.
ТРОМБОЭМБОЛИЧEСКИE ОСЛОЖНEНИЯ Выраженность клинических проявлений НТФ сильно варьирует. Часто они протекают в очень мягкой форме и их наличие можно определить только лабораторными методами. Однако во многих случаях у носителей мутаций развиваются тромбоз глубоких вен нижних конечностей, легочный тромбоэмболизм, поверхностный тромбофлебит, а также венозные тромбозы другой локализации. Эти наследственные дефекты обычно не связаны с риском артериальной окклюзии. НТФ особенно предрасполагают к развитию тромбозов в молодом возрасте: до 40% пациентов моложе 45 лет с неспровоцированным тромбозом глубоких вен имеют одну из форм НТФ. У пациентов старшего возраста или при наличии провоцирующих факторов НТФ наблюдаются в 30% случаев тромбозов. У пациентов с сочетанием наследственных дефектов риск тромбоэмболических осложнений дополнительно повышается.
Наследственный дефицит антитромбина III и протеинов С и S встречается суммарно менее чем у 1% населения, однако у больных с венозным тромбоэмболизмом (ВТЭ) он обнаруживается почти в 10% случаев. Риск ВТЭ у таких больных в 5-8 раз выше, чем в общей популяции. Причинами дефицита этих естественных антикоагулянтов может быть снижение их синтеза или (гораздо чаще) снижение функциональной активности белка при сохранении нормального уровня. Дефекты синтеза или функционирования белка вызываются сотнями разнообразных мутаций в данных генах.
Наследственная резистентность к активированному протеину С является наиболее частой причиной НТФ. Более чем в 95% случаев резистентность вызывается миссенс-мутацией в гене фактора V, получившей название лейденской, при которой в положении 506 аргинин заменяется глутамином. По данному аминокислотному остатку в норме происходит протеолитическое расщепление фактора V активированным протеином С. Протеин С является естественным антикоагулянтом, который активируется тромбин-тромбомодулиновым
комплексом на эндотелиальных клетках и разрушает факторы Va и VIIIa, приводя к остановке тромбообразования. Этот процесс значительно ускоряется в присутствии протеина S, действующего в качестве кофактора протеина С. При наличии в факторе Vа аминокислотной замены Арг506-Глн активированный протеин С не может его расщепить, что приводит к сохранению активности фактора Vа и повышенному тромбообразованию (рис. 4.17).
Лейденская мутация встречается почти исключительно у представителей европеоидной расы, в которой носителями являются около 5% населения. Вследствие высокой частоты данной генетической формы в общей популяции ее следует относить к полиморфизму, однако
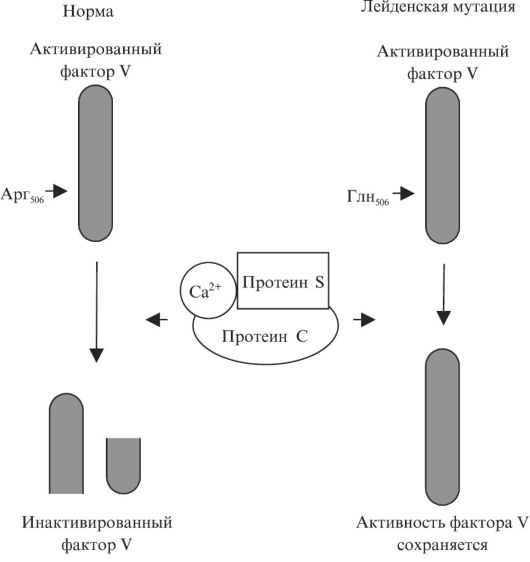 Рис. 4.17. Устойчивость к активированному протеину С, вызванная лейденской мутацией.
Рис. 4.17. Устойчивость к активированному протеину С, вызванная лейденской мутацией.
в литературе за ней закрепилось название мутации. Среди пациентов с ВТЭ частота данной мутации выше и составляет около 20%. Риск ВТЭ у носителей лейденской мутации зависит от дозы гена: у гетерозигот она повышена в 2-7 раз, а у гомозигот - в 40-80 раз. Суммарная вероятность развития тромбоэмболизма в течение жизни у носителей данной мутации составляет 30%.
Полиморфный аллель G20210А в З'-нетранслируемой области гена протромбина в общей популяции встречается с частотой 2%, однако среди больных с ВТЭ доля носителей полиморфизма возрастает до 7%. Таким образом, наличие полиморфизма G20210А в гене протромбина повышает риск ВТЭ приблизительно в 3 раза. Патологическое действие данного полиморфизма заключается в повышении активности протромбина в плазме. Уровень протромбина у гомозигот АА в 1,5 раза выше, чем у гомозигот по нормальному аллелю GG, что способствует тромбообразованию. По-видимому, мутация G→A относится к типу мутаций с приобретением функции, поскольку она увеличивает эффективность процессинга З'-конца мРНК, что приводит к накоплению мРНК и повышению синтеза белка протромбина.
Еще одним фактором предрасположенности к тромбозам является повышенный уровень гомоцистеина - аминокислоты, образующейся при метаболизме метионина. Умеренное повышение гомоцистеина повышает риск артериальных и венозных тромбозов. Причиной повышения может быть как неправильная диета (недостаток пиридоксина, кобаламина, фолата), так и генетические факторы, такие, как полиморфизм Ала677~Вал в гене метилентетрагидрофолатредуктазы - фермента, играющего важную роль в определении уровня гомоцистеина в плазме. Активность данного варианта фермента составляет лишь около 1/3 от нормальной. Примерно 10% европеоидного населения являются гетерозиготными носителями данного полиморфизма. Частота ВТЭ у изолированных носителей этого полиморфизма не отличается от нормальной, однако ряд данных показывает, что полиморфизм С677Т способствует проявлению других НТФ.
БEРEМEННОСТЬ И АКУШЕРСКАЯ ПАТОЛОГИЯ При беременности повышается уровень витамин К-зависимых факторов свертывания, снижается содержание протеина S и ингибируется фибринолиз. Эти изменения физиологически целесообразны, поскольку направлены на снижение потери крови при родах, но при этом они приводят к повышению вероятности ВТЭ во время беременности (в 2,5 раза) и особенно в послеродовом периоде (в 20 раз).
При наличии НТФ эта вероятность еще выше и может достигать 100-кратной у гомозигот по лейденской мутации фактора V. У большинства (до 60%) женщин с ВТЭ, развившимся во время беременности, обнаруживается лейденская мутация.
Помимо венозного тромбоэмболизма, НТФ вносят вклад в развитие акушерской патологии. Нарушение полноценной маточноплацентарной циркуляции за счет тромбозов может приводить к разнообразным осложнениям беременности, таким, как невынашивание, мертворождение, отслойка плаценты, гестоз и внутриутробная задержка роста плода. В многочисленных исследованиях показана повышенная частота НТФ у пациенток с этими осложнениями. Есть также данные, что наличие мутации не только у матери, но и у плода может дополнительно увеличивать риск тромбозов и инфарктов плаценты, приводящих к потере плода. Относительный риск осложнений беременности у гетерозиготных носителей лейденской мутации или полиморфизма протромбинового гена G20210A по данным разных исследований увеличен в среднем в 2-3 раза.
Прием оральных контрацептивов также способствует развитию ВТЭ. Этот эффект многократно усиливается у женщин с НТФ. Риск развития ВТЭ у носительниц лейденской мутации, принимающих оральные контрацептивы, по разным оценкам, увеличивается в 20-65 раз. При наличии протромбина G20210A риск ВТЭ несколько ниже, но тоже существенно превышает нормальную величину. На основе этих наблюдений женщинам с дефицитом естественных антикоагулянтов, гомозиготам по лейденской мутации и при наличии сочетанных дефектов рекомендуется не использовать оральные контрацептивы.
Гормонозаместительная терапия после менопаузы является еще одним ятрогенным состоянием с 2-4-кратным повышением риска ВТЭ. При наличии лейденской мутации относительный риск может повышаться в 15 раз, а также возрастает частота повторных тромбозов. В связи с этим носительницам НТФ, у которых были эпизоды ВТЭ, рекомендуется не использовать гормонозаместительную терапию.
ПОКАЗАНИЯ ДЛЯ ГЕНЕТИЧЕСКОГО АНАЛИЗА Анализ лейденской мутации и протромбинового полиморфизма G20210A, так же как определение дефицита антитромбина и протеинов С и S, является эффективным методом выявления лиц с повышенным риском тромботических состояний. Обнаружение данных мутаций позволяет проводить носителям профилактическую терапию антикоагулянтами.
В связи с невысокой абсолютной частотой ВТЭ массовый скрининг населения на наличие НТФ не оправдан. Считается более целесообразным обследовать на наличие НТФ следующие группы пациентов:
• лиц с ВТЭ независимо от возраста и тяжести проявлений;
• женщин с одним или более спонтанным абортом на поздней стадии либо с двумя или более выкидышами;
• беременные с внутриутробной задержкой роста плода или отслойкой плаценты;
• родственников первой степени родства пациента с НТФ в анамнезе;
• женщин с семейным анамнезом НТФ перед использованием оральных контрацептивов, гормонозаместительной терапии или беременностью.
ДИАГНОСТИЧЕСКИЕ ТЕСТЫ Первоочередные тесты на наличие НТФ включают следующее:
• определение активности антитромбина (амидолитический метод);
• определение активности протеина С (коагулометрический или амидолитический метод);
• определение концентрации протеина S (общая и свободная фракции антигена);
• коагулометрическое определение устойчивости к активированному протеину С;
• определение лейденской мутации фактора V;
• определение полиморфизма протромбина G20210A;
• определение уровня гомоцистеина в плазме.
Как видно из приведенного списка, дефицит антитромбина и протеинов С и S определяют функциональными методами. Это связано с тем, что данные дефекты вызываются большим количеством мутаций и для их выявления требуются большие усилия и затраты, в то время как функциональные анализы просты и надежны.
Анализ лейденской мутации и полиморфизма протромбина несложен и хорошо дополняет функциональные тесты. По-видимому, анализ полиморфизма С677Т в гене метилентетрагид-рофолатредуктазы не имеет отдельного диагностического значения и должен использоваться в комбинации с биохимическим определением концентрации гомоцистеина в плазме. Применение данного набора тестов позволяет обнаружить наследственный дефект факторов свертывания или повышение гомоцистеина приблизительно у 40% пациентов с ВТЭ.
Наиболее надежным методом выявления лейденской мутации и протромбина G20210A является рестрикционный анализ, но также широко используются аллельспецифическая ПЦР и гибридизация.
4.5.3.3. Семейная гиперхолестеринемия
Семейная гиперхолестеринемия (СГХС) является, по-видимому, наиболее частым аутосомно-доминантным заболеванием человека. Частота СГХС в большинстве популяций 1 на 500. В популяциях с эффектом основателя гетерозиготные формы встречаются гораздо чаще: 1 на 70 у африканеров в Южной Африке и 1 на 200 у канадцев французского происхождения. По той же причине повышена частота СГХС у финнов, друзов и ливанцев.
Далеко не все случаи СГХС диагностируются клинически. Например, в России менее чем 1% пациентов с СГХС ставится клинический диагноз, а наиболее эффективная диагностика (свыше 40% идентифицированных носителей) проводится в Исландии благодаря небольшому размеру популяции с выраженным эффектом основателя и небольшой вариабельностью мутаций.
Основными диагностическими признаками СГХС являются повышенный уровень холестерина в крови, наличие сухожильных ксантом у больного или родственников первой степени родства и доминантный характер наследования повышенного уровня холестерина или ИБС.
Клинически СГХС проявляется повышением риска развития атеросклероза и его осложнений. Механизмы, связывающие повышение уровня холестерина с развитием ИБС, до конца не изучены. Предполагается, что высокий уровень богатых холестерином ЛПНП способствует их проникновению в стенку сосуда, где они окисляются и запускают цепь клеточных реакций, приводящих к накоплению липидов и локальной перестройке стенки сосуда, в результате чего образуется атеросклеротическая бляшка. При СГХС особенно повышается риск смерти от инфаркта миокарда в молодом возрасте - до 40 лет - в 100 раз. У не получающих лечения мужчин с СГХС к 60 годам вероятность ИБС составляет около 75%. По некоторым оценкам, лишь половина мужчин с СГХС доживает до 60 лет. Средний возраст начала ИБС равен 40-45 годам у мужчин, у женщин он на 10 лет больше. Таким образом, ИБС у больных с СГХС развивается на 10-20 лет раньше, чем в среднем по популяции.
Для снижения уровня липопротеинов плазмы при СГХС эффективно используются статины и другие липидснижающие препараты.
Наиболее тяжелых больных (как правило, это гомозиготные случаи) лечат, удаляя избыток ЛПНП плазмаферезом. Иногда применяют пересадку печени.
БИОХИМИЧЕСКИЕ И ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ
При СГХС уровень холестерина повышен за счет увеличения содержания в плазме ЛПНП. Это метаболическое нарушение связано с уменьшением клиренса ЛПНП печенью в результате снижения экспрессии или активности клеточных рецепторов, опосредующих захват частиц ЛПНП (ЛПНП-рецепторы). Активность ЛПНП-рецептора при СГХС снижается на всех клетках, экспрессирующих данный рецептор, однако функциональные последствия связаны главным образом с дефектом рецептора в печени, поскольку нарушение превращения холестерина в желчные кислоты приводит к снижению его выведения через кишечник. Аналогичные биохимические нарушения наблюдаются при мутационном изменении белка апоВ-100, который является лигандом для ЛПНП-рецептора. В результате такой мутации частицы ЛПНП перестают узнаваться ЛПНП-рецептором и накапливаются в плазме.
Ген ЛПНП-рецептора содержит 18 экзонов, которые кодируют шесть функциональных доменов этого белка: сигнальный пептид, лигандсвязывающий домен, домен, гомологичный предшественнику эпидермального фактора роста, участок О-гликозилирования, трансмембранный и цитоплазматический домены. Все известные мутации в гене LDLR собраны в базе данных UMD-LDLR, которая доступна через Интернет. Количество записей в ней превысило 800 и продолжает расти. По данным базы UMD-LDLR, однонуклеотидные замены составляют 90% всех мутаций в гене LDLR, из них большинство - миссенс- и нонсенс-мутации. Остальные 10% - в основном макроперестройки, вызванные неравной рекомбинацией с более чем 30 копиями Alu-последовательностей, присутствующими в данном гене. В промоторе обнаружено менее 10 мутаций.
Хотя СГХС является моногенным заболеванием, фенотипическая экспрессия, а именно тяжесть ИБС, сильно варьирует даже среди пациентов, несущих одинаковые мутации. Некоторые пациенты доживают до 80 лет и старше, в то время как другие умирают от инфаркта в 20 лет. Факторы, влияющие на клинические проявления, могут быть внешними, метаболическими и генетическими.
Из факторов внешней среды особую роль играют курение и диетические привычки. Курение является одним из сильнейших предикторов смертности от ИБС у больных с СГХС. Роль диеты в развитии
СГХС была продемонстрирована путем сравнения пациентов китайского происхождения, проживающих в Канаде, с носителями тех же мутаций, но живущими в Китае.
У канадских китайцев уровень холестерина ЛПНП был на 70% выше, чем в Китае. Кроме того, 6 из 16 гетерозигот, живущих в Канаде, имели ксантомы, а у 4 была ИБС. Ни один из 18 обследованных, проживающих в Китае, не имел ксантом или ИБС. По-видимому, такие различия в клинических проявлениях связаны с разным потреблением ненасыщенных жиров. Этот пример ярко иллюстрирует модифицирующее влияние внешних факторов, таких, как диета, на фенотип гетерозиготной СГХС.
Течение заболевания сильно зависит от типа мутации, вызывающей гиперлипидемию. Наиболее тяжелая гиперхолестеринемия развивается при наличии нуль-мутаций, приводящих к полному отсутствию активного рецептора, в то время как мутации с сохранением частичного синтеза или активности ЛПНП-рецептора обычно вызывают более мягкое заболевание.
Известен ряд биохимических параметров, модифицирующих развитие ИБС у пациентов с СГХС. Такими метаболическими факторами являются: уровень ЛПВП-холестерина, С-реактивного белка и фибриногена. Некоторые из этих факторов, например уровень ЛПВПхолестерина и липопротеина Лп(а), имеют выраженную генетическую основу. Другие доказанные или предполагаемые генетические факторы включают мутации в гене липопротеинлипазы - изоформы аполипопротеина E, варианты белка, переносящего эфиры холестерина, полиморфизм параоксоназы (фермента, расщепляющего липидные перекиси), особый генотип метилентетрагидрофолатредуктазы (связанный с повышенным уровнем гомоцистеина), полиморфизм в генах ренин-ангиотензиновой системы, а также микросомального триглицеридпереносящего белка, влияющего на секрецию ЛПОНП.
Таким образом, в генетическом плане мутации ЛПНП-рецептора являются главным фактором, определяющим развитие СГХС. Вклад других генов несомненен, однако вследствие относительной немногочисленности больных с идентифицированными мутациями ЛПНП-рецептора, требуются дальнейшие исследования генов-модификаторов. В идеале определение генотипа пациента по этим дополнительным генам позволит определять степень риска ИБС и других осложнений у носителей той или иной мутации в гене ЛПНП-рецептора или апоВ-100.
ДНК-ДИАГНОСТИКА
Индивидуальный уровень ХС подвержен естественным изменениям, поэтому на основании одного измерения ХС нельзя делать вывод
о наличии СГХС. Кроме того, уровень ХС зависит от возраста, пола и различается в разных популяциях. Уровень ХС при СГХС часто превышает средний уровень в общей популяции, поэтому ставить диагноз, основываясь только на результатах измерения ХС плазмы в ряде случаев, невозможно.
В настоящее время обнаружение мутаций в гене ЛПНП-рецептора или апоВ-100 является общепринятым критерием при диагностике СГХС. Мутация по 3500-му нуклеотиду в гене апоВ-100 (семейный дефект апоВ) является самой распространенной причиной СГХС в большинстве популяций. В Европе и странах, где проживают выходцы из Европы (Австралия, США, Канада и Новая Зеландия), у 3-5% пациентов СГХС вызывается именно этой мутацией. В странах со сложной генетической структурой заболевания удается найти мутации у 30-50% больных с клиническим диагнозом СГХС. Это связано как с недостаточной чувствительностью скрининговых методов, так и с неправильным диагнозом, установленным на основе уровня ХС и клинических проявлений. Не исключено также существование дополнительных генов, помимо LDLR и APOB, мутации в которых сопровождаются аналогичной клинической картиной.
В ряде популяций ДНК-диагностика СГХС существенно упрощается за счет наличия ограниченного количества мутантных аллелей.
Однако в большинстве генетически открытых популяций, к которым относится и Россия, ни одна мутация в гене ЛПНП-рецептора не встречается чаще, чем у 1% пациентов с СГХС, а обычно много реже. В связи с этим основную роль в ДНК-диагностике СГХС играют скрининговые методы поиска мутаций, такие как определение полиморфизма конформации одноцепочечной ДНК с последующим подтверждением с помощью секвенирования.
4.5.3.4. Кистозный фиброз
Кистозный фиброз (КФ) является одним из наиболее распространенных и одновременно тяжелых аутосомно-рецессивных заболеваний человека. Среди европейцев частота носителей составляет около
1 на 50, а клинические формы встречаются в зависимости от региона с частотой 1 на 2-3 тыс. населения.
КФ получил свое название по характеру микроскопических изменений, наблюдаемых в поджелудочной железе у таких больных. При этом заболевании страдают также легкие, печень, тонкая кишка и мужская репродуктивная система. Ключевую роль в патогенезе играет избыточная секреция слизи эпителием этих органов, что приводит к закупорке бронхов или выводных протоков печени и поджелудочной железы. Несмотря на значительное усовершенствование симптоматических методов лечения, больные с КФ обычно не живут дольше 20-30 лет. Основной причиной смерти является поражение легких, вызванное закупоркой бронхов, создающей благоприятную среду для вторичных инфекций. Хронические инфекции и воспалительная реакция приводят к фиброзу легочной ткани, что в сочетании с обструкцией дыхательных путей может вызвать дыхательную недостаточность. У 65% пациентов закупорка протоков поджелудочной железы препятствует выделению пищеварительных ферментов в кишечник, что приводит к нарушениям пищеварения. Аналогично развивается нарушение секреции желчи печенью, наблюдающееся у 5% больных. Помимо этих проявлений, у 10% новорожденных развивается непроходимость тонкой кишки, требующая хирургического вмешательства. Кроме того, у 95% мужчин с КФ наблюдается бесплодие. Характерным признаком КФ, который широко используется для его диагностики, является повышенная соленость пота, связанная с нарушением реабсорбции ионов С1~эпителием, выстилающим протоки потовых желез.
КФ вызывается мутациями в белке, кодируемом геном CFTR (cystic fibrosis transmembrane conductance regulator). Этот ген состоит из 27 экзонов и кодирует белок с молекулярной массой 168 кД, который содержит два трансмембранных домена, два внутриклеточных нуклеотидсвязывающих домена и регуляторный домен. Данный белок является каналом для ионов С1-. Этот канал активируется под действием cAMP-зави- симой протеинкиназы, которая фосфорилирует регуляторный домен. Выход С1- из клетки запускает цепь реакций, приводящих к закрытию Na+-каналов и усилению выработки слизистого секрета.
Наиболее частой причиной КФ является делеция трех нуклеотидов в 508-м кодоне, приводящая к потере фенилаланина. Частота данной мутации у больных с КФ варьирует от 50% в Центральной Eвропе до почти 90% в Северной. В результате этой мутации нарушается нормальный процессинг белка и он после синтеза не транспортируется в плазматическую мембрану, а задерживается в эндоплазматическом ретикулуме и подвергается деградации. Однако существует большое число
других мутаций, повреждающих данный белок; их число приближается к 1000. Эти более редкие мутации могут оказывать различное влияние на хлоридный канал, например частично или полностью снижать синтез белка, нарушать его внутриклеточный транспорт или снижать функциональную активность канала. Некоторые из этих мутаций вызывают лишь частичное снижение синтеза или активности канала, что может приводить к различным функциональным проявлениям. В тех случаях, когда сохраняется менее 3% активности, развивается тяжелый КФ, сопровождающийся поражением поджелудочной железы. При сохранении 3-8% активности поражаются легкие, а поджелудочная железа находится в норме. Если активность С1- канала составляет 8-12%, наблюдаются легкие формы, такие, как азооспермия у мужчин. Однако такое простое соотношение наблюдается далеко не всегда. Предсказать течение болезни можно только при наличии гомозиготности по делеции фенилаланина-508 или одновременного присутствия этой делеции и мутации G551D. При наличии этих мутаций заболевание протекает в классической тяжелой форме с поражением поджелудочной железы. В большинстве других случаев связь между типом мутации и проявлением заболевания предсказать сложно. Накапливается все больше данных, что КФ является олигогенным заболеванием и его фенотипические проявления зависят не только от характера мутации, но и от набора генов-модификаторов, присутствующих у пациента.
КФ почти всегда можно диагностировать на пренатальной стадии с помощью анализа ДНК из ворсин хориона, либо путем прямого определения мутаций, либо с помощью анализа сцепления с использованием полиморфных внутригенных маркеров в тех случаях, когда мутации у больного ребенка неизвестны. В настоящее время рассматривается вопрос о скрининге населения на наличие КФ. Накопленная информация о генетической структуре КФ позволила выбрать 30 мутаций из почти 1000 известных, которые, однако, объясняют 90% случаев КФ в разных регионах Европы и США. Технически ДНК-диагностика КФ достаточно хорошо отработана, и для ее проведения выпускается ряд коммерческих наборов.
4.5.3.5. Гипертрофическая кардиомиопатия
Гипертрофическая кардиомиопатия (ГКМП) является одним из наиболее частых заболеваний человека с выраженной генетической предрасположенностью. Она встречается с частотой 1 на 500, что значительно превышает частоту другой семейной формы кардиомиопатии - дилатационной (1 на 2500). ГКМП наследуется
по аутосомно-доминантному типу и характеризуется пенетрантностью до 75%. Клинически заболевание проявляется в виде гипертрофии левого и/или правого желудочка и увеличения размеров предсердия. Гипертрофия обычно является асимметричной и затрагивает межжелудочковую перегородку. Гистологически в мышце сердца наблюдаются гипертрофия и неупорядоченное расположение кардиомиоцитов, а также интерстициальный фиброз. Заболевание приводит к аритмиям и внезапной смерти, а также к сердечной недостаточности.
Причиной заболевания на молекулярном уровне является нарушение функции белков, входящих в состав саркомера, поэтому ГКМП иногда называют болезнью саркомера. Гипертрофия является компенсаторным ответом миокарда на снижение сократительной способности. В настоящее время идентифицировано 11 генов, мутации в которых приводят к ГКМП (табл. 4.11).
Мутации саркомерных белков по-разному влияют на сократительную функцию кардиомиоцитов. В результате миссенс-мутаций часто образуются стабильные, но неактивные белки, которые встраиваются в саркомер и нарушают его функцию, т.е. оказывают доминантно-негативное действие. В отличие от этого мутации
Таблица 4.11. Мутации, приводящие к гипертрофической кардиомиопатии
 со
сдвигом рамки приводят к образованию неактивных укороченных белков,
подверженных ускоренной деградации. В обоих случаях сократительная
активность падает и развивается компенсаторная гипертрофическая реакция.
со
сдвигом рамки приводят к образованию неактивных укороченных белков,
подверженных ускоренной деградации. В обоих случаях сократительная
активность падает и развивается компенсаторная гипертрофическая реакция.
Тип мутации может влиять на тяжесть заболевания. Например, высокий риск внезапной сердечной смерти связан с мутациями в гене MYH7 Арг4оз-Глн, Арг45з-Цис и Арг72з-Гли. В отличие от этого мутации Гли25б-Глю, Вал606-Мет и Лей908- Вал не связаны с повышенным риском аритмий. Мутации в гене MYBPC3 обычно связаны с мягкой гипертрофией у молодых пациентов, поздним началом заболевания и относительно благоприятным прогнозом. Таким образом, знание типа мутации не только подтверждает диагноз ГКМП, но в ряде случаев помогает в определении прогноза.
В связи со значительной генетической гетерогенностью молекулярная диагностика ГКМП представляет определенную сложность. Из-за разнообразия мутаций для поиска при этом заболевании главным образом используются такие скрининговые методы, как анализ полиморфизма конформации одноцепочечной ДНК, электрофорез в градиенте денатуранта, а также денатурирующая ВЭЖХ. Поиск мутаций проводится главным образом в гене тяжелой цепи β-миозина, а также в генах сердечного тропонина Т и сердечного миозинсвязывающего белка С.