Клиническая биохимия : учебное пособие. 3-е издание / под ред. В.А. Ткачука. - 2008
|
|
|
|
ГЛАВА 1 КЛИНИЧЕСКАЯ ЛАБОРАТОРНАЯ ДИАГНОСТИКА
1.1. КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ
При планомерно проводимом лабораторном диагностическом процессе во многих разделах клинической медицины основное значение имеет определение субстратов, специфических белков, активности ферментов, в связи с чем применяют методы клинической биохимии. В отличие от этого в диагностике неотложных состояний, особенно в отделении реанимации, когда приходится диагностировать пограничные состояния между жизнью и смертью, доминируют методы, отражающие состояние жизненно важных физико-химических процессов. Основу неотложной диагностики составляют определения кислотно-щелочного равновесия (КЩР), парциального давления кислорода и углекислоты крови, состояния буферных систем крови, ионного состава внеклеточной среды, объема внеклеточной и внутрисосудистой жидкости, осмолярности биологических жидкостей, параметров свертывающей системы крови и диссоциации гемоглобина. В неотложных состояниях при отравлениях появляется реальная необходимость определять параметры гемоглобина, фракционный состав гемоглобина - наличие карбоксигемоглобина, тиогемоглобина, способности оксигемоглобина к диссоциации. В настоящее время в реанимационных отделениях имеются анализаторы КЩР, которые одновременно из одной пробы крови, взятой в анаэробных условиях, определяют все параметры КЩР, буферные системы крови, парциальное давление кислорода и углекислоты, содержание в крови гемоглобина, глюкозы, лактата и фракции гемоглобина. Основное место в диагностике неотложных состояний занимает определение параметров КЩР. В поддержании КЩР принимают участие:
• буферные системы крови;
• внутриклеточный метаболизм, в процессе которого образуется и используется ион водорода;
• легкие, удаляющие углекислый газ;
• почки, реабсорбирующие бикарбонат и выделяющие ион водорода в форме NH4+ и Н3РО4.
В результате метаболических процессов в организме образуются ионы Н+ и СО2. В покое человек выделяет 230 мл СО2 в 1 мин или около 15000 ммоль/сут. Потенциально это сопровождается исчезновением из крови 15 моль Н+ (летучие кислоты). Летучие кислоты экскретируются из организма только через легкие. В организме примерно 1 ммоль / (кг-сут) Н+ образуется в виде нелетучих кислот, таких как Н2SO4 и Н3РО4. Они экскретируются почками.
Значение рН артериальной крови обозначают символом рНа, в норме поддерживающимся в ограниченном диапазоне между 7,37 и 7,44. Отклонение рНа за эти границы означает нарушение КЩР. Значения рН ниже 7,37 свидетельствуют об ацидемии (в крови) и ацидозе (в ткани). Значения рН выше 7,44 указывают на развитие алкалемии (в крови) или алкалоза (в ткани). В рутинной практике традиционно при анализе крови используют термины «ацидоз» и «алкалоз».
рНа зависит от величины легочной вентиляции, функции почек, уровня оксигенации, интенсивности метаболических реакций, состояния гемодинамики и др. Рассмотрение этих факторов выявляет два основных звена регуляции КЩР - дыхательное и метаболическое. Регистрация только рНа не позволяет установить возможные причины нарушения КЩР; чтобы определить дыхательный и метаболический компоненты, необходимо исследовать дополнительные параметры.
рСО2 - парциальное давление углекислого газа. В пробах артериальной крови его принято обозначать как РаСО2. Этот показатель отражает количество растворенного СО2 в плазме. СО2 находится также в составе угольной кислоты (Н2СО3), иона бикарбоната (НСО-3), в комбинации с разными белками плазмы и в связанном виде с гемоглобином.
В капиллярах СО2 диффундирует в эритроциты, где при взаимодействии с водой превращается в Н2СО3, реакция катализируется карбонатдегидратазой. Н2СО3 в свою очередь диссоциирует на Н+, который связывается гемоглобиновым буфером, и НСО-3, который выходит из клеток в обмен на ионы Cl-. В альвеолах процесс проходит в обратном направлении и СО2 удаляется с выдыхаемым воздухом.
При нормальной вентиляции раСО2 находится в диапазоне 38-42 мм рт.ст. (5,06-5,60 кПа). Некоторые авторы считают нормальным диапазон раСО2 35-45 мм рт.ст. (4,7-6,0 кПа). Патологическими значениями считают отклонения за пределы <30 и >50 мм рт.ст. (< 4 и > 6,7 кПа).
Накопление или уменьшение количества СО2 существенно влияют на КЩР. Так как растворение СО2 сразу же сопровождается образо-
ванием угольной кислоты, то накопление СО2 приводит к ацидозу, поэтому при гиповентиляции развивается дыхательный ацидоз. При гипервентиляции СО2 избыточно удаляется из организма и пополняется из нестойкой НСО3. В результате снижается концентрация Н+, увеличивается рН, развивается дыхательный алкалоз.
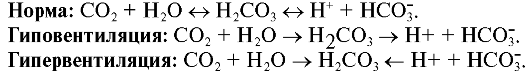 Определение раСО2 используют как индекс, отражающий дыхательный компонент КЩР.
Определение раСО2 используют как индекс, отражающий дыхательный компонент КЩР.
Непосредственно поддержание постоянства рН крови осуществляют буферные системы, из которых наиболее важен бикарбонатный буфер. Емкость этого буфера, а значит и физиологическая способность противостоять изменениям концентрации иона Н+, составляют более половины всей буферной емкости крови.
Составные части этого буфера - угольная кислота (Н2СО3) и ионы бикарбоната (НСО3). Угольная кислота - нестойкое соединение, разлагается с образованием воды и двуокиси углерода, углекислый газ через дыхательную систему удаляется в атмосферу. Учитывая эту особенность, бикарбонатную буферную систему называют летучим буфером. Основными параметрами, определяющими вклад бикарбонатной системы в регуляцию КЩР, служат парциальное давление двуокиси углерода и концентрация бикарбоната в крови. Концентрацию бикарбоната можно использовать в качестве показателя метаболического компонента КЩР. Нормальная концентрация НСО-3 составляет 22-26 ммоль/л.
При оценке бикарбоната с помощью анализаторов регистрируют два показателя - истинный (актуальный) бикарбонат и стандартный бикарбонат.
Истинный бикарбонат (HCO3--act). Уравнение Хендерсона- Хассельбаха для концентрации иона бикарбоната решается следующим образом:
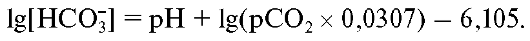 Рассчитанная по уравнению концентрация бикарбоната эквивалентна его активности в водной части плазмы, так как рН и СО2 измеряют
для водной части плазмы. Для истинной плазмы могут быть определенные
отклонения [НСО3], если в ней увеличено содержание липидов и белков.
Правильнее использовать рассчитанные значения, чем измеренные
показатели.
Рассчитанная по уравнению концентрация бикарбоната эквивалентна его активности в водной части плазмы, так как рН и СО2 измеряют
для водной части плазмы. Для истинной плазмы могут быть определенные
отклонения [НСО3], если в ней увеличено содержание липидов и белков.
Правильнее использовать рассчитанные значения, чем измеренные
показатели.
Стандартный бикарбонат (HCO3--std). Стандартный бикарбонат - концентрация всех форм бикарбоната в плазме, уравновешенной при рСО2 40 мм рт.ст., при насыщении кислородом на 100%. При таком подходе определяют концентрацию бикарбоната, зависящую только от метаболизма, и полностью исключают влияние дыхания на этот показатель. Для расчета стандартного бикарбоната используют уравнение, предложенное Ван-Слайком:
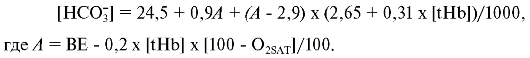 [tHb]
- концентрация общего гемоглобина - может быть измерена в той же пробе
или введена в расчет дополнительно; BE - избыток или дефицит оснований -
эмпирическое выражение, определяемое требуемым количеством кислоты или
щелочи для титрования 1 л крови до достижения нормального рН = 7,4; ВЕ
при рН = 7,4, рСО2 40 мм рт.ст. (5,33 кПа), общем гемоглобине 150 г/л и температуре 37 °С равен нулю.
[tHb]
- концентрация общего гемоглобина - может быть измерена в той же пробе
или введена в расчет дополнительно; BE - избыток или дефицит оснований -
эмпирическое выражение, определяемое требуемым количеством кислоты или
щелочи для титрования 1 л крови до достижения нормального рН = 7,4; ВЕ
при рН = 7,4, рСО2 40 мм рт.ст. (5,33 кПа), общем гемоглобине 150 г/л и температуре 37 °С равен нулю.
О2SАТ - сатурация (насыщение) гемоглобина - отношение (в процентах) объема кислорода, которое может связать то же количество гемоглобина.
Так как уравнения Хендерсона-Хассельбаха и Ван-Слайка не связаны между собой, то и рассчитанный по ним истинный и стандартный бикарбонат не может быть связан никакими пересчетными коэффициентами.
Хотя кроме бикарбонатного буфера в крови присутствуют другие основания и кислоты, тем не менее соотношение НСО3-/H2СО3 характеризуется высокой чувствительностью и динамичностью и отражает суммарные изменения системы кислоты/основания.
Действие бикарбонатного буфера дополняется в организме действием нелетучих буферных систем, наиболее важным из которых является гемоглобиновый буфер, составляющий около 1/3 всей буферной емкости крови. Кроме того, в организме существуют фосфатный и белковый буферы. При оценке способности крови противостоять изменению рН нужно принимать во внимание участие всех буферных систем крови.
Показателем, характеризующим это свойство, служит концентрация буферных оснований крови (ВВ).
ВВ (Buffer Bases) состоит из бикарбонатного и небикарбонатного буферных компонентов (БУФ):
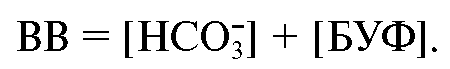 Значение
этого параметра слабо зависит от изменения парциального давления
углекислого газа в крови, но отражает тканевый метаболизм и частично
функцию почек. По величине ВВ можно судить о сдвигах КЩР, связанных с
увеличением или уменьшением содержания нелетучих кислот в крови. В норме
ВВ составляет 48 ммоль/л. Эту величину обозначают как норму буферных
оснований (NBB), или должную концентрацию буферных оснований.
Значение
этого параметра слабо зависит от изменения парциального давления
углекислого газа в крови, но отражает тканевый метаболизм и частично
функцию почек. По величине ВВ можно судить о сдвигах КЩР, связанных с
увеличением или уменьшением содержания нелетучих кислот в крови. В норме
ВВ составляет 48 ммоль/л. Эту величину обозначают как норму буферных
оснований (NBB), или должную концентрацию буферных оснований.
Производным по отношению к концентрации буферных оснований и удобным для оценки служит показатель избытка или недостатка буферных оснований (ВЕ, Bases Excess), определяемый разницей между истинной и должной концентрацией буферных оснований:
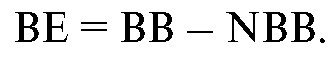 Очевидно, что в норме ВЕ равен нулю. Учитывая биологическую вариабельность, принято считать референсными значениями ВЕ:
Очевидно, что в норме ВЕ равен нулю. Учитывая биологическую вариабельность, принято считать референсными значениями ВЕ:
- для взрослых 0 ± 2,5 ммоль/л;
- для детей 0 ± 3 ммоль/л.
При патологическом увеличении содержания буферных оснований ВЕ становится положительным, а при снижении - отрицательным. В последнем случае лучше использовать термин «дефицит оснований». Этот параметр имеет значительное клиническое и диагностическое значение. Он позволяет:
1) оценить степень метаболической компенсации дыхательных нарушений КЩР;
2) оценить степень метаболических нарушений КЩР;
3) вычислить общий недостаток (избыток) оснований (ОВЕ) всего организма с помощью формулы:
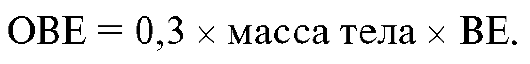 Значение ОВЕ - основа для определения дозировки лекарственных препаратов, используемых для коррекции метаболических нарушений.
Значение ОВЕ - основа для определения дозировки лекарственных препаратов, используемых для коррекции метаболических нарушений.
Таким образом, имеется возможность оценить вклад метаболического и дыхательного компонентов в изменение КЩР (рис. 1.1).
Буферные системы крови отражают активность всех гомеостатических механизмов, которые влияют на [H+] или рН через изменение двух компонентов: метаболического (недыхательного), который можно оценить по величине ВВ (ВЕ); дыхательного, который можно оценить по СО2 (раСО2).
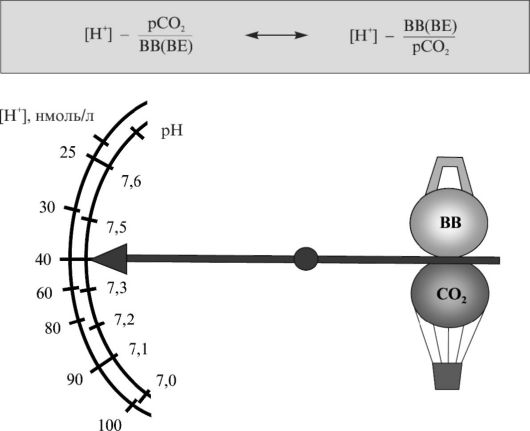 Рис. 1.1. Кислотно-щелочное равновесие крови
Рис. 1.1. Кислотно-щелочное равновесие крови
Это позволяет более объективно характеризовать состояние КЩР организма, поскольку возможна независимая оценка метаболической и дыхательной функций.
Клетки служат постоянным источником углекислого газа и нелетучих кислот (рис. 1.2). Как нелетучие кислоты, так и СО2 в плазме способствуют повышению концентрации ионов
Н+. Индикатором способности клеток утилизировать ионы Н+ служит изменение содержания калия в плазме. Это происходит в результате того, что поступление Н+ в клетку связано с перемещением К+ из нее. Поэтому чаще всего ацидоз сопровождается гиперкалиемией, а алкалоз - гипокалиемией. Показатель, в значительной степени отражающий количество образованных и/или задержанных в организме нелетучих кислот, - анионный интервал (АИ) плазмы крови.
Значение АИ рассчитывают из разницы концентраций катионов натрия и двух главных анионов - хлора и бикарбоната:
АИ = ([Na+] + [K+]) - [С1-] - [НСО3-].
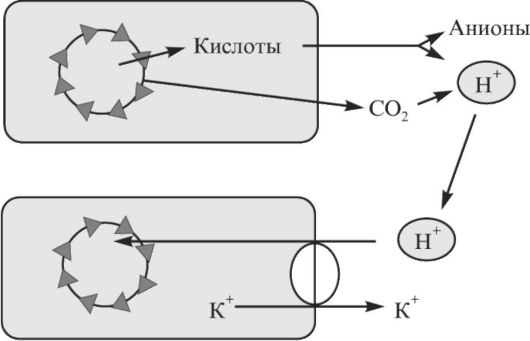 Рис. 1.2. Вклад клеток в поддержание кислотно-щелочного равновесия
Рис. 1.2. Вклад клеток в поддержание кислотно-щелочного равновесия
АИ отражает концентрации тех анионов, которые фактически имеются в сыворотке, но обычно не определяются, включая отрицательно заряженные белки плазмы (в основном альбумины), фосфаты, сульфат и органические кислоты (например, молочную кислоту). В норме АИ составляет 16 ± 4 мэкв/л. Увеличение АИ чаще всего связано с накоплением органических кислот (ацидоз) или с гиперпротеинемией. Уменьшение АИ происходит при гипопротеинемии.
При метаболическом ацидозе органические анионы накапливаются одновременно с эквивалентным количеством ионов водорода. Так, при диабетическом кетоацидозе накапливаются ацетоацетат и гидроксибутират, при лактоацидозе - лактат. При этом электронейтральность поддерживается за счет снижения бикарбоната. Существенное увеличение АИ наблюдается при отравлениях метанолом или этиленгликолем. Большинство видов метаболического ацидоза возникает в результате снижения уровня бикарбоната сыворотки без соответствующего повышенния концентрации ионов хлора, что сопровождается увеличением АИ.
В то же время при почечном канальцевом ацидозе, связанном с потерей бикарбоната, происходит повышение концентрации в плазме ионов хлора и АИ будет в пределах нормы, поэтому расчет АИ имеет диагностическое значение. Хотя в клинических условиях причину метаболического ацидоза достаточно легко установить с помощью обычных анализов, тем не менее расчет АИ может быть полезен при анализе комплексных нарушений КЩР.
Особое значение для компенсации сдвигов КЩР имеет регуляция дыхания. Если в результате обменных нарушений кислотность крови увеличивается, то повышение содержания Н+ приводит к возрастанию легочной вентиляции (гипервентиляции); при этом молекулы СО2 выводятся в большем количестве и рН возвращается к нормальному уровню. Напротив, увеличение содержания оснований сопровождается гиповентиляцией, в результате напряжение СО2 и концентрация ионов Н+ возрастают, сдвиг реакции крови в щелочную сторону частично компенсируется. Другие органы также могут значительно влиять на КЩР, но не в состоянии заменить легкие и почки в выведении продуктов метаболизма.
Дыхательные нарушения КЩР часто связаны с заболеванием легких. Первичная функция дыхательной системы - поддерживать оптимальный уровень напряжения кислорода (рО2) и углекислого газа (рСО2) в артериальной крови. Эта функция обеспечивается тремя ключевыми процессами: вентиляцией, кровотоком и диффузией газов в легких. Нарушение каждого из них может привести к дыхательной недостаточности, которая определяется как снижение раО2 ниже 8,0 кПа и/или повышение раО2 выше 8,0 кПа в покое у пациентов, дышащих воздухом.
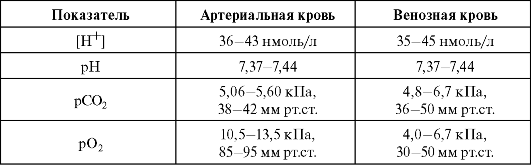
При альвеолярной гиповентиляции повышается альвеолярное и артериальное рСО2 и падает альвеолярное и артериальное рСО2. Оценку альвеолярной вентиляции проводят путем измерения артериального рСО2. Показатели крови при нормальном газообмене в покое при дыхании воздухом представлены в табл. 1.1.
Таблица 1.1. Показатели крови при нормальной функции легких
 К параметрам, характеризующим функцию дыхательной системы, относят не только рО2 и рСО2, но и насыщение гемоглобина кислородом (S02), общее содержание кислорода в крови (ТО2), фракцию
К параметрам, характеризующим функцию дыхательной системы, относят не только рО2 и рСО2, но и насыщение гемоглобина кислородом (S02), общее содержание кислорода в крови (ТО2), фракцию
оксигемоглобина в общем гемоглобине (О2Hb) и другие параметры. Последние показатели в определенной степени характеризуют процессы тканевого обмена кислорода и его транспорт кровью.
Одна из функций почек - возможность поставки в кровоток дополнительных количеств ионов НСО-3, уравновешивающих образование ионов Н+ в организме. Функция почек, направленная на поддержание КЩР, состоит из двух компонентов: реабсорбции НСО-3; выведения Н+ с мочой. Реабсорбция НСО-3 происходит главным образом в проксимальных канальцах нефрона (рис. 1.3).
Существует взаимосвязь между количеством реабсорбированного бикарбоната и ионами хлора. Так, увеличение реабсорбции НСО-3 при нарушениях КЩР сопровождается снижением реабсорбции С1- и ведет к гипохлоремии. Поэтому определение концентрации С1- в
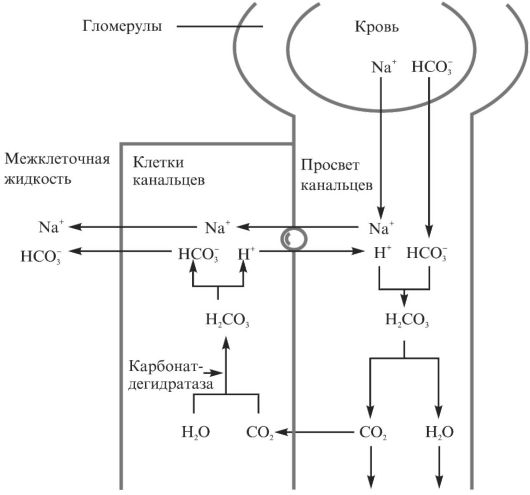 Рис. 1.3. Реабсорбция бикарбоната в канальцах почек
Рис. 1.3. Реабсорбция бикарбоната в канальцах почек
плазме и НСО-3 в моче может предоставить дополнительную информацию о типе нарушения КЩР.
Минимальное значение рН мочи может быть 4,6, что эквивалентно концентрации ионов Н+ 25 мкмоль/л. Так как за сутки обычно выделяется около 1,5 л мочи, то в свободном виде выделяется примерно только тысячная часть общего экскретируемого количества ионов Н+. Основной буфер мочи фосфатный. При минимальном рН мочи практически все фосфаты находятся в форме H2P04-. За сутки примерно 30-40 ммоль ионов Н+ нормально экскретируются этим путем.
Аммиак, образуемый при дезаминировании глутамина в клетках дистальных канальцев, - важный буфер мочи. Фермент, катализирующий эту реакцию, - глутаминаза, активируется при хроническом ацидозе, что сопровождается увеличением экскреции ионов водорода в виде ионов аммония (аммониогенез).
NH3 может свободно диффундировать через клеточные мембраны, тогда как ион NH+4 такой способностью не обладает. В просвете почечного канальца формируется аммонийная буферная система. Отсюда следует, что определение выведенного с мочой аммония и одноосновных фосфатов (титруемая кислотность) наряду с определением рН составляет основу для оценки функции дистальной части нефрона.
Клиническое значение определения параметров
Различают два основных типа нарушений КЩР - ацидоз (рН < 7,37) и алкалоз (pH > 7,44). Каждое из них может быть метаболическим или дыхательным (последний подразделяют на острый и хронический).
При первичном изменении рСО2 говорят о первичном дыхательном нарушении КЩР; при первичном изменении концентрации бикарбоната говорят о первичном метаболическом нарушении. И в том, и в другом случае второй (зависимый) параметр для поддержания рН в фиксированном диапазоне (7,37-7,44) изменяется в том же направлении, что и первый (нормальная компенсаторная реакция). Компенсаторные механизмы приводят только к ограничению сдвигов рН плазмы крови, но не предотвращают полностью их развитие. Важно понимать, что компенсаторная реакция со стороны легких происходит быстрее, чем таковая реакция со стороны почек (последняя может занимать 1-2 дня).
• Дыхание Куссмауля (равномерные редкие дыхательные циклы, глубокий шумный вдох и усиленный выдох) компенсаторная
реакция организма в ответ на метаболический ацидоз. Патогенез дыхания Куссмауля объясняют стимуляцией дыхательного центра повышенным (относительно бикарбоната) содержанием в крови pC02.
• Урежение и ослабление дыхания - компенсаторная реакция организма в ответ на метаболический алкалоз.
ДВА ПРАВИЛА ПРИ ИНТЕРПРЕТАЦИИ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ КЩР
Правило 1. Увеличение рСО2 на 10 мм рт.ст. приводит к уменьшению рН на 0,08 и, соответственно, наоборот (т.е. налицо обратно пропорциональная зависимость между рН и рСО2). 0,08 - минимальная величина, превышающая нормальный диапазон рН (7,44 - 7,37 = 0,07).
Правило 2. Увеличение НСО3 на 10 мэкв/л приводит к увеличению рН на 0,15 и, соответственно, наоборот (т.е. налицо прямая зависимость между рН и НСО-3).
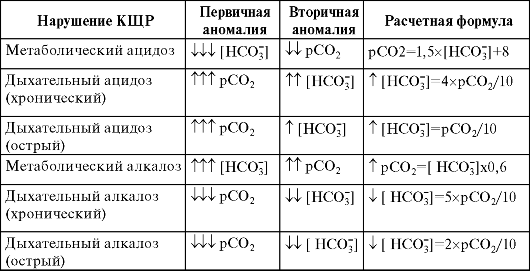
Уточнение характера нарушения КЩР (метаболическое или дыхательное) проводят по направлению изменений концентраций двуокиси углерода и бикарбоната (табл. 1.2)
Таблица 1.2. Основные нарушения КЩР
 У
пациентов с тяжелой патологией часто определяют два или даже три
первичных нарушения КЩР. Результат этих нарушений может быть аддитивным,
что проявляется выраженными изменениями
У
пациентов с тяжелой патологией часто определяют два или даже три
первичных нарушения КЩР. Результат этих нарушений может быть аддитивным,
что проявляется выраженными изменениями
рН (например, при метаболическом и сопутствующем дыхательном ацидозе), или нивелирующим, когда рН нормален (например, при метаболическом ацидозе и сопутствующем дыхательном алкалозе). Смешанное нарушение КЩР можно заподозрить при выявлении значительной разницы между реальным и ожидаемым изменением второго (зависимого) параметра.
В практике можно встретить результаты, не поддающиеся логической интерпретации (например, рС02 50 мм рт.ст., НСO3- 18 мэкв/л, а рН = 7,8, т.е. рН щелочной, а двуокись углерода и бикарбонат отражают сдвиг КЩР в кислую сторону). Этот результат следует рассматривать как ошибку лаборатории, проводившей исследование.
Метаболический ацидоз
Метаболический ацидоз - наиболее частое нарушение КЩР, наблюдаемое в клинической практике (классический пример - диабетический кетоацидоз). Метаболический ацидоз характеризуется первичным снижением бикарбоната сыворотки и вторичным компенсаторным снижением рСО2, что клинически проявляется дыханием Куссмауля (т.е. в ответ на первичный метаболический ацидоз развивается вторичный дыхательный алкалоз). Метаболический ацидоз дифференцируют в зависимости от нормального или увеличенного анионного интервала (см. выше).
• Увеличение АИ отражает возрастание одной из этих долей, обычно органических кислот. При этом не происходит задержки хлора в почечных канальцах (нормохлоремический метаболический ацидоз).
• При отсутствии изменения АИ при снижении как концентрации бикарбоната плазмы, так и рН сыворотки предполагают первичную потерю бикарбоната или добавление минеральной кислоты. При этом происходит задержка хлора в почечных канальцах (гиперхлоремический метаболический ацидоз). Поэтому существенную роль в диагностике метаболического ацидоза может играть определение хлоридов в сыворотке.
Клинический пример. Молодой пациент, 21 год, поступил в приемный покой с температурой тела 38 °С и запахом ацетона изо рта (рН 7,35, рСO2 17 мм рт.ст., НСО3 9 мэкв/л).
Этап 1. рН < 7,37, т.е. это ацидоз.
Этап 2. рСO2 и НСО3- снижены, т.е. это метаболический ацидоз (при дыхательном ацидозе оба параметра увеличены).
Этап 3. Определяем компенсаторное снижение рСO2 - 1,5 х 9+8=21,5. А реальное значение рСO2 17, т.е. нарушение КЩР смешанное; есть сопутствующий первичный дыхательный алкалоз (что характерно для начинающегося сепсиса).
Этап 4. (корреляция с клинической картиной). У пациента метаболический ацидоз вследствие кетоацидоза и сопутствующий дыхательный алкалоз вследствие начинающегося сепсиса.
МЕТАБОЛИЧЕСКИЙ АЦИДОЗ С УВЕЛИЧЕННЫМ АИ (НОРМОХЛОРЕМИЧЕСКИЙ АЦИДОЗ) Кетоацидоз. Увеличено образование кетоновых тел (кетокислот). Может возникать как при сахарном диабете, так и при голодании и алкоголизме. Кетоновые тела - группа органических соединений, относящихся к промежуточным продуктам обмена жиров, белков и углеводов. Основной путь синтеза кетоновых тел (кетогенез), который происходит главным образом в печени, - конденсация под действием тиолазы двух молекул ацетил-КоА, образованного при β-окислении высших жирных кислот или при окислительном декарбоксилировании пирувата. Кетоновые тела используются организмом в качестве источников энергии при ограниченном питании. При полном окислении 1 г кетоновых тел образуется 4 ккал энергии.
Молочнокислый ацидоз (лактат-ацидоз) - характерный признак многих состояний, сочетающихся с гипоксией тканей, и сопровождающийся повышением концентрации молочной кислоты в крови. Молочная кислота - конечный продукт анаэробного гликолиза и гликогенолиза - вырабатывается в организме в количестве 1 мэкв/(кг ч) (в норме при мышечном покое). Нормальный уровень лактата в сыворотке крови составляет 2 мэкв/л и менее, но при больших физических нагрузках содержание молочной кислоты в крови может достигать 4 мэкв/л. Большая часть лактата метаболизируется печенью, являясь субстратом глюконеогенеза (кроме того, молочная кислота поглощается сердечной мышцей, где используется как энергетический материал). Печень способна перерабатывать в 10 раз больше лактата, чем его образуется в норме.
Основные причины, вызывающие развитие лактат-ацидоза: Клинический шок (кардиогенный или септический) - главная причина молочнокислого ацидоза. Однако при сепсисе возможно развитие лактат-ацидоза и без артериальной гипотензии и других клинических симптомов шока. Гиперлактацидемия при шоке возникает из-за интенсивного образования молочной кислоты и снижения
способности печени к ее переработке, т.е. способности превращать лактат в глюкозу и гликоген. Угнетение метаболизма лактата может быть результатом нарушения печеночного кровообращения вследствие падения АД при шоке. Накопление в крови молочной кислоты при любом виде шока считается плохим прогностическим признаком.
Заболевания печени также могут приводить к молочнокислому ацидозу, в первую очередь из-за нарушения способности печени к утилизации лактата. Однако даже при тяжелой патологии печени лактатацидоз не развивается вплоть до появления артериальной гипотензии или других клинических признаков шока.
Анемии любого генеза и почечная недостаточность также приводят к развитию молочнокислого ацидоза.
Дефицит тиамина может способствовать возникновению лактатацидоза вследствие угнетения окисления пирувата в митохондриях. Тиамин - предшественник тиаминпирофосфата, выполняющего функцию кофермента для ряда ферментов, катализирующих реакции как неокислительного, так и окислительного декарбоксилирования α-кетокислот, в частности пировиноградной кислоты. Дефицит тиамина приводит к блокированию превращения пирувата в ацетилированную форму кофермента А (ацетил-КоА) и направляет метаболизм пировиноградной кислоты по пути образования лактата. Лактат-ацидоз, обусловленный недостатком тиамина, развивается при отсутствии серьезных расстройств со стороны сердечно-сосудистой системы; возможна коррекция такого ацидоза введением тиамина. Дефицит тиамина отмечен у больных в критических состояниях, это следует принимать во внимание в каждом случае молочнокислого ацидоза у пациентов со стабильной гемодинамикой, а также при содержании лактата в крови, превышающем уровень, соответствующий выраженности сердечно-сосудистой патологии.
Алкалоз. Повышенная концентрация лактата в крови может быть обусловлена и выраженным алкалозом (метаболическим или дыхательным). Предполагаемый механизм, приводящий к увеличению продукции молочной кислоты, связан с повышенной активностью рНзависимых ферментов, катализирующих реакции гликолиза. Обычно печень оказывается способной адекватно реагировать на повышение образования лактата при алкалозе, так что уровень молочной кислоты в сыворотке крови возрастает только при тяжелых формах алкалоза (рН сыворотки более 7,6). Следует помнить, что при нарушениях функции печени, обусловленных расстройствами печеночного кровотока,
индуцированная алкалозом повышенная продукция лактата может иметь важное значение во время внутривенных вливаний щелочных растворов.
D-лактат-ацидоз. Как известно, молочная кислота - оптически активное соединение. В мышцах человека и животных найдена L-молочная кислота (левовращающий изомер), а ее правовращающий изомер образуется в результате действия ферментов микроорганизмов, расщепляющих глюкозу в кишечнике. D-молочную кислоту могут вырабатывать несколько видов бактерий, например Bacteroides fragilis, и некоторые грамотрицательные кишечные аэробы, такие как Escherichia coli. D-лактат-ацидоз чаще отмечают у больных с обширной резекцией тонкой кишки, кишечными анастомозами, а также у лиц с выраженным ожирением. При измерении содержания лактата в крови стандартными лабораторными методами определяют только его левовращающий изомер. Для правильной диагностики необходимо иметь специальные тест-системы для выявления D-молочной кислоты. Такие исследования обычно проводят в хорошо оснащенных клинических биохимических лабораториях.
Лекарственные препараты и молочная кислота. К лекарственным препаратам, наиболее часто вызывающим молочнокислый ацидоз, относят адреналин, натрия нитропруссид и бигуаниды.
Почечная недостаточность. Накопление органических и неорганических анионов, связанное со снижением скорости клубочковой фильтрации, приводит к увеличению АИ при тяжелой почечной недостаточности.
Отравления алкоголем, метанолом и этиленгликолем могут привести к накоплению органических кислот (например, молочной кислоты). При отравлении салицилатами метаболический ацидоз развивается в ответ на первичный дыхательный алкалоз (см. ниже).
МЕТАБОЛИЧЕСКИЙ АЦИДОЗ С НОРМАЛЬНЫМ АИ (ГИПЕРХЛОРЕМИЧЕСКИЙ МЕТАБОЛИЧЕСКИЙ АЦИДОЗ)
Проксимальный канальцевый ацидоз характеризуется сниженной проксимальной канальцевой реабсорбцией бикарбоната, приводящей к чрезмерной экскреции бикарбоната с мочой. К причинам относят цистиноз, системную красную волчанку, множественную миелому, отравление тяжелыми металлами, гепатолентикулярную дегенерацию и нефротический синдром.
Дистальный канальцевый ацидоз. К причинам относят отравления тяжелыми металлами, прием амфотерицина В, системную красную
волчанку, обструктивную уропатию, синдром Шегрена и другие состояния, сопровождающиеся гиперглобулинемией.
Гиперкалиемический почечный канальцевый ацидоз. Гиперкалиемия, в частности сочетающаяся с гипоренинемическим гипоальдостеронизмом, характеризуется снижением экскреции аммиака, уменьшением образования бикарбоната и неспособностью забуферивать нелетучие кислоты.
Ингибирование карбоангидразы. Диуретик ацетазоламид (диакарб) и мафенид (местно при лечении ожогов) ингибируют карбоангидразу и уменьшают проксимальную канальцевую реабсорбцию бикарбоната.
Потеря бикарбоната через ЖКТ (диарея, фистула поджелудочной железы, уретеросигмоидостомия).
Применение минеральной кислоты. Гиперхлоремический метаболический ацидоз развивается при назначении соляной кислоты или любых ее метаболических предшественников, включая хлорид аммония, гидрохлорид аргинина, хлорид кальция (только при пероральном приеме).
Клиническая картина метаболического ацидоза обычно связана с основным заболеванием. Ключ к диагностике метаболического ацидоза - дыхание Куссмауля. При рН крови менее 7,2 может возникать снижение сердечного выброса. Ацидоз может сопровождаться резистентностью к сосудосуживающему действию катехоламинов (приводящей к развитию артериальной гипотензии) и инсулина (что требует увеличения дозы инсулина при прогрессировании диабетического кетоацидоза). Диагноз ставят по результатам исследования газов артериальной крови (снижение уровня бикарбоната с компенсаторным снижением рСО2 крови) и электролитов сыворотки (непостоянные величины содержания хлорида в зависимости от того, сочетается ли ацидоз с нормальным или увеличенным АИ).
Дыхательный ацидоз
Дыхательный ацидоз характеризуется первичным повышением рСО2 и компенсаторным повышением НСО-3. Таким образом, физиологическая реакция на первичный дыхательный ацидоз - вторичный метаболический алкалоз. Как правило, дыхательный ацидоз наблюдают при бронхообструктивных заболеваниях (классический пример - приступ бронхиальной астмы). Фактически любое нарушение, угнетающее функцию легких и клиренс СО2, приводит к развитию дыхательного ацидоза.
Первичное поражение легких (альвеолярно-капиллярная дисфункция) может привести к задержке СО2 (обычно в качестве позднего проявления).
Нервно-мышечные поражения. Любая патология дыхательной мускулатуры, приводящая к снижению вентиляции (например, myasthenia gravis), может вызывать задержку СO2.
Патология ЦНС. Любое тяжелое повреждение ствола мозга может сочетаться со снижением вентиляционной способности и задержкой C02.
Лекарственно-обусловленная гиповентиляция. Любой препарат, вызывающий выраженное угнетение ЦНС или функции мышц, может сочетаться с дыхательным ацидозом.
Важные отличия от метаболического ацидоза - отсутствие дыхания Куссмауля и бесполезность назначения бикарбоната натрия. Концентрация бикарбоната натрия при дыхательном ацидозе повышена (при метаболическом снижена), поэтому его назначение приводит к быстрому развитию метаболического алкалоза (см. ниже). Остальные признаки дыхательного ацидоза (снижение сердечного выброса, чувствительности к катехоламинам и инсулину) аналогичны таковым при метаболическом ацидозе.
Клинический пример. В приемный покой поступил пациент с хроническим обструктивным заболеванием легких (рН 7,34, рСО2 55 мм рт.ст., НСО-3 29 мэкв/л).
Этап 1. рН < 7,37, т.е. это ацидоз.
Этап 2. рСО2 и НСО-3 увеличены, т.е. это дыхательный ацидоз.
Этап 3. Расчет нормальной компенсаторной реакции. Увеличение НСО-3 должно равняться: 4× рСO2/10 = 4 × 15/10 = 6. Таким образом, ожидаемая величина НСО3- = 24 + 6 = 30, а реальная - 29, что практически соответствует расчетной. Следовательно, это простое нарушение КЩР.
Этап 4 (корреляция с клинической картиной). У пациента хронический дыхательный ацидоз вследствие гиповентиляции.
Метаболический алкалоз
Метаболический алкалоз характеризуется первичным повышением уровня бикарбоната с компенсаторным повышением рСО2 крови. Таким образом, физиологическая реакция на первичный метаболический алкалоз - вторичный дыхательный ацидоз, клинически проявляющийся урежением и ослаблением дыхания.
Метаболический алкалоз - наиболее распространенная форма нарушений КЩР у больных, находящихся в отделениях интенсивной
терапии, вероятно, из-за широкого и часто необоснованного применения диуретиков. В последние годы метаболическому алкалозу придают значительно большее значение, поскольку это состояние трудно поддается коррекции; в частности, в случаях с повышением рН сыворотки крови более 7,55 летальность может достигать 40%.
Сложность проблемы метаболического алкалоза связана не только с различными расстройствами, возникающими на его фоне, но и со способностью алкалоза поддерживать самого себя, несмотря на устранение некоторых причин, его вызвавших. В основном это обусловлено истощением запасов хлоридов, что ограничивает экскрецию бикарбоната почками путем усиления реабсорбции и угнетения его секреции в почечных канальцах.
Различают два основных типа метаболического алкалоза, при котором почки задерживают бикарбонат. Они отличаются по реакции на терапию хлоридом натрия, а также по уровню хлоридов в моче.
Хлоридчувствительный метаболический алкалоз. Хлориды теряются в большей степени, чем натрий (неважно, каким образом - через ЖКТ или мочевыводящие пути). Концентрация хлоридов в моче менее 10 ммоль/л. Потеря хлоридов приводит к задержке натрия и соответственно бикарбоната почками. Этот тип алкалоза хорошо поддается лечению хлоридом натрия. Причинами данного типа алкалоза могут выступать потери хлоридов через ЖКТ (рвота, диарея) и мочевыводящие пути (например, прием диуретиков).
Хлоридрезистентный метаболический алкалоз развивается в результате прямой стимуляции почек к задержке бикарбоната независимо от потребления и потери электролитов. Концентрация хлоридов в моче - более 10 ммоль/л. Этот тип алкалоза не поддается лечению хлоридом натрия. К причинам данного типа алкалоза относят гиперкортицизм любой этиологии, применение щелочей в виде бикарбоната натрия (например, при кардиореанимации) или в виде органических ионов (например, лактата, цитрата и ацетата, метаболизирующих в бикарбонат в печени), а также синдромы Барттера и Гительмана.
Синдром Барттера - наследственное заболевание с выраженным снижением АД и объема циркулирующей крови из-за потери солей с почками (дополнительный компонент артериальной гипотензии - резистентность рецепторов к ангиотензину II), гипокалиемическим алкалозом, гиперкальциурией и нормальным содержанием магния в сыворотке. Последние две особенности отличают пациентов
с этим синдромом от пациентов с синдромом Гительмана, у которых в дополнение к гипокалиемическому алкалозу и потере солей обнаруживают гипокальциурию и гипомагниемию. Пациенты тяжело больны с рождения при обоих синдромах, при длительном течении часто развивается нефрокальциноз, ведущий к почечной недостаточности. Гипокалиемия приводит к увеличению продукции простагландинов в почках (которые в свою очередь увеличивают продукцию альдостерона как прямо, так и опосредованно через ренин-ангиотензиновую систему). Несмотря на это гипокалиемия per se подавляет выработку альдостерона, результирующий эффект при синдромах Барттера и Гительмана - незначительный гиперальдостеронизм (биологический смысл - поддержание нормального АД). Чувствительность рецепторов к ангиотензину II восстанавливается при адекватной инфузионной терапии, назначении ингибиторов синтеза простагландинов (нестероидных противовоспалительных средств) или пропранолола. Таким образом, резистентность к ангиотензину II - вторичный феномен при синдромах Барттера и Гительмана.
Клиническая картина. Метаболический алкалоз можно заподозрить по редкому и поверхностному дыханию, изменениям в периферической и центральной нервной системе, напоминающим таковые при гипокальциемии (нарушения сознания различной степени выраженности, парестезии, предрасположенность к судорогам) и увеличению сердечного выброса.
Дыхательный алкалоз
Дыхательный алкалоз характеризуется первичным снижением уровня рСО2 вследствие альвеолярной гипервентиляции и компенсаторным снижением бикарбоната. Как правило, он имеет вторичный характер (развиваясь в ответ на метаболический ацидоз). Любое нарушение, связанное с центральной или периферической стимуляцией дыхательного центра, приводит к развитию первичного дыхательного алкалоза. К причинам дыхательного алкалоза относят центральную стимуляцию дыхательного центра (истерия, начинающийся грамотрицательный сепсис, отравление салицилатами, патология ЦНС), периферическую стимуляцию (любое состояние, сопровождающееся гипоксией, например тромбоэмболия легочной артерии) или другие причины (печеночная недостаточность, неконтролируемая гипервентиляция при ИВЛ, гипертиреоз, беременность).
Клиническая картина в целом аналогична таковой при метаболическом алкалозе.
Клинический пример. В приемный покой поступила 30-летняя беременная женщина с тошнотой и рвотой (pH 7,55, рСО2 25 мм рт.ст., 22 мэкв/л). Этап 1. рН > 7,44, т.е. это алкалоз.
Этап 2. рСО2 и НСО3 снижены, т.е. это дыхательный алкалоз. Этап 3. Расчет ожидаемого снижения НСО-3
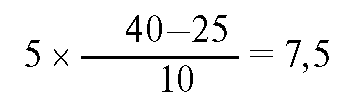 Таким
образом, бикарбонат должен снизиться до 16,5 ммоль/л (24-7,5). Реальное
значение бикарбоната 22 ммоль/л, что свидетельствует об относительном
метаболическом алкалозе. Таким образом, это смешанное нарушение КЩР.
Таким
образом, бикарбонат должен снизиться до 16,5 ммоль/л (24-7,5). Реальное
значение бикарбоната 22 ммоль/л, что свидетельствует об относительном
метаболическом алкалозе. Таким образом, это смешанное нарушение КЩР.
Этап 4. У пациентки дыхательный алкалоз вследствие беременности и относительный метаболический алкалоз вследствие рвоты.
Диагностика основана на измерении параметров газов артериальной крови, повышении содержания хлоридов сыворотки и снижении уровня свободного ионизированного кальция. Последнее связано с тем, что меньшее количество ионов водорода связывается с белками плазмы, соответственно с ними может связаться большее количество ионизированного кальция.
1.2. БЕЛКИ И СУБСТРАТЫ
Определение содержания общего белка плазмы (сыворотки) крови - элемент комплекса профилактических и лечебных мероприятий уже на начальном этапе оказания медицинской помощи. Большинство белков плазмы крови синтезировано в гепатоцитах. Катаболизм многих белков плазмы крови происходит в эндотелиальных клетках капилляров и системе функциональных фагоцитов - моноцитов и макрофагов - после поглощения белков путем пиноцитоза. Белки с небольшой молекулярной массой проходят через фильтрационный барьер почечных телец в первичную мочу, из которой их реабсорбируют эпителиальные клетки проксимальных канальцев и катаболизируют до аминокислот.
Содержание белков во внутрисосудистом пространстве в каждый момент времени - результат постоянного равновесия, имеющегося между синтезом и секрецией белков в кровь, поглощением
их клетками, процессами катаболизма и экскрецией низкомолекулярных белков с мочой. Кроме того, постоянный обмен белками происходит между внутрисосудистым и внесосудистым пулом внеклеточной жидкости. Поддержание постоянства внутрисосудистого объема крови осуществляет коллоидно-осмотическая система. Постоянство онкотической составляющей осмотического давления в крови обеспечивает альбумин.
Группы белков плазмы крови
Плазма крови содержит смесь белков, различных как по происхождению, так и по их функции. Для многих белков их функции еще не установлены. В сыворотке крови идентифицировано несколько десятков индивидуальных белков, имеющих диагностическое значение. В патологических ситуациях изменяется главным образом не общее содержание белка, а значительно увеличиваются или уменьшаются отдельные его составляющие с появлением в ряде случаев белков, не содержащихся в нормальных условиях.
Компоненты системы свертывания крови и множество пептидных гормонов в функциональном отношении охарактеризованы достаточно хорошо. Только несколько из циркулирующих в крови ферментов имеет здесь реальную физиологическую функцию, большинство же из них попадает в кровоток в результате разрушения клеток. Все белки системы комплемента функционально значимы, как и большая группа белков острой фазы, содержание которых в ходе воспалительного процесса возрастает на два порядка.
Большую функциональную группу белков плазмы крови составляют транспортные белки с более или менее выраженной специфичностью. Они переносят в кровотоке от клеток к клеткам гидрофобные (водонерастворимые) вещества и соединения - гормоны, метаболиты, витамины, жирные кислоты и их транспортные формы - триглицериды (ТГ) и фосфолипиды, ионы кальция, железа, меди, а также лекарственные препараты. Основной транспортный белок кровотока - альбумин. Связанный с носителем пул биологически активных веществ в крови функционально неактивен. В силу гораздо более высокого сродства клеточных рецепторов к этим веществам при омывании кровью тканей-мишеней равновесие в связывании биологически активных соединений нарушается, и их могут связывать клетки со специфическими рецепторами на мембране.
Общий белок
Плазму крови, экссудаты и транссудаты можно использовать в качестве биологического материала. Все они дают сравнимые результаты, хотя из-за присутствия фибриногена уровень общего белка в плазме крови на 2-4 г/л выше, чем в сыворотке. Белок стабилен в сыворотке и плазме крови в течение недели при комнатной температуре, по крайней мере до 2 мес при -20 °С. Гемолиз дает ложноположительное увеличение общего белка на 3% на каждый 1 г свободного гемоглобина в 1 л сыворотки крови.
Содержание общего белка у мужчин и женщин в среднем составляет 66-81 г/л. Результаты для мужчин примерно на 1 г/л выше, чем для женщин. При беременности концентрация белка в сыворотке крови заметно уменьшается - с 69 до 61 г/л к моменту родов. Не отмечено различий в концентрации белка сыворотки до и после еды.
Физиологические колебания содержания общего белка в сыворотке крови зависят в большинстве случаев от изменения объема жидкой части крови и в меньшей степени связаны с синтезом или потерей белка. В норме содержание белка в сыворотке крови одинаково как у вегетарианцев, так и у людей с обычным характером питания, хотя нагрузка белком может увеличить в крови содержание общего белка. Высокая физическая активность способствует только незначительному повышению в крови содержания общего белка.
Гипопротеинемия. Некоторое уменьшение концентрации общего белка в сыворотке крови происходит с возрастом. У новорожденных концентрация белка в сыворотке крови составляет 57 г/л, увеличивается до 60 г/л к 6 мес и достигает уровня у взрослых к 3 годам жизни. У недоношенных детей содержание может быть ниже, чем у родившихся в срок (36-60 г/л). Изменение положения тела дает значимое различие в концентрации белка сыворотки крови. Общий белок сыворотки крови ниже на 4-8 г/л у людей в положении лежа, чем у людей в положении стоя. Содержание белка может быть увеличено на 4-8 г/л через несколько часов после физических нагрузок.
Содержание белка в сыворотке крови первоначально зависит от синтеза в печени и потери белков с мочой при заболеваниях почек. Некоторое снижение содержания белка может быть вызвано недостаточным поступлением с пищей, нарушениями пищеварения, всасывания. Хронические заболевания печени также уменьшают уровень общего белка в сыворотке крови. Заболевания почек (гломерулонефрит, нефротический синдром и некоторые заболевания проксимальных
канальцев) могут вызвать хроническую потерю белка из сыворотки крови. Когда содержание общего белка в сыворотке крови снижается до 40 г/л, развиваются отеки.
Гиперпротеинемия. Увеличение общего белка в сыворотке крови может быть вызвано явлениями дегидратации или быть результатом накопления иммуноглобулинов; последнее часто наблюдают у пациентов с моноклональной гаммапатией.
На концентрацию белков в плазме крови сильно влияет содержание в плазме крови воды (величина гематокрита). В остальных ситуациях определение общего белка в сыворотке крови не позволяет провести органотопическую диагностику, однако широко используется при скрининге и профилактических осмотрах. Снижение содержания белков в плазме крови далеко не всегда отражает нарушенный белковый обмен.
Методы определения
Идеальным для определения общего белка был бы метод, не зависящий от вида белка. Однако в настоящее время с помощью всех методических приемов определения содержания общего белка в сыворотке крови со значительно большей аналитической чувствительностью и специфичностью устанавливают концентрацию доминирующего вида белка. Кроме того, некоторые белки в крови связаны с липидами и углеводами, что также накладывает отпечаток на методы их количественного определения. Особенность общего белка как определяемого соединения - его выраженная гетерогенность уже в физиологических условиях, которая становится более выраженной при разных видах патологии.
Наиболее часто используемый для определения общего белка в сыворотке метод основан на биуретовой реакции. В ней ионы меди взаимодействуют с атомами азота пептидной связи белка. Образуемый комплекс реагирует с биуретом (карбамилмочевиной) в сильно щелочной среде (обычно NaOH) с образованием окрашенного в сиреневый цвет продукта конденсации с максимальной абсорбцией при длине волны 450 нм.
Метод Лоури и соавт., широко используемый для количественного определения белка, может быть применен и для анализа общего белка сыворотки крови. В этом методе белок в пробе предварительно обрабатывают щелочным раствором меди. После добавления фенолового реактива при связывании медно-белкового комплекса с тирозином и
триптофаном в цепях белковых молекул образуется хромоген с максимумом абсорбции при длине волны 745-750 нм. Цистин, цистеин и гистидин также реагируют в этих условиях, но в меньшей степени.
Многие белки сыворотки и плазмы крови определяют при использовании более специфичных методов (реакция Аг-АТ) или выражают в форме каталитической концентрации. Чаще всего в диагностике используют количественные параметры белков и существенно реже определяют нарушение их качественных параметров. Это относится к генетическим нарушениям первичной структуры белковых молекул.
Электрофорез (ЭФ) - наиболее распространенный метод оценки качественного состава белков сыворотки крови. Обладая разным зарядом, белки в буферном растворе движутся в электрическом поле к аноду со скоростью, пропорциональной величине их отрицательного заряда. Использование одного из носителей, чаще ацетата целлюлозы, применение буферной системы с постоянными рН и ионной силой, оптимизация параметров электрического поля и времени разгонки позволяют стандартизировать процедуру ЭФ и получать воспроизводимые результаты.
Альбумины и глобулины
Окрашивание белков сыворотки крови и последующая процедура денситометрии позволяют получить 5 фракций белков, именуемых по скорости их движения как альбумин, α1-, α2-, β- и γ-глобулины (рис. 1.4). Каждая из фракций глобулинов содержит несколько специфических белков. Процедура ЭФ позволяет установить:
• снижение содержания альбумина;
• увеличение одной или нескольких фракций глобулинов;
• появление фракции глобулинов, отсутствующих в крови здорового человека.
Фракция альбумина гомогенна, перед ней иногда можно обнаружить белок, связывающий тиреоидные гормоны. Во фракции α-глобулинов доминирует α1-антитрипсин - ингибитор протеиназ. Фракцию α2-глобулинов формируют в основном α2-макроглобулин и гаптоглобин. β-лобулины часто представлены двумя нечеткими пиками, которые формируют трансферрин и апоВ-100; второй пик содержит в основном компонент комплемента C3. Во фракции γ-глобулинов (иммуноглобулинов) отдельные белковые цепи - это компоненты β-глобулинов.
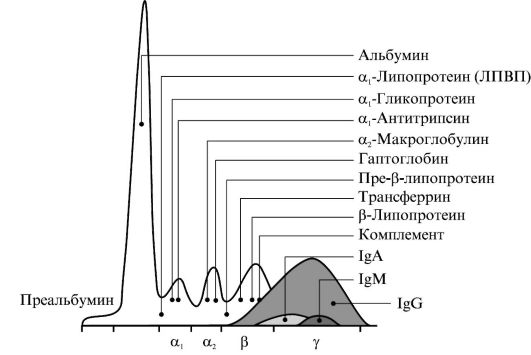 Рис. 1.4. Электрофореграмма белков сыворотки крови
Рис. 1.4. Электрофореграмма белков сыворотки крови
Снижение интенсивности окраски всех фракций белка при ЭФ может указывать на нарушение всасывания белков в тонкой кишке или выраженное разведение плазмы крови. Противоположную картину можно наблюдать при выраженном сгущении крови при существенном увеличении показателя гематокрита. Развитие синдрома воспаления вне зависимости от его этиологии будет сопровождаться выраженным увеличением в крови белков острой фазы и увеличением фракции α1- и α2-глобулинов. В наибольшей степени при этом возрастает в крови содержание С-реактивного белка, ингибитора протеиназ и амилоида А.
При хроническом воспалительном процессе в крови увеличивается содержание фракции γ-глобулинов. В условиях обострения хронического процесса возможно одновременное увеличение в крови содержания фракций γ-, α1- и α2-глобулинов. При снижении синтетической функции гепатоцитов в крови понижается содержание альбумина, α1- и α2-глобулинов при существенном увеличении фракции γ-глобулинов. Напротив, в условиях лечения цитостатиками фракция γ-глобулинов может быть существенно снижена или даже отсутствовать.
При нефротическом синдроме изменения во фракциях белка зависят от особенностей патологического процесса. В начальной
стадии патологический процесс может проявляться только выраженной гипоальбуминемией. Позднее через фильтрационный барьер почечных телец проходят также α1- и α2-глобулины. При выраженном необратимом повреждении мембраны в мочу могут выходить и γ-глобулины.
БИЛИРУБИН
Билирубин - тетрапиррольный пигмент с молекулярной формулой С33Н56N406 и молекулярной массой 584,65 Д. В организме билирубин образуется в процессе катаболизма геминовой части гемоглобина (протопорфирина IX) эритроцитов, закончивших свой жизненный цикл. Гемоглобин подвергается разрушению главным образом в клетках РЭС селезенки и печени. Таким же путем билирубин образуется в клетках РЭС при катаболизме других гемсодержащих белков (миоглобин, каталаза, пероксидаза), правда, в значительно меньшем количестве. При резорбции гематомы билирубин формируется в месте кровоизлияния. При среднем времени жизни эритроцитов 120 дней в сутки в организме формируется билирубин в количестве 3,8 ± 0,6 мг/кг массы тела.
Билирубин - неполярная молекула; он почти не растворяется в воде, но хорошо растворим в щелочной среде благодаря ионизации карбоксильных групп и возрастающей полярности. В сыворотке крови стабильность билирубина в водной среде объясняется связыванием с альбумином.
Билирубин, попадая из клеток РЭС в сыворотку крови, электростатически взаимодействует с альбумином и транспортируется в печень. Эта фракция носит название неконъюгированного (свободного) билирубина. Гепатоциты активно захватывают билирубин из крови - за 18 мин из крови исчезает 50% экзогенного билирубина. Поглощение гепатоцитами из крови неконъюгированного билирубина - активный процесс, в котором принимают участие лиганд и специфический белок протеин Z.
В гепатоцитах карбоксильные группы билирубина взаимодействуют с гидроксильными группами углеводов (глюкуроновые кислоты), формируя эфиры, преимущественно диглюкурониды билирубина (конъюгированный билирубин). Образование эфирной связи между билирубином и двумя молекулами глюкуроновой кислоты катализирует уридиндифосфат-глюкуронилтрансфераза (КФ 2.4.1.17). Так же образуются и другие конъюгаты билирубина (сульфаты, фосфаты, гликозиды, ксилозиды), но их физиологическое значение остается
неясным. Полярные молекулы конъюгированного (связанного) билирубина растворимы в воде.
Конъюгированный билирубин экскретируется с желчью, накапливается в желчном пузыре, затем выделяется в тонкую кишку, где при действии микробной флоры восстанавливается с образованием бесцветных пирролов (уробилиногенов). Большинство образованных уробилиногенов окисляется в уробилины и покидает организм с калом или мочой. Некоторое количество уробилиногенов может быть абсорбировано в кишечнике и по портальной системе поступает в печень. Небольшую часть конъюгатов билирубина в толстой кишке гидролизует бактериальная β-глюкуронидаза с образованием неконъюгированного билирубина, который также может поступать по портальной системе в печень. Когда уровень конъюгированного билирубина в сыворотке крови достаточно высок, он проходит через фильтрационный барьер почечных телец и экскретируется с мочой. Неконъюгированный билирубин, прочно связанный с альбумином в сыворотке крови, не проходит через фильтрационный барьер почечных телец.
В норме конъюгированный (прямой, связанный) билирубин составляет менее 1/5 содержания пигмента в сыворотке крови, неконъюгированный (непрямой, свободный) - 4/5.
Клиническое значение гипербилирубинемии
Содержание общего билирубина в сыворотке крови в норме не превышает 15 мг% (25,7 мкмоль/л), среднее значение - 7 мг% (12 мкмоль/л), при более высоких значениях используют термин «гипербилирубинемия». Как у мальчиков, так и у девочек содержание билирубина увеличивается после пубертатного возраста, снижается после 30 лет и далее остается стабильным. Небольшие половые различия в уровне билирубина в сыворотке крови практического значения не имеют. Содержание билирубина в крови не превышает 25 мкмоль/л в норме, наличие в сыворотке крови 50 мкмоль/л билирубина можно определить визуально (незначительная желтуха), а при повышении содержания билирубина до 100 мкмоль/л уже ясно выражена желтушность кожных покровов.
Считается, что гипербилирубинемия имеет печеночное происхождение, если более 80% общего билирубина составляет конъюгированный билирубин. Гипербилирубинемию рассматривают как гемолитическую, если более 80% общего билирубина представлено неконъюгированным пигментом.
Умеренное повышение содержания в крови неконъюгированного (непрямого, свободного) билирубина происходит при повышенном образовании из гемоглобина при усиленном разрушении эритроцитов в селезенке; конкурентном вытеснении неконъюгированного билирубина из связи с альбумином (салицилаты, желчные кислоты, сульфаниламиды, тетрациклины); нарушении захвата гепатоцитами неконъюгированного билирубина из крови; недостаточной активности уридиндифосфат-глюкуронилтрансферазы гепатоцитов, которая осуществляет конъюгирование билирубина. Различают наследственную и приобретенную недостаточность глюкуронилтрансферазы. К первой относят, в частности, синдром Криглера-Найяра.
Гемолитическая гипербилирубинемия обычно достигает 75 мкмоль/л. Длительное умеренное повышение содержания неконъюгированного билирубина в крови отмечают при сердечной недостаточности. Неконъюгированный билирубин особенно токсичен для нервных клеток; связывание с альбумином делает его менее токсичным. Для определения связывающей способности альбумина по отношению к билирубину используют хроматографию на сефадексе. Для прояснения специальных случаев патологии применяют методы электрофоретического определения билирубина, обнаруживая связывание пигмента с отдельными фракциями белка. Накопление в крови конъюгированного билирубина обусловлено двумя факторами: снижением активности экскреции пигмента при внутриклеточном холестазе; холестатическими процессами с гипертензией в желчных протоках и затруднением выхода пигмента из гепатоцитов против градиента концентрации (внепеченочный холестаз). В обеих ситуациях конъюгированный билирубин оказывается в крови. Желтуху классифицируют как острую гепатоцеллюлярную (гепатит), хроническую гепатоцеллюлярную (цирроз), обструкцию желчных ходов, внепеченочный холестаз. При гепатоцеллюлярном поражении конъюгированная фракция составляет меньшую долю общего билирубина, чем при внеклеточном блоке. Повышение содержания билирубина в крови при гепатотоксическом влиянии фармакологических препаратов - как правило, проявление легкого внутрипеченочного холестаза, а не аналитической интерференции лекарственных препаратов. Повышение в крови содержания конъюгированного билирубина характерно для острого вирусного гепатита, лекарственного и токсического гепатита, метастазов в печень.
Высокое содержание билирубина в крови новорожденных с гемолитической желтухой связано со значительным риском неврологических
осложнений. Билирубин способен откладываться в тканях, в том числе в коже, при этом содержание его в разных участках кожи неодинаково.
Новые аналитические методы не поколебали уверенность в том, что определение повышенной концентрации неконъюгированного билирубина отражает деструкцию эритроцитов, а конъюгированный билирубин доминирует при обструктивных процессах в печени.
Методы определения
Несмотря на длительное применение исследования билирубина в клинической практике, до настоящего времени полностью не решены аналитические проблемы исследования пигмента. Ряд серьезных трудностей обусловлен характерными свойствами пигмента - нерастворимостью в воде и нестабильностью соединения. Наличие двух форм билирубина в сыворотке крови затрудняет стандартизацию определения общего билирубина. Определение как прямого, так и общего билирубина не вполне специфично, соотношение сво- бодный/конъюгированный билирубин недостаточно точно, так как большинство диазометодов (см. ниже) значительно завышает уровень конъюгированного билирубина. Это следует принимать во внимание, поскольку соотношение прямого и непрямого билирубина используют в дифференциальной диагностике гипербилирубинемии.
Содержание общего билирубина в сыворотке крови можно определить методом прямой спектрофотометрии при длине волны 450-460 нм. В условиях прямой спектрофотометрии получаемые оптические плотности необходимо скорригировать на величину интерференции гемоглобина. С этой целью созданы двухволновые спектрофотометры (билирубинометры), измеряющие оптическую плотность при длине волны 454 и 540 нм. Невозможность раздельного определения свободного и конъюгированного билирубина в пробе затрудняет трактовку результатов. Другие хромогены сыворотки крови (каротин и ксантофил) также оказывают влияние на результаты определения.
Стандартизация билирубинометров представляет большие трудности, поскольку спектр связанного с альбумином пигмента отличается от свободного билирубина в стандарте. Из этого следует, что стандарт при прямой спектрофотометрии билирубина должен быть приготовлен с использованием альбумина человека. Метод прямой спектрофотометрии применяют для оценки гипербилирубинемии у младенцев с гемолитической желтухой новорожденных и определения содержания
пигмента в околоплодных водах с целью пренатальной диагностики этого заболевания.
Необходимость оценки гипербилирубинемии при гемолитической желтухе новорожденных стимулировала создание новых способов диагностики, включая методы оценки цвета кожи. Чрескожная оценка гипербилирубинемии основана на отражательной спектрофотометрии и позволяет получить только полуколичественные данные об уровне пигмента.
Наиболее широко используемые методы определения билирубина основаны на его взаимодействии с диазореагентом (реактивом Эрлиха). Реакция взаимодействия диазотированной сульфаниловой кислоты с углеродным атомом метиленовой группы билирубина протекает в два этапа, на каждом образуются изомеры азодипиррола, спектры их абсорбции практически идентичны с максимумом при длине волны 530 нм. Для прохождения второго этапа необходим избыток сульфаниловой кислоты. В прямую реакцию с диазореактивом Эрлиха вступает только растворимый, конъюгированный (прямой) билирубин. Для определения уровня общего билирубина необходимо добавить в реакционную среду «ускоритель», способствующий растворению неконъюгированного билирубина и/или отщеплению его от молекулы альбумина. В сумме эти реакции дают представление о содержании в сыворотке крови общего, конъюгированного и неконъюгированного (прямого и непрямого) билирубина.
Широкое распространение получил метод Ендрассика-Грофа. В этом методе в качестве «освободителя» билирубина используют смесь кофеина и бензоата натрия в ацетатном буфере. Реакция протекает при pH 6,5, но абсорбцию хромогена измеряют при pH 13,0 после добавления щелочи. В щелочной среде азодипиррол имеет максимум абсорбции при длине волны 600 нм. Преимущества метода Ендрассика-Грофа - более короткое время реакции (1 мин для определения прямого и 10 мин для определения общего билирубина), отсутствие преципитации белков, высокая чувствительность и воспроизводимость. Предложенные впоследствии модификации включали замену кофеина на дифиллин и добавление в реакционную смесь аскорбиновой кислоты и йодида калия для нейтрализации избытка диазореагента.
Ферментативное определение билирубина основано на его окислении билирубиноксидазой, выделенной из грибов Myrothecium verrucaria. Билирубиноксидаза катализирует окисление билирубина в бесцветный биливердин, при этом при длине волны 460 нм исчезает
абсорбция, свойственная билирубину. Предложенный метод позволяет определить не только уровень общего билирубина, но и его фракций. Определение фракций билирубина основано на разном сродстве фермента к ним при различном рН в присутствии или отсутствии анионного детергента додецилсульфата натрия или холата натрия. Метод более специфичен, чем метод Ендрассика-Грофа.
Возможно определение неконъюгированного билирубина и другим методом ферментативного окисления. Пероксидазу добавляют к пробе вместе с Н2О2, при этом билирубин окисляется в бесцветный продукт с одновременным падением оптической плотности билирубина при длине волны 460 нм; метод нашел применение при исследовании билирубина в крови новорожденных.
Билирубин слабо флюоресциирует в водных растворах, но в комплексе с альбумином эффективность флюоресценции возрастает, что позволяет определять связанный с белком билирубин. Возбуждение комплекса билирубин-альбумин происходит при длине волны 430 нм, испускание - при 520 нм. На этом принципе работают гематофлюориметры; прибор позволяет оценить в капле крови уровень связанного с белком билирубина, а после обработки детергентом - и уровень общего билирубина. Преимущества метода - возможность использования микропроб крови, хорошая воспроизводимость и корреляция с методом Ендрассика-Грофа.
В настоящее время все большее распространение, особенно при экспресс-диагностике, получает определение билирубина методами «сухой химии». При нанесении капли крови на полоску реактивы вступают в реакцию, формируя те же азопиррольные производные. Оценку результатов реакции проводят методом отражательной спектрофотометрии при длине волны 560 нм. Методы «сухой химии» часто используют для определения билирубина в моче.
КРЕАТИНИН
Креатинин формируется в процессе спонтанного и необратимого превращения креатина. Синтез креатина - двухступенчатый процесс, происходящий в почках, эпителии тонкой кишки, поджелудочной железе и, возможно, в печени. Образование креатинина в организме - величина постоянная - около 2% креатина превращается в креатинин в течение 24 ч. Образование креатинина зависит от массы мышц и в меньшей степени от массы тела. Оно не меняется при сепсисе, травмах, лихорадке, не зависит от степени гидратации
организма, повышенного потребления белка, что, однако, может повысить экскрецию креатинина в пределах 10%.
Свободный креатинин - единственный продукт катаболизма креатина, не участвующий в метаболизме. Креатинин присутствует в сыворотке крови, поте, желчи, содержимом кишечника, он преодолевает гематоэнцефалический барьер и появляется в спинномозговой жидкости. Креатинин фильтруется через базальную мембрану гломерул и в норме не подвержен реабсорбции в тубулярном отделе нефрона. В то же время в условиях повышенной концентрации креатинина в крови часть его активно экскретируют клетки тубулярного эпителия. Уровень креатинина в крови определен его продукцией и элиминацией через фильтрационный барьер почечных телец, т.е. клиренсом креатинина.
Клиническое значение
В нормальном состоянии образование креатинина и его элиминация эквивалентны. В условиях острой почечной недостаточности при значительном падении уровня гломерулярной фильтрации концентрация креатинина в первые дни может быть в пределах нормы и не отражать нарушение функции почек.
Повышение уровня креатинина и мочевины в крови - признак почечной недостаточности. В то же время определение содержания креатинина - более надежный тест, так как повышение концентрации его в крови происходит раньше, чем повышение концентрации мочевины. Образование креатинина не связано с метаболизмом экзогенного белка, в то время как мочевина - основная катаболическая форма белка пищи. Мочевина образуется в печени, фильтруется гломерулярным фильтром и активно реабсорбируется в тубулярной части нефрона, поэтому содержание мочевины в крови зависит не только от нефрогенных факторов. Лихорадка, олигурия, дегидратация приводят к увеличению концентрации мочевины в крови. В свою очередь малобелковая диета и полиурия снижают уровень мочевины крови, не оказывая влияния на содержание креатинина.
Креатинин в моче исследуют главным образом для учета экскреции многих физиологически значимых соединений. Исследование экскреции с мочой гормонов, ферментов и метаболитов во многих случаях составляет основу диагностического процесса. Учитывая, что креатинин не встречает препятствия при экскреции, предложено проводить расчет экскреции анализируемого компонента на 1 мг
экскретируемого с мочой креатинина. Такой подход верен только при учете экскреции исследуемых веществ в короткие промежутки времени (после криза или при проведении функциональных тестов). Это в полной мере относится к соотношению белок мочи/креатинин, амилаза/креатинин мочи, отношению экскреции стероидов и катехо- ламинов/креатинин, одновалентным катионам и другим субстратам.
Методы определения
Щелочной пикрат натрия используют как аналитический реагент для определения креатинина с 1886 г. Вначале реакцию использовали для определения креатинина в моче, позже применяли для определения креатинина сыворотки крови после депротеинизации. Однако до сих пор немного известно о механизме реакции и структуре образующихся продуктов. Реакция креатинина с пикриновой кислотой (реакция Яффе) неспецифична. В принципе каждое вещество, имеющее активную метильную группу, может реагировать с пикратом в описанных условиях. Это относится к ацетоацетату, ацетону, β-оксибутирату, билирубину, глюкозе, фруктозе, оксалоацетату, пирувату, мочевой кислоте. Из лекарственных препаратов в реакцию со щелочным пикратом могут вступать аспирин, амитриптилин, ампициллин, аскорбиновая кислота, фуросемид, пропранолол, салициловая кислота, тетрациклин, толбутамид, антибиотики цефалоспоринового ряда. Из антикоагулянтов на результаты определения уровня креатинина оказывают влияние ЭДТА, гепарин, цитрат, оксалат. Это послужило основой многочисленных модификаций, направленных на повышение специфичности метода определения креатинина.
Депротеинизация сыворотки крови кислотой заменена использованием детергентов (додецилсульфат натрия, тритон Х-100), что предотвращало преципитацию белков в кислой среде. В реакционную смесь был включен боратный буфер с целью комплексования углеводов и кетокислот, для удаления их из реакционной смеси до взаимодействия с пикратом. Предварительное окисление вызывает обесцвечивание билирубина и некреатининовых хромогенов.
Важный момент реакции Яффе - поддержание pH в реакционной смеси. Даже слабое изменение рН приводит к вариабельности результатов. При pH менее 7,0 реакция Яффе происходит, но повышение pH до 10,0 значительно увеличивает скорость развития окраски, которая достигает максимума при рН 12,5. При более высоком значении pH можно достигнуть полного образования комплекса креатинин-пикрат
со сведением неспецифичной реакции хромогенов до минимума.
Проведенными исследованиями показано, что влияние некреатининовых хромогенов зависит от времени добавления пикриновой кислоты, после чего кинетика образования пикратного комплекса с креатинином и другими хромогенами имеет временные различия.
Применение кинетического метода исследования креатинина позволяет в первую очередь избежать фотометрических ошибок, а во вторую - значительно повысить специфичность метода, учитывая различие в кинетике реакции со щелочным пикратом натрия креатинина и интерферирующих субстанций. Кинетическое измерение реакции проводят в тот временной интервал, когда реакция щелочного пикрата с хромогенами оказывается низкой по сравнению с креатинином. Этот принцип используют наиболее часто. Существование «медленных» и «быстрых» хромогенов сыворотки крови привело к предложению регистрировать скорость нарастания абсорбции по истечении 60 с после добавления пикрата. В автоматизированных методах кинетику реакции считывают в интервале 20-80 с после добавления пикрата.
Реакция с пикратом - не единственная для определения креатинина. Предложены также метод с 1,4-нафтохинол-2-сульфонатом и метод превращения креатинина в метилгуанидин с последующим определением его в реакции Сакагуши, в которой метилгуанидин реагирует с α-нафтолом и хлоридом натрия с образованием хромогена красного цвета. Эти методы не имеют преимуществ перед пикратом, но нашли применение в отработке реакции на твердой фазе.
Выделяют три группы ферментативных методов определения креатинина. Методы с использованием креатиназы связаны с относительной доступностью фермента, но они завышают низкие концентрации креатинина. Во второй группе методов, основанных на использовании креатининазы, используют сопряженные ферментативные реакции. Скорость изменения абсорбции реакционной смеси при длине волны 340 нм прямо пропорциональна количеству присутствующего в среде креатинина. Эндогенные креатинин и пируват удаляют преинкубацией с соответствующими ферментами. Третья группа ферментативных методов включает комбинированное использование креатининазы и креатиназы. Реакции приводят к образованию хромогена, имеющего пик абсорбции при длине волны 510 нм. Эндогенное влияние креатина преодолевают выполнением преинкубации сыворотки крови с КК.
В качестве референсных методов определения креатинина предложено использовать газожидкостную и высокоэффективную жидкостную хроматографию. По сравнению с реакцией Яффе референсные методы дают более низкие результаты содержания креатинина как в сыворотке крови, так и в моче.
МОЧЕВАЯ КИСЛОТА
Мочевая кислота - основной продукт катаболизма пуриновых нуклеозидов, входящих в состав нуклеиновых кислот, макроэргических соединений (АТФ, АДФ), АМФ, некоторых витаминов. Мочевая кислота - конечный продукт обмена пуринов лишь у человека и высших обезьян. У остальных млекопитающих мочевая кислота выступает в роли промежуточного продукта их метаболизма. Под влиянием уриказы мочевая кислота окисляется до аллантоина, обладающего большей растворимостью в воде.
Мочевая кислота имеет молекулярную массу 168 Д. Из эндогенных нуклеозидов в организме человека формируется около 500 мг мочевой кислоты в сутки, из поступающих с пищей образуется примерно 200 мг.
Большая часть (75%) мочевой кислоты, поступившей из тканей в кровь, выделяется в дальнейшем с мочой; оставшаяся доля экскретируется с калом. Мочевая кислота проходит через фильтрационный барьер почечных телец, одновременно реабсорбируясь в канальцах. Эпителий проксимальных канальцев способен секретировать мочевую кислоту в мочу, но и в этом случае мочевая кислота реабсорбируется в их дистальных отделах. Около 10% мочевой кислоты, прошедшей через фильтрационный барьер почечных телец или секретированной канальцами, экскретируется с мочой. Повышенную экскрецию мочевой кислоты наблюдают при лейкозе, полицитемии, подагре, гепатите, а также при введении аспирина и кортикостероидов.
Мочевая кислота обладает низкой растворимостью в водных растворах: в 1 л дистиллированной воды удается растворить 60 мг мочевой кислоты. Вследствие плохой растворимости повышенное содержание мочевой кислоты в крови приводит к отложению ее солей (уратов) в тканях, что сопровождается формированием асептического воспаления и клинического синдрома, именуемого подагрой.
Клиническое значение
Нарушения обмена мочевой кислоты сопровождаются либо повышением (гиперурикемия), либо снижением (гипоурикемия) ее продукции.
ГИПЕРУРИКЕМИЯ
Выраженная и продолжительная гиперурикемия - условие для развития подагры. Патофизиологическая основа заболевания - кристаллизация уратов из насыщенных биологических жидкостей. Болезнь квалифицируют как первичную подагру, если в ее основе лежат врожденные нарушения метаболизма мочевой кислоты (см. ниже). Гиперпродукцию мочевой кислоты, обусловленную наследственным увеличением синтеза пуринов, отмечают у 25% пациентов с гиперурикемией.
Вторичная подагра возникает, если гиперурикемия развивается в результате другого патологического процесса, например усиленного распада лимфоидных клеток при лейкозе и лимфоме при применении цитостатиков. Подагра может быть следствием недостаточности естественных механизмов выделения мочевой кислоты почками. Гиперурикемию можно наблюдать при сахарном диабете, остром алкоголизме, врожденном дефиците глюкозо-6-фосфатдегидроге- назы, избыточной продукции лактата. В любых ситуациях сначала происходит поражение суставов.
Кристаллы уратов - нормальный компонент синовиальной жидкости, однако с их накоплением связывают развитие воспалительного процесса в суставах. Достаточно ли повышения концентрации уратов в синовиальной жидкости для развития воспалительного процесса (подагрический артрит), остается неясным. Синовиальная жидкость содержит также гликозаминогликаны в высокой концентрации, которые способствуют солюбилизации уратов даже в насыщенном растворе. Возможно, что усиленное разрушение гликозаминогликанов или снижение их поступления в полость сустава может способствовать кристаллизации уратов. Не исключено, что снижение pH синовиальной жидкости, обусловленное гиперпродукцией лактата при анаэробном гликолизе лейкоцитов, способствует кристаллизации мочевой кислоты. Полиморфноядерные лейкоциты в полости сустава фагоцитируют выпавшие кристаллы уратов, освобождают биологически активные вещества, которые и инициируют развитие воспалительной реакции. Острые приступы подагры часто связаны с интеркуррентной инфекцией; возможно, микробные токсины способствуют активации
воспалительной реакции, приводя в условиях гиперурикемии к кристаллизации уратов в тканях.
Гиперурикемия и подагра взаимосвязаны. Наиболее часто клиническая картина подагры была отмечена у пациентов с высокой концентрацией мочевой кислоты в крови: у 90% пациентов с уровнем мочевой кислоты 80-89 мг/л развилась подагра. Популяционные исследования выявили значимую корреляцию гиперурикемии и подагры с ожирением, атеросклерозом, гипертриглицеридемией и алкоголизмом. Указывается на отчетливую связь гиперурикемии и ИБС.
Гиперурикемия развивается во всех состояниях, при которых усилен обмен нуклеопротеинов. К ним относят миелопролиферативные состояния, ретикулезы, миеломатоз, гемоглобинопатии, пернициозную анемию, инфекционный мононуклеоз, метастазирование опухолей. При хроническом заболевании почек снижение скорости гломерулярной фильтрации и уменьшение числа функционирующих нефронов могут провоцировать гиперурикемию. Снижение тубулярной секреции мочевой кислоты и гиперурикемию отмечают при патологии печени, сахарном диабете, саркоидозе. Ежедневное потребление 100 мл этанола приводит к гиперурикемии и повышенной экскреции мочевой кислоты.
Диета, богатая фруктозой или сахарозой, но не глюкозой, повышает содержание мочевой кислоты в крови здоровых людей, пациентов с ожирением и больных подагрой. Механизм повышения уровня мочевой кислоты в этих ситуациях может быть связан с активацией синтеза мочевой кислоты, снижением ее экскреции с мочой или сочетанием этих факторов. Усиление разрушения АТФ в гепатоцитах при богатой сахарозой диете также способствует повышению в крови уровня мочевой кислоты.
Высокая концентрация мочевой кислоты в моче создает условия для формирования конкрементов в мочевыводящих путях. Длительная гиперурикозурия может лежать в основе формирования мочекислой нефропатии. У пациентов с усиленным катаболизмом нуклеиновых кислот и гиперурикемией может внезапно развиться олигурия или даже анурия. Острое нарушение оттока мочи возникает при отложении большого количества кристаллов уратов в канальцах. Такие же изменения наступают и при подагре: не менее 10-25% пациентов с подагрой имеют камни в почках, образованные из мочевой кислоты, что почти в 1000 раз превышает данные, полученные в популяционном исследовании. У пациентов со вторичной подагрой этот процент выше (40%).
Фармакологические препараты способствуют возникновению гиперурикемии несколькими путями: небольшие дозы салицилатов, гуанетидин, многие диуретики подавляют тубулярную секрецию мочевой кислоты. Цитотоксические препараты и радиоизлучение, разрушающие ткань опухоли, приводят к гибели клеток и высвобождению большого количества нуклеопротеинов, которые катаболизируются в мочевую кислоту. Гиперурикемия может возникнуть также при интенсивном лечении глюкокортикоидами и большими дозами аспирина.
ГИПОУРИКЕМИЯ
В ряде клинических ситуаций приходится встречаться с гипоурикемией [содержание мочевой кислоты в крови ниже 0,12 ммоль/л (2 мг%)]. Это может быть связано с недостаточностью ксантиноксидазы, другими (более редкими) врожденными нарушениями метаболизма (см. ниже), дефектом механизма реабсорбции мочевой кислоты в канальцах, влиянием препаратов, способствующих экскреции мочевой кислоты с мочой. Пониженный уровень мочевой кислоты в сыворотке крови отмечают при гепатолентикулярной дегенерации и синдроме Фанкони.
ВРОЖДЕННЫЕ НАРУШЕНИЯ ОБМЕНА ПУРИНОВ К врожденным нарушениям обмена пуринов относят недостаточность гипоксантин-фосфорибозилтрансферазы, аденинфосфорибозилтрансферазы, ксантиноксидазы, аденилосукцинатлиазы, миоаденилатдезаминазы, аденозиндезаминазы и пуриннуклеозидфосфорилазы, а также повышение активности фосфорибозилпирофосфатсинтетазы (табл. 1.3).
Недостаточность гипоксантинфосфорибозилтрансферазы. Отсутствие активности фермента приводит к синдрому Леша-Нихена, проявляющемуся только у мальчиков повышенной экскрецией мочевой кислоты и уратов, хореоатетозом, умственной отсталостью, спастическими центральными парезами, приступами агрессивного поведения со склонностью к членовредительству. При частичной недостаточности фермента развиваются острый подагрический артрит и нефролитиаз без неврологических проявлений.
Недостаточность аденинфосфорибозилтрансферазы (АМФ-пирофосфорилазы, трансфосфорибозидазы). Аденинфосфорибозилтрансфераза катализирует реакцию: АМФ + дифосфат = аденин + 5-фосфо-α-D-рибозо-1-дифосфат. Недостаточность фермента
Таблица 1.3. Врожденные нарушения пуринового метаболизма
 Примечание. К - связанное с Х-хромосомой наследование; ρ - аутосомнорецессивное наследование
Примечание. К - связанное с Х-хромосомой наследование; ρ - аутосомнорецессивное наследование
приводит к образованию в почках камней из 2,8-дигидроксиаде- нина. Клинически эта недостаточность проявляется уролитиазом без гиперурикемии и подагры. Лабораторно определяют камни из 2,8-дигидроксиаденина коричнево-красного цвета (сероватого при высыхании) и округлые коричневатые кристаллы в моче. Для лечения эффективны диета с низким содержанием пуринов и аллопуринол. Без лечения развивается почечная недостаточность.
Недостаточность ксантиноксидазы приводит к развитию наследственной ксантинурии - наследственному нарушению обмена ксантина. В этих условиях в тканях накапливается ксантин и не образуется мочевая кислота. Однако ксантин (основной пурин мочи при ксантинурии) растворяется в водных растворах не более чем мочевая кислота. В условиях ксантинурии формируется «ксантинная» подагра; количество
больных ксантинурией довольно ограничено. Клинически характерны гидронефроз, пиелонефрит и миопатия, лабораторно - ксантинурия, низкие уровни мочевой кислоты в сыворотке и моче, отложения кристаллов в скелетных мышцах и ксантиновые камни в мочевых путях.
Недостаточность аденилосукцинатлиазы. Характерны выраженная задержка психомоторного развития, судорожные припадки, мышечная слабость. В крови, спинномозговой жидкости повышено содержание риботидов сукциниладенозина и сукциниламиноимидазолкарбоксамида. У гомозигот развивается тяжелая форма аутизма (сукцинилпуринемический аутизм).
Недостаточность миоаденилатдезаминазы - наиболее частая причина метаболических миопатий (мышечная слабость и подергивания после физической нагрузки). Недостаточность может быть не только наследственной, но и приобретенной (в результате различных нервномышечных заболеваний, например миодистрофий или нейропатий).
Недостаточность аденозиндезаминазы приводит к развитию тяжелого комбинированного иммунодефицита.
Недостаточность пуриннуклеозидфосфорилазы. Этот фермент катализирует реакцию:
пуриновый нуклеозид + фосфат = пурин + α-D-рибозо-1-фосфат.
Недостаточность фермента ведет к развитию Т-клеточного иммунодефицита с выраженными неврологическими расстройствами. Кроме Т-клеточного иммунодефицита характерны спастическая диплегия, спастический тетрапарез, поведенческие расстройства, пирамидная симптоматика, гиперрефлексия, высокий риск развития В-иммунобластной злокачественной лимфомы. Лабораторно отмечают гипоурикемию, гипоурикозурию, экскрецию пуринов (особенно инозина и гуанозина) и лимфопению.
Методы определения
Концентрация мочевой кислоты в сыворотке крови может быть определена с помощью различных методов. Концентрация мочевой кислоты в сыворотке крови взрослых мужчин составляет 0,21-0,42 ммоль/л (3,6-7,7 мг%), в крови женщин уровень ее на 25% ниже. В постменопаузальном периоде половые различия в содержании мочевой кислоты в крови сглаживаются. Нет достоверных данных, свидетельствующих о повышении содержания мочевой кислоты в крови с возрастом; напротив, у новорожденных содержание
мочевой кислоты более высокое, чем у взрослых. Содержание мочевой кислоты в сыворотке крови детей младше 1 года составляет 1,0- 7,6 мг% (0,06-0,45 ммоль/л), 1-9 лет - 0,8-6,7 мг% (0,05-0,4 ммоль/л), 10-19 лет - 1,8-7,1 мг% (0,11-0,42 ммоль/л).
Выделение мочевой кислоты с мочой составляет 1,5-4,5 ммоль (250-750 мг)/сут; величина экскреции зависит также от присутствия пуринов в пище. При употреблении обычной пищи ежедневно в норме с мочой выделяется 0,7 г мочевой кислоты. Эта величина редко снижается ниже 0,5-0,6 г/сут даже при отсутствии в пище пуринов, однако может возрастать до 1 г/сут, если пища богата ими.
В течение длительного времени при определении мочевой кислоты в клинической биохимии доминировали химические колориметрические методы, основанные на ее окислении. При выполнении этих методов требуется предварительная депротеинизация. В качестве преципитирующих агентов использовали трихлоруксусную и фосфорновольфрамовую кислоты, предложена также смесь сульфата цинка и гидроокиси бария. Ультрафильтрацию для получения безбелкового фильтрата сыворотки крови применяли в первых моделях автоматических проточных автоанализаторов.
Многие фотометрические методы основаны на окислении мочевой кислоты в аллантоин и одновременном восстановлении фосфорновольфрамовой кислоты в щелочной среде с образованием синего хромогена. Для создания щелочной среды в реакционную смесь вносят карбонат, глицин, триэтаноламин. Эта реакция неспецифична: восстановление фосфорновольфрамовой кислоты вызывают (кроме мочевой кислоты) присутствующие в сыворотке крови глутатион, фенолы, аскорбиновая кислота, глюкоза, тирозин, цистин, цистеин. Многие из этих соединений содержатся в эритроцитах, поэтому гемолиз сыворотки крови при определении мочевой кислоты нежелателен.
МЕТОДЫ С ИСПОЛЬЗОВАНИЕМ УРИКАЗЫ Несмотря на преимущества отдельных модификаций, применение химических методов было вытеснено использованием уриказы. Уриказа (оксидаза мочевой кислоты, КФ 1.7.3.3) катализирует превращение мочевой кислоты в присутствии растворенного кислорода в аллантоин с образованием перекиси водорода и углекислого газа. Активность уриказы ингибируют ионы меди и ртути, а также цианиды; фосфат и ацетат активируют фермент. Присутствие в пробе ксантина может занижать результаты определения мочевой кислоты, так как ксантин конкурентно ингибирует уриказу.
1.3. ИОНЫ
Среди всех ионов, содержание которых в биологических жидкостях (средах) определяют в клинико-диагностических лабораториях, только четыре называют электролитами. Это катионы натрий и калий, а также анионы хлорид и бикарбонат. Именно они определяют ионную силу биологической среды - внеклеточной жидкости и ионного состава цитозоля. Все другие биологически важные ионы, например кальций, имеют либо регуляторное значение, либо составляют основу определенных тканей или структур, например кальций и фосфор в костной ткани, фосфор фосфолипидов биологических мембран, железо эритроцитов, микроэлементы как активные компоненты структуры активного центра ферментов и витаминов.
Определение электролитов и кальция - основа диагностического процесса при мониторировании состояния вне- и внутриклеточной среды в отделениях реанимации и неотложной терапии. Определить содержание калия и натрия методически сложно. Именно это приводит к тому, что в разных лабораториях содержание в биологических жидкостях электролитов находят методами ионоселективного (непрямого) анализа, пламенной и атомно-абсорбционной спектроскопии и существенно менее совершенным методом турбодиметрии.
ЖЕЛЕЗО
В организме взрослого человека массой 70 кг содержится 3,5-4,5 г железа, основная часть которого находится в связанной с белками форме (табл. 1.4). Связывание может быть функционально активным, как это происходит в случае гемоглобина и железосодержащих ферментов (цитохромы и каталаза), или в виде неактивных транспортных форм. Железо сыворотки крови находится в связанном состоянии, так как образует комплексы с β-глобулинами и трансферрином. Небольшая оставшаяся часть катиона связана электростатическими силами взаимодействия с аминокислотами.
Обычная диета человека содержит в день 10-15 мг железа, из которых не более 10% оказывается в сыворотке крови. В результате абсорбции в двенадцатиперстной, тощей и подвздошной кишках ионы железа поступают в сыворотку крови, связываясь с трансферрином. Сывороточный пул железа в большей части (до 80%) использован для формирования гемоглобина эритроцитов. Увеличение синтеза гемоглобина - основное условие, оказывающее выраженное влияние на
Таблица 1.4. Распределение железа в организме человека
 метаболизм
железа. Железо, включенное в гемоглобин, - своего рода буферная
система, сглаживающая большие колебания в поступлении железа с пищей. В
физиологических условиях эритропоэз - основной потребитель железа в
организме. Оставшиеся 20% железа обычно поступают в ткани для
формирования миоглобина и ферментов. Небольшая доля железа оказывается
резервированной в РЭС, печени, селезенке, костном мозге. Атомы железа,
освобождающиеся вследствие катаболизма гемоглобина и возникновения
некротических изменений в клетках, частично экскретируются с мочой,
калом, потом и желчью, частично поступают в клетки РЭС и далее опять в
пул железа сыворотки крови. Экскреция железа с мочой колеблется в
значительных пределах, составляя у здоровых людей 32-285 мкг/сут.
Экскреция железа с калом равна в среднем 13 мг/сут и зависит от
характера пищи. Таким образом, основные этапы метаболизма железа - это
абсорбция, транспорт, утилизация, хранение и экскреция.
метаболизм
железа. Железо, включенное в гемоглобин, - своего рода буферная
система, сглаживающая большие колебания в поступлении железа с пищей. В
физиологических условиях эритропоэз - основной потребитель железа в
организме. Оставшиеся 20% железа обычно поступают в ткани для
формирования миоглобина и ферментов. Небольшая доля железа оказывается
резервированной в РЭС, печени, селезенке, костном мозге. Атомы железа,
освобождающиеся вследствие катаболизма гемоглобина и возникновения
некротических изменений в клетках, частично экскретируются с мочой,
калом, потом и желчью, частично поступают в клетки РЭС и далее опять в
пул железа сыворотки крови. Экскреция железа с мочой колеблется в
значительных пределах, составляя у здоровых людей 32-285 мкг/сут.
Экскреция железа с калом равна в среднем 13 мг/сут и зависит от
характера пищи. Таким образом, основные этапы метаболизма железа - это
абсорбция, транспорт, утилизация, хранение и экскреция.
Транспорт железа в организме. Железо в плазме крови в основном связано с трансферрином, гликопротеином с молекулярной массой 76-77 кД, обладающим значительным генетическим полиморфизмом (более 20 вариантов нарушений первичной структуры). Трансферрин, как и все транспортные белки, синтезируется в печени, в небольшом количестве он также образуется в лимфоидной ткани, молочной железе, яичках и яичниках. Каждая молекула трансферрина способна связать два атома железа. Атом металла связывается с трансферрином только в присутствии бикарбонатов, которые, вероятно, необходимы для образования комплекса железо-трансферрин. В физиологических условиях трансферрин насыщен железом примерно на 30%. Трансферрин принимает участие в обмене железа, транспортируя его между эритроидными элементами костного мозга и макрофагами. В ряде патологических ситуаций нарушается переход железа
с макрофагов на трансферрин. Это может происходить при воспалении вследствие снижения содержания железа в эритроцитах и увеличения отложения его в клетках. Трансферрин также регулирует транспорт железа в гепатоциты.
Атомы железа транспортируются непосредственно в клетку путем взаимодействия комплекса железо-трансферрин со специфическими рецепторами плазматической мембраны. Комплекс железо-транс- феррин проникает в цитозоль, где освобождается атом железа, а трансферрин выносится из клетки, оставаясь способным к повторному и многократному связыванию ионов железа. Ретикулоциты обладают наибольшей плотностью рецепторов к трансферрину на плазматической мембране. Железо в этих клетках связывается с протопорфирином с образованием гема, который, соединяясь с глобином, образует гемоглобин или миоглобин.
Другой белок, обладающий высокой аффинностью к железу, - лактоферрин - присутствует в биологических секретах (в бронхиальном, а также в женском молоке и цитоплазме нейтрофилов). В кислой среде сродство лактоферрина к атомам железа более высокое, чем трансферрина; в этой связи в очагах воспаления и тканевого ацидоза железо может находиться в малорастворимых комплексах и поэтому не транспортироваться в кровь. Это объясняет снижение содержания железа в сыворотке крови в условиях воспаления. К другим транспортным белкам железа относят гаптоглобин, гемопексин и альбумин.
Железо присутствует также в форме депонированного элемента в виде ферритина и гемосидерина ретикулярных клеток. Основная форма депонирования железа - ферритин, накапливающийся главным образом в печени, селезенке и костном мозге. Ферритин имеет оболочку (апоферритин) и ядро молекулы, в котором накапливается до 4500 атомов железа в форме гидроксилфосфата. Молекула гемосидерина образуется в результате частичного разрушения ферритина. Гемосидерин присутствует в виде нерастворимого комплекса в клетках РЭС. Железо, циркулирующее в плазме крови, имеет функциональную связь с депонированным железом, которое при необходимости может быть мобилизовано и транспортировано в сыворотку крови от ретикулоэндотелиальных клеток, вовлеченных в катаболизм гемоглобина, к гепатоцитам.
Клиническое значение
Содержание железа в крови может быть как повышенным, так и сниженным.
Избыток железа в организме. Основные причины повышенного содержания железа в сыворотке крови:
• усиление разрушения эритроцитов при гемолитической и аутоиммунной анемии;
• нарушение синтеза гемоглобина (пернициозная анемия);
• острый гепатит (вирусный гепатит, токсические гепатиты);
• гемосидероз и гемохроматоз.
Недостаток железа в организме развивается постепенно, возможно, с периодами обострения, пока не возникнет выраженная анемия. Следует помнить, что снижение уровня железа в сыворотке крови не всегда соответствует дефициту железа в организме. Низкое содержание железа в крови отмечают при недостаточном поступлении его в организм у детей и вегетарианцев, вследствие нарушения депонирования железа при беременности и грудном вскармливании, в условиях нарушенного всасывания железа при тотальной и субтотальной гастрэктомии, сниженной кислотности и ахлоргидрии, хронической диарее и стеаторее. Хронические повторяющиеся потери крови при язвенной болезни, неспецифическом колите также способствуют снижению содержания в крови свободного железа. В условиях хронической инфекции возможно накопление железа в клетках РЭС.
Методы определения
Концентрация железа в крови - нестабильный параметр; отмечены колебания содержания железа в сыворотке крови даже в течение суток. Рядом исследователей продемонстрирован циркадный ритм содержания железа в крови с пиком между 8-10 ч утра и низкими значениями после полудня. Интересно, что лица, работающие в ночную смену, имеют смещение максимума содержания железа на вторую половину дня, при этом биологический ритм оказывается инвертированным. Отмечены возрастные и половые различия в уровне железа в сыворотке крови.
Определение содержания железа сыворотки крови дает представление об уровне транспортируемого железа в плазме крови, связанного с трансферрином. Большие вариации содержания железа в сыворотке крови, возможность его увеличения в условиях некротических
процессов в тканях (острый гепатолизис), его снижение при воспалительных процессах ограничивают диагностическое значение измерения железа сыворотки крови. Очевидно, что, измеряя только содержание железа в сыворотке крови, получить желаемую информацию о причинах его нарушенного обмена невозможно. Результаты этого исследования служат основанием для выполнения более сложных методов - определения содержания в крови трансферрина и ферритина.
Трансферрин. В сопоставлении с содержанием железа в сыворотке крови уровень трансферрина и насыщение его железом - более стабильные величины с менее выраженными различиями по полу и возрасту. Основные причины сниженного содержания трансферрина в сыворотке крови: торможение синтетических процессов в гепатоцитах (хронический гепатит, цирроз, хроническая нефропатия, голодание, неопластические процессы), а также значительная потеря белка при нефротическом синдроме или заболеваниях тонкой кишки. Концентрация трансферрина в крови может быть повышенной при железодефицитной анемии, беременности в последнем триместре, у женщин при приеме пероральных контрацептивов.
Ферритин. Определение ферритина в клинической практике позволяет улучшить диагностику нарушений метаболизма железа. Это наиболее чувствительный тест с целью выявления дефицита или избытка железа. Однако определение ферритина может давать ложноположительные или ложноотрицательные результаты при воспалениях, опухолях, патологии печени, когда содержание ферритина может быть увеличено, отражая дефицит депонированного железа. В ряде случаев у пациентов, находящихся на программном гемодиализе, отмечают парадоксально повышенный уровень ферритина при аккумуляции железа в клетках РЭС, при этом в костном мозге может быть одновременно дефицит железа. Следовательно, при оценке обмена железа следует проводить комплексные исследования.
Нарушения метаболизма железа следует дифференцировать от снижения содержания железа в сыворотке крови, сопровождающего воспалительные процессы. Это требует точных и воспроизводимых методов исследования.
Доминирующий метод определения железа сыворотки крови - спектрометрия. Колориметрическое определение железа сыворотки крови предполагает проведение нескольких этапов: диссоциацию железа из комплекса с трансферрином, восстановление иона железа из Fe3+ в Fe2+, формирование комплекса железо-хелатированный хромоген.
Часть белков в кислой среде мешает определению окрашенного комплекса, что требует депротеинизации. Международным комитетом по стандартизации в гематологии предложено преципитировать белки трихлоруксусной кислотой. Однако вследствие широкого применения автоматизированных систем методы, включающие депротеинизацию, большого распространения не получили. В прямых методах стабилизация белков достигается добавлением детергентов.
Диссоциацию комплекса железо-трансферрин осуществляют снижением рН. Для диссоциации комплекса предпочтительно значение рН 5,0, при этом одновременное добавление восстановителя позволяет провести диссоциацию полностью. В качестве восстановителей используют сульфит, дитионит, гидразин, гидроксиламин, гидроквитон, меркаптоацетат. Наиболее распространено применение тиогликолевой и особенно аскорбиновой кислот.
Некоторые комплексонообразователи, связывающие электростатически двухвалентные катионы (хелаторы), могут после комплексирования с ионами железа изменять цвет комплекса. Для удовлетворения требованиям клинической биохимии комплексон должен обладать определенной специфичностью именно к атомам двухвалентного железа, иметь достаточно высокий коэффициент молярного поглощения, обладать максимумом поглощения в удобной для фотометрии области длин волн. Кроме того, комплексон должен быть хорошо растворим и устойчив в водной среде, образовывать стабильные комплексы.
В течение длительного времени в клинической биохимии для определения железа применяли батофенантролин, хотя для растворения его требовалась хлорсульфоновая кислота, опасная при использовании в лаборатории. В настоящее время наиболее чувствительный хромоген - ферен-S. Хромогены с высокой чувствительностью (феррозин и ферен-S) не обладают достаточной специфичностью: они способны образовывать окрашенные комплексы и с медью. В случаях повышенного содержания меди превышение определения железа достигает 10%. Интерферирующее влияние меди может быть устранено добавлением соответствующих реагентов. Применение неокупроина, тиосемикарбазида и тиомочевины, которые образуют устойчивые комплексы с медью, исключает ее взаимодействие с хромогеном.
Прямое определение железа в реакции с ференом-S в качестве хромогена при отсутствии интерференции ионов меди рассматривают как метод выбора, обладающий достаточной чувствительностью
и специфичностью, не требующий специальной аппаратуры. В умеренно кислой среде (рН 4,8, ацетатный буфер) даже при наличии в сыворотке крови гемоглобина диссоциации железа из комплекса гемоглобина не происходит, что исключает возможность получения ложнозавышенных результатов. Метод на 60% более чувствителен по отношению к реакции с бато-фенантролином. Использование ферена-S позволяет проводить исследование с высокой точностью, достаточной специфичностью, требует малого количества образца, что особенно важно в педиатрии.
В ходе метода происходит диссоциация железа сыворотки крови и трансферрина в кислой среде, затем ионы железа восстанавливают до Fe2+ аскорбиновой кислотой, после чего при взаимодействии с комплексоном ференом-S образуется комплекс синего цвета. Для предупреждения образования комплекса ферена-S с атомами меди их предварительно связывают тиомочевиной. Добавление детергента к реакционной смеси позволяет избежать депротеинизации. Окраска развивается в течение 5 мин при комнатной температуре. Образованный комплекс оказывается стабильным по меньшей мере в течение 90 мин. Метод обладает хорошей линейностью: он позволяет без разведения образца определить концентрацию железа в пробе свыше 1000 мкг/дл. Исследование может быть проведено при использовании как сыворотки, так и плазмы крови. Если в пробе высокая концентрация липидов или билирубина, требуется постановка контрольной пробы или двухволновое фотометрирование пробы. Метод не только прост в ручном исполнении, но и служит лучшей основой для применения на многоканальных биохимических анализаторах.
Измерение содержания железа сыворотки крови с целью диагностики истинной железодефицитной анемии дополняют исследованием трансферрина и степени его насыщения железом. Наиболее достоверный тест оценки железодефицитной анемии - определение в крови содержания трансферрина. Содержание трансферрина в крови можно измерить как иммунохимическими методами, включая радиальную иммунодиффузию, турбоди-метрию и нефелометрию, так и функциональными методами, основанными на связывании ионов железа. Широко используют определение насыщения трансферрина (как транспортного белка) ионами железа в растворе с избытком ионов железа. Избыток не связанных с белком ионов железа удаляют из раствора при обработке последнего основным карбонатом магния или взаимодействием с ионообменными смолами, после чего
определяют содержание сывороточного железа. Методы, основанные на абсорбции железа, просты и дают воспроизводимые результаты, если тщательно удалять избыток добавленных ионов железа.
Ферритин - один из наиболее важных лабораторных параметров при заболеваниях, вызванных недостатком или избытком железа. Разработаны иммунохимические методы определения ферритина в плазме крови. В настоящее время отработан международный стандарт ферритина, что позволяет стандартизировать выполняемые исследования.
Таким образом, современное исследование метаболизма железа включает определение железа, трансферрина и ферритина сыворотки крови. Нормальные значения основных параметров, характеризующих обмен железа, представлены в табл. 1.5.
Таблица 1.5. Нормальные значения основных параметров обмена железа в организме человека
 КАЛЬЦИЙ
КАЛЬЦИЙ
При нормальных условиях в организме более 90% кальция фиксируется костной тканью. Из оставшегося количества 40% циркулирует в комплексе с белками, а 9% - в виде солей (фосфаты, цитрат). Таким образом, только 51% от общего содержания присутствуют в ионизированной форме (Са2+) и способны диффундировать в межклеточную жидкость.
Внутриклеточная концентрация ионов Са2+ на несколько порядков ниже содержания таких катионов, как калий, натрий и магний.
Большая часть кальция в клетке связана с растворимыми лигандами, клеточными мембранами или аккумулирована во внутриклеточных депо. Именно свободный кальций (Са2+) служит регулятором внутриклеточных процессов. В клетке концентрация Са2+ очень мала (0,1 мкмоль/л воды). С наружной стороны плазматической мембраны содержание Са2+ достигает 1,5-2,5 ммоль/л, т.е. оно в 2000 раз выше, чем с внутренней. Плазматическая мембрана клеток обладает низкой проницаемостью для Са2+; выведение Са2+ из клетки - энергозависимый процесс. Благодаря низкому содержанию Са2+ в цитоплазме клеток и высокому градиенту концентрации по обе стороны плазматической мембраны этот ион имеет важное значение в регуляции жизнедеятельности клеток. Общепринято, что Са2+ участвует в передаче сигнала из внешней среды. Физиологически действие кальция связано с регуляцией проницаемости клеточных мембран: при низкой концентрации Са2+ в экстрацеллюлярной жидкости проницаемость мембран клеток увеличивается, приводя к повышению возбудимости клеток в центральной и периферической нервной системе. В противоположность этому при высокой концентрации Са2+ проницаемость клеточных мембран уменьшается со снижением рефлекторной активности, изменениями ЭКГ и возникновением болей в животе, миопатий и потерей аппетита. Изменение проводимости кальциевых каналов мембраны и внутриклеточного содержания Са2+ изменяет функционирование многих систем, включая процессы клеточного деления.
Клиническое значение
Содержание кальция в сыворотке крови изменяется при дисфункции паращитовидных и щитовидной желез, новообразованиях различной локализации (особенно при метастазировании в кости) и почечной недостаточности. Вторичное вовлечение кальция в патологический процесс происходит при почечной недостаточности, патологии ЖКТ. Нередко гипо- и гиперкальциемия могут быть первым проявлением патологического процесса. Терапевтические процедуры (гемотрансфузия, экстракорпоральные методы лечения) способны изменить обмен кальция и концентрацию катиона в сыворотке крови.
Частота гиперкальциемии при язвенной болезни более высокая, чем при других видах патологии. Наличие клинической картины панкреатита также может быть связано с нарушением метаболизма кальция. В первую неделю острого панкреатита возможно развитие гипокальциемии, которая позже может смениться гиперкальциемией.
Гиперкальциемия может быть следствием интоксикации витамином D. Опасную для жизни гиперкальциемию отмечают при уровне кальция в сыворотке крови выше 15 мг% (3,75 ммоль/л). Клинические симптомы выраженной гиперкальциемии: стойкий запор, рвота, полиурия, сонливость и кома.
В популяции значительная гиперкальциемия отмечена у 0,6% обследованных; гиперпаратиреоз установлен у 86% этих пациентов. В клинической практике гиперкальциемия отмечена у 5% больных; наиболее частой причиной был злокачественный процесс, менее часто выявлен первичный гиперпаратиреоз. Причинами гиперкальциемии могут быть также вторичный гиперпаратиреоз и другие эндокринные нарушения (тиреотоксикоз, надпочечниковая недостаточность, акромегалия, секреция ПТГ клетками опухолей разных органов).
Показания для исследования концентрации кальция в сыворотке крови в клинике общего профиля: почечнокаменная болезнь, патология костной ткани, артериальная гипертензия, подагра, миопатия, пептические язвы желудка, панкреатит, выраженное снижение массы тела, психические нарушения. Исследования уровня кальция проводят у пациентов с острой и хронической почечной недостаточностью, при гемодиализе и экстракорпоральных методах лечения. Мониторирование содержания кальция в крови проводят в ходе больших оперативных вмешательств. Исследование кальция сыворотки крови показано также при почечной колике, гематурии и пиелонефрите.
От 30 до 70% случаев первичного гиперпаратиреоза сопровождается повышенным АД. В этих случаях лечение тиазидными диуретиками может маскировать гиперкальциемию. Артериальная гипертензия при гиперкальциемии может быть связана с патологией почек.
Основная причина гиперкальциемии в пожилом возрасте - новообразование с метастазами в кости. В большинстве случаев при гиперкальциемии обнаруживается нормальное содержание в сыворотке крови фосфора и хлоридов. Наиболее часто метастазы в кости выявляются при раке легких, молочной железы, почек и печени. Заболевания системы крови (множественная миелома, лимфома, острый лейкоз) часто сопровождаются гиперкальциемией. Стероидиндуцированную гиперкальциемию можно наблюдать при приеме андрогенов, эстрогенов и глюкокортикоидов. Саркоидоз, туберкулез, гистоплазмоз также сопровождаются гиперкальциемией. Гиперкальциемию отмечают в педиатрической практике, особенно в
условиях недостаточного поступления с пищей витамина D. В этих ситуациях витаминотерапия способствует нормализации содержания в крови как кальция, так и фосфора.
Методы определения
В норме содержание кальция в сыворотке крови здорового человека составляет 2,2-2,6 ммоль/л. При определении концентрации кальция необходимо учитывать состояние пациента в момент взятия крови. Гиперкальциемия как артефакт может возникать при взятии крови в условиях выраженного венозного стаза. Содержание Са2+ у человека в горизонтальном и вертикальном положении после небольшой физической активности отличается на 0,32 ммоль/л, поэтому кровь на определение кальция следует брать в условиях минимального венозного стаза. Содержание кальция в крови зависит также и от приема пищи: после еды оно возрастает на 0,1 ммоль/л. Поскольку почти половина количества кальция сыворотки крови связана с альбумином, следует учитывать также вариации в содержании белка.
После взятия крови имеется несколько источников ошибок. Абсорбция Са2+ на стенках пластикового шприца, взаимодействие с СО2 воздуха, изменение температуры меняют соотношение свободного и ионизированного кальция. Использование в отдельных видах вакутейнеров полистироловых шариков, геля акриламида также способствует абсорбции кальция, в результате чего получаются заниженные результаты. В моче при стоянии соли кальция преципитируют, особенно фосфат кальция, что снижает результаты определения экскреции кальция. Мочу для определения кальция следует собирать в контейнеры, содержащие НС1 при хорошем перемешивании.
Определение содержания кальция в сыворотке крови дает представление о суммарной концентрации его ионизированной и неионизированной форм. Общепринято, что определение ионов Са2+ дает более ценную диагностическую информацию, чем определение общего уровня кальция. Определение Са2+ наиболее обосновано в условиях высокой концентрации в крови низкомолекулярных лигандов, при острых клинических ситуациях, сопровождающихся нарушением электролитного баланса и КЩР. Определение Са2+ должно быть компонентом оценки состояния КЩР, газов и электролитов крови в любых экстренных ситуациях. Для подобного комплекса имеются и методические обоснования: определение содержания Са2+ в крови проводят в анаэробных условиях с последующей коррекцией в зависимости
от pH. Наиболее современный метод определения ионизированного кальция - использование ионоселективных электродов.
Старейший метод определения общего кальция включает количественную преципитацию кальция избытком анионов щавелевой, хлоранилиновой или нафтилгидроксаминовой кислоты. В случае оксалата преципитат определяют титрованием с перманганатом калия и сульфатами. Самый распространенный оксалатный метод служил в течение многих лет референсным методом для определения кальция.
Методы с использованием ионов хлоранилата и нафтилгидроксамата для преципитации кальция основаны на колориметрическом определении преципитирующего иона. Избыток хлоранилата вносят для реакции с ионами кальция. Образованный комплекс преципитируется и растворяется в щелочном растворе ЭДТА.
Предложен чувствительный флюоресцентный метод для микроанализа в сыворотке крови и моче - взаимодействие кальция с кальцеином, флюоресцирующим при 520 нм и высоком значении рН. Флюоресцирующий комплекс титруют этиленгликольтетрауксусной кислотой, связывающей кальций, что приводит к снижению флюоресценции. Магний и фосфор не влияют на этот метод.
Прямое спектрофотометрическое определение концентрации кальция в сыворотке и моче основано на формировании окрашенных комплексов кальция и органических молекул. Наиболее распространенный реагент - о-крезолфталеин. В ходе реакции образуется красный комплекс (570 или 575 нм) при рН 10,0-12,0. Продукт реакции можно стабилизировать цианидом калия, способствующим устранению влияния тяжелых металлов. Для устранения влияния магния следует добавить 8-гидроксихинолин. Для уменьшения влияния белков пробы могут быть диализованы или значительно (в 40-100 раз) разведены кислым раствором для освобождения связанного кальция. Метод с о-крезолфталеином адаптирован для многих автоанализаторов, что дает высокую воспроизводимость. Проблема использования этого метода состоит в поддержании постоянной температуры во время проведения анализов, поскольку молярная абсорбция хромогена зависит от температуры.
Наиболее часто используемый референсный метод точного определения кальция - атомная абсорбция. Метод не подвержен влиянию гемоглобина, билирубина и липемии, на него оказывают влияние только хелаторы. По сравнению с атомной абсорбцией результаты метода с о-крезолфталеином дают небольшое завышение (10-15 мг/л).
Дополнительный метод для определения кальция - изотопно-разведенная массспектроскопия. Метод обладает высокой точностью, но применение его ограничено.
МАГНИЙ
Общее содержание магния в организме человека составляет около 25 г, при этом примерно 60% его содержится в костной ткани. Сбалансированная диета содержит 300-350 мг магния в сутки. Главные источники магния - орехи, овес, зелень, мясо. Большая часть магния абсорбируется в тонкой кишке. Витамин D и его метаболиты повышают абсорбцию магния, но в меньшей степени, чем кальция. Избыток в пище органических кислот связывает магний, нарушая его всасывание. Магний содержится во всех тканях организма, но наибольшее его содержание на единицу массы тела отмечено в миокарде. 1/3 всего магния не участвует в обменных процессах. Около 75% магния в сыворотке крови присутствует в ионизированной форме, 22% связано с альбумином и 3% - с глобулинами. Физиологически магний выступает как антагонист кальция; его дефицит сопровождается накоплением кальция в сыворотке крови.
Большая часть магния содержится внутри клетки. Чем выше метаболическая активность клетки, тем выше содержание в ней магния. В клетке основная часть магния связана с белками, он присутствует в ядре, митохондриях, эндоплазматическом ретикулуме, цитоплазме. В цитоплазме около 80% магния находится в комплексе с АТФ. Концентрация ионизированного магния в клетке поддерживается на постоянном уровне даже при резких колебаниях внеклеточного содержания катиона. Этому способствуют относительно ограниченная проницаемость плазматической мембраны для катиона и наличие системы транспорта магния в клетку для поддержания высокого трансмембранного градиента. Скорость обмена магния в миокарде, гепатоцитах, ткани почек более высокая по сравнению со скелетной мускулатурой, тканью мозга, эритроцитами. Поступление магния в клетку ингибируют β-адреноблокаторы, PG Е, усиливает форболовый эфир. Инсулин способствует выходу внутриклеточного магния во внеклеточную среду, адреналин и глюкокортикоиды, наоборот, повышают содержание магния в клетке.
Магний - облигатный кофактор многих ферментативных реакций. Он формирует субстрат для многих ферментов в виде комплекса магний-АТФ. Магний выступает в роли физиологического регулятора
клеточного роста, поддерживая адекватный запас пуриновых и пиримидиновых нуклеотидов, необходимых для синтеза ДНК и РНК. При истощении внутриклеточного содержания магния снижается синтез белка: магний необходим на всех этапах синтеза белковой молекулы.
Почки - основной регулятор поддержания постоянной концентрации магния в организме. При истощении запасов магния его экскреция снижается или прекращается вообще. При усиленном поступлении магния с пищей или водой, при парентеральном введении почки быстро экскретируют избыток катиона. Магний проходит через фильтрационный барьер почечных телец, после чего 80% катиона реабсорбируется в проксимальных канальцах восходящего сегмента петли Генле. Реабсорбция зависит от содержания в моче солей и скорости прохождения жидкости через почечные канальцы. Транспорт магния в канальцах зависит от трансэпителиального потенциала, возникающего при реабсорбции натрия. Гипермагнезиемия сопровождается снижением реабсорбции магния. Большие дозы ПТГ способствуют снижению экскреции магния с мочой. Глюкагон и кальцитонин оказывают такое же действие.
Клиническое значение
Активное участие магния в физиологических процессах - основа многообразия клинической симптоматики при гипо- и гипермагнезиемии.
ГИПОМАГНЕЗИЕМИЯ
В клинической практике дефицит магния распространен чаще, чем его выявляют при исследовании содержания катиона в сыворотке крови. В больших многопрофильных клинических отделениях гипомагнезиемию отмечают у каждого 10-го пациента. Гипомагнезиемия развивается вследствие потери магния через ЖКТ или с мочой. Потери магния велики при острой и хронической диспепсии, энтеритах, язвенном колите, наличии кишечной фистулы. 20% выраженных гипомагнезиемий выявляются при острой непроходимости кишечника и отечном панкреатите. Снижено содержание магния в крови при алкоголизме и сахарном диабете. Причина гипомагнезиемии у новорожденных - нарушение всасывания магния.
В ряде клинических ситуаций потери магния с мочой также приводят к истощению катиона. Дефицит магния отмечают при первичном гипоальдостеронизме. Гиперкальциемия, сопровождающаяся
понижением реабсорбции магния в канальцах, также способствует гипомагнезиемии. Диуретик фуросемид, воздействуя на проксимальные отделы нефрона, повышает экскрецию магния. Фармакологические препараты, действующие на уровне дистальных отделов нефрона (амилорид, спиронолактон), также способствуют экскреции магния с мочой. Аминогликозиды повышают экскрецию магния и вызывают гипомагнезиемию; циклоспорин, обладая нефротоксичностью, усиливает выведение магния с мочой. При хроническом ацидозе, как и при хроническом алкоголизме, потеря магния с мочой возрастает. Любые патологические процессы в канальцах почек усиливают экскрецию магния с мочой.
Около 30% больных сахарным диабетом имеют разную степень гипомагнезиемии. При гипомагнезиемии у пациентов с сахарным диабетом гипергликемия натощак более значительна и течение диабета, как правило, более тяжелое. Отношение магний/креатинин в моче увеличивается пропорционально тяжести клинического течения сахарного диабета. Такое состояние можно наблюдать и при тяжелом клиническом течении гиперпаратиреоза и тиреотоксикоза.
Среди клинических симптомов гипомагнезиемии доминируют нейромышечные расстройства. Поскольку дефицит магния часто оказывается вторичным, клинические симптомы не всегда ярко выражены. Гипомагнезиемия даже без гипокалиемии приводит к мышечной гиперактивности (атаксия, тремор, рвота), повышает мышечную возбудимость, вызывает гиперрефлексию. Важный аспект дефицита магния - аритмия; применение сульфата магния приводит к нормализации ритма сердца. Интоксикация сердечными гликозидами тоже сопровождается гипомагнезиемией. Гипомагнезиемия активирует секрецию ПТГ. Неэффективность лечения гипокальциемии витамином D в ряде случаев обусловлена именно гипомагнезиемией; инъекции сульфата магния купируют гипокальциемию. Следует заметить, что выраженная гипомагнезиемия часто сопровождается гипокалиемией. При дефиците магния калий покидает клетку, что приводит к снижению его концентрации в цитоплазме. Введение в таких случаях больших доз калия без добавления магния недостаточно эффективно. При истощении запасов магния и гипомагнезиемии содержание натрия и кальция в клетках повышается, а уровень калия падает.
Магний - один из активных регуляторов сосудистого тонуса. Спазм сосудов, стенокардия, аритмия, тромбозы развиваются чаще на фоне гипомагнезиемии. Магний влияет на тонус сосудистой стенки,
способствуя ее дилатации. Эпидемиологические исследования выявили повышение частоты гипертонической болезни в биогеохимических провинциях, в которых в воде понижено содержание магния и кальция. С другой стороны, у пациентов с эссенциальной гипертензией снижено содержание магния в эритроцитах. Низкая концентрация внеклеточного магния приводит к спазму сосудов, повышая их чувствительность к прессорным агентам. В условиях гипомагнезиемии назначение сульфата магния способствует снижению АД и повышает чувствительность к гипотензивным препаратам.
Эпидемиологические исследования выявили также более частое развитие инфаркта миокарда у лиц, живущих в местности с мягкой водой. При этом содержание магния в ткани миокарда оказывается сниженным. Низкое содержание магния отмечено и в сердечной мышце пациентов, погибших от инфаркта миокарда. Клинические исследования показали, что при инфаркте миокарда в условиях быстрого обмена магния между сывороткой крови и миоцитами наиболее выраженное падение содержания катиона в сыворотке крови наступает через 24-48 ч после приступа стенокардии. В условиях стресса, при повышении в крови концентрации катехоламинов и стероидов, содержание магния как в клетке, так и сыворотке крови понижается. У пациентов с ИБС содержание магния в сыворотке крови также понижено; резкое падение концентрации магния в крови может быть одной из причин внезапной смерти. Терапия магнием при инфаркте миокарда сопровождается ограничением зоны поражения, снижением частоты сердечных аритмий и уменьшением смертности.
Недостаток магния влияет на жирнокислотный состав липидов, снижает активность ферментов системы элонгации и десатурации жирных кислот, блокируя синтез арахидоновой кислоты. Изменение жирнокислотного состава липидов сопровождается уменьшением жидкой консистенции биологических мембран и изменяет активность мембранно-связанных ферментов. Повышение агрегации тромбоцитов в условиях гипомагнезиемии увеличивает опасность тромбоэмболических осложнений. В условиях атерогенной диеты недостаток в пище магния способствует прогрессированию склеротического поражения сосудов; введение магния приводит к регрессии гиперхолестеринемии.
По мнению ряда исследователей, магний играет роль природного гиполипидемического агента. Длительное состояние гипомагнезиемии действительно способствует активации атеросклеротического
процесса, поддержанию ГЛП, имеющей ретенционное происхождение. В условиях гипомагнезиемии снижена активность основных ферментов метаболизма ЛП: гепаринзависимой липопротеинлипазы и лецитинхолестеринацилтрансферазы. ГЛП при гипомагнезиемии способствует также прогрессированию жировой инфильтрации печени.
Гипомагнезиемию наиболее часто отмечают у пациентов, страдающих алкоголизмом. Этим в определенной степени можно объяснить клиническую симптоматику, свойственную этому заболеванию. Возможно, это связано с токсическим влиянием метаболитов алкоголя на процессы энергообразования. Гипомагнезиемия часто развивается при терапии антибиотиками, производными аминогликозидов. В процессе деструкции их в лизосомах образуются токсичные аминосоединения, которые в митохондриях нарушают формирование макроэргических соединений. Применение диуретиков также способствует гипомагнезиемии. Гипокалиемия, возникающая при многих патологических состояниях, может быть купирована более успешно, если одновременно с калием вводить соли магния. Введение солей магния способно повышать внутриклеточное содержание калия.
ГИПЕРМАГНЕЗИЕМИЯ
Слабое или умеренное повышение содержания магния в сыворотке крови отмечено у 8-12% больных, госпитализированных в многопрофильные учреждения. В небольшом проценте случаев гипермагнезиемия может быть следствием усиленного поступления магния с пищей. Чаще всего гипермагнезиемия возникает в результате применения солей магния с лечебной целью. Выраженная гипермагнезиемия сопровождает почечную недостаточность. Лечение маниакального синдрома карбонатом лития приводит к выраженной гипермагнезиемии. Гипермагнезиемия отмечена также при гипотиреозе, лактатацидозе, гепатите, злокачественных новообразованиях. Клинические симптомы гипермагнезиемии проявляются при содержании магния в сыворотке крови выше 5 мг% (норма 1,7-2,2 мг%). Сонливое состояние наступает при содержании магния в сыворотке крови, превышающем 4 мг%. Паралич мускулатуры и остановка дыхания возникают при гипермагнезиемии порядка 10-12 мг%.
Гипермагнезиемию у взрослых чаще наблюдают в амбулаторных условиях; в стационаре она преобладает в гинекологическом, хирургическом и психиатрическом отделениях.
Методы определения
Как было сказано выше, основное содержание Mg2+ выявляется внутри клеток. Несмотря на это, его содержание наиболее часто исследуют в сыворотке крови, что проще и доступней. При оценке результатов определения магния следует принимать во внимание состояние пациента: стресс, наличие острых инфекций.
В норме содержание магния в сыворотке крови составляет 0,65- 1,05 ммоль/л; оно несколько выше у детей, чем у взрослых, и не отличается у мужчин и женщин. Экскреция магния с мочой у здорового человека составляет примерно 100 мг в сутки.
Способы определения магния в биологических жидкостях включают: преципитацию; комплексонометрию и спектрофотометрию; плазменно-абсорбционную спектроскопию; электротермальную абсорбционную спектроскопию; ионоселективную потенциометрию; плазменно-эмиссионную спектрофотометрию; ферментативные методы.
Первым методом определения магния была преципитация в форме MgNH4PO4: количество преципитата измеряли гравиметрически или по содержанию фосфата. Позже было предложено преципитировать магний гидроксихинолином; сейчас эти методы представляют только исторический интерес. При пламенной спектрофотометрии возможно замерить эмиссию магния при длине волны 285, 370 или 383 нм. Позже были предложены методы комплексонометрии при использовании ЭДТА. Одновременно для определения содержания магния в биологической жидкости использовали красители эриохром, титановый желтый, магон, кальмагит. Последний в разных модификациях применяют при работе на биохимических анализаторах. Возможно использовать и флюорометрический способ определения магния при образовании комплексов с кальцеином, дигидробензолом и 8-гидроксихинолином. При использовании последнего соединения образуется хелатный комплекс с максимумом возбуждения при длине волны 420 нм и испускания 530 нм. Применение этиленгуанинтетраацетата натрия позволяет увеличить специфичность определения. В настоящее время используют кальмагит - металлохромный краситель, применение которого не требует депротеинизации сыворотки крови. В ходе реакции при формировании комплекса Mg-кальмагит щелочной реактив голубого цвета превращается в фиолетовый. Этиленгуанинтетраацетат натрия предотвращает реакцию с кальцием, а цианистый калий ингибирует
образование комплексов с тяжелыми металлами. Наличие в среде поливинилпирролидона предотвращает связывание комплекса Mg-кальмагит с белками сыворотки крови.
В спектрофотометрическом методе, основанном на реакции магния с титановым желтым, реакция протекает в щелочной среде с формированием гидроокиси магния. Коллоидные частицы гидроокиси абсорбируют титановый желтый с формированием комплекса красного цвета (максимум абсорбции при длине волны 540 нм). Для предотвращения преципитации коллоидных частиц в среду добавляли поливиниловый спирт. В настоящее время в качестве референсного метода определения магния используют атомно-абсорбционную спектроскопию. Атомы магния обладают выраженной абсорбцией в области 285,2 нм, которую и используют для измерения его концентрации. Для определения магния отработаны и методы «сухой химии» - диагностические полоски. Последний из предложенных методов определения содержания магния в биологических жидкостях - ферментативный метод. Его основа - определение глюкозы при действии гексокиназы и глюкозо-6-фосфатдегидрогеназы. В реакции при избытке субстрата образование НАДФН пропорционально наличию комплекса Mg-АТФ. Исследование катиона в сыворотке крови и моче таким способом хорошо согласуется с данными атомно-абсорбционного анализа.
Ионизированный Mg2+ измеряют потенциометрически. Ионоселективный электрод снабжен жидкостной мембраной с нейтральным компонентом, ответственным за ее селективность. Ионный радиус Mg2+ составляет 72 пм, в то время как Ca2+ - 100 пм. Растворимость соединений кальция более низкая, чем магния. Линейность процедуры составляет от 0,2 до 3 мМ. Потенциометрию проводят в буферном растворе, содержащем ионы Mg2+ в той же концентрации, что и в сыворотке крови; коэффициент вариации при определении магния в сыворотке крови не превышает 2,8% в серии и 3,9% - изо дня в день. Метод не вполне специфичен: электроды регистрируют также ионы Са2+ и ионы Na+. Водородные ионы не оказывают влияния в пределах рН 5,6-7,8. Концентрация ионизированного Mg2+ в сыворотке крови составляет 0,54-0,55 ммоль/л. Определение Mg2+ при применении ионоселективного электрода достоверно коррелирует с анализом содержания магния в ультрафильтрате. Приведенные методы, однако, не позволяют определить содержание магния в клетке.
Измерение внутриклеточного содержания магния способно дать дополнительную диагностическую информацию. Описаны методы флюорометрического определения содержания магния в лимфоцитах и моноцитах крови. Разработана также техника измерения содержания внутриклеточного магния в эксперименте при использовании селективных электродов.
Нагрузочный тест. Содержание магния в сыворотке крови в ряде клинических ситуаций не отражает его внутриклеточный дефицит. Уточнить ситуацию помогает нагрузочный тест, при выполнении которого в течение 8-12 ч пациенту внутривенно вводят 30 ммоль сернокислого магния в 0,5 л 5% раствора декстрозы, одновременно собирая суточную мочу. Если за это время с мочой экскретируется менее 50% введенного магния, диагностируют скрытый недостаток магния в организме.
НАТРИЙ
Для более детального понимания изменений содержания натрия в сыворотке крови необходимо вспомнить, что в организме есть два водных пространства: внутриклеточное и внеклеточное. Внеклеточное в свою очередь делят на внутрисосудистое (сыворотка, плазма крови) и внесосудистое (межклеточная жидкость). Общее количество воды в организме составляет 60% массы тела, при этом 2/3 приходится на внутриклеточную жидкость, 1/3 - на внеклеточную жидкость. 75% внеклеточной жидкости составляет интерстициальная жидкость, 25% внеклеточной жидкости - плазма крови.
Сопоставление химического состава вне- и внутриклеточной жидкости выявляет существенные различия. Na+ - основной одновалентный катион внеклеточной жидкости, основной внутриклеточный катион - К+. Нарушение взаимоотношения вне- и внутриклеточных катионов - патогенетическое звено многих патологических процессов.
Изменение соотношения Na+ во внеклеточном и внутриклеточном пространстве определяет соотношение объемов внутри- и внеклеточной жидкости, изменение осмотического давления, развитие отеков и обезвоживания. Повышенное или пониженное содержание Na+ во внутрисосудистом пространстве определяет соотношение потоков жидкости, то есть или переполнение сосудистого русла (артериальная гипертензия), или выход воды в межклеточное пространство (отеки).
Кроме поддержания постоянства внеклеточной среды натрий обладает и рядом регуляторных влияний. Так, транспорт глюкозы в клетку зависит от присутствия натрия во внутриклеточной среде: увеличение внутриклеточной концентрации натрия усиливает вход глюкозы в клетку. Транспорт аминокислот и моносахаров в клетки - также Na-зависимый процесс. Развитие гипогликемии у пациентов с недостаточностью надпочечников (болезнь Аддисона) связывают с нарушением всасывания глюкозы энтероцитами в условиях гипонатриемии, когда снижено фосфорилирование глюкозы.
Na+ - ион, концентрация которого в крови поддерживается в наиболее узком пределе. Для Na+ колебания значений нормы (135- 145 ммоль/л) составляют только 7% его содержания. Поддержание концентрации натрия в плазме крови в узких пределах - результат сочетанного действия многих регуляторных факторов: гипоталамуса, гипофиза, надпочечников и почек, стенки предсердий. Накопление натрия в плазме крови может быть следствием как пониженного содержания в тканях воды, так и избытка натрия. Содержание воды в тканях изменяется более часто по сравнению с истинным накоплением или падением концентрации натрия. Патофизиологические аспекты нарушения распределения натрия и воды между водными пространствами имеют большое значение в формировании клинической картины; порой эти состояния трудно удается дифференцировать. Для понимания патофизиологии гомеостаза натрия следует рассмотреть взаимоотношение между уровнем натрия в сыворотке крови и степенью гидратации (содержанием в организме воды).
Сыворотка крови на 93% состоит из воды и только на 7% - из неводных компонентов, главным образом липидов и белков. Натрий распределен только в водной фракции. При гиперпротеинемии или гипергликемии масса неводных компонентов увеличивается, а жидких уменьшается. При нормальном содержании натрия в жидкой части сыворотки крови и расчете его на весь объем биологической пробы возможно получение ложнозаниженных результатов. Чем больше в биологической пробе белков, ЛП или глюкозы, тем с большей вероятностью ошибки будет диагностирована ложная гипонатриемия, особенно при непрямом ионоселективном анализе. При сахарном диабете гиперлипидемия наблюдается у 20-70% больных, у половины из них обычно отмечают кетоацидоз; именно в таких клинических ситуациях у 40% больных выявлена псевдогипонатриемия.
Клиническое значение
Содержание натрия различается в отдельных пулах внеклеточной жидкости. Так, если в плазме крови содержание натрия составляет 135-145 ммоль/л, то в отечной жидкости - 135 ммоль/л, синовиальной - 142 ммоль/л, спинномозговой жидкости - 146 ммоль/л. В слезной жидкости содержание натрия такое же, как и в плазме крови. Содержание натрия в плазме крови, определенное прямым методом ионоселективного анализа, составляет 135-145 ммоль/л. Уровень натрия в моче при разном пищевом режиме равен 40-220 ммоль/сут.
ГИПЕРНАТРИЕМИЯ
В клинически сложных ситуациях гипернатриемию встречают нечасто. Она характерна для состояния сильного потоотделения, несахарного мочеизнурения при патологических процессах в гипоталамической области мозга, болезни и синдрома Кушинга. При заболеваниях почек патофизиологические процессы меняют обмен натрия. Когда протеинурия возникает в результате первичного поражения фильтрационного барьера почечных телец и скорость клубочковой фильтрации не изменена, развивается гипопротеинемия. При этом задержка натрия в почках - следствие снижения объема крови. Если снижение скорости клубочковой фильтрации первично, задержка воды и соли ведет к увеличению объема крови и повышению АД. Возможно сочетание обоих патологических процессов.
ГИПОНАТРИЕМИЯ
Гипонатриемия встречается в клинике значительно чаще, сопровождая разнообразные патологические состояния. Наиболее частая причина гипонатриемии - применение диуретиков. Большинство диуретических препаратов активирует экскрецию натрия с мочой. Последствием этого может быть снижение общего содержания натрия в организме и уменьшение внеклеточного водного пространства.
Низкая концентрация натрия в плазме крови характерна для некоторых заболеваний почек, когда почки утрачивают способность реабсорбировать катион из гломерулярного фильтрата. Это может сопровождаться и нарушением секреции воды. Гипонатриемия характерна и для застойной сердечной недостаточности, главным образом потому, что пациенты с сердечной недостаточностью в течение длительного времени получают диуретические препараты. В начальных стадиях патологического процесса застойная сердечная недостаточность
per se сопровождается гипонатриемией. Это происходит в силу того, что снижение сердечного выброса воспринимается мозгом как уменьшение объема крови, вследствие чего происходит активация секреции антидиуретического гормона. Дополнительное условие снижения экскреции воды - падение тока крови через почки.
Гипонатриемия сопровождает и патологию ЖКТ. Диарея может снижать содержание натрия в сыворотке крови и экстрацеллюлярной жидкости. Наличие илеостомы всегда сопровождается гипонатриемией. При циррозе печени, несмотря на высокое содержание натрия в организме, содержание его в плазме крови может быть снижено. Первичная недостаточность надпочечников (болезнь Аддисона) сопровождается очень низкой секрецией всех гормонов, включая альдостерон. В этих условиях большое количество натрия экскретируется с мочой с развитием выраженной гипонатриемии. При сахарном диабете наличие кетоацидоза сопровождается усиленной потерей натрия в почках. В результате этого развивается гипонатриемия и снижается содержание натрия в организме. Гипонатриемия сопровождает и выраженную гипергликемию.
КАЛИЙ
В организме человека с массой тела 70 кг содержится примерно 3500 ммоль калия. Калий (К+) - основной катион внутриклеточной жидкости, в ней содержится 98% калия всего организма. К+ обеспечивает осмолярность цитоплазмы и создает условия для протекания в ней биохимических реакций. В клинической биохимии обмен калия оценивают на основании его содержания в плазме крови (внутрисосудистый пул), хотя в нем содержится не более 2% общего количества катиона. Тем не менее изменения содержания калия в плазме крови достоверно отражают сдвиги его концентрации как в межклеточной жидкости, так и в тканях.
В ряде ситуаций исследуют содержание калия внутри клеток. Учитывая, что более 60% калия содержится в миоцитах поперечнополосатых мышц, также проводят исследование биоптатов. В условиях переедания, почечной недостаточности содержание калия в ткани меняется; только сердечная мышца в относительной степени защищена от истощения запасов калия. Основная причина изменения содержания внутриклеточного содержания калия - нарушение КЩР.
Использование клеток крови (эритроциты, лейкоциты) для оценки внутриклеточного содержания калия имеет ряд преимуществ. Вместе
с тем даже в физиологических условиях содержание калия в эритроцитах слабо коррелирует с его содержанием в клетках тканей. Однако потоки калия в лейкоцитах происходят в 70-80 раз активнее, чем в эритроцитах, возможно, поэтому концентрация калия в лимфоцитах в большей мере, чем в эритроцитах, соответствует его содержанию в клетках тканей. Внутриклеточная гипокалиемия у пациентов с почечной недостаточностью и недостаточностью кровообращения установлена именно на основании определения содержания калия в лимфоцитах.
Поступивший в организм калий распределяется среди тканей тела в течение 24-30 ч; поступление катиона в эритроциты происходит более медленно. В костной ткани существует пул необмениваемого калия, но он мал. Поступление К+ в клетку через плазматическую мембрану определено многими факторами. Калиевые каналы обеспечивают пассивную проницаемость мембраны для катиона, при этом движение К+ определено величиной электрического потенциала и градиентом концентрации. Калиевые каналы могут находиться в открытом и закрытом состоянии, пассивный поток К+ в клетку зависит именно от количества открытых в данный момент каналов. Высокая проницаемость мембран клеток для К+, особенно в состоянии возбуждения, и относительная непроницаемость для Na+ приводят к возникновению разности потенциалов по обе стороны плазматической мембраны.
Клиническое значение
Стабильность содержания калия в организме - следствие сбалансирования процессов его поступления и выделения. Поступление калия с пищей - самый важный фактор в регуляции общего пула катиона. Взрослый человек потребляет ежедневно 80-100 ммоль калия. От 85 до 90% калия, принятого с пищей, экскретируют почки. При отсутствии калия в пище в течение нескольких дней с мочой выделяется 40-60 ммоль/сут, после чего потеря калия с мочой уменьшается до 10-20 ммоль/сут. 10-15% потребленного с пищей калия выводится через ЖКТ. Этот путь выведения катиона усиливается при гиперсекреции минералокортикоидов и почечной недостаточности. Через кожу значительное количество калия может быть выделено только в случае интенсивного потоотделения.
Ионы калия легко проходят через фильтрационный барьер почечных телец. Содержание его в первичном фильтрате соответствует таковому в плазме крови при учете различия в содержании белка.
Далее 50-70% калия реабсорбируется в проксимальном (извитом) сегменте нефрона. Экскреция калия - результат сочетания процессов фильтрации, реабсорбции и секреции. При патологии большое значение имеют внепочечные пути выделения калия. В условиях гиперкалиемии в извитых канальцах подавляется реабсорбция как калия, так и воды.
Все факторы, которые могут изменить электрохимический потенциал мембраны клеток извитого канальца, оказывают влияние на экскрецию калия. К ним относят КЩР, скорость протекания мочи по дистальному канальцу, действие минералокортикоидов, поступление нереабсорбируемых в дистальном канальце анионов бикарбоната при почечном канальцевом ацидозе, некоторые антибиотики.
Альдостерон увеличивает поступление калия в клетки и экскрецию его с мочой, контролируя реабсорбцию в дистальных канальцах. При недостаточности коры надпочечников экскреция калия с мочой снижается и может развиться гиперкалиемия. В то же время при гиперактивности коры надпочечников (гиперальдостеронизме) усиленная реабсорбция натрия приведет к повышенному выделению калия и угрожающей гипокалиемии (2,4-1,6 ммоль/л). Существенное влияние на уровень калия в плазме крови оказывает нарушение pH крови. Так, метаболический ацидоз вызывает перемещение ионов водорода внутрь клетки в обмен на внутриклеточный калий, что приводит к тканевой гипокалиемии. При алкалозе, наоборот, развивается гиперкалиемия. На уровень калия в плазме влияет содержание в крови аниона НСО3, отражающее степень катаболических процессов.
Экскреция калия в почках имеет циркадный ритм, наименьшие ее значения отмечены в ночное время, что отражает ритм секреции глюкокортикоидов. Экскреция К+ быстро возрастает в ответ на нагрузку этим катионом. Гиперкалиемия в свою очередь стимулирует секрецию альдостерона. Альдостерон определяет транспорт калия в почках, а также в толстой кишке, слюнных и потовых железах. Введение большой дозы глюкокортикоидов вызывает гипокалиемию и усиливает калийурез, который продолжается значительно дольше действия стероидов.
Повышение концентрации инсулина в крови сопровождается снижением содержания калия, что происходит в результате поглощения калия миоцитами скелетных и сердечной мышц, клетками печени и жировой ткани. При сахарном диабете гиперкалиемия развивается легче, чем в норме. Инсулин способствует накоплению внутриклеточного калия независимо от уровня глюкозы в крови.
Гиперкалиемия в свою очередь активирует секрецию инсулина клетками островков Лангерганса. При снижении или повышении содержания калия в крови нарушается поступление в клетки глюкозы и аминокислот.
ГИПОКАЛИЕМИЯ
Недостаточное потребление калия редко вызывает гипокалиемию, повышенная экскреция калия почками - наиболее частая причина гипокалиемии. Прием лакрицы или ее производных может спровоцировать клиническую картину первичного гиперальдостеронизма, поскольку содержащаяся в лакрице глицерризиновая кислота обладает минералокортикоидной активностью. В таких случаях показано определение в крови содержания альдостерона и активности ренина. При первичном гиперальдостеронизме избыток альдостерона угнетает секрецию ренина. При приеме производных лакрицы в крови понижаются содержание как альдостерона, так и ренина.
Вторичные формы гиперальдостеронизма характеризуются повышением в крови уровня ренина и альдостерона. Это происходит при стенозе почечной артерии, злокачественной гипертензии, длительном приеме пероральных контрацептивов (синтетических эстрогенов и прогестинов), наличии ренинпродуцирующей опухоли (гемангиоперицитома).
Таким образом, выраженная гипокалиемия развивается при снижении поступления калия с пищей; усиленной экскреции калия почками при приеме диуретиков, диуретической фазе острой почечной недостаточности, гиперальдостеронизме, синдроме и болезни Кушинга, внепочечной потере калия при диарее, профузной рвоте; перераспределении калия между вне- и внутриклеточной жидкостью.
Гипокалиемию в условиях перемещения катиона в клетку отмечают при остром и хроническом метаболическом ацидозе; остром дыхательном алкалозе; введении инсулина или глюкозы; семейном гипокалиемическом параличе и пароксизмальных миопатиях, а также при некоторых эндокринных заболеваниях.
Клетки нервной системы быстро реагируют на уровень калия в плазме, чем можно объяснить раннее появление неврологической симптоматики. Первые признаки дефицита калия - ослабление рефлексов, гипотония мышц, слабость и астения. Некоторые случаи гипокалиемии приводят к явлениям паралича и даже рабдомиолиза. Ослабление тонуса гладкой мускулатуры при низком уровне калия может вызвать атонию желудка и парез кишечника, особенно на 2-3-й день послеоперационного периода.
В условиях гипокалиемии содержание калия в миоцитах миокарда снижается медленнее, чем в скелетных мышцах. Выраженная гипокалиемия сопровождается возникновением нарушения проводимости и ритма, что отражается на ЭКГ (уменьшение амплитуды зубцов, инверсия зубца T, расширение интервала S-T и появление зубца U). При хроническом дефиците калия увеличиваются размеры сердца, возникают нарушения ритма, а при резком снижении уровня калия в плазме возможна остановка сердца в систоле.
Для выявления причины гипокалиемии необходимы подробный сбор анамнеза и результаты лабораторного исследования. В анамнезе обращают внимание на прием диуретиков, слабительных, препаратов лакрицы, рвоту, диарею. При лабораторном обследовании определяют в плазме крови концентрацию калия и натрия, показатели КЩР. В качестве антикоагулянта при определении калия и натрия применяют не натриевую, а литиевую соль гепарина, стараются избегать гемолиза. Одновременно с исследованием концентрации калия плазмы крови часто определяют содержание катиона в суточной моче. Если за сутки больной выделяет с мочой менее 20-30 ммоль калия, причина гипокалиемии внепочечная, большие потери калия с мочой связаны с патологией почек. Желательно исследовать концентрацию альдостерона и активность ренина. Определение в крови концентрации магния и кальция показано в случаях неясной причины гипокалиемии.
Электролитные нарушения отмечают у многих пациентов, интенсивно потребляющих алкоголь. Гипокалиемия может возникать у алкоголиков даже при небольшом повышении в крови содержания натрия. Употребление большого количества пива также приводит к гипокалиемии и гипонатриемии; в пиве содержится очень мало солей. Гипонатриемия у алкоголиков не сопровождается избытком альдостерона.
ГИПЕРКАЛИЕМИЯ
Усиленное потребление калия с пищей редко вызывает гиперкалиемию, если при этом нет почечной или надпочечниковой недостаточности. Гиперкалиемия может развиваться при повышенном поступлении калия (прием избытка калия при терапии диуретиками, переливание крови с просроченным сроком хранения); перераспределении калия между водными пространствами (повреждение тканей, активация катаболических процессов, системный ацидоз); снижении выведения калия (острая почечная недостаточность, хроническая
почечная недостаточность, длительный прием калийсберегающих диуретиков, гипоальдостеронизм).
Гиперкалиемия при недостаточности надпочечников (болезнь Аддисона) сопровождается низким уровнем натрия в плазме крови, гипокалиурией, высокой активностью ренина. Гиперкалиемия при селективной недостаточности альдостерона сопровождается низким уровнем ренина и нарушением секреции кортизола. Нарушения метаболизма углеводов при острой и хронической почечной недостаточности провоцируют гиперкалиемию и метаболический алкалоз.
Симптомы гиперкалиемии зависят от скорости нарастания содержания катиона в плазме и связаны с изменениями мембранного потенциала нейронов и мышечных клеток. Нейромышечные симптомы гиперкалиемии выражаются в парестезиях, а в более тяжелых случаях в восходящем параличе конечностей. Выраженность кардиальных симптомов зависит от степени повышения калия в плазме - от минимальных изменений на ЭКГ до серьезных нарушений ритма и проводимости (поперечная блокада и фибрилляция желудочков). При концентрации калия выше 6 ммоль/л, как правило, обнаруживают изменения на ЭКГ, которые при прогрессировании гиперкалиемии становятся более тяжелыми. При концентрации калия выше 10 ммоль/л сердце может остановиться в диастоле. Гиперкалиемия (более 5 ммоль/л) отмечена в большом проценте случаев у детей, родившихся недоношенными. При уровне калия выше 7 ммоль/л могут развиться аритмии сердца с летальным исходом. В клинической практике продолжительная гиперкалиемия чаще всего происходит в результате хронической почечной недостаточности.
Гиперкалиемия требует неотложной диагностики. Необходимо определить, нет ли явлений гиповолемии, исследовать содержание электролитов повторно. Следует рационально определить газовый состав крови, провести функциональные пробы почек, исследовать параметры КЩР, определить активность ренина и оценить функцию надпочечников. Наибольшую опасность для пациента представляет острое повышение концентрации калия более 7 ммоль/л, что требует экстренной диагностики и длительного наблюдения. Однако следует отметить, что снизить высокое содержание калия в плазме крови достаточно трудно; в тяжелых случаях прибегают к гемодиализу.
Частая причина повышенного содержания калия в плазме крови - несоблюдение условий взятия крови. Наиболее частая ошибка - гемолиз. В ряде случаев при внутривенном введении калия по окончании
инфузии из этой же иглы (катетера) берут кровь для исследования. В таких ситуациях лаборатория может определить содержание калия в плазме крови, превышающее 10 ммоль/л. При большом количестве тромбоцитов или лейкоцитов, что происходит при миелопролиферативных заболеваниях, может возникнуть псевдогиперкалиемия в результате повышенного выхода калия из клеток в случае определения калия в сыворотке крови, а не в плазме.
Методы определения натрия и калия
Концентрацию натрия и калия измеряют сходными способами: методом пламенной атомно-эмиссионной спектроскопии (ПАЭС), потенциометрически при помощи ионоселективных электродов (ИСЭ), атомно-абсорбционной спектрометрией.
Физиологический эффект ионов зависит от их концентрации (активности) в объеме воды, в котором они растворены. В сыворотке крови содержится обычно 93,5% воды, 5,4% белка, 0,6% липидов и 0,9% других молекул. Соответственно при заболеваниях, изменяющих объем воды в сыворотке, физиологический контрольный механизм будет способствовать поддержанию на постоянном уровне отношения активности ионов к объему воды. Однако если объем водной фракции уменьшается, как это происходит при гиперпротеинемии или гиперлипидемии, действительная концентрация ионов в общем объеме пробы уменьшится, хотя эффективная активность ионов в объеме воды останется нормальной. При использовании методов ПАЭС эти физиологические факторы ответственны за появление псевдогипонатриемии или псевдогипохлоремии, наблюдаемых в этих случаях. При гиперпротеинемии лучше использовать метод ИСЭ. В этом случае наличие объемной ошибки не сопровождается трудностями клинической интерпретации для ионов калия, поскольку интервал нормальных значений концентрации калия в сыворотке достаточно велик и составляет 33% (3,6-5 ммоль/л). Интересно, что для натрия интервал нормальных значений концентрации в сыворотке крови (135-145 ммоль/л) составляет только 7%. Гиперпротеинемия и гиперлипидемия также увеличивают вязкость сыворотки, что может вызвать ошибки при разведении образца.
Метод ПАЭС обычно требует разведения пробы 1 : 100 или 1 : 200 дилюентом, содержащим внутренний стандарт. В качестве внутреннего стандарта наиболее часто используют литий (15 ммоль/л) или цезий (1,5 ммоль/л). Метод позволяет определять концентрацию ионов в общем объеме образца.
При нагревании в пламени пропана испаряется соль, которая получает электроны из восстанавливаемых газов с образованием атомов натрия и калия, нагревающихся в пламени, что приводит к формированию возбужденных атомов натрия и калия. Возбужденные атомы немедленно приходят в спокойное состояние, что сопровождается выделением света (эмиссией). Эмиссию натрия можно регистрировать при длине волны 589 нм, калия - при 766 нм. Количество выделенного света прямо пропорционально концентрации натрия или калия. Хотя только 1-5% атомов в пламени возбуждается для эмиссии, это достаточно точный и воспроизводимый метод.
Имеется несколько факторов, влияющих на определение калия и натрия в биологических жидкостях методом ПАЭС. Относительно высокая концентрация натрия будет оказывать влияние на определение калия вследствие воздействия на степень ионизации атомов калия в пламени. Степень влияния зависит от соотношения натрия и калия в калибраторе и пробах. Поскольку не отмечена клиническая корреляция между уровнем натрия и калия в сыворотке, то калибровка стандартным раствором (140 ммоль Na/л и 5 ммоль К/л), отражающая нормальный состав сыворотки, уменьшает вероятность ошибки. Влияние ионизации больше ощущается при проведении анализов мочи, но это не имеет клинического значения вследствие большого разброса нормальных значений.
Метод ИСЭ требует использования стеклянной ионообменной мембраны для определения натрия и мембраны валиномицина с нейтральными носителями для определения калия. Обычные натриевые электроды имеют в 1000 раз большую специфичность для натрия, чем для калия. Хотя отношение Na/К в сыворотке приблизительно равно 30, электрод для определения калия также имеет высокую специфичность, что устраняет влияние натрия на результаты. Определение ионов может быть проведено прямым (в неразведенной пробе) или непрямым (при разведении образца) способом. Прямые методы не испытывают влияния гиперпротеинемии и гиперлипидемии, тогда как разведение таких проб может привести к ошибке. Прямой метод ИСЭ выгоднее применять при определении ионов в цельной крови, непрямой метод - при исследовании малых объемов пробы. Определение ионов в моче методом ИСЭ имеет ограниченную линейность и подвержено влиянию ионного состава мочи.
Атомно-абсорбционная спектрофотометрия. Концентрация натрия и калия может быть определена атомноабсорбционной спектрофотометрией. Разведенную пробу помещают в пламя, металлы испаряются, и их атомы восстанавливаются до основного состояния. Монохроматический свет специфической линии резонанса (766,5 нм для калия и 589,0 нм для натрия), образуемый полой катодной лампой, проходит через пламя и абсорбируется атомами. Измеряют количество абсорбированного света, пропорциональное концентрации металла. Атомная абсорбция имеет большую чувствительность, но меньшую воспроизводимость и не используется в клинических лабораториях.
В рутинных лабораториях ранее самым распространенным методом определения натрия и калия была ПАЭС, однако в настоящее время возрастает число лабораторий, использующих метод ИСЭ.
Референсный метод определения натрия и калия - ПАЭС. Единственный значительный недостаток ПАЭС, также как и непрямого метода ИСЭ, - влияние объема водной фракции сыворотки при некоторых заболеваниях. Прямой метод ИСЭ не подвержен влиянию этого фактора, но может приводить к ошибке при калибровке вследствие электрохимических различий водного стандарта и сыворотки.
ФОСФОР
Фосфор - один из элементов, участвующий в построении тканей организма; в организме человека содержание фосфора составляет около 650 г. Фосфор содержится в большом спектре органических и неорганических веществ, что отражает и различие биохимической активности его соединений. Основные процессы, в которых соединения фосфора играют важную роль: метаболизм костной ткани, обмен углеводов, метаболизм липидов, построение мембран. Наибольшее диагностическое значение имеет определение в крови неорганического фосфора. В сыворотке крови неорганический фосфор представлен ионами НРО24- и Н2РО-4; содержание иона РО34- при физиологических значениях рН крови незначительно.
Ежедневная потребность в фосфоре составляет 1000-2000 мг (у взрослых); содержание его в пище достаточно. Особенно богаты фосфором молоко и молочные продукты, мясо, яйца; дефицит фосфора в пище практически не наблюдается. Всасывание фосфора в наибольшей степени происходит в тощей кишке. Снижение активности этого процесса отмечено в условиях повышенной кислотности желудочного сока, приеме некоторых лекарственных препаратов
(гидроокись алюминия), при увеличении содержания в пище кальция вследствие образования с фосфором в кишечнике нерастворимых соединений.
В норме у взрослых большая часть фосфора, абсорбированного в кишечнике, элиминируют почки. В случае низкого содержания фосфора в крови уровень экскреции его с мочой может быть даже ниже чувствительности используемых в лабораториях методов. Около 90% фосфора в крови проходит через фильтрационный барьер почечных телец, оказываясь в первичной моче, затем фосфаты фактически полностью (88-96%) реабсорбируются в проксимальных канальцах нефрона. Среди индексов, используемых для оценки экскреции фосфора, наиболее часто рассчитывают клиренс фосфора.
Клиническое значение
ГИПОФОСФАТЕМИЯ
Гипофосфатемия развивается при недостатке витамина D3, вызванном стеатореей. В этих условиях экскреция с калом жиров приводит к потере витамина D. У взрослых это наиболее частая причина недостатка витамина D и развития гипофосфатемии. Мальабсорбция возникает при ряде заболеваний печени и поджелудочной железы.
Выраженная гипофосфатемия наблюдается при синдроме первичного гиперпаратиреоза, связанного с гиперпродукцией ПТГ паращитовидными железами. В этих условиях ингибирована реабсорбция фосфатов в канальцах и, следовательно, увеличена его экскреция, повышен клиренс фосфатов с возникновением гиперкальциемии в условиях резорбции костной ткани с развитием остеопороза.
В отличие от специфических форм выраженной гипофосфатемии умеренное снижение фосфатов крови можно отметить при многих заболеваниях почек (в том числе тубулопатиях). При этом реабсорбция фосфатов снижается на уровне проксимальных канальцев нефрона; развивается фосфатурия, сопровождаемая снижением содержания фосфатов в крови.
Гипофосфатемия - симптом почечного тубулярного ацидоза (как наследственного, так и приобретенного), для которого характерны развитие метаболического ацидоза и повышение экскреции с мочой как фосфора, так и кальция. В условиях почечного тубулярного ацидоза в качестве компенсаторного механизма активируется секреция ПТГ, что усложняет дифференциальную диагностику первичного и вторичного гиперпаратиреоза.
ГИПЕРФОСФАТЕМИЯ
Столь же часто (как и гипофосфатемию) в клинической биохимии отмечают случаи гиперфосфатемии. К ним относят первичный гипопаратиреоз, псевдогипопаратиреоз, хроническую почечную недостаточность и метастазы в кости.
Методы определения
Определение содержания фосфора в сыворотке крови основано на том, что неорганические фосфаты, но не стабильные эфиры фосфорной кислоты способны реагировать с молибдатом в кислой среде с образованием комплексной соли фосфомолибдата аммония, имеющей слабо-желтую окраску. Это соединение можно определить непосредственно по пику абсорбции при длине волны 340 нм или после восстановления в молибденовый синий в диапазоне длин волн 640-750 нм, возможно и образование комплексов с другими красителями.
Количество экскретируемого с мочой фосфора колеблется от 0,3 до 1,3 г в сутки у взрослых людей и зависит от возраста, уровня физической активности и содержания фосфора в пище.
ХИМИЧЕСКИЕ МЕТОДЫ
Многочисленные методы, основанные на восстановлении молибденового синего, отличаются в основном видом примененного восстановителя; он должен восстанавливать только фосфорно-молибденовый комплекс, но не излишек молибдата в среде. Каждый из примененных восстановителей оказывает влияние на специфичность метода, его чувствительность, стабильность образованного окрашенного комплекса, формирование которого может происходить разными путями. В целом методы, основанные на восстановлении фосфорномолибденового комплекса в молибденовый синий, имеют линейность в ограниченном диапазоне концентраций определяемого вещества, слабую чувствительность и воспроизводимость; автоматизация их затруднена. Несмотря на недостатки, в настоящее время эти методы используют в практике работы клинических лабораторий.
Недостаток всех химических методов - проведение реакции в кислой среде, что сопровождается гидролизом стабильных эфиров фосфорной кислоты. Метод, лишенный этих недостатков, - измерение оптической плотности при 340 нм фосфорно-молибденового комплекса без применения восстановителей. Метод прост, легко поддается автоматизации. В настоящее время метод адаптирован к большинству биохимических автоанализаторов.
ФЕРМЕНТАТИВНЫЕ МЕТОДЫ
Ферментативный метод определения неорганического фосфора предложен в 1967 г., в качестве субстрата используется гликоген. После ряда сопряженных ферментативных реакций количество образующегося НАДФН измеряют спектрофотометрически при длине волны 340 нм; оптическая плотность инкубационной среды пропорциональна концентрации неорганического фосфора. Этот метод, описанный для анализа фосфатов в тканях, модифицирован позднее для определения ионов в сыворотке крови и моче.
Описан также ферментативный метод, основанный на использовании пуриннуклеозидфосфорилазы (КФ 2.4.2.1), ксантиноксидазы (КФ 1.2.3.2) при прямой спектрометрии мочевой кислоты при длине волны 293 нм. Мочевая кислота образуется при действии упомянутых ферментов в реакции инозина с неорганическим фосфатом. Все этапы определения проводят в одной кювете, высокая чувствительность метода позволяет использовать микроколичества исследуемого материала. Реакция протекает в течение короткого промежутка времени (5 мин при температуре 37 °С), что сокращает время исследования, к тому же не требует депротеинизации. Линейность реакции сохраняется в пределах пятикратного превышения нормального уровня фосфора в сыворотке крови. Несмотря на ряд примененных в методе ферментов, стабильность реагентов достаточно высокая. Для анализа мочи требуется предварительное разбавление пробы дистиллированной водой. Большое преимущество метода - возможность адаптации к биохимическим анализаторам; метод можно выполнить в режиме монореагента, в технике конечной точки или кинетического определения.
Необходимость спектрофотометрии в УФ-области можно преодолеть при использовании колориметрии. Предложено измерять перекись водорода, образуемую одновременно с мочевой кислотой в процессе окисления гипоксантина ксантиноксидазой. Для этого используют формирование хромогена в системе, содержащей 4-ами- нофеназон и фенол, в которой в присутствии Н2О2 образовывался красный комплекс хинонимина.
Ферментативные методы определения неорганического фосфора имеют значительные преимущества перед химическими: высокая чувствительность и специфичность, увеличение скорости исследования, возможность использования малых количеств образцов, легкость автоматизации. Тем не менее многие ферментативные методы определения фосфора имеют ограничения: необходимость УФ-спектрометрии
и недостаточная стабильность ферментов затрудняет их использование. Ферментативный колориметрический метод определения неорганического фосфора в биологических жидкостях удовлетворяет всем требованиям клинико-диагностических лабораторий в плане линейности, чувствительности, специфичности и простоты использования.
РЕФЕРЕНСНЫЕ МЕТОДЫ
Общепринятого референсного метода определения неорганического фосфора нет. Среди существующих реакций с молибденовым комплексом без последующего восстановления спектрофотометрия при длине волны 340 нм обладает высокой аналитической надежностью и может быть использована в качестве референсного метода.
Другая группа методов основана на использовании фосфорномолибденованадиевого комплекса. В этом случае нет необходимости использовать восстановители, так как комплекс имеет окраску, однако из-за низкого значения рабочего раствора фосфорные эфиры подвергаются частичному гидролизу, что завышает результаты на 0,2-0,3 мг/дл. Кроме того, метод имеет более низкую чувствительность, чем формирование молибденового синего.
1.4. ФЕРМЕНТЫ
АЛАНИИ- И АСПАРТАТАМИНОТРАНСФЕРАЗА
Метаболическое превращение оксикислот в аминокислоты было установлено в начале ХХ века, но только в 1937 г. отечественные ученые Браунштейн и Крицман доказали существование специфичного фермента - аспартатаминотрансферазы.
Аспартатаминотрансфераза (АСТ; глутамат-оксалоацетат-трансаминаза; GOT L-аспартат: 2-оксоглутаратаминотрансфераза, КФ 2.6.1.1) катализирует реакцию переаминирования (трансаминирования) между аспартатом и α-кетоглутаратом:
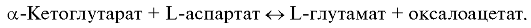 У
млекопитающих наиболее высокая активность и концентрация АСТ отмечена в
печени, нервной ткани, скелетной мускулатуре и миокарде. Незначительная
активность АСТ определена и в крови здоровых людей. В большинстве
тканей существует как минимум два изофермента АСТ: митохондриальный
изофермент (мАСТ),
У
млекопитающих наиболее высокая активность и концентрация АСТ отмечена в
печени, нервной ткани, скелетной мускулатуре и миокарде. Незначительная
активность АСТ определена и в крови здоровых людей. В большинстве
тканей существует как минимум два изофермента АСТ: митохондриальный
изофермент (мАСТ),
на всех поддерживающих средах движущийся к катоду, и растворимый в цитозоле изофермент АСТ (цАСТ), мигрирующий к аноду. цАСТ состоит из двух идентичных субъединиц; это димер с молекулярной массой 93 кД. мАСТ - тоже димер с молекулярной массой 91 кД. Выделение изоферментов выявило существование нескольких изоформ со сходной кинетикой, но выраженными иммунологическими различиями. Изоферменты ACT имеют некоторое различие кинетических характеристик: оптимум действия мАСТ более низкий, чем цАСТ.
Аланинаминотрансфераза (АЛТ; глутамат-пируваттрансаминаза; GPT, L-аланин: 2-оксоглутаратаминотрансаминаза, КФ 2.6.1.2) катализирует реакцию переаминирования между L-аланином и α-кетоглутаратом:
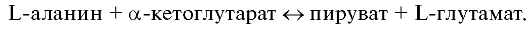 АЛТ
- вторая активная аминотрансфераза, выделенная из тканей человека. АЛТ
присутствует во многих органах: печени, почках, скелетных мышцах,
миокарде, поджелудочной железе. Невысокая активность АЛТ отмечена и в
сыворотке крови здоровых людей. Как и АСТ, АЛТ присутствует в клетках в
форме двух изоферментов - цитозольного и митохондриального, но последний
нестабилен, содержание его в клетке низкое.
АЛТ
- вторая активная аминотрансфераза, выделенная из тканей человека. АЛТ
присутствует во многих органах: печени, почках, скелетных мышцах,
миокарде, поджелудочной железе. Невысокая активность АЛТ отмечена и в
сыворотке крови здоровых людей. Как и АСТ, АЛТ присутствует в клетках в
форме двух изоферментов - цитозольного и митохондриального, но последний
нестабилен, содержание его в клетке низкое.
Клиническое значение определения концентрации аминотрансфераз
Повышение активности аминотрансфераз отмечено при ряде патологических процессов, в которые вовлечена печень. Активность АСТ и АЛТ повышена при остром панкреатите, холецистите, паразитарных заболеваниях, псориазе, ожогах, применении пропионлактона как противовирусного средства, перегрузке организма железом, гепатобилиарной патологии. В условиях пересадки почек и последующей терапии циклоспорином и азатиоприном активность как АЛТ, так и АСТ оказывается повышенной. Введение азатиоприна в большей степени, чем циклоспорина, повышает активность АСТ и АЛТ, свидетельствуя о гепатотоксическом действии препаратов. Увеличение активности аминотрансфераз можно отметить и у здоровых людей при диете, богатой белком или содержащей 25-30% сахарозы, а также у доноров.
Большое практическое значение имеет упоминание лекарственных препаратов, обладающих невыраженным гепатотоксическим свойством. К ним на основании накопленного многими исследователями
опыта относят аспирин, индометацин, линко-мицин, анаболические стероиды, пероральные контрацептивы, ингибиторы МАО, тестостерон и другие андрогены, прогестерон, сульфаниламиды, пиридоксин, барбитураты, препараты меди и железа, антибиотики (эритромицин, гентамицин, ампициллин, тетрациклин).
Активность АСТ в крови возрастает при туберкулезе легких, септицемии, герпетической инфекции, вирусном гепатите, опухолях разной локализации.
Активность АСТ снижается при малярии и беременности, не меняется при эмболии легочной артерии, пневмониях, абсцессах легкого, ревматоидном артрите. Активность АСТ повышается при приеме анаболических стероидов, андрогенов, пероральных контрацептивов, анестетиков и опиатов, антибиотиков, обладающих гепатотоксическим свойством, клофибрата. Увеличение активности АЛТ отмечено у пациентов при терапии некоторыми лекарственными средствами, особенно антибиотиками, гиполипидемическими препаратами, кетоацидозе, азотемии.
Исследование отношения мАСТ/общая активность АСТ также было предложено в качестве диагностического теста. Отношение мАСТ/общая активность АСТ снижено при общем гепатите и не изменено при обтурации желчных протоков, алкогольном поражении печени, метастазах в печень. Появление в сыворотке крови высокой активности мАСТ свидетельствует о некротических процессах в гепатоцитах. Однако эти исследования не нашли широкого применения в клинической химии, так как диагностическая чувствительность и специфичность исследования мАСТ оказались не выше, чем общая активность АСТ и АЛТ.
В остром периоде инфаркта миокарда повышение активности ACT - достоверный диагностический тест. В то же время активность АСТ повышена в значительно меньшей степени, чем активность КК или ЛДГ. Ретроспективный дискриминационный анализ выявил хорошую клиническую чувствительность и специфичность исследования активности АСТ (на уровне 73%). Клинико-морфологические исследования показали, что динамику активности АСТ можно использовать для расчета объема поражения при инфаркте миокарда при небольших очагах некроза миоцитов столь же достоверно, как и на основании активности КК.
Предложено использовать повышение активности АСТ в сыворотке крови как прогностический тест при остром лейкозе.
Методы определения аминотрансфераз
Много методических приемов было предложено для исследования общей активности АСТ: хроматографическое исследование аминокислот в инкубационной среде, реакция оксалоацетата с 2,4-динит- рофенилгидразином (2,4-ДНФГ), определение сформированного глутамата при действии глутаматдегидрогеназы (ГлДГ). В качестве унифицированного в России утвержден метод Райтмана-Френкеля, в котором оксалоацетат, образованный при переаминировании L-аспартата и α-кетоглутаровой кислоты, в щелочной среде превращается в пируват, который в реакции с 2,4-ДНФГ образует гидразон пирувата, оптическую плотность которого измеряют при длине волны 540 нм. Наиболее удобный аналитический спектрофотометрический метод, нашедший широкое применение, предложен Карменом. В этом методе образовавшийся в результате переаминирования оксалоацетат восстанавливают в малат с одновременным окислением НАДН при действии малатдегидрогеназы и измеряют кинетику оптической плотности НАДН при длине волны 340 нм. Специфические субстраты АСТ - L-аспартат или L-глутамат, хотя L-тирозин и некоторые аналоги аспартата также могут быть субстратом для фермента. Специфический ингибитор АСТ - аналог аспартата (винилглицин). Раздельное исследование активности цАСТ и мАСТ можно провести, используя хроматографические методы, а также методы ЭФ и иммуноингибирования.
Другой метод - титрование специфическим ингибитором винилглицином, который позволяет достичь наилучшего приближения к абсолютному референсному методу.
Методы исследования активности АЛТ в биологических жидкостях сходны с АСТ, особенно в колориметрическом методе Райтмана-Френкеля. В наиболее предпочтительном методе ультрафиолетовой кинетики (длина волны 340 нм) образованный при переаминировании аланина и α-кетоглутарата пируват восстанавливают в лактат с одновременным окислением НАДН, катализируемым ЛДГ. Преимущества метода следующие: а) возможность использовать для расчета активности фермента коэффициент молярной экстинкции НАДН; б) высокая степень специфичности; в) возможность учитывать степень ингибирования реакции при накоплении в инкубационной среде пирувата. После незначительной лаг-фазы снижение оптической плотности инкубационной среды при 340 нм пропорционально активности АЛТ.
В качестве кофермента в реакции переаминирования, осуществляемой обоими ферментами, выступает витамин В6 (пиридоксин), в ходе реакции превращающийся в физиологически активную форму - пиридоксаль-5-фосфат (П-5-Ф). Добавление в сыворотку крови П-5-Ф приводит к повышению активности как АСТ, так и АЛТ. В крови здоровых людей при добавлении П-5-Ф отмечена отрицательная корреляционная зависимость между содержанием в крови П-5-Ф и активностью АСТ и АЛТ. Витамин В6 широко представлен в пищевых продуктах, но разрушается при приготовлении пищи. Содержание П-5-Ф в крови снижается с возрастом, поэтому активность АСТ и АЛТ у лиц старше 64 лет на 30% ниже, чем в возрасте 46-63 лет. В старшей группе выявлено наиболее значительное повышение активности ACT и АЛТ при добавлении в инкубационную среду П-5-Ф (19% по сравнению с 6,5% в более молодой группе). Содержание витамина В6 в сыворотке крови оказывает выраженное влияние на активность АСТ, АЛТ и их соотношение. Следует заметить, что у здоровых людей коэффициент вариации активности АСТ значительно выше, чем АЛТ.
Для исследования активности АСТ предпочтительно использовать свежую сыворотку крови, взятую в условиях минимального стаза. Можно применять и плазму крови, полученную при добавлении гепарина не более 0,2 мг/мл, ЭДТА (1 мг/мл), фторида (2 мг/мл), оксалата (1 мг/мл) и цитрата (1 мг/мл).
АМИЛАЗА
α-Амилаза [а-(1,4)-глюкан-4-глюканогидролаза, КФ 3.2.1.1] - фермент, гидролизующий внутренние 1,4-α-гликозидные связи крахмала, гликогена и других полимеров глюкозы. В организме человека основные источники а-амилазы - поджелудочная и слюнные железы. Многочисленные изоформы, выделенные из биологических жидкостей и тканей человека, представляют собой, вероятно, гетерогенные продукты посттрансляционных изменений двух семейств изоферментов амилазы, синтез которых кодируют два локуса гена Amy-1, слюнной (С) тип амилазы и Amy-2, панкреатический (П) тип фермента, тесно связанные в хромосоме 1. Изоферменты С и П не имеют больших различий в аминокислотном составе. Гель-фильтрацией на сефадексе во фракции С-амилаз выделены две изоформы, одна из которых содержит углеводы. Молекулярная масса изоформ, содержащих углеводы, 57 кД, не содержащих углеводы - 55 кД.
Изоэлектрические точки основных изоформ С-изоамилаз от 5,5 до 6,5. П-группа изоамилаз имеет меньшую молекулярную массу (53 кД) и не содержит углеводов. Изоэлектрические точки этих белков варьируют от 5,7 до 7,0.
Убедительным доказательством того, что П-тип амилазы образуется только в поджелудочной железе, служит отсутствие этого изофермента у лиц с тотальной панкреатэктомией. С-изофермент а-амилазы, напротив, может быть синтезирован в разных органах и тканях. Высокая активность С-амилазы зафиксирована в ткани фаллопиевых труб и содержимом кисты яичников. Специфическая группа изоамилаз, продуцируемых тканями женских половых органов, не выявляется в сыворотке крови или моче здоровых людей; распределение изоамилаз идентично у мужчин и женщин. Изоамилазы, принадлежащие к С-группе, обнаружены и в женском молоке. В раневой жидкости также содержатся амилазы, относящиеся к С-группе.
Клиническое значение определения активности амилазы в сыворотке крови
Определение активности α-амилазы в сыворотке крови - наиболее распространенный тест диагностики острого панкреатита. При остром панкреатите активность фермента в сыворотке крови возрастает через 3-12 ч после болевого приступа, достигает максимума через 20-30 ч и возвращается к норме при благоприятном течении в пределах четырех дней. Активность α-амилазы (диастазы) в моче возрастает через 6-10 ч после подъема активности в сыворотке и возвращается к норме чаще всего через три дня после подъема.
В настоящее время широко известно, что увеличение общей активности α-амилазы неспецифично для панкреатита и других заболеваний поджелудочной железы. Клинические исследования показали, что повышение активности α-амилазы происходит при ряде заболеваний, к которым относят кишечную непроходимость, заболевания желчных путей, аппендицит, паротит, внематочную беременность. Исследования активности α-амилазы в сыворотке крови и моче у лиц с разной степенью некроза паренхимы поджелудочной железы показали, что активность фермента в биологических жидкостях не отражает степень воспаления железы и их измерение имеет малое значение для наблюдения за состоянием больного. Тем не менее чувствительность и специфичность определения α-амилазы при диагностике острого панкреатита возрастают при изменении границ нормальных
значений (дискриминационный уровень нормы и патологии - активность, в 1,5-2 раза превышающая верхние границы нормы). В этом случае определение активности α-амилазы наиболее информативно в первые сутки развития острого панкреатита. По мнению ряда авторов, определение активности α-амилазы в сыворотке крови при хроническом панкреатите не имеет диагностического значения. Возможно, этот вывод сделан на основании неудовлетворительной точности и воспроизводимости методов определения активности α- амилазы при низких (часто субнормальных) значениях активности фермента, характерных для данного заболевания.
У человека α-амилазу, свободно проходящую через фильтрационный барьер почечных телец, реабсорбируют клетки эпителия почечных канальцев так же, как и другие низкомолекулярные белки сыворотки крови. Увеличение активности амилазы в сыворотке крови может быть вызвано нарушением элиминации фермента. Пример - состояние, называемое макроами-лаземией, когда фермент связан с иммуноглобулинами сыворотки крови и образует макромолекулярный комплекс. Такой комплекс не фильтруется в мочу и не может быть удален при помощи каких-то иных механизмов, что ведет к значительному и порой длительному увеличению активности α-амилазы в сыворотке крови. Макроамилаземия встречается у здоровых людей с частотой 1%, у лиц с гиперамилаземией - с частотой 2,5%. Макроамилаземия может быть диагностирована методом ультрацентрифугирования, ЭФ, гельхроматографии, предложен также простой тест преципитации комплекса полиэтиленгликолем.
Активность α-амилазы в сыворотке крови часто увеличена при почечной недостаточности, однако не совсем ясно, что является причиной такого увеличения - возрастание образования фермента или снижение его элиминации. В таких случаях дополнительную информацию может дать определение скорости экскреции α-амилазы или расчет клиренса фермента.
По данным многих авторов, наиболее чувствительным и специфичным тестом для диагностики панкреатита служит уровень активности П-изофермента α-амилазы. Особое значение этот тест приобретает, если у больного с предполагаемым диагнозом панкреатита обнаружена нормальная общая активность амилазы. По сниженной активности П-амилазы может быть диагностирован хронический панкреатит. Доля П-изоамилаз в общей активности α-амилазы значительно выше в моче, чем в сыворотке крови,
возможно, вследствие различий в экскреции изоферментов почками. Тем не менее диагностическое значение определения активности изоферментов α-амилазы в моче уступает таковому в крови.
Методы определения активности амилазы
Измерение активности α-амилазы для диагностических целей широко применяют в клинике на протяжении более 100 лет. За это время описано более 200 методов определения активности фермента. Несмотря на большое разнообразие предложенных методов, они могут быть объединены в три группы: амилокластические, глюкокластические и хромогенные.
Амилокластические методы. В амилокластических методах определения активности α-амилазы измеряют распад крахмального субстрата, используя турбодиметрический, йодометрический или нефелометрический принцип. Йодометрические методы основаны на способности избытка негидролизованного субстрата давать в реакции с йодом окрашенные соединения. Интенсивность окраски зависит от состава субстрата: молекулы декстринов, имеющие более 30 гексозных остатков, дают красную окраску; молекулы, состоящие из четырех-пяти гексозных остатков, окрашенных продуктов в реакции с йодом не дают. Зависимость окраски от свойств и состава крахмального субстрата ставит вопрос о его унификации. Активность фермента определяют по убыли оптической плотности субстрата после гидролиза амилазой.
Хромогенные методы. Другая группа методов определения активности α-амилазы основана на использовании хромогенных нерастворимых субстратов. Хромогенный субстрат - полисахарид, который вследствие ковалентного связывания с красителем становится нерастворимым. Методы различаются как субстратом (крахмал, амилопектин, амилоза), так и связанным с ним красителем. α-Амилаза гидролизует субстрат с образованием растворимого хромогена. После остановки реакции непрореагировавший нерастворимый субстрат удаляют центрифугированием, и в супернатанте определяют оптическую плотность хромогена; для лучшей воспроизводимости желательно провести фильтрование супернатанта. Активность фермента рассчитывают по сравнению со стандартом (препаратом α-амилазы) или контрольной сывороткой с известной активностью фермента, учитывая спонтанный гидролиз хромогенного субстрата. Единицу активности α-амилазы в этой группе методов рассчитывают по коэффициенту экстинкции хромогена.
Глюкокластические методы. В последнее время получили распространение сахарогенные методы определения активности α-амилазы, основанные на ферментативном определении продукта реакции (глюкозы). Субстрат и ферменты, способствующие образованию глюкозы, различаются в коммерческих наборах разных фирм. Широкое применение получили методы с использованием УФ-спектроскопии. В этих методах образование сахаров сопряжено с восстановлением НАД и активность α-амилазы определяют по скорости увеличения абсорбции при длине волны 340 нм, обусловленной формированием НАДН. Ферментативные методы определения активности α-амилазы особенно удобны при наличии автоматического автоанализатора, они позволяют использовать микроколичества (2-5 мкл) биологического материала, просты в исполнении. Однако они не лишены недостатков, обусловленных составом субстрата и комплексом сопряженных реакций; промежуточные продукты могут исказить конечный результат.
ПРОБЛЕМЫ, СВЯЗАННЫЕ С ОПРЕДЕЛЕНИЕМ АКТИВНОСТИ
АМИЛАЗЫ
Несмотря на пристальное внимание, уделяемое изучению α-амилазы на протяжении многих лет, исследование активности фермента сопряжено с отдельными трудностями: отсутствием гомогенного субстрата с определенной химической структурой, образованием смеси продуктов реакции, множественными механизмами реакции. В настоящее время в клинической биохимии это единственный фермент, для которого не разработан не только референсный, но даже оптимальный метод определения активности, малодоступен стабильный материал для проведения внешнего контроля качества. Отсутствие унифицированного субстрата, разные механизмы реакции и образуемые продукты реакции - все это находит отражение во множестве способов выражения активности фермента (амилокластические единицы, хромогенные и др.), что затрудняет сопоставление данных, полученных разными методами.
Различие в механизме и продуктах реакции, способе выражения активности фермента ставит вопрос о сопоставимости данных, полученных разными методами. В ряде работ установлено, что результаты определения активности α-амилазы хорошо коррелировали друг с другом, однако значения активности фермента, определенные каждым из методов, были различными. В этой связи высказано сомнение в идентичности данных, полученных в реакциях с разными механизмами действия.
Среди обычно используемых методов разделения изоферментов α-амилазы следует отметить ЭФ на разных поддерживающих средах, хроматографию, изоэлектрическое фокусирование, определение активности с учетом специфичности по субстратам и ингибиторам каждого из изоферментов, иммунохимические методы.
α-Амилаза - стабильный фермент, активность которого не изменяется при хранении при 20 °С в течение недели и при 4 °С в течение месяца. Хранение проб сыворотки крови при -20 °С в течение 3 мес при неоднократных замораживаниях и оттаиваниях не изменяет спектр изоферментов. Изменения истинного распределения фракций амилазы могут происходить, если процедуру ЭФ проводят при 37 °С в течение нескольких часов. Нежелательна также длительная инкубация при 37 °С при определении низкой активности фермента.
Особые проблемы связаны с хранением проб мочи. Известно, что амилаза быстро инактивируется при рН ниже 5,0, поэтому рекомендовано собирать мочу в буфер при рН 7,0. Однако если моча находится в мочевом пузыре хотя бы некоторое время, фермент будет инактивирован кислой мочой. Сомнительно также, сможет ли фермент избежать распада в очень кислой моче, перед тем как покинет почки. Влияние мочи с низким рН на активность фермента необходимо учитывать при исследовании отношений клиренсов амилазы и креатинина, проводимом у больных с нарушенной функцией почек.
γ-Глутамилтранспептидаза
В последние годы в клинической химии подобающее место заняло определение активности у-глутамилтрансферазы (ГГТ; γ-глутамилтранспептидазы, КФ 2.3.2.2).
ГГТ катализирует перенос у-глутамила на аминокислоту или пептид, на другую молекулу субстрата или воду. ГГТ - белок, состоящий из одной полипептидной цепи с молекулярной массой 90 кД. Фермент содержит гидрофильный и гидрофобный фрагменты. Активный центр расположен на гидрофильном участке полипептидной цепи. Гидрофобная область - часть цепи, которой фермент прикреплен к мембране. Если экстракцию фермента из тканей провести с использованием в качестве детергента желчных кислот или тритона Х-100, ГГТ вместе с гидрофобным участком может быть переведена в раствор. Если в экстрагирующую смесь включены только протеазы (папаин или трипсин), гидрофобный фрагмент ГГТ остается на мембране, а в растворе оказывается гидрофильная часть полипептида ГГТ.
Гидрофильные фрагменты ГГТ, изолированные из печени или почек, иммунологически сходны, так же как и гидрофобные фрагменты ГГТ, изолированные из разных органов.
ГГТ занимает важное место в метаболизме аминокислот. Комплекс биохимических реакций реабсорбции аминокислот из первичной мочи, профильтрованной через фильтрационный барьер почечных телец, назван глутамиловым циклом. Этот процесс начинается с действия ГГТ, которая расположена на наружной поверхности клеточной мембраны и связывает аминокислоту первичной мочи с клеткой эпителия канальцев при участии естественного субстрата глутатиона, образуя тройной комплекс: аминокислота-ГГТ-глутатион. Отмечено ингибирование реакции высокими концентрациями субстратов. Как следствие связывания двух субстратов в активном центре фермента происходит перенос глутамиловой кислоты от глутатиона к аминокислоте. В этой фазе цикла аминокислоту переносят в клетку, где происходят последующие реакции, в которых глутамиловая циклотрансфераза расщепляет связь между амино- и глутамиловой кислотой, потребляя молекулу АТФ. Присутствие ГГТ на мембране клеток других органов (тонкая кишка, хориоидальное сплетение и др.) дает основание предположить, что и в этих органах фермент принимает участие в транспорте аминокислот. Роль ГГТ печени полностью не выяснена; предположительно фермент связывает молекулы веществ, которые необходимо экскретировать.
Биологическая роль фермента связана также с регуляцией уровня глутатиона в тканях. Именно этим можно объяснить высокий уровень глутатиона в плазме крови и моче пациентов с генетически детерминированным отсутствием синтеза ГГТ. Регулируя уровень глутатиона, ГГТ может влиять на синтез белка, что объясняет повышенную удельную активность фермента в тканях с высокой скоростью метаболизма. Это же может быть причиной повышенного уровня фермента в тканях и крови новорожденных.
ГГТ содержится в основном в мембране клеток, обладающих высокой секреторной или адсорбционной способностью: эпителиальных клетках, выстилающих желчные пути, печеночных канальцах, проксимальных канальцах нефрона, панкреатической экзокринной ткани и выводных протоках, ворсинчатых клетках тонкой кишки. В порядке снижения удельной активности ГГТ ткани располагаются в следующей последовательности: почки, печень, поджелудочная железа, щеточная кайма клеток тонкой кишки. У взрослых высокая удельная
активность ГГТ присутствует только в гепатоцитах периферической зоны печеночных долек, богатых билиарными эпителиальными клетками, тогда как у новорожденных отмечена высокая удельная активность ГГТ во всей ткани печени. Активность ГГТ не обнаружена в скелетных мышцах и миокарде. Активность фермента в сыворотке крови здоровых лиц по сравнению с тканями невелика.
Синтез ГГТ в организме человека кодирует один локус гена, гетерогенность фермента связана с постсинтетическими изменениями и зависит от степени сиалилирования, гликозилирования и т. д. В сыворотке крови отмечено наличие форм ГГТ, имеющих одинаковую молекулярную массу и каталитические свойства, но отличающихся по электрофоретической подвижности. Диагностическое значение изоформ ГГТ при ряде патологических состояний до конца не изучено. Уточнению диагностического значения изоформ ГГТ при патологических состояниях и внедрению этого теста в лабораторную практику будет способствовать введение единой классификации различных молекулярных форм ГГТ.
Клиническое значение определения концентрации ГГТ в сыворотке крови
Наиболее частая причина повышения активности ГГТ в сыворотке крови - патология печени. Слабое токсическое воздействие на печень, вызывающее жировую инфильтрацию, прием алкоголя и лекарственных препаратов сопровождаются умеренным увеличением активности ГГТ. Более выраженное повышение активности фермента связано с внепеченочной и внутрипеченочной обструкцией, вторичным вовлечением печени в онкологические процессы организма путем метастазирования. Самая высокая активность ГГТ в сыворотке крови отмечена при закупорке желчного протока или злокачественных опухолях, прямо или опосредованно поражающих печень.
При отсутствии желтухи определение ГГТ - чувствительный тест для выявления патологии печени; клиническая чувствительность выше, чем у таких ферментов, как ЩФ и 5-нуклеотидаза. При онкологических заболеваниях нормальная активность ГГТ в сыворотке крови свидетельствует об отсутствии метастазов в печени, тогда как высокая активность ГГТ (в 12 раз и более выше нормы) служит индикатором поражения печени метастазами. При остром вирусном гепатите многократное исследование активности ГГТ позволяет следить за течением болезни: постоянно увеличенная
активность ГГТ указывает на развитие хронической формы заболевания. При увеличении активности ЩФ и трудностях определения ее изоферментов полезно определять активность ГГТ для идентификации возможного источника гиперферментемии: активность ГГТ остается в пределах нормы, если увеличение активности ЩФ вызвано костным изоферментом, и увеличена, когда фермент образуется в печени. В педиатрии определение активности ГГТ предпочтительнее, чем определение ЩФ, особенно в условиях скрининга, так как активность ГГТ не меняется с возрастом и полученные результаты легче интерпретировать.
Высокая активность ГГТ присутствует в крови людей, злоупотребляющих алкоголем. У 74% алкоголиков, страдающих гистологически подтвержденным поражением печени, увеличение активности ГГТ было постоянным даже в периоды абстиненции. Существуют определенные различия между активностью ГГТ в крови алкоголика и человека, принявшего значительную дозу алкоголя. У первых наступает увеличение активности ГГТ до 140% от нормальных значений с пиком активности через 18 ч, у вторых даже после тяжелого опьянения увеличение активности ГГТ не превышает 15% в течение 12 ч.
Развитие инфаркта миокарда сопровождается изменениями активности ферментов сыворотки крови (КК, ЛДГ, АСТ). К ним может быть отнесена и ГГТ, активность которой после приступа стенокардии остается повышенной в течение длительного времени. Повышение активности ГГТ отмечено у 50% больных стенокардией и у части пациентов с другими заболеваниями (коронарная недостаточность, недостаточность кровообращения); изменения активности ГГТ не имеют значения в диагностике инфаркта миокарда. При инфаркте миокарда остаются неясными механизмы увеличения активности ГГТ, поскольку она отсутствует в сердечной мышце.
Активность ГГТ в моче выше, чем в сыворотке крови. Присутствующая в моче ГГТ имеет почечное происхождение: фермент выделяется в мочу из разрушенных клеток проксимальных отделов канальцев, которые содержат ГГТ в высокой концентрации.
Методы определения активности ГГТ
В настоящее время при определении активности ГГТ в качестве акцептора глутамиловой группы используют глицинглицин: оптимальная концентрация его подавляет реакцию гидролиза, но не транспептидации. В качестве донора глутамилового радикала предложено использоватьмногиесоединения:N-γ-глутамил-аминопроприонитрил,
γ-L-глутамил-β-нафтиламид, N-(DL-γ-глутамил)-анилин и L-γ-глутамил-р-нитроанилин (glu-PA). Широкое применение нашло последнее соединение, для выявления окрашивания которого не требуется дополнительных реакций. Кроме того, коэффициент молярной экстинкции р-нитроанилина (Е = 9,9 см/мкмоль при длине волны 405 нм) достаточно высокий.
Активность ГГТ в сыворотке крови мужчин в полтора раза выше, чем у женщин, что можно связать с влиянием андрогенов. Отмечена положительная корреляция между активностью фермента и массой тела. В течение беременности активность ГГТ в крови снижается, особенно в первые недели. Плазма новорожденных содержит ГГТ в концентрации, в 8-10 раз превышающей таковую у взрослых; у недоношенных она даже выше. В течение 7-9 мес жизни активность ГГТ в крови уменьшается (20-50% активности взрослых), оставаясь постоянной до периода полового созревания.
КРЕАТИНКИНАЗА
Креатинкиназа-АТФ: креатин-N-фосфотрансфераза (КФ 2.7.3.2) - катализирует обратимый перенос фосфатного остатка между АТФ и креатином с образованием АДФ и креатинфосфата. Общепринято сокращенное название фермента - креатинкиназа (КК). КК - цитозольный и митохондриальный фермент, который функционирует в клетках многих тканей. Продукт реакции фосфокреатин - макроэргическое соединение, обеспечивающее энергией сокращение мышцы, ее расслабление и транспорт метаболитов в миоцит. В первое время активность КК в крови интересовала клинических химиков как тест для выявления поражения поперечнополосатой мускулатуры. В настоящее время активность КК - ведущий тест в диагностике инфаркта миокарда.
Наибольшее содержание КК отмечено в миокарде и скелетных мышцах, высокое содержание - в языке, мышце диафрагмы, низкое - в почках, легких, печени. КК - димер; в цитозоле клеток тканей человека присутствуют 2 субъединицы: М - мышечный тип и В - мозговой тип. Субъединицы представляют собой белки с молекулярной массой 41000 Д с активным центром в каждой субъединице. Соответственно двум формам субъединиц димерная форма молекулы КК имеет следующие варианты: мышечный тип КК-ММ, гибридный димер КК-МВ, характерный для миокарда, и изофермент КК-ВВ, локализованный преимущественно в мозговой ткани (табл. 1.6).
Таблица 1.6. Общая активность КК и ее коферментные спектры в различных органах и тканях крыс
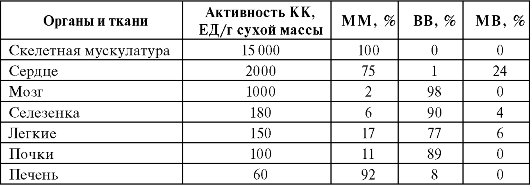 Активность
фермента и распределение его изоферментов органоспецифичны, поэтому
идентификация и количественное определение изоферментов КК в сыворотке
крови не только полезно для установления увеличения проницаемости
мембран или повреждения специфического органа, но и дает возможность
установления диагноза, наблюдения клинического течения и оценки прогноза
заболевания. В электрическом поле наибольшей подвижностью обладает
КК-ВВ, наименьшей - КК-ММ, гибридная форма КК-МВ занимает промежуточное
положение. В соответствии с этим в классификации Международного союза
теоретической и прикладной химии КК-ВВ обозначена изоферментом I КК,
КК-МВ - II, КК-ММ - III. Для понимания источников появления в крови
активности КК-МВ следует отметить, что у плода до 16-недельного возраста
в мышечной ткани доминирует зародышевая форма КК, а именно КК-МВ,
которая позже замещается КК-ММ. Определенная перестройка изоферментного
состава КК происходит и при гипертрофии миокарда: повышается процентное
содержание КК-МВ и КК-ВВ, а доля КК-ММ оказывается сниженной. Миоциты в
условиях длительной гиперфункции повышают синтез изоформы КК-ВВ.
Активность
фермента и распределение его изоферментов органоспецифичны, поэтому
идентификация и количественное определение изоферментов КК в сыворотке
крови не только полезно для установления увеличения проницаемости
мембран или повреждения специфического органа, но и дает возможность
установления диагноза, наблюдения клинического течения и оценки прогноза
заболевания. В электрическом поле наибольшей подвижностью обладает
КК-ВВ, наименьшей - КК-ММ, гибридная форма КК-МВ занимает промежуточное
положение. В соответствии с этим в классификации Международного союза
теоретической и прикладной химии КК-ВВ обозначена изоферментом I КК,
КК-МВ - II, КК-ММ - III. Для понимания источников появления в крови
активности КК-МВ следует отметить, что у плода до 16-недельного возраста
в мышечной ткани доминирует зародышевая форма КК, а именно КК-МВ,
которая позже замещается КК-ММ. Определенная перестройка изоферментного
состава КК происходит и при гипертрофии миокарда: повышается процентное
содержание КК-МВ и КК-ВВ, а доля КК-ММ оказывается сниженной. Миоциты в
условиях длительной гиперфункции повышают синтез изоформы КК-ВВ.
Клиническое значение определения активности КК и ее изоферментов
Повышение активности КК в крови может быть следствием травмы, переохлаждения или перегревания, голодания и бактериальной интоксикации, дегидратации, поражения электрическим током. Повышенная активность КК-МВ отмечена при мышечной дистрофии разной этиологии, ишемическом рабдомиолизе с миоглобинурией,
отравлении угарным газом. Активность КК-МВ повышалась, более чем на порядок превышая норму, у больных острым перикардитом при инверсии сегмента S-T.
Опыт применения изоферментной диагностики в блоке интенсивной терапии показал, что повышение в крови активности КК-МВ может происходить при выраженной недостаточности кровообращения, катетеризации сердца, отеке легких, аритмиях, кардиогенном шоке, алкогольной интоксикации, кровотечении из ЖКТ, травматической эпилепсии, травме грудной клетки. Активность КК-МВ повышена в крови пациентов при синдроме шока, развившемся при анемии, гиперкапнии, гипоксемии, молочнокислом ацидозе, выраженной гипотонии. Однако только в редких случаях в указанных ситуациях активность КК-МВ на 6% превышала активность КК. Учитывая возможности неспецифического повышения активности КК-МВ, надо помнить и о возможности пропустить небольшой инфаркт миокарда. У больных с гипертрофией миокарда активность КК-МВ в период инфаркта может достигать 1/3 активности КК.
Повышение активности КК в сыворотке крови может быть обусловлено увеличением активности изофермента КК-ММ. Активность КК-ММ в сыворотке крови повышается при прогрессирующей мышечной дистрофии, дерматомиозите, полимиозите, инфаркте миокарда, гипотиреозе, некоторых заболеваниях нервной системы. Активность КК-ММ увеличивается также после физической нагрузки, внутримышечных инъекций, хирургических операций. При мышечной дистрофии типа Дюшенна (наследственном, связанным с полом рецессивном заболевании) активность КК-ММ увеличивается в 8-90 раз по сравнению с нормой, активность изофермента увеличена также у носителей этого гена.
Активность КК-ВВ в крови отмечали во время аортокоронарного шунтирования. Полагают, что активность КК-ВВ может быть тестом аноксии тканей. Активность КК-ВВ в крови может также быть следствием гипоксического повреждения мозга, особенно в условиях перинатальной гипоксии. Активность КК-ВВ увеличена у 53% новорожденных с асфиксией. КК-ВВ присутствует в гладкой мускулатуре, но не определяется в сыворотке крови лиц с доброкачественными заболеваниями этих тканей. Одним из возможных объяснений повышения активности КК-ВВ в крови при сосудистых операциях служит предположение, что стенки вен, как, впрочем, и аорты, содержат только одну изо-форму КК, а именно КК-ВВ.
Активность изофермента КК-ВВ может быть повышена в крови при раке предстательной железы, мелкоклеточном раке легкого, аденокарциноме желудка, лейкозах, хронической почечной недостаточности, передозировке миорелаксантов. Метастазирование рака предстательной железы сопровождается особенно высокими цифрами активности КК-ВВ в крови. Исследователи сходятся во мнении, что активность КК-ВВ может быть использована как неспецифический маркер опухолевого процесса. Следует отметить, что при опухолевом процессе активность КК-ВВ в крови присутствует в форме макро-КК-I.
В ряде случаев при инфаркте миокарда, а иногда и в его отсутствие высокая активность КК сохраняется неопределенно долго. Наблюдаемые явления обусловлены циркуляцией в крови необычных форм КК и ее изоферментов. После разделения при ЭФ фракций КК на электрофореграмме становятся видимыми полосы, не соответствующие положению полос КК-ММ, КК-МВ и КК-ВВ, и можно отметить наличие изоформ КК, движущихся к катоду, что из белков сыворотки крови свойственно иммуноглобулинам. Известно, что окисление сульфгидрильных групп КК изменяет электрофоретическую подвижность молекул, однако при этом они по-прежнему движутся к аноду. У больных метастазирующим раком предстательной железы выделен изо-фермент КК, мигрирующий
между КК-МВ и КК-ВВ.
Методы определения активности КК
Фермент КК катализирует обратимое фосфорилирование креатина и АДФ согласно реакции:
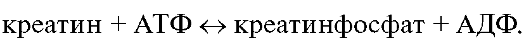 Аналитические
методы, используемые в клинической биохимии для определения активности
КК, могут быть основаны как на прямой, так и на обратной реакции. В ходе
реакции можно определить количество креатина или концентрацию
креатинфосфата. Первыми методами определения активности КК были методы
конечной точки; в настоящее время доминируют кинетические методы.
Аналитические
методы, используемые в клинической биохимии для определения активности
КК, могут быть основаны как на прямой, так и на обратной реакции. В ходе
реакции можно определить количество креатина или концентрацию
креатинфосфата. Первыми методами определения активности КК были методы
конечной точки; в настоящее время доминируют кинетические методы.
Креатинфосфат в кислой среде гидролизуется с большей скоростью, чем АДФ и АМФ, при этом образуются креатин и ортофосфат. Далее количество освобожденного при гидролизе ортофосфата определяют по формированию молибденового синего в реакции
Фиске-Суббароу (прямой метод). В других реакциях освобожденный при гидролизе креатин взаимодействует с нингидрином, диацетилом или α-нафтолом с формированием флюорофоров. Флюоресценцию последних измеряют при специфических длинах волн испускания на флюоресцентном спектрофотометре.
В настоящее время для определения активности КК используют метод, предложенный Оливер и соавт., который основан на обратной реакции - кинетическом определении образующегося в реакции креатинфосфата. Кинетическая УФ-спектроскопия - референсный метод определения активности КК в соответствии с методом Оливер и соавт.
Увеличение абсорбции реакционной смеси при длине волны 340 нм и кинетическом измерении позволяет определить активность КК в большом интервале активности. Дальнейшее совершенствование метода касается введения в реакцию АМФ для ингибирования аденилаткиназы и добавления N-ацетилцистеина с целью защиты тиоловых групп фермента от окисления.
Методы исследования изоферментов КК обычно делят на 5 категорий: ЭФ на разных поддерживающих средах, ионообменная хроматография, иммуноингибирование, иммунопреципитация, радиоиммунные методы.
Электрофоретические методы идентификации изоферментов КК надежны, хотя требуют много времени; их относят к полуколичественным. Чувствительность колориметрического метода идентификации изоферментов после ЭФ-разделения очень низкая, поэтому для получения точных результатов рекомендуют применение флюоресцентного метода, хотя линейный диапазон его относительно узок. Диффузия флюоресцентных полос меньше в ацетате целлюлозы, чем в агарозе, однако разделение изоферментов происходит лучше в агарозе.
Активность КК определяют в сыворотке и плазме крови (в качестве антикоагулянта можно применять только гепарин), в спинномозговой и амниотической жидкости.
В крови здоровых людей активность КК составляет 20-75 МЕ/л у женщин и 20-150 МЕ/л у мужчин. Более высокая граница нормы для мужчин связана с большей массой мышечной ткани; увеличение массы тела при ожирении не сопровождается повышением активности КК. Дискриминационный уровень, выше которого активность КК может свидетельствовать о наличии инфаркта миокарда, составляет 200 МЕ/л, хотя и не исключено наличие субэндокардиального инфаркта при активности КК 160-180 МЕ/л. Современные методические приемы
позволяют получать линейные результаты активности КК от 3 до 1000 МЕ/л. Принято считать, что активность КК-МВ, на 6% превышающая активность КК, свидетельствует о наличии инфаркта миокарда, меньшая доля изофермента КК-МВ - о поражении скелетных мышц. Эта величина условна и связана с диагностикой инфаркта миокарда.
ЛАКТАТДЕГИДРОГЕНАЗА
Лактатдегидрогеназа (ЛДГ; L-лактат-НАД-оксидоредуктаза, КФ 1.1.1.27) - цинксодержащий фермент, обратимо катализирующий окисление лактата в пируват. ЛДГ - тетрамер; два локуса генов кодируют синтез двух олигомеров - М- и Н-субъединиц. М-субъединица синтезируется главным образом в тканях с анаэробным метаболизмом, в то время как Н-субъединица присутствует в тканях с преобладанием аэробных процессов. Молекулярная масса каждой субъединицы составляет 35 кД, каждого тетрамера - 140 кД. Полипептидная цепь обеих субъединиц содержит 330 аминокислотных остатков; различия в их последовательности в субъединицах обнаружены на протяжении более чем 25% длины полипептидной цепи. В тетрамерной структуре ЛДГ субъединицы связаны силами ионных и водородных взаимодействий. На каждой субъединице расположен каталитический центр; диссоциация тетрамера на димеры или мономеры приводит к потере ферментативной активности.
В цитоплазме клеток и сыворотке крови ЛДГ имеет 5 изоферментов, обозначаемых в соответствии с их подвижностью к аноду в
электрическом поле: ЛДГ1 (НННН), ЛДГ2 (НННМ), ЛДГ3 (ННММ),
ЛДГ4 (НМММ) и ЛДГ5 (ММММ). ЛДГ1 участвует в окислении лактата в пируват в тканях с аэробным типом метаболизма (миокард, мозг, почки, эритроциты, тромбоциты). ЛДГ5 оптимизирована природой для превращения пирувата в лактат в тканях с высоким уровнем гликолиза (скелетные мышцы, печень). Не все изоферменты ЛДГ гомогенны: при электрофоретическом разделении изоферментов ЛДГ сыворотки и эритроцитов в полиакриламидном геле обнаружено расщепление ЛДГ3 на две полосы, которое позволяет предположить синтез двух форм ЛДГ3 в тканях. Наличие молекулярных структур двух форм, подтвержденное в реакции с антисывороткой, объясняют различием пространственного (цис и транс) расположения Н-субъединиц и М-субъединиц в тетрамере.
В тканях человека активность ЛДГ на 1 г сухой массы уменьшается в последовательности: почки - скелетная мышца - поджелудочная
железа - селезенка - печень - плацента. ЛДГ присутствует в эритроцитах, тромбоцитах и лейкоцитах. Изоферменты ЛДГ1 и ЛДГ2 преобладают в эритроцитах, лейкоцитах, миокарде, почках, ЛДГ4 и ЛДГ5 - в печени, скелетных мышцах, неопластических тканях, наиболее высокое содержание ЛДГ3 отмечают в лимфоидной ткани, тромбоцитах и опухолях.
Свойства изоферментов ЛДГ определены особенностями входящих в них субъединиц. Изоферментам ЛДГ присущи разные кинетические характеристики: рН, при котором они проявляют максимальную активность, сродство к субстратам и кофакторам. Так, например, у ЛДГ5 (М4) константа Михаэлиса выше, чем у ЛДГ5, а максимальная скорость реакции ЛДГ3 меньше, чем у других изоферментов. Изофермент ЛДГ1 чувствителен к ингибированию высокими концентрациями пирувата, тогда как на активность ЛДГ5 не оказывает влияние изменение концентрации субстрата, по крайней мере в физиологических пределах. Иммунологическое исследование показало, что субъединицы ЛДГ не имеют общих антигенных детерминант.
Клиническое значение определения активности ЛДГ
Активность ЛДГ в сыворотке крови повышается при многих патологических состояниях, поэтому для дифференциальной диагностики заболеваний более целесообразно исследовать изменения спектра изоферментов ЛДГ. В настоящее время накоплено большое количество данных о распределении изоферментов ЛДГ в тканях и об изменении спектра изоферментов ЛДГ в сыворотке крови при различных заболеваниях. Изоферментный спектр скелетной мускулатуры показывает преобладание ЛДГ5. При мышечной дистрофии отмечены увеличение более подвижных изоферментов ЛДГ и снижение активности ЛДГ5, что характерно и для многих нейромышечных заболеваний. Причиной изменения спектра изоферментов может быть быстрое удаление малоподвижных изоферментов из циркуляции. Активность ЛДГ5 в сыворотке крови - чувствительный индикатор гепатоцеллюлярного поражения, увеличение его активности обычно наблюдают при гепатите, гипоксии печени (включая застой крови в печени вследствие сердечной недостаточности), лекарственной интоксикации, циррозе, опухолях и травме. Активность ЛДГ сыворотки крови всегда повышена при мегалобластной и гемолитической анемии, увеличение это связано с ростом активности ЛДГ1 и ЛДГ2. Распределение изоферментов почти всегда соответствует
норме при железодефицитных анемиях, панцитопении и вторичных полицитемиях. Активность ЛДГ в сыворотке крови не повышается при хронических заболеваниях почек и уремии, но иногда возрастает после гемодиализа или плазмафереза, что может быть объяснено удалением из крови ингибиторов (мочевина, оксалаты).
Общая активность ЛДГ при инфаркте миокарда наиболее значительно повышается в течение первых 2 сут после приступа стенокардии и до исходного уровня понижается медленно, в течение 14-16 дней, эпизодическое повышение ЛДГ можно отметить и в более поздние сроки. В остром периоде инфаркта миокарда активность ЛДГ в сыворотке крови может возрастать до 10-20 МЕ/л. В диагностике инфаркта миокарда единичное определение общей активности ЛДГ имеет невысокую клиническую специфичность - не выше 60%, однако динамическое исследование фермента на протяжении 24-48 ч повышает специфичность теста до 72-84%. Все пять изоферментов присутствуют в экстракте кардиомиоцитов, содержание ЛДГ1 в изоферментном спектре миокарда составляет 55-65%. Выброс миокардиальных изоферментов ЛДГ в сыворотку крови ведет к увеличению активности ЛДГ1 и ЛДГ2, при этом активность ЛДГ1 будет выше. Достоверное повышение в сыворотке крови активности ЛДГ1 можно отметить и раньше того момента, когда активность ЛДГ1 станет выше таковой ЛДГ2, что дает основание использовать активность ЛДГ1 для более ранней диагностики инфаркта миокарда. Активность ЛДГ1 увеличивается через 12-24 ч после возникновения инфаркта миокарда, совпадая во времени с максимумом активности КК-МВ и опережая возникновение пика общей активности ЛДГ (24 ч).
Активность ЛДГ подвержена гормональному влиянию. Большие дозы тироксина снижали синтез фермента, при этом в большей мере отмечено ингибирование синтеза субъединицы М. Но-радреналин и адреналин вызывают увеличение общей активности ЛДГ с преобладанием активности ЛДГ1 и ЛДГ2. Активность фермента в крови возрастает при действии анаболических стероидов и этанола, а также ряда медикаментозных препаратов - клофибрата, кофеина, сульфаниламидов и др.
Спектр изоферментов ЛДГ может меняться при неопластических процессах. В таких случаях его трудно интерпретировать, так как источником изоферментов ЛДГ служит не только неопластическая ткань, но и ткани, разрушаемые метастазами. Однако изоферментный спектр транссудатов при опухолевом поражении сходен с таковым
сыворотки крови, тогда как в воспалительных экссудатах преобладает активность ЛДГ1 и ЛДГ2. Для ЛДГ, как и для других ферментов, при опухолевом процессе характерен синтез изоферментов, свойственных эмбриональным тканям. Недифференцированные эмбриональные ткани имеют спектр изоферментов ЛДГ, в котором преобладают ЛДГ2 и ЛДГ3, а также ЛДГ4. В злокачественных опухолях обнаружено три вида распределения изоферментов ЛДГ. Увеличение содержания ЛДГ4 и ЛДГ5 выявлено при опухолях предстательной железы, матки, молочных желез, желудка, толстой кишки, мочевого пузыря и некоторых типах опухолей мозга. У больных лейкозом, злокачественной лимфомой, нейробластомой, феохромоцитомой, а также при опухолях полости рта, раке бронхов и некоторых типах опухолей мозга увеличена активность ЛДГ2, ЛДГ3, ЛДГ4. Увеличение активности ЛДГ1 отмечено в сыворотке крови больных с некоторыми типами опухолей мозга и разными типами опухолей половых органов. Активность ЛДГ1 в сыворотке крови считают хорошим маркером тестикулярных опухолей, позволяющим установить дифференциальный диагноз между злокачественным и доброкачественным поражением ткани. Возможность повышения активности ЛДГ1 при опухолевом процессе следует учитывать при диагностике инфаркта миокарда. Иногда при опухолях мозга, раке пищевода, нейробластоме отмечают необычную дополнительную полосу при ЭФ сыворотки крови и ткани опухоли. Определение спектра изоферментов ЛДГ в сыворотке крови при онкологических заболеваниях полезно не только для диагностики, но и для контроля эффективности лечения. Обнаружено, что нормализация спектра изоферментов ЛДГ коррелирует с успешностью ответа больного на лечение.
Наличие осложнений при инфаркте миокарда и сопутствующие заболевания могут изменить спектр ЛДГ и активность ЛДГ1. Выявление спектра изоферментов, характерного для инфаркта миокарда, возможно при застое крови в печени и почках вследствие сердечной недостаточности, при ишемическом поражении некоторых органов из-за резкого снижения сердечного выброса. При эмболии легочной артерии, которую в ряде случаев приходится дифференцировать с инфарктом миокарда, увеличение в крови активности ЛДГ2 и ЛДГ3 может быть объяснено выходом ферментов из тромбоцитов, патологией печени, вызванной венозной гипертензией, анемией коркового слоя надпочечников и почек. Поскольку эти нарушения
не всегда удается различить, изменение спектра изоферментов ЛДГ интерпретировать непросто.
В сыворотке крови тяжелобольных (как правило, в терминальном состоянии) методом ЭФ на ацетате целлюлозы выявляется дополнительная полоса, более близкая к катоду, чем ЛДГ5, названная ЛДГ6. Во всех наблюдениях в тканях печени, скелетных мышцах, почке, селезенке и надпочечниках также отмечено присутствие ЛДГ6; в ряде случаев появление этой фракции носило транзиторный характер, ЛДГ6 не обнаружена в тканях миокарда. Считают, что нет нозологической формы заболевания, для которой характерна ЛДГ6, но есть тяжелые клинические состояния, обусловливающие ее появление, к которым следует отнести выраженный ацидоз, гипотонию и сепсис.
Описаны случаи низкой активности ЛДГ в сыворотке крови. В крови здоровых лиц обнаружен термозависимый ингибитор, присутствие которого снижает активность ЛДГ. Выявлено 42 случая низкой активности ЛДГ при исследовании 20000 образцов сыворотки крови. В качестве ингибитора активности фермента в крови с разной частотой выступают IgG, IgA и IgM. Макро-ЛДГ с низкой активностью фермента отмечена у женщин с лекарственной интоксикацией. После обработки иммунных комплексов меркаптоэтанолом иммуноглобулин оставался связанным с ЛДГ, но его ингибирующее влияние было подавлено; при добавлении меркаптоэтанола в сыворотку крови активность ЛДГ возрастала в два раза. Механизмы формирования иммунных комплексов с ЛДГ остаются неясными. Описаны случаи образования АТ к ЛДГ при приеме сульфаниламидных препаратов; после отмены препаратов АТ исчезали. Низкая активность ЛДГ в сыворотке крови может быть объяснена не только ингибированием, но и уменьшением времени пребывания в крови, быстрой элиминацией иммунных комплексов из циркуляции.
Вторичная причина низкой активности ЛДГ в сыворотке крови и тканях связана с генетическими нарушениями. Описаны особые варианты Н-субъединиц у американских индейцев, ферментативно неактивные, поскольку в составе тетрамера присутствовала только одна активная субъединица. Полное отсутствие Н- или М-субъединиц отмечено в японской популяции. Распространенность гетерозигот с дефицитом субъединиц ЛДГ составляет 0,15-0,2%. Клинически гомозиготы с дефицитом М-субъединиц имеют периодическую миоглобинурию после напряженной физической нагрузки, поражения кожи; роды у них протекают тяжело.
Методы определения активности ЛДГ
Основной метод определения активности ЛДГ - измерение оптической плотности НАДН при длине волны 340 нм. Выбор для практических целей реакции превращения пирувата в лактат объясняется тем, что вследствие высокого сродства ЛДГ к пирувату максимальная скорость этой реакции в три раза выше, чем образование пирувата из лактата. В случае прямой реакции аналитические трудности связаны с подбором оптимальной концентрации пирувата, поскольку его высокая концентрация в инкубационной среде ингибирует активность Н-субъединицы. Добавление к раствору пирувата ионов натрия и хлора позволяет снизить ингибирование ЛДГ субстратом.
Период преинкубации сыворотки крови с субстратной смесью до добавления стартового реагента (пирувата) необходим для завершения реакций, катализируемых другими НАДН-зависимыми дегидрогеназами, присутствующими в сыворотке крови. Структурные аналоги лактата (α-оксибутират, α-оксикапронат) и пиру-вата (α-кетобутират, гликоксилат) также могут служить субстратом для ЛДГ.
Для определения относительного содержания изоферментов ЛДГ используют ряд физико-химических методов. К ним относят ЭФ, ионообменную хроматографию, иммунохимические методы, а также методы, в которых используют различия кинетических параметров отдельных изоферментов и дифференцированную чувствительность их к субстратам и ингибиторам. Метод ЭФ изоферментов ЛДГ относят к референсным.
Активность ЛДГ присутствует в крови здорового человека независимо от его пола и возраста. Общая активность ЛДГ в сыворотке крови здоровых лиц, определенная при 25 °С, составляет 100-225 МЕ/л. Методом ЭФ на любой поддерживающей среде в сыворотке крови здоровых лиц удается разделить все 5 изоферментов ЛДГ, которые в процентом отношении распределены следующим образом: ЛДГ1 - 14-26, ЛДГ2 - 29-39, ЛДГ3 - 20-26, ЛДГ4 - 8-16, ЛДГ5 - 6-16. Получены и несколько иные варианты распределения изоферментов ЛДГ в сыворотке крови здоровых лиц, однако во всех наблюдениях процентное содержание ЛДГ2 в сыворотке крови было выше, чем ЛДГ1. При некоторых методах ЭФ фракция ЛДГ5 может быть и не выявлена, доля ее составляет 0-6%.
Стабильность активности ЛДГ зависит от температуры хранения и состава среды. Общая активность ЛДГ понижается на 10% через сутки хранения при 4 °С. При хранении разные образцы сыворотки значительно различаются по степени изменения общей активности ЛДГ и соотношению ее изоферментов. Имеются данные, что хранение проб
замороженными приводит к значительным изменениям в распределении изоферментов - уменьшению доли слабоподвижных изоферментов и увеличению быстрых фракций, что может быть причиной ложного увеличения отношения ЛДГ1/ЛДГ2. ЛДГ1 и ЛДГ2 сохраняли активность неизменной в течение 10 дней при хранении как при 4 °С, так и при -20 °С или 20 °С. Активность ЛДГ4 понижается на 50% через 48 ч хранения при 4 °С. В этих же условиях активность ЛДГ5 оказалась пониженной на 72%. Последующее нагревание сывороток и крови, хранящихся в холодильнике, до 37 °С не возвращает активность ЛДГ к исходному уровню. Для предотвращения ошибок рекомендуют определять активность ЛДГ и соотношение ее фракций в день взятия крови, а если такой возможности нет, хранить сыворотку в течение 24 ч при комнатной температуре.
ЩЕЛОЧНАЯ ФОСФАТАЗА
Щелочная фосфатаза (ЩФ) - фосфогидролаза моноэфиров ортофосфорной кислоты (КФ 3.1.3.1) - гидролизует разные синтетические субстраты при оптимуме рН, равном 10,0; субстрат фермента in vivo точно не известен. ЩФ - гликопротеин; по структуре это димер с кажущейся значительной вариацией молекулярной массы фермента в разных тканях. ЩФ - металло-фермент, в состав активного центра фермента входит атом цинка. Полагают, что атом цинка повышает активность фермента, обеспечивая конформационные изменения и гидролиз моноэфиров ортофосфорной кислоты. Каждый мономер ЩФ содержит три металлосвязывающих центра. Лишенный ионов цинка фермент теряет активность, но восстанавливает ее после добавления металла. Активность фермента возрастает в присутствии ионов магния, для оптимальной активности необходимо определенное соотношение ионов магния и цинка.
ЩФ присутствует во всех органах человека; наиболее высокая удельная активность фермента обнаружена в эпителии тонкой кишки, эпителии канальцев почек, остеобластах, гепатоцитах и плаценте. Фермент плотно связан с клеточной мембраной гидрофобным карбоксильным концом полипептидной цепи; гидрофобный конец цепи идентичен у всех изоферментов ЩФ. ЩФ прикреплена к плазматической мембране с помощью фосфатидилинозитолгликанового якоря. Молекулы ЩФ на поверхности плазматической мембраны располагаются неравномерно. Возможно, что такая топография фермента связана с его невыясненной физиологической ролью.
Молекулярная масса ЩФ составляет 130-220 кД. Ассоциация ЩФ с гликозаминогликанами (нейраминовой кислотой) может изменить не только молекулярную массу фермента, но и заряд молекулы и ее подвижность в электрическом поле. Степень гликозилирования ЩФ в тканях может влиять на ее термолабильность.
Гетерогенность ЩФ выявлена уже при первом выделении фермента и подтверждена позднее при использовании разных субстратов, ингибиторов, а также методами иммунохимии, при использовании поли- и моноклональных АТ. Гетерогенность ЩФ имеет генетическую природу (изоферменты), а также может быть вызвана посттрансляционными изменениями белка (фосфорилированием, ацетилированием и гликозилированием).
В организме человека биосинтез фермента кодируют три гена: один - печеночный, костный и почечный изоферменты, другой - кишечный изофермент и третий - плацентарную ЩФ. Полагают, что существует и 4-й ген, кодирующий синтез зародышевой ЩФ. Последняя локализована в тонкой кишке плода примерно до 30 нед беременности. Эмбриональные и зрелые формы ЩФ сходны по каталитической активности. Выделение ЩФ из ткани печени с помощью фосфатидилинозитолспецифической фосфолипазы приводит к образованию форм, сходных с присутствующими в сыворотке крови. Эти данные позволяют считать, что формы ЩФ сыворотки крови образуются путем ферментативного гидролиза тканевых форм.
Клиническое значение определения активности ЩФ
Повышение активности ЩФ в сыворотке крови не всегда позволяет с достаточной степенью достоверности составить представление об органотопической патологии. Более детальную информацию позволяет получить исследование изоферментов ЩФ.
Анализ изоферментов ЩФ в настоящее время - прерогатива специализированных лабораторий. Изоферменты ЩФ имеют разную чувствительность к термической инактивации, при температуре 56 °С в течение 15 мин изоферменты ЩФ инактивируются в следующей последовательности: изофермент костной ткани-кишечный-плацентарный. При температуре 65 °С термостабильностью обладает только плацентарный изофермент ЩФ. При химической инактивации мочевиной костный изофермент также оказывается чувствительным; наиболее резистентны плацентарный и кишечный изоферменты, ЩФ печени занимает промежуточное положение.
В клинической биохимии активность ЩФ наиболее часто используют в диагностике патологии гепатобилиарной системы и костной ткани. Активность ЩФ сыворотки крови часто повышена при обструктивных заболеваниях печени, холестазе, гепатите, явлениях гепатотоксичности, болезни Педжета, остеомаляции, новообразованиях, вовлекших в патологический процесс печень и костную ткань.
Низкая или даже неопределяемая активность ЩФ отмечена при гепатолентикулярной дегенерации. Механизм этого феномена неясен, предполагают, что ион меди конкурирует с цинком за место в активном центре ЩФ, что ведет к резкому падению активности фермента. Применение гиполипидемических препаратов, в частности клофибрата, также ингибирует фермент.
ЩФ - маркер остеобластов, хотя ее физиологическая роль в этом виде клеток окончательно не выяснена. ЩФ присутствует на внешней стороне плазматической мембраны остеобластов и, как эктоэнзим, может осуществлять гидролиз фосфатов на поверхности клетки. Возможно, физиологическая роль ЩФ сводится к участию в кальцификации тканей, минерализации костной ткани, хотя конкретные пути ее влияния не установлены. Активность ЩФ в ткани увеличивается от неорганизованного хряща через пролиферирующий хрящ к примитивной губчатой костной структуре. Во время активного остеогенеза ЩФ попадает в кровяное русло, отражая процесс формирования костной ткани. У недоношенных детей с целью ранней диагностики рахита рекомендовано определять активность ЩФ.
Исследование активности ЩФ у больных с синдромом гипофосфатазии указывает на важную роль ЩФ в процессах минерализации костной ткани. Синдром гипофосфатазии - врожденное заболевание костной ткани, характеризующееся избирательной недостаточностью синтеза ЩФ. У пациентов с подобной патологией в тканях и сыворотке крови значительно снижена активность печеночного, костного и почечного изоферментов ЩФ при нормальной активности плацентарного и кишечного изоферментов. Другая особенность заболевания - накопление в крови и моче фосфорсодержащих комплексов, служащих эндогенным субстратом ЩФ. К ним относят фосфоэтаноламин, пирофосфат, П-5-Ф и т. д. Заболевание вызвано точечными мутациями гена, кодирующего синтез фермента.
Во много раз более высокая активность ЩФ в крови новорожденных и в детском возрасте по сравнению со взрослыми указывает на
важную роль ЩФ в процессах остеосинтеза, точнее, кальцификации - образования кристаллов фосфоапатита. Возможно, ЩФ принимает активное участие и в становлении патологических процессов, сопровождающихся кальцификацией в органах, непохожих на костную ткань (участки петрификации в органах, кальцификация атероматозных бляшек, трансплантатов). Не исключено, что в условиях низкой активности ЩФ высокая концентрация фосфорсодержащих компонентов в среде препятствует кристаллообразованию, что, однако, требует специального исследования.
Повышение активности ЩФ происходит не только в условиях активного роста костной ткани, но и при ее разрушении - остеопорозе и последующей остеомаляции. При тяжелом остеопорозе и остеомаляции активность ЩФ в сыворотке крови может быть нормальной или слабо повышенной (в 2-3 раза). Остеомаляция, верифицированная гистологически, может протекать при нормальной активности ЩФ.
Активность ЩФ в сыворотке крови может быть повышена при остеомиодистрофии, развивающейся как осложнение длительного гемодиализа. При введении циклоспорина после трансплантации повышенная активность ЩФ в большей мере зависит от токсического влияния препарата на гепатоциты и в меньшей мере связана с патологией остеобластов. У пациентов с гиперпа-ратиреозом активность ЩФ сыворотки крови обычно в пределах нормы, но при развитии остеопороза, особенно остеонекроза, может быть значительно увеличена.
У пациентов с болезнью Педжета отмечена достоверная корреляция активности ЩФ и степени поражения скелета. При остеопорозе показана прямая зависимость активности ЩФ крови и экскреции с мочой оксипролина. В этих условиях активность ЩФ сыворотки крови можно применить для оценки эффективности терапии кальцитонином и фосфатами.
В печени ЩФ локализована в клетках эндотелия вокруг портальной и центральной вен как в синусоидах, так и в желчных канальцах. Многие фармакологические препараты вызывают холестаз, сопровождающийся увеличением активности ЩФ в крови в 2-10 раз, однако не следует исключать возможность токсического влияния лекарств и на остеобласты. Обобщая возможные механизмы гиперферментемии ЩФ при холестазе, следует отметить активацию желчными кислотами синтеза фермента de novo, экстракцию фермента с плазматической мембраны желчными кислотами, поступление свободного или мембранно-связанного фермента в циркуляцию. Исследование
активности ЩФ оказывается полезным и в дифференциальной диагностике внутри- и внепеченочного холестаза. В случае экстрагепатобилиарной обструкции при камнях желчного протока и желчного пузыря, а также при новообразованиях в этих органах активность ЩФ повышается в 10 раз и более. Внутрипеченочная обструкция желчных путей при гепатите также сопровождается повышением активности ЩФ, но степень гиперферментемии не превышает 2-3-кратного значения. Острые некротические изменения гепатоцитов могут не сопровождаться повышением активности ЩФ до тех пор, пока в патологический процесс не будут вовлечены желчные канальцы и не произойдет задержка желчеотделения. В то же время далеко не во всех случаях поражения паренхимы печени существует четкая корреляционная зависимость между активностью ЩФ сыворотки крови и содержанием в ней билирубина. В начале развития внутрипеченочного стаза увеличение активности ЩФ может быть следствием повышения синтеза белка в гепатоцитах; последующее повышение активности ЩФ в сыворотке крови, особенно в форме макро-ЩФ, связано с нарушением целостности клеток желчных канальцев.
ЩФ с высокой молекулярной массой, присутствующая в сыворотке крови больных c внутри- и внепеченочным холестазом, - комплекс фермента с фрагментами плазматической мембраны гепатоцитов синусоидальной зоны печени. В разное время ЩФ с высокой молекулярной массой называли желчной, высокомолекулярной, каналикулярной, быстрой. Методом электронной микроскопии установлено, что ЩФ в крови больных с холестазом состоит из везикул трехслойной структуры, характерных для плазматической мембраны гепатоцитов. Помимо ЩФ, эти фрагменты плазматической мембраны содержат и другие мембранно-связанные ферменты - γ-глутамилтранспептидазу, лейцинами-нопептидазу, 5-нуклеотидазу. Специфичный для холестаза ЛП, названный ЛП-Х, имеет не большее диагностическое значение, чем ЩФ или ГГТ. Возможно, что ассоциация ЩФ с ЛП-Х дала основание назвать его холестатическим комплексом, хотя более верно для ЩФ с высокой молекулярной массой оставить термин «мембранно-связанный комплекс ЩФ». При идентификации методом высокоэффективной жидкостной хроматографии определение высокомолекулярного изофермента ЩФ - лучший тест и более чувствительный индикатор ранних сроков холестаза (по сравнению со всеми другими тестами).
С момента сообщения о возможности эктопической продукции ЩФ опухолевой тканью описаны 3 изофермента: изофермент Регана
(плацентарная ЩФ), изофермент Нагао (тестикулярная, плацентарноподобная ЩФ), изофермент Касахара (зародышевая кишечная ЩФ). Возможность исследования их возникла только при использовании техники гибридом и получении моноклональных АТ. Все три изофермента - потенциальные маркеры опухолевого процесса. Несмотря на наличие более специфичных изоферментов, общую активность ЩФ также рассматривают как полезный индикатор рака молочной железы с метастазами в кости. В оценке выживаемости больных раком предстательной железы увеличение общей активности ЩФ рассматривают как прогностически неблагоприятный фактор.
Нейтрофильные гранулоциты также содержат ЩФ, но природа этой изоформы остается неясной. Разные формы ЩФ описаны в нейтрофилах больных лимфолейкозом и инфекционным мононуклеозом; они могут исчезать из циркуляции после излечения мононуклеоза. Активность ЩФ в нейтрофилах снижается при миелолейкозе, возрастает при полицитемии, миелопролиферативном синдроме.
Методы определения активности ЩФ
В течение длительного времени активность ЩФ в сыворотке крови исследовали в реакции с р-глицерофосфатом. Освобожденный в результате гидролиза фосфат определяли в реакции с фосфомолибденовой кислотой с образованием желтого комплекса, который при действии восстановителей (аскорбиновая кислота, эйконоген) переводили в фосфомолибденовый синий и колориметрировали при длине волны 620- 640 нм. Метод привлекал использованием природного субстрата, но реакция многостадийна и длительна. В качестве субстрата для определения ЩФ предложено применять фенилфосфат с последующим определением освобожденного при гидролизе фенола в реакции с фосфорновольфрамовой кислотой или же при идентификации фенола в реакции с 4-аминоантипирином по образованию цветного хромогена. В настоящее время эти методы представляют только исторический интерес.
Первым кинетическим методом определения ЩФ, не требующим предварительной депротеинизации сыворотки крови, была реакция с п-нитрофенилфосфатом. В результате гидролиза субстрата образуется п-нитрофенол, имеющий желтую окраску; именно этот метод был впервые автоматизирован. В настоящее время этот метод определения активности ЩФ предложен в качестве референсного.
В детском возрасте активность ЩФ в сыворотке крови повышена в связи с более интенсивным ростом костей (у мальчиков активность ЩФ выше, чем у девочек); постоянный уровень устанавливается к 20 годам.
В зрелом возрасте активность ЩФ в крови мужчин незначительно выше, чем у женщин. Активность ЩФ в сыворотке крови увеличивается при беременности, достигая максимума к моменту родов.
1.5. ЛИПИДЫ И ЛИПОПРОТЕИНЫ
Липиды нерастворимы в воде, поэтому они транспортируются в крови в комплексе с белками. Жирные кислоты в крови ассоциированы с альбумином, другие липиды транспортируются в составе липопротеинов (ЛП).
Один из факторов, способствующих развитию атеросклеротического процесса, - нарушение обмена ЛП. Этот факт на протяжении последних 25 лет послужил причиной широких исследований структуры ЛП, их синтеза, метаболических превращений и интернализации ЛП-частиц клетками. В многочисленных работах представлены данные о свойствах и составе ЛП-частиц разных классов, а также об особенностях биосинтеза и катаболизма липидных и белковых компонентов.
На рис. 1.5 представлены структурные формулы основных липидов плазмы крови.
Свободные, или неэтерифицированные, жирные кислоты - основной поставщик энергии в организме. В крови человека присутствуют также насыщенные, мононенасыщенные и полиненасыщенные жирные кислоты (табл. 1.7).
Таблица 1.7. Жирные кислоты, присутствующие в плазме
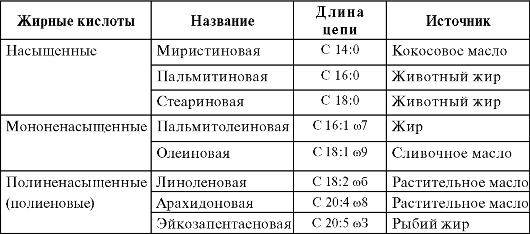 Примечание. В
сокращенной формуле указаны количество атомов углерода и число двойных
связей. Ближайшая к метильному концу двойная связь обозначена символом ω
Примечание. В
сокращенной формуле указаны количество атомов углерода и число двойных
связей. Ближайшая к метильному концу двойная связь обозначена символом ω
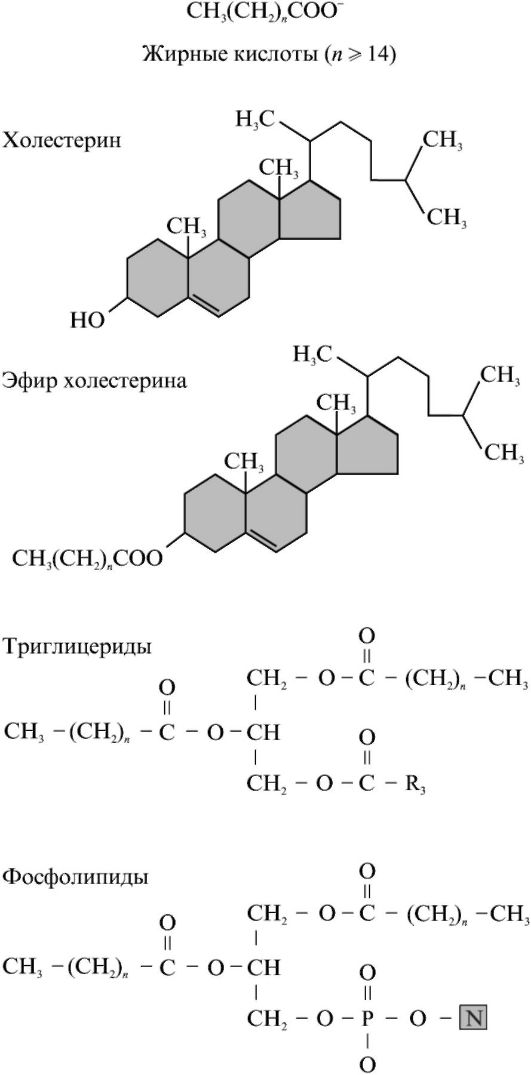 Рис. 1.5. Структурные формулы липидов
Рис. 1.5. Структурные формулы липидов
ТГ - это эфиры глицерина и жирных кислот; они так же как и жирные кислоты служат важным источником энергии.
Фосфолипиды - эфиры глицерина или сфингозина с жирными кислотами и фосфорной кислотой. В состав фосфолипидов входят также азотсодержащие соединения (холин, этаноламин, серин) или другие гидрофильные группы, соединенные эфирной связью с фосфатом. Фосфолипиды - компоненты всех клеточных мембран и ЛП.
Холестерин - стероид, на основе которого образуются стероидные гормоны и желчные кислоты. Около 2/3 холестерина в крови представлено в форме эфиров холестерина и жирных кислот, около 1/3 - в форме свободного холестерина. Свободный холестерин входит в состав всех клеточных мембран; в составе ЛП имеется как свободный, так и этерифицированный холестерин.
В клинической практике для выявления нарушений липидного обмена определяют уровень холестерина и ТГ в сыворотке крови.
ЛИПОПРОТЕИНЫ
Частицы ЛП - макромолекулярные комплексы, внутренняя часть которых содержит нейтральные липиды (ТГ и эфиры холестерина), а поверхностный слой состоит из фосфолипидов, неэтерифицированного холестерина и специфических липидтранспортных белков, называемых аполипопротеинами (апоЛП).
ЛП классифицируют на основании подвижности их в электрическом поле (при проведении ЭФ) или гидратированной плотности в условиях усиленной гравитации при препаративном ультрацентрифугировании (флотация или седиментация). При проведении ЭФ ЛП подразделяют на фракции, одна из которых остается на старте (хиломикроны), другие мигрируют к зонам глобулинов - β-ЛП, пре- β-ЛП, α-ЛП. По величине гидратированной плотности ЛП принято разделять на пять классов: хиломикроны (ХМ), ЛП очень низкой плотности (ЛПОНП), ЛП промежуточной плотности (ЛППП), ЛП низкой плотности (ЛПНП), ЛП высокой плотности (ЛПВП). По электрофоретической подвижности ЛПОНП соответствуют пре- β-ЛП, ЛПНП - β-ЛП, ЛПВП - α-ЛП, а ХМ остаются на старте (рис. 1.6).
АпоЛП способствуют формированию мицелл ЛП в эндоплазматическом ретикулуме гепатоцитов, служат лигандами для специфических рецепторов на поверхности плазматической мембраны клеток и кофакторами (активаторами и ингибиторами) процессов липолиза и метаболизма ЛП в сосудистом русле (табл. 1.8).
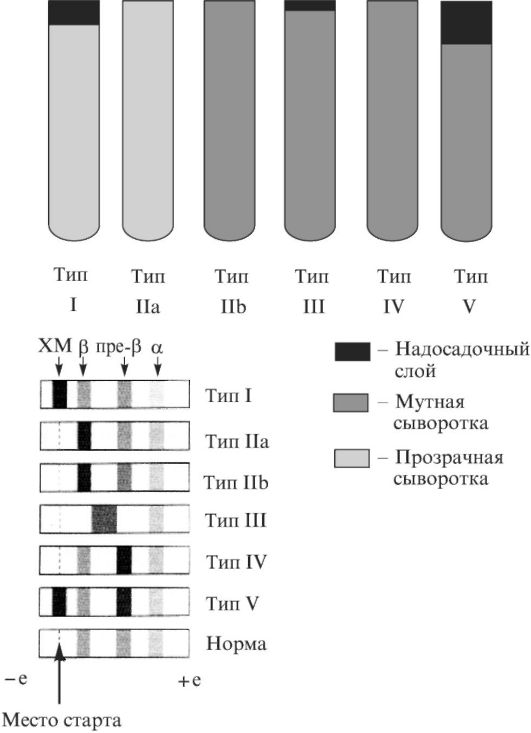 Рис. 1.6. Электрофорез липопротеинов и классификация гиперлипопротеинемий
Рис. 1.6. Электрофорез липопротеинов и классификация гиперлипопротеинемий
В зависимости от роли апоЛП в организации первичных частиц ЛП и их последующих превращениях апопротеины условно можно разделить на два класса. К одному из них следует отнести апоЛП, которые формируют мицеллярную структуру ЛП-комплексов и служат ядром ЛП-частиц. Особенностью таких апопротеинов является то, что белки не покидают ЛП-частицу, в формировании которой они участвуют. В эту группу апоЛП входят апоВ (апоВ-100 и апоВ-48) и апоА (А-I и А-II), ответственные за осуществление афферентного и эфферентного транспорта липидов. АпоВ - основной структурный белок
Таблица 1.8. Свойства и функции аполипопротеидов
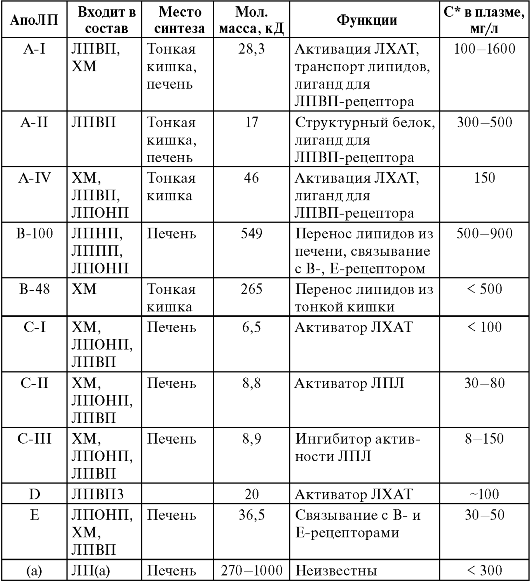 Примечание. С* - концентрация; мол. масса - молекулярная масса; ЛХАТ - лецитинхолестеринацилтрансфераза; ЛПЛ - липопротеинлипаза
Примечание. С* - концентрация; мол. масса - молекулярная масса; ЛХАТ - лецитинхолестеринацилтрансфераза; ЛПЛ - липопротеинлипаза
богатых триглицеридами ЛП-частиц; он не покидает мицеллярный комплекс в процессе последовательных метаболических превращений ЛПОНП в ЛППП и далее в ЛПНП, накопление которых в сосудистой стенке служит патогенетическим звеном атеросклеротического
процесса. Апопротеины А-I и А-II - основные белки ЛПВП. Основой предположения, что апоВ и апоА формируют разные по составу и функции классы ЛП, послужил факт, что апоВ и апоА не присутствуют вместе в длительно циркулирующих ЛП-частицах. Генетические нарушения синтеза этих апопротеинов - причина нарушений афферентного и эфферентного транспорта липидов.
К другому классу можно отнести апоЛП, их основная роль - регуляция метаболизма ЛП в сосудистом русле и процесса интернализации их клетками. Эти апопротеины содержатся в ЛП в значительно меньших количествах и в процессе взаимопревращения ЛП-частиц в кровеносном русле перемещаются между ЛП разных классов в виде белково-липидных комплексов. Метаболически активные апоЛП находятся в сосудистом русле дольше, чем частицы ЛП, в состав которых они были включены в момент синтеза. Основные представители группы метаболически активных апоЛП - апоЕ (с изоформами Е2, Е3, Е4) и апоС (С-I, С-II, С-III).
АпоЛП имеют большое значение для метаболизма ЛП, играя роль лигандов ЛП-частиц, взаимодействующих с клеточными рецепторами для специфических ЛП. АпоВ-100 и апоЕ взаимодействуют с рецептором ЛПНП, начиная абсорбционный эндоцитоз, сопровождающийся катаболизмом ЛПНП. АпоЕ взаимодействует с рецептором остаточных компонентов ХМ, играющего важную роль в удалении этих компонентов печенью. Предполагают, что апоА-I взаимодействует с рецептором к ЛПВП и облегчает удаление холестерина из периферических клеток для обратного транспорта в печень.
В плазме содержатся четыре основных класса ЛП: ХМ, ЛПОНП, ЛПНП и ЛПВП и несколько других ЛП, представленных в сравнительно низких концентрациях: ЛППП и ЛП(а). В табл. 1.9 представлены некоторые свойства ЛП.
ХМ синтезируются в кишечнике и служат для переноса экзогенных липидов. Основной белок насцентных (первичных) ХМ - апоВ-48. Вскоре после секреции ХМ энтероцитами в их состав в сосудистом русле включаются два дополнительных апопротеина, содержащихся в ЛПВП, - апоС-II и апоЕ. АпоС-II активирует гепаринзависимую липопротеинлипазу - фермент, фиксированный на эндотелии капилляров. Липопротеинлипаза гидролизует ТГ хиломикронов с образованием свободных жирных кислот. В процессе гидролиза ЛП частицы теряют около 96% своей массы, в основном за счет ТГ, а также апоЛП А и С. В результате этого ЛП-частица преобразуется
Таблица 1.9. Характеристика липопротеидов
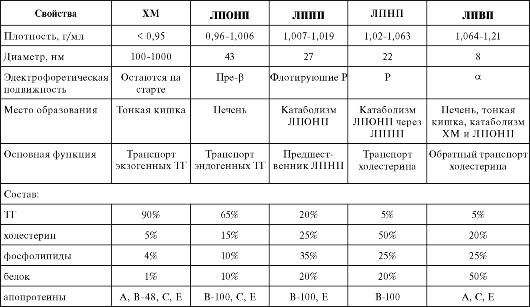 в
меньший по размерам, обогащенный холестерином остаток ХМ, в котором
апоВ и апоЕ служат основными апоЛП. Образованные остаточные компоненты
ХМ имеют гидратированную плотность ЛПОНП и ЛППП, и в норме из сыворотки
крови их элиминируют гепатоциты посредством специфических рецепторов
(апоЕ-рецепторы). Поэтому у здоровых лиц промежуточные формы ЛП имеют
короткий период жизни и в физиологических условиях находятся в сыворотке
крови в низкой концентрации. Однако при некоторых формах ГЛП происходит
накопление ЛППП в сыворотке крови. В результате этих метаболических
превращений транзиторная ГЛП, имеющая место в течение нескольких часов
после приема пищи, устраняется, после чего утилизация экзогенных липидов
идет в печени. Поступившие в печень липиды по жирнокислотному составу
соответствуют экзогенным липидам. Секретируемые печенью в кровоток
ЛП-частицы имеют жирнокислотный состав, свойственный организму человека.
в
меньший по размерам, обогащенный холестерином остаток ХМ, в котором
апоВ и апоЕ служат основными апоЛП. Образованные остаточные компоненты
ХМ имеют гидратированную плотность ЛПОНП и ЛППП, и в норме из сыворотки
крови их элиминируют гепатоциты посредством специфических рецепторов
(апоЕ-рецепторы). Поэтому у здоровых лиц промежуточные формы ЛП имеют
короткий период жизни и в физиологических условиях находятся в сыворотке
крови в низкой концентрации. Однако при некоторых формах ГЛП происходит
накопление ЛППП в сыворотке крови. В результате этих метаболических
превращений транзиторная ГЛП, имеющая место в течение нескольких часов
после приема пищи, устраняется, после чего утилизация экзогенных липидов
идет в печени. Поступившие в печень липиды по жирнокислотному составу
соответствуют экзогенным липидам. Секретируемые печенью в кровоток
ЛП-частицы имеют жирнокислотный состав, свойственный организму человека.
ЛПОНП образуются в печени, секретируются гепатоцитами в кровоток и транспортируют эндогенные ТГ. Насцентные ЛПОНП имеют в составе только апоВ-100. В кровотоке в состав ЛПОНП также включаются апоЛП из ЛПВП - апоС-II и апоЕ. Исследования метаболизма показали, что радиоактивность, первоначально присутствующая во фракции ЛПОНП, быстро оказывается в ЛП-частицах с гидратированной плотностью ЛПНП. У здоровых людей практически все ЛПНП образованы в сосудистом русле из ЛПОНП. В ходе метаболизма богатых ТГ ЛП, содержащих апоВ, вследствие гидролиза ТГ ЛП меньшей плотности и больших размеров преобразуются в более плотные и меньшие по размеру ЛППП и затем ЛПНП. Некоторое количество остаточных компонентов ЛПОНП и ЛППП покидает сосудистое русло посредством взаимодействия со специфическими апоВ/Е-рецепто- рами на поверхности эндотелиальных клеток. В процессе метаболического превращения ЛППП в ЛПНП, кроме гепаринзависимой липопротеинлипазы, принимает участие еще один липолитический фермент - триглицеридлипаза печени. Этот фермент способен действовать не только как гидролаза ТГ, но и как фосфолипаза.
ЛПНП у человека содержат большую часть циркулирующего холестерина и транспортируют его к периферическим тканям для формирования мембран и процессов стероидогенеза. ЛПНП взаимодействуют с рецепторами на плазматической мембране клеток печени, надпочечников и периферических тканей, включая ГМК и фибробласты. После взаимодействия с рецептором ЛПНП подвергаются эндоцитозу
и компоненты ЛПНП катаболизируются в лизосомах. В результате этих процессов образуются отдельные классы липидов; апобелки разрушаются до аминокислот.
ЛП(а) - сходная с ЛПНП, обогащенная холестерином и белком частица, содержит две молекулы апо(а) в дополнение к одной молекуле апоВ. Увеличенный уровень ЛП(а) ассоциирован с ранним развитием ИБС: 50% больных ИБС имели уровень ЛП(а) выше 40 мг/л по сравнению с 17% в контрольной группе. Увеличение концентрации ЛП(а) в крови считают независимым фактором риска атеросклероза.
ЛПВП образуются несколькими путями, включая синтез и секрецию насцентных ЛПВП печенью и кишечником, в процессе липолиза ЛП, богатых ТГ, или в результате взаимодействия новообразованных апопротеинов с мембранами клеток. Насцентные ЛПВП - бислойные диски, состоящие из апоЛП и фосфолипидов. Свободный холестерин диффундирует в ЛПВП из клеток эндотелия, эритроцитов и других клеток. Кроме того, во время липолиза ЛПОНП или ХМ поверхностные липиды (фосфолипиды и холестерин) и белки (апоА-I, апоА-II, апопротеины группы С) переносятся во фракцию ЛПВП. Эти компоненты могут сформировать насцентные дискоидальные частицы ЛПВП или быть включены в уже существующие частицы ЛПВП. Дискоидальные насцентные ЛПВП в плазме крови взаимодействуют с ферментом ЛХАТ, в результате образуются эфиры холестерина, быстро перемещающиеся в ядро частицы; формируются сферические (зрелые) частицы ЛПВП - ЛПВП3.
У человека большая часть эфиров холестерина, образованных в ЛПВП, переносится в более крупные ЛП, богатые ТГ. Белок, переносящий эфиры холестерина, способствует обмену эфиров холестерина из ЛПВП на ТГ из ЛП, содержащих апоВ, что приводит к снижению содержания эфиров холестерина и увеличению содержания ТГ в ЛПВП. Комбинированный эффект липолиза и переноса липидов приводит к обогащению частиц ЛПВП дополнительными липидами и апопротеинами, в результате чего происходят увеличение размера и снижение плотности частиц ЛПВП, сопровождающиеся превращением частиц ЛПВП3 в ЛПВП2. Частицы ЛПВП2 затем подвергаются воздействию триглицеридлипазы печени - фермента, обнаруженного в основном в эндотелиальных клетках синусоидов печени. Триглицеридлипаза печени обладает как триглицеридгидролазной, так и фосфолипазной активностью, что приводит к снижению содержания ТГ и фосфолипидов в ЛПВП и уменьшению размера частицы.
Таким образом, ЛП плазмы крови, традиционно разделяемые на классы физическими, химическими и иммунохимическими методами, метаболически составляют единую систему.
Содержание классов ЛП в сыворотке крови можно измерить количественно. Такие измерения проводят методом аналитического ультрацентрифугирования, который требует сложного аналитического оборудования. Возможно также рассчитать концентрацию ЛП, исходя из анализа каждого компонента. Этот подход требует количественного выделения и очистки каждого класса ЛП методом препаративного ультрацентрифугирования. Уровень ЛП в плазме крови в клинической биохимии обычно оценивают по содержанию в них холестерина. Содержание ТГ в отдельных классах ЛП, как правило, не исследуют, поскольку оно подвержено более значительным колебаниям, чем уровень холестерина. Следует подчеркнуть, что большая часть эпидемиологических данных о связи ЛП и развития заболеваний ССС основана на измерениях именно содержания холестерина в отдельных классах ЛП.
Соотношение общего холестерина плазмы крови и холестерина основных классов ЛП можно выразить следующей формулой:
 Для
измерения холестерина классов ЛП определяют общий холестерин и ТГ
сыворотки крови и концентрацию холестерина ЛПВП в супернатанте после
преципитации ЛП, содержащих апоВ (ЛПОНП и ЛПНП). Концентрацию
холестерина ЛПНП рассчитывают по формуле Фридвальда:
Для
измерения холестерина классов ЛП определяют общий холестерин и ТГ
сыворотки крови и концентрацию холестерина ЛПВП в супернатанте после
преципитации ЛП, содержащих апоВ (ЛПОНП и ЛПНП). Концентрацию
холестерина ЛПНП рассчитывают по формуле Фридвальда:
 Для
ориентировочной оценки концентрации холестерина ЛПОНП используют
величину ТГ/5, если концентрации холестерина и ТГ выражены в мг/дл, или
ТГ/2,2, если концентрации холестерина и ТГ выражены в ммоль/л.
Применение этой формулы при концентрации ТГ выше 400 мг/дл приводит к
завышению содержания холестерина ЛПОНП и занижению содержания
холестерина ЛПНП. Для оценки распределения ЛП у больных с очень высоким
уровнем ТГ и наличием значительного количества ХМ необходимо
предварительное ультрацентрифугирование для отделения ХМ и ЛПОНП. После
отделения фракции ЛПОНП и преципитации ЛПНП в супернатанте можно
определить концентрацию холестерина ЛПВП.
Для
ориентировочной оценки концентрации холестерина ЛПОНП используют
величину ТГ/5, если концентрации холестерина и ТГ выражены в мг/дл, или
ТГ/2,2, если концентрации холестерина и ТГ выражены в ммоль/л.
Применение этой формулы при концентрации ТГ выше 400 мг/дл приводит к
завышению содержания холестерина ЛПОНП и занижению содержания
холестерина ЛПНП. Для оценки распределения ЛП у больных с очень высоким
уровнем ТГ и наличием значительного количества ХМ необходимо
предварительное ультрацентрифугирование для отделения ХМ и ЛПОНП. После
отделения фракции ЛПОНП и преципитации ЛПНП в супернатанте можно
определить концентрацию холестерина ЛПВП.
Достоверный метод оценки содержания отдельных классов ЛП в сыворотке крови - метод ЭФ на одной из поддерживающих сред: геле агарозы, геле полиакриламида, ацетате целлюлозы, бумаге. Эти методы позволяют получить только процентное соотношение отдельных классов ЛП, включая ХМ, β-, пре-β-и α-ЛП. ЭФ - основа фенотипирования ГЛП по классификации, предложенной Фредриксоном (табл. 1.10). Окончательное решение о фенотипе ГЛП проводят по данным ЭФ ЛП с учетом концентрации в крови холестерина и ТГ, а также холестерина ЛПНП.
Таблица 1.10. Классификация гиперлипопротеинемий, принятая ВОЗ
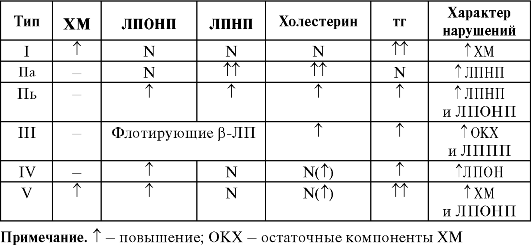 Клиническое значение определения липопротеинов в крови
Клиническое значение определения липопротеинов в крови
Многочисленными клиническими и эпидемиологическими исследованиями установлено, что повышение уровня холестерина в крови - один из основных факторов риска атеросклероза. Развитие ГЛП может быть обусловлено генетическими аномалиями и факторами среды (первичные ГЛП), а также такими заболеваниями, как сахарный диабет, патология печени, почек, гормональными нарушениями (вторичные ГЛП). В формировании первичных ГЛП основную роль играет наследственная предрасположенность. В популяции белых американцев вариабельность уровня холестерина на 63% обусловлена генетической изменчивостью. По данным обследования моно- и дизиготных близнецов в России, изменчивость общего холестерина на 82% обусловлена генетическими факторами.
В настоящее время изучено много наследственных аномалий обмена ЛП, но только для некоторых известны точные биохимические дефекты, позволяющие диагностировать заболевание. К таким формам ГЛП относят семейную дисбеталипопротеине-мию (ГЛП типа III) и семейную гиперхиломикронемию (ГЛП типа I).
СЕМЕЙНАЯ ГИПЕРХОЛЕСТЕРИНЕМИЯ Среди пациентов с первичной гиперхолестеринемией наиболее изучены нарушения обмена липидов при семейной гиперхолестеринемии. Это наследственное моногенное заболевание, при котором отмечают высокий уровень холестерина в сыворотке крови и ЛПНП, а также раннее развитие атеросклероза и ИБС.
Тип наследования при семейной гиперхолестеринемии - аутосомно-доминантный. У гомозигот заболевание протекает более тяжело, чем у гетерозигот. У 60% гомозигот ИБС развивается в возрасте до 10 лет. Уровень холестерина сыворотки крови у гетерозигот варьирует от 250 до 550 мг/дл, у гомозигот отмечено повышение до 800 мг/дл. Ксантомы сухожилий считают патогномоничными для больных с семейной гиперхолестеринемией. Частота распространения семейной гиперхолестеринемии среди популяций Европы и Америки составляет 1 : 1000000 для гомозигот и 1 : 500 для гетерозигот, хотя существуют популяции с более высокой частотой проявления заболевания - 1 : 100 (канадские французы, финны, европеоиды в ЮАР).
Молекулярный дефект, определяющий развитие семейной гиперхолестеринемии, был описан Брауном и Гольдштейном. Причина гиперхолестеринемии - дефект ЛПНП-рецептора, вызывающий резкое снижение поглощения ЛПНП, вследствие чего происходят накопление частиц ЛПНП и соответственно возрастание в крови их концентрации. Степень снижения активности ЛПНП-рецептора у пациентов с семейной гиперхолестеринемией коррелирует с уровнем холестерина ЛПНП, но не с клиническими проявлениями заболевания (ранние проявления ИБС, наличие сухожильных ксантом). Установлено четыре типа генетических дефектов ЛПНПрецептора:
• полное отсутствие белка-рецептора;
• нарушение транспорта белка-рецептора к поверхности клетки;
• дефект рецептора, препятствующий связыванию ЛПНП;
• дефект рецептора, препятствующий его интернализации после связывания с ЛПНП. В настоящее время выявлено более 150 мутаций этого белка.
Несмотря на установление генетического дефекта, определяющего развитие семейной гиперхолестеринемии, характеристику клинических проявлений заболевания и нарушений липидного обмена, критерии диагностики семейной гиперхолестеринемии окончательно не определены. К сожалению, определение активности ЛПНП-рецептора для диагностики семейной гиперхолестеринемии не нашло широкого распространения. Полагают, что использование анализа ДНК для диагностики семейной гиперхолестеринемии нецелесообразно вследствие большого количества мутаций. Увеличение уровня холестерина - нечеткий диагностический критерий семейной гиперхолестеринемии, поскольку описаны пациенты, имеющие сниженную активность апоВ-рецептора и нормальный уровень холестерина.
Снижение связывания частиц ЛПНП с рецептором может быть обусловлено не только генетическими дефектами, вызывающими отсутствие ЛПНП-рецептора или его функциональные нарушения, но и наследственными изменениями лиганда - апоВ-100. Анализ ДНК пациентов с гиперхолестеринемией позволил выявить мутацию гена, кодирующего синтез апоВ-100, в результате которой аргинин в положении 3500 заменен глутамином. Эта патология получила название «наследственный дефект апоВ-100». Частота распространения этого дефекта в популяции сопоставима с таковой для семейной гиперхолестеринемии (1 : 500), по другим данным значительно ниже
(1 : 1300).
СЕМЕЙНАЯ КОМБИНИРОВАННАЯ ГИПЕРЛИПИДЕМИЯ Термин «семейная комбинированная гиперлипидемия» (СКГЛ) впервые предложен Гольдштейном и соавт. в 1973 г. для характеристики наследственного нарушения липидного обмена, при котором у пробанда и его родственников I степени родства отмечают разные типы ГЛП (IIа, IIb, IV). Нарушения липидного обмена проявляются обычно после 20 лет, но могут быть выявлены и в более раннем возрасте. Частота встречаемости СКГЛ в популяции составляет, по данным разных исследователей, от 0,5 до 2%, тогда как среди больных инфарктом миокарда - 5%, а среди пациентов в возрасте до 60 лет с ангиографически документированной ИБС - 15-20%. Изучение родословных показало, что СКГЛ - наследственное заболевание с аутосомно-доминантным типом наследования. Несмотря на многочисленные исследования, биохимический маркер СКГЛ не определен; точный молекулярный дефект, приводящий к формированию СКГЛ, пока неизвестен.
ПОЛИГЕННАЯ ГИПЕРХОЛЕСТЕРИНЕМИЯ
Среди наследственных нарушений липидного обмена наиболее распространена полигенная гиперхолестеринемия. При этом заболевании распределение уровней холестерина у членов таких семей сдвинуто в сторону более высоких значений, чем в среднем в популяции. Кроме того, распределение унимодально, что указывает на отсутствие моногенного наследования. Полагают, что наличие полигенной гиперхолестеринемии обусловлено суммарным влиянием нескольких генов, при этом проявление полигенной гиперхолестеринемии в большой степени провоцируют средовые факторы, особенно характер питания. Термин «полигенная гиперхолестеринемия» применяют для характеристики пациентов с наследственной гиперхолестеринемией с неустановленным генетическим дефектом и при отсутствии признаков моногенного наследования.
Учитывая полигенный характер наследования гиперхолестеринемии, генетический дефект, определяющий заболевание, и его биохимический маркер (или маркеры) неизвестны. Распространенность полигенной гиперхолестеринемии в популяции и среди больных ИБС зависит от значений уровня холестерина, принятых в качестве нормальных: при снижении нормы доля пациентов с полигенной гиперхолестеринемией, естественно, увеличивается.
СЕМЕЙНАЯ ГИПЕРТРИГЛИЦЕРИДЕМИЯ
Семейная гипертриглицеридемия - наследственное нарушение липидного обмена, при котором у пробанда и его родственников выявляют умеренное или значительное увеличение уровня ТГ при нормальной концентрации холестерина ЛПНП - ГЛП IV или V типа. Заболевание обычно проявляется после 30 лет. У таких пациентов часто, но не всегда отмечают снижение уровня холестерина ЛПВП. Тип наследования - аутосомно-доминантный. Семейная гипертриглицеридемия встречается в популяции с частотой 1%, а у больных ИБС в возрасте до 60 лет с частотой 5-8%. Генетический дефект, обусловливающий развитие семейной гипертриглицеридемии, и биохимический маркер этого заболевания в настоящее время неизвестны.
Диагностические критерии гиперлипопротеинемий
Для установления ГЛП необходимы четкие биохимические критерии. В настоящее время есть два подхода к этому вопросу. Долгие годы нормальный уровень холестерина и ТГ сыворотки крови, а также
холестерина ЛПНП и ЛПВП устанавливали по результатам эпидемиологических исследований. Для каждой популяции определяли свои критерии нормы показателей липидного обмена в зависимости от 5-10% минимальных и максимальных значений при гауссовском распределении. Гиперлипидемией в этом случае считали такую концентрацию холестерина и ТГ, которая превышала 90 или 95% уровень на графике Гаусса (в соответствии с полом и возрастом). Именно эти критерии значений нормы положены в основу классификации ГЛП, предложенной Фредриксоном и соавт. и после некоторых дополнений принятой ВОЗ. Впоследствии, учитывая накопленные данные о взаимосвязи повышенного уровня холестерина и риска ИБС, экспертными группами Национальной образовательной программы по холестерину в США и Европейского общества по изучению атеросклероза предложена иная классификация ГЛП. В зависимости от риска ИБС предложено выделять желаемый уровень холестерина в крови < 5,2 ммоль/л, погранично-высокий 5,2-6,2 ммоль/л и высокий > 6,2 или > 6,5 ммоль/л соответственно для мужчин и женщин старше 20 лет. На основании названных критериев предложено выделять умеренную гиперхолестеринемию (6,2-7,5 или 6,5-7,8 ммоль/л) и тяжелую гиперхолестеринемию (> 7,5 или > 7,8 ммоль/л).
Соответственно изменены критерии и для холестерина ЛПНП, тогда как уровень нормы для ТГ и холестерина ЛПВП оставлен прежним. Хотя для американской популяции умеренная гиперхолестеринемия соответствует 75-95% уровню гауссовского распределения, эти критерии используют для типирования ГЛП в США и России. Выбор более низких значений нормы, несомненно, оправдан с точки зрения первичной и вторичной профилактики ИБС. Кроме того, применение единых критериев для диагностики позволяет сопоставить распространенность ГЛП в популяциях с различным средним уровнем холестерина. С другой стороны, 95% лиц с ГЛП, установленной по эпидемиологическим критериям, имеют наследственно обусловленную ГЛП. Соответственно по мере снижения нормальных значений будет возрастать доля лиц, ГЛП которых обусловлена только факторами среды. В этой связи при поиске пациентов с тяжелыми наследственными формами гиперхолестеринемии по-прежнему применяют эпидемиологически установленный 90-95% уровень холестерина в соответствии с полом и возрастом пациента.
Гиполипопротеинемии
Гиполипопротеинемии возникают в результате некоторых дефектов, регулирующих липидный метаболизм ферментов либо мутаций гена апоВ.
Абеталипопротеинемия и гипобеталипопротеинемия - наследуемые расстройства, вызванные мутациями гена апоЛП B, главного апоЛП ХМ и ЛПОНП. Специфическая терапия этих расстройств не разработана.
Абеталипопротеинемия: в крови отсутствуют β-липопротеины, ХМ, ЛП с плотностью ниже 1,063 (ЛПНП и ЛПОНП), эритроциты имеют множественные шиповидные выросты (акантоциты), развивается дефицит витаминов Е и А (результат отсутствия ЛПНП, транспортирующих жирорастворимые витамины). Часты нарушения всасывания в кишечнике, а также нарушения координации (вследствие демиелинизации аксонов), атаксия, нистагм, пигментная дегенерация сетчатки и отставание в умственном развитии. Стеаторея возникает вследствие недостатка апоВ, определяющего образование ХМ в клетках кишечника. При биопсии тонкой кишки обнаруживают жировые включения в эпителиальных клетках.
Гипобеталипопротеинемия сопровождается уменьшением содержания β-липопротеинов и часто протекает бессимптомно. Содержание ЛПВП или в норме или увеличено, триглицеридов 70-120 мг%, ЛПНП 20-70 мг%. Всасывание жиров обычно не нарушено.
ТРИГЛИЦЕРИДЫ
Триглицериды (ТГ; триацилглицерины) - эфиры трехатомного спирта глицерина и длинноцепочечных жирных кислот, среди которых в организме человека доминируют стеариновая, пальмитиновая, пальмитоолеиновая, олеиновая, линолевая кислоты, реже присутствуют полиненасыщенные линоленовая и арахидоновая кислоты. Клетки тканей человека не синтезируют линолевую кислоту, поэтому ее относят к эссенциальным кислотам. Распределение жирных кислот в молекуле ТГ зависит от длины цепи и степени ненасыщенности. В средней позиции чаще находится кислота с наибольшей длиной цепи и наибольшим числом двойных связей, крайние позиции обычно занимают насыщенные кислоты.
Жирные кислоты поступают в организм с пищей в форме триацилглицеринов, которые в тонкой кишке под действием липазы подвергаются гидролизу. Образовавшиеся глицерин и свободные
жирные кислоты абсорбируются клетками эпителия, где происходит ресинтез ТГ. Формирование ТГ происходит в печени; жирные кислоты поступают в печень из жировой ткани или синтезируются в гепатоцитах. Жирнокислотный состав ТГ в организме в большей степени, чем фосфолипидов, зависит от состава жиров пищи. Длинноцепочечные жирные кислоты, входящие в состав ТГ, - оптимальный источник макроэргических соединений, образуемых при β-окислении жирных кислот в митохондриях. Большинство органов реализует именно ТГ для покрытия энергетических потребностей. Исключение составляет мозг; его энергетическое обеспечение происходит за счет метаболизма глюкозы (аэробного гликолиза).
В плазме крови ТГ, как и другие липиды (холестерин и его эфиры, фосфолипиды), транспортируются в составе макромолекулярных мицеллярных комплексов - ЛП. ТГ присутствуют во всех классах ЛП, в ЛПОНП и ХМ они составляют большую часть липидов. При определенном опыте внешний вид плазмы позволяет ориентировочно определить содержание в ней ТГ. Если плазма крови прозрачна, уровень ТГ в ней не превышает 180-200 мг%; выраженная опалесценция плазмы крови характерна для гипертриглицеридемии порядка 300-500 мг%, при уровне ТГ, превышающем 600 мг%, плазма и сыворотка крови непрозрачны. Наличие ХМ в крови можно выявить при проведении «теста стояния» - появление «крема» на поверхности плазмы при ее хранении в течение 16 ч при температуре 4 °С. Прозрачная сыворотка крови и наличие ХМ свидетельствуют о I типе ГЛП, отсутствие ХМ при выраженной опалесценции или молочном цвете сыворотки указывает на IV тип ГЛП; присутствие ХМ на поверхности образца сыворотки с выраженной опалесценцией или молочного цвета позволяет предположить у пациента III или V тип ГЛП.
Клиническое значение определения концентрации ТГ
Необходимо помнить, что ХМ могут присутствовать в сыворотке крови здорового человека, принимавшего пищу менее чем за 12 ч до взятия крови. В силу значительного влияния на уровень ТГ субстратной индукции уровень ТГ в крови может изменяться в течение суток в значительных пределах. Гипертриглицеридемия может быть охарактеризована как физиологическая или патологическая. Физиологическая гипертриглицеридемия возникает после приема пищи и может продолжаться 12-14 ч; степень ее проявления зависит от характера и количества принятой пищи.
Гипертриглицеридемия во II-III триместре беременности также физиологическая. Патологическая гипертриглицеридемия по своим патогенетическим характеристикам может быть дифференцирована на первичную и вторичную. Первичная гипертриглицеридемия обусловлена генетическими нарушениями метаболизма ЛП или усиленной субстратной индукцией (переедание). Нарушения обмена ТГ, возникающие как осложнение основного патологического процесса, относят к вторичным гипертриглицеридемиям.
Известно несколько первичных форм гипертриглицеридемий, обусловленных наследственными дефектами метаболизма ЛП: семейная гипертриглицеридемия, семейная комбинированная гиперлипидемия, семейная дисбеталипопротеинемия (тип III ГЛП), семейная гиперхиломикронемия (тип I ГЛП). К первичным формам нарушения обмена ТГ могут быть отнесены и гипотригли-церидемии, вызванные генетическими изменениями синтеза или секреции апоВ. При этих заболеваниях (наследственной абета-липопротеинемии или гомозиготной гипобеталипопротеинемии) содержание триглицеридов может быть снижено до 19-20 мг%.
Развитие вторичных гипертриглицеридемий отмечено при сахарном диабете, гипотиреозе, нефротическом синдроме, приеме пероральных контрацептивов, лечении глюкокортикоидами. Как правило, патогенетическое лечение, направленное на основной патологический процесс, сопровождается снижением уровня ТГ. Коррекция уровня гликемии инсулином или пероральными гипогликемическими препаратами способствует нормализации содержания ТГ в крови. При купировании нефротического синдрома уровень ТГ в крови также снижается, но иногда остается повышенным в течение длительного времени. Прекращение приема гормональных контрацептивов, глюкокортикоидов и ряда других препаратов (β-блокаторы) также способствует нормализации уровня ТГ.
Гипертриглицеридемию отмечают при жировой инфильтрации печени. В основе патогенеза этого заболевания лежит повышенное поступление свободных жирных кислот в печень (усиленный липолиз) или их усиленный синтез (ресинтез), с одной стороны, и нарушение секреции ЛПОНП печенью - с другой. Многие токсичные соединения, алкоголь, фармакологические препараты способствуют нарушению синтеза апоЛП, в частности апоВ, в отсутствие или при недостатке которых не происходит формирования ЛПОНП. В этих условиях поступающие из крови или вновь синтезируемые ТГ оказываются
в печени, формируя структуру «свиной печени», вызывая ее жировую инфильтрацию и цирроз.
Гипертриглицеридемию обычно отмечают у пациентов с острым панкреатитом. Однако увеличение уровня ТГ нехарактерно для острого поражения поджелудочной железы, напротив, выраженная гипертриглицеридемия (> 1000 мг%), как первичная, так и вторичная, способствует развитию заболеваний поджелудочной железы и зачастую осложняется панкреатитом. Панкреатит считают одним из клинических проявлений семейных форм гипертриглицеридемии. Развитие панкреатита часто отмечают у больных сахарным диабетом, при алкоголизме, у женщин, принимавших гормональные контрацептивы.
Данные о взаимосвязи гипертриглицеридемии и ИБС противоречивы, хотя эпидемиологическими исследованиями на многих популяциях показана независимость ТГ как фактора риска ИБС. Оценка независимости ТГ как фактора риска ИБС крайне затруднена вследствие наличия отрицательной зависимости между уровнем ТГ и холестерина ЛПВП, независимого отрицательного фактора риска ИБС. Тем не менее если повышение концентрации ТГ и не является независимым фактором риска ИБС, тесная связь метаболизма ТГ и ЛПВП не дает оснований отрицать значение гипертриглицеридемии в генезе ИБС. Биохимической основой этого может быть накопление в крови ЛППП, обладающих выраженной атерогенностью.
Значение гипертриглицеридемии в формировании патологии периферических и церебральных сосудов в отличие от ИБС более определенно. Исследования японских специалистов показали, что в этой популяции при низком уровне холестерина крови и частоты возникновения инфаркта миокарда гипертриглицеридемия - фактор риска патологии периферических артерий. Аналогичные данные получены и на других популяциях.
Исследование содержания ТГ в сыворотке крови имеет много общего с определением холестерина. Как холестерин, так и ТГ - структурные компоненты ЛП, которые необходимо разрушить, чтобы сделать липиды доступными для химических или ферментативных реакций. Оба соединения гидрофобны, обладают низкой растворимостью в водных растворах. Однако в определении содержания в сыворотке крови ТГ имеются и существенные отличия: для оценки содержания ТГ определяют глицерин, освободившийся после гидролиза ТГ.
Методы определения содержания ТГ в крови
Существуют два способа определения содержания ТГ в сыворотке крови - химический и ферментативный; каждый из них включает многочисленные методические приемы. В настоящее время определение ТГ возможно также методом «сухой химии».
Химические методы. Для определения ТГ прямые химические методы (без предварительной экстракции органическим растворителем) неприемлемы, так как в сыворотке крови присутствуют многие соединения, которые в процессе химического гидролиза (омыления жирных кислот) также могут превращаться в глицерин, например фосфолипиды и глюкоза. В этой связи в химических методах определения ТГ первая стадия - экстракция ТГ и удаление интерферирующих соединений. Для экстракции используют органические растворители: метанол, этанол, изопропанол и хлороформ. Растворители денатурируют ЛП и способствуют диссоциации ТГ. Интерферирующие соединения удаляют экстракцией органическими растворителями (гексан, нонан) или при использовании адсорбентов (цеолит, кремниевая кислота, флоризил).
Вторая стадия химического определения ТГ - гидролиз ТГ с образованием глицерина и свободных жирных кислот - обычно осуществляется реакцией с этанольным раствором гидроокиси калия при повышенной температуре (омыление).
После окисления глицерина в формальдегид его определяют одной из перечисленных ниже реакций:
• реакцией формальдегида со смесью хромотроповой и серной кислот (измерение при 570 нм);
• реакцией со смесью фенилгидразина, цианида железа и соляной кислоты (измерение при 540 нм);
• реакцией со смесью 3-метил-2-бензотиазолина и хлорида железа (измерение при 620 нм);
• реакцией с ацетатом аммония и ацетилацетоном.
Продукт реакции может быть измерен колориметрически при 412 нм или флюорометрически. Более распространен флюорометрический метод, он адаптирован к полуавтоматическим анализаторам.
Ферментативные методы. При ферментативных методах определения ТГ разрушение ЛП-комплексов, гидролиз ТГ проводят в присутствии детергентов, липазы и протеазы. В условиях ферментативного гидролиза ТГ не происходит освобождения глицерина из фосфолипидов и глюкозы, следовательно, повышается специфичность определения.
Для определения глицерина, образованного при гидролизе ТГ, применяют множество методических приемов, используя в каждом случае ряд сопряженных ферментативных реакций. Ферментативные методы позволяют определять ТГ по уменьшению или увеличению концентрации НАДН при длине волны 340 нм. Предложены и колориметрические методы: восстановление солей тетразолия нитросинего при помощи НАДН и измерение образованного формазана (длина волны 505 нм) или окисление 4-аминофеназона в присутствии пероксидазы с образованием хромогена (длина волны 510 нм).
Использование ферментативного метода позволяет избежать применения органических растворителей, очистки экстрактов для удаления интерферирующих соединений, использования концентрированной гидроокиси калия и проведения гидролиза при высокой температуре. По сравнению с химическими методами ферментативное определение ТГ обладает более высокой специфичностью и точностью, что удобно для автоматизации.
Основные сложности ферментативного определения ТГ - возможность неполной деструкции комплекса ЛП и неполного гидролиза с освобождением свободного глицерина. Из экспериментальных работ известно, что ТГ, образованные насыщенными и ненасыщенными жирными кислотами, с разной скоростью гидролизируются при действии липазы; соотношение коротко- и длинноцепочечных жирных кислот также имеет значение для скорости гидролиза.
Поскольку определение содержания ТГ в сыворотке крови как в химических, так и ферментативных методах основано на освобождении глицерина, необходимо принимать во внимание содержание свободного глицерина в сыворотке крови. Для большинства свежих образцов сыворотки крови при уровне ТГ ниже 700 мг% изменение свободного глицерина не оказывает существенного влияния на получаемые результаты. Накопление свободного глицерина в сыворотке крови происходит при сахарном диабете, некоторых видах патологии печени, в условиях гемодиализа, при острой и хронической почечной недостаточности, приеме нитроглицерина, терапии гепарином. Острые инфекции, кратковременные состояния стресса, прием лекарственных препаратов, обладающих липолитическим свойством, значительно увеличивают содержание свободного глицерина в крови. Спонтанный гидролиз ТГ происходит и в сыворотке крови, особенно при хранении образцов при комнатной температуре.
Для точности определения уровня ТГ следует измерить уровень свободного глицерина и результат вычесть из общего значения. При определении уровня свободного глицерина колориметрическим и флюорометрическим методами он может быть разным в одной и той же пробе плазмы крови. Флюорометрия дает более стабильные результаты, но менее специфична: в условиях почечной недостаточности и активированного протеолиза флюоресцирующие пептиды могут значительно завышать результаты.
Для получения точных данных при определении ТГ необходимо использовать первичный стандарт - раствор триацилглицеринов в органических растворителях. В качестве стандарта обычно применяют триолеин, хотя смесь триолеина и трипаль-митина (2:1 по массе) более сходна по степени ненасыщенности жирных кислот с ТГ человека. В качестве стандарта раствор триолеина в изопропаноле можно применять только для химических методов исследования, так как изопропанол неспецифически активирует ферменты, используемые для определения ТГ. В этой связи при определении ТГ ферментативными методами используют вторичные стандарты (калибраторы) - сыворотки крови человека, содержание ТГ в которых определено референсными методами, с применением первичных стандартов.
Взятие крови для определения ТГ необходимо проводить через 12- 14 ч после приема пищи. Значения ТГ, определенные в плазме крови, на 2-4% ниже таковых в сыворотке. Это обусловлено разведением за счет жидкости, теряемой эритроцитами под действием антикоагулянта. Некоторые антикоагулянты (фторид, цитрат и оксалат) вызывают более значительную потерю жидкости эритроцитами, что находит отражение в большем снижении значений ТГ (до 10%). В качестве антикоагулянта при определении ТГ предпочтительнее использовать ЭДТА (1 мг/мл цельной крови). Для уменьшения эффекта разбавления необходимо центрифугировать образцы крови и отделить полученную плазму в течение 2 ч после взятия крови.
ХОЛЕСТЕРИН
Холестерин, 3-β-гидроксихолест-5-ен, - мононенасыщенный стерин состава С27Н4О(ОН)5; по химической структуре это одноатомный вторичный спирт (холестерол). Молекула холестерина имеет в основе структуру циклопентанпергидрофенантрена, в третьем положении расположена гидроксильная группа, присутствуют двойная связь между 5-м и 6-м углеродными атомами и боковая алифатическая цепь
из восьми атомов углерода. Термин «холестерин» определяет источник, из которого он впервые был выделен (от греч. chole - желчь). Молекулярная масса холестерина 387 Д, в чистом виде это порошок белого цвета. Холестерин хорошо растворяется в органических растворителях (особенно хорошо в спиртах с 6-7 атомами углерода). Растворимость холестерина в воде крайне низкая, составляет 4,7 мкмоль/л при 25 °С.
Химическая структура холестерина ограничивает число биохимических реакций, в которые он вступает. Основное биохимическое превращение холестерина (как спирта) - образование эфирной связи с кислотами, в частности со свободными жирными кислотами, с формированием эфиров холестерина. 80% холестерина в организме составляет свободный холестерин, почти весь он входит в состав биологических мембран. В то же время в сыворотке крови 2/3 холестерина представлено в форме эфиров с жирными кислотами.
Холестерин входит в состав всех живых клеток. В биологических мембранах холестерин выполняет структурную роль. Со структурой неразрывно связана и его функция, определяющая проницаемость мембраны и создание микроокружения для встроенных в мембрану ферментов. Важная функция холестерина - его роль как предшественника синтеза стероидных гормонов.
Все клетки организма синтезируют холестерин из ацетата, последовательно проходя стадии ацетоацетата, метилглутарил-КоА и, наконец, мевалоновой кислоты. Превращение метилглутарил-КоА в мевалоновую кислоту при действии гидроксиметилглутарилКоА-(ГМГ-КоА)-редуктазы - ключевой момент синтеза холестерина. Образованная мевалоновая кислота может быть использована только в синтезе холестерина, поэтому активация ГМГ-КоА-редуктазы всегда приводит к гиперхолестеринемии.
Основная масса холестерина синтезируется в печени и поступает с пищей; в сутки организм синтезирует 1 г холестерина. Часть холестерина окисляется в желчные кислоты, часть удаляется с калом. Существуют реципрокные отношения между холестерином, поступающим с пищей, и синтезируемым в организме. Холестерин, как и другие липиды, транспортируется в сыворотке крови в составе ЛП.
Основную массу холестерина сыворотки крови содержат ЛПНП; их основной апоЛП - апоВ-100. ЛПНП - основная форма транспорта холестерина и полиеновых жирных кислот от печени к периферическим тканям. ЛПНП при взаимодействии с апоВ-рецепторами
плазматической мембраны подвергаются интернализации; в липосомах происходит деструкция ЛП-частицы с освобождением свободного холестерина. Клетка использует холестерин для построения мембран, часть его этерифицируется. Молекулы холестерина плазматических мембран, оказавшись в сыворотке крови, начинают афферентный путь к печени в составе ЛПВП. Поступивший в печень в составе ЛПВП холестерин подвергается микросомальному гидроксилированию, превращаясь в желчные кислоты, а также экскретируется с желчью в форме свободного холестерина или его эфиров.
На уровень холестерина влияют характер пищи и прием алкоголя, интенсивные физические тренировки, фармакологические препараты, включая гормональные контрацептивы, стероиды, гиполипидемические препараты. Сезонные и дневные вариации не оказывают существенного влияния на уровень холестерина в сыворотке крови. Индивидуальные колебания значений холестерина составляют, по данным разных авторов, от 3 до 14%. Суточные колебания уровня холестерина у мужчин и женщин (0,7-4,3%) значительно ниже, чем колебания в течение 1 мес (2,0-12,2%) и 1 года (3,9-10,9%).
Клиническое значение гиперхолестеринемии
Гиперхолестеринемия - наиболее документированный фактор риска коронарного атеросклероза. Это подтверждено многочисленными эпидемиологическими и клиническими исследованиями, установившими связь гиперхолестеринемии с коронарным атеросклерозом, частотой клинических проявлений ИБС (стенокардии и инфаркта миокарда). При вторичной профилактике коронарного атеросклероза в ходе гиполипидемической терапии продемонстрирована регрессия клинической картины ИБС и кардиосклероза при нормализации уровня холестерина сыворотки крови. Для более детальной характеристики факторов риска коронарного атеросклероза исследуют содержание холестерина в отдельных классах ЛП; наибольшее распространение получило исследование холестерина ЛПНП и ЛПВП, являющихся достоверными факторами соответственно риска и антириска коронарного атеросклероза.
Исследование холестерина не несет диагностической информации относительно определенного заболевания, а характеризует патологию обмена липидов и ЛП. Определение уровня холестерина имеет социальное значение, так как повышенный популяционный уровень холестерина требует осуществления организационных мероприятий
по первичной профилактике коронарного атеросклероза. Наиболее высокие цифры гиперхолестеринемии отмечаются при генетических нарушениях обмена ЛП: семейной гомо- и гетерозиготной гиперхолестеринемии, семейной комбинированной гиперлипидемии, полигенной гиперхолестеринемии.
При ряде патологических состояний развивается вторичная гиперхолестеринемия. К таким процессам относят гипотиреоз, нефротический синдром, сахарный диабет и др. Гипохолестеринемия возникает при гипертиреозе, при тяжелых клинических ситуациях, сопровождающих разные нозологические формы заболеваний, при острой стадии воспалительного процесса, а также онкологических заболеваниях.
Методы определения холестерина в сыворотке
Методы определения холестерина в сыворотке крови многочисленны; можно выделить химические и ферментативные методы. В свою очередь среди химических методов выделяют прямые и непрямые (экстракционные) методы.
ХИМИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ
ХОЛЕСТЕРИНА Прямые методы. Основа прямых методов определения холестерина - реакция Либермана-Бурхарда, в которой холестерин взаимодействует со смесью серной и уксусной кислот, а также уксусного ангидрида. Реакция протекает в сильнокислой безводной среде. В ходе реакции молекула холестерина последовательно окисляется и образуется окрашенное соединение холестагексаен - серная кислота с максимумами абсорбции при 410 и 610 нм. Развивающаяся окраска неустойчива, поэтому следует точно выдерживать время фотометрирования. В литературе можно встретить разное соотношение ингредиентов в реактиве Либермана-Бурхарда; чем выше содержание уксусного ангидрида, тем с большей скоростью протекает реакция. Реакция холестерина со смесью Либермана-Бурхарда неспецифична. В реакции прямого определения холестерина окраска реакционной смеси со стандартным раствором имеет изумрудный цвет; пробы сыворотки могут давать зеленый, голубой, бурый цвет. Это связано с тем, что в реакцию вступают многие компоненты сыворотки крови. Кроме того, в реакции Либермана- Бурхарда свободный холестерин и его эфиры формируют окрашенные комплексы с разным коэффициентом молярного поглощения:
в случае эфиров холестерина оптическая плотность оказывается более высокой. Это изначально вносит ошибку в исследование, поскольку неизвестно отношение свободный холестерин/эфиры холестерина в каждой из проб.
Реакция Киллиани-Зака - другой распространенный метод определения холестерина (реакция холестерина с солями железа, уксусной и серной кислотами). Эта химическая реакция протекает в присутствии ионов трехвалентного железа с последовательным формированием в молекуле холестерина двух, трех и четырех двойных сопряженных связей, при этом максимум поглощения образовавшихся соединений меняется от 420 до 563 нм. В реакции Киллиани-Зака свободный холестерин и его эфиры дают сходные цветные комплексы.
Непрямые методы. К непрямым методам относят приемы, когда липиды из сыворотки крови вначале экстрагируют органическими растворителями, а после упаривания проводят реакцию Либермана- Бурхарда. Такой метод более воспроизводим и точен, поскольку удается убрать интерферирующие вещества, остающиеся в водной фазе. Для экстракции используют системы этанолдиэтиловый эфир, этанол-ацетон, метанол-хлороформ; наиболее часто применяют гексан и изопропиловый спирт. Включение этапа экстракции повышает специфичность метода; результаты определения холестерина на 7% ниже, чем при прямом методе.
Референсные методы определения холестерина проходят три стадии; они включают экстракцию липидов в неполярный растворитель, омыление эфиров холестерина и повторную экстракцию холестерина из омыленной смеси. В качестве референсного метода наиболее предпочтителен метод Абелл-Кендалла, предложенный в 1952 г.: липидный экстракт омыляют спиртовым раствором гидроокиси калия и экстрагируют петролейным эфиром. Реакцию Либермана-Бурхарда проводят после упаривания петролейного эфира.
Трудности приготовления стандартных растворов холестерина связаны с его гидрофобностью. Длительное время в качестве стандартного раствора применяли раствор холестерина в ледяной уксусной кислоте. Далее в качестве стандартного был предложен раствор холестерина в изопропаноле, однако такой стандарт оказался неудобным при ферментативных методах определения холестерина, поскольку изопропанол активировал ферментные системы, завышая оптическую плотность. Для определения холестерина при работе с биохимическими анализаторами общепринято использование вторичных
стандартов (калибраторов) - сывороток крови, уровень холестерина в которых определен референсными методами.
Несмотря на относительную простоту исполнения и дешевизну процедуры, химические методы токсичны, применение их на современных анализаторах связано с коррозией системы.
ФЕРМЕНТАТИВНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ
ХОЛЕСТЕРИНА
Преимущества ферментативного определения: проведение реакции в водной фазе; удобство автоматизации; высокая чувствительность и специфичность.
Ферментативное определение холестерина также включает несколько этапов: ферментативный гидролиз эфиров холестерина при действии холестеролэстеразы с образованием свободного холестерина и свободных жирных кислот; окисление холестерина кислородом, растворенным в реакционной среде при действии холестеролоксидазы с образованием холест-4-ен-3-ола и Н2О2. В наиболее широко используемых методах образующаяся перекись водорода окисляет некоторые соединения с образованием хромогенов, которые могут быть измерены фотометрически. К таким хромогенам могут быть отнесены 4-аминофеназон (максимум абсорбции 500-525 нм), а также образование гетероцикла Хенача в реакции с метанолом (максимум абсорбции 405 нм). Возможна регистрация образованной перекиси водорода в реакции с НАД-зависимыми дегидрогеназами и измерением оптической плотности при длине волны 340 нм.
Как и в химических методах, некоторые компоненты сыворотки крови холестерина могут оказывать влияние на результаты определения. Билирубин ингибирует реакцию пероксидазы с 4-аминоантипи- рином и фенолом. Восстановители сульфгидрильных групп (глутатион, цистеин, дитиотреитол) также оказывают влияние на результаты реакции. Методы, основанные на разных ферментативных реакциях, могут давать различные результаты.
Методические трудности ферментативного определения холестерина связаны с гетерогенностью распределения холестерина между ЛП, а также с его этерификацией в крови. Полнота гидролиза эфиров холестерина зависит от источника выделения фермента. Микробиальная холестеролэстераза более активно гидролизует эфиры холестерина, образованные насыщенными жирными кислотами, тогда как панкреатическая - полиненасыщенными жирными кислотами.
Взятие крови для определения всех липидов обычно проводят после 12-16 ч голодания. Концентрация холестерина в крови не меняется до и после приема пищи, однако выраженная опалесценция сыворотки крови, обусловленная наличием ХМ и ЛПОНП, может мешать определению. Желательно, чтобы в течение по меньшей мере 2 нед до взятия крови пациент не менял привычного питания. Для определения уровня холестерина можно использовать сыворотку или плазму крови. В качестве антикоагулянта для получения плазмы обычно используют сухую ЭДТА (1 мг/мл крови), которая обладает также антиоксидантными свойствами. Концентрация холестерина в сыворотке крови на 2-4% ниже, чем в плазме крови.