Клиническая биохимия : учебное пособие. 3-е издание / под ред. В.А. Ткачука. - 2008
|
|
|
|
ГЛАВА 3 НЕЙРОЭНДОКРИННАЯ СИСТЕМА
В основе всех регуляторных процессов в организме человека находятся нервная система и железы внутренней секреции. Свою функцию они осуществляют путем секреции соответственно нейромедиаторов и гормонов.
Гормоны секретируются в эндокринных железах, т.е. в тканях, протоки которых выводятся в кровеносную (главным образом в вены) или лимфатическую систему. Нейромедиаторы синтезируются в теле нейрона или в нервных окончаниях и, как правило, скапливаются в так называемых синаптических пузырьках.
В состоянии покоя происходит спонтанная, с определенной частотой и определенными порциями секреция нейромедиаторов и гормонов. Разрыв синаптического пузырька приводит к выделению в синапс всего содержимого. В каждом пузырьке содержится приблизительно одинаковое количество нейромедиаторов, поэтому принято говорить о выделении дробного числа квантов нейромедиаторов. Катехоламины и многие белково-пептидные гормоны также секретируются в кровь определенными порциями, так как данные гормоны, подобно нейромедиаторам, секретируются путем опустошения везикул. В состоянии покоя это опустошение происходит самопроизвольно с низкой частотой. Регуляторный сигнал, стимулирующий эндокринную железу, увеличивает частоту опустошения везикул, что приводит к секреции большего количества нейромедиатора или гормона. Ингибирующее влияние на секрецию осуществляется путем снижения частоты выброса гормона или нейромедиатора.
В отличие от катехоламинов и белково-пептидных гормонов, стероидные гормоны, по-видимому, не накапливаются в специальных структурах клетки, а благодаря своей липофильности свободно проходят через плазматическую мембрану клеток эндокринной железы и попадают в кровь. Регуляция функциональной активности желез, в которых образуются стероидные гормоны, сводится лишь к ускорению или замедлению синтеза этих гормонов. Следует отметить, что факторы, стимулирующие или ингибирующие секреторную активность желез, соответственно ускоряют или замедляют также и биосинтез гормонов. Это осуществляется по механизму обратной связи.
Время появления гормонального эффекта определяется тем, когда поступит сигнал на соответствующую железу внутренней секреции. Сколь велик будет эффект гормона, зависит от силы этого сигнала.
В ряде случаев функциональная активность железы регулируется субстратом, на который направлено действие гормона. Так, например, глюкоза стимулирует секрецию инсулина из островков Лангерганса, а инсулин понижает концентрацию глюкозы, облегчая ее транспорт в ткани, и тем самым устраняет стимулирующее влияние сахара на поджелудочную железу.
По такому же механизму осуществляется секреция ПТГ и кальцитонина.
Эта регуляция, происходящая по механизму отрицательной обратной связи, очень эффективна для поддержания гомеостаза в организме. Задачи адаптации организма не могут быть решены с помощью этого механизма. Так, например, кора надпочечников должна производить глюкокортикоиды в ответ на голод, болезни, эмоциональное возбуждение и т.п. Очевидно, что для того чтобы эндокринная система могла отвечать на эти изменения в организме, а также на свет, звуки, запахи, должна существовать связь между эндокринными железами и нервной системой.
Наиболее простым примером подобной связи является регуляция клеток мозгового слоя надпочечников нервными волокнами. В мозговом слое надпочечников образуется адреналин и в меньшей степени норадреналин. Электрические сигналы, идущие по нервным волокнам, через синаптическую передачу (нейромедиатор ацетилхолин) активируют клетки мозгового слоя надпочечников и вызывают в них синтез и секрецию катехоламинов. Однако такой способ замыкания нейроэндокринных связей является скорее исключением, чем правилом. Клетки мозгового слоя надпочечников можно рассматривать как переродившуюся нервную ткань, а такую регуляцию - как сохранившуюся связь между нервными клетками.
3.1. ВЗАИМОСВЯЗЬ МЕЖДУ НЕРВНОЙ И ЭНДОКРИННОЙ СИСТЕМАМИ
Основные связи между нервной и эндокринной системой регуляции осуществляются с помощью специальных отделов мозга - гипоталамуса и гипофиза. Нервные сигналы, приходящие в гипоталамус, активируют секрецию так называемых рилизинг-факторов: тиреолиберина,
соматолиберина, пролактолиберина, гонадолиберина и кортиколиберина, а также соматостатина и пролактостатина (рис. 3.1). Мишенью либеринов и статинов, секретируемых гипоталамусом, является гипофиз. Каждый из либеринов взаимодействует с определенной популяцией клеток гипофиза и вызывает в ней синтез соответствующих тропинов: тиреотропина, соматотропина (гормона роста), пролактина, гонадотропинов (два гормона - лютеинизирующий и фолликулостимулирующий), а также адренокортикотропного гормона (АКТГ). Влияние на гипофиз статинов противоположное - они подавляют секрецию тропинов.
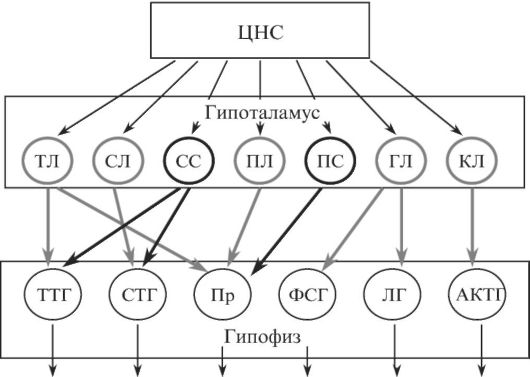 Рис. 3.1. Регуляция
эндокринных желез ЦНС. ТЛ, СЛ, ПЛ, ГЛ и КЛ - оответственно,
тиреолиберин, соматолиберин, пролактолиберин, гонадолиберин и
кортиколиберин. СС и ПС - соматостатин и пролактостатин. ТТГ -
тиреотропный гормон, СТГ - соматотропный гормон (гормон роста), Пр -
пролактин, ФСГ - фолликулостимулирующий гормон, ЛГ - лютеинизирующий
гормон, АКТГ - адренокортикотропный гормон
Рис. 3.1. Регуляция
эндокринных желез ЦНС. ТЛ, СЛ, ПЛ, ГЛ и КЛ - оответственно,
тиреолиберин, соматолиберин, пролактолиберин, гонадолиберин и
кортиколиберин. СС и ПС - соматостатин и пролактостатин. ТТГ -
тиреотропный гормон, СТГ - соматотропный гормон (гормон роста), Пр -
пролактин, ФСГ - фолликулостимулирующий гормон, ЛГ - лютеинизирующий
гормон, АКТГ - адренокортикотропный гормон
Роль тропинов, секретируемых гипофизом, заключается в регуляции соответствующих эндокринных желез. С током крови тропины попадают на соответствующие железы и активируют в них секреторные процессы.
Β этой системе передачи сигнала от ЦНС до эндокринных желез на каждой ступени происходит увеличение количества секретируемого гормона. Последовательное участие в этом процессе нескольких эндокринных желез обеспечивает интеграцию регуляторных
воздействий, так как секреторная активность каждой из этих желез зависит не только от гормональных и нервных стимулов, но и от таких факторов, как концентрация субстрата и кофакторов синтеза, состояние биосинтетического аппарата, обеспеченность энергией и т. п. Несомненно также, что многоступенчатость этой системы исключает реагирование эндокринной системы по принципу «все или ничего», позволяет регулировать силу сигнала, усиливая или ослабляя его в зависимости от состояния организма.
Еще одна особенность этой эстафетной системы проведения сигнала заключается в том, что одним стимулом можно вызвать образование нескольких разных гормонов, т.е. запустить несколько регуляторных сигналов. Так, например, при стрессе стимулируется следующий путь нейроэндокринной регуляции: гипоталамус-кортиколиберин-гипо- физ-АКТГ-надпочечник-кортизол. АКТГ - это полипептид, состоящий из 39 аминокислот, который образуется из белка-предшественника путем его протеолиза (рис. 3.2). Помимо АКТГ, из С-концевой части белка-предшественника образуется еще один пептид - β-липотропный гормон (ЛТГ), дальнейший протеолиз которого приводит к образованию либо γ-ЛТГ и β-эндорфина, либо β-меланоцит-стимулирующего гормона (МСГ) и γ-эндорфина. Образующийся при стрессе β-ЛТГ несет в своей структуре также последовательность α-эндорфина и мет-энкефалина. Следовательно, при стрессе за счет протеолиза одного и того же белка может образовываться несколько нейропептидов, в том числе и так называемые эндогенные опиоиды (эндорфины и энкефалины). Эти гормоны дают обезболивающий эффект и чувство эйфории при связывании с опиоидными рецепторами, теми самыми, на которые действуют морфиноподобные наркотики.
Возникновение нескольких регуляторных сигналов под влиянием всего одного стимула позволяет организму одновременно изменять целый спектр своих функций, например в случае стресса активировать обмен углеводов (глюкокортикоиды) и липидов (липотропины), а также уменьшать чувство боли (эндорфины и энкефалины), стимулировать иммунную систему (МСГ).
Приведенные выше примеры свидетельствуют о том, что передача регуляторного сигнала от одних клеток к другим происходит путем умножения сигнала. При этом в ответ на одно воздействие образуется, как правило, не один, а несколько гормонов, каждый из которых имеет свои рецепторы на клетках и, связываясь с ними, вызывает свой спектр биологических эффектов.
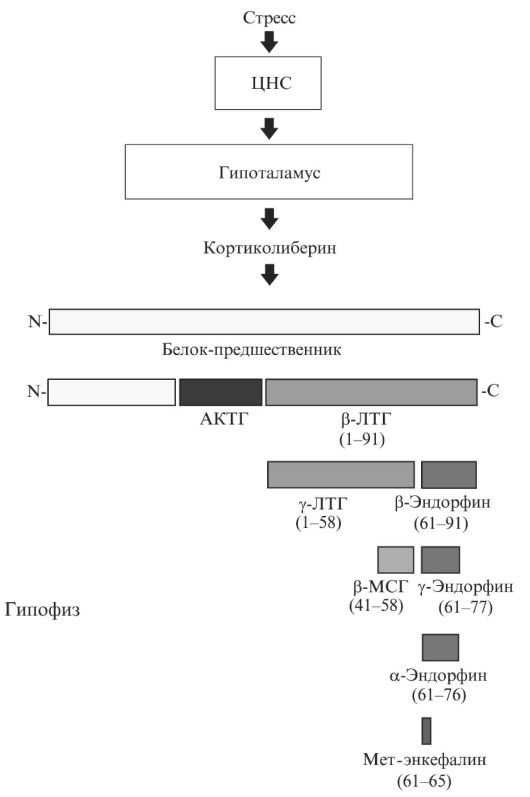 Рис. 3.2. Образование белковых и пептидных гормонов в гипофизе из общего белка-предшественника под действием стресса. ЛТГ - липотропный гормон, МСГ - меланоцитстимулирующий гормон
Рис. 3.2. Образование белковых и пептидных гормонов в гипофизе из общего белка-предшественника под действием стресса. ЛТГ - липотропный гормон, МСГ - меланоцитстимулирующий гормон
Гипоталамус состоит из специализированных нервных клеток, аксоны которых содержат в синаптических пузырьках либерины или статины. Возбуждение аксонов приводит к выбросу рилизинг-факторов из синаптических пузырьков. Они попадают в портальную вену, а затем на клетки гипофиза.
Перерезка ножки гипофиза приводит к потере связи между гипоталамусом и гипофизом. При этом секреция тиреотропного, соматотропного, гонадотропных гормонов и АКТГ понижается, а секреция пролактина возрастает.
Каждый из тропинов синтезируется строго определенной группой клеток гипофиза. При этом каждая из этих групп клеток находится под контролем определенного участка гипоталамуса. Так, например, задний отдел гипоталамуса стимулирует в гипофизе секрецию АКТГ, а передний отдел гипоталамуса - секрецию тиреотропного гормона.
Гормоны гипоталамуса и гипофиза - это в основном пептиды, полипептиды и белки. Полупериод их жизни в крови составляет 2-5 мин.
Самый большой из либеринов - это соматолиберин, состоящий из 15 аминокислотных остатков, самый маленький - трипептид тиреолиберин. В качестве рилизинг-факторов выступают также гипоталамические дофамин и норадреналин.
Разные тропины, образующиеся в гипофизе, содержат от 13 до 198 аминокислотных остатков. Лютеинизирующий, фолликулостимулирующий гормоны и тиреотропин - это гликопротеиды, состоящие из двух разных субъединиц. За связывание с рецептором и проявление биологического эффекта гормона ответственны β-субъединицы, а α-субъединицы у всех трех гормонов идентичны, и их роль, по-видимому, сводится к защите β-субъединиц от протеолиза.
Основные эффекты либеринов, статинов и тропинов опосредуются активацией синтеза цАМФ. Эффекты же гормонов, образование и секреция которых находится под контролем тропинов, осуществляется путем изменения скорости синтеза белка (тиреоидные и стероидные гормоны).
Кроме регуляторных сигналов, идущих сверху вниз, существует регуляция гипофиза и гипоталамуса гормонами исполнительных желез. Обычно соблюдается следующая закономерность: при дистрофии эндокринной железы в гипофизе стимулируется секреция соответствующего тропного гормона, при гиперфункции железы секреция соответствующего тропина подавляется.
Эта обратная связь позволяет не только осуществлять тонкую регуляцию уровня гормонов в крови, но и участвует в дифференцировке гипоталамуса. Известно, что образование половых гормонов в женском организме происходит циклически, что объясняется циклической секрецией гонадотропных гормонов. Под действием фолликулостимулирующего гормона происходит развитие фолликулов. Затем секретируется лютеинизирующий гормон, который вызывает образование желтого тела - временной эндокринной железы, производящей эстрогены. Причина циклической секреции гонадотропинов кроется не в гипофизе, который синтезирует эти гормоны, а в гипоталамусе, образующем рилизинг-фактор этих тропинов (гонадолиберин). Если самке пересадить гипофиз самца, он тоже начинает работать циклично. Половая дифференцировка гипоталамуса происходит под действием андрогенов. Если самца лишить этих половых гормонов, то гипоталамус будет дифференцироваться по женскому типу.
Активность гипоталамуса контролируется также эпифизом - еще одной эндокринной железой, расположенной в мозге. Многие ферментные и секреторные процессы в нем протекают с цикличностью, равной световому и темновому периодам суток. Эта регуляция осуществляется следующим образом. Кванты света, попадая на свой рецептор - родопсин, локализованный в наружных сегментах палочек сетчатки, вызывают возникновение потенциала действия, который распространяется по зрительному нерву и, в частности, активирует нервные волокна, иннервирующие эпифиз. Через эти волокна осуществляется торможение синтеза белка в эпифизе, в частности синтеза метилазы, участвующей в образовании мелатонина. В темное время суток растет концентрация метилазы и поэтому возрастает образование мелатонина из серотонина. Мелатонин участвует в регуляции окраски кожи (вызывает ее просветление), подавляет эффекты гонадотропинов и влияет на секрецию рилизинг-факторов в гипоталамусе.
Мелатонин образуется только в эпифизе. В других тканях (нейроны, слизистая оболочка желудка и кишечника, тучные клетки, печень и почки) нет этой специфической метилазы, а гидроксилирование и декарбоксилирование триптофана приводят к образованию серотонина (5-окситриптамина) (рис. 3.3). Этот гормон регулирует функции многих клеток, но в эпифизе серотонин является промежуточным веществом биосинтеза мелатонина. Свет, подавляя активность метилазы в эпифизе, замедляет превращение серотонина в мелатонин. Сигнал от зрительных клеток на эпифиз передается через нервные
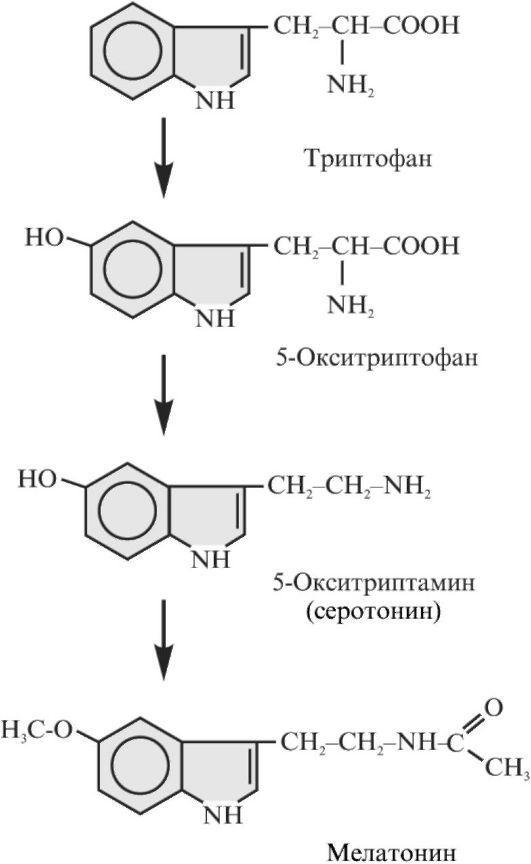 Рис. 3.3. Биосинтез серотонина и мелатонина
Рис. 3.3. Биосинтез серотонина и мелатонина
волокна, которые секретируют катехоламины. При этом в частности, повышается концентрация цАМФ - внутриклеточного регулятора, стимулирующего ферменты синтеза серотонина из триптофана, но не влияющего на активность метилаз. Β результате всех этих процессов в светлое время суток в эпифизе повышена концентрация серотонина, а в темное - мелатонина.
Принято считать, что существует также сезонная и годичная циклическая активность эпифиза. Очевидно, что, воздействуя на гипоталамус, гормоны эпифиза могут задавать цикличность многим другим железам. Так, например, в темное время суток секреция пролактина выше, чем в светлое время. Это не связано ни со сном, ни с бодрствованием организма. Показано также, что нарушения циклической
активности эпифиза, происходящие при частой перемене временных поясов или при экспериментальном изменении длительности «дня» и «ночи», могут приводить к нарушениям циклической секреции гонадотропинов и половых гормонов.
По-видимому, существует лишь три эндокринных железы, функциональная активность которых находится под прямым контролем нервных механизмов регуляции: мозговой слой надпочечников, эпифиз и гипоталамус. Все остальные железы находятся под гуморальным контролем. В таких железах могут быть иннервированы только сосуды, а эндокринные клетки изменяют свою биосинтетическую и секреторную активность лишь под действием определенных метаболитов, кофакторов и гормонов, поступающих к ним с током крови и лимфы. Следует отметить, что помимо тропинов регуляторами эндокринных желез могут быть и другие гормоны. Так, например, глюкагон стимулирует секрецию инсулина, а инсулин - секрецию катехоламинов, ангиотензин II стимулирует синтез и секрецию альдостерона. Отметим также, что некоторые гормоны гипоталамуса и гипофиза могут образовываться и в других тканях и там выполнять свои специфические функции. Так, например, соматостатин - гормон гипоталамуса, ингибирующий образование и секрецию гормона роста, обнаружен также в поджелудочной железе, где он подавляет секрецию инсулина и глюкагона.
Эти примеры ни в коей мере не умаляют значения гипоталамогипофизарного механизма регуляции. Подавляющее большинство нервных и гуморальных путей регуляции сходится на уровне гипоталамуса и благодаря этому в организме образуется единая нейроэндокринная система. К клеткам гипоталамуса подходят аксоны нейронов, расположенных в коре больших полушарий, в спинном, продолговатом и среднем мозге, таламусе и т. д. Эти аксоны секретируют норадреналин, дофамин, серотонин и другие нейромедиаторы, оказывающие на секреторную активность гипоталамуса как активирующее, так и ингибирующее влияние. Как отмечалось выше, гипоталамус испытывает также влияние многих гуморальных факторов. Поступающие из мозга нервные импульсы эта железа превращает в эндокринные стимулы, которые могут быть усилены или ослаблены в зависимости от гуморальных сигналов, поступающих на гипоталамус от желез, ему подчиненных.
Нельзя не отметить и уникальную роль гипофиза в нейрогуморальной регуляции. Тропины, образующиеся в гипофизе, не только
регулируют подчиненные железы, но и имеют самостоятельные эндокринные эффекты. Так, например, помимо регуляции образования и экскреции молока, пролактин влияет на процессы дифференцировки клеток, повышает чувствительность половых желез к гонадотропинам, стимулирует родительский инстинкт. АКТГ - это не только стимулятор стероидогенеза, но и важный регулятор липолиза в жировой ткани, а также предшественник α-МСГ и пептида (фрагмент 4-10), участвующего в консолидации памяти (превращение кратковременной памяти в долговременную). Гормон роста может регулировать активность иммунной системы, обмен липидов, сахаров и т.д.
В задней доле гипофиза (этот отдел называют также нейрогипофизом) депонируется антидиуретический гормон (вазопрессин) и окситоцин (рис. 3.4). Первый вызывает задержку воды в крови и повышает тонус сосудов, второй стимулирует сокращение матки при родах и секрецию молока. Оба гормона синтезируются в клетках гипоталамуса, затем транспортируются по аксонам в заднюю долю гипофиза и там секретируются.
Интересно, что одна из форм антидиуретического гормона (лизинвазопрессин) имеет дополнительную функцию - способствует восстановлению памяти, облегчает процесс извлечения из памяти, акт воспоминания.
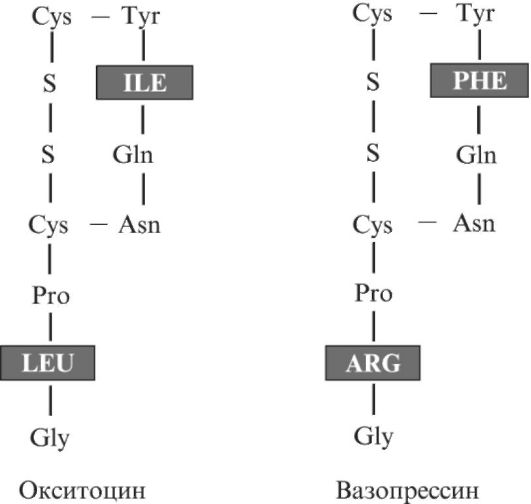 Рис. 3.4. Пептидные гормоны окситоцин и вазопрессин
Рис. 3.4. Пептидные гормоны окситоцин и вазопрессин
Рассматривая роль гормонов гипофиза, мы обнаруживаем, что они влияют на развитие инстинктов, поведение и память, т. е. на процессы, протекающие в высших отделах головного мозга. Известно, что и другие, не гипофизарные гормоны, могут влиять на ЦНС. Так, например, андрогены и эстрогены определяют половой инстинкт, многие поведенческие реакции. Все это свидетельствует о том, что нейроны, точно так же, как и другие клетки нашего организма, находятся под контролем гуморальной системы регуляции. Эта регуляторная система включает в себя также другие органы и ткани (печень, мышцы, почки, кровь и др.), которые имеют не только подчиненную, но и управляющую функцию, так как секретируют в кровь гормоны, простагландины, факторы роста, цитокины и другие биологически активные вещества, влияющие (в числе прочего) на работу мозга и желез внутренней секреции.
Объединение многих миллиардов нервных клеток человека в одну ткань - мозг - позволяет ему хранить наследственные инстинкты, формировать рефлексы, иметь память, интеллект и способность к творчеству. Своеобразная память присуща и другим тканям человека, например существует врожденный и приобретенный иммунитет (память клеток крови), с помощью физических упражнений можно влиять на фенотип мышечных клеток, существуют упражнения, которые усиливают слух или обостряют обоняние и т. п. Подобное возможно за счет того, что клетки наших органов и тканей общаются между собой с помощью гормонов, простагландинов, лейкотриенов, цитокинов, молекул межклеточного узнавания (селектинов, кадгеринов), факторов роста и др. Разнообразие регуляторных молекул, участвующих в межклеточной коммуникации, значительно больше, чем разнообразие нейромедиаторов, участвующих в функционировании нервной ткани. Число клеток, секретирующих гормоны и гормоноподобные вещества, также сравнимо с численностью нейронов в мозге, а механизмы передачи регуляторного сигнала от клетки к клетке очень похожи на те, которые мы наблюдали при рассмотрении гипоталамо-гипофизарной системы регуляции.
3.2. ВЗАИМОСВЯЗЬ МЕЖДУ ХЕМО- И МЕХАНОРЕЦЕПЦИЕЙ
Взаимодействие между системами хеморецепции и механорецепции удобно рассмотреть на примере клеток кровеносного сосуда. Изнутри сосуд покрыт монослоем эндотелиальных клеток, которые служат молекулярным ситом для всех веществ, растворенных в крови.
Кроме того, они делают внутреннюю поверхность сосуда неадгезивной, т. е. препятствуют прилипанию клеток крови к сосудистой стенке. Очень важна также эндокринная функция эндотелиальных клеток.
Многие гормоны, имея гидрофильную природу, не могут проникать через эндотелиальный барьер в глубь сосуда, а затем достигать определенного органа (рис. 3.5). Они действуют на эндотелиальные клетки и вызывают в них образование новых межклеточных регуляторов: эндотелина (пептидный гормон) и тромбоксана (простаноид, образующийся из арахидоновой кислоты), которые стимулируют сокращение ГМК в стенке сосуда, а также агрегацию тромбоцитов. Эти же гормоны стимулируют образование в эндотелиальных клетках простациклина (простагландин I2) и оксида азота (NO), которые вызывают расслабление ГМК и препятствуют агрегации тромбоцитов. Таким образом, в результате секреторной активности эндотелия могут произойти либо сужение сосуда и усиление тромбоза (если секреция тромбоксана и эндотелина превышает секрецию простациклина и NO), либо расширение сосуда и ослабление тромбоза (если секреция тромбоксана и эндотелина окажется слабее, чем секреция простациклина и NO).
Спектр гормонов и уровень их секреции эндотелием зависит от эндокринных сигналов, которые действуют на эндотелиальную клетку, а также от функционального состояния эндотелия. Для регуляции
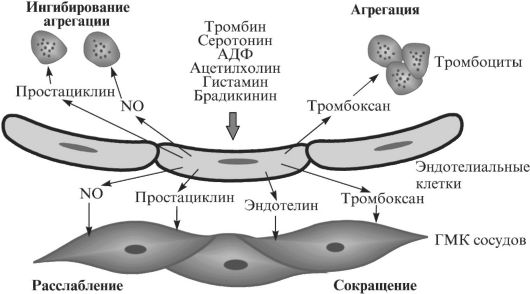 Рис. 3.5. Регуляция гормонами клеток сосуда и крови
Рис. 3.5. Регуляция гормонами клеток сосуда и крови
давления и скорости протекания крови по сосудам чрезвычайно важно то, что эндокринный ответ эндотелия зависит также от механических сигналов, поступающих на клетки монослоя. Когда скорость протекания крови по сосудам повышается, это вызывает напряжение сдвига мембраны эндотелиальной клетки, в результате чего она вырабатывает NO, расширяющий сосуд. Данная рефлекторная реакция позволяет немедленно открывать так называемые коллатерали (сосудистые шунты), когда по какой-то причине перекрывается кровоток по основной магистрали.
При высоком АД происходит растяжение сосуда, которое также воспринимается клетками сосудистой стенки. В ответ на это в них повышается синтез белков, секретируются гормоны, факторы роста и коллаген, усиливается также деление клеток. Все эти процессы происходят за счет возбуждения так называемых рецепторов растяжения. Хроническое действие этого стимула (например, вследствие артериальной гипертензии) может приводить к существенному сужению просвета сосуда и гипертрофии сердца.
Таким образом, эндотелий, выстилающий внутреннюю поверхность кровеносного сосуда, может воспринимать многочисленные гормональные и механические сигналы, интегрировать все эти воздействия и отвечать на них секрецией собственных гормонов, которые регулируют активность близлежащих ГМК. Эти клетки в свою очередь могут не только сокращаться и расслабляться, определяя тем самым величину кровяного давления, но также секретируют гормоны и факторы роста, которые влияют на функциональное состояние снабжаемых кровью органов, а также клеток крови и эндотелия.
Очевидно, что механизм эстафетной передачи регуляторного сигнала в кровеносном сосуде очень похож на гипоталамо-гипофизарный путь проведения сигнала от ЦНС на эндокринные железы. Подобная эстафетная передача регуляторного сигнала от одного типа клеток к другому функционирует также в печени, мышцах, почках, желудке и других органах.
Механическое воздействие испытывают практически все ткани нашего организма. Так, например, при растяжении клеток мышечной и костной ткани стимулируется ее рост, активируется синтез специфических белков, увеличивается объем межклеточного пространства, т. е. происходит гипертрофия ткани. Растяжение легких при каждом вдохе воздуха вызывает секрецию эпителиоцитами специальных поверхностно-активных веществ, защищающих клетки альвеол от
повреждения воздухом и взвешенными в нем частицами, а также предотвращающих схлопывание альвеол. Механическое растяжение любой ткани нашего организма приводит к активации тех самых внутриклеточных процессов, которые опосредуют действие гормонов и других биологически активных веществ (повышению концентрации Са2+ в цитоплазме, фосфорилированию белков и т.п.), в результате чего стимулируется рост и дифференцировка клеток, синтез белков, секреция гормонов, простагландинов и факторов роста. Подобным образом осуществляется взаимосвязь между системами нейроэндокринной регуляции и механорецепции в нашем организме.
3.3. РЕГУЛЯЦИЯ ОБРАЗОВАНИЯ И РАСПАДА ГОРМОНОВ
В поддержании упорядоченности, согласованности всех физиологических и метаболических процессов у человека участвует более 100 гормонов и нейромедиаторов. Их химическая природа разная - это белки, полипептиды, пептиды, некоторые аминокислоты, производные аминокислот, стероиды, производные жирных кислот, некоторые нуклеотиды, эфиры и т.д. Естественно, что у каждого класса этих веществ пути образования и распада разные. Рассмотрим основные принципы регуляции этого метаболизма.
3.3.1. БЕЛКОВО-ПЕПТИДНЫЕ ГОРМОНЫ
Эти гормоны, как правило, образуются путем процессинга белковых предшественников. Такие белки-предшественники называются прогормонами. Однако обычно сначала синтезируются препрогормоны, из которых образуются прогормоны, а затем уже сами белковые гормоны.
Синтез белковых предшественников гормонов осуществляется на мембранах шероховатого ретикулума эндокринной клетки. Синтез внутриклеточных белков также происходит на этих мембранах, а завершается отщеплением образовавшейся полипептидной цепи в цитоплазму. В случае же секреторных белков образовавшаяся полипептидная цепь должна проникнуть через мембрану во внутренние полости ретикулума. Синтез белка начинается с N-конца, а у многих секретируемых белков первые 20-25 аминокислотных остатков на N-конце являются одинаковыми. Как только произошел синтез этого
сигнального пептида, рибосома вместе с мРНК и синтезирующимся белком прикрепляется к мембране ретикулума, поскольку на мембране есть структуры, узнающие и связывающие эту последовательность, общую для секретируемых белков. Эта общая для секретируемых белков сигнальная последовательность состоит из гидрофобных аминокислотных остатков, поэтому она внедряется в мембрану и по мере синтеза пептидной цепи проникает через мембрану во внутреннее пространство ретикулума. После терминации синтеза препрогормон оказывается внутри ретикулума, после чего от него отщепляется «лишний» N-фрагмент, построенный из 20-25 аминокислотных остатков, и препрогормон становится прогормоном.
Превращение прогормона в гормон осуществляется в мембранах, формирующих аппарат Гольджи. Для того чтобы белковый гормон попал в эти мембраны, эндоплазматический ретикулум формирует специальные везикулы, которые затем отшнуровываются от него и попадают в цитоплазму. Везикулы с прогормоном движутся в цитоплазме за счет энергозависимых процессов, в которых участвуют микротрубочки и микрофиламенты. Попадая на мембраны аппарата Гольджи, эти везикулы сливаются с ними, а прогормон оказывается внутри полостей, окруженных мембранами аппарата Гольджи. Там специфическая протеаза отщепляет от прогормона «лишние» фрагменты. Образующиеся при этом молекулы гормона окружаются мембраной аппарата Гольджи и в виде специальных везикул транспортируются к плазматической мембране. Внутри этих везикул, как правило, содержатся специальные белки и кофакторы, что приводит по мере транспорта этих везикул к их созреванию. Внутри этих везикул завершается модификация молекулы гормона (например, ацетилирование N-конца белка или амидирование его С-конца). После слияния зрелых везикул, содержащих молекулы гормона, с плазматической мембраной происходят их разрыв и выброс гормона и опустошенные везикулы вновь поступают в цитоплазму эндокринной клетки.
Такая последовательность событий установлена для целого ряда белково-пептидных гормонов. Проиллюстрируем ее на примере синтеза и процессинга молекулы инсулина.
Препроинсулин человека, образующийся в результате синтеза на шероховатом ретикулуме β-островков Лангерганса поджелудочной железы, представляет собой одну полипептидную цепь, состоящую из 109 аминокислотных остатков. После завершения синтеза этот пептид оказывается внутри ретикулума. Там от его N-конца отщепляется
гидрофобный фрагмент, состоящий из 23 аминокислотных остатков. В молекуле проинсулина все сульфгидрильные группы замкнуты правильно, т. е. так же, как и в молекуле инсулина. Везикулы с проинсулином переносятся в аппарат Гольджи, и там мембранная протеиназа выщепляет из молекулы проинсулина (1-86) фрагмент 31-65. В результате этого образуется инсулин - 2 цепи А и Б, соединенные между собой S-S-мостиками. Везикулы, которые формирует аппарат Гольджи, захватывают инсулин, выщепленный пептид (31-65), часть проинсулина (около 5% от количества инсулина), Zn2+ (эти ионы с высоким сродством присоединяются к инсулину, изменяют его пространственную структуру и препятствуют растворению). После присоединения инсулиновых гранул к плазматическим мембранам в межклеточное пространство высвобождается весь секрет везикул.
Синтез молекулы проинсулина происходит за 1-2 мин. Транспорт проинсулина от эндоплазматического ретикулума до аппарата Гольджи занимает 10-20 мин. Созревание везикул, несущих инсулин от аппарата Гольджи до плазматической мембраны, протекает в течение 1-2 ч. При действии на β-клетки глюкозы стимулируется главным образом слияние инсулиновых везикул с плазматическими мембранами, что приводит к усиленной секреции, а скорости синтеза, процессинга и внутриклеточного транспорта инсулина практически не изменяются.
От начала синтеза белково-пептидных гормонов до момента появления их в местах секреции проходит 1-3 ч. Регуляция уровня этих гормонов в крови реализуется не путем изменения скорости синтеза или внутриклеточного транспорта, а путем активации или ингибирования их секреции. Большое количество этих гормонов запасено в секреторных гранулах. Регуляторный сигнал, поступающий в эндокринную железу, вызывает опустошение части этих гранул, в результате чего концентрация гормона в крови может быстро и значительно повышаться.
Концентрация белково-пептидных гормонов в крови обычно составляет 10-10-10-11 М. При стимуляции эндокринной железы концентрация соответствующего гормона возрастает в 2-5 раз. Так, например, в состоянии покоя в крови человека содержится около 0,2 мкг АКТГ (в расчете на 5 л крови), а при стрессе это количество возрастает до 0,8-1,0 мкг. В нормальных условиях в крови содержится 0,15 мкг глюкагона и 5 мкг инсулина. Когда человек голоден, содержание глюкагона может повышаться до 1 мкг, а содержание
инсулина - снижаться на 40-60%. После сытного обеда концентрация глюкагона в крови в 1,5-2,8 раза снижается, а содержание инсулина повышается до 10-25 мкг.
Полупериод жизни белково-пептидных гормонов в крови составляет 10-20 мин. Они разрушаются протеиназами клеток-мишеней, крови, печени, почек. Возможна инактивация гормона и в самой эндокринной железе.
Помимо протеиназ, инактивировать гормоны могут и другие ферменты, модифицирующие структуру белковой или пептидной молекулы. Так, например, нативная молекула инсулина не подвергается протеолизу. Первым этапом в инактивации инсулина является действие трансдегидрогеназы, которая катализирует реакцию восстановления сульфгидридных групп в молекуле инсулина. Свободные цепи инсулина становятся доступными для протеолиза и разрушаются инсулиназой, протеиназой, расположенной на мембранах клеток-мишеней и обладающей специфичностью и высоким сродством к инсулину.
3.3.2. СТЕРОИДНЫЕ ГОРМОНЫ
Эти гормоны являются производными циклопентанпергидро-фенантрена. Образуются из холестерина в коре надпочечников (кортикостероиды), а также в семенниках и яичниках (половые стероиды). Минорные количества половых стероидов могут образовываться в коре надпочечников, а кортикостероидов - в гонадах. Тип стероидного гормона, который образуется в той или иной ткани, определяется соотношением активности ферментов, катализирующих альтернативные пути его синтеза.
Большая часть холестерина, который используется для синтеза стероидных гормонов, поступает в эндокринные клетки из плазмы, где он связан преимущественно с ЛПНП. Около 30-40% холестерина, потребляемого на синтез гормонов, - это эндогенный холестерин, который образуется в эндокринных клетках и запасается в липидных каплях (рис. 3.6). И эндогенный, и экзогенный холестерин находятся в этерифицированной форме в виде эфиров с ненасыщенными жирными кислотами, поэтому первым этапом синтеза стероидных гормонов является отщепление жирной кислоты. Эту реакцию катализируют холестеринэстеразы.
Свободный холестерин поступает в митохондрии и там превращается в прегненолон. В этом превращении участвуют цитохром Р450 (оксидаза со смешанным типом действия), десмолаза и другие ферменты. Лимитирующей стадией синтеза прегненолона является
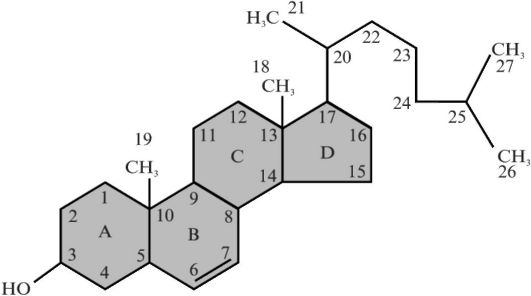 Рис. 3.6. Структурная формула холестерина
Рис. 3.6. Структурная формула холестерина
гидроксилирование боковой цепи холестерина. Характерно, что прегненолон оказывает ингибирующее влияние на этот процесс.
Образовавшийся прегненолон покидает митохондрии и попадает в эндоплазматический ретикулум. Βсе дальнейшие реакции образования стероидных гормонов протекают на мембранах ретикулума или в цитоплазме.
Β коре надпочечников синтез стероидных гормонов стимулируется АКТГ, а в половых железах - лютеинизирующим гормоном (ЛГ) (рис. 3.7). Эти гормоны активируют транспорт эфиров холестерина, а также расщепление эфирной связи. Оба тропных гормона ускоряют также гидроксилирование ациклической части молекулы холестерина и ее последующее отщепление, т. е. активируют митохондриальные ферменты, участвующие в образовании прегненолона. Кроме того, тропные гормоны активируют процессы окисления сахаров и жирных кислот в эндокринных клетках, что обеспечивает процессы стероидогенеза энергией и пластическим материалом. Так, например, АКТГ стимулирует фосфорилазу, глюкозо-6-фосфатдегидрогеназу, изоцитратдегидрогеназу и малатдегидрогеназу. Β результате этого в коре надпочечников накапливается НАДФН, необходимый для гидроксилирования стероидов.
Молекулярные механизмы действия АКТГ и ЛГ на синтез стероидных гормонов связаны с образованием цАМФ и последующими реакциями цАМФ-зависимого фосфорилирования. С помощью этого механизма стимулируется транспорт холестерина, активируются эстераза эфиров холестерина, триглицеридлипаза и фосфорилаза.
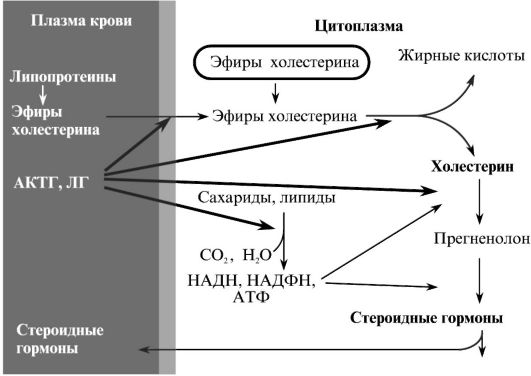 Рис. 3.7. Регуляция и компартментализация в клетке процессов биосинтеза стероидных гормонов
Рис. 3.7. Регуляция и компартментализация в клетке процессов биосинтеза стероидных гормонов
В надпочечниках образуется около 30 стероидов. Большая часть из них, по-видимому, является прогормонами. Так, например, дезоксикортикостерон оказывает то же действие, что и альдостерон, но он в 25-30 раз менее активен.
Кортикостероиды - это С21-стероиды, имеющие в кольце А двойную связь, ОН-группу в положении 21 и две кетогруппы (положения 3 и 20) (рис. 3.8). Они подразделяются на две группы. Глюкокортикоиды (типичный представитель - кортизол) индуцируют синтез ферментов глюконеогенеза в печени, препятствуют поглощению глюкозы мышцами и жировыми клетками, а также способствуют высвобождению из мышц молочной кислоты и аминокислот, тем самым ускоряя также глюконеогенез в печени. Минералокортикоиды (типичный представитель - альдостерон) задерживают Na+ в крови. Снижение концентрации Na+ в секретах слюнных и потовых желез, а также в первичной моче приводит к меньшим потерям воды, так как вода движется через биологические мембраны в направлении высокой концентрации солей. В результате этого минералокортикоиды повышают кровяное давление.
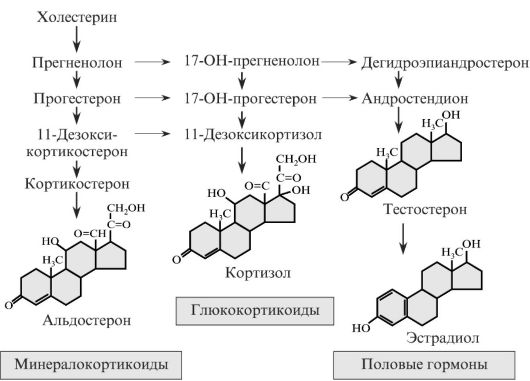 Рис. 3.8. Основные пути биосинтеза минералокортикоидов, глюкокортикоидов и половых гормонов в коре надпочечников
Рис. 3.8. Основные пути биосинтеза минералокортикоидов, глюкокортикоидов и половых гормонов в коре надпочечников
Стимуляция синтеза глюкокортикоидов осуществляется через систему гипоталамус-гипофиз-надпочечники. Факторы стресса (эмоциональное возбуждение, боль, холод и т.п.), тироксин, адреналин и инсулин стимулируют секрецию кортиколиберина из аксонов гипоталамуса, этот гормон связывается с мембранными рецепторами аденогипофиза и вызывает секрецию АКТГ. Кортикотропин с током крови попадает в надпочечники и, связываясь там с мембранными рецепторами, стимулирует образование глюкокортикоидов и гормонов, вызывающих перераспределение энергетических ресурсов между тканями и повышающих устойчивость организма к неблагоприятным воздействиям.
На синтез минералокортикоидов АКТГ влияет слабо. Синтез минералокортикоидов имеет дополнительный механизм регуляции, осуществляющийся через так называемую ренин-ангиотензинную систему. Анализаторы, реагирующие на давление крови, локализованы в афферентных артериолах почек. При снижении давления крови они вызывают секрецию ренина - специфической эндопротеазы
с молекулярной массой 40000 Д. Эта протеаза отщепляет от α2-глобулина крови С-концевой декапептид Асп-Арг-Вал-Тир-Иле-Гис- Про-Фен-Гис-Лей, который называют ангиотензин I. Затем от С-конца этого пептида ангиотен-зинпревращающий фермент, который локализован на наружной стороне эндотелиальных клеток, отщепляет два аминокислотных остатка и образуется октапептид ангиотензин II. Это гормон, который имеет специальные рецепторы на мембране клеток сосудов и коры надпочечников. Связываясь с этими рецепторами, ангиотензин II активирует фосфоинозитидный обмен и тем самым стимулируется вход Са2+ в клетки. В результате этого активируется превращение кортикостерона или 11-дезоксикор- тикостерона в альдостерон. Образовавшийся альдостерон действует на дистальные канальцы почек, потовые и слюнные железы, а также слизистую оболочку кишечника и увеличивает в них реабсорбцию Na+, Cl- и НСО-3. При этом в крови повышается концентрация Na+ и С1- и снижается концентрация К+. Эти эффекты альдостерона полностью блокируются ингибиторами синтеза белка. Отметим также, что, кроме ангиотензина II и АКТГ, синтез и секрецию альдостерона стимулируют также гормон роста и ионы К+ в плазме крови.
Андрогены - мужские половые гормоны - являются С19-стероидами, которые продуцируются интерстициальными клетками семенников и в меньших количествах яичниками и корой надпочечников. Основным андрогеном является тестостерон. Этот гормон может претерпевать изменения в клетке-мишени - превращаться в дигидротестостерон, который обладает большей активностью, чем тестостерон. Интересно, что ЛГ, который стимулирует начальные этапы биосинтеза стероидов в эндокринной железе, активирует также превращение тестостерона в дигидротестостерон в клетке-мишени, тем самым усиливая андрогенные эффекты.
Эстрогены, или женские половые гормоны, в организме человека в основном представлены эстрадиолом. Это С18-стероиды с ароматизированным А-кольцом и ОН-группой в положении 3. В клетках-мишенях они, по-видимому, не метаболизируют.
Действие андрогенов и эстрогенов направлено в основном на органы воспроизведения, проявление вторичных половых признаков, поведенческие реакции. Андрогенам свойственны также метаболические эффекты - усиление синтеза белка в мышцах, печени и почках. Эстрогены оказывают катаболическое влияние на скелетные мышцы, но стимулируют синтез белка в сердце и печени. Половые гормоны
могут влиять на активность ключевых ферментов редупликации ДНК, поэтому им свойственны митогенные эффекты. Основные эффекты половых гормонов опосредуются процессами индукции и репрессии синтеза белка.
Стероидные гормоны влияют на общую нейроэндокринную регуляцию в организме. Поскольку рецепторы стероидов есть во многих отделах мозга, изменение уровня этих гормонов в крови сказывается на функции ЦНС, работе гипоталамо-гипофизарной системы (например, глюкокортикоиды тормозят секрецию тироксина, действуя на гипоталамус). Эстрогены индуцируют образование рецепторов прогестинов в эпителиальных клетках, рецепторов окситоцина в матке. Глюкокортикоиды усиливают чувствительность жировых клеток и сердца к катехоламинам (пермиссивный эффект).
Как уже отмечалось, мембрана эндокринной клетки не чинит препятствия стероидным гормонам, поэтому их секреция происходит параллельно с синтезом. Содержание стероидов в крови определяется соотношением скоростей их синтеза и распада. Регуляция этого содержания осуществляется главным образом путем изменения скорости синтеза. Тропные гормоны (АКТГ, ЛГ) и ангиотензин стимулируют этот синтез. Устранение тропного влияния приводит к торможению синтеза гормонов.
В крови человека около 500 мкг кортизола. При стрессе его содержание повышается до 2000 мкг. Альдостерона в 1000 раз меньше - около 0,5 мкг. Если человек находится на бессолевой диете, содержание альдостерона повышается до 2 мкг. У мужчин содержание тестостерона (20-40 мкг) больше, чем у женщин (2-4 мкг). Содержание же эстрадиола у женщин (0,25-2,5 мкг, при беременности 50-100 мкг) большее, чем у мужчин (0,1-0,2 мкг). Следует отметить, что 90-95% стероидных гормонов в крови обычно находится в связанном состоянии с белками плазмы. Действующие концентрации стероидных гормонов 10-8-10-10 М. Полупериод их жизни в крови человека равен 0,5-1,5 ч.
Распад стероидных гормонов может происходить во многих тканях: печени, почках, кишечнике, мышцах и др. Инактивация начинается с восстановления двойной связи в кольце А и гидроксилирования. У эстрогенов, имеющих ароматическое А-кольцо, восстановления двойных связей не происходит. Гормон инактивируется путем гидроксилирования и метоксилирования. Все эти модификации не только лишают молекулу биологической активности, но и повышают ее гидрофильность. Это имеет важное значение для экскреции метаболитов почками.
Дальнейшее присоединение к инактивированным гормонам сульфата, фосфата, глюкуроновой кислоты и глутатиона делает молекулы еще более гидрофильными и тем самым ускоряет их удаление из организма.
3.3.3. ТИРЕОИДНЫЕ ГОРМОНЫ
Синтез этих гормонов протекает в щитовидной железе, для которой характерно высокое содержание ионов йода. Йодид химически инертен, окисление его в щитовидной железе происходит при участии пероксидазы. Образующийся йодиниум - ион I+ - присоединяется к фенольному кольцу тирозила или к имидазольному кольцу гистидила, входящих в состав белков. В щитовидной железе йодируется главным образом тиреоглобулин - тетрамерный белок, имеющий молекулярную массу 660000 Д и содержащий около 120 тирозилов. Йодирование тирозиловых остатков происходит при участии Н2О2 и завершается образованием монойодтирозилов и дийодтирозилов. После этого происходит внутримолекулярная перегруппировка - сшивка двух йодированных тирозилов. Эта окислительная реакция также протекает с участием пероксидазы и завершается образованием в составе тиреоглобулина трийодтиронина и тироксина. Для того чтобы эти гормоны освободились из связи с белком, должен произойти протеолиз тиреоглобулина. При расщеплении одной молекулы этого белка, построенной более чем из 5000 аминокислот и 300 углеводов, образуется всего 2-5 молекул тироксина (Т4) (рис. 3.9) и трийодтиронина (Т3). Т4 и Т3 секретируются в кровь в молярном соотношении, соответственно равном 4:1.
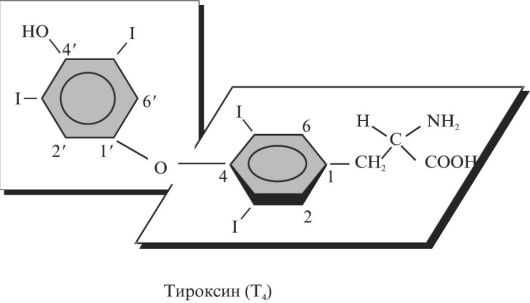 Рис. 3.9. Структурная формула тироксина
Рис. 3.9. Структурная формула тироксина
Синтез и секреция тиреоидных гормонов находятся под контролем гипоталамо-гипофизарной системы. Тиролиберин, секретируемый гипоталамусом, связывается с рецепторами аденогипофиза и вызывает секрецию тиреотропного гормона - белка с молекулярной массой 28 000 Д, построенного из двух субъединиц и содержащего 22 остатка цистеина. Как и у других секретируемых белков, у тиреотропного гормона все SH-группы окислены - они образуют 11 S-S-мостиков, стабилизирующих молекулу белка. Тиреотропный гормон активирует аденилат-циклазу щитовидной железы, и именно этим, по-видимому, объясняется его стимулирующее действие на синтез и секрецию Т3 и Т4. Адреналин и простагландин Е2 также могут повышать концентрацию цАМФ в щитовидной железе, при этом они вызывают такие же эффекты, как и тиротропин.
Активный транспорт ионов йода в железу происходит против 500-кратного градиента. Он ускоряется путем цАМФ-зависимого фосфорилирования клеточных мембран щитовидной железы. Под действием тиреотропина стимулируется также синтез рибосомальной РНК и мРНК тиреоглобулина, т. е. происходит усиление как транскрипции, так и трансляции белка, служащего источником тирозинов для синтеза Т3 и Т4. Тиреотропин стимулирует также рост эпителиальных клеток щитовидной железы. Эти клетки формируют фолликул, в полости которого (бесклеточная среда, заполненная коллоидом, основной частью которого является тиреоглобулин) происходит йодирование тирозилов.
Секреция Т3 и Т4 идет путем пиноцитоза. При этом на апикальной стороне эндотелиальных клеток происходит захват частичек коллоида (вместе с йодированным тиреоглобулином). Эти частички окружаются мембраной эпителиальной клетки и поступают в цитоплазму в виде пиноцитозных пузырьков. При слиянии пузырьков с лизосомами эпителиальной клетки тиреоглобулин расщепляется, а Т3 и Т4 через базальную мембрану секретируются в кровь и лимфу. Вместе с Т3 и Т4 могут секретироваться моно- и дийодтирозины. Они быстро дейодируются и вновь поступают в фолликул.
Тиреотропный гормон и другие факторы, повышающие концентрацию цАМФ в щитовидной железе, стимулируют пиноцитоз коллоида, процесс образования и движения пиноцитозных пузырьков. Таким образом, тиреотропин ускоряет не только биосинтез, но и секрецию Т3 и Т4.
При повышении в крови концентрации Т3 и Т4 подавляется секреция тиреолиберина и тиреотропного гормона. Кроме того, тиреотропные гормоны повышают в плазме крови концентрацию протеиназ, расщепляющих тиролиберин.
Ретроингибирование, наблюдающееся в процессах биосинтеза тиреоидных гормонов, может сказываться и на других гормональных системах организма, так как тиреолиберин стимулирует секрецию не только тиреотропного гормона, но и гормона роста, а кроме того, вызывает так называемые поведенческие эффекты. Обратная связь в биосинтезе тиреоидных гормонов может замыкаться также за счет того, что Т4 тормозит синтез тиреоглобулина.
Тиреоидные гормоны являются долгожителями среди всех гормонов и нейромедиаторов. Они могут циркулировать в крови в неизменном виде в течение нескольких дней. Такая устойчивость гормонов объясняется, по-видимому, образованием прочной связи с Т4-связывающими глобулинами и преальбуминами в плазме крови. Эти белки имеют в 10-100 раз большее сродство к Т4, чем к Т3, поэтому в крови человека содержится 300-500 мкг Т4 и лишь 6-12 мкг Т3.
Инактивация тиреоидных гормонов. Наиболее уязвимыми в молекулах Т3 и Т4 являются атомы йода в положениях 3' и 5'. Их отщепление приводит к потере биологической активности гормона. Дейодирование наружного кольца тироксина, частично происходящее в щитовидной железе, полностью завершается в печени и приводит к формированию Т3. Внутреннее кольцо тироксина дейодируется преимущественно в печени и частично в щитовидной железе и почках; в результате образуется так называемый реверсивный (обратный) Т3, имеющий незначительную физиологическую активность.
Тиронин и йодтиронин могут подвергаться также декарбоксилированию, дезаминированию и переаминированию. В печени и почках могут образовываться конъюгаты тиронина с глюкуроновой кислотой или сульфатом, после чего конъюгат экскретируется.
3.3.4. КАТЕХОЛАМИНЫ
Источником катехоламинов, как и тиреоидных гормонов, служит тирозин, однако в случае биосинтеза катехоламинов метаболизму подвергается свободная аминокислота, а не тирозин белка (рис. 3.10). Образование катехоламинов происходит через стадии окисления, декарбоксилирования и метилирования молекулы. Синтез катехоламинов происходит в аксонах нервных клеток, запасание - в специальных
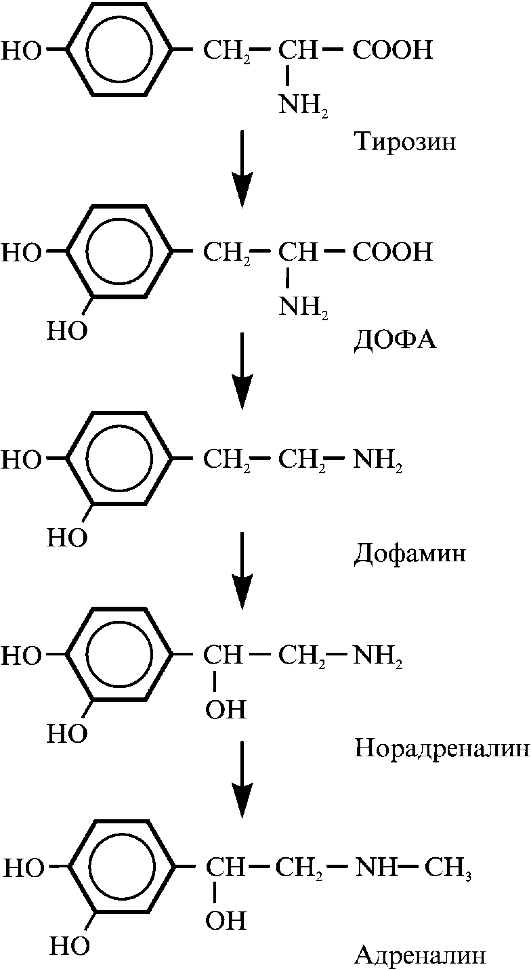 Рис. 3.10. Биосинтез катехоламинов в мозговом слое надпочечников. ДОФА - диоксифенилаланин
Рис. 3.10. Биосинтез катехоламинов в мозговом слое надпочечников. ДОФА - диоксифенилаланин
везикулах. Катехоламины, образующиеся в мозговом слое надпочечников, секретируются в кровь, а не в синаптическую щель, т.е. являются типичными гормонами.
Синтез катехоламинов в гипоталамусе заканчивается образованием и накоплением в везикулах дофамина. Адреналин и норадреналин образуются этими клетками в минорных количествах. Предполагается, что пролактостатином, т. е. гормоном гипоталамуса, подавляющим секрецию пролактина, является дофамин. Известны
и другие структуры мозга (например, стриарная система), которые находятся под влиянием дофамина и нечувствительны, например, к адреналину.
В симпатических нервных волокнах дофамин не накапливается, а быстро превращается в норадреналин, который хранится в синаптических пузырьках. Адреналина в этих волокнах значительно меньше, чем норадреналина.
В мозговом слое надпочечников биосинтез завершается образованием адреналина. Норадреналина образуется в 4-6 раз меньше, а дофамин сохраняется лишь в следовых количествах.
Превращение тирозина в диоксифенилаланин (ДОФА), а затем в дофамин протекает в цитоплазме. Дофамин проникает в специальные везикулы, и если в них есть соответствующий фермент (дофамин-β-оксидаза) и кофакторы, то дофамин превращается в норадреналин. Норадреналин может секретироваться из этой везикулы во внеклеточное пространство или же выходить из нее в цитоплазму нервной клетки и там под действием метилазы превращаться в адреналин. Адреналин из цитоплазмы поступает в специальные везикулы на плазматической мембране, а затем из них секретируется.
В везикулах, запасающих катехоламины, содержатся также специальный катехоламинсвязывающий белок и АТФ. Секреция сопровождается выбросом в кровь или в синаптическую щель как катехоламинов, так и АТФ и связывающего белка.
Синтез катехоламинов в мозговом слое надпочечников стимулируется нервными импульсами, поступающими по чревному нерву. Выделяющийся в синапсах ацетилхолин взаимодействует с холинергическими рецепторами никотинового типа и возбуждает нейросекреторную клетку надпочечника.
Наиболее медленной стадией в биосинтезе катехоламинов является первый этап - превращение тирозина в ДОФА. Эту реакцию катализирует тирозингидроксилаза - фермент, который активируется при холинергической стимуляции клетки. Благодаря существованию нервно-рефлекторных связей надпочечники отвечают усилением синтеза и секреции катехоламинов в ответ на болевые и эмоциональные раздражители, гипоксию, мышечную нагрузку, охлаждение и т.п. Существуют и гуморальные пути регуляции активности клеток мозгового вещества надпочечников. Синтез и секреция катехоламинов могут повышаться также под действием инсулина, глюкокортикоидов, при гипогликемии.
Катехоламины подавляют как собственный синтез, так и секрецию. Адреналин является мощным ингибитором метилазы, катализирующей превращение норадреналина в адреналин.
Активируя аденилатциклазу нейросекреторной клетки, катехоламины могут вызывать цАМФ-зависимое фосфорилирование тирозингидроксилазы, в результате чего активность начального фермента в процессе биосинтеза катехоламинов резко снижается. В адренергических синапсах на пресинаптической мембране есть α-адренергические рецепторы. При выбросе катехоламинов в синапс эти рецепторы активируются и начинают оказывать ингибирующее влияние на секрецию катехоламинов. Аутоингибирование секреции свойственно, по-видимому, всем тканям, секретирующим эти гормоны или нейромедиаторы.
В отличие от холинергических синапсов, постсинаптическая мембрана которых содержит как рецепторы, так и ацетилхолинэстеразу, разрушающую ацетилхолин, в адренергических синапсах нет ферментов, разрушающих медиатор. Удаление из синапсов катехоламинов происходит путем обратного захвата медиатора нервным окончанием. Это активный транспорт, происходящий с большой скоростью и имеющий высокую избирательность. Поступающие в нервное окончание из синапса катехоламины вновь концентрируются в специальных везикулах и могут повторно участвовать в синаптической передаче.
Определенные количества катехоламинов могут диффундировать из синапсов в межклеточное пространство, а затем в кровь. Поэтому содержание норадреналина в крови может быть большим, чем содержание адреналина, несмотря на то что мозговое вещество надпочечников секретирует в кровь адреналин, а норадреналин секретируется в синапсах. Суммарное содержание катехоламинов в крови человека равно 1,5-2,5 мкг. При стрессе оно повышается в 4-8 раз. Период полужизни катехоламинов в крови равен 1-3 мин.
Гематоэнцефалический барьер не пропускает катехоламины из крови в мозг. В то же время ДОФА - предшественник катехоламинов - легко проникает через этот барьер и может усилить образование катехоламинов в мозге.
Инактивация катехоламинов. Катехоламины могут инактивироваться в тканях-мишенях, а также в печени и почках. Решающее значение в этом процессе играют два фермента - моноаминооксидаза, расположенная на мембране митохондрий, и цитозольный фермент катехол-О-метилтрансфераза. Моноаминооксидаза вызывает окислительное дезаминирование не только катехоламинов, но и
гистамина, тирамина, серотонина и др. Катехол-О-метилтрансфераза катализирует оксиметилирование катехольного кольца. После этого катехоламины утрачивают биологическую активность и экскретируются. Минорные количества катехоламинов экскретируются в виде сульфопроизводных и глюкуронидов.
3.3.5. ПРОСТАГЛАНДИНЫ
Простагландины образуются из ненасыщенных жирных кислот. Количество ненасыщенных связей в молекуле простагландинов обозначают цифрой, стоящей справа внизу от названия: ПГ1, ПГ2, ПГ3. Их подразделяют также на группы: А - ненасыщенные кетоны, Е - оксикетоны, F - 1,3-диолы.
Биосинтез простагландинов начинается с отщепления арахидоновой кислоты от мембранного фосфолипида или диацилглицерина. Эту реакцию катализирует фосфолипаза А2, липаза моноацилглицерина или липаза триглицеридов.
Циклооксигеназа при участии О2 преобразует арахидоновую кислоту в эндоперекись, из которой образуется целое семейство простагландинов (рис. 3.11).
Эндоперекиси, образующиеся в процессе биосинтеза простагландинов, обладают высокой биологической активностью в опытах in vitro, но едва ли влияют на клетки in vivo, так как очень неустойчивы - период их полужизни равен менее 1 с. Простагландин-синтетазный комплекс представляет собой полиферментную систему, функционирующую на мембранах эндоплазматического ретикулума. Образующиеся простагландины проникают в плазматическую мембрану клетки. Они могут выходить из клетки и через межклеточное пространство переноситься на соседние клетки или проникать в кровь и лимфу.
Лимитирующим этапом в биосинтезе простагландинов является высвобождение арахидоновой кислоты, которое происходит при повышении в цитоплазме клетки ионов Са2+ или цАМФ. Благодаря этому все гормоны и нейромедиаторы, активирующие аденилатциклазу или повышающие концентрацию Са2+ в клетке, могут стимулировать синтез простагландинов. Другой причиной образования простагландинов под действием многих гормонов и факторов роста является то, что эти биологически активные вещества стимулируют образование диацилглицерина - источника арахидоновой кислоты.
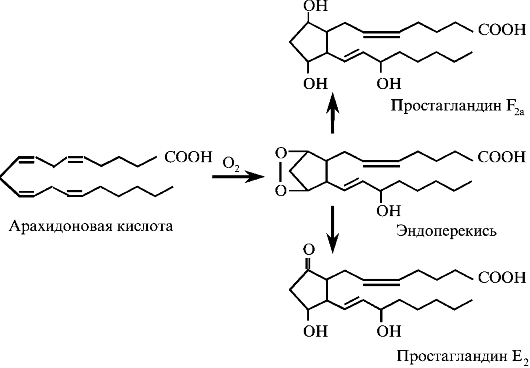 Рис. 3.11. Основные пути образования простагландинов из арахидоновой кислоты
Рис. 3.11. Основные пути образования простагландинов из арахидоновой кислоты
В семенниках и яичниках, где синтез простагландинов наиболее интенсивен, используется арахидоновая кислота, отщепляемая не только от фосфолипидов, но и от этерифицированного холестерина. В этих тканях лютеинизирующий гормон путем повышения концентрации цАМФ стимулирует холестеринэстеразу и холестеринацилтрансферазу, в результате чего образуются свободный холестерин, поступающий в стероидогенез, и арахидоновая кислота - источник простагландинов.
Простагландины группы Е могут активировать аденилатциклазу, аF - увеличивать проницаемость мембран для Са2+. Поскольку цАМФ и Са2+ стимулируют синтез простагландинов, замыкается положительная обратная связь в специфических регуляторов.
Во многих тканях кортизол тормозит высвобождение арахидоновой кислоты, тем самым подавляя образование простагландинов. Именно этим принято объяснять противовоспалительное действие глюкокортикоидов. Простагландин Е1 является мощным пирогеном. Подавлением синтеза этого простагландина объясняют терапевтическое действие аспирина, который ингибирует циклооксигеназу, вызывая ее ацетилирование.
Период полужизни простагландинов составляет 1-20 с. У человека и большинства млекопитающих основной путь инактивации простагландинов - это окисление 15-гидроксигруппы до соответствующего кетона. Данную реакцию катализирует 15-гидрокси-простагландин- дегидрогеназа - фермент, который есть практически во всех тканях, но в наибольшем количестве содержится в легких. Окисление ОНгруппы в положении 15 приводит к инактивации молекулы, поэтому кровь, прошедшая через легкие, полностью лишена биологически активных простагландинов.
Дальнейшая деградация простагландинов происходит путем восстановления двойной связи (в положении 13-14), β-окисления СООН-конца и ω-окисления СН3-конца молекулы. После этого образуется 16-углеродная дикарбоновая кислота, которая выводится из организма.
3.4. СЕКРЕЦИЯ И МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ДЕЙСТВИЯ ГОРМОНОВ
Благодаря своей липофильности стероидные гормоны не накапливаются в эндокринных клетках, а легко проходят через мембрану и поступают в кровь и лимфу. Поэтому регуляция содержания этих гормонов в крови осуществляется путем изменения скорости их биосинтеза.
Тиреоидные гормоны также липофильны и также легко проходят через мембрану, однако они ковалентно связаны в эндокринной железе с тиреоглобулином, поэтому могут секретироваться только после нарушения этой связи. Чем больше йодированных тиронилов в составе тиреоглобулина и чем выше скорость протеолиза йодированного белка, тем больше будет тиреоидных гормонов в крови. Регуляция содержания тиреоидных гормонов осуществляется двумя путями - ускорением как процессов йодирования, так и разрушения тироглобулина.
Гормоны, имеющие белковую и пептидную природу, а также катехоламины, гистамин, серотонин и т. п. - это гидрофильныевещества, которые не могут диффундировать через мембрану. Для секреции этих молекул созданы специальные механизмы, чаще всего пространственно и функционально разобщенные с процессами биосинтеза.
Многие белково-пептидные гормоны образуются из предшественников большей молекулярной массы, и секреция этих гормонов
становится возможной только после того, как произойдет отщепление «лишнего» фрагмента. Так, секреции инсулина предшествует превращение в β-клетках препроинсулина в проинсулин, а затем в инсулин. Существование прогормонов защищает эндокринную железу от местного действия гормона, а также обеспечивает его внутриклеточный транспорт. По мере превращения препрогормона в гормон обычно возрастает гидрофильность молекулы.
Последовательная модификация белка приводит к тому, что из эндоплазматического ретикулума он переходит в цистерны аппарата Гольджи, а затем в специальные везикулы на плазматической мембране. В везикулах завершается синтез молекулы гормона, мембрана везикулы защищает гормон от инактивации, но главный выигрыш, который дает такой способ запасания гормона, - это возможность одновременного выброса в кровь большого количества регулятора. Биосинтез некоторых белково-пептидных гормонов, а также их транспорт к периферии секреторной клетки занимает обычно 1-3 ч. Очевидно, что воздействие на биосинтез приведет к изменению уровня гормона в крови лишь через несколько часов. Влияние же различных факторов на секрецию этих гормонов, синтезированных впрок и запасенных в специальных везикулах, позволяет повышать их концентрацию в несколько раз за секунды или минуты. В случае нейромедиаторов (норадреналин, дофамин, глутаминовая кислота, -аминомасляная кислота, глицин и нейропептиды) влияние тех же факторов на их секрецию позволяет осуществляться физиологическому эффекту этих регуляторов спустя доли миллисекунды или несколько миллисекунд.
Нейромедиаторы, вызывающие появление потенциала действия на клетке, синтезируются в нервных окончаниях и накапливаются в везикулах, окруженных мембраной. Везикула может передвигаться в нервном окончании. Попадая в участок выброса медиатора, везикула разрывается и ее содержимое изливается в синаптическую щель. Нейромедиатор диффундирует через эту щель, связывается с рецептором на постсинаптической мембране, а активированный рецептор вызывает ток ионов через мембрану. Содержимое одного синаптического пузырька мало (несколько тысяч молекул медиатора).
Такое количество нейромедиатора может активировать лишь малую долю синаптических рецепторов. Поэтому разрыв одной везикулы приводит к изменению мембранного потенциала на величину порядка 0,5 мВ. Это изменение заряда называют миниатюрным
потенциалом. Он не распространяется далее синапса и не приводит к каким-либо физиологическим эффектам, хотя играет важную роль в поддержании синаптических структур в состоянии готовности к восприятию и проведению возбуждающего сигнала. Частота возникновения миниатюрных потенциалов (в среднем один раз в секунду) полностью определяется частотой разрыва синаптических везикул.
Нейромедиаторы выделяются квантами по нескольку тысяч молекул. Нервный импульс не изменяет величину квантов медиатора, но повышает частоту их выделения. Когда возбуждающий потенциал приходит в нервное окончание, за 1 мс в синапс изливается содержимое 200-400 везикул. Следовательно, при возбуждении частота миниатюрных потенциалов возрастает в 200 000-400 000 раз. При этом в тысячи раз большее число молекул нейромедиатора достигает постсинаптической мембраны, поэтому все (или почти все) рецепторы переходят в активированное состояние. Открывается большое число каналов для входа в клетку Na+ или выхода из клетки К+ и С1 , в результате чего на постсинаптической мембране либо возникает потенциал действия, либо развивается гиперполяризация. Так химическим путем осуществляется передача электрического заряда с нервной клетки на иннервируемую. Решающее значение в этом, как и в других секреторных процессах, играет Са2+. Появление потенциала действия на нервном окончании приводит к входу Са2+ в аксоплазму, в результате чего стимулируется секреция нейромедиатора. Зависимость выброса медиатора от концентрации Са2+ - кооперативный процесс с коэффициентом Хилла, равным 3-4.
Вместе с гормоном или нейромедиатором из везикулы выбрасываются и другие вещества, которые могут влиять на проведение регуляторного сигнала. В случае секреции катехоламинов это специальные связывающие белки, АТФ и РНК, в случае инсулина - ионы Zn2+. Опустошенные везикулы не разрушаются. Они реконструируются и вновь возвращаются к месту синтеза гормона.
Ионы Са2+ необходимы и для секреции гормонов гипофиза. Известно также, что в отсутствие Са2+ не происходит выброса нейромедиаторов (ацетилхолина и норадреналина) из нервных окончаний. Устранение Na+ и К+ из перфузируемых растворов мало влияет на секреторную активность эндокринных и экзокринных желез, а устранение Са2+ полностью блокирует их функции. Следовательно, для секреции гормонов и нейромедиаторов важна не собственно деполяризация мембраны, а происходящий при ней вход Са2+ в цитоплазму клетки.
Поступив в кровь, гормоны связываются с транспортными белками. Это название, закрепившееся за специфическими белками крови, нельзя понимать буквально. Белки крови связывают молекулы гормона, тем самым защищая их от разрушения и экскреции. В связанной форме гормон с током крови переносится от места секреции к клеткам-мишеням. В этих клетках есть рецепторы, которые имеют большее сродство к гормону, чем белки крови. Однако, находясь в комплексе с белками крови, гормон не может взаимодействовать с рецептором.
Связывание с белками крови приводит к забуфериванию гормонов. Лишь свободные молекулы гормона могут взаимодействовать с рецептором. Однако как только они свяжутся с рецептором, равновесие в реакции взаимодействия гормона с транспортными белками сдвинется в сторону распада комплекса и концентрация свободных молекул гормона останется практически неизменной. При избытке гормонсвязывающих белков в крови концентрация свободных молекул гормона может снизится до критической величины.
Связывание гормонов в крови зависит от их сродства к связывающим белкам и концентрации этих белков. У специфических гормонсвязывающих белков крови константа диссоциации для гормонов равна 10-7-10-9 М. К числу таких белков относятся транскортин, связывающий кортикостероиды, тестостерон-эстрогенсвязывающий глобулин, тироксинсвязывающий глобулин, тироксинсвязывающий преальбумин и т. д. Едва ли не все гормоны могут связываться с альбумином, концентрация которого в крови в 1000 раз выше концентрации других гормонсвязывающих белков. Однако сродство к альбумину у гормонов в десятки тысяч раз ниже, поэтому с альбуминами обычно связано 5-10% гормонов, а со специфическими белками - 85-90%. Альдостерон, повидимому, не имеет специфических транспортных белков, поэтому находится преимущественно в связи с альбумином. Лишь 0,5-5,0% молекул гормонов находится в крови в свободном состоянии.
Концентрация гормонсвязывающих белков в крови может зависеть от функционального состояния организма, прежде всего от гуморальных факторов регуляции. Так, например, тиреоидные гормоны индуцируют образование тестостерон-эстрогенсвязывающего глобулина и транскортина.
На отклонение от нормы того или иного процесса жизнедеятельности первой реагирует нервная система регуляции. Нейромедиаторы, изменяя активность ионных каналов (являющихся одновременно рецепторами нейромедиаторов), вызывают гиперили деполяризацию
мембраны. Эта регуляция клеточной активности, происходящая за счет физических процессов (перемещение ионов через мембрану), развивается и гасится за доли секунд.
Если нервная система не в состоянии вернуть тот или иной фактор гомеостаза к норме, подключаются гормоны, действующие через мембранные рецепторы и системы вторичных посредников, которые стимулируют химическую модификацию белков. Наиболее хорошо изучено фосфорилирование, но известны также такие модификации белков, как миристилирование, АДФ-рибозилирование, гликозилирование и др., которые тоже могут находиться под контролем гормонов и изменять каталитическую активность, субклеточную локализацию или продолжительность жизни белков. Регуляция, происходящая за счет химических процессов (синтез и расщепление вторичного посредника, фосфорилирование и дефосфорилирование белка), развивается и гасится за минуты или десятки минут.
Если же отклонения от нормы того или иного процесса достигают опасных для организма величин или же должны произойти морфогенетические изменения организма, подключаются стероидные и тиреоидные гормоны, которые имеют цитозольные или ядерные рецепторы, что позволяет им взаимодействовать с хроматином и влиять на экспрессию генов. Эта регуляция, развивающаяся путем индукции или репрессии синтеза мРНК и белков, реализуется спустя 3-6 ч после появления гормона в крови, а гасится спустя 6-12 ч.
Промежуточное положение в этой иерархии занимают факторы роста, рецепторы которых являются тирозиновыми киназами. Взаимодействие фактора роста с рецептором приводит сначала к фосфорилированию определенных белков по ОН-группам тирозина, а затем к делению клеток. Следует отметить также, что многие нейромедиаторы (ацетилхолин, γ-аминомасляная кислота и др.), диффундируя из синаптической щели (которая всегда сообщается с межклеточным пространством) в кровь, приобретают свойства гормонов, вызывающих фосфорилирование белков.
3.5. НАРУШЕНИЯ ЭНДОКРИННЫХ ФУНКЦИЙ
Для нормального функционирования эндокринной системы ключевыми являются три звена: секреторная железа, рецептор для гормона на поверхности или внутри клетки-мишени и система обратной связи, позволяющая регулировать секрецию гормона в соответствии
с эффективностью влияния этого гормона на ту или иную функцию в организме. Характерной особенностью патофизиологии эндокринной системы является то, что нарушение одного единственного регуляторного звена может приводить к развитию патологии в нескольких органах и тканях. Так, например, сахарный диабет, вызванный нехваткой инсулина в крови, приводит к сердечно-сосудистым заболеваниям, неврологическим и почечным осложнениям, ретинопатии и др.
Эндокринные заболевания могут возникать вследствие стресса, инфекций, плохого кровоснабжения желез, их воспалений или образования опухолей. В основе патогенеза часто лежит наследственный фактор, причем он может реализоваться как через гипотрофию или гипертрофию эндокринных желез, так и через аутоиммунный процесс, а также через дефекты в структуре и нарушения экспрессии гормональных рецепторов, G-белков, протеинкиназ и т. п.
При дефектах эндокринной системы регуляции могут происходить генерализованные нарушения метаболизма и функциональной активности во многих клетках и тканях организма, в том числе в тех, которые не являются мишенями данных эндокринных факторов. Это объясняется прежде всего тем, что функция подавляющего большинства желез внутренней секреции находится под контролем гипоталамуса и гипофиза, которые воспринимают прямые и обратные связи соответственно от ЦНС и эндокринных желез. Кроме того, для эндокринной системы регуляции характерны перекрестное действие разных гормонов на одни и те же физиологические процессы, а также замыкание отрицательных обратных связей в процессах как секреции гормонов, так и внутриклеточного проведения их сигнала.
В целом нарушения эндокринных функций могут проявляться как снижением активности эндокринных желез, так и ее повышением.
3.5.1. ГИПОТАЛАМУС И ГИПОФИЗ
Мозг воспринимает сигналы от всех тканей организма. Это происходит путем возбуждения афферентных (идущих к мозгу) нервных волокон, а также благодаря изменению состава или температуры крови, питающей мозг. Полагают, что все сигналы от органов чувств, а также соматических и висцеральных тканей, поступившие в мозг, анализируются в его высших отделах, после чего мозг направляет распорядительные нервные стимулы в гипоталамус (см. рис. 3.2).
Гормоны гипофиза можно подразделить на три группы: гормон роста и пролактин; гликопротеиновые гормоны - тиреотропный,
лютеинизирующий и ФСГ; АКТГ, эндорфины, энкефалины и родственные им пептиды.
Гормон роста вскоре после рождения человека и вплоть до 20-25 лет стимулирует рост костей, скелетных мышц и внутренних органов. В течение всей жизни человека этот гормон стимулирует клетки иммунной системы. Пролактин вызывает формирование молочных желез и образование в них молока, стимулирует родительский инстинкт. По механизму своего действия оба эти гормона относятся к цитокинам, так как действуют на клетку через типичные цитокиновые рецепторы, стимулирующие тирозиновое фосфорилирование белков.
Тиреотропный, лютеинизирующий и ФСГ имеют сложную четвертичную структуру. Они состоят из α-субъединиц, которые одинаковы у всех трех гормонов, и β-субъединиц, которые у них разные. Влияют гормоны на свои ткани-мишени путем активации в них синтеза цАМФ. Тиреотропный гормон действует на щитовидную железу и стимулирует в ней образование и секрецию тироксина и трийодтиронина. У женщин ФСГ стимулирует созревание фолликулов яичника и синтез в них эстрогенов, а у мужчин усиливает сперматогенез. Другой гонадотропин, лютеинизирующий гормон, стимулирует образование андрогенов в семенниках и яичниках.
Третья группа гормонов (АКТГ, эндорфины, энкефалины и родственные им пептиды) представлена короткими пептидами, способными связываться с рецепторами, которые через G-белки стимулируют фосфоинозитидный обмен, а также К+-каналы и Са2+-каналы в тканях-мишенях. АКТГ взаимодействует с рецепторами в корковом слое надпочечников, вызывая синтез кортизола. Эта регуляция крайне важна для выживания человека в условиях стресса.
Нарушения в гипоталамо-гипофизарной системе могут проявляться как снижением функциональной активности гипофиза (гипопитуитаризм), так и ее повышением (гиперпитуитаризм).
Гипопитуитаризм
Гипопитуитаризм - недостаточность функций гипофиза или гипоталамуса с уменьшением или прекращением продукции одного или нескольких тропных гормонов передней доли. Достаточно редко наблюдается снижение уровня всех гипофизарных гормонов (пангипопитуитаризм, болезнь Симмондса). В случае медленно прогрессирующей деструкции ткани гипофиза сначала формируется недостаточность гормона роста и гонадотропинов, а затем развивается недостаточность тиреотропного гормона, АКТГ и пролактина.
В целом симптомы определяются снижением функции щитовидной железы, надпочечников и гонад. У детей отмечают задержку физического и полового развития.
Гиперпитуитаризм
Гиперпитуитаризм - расстройство функции аденогипофиза, характеризующееся повышением его гормональной активности (как правило, гормонально-активные аденомы гипофиза). В подавляющем числе случаев гиперфункция гипофиза выражается в повышенной секреции только одного из тропинов.
• Подавляющее большинство аденом гипофиза - пролактиномы (в гипофизе 15% женщин присутствуют бессимптомные микропролактиномы), секретирующие повышенное количество пролактина (при этом уровень пролактина в сыворотке превышает 20 нг/мл). У женщин пролактинома проявляется аменореей, галактореей и бесплодием (синдром галактореи-аменореи) вследствие ингибирования повышенным уровнем пролактина подъема секреции ЛГ, необходимого для овуляции. У мужчин пролактинома проявляется галактореей, гинекомастией, снижением либидо и импотенцией вследствие низкого уровня тестостерона. Дети, страдающие пролактиномой, характеризуются задержкой полового развития. 50% таких больных страдают ожирением.
• Гиперфункция клеток, которые секретируют гормон роста, приводит к гигантизму (до завершения остеогенеза) и акромегалии (по завершении окостенения эпифизарных хрящей). Обычно это является следствием потери чувствительности к ингибирующему действиюсоматостатина и не связано с нарушением действия соматолиберина. Уровень соматотропного гормона в крови повышается также при стрессе, голодании и почечной недостаточности.
• Гиперфункция клеток, секретирующих АКТГ (с последующей гиперсекрецией кортикостероидов), обычно проявляется болезнью Кушинга. Для этой патологии характерны гиперпигментация кожных покровов (эффект АКТГ), а также симптомы гиперкортицизма (уменьшение костной и мышечной массы, стрии красно-фиолетового цвета вследствие атрофии кожных покровов, ожирение, артериальная гипертензия, гипергликемия с развитием стероидного диабета, гипокалиемия, а также подавление специфического иммунитета с развитием вторичного дефицита) и гиперандрогении, проявляющиеся снижением гонадотропной функции гипофиза и развитием половых расстройств (аменорея, бесплодие, гирсутизм, акне).
• Образование АКТГ повышено также у больных с адреногенитальным синдромом (врожденный дефект ферментов, участвующих в синтезе кортикостероидов), а также при некоторых формах первичного гиперальдостеронизма и гипертонии. Эти нарушения в синтезе АКТГ являются вторичными, т. е. опосредованы ослаблением действия стероидных гормонов на гипофиз.
• Реже всего отмечают гонадотропные и тиреотропные аденомы. Гонадотропные аденомы (как правило, макроаденомы, т.е. аденомы размером более 1 см) с повышением секреции ФСГ и ЛГ проявляются головными болями, нарушением зрения и приобретенным гипогонадизмом. Наиболее часто их отмечают у мужчин средних лет. Поскольку ЛГ в норме стимулирует продукцию тестостерона яичками, гипогонадизм у мужчин с гонадотропными аденомами кажется парадоксальным. Этот факт обычно объясняют секрецией ЛГ с неадекватной биологической активностью или нарушением самого характера секреции (в норме пульсирующего). Тиреотропные аденомы (повышение секреции тиреотропного гормона) проявляются симптомами гипертиреоза, зобом и очаговой симптоматикой.
Оценка функции
Клинико-биохимическая лабораторная диагностика, как правило, используется, если имеет место избыточная секреция гормонов гипофиза. Простые скрининговые тесты обычно дополняются более сложными динамическими исследованиями. Очень часто используется комбинированный тест исследования функции аденогипофиза. При выполнении теста отдельными шприцами вводят тиреолиберин, гонадолиберин и инсулин. Затем все гормоны определяют на 0-й, 30-й и 60-й минуте, а кортизол и гормон роста - дополнительно на 45-й, 90-й и 120-й минуте. При проведении теста врач должен обязательно запастись глюкозой и гидрокортизоном (для внутривенного введения). Тест опасен в отношении развития инсулининдуцированной гипогликемии, поэтому часто инсулин заменяют соматолиберином и кортиколиберином.
Таким образом, для исследования гипофизарной функции используется комбинированный тиреолиберин-гонадолиберин-соматолиберин-кортиколиберин тест. С некоторыми модификациями этот же тест применим для оценки тиреоидной функции (тироксин) и функции гонад (тестостерон и эстрадиол).
Существующая в организме тесная взаимосвязь между гипоталамо-гипофизарной системой и надпочечниками позволяет оценивать функциональные возможности этой системы по уровню кортизола
в сыворотке и моче. Ниже приведены особенности некоторых клинико-биохимических подходов, позволяющих оценивать активность гипоталамо-гипофизарной системы с точки зрения ее связи с корой надпочечников.
КОРТИЗОЛ СЫВОРОТКИ Измерение уровня кортизола в сыворотке чаще всего проводят радиоиммунологическими методами. Необходимо учитывать, что назначение преднизолона и преднизона пациентам может существенно искажать результаты таких исследований. Время сбора образцов крови для анализов должно быть строго регламентировано, так как для секреции гормона характерны циркадные ритмы с максимумом в 8.00-9.00 и минимумом в 22.00-24.00. Стресс во время взятия крови может повысить уровень кортизола. Интересно, что при синдроме Иценко-Кушинга циркадный ритм секреции кортизола нарушается.
КОРТИЗОЛ МОЧИ
После того как кортизол метаболизировался в печени, его метаболиты, в том числе 17-оксикетостероиды, выводятся с мочой. Лишь небольшое количество неизмененного кортизола выводится с мочой. Уровень выведения кортизола с мочой связан с уровнем свободного кортизола в сыворотке и скоростью адреналовой секреции. Измерение кортизола в 24-часовом сборе мочи является чувствительным тестом избыточной секреции этого гормона. Вместе с тем тест малоинформативен при дифференциации нормальной и сниженной секреции.
УРОВЕНЬ АКТГ В ПЛАЗМЕ Исследование уровня АКТГ в плазме имеет важное значение и для оценки функции надпочечников. Повышение уровня гормона наблюдается при болезни Аддисона как следствие нарушения регуляторного влияния гормонов надпочечников на гипофиз. Снижение уровня АКТГ наблюдается при надпочечниковой недостаточности, связанной с нарушением гипоталамо-гипофизарной функции. Уровень АКТГ также снижается при синдроме Иценко-Кушинга, если последний вызван опухолью надпочечников или приемом экзогенных стероидов.
АЛЬДОСТЕРОН
Определение уровня альдостерона проводится при подозрении на первичный гиперальдостеронизм. В связи с тем что на секрецию альдостерона влияет положение человека, это исследование проводят либо утром после сна, либо после перехода человека из горизонтального
положения в вертикальное. Исследование проводится при следующих условиях: диуретическая и антигипертензивная терапия прекращается за 4-6 нед до анализа; строго контролируется прием натрия; параллельно с уровнем альдостерона измеряется концентрация ренина.
СТЕРОИДЫ В МОЧЕ
С этой целью используются хроматографические методы, преимущественно газожидкостная хроматография, которые позволяют одновременно определять большое число стероидов и их метаболитов. С помощью таких методов удается достаточно точно оценить экскрецию гормонов.
ДИНАМИЧЕСКИЕ ТЕСТЫ
Чувствительность и информативность многих методов определения гормонов в биологических жидкостях зачастую ограничены. Это связано со сложностями в определении небольших функциональных отклонений работы эндокринных желез и многофакторном влиянии на гормональный статус. Для преодоления этих ограничений в клинической практике используют динамические тесты, преимуществом которых является возможность непосредственно определить причину заболевания. К таковым относятся декзаметазонсупрессорный, инсулинотолерантный гипогликемический и АКТГ-стимулирующий тесты.
Дексаметазонсупрессорный тест. Дексаметазон, синтетический аналог кортизола, используется для подавления продукции АКТГ гипофизом. Суть теста заключается в дробном введении дексаметазона при контроле за уровнем кортизола в сыворотке и моче. Ложноположительные результаты крайне редки. Этот тест используется для дифференциальной диагностики гипоталамозависимого синдрома Иценко-Кушинга, так как при опухолях надпочечников или эктопической продукции АКТГ угнетения секреции кортизола не происходит.
Инсулинотолерантный гипогликемический тест. Инсулин, вводимый внутривенно, приводит к развитию у пациента гипогликемии. Характер ответа на такой индуцированный стресс подтверждает или исключает диагноз синдрома Иценко-Кушинга. Тест также применяется для диагностики гипопитуитаризма. Нормальная реакция на введение инсулина свидетельствует об отсутствии нарушений гипоталамо-гипофизарно-адреналовой связи, исключает надпочечниковую недостаточность и нарушение гипоталамических резервов. Это исследование не очень удобно, поскольку связано с риском развития гипогликемии.
АКТГ-стимулирующий тест. Вводят синтетический аналог АКТГ, обладающий адекватной биологической активностью и меньшей аллергенностью, при одновременном мониторировании уровня кортизола в крови. Данный тест позволяет проводить дифференциальную диагностику первичной адренокортикальной недостаточности (болезнь Аддисона).
3.5.2. ПОЛОВЫЕ ЖЕЛЕЗЫ
3.5.2.1. Женские половые железы
Яичники секретируют эстрадиол, андростендион и прогестерон. Фолликул яичника представляет собой яйцеклетку, окруженную плоскими эпителиальными клетками и соединительнотканной оболочкой. Изнутри эта капсула заполнена фолликулярной жидкостью и зернистыми (гранулярными) клетками. При синтезе эстрогенов гранулярные и эпителиальные клетки функционируют согласованно: оболочка синтезирует андростендион, который внутри везикул превращается в эстрадиол (рис. 3.12).
При половом созревании женщины синтез этих гормонов начинает контролироваться гонадотропинами. При этом ФСГ стимулирует стероидогенез в зернистых клетках, погруженных во внутреннее пространство фолликула, а ЛГ действует на клетки, формирующие оболочку капсулы. Так как в оболочке образуются мужские половые гормоны (андростерон и тестостерон), а в зернистых клетках они превращаются в женские половые гормоны (эстрон и эстрадиол). Очевидно, что для продукции женских половых стероидов должна осуществляться строгая согласованность синтеза и секреции гонадотропинов в гипофизе.
Образование в гипоталамусе гонадолиберина и стимуляция им секреции ФСГ и ЛГ служат основным сигналом для полового созревания. Время начала секреции и количества секретируемого гонадолиберина детерминировано генетически, однако на его секрецию влияют также нейромедиаторы ЦНС: норадреналин, дофамин, серотонин и эндорфины.
Обычно гонадолиберин выбрасывается из гипоталамуса короткими импульсами, между которыми наблюдается 2-3-часовая пауза. Спустя несколько минут после выброса гонадолиберина в крови появляются гонадотропины. Секреция гонадотропинов зависит также от уровня половых стероидов в крови: эстрогены подавляют выброс ФСГ и стимулируют секрецию ЛГ гипофизом, а прогестерон тормозит
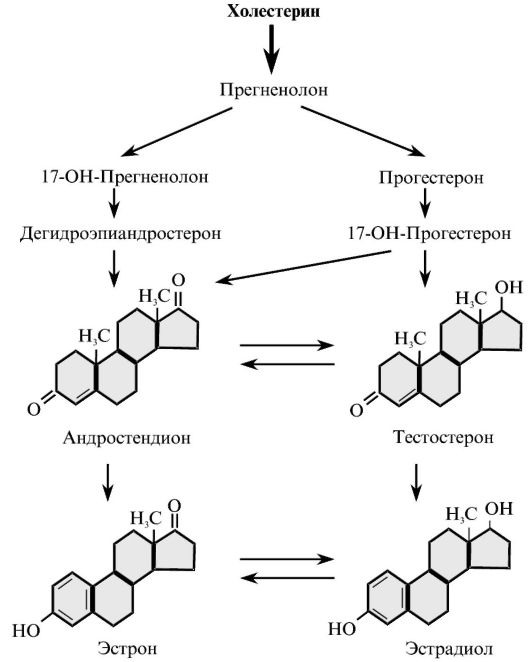 Рис. 3.12. Биосинтез эстрогенов в яичниках
Рис. 3.12. Биосинтез эстрогенов в яичниках
секрецию гонадолиберина в гипоталамусе. Таким образом замыкаются регуляторные связи между сигналами из центральной нервной системы и активностью яичников, осуществляющих стероидогенез.
Ключевую роль в циклическом функционировании женских половых желез играет ФСГ, секреция которого стимулируется гонадолиберином и низким уровнем эстрогенов. ФСГ проводит селекцию только одного из фолликулов (доминантного), который вступает в менструальный цикл. После этого резко усиливается синтез эстрогенов, что вызывает (по механизму отрицательной обратной
связи) снижение уровня ФСГ. Почти одновременно с этим наблюдается резкий подъем уровня ЛГ, который стимулирует созревание доминантного фолликула, его разрыв и выход яйцеклетки. Сразу же после этого снижается продукция эстрогенов, что приводит (по механизму отрицательной обратной связи) к подавлению секреции ЛГ. Наступает фаза созревания желтого тела, которая сопровождается перемещением яйцеклетки в матку. Это путешествие длится 8-9 дней, и, если не происходит оплодотворения яйцеклетки, желтое тело постепенно снижает продукцию эстрогенов и прогестерона, в результате чего наступает менструация. Если же оплодотворение все-таки происходит, то желтое тело начинает играть важнейшую роль в прикреплении оплодотворенной яйцеклетки и образовании плаценты.
СНИЖЕНИЕ ФУНКЦИИ
Аменорея (отсутствие менструации) является самой частой причиной женского бесплодия. Сравнительно редко она имеет первичный характер, т. е. вызвана недоразвитостью половых органов, отсутствием желтого тела, гиперплазией надпочечников, сниженной функцией гипофиза или щитовидной железы. В подавляющем большинстве случаев аменорею вызывают стресс, значительное снижение массы тела, тяжелые физические упражнения, хронические заболевания. Все эти факторы влияют на секрецию гонадолиберина гипоталамусом, вследствие чего нарушается согласованность в образовании гонадотропинов, а следовательно, изменяются синтез стероидных гормонов и функциональное состояние яичников и матки.
Интересен механизм развития аменореи при инсулиннезависимой форме гиперинсулинемии. При высокой концентрации инсулин способен не только связываться со своим рецептором, но и активировать рецептор инсулиноподобного фактора роста, что приводит к синтезу андрогенов в оболочке фолликулов.
Причиной аменореи может быть также избыточная продукция гипофизом пролактина, что приводит к нарушению частоты секреции гонадолиберина гипоталамусом. Иногда аменорею вызывают болезнь Кушинга и акромегалия.
ПОВЫШЕНИЕ ФУНКЦИИ
К гиперфункции яичников приводят синдром поликистоза яичников и гормонально-активные опухоли яичников (адренобластома, арренобластома и гранулезотекаклеточные опухоли).
• Поликистоз яичников характеризуется отсутствием овуляции, связанным с избытком андрогенов (преимущественно андростендиона) вследствие врожденной или приобретенной недостаточности ферментных систем, катализирующих превращение андрогенов в эстрогены, и ожирением. Синдром обнаруживается у 3-5% женщин репродуктивного возраста. В биохимической диагностике этого синдрома важное значение придают соотношению ЛГ и ФСГ (не менее 2:1).
• Андробластома и арренобластома - редкие опухоли мезенхимного происхождения, обычно обладающие андрогенной активностью. Проявления: дефеминизация, включающая атрофию молочных желез и матки с последующей маскулинизацией (гирсутизм, появление угрей, изменение линии оволосения, гипертрофия клитора и огрубение голоса).
• Гранулезотекаклеточные опухоли возникают у женщин как до первой менструации, так и во время менопаузы и пост менопаузы и характеризуются патологическими кровотечениями и преждевременным развитием молочных желез. Опухоли, секретирующие эстрогены, состоят из клеток гранулезы атрезирующего фолликула и клеток стромы яичников.
ОЦЕНКА ФУНКЦИИ Гонадотропины сыворотки В норме в сыворотке уровень гонадотропинов вариабелен, что обусловлено пульсаторным характером их секреции. Определение уровня ЛГ и ФСГ используется для оценки аменореи. Повышенный уровень наблюдается при первичной половой недостаточности, крайне низкий уровень - при гипоталамо-гипофизарных заболеваниях. Повышение соотношения ЛГ/ФСГ наблюдается при синдроме овариального поликистоза.
Эстрогены
Секреция эстрогенов носит цикличный характер. В лаборатории клинической биохимии обычно определяют уровень 17β-эстрадиола, по которому проводят мониторирование ановулярных женщин, страдающих ановуляцией, и пациенток, подлежащих экстракорпоральному оплодотворению.
Прогестерон
Определение концентрации прогестерона используют для визуализации овуляции, так как его уровень возрастает примерно в четыре
раза после овуляции. Прогестерон является термогенным фактором, поэтому повышение температуры тела также свидетельствует о произошедшей овуляции.
Андрогены
Хотя и установлено, что гирсутизм и вирилизация вызываются повышением уровня андрогенов, часто бывает затруднительно сразу определить, что является источником тестостерона - яичники, кора надпочечников или усиленная периферическая продукция. Об источнике тестостерона обычно судят по результатам измерения концентрации других андрогенов - андростендиона и дегидроэпиандростерона. Повышение концентрации последнего подтверждает, что источником гиперпродукции является кора надпочечников, а если в роли источника выступают яичники, то возрастает концентрация андростендиона.
3.5.2.2. Мужские половые железы
Тестостерон, естественный андроген, секретируется интерстициальными клетками яичек. Он необходим для нормального сперматогенеза, развития вторичных мужских половых признаков и роста мужских половых органов в пубертатном периоде.
Андрогены повышают анаболические процессы в организме и увеличивают количество белков, накапливающихся в тканях, особенно в мышечной. Ускоряется как рост костей, так и скорость закрытия эпифизов, что определяет низкорослость при преждевременной половозрелости или передозировке андрогенов в процессе лечения ребенка с гипогонадизмом.
Неадекватное влияние андрогенов во время эмбриогенеза приводит к развитию крипторхизма и микрофаллоса. Если нарушение функционирования клеток Лейдига происходит до пубертатного периода, то это приводит к задержке полового созревания, если оно происходит после полового созревания, то диагностика часто бывает крайне затруднительной.
ТЕСТИКУЛЯРНАЯ НЕДОСТАТОЧНОСТЬ Гипогонадизм у мужчин проявляется при недостаточном сперматогенезе в извитых семенных канальцах и нарушении синтеза тестостерона в клетках Лейдига. Дефекты сперматогенеза вызывают стерильность, тогда как дефицит тестостерона приводит к неадекватному развитию и поддержанию вторичных половых признаков.
Определение уровня гонадотропина, тестостерона и пролактина позволяет установить тип гипогонадизма (гипергонадотропный
или гипогонадотропный). При этом не рекомендуют использовать определение 17-кортикостероидов в моче из-за низкой информативности. Микроскопическое исследование эякулята позволяет прямо оценить репродуктивную функцию яичек и косвенно определить гормональный статус мужчины. По биопсии яичек судят о состоянии сперматогенеза.
ПОВЫШЕНИЕ ФУНКЦИИ
Повышение функциональной активности тестикул отмечают в период полового созревания у подростков, а в более старшем возрасте оно может быть вызвано опухолями или гиперплазией клеток Лейдига и надпочечников. Причины преждевременного полового созревания у мальчиков разделяют на гонадотропиннезависимые и гонадотропинзависимые синдромы.
ОЦЕНКА ФУНКЦИИ Гонадотропины
У мужчин пульсаторные колебания ЛГ в крови более выражены, чем колебания ФСГ, поэтому пробы для анализа берут в одно и то же время, например около 9.00, чтобы минимизировать эти эффекты. Низкий уровень и гонадотропинов, и тестостерона может свидетельствовать о поражении гипоталамуса. Высокий уровень ЛГ при низком уровне тестостерона заставляет думать о первичном поражении семенников. Только повышение ФСГ обычно указывает на поражение зародышевого эпителия.
Тестостерон
У здорового мужчины пики секреции тестостерона происходят каждые 60-90 мин. Большая часть тестостерона связана с белками: 65% - с глобулинами, 30-33% - с альбумином крови. Физиологической активностью обладает свободная фракция тестостерона (2-5% от общего уровня).
Пролактин
Гиперпролактинемия у мужчин приводит к нарушению сперматогенеза.
Эстрогены
Повышение уровня эстрогенов у мужчин может наблюдаться при интенсивном синтезе при заболеваниях надпочечников или опухолях семенников; снижении скорости метаболизма эстрогенов при болезнях печени; при ожирении, когда происходит усиление ароматизации андрогенов.
Динамические тесты
В настоящее время динамические тесты при заболеваниях половых желез используются в основном для оценки пограничных состояний недостаточности секреции гормонов.
Кломифеновый тест. Кломифен, антиэстроген, препятствует отрицательному регуляторному влиянию на гипофиз, что приводит к повышению секреции ЛГ и ФСГ. В течение недели кломифен дают пациенту и проводят мониторирование уровней ЛГ и ФСГ. Недостаточность реакции может свидетельствовать в пользу гипоталамо-гипофизарного гипогонадизма.
Гонадолибериновый тест. Тест основан на мониторировании уровня гонадотропинов в ответ на прием 100 мг гонадолиберина и позволяет дифференцировать гипофизарные и гипоталамические причины гипогонадизма. Повышение секреции гонадотропинов наблюдается при гипоталамических заболеваниях.
Тест стимуляции хорионическим гонадотропином. Хорионический гонадотропин человека стимулирует клетки Лейдига. Этот тест используют для оценки секреции тестостерона семенниками. При первичных поражениях семенников ответной реакции не наблюдается.
3.5.3. ЩИТОВИДНАЯ ЖЕЛЕЗА
Нарушения функции щитовидной железы приводят ко многим тяжелым заболеваниям, так как Т4 и Т3, образующиеся в щитовидной железе под действием тиреотропного гормона, регулируют множество процессов в организме. Т4 и Т3 увеличивают скорость обменных процессов (ускоряют катаболизм белков, жиров и углеводов), необходимы для нормального развития ЦНС, увеличивают ЧСС и сердечный выброс (наиболее вероятно за счет повышения чувствительности рецепторов миокарда к катехоламинам и прямого токсического эффекта тироксина на миокард), влияют на водно-солевой обмен (подавляют продукцию антидиуретического гормона). Крайне разнообразные эффекты йодсодержащих гормонов на клетки-мишени (практически все клетки организма) объясняют увеличением синтеза белка и потребления кислорода.
• Синтез белка увеличивается в результате активации транскрипции в клетках-мишенях (рецепторы тиреоидных гормонов относят к факторам транскрипции).
• Потребление кислорода возрастает в результате увеличенной активности Nа+,К+-АТФазы.
В щитовидной железе также образуется кальцитонин, функции которого как одного из регуляторов кальциевого обмена относят к антагонистическим функциям ПТГ. Регулятор экспрессии кальцитонина - Са2+ плазмы крови; внутривенное введение препаратов кальция существенно увеличивает секрецию кальцитонина.
Заболевания щитовидной железы наряду с сахарным диабетом - наиболее частая эндокринная патология. Эти заболевания возникают вследствие либо дефицита йода, либо аутоимунной агрессии, либо воспаления и опухолевых заболеваний и проявляются снижением (гипотиреоз) или повышением (гипертиреоз) функций щитовидной железы.
Снижение функции
Гипотиреоз - патологическое состояние, обусловленное недостаточной секрецией тиреоидных гормонов щитовидной железой, их повышенным разрушением или снижением их эффекта на тканевом уровне (последнее отмечают крайне редко). В среднем каждый 5-тысячный ребенок в Европе рождается с первичным гипотиреозом (врожденный гипотиреоз). Число случаев гипотиреоза нарастает в возрасте старше 40 лет, преимущественно у женщин (7,5:1).
Снижение уровня тиреоидных гормонов у новорожденных вызывает необратимые нарушения ЦНС, приводящие к кретинизму, плохому усвоению пищи и замедленному росту, гипотермии, брадикардии, гипотонии. Клинические проявления отмечают в первые недели жизни. Характерны также плохое сосание, длительная желтуха новорожденных (icterus neonatorum prolongatus). Живот увеличен в размерах, часто отмечают пупочные грыжи. Температура тела обычно ниже 35 °С, кожа бледная, холодная. Часто отмечают рефрактерную анемию и дилатационную кардиомиопатию. Клиническая картина полностью развивается к 6 мес.
Наиболее частая причина гипотиреоза у взрослых - болезнь Хашимото. Это аутоиммунное заболевание, при котором в крови появляется большое количество антител к белкам щитовидной железы. При этом подавляются синтез и секреция Т4 и Т3, поэтому по принципу обратной связи усиливается секреция гипофизом тиреотропного гормона, который стимулирует гипертрофию щитовидной железы, в результате чего появляется зоб.
Клиническая картина гипотиреоза многолика (отдельно взятые симптомы неспецифичны) и определяется сниженным уровнем тиреоидных гормонов в крови в сочетании с компенсаторными реакциями со
стороны других органов и систем. Поразительная амбивалентность симптомов (одинаково возможны как брадикардия, так и тахикардия, как аменорея, так и полименорея, как задержка полового созревания, так и преждевременное половое созревание и т.д.) делают порой диагностику первичного гипотиреоза достаточно трудной. У пожилых больных клиническая картина часто стертая, в этом случае диагностика может быть основана только на лабораторных критериях (прежде всего определяют уровень ТТГ как наиболее чувствительного показателя гипотиреоза). При первичном поражении щитовидной железы уровень ТТГ повышен, при вторичном (при поражении гипофиза), снижен.
К типичным клиническим проявлениям гипотиреоза относят снижение температуры тела (обычно ниже 36°С), непереносимость холода (больные постоянно мерзнут), сонливость и общую слабость. В большинстве случаев отмечают брадикардию, тенденцию к снижению АД, сухость кожных покровов и выпадение волос, одутловатость лица и характерные отеки (не оставляющие ямок при надавливании) вследствие накопления слизистого, богатого мукополисахаридами вещества в тканях. Последний феномен описывают термином «микседема», который иногда употребляют в качестве синонима тяжелого гипотиреоза.
Повышение функции
Гипертиреоз - физиологическое или патологическое повышение активности щитовидной железы (дефиниция, используемая в русской медицинской литературе). В англо- и немецкоязычной литературе термины «гипертиреоз» и «тиреотоксикоз» - синонимы.
Тиреотоксикоз - более широкий термин, означающий патологическое состояние, обусловленное чрезмерным количеством гормонов щитовидной железы в организме (не обязательно вследствие гиперфункции щитовидной железы) и характеризующееся повышением основного обмена, нарушениями функций нервной и сердечно-сосудистой систем. Возможны тиреотоксикоз без гипертиреоза (например, при передозировке препаратов тиреоидных гормонов) и гипертиреоз без тиреотоксикоза (например, при беременности).
Гипертиреоз никогда не наблюдается у новорожденных. Он очень редок у детей, но у взрослых отмечается значительно чаще, чем гипотиреоз. Одна из частых причин гипертиреоза - образование АТ, которые, связываясь с рецептором тиреотропного гормона на наружной поверхности плазматической мембраны клеток щитовидной железы, имитируют действие этого гормона - стимулируют аденилатциклазу,
которая через систему цАМФ-зависимого фосфорилирования вызывает образование и секрецию Т4 и Т3. В результате этого происходит также диффузное увеличение щитовидной железы.
Высокий уровень в крови тиреоидных гормонов вызывает повышенную возбудимость и потливость, непереносимость тепла или постоянное чувство жара, учащенное сердцебиение, увеличение пульсового АД (повышение систолического АД при снижении диастолического), тремор, высокую утомляемость, снижение массы тела, увеличение щитовидной железы, изменения со стороны глаз и расстройства в половой сфере (у женщин вплоть до аменореи, у мужчин отмечают снижение потенции). Многие из этих эффектов объясняют тем, что тиреоидные гормоны изменяют чувствительность тканей к катехоламинам. Они стимулируют экспрессию β-адренергических и подавляют экспрессию α-адренергических рецепторов. При гипертиреозе образование тиреотропного гормона резко снижается (по механизму отрицательной обратной связи).
Оценка функции
По традиции биохимические исследования в диагностике заболеваний щитовидной железы называют тестами тиреоидной функции, подразумевая при этом первоочередное определение ТТГ, общего и свободного Т4. Прежде чем остановиться на особенностях лабораторной оценки функции щитовидной железы, необходимо отметить, что часто у пациентов с тяжелыми тиреоидными заболеваниями, такими, как зоб или рак, в крови может определяться нормальная концентрация гормонов щитовидной железы.
ТИРЕОТРОПНЫЙ ГОРМОН
Уровень ТТГ в крови - чувствительный показатель поражения щитовидной железы, так как снижение синтеза и секреции тиреоидных гормонов по принципу отрицательной обратной связи тут же сказывается на этом параметре. Интенсивное развитие методов клинической биохимии привело к тому, что в настоящее время в арсенале диагноста-эндокринолога имеются сверхчувствительные методы определения ТТГ, способные определять крайне низкие уровни гормона и отличать их от нижних пределов референтных значений.
В общем случае повышение уровня ТТГ наблюдается при гипотиреозе и действии таких лекарственных препаратов, как амиодарон и литий. Напротив, снижение концентрации ТТГ отмечается при гипертиреозе, нарушении функции гипофиза, некоторых нетиреоидных
заболеваниях. В некоторых странах определение уровня ТТГ в крови новорожденных используют как скрининговый тест в диагностике кретинизма, сочетая этот показатель с диагностикой фенилкетонурии. При кретинизме уровень ТТГ всегда высокий. Для точной диагностики определение уровня ТТГ всегда сочетают с параллельным измерением уровня Т4.
ОБЩИЙ И СВОБОДНЫЙ ТИРОКСИН
В плазме большая часть Т4 (99,95%) транспортируется в виде комплексов со следующими белками: тироксинсвязывющим глобулином, альбумином и транстиреином (преальбумином). Вместе с тем в определении биологических эффектов гормонов решающую роль играют несвязанные, или свободные молекулы Т4. Кроме того, показатель свободного Т4 всегда более информативен по сравнению с общим уровнем Т4, поскольку менее зависим от уровня ТТГ.
ТРИЙОДТИРОНИН
Данные об уровне Т3 часто необходимы для диагностики некоторых случаев гипертиреоза, когда уровень Т4 нормален. В диагностике гипотиреоза определение уровня Т3 имеет небольшое значение.
ТИРЕОЛИБЕРИНОВЫЙ ТЕСТ
Этот тест предполагает внутривенное введение тиреолиберина при мониторировании ТТГ. Отмечаются отсутствие ответа при гипофизарном гипотиреозе и резкое усиление ответа при первичном гипотиреозе. Также наблюдается угнетение реакции при гипертиреозе за счет подавления гипофизарной секреции высоким уровнем циркулирующих тиреоидных гормонов.
3.5.4. НАДПОЧЕЧНИКИ
Кора надпочечников синтезирует стероидные гормоны (глюкокортикоиды, минералокортикоиды и андрогены), хромаффинная ткань мозговой части - катехоламины.
Кора надпочечников
Кора надпочечников - источник трех важнейших классов гормонов: глюкокортикоидов, минералокортикоидов и половых гормонов (см. рис. 3.8). Нормальное функционирование пары надпочечников возможно только при секреции гипофизом АКТГ, стимулирующего главным образом синтез глюкокортикоидов (в меньшей степени половых стероидов и альдостерона).
Глюкокортикоиды. Основной представитель - кортизол, на его долю приходится 80% всех глюкокортикоидов в организме (остальные 20% - кортизон, кортикостерон, 11-дезоксикортизол и 11-дезоксикор- тикостерон).
Функции глюкокортикоидов разнообразны - от регуляции метаболизма до модификации иммунного и воспалительного ответов.
Углеводный обмен. Глюкокортикоиды стимулируют образование глюкозы в печени путем увеличения скорости глюконеогенеза (за счет стимуляции синтеза его ключевых ферментов) и освобождения аминокислот (субстратов глюконеогенеза) в мышцах, а также стимуляции гликогенолиза. Поэтому глюкокортикоиды играют жизненно важную роль при стрессе, позволяя превращать почти все конечные продукты катаболизма в глюкозу, снабжающую энергией активно работающие ткани.
Липидный обмен. Липолиз усиливается в конечностях. Липогенез усиливается в других частях тела (туловище и лицо). Такая дифференцировка обменного процесса при синдроме Кушинга придает характерный внешний вид больным.
Белковый обмен. Глюкокортикоиды оказывают анаболическое действие в печени и катаболическое - в других органах.
Эндокринная система. Длительная терапия глюкокортикоидами приводит к подавлению секреции АКТГ, что в свою очередь при длительном применении (4-6 мес и более) ведет к атрофии коры надпочечников почти у половины больных (поэтому при отмене глюкокортикоидов после длительного применения появляются клинические и лабораторные признаки надпочечниковой недостаточности). Глюкокортикоиды при длительном использовании также подавляют секрецию ТТГ и гормона роста гипофизом и соматомединов печенью. Поэтому в детском возрасте применение глюкокортикоидов может приводить к задержке роста.
Иммунная система. В высоких дозах глюкокортикоиды выступают как иммунодепрессанты (их применяют для предупреждения отторжения трансплантированных органов, при myasthenia gravis): они подавляют пролиферацию В- и Т-лимфоцитов, вызванную Аг, что приводит к снижению уровня АТ при инфекциях.
Воспаление. Глюкокортикоиды имеют выраженный противовоспалительный эффект. Механизмы противовоспалительного действия многообразны. Определяющим звеном считают способность глюкокортикоидов увеличивать синтез липокортина и подавлять синтез
коллагена (за счет подавления активности фибробластов). Кроме того, глюкокортикоиды подавляют синтез некоторых провоспалительных цитокинов (например, ИЛ-1, ИЛ-6, ИЛ-8, ФНО-α), стабилизируют лизосомальные мембраны, тормозят хемотаксическую и фагоцитарную активность нейтрофилов и моноцитов. Поэтому у пациентов с синдромом Кушинга даже минимальная травма, приводящая к поражению кожи, может вызвать тяжелое инфекционное воспаление.
Костно-мышечная система. Глюкокортикоиды при длительном применении ингибируют синтетическую активность остеобластов, в результате чего развивается остеопороз. В развитие остеопороза вносит вклад способность глюкокортикоидов повышать резорбцию кости и увеличивать экскрецию кальция почками (таким образом, глюкокортикоиды - антагонисты витамина D). Длительное применение глюкокортикоидов также поддерживает катаболизм мышц, что приводит к их атрофии и мышечной слабости.
Обмен калия и натрия. Большая часть глюкокортикоидов обладает минералокортикоидной активностью, что проявляется задержкой в организме натрия (с возможным развитием отеков и артериальной гипертензии) и потерей калия (см. гл. 1). Кортизон и гидрокортизон обладают выраженным минералокортикоидным эффектом. Синтетический глюкокортикоид преднизолон обладает преимущественно глюкокортикоидной активностью. Синтетические препараты глюкокортикоидов дексаметазон и бетаметазон обладают небольшим минералокортикоидным эффектом, поэтому широко применяются при необходимости подавления АКТГ (дексаметазоновые пробы). Угнетающий эффект этих стероидов на ось гипоталамус-гипо- физ-надпочечники наиболее выражен при их назначении на ночь. Дексаметазон и бетаметазон также показаны в случаях, когда реабсорбция воды нежелательна (например, при лечении отека мозга).
Нервная система. Действие глюкокортикоидов на ЦНС неоднозначно. Связываясь со своими рецепторами в ЦНС, глюкокортикоиды вызывают изменения настроения, эйфорию или, наоборот, депрессию, различные психозы. Разнообразное действие на ЦНС может отмечаться как при избытке глюкокортикоидов, так и при их недостатке.
Кроветворная система. Глюкокортикоиды оказывают стимулирующее влияние на гранулоцитарный и эритроидный ростки гемопоэза, приводя к эритроцитозу и нейтрофилезу с относительной лимфопенией и эозинопенией.
Минералокортикоиды. Основной представитель - альдостерон. Суммарный вклад других кортикостероидов, обладающих минералокортикоидной активностью, мал (по сравнению с альдостероном). Главный регулятор синтеза и секреции альдостерона - ангиотензин II; в меньшей степени влияние на синтез и секрецию альдостерона оказывают АКТГ, натрийуретические факторы, концентрация ионов натрия и калия, а также проста-гландины.
Функция минералокортикоидов - поддержание баланса электролитов и жидкостей организма. Она осуществляется посредством влияния на реабсорбцию ионов в почечных канальцах при связывании с альдостероновыми рецепторами.
Na+. Альдостерон увеличивает реабсорбцию ионов натрия. Задержка натрия приводит к увеличению содержания воды в организме и повышению АД.
К+. Альдостерон увеличивает экскрецию ионов калия. Потеря калия вызывает гипокалиемию.
Cl- HCO-3 H+, Mg2+, Ca2+. Альдостерон увеличивает реабсорбцию хлора, бикарбоната и почечную экскрецию ионов водорода.
Андрогены. В коре надпочечников синтезируются дегидроэпиандростерон и в меньшей степени андростендион. Недостаточность ферментов стероидогенеза (11-, 17- и 21-гидроксилазы) приводит к изменениям наружных гениталий у плодов, нарушениям электролитного баланса и в зависимости от типа дефекта и пола плода к различным нарушениям полового созревания. Функция андрогенов надпочечников остается во многом неизученной; несомненны анаболический и гипохолестеринемический эффекты. У мужчин надпочечники играют незначительную роль в создании общей концентрации андрогенов в плазме.
Мозговая часть надпочечников
Мозговая часть надпочечников в отличие от коркового слоя регулируется не эндокринными механизмами, а прямыми нервными сигналами: по чревному нерву приходит возбуждающий импульс, в синапс выбрасывается ацетилхолин, который связывается с ацетилхолинергическими рецепторами никотинового типа, в результате чего возникает потенциал действия на иннервируемых клетках. При этом на короткое время возрастает концентрация Са2+ в цитоплазме, что служит сигналом как для секреции катехоламинов, так и для их дополнительного синтеза. Подобный тип регуляции эндокринной железы - исключение из обычного правила; его можно объяснить
тем, что мозговая часть надпочечника в эмбриогенезе образуется из нервной ткани, поэтому у нее сохраняется типичный нейрональный тип регуляции. В мозговой части надпочечников образуется адреналин и в меньшем количестве норадреналин.
Катехоламины имеют широкий спектр эффектов (воздействие на гликогенолиз, липолиз, глюконеогенез, существенное влияние на ССС). Вазоконстрикция, сокращение миокарда и другие эффекты катехоламинов реализуются через α- и β-адренергические рецепторы на поверхности клеток-мишеней (ГМК, секреторные клетки, кардиомиоциты). Серьезные клинические проблемы возникают при опухолях эндокринных клеток и их предшественников (феохромоцитома, нейробластома).
Дисфункция коры надпочечников
Как правило, гипофункция коры надпочечников сопровождается снижением секреции как глюкокортикоидов (обладающих минералокортикоидной активностью), так и собственно минералокортикоидов (альдостерона). В этом случае используют термин «гипокортицизм». Гиперфункцию коры надпочечников обозначают термином «гиперкортицизм». При изолированной пониженной секреции альдостерона используют термин «гипоальдостеронизм», при повышенной - «гиперальдостеронизм».
Гипокортицизм. Снижение продукции гормонов корой надпочечников может происходить в результате разрушения надпочечников различного генеза (первичная надпочечниковая недостаточность) или дисфункции гипоталамуса или гипофиза (вторичная надпочечниковая недостаточность).
Основа патогенеза - дефицит кортизола, приводящий к гиперпродукции АКТГ гипофизом (согласно принципу отрицательной обратной связи), что объясняет появление гиперпигментации. Прогрессирующий дефицит кортизола и альдостерона также приводит к нарушениям углеводного, белкового, липидного и водно-солевого обмена. В частности, развивается гипонатриемическая дегидратация с гиперкалиемией, гиперкальциемией, гипохлоремией, гипогликемией и кетозом. Уменьшение объема циркулирующей крови приводит к нарастанию внутриклеточной дегидратации с развитием метаболического ацидоза, выраженной артериальной гипотензии (вплоть до коллапса), снижением сердечного выброса и клубочковой фильтрации (вплоть до анурии).
Гипофункция коры надпочечников приводит к повышению утомляемости, мышечной слабости, снижению массы тела, анорексии,
гиперпигментации кожи и снижению АД. У мужчин, страдающих болезнью Аддисона (первичная надпочечниковая недостаточность, как правило, аутоиммунного генеза), снижается либидо, у женщин сохраняется способность к зачатию, а также к вынашиванию ребенка, так как гормоны, образующиеся в плаценте и у плода, защищают мать от стероидной недостаточности. У женщин также отмечают выпадение волос на лобке и в подмышечной области (вследствие уменьшения выработки андрогенов в надпочечниках). У мужчин подобной симптоматики не отмечают, поскольку большая часть андрогенов синтезируется в яичках. У детей отмечают заметное отставание в росте и предрасположенность к гипогликемическим состояниям.
Дефицит кортизола надпочечниками снижается также при туберкулезе почек и адреногенитальном синдроме.
Адреногенитальный синдром (врожденная дисфункция коры надпочечников) - аутосомно-рецессивное заболевание, обусловленное дисфункцией коры надпочечников вследствие нарушения выработки того или иного фермента стероидогенеза, обычно сопровождающееся чрезмерной секрецией андрогенов и признаками вирилизации. Дефицит кортизола уже внутриутробно стимулирует выработку АКТГ, что приводит к гиперплазии коры надпочечников и избыточной продукции АКТГ-зависимых стероидов, синтез которых при данной недостаточности фермента не нарушен (в основном надпочечниковых андрогенов - дегидроэпиандростерона, андростендиона). Наиболее известная форма синдрома обусловлена частичной или полной недостаточностью 21-гидроксилазы.
Гиперкортицизм, обусловленный гиперпродукцией глюкокортикоидов корой надпочечников вследствие кортикостеромы (доброкачественной или злокачественной опухоли надпочечников) или синдрома эктопической продукции АКТГ (например, при мелкоклеточном раке легкого), называют синдромом Кушинга. Отдельно выделяют ятрогенный (лекарственный) синдром Кушинга, отмечаемый значительно чаще, чем спонтанный (обычно развивающийся у больных, длительное время получающих глюкокортикоиды по поводу бронхиальной астмы, ревматоидного артрита и других заболеваний). При гиперкортицизме, обусловленном аденомой гипофиза, говорят о болезни Кушинга (см. раздел «Гиперпитуитаризм»), при которой развивается гиперплазия обоих надпочечников. Дифференциальнодиагностические критерии гиперкортицизма приведены в табл. 3.1.
Таблица 3.1. Дифференциально-диагностические критерии гиперкортицизма
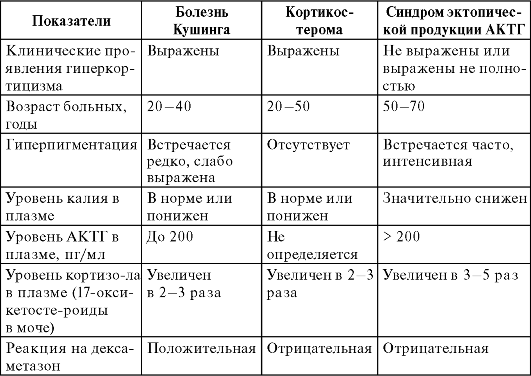 Уровень
кортизола в крови повышается не только при синдроме (болезни) Кушинга,
но также при стрессе, болевом шоке, алкоголизме, беременности и
гипотиреозе (так называемый функциональный гиперкортицизм).
Уровень
кортизола в крови повышается не только при синдроме (болезни) Кушинга,
но также при стрессе, болевом шоке, алкоголизме, беременности и
гипотиреозе (так называемый функциональный гиперкортицизм).
Гипоальдостеронизм может быть изолированным, сочетаться с дефицитом других кортикостероидов (например, при болезни Аддисона или адреногенитальном синдроме) или вызываться снижением чувствительности рецепторов к действию альдостерона, синтез которого не нарушен (псевдогипоальдостеронизм). Различают первичный и вторичный гипоальдостеронизм. В обоих случаях недостаточность альдостерона приводит к снижению реабсорбции натрия и воды в почечных канальцах и повышению реабсорбции калия и хлора с развитием артериальной гипотензии и метаболического ацидоза.
• Первичный гипоальдостеронизм у грудных детей обусловлен недостаточностью двух ферментных систем - 18-оксидазы и 18-гид- роксилазы. Он может сочетаться с полигландулярным аутоиммунным синдромом I типа. Потеря натрия и артериальная гипотензия повышают продукцию ренина (гиперренинемический гипоальдостеронизм).
• Вторичный гипоальдостеронизм наблюдают у взрослых. Он связан с недостаточной продукцией ренина почками или сниженной его активностью (гипоренинемический гипоальдостеронизм). Часто осложняет течение сахарного диабета и хронического нефрита с почечно-канальцевым ацидозом с поражением сосудов почек. Может возникать при длительном приеме определенных лекарственных препаратов (гепарин, нестероидные противовоспалительные препараты, β-адреноблокаторы и ингибиторы АПФ). Может развиться после удаления альдостеромы одного из надпочечников в результате атрофии клубочковой зоны другого, при острой алкогольной интоксикации или болезни Аддисона.
• Псевдогипоальдостеронизм может быть наследуемым и приобретенным. Приобретенный псевдогипоальдостеронизм может развиваться вследствие поражения почек при системной красной волчанке и серповидноклеточной анемии, амилоидозе, интерстициальном нефрите, обструктивной нефропатии, применении триамтерена, амилорида или спиронолактона.
Гиперальдостеронизм может быть первичным и вторичным. Первичный гиперальдостеронизм развивается вследствие альдостеронпродуцирующей аденомы (синдром Конна) или гиперплазии надпочечников (идиопатический гиперальдостеронизм) и проявляется артериальной гипертензией, гипокалиемией и низким уровнем ренина в сыворотке крови. Вторичный гиперальдостеронизм (в отличие от первичного) обусловлен причинами, локализованными вне надпочечников (стеноз почечных артерий, злокачественная гипертензия, ренинсекретирующие опухоли, эктопические очаги секреции АКТГ, нефротический синдром, сердечная недостаточность, цирроз печени, кровотечения), при этом содержание ренина значительно повышено. Составляет большую часть случаев гиперальдостеронизма.
Дисфункция мозговой части надпочечников
Гиперфункция, проявляющаяся повышенной секрецией катехоламинов, наблюдается при стрессовых ситуациях, феохромоцитоме (опухоли мозговой части надпочечников), при хирургических вмешательствах, в острой фазе инфаркта миокарда, при артериальной гипертензии, длительной гиподинамии, тяжелой физической нагрузке, недостаточности коры надпочечников и почек, при курении и хроническом алкоголизме. Содержание норадреналина возрастает практически при всех тех нарушениях, которые вызывают рост уровня адреналина в крови, а также при эпилепсии в период приступов и при переохлаждении организма.
Клинически гиперфункция мозговой части надпочечников проявляется тахикардией, обильным потоотделением, тремором, головной болью, повышенным чувством тревоги. При феохромоцитоме ко всем этим симптомам присоединяется артериальная гипертензия. Поскольку адреналин подавляет секрецию инсулина, активирует гликогенолиз и липолиз, у больных с феохромоцитомой отмечают гипергликемию и глюкозурию, а также быстрое снижение массы тела.
Гипофункция. Сниженный уровень адреналина и норадреналина наблюдают при недоразвитии мозгового вещества надпочечников, олигофрении, депрессии, миопатиях и мигрени.
3.5.5. ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
Эндокринная часть поджелудочной железы - совокупность островков Лангерганса (1-2% от всего объема железы). В островках различают несколько типов эндокринных клеток, синтезирующих и секретирующих в просвет капилляров инсулин (β-клетки), глюкагон (α-клетки), соматостатин (δ-клетки), панкреатический полипептид (PP-клетки) и у детей младшего возраста гастрин (G-клетки). Наиболее многочисленны (примерно 70%) синтезирующие инсулин β-клетки. β-Клетки составляют около 20% от общего количества островковых клеток, оставшаяся часть принадлежит δ-, PP- и G-клеткам. В клинической практике наиболее важны гормоны-антагонисты инсулин и глюкагон, участвующие в регуляции уровня глюкозы в крови.
Концентрация глюкозы в крови обычно составляет 3,3-6,05 ммоль/л. Если она повышается на 20-30% (вследствие приема пищи, богатой углеводами, или выброса в кровь больших количеств адреналина и глюкагона), происходит секреция инсулина.
Инсулин
Главные мишени инсулина - печень, скелетные мышцы, жировые клетки. Действие инсулина на мишени разнообразно (регуляция обмена углеводов, липидов и белков). Инсулин - гормон с анаболическим действием, а также главный регулятор гомеостаза глюкозы. Это единственный гормон, снижающий концентрацию глюкозы в крови. Инсулин стимулирует следующие процессы.
• Мембранный транспорт глюкозы, т. е. перенос глюкозы через клеточные мембраны в мышцах и жировой ткани с помощью специальных трансмембранных белков-переносчиков глюкозы. Стимуляция инсулином приводит к увеличению скорости поступления глюкозы внутрь
клетки в 20-40 раз. Β сердце, скелетных мышцах и жировой ткани инсулин стимулирует переносчик глюкозы в плазматической мембране, а в печени этот гормон активирует гексокиназу и глюкокиназу, что также ускоряет проникновение углеводов в клетку. Параллельно с активацией транспорта глюкозы инсулин подавляет синтез ключевых ферментов глюконеогенеза (фосфоенолпируваткарбоксикиназы и фруктозо-1,6-дифосфатазы), снижает концентрацию цАМФ в печени, тем самым уменьшая активность фосфорилазы и триглицеридлипазы, но стимулируя гликогенсинтазу и глюкозо-6-фосфатдегидроге- назу, продуцирующую НАДФН, кофермент синтеза жирных кислот и глицерофосфата (рис. 3.13). Β результате этого в печени начинается активный синтез гликогена и ТГ - создается запас высококалорийных и легкомобилизуемых питательных веществ. Таким образом, инсулин ингибирует распад и активирует синтез гликогена, жиров и белков, т.е. оказывает действие, противоположное действию таких гормонов, как глюкагон, кортизол и адреналин.
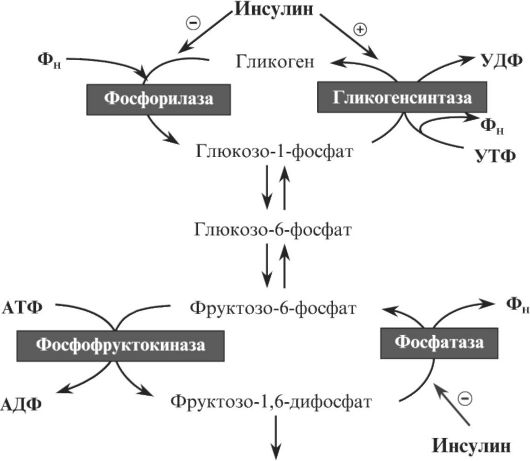 Рис. 3.13. Регуляция инсулином метаболизма углеводов. (-) - ингибирующее влияние; (+) - активирующее влияние; Фн - неорганический фосфат; УТФ - уридинтрифосфат; УДФ - уридиндифосфат
Рис. 3.13. Регуляция инсулином метаболизма углеводов. (-) - ингибирующее влияние; (+) - активирующее влияние; Фн - неорганический фосфат; УТФ - уридинтрифосфат; УДФ - уридиндифосфат
• Гликолиз, т. е. ферментативный процесс расщепления глюкозы, протекающий без потребления кислорода, приводящий к образованию молочной кислоты и сопровождающийся образованием АТФ (гликолиз - основной источник энергии в анаэробных условиях, например в работающей скелетной мышце).
• Синтез АТФ, ДНК и РНК, что проявляется ускоренной пролиферацией клеток.
Рецептор инсулина обеспечивает реализацию эффектов инсулина на мишени. При взаимодействии инсулина со своим рецептором в цитоплазматической мембране происходит активация аденилатциклазы с образованием цАМФ, который при участии кальция и магния регулирует утилизацию глюкозы и синтез белка.
• Чувствительность и экспрессия инсулиновых рецепторов обратно пропорциональны уровню инсулина в крови, т. е. при снижении уровня циркулирующего инсулина (например, при инсулинзависимом сахарном диабете) увеличиваются экспрессия инсулиновых рецепторов и их чувствительность к гормону, а при повышении уровня циркулирующего инсулина (например, при инсулиннезависимом сахарном диабете) экспрессия инсулиновых рецепторов и их чувствительность к гормону снижены.
• Чувствительность инсулиновых рецепторов увеличивают физическая нагрузка, соблюдение диеты и прием любых сахароснижающих препаратов вследствие уменьшения уровня глюкозы в крови. Эффекты инсулина на рецепторы выше в вечерние часы, чем в утренние (что связывают, в частности, с циркадным ритмом глюкокортикоидов, секреция которых достигает максимума с 3 до 7 ч утра). Поскольку глюкокортикоиды обладают контринсулярным свойством, потребность в инсулине выше в утренние часы (что важно при расчете суточной дозы инсулина).
Мутации гена рецептора инсулина (ген INSR). Известно множество мутаций гена INSR, приводящих к полной или частичной резистентности мишеней к эффектам инсулина, что проявляется развитием инсулиннезависимого сахарного диабета. В качестве примеров клинических форм, возникающих при мутациях гена INSR, можно привести лепречаунизм, инсулиннезависимый сахарный диабет с акантозом кожи чернеющим и синдром Рабсона-Менденхолла.
Глюкагон
Основные мишени глюкагона - гепатоциты и жировые клетки. Глюкагон расценивают как антагонист инсулина, этот гормон
стимулирует гликогенолиз и липолиз, что ведет к быстрой мобилизации источников энергии (глюкозы и жирных кислот). Таким образом, глюкагон - гормон с катаболическим действием.
Рецептор глюкагона расположен в плазмолемме клеток-мишеней, связывает только глюкагон и посредством G-белков активирует аденилатциклазу.
Сахарный диабет
При недостаточной секреции инсулина или его неадекватном действии на мишени развивается сахарный диабет. В 1981 г. Комитет экспертов ВОЗ определил сахарный диабет как синдром хронической гипергликемии, развивающийся вследствие абсолютного или относительного дефицита инсулина и проявляющийся глюкозурией, полиурией, полидипсией, нарушениями липидного, белкового и минерального обмена и развитием характерных осложнений (острых и хронических).
Традиционно выделяют два типа сахарного диабета: инсулинзависимый (тип I) и инсулиннезависимый (тип II), различаемых по патогенетическим механизмам. К причинам сахарного диабета I типа относят вирусное поражение поджелудочной железы, образование ауто-АТ к инсулину или генетический дефект системы синтеза этого гормона. Диабет II типа развивается чаще всего у тучных людей. Его причина - не низкий уровень инсулина в крови, а сниженная экспрессия рецепторов инсулина в тканях-мишенях или же нарушения в системе проведения регуляторного сигнала от рецептора инсулина к переносчику глюкозы в плазматической мембране клеток. Больные инсулиннезависимым сахарным диабетом составляют 80-90% всех больных сахарным диабетом.
Следует отметить, что концентрация глюкозы в крови возрастает не только из-за нехватки инсулина или замедленного транспорта углеводов в клетку, но и при синдроме Кушинга, феохромоцитоме, акромегалии, гигантизме, гипертиреозе, при гиперпродукции эстрогенов или прогестинов, при беременности, инфаркте миокарда, нарушении мозгового кровообращения, эмоциональном возбуждении, отравлении углекислым газом, ожогах, шоке, лихорадке.
Пониженный уровень инсулина в крови наблюдают не только при инсулинзависимой форме сахарного диабета, но также в большинстве случаев при поздней стадии инсулиннезависимого сахарного диабета (так называемая инсулинопотребная стадия инсулиннезависимого сахарного диабета). Гиперинсулинемия развивается при опухолях поджелудочной железы, инсулиннезависимой форме сахарного
диабета, при панкреатитах и ожирении, болезни Кушинга, тиреотоксикозе и акромегалии, а также при язвенной болезни двенадцатиперстной кишки.
ОСТРЫЕ ОСЛОЖНЕНИЯ САХАРНОГО ДИАБЕТА Крайнее проявление инсулиновой недостаточности - диабетический кетоацидоз. В его патогенезе важно отметить роль гипергликемии, метаболического ацидоза и электролитных нарушений.
Абсолютный дефицит инсулина снижает утилизацию глюкозы на периферии, приводит к энергетическому голоду в инсу-линзависимых тканях, что вызывает повышение уровней контринсулярных гормонов (глюкагона, АКТГ, гормона роста, кортизола, катехоламинов), и стимуляции гликогенолиза, липолиза и протеолиза, то есть метаболических путей, поставляющих субстраты для глюконеогенеза в печени и в меньшей степени в почках. В результате повышения осмолярности плазмы развиваются осмотический диурез (с потерей натрия, калия, фосфата и других веществ с мочой), дегидратация тканей, гиповолемия (с уменьшением мозгового, почечного и периферического кровотока и последующей олиго- и анурией). В результате развивается гипоксия тканей с переключением их метаболизма на гликолитический путь и накоплением лактата. Повышенный уровень глюкозы в крови больных увеличивает тоническое (осмотическое) давление в межклеточном пространстве, что приводит к выходу воды из клетки. Этот процесс - главная причина потери жидкости, а также ионов Na+, K+ и С1- при сахарном диабете. Неспособность глюкозы поступать в мышцы и печень при сахарном диабете приводит к снижению массы тела, а потеря воды и электролитов (особенно К+) вызывает мышечную слабость.
Метаболический ацидоз (см. гл. 1) имеет смешанное происхождение. Повышенное образование в печени кетоновых тел (кетогенез) превышает способность организма к их метаболизированию или экскреции. Липолиз (преобладающий над липогенезом), возникающий в результате дефицита инсулина и избытка контринсулярных гормонов (главным образом катехоламинов), мобилизует свободные жирные кислоты из депо в жировой ткани. Вместо реэтерификации поступающих свободных жирных кислот в триглицериды печень переключает их метаболизм на образование кетоновых тел, опосредованное продукцией ацетил-КоА с формированием сначала ацетоацетата (первое кетоновое тело), из которого образуются β-гидроксибутират (второе кетоновое тело) при участии НАДФ и ацетон без участия НАДФ.
Дополнительный компонент метаболического ацидоза - лактатацидоз, возникающий за счет переключения метаболизма «голодающих» тканей на гликолитический путь с образованием лактата на фоне относительного дефицита ЛДГ и невозможности полной утилизации лактата.
Электролитные нарушения возникают не только за счет осмотического диуреза (см. выше), но и за счет назначения инсулинотерапии. Главное из нарушений - гипокалиемия, поскольку инсулин усиливает транспорт калия в клетку, а также экскрецию калия с мочой. Эффекты инсулинотерапии на выведение калия проявляются через 2-3 ч от ее начала (поэтому именно тогда и следует начинать заместительную терапию калием с помощью раствора калия хлорида).
ХРОНИЧЕСКИЕ ОСЛОЖНЕНИЯ САХАРНОГО ДИАБЕТА Основную роль в развитии хронических осложнений сахарного диабета играют длительная гипергликемия и гликозилирование белков крови. Особенно важно отметить повреждающее действие этих факторов на кровеносные сосуды (коронарные артерии, сосуды мозга и нижних конечностей, а также почек и сетчатки глаза). Обычно развиваются утолщение базальной мембраны в капиллярах, пролиферация ГМК и усиленная секреция коллагена в крупных сосудах, микроаневризмы и повышенная проницаемость капилляров в сетчатке глаза.
При длительной гипергликемии происходят стимуляция гликозилирования ЛП и других белков в плазме крови, вследствие чего эти белки депонируются в стенках сосудов и тем самым стимулируют агрегацию тромбоцитов, а также миграцию и адгезию моноцитов и макрофагов. Биохимические механизмы развития подобных изменений в сосудах точно не установлены. Есть свидетельства в пользу того, что гипергликемия повышает гликозилирование белков плазмы путем неферментативного ковалентного присоединения глюкозы к свободным аминогруппам белка, в результате чего изменяется его третичная структура. Важную роль может играть также стимуляция глюкозой агрегации тромбоцитов, которые при этом секретируют тромбоцитарный фактор роста, способный стимулировать гиперплазию и гипертрофию сосудистых клеток. Гиперинсулинемия per se также вносит свой вклад в развитие патологии сосудов. При инсулиннезависимой форме сахарного диабета уровень инсулина в крови может быть повышен в несколько раз.
Помимо того что инсулин действует как гормон, его также относят к типичным факторам роста. Связываясь со своим рецептором,
а также (при высоких концентрациях) с рецептором инсулиноподобного фактора роста, он стимулирует тирозиновое фосфорилирование ряда белков клетки, в результате чего происходят гиперплазия и гипертрофия клеток сосудистой стенки и крови.
Таким образом, основные патогенетические процессы при хронических осложнениях сахарного диабета развиваются в кровеносных сосудах. Они вызваны не нарушением метаболизма углеводов в клетке, а химической модификацией внеклеточных (гликозилирование) и внутриклеточных (фосфорилирование по тирозиновым остаткам) белков.
Диагностика и мониторинг
Диагностика сахарного диабета налагает особую ответственность на клинических биохимиков, поскольку данное заболевание имеет не только медицинское, но и социальное значение. Для постановки диагноза и последующего длительного мониторирования пациентов используют следующие тесты.
ГЛЮКОЗА МОЧИ
Как правило, в норме глюкоза не содержится в моче, поэтому уринарный глюкотест является одним из самых распространенных методов скринингового анализа в поликлиниках и стационарах.
Глюкозурия наблюдается у пациентов при превышении уровня глюкозы в крови 10 ммоль/л. Необходимо учитывать, что у отдельных здоровых индивидуумов с низким почечным порогом для глюкозы может наблюдаться глюкозурия без наличия сахарного диабета. С другой стороны, с возрастом характерно увеличение почечного порога для глюкозы и у многих пожилых больных диабетом глюкозурия отсутствует. Таким образом, при интерпретации данных уринарного глюкотеста всегда надо учитывать то, что уровень глюкозы в моче зачастую не является прямым отражением ее уровня в крови.
КЕТОНОВЫЕ ТЕЛА В МОЧЕ И ПЛАЗМЕ В плазме у больных сахарным диабетом могут накапливаться кетоновые тела, однако их присутствие также не является явным признаком заболевания. Это связано с тем, что кетоновые тела присутствуют и в норме в том случае, если у пациента были достаточно длительные промежутки между приемами пищи. В клинической лаборатории для определения кетоновых тел используют тест-полоски на наличие ацетоацетата.
ГЛЮКОЗА КРОВИ
Современные тесты основаны на высокоспецифических ферментативных реакциях и дают достаточно точные результаты анализа. Концентрация глюкозы при этом определяется как визуально, так и с помощью портативных приборов. Все это позволяет больным диабетом осуществлять бытовой самоконтроль уровня глюкозы в крови. При этом каждый использующий портативную тест-систему должен соблюдать следующие правила.
• Во-первых, точно следовать инструкции к тест-системе. Различные производители данных систем используют тонкие модификации метода, поэтому даже нюансы в нанесении образца на полоску могут существенно сказаться на конечном результате. Особенно это надо учитывать при смене фирмы-производителя тест-системы.
• Во-вторых, неправильное хранение полосок может сказаться на аналитической ценности результата. Любое нарушение условий длительного хранения обязательно отразится на чувствительности полоски, представляющей собой сложное многослойное образование на твердой подложке.
• В-третьих, любые аномальные результаты должны обязательно проверяться в лабораторных условиях, где к образцам крови перед анализом обязательно добавляют ингибиторы гликолиза.
Согласно рекомендациям ВОЗ (табл. 3.2), существуют вероятностные критерии для диагностики сахарного диабета в зависимости от образца измерения. Этими критериями рекомендовано пользоваться при проведении портативных глюкотестов.
Таблица 3.2. Критерии ВОЗ для диагностики сахарного диабета по случайным определениям глюкозы (в ммоль/л)
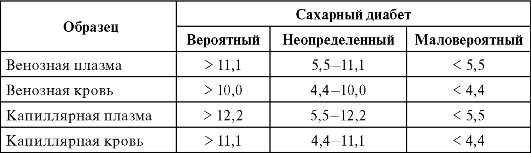 ГЛЮКОЗОТОЛЕРАНТНЫЙ
ТЕСТ Наиболее информативным методом диагностики диабета считается
динамика изменения уровня глюкозы в плазме пациента в ответ на сахарную
нагрузку. Натощак определяется уровень глюкозы, а затем обследуемый
получает 75 г глюкозы перорально в 300 мл воды, выпиваемой за 5 мин.
Уровень глюкозы измеряется каждые 30 мин на протяжении 2 ч. При этом
пациенты должны удобно сидеть, не курить и не испытывать физических
нагрузок, а три дня до теста обязаны придерживаться сбалансированной
диеты.
ГЛЮКОЗОТОЛЕРАНТНЫЙ
ТЕСТ Наиболее информативным методом диагностики диабета считается
динамика изменения уровня глюкозы в плазме пациента в ответ на сахарную
нагрузку. Натощак определяется уровень глюкозы, а затем обследуемый
получает 75 г глюкозы перорально в 300 мл воды, выпиваемой за 5 мин.
Уровень глюкозы измеряется каждые 30 мин на протяжении 2 ч. При этом
пациенты должны удобно сидеть, не курить и не испытывать физических
нагрузок, а три дня до теста обязаны придерживаться сбалансированной
диеты.
Подходы к интерпретации глюкозотолерантного теста представлены в табл. 3.3. При этом необходимо учитывать, что у пациентов с отсутствием каких-либо других симптомов вывод о наличии сахарного диабета делается только тогда, когда наблюдается увеличение уровня глюкозы на 2-м часе, или когда определяемое значение равно (превышает) 11 ммоль/л в любой временной точке глюкозотолерантного теста.
Таблица 3.3. Критерии ВОЗ для нарушенной толерантности к глюкозе (в ммоль/л)
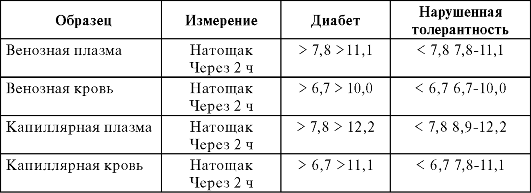 Если
у пациента уровень глюкозы в крови натощак нормальный, а диабетических
значений он достигает только спустя 2 ч, то тест повторяют через 6 нед.
Если
у пациента уровень глюкозы в крови натощак нормальный, а диабетических
значений он достигает только спустя 2 ч, то тест повторяют через 6 нед.
Обнаруженная по результатам теста нарушенная толерантность к глюкозе не расценивается как болезнь. Это всего лишь сигнал о том, что обследуемый находится в промежуточной стадии между нормой и болезнью, характеризуемой повышенным риском развития диабета. Такие индивидуумы должны соблюдать диету и проходить ежегодную диспансеризацию.
Долговременные показатели
Как уже отмечалось выше, высокая концентрация глюкозы в биологических жидкостях приводит к неферментативному гликозилированию остатков лизина в различных белках. Этот процесс необратим при физиологическом значении рН, поэтому концентрация гликозилированных белков является отражением долговременного повышения уровня глюкозы. В клинической лаборатории обычно измеряют содержание гликозилированного гемоглобина и фруктозамина.
Гликозилированный гемоглобин (гемоглобин А1с). Этот показатель отражает уровень гликемии в крови на протяжении 2 мес, т. е. за период времени полужизни гемоглобина.
Фруктозамин. Источником этого белка служит гликозилированный альбумин. Фруктозамин имеет меньший период жизни и отражает уровень глюкозы в течение 3 нед до измерения.
К долговременным лабораторным показателям при сахарном диабете относится и определение микроальбуминурии, позволяющее провести раннюю диагностику почечных осложнений.
Лабораторная диагностика метаболических осложнений
Метаболические осложнения сахарного диабета, в частности кетоацидоз и гипогликемия, представляют собой угрожающие жизни состояния и могут вызывать неврологические нарушения - у больных диабетом часты нарушения сознания. Рассмотрим некоторые особенности биохимического обследования больных сахарным диабетом в стадии осложнений.
• Во-первых, необходимо удостовериться в наличии гипергликемии и кетоза. Оба исследования можно провести с помощью индикаторных полосок с последующим обязательным лабораторным подтверждением.
• Во-вторых, должны быть взяты образцы: венозной крови для определений глюкозы в плазме и натрия, калия, хлоридов, бикарбонатов, мочевины и креатинина в сыворотке; артериальной крови для измерения газового состава. Необходимо учитывать, что наличие кетоновых тел в сыворотке мешает определению креатинина, поэтому этот показатель может быть ложно повышенным в острой стадии. Реальный уровень креатинина определяется только после возвращения кетонемии в нормальные границы.
• В-третьих, надо учитывать, что активность сывороточной амилазы возрастает во время диабетического кетоацидоза, т. е. наличие у больного панкреатита может рассматриваться лишь при стойких абдоминальных болях.
• В-четвертых, глюкоза крови должна определяться ежечасно до тех пор, пока уровень не снизится до значений ниже 15 ммоль/л. После этого рекомендуемая частота измерений составляет 1 раз в 2 ч. Эти исследования должны подтверждаться каждые 3 ч лабораторными анализами.
• В-пятых, частота мониторинга газов крови должна составлять как минимум 1 раз в 2 ч. Уровень калия в плазме также измеряется не реже 1 раза за 2 ч, тогда как мочевина и электролиты определяются с 4-часовым интервалом.