Фармакология : учебник. - 10-е изд., испр., перераб. и доп. - Харкевич Д. А. 2010. - 752 с.
|
|
|
|
ГЛАВА 29 АНТИБАКТЕРИАЛЬНЫЕ ХИМИОТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА 1
Антибактериальные химиотерапевтические средства характеризуются двумя основными свойствами:
1) избирательностью действия в отношении определенных видов возбудителей, т.е. имеют определенный спектр противомикробного действия;
2) низкой токсичностью для человека и животных.
Чаще всего их используют при системных инфекциях, при которых необходимы препараты резорбтивного действия (вводимые энтерально и парентерально). Вместе с тем химиотерапевтические средства назначают и местно; в данном случае их всасывание должно быть минимальным. Последнее важно для получения наиболее выраженного и стойкого противомикробного эффекта и уменьшения возможности побочных влияний. С целью локального действия препараты наносят на слизистые оболочки или на кожные покровы, а также вводят внутрь для воздействия на возбудителей кишечных инфекций (вещества, которые не всасываются из пищеварительного тракта).
Применение антибактериальных химиотерапевтических средств имеет свои особенности. Прежде всего для успешного лечения важно установить возбудитель заболевания и определить его чувствительность к тем препаратам, которые могут быть использованы в качестве химиотерапевтических средств. Если возбудитель заболевания известен, подбирают препараты с соответствующим спектром антибактериального действия. При неизвестном возбудителе целесообразно использовать вещества с широким спектром или комбинацию двух препаратов, суммарный спектр которых включает вероятных возбудителей.
Начинать лечение необходимо как можно раньше. В начале заболевания микробных тел меньше и они находятся в состоянии энергичного роста и размножения. В этой стадии микроорганизмы наиболее чувствительны к действию химиотерапевтических средств.
1 Как указывалось выше, химиотерапевтическими средствами обозначают вещества, обладающие избирательной токсичностью в отношении определенных возбудителей инфекционных и паразитарных заболеваний. Помимо антибактериальных препаратов, к ним относятся противовирусные, противогрибковые, противопротозойные и противоглистные препараты.

П. ЭРЛИХ (1854-1915). Основоположник химиотерапии инфекций. Получил первое эффективное противосифилитическое средство из группы органических соединений мышьяка - сальварсан.
Дозы препаратов должны быть достаточными для того, чтобы обеспечить в биологических жидкостях и тканях бактериоста- тические или бактерицидные концентрации. В начале лечения иногда дают ударную дозу, превышающую последующие.
Очень важна оптимальная продолжительность лечения. Следует учитывать, что клиническое улучшение (снижение температуры и др.) не является основанием для прекращения приема препарата. Если необ- ходимый курс лечения не был проведен, возможен рецидив болезни.
При некоторых инфекционных заболеваниях приходится прибегать к повторным курсам лечения.
Значительную роль играет также выбор рациональных путей введения веществ с учетом того, что некоторые из них не пол- ностью всасываются из желудочно-кишечного тракта, плохо проникают через гема- тоэнцефалический барьер и т.д.
Нередко назначают одновременно 2-3 антибактериальных средства. Следует, однако, учитывать, что комбинированное применение таких препаратов должно быть достаточно обоснованным, так как при неправильном сочетании возможен не только антагонизм веществ в отношении антибактериальной активности, но и суммирование их токсических эффектов. Наиболее показано сочетание препаратов при хронических инфекциях (например, при туберкулезе) для предупреждения развития устойчивости бактерий к химиотерапевтическим средствам.
К антибактериальным химиотерапевтическим средствам относятся следующие группы:
антибиотики,
сульфаниламидные препараты, производные хинолона,
синтетические антибактериальные средства разного химического строения, противосифилитические средства, противотуберкулезные средства.
29.1. АНТИБИОТИКИ
Антибиотики1 - это химические соединения биологического происхождения, оказывающие избирательное повреждающее или губительное действие на микроорганизмы. Антибиотики, применяемые в медицинской практике, продуцируются актиномицетами (лучистыми грибами), плесневыми грибами, а также некоторыми бактериями. К этой группе препаратов относят также синтетические аналоги и производные природных антибиотиков.
1 От греч. anti - против, bios - жизнь.
Существуют антибиотики с антибактериальным, противогрибковым и противоопухолевым действием.
В настоящем разделе будут рассмотрены антибиотики, влияющие преимущественно на бактерии. Они представлены следующими группами:
1. Антибиотики, имеющие в структуре β-лактамное кольцо Пенициллины Цефалоспорины Карбапенемы Монобактамы
2. Макролиды - антибиотики, структура которых включает макроциклическое лактонное кольцо (эритромицин и др.), и азалиды (азитромицин)
3. Тетрациклины - антибиотики, структурной основой которых являются 4 конденсированных 6-членных цикла (тетрациклин и др.)
4. Производные диоксиаминофенилпропана (левомицетин)
5. Аминогликозиды - антибиотики, содержащие в молекуле аминосахара (стреп- томицин, гентамицин и др.)
6. Антибиотики из группы циклических полипептидов (полимиксины)
7. Линкозамиды (клиндамицин)
8. Гликопептиды (ванкомицин и др.)
9. Фузидиевая кислота
10. Антибиотики для местного применения Фюзафюнжин и др.
По спектру противомикробного действия антибиотики различаются довольно существенно. Одни влияют преимущественно на грамположительные бактерии (биосинтетические пенициллины, макролиды), другие - в основном на грамотрицательные бактерии (например, полимиксины, азтреонам). Ряд антибиотиков обладают широким спектром действия (тетрациклины, цефалоспорины, левомицетин, аминогликозиды и др.), включающим грамположительные и грамотрицательные бактерии и ряд других возбудителей инфекций (табл. 29.1; рис. 29.1).
Таблица 29.1. Основной механизм и характер противомикробного действия ряда антибиотиков
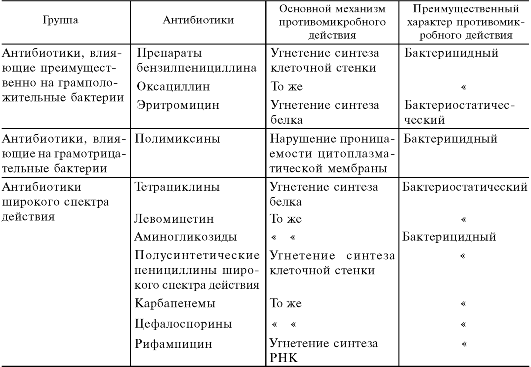
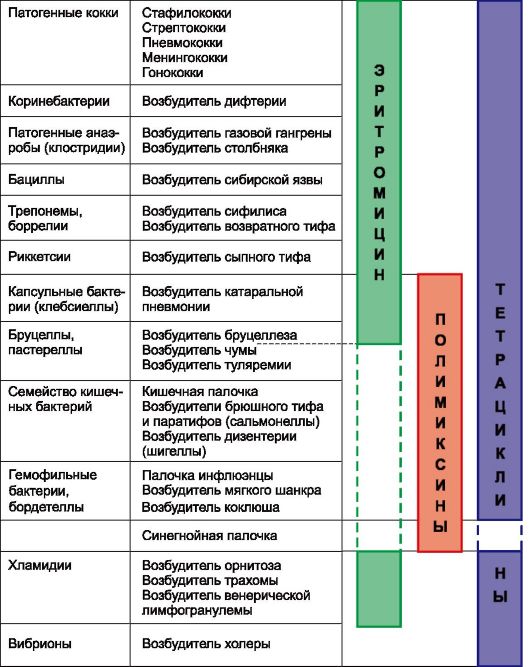
Рис. 29.1. Примеры антибиотиков с разными спектрами антибактериального действия.
Антибиотики воздействуют на микроорганизмы, подавляя их размножение (бактериостатический эффект) либо вызывая их гибель (бактерицидный эффект).
Известны следующие основные механизмы противомикробного действия антибиотиков (рис. 29.2):
1) нарушение синтеза клеточной стенки бактерий (по такому принципу действуют пенициллины, цефалоспорины);
2) нарушение проницаемости цитоплазматической мембраны (например, полимиксинами);
3) нарушение внутриклеточного синтеза белка (так действуют тетрациклины, левомицетин, аминогликозиды и др.);
4) нарушение синтеза РНК (рифампицин).
Высокая избирательность действия антибиотиков на микроорганизмы при относительно малой их токсичности в отношении макроорганизма, очевидно, объясняется особенностями структурной и функциональной организации микробных клеток. Действительно, клеточная стенка бактерий по химическому составу принципиально отличается от мембран клеток млекопитающих. Состоит клеточная стенка бактерий из мукопептида муреина (содержит N-ацетил-глюкозамин, N-аце- тил-мурамовую кислоту и пептидные цепочки, включающие некоторые L- и
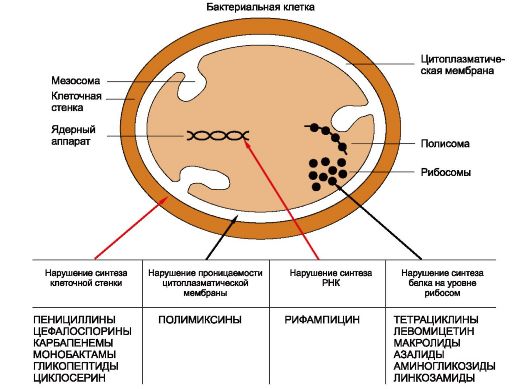
Рис. 29.2. Основные механизмы противомикробного действия ряда антибиотиков.
D-аминокислоты). В связи с этим вещества, нарушающие ее синтез (например, пенициллины), оказывают выраженное противомикробное действие и практически не влияют на клетки макроорганизма. Определенную роль, возможно, играет неодинаковое количество мембран, окружающих те активные центры, с которыми могут взаимодействовать антибиотики. Так, в отличие от микроорганизмов у клеток млекопитающих, помимо общей плазматической мембраны, все внутриклеточные органеллы имеют свои, иногда двойные мембраны. По-видимому, важное значение принадлежит различиям в химическом составе отдельных клеточных компонентов. Следует учитывать также существенные различия в темпе роста и размножения клеток макро- и микроорганизмов, а следовательно, и скорости синтеза их структурных материалов. В целом проблема избирательности действия антибиотиков, как и других противомикробных средств, нуждается в дальнейшем изучении.
В процессе использования антибиотиков к ним может развиваться устойчивость микроорганизмов. Особенно быстро она возникает по отношению к стрептомицину, олеандомицину, рифампицину, относительно медленно - к пенициллинам, тетрациклинам и левомицетину, редко - к полимиксинам. Возможна так называемая перекрестная устойчивость, которая относится не только к применяемому препарату, но и к другим антибиотикам, сходным с ним по химическому строению (например, ко всем тетрациклинам). Вероятность развития устойчивости уменьшается, если дозы и длительность введения антибиотиков оптимальны, а также при рациональной комбинации антибиотиков. Если к основному антибиотику возникла устойчивость, его следует заменить другим, резервным1 антибиотиком.
1 Резервные антибиотики по одному или по ряду свойств уступают основным антибиотикам (обладают меньшей активностью либо более выраженными побочными эффектами, большей токсичностью или быстрым развитием резистентности к ним микроорганизмов). Поэтому их назначают лишь при устойчивости микроорганизмов к основным антибиотикам или при непереносимости последних.
Хотя антибиотики и характеризуются высокой избирательностью действия, тем не менее они оказывают целый ряд неблагоприятных влияний на макроорганизм. Так, при использовании антибиотиков нередко возникают аллергические реакции немедленного и замедленного типа (сывороточная болезнь, крапивница, ангионевротический отек, анафилактический шок, контактные дерматиты и др.).
Кроме того, антибиотики могут обладать побочным эффектом неаллергической природы. Результат прямого раздражающего действия антибиотиков - диспепсические явления (тошнота, рвота, диарея), болезненность в месте внутримышечного введения препарата, развитие флебита и тромбофлебита при внутривенных инъекциях антибиотиков. Неблагоприятные эффекты возможны также со стороны печени, почек, кроветворения, слуха, вестибулярного аппарата и др. (примеры приведены в табл. 29.2).
Таблица 29.2. Возможные неблагоприятные влияния ряда антибиотиков
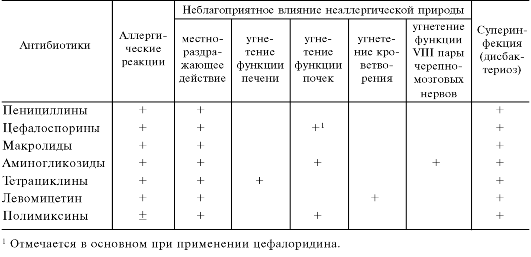
Для многих антибиотиков типично развитие суперинфекции (дисбактериоз), которая связана с подавлением антибиотиками части сапрофитной флоры, например, пищеварительного тракта. Последнее может благоприятствовать размножению других микроорганизмов и грибов, нечувствительных к данному антибиотику (дрожжеподобных грибов, Clostridium difficile, протея, синегнойной палочки, стафилококков). Наиболее часто суперинфекция возникает на фоне лечения антибиотиками широкого спектра действия.
Несмотря на большое распространение антибиотиков в медицинской практике, поиски новых, более совершенных препаратов этого типа ведутся в довольно значительных масштабах. Усилия исследователей направлены на создание таких антибиотиков, которые бы в максимальной степени сочетали положительные качества и были лишены отрицательных свойств. Такие «идеальные» препараты должны обладать высокой активностью, выраженной избирательностью действия, необходимым противомикробным спектром, бактерицидным характером действия, проницаемостью через биологические мембраны (в том числе через гематоэнцефалический барьер), эффективностью в разных биологических средах. Они не должны вызывать быстрое развитие устойчивости у микроорганизмов и сенсибилизацию макроорганизма. Отсутствие побочных эффектов, минимальная токсичность и большая широта терапевтического действия - все это также относится к числу основных требований, предъявляемых к новым антибиотикам. Кро-

А.ФЛЕМИНГ (1881-1955). В

ЗИНАИДА ВИССАРИОНОВНА ЕРМОЛЬЕВА (1898-1974).
Автор первого отечественного пенициллина (1942).
ме того, важно, чтобы препараты антиби- отиков были технически доступны для изготовления на фармацевтических пред- приятиях и имели низкую стоимость.
29.1.1. ПЕНИЦИЛЛИНЫ
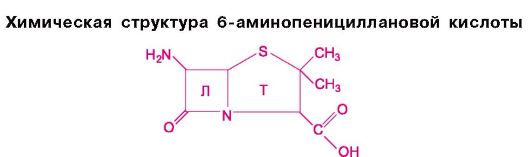
В настоящее время группа пенициллинов представлена большим количеством препаратов. Часть из них получают из культуральной среды, на которой произрастают определенные штаммы плесневых грибов (Penicillium), являющихся продуцентами пенициллина. Это так называемые биосинтетические пенициллины. Кроме того, путем химической модификации 6-аминопенициллановой кислоты, являющейся структурной основой биосин- тетических пенициллинов, создан ряд полусинтетических пенициллинов. На раз- личиях в путях получения пенициллинов, а также на ряде других признаков и осно- вывается приводимая классификация.
I. Препараты пенициллинов, получаемые путем биологического синтеза (биосинтетические пенициллины)
Для парентерального введения (разруша- ются в кислой среде желудка)
а) Непродолжительного действия Бензилпенициллина натриевая соль Бензилпенициллина калиевая соль
б) Продолжительного действия Бензилпенициллина новокаиновая соль
Бициллин-1 Бициллин-5 Для энтерального введения (кислотоустойчивы)
Феноксиметилпенициллин
II. Полусинтетические пенициллины
Для парентерального и энтерального введения (кислотоустойчивы)
а) Устойчивые к действию пенициллиназы
Оксациллина натриевая соль Нафциллин
б) Широкого спектра действия
Ампициллин Амоксициллин
Для парентерального введения (разрушаются в кислой среде желудка) Широкого спектра действия, включая синегнойную палочку
Карбенициллина динатриевая соль
Тикарциллин
Азлоциллин Для энтерального введения (кислотоустойчивы)
Карбенициллин инданил натрий
Карфециллин
Пенициллины оказывают бактерицидное действие. Они влияют только на делящиеся клетки. Механизм антибактериального эффекта связан с нарушением синтеза компонентов клеточной стенки. Считают, что пенициллины нарушают поздние этапы синтеза клеточной стенки, препятствуя образованию пептидных связей за счет ингибирования фермента транспептидазы.
а) Биосинтетические пенициллины
Существует несколько разновидностей природных пенициллинов, образующихся плесневыми грибами. В практической медицине большое распространение получил бензилпенициллин, выпускаемый в виде ряда солей.
В производственных условиях бензилпенициллин получают на жидких питательных средах в так называемых ферментаторах. Продуцентами его являются определенные штаммы Penicillium.
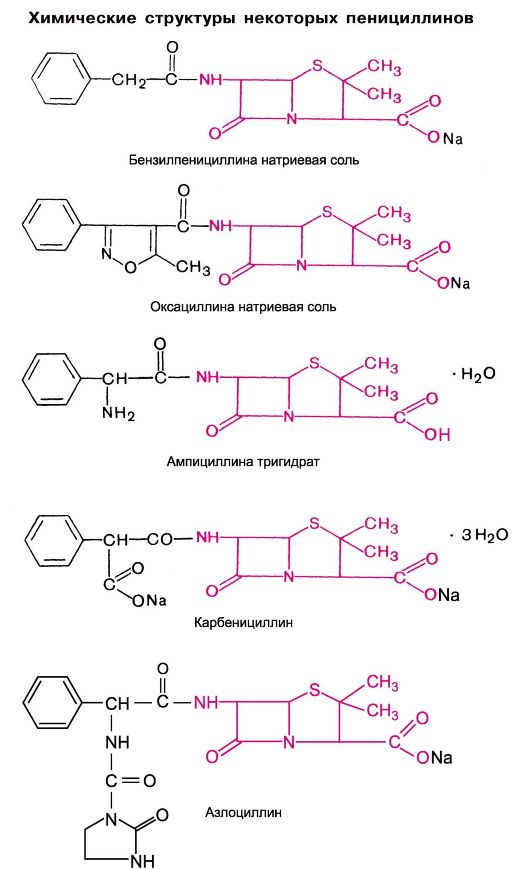
Бензилпенициллин является одноосновной кислотой, в структуру которой входят β-лактамный (л) и тиазолидиновый (т) циклы [см. структуру в разделе б)]. По своей природе это циклический дипептид (L-цистеина и D-валина).
Активность бензилпенициллина (как и других антибиотиков) может быть определена методом диффузии в агар. При этом на чашки Петри с агаром наносят бензилпенициллин в разных концентрациях (в стеклянные цилиндры или на лунки) и определяют зоны задержки роста тест-культуры для испытуемых образцов по сравнению со стандартом. Одна единица действия (1 ЕД) соответствует активность 0,6 мкг чистого кристаллического бензилпенициллина (в виде натриевой соли).
Бензилпенициллин обладает высокой антибактериальной активностью, но спектр его действия ограничен. Препарат относится к антибиотикам, действующим преимущественно на грамположительные бактерии (рис. 29.3). К нему чувствительны грамположительные кокки (стафилококки, не продуцирующие пенициллиназу, стрептококки, пневмококки), грамотрицательные кокки (менингококки, гонококки), палочки дифтерии (коринебактерии), сибиреязвенные палочки, возбудители газовой гангрены и столбняка (клостридии), спирохеты (в том числе бледная спирохета), некоторые патогенные грибы (например, актиномицеты). К бензилпенициллину резистентны семейство кишечных бактерий, кислотоустойчивые микобактерии туберкулеза, вирусы, риккетсии, простейшие, дрожжеподобные грибы.
Все соли бензилпенициллина предназначены для парентерального применения, так как они разрушаются в кислой среде желудка.
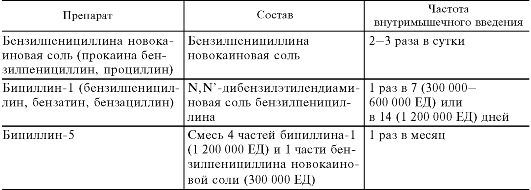
Хорошо растворимые бензилпенициллина натриевая и калиевая соли действуют относительно кратковременно (3-4 ч). Последним объясняется необходимость частых инъекций препаратов, что существенно осложняет их применение. В связи с этим возникла идея создания длительно действующих препаратов бензилпенициллина. Исследования развивались в двух направлениях. Одно из них основывалось на том, что бензилпенициллин выделяется из организма глав-
ным образом почками путем секреции эпителием почечных канальцев. Были синтезированы соединения (например, пробенецид), которые угнетают процесс секреции и тем самым задерживают бензилпенициллин в организме, пролонгируя его действие. Однако эффективность таких веществ ограничена и с этой целью они практически не применяются (см. главу 25).
В качестве длительно действующих препаратов большее значение приобрели плохо растворимые соли бензилпенициллина (бензилпенициллина новокаиновая соль, бициллины). Их вводят внутримышечно, и они медленно всасываются из места введения. Создание депо препаратов в мышечной ткани позволяет поддерживать необходимые концентрации антибиотиков в крови длительное время (табл. 29.3). Через гематоэнцефалический барьер в обычных условиях препараты бензилпенициллина не проникают.
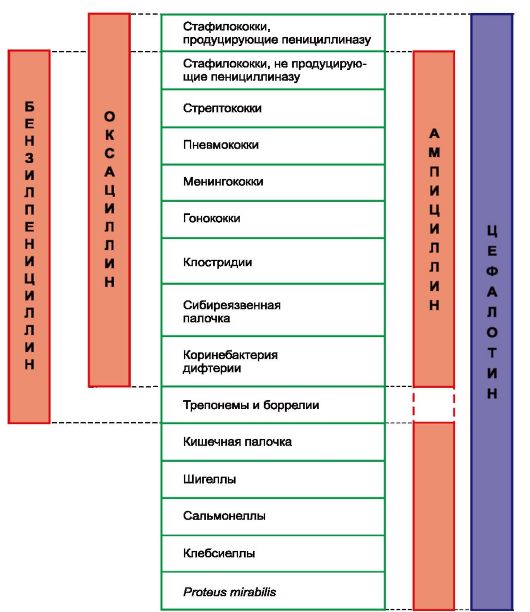
Рис. 29.3. Основной спектр действия некоторых пенициллинов и цефалоспоринов.
Таблица 29.3. Препараты бензилпенициллина длительного действия
б) Полусинтетические пенициллины
Значительные возможности усовершенствования пенициллинов открылись с выделением их структурной основы - 6-аминопенициллановой кислоты.
Получают 6-аминопенициллановую кислоту путем ферментативного расщепления (имидазами) бензилпенициллина, а также путем его химического деацилирования.
Химические модификации 6-аминопенициллановой кислоты проводились за счет присоединения разнообразных радикалов к аминогруппе. Исследования были направлены на создание обладающих определенными свойствами полусинтетических пенициллинов (табл. 29.4):
а) устойчивых к действию пенициллиназы (β-лактамазы), продуцируемой рядом микроорганизмов;
б) кислотоустойчивых препаратов, эффективных при введении внутрь;
в) пенициллинов широкого спектра действия.
Важным шагом явилось получение пенициллинов, устойчивых к пенициллиназе1. К полусинтетическим пенициллинам, обладающим таким свойством, относятся оксациллина натриевая соль, диклоксациллин и некоторые другие. Ценность этих препаратов определяется тем, что они эффективны в отношении штаммов стафилококков, устойчивых к бензилпенициллину (благодаря выработке этими штаммами пенициллиназы).
У оксациллина устойчивость к пенициллиназе сочетается со стойкостью в кислой среде. По спектру противомикробного действия он аналогичен бензилпенициллину. Значительная часть связывается с белками плазмы крови (> 90%). Через гематоэнцефалический барьер препарат не проникает. Выделяется главным образом почками. Периодичность введения - каждые 4-6 ч.
К группе препаратов, устойчивых к действию пенициллиназы, относится также нафциллин, обладающий высокой антибактериальной активностью и проникающий через гематоэнцефалический барьер. Выделяется он в основном с желчью, в меньшей степени - почками. Вводят энтерально и парен- терально.
Полусинтетические пенициллины широкого спектра действия подразделяются на следующие группы:
I. Препараты, не влияющие на синегнойную палочку
Аминопенициллины
Ампициллин Амоксициллин
1 β-Лактамазы, издавна существовавшие бактериальные ферменты, являются основной защитой грамотрицательных микроорганизмов против β-лактамных антибиотиков. В процессе применения этой группы антибиотиков β-лактамазы стали чаще вырабатываться многими штаммами Staphylococcus aureus, что ранее наблюдалось у этих бактерий очень редко. Кроме того, продуцентами β-лактамаз стали Haemophilus influenzae и Neisseria gonorrhoeae, которые раньше вообще не вырабатывали этот фермент. В процессе создания новых β-лактамных антибиотиков была отмечена модификация имеющихся β-лактамаз, «приспосабливающихся» к более эффективной инактивации новых препаратов. В настоящее время описано более 100 разновидностей β-лактамаз. Исходя из первичной структуры их часто подразделяют на 4 группы (А, В, С и D). Группы А, В и D имеют в своем составе остаток серина, а группа В представляет металло-β-лактамазы. Ингибитор β-лактамаз кислота клавулановая неодинаково влияет на разные группы ферментов. Наиболее эффективно ингибирует группу А β-лактамаз, в небольшой степени подавляет группу D. Активность β-лактамаз групп В и С не изменяет.
Таблица 29.4. Сравнительная оценка ряда пенициллинов
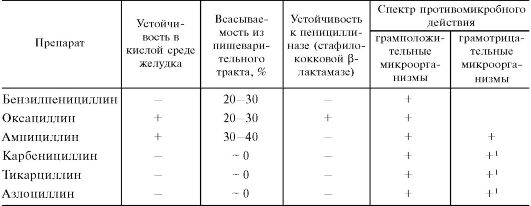
1 Активен в отношении синегнойной палочки (Pseudomonas aeruginosa) и разных видов протея - как индолположительных (P. vulgaris, P. morganii, P. rettgeri), так и индолотрицательных (P. mirabilis).
Примечание. Плюс - наличие, минус - отсутствие определенного свойства.
II. Препараты, активные в отношении синегнойной палочки Карбоксипенициллины Карбенициллин Тикарциллин Карфециллин Уреидопенициллины Пиперациллин Азлоциллин Мезлоциллин
Одним из аминопенициллинов, широко применяемых в медицинской практике, является ампициллин. Он влияет не только на грамположительные, но и на грамотрицательные микроорганизмы (сальмонеллы, шигеллы, некоторые штаммы протея, кишечную палочку, палочку Фридлендера, палочку инфлюэнцы). В отношении грамположительных бактерий он уступает по активности бензилпенициллину (как и все другие полусинтетические пенициллины), но превосходит оксациллин. Разрушается пенициллиназой и поэтому неэффективен в отношении пенициллиназообразующих стафилококков. Ампициллин кислотоустойчив. Из желудочно-кишечного тракта всасывается не полностью (биодоступность ~ 40%) и медленно. С белками плазмы крови связывается в небольшой степени (10-30%). Через гематоэнцефалический барьер проникает лучше, чем оксациллин. В основном выводится почками. Вводят ампициллин с интервалом 4-8 ч. Препарат малотоксичен и хорошо переносится больными.
Выпускается комбинированный препарат ампиокс (ампициллин с оксациллином).
Амоксициллин аналогичен по активности и спектру действия ампициллину, но абсорбируется из кишечника более полно. Вводят его только энтерально.
Перечисленные полусинтетические пенициллины широкого спектра действия, активные в отношении синегнойной палочки, разрушаются пенициллиназой.
Карбенициллин (пиопен) по противомикробному спектру действия сходен с ампициллином. Отличается от него тем, что активно действует на все виды протея и синегнойную палочку (Pseudomonas aeruginosa).
В кислой среде желудка препарат разрушается; всасывается в незначительной степени. Поэтому его вводят внутримышечно и внутривенно. Около 50% препа-
рата связывается с белками плазмы крови. Через гематоэнцефалический барьер он проникает плохо. Выделяется почками (секрецией и фильтрацией) и частично печенью. Продолжительность действия 4-6 ч.
Создан новый препарат - карбенициллин инданил натрий, обладающий кислотоустойчивостью и предназначенный для энтерального введения (при инфекциях мочевыводящих путей).
Препараты карфециллин и тикарциллин аналогичны по своим свойствам карбенициллину. Карфециллин в отличие от карбенициллина кислотоустойчив и вводится внутрь. Тикарциллин несколько активнее карбенициллина, особенно по влиянию на синегнойную палочку.
Антибактериальная активность уреидопенициллинов сходна с таковой карбоксипенициллинов. В отношении Klebsiella более эффективны уреидопенициллины. По влиянию на синегнойную палочку препараты можно расположить в следующий ряд (по убывающей активности): азлоциллин = пиперациллин > мезлоциллин = тикарциллин > карбенициллин.
Важной проблемой является преодоление резистентности ряда микроорганизмов к β-лактамным антибиотикам, которая обусловлена способностью опреде- ленных штаммов продуцировать β-лактамазы. Исходя из этих данных, были синтезированы специфические ингибиторы β-лактамаз (клавулановая кислота, сульбактам, тазобактам), препятствующим деструкции указанной группы антибиотиков. Ингибиторы β-лактамаз входят в состав ряда комбинированных препаратов (β-лактамные антибиотики + ингибиторы β-лактамаз).
Одним из широко применяемых препаратов является аугментин (амоксициллин + клавулановая кислота). Как уже отмечалось, амоксициллин - это бактерицидный β-лактамный антибиотик широкого спектра действия. Клавулановая кислота (продуцируемая Streptomyces clavuligerus) также относится к β-лактамным производным. Однако антибактериальное действие выражено у нее в очень не- большой степени. Основной эффект - конкурентное необратимое ингибирование ряда β-лактамаз. На β-лактамазы, продуцируемые некоторыми Enterobacte- riaceae, не действует.
Аугментин обладает широким антибактериальным спектром, включающим продуцирующие β-лактамазы грамположительные бактерии (стафилококки и большинство стрептококков, в том числе энтерококки) и грамотрицательные бактерии (N. gonorrhoeae, N. meningitidis, N. influenzae, Gardenella vaginalis, Bordetella pertussis, E. coli, Klebsiella pneumonia, Proteus mirabilis, Salmonella). Высокая эффек- тивность отмечена в отношении многих штаммов анаэробных бактерий, проду- цирующих β-лактамазы.
Вводится препарат обычно энтерально 1 раз в сутки. Всасывается хорошо (74- 92%). Биодоступность около 70%. Выводятся вещества и их метаболиты почками.
Применяется при инфекциях дыхательных путей, мочеполового тракта, при бактериальном поражении кожи и мягких тканей, костей, суставов, при септических состояниях.
Созданы и другие комбинированные препараты: уназин (ампициллин + сульбактам), амоксиклав (амоксициллин + клавулановая кислота), тазоцин (пиперациллин + тазобактам) и пр.
Синтезирован «атипичный» препарат пенициллина певмециллинам, действующий преимущественно на грамотрицательные бактерии. Является пролекарством. В организме из него образуется мециллинам. Назначают препарат внутрь, однако всасывается он плохо.
Полусинтетические пенициллины оксациллин, диклоксациллин, нафциллин являются препаратами выбора при инфицировании стафилококками, продуцирующими пенициллиназу, т.е. устойчивыми к бензилпенициллину. Оксациллин вводят внутрь и внутримышечно, нафциллин - внутрь, внутримышечно и внутривенно.
Ампициллин, обладающий широким спектром действия, представляет наибольший интерес в качестве средства для лечения заболеваний, вызванных грамотрицательными микроорганизмами или смешанной флорой. Его применяют внутрь при инфекциях мочевыводящих, желчных, дыхательных путей, желудочно-кишечного тракта, в случае гнойной хирургической инфекции. Натриевую соль ампициллина (пентрексил) вводят внутримышечно и внутривенно. Амоксициллин имеет аналогичные показания к применению. Вводят его энтерально.
Карбенициллин, карфециллин, тикарциллин, азлоциллин и другие препараты этой группы особенно показаны при инфекциях, вызванных синегнойной палочкой, протеем, кишечной палочкой (при пиелонефрите, пневмонии, септицемии, перитоните и др.).
в) Побочное и токсическое действие пенициллинов
Токсичность пенициллинов низкая, широта терапевтического действия большая. К основным побочным эффектам относятся аллергические реакции, которые наблюдаются у значительного числа больных (1-10%)1. Они связаны с образованием в организме антител. Обычно аллергические реакции возникают через несколько дней после начала применения пенициллина. Однако эти сроки колеблются в широких пределах (от минут до недель). Корреляции между дозой пенициллинов, временем, необходимым для развития аллергических реакций, и степенью их выраженности не отмечено. Последняя может быть различной. В ряде случаев аллергические реакции ограничиваются кожными высыпаниями, дерматитом, лихорадкой. Более тяжелые формы сопровождаются отеком слизистых оболочек, артритом, артралгией, поражением почек, эритродермией и другими нарушениями. Тяжелой и быстро развивающейся аллергической реакцией, иногда со смертельным исходом, является анафилактический шок2 (падает артериальное давление, возможны бронхоспазм, боли в области живота, отек мозга, потеря сознания и многие другие проявления).
Лечение аллергических реакций заключается в отмене препаратов пенициллина, а также во введении глюкокортикоидов (оказывают выраженное противовоспалительное и десенсибилизирующее действие), противогистаминных средств (блокируют гистаминовые Н1-рецепторы и устраняют эффекты гистамина, играющего важную роль в развитии аллергических реакций), кальция хлорида и ряда других средств. При анафилактическом шоке внутривенно вводят адреномиметики, стимулирующие α- и β-адренорецепторы (повышают артериальное давление, устраняют бронхоспазм), адреналина гидрохлорид (является препаратом выбора) или эфедрина гидрохлорид, а также гидрокортизон, димедрол, кальция хлорид.
Кроме того, пенициллины вызывают некоторые побочные и токсические эффекты неаллергической природы. К ним относится раздражающее действие пе-
1 Аллергические реакции на препараты пенициллина возникают также у применяющего их медицинского персонала и у лиц, занятых в их производстве и расфасовке.
2 Наступает обычно в течение 20 мин после инъекции препаратов пенициллина.
нициллинов. При приеме препаратов внутрь они могут вызывать воспаление слизистой оболочки языка (глоссит), ротовой полости (стоматит), тошноту, диарею. Внутримышечное введение может сопровождаться болевыми ощущениями, развитием инфильтратов и асептического некроза мышцы, а внутривенное - флебитом и тромбофлебитом.
При использовании чрезмерно высоких доз натриевой соли бензилпенициллина (особенно эндолюмбально) возможно нейротоксическое действие (арахноидит, энцефалопатия). Это осложнение иногда возникает и при назначении препарата на фоне почечной недостаточности.
Токсическое действие пенициллинов в отдельных случаях отрицательно сказывается на деятельности сердца. В единичных наблюдениях отмечено угнетающее влияние оксациллина на ферменты печени. Прием кислотоустойчивых пенициллинов (особенно широкого спектра действия, например ампициллина) может быть причиной дисбактериоза (чаще кандидамикоза).
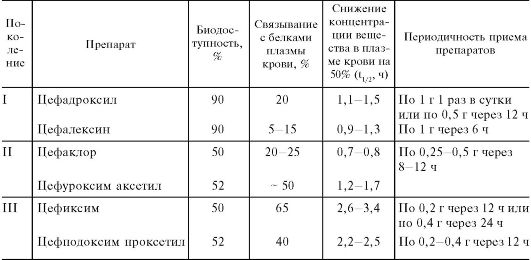
29.1.2. ЦЕФАЛОСПОРИНЫ
Из гриба Cephalosporinum acremonium был выделен ряд антибиотиков, в том числе цефалоспорин С. Его полусинтетические производные получили название «цефалоспорины». К ним относятся цефалотин, цефалексин, цефаклор, цефотаксим, цефуроксим, цефоперазон, цефепим, цефтриаксон и др. (табл. 29.5; см. рис. 29.3). Химической основой этих соединений является 7-аминоцефало- спорановая кислота.
Таблица 29.5. Цефалоспорины1
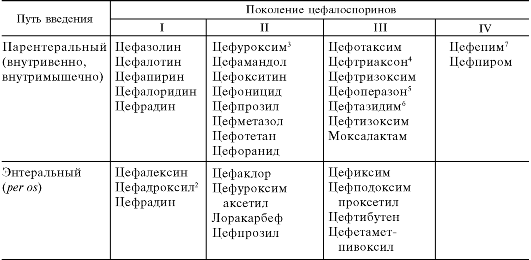
1 Приведен ряд типичных препаратов. Об остальных см. в специальной литературе и справочниках.
2 Синоним: дурацеф.
3 Синонимы: препарат для инъекций (цефуроксим натрия) - зинацеф, препарат для энтерального введения (цефуроксим аксетил) - зиннат.
4 Синоним: роцефин.
5 Синоним: цефобид.
6 Синоним: фортум.
7 Синоним: максипим.
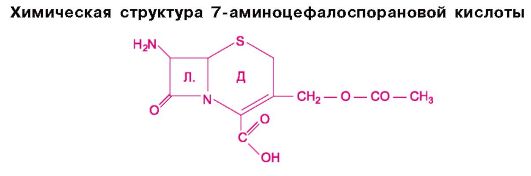
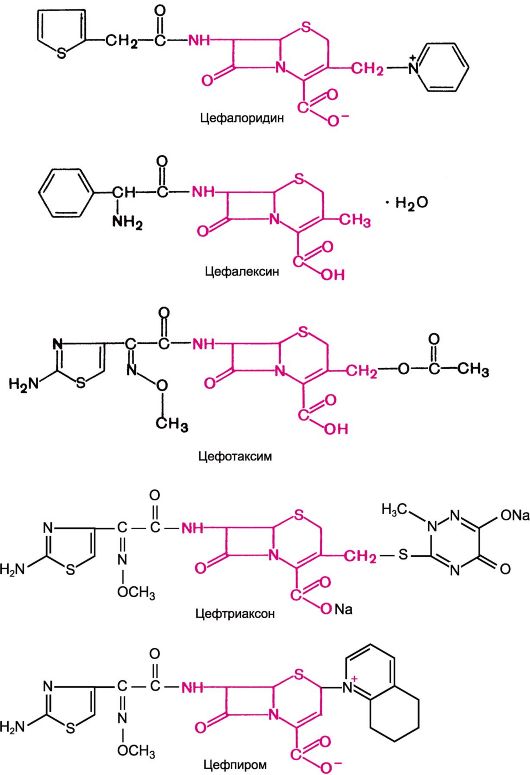
По строению цефалоспорины сходны с пенициллинами (см. химические структуры). Так, обе группы антибиотиков содержат β-лактамное кольцо (л). Однако имеются и существенные различия: структура пенициллинов включает тиазолидиновое кольцо, а цефалоспоринов - дигидротиазиновое (д).
Действуют цефалоспорины бактерицидно, что связано с их угнетающим влиянием на образование клеточной стенки. Аналогично пенициллину они угнетают активность фермента транспептидазы, участвующей в биосинтезе клеточной стенки бактерий.
По противомикробному спектру цефалоспорины относятся к антибиотикам широкого спектра действия. Они устойчивы к стафилококковой пенициллиназе, но многие из цефалоспоринов разрушаются β-лактамазами, продуцируемыми некоторыми грамотрицательными микроорганизмами (например, Pseudomonas aeruginosa, Enterobacter aerogenes; нередко этот тип β-лактамаз называют цефалоспориназами).
Цефалоспорины условно подразделяют на 4 поколения (табл. 29.6). Представители I поколения особенно эффективны в отношении грамположительных кокков (пневмококков, стрептококков, стафилококков). К ним чувствительны и некоторые грамотрицательные бактерии (Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis). Они практически не действуют на синегнойную палочку, Enterobacter, Serratia marcescens, индолположительные протеи, бактероиды (Bacteroides fragilis).
Спектр действия цефалоспоринов II поколения включает таковой для препаратов I поколения и дополняется Enterobacter, индолположительными протеями. Ряд препаратов эффективен также в отношении Bacteroides fragilis и некоторых штаммов Serratia (цефокситин, цефметазол, цефотетан). Все препараты этой группы менее активны, чем препараты I поколения, по влиянию на грамположительные кокки. Синегнойная палочка нечувствительна к ним.
Для III поколения цефалоспоринов характерен более широкий спектр действия, особенно в отношении грамотрицательных бактерий. На грамположительные кокки они действуют в меньшей степени, чем цефалоспорины II поколения. Для цефтазидима и цефоперазона отмечено выраженное действие на Pseudomonas aeruginosa. Цефотаксим также действует на этот возбудитель, но в небольшой степени. Цефтизоксим и моксалактам обладают антибактериальной активностью в отношении Bacteroides fragilis. Эта группа цефалоспоринов действует на Enterobacter, Serratia, а также на штаммы Haemophilus и Neisseria, продуцирующие β-лактамазы. Важным свойством большинства цефалоспоринов III поколения (кроме цефоперазона и цефиксима) является их способность проникать через гематоэнцефалический барьер.
У цефалоспоринов IV поколения еще более широкий противомикробный спектр, чем у препаратов III поколения. Они более эффективны в отношении грамположительных кокков. Обладают высокой активностью в отношении синегнойной палочки и других грамотрицательных бактерий, включая штаммы, продуцирующие β-лактамазы. На бактероиды влияют незначительно.
Таблица 29.6. Спектр противомикробного действия ряда цефалоспоринов
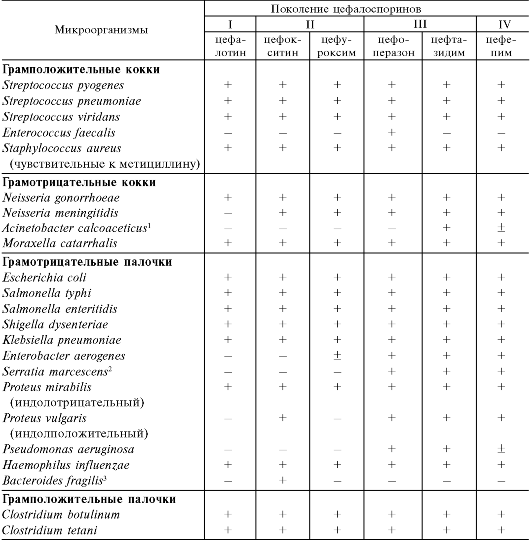
1 Acinetobacter spp. - условно-патогенные грамотрицательные бактерии; возбудители гнойновоспалительных заболеваний (сепсис, эндокардит, абсцессы, инфекции мочевыводящих путей и др.).
2 Serratia marcescens (Bacterium prodigiosum) - условно-патогенные грамотрицательные бактерии; возбудители гнойно-воспалительных заболеваний (раневая инфекция, остеомиелит, инфекции дыхательных и мочевыводящих путей и др.).
3 Bacteroides fragilis - неспорообразующие анаэробные грамотрицательные бактерии; возбудители гнойных послеоперационных осложнений, сепсиса, абсцессов (легких, мозга и др.). Примечание. Плюс - чувствительны; (?) - не всегда чувствительны; минус - устойчивы.
Исходя из путей введения, цефалоспорины подразделяют на 2 группы (см. табл. 29.5):
1. Для парентерального применения
Цефалотин Цефуроксим Цефотаксим Цефепим и др.
2. Для энтерального применения Цефалексин Цефаклор Цефиксим и др.
Большинство цефалоспоринов плохо всасываются из пищеварительного тракта. Однако часть препаратов абсорбируется достаточно хорошо, и поэтому их вводят энтерально. Биодоступность последних соответствует 50-90%. Они накапливаются в крови в бактерицидных концентрациях, что и обеспечивает необходимый фармакотерапевтический эффект.
Через гематоэнцефалический барьер препараты I и II поколения практически не проходят. Вместе с тем, как уже отмечалось, многие цефалоспорины III поколения проникают в ткани мозга.
В крови цефалоспорины частично связываются с белками плазмы (табл. 29.7). Большинство препаратов выделяются почками (путем фильтрации и секреции), отдельные препараты - преимущественно с желчью в кишечник (цефоперазон, цефтриаксон).
Время «полужизни» (t1/2) и режим дозирования различаются для конкретных препаратов разных поколений. Для общей ориентировки см. данные, приведенные в табл. 29.7.
Таблица 29.7. Фармакокинетика ряда цефалоспоринов для энтерального введения
Иногда цефалоспорины комбинируют с ингибитором β-лактамаз сульбактамом. Это повышает их эффективность при лечении бактериальных инфекций. Одним из таких препаратов является сульперазон (цефоперазон + сульбактам).
Применяют цефалоспорины при заболеваниях, вызванных грамотрицательными микроорганизмами (например, при инфекциях мочевых путей), при инфицировании грамположительными бактериями в случае неэффективности или непереносимости пенициллинов. При катаральной пневмонии (возбудитель - палочка Фридлендера - Klebsiella pneumoniae) цефалоспорины являются препаратами выбора. При инфекциях, связанных с синегнойной палочкой, назначают цефтазидим и цефоперазон. Препаратом выбора при гонорее является цефтриаксон. Для лечения менингита, вызванного менингококками или пневмококками, следует использовать препараты, которые проходят через гематоэнцефалический барьер, например цефуроксим, цефалоспорины III поколения (кроме цефоперазона и цефиксима). Ряд препаратов (цефокситин, цефтизоксим) эффективен при инфицировании бактероидами (Bacteroides fragilis).
Химические структуры некоторых цефалоспоринов
Цефалоспорины у значительного процента больных вызывают аллергические реакции. Иногда отмечается перекрестная сенсибилизация с пенициллинами. Из неаллергических осложнений возможно поражение почек (наблюдается в основном при использовании цефалоридина и цефрадина). Может возникать небольшая лейкопения. Кроме того, многие препараты вызывают местное раздражающее действие (особенно цефалотин). В связи с этим при внутримышечном введении могут возникать боль, инфильтраты, а при внутривенном - флебиты. Следует также учитывать возможность суперинфекции. Энтерально применяемые препараты могут вызывать диспепсические явления. При назначении некоторых препаратов (цефоперазон и др.) иногда отмечается гипопротромбинемия.
29.1.3. ПРОЧИЕ АНТИБИОТИКИ, ИМЕЮЩИЕ В СТРУКТУРЕ β-ЛАКТАМНОЕ КОЛЬЦО
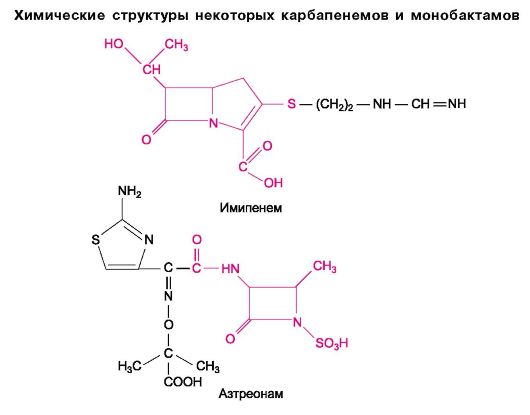
Карбапенемы
К этой группе относится имипенем - высокоактивный полусинтетический антибиотик с широким спектром действия. Он является производным тиенамицина, продуцируемого Streptomyces cattleya. Эффективен в отношении многих аэробных и анаэробных бактерий. Угнетает синтез клеточной стенки и благодаря этому оказывает бактерицидное действие. Устойчив к β-лактамазам, но разрушается дегидропептидазой-1 проксимальных почечных канальцев. Последним объясняется низкая концентрация препарата в моче. Для устранения этого недостатка имипенема был синтезирован ингибитор дегидропептидазы-1, получивший название циластатин. В настоящее время имипенем применяется в сочетании с циластатином. Один из таких комбинированных препаратов - тиенам (примаксин). Вводят его внутривенно с интервалом 6 ч. В желудочно-кишечном тракте имипенем не всасывается. Из побочных эффектов возможны тошнота, рвота, судороги, аллергические реакции.
К группе карбапенемов относится также антибиотик меропенем (меронем). От имипенема он отличается значительной устойчивостью к дигидропептида- зе-1, и потому не требуется его сочетание с ингибиторами этого фермента. Стабилен в отношении большинства β-лактамаз. По механизму, характеру и спектру противомикробного действия аналогичен имипенему. t1/2 ~ 1,5 ч. Около 2% связывается с белками плазмы крови. Хорошо проникает через тканевые барьеры. Метаболизируется в печени. Выводится в основном (~ 98%) почками. Применяется при тяжелых инфекциях различной локализации: пневмонии, перитоните, менингите, сепсисе. Препарат показан также в случае обострения хронического бактериального бронхита, при неосложненной инфекции мочевыводящих путей, кожи и ее придатков. Вводят внутримышечно и внутривенно через 8 или 12 ч.
Из побочных эффектов возможны аллергические реакции, раздражающее действие в месте введения, диспепсические явления, обратимые нарушения лейкопоэза, головная боль, дисбактериоз.
Монобактамы
К этой группе относится препарат азтреонам, выделенный из культуры Chromobacterium vialaceum. Устойчив в отношении β-лактамаз, продуцируемых рядом грамотрицательных бактерий, относящихся к группам Klebsiella, Pseudomonas, Serratia. На грамположительные бактерии и анаэробы он не действует. Угнетает синтез клеточной стенки и благодаря этому оказывает бактерицидный эффект. Вводят азтреонам парентерально. t1/2 ~ 1,7 ч. Выводится почками (секрецией). Применяют при инфекциях мочевыводящего тракта, дыхательных путей, кожи и др. Из побочных эффектов отмечаются диспепсические нарушения, кожные аллергические реакции, головная боль, возможна суперинфекция, редко гепатотоксическое действие.
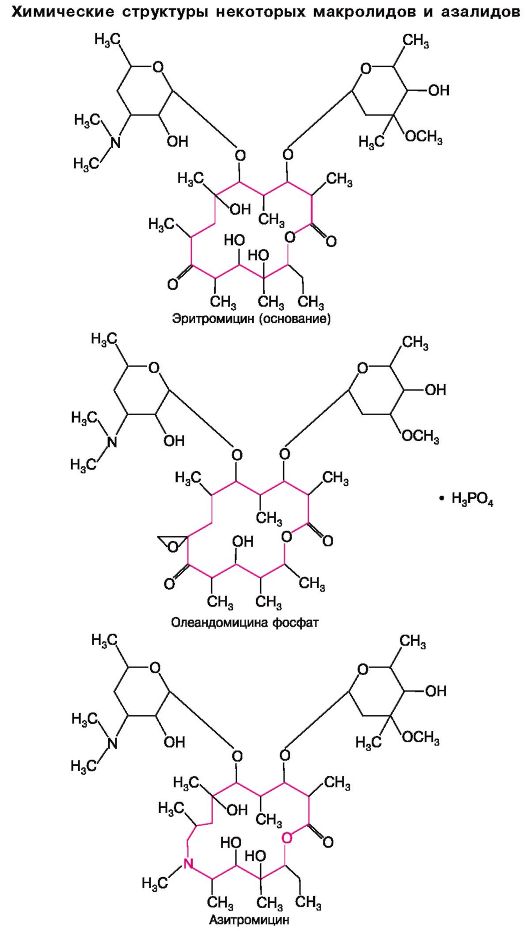
29.1.4. МАКРОЛИДЫ И АЗАЛИДЫ
Антибиотики этой группы в основе своей молекулы содержат макроциклическое лактонное кольцо, связанное с различными сахарами. Представителями макролидов являются эритромицин, олеандомицин, рокситромицин, кларитромицин, а азалидов - азитромицин.
Эритромицин (эритран, эритроцин) продуцируется Streptomyces erythreus. Наиболее чувствительны к нему грамположительные кокки и патогенные спирохеты. Однако в спектр его действия входят также грамотрицательные кокки, палочки дифтерии, патогенные анаэробы, риккетсии, хламидии, микоплазмы, возбудители амебной дизентерии и др. (см. рис. 29.1). Таким образом, по влиянию на различные микроорганизмы эритромицин напоминает бензилпенициллин, но спектр его действия несколько шире.
Механизм действия эритромицина заключается в угнетении синтеза белка рибосомами бактерий. Связано это с угнетением фермента пептидтранслоказы.
Из желудочно-кишечного тракта препарат всасывается не полностью, но в достаточной степени для того, чтобы в крови и тканях создались бактериостатические концентрации. Следует учитывать, что в кислой среде желудка эритромицин частично разрушается, поэтому вводить его следует в кислотоустойчивых капсулах или в таблетках (драже) со специальным покрытием, обеспечивающим высвобождение эритромицина только в тонкой кишке. Препарат легко проникает в различные ткани, в том числе через плаценту. В значительных концентрациях накапливается в фагоцитах (как и другие макролиды). В ткани мозга в обычных условиях не поступает. Длительность действия 4-6 ч. Выделяется с желчью и частично почками.
Применение эритромицина ограничено, так как к нему быстро развивается устойчивость микроорганизмов. Поэтому его относят к антибиотикам резерва и используют в тех случаях, когда пенициллины и другие антибиотики оказываются неэффективными. Назначают эритромицин внутрь (основание эритромицина) и местно.
Эритромицин - малотоксичный антибиотик и относительно редко вызывает побочные эффекты. Иногда возникают диспепсические нарушения, аллергические реакции, возможна суперинфекция.
Аналогичными свойствами и показаниями к применению обладает олеандомицин. Продуцентом его является Streptomyces antibioticus. По активности олеандомицин уступает эритромицину. Спектр и механизм противомикробного действия у них сходны. Продолжительность действия олеандомицина примерно 6 ч. Токсичность низкая. Он обладает более выраженным раздражающим эффектом, чем эритромицин. Относится к антибиотикам резерва. В медицинской практике применяют внутрь олеандомицина фосфат (олеандоцин, ромицил).
Олеандомицина фосфат выпускают в сочетании с тетрациклином (олететрин) и с тетрациклина гидрохлоридом (сигмамицин, тетраолеан).
За последние годы в медицинскую практику внедрен ряд полусинтетических макролидов - кларитромицин, рокситромицин и др. По механизму действия они аналогичны эритромицину.
Кларитромицин (клацид) в 2-4 раза активнее эритромицина в отношении стафилококков и стрептококков. Эффективен при инфекциях, вызванных Micobacterium avium intracellulare и Helicobacter pylori.
Хорошо всасывается из желудочно-кишечного тракта, в том числе после приема пищи. В ткани мозга не проходит. Частично метаболизируется в печени с образованием активного метаболита. Выделяется почками. Действует более продолжительно, чем эритромицин. t1/2 для кларитромицина примерно в 3 раза больше, чем для эритромицина.
Эффективным полусинтетическим макролидом является также рокситроми- ц и н (рулид). Он обладает широким антибактериальным спектром действия. Хорошо всасывается при приеме внутрь.
Азалиды1 химически отличаются от макролидов, однако по основным свойствам сходны с ними. Один из препаратов этой группы, азитромицин (сумамед), в 2-4 раза менее активен по влиянию на стафилококки и стрептококки, чем эритромицин, но превосходит последний по влиянию на Haemophilus influenzae, а также на грамотрицательные кокки. Плохо всасывается в кишечнике, особенно при наличии пищевого содержимого. Для азитромицина характерно накопление в высоких концентрациях в клетках - он может превышать концентрации в плазме крови в 10-100 раз. Действует длительно. t1/2 = 2-4 дня (для эритромицина t1/2 = 2-5 ч). Через гематоэнцефалический барьер не проходит. Выделяется почками в неизмененном виде.
Принимают энтерально. Из побочных эффектов иногда отмечаются тошнота, диарея, редко возникает снижение слуха. Стоимость выше, чем эритромицина.
Получен новый антибиотик из группы макролидов - джозамицин (вильпрафен). Продуцируется Streptomyces narbonensis var. josamycetics. Основное отличие от других макролидов - более редкое развитие к нему резистентности микроорганизмов.
Следует отметить, что макролиды и азалиды эффективны в отношении облигатных внутриклеточных микроорганизмов - хламидий, микоплазм и легионелл, которые могут быть возбудителями так называемых «атипичных» пневмоний.
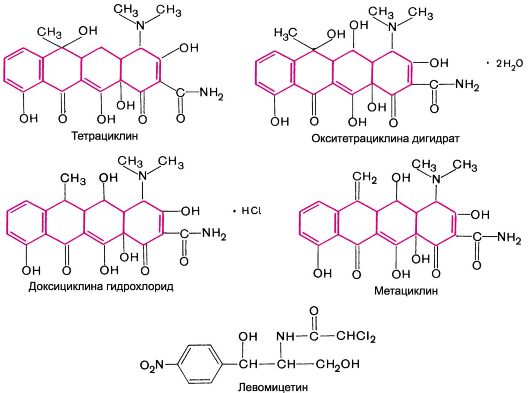
29.1.5. ТЕТРАЦИКЛИНЫ
Тетрациклины включают группу антибиотиков, структурную основу которых составляют 4 конденсированных 6-членных цикла (см. структуры). Биосинтетическим путем (ферментацией) получают следующие препараты: окситетрациклина дигидрат (террамицин, тетран, тархоцин) - продуцент Streptomyces rimosus, тетрациклин (десхлорбиомицин) - продуцент Streptomyces aureofaciens2. Демеклоциклин продуцируется мутантным штаммом Streptomyces aureofaciens. К числу
1 У макролидов группы эритромицина основой структуры является 14-членное кольцо с гетероатомом кислорода. У азалидов типа азитромицина имеется 15-членное кольцо с гетероатомами азота и кислорода. Антибиотик джозамицин (вильпрафен) содержит 16-членное лактонное кольцо.
2 Получают ферментативным путем из питательной среды с пониженным содержанием хлора.
полусинтетических тетрациклинов относятся метациклина гидрохлорид (рондомицин), доксициклина гидрохлорид (вибрамицин), миноциклин и др.
Тетрациклины обладают широким спектром действия (см. рис. 29.1). Они активны в отношении грамположительных и грамотрицательных кокков; возбудителей бациллярной дизентерии, брюшного тифа; патогенных спирохет; возбудителей особо опасных инфекций - чумы, туляремии, бруцеллеза, холеры; риккетсий; хламидий, некоторых простейших (возбудителей амебной дизентерии). На протеи, синегнойную палочку, истинные вирусы и патогенные грибы тетрациклины не действуют. По влиянию на грамположительные микроорга- низмы они уступают пенициллинам. Постепенно развивается устойчивость к тетрациклинам1.
Механизм их противомикробного действия связан с угнетением внутриклеточного синтеза белка рибосомами бактерий. Кроме того, тетрациклины связывают металлы (Mg2+, Ca2+), образуя с ними хелатные соединения, и ингибируют ферментные системы. Тетрациклины оказывают бактериостатическое влияние. Наиболее активны в отношении размножающихся бактерий. По активности все тетрациклины сходны.
Всасываются тетрациклины из желудка и тонкой кишки. Абсорбция неполная (особенно после приема пищи), но достаточная для того, чтобы обеспечить в организме бактериостатические концентрации. Максимальные концентрации в плазме крови при введении тетрациклинов внутрь достигаются через 2-4 ч.
Тетрациклины образуют хелатные соединения с ионами кальция, железом, алюминием, которые не абсорбируются. Поэтому всасывание тетрациклинов нарушается при содержании в пище этих ионов (например, ионов кальция в молоке и молочных продуктах) или веществ, в состав которых входят эти ионы (например, антацидные средства). В этом отношении особое место занимают доксициклин и миноциклин, которые лишь в небольшой степени образуют хелатные соединения с ионами кальция и поэтому наличие в пищеварительном тракте пищевых масс и ионов кальция не сказывается на их всасывании, которое происходит полно и быстро.
В циркулирующей крови значительная часть тетрациклинов связывается с белками плазмы (от 20 до 80%).
Наиболее продолжительно действуют демеклоциклин, доксициклин и метациклин. По длительности действия тетрациклины располагаются в следующем порядке: демеклоциклин > доксициклин > метациклин > окситетрациклин > тетрациклин.
Тетрациклины хорошо проникают через многие тканевые барьеры, в том числе через плацентарный. Определенные их количества проходят через гематоэнцефалический барьер. Однако при введении тетрациклинов внутрь бактериостатические их концентрации в ликворе обычно не накапливаются. Для этого требуется очень высокое содержание антибиотиков в крови, что легче достигается при парентеральном (особенно при внутривенном) введении препаратов (например, доксициклина гидрохлорида). Миноциклин практически не проникает в ткани мозга.
Небольшие количества тетрациклинов обнаруживаются в печени и костях в течение очень длительного времени.
1 Вырабатывается перекрестная устойчивость по отношению ко всем препаратам тетрациклинового ряда.
Выделяются тетрациклины с мочой и желчью. Часть выделяющихся с желчью тетрациклинов подвергается повторному всасыванию из тонкой кишки. Доксициклин выделяется преимущественно с желчью. В экскрементах определяется до 90% препарата.
Тетрациклины имеют широкие показания к применению. Они эффективны при риккетсиозах, сыпном тифе, пневмонии, вызванной микоплазмами, при инфицировании хламидиями (пневмонии, пситтакозе, трахоме и др.), при гонорее, сифилисе, возвратном тифе, бруцеллезе, туляремии, холере, при бациллярной и амебной дизентерии, при кокковой инфекции, лептоспирозах и т.д. Тетрациклины используют при развитии устойчивости микроорганизмов к пенициллинам и стрептомицину или при сенсибилизации больного к этим антибиотикам. Назначают их чаще внутрь с интервалом 4-8 ч. Кроме того, их растворимые соли вводят парентерально (внутривенно, внутримышечно, в полости тела). Под мозговые оболочки тетрациклины не инъецируют, так как у них выражено раздражающее действие. Местно их применяют чаще всего в мазях при заболеваниях глаз (особенно при трахоме).
Тетрациклины оказывают ряд неблагоприятных эффектов. Так, они могут вызывать аллергические реакции. При этом поражаются кожные покровы, возможна легкая лихорадка и др. Аллергические реакции на тетрациклины наблюдаются значительно реже, чем на пенициллины и цефалоспорины.
Из побочных эффектов неаллергической природы прежде всего следует отметить раздражающее действие (особенно выражено у окситетрациклина). При приеме препаратов внутрь оно является одной из основных причин диспепсических явлений (тошноты, рвоты, диареи), глоссита, стоматита и других нарушений со стороны слизистой оболочки пищеварительного тракта. Вследствие раздражающего действия внутримышечные инъекции болезненны, внутривенная инфузия может приводить к тромбофлебитам.
Химические структуры некоторых тетрациклинов и левомицетина
Тетрациклины обладают некоторой гепатотоксичностью (главным образом окситетрациклин). С осторожностью нужно назначать тетрациклины во второй половине беременности и детям. Связано это с тем, что тетрациклины депонируются в костной ткани, в том числе в тканях зубов, и образуют хелатные соединения с солями кальция. При этом формирование скелета нарушается, происходят окрашивание и повреждение зубов.
Одним из нежелательных эффектов тетрациклинов (особенно демеклоциклина) является их способность вызывать фотосенсибилизацию1 и связанные с ней дерматиты.
Типично для тетрациклинов влияние на обмен веществ. Они угнетают синтез белка (антианаболическое действие), увеличивают выведение из организма ионов натрия, воды, аминокислот, отдельных витаминов и ряда других соединений.
Миноциклин может вызывать вестибулярные расстройства.
Характерным осложнением при лечении тетрациклинами является суперинфекция. Будучи антибиотиками широкого спектра действия, тетрациклины подавляют сапрофитную флору пищеварительного тракта и благоприятствуют развитию кандидамикоза, суперинфекции стафилококками, протеем, синегнойной палочкой. Наибольшие опасения вызывают стафилококковые энтероколит и пневмония, которые могут протекать очень тяжело. Угнетение сапрофитной флоры является одной из причин развития у больных недостаточности витаминов группы В (сапрофиты участвуют в их синтезе), которая отягощает поражение сли- зистой оболочки пищеварительного тракта, вызываемое раздражающим действием тетрациклинов и суперинфекцией.
Для предупреждения и лечения кандидамикоза тетрациклины сочетают с противогрибковым антибиотиком нистатином. Кроме того, целесообразно одновременно с тетрациклинами назначать витамины группы В. Для подавления суперинфекции стафилококками, протеем или синегнойной палочкой используют противомикробные средства с соответствующим спектром действия.
Изредка может развиваться псевдомембранозный колит2, который лечат ванкомицином.
В связи с резистентностью микроорганизмов, развивающейся в отношении известных тетрациклинов, закономерны поиски новых производных этой группы. Одно из последних достижений связано с синтезом глицилциклинов. Перспективным соединением этого ряда является тигециклин. Относится к производным тетрациклина. Обладает высокой активностью в отношении грамотрицательных и грамположительных бактерий. Синегнойная палочка и протеи устойчивы к действию тигециклина. Препарат используется при неэфективности многих других антимикробных средств, связанной с развитием к ним резистентности.
29.1.6. ГРУППА ЛЕВОМИЦЕТИНА
Антибиотик левомицетин (см. химическую структуру) продуцируется Streptomyces venezuelae. Его получают из культуральной жидкости, а также синтетическим путем.
Левомицетин (хлорамфеникол) обладает широким спектром действия, в который входят грамположительные и грамотрицательные бактерии, в том числе
1От греч. phos (photos) - свет, лат. sensibilis - чувствительный.
2Одна из форм дисбактериоза, обусловленного токсинами Clostridium difficile.
семейство кишечных бактерий, палочки инфлюэнцы, а также риккетсии, хламидии, возбудители бруцеллеза, туляремии. К левомицетину мало или совсем нечувствительны кислотоустойчивые микобактерии, синегнойная палочка, протеи, простейшие.
Механизм противомикробного действия левомицетина связан с его влиянием на рибосомы и угнетением синтеза белка. Он также ингибирует пептидилтрансферазу. Проявляются эти влияния в основном бактериостатическим эффектом. Привыкание микроорганизмов к левомицетину развивается относительно медленно.
Из желудочно-кишечного тракта левомицетин всасывается хорошо. Максимальная концентрация в плазме создается примерно через 2 ч. Для поддержания бактериостатических концентраций в крови левомицетин назначают с интервалом 6 ч. Значительная часть антибиотика связывается с альбуминами плазмы. Левомицетин хорошо проникает в различные ткани, в том числе проходит через гематоэнцефалический барьер. В ликворе концентрация левомицетина в 2 раза меньше, чем в плазме. Основное его количество подвергается в печени химическим превращениям. Образующиеся при этом конъюгаты и около 10% неизмененного препарата выделяются почками.
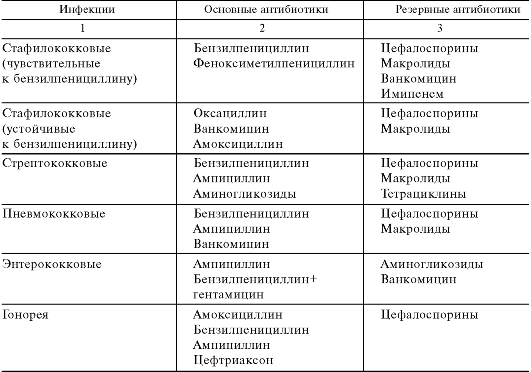
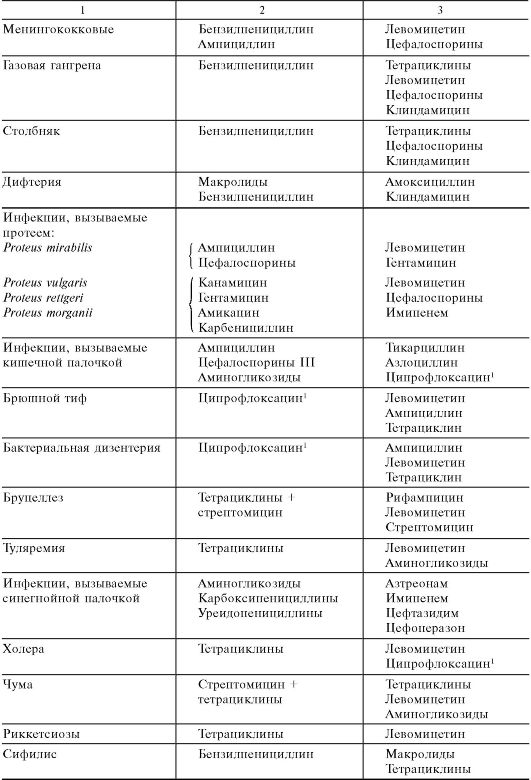
В связи с серьезными неблагоприятными эффектами в отношении кроветворения (см. ниже) левомицетин, как правило, относят к антибиотикам резерва; применяется он только при неэффективности других антибиотиков (табл. 29.8). Основные показания к его назначению: брюшной тиф, пищевые токсикоинфекции (сальмонеллезы) и риккетсиозы. Иногда его используют при заболеваниях, вызванных палочкой инфлюэнцы (например, при менингите, при инфицировании мочевыводящих путей), при бруцеллезе и ряде других инфекций.
Таблица 29.8. Некоторые показания к применению ряда основных и резервных антибиотиков
Продолжение табл. 29.8.
1 Синтетический антибактериальный препарат из группы фторхинолонов (см. главу 29.3).
Принимают левомицетин обычно внутрь. Растворы и линимент левомицетина используют местно1 . Для парентерального введения выпускают левомицетина сукцинат растворимый (хлороцид С). Вводят его подкожно, внутримышечно и внутривенно.
Как уже отмечалось, левомицетин может вызывать выраженное угнетение кроветворения, сопровождающееся ретикулоцитопенией, гранулоцитопенией и в тяжелых случаях апластической анемией, которая обычно заканчивается смертельным исходом2. Поэтому при применении левомицетина требуется регулярный контроль картины крови. Чтобы уменьшить возможность угнетения кроветворения, антибиотик следует назначать в течение возможно более короткого периода времени. Повторные курсы лечения не рекомендуются.
В ряде случаев отмечаются аллергические реакции в виде кожных высыпаний, лихорадки и др.
Из побочных эффектов неаллергической природы наиболее часто возникает раздражение слизистых оболочек (тошнота, диарея), в том числе аноректальный синдром (с соответствующей локализацией раздражения). Поражаются также кожные покровы (сыпь, дерматит). Иногда отмечаются психомоторные нарушения, угнетающее влияние на миокард.
Тяжелая интоксикация с сердечно-сосудистым коллапсом нередко возникает у новорожденных и на 1-м месяце жизни. Связано это с медленным выведением антибиотика почками и недостаточностью ферментов печени у детей в этот период.
При применении левомицетина может развиться суперинфекция (например, кандидамикоз, инфекция стафилококками, протеем).
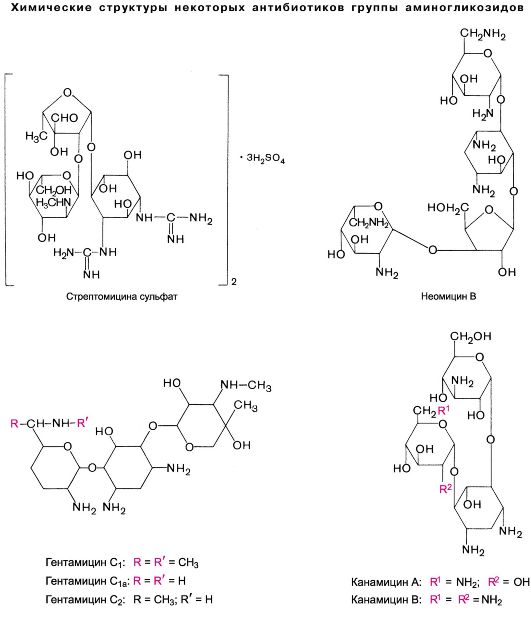
29.1.7. ГРУППА АМИНОГЛИКОЗИДОВ
Основными представителями этой группы антибиотиков являются стрептомицин, неомицин, канамицин, гентамицин, амикацин, тобрамицин, сизомицин, мономицин и др. (см. также главу 29.5).
Механизм действия аминогликозидов связывают с непосредственным их влиянием на рибосомы и угнетением синтеза белка. Для аминогликозидов характерен бактерицидный эффект.
Стрептомицин является антибиотиком, продуцируемым Actinomyces globisporus streptomycini. В медицинской практике применяется стрептомицина сульфат (см. химическую структуру). Активность стрептомицина определяется в единицах действия (ЕД) и в весовых единицах. 1 ЕД стрептомицина основания соответствует 1 мкг.
Стрептомицин имеет широкий спектр противомикробного действия. Наиболее важно его угнетающее влияние на микобактерии туберкулеза, возбудители туляремии, чумы. Кроме того, он губительно действует на патогенные кокки, некоторые штаммы протея, синегнойную палочку, бруцеллы и другие грамотрица-
1 Местно используют также синтомицин - синтетический рацемат левомицетина. Левомицетин является левовращающим изомером. Синтомицин состоит из левомицетина и правовращающего изомера. Последний противомикробной активностью не обладает.
2 Считают, что причиной тяжелых нарушений кроветворения, вызываемых левомицетином, является сенсибилизация или идиосинкразия (связана с генетически обусловленной энзимопатией). Вместе с тем левомицетин оказывает и прямое токсическое действие на костный мозг, зависящее от дозы вещества.
тельные и грамположительные бактерии. К стрептомицину нечувствительны анаэробы, спирохеты, риккетсии, вирусы, патогенные грибы, простейшие.
К этому антибиотику относительно быстро развивается привыкание. В ряде случаев наблюдается образование стрептомицинозависимых штаммов, для роста и размножения которых необходим стрептомицин.
Из желудочно-кишечного тракта препарат всасывается плохо. При внутримышечном введении через 1-2 ч стрептомицин накапливается в плазме крови в максимальных концентрациях. Распределяется он в основном экстрацеллюлярно. Проникает в полости брюшины и плевры, при беременности - в ткани плода. Через гематоэнцефалический барьер, как правило, не проходит; при менингите проницаемость гематоэнцефалического барьера для стрептомицина увеличивается. t1/2 ~ 2-4 ч. Выводится стрептомицин большей частью почками (путем фильтрации) в неизмененном виде. Незначительная часть выделяется с желчью в кишечник.
Применяют стрептомицина сульфат главным образом при лечении туберкулеза1. Кроме того, его используют при лечении туляремии, чумы, бруцеллеза, инфекций мочевыводящих путей, органов дыхания, а также при других заболеваниях. Вводят препарат чаще внутримышечно (1-2 раза в сутки), а также в полости тела. С целью воздействия на кишечную флору стрептомицина сульфат назначают внутрь. Для инъекции под оболочки мозга при менингите используют только стрептомицин-хлоркальциевый комплекс (двойная соль стрептомицина гидрохлорида и кальция хлорида). Последний оказывает меньшее раздражающее действие, чем другие препараты стрептомицина. Однако токсичность стрептомицин-хлоркальциевого комплекса значительная.
Отрицательные эффекты стрептомицина включают неаллергические и аллергические влияния. Наиболее серьезным является ототоксическое действие, связанное с повреждением чувствительных клеток вестибулярного органа и ушной улитки VIII пары черепных нервов. Возникают вестибулярные расстройства и снижение слуха. По мнению ряда авторов, назначение кальция пантотената уменьшает возможность возникновения указанных побочных эффектов. Стрептомицин обладает нефротоксичностью. Оказывает угнетающее влияние на нервно-мышечные синапсы, что может быть причиной угнетения дыхания. Кроме того, он обладает раздражающим эффектом, в связи с чем инъекции его болезненны.
При назначении препаратов стрептомицина отмечаются и аллергические реакции (лихорадка, кожные поражения, эозинофилия, редко анафилактический шок и др.). На фоне действия стрептомицина возможно развитие суперинфекции.
Неомицин представляет собой смесь антибиотиков неомицинов А, В и С, продуцируемых Actinomyces fradiae. Выпускается в виде препарата неомицина сульфата. Обладает широким спектром действия. К нему чувствительны как грамположительные, так и грамотрицательные микроорганизмы. На анаэробы, спирохеты, патогенные грибы и вирусы влияния не оказывает. Устойчивость микроорганизмов к неомицину развивается относительно медленно.
При приеме внутрь препарат всасывается плохо, поэтому его действие при таком пути введения ограничивается в основном пищеварительным трактом. Неомицин используют для лечения энтерита, вызванного чувствительными к нему
1Как правило, в сочетании с другими противотуберкулезными средствами (см. главу 29.5).
микроорганизмами. Рационально его применение при резистентности соответствующих возбудителей к другим антибиотикам. Неомицин может быть полезен при подготовке больных к операции на пищеварительном тракте (с целью частичной «стерилизации» кишечника). Положительным качеством является его высокая активность в отношении кишечной палочки, некоторых штаммов протея и синегнойной палочки. Из побочных эффектов возможны диспепсические нарушения, аллергические реакции, кандидамикоз.
Нередко неомицин применяют местно. Его назначают при лечении инфицированных ран, ряда кожных заболеваний (пиодермии и др.), заболеваний глаз (например, конъюнктивита) и т.д. С неповрежденной кожной поверхности и слизистых оболочек всасывается незначительно. Наружно неомицин в ряде случаев используют совместно с глюкокортикоидами (например, с синафланом или флу-
метазона пивалатом)1. При этом противомикробный эффект сочетается с противовоспалительным.
Парентерально неомицин не используют в связи с его высокой токсичностью в отношении почек (появляется белок в моче) и слухового нерва (возникают шум в ушах и снижение слуха вплоть до полной глухоты). Кроме того, неомицин обладает курареподобной активностью (может вызывать угнетение и остановку дыхания).
Препарат противопоказан при заболеваниях почек и слухового нерва.
Гентамицин продуцируется Micromonospora purpurea и M. echinospora. Выпускается в виде гентамицина сульфата (гарамицин).
Обладает широким спектром действия, включающим грамположительные и грамотрицательные бактерии. Наибольший практический интерес представляет его активность в отношении синегнойной палочки, протея, кишечной палочки, а также стафилококков, устойчивых к бензилпенициллину. Устойчивость к гентамицину развивается медленно.
Из желудочно-кишечного тракта препарат всасывается недостаточно полно, поэтому для системного действия его назначают внутримышечно. Максимальные количества гентамицина в плазме крови при этом пути введения накапливаются через 60 мин. Противомикробные концентрации сохраняются в организме в течение 8-12 ч. Через гематоэнцефалический барьер в обычных условиях гентамицин почти не проникает. При менингите в ликворе обнаруживаются небольшие его концентрации. Выделяется почками преимущественно в неизмененном виде.
Применяют гентамицин главным образом для лечения заболеваний, вызванных грамотрицательными бактериями. Особенно ценен препарат при инфекции мочевыводящих путей (пиелонефрите, цистите), сепсисе, раневой инфекции, ожогах. Пути введения: внутримышечно или наружно.
Гентамицин менее токсичен, чем неомицин. Однако основные неблагоприятные эффекты, типичные для аминогликозидов, наблюдаются и при использовании гентамицина. Одним из них является ототоксическое действие. В основном гентамицин поражает вестибулярную ветвь VIII пары черепных нервов. Слух страдает реже. Нефротоксичность также выражена в меньшей степени, чем у неомицина. Обладает курареподобными свойствами.
Группу аминогликозидов представляет также тобрамицин (бруламицин). Продуцируется Str. tenebrarius. Обладает широким спектром действия. Высокоактивен в отношении синегнойной палочки. Эффективные противомикробные концентрации после однократного введения сохраняются в течение 6-8 ч. Вводят препарат внутримышечно и внутривенно. Выделяется он преимущественно почками. Показания к применению аналогичны таковым для гентамицина и определяются спектром противомикробного действия. Обладает нефро- и ототоксичностью, но менее выраженной, чем у гентамицина.
К аминогликозидам относится также антибиотик сизомицин. Продуцируется Micromonospora inyoensis. Обладает широким спектром противомикробного действия, подобным таковому гентамицина. Активнее последнего в отношении разных видов протея, синегнойной палочки, клебсиелл, энтеробактера.
Устойчивость к сизомицину развивается медленно. Возникает также перекрестная устойчивость ко всем аминогликозидам.
1 Выпущены специальные мази «Локакортен-Н», «Синалар-Н» (Н обозначает наличие неомицина).
Из пищеварительного тракта препарат всасывается плохо, поэтому его вводят внутримышечно и внутривенно. Около 25% связывается с белками плазмы крови. Периодичность введения в клинических условиях 8 ч.
Показания к применению и побочные эффекты аналогичны таковым для гентамицина.
К числу наиболее эффективных аминогликозидов относится амикацин (амикин)1. Он является производным канамицина. Из всех аминогликозидов обладает наиболее широким спектром противомикробного действия, включающим аэробные грамотрицательные бактерии (в том числе синегнойную палочку, протей, клебсиеллы, кишечную палочку и др.) и микобактерии туберкулеза. На большинство грамположительных анаэробных бактерий не влияет. Устойчив к действию многих бактериальных ферментов, инактивирующих аминогликозиды. Обладает ототоксичностью и нефротоксичностью. Вводят амикацин внутримышечно и внутривенно.
29.1.8. ЦИКЛИЧЕСКИЕ ПОЛИПЕПТИДЫ (ПОЛИМИКСИНЫ И ДР.)
Полимиксины в химическом отношении представляют собой группу циклических полипептидов. В нашей стране используется полимиксин М (в виде сульфата), продуцируемый Bac. polymyxa Ross2.
У полимиксина М сульфата противомикробное действие выражено преимущественно в отношении грамотрицательных бактерий: синегнойной палочки, семейства кишечных бактерий (кишечной палочки, шигелл, сальмонелл), а также капсульных бактерий, пастерелл и бруцелл, палочек инфлюэнцы. К полимиксину М устойчивы патогенные кокки, протей, патогенные анаэробы, кислотоустойчивые микобактерии, палочка дифтерии и некоторые другие возбудители.
Механизм противомикробного действия связан с повреждающим влиянием полимиксина М на цитоплазматическую мембрану. Нарушая ее проницаемость, полимиксин М способствует выведению многих компонентов цитоплазмы в окружающую среду. Происходит лизис микроорганизмов. Бактерицидный эффект наблюдается как в состоянии покоя, так и в процессе роста и размножения бактерий. Действует полимиксин М только на внеклеточно расположенные микроорганизмы.
Устойчивость к полимиксину М развивается медленно, что является несомненным достоинством препарата.
Назначают полимиксина М сульфат внутрь (в кишечнике накапливаются высокие концентрации препарата; из желудочно-кишечного тракта он всасывается плохо) и местно. Парентерально его не применяют, так как при таком пути введения он вызывает тяжелые нейро- и нефротоксические нарушения. Энтерально препарат используют при энтероколите, вызванном синегнойной палочкой, кишечной палочкой, шигеллами, а также для санации кишечника перед операциями. Местно полимиксина М сульфат эффективен при лечении гнойных процессов, вызванных чувствительными к нему возбудителями (главным образом грамотрицательными микроорганизмами, включая синегнойную палочку).
1 Иногда аминогликозиды подразделяют на 3 группы:
1 поколение - стрептомицин, неомицин, мономицин, канамицин;
II поколение - гентамицин;
III поколение - тобрамицин, амикацин, сизомицин, нетилмицин.
2 В ряде других стран наибольшее распространение получили полимиксин В и полимиксин Е (колистин).
Побочные эффекты при энтеральном и местном применении полимиксина М сульфата возникают редко. При приеме внутрь возможны диспепсические явления, связанные с некоторым раздражающим действием препарата. Иногда возникает суперинфекция. Аллергических реакций практически не наблюдается.
Противопоказанием к назначению полимиксина М сульфата являются заболевания почек.
Учитывая выраженную нефротоксичность этого антибиотика, даже в случае применения его внутрь или местно необходимо систематически контролировать функцию почек.
Новый антибиотик даптомицин химически напоминает полимиксин. Относится к циклическим липопептидам. Является полусинтетическим антибиотиком, получаемым из продуктов ферментации Streptomyces roseosporus. Связывается с цитоплазматической мембраной бактерий, вызывая их гибель. Обладает бактерицидным действием на грамотрицательные и грамположительные бактерии. На анаэробные бактерии оказывает незначительное влияние.
Из побочных эффектов возможны тошнота, рвота, мышечные боли, миопатия и др. Вводят внутривенно. Применяется при неэффективности других антимикробных средств.
29.1.9. ЛИНКОЗАМИДЫ
К этой группе относится клиндамицин. Он является ингибитором синтеза белка бактерий и обычно действует бактериостатически. Активен главным образом в отношении анаэробов (Bacteroides fragilis и др.), стрептококков и стафилококков. Хорошо всасывается из кишечника. Через гематоэнцефалический барьер проникает плохо. Метаболизируются в печени. Выделяется почками и с желчью.
Применяется при инфекциях, вызванных бактероидами, особенно при поражении Bacteroides fragilis брюшной полости.
Наиболее опасный побочный эффект - псевдомембранозный колит (развиваются диарея со слизистыми и кровянистыми выделениями, боли в области живота, лихорадка). Это одно из проявлений дисбактериоза, связанного с действием токсина Clostridium difficile, которые могут находиться в кишечнике. Лечат это осложнение ванкомицином и метронидазолом. Редко отмечаются аллергические реакции, поражение печени, лейкопения.
29.1.10. ГЛИКОПЕПТИДЫ
Основным препаратом этой группы является ванкомицин, являющийся сложным гликопептидом. Он продуцируется актиномицетами Streptomyces orientalis. Нарушает синтез клеточной стенки бактерий и действует бактерицидно1. Обладает высокой активностью в отношении грамположительных кокков, включая стафилококки, устойчивые к метициллину, и штаммы, продуцирующие β-лактамазы; действует на клостридии, в том числе на Clostridium difficile, а также на коринебактерии. Из пищеварительного тракта всасывается плохо. Если требу- ется системное действие, препарат вводят внутривенно. Он проходит через гема- тоэнцефалический барьер, особенно при менингите.
1 Кроме того, имеются данные, что ванкомицин влияет на проницаемость цитоплазматической мембраны и синтез РНК.
Применяют ванкомицин при инфекциях, вызванных грамположительными кокками, устойчивыми к пенициллину, при энтероколитах, в том числе при псевдомембранозном колите.
Препарат токсичен, что ограничивает его применение. Он обладает ототоксичностью и нефротоксичностью, может вызывать флебиты. Редко возникают аллергические реакции, нейтропения, тромбоцитопения.
К этой же группе относится антибиотик тейкопланин. Аналогичен по свойствам ванкомицину. Действует длительно. Вводят один раз в сутки внутримышечно или внутривенно.
29.1.11. ФУЗИДИЕВАЯ КИСЛОТА
Это антибиотик с узким спектром действия. Применяется в виде натриевой соли. В основном влияет на грамположительные бактерии. Угнетает синтез белка бактерий. Действует бактериостатически. Хорошо всасывается при энтеральном введении. В значительных количествах накапливается в костной ткани. Метаболизируется в печени. Выделяется с желчью. Применяется при стафилококковых инфекциях, устойчивых к действию пенициллина, особенно при остеомиелите. Побочные эффекты: диспепсические явления, кожная сыпь, желтуха.
29.1.12. АНТИБИОТИКИ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ
Для местного воздействия предложен антибиотик фюзафюнжин (биопарокс), обладающий противомикробным и противовоспалительным эффектами. Продуцируется специальным штаммом грибов Fusarium lateritium WR. По химическому строению относится к пептидам. Выпускают препарат в виде аэрозоли для ингаляций. Он эффективен в отношении многих кокков, некоторых анаэробов, микоплазм, грибов рода Candida. Рекомендован для применения при инфекциях носоглотки и дыхательных путей. Из побочных эффектов иногда отмечается раздражающее действие.
Для местного применения предложен также антибиотик мупироцин (бактробан). Продуцируется он Pseudomonasfluorescens. Ингибирует синтез белка. В низких концентрациях оказывает бактериостатическое, а в высоких - бактерицидное действие. В незначительной степени всасывается с неповрежденной кожи (0,25-0,3%). Применяется накожно или интраназально в виде мази при поражении кожи и слизистой оболочки носовых ходов стафилококками (в том числе устойчивыми к метициллину) и β-гемолитическими стрептококками.
Препараты
Название | Средняя терапевтическая доза для взрослых; путь введения | Форма выпуска |
1 | 2 | 3 |
Бензилпенициллина натриевая соль - Benzylpenicillinum- natrium | Внутримышечно 250 000-500 000 ЕД; внутривенно медленно 1 000 000- 2 000 000 ЕД, капельно 2 000 000- 5 000 000 ЕД; эндолюмбально 5000- 10 000ЕД; ингаляционно 100 000 - 300 000 ЕД; в виде глазных капель, а также капель в нос и в ухо раство- | Флаконы по 250 000; 500 000 и 1 000 000 ЕД |
Продолжение табл.
1 | 2 | 3 |
ры, содержащие в 1 мл 10 000 - 100 000 ЕД; в полости растворы, содержащие в 1 мл 20 000 ЕД | ||
Бензилпенициллина калиевая соль - Benzylpenicillinum- kalium | Внутримышечно 250 000-500 000 ЕД; местно в растворах, содержащих в 1 мл 10 000-100 000 ЕД | Флаконы по 250 000; 500 000 и 1 000 000 ЕД |
Бензилпенициллина новокаиновая соль - Benzylpenicillinum- novocainum | Внутримышечно 300 000 ЕД | Флаконы по 300 000; 600 000 и 1 200 000 ЕД |
Бициллин-1 - Bicillinum-1 | Внутримышечно 300 000-600 000 ЕД 1 раз в неделю или 1 200 000 - 2 400 000 ЕД 1 раз в 2 нед | Флаконы по 300 000; 600 000; 1 200 000 и 2 400 000 ЕД |
Бициллин-5 - Bicillinum-5 | Внутримышечно 1 500 000 ЕД 1 раз в 4 нед | Флаконы по 1 500 000 ЕД |
Феноксиметилпенициллин - Phenoxyme- thylpenicillinum | Внутрь | Таблетки по 0,1 и |
Оксациллина натриевая соль - Oxacillinum- natrium | Внутрь, внутримышечно и внутривенно 0,25-0,5 г | Таблетки по 0,25 и 0,25 и |
Ампициллин - Ampicillinum | Внутрь | Таблетки и капсулы по |
Карбенициллина динатриевая соль - Car- benicillinum-dinatricum | Внутримышечно 1-1,5 г; внутривенно 4-5 г | Флаконы по |
Азлоциллин - Azlocillin | Внутримышечно и внутривенно по | Флаконы, содержащие порошок для внутримышечного введения, по 0,5; 1 и |
Цефалотина натриевая соль - Cefalotinum- natrium | Внутримышечно и внутривенно 4- 5г | Флаконы по |
Цефалексин - Cefalexinum | Внутрь 0,25-0,5 г | Капсулы по |
Цефаклор - Cefaclor | Внутрь по | Капсулы по 0,25 и |
Цефотаксим - Cefotaxim | Внутримышечно и внутривенно по 0,5-1 г | Флаконы по 0,5; 1 и |
Цефокситин - Cefoxitin | Внутривенно и внутримышечно по 1-2 г | Лиофилизированный порошок во флаконах по 1 и |
Эритромицин - Erythromycinum | Внутрь 0,1-0,25 г; наружно в полость конъюнктивы 1% мазь | Таблетки по 0,1 и |
Продолжение табл.
1 | 2 | 3 |
Олеандомицин - Oleandomycinum | Внутрь | Таблетки, покрытые оболочкой, по |
Рокситромицин - Roxithromycin | Внутрь | Таблетки по |
Азитромицин - Azithromycin | Внутрь 0,25-0,5 г | Капсулы по 0,125 и |
Имипенем - Imipenem | Внутривенно | |
Азтреонам - Aztreonam | Внутривенно и внутримышечно по 0,5-1 и | Флаконы по 0,5 и |
Тетрациклин - Tetracyclinum | Внутрь 0,2-0,25 г; в полость конъюнктивы 1% мазь | Таблетки, покрытые оболочкой, по 0,05; 0,1 и глазная мазь, содержащая |
Метациклина гидрохлорид - Methacyclini hydrochloridum | Внутрь | Капсулы по 0,15 и |
Левомицетин - Laevomycetinum | Внутрь 0,25-0,5 г; наружно 1 - 10% линимент; в полость конъюнктивы 0,25% раствор и 1% линимент | Таблетки по 0,25 и |
Синтомицин - Synthomycinum | Наружно 1-10% линимент; интравагинально | 1-5% и 10% линимент; суппозитории вагинальные по |
Стрептомицина сульфат - Streptomycini sul- fas | Внутримышечно | Флаконы по 0,25; 0,5 и |
Неомицина сульфат - Neomycini sulfas | Внутрь 0,1-0,2 г; наружно 0,5% раствор; 0,5% и 2% мазь | Таблетки по 0,1 и |
Амикацина сульфат - Amicacini sulfas | Внутримышечно и внутривенно | Флаконы по 0,1; 0,25 и |
Гентамицина сульфат - Gentamycini sulfas | Внутримышечно и внутривенно 0,0004 г/кг; накожно мазь или крем 0,1%; в глаз 0,3% раствор | Порошок по |
Полимиксина М сульфат - Polymyxini M sulfas | Внутрь 500 000 ЕД; наружно линимент, содержащий 10 000 ЕД в | Флаконы по 500 000 и 1 000 000 ЕД; таблетки по 500 000 ЕД; линимент в тубах по |
29.2. СУЛЬФАНИЛАМИДНЫЕ ПРЕПАРАТЫ
Сульфаниламиды были первыми химиотерапевтическими антибактериальными средствами широкого спектра действия, которые нашли применение в практической медицине. Химически они являются производными сульфаниламида (амида сульфаниловой кислоты).
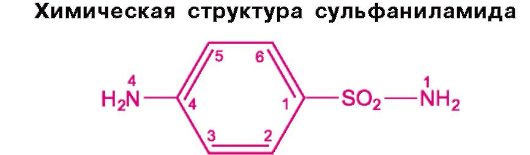
Создание наиболее эффективных, продолжительно действующих и менее токсичных сульфаниламидов основано на замещении атома водорода в амидной группе (у N1). Наличие свободной аминогруппы (-N4H2) в пара-положении обязательно для противомикробного действия. В связи с этим к замещению атомов водорода у N4 прибегают крайне редко; это допускается только в том случае, если в организме радикал отщепляется и аминогруппа высвобождается (например, у фталазола). Введение дополнительных радикалов в бензольный цикл снижает активность соединений.
Сульфаниламиды могут быть представлены следующими группами.
I. Препараты, применяемые для резорбтивного действия (хорошо всасывающиеся из желудочно-кишечного тракта)
A. Средней продолжительности действия (4-6 ч)
Сульфадимезин Этазол Сульфазин Уросульфан
Б. Длительного действия (12-24 ч) Сульфапиридазин Сульфадиметоксин
B. Сверхдлительного действия (>7 дней)
Сульфален
II. Препараты, действующие в просве- те кишечника (плохо всасывающиеся из желудочно-кишечного тракта)
Фталазол
III. Препараты для местного приме- нения
Сульфацил-натрий Сульфазина серебряная соль Спектр действия сульфаниламидов довольно широк. Он включает в основном следующие возбудители инфекций:
а) бактерии - патогенные кокки (грам- положительные и грамотрицательные), кишечная палочка, возбудители дизентерии (шигеллы), холерный вибрион, возбудители

Г. ДОМАГК (1895-1964). В
газовой гангрены (клостридии), возбудители сибирской язвы, дифтерии, катаральной пневмонии, инфлюэнцы;
б) хламидии - возбудители трахомы, орнитоза, паховой лимфогранулемы;
в) актиномицеты;
г) простейшие - возбудитель токсоплазмоза, плазмодии малярии.
Особенно активны сульфаниламиды в отношении пневмококков, менингококков, гонококков, некоторых типов гемолитических стрептококков, а также возбудителей бактериальной дизентерии.
Механизм противомикробного действия сульфаниламидов связан с их конкурентным антагонизмом с пара-аминобензойной кислотой. Последняя включается в структуру дигидрофолиевой кислоты, которую синтезируют многие микроорганизмы. В тканях человека этого не происходит, так как эти ткани утилизируют уже готовую дигидрофолиевую кислоту, чем, по-видимому, и объясняется избирательность противомикробного действия сульфаниламидов. Благодаря химическому сходству с пара-аминобензойной кислотой сульфаниламиды препятствуют ее включению в дигидрофолиевую кислоту. Кроме того, они конкурентно угнетают дигидроптероатсинтетазу. Нарушение синтеза дигидрофолиевой кислоты уменьшает образование из нее тетрагидрофолиевой кислоты, которая необходима для синтеза пуриновых и пиримидиновых оснований (схема 29.1). В результате угнетается синтез нуклеиновых кислот, вследствие чего рост и размножение микроорганизмов подавляются (бактериостатический эффект). При длительном применении сульфаниламидов к ним постепенно развивается устойчивость микроорганизмов. Высказывается предположение, что это может быть связано с повышением интенсивности синтеза микроорганизмами дигидрофолиевой кислоты. Следует учитывать, что устойчивость возникает ко всем сульфаниламидам (т.е. развивается перекрестная устойчивость).
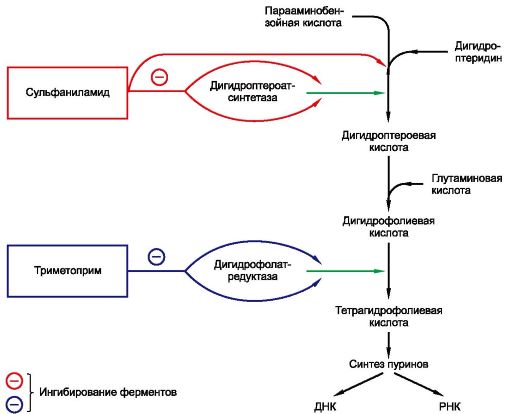
Схема 29.1. Локализация действия сульфаниламидов и триметоприма.
29.2.1. СУЛЬФАНИЛАМИДЫ ДЛЯ РЕЗОРБТИВНОГО ДЕЙСТВИЯ
Препараты этой группы быстро и полно всасываются из желудочно-кишечного тракта. Сульфаниламиды частично связываются с альбуминами плазмы. Распределяются по всем тканям, в том числе проходят через гематоэнцефалический барьер, плаценту, накапливаются в серозных полостях тела. Основной путь превращения сульфаниламидов в организме - ацетилирование (по N4), которое происходит в печени. Образующиеся при этом соединения лишены антибактериальной активности. Некоторые ацетилированные производные хуже растворяются, чем исходные сульфаниламиды, и могут быть причиной образования в моче кристаллов (кристаллурии). Степень ацетилирования разных препаратов неодинакова. Меньше всего ацетилируются уросульфан, сульфацил-натрий, этазол. Выделяются сульфаниламиды и их метаболиты главным образом почками путем фильтрации. Часть сульфаниламидов подвергается реабсорбции. Небольшие количества веществ выводятся кишечником, потовыми и слюнными железами.
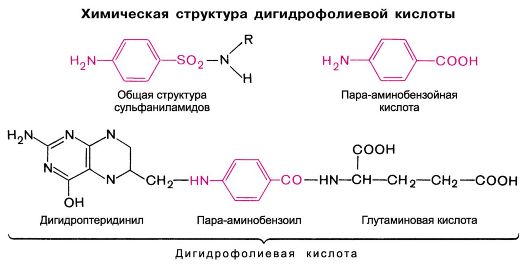
Сульфаниламиды, предназначенные для резорбтивного действия, различаются преимущественно по длительности антибактериального эффекта. Препараты средней продолжительности действия хорошо всасываются и относительно быстро выделяются. При их энтеральном введении максимальные концентрации в плазме создаются через 2-3 ч. Для поддержания бактериостатических концентраций их назначают через 4-6 ч.
Из сульфаниламидов средней продолжительности действия наиболее часто используют сульфадимезин (сульфаметазин), этазол (сульфаэтилтиадиазол), сульфазин (сульфадиазин), уросульфан (сульфакарбамид). К этой же группе относится стрептоцид (стрептоцид белый, сульфаниламид). Однако в настоящее время стрептоцид практически не применяют, так как он менее активен и чаще, чем другие сульфаниламиды, вызывает побочные эффекты.
К препаратам длительного действия относятся сульфапиридазин (сульфаметоксипиридазин, спофадазин) и сульфадиметоксин (мадрибон, мадроксин). Они хорошо всасываются из желудочно-кишечного тракта, но медленно выводятся. Максимальные концентрации их в плазме крови определяются через 3-6 ч.
Длительное сохранение в организме бактериостатических концентраций препаратов, по-видимому, зависит от их эффективной реабсорбции в почках. Может иметь значение и выраженная степень связывания с белками плазмы крови (например, для сульфапиридазина она соответствует примерно 85%).
Таким образом, при использовании препаратов длительного действия в организме создаются стабильные концентрации вещества. Это является несомненным преимуществом препаратов при антибактериальной терапии. Однако если возникают побочные явления, продолжительный эффект играет отрицательную роль, так как при вынужденной отмене вещества должно пройти несколько дней, прежде чем закончится его действие.
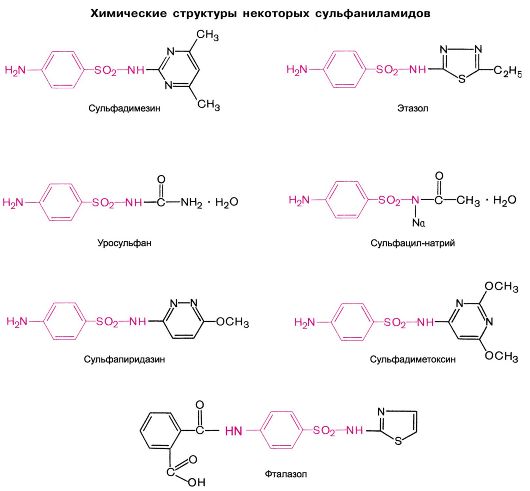
Следует учитывать также, что концентрация сулфапиридазина и сульфадиметоксина в спинномозговой жидкости невелика (5-10% от концентрации в плазме крови). Этим они отличаются от сульфаниламидов средней продолжительности действия, которые накапливаются в ликворе в довольно больших количествах (50- 80% от концентрации в плазме).
Назначают сульфапиридазин и сульфадиметоксин 1-2 раза в сутки.
Препаратом сверхдлительного действия является сульфален (келфизин, сульфаметоксипиразин), который в бактериостатических концентрациях задерживается в организме до 1 нед.
По противомикробной активности сульфаниламиды значительно уступают антибиотикам, поэтому сфера их применения довольно ограничена. Их назначают главным образом при непереносимости антибиотиков или развитии привыкания к ним. Нередко сульфаниламиды комибинируют с некоторыми антибиотиками.
Сульфаниламиды для резорбтивного действия1 применяют при кокковых инфекциях, особенно при менингококковом менингите, заболеваниях органов дыхания, при инфекции мочевыводящих и желчевыводящих путей и др.
Для лечения инфекций мочевых путей (при пиелонефрите, пиелите, цистите) особенно показан уросульфан, который быстро выделяется почками, преимущественно в неизмененном виде (т.е. в активной форме), при этом в моче создаются высокие его концентрации. Отрицательного влияния на функцию почек уросульфан практически не оказывает.
Препараты длительного действия наиболее целесообразно использовать при хронических инфекциях и для профилактики инфекций (например, в послеоперационном периоде).
При резорбтивном действии сульфаниламиды вызывают много побочных эффектов. При их применении могут наблюдаться диспепсические явления (тошнота, рвота), головная боль, слабость, нарушения со стороны ЦНС, поражения системы крови (гемолитическая анемия, тромбоцитопения, метгемоглобинообразование). Возможна кристаллурия. Вероятность выпадения кристаллов в почках можно уменьшить путем введения больших объемов жидкостей, особенно щелочных (так как кислая среда благоприятствует выпадению в осадок сульфаниламидов и их ацетилированных производных).
Аллергические реакции относительно редки, но тем не менее они иногда возникают и выраженность их может быть различной. Наблюдаются кожная сыпь, лихорадка, иногда гепатит, агранулоцитоз, апластическая анемия. Наличие в анамнезе аллергических реакций на сульфаниламиды является противопоказанием к их повторному применению.
29.2.2. СУЛЬФАНИЛАМИДЫ, ДЕЙСТВУЮЩИЕ В ПРОСВЕТЕ КИШЕЧНИКА
Основным отличием этих препаратов является их плохая всасываемость из желудочно-кишечного тракта, поэтому в просвете кишечника создаются высокие их концентрации. Наиболее часто используют фталазол (фталилсульфатиазол, талисульфазол). Из кишечника препарат всасывается в незначительной степени. В моче обнаруживается лишь 5% от введенного вещества. Противомикробное действие фталазола развивается после отщепления фталевой кислоты (от N4) и высвобождения аминогруппы. В итоге действует выделяющийся при этом нор- сульфазол.
Применяют фталазол при лечении кишечных инфекций - бациллярной дизентерии, энтероколита, колита, для профилактики кишечной инфекции в послеоперационном периоде. Учитывая, что микроорганизмы при этих заболеваниях локализуются не только в просвете, но и в стенке кишечника, фталазол целесообразно сочетать с хорошо всасывающимися сульфаниламидами (сульфадимезином, этазолом и др.). Часто фталазол комбинируют с антибиотиками (например, с тетрациклинами). Принимают его через каждые 4-6 ч. Переносится фталазол хорошо. Токсичность у него низкая. Применение фталазола желательно
1 Созданы препараты, сочетающие в своей структуре фрагменты сульфаниламида и салициловой кислоты. К ним относятся салазосульфапиридин (сульфасалазин), салазопиридазин (салазодин), салазодиметоксин. В тканях организма из них высвобождаются 5-аминосалициловая кислота и сульфаниламидный компонент (соответственно сульфапиридин, сульфапиридазин и сульфадиметоксин). Все эти препараты обладают антибактериальным и противовоспалительным эффектами. Показания к применению: неспецифический язвенный колит и болезнь Крона (гранулематозный колит).
сочетать с витаминами группы В. Это целесообразно в связи с подавлением фталазолом роста и размножения кишечной палочки, участвующей в синтезе этих витаминов.
Для лечения кишечных инфекций используют и ряд других плохо всасывающихся препаратов - сульгин (сульфагуанидин), фтазин.
29.2.3. СУЛЬФАНИЛАМИДЫ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ
Местно сульфаниламиды применяют для лечения и профилактики инфекций глаз. С этой целью чаще всего используют растворимый в воде сульфацил-натрий. Он достаточно эффективен и не оказывает раздражающего действия. Его применяют для лечения и профилактики гонорейного поражения глаз у новорожденных и взрослых, при конъюнктивите, блефарите1, язвах роговицы и др.
Сульфаниламиды могут быть использованы при раневой инфекции (обычно путем припудривания ран). При этом следует учитывать, что в присутствии гноя, раневого отделяемого, некротических масс, содержащих большие количества пара-аминобензойной кислоты, сульфаниламиды мало или совсем неэффективны. Их следует применять только после первичной обработки раны или в условиях «чистой» раны.
Синтезирована сульфазина серебряная соль (сульфаргин), имеющая в своей молекуле атом серебра. Препарат применяется только местно при ожоговых ранах. Высвобождающееся из препарата серебро усиливает противомикробное действие сульфазина и способствует заживлению ран. Входит в состав мази «Сульфаргин».
29.2.4. КОМБИНИРОВАННЫЕ ПРЕПАРАТЫ СУЛЬФАНИЛАМИДОВ С ТРИМЕТОПРИМОМ
Представляет интерес сочетание сульфаниламидов с препаратами, которые, угнетая дигидрофолатредуктазу, блокируют переход дигидрофолиевой кислоты в тетрагидрофолиевую. К таким веществам относится триметоприм.
Угнетающее действие подобной комбинации, проявляющееся на двух разных этапах биосинтеза прекурзоров нуклеиновых кислот, существенно повышает противомикробную активность - эффект становится бактерицидным.
Направленность действия сульфаниламидов и триметоприма см. на схеме 29.1.
Выпускается препарат бактрим (бисептол, котримоксазол, септрин), содержащий триметоприм и сульфаметоксазол. Он обладает высокой антибактериальной активностью. Оказывает бактерицидное действие. Хорошо всасывается из желудочно-кишечного тракта. Максимальная концентрация в плазме крови определяется через 3 ч. Продолжительность эффекта 6-8 ч. Выделяются оба компонента бактрима в основном почками. При использовании бактрима наблюдаются различные побочные эффекты. Наиболее часты диспепсические явления (тошнота, рвота, анорексия, диарея) и аллергические реакции со стороны кожи (эритематозная сыпь, крапивница, зуд). Возможно угнетение кроветворения (лейкопения, агранулоцитоз, тромбоцитопения, мегалобластическая анемия и др.). Иногда возникают нарушения функции печени, почек.
Описаны случаи суперинфекции (кандидамикоз полости рта). При длительном применении бактрима необходимо контролировать состав периферической крови.
1Воспаление краев век. От греч. blepharon - веко.
Бактрим противопоказан при выраженных нарушениях функции печени, почек и кроветворения. Не следует назначать его детям до 6 лет и при беременности.
Аналогичными препаратами являются лидаприм (сульфаметрол + триметоприм), сульфатон (содержит сульфамонометоксин и триметоприм), а также потесептил (сульфадимезин + триметоприм). Показания, побочные эффекты и противопоказания для обоих препаратов такие же, как для бактрима.
Препараты
Название | Средняя терапевтическая доза для взрослых; путь введения | Форма выпуска |
Сульфадимезин - Sulfadimezinum | Внутрь | Порошок; таблетки по 0,25 и |
Этазол - Aethazolum | Внутрь | Порошок; таблетки по 0,25 и |
Уросульфан - Urosulfanum | Внутрь 0,5-1 г | Порошок; таблетки по |
Сульфапиридазин - Sulfapyridazinum | Внутрь 0,5-1 г | Порошок; таблетки по |
Сульфадиметоксин - Sulfadimethoxinum | Внутрь 0,5-1 г | Порошок; таблетки по 0,2 и |
Фталазол - Phthalazolum | Внутрь | Порошок; таблетки по |
Сульфацил-натрий - Sulfacylum-natrium | Внутрь 0,5-1 г; внутривенно (медленно) 0,9-1,5 г; в полость конъюнктивы 1-2 капли 10-30% раствора или 10-30% мазь | Порошок;
ампулы по 5 мл 30% раствора; флаконы по 5 и 10 мл 30% раствора; 20%
раствор (глазные капли) в тюбиках-капельницах по 1,5 мл; 30% мазь в
упаковке по |
Бактрим - Bactrimum | 2 таблетки | Таблетки (в 1 таблетке |
29.3. ПРОИЗВОДНЫЕ ХИНОЛОНА
К числу первых производных хинолона, получивших практическое применение, относится кислота налидиксовая (невиграмон, неграм). Основной спектр ее действия включает грамотрицательные бактерии (отсюда одно из названий - «неграм»). Она эффективна в отношении кишечной палочки, протея, капсульных бактерий (клебсиелл), шигелл, сальмонелл. Синегнойная палочка устойчива к кислоте налидиксовой. Механизм ее противомикробного действия связывают с угнетением синтеза ДНК. Устойчивость бактерий к препарату развивается довольно быстро (иногда через несколько дней после начала лечения).
Из желудочно-кишечного тракта препарат всасывается хорошо. Химическим превращениям подвергается примерно 20% от введенной дозы вещества. Выводится кислота налидиксовая (и ее метаболиты) главным образом почками, вследствие чего в моче создаются достаточно высокие концентрации вещества.
Основное применение - инфекции мочевыводящих путей, вызванные кишечной палочкой, протеем и другими микроорганизмами, чувствительными к кислоте налидиксовой. Ценным качеством препарата является его активность в отношении штаммов, устойчивых к антибиотикам и сульфаниламидным препаратам.
Из побочных эффектов возможны диспепсические нарушения, аллергические реакции, фотодерматозы, скоропреходящие нарушения зрения (снижение остроты зрения, светобоязнь), головная боль.
Противопоказанием служат заболевания с выраженным нарушением функции печени и почек. Не следует назначать препарат женщинам в первые 3 мес беременности и детям в возрасте до 2 лет.
За последние годы большое внимание привлекли фторхинолоны - производные хинолона, содержащие в структуре атомы фтора. Синтезировано значительное количество таких препаратов: ципрофлоксацин (ципробай), норфлоксацин, пефлоксацин, ломефлоксацин, офлоксацин (таривид) и др. Они являются высокоактивными антибактериальными средствами широкого спектра действия. Оказывают бактерицидное действие на грамотрицательные бактерии, в том числе на гонококки, кишечную палочку, шигеллы, сальмонеллы, Klebsiella pneumoniae, Enterobacter, Haemophilus influenzae, синегнойную палочку1, микоплазмы, хламидии и др. В отношении грамположительных бактерий менее активны.
Механизм антибактериального действия фторхинолонов (рис. 29.4) заключается в ингибировании бактериальных ферментов топоизомераз II и IV (в том числе ДНК-гиразы - топоизомеразы II), что нарушает репликацию ДНК и соответственно образование РНК. Все это препятствует росту и размножению бактерий.
Фторхинолоны хорошо всасываются из пищеварительного тракта. Проникают в большинство тканей. Через гематоэнцефалический барьер проникают в необходимых концентрациях только отдельные препараты (офлоксацин, пефлоксацин, ципрофлоксацин), да и то при воспалении оболочек мозга. В умеренной степени связываются с белками плазмы. Выделяются в основном почками (путем фильтрации и активной секреции). Сравнительная фармакокинетика ряда фторхинолонов приведена в табл. 29.9.
Применяются они при инфекциях мочевыводящих, дыхательных путей, желудочно-кишечного тракта, вызванных микроорганизмами, чувствительными к фторхинолонам.
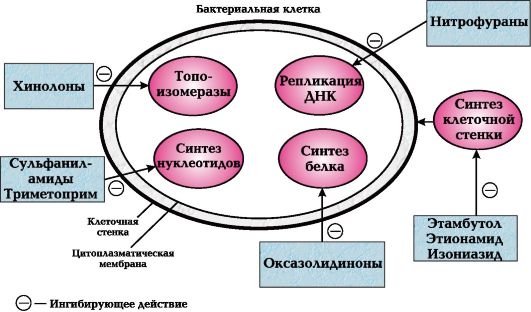
Рис. 29.4. Принцип действия ряда синтетических противомикробных средств.
1 Особенно эффективен в отношении синегнойной палочки ципрофлоксацин.
Таблица 29.9. Фармакокинетика фторхинолонов
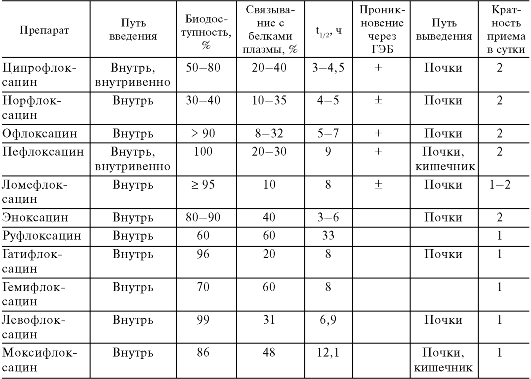
Примечание. ГЭБ - гематоэнцефалический барьер. Плюс - проникает хорошо только при воспалении, (?) - проникает плохо (в том числе при воспалении).
Привыкание микроорганизмов к фторхинолонам развивается относительно медленно. Из побочных эффектов отмечаются диспепсические нарушения, кожные высыпания и другие аллергические реакции, головная боль, головокружение, бессонница, фотосенсибилизация. Возможна суперинфекция. Однако в целом фторхинолоны переносятся хорошо.
Противопоказаны беременным и кормящим женщинам, а также пациентам в возрасте до 18 лет.
Одно из важных направлений в создании новых фторхинолонов - повышение противомикробного действия соединений на грамположительные бактерии, в частности на Streptococcus pneumoniae и другие стрептококки, атипичные и анаэробные возбудители. К числу таких препаратов относится моксифлоксацин (авелокс), отличающийся высокой бактерицидной активностью в отношении стрептококков, стафилококков, листерий, коринебактерий и в меньшей степени - энтерококков. Так, например, по влиянию на пневмококки (и бактероиды) in vitro моксифлоксацин в 4-16 раз активнее ципрофлоксацина и офлоксацина. Следует отметить, что моксифлоксацин эффективен при инфицировании грамположительными бактериями, устойчивыми ко многим другим антибактериальным средствам. Кроме того, моксифлоксацин характеризуется высокой активностью в отношении хламидий, микоплазм, уреаплазм и анаэробных возбудителей. Активность моксифлоксацина в отношении анаэробов находится на уровне метронидазола, клиндамицина и имипенема.
Препарат хорошо всасывается из кишечника. Биодоступность около 90%. Порядка 48% связывается с белками плазмы крови. 50% вещества метаболизируется
в печени. Выделяются моксифлоксацин и его метаболиты почками и с желчью в кишечник. Назначают препарат 1 раз в сутки.
Переносится моксифлоксацин хорошо. Побочные эффекты в основном аналогичны таковым других фторхинолонов (отсутствует фотосенсибилизирующее действие). Нередко отмечаются тошнота, диарея, головокружение.
К новым фторхинолонам относятся также гатифлоксацин, гемифлоксацин, левофлоксацин. Все они эффективны при энтеральном введении, обладают высокой биодоступностью, характеризуются значительной эффективностью в отношении грамположительных бактерий при сохранении бактерицидного действия на грамотрицательные бактерии. Весьма эффективны в отношении Streptococcus pneumoniae и других возбудителей инфекций дыхательных путей - Haemophilus influenzae, Moraxella catarrhalis. Этому способствует то, что они накапливаются в высоких концентрациях в тканях и жидкостях органов дыхания (в бóльших концентрациях, чем в плазме крови). Вводят их, как и моксифлоксацин, 1 раз в сутки.
Установлено, что моксифлоксацин и гатифлоксацин обладают выраженной активностью в отношении M. tuberculosis.
29.4. СИНТЕТИЧЕСКИЕ АНТИБАКТЕРИАЛЬНЫЕ СРЕДСТВА РАЗНОГО ХИМИЧЕСКОГО СТРОЕНИЯ
29.4.1. ПРОИЗВОДНЫЕ 8-ОКСИХИНОЛИНА
Препараты этого ряда обладают антибактериальным и антипротозойным эффектами.
К противомикробным средствам данной группы относится 5-нитро-8-окси- хинолин - нитроксолин (5-НОК). Препарат обладает широким спектром антибактериального действия. Кроме того, он оказывает угнетающее влияние на некоторые грибы (дрожжеподобные и др.).
Нитроксолин быстро всасывается из кишечника. Выделяется в неизмененном виде с мочой, где накапливается в бактериостатических концентрациях.
Применяют нитроксолин при инфекциях мочевыводящих путей, вызванных различными микроорганизмами. Назначают внутрь. Из побочных эффектов возможны диспепсические явления. Следует учитывать, что при приеме нитроксолина моча приобретает ярко-желтый цвет.
29.4.2. ПРОИЗВОДНЫЕ НИТРОФУРАНА
К этой группе соединений относятся многие препараты. Одни используются преимущественно в качестве антисептиков для наружного применения (например, фурацилин), другие - в основном для лечения инфекций кишечника и мочевыводящих путей (фуразолидон, фурадонин, фурагин).
Важно отметить, что нитрофураны эффективны в отношении микроорганизмов, устойчивых к антибиотикам и сульфаниламидам.
Фуразолидон применяют при кишечных инфекциях (бациллярной дизентерии, паратифе, токсикоинфекциях), а также при трихомонадном кольпите1 и лямблиозе. Вводят его внутрь, интравагинально, ректально. Может вызывать диспепсические явления, аллергические реакции. Эффективным препаратом для лечения инфекций мочевыводящих путей является фурадонин (нитрофурантоин). На-
1Воспаление слизистой оболочки влагалища. От греч. colpos - влагалище.
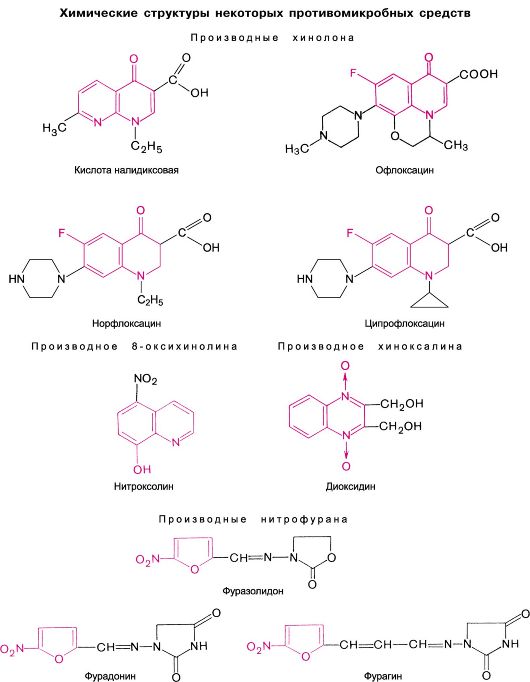
значают его внутрь. Он быстро всасывается и выделяется в значительном количестве почками, где создаются бактериостатические и бактерицидные его концентрации. Как и фуразолидон, он может нарушать аппетит, вызывать тошноту, рвоту. У некоторых больных наблюдаются аллергические реакции. Фурагин применяют при инфекциях мочевыводящих путей, а также местно.
С целью уменьшения побочных эффектов при приеме производных нитрофурана рекомендуются обильное питье, блокаторы гистаминовых Н1-рецепторов, витамины группы В.
29.4.3. ПРОИЗВОДНЫЕ ХИНОКСАЛИНА
Эта группа антибактериальных средств представлена хиноксидином и диоксидином. Они обладают широким спектром противомикробного действия, включая вульгарного протея, синегнойную палочку, патогенные анаэробы и др. Активны в отношении бактерий, устойчивых к другим антимикробным средствам. Применяют при тяжелых гнойно-воспалительных процессах. Назначают только взрослым при стационарном лечении под контролем врача. Препараты довольно токсичны и нередко вызывают побочные эффекты. Из числа последних возможны диспепсические расстройства, головная боль, головокружение, озноб, судорожные сокращения мышц и др.
29.4.4. ОКСАЗОЛИДИНОНЫ
Новым классом активных противомикробных средств являются оксазолидиноны. Первый препарат этой группы линезолид (зивокс) эффективен в отношении широкого спектра возбудителей - аэробных грамположительных бактерий, некоторых грамотрицательных бактерий и многих анаэробов. Линезолид применяется и при инфекциях, вызванных резистентными к другим препаратам бактериями.
Механизм противомикробного действия связан с ингибированием начальных стадий синтеза белка. Высказывается предположение, что в условиях целостного организма препарат действует бактерицидно (in vitro - бактериостатически).
Эффективен при энтеральном и парентеральном введении.
Предназначен в основном для лечения тяжелых инфекций, вызванных грамположительными бактериями.
Препараты
Название | Средняя терапевтическая доза для взрослых; путь введения | Форма выпуска |
Кислота налидиксовая - Acidum nalidixicum | Внутрь | Капсулы и таблетки по |
Ципрофлоксацин - Ciprofloxacin | Внутрь и внутривенно 0,125- | Таблетки по 0,25; 0,5 и |
Моксифлоксацин - Moxifloxacin | Внутрь | Таблетки по |
Офлоксацин - Ofloxacin | Внутрь | Таблетки по |
Норфлоксацин - Norfloxacin | Внутрь | Таблетки по |
Нитроксолин - Nitroxolinum | Внутрь | Таблетки, покрытые оболочкой, по |
Фуразолидон - Furazolidonum | Внутрь 0,1-0,15 г | Таблетки по |
Фурадонин - Furadoninum | Внутрь 0,1-0,15 г | Таблетки по |
Фурагин - Furaginum | Внутрь 0,1-0,2 г; в полость конъюнктивы 1-2 капли раствора 1:13 000 | Порошок; таблетки по |
29.5. ПРОТИВОСИФИЛИТИЧЕСКИЕ СРЕДСТВА
Основное место в лечении сифилиса занимают препараты бензилпенициллина. Для этой цели используют как короткодействующие (бензилпенициллина натриевую или калиевую соль), так и длительно действующие (новокаиновую соль бензилпенициллина, бициллины)1 препараты. Бензилпенициллин оказывает быстрое и выраженное трепонемоцидное действие. Развития к нему устойчивости бледной трепонемы не отмечено. Препараты бензилпенициллина эффективны при сифилисе на всех его стадиях. Назначают их курсами, длительность которых определяется формой и стадией заболевания.
При непереносимости бензилпенициллина (например, в связи с аллергическими реакциями) для лечения сифилиса можно использовать другие антибиотики - тетрациклины, а также эритромицин, азитромицин, цефтриаксон. Однако по эффективности они уступают препаратам бензилпенициллина.
Помимо антибиотиков, при лечении сифилиса применяют препараты висмута. К ним относятся бийохинол (8% взвесь йодовисмутата хинина в нейтрализованном персиковом масле) и бисмоверол (взвесь основной висмутовой соли моновисмутвинной кислоты в нейтрализованном персиковом масле). В отличие от антибиотиков спектр действия препаратов висмута ограничивается возбудителем сифилиса. По активности они уступают бензилпенициллину. Трепонемостатическое действие их связывают с угнетением ферментов, содержащих сульфгидрильные группы. Терапевтический эффект препаратов висмута развивается значительно медленнее, чем бензилпенициллина. Из желудочно-кишечного тракта препараты висмута не всасываются, в связи с чем их вводят внутримышечно. Выделяются они преимущественно почками, а также в небольших количествах кишечником и потовыми железами. Применяют препараты висмута при всех формах сифилиса.
Побочные эффекты наблюдаются относительно редко. Типично для действия этих препаратов появление темной каймы по краю десен (так называемая висмутовая кайма). Возможно развитие гингивита2, стоматита3, колита, диареи, дерматита. Редко наблюдаются поражения почек и печени.
При применении препаратов висмута необходимо следить за состоянием слизистой оболочки полости рта, функцией почек и печени.
В поздних стадиях сифилиса для ускорения рассасывания гумм назначают соединения йода (калия йодид).
Препараты
Название | Средняя терапевтическая доза для взрослых; путь введения | Форма выпуска |
Бийохинол - Biiochinolum | Внутримышечно 2 мл (1 раз в 2-3 дня) | Флаконы по 100 мл |
Бисмоверол - Bismoverolum | Внутримышечно 1,5 мл (2 раза в неделю) | Флаконы по 100 мл |
1Свойства антибиотиков см. в главе 29.1. 2Воспаление десен. От лат. gingiva - десна.
3Воспаление слизистой оболочки полости рта. От греч. stoma - рот.
29.6. ПРОТИВОТУБЕРКУЛЕЗНЫЕ СРЕДСТВА
В комплексе медикаментозной терапии туберкулеза основное место занимают химиотерапевтические средства. К ним относятся следующие препараты: А. Синтетические средства
Изониазид Этионамид
Этамбутол Протионамид
Натрия пара-аминосалицилат (ПАСК) Пиразинамид Бепаск Тиоацетазон
Б. Антибиотики
Рифампицин Циклосерин
Стрептомицина сульфат Канамицина сульфат
Стрептомицин-хлоркальциевый комплекс Флоримицина сульфат По противомикробному спектру указанные группы средств различаются весьма существенно. Синтетические средства действуют только на микобактерии туберкулеза (отдельные соединения эффективны и в отношении микобактерий проказы). На прочие микроорганизмы они не влияют. В то же время антибиотики, применяемые при лечении туберкулеза, характеризуются широким противомикробным спектром действия (рис. 29.5).
Противотуберкулезные средства в основном оказывают бактериостатическое действие. Однако некоторые препараты в определенных концентрациях вызывают и бактерицидный эффект (изониазид, рифампицин, стрептомицин).
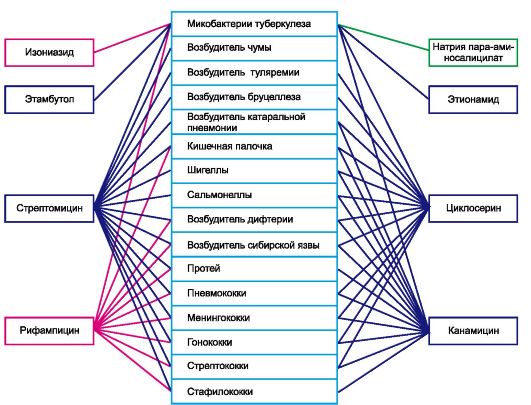
Рис. 29.5. Спектры действия противотуберкулезных средств.
Красный цвет - препараты I группы, фиолетовый - препараты II группы, зеленый - препара- ты III группы.
С учетом длительности химиотерапии туберкулеза (12-18 мес и более) особенно важное значение приобретает проблема лекарственной устойчивости возбудителя. В принципе устойчивость микобактерий туберкулеза развивается ко всем препаратам, однако к одним она возникает быстро (рифампицин, стрептомицин), к другим - относительно медленно (например, к натрия пара-аминосалицилату). Для уменьшения скорости развития резистентности обычно комбинируют 2-3 препарата. В начале лечения одновременное применение ряда противотуберкулезных средств имеет смысл еще и потому, что чувствительность возбудителя у данного больного к определенным препаратам неизвестна и может быть установлена лишь через несколько недель. Вместе с тем чем раньше начато лечение, тем оно успешнее. Поэтому химиотерапию начинают, не дожидаясь результатов бактериологических исследований. Как правило, это дает необходимый лечебный эффект, так как штаммы микобактерий туберкулеза, устойчивые одновременно к 2-3 препаратам, встречаются относительно редко.
Осложняющим моментом лекарственного лечения туберкулеза являются также побочные эффекты. Они могут быть как аллергической, так и неаллергической природы (табл. 29.10). Кроме того, при применении антибиотиков возможна суперинфекция. К сожалению, побочными эффектами обладают все известные противотуберкулезные средства, варьируют лишь их характер и частота. Некоторые носят угрожающий характер (гепатотоксичность, нефротоксичность, угнетение кроветворения, нейротоксичность) и являются показанием к отмене препаратов.
Таблица 29.10. Побочные эффекты, типичные для ряда противотуберкулезных средств
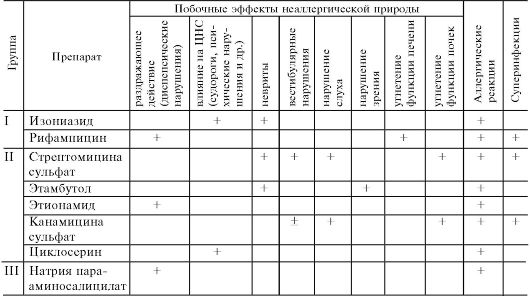
Предложена следующая классификация противотуберкулезных средств1:
1 Противотуберкулезные средства раньше подразделяли на основные (препараты I ряда) и резервные (препараты II ряда). Этой классификацией нередко пользуются и в настоящее время. К основным препаратам относятся изониазид, этамбутол, стрептомицин и рифампицин. Препараты II ряда представлены синтетическими средствами - ПАСК, этионамидом, пиразинамидом, тиоацетазоном, а также антибиотиками циклосерином, канамицина сульфатом, флоримицина сульфатом. Активность резервных препаратов, как правило, меньше, чем основных (изониазида, этамбутола, стрептомицина, рифампицина). Кроме того, многие из них более токсичны и чаще вызывают побочные эффекты. Назначают резервные препараты при устойчивости микобактерий к основным препаратам или при непереносимости последних.
I группа - наиболее эффективные препараты: изониазид и рифампицин;
II группа - препараты средней эффективности: этамбутол, стрептомицин, этионамид, пиразинамид, канамицин, циклосерин, флоримицин;
III группа - препараты с умеренной эффективностью: ПАСК, тиоацетазон.
Поиски новых противотуберкулезных средств продолжаются. Задача заключается в создании высокоактивных и малотоксичных препаратов, лишенных побочных эффектов. Важно, чтобы устойчивость к ним микобактерий туберкулеза развивалась возможно медленнее. Следует учитывать и экономическую сторону. Такие препараты должны быть доступны для широкого применения в медицинской практике, тем более что курс лечения ими весьма продолжителен.
29.6.1. ПРОТИВОТУБЕРКУЛЕЗНЫЕ СРЕДСТВА I ГРУППЫ
а) Синтетические средства
Основным представителем группы гидразидов изоникотиновой кислоты (ГИНК) является изониазид (тубазид, изоницид). Он обладает высокой активностью в отношении микобактерий туберкулеза (превосходит стрептомицин). В отличие от стрептомицина воздействует и на внутриклеточно расположенные микобактерии туберкулеза. Оказывает угнетающее влияние на возбудителя проказы. Другие микроорганизмы к изониазиду нечувствительны.
На микобактерии туберкулеза изониазид оказывает бактериостатическое или бактерицидное действие, механизм которого до сих пор не выяснен. Имеются данные, что изониазид угнетает синтез миколевых кислот, являющихся важнейшим структурным компонентом клеточной стенки микобактерий туберкулеза. С этим связывают и высокую избирательность действия изониазида на микобактерии, так как в тканях макроорганизма, а также у других микроорганизмов миколевых кислот нет. Не исключено, что определенное значение имеет ингибирование синтеза нуклеиновых кислот.
Устойчивость микобактерий туберкулеза к изониазиду развивается значительно медленнее, чем к стрептомицину и рифампицину.
Изониазид хорошо всасывается из желудочно-кишечного тракта. Препарат легко проникает через тканевые барьеры и относительно равномерно распределяется по всем тканям. Обнаруживается в бактериостатических концентрациях в ликворе и серозных полостях. Бóльшая часть изониазида подвергается химическим превращениям с образованием метаболитов и конъюгатов. Одним из важных путей инактивации изониазида в организме является ацетилирование. Установлено, что скорость этого процесса генетически обусловлена. У одних людей1 происходит медленная инактивация изониазида, при этом его концентрация в организме снижается более постепенно, чем в случае быстрой инактивации препарата. Скорость снижения содержания изониазида в плазме на 50% (t1/2) в этих группах может различаться в 2,5 раза. Естественно, что отмеченные особенности следует учитывать при дозировании изониазида, так как от этого зависит не только поддержание бак- териостатических концентраций вещества, но и развитие побочных эффектов.
Основное количество изониазида и продуктов его превращения выделяется в течение 1-х суток. Выводятся они главным образом почками.
Используют изониазид при всех формах туберкулеза. Вводят препарат обычно внутрь, иногда ректально. При необходимости его можно назначать внутривенно
1Среди европейцев - примерно половина.
Химические структуры некоторых противотуберкулезных средств
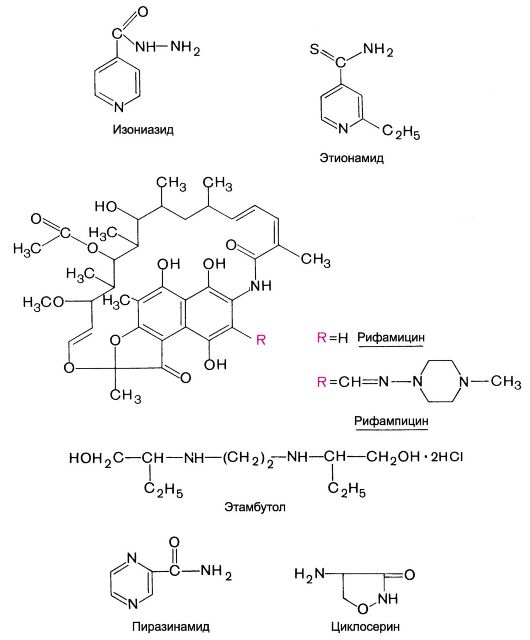
(он хорошо растворяется), внутримышечно. Растворы изониазида используют также для промывания серозных полостей и свищевых ходов.
Применение изониазида может сопровождаться разнообразными побочными эффектами. Основным отрицательным свойством изониазида является его нейротоксичность. Проявляется она главным образом невритами, в том числе иногда отмечается поражение зрительного нерва. Возможны неблагоприятные эффекты со стороны ЦНС (бессонница, судороги, психические нарушения, расстройства памяти, нарушение равновесия). У некоторых больных отмечаются сухость в полости рта, тошнота, рвота, запор, легкая анемия. Аллергические реакции относительно редки. В ряде случаев возникают кожные реакции, лихорадка, эозинофилия.
Многие из побочных эффектов изониазида связаны с угнетением процесса образования пиридоксальфосфата (схема 29.2), который является коэнзимом, необходимым для разнообразных превращений аминокислот.
В связи с этим для предупреждения побочных эффектов (например, невритов) одновременно с изониазидом назначают пиридоксин (витамин В6).
Аллергические реакции устраняют противоаллергическими средствами.
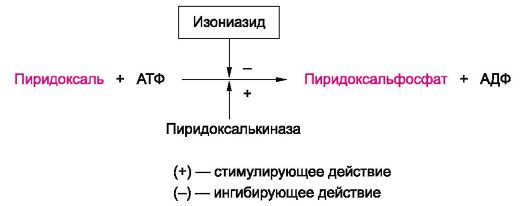
Схема 29.2. Направленность действия изониазида.
К производным гидразида изоникотиновой кислоты относятся также фтивазид, метазид, салюзид растворимый. Все они менее активны, чем изониазид, и никаких преимуществ по сравнению с ним не имеют. Применяют их редко, обычно при непереносимости изониазида.
б) Антибиотики
Группа рифамицина
Рифамицин (рифоцин) является антибиотиком, продуцируемым Streptomyces mediterranei. Он представляет собой сложную макроциклическую структуру. К этой же группе относится полусинтетический препарат рифампицин (рифампин, рифадин, римактан).
Оба соединения оказывают выраженное действие на микобактерии туберкулеза и лепры, а также на грамположительные бактерии. В высоких концентрациях активны в отношении грамотрицательных микроорганизмов (кишечной палочки, капсульных бактерий, отдельных штаммов синегнойной палочки, шигелл, сальмонелл) и некоторых видов протея.
Механизм противомикробного действия антибиотиков группы рифамицина связан, по-видимому, с угнетением синтеза РНК (очевидно, за счет ингибирования ДНК-зависимой РНК-полимеразы). Они оказывают бактериостатическое, а в больших концентрациях бактерицидное действие.
Особенно интересен рифампицин, который при приеме внутрь по активности приближается к изониазиду. Рифампицин хорошо всасывается из желудочнокишечного тракта. Он легко проникает через тканевые барьеры, в том числе через гематоэнцефалический барьер. Терапевтический эффект сохраняется до 8- 12 ч. Выделяется препарат с желчью, частично с мочой, бронхиальными и слезными железами.
Основное применение - лечение всех форм туберкулеза. Однако к рифампицину довольно быстро развивается устойчивость микобактерий туберкулеза, в связи с чем его целесообразно комбинировать с другими противотуберкулезными средствами. Рифампицин используют также в случаях, когда другие препараты неэффективны.
Рифампицин назначают внутрь и внутривенно, рифамицин - внутримышечно, внутривенно и местно.
Препараты группы рифамицина могут оказывать отрицательное влияние на функцию печени (особенно на фоне имеющегося заболевания или при длительном использовании препаратов). Возможна лейкопения. У ряда больных наблюдаются диспепсические нарушения. Иногда отмечаются аллергические реакции. Не рекомендуется применять эти антибиотики в первые 3 мес беременности (не
Таблица 29.11. Фармакокинетика ряда противотуберкулезных средств
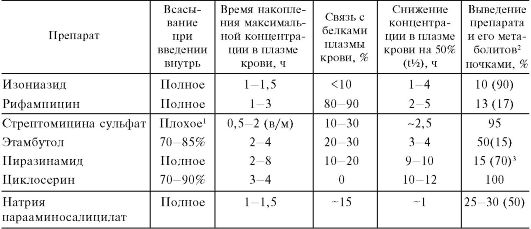
1 Вводят парентерально.
2 Количество выделяющихся метаболитов в % приведено в скобках.
3 За 24 ч.
в/м - внутримышечно.
исключено неблагоприятное влияние на плод). Следует учитывать, что рифампицин окрашивает мочу, мокроту и слезную жидкость в красный цвет. Одним из недостатков рифампицина является его высокая стоимость.
29.6.2. ПРОТИВОТУБЕРКУЛЕЗНЫЕ СРЕДСТВА II ГРУППЫ а) Синтетические средства
Высокой противотуберкулезной активностью характеризуется этамбутол (диамбутол, миамбутол). По экспериментальным данным, при энтеральном введении этамбутол аналогичен по активности изониазиду. На другие микроорганизмы не влияет. Механизм действия этамбутола связывают с угнетением синтеза клеточной стенки. Устойчивость микобактерий к этамбутолу развивается относительно медленно.
Из желудочно-кишечного тракта препарат всасывается не полностью (примерно 3/4), но в достаточном для обеспечения бактериостатического эффекта количестве.
Выделяется в основном почками в течение 1-х суток. В моче обнаруживаются неизмененный этамбутол, а также его метаболиты. Небольшая их часть выводится кишечником.
Этамбутол назначают при разных формах туберкулеза, обычно в сочетании с другими препаратами (например, рифампицин + этамбутол + изониазид; рифампицин + этамбутол; изониазид + этамбутол).
Из побочных эффектов для этамбутола наиболее характерны нарушения зрения (в том числе расстройство цветового восприятия, особенно способность различать зеленый и красный цвета). Если возникает неврит глазного нерва, это осложнение принимает тяжелое течение. Нарушения зрения возникают обычно через 2-6 мес после начала лечения этамбутолом и зависят от дозы вещества. При своевременной отмене препарата зрение постепенно восстанавливается. В связи с возможностью развития такого побочного эффекта лечение этамбутолом проводят под систематическим контролем функции зрения. Аллергические реакции этамбутол вызывает редко.
Спектр действия этионамида (тионид, трекатор) включает микобактерии туберкулеза и возбудитель проказы. Привыкание к нему микобактерий туберкулеза возникает быстро, поэтому его всегда применяют в сочетании с другими препаратами.
Из желудочно-кишечного тракта всасывается хорошо. Этионамид довольно хорошо проникает через гематоэнцефалический барьер. Быстро инактивируется в печени и выводится с мочой, главным образом в виде метаболитов.
Вводят препарат внутрь и ректально. Для внутривенных инъекций применяют этионамида гидрохлорид.
Этионамид часто вызывает побочные эффекты. Наиболее выражено у него раздражающее действие. Так, возникающие при приеме внутрь диспепсические явления (иногда тяжело протекающие) наблюдаются примерно у 50% больных. Для их уменьшения назначают никотинамид. Отмечаются также аллергические реакции. Иногда развиваются гепатит, ортостатический коллапс, нарушения со стороны центральной и периферической нервной системы и многие другие побочные эффекты.
Аналогичным препаратом является протионамид (тревентикс). Есть данные, что он несколько менее токсичен, чем этионамид.
Пиразинамид по туберкулостатической активности превосходит ПАСК, но уступает изониазиду, рифампицину и стрептомицину. На другие микроорганизмы не влияет. При применении только пиразинамида к нему быстро развивается устойчивость микобактерий туберкулеза.
Хорошо всасывается из желудочно-кишечного тракта. Проникает через гематоэнцефалический барьер. Основное количество пиразинамида и его метаболитов выводится почками.
Применяется в сочетании с другими препаратами. Пиразинамид назначают энтерально 3-4 раза в день.
Из побочных эффектов наиболее серьезным является гепатотоксичность. В связи с этим при использовании пиразинамида необходим систематический контроль за функцией печени. Нарушение функции печени является основанием к отмене препарата. У ряда больных наблюдаются также диспепсические явления. Задержка в организме мочевой кислоты под влиянием пиразинамида иногда приводит к появлению приступов подагры. Могут возникать аллергические реакции (лихорадка, дерматиты, эозинофилия и др.).
б) Антибиотики
Группа стрептомицина (см. 29.1) Разные антибиотики
Циклосерин продуцируется различными видами актиномицетов: Actinomy-
ces orchidaceus, Actinomyces garyphalus, Actinomyces lavendulae. Получен также синтетическим путем. В качестве лекарственного препарата используется D-изомер циклосерина.
Обладает широким спектром действия. Наиболее эффективен в отношении вне- и внутриклеточных микобактерий туберкулеза (уступает по активности изониазиду, рифампицину, стрептомицину). На другие микроорганизмы влияет только в больших концентрациях.
Циклосерин действует бактерицидно, нарушая синтез клеточной стенки. Это связано с тем, что, обладая химическом сходством с D-аланином, циклосерин способен по конкурентному принципу ингибировать активность ферментов
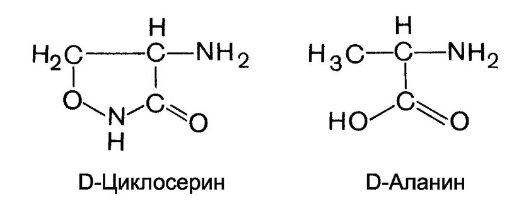
D-аланинрацемазы и D-аланинсинтетазы. В результате нарушается образование дипептида D-аланил-D-аланина, необходимого для построения клеточной стенки ряда бактерий.
Устойчивость микобактерий туберкулеза к циклосерину развивается относительно медленно.
Из желудочно-кишечного тракта циклосерин всасывается хорошо. Легко проникает в ликвор, где его концентрации близки к таковым в плазме крови.
Около 1/3 введенного циклосерина подвергается химическим превращениям. Выделяется препарат почками (в 1-е сутки около 50%).
Показанием к назначению циклосерина является непереносимость или неэффективность прочих противотуберкулезных средств. Наилучший результат наблюдается при комбинированном применении циклосерина с другими препаратами I или II группы. Вводят его внутрь.
При использовании циклосерина часто наблюдаются побочные эффекты. В основном это нервно-психические нарушения: головная боль, головокружение, тремор, судороги, возбуждение или депрессия, психозы. Иногда отмечаются диспепсические расстройства. Аллергические реакции возникают редко.
Для коррекции изменений со стороны функций ЦНС вводят пиридоксин, глутаминовую кислоту, препараты АТФ.
Продуцентом канамицина является Streptomyces kanamyceticus. Препарат относится к антибиотикам группы аминогликозидов. Выпускается в виде сульфата.
Канамицин обладает широким спектром действия, включающим микобактерии туберкулеза, многие грамположительные и грамотрицательные бактерии. К нему малочувствительны стрептококки (за исключением энтерококков), пневмококки. Он не действует на синегнойную палочку, анаэробы, спирохеты, патогенные грибы и истинные вирусы.
Механизм его противомикробного действия связывают с угнетением синтеза белка у бактерий. Канамицин оказывает как бактериостатическое, так и бактерицидное действие.
Привыкание бактерий к канамицину развивается довольно быстро. Из желудочно-кишечного тракта препарат всасывается в незначительной степени. Для резорбтивного действия его назначают внутримышечно. При этом пути введения максимальные концентрации канамицина в плазме определяются примерно через 1 ч. Антибактериальный эффект сохраняется до 6-12 ч. Через гематоэнцефалический барьер канамицин практически не проникает. Выделяется почками.
В медицинской практике канамицин используют в качестве противотуберкулезного препарата II группы, а также при инфицировании грамотрицательными микроорганизмами (кишечной палочкой, капсульными бактериями и др.), протеем, золотистым стафилококком и прочими возбудителями, чувствительными к канамицину. Основанием для применения канамицина является неэффективность других антибиотиков.
Помимо внутримышечных инъекций, препарат может быть введен в полости тела. Кроме того, его иногда назначают внутрь (для подавления кишечной микрофлоры).
Канамицин характеризуется высокой токсичностью. Так, он обладает большей ототоксичностью, чем гентамицин и стрептомицин (но меньшей, чем неомицин). Появление шума в ушах является поводом к отмене препарата, так как он может вызвать в результате повреждения слухового нерва необратимое снижение слуха вплоть до полной глухоты. Ототоксический эффект канамицина особенно опасен при длительном использовании антибиотика (при лечении туберкулеза). Вестибулярные нарушения возникают относительно редко. Канамицин обладает и отчетливой нефротоксичностью. В связи с этим в процессе лечения необходимо регулярно контролировать не только состояние слуха, но и функцию почек. Кроме того, возможно его отрицательное влияние на печень. Иногда отмечаются аллергические реакции.
Противопоказания и меры предосторожности такие же, как при применении неомицина и гентамицина.
К противотуберкулезным средствам II группы из числа антибиотиков относятся также капреомицин и флоримицина сульфат (виомицин).
29.6.3. ПРОТИВОТУБЕРКУЛЕЗНЫЕ СРЕДСТВА III ГРУППЫ а) Синтетические средства
Эта группа резервных противотуберкулезных средств представлена соединениями различного химического строения. К ним относятся ПАСК и тиоацетазон (см. структуры веществ). Каждое из этих веществ применяют в комбинации с другими препаратами.
Натрия пара-аминосалицилат (ПАСК) оказывает бактериостатическое действие на микобактерии туберкулеза. Механизм его действия обусловлен конкурентными взаимоотношениями с пара-аминобензойной кислотой, необходимой для роста и размножения микобактерий туберкулеза. На другие микроорганизмы он не влияет.
Активность натрия пара-аминосалицилата невысокая. В связи с этим применяют его только в комбинации с другими, более активными препаратами. Как уже отмечалось, устойчивость к ПАСК развивается медленно.
Натрия пара-аминосалицилат хорошо всасывается из пищеварительного тракта. В серозных полостях накапливается в достаточных количествах. Через гематоэнцефалический барьер проникает в небольшой степени. Через 6 ч в плазме крови обнаруживается в незначительной концентрации. Из организма выводится почками в неизмененном виде, а также в виде метаболитов и конъюгатов (в основном ацетилированное производное пара-аминосалициловой кислоты). За 6 ч выделяется около 60%, а за 24 ч - примерно 90% от введенной дозы.
Применяют при всех формах туберкулеза. Назначают обычно внутрь, иногда прибегают к внутривенному введению.
Из побочных эффектов наиболее часты диспепсические расстройства, связанные с раздражающим действием препарата. При этом наблюдаются тошнота, рвота, диарея, боли в области живота, нарушается аппетит. Редко возникают агранулоцитоз, гепатит, кристаллурия. У ряда больных отмечается развитие зоба с явлениями гипотиреоза. Возможны осложнения аллергического происхождения, которые проявляются кожными реакциями, лихорадкой, артритами, эозинофилией и др.
Спектр противомикробного действия тиоацетазона (тибон, контебен) ограничивается микобактериями туберкулеза и возбудителем проказы. По противотуберкулезной активности тиоацетазон уступает препаратам I и II групп. Устойчивость микобактерий туберкулеза к тиоацетазону развивается относительно медленно.
Препарат хорошо всасывается из желудочно-кишечного тракта. Частично инактивируется в печени. Выделяется из организма в течение 1-х суток. Бóльшая часть препарата выводится почками.
Применяют тиоацетазон внутрь, главным образом при внелегочных формах туберкулеза (при туберкулезе слизистых и серозных оболочек, лимфатических узлов и др.). В ряде случаев тиоацетазон назначают при проказе.
Тиоацетазон обладает значительной токсичностью. Он относительно часто вызывает тяжелые осложнения со стороны кроветворения (анемию, лейкопению, агранулоцитоз), почек (альбуминурию, цилиндрурию) и печени (вплоть до желтой атрофии печени). Кроме того, при его использовании отмечаются диспепсические расстройства, аллергические реакции и другие побочные эффекты.
Применение тиоацетазона требует постоянного контроля состояния кроветворения, функций печени и почек.
Препараты
Название | Средняя терапевтическая доза для взрослых; путь введения | Форма выпуска |
Изониазид - Isoniazidum | Внутрь | Порошок; таблетки по 0,1; 0,2 и |
Рифампицин - Rifampicinum | Внутрь по 0,3-0,9 г | Капсулы по 0,05 и |
Этамбутол - Ethambutolum | Внутрь 0,025 г/кг | Таблетки по 0,1; 0,2 и |
Этионамид - Ethionamide | Внутрь | Таблетки, покрытые оболочкой, по |
Протионамид - Protionamidе | Внутрь | Таблетки (драже) по |
Пиразинамид - Pirazinamidе | Внутрь | Таблетки по 0,5 и |
Циклосерин - Cycloserinum | Внутрь | Таблетки и капсулы по |
Канамицина сульфат - Kanamycini sulfas | Внутримышечно | Флаконы по 0,5 и |
Флоримицина сульфат - Florimycini sulfas | Внутримышечно 0,5-1 г | Флаконы по 0,5 и |
Натрия пара-аминосалицилат - Natrii para-aminosalicylas | Внутрь 3-4 г; внутривенно капельно 250 мл 3% раствора | Порошок; таблетки по |
Тиоацетазон - Thioacetazonum | Внутрь | Таблетки по 0,025 и |