Атлас по физиологии. В двух томах. Том 2: учеб. пособие / А. Г. Камкин, И. С. Киселева - 2012. - 448 с. : ил.
|
|
|
|
Глава 9. Физиология почек
Структура мочевой системы
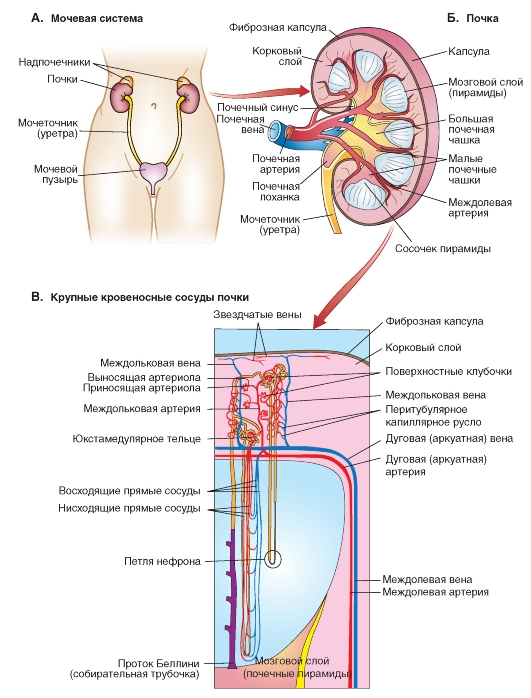
В организме человека имеются две почки (рис. 9-1 А). Они расположены по обеим сторонам позвоночного столба на уровне XI грудного и III поясничного позвонков. Правая почка расположена несколько ниже левой почки, поскольку сверху она граничит с печенью. Почки имеют бобовидную форму. Размеры одной почки составляют примерно 10-12 см в длину, 5-6 см в ширину и 3 см в толщину. Масса почки взрослого человека составляет примерно 120-300 г.
Кровоснабжение почек осуществляется почечными артериями, которые отходят непосредственно от аорты. Из чревного сплетения в почки проникают нервы, которые осуществляют нервную регуляцию функции почек, а также обеспечивают чувствительность почечной капсулы.
Почка состоит из прочной капсулы, паренхимы (ткани почки) и системы накопления и выведения мочи (рис. 9-1 Б). Капсула почки представляет собой плотный чехол из соединительной ткани, покрывающий почку снаружи. Паренхима почки представлена внешним слоем коркового вещества и внутренним слоем мозгового вещества, составляющим внутреннюю часть органа. Система накопления мочи представлена почечными чашечками, которые впадают в почечную лоханку. Почечная лоханка переходит непосредственно в мочеточник. Правый и левый мочеточники впадают в мочевой пузырь.
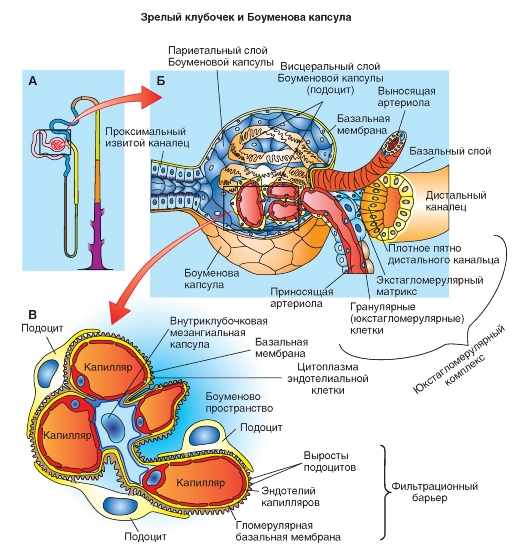
Морфофункциональной единицей почки является нефрон - специфическая структура, выполняющая функцию мочеобразования. В каждой почке насчитывается более 1 млн нефронов (рис. 9-1 В). Каждый нефрон состоит из нескольких частей: клубочка, капсулы Шумлянского- Боумена и системы последовательных канальцев.
Клубочек представляет собой скопление капилляров по которым протекает кровь. Петли капилляров, составляющих клубочек, погружены в полость капсулы Шумлянского-Боумена. Капсула имеет двойные стенки, между которыми имеется полость. Полость капсулы переходит непосредственно в полость канальцев.
Большая часть нефронов расположена в корковом веществе почки. Только 15% от всех нефронов расположены на границе между корковым и мозговым веществом почки. Таким образом корковое вещество почек состоит из нефронов, кровеносных сосудов и соединительной ткани. Канальцы нефронов образуют петлю, которая проникает из коркового вещества в мозговое. Также в мозговом веществе расположены выводящие канальцы, по которым моча, образовавшаяся в нефроне, выводится в почечные чашечки. Мозговое вещество образует так называемые пирамиды, вершины которых заканчиваются сосочками, впадающими в чашечки. На уровне сосочков происходит объединение всех почечных канальцев, по которым выводится моча.
Каждая почка имеет артериальный приток (A. renalis), венозный отток (V. renalis), лимфатические сосуды и мочеточник, по которому оттекает постоянно образующаяся в почках моча. По левому и правому мочеточникам моча попадает в мочевой пузырь и собирается там, чтобы время от времени выводиться оттуда через мочевую трубочку (уретра) (микция или мочеиспускание).
На гистологических срезах в корковом веществе почек, лежащем близко к поверхности, можно увидеть хаотичное переплетение канальцев и разбросанные между ними круглые почечные тельца, образованные капиллярами клубочков. Клубочек вместе с выходящим из него почечным канальцем входит в состав нефрона. В каждой почке находится более миллиона таких нефронов.
Рис. 9-1. Макроскопическое и микроскопическое строение мочевой системы и почек.
А - мочевыводящие пути. Моча собирается в чашечках и попадает через почечную лоханку и мочеточники в мочевой пузырь. Отток мочи обеспечивается перистальтикой мочеточников; она различима в левом мочеточнике. Б - строение почки. Изображена задняя сторона почки в разрезе. Демонстрируются слои паренхимы почек (кора и мозговое вещество почки), а также система чашечек и почечной лоханки. Вся почка окружена ригидной (плохо растяжимой) капсулой. В - крупные кровеносные сосуды почки
Кровеносные системы почки
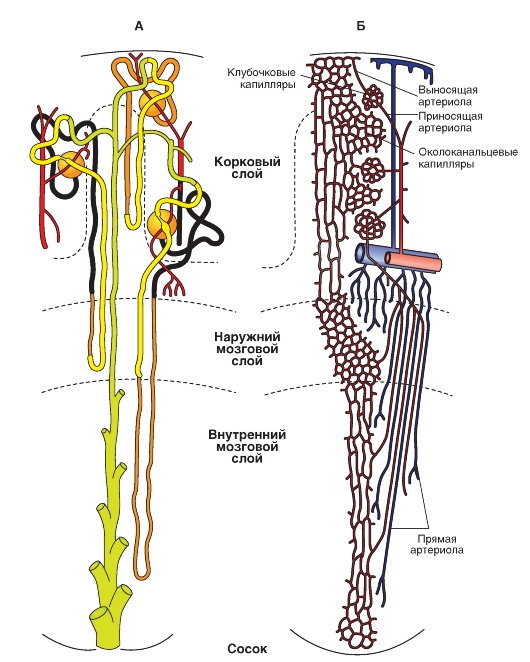
Эти выносящие артериолы разветвляются в мозговом веществе и образуют нисходящие прямые сосуды (Vasa recta) (третья капиллярная сеть). Венозная кровь околоканальцевых капилляров (кора почек), а также восходящих прямых сосудов (Vasa recta, мозговое вещество почек) попадает последовательно в междолевые вены (Vv. intelobares), дуговые вены (Vv. arcuatae) и вену почки (V.renalis) и в конце концов достигает нижней полой вены (V. cava) (см. рис. 9-1 В).
В целом, в почке представлены три капиллярные сети. Первая капиллярная сеть это та, на которую распадается приносящая артериола, образуя клубочек, который контактирует с капсулой Шумлянского-Боумена. Вторая капиллярная сеть следующая. Капилляры клубочка собираются в выносящую артериолу, а та распадается в корковом веществе на сеть капилляров. Эти капилляры оплетают отделы нефрона в корковом веществе и частично в мозговом. Это и есть вторая капиллярная сеть. Третья капиллярная сеть - это сеть мозгового вещества. Кровоснабжение мозгового вещества почки осуществляется с помощью выносящих артериол, выходящих из юкстамедулярных клубочков. Эти выносящие артериолы разветвляются в мозговом веществе и образуют нисходящие прямые сосуды. Это и есть так называемая третья капиллярная сеть.
Рис. 9-2. Макроскопическое и микроскопическое строение мочевой системы и почек.
А - схема мочеобразующей системы почки. Б - схема сосудистой системы почки
Каждая из двух почек получает артериальную кровь через артерию почек (A. renalis), которая через междолевые артерии (Aa. interlobares) попадает в дуговые артерии (Aa. arcuatae). От них вертикально ответвляются в направлении поверхности почек междольковые артерии (Aa. interlobulares), от которых при прохождения через корковое вещество отходят приносящие артериолы. Приносящая артериола (Vas afferens) разветвляется в клубочке на клубочковые капилляры (первая капиллярная сеть), которые выглядят как висящие на веточках яблоки. В отличие от кровоснабжения в других органах, капилляры клубочков не сразу переходят в венулы: клубочковые капилляры снова собираются вместе в выносящую артериолу (Vas efferens). Выносящие артериолы клубочков, расположенных в поверхностных и средних слоях коркового вещества, снова разветвляются на околоканальцевые капилляры. Они контактируют прежде всего с клетками дистальных канальцев, расположенных в корковом веществе почек (вторая капиллярная сеть). Кровоснабжение мозгового вещества почки осуществляется не с помощью артерий, а с помощью выносящих артериол, выходящих из так называемых юкстамедулярных клубочков.
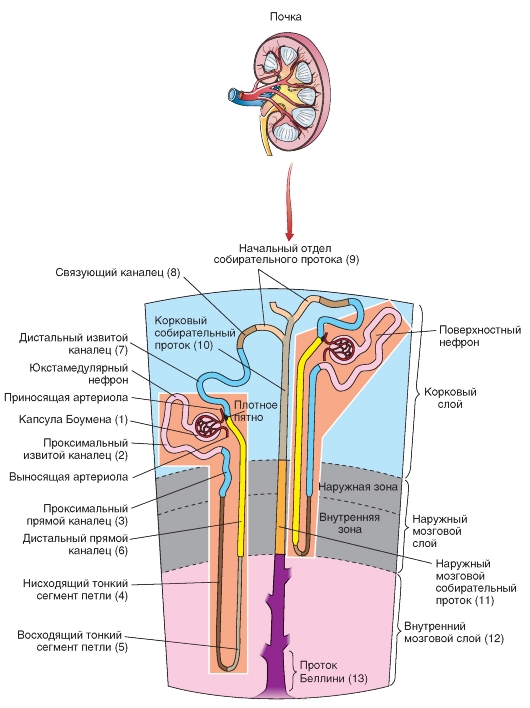
Строение нефрона
Почечная доля состоит из большого числа структурных единиц - нефронов.
Различают два типа нефронов - кортикальные (корковые) нефроны (~85%) и юкстамедулярные нефроны (~15%). Почечное тельце кортикального нефрона расположено в наружной части коркового вещества (внешняя кора) почки. Петля Генле (старая номенклатура, которую в редких случаях мы применяем для простоты изложения) у большинства кортикальных нефронов имеет небольшую длину и располагается в пределах внешнего мозгового вещества почки. Почечное тельце юкстамедулярного нефрона расположено в юкстамедулярной коре, около границы коры почки с мозговым веществом. Большинство юкстамедулярных нефронов имеют длинную петлю Генле. Их петля Генле проникает глубоко в мозговое вещество и иногда достигает верхушек пирамид.
Одна почка содержит около 1 млн клубочков, которые расположены большей частью в поверхностных слоях коркового вещества (клубочки поверхностных корковых нефронов), а часть их лежит близко к мозговому веществу (клубочки
юкстамедулярных нефронов). Клубочек вместе с капсулой Боумена с системой канальцев образует структурную и функциональную единицу почки - нефрон. У юкстамедулярных нефронов часть канальца, называемая петлей Генле, глубоко уходит во внутреннее мозговое вещество почки. Дистальный участок канальца вливается через связывающий каналец в собирательный проток.
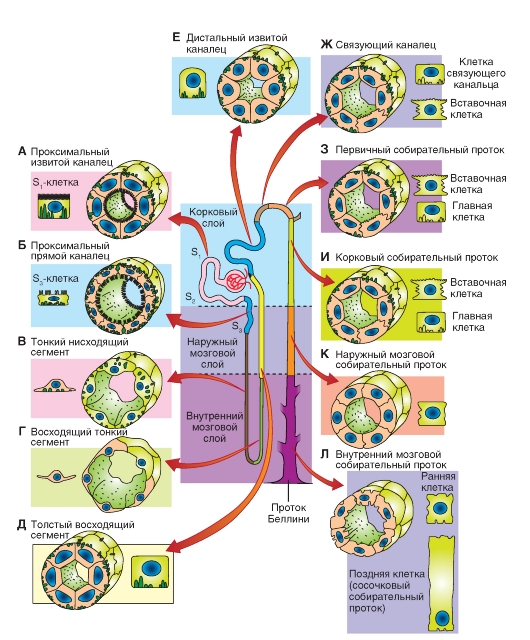
В каждом нефроне (по новой номенклатуре) ясно различимы следующие отделы рис. 9-3:
(1) капсула клубочка, capsula glomeruli (Bowmom) - боуменова капсула в виде чаши, охватывающей клубочек артериальных капилляров (glomerulus);
(2) проксимальный извитой каналец; (3) проксимальный прямой каналец; (4) нисходящий тонкий сегмент петли (тонкий нисходящий отдел петли Генле); (5) восходящий тонкий сегмент петли (тонкий восходящий отдел петли Генле); (6) дистальный прямой каналец (толстая восходящая часть петли Генле); (7) дистальный извитой каналец; (8) связующий каналец; (9) начальный отдел собирательного протока; (10) корковый собирательный проток; (11) наружный мозговой собирательный проток; (12) внутренний мозговой собирательный проток; (13) проток Беллини.
Рис. 9-3. Микроанатомия почки
Клубочек и околоклубочковый аппарат нефроза
На рис. 9-4 последовательно показано строение нефрона (рис. 9-4 А), дан переход к строению капсулы Боумена (рис. 9-4 Б) и к структуре фильтрационного барьера (рис. 9-4 В).
Клубочковый фильтр состоит из трех слоев: фенестрированного эндотелия капилляров, базальной мембраны и расположенного со стороны нефрона эпителия с подоцитами. Между пальцевидными отростками подоцитов натянуты щелевидные мембраны с порами малого диаметра. В одном клубочке через этот фильтр фильтруется около 70 мкл в день, а в двух почках вместе взятых - 180 л в день (GFR).
Юкстагломерулярный, или околоклубочковый, аппарат является совокупностью клеток почки, регулирующей функции отдельного нефрона. Назван юкстагломерулярный аппарат так потому, что расположен вблизи клубочка, образуя треугольник: с двух сторон окружен афферентной и выходящей эфферентной артериолами, а с третьей - стенкой дистального извитого канальца. Такое расположение обеспечивает выполнение ключевых функций - регуляции потока почечной крови и уровня клубочковой фильтрации. Юкстагломерулярный аппарат (JGA) состоит из
трех основных частей - macula densa (плотное пятно) - область плотно упакованных призматических эпителиальных клеток дистального извитого канальца нефрона в области, прилегающей к почечному тельцу, юкстагломерулярных и юкставаскулярных клеток.
Клетки macula densa чувствительны к ионному составу, а также к количеству воды в моче, вызывая синтез ренина остальными клетками юкстагломерулярного аппарата.
Юкстагломерулярные клетки (или, иначе, гранулярные клетки, расположенные в стенке приносящей артериолы, содержащие ренин. Ренин - неотъемлемая часть ренин-ангиотензинальдостероновой системы, регулирующей давление крови.
Юкставаскулярные клетки, или клетки Гурмагтига, - это клетки почки, расположенные между macula densa и приносящей артериолой. Эти клетки относятся к специализированным мезангиальным. Они имеют длинные отростки, контактирующие с остальными клетками. Юкставаскулярные клетки вырабатывают фермент ангиотензиназу, обусловливающий инактивацию ангиотензина, следовательно, является антагонистом деятельности ренин-ангиотензинового аппарата и способны вырабатывать ренин.
Рис. 9-4. Клубочковый фильтр и юкстагломерулярный аппарат
Канальцевый аппарат нефрона
Канальцы и собирательная трубочка выстланы клетками эпителия, в мембраны которых и со стороны просвета канальца (апикальная или люминальная мембрана), и со стороны интерстициального пространства и капилляров (базолатеральная мембрана) асимметрично встроены белковые структуры (насосы, переносчики и ионные каналы), обеспечивающие перенос веществ через мембраны путем активного (первичного и вторичного) транспорта, облегченной и простой диффузии. Это делает возможным направленный транспорт тех или иных соединений.
Проксимальный извитой каналец. Стенка проксимального извитого канальца (сегмент S1), выстлана высокими сцепленными друг с другом эпителиальными клетками, которые со стороны просвета канальца несут на себе щеточную каемку и на базальной мембране имеют глубокие складки (базальный лабиринт), что совместно увеличивает поверхность в 30-60 раз. Это свидетельствует о количественно высоких транспортных задачах проксимального канальца. Прилежащие к базальным складкам митохондрии обеспечивают работу Na+/К+-АТФазы базолатеральной мембраны АТФ. Кроме того клетки эпителия имеют контакты типа tight junction и через эти плотные контакты между эпителиальными клетками (межклеточно) переносятся сравнительно большие количества растворенных веществ.
Высокая проницаемость проксимального канальца для воды лишь в некоторой мере объясняется «протеканием» его плотных контактов. Важнее то, что как в апикальную клеточную мембрану (со стороны просвета канальца), так и в базолатеральную мембрану (со стороны интерстициума) встроены водные каналы (AQP 1, аквапорин 1).
В целом, после многочисленных поворотов извитой части в корковом веществе почки проксимальный каналец спускается своей прямой частью во внешние слои мозгового вещества почки. Размер клеток, плотность и высота щеточной каемки, глубина базолатеральных складок, а также плотность митохондрий уменьшаются по ходу проксимального канальца, что отражает снижение количества транспортируемых веществ (путем реабсорбции)
в нижележащих отделах проксимального канальца. Различают (нечетко разделенные) сегменты S1 (или P1; большая часть извитого канальца) и S2, а также лежащий исключительно в мозговом веществе почки сегмент S3 (каналец - см. ниже).
Проксимальный прямой каналец. Стенка проксимального прямого канальца (сегмент S3), выслана эпителиальными клетками, но их характерные черты (описанные выше) уже не так сильно выражены. Однако прилежащие к базальным складкам митохондрии обеспечивают Na+/К+-АТФазу базолатеральной мембраны АТФ. Кроме того, эти клетки также имеют контакты типа tight junction и через эти плотные контакты между ними (межклеточно) переносятся растворенные вещества.
Нисходящий тонкий сегмент петли (тонкий нисходящий отдел петли Генле). Клетки эпителия нисходящего тонкого сегмента лишены щеточной каемки, бедны митохондриями и обладают низким уровнем метаболической активности.
Восходящий тонкий сегмент петли (тонкий восходящий отдел петли Генле). Клетки эпителия восходящего тонкого сегмента аналогичны предыдущим, однако более уплощены. Они также лишены щеточной каемки, бедны митохондриями и обладают низким уровнем метаболической активности.
Дистальный прямой каналец (толстая восходящая часть петли Генле). Клетки эпителия этого отдела нефрона - крупные клетки, обладающие высокой метаболической активностью и способностью к активной реабсорбции.
Дистальный извитой каналец. Эпителиальные клетки этого отдела нефрона похожи на клетки дистального прямого канальца, но основное отличие связано с тем, что в дистальном извитом канальце представлено два типа клеток, которые различаются по структуре и функциям - это главные и вставочные клетки. Эти два типа клеток реабсорбируют и секретируют разные вещества.
Эпителиальные клетки связующего канальца, начального отдела собирательного протока, коркового собирательного протока, наружного мозгового собирательного протока и внутреннего мозгового собирательного протока имеют практически кубическую форму с гладкой поверхностью и содержат небольшое количество митохондрий. Они выполняют разные функции.
Рис. 9-5. Строение трубочек по длине нефрона
Определение фильтрационной способности почек
Скорость клубочковой фильтрации, равная 120 мл/мин, является важнейшей константой организма. Фильтрация загружает работой весь нефрон. Любые изменения фильтрации приведут к изменению работы всех отделов нефрона. Скорость фильтрации оценивают по клиренсу. Клиренс вещества - скорость, с которой объем плазмы полностью очищается от данного вещества почками в единицу времени.
Высокая скорость клубочковой фильтрации (т.е. объем фильтрата, образующийся в единицу времени; GFR: glomerular filtration rate) является решающей для нормальной функции почек. Обычно GFR составляет 85-135 мл/мин на каждые 1,73 м2 поверхности тела. Многие заболевания почек опасны из-за того, что они приводят к значительному снижению величины GFR. Поэтому измерение GFR становится главной задачей, когда необходимо оценить работу почек. Как же можно измерить у пациентов скорость протекающей внутрипочечной фильтрации?
В соответствии с правилом, введенным в обиход А. Фиком, с помощью растворенного в плазме крови вещества-индикатора, концентрация которого измеряется на входе (артерия) и на выходе (вена) любого органа, можно рассчитать объемную скорость плазматока через данный орган. Существуют три способа, с помощью которых может быть увеличено количество определенного вещества в просвете нефрона - это фильтрация, секреция и метаболический синтез. Также существует три возможности снижения количества вещества в просвете нефрона: реабсорбция, экскреция и метаболическое расщепление. Если в крови циркулирует вещество, например полисахарид инулин, который свободно фильтруется, не реабсорбируется, не секретируется, не синтезируется и не расщепляется в просвете нефрона, то он может попасть в просвет почечных канальцев лишь в результате фильтрации и может быть выведен из организма только с мочой. В результате, справедливо утверждение: профильтрованное количество инулина / время = выведенное с мочой количество инулина / время (1).
Так как (количество вещества в растворе / время) = (объем раствора / время), то концентрация вещества, а кроме того концентрация свободно фильтруемого вещества, такого как инулин, в плазме крови и фильтрате практически равны (Pin [г/л]), уравнение (1) может быть записано в следующем виде:
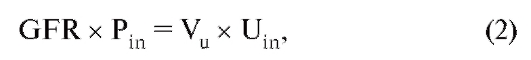
где GFR измеряется в мл/мин, Vu - скорость образования мочи (мл/мин) и Uin - концентрация инулина в конечной моче (г/л). На практике инулин вводится в организм, а затем измеряется его концентрация (например, фотометрически) в плазме крови и моче. Для определения Vu сначала опорожняется мочевой пузырь (эта моча не берется в расчет: объем = 0; время = 0), после чего собирается моча в течение длительного (12-24 ч) периода времени. Разделив собранное количество мочи на время, прошедшее с момента первичного опорожнения мочевого пузыря, получают Vu. С помощью правила Фика можно напрямую рассчитать величину GFR, используя преобразованное уравнение (2):
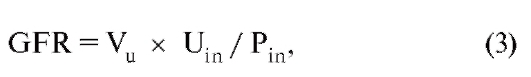
где GFR - скорость клубочковой фильтрации, Vu - скорость образования мочи (мл/мин), Uin - концентрация инулина в конечной моче (г/л), Pin - концентрация инулина в плазме крови (г/л).
Правая часть уравнения (3) называется клиренсом, и, таким образом: клиренс инулина (Cin) = GFR. Поскольку инфузия инулина является трудоемким методом, клиренс инулина определяется лишь в исключительных случаях. Проще проводить измерение GFR с помощью индикатора, который обычно находится в плазме крови, - креатинина. Он образуется из фосфокреатина в процессе обмена веществ в мышцах. Эндогенный креатинин не столь строго как инулин соответствует вышеназванным критериям (в том числе отсутствию секреции), но при этом определение клиренса эндогенного креатина вполне достаточно для рутинной проверки фильтрационной способности почек.
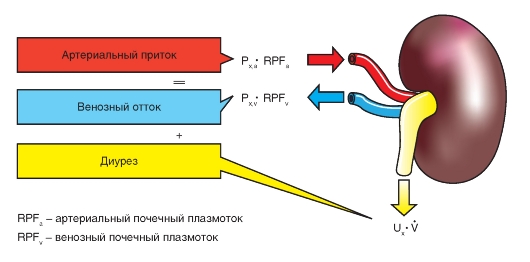
Для расчетов можно также использовать метод баланса массы (рис. 9-6). Поскольку вход вещества Х равен выходу Х,
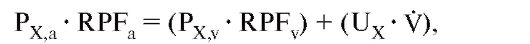
где PX,a и PX,v - концентрация вещества Х в плазме почечной артерии и почечной вены соответственно. RPFa и RPFv - скорость артериального и венозного тока плазмы в почке. Ux - концентрация вещества Х в моче.
На основании этого рассчитывается классическое уравнение клиренса:
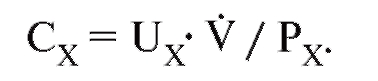
Рис. 9-6. Клиренс
Фильтрационный барьер нефрона
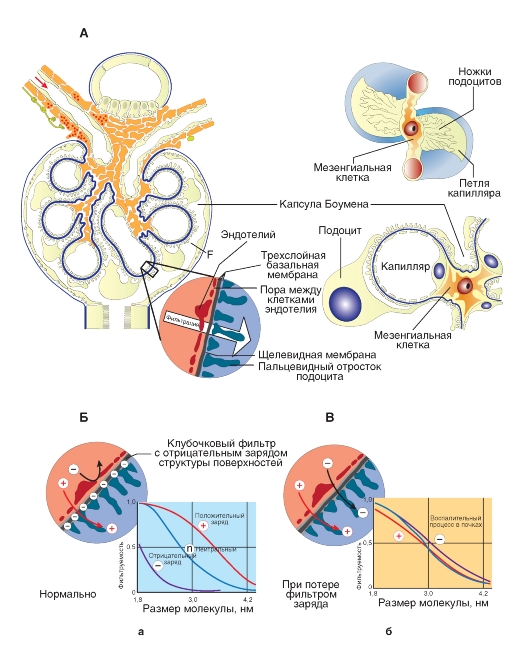
Эндотелий капилляров, базальная мембрана и отростки подоцитов образуют фильтр. В узком смысле понятие клубочек охватывает лишь сеть капилляров между приносящей и выносящей артериолами. Вместе с боуменовой капсулой он образует почечное тельце (рис. 9-7 А) диаметром 0,2 мм. На рис. 9-7 А структура клубочка схематично показана на срезе. Приток крови к капиллярным петлям (подключенным параллельно) обеспечивается за счет приносящей артериолы, а отток - выносящей артериолы. Между входящей в клубочек приносящей артериолой и выходящей из него выносящей артериолой лежат клетки мезангиума, к которым прижимается область Macula densa дистального канальца этого же нефрона. Капиллярное переплетение вдается во внутреннее пространство боуменовой капсулы, проксимальный каналец начинается на противоположной стороне боуменовой капсулы. Пространство боуменовой капсулы отделяется от просвета капилляра трехслойным фильтрационным барьером (рис. 9-7 Б). Его образуют: эндотелий капилляров клубочков, целостность которого прерывается порами с диаметром в 50-100 нм; трехслойная базальная мембрана, в которой в качестве фильтра служит сеть из коллагена IV, ламинина и нидогена, в которую встроены отрицательно заряженые глюкозаминогликаны (анионный барьер), и наконец, «висцеральный» листок эпителия боуменовой капсулы.
Висцеральный листок в разрезе прерывист, так как отростки эпителиальных клеток (подоцитов) переплетаются друг с другом, при этом между отростками остаются свободные щели. При более сильном увеличении можно увидеть, что эти щели перекрыты щелевидной мембраной и имеют отверстия величиной лишь около 4x14 нм. Щелевидная мембрана содержит важный для проницаемости фильтра протеин, нефрин, который заякорен через другой протеин, CD2AP, на соседних отростках подоцитов. Торчащие с обеих сторон в щель молекулы нефрина скрепляются друг с другом на подобии застежки молнии и оставляют между собой свободными щелевые поры, которые едва пропускают молекулы альбумина.
Клетки крови задерживаются уже первым слоем фильтра - эндотелием. Это справедливо и для больших белковых молекул, поскольку in vivo поры эндотелия вероятно покрыты отрицательно заряженным слоем белков. Способность к фильтрации макромолекул (молекулярная масса которых
около 10 000-70 000 Da) через следующие два слоя определяются не только шириной пор компонентов фильтра, но также и электрическим зарядом структур поверхностей фильтра.
Очищение фильтра обеспечивается клетками мезангиума и подоцитами клубочка, которые способны удалять высокомолекулярные отложения за счет фагоцитоза и последующего переваривания в лизосомах. При патологии масса отложений возрастает (например, комплексов антиген-антитело) клетки мезангиума начинают усиленно делиться. Это приводит к тому, что из-за ограниченного пространства капилляры сжимаются и количество фильтрата снижается.
В клубочке образуется ультрафильтрат, который наряду с водой содержит только небольшие молекулы. Свободно фильтруются лишь молекулы малого размера, радиус которых меньше 1,6-1,8 нм. Это соответствует молекулярной массе 6 000- 15 000 Da. Инулин, который используется для определения клиренса, имеет молекулярную массу около 5 000 Da и относится к данной группе. Для глобулинов радиусом >4,4 нм (> 80 kDa) фильтр обычно непроницаем, тоже самое справедливо и для эритроцитов, обладающих еще большими размерами. Вещества, радиусы молекул которых находятся в этих границах, фильтруются лишь частично: миоглобин (17 000 Da) на 75% и альбумин (69 000 Da) лишь на 0,03%. Плохо фильтруются также низкомолекулярные вещества, связанные с белками плазмы крови. Ca2+, например, фильтруется лишь на 60% вследствие того, что около 40% Ca2+ связывано с белками плазмы крови. Многие медикаменты, например большинство сульфаниламидов или сердечный гликозид дигитоксин, еще в большей степени связаны с белками плазмы крови, поэтому они крайне медленно выводятся почками.
Проницаемость фильтра для макромолекул с радиусом <4,4 нм зависит от заряда молекулы (рис. 9-7 Б). Причиной тому является отрицательный заряд структур поверхностей фильтра, за который ответственны анионные глико(сиало)- протеины. Они расположены на структурах базальной мембраны (как со стороны капилляра, так и со стороны боуменовой капсулы), а кроме того на поверхности внешней мембраны отростков подоцитов. Этот факт важен с точки зрения патофизиологии, поскольку уменьшение заряда структуры поверхностей фильтра резко повышает фильтрацию альбумина (рис. 9-7 В), что приводит к потерям большого количества этого белка плазмы крови с мочой - альбуминурия.
Рис. 9-7. Макро- и микроструктура фильтра капсулы Боумена (А). Зависимость проницаемости фильтра от заряда молекулы (Б, В)
Движущая сила фильтрации в нефроне
Эффективное фильтрационное давление является движущей силой фильтрации, причем давление крови в клубочковых капиллярах является его значительной составной частью. Процесс фильтрации сам по себе хотя и является пассивным процессом, однако для поддержания градиента давления должна постоянно затрачиваться энергия. Это происходит вдали от почек: в сердце, где АТФ потребляется для сокращения желудочка сердца, обеспечивающего давление крови.
По пути к капиллярам клубочков давление крови падает до уровеня 48 мм рт.ст. (Ркап; рис. 9-8 А). Однако оно не может быть полностью использовано для фильтрации, поскольку ему противодействуют два других давления. С одной стороны - это давление в боуменовой капсуле (РБоум) величиной около 13 мм рт.ст. Вычитание РБоум из Ркап дает гидравлическую разницу давлений (ΔΡ) величиной 35 мм рт.ст. С другой стороны, белки плазмы практически не проходят через фильтр, что обуславливает коллоидоосмотическое (онкотическое) давление крови (πкап), которое действует против ΔΡ. В плазме πкап составляет в среднем примерно 25 мм рт.ст. (Онкотическое давление в фильтрате не принимается в расчет, поскольку он практически не содержит макромолекул, отсюда и происходит название «ультрафильтрат»). Итак, эффективное фильтрационное давление (Рэфф) рассчитывается следующим образом:
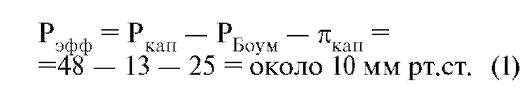
Это значение, измеренное у крысы (у человека оно не должно сильно отличаться), превалирует на приносящем конце клубочкового капилляра. По ходу капилляра значительно изменяется не
Ркап, а πкап. Это связано с тем, что во время про-
хождения по капилляру из плазмы в процессе фильтрации постоянно удаляется вода. В результате πкап возрастает нелинейно и достигает в капилляре при 20%-м удалении воды (фильтрационная фракция) значений около 35 мм рт.ст. Рэфф снижается до 0 (рис. 9-8 А), и фильтрация прекращается. Если эта точка достигается еще до конца капилляра клубочка, то данное фильтрационное равновесие ограничивает фильтрацию (рис. 9-8 Б). Если же в этом случае увеличивается почечный кровоток, то место фильтрационного равновесия сдвигается в конец капилляра, так что используется большая фильтрационная поверхность. Это может быть причиной зависимости GFR от почечного кровотока.
Итак, для нормальной GFR необходимы не только нормально функционирующие клубочки (поверхность фильтра, гидравлическая прницаемость, количество), но также:
- нормальное капиллярное давления Ркап;
- нормальный состав белков и их концентрация и, тем самым, нормальное онкотическое давление плазмы (πкапк);
- нормальное давление в пространстве боуменовой капсулы (РБоум).
Поэтому изменения в GFR могут быть вызваны колебаниями трех вышеназванных давлений. Так GFR снижается, например, при падении среднего системного давления крови ниже 75 мм рт.ст., при шоке (снижается Ркап), при патологически повышенной концентрации белков в плазме (множественная миелома; повышается πкап), или когда препятствие в мочевыводящих путях (опухоль или почечный камень) затрудняет отток мочи (повышается РБоум). Наоборот, GFR повышается, когда поднимается Ркап (например, при гипертонии со значениями давления крови за пределами ауторегуляторной области), или когда снижается πкап (при гипоальбуминемии в результате недоедания).
Рис. 9-8. Эффективное фильтрационное давление (Рэфф). Рэфф - движущая сила фильтрации.
равно давлению в капиллярах минус онкотическое давление в плазме πкап) и давление в Боуменовой капсуле (PБоум). Поскольку отток воды из плазмы (фильтрационная фракция - 0,2=20%) увеличивает концентрацию белков в плазме и повышает тем самым по ходу капилляров, уменьшается и даже может достичь нулевого значения (фильтрационное равновесие; А). Произведение среднего эффективного фильтрационного давления проницаемости фильтра для воды и его поверхности (два последних множителя вместе дают Kf) соответствует скорости клубочковой фильтрации одного клубочка (Б). Если фильтрационное равновесие сдвигается в конец капилляра, как это происходит в случае усиления почечного кровотока, то может быть использована большая поверхность фильтра, и GFR возрастает
Механизмы реабсорбции Na+ и Cl-
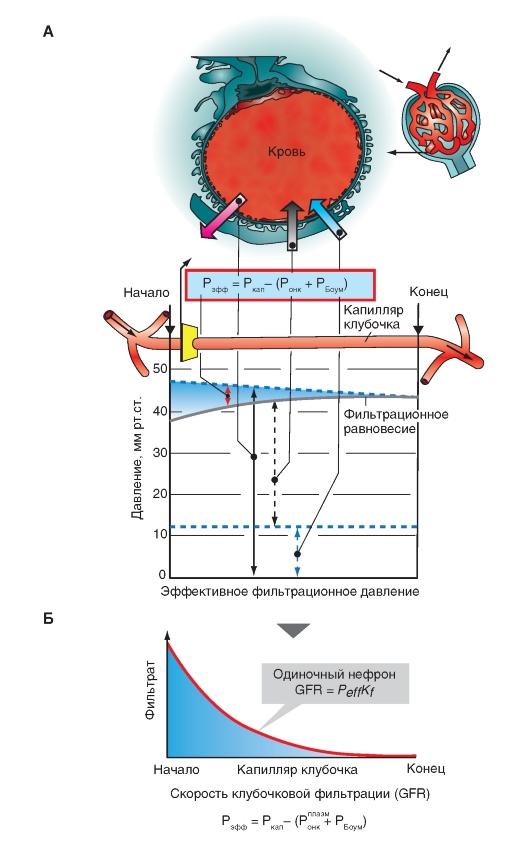
Проксимальные канальцы могут реабсорбировать ионы, например, Na+ и Cl- двумя путями - через клетку (трансклеточным: transcellular) и межклеточным (параклеточным: paracellular) способом, как это показано в виде принципиальной схемы путей на рис. 9-9 А. При трансклеточном пути Na+ и Cl- последовательно пресекают апикальную и базолатеральную мембраны до поступления в кровь. При параклеточном пути эти ионы двигаются полностью внеклеточным путем через tight junction между соседними клетками.
При трансклеточном пути скорость транспорта зависит от электрохимического градиента, наличия ионных каналов и транспортеров на апикальной и базолатеральной мембране. При параклеточном пути трансэпителиальные электрохимические движущие силы и проницаемость tight junctions определяет движение ионов.
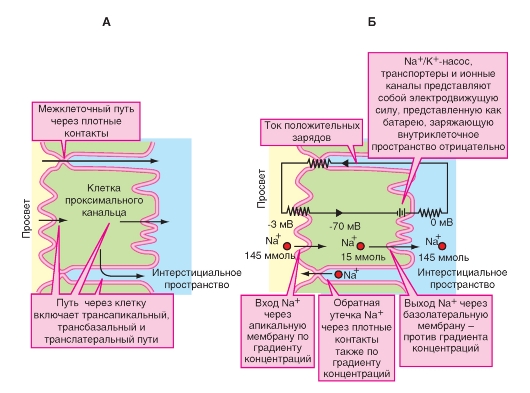
Основной механизм трансклеточной реабсорбции Na+ одинаков во всех сегментах нефрона и представляет собой различные варианты классического эпителиального транспорта в условиях модели, включающей две мембраны (рис. 9-9 Б). Первая ступень в этой модели - пассивный вход Na+ в клетку через апикальную мембрану. Поскольку внутриклеточная концентрация Na+ мала и потенциал клетки негативный по сравнению с канальцем, электрохимический градиент благосклонен для пассивного входа Na+ через апикальную мембрану. Однако различные сегменты канальцев используют различные механизмы для пассивного входа Na+ через апикальную мембрану.
Вторая ступень в этой модели трансклеточной реабсорбции - активное «выталкивание» Na+ из клетки через базолатеральную мембрану. Na+/К+-АТФаза, расположенная на базолатеральной мембране (первично-активный транспорт), играет основную роль в этом процессе.
Рис. 9-9. Трансклеточные и межклеточные пути реабсорбции на примере Na+ и Cl-
Реабсорбция Na+ в различных частях нефрона
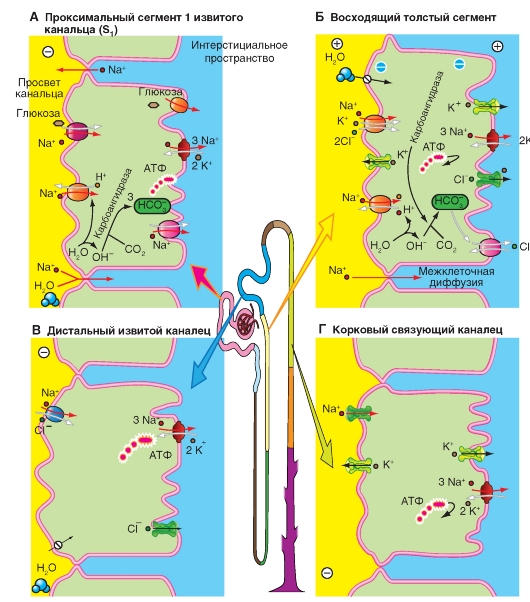
В проксимальном извитом канальце (рис. 9-10 А) Na+ переходит из просвета канальца в клетки по его электрохимическому градиенту с помощью белков-переносчиков, которые одновременно переносят в клетки глюкозу (рис. 9-10 А), а также аминокислоты, фосфат и т.д. (котранспорт). Кроме того, в процессах переноса Na+ в клетки участвует также Na+-Н+-переносчик (антипорт), работа которого способствует в данном случае реабсорбции профильтрованного бикарбоната (рис. 9-10 А). Большинство переносчиков (котранспорт) электрогенны, поэтому развивается трансэпителиальный потенциал более отрицательный в просвете канальца. Благодаря ему в нижележащих сегментах канальца межклеточно реабсорбируются ионы Cl-. В результате реабсорбции любого вещества устанавливается осмотическая разница между просветом канальца и интерстициальной жидкости, осмотическое давление которой увеличивается, что ведет к оттоку воды из просвета канальца по осмотическому градиенту. Вода увлекает за собой растворенные в ней вещества (перенос вместе с растворителем или solvent drag), что является еще одной формой пассивного транспорта веществ.
В целом реабсорбция Na+ в проксимальном извитом канальце может осуществляться (1) посредством (электронейтрального) Na+-H+-переносчика (антипорт), таким образом на каждый реабсорбируемый ион Na+ в просвет канальца выделяется в результате вторичного активного транспорта ион Н+, который в этом отделе участвует в сложном механизме реабсорбции бикарбоната HCO3-; (2) посредством целого ряда переносчиков Na+, которые помимо Na+ присоединяют и переносят в клетку в результате вторично-активного транспорта D-глюкозу, нейтральные или кислые аминокислоты, фосфат, сульфат, галактозу, витамин С, лактат, ацетат, цитрат, ацетоацетат, сукцинат или другие вещества (котранспорт). В этом случае Na+ движется в клетку по электрохимическому градиенту, а названные вещества идут против их электрохимических градиентов.
Проникновение Na+ в клетку при этом является процессом пассивным. Энергия высокого электрохимического градиента Na+, созданного Na+/К+-АТФазой, используется также для того, чтобы названные в пункте (1) ионы Н+ в результате вторичного активного транспорта были секретированы в просвет канальца в обмен на ионы Na+ (антипорт) и названные в пункте (2) вещества
реабсорбировались в результате вторичного активного транспорта, обусловленного работой белковпереносчиков, связывающихся одновременно с Na+ и этими веществами (котранспорт). Некоторые белки-переносчики могут связывать более одного иона Na+ и одновременно несколько других, переносимых веществ. В результате увеличивается движущая сила транспорта для веществ, переносимых с помощью вторичного активного транспорта: в случает двух ионов Na+ - в 2 раза (котранспорт).
В дистальном прямом канальце (толстой восходящей части петли Генле) процесс реабсорбции осуществляется с помощью белка-переносчика (вторичный активный транспорт, котранспорт), расположенного на апикальной мембране клеток эпителия. Он переносит одновременно 1Na+, 1К+ и 2Cl-, при этом движущей силой является градиент Na+ опять создаваемый Na+/К+-АТФазой, расположенной на базолатеральной мембране (первично-активный транспорт, рис. 9-10 Б). Через каналы на люминальной мембране К+ диффундирует обратно в просвет канальца (процесс рециркуляции). Диффузия К+ из клетки приводит к гиперполяризации люминальной мембраны. Кроме того, наличие ионов К+ в просвете канальца устанавливает трансэпителиальный потенциал, при котором жидкость в просвете канальца по отношению к интерстициальной жидкости заряжена положительно. Под влиянием этого трансэпителиального потенциала Na+ (и ряд других катионов) может быть реабсорбирован пассивно через проницаемые для катионов плотные контакты.
В дистальном извитом канальце реабсорбция Na+ продолжается вместе с Cl- (рис. 9-10 В). Оба этих иона из просвета канальца попадает в клетки дистального извитого канальца посредством механизма вторичного активного транспорта, обуславливающий одновременный перенос Na+ и Cl- (котранспорт; белок-переносчик: TSC). NaCl входит в клетку через апикальную мембрану посредством локализованного на люминальной мембране переносчика Na+ и Cl- (котранспорт), при этом Na+/К+-АТФаза на базолатеральной мембране активно выводит Na+ из клетки, поддерживая электрохимический градиент, обеспечивающий вход Na+ через люминальную мембрану. Работа этого электронейтрального Na+-Cl--переносчика стимулируется альдостероном, и тормозится диуретиком тиацидом. Поэтому он был назван TSC (thiazid-sensitive co-transporter). Cl- выходит из клетки через Cl--каналы (тип CLC-Kb).
В корковом собирательном протоке (рис. 9-10 Г) в главные клетки Na+ попадает через Na+-каналы.
Рис. 9-10. Клеточные модели реабсорбции Na+ в различных участках нефрона.
А - в проксимальном извитом канальце. Б - в дистальном прямом канальце (толстой восходящей части петли Генле). В - в дистальном извитом канальце. Г - в корковом связующем канальце
Реабсорбция Cl- в различных отделах нефрона
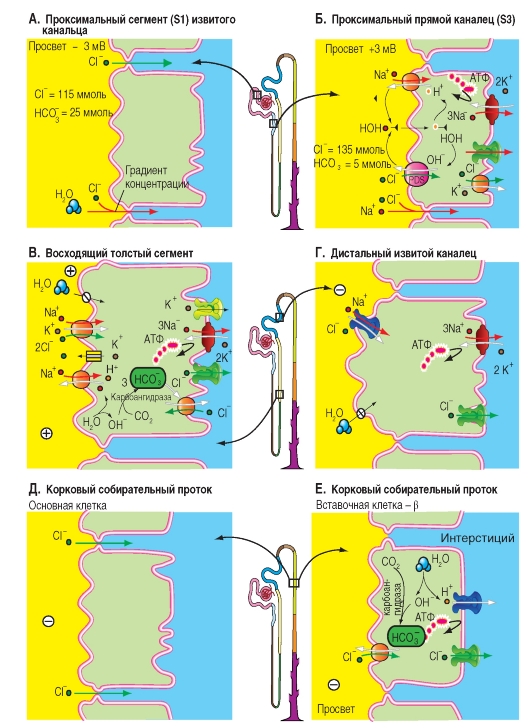
В проксимальном извитом канальце Cl- реабсорбируется преимущественно межклеточно (рис. 9-11 А). В начальных отделах проксимального канальца (S1), где концентрация Cl- равна 115 ммоль, реабсорбция Cl- идет только вслед за водой (поток воды увлекает за собой растворенные в ней вещества: перенос вместе с растворителем или solvent drag). По мере продвижения фильтрата по канальцам несмотря на небольшую реабсорбцию Cl- его концентрация возрастает поскольку из просвета канальца уходит вода и Na+. Из-за реабсорбции воды концентрация Cl- в просвете канальца достигает 135 ммоль, то есть становится больше, чем концентрация Cl- в интерстициальной жидкости, (например, в просвете проксимального прямого канальца). Разница концентраций Cl- в просвете проксимального канальца по сравнению с концентрацией Cl- в интерстициальной жидкости на каждом участке канальца представляет собой движущую силу для межклеточной диффузии Cl- из просвета канальца в направлении к кровеносным сосудам. Таким образом, Cl- может покинуть просвет канальца под воздействием химической движущей силы (∆[Cl-]): через плотные контакты между апикальными участками мембраны эпителиальных клеток (межклеточная диффузия). Таким способом реабсорбируется часть профильтровавшегося Cl-. В результате этой диффузии Cl- далее по ходу проксимального канальца возникает трансэпителиальный потенциал, при котором жидкость просвета канальца несет положительный заряд (изменение знака потенциала), что в свою очередь обеспечивает межклеточную реабсорбцию катионов Na+, К+, Ca2+ и Mg2+. Величина трансэпителиального потенциала составляет 2 мВ.
В проксимальном прямом канальце Cl- реабсорбируется как межклеточно вместе с Na+, так и при помощи переносчика (рис. 9-11 Б). В люминальной мембране доказано наличие переносчика (пендрин = PDS), который обменивает Cl- в том числе на формиат- (HCOO-). Кроме того клеточная мембрана проницаема (неионная диффузия) для муравьиной кислоты (HCOOH). При посредничестве переносчика NHE3 (антипорт Na+/H+), активность которого способствует циркуляции формиат- (НСОО-) через люминальную мембрану, Cl- накапливается в клетке результате вторичноактивного транспорта. Для этого, среда в просвете канальца должна быть более кислой чем в клетке, чтобы выделяемый формиат- (HCOO-) мог
титроваться в HCOOH. Через базолатеральную мембрану Cl- выходит из клетки в интерстициум через Cl--каналы и с помощью К+/Cl--переносчи- ка (котранспорт). На базолатеральной мембране при этом идет активная реабсорбция Na+, при участии Na+/К+-АТФазы.
Наиболее вероятный механизм для реабсорбции Na+ в средних и дальних участках проксимального канальца - обмен Na+/H+ (NНЕ3-переносчик), спаренный одновременно с обменом Cl-/OH- (PDS-переносчик). При этом OH- и Н+ взаимодействуют друг с другом в просвете канальца, превращаясь в воду, и в результате Na+ и Cl- входят в клетку эквимолярно. Из чего следует, что реабсорбция Cl- на этом участке в проксимального канальца осуществляется трансклеточно. Обнаружены еще два других механизма проникновения Cl- в клетку, в которые вовлечены процессы вторичного использов-ания формиата- (НСОО-) и секреции оксалата2 соответственно. Обмен Cl-/формиат- осуществляется PDS-переносчиком. Cl- выходит из клетки через базолатеральную мембрану пассивно через Cl--каналы, в результате осуществляемого белкомпереносчиком совместного транспорта К+-Cl- и в результате обмена Cl-/HCO3-.
В дистальном прямом канальце (толстой восходящей части петли Генле) процесс реабсорбции осуществляется с помощью белка-переносчика (вторичный активный транспорт, котранспорт), расположенного на апикальной мембране клеток эпителия. Он переносит одновременно 1Na+, 1К+ и 2Cl-, при этом движущей силой является градиент Na+ опять создаваемый Na+/К+-АТФазой, расположенной на базолатеральной мембране (первичный активный транспорт, рис. 10 В). В результате вторично-активного транспорта, Cl- накапливается в клетках и покидает их через Cl--каналы типа CLC-Кb на базолатеральной мембране (рис. 9-11 В). Медикаментозно Na+- К+-2Cl--переносчик (NKCC2), расположенный со стороны просвета толстого восходящего отдела петли Генле, может быть ингибирован диуретиками (например, буметанидом). Поэтому данный переносчик называется также BSC1 (bumetanidsensitive cotransporter). Этот переносчик может также вместо Cl- переносить в клетку ионы NH4+.
Реабсорбция в дистальном прямом канальце характеризуется высокой активностью процессов реабсорбции Na+. Со стороны просвета нефрона градиент Na+ используется для вторично-активного электронейтрального переноса Cl- и К+ (1). Через каналы К+ диффундирует обратно в просвет канальца (рециркуляция), а Cl- - в сторону кровеносных сосудов (2). Диффузия К+ из клетки приводит к гиперполяризации люминальной мембраны.
Кроме того, наличие ионов К+ в просвете канальца устанавливает трансэпителиальный потенциал, при котором жидкость в просвете канальца по отношению к интерстициальной жидкости заряжена положительно (3). Под влиянием этого трансэпителияльного потенциала Na+, К+, Ca2+ и Mg2+ могут быть реабсорбированы пассивно через проницаемые для катионов плотные контакты (3). В конечном итоге, здесь активно реабсорбируется NaCl, за которым пассивно следуют катионы (включая Na+) (4). Трансмембранный перенос К+ через базолатеральные мембраны канальцев в интерстициум (который электрически нейтрализует выход Cl-) и перенос К+ посредством Na+/К+-АТФазы здесь не изображены, чтобы не загромождать рисунок. Для воды этот сегмент канальца непроницаем, поэтому активный транспорт NaCl вызывает появление трансэпителиального осмотического градиента.
В дистальном извитом канальце продолжается реабсорбция Na+ и Cl-, которые, как важные компоненты осмоляльности, все больше заменяются мочевиной, поставляемой из мозгового вещества почек (рис. 9-11 Г). NaCl из просвета канальца попадает в клетки дистального извитого канальца посредством механизма вторичного активного транспорта, обуславливающий
одновременный перенос Na+ и Cl- (котранспорт; белок-переносчик: TSC), а в главные клетки связующего отдела и собирательной трубки - через Na+-каналы. Проникновение Na+ в клетку через Na+ -каналы деполяризует люминальную мембрану, что усиливает секрецию К+ и способствует возникновению трансэпителиального потенциала, отрицательного в просвете канальца, под действием которого межклеточно реабсорбируется Cl-. В дистальном извитом канальце NaCl входит в клетку через апикальную мембрану посредством локализованного на люминальной мембране переносчика Na+ и Cl- (котранспорт), при этом Na+/ К+-АТФаза на базолатеральной мембране активно выводит Na+ из клетки, поддерживая электрохимический градиент, обеспечивающий вход Na+ через люминальную мембрану. Работа этого электронейтрального Na+-Cl--переносчика стимулируется альдостероном, и тормозится диуретиком тиацидом. Поэтому он был назван TSC (thiazidsensitive co-transporter). Cl- выходит из клетки через Cl--каналы (тип CLC-Кb).
В корковом собирательном протоке (рис. 9-11 Д, Е) NaCl может реабсорбироваться против химического градиента, поэтому концентрация NaCl в конечной моче может снижаться в случае необходимости до нескольких ммоль.
Рис.9-11. Клеточные модели транспорта Cl- в различных отделах нефрона.
А - реабсорбция Cl- в проксимальном извитом канальце. Б - реабсорбция Cl- в проксимальном прямом канальце. В - реабсорбция Cl- в дистальном прямом канальце (толстой восходящей части петли Генле), Г - реабсорбция Cl- в дистальном извитом канальце, Д - реабсорбция Cl- в корковом собирательном протоке. Е - реабсорбция Cl- в β-вставочной клетке коркового собирательного протока
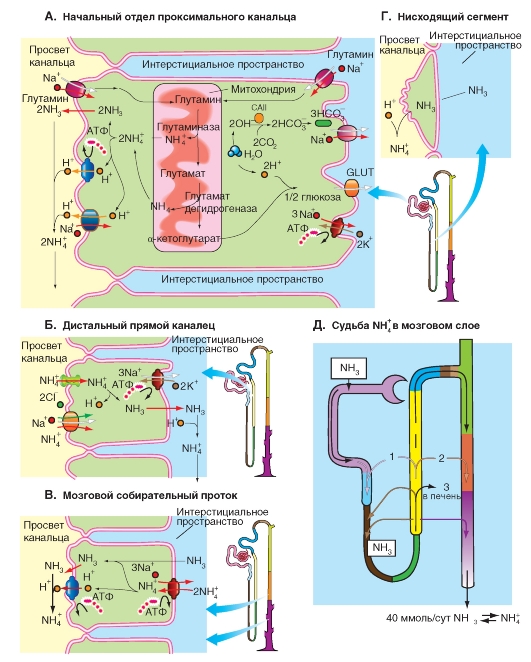
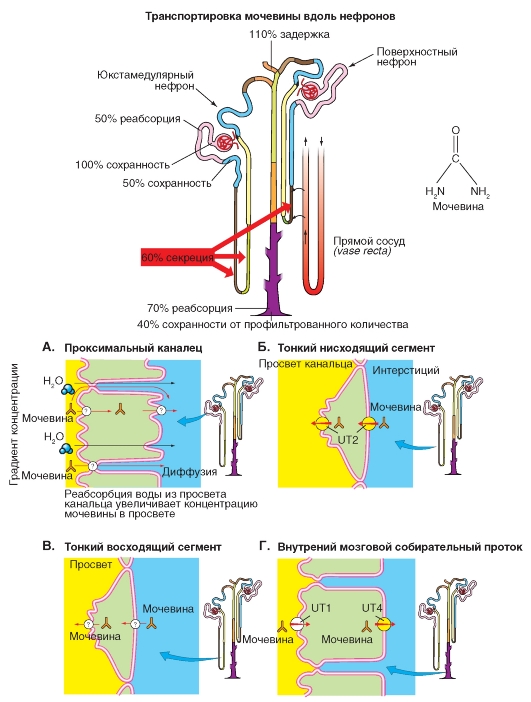
Транспорт мочевины
До конца проксимального канальца реабсорбируется (пассивно) около половины профильтровавшейся мочевины, так как этот отдел нефрона проницаем для нее (рис. 9-12 А).
Поскольку петля Генле погружается в богатый мочевиной интерстициум мозгового вещества почек, мочевина транспортируется из интерстициума в просвет тонкой нисходящей части петли Генле (рис. 9-12 Б), в стенке которой имеется переносчик мочевины (UT2 = Urea Transportert, Typ 2).
В тонкой восходящей части петли Генле мочевина идет пассивно (диффузия) по градиенту концентрации. Концентрация мочевины в интерстициальной жидкости превышает ее концентрацию в просвете тонкой восходящей части петли Генле.
Другие участки нефрона (толстая восходящая часть петли Генле, дистальный каналец, а также корковая и внешняя медуллярная собирательная трубочка) непроницаемы для мочевины, поэтому ее концентрация в просвете нефрона возрастает вследствие реабсорбции воды в этих отделах. В этих отделах нефрона мочевина даже замещает NaCl - важнейший компонент осмоляльности мочи.
Лишь стенки нижних отделов собирательной трубочки вновь (в особенности в присутствии АДГ) проницаемы для мочевины. Там на апикальной мембране имеется переносчик UT1 (Urea Transportert, Typ 1), а на базолатеральной мембране - переносчик UT4 (Urea Transportert, Typ 4). При помощи эих двух переносчиков мочевина переносится из просвета собирательной трубочки по направлению ее химического градиента
в клетку, а из нее в интерстициум внутреннего мозгового вещества (рис. 9-12 В). В конечном итоге происходит циркуляция мочевины между тонким нисходящим и восходящим отделом петли Генле и отделом собирательной трубочки, лежащей глубоко в мозговом веществе почки.
Из медуллярного отдела собирательной трубочки вследствие ее высокой проницаемости для мочевины, в особенности в присутствии антидиуретического гормона, мочевина по градиенту концентрации пассивно выходит в мозговое вещество почки. Ее концентрация в интерстициальной жидкости превышает ее концентрацию в нисходящем тонком и восходящем отделах петли Генле, которые проницаемы для мочевины. Следующие отделы нефрона - толстая часть петли Генле, дистальный каналец и большая часть собирательной трубочки не проницаемы для мочевины и она не может покинуть эти отделы нефрона. В тех отделах нефрона (где в отличие от толстой восходящей части петли Генле нет активной реабсорбции NaCl: нисходящих и восходящих тонких сегментах петли Генле) мочевина принимает участие в процессе концентрирования мочи, до тех пор пока она в конце концов не покинет организм, как вещество, выводимое исключительно с мочой.
Поскольку концентрация мочевины в интерстициуме мозгового вещества почки вблизи сосочка велика, она значительно влияет на общую осмоляльность, и поэтому концентрация NaCl в инерстициальной жидкости может поддерживаться на более низком уровне. Это способствует пассивной межклеточной реабсорбции NaCl из тонкой восходящей части петли Генле.
Рис. 9-12. Транспорт мочевины. Мочевина является продуктом преобразования белков.
А - проксимальный каналец. Б - тонкий нисходящий сегмент (нисходящая часть петли Генле). В - тонкий восходящий сегмент (восходящая часть петли Генле) и Г - внутренний мозговой собирательный проток проницаемы для мочевины, что приводит к ее частичной реабсорбции путем пассивной диффузии по градиенту концентрации. Прежде чем мочевина покинет почку, ее осмотическая активность используется для процесса концентрирования и для экономии Na+, так как некоторые отделы нефрона непроницаемы для мочевины. С начала дистального прямого канальца (толстой восходящей части петли Генле), в дистальном канальце и до начала нижней собирательной трубочки мочевина не может покинуть просвет нефрона, поэтому концентрация мочевины в просвете нефрона возрастает за счет оттока воды в дистальном извитом канальце и собирательной трубочке. Лишь во внутреннем медуллярном сегменте собирательной трубочки, особенно в присутствии AДГ мочевина переходит в интерстициум, где она в значительной мере определяет высокую осмоляльность. Затем мочевина большей частью вновь переходит в нисходящую и восходящую тонкие части петли Генле (медулло-медуллярная рециркуляция) и частично реабсорбируется в прямых сосудах
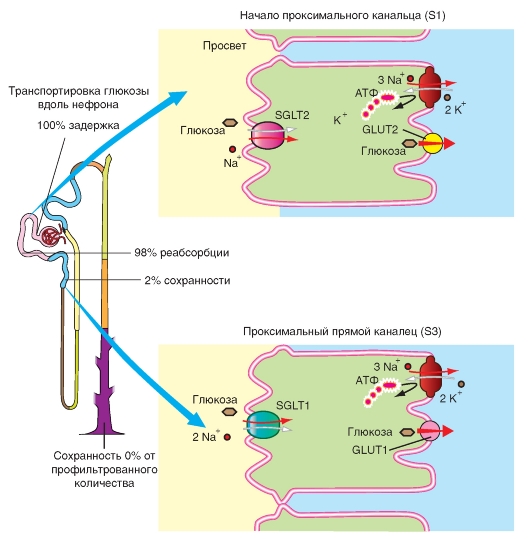
Реабсорбция глюкозы
В почке D-глюкоза практически полностью реабсорбируется (рис. 9-13). Местом реабсорбции является проксимальный каналец. В настоящее время описана молекулярная структура ответственных за это белков-переносчиков.
В апикальной мембране проксимального извитого канальца в сегменте S1 работает механизм вторичного активного транспорта, который осуществляется белком-переносчиком SGLT2 (sodium-glucose transporter, Typ2: SGLT2), обладающем низкой аффинностью. Он одновременно переносит Na+ и глюкозу (но не галактозу) в соотношении 1:1. С помощью данного переносчика к концу проксимального извитого канальца (например, у крысы) реабсорбируется около 95% профильтровавшегося количества глюкозы.
В сегменте S3 прямой части проксимального канальца обнаружен еще один белок-переносчик
SGLT1, расположенный на апикальной мембране, который обладает высокой аффинностью и на одну молекулу глюкозы переносит два иона Na+ (котранспорт). С помощью этого переносчика концентрация глюкозы в просвете канальца может быть снижена настолько, что в конечной моче обнаруживается лишь 1/1000 профильтровавшегося количества глюкозы.
Переход глюкозы, поступившей из просвета канальца, в кровь околоканальцевых капилляров является пассивным. Он обеспечивается (независимым от ионов) переносчиком GLUT2 (glucose transporter 2: GLUT2) и движим химическим градиентом глюкозы (так называемая облегченная диффузия). GLUT2 также может переносить галактозу и фруктозу, при этом галактоза переносится в клетку из просвета канальца в результате вторично-активного транспорта с помощью SGLT1, а фруктоза - пассивно с помощью переносчика GLUT5.
Рис. 9-13. Транспорт глюкозы.
Реабсорбция глюкозы происходит большей частью в начальных отделах проксимального канальца. Если увеличивается профильтровавшееся количество глюкозы, то по мере насыщения переносчиков в начальных отделах проксимального канальца в процесс реабсорбции вовлекаются дистальные сегменты проксимального канальца, и ценная для организма глюкоза практически полностью реабсорбируется
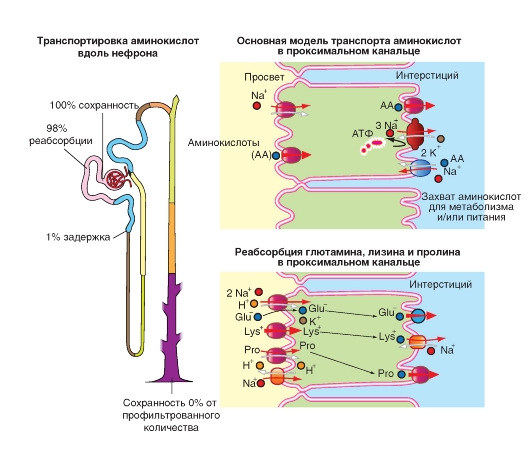
Реабсорбция аминокислот
Аминокислоты реабсорбируются на >98% (отдельные аминокислоты, например, L-валин до >99,8%). Исключениями являются глицин (96%), гистидин (94%), а также таурин (около 90%). Для аминокислот существует множество белков-переносчиков, которые обладают специфичностью к одной группе структурно-родственных L-аминокислот (рис. 9-14).
Так в апикальной мембране клеток эпителия проксимального канальца имеются белки-переносчики, обеспечивающие сопряженный перенос Na+ и аминокислот (котранспорт):
а) для анионных аминокислот, таких как L-глю- тамат- и L-аспартат- (переносит 2Na+/анион аминокислоты-);
б) для большинства нейтральных L-аминокис- лот (1Na+/нейтральная аминокислота; высокая эффективность);
в) для L-пролина;
г) для β-аминокислот, таких как таурин, β-аланин и др.
Благодаря им внутриклеточные концентрации аминокислот увеличиваются в несколько раз по сравнению с концентрациями в плазме крови: таурина, например, - в 30 раз, а L-глутамата- -
в 50 раз. Поэтому выход аминокислот из клетки в интерстициальное пространство и далее к капиллярам может осуществляться пассивно («облегченная диффузия» за счет различных переносчиков).
Катионные аминокислоты L-аргинин+, L-ли- зин+ и L-орнитин+ могут проникать в клетку как пассивно (мембранный потенциал как движущая сила!), так и переноситься в результате вторично-активного транспорта совместно с Na+. Такой переносчик (называемый D2H) связывает и переносит также цистеин и другие нейтральные аминокислоты. Как, вопреки направленному против них потенциалу, катионные аминокислоты покидают клетку через базолатеральную мембрану, пока неясно.
Переносчики аминокислот стереоспецифичны, хотя есть и исключения (например, транспорт D-аспартата переносчиком анионных аминокислот). Как переносчик глюкозы принимает лишь D- (но не L-глюкозу), так и в случае аминокислот транспортируются лишь L- (но не D-) изомеры.
Поскольку сходные аминокислоты переносятся одним и тем же переносчиком, одна аминокислота (например, аргинин+) может тормозить реабсорбцию другой аминокислоты (в данном случае, лизина+).
Рис. 9-14. Транспорт аминокислот.
Реабсорбция аминокислот происходит большей частью в начальных отделах проксимального канальца. В начальных отделах проксимального канальца в процесс реабсорбции вовлекаются дистальные сегменты проксимального канальца, и ценные для организма аминокислоты практически полностью реабсорбируются. В качестве примера на рисунке представлены лишь отдельные переносчики. В общем случае переносчик для аминокислот обозначен как АА - аминокислоты. Далее представлены отдельные примеры переносчиков: Glu - для глутамата, Lys - для лизина, Pro - для пролина
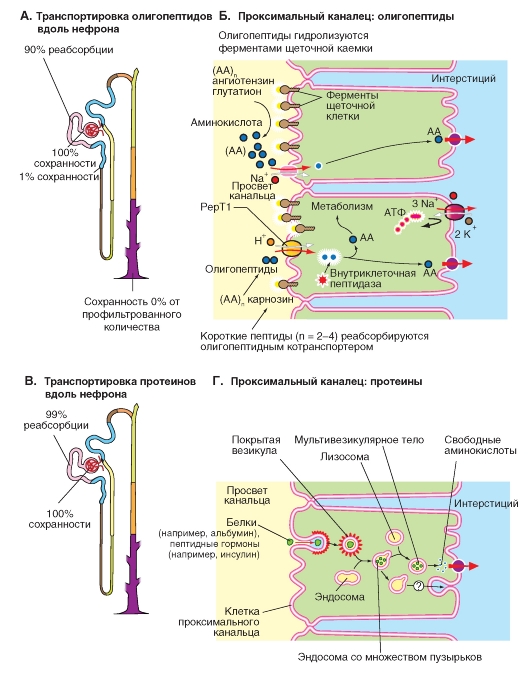
Реабсорбция олигопептидов и белков
Пептиды реабсорбируются расщепленными и нерасщепленными. Некоторые ди- и трипептиды (например, карнозин) устойчивы по отношению к действию пептидаз просвета канальца. Для них в апикальной мембране клеток проксимального канальца имеется два переносчика, обеспечивающих перенос пептида и H+ в клетку (котранспорт): PерT1 (сегмент S1) и PерT2 (сегмент S2). С помощью этих переносчиков дипептиды (и определенные антибиотики - цефалоспорины) могут в результате вторичного активного транспорта переноситься через щеточную каемку в клетку по направлению градиента H+ (рис. 9-15 Б). Такие пептиды в большинстве случаев расщепляются до аминокислот внутриклеточно.
Для коротких пептидных цепочек существует еще одна форма реабсорбции. В щеточной каемке проксимального канальца одновременно с рядом ферментов (например, мальтаза, трегалаза) обнаруживается высокая активность аминопептидаз, эндопептидаз и γ-глютамилтрансфераз (γ-GT), которые действуют в просвете нефрона. Они способны настолько быстро расщеплять белки в просвете канальца, что при прохождении мочи через проксимальный каналец (около 12 с) остается еще достаточно времени для реабсорбции образующихся продуктов расщепления, т.е. аминокислот.
Для больших белков клубочковый фильтр не-проницаем, особенно если они заряжены отрицательно. Концентрации в фильтрате количественно важного белка плазмы крови альбумина составляет лишь 0,01-0,05% от его концентрации в плазме крови (около 40 г/л). Несмотря на слабую проницаемость фильтра, профильтровавшееся количество альбумина при GFR 180 л/ сут может достигать (180 x 40 x 0,0001 соответственно = 0,0005) 0,75-4 г/сут. К нему могут быть
добавлены другие белки плазмы, в особенности низкомолекулярные: лизоцим, обломки иммунглобулинов, α1- и β2-микроглобулин и т.д. В моче обычно появляется лишь 35 мг альбумина в день. Это означает, что более чем 96% профильтровавшегося альбумина реабсорбируется в проксимальном канальце (подобное справедливо и для других белков).
В то время как короткие пептидные цепочки гидролизуются уже в просвете канальца, большие пептиды с дисульфидными мостиками (такие как инсулин, β2-микроглобулин) и белки, такие как альбумин, могут реабсорбироваться в проксимальном канальце за счет эндоцитоза, который запускается взаимодействием белка со специфическим рецепторным комплексом щеточной каемки (рис. 9-15 Г). Этот процесс идет с потреблением АТФ. Белки связываются с рецепторами (=комплекс мегалинкубилин) щеточной каемки и транспортируются к основанию микроворсинок, где отшнуровываются эндоцитозные везикулы, превращающиеся внутри клетки в эндосомы. Эндосомы сливаются с лизосомами, и протеазы лизосом расщепляют захваченные белки до аминокислот. (Некоторые белки гидролизируются уже в эндосомах). Появляющиеся при этом аминокислоты посредством переносчика везикулярной мембраны переносятся в цитоплазму. Мембрана везикулы, несущая рецепторы, снова встраивается в плазматическую мембрану, обращенную в просвет канальца (мембраный цикл). С помощью опосредованного мегалин-кубилином эндоцитоза реабсорбируются также некоторые связанные с белками витамины, например ретинол (на ретинол-связывающем белке), кобаламин (на транс-кобаламине) и 25-OH-холекальциферол (=кальцидол; на белке, связывающем витамин D, DBP). Так 25-OH-холекальциферол попадает в клетки, и под действием 1-α-гидроксилазы превращается в кальцитриол.
Рис. 9-15. Транспорт олигопептидов и белков.
Рассматривается канальцевая реабсорбция олигопептидов и белков. Большинство коротких пептидных цепочек (например, глюкагон, ангиотензин II, рилизинг факторы и глутатион) настолько быстро гидролизуются пептидазами щеточной каемки, действующими в просвете канальца, что образующиеся при этом аминокислоты могут быть реабсорбированы, прежде чем они достигнут конца проксимального канальца. Определенные ди- и трипептиды (например, карнозин) более устойчивы к действию пептидаз. Поэтому в проксимальном канальце они транспортируются внутрь клетки белком-переносчиком, осуществляющим сопряженный перенос пептид-H+ (котранспорт), где и расщепляются (А). Белки, такие как лизоцим, β2-микроглобулин и альбумин, а также пептиды, содержащие дисульфидные мостики (например, инсулин), реабсорбируются в проксимальном канальце посредством эндоцитоза, который запускается взаимодействием белка со специальными рецепторами, и гидролизуются в лизосомах
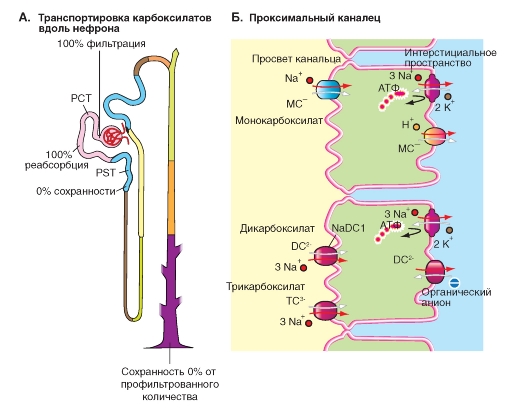
Транспорт трикарбоксилатов
Дикарбоксилаты появляются в клетке либо в результате обмена веществ, протекающего в клетках проксимального канальца, или переносятся в клетку из внеклеточного пространства в результате вторично-активного транспорта с помощью переносчика hNaDCl, который осуществляет сопряженный перенос Na+ - дикарбоксилат
(котранспорт, рис. 9-16). В последнем случае перенос OA- представляет собой «третично»-активный транспорт. Для секреции амфифильных конъюгатов (например, сцепленных с глутатионом липофильных токсинов) в апикальной мембране, отделяющей клетку от просвета канальца, дополнительно существует АТР-зависимый конъюгатный насос MRP2 (Multi-drug-resistance protein, Typ 2: MRP2).
Рис. 9-16. Транспорт моно-, ди- и трикарбоксилатов
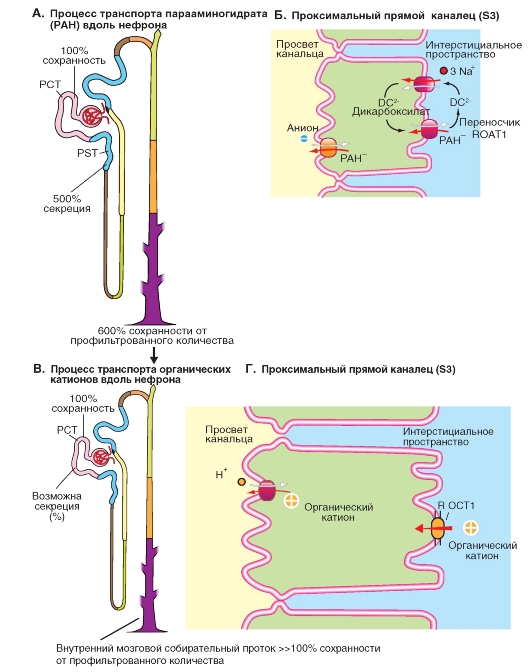
Секреция органических ионов
а из клетки выносит дикарбоксилаты (2 оксиглутарат2-, сукцинат2-; антипорт). На апикальной мембране имеется обменник, который выводит из просвета канальца анионы (например, ураты) в обмен на РАН, который секретируется в просвет канальца.
Секреция органических катионов, OK+ (органические основания) также осуществляется в проксимальном канальце (рис. 9-17 В, Г). К органическим катионам относится ряд растительных алкалоидов (таких как атропин и морфин), диуретик амилорид или присущий организму гистамин. Рассмотрим пример, представленный на рис. 9-17 В, Г. В этом случае механизм вторичного активного транспорта локализован в апикальной мембране клеток эпителия канальца, где путем переноса обмениваются органические катионы на Н+ (противоположно направленный транспорт или антипорт). Движущей силой этого процесса является электрохимический градиент Н+ через апикальную мембрану со стороны просвета канальца, который поддерживается переносчиком, осуществляющим обмен Na+ на Н+ (антипорт) и Н+-АТФазой. Дополнительно, по всей видимости, возможна первично-активная секреция OK+ посредством MDR1 (Multi Drug Resistance Protein Type 1: MDR1). Переход OK+ из интерстициального пространства в клетку через базолатеральную мембрану осуществляется за счет полиспецифичного переносчика органических катионов ROCT1 (renal organic cation transporter Typ1: ROCT1; облегченная диффузия).
Рис. 9-17. Секреция органических анионов и катионов.
A, Б - органические анионы (OA-, в качестве примера на рисунке продемонстрирована PAH-) и
B, Г - органические катионы (OK+) попадают в просвет проксимального канальца не только в результате клубочковой фильтрации, но и в результате активной секреции. Поскольку OA- и OK+ практически не реабсорбируются, то они могут быть выведены с мочой в больших количествах
Если говорить коротко, то в мембране клеток проксимального канальца имеются переносчики, которые активно секретируют в просвет канальца органические кислоты и основания. Таким образом, разнообразные конечные продукты обмена веществ, чужеродные и ядовитые вещества могут быть быстро выведены из организма. Интенсивность процессов секреции может быть настолько высокой, что выводимое количество оказывается в четыре раза выше профильтрованного.
Итак, к задачам проксимального канальца относится также секреция органических веществ. Эта секреция может очень сильно ускорять процесс выведения веществ (по сравнению с только фильтрующимися веществами), поскольку к профильтровавшемуся количеству вещества добавляется секретируемое количество вещества.
Секреция органических анионов, ОА- (органические кислоты), таких как парааминогиппуровая кислота (РАН), мочевая кислота, гиппуровая кислота, пенициллин, фуросемид, индометацин и различных конъюгатов токсинов, осуществляется путем вторичного активного транспорта. Рассмотрим пример для РАН, представленный на рис. 9-17 А, Б. В базолатеральной мембране имеется по крайней мере один переносчик органических анионов ROAT1 (ROAT1, renal organic anion transporter Typ1). ROAT1 связываясь с ОА- переносит его через базолатеральную мембрану в клетку,
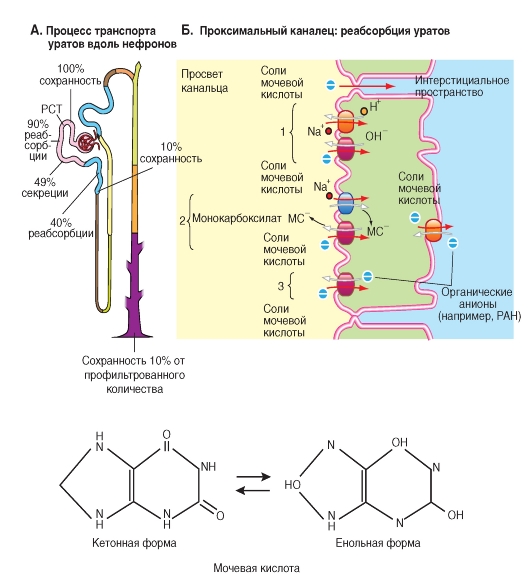
Транспорт уратов
Ураты - кислые, хорошо растворимые натриевая и калиевая соли мочевой кислоты. Высокая растворимость уратов в плазме объясняется наличием связывающих белков и, возможно, некоторых растворяющих низкомолекулярных соединений. По мере продвижения по системе почечных канальцев часть экскретируемых с мочой уратов превращается в мочевую кислоту: 2,6,8-триоксипу- рин, или C5H4N4O3.
Мочевая кислота является конечным продуктом пуринового обмена, причем ксантиноксидаза катализирует два последних этапа образования мочевой кислоты (гипоксантин - ксантин - урат). В проксимальном канальце мочевая кислота одновременно реабсорбируется и секретируется; процессы реабсорбции превалируют, поэтому около 10% профильтровавшегося количества мочевой кислоты выводится с мочой. При высококонцентрированной моче это означает, что концентрация мочевой кислоты в 20-30 раз превышает ее концентрацию в плазме крови, нормальное значение для которой составляет около 0,25 ммоль. Повышение концентрации мочевой кислоты в плазме крови (гиперурикемия, концентрация от 0,4 и выше 0,6 ммоль) может быть вызвано несколькими причинами: уменьшением выделения почками (ослабленная секреция или усиленная реабсорбция); образованием больших количеств мочевой кислоты в
результате обмена веществ, например при богатом пуринами питании (мясо, внутренности); определенными дефектами ферментов; болезнями, вызывающими многочисленную гибель клеток. Мочевая кислота и ее соли при низком значении рН плохо растворимые. Поэтому при гиперурикемии они выпадают в виде кристаллов, следствием чего является тяжелое поражение органов.
На рис. 9-18 представлена и реабсорбция и секреция уратов, при этом реабсорбция обычно доминирует. Прописанный на рисунке путь (1) включает в себя обменник уратов на ОН- или НСО3- со стороны просвета проксимального канальца, расположенный на апикальной мембране (третично активный транспорт - tertiary active transport) и работающий параллельно с апикальным Na-H-обменником (вторично активный транспорт). Второй путь (2) представляет собой обменник уратов на монокарбоксилат (лактат, β -гидроксибутират) или дикарбоксилат (третично активный транспорт) в параллель с работающим по Na+ карбоксилатным контранспортом (вторично активный транспорт - разница градиента Na+). Третий путь (3) - обменник уратов со стороны просвета проксимального канальца на анионы, такие как РАН (третично активный транспорт), и обменник на базолатеральной мембране, осуществляющий усвоение РАН-подобных анионов (вторично активный транспорт) в обмен на соли мочевой кислоты.
Рис. 9-18. Транспорт уратов (солей мочевой кислоты).
Рассматривается реабсорбция и секреция уратов (солей мочевой кислоты). РТС - проксимальный извитой каналец
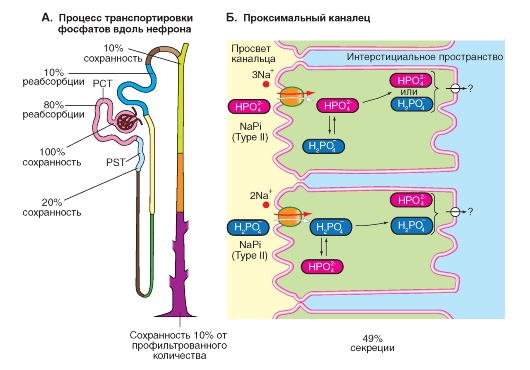
Транспорт фосфатов
Фосфат реабсорбируется на две трети посредством вторично-активного транспорта в проксимальном канальце с помощью переносчика NaPi-3, расположенного на апикальной мембране эпителиальных клеток и осуществляющего сопряженный с Na+ перенос (котранспорт). При этом вместе с одной молекулой фосфата (как HPO42-, так и H2PO4-) три иона Na+ переносятся в клетку (рис. 9-19). Высокие концентрации паратиреоидного гормона, действие которого опосредуется циклическим монофосфатом (цАМФ) или инозитолтрифосфатом (IР3/DАО), а также избыток фосфата, ацидоз и гипокальциемия уменьшают количество этих переносчиков в мембране, тогда как низкие концентрации паратиреоидного гормона, недостаток фосфата, алкалоз и гиперкальциемия увеличивают их число. Кроме того, описана молекулярная структура еще одного переносчика (NaPi-1), который был обнаружен в апикальной мембране клеток эпителия других отделов нефрона, локализованных в корковом веществе почки. Однако его функция еще неясна.
Выход фосфата через базолатеральную мембрану осуществляется, возможно, за счет облегченной
диффузии. Ответственный за это переносчик (переносчики) еще не идентифицирован с достаточной точностью, поэтому на рис. 9-19 около него стоит знак вопроса. Реабсорбция фосфата продолжается и дистальнее, так что в конечном итоге фракционное выведение составляет 10-20%. Выведение фосфата значительно увеличивается уже тогда (достижение так называемого «порогового значения»), когда концентрация фосфата в плазме крови увеличивается (и тем самым увеличивается количество профильтровавшегося фосфата) и ее значение становится больше значения для концентрации в нормальных условиях (0,8-1,4 ммоль). Реабсорбционная мощность почки по отношению к фосфату (подобным образом обстоит дело с бикарбонатом и сульфатом) используется так, что и в нормальных условиях почка работает как при «перегрузке» и излишки фосфата мгновенно выводятся. В плазме крови и клубочковом фильтрате (рН 7,4) фосфат представлен на 80% в виде HPO42- и только на 20% в виде H2PO4- (pKa' = 6,8). По мере прохождения через канальцы и собирательную трубочку нереабсорбированный HPO42- посредством секретируемых ионов Н+ титруется в H2PO4-, что в значительной мере способствует почечному выведению ионов Н+.
Рис. 9-19. Транспорт фосфатов.
Рассматривается реабсорбция фосфата в проксимальном канальце. Неорганический фосфат (Pi) встречается в плазме (pH 7,4) в форме HPO42- и H2PO4- (в соотношении 4:1). Обе формы свободно фильтруются и в проксимальном канальце реабсорбируются посредством механизма вторичного активного транспорта (котранспорта с Na+). Экскретируемая фракция фосфата (обычно 10-20%), величина которой регулируется почками, увеличивается при возрастающей и уменьшается при снижающейся концентрации фосфата в плазме крови. Паратиреоидный гормон увеличивает выведение фосфата. Выведение H2PO4 - способствует удалению из организма H+.
РСТ - проксимальный извитой каналец. PST - проксимальный прямой каналец
Транспорт ионов кальция
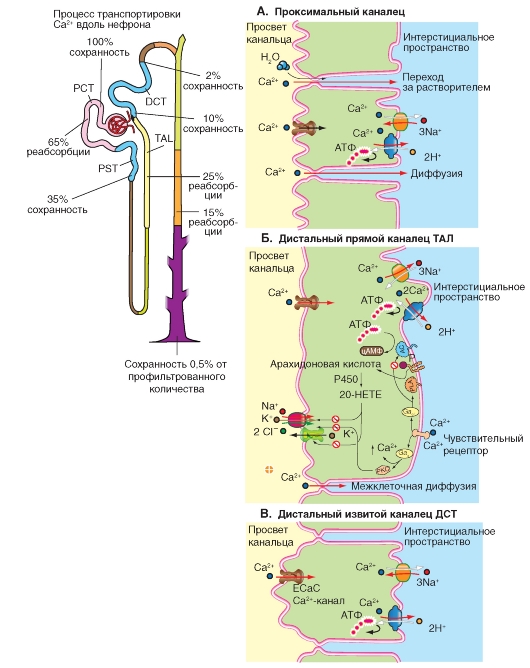
Почка в значительной мере принимает участие в балансе Ca2+. Ca2+ в плазме крови частично связан с белками, т.е он фильтруются лишь отчасти. Реабсорбция Ca2+ происходит во многих отделах нефрона, однако большая - часть Ca2+ реабсорбируется в проксимальном извитом канальце. Ca2+ реабсорбируется преимущественно пассивно - межклеточно (хотя возможна и трансклеточная реабсорбция). Выделение ионов контролируется гормонами. Паратиреоидный гормон снижает выведение Ca2+.
Концентрация Ca2+ в плазме составляет около 2,5 ммоль и только около 60% от этой величины, из-за связывания Ca2+ с белками, оказывается в клубочковом фильтрате, т.е. 1,5 ммоль. Из профильтровавшегося количества Ca2+ в проксимальном канальце реабсорбируется до 60%, в петле Генле (в дистальном прямом канальце (толстой восходящей части петли Генле)) - около 30% и в лежащих далее отрезках нефрона (дистальном извитом канальце) - от 5 до 9%. В итоге экскретируемая фракция обычно составляет 1-2%, а максимально - 5%.
Основные формы реабсорбции Ca2+ в проксимальном канальце - межклеточный и трансклеточный транспорт. Пассивный межклеточный механизм реабсорбции Ca2+ в проксимальном канальце (рис. 9-20 А) и в дистальном прямом канальце (толстой восходящей части петли Генле: рис. 9-20 Б) представлен на схемах. Трансэпителиальный потенциал (жидкость канальца в этих отделах нефрона заряжена положительно по отношению к плазме крови) представляет собой движущую силу этого процесса. Поскольку диуретики, действующие в петле Генле, снижают этот потенциал в дистальном прямом канальце, то эти диуретики увеличивают выведение Ca2+ (и Mg2+). Трансклеточный транспорт Ca2+ складывается из пассивного проникновения Ca2+ в клетку через апикальную мембрану (Ca2+-каналы) и переноса через базолатеральную мембрану (против крайне высокого электрохимического
градиента), осуществляемого посредством механизма первично-активного транспорта при участии Ca2+-ATФазы.
В дистальном извитом канальце (рис. 9-20 В) работает вторично-активный переносчик, обеспечивающий обмен 1Ca2+/3Na+ (антипорт), и первично-активный Ca2+-насос (Ca2+-АТФаза). На пути между апикальной и базолатеральной мембраной Ca2+, по всей видимости, образует комплекс с цитозольным кальций-связывающим белком, называемым также кальбиндином. Гормон кальцитриол, который усиливает реабсорбцию кальция в почке, стимулирует синтез кальбиндина. Поскольку паратиреоидный гормон (PTH) в свою очередь усиливает почечный синтез кальцитриола, то его действие, направленное на удержание Ca2+, может, по крайней мере частично, проходить по этому непрямому пути. Усиленная реабсорбция Na+ в дистальном извитом канальце повышает концентрацию Na+ в цитозоле и снижает тем самым движущую силу для 1Ca2+/3Na+-обменника. Это объясняет, почему снижается реабсорбция Ca2+ в дистальном извитом канальце при использовании диуретиков, действующих на транспортные системы петли.
Многие гормоны (паратиреоидный гормон, кальцитонин и др.) регулируют как трансклеточную реабсорбцию Ca2+ в дистальном извитом канальце, так и межклеточную реабсорбцию в дистальном прямом канальце. На межклеточный пассивный перенос может быть оказано влияние как за счет изменений положительного потенциала жидкости в просвете канальца (= движущая сила), так и за счет регуляции проницаемости плотных контактов. В последнем процессе ключевую роль, по всей видимости, играет белок клаудин. Контроль за уровнем концентрации Ca2+ и Mg2+ в плазме крови осуществляется с помощью специального экстраклеточного сенсора: Са2+/Mf2+-сенсора (Casr = Ca2+/Mg2+-sensing receptor), локализованного в гормональных железах, на базолатеральной мембране толстого отдела восходящей части петли Генле и дистального извитого канальца.
Рис. 9-20. Транспорт кальция.
Ca2+ реабсорбируется в проксимальном канальце - А (Ca2+ > Mg2+ см. также рис. 9-21) и в дистальном прямом канальце (толстой восходящей части петли Генле) - Б (Mg2+ > Ca2+, см. также рис. 9-21) пассивно через плотные межклеточные контакты. Движущей силой этого процесса является положительный в просвете канальца трансклеточный потенциал, т.е. жидкость канальца заряжена положительно по отношению к плазме крови. В дистальном извитом канальце (В) дополнительно осуществляется активная трансклеточная реабсорбция.
РСТ - проксимальный извитой каналец. - дистальный извитой каналец. РSТ - проксимальный прямой каналец. ТАL - дистальный прямой каналец
Транспорт ионов магния
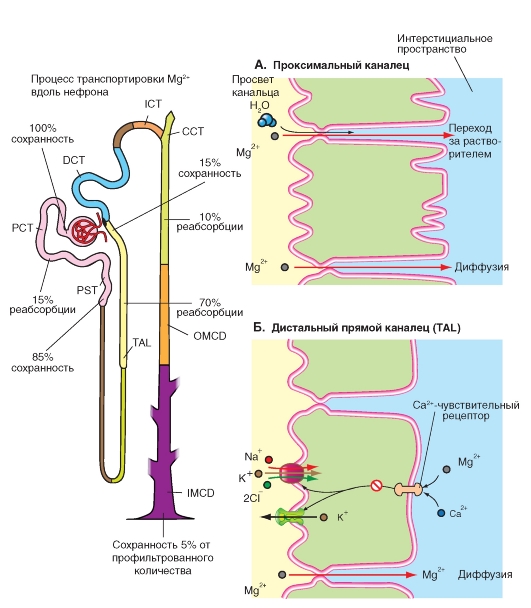
Почка в значительной мере принимает участие в балансе Mg2+, при этом выделение ионов контролируется гормонами. Паратиреоидный гормон снижает выведение Mg2+.
В плазме крови находится 0,7-1,2 ммоль Mg2+ (частично связанного с белками), а в клубочковом фильтрате - около 0,5-0,9 ммоль. Экскретируемая фракция составляет <5%, максимально - 20%. Она возрастает при увеличении объема внеклеточной жидкости, гипермагнезиемии и гиперкальциемии, а также под воздействием диуретиков, влияющих на транспортные системы петли Генле, тогда как уменьшение объема внеклеточной жидкости, недостаток Ca2+ и Mg2+, а также гормоны действующие через cAMP (паратиреоидный гормон, кальцитонин и др.) снижают выведение Mg2+.
В проксимальном канальце Mg2+ реабсорбируется значительно медленнее чем вода (и медленнее, чем Ca2+), поэтому концентрация Mg2+ в просвете канальца возрастает по отношению к концентрации (не связанного с белками) Mg2+ в плазме крови (с коэффициентом = 1,5), что вместе с положительным потенциалом жидкости в просвете канальца по отношению к плазме крови создает движущую силу для пассивной межклеточной реабсорбции Mg2+ в среднем и конечном отделах проксимального канальца (рис. 9-21 А). К концу проксимального канальца реабсорбируется около 15-20% Mg2+.
Дистальный прямой каналец (толстая восходящая часть петли Генле) берет на себя большую часть реабсорбции Mg2+ (около 70%, это значение изменяется за счет регуляции) (межклеточный пассивный транспорт) (рис. 9-21 Б). Поскольку в этом отделе канальца трансэпителиальный потенциал тесно связан с происходящей там реабсорбцией NaCl, то изменения этой реабсорбции (например, за счет диуретиков, действующих на транспортные системы этого отдела, или в результате усиленного тока мочи) значительно влияют на реабсорбцию Mg2+.
Наконец, дистальный извитой каналец реабсорбирует еще 2-8% профильтровавшегося количества Mg2+.
Многие гормоны (паратиреоидный гормон, кальцитонин и др.) регулируют как трансклеточную реабсорбцию Mg2+ в дистальном извитом канальце, так и межклеточную реабсорбцию в толстом восходящем сегменте петли Генле. На межклеточный пассивный перенос может быть оказано влияние как за счет изменений положительного потенциала жидкости в просвете канальца (= движущая сила), так и за счет регуляции проницаемости плотных контактов. (В последнем процессе ключевую роль, по всей видимости, играет белок клаудин). Контроль за уровнем концентрации Ca2+ и Mg2+ в плазме крови осуществляется с помощью специального экстраклеточного сенсора: Ca2+/Mg2+-сенсора (Casr=Ca2+/Mg2+-sensing receptor), локализованного в гормональных железах, на базолатеральной мембране дистального прямого канальца и дистального извитого канальца.
Рис. 9-21. Транспорт магния.
Mg2+ реабсорбируются в проксимальном канальце - А (Ca2+ > Mg2+) и в дистальном прямом канальце - Б (толстой восходящей части петли Генле) (Mg2+ > Ca2+, см. также рис. 9-20) пассивно через плотные межклеточные контакты. Движущей силой этого процесса является положительный в просвете канальца трансклеточный потенциал, т.е. жидкость канальца заряжена положительно по отношению к плазме крови. В дистальном прямом канальце дополнительно осуществляется активная трансклеточная реабсорбция (Б). ICT - начальный отдел собирательного протока. CCT - корковый собирательный проток. 0MCD - наружный мозговой собирательный проток. IMCD - внутренний мозговой собирательный проток
Транспорт ионов калия
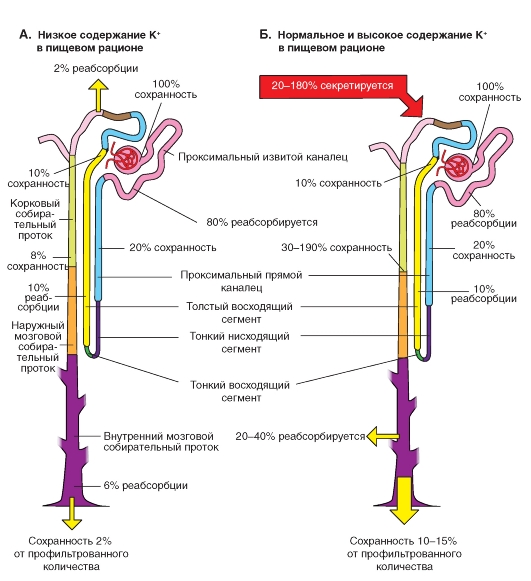
Регуляция содержания К+ в организме осуществляется почками. Экскретируемая (выделяемая) фракция К+ составляет в среднем 5-15%, однако она изменяется в пределах между 1-3% при недостатке калия и 150-200% и при сильной гиперкалиемии.
Поскольку реабсорбируемая фракция в проксимальном извитом канальце и в петле Генле (нисходящий тонкий сегмент петли - тонкий нисходящий отдел петли Генле, восходящий тонкий сегмент петли - тонкий восходящий отдел петли Генле, дистальный прямой каналец - толстая восходящая часть петли Генле) постоянна и составляет 85-90%, изменение выделения K+ обеспечивается связующими канальцами и собирательными протоками.
Жизненно важно поддерживать концентрацию К+ в плазме крови в узких границах (обычно в пределах 4,1 +/- 0,6 моль/л). Поскольку почка в основном отвечает за выделение К+ в широком диапазоне, она должна реагировать на изменения концентрации К+ в крови (гипер- и гипокалиемия). Рассмотрим транспорт К+ в разных отделах нефрона.
Экскретируемая фракция К+ составляет в среднем 5-15%, однако при недостатке К+ экскретируемая фракция К+ может быть уменьшена до значений 1-3%, при очень высоком потреблении или высвобождении К+ экскретируемая фракция может увеличиваться до 150-200%. К+ может полностью реабсорбироваться, а также полностью
выводиться из организма с мочой. Эта приспособляемость реабсорбции К+ обеспечивается дистальным прямым канальцем (толстой восходящей части петли Генле) и собирательными протоками, поскольку, вне зависимости от потребностей К+-баланса, в проксимальных канальцах и в петле Генле (нисходящий тонкий сегмент петли - тонкий нисходящий отдел петли Генле, восходящий тонкий сегмент петли - тонкий восходящий отдел петли Генле, дистальный прямой каналец - толстая восходящая часть петли Генле) вместе взятых реабсорбируется постоянно 85-90% профильтровавшегося количества К+.
Деполяризация апикальной мембраны главных клеток эпителия связующего отдела и собирательной трубочки стимулирует секрецию К+ этими клетками. Поскольку деполяризация мембраны зависит от регулируемой альдостероном электрогенной реабсорбции Na+, то секреция K+ тесно связана с реабсорбцией Na+ и зависит от концентрации альдостерона. Кроме того, сдвиг внутриклеточного значения pH в кислую сторону увеличивает проницаемость апикальной мембраны для К+ и следовательно секреция К+ увеличивается.
За реабсорбцию K+ при его недостатке отвечают, по всей видимости, вставочные клетки эпителия связующих канальцев и собирательных протоков, в апикальной мембране которых, как и у обкладочных клеток желудка, локализована H+/К+-АТФаза, которая реабсорбирует К+ и секретирует в просвет собирательной трубочки ионы H+.
Рис. 9-22. Транспорт K+ в корковых (кортикальных) нефронах.
Невзирая ни на какие условия, в нефронах (А или Б), осуществляется реабсорбция и секреция K+. На рисунках представлены профильтровавшиеся фракции K+, реабсорбирующегося из просвета канальцев в интерстициальную жидкость (оранжевые заливки), и фракции K+, секретирующегося из интерстициальной жидкости в просвет канальца K+ (зеленые заливки). В проксимальных канальцах и в дистальном прямом канальце (толстой восходящей части петли Генле) постоянно реабсорбируется до 90% профильтровавшегося K+. Реабсорбция K+ осуществляется в этих отделах нефрона большей частью пассивно по межклеточному пути. Связующие канальцы, начальные отделы собирательных протоков и собирательные протоки имеют механизмы, обеспечивающие гомеостаз K+. При повышении содержания K+ (и потому высоком выделении альдостерона в кровь) главные клетки связующих канальцев и собирательные протоки могут секретировать большие количества K+, а при недостатке K+ (нет выделения альдостерона) вставочные клетки типа β этих отделов нефрона могут реабсорбировать K+
Клеточные механизмы транспорта K+
В проксимальных канальцах (рис. 9-23 А) в апикальной мембране с одной стороны происходит минимальная секреция K+ из клетки в просвет канальца через K+ -каналы, движущей силой чего является пассивная диффузия ионов. С другой стороны наблюдается реабсорбция в виде межклеточной диффузии или межклеточного перехода K+ вслед за водой. Это происходит большей частью за счет пассивного, межклеточного транспорта. В базолатеральной мембране Na+/K+ -АТФаза, потребляя АТФ, снижает внутриклеточную концентрацию Na+ и повышает внутриклеточную концентрацию K+ (первично-активный транспорт). K+ затем диффундирует из клетки через K+-каналы, локализованные в базолатеральной мембране (а не только в апикальной), что приводит к поляризации мембраны. Кроме того, на базолатеральной мембране расположен К+-С1--котранспортер, который переводит из клетки ионы K+ в интерстициальное пространство.
В дистальном прямом канальце (толстая восходящая часть петли Генле) (рис. 9-23 Б) в апикальной мембране, обращенной в просвет канальца, имеется белок-переносчик (BSC1), который осуществляет одновременную реабсорбцию ионов Na+, K+ и 2C1- (механизм вторичного активного транспорта, котранспорт), при этом движущей силой является градиент Na+ опять создаваемый Na+/K+-ATФазой, расположенной на базолатеральной мембране (первичный активный транспорт). Однако на апикальной мембране наблюдается секреция K+ из клетки в просвет канальца через K+-каналы, движущей силой чего является пассивная диффузия ионов. Иначе говоря, поступающий в клетку с двух сторон K+ (переносчик BSC1 и Na+/K+-ATФаза) покидает клетку через опять же двусторонне локализованные K+-каналы. На базолатеральной мембране помимо Na+/K+-ATФазы и K+-каналов имеются C1- каналы, которые выводят из клетки в интерстициальное пространство избыток ионов C1-, закаченных переносчиком BSC1. Помимо всего прочего положительный в просвете канальца трансэпителиальный потенциал обеспечивает пассивную межклеточную реабсорбцию ионов Na+ и K+. Движущими силами этой межклеточной реабсорбции являются установившиеся в результате реабсорбции воды химические градиенты, положительный в просвете канальца трансэпителиальный потенциал - жидкость в просвете нефрона заряжена положительно по отношению к интерстициуму.
Корковый собирательный проток (рис. 9-23 В, Г). Ультраструктурные особенности плотных контактов между клетками эпителия указывают на то, что в данном отделе нефрона мы имеем дело с относительно плотным эпителием. В этом отделе присутствуют, так называемые, вставочные клетки (intercalated cells), которые поодиночке разбросаны между многочисленными главными клетками (principal cells). Вставочные клетки находятся в корковом веществе почки и начальном отделе медуллярной собирательной трубочки. Они могут находиться в двух функциональных состояниях: их люминальная мембрана, обладающая большой поверхностью и снабженная микроворсинками, может быть либо выпячена в просвет канальца, (функциональный тип А), либо сокращена до небольшой поверхности (функциональный тип Б). Тип А секретирует ионы Н+ в просвет канальца, тогда как тип Б секретирует HCO3-. «Переключение» из А в Б подразумевает в том числе «обратное» встраивание транспортных протеинов для Н+ и HCO3-. Это демонстрирует, что регуляция транспортных свойств может включать в себя даже морфологическую перестройку клеток эпителия.
В этой области плотные контакты собирательного протока сравнительно непроницаемы для катионов. Только C1- реабсорбируется в этом отделе нефрона межклеточным путем.
В корковом собирательном протоке во вставочных клетках α-типа (рис. 9-23 В) в апикальной мембране осуществляется секреция в просвет канальца Н+ (Н+/K+-АТФаза) и переход во вставочную клетку К+. Кроме того в просвет канальца Н+ выкачивает Н+-АТФаза. В базолатеральной мембране находится белок-переносчик AE1 (антипорт HCO3-/C1-). Одновременно работает Na+/K+-ATФаза, закачивая во вставочную клетку К+. Однако эти ионы поступают в интерстициальное пространство по K+-каналам.
В корковом собирательном протоке в главных клетках (рис. 9-23 Г) C1- реабсорбируется межклеточным путем. На апикальной мембране секреция К+ в просвет канальца зависит от реабсорбции Na+ по ENaC-каналам в клетку и потому от альдостерона и т.д. На люминальной мембране находятся K+-каналы и К+-С1-котранспортер, и обе эти системы секретируют K+ в просвет канальца. На базолатеральной мембране Na+/K+-ATФаза закачивает K+ в клетку, но его избыток уходит не только через K+-каналы люминальной мембраны, но и через K+-каналы базолатеральной мембраны.
Рис. 9-23. Клеточные модели К+ транспорта.
Рассматриваются четыре примера. А - проксимальный каналец. Б - дистальный прямой каналец (толстая восходящая часть петли Генле). В - вставочная клетка α-типа коркового собирательного протока. Г - главная клетка коркового собирательного протока
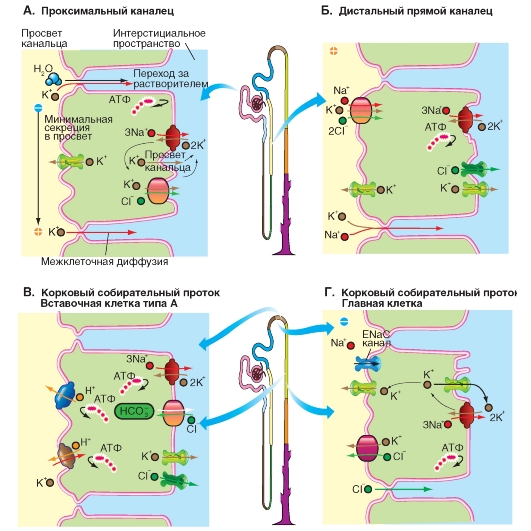
Функция концентрированной мочи
В зависимости от количества воды, поступающей в организм, почки могут или выделять небольшое количество концентрированной мочи (0,3% клубочкового фильтрата; скорость образования мочи - 0,35 мл/мин; антидиурез (рис. 9-24 А); осмоляльность мочи около 1300 мосм/кг H2O) или большое количество гипотоничной мочи (20% клубочкового фильтрата; скорость образования мочи - 25 мл/мин; водный диурез (рис. 9-24 Б); 50 мосм/кг H2O).
Для концентрирования мочи необходимы: (1) корково-медуллярный осмотический градиент, который устанавливается в результате реабсорбции NaCl в толстой восходящей части петли Генле и поддерживается противоточно-множительной системой мозгового вещества почек; (2) противоточный обмен в прямых сосудах (Vasa recta); (3) рециркуляция мочевины: медуллярная собирательная трубочка (проницаема для мочевины) - тонкая нисходящая часть петли Генле (проницаемы для мочевины) - толстый восходящий отдел петли Генле (непроницаем для мочевины) - дистальный извитой каналец (не-проницаем для мочевины) - медуллярная собирательная трубочка (проницаема для мочевины); (4) проницаемость собирательной трубочки для воды (вызванная антидиуретическим гормоном).
Без антидиуретического гормона (АДГ) дистальный извитой каналец и собирательная трубочка непроницаемы для воды, поэтому гипотоничная моча, выходящая из толстого восходящего отдела петли Генле, за счет реабсорбции NaCl в последующих отделах нефрона становится еще более гипотоничной: водный диурез. Осмотический диурез вызывается нереабсорбируемыми профильтровавшимися веществами,
тогда как диуретики тормозят реабсорбцию Na+ в различных отделах нефрона.
Скорость образования мочи составляет у мужчин в среднем 1,35 и 1,15 л/сут у женщин, при этом наблюдается разброс индивидуальных значений в диапазоне от 0,5 до 2,0 л/сут. Если наблюдаемая скорость образования мочи соответствует значениям около нижней границы разброса (высококонцентрированная моча), то такое состояние называется антидиурезом, а при значениях около верхней границы разброса - диурезом. При количествах мочи больше 2,0 л/сут говорят о полиурии, при количествах меньше 0,5 или 1,0 л/сут об олигоурии и, соответственно, анурии. Кроме того, существует выраженная дневная периодичность, в ходе которой количество мочи рано утром на 40% ниже индивидуального среднесуточного значения, а в полдень - на 40% выше.
Водный диурез. При переизбытке воды в организме прекращается выделение АДГ в кровь, и собирательная трубочка, как и дистальный извитой каналец, становятся непроницаемыми для воды, а проницаемость для мочевины уменьшается. В результате моча остается такой же гипотоничной, как и при переходе из петли Генле в дистальный каналец, а в дистальном канальце и собирательной трубочке она становится еще более гипотоничной за счет активной реабсорбции NaCl (минимально около 50 мосм/кг H2O). Подобное разбавление мочи обеспечивает выведение большого количества воды без одновременной потери NaCl и других веществ. При водном диурезе говорят о выведении «свободной» воды. Под этим подразумевается количество воды, которое может быть удалено из мочи, до тех пор пока ее осмоляльность не сравняется с осмоляльностью плазмы крови (Pосм = осмоляльность плазмы крови = 290 мосм/кг H2O). Относительная доля свободной воды в объеме мочи вычисляется из 1 - (U/P), при этом U - осмоляльность мочи. Если последняя составляет, например, 145 мосм/кг H2O, то доля свободной воды составляет 0,5 или 50%.
Рис. 9-24. Осмолярность интерстициальной жидкости.
А - ограничение воды (антидиурез). Б - высокое потребление воды (водный диурез)
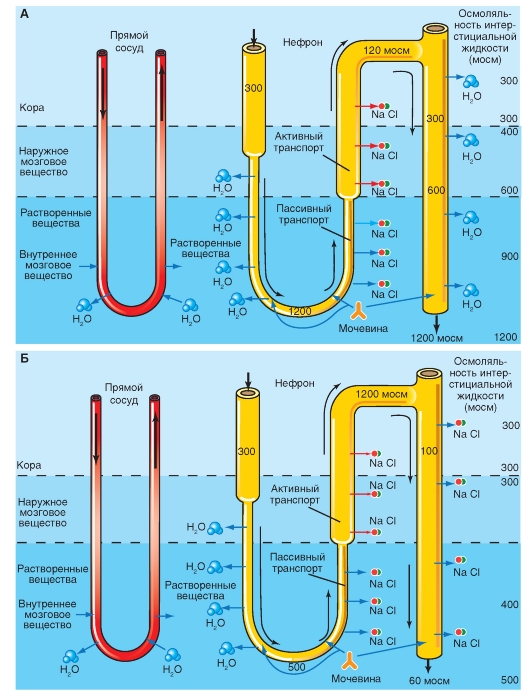
Роль почек в поддержании рН крови
На рис. 9-25 А представлен один из путей НСО3- в
начальных отделах проксимального канальца. Его количество составляет 90% от профильтровавшегося. Механизм реабсорбции связан с секрецией ионов Н+ в просвет канальца (рис. 9-25 А), вступающих в реакцию с профильтровавшимся HCO3- с образованием CO2, который диффундирует в клетку. Превращение HCO3- в CO2 (и наоборот) катализируют мембранная (CA IV) и соответственно цитоплазматическая (CA II) карбоангидраза клеток канальца. Там CO2 вступает в реакцию, ведущую к образованию HCO3-, который частично вступает в реакцию с OH- с образованием CO32- и H2O, таким образом, в клетке содержатся вновь образованные HCO3-, CO32- и H2O. В конечном итоге HCO3-, CO32- и Na+ (в соотношении 1:1:1) или альтернативно (не изображено) HCO3- вместе с 1Na+ покидают клетку через базолатеральную мембрану с участием общего переносчика NBC-1. В дополнение HCO3- выходит из клетки через базолатеральную мембрану в обмен на C1- (антипорт, не изображен). При этом OH- и Н+ взаимодействуют друг с другом в просвете канальца, превращаясь в воду.
На рис. 9-25 Б на примере H2PO4- показано выведение кислот. Неорганический фосфат (Pi) встречается в плазме (рН 7,4) в форме HPO42- и H2PO4- (в соотношении 4:1). Обе формы свободно фильтруются и в проксимальном канальце реабсорбируются посредством механизма вторичного активного транспорта (котранспорта с Na+). Экскретируемая фракция фосфата (обычно 10-20%), величина которой регулируется почками, увеличивается при возрастающей и уменьшается при снижающейся концентрации фосфата в плазме крови. Фосфат, реабсорбируется на две трети посредством вторично-активного транспорта в проксимальном канальце с помощью переносчика NaPj-3, расположенного на апикальной мембране эпителиальных клеток и осуществляющего сопряженный с Na+ перенос (котранспорт). Ацидоз уменьшает количество этих переносчиков в мембране, тогда как алкалоз увеличивает их число. В плазме крови и клубочковом фильтрате (рН 7,4) фосфат представлен на 80% в виде HPO42- и только на 20% в виде H2PO4- (pKa' = 6,8). По мере прохождения через канальцы и собирательную трубочку нереабсорбированный HPO42- посредством секретируемых ионов Н+ титруется в H2PO4-, что в значительной мере способствует почечному выведению ионов Н+.
В проксимальном канальце ионы Н+ в просвете канальца титруют профильтровавшийся в клубочке бикарбонат- и фосфат2- (рис. 9-25 А, Б), поэтому рН-значение в просвете канальца снижается
до 6,4-6,8.
На рис. 9-24 В представлена секреция и выведение аммиака NH3 и аммония NH4+. В результате клеточного метаболизма образуется NH4+ и ОН-. NH4+ диссоциирует в клетках канальца на NH3 и Н+, которые с одной стороны независимо друг от друга попадают в просвет канальца (неионная диффузия и соответственно активная секреция Н+), и с другой стороны в недиссоциированном виде покидают клетку в направлении просвета канальца в качестве заряженных ионов NH4+ с помощью Na+-H+- переносчика (вместо Н+) (на рисунке не показано). Итак, оба продукта - NH3+ и Н+ попадают независимо друг от друга в просвет канальца, где они вновь образуют NH4+. Хотя удаление NH4+ с мочой само по себе не способствует выведения кислот, оно представляет собой косвенную количественную меру выведение кислот. Если образованный таким образом NH4+ действительно покидает организм с мочой (а не возвращается обратно в печень и там при синтезе мочевины использует HCO3-), количество NH4+ является косвенным показателем элиминации Н+. Итак, выведение NH4+ способствует удалению Н+, причем на каждый выведенный NH4+ в печени для синтеза мочевины используется меньше на один анион HCO3-. Однако это происходит не потому что NH3 после выделения Н+ связывает ионы Н+. (При рН около 9 приблизительно 97% NH4+ (↔NH3) находится в ионизированном виде). Этот способ «выведения» Н+ принципиально отличается от канальцевого титрования фосфата (см. выше) и поэтому не может рассматриваться как титруемая кислота.
Для регуляции кислотно-щелочного баланса важно, что при ацидозе образование и выведение NH4+ в проксимальном канальце может возрасти в течение 1-2 дней в несколько раз по сравнению с нормальным значением. Это обеспечивается усиленным транспортом глутамина из печени в почку, так и активация в почке глутаминазы, а также глюконеогенеза. И наоборот, изменение кислотности мочи в собирательной трубочке (например, дефект Н+/АТФазы и/или переносчика, обеспечивающего обмен C1-/HCO3-(антипорт)) приводит к недостаточному выведению NH4+ и титруемых кислот, так что развивается дистальный почечный канальцевый ацидоз.
Рис. 9-25. Роль почек в поддержании кислотно-щелочного равновесия.
А - реабсорбция НСO3-. Б - принцип выведения кислот. В - экскреция аммония. СА II - карбонгидраза II. СА VI - карбонгидраза VI
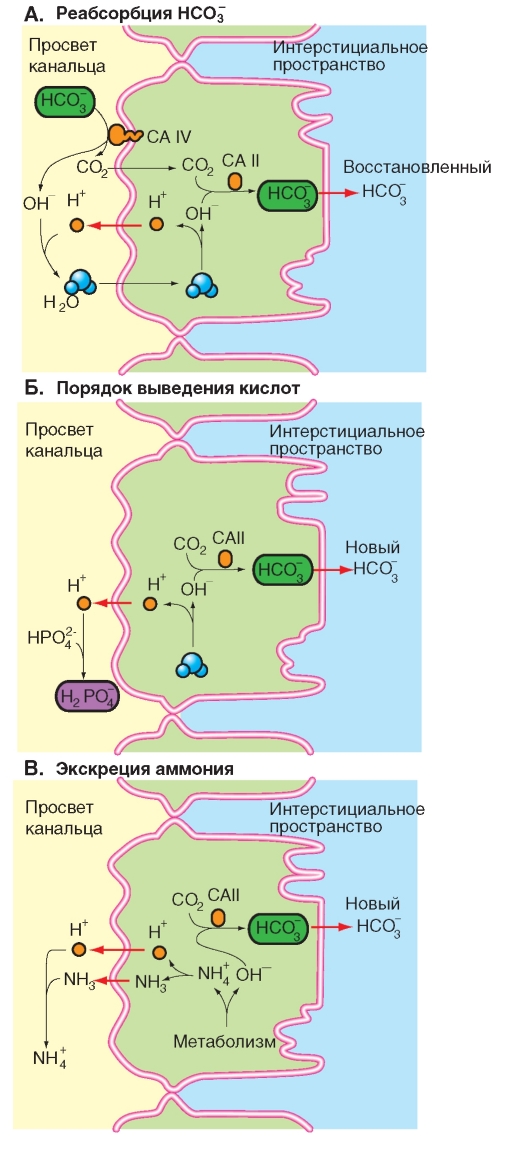
Механизмы регуляции кислотнощелочного равновесия почками
Проксимальный извитой каналец (S1). В начальных отделах проксимального извитого канальца (рис. 9-26 А) количество профильтровавшегося HCO3- составляет 90%. Превращение HCO3- в CO2 и ОН- катализирует мембранная карбоангидраза IV IV), расположенная в апикальной мембране. CO2, диффундирует в клетку через люминальную мембрану. В клетке CO2 вступает в реакцию, катализируемую цитоплазматической карбоангидразой II II), ведущую к образованию HCO3- , который частично вступает в реакцию с OH- с образованием CO32- и H2O, таким образом, в клетке содержатся вновь образованные HCO3- , CO32- и H2O. В базолатеральной мембране переносчик Na+-HCO3- (котранспорт) удаляет HCO3- из клетки, но в интерстициальном пространстве HCO3- вступает в реакцию, катализируемую мембранной (CА?) с образованием CO2 и ОН-. В апикальной мембране расположен электронейтральный (обмен 1:1) переносчик NHE3 или, иначе, Na+-H+-переносчик (антипорт), который осуществляет секрецию ионов H+ в просвет канальца в обмен на ионы Na+. Его движущая сила обмена - химический градиент Na+. При его работе ионы H+ в результате вторично-активного транспорта секретируются в просвет канальца. Снижение внутриклеточного pH (сдвиг в кислую сторону) активирует данный Na+-H+-переносчик (антипорт), поэтому в случае ацидоза усиленно секретируются ионы H+; и наоборот при алкалозе секреция ионов H+ снижается. Кроме того в апикальной мембране расположена Н+-АТФаза, которая секретирует ионы H+ в просвет канальца. Данный насос позволяет секретировать ионы H+ независимо от реабсорбции Na+. Секреция H+ уже в первой трети проксимального канальца снижает рН в просвете канальца с 7,4 (в фильтрате) до 6,5-6,8 (рис. 9-26 А). Эти ионы вступают в реакцию с OH- с образованием H2O, которая уходит в клетку и там формирует ионы H+ и OH-, замыкая, тем самым, цикл.
Проксимальный прямой каналец (S3). Посредством электронейтрального Na+-Н+-переносчика (антипорт), расположенного в апикальной мембране, осуществляется реабсорбция Na+ (рис. 9-26 Б). Кроме того в апикальной мембране расположена Н+-АТФаза, которая секретирует ионы H+ в просвет канальца. Большая часть HCO3- была
реабсорбирована в проксимальном извитом канальце на первой стадии реабсорбции, поэтому H+, выходящий в просвет канальца в результате обмена с Na+ (антипорт), не может быть использован для связывания с HCO3-. Здесь основная роль принадлежит реабсорбции Na+ и ее механизм - обмен Na+/Н+ (NHE3-переносчик). Из клетки в интерстициальное пространство HCO3- попадает двумя путями: в результате обмена С1-/НСO3- (антипорт) и Na+/НСO3- (синпорт).
Дистальный прямой каналец (толстая восходящая часть петли Генле). В этом отделе на апикальной мембране клеток эпителия локализован переносчик, обеспечивающий обмен Na+/H+. Он предотвращает увеличение значения pH канальцевой мочи, которое в верхнем отделе проксимального канальца было снижено до 6,5-6,8, тем более что на этом отрезке нефрона положительный в просвете канальца трансэпителиальный потенциал представляет собой движущую силу для межклеточной реабсорбции H+. Кроме того переносчик, обеспечивающий обмен Na+/H+ (антипорт), расположенный на апикальной мембране, служит для того, чтобы доставлять в просвет канальца ионы H+, возникающие из другого источника: диссоциация реабсорбированного NH4+
на NH3 + H+ (рис. 9-26 В).
Собирательные протоки. В эпителии связующего канальца, коркового и мозгового собирательного протока находятся вставочные клетки α-типа которые имеют в люминальной мембране, как уже упоминалось, Н+/К+-АТФазу и Н+/ АТФазу (рис. 9-26 Г). Вставочным клеткам типа α удается с помощью H+-АТФаз сдвинуть значение рН в собирательном протоке и конечной моче до уровня меньше 5. Образующийся с помощью карбоангидразы HCO3- через базолатеральную мембрану выводится из клетки с помощью переносчика, осуществляющего обмен HCO3- /Cl-, при этом входящий Cl- снова выводится из клетки через Cl--каналы.
Итак, pH в просвете связующего канальца, а также в корковом и мозговом собирательном протоках, может быть значительно сдвинуто в кислую сторону за счет механизма первичного активного транспорта (H+-АТФаза вставочных клеток α-типа), обеспечивающего секрецию ионов H+ в просвет нефрона. При ацидозе оно может достигать значения 4,5. При алкалозе вставочные клетки (вместо ионов H+) выделять бикарбонат в базолатеральной мембране, поэтому значение pH мочи сдвигается до 8,2.
Рис. 9-26. Роль почек в подержании кислотно-щелочного равновесия.
Превращение HCO3- в CO2 (и наоборот) катализируют мембранная (CA IV) и, соответственно, цитоплазматическая (CA II) карбоангидраза клеток канальца
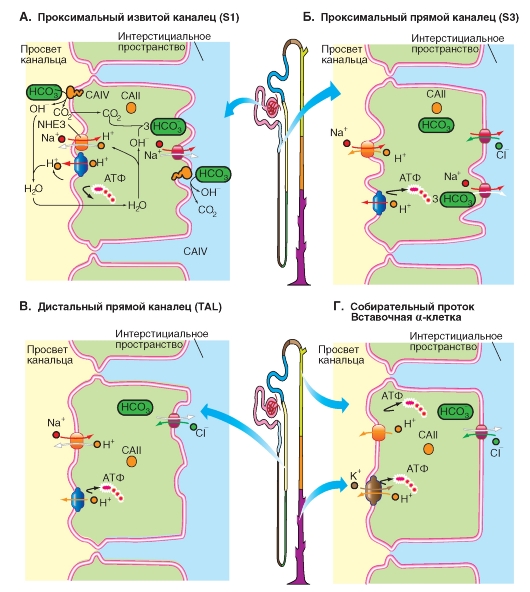
Транспорт NH4+
Аммиак NH3 (соответственно, ионы аммония: NH3 о NH4+) образуется в больших количествах (около 1000 ммоль в день) при расщеплении аминокислот в печени, но он ядовит даже в малых концентрациях, поэтому в печени в среднем около 95% его количества, взаимодействует с эквимолярным количеством HCO3-, и превращается (при потреблении АТФ-) в мочевину, которая выводится с мочой как инертное вещество (2NH4+ + 2HCO3- ↔ NH2 - C(=O) - NH2 + CO2 + 3H2O).
Оставшиеся 5% NH3 ↔ NH4+ (около 50 ммоль в день) попадают в неизменном виде или в виде глутамина в почки, где снова из глутамина образуется NH3 ↔ NH4+, который большей частью выводится из организма.
Проксимальный извитой каналец. Глутамин, который переносится с кровью в почки, где он транспортируется в клетки проксимального канальца как через апикальную, так и через базолатеральную мембрану (рис. 9-27 А). В митохондриях этих клеток локализована глутаминаза, которая снова гидролизует глутамин с образованием NH4+ и глутамат-, который посредством глутаматдегидрогеназы расщепляется далее на второй NH4+ и на 2-оксоглутарат2- (а-кетоглутарат2-), при превращении которого в глюкозу используется два иона H+, т.е. образуется два иона HCO3-. Образование этих двух ионов HCO3- остается неучтенным в общем балансе выведения NH4+(↔NH3), поскольку они используются для образования 2-оксоглутарата2-, который в печени необходим для синтеза глутамина (рис. 9-27 А). NH4+ диссоциирует внутриклеточно с образованием NH3 + Н+; оба продукта попадают независимо друг от друга (за счет неионной диффузии и соответственно секреции H+) в просвет канальца, где они вновь образуют NH4+. Последние данные демонстрируют, что по крайней мере такое же количество аммиака выделяется в ионизированной NH4+-форме. В этом случае секреция в просвете канальца осуществляется с помощью Na+-Н+-обменника, который, по всей видимости, вместо ионов H+ может принимать также NH4+.
Небольшие количества NH4+ могут отщепляться от глутамина и в просвете проксимального канальца. Там в качестве «глутаминазы» действует γ-глутамилтрансфераза (γ-GT).
Дистальный прямой каналец (толстая восходящая часть петли Генле).
В результате секреции NH3 и соответственно NH4+ в конце проксимального канальца обнаруживается в 9 раз больше NH4+ (↔ NH3), чем в фильтрате. Однако лишь одна треть этого количества достигает дистального извитого канальца, оставшиеся две трети реабсорбируются (с помощью вторичного активного транспорта) в виде NH4+-ионов в дистальном прямом канальце (рис. 9-27 Б) посредством расположенного на люминальной мембране переносчика BSC1 (котранспорт), который при этом связывает NH4+-ионы вместо K+. После внутриклеточной диссоциации NH4+ (на NH3 и H+) H+ возвращается обратно в просвет канальца (Na+-H+-обменник), а NH3 диффундирует из петли Генле в интерстициум мозгового вещества почек, поэтому там устанавливается высокая (возрастающая по направлению к сосочкам до 10 ммоль) концентрация NH4+ о NH3. NH3 попадает оттуда за счет неионной диффузии в просвет собирательного протока.
Кроме того в дистальном прямом канальце на апикальной мембране клеток эпителия локализован переносчик, обеспечивающий обмен Na+/H+. Он предотвращает увеличение значения рН канальцевой мочи, которое в верхнем отделе проксимального канальца было снижено до 6,5-6,8, тем более что на этом отрезке нефрона положительный в просвете канальца трансэпителиальный потенциал представляет собой движущую силу для межклеточной реабсорбции H+.
Просвет собирательного протока
NH3 в просвете собирательного протока (рис. 9-27 В) вследствие обычно очень низкого значения рН тотчас же превращается в NH4+. Почти 80% секретируемого в проксимальном канальце количества попадает в конечную мочу.
На рис. 9-27 Д суммированы пути почечной секреции и выведения аммиака/аммония.
Рис. 9-27. Транспорт аммония (NH4+) - почечная секреция и выведение аммиака/ аммония.
А - на люминальной и базолатеральной мембране клеток проксимального канальца существуют механизмы транспорта (котранспорт с Na+) внутрь клетки глутамина, который образуется в печени и превращается в почках в 2 NH4+ + 2-оксоглутарат2-. NH4+ диссоциирует в клетках канальца на NH3 и H+, которые с одной стороны независимо друг от друга попадают в просвет канальца, и с другой стороны в недиссоциированном виде покидают клетку в направлении просвета канальца в качестве заряженных ионов NH4+ с помощью Na+-Н+-переносчика (вместо H+). Б - большая часть образованного в проксимальном канальце NH3 ↔ NH4+ реабсорбируется в дистальном прямом канальце (толстой восходящей части петли Генле) в ионизированном виде и попадает в интерстициум мозгового вещества почки. В - из интерстициума мозгового вещества почки соединение в результате неионной диффузии переходит в собирательный проток. Высокая концентрация NH3 ↔ NH4+ в мозговом веществе почек и низкие значения pH мочи в собирательной трубочке ускоряют эту диффузию