Атлас по физиологии. В двух томах. Том 2: учеб. пособие / А. Г. Камкин, И. С. Киселева - 2012. - 448 с. : ил.
|
|
|
|
Глава 6. Сердечно-сосудистая система
Физиология сердца Общие представления
Кровеносная система служит для доставки к тканям необходимых веществ и их распределения и для удаления побочных продуктов обмена веществ. Кровеносная система принимает участие в механизмах поддержания гомеостаза, таких как регуляция температуры тела, поддержание баланса жидкости в организме, регулирование снабжения клеток кислородом и питательными веществами при различных физиологических состояниях организма.
Сердечно-сосудистая система состоит из насоса - сердца, системы распределяющих и собирающих трубок - кровеносных сосудов и обширной системы тонких сосудов, обеспечивающих быстрый обмен веществ между тканями и сосудами - капилляров. Поступление крови к тканям регулируется определенными механизмами, и эти регулирующие механизмы способны удовлетворять меняющиеся потребности различных тканей
в соответствии с различными физиологическими и патологическими состояниями.
Сердце
Сердце (рис. 6-1 А) состоит из двух последовательных насосов (рис. 6-1 Б): один насос проталкивает кровь через легкие для обеспечения обмена кислорода и углекислого газа. Это так называемая легочная циркуляция или легочный круг кровообращения. Через другой насос кровь движется ко всем остальным тканям тела. Это системная циркуляция. Кровь может двигаться через сердце только в одном направлении. Одностороннее движение крови через сердце обеспечивается соответствующим устройством створок клапанов. Хотя сердечный выброс имеет прерывистый или пульсирующий характер, к тканям тела (на периферию) кровь движется сплошным (непрерывным) потоком за счет растяжения аорты и ее ветвей во время сокращения желудочков (систола) и за счет эластической тяги стенок крупных артерий при поступательном проталкивании крови во время релаксации желудочков (диастола).
Рис. 6-1. Общие представления о системе кровообращения.
А - камеры сердца и магистральные сосуды. Б - взаимосвязь камер сердца с большим и малым кругами кровообращения. Стрелки указывают направления кровотока
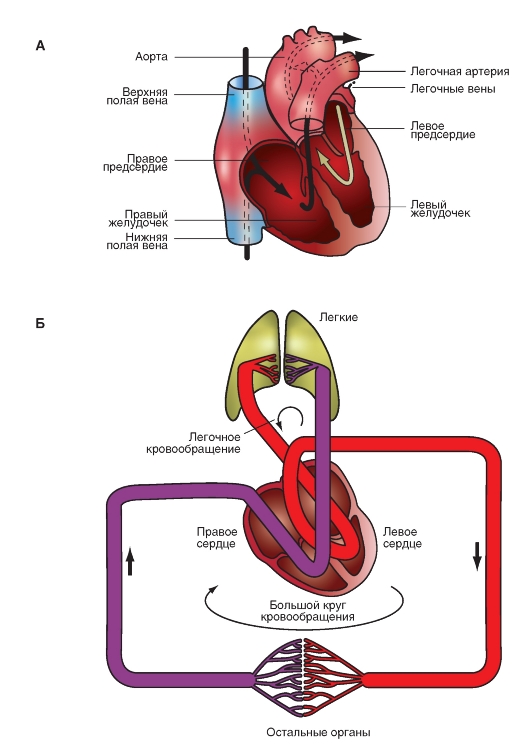
Структура сердечно-сосудистой системы
Кровь, поступающая в правый желудочек из правого предсердия, через легочную артерию прокачивается в систему артерий легких под давлением, равным в среднем одной седьмой давления в артериях большого круга кровообращения. Затем кровь проходит через легочные капилляры, где она освобождается от углекислого газа и насыщается кислородом. Обогащенная кислородом кровь возвращается через легочные вены в левое предсердие и затем в левый желудочек. Далее она прокачивается левым желудочком в аорту. Кровь быстро движется через аорту и ее артериальные ветви. По мере приближения к периферии диаметр этих ветвей уменьшается. Также меняются и гистологические характеристики тканей стенок сосудов. Стенки аорты и крупных артерий содержат преимущественно эластическую ткань, тогда как стенки периферических артерий содержат больше мышечной ткани, а в стенках артериол преобладает мышечный слой. От каждой артериолы отходит много капилляров. Общая площадь поперечного сечения капиллярного русла весьма значительна, несмотря на то что площадь поперечного сечения отдельного капилляра меньше площади отдельной артериолы.
Возвращаясь из капилляров к сердцу, кровь проходит через венулы, затем через вены все большего размера. Ближе к сердцу количество вен уменьша-
ется, меняются толщина и строение стенок вен, уменьшается общая площадь поперечного сечения венозного русла. Кровь в сердце поступает по двум полым венам - верхней и нижней. Обе впадают в правое предсердие. Оттуда кровь поступает в правый желудочек.
Таким образом, большой круг кровообращения начинается аортой, выходящей из левого желудочка и заканчивается двумя полыми венами, впадающими в правое предсердие. Малый круг кровообращения начинается легочной артерией, выходящей из правого желудочка, и заканчивается четырьмя легочными венами, впадающими в левое предсердие.
При нормальном кровообращении в здоровом организме общий объем крови остается постоянным, и увеличение объема крови в одном участке должно сопровождаться уменьшением объема крови в другом. Тем не менее распределение циркулирующей крови по различным участкам тела определяется сердечным выбросом левого желудочка и состоянием сократительной способности резистивных сосудов (артериол), расположенных в этих участках.
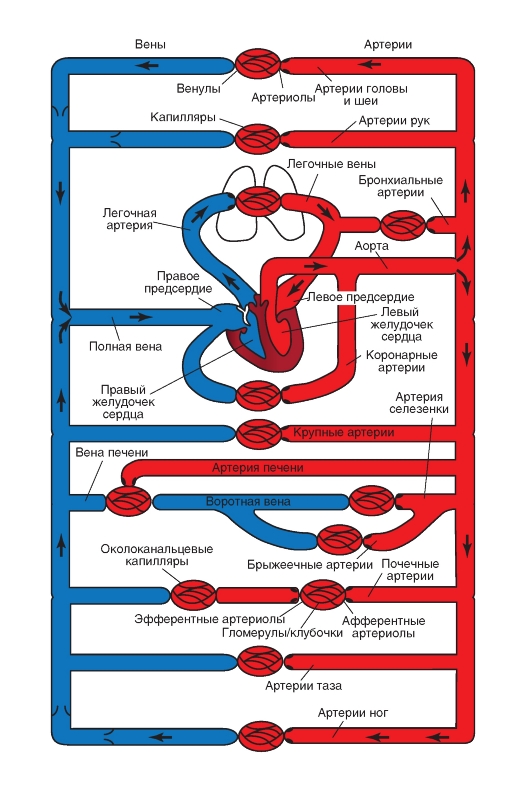
Система кровообращения состоит из последовательно и параллельно расположенных каналов - сосудов (рис. 6-2). Такое расположение оказывает значительное влияние на показатели сопротивления сосудов, давления и движения крови в кровеносных сосудах.
Рис. 6-2. Кровеносные сосуды.
На рисунке изображены большой (красным) и малый (синим) круги кровообращения с параллельным и последовательным расположением кровеносных сосудов. Капилляры изображены тонкими линиями
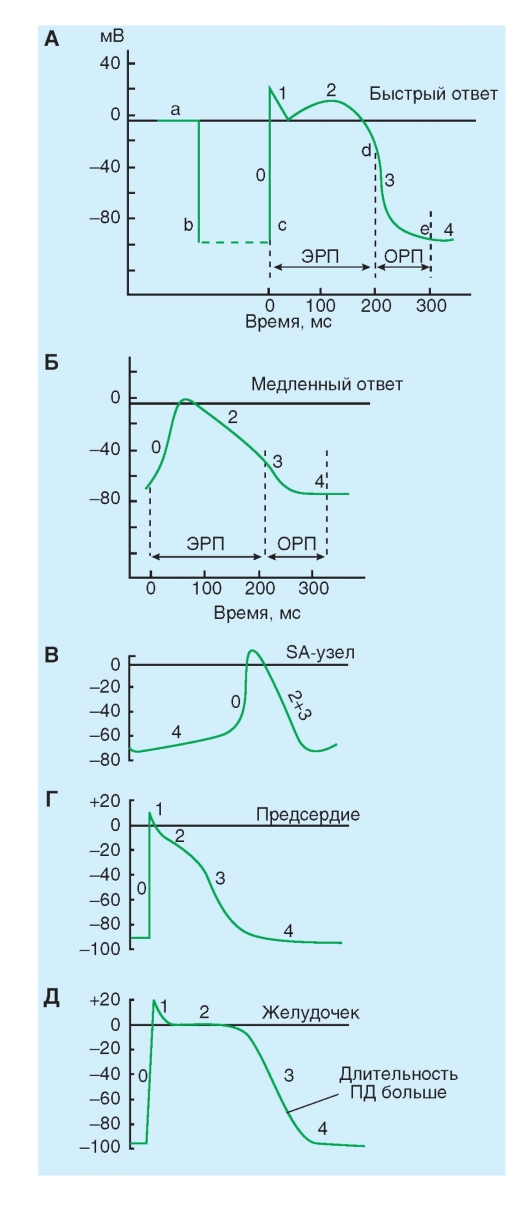
Типы и характеристика потенциалов действия кардиомиоцитов
Изменения потенциала, отводимого от типичного мышечного волокна желудочка, показаны на рис. 6-3 А. Когда два электрода помещены в раствор электролита рядом с полоской покоящейся сердечной мышцы, то между этими двумя электродами не регистрируется разность потенциалов (точка а). В точке b, когда один из электродов введен внутрь мышечного волокна сердца, измерительный прибор мгновенно регистрирует разность потенциалов (Vm) между внутренней и внешней стороной клеточной мембраны. Потенциал внутри клетки примерно на -90 мВ ниже, чем у окружающей среды.
В точке c клетка желудочка возбуждается электрическим стимулом, и клеточная мембрана быстро деполяризуется. Во время деполяризации разность потенциалов фактически меняет знак таким образом, что потенциал внутри клетки превышает таковой снаружи приблизительно на 20 мВ. Быстрое нарастание потенциала действия обозначается как фаза 0. За нарастанием мгновенно следует короткий период частичной ранней реполяризации (фаза 1) и затем плато (фаза 2), которое удерживается приблизительно от 0,1 до 0,2 с. Мембрана затем реполяризуется (фаза 3) до тех пор, пока поляризация снова не достигнет (в точке e) состояния покоя (фаза 4). Окончательная реполяризация (фаза 3) развивается более медленно, чем деполяризация (фаза 0).
В сердце регистрируют два основных типа по-тенциалов действия, которые показаны на рис. 6-3. Один тип, быстрый ответ (рис. 6-3 А),
возникает в рабочих миоцитах предсердий и желудочков и в специализированных проводящих волокнах (волокна Пуркинье сердца). Другой тип потенциала действия, медленный ответ (рис. 6-3 Б), встречается в синоатриальном (SA) узле, области естественного водителя ритма сердца, и в атриовентрикулярном (AV) узле, специализированной ткани, проводящей импульсы сердца из предсердий в желудочки.
Сравним эти два принципиальных типа потенциалов действия (рис. 6-3). Потенциал покоя (фаза 4) у быстрого ответа значительно более отрицателен, чем потенциал покоя у медленного ответа. Кроме этого, крутизна нарастания (фаза 0), амплитуда потенциала действия и величина овершута быстрого ответа больше, чем медленного ответа. Амплитуда потенциала действия и крутизна нарастания являются важными факторами, определяющими то, как быстро будет распространяться потенциал действия. В ткани сердца с медленным ответом потенциал действия распространяется более медленно, чем в ткани сердца с быстрым ответом. К тому же проведение возбуждения, скорее всего, будет заблокировано в сердечной ткани с медленным ответом, а не в ткани с быстрым ответом. Медленное проведение и склонность к блоку проведения увеличивает вероятность развития некоторых нарушений ритма.
Далее на панелях представлены типичные потенциалы действия, зарегистрированные от клеток SA-узла (B), предсердия (Г) и желудочка (Д).
Заметьте, что нумерация фаз потенциала действия дана в соответствии с международными принципами.
Рис. 6-3. Изменения трансмембранного потенциала, отводимого от сердечных волокон с быстрым и медленным ответом в изолированной сердечной ткани, помещенной в раствор электролита.
А - во время a микроэлектрод был в растворе, который окружает сердечное волокно. Во время b микроэлектрод вошел в клетку. Во время c возник потенциал действия в волокне, в которое введен микроэлектрод. Время от c до d представляет собой фазу абсолютной рефрактерности или эффективный рефрактерный период (ЭРП), а время от d до e представляет относительный рефрактерный период (ОРП). Б - потенциал действия, отводимый от сердечного волокна с медленным ответом. Обратите внимание на то, что по сравнению с волокном, в котором был зарегистрирован быстрый ответ, потенциал покоя медленного волокна менее негативен, фаза 0 (нарастание) потенциала действия менее крутая, амплитуда потенциала действия меньше, фаза 1 отсутствует и ОРП продолжается в значительной мере и в течение фазы 4, после того как волокно полностью реполяризовалось.
На панелях В, Г, Д продемонстрированы типичные потенциалы действия, зарегистрированные от клеток СA-узла (B), предсердия (Г) и желудочка (Д). Развертка в B составляет половину от таковой в Г или Д
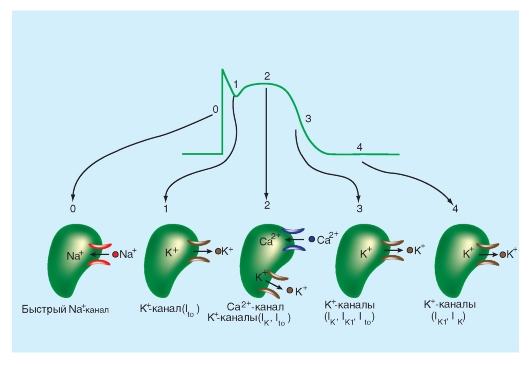
Типы ионных токов, формирующие фазы ПД рабочего кардиомиоцита
Потенциал покоя рабочего кардиомиоцита (Vm) составляет примерно -90 мВ. Когда потенциал покоя рабочего кардиомиоцита внезапно изменяется до порогового уровня, равного примерно -65 мВ, свойства клеточной мембраны резко изменяются.
Ионы Na+ входят в кардиомиоциты через существующие в мембране селективные быстрые Na+-каналы. Быстрая деполяризация - фаза 0 - связана с входом ионов Na+ в кардиомиоцит за счет резкого увеличения GNa. По мере того как Na+ стремительно входит в клетку сердца в течение фазы 0, отрицательные заряды внутри клетки нейтрализуются, и Vm становится менее отрицательным. Когда Vm падает до нуля, электростатическая сила, необходимая для перемещения Na+ в клетку, перестает существовать. Тем не менее пока быстрые Na+-каналы открыты, Na+ продолжает поступать в клетку из-за большого концентрационного градиента. Это пролонгирование входящего Na+ тока приводит к тому, что внутренняя часть клетки становится заряженной положительно. Эта реверсия полярности мембраны и есть так называемый овершут потенциала действия сердца. Такая реверсия электростатического градиента будет, конечно, способствовать ограничению входа дополнительного Na+. Тем не менее на протяжении всего времени, когда направленные внутрь химические силы превосходят направленные вовне электростатические силы, результирующий поток Na+ направлен внутрь, хотя скорость, с которой Na+ поступает в клетку, уменьшается. Поскольку быстрые Na+-каналы являются потенциал-управляемыми, они инактивируются при определенном потенциале и фаза 0 завершится (рис. 6-4).
Далее наступает фаза 1 - ранняя реполяризация. Реполяризация происходит быстро вследствие активации транзиторного выходящего тока (Ito) создаваемого главным образом K+. Активация К+-каналов во время фазы 1 вызывает непродолжительный выброс K+ из клетки, потому что внутренняя часть клетки позитивно заряжена и потому, что внутренняя концентрация K+ значительно превосходит внешнюю концентрацию K+. В результате такого транзиторного выхода позитивно заряженных ионов клетка на короткое время частично реполяризуется.
Во время фазы 2 - плато потенциала действия - Ca2+ входит в кардиомиоциты через кальциевые
каналы, которые активируются и инактивируются гораздо медленнее, чем это делают быстрые Na+-каналы. Во время горизонтального участка фазы 2 такой вход положительного заряда, переносимого Ca2+, сбалансирован выходом положительного заряда, переносимого K+. K+ выходит через каналы, которые проводят в основном Ito, IK и IK1 токи. Как было сказано ранее, ток Ito ответственен за фазу 1, но он не инактивируется полностью до тех пор, пока не закончится фаза 2.
Процесс окончательной реполяризации - фаза 3 - начинается в конце фазы 2, когда выход K+ из клетки сердца начинает превышать вход Ca2+. Как мы уже отмечали, по крайней мере, три К+ тока направленных наружу (Ito IK и IK1) вносят вклад в окончательную реполяризацию (фаза 3) клеток сердца (рис. 6-4).
В завершение избыток Na+, который входит в клетку в течение фазы 0, активно удаляется Na+/К+-АТФазой. Этот фермент переносит 3 Na+ в обмен на 2 K+, который вышел из клетки главным образом в течение фаз 2 и 3. Точно так же большая часть излишка Ca2+, который вошел в клетку главным образом в течение фазы 2, удаляется преимущественно Na+-Ca2+-обменником, который обменивает 3 Na+ на 1 Ca2+. Восстановление концентраций знаменует фазу 4 - потенциал покоя.
Напомним, что IK1 - это inwardly rectifying K+-current, который проводится через К+-кана- лы аномального выпрямления с током входящего направления. Это, inward rectifiers K+-chan- neks - каналы, названные сокращенно Kir (для детализации см. Атлас по физиологии - том 1, рис. 1-16, с. 42 и рис. 1-77, с. 160). Напомним также, что Ito - это fast transient K+-current или transient outward current, который проводится через быстро инактивирующиеся (и поэтому транзиторные) K+-каналы выходящего тока. Это группа потенциал-управляемых K+-каналов - KV. Каналы этого типа обычно образованы членами
подсемейств KV1.4, KV3.3, KV3.4, KV4.1 - KV4.3 и
вспомогательной β-субъединицы, часто необходимой для феномена быстрой инактивации (для детализации см. Атлас по физиологии - том 1, рис. 1-14, с. 38 и рис. 1-15, с. 40, а также рис. 1-76, с. 158). Напомним, что delayed rectifier K+-channels - K+-каналы задержанного выпрямления, через которые идет ток IK. Это также КV, -каналы, например
KV1.1 - KV1.3, KV1.5 - KV1.8, KV2.2, KV3.1, KV3.2
(для детализации см. Атлас по физиологии - том 1, рис. 1-15, с. 40, а также рис. 1-76, с. 158).
Рис. 6-4. Ионные токи, текущие через основные ионные каналы, активирующиеся в различные фазы потенциала действия рабочего кардиомиоцита
Ионные токи, формирующие потенциал действия рабочего кардиомиоцита
Любой стимул, который делает Vm менее негативным, стремится открыть m-ворота и, таким образом, стремится активировать быстрые Na+-каналы. Величина отдельно взятого потенциала, необходимого, чтобы открыть m-ворота и таким образом активировать Na+-каналы, слегка варьирует от одного канала клеточной мембраны к другому. Когда Vm достигает значений порядка -65 мВ, m-ворота быстрых Na+-каналов стремительно открываются, пока фактически все m-ворота не станут открытыми (фаза 0). Стремительное открытие m-ворот быстрых Na+-каналов ответственно за большое и резкое увеличение Na+ проводимости (GNa), которое происходит в фазу 0. Входящий Na+ ток окончательно останавливается, когда h- (инактивационные) ворота закрываются. Активность h-ворот, как и активность m-ворот, управляется значением Vm. Однако m-ворота открываются очень быстро (примерно за 0,1 м/с), в то время как закрытие h-ворот требует нескольких миллисунд. Фаза 0 заканчивается, когда все h-ворота инактивируются, таким образом, быстрые Na+-каналы закрываются. Такое быстрое закрытие h-ворот вскоре после открытия m-ворот объясняет быстрое возвращение GNa от ее максимума до значения покоя. Затем h-ворота остаются закрытыми до того момента, пока клетка частично реполяризуется во время фазы 3 (рис. 6-5 А1, А2).
Фаза 1 - короткий период ограниченной реполяризации происходит быстро вследствие активации транзиторного выходящего тока (ito) создаваемого главным образом K+. Непродолжительный выброс K+ из клетки уменьшает амплитуду потенциала действия.
Во время плато - (фаза 2) Ca2+ входит в кардиомиоциты через кальциевые каналы, которые активируются и инактивируются гораздо медленнее, чем это делают быстрые Na+-каналы. Во время фазы 2 такой вход положительного заряда, переносимого Ca2+, сбалансирован выходом положительного заряда, переносимого K+. K+ выходит через каналы, которые проводят в основном Ito, IK и IK1 токи. Различные типы Ca2+-каналов были идентифицированы в тканях сердца, но наиболее
распространены так называемые, Ca2+-каналы L-типа (long lasting). Открытие Ca2+-каналов приводит к увеличению Ca2+ проводимости (GCa) сразу же после нарастания потенциала действия (рис. 6-5, А2).
Во время плато потенциала действия трансмембранный концентрационный градиент K+ фактически такой же, как и во время фазы 4, но Vm положителен, поэтому обе силы, химическая и электростатическая, способствуют выходу K+ из клетки. Если бы GK была во время плато такая же, как во время фазы 4, то выход K+ во время фазы 2 значительно превосходил бы вход Ca2+ , и устойчивое плато не возникало бы. Однако по мере того как Vm приближается, а затем достигает положительных значений около пика нарастания потенциала действия, GK внезапно уменьшается. Уменьшенный K+ ток, связанный с понижением GK, предотвращает избыточную потерю K+ из клетки во время плато.
Снижение GK как при положительных, так и при небольших отрицательных значениях Vm называется аномальным выпрямлением с током входящего направления (inward rectification). Аномальное выпрямление с током входящего направления присуще нескольким типам K+ токов, включая IK1 ток.
Другие K+-каналы - К+-каналы задержанного выпрямления (delayed rectifier channels). Протекающие через них токи обозначаются как IK. Эти каналы закрыты в течение фазы 4, но они активируются потенциалами, которые преобладают к концу фазы 0. Однако активация развивается медленно в течение плато. Следовательно, активация этих каналов ведет к постепенному увеличению GK в течение фазы 2. Таким образом, указанные каналы играют в течение фазы 2 небольшую роль, но вносят определенный вклад в процесс окончательной реполяризации (фаза 3), как это описано ниже.
Процесс окончательной реполяризации (фаза 3) начинается в конце фазы 2, когда выход K+ из клетки сердца начинает превышать вход Ca2+. Как мы уже отмечали, по крайней мере, три K+ тока, направленных наружу (Ito IK и IK1), вносят вклад в окончательную реполяризацию (фаза 3) клеток сердца. Необходимо отметить, что определенный вклад вносит ток через катион-неселективные ионные каналы - INS (рис. 6-5 Б).
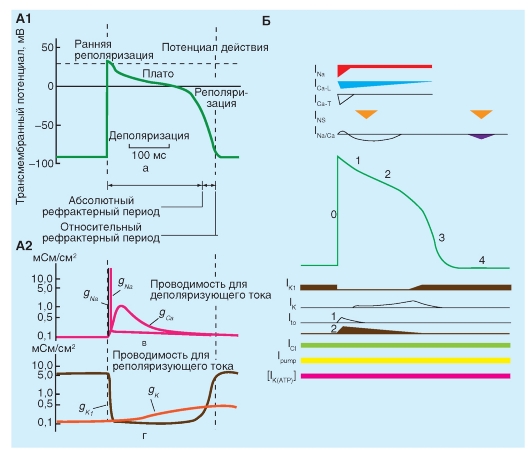
Рис. 6-5. Изменение проводимости мембраны рабочих кардиомиоцитов предсердий и желудочков для ионов (А) и основные ионные токи, принимающие участие в формировании потенциалов действия этих клеток рабочего миокарда (Б).
На панели Б в центре - потенциал действия миокардильной клетки желудочка, вверху и внизу - относительная проводимость для входящих и выходящих ионных токов соответственно. Прямые жирные линии для ICl, Ipump и IК(АТФ) указывают лишь на присутствие тока, обусловленного этими каналами или насосами, величины этих токов изменяются при различных физиологических состояниях
Ионные токи, формирующие потенциал действия пейсмейкерной клетки
У медленного же ответа (рис. 6-6 А) нарастание гораздо менее крутое, чем у быстрого. Ранняя реполяризация (фаза 1) отсутствует, плато либо отсутствует, либо значительно меньшей длительности и не такое горизонтальное, а переход от плато к окончательной реполяризации менее выражен. Прежде всего, к клеткам с медленным ответом относятся клетки в синусном (SA) и атриовентрикулярном (AV) узлах.
Типичный трансмембранный потенциал действия, зарегистрированный от клетки в SA-узле, изображен на рис. 6-6 А, а реконструированный с помощью компьютерной модели DiFrancescoNoble на рис. 6-6 Б. По сравнению с трансмембранным потенциалом, записанным от кардиомиоцита желудочка, потенциал покоя клетки SA-узла обычно менее негативен, нарастание потенциала действия (фаза 0) менее крутое, плато непродолжительно и реполяризация (фаза 3) более постепенна. Все эти черты характерны для медленного ответа. Нарастание потенциала действия не создается током, направленным внутрь через быстрые Na+-каналы. В таких клетках деполяризация
достигается главным образом за счет входа Ca2+ через Ca2+-каналы. Реполяризация в этих волокнах сопровождается инактивацией Ca2+-каналов и увеличенной K+ проводимостью через IK1 и IK каналы (рис. 6-6 В).
Трансмембранный потенциал в течение фазы 4 намного менее негативен у клеток, обладающих автоматией в SA- (и AV) узлах, чем у предсердных или желудочковых кардиомиоцитов, потому что IKl (К+-ток аномального выпрямления входящего направления) через К+-каналы аномального выпрямления редко встречается у клеток узлов. Ввиду этого отношение GK к GNa в течение фазы 4 намного меньше у клеток узлов, чем у кардиомиоцитов. Следовательно, во время фазы 4, Vm отклоняется намного больше от равновесного K+ потенциала (EK) у клеток узлов, чем у кардиомиоцитов.
Однако принципиальное свойство пейсмейкерного волокна, которое отличает его от других рассмотренных нами волокон, заключается в фазе 4. У клеток, не обладающих автоматией, мембранный потенциал остается постоянным в течение этой фазы, в то время как пейсмейкерное волокно характеризуется медленной диастолической деполяризацией в течение фазы 4. Деполяризация развивается с постоянной скоростью до достижения порога, запуская потенциал действия.
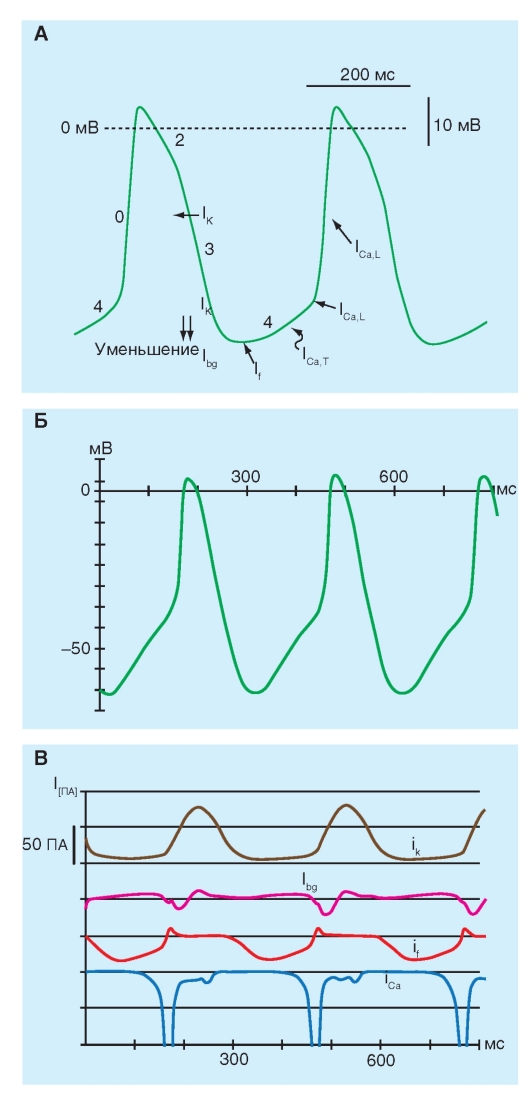
Рис. 6-6. Основные ионные токи, активирующиеся в различные фазы потенциала действия пейсмейкерной клетки в синоатриальном узле.
А - потенциалы действия и ионные токи, участвующие в формировании потенциалов действия пейсмейкерной клетки в синоатриальном узле. IK - калиевый ток задержанного выпрямления, Ibg - фоновый ток утечки, If - пейсмейкерный ток, активируемый гиперполяризацией, ICa,T - T-тип (от transient - преходящий) Са2+-токов активируется слабой деполяризацией и эти токи мимолетные (преходящие), ICa,L (от long-lasting - долгодлящийся) Са2+-токов, требующий сильной деполяризации для активации; он долго-длящийся и блокируется органическими антагонистами L-типа Са2+-каналов, включая дигидропиридины, фенилалкиламины и бензотиазепины. Б - реконструкция спонтанной активности клетки синоатриального узла с помощью компьютерной модели DiFrancesco-Noble. Показаны потенциалы действия. В - реконструкция ионных токов клетки синоатриального узла с помощью компьютерной модели DiFrancesco-Noble. Показаны амплитуды ионных токов IK, Ibg, If и ICa (ICa,L + ICa,T)
Ионные механизмы автоматии
Несколько ионных токов вносят вклад в медленную диастолическую деполяризацию, которая характерна для клеток сердца, обладающих автоматией. В пейсмейкерных клетках SA-узла, по крайней мере, три ионных тока опосредуют медленную диастолическую деполяризацию: (1) входящий ток, If , вызванный гиперполяризацией; (2) входящий Ca2+ ток, ICa и (3) выходящий K+ ток, IK (рис. 6-7 А и Б).
Входящий ток If (funny) активируется ближе к концу реполяризации. Этот «странный» ток переносится главным образом Na+ через специфические каналы, которые отличаются от быстрых №+-каналов. Току был пожалован титул «странного», потому что его первооткрыватели не ожидали обнаружить направленный внутрь Na+ ток в пейсмейкерных клетках после завершения реполяризации. Этот ток активируется по мере того, как мембранный потенциал становится более негативным, чем приблизительно -50 мВ. Чем более негативен мембранный потенциал в это время, тем больше активация If тока.
Второй ток, ответственный за диастолическую деполяризацию, Ca 2+ ток, ICa. Этот ток активируется к концу фазы 4 по мере того, как трансмембранный потенциал достигает величины около - 55 мВ. Как только каналы активированы, вход Ca2+ в клетку увеличивается. Этот приток ускоря-
ет диастолическую деполяризацию, которая затем приводит к фазе нарастания потенциала действия. Уменьшение концентрации внешнего Ca2+ или добавление антагонистов кальциевого канала уменьшает амплитуду потенциала действия и крутизну медленной диастолической деполяризации в клетках SA-узла.
Прогрессивной диастолической деполяризации, опосредованной двумя входящими токами, If и ICa, противодействует выходящий ток K+ - ток задержанного аномального выпрямления IK. Эта утечка K+ стремится реполяризовать клетку после нарастания потенциала действия. K+ продолжает выходить наружу в течение значительного времени после максимальной реполяризации, но этот выход уменьшается на всем протяжении фазы 4. Как только ток уменьшается, его противодействие деполяризующим влияниям двух входящих токов (ICa и If) также постепенно уменьшается.
Ионные основы автоматии в пейсмейкерных клетках AV-узла похожи на таковые в клетках SA-узла. Подобные механизмы также отвечают за автоматию в волокнах Пуркинье желудочков, за исключением того, что в них не участвует Ca2+ ток. Другими словами, медленная диастолическая деполяризация опосредована преимущественно неустойчивостью между влиянием вызванного гиперполяризацией входящего тока If и постепенно уменьшающимся выходящим K+ током IK.
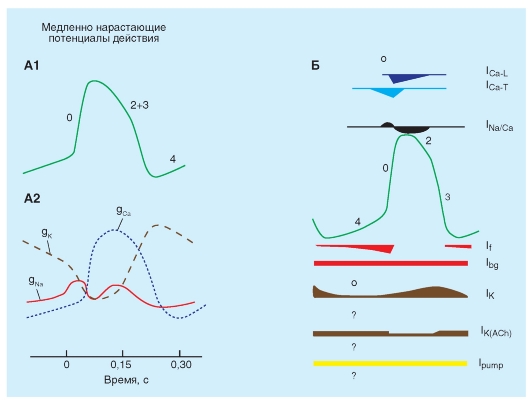
Рис. 6-7. Изменение проводимости мембраны пейсмейкерных клеток синоатриального узла для ионов (А) и основные ионные токи, принимающие участие в формировании потенциалов действия этих клеток (Б).
На панели Б в центре - потенциал действия клетки синоатриального узла, вверху и внизу - входящие и выходящие ионные токи соответственно. Прямые жирные линии для Ipump и Ibg указывают лишь на присутствие тока, обусловленного этими каналами или насосами, величины этих токов изменяются при различных физиологических состояниях. Знак вопроса указывает на то, что роль этих токов в формировании потенциала действия синоатриальных клеток до конца не выяснена, тогда как знак «0» говорит о том, что этот ток отсутствует
Истинные и латентные пейсмейкерные комплексы
Свойство автоматии - ведущей пейсмейкерной активности - позволяет сердцу сокращаться даже тогда, когда сердце изолировано из организма. Если коронарные сосуды извлеченного сердца искусственно перфузировать раствором электролита, насыщенного кислородом, ритмические сердечные сокращения сохраняются в течение многих часов. По крайней мере, некоторые клетки предсердий и желудочков могут возбуждаться и инициировать сокращения. Такие клетки главным образом находятся в тканях узлов или специализированных проводящих волокнах сердца.
Областью сердца млекопитающих, которая обычно генерирует импульсы с самой большой частотой (рис. 6-8 А), является синоатриальный (SA) узел. Это главный водитель ритма сердца. Детализированное картирование электрических потенциалов на поверхности правого предсердия показывает, что существуют две или три области автоматии, находящиеся в 1 или 2 см от SA-узла, и составляют совместно с SA-узлом предсердный пейсмейкерный комплекс. Иногда все эти локусы одновременно инициируют импульсы. Однако принципиальное свойство пейсмейкерного
волокна, которое отличает его от других рассмотренных нами волокон, заключается в фазе 4. У клеток, не обладающих автоматией, потенциал остается постоянным в течение этой фазы, в то время как пейсмейкерное волокно характеризуется медленной диастолической деполяризацией в течение фазы 4. Деполяризация развивается с постоянной скоростью до достижения порога, запуская потенциал действия.
Однако существуют и латентные пейсмейкеры. Когда SA-узел или другие составляющие предсердного пейсмейкерного комплекса удалены или разрушены, клетки водителя ритма AV-узла обычно берут на себя пейсмейкерную функцию всего сердца. Через некоторое время клетки предсердий, обладающие автоматией, обычно становятся доминирующими. Волокна Пуркинье представляют специализированную проводящую систему желудочков, которая также способна проявлять автоматию. Как правило, эти волокна разряжаются с очень низкой частотой. Когда AV-узел не может проводить импульсы от предсердий к желудочкам (рис. 6-8 Б), собственный желудочковый водитель ритма в сети волокон Пуркинье инициируют сокращения желудочков, но только с частотой от 30 до 40 ударов в минуту.
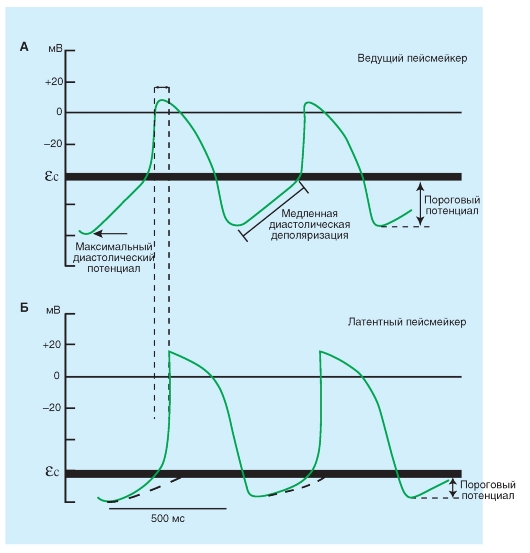
Рис. 6-8. Потенциалы действия ведущего пейсмейкера.
А - клетки синусового узла и латентного пейсмейкера. Б - клетки пучка Гиса. Вертикальными пунктирными линиями отмечены моменты начала возбуждения пейсмейкеров, стрелкой отмечено время проведения возбуждения от истинного пейсмейкера к латентному.
Пунктирными линиями показано время достижения порогового потенциала латентными пейсмейкерными клетками. В результате они возбуждаются в ритме, заданном истинным пейсмейкером, поскольку в латентных пейсмейкерах медленная диастолическая деполяризация не успевает достигнуть порогового уровня. ɛс - критический уровень деполяризации
Возможные пути изменения частоты разрядов пейсмейкерных клеток
Частота разрядов пейсмейкерных клеток, определяющих частоту сердечных сокращений, может варьировать в результате изменения следующих условий: (1) при изменении скорости диастолической деполяризации в фазу 4; (2) при изменении максимально отрицательной величины мембранного потенциала в фазу 4; (3) при изменении порогового потенциала за счет сдвига величины критического уровня деполяризации; (4) при изменении скорости нарастания переднего фронта деполяризации и скорости реполяризации
(рис. 6-9). Когда скорость медленной диастолической деполяризации увеличивается (от 2 до 1 на рис. 6-9 А1), потенциал порога достигается раньше и частота сердечных сокращений увеличивается. Повышение порогового потенциала (от Ес-1 до Ес-2 на рис. 6-9 А2) задерживает начало фазы 0 (от момента времени 2 до момента времени 3) и частота сердечных сокращений соответственно уменьшается. Точно так же, когда максимальный, негативный потенциал увеличен (от 1 до 4 на рис. 6-9 А2), то требуется больше времени, чтобы достигнуть порога Ес-2, когда крутизна фазы 4 остается неизменной, а частота сердечных сокращений, следовательно, уменьшается.
Рис. 6-9. Основные пути, обусловливающие изменения частоты возбуждения пейсмейкерных клеток.
А - причины изменения частоты пейсмейкерной активности. А1 - изменение частоты спонтанной активности за счет изменения скорости медленной диастолической деполяризации (1 и 2). А2 - изменение частоты спонтанной активности за счет изменения порогового уровня деполяризации (Ес-1, Ес-2 - 1 и 4). Изменение частоты спонтанной активности за счет изменения уровня максимального диастолического потенциала (2, 3 и 5). Б - влияние кратковременного раздражения блуждающего нерва (стрелка) на трансмембранный потенциал, регистрируемый от пейсмейкерной клетки SA-узла препарата изолированного предсердия кошки. Длительности сердечного цикла, в миллисундах, обозначены числами наверху рисунка
Влияние величины мембранного потенциала покоя на скорость распространения потенциала действия
Уровень потенциала покоя мембраны управляет скоростью проведения потенциалов действия, поскольку влияет на амплитуду потенциала действия и крутизну его нарастания.
Скорость распространения потенциала действия по миокарду определяют следующие факторы: (1) величина мембранного потенциала покоя, (2) амплитуда ПД и (3) скорость нарастания его переднего фронта в фазу 0.
(1) Чем более деполяризована мембрана, тем меньше скорость распространения независимо от причин возникновения. В основе этого явления лежит инактивация потенциал-управляемых h-ворот. А именно, когда начинается регенеративная деполяризация, то часть быстрых натриевых каналов могут быть уже инактивированы.
(2) Амплитуда ПД определяет разность потенциалов между возбужденным и невозбужденным участком, т.е. величину локальных токов, которые деполяризуют мембрану до порогового уровня.
(3) Скорость нарастания переднего фронта влияет на величину разности потенциалов между возбужденным и еще не возбужденным участками. Иными словами, если ПД развивается медленно, то это сопровождается снижением возникающей разности потенциалов, поскольку покоящаяся часть деполяризуется постепенно по отношению к активной зоне.
Этими механизмами можно объяснить более медленное распространение возбуждения потенциалов с медленным ответом. Следует учитывать, что блокируются в первую очередь потенциалы с медленным ответом. Трансмембранный потенциал может изменяться в сторону деполяризации по следующим причинам: (1) изменилась внеклеточная концентрация K+; (2) у волокон сердца, способных к автоматии, Vm постепенно становится менее негативным во время фазы 4; и (3) при преждевременном возбуждении мембрана клетки полностью не реполяризуется после
предыдущего возбуждения. Вообще говоря, чем менее отрицателен уровень Vm, тем меньше скорость распространения импульса, независимо от причины изменения Vm.
Уровень Vm влияет на скорость проведения, потому что инактивация h-ворот быстрых Na+-каналов, является потенциал-управляемой. Чем менее отрицателен Vm, тем больше количество h-ворот, которые стремятся закрыться. В течение нормального процесса возбуждения, деполяризация развивается так быстро в течение фазы 0, что сравнительно медленные h-ворота не закрываются до конца этой фазы. Однако если неполная деполяризация произведена постепенно, например, как при повышении уровня внешнего K+, то ворота имеют вполне достаточное время, чтобы закрыться и таким образом инактивировать некоторые из Na+-каналов. Когда клетка не полностью деполяризована, многие из Na+-каналов уже инактивированы; таким образом, только часть Na+-каналов способна проводить направленный внутрь Na+ ток в течение фазы 0.
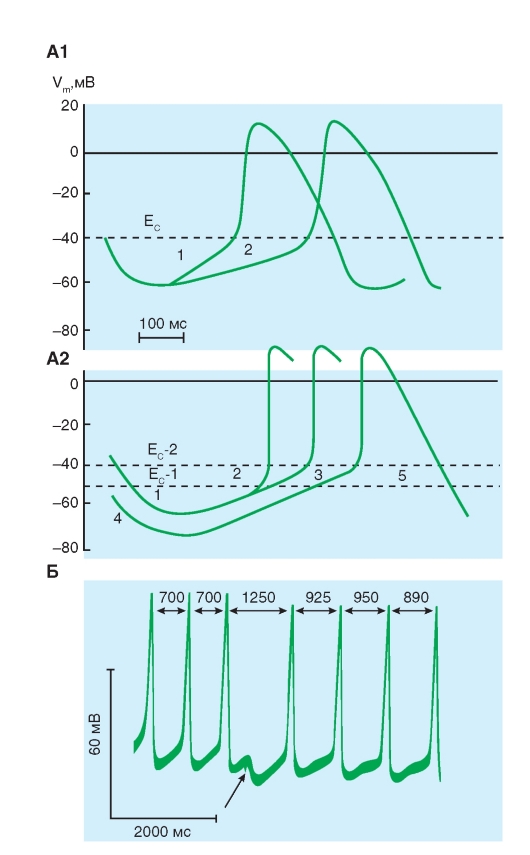
На рис. 6-10 показаны результаты эксперимента, в котором потенциал покоя пучка волокон Пуркинье уменьшали, изменяя величину [K+]o. Ткань стимулируется на некотором удалении от клетки с вживленным электродом, и артефакт от раздражения (St) появляется как двухфазное отклонение перед фазой 0. Интервал от этого артефакта до начала фазы 0 обратно пропорционален скорости проведения. Когда [K+]o равна 3 мМ (A и Е), Vm составляет -82 мВ, и наблюдается крутой наклон в фазе 0. В конце фазы 0, овершут достигает 30 мВ. Следовательно, амплитуда потенциала действия составляет 112 мВ.
Когда [K+]o постепенно увеличивается до 16 мМ (от Б к Д), потенциал покоя постепенно становится менее негативным. В то же самое время и амплитуды, и длительности потенциалов действия, и крутизны нарастания уменьшаются. Как следствие, скорость проведения прогрессивно снижается. При уровнях [K+]o в 14 и 16 мМ (Д и E), Vm достигает значений, достаточных, чтобы инактивировать все быстрые Na+-каналы. Потенциалы действия на рис. 6-9 Д и E являются характерными медленными ответами.
Рис. 6-10. Зависимость мембранного потенциала и потенциала действия клеток Пуркинье от внеклеточной концентрации калия (St - стимуляция)
Взаимосвязь частоты стимуляции и длительности потенциала действия кардиомицита
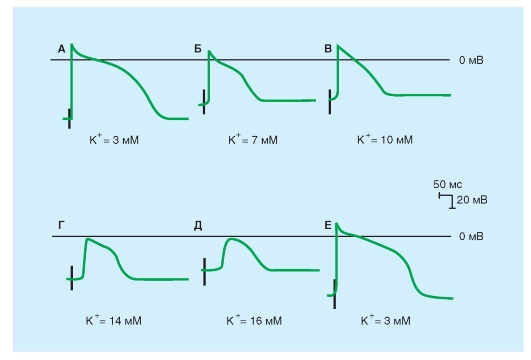
Изменения частоты стимулирующих импульсов изменяют длительность потенциалов действия в клетках сердца (рис. 6-11) и таким образом изменяют их рефрактерные периоды. Следовательно, изменения частоты стимулирующих импульсов часто являются важными факторами при инициировании или прекращении некоторых аритмий. Изменения длительности потенциала действия, которые происходили при уменьшении длительности межстимуляционного интервала от 2000 до 200 мс в волокне Пуркинье показаны на рис. 6-11. Обратите внимание, что по мере того, как длительность межстимуляционного интервала сокращается, длительность потенциала действия уменьшается. Прямая корреляция между длительностью потенциала действия и длительностью межстимуляционного интервала опосредована изменениями в GK, во что вовлечены, по крайней мере, два типа K+-каналов, а именно, K+-каналы задержанного выпрямления (delayed rectifier channels), формирующие ток IK и быстро инактивирующиеся (и поэтому транзиторные) K+-каналы, которые проводят направленный наружу Ito.
Ток IK активируется при значениях Vm близких к нулю, но ток активируется медленно и остается активированным сотни миллисунд. Ток IK также очень медленно инактивируется. Следовательно, поскольку длительность межстимуляционного интервала уменьшается, каждый следующий потенциал действия имеет тенденцию возникать в начале периода инактивации тока IK предшествующего потенциала действия. Таким образом, чем короче длительность межстимуляционного интервала, тем больше направленный наружу K+-ток в течение фазы 2, и, следовательно, короче длительность потенциала действия.
Ток Ito влияет на связь между частотой стимуляции и длительностью потенциала действия. Ток Ito также активируется при значениях потенциалов, близких к нулю, и его величина изменяется обратно пропорционально длине сердечного цикла. Следовательно, при уменьшении межстимуляционного интервала, результирующее увеличение направленного наружу K+ тока сокращает плато.
Относительные вклады IK и Ito во взаимосвязь между длительностью потенциала действия и длиной сердечного цикла варьируют в сердцах разных видов животных.
Рис. 6-11. Влияние длительности межстимуляционного интервала (CL) на длительность потенциала действия (APD) клеток Пуркинье
Влияние стимуляции вегетативных нервов на форму потенциалов клеток синусного, атриовентрикулярного узлов и кардиомиоцитов предсердий
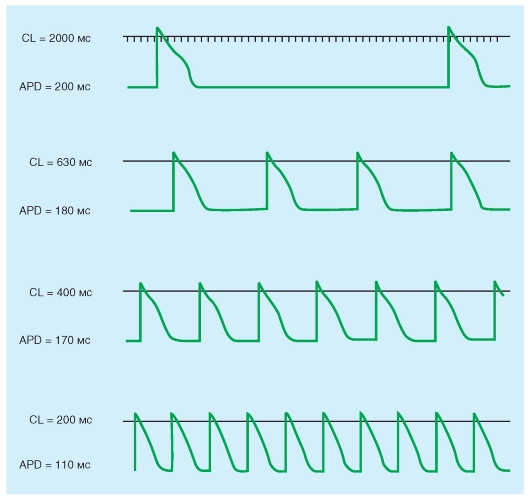
Обычно частота разряда водителя ритма регулируется действием обоих отделов вегетативной нервной системы. Усиленная симпатическая нервная активность, посредством высвобождения норадреналина, повышает частоту сердечных сокращений, увеличивая, преимущественно, крутизну медленной диастолической деполяризации рис. 6-12 А1, А2, А3). Этот механизм увеличения частоты сердечных сокращений осуществляется при физической нагрузке, беспокойстве, или при некоторых заболеваниях.
Повышенная активность блуждающего нерва, посредством высвобождения ацетилхолина, уменьшает частоту сердечных сокращений, гиперполяри-
зуя клеточную мембрану пейсмейкера и уменьшая крутизну медленной диастолической деполяризации (рис. 6-12 Б1, Б2, Б3). Эти механизмы уменьшения частоты сердечных сокращений осуществляются, когда преобладает действие блуждающего нерва. Примером крайнего случая является вазовагальный обморок: короткий период головокружения или потери сознания, вызванного интенсивным всплеском вагусной активности. Этот тип обморока является рефлекторным ответом на боль или некоторые психологические стимулы.
Изменения активности внутрисердечной нервной системы обычно не изменяют частоту сердечных сокращений посредством изменения порогового значения Vm, что инициирует разряд пейсмейкерной клетки узла. Однако некоторые антиаритмические препараты, например, хинидин и прокаинамид, поднимают пороговый потенциал клеток, обладающих автоматией до менее негативных величин за счет смещения ɛс.
Рис. 6-12. Влияния парасимпатической и симпатической стимуляции на форму потенциалов действия клеток синоатриального узла (А1, Б1), атриовентрикулярного узла (А2, Б2) и рабочего миокарда предсердий (А3, Б3). На «В», также приведены кривые изометрических сокращений предсердий.
Стрелки указывают направления изменений от контрольных значений потенциалов действия и амплитуды силы сокращения
Влияние нейтротрансмиттеров, их агонистов и антагонистов на клетки синоатриального узла
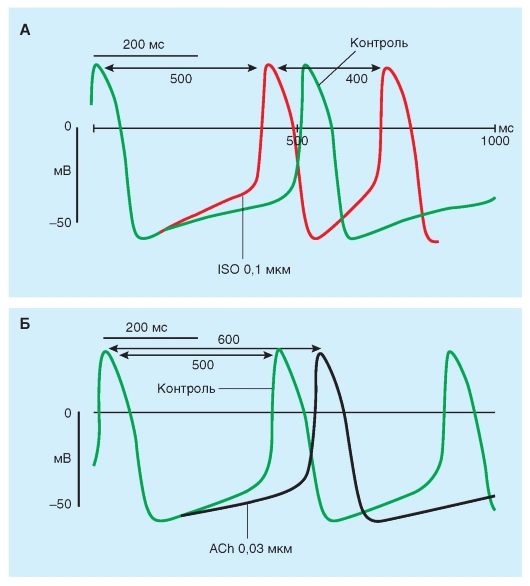
Нейротрансмиттеры вегетативной нервной системы воздействуют на автоматию, изменяя клеточные трансмембранные ионные токи. Адренергические трансмиттеры увеличивают все три тока, участвующих в автоматии SA-узла. Чтобы увеличить крутизну диастолической деполяризации, усиление If и ICa адренергическими трансмиттерами должно превысить усиление IK. Адренергические трансмиттеры могут существенно влиять на GCa. Так, адренергический нейротрансмиттер норадреналин или, например, агонист β-адренергического рецептора изопротеренол (рис. 6-13 А) и различные другие катехоламины могут усиливать Ca2+-проводимость. Увеличение Ca2+-проводимости катехоламинами, возможно, является основным механизмом, по которому они усиливают сократимость сердечной мышцы.
Гиперполяризация (рис. 6-13 Б), вызванная ацетилхолином, который высвобождается из окончаний блуждающего нерва, достигается увеличением GK. Это изменение в проводимости опосредуется через активацию специфических K+-каналов, регулируемых ацетилхолином. Эти
каналы регулируются под действием ацетилхолина (например, внеклеточной концентрацией ацетилхолина). В сердце имеются мускариновые K+-каналы (KACh) - тип KG каналов, активирующийся G-белками, ответственными за эффект ацетилхолина. Возникающий ток обозначают как IKACh. В сердце ацетилхолин также понижает If и ICa токи.
У здоровых людей, находящихся в спокойном состоянии, преобладает обычно тоническое влияние парасимпатической нервной системы. Когда здоровому человеку вводят атропин, антагонист мускариновых рецепторов, который блокирует воздействия парасимпатической нервной системы, частота сердечных сокращений обычно значительно возрастает. Если здоровому человеку вводят пропранолол, антагонист β-адренергических рецепторов, который блокирует воздействия симпатической нервной системы, частота сердечных сокращений незначительно уменьшается. Когда оба отдела вегетативной нервной системы блокированы, частота сердечных сокращений у молодых людей в среднем достигает значения 100 ударов в минуту. Частота сердечных сокращений, которая устанавливается при полной блокаде вегетативной нервной системы, называется собственной частотой сердечных сокращений.
Рис. 6-13. Изменение ритма пейсмейкерной активности изолированной синоатриальной клетки под действием низких концентраций агониста β-адренорецепторов изопротеренола (ISO) (А) и агониста мускариновых холинорецепторов ацетилхолина (ACh) (Б). Ускорение или замедление ритма происходят, главным образом, за счет активации изопротеренолом или подавлением ацетилхолином пейсмейкерного тока If
Механизм влияния норадреналина и ацетилхолина
Различные факторы, такие как нейротрансмиттеры и лекарственные средства, могут существенно влиять на проводимость каналов.
Чтобы усилить Ca2+ проводимость, катехоламины сначала взаимодействуют с β-адренергическими рецепторами мембраны клетки сердца. Это взаимодействие стимулирует мембранно-связанный фермент аденилилатциклазу, что повышает внутриклеточную концентрацию циклического аденозин монофосфата (цАМФ). Повышение уровня цАМФ усиливает активацию Ca2+-каналов L-типа в клеточной мембране и таким образом увеличивает вход Ca2+ в клетки из межклеточной жидкости.
Ацетилхолин взаимодействует с мускариновыми рецепторами клеточной мембраны, чтобы наоборот ингибировать аденилилатциклазу. Таким путем ацетилхолин противодействует активации Ca2+-каналов, уменьшая, таким образом, GCa.
Синоатриальный и атриовентрикулярный узлы содержат много холиностеразы, фермента, разрушающего ацетилхолин. Ацетилхолин, высвобож-
денный из окончаний блуждающих нервов быстро гидролизируется. Благодаря быстрому разрушению ацетилхолина воздействия, вызываемые любой стимуляцией блуждающего нерва, очень быстро прекращаются после окончания стимуляции. Кроме того, влияние блуждающего нерва на деятельность синоатриального или атриовентрикулярного узлов имеет очень короткий латентный период (от 50 до 100 мс), потому что выделяемый ацетилхолин активирует специфические ацетилхолин-регулируемые К+-каналы (IKACh) в клетках сердца. Эти каналы открываются так быстро потому, что ацетилхолин действует минуя систему вторичных мессенджеров такую, как система аденилатциклазы. Сочетание двух характерных особенностей блуждающих нервов - короткого латентного периода и быстрого угасания ответной реакции - позволяет блуждающим нервам регулировать деятельность синоатриального и атриовентрикулярного узлов при каждом сокращении сердца.
В области синоатриального узла влияние парасимпатической нервной системы обычно превосходит влияние симпатической нервной системы.
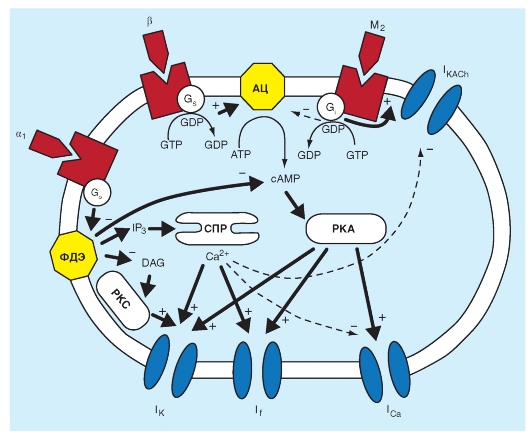
Рис. 6-14. Влияние агонистов α1- и β-адренорецепторов и М2-холинорецепторов через вторичные внутриклеточные посредники на потенциал-зависимые ионные токи IK, If и ICa,L сердечных клеток. Кроме того, стимуляция М2-холинорецептора приводит к активации выходящего калиевого тока IKACh.
АЦ - аденилатциклаза, ФДЭ - фосфодиэстераза, СПР - саркоплазматический ретикулум, IP3 - инозитолтрифосфат, DАG - диацилглицерол, PKA и PKC - протеинкиназы A и C, соответственно
Структура проводящей системы сердца
Автоматия - это способность к самовозбуждению, или способность генерировать свое собственное возбуждение и сокращение. Регулярность такой пейсмейкерной активности определяет ритмичность работы сердца. Доказательством наличия автоматизма служит сокращение сердца, полностью извлеченного из организма.
Областью сердца млекопитающих, которая обычно генерирует импульсы с самой большой частотой, является синоатриальный (SA) узел, это главный водитель ритма сердца. Детализированное картирование электрических потенциалов на поверхности правого предсердия показывает, что существуют две или три области автоматии, находящиеся в 1 или 2 см от SA-узла, и составляют совместно с SA-узлом предсердный пейсмейкерный комплекс. Иногда все эти локусы одновременно инициируют импульсы. А иногда, область самого раннего возбуждения сдвигается от локуса к локусу, в зависимости от определенных условий, таких как уровень активности автономной нервной системы.
Из SA-узла сердца импульсы радиально распространяются по всему правому предсердию по обычным предсердным волокнам миокарда со скоростью проведения около 1 м/с. Специальный путь, передний межпредсердный пучок миокарда (или пучок Бахмана), проводит импульс из SA-узла непосредственно к левому предсердию. Волна возбуждения, которая направляется вниз через правое предсердие, в конечном счете, достигает атриовентрикулярного (AV) узла, который является обычно единственным путем прохождения сердечного импульса к желудочкам.
Волна возбуждения из предсердий достигает желудочков через AV-узел. У взрослых людей этот узел около 22 мм в длину, 10 мм в ширину и 3 мм в толщину. Узел расположен сзади, на правой стороне межпредсердной перегородки, вблизи устья коронарного синуса. AV-узел содержит те же самые два типа клеток, что и SA-узел, но круглые клетки в AV-узле менее распространены, а преобладают удлиненные.
AV-узел состоит из трех функциональных областей: (1) область AN (atrium-nodus), переходная зона
между предсердием и остальной частью узла; (2) N (nodus) средняя часть AV-узла; и (3) NH (nodus-His) - зона, в которой волокна узла постепенно сливаются с пучком Гиса, и которая представляет собой верхнюю часть специализированной проводящей системы желудочков. Обычно AV-узел и пучок Гиса являются единственными проводящими путями, по которым импульсы сердца проходят от предсердий к желудочкам.
Пучок Гиса проходит субэндокардиально вниз, приблизительно на 1 см, по правой стороне межжелудочковой перегородки и затем разделяется на правую и левую ножки пучка. Правая ножка пучка, которая является прямым продолжением пучка Гиса, направляется вниз по правой стороне межжелудочковой перегородки. Левая ножка пучка, которая значительно толще, чем правая, отходит почти перпендикулярно от пучка Гиса и проникает через межжелудочковую перегородку. На субэндокардиальной поверхности левой стороны межжелудочковой перегородки, левая ножка пучка разделяется на тонкую переднюю и толстую заднюю ветви.
Правая ножка пучка и две ветви левой ножки пучка в конечном счете ветвятся, образуя сложную сеть проводящих волокон, названных волокнами Пуркинье, которые распространяются по субэндокардиальным поверхностям обоих желудочков. У некоторых видов млекопитающих, например у крупного рогатого скота, сеть волокон Пуркинье организована в виде дискретных, инкапсулированных волокон.
Волокна Пуркинье имеют множество линейно организованных саркомеров, таких же, как у кардиомиоцитов. Однако T-тубулярная система отсутствует в волокнах Пуркинье у многих видов, хотя она хорошо развита в кардиомиоцитах. Волокна Пуркинье - самые крупные клетки сердца: они имеют диаметр от 70 до 80 мкм, в то время как диаметр кардиомиоцитов желудочков лежит в диапазоне от 10 до 15 мкм. Частично из-за своего большого диаметра, скорость проведения возбуждения (от 1 до 4 м/с) в волокнах Пуркинье превышает таковую у любого другого типа сердечных волокон. Более высокая скорость проведения обеспечивает быструю активацию всей эндокардиальной поверхности желудочков.
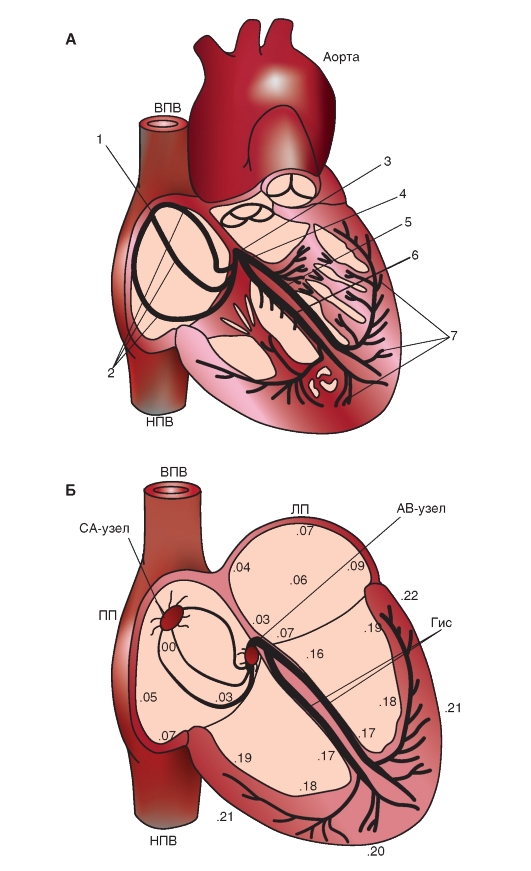
Рис. 6-15. Проводящая система сердца.
А - строение проводящей системы сердца: 1 - синоатриальный узел, 2 - проводящие пути предсердий, 3 - атриовентрикулярный узел, 4 - пучок Гиса, 5 и 6 - правая и левая ножки пучка Гиса, 7 - волокна Пуркинье, ВПВ и НПВ - верхняя и нижняя полые вены. Б - скорость распространения возбуждения по миокарду предсердий и желудочков. Цифры указывают время (в сундах) от момента возникновения возбуждения в синоатриальном узле до начала возбуждения в данном отделе миокарда. Скорость проведения возбуждения в синоатриальном узле - 1-2 см/с, в предсердиях около 1 м/с, в атриовентрикулярном узле - 1-5 см/с, в проводящей системе Гиса-Пуркинье - 2-4 м/с. Обозначения: СА - синоатриальный узел, АВ - атриовентрикулярный узел, Гис - ножки пучка Гиса, ВПВ и НПВ - верхняя и нижняя полые вены, ПП и ЛП - правое и левое предсердия
Функции и свойства проводящей системы сердца
Проводящая система сердца обеспечивает генерацию ритма возбуждений, последовательность и синхронность возбуждения, а потом и сокращения. Все это повышает эффективность работы сердца как насоса. Разные отделы проводящей системы выполняют различную функцию, что определяет их свойства. Синоатриальный узел ответственен за генерацию потенциалов и в норме является водителем ритма. Основным свойством атриовентрикулярного узла является проведение возбуждения. Возбуждение в АV-узле пройдет только в том случае, если оно произойдет сразу в нескольких клетках. Необходимо еще обратить внимание на важное свойство АV-узла: это значительное снижение скорости проведения возбуждения до 0,02-0,05 м/с. Это снижение скорости происходит на участке длиной 1,5-2 мм и обусловлено особенностями распространения потенциала с медленным ответом. Необходимость значительного снижения скорости очевидна, поскольку механические процессы в сердце протекают значительно медленнее, чем электрические, и нужно
время, чтобы кровь успела из предсердий попасть в желудочки. Наименьшая скорость проведения имеет места в средней части (nodus). АV-узел обладает односторонней проводимостью.
Атриовентрикулярный узел помимо проведения возбуждения при необходимости может взять на себя функцию водителя ритма. Кроме того, особые свойства АУ-узла обеспечивают неполную блокаду при проведении возбуждения свыше 180-200 в минуту. Далее возбуждение идет по пучку Гиса и его ножкам со скоростью 2-3 м/с, переходит на волокна Пуркинье, здесь скорость максимальная - 4-5 м/с и, наконец, достигает клеток рабочего миокарда. Скорость распространения возбуждения от субэндокардиальных окончаний волокон Пуркинье по рабочему миокарду желудочков составляет около 1 м/с.
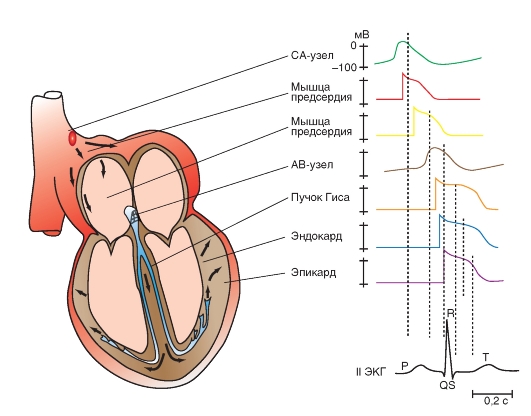
На рис. 6-16 продемонстрированы различные типы потенциалов действия, зарегистрированные последовательно от различных участков сердца и сопоставлены с одновременной записью электрокардиограммы. На данном рисунке отчетливо видно, что наибольшая задержка проведения возбуждения имеет место на участке: предсердие - атриовентрикулярный узел.
Рис. 6-16. Последовательная регистрация потенциалов действия от различных участков сердечной мышцы и сопоставление их с электрокардиограммой, зарегистрированной во втором стандартном отведении
Автоматия различных отделов сердца
Проводящая система холоднокровных животных включает два узла автоматии: синусный, расположенный в венозном синусе, и атриовентрикулярный - на границе предсердий и желудочка.
Все участки проводящей системы обладают способностью к автоматии, которая изменяется от основания сердца к верхушке (градиент автоматии). Наибольшей автоматией обладает синоатриальный узел (синусный - у холоднокровных). Его называют центром автоматии первого порядка.
При нарушении функции синоатриального узла какими-либо факторами проявляется автоматия атриовентрикулярного узла. Ритм сокращений сердца, задаваемый этим узлом, вдвое и более раз реже, чем в норме. После выключения атриовентрикулярного узла роль водителя ритма переходит к пучку Гиса, сокращения сердца становятся еще реже и т.д.
Автоматия вторичных узлов проявляется не сразу после выключения узла высшего порядка, а через промежуток времени, который длится от нескольких сунд до нескольких минут, - это так называемая преавтоматическая пауза.
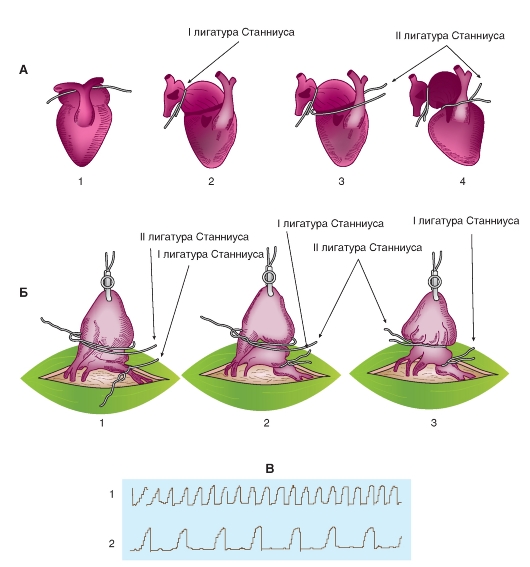
Для изучения проводящей системы сердца лягушки используют метод наложения лигатур на области расположения центров автоматии (лигатуры Станниуса). Применяют две лигатуры Станниуса (рис. 6-17 A). Первая лигатура накладывается в виде тугой перевязки между венозным синусом и предсердиями. Она отделяет синусный узел от остальных отделов сердца и препятствует доступу возбуждения к ним. Вследствие этого сокращения предсердий и желудочка прекращаются. Венозный синус продолжает сокращаться в исходном ритме. Опыт доказывает наличие в венозном синусе ведущего узла автоматии.
Вторая лигатура Станниуса накладывается между предсердиями и желудочком, она служит для раздражения атриовентрикулярного узла и пробуждения его автоматии. После наложения второй лигатуры возникают сокращения предсердий и желудочка, но в ином ритме, чем сокращения синуса. Опыт доказывает существование второго узла автоматии, расположенного в атриовентрикулярной области.
Регистрируют работу сердца в норме с подведенными лигатурами Станниуса. Затем туго завязывают лигатуру на границе между предсердиями и венозным синусом (рис. 6-17 Б). Сразу после перетяжки предсердия и желудочек останавливаются, а сокращения венозного синуса продолжаются в прежнем ритме. Результаты наложения первой лигатуры регистрируют на самописце. Слабые сокращения венозного синуса можно записать только при очень хорошо отпрепарированном препарате.
На некоторых препаратах удается иногда обнаружить самостоятельное проявление автоматии атриовентрикулярного узла через какое-то время после наложения первой лигатуры Станниуса (иногда через несколько минут). Ритм спонтанно возникающих сокращений меньше исходного синусного ритма.
Если же автоматия атриовентрикулярного узла спонтанно не восстанавливается, можно ускорить ее проявление каким-либо внешним стимулом. Таким раздражителем может служить вторая лигатура Станниуса, которая накладывается в области атриовентрикулярной борозды (рис. 6-17 Б). Вторую лигатуру затягивают нетуго, до появления сокращений сердца. Вначале эти сокращения, как правило, довольно часты, но постепенно урежаются, и вскоре устанавливается истинный атриовентрикулярный ритм, который в 2-3 раза реже исходного ритма сердца (рис. 6-17 В2).
Рис. 6-17. Изучение автоматии различных отделов сердца лягушки - опыт Станниуса.
А - выключение отдельных узлов проводящей системы с помощью лигатур Станниуса: 1 - подведение лигатуры для перевязки венозного синуса; 2 - венозный синус отделен лигатурой от предсердий; 3 - подведена вторая лигатура для отделения предсердий от желудочков; 4 - предсердия отделены от желудочков. Б - схема наложения лигатур Станниуса на сердце лягушки. Принцип наложения лигатур Станниуса с целью получения искусственного блока сердца (I - первая лигатура Станниуса; II - вторая лигатура Станниуса): 1 - подведение первой и второй лигатур Станниуса, 2 - затягивание первой лигатуры Станниуса, 3 - затягивание второй лигатуры Станниуса. В - механограмма сердца лягушки: 1 - механограмма сердца лягушки в норме, 2 - механограмма после искусственного поперечного блока
сердца
Влияние температуры на частоту сокращений сердца
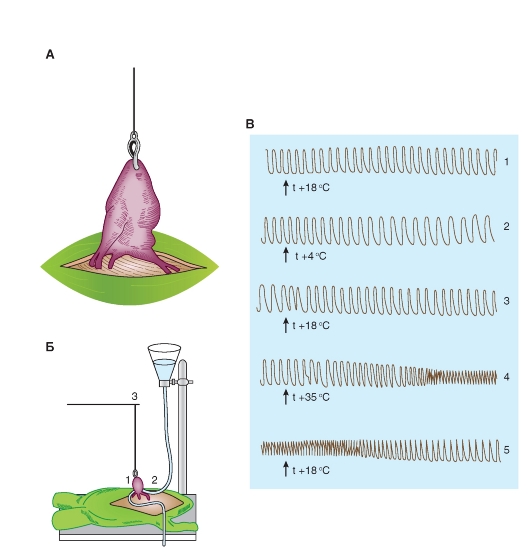
Доказательством автоматии сердца служит тот факт, что вырезанное из организма сердце продолжает ритмически сокращаться. Сердце имеет несколько центров автоматизма, однако используя факт влияния температуры на скорость течения физиологических процессов, можно доказать ведущую роль синусного узла в автоматизме сердца. Если нагревать или охлаждать различные отделы сердца лягушки, то выявляется изменение частоты его сокращений только при изменении температуры синуса, тогда как изменение температуры других отделов сердца (предсердий, желудочка) сказывается лишь на силе мышечных сокращений. Эффект влияния температуры можно наблюдать и на изолированном, и на неизолированном сердце лягушки.
У обездвиженной лягушки обнажают сердце (рис. 6-18 А) собирают установку по схеме, представленной на рис. 6-18 Б. Захватывают серфином или лигатурой верхушку сердца и устанавливают штырь регистратора в горизонтальном положении, опуская или поднимая дощечку с лягушкой. К основанию сердца, находящегося в вертикальном положении (к зоне синусного узла), подводят термод, заполненный водой комнатной температуры. С помощью механоэлектрического преобра-
зователя записывают на самописце кривую сокращений сердца - механограмму (рис. 6-18 В1).
По термоду пропускают воду температурой 4 °С и продолжают запись механограммы, регистрируя изменение механограммы сердца (рис. 6-18 В2). После получения устойчивого эффекта вновь пропускают через термод воду комнатной температуры для получения исходной механограммы (рис. 6-18 В3). Затем пропускают через термод воду температурой около 36 °С и продолжают запись механограммы, регистрируя изменение механограммы сердца (рис. 6-18 В4). После получения эффекта пропускают через термод воду комнатной температуры для получения исходной механограммы (рис. 6-18 В5).
Аналогичным образом проводят исследование влияния температуры на частоту сокращений сердца, перемещая термод к другим участкам сердца (желудочку).
После прекращения температурного воздействия изолируют сердце из организма, для чего предварительно перевязывают сосуды и перерезают их ниже места перевязки. Перерезают полую вену, следя за тем, чтобы не повредить венозный синус. Если изоляция сделана правильно, то сердце, вырезанное из тела лягушки и помещенное в физиологический раствор, будет сокращаться продолжительное время.
Рис. 6-18. Влияние нагревания и охлаждения венозного синуса на частоту сокращений сердца лягушки (опыт Гаскелла).
А - схема сердца с серфином, соединенным с регистратором. Б - схема постановки опыта по изучению влияния температуры на автоматию сердца. В - непрерывная запись механической активности сердца
Условия необходимые для возникновения возбуждения
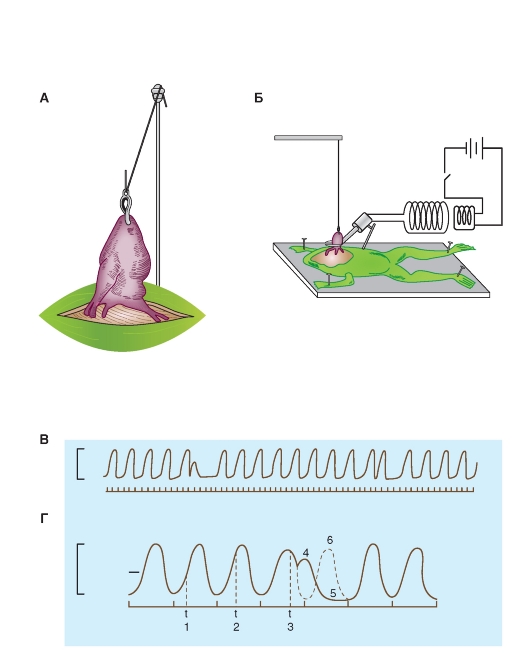
Сердечная мышца обладает рядом свойств, характерных для любой мышцы, в том числе возбудимостью, т.е. способностью отвечать на действие адекватного раздражителя специфическим изменением ионных токов с последующим изменением потенциала, т.е. отвечать возбуждением на раздражение. Чаще всего возбудимость определяют по порогу раздражения, т.е. по минимальной силе раздражителя, вызывающей ответ. Возбудимость сердечной мышцы, как и любой возбудимой ткани (скелетной и гладкой мышц, нервных волокон), меняется во время ее деятельности. При развитии возбуждения сердце теряет способность отвечать на раздражение новой волной возбуждения. Такое состояние потери возбудимости называют абсолютной рефрактерностью. Период абсолютной рефрактерности совпадает с систолой сердца и продолжается в желудочке 0,27 с. Любой силы раздражитель не способен возбудить сердечную мышцу в этот период. В основе механизма абсолютной рефрактерности лежит явление активации всех каналов входящего тока (прежде всего быстрых натриевых каналов, обеспечивающих ионные токи в фазу деполяризации потенциала действия) с последующей их инактивацией в фазу плато, на которую и приходится фаза абсолютной рефрактерности. Для снятия этой инактивации необходимо смещение потенциала в отрицательную область. Поэтому применение раздражителя любой силы неэффективно.
Абсолютная рефрактерность сменяется состоянием пониженной возбудимости или относительной рефрактерности, которая продолжается в мышце желудочка около 0,03 с и совпадает с фазой его расслабления. Возбудимость сердца в этот период постепенно нарастает, но остается ниже нормы. В это время можно возбудить сердечную мышцу, нанося раздражения большей, чем обычно, силы. В основе механизма относительной рефрактерности лежит явление снятия инактивации всех каналов входящего тока и параллельное приближение потенциала клеток к уровню мембранного потенциала. Именно поэтому в поздний
период относительной рефрактерности сердце легче возбудить, чем в ранний.
Наконец, возбудимость сердца возвращается к норме. С развитием в сердце новой волны возбуждения повторяются вышеописанные изменения возбудимости. Выражением возбуждения сердечной мышцы является потенциал действия. При соотношении изменения возбудимости мышцы сердца и потенциала действия можно видеть, что абсолютная рефрактерность занимает большую часть потенциала действия. Относительная рефрактерность приходится на фазу реполяризации. Раздражение, нанесенное на сердечную мышцу в период нормальной возбудимости и относительной рефрактерности, вызывает добавочное, внеочередное сокращение - экстрасистолу. Если внеочередное раздражение подается на венозный синус, то оно вызывает преждевременное возникновение импульса возбуждения в синусном узле и развитие внеочередного сердечного цикла. Следующий импульс возбуждения и соответствующий ему сердечный цикл возникают через обычный интервал времени. После желудочковой экстрасистолы наступает удлиненная, так называемая компенсаторная пауза. Происхождение ее связано с тем, что очередной импульс, приходящий в желудочек из синусного узла, попадает в рефрактерную фазу экстрасистолы. Этот импульс не может вызвать сокращения желудочка, оно наступает лишь в ответ на следующий импульс водителя ритма. Выпадение одного сокращения и создает удлиненную паузу.
У лягушки обнажают сердце (рис. 6-19 А). Собирают установку по схеме, представленной на рис. 6-19 Б. Захватывают серфином или лигатурой верхушку сердца и соединяют с механоэлектрическим преобразователем. На макроманипуляторе закрепляются вилочковые электроды, соединенные со стимулятором, которые подводятся к желудочку. Записывают кривую сокращений сердца - механограмму.
Исследование изменений возбудимости сердца производят путем получения экстрасистолы и определения интенсивности (раздражения, вызывающего ее в различные моменты деятельности желудочка). Внеочередное раздражение подают на желудочек в виде прямоугольных импульсов электрического тока от электростимулятора.
Рис. 6-19. Получение желудочковой экстрасистолы на сердце лягушки.
А - схема сердца с серфином. Б - схема постановки опыта. В - запись механограммы лягушки. Отметка времени 1 с. Видны две экстрасистолы. Г - желудочковая экстрасистола и компенсаторная пауза. Схематическое изображение моментов нанесения внеочередных раздражений (1, 2, 3), желудочковая экстрасистола (4), компенсаторная пауза (5), несостоявшееся сокращение обозначено пунктиром (6). Внизу отметка времени
Понятие о реентри
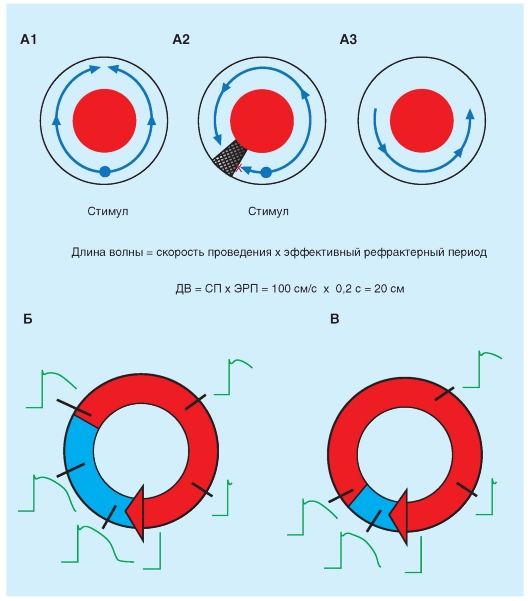
При определенных условиях сердечный импульс может снова возбудить некоторую область миокарда, через которую он проходил ранее. Это явление, известное как реентри (циркуляция волны возбуждения), ответственно за многие клинические аритмии (нарушения сердечного ритма). Реентри может быть упорядоченным или беспорядочным. В случае упорядоченной формы реентри импульс проходит по фиксированному анатомическому пути, в то время как при беспорядочной форме реентри путь непрерывно меняется. Условия необходимые для реентри иллюстрируются на рис. 6-20. Необходимое условие для реентри состоит в том, что в некоторой точке петли импульс может проходить в одном направлении, но не в другом. Это явление названо однонаправленным блоком. Хотя однонаправленный блок является необходимым условием для реентри, сам он не может вызвать циркуляции возбуждения. Чтобы возникло реентри, эффективный рефрактерный период области реентри должен быть короче, чем время проведения по петле. Функциональные компоненты петель реентри, ответственные за специфические аритмии в интактном сердце, разнообразны. Некоторые петли - большие и включают все спе-
циализированные проводящие пути, в то время как другие - микроскопические. Петля может включать кардиомиоциты, специализированные волокна проводящей системы, клетки узлов и атриовентрикулярные ткани почти в любой мыслимой компоновке. К тому же клетки сердца в петле могут быть нормальными или патологическими. Следовательно, условиями, которые поддерживают реентри, являются те, которые продлевают время проведения или сокращают эффективный рефрактерный период.
У пациентов с нерегулярными преждевременными деполяризациями, время появления этих внеочередных сокращений может обуславливать их клиническое состояние. Если они происходят на поздней стадии периода относительной рефрактерности, предшествующей деполяризации, или после полной реполяризации, то преждевременная деполяризация, вероятно, несущественна. Однако если преждевременные деполяризации происходят на ранней стадии периода относительной рефрактерности, проведение преждевременного импульса от места возникновения будет медленным, и, следовательно, возникновение реентри более вероятно. Если реентри нерегулярено (т.е. если наступает фибрилляция), последствия могут быть очень серьезными.
Рис. 6-20. Циркуляция волны возбуждения (re-entry - повторный вход) в кольце возбудимой ткани (по Mayer и Mines).
А - циркуляция волны возбуждения. А1 - при стимуляции кольца в определенной точке распространяющиеся импульсы сталкиваются. А2 - во время стимуляции на короткое время сдавливается заштрихованный участок, при этом возбуждение распространяется только в одном направлении, так как в области сжатия распространение импульса блокируется. A3 - кольцо больше не пережимается, импульс возвращается к исходной точке и затем продолжает свое движение по кольцу, начинается циркуляция возбуждения. Длина волны (ДВ) для re-entry равна произведению скорости проведения (СП) возбуждения на эффективный рефрактерный период (ЭРП). Значения СП и ЭРП, взяты для нормальной ткани рабочего миокарда человека. Циркуляция возбуждения по кольцу возможна только при условии, если ДВ меньше, чем путь, по которому двигается волна (длина окружности - 2πr). Б - циркуляция волны возбуждения вокруг анатомического препятствия. В - циркуляция волны возбуждения вокруг функционального препятствия. На (Б) и (В) стрелкой отмечено направление распространение волны. Синим цветом закрашены участки ткани, находящиеся в состоянии абсолютной рефрактерности. Рядом с каждым участком показаны фазы потенциала действия в данный момент. Циркуляция возбуждения возможна только при наличии возбудимого окна между «головой» и «хвостом» волны
Ранние и задержанные деполяризации
Триггерная (пусковая или запускающая) активность
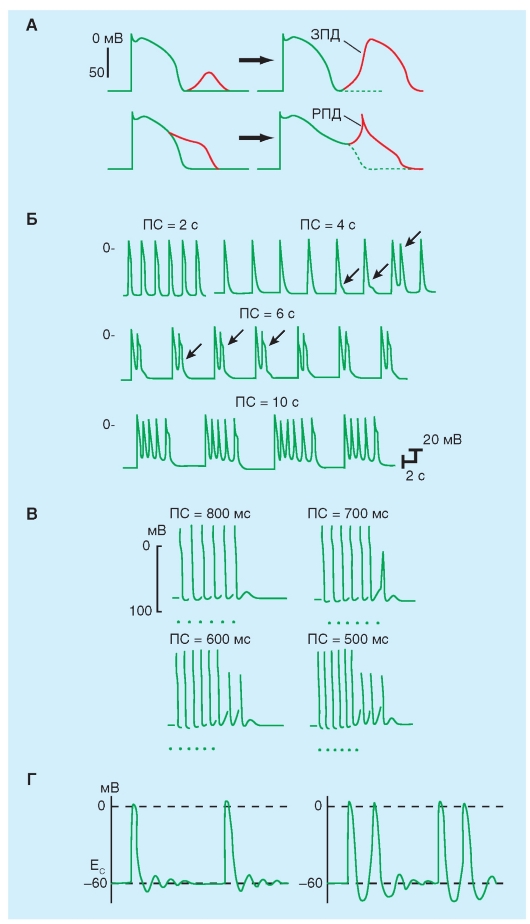
называется так потому, что она всегда сопряжена с предшествующим потенциалом действия. Она вызывается следовыми деполяризациями. Различают два типа следовых деполяризаций (рис. 6-21 А): раннюю (early afterdepolarization: РПД) и задержанную (delayed afterdepolarization: ЗПД).
Ранние постдеполяризации. РПД имеют тенденцию возникать ближе к концу плато потенциала действия или в течение фазы реполяризации, но прежде чем в клетке полностью закончится реполяризация. Чаще всего РПД возникают тогда, когда преобладает медленная частота сердечных сокращений; высокая частота сердечных сокращений их подавляет РПД. В эксперименте, показанном на рис. 6-21 Б, в препарате изолированного волокна Пуркинье РПД вызваны цезием. Явных следовых деполяризаций не наблюдается, когда препарат искусственно стимулируется импульсами с межстимуляционным интервалом в 2 с. Если период стимуляции увеличивается до 4 с, то появляются РПД. Большинство РПД - подпороговые (первые две стрелки), но одна из РПД достигает порога и запускает потенциал действия. Когда период стимуляции увеличивается до 6 с, каждый вызванный стимуляцией потенциал действия генерирует РПД, которая запускает второй потенциал действия. Кроме того, когда длительность межстимуляционного интервала увеличивается до 10 с, каждый вызванный стимуляцией потенциал действия запускает залп из четырех или пяти дополнительных потенциалов действия.
Прямая корреляция между длительностью потенциала действия клетки и ее способности к развитию РПД вероятно связана со временем, требуемым для Ca2+-каналов в мембранах клетки, чтобы восстановиться от инактивации. Когда длительность потенциала действия увеличена, Ca2+-каналы, которые были активированы в начале плато, имеют достаточное время, чтобы восстановиться от инактивации, прежде чем клетка полностью реполяризуется. Эта вторичная активация может запустить раннюю постдеполяризацию.
Задержанные постдеполяризации. В отличие от РПД, ЗПД чаще происходят, когда частота сердечных сокращений высока. Наиболее важные характеристики ЗПД показаны на рис. 6-21 В. В эксперименте, представленном на этом рисунке, трансмембранные потенциалы зарегистрированы от волокон Пуркинье, подвергнутых воздействию высокой кон-
центрации ацетил-строфантидина, вещества подобного дигиталису. В отсутствие каких-либо сильных раздражителей, эти волокна являются молчащими.
В каждой записи на рис. 6-21 В последовательность из шести вызванных стимуляцией деполяризаций вызывалась импульсами с определенным периодом. При длительности межстимуляционного интервала в 800 мс, последняя вызванная стимуляцией деполяризация сопровождается краткой деполяризацией (ЗПД), которая не достигает порога.
При уменьшении длительности межстимуляционного интервала до 700 мс, ЗПД, которая следовала за последним вызванным стимуляцией сокращением, достигает порога, и в результате наступает не вызванная стимуляцией деполяризация (или экстрасистола). Эта экстрасистола сама сопровождается подпороговым потенциалом последействия. Уменьшение длительности межстимуляционного интервала до 600 мс также вызывает экстрасистолу после последней вызванной стимуляцией деполяризации. Однако потенциал последействия, который следует за экстрасистолой, достигает порога и возникает вторая экстрасистола. Когда шесть вызванных стимуляцией деполяризаций отделены интервалами в 500 мс, вызывает последовательность из трех экстрасистол. Более короткий период стимуляции или немного большие концентрации ацетил-строфантидина вызывают длинную последовательность не вызванных стимуляцией сокращений; такая последовательность напоминает пароксизмальную тахикардию.
ЗПД связаны с повышением внутриклеточной концентрации Ca2+ [Ca2+]in, например, при увеличении концентрации внеклеточного Ca2+ и введении токсических количеств гликозидов наперстянки. Повышение концентрации [Ca2+]in вызывает осциллирующий выброс Ca2+ из саркоплазматического ретикулума. Следовательно, в кардиомиоцитах DADs сопровождаются малыми, ритмическими изменениями в развиваемой силе. Высокая [Ca2+]in также активируют некоторые мембранные каналы, которые проводят Na+ и K+. Суммарный поток этих катионов составляет транзиторный входящий ток, Iti, который является, по крайней мере, частично ответственным за следовую деполяризацию мембраны клетки. Повышенная концентрация [Ca2+]in может также активировать электрогенный обменник 3Na+in/Ca2+out. Он также создает суммарный ток катионов внутрь, который вносит вклад в ЗПД.
Наконец, на рис. 6-21 Г показано возникновение триггерной активности, обусловленной появлением ЗПД, вызванных оубаином.
Рис. 6-21. Триггерная активность, вызванная в сердечных клетках ранними постдеполяризациями (РПД), или иначе early afterdepolarization (EAD), и задержанными постдеполяризациями (ЗПД), или иначе delayed afterdepolarization (DAD)
Возможности фармакологического влияния на длительность потенциалов действия кардиомиоцитов
Длительность потенциала действия в основном зависит от активности калиевых каналов, которые ответственны за реполяризацию. Выходящий транзиторный калиевый ток и калиевый ток задер - жанного выпрямления являются ответственными за длительность потенциала действия. Известно, что длительность потенциала действия желудочковых кардиомиоцитов существенно превышает длительность потенциалов клеток предсердия. Это объясняется большей плотностью калиевого тока в предсердных кардиомиоцитах. Длительность потенциалов действия в разных желудочковых кардиомиоцитах может варьировать и именно калиевый ток задержанного выпрямления будет ответственным за эти различия.
Длительность потенциалов действия имеет существенное значение для нормальной работы сердца, так как от нее зависят фазы невозбудимости сердечных клеток. В случаях нарушения ритма, когда сокращен эффективный рефрактерный
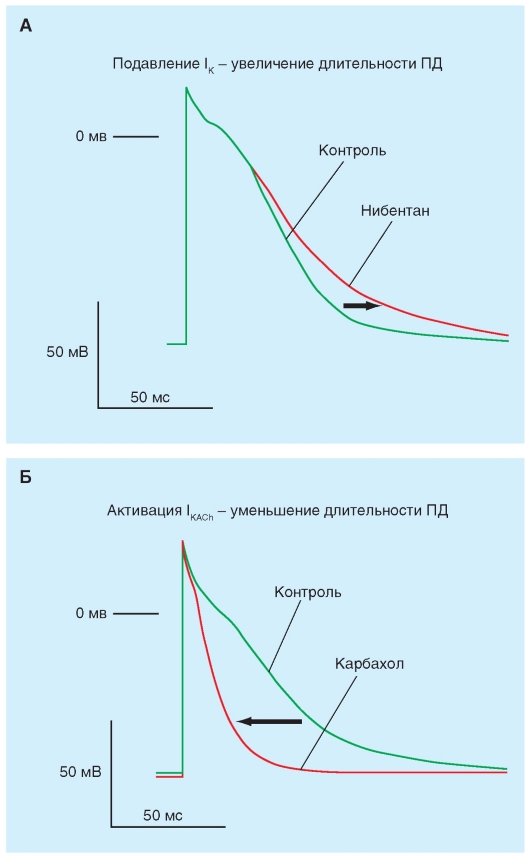
период, могут возникать дополнительные внеочередные эктопические возбуждения, что снижает эффективность работы сердца как насоса. Для предотвращения подобных явлений в клинике применяют антиаритмические препараты, которые удлиняют потенциал действия, не изменяя остальные его параметры, за счет избирательного снижения калиевого тока задержанного выпрямления. На рис. 6-22 А показано действие антиаритмического препарата - нибентана, который в результате подавления калиевого тока увеличил длительность потенциала действия.
В некоторых случаях необходимо добиться обратного эффекта, а именно сократить длительность потенциалов действия. В этих случаях используют препараты, которые активируют калиевые токи и тем самым укорачивают длительность потенциалов, уменьшая тем самым эффективный рефрактерный период. К таким препаратам относится карбахол. Это м- и н-холиностимулятор, синтетическое производное холина. Он связывается с м- и н-холинорецепторами и возбуждает их, имитируя эффект ацетилхолина. На рис. 6-22 Б наглядно представлен эффект карбахола, выражающийся в значительном укорочении потенциала действия кардиомиоцита предсердия.
Рис. 6-22. Изменение длительности потенциала действия (ДПД) под действием различных веществ.
А - ДПД волокна правого предсердия кролика за счет подавления антиаритмиком III класса нибентаном K+-каналов задержанного выпрямления (delayed rectifier channels), формирующих ток IK. Б - уменьшение ДПД волокна правого предсердия кролика за счет активации выходящего калиевого тока (IKACh) холинергическим агонистом карбахолом. При действии карбахола за счет активации IKACh, происходит также смещение потенциала покоя - гиперполяризация
Фазовые изменения возбудимости во время возбуждения кардиомиоцита
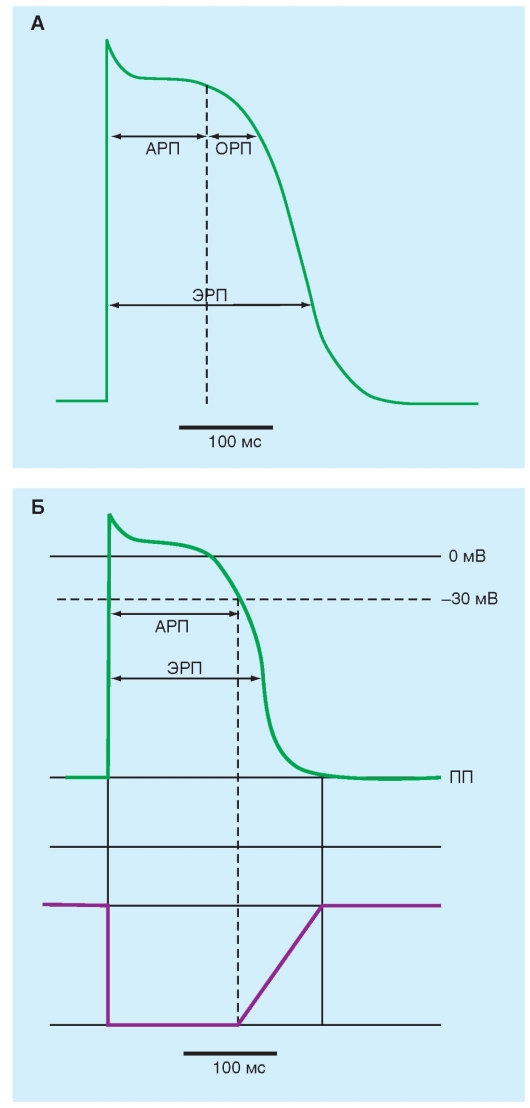
В процессе потенциала действия возбудимость клетки меняется, что определяется теми механизмами, которые лежат в основе генерации потенциала действия. Обычно выделяют несколько фаз, отражающих изменения возбудимости клетки в течение развития потенциала действия. Фаза нормальной возбудимости характерна для периода покоя клетки, фаза абсолютной рефрактерности - клетку возбудить невозможно, и, наконец, фаза относительной рефрактерности - клетка принципиально может быть возбуждена.
На рис. 6-23 в верхней части представлен потенциал действия рабочего кардиомиоцита. На уровне потенциала покоя мембрана клетки имеет нормальную возбудимость (принятую условно за 100%). Далее, для того, что бы возбудить клетку требуется пороговый импульс электрического тока, который открывает все Na+-каналы. Начинается фаза деполяризации потенциала действия. В этот период, именно из-за активации
всех потенциал-управляемых Na+-каналов, клетку невозможно вторично возбудить. То есть возбудимость сразу же падает до 0%, и начинается поддерживаемая фаза абсолютной рефрактерности. Эта фаза длится до того момента, пока фаза реполяризации потенциала действия не пересечет нулевую линю. Чем ближе реполяризация потенциала действия подходит к уровню потенциала покоя, тем проще вторично вызвать процесс возбуждения мембраны клетки. Все это время мембрана клетка находится в фазе относительной рефрактерности. Наконец, реполяризация пересает потенциал покоя. Если в этой точке мы подадим тестовый импульс, ответом будет полноценный потенциал действия. Следовательно, при возврате к уровню потенциала покоя возбудимость будет вновь нормальной и равной 100%.
Следует отметить, что у рабочего кардиомиоцита фаза относительной рефрактерности начинается позже, чем у других типов клеток, поскольку выход из инактивации Na+-каналов начинается приблизительно с -30 мВ. Разумеется, рисунки представлены схематично.
Рис. 6-23. Фазовые изменения возбудимости (фиолетовая кривая) и их связь с потенциалом действия рабочего кардиомиоцита (зеленая кривая). Эффективный рефрактерный период (ЭРП), абсолютный рефрактерный период (АРП), за ним следует относительный рефрактерный период (ОРП)
Механизм электромеханического сопряжения в кардиомиоцитах
Сопряжение возбуждения - сокращения иначе называется электромеханическим сопряжением. Его идею отражают три кривые, приведенные на рис. 6-24 А, - потенциал действия (1), который запускает процесс, изменение внутриклеточной концентрации Ca2+ [Ca2+]in на его фоне (2), что запускает механизм сокращения и механограмма (3), т.е. само сокращение.
Ca2+ существенно важен для сокращения сердца. Удаление Ca2+ из внеклеточной жидкости приводит к уменьшению силы сердечных сокращений и последующей остановке сердца в диастоле. Напротив, увеличение концентрации внеклеточного Ca2+ увеличивает силу сердечных сокращений, и очень высокие концентрации Ca2+ приводят к остановке сердца в систоле. Свободный внутриклеточный Ca2+ является ионом, отвечающим за сократительную способность миокарда.
Волна возбуждения в сердечной мышце быстро распространяется вдоль сарколеммы клеток миокарда от клетки к клетке через щелевые контакты. Возбуждение также распространяется внутрь клеток через поперечные трубки, которые инвагинированы в сердечные волокна на полосах Z (рис. 6-24 Б). Во время плато (фаза 2) потенциала действия повышается проницаемость сарколеммы для Са2+. Са2+ входит в клетку по его электрохимическому градиенту через Са2+-каналы сарколеммы и ее инвагинаций, то есть через мембраны Т-системы.
Считается, что открытие Са2+-каналов происходит в результате фосфорилирования протеинов каналов с помощью циклической аденозинмонофосфат-зависимой протеинкиназы (цАМФ-зависи- мой протеинкиназы). Первоначальным источником внеклеточного Са2+ является интерстициальная жидкость (10-3 М Са2+). Некоторое количество Са2+ может также быть связано с сарколеммой и с гликокаликсом, мукополисахаридом, покрывающим сарколемму. Количество Са2+, который попадает внутрь клетки из внеклеточного пространства, недостаточно для того, чтобы вызвать сокращение миофибрилл. Вошедший внутрь Са2+ («запускающий» Са2+) вызывает высвобождение Са2+ из саркоплазматического ретикулума. [Ca2+]in возрастает от уровня покоя примерно в 10-7 М до уровней от 10-6 до 10-5 во время возбуждения. Затем Са2+ связывается с белком тропонином-С. Кальциево-тропониновый комплекс взаимодействует с тропомиозином, чтобы снять блок с активных участков между актиновыми
и миозиновыми филаментами. Это снятие блока позволяет образовываться циклическим поперечным связям между актином и миозином и, следовательно, позволяет миофибриллам сокращаться.
Механизмы, которые повышают [Ca2+]in, увеличивают развиваемую силу сердечных сокращений, а механизмы, которые снижают [Ca2+]in, уменьшают ее.
В конце систолы приток Са2+ в клетку прекращается и саркоплазматический ретикулум не получает дальнейшей стимуляции для высвобождения Са2+. Фактически саркоплазматический ретикулум начинает активно поглощать Са2+ благодаря кальциевому насосу, который работает за счет энергии аденозинтрифосфата. Работа этого насоса стимулируется фосфоламбаном в результате фосфорилирования фосфоламбана цАМФ-зависимой протеинкиназой. К тому же фосфорилирование тропонина I подавляет связывание Са2+ тропонином-С. Этот процесс позволяет тропомиозину снова заблокировать участки взаимодействия актиновых и миозиновых нитей, что приводит к расслаблению (диастоле).
И сокращения, и расслабления сердечной мышцы ускоряются катехоламинами и активацией аденилатциклазы. Увеличение цАМФ стимулирует цАМФ-зависимую протеинкиназу, которая фосфорилирует кальциевый канал в сарколемме. Эти процессы приводят к тому, что больше Са2+ поступает в клетку, ускоряя, таким образом, сердечные сокращения. Однако эти процессы также ускоряют и релаксацию путем фосфорилирования фосфоламбана, который увеличивает захват Са2+ саркоплазматическим ретикулумом, и путем фосфорилирования тропонина I, что угнетает связывание Са2+ с тропонином-С. Таким образом, процессы фосфорилирования, вызванные цАМФ-зависимой протеинкиназой, служат для увеличения как скорости сердечных сокращений, так и скорости релаксации.
Митохондрии также поглощают и высвобождают Са2+, но этот процесс протекает слишком медленно, чтобы влиять на нормальный процесс сопряжения возбуждения и сокращения (электромеханическое сопряжение). Лишь при очень высоких уровнях внутриклеточного Са2+ (при патологических состояниях) митохондрии всасывают значительное количество Са2+.
Са2+, поступающий в клетку для инициирования сокращения, должен быть удален во время диастолы. Это удаление из цитозоля осуществляется прежде всего за счет 3Na+/1Са2+-обменника. Также Са2+ удаляется из клетки электрогенным насосом, который использует АТФ для переноса Са2+ через сарколемму.
Рис. 6-24. Электромеханическое сопряжение в сердце.
А - кривая, отражающая процесс сопряжения возбуждения и сокращения в миокарде желудочка: 1 - потенциал действия, 2 - внутриклеточное содержание свободных ионов кальция, 3 - сократительная активность, АРП - абсолютный рефрактерный период. Б - механизм электромеханического сопряжения в сердце
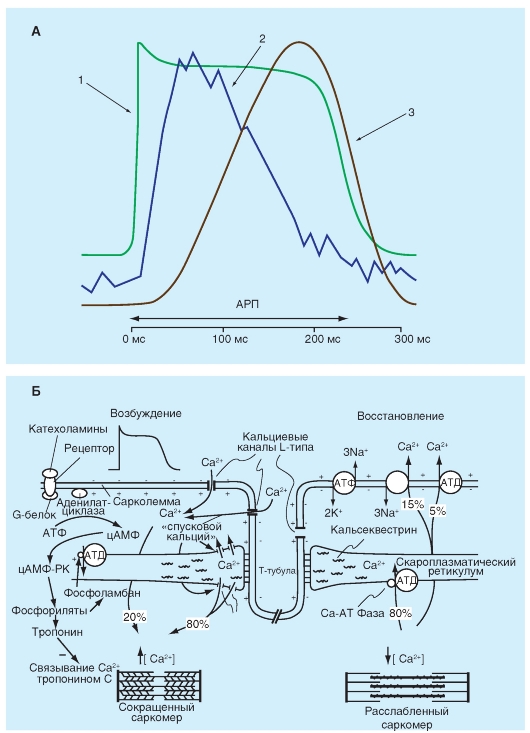
Механоэлектрическая обратная связь в сердце
Обратный электромеханическому сопряжению процесс носит название механоэлектрическая обратная связь. Механоэлектрическая обратная связь в сердце представляет собой механизм, при котором механические изменения в миокарде приводят к изменению в нем электрических процессов. Возникает так называемая механо-индуцированная деполяризация мембраны кардиомиоцитов, которая, достигая порога, вызывает экстрапотенциалы действия, что ведет к различным нарушениям частоты и ритма сердечной деятельности. Механические факторы, модулирующие электрическую активность сердца - это растяжение миокарда и/или изменение его сократительной активности.
Для оценки механоиндуцированной деполяризации анализу подвергали монофазный потенциал действия на уровне 25, 50 и 90% фазы реполяризации монофазного потенциала (MAPD25, MAPD50, MAPD90). На фоне растяжения сердца МАР демонстрировал увеличение MAPD90, типичный пример которого представлен на рис. 6-25 А. Кроме этого, наблюдали уменьшение MAPD25 и MAPD50. Изменения МАР90 при
механической нагрузке наблюдаются как в здоровом сердце, так и в патологических сердцах. Когда механическая нагрузка приводила к тому, что МАР90 достигал порогового потенциала, возникали экстрасистолы. Но метод регистрации монофазного потенциала считается очень неточным, поэтому позднее был применен метод стандартной микроэлектродной техники.
В этих экспериментах было показано, что растяжение полоски правого предсердия здоровых животных до 2 мН вызывало небольшое укорочение APD50, но значительное увеличение APD90 (рис. 6-25 Б). Рисунок демонстрирует влияние длительного растяжения полоски миокарда на потенциал действия на трех различных уровнях фазы реполяризации. Из рисунка следует, что в условиях растяжения ткани APD25 не изменялась, APD50 была укорочена, в то время как APD90 значительно увеличивалась. Увеличение APD90 было следствием развития механоиндуцированной деполяризации (stretch-induced depolarization - SID). В противоположность ранней или задержанной автодеполяризации, SID, которая увеличивала APD90, не запускалась предыдущим потенциалом действия, т.е. SID была результатом растяжения клеток миокарда.
Среди изменений электрических свойств миокарда при его растяжении или изменении силы сокращений по механизму механоэлектрической обратной связи можно схематически выделить следующее: (1) деполяризация мембраны, (2) изменение продолжительности потенциала действия (ПД) /монофазного потенциала действия (МПД) кардиомиоцита, главным образом за счет (3) иного протекания процесса реполяризации на разных ее уровнях, часто проявляющееся в (4) развитии stretch-induced/activated depolarization (SID/SAD) или, механоиндуцированной деполяризации, (5) изменение возбудимости и времени протекания фаз рефрактерности, (6) изменение скорости проведения возбуждения, (7) модуляции сократительной функции сердца. В результате может меняться или частота сердечной деятельности или возникают аритмии.
Рис. 6-25. Механоиндуцированная деполяризация кардиомиоцита.
А - монофазный потенциал действия (МАР) нерастянутого левого предсердия, зарегистрированный при помощи электрода присоски (зеленая линия) и МАР на фоне растяжения предсердия (красная линия). У последнего продемонстрировано появление механоиндуцированной ранней постдеполяризации, приводящей к удлинению MAPD90. (Компьютерное наложение). Б - потенциал действия (АР) кардиомиоцита правого предсердия крысы, полученный на фоне предрастяжения (1 мН) препарата (зеленая кривая) и потенциал действия (АР) на фоне дальнейшего растяжения препарата на 1,75 ± 0,04 мН (красная кривая). У последнего продемонстрировано появление механоиндуцированной деполяризации, приводящей к удлинению APD90. (Компьютерное наложение)
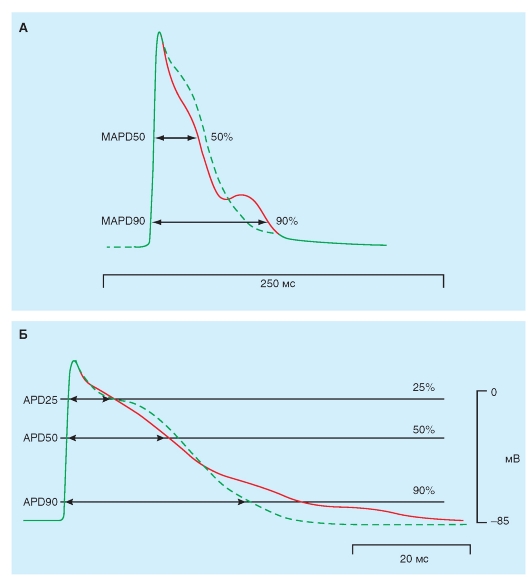
Иллюстрации механоиндуцированной деполяризации
Растяжение полоски предсердия здоровых животных вызывает появление механоиндуцированной деполяризации SID (стрелки на фрагментах 3, 4, 5, 6 рис. 6-26 А) в виде увеличения APD90. Дальнейшее увеличение растяжения ткани обычно вызывает появление дополнительных «экстра» потенциалов действия (фрагмент 7 на рис. 6-26 А). Экстрапотенциалы действия возникают исключительно тогда, когда амплитуда SID достигает порогового потенциала. При этом амплитуда каждого экстрапотенциала уменьшена, что совершенно типично для любого экстрапотенциала действия на фоне деполяризации мембраны. Эти механически вызванные изменения потенциала действия полностью исчезают при снятии растяжения.
После инфаркта миокарда в предсердиях обнаруживаются два типа потенциалов действия. Первый тип удлиненных потенциалов действия оказался подобным по величине APD25 и APD50 потенциалам действия контрольной группы, но был значительно удлинен на уровне APD90. Второй тип показывал значительное увеличение в APD25, APD50 и APD90 по сравнению с контролем.
У сердец, имеющих патологию, например как результат предшествующего инфаркта миокарда, значительно меньшее по величине растяжение препарата, по сравнению с препаратами здоровых сердец, вызывало появление SID. Рис. 6-26 Б показывает связь между SID на уровне APD90 и степенью растяжения препарата ткани сердца после инфаркта миокарда. Рис. 6-26 Б1 демонстрирует потенциалы действия, зарегистрированные при стандартном предрастяжении препарата, равном 0,2 мН. Хотя небольшое растяжение препарата в контрольной группе не вызывало SID, тот же самый уровень растяжения у животных после инфаркта миокарда вызывал появление SID (рис. 6-26 Б2). Более того, увеличение растяжения вызывало SID, которая развивалась в дополнительные потенциалы действия (рис. 6-26 Б3). В этом случае экстра потенциалы имели уменьшенную амплитуду потенциала действия, как это и ожидается при частично деполяризованной мембране. Необходимо подчеркнуть, что наблюдаемые изменения потенциалов в группе животных с патологиями сердца наступали при значительно меньшей степени растяжения препарата по сравнению с контролем (примерно в 10 раз). Возвращение к исходной длине препарата демонстрировало полное исчезновение этих механозависимых изменений (рис. 6-26 Б4).
Рис. 6-26. Механоиндуцированная деполяризация в здоровом сердце и после инфаркта миокарда.
А - механоиндуцированная деполяризация и экстра потенциалы действия (экстра-АР: нижняя кривая) при увеличении силы растяжения препарата правого предсердия здоровой крысы до 2 мН (верхняя кривая). Б - механоиндуцированная деполяризация на уровне APD90 клетки правого предсердия крысы после инфаркта миокарда левого желудочка: 1 - контрольная регистрация; 2 - небольшая величина растяжения препарата (0,2 мН) ведет к возникновению механоиндуцированной деполяризации; 3 - увеличение растяжения ведет к появлению экстра потенциалов действия (экстра-АР) на фоне деполяризации; 4 - восстановление исходного уровня растяжения ткани приводит к возвращению потенциалов к исходному состоянию. Верхняя кривая - регистрация силы сокращения препарата, нижняя кривая - регистрация биоэлектрической активности клетки.
На (А) и (Б) символы () показывают моменты растяжения препарата, а символы () - моменты возвращения величины растяжения препарата к исходному уровню. AF - active force, RF - resting force, Em - величина потенциала покоя, AP - потенциал действия
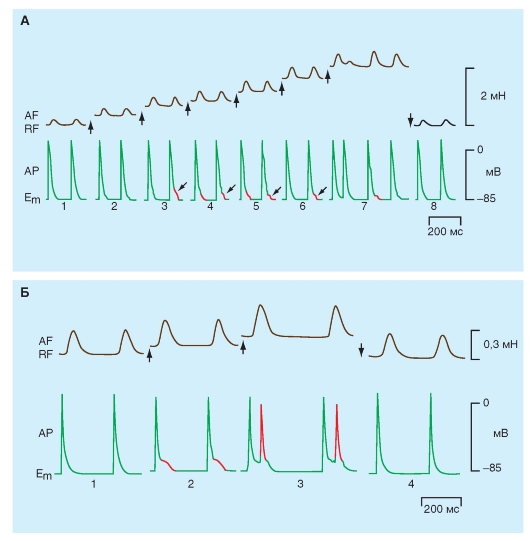
Влияние растяжения на возникновение
механоиндуцированной
деполяризации
На рис. 6-27 А, Б представлена динамика развития одного экстрапотенциала действия в правом предсердии инфарктной крысы при увеличении степени растяжения (1-5) препарата до 0,2 мН. Второй потенциал возникает при достижении SID критического уровня деполяризации (Ec = -66,6 мВ). Механоиндуцированные экстрасистолы и фибрилляция связаны с развитием SID, которая появляется на уровне APD90. Показано, что растяжение ткани прямо вызывает аритмию. Однако механизм, лежащий в основе
этих аритмий, нуждался в дальнейших исследованиях на изолированных клетках.
SID, которая появляется на уровне APD90, соответствует поздней фазе реполяризации, где инактивация потенциал-управляемых Na+-каналов уже исчезла. Сравнительно большие различия между мембранным потенциалом, принадлежащим APD90 и равновесным потенциалом для механосенситивных токов, могут способствовать генерации развития эффективной движущей силы для токов, входящих через МСК и, соответственно, способствовать развитию SID. SID на уровне APD90 может деполяризовать мембрану до уровня порога вследствие активации быстрых Na+-токов и приводить к генерации дополнительных потенциалов действия.
Рис. 6-27. Динамика преобразования механоиндуцированной деполяризации в потенциал действия (АР) при различных степенях (1-5) растяжения препарата. Ec - критический уровень деполяризации.
Зеленым обозначен исходный потенциал действия. Красным - ГД после растяжения ткани
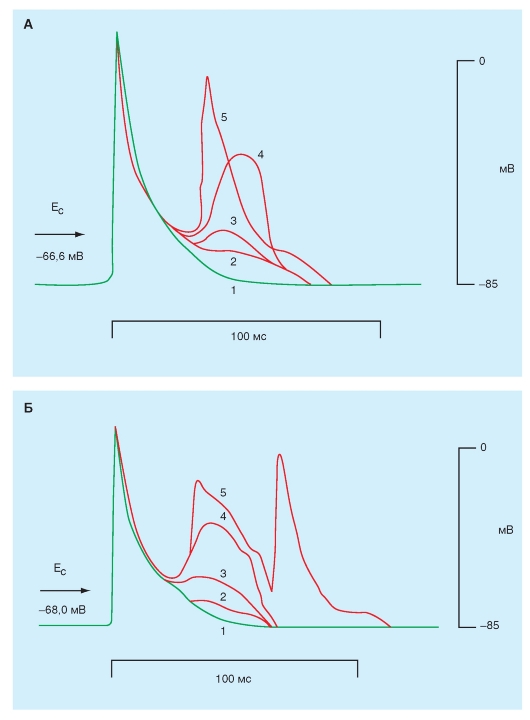
Влияние растяжения мембраны на потенциалы покоя и действия
В нормальном растворе Тироде с использованием метода patch-clamp в конфигурации wholecell изолированные вентрикулярные кардиомиоциты мыши (рис. 6-28 А) и морской свинки (рис. 6-28 Б) отвечают на их растяжение на 8-10 мкм деполяризацией мембраны клетки, увеличением длительности АР и возникновением экстра-АР. Снятие растяжения полностью возвращает регистрируемые параметры к исходному состоянию. На рисунках показан фрагмент непрерывной регистрации на самописце в режиме фиксации тока (current clamp) на клетке.
При тех же экспериментальных условиях при компьютерной регистрации изолированные кардиомиоциты здорового желудочка морской свинки отвечают на растяжение изменением величины потенциала покоя и длительности потенциала действия. Растяжение на 2 мкм и 4 мкм не меняет величину потенциала покоя и форму ПД кардиомиоцитов. Растяжение на 6 мкм деполяризует покоящуюся мембрану в среднем на 3 мВ (рис. 6-28 В), а растяжение на 8 мкм деполяризует в среднем на 6 мВ (рис. 6-28 Г). Растяжение на 8 мкм удлиняют средние значения APD90 от 360 мс до 502 мс. Кроме того, растяжение на 8 мкм и, далее на 10 мкм запускает экстра-ПД, которые начинаются от диастолической деполяризации.
Рис. 6-28. Растяжение изолированного кардиомиоцита левого желудочка при исследовании методом patchclamp в конфигурации whole-cell.
А - влияние растяжения изолированного кардиомиоцита сердца мыши на потенциал покоя и потенциал действия. Б - влияние растяжения изолированного кардиомиоцита сердца морской свинки на потенциал покоя и потенциал действия. На обеих панелях (А) и (Б) символами () показаны моменты увеличения растяжения клетки, символами () - моменты возвращения к исходному растяжению. AP - потенциал действия, Em - потенциал покоя. В - кардиомиоцит желудочка морской свинки, растянутый на 4 мкм. Г - кардиомиоцит желудочка морской свинки, растянутый на 8 мкм. На обеих панелях (В) и (Г) показано изменение величины потенциала покоя, формы AP и возникновение внеочередного потенциала
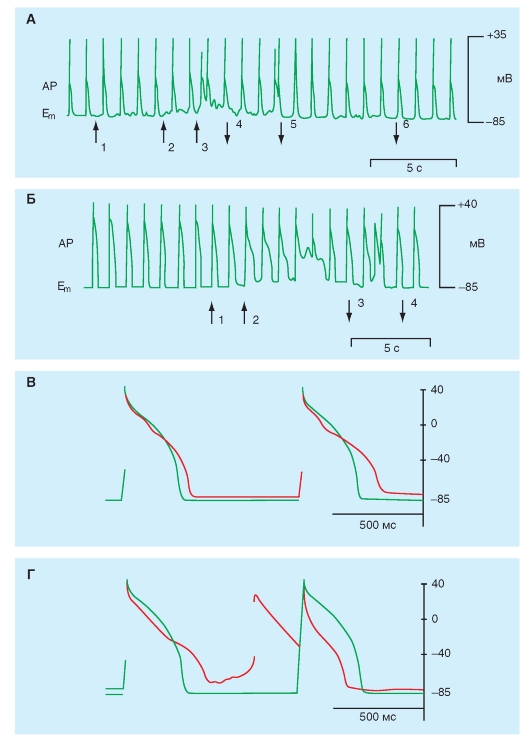
Характеристика механоуправляемых токов
Влияние растяжения на временной курс базового мембранного тока в реальных физиологических условиях, т.е. когда и перфузионный раствор и раствор в patch-пипетке содержит все необходимые для клетки ионы, представлено на рис. 6-29 А. Обычно такое соотношение растворов включает ионы K+ и поэтому называется Kin/Kout конфигурацией.
Растяжение на 12 мкм меняет holding current от +0,15 нА (начало зеленой кривой - C на рис. 6-29 А1) до -0,65 нА (начало красной кривой - S на рис. 6-29 А1). Это свидетельствует, что растяжение индуцирует входящий ток, причем этот входящий ток равен -0,80 нА при -45 мВ. Этот ток представлен в виде дифференциальной кривой, отражающей разность между кривыми C и S (фиолетовая кривая - D на рис. 6-29 А1) и представляет собой истинный ток, текущий через МСК при растяжении кардиомиоцита. В течение ступеньки до 0 мВ растяжение смещает ток (т.е. ток, регистрируемый в конце ступеньки) от 0,30 нА (синяя кривая - С на рис. 6-29 А1) до 0,50 нА (красная кривая - S на рис. 6-29 А). Таким образом, механоиндуцированный дифференциальный ток равен +0,20 нА (рис. 6-29 А1, кривая D). Из рисунка следует, что растяжение клетки резко уменьшает ток Ca2+ через L-тип каналы (ICa-L), возникающий на фоне ступеньки до 0 мВ. Это связано с увеличением внутриклеточной концентрации ионов Ca2+ на фоне растяжения и, следовательно, снижения концентрационного градиента для ионов Ca2+.
Аналогичным образом можно проанализировать рис. 6-29 А2, где смещение поддерживаемого потенциала проходило от -45 до -80 мВ.
Результаты экспериментов были представлены как вольт-амперные характеристики (I-V кривые). Поскольку из внешней и внутренней среды не устранялся калий (Kin/Kout) интерпретация I-V кривых достаточно сложна и специфична. До растяжения клетки I-V кривая имела N-форму (рис. 6-29 Б1). В точке пересечения I-V кривой с осью потенциала ток равен нулю, и эта точка эквивалентна диастолическому мембранному потенциалу (V0), кото-
рый обычно измеряется методом фиксации тока (примерно V0 = -80 - -85 мВ). В точке пересечения кривой с осью потенциала, т.е. при калиевом равновесном потенциале IK1 равен нулю. Поэтому отрицательный механоиндуцированный ток I (EK) может быть интерпретирован как механоиндуцированный катион-неселективный ток Ins в разное время названный как ISAC (stretch-activeted current) или IMGC (mechanically gated current). Горб на I-V кривой на уровне -60 мВ приписывается inwardly rectifying K+-current IK1. При V, более отрицательных, чем -20 мВ вклад в I-V кривую вносят ∆GK1 и катион-неселективная ∆Gns, определяемая работой MGCs. При V, более положительных, чем - 20 мВ механосенситивные токи переносятся ионами K+ через TRPC6 - outwardly rectifying channels и TREK1 (K2P2,1) и TREK2 (K2P10,1) - leak channels.
Растяжение смещает I-V кривую вниз, уменьшает или устраняет пик IK1 и деполяризует V0. Модуляция растяжением вольт-амперной характеристики клетки приведена на рис. 6-29 Б1. До растяжения (синие треугольники, объединенные кривой), кривая имела типичную N-образную форму и пересала ось потенциала при V0 = -76 мВ, что соответствует диастолическому мембранному потенциалу в условиях типичных растворов внешней и внутренней среды. Растяжение клетки на 6 мкм смещает величину токов в более негативную область, а мембранный потенциал до -70 мВ, т.е. в более позитивную область (зеленые треугольники, объединенные кривой). Растяжение до 10 мкм смещает вольт-амперную характеристику клетки при негативных потенциалах еще в большую отрицательную область (красные кружечки, объединенные кривой) и деполяризует мембрану до -35 мВ. Значительное растяжение в 12 мкм практически устраняет N-образную форму вольт-амперной характеристики увеличивая входящий ток в негативной области и деполяризуя мембранный потенциал до -20 мВ (коричневые квадраты, объединенные кривой).
Таким образом, и на клетках предсердий, и на клетках желудочков выявляется базовый мембранный IMGC, который увеличивался при увеличении степени прямого растяжения клетки (рис. 6-29 Б2) и уменьшался вплоть до полного исчезновения при снятии растяжения с клетки.
Рис. 6-29. Вольтамперные характеристики механочувствительных ионных токов (К+ токи не заблокированы).
А - поддерживаемый потенциал -45 мВ, стимулирующие импульсы до 0 мВ (А1) или -80 мВ (А2). Показаны записи токов, сделанные до (С) и на фоне растяжения на 12 мкм (S), и механочувствительный дифференциальный ток (D). Обратите внимание, что механочувствительный ток более отрицателен, чем ток в контроле, при потенциалах -80 и -45 мВ, однако более положителен при 0 мВ. Б1 - вольтамперная характеристика позднего тока (измеренного в конце импульса) до растяжения (пустые треугольники) и после растяжения на 6 мкм (заполненные треугольники), 10 мкм (заполненные кружочки) или 12 мкм (заполненные квадраты). Б2 - дифференциальные токи, активируемые при растяжении на 10 мкм (заполненные кружочки, Erev= 5 мВ) и 12 мкм (заполненные квадраты, Erev = 0 мВ)
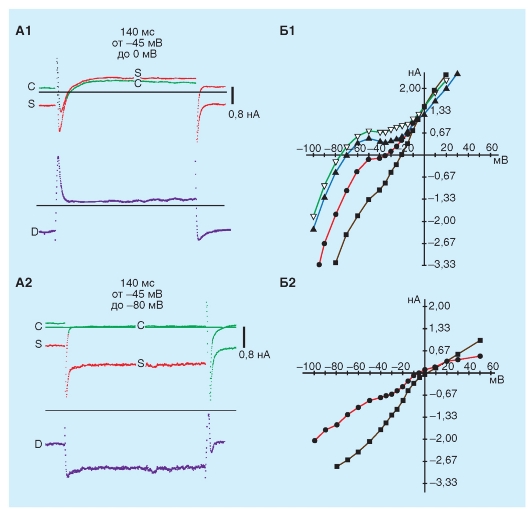
Характеристика механоуправляемых токов в кардиомиоцитах сердца после инфаркта
Дальнейшие исследования были посвящены разделению базового тока IMGC на компоненты. Чтобы сделать разделение базового тока на токовые компоненты у кардиомиоцитов токи через калиевые каналы были подавлены заменой К+ на Cs+ и в цитозоле, и в перфузионной камере (Csi/Cso). Это приводило, разумеется к изменению формы вольт-амперной характеристики, но полностью сохраняло реакцию МСК клетки на растяжение выделив только Ins. Кроме того, замена ионов K+ на ионы Cs+ позволила в качестве основы механоиндуцированного тока взять поздний ток (IL).
Рис. 6-30 A1, A2, A3 демонстрируют модуляцию растяжением мембранных токов в течение 140 мс импульса от -45 мВ до -30 мВ, до -20 мВ и до 0 мВ. На рис. 6-30 Б сравниваются IV-кривые мембранных токов до растяжения (пустые символы) с мембранными токами на фоне растяжения (заполненные символы). Растяжение клетки уменьшает ICa-L ток (кружки). Более важно, что
поздние токи, измеренные в конце 140 мс импульса (IL, отмеченные треугольниками), были выражено изменены на фоне растяжения клетки. В этих условиях растяжение кардиомиоцитов человека на
4 мкм вызывало поздний дифференциальный ток, который выражался как линейная IV-кривая и пересал V-ось координат при потенциале реверсии -16 мВ (-11±5 мВ) (рис. 6-30 В).
У кардиомиоцитов желудочков крыс, морских свинок и человека ISAC во всех случаях был блокирован введением в перфузионный раствор
5 мкмоль Gd3+. На рис. 6-30 Г представлены типичные примеры изменения I-V кривой кардиомиоцита человека при его растяжении (заполненные символы) и при последующем добавлении на фоне растяжения в омывающий клетку раствор 5 мкмоль Gd3+ (пустые символы). На фоне растяжения поздние токи, измеренные в отсутствии и присутствии Gd3+ пересались при Еrev = -1±4 мВ. Линейная I-V зависимость, Еrev = -11 мВ и Gd3+ чувствительность предполагают, что ISAC - это ток, который течет через неселективные катионные механо-сенситивные каналы.
Рис. 6-30. Активация растяжением Gd3+-чувствительного неселективного катионного тока при растяжении на 4 мкм кардиомиоцита левого желудочка человека после инфаркта миокарда в условиях подавленного цезием калиевого тока.
А - модуляция растяжением мембранных токов на фоне ступеньки импульсного тока длительностью 140 мс от поддерживаемого потенциала -45 мВ до -30 мВ (А1), до -20 мВ (А2) и до 0 мВ (A3). Б - I-V кривые поздних токов, измеренных в конце 140 мс импульса (IL - отмечены треугольниками), и I-V кривые, характеризующие работу L-типа Ca2+ каналов (ICa-L - отмечены кружочками). I-V кривые мембранных токов до растяжения отмечены пустыми символами, а на фоне растяжения клетки на 4 мкм - заполненными символами. В - растяжение клетки индуцирует дифференциальный ток, характеризующийся линейной I-V кривой и потенциалом реверсии (Erev), равным -16 мВ. Г - механоиндуцированный поздний (треугольники) и входящий ICa-L ток (кружочки) до (заполненный) и после (пустые) добавления в перфузионный раствор 5 мкмоль гадолиния. Примечание: гадолиний, как это и должно быть, ингибирует входящий ICa-L
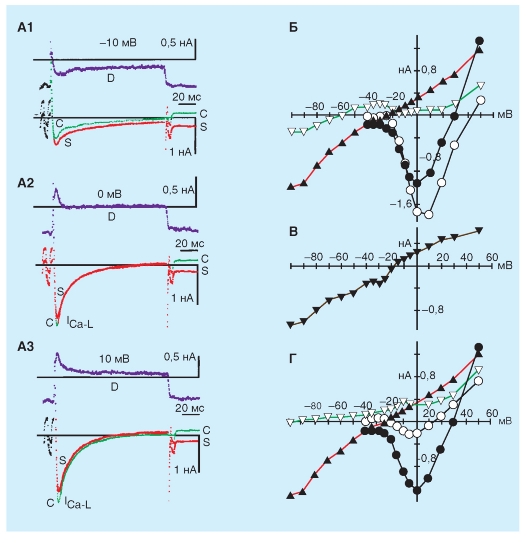
Суммарный механоуправляемый ток при различных величинах растяжения клетки
У изолированных кардиомиоцитов потенциал фиксировали на уровне -45 мВ. В этих условиях увеличение степени растяжения кардиомиоцитов приводило к увеличению базового мембранного тока через МСК.
На рис. 6-31 А, Б, В, Г показано, что растяжение клетки здорового сердца на 6 мкм вызывало появление входящего через МСК тока величиной 0.16 нА и дальнейшее увеличение растяжения до 8 мкм, 10 мкм, 12 мкм вызывало увеличе-
ние этого тока до 0.48 нА, 0.80 нА, 1.44 нА, соответственно. Растяжение клеток здорового сердца на 2 мкм и 4 мкм не приводило к какой либо реакции со стороны МСК. (Растяжение клетки от исходного уровня до конечных значений длилось очень быстро и определялось только скоростью движения микроманипулятора). У растянутой до определенного значения клетки, ISAC был постоянным в течение нескольких минут регистрации, т.е. инактивация или адаптация не наблюдалась (рис. 6-31 Д). Отсутствие инактивации МСК в течение длительного растяжения было и у кардиомиоцитов, полученных от больных сердец.
Рис. 6-31. При растяжении активируется суммарный входящий ток, который пропорционален величине растяжения и при возвращении к исходному состоянию исчезает. Запись суммарного мембранного тока, калиевые токи не блокированы. Мембранный потенциал фиксировали на уровне -45 мВ, от которого подавали стимулирующие импульсы до 0 мВ длительностью 140 мс с частотой 1 Гц. Показаны амплитуда растяжения и амплитуда активируемого растяжением входящего тока при потенциале -45 мВ.
A-Г - амплитуда входящего тока увеличивается с увеличением степени растяжения. Д - при растяжении входящий ток в течение 10 мин остается постоянным (не инактивируется). После того как растяжение убирают, амплитуда тока возвращается к исходному значению. При растяжении на 2 и 4 мкм амплитуда тока не изменялась (не показано)
Зависимость механочувствительности кардиомиоцитов от возраста животного или человека и патологии сердца
Как было показано выше, у изолированных кардиомиоцитов здорового сердца амплитуда ISAC увеличивалась с увеличением растяжения клеток. У клеток больных людей растяжение кардиомиоцита на 2 мкм вызывало ISAC, равный примерно -16 пА, а растяжение клетки на 4 мкм вызывало ISAC, равный -483 пА (рис. 6-32 А).
Для сравнения, у кардиомиоцитов молодых и здоровых морских свинок ISAC вообще не возникал при растяжении на 2 мкм и 4 мкм. При дальнейшем увеличении степени растяжения ISAC реагировали у всех исследуемых клеток. На растяжение величиной 6 мкм клетки отвечали возникновением ISAC величиной до -300 пA, при растяжении на 8 мкм ISAC был равен около -557 пА, а при растяжении на 10 мкм ISAC был равен в среднем -1050 пA (рис. 6-32 Б).
Таким образом, кардиомиоциты больных людей имеют несравнимо большую чувствительность к растяжению, чем кардиомиоциты здоровых морских свинок. Высокая чувствительность к растяжению клеток больных людей может быть объяснена за счет гипертрофии, которая возникает в течение заболевания и экспрессии SAC.
Чтобы проверить связана ли чувствительность кардиомиоцитов к растяжению с вентрикулярной гипертрофией изучали эффект растяжения клеток, полученных от здоровых молодых крыс, здоровых старых крыс и также от старых спонтанно гипертензивных животных (рис. 6-32 В). У гипертензивных крыс не было симптомов сердечной недостаточности, однако их сердца были гипертрофированны. Растяжение кардиомиоцитов желудочков молодых крыс (3 мес) на 2 и 4 мкм не приводило к появлению ISAC. При дальней-
шем увеличении степени растяжения клетки ISAC регистрировали у всех исследованных клеток. Так, растяжение кардиомиоцита на 8 мкм индуцирует входящий ток величиной примерно равной - 269 пА (при поддерживаемом потенциале -45 мВ). Аналогичное растяжение на 8 мкм кардиомиоцитов желудочков здоровых старых крыс (15 месяцев) вызывает значительно больший ISAC, равный около -460 пA. А растяжение кардиомиоцитов желудочков старых крыс (15 мес) со спонтанной гипертензией вызывает ISAC, среднее значение которого равно -420 пА уже при растяжении клетки на 2 мкм. У этих же животных растяжение клеток на 4 мкм вызывало ISAC, равный -1205 пА, а на 6 мкм ISAC, равный -1500 пА.
Графики зависимости величины ISAC от степени растяжения у здоровых и больных крыс представлены на рис. 6-32 Г, а у человека на рис. 6-32 Д.
Рис. 6-32 Г демонстрирует зависимость величины ISAC (пА) от величины растяжения клетки (мкм). Показана реакция кардиомиоцитов желудочка сердца здоровой крысы возрастом 3 мес, здоровой крысы возрастом 15 мес, гипертензивной крысы возрастом 15 мес. На рис. 6-32 Д показана зависимость величины ISAC (пА) от величины растяжения клетки (мкм). Показана реакция кардиомиоцитов желудочка сердца здорового молодого человека, и кардиомиоцитов желудочков и предсердий старого человека после инфаркта миокарда.
Эти изменения являются важнейшими физиологическими данными и показывают, что чувствительность клеток к растяжению увеличивается с гипертрофией, которая развивается в течение возраста, но сильнее с гипертензией. Чувствительность к растяжению, определенная для клеток больных человеческих сердец, была сходной с величиной, полученной у кардиомиоцитов от спонтанно гипертензивных старых крыс. В целом, результаты демонстрируют, что чувствительность кардиомиоцитов к растяжению увеличивается с возрастом и крайне высока при гипертрофии сердца.
Рис. 6-32. Оригинальные кривые токов, зарегистрированных до растяжения и при растяжении кардиомиоцитов. IK подавлен.
А - кардиомиоциты желудочка человека после инфаркта миокарда. Б - кардиомиоциты желудочка морской свинки возрастом 3 мес. В - кардиомиоциты желудочка сердца здоровой крысы. В возрасте 3 мес (верхняя кривая), здоровая крыса в возрасте 15 мес (средняя кривая), гипертензивная крыса в возрасте 15 мес (нижняя кривая). Примечание к обозначениям: на каждой кривой растяжение клетки с указанием степени растяжения показано линией сверху.
Графики зависимости величины ISAC от степени растяжения у здоровых и больных крыс представлены на панели (Г), а у человека на панели (Д)
Механоуправляемые каналы кардиомиоцитов
Впервые SAC были выявлены и описаны в экспериментах с использованием метода patch-clamp в конфигурации cell-attached на культивируемых эмбриональных скелетных мышечных клетках цыпленка F. Guharay и F. Sachs (США) в 1984 году. На кардиомиоцитах желудочков SAC впервые описал в 1988 году W. Craelius (США) настоящему времени они обнаружены у кардиомиоцитов во всех отделах сердца. Вероятность открытия SAC увеличивается при приложении к фрагменту мембраны через patch-пипетку отрицательного давления.
Казалось бы, что изучение одиночных каналов, реагирующих на механическое воздействие, отвечает на все вопросы, связанные с работой SAC в клетке. Однако это не так. Приложение положительного или отрицательного давления в пипетку вызывает не физиологическое растяжение мембраны, а ее деформацию в ту или иную сторону на локальном участке мембраны. Кроме того, не ясно, может ли открытие такого количества каналов (штук на диаметр пипетки) в пересчете на размер клетки, вызвать выраженную деполяризацию и возникновение AP. Хотя косвенно, используя методы математического моделирования, это возможно рассчитать.
Рис. 6-33 А2 (увеличенный фрагмент регистрации) демонстрирует активацию SAC с проводимостью 21 пС при регистрации методом
patch-clamp в конфигурации cell-attached от свежеизолированных вентрикулярных клеток эмбриона цыпленка. Разумеется, что речь идет не о прямом растяжении клетки, а о деформации клеточной мембраны под пипеткой отрицательным давлением -25 мм рт.ст. в пипетке.
Используя метод patch-clamp в конфигурации cell-attached в 1988 году Craelius и соавт впервые зарегистрировали SAC у вентрикулярных миоцитов неонатальных крыс, которые открывались в ответ на отрицательное давление от -1 до -6 см рт.ст. (рис. 6-33 Б). Эти каналы имели проводимость 120 пС в изотоническом растворе KCl и средний реверсный потенциал 31 мВ, деполяризованный от потенциала покоя. Каналы не требовавали внешнего Са2+ для активации и были сравнительно неселективны для катионов.
В дальнейших исследованиях на этой же модели и аналогичным методом деформации мембраны под пипеткой в конфигурации cell-attached приложение отрицательного давления запускало возникновение AP, которые зарегистрировали как «токи действия». Была изучена временная корреляция между возможностью открытия SAC и токами действия. На основе этих данных авторы предположили, что ток через небольшое число SAC достаточен (0,2 пС в течение 50 мс) чтобы запустить AP в кардиомиоцитах. Эти результаты свидетельствуют о том, что пассивное механическое растяжение миокарда может быть аритмогенным.
Рис. 6-33. Механосенситивные ионные каналы сердца.
А - активируемые растяжением ионные каналы клеток сердца. Одноканальная запись активируемого растяжением ионного канала проводимостью 21 пС в свежеизолированной клетке 17-дневного эмбриона цыпленка. Верхняя панель: токи до, во время и после приложения негативного давления величиной -25 мм рт.ст. к patch-пипетке. Канал активировался во время приложения негативного давления к пипетке и деактивировался при снятии давления. Нижняя панель: увеличение по временной шкале помеченного сегмента записи, показанной на верхней панели. Условия записи: пипеточный и омывающий растворы в ммоль, 150 NaCl, 5 KCl, 2 CaCl2, 1 MgCl2, 10 HEPES, pH 7,4 (NaOH). Поддерживаемый потенциал +60 мВ. Б - эффект suction в конфигурации cell-attached на катионселективный канал в мышце эмбриона цыпленка. Входящий ток представляет собой смещение нулевого тока вниз. (150 ммоль К+ в пипетке и обычный раствор Тироде в камере). Потенциал на пипетке +50 мВ. Б1 -0 мм рт.ст., Б2 -30 мм рт.ст., Б3 -50 мм рт.ст. подается в пипетку
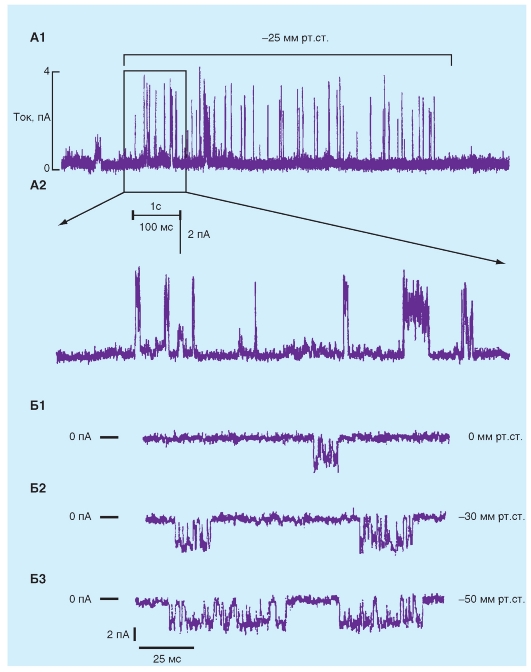
Электрокардиография
Процесс возбуждения сердца сопровождается возникновением в его тканях разности потенциалов, закономерно изменяющихся по величине и направлению. Биоэлектрическая активность различных отделов сердца возникает в строго определенной последовательности (рис. 6-34 А), повторяющейся в каждом цикле возбуждения. В ходе возбуждения меняется поляризация клеточных мембран и между возбужденными и невозбужденными участками регистрируется разность потенциалов, которую можно представить как электродвижущую силу (ЭДС) сердца. Поскольку сердце окружено проводящей средой, то эту разность потенциалов можно после соответствующего усиления зарегистрировать и с поверхности тела. При этом получается характерная кривая, состоящая из нескольких зубцов, разделенных определенными интервалами. Эта кривая получила название электрокардиограммы - ЭКГ. Зубцы ЭКГ обозначаются латинскими буквами - P, Q, R, S, T (зубцы перечислены в порядке их появления), а соответствующие интервалы: P-Q, S-T, T-P. На рис. 6-34 Б, В показана их длительность и амплитуда.
В общих чертах кривая ЭКГ состоит из волн: P, QRS, и T (рис. 6-34 Б, В). Интервал P-Q - это промежуток времени от начала активации предсердий до начала активации желудочков, он обычно колеблется в пределах от 0,12 до 0,20 с. Значительная часть этого времени включает прохождение импульса через AV-узел (Патологическое удлинение интервала P-Q связано с нарушениями проведения через AV-узел, которое может быть вызвано воспалительными процессами, патологией сосудов, фармакологическими веществами или влиянием нервной системы).
Конфигурация и амплитуда QRS комплекса варьирует в значительной мере у разных индивидуумов. Продолжительность обычно составляет 0,06-0,10 с. Аномально удлиненный QRS комплекс может указывать на блокаду в проводящей системе желудочков (типа блокады правой
или левой ножек пучка). В течение ST-сегмента весь миокард желудочков деполяризован. Поэтому, ST-сегмент обычно находится на изоэлектрической линии. (Любое заметное отклонение ST-сегмента от изоэлектрической линии может указывать на ишемическое повреждение миокарда). Интервал Q-T иногда рассматривается как период «электрической систолы» желудочков; интервал Q-T тесно коррелирует со средней продолжительностью потенциала действия кардиомиоцитов желудочков. Интервал Q-T имеет продолжительность около 0.4 сунд, и он изменяется обратно пропорционально частоте сердечных сокращений главным образом потому, что продолжительность потенциала действия кардиомиоцитов изменяется пропорционально частоте сердечных сокращений.
В большинстве отведений, T-волна отклоняется в том же самом направлении от изоэлектрической линии, как и большинство компонентов QRS комплекса, хотя бифазные или направленные в противоположную сторону T-волны являются совершенно нормальным явлением в некоторых отведениях. Отклонение в одном направлении от изоэлектрической линии T-волны и QRS комплекса указывает на то, что процесс реполяризации развивается в противоположном направлении. (T-волны, которые являются атипичными по направлению или по амплитуде, могут указывать на повреждение миокарда, нарушения электролитного баланса или на гипертрофию сердца).
ЭКГ позволяет сделать заключение о пути распространения волны возбуждения в сердце, регистрируя изменения электрического потенциала от различных участков поверхности тела. Анализируя детали этих флуктуаций электрического потенциала, можно получить важные сведения об: (1) анатомической ориентации сердца; (2) относительных размерах камер; (3) различных нарушениях ритма и проведения; (4) степени, местоположении и прогрессе ишемического повреждения миокарда; (5) эффектах измененных концентраций электролита; и (6) влиянии определенных препаратов (особенно наперстянки, антиаритмических средств, и антагонистов Ca2+-каналов).
Рис. 6-34. Электрокардиография.
А - потенциалы действия, характерные для основных частей сердца, и их соответствие во времени фазам электрокардиограммы (ЭКГ): 1 - синусный узел, 2 - правое предсердие, 3 - атриовентрикулярный узел, 4 - пучок Гиса, 5 - ножки пучка Гиса, 6 - конечные волокна Пуркинье, 7 - сократительный миокард левого желудочка. Б - образец электрокардиограммы человека во II стандартном отведении. В - амплитудно-временные характеристики зубцов, сегментов и интервалов нормальной электрокардиограммы
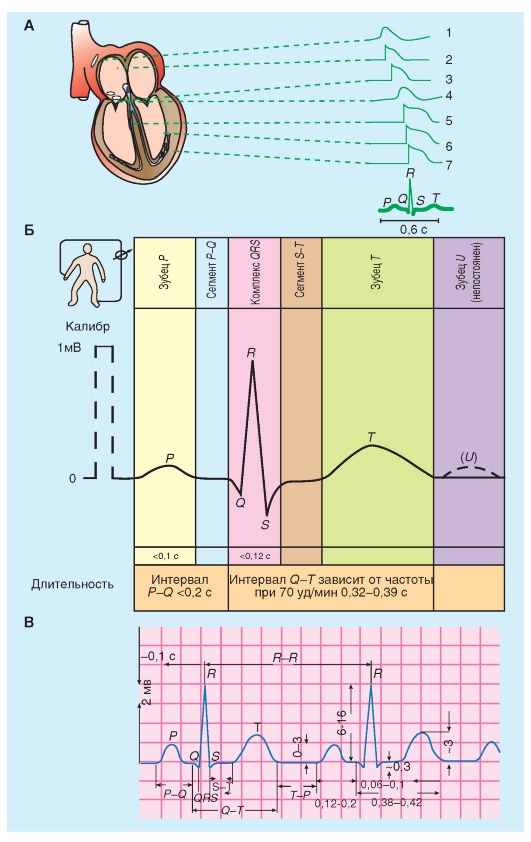
Стандартные и грудные отведения ЭКГ
Отведение в электрокардиографии - это электрическое соединение кожной поверхности пациента с регистрирующим устройством (электрокардиографом). Контакты от пациента связаны с гальванометром (устройством, измеряющим силу электрического тока), который находится в электрокардиографе. Точки отведений, используемые для записи обычных ЭКГ, располагаются в определенных плоскостях тела.
Следует подчеркнуть, что ЭКГ отражает именно процесс возбуждения в сердце, а не сокращения его структур. Эти два процесса в известной мере разделены во времени, так как второй является следствием первого. При определенных экспериментальных условиях (например, при перфузии сердца бескальциевым раствором) сократительный акт можно устранить, однако при этом продолжает регистрироваться нормальная ЭКГ, отражающая процесс распространения возбуждения.
Амплитуда и направленность зубцов ЭКГ зависят от ряда факторов, таких как расстояние электродов от сердца, степени электропроводности ткани между электродами и сердцем, а также величиной вектора ЭДС и соотношение с осью отведений. (Ось отведения - воображаемая линия между электродами, расположенными на кожной поверхности конечностей и соединенными с прибором для регистрации). Поэтому, для того чтобы можно было сравнивать ЭКГ между собой, необходимо стандартизировать методы их регистрации. С этой целью отводящие электроды накладываются на строго определенные участки тела - в зависимости от этого говорят о том или ином способе отведения.
Основными способами являются отведения от конечностей, или стандартные отведения, усиленные отведения и однополюсные отведения от грудной клетки. Стандартные отведения приняты как обязательный метод, так как они регистрируют колебания потенциалов во фронтальной плоскости от больших поверхностей сердца.
Определенные международные соглашения диктуют способ, которым эти стандартные отведения от конечностей связаны с гальванометром электрокардиографа (рис. 6-35 А). Отведение I регистрирует разность потенциалов между левой (LA) и правой (RA) руками. Соединения гальванометра устроены таким образом, что когда потенциал в LA (VLA) превышает потенциал в RA (VRA), пищик гальванометра отклоняется вверх от изоэлектрической линии. На рис. 6-35 А и Б, это расположение соединений гальванометра для отведения I обозначено (+) в LA и (-) в RA. Отведение II регистрирует разность потенциалов между RA и LL (левая нога), и пищик отклоняется вверх, когда VLL превышает VRA. Наконец, отведение III регистрирует разность потенциалов между LA и LL, и пищик отклоняется вверх, когда VLL превышает VRA. Эти соединения гальванометра были произвольно выбраны так, чтобы QRS-комплексы были направлены вверх во всех трех стандартных отведениях от конечностей у большинства нормальных индивидуумов.
В дополнение к стандартным отведениям от конечностей: I, II, и III. проводят регистрацию также и от грудных отведений, чтобы определить проекции вектора сердца на сагиттальных и поперечных плоскостях тела. Эти грудные отведения регистрируют от шести выбранных точек на передней и латеральной поверхностях груди около сердца.
Рис. 6-35. Расположение электродов на поверхности тела для записи стандартных (I, II и III) электрокардиографических отведений по Эйнтховену (А) и грудных отведений (V1-V6) по Вильсону (Б)
Основные виды
электрокардиографических
отведений
Регистрация временных изменений разности потенциалов между двумя точками на поверхности кожи называется скалярной ЭКГ. Скалярная ЭКГ обнаруживает временные изменения электрического потенциала между некоторыми точками на поверхности кожи и индифферентным электродом или между парами точек на поверхности кожи. Сердечный импульс распространяется в виде сложной трехмерной волны возбуждения. Следовательно, точная конфигурация ЭКГ изменяется от индивидуума к индивидууму, и у любого отдельно взятого индивидуума, картина меняется в зависимости от анатомического местоположения отведения. Графическое изображение электрической активности, зарегистрированной методом ЭКГ, называется кривой ЭКГ.
Разность потенциалов правой и левой руки обозначается как I отведение, разность потенциалов правой руки и левой ноги - как II отведение, разность потенциалов левой руки и левой ноги - как III отведение ЭКГ (рис. 6-36).
При грудных отведениях (рис. 6-36) один из электродов накладывают на определенную точку грудной клетки, а второй электрод представляет объединенный электрод от конечностей, поскольку электроды от правой, левой рук и от левой нижней конечности соединяют в приборе через сопротивление. В результате этого регистрируется разность потенциалов между активным электродом, расположенным на грудной клетке, и объединенным «нулевым» электродом от конечностей. Электрод, расположенный на грудной клетке, является активным (так называемым дифферентным электродом). В связи с тем что активный электрод располагается в непосредственной близости от сердца, колебания потенциала под ним значительно превышают колебания потенциала под вторым, удаленным сердца электродом (так называемым индифферентным электродом). Колебания потенциала, возникающие под индифферентным электродом, условно считают близкими к нулю. При этом форма ЭКГ в основном определяется локализацией активного электрода, расположенного на грудной клетке. Даже незначительные смещения этого электрода
существенно изменяют форму ЭКГ в связи с тем, что при этом происходит дифференцированная регистрация колебаний потенциалов от локальных участков миокарда, расположенных непосредственно под данным электродом.
Используют шесть позиций грудных электродов: V1 - четвертое межреберье справа от грудины, V2 - четвертое межреберье слева от грудины, V3 - на равном расстоянии от левого края грудины и среднеключичной линии, на линии, соединяющей положение 2-й и 4-й позиций, V4 - пятое межреберье по средней ключичной линии, V5 - пятое межреберье по левой передней подмышечной линии, V6 - пятое межреберье. V1 и V2 отражают активность правого желудочка, V5 и V6 - активность левого желудочка, причем самых близких к электроду участков сердца. В клинике и в физиологических экспериментах помимо указанных выше отведений используется целый ряд других способов регистрации ЭКГ: униполярные отведения от конечностей и грудной клетки, пищеводные отведения (активный электрод локализуется в пищеводе в области расположения тех или иных отделов сердца), внутриполостные отведения (в качестве активного электрода служит электрод-катетер, который вводится через яремную вену в полость сердца) и др.
Амплитуда и длительность зубцов, а также величина интервалов ЭКГ закономерно меняются при различных физических и физиологических воздействиях на сердце - при физической нагрузке, изменении положения тела и др. Эти изменения могут быть обусловлены, с одной стороны, чисто физическими явлениями, например изменением положения сердца в грудной клетке при дыхании, при перемене позы, изменением электропроводности тканей между сердцем и отводящими электродами при дыхании. С другой стороны, они могут быть обусловлены и физиологическими причинами: изменением венозного притока, рефлекторными влияниями на работу сердца и на скорость проведения в нем.
Таким образом, при нормальном функционировании сердца форма ЭКГ может варьировать в определенных пределах. В связи с этим непременным условием правильного толкования ЭКГ при различных видах сердечной патологии является умение распознавать нормальную электрокардиографическую кривую во всех ее разновидностях.
Рис. 6-36. Основные виды электрокардиографических отведений.
А - стандартные двухполюсные отведения от конечностей: I, II, III - первое, второе и третье стандартные отведения; Б, В, Г - однополюсные отведения от конечностей avL, avR, avF. Д - однополюсные грудные V1-V6. Е - точки наложения электродов на грудную клетку при грудных отведениях
Принцип формирования электрокардиограммы
Хотя первые попытки создания теории, объясняющей механизм формирования ЭКГ, были предприняты практически одновременно со становлением самого метода, законченной теории формирования ЭКГ нет до настоящего времени. Трудности, возникающие при создании теории генеза ЭКГ, связаны с тем, что такая теория должна объяснить связь ЭКГ с элементарными формами биоэлектрической активности всех структур сердца. При этом следует учитывать, что сердце представляет собой электрический генератор сложного строения, состоящий из огромного числа клеток - элементарных генераторов. Последовательность моментов включения этих генераторов, их число и пространственное расположение, а следовательно и структура суммарного генератора сердца непрерывно меняются. На ЭКГ эти сложные изменения предстают в обобщенном и упрощенном виде. При проекции ЭДС сердца на поверхность тела, где обычно в клинике располагают отводящие электроды, возникают дополнительные искажения, которые во многом зависят от электрической неоднородности окружающей сердце среды.
Дополнительные трудности возникают также в связи с тем, что отводящие электроды регистрируют активность участков, расположенных как непосредственно под электродом, так и вдали от него. Количественные соотношения ЭДС прилежащих и удаленных участков неизвестны для любого положения отводящего электрода. Все названные выше факторы не поддаются количественной оценке и затрудняют создание полного представления о механизме генерации ЭКГ. Тем не менее основные моменты формирования ЭКГ могут быть объяснены в рамках существующих в настоящее время теорий, гипотез, моделей.
Одной из основных теорий, на основе которой в настоящее время ведется векторный анализ ЭКГ
и строят математические модели генераторов сердца, является дипольная теория. Дипольная теория и ее различные модификации исходят из представлений о том, что граница между возбужденными и невозбужденными участками миокарда представляет собой линию, вдоль которой как бы выстроен двойной слой электрических зарядов - диполей. На протяжении сердечного цикла двойной слой непрерывно перемещается, изменяет свою конфигурацию и в некоторые моменты может состоять из нескольких фрагментов (рис. 6-37 А). Совокупность этих диполей можно представить в виде одного суммарного диполя, отражающего ЭДС сердца. Величина и ориентация в пространстве суммарного диполя в каждый момент сердечного цикла непрерывно меняются, т.е. ЭДС сердца является векторной величиной. В проводящей среде, окружающей суммарный диполь, будет возникать переменное электрическое поле (рис. 6-37 Б, В). Потенциал любой точки этого поля в каждый конкретный момент времени определяется законами электрического поля.
При этом потенциал точек, расположенных ближе к положительному полюсу, положителен, а точек, расположенных ближе к отрицательному полюсу, отрицателен. Если точка одинаково удалена от обоих полюсов, то ее потенциал равен нулю.
На рис. 6-37 Г показана разность потенциалов электрического поля. На поверхности груди она формируется вследствие распространения деполяризации по миокарду желудочков.
Основные представления дипольной теории используются в настоящее время для интерпретации клинического материала и для построения различных биофизических моделей генераторов ЭДС сердца. Эти модели имеют своей целью уточнить представления о генезе ЭКГ, но ввиду их сложности имеют пока лишь специальный теоретический интерес и в практической электрокардиографии используются мало.
Рис. 6-37. Принцип формирования электрокардиограммы.
А - последовательные изменения направления и величины ЭДС сердца во время деполяризации желудочков. В центре - последовательные изменения суммарного вектора (1-11. Направление суммарного вектора показано стрелкой, линия, соединяющая концы моментных векторов, - векторная петля; а, б, в, г, д - последовательные моменты изменения суммарного вектора в ходе возбуждения желудочков). Б - схематическое изображение изопотенциальных линий электрического поля суммарного диполя на поверхности тела человека. Стрелкой показано направление вектора ЭДС. В - направления электрических токов во время начала деполяризации миокарда желудочков. Прямой стрелкой отмечено направление главного суммарного вектора электрического поля. Г - разность потенциалов электрического поля на поверхности груди формируется вследствие распространения деполяризации по миокарду желудочков
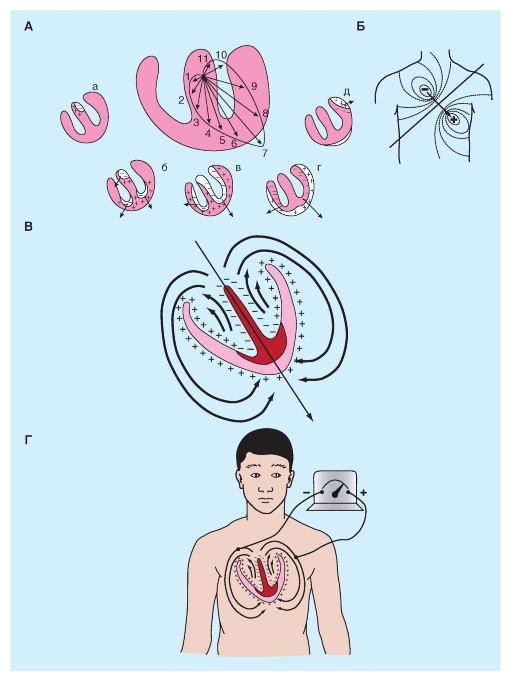
Результирующий вектор сердца
Суммарный вектор всей электрической деятельности сердца в любой момент времени называется результирующим вектором сердца. Предполагается, что эта направленная электрическая сила находится в центре равностороннего треугольника, вершины которого расположены на левом и правом плечах и на лобковой области (рис. 6-38 А). Этот треугольник, называемый треугольником Эйнтховена, расположен во фронтальной плоскости тела. Следовательно, эта система отведения позволяет выделить проекцию результирующего вектора сердца только на фронтальную плоскость тела. Для удобства электроды прикреплены к правому и левому предплечью, а не к соответствующим плечам, так как отведение от рук представляет собой просто удлиненное отведение от плеч. Точно так же отведение от ноги представляет собой удлинение системы отведения от лобка, и таким образом третий электрод обычно соединяется с лодыжкой (обычно левой).
Определенные международные соглашения диктуют способ, которым эти стандартные отведения от конечностей связаны с гальванометром электрокардиографа. Отведение I регистрирует разность потенциалов между левой (LA) и правой (RA) рукой. На рис. 6-38 Б это расположение соединений гальванометра для отведения I обозначено (+) в LA и (-) в RA. Отведение II регистрирует разность потенциалов между RA и LL (левая нога). Наконец, отведение III регистрирует разность потенциалов между LA и LL.
Допустим, что фронтальная проекция результирующего вектора сердца в некоторый момент времени представлена стрелкой (хвост - негативен, острие стрелки - позитивно), как это изображено на рис. 6-38 А. Разность потенциалов, VLA-VRA, зарегистрированная в отведении I, представлена компонентой проекции вектора на горизонтальной линии между LA и RA, также показанной на рис. 6-38 А. Если вектор составляет угол θ в 60° с горизонтальной линией (как на рис. 6-38 Б1), величина потенциала, зарегистрированного в отведении I, равняется векторной величине умноженной на косинус 60°. Отклонение, зарегистрированное в отведении I, направлено вверх, потому что позитивный конец стрелки лежит ближе к LA, чем к RA. Отклонение в отведении II также направлено вверх, потому что конец стрелки лежит ближе к LL, чем к RA. Величина отклонения в отведении II больше чем в отведении
I, потому что величина проекции в отведении II превышает таковую в I отведении. Точно так же в отведении III: отклонение направлено вверх и его величина такая же, как в отведении I.
Если вектор на рис. 6-38 Б1 является результатом электрических событий, которые происходят в течение пика QRS-комплекса, то говорят, что ориентация этого вектора, представляет главную электрическую ось сердца во фронтальной плоскости. В качестве положительного направления этой оси принято вращение по часовой стрелке от горизонтальной плоскости (вопреки соглашению принятому в математике). У нормальных индивидуумов, среднее значение электрической оси составляет приблизительно + 60° (как на рис. 6-38 Б1).
Отклонения главной электрической оси могут происходить, если анатомическое положение сердца изменено, или при некоторых сердечно-сосудистых нарушениях, которые меняют относительную массу правого и левого желудочка. Например, ось имеет тенденцию смещения влево (более горизонтально) у коренастых людей небольшого роста и вправо (более вертикально) у высоких, худых людей. Также, при левой или правой желудочковой гипертрофии (увеличение массы миокарда любого желудочка), ось смещается в сторону гипертрофированного желудочка.
Если главная электрическая ось существенно смещается вправо (как на рис. 6-38 Б2, где α = 120°), проекции QRS-комплексов в стандартных отведениях значительно изменяются. В этом случае самое большое отклонение вверх происходит в отведении III, а отклонение в отведении I инвертировано, потому что конец стрелки ближе к RA, чем к LA. Когда ось смещена влево (рис. 6-38 Б3, где α = 0°) самое большое отклонение вверх происходит в отведении I, а QRS-комплекс в отведении III инвертирован.
В дополнение к стандартным отведениям от конечностей: I, II, и III, у пациентов часто производят регистрацию от других отведений, тоже от конечностей, которые также ориентированы во фронтальной плоскости. Оси таких униполярных отведений от конечности образуют углы в +90°, -30°, и -150° с горизонтальной осью. Кроме того, проводят регистрацию также и от грудных отведений, чтобы определить проекции вектора сердца на сагиттальных и поперечных плоскостях тела. Эти грудные отведения регистрируют от шести выбранных точек на передней и латеральной поверхностях груди около сердца.
Рис. 6-38. Результирующий вектор сердца.
А - треугольник Эйнтховена, иллюстрирующий соединения электрокардиографа при стандартных отведениях I, II, и III от конечностей. Б - величины и направление QRS-комплексов при стандартных отведениях I, II, и III от конечностей, когда главная электрическая ось (θ) составляет 60° (Б1), 120° (Б2) и 0° (Б3)
Шестиосевая система координат
При электрокардиографическом обследовании обычно используют двенадцать отведений: шесть отведений от конечностей - это три стандартных отведения, три усиленных отведения и шесть грудных отведений. Первые шесть отведений от конечностей позволяют зарегистрировать ЭДС сердца во фронтальной плоскости. В отличие от стандартных и усиленных отведений грудные отведения регистрируют ЭДС сердца преимущественно в горизонтальной плоскости.
Для более наглядного представления об отклонении ЭДС сердца во фронтальной плоскости Bayley в 1943 году предложил шестиосевую систему координат. Она создается при совмещении осей трех стандартных отведений Эйнтховена и трех усиленных отведений от конечностей Гольдбергера, которые проведены через электрический центр сердца. Две ветви одной и той же оси, исходящие из центра, составляют положительную (обращенную к активному или положительному электроду) и отрицательную (обращенную к индифферентному или отрицательному электроду) части (рис. 6-39 А).
Амплитуда электрокардиографических зубцов в разных отведениях есть не что иное, как
проекция одной и той же ЭДС сердца на ось данного отведения. В связи с этим при сопоставлении полярности и величины зубцов в различных отведениях, входящих в состав шестиосевой системы координат, можно с достаточно высокой точностью определить величину и направление главного вектора ЭДС сердца во фронтальной плоскости.
Направление осей обычно определяют в градусах. Началом отсчета (0°) условно служит прямая, проведенная строго горизонтально из электрического центра влево по направлению к активному положительному полюсу первого стандартного отведения. Положительный полюс второго стандартного отведения расположен под углом +60°, отведения aVF - под углом +90°, третьего стандартного отведения - под углом +120°, aVL - под углом -30°, aVR - под углом -150° (рис. 6-39 А).
Возбуждение желудочков начинается с возбуждения межжелудочковой перегородки (рис. 6-39 Б1). После этого деполяризация распространяется вдоль эндокардиальной поверхности стенки обоих желудочков (рис. 6-39 Б2,3) и наконец возбуждение охватывает наружную поверхность желудочков (рис. 6-39 Б3-5). Для каждой стадии этого процесса на рис. 6-39 Б1-5 моментный результирующий вектор показан черной стрелкой на схематическом изображении желудочков.
Рис. 6-39. Шестиосевая система координат.
А - направление осей трех стандартных отведений Эйнтховена (I, II, III) и трех усиленных Гольдбергера (aVR, aVL и aVF). Б - формирование комплекса QRS в трех стандартных отведениях Эйнтховена. Серым цветом обозначен деполяризованный миокард, стрелки показывают направления суммарного вектора и его проекций в данный момент времени
Нарушения ритма Аритмии
Аритмии сердца отражают нарушения в возникновении импульса или в его распространении.
Нарушения возникновения импульса включают те, которые исходят из SA-узла и те, которые происходят от различных эктопических фокусов. Основными нарушениями распространения импульса являются блокады проведения и ритмы, в основе которых лежит возникновение реентри.
Нарушение синоатриального ритма
Примеры ЭКГ с нормальным ритмом, с синусовой тахикардией и синусовой брадикардией показаны на рис. 6-40. P-, QRS- и T-отклонения - нормальные, но продолжительность сердечного цикла (интервал RR) изменена. Характерно, что в ответ на синусную брадикардию или развитие тахикардии, изменения частоты сокращений сердца наступают постепенно и требуется несколько циклов сокращений, чтобы достигнуть величины нового устойчивого состояния. Признак дыхательной аритмии сердца на ЭКГ общеизвестен и проявляется как ритмическое изменение RR-интервала, совпадающее с частотой дыхания.
Рис. 6-40. Синоатриальные ритмы.
A - нормальный синусный ритм. Б - синусовая тахикардия. В - синусовая брадикардия
Нарушение атриовентрикулярной проводимости
Атриовентрикулярные блокады проведения
Различные физиологические, фармакологические воздействия и патологические процессы могут препятствовать распространению импульса через проводящую ткань AV-узла. Место блокады может быть локализовано более точно при регистрации электрограммы пучка Гиса. Чтобы получить такие записи, электродный зонд вводится в периферическую вену и перемещается к центру до тех пор, пока электрод не ляжет в области AV-узла (рис. 6-41 А). Когда электрод должным образом установлен, регистрируется хорошо различимое отклонение при прохождении сердечного импульса через пучок Гиса. Промежуток времени, требуемый для распространения возбуждения от предсердия до пучка Гиса (A-H интервал) и от пучка Гиса к желудочкам (H-V интервал), может быть точно измерен. Патологическое удлинение первого или последнего упомянутого интервалов указывает на блокаду выше или ниже пучка Гиса соответственно.
По электрокардиограмме различают три степени AV-блокады, как это показано на рис. 6-41 Б, В и Г. AV-блокада первой степени характеризуется длительным интервалом P-Q(R). На рис. 6-41 Б интервал P-Q(R) составляет 0.28 сунды; а интервал больше чем 0,20 с является отклонением от нормы. В большинстве случаев блокады первой степени, интервал A-H удлинен а интервал H-V нормальный. Следовательно, задержка при
AV-блокаде первой степени расположена выше пучка Гиса (т.е. в AV-узле).
В AV-блокаде второй степени, всем QRS-комп- лексам предшествуют P-волны, но не все P-волны сопровождаются QRS-комплексами. Отношение P-волн к QRS-комплексам обычно выражается отношением двух малых целых чисел (например: 2:l, 3:l или 3:2). Рис. 6-41 В иллюстрирует типичную блокаду 2:l. Место блокады может быть расположено выше или ниже пучка Гиса. В тех случаях, когда место блокады ниже пучка Гиса это последствия бывают более серьезные, чем в тех случаях, когда место блокады расположено выше пучка Гиса, потому что в первом случае развивается блокада третьей степени. Когда место блока расположено ниже пучка Гиса, то часто имплантируют электрокардиостимулятор.
AV-блокада третьей степени часто именуется как полная блокада сердца, потому что импульс полностью не способен преодолеть AV-путь проведения от предсердий к желудочкам. Чаще всего область полной блокады располагается дистальнее пучка Гиса. При полной блокаде сердца, предсердные и желудочковые ритмы полностью независимы, как показано на рис. 6-41 Г. Из-за медленного желудочкового ритма (в данном случае 32 уд/мин), кровоснабжение оказывается недостаточным, особенно при мышечной нагрузке. Блокада третьей степени часто сопровождается обмороком (резко выраженным головокружением), причиной которого в большинстве случаев является недостаточный мозговой кровоток. Блокада третьей степени - одно из наиболее часто встречаемых состояний, которые требуют применения искусственных водителей ритма.
Рис. 6-41. Атриовентрикулярные (AV) блокады.
А - схематическое представление положения катетеров-электродов при внутрисердечных регистрациях электрограмм. ВОПП и НОПП - верхний и нижний отдел правого предсердия, Гис - пучок Гиса, ВПЖ - верхушка правого желудочка, КС - коронарный синус. Б - блокада первой степени. P-R интервал составляет 0,28 с. B - блокада второй степени (2:1). Г - блокада третьей степени, обратите внимание на расхождение между P-волнами и QRS-комплексами
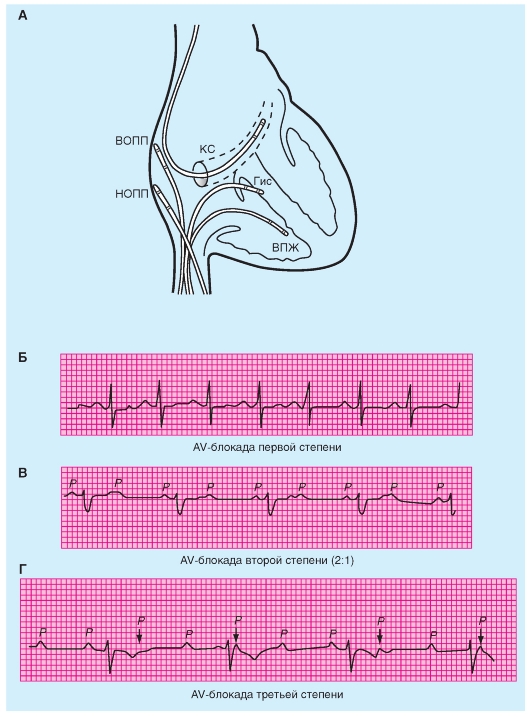
Внеочередные сокращения сердца Экстрасистолы
Внеочередные деполяризации (экстрасистолы) возникают иногда у здоровых людей, но чаще всего они бывают при определенных патологических состояниях. Их источниками могут быть предсердия, AV-узел или желудочки.
Внеочередная предсердная деполяризация показана на рис. 6-42 A1. На этой записи нормальный интервал между сокращениями составляет 0,89 с (частота сердечных сокращений - 68 уд/мин). Внеочередная предсердная деполяризация (вторая P-волна на рисунке) следует за предшествующей P-волной всего через 0,56 с. Конфигурация внеочередной P-волны отличается от конфигурации другой, нормальной P-волны, потому что ход предсердного возбуждения, которое возникает в некотором эктопическом фокусе предсердия, отличается от нормального распространения возбуждения, которое возникает в SA-узле. Конфигурация комплекса QRS при внеочередной предсердной деполяризации обычно бывает нормальной, потому что возбуждение в желудочке распространяется по обычным проводящим путям.
Внеочередная желудочковая деполяризация представлена на рис. 6-42 А2. Распространение импульса происходит аномально, и конфигурации QRS и T-волны полностью отличаются от таковых на нормальной электрокардиограмме, потому что внеочередное возбуждение возникает в некотором эктопическом фокусе в желудочках. Внеочередной QRS-комплекс следует за предшествующим нормальным QRS-комплексом всего через 0,47 с. Интервал после экстрасистолы составляет 1,28 с, что значительно длиннее нормального интервала между ударами (0,89 с). Интервал (1,75 с) от QRS-комплекса сразу перед экстрасистолой до QRS-комплекса сразу после него фактически равен длительности двух нормальных сердечных циклов (0,89 + 0,89 = 1,78 с).
Длительный интервал, который обычно следует за внеочередной желудочковой деполяризацией, называется компенсаторной паузой. Эта пауза происходит, потому что эктопический желудочковый импульс не нарушает естественного ритма SA-узла, так как эктопический желудочковый импульс не проводится ретроградно через AV-узел. Импульс SA-узла, возникший сразу до или после желудоч-
ковой экстрасистолы, обычно не оказывает влияние на желудочек, потому что AV-узел и, возможно, также желудочки являются все еще рефрактерными из-за внеочередного возбуждения. На рис. 6-42 А2 P-волна, связанная с экстрасистолой, совпадает с T-волной внеочередной желудочковой деполяризации, и, следовательно, ее не так-то легко идентифицировать на записи.
Эктопические тахикардии
В отличие от постепенных изменений в частоте, которые служат отличительным признаком синусовой тахикардии, тахикардии, которые происходят из эктопического центра, обычно начинаются и кончаются резко. Поэтому такие эктопические тахикардии обычно называют пароксизмальными тахикардиями. Приступы пароксизмальной тахикардии могут продолжаться всего лишь в течение нескольких сокращений или в течение многих часов и дней, причем приступы часто повторяются. Пароксизмальные тахикардии могут быть следствием: (1) высокочастотных разрядов из эктопического водителя ритма, (2) вторичной пусковой активности, обусловленной потенциалами последействия достигших порога, или (3) циркуляции возбуждающего импульса по петле реентри.
Пароксизмальные тахикардии, которые возникают в предсердиях или в тканях AV-узла (рис. 6-42 Б1) обычно неразличимы и поэтому обе обозначаются термином пароксизмальная суправентрикулярная тахикардия. При этой форме тахикардии, импульс часто ходит по кругу (реентри), который включает в себя предсердную и AV-узловую ткань. QRS-комплексы часто бывают нормальными, потому что возбуждение желудочков происходит по традиционному проводящему пути.
Как следует из самого названия, желудочковая пароксизмальная тахикардия возникает в эктопическом фокусе желудочков. В этих случаях ЭКГ характеризуется частыми, измененными QRS-ком- плексами, которые отражают аномальное внутрижелудочковое проведение импульса (рис. 6-42 Б2). Желудочковая пароксизмальная тахикардия гораздо более грозное нарушение ритма, чем суправентрикулярная тахикардия, потому что первая часто является предшественником желудочковой фибрилляции, смертельной аритмии, описываемой в следующем разделе.
Рис. 6-42. Экстрасистолы и пароксизмальные тахикардии.
А - внеочередные деполяризации. Внеочередная предсердная деполяризация (A1) и внеочередная желудочковая деполяризация (А2). Ранняя предсердная деполяризация (второе сокращение на верхней записи) характеризуется инвертированной P-волной и нормальными QRS- и T-волнами. Интервал после внеочередной деполяризации ненамного длиннее обычного интервала между ударами сердца. Короткое прямоугольное отклонение перед последней деполяризацией - калибровочный сигнал. Внеочередная желудочковая деполяризация характеризуется измененными комплексом QRS- и T-волнами и сопровождается компенсаторной паузой. Б - пароксизмальные тахикардии. Суправентрикулярная тахикардия ( Б1) и вентрикулярная тахикардия (Б2)
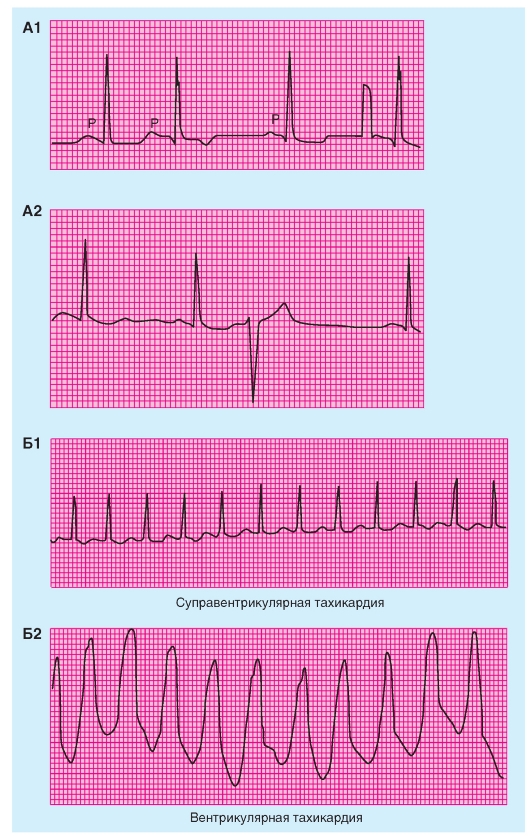
Фибрилляция предсердий и желудочков
Фибрилляция
При некоторых условиях сердечная мышца начинает сокращаться некоординировано и полностью не эффективно для выброса крови. Такая аритмия называется фибрилляцией, и это нарушение может затрагивать или предсердия или желудочки. Фибрилляция, вероятно, представляет собой явление циркуляции возбуждения, при котором реентри фрагментируется во множественные, беспорядочные цепи.
Изменения в ЭКГ при предсердной фибрилляции показаны на рис. 6-43 А. Эта аритмия происходит при различных типах хронических заболеваний сердца. Предсердия не сокращаются и не расслабляются последовательно в течение каждого сердечного цикла, и, таким образом, они не способствуют наполнению желудочков. Вместо этого предсердия совершают непрерывные, некоординированные пульсирующие сокращения. P волны не появляются на ЭКГ; они заменены непрерывными неправильными колебаниями потенциала, которые называются f-волнами. AV-узел активируется с интервалами времени, которые могут значительно изменяться от цикла к циклу. Следовательно, отсутствует постоянный интервал между последовательными QRS-комплексами или между последовательными желудочковыми сокращениями. Так как сила желудочкового сокращения зависит от интервала времени между сокращениями, то объем и периодичность ритма становятся нерегулярными. У многих больных предсердный цикл реентри и проведение импульса через AV-узел являются более регулярными, чем при предсердной фибрилляции. Поэтому этот ритм получил название «трепетание предсердий».
Предсердная фибрилляция и трепетание не опасны для жизни некоторые люди с этими расстройствами могут даже полноценно трудиться. Желудочковая фибрилляция, наоборот, ведет к потере сознания в течение нескольких сунд. Постоянные, беспорядочные, несогласованные сокращения желудочковых мышечных волокон не способны перекачивать кровь. Если не произведена немедленная, действенная реанимация и если не произошло спонтанного восстановления ритма, что происходит редко, то наступает смерть.
Желудочковая фибрилляция может развиться, когда весь желудочек, или некоторая часть его, лишена нормального кровоснабжения. Она может также возникнуть в результате электрического удара или в ответ на действие некоторых лекарств и анестезирующих средств. На ЭКГ (рис. 6-43 Б) при этом регистрируются нерегулярные колебания потенциала.
Желудочковая фибрилляция часто инициируется, когда внеочередной импульс приходит во время так называемого уязвимого периода сердечного цикла, который совпадает с нисходящей волной зубца T на ЭКГ. В течение этого периода возбудимость клеток сердца разная в разных его участках. Некоторые волокна все еще находятся в эффективном рефрактерном периоде, другие почти полностью восстановили свою возбудимость и они по-прежнему способны проводить импульсы, но только с очень медленными скоростями проведения. Следовательно, потенциалы действия распространяются в виде множества нерегулярных волн возбуждения, которые перемещаются по обходным путям с различными скоростями проведения. Когда кардиомиоциты определенной области становится снова возбудимыми, то в конечном счете какая-нибудь перемещающаяся волна возбуждения начинает циркулировать по кругу. Следовательно, процесс является самоподдерживающимся.
Предсердная фибрилляция может быть изменена на нормальный синусный ритм препаратами, которые продлевают рефрактерный период. Тогда, по мере того как импульс сердца завершает цикл реентри, он поступает к волокнам миокарда, которые еще не возбудимы. При желудочковой фибрилляции необходимо иное воздействие. Преобразование патологического ритма в нормальный синусовый ритм осуществляется посредством применения сильного электрического тока, который на короткое время приводит все клетки миокарда в рефрактерное состояние. Были разработаны приемы безопасного воздействия током через интактную грудную клетку. В успешных случаях, SA-узел снова берет на себя функцию нормального нейсмейкера для всего сердца. Когда действие препаратов не приводит к удовлетворительным результатам при предсердной дефибрилляции, то для коррекции этого состояния также может быть использована электрическая дефибрилляция.
Рис. 6-43. Фибрилляция. Предсердная фибрилляция (А) и желудочковая фибрилляция (Б)
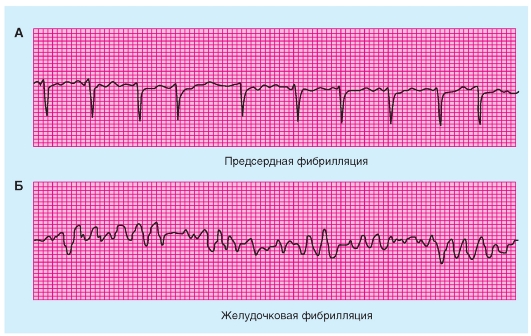
Клапанный аппарат сердца
Сердечные клапаны. Клапаны сердца состоят из тонких листков гибкой, упругой, покрытой эндотелием фиброзной ткани (створки клапанов), которые прочно прикреплены к основанию фиброзных колец клапанов. Движения створок клапанов в значительной степени пассивны, и расположение сердечных клапанов отвечает за одностороннее направление кровотока через сердце. Различают два вида сердечных клапанов: атриовентрикулярные (предсердно-желудочковые) и полулунные клапаны (рис. 6-44).
Атриовентрикулярные клапаны. AV-клапан, расположенный между правым предсердием и правым желудочком, сформирован тремя створками (трехстворчатый клапан), тогда как клапан, расположенный между левым предсердием и левым желудочком, имеет две створки (митральный клапан). Общая площадь створок каждого AV-кла- пана примерно вдвое больше соответствующего AV-отверстия, так что в закрытом положении имеет место значительное взаимное перекрывание створок клапана (рис. 6-44). К свободным кромкам этих клапанов прикреплены тонкие, сильные связки (сухожильные нити), которые отходят от мощных папиллярных мышц соответствующих желудочков и не позволяют клапанам выворачиваться наружу во время сокращения желудочков.
В нормальном сердце во время наполнения желудочков створки клапана располагаются относительно близко друг к другу и, таким образом, служат воронкой для перехода крови из
предсердия в желудочек. Частичное сближение поверхностей клапана во время диастолы вызывается вихревыми потоками позади створок, а также некоторым напряжением свободных кромок клапанов. Это напряжение вызывают сухожильные нити и папиллярные мышцы, растянутые наполняющимся желудочком.
Полулунные клапаны. Полулунные клапаны расположены между правым желудочком и легочной артерией и между левым желудочком и аортой. Они представлены тремя чашеобразными створками, прикрепленными к клапанному кольцу (рис. 6-44). В конце фазы медленного изгнания систолы желудочков кровоток быстро меняет направление в сторону желудочков. Этот обратный ток крови сближает створки вместе, закрывая отверстие и препятствуя забрасыванию крови в желудочки. Во время систолы желудочков створки не примыкают плотно к стенкам легочной артерии и аорты, а плавают в кровотоке, находясь примерно посередине между стенками сосуда и положением, когда клапан находится в закрытом состоянии. Позади полулунных клапанов находятся маленькие закрытые участки легочной артерии и аорты (пазухи Вальсальвы), где создаются вихревые потоки, удерживающие створки клапана на расстоянии от стенок сосуда. К тому же отверстия правой и левой коронарных артерий расположены позади соответственно правой и левой створок аортального клапана. Если бы не пазухи Вальсальвы и не вихревые потоки, образующиеся в них, коронарные отверстия могли бы быть блокированы створками клапана.
Рис. 6-44. Схема перпендикулярного разреза сердца вдоль межжелудочковой перегородки, иллюстрирующая анатомическую взаимосвязь створок атриовентрикулярных и аортальных клапанов (А). Четыре сердечных клапана. Вид от основания сердца (Б). Обратите внимание, как створки закрытых клапанов перекрывают друг друга
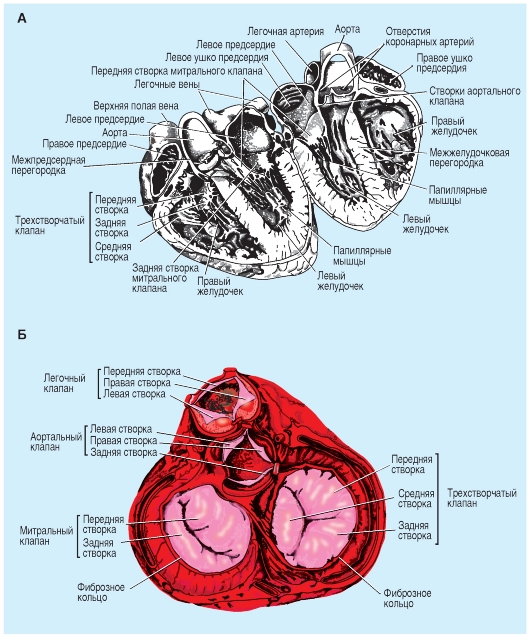
Ультразвуковое исследование клапанного аппарата сердца
Движения створок митрального клапана в течение сердечного цикла показаны на эхокардиограмме (рис. 6-45). Принцип эхокардиограммы заключается в том, что на человека воздействуют короткими высокочастотными сигналами звукового диапазона (ультразвук), которые проходят сквозь ткани грудной клетки и сердца и при этом регистрируют отраженный от различных органов сигнал, т.е. эхо. Применительно к сердцу, как органу, этот метод называется эхокардиограммой. Время отражения и вид отраженных волн дают информацию о диаметре сердца, толщине стенок желудочка, величине и направлении движения различных структур сердца.
На рис. 6-45 эхокардиограмма расположена так, чтобы показать движение передней створ-
ки митрального клапана. Движения задней створки представляют собой зеркальное отражение движений передней створки, но в проекции, представленной на рис. 6-45, ее движения кажутся гораздо меньшими. В точке D митральный клапан открывается, и во время быстрого наполнения (от точки D до точки Е) передняя створка движется по направлению к межжелудочковой перегородке. В течение фазы медленного наполнения (от Е до F) створки клапанов движутся навстречу друг другу, но клапан не закрывается. Наполнение желудочка вследствие сокращения предсердия (от F до А) раздвигает створки; затем наступает второе сближение створок клапана (от А до С). В точке С клапан закрыт сокращением желудочка. Створки клапана, выгнутые в направлении предсердия, остаются сжатыми вместе в течение систолы желудочка
(от С до D).
Рис. 6-45. Принцип эхокардиографии. Датчик испускает и улавливает ультразвуковые сигналы, т.е. работает по принципу эха. Стрелками отмечен момент захлопывания митрального клапана в начале систолы. ПЖ - правый желудочек, МЖС - межжелудочковая стенка, ЛЖ - левый желудочек, ПМК и ЗМК - передний и задний митральные клапаны соответственно
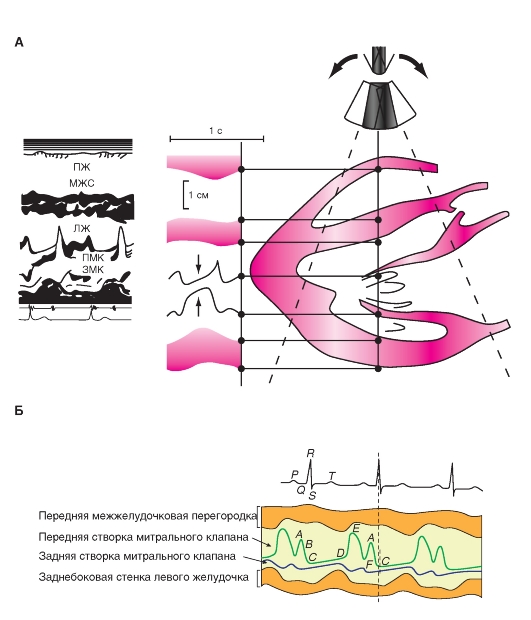
Закон сердца Старлинга
К внутриклеточным механизмам регуляции силы сокращений относится механизм Франка- Старлинга, называемый также закон сердца Старлинга. Закон Франка-Старлинга указывает на зависимость силы сердечных сокращений от степени растяжения мышечных волокон в диастолу. Зависимость «сила-длина» впервые обнаружил Франк. На рис. 6-46 показана схема эксперимента, из которой видно, что увеличение растяжения волокон изолированного сердца в диастолу приводит к усилению сердечных сокращений. Окончательную формулировку этого эффекта дал Э. Старлинг «чем больше конечно-диастолический объем желудочка, тем больше величина систолического выброса».
Механизм Франка-Старлинга является идеальным средством для поддержания соответствия сердечного выброса венозному возврату.
Физиологическая сущность этого эффекта заключается в обеспечении согласованности величины притока крови и сердечного выброса. Причем соответствие достигается не только при любом изменении притока крови к предсердиям, т.е. при изменении преднагрузки, но также и в результате изменения ритма сердца, например, при брадикардии. Впоследствии заметили, что увеличение объема желудочков связано с увеличением длины каждого мышечного волокна миокарда, образующего камеры желудочков. Был сделан вывод, что увеличение длины волокон влияет на работу сердца, главным образом, за счет изменения количества взаимодействующих перекрещивающихся соединений миофиламентов. Позднее показали, что основной механизм, с помощью которого осуществляется влияние на сердечную деятельность, заключается в изменении чувствительности сердечных миофиламентов к Ca2+ в связи с растяжением миокарда желудочков. Существует оптимальная длина мышечных волокон. Чрезмерно высокие значения наполняющего давления, когда мышечные волокна миокарда растягиваются слишком сильно, скорее понижают, чем увеличивают насосную мощность желудочков.
Старлинг также показал, что препараты изолированного сердца способны приспосабливаться к изменениям силы, противодействующей выбросу крови из желудочков во время систолы. При сокращении левого желудочка выброс крови в
аорту не производится, пока желудочек не разовьет давление, которое будет выше давления в аорте. Давление в аорте во время желудочкого выброса в основном и составляет постнагрузку левого желудочка. В экспериментах, проведенных Старлингом, артериальное давление контролировалось с помощью гидравлического устройства, находившегося в трубке, которая соединяла восходящую часть аорты с резервуаром крови, соединенным с правым предсердием. Постоянный объем венозного возврата в правое предсердие поддерживался на постоянном уровне путем поддержания гидростатического уровня крови в резервуаре. Когда Старлинг повышал артериальное давление до нового постоянного уровня, левый желудочек сначала реагировал на увеличившуюся постнагрузку, уменьшением систолического объема. Так как поддерживался постоянный объем венозного возврата, то уменьшение систолического объема сопровождалось увеличением диастолического объема желудочка и удлинением мышечных волокон миокарда. Это изменение конечно-диастолической длины волокон в результате давало возможность желудочку прокачивать нормальный систолический объем при большем периферическом сопротивлении. Хотя изменение количества циклических поперечных связей (cross-bridges) между толстыми и тонкими филаментами, возможно, способствует адаптации сердечной мышцы к изменившимся условиям, основным фактором здесь является изменение чувствительности сократительных белков к кальцию, вызванное растяжением миокарда.
Механизм Франка-Старлинга является идеальным средством для поддержания соответствия сердечного выброса венозному возврату. Любой внезапный, слишком большой выброс из одного желудочка вызывает увеличение венозного возврата к другому желудочку. Последующее увеличение длины мышечных волокон в диастолу увеличивает выброс из второго желудочка для соответствия выбросу, сделанному первым желудочком. Так механизм Франка-Старлинга позволяет поддерживать точное равновесие между выбросами из правого и левого желудочков. Так как два последовательно расположенных желудочка являются частью замкнутой цепи, то любое, пусть маленькое, но продолжительное нарушение равновесия между выбросами из обоих желудочков имело бы катастрофические последствия.
Рис. 6-46. Внутрисердечные механизмы регуляции работы сердца. Закон сердца Старлинга - первый принцип внутриклеточного механизма регуляции работы сердечной мышцы.
А - сердце на канюле Штраубе. Б - подсоединенное к механоэлектрическому преобразователю сердце на канюле Штраубе. В - увеличение амплитуды сократительной активности сердца в ответ на увеличение к нему притока раствора. Стрелками обозначено увеличение притока и возвращение его к норме
Ритмоинотропная регуляция
Ритмоинотропная зависимость - это зависимость силы сокращений от частоты сокращений, которая рассматривается как внутриклеточный механизм регуляции работы сердечной мышцы. Работа миокарда также регулируется путем изменения частоты, при которой миокардиальные волокна сокращаются. Влияние изменений частоты сокращений на силу, развиваемую при изометрическом сокращении папиллярной мышцы кошки, показано на рис. 6-47 А, Б. Сначала сокращение полоски сердечной мышцы вызывали стимуляцией 1 раз через каждые 20 с (рис. 6-47 А). Когда интервал между стимуляцией (а следовательно и сокращениями) внезапно сократили до 0,63 с, развиваемая сила прогрессивно возрастала на протяжении нескольких следующих сокращений. Когда установилось новое стабильное состояние, то новое значение силы более чем в 5 раз превышало ее предыдущее значение, достигнутое при более редких сокращениях. Возврат к большему интервалу между сокращениями (20 с) произвел обратный эффект на развиваемую силу.
Эффект широкого диапазона интервалов между сокращениями на достигнутые постоянные значения развиваемой силы показан на рис. 6-47 Б. При уменьшении интервала между сокращениями с 300 до 20 с развиваемая сила сокращений изменялась незначительно. При дальнейшем укорочении интервала до 0,5 с развиваемая сила сокращений резко возрастала. Дальнейшее уменьшение паузы между сокращениями до 0,2 с производило уже незначительный дополнительный эффект на развиваемую силу сокращений.
Прогрессирующее увеличение силы вначале, когда интервал между сокращениями резко уменьшается (например, с 20 до 0,63 с на рис. 6-47 Б), вызвано постепенным увеличением концентрации внутриклеточного Са2+. Увеличению концентрации внутриклеточного Са2+ способствуют два механизма: (1) увеличение числа деполяризаций в минуту и (2) увеличение входящего Са2+-тока за одну деполяризацию.
Действие первого механизма заключается в следующем: Са2+ входит в клетку миокарда в период плато каждого потенциала действия. Когда
интервал между сокращениями уменьшается, количество фаз плато в минуту возрастает.
Второй механизм действует следующим образом: когда интервал между сердечными сокращениями резко уменьшается, входящий Са2+ - ток (ICa) прогрессивно увеличивается с каждым последующим сокращением до тех пор, пока не будет достигнут новый устойчивый максимум силы при новой длительности между стимулами, вызывающими сокращение. На рис. 6-47 В показано, что в изолированной мышечной клетке желудочка, подвергнутой повторяющимся деполяризациям, вход Са2+ в кардиомиоцит возрастал с каждым последующим сокращением. Например, максимальный уровень ICa был значительно выше во время седьмой деполяризации, чем во время первой. Кроме того, скорость его инактивации во время седьмой деполяризации происходила значительно медленнее, чем во время первой. Обе из этих характеристик ICa приведут к большему входу Са2+ в кардиомиоцит во время седьмой деполяризации, чем при первой деполяризации. Больший вход Са2+, естественно, увеличивает силу сокращений.
Кратковременное изменение интервалов между сокращениями также сильно влияет на силу сокращений. Когда левый желудочек сокращается раньше времени (рис. 6-47 Г, сокращение 1), такое внеочередное сокращение (экстрасистола) само по себе является слабым, тогда как сокращение (2) (следующее сокращение после экстрасистолы) после компенсаторной паузы является очень сильным. Эта реакция частично зависит от механизма Франка-Старлинга. Неадекватное наполнение желудочка непосредственно перед внеочередным сокращением частично является причиной его слабости. Следовательно, увеличенное наполнение, связанное с компенсаторной паузой, частично объясняет значительную силу постэкстрасистолического сокращения.
Хотя объем левого желудочка оставался постоянным на протяжении всего наблюдения, внеочередное сокращение (1) было слабым, а постэкстрасистолическое сокращение (2) было сильнее обычного. Это усиление сокращения у следующего за экстрасистолой сокращения служит примером постэкстрасистолической потенциации и может проявляться на протяжении одного и более последующих сокращений (например, в сокращении 3).
Рис. 6-47. Внутрисердечные механизмы регуляции работы сердца. Ритмо-инотропная зависимость - второй принцип внутриклеточного механизма регуляции работы сердечной мышцы.
А - изменения силы, развиваемой изолированной папиллярной мышцей кошки при изменении интервала между сокращениями с 20 до 0,63 с и затем обратно до 20 с. Б - на графике точки обозначают устойчивые значения силы, развиваемой той же папиллярной мышцей во время указанных интервалов между сокращениями (в секундах). В - ток кальция, вызванный в кардиомиоците морской свинки во время первой и седьмой деполяризации в последовательной серии деполяризаций. Г - на изоволюмическом препарате левого желудочка сердца собаки внеочередная систола желудочка (сокращение 1) обычно слабая, тогда как постэкстрасистолическое сокращение (сокращение 2) обычно сильное. Увеличившаяся сократимость может уменьшаться на протяжении нескольких последующих сокращений (например, сокращение 3)
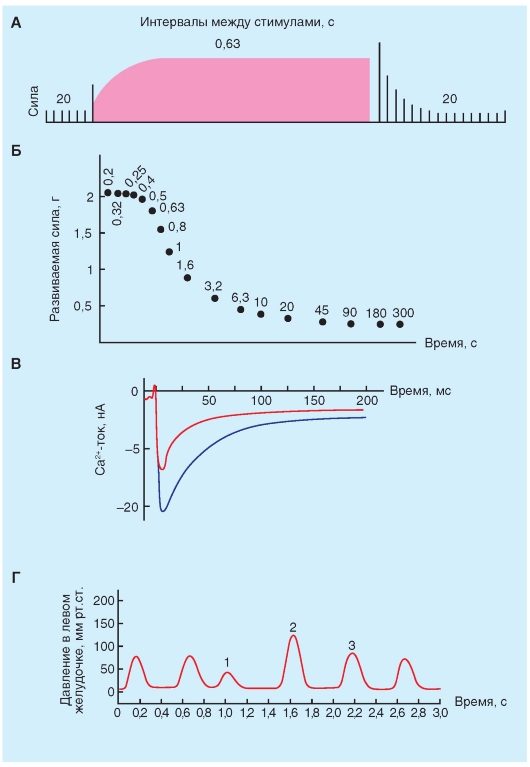
Внутрисердечная нервная система
Сердце способно к автоматическому контролю своей деятельности. Автоматический контроль осуществляется как за счет миогенных механизмов (закон Франка-Старлинга и ритмоинотропная зависимость), так и за счет нейрогенных с участием внутрисердечной нервной системы.
Внутрисердечная нервная система - это совокупность нервных сплетений и ганглиозных клеточных структур, расположенных в тканях сердца. Ганглиозно-синаптические структуры внутрисердечной нервной системы участвуют в процессах саморегуляции сердца как периферический нервный аппарат, в котором происходит замыкание местных внутрисердечных рефлекторных дуг (рис. 6-48 А).
Внутрисердечная нервная система включает афферентные нейроны, дендриты которых образуют рецепторы растяжения на миокардиальных волокнах и коронарных сосудах, вставочные нейроны и эфферентные нейроны. Их аксоны иннервируют кардиомиоциты и коронарные сосуды. Все эти нейроны соединены между собой синаптическими связями.
На изолированных сердцах холоднокровных (М.Г. Удельнов с сотр.) и теплокровных (Г.И. Косицкий с сотр.) животных в 60-х годах ХХ века было доказано участие внутрисердечной нервной системы в рефлекторной регуляции силы сердечных сокращений, ритма, возбудимости, проводимости, расслаблении миокарда и регуляции тонуса коронарных сосудов. Существенным является факт разнонаправленных рефлекторных реакций при раздражении одних и тех же рецепторов в зависимости от исходного состояния деятельности рабочей камеры. В настоящее время в интрамуральных ганглиях сердца доказано наличие не только холинергических нейронов, но и нервных клеток, выделяющих дофамин, норадреналин и некоторые пептиды. На нейронах, расположенных в ганглиях сердца, обнаружены М-, Н-холинорецепторы и адренорецепторы. Ганглии
в основном сгруппированы в предсердиях, меньшее их количество обнаружено в желудочках. На нейроны ВСНС конвергируют волокна парасимпатической, симпатической и интракардиальной нервной системы. Было показано, что экстракардиальные входы внутрисердечных нейронов составляют всего лишь 25%. Чувствительных клеток приблизительно в 5 раз больше, чем двигательных клеток. Путем избирательной блокады, фармакологического анализа было показано, что каждый ганглий иннервирует только определенную структуру сердца и соответственно регулирует какой-то параметр деятельности: ЧСС, проводимость, силу сокращений.
В естественных условиях ВСНС не является автономной, а подчиняется вышележащим регулирующим системам. Однако ее функционирование показывает возможность приспособительных реакций уже на уровне самого органа.
После экстракардиальной денервации (например, при трансплантации сердца) именно внутрисердечные рефлексы совместно с миогенными механизмами обеспечивают приспособление работы сердца к изменяющимся гемодинамическим потребностям организма.
В интактном организме экстракардиальные и внутрисердечные механизмы регуляции функционируют как единый регуляторный аппарат.
Особенностью внутрисердечной нервной системы лягушки является наличие двух внутрисердечных нервных стволов, идущих по межпредсердной перегородке от ганглиозных структур венозного синуса к атриовентрикулярной воронке и к желудочку. В состав этих стволов входят афферентные волокна рецепторов желудочка, постганглионарные нервные волокна симпатической нервной системы, преганглионарные и постганглионарные нервные волокна парасимпатической нервной системы. Афферентные волокна могут направляться в ЦНС или принадлежать ганглиям вегетативной и внутрисердечной нервной системы. В последнем случае возможно замыкание внутрисердечного рефлекса.
Рис. 6-48. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система.
А - принципиальная схема организации внутрисердечной нервной системы по Г.И. Косицкому. Б - внутрисердечные рефлекторные эффекты, вызванные стимуляцией центрального конца внутрисердечного нерва межпредсердной перегородки сердца лягушки. Верхняя запись - механограмма сердца: хронотропные и инотропные эффекты. Нижние кривые - изменения потенциалов действия в пейсмейкере (1), предсердии (2) и желудочке (3) соответственно
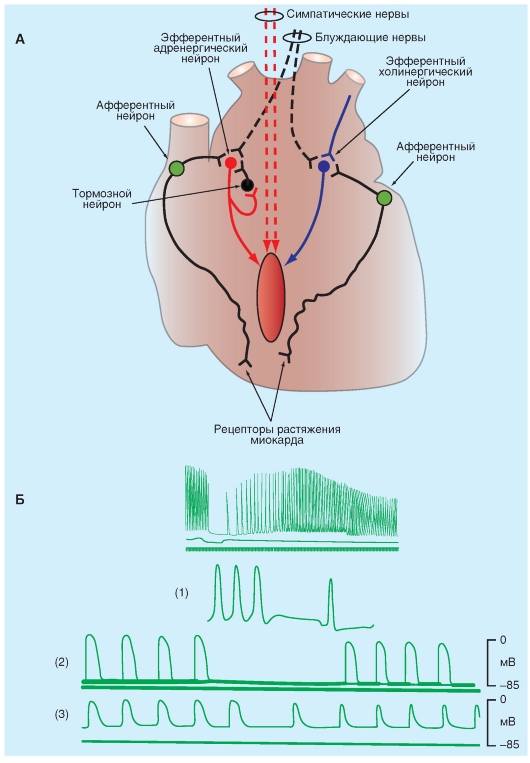
Влияние ацетилхолина на работу
сердца
Показано, что во внутрисердечной нервной системе определенную роль играют холинергические нейроны, поэтому рассмотрим влияние ацетилхолина на сердце. В передаче нервных воздействий со стороны вегетативной нервной системы на эффекторные органы участвуют ацетилхолин (парасимпатическая система).
Для изучения действия ацетилхолина на механическую работу сердца лягушки пользуются препаратом изолированного на канюле Штраубе (рис. 6-49 А, Б). Верхушка сердца через серфин или лигатуру соединяется со штырем механоэлектрического преобразователя.
На рис. 6-49 В показан контрольный период, во время которого записывают работу желудочка сердца при нахождении в нем постоянно сменяемого физиологического раствора. Стрелка показывает момент смены физиологического раствора на раствор, содержащий 10-6 г/мл ацетилхолина.
На рис. 6-49 Г показан контрольный период, во время которого записывают работу желудочка сердца при нахождении в нем постоянно сменяемого физиологического раствора. Первая стрелка показывает момент смены физиологического раствора на раствор, содержащий 10-7 г/мл ацетилхолина, а вторая стрелка показывает момент смены физиологического раствора на раствор, содержащий 10-8 г/мл ацетилхолина,
Действие ацетилхолина выражается в снижении амплитуды и частоты сердечных биений. При избытке ацетилхолина может наступить остановка сердца в диастоле. Влияние блуждающего нерва на миокард желудочков осуществляется с помощью, по крайней мере, двух механизмов. Действие одного механизма заключается в том,
что ацетилхолин, высвобожденный нервными окончаниями блуждающего нерва, получает возможность взаимодействовать с мускариновыми рецепторами мембраны кардиомиоцитов синусного узла. Это взаимодействие вызывает угнетение аденилатциклазы. Последующее уменьшение внутриклеточной концентрации циклического АМФ приводит к уменьшению Са2+ проводимости клеточной мембраны и, таким образом, приводит к уменьшению сократительной способности миокарда.
Во время действия другого механизма ацетилхолин (ACh), освобождаемый нервными окончаниями блуждающего нерва, может также угнетать освобождение норадреналина соседними окончаниями нервных волокон симпатической нервной системы (см. рис. 6-55). Эксперименты показывают, что стимуляция симпатических нервов сердца вызывает значительное увеличение поступления норадреналина в кровь коронарного синуса. Сопутствующая стимуляция блуждающего нерва снижает это усиленное поступление норадреналина примерно на 30%. Количество норадреналина, который попадает в кровь коронарного синуса, возможно, равно количеству норадреналина, освобождаемого нервными окончаниями симпатической нервной системы. Таким образом, активность блуждающих нервов может уменьшить сократительную способность желудочков частично противодействуя любым стимулирующим эффектам со стороны одновременно активной симпатической нервной системы. Подобным образом нервные волокна симпатической нервной системы высвобождают норадреналин и некоторые нейропептиды, включая нейропептид Y (NPY). Оба вещества, норадреналин и NPY, угнетают высвобождение ацетилхолина из соседних нервных волокон блуждающих нервов (рис. 6-55).
Рис. 6-49. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система. Влияние ацетилхолина на работу изолированного сердца.
А - сердце на канюле Штраубе. Б - подсоединенное к механоэлектрическому преобразователю сердце на канюле Штраубе. В - влияние на изолированное на канюле Штраубе сердце лягушки ацетилхолина
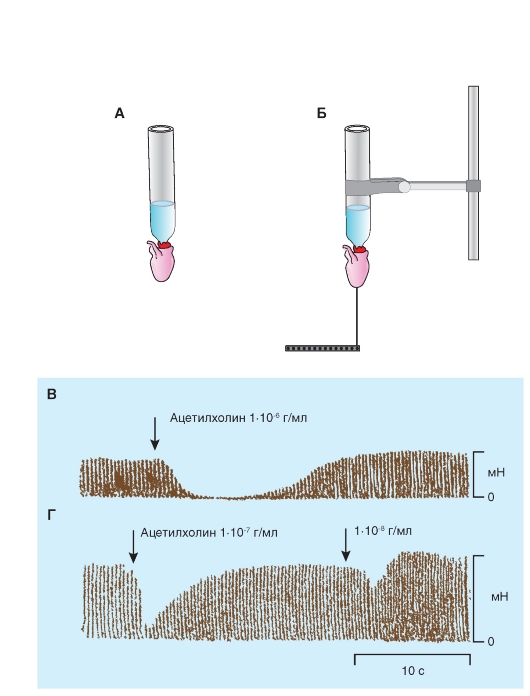
Влияние адреналина на деятельность
сердца
Для изучения действия адреналина на механическую работу сердца лягушки пользуются препаратом изолированного на канюле Штраубе (рис. 6-50 А, Б). Верхушка сердца через серфин или лигатуру соединяется со штырем механоэлектрического преобразователя.
На рис. 6-50 В показан контрольный период, во время которого записывают работу желудочка сердца при нахождении в нем постоянно сменяемого физиологического раствора. Стрелка показывает момент смены физиологического раствора на раствор, содержащий 10-6 г/мл адреналина.
Механизм действия катехоламинов через β-рецепторы
Известно, что КА влияют на аденилатциклазный путь. КА соединяется с рецептором, расположенным на наружной поверхности мембраны. Через G-белки, которые находятся в ассоциации с ГДФ, на внутренней стороне мембраны G-белок получает способность после обмена ГДФ на ГТФ диссоциировать и активировать аденилатциклазу. Она стимулирует образование цАМФ из АТФ, которая в свою очередь активирует образование протеинкиназ в цитоплазме клетки, которые приводят к фосфорилированию многочисленных вну-
триклеточных белков, меняющих проницаемость мембраны и активность ферментов. Активация происходит через взаимодействие с β-рецеторами. В результате, адреналин увеличивает сократимость за счет увеличения поступления кальция во время фазы плато. Ионы Ca++ в саркомерах взаимодействуют с С-тропонином. Количество образующихся кальций тропониновых комплексов зависит от концентрации Ca++, от количества молекул тропонина и от сродства тропонина к кальцию. Число образовавшихся кальций-тропониновых комплексов определяет активацию миофибрилл и их инотропное состояние, т.е. количество образовавшихся актомиозиновых связей.
Одновременно катехоламины приводят к фосфорилированию тропонина и фосфоламбана - белка ретикулума. Фосфорилирование тропонина увеличивает скорость распада кальций-тропонинового комплекса, снижает механическое напряжение, развиваемое сократительными белками, а также увеличивает скорость обратного захвата кальция, тем самым, ускоряя расслабление. Способность сердца к расслаблению влияет на насосную функцию сердца, поскольку степень и скорость диастолического расслабления определяют величину венозного возврата и последующий ударный выброс.
Таким образом суммарный эффект катехоламинов состоит не только в положительном инотропном действии, но и в ускорении расслабления.
Рис. 6-50. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система. Влияние адреналина на работу изолированного сердца.
А - сердце на канюле Штраубе. Б - подсоединенное к механоэлектрическому преобразователю сердце на канюле Штраубе. В - влияние на изолированное на канюле Штраубе сердце лягушки ацетилхолина
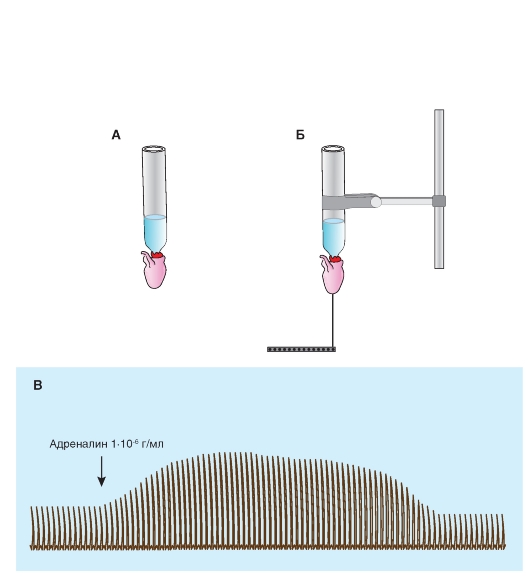
Влияние отдельных ионов на работу
сердца
Наряду с нервной регуляцией деятельности органов существует так называемая гуморальная регуляция. Она осуществляется за счет физиологически активных веществ организма, выделяемых в кровь. К таким веществам относятся гормоны, вырабатываемые железами внутренней среции, ряд продуктов клеточного метаболизма, некоторые электролиты и др. Нервные и гуморальные влияния тесно связаны и часто осуществляются параллельно.
Важная роль в регуляции состояния сердечной мышцы принадлежит некоторым ионам. Особенно существенно для нормального функционирования сердца содержание в плазме крови и межклеточных пространствах ионов калия, натрия и кальция и правильное их соотношение.
Амплитуда сердечных сокращений зависит и от изменения в окружающей ее среде концентрации иона калия. В мышечной клетке концентрация калия в 40-50 раз выше, чем в межклеточном пространстве. Увеличение калия в наружном растворе приведет к уменьшению градиента концентраций калия внутри и снаружи мышечной клетки и вызовет уменьшение (деполяризацию) ее мембранного потенциала. Это в свою очередь приведет к уменьшению амплитуды и укорочению потенциала действия клетки. В результате в мышечные клетки при их возбуждении проникнет меньшее количество ионов кальция (поскольку потенциал действия укорочен, то и время повышенной ионной проницаемости будет короче). В связи с этим амплитуда сердечных сокращений будет уменьшаться.
Кальций из омывающей клетку межклеточной жидкости входит внутрь мышечного волокна, стимулируя процесс сокращения мышцы: чем больше кальция входит в мышечную клетку при ее возбуждении, тем больше амплитуда мышечного сокращения. Экспериментально показано, что амплитуда сокращений сердца зависит от количества кальция в омывающем его растворе. Удаление кальция из раствора приводит к падению силы сердечных сокращений, увеличение концентрации кальция - к повышению силы сокращений сердечной мышцы. Кроме того, кальций рассма-
тривается как важнейший вторичный мессенджер.
При действии на сердце избыточных количеств ионов калия и кальция наблюдаются нарушения в ритме сердечных сокращений. Это связано с их влиянием на пейсмейкерные структуры. При использовании канюли Штраубе при наличии неповрежденного клапанного аппарата между правым предсердием и желудочком исследуемый раствор не должен попадать в предсердие и венозный синус. И, следовательно, не могут возникать хронотропные эффекты. Однако на практике при отмывании изолированного сердца клапанный аппарат часто повреждается. И как следствие выявляются влияния исследуемого раствора на ритм. При использовании круговой и проточной перфузии возникают как хронотропные, так и инотропные эффекты, т.к. перфузионный раствор проходит через все камеры сердца. В пейсмейкерных структурах ионы калия затягивают время достижения диастолической деполяризацией критического уровня. В результате интервалы между возникающими в пейсмейкере потенциалами действия увеличиваются и ритм сердечных сокращений уменьшается. При действии избытка ионов кальция, наоборот, этот интервал уменьшается и ритм сердечных сокращений увеличивается.
Для изучения действия ионов на механическую работу сердца лягушки пользуются препаратом изолированного сердца на канюле Штраубе (рис. 6-51 А). Верхушка сердца через серфин или лигатуру соединяется со штырем механоэлектрического преобразователя.
На рис. 6-51 Б показан контрольный период, во время которого записывают работу желудочка сердца при нахождении в нем постоянно сменяемого физиологического раствора. Первая стрелка показывает момент смены физиологического раствора на раствор, содержащий 0,65% NaCl, а вторая стрелка - на возврат протока физиологическим раствором. На рис. 6-51 В показано влияние на механическую активность сердца CaCl2. На рис. 6-51 Е в качестве примера показано влияние разной концентрации ионов K+ на параметры потенциала действия. Этот вопрос обсуждался ранее.
Рис. 6-51. Ионы как пример гуморальной регуляции сердца.
А - сердце на канюле Штраубе. Б - перфузия изотоничным раствором хлористого натрия (недостаток ионов кальция). В - добавление 1% раствора хлористого кальция. Г - связывание ионов кальция 5% щавелевокислым аммонием. Д - добавление 1% раствора хлористого калия. Е - влияние различных концентраций ионов калия в растворе на параметры потенциала действия кардиомиоцита
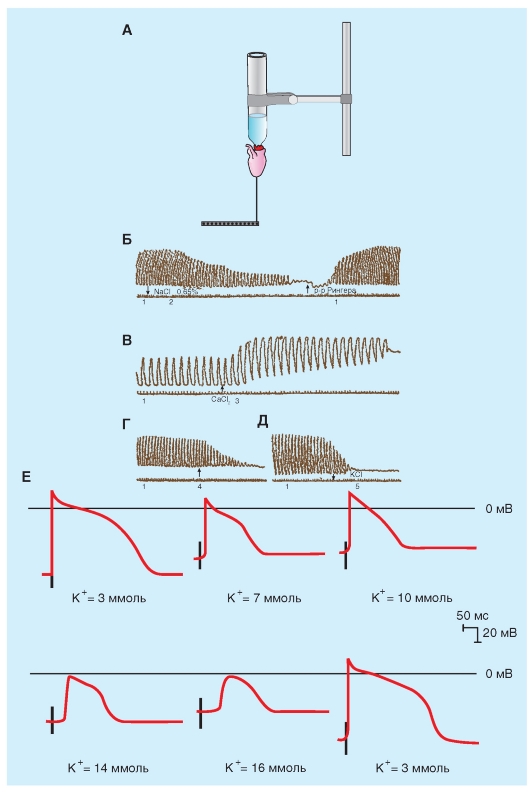
Влияние вегетативной нервной системы на деятельность сердца
Внешние регулирующие факторы можно подразделить на нервные и гуморальные. При этом экстракардиальную нервную регуляцию можно разделить на парасимпатическую и симпатическую.
Парасимпатические нервные волокна, иннервирующие сердце, берут начало в продолговатом мозге, в клетках, которые находятся в дорсальном ядре блуждающего нерва (nucleus dorsalis nervi vagi) или в двойном ядре (nucleus ambiguus) Х черепного нерва. У людей эфферентные волокна блуждающего нерва (рис. 6-52) проходят вниз по шее вблизи общих сонных артерий и затем через средостение и образуют синапсы с постганглионарными клетками. Эти клетки располагаются либо на поверхности эпикарда, либо в толще стенок сердца. Большинство клеток сердечных ганглиев располагаются вблизи синоатриального узла и атриовентрикулярного (AV) узла.
Правый и левый блуждающие нервы распределяются среди разных сердечных структур. Правый блуждающий нерв оказывает влияние преимущественно на синоатриальный узел. Стимуляция этого нерва замедляет возникновение процесса возбуждения синоатриального узла и может даже остановить его на несколько сунд.
Левый блуждающий нерв, главным образом, подавляет атриовентрикулярный узел, вызывая предсердно-желудочковую блокаду различной степени.
Синоатриальный и атриовентрикулярный узлы содержат много холинестеразы фермента, разрушающего нейротрансмиттер ацетилхолин. Ацетилхолин, высвобожденный из окончаний блуждающих нервов быстро гидролизируется. Благодаря быстрому разрушению ацетилхолина воздействия, вызываемые любой стимуляцией блуждающего нерва, очень быстро прекращаются после прекращения стимуляции. Кроме того, влияние блуждающего нерва на деятельность синоатриального или атриовентрикулярного узлов имеет очень короткий латентный период (от 50 до 100 мс), потому что выделяемый ацетилхолин активирует специфические ацетилхолин-регулируемые К+-каналы в клетках сердца. Эти каналы открываются так быстро потому, что ацетилхолин действует минуя систему вторичных мессенджеров, такую как система аденилатциклазы. Сочетание двух характерных особенностей блуждающих
нервов - короткого латентного периода и быстрого угасания ответной реакции - позволяет блуждающим нервам регулировать деятельность синоатриального и атриовентрикулярного узлов при каждом сокращении сердца.
В области синоатриального узла влияние парасимпатической нервной системы обычно превосходит влияние симпатической нервной системы.
Симпатические нервы, иннервирующие сердце, берут начало в пяти или шести верхних грудных и одном или двух нижних шейных ганглиях симпатической цепочки. В средостении постганглионарные волокна симпатических нервов и преганглионарные волокна парасимпатических нервов соединяются вместе, образуя сложное нервное сплетение смешанных эфферентных нервов, идущих к сердцу.
Постганглионарные сердечные волокна симпатических нервов этого сплетения достигают основания сердца в составе адвентиции крупных сосудов. Дойдя до основания сердца, эти волокна распределяются по различным камерам сердца, образуя обширное нервное сплетение эпикарда. Затем они проходят сквозь миокард, обычно вдоль коронарных сосудов.
Как и блуждающие нервы, правые и левые симпатические нервы распределены по разным зонам сердца. У собак, например, нервные волокна на левой стороне сердца оказывают более выраженное влияние на сократительную способность миокарда, чем волокна на правой стороне сердца, тогда как на частоту сердечных сокращений нервные волокна на левой стороне сердца влияют гораздо меньше, чем нервные волокна на правой стороне. Воздействие, вызываемое стимуляцией симпатических нервов, после прекращения этой стимуляции ослабевает постепенно. Начало ответной реакции сердца на стимуляцию нервных волокон симпатической НС протекает медленно по двум основным причинам. Во-первых, норадреналин, судя по всему, вырабатывается нервными окончаниями сердечных нервных волокон симпатической НС довольно медленно. Во-вторых, норадреналин, выделенный из нервных окончаний, влияет на сердце, главным образом, через относительно медленную систему вторичных мессенджеров, в основном, через систему аденилатциклазы. Таким образом, влияние симпатической нервной системы изменяет частоту сердечных сокращений и проведение возбуждения по атриовентрикулярному узлу гораздо медленнее, по сравнению с влиянием блуждающего нерва.
Рис. 6-52. Симпатическая и парасимпатическая иннервация сердца.
1 - правый блуждающий нерв, 2 - левый блуждающий нерв, 3 - левый симпатический нерв, 4 - правый симпатический нерв, 5 - синусный узел, 6 - атриовентрикулярный узел, 7 - ножки пучка Гиса
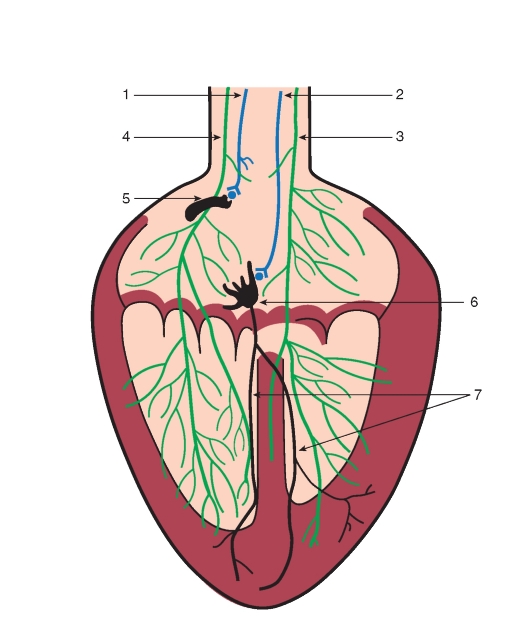
Влияние раздражения блуждающего нерва на автоматию и инотропную функцию миокарда
Блуждающие нервы вызывают угнетение сердечного пейсмейкера (водителя ритма сердца), сокращения миокарда предсердий и атриовентрикулярного проведения. Блуждающие нервы также оказывают угнетающее влияние на миокард желудочков, но в желудочках эти эффекты менее выражены, чем в предсердиях. На изоволюмическом препарате левого желудочка стимуляция блуждающего нерва снижает максимальное давление в левом желудочке, максимальную скорость повышения давления (dP/dt) и максимальную скорость снижения давления во время диастолы. У препаратов сердца, перекачивающих кровь, при стимуляции блуждающего нерва кривые желудочковой функции смещают вправо.
Влияние блуждающего нерва на миокард желудочков осуществляется с помощью, по крайней мере, двух механизмов. Действие одного механизма заключается в том, что ацетилхолин (ACh),
высвобожденный нервными окончаниями блуждающего нерва, получает возможность взаимодействовать с мускариновыми рецепторами (М) мембраны кардиомиоцитов. Это взаимодействие вызывает угнетение аденилатциклазы. Последующее уменьшение внутриклеточной концентрации циклического АМФ приводит к уменьшению Са2+ проводимости клеточной мембраны и, таким образом, приводит к уменьшению сократительной способности миокарда.
Во время действия другого механизма ацетилхолин, освобождаемый нервными окончаниями блуждающего нерва, может также угнетать освобождение норадреналина соседними окончаниями нервных волокон симпатической нервной системы.
На рис. 6-53 А показано влияние раздражения блуждающего нерва на мембранный потенциал клеток водителя ритма. Отчетливо видна гиперполяризация мембранного потенциала и подавление автоматии. На рис. 6-53 Б зарегистрировано влияние раздражения блуждающего нерва на сердце лягушки.
Рис. 6-53. Внесердечная регуляция работы сердца - влияние парасимпатической нервной системы.
А - электрическая активность кардиомиоцитов. Б - механическая деятельность сердца
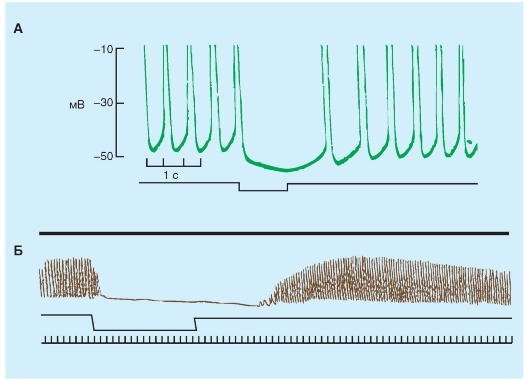
Влияние раздражения симпатических нервов на деятельность сердца
Влияние симпатической нервной системы
Деятельность симпатической нервной системы увеличивает сократительную способность предсердий и желудочков. Влияние возросшей активности нервных волокон симпатической нервной системы на миокард желудочков асимметрично. Сердечные нервные волокна симпатической нервной системы, расположенные в левой части тела, на сокращение желудочков оказывают обычно гораздо большее влияние, чем нервные волокна симпатической нервной системы, расположенные в правой части тела.
Влияние симпатической нервной системы усиливает деятельность сердечной мышцы с помощью активации Са2+-каналов, расположенных в мембранах кардиомиоцитов. Норэпинефрин, освобождаемый нервными окончаниями, или катехоламины, находящиеся в циркулирующей крови, взаимодействуют с бета-адренергическими рецепторами мембран клеток сердца. Это взаимодействие активирует аденилатциклазу, которая вызывает увеличение внутриклеточной концентрации циклического АМФ. В результате происходит активация протеинкиназы, что вызывает фосфорилирование различных белков в кардиомиоцитах. Фосфорилирование особых белков сарколеммы активирует Са2+-каналы мембраны кардиомиоцитов.
Активация Са2+-каналов увеличивает вход Са2+ во время фазы плато потенциала действия, и большее количество Са2+ освобождается из саркоплаз-
матического ретикулума в ответ на каждое возбуждение сердца. Сила сердечных сокращений, таким образом, увеличивается.
Общий эффект от увеличения влияния на сердце симпатической нервной системы у интактных животных лучше всего виден на примере сразу нескольких кривых желудочковой функции. Когда проводят электростимуляцию левого звездчатого ганглия с нарастающей частотой, кривые желудочковой функции выраженно сдвигаются влево. Эти изменения параллельны изменениям, происходящим при введении норэпинефрина. Таким образом, при любом заданном значении конечно-диастолического давления в левом желудочке этот желудочек способен выполнять больше работы при увеличении активности симпатической нервной системы.
При стимуляции сердечной деятельности симпатической нервной системой увеличение выполняемой сердцем работы обычно сопровождается уменьшением конечно-диастолического давления в левом желудочке. Характерен пример ответной реакции сердца на стимуляцию звездчатого ганглия в условиях, когда сердце стимулировалось с постоянной частотой. В этом эксперименте работа, выполняемая сердцем при выбросе, увеличилась примерно на 50%, несмотря на уменьшение конечно-диастолического давления в левом желудочке.
На рис. 6-54 А показано влияние раздражения симпатического нерва на мембранный потенциал кардиомиоцита водителя ритма лягушки. На рис. 6-54 Б продемонстрирован положительный инотропный и хронотропный эффект зарегистрированный на сердце лягушки при раздражении симпатического нерва.
Рис. 6-54. Внесердечная регуляция работы сердца - влияние симпатической нервной системы.
А - регистрация электрической активности. Б - регистрация механической активности
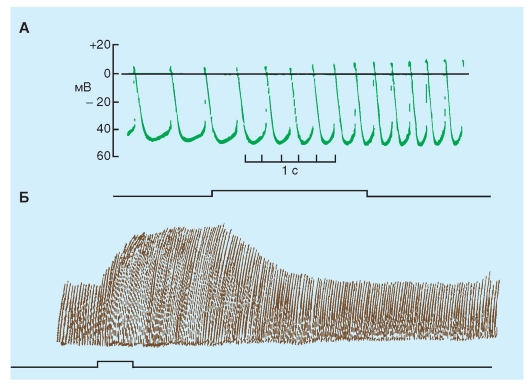
Взаимодействие влияний симпатической и парасимпатической систем на сердце
Экстракардиальные нервные механизмы регуляции реализуются через симпатическую и парасимпатическую нервную системы. Правый блуждающий нерв в основном действует на синусный узел, а левый на проводимостиь атриовентрикулярного узла. Влияния, осуществляемые симпатическими нервами, также ассиметричны: левый симпатический нерв действует в основном на миокард левого желудочка, увеличивая его силу сокращений, а правый симпатический нерв оказывает большее влияние на частоту сокращений.
При одновременном раздражении вагосимпатического ствола вначале проявляется эффект раздражения блуждающего нерва, а затем симпатический эффект. Объясняется это следующим образом: ацетилхолин, выделяясь из нервных окончаний и взаимодействуя с м-холинорецепторами, может непосредственно без посредников влиять на
к-каналы (лигандуправляемые). Это обеспечивает короткий латентный период влияния парасимпатической нервной системы. Реакция же на раздражение симпатического нерва имеет более длительный латентный период и большую продолжительность, так как действует через систему вторичных посредников и более медленно инактивируется.
Следует почеркнуть, что симпатическая и парасимпатическая нервные системы взаимодействуют друг с другом (рис. 6-55). Возбуждение парасимпатической нервной системы не только активирует м-холинорецепторы, но и угнетает высвобождение норадреналина из окончаний симпатических нервов. В свою очередь норадреналин способен угнетать высвобождение АХ (рис. 6-55).
В целом организме влияния блуждающего и симпатического нервов реализуются посредством рефлекторных реакции на сердце. Это собственные рефлексы сердечно-сосудистой системы. Рефлексы могут возникать и с рецептивных полей любого другого органа (сопряженные рефлексы).
Рис. 6-55. Взаимодействие в пределах вегетативной (симпатической и парасимпатической) нервной систем и внутриклеточные механизмы, ответственные за взаимодействие между симпатической и парасимпатической системами при контроле сердечной деятельности. NE - норэпинефрин (норадреналин); ACh - ацетилхолин; NPY - нейропептид Y; β - β-адренергический рецептор; М - мускариновый рецептор; Gs и Gi - стимулирующий и угнетающий G-белки; Ad. cycl. - аденилатциклаза; АТФ - аденозинтрифосфат; цАМФ - циклический аденозинмонофосфат
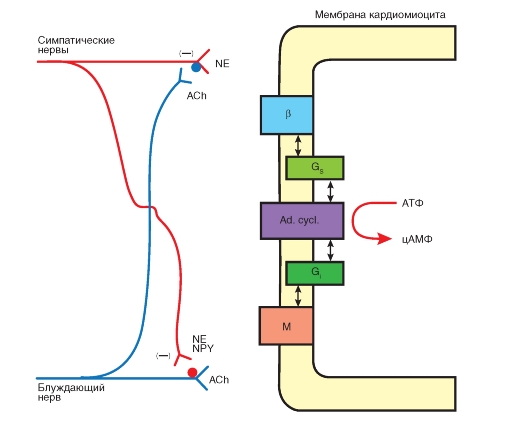
Метод исследования сердечного выброса
В 1870 году немецкий физиолог Адольф Фик впервые предложил метод измерения объема сердечного выброса у здоровых животных и людей. Основой этого метода, названного принципом Фика, является простое применение закона сохранения массы. Данный закон исходит из положения, что количество кислорода (О2), доставленного в легочные капилляры через легочную артерию, плюс количество О2, который попадает в легочные капилляры из альвеол, должно равняться количеству О2, которое уносится легочными венами.
Принцип Фика схематически изображен на рис. 6-56. Количество (q1) кислорода, доставленного в легкие, равно концентрации О2 в крови легочной артерии ([О2]ра), умноженной на кровоток в легочной артерии (Q), который равен сердечному выбросу, т.е.:

Обозначим количество О2, полученное легочными капиллярами из альвеол, как q2. При равновесии, q2 равно потреблению О2 организмом. Количество О2, которое выводится по легочным венам (обозначим его q3), равно концентрации кислорода в крови легочной вены, [O2]pv, умноженной на общий кровоток в легочной вене, который фактически равен кровотоку в легочной артерии, Q, т.е:

Согласно закону сохранения массы,

Поэтому
Вычисление объема сердечного выброса:
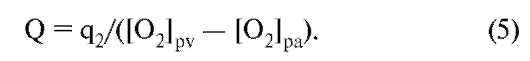
Уравнение (5) является формулировкой принципа Фика.
Для клинического определения объема сердечного выброса необходимы три значения:
(1) объем потребления кислорода организмом,
(2) концентрация кислорода в крови легочной вены ([О2]рv) и (3) концентрация кислорода в крови легочной артерии ([O2]pa). Потребление кислорода рассчитывается на основе измерений объема выдыхаемого воздуха и содержания в нем кислорода через определенный промежуток времени. Так как концентрация кислорода в периферической артериальной крови в значительной мере идентична концентрации кислорода в легочных венах, [O2]pv определяется в пробе периферической артериальной крови, взятой иглой для пункций. Кровь легочной артерии, [О2]ра, фактически представляет собой смешанную венозную кровь. Образцы для анализа кислорода берутся из легочной артерии или из правого желудочка через катетер. Раньше для этого использовался относительно жесткий катетер, который надо было вводить в легочную артерию под рентгеновским контролем. Сегодня очень гибкий катетер с маленьким баллончиком возле наконечника может быть введен в периферическую вену. Когда трубка введена, кровоток переносит ее к сердцу. Следуя изменениям давления, врач может ввести наконечник катетера в легочную артерию без помощи рентгеноскопии.
Пример расчета объема сердечного выброса здорового взрослого человека, находящегося в состоянии покоя, показан на рис. 6-56. При потреблении кислорода 250 мл/мин, содержании кислорода в артериальной крови 0,20 мл О2 на 1 мл крови и содержании кислорода в смешанной венозной крови 0,15 мл О2 на 1 мл крови объем сердечного выброса равен 250/(0,20-0,15) = 5000 мл/мин.
Принцип Фика также используется для оценки потребления кислорода органами, когда есть возможность для определения кровотока и содержания кислорода в артериальной и венозной крови. Алгебраическая подстановка показывает, что потребление кислорода равно кровотоку, умноженному на разницу между концентрациями О2 в артериальной и венозной крови. Например, если кровоток через одну почку составляет 700 мл/мин, содержание кислорода в артериальной крови равно 0,20 мл О2/1 мл крови, а содержание кислорода в крови почечной вены равно 0,18 мл О2/1 мл крови, скорость потребления кислорода этой почкой должна быть 700 ? (0,2-0,18) = 14 мл О2/мин.
Рис. 6-56. Схема, иллюстрирующая принцип Фика для измерения сердечного выброса. Изменение цвета от легочной артерии к легочной вене показывает изменение цвета крови, так как венозная кровь становится полностью оксигенированной (насыщенной кислородом)
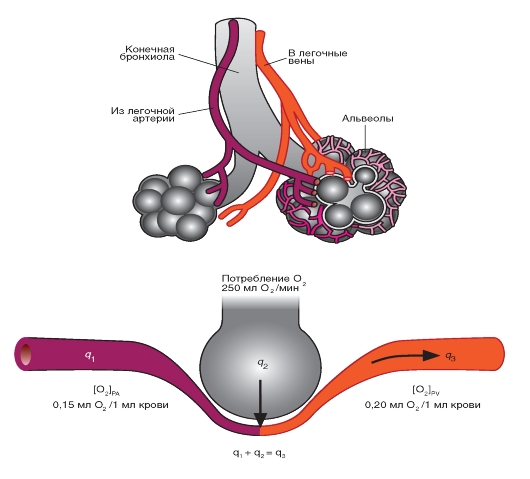
Фазовый анализ сердечного цикла
Систола желудочков начинается после окончания систолы предсердий. Волна сокращения, постепенно распространяясь по миокарду, не сразу охватывает все кардиомиоциты ткани желудочков. Часть их сокращается, вследствие чего другая их часть, еще не сократившаяся, растягивается. Этот период систолы желудочков, когда происходит распространение волны возбуждения по миокарду, называют фазой асинхронного сокращения. Он продолжается 0,05 с. Поскольку часть клеток сократилась, то другие, несократившиеся клетки, должны растянуться, так как кровь в желудочках, подобно всякой жидкости, практически несжимаема (в качестве примечания необходимо напомнить, что в каждую фазу асинхронного сокращения в сердце начинаются проблемы, связанные с механоэлектрической обратной связью). Форма желудочков изменяется, однако давление в них не меняется.
Далее следует фаза изометрического сокращения (напомним, что изометрическим называют такое сокращение мышцы, при котором мышечные волокна развивают напряжение, но не укорачиваются), имеющая следующую феноменологию. Эта фаза развивается при закрытых клапанах. После того как все мышечные волокна желудочков охвачены сокращением, давление крови в полости желудочков начинает увеличиваться, что вызывает закрытие атриовентрикулярных клапанов. Полулунные клапаны в это время также закрыты, потому что давление в желудочках пока еще ниже, чем в аорте и легочной артерии. Поэтому в течение короткого времени - 0,03 с - мышца желудочков напрягается, но их объем не меняется (так как кровь в желудочках, подобно всякой жидкости, практически несжимаема) до тех пор, пока давление в желудочке не превысит давления в аорте и легочной артерии и пока под влиянием напора крови не откроются полулунные клапаны. По другой терминологии время между началом сокращения желудочков и открытием полулунных клапанов (когда желудочковое давление резко повышается) называется изоволюмическим сокращением («изоволюмический» буквально означает «того же объема»). Данный термин также является подходящим, так как желудочковый объем остается неизменным в течение этого короткого периода. На рис. 6-57 показано, что начало сокращения желудочков совпадает с пиком зубца R на ЭКГ и с начальной вибрацией первого сердечного тона. Это можно видеть на кривой желудочкового давления как начало подъема внутрижелудочкового давления после сокращения предсердия.
Фазы асинхронного и изометрического сокращений вместе называют периодом напряжения желудочков. Когда в результате изометрического сокращения давление в желудочках становится выше, чем давление в аорте и легочной артерии, клапаны аорты и легочной артерии открываются и наступает период изгнания крови из желудочков, и кровь поступает из желудочков в аорту и легочную артерию.
Период изгнания (выброса) крови начинается с открытия полулунных клапанов, свидетельствует о начале фазы желудочкового выброса, которую можно подразделить на раннюю, более короткую - фазу быстрого изгнания и на позднюю, более длительную фазу медленного изгнания. Фаза быстрого изгнания отличается от фазы медленного изгнания тремя факторами: (1) резким повышением внутрижелудочкового и аортального давлений, которое завершается на высшей точке желудочкового и аортального давления, (2) более резким уменьшением объема желудочков и (3) более сильным аортальным кровотоком (рис. 6-57). Резкий спад кривой давления в левом предсердии в начале выброса происходит из-за опущения основания сердца и растягивания предсердий. Во время фазы медленного изгнания отток крови из аорты на периферию превышает выброс из желудочка, и поэтому аортальное давление понижается. На протяжении систолы желудочков кровь, поступающая по венам в предсердия, вызывает повышение давления в предсердиях.
Показатель состояния сократительной способности миокарда можно вычислить по скорости кровотока в восходящей части аорты во время сердечного цикла (начальный наклон кривой аортального кровотока) (рис. 6-57). Фракция выброса, которая представляет собой отношение объема крови, выбрасываемой из левого желудочка за 1 удар (объем систолического выброса) к объему крови в левом желудочке в конце диастолы (конечный диастолический объем), широко применяется клинике в качестве индекса сократительной способности.
Полулунные клапаны расположены между правым желудочком и легочной артерией и между левым желудочком и аортой. Они представлены тремя чашеобразными створками. В конце фазы медленного изгнания систолы желудочков кровоток быстро меняет направление в сторону желудочков (показан как негативный поток на кривой фазового аортального кровотока на рис. 6-57).
Вслед за фазой изгнания наступает диастола желудочков. Они начинают расслабляться, поэтому давление в аорте становиться выше, чем в желудочке, и полулунные клапаны захлопываются. Время
от начала расслабления желудочков до закрытия полулунных клапанов названо протодиастолическим периодом, который длится 0,04 с. Затем в течение некоторого времени (около 0,08 с) желудочки продолжают расслабляться при закрытых и атриовентрикулярных, и полулунных клапанах, пока давление в желудочках не упадет ниже, чем в предсердиях, уже наполненных к этому времени кровью. Этот период диастолы обозначают как период изометрического расслабления. Его длительность в среднем 0,08 с. Вслед за этим створчатые клапаны открываются, и кровь из предсердий начинает наполнять желудочки.
Далее следует период наполнения желудочков кровью. Поступление крови в желудочки идет вначале быстро, так как давление в них после их расслабления падает до 0 - фаза быстрого наполнения, длящаяся 0,08 с. По мере наполнения желудочков давление в них немного увеличивается и наполнение замедляется - фаза медленного наполнения, продолжающаяся 0,17 с. В конце диастолы желудочков происходит систола предсердий длительностью 0,1 с - которая носит название пресистола желудочков.
Рассмотрим фазу быстрого наполнения. Главная часть наполнения желудочка происходит сразу после открытия AV-клапанов. В этот момент кровь, возвратившаяся в предсердия во время предшествующей желудочковой систолы, стремительно поступает в расслабленные желудочки. Этот этап наполнения желудочков называется фазой быстрого наполнения. На рис. 6-57 начало фазы быстрого наполнения обозначено падени-
ем давления в левом желудочке ниже давления в левом предсердии. Это изменение направления давления вызывает открытие митрального клапана. Быстрое поступление крови из предсердий в расслабленные желудочки вызывает понижение давления в предсердиях и желудочках и резкое увеличение объема желудочков.
Рассмотрим фазу медленного наполнения. За фазой быстрого наполнения следует фаза, называемая фазой медленного наполнения. При фазе медленного наполнения кровь, возвращающаяся с периферии, поступает в правый желудочек, а кровь из легких поступает в левый желудочек. Это небольшое, медленное дополнение к желудочковому наполнению проявляется постепенным ростом предсердного, желудочкового и венозного давления и увеличением объема желудочков (рис. 6-57).
Во время диастолы желудочков давление крови в аорте и легочной артерии постепенно снижается по мере оттока из них крови и к концу диастолы оно равно в аорте 65-75 мм рт.ст., а в легочной артерии - 5-10 мм рт.ст. Так как это конечно-диастолическое давление выше давления в желудочках, то полулунные клапаны остаются закрытыми до тех пор, пока давление в желудочках при их сокращении не превысит уровня давления в крупных артериальных стволах.
Последовательность отдельных фаз цикла деятельности желудочков может быть представлена следующим образом:
Обычно сердце производит четыре тона, но, как правило, через стетоскоп прослушиваются только два из них. При электронном усилении можно

обнаружить и менее интенсивные тоны и графически записать их в виде фонокардиограммы. Этот способ записи слабых сердечных тонов помогает установить точное время возникновения тонов сердца по отношению к другим процессам сердечного цикла. Первый сердечный тон начинается в начале систолы желудочков (рис. 6-57) и состоит из нескольких серий вибраций, представляющих смешанные низкочастотные колебания, которые не связаны между собой (шум). Это самый громкий и самый длительный из сердечных тонов, имеющий нарастающе-затухающий характер; лучше всего он прослушивается в районе верхушки сердца. Тоны трехстворчатого клапана лучше всего прослушиваются в пятом межреберье слева от грудины; тоны митрального клапана лучше всего слышны в пятом межреберье у верхушки сердца.
Второй сердечный тон, который появляется при резком закрытии полулунных клапанов (рис. 6-57), состоит из колебаний более высокой частоты (с большей высотой звука), имеет более короткую продолжительность и меньшую интенсивность и более «щелкающий» характер, чем первый сердечный тон. Закрытие полулунного клапана вызывает осцилляции крови в сосуде и приводит к напряжению (tension) стенок сосуда вследствие растяжения и отдаче (recoil) закрытого клапана. Часть второго сердечного тона, производимая закрытием легочного клапана, лучше
всего прослушивается во втором межреберном промежутке слева от грудины, тогда как звук, производимый закрытием аортального клапана, лучше всего слышен в том же самом межреберном промежутке, только справа от грудины. Причиной, по которой полулунные клапаны закрываются быстрее, чем обычно, может быть повышение давления в легочной артерии или аорте (например, при легочной или системной гипертензии). При этом увеличивается громкость второго сердечного тона. Звук аортального клапана обычно громче, чем легочного, но в случаях легочной гипертензии наблюдается обратное соотношение.
Четвертый, или предсердный сердечный тон состоит из нескольких низкочастотных колебаний. Этот тон иногда прослушивается у здоровых людей. Данный тон производится пульсацией крови и пульсовыми колебаниями стенок камер, вызванными сокращением предсердий (рис. 6-57).
На рис. 6-57 показана запись кривой венозного пульса, снятого на яремной вене. Зубец С этой кривой появляется следствием влияния пульсации общей сонной артерии на примыкающую яремную вену и, в какой-то мере, из-за быстрого закрытия трехстворчатого клапана в начале систолы желудочка. Обратите внимание, что, за исключением зубца С, кривая венозного пульса точно следует за кривой давления в предсердиях.
Рис. 6-57. Пульсации давлений в левом предсердии, аорте и левом желудочке, соотнесенные по времени с аортальным кровотоком, желудочковым объемом, тонами сердца, венозным пульсом и электрокардиограммой в течение полного сердечного цикла у собаки. На рисунке представлены давление в левом желудочке, давление в аорте, объем желудочка, тоны сердца, венозный пульс, электрокардиограмма на фоне фаз - систола предсердий, изометрическое (изоволюмическое) сокращение, фазы быстрого изгнания, фаза медленного изгнания, изоволюмического расслабления, фазы быстрого наполнения желудочков, фазы медленного наполнения желудочков
Морфо-функциональная характеристика сосудистой системы
Между малым и большим кругами кровообращения существуют принципиальные функциональные различия. Они заключаются в следующем: 1. Временем прохождения частицы крови - 5-6 с для малого круга и 15-18 с для большого круга кровообращения. 2. Различным распределением равных объемов крови из правого и левого отделов сердца. Из правого желудочка кровь попадает только в легкие, где осуществляется функция газообмена и теплоотдачи. Из левого желудочка кровь распределяется по всем органам и тканям, потребности которых различны даже в состоянии покоя. На долю головного мозга приходится 13-15%, в сердце по коронарным сосудам поступает около 5%, через ЖКТ и печень проходит 20-25%, через почки - 15-20%, через скелетные мышцы 15-20%, в коже протекает 3-6%, и через кости, костный мозг, жировую и соединительную ткани - 10-15%. 3. Обилием регуляторных механизмов в большом круге кровообращения. Малый круг имеет несложную регуляцию. 4. Различием в реакции на снижение кислорода: сосуды малого круга, оплетающие альвеолы, суживаются, а сосуды большого круга расширяются. 5. Различием давлений: в большом круге - высокое артериальное давление (~100 мм рт.ст.), а в малом - низкое (15-20 мм рт.ст.). На рис. 6-58 схематично представлены величины кровяного давления в разных отделах сердечно-сосудистой системы. 6. Различным периферическим сопротивлением: большой круг обладает высоким сопротивлением (140 Па с•мл-1 или 0,02 мм рт.ст./(мл/мин)), а малый - низким (11Па с•мл-1 или 0,004 мм рт.ст./(мл/мин) сопротивлением, которое изменяется в течение дыхательного цикла. 7. Разным гидростатическим давлением: большой круг имеет высокое гидростатическое давление, а малый - низкое давление.
Кровь быстро движется через аорту и ее артериальные ветви. По мере приближения к периферии эти ветви суживаются, их стенки становятся тоньше. Также меняются и гистологические характеристики тканей стенок сосудов. Аорта является преимущественно эластической структурой, тогда как стенки периферических артерий содержат
больше мышечной ткани, а в стенках артериол мышечный слой преобладает (рис. 6-58 А).
В крупных артериях сопротивление, производимое трением, относительно невелико, и давление в них лишь в незначительной степени ниже, чем в аорте. Малые артерии, с другой стороны, оказывают движению крови умеренное сопротивление. Максимальное сопротивление кровоток встречает в артериолах, которые И.М. Сеченов назвал «кранами» сосудистой системы. Таким образом, наибольшее падение давления происходит в окончаниях малых артерий и в артериолах (рис. 6-58 Б). Изменение силы сокращений круговых мышц этих малых сосудов позволяет регулировать приток крови к тканям и помогает контролировать артериальное кровяное давление.
Возвращаясь из капилляров к сердцу, кровь проходит через венулы, затем через вены все большего размера. Давление внутри этих сосудов постоянно уменьшается, пока кровь не достигнет правого предсердия (рис. 6-58 Б). Ближе к сердцу количество вен уменьшается, меняются толщина и строение стенок вен (рис. 6-58 А), уменьшается общая площадь поперечного сечения венозного русла, а скорость движения крови увеличивается. Скорость кровотока фактически обратно пропорциональна площади поперечного сечения сосудов на любом участке сосудистой сети.
Данные на примере собаки показывают, что число сосудов от аорты до капилляров возрастает примерно в 3 биллиона раз, а общая площадь поперечного сечения сосудов увеличивается примерно в 500 раз. Большая часть крови, содержащейся в сосудах большого круга кровообращения, находится в венах и венулах (75%); лишь 7% от общего объема крови находится в капиллярах, и 15% общего объема крови содержится в аорте, артериях и артериолах 3%. Напротив, кровь, содержащаяся в малом, легочном круге кровообращения, почти поровну делится между артериальными, капиллярными и венозными сосудами.
Помимо понижения давления, в артериолах происходит изменение характера движения крови с пульсирующего на равномерный (рис. 6-58 В). Пульсация артериального кровотока, вызванная прерывистым выбросом крови из сердца, полностью сглаживается на капиллярном уровне за счет сочетания двух факторов: растяжимости крупных артерий и сопротивления, производимого трением, в малых артериях и артериолах.
Рис. 6-58. Часть I. Общие представления о сосудах и давлении крови в них.
А - внутренний диаметр, толщина стенок и соответствующее количество основных компонентов стенок различных кровеносных сосудов, формирующих систему кровообращения. Поперечные разрезы сосудов не изображены на данной шкале из-за огромной разницы в размерах сосудов - от аорты и полых вен до капилляра. Б - падение давления при движении крови по сосудистой системе: АД - среднее артериальное давление, ВД - венозное давление. В - изменение давления в разных отделах сосудистой системы
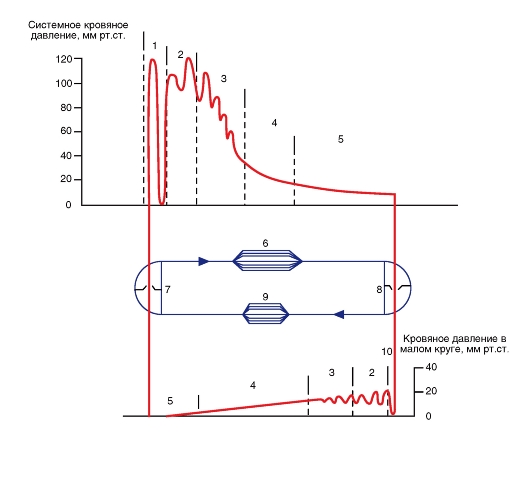
Рис. 6-58. Часть II. Общие представления о сосудах и давлении крови в них.
Величина кровяного давления в различных участках сердечно-сосудистой системы: 1 - левый желудочек, 2 - артерии, 3 - артериолы, 4 - капилляры, 5 - вены, 6 - системное кровообращение большого круга, 7 - левое сердце, 8 - правое сердце, 9 - кровообращение в малом круге, 10 - правый желудочек
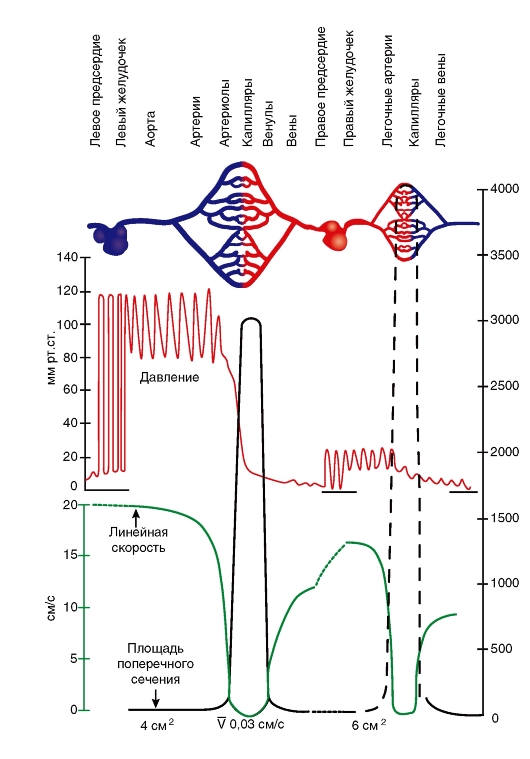
Рис. 6-58. Часть III. Общие представления о сосудах и давлении крови в них.
Соотношение между площадью поперечного сечения, давлением и средней линейной скоростью кровотока в различных отделах сердечно-сосудистой системы
Скорость кровотока. Линейная скорость
Перед описанием изменения кровотока в разных сосудах необходимо ввести термины скорость (velocity) и объемная скорость (flow) кровотока и определить их различия. Скорость, которую иногда называют линейной скоростью, является скоростью перемещения жидкости в единицу времени и выражается в единицах расстояния, пройденного кровью, за единицу времени (например, см/с). Объемная скорость кровотока, которую часто называют объемным кровотоком, выражается в единицах объема крови, пройденного за единицу времени (например, см3/с). Для трубки с переменными размерами поперечного сечения взаимосвязь линейной скорости (v), объемной скорости (Q) и площади поперечного сечения (А) выражается уравнением:
Взаимосвязь между скоростью, объемной скоростью и площадью поперечного сечения трубки изображена на рис. 6-59 А. Согласно принципу сохранения массы, поток несжимаемой жидкости через последовательно расположенные жесткие трубки с разными поперечными сечениями должен оставаться постоянным. При заданном потоке изменения линейной скорости жидкости обратны изменениям площади поперечного сечения трубки. Таким образом, когда жидкость в трубке поступает из сции а в сцию b, где площадь поперечного сечения в пять раз больше, линейная скорость жидкости уменьшается до 1/5 своего предыдущего значения, так как площадь поперечного сечения сции b в 5 раз больше площади поперечного сечения сции а (рис. 6-59 А). Напротив, когда жидкость поступает из секции b в сцию с, площадь поперечного сечения которой равно 1/10 площади поперечного сечения сции b, скорость потока жидкости 10-кратно возрастает.
Линейная скорость жидкости в любой точке гидравлической системы зависит не только от площади поперечного сечения, но также и от объемной скорости кровотока Q. Объемная скорость, в свою очередь, зависит от градиента давления, особенностей жидкости и общих размеров
гидравлической системы, что рассматривается в следующем разделе. Впрочем при любой заданной объемной скорости, отношение линейной скорости жидкости, проходящей через одну площадь поперечного сечения, к линейной скорости жидкости, проходящей через вторую площадь поперечного сечения, зависит только от обратной пропорции этих площадей, т.е.:
Это правило относится и к системам, состоящим из одной большой трубки, и к системам, состоящим из нескольких трубок меньшего размера, расположенных параллельно.
Как показано на рис. 6-59 Б, линейная скорость кровотока прогрессивно уменьшается по мере того, как кровь проходит по аорте, затем по артериям все меньшего диаметра и по артериолам. Наконец, в капиллярах скорость падает до своего минимального значения. Так как кровь затем проходит по венулам и продолжает двигаться по направлению к центру, к полым венам, скорость снова прогрессивно возрастает. Соответствующие скорости кровотока в разных отделах системы кровообращения связаны только с соответствующими площадями поперечных сечений. Таким образом, каждая точка на графике площади поперечного сечения обратно пропорциональна соответствующей точке на кривой линейной скорости кровотока (рис. 6-59 Б).
От каждой артериолы отходит много капилляров. Общая площадь поперечного сечения капиллярного русла весьма значительна, несмотря на то, что площадь поперечного сечения отдельного капилляра меньше площади отдельной артериолы. В результате скорость кровотока в капиллярах значительно снижается, подобно тому, как замедляется течение воды (рис. 6-59 Б) на широких участ-ках реки. Так как капилляры состоят из коротких трубок со стенками толщиной всего в одну клетку и скорость кровотока в них низкая, в капиллярах создаются идеальные условия для обмена веществ между кровью и тканями путем диффузии.
Площадь поперечного сечения полых вен больше, чем у аорты, поэтому скорость движения крови в полых венах ниже, чем в аорте (рис. 6-59 Б).
Рис. 6-59. Линейная скорость кровотока.
А - при движении жидкости в гидравлической системе с переменной площадью поперечного сечения, а - изменения линейной скорости, v - обратны изменениям площади поперечного сечения. Q - объемная скорость. Б - скорость движения крови и площадь поперечного сечения кровеносных сосудов в различных отделах сосудистой системы. Важными особенностями здесь являются: обратная зависимость между скоростью движения крови и площадью поперечного сечения сосудов, наибольшее падение давления в малых артериях и артериолах и максимальная площадь поперечного сечения у капилляров при минимальной скорости движения крови в капиллярах
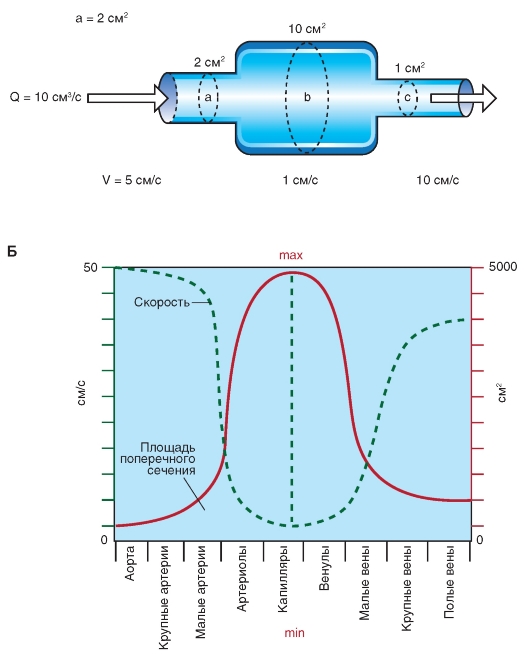
Взаимосвязь линейной скорости кровотока и величины давления
В определенной части гидравлической системы, где общая энергия остается фактически постоянной, изменения линейной скорости могут сопровождаться ощутимыми изменениями динамической составляющей измеренного давления. Рассмотрим три сции (А, В и С) гидравлической системы, изображенной на рис. 6-60 А. Шесть зондов для измерения давления, или трубок Пито, введены в различные точки этой гидравлической системы. Отверстия трех из этих трубок Пито (2, 4 и 6) направлены по касательной к направлению течения жидкости в гидравлической системе, таким образом они измеряют боковое, или статичное, давление внутри сций разного диаметра этой гидравлической системы. Отверстия остальных трех трубок Пито (1, 3 и 5) направлены навстречу течению жидкости в гидравлической системе. Эти трубки Пито измеряют общее давление, которое складывается из бокового давления и динамической составляющей, величина которой зависит от кинетической энергии текущей жидкости. Эту динамическую составляющую (Pd) общего давления можно вычислить с помощью следующего уравнения:
где ρ - это плотность жидкости, а v - ее линейная скорость. Если трубки Пито (1, 3 и 5) в сциях А, В и С изучаемой гидравлической системы будут установлены на одинаковом среднем уровне (т.е. находятся на одном гидростатическом уровне), то соответствующие общие давления Р1, Р3 и Р5, будут равными, при условии, что потерей энергии из-за вязкости жидкости в этих сциях можно пренебречь (другими словами, жидкость, которую мы здесь рассматриваем, есть «идеальная жидкость»). Однако вследствие разницы в площади поперечного сечения вдоль этой гидравлической системы, соответствующие изменения линейной скорости жидкости изменяют динамическую составляющую, как показывает приведенное выше уравнение.
Пусть в сциях гидравлической системы А и С ρ будет равно 1 г/см3 и пусть v будет равна 100 см/с. вспомним также, что 1 мм рт.ст. равен 1330 дин/см2. Тогда:
Пусть в узкой сции трубки, В, линейная скорость жидкости будет в 2 раза больше линейной скорости в сциях А и С. Поэтому в узкой сции гидравлической системы
Следовательно, в широких сциях гидравлической системы (А и С) значения бокового давления (Р2 и будут лишь на 3,8 мм рт.ст. ниже соответствующих значений общего давления (Р1 и Р5), тогда как в узкой сции гидравлической системы (В) боковое давление (Р4) будет ниже общего давления (Р3) на 15 мм рт.ст.
На основании этих вычислений мы можем сделать два обобщения. Первое: при уменьшении линейной скорости доля динамической составляющей (величина которой, как вы помните, зависит от кинетической энергии текущей жидкости) в общем давлении тоже уменьшается. Второе: в узких участках гидравлической системы динамическая составляющая значительно увеличивается, потому что линейная скорость потока жидкости связана с освобождением кинетической энергии.
Записи давления, представленные на рис. 6-60 В, были получены с помощью двух датчиков давления, вставленных в левый желудочек сердца, у пациента со стенозом устья аорты. Когда оба датчика находились глубоко в полости левого желудочка (рис. 6-60 В1), оба они регистрировали одинаковое давление. Однако когда ближайший датчик был помещен в устье аорты в области клапанов (рис. 6-60 В2), боковое давление, зарегистрированное во время сердечного выброса, оказалось значительно ниже давления, зарегистрированного датчиком, находившимся в полости желудочка. Причина этой разницы давлений почти целиком заключается в том, что в суженном устье аорты линейная скорость кровотока гораздо выше, чем в полости желудочка.
Рис. 6-60. Связь между линейной скоростью кровотока и боковым давлением.
А - в узкой сции В гидравлической системы линейная скорость, v, а следовательно, и динамическая составляющая давления, ρν2/2, больше, чем в широких сциях этой же гидравлической системы, А и С. Если общая энергия является фактически постоянной на протяжении всей гидравлической системы (т.е. если потерей энергии из-за вязкости жидкости можно пренебречь), то значения общего давления (Р1, Р3 и Р5) не будут сколько-нибудь ощутимо отличаться друг от друга, но боковое давление, Р4, в узкой сции будет меньше бокового давления (Р2 и Р6) в широких сциях трубки. Б - линейная скорость кровотока в восходящем и нисходящем участках аорты собаки. В - показатели давления (Р), записанные двумя датчиками у пациента со стенозом аорты. В1 - оба датчика находились в левом желудочке (ЛЖ-ЛЖ); В2 - один датчик в левом желудочке, а другой в устье аорты в области клапанов (ЛЖ-УА); В3 - один датчик находился в левом желудочке, а другой - в восходящем участке аорты (ЛЖ-ВА)
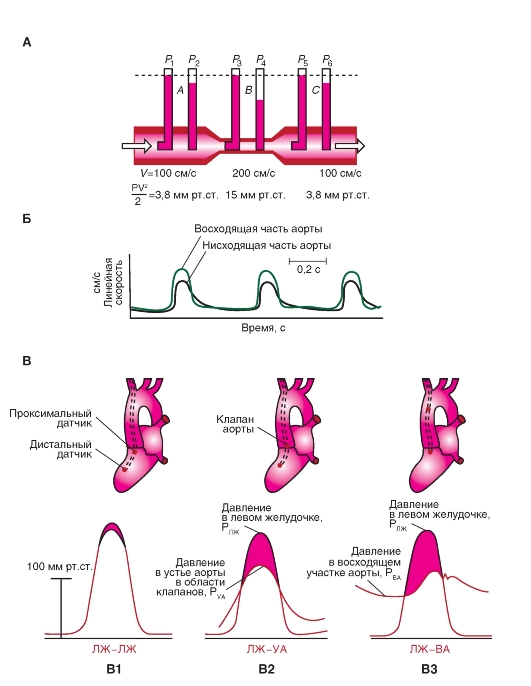
Ламинарный и турбулентный потоки жидкости в сосуде
Введем ряд понятий. Термин «равномерный поток - steady flow» означает отсутствие изменений в потоке жидкости на протяжении времени (т.е. не пульсирующий поток жидкости). Термин ламинарный поток - laminar flow является таким типом движения, когда жидкость движется в виде последовательности отдельных слоев, причем каждый слой движется со своей скоростью, отличной от скорости соседних слоев (рис. 6-61 А). При ламинарном течении в трубке жидкость состоит из последовательности бесконечно малых тонких концентрических слоев, скользящих один относительно другого.
По мере движения жидкости в трубке тонкий слой жидкости, соприкасающийся со стенками трубки, прилипает к стенкам и, таким образом, остается неподвижным. Слой жидкости, находящийся ближе к центру непосредственно после этого тонкого внешнего слоя, должен продвигаться мимо неподвижного слоя, и поэтому этот слой движется медленно, но с умеренной скоростью. По этому же принципу следующий слой, расположенный ближе к центру, движется быстрее; продольный профиль скорости здесь имеет форму параболоида. Частицы жидкости, находящиеся в любом слое, остаются в этом же слое, пока жидкость движется в трубке в продольном направлении. Скорость в осевой части потока максимальна и в 2 раза выше средней скорости потока на всей площади поперечного сечения трубки.
Беспорядочное движение частиц жидкости может привести к развитию неравномерного течения жидкости в трубке; такое течение называется турбулентным. При таких условиях частицы
жидкости не остаются в определенном слое, а происходит их быстрое перемешивание в радиальном направлении (рис. 6-61 Б). Для продвижения заданного потока жидкости по одной и той же трубке требуется значительно большее давление при турбулентном потоке, чем при ламинарном. При турбулентном течении падение давления примерно пропорционально квадрату скорости потока, тогда как при ламинарном течении падение давления пропорционально скорости потока в первой степени. Таким образом, чтобы создать заданный поток жидкости, насос, такой, как сердце, должен проделать значительно большую работу при возникновении турбулентного течения.
Турбулентным или ламинарным будет течение жидкости в трубке при заданных условиях, можно предсказать с помощью безразмерной величины, называемой числом Рейнольдса, NR. Эта величина представляет собой отношение сил инерции к силе внутреннего трения (вязкости). Для жидкости, текущей в цилиндрической трубке,
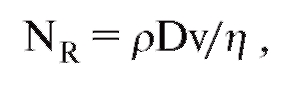
где ρ - плотность жидкости, D - диаметр трубки, v - средняя скорость и η - вязкость. При NR менее 2000 течение обычно бывает ламинарным; при NR больше 3000 течение будет турбулентным; при NR от 2000 до 3000 течение будет переходным между ламинарным и турбулентным. Уравнение показывает, что высокая плотность жидкости, большие диаметры трубок, высокая линейная скорость потока и низкая вязкость жидкости предрасполагают к возникновению турбулентности. Кроме перечисленных причин, турбулентность может быть вызвана резким изменением размеров трубки или неровностями стенок трубки.
Рис. 6-61. Ламинарный и турбулентный потоки жидкости в сосуде.
А - при ламинарном течении все мельчайшие частицы жидкости движутся в потоках, параллельных оси трубки; движения жидкости в радиальном направлении или по окружности не происходит. Пристеночный слой жидкости неподвижен; центральный поток жидкости в трубке имеет максимальную скорость. Б - в турбулентном потоке мельчайшие частицы жидкости беспорядочно движутся в центральном, радиальном и круговом направлениях. Часто наблюдаются вихревые движения и переход через среднюю линию
Объемная скорость течения жидкости зависит от давления
Гемодинамика подчиняется основным главным законам гидродинамики, а основной закон, которому подчиняется движение жидкостей в цилиндрических трубках, был выведен эмпирическим путем Пуазейлем.
Закон Пуазейля применим только к равномерному ламинарному потоку ньютоновских жидкостей в цилиндрических трубках. (Подробнее термин «ньютоновские жидкости» будет объяснен ниже).
Говоря упрощенно, закон Пуазейля описывает движение жидкостей в цилиндрических трубках, используя такие характеристики, как объемная скорость, давление, размеры трубки и вязкость жидкости, находящейся в трубке. На следующих страницах эти термины рассмотрены подробно и затем соотнесены друг с другом для выведения закона Пуазейля.
Давление является одной из главных причин, определяющих скорость потока. Давление Р, измеряемое в динах/см2, на расстоянии h см ниже поверхности жидкости равно:
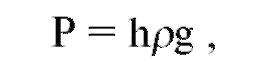
где ρ - это плотность жидкости, измеряемая в г/ см3, аg - это ускорение силы тяжести в см/с2. Однако для удобства давление часто выражают просто как высоту столба жидкости (h) над произвольной исходной точкой.
Рассмотрим трубку, соединяющую резервуары R1 и R2 на рис. 6-62 А. Резервуар R1 заполнен
жидкостью на высоту h1, а резервуар R2 - пуст. Поэтому давление жидкости, вытекающей в резервуар R2 из соединяющей эти резервуары трубки, обозначенное как Р0, равно атмосферному давлению, которое следует принять за нулевой, или исходный, уровень. Давление жидкости, втекающей в трубку из резервуара R1, обозначенное как Рi, будет равно сумме исходного уровня и высоты столба жидкости h1 в резервуаре R1. При этом пусть объемная скорость жидкости (Q), протекающей через трубку будет равна 5 мл/с.
На рис. 6-62 Б, резервуар R1 наполнен до высоты h2, которая в 2 раза больше, чем h1, а резервуар R2 снова пуст. Объемная скорость жидкости в части В рисунка в два раза больше, чем в части А (т.е. 10 мл/с). Следовательно, когда давление жидкости, вытекающей в резервуар R2 из соединяющей эти резервуары трубки, обозначенное как (Р0) равно нулю, объемная скорость прямо пропорциональна давлению жидкости Рi втекающей в трубку из резервуара R1. Если сейчас дать резервуару R2 заполниться на высоту h1, а уровень жидкости в R1 поддерживать на высоте h2 (как на рис. 6-62 В), то объемная скорость снова будет 5 мл/с. Следовательно, объемная скорость жидкости прямо пропорциональна разнице между давлением втекающей в трубку жидкости и давлением вытекающей из трубки жидкости:
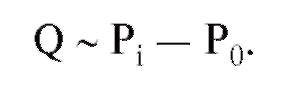
Если уровень жидкости в R2 достигнет такой же высоты, как в R1, движение жидкости по трубке прекратится (рис. 6-62 Г).
Рис. 6-62. Объемная скорость жидкости, Q, в трубке, соединяющей два резервуара, R1 и R2, пропорциональна разнице между давлением Рi в том конце трубки, по которому жидкость втекает в трубку из резервуара R1 , и давлением Р0 в том конце трубки, из которой жидкость вытекает из трубки в резервуар R2.
А - когда R2 пуст, жидкость течет из R1 в R2 со скоростью, пропорциональной давлению в Б - когда уровень жидкости в R1 поднимается в два раза, объемная скорость жидкости пропорционально увеличивается. В - объемная скорость жидкости, текущей из R1 в R2, пропорциональна разнице давлений в резервуарах R1 и R2. Г - когда давление в R2 повышается и становится равным давлению в R1, движение жидкости в соединяющей трубке прекращается
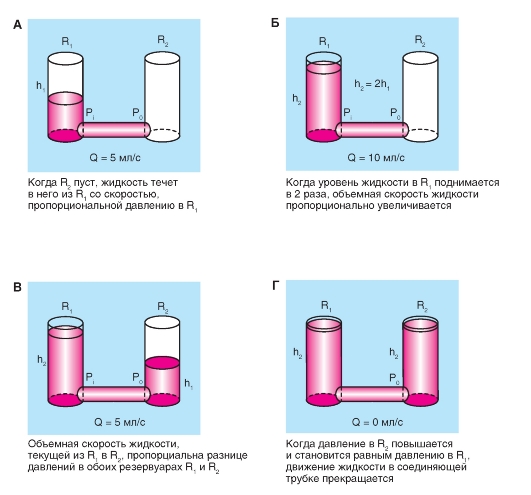
Зависимость объемной скорости от размеров трубки
Рассмотрим, как на объемную скорость влияют размеры трубки. При любой заданной разнице давлений в двух концах трубки объемная скорость зависит от размеров трубки. Рассмотрим трубку, соединенную с резервуаром на рис. 6-63 А. При длине трубки l1 и радиусе r1 объемная скорость Q1 равна 10 мл/с. Трубка, соединенная с резервуаром на рис. 6-63 Б, имеет такой же радиус, но вдвое длиннее трубки, представленной в части А рисунка. При таких условиях объемная скорость Q2 будет равна 5 мл/с, или лишь 1/2 объемной скорости Q1. Другими словами, объемная скорость жидкости обратно пропорциональна длине трубки:
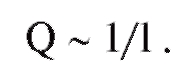
Длина трубки, соединенной с резервуаром на рис. 6-63 В равна l1, но ее радиус, r3, в 2 раза больше r1. В этих условиях наблюдается увеличение объемной скорости Q3, до 160 мл/с, что в 16 раз больше Q1. Точные измерения, сделанные Пуазейлем, позволили установить, что объемная скорость жидкости прямо пропорциональна радиусу трубки в четвертой степени:
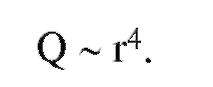
Таким образом, так как r3 = 2r1, в вышеприведенном примере Q3 будет пропорциональна (2r1)4 , или 16r14 ; поэтому Q3 будет равна 16Q1.
На рис. 6-63 Г продемонстрировано влияние вязкости жидкости на объемную скорость. Детально этот вопрос обсуждается на следующем рисунке.
Рис. 6-63. Объемная скорость жидкости в трубке, Q, обратно пропорциональна длине трубки, l, и вязкости жидкости, η, и прямо пропорциональна радиусу трубки, r, в четвертой степени.
А - исходное условие: при заданных величинах давления, длины, радиуса и вязкости пусть объемная скорость, Q1, будет равна 10 мл/с. Б - если длину трубки увеличить вдвое, объемная скорость уменьшится на 50%. В - если радиус трубки увеличить вдвое, объемная скорость увеличивается в 16 раз. Г - если вязкость жидкости увеличивается в 2 раза, объемная скорость уменьшается на 50%
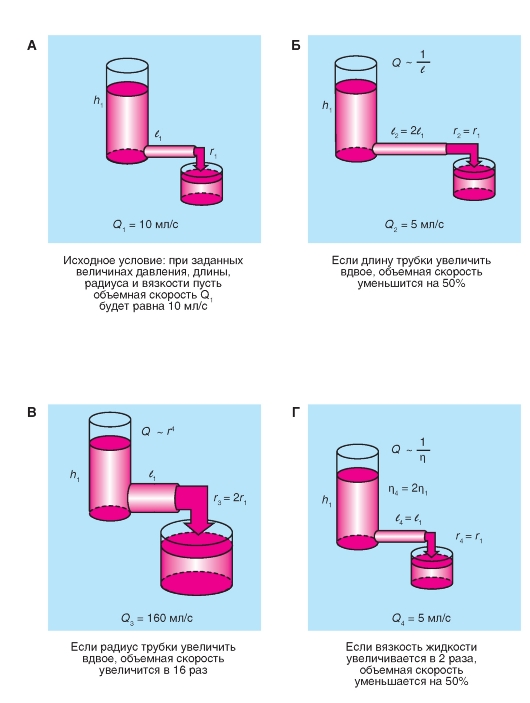
Вязкость крови
При заданной разнице давлений и при заданных размерах цилиндрической трубки объемная скорость жидкости зависит и от природы самой жидкости. Свойство жидкостей, влияющее на скорость их движения, называется вязкостью η, которую Ньютон определил как отношение напряжения сдвига (shear stress) к скорости сдвига (shear rate).
Смысл этих терминов можно яснее всего понять, рассматривая поток однородной жидкости между параллельными пластинами. На рис. 6-64 нижняя пластина (дно большого бассейна) неподвижна, а верхняя пластина движется по поверхности жидкости. Напряжение сдвига τ, определяется как отношение F:A, где F - сила, приложенная к верхней пластине в направлении ее движения по поверхности жидкости, а А - это площадь верхней пластины, соприкасающаяся с жидкостью. Скорость сдвига равна du/dy, где u - это линейная скорость мельчайшей частицы жидкости в направлении, параллельном движению верхней пластины, а у - это расстояние от этой частицы текущей жидкости до нижней, неподвижной пластины.
Для пластины, которая движется с постоянной скоростью U по поверхности однородной жидкости, тип скорости потока жидкости будет линейным. Слой жидкости, соприкасающийся с верхней пластиной, будет прилипать к ней и поэтому двигаться с той же самой скоростью U, что и пластина. Каждая мельчайшая частица жидкости между пластинами будет двигаться со скоростью u, пропорциональной расстоянию у, на которое частица отстоит от нижней пластины. Поэтому скорость сдвига будет равна U/Y, где Y - это расстояние
между двумя пластинами. Так как вязкость η определяется как отношение напряжения сдвига τ, к скорости сдвига, du/dy, то в примере, показанном на рис. 6-64,
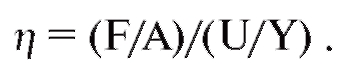
Таким образом, единица измерения вязкости - это дин/см2, деленный на (см/с)/см, или дин•с/см2. В честь Пуазейля 1 дин•с/см2 был назван Пуазом. Вязкость воды при 20 °С составляет примерно 0,01 пуаза, или 1 сантипуаз. У ряда неоднородных жидкостей, в особенности у суспензий, таких, как кровь, отношение напряжения сдвига к скорости сдвига не является постоянным, т.е. жидкость не обладает постоянной вязкостью. Такие жидкости называютненьютоновскими. Что касается движения ньютоновских жидкостей в цилиндрических трубках, то их объемная скорость изменяется обратно пропорционально их вязкости.
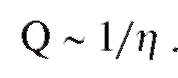
Возвращаясь к примеру с движением жидкости из резервуара: если вязкость жидкости в резервуаре увеличится вдвое, объемная скорость уменьшится в 2 раза (5 мл/с вместо 10 мл/с).
Подытожим: при равномерном ламинарном течении ньютоновской жидкости в цилиндрической трубке объемная скорость жидкости, Q, изменяется прямо пропорционально разнице давлений, Pi - Po, и радиусу трубки, r, в четвертой степени, и обратно пропорционально длине трубки, l, и вязкости жидкости, η. Полная формула закона Пуазейля выглядит следующим образом:
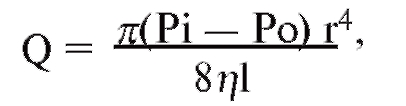
где π/8 - коэффициент пропорциональности.
Рис. 6-64. Для ньютоновской жидкости вязкость η определяется как отношение напряжения сдвига τ к скорости сдвига du/dy. Для пластинки, плывущей по поверхности жидкости и имеющей площадь соприкосновения с поверхностью жидкости А, τ равно отношению силы F, приложенной в направлении движения, к площади соприкосновения А; du/dy равно отношению линейной скорости пластинки U к глубине жидкости Y
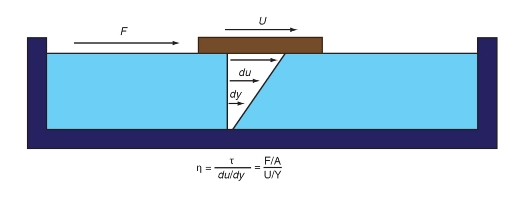
Сопротивление при последовательном и параллельном расположениях сосудов
Применение закона Пуазейля показывает, что сопротивление потоку жидкости зависит только от размеров трубки и характеристик жидкости:
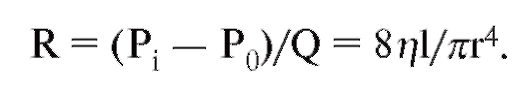
Так как изменения сопротивления обратно пропорциональны радиусу трубки в четвертой степени, основным фактором, определяющим сопротивление кровотоку в любом отдельном сосуде системы кровообращения, является диаметр сосуда.
Сопротивление последовательно расположенных сосудов продемонстрировано на рис. 6-65 А. В этой системе три гидравлических сопротивления, R1, R2 и R3, расположены последовательно. Общее падение давления в системе, т.е. разница между давлением притекающей жидкости, Pi, и давлением вытекающей жидкости, P0, представляет собой сумму значений разницы давлений в каждом отдельном сопротивлении (уравнение а). При статичном состоянии системы объемная скорость жидкости, Q, в любом заданном поперечном сечении должна быть равна объемной скорости в любом другом поперечном сечении. При делении каждого компонента уравнения а на Q (уравнение b) из определения сопротивления становится очевидным, что при последовательно расположенных сопротивлениях общее сопротивление всей системы, Rt, равно сумме сопротивлений всех отдельных элементов, т.е.
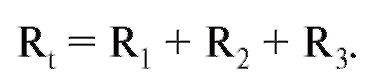
Сопротивление параллельно расположенных сосудов продемонстрировано на рис. 6-65 Б. При параллельном расположении сопротивлений давление притекающей жидкости и давление вытекающей жидкости одинаковы у всех трубок. При статичном состоянии системы общая объемная скорость, Qt, равна сумме объемных скоростей
в отдельных параллельно расположенных элементах системы (уравнение а). Так как градиент давления (Рi - Р0) один и тот же во всех параллельно расположенных элементах, каждую составляющую уравнения а можно разделить на этот градиент для получения уравнения b. Из определения сопротивления можно вывести уравнение с, которое устанавливает, что при параллельном расположении сосудов обратная величина общего сопротивления, Rv, равна сумме обратных величин отдельных сопротивлений, т.е.:
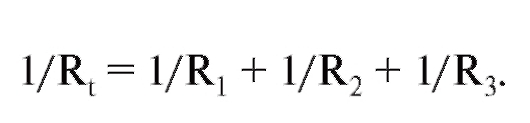
Более простой способ вывести это отношение - использовать термин «гидравлическая проводимость», которую можно определить как величину, обратную сопротивлению.
Сопротивление кровотоку малых артерий и артериол (что демонстрируется падением давления от артериол до капиллярных концов этих сосудов) значительно выше сопротивления кровотоку других сосудов артериальной системы, таких как крупные артерии, несмотря на то, что общая площадь поперечного сечения малых артериальных сосудов превышает площадь поперечного сечения крупных артерий (рис. 6-65 В).
Рассмотрение простых моделей систем, состоящих из параллельных трубок, поможет понять этот явный парадокс. На рис. 6-65 В сопротивление потоку жидкости в одной широкой трубке, имеющей площадь поперечного сечения Аw, сравнивается с сопротивлением потоку жидкости в четырех более узких трубках, расположенных параллельно, с площадью поперечного сечения каждой трубки An. Общая площадь поперечного сечения четырех параллельных узких трубок равна площади поперечного сечения широкой трубки. Анализ показывает, что общее сопротивление Rt четырех узких параллельных трубок в 4 раза больше сопротивления одной широкой трубки Rw при одинаковой общей площади поперечного сечения.
Рис. 6-65. Сопротивление кровотоку.
А - при последовательном расположении общее сопротивление, Rt, равно сумме сопротивлений отдельных элементов (R1, R2 и R3). P - давление, Q - объемная скорость потока. Б - при параллельном расположении величина, обратная общему сопротивлению, Rt, равна сумме обратных величин сопротивлений отдельных элементов. В - когда четыре узкие трубки, каждая площадью поперечного сечения Аn, расположены параллельно, их общая площадь поперечного сечения равна площади поперечного сечения широкой трубки, Aw, т.е. Aw = 4Аn. Хотя общие площади поперечного сечения равны, общее сопротивление потоку жидкости в параллельных узких трубках, Rt, в 4 раза выше сопротивления потоку жидкости в одной широкой трубке, Rw. Rn - сопротивление одной узкой трубки; k - коэффициент пропорциональности
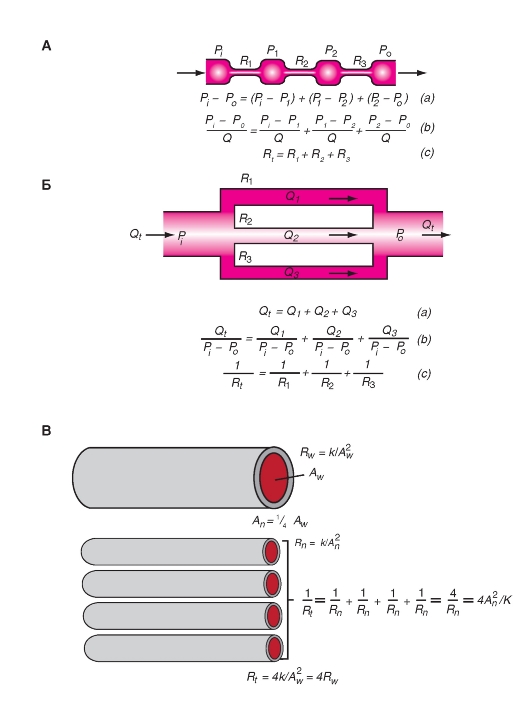
Реология крови
Вязкость ньютоновской жидкости, такой, как вода, можно определить с помощью измерения равномерного ламинарного течения жидкости при заданном градиенте давления в цилиндрической трубке известной длины и радиуса. Вязкость затем вычисляется подстановкой этих величин в уравнение Пуазейля. Вязкость определенной ньютоновской жидкости при определенной температуре будет постоянной при любых размерах трубки и объемной скорости потока. Однако вязкость неньютоновской жидкости, вычисленная с помощью уравнения Пуазейля, может значительно изменяться в зависимости от размеров трубки и объемной скорости потока. Поэтому при рассмотрении реологических свойств суспензии, такой, как кровь, термин «вязкость» имеет не одно значение. Термины аномальная вязкость и структурная вязкость (apparent viscosity) часто применяют для обозначения вязкости крови, в условиях, в которых проводились измерения.
С точки зрения реологии кровь представляет собой суспензию форменных элементов, главным образом, эритроцитов, в относительно однородной жидкости - плазме крови. Так как кровь - это суспензия, то структурная вязкость крови меняется в зависимости от гематокритного числа (отношения объема красных кровяных клеток к объему цельной крови). Вязкость плазмы в 1,2-1,3 выше вязкости воды. У крови с нормальным числом гематокрита - 45% - структурная вязкость в 2,4 раза выше, чем у плазмы.
При любом заданном гематокритном числе структурная вязкость крови зависит от размеров трубки, используемой при измерении вязкости. Структурная вязкость крови прогрессивно уменьшается, когда диаметр трубки становится меньше 0,3 мм. Диаметр артериол - кровеносных сосудов, имеющих самое высокое сопротивление, -
значительно меньше этого критического значения. Это и является причиной уменьшения сопротивления кровотоку в кровеносных сосудах с наибольшим сопротивлением. Влияние диаметра трубки на структурную вязкость крови частично объясняется действительным изменением состава крови при ее движении через маленькие трубки. Состав изменяется, потому что красные кровяные клетки собираются в быстром центральном потоке, тогда как плазма чаще движется в более медленных боковых слоях.
К чему приводит разница скорости движения красных кровяных клеток и скорости плазмы, можно понять на примере следующей аналогии: рассмотрим движение транспортного потока по тоннелю длиной 3 мили. Пусть автомобили движутся по одной линии со скоростью 60 миль в час, а грузовики по другой линии со скоростью 20 миль в час, как показано на рис. 6-66. Если каждую минуту одна автомашина и один грузовик въезжают в тоннель и начинают свое движение в тоннеле, тогда, за исключением нескольких первых минут движения транспорта, каждую минуту одна автомашина и один грузовик будут подъезжать к другому концу тоннеля. Если посчитать фактическое количество автомобилей и грузовиков в тоннеле в любой момент, то окажется, что медленно движущихся грузовиков в тоннеле в 3 раза больше, чем быстро проезжающих машин.
Так как центральные слои кровотока содержат больше красных кровяных клеток и движутся с большей скоростью, то красные кровяные клетки обычно проделывают весь путь по трубке быстрее, чем плазма. Поэтому в вышеприведенной аналогии красные кровяные клетки соответствуют быстро проезжающим автомобилям, а плазма - медленно движущимся грузовикам. Измерение времени прохождения крови через различные органы показало, что красные кровяные клетки движутся быстрее плазмы.
Рис. 6-66. Модель, демонстрирующая разницу скорости движения красных кровяных клеток и скорости плазмы.
Когда скорость автомобиля в 3 раза больше скорости грузовика, отношение количества автомобилей к количеству грузовиков на мосту будет 1:3 после 9 мин движения, даже если каждую минуту по одной машине каждого типа въезжает в тоннель и выезжает из тоннеля
Гидравлический фильтр артериальной системы
Основной функцией артериальной системы большого круга кровообращения и артериальной системы легких является доставка крови в капилляры сосудистого русла всего организма. Артериолы - кровеносные сосуды, которыми заканчивается ветвление артерий. Артериолы являются сосудами высокого сопротивления, которые регулируют распределение кровотока к различным капиллярам. В силу своей эластичности аорта, легочная артерия и их основные ветви формируют систему сосудов, способных вмещать значительные объемы крови. Два этих свойства артериальной системы, ее эластичность и высокое сопротивление артериол, делают артериальную систему организма схожей с жидкостной системой, называемой гидравлическим фильтром, который способен смягчать колебания кровотока (жидкости). Таким образом, артериальная система организма представляет собой гидравлический фильтр. Этот фильтр является аналогом RC-фильтров (сопротивление-емкость) в электрических цепях.
Главное назначение артериальной системы как гидравлического фильтра состоит в том, что она преобразует прерывистый (пульсирующий) выброс из сердца в непрерывный кровоток через капилляры. Эта важная функция магистральных эластичных артерий вызывает ассоциацию с воздушными (компрессорными) камерами старинных ручных пожарных насосов. Такая камера содержала значительный объем сжатого воздуха. Сжатие воздуха, который оставался над уровнем
воды в воздушной камере, преобразовывало поступающую внутрь прерывистую струю воды из пожарной бочки в непрерывный поток на выходе из брандспойта пожарного шланга. Без такой воздушной камеры вода поступала бы рывками, делая борьбу с огнем, в лучшем случае, неэффективной, а в худшем - опасной.
Роль, которую играют крупные эластичные артерии в такой функции, как гидравлический фильтр, демонстрируется на рис. 6-67. В силу того, что сердце производит выброс крови прерывисто, весь объем сердечного выброса попадает в артериальную систему в период систолы. Систола обычно занимает всего лишь около 1/3 сердечного цикла. Однако, фактически, большая часть систолического объема в действительности перекачивается в момент короткой фазы быстрого изгнания, которая составляет около половины продолжительности систолы. Лишь незначительная часть энергии сердечного сокращения рассеивается, т.е. переходит в кинетическую энергию движущейся крови к капиллярам во время систолы. Большая часть энергии сохраняется - переходит в потенциальную энергию сосудистой стенки за счет ее растяжения кровью, поступившей в аорту при систоле (рис. 6-67 А и Б). Во время диастолы эластичная отдача (т.е. стремление эластичных артериальных стенок вернуться к исходному состоянию) превращает эту потенциальную энергию в кинетическую энергию потока крови, движущегося к капиллярам. Если бы артериальные стенки были жесткими, то кровоток к капиллярам во время диастолы прекращался бы (рис. 6-67 В и Г).
Рис. 6-67. При нормальной эластичности артерий кровь проходит через капилляры в течение всего сердечного цикла. Если артерии ригидны, то кровь проходит через капилляры во время систолы, а во время диастолы кровоток прекращается
Функция гидравлического фильтра
Гидравлический фильтр уменьшает рабочую нагрузку сердца. Для перекачки имеющегося пульсирующего кровотока требуется больше усилий, чем для равномерного. Чем более эффективно работает гидравлический фильтр, тем меньше усилий требуется. Проиллюстрируем примером.
Рассмотрим сначала равномерный поток жидкости, протекающий со скоростью 100 мл/с через гидравлическую систему, имеющую сопротивление 1 мм рт.ст.(мл/с). Такая комбинация скорости потока и сопротивления даст в результате постоянное давление в 100 мм рт.ст., как показано на рис. 6-68 А. Если пренебречь некоторой долей инерции, то гидравлическая работа W, может быть определена как
То есть, каждое бесконечно малое приращение перекачиваемого объема dV, умножается на связанное с ним давлению Р, и результат (PdV) интегрируется в течение отрезка времени, t2 - t1 , чтобы определить всю работу W.
Для равномерного потока,
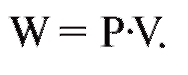
В примере на рис. 6-68 А работа по перекачиванию жидкости за 1 с, составит 10000 мм рт.ст. • мл (или 1.33•107 дин•см).
Далее, рассмотрим пульсирующий насос, который выдает тот же самый объем в сунду, но перекачивает его с постоянной скоростью за 0,5 с, и затем работает вхолостую в течение второй половины секунды. Следовательно, он качает со скоростью 200 мл/с в течение 0,5 с, как показано на рис. 6-68 Б и В. На рис. 6-68 Б гидравлическая система (труба) регидная (жесткая) и жидкость несжимаема, но гидравлическая система обладает тем же сопротивлением, что и на рис. 6-68 А. Во время фазы выброса жидкости из насоса (систолы) поток со скоростью
200 мл/с при сопротивлении 1 мм рт.ст./(мл/с) будет создавать давление в 200 мм рт.ст. Во время фазы заполнения насоса (диастолы) давление будет равно 0 мм рт.ст. в этой жесткой гидравлической системе. Работа, выполненная во время систолы, составит 20 000 мм рт.ст. • мл, что вдвое больше, чем требуемая работа в примере, показанном на рис. 6-68 А.
Чем более растяжима система, тем эффективнее работает гидравлический фильтр. Причиной этой возросшей эффективности является то, что в очень растяжимой системе давление остается фактически постоянным в течение всего цикла (рис. 6-68 В). Из 100 мл жидкости, перекачанной за 0,5 сунды систолы, только 50 мл будут пропущены через выходящий конец этой системы, обладающий высоким сопротивлением в течение систолы. Оставшиеся 50 мл во время систолы останутся в растяжимой трубе и вытекут во время диастолы. Следовательно, давление будет фактически постоянным на уровне 100 мм рт.ст. на протяжении всего цикла. Жидкость, перекачанная во время систолы, будет выброшена при давлении, вдвое меньшем, чем то, которое преобладало на рис. 6-68 Б, и таким образом, работа будет вдвое меньше. При почти идеальном гидравлическом фильтре, как показано на рис. 6-68 В, работа будет идентична той, которая бывает при равномерном движении потока жидкости (рис. 6-68 А).
Функция гидравлического фильтра, выполняемая артериальной системой большого и малого кругов кровообращения, является промежуточной между системой с регидными трубками, показанными на рис. 6-68 Б, и системой с идеально растяжимыми трубками, представленными на рис. 6-68 В. В норме дополнительная работа, обусловленная прерывистым характером сердечной деятельности, которое не требуется при постоянном кровотоке, составляет до 35% для правого желудочка и до 10% - для левого. Однако эти соотношения изменяются при изменении частоты сердечных сокращений, сопротивления периферических сосудов и растяжимости артерий.
Рис. 6-68. Взаимодействие между давлением и потоком жидкости для трех гидравлических систем. В каждой общая скорость потока жидкости составляет 100 мл/с, а сопротивление равняется 1 мм рт.ст./(мл/с)
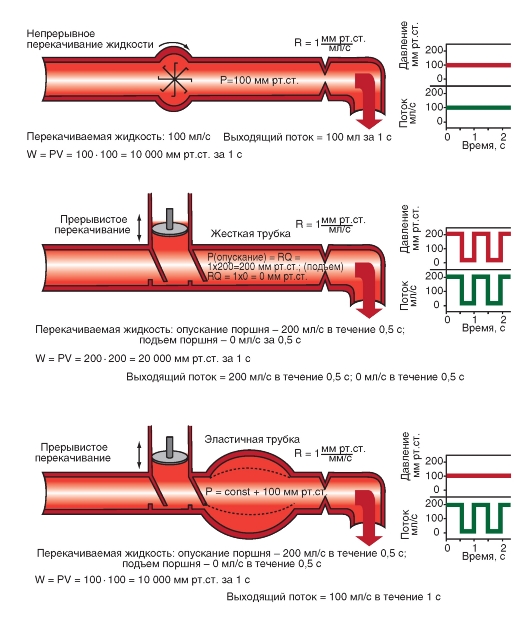
Среднее артериальное давление
Среднее артериальное давление Ра, можно определить, исходя из кривой артериального давления, путем измерения площади, расположенной под кривой, и разделив эту площадь на соответствующий интервал времени. Альтернативно Ра можно, рассчитать с достаточной степенью точности с помощью измерения значений систолического (Ps) и диастолического (Pd) давлений на основе следующей формулы:
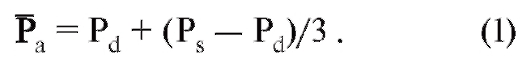
Как отмечено выше, в этом обсуждении мы полагаем, что среднее артериальное давление зависит только от двух физических факторов: среднего объема крови в артериальной системе и compliance артериальной системы. Артериальный объем Va, в свою очередь, зависит от скорости притока крови Qh в артерии из сердца (сердечный выброс) и скорости, с которой кровь вытекает из артерий Qr через сосуды сопротивления (периферический отток). Математически такие взаимосвязи могут быть выражены как:
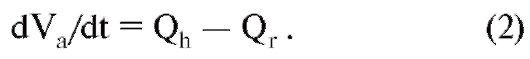
Уравнение в действительности является выражением закона сохранения массы. Оно подтверждает, что изменение объема артериальной крови в единицу времени (dVa/dt) представляет собой разницу между скоростью, при которой сердце перекачивает кровь в артериальную систему (Qh) и скоростью, при которой кровь вытекает из артериальной системы через сосуды сопротивления (Qr). Если приток крови в артериальную систему превышает отток, то объем крови в артериальной системе увеличивается и артериальные стенки растягиваются в большей степени, и давление повышается. Противоположные события имеют место, когда отток крови из артериальной системы превышает ее приток. Когда приток крови в артериальную систему равен оттоку, артериальное давление остается постоянным. Изменение давления в ответ на изменение сердечного выброса может быть лучше понято при рассмотрении простого примера.
Допустим, что в контролируемых условиях сердечный выброс равен 5 л/мин и среднее артериальное давление (Ра) равно 100 мм рт.ст. (рис. 6-69 А). Из определения общего периферического сопротивления:
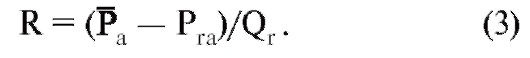
Если Pra (среднее давление в правом предсердии) ничтожно мало в сравнении с Ра, тогда:

Следовательно, в этом примере сопротивление R составляет 100/5, или 20 мм рт.ст.(л/мин). Теперь допустим, что сердечный выброс Qh резко возрос до 10 л/мин (рис. 6-66 Б). В этот момент Ра останется неизменным. Поскольку скорость оттока крови, вытекающей из артериальной системы Qr, зависит от Ра и R, Qr также останется поначалу неизменным. Следовательно, Qh равный теперь 10 л/мин превысит Qr, который все еще равен лишь 5 л/мин. Это повысит средний объем артериальной крови (Va). Из уравнения (2) следует, что если Qh больше Qr, то dVa/dt больше 0, и это значит, что объем увеличился.
Поскольку Ра зависит от среднего объема артериальной крови Va, и артериального compliance Са, увеличение Va вызовет увеличение Ра. По определению,

После перемены частей уравнения местами и деления их на dt,
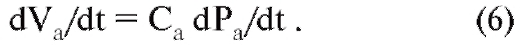
Из уравнения (2) мы можем заменить Qh - Qr на dVa/dt в уравнении (6). Следовательно,
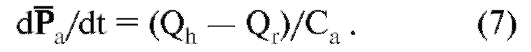
Отсюда, Ра повысится, если Qh > Qr, и понизится, если Qh < Qr, и останется постоянным, если
Qh = Qr.
В примере, когда сердечный выброс (Qh) неожиданно возрос до 10 л/мин, среднее артериальное давление (Ра) продолжает повышаться до тех пор, пока сердечный выброс превосходит скорость оттока крови (Qr) из артериальной системы. Уравнение (4) показывает, что скорость оттока крови из артериальной системы не достигнет 10 л/мин до тех пор, пока среднее артериальное давление не достигнет уровня 200 мм рт.ст., и так долго пока периферическое сопротивление (R) останется постоянным и равным 20 мм рт.ст.(л/мин). Отсюда, по мере того, как среднее артериальное давление приближается к 200 мм рт.ст., скорость оттока крови из артериальной системы будет полностью равна сердечному выбросу, и среднее артериальное давление будет подниматься очень медленно. Но, если сердечный выброс возрастает первично, он значительно превосходит скорость оттока крови из артериальной системы и, следовательно, среднее артериальное давление резко увеличивается.
Рис. 6-69. Взаимосвязь среднего артериального давления со скоростью притока крови в артериальную систему из сердца (Qh), скоростью оттока крови из артериальной системы (Qr) и периферическим сопротивлением (R) в контрольных условиях (A) в ответ на увеличение сердечного выброса (Б и В) и в ответ на увеличение периферического сопротивления (Г и Д)
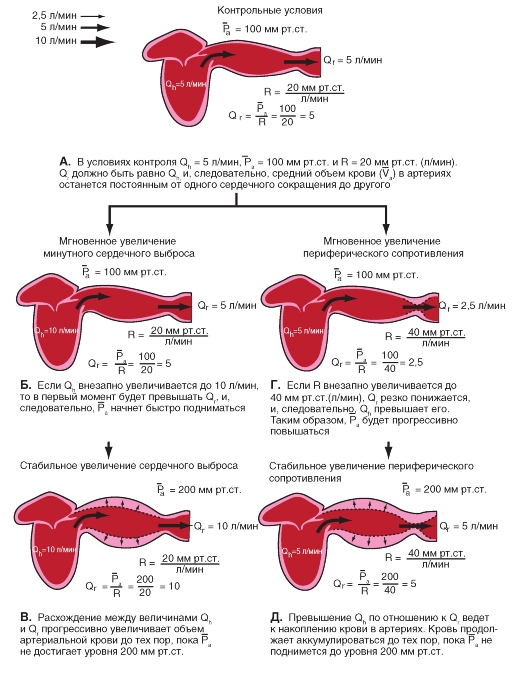
Измерение артериального давления
В больничных отделениях интенсивной терапии существует возможность введения игл или катетеров в периферические артерии пациентов, и артериальное кровяное давление может в этом случае измеряться прямым способом с помощью тензометрических датчиков. В обычных условиях, однако, кровяное давление определяется непрямым способом с помощью сфигмоманометра. Данный прибор состоит из относительно жесткой манжеты, сделанной обычно из плотного материала, внутри которой находится резиновый надувной вкладыш. Манжетой охватывают конечность (обычно плечо); надувной вкладыш оказывается прямо над артерией, которая будет подвергнута сдавливанию. Артерия пережимается в результате надувания резинового вкладыша с помощью резиновой груши для нагнетания воздуха до величины, превосходящей артериальное систолическое давление. Давление воздуха в надувном вкладыше измеряется при помощи ртутного или анероидного манометра. Давление в надувном вкладыше снижается со скоростью 2-3 мм рт.ст. в сунду через игольчатый клапан в надувной груше.
Когда показатели кровяного давления исследуются в районе предплечья, систолическое давление может быть определено путем пальпации лучевой артерии на запястье (метод пальпации). Пока давление в надувном вкладыше превышает уровень систолического давления, пульс не прощупывается. По мере падения давления чуть ниже систолического уровня (рис. 6-70 А) порция крови на пике систолы проходит через плечевую артерию под манжетой, и слабый пульс будет прощупываться на запястье.
Аускультативный метод является более чувствительным и, следовательно, более точным способом
измерения систолического давления. Этот метод также позволяет определить уровень диастолического давления. Врач ведет прослушивание при помощи фонендоскопа, приложенного к коже в области локтевого сгиба над плечевой артерией. До тех пор, пока давление в надувном вкладыше превышает систолическое, плечевая артерия перекрыта, и никаких звуков не слышно (рис. 6-70 Б). Когда давление сжатого воздуха в надувном вкладыше падает чуть ниже уровня систолического (120 мм рт.ст. на рис. 6-70 А), небольшая порция крови преодолевает давление в манжете, и появляются слабые, едва слышные звуки при каждом ударе сердца (называемые, тоны Короткова). Давление, при котором отмечается самый первый звук, и представляет собой систолическое давление. Он обычно точно соответствует показателям систолического давления, измеренного прямым способом.
По мере того, как давление сжатого воздуха в манжете продолжает снижаться, большие порции крови проникают под манжету при каждом сокращении сердца, и звуки становятся громче. Когда давление сжатого воздуха приближается к диастолическому, тоны Короткова становятся глуше. Когда же давление сжатого воздуха падает чуть ниже диастолического уровня (80 мм рт.ст. на рис. 6-70 А), звуки исчезают; величина давления в этой точке соответствует диастолическому давлению. Происхождение тонов Короткова обусловлено прерывистыми толчками крови, которая проходит под манжетой и сталкивается со статическим столбом крови ниже манжеты; удар и турбулентность порождают улавливаемые слухом вибрации. Как только давление сжатого воздуха становится меньше диастолического, кровоток в плечевой артерии становится непрерывным, и звуки больше не прослушиваются (рис. 6-70 В).
Рис. 6-70. Измерение артериального кровяного давления при помощи сфигмоманометра
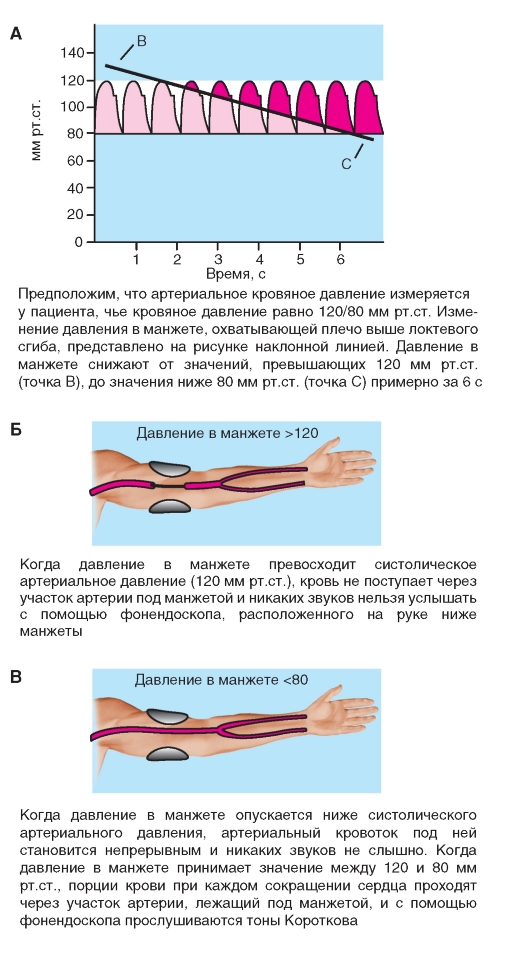
Сфигмография
Сфигмография - регистрация движения артериальной стенки под влиянием давления крови при каждом сердечном сокращении (рис. 6-71). Степень деформации сосудов зависит от состояния сосудистой стенки, от величины среднего и пульсового давления и скорости выброса. Колебания давления и объема распространяются по сосудистой системе в виде пульсовой волны, обладающей определенной скоростью. Скорость пульсовой волны (СПВ) гораздо выше, чем скорость кровотока. Пульсовая волна распространяется до артериол стопы за 0,2 с, тогда как частицы крови за это время едва успевают дойти до нисходящей аорты. Скорость распространения пульсовой волны зависит от эластичности и от соотношения
толщины стенки к ее радиусу. Чем толще стенка сосуда и жестче, тем больше скорость распространения. СПВ аорты = 4-6 м/с, артерии мышечного типа = 8-12 м/с, а в венах СПВ = 1-2 м/с.
Форму пульсовой волны можно исследовать и путем пальпации. Пальпаторно можно получить важные сведения о функциональном состоянии сердечно-сосудистой системы.
1. Частоте.
2. Ритмичности.
3. Напряженности (величине среднего давления).
4. Высоте (высокий, низкий), что зависит от величины ударного объема, а также эластичности амортизирующих сосудов.
5. Скорости (скорый, медленный). Крутизна нарастания зависит от скорости изменения давления.
Рис. 6-71. Сфигмограмма.
А - сфигмограмма сонной артерии: 1 - анакрота, 2 - катакрота, 3 - дикротический зубец, 4 - инцизура. Б - одновременная запись электрокардиограммы во II стандартном отведении (1), фонокардиограммы (2) и каротидной сфигмограммы (3)
Регуляторная функция эндотелия
Много лет эндотелий капилляров рассматривали как инертный однослойный пласт клеток, который служит исключительно пассивным фильтром, позволяющим проходить воде и малым молекулам через стенку кровеносного сосуда и сохраняющим клетки крови и крупные молекулы (белки) в пределах сосудистого русла. Однако теперь признано, что эндотелий является важным источником веществ, которые вызывают сокращение или расслабление гладкой мышцы сосуда.
Одно из этих веществ - простациклин. Как показано на рис. 6-72, простациклин может расслаблять гладкую мышцу сосуда путем увеличения концентрации циклического аденозинмонофосфата (цАМФ). Простациклин образуется в эндотелии из арахидоновой кислоты, и процесс катализируется простациклин синтазой. Механизм, по которому запускается синтез простациклина, неизвестен. Однако простациклин может высвобождаться при действии динамической механической силы, действующей на эндотелий сосуда, которую вызывает пульсирующий кровоток (shear stress). Основная функция простациклина заключается в ингибировании прилипания тромбоцитов к эндотелию и их агрегации, что предотвращает, соответственно, формирование тромба внутри сосуда.
Гораздо более важное значение эндотелия в расширении сосудов имеет синтез и высвобождение выделенного из эндотелия фактора релаксации (EDRF) (рис. 6-72), который был идентифицирован как окись азота (NO). Когда эндотелиаль-
ные клетки стимулируются ацетилхолином или некоторыми другими веществами (аденозинтрифосфатом [АТФ], брадикинином, серотонином, веществом P, гистамином), то продуцируется и высвобождается NO. В кровеносных сосудах, из которых эндотелий был механически удален, эти вещества не вызывают вазодилатацию. NO (синтезируемый из L-аргинина) активирует гуанилатциклазу в гладкой мышце сосуда, чтобы увеличить концентрацию циклического гуанозинмонофосфата (цГМФ), который вызывает релаксацию, уменьшая концентрацию свободного Ca2+ в цитозоле. Высвобождение NO может стимулироваться воздействием динамической механической силы, действующей на эндотелий сосуда, которую взывает пульсирующий кровоток (shear stress), а физиологическую роль NO в местной регуляции кровотока предстоит еще определить. Нитропруссид также увеличивает цГМФ, который вызывает вазодилатацию, но он действует непосредственно на сосудистую гладкую мышцу и его действие не опосредовано эндотелием (рис. 6-72). Сосудорасширяющие средства типа аденозина, водородных ионов, CO2 и калия могут высвобождаться из паренхиматозной ткани и действовать локально на резистивные сосуды (рис. 6-72).
Эндотелий может также синтезировать эндотелин, сильнодействующий сосудосуживающий пептид. Эндотелин может воздействовать на сосудистый тонус и кровяное давление людей и может быть причастным к таким патологическим состояниям, как атеросклероз, легочная гипертензия, застойная сердечная недостаточность и почечная недостаточность.
Рис. 6-72. Опосредованная эндотелием и не опосредованная эндотелием вазодилатация.
Простациклин (PGI2) образуется в эндотелии из арахидоновой кислоты (AA) при действии циклооксигеназы (Cyc Ox) и простациклин синтазы (PGj2Syn) и вызывает релаксацию расположенной рядом васкулярной гладкой мышцы посредством увеличения циклического аденозинмонофосфата (цАМФ). Стимуляция эндотелиальных клеток ацетилхолином (ACh) или другими соединениями (смотрите в тексте) приводит к образованию и высвобождению выделенного из эндотелия фактора релаксации (EDRF), идентифицированного как окись азота (NO). NO стимулирует гуанилатциклазу (ГЦ), что приводит к увеличению циклического гуанозинмонофосфата (цГМФ) в гладкой мышце сосуда, и вызывает релаксацию. Сосудорасширяющее вещество нитропруссид (NP) действует непосредственно на гладкую мышцу сосуда. Такие вещества, как аденозин, водородные ионы (H+), CO2, и ионы калия (K+) могут появляться в паренхиматозной ткани и вызывать вазодилатацию путем непосредственного воздействия на гладкую мышцу сосуда
Транскапиллярный обмен
Проницаемость капиллярной эндотелиальной стенки не одинакова в разных тканях. Некоторая часть воды проходит через мембраны эндотелиальных клеток капилляров, но большая часть проходит через отверстия (поры) эндотелиальной стенки капилляров. Поры у скелетной и сердечной мышцы имеют диаметры около 4 нм. Щели (поры), немногочисленны и составляют только приблизительно 0,02% площади капиллярной поверхности. В капиллярах мозга, где гематоэнцефалический барьер блокирует поступление многих небольших молекул, поры отсутствуют.
В дополнение к щелям, некоторые из более пористых капилляров (например, в почке, кишечнике) содержат фенестрации от 20 до 100 нм в ширину, в то время как другие (например, в печени) имеют прерывистый эндотелий. Фенестрации и прерывистый эндотелий допускают транспорт молекул, которые являются слишком большими, чтобы пройти через щели между клетками эндотелия. Направление и величина перемещения воды через капиллярную стенку может быть определена алгебраической суммой трансмембранного гидростатического и трансмембранного осмотического давления. Увеличение интракапиллярного гидростатического давления способствует движению жидкости из сосуда в интерстициальное пространство, в то время как увеличение концентрации осмотически активных частиц внутри сосуда способствует движению жидкости в сосуды из интерстициального пространства.
Гидростатическое давление является основной силой фильтрации в капиллярах. Капиллярное гидростатическое давление (Pc) в разных тканях различно. Средние значения, полученные прямыми измерениями в коже людей, составляют приблизительно 32 мм рт.ст. в артериальном конце капилляров и 15 мм рт.ст. в венозном конце капилляров на уровне сердца (рис. 6-73). Давление
ткани, или более точно давление интерстициальной жидкости (Pi) вне капилляров, противодействует капиллярной фильтрации. Pc - Pi создает движущую силу для фильтрации. В нормальном (при отсутствии отеков) состоянии Pi близко к нулю, так что гидростатическую движущую силу по существу представляет Pc.
Отношение между гидростатическим давлением и онкотическим давлением и роль этих сил в регулировании транспорта жидкости через капиллярный эндотелий, были детально изложены Starling в 1896 г. и представляют гипотезу Starling. Она может быть выражена уравнением:
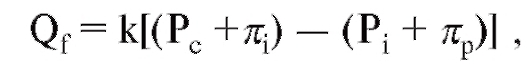
где Qf - движение жидкости, Pc - гидростатическое давление в капилляре, Pi - гидростатическое давление интерстициальной жидкости, πρ - онкотическое давление плазмы, πi - онкотическое давление интерстициальной жидкости, k - константа фильтрации для стенки капилляра.
Фильтрация происходит, когда алгебраическая сумма положительна; абсорбция происходит, когда она отрицательна.
Традиционно считалось, что фильтрация происходит в артериальном конце капилляра, а абсорбция в венозном конце из-за градиента гидростатического давления вдоль капилляра. Эта схема подходит только для теоретического капилляра, изображенного на рис. 6-73. Однако прямые наблюдения показали, что многие капилляры только фильтруют, тогда как другие только абсорбируют. В некоторых сосудистых руслах (например, почечный клубочек), гидростатическое давление в капилляре достаточно высокое, в результате чего фильтрация идет по всей длине капилляра. В других сосудистых руслах (например, слизистая оболочка кишечника), гидростатическая и онкотическая силы таковы, что по всему капилляру происходит абсорбция.
Рис. 6-73. Схематическое изображение факторов, ответственных за фильтрацию и абсорбцию через капиллярную стенку, и образование лимфы
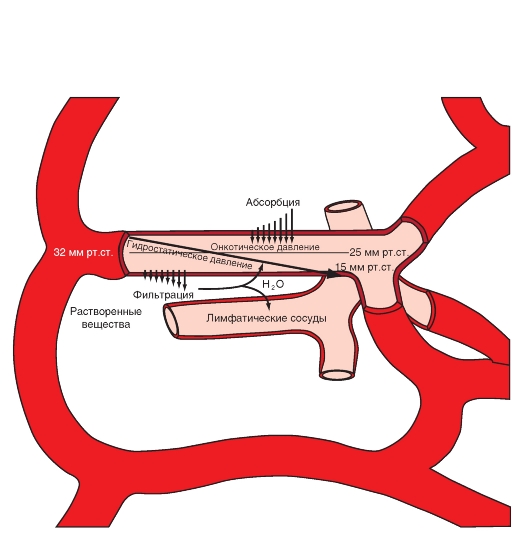
Электромеханическое сопряжение в гладких мышцах сосудов
Гладкомышечные клетки сосудов содержат большое количество тонких (актиновых) филаментов и сравнительно малое количество толстых (миозиновых) филаментов. Эти филаменты выстроены вдоль длинной оси клетки, но они не формируют видимых саркомеров с поперечными полосами. Однако полагают, что в этой ткани действует механизм скольжения филаментов, и фосфорилирование поперечных мостиков регулирует скорость их цикличной работы. По сравнению со скелетной мышцей, гладкая мышца сокращается более медленно, развивает большую силу, которая может сохраняться в течение длительного периода времени при низком потреблении аденозинтрифосфата (АТФ) и работает в большом диапазоне длины при физиологических условиях.
Как и в клетках скелетных мышц, взаимодействие между миозином и актином в клетках гладких мышц, приводит к сокращению. Это взаимодействие так же, как и у скелетной мышцы, регулируется внутриклеточной концентрацией Ca2+. Однако молекулярный механизм, посредством которого Ca2+ регулирует сокращение, имеет свои отличия. Например, в гладкой мышце отсутствуют тропонин и быстрые натриевые каналы. Повышенная внутриклеточная концентрация Ca2+, которая вызывает сокращение, может наступать за счет поступления кальция через потенциалзависимые кальциевые каналы (электромеханическое сопряжение) и через рецептор-управляемые кальциевые каналы (фармакомеханическое сопряжение) в сарколемме также как и через высвобождение Ca2+ из саркоплазматического ретикулума (рис. 6-74). Клетки расслабляются, когда свободный внутриклеточный Ca2+ (1) закачивается обратно в саркоплазматический ретикулум, (2) откачивается из клетки кальциевым насосом, расположенным в клеточной мембране, и (3) удаляется с помощью Na-Ca-обмен- ника, также расположенного в мембране клетки.
Фармакомеханическое сопряжение является доминирующим механизмом, вызывающим сокращение гладких мышц сосудов. Воздействия, которые вызывают такое сокращение или расслабление, включают в себя такие вещества, как катехоламины, гистамин, ацетилхолин, серотонин, ангиотензин, аденозин, окись азота, CO2, K+, H+ и простагландины. Эти вещества активируют рецепторы мембраны гладкой мышцы сосуда. Рецепторы, в свою очередь, активируют фосфолипазу C в реакции, сопряженной с белками, связывающими гуаниновые нуклеотиды (G-белки). Фосфолипаза C гидролизует в мембране фосфатидилинозитол дифосфат, в результате чего образуется диацилглицерол и инозитолтрисфосфат, последний вызывает высвобождение Ca2+ из саркоплазматического ретикулума. Ca2+ связывается с кальмодулином, который, в свою очередь, присоединяется к киназе легкой цепи миозина. Этот активированный комплекс Ca2+-кальмодулинмиозинкиназа фосфорилирует легкие цепи (20 000 дальтон) миозина. Фосфорилированная миозинАТФаза затем активируется актином, и получающаяся в результате цикличная работа поперечных мостиков инициирует сокращение.
Локальные гуморальные сдвиги изменяют степень сокращения гладкой мышцы сосуда, а такие факторы, как повышенная температура или повышенный уровень двуокиси углерода, приводят к релаксации этой ткани.
Большинство артерий и вен тела иннервируется исключительно волокнами симпатической нервной системы. Эти нервные волокна вызывают тоническое сокращение гладких мышц стенок кровеносных сосудов. Этот эффект был продемонстрирован при перерезке или охлаждении симпатических нервов, идущих к сосудистому руслу (например, мышцы), что приводит к увеличению кровотока (кровеносные сосуды расслабляются). Как прямая, так и рефлекторная активация симпатических нервов увеличивает сосудистое сопротивление.
Рис. 6-74. Электромеханическое сопряжение в гладкой мышце сосуда. Кальций может входить в клетку через потенциал-управляемые каналы (электромеханическое сопряжение) или через рецепторуправляемые каналы (химическая активация, названная фармакомеханическим сопряжением) в сарколемме. Кальций также высвобождается из саркоплазматического ретикулума в ответ на воздействие инозитолтрисфосфата (IP3) и закачивается обратно в саркоплазматический ретикулум кальциевой помпой. Кальций выбрасывается из клетки кальциевой помпой и Na-Ca-обменником. G-p - белок, связывающий гуаниновые нуклеотиды; PI-C - фосфолипаза C; PIP2 - фосфатидилинозитол дифосфат; DC - диацилглицерол; MLCK - киназа легкой цепи миозина; LC - легкая цепь киназы, молекулярная масса 20 000
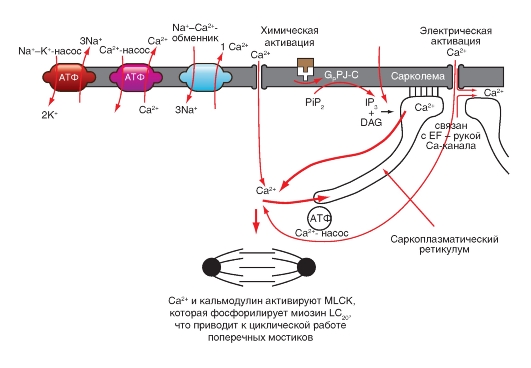
Аортальная и синокаротидная рефлексогенные зоны
Барорецепторы (или рецепторы давления) являются рецепторами растяжения, которые располагаются в каротидных синусах. Каротидные синусы - это слегка расширенные области внутренних сонных артерий. Барорецепторы также располагаются в дуге аорты (рис. 6-75). Импульсы, которые возникают в каротидном синусе идут вверх по синусному нерву (нерв Геринга) к языкоглоточному нерву и, по последнему, к ядру одиночного пучка (nucleus of the tractus solitarius - NTS) продолговатого мозга. NTS является местом центральных проекций хеморецепторов и барорецепторов. Стимуляция NTS приводит к торможению импульсации, идущей по симпатическим нервам к периферическим кровеносным сосудам, в то время как разрушение NTS приводит к вазоконстрикци. Импульсы, которые возникают в барорецепторах дуги аорты, достигают NTS по афферентным волокнам блуждающего нерва. Нервные окончания барорецепторов в стенке каротидного синуса и дуги аорты отвечают на растяжение и деформацию сосуда, вызванную изменениями артериального давления. Частота импульсации в этих нервных окончаниях увеличивается при повышении кровяного давления и уменьшается при снижении кровяного давления. Увеличение частоты импульсации при повышении артериального давления, приводит к торможению прессорных областей, в результате чего происходит периферическая вазодилатация и снижение кровяного давления. Брадикардия, вызванная активацией сердечных ветвей блуждающего нерва, вносит вклад в это снижение кровяного давления.
Барорецепторы каротидного синуса и аорты оказывают не одинаковые по силе эффекты на периферическое сопротивление в ответ на непульсирующие изменения кровяного давления. Барорецепторы каротидного синуса более чувствительны, чем таковые в дуге аорты. Изменение давления в каротидном синусе вызывают большее изменение в системном артериальном давлении, чем такое же изменение давления в дуге аорты. Однако барорецепторы двух зон отвечают оди-
наково на пульсирующие изменения кровяного давления.
Каротидный синус может быть изолирован вместе с синусным нервом от остальной части кровообращения и перфузироваться от животного-донора или при помощи искусственной системы перфузии. При этих условиях изменения давления в каротидном синусе связаны с соответствующими изменениями в кровяном давлении животного-донора. Рецепторы в стенке каротидного синуса более чувствительны к регулярным колебаниям давления, чем к поддерживаемому постоянному давлению.
Периферические хеморецепторы. Эти хеморецепторы состоят из небольших, сильно васкуляризированных телец, расположенных в области дуги аорты (аортальные тельца, рис. 6-75 Б, В) и посередине каротидных синусов (каротидные тельца, рис. 6-75 А). Они чувствительны к изменениям в РО2, РСО2 и pH крови. Главным образом они принимают участие в регуляции дыхания, и в меньшей степени рефлекторно влияют на сосудодвигательные центры. Уменьшение напряжения O2 в артериальной крови (РО2) стимулирует хеморецепторы, и увеличивает импульсацию в афферентных нервных волокнах, идущих от каротидных и аортальных телец, возбуждает сосудосуживающие области, что приводит к усилению тонуса резистивных и емкостных сосудов.
Хеморецепторы также возбуждаются при увеличении напряжения CO2 в артериальной крови (РСО2) и снижении pH, но возникающий рефлекторный эффект довольно мал по сравнению с эффектом прямого действия гиперкапнии (высокое РСО2) и водородных ионов на сосудодвигательные области продолговатого мозга. Когда одновременно действует гипоксия и гиперкапния, стимуляция хеморецепторов больше, чем сумма двух стимулов при их раздельном действии.
Когда хеморецепторы стимулируются одновременно со стимуляцией барорецепторов (понижением давления в области расположения барорецепторов), то раздражение хеморецепторов вызывает сужение переферических сосудов. Однако, когда барорецепторы и хеморецепторы стимулируются одновременно (например при высоком давлении в каротидном синусе и низком РО2), преобладают влияния с барорецепторов.
Рис. 6-75. Артериальные барорецепторы.
А - схематическое изображение каротидного синуса и каротидного тельца и их иннервации у собаки. Б - вид спереди дуги аорты, показывающий иннервацию аортальных телец и барорецепторов у собаки. B - вид сзади дуги аорты, показывающий иннервацию аортальных телец и барорецепторов у собаки
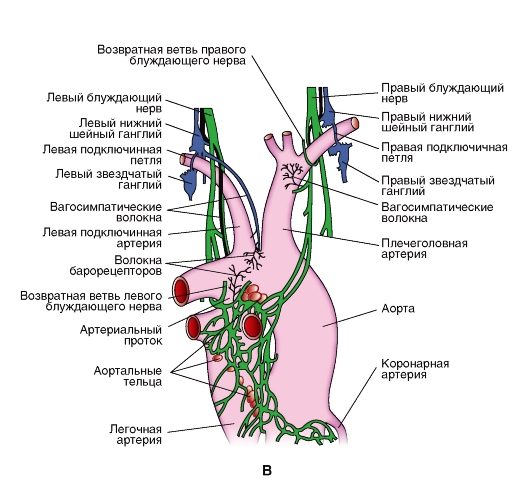
Зависимость импульсации синусного нерва от параметров артериального давления
Каротидный синус может быть изолирован вместе с синусным нервом от остальной части кровообращения и перфузироваться от животного-донора или при помощи искусственной системы перфузии. При этих условиях изменения давления в каротидном синусе связаны с соответствующими изменениями в кровяном давлении животного-донора. Рецепторы в стенке каротидного синуса более чувствительны к регулярным колебаниям давления, чем к поддерживаемому постоянному давлению. Это иллюстрируется на рис. 6-76, на котором показано, что в условиях нормального среднего давления крови (приблизительно 100 мм рт.ст.) при повышении давления во время ранней систолы возникает разряд импульсов, регистрируемых от единично-
го волокна синусного нерва, и только несколько спайков наблюдается в течение поздней систолы и ранней диастолы. При более низких величинах давления, эти фазные изменения даже более заметны, но суммарная частота разряда снижена. Порог кровяного давления для возникновения импульсации в синусных нервах приблизительно равен 50 мм рт.ст., а максимальная непрерывная импульсация происходит при значениях давления порядка 200 мм рт.ст. Так как барорецепторы проявляют некоторую степень адаптации, то их ответ при любом уровне среднего артериального давления более значителен при большом, чем при малом пульсовом давлении. Если пульсовое давление в каротидных синусах снизить воздушной камерой, а среднее давление оставить постоянным, частота электрических импульсов, зарегистрированных от синусного нервного волокна, уменьшается, а системное артериальное давление увеличивается.
Рис. 6-76. Взаимоотношение фазного аортального кровяного давления и импульсации единичного афферентного нервного волокна, идущего от каротидного синуса, при различных уровнях среднего артериального давления
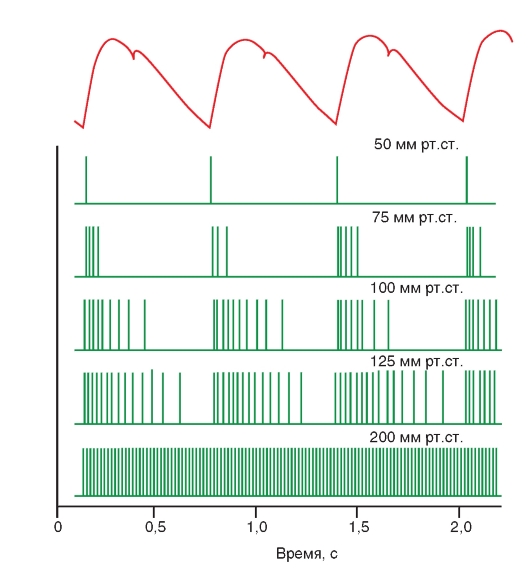
Соотношение местных и центральных механизмов регуляции сосудистого тонуса
Двойное управление периферическими сосудами, за счет местных и центральных механизмов, вызывает ряд регуляторных сосудистых реакций, которые дают возможность направлять кровоток в те части организма, где он более всего необходим, и ограничивать в тех областях, которые имеют в нем меньшую потребность. В некоторых тканях влияние центральных и местных механизмов постоянно, в других тканях их соотношение изменчиво и зависит от степени активности этой ткани.
В мозге и сердце, которые являются жизненно важными органами с ограниченной устойчивостью к недостаточному кровоснабжению, доминируют местные механизмы регуляции кровотока. Например, массированный разряд по симпатическим нервам из сосудосуживающей области, который может происходить при тяжелой, острой кровопотере, оказывает незначительное влияние на резистивные сосуды мозга и сердца, в то время как кровеносные сосуды кожи, почек и внутренних органов сильно суживаются.
В коже преобладает центральная регуляция сосудов. Сосуды кожи не только принимают активное участие в генерализованной сосудосуживающей реакции, но они также селективно отвечают на приходящие из гипоталамуса стимулы, и содействуют потере или сохранению тепла, что необходимо для регуляции температуры тела. Тем не менее местная регуляция может проявляться при локальных изменениях температуры, что может модифицировать или подавлять центральное влияние на резистивные и емкостные сосуды.
В скелетных мышцах взаимодействуют центральные и местные механизмы регуляции. В скелетной мышце, находящейся в состоянии покоя, доминирует нервная регуляция (сосудосуживающий тонус), что можно обнаружить по значительному увеличению кровотока, который происходит сразу же после перерезки симпатических нервов, идущих к ткани. При ожидании и в начале физических упражнений, например бега, в мышцах ног увеличивается кровоток. После начала физической нагрузки местные механизмы регуляции кровотока контроль берут на себя, и в работающих мышцах происходит вазодилатация из-за местного увеличения метаболитов. Вазоконстрикция происходит в неработающих тканях в результате генерализованного разряда в симпатических нервах. Однако действие импульсов, приводящих к сужению сосудов, которые достигают резистивных сосудов работающих мышц, подавляется местным метаболическим влиянием. Действие этого механизма двойного контроля, таким образом, обеспечивает увеличение кровотока, где это требуется, и снижает кровоток в относительно неактивных областях. Подобных эффектов можно достичь, увеличивая РСО2. Обычно гипервентиляция, связанная с физической нагрузкой, поддерживает РСО2 на нормальном уровне. Однако, если увеличить РСО2, то произойдет генерализованная вазоконстрикция из-за возбуждения сосудосуживающей области продолговатого мозга углекислым газом. В работающих мышцах, где концентрация CO2 самая высокая, гладкие мышцы артериол расслабляются в ответ на местное действие РСО2.
Факторы, которые воздействуют на сосудодвигательный центр и на которые воздействует сам сосудодвигательный центр, представлены на рис. 6-77.
Рис. 6-77. Схема, иллюстрирующая афферентные и эфферентные связи сосудодвигательного центра. IX - языкоглоточный нерв; X - блуждающий нерв
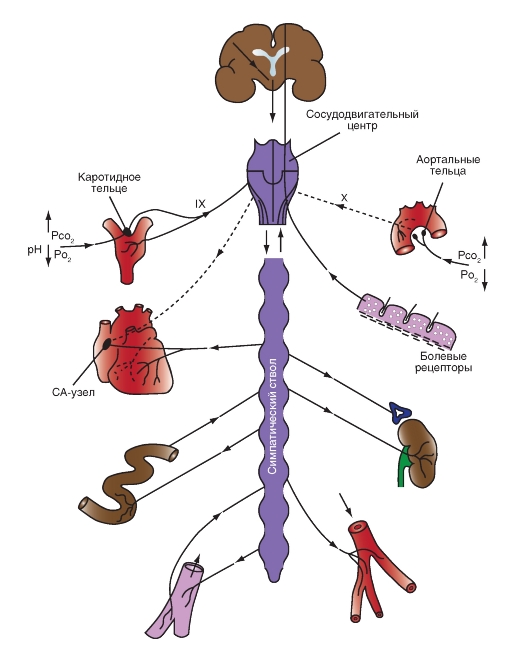
Коронарный кровоток
Главный фактор, ответственный за перфузию миокарда, - аортальное давление, которое, конечно же, создается самим сердцем. Изменения в аортальном давлении, как правило, вызывают направленные в ту же сторону изменения коронарного кровотока. Это частично обусловлено изменениями коронарного перфузионного давления. Другим ведущим фактором в регуляции коронарного кровотока является изменение сопротивления артериол, вызванное изменениями метаболической активности миокарда. Когда метаболическая активность сердца увеличивается, то уменьшается коронарное сопротивление; когда метаболизм сердца снижается, то увеличивается коронарное сопротивление.
Кроме создания давления, обеспечивающего движение крови по коронарным сосудам, сердце также влияет на свое кровоснабжение эффектом сдавливания сокращающимся миокардом проходящих через него кровеносных сосудов (внесосудистое сжатие, или экстракоронарное сопротивление). Эта сила настолько велика в течение ранней систолы желудочков, что кровоток, измеренный в крупной коронарной артерии, которая снабжает левый желудочек, на короткий промежуток времени меняет свое направление. Максимальный приток крови из левой коронарной артерии происходит в ранней диастоле, когда желудочки расслабились, а внесосудистое сжатие коронарных
сосудов фактически отсутствует. Такая структура кровоснабжения видна на кривой фазного коронарного кровотока для левой коронарной артерии (рис. 6-78). После начальной реверсии в ранней систоле, кровоток в левой коронарной артерии следует за аортальным давлением до ранней диастолы, здесь он резко повышается, а затем медленно снижается, по мере того как аортальное давление падает в течение оставшегося периода диастолы.
Давление внутри миокарда левого желудочка - самое большое в области эндокарда и самое низкое - у эпикарда. Однако, при нормальных условиях, этот градиент давления не нарушает эндокардиальный кровоток, потому что больший кровоток к эндокарду в течение диастолы компенсируется большим кровотоком к эпикарду в течение систолы. Так как внесосудистое сжатие самое большое в области эндокардиальной поверхности желудочка, то равенство эпикардиального и эндокардиального кровотока объясняется тем, что тонус резистивных сосудов эндокарда меньше, чем тонус эпикардиальных сосудов.
Картина кровотока в правой коронарной артерии подобна таковой в левой коронарной артерии (рис. 6-78). Однако из-за более низкого давления, развиваемого во время систолы тонким правым желудочком, в ранней систоле кровоток не меняет направления. Следовательно, систолический кровоток здесь составляет намного большую долю от общего коронарного кровотока, чем это имеет место в левой коронарной артерии.
Рис. 6-78. Фазное изменение коронарного кровотока в левой и правой коронарных артериях в течение сердечного цикла
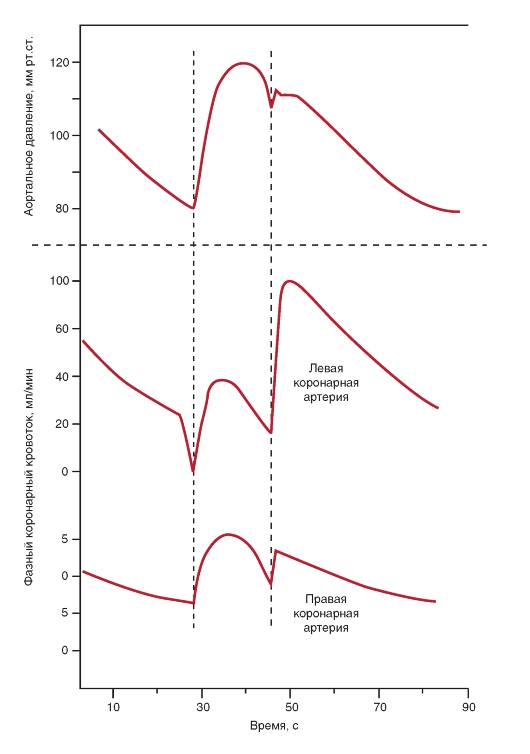
Метаболическая регуляция коронарного кровотока
Наиболее важная характеристика коронарного кровообращения - связь уровеня метаболической активности миокарда с величиной коронарного кровотока. Эта взаимосвязь также обнаружена у денервированного или полностью изолированного сердца, находящегося как в состоянии ритмического сокращения, так и в состоянии фибрилляции.
Пока механизм, по которому осуществляется связь между интенсивностью метаболизма сердца и коронарным кровотоком, остается неустановленным. Однако обнаружено, что уменьшение отношения снабжения кислородом к потребности в кислороде (произведено ли это уменьшением доставки кислорода или увеличением потребности в кислороде) приводит к высвобождению сосудорасширяющего вещества из миокарда в интерстициальную жидкость, которое снижает тонус коронарных сосудов сопротивления. Снижение содержания кислорода в артериальной крови или снижение коронарного кровотока, или все вместе, или же увеличение интенсивности метаболизма - уменьшают отношение снабжения к потребности в кислороде. В ответ на уменьшение отношения снабжения к потребности в кислороде, высвобождается сосудорасширяющее вещество, например аденозин. Это вещество расширяет артериолы и, таким образом, регулирует доставку кислорода в соответствии с потребностью в нем. Уменьшение потребности в кислороде снижает высвобождение вазодилататора и делает возможным усиление базального тонуса.
Многие вещества, которые носят общее название метаболитов, предлагались в качестве медиаторов
вазодилатации, наблюдаемой при усилении работы сердца. Накопление вазоактивных метаболитов может также отвечать за реактивную гиперемию, потому что продолжительность повышенного коронарного кровотока после снятия окклюзии у пережатого на непродолжительное время сосуда, в определенных пределах пропорциональна длительности периода окклюзии. Среди рассматриваемых в качестве медиаторов вазодилатации веществ находятся: CO2, O2 (пониженное напряжение O2), ионы водорода (молочная кислота), ионы калия и аденозин.
Из этих веществ аденозин больше всего удовлетворяет критериям физиологического посредника. Согласно аденозиновой гипотезе, уменьшение напряжения O2 в миокарде, в связи с низким коронарным кровотоком, гипоксемией или повышенной метаболической активностью, приводит к образованию аденозина в миокарде. Этот нуклеозид проходит через интерстициальную жидкость, достигает коронарных резистивных сосудов вызывает вазодилатацию, активируя аденозиновый рецептор.
Освобождение калия из миокарда может отвечать приблизительно за половину начального снижения коронарного сопротивления. Однако он не может быть ответственным за увеличенный коронарный кровоток, наблюдаемый при длительном усилении метаболической активности миокарда, потому что его высвобождение из сердечной мышцы временно. Существует мало свидетельств того, что CO2, водородные ионы или O2 играют значительную непосредственную роль в регуляции коронарного кровотока. Факторы, которые изменяют коронарное сосудистое сопротивление, схематически представлены на рис. 6-79.
Рис. 6-79. Схематическое представление факторов, которые увеличивают (+) или уменьшают (-) коронарное сосудистое сопротивление. Внутрисосудистое давление (артериальное кровяное давление) растягивает стенку сосуда
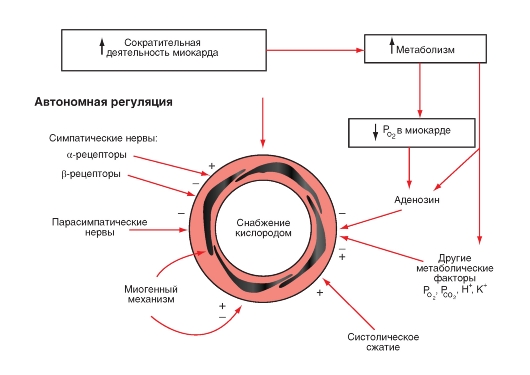
Кровообращение в скелетной мышце
Скорость кровотока в скелетной мышце варьирует в зависимости от сократительной активности ткани и типа мышцы. Кровоток и капиллярная плотность в красной (медленно сокращающейся, с высокими окислительнымм свойствами) мышце больше, чем в белой (быстро сокращающейся, с низкими окислительеыми свойствами) мышце. В покоящейся мышце, прекапиллярные артериолы периодически асинхронно сокращаются и расслабляются. Таким образом, большая часть капиллярного русла не перфузируется. Следовательно, полный кровоток через покоящуюся скелетную мышцу низок (от 1,4 до 4,5 мл/мин/100 г). Во время физической нагрузки происходит релаксация сосудов сопротивления, и кровоток мышцы может увеличиваться в 15-20 раз по сравнению с состоянием покоя. Значение этого увеличения сильно зависит от степени физической нагрузки.
Кровообращение в мышце регулируется нервными и местными факторами. Как и во всех тканях, физические факторы, такие как артериальное давление, давление ткани и вязкость крови, влияют на кровоток в мышце. Однако другой физический фактор выходит на сцену во время физической нагрузки - эффект сдавливания сосудов активной скелетной мышцей. При периодических сокращениях приток крови ограничен, а венозный отток крови увеличен во время каждого непродолжительного сокращения (рис. 6-80). Венозные клапаны предотвращают обратный ток крови в венах между сокращениями и, таким образом, помогают в продвижении крови вперед. При сильных продолжительных сокращениях, например таких, которые происходят в течение физической нагрузки, сосудистое русло может быть сжато до такой степени, при которой кровоток фактически временно останавливается.
Хотя у сосудов сопротивления мышцы высокий уровень базального тонуса, они также обладают тонусом, связанным с непрерывной низкочастотной активностью в симпатических сосудосуживающих нервных волокнах. Фоновая частота импульсации в симпатических сосудосуживающих волокнах весьма низка (приблизительно от 1 до 2 в секунду), а максимальная вазоконстрикция наблюдается при частотах всего 8-10 в секунду).
Вазоконстрикция, вызванная раздражением симпатического нерва, происходит за счет высвобождения норадреналина из окончаний нервных волокон. Введение норадреналина в артерию скелетной мышцы вызывает только вазоконстрикцию, в то время как малые дозы адреналина вызывают вазодилатацию, а большие дозы вызывают вазоконстрикцию.
На тоническую активность симпатических нервов оказывают сильное влияние рефлексы с барорецепторов. Увеличение давления в каротидном синусе приводит к расширению сосудистого русла мышцы, а уменьшение давления в каротидном синусе вызывает вазоконстрикцию. При высоком симпатическом сосудосуживающем тонусе уменьшение кровотока, связанное с окклюзией общих сонных артерий, - незначительное, а увеличение после снятия окклюзии - большое. Вазодилатация, вызванная раздражением барорецепторов, обусловлена торможением симпатической сосудосуживающей активности.
Сосуды сопротивления мышцы вносят существенный вклад в поддержание кровяного давления, потому что скелетные мышцы составляют большую часть массы тела, и, следовательно, сосудистая сеть мышц является самым большим сосудистым руслом. Поэтому участие ее сосудов сопротивления в сосудистых рефлексах имеет важное значение в поддержании постоянства артериального кровяного давления.
Рис. 6-80. Кровообращение в скелетной мышце. Мышечный «насос», способствующий венозному возврату крови из ног.
A - при неподвижном стоянии венозные клапаны открыты и кровь течет вверх к сердцу в силу давления, производимого сердцем и передаваемого через капилляры к венам из артериальной части сосудистой системы. Б - сокращение мышцы сжимает вену так, что увеличенное давление в вене продвигает кровь по направлению к грудной клетке через верхний клапан, и закрывает нижний клапан в несжатом сегменте вены чуть ниже области мышечного сжатия. В - сразу после расслабления мышцы, давление в венозном сегменте, который был до этого сжат, падает и изменение направления градиента давления приводит к закрытию верхнего клапана. Клапан ниже сегмента, который был до этого сжат, открывается, потому что давление ниже клапана превышает давление выше клапана. Сегмент вены тогда заполняется кровью, идущей от стопы. Поскольку кровь продолжает поступать от стопы, то давление в сегменте, который был до этого сжат, повышается. Когда оно превысит давление выше верхнего клапана, то этот клапан открывается и создается непрерывный поток, как это показано на A. Г - реакция сердечно-сосудистой системы на значительные физические нагрузки
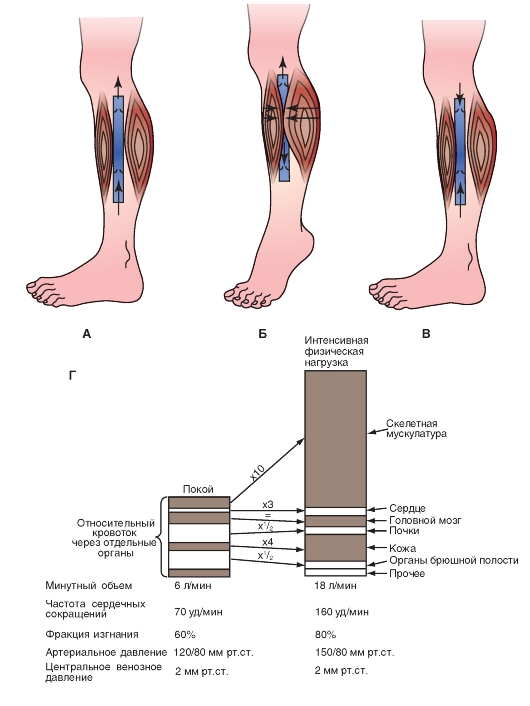
Регуляция кровоснабжения в скелетной мышце
В работающей мышце кровоток регулируется метаболическими факторами. В покоящейся мышце преобладают влияния нервной системы и тонус, обусловленный нервными влияниями, накладывается на базальный тонус, имеющий не нейрогенную природу (рис. 6-81). Перерезка симпатических нервов, идущих к сосудам мышц,
устраняет нервную составляющую сосудистого тонуса и демаскирует собственный базальный тонус кровеносных сосудов. Нервные и местные механизмы регуляции кровотока противостоят друг другу, но во время мышечного сокращения преобладает местный сосудорасширяющий механизм. Однако во время физической нагрузки, сильное возбуждение симпатического нерва несколько снижает вазодилатацию, вызванную локальным высвобождением метаболитов.
Рис. 6-81. Местные механизмы регуляции кровообращение в скелетной мышце. Базальный тонус и диапазон ответа сосудов сопротивления в мышце (пунктирные линии) и коже (затененная область) на стимуляцию и перерезку симпатических нервов. Периферическое сопротивление представлено в логарифмической шкале
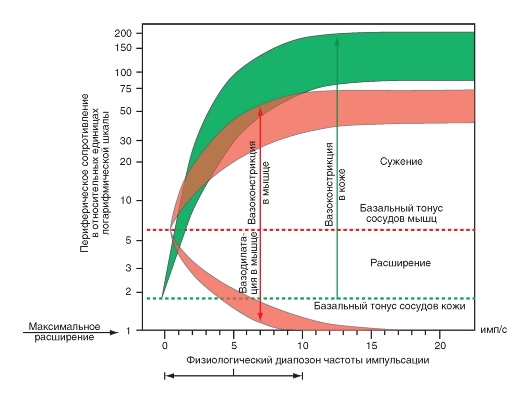
Реакция сердечно-сосудистой системы на физическую нагрузку
Основные изменения деятельности сосудистой системы при продолжительной физической нагрузке происходят в сосудах работающих мышц. Местное образование вазоактивных метаболитов значительно расширяет резистивные сосуды. Калий является одним из сосудорасширяющих веществ, выделяемых сокращающейся мышцей. Другими факторами, влияющими на этот процесс, может быть выработка аденозина и снижение уровня рН. Локальное накопление метаболитов вызывает расслабление конечных артериол. В результате кровоснабжение в мышце может увеличиться в 15-20 раз по сравнению с уровнем кровотока в мышце в состоянии покоя. Расширение прекапиллярных сосудов работающих мышц вазодилататорами происходит сразу после начала выполнения физических упражнений. Уменьшение общего периферического сопротивления позволяет сердцу прокачивать больше крови с меньшей нагрузкой для сердца и с большей эффективностью.
В состоянии покоя только небольшой процент всех капилляров наполняется кровью и вовлекается в работу сердечно-сосудистой системы, тогда как в активно сокращающейся мышце все или почти все капилляры наполнены движущейся кровью (капиллярное выравнивание). Поверхность, на которой происходит газообмен, водообмен и обмен растворенных в воде веществ, увеличивается во много раз. Сокращающаяся мышца активно извлекает О2 из протекающей через нее крови и, таким образом, увеличивает разницу в содержании кислорода в артериальной и венозной крови (рис. 6-82). Высвобождению О2 из крови способствует сдвиг в кривой диссоциации оксигемоглобина во время выполнения упражнений. При физической нагрузке высокая концентрация СО2 и образование молочной кислоты снижают уровень рН. Это уменьшение рН плюс увеличение температуры в сокращающейся мышце производит сдвиг вправо в кривой диссоциации оксигемоглобина. Поэтому при любом заданном парциальном давлении кислорода в эритроцитах гемоглобином удерживается меньше кислорода и, следовательно, больше кислорода попадает в ткани.
Вследствие увеличения активности симпатической нервной системы и ослабления парасимпатического торможения синоатриального узла, которые продолжаются в течении всего периода выполнения физических упражнений, возникает устойчивая тахикардия. При умеренной постоянной
сердечной нагрузке частота сердечных сокращений достигает определенного уровня и остается таковой в продолжение всего периода выполнения упражнений. Однако при увеличении сердечной нагрузки частота сердечных сокращений тоже будет соответственно возрастать, пока не достигнет своего плато - около 180 уд/мин при выполнении интенсивных упражнений. В отличие от значительного возрастания частоты сердечных сокращений, увеличение объема систолического выброса составляет лишь от 10 до 35%; большие значения достигаются сердцем тренированных людей. Таким образом, увеличение сердечного выброса, наблюдаемое при физической нагрузке, связано, главным образом, с увеличением частоты сердечных сокращений.
Если для выполнения физических упражнений задействована большая часть мускулатуры тела, уменьшение общего сопротивления сосудов может быть значительным. Тем не менее артериальное давление начинает повышаться с началом выполнения физических упражнений, и его дальнейшее повышение приблизительно соответствует увеличению интенсивности физической нагрузки (рис. 6-82).
Деятельность симпатической нервной системы вызывает сужение сосудов в работающих скелетных мышцах и тогда, когда в выполнение физических упражнений вовлекаются дополнительные мышцы. Во время экспериментов, когда одна нога работает с максимальной нагрузкой, а затем начинает работать другая нога, в первой работающей ноге кровоток уменьшается. Более того, уровень норадреналина в крови значительно повышается во время выполнения упражнений и большая его часть освобождается из окончаний симпатических нервов работающих мышцах.
В принципе, при выполнении физических упражнений среднее артериальное давление повышается в результате увеличения сердечного выброса. Сужение сосудов, не занятых в упражнении мышц, помогает поддерживать нормальное артериальное кровяное давление для обеспечения нормального кровотока в работающих тканях. Систолическое давление обычно возрастает больше, чем диастолическое давление, что вызывает повышение пульсового давления (рис. 6-82). Возрастание пульсового давления относят прежде всего за счет увеличения систолического объема и, в меньшей степени, за счет более быстрого выброса крови из левого желудочка при меньшем периферическом оттоке во время фазы быстрого изгнания крови из желудочка.
Рис. 6-82. Влияние физической нагрузки различной степени на некоторые переменные сердечно-сосудистой системы
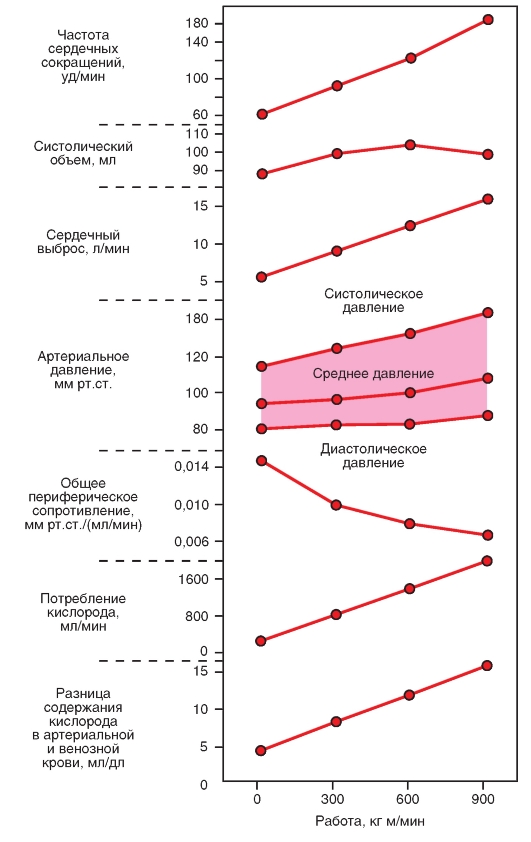
Центральные и местные факторы регуляции сердечно-сосудистой системы при интенсивной физической нагрузке
При интенсивном выполнении физических упражнений, приводящем к наступлению сильной усталости, компенсаторные механизмы начинают отказывать. Частота сердечных сокращений достигает максимального уровня - около 180 уд/мин, систолический объем достигает своего плато и затем зачастую уменьшается, вызывая падение кровяного давления. Организм также обезвоживается. Симпатические сосудосуживающие влияния на сосуды кожи преобладают над влиянием вазодилататоров, вызывая гемодинамический эффект в виде небольшого увеличения объема циркулирующей крови. Однако
сужение сосудов кожи также уменьшает потерю тепла. Во время физических упражнений температура тела обычно повышается, и при интенсивной нагрузке, вследствие сужения сосудов кожи. Уменьшение расхода тепла может привести к очень высокой температуре тела с соответствующим ощущением острого дискомфорта. Уровень рН тканей и крови понижается в результате увеличения выработки молочной кислоты и СО2. Снижение уровня рН является, возможно, ключевым фактором, определяющим максимальный предел физической нагрузки, больше которого данный человек выдержать не может из-за боли в мышцах, субъективного чувства усталости и невозможности или отсутствия силы воли продолжать физические упражнения. Выводы о нервных и локальных воздействиях физической нагрузки на сердечно-сосудистую систему отражены на диаграмме на рис. 6-83.
Рис. 6-83. Изменения деятельности сердечно-сосудистой системы во время физической нагрузки. VR - вазомоторный отдел, С - сосудосуживающая активность, D - сосудорасширяющая активность,
IX - языкоглоточный нерв, Х - блуждающий нерв, + - увеличение активности, - - снижение
активности
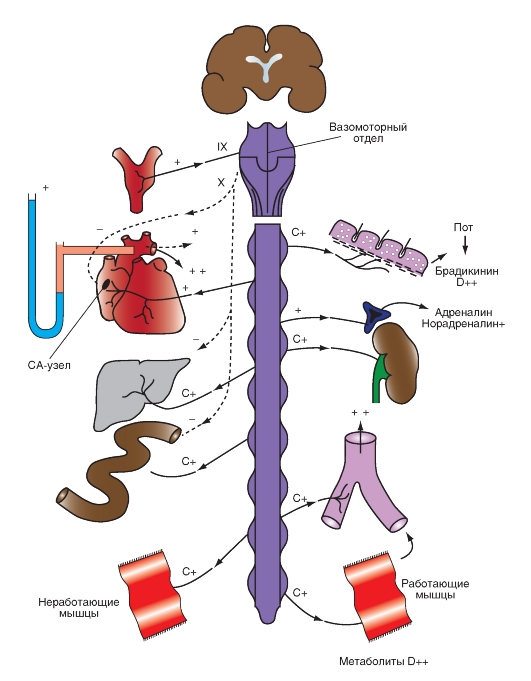
Ренин-ангиотензин-альдостероновая система
На рис. 6-84 схематично представлена последовательность событий, приводящая к увеличению среднего артериального давления с помощью ренин-ангитензин-альдостероновой системы. В схематичном описании события, происходящие при понижении давления, следующие. Если среднее давление крови (в почке) падает ниже определенного значения, гранулярные клетки юкстамедуллярного аппарата выделяют ренин. Ренин сам по себе является не гормоном, а, скорее, протеолитическим ферментом. Выделение ренина ведет к образованию ангиотензина II, важного гормона регуляции кровяного давления и баланса электролитов.
Ангиотензин II обладает вазоконстрикторным действием и, кроме того, стимулирует выделение корой надпочечников альдостерона, что повышает давление крови за счет увеличения периферического сопротивления и соответственно объема внеклеточной жидкости. По этим причинам повышается кровяное давление. Пороговое значение снижения артериального давления может смещаться в сторону более высоких значений при стимуляции α1-адренорецепторов, а стимуляция β1-рецепторов усиливает высвобождение ренина в покое.
Выделение ренина усиливается в течении долей минуты в том случае, если давление в почечной атерии снижается более чем на 10-15 мм рт.ст. Активность симпатических нервов
(α1-адренорецепторы, нейропептид Y) может изменять пороговое значение давления, при котором начинается выделение ренина. В системе кровообращения ренин отщепляет от образующегося в печени ангиотензиногена декапептид ангиотензин I, из которого в результате дальнейшего ферментативного гидролиза с помощью конвертирующего фермента (прежде всего в сосудах легких) в итоге образуется активный октапептид ангиотензин II. Ангиотензин II расщепляется с участием ферментов плазмы с образованием ангиотензин III. Прессорная активность ангиотензина III в 2 раза ниже. Разрушение ангиотензина II и его удаление из кровеносного русла компенсируется усилением образования ренина и новым образованием ангиотензина II. Все три вида ангиотезина участвуют в регуляции внутрипочечного кровотока.
Ангиотензин II служит главным стимулятором выработки альдостерона. Максимальный рениновый эффект развивается через 20 мин и продолжается в течение длительного времени. Главным антагонистом ренин-ангиотензиновой системы является система почечных кининов - сосудорасширяющих веществ, вырабатываемых почкой. Основным противодействующим фактором является простациклин. В настоящее время предполагается, что этот опосредованный низким давлением ренин-ангиотензин-альдостероновый механизм не только обеспечивает комплекс мер неотложной помощи, но и принимает значительное участие в регуляции кровяного давления (от минут до часов).
Рис. 6-84. Упрощенная схема механизма поддержания среднего артериального давления с помощью ренин-ангиотензин-альдостероновой системы. Pa - среднее артериальное давление, ОПС - общее периферическое сопротивление сосудов
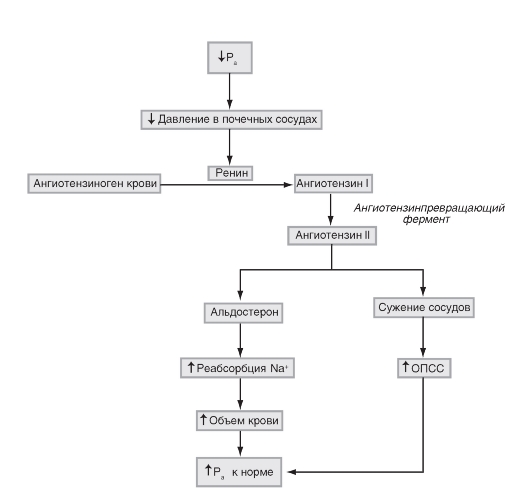
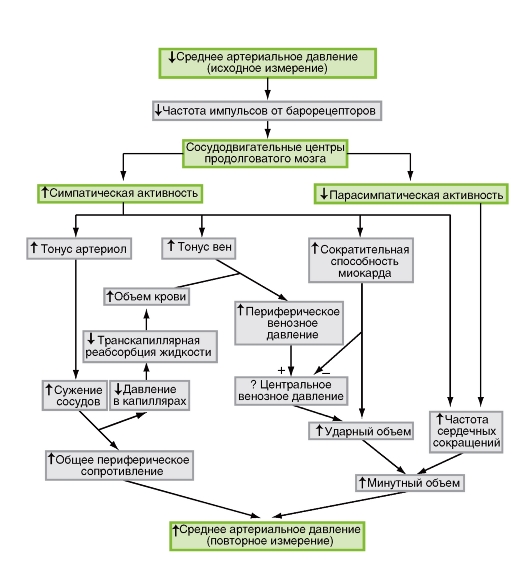
Рис. 6-85. Упрощенная схема механизмов, компенсирующих острое снижение величины среднего давления