Атлас по физиологии. В двух томах. Том 2: учеб. пособие / А. Г. Камкин, И. С. Киселева - 2012. - 448 с. : ил.
|
|
|
|
Глава 7. Физиология дыхания
Основные этапы процесса дыхания
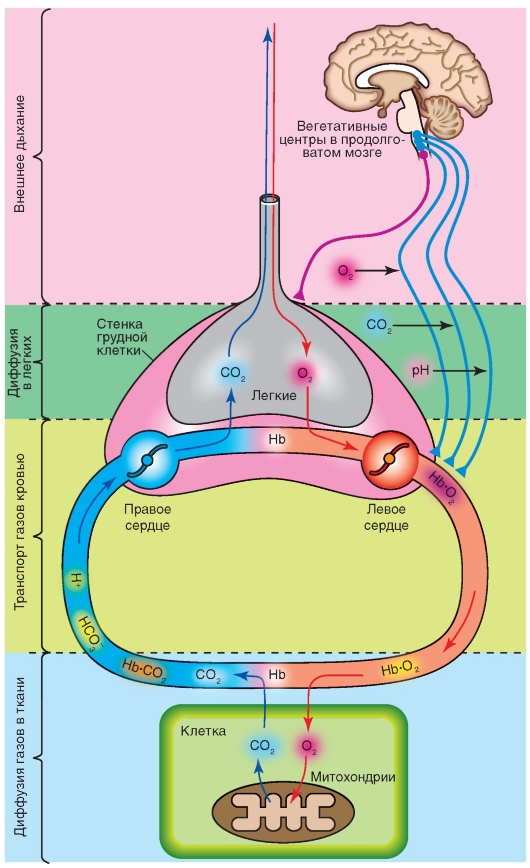
Клетки нашего организма получают энергию с использованием кислорода. Из-за больших расстояний между внешней средой и клетками требуются специальные системы транспорта для доставки к клеткам кислорода (О2) и удаления из клеток углекислого газа (СО2), образующегося в результате окислительного обмена веществ. Эти транспортные процессы О2 и СО2 обозначают как газообмен. При этом благодаря вентиляции легких О2 поступает в альвеолярное пространство, откуда он посредством диффузии попадает
в кровь, которая доставляет его к клеткам организма, куда он поступает также благодаря диффузии (рис. 7-1). Таким образом, дыхание включает: (1) обмен воздуха между внешней средой и альвеолами легких, (2) диффузию газов в легких (обмен газов между альвеолярным воздухом и кровью), (3) транспорт газов кровью, (4) диффузию газов в ткани (обмен газов между кровью и тканью), (5) клеточное дыхание (потребление кислорода и выделение углекислого газа клетками организма). Первые два процесса составляют внешнее дыхание, последние два - внутреннее дыхание.
Рис. 7-1. Этапы процесса дыхания.
Обозначение. Hb - гемоглобин
Основные физические характеристики компонентов газовой смеси
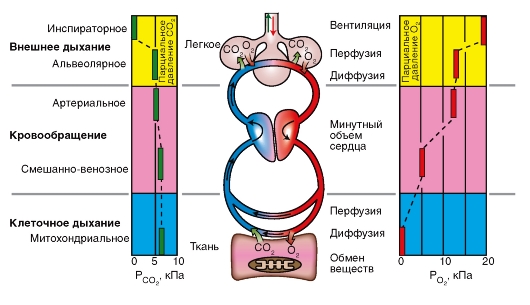
Важнейшими составляющими транспортной системы для внешнего дыхания являются вентиляция, диффузия и перфузия; для кровообращения - сердечно-временной (минутный) объем и транспортные свойства крови для О2 и СО2; для клеточного дыхания - кровоснабжение ткани, диффузия и обмен веществ (потребление О2, образование СО2). Вдоль этой транспортной цепи парциальное давление СО2 (РСО2, слева) повышается, а парциальное давление О2 (РО2, справа) снижается (рис. 7-2).
Парциальное давление газа вида Х в смеси газов является тем давлением, которое осуществляют молекулы газа Х, т.е. которое остается в наличии при удалении всех других газовых компонентов. По закону Дальтона, сумма парциальных давлений всех компонентов смеси газов (также паров Н2О) дает общее давление:
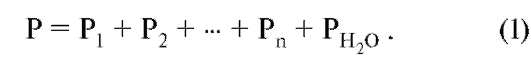
Закон для идеального газа действителен и для смеси газов, заключенных в объеме V, а также для каждого компонента этой смеси газов:
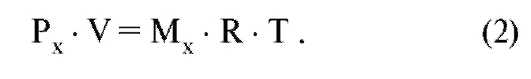
Причем Mx обозначает количество (число молей) газа вида Х. Фракционная часть Х в общем количестве газовых молекул

обозначается как фракция или (что менее корректно) фракционная концентрация Х (безразмерная величина). Для очень низких концентраций помимо системы СИ применяются также другие единицы - ppm (частей в миллионе) и ppb (частей в биллионе), при этом 1 ppm соответствует 1 фракции в 10-6, а 1 ppb таковой же в 10-9.
Уравнение для идеального газа, для влажной смеси недействительно, поэтому РН2О , прежде всего, должно быть математически устранено, что удается путем простого вычитания:
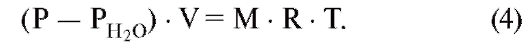
В этом уравнении (P - PH2O) представляет собой общее давление сухой смеси газов (смесь идеальных газовых компонентов), аМ - количество этого сухого газа. Из уравнений 2-4 вытекает важное отношение между фракцией и парциальным давлением компонента газа:
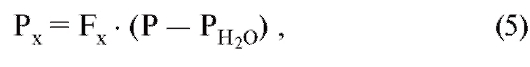
причем PH2O при заданной температуре независимо от общего давления имеет постоянное значение, которое при 37 оС достигает 6,3 кПа.
Рис. 7-2. Транспортная система дыхания, включающая систему внешнего дыхания, систему кровообращения и систему клеточного дыхания
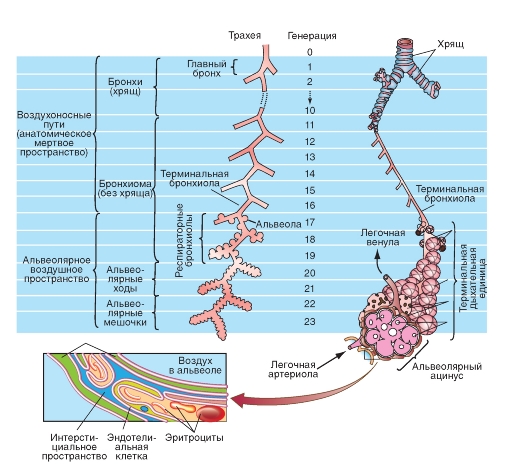
Воздухоносные пути
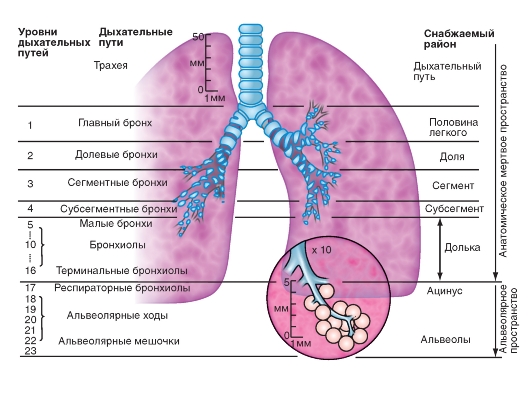
Воздухоносные пути ветвятся, как дерево, разделяясь на несколько уровней (рис. 7-3), причем проксимальные отделы (рот, нос, гортань, трахея, главные бронхи, долевые бронхи, сегментарные бронхи и дольковые бронхи, которые разветвляются на конечные бронхиолы - bronchioli terminales), служат исключительно для подачи и распределения дыхательного воздуха. Их обозначают как анатомическое мертвое пространство, подчеркивая тем самым, что в этих отделах не происходит газообмен. Однако именно эти
проводящие дыхательные пути выполняют, наряду с их функцией подачи воздуха, важнейшие задачи обогрева, увлажнения и очищения вдыхаемого воздуха. Например, очень холодный, сухой вдыхаемый воздух принимает температуру тела и становится влажным, прежде чем достигнет альвеолярного эпителия.
На рис. 7-3 следует обратить внимание на десятикратно увеличенный масштаб периферических дыхательных путей.
Область дыхательных путей, состоящая из терминальных бронхиол, которые несут альвеолы, называется ацинусом.
Рис. 7-3. Легочные пути и их вентиляция
Бронхиальное дерево
Только около семи последних уровней разветвления бронхиального дерева, заканчивающихся дыхательными бронхиолами (bronchioli respiratorii) и отходящими от них радиально альвеолярными ходами (ductuli alveolares), которые переходят в слепые альвеолярные мешочки (sacculi alveolares), несут альвеолы и служат для газообмена. Респираторные бронхиолы, альвеолярные ходы и альвеолярные мешочки с альвеолами составляют единую альвеолярную зону (или дыхательную зону), образуя функционально-анатомические единицы, называемые ацинусами или гроздями (acinus). Объем альвеолярной зоны приблизительно равен 3000 мл в конце нормально выдоха,
что гораздо больше, чем объем анатомического мертвого пространства (приблизительно 150 мл, или около 5% экспираторного объема альвеол). Дыхательный объем (VT - Tidal volume) приблизительно в 3 раза больше, чем объем мертвого пространства (VD - Deade space volume), так что около 2/3 свежего воздуха при каждом вдохе достигает альвеолярной зоны. Итак, воздух поступает благодаря вдыхаемому (инспираторному) потоку на поверхность газообмена. Таким образом, в конце вдоха в альвеолярной зоне находится смешанный газ, в то время как в воздухоносных путях мертвого пространства остается атмосферный, несмешанный воздух. Остаток пути газы проходят через альвеолярно-капиллярный барьер благодаря диффузии.
Рис. 7-4. Ветвление дыхательных путей
Защита организма от вредоносных компонентов вдыхаемого воздуха
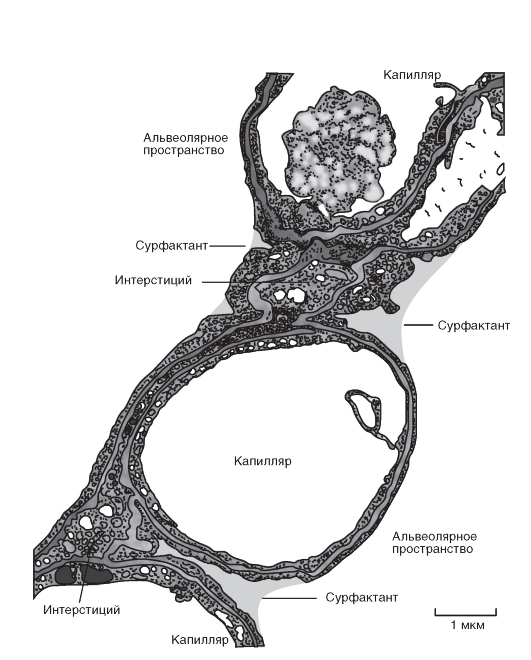
Слой ткани, который отделяет газы альвеолярного пространства от крови легочных капилляров (рис. 7-5)? необыкновенно тонок и называется альвеолярно-капиллярным (аэро-гематическим) барьером. Его толщина представляет собой компромисс между достаточной механической защитной функцией, которая препятствует кровотечению в альвеолы, и, по возможности, короткому диффузионному расстоянию для О2 и СО2. Общая поверхность этого диффузионного барьера 50- 100 м2, приблизительно в 50 раз больше, чем внешняя поверхность организма. Такая огромная поверхность диффузионного барьера только потому находит место в грудной клетке, что легкие разделены на большое количество (приблизительно 300 млн) мелких альвеол (диаметром около 1/3 мм).
Газ по воздухоносным путям достигает одной стороны этой поверхности обмена, а кровь по легочным капиллярам достигает другой ее стороны.
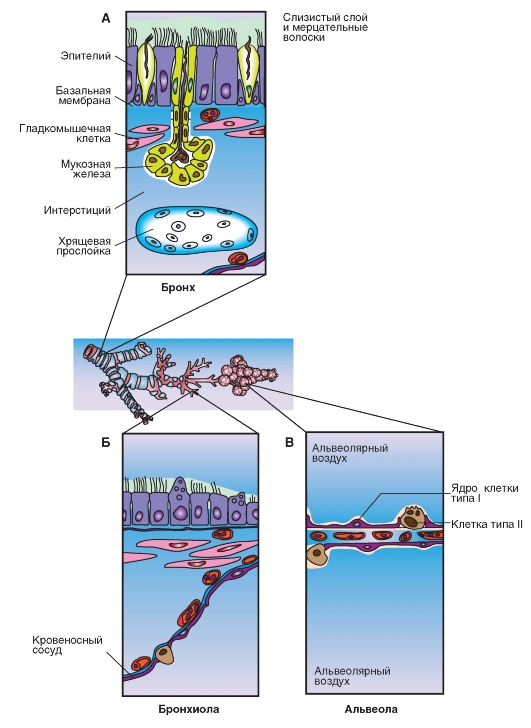
Воздух, которым мы дышим, наряду с газами, предназначенными для дыхания, содержит большое количество других газов, которые, в большинстве случаев, даже в низких концентрациях оказывают токсическое влияние (например, NO2, SO2, CO, O3 и другие). Кроме того, во вдыхаемом воздухе присутствуют чужеродные частицы, среди которых твердые частицы и микроорганизмы. Большие частицы остаются в верхних дыхательных путях (в полости носоглотки). Меньшие частицы осаждаются в более глубоких дыхательных путях. Покрытый слизью мерцательный эпителий легочных путей и альвеолярные макрофаги заботятся об удалении этих вредных пришельцев.
Воздухоносные дыхательные пути снабжены несущими реснички мерцательным эпителием и
слизистыми (мукозными) железами. Образуемая пленка вязкой слизи гонится быстрыми ударами ресничек мерцательного эпителия в направлении рта, перенося чужеродные частицы, находящиеся на ней, как на конвейере, к глотке (мукоцилиарный транспорт), где они потом откашливаются со слизью или глотаются.
Альвеолярная поверхность должна быть полностью очищена от проникающих чужеродных факторов. Эту функцию выполняют, как пылесос, альвеолярные макрофаги. Они фагоцитируют чужеродные вещества и ферментативно разрушают их (органические чужеродные вещества). В тех случаях, когда ферментативная деградация невозможна (например, частицы пыли из угля и кварца, асбестовых волокон и т.п.), макрофаги отгораживают фагоцитированные чужеродные вещества от окружающей ткани. Благодаря амебоидной подвижности они мигрируют также к воздухоносным путям, где устраняются мукореснитчатым транспортом из легких. Часть фагоцитированных веществ попадает в перибронхиальную и междольковую соединительную ткань, где депонируется в гистиоцитах и там частично остается в течение всей жизни, являясь причиной целого ряда заболеваний.
Дыхательная система, особенно в области верхних дыхательных путей, содержит также клетки специфической противоинфекционной защиты. Главным образом, это лимфоциты и плазматические клетки (бронхоассоциированная лимфатическая система). Плазматические клетки имеются, кроме того, в лимфатических узлах, особенно вблизи бронхиальных желез. Плазматические, а также эпителиальные клетки образуют в верхних дыхательных путях иммуноглобулин А (IgA). В небольшой концентрации в секрете содержится также IgG. В нижних дыхательных путях и в альвеолярном пространстве IgG преобладает.
Рис. 7-5. Эпителий дыхательного пути.
А - бронх: мерцательный эпителий с экзокринными (мукозными) клетками и железами. Б - бронхиола: плоские эпителиальные клетки. В - альвеола: альвеолярные эпителиальные клетки типа I (образуют большую поверхность) и типа II (секретируют составные части сурфактанта)
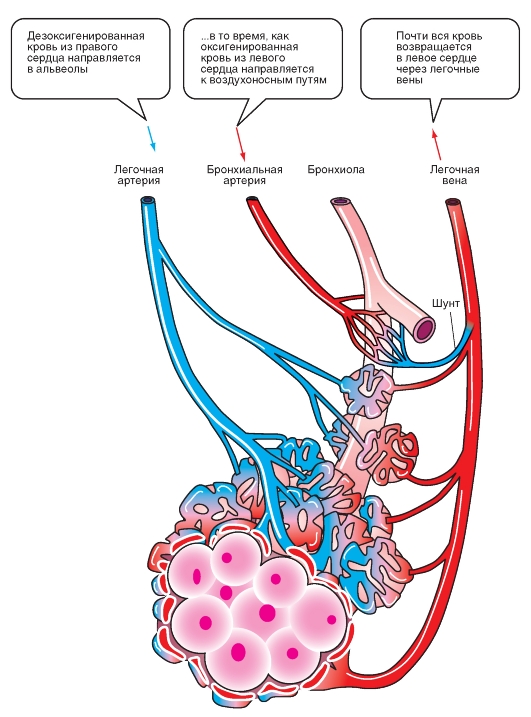
Кровоснабжение дыхательных путей
Ветви легочной артерии многократно разветвляются, причем они следуют разветвлениям воздухоносных дыхательных путей. Затем они ветвятся на капиллярную сеть, которая оплетает альвеолы и образует со стороны крови очень большую поверхность обмена для альвеолярного газа (рис. 7-6). Вначале бронхи, артерии и вены проходят вместе, но в периферических отделах вены отделяются и проходят между дольками, тогда как артерии и бронхи следуют рядом к центру долек. Таким образом, вены находятся на бронхиальном дереве только в центре легкого.
В противоположность системе большого круга кровообращения, внутрисосудистое давление крови в сосудах малого круга кровообращения очень низкое. Согласно современным данным, падение давления вдоль пути легочного кровотока является более равномерным, чем в системном круге кровообращения, поскольку отсутствуют сосуды с выраженным сопротивлением, которые были бы сравнимы с артериолами большого круга кровообращения. Из-за низкого внутрисосудистого давления кровоток сильно зависит от гидравлических эффектов и от периваскулярного давления, т.е. давления на сосуды со стороны окружающих тканей.
Вдоль пути кровотока с точки зрения периваскулярного давления можно выделить три сосудистые зоны.
• Первая зона - большие экстрапульмональные сосуды лежат вместе с сердцем и большими венами организма в средостении (mediastinum), где на них оказывает влияние плевральное давление (Рpl). Так как оно большей частью отрицательно и действует на сосуды извне, растягивая их, плевральное давление способствует поддержанию сосудов в открытом состоянии. Во время вдоха плевральное давление становится еще более отрицательным, и, следовательно, просвет сосудов увеличивается, а кровоток в них усиливается.
• Вторая зона - артериальные и венозные сосуды, сопровождающие бронхи, так же как сами бронхи, окружены легочной тканью с действующими эластическими силами. Периваскулярное давление на эти сосуды определяется плевральным давлением, так как они находятся в плевральном пространстве.
• Третья зона - альвеолярные капилляры, находятся под действием альвеолярного давления, если пренебрегать дополнительным влиянием сил поверхностного натяжения жидкости в альвеолах.
Рис. 7-6. Снабжение кровью воздухоносных дыхательных путей
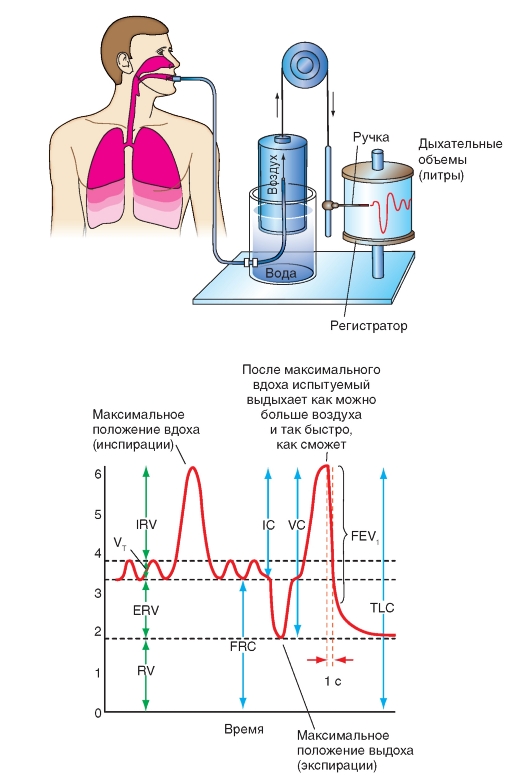
Спирография
Спирометр (рис. 7-7) представляет собой прибор с ограниченным газовым пространством, из которого газ можно вдыхать и в которое газ можно выдыхать. Если связать дыхательные пути испытуемого со спирометром, то можно записать в виде спирограммы изменения дыхательного объема за промежуток времени.
Испытуемый вдыхает и выдыхает через шланг из закрытого пространства, при этом свободно подвешенный колокол, для герметизации погруженный в воду, движется из воды вверх и вниз. Нос испытуемого закрыт носовой клеммой. Посредством вращающихся роликов колокол связан с записывающим рычагом, чье фиксированное отклонение регистрирует изменение объема дыхания во времени. Если испытуемый вдыхает максимально, то колокол опускается, а пишущий рычаг поднимается на высоту, которая обозначает максимальное положение инспирации. При максимальном выдохе колокол поднимается, и пишущий рычаг опускается до максимального положения экспирации. Амплитуда при нормальном дыхании обозначает объем вдоха. Нормальная экспирация следует до паузы между дыхательными циклами.
На спирограмме можно фиксировать следующие объемы дыхания:
• дыхательный объем VT, равный вдыхаемому и выдыхаемому объему (индекс Т от
английского слова «tidal», в России также принята аббревиатура «ДО»);
• емкость вдоха (IC, инспираторная емкость);
• резервный объем вдоха (IRV, инспираторный резервный объем), т.е. объем воздуха, который после нормального вдоха еще можно дополнительно вдохнуть (в России также принята аббревиатура «РОвд»);
• резервный объем выдоха (ERV, экспираторный резервный объем), представляющий собой объем воздуха, который после нормального выдоха (в состоянии спокойного дыхания) еще можно выдохнуть (в России также принята аббревиатура «РОвыд»;
• жизненная емкость легких (VC), представляющая собой максимальным объем дыхания, и равную IRV + VT. + ERV (в России также принята аббревиатура «ЖЕЛ»);
• функционная остаточная емкость (FRC = RV + ERV). Она равна легочному объему в состоянии покоя дыхания, когда дыхательные мышцы расслаблены (в России также принята аббревиатура «ФОЕ»);
• общая емкость легких (TLC), представляющая собой максимальный легочный объем (RV + VC) (в России также принята аббревиатура «ОЕЛ»);
• остаточный объем (RV) не может выдыхаться и также не может быть измерен при помощи спирометрии.
Рис. 7-7. Спирометр и спирограмма
Плетизмография
Общая плетизмография (body plethys mography) используется для исследования функций внешнего дыхания. Плетизмограф представляет собой герметичную камеру, в которой автоматически измеряется температура, давление воздуха и объем газовой среды камеры. Испытуемый помещается в камеру и через короткую дыхательную трубку дышит воздухом, находящимся вне камеры. Дыхательная трубка со стороны камеры начинается загубником. Дистальнее загубника расположена заслонка. Посредством заслонки можно на короткое время полностью перекрыть потоки дыхательной смеси газов. Между загубником и заслонкой в дыхательной трубке размещен датчик давления. Он позволяет измерять давление газовой смеси в дыхательной трубке (давление в полости рта - эквивалент внутриальвеолярного давления) тогда, когда испытуемому дается задание совершать попытки дыхательных движений при закрытой заслонке. Дистальнее заслонки в трубке расположен пневмотахометр. При открытой заслонке с помощью пневмотахометра можно измерить объемную скорость потоков вдоха и
выдоха. Пневмотахометр соединяется с интегратором, позволяющим по объемной скорости потоков вычислять легочные объемы.
Наиболее общепринятыми измерениями, которые могут быть сделаны посредством плетизмографии тела - это объем газовой смеси, находящейся в органах внешнего дыхания (эквивалент - функциональная остаточная емкость легких, FRC) и сопротивление дыхательных путей. Обратной переменной является проводимость дыхательных путей, Gaw.
Стандартизованным показателем является специфическая проводимость дыхательных путей,
определяемая как проводимость дыхательных путей, отнесенная к единице объема легких.
Другими тестами, которые могут быть сделаны с помощью плетизмографии тела являются спирометрия, оценка возможностей нижних дыхательных путей (бронхов), диффузионная способность легких - DLCO, тест вымывания азота за один цикл внешнего дыхания (single-breath nitrogen, N2), тест вымывания азота при многократных циклах дыхания (multiple-breath N2 washout), Compliance (податливость легких в русской терминологии) и окклюзионное давление.
Рис. 7-8. Плетизмография
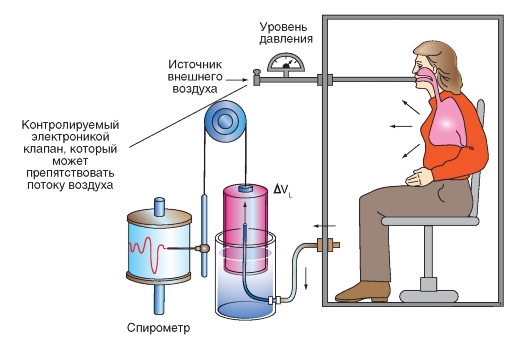
Определение общей и функциональной остаточных емкостей легких
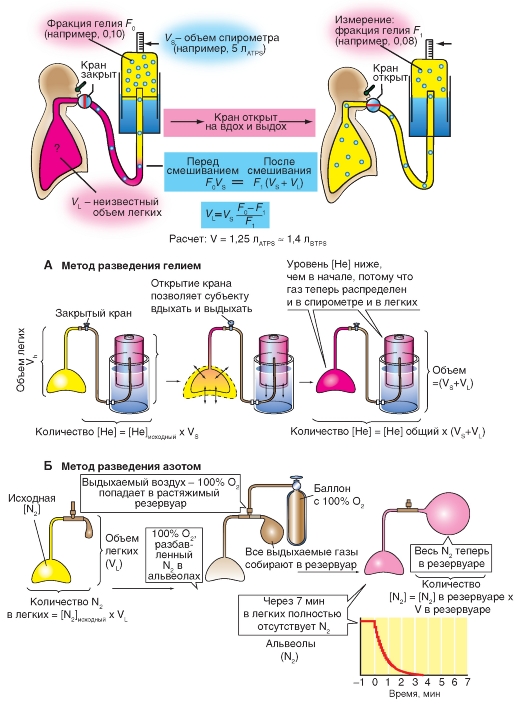
После максимального выдоха в легком остается еще около 1,5 л газовой смеси. Этот остаточный объем (RV) не может выдыхаться, и также не может быть измерен при помощи спирометрии. Но его можно определить, например, методом разведения чужеродным газом (рис. 7-9), при котором известное количество плохо растворимого инертного газа, например, гелия, смешивается с газом в легких. На основании концентраций газов после перемешивания остаточный объем может быть крайне просто рассчитан.
Испытуемый связан со спирометром, в газовом пространстве которого (объем VS) находится плохо растворимый инертный газ (например, гелий) с известной фракцией (F0). После открытия связывающего крана испытуемый смешивает несколькими глубокими вдохами свой легочный
воздух с газом спирометра, так что фракция инертного газа после смешивания в легких и спирометре становится одинаково большой (F1). Так как плохо растворяющийся в крови инертный газ не удаляется из легочного пространства, то его количество остается одинаковым до и после смешивания: F0 • FS = F1 ? (VS + VL). Если F0 и VS известны, и F1 измеряется, то неизвестный объем легких VL может быть рассчитан. Если испытуемый открыл кран спирометра после максимального выдоха и начал дышать газовой смесью из спирометра, то рассчитанная в этих условиях VL будет равным остаточному объему; если испытуемый начинает дышать из положения дыхания покоя, то VL будет равен функциональной остаточной емкости (FRC).
С учетом остаточного объема в список объемов дыхания можно включить функционную остаточную емкость (FRC = RV + ERV) и общую емкость легких (TLC).
Рис. 7-9. Основные методы разведения чужеродным газом.
А - метод разведения гелием. Б - метод разведения азотом
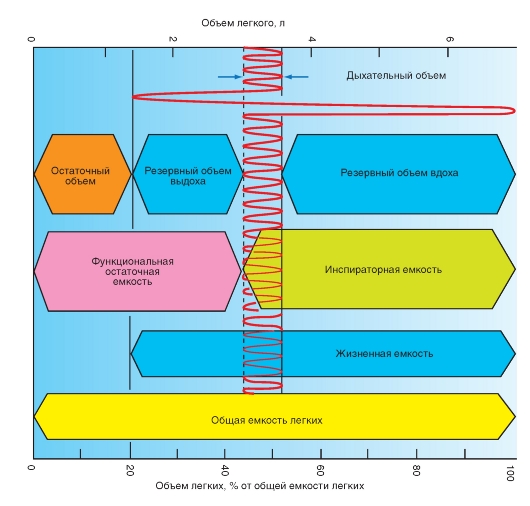
Легочные объемы
Из спирометрических измерений (рис. 7-7) и измерения остаточного объема (рис. 7-9) получаются легочные объемы. Левая ордината на рис. 7-10 демонстрирует абсолютное значение
для здорового легкого молодого мужчины, правая ордината на том же рисунке - объемы легкого в процентах общей емкости легкого (табл. 7-1).
Некоторые приведенные величины будут обсуждаться дальше.
Таблица 7-1. Нормальные значения параметров, характеризующих механику дыхательной системы, для мужчин и женщин (возраст - 25 лет, рост - 1,80 м). Значения compliance относятся к области положения покоя дыхания
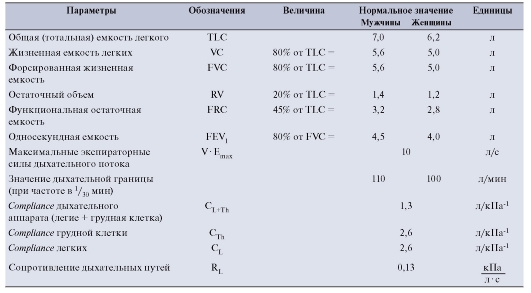
Рис. 7-10. Легочные объемы и емкости
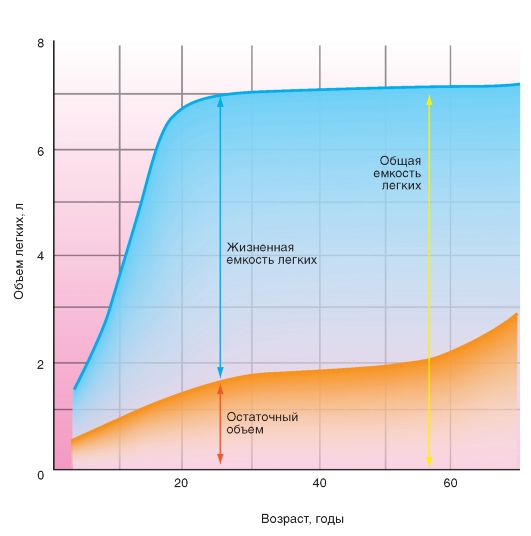
Возрастная динамика легочных объемов
Периоду роста до его завершения соответствует увеличение жизненной емкости и остаточного объема легких. Общая емкость легких остается у взрослого постоянной. Характер кривой, представленной на рис. 7-10, действителен для мужчин и женщин, абсолютные значения ординаты действительны для мужчин, чей рост достигает во взрослом возрасте приблизительно 1,80 м.
Изменения RV, VC и TLC с возрастом представлены на рис. 7-11. У взрослых людей RV увеличивается за счет VC. Это ведет к потере эластичности грудной клетки (уменьшение VC) и к атрофии легочной ткани со снижением эластичной ретракции - эластической тяги легкого (увеличение RV). Значения легочных объемов и их зависимость от возраста, пола находят широкое применение в клинических диагностических исследованиях.
Рис. 7-11. Изменения остаточного объема и жизненной емкости легких с возрастом
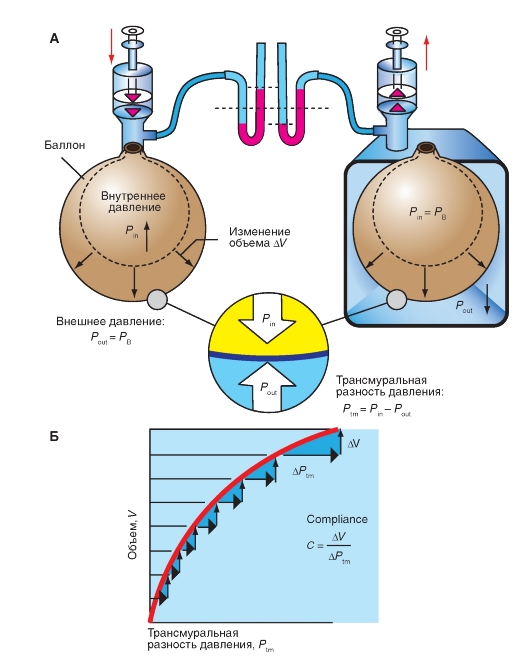
Сompliance и elastance легких
Если воздушный баллон, например воздушный шарик, постепенно заполняется воздухом, то внутри его развивается давление (Pin), которое выше, чем внешнее давление (Pout) (рис. 7-12 А, слева). Этот воздушный баллон можно также наполнить воздухом, предварительно поместив его в сосуд, где создается низкое давление газа (рис. 7-12 А, справа). В обоих случаях состояние растяжения баллона зависит только от разности давления на его стенки, т.е. трансмуральной разности давления Ptm:
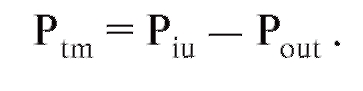
Если при каждом этапе надувания баллона регистрируют Ptm и V, то получают кривую зависимости давления от объема (кривая давление - объем) или кривую растяжения (рис. 7-12 Б). Изгиб (кривизна)
этой кривой показывает, что прирост трансмуральной разности давления (∆Ptm), который необходим для растяжения (∆V), становится все больше с увеличивающимся заполнением воздухом. Это отношение обозначается термином compliance. и подразумевает эластические характеристики всей ткани (в русскоязычной литературе нередко используются термины «объемная растяжимость», «податливость»).
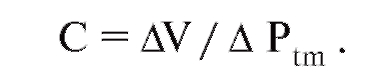
Обратная величина 1/C называется термином elastance, который подразумевает не просто эластичность, а способность к полностью обратимой растяжимости, т.е. способность ткани легких возвращаться после растяжения в исходное состояние (т.е. к их первоначальному объему). Итак, с увеличивающимся растяжением уменьшается compliance, а elastance увеличивается.
Рис. 7-12. Трансмуральная разность давления (Рtm).
А - слева - внутреннее давление (Рi) повышается, в то время как внешнее давление (Ро) остается атмосферным (РВ). Справа - Ро понижается, а Рi остается атмосферным. В обоих случаях баллон расширяется, потому что трансмуральная разность давления Рtm = Рi - Ро увеличивается. Б - кривая растяжения, показывает, что с увеличением объема (V) повышение трансмуральной разности давления (∆Рtm), необходимое для расширения (∆V), станет больше. Отношение ∆V/∆Рtm , т.е. растяжимость или compliance, уменьшается с увеличением объема
Кривые растяжения покоя
Растяжимость легкого определяется его пассивными структурными элементами, т.е. изменяется не активно (например, с помощью силы, которую развивают дыхательные мышцы). Это не относится к грудной клетке. Растяжимость мышц грудной клетки изменяется при активации, т.е. так, как это происходит у любой скелетной мышцы. Растяжимость легкого в этом случае, может быть измерена при ненапряженных или напряженных дыхательных мышцах. Измерение пассивной растяжимости грудной клетки требует, однако, ненапряженных дыхательных мышц. Как проводят измерения, показывает рис. 7-13. На этом рисунке кривые, описывающие зависимость давления от объема для грудной клетки и легкого, разделены, кроме того, продемонстрирована кривая для всего дыхательного аппарата. Эти кривые регистрируются при ненапряженной дыхательной мускулатуре и, отсюда, называются кривые растяжения покоя. В то время как добавление слова «покой»
для полученной таким образом кривой растяжения покоя грудной клетки указывает на ненапряженную дыхательную мускулатуру, это добавление не является необходимым для легкого, так как эластичные свойства легкого являются независимыми от состояния напряжения дыхательных мышц.
Кривая растяжения покоя общего дыхательного аппарата становится более плоской как в верхней части, так и в нижней части - она имеет S-образ- ную форму (рис. 7-13, красная кривая). Так как при нормальном дыхании положение покоя дыхания достигается в конце выдоха, т.е., если объем легкого равняется функциональной остаточной емкости (FRC). Это означает, что дыхательный аппарат при функциональной остаточной емкости проявляет свою самую большую растяжимость. Ниже FRC увеличивается сила возврата сжатой грудной клетки, выше FRC и выше положения равновесия грудной клетки с увеличивающимся растяжением, как легкие, так и грудная клетка становится растянутой, и это значит, что compliance становится меньше.
Рис. 7-13. Кривые пассивного изменения давления от объема легкого, грудной клетки и дыхательного аппарата (кривые давление-объем).
Испытуемый вдыхает определенный объем, закрывает кран на спирометре и производит спокойный выдох. Так как он оставляет открытой свою голосовую щель, то альвеолярное давление (РА) может быть измерено на связывающей трубке со спирометром. Плевральное давление (Рpl) рассчитывается при помощи пищеводного зонда, и из значений обоих давлений рассчитывают трансмуральные разности давления легкого (РА - Рpl), грудной клетки (Рpl) и общего дыхательного аппарата (РА). Измерение может быть повторено после вдоха и выдоха разных объемов. Спирометр служит исключительно для определения вдыхаемых и выдыхаемых объемов. Если построить зависимость легочного объема (ордината) от соответствующей трансмуральной разности давления (абсцисса), то получают три кривых растяжения покоя: для грудной клетки (коричневая кривая), легкого (желтая кривая) и грудной клетки + легкое (=дыхательный аппарат; красная кривая). Положение равновесия легкого находится там, где его трансмуральная разность давления (РА - Рpl) равна нулю. Соответственно, положение равновесия грудной клетки будет при Рpl = 0. Введенные в действие графические изображения схематично показывают величину и направление ретракционных сил легких (красная стрелка) и грудной клетки (черная стрелка)
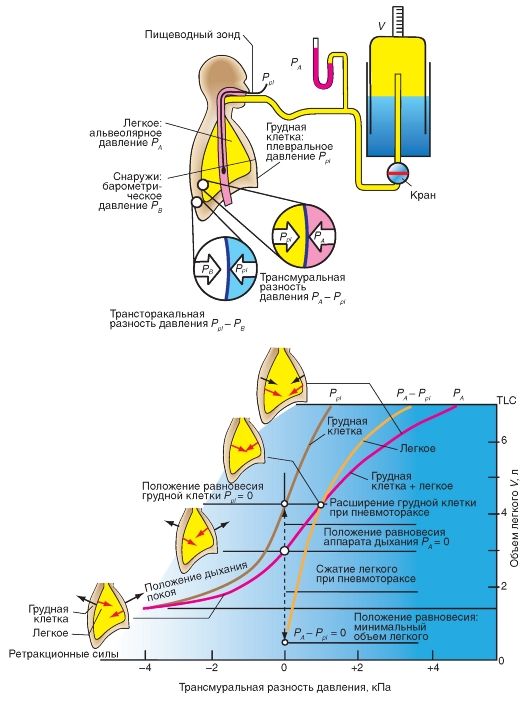
Дыхательные мышцы
Дыхательные мышцы являются двигателем вентиляции. При спокойном дыхании диафрагма выполняет функцию основной дыхательной мышцы, а экспираторные мышцы не активируются. При усиленном дыхании активными становятся и инспираторные, и экспираторные мышцы.
Вдох (инспирация)
При нормальном спокойном дыхании положение покоя дыхания достигается в конце выдоха. Во время вдоха инспираторные мышцы отклоняют дыхательный аппарат от положения равновесия.
Основными инспираторными мышцами при спокойном дыхании являются диафрагма, лестничные мышцы (mm. scalene) и межхрящевые мышцы (mm. intercartilaginei). Повышенный тонус наружных межреберных мышц (mm. intercostals externi) служит исключительно для стабилизации стенки грудной клетки. В качестве инспираторных мышц, они вступают в действие, например при физической работе, произвольном частом дыхании или при патологически осложненном дыхании. В этих случаях в процесс вдоха также включаются и дополнительные мышцы.
Диафрагма представляет собой краниально выпуклый мышечный листок, который крепится к нижним ребрам. При сокращении он становится плоским, причем абдоминальные органы каудально сжимаются, и при этом стенка живота становится выпуклой кнаружи. Вследствие этого полость грудной клетки каудально увеличивается. Одновременно диафрагма поднимает ребра и расширяет грудную клетку (рис. 7-14 А).
Наружные межреберные мышцы (mm. intercostals externi) (рис. 7-14 Б) проходят косо дорсокраниаль-
но и вентрокаудально, т.е. идут от ребра к ребру в косом направлении сзади и сверху, вперед и вниз. Хотя их сокращение влияет с равной силой на соседние ребра, однако поворотный момент в большей степени приходится на каудальные ребра (более длинное плечо рычага), чем на краниальные. Поэтому ребра поднимаются, и как латеральный, так и сагиттальный размер грудной клетки увеличивается. Такое же действие имеют межхрящевые мышцы (mm. intercartilaginei).
Выдох (экспирация)
Выдох протекает при спокойном дыхании пассивно при помощи эластических сил, точно так же, как растянутая пружина сама возвращается в исходное положение. К началу выдоха инспираторные мышцы еще активны и обуславливают крайне «мягкое» возвращение к равновесию (так, тяжелый предмет осторожно ставят на пол, вместо того, чтобы бросить).
При учащенном дыхании экспирация активно поддерживается, в первую очередь, мышцами брюшной стенки - наружными косыми мышцами живота (mm. obliqui abdominis externi) и внутренними косыми мышцами живота (mm. obliqui abdominis interni), поперечными мышцами живота (mm. transverses abdominalis) и прямыми мышцами живота (m. rectus abdominis), которые сдвигают внутренние органы брюшной полости вверх и этим прижимают диафрагму к грудной клетке. Аналогичное действие производят внутренние межреберные мышцы (mm. intercostals interni), которые являются антагонистами по отношению к наружным межреберным мышцам (mm. intercostals externi) (рис. 7-14 В). Диафрагма и мышцы живота работают одновременно, если должно быть создано высокое внутрибрюшное давление.
Рис. 7-14. Работа дыхательных мышц.
А - при движении вниз диафрагмы грудная клетка увеличивает свой объем. Одновременно это движение вниз вызывает поднятие нижних краев ребер, что существенно расширяет пространство грудной клетки. Под влиянием импульсов из центральной нервной системы наружные межреберные мышцы (mm. intercostales externi) сокращаются и поднимают ребра. Б - одновременно на основе косой ротационной оси ребер на позвонках как сагиттальный, так и трансверсальный диаметр грудной клетки увеличивается, следовательно, эти мышцы служат инспирации. Внутренние межреберные мышцы (mm. intercostales interni) способствуют выдоху. В - обратный процесс приводит к выдоху
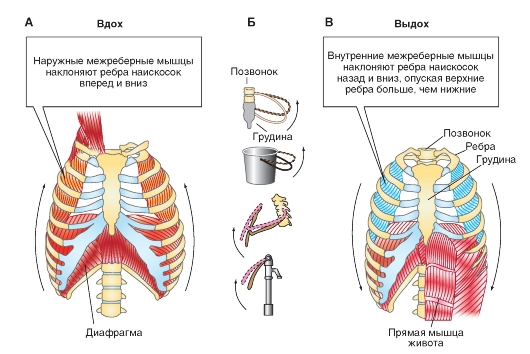
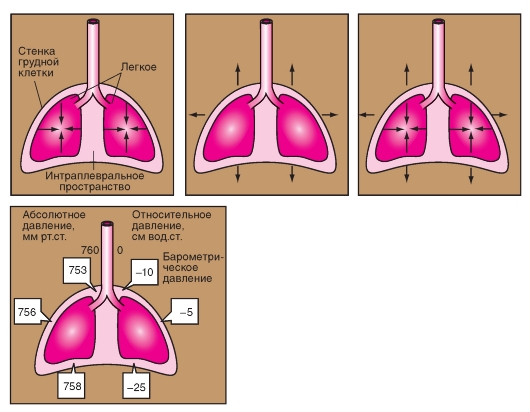
Пневмоторакс
При положении покоя дыхания альвеолярное давление (РА), которое представляет собой трансмуральную разность давления дыхательного аппарата, равняется нулю. Дыхательный аппарат находится в равновесии. При этом плевральное давление (Рpl) негативно (около -0,5 кПа). Трансмуральная разность давления легкого, РА - Ppl, позитивна на одинаковое значение (+0,5 кПа). Итак, легкое растянуто и стремится сжаться, в то время как грудная клетка сжата и стремится расшириться. Эластическая тяга легкого (ретракционная сила легкого) и возвратная сила грудной клетки держатся в положении покоя дыхания, как весы, и их соотношение таково, что плевральное давление является негативным. Легкое и грудная клетка не следуют
этим силам потому, что в плевральной щели находится жидкость. Ее количества достаточно, чтобы сделать возможным скольжение листков плевры относительно друг друга без трения. Так как жидкость нерастяжима, листки плевры (а в сущности, легкое и грудная клетка) сцепляются также прочно, как два влажных стекла, которые хотя легко передвигаются относительно друг друга, но с большим трудом могут быть разделены.
Это сцепление ликвидируется, если воздух поступает в плевральную щель, как это может произойти при повреждении стенки легкого или грудной клетки. Возникает пневмоторакс (рис. 7-15), при котором легкое спадается до минимального объема, а грудная клетка расширяется, принимая положение покоя. Трансмуральная разность давления равняется при этом нулю.
Рис. 7-15. Пневмоторакс (коллапс легких)
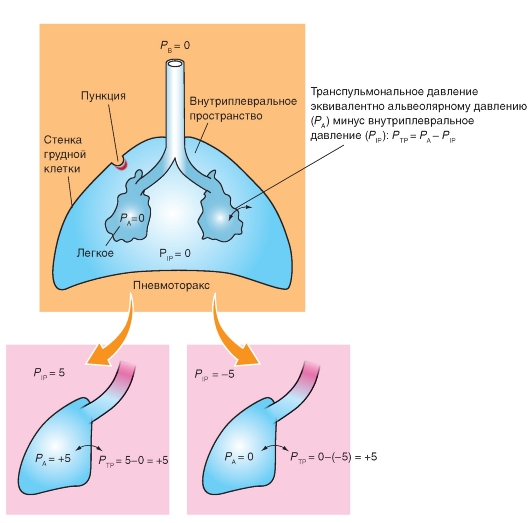
Зависимость между давлением и объемом легких
Эластические свойства присущи как отдельным элементам легких, так и легким в целом. Зависимость между давлением и объемом твердо установлена. Она значительно отличается от таковой для идеально упругого тела, для которого она в координатах давление-объем описывается прямой линией. В отличие от такой прямой, для легких характерны S-образные кривые, различные в зависимости от последовательности изменений. Если начать исследование со спавшихся легких при давлении воздуха в легких, равном атмосферному, и повышать давление в легких последовательно и многократно на определенную величину (например, через вставленную в трахею трубку), то вначале объем легких увеличивается незначительно, затем быстро возрастает и в конце (при приближении к предельному объему) вновь мало меняется (рис. 7-16 А). Если проводить исследование в обратном порядке, т.е. начать с легкого, имеющего большой объем, вызванный приложенным высоким давлением, и затем понижать давление, то объемы легкого при тех же величинах давления, при которых проводилось первое исследование, окажутся иными, значительно большими (рис. 7-16 Б).
Таким образом, были обнаружены две важные особенности: 1) между давлением и объемом не
существует линейной зависимости (в широком диапазоне изменений этих величин); 2) эластические свойства легких меняются в зависимости от их исходного объема. Последнее обусловливает появление на графике, представленном на рис. 7-16, площади - так называемой петли гистерезиса. Эти явления трудно объяснить особенностями свойств эластических волокон легкого, и они побудили обратить внимание на гипотезу о значении поверхностного натяжения альвеол, точнее, пленки жидкости, выстилающей их внутреннюю поверхность.
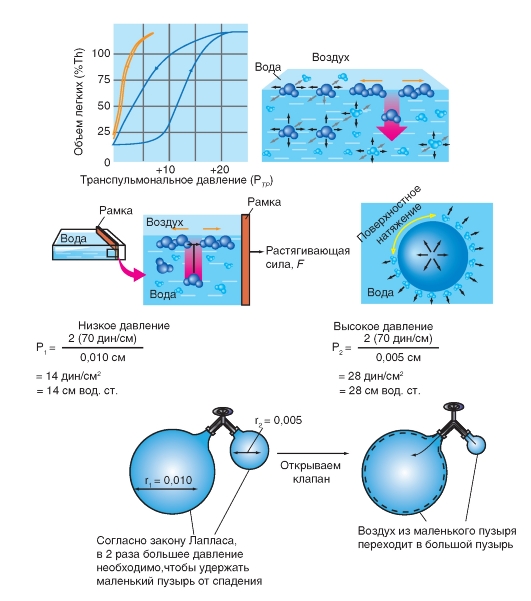
Оказалось, что если полностыо удалить воздух из легких и заполнить их физиологическим раствором (т.е. устранить поверхностное натяжение, возникающее в альвеолах на границе жидкость - газ), то: 1) растяжимость таких легких значительно повышается - при меньшем давлении они занимают больший объем; 2) кривая растяжимости (давление - объем) приближается к прямой; 3) почти полностью исчезает петля гистерезиса (рис. 7-16 Б). Следовательно, значительная часть эластического сопротивления воздухонаполненных легких зависит не от эластических структур легкого, а от поверхностного натяжения, отсутствующего в легких, заполненных физиологическим раствором. Вместе с тем оказалось, что поверхностное натяжение альвеол не приводит к столь серьезным последствиям, которые можно было ожидать, исходя из расчетных данных.
Рис. 7-16. Зависимость между давлением и объемом легких
Применение закона Лапласа к альвеолам
Кривую гистерезиса и ее устранение при помощи заполнения легких водой трудно объяснить особенностями свойств эластических волокон легкого, что побудило обратить внимание на гипотезу о значении поверхностного натяжения альвеол, точнее, пленки жидкости, выстилающей их внутреннюю поверхность.
Эта гипотеза легко объясняла гистерезис. Действительно, при одинаковой геометрической конфигурации малозаполненные воздухом альвеолы должны иметь высокое поверхностное натяжение, а значительно раздутые - меньшее поверхностное натяжение (закон Лапласа). Поэтому легкие с малым исходным объемом воздуха трудно заполнить воздухом, но раздутые легкие сохраняют большой объем даже при снижении давления. Действительно, расчеты, основанные на законе Лапласа, показали, что при микроскопических размерах альвеол и наличии выстилающего их внутри пристеночного слоя жидкости должно возникать значительное поверхностное натяжение. По расчетам разных авторов, его величина столь велика, что при обычном альвеолярном давлении альвеолы должны были бы спадаться, и для того, чтобы они приняли сферичесную форму, необходимо увеличить разность между внутрилегочным и плевральным давлением до 15-20 см вод. ст., т. е. до величины, в несколько раз превышающей существующую в действительности. В соответствии с этим, для эффективного вдоха работа дыхательных мышц должна была бы быть в несколько раз больше реально существующей.
Эти следствия так называемой гипотезы Неегарда столь резко расходились с действительностью, что она долгое время не принималась во внимание. Тем не менее гипотеза Неегарда полностью подтвердилась, и указанные противоречия в настоящее время разрешены.
Легкое, заполненное жидкостью, намного более растяжимо, чем легкое, заполненное воздухом. Это эффект основывается на том, что помимо эластичных волокон, которые входят в состав ткани легкого, его растяжимости противодействуют силы поверхностного натяжения пленки жидкости, выстилающей изнутри альвеолы. Эти силы возникают на изогнутых пограничных поверхностях между жидкой и газообразной фазами, т.е. в альвеолах, которые в большей степени представляют изогнутые структуры в легком.
По закону Лапласа, в газовом пузыре, окруженном жидкостью, возникает трансмуральная разность давления (Рtm), величина которой зависит от радиуса пузыря (r) и от поверхностного натяжения жидкости на пограничной поверхности γ:
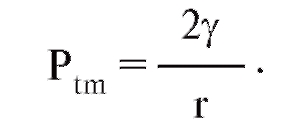
Не надо путать применение закона Лапласа к альвеолам, где в создании давления принимает участие только одна поверхность, и применение закона Лапласа, например, к банальному мыльному пузырю, где в создании давления принимают участие две поверхности. В последнем случае в числителе стоит 4γ.
Рис. 7-17. Закон Лапласа
Обнаружение сурфактанта
В экстрактах легкого, в смывах и в жидкости, полученной из отечного легкого, удалось обнаружить присутствие вещества, резко понижающего поверхностное натяжение. Это вещество оказалось богатым фосфолипидами, липопротеидами, образующимися в клетках альвеолярного эпителия. Таким образом, стало возможным понять, почему величина поверхностного натяжения не столь велика, чтобы вызвать спадение альвеол и невозможность их растяжения в условиях, существующих при нормальном дыхании.
Интерес к этой проблеме значительно возрос, когда было обнаружено, что в легких нежизнеспособных новорожденных, погибших от асфиксии из-за невозможности дыхания (гиалиновый мембраноз новорожденных), снижено содержание поверхностно активного вещества. Поэтому
вопрос приобрел значительный практический интерес, и стало выясняться значение изменений поверхностного натяжения легких и регулирующего его фактора при различных патологических состояниях, особенно с нарушениями дыхания и возникновением ателектазов. Появились десятки статей, посвященных этому веществу, которое стали называть сурфактантом. Роль сурфактанта была показана в опытах, где его активность подавлялась специально подобранными веществами, не влияющими на структуры легкого. Оказалось, что и в контрольных, и в подвергнутых такой обработке легких альвеолы полностью расправляются при давлении в 22 см вод. ст., однако при понижении давления до 5 см вод. ст. объем альвеол контрольного легкого уменьшается лишь наполовину, в то время как альвеолы легкого с инактивированным сурфактантом спадаются даже при небольшом снижении - до 18 см вод. ст.
Рис. 7-18. Срез альвеолярной перегородки со скоплением сурфактанта, особенно в углах. Так устраняются сильные изгибы (маленькие радиусы изгибов), которые по закону Лапласа могли бы производить высокие ретракционные силы (давление распрямления)
Сурфактант
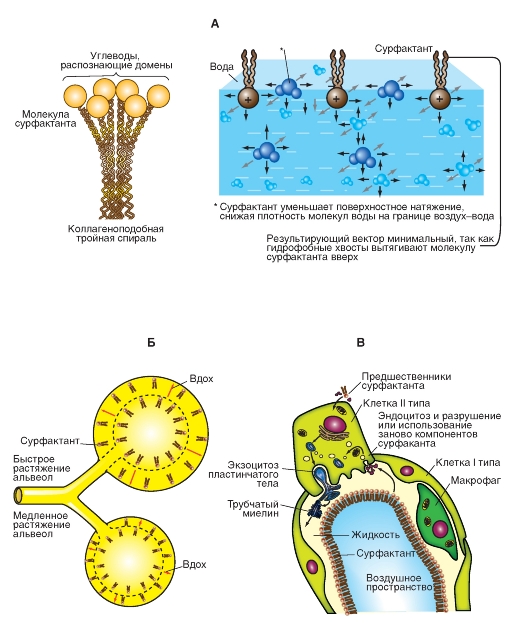
Существующее в легком поверхностное натяжение уменьшается при помощи пленки поверхностно активного вещества, названного сурфактантом, который действует как детергент.
Сурфактант представляет собой смесь, состоящую из фосфолипидов (90-95%), включающих, прежде всего, фофсатидилхолин (лецитин). Наряду с этим, сурфактант содержит четыре специфических для сурфактанта протеина (SP-A, SP-B, SP-C и SP-D), а также небольшую часть угольного гидрата. Сурфактант образуется в эпителиальных клетках типа II альвеол (рис. 7-19 В). В секреторных везикулах эпителиальных клеток накапливаются ламеллярные тельца, которые затем в результате различных раздражений передаются в водный слой, выстилающий альвеолярное пространство изнутри. Там сурфактант с помощью протеина SP-A превращается в трубчатый миелин, а липидные и протеиновые части разделяются. Под действием протеинов SP-B и SP-C липиды располагаются в виде мономолекулярного слоя в пограничном слое жидкость/газ так, что их гидрофильные части заякариваются в водной фазе, а их липофильные части выпячиваются в газовую фазу. Активное поверхностное действие сурфактанта приписывается отталкивающим межмолекулярным силам этих липофильных частей. Иначе говоря, поскольку молекулы сурфактанта с одного конца - гидрофобны, а с другого - гидрофильны, действующие между ними силы молекулярного отталкивания противодействуют силам притяжения между молекулами воды, которые обусловливают поверхностное натяжение. Кроме того, эта жидкостная пленка, выстилающая альвеолы, сглаживает все углы и впадины альвеолярной стенки (рис. 7-19 А, Б).
Путем прямого изучения физико-химических свойств пленки из экстракта, полученного из легких, было установлено, что она резко меняет свое поверхностное натяжение в зависимости от степени растяжения. При уменьшении в 2-4 раза поверхности слоя экстракта из легкого его поверхностное натяжение падает с 40-50 до 5-10 дин/см. Это явление, по-видимому, имеет большое зна-
чение в физиологических условиях, так как оно обеспечивает резкое снижение поверхностного натяжения «малых» альвеол (у которых оно велико) и незначительное снижение поверхностного натяжения «больших» альвеол (у которых оно мало). Оказалось, что пленка из легочного экстракта обладает гистерезисом, и ее поверхностное натяжение меняется в зависимости от частоты и длительности воздействия на размеры занимаемой ею площади.
В общем виде регуляция поверхностного натяжения в альвеолах с помощью сурфактанта сводится к тому, что: 1) снижается поверхностное натяжение альвеол и обеспечивается возможность их расправления и функционирования при небольшой разности между альвеолярным и плевральным давлением; 2) поверхностное натяжение тем больше снижается, чем меньше занимаемый ими объем; это способствует устранению опасности нестабильности альвеол. В результате сохраняется достаточная растяжимость легких (хотя и меньшая, чем если бы вообще фактор поверхностного натяжения не играл роли) и устраняется опасность ателектазов.
Растяжимость легких зависит как от поверхностного натяжения альвеол, так и от тканевых эластических структур легкого. Она выявляется в опытах с легкими, заполненными жидкостью, и определяет их растяжимость. Растяжимость таких легких значительно больше, чем содержащих воздух. Однако при относительно высоком давлении, когда объем легких приближается к максимальному, их растяжимость снижается. Отсюда можно заключить, что основное значение эластических структур легких сводится к тому, что: 1) они вносят свой компонент в эластическое сопротивление легких; 2) предохраняют легкие от перерастяжения. Последнее в физиологических условиях, по-видимому, особенно важно не только по отношению к легким в целом (которые защищены от перерастяжения грудной клеткой), но и для отдельных альвеол и их групп, предельные размеры которых в случаях высокого альвеолярного давления (например, при кашле) лимитируются эластическими свойствами составляющих их тканевых структур.
Рис. 7-19. Строение (А), механизм действия (Б) и метаболизм (В) сурфактанта
Эластическая тяга легких
Легкое растянуто и стремиться сжаться, в то время как грудная клетка сжата и стремится расшириться. Эластическая тяга легкого (ретракционная сила легкого) и возвратная сила грудной клетки держатся в положении покоя дыхания, как весы и их соотношение таково, что плевральное давление является негативным. Легкое и грудная клетка не следуют этим силам потому, что в плевральной щели находится жидкость. Ее количество достаточно, чтобы сделать возможным скольжение листков плевры относительно друг друга без трения. Поскольку жидкость нерастяжима, листки плевры (а в сущности, легкое и грудная клетка)
сцепляются также прочно, как два влажных стекла, которые, хотя легко передвигаются относительно друг друга, но с большим трудом могут быть разделены.
Эластическая тяга легких влияет также на бронхи (и сосуды), лежащие в ткани легкого, и существенно определяет их просвет. Так как в сущности большие и среднебольшие бронхи определяют сопротивление дыхательного пути (RL), величина RL сильно уменьшается с увеличением объема легкого. В положении покоя дыхания RL достигает приблизительно 0,13 кПа/л • с. При очень небольшом объеме легких мелкие воздухоносные пути, которые расправляются хуже, могут полностью спадаться, что обуславливает сильный подъем RL.
Рис. 7-20. Эластическая тяга легких
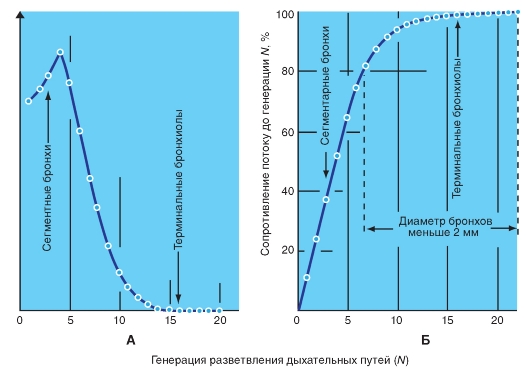
Сопротивление воздухоносных путей
Сопротивление воздухоносных путей локализуется в верхних дыхательных путях. Так как воздухоносные пути по мере разветвления бронхиального дерева к периферии становятся всегда все более узкими, можно было бы предположить, что именно самые узкие ветви оказывают наибольшее сопротивление дыханию. Число бронхов каждого уровня, сильно увеличивающееся к периферии, ведет, однако, к все большему увеличению суммарного диаметра, так что сопротивление воздухоносных путей, несмотря на сильно увеличивающееся сопротивление в отдельных бронхах, в сущности, локализовано
в верхних дыхательных путях: во рту, носу и зеве, а также в трахее, долевых и сегментарных бронхах приблизительно до шестой генерации разветвления (рис. 7-21). На периферические воздухоносные пути с диаметром ниже 2 мм приходится менее 20% сопротивления дыханию. Именно эти отделы обладают наибольшей compliance (растяжимостью - CL). Клинически это крайне важно, потому что заболевания легких часто начинаются на периферии. Измерение сопротивления воздухоносных путей не является и в этом случае адекватным диагностическим приемом для распознавания ранних стадий заболеваний. Должны применяться специальные диагностические исследования.
Рис. 7-21. Сопротивление потоку воздуха в дыхательном тракте.
А - сопротивление потоку воздуха во всех (параллельно расположенных) бронхах данной генерации разветвления N убывает по направлению к периферии. Б - около 80% общего сопротивления потоку воздуха оказывают дыхательные пути с диаметром выше 2 мм
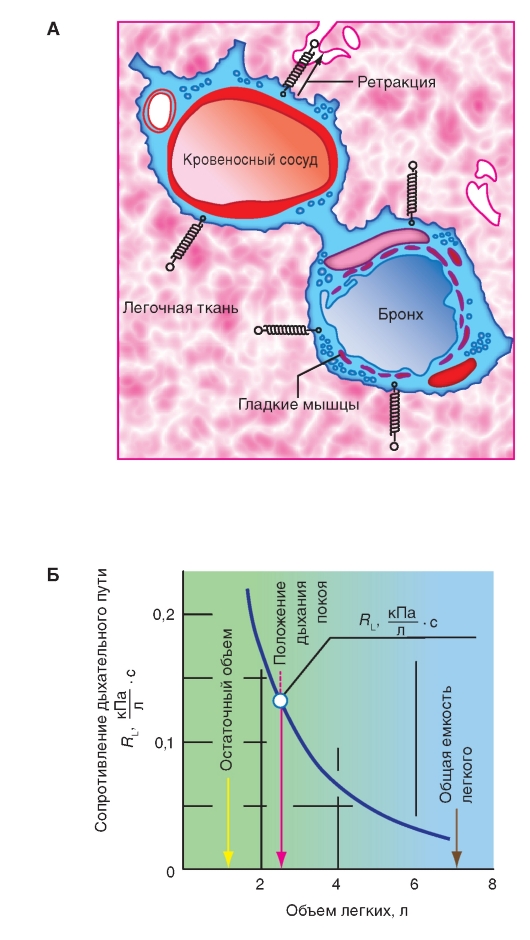
Модель крепления альвеол
Крепление альвеол друг другом является третьим фактором, определяющим эластичность легкого. Стремление к ретракции альвеол, имеющих большой объем, которые скреплены с альвеолами, имеющими меньший объем, растягивает последние, предотвращая их коллапс. Таким образом, коллапс альвеолы, имеющей меньший объем, предотвращается посредством ретракции окружающих альвеол, имеющих больший объем. Это эластичное взаимодействие в легочной ткани имеет большое значение для поддержания диаметра маленьких бронхов (и сосудов) в легочной ткани (рис. 7-22 А). Если уменьшается стремление к ретракции альвеол, имеющих большой объем, то это может привести к сужению или коллапсу маленьких бронхов, что приводит к увеличению сопротивления дыхательных путей. Подобного рода уменьшение эластичной ретракции (увеличение CL) находят при легочной
эмфиземе, при которой по различным причинам наступает чрезмерное вздутие легкого с атрофией ткани в периферических отделах легкого. То есть ретракционная сила не должна быть ни слишком большой (плотное легкое; трудности развертывания, например, при недостатке сурфактанта), ни слишком маленькой (вялое легкое; коллапс бронхиол, например, при эмфиземе).
Эластическая тяга легких влияет также на бронхи и сосуды, лежащие в ткани легкого и существенно определяет их просвет (рис. 7-22 А). Так как в сущности большие и среднебольшие бронхи определяют сопротивление дыхательного пути (RL), величина RL сильно уменьшается с увеличением объема легкого (рис. 7-22 Б). В положении покоя дыхания RL достигает приблизительно 0,13 кПа/л • с. При очень небольшом объеме легких мелкие воздухоносные пути, которые расправляются хуже, могут полностью спадаться, что вместе обусловливает сильный подъеме RL.
Рис. 7-22. Ретракция легочной ткани. Эластичная альвеолярная ткань осуществляет растяжение интропульмональных бронхов и сосудов, которые моделируются при помощи пружинок. Это растяжение увеличивается с увеличением легочного объема (ретракционная сила увеличивается)
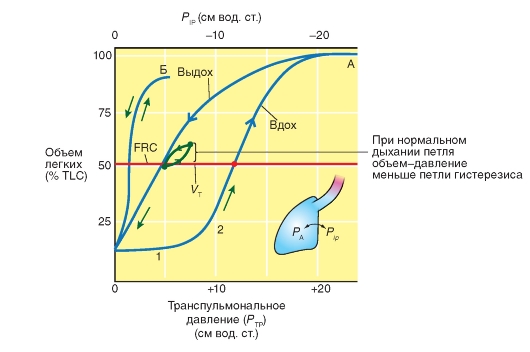
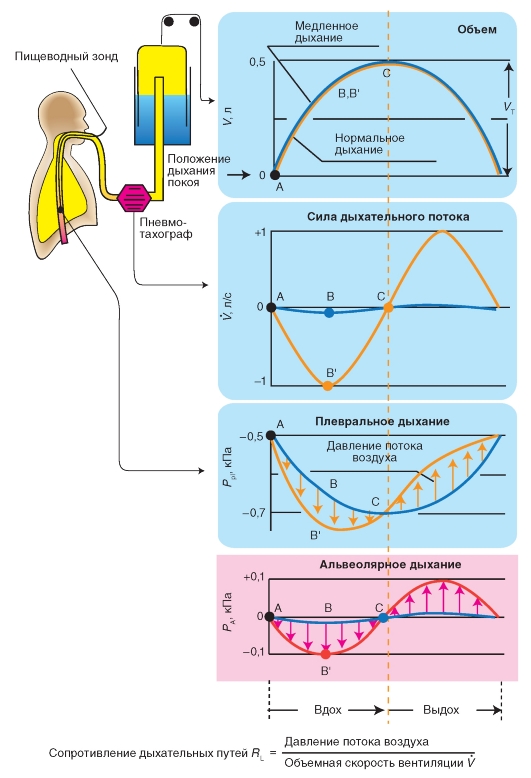
Измерение альвеолярного давления
Мы вновь прибегаем к построению, причем на этот раз мы дополнительно измеряем с помощью пневмотахографа интенсивность дыхательного потока (V - объемная скорость вентиляции) во время дыхания испытуемого. На рис. 7-23 представлены измеренные во времени изменения дыхательного объема (V), интенсивности дыхательного потока (V) и плеврального давления (Ppl). При крайне медленном дыхании с едва измеримой, незначительной интенсивностью дыхательного потока получаются кривые, обозначенные на рис. 7-23 синим цветом. Объем повышается при вдохе от точки А через точку В к точке С и падает далее вновь при выдохе. Плевральное давление остается отрицательным при положении покоя дыхания и становится во время вдоха еще в большей степени отрицательным. Альвеолярное давление остается относительно небольшим, так как небольшая интенсивность дыхательного потока также не ведет к большим перепадам давления вдоль дыхательных путей.
Если испытуемый дышит тем же самым объемом с высокой интенсивностью дыхательного потока, то он нуждается в существенно высокой «движущей» разности давления. Для того чтобы произошел вдох, альвеолярное давление (РА) должно быть при вдохе негативнее, при выдохе - позитивнее. Но при этом, при каждом объеме легкого,
разность РА-Рр1 примерно одинакова, как и в отсутствии потока воздуха, так как она определяется только эластичностью легкого, которое не зависит от активности дыхательных мышц (см. выше). Отсюда плевральное давление во время вдоха с выраженной интенсивностью дыхательного потока (имеющей большое значение), должно стать еще негативнее (рис. 7-23 оранжевая кривая АВ'С), чем при незначительной интенсивности дыхательного потока (голубая кривая АВС). Разность плеврального давления между голубой и оранжевой кривыми является как раз искомой «движущей» разностью давления, т.е. альвеолярным давлением РА. Если разделить эту разность на соответствующее значение V, то получают искомое сопротивление дыхательных путей (RL).
Альвеолярное давление можно также измерить методом общей плетизмографии, и из зарегистрированного при этом отношения «давление-интен- сивность потока» можно вывести сопротивление дыхательных путей.
При спокойном дыхании давление потока воздуха вдоль дыхательных путей достигает максимум 0,1 кПа, однако при учащенном дыхании это значение может сильно возрастать. Тогда при вдохе должны создаваться, соответственно, более сильные негативные плевральные давления, а при выдохе плевральное давление может даже стать позитивным с опасностью компрессии дыхательных путей.
Рис. 7-23. Объемная скорость вентиляции, альвеолярное давление и плевральное давление.
При очень медленном дыхании (дыхательный объем VT = 0,5 л) объемная скорость вентиляции (V) и альвеолярное давление (РА) близки к нулю (синие кривые, АBC). При этом объем легкого (V) и (негативное) плевральное давление (Рр1) на кривой растяжения покоя легко связаны друг с другом. При нормальном дыхании (неизменное VT, оранжевые кривые АВ'С) объемная скорость вентиляции является измеримой, и альвеолярное давление (которое не измеряется прямым методом) является инспираторно негативным, экспираторно позитивным (красная кривая). Плевральное давление становится инспираторно более негативным (АВ'С) и экспираторно менее негативно, чем при медленном дыхании. Разность обеих кривых плеврального давления является в каждой временной точке, одинаковой с альвеолярным давлением, т.е. его можно найти по точкам кривых плеврального давления (идеальное, схематичное прохождение кривых)
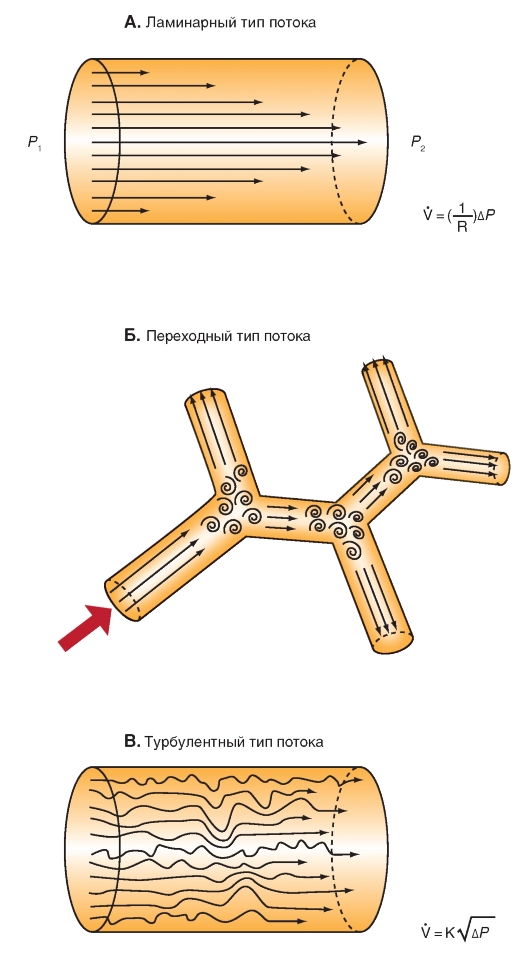
Типы потоков воздуха в дыхательных трубках
Ламинарный поток (laminar flow) является таким типом движения, когда воздух движется в виде последовательности отдельных слоев, причем каждый движется со своей скоростью (рис. 7-24 А). При ламинарном течении в трубке воздух состоит из последовательности бесконечно малых тонких концентрических слоев, скользящих один относительно другого.
Переходный поток (transitional flow) является таким типом потока, при котором в разветвлениях трубок возникают вихревые движения воздуха (рис. 7-24 Б).
Турбулентный поток (turbulent flow) представляет собой беспорядочное движение частиц, что может привести к развитию неравномерного течения воздуха в трубке. При таких условиях частицы не остаются в определенном слое, а происходит их быстрое перемешивание в радиальном направлении (рис. 7-24 В).
Воздух проходит через трубку, если между ее концами существует перепад давлений, от величины которого зависят скорость и особенности воздушного потока. При низких скоростях линии течения параллельны стенкам трубки (ламинарный поток). По мере возрастания скорости потока он становится все менее однородным, особенно в местах ветвления трубки. Наконец, при очень высоких скоростях линии течения полностью теряют упорядоченность (турбулентный поток).
Уравнение, связывающее давление и расход (т.е. объемную скорость), при ламинарном потоке было впервые выведено французским врачом Пуазейлем:
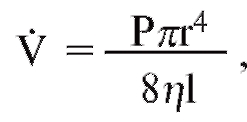
где V - расход, Р - давление, создающее поток (АР), r - радиус трубки, η - вязкость, l - длина трубки). Из уравнения видно, что давление пропорционально расходу (Р = KV). Поскольку сопротивление потоку R равно давлению, деленному на расход, можно записать:
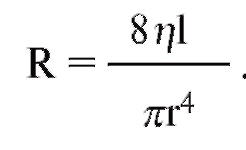
Как видно, наибольшую роль играет радиус трубки. Важно также, что на взаимоотношение между
давлением и расходом влияет вязкость, а не плотность вещества.
Одна из особенностей ламинарного потока заключается в том, что частицы газа в центре трубки передвигаются со скоростью, в 2 раза превышающей среднюю. Распределение скоростей движения частиц по диаметру трубки называется профилем скорости.
Особенности турбулентного потока совершенно иные. Давление в этом случае пропорционально уже не расходу, а квадрату расхода (P = KV?2). Кроме того, вязкость при таком режиме не играет существенной роли, зато увеличение плотности при данном расходе повышает перепад давлений. Профиль скоростей с максимумом в области оси трубки для турбулентного потока нехарактерен.
Будет поток ламинарным или турбулентным, в значительной степени зависит от так называемого числа Рейнольдса (Re):
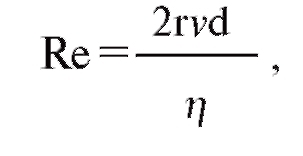
где d - плотность, v - средняя линейная скорость, r - радиус трубки, η - вязкость. В прямых гладких трубках турбулентность возможна при числе Рейнольдса больше 2000. Из уравнения видно, что турбулентный поток легче возникает при высоких скоростях и в широких трубках. Кроме того, вещества с низкой плотностью (например, гелий) имеют меньшую тенденцию к турбулентности.
Применить все эти закономерности к такой сложной системе трубок, как бронхиальное дерево - со всеми его разветвлениями, изменениями диаметра и неровными стенками - трудно. Особенности потока очень сильно зависят от «входных» характеристик трубки. Поскольку бронхиальное дерево постоянно ветвится, можно полагать, что истинный ламинарный поток возникает лишь в самых мелких воздухоносных путях, где число Рейнольдса очень мало (в конечных бронхиолах - около 1). В остальных участках течение носит переходный характер. Турбулентный поток может наблюдаться в трахее, особенно при физической нагрузке, когда скорость тока воздуха возрастает. В целом для расчета «перепада» давления в бронхиальном дереве следует использовать как первую, так и вторую степени расхода воздуха: Р = K1V + K2V2.
Рис. 7-24. Типы потоков воздуха в трубке.
А - при ламинарном течении все мельчайшие частицы движутся в потоках, параллельных оси трубки. Пристеночный слой менее подвижен; центральный поток воздуха в трубке имеет максимальную скорость. Б - при переходном течении воздуха вихревые движения образуются в местах разветвления трубок. В - в турбулентном потоке мельчайшие частицы беспорядочно движутся в центральном, радиальном и круговом направлениях. Часто наблюдаются вихревые движения и переход через среднюю линию
Изменение давлений во время дыхательного цикла
Дыхательный аппарат упрощенно можно себе представить как два заключенных друг в друга полых, эластичных образования - легкие в полости грудной клетки. Под грудной клеткой подразумевают, в данном случае, все ткани, окружающие легкие, включая ребра, межреберные мышцы и диафрагму. Эластические свойства легкого и грудной клетки очень различны, однако их можно определить с помощью трансмуральной разности давления.
Внутреннее давление в легких (давление в альвеолах) обозначается как интрапульмональное давление или альвеолярное давление (РА). Давление на поверхности легкого и на внутренней поверхности грудной клетки (давление в плевральной щели) называется внутриплевральным или плевральным давлением (Рр1). На внешнюю поверхность грудной клетки оказывает влияние барометрическое давление (РВ), с которым в механике дыхания соотносятся все давления. В этом случае, атмосферным давлением будет являться давление, принятое за 0. Отрицательное давление называется субатмосферным. С этими давлениями получается искомая
трансмуральная разность давления (внутреннее давление - внешнее давление):
• легкое: PA - Pp1; трансмуральная разность давления,
• грудная клетка: Ppl; трансторокальная разность давления,
• аппарат дыхания: PA «трансдыхательный аппарат» - разность давления, т.е. разность давления между внутренней средой легкого и внешней поверхностью грудной клетки.
В течение полного дыхательного цикла - вдоха около 500 мл, и последующего выдоха - сначала генерируется негативное, а затем позитивное давление PA. Четыре панели на рис. 75 показывают идеализированное время развития пяти ключевых параметров.
Отметим, что если вдыхать определенный объем (измеренный спирометром) и задерживать дыхание при открытой голосовой щели (заставляя дыхательные мышцы напрягаться), то альвеолярное давление будет равным атмосферному, принятому за ноль (рис. 7-25 А). Трансмуральное давление легкого (PA - Ppl) равно -Рр1, так как РА = 0. С помощью пищеводного зонда измеряется не -Рр1, а само Рр1.
Рис. 7-25. Связь альвеолярного (РА) и плеврального (Рр1) давлений во время дыхательного цикла.
На рисунке введены обозначения: PB - барометрическое давление, PA - альвеолярное давление, Ppl - давление в плевральной полости, РТР - транспульмональное давление. Все величины давления представлены в см вод. ст. VL - объем легких; V - интенсивность дыхательного потока. Цветные точки на графиках в правой части рисунка, отмеченные как а, б, в, г, соответствуют номеру иллюстрации на левой части рисунка А, Б, В, Г. Строчными буквами промаркированы ситуации: а - до начала вдоха, б - половина вдоха, в - полный вдох, г - половина выдоха
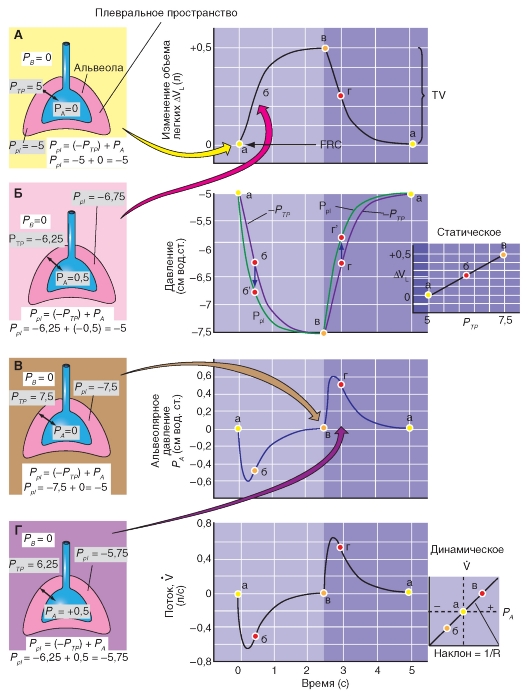
Изменение давлений в респираторной системе во время дыхательного цикла
Во время вдоха инспираторные мышцы отклоняют дыхательный аппарат от положения равновесия. При нормальном спокойном дыхании положение покоя дыхания достигается в конце выдоха. Выдох, напротив, следует пассивно при помощи эластичных возвратных сил, точно так же, как растянутая пружина сама возвращается в исходное положение.
Дилатация и спадение воздухоносных путей при потоке воздуха обусловлена компрессией, т.е. сжатием воздухоносных путей под действием внутригрудного давления. На рис. 7-26 схематично изображены действующие на них силы. Давление, приложенное снаружи, здесь соответс-твует внутриплевральному (хотя практически все гораздо сложнее). Схема легкого с интраторокальными дыхательными путями при задержке дыхания представлена на рис. 7-26 Б. Давление в альвеолах (РА) и в дыхательных путях (Раw) равно нулю (равно атмосферному). На основе эластичного движения легкого плевральное давление Рр1 является на значение Ре1 ниже, чем РА. Эта трансмуральная разность давления Ре1 = РА - Рр1 держит дыхательные пути открытыми. Перед началом вдоха давление в воздухоносных путях везде равно нулю (воздушного потока нет - рис. 7-26 Б), а, поскольку внутриплевральное давление составляет -5 см вод.ст. (рис. 7-26 Б; график), на эти пути действует давление 5 см вод.ст., поддерживающее их в открытом состоянии. В момент начала вдоха (рис. 7-26 А) внутриплевральное и внутриальвеолярное давления снижаются (мы допускаем, что объем легких остался прежним и пренебрегаем сопротивлением тканей), и в дыхательных путях создается воздушный поток. Внутреннее давление по ходу дыхательных путей падает. К концу вдоха поток воздуха прекращается и на дыхательные пути действует трансмуральное давление 8 см вод.ст. В начале форсированного
выдоха (рис. 7-26 Г) и впутриплевральное, и альвеолярное давления возрастают. Когда начинается движение воздуха, давление по ходу дыхательных путей падает и стремится перекрыть дыхательные пути. Происходит спадение воздухоносных путей, и ограничивать поток начинает давление снаружи дыхательных путей, т.е. внутриплевральное. Таким образом, эффективное движущее давление для воздушного потока становится равным внутриальвеолярному за вычетом внутриплеврального. Скорость воздушного потока в этом случае не зависит от давления в ротовой полости. Следует отметить, что при попытке повысить расход воздуха, увеличив усилие дыхательных мышц (за счет возрастания внутриплеврального давления), эффективное «движущее» давление не изменится. Иными словами, расход воздуха в данной ситуации не зависит от усилия. Максимально возможный расход при уменьшении легочного объема снижается, так как уменьшается разница между внутриальвеолярным и внутриплевральным давлением, кроме того, воздухоносные пути становятся уже. Видно также, что расход не зависит от сопротивления дыхательных путей, расположенных проксимальнее области спадения.
Ограничение расхода воздуха за счет этого механизма еще более усиливается под действием нескольких факторов. Один из них - повышение сопротивления периферических воздухоносных путей. Оно увеличивает перепад давления в этих путях и, следовательно, снижает внутрибронхиальное давление при выдохе. Еще один фактор - низкий исходный легочный объем, при котором уменьшается «движущая» разница между внутриальвеолярным и внутриплевральным давлением. Кроме того, эта разница уменьшается при увеличении растяжимости легких, например при эмфиземе. У здоровых людей механизмы ограничения расхода воздуха действуют лишь при форсированном выдохе, а у больных с тяжелыми поражениями легких - даже при спокойном дыхании.
Рис. 7-26. Дилятация и спадение воздухоносных путей при прохождении потока воздуха.
Представлена схема, иллюстрирующая сдавливание дыхательных путей во время дыхательного цикла. Видно, что во всех случаях, кроме форсированного выдоха, давление, действующее на воздухоносные пути, поддерживает их в открытом состоянии. Изменение давления в легких: А - при вдохе, Б - без того или иного потока воздуха, В - при выдохе, Г - при форсированном выдохе.
PB - барометрическое давление, PA - альвеолярное давление, Ppl - давление в плевральной полости, РТР - транспульмональное давление, РТМ - трансмуральное давление поперек проведения воздушного пути, Рaw - давление в воздухоносных путях
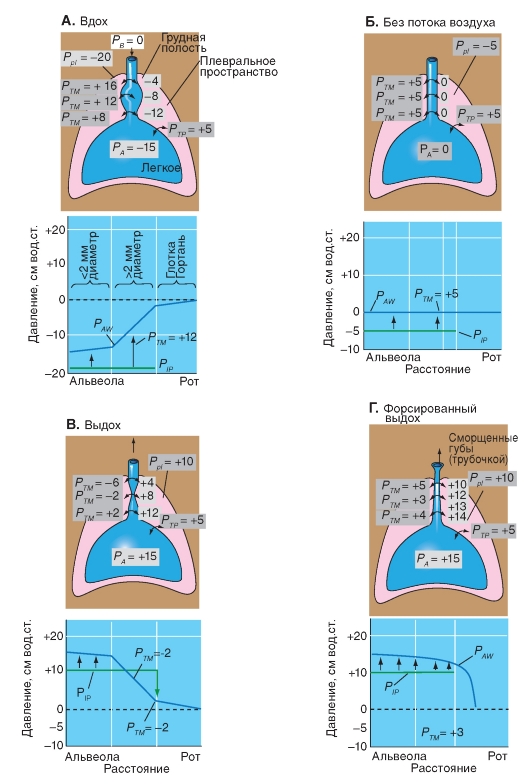
Изменение давлений в респираторной системе во время форсированного выдоха
Максимальный форсированный выдох или выдох, осуществленный с максимальным напряжением, позволяет сделать важные диагностические заключения о функциональном состоянии дыхательного аппарата. В конце выдоха интенсивность дыхательного потока ограничивается за счет компрессии мелких дыхательных путей.
Схема легкого с дыхательными путями при задержке дыхания представлена на рис. 7-27 А. Давление в альвеолах (РА) и в дыхательных путях является равным нулю (равно атмосферному РБ). Если ориентироваться на общую емкость легких (TLC), то РА равно 0 потому, что рассматривается статическое состояние, при котором РТР (транспульмональное давление) равно +30 см вод.ст. при поддерживаемой общей емкости легких (TLC), и Рр1 (давление в плевральной полости) равно, таким образом -30 см вод.ст. Теперь, начиная от значения TLC, человек делает максимальный форсированный выдох. Рис. 7-27 Б показывает давление в легких и дыхательных путях в начале этой процедуры. В начале форсированного выдоха и впутриплевральное, и альвеолярное давления возрастают.
На рис. 7-27 В представлены кривые зависимости объема легких от дыхательного потока (кривая «поток-объем»). Измеренные наосновеспирограммы форсированного выдоха значения экспираторной интенсивности дыхательного потока (VE) и объема (V) могут накладываться друг на друга. При этом получают кривые зависимости объема легких от экспираторной интенсивности дыхательного потока. Уже после начала выдоха (исходя из максимального вдоха = TLC) VE достигает максимума (максимальная экспираторная интенсивность дыхательного потока, VEmax), затем величина VE вместе с объемом линейно падает до значений, близких к остаточному объему. Если сопоставляют кривую зависимости объема легких от экспираторной интенсивности дыхательного потока при других экспираторных формах, например, с меньшим напряжением или при более медленной и затем форсированной экспирации, то получают
абсолютно различные кривые. Однако последняя часть напряжения дыхания является совершенно независимой (левая часть кривой). Это объясняется тем, что плевральное давление, которое становится позитивным при форсированном выдохе, сжимает мелкие дыхательные пути так, что повышение экспираторного напряжения не повышает экспираторную интенсивность потока.
В здоровых легких эта динамическая компрессия дыхательных путей наступает только при форсированном выдохе. В нормальных условиях дыхательные пути, благодаря ретракции легких, находятся в открытом состоянии. Проявлением ретракции является отрицательное плевральное давление (Рр1). Но при сильном напряжении выдоха Рр1 становится положительным и более высоким, чем в мелких дыхательных путях, которые потом под действием положительного Рр1 сжимаются. Это особенно проявляется при уменьшенной ретракции легочной ткани (CL повышено) и при повышенном сопротивлении дыхательных путей, когда «движущая» разность давления увеличивается. Но динамическая компрессия дыхательных путей имеется только при выдохе, но не при вдохе, при котором Рр1 становится более отрицательным и держит дыхательные пути открытыми.
Рис. 7-27 Г иллюстрирует зависимость «поток- усилие». Заметим, кроме того, что инспираторная работа состоит из работы по преодолению эластических сопротивлений при растяжении легкого и грудной клетки и по преодолению вязкого сопротивления (равна работе по преодолению трения, что равно сумме аэродинамического сопротивления воздухоносных путей, вязкого сопротивления тканей и инерционному сопротивлению). Инспираторная работа должна привести к инспираторному движению воздуха. Инспираторная работа против эластических сил (как у металлической пружины) «аккумулируется» и опять применяется для производства экспираторной работы. Потенциальной энергии, накопленной при инспираторной работе дыхательных мышц, достаточно, чтобы обеспечить преодоление вязких сил при экспирации. Отсюда следует, что при выдохе не требуется, чтобы мышцы при спокойном дыхании производили работу, а это значит, что выдох является пассивным при спокойном дыхании.
Рис. 7-27. Форсированный выдох.
А - отсутствие потока. Б - максимальный форсированный выдох. В - кривые «поток-объем» легкого. При форсированной экспирации (исходя из 100% общей емкости легкого) до остаточного объема достигается максимальная экспираторная сила дыхательного потока (VEmax). Левая часть кривой независима от напряжения дыхания, т.е. и при других экспираторных формах одинакова по форме с кривой максимального экспираторного напряжения. Г - кривые «поток усилие».
PB - барометрическое давление, Ppl - давление в плевральной полости, PA - альвеолярное давление, РТР - транспульмональное давление. Все величины давления представлены в см вод.ст.
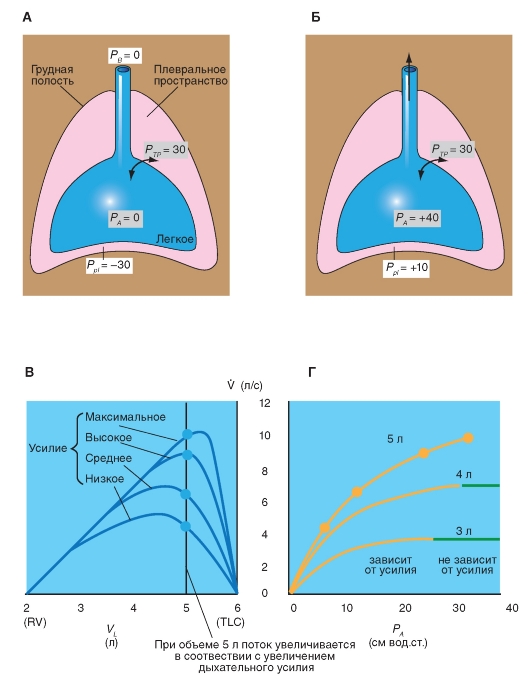
Альвеолярная вентиляция
С каждым литром воздуха мы вдыхаем около 170 мл О2. Часть кислорода попадает в альвеолярное пространство и оттуда в кровь, так что выдыхаемый воздух при нормальном дыхании в покое содержит еще около 130 мл О2 на литр. Если вентиляция при неменяющемся поступлении О2 в кровь повышается, то выдыхается даже еще большее количество О2. Если, наоборот, потребность организма в О2 повышается, но повышения вентиляции в одинаковой мере не происходит, то потребляется большее количество О2 из вдыхаемого воздуха.
Важное соотношение между вентиляцией VE (измеренной на выдохе), поступлением О2 или (количество О2, поступившее за единицу времени) и экспираторным составом газа можно выразить следующим уравнением:
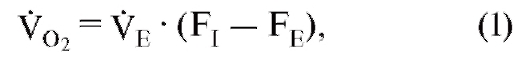
где FI и FE являются, соответственно, фракциями О2 во вдыхаемом воздухе или выдыхаемом воздухе. Для выделения СО2 (выделенное количество СО2 за единицу времени, VCO2) подходит аналогичное соотношение (причем инспираторная фракция СО2 FI СО2 равна нулю):
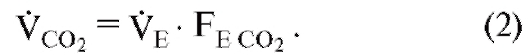
Объемная скорость легочной вентиляции или
просто вентиляция, представляющая собой объем газа, вдыхаемого или выдыхаемого за единицу времени, определяется большей частью из дыхательного объема (VT) и частоты дыхания (fR):

Инспираторный и экспираторный объемы являются практически одинаковыми. Незначительные различия получаются из того, что несколько меньший объем СО2 выдыхается, чем вдыхается О2. При дальнейшем рассмотрении можно пренебречь этими различиями, которые благодаря вводу так называемой азотной коррекции могут быть учтены, и символ VT характеризует дыхательный объем, изме-
ренный на выдохе. Соответствующие различия имеются между инспираторной и экспираторной вентиляцией, которые, однако, как крайне незначительные, не должны приниматься во внимание. Вместо символа VT для вентиляции чаще употребляется символ VE , который подразумевает, что вентиляция большей частью измеряется в условиях выдоха, например, благодаря сбору выдыхаемого воздуха в спирометре.
При использовании уравнений (1) и (2) должны учитываться условия измерения. Так VО2 и VCO2 вводились в STPD, но VE - в BTPS. С учетом приведенных ниже уравнений:
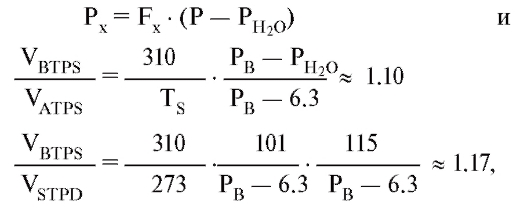
эти пересчеты могут быть внесены в уравнения (1) и (2), и фракция F может быть заменена парциальным давлением Р (которое при дальнейшем рассмотрении газообмена является предпочтительным). Отсюда получается:
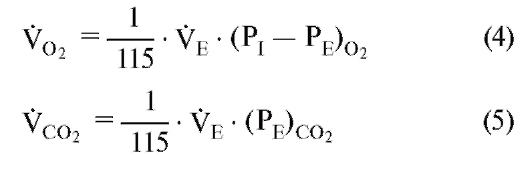
(VO2 и VCO2 в 1STPD; VE в 1BTPS; P в кПа; число 115 имеет размерность кПа и обладает другим значением, если Р измеряется в других единицах).
Уравнения (4) и (5) демонстрируют простой путь измерения важных величин поступления О2 (VO2) и выделения СО2 (VCO2) в легких. Кроме того, нужно только собрать выдыхаемый воздух (смешанный выдыхаемый газ) и в нем измерить фракции О2 и СО2 или их парциальное давление. Вентиляция (объем дыхания за единицу времени или, иначе, объемная скорость вентиляции) VE оказывается собранным объемом газа за единицу времени.
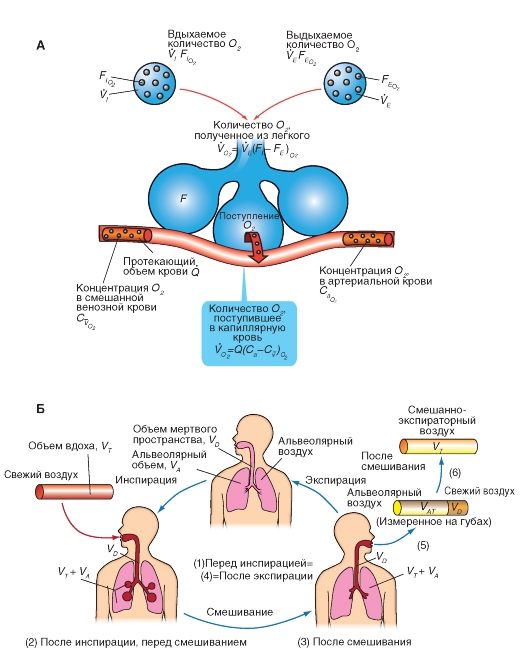
Рис. 7-28. Поступление О2 в легкие и выделение СО2.
А - балансы поступления О2 с дыханием и поступлением О2 в кровь легочных капилляров. Б - альвеолярный воздух и выдыхаемый воздух. Перед инспирацией (1) альвеолярное и мертвое пространства заполняются (от последней экспирации) альвеолярным воздухом. После инспирации (2) дыхательного объема VТ расширяется альвеолярное пространство на величину VT Часть VТ - VD = VTA свежего воздуха, поступившего при вдохе, достигло альвеолярного пространства, остаток (VD) находится в мертвом пространстве. Часть свежего воздуха, достигшего альвеолярного пространства, смешивается (во время инспирации) с альвеолярным воздухом (3), что освежает последний. При экспирации выдыхается прежде всего, воздух мертвого пространства (VD , свежий воздух), потом альвеолярный воздух (VTA) (5). Смесь обеих частей образует смешанно-экспираторный воздух (6). Концентрация газов в легком является в конце экспирации (4) равной токовой как перед инспирацией (1). Так как во время общего дыхательного цикла О2 диффундирует в кровь и СО2 из крови в альвеолярное пространство, освеженный альвеолярный газ (3) опять теряет О2 и обогащается СО2
Структура и функции гемоглобина
Кислород и углекислый газ частично переносятся в крови в физически растворенном виде. Физическое растворение О2 с СО2 подчиняется закону Генри, согласно которому количество растворенного в жидкости газа пропорционально его парциальному давлению, поэтому содержание физически растворенного О2 в крови крайне мало. Из-за своей незначительной физической растворимости О2 транспортируется в основном транспортным протеином-гемоглобином (Hb), на котором атомы железа в геме обратимо связываются с кислородом, т.е. кислород в крови химически связан с гемоглобином.
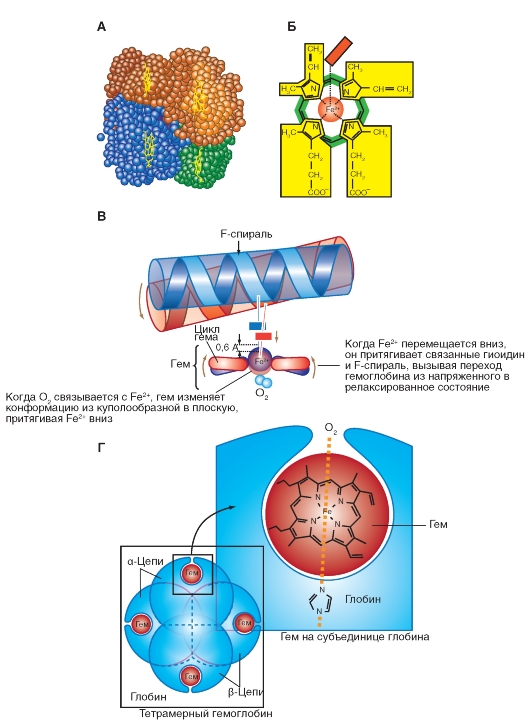
Гемоглобин - это хромопротеид, представляющий собой тетрамер (рис. 7-29 А). Молекулярная масса каждой цепи - около 16 100 Да, поэтому молекула гемоглобина, состоящая из четырех субъединиц, имеет молекулярную массу около 64 500 Да. Каждый мономер состоит из гема и глобина. Гем - это порфириновое соединение, связанное с одним атомом железа (рис. 7-29 Б). Глобин - это полипептид, представляющий собой α-цепь (141 аминокислота) или β-цепь (146 аминокислот). Гомология между α-и β-цепью достаточно высока, что дает возможность цепям иметь одинаковые конформации. Таким образом, ком-
плекс гемоглобина имеет форму [а(Гем)]2[β (Гем)]2 и может связывать 4 молекулы О2.
Когда О2 связывает Fe2+, гем переходит из куполообразной в плоскую конформацию, оттягивая Fe2+ вниз (рис. 7-29 В)
При обратимой реакции присоединения к гему молекула О2 связывается с атомом железа, которое находится во второй степени окисления (т.е. это двухвалентное железо Fe2+). Соеди-нение, образовавшееся в результате связывания называется оксигемоглобин (HbO2), тогда как гемоглобин без О2 называется дезоксигемоглобин (Hb). Это присоединение О2, которое проходит без изменения степени окисления (оксидации) железа, называется оксигенацией (это не оксидация или окисление), отщепление О2 - дезоксигенация. В 2% случаев глобин взрослых представляет собой HbA2 и состоит из 2 α-субъединиц и 2 δ-субъединиц. В отличие от глобина взрослых HbA1, глобин плода HbF состоит из двух α-цепей и двух γ-цепей.
Оксигенированная кровь светло-красная, тогда как дезоксигенированная - синевато-темнокрасная (синюшно-багровый цвет НЬ). Если абсолютная концентрация дезоксигенированного гемоглобина в капиллярной крови повышается более, чем на 50 г/л, то это приводит к посинению кожи и слизистых покровов (цианоз).
Рис. 7-29. Гемоглобин.
А - гемоглобиновый тетрамер. Б - молекула гена. В - конформационные изменения при связывании О2. Г - масса связывания О2 в молекуле гемоглобина
Связывание кислорода с гемоглобином
Чтобы лучше представить свойства реакции связывания О2 гемоглобином, принимают во внимание только концентрацию О2, связанного с гемоглобином, это значит, концентрацию оксигенированного гема в гемоглобине (HbO2). Ее можно соотнести к кислородной емкости крови, что значит к общей, способной к связыванию, концентрации гемоглобина, и таким образом, получить насыщение О2:
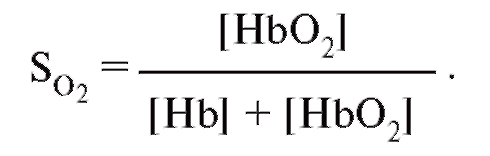
В этом случае [Hb] отражает концентрацию дезоксигенированного гема в гемоглобине. (Также кратко обозначаются как [Hb] и [HbO2] концентрации дезоксигенированного и оксигенированного гемоглобина. Но надо помнить, что каждый моль гемоглобина может связать четыре моля О2. SO2 может принимать значения между 0 (полностью дезоксигенированный гемоглобин) и 1,0 (полностью оксигенированный гемоглобин). Концентрация химически связанного О2 является в крови произведением SO2 и кислородной емкости.
Рис. 7-31 демонстрирует кривую связывания гемоглобина, как зависимость насыщения гемоглобина кислородом от РО2 (сатурационная кривая О2). Важным параметром для описания этой кривой является Р0.5, что соответствует РO2 при
половинном насыщении гемоглобина (SO2 = 0,5). В человеческой крови Р0,5 = 3,6 кПа = 27 мм рт.ст.
S-образная форма кривой связывания О2 основана на взаимодействии четырех субъединиц, составляющих тетрамер гемоглобина. Присоединение О2 к гему одной субъединицы повышает аффинность (сродство) для соединения О2 с остальными субъединицами. Кривая связывания О2 мономерным миоглобином - протеином, связывающим О2 в мышечных клетках, является, напротив, гиперболической, что можно вывести из одноступенчатой реакции Mb + O2 = MbO2.
S-образная форма кривой связывания гемоглобином О2 имеет большое значение для транспортной функции крови. В области значений РО2, выше, чем 8 кПа, кривая плоская и изменение РО2 только немного меняют насыщение кислородом. Это область нормальных значений альвеолярного РО2, которое может немного снижаться без заметного уменьшения насыщения гемоглобина кислородом в крови капилляров легких. При увеличении альвеолярного РО2 (например, при дыхании воздухом, обогащенным О2) кровь принимает небольшое количество кислорода, так как уже при дыхании атмосферным воздухом гемоглобин почти полностью насыщен кислородом. Отвесный спад в нижней области кривой связывания гарантирует, с другой стороны, что РО2 в капиллярной крови периферических тканей, несмотря на отдачу О2, остается достаточно высоким, чтобы обеспечить ткани О2 путем диффузии.
Рис. 7-31. Сатурационная кривая О2.
Кривая связывания О2 крови (оранжевая кривая). Показана зависимость между насыщением гемоглобина О2 (SO2 ) от РО2 , так что кривая отражает кислородную емкость крови при разных значениях РО2 . Кривая имеет S-образную форму и парциальное давление полунасыщения (Р0,5) в 3,6 кПа. Далее при увеличении значения РО2 насыщение гемоглобина кислородом увеличивается от 75 до 98%. Кривая действительна для приведенных значений, характерных для нормальной артериальной крови. Для сравнения приведена кривая связывания кислорода миоглобином, имеющая форму гиперболы (зеленая кривая). Как видно из нижнего участка зеленой кривой, одинаковой с артериальной кровью (оранжевая кривая), SO2 достигается при меньших значениях РО2 . Как видно из верхнего участка зеленой кривой, насыщение SO2 мало зависит от РО2
Изменение сродства гемоглобина к кислороду
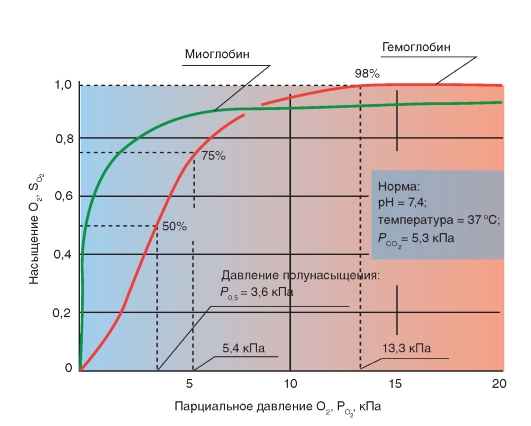
Ряд факторов влияет на аффинность гемоглобина
к О2, т.е. на насыщение гемоглобина кислородом при данном РО2. При этом, в первую очередь, изменяется положение кривой и гораздо меньше форма кривой. Отсюда можно описать уменьшение аффинности как сдвиг кривой связывания гемоглобином кислорода вправо (повышенный Р0.5), а увеличение аффинности, как сдвиг кривой связывания гемоглобином кислорода влево (пониженный Р0,5). Повышение температуры приводит к понижению аффинности, т.е. приводит к сдвигу кривой связывания вправо (рис. 7-32). Наоборот, охлаждение вызывает сдвиг кривой влево. У гомойотермных организмов значение этого влияния небольшое, хотя температура крови на периферии тела отчетливо может отклоняться от температуры всего организма.
Более важным является влияние концентрации ионов Н+ и РСО2. Повышение концентрации ионов Н+ (понижение рН) вызывает снижение аффинности гемоглобина к кислороду (сдвиг кривой вправо), понижение концентрации ионов Н+ вызывает повышение аффинности гемоглобина к кислороду. Эта зависимость, известная как эффект Бора, осуществляется путем аллостерического обменного влияния (термин «аллостерический» означает «связанный с другим центром») между местом связывания Н+ и местом связывания О2. Эффект Бора может быть связан также с изменением РСО2: повышение РСО2сдвигает кривую связывания О2 вправо, понижение - влево.
Это влияние основывается, в первую очередь, на том, что повышение РСО2 ведет к понижению рН и наоборот. Влияние самих молекул СО2 на аффинность гемоглобина к О2 является, напротив, незначительным.
Эффект Бора помогает как насыщению гемоглобина кислородом, так и отдаче О2 в тканях. В легких РСО2 в крови понижается именно в связи с отдачей СО2 и при этом рН повышается. Из-за этого повышается способность гемоглобина связывать О2. В тканях в связи с поступлением СО2, РСО2 в крови повышается и рН понижается. Это способствует отдаче гемоглобином кислорода и поступлению О2 в клетки. Вообще сдвиг кривой связывания гемоглобином О2 влево благоприятствует процессам насыщения гемоглобина кислородом в легких, так как при одинаковом РО2 достигается более высокое насыщение гемоглобина кислородом. С другой стороны, сдвиг кривой вправо облегчает освобождение О2 в тканях, так как при одинаковом насыщении О2 РО2, вызывающее диффузию, повышается.
К2 роме того, на аффинность гемоглобина к О2 влияет внутриэритроцитная концентрация катионов. Но особенно выраженным является снижающий аффинность гемоглобина к О2 эффект 2,3-дифосфоглицерата (2,3-BPG), чья концентрация в эритроцитах сходна с концентрацией тетрамерного гемоглобина (приблизительно 2,5 ммоль). В отсутствии 2,3-BPG аффинность гемоглобина к О2 является очень высокой (Р0,5 = 2 кПа). Главная функция 2,3-BPG состоит, следовательно, в правом перемещении кривой связывания О2, т.е. в область, которая соответствует физиологическим условиям.
Рис. 7-32. Факторы влияющие на аффинность гемоглобина к О2.
Уменьшение аффинности означает, что при одинаковом РО2 Hb способен связывать О2 в меньшей степени; кривая при этом сдвигается вправо. Причиной этого является повышение ряда факторов в эритроците (t°, рН, CO2 и т.п.). Уменьшение этих факторов влияет, наоборот, на повышение аффинности, т.е. сдвиг кривой влево
Карбоксигемоглобин
Способность к транспорту кислорода кровью нарушается, если гемоглобин не способен присоединять О2. При этом, практически важными являются две формы гемоглобина. Угарный газ (окись углерода, монооксид углерода: CO) может вместо О2 обратимо связать двухвалентное железо гемма, и тогда возникает карбоксигемоглобин (HbCO). Аффинность гемоглобина к СО приблизительно в 300 раз больше, чем к О2, т.е. гемоглобин связывает СО более активно. В этом случае гемоглобин не может быть использован для транспорта О2. Соединение СО с железом гема ведет к увеличению аффинности остальных молекул гема тетрамерного Hb к О2. То есть при связывании Hb с СО повышается аффинность Hb к О2, что препятствует отдаче О2 в тканях (см. выше), и кривая связывания О2, следовательно, сдвигается влево (рис. 7-33). Из-за высокой аффинности гемоглобина к СО даже очень низкие парциальные давления СО приводят к связыванию значительного количества гемоглобина с СО с образованием HbCO. То, что у людей, находящихся в условиях интенсивного уличного движения транспорта, или при курении отравления СО наступают редко, объясняется только медленным переходом СО из альвеолярного газа в кровь.
Метгемоглобин
Двухвалентное железо гема (Fe2+) может окисляться в трехвалентное (Fe3+). Гемоглобин с трехвалентным железом называется метгемоглобин (MetHb, также хемиглобин). Он не может обратимо присоединять О2 и поэтому является для транспорта О2 неактивным. Совершенно похоже, как и при соединении с СО, окисление железа гема ведет к увеличению аффинности остальных (неоксидированных) молекул гема к О2. То есть кривая связывания О2 частично метгемоглобинизированным Hb сдвинута влево. При помощи средств восстановления (например, дитионит) MetHb может опять восстановиться в гемоглобин (Fe3+ становится Fe2+). В организме восстановление MetHb, который возникает спонтанно или под действием ряда токсических соединений (например, нитраты, нитриты, анилинсодержащие вещества), обеспечивает метгемоглобинредуктаза. Особенно подвержены действию токсических соединений, образующих MetHb (например, питьевая вода с высокой концентрацией нитрата), грудные дети, так как у них MetHb-редуктаза еще недостаточно активна.
Рис. 7-33. Влияние угарного газа на связывание гемоглобином О2 крови.
Если построить кривую, отражающую половину кислородной емкости крови (что соответствует 50% анемии, голубая кривая) и затем ее значения умножить на 2, то кривая связывания в своей верхней части совпала бы с кривой, отражающей кислородную емкость крови, причем ее форма была бы нормальной. Напротив, связывание 50% гемоглобина с СО (50% HbCO, фиолетовая кривая) ведет также к делению пополам кислородной емкости крови. Но при этом форма кривой связывания сильно изменена (сдвиг влево), что затрудняет отдачу О2 в ткани
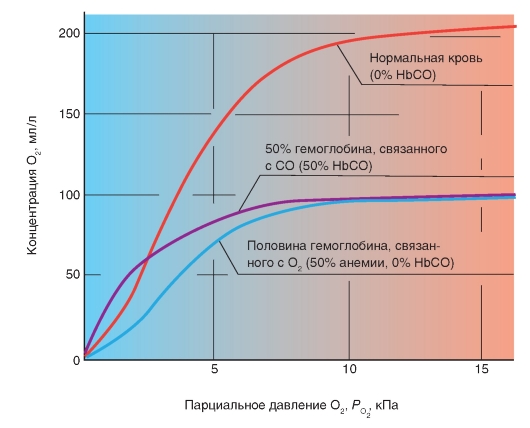
Факторы, влияющие на связывание кислорода гемоглобином
Напомним, что существует ряд факторов, которые влияют на аффинность гемоглобина к О2, т.е. на насыщение гемоглобина кислородом при данном РО2. Характерно, что эти факторы смещают в ту или иную сторону (вправо или влево) саму кривую, но мало влияют на ее форму. Уменьшение аффинности приводит к сдвигу кривой связывания гемоглобином кислорода вправо, а увеличение аффинности приводит к сдвигу кривой связывания гемоглобином кислорода влево.
Способность гемоглобина связывать и отдавать кислород изменяется в зависимости от температуры. Оксигемоглобин при одном и том же парциальном давлении кислорода в окружающей среде отдает больше кислорода при более высокой температуре тела, чем при более низкой (рис. 7-34 А). То есть повышение температуры приводит к понижению аффинности, что приводит к сдвигу кривой связывания вправо.
На рис. 7-34 Б показаны смещения кривой в право и влево при различных респираторных нарушениях, которые вызывают изменения РСО2 и рН. Необходимо напомнить, что эффект Бора, может быть связан также с изменением РСО2 - повышение РСО2 сдвигает кривую связывания О2 вправо, понижение - влево, поскольку повышение РСО2 ведет к понижению рН и наоборот. Ниже будет показано, что уменьшение рН сдвигает кривую влево. Влияние самих молекул СО2 на аффинность гемоглобина к О2 является, напротив, незначительным. Далее мы можем рассмотреть изменение кривой в каждом отдельном случае.
При неизменном РСО2 (40 мм рт.ст.) повышение концентрации ионов Н+2 (понижение рН) вызывает снижение аффинности гемоглобина к кислороду (сдвиг кривой вправо), понижение концентрации ионов Н+ вызывает повышение аффинности гемоглобина к кислороду (рис. 7-34 В).
При неизменной рН (7,4) при повышении напряжения углекислого газа (при одном и том же парциальном давлении кислорода) происходит снижение аффинности гемоглобина к кислороду (сдвиг кривой вправо), т.е. при повышении напряжения углекислого газа образуется меньше оксигемоглобина (рис. 7-34 Г).
Заметим, что резкое снижение способности гемоглобина связывать кислород в присутствии углекислого газа отмечается при парциальном давлении кислорода, равном 46 мм рт.ст., (при том его напряжении) которое имеется в венозной крови. Это свойство гемоглобина имеет важное значение для организма. В капиллярах тканей напряжение углекислого газа в крови увеличивается и потому уменьшается способность гемоглобина связывать кислород, что облегчает отдачу кислорода тканям. В альвеолах легких, где часть углекислого газа переходит в альвеолярный воздух, способность гемоглобина связывать кислород возрастает, т.е. увеличивается образование оксигемоглобина.
Особенно резкое снижение способности гемоглобина связывать кислород отмечается в крови мышечных капилляров во время интенсивной мышечной работы, когда в кровь поступают кислые продукты обмена веществ, в частности молочная кислота. Это способствует отдаче большого количества кислорода мышцам.
Рис. 7-34. Сдвиги сатурационной кривой О2 при ряде воздействий.
А - эффекты респираторных нарушений, связанные с изменением рСО2 и рН. Б - сдвиги сатурационной кривой при изменения рН, но при неизменном рСО2. В - сдвиги сатурационной кривой при изменения рCO2, но при неизменном рН
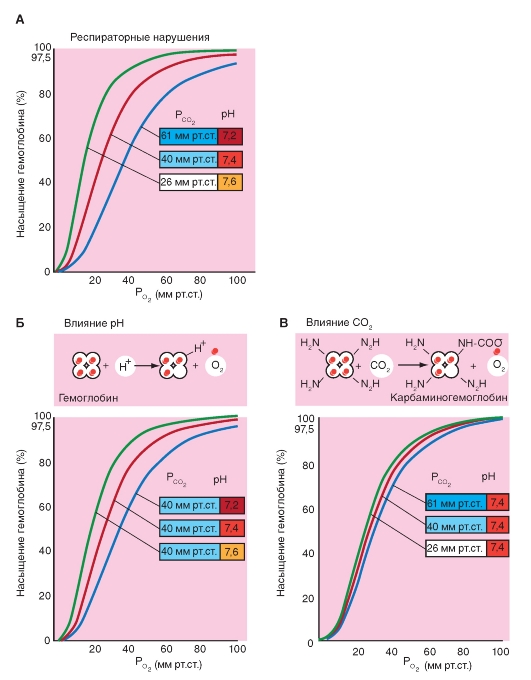
Связывание углекислого газа
По аналогии с кривой связывания О2, кривая связывания СО2 описывает связь между концентрацией СО2 (все три формы: физически растворенный, в составе бикарбонатов и в соединении с белками) и парциальным давлением СО2 крови (рис. 7-35 А). При этом концентрация химически связанного СО2 (особенно НСО3-) несколько превышает его физически растворенную часть. В противоположность к кривой связывания О2, химически связанная часть СО2 не достигает, однако, «значения насыщения», т.е. не имеется «емкости СО2» крови.
На кривую связывания СО2 оказывает влияние ряд факторов. Понижение рН или повышение температуры сдвигают кривую связывания вправо. При равном же РСО2 дезоксигенированная кровь связывает значительно больше СО2, чем оксигенированная (рис. 7-35 А). Этот феномен, известный как эффект Холдейна, основывается на одинаковом механизме с эффектом Бора, а именно на аллостерическом обмене на гемоглобине. При освобождении гемом места связывания кислорода происходит присоединение иона Н+ к его месту связывания на глобине (рис. 7-35 Б). Кроме того,
часть карбамино-СО2 является зависимой от насыщения О2 (оксилабильное карбомат-связывание).
Присоединение О2 уменьшает способность связывания СО2 в качестве карбомата.
Как и эффект Бора, эффект Холдейна имеет большое физиологическое значение. Повышение парциального давления О2 в легком облегчает освобождение СО2 из химического связанного состояния и его переход в физически растворенное состояние. Концентрации НСО3- и карбомата понижаются, РСО2 повышается так, что СО2 может лучше диффундировать в альвеолярный воздух. Напротив, поступление О2 в ткани способствует увеличению связывания СО2 в крови.
В условиях артериальной крови (рН = 7,4, РСО2 = 5,3 кПа) с помощью эффекта Холдейна при связывании 1 моля О2 освобождается 0,28 моль СО2. При RQ (отношение выделенного СО2 и поступившего О2), равном 0,85, на 1 моль О2 образуется 0,85 моль СО2. Как упоминалось выше, 0,28 моль есть 1/3 газа, освобождающегося через эффект Холдейна, не требующего изменения РСО2 в крови. Ну а 2/3 освобожденного CO2 образуются в результате реакции с образованием угольной кислоты из диссоциированных ионов Н+ и НСО3-, которая превращается в СО2 и воду.
Рис. 7-35. Связывание СО2.
А - кривая связывания СО2 в крови человека. Общая концентрация СО2 составляется из физически растворенной и химически связанной части (HCO3-, карбамат). На основе эффекта Холдейна дезоксигенированная кровь связывает (насыщение О2, SO2 = 0%) больше СО2, чем оксигенированная кровь (SO2 = 100%). Физиологическая кривая связывания СО2, которая учитывает изменение SO2 в легких и тканях, проходит поэтому отвеснее, чем кривые связывания при постоянном SO2 . Б - при эффекте Холдейна связывание гемма с О2 способствует отдаче глобином Н+ (буфер), что, в свою очередь, влияет на равновесие НСО3- и СО2. Дополнительно, влияет часть насыщения О2 (оксилабильное связывание карбомата) на связывание карбомата СО2. Дополнительно часть карбоматного соединения СО2 испытывает влияние от насыщения гемоглобина О2 (оксилабильное связывание карбомата)
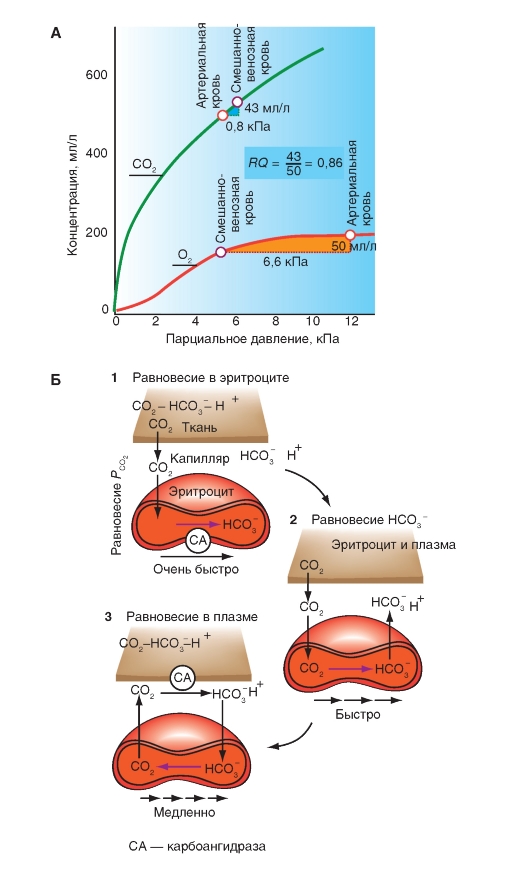
Обмен СО2
Рисунок 7-36 демонстрирует процессы, которые происходят в крови, когда в тканях образуется СО2, который выделяется легкими. Из ткани СО2 диффундирует в плазму и, далее, в эритроциты. Из-за высокой диффузионной способности СО2 быстро происходит полное уравнивание парциального давления между эритроцитами и плазмой.
Повышение РСО2 ведет к образованию НСО3-, а именно, в размере, в котором небикарбонатные буферы могут связывать ионы Н+, возникающие в результате реакции СО2 + Н2О ↔ НСО3- + Н+. Так как буферная емкость небикарбонатного буфера в эритроцитах (гемоглобин, около 60 ммоль • рН) много больше, чем буферная емкость белков плазмы (белки плазмы, около 8 ммоль • рН), в эритроцитах образуется больше НСО3-, чем в плазме. К этому надо добавить, что установление равновесия СО2 + Н2О ↔ НСО3- + Н+ в плазме протекает медленно. В эритроцитах, однако, имеется фермент карбоангидраза, которая значительно ускоряет эту реакцию, так что равновесие в эритроцитах достигается намного быстрее, чем в плазме. Поэтому концентрация НСО3- в эритроцитах повышается быстрее, чем в плазме, и возникает химический градиент НСО3-, вследствие чего НСО3- попадает из эритроцитов в плазму. Для сохранения электронейтральности из плаз-
мы в эритроциты входят ионы Cl- с помощью электронейтрального обменника.
Однако равновесие может быть достигнуто окончательно только тогда, когда и концентрация Н+ плазмы соответствует измененным значениям НСО3- и СО2. В этом установлении равновесия Н+ в меньшей степени участвует обмен Н+ или ОН- на мембране эритроцита, но в гораздо большей степени медленная реакция СО2 с Н2О в плазме с образование Н+ и НСО3- (рис. 7-36). По новым данным, эта реакция ускоряется посредством карбоангидразы, которая закреплена в эндотелии капилляров, но является доступной плазме (см. также внутриклеточная и мембраносвязанная карбоангидраза почек). Таким образом, в плазме одна часть СО2 реагирует с водой и это ведет к повышению концентрации Н+, т.е. способствует установлению его равновесия. Образовавшийся при этом НСО3- попадает опять в эритроциты и является источником там образования СО2. Этот круг событий (цикл Якоба-Стюарта) протекает в обратном направлении по сравнению с первичной последовательностью.
На рис. 7-36 далее представлены реакция СО2 с карбоматом и связывание возникающих ионов Н+ с помощью буферных систем, а именно белков плазмы и гемоглобина, а также влияние эффекта Бора-Холдейна. В легком все эти этапы протекают в обратном направлении.
Рис. 7-36. Процессы обмена СО2 в большом круге кровообращения
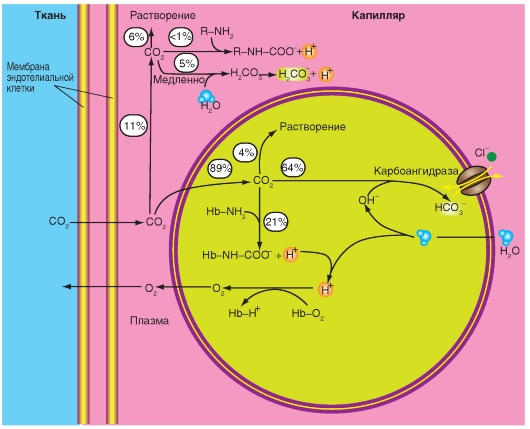
Эффекты Бора и Холдейна
Эффект Холдейна, основывается на одинаковом механизме с эффектом Бора, а именно на аллостерическом обмене на гемоглобине. При освобождении гемом места связывания кислорода происходит присоединение иона Н+ к его месту связывания на глобине (рис. 7-37 А, Б). Кроме того, часть карбамино-СО2 является зависимой от насыщения О2 (оксилабильное карбомат-связывание). Присоединение О2 уменьшает способность связывания СО2 в качестве карбомата.
Как и эффект Бора, также и эффект Холдейна имеет большое физиологическое значение. Повышение парциального давления О2 в легком облегчает освобождение СО2 из химического связанного состояния и его переход в физически растворенное состояние. Концентрации НСО3- и карбомата понижаются, РСО2 повышается так, что СО2 может лучше диффундировать в альвеолярный воздух. Напротив, поступление О2 в ткани способствует увеличению связывания СО2 в крови.
В условиях артериальной крови (рН = 7,4, РСО2 = 5,3 кПа) с помощью эффекта Холдейна при связывании 1 моля О2 освобождается 0,28 моль СО2. При RQ (отношение выделенного СО2 и поступившего О2), равном 0.85, на 1 моль О2 образуются 0,85 моль СО2. Как упоминалось выше, 0,28 моль есть 1/3 газа, освобождающегося через эффект Холдейна, не требующего изменения РСО2 в крови. Ну а 2/3 освобожденного CO2 образуются в результате реакции с образованием угольной кислоты из диссоциированных ионов Н+ и НСО3-, которая превращается в СО2 и воду.
Рис. 7-37 В демонстрирует процессы, которые происходят в крови, когда в тканях образуется СО2, выделяемый затем легкими. Из ткани СО2 диффундирует в плазму и, далее, в эритроциты. Из-за высокой диффузионной способности СО2 быстро происходит полное уравнивание парциального давления между эритроцитами и плазмой.
Повышение РСО2 ведет к образованию НСО3-, а именно в размере, в котором небикарбонатные буферы могут связывать ионы Н+, возникающие в
результате реакции СО2 + Н2О ↔ НСО3- + Н+. Так как буферная емкость небикарбонатного буфера в эритроцитах (гемоглобин, около 60 ммоль • 1-1 • рН -1) много больше, чем буферная емкость белков плазмы (белки плазмы, около 8 ммоль • 1-1 • рН-1 в эритроцитах образуется больше НСО3-, чем в плазме. К этому надо добавить, что установление равновесия СО2 + Н2О ↔ НСО3- + Н+ в плазме протекает медленно. В эритроцитах, однако, имеется фермент карбоангидраза, которая значительно ускоряет эту реакцию, так что равновесие в эритроцитах достигается намного быстрее, чем в плазме (шаг 1-2). В целом, поэтому концентрация НСО3- в эритроцитах повышается быстрее, чем в плазме, и возникает химический градиент НСО3-, вследствие чего НСО3- попадает из эритроцитов в плазму. Для сохранения электронейтральности из плазмы в эритроциты входят ионы C1- с помощью электронейтрального обменника.
Однако равновесие может быть достигнуто окончательно только тогда, если и концентрация Н+ плазмы соответствует измененным значениям НСО3- и СО2. В этом установлении равновесия Н+ в меньшей степени участвует обмен Н+ или ОН- на мембране эритроцита, но в гораздо большей степени медленная реакция СО2 с Н2О в плазме с образованием Н+ и НСО3-. По новым данным, эта реакция ускоряется посредством карбоангидразы, которая закреплена в эндотелии капилляров, но является доступной плазме. Таким образом, в плазме одна часть СО2 реагирует с водой и это ведет к повышению концентрации Н+, т.е. способствует установлению его равновесия. Образовавшийся при этом НСО3- попадает опять в эритроциты и является источником там образования СО2. Этот круг событий (цикл Якоба-Стюарта) протекает в обратном направлении по сравнению с первичной последовательностью.
На рис. 7-37 В представлены реакция СО2 с карбоматом и связывание возникающих ионов Н+ с помощью буферных систем, а именно белков плазмы и гемоглобина, а также влияние эффекта Бора-Холдейна. В легком все эти этапы протекают в обратном направлении.
Рис. 7-37. Принципы эффекта Бора (А) и эффекта Холдейна (Б).
A - эффект Бора описывает влияние изменения концентрации ионов Н+, и тем самым, связывание Н+ с гемоглобином, на связывание гемом О2. Изменение концентрации СО2 влияет на изменение концентрации ионов Н+, которые, в свою очередь, при связывании с белком в виде карбомата влияют на аффинность гемма к О2. Б - при эффекте Холдейна связывание гема с О2 способствует отдаче глобином Н+ (буфер), что, в свою очередь, влияет на равновесие НСО3- и СО2. Дополнительно, влияет часть насыщения О2 (оксилабильное связывание карбомата) на связывание карбомата СО2. Дополнительно часть карбоматного соединения СО2 испытывает влияние от насыщения гемоглобина О2 (оксилабильное связывание карбамата). В - реакции при поступлении СО2 в кровь (ткани, голубые стрелки) и при выделении СО2 из крови (легкое, зеленые стрелки). Пунктирные стрелки в плазме означают, что установка в положение равновесия происходит медленно. Hb-СОО- = карбамат, ННb/Hb- указывает на буферные свойства гемоглобина. Транспортер Band-3 обеспечивает равный обмен НСО3- -С1-
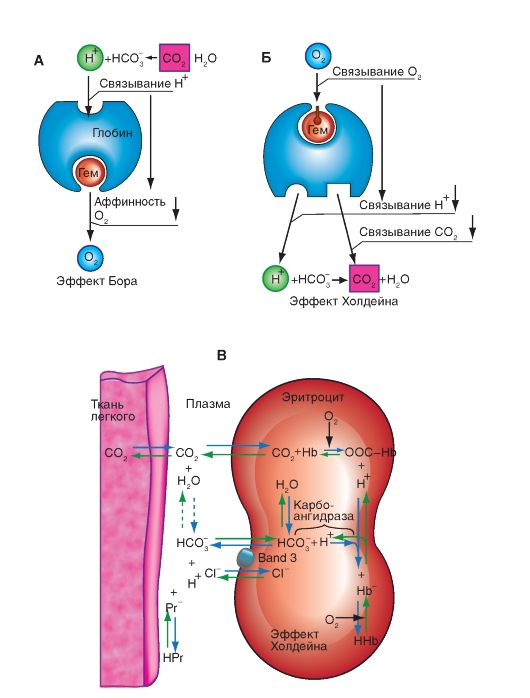
Газообмен в большом круге кровообращения
На рисунке представлен эритроцит, пришедший в большой круг кровообращения, плазма, в которой он находится, и ткань. Эритроцит принес в большой круг кровообращения О2 для обмена на СО2. В эритроците СО2 находится в виде КНbO2, т.е. в связанном с гемоглобином. Переход О2 из эритроцита в плазму и далее в ткань осуществляется по градиенту рО2, а переход СО2 в обратном направлении - по градиенту рСО2.
При достижении артериальной кровью периферических тканей рО2 в ней находится на уровне 95 мм рт.ст. На рис. 7-38 видно, что в окружающей тканевые клетки интерстициальной жидкости рО2 достигает только 40 мм рт.ст. Таким образом, имеется большой градиент давления, под влиянием которого кислород начинает быструю диффузию из капиллярной крови в ткани - настолько быструю, что рО2 в капиллярах почти сравняется с рО2 (40 мм рт.ст.) в интерстиции, поэтому рО2 в крови, покидающей капилляры и поступающей в системные вены, составляет около 40 мм рт.ст.
Величина рО2 ткани определяется равновесием между: (1) скоростью транспорта О2 кровью
к ткани; (2) скоростью потребления О2 тканями. Клетки непрерывно потребляют О2. Следовательно, рО2 в клетках периферических тканей постоянно ниже, чем рО2 в периферических капиллярах, поэтому нормальное рО2 внутри клеток может оказаться как низким (5 мм рт.ст.), так и довольно высоким (40 мм рт.ст.) и в среднем (при прямом измерении у низших животных) составляет 23 мм рт.ст. Обычно для полного обеспечения кислородом клеточных процессов вполне достаточно рО2, равного 1-3 мм рт.ст.
Кислород в клетках практически полностью превращается в двуокись углерода, в результате в клетке повышается рСО2. Из-за повышения рСО2 двуокись углерода диффундирует из клеток в тканевые капилляры и переносится кровью в легкие. В качестве примера рассмотрим градиент парциального давления СО2 в на уровне системы клетка - интерстициальная жидкость. В этом случае рСО2 внутри клетки равно 46 мм рт.ст., а рСО2 В интерстициальной ткани - 45 мм рт.ст. Таким образом, градиент составляет только 1 мм рт.ст. Как же далее СО2 попадает в эритроцит. В артериальной крови, пришедшей в большой круг кровообращения, рСО2 равно 40 мм рт.ст. Заметим также, что в плазме работает бикарбонатная буферная система.
Рис. 7-38. Обмен газов в большом круге кровообращения
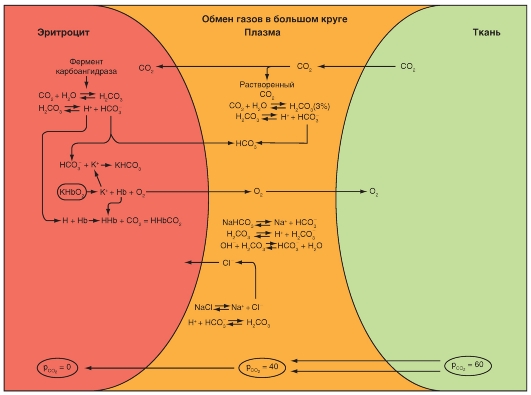
Газообмен в малом круге кровообращения
На рис. 7-39 представлен эритроцит, пришедший в малый круг кровообращения, плазма, в которой он находится, и альвеола. Эритроцит принес в малый круг кровообращения СО2 для обмена на О2. В эритроците СО2 находится в двух состояниях. Первое - в виде HHbCO2, т.е. связанное с гемоглобином, и второе - KHCO3. Переход СО2 из эритроцита в плазму и далее в альвеолу осуществляется по градиенту рСО2, а переход О2 в обратном направлении - по градиенту рО2.
На рис. 7-39 показана диффузия молекул О2 из альвеолярного воздуха в кровь. рО2 в альвеолярной газовой смеси составляет 104 мм рт.ст., а рО2в венозной крови, входящей в легочный капилляр через его артериальный конец, составляет только 40 мм рт.ст. (большое количество О2 было поглощено из крови во время прохождения ее через периферические ткани). Таким образом, разница рО2, являющаяся причиной диффузии кислорода в легочные капилляры, составляет 104 - 40 = 64 мм рт.ст. Очень быстро рО2 в крови составит около 104 мм рт.ст., т.е. почти достигает рО2 в альвеолярном воздухе. В целом, около 98% объема крови, входящей в левое предсердие после прохождения легких, прошло через легочные капилляры и было оксигенировано до рО2, равного приблизительно 104 мм рт.ст.
После диффузии кислорода из альвеол в капиллярную кровь его дальнейший транспорт в капилляры периферических тканей совершается
почти полностью в связанной с гемоглобином форме. Наличие в эритроцитах гемоглобина позволяет крови транспортировать в 30-100 раз больше кислорода, чем могло бы транспортироваться в виде газа, растворенного в водной со ставляющей крови.
Ранее обсуждалось, что при достижении артериальной кровью периферических тканей рО2 в ней находится на уровне 95 мм рт.ст., т.е. кровь в аорте имеет рО2 примерно равное 95 мм рт.ст. Откуда же берется эта разница? Выше отмечалось, что около 98% объема крови, входящей в левое предсердие после прохождения легких, прошло через легочные капилляры и было оксигенировано до рО2, равного приблизительно 104 мм рт.ст. Но 2% объема крови ушли из аорты в бронхиальное кровообращение, которое снабжает в основном глубокие ткани легких, и не вошли в контакт с альвеолярным воздухом. Эту часть кровотока в легких называется «шунтирующей», поскольку она направляется мимо газообменных участков легких. На выходе из легких рО2 шунтированной крови находится примерно на уровне нормальной системной венозной крови - около 40 мм рт.ст. При смешивании этой крови (рО2 = 40 мм рт.ст.) в легочных венах с оксигенированной кровью (рО2 равно 104 мм рт.ст.) из альвеолярных капилляров, эта так называемая «венозная примесь» крови приведет к снижению рО2, входящей в левую половину сердца и выбрасываемой оттуда в аорту крови, примерно до 95 мм рт.ст. Кроме того, как показано на рис. 7-39, в плазме работает бикарбонатная буферная система.
Рис. 7-39. Обмен газов в малом круге кровообращения
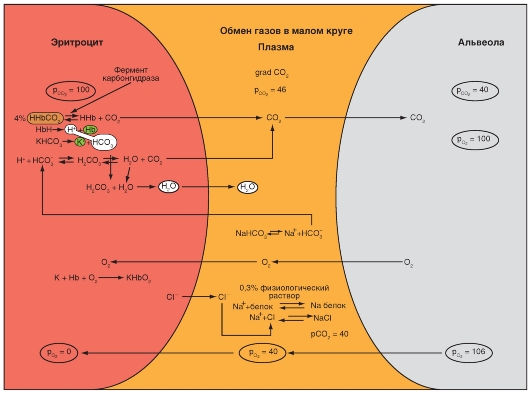
Диффузионная способность легких
Между газовой средой в альвеолярном пространстве и кровью, протекающей в легочных капиллярах, находится альвеолярно-капиллярный барьер, включающий структуры альвеолярной и капиллярной стенок. Именно эту, хотя и очень тонкую стенку между газом в альвеолярном пространстве и кровью легочных капилляров, газы должны преодолеть путем диффузии. Эта стенка состоит из нескольких слоев: альвеолярного эпителия, интерстициума и капиллярного эндотелия. Необходимо отметить, что кроме диффузии через альвеолярно-капиллярный барьер, например, кислород на своем пути к гемоглобину, дополнительно должен проникнуть в плазму, пройти через мембрану эритроцитов и попасть во внутреннюю часть красных кровяных клеток. Так как реакция О2 с гемоглобином (а также реакция перехода от СО2 к НСО3-) протекает очень быстро, она незначительно ограничивает транспорт газа. Отсюда обоснованно рассматривать переход О2 и СО2 между альвеолами и эритроцитами в легочных капиллярах как диффузию, осуществляемую через объединяющий общий барьер в виде тканевого слоя и плазмы крови.
Диффузионный поток (V) через альвеолярнокапиллярную мембрану пропорционален разности парциальных давлений (∆Р) между альвеолярным газом и капиллярной кровью легких:
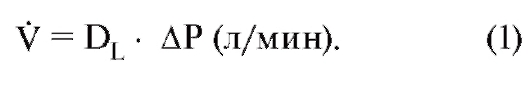
Коэффициент пропорциональности DL называется диффузионной способностью легких. Он
зависит, по закону диффузии Фика, от поверхности проникновения - площади (А) и толщины (х) мембраны, а также от растворимости (α) и от коэффициента диффузии (D) диффундирующего газа:
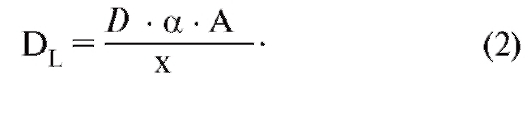
Произведение D • α обозначается как константа диффузии Крога (К).
Геометрические факторы А и х in vivo можно оценить с крайне низкой степенью точности. Кроме того, толщина х в различных частях альвеолы весьма различна. Наконец, в процессе респираторного цикла толщина и площадь претерпевают изменения, как это показано на графиках (рис. 7-40 А). Так, в конце вдоха растяжение максимизирует площадь и минимизирует толщину; в конце выдоха - наоборот. Далее, нельзя легко измерить К и α, так как их значения в отдельных слоях альвеолярной мембраны могут быть совершенно различными.
Во время респираторного цикла помимо площади и толщины меняются и два других параметра - РО2 и РСО2, как это показано на графиках (рис. 7-40 Б) - и эти изменения связаны с пространственными и временными свойствами. В конце вдоха поступление свежего воздуха максимизирует альвеолярное РО2 и минимизирует альвеолярное РСО2; в конце выдоха - наоборот.
Наконец, обратим внимание на РО2 вдоль капилляра (рис. 7-40 В), которое претерпевает существенное изменение, показанное на графике в увеличенном размере. В начале капилляра «поддерживаемая» разность давления является высокой, и большое количество О2 диффундирует через альвеолярно-капиллярную мембрану. Благодаря поступлению О2 в кровь увеличивается РО2 вдоль капилляра, вследствие чего «поддерживаемая» разность давления и диффузионный поток снижаются. Конечно-капиллярная артериальная кровь, которая покидает капилляр, имеет практически то же самое РО2 (и РСО2), как альвеолярный воздух. Кривая капиллярного уравнения РО2 проходит в нормальных условиях более отвесно, чем на представленном для пояснения рисунке. Усредненная альвеолярно-капиллярная разность РО2 в норме равна примерно 1 кПа.
Это является причиной того, почему все эти факторы обобщают в глобальную, но измеримую величину диффузионной способности легких DL. Но кислород должен диффундировать не только через альвеолярную мембрану, а также еще через слой в крови, пока он не достигнет гемоглобина. Как правило, значение DL включает также диффузию в крови и определяется, таким образом, еще и диффузионными свойствами крови.
Рис. 7-40. Закон Фика и сложность его использования.
А - изменение площади и толщины. Б - изменение альвеолярного РО2 и РСО2. В - изменение капиллярного ро2
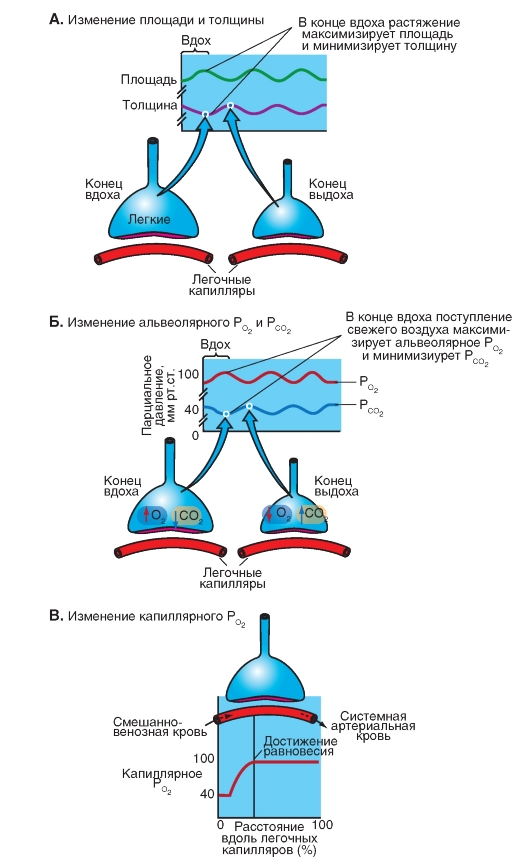
Диффузия кислорода в легких
На рис. 7-41 А продемонстрировано поступление О2 из альвеолярного воздуха в кровь легочных капилляров. В верхней части рис. 7-41 А изображена альвеола, расположенная рядом с легочным капилляром, и показана диффузия молекул кислорода из альвеолярного воздуха в кровь. РО2 в альвеолярной газовой смеси составляет 104 мм рт.ст., а РО2 в венозной крови, входящей в легочный капилляр через его артериальный конец, составляет только 40 мм рт.ст., так как большое количество кислорода было поглощено из крови во время прохождения ее через периферические ткани. Таким образом, начальная разница в парциальном давлении, являющаяся причиной диффузии кислорода в легочные капилляры, составляет 104-40, или 64 мм рт.ст. На графике рис. 7-41 Б виден резкий подъем РО2 крови во время прохождения ее через капилляр; к моменту прохождения 1/3 длины капилляра РО2 в крови составляет около 104 мм рт.ст., т.е. почти достигает РО2 в альвеолярном воздухе.
При контакте с альвеолярной мембраной кровь в капиллярах легких непрерывно получает О2, вследствие чего парциальное давление О2 вдоль капиллярной контактной поверхности от смешено-венозного исходного значения (РО2) в начале капилляра (альвеолярно-начально-капиллярное РО2) повышается до более высокого значению в конце капилляра. Это РО2 крови в конце капилляра (альвеолярно-конечно-капиллярное РО2 или Рс'О2) в нормальном легком при дыхании воздухом является практически одинаковым с альвеолярным РО2 (Рао2), так как диффузионная способность нормального легкого так высока, что альвеолярная мембрана в покое не представляет собой диффузионного препятствия для О2 (так же, как и для СО2). Поэтому в норме, уже в первой трети капилляра РО2 становится равным РАО2. (рис. 7-41 Б). Только при сильно повышенном поступлении О2 (например, при тяжелой физической работе: рис. 7-41 В) или в условиях гипоксии
(рис. 7-41 Г) можно констатировать незначительный диффузионный лимит для О2. При глубокой гипоксии диффузионный лимит может стать значительным, так как кривая связывания О2 в гипоксической области РО2 имеет вертикальный характер при поступлении О2 РО2 вдоль легочных капилляров мало меняется, так что остается большая разность между РАо2 и Рс'О2. Как показывает рисунок разность давления ∆РО2 меняется вдоль капилляра. Среднее значение при расчете DL для О2 по уравнению является, отсюда, сложно измеряемым. Особыми методами определили DL для О2 у здорового легкого, и ее величина приблизительно равна 275 мл/мин • кПа. При поступлении О2 в покое = 310 мл/мин. С учетом этой величины и уравнения 10,46 средняя разность альвеолярнокапиллярного РО2 приблизительно равна 1,1 кПа (8 мм рт.ст.).
Хотя в отдельной альвеоле альвеолярный газ и кровь в конце капилляра (альвеолярно-конечнокапиллярная кровь) имеют практически одинаковые значения РО2 и значения РСО2, из-за вентиляционно-перфузионной неравномерности легкого имеются отчетливо измеряемые различия РО2 между смешанно-альвеолярным газом и артериальной кровью, которая смешивается из альвеолярноконечно-капиллярной крови, то есть крови, оттекающей от всех альвеол легкого.
Уравнение
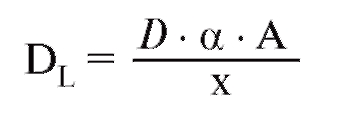
показывает, однако, как DL ведет себя по отношению к различным газам. Так как указанное A/x для всех газов одинаково, то различие диффузионной способности отдельных газов (О2, СО2, СО и т.д.) основано на различиях D • α, причем D для О2, СО2 и СО обладает очень похожими значениями. Крайне различно, напротив, значение α, которое для СО2 так велико, что превышает более чем в 20 раз значение для О2. Поэтому СО2 диффундирует значительно легче через альвеолярнокапиллярный барьер, чем О2.
Рис. 7-41. Диффузия кислорода.
На панели А показаны гипотетическая альвеола и капилляр. Продемонстрировано, как эритроциты входят в капилляр. В этом случае О2 занимает три из четырех мест на гемоглобине. На панелях Б, В, Г показаны графики РО2 в покое (Б), при нагрузке (В), на большой высоте (Г). Оценка проведена в диффузионной способности легких DL
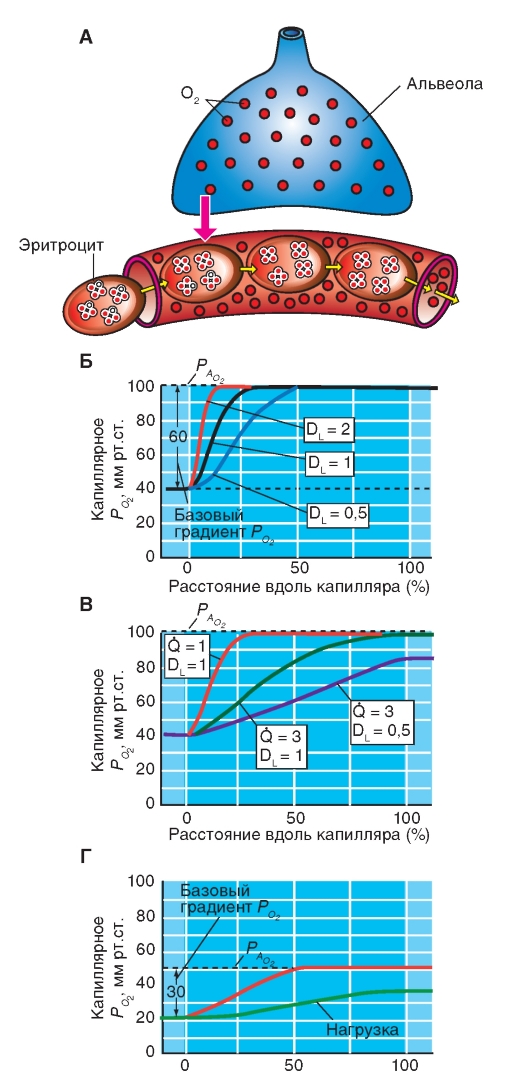
Диффузия углекислого газа в легких
Углекислый газ диффундирует из легочных капилляров в альвеолы и выводится из легких. В каждой точке легочного капилляра направление диффузии СО2 прямо противоположно направлению диффузии О2. В качестве измеряемой величины и в этом случае рассматривается диффузионная способность легких DL. Ранее отмечалось, что в уравнении
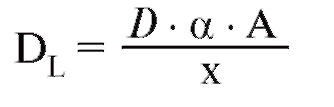
значение α для СО2 так велико, что превышает более чем в 20 раз значение для О2. Градиенты парциального давления, необходимые для диффузии СО2, в каждой точке намного меньше таковых для диффузии О2. Поэтому СО2 диффундирует значительно легче через альвеолярнокапиллярный барьер, чем О2. Фактически для СО2 не имеется измеряемого диффузионного препятствия в легком, так как диффузионная способность нормального легкого DL так высока, что альвеолярная мембрана в покое не представляет собой диффузионного препятствия для.
Парциальное давление СО2 в разных структурах организма имеет приблизительно следующие значения. Рассмотрим значения градиента на уровне системы клетка - интерстициальная жидкость. В этом случае РСО2 внутри клетки равно 46 мм рт.ст., а РСО2 в интерстициальной ткани - 45 мм рт.ст. Таким образом, градиент составляет только 1 мм рт.ст. В крови РСО2 различно. В артериальной крови, поступающей в ткани, равно 40 мм рт.ст., а РСО2 в венозной крови, покидающей ткани, - 45 мм рт.ст. Таким образом, РСО2 крови в тканевых капиллярах практически уравновешивается с РСО2 в интерстициальной ткани (45 мм рт.ст.). Наконец, РСО2 крови, поступающей в артериальный конец легочных капилляров, равно 45 мм рт.ст.
Парциальное давление СО2 - РСО2 в альвеолярном воздухе - 40 мм рт.ст. Таким образом, для обеспечения всей необходимой диффузии СО2 из легочных капилляров в альвеолы достаточно градиента парциального давления двуокиси углерода, равного 5 мм рт.ст. Далее РСО2 в крови легочных капилляров падает и становится практически равным РСО2 в альвеолярном воздухе (40 мм рт.ст.) прежде, чем эта кровь пройдет через первую треть капилляра.
Рис. 7-42. Диффузия углекислого газа.
На панели А показана гипотетическая альвеола и капилляр. Продемонстрировано, как эритроциты входят в капилляр. В этом случае СО2 уходит в альвеолу. На панели Б показаны графики РСО2 в покое. Оценка проведена в диффузионной способности легких DL
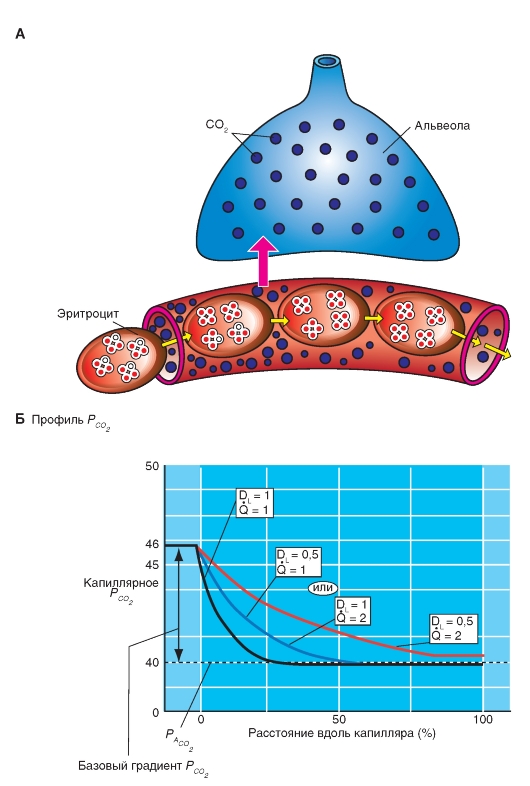
Диффузия угарного газа (СО) в легких
На рис. 7-43 представлена диффузия оксида углерода (II) (угарный газ, окись углерода, монооксид углерода). Это бесцветный газ без вкуса и запаха. Мы останавливаемся на этом газе, поскольку он очень важен для клиники: он вызывает отравление, часто заканчивающееся смертью. Основные признаки отравления: головная боль, головокружение, шум в ушах, одышка, сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота, иногда рвота; в тяжёлых случаях судороги, потеря сознания и кома. Концентрация в воздухе более 0,1 % приводит к смерти в течение 1 ч.
Предположим, что в некой альвеоле содержится окись углерода, и в капилляры этой альвеолы поступают эритроциты. Как быстро поднимется парциальное давление этого газа в крови? На рис. 7-43 приведены кривые, отражающие процессы переноса СО по мере прохождения эритроцита через капилляры легких. Когда эритроцит попадает в капилляр, СО быстро пересекает чрезвычайно тонкий барьер, разделяющий альвеолярный воздух и кровь. В результате содержание СО в эритроците возрастает. Однако поскольку СО очень прочно связывается с гемоглобином, кровь может захватывать большое количество СО практически без повышения его парциального давления. Таким образом, по мере продвижения эритроцита через капилляр это давление возрастает мало, т.е. препятствий для дальнейшего перехода СО в кровь не возникает, и он продолжает с большой скоростью пересекать альвеолярную стенку. Значит, количество СО, поступающей в кровь, ограничено ни тем, сколько крови проходит через капилляр, а свойствами диффузионного барьера. Таким образом, перенос СО ограничен диффузией.
Как было показано на рис. 40, диффузионный поток (V) через альвеолярно-капиллярную мембрану является пропорциональным разности давлений, т.е. разности парциальных давлений (∆Р) между альвеолярным газом и капиллярной кровью легких:
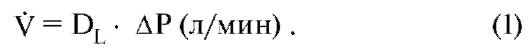
Следовательно, диффузионная способность легких для СО равна:
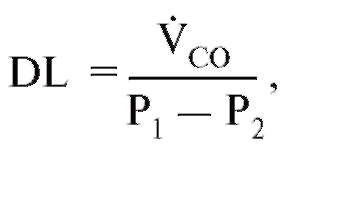
где Р1 и Р2 - парциальные давления СО в альвеолярном воздухе и капиллярной крови соответственно. Однако, как мы уже знаем, парциальное давление СО в крови настолько мало, что им можно пренебречь. Следовательно,
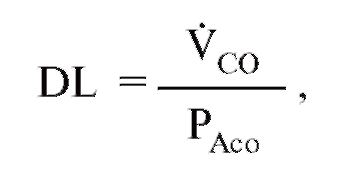
т.е. диффузионная способность легких для СО равна отношению объема СО (мл), переносимого за 1 мин, к парциальному давлению СО в альвеолах (мм. рт.ст.).
Токсическое действие СО основано на том, что он может вместо О2 обратимо связать двухвалентное железо гема, и тогда образуется карбоксигемоглобин (HbCO). Аффинность гемоглобина к СО приблизительно в 300 раз больше, чем к О2. В этом случае гемоглобин не может быть использован для транспорта О2. Соединение СО с железом гема ведет к увеличению аффинности остальных молекул гема тетрамерного Hb к О2. То есть при связывании Hb с СО повышается аффинность Hb к О2, что препятствует отдаче О2 в тканях, и кривая связывания О2, следовательно, сдвинута влево. Сатурационная кривая СО по форме почти идентична аналогичной кривой для О2, только масштаб оси РСО гораздо мельче. Так, если РСО составляет всего 0,16 мм рт.ст., 75% НЬ соединяется с СО, образуя НЬСО. Именно поэтому даже небольшие количества угарного газа могут связывать значительную часть Нв крови, выключая тем самым его кислородпереносящую функцию. При этом концентрации НЬ и РО2 в крови могут быть нормальными, однако содержание О2 в ней резко падает. Кроме того, в присутствии НЬСО сатурационная кривая О2 (как отмечалось выше) сдвигается влево, что препятствует выходу кислорода в ткани и усугубляет токсичное действие угарного газа.
Из-за высокой аффинности гемоглобина к СО даже очень низкие парциальные давления СО приводят к связыванию значительного количества гемоглобина с СО с образованием HbCO. То, что у людей, находящихся в условиях интенсивного уличного движения транспорта, или при курении отравления СО наступают нечасто, объясняется только медленным переходом СО из альвеолярного газа в кровь.
Рис. 7-43. Диффузия монооксида углерода (угарного газа) из альвеол в кровь
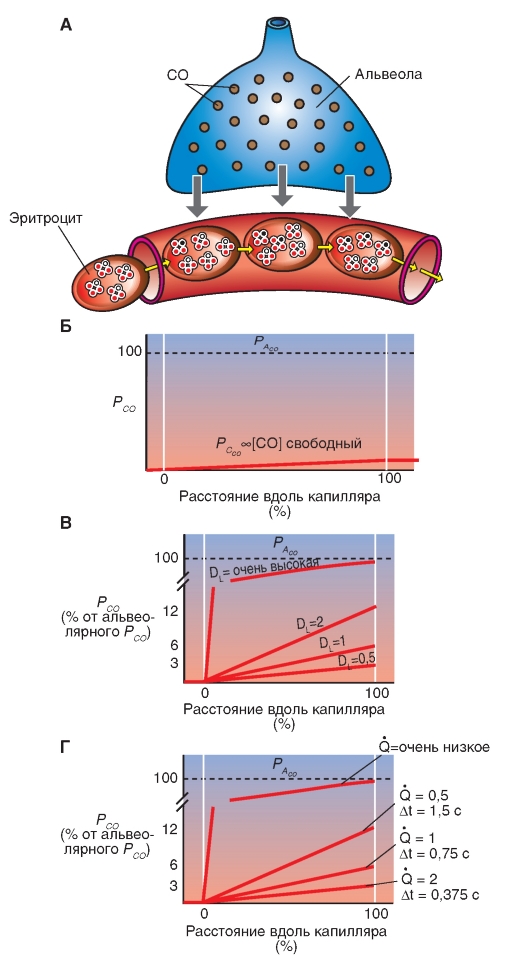
Диффузия оксида азота (N2O) в легких
Предположим, что в некой альвеоле содержится другой чужеродный газ, например закись азота, и в капилляры этой альвеолы поступают эритроциты. Как быстро поднимется парциальное давление этого газа в крови?
На рис. 7-44 представлена диффузия оксида азота (I) (оксид диазота, закись азота, веселящий газ). При нормальной температуре это - бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Его часто называют «веселящим газом» из-за производимого им опьяняющего эффекта: малые концентрации закиси азота вызывают чувство опьянения и лёгкую сонливость. При вдыхании чистого газа быстро развиваются состояние наркотического опьянения, а затем асфиксия. В смеси с кислородом при правильном дозировании закись азота вызывает наркоз без предварительного возбуждения и побочных явлений. В большинстве случаев применяют комбинированный наркоз, при котором закись азота сочетают с другими, более мощными, средствами для наркоза, а также с миорелаксантами.
В отличие от описанных выше газов (О2, СО2 и СО), закись азота (N2O) не связывается с гемоглобином. Тем не менее, если человек вдыхает N2O, газ попадает и в плазму крови, и в цитоплазму эритроцита (рис. 7-44 А).
Перенос N2O осуществляется совершенно поиному. Проходя через альвеолярную стенку в кровь, N2O не соединяется с гемоглобином. В связи с этим сродство крови к N2O ничтожно по сравнению со сродством, например, к СО, и парциальное давление N2O в крови быстро воз-
растает. Из рис. 7-44 Б видно, что парциальное давление N20 в крови становится почти таким же, как и в альвеолярном воздухе, когда эритроцит проходит лишь 1/10 общей длины капилляра. После этого перенос N20 практически прекращается. Значит, количество газа, поступающего в кровь, в данном случае целиком зависит от ее объема, протекающего через капилляр, а не от свойств диффузионного барьера. Следовательно, перенос N2O ограничен перфузией.
Мы рассмотрели ранее диффузию О2, СО2 и СО и можем сравнить ее с диффузией N2O. Что касается О2, то кривая переноса этого газа занимает промежуточное положение между кривыми СО и N2O. В отличие от N2O, O2 соединяется с гемоглобином, однако значительно слабее, чем СО. В связи с этим, когда О2 поступает в эритроцит, парциальное давление этого газа в крови растет намного сильнее, чем при переходе в кровь такого же количества молекул СО. В начале капилляра Ро2 в эритроците уже составляет примерно 4/10 парциального давления этого газа в альвеолярном воздухе. Это связано с наличием О2 в смешанной венозной крови. В условиях покоя Ро2 в капиллярной крови обычно становится практически такимже, как в альвеолярном воздухе, когда эритроцит проходит примерно треть капилляра. При этом перенос О2, как и у N2O, ограничен перфузией. В то же время при некоторых патологических состояниях, сопровождающихся нарушением диффузионных свойств легких (например, при утолщении альвеолярной стенки), Ро2 в крови даже к концу капилляра не становится равным парциальному давлению кислорода в альвеолярном воздухе, и в этом случае перенос О2 ограничивается отчасти и диффузией.
Рис. 7-44. Диффузия оксида азота (веселящего газа) из альвеол в кровь
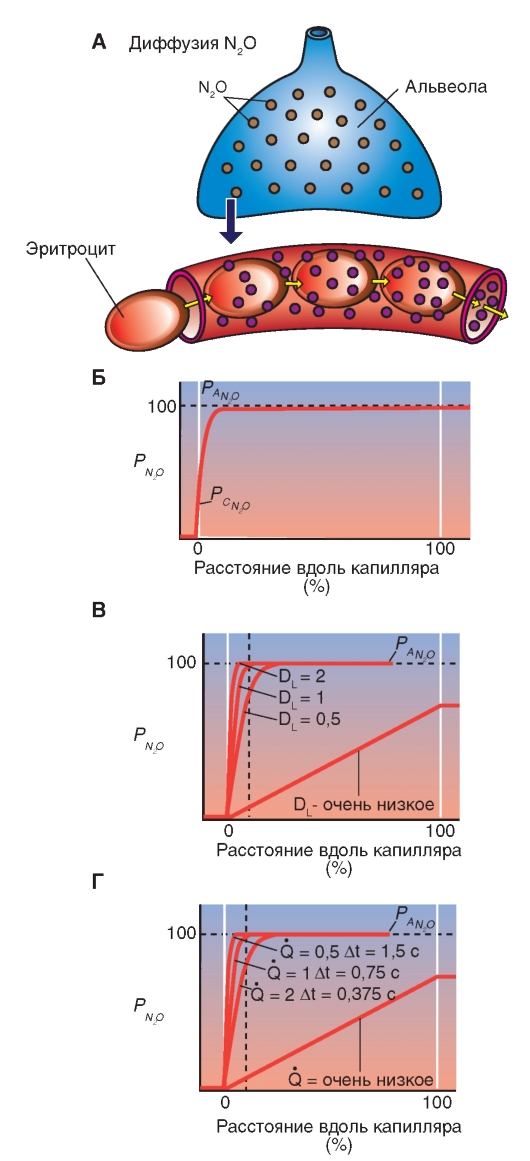
Неравномерность вентиляционноперфузионного отношения в легких
Под влиянием силы тяжести объемная скорость кровотока или (применительно к анатомическофункциональной единице легких - альвеоле) перфузия (Q) распределена во всех участках легкого неравномерно. Подобная неравномерность справедлива и для альвеолярной вентиляции (VА, рис. 7-45). Легкие висят в грудной полости, поэтому их нижние участки растягивают верхние. Растяжение верхних участков легких приводит к тому, что альвеолярные стенки в этих зонах легких становятся натянутыми. Поэтому верхние участки легких вентилируются хуже, чем нижние. Однако, в целом, вертикальный градиент альвеолярной вентиляции является менее выраженным, чем вертикальный градиент альвеолярной перфузии, так что вентиляционно-перфузионное
отношение VА / Q в верхних участках легких выше, чем в нижних. Также и в положении лежа имеются аналогичные, обусловленные силами собственного веса легких, вертикальные градиенты VА / Q . Однако они менее выражены, так как вертикальное растягивание легкого в положении лежа, в сущности, незначительно. Наряду с этими, обусловленными силами собственного веса, градиентами VА / Q в легком, имеется и случайное распределение УА / Q, которое основано на вариации бронхо-обеспечений и сосудообеспечений отдельных участков. Итак, даже в здоровом легком имеется неравномерное распределение VА и Q , которые называют неравномерностью вентиляционно-перфузионного отношения VА / Q . Эта неравномерность ограничивает эффективность пульмонального газообмена, что особенно проявляется, если при патологических изменениях легкого неравномерность VА / Q значительно увеличивается.
Рис. 7-45. Распределение вентиляции - перфузии в легком.
Под действием силы тяжести увеличивается перфузия (Q слева) и альвеолярная вентиляция (VA , справа) при прямой грудной клетке сверху вниз. Представлена перфузия и вентиляция (на единицу объема легкого) на различной высоте легкого. Так как перфузия с высотой сильнее варьирует, чем вентиляция, то вентиляционно-перфузионное отношение VΑ /Q вверху выше и внизу ниже, чем в середине, это значит выше или ниже, чем отношение общей вентиляции к общей перфузии. Значения РО и РСО2 , которые получаются из этой неравномерности VA /Q показаны на примере трех альвеолярных участков (I, II, III)
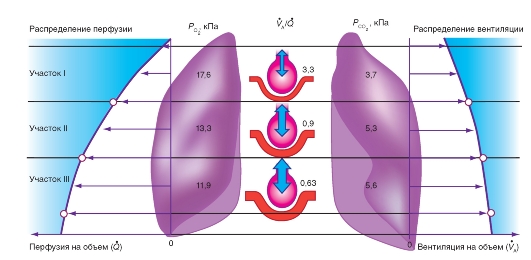
Вентиляционно-перфузионное отношение
Региональная неравномерность VA / Q означает региональные различия альвеолярных парциальных давлений. Альвеолярная вентиляция (VA) доставляет к альвеолам О2, альвеолярная перфузия (Q) обеспечивает транспорт О2 к тканям. На основании этого, легко понять, что концентрация О2 в альвеолярном воздухе или альвеолярное парциальное давление О2(РА) зависит как от VA , так и от Q . Чем выше VA для определенного участка легкого и чем ниже Q в этом участке, тем выше РА для О2, т.е. тем «свежее» альвеолярный газ. Итак, высокое значение отношения VA / Q на участке легкого означает «свежий» альвеолярный воздух (парциальное давление О2 близко к его значению во вдыхаемом воздухе), пониженное значение отношения VA / Q означает, что парциальные дав-
ления газов в альвеолах ближе к венозным значениям. Следовательно, неравномерность в VA / Q соответствует неравномерности альвеолярным и конечно-капиллярным парциальным давлениям. Области, в которых VA / Q выше или ниже среднего, называют гипервентилированными или гиповентилированными участками (не надо путать с гипервентиляцией или гиповентиляцией, которые могут наступать при изменении дыхания или при изменении обмена веществ). Области со средним значением отношения VA / Q , которое так же велико, как отношение общего VA к общему Q, обозначают как нормовентилируемые участки. Верхние участки легкого при прямой грудной клетке гипервентилированы, потому что их перфузия еще сильнее ограничена, чем их вентиляция. Их альвеолярный РО2 приблизительно на 6 кПа выше, ее РСО2 приблизительно на 2 кПа ниже, чем в базальных участках.
Рис. 7-46. Отношение вентиляции и перфузии (VA/Q) альвеолы определяет ее газовый состав (показан только О2).
Альвеолярная вентиляция (VA) определяет доставку О2 к альвеоле, перфузия (Q) отправку О2 из нее с кровью. Альвеолярное РО определяется через отношение . Если VA и/или повышает Q, т.е. Va/Q становится пониженным, содержание О2 в альвеолярном воздухе уменьшается, альвеолярное РО2 снижается и с ним артериальное РО2. Наоборот, альвеолярный воздух будет содержать большее количество О2 при увеличении. В следствие этого альвеолярное и артериальное РО2 также увеличиваются. Это представлено в правой части рисунка (левая шкала). Для СО2 при повышении альвеолярное и артериальное РСО2 снижаются, приуменьшении VA/Q альвеолярное и артериальное РСО2 повышаются. То есть высокое значение является «свежим альвеолярным воздухом», низкое «использованным альвеолярным воздухом». При VA/Q = 0 вентиляция альвеол отсутствует, но есть перфузия. При этом РО2 капиллярной крови остается смешанно-венозным, и сходным с РО2 альвеолярного воздуха. При VA/Q→ ∞ перфузия отсутствует, но есть вентиляция. При этом альвеолярное РО2 остается неизменным в рамках инспираторных значений
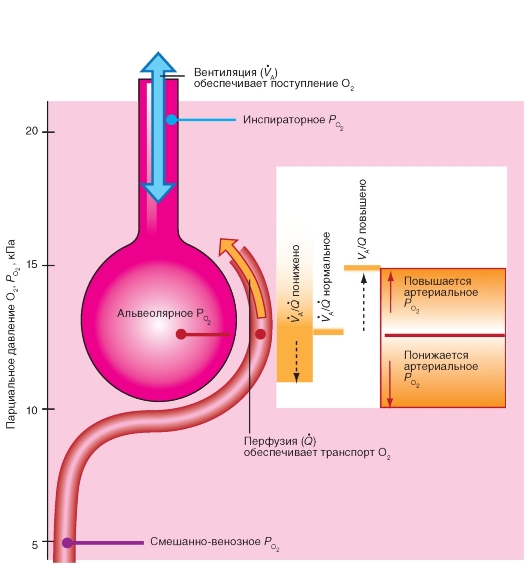
Нормальное перфузионновентиляционное отношение в легких
Как было показано на рис. 7-45 перфузия (Q) распределена во всех участках легкого неравномерно. Подобная неравномерность справедлива и для альвеолярной вентиляции (VА). Крайними случаями являются альвеолярная вентиляция мертвого пространства (перфузия Q = 0) и шунт (венозное смешивание, вентиляция VА = 0). Итак, даже в здоровом легком имеется неравномерное распределение VА и Q , которые называют неравномерностью вентиляционно-перфузионного отношения VА / Q .
Исходя из среднего значения VА / Q , которое было бы в легких, если бы VА и Q повсюду были бы распределены равномерно (идеальное легкое), в здоровом легком имеются все степени гипер- и гиповентиллированных участков. На рис. 7-47 представлено нормальное распределение VА и Q , соответствующее идеализированному состоянию. Даже если в целом VА и Q нормальны, изменения соотношения VА / Q ведут к гипоксии и респираторному ацидозу. Компенсаторные ответы вентиляции альвеолярного мертвого пространства и шунт помогают предохранять человека от последствий изменений VА / Q - респираторного ацидоза и гипоксии. Для иллюстрации, как эти изменения VА / Q вызывают такие последствия, здесь мы рассмотрим случаи с О2, СО2 в норме (рис. 7-47) и затем два экстремальных идеализированных примера - вентиляции альвеолярного мертвого пространства (см. рис. 7-48) и шунт (см. рис. 7-49).
На рис. 7-47 показано, как человек с нормальным VА / Q в каждом легком транспортирует О2, СО2. Мы принимаем, что тотальный VА (4,2 л/мин) и Q (5 л/мин) - это норма, и делим эти величины в равных частях на два легких. Каждое легкое элиминирует половину от 200 мл/мин СО2, продуцируемого в результате метаболизма (рис. 7-47 А). Как результат, альвеолярное РСО2 будет равно примерно 40 мм рт.ст. в каждом легком, а альвеолярное РО2 примерно равно 100 мм рт.ст. Поскольку
постоянная смена СО2 и О2 через альвеолярнокапиллярный барьер для каждого газа лимитирована перфузией, парциальное давление СО2 и О2 в системной артериальной крови такое же, как в альвеолах, и рН артериальной крови в норме. Ранее частично было показано, что диффузия и, прежде всего, перфузия - это факторы, ограничивающие перенос газов. Пусть в альвеоле содержится газ. Как быстро поднимется парциальное давление данного газа в крови? Когда О2 поступает в эритроцит, парциальное давление этого газа в крови растет намного сильнее, чем при переходе в кровь такого же количества молекул, например СО. В начале капилляра РО2 в эритроците уже составляет примерно 4/10 парциального давления этого газа в альвеолярном воздухе. Это связано с наличием О2 в смешанной венозной крови. В условиях покоя РО2 в капиллярной крови обычно становится практически таким же, как в альвеолярном воздухе, когда эритроцит проходит примерно треть капилляра. При этом перенос О2 ограничен перфузией. В то же время при некоторых патологических состояниях, сопровождающихся нарушением диффузионных свойств легких (например, при утолщении альвеолярной стенки), РО2 в крови даже к концу капилляра не становится равным парциальному давлению кислорода в альвеолярном воздухе, и в этом случае перенос О2 ограничивается отчасти и диффузией.
Как осуществляет изменения соотношения VА / Q свое действие на газы артериальной крови? Основной принцип предельно прост: некомпенсированные VА / Q аномалии ведут к респираторному ацидозу и гипоксии. Конечно, компенсация на уровне легких (констрикция бронхиол, уменьшение синтеза сурфактанта, гипоксическая вазоконстрикция), компенсация на уровне целой респираторной системы (например, увеличение вентиляции) помогают уменьшить непрямое влияние изменения соотношения VА / Q . На рис. 7-48 и 7-49 мы рассмотрим вопросы в отсутствии каких бы то ни было локальных или системных компенсаций.
Рис. 7-47. Нормальное распределение VA/Q . Приведенный на рисунке пример является идеализированным
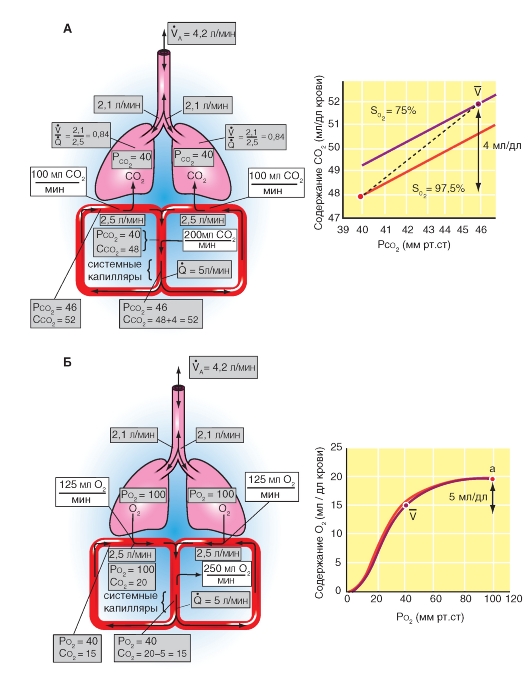
Перфузионно-вентиляционное отношение в области мертвого пространства
Рассмотрим случай, при котором вентиляционноперфузионное отношение постепенно увеличивается в результате перекрывания кровотока (рис. 7-48). Для стимуляции вентиляции альвеолярного мертвого пространства (рис. 7-48) в эксперименте можно перевязать левую пульмонарную артерию и таким образом устранить всю перфузию левого легкого (значенияй VA / Q → ∞). Тотальная Q будет оставаться на нормальном уровне и равна 5 л/мин, но все это будет связано только с работой правого легкого. Тотальный VA также будет соответствовать нормальным значениям 4.2 л/мин и в конечном счете распределяться между двумя легкими. Таким образом, VA / Q левого легкого есть 2,1/0 или бесконечности, тогда какй Va / Q правого легкого есть 2,1/5 или 0,42. Полный VA/ Q в норме 0,84. То есть в результате перекрывания кровотока левого легкого вентиляционно-перфузионного отношенияй Va / Q постепенно увеличивается. Теперь РО2 будет повышаться, а Рсо2 - снижаться, и при полной остановке кровотока (вентиляционно-перфузионное отношение стремится к бесконечности)
эти показатели станут такими же, как и во вдыхаемом воздухе. Основной вопрос, может ли комбинация высокогой VA / Q в условиях абнормального легкого и низкогой VA / Q в нормальном легком давать на выходе нормальный газы крови.
Рис. 7-48 демонстрирует два принципиальных заключения относительно вентиляции области альвеолярного мертвого пространства.
Даже с выраженнымий VA / Q абнормальностями продуцируемыми вентиляцией альвеолярного мертвого пространства, легкие могут изгонять обычные 200 мл/мин СО2, но дорогой ценой - очень большим артериальным РСО2 и, как следствие, респираторным ацидозом.
Даже с выраженнымий Va / Q абнормальностями легкие могут получать обычные 250 мл/мин О2, но дорогой ценой - очень небольшим значением артериального РО2, т.е. гипоксией.
Альвеолярная вентиляция мертвого пространства влияет на парциальные давления О2 и СО2 приблизительно в одинаковой степени. Из этого становится понятным, что многие нарушения функций легких, которые усиливают неравномерностьй Va / Q , скорее, ведут к артериальной гипоксии, чем к задержке СО2 с артериальной гиперкапнией.
Рис. 7-48. Вентиляция области альвеолярного мертвого пространства
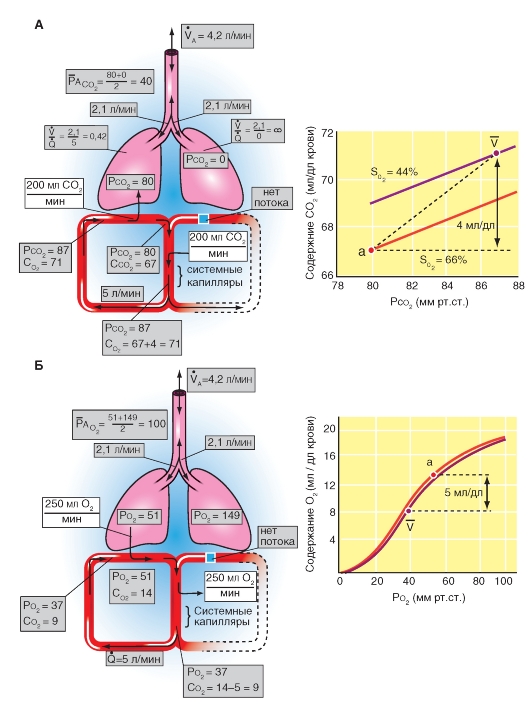
Перфузионно-вентиляционное отношение в области шунта
Предположим теперь, что вентиляционно-перфузионное отношение постепенно уменьшается за счет снижения вентиляции при постоянном кровотоке (рис. 7-49). Для этого в эксперименте можно перекрыть левый бронх и полностью элиминировать всю вентиляцию в левом легком. Исходя из среднего значения VA / Q , которое было бы в легких, если бы VA и Q повсюду были бы распределены равномерно (идеальное легкое), в здоровом легком имеются все степени гипер- и гиповентиллированных участков. Еще один крайний случай сводится к областям со значением VA / Q = 0, которые обозначают как шунты, так как они примешивают венозную кровь к артериальной.
Ясно, что Ро2 в легочной единице будет падать, а Рсо2 - повышаться (хотя количественные соотношения между изменениями этих величин не столь очевидны, как кажется на первый взгляд). Легко можно понять, что при полном прекращении вентиляции (вентиляционно-перфузионное
отношение равно нулю: Va / Q = 0) Ро2 и Рсо2 в альвеолярном воздухе и в крови конечных отрезков капилляров будут такими же, как и в смешанной венозной крови (на самом деле участки легких, в которых прекращается вентиляция, спадаются, однако это происходит не сразу, и поэтому здесь мы этого касаться не будем). Необходимо подчеркнуть сделанное нами допущение: процессы, происходящие в одной легочной единице (а таких единиц огромное количество), не влияют на состав смешанной венозной крови.
Рис. 7-49 демонстрирует два принципиальных заключения относительно шунтов.
Даже с выраженными Va / Q абнормальностями, продуцируемыми шунтом, легкие могут изгонять обычные 200 мл/мин СО2, но опять дорогой ценой - очень большим артериальным Рсо2, и как следствие респираторным ацидозом.
Даже с выраженными Va / Q абнормальностями, вызванными шунтом, легкие могут получать обычные 250 мл/мин О2, но цена за это - очень небольшое значение артериального Ро2, т.е. гипоксия.
Рис. 7-49. Шунт
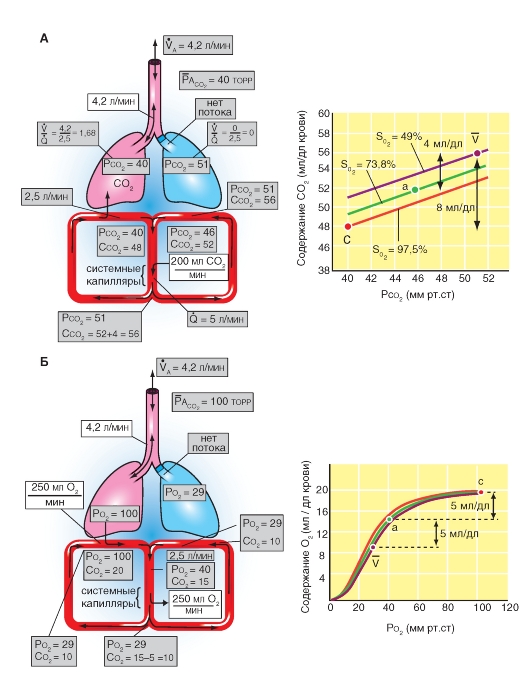
Регуляция дыхания
Под регуляцией дыхания понимают способность легочной вентиляции приспосабливаться к потребностям обмена веществ организма и условием внешней среды. Респираторные нейроны продолговатого мозга посылают ритмические импульсы, характер которых может изменяться благодаря ряду афферентных влияний различной продолжительности и интенсивности. Особенно хорошо описаны афферентные влияния с легочных рецепторов растяжения, а также артериальных и центральных хеморецепторов. Но они одни не могут объяснить ни установки нормального дыхания, ни приспособления дыхания при работе.
Рассмотрим центральный дыхательный ритмогенез. Дыхательные движения (сокращения дыхательных мышц) вызываются группами нейронов в продолговатом мозге (medulla oblongata), обладающими ритмической активностью. При отведении потенциалов с помощью микроэлектродов у собак и кошек в продолговатом мозге нашли нейроны, деятельность которых строго связана с дыхательным ритмом. При этом были обнаружены инспираторные нейроны, которые активны при вдохе (но могут обусловливать также и экспирацию), и экспираторные нейроны, увеличение биоэлектрической активности которых приходится на выдох. Точный анализ биоэлектрической активности позволил разделить инспираторные и экспираторные нейроны на подгруппы. Инспираторные нейроны лежат в области ядра одиночного пути (tractus solitarius) и вблизи двойного ядра (nucleus ambiguous), а также в шейных сегментах С1 и С2 спинного мозга. Экспираторные нейроны находятся рядом с nucleus ambiguous рострально по отношению nucleus retrofacialis (рис. 7-50). Ритмическая активность этих дыхательных ней-
ронов продолговатого мозга основана на комплексном переключении. Поэтому, в целом, они обозначаются как генератор ритма. Это название более предпочтительно, чем понятие дыхательный центр, вследствие того, что из-за рассеянного положения этих нейронов такой центр едва ли можно строго локализовать. Для формирования ритмогенеза важны не только противоположные процессы, такие, как возбуждение и торможение дыхательных нейронов, но и тонические (неспецифические) активирующие влияния на них из ретикулярной формации ( formation reticularis), которые модулируются через специфические и неспецифические афферентные входы с различных периферических рецепторов организма. К модулирующим влияниям необходимо отнести и описанные ниже обратимую афферентацию и возбуждение других дыхательных структур центральной нервной системы, участвующих в формировании процесса дыхания. Респираторные нейроны в продолговатом мозге имеют синаптическую связь не только с другими респираторными нейронами этой части мозга, но и со спинальными мотонейронами дыхательных мышц. При нормальном спокойном дыхании активность респираторных нейронов продолговатого мозга не связана с возбуждением экспираторных мотонейронов, и, фактически, выдох в покое происходит пассивно. Генератор ритма создает базальный ритм, который модифицируется другими влияниями (возбуждение различных дыхательных нейронов), модифицируется частично выше расположенными центрами мозга (пневмотаксический центр в воролиевом мосту), и модифицируется частично с различных рецепторов организма, которые и адаптирует его к необходимым условиям. Часть дыхательных нейронов имеют обратную связь и обеспечивают гомеостаз дыхательной системы (регуляция).
Рис. 7-50. Распределение респираторных нейронов в дыхательном центре продолговатого мозга.
Вид на продолговатый мозг (medulla oblongata), инспираторные (I, красные) и экспираторные нейронные группы (E, зеленые) и их приблизительное расположение. В действительности они находятся внутри ретикулярной формации и их трудно отграничить. Справа: поперечный срез на данном уровне с инспираторными нейронными группами. Nn. IX, X - места выхода nn. Glossopharyngeus и Vagus. Ncl. N. XII - ядра подъязычного нерва
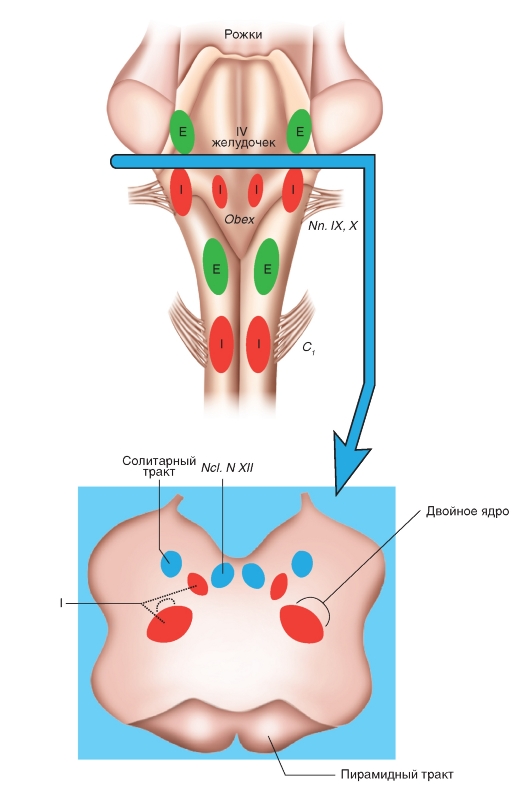
Регуляция дыхания под влиянием сигналов хеморецепторов
Изменение дыхания под влиянием химических факторов осуществляется через хеморецепторы, которые, частично, лежат в крупных артериях (периферические хеморецепторы), частично в продолговатом мозге (центральные хеморецепторы). Периферические хеморецепторы находятся, в основном, в каротидных тельцах (glomera carotica), расположенных в области бифуркации общих сонных артерий, и в аортальных тельцах (glomera aortica), расположенных в верхней и нижней частях дуги аорты (рис. 7-51 A).
Каротидные тельца - это маленькие васкуляризированные образования, которые состоят из скопления клеток типа I. Эти клетки окутаны глиаподобными клетками типа II и имеют тесный контакт с открытыми капиллярами. Соседние клетки типа I связаны друг с другом (рис. 7-51 Б) посредством щелевых контактов (gap junction). Эти рецепторные структуры относятся ко вторичным рецепторам, где клетки типа I не имеют аксона, но синаптически контактируют с терминалями афферентных волокон каротидного нерва. Клетки типа I реагируют освобождением трансмиттера, который вызывает возбуждение связанных с ними афферентных волокон, как под влиянием гипоксии, так и под влиянием гиперкапнии и ацидоза. Гипоксия уменьшает проводимость К+-каналов в мембране клеток типа I, что ведет к деполяризации их мембраны. Благодаря этому открываются потенциал-управляемые Са2+-каналы, и Са2+ устремляется из внеклеточного пространства в клетку (рис. 7-51 В). Повышение
цитозольной концентрации Са2+ приводит на освобождению дофамина, который вызывает потенциал действия в афферентных волокнах каротидного нерва. Респираторные и нереспираторные нарушения кислотно-щелочного равновесия приводят к изменению внеклеточного рН или РСО2, вследствие чего меняется и внутриклеточная рН клеток типа I, что и вызывает их возбуждение (рис. 7-51 В). Уменьшение рН также уменьшает проводимость К+-каналов клеток типа I, что запускает ту же последовательность событий, как при гипоксии, и приводит к освобождению трансмиттера. Клетки типа I находятся под эфферентным контролем центральной нервной системы. Кроме того, на их мембране имеются ауторецепторы, так что вполне возможна модуляция чувствительности этих клеток химическим раздражителем. Реакция клетки типа I на гипоксию имеет большое сходство с ответом на гипоксию гладкомышечной клетки в стенке мелких пульмональных артерий, которые отвечают за гипоксическую вазоконстрикцию легочных сосудов. При выключении периферических хеморецепторов даже сильная гипоксия не вызывает увеличения глубины и частоты дыхания, но, скорее, ведет к уменьшению вентиляции (центральная депрессия). Повышение артериального РСО2 и артериальной концентрации Н+ является, напротив, сильным раздражителем, который действует через центральные хеморецепторы, находящиеся на вентральной стороне продолговатого мозга.
Дыхательные нейроны, расположенные вблизи вентральной поверхности продолговатого мозга, также обладают химической чувствительностью.
Рис. 7-51. Периферические хеморецепторы.
А - каротидные тельца (glomera carotica) в месте бифуркации сонной артерии получают кровь из наружной сонной артерии (a. carotis externa) и иннервируются языкоглоточным нервом (IX пара) (n. glossopharyngeus - n. IX). По аортальным тельцам (glomera aortica) циркулирует кровь из аорты и они иннервируются ветвями n. vagus (n. X). Прессорецепторные области в области сонной артерии (sinus caroticus) и в дуге аорты обозначены темно-коричневым цветом. Б - показаны две клетки типа I с их синапсами на афферентных волокнах синусного нерва сонной артерии, причем обе клетки окутаны глиаподобными клетками типа II и имеют тесный контакт с открытыми капиллярами. В - схематически представлены механизмы передачи сигнала с помощью трансмиттера (подробнее в тексте)
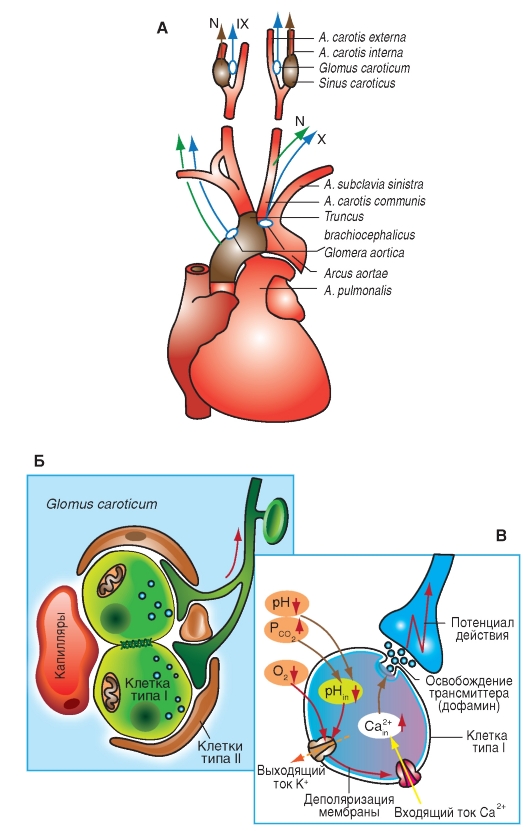
Типы дыхания
При нормальном дыхании дыхательный объем и частота дыхания могут значительно изменяться (рис. 7-52). При сильном метаболическом ацидозе, например, при диабетической коме, появляется углубленное дыхание с удлиненным выдохом, так называемое «дыхание поцелуя» или большое дыхание. Даже у здоровых людей наблюдают тип дыхания, характеризующийся периодичностью возникновения дыхательных движений, между которыми имеются длительные паузы. Последовательное изменение дыхательных движений ведет к постепенномуувеличениюдыхательного объема с последующим уменьшением, переходящим в паузу. Этот тип дыхания, обозначенный как дыхание Чейна- Стокса, бывает у пациентов при отравлениях или уремии. В случае выпадения более высоких центров дыхания при агонии можно наблюдать особую патологическую форму периодического с резко удлиненным вдохом.
Особую форму патологического дыхания представляет апноэ сна, для которого характерны длящиеся от 10 с до нескольких минут периоды остановки (апноэ) дыхания. В зависимости от причины можно выделить обструктивное апноэ сна и центральное апноэ сна, которые имеют разные механизмы. Центральное апноэ сна связано с нарушением структур центральной нервной системы, участвующих в формировании дыхательного ритма. Обструктивное апноэ сна связано с закрытием верхних дыхательных путей. При этом дыхание происходит в условиях создания в дыхательных путях резко пониженного давления при вдохе, и дыхательные пути не могут сохранить открытое состояние. Обструктивное апноэ сна часто бывает у лиц с избыточным весом, алкоголизм также повышает риск. Лица с апноэ сна благодаря дневной усталости обращают на себя внимание, хотя лечить это заболевание очень трудно.
Рис. 7-52. Различные формы дыхания