Биоэтика: учебник для вузов / Под ред. В.П. Лопатина. - 4-е изд., - 2009. - 272 с.
|
|
|
|
ГЛАВА 3 ОСНОВНЫЕ БИОЭТИЧЕСКИЕ И ЭТИЧЕСКИЕ ПРОБЛЕМЫ СОЗДАНИЯ И ВОСПРОИЗВОДСТВА ЛЕКАРСТВ
Мировой и российский фармацевтические рынки в настоящее время бурно развиваются (рис. 6., табл. 1).
Однако дженериковые ЛС доминируют и продолжат доминировать (см. табл. 1). Доля инновационных ЛС все еще остается небольшой: так, в 2008 г. она составит в среднем около 13%.
Инновационные лекарства позволяют реально снижать расходы на лечение хронических заболеваний. Например, по данным США, годовая стоимость расходов на обслуживание пациентов, страдающих болезнью Альцгеймера, на 4 тыс. долл. ниже у пациентов, принимающих меди-
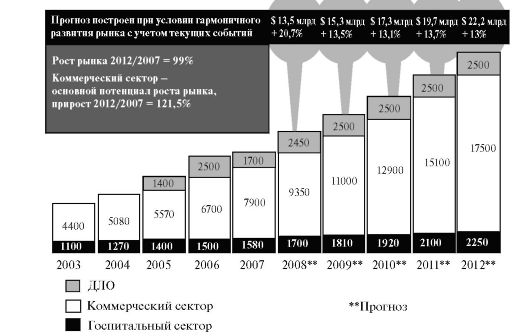 Рис. 6. Объем
российского фармацевтического рынка в 2003 - 2012 г. (млрд. долл. США,
цены потребителя, включая 18% НДС). Расчеты ЦМИ «Фармэксперт» ДЛО -
дополнительное лекарственное обеспечение.
Рис. 6. Объем
российского фармацевтического рынка в 2003 - 2012 г. (млрд. долл. США,
цены потребителя, включая 18% НДС). Расчеты ЦМИ «Фармэксперт» ДЛО -
дополнительное лекарственное обеспечение.
Таблица 1. Доля основных категорий продукции на фармацевтическом рынке России (%), 2004 - 2012 гг. Расчеты ЦМИ «Фармэксперт»
2004 | 2005 | 2006 | 2007* | 2008** | 2009** | 2010** | 2011** | 2012** | |
Дженерики и другие | 89 | 85 | 80 | 88 | 87 | 86 | 85 | 85 | 85 |
Инновационные | 11 | 12 | 50 | 12 | 13 | 14 | 15 | 15 | 15 |
'Расчеты ЦМИ «Фармэксперт» "Прогноз
каментозную терапию, по сравнению с контрольной группой без медикаментозного лечения. Или другие цифры: вследствие использования инновационных продуктов количество койко-дней на 100 человек в год сократилось в США со 130 в 1980 г. до 57 в 2000 г. (всего на 56%).
Хотя, в среднем, инновационные продукты стоят на 18 долл. дороже «старого» аналога, уже присутствующего на рынке, экономия от их использования составляет 129 долл., т.е. на 1 долл. прироста стоимости лекарства приходится около 7 долл. экономии совокупных расходов на лечение.
По данным Роспрома, более 70% объема продаж лекарственных препаратов на российском фармацевтическом рынке приходится на импортные средства, и только около 5% готовых препаратов производится на основе отечественных субстанций. На фармацевтическом рынке России полностью отсутствуют отечественные антибиотики нового поколения, противотуберкулезные, онкологические и обезболивающие препараты, инсулин и многие другие лекарства. Такое положение вещей не только удручающе сказывается на здоровье средне- и малообеспеченных слоев населения, но и, безусловно, ставит под угрозу само существование фармацевтической отрасли в России.
Вышеизложенное позволяет сделать заключение, что интересы здравоохранения, в том числе клинической медицины, требуют активизации исследований по созданию инновационных ЛС.
При решении этой проблемы наибольшую значимость в настоящее время приобретают исследования, направленные на создание лекарств на основе отобранных в эксперименте веществ.
В конце 1970-х гг. П.В. Лопатиным была сформулирована концепция лекарства как материализованной программы доставки лекарственного вещества к биологической мишени и предложена закрытая графическая модель процесса его разработки (рис. 7);
 Примечание; 1) На
всех этапах проводятся необходимые контроли в соответствии с
разработанными критериями и параметрами. 2) На отдельных этапах следует
проводить сравнительную оценку конкурентоспособности создаваемого
лекарства и возможности продвижения его на рынок, с использованием, как
правило, экспресс-оценки целесообразности инноваций и инвестиций. 3) На
всех этапах следует рассматривать вопросы защиты интеллектуальной
собственности.
Примечание; 1) На
всех этапах проводятся необходимые контроли в соответствии с
разработанными критериями и параметрами. 2) На отдельных этапах следует
проводить сравнительную оценку конкурентоспособности создаваемого
лекарства и возможности продвижения его на рынок, с использованием, как
правило, экспресс-оценки целесообразности инноваций и инвестиций. 3) На
всех этапах следует рассматривать вопросы защиты интеллектуальной
собственности.
Рис. 7. Закрытая графическая модель процесса разработки лекарства на основе отобранных в эксперименте веществ
теоретически и экспериментально обоснованы приемы направленной (программируемой) доставки действующих веществ к биологическим мишеням (табл. 2) и сформирована концепция науки о создании готовых лекарств на основе отобранных соединений (субстанций) - лекаристики (рис. 8).
Модель процесса создания лекарства
Эта модель с учетом современных требований представлена на рис. 7.
В дальнейшем она была использована для создания регламентирующих документов для соисполнителей государственных программ, связанных с созданием лекарств для лечения наиболее распространенных заболеваний.
Одним из первых таких документов был порядок организации работ по созданию и подготовке к клиническому изучению противоопухолевых лекарств во Всесоюзном онкологическом центре АМН СССР
Таблица 2. Приемы направленной доставки действующих веществ к биологическим мишеням
Для программируемой доставки можно использовать: |
в органы - ультраэмульсии, микросферы, микрокапсулы и др.; |
в ткани - ультраэмульсии с различным размером частиц и составом, в том числе покрытые глобулином; липосомы, термочувствительные нанокапсулы, наночастицы на основе полимеров, магнитные носители, фотосенсибилизаторы, сопряженные с лазерами, генерирующими излучение с конкретными длинами волн, обеспечивающими лечение опухолей, расположенных на разной глубине, и др.; |
для более точной доставки в конструкцию носителей вводятся элементы узнавания мишени, например моноклональные антитела, ассоциированные с лекарственным веществом; нагруженные эритроциты, к поверхности которых присоединены антитела; липосомы, во внешнюю оболочку которых встроены векторы, обеспечивающие избирательное «причаливание» к клетке, на поверхности которой имеется комплементарный вектору маркер; лиганды, включающие остатки сахаров, узнаваемые некоторыми клетками (гепатоцитами, макрофагами и др.) |
Отдельные элементы программы доставки могут быть реализованы за счет более простых решений, например, с использованием неводных растворителей, пленочных и напрессованных покрытий, твердых дисперсных систем, спансул и т.п. |
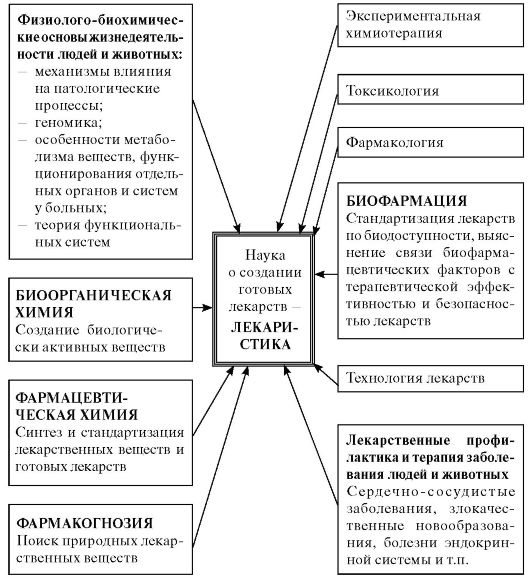 Рис. 8. Место науки о создании готовых лекарств (лекаристики) в современном знании.
Рис. 8. Место науки о создании готовых лекарств (лекаристики) в современном знании.
и участию в их внедрении в промышленное производство, который был разработан П.В. Лопатиным и сотрудниками. В нем излагалась методология создания лекарств, были реализованы принципы последовательно-параллельного выполнения необходимых фрагментов проекта, а также порядок управления процессом создания лекарств. Вместе с тем в документе впервые был приведен четкий понятийный
аппарат, позволивший всем участникам создания лекарств хорошо ориентироваться в проблеме, обеспечить тесное взаимодействие всех подразделений, занятых в проекте, что привело к повышению эффективности исследования и сокращению сроков выполнения всего комплекса научно-исследовательских работ (НИР).
В последующем этот документ был принят как обязательный для всех соисполнителей государственной программы 069.02.
Модель включает несколько блоков последовательного решения необходимых задач. Первый блок (этап) предусматривает формулировку требований к создаваемому лекарству. На первом этапе выбирается биологическая мишень, к которой должны быть доставлены соответствующие лекарственные вещества. Это может быть выполнено на основе теоретических и экспериментальных изысканий. Поэтому в начале конструируются определенные модели лекарства, позволяющие обосновать программу доставки фармакологического вещества к биологической мишени. При этом, как правило, рассматривается и обосновывается минимум 9 элементов программы доставки. Особое внимание уделяется теоретическому и экспериментальному обоснованию пути введения фармакологического лекарственного вещества в организм. Он определяет особенности взаимоотношения лекарственного вещества с путями и механизмами транспортировки, в том числе преодоление гистогематического барьера, влияние среды транспортировки, метаболизм и распределение введенного вещества.
Второй блок предусматривает создание прототипов лекарства, т.е. вариантов композиций и конструкций его, из которых в дальнейшем будет отобран лучший. На этом этапе помимо поиска оптимальной конструкции и композиции потенциального лекарства определяется доза действующего вещества в потребительской таре и сама потребительская тара. Затем проводятся исследования соответствия характеристик прототипов лекарства ранее сформулированным требованиям (блоки 3 и 4); такое соответствие может оцениваться лишь по интегральным критериям, устанавливающим возможность введения препарата в организм - отсутствие выраженных местных тканевых реакций и т.п.; мини-программам, характеризующим основные технологические, фармакологические параметры; оценивают фармакопейное качество и главное, специфическую активность. Такие исследования позволяют осуществить выбор наиболее рационального варианта изученного прототипа, который получает статус фармакологического средства и передается на 5-й этап (блок изучения).
На 5-м и 6-м этапах научно-исследовательской работы ведутся параллельные исследования, направленные на углубленное терапевтическое, токсикологическое и фармакологическое изучение фармакологического средства; разрабатываются антидоты и способы лечения осложнений, связанных с передозировкой фармакологического средства; составляются документы, необходимые для разрешения клинических испытаний.
Одновременно другая группа исследователей (технологов) разрабатывает технологию и аппаратурное оформление производства фармакологического средства, необходимые для крупнолабораторной наработки его с целью углубленных лабораторных испытаний, разработки критериев, методов, методик и параметров стандартизации и контроля качества.
После этого на 7-м этапе разрабатывается нормативная документация, обеспечивающая наработку ЛС для клинических испытаний и, в случае их успешного завершения, последующего продвижения, в том числе лабораторный регламент производства, предварительные нормативно-технические требования (проекты ВФС или Фармакопейные статьи предприятия).
Важнейшим этапом (блок 8) является наработка фармакологического средства для клинических испытаний. Следует подчеркнуть, что наибольшего успеха достигают организации, имеющие собственную наработочную базу. В России такие базы имеют ряд ведущих научно-исследовательских центров и производственных фармацевтических организаций, в частности: ОАО «Нижфарм», ОАО «ХимФармКомбинат», ЗАО «Акрихин», ЗАО «Верофарм» и др. Это позволяет в сжатые сроки разрабатывать нормативные документы, необходимые и для промышленного выпуска продукции (блок 10), в том числе опытно-промышленные и другие регламенты, ФСП, ВФ и ФС, а также при регистрации ЛС и введения их в государственный реестр лекарств.
Изложенное позволяет не только обеспечить широкое внедрение инновационного препарата в широкую медицинскую практику, но и максимально использовать сроки патентной защиты разработки, а также максимизировать прибыль.
В связи с введением в действие нового законодательства о защите интеллектуальной собственности и предполагаемого вступления России во Всемирную торговую организацию необычайно возросло значение защиты прав разработчиков новых лекарств, способов их
изготовления, промышленных образцов и торговых марок, а также лекарственных технологий лечения и предупреждения заболевания. Поэтому деятельность по защите интеллектуальной собственности должна сопровождать все этапы процесса разработки лекарства и его использования; необходим постоянный мониторинг, связанный с охраной инновационной и интеллектуальной собственности.
В условиях острой конкурентной борьбы вся деятельность в области разработки инновационных ЛС должна охраняться. Непременным условиям эффективной охраны интеллектуальной собственности является высокая морально-нравственная зрелость персонала.
По-видимому, воспитание морально-нравственной позиции сотрудников должно основываться на корпоративных и профессиональных кодексах. Очень важно, чтобы они включали положения, обеспечивающие интересы коллективов (организаций), проводящих исследования в области разработки и испытания инновационных лекарств, потому что создание лекарства - чрезвычайно ресурсоемкий и длительный процесс. Исследования на различных этапах разработки лекарств и полученные в результате их данные по ряду причин не могут быть полно и объективно проверены. Это диктует повышенные требования к морально-нравственным характеристикам исследователей. Они не должны быть тенденциозными, поскольку это влечет увеличение вероятности ошибки наблюдателя и необоснованного перехода к следующему этапу выполнения проекта.
Биоэтические позиции специалистов, занятых в цепи исследований и разработок по созданию лекарств и продвижению их на рынок, а также производству и доведению их до потребителя, т.е. в сфере обращения лекарств, являются решающим элементом в решении проблемы эффективной медицинской помощи, основанной на принципах доказательной терапии, доказательной фармакотерапии, фармацевтической бдительности и фармакоэкономики. В связи с этим биоэтические проблемы в сфере обращения лекарств рассматриваются более подробно в последующих разделах учебника.
Биоэтические аспекты использования достижений биологических, фармацевтических и медицинских наук для создания лекарств
В последние десятилетия ХХ в. достигнут впечатляющий прогресс в области биологических, фармацевтических и медицинских наук, что может быть реализовано при создании инновационных лекарств.
В их числе следует отметить успехи генетики, открытие рецепторов лекарств, возможности создания лекарств с программируемой доставкой действующих веществ к биологическим мишеням.
Генетические аспекты медицинской и фармацевтической биоэтики
В настоящее время достигнуты большие успехи в генетике и расшифровке генома человека, а также ряда других организмов. Генеральная конференция ЮНЕСКО на 29-й сессии 11 ноября 1997 г. еще до завершения расшифровки генома человека единогласно приняла «Всеобщую декларацию о геноме человека и о правах человека». В первой статье этого документа записано, что «геном человека лежит в основе изначальной общности всех представителей человеческого рода, а также признания их неотъемлемого достоинства и разнообразия. Геном человека знаменует собой достояние человечества».
Статья 4 гласит, что «геном человека в его естественном состоянии не должен служить источником извлечения доходов».
В статье 12 постулируется всеобщий доступ к генетической информации. Вместе с тем эта Декларация в ряде других статей рекомендует создавать в различных странах этические комитеты разного уровня для оценки социальных, этических и правовых вопросов, касающихся генома человека и жестко контролировать все исследования.
Вместе с тем, поскольку Декларации ЮНЕСКО носят рекомендательный характер, уже 26 июня 2000 г. Международный консорциум Human Genome Project и частная компания Celera Genomics официально объявили, что расшифровано около 97% всех текстов наследственной информации, записанной на двойной спирали ДНК человека. При этом было идентифицировано до 3 млрд нуклеотидов, из которых состоят около 30 тыс. генов, «упакованных» в 46 хромосом человека.
Это событие сразу породило множество проблем этического и правового порядка и, прежде всего, собственности на полученную информацию: кому она должна принадлежать - всему человечеству или компаниям, которые ее открыли. Национальный институт здравоохранения США подал заявки на регистрацию фрагментов ДНК как своей интеллектуальной собственности.
Между тем в проекте «Геном человека» участвовало большое количество стран и отдельных исследователей. Как честный и принципиальный исследователь, нобелевский лауреат, открывший РНК,
Джеймс Уотсон (руководитель Международного консорциума Human Genome Project) в ответ на это заявил, что «геном должен принадлежать всем» и в знак протеста против действий США подал в отставку.
Желание патентовать геном обусловлено тем, что полученная информация может быть использована для создания различных лекарств, которые будут полезны в лечении наследственных болезней, различных дефектов и т.п. По мнению ряда ученых, эти лекарства смогут изменять генетическую основу ряда заболеваний, в том числе диабета. Грядущие баснословные барыши, которые могут быть получены фармацевтическими фирмами при условии монополии на эти лекарства, обусловили жесткую конкуренцию между ними, в связи с чем эта проблема обсуждалась на Окинавской встрече глав государств «большой восьмерки», однако решение так и не было найдено.
Многие вопросы, связанные с созданием и использованием в клинической практике лекарств, созданных на генетической основе, еще не разрешены. Тем не менее прогнозируется, что через несколько десятков лет индивидуальная расшифровка генома любого человека может стать рутинной процедурой, выполняемой за короткое время, что снимет ограничение в использовании стандартных лекарств у людей, которые, как известно, имеют в геноме и индивидуальные различия.
Из этого можно заключить, что, несмотря на захватывающие перспективы генетики, в том числе в области создания новых лекарств, пока еще рано на уровне вузовской подготовки провизора в деталях рассматривать эту проблему. Тем не менее представление о ней и современное отношение каждого специалиста к этой проблеме должны формироваться.
Известие о клонировании животных, в том числе овечки Долли в Англии, а затем и других животных в различных странах вызвало большой интерес в современном обществе.
Клонирование производится следующим образом: берется половая клетка живого существа и из нее удаляется имеющееся ядро, в котором содержится половинный генетический материал, затем туда пересаживается ядро соматической (от греч. «сома» - тело), но не половой клетки. Все соматические клетки клонируемого организма несут в себе полный генетический материал. Далее путем воздействия слабых электрических разрядов достигается сращение нового ядра с цитоплазмой клетки. В образовавшейся таким образом гамете запускаются генетические механизмы деления. При пересадке этой искусственно созданной зиготы в матку развивается живое существо - это
и есть клон. Он несет в себе генетическую информацию только одного животного или человека, от которого было взято ядро, хотя в нем присутствует незначительное количество (доли процента) генетического материала от матери (происходящего из митохондрий цитоплазмы).
Теоретические основы клонирования были известны давно, но практическое клонирование низших позвоночных впервые удалось в 1952 г.
По-настоящему эпоха клонирования высших позвоночных началась в 1996 г., когда путем клонирования шотландским ученым во главе с Янгом Уилмутом удалось вывести овцу, названную Долли. В 1998 г. появилось сообщение, что американским ученым на Гавайях удалось клонировать 580 мышей, в Японии от одной коровы получить 8 клонированных телят, а затем получить и клон свиней. В 2002 г. в Техасском университете был получен клонированием котенок. В эти же годы по той же технологии в Южной Корее проводился эксперимент по делению человеческой клетки, однако этот эксперимент был остановлен на ранней стадии.
Теоретически клонировать человека возможно. Для этого у женщины берут яйцеклетку, удаляют из нее ядро, затем имплантируют ядро из ее же соматической клетки. Образовавшуюся таким образом гамету побуждают к делению и пересаживают в матку этой же женщины. Доносив такой плод, женщина родит как бы саму себя. Гамета может быть создана также из соматических клеток детей этой женщины. В случае состоявшихся родов она родит копии своих детей. В процессе генетических манипуляций имеется также возможность выбора пола.
Хотя медико-биологические проблемы клонирования человека до конца еще не решены, в обществе уже обсуждаются возможные изменения в гражданском, семейном и других кодексах и необходимость разработки нормативов, регулирующих юридический и правовой статус родившихся таким путем людей.
В связи с этим вопрос о клонировании обсуждается на уровне правительств ряда стран и международных организаций. Совет Европы дополнительно к Конвенции о правах человека и биомедицине, где имеется Глава IV «Геном человека», принял протокол о запрете клонирования человека. Статья 11 Всеобщей декларации ООН по геному и правам человека постулирует: «Не допускается практика, противоречащая человеческому достоинству, такая как практика клонирования человеческой особи». Межправительственный комитет ЮНЕСКО на заседании в 2001 г. в Париже призвал государства-
члены Организации «принять соответствующие меры, в том числе законодательного и регламентирующего характера, с целью эффективного запрещения репродуктивного клонирования человека».
Под влиянием этих документов к 2005 г. уже 30 государств приняли законы, запрещающие клонирование человека. Россия в 2002 г. приняла пятилетний мораторий на клонирование человека.
Однако факты свидетельствуют, что работы по клонированию человека продолжаются.
Чикагский ученый Р. Сид сообщает о целесообразности создания сети суперсовременных генетических клиник. В них наряду с экстракорпоральным оплодотворением будет проводиться генетический скрининг, а также клонирование вначале животных, а в последующем и человека.
В последние годы обнаружено, что при клонировании могут нарушаться некоторые молекулярно-генетические механизмы. Это может быть причиной нежизнеспособности клона: овца Долли, как известно, жила недолго. Возникает много и других вопросов, что обусловило возникновение этической проблемы - допустимо ли клонирование, если не решены вопросы технической и медицинской безопасности.
В российском обществе есть как защитники, так и противники клонирования. Бескомпромиссную позицию по отношению к клонированию занимает Русская православная церковь. В Заявлении Церковно-общественного Совета Московской патриархии по биомедицинской этике «Об этической недопустимости клонирования человека» от 20 октября 1999 г. отмечается: «Глобальный кризис, охвативший мир, в значительной мере вызван игнорированием этических критериев при принятии решений о направлениях научных исследований и путях использования их достижений. Восстановление согласия между духовно-нравственной жизнью человека и его научно-технической деятельностью сегодня не просто желательно, но и во многом предопределяет возможность дальнейшего существования человеческой цивилизации. Однако в недрах современной науки порой рождаются опасные проекты, среди которых особое место принадлежит идее клонирования человека... И с научной, и с религиозной точек зрения эта идея представляется абсолютно неприемлемой».
Хотя в настоящее время против клонирования в целом протестует большинство религиозных и светских лиц, некоторые аспекты клонирования могут быть использованы во имя человека. Например, путем клонирования могут быть выращены человеческие ткани, возможно,
и органы, годные для трансплантации. Такое клонирование часто называют терапевтическим. ВОЗ поддерживает необходимость развития данного направления клонирования. В Российской Федерации Федеральный закон «О временном запрете на клонирование человека» (2002 г.), введя временный, сроком на 5 лет, запрет на клонирование человека, не запрещает научных исследований по клонированию животных, а также выращиванию тканей для трансплантации, поскольку такой материал полностью совместим с организмом и не будет им отторгаться. Это очень важно, так как при использовании современной технологии трансплантации тканей реципиент обречен на пожизненное использование иммуносупрессоров.
В указанном выше Заявлении Совета по биоэтике Московского патриархата поддерживается возможность клонирования изолированных клеток и тканей живых организмов, равно как и использования современных молекулярно-генетических методов, поскольку они не нарушают суверенитета человеческой личности и полезны медицинской и сельскохозяйственной практике. Таким образом, клонирование тканей и органов сулит человечеству огромные выгоды и является морально приемлемым аспектом клонирования.
Протеомика
Расшифровка генома человека потребовала изучения функций соответствующих генов. Для решения этой задачи была разработана Международная программа «Протеомика человека».
Протеомика - это наука, изучающая белки клеток, их взаимодействие в целом организме. Она охватывает изучение процесса синтеза белков, их состава и структуры, возникновения модификаций, их функций и т.д., т.е. создание своеобразного каталога структуры и функций всех белков человека.
В человеческом организме около 1 млн различных белков; в зависимости от стадии развития клетки, возраста человека, его здоровья и множества других обстоятельств они постоянно изменяются. Повидимому, биоэтические проблемы протеомики во многом совпадают с проблемами геномики и связаны с созданием и применением белковых лекарственных препаратов, коррекции наследственных болезней и др.
В настоящее время удается проследить взаимосвязи между изменениями белков и различными болезненными состояниями. Это дает возможность в перспективе по изменению состава белков внутри патологической клетки выявлять мультифакторные болезни.
Протеомика начинает развиваться ускоряющимися темпами, и это дает основание надеяться, что в будущем она окажется полезной в борьбе с болезнями человека.
Генетический скрининг
Генетический скрининг предусматривает массовое генетическое обследование людей для решения ряда вопросов, в том числе наследственной патологии, лечебного воздействия на наследственные заболевания, выбора пола будущего ребенка на стадии эмбриона при экстракорпоральном оплодотворении, пренатальной диагностики естественно зачатого ребенка и др.
Отношение к генетическому скринингу среди ученых, политиков и населения в большинстве случаев дискуссионное. Одни являются сторонниками негативной евгеники (т.е. евгеники, устраняющей негативные генные влияния), поддерживают вмешательство в процесс оплодотворения с целью выбора пола плода, другие - противниками. Так, в некоторых культурах издавна считают предпочтительным рождение сына; менталитет других наций противится идее выбирать эмбрион подобно автомобилю у дилера.
Конвенция Совета Европы (ст. 14) без всякого обоснования запрещает выбор пола ребенка. В заявлении, принятом на 39-й сессии Всемирной медицинской ассамблеи в 1987 г., указывается, что ВМА предлагает не вмешиваться в процесс оплодотворения с целью выбора пола плода, кроме тех случаев, когда идет речь о профилактике сцепленных с полом врожденных патологий.
Пока значение этой проблемы для практического работника здравоохранения ничтожно. К концу 2000 г. в США родилось всего 300 детей, подвергшихся генетическому скринингу. Гораздо более важна проблема, называемая в литературе «правом плода не быть рожденным», связанная с вопросом, что лучше - смерть или жизнь с тяжелыми последствиями, если заранее были определены серьезные генетические нарушения.
В проблеме генетического скрининга существенны фундаментальные моральные проблемы - принцип автономии (любой генетический скрининг должен быть основан на добровольном информированном согласии участников) и конфиденциальности (запрет предоставления полученной информации кому бы то ни было без согласия участников). Эти принципы представляются аксиомами, не подлежащими обсуждению.
Генная терапия
При помощи современных генно-инженерных технологий возможно введение в генетический аппарат соматических клеток больного человека «здоровых» генов вместо «больных». Это дает возможность излечить пациента от ряда наследуемых болезней. Цели такой терапии следует признать нравственными и приемлемыми.
Однако современные генно-инженерные технологии еще не достаточно отработаны и таят в себе ряд опасностей. Например, вызывает сомнение возможность использования в качестве «переносчиков» в соматические клетки различных ретровирусов, аденовирусов и вирусов герпеса. Не решены проблемы обеспечения устойчивой экспрессии новых генов в клетках донора.
Возникают вопросы, не превышает ли риск пользу, справедливо ли распределение ресурсов для генной терапии и т.д.
Можно ожидать, что эти проблемы в недалеком будущем будут решены, так как разрабатываются, в частности, альтернативные технологии доставки «здоровых» генов в соматические клетки (например, с помощью систем направленного транспорта действующих веществ).
Фетальная терапия
Применение материалов эмбрионов, полученных при аборте, с лечебной целью составляет суть фетальной терапии. Ныне фетальная терапия начинает широко использоваться и является платной формой медицинской помощи. В связи с высокой стоимостью этой терапии она недоступна для широких слоев населения и противоречит положениям Конвенции Совета Европы по этой проблеме (запретное извлечение финансовой прибыли).
Статья 21 этой Конвенции постулирует, что тело человека и его части не должны в качестве таковых являться источником получения финансовой выгоды. Это же вытекает и из статьи 47 Основ законодательства РФ «Об охране здоровья граждан». Считается, что за исключением возмещения реальных расходов на получение, хранение, подготовку и транспортировку тканей различные платежи и другие формы вознаграждения и компенсации, связанные с их ведением, должны быть запрещены. С точки зрения биомедицинской этики, большое значение имеет информированное согласие женщины, от которой получают фетальные ткани. Это положение оговорено статьей 1 Закона «О трансплантации органов и (или) тканей
человека» РФ ? 4180-1 «Условия и порядок трансплантации органов и (или) тканей человека»: «Трансплантация органов и /или тканей допускается исключительно с согласия живого донора».
Ряд положений, определяющих использование фетальных тканей, сформулированы в нескольких статьях Конвенции Совета Европы. Например, статья 22 «Возможное использование изъятых частей тела человека» устанавливает, что любая часть человека, изъятая в ходе медицинского вмешательства, может храниться и использоваться в целях, отличных от тех, ради которых она была изъята, только при условии соблюдения надлежащих процедур информирования и получения согласия.
В законодательствах ряда стран имеются более жесткие нормы, чем это место в Конвенции. В Швеции требуется, что женщина не только дала согласие на использование абортивного материала, но и была информирована о предполагаемых манипуляциях и том, как будут использованы извлеченные ткани. В Испании действует норма, что прерывание беременности никогда не должно иметь своей целью донорство и последующее использование эмбриона или плода или их биологической структуры. Такие нормы основаны на предпосылке, что эмбрион имеет такой же моральный статус, как и человеческая личность.
В последние годы фетальные ткани широко используются с косметическими целями и для омоложения. Большинство в гражданском обществе считает это недопустимым. Такая же позиция в данном вопросе и в Русской Православной церкви, она изложена в основах социальной концепции Русской Православной церкви, принятых на Юбилейном Архиерейском Соборе, прошедшем в Москве 13-16 августа 2000 г.
Генетическая паспортизация
Генетическая паспортизация в зависимости от преследуемых целей (например, чтобы опознать человека) может основываться на расшифровке всего нескольких небольших участков хромосомной спирали. Подобные генетические паспорта уже существуют во многих странах мира.
Собранная в банках генетическая информация может быть использована как с позитивными, так и негативными целями. Одним из самых важных может оказаться генетический паспорт, ориентированный на медицинские задачи. Примером может быть ситуация с тяже-
лым наследственным заболеванием крови, связанная с нарушениями синтеза белковых цепей гемоглобина - талассемией. Талассемия особенно распространена в Средиземноморье. Власти Кипра приняли решение о составлении генетического паспорта всех болеющих талассемией. После этого были осуществлены меры по предотвращению браков между болеющими, налажены пренатальная диагностика и своевременное прерывание беременности в случае гомозиготности по бетаталассемическому гену. К настоящему времени в результате осуществления этих мероприятий киприоты практически полностью освободились от гомозиготных случаев талассемии.
Регистр наследственных генетических заболеваний создается и в нашей стране. Выяснилось, что в отдельных регионах отягощенность населения наследственными заболеваниями бывает в 2 раза выше, чем в среднем по России. Но надо понимать, что утечка информации о генетическом диагнозе может иметь негативные последствия для людей. Они могут быть уволены или подвергнуты другой дискриминации. Например, страховые компании могут требовать более высокие страховые взносы или вообще отказаться от страхования таких людей.
В связи с этим во Всеобщей декларации ЮНЕСКО «О геноме человека» в статье 2 записано: «Каждый человек имеет право на уважение его достоинства и его прав вне зависимости от его генетических характеристик». 32-я Сессия Генеральной Конференции ЮНЕСКО приняла в 2003 г. решение, согласно которому во избежание злоупотребления процесс сбора информации о генах населения Земли должен быть поставлен под строгий этический контроль.
Генетически модифицированные продукты
Генетически модифицированные продукты (ГМП) получают из различных растений или живых организмов, в генетический аппарат которых сделаны вставки для придания им определенных полезных свойств. Такие продукты называются трансгенными. Хотя ученые научились вырезать нужный участок гена из одной клетки и вносить в другую клетку еще в 1951 г. (этот год считается годом возникновения генной инженерии), трансгенные продукты начали широко использоваться всего 20 лет назад. Трансгенные растения и животные могут создаваться не только с целью повышения устойчивости к тем или иным заболеваниям или сельскохозяйственным вредителям, но и увеличения урожайности или для продуцирования конкретных веществ.
Сегодня более половины сои является трансгенной, широко используются трансгенная кукуруза, хлопчатник, рапс, картофель, помидоры и т.д. Созданы бактерии со способностью интенсивно синтезировать различные биологически активные вещества. Например, эритропоэтин, интерферон, инсулин и другие лекарственные вещества производятся исключительно трансгенными бактериями и дрожжами, в геном которых включают соответствующий человеческий ген; созданы экспериментальные стада трансгенных кроликов, коз и коров, выделяющих с молоком факторы лечения злокачественных новообразований, атеросклероза и др.
Многие страны, особенно Китай и Индия, ныне просто не могут обойтись без трансгенных продуктов. Однако любое новшество, в том числе и ГМП, имеет своих сторонников и противников.
В области фармации генные технологии позволяют ускорить селекцию в несколько раз и получить уникальные лекарственные растения и продукты животного происхождения.
Таким образом, прогресс генетики обусловил появление перспективных научных направлений, таких как геномика, достижения которой привели к становлению клонирования, включая терапевтическое клонирование, протеомика, генная и фетальная терапия, генетическая паспортизация, получение трансгенных продуцентов пищевых и лекарственных продуктов.
Развитие этих направлений и внедрение их достижений в практику стали причиной конкурентной борьбы как в сфере науки, так и в практической деятельности в обеспечении населения продуктами питания, лекарствами, медицинскими услугами в области средств лечения, профилактики заболеваний, связанных с дефектами генов; повышения качества жизни и долголетия.
Стремление некоторых кругов и даже государств монополизировать достижения современной генетики, в том числе информацию, полученную в результате расшифровки генома человека, рассматривается всеми честными исследователями и специалистами как неправомерное и не подлежащее удовлетворению. Расшифрованный геном человека должен быть поставлен на благо всего человечества.
Как считает ЮНЕСКО, «геном человека лежит в основе изначальной общности всех представителей человеческого рода, а также признания их неотъемлемого достоинства и разнообразия. Геном человека знаменует собой достояние всего человечества». Эта позиция ЮНЕСКО должна быть поддержана всем гражданским обществом и
механизмами формирования морально-нравственных основ современного человечества.
Генетический скрининг, если он проводится с целью устранения тяжелых наследственных заболеваний на основе добровольного информированного согласия, несет в себе благоприятные возможности для отдельного человека и для общества. Поэтому он не противоречит современной концепции биомедицинской этики и может развиваться.
Современные генно-инженерные технологии еще недостаточно отработаны и таят в себе ряд опасностей. В будущем генная терапия может излечить пациента от ряда наследуемых болезней, поэтому ее следует считать приемлемой и отвечающей современной концепции биомедицинской этики.
Морально-нравственные основы фетальной терапии должны основываться на информированном согласии женщины на использование абортивного материала и информировании ее о предполагаемых манипуляциях, а также использовании извлеченных тканей. Использование абортивного материала с косметическими целями большинство гражданского общества считает недопустимым.
Генетическая паспортизация должна быть в основном ориентирована на медицинские задачи, при этом такая информация должна быть защищена во избежание злоупотребления ею. Процесс сбора информации о генах населения Земли должен быть поставлен под строгий этический контроль.
Генетическая модификация продуктов является перспективной областью для получения продуктов питания и лекарственных препаратов. Но и это направление требует выработки и совершенствования морально-нравственных позиций, соответствующих состоянию человечества, а также контроля, включающего такой важный элемент, как непреднамеренное опыление традиционных растений пыльцой генно-инженерных видов, что может привести к непредвиденным последствиям.
Таким образом, современные достижения генетики, в том числе генная инженерия, представляются весьма перспективной областью для фармации. К сожалению, на вузовском этапе системы непрерывного фармацевтического образования эти проблемы пока изучаются недостаточно.