Урология : учебник / Б. К. Комяков. - 2012. - 464 с.: ил.
|
|
|
|
Глава 9. НЕСПЕЦИФИЧЕСКИЕ ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ МОЧЕПОЛОВОЙ СИСТЕМЫ
9.1. ПИЕЛОНЕФРИТ
Пиелонефрит - инфекционно-воспалительное заболевание почек с преимущественным поражением чашечно-лоханочной системы, тубулоинтерстици-альной ткани и последующим вовлечением в процесс клубочкового аппарата.
Эпидемиология. Пиелонефрит - наиболее частое воспалительное заболевание мочевыделительной системы: на его долю приходится 65-70 % случаев. У взрослых пиелонефрит встречается у одного человека из 100, а у детей - у одного из 200. Чаще всего болезнь развивается в возрасте 30-40 лет.
Молодые женщины болеют пиелонефритом чаще, чем мужчины. Это объясняется анатомо-физиологическими особенностями мочеиспускательного канала у женщин. Женская уретра значительно короче, располагается рядом с влагалищем и прямой кишкой, благодаря чему инфекция легче и быстрее проникает через нее в мочевой пузырь, а затем в верхние мочевыводящие пути и почки. В жизни женщины имеются три периода повышенного риска инфицирования мочевых путей. Первый - при рождении, во время прохождения по инфицированным родовым путям матери; второй - при дефлорации и третий - в период беременности.
У мужчин чаще развивается вторичный пиелонефрит, обусловленный аномалиями мочеполовой системы, сужениями мочеточников, МКБ, доброкачественной гиперплазией простаты и др.
Этиология и патогенез. Возбудителями пиелонефрита могут быть эндогенные (внутренние) или экзогенные (проникающие из окружающей среды) микроорганизмы. Наиболее часто встречаются кишечная палочка, протей, стафилококк, энтерококк, синегнойная палочка и клебсиелла. Возможно развитие пиелонефрита при участии вирусов, грибов, микоплазм.
Микроорганизмы проникают в почку тремя путями.
Восходящий, или уриногенный (urina - моча), путь чаще всего встречается у детей. При этом микроорганизмы попадают в почку из нижних мочевых путей с обратным током мочи, то есть при патологическом состоянии, называемом ПМР.
Восходящий путь - по стенке мочеточника в лоханку и почку. Ряд микроорганизмов обладают способностью к адгезии (прилипанию) и продвижению вверх по уротелию при помощи специальных клеточных структур - фимбрий.
Кроме того, инфекционные агенты могут распространяться вверх в результате воспалительных и деструктивных изменений стенки мочеточника.
При локализации первичного воспалительного очага в любом другом органе (коже, миндалинах, носоглотке, легких и др.) микроорганизмы попадают в здоровую почку гематогенным путем, то есть с током крови, и вызывают в ней нарушение микроциркуляции и развитие инфекционно-воспалительного процесса. Предрасполагающими к развитию гематогенного пиелонефрита факторами могут быть: расстройство кровообращения в почке и нарушение оттока мочи. Занесенные кровью микроорганизмы оседают на сосудистых петлях почечных клубочков, приводя к воспалительным изменениям сосудистой стенки, разрушают ее, проникают в просвет почечных канальцев и выводятся с мочой. Вокруг образовавшихся инфекционных тромбов развивается воспалительный процесс.
Наиболее часто пиелонефрит развивается гематогенным и уриногенным путями.
Развитию заболевания способствуют предрасполагающие факторы, которые подразделяют на общие и местные. К общим относятся нарушение состояния иммунной системы организма, стресс, переохлаждение, гиповитаминоз, тяжелая соматическая патология, сахарный диабет. Местными факторами являются нарушение кровоснабжения почки и нарушение уродинамики верхних мочевых путей (аномалии почек и мочевых путей, МКБ, травмы, сужения мочеточников, доброкачественная гиперплазия предстательной железы и др.). В ряде случаев развитию пиелонефрита способствуют различные инструментальные и эндоскопические методы исследования (катетеризация мочевого пузыря, бу-жирование уретры, цистоскопия, стентирование мочеточников).
Классификация. По клиническому течению различают острый, хронический и рецидивирующий пиелонефрит.
По причинам возникновения и состоянию проходимости мочевых путей выделяют первичный (без наличия обструкции) и вторичный (обструктивный) пиелонефрит, который встречается значительно чаще, в 80-85 % случаев.
По количеству пораженных почек пиелонефрит может быть односторонним и двусторонним. Односторонний пиелонефрит встречается значительно чаще.
Также различают анатомо-морфологические формы пиелонефрита: серозный и деструктивный (гнойный): апостематозный пиелонефрит (рис. 57, см. цв. вклейку), карбункул (рис. 58, см. цв. вклейку), абсцесс почки, некротический папиллит.
Иногда встречаются такие редкие формы заболевания, как эмфизематозный пиелонефрит и ксантогранулезный пиелонефрит.
Патологическая анатомия. Морфологически как первичный, так и вторичный острый пиелонефрит могут протекать в виде серозного (чаще) и гнойного (реже) воспалительного процесса.
При остром серозном пиелонефрите почка увеличенная, темно-красная. Вследствие повышения внутрипочечного давления при рассечении фиброзной капсулы паренхима отечна, напряжена, пролабирует через вскрытую капсулу. Гистологически в интерстициальной ткани обнаруживаются периваску-лярные инфильтраты. Для серозного пиелонефрита характерны очаговость и полиморфность поражения: очаги воспалительной инфильтрации чередуются
с участками неизмененной (здоровой) почечной ткани. Отмечается также отек интерстиция со сдавливанием почечных канальцев. В большинстве случаев наблюдаются явления паранефрита с отеком околопочечной клетчатки. При своевременно начатом лечении и благоприятном течении заболевания можно добиться обратного развития воспалительного процесса. В противном случае серозный пиелонефрит переходит в гнойный с более тяжелым клиническим течением.
Острый гнойный пиелонефрит морфологически проявляется в виде гнойничкового (апостематозного) нефрита (рис. 57, см. цв. вклейку), карбункула почки (рис. 58, см. цв. вклейку) или абсцесса. В случае проникновения инфекции урогенным путем наблюдаются значительные изменения в лоханке и чашечках: слизистая оболочка их гиперемирована, полости расширены, в просвете содержится гной. Нередко имеют место некрозы сосочков пирамид - папиллярный некроз. Очаги гнойного воспаления могут сливаться между собой и вести к разрушению пирамид. В дальнейшем в патологический процесс вовлекается и корковое вещество почки с развитием в нем мелких абсцессов (гнойничков) - апостематозного пиелонефрита.
При гематогенном пути распространения инфекции множественные гнойнички величиной от 2 до 5 мм первоначально образуются в корковом, а затем в мозговом веществе почки. Вначале они находятся в интерстиции, затем поражают канальцы и, наконец, клубочки. Гнойнички могут располагаться в виде одиночных мелких абсцессов или носить диссеминированный характер, сливаясь в более крупные воспалительные очаги. При снятии фиброзной капсулы поверхностно расположенные гнойнички вскрываются. На разрезе они видны и в корковом, и в мозговом веществе. Почка увеличена, темно-вишневого цвета, околопочечная клетчатка резко отечна. Изменения в лоханке и чашечках обычно менее выражены, чем при урогенном гнойном пиелонефрите. Сливаясь между собой, мелкие гнойнички образуют более крупный гнойник - соли-тарный абсцесс.
Карбункул почки представляет собой сегментарный ишемический воспалительно-некротический участок почки. Он образуется в результате закрытия кровеносного сосуда септическим тромбом с последующим некрозом и гнойным расплавлением соответствующего сегмента почки (рис. 58, см. цв. вклейку). Внешне он напоминает карбункул кожи, по аналогии с которым и получил свое название. Нередко карбункул почки сочетается с апостематозным пиелонефритом, чаще бывает односторонним или одиночным. Одновременное развитие карбункулов в обеих почках встречается крайне редко. Как и при других формах острого гнойного пиелонефрита, возможно развитие гнойного паранефрита (рис. 59, см. цв. вклейку).
Рассмотренные варианты острого гнойного пиелонефрита представляют собой различные стадии одного и того же гнойно-воспалительного процесса. Микроскопически после стихания активного воспалительного процесса в ин-терстициальной ткани на месте инфильтративных очагов развивается рубцовая ткань. При выздоровлении от острого пиелонефрита сморщивания почки не происходит, поскольку развитие рубцовых изменений вследствие гибели почечной ткани носит не диффузный, а очаговый характер.
9.1.1. Острый пиелонефрит
Симптоматика и клиническое течение. Острый пиелонефрит - это инфек-ционно-воспалительное заболевание, протекающее с яркой симптоматикой. Начальные клинические проявления первичного острого пиелонефрита обычно возникают через несколько дней или недель (в среднем спустя 2-4 недели) после затухания очагов инфекции в других органах (ангины, обострения хронического тонзиллита, мастита, остеомиелита, фурункулеза).
Клиническая картина острого пиелонефрита характеризуется общими и местными симптомами. При первичном гнойном пиелонефрите и гематогенном пути проникновения инфекции более выражены общие симптомы заболевания, а при вторичном пиелонефрите на первый план выступают местные обструктивные симптомы. В типичных случаях характерна триада симптомов: повышение температуры, сопровождающееся ознобом, боли в соответствующей поясничной области и дизурические явления.
Острый пиелонефрит чаще начинается с общих симптомов, обусловленных интоксикацией: головная боль, слабость, общее недомогание, боли в мышцах, суставах, повышение температуры с ознобом и последующим обильным потоотделением. Степень выраженности этих клинических проявлений различна и зависит от тяжести воспалительного процесса в почке.
Гнойный пиелонефрит протекает значительно тяжелее серозного, иногда с быстрым развитием уросепсиса и бактериемического шока. Ознобы бывают потрясающими с последующим повышением температуры до 39-40 °С и выше. Спустя 1-2 часа появляется профузный пот, и температура на короткий срок снижается. Ознобы с резким повышением температуры и обильным потоотделением повторяются ежедневно, несколько раз в сутки. Для гнойного пиелонефрита характерна температура гектического типа с суточными колебаниями до 1-2 °С и более, однако она может оставаться и стойко повышенной. Повторное гектическое повышение температуры через определенные промежутки времени обусловлено появлением новых гнойничков (у больных апостематозным пиелонефритом) или образованием карбункула почки.
Местные симптомы острого пиелонефрита - боли в поясничной области и дизурические явления - имеют различную степень выраженности в зависимости от характера и тяжести заболевания. Боли в поясничной области в той или иной форме присутствуют практически у каждого больного. Они могут быть разными: от выраженных, в виде почечной колики, до ощущения тяжести в зоне, ограниченной треугольником позвоночник-место прикрепления нижнего ребра-условная линия на уровне самой нижней точки изгиба (дуги) ребра. Для этих болей типично отсутствие связи с движением, положением тела, однако они усиливаются при глубоком вдохе, сотрясении тела и при поколачива-нии в зоне почек. Вначале боли в поясничной области или в верхней половине живота имеют неопределенные характер и расположение. Лишь спустя 2-3 дня они локализуются в области правой или левой почки, часто с иррадиацией в соответствующее подреберье, в паховую область, половые органы; усиливаются по ночам, при кашле, движении ногой. У части пациентов в первые дни развития пиелонефрита болевой синдром может быть выражен слабо или вообще
отсутствовать и появиться через 3-5 дней. Отмечается болезненность при по-колачивании по поясничной области - так называемый положительный симптом Пастернацкого. Характерна болезненность и защитное напряжение мышц живота на стороне пораженной почки. Если гнойник локализуется на передней поверхности почки, возможно вовлечение в воспалительный процесс брюшины с развитием перитонеальных симптомов. В таких случаях сильные боли в сочетании с симптомами раздражения брюшины нередко приводят к ошибочному диагнозу острого аппендицита, холецистита, панкреатита, прободной язвы желудка и других острых хирургических заболеваний органов брюшной полости. В данных случаях дифференциальный диагноз особенно затруднен, если дизурические явления и патологические изменения в моче отсутствуют, как это нередко бывает в первые дни заболевания. При учащенном и болезненном мочеиспускании диагностика пиелонефрита упрощается.
Диагностика. Обследование больных пиелонефритом включает сбор жалоб, анамнеза, физикальное обследование, после чего переходят к специальным методам диагностики.
При лабораторном исследовании в анализе крови отмечается выраженный лейкоцитоз (до 30-40 тыс.) со значительным нейтрофильным сдвигом лейкоцитарной формулы влево до юных форм, увеличение СОЭ до 40-80 мм/ч. Однако четкая зависимость изменений со стороны периферической крови от выраженности клинических проявлений наблюдается не всегда: при тяжелом течении заболевания, а также у ослабленных больных лейкоцитоз может быть умеренным, незначительным либо отсутствовать, иногда отмечается лейкопения.
Характерными признаками острого пиелонефрита при исследовании осадка мочи являются протеинурия, лейкоцитурия и значимая (истинная) бактери-урия, особенно если они обнаруживаются одновременно. Ложная протеинурия при воспалительном процессе в почке обусловлена распадом при попадании в мочу форменных элементов крови и в большинстве случаев не превышает 1,0 г/л (от следов до 0,033-1,0 г/л). Она представлена преимущественно альбуминами, реже гаммаглобулинами. Лейкоцитурия (пиурия) - наиболее характерный признак пиелонефрита. Она часто достигает значительной выраженности (лейкоциты покрывают все поле зрения либо обнаруживаются скоплениями) и может отсутствовать лишь при локализации воспалительного процесса только в корковом веществе почки или при обтурации мочеточника. При пиелонефрите может наблюдаться эритроцитурия (микрогематурия), реже - макрогематурия (при некрозе почечных сосочков, калькулезном пиелонефрите). Тяжелое течение заболевания сопровождается цилиндрурией (зернистые и восковидные цилиндры). Бактериурия обнаруживается в большинстве случаев, однако, как и лейкоцитурия, носит интермиттирующий характер, поэтому важны повторные исследования мочи на микрофлору. Для подтверждения пиелонефрита имеет значение лишь наличие истинной бактериурии, подразумевающей присутствие не менее 50-100 тыс. микробных тел в 1 мл мочи.
Посев мочи и определение чувствительности микроорганизмов к антибиотикам производят до начала, в процессе и после окончания лечения больного. При неосложненном остром пиелонефрите контрольный посев мочи выполняют на 4-й день и через 10 дней после окончания терапии антибиотиками, при
осложненном пиелонефрите - соответственно на 5-7-й день и через 4-6 недель. Такое бактериологическое исследование необходимо для выявления устойчивых форм микроорганизмов и коррекции антибиотикотерапии в процессе лечения, а также для определения рецидива инфекции после проведенного курса терапии.
Посев крови с определением чувствительности микрофлоры к антибиотикам показан больным с клинической картиной сепсиса. В целом бактериемия выявляется примерно в 20 % всех случаев острого пиелонефрита.
Повышение уровня креатинина и мочевины в сыворотке является признаком почечной недостаточности. Уровень креатинина и мочевины в сыворотке крови следует определять до проведения исследований с внутривенным введением рентгеноконтрастных препаратов. Повышение содержания в крови мочевины, креатинина как следствие нарушения функции почек возможно при тяжелом гнойном пиелонефрите с выраженной интоксикацией или двустороннем процессе. В данных случаях нередко наблюдается поражение печени и развитие гепаторенального синдрома с нарушением белковообразовательной, дезинтоксикационной, пигментной (с наличием желтухи), протромбинообра-зовательной и других ее функций.
УЗИ почек обладает высокой точностью в выявлении размеров почки, неоднородности ее структуры, деформации чашечно-лоханочной системы, наличия пионефроза и состояния околопочечной жировой клетчатки. Снижение подвижности почки в сочетании с ее увеличением - важнейший ультразвуковой признак острого пиелонефрита, а расширение чашечно-лоханочной системы свидетельствует в пользу обструктивного (вторичного) характера заболевания.
С помощью сонографии обнаруживаются очаговые изменения (как правило, гипоэхогенные участки) в паренхиме почки и в паранефрии, возникающие в результате их гнойного поражения.
Обзорная и экскреторная урография позволяет установить причину и уровень обструкции мочевых путей. В первые 3-4 суток острый пиелонефрит может не сопровождаться лейкоцитурией. В таких случаях особенно затруднена диагностика первичного пиелонефрита, так как признаки нарушения оттока мочи из почки отсутствуют. У таких больных экскреторная урография с выполнением снимков на вдохе и выдохе на одной пленке имеет большую диагностическую ценность: она позволяет выявить ограничение подвижности почки на стороне поражения.
КТ является наиболее современным и информативным диагностическим методом исследования гнойно-воспалительных заболеваний почек. КТ позволяет определить причину и уровень возможной обструкции мочеточника, обнаружить очаги деструкции почечной паренхимы. Диагностическая ценность этого метода обусловлена высокой разрешающей способностью и возможностью четко дифференцировать нормальные ткани от патологически измененных. Результаты КТ облегчают хирургу выбор оптимального доступа для открытого или чрескожного вмешательства, в частности при карбункуле почки или пери-нефральном абсцессе.
При подозрении на ПМР (например, у больных с нейрогенным мочевым пузырем или детей) целесообразно выполнение микционной цистографии.
Дифференциальная диагностика. Острый пиелонефрит необходимо дифференцировать с заболеваниями, протекающими с симптомами общей интоксикации, высокой температурой тела, тяжелым общим состоянием. Может наблюдаться картина острого живота с перитонеальными симптомами и локальными болями, симулирующими острый аппендицит, холецистит, панкреатит, прободную язву желудка и двенадцатиперстной кишки и другие острые заболевания органов брюшной полости. Острый пиелонефрит, сопровождаемый сильной головной болью и менингеальными симптомами, иногда ошибочно расценивается как острое инфекционное заболевание (сыпной и брюшной тиф, паратифы, менингококковая инфекция и др.), что нередко дает повод к ошибочной госпитализации таких больных в инфекционную больницу. При латентном течении острого пиелонефрита возникают трудности в дифференциальной диагностике с острым или хроническим гломерулонефритом, проявляющимся только изолированным мочевым синдромом.
Лечение. Острый пиелонефрит требует лечения в условиях стационара. При выявлении обструктивного характера заболевания в первую очередь необходимо обеспечить адекватный отток мочи из пораженной почки. Восстановить проходимость мочеточника можно путем его катетеризации (рис. 21, см. цв. вклейку) или стентирования (рис. 22, см. цв. вклейку). При невозможности проведения катетера по мочеточнику выше места его обструкции следует выполнить чрескожную пункционную нефростомию. Дальнейшее лечение заключается в назначении антибактериальной и симптоматической терапии, соблюдении постельного режима, применении нестероидных противовоспалительных препаратов и употреблении большого количества жидкости.
Эмпирическая антибактериальная терапия должна включать парентеральное введение препаратов широкого спектра действия, преимущественно влияющих на грамотрицательную флору (фторхинолоны, цефалоспорины, аминогликозиды). В дальнейшем производится коррекция лечения с учетом результатов посевов мочи и определения чувствительности возбудителя к антибиотикам. Курс лечения для острого неосложненного пиелонефрита составляет 7-14 дней.
Хинолоны и фторхинолоны. Препараты данной группы нашли широкое применение в лечении инфекций почек и мочевых путей. Нефторированные хи-нолоны (пипемидовая, оксолиновая, налидиксовая кислоты) обладают более низкой микробиологической активностью по сравнению с фторхинолонами, что ограничивает их применение. Наиболее рациональными для эмпирической терапии пиелонефрита являются современные фторированные хиноло-ны: левофлоксацин (по 500 мг 1 раз в день), ципрофлоксацин (по 500 мг 2 раза в день), офлоксацин (по 200 мг 2 раза в день) и др. Они характеризуются широким антимикробным спектром и высокой активностью в отношении основных возбудителей пиелонефрита. Фторхинолоны обладают хорошей биодоступностью, обеспечивают высокие бактерицидные концентрации в моче и в паренхиме почек.
Цефалоспорины - один из наиболее обширных классов антибиотиков, характеризующихся высокой эффективностью и низкой токсичностью. При не-осложненном пиелонефрите легкого течения достаточно применять перораль-ные формы цефалоспоринов: цефуроксим аксетил (по 500 мг 2 раза в день),
цефиксим (по 400 мг 1 раз в день). Для терапии осложненных инфекций мочевых путей используют парентеральные формы (цефуроксим, цефотаксим, це-фепим, цефтриаксон).
Аминогликозиды (гентамицин, амикацин, неомицин, тобрамицин) активны в отношении большинства возбудителей пиелонефрита, однако в клинической практике их следует использовать с осторожностью, как правило, в условиях стационара. Препараты данной группы обладают потенциальной ото- и нефро-токсичностью.
Карбапенемы (имипенем, меропенем) рассматриваются как препараты резерва при неэффективности антибиотиков первой линии.
Одним из важных компонентов лечения является терапия, направленная на повышение иммунитета и улучшение общего состояния организма. Среди им-муномодуляторов применяют вобэнзим, лавомакс, препараты эхинацеи (имму-нал и др.).
Комплексное лечение как острого, так и хронического пиелонефрита включает назначение фитоуросептиков, оказывающих мочегонное, антибактериальное, противовоспалительное, вяжущее и тонизирующее действие (лист брусники, толокнянки, трава зверобоя, почечный чай, почки березы, ягоды можжевельника и др.).
Как правило, острый пиелонефрит при своевременно начатом лечении протекает благоприятно. Через 3-5 дней снижается температура, уменьшаются проявления интоксикации и боли в поясничной области, улучшается картина крови. В течение 7-10 дней бактериурия и лейкоцитурия практически ликвидируются. Абсолютное выздоровление наступает через 3-4 недели.
Прогноз. Острый серозный пиелонефрит в большинстве случаев заканчивается выздоровлением. Успешность лечения определяется своевременно назначенной антибактериальной терапией и обеспечением адекватного оттока мочи из почки при обструктивной форме заболевания. Препятствуют окончательному выздоровлению и способствуют переходу острого пиелонефрита в хронический поздно начатое, недостаточно активное и преждевременно оконченное лечение; резистентность микрофлоры к противомикробным препаратам; наличие тяжелой сопутствующей патологии, ослабляющей защитные силы организма, и др. В таких случаях пиелонефрит приобретает хроническое течение с последующим развитием хронической почечной недостаточности. При гнойных формах заболевания прогноз неблагоприятный и зависит от своевременности выполненного оперативного вмешательства.
После излечения острого пиелонефрита необходимы диспансерное наблюдение и назначение при необходимости противорецидивного лечения. Это связано с опасностью перехода заболевания в хроническую форму, что наблюдается в 20-25 % случаев.
9.1.2. Хронический пиелонефрит
В большинстве случаев является следствием перенесенного острого пиелонефрита. Основными причинами перехода заболевания в хроническую форму являются:
■ неадекватное и несвоевременное лечение острого пиелонефрита;
■ нарушение оттока мочи из полостной системы почки при МКБ, стриктурах мочеточника, ПМР, доброкачественной гиперплазии предстательной железы, нефроптозе и др.;
■ переход бактерий в L-формы, которые могут длительное время находиться в неактивном состоянии в почечной ткани, а при снижении иммунитета переходить в исходное состояние, вызывая обострение воспалительного процесса;
■ общие сопутствующие заболевания, вызывающие ослабление организма, - сахарный диабет, ожирение, болезни желудочно-кишечного тракта и др.;
■ иммунодефицитные состояния.
Нередки случаи возникновения хронического пиелонефрита в детском возрасте (особенно у девочек). Типичным вариантом является манифестация с острой формы заболевания, которая по различным причинам полностью не излечивается, а приобретает латентное течение. В дальнейшем различные острые воспалительные заболевания могут стать причиной обострения пиелонефрита с типичной клинической картиной. Со временем его течение приобретает волнообразный характер. Таким образом, длительно существующий хронический пиелонефрит с периодическими обострениями каждый раз вовлекает в патологический процесс все новые и новые участки почечной паренхимы. В результате каждая пораженная область впоследствии замещается рубцовой тканью. Возникают деформация паренхимы и чашечно-лоханочной системы почки, уменьшение размеров (сморщивание) органа с развитием функциональной недостаточности.
Симптоматика и клиническое течение. В зависимости от активности воспалительного процесса выделяют следующие фазы течения хронического пиелонефрита.
1. Активная фаза. Клиническая картина, как при остром пиелонефрите. В моче обнаруживают лейкоциты, бактерии, в анализе крови - признаки воспалительного процесса в организме, повышение СОЭ. При лечении хронического пиелонефрита, а иногда и без него острая фаза переходит в следующую - латентную.
2. Латентная фаза. Клинические проявления скудные или отсутствуют. Могут наблюдаться общие симптомы в виде слабости, субфебрилитета, быстрой утомляемости, снижения работоспособности, ухудшения аппетита, неприятного привкуса во рту, дискомфортных ощущений в поясничной области, то есть симптоматика, характерная для вялотекущего инфекционно-воспалитель-ного процесса, когда присутствуют минимальные признаки интоксикации.
3. Фаза ремиссии означает клиническое выздоровление и подразумевает отсутствие каких-либо проявлений заболевания.
Клиническое течение хронического пиелонефрита зависит от многих факторов, в том числе от локализации в одной или обеих почках, распространенности воспалительного процесса, наличия или отсутствия препятствия оттоку мочи, эффективности предшествующего лечения, характера сопутствующих заболеваний. Наибольшие диагностические трудности представляет хронический пиелонефрит в латентной фазе или в период ремиссии. У таких пациентов
боли в области поясницы незначительные и непостоянные, ноющего или тянущего характера. Дизурические явления в большинстве случаев отсутствуют либо отмечаются изредка и мало выражены. Температура тела нормальная или субфебрильная.
Длительное течение хронического пиелонефрита приводит к рубцеванию почечной ткани и развитию хронической почечной недостаточности. Больные жалуются на повышенную утомляемость, снижение работоспособности, потерю аппетита, похудение, вялость, сонливость, периодические головные боли. Позже присоединяются диспептические явления, сухость и шелушение кожных покровов. Кожа приобретает своеобразный серовато-желтый цвет с землистым оттенком. Лицо одутловатое, с постоянной пастозностью век; язык сухой, обложен грязно-коричневым налетом, слизистая губ и рта сухая и грубая. У 40-70 % больных хроническим пиелонефритом по мере прогрессирования заболевания с исходом в сморщивание почек развивается симптоматическая артериальная гипертензия. Примерно у 20-25 % больных она имеется уже в начальной стадии заболевания. Гипотензивная терапия при отсутствии этиотропного лечения малоэффективна.
Для поздних стадий хронического пиелонефрита характерна полиурия с выделением в течение суток до 2-3 л и более мочи. Описаны случаи полиурии, достигающей 5-7 л в сутки, что может привести к развитию гипокалиемии, гипона-триемии и гипохлоремии. Полиурия сопровождается поллакиурией и никтурией, гипостенурией. Как следствие полиурии появляются жажда и сухость во рту.
Диагностика. Клинические и лабораторные признаки хронического пиелонефрита наиболее выражены в фазе обострения и незначительны в латентной фазе и в период ремиссии. Обострение заболевания может напоминать острый пиелонефрит и сопровождаться аналогичной клинической картиной с соответствующими лабораторными данными.
Протеинурия и лейкоцитурия могут быть незначительны и непостоянны. Концентрация белка в моче колеблется от следов до 0,033-0,099 г/л. Количество лейкоцитов при повторных анализах мочи не превышает нормы, либо достигает 6-8, реже 10-15 в поле зрения. Активные лейкоциты и бактериурия в большинстве случаев не выявляются. Нередко отмечаются незначительная или умеренная анемия, небольшое увеличение СОЭ.
Сонографическими признаками хронического пиелонефрита являются уменьшение размеров почки, деформация ее контуров и чашечно-лоханочной системы, что свидетельствует о сморщивании органа.
Один из основных методов диагностики хронического пиелонефрита - экскреторная урография. Рентгенологическая картина отличается полиморфизмом. Характерными для данного заболевания рентгенологическими признаками являются снижение тонуса чашечек, лоханки и верхней трети мочеточника в виде умеренного их расширения, появление симптома края поясничной мышцы (в месте соприкосновения лоханки и мочеточника с краем m. psoas наблюдается ровное уплощение их контура). Со временем развиваются различные деформации чашечек: они приобретают грибовидную, булавовидную форму, смещаются, шейки их удлиняются и суживаются, сосочки сглаживаются. Примерно у 30 % больных хроническим пиелонефритом наблюдается симптом Ходсона.
Сущность его заключается в том, что, если на экскреторной урограмме соединить чашечки пиелонефритически измененной почки, получится резко извилистая линия, которая в норме должна быть равномерно выпуклой, параллельной наружному контуру почки. Заболевание сопровождается постепенным уменьшением функционирующей паренхимы почки, что можно определить с помощью ренально-кортикального индекса - отношения площади чашечно-лоханочной системы к площади почки.
Почечная артериография не является основным методом диагностики хронического пиелонефрита, однако позволяет оценить архитектонику и особенности кровоснабжения пораженной почки. Характерный признак заболевания - уменьшение числа или даже полное исчезновение мелких сегментарных артерий (симптом обгорелого дерева.)
Радиоизотопная диагностика у пациентов с хроническим пиелонефритом позволяет определить количество функционирующей почечной паренхимы, изучить раздельную функцию почек. С помощью статической и динамической сцинтиграфии оценивают размеры почки, характер накопления и распределения в ней препарата. При сегментарном поражении органа сцинтиграфия выявляет задержку транспорта гиппурана в зоне рубцово-склеротических изменений. Метод позволяет также осуществлять динамический контроль восстановления функции почки в процессе лечения.
Дифференциальная диагностика. Хронический пиелонефрит необходимо дифференцировать прежде всего с хроническим гломерулонефритом, амилоидозом почек, диабетическим гломерулосклерозом и гипертонической болезнью.
Лечение. Хронический пиелонефрит может принимать форму часто рецидивирующего заболевания. В таком случае показан длительный прием антибактериальных препаратов в адекватных дозах. При назначении такой терапии необходимо учитывать возможность возникновения резистентных штаммов микроорганизмов, аллергические реакции и индивидуальную непереносимость препаратов.
Причиной постоянного рецидивирования инфекции и перехода заболевания в хроническую форму может быть нарушение адекватного пассажа мочи по мочевому тракту. Нередко хронический пиелонефрит наблюдается у больных с ПМР, сужениями мочеточников различного генеза, МКБ, обструкцией шейки мочевого пузыря, доброкачественной гиперплазией предстательной железы и др. Невозможно купировать инфекционный процесс без восстановления нормального оттока мочи из почек.
Достигнуть высокой концентрации антибиотиков в почечной ткани достаточно сложно, что объясняет частое рецидивирование хронического пиелонефрита, несмотря на длительно проводимое лечение. Необходимо назначение антибактериальных препаратов, избирательно накапливающихся в почечной ткани с последующей высокой концентрацией их в моче. Выбор и чередование антибиотиков следует производить с учетом регулярных посевов мочи с целью контроля эффективности лечения и подтверждения отсутствия рецидива инфекции. В случае реинфекции требуется коррекция терапии с периодическим назначением соответствующих препаратов на продолжительное время, порой достигающее сроков от 1 до 3 лет. Если моча остается стерильной после первого
3-6-месячного курса и в течение полугода после прекращения лечения, посев мочи производится каждые 3-6 месяцев в течение следующего года, а затем ежегодно.
Санаторно-курортное лечение является востребованным в комплексной терапии хронического пиелонефрита. Предпочтительны курорты Кисловодск, Железноводск, Трускавец, Джермук, Саирме. Лечебные минеральные питьевые воды должны иметь противовоспалительный эффект, оказывать диуретическое действие, улучшая почечный кровоток и фильтрацию мочи. Питьевые воды некоторых источников уменьшают спазм гладкой мускулатуры почечной лоханки и мочеточника. Состав минеральных вод различных источников неоднороден. Лечебные воды Славянского, Смирновского и Лермонтовского источников являются гидрокарбонатно-сульфатно-натриево-кальциевыми, чем и обусловлено их противовоспалительное действие. Нафтуся (Трускавец) - гидро-карбонатно-кальциево-магниевая минеральная вода с большим содержанием нафталановых веществ - оказывает противовоспалительное действие. На курорте Трускавец прием минеральной воды нередко сочетают с аппликациями озокерита и другими методами физического лечения. Противопоказаниями к санаторно-курортному лечению являются общие (сердечно-сосудистая и сердечно-легочная недостаточность, онкологические заболевания и др.) и местные (нарушение оттока мочи, требующее хирургического лечения, хроническая почечная недостаточность и пиелонефрит в активной фазе) факторы.
Прогноз при хроническом пиелонефрите благоприятный, если своевременно устранена причина, поддерживающая воспалительный процесс (санация хронических очагов инфекции, устранение обструкции мочевыводящих путей, ПМР). Длительное течение хронического пиелонефрита с частыми обострениями инфекционно-воспалительного процесса приводит к рубцовому сморщиванию почек, развитию артериальной гипертензии и хронической почечной недостаточности.
9.1.3. Пиелонефрит беременных
Пиелонефрит при беременности выделен в отдельную нозологическую группу и характеризуется как инфекционно-воспалительный процесс почечной паренхимы и чашечно-лоханочной системы, который развивается на фоне беременности. В той или иной степени заболевание встречается у 1-10 % беременных женщин.
Этиология и патогенез. Этиологическим фактором являются микроорганизмы, проникающие в почку как уриногенным, восходящим, так и гематогенным путем при наличии очагов инфекции. Механизм развития пиелонефрита во время беременности обусловлен сдавливанием мочеточников увеличенной в размерах маткой. Уростазу способствуют изменения гормонального фона, снижение тонуса симпатической нервной системы, гипокальциемия. С 10-й по 30-ю неделю беременности снижаются мышечный тонус и сократимость мочеточников, происходит повышение фильтрации и уменьшение реабсорбции воды, образование большего количества суточной мочи, что также способствует развитию гидроуретеронефроза. Вышеуказанные изменения создают благоприятные
условия для развития инфекции в почке. Как правило, выявляются кишечная палочка, протей, клебсиелла, энтеробактерии и др. Чаще поражается правая почка, а заболевание может носить как односторонний, так и двусторонний характер.
Симптоматика и клиническое течение. Если воспалительный процесс слабо выражен, клиническая картина остается скудной. Могут наблюдаться ноющие боли в поясничной области, патологические изменения в моче. При активном воспалении клинические проявления идентичны острому пиелонефриту.
Диагностика. В анализах мочи отмечаются лейкоцитурия, бактериурия. Обязательно проведение культурального исследования мочи. Ультразвуковое сканирование позволяет выявить расширение мочеточника и чашечно-лоха-ночной системы почки, утолщение паренхимы, обусловленное ее отеком.
Лечение проводится совместно с акушерами-гинекологами. Рекомендуется госпитализация в специализированное учреждение. При выраженном расширении полостной системы почки выполняется стентирование мочеточника или перкутанная нефростомия. Установка стента, как правило, несложна и проводится в положении больной на спине, что немаловажно во время беременности. Рекомендовано использование стента с антирефлюкс-ным механизмом.
Антибактериальная терапия во время беременности сопряжена с риском эмбриотоксического и тератогенного действия антибиотиков, особенно фтор-хинолонового и цефалоспоринового ряда. Поэтому чаще всего в лечении пиелонефрита беременных применяются полусинтетические пенициллины. В тяжелых случаях возможно назначение цефалоспоринов. При наличии деструктивных форм пиелонефрита показаны люмботомия, декапсуляции почки и нефростомия.
В целях профилактики во время планирования беременности рекомендуется проведение санации всех возможных очагов инфекции (лечение кариеса, отита и др.). Половые контакты во время беременности рекомендуются при пустом мочевом пузыре и с обязательным использованием барьерных средств контрацепции.
Прогноз в большинстве случаев благоприятный.
9.1.4. Пионефроз
Пионефроз, или гнойная почка - это конечная стадия обструктивного хронического пиелонефрита (инфицированного гидронефроза).
Этиология и патогенез. Вследствие гнойно-деструктивного процесса ткань почки полностью расплавляется, орган состоит из очагов гнойного детрита, полостей, заполненных мочой, и участков распадающейся паренхимы. Воспалительный процесс, как правило, переходит и на окружающую жировую клетчатку.
Симптоматика и клиническое течение. Пионефроз проявляется тупыми ноющими болями в поясничной области. Они могут значительно усиливаться во время обострения воспалительного процесса. Увеличенная в размерах поч-
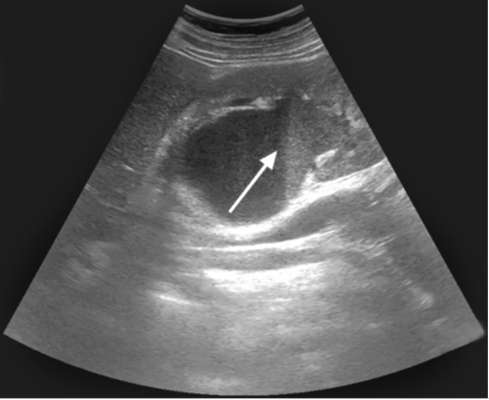
Рис. 9.1. Сонограмма. Пионефроз: определяется уровень гнойной мочи в расширенной полостной системе почки (стрелка)
ка прощупывается через переднюю брюшную стенку. Если мочеточник полностью окклюзирован, говорят о закрытом пионефрозе. Течение заболевания приобретает тяжелый септический характер: у пациента наблюдается гектическая температура тела, озноб,признаки интоксикации - бледность, слабость, потливость. При открытом пионефрозе проходимость мочеточника частично сохранена, что обеспечивает дренирование гнойного содержимого. В таких случаях течение пионефроза менее тяжелое. При двустороннем процессе быстро развивается и прогрессирует хроническая почечная недостаточность.
Диагностика. В лабораторных анализах присутствуют характерные воспалительные изменения. В анализе крови наблюдаются выраженный лейкоцитоз со сдвигом лейкоцитарной формулы влево, повышение СОЭ. У больных с открытым пионефрозом моча гнойная, мутная, с большим количеством хлопьев и осадка. При закрытом пионефрозе на фоне тяжелой септической картины изменения в моче могут отсутствовать.
При цистоскопии наблюдается выделение гноя из устья пораженного мочеточника.
УЗИ позволяет выявить значительно увеличенную в размерах почку с истончением паренхимы. Характерны резкое расширение и деформация полостной системы органа, наличие в просвете неоднородной взвеси, детрита, конкрементов (рис. 9.1).
На обзорной рентгенограмме могут определяться тени конкрементов в про-
екции мочевых путей, увеличенная в размерах почка.
На экскреторных урограммах выделение контрастного вещества больной почкой резко замедленно или, чаще, отсутствует.
КТ выявляет значительно увеличенную почку, паренхима которой истончена или представляет собой рубцовую пиогенную капсулу. Полостная система почки расширена, деформирована и представляет собой единую разделенную перегородками полость, содержащую жидкость неоднородного состава
(рис. 9.2).
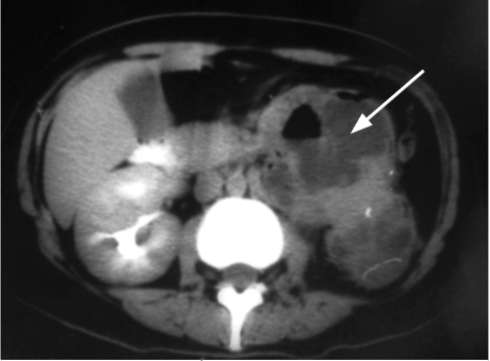
Рис. 9.2. КТ с контрастированием, аксиальная проекция. Определяется левосторонний пионефроз больших размеров (стрелка)
Дифференциальную диагностику пионефроза проводят с нагноившейся кистой, туберкулезом и опухолью почки.
Лечение пионефроза исключительно оперативное и заключается в зависимости от уровня обструкции мочеточника в нефрэктомии или нефруретерэктомии.
Прогноз при одностороннем пионефрозе и своевременном оперативном лечении благоприятный. После операции больной должен находиться под диспансерным наблюдением врача-уролога.
9.2. ПАРАНЕФРИТ
Паранефрит - инфекционно-воспалительный процесс в околопочечной жировой клетчатке.
Эпидемиология. Паранефрит встречается относительно редко. Наиболее частым фактором риска развития паранефрита являются МКБ с обструкцией мочевых путей и гнойные формы пиелонефрита (рис. 59, см. цв. вклейку). У лиц, страдающих паранефритом, мочевые камни обнаруживаются в 20-60 % случаев. К другим факторам риска относят врожденные и приобретенные аномалии мочевой системы, перенесенные операции и травмы мочевых путей, а также сахарный диабет.
Этиология и патогенез. Паранефрит вызывается стафилококком, кишечной палочкой, протеем, синегнойной палочкой, клебсиеллой и другими видами микроорганизмов.
Различают первичный и вторичный паранефрит. Первичный возникает в результате инфицирования паранефральной клетчатки гематогенным путем из отдаленных очагов гнойного воспаления в организме (панариций, фурункул, остеомиелит, пульпит, ангина и др.). Его развитию способствуют травма поясничной области, переохлаждение и другие экзогенные факторы. Вторичный паранефрит встречается в 80 % случаев. Он развивается как осложнение гнойно-воспалительного процесса в почке: в одних случаях при непосредственном распространении гноя из очага воспаления (карбункул почки, абсцесс, пионефроз) на паранефральную клетчатку, в других (при пиелонефрите) - по лимфатическим путям и гематогенно.
Классификация. В зависимости от локализации гнойно-воспалительного очага в паранефральной клетчатке выделяют передний, задний, верхний, нижний и тотальный паранефрит. Чаще всего наблюдается задний паранефрит вследствие большего развития жировой клетчатки по задней поверхности почки. Поражение может быть односторонним или двусторонним. Воспалительный процесс развивается быстро, поскольку околопочечная клетчатка является благоприятной средой для развития инфекции.
По характеру воспалительного процесса различают острый и хронический паранефрит.
Острый паранефрит проходит вначале стадию экссудативного воспаления, которое может подвергнуться обратному развитию или перейти в гнойную форму. Если гнойный процесс в паранефральной клетчатке имеет тенденцию к распространению, обычно расплавляются межфасциальные перегородки и гной
устремляется в места поясничной области, имеющие наименьшее сопротивление. При дальнейшем развитии процесса он выходит за пределы паранефраль-ной клетчатки, образуя флегмону забрюшинного пространства. Последняя может прорваться в кишку, брюшную или плевральную полости, в мочевой пузырь или под кожу паховой области, распространяясь по поясничной мышце, а через запирательное отверстие - на внутреннюю поверхность бедра. В последние годы в связи с широким применением антибиотиков паранефрит, особенно его распространенные гнойные формы, встречается гораздо реже.
Хронический паранефрит чаще всего возникает как осложнение хронического калькулезного пиелонефрита либо как исход острого паранефрита. Он нередко является следствием оперативных вмешательств на почке (в результате попадания мочи в паранефральную клетчатку), травматических повреждений почки с развитием урогематомы. Хронический паранефрит протекает по типу продуктивного воспаления с замещением паранефральной клетчатки соединительной тканью («панцирный» паранефрит) или фиброзно-липоматозной тканью. Почка оказывается замурованной в инфильтрате деревянистой плотности и значительной толщины, что сильно затрудняет оперативное вмешательство.
Симптоматика и клиническое течение. Острый паранефрит в начальной стадии заболевания не имеет характерных симптомов и начинается с повышения температуры тела до 39-40 °С, озноба, недомогания. Лишь через трое-четверо суток и более появляются локальные признаки в виде болей в поясничной области различной интенсивности, болезненности при пальпации в костовер-тебральном углу с соответствующей стороны. Несколько позже обнаруживают искривление поясничного отдела позвоночника за счет защитного сокращения m. psoas, характерное положение больного с приведенным к животу бедром и резкую болезненность при его разгибании за счет вовлечения в процесс поясничной мышцы. Обращают внимание на пастозность кожи, местную гиперемию, более высокий лейкоцитоз крови, взятой из поясничной области на стороне заболевания. Получение гноя при пункции паранефральной клетчатки служит убедительным подтверждением гнойного паранефрита, однако отрицательный результат исследования не исключает его. Иногда паранефрит может имитировать аппендицит, абсцесс поддиафрагмального пространства, пневмонию.
Диагностика. Анализ крови обнаруживает нейтрофильный лейкоцитоз со сдвигом формулы влево. Иногда при стертых формах паранефрита диагностическую ценность имеет подсчет лейкоцитов в крови, взятой из трех точек (из пальца, поясничной области справа и слева).
Моча при первичном паранефрите не изменена; при вторичном в ней обнаруживаются изменения, характерные для вызвавшего его почечного заболевания (как правило, пиурия).
Существенную помощь в распознавании острого паранефрита оказывают рентгенологические методы исследования. При рентгеноскопии грудной клетки при верхних паранефритах выявляется понижение подвижности соответствующего купола диафрагмы, а нередко и выпот в плевральной полости. На обзорной рентгенограмме мочевыводящих путей определяется сколиоз позвоночника в здоровую сторону. Контуры m. psoas с пораженной стороны сглажены или отсутствуют, тогда как со здоровой стороны они хорошо заметны.
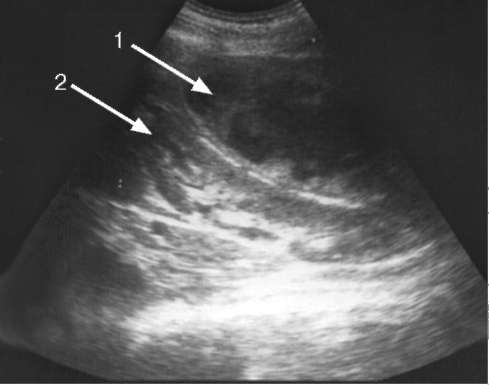
Рис. 9.3. Сонограмма:
1 - паранефрит; 2 - почка
Экскреторная урография, произведенная на вдохе и выдохе, позволяет выявить отсутствие или резкое ограничение подвижности пораженной почки. Ультразвуковое сканирование при остром гнойном паранефрите отчетливо визуализирует очаг гнойного расплавления жировой клетчатки, а при хроническом - ее неоднородную эхоструктуру (рис. 9.3).
Более точные сведения могут быть получены при использовании МРТ или мультиспиральной КТ.
Хронический паранефрит диагностируется с помощью тех же ме-
тодов, что и острая форма, но обнаружить его значительно сложнее. Поэтому длительное время заболевание может оставаться нераспознанным.
Дифференциальная диагностика. Проводится с натечным гнойником при туберкулезе позвоночника, когда при обзорной рентгенографии обнаруживается деструкция одного или нескольких позвонков при отсутствии температурной реакции. Плотное, бугристое опухолевидное образование, пальпируемое в поясничной области при хроническом паранефрите, следует дифференцировать с дистопией, опухолью почки, гидронефрозом и др.
Лечение. В ранней стадии острого паранефрита применение антибактериальной (фторхинолоны, цефалоспорины, защищенные пенициллины) и дезин-токсикационной терапии позволяет добиться выздоровления у большинства больных без хирургического вмешательства. Обязательно производят санацию других очагов инфекции и назначают препараты для повышения иммунной защиты организма. Гнойные формы заболевания являются показанием к экстренной операции. При изолированном абсцессе забрюшинной клетчатки возможна его пункция с эвакуацией содержимого и дренированием. Люмботомия с санацией забрюшинного пространства показана при более распространенном процессе, в том числе и для выполнения операции на почке по поводу вызвавшего паранефрит заболевания.
Лечение хронического паранефрита включает назначение антибиотиков в сочетании с физиотерапевтическими процедурами, общеукрепляющими средствами и рассасывающей терапией.
Прогноз благоприятный при своевременном и адекватном лечении заболевания. При хроническом паранефрите прогноз во многом определяется характером основного заболевания.
9.3. УРОСЕПСИС
Уросепсис представляет собой самое грозное осложнение воспалительных заболеваний мочеполовой системы и характеризуется генерализацией инфекции с развитием септикопиемии, бактериемического шока и высоким риском
летального исхода. Уросепсис может быть следствием острого пиелонефрита, эпидидимита, гнойного простатита.
Этиология и патогенез. Механизм развития уросепсиса в первую очередь связан с наличием обструкции мочевых путей. В результате происходит повышение внутрилоханочного давления с развитием лоханочно-почечных рефлюксов и проникновением вирулентных микроорганизмов в кровеносные сосуды. Попадание мочевой инфекции в ток крови возможно также при грубой, травматичной катетеризации мочевого пузыря, при инструментальных исследованиях (уретроцистоскопия), при проведении ретроградной уретеропиелографии, эндоскопических оперативных вмешательств.
Классификация. Выделяют следующие клинические формы уросепсиса: острая, подострая, хроническая и бактериемический (эндотоксический) шок.
Симптоматика и клиническое течение уросепсиса соответствуют тому или иному воспалительному заболеванию, которое привело к развитию уросепсиса. Как правило, это высокая температура тела, потрясающие ознобы, слабость, головная боль и другие признаки интоксикации. Кожные покровы бледные, могут иметь место петехиальные геморрагические высыпания. Возможна спутанность сознания.
При исследовании крови определяется лейкоцитоз с выраженным сдвигом формулы влево, повышение СОЭ. Моча гнойная. Обязательно бактериологическое исследование крови, которое подтверждает диагноз.
Самым частым клиническим проявлением уросепсиса является бактериеми-ческий шок. Механизм его развития обусловлен выбросом в кровоток большого количества бактерий из очага мочевой инфекции. Образующиеся в результате их распада эндотоксины воздействуют на сосудистую стенку, значительно увеличивая просвет сосудистого русла и нарушая микроциркуляцию в органах и тканях.
Различают следующие стадии бактериемического шока: ранняя, стадия клинических проявлений и терминальная. Для ранней стадии характерен резкий и внезапный подъем температуры тела до высоких цифр, озноб, уменьшение количества мочи. У пациентов отмечаются снижение артериального давления, тахикардия, холодный пот. Далее состояние больного усугубляется: появляются заторможенность, нарушение сознания. В этой стадии наблюдается некоторое снижение температуры тела. В третьей стадии в организме развиваются необратимые изменения.
Диагностика. Обследование больных уросепсисом начинают с выявления вызвавшего его урологического заболевания. УЗИ, экскреторная урография и КТ являются наиболее информативными методами диагностики гнойно-воспалительных заболеваний мочеполовых органов. Окончательный диагноз сепсиса устанавливают после трехкратного бактериологического посева крови и исследования крови на прокальцитонин.
Лечение заключается в проведении неотложных реанимационных мероприятий с последующим экстренным оперативным вмешательством. В зависимости от тяжести состояния может быть выполнена чрескожная пункционная или открытая нефростомия или нефрэктомия.
Прогноз и профилактика. Прогноз при адекватном лечении и диспансерном наблюдении благоприятный. Меры профилактики уросепсиса заключаются
в своевременном и тщательном лечении больных с острыми воспалительными заболеваниями мочеполовых органов, своевременном устранении причин, препятствующих нормальному оттоку мочи из почки, санации хронических очагов инфекции.
9.4. ЗАБРЮШИННЫЙ ФИБРОЗ (БОЛЕЗНЬ ОРМОНДА)
Впервые ретроперитонеальный, или забрюшинный, фиброз был описан в 1948 году Ормондом. Почти всегда заболевание носит двусторонний характер. Прогрессирующий рубцовый фиброз забрюшинной клетчатки приводит к сдавливанию мочеточников на любом участке от пиелоуретерального сегмента до промонториума. Наиболее частая локализация ретроперитонеального фиброза - уровень IV и V поясничного позвонков. Иногда в воспалительный процесс вовлекаются нижняя полая вена и аорта.
Этиология и патогенез. Болезнь Ормонда - неспецифический воспалительный процесс в забрюшинной клетчатке с образованием плотной фиброзной ткани. Причины развития этой болезни еще не до конца изучены. Существует несколько теорий ее развития.
Согласно воспалительной теории, самостоятельного поражения забрюшин-ной клетчатки не бывает и ретроперитонеальный фиброз возникает вторично, вследствие перехода инфекционно-воспалительного процесса из почечной паренхимы (пиелонефрит) или околопочечной клетчатки (паранефрит), женских половых органов (кольпит, эндометрит), желудочно-кишечного тракта (панкреатит, холецистит, колит).
В соответствии с травматической теорией пусковым механизмом развития болезни Ормонда является травматическое повреждение органов забрюшинно-го пространства.
Иммуноаллергическая теория подразумевает, что неспецифическое воспаление в забрюшинной клетчатке с образованием плотной фиброзной ткани возникает в результате аутоиммунной реакции.
Патологическая анатомия. Различают три фазы неспецифического воспаления забрюшинной клетчатки. Для первой характерна эозинофильная, лимфо-цитарная и гистиоцитарная инфильтрация тканей. Во второй фазе образуются соединительнотканные фиброзные изменения с постепенным коллагенозом. Склероз и сморщивание забрюшинной клетчатки с образованием плотной фиброзной ткани наблюдаются в третьей фазе болезни Ормонда.
Симптоматика и клиническое течение. Пациенты жалуются на тупые, ноющие боли в поясничной области, в соответствующем фланге живота. Клиническая картина характерна для гидронефроза. В 80 % случаев имеет место артериальная гипертензия. При прогрессировании двустороннего гидронефроза в результате обструкции мочеточников развивается хроническая почечная недостаточность.
Диагностика. Обследование включает общие анализы крови, мочи, определение биохимических показателей (мочевины, креатинина, электролитов). Выполняют УЗИ, обзорную и экскреторную урографию, КТ и МРТ. При помощи
этих исследований можно выявить признаки фиброза забрюшинной клетчатки и гидроуретеронефроз. Характерна двусторонняя обструкция мочеточников на уровне их перекреста с подздошными сосудами, выше которого они расширены, а ниже не изменены. Динамическая и статическая сцинтиграфия почек используется для определения их функционального состояния.
Дифференциальный диагноз болезни Ормонда осуществляют с гидроуретеро-нефрозом, забрюшинными неорганными образованиями и хроническим паранефритом.
Лечение. В ранних стадиях проводится лечение глюкокортикостероидами и другими препаратами, способствующими профилактике или рассасыванию рубцовых тканей. Назначается антибактериальная терапия. Оперативное лечение показано при выраженном развитии фиброзной ткани и образовании гид-роуретеронефроза. Может быть выполнен уретеролиз, резекция мочеточника с уретероуретероанастомозом, изоляция мочеточников от рубцовых тканей за-брюшинной клетчатки путем их перемещения в брюшную полость. При протяженных стриктурах - замещение мочеточника сегментом тонкой кишки или эндопротезирование.
Прогноз благоприятный при своевременном лечении и неблагоприятный при выявлении заболевания на стадии двусторонней гидронефротической трансформации и хронической почечной недостаточности.
9.5. ЦИСТИТ
Цистит - инфекционно-воспалительное заболевание стенки мочевого пузыря с преимущественным поражением его слизистой оболочки.
Эпидемиология. Женщины болеют чаще мужчин, в соотношении 3 : 1, что обусловлено:
■ анатомо-физиологическими особенностями мочеполовой системы женщин (короткая и широкая уретра, близость половых путей и прямой кишки);
■ гинекологическими заболеваниями;
■ изменениями гормонального фона во время беременности, при приеме гормональных контрацептивов, в постклимактерическом периоде (нарушения микроциркуляции, приводящие к ослаблению местного иммунитета, атрофия слизистой влагалища, уменьшение образования слизи).
У мужчин данное заболевание встречается гораздо реже и может быть обусловлено воспалительными процессами в предстательной железе, семенных пузырьках, придатках яичка и мочеиспускательном канале. Частой причиной развития вторичного цистита у мужчин является инфравезикальная обструкция с хронической задержкой мочеиспускания в результате стриктур уретры и опухолевых заболеваний предстательной железы.
Этиология и патогенез. Наиболее частая причина цистита - бактериальная инфекция. Кроме того, возбудителями заболевания могут быть вирусы, мико-плазмы, хламидии, грибы. Чаще всего у больных циститом в моче определяют кишечную палочку, стафилококк, энтеробактер, протей, синегнойную палочку, клебсиеллу. Ведущим микробным возбудителем при остром цистите является
кишечная палочка (80-90 % наблюдений), что объясняется высокими патогенными и адаптивными возможностями данного микроорганизма (феномен адгезии, высокая скорость размножения, выработка аммиака, который ослабляет иммунитет и нарушает функцию гладкомышечных волокон мочевыводя-щих путей).
Пути проникновения инфекции в мочевой пузырь следующие:
■ восходящий - самый частый вариант заноса инфекции из внешней среды по мочеиспускательному каналу;
■ нисходящий - попадание инфекции из верхних мочевых путей, почек при хроническом пиелонефрите;
■ гематогенный - встречается редко, может возникнуть при наличии отдаленного очага хронической инфекции, в том числе и в тазовых органах;
■ лимфогенный - наблюдается при заболеваниях половых органов: у женщин - это эндометрит, сальпингоофорит и др., у мужчин - везикулит, простатит и др.;
■ контактный - возможен при наличии гнойных заболеваний окружающих мочевой пузырь органов: параметрите, абсцессе предстательной железы и т. д. Прямое инфицирование мочевого пузыря может возникать при наличии мочевых свищей, быть следствием различных инструментальных манипуляций (катетеризация мочевого пузыря, цистоскопия и др.).
Факторы риска развития цистита следующие:
■ снижение общей сопротивляемости организма вследствие гиповитамино-зов, стрессов, переохлаждения, изменения гормонального фона;
■ нарушение оттока мочи из мочевого пузыря. У мужчин причинами этого являются доброкачественная гиперплазия предстательной железы, стриктуры мочеиспускательного канала, простатит. У женщин нарушение уродинамики может быть обусловлено стенозом (сужением) уретры, эктопией наружного отверстия мочеиспускательного канала, фиброзиро-ванием (разрастанием плотной соединительной ткани) в области уретры. Различные аномалии мочеполового аппарата также отрицательно влияют на процесс мочеиспускания и часто сопровождаются воспалительными заболеваниями как мочевого пузыря, так и верхних мочевых путей;
■ нарушение кровообращения в тазовых органах;
■ травматические повреждения слизистой мочевого пузыря во время эндоскопических исследований и операций;
■ эндокринные заболевания (сахарный диабет) и нарушение обмена веществ (например, гиперкальциурия);
■ наличие камней и новообразований в мочевом пузыре;
■ половая активность, особенно при наличии гипермобильности или эктопии уретры у женщин.
Реже встречается неинфекционный (аллергический) цистит. В роли аллергенов могут выступать самые разнообразные вещества: пищевые продукты (бобовые, цитрусовые, орехи), медикаменты (нестероидные противовоспалительные средства), бытовые и парфюмерные химические вещества.
Аллергические реакции также иногда наблюдаются после использования влагалищных тампонов и презервативов.
Классификация. Цистит классифицируют по ряду признаков. По клиническому течению:
■ острый;
■ хронический;
■ интерстициальный.
По вовлеченности мочевого пузыря в патологический процесс:
■ первичный;
■ вторичный, являющийся следствием какого-либо заболевания (инфраве-зикальная обструкция, травма, МКБ и др.).
По причине развития заболевания:
■ инфекционный;
■ аллергический;
■ химический;
■ лучевой, или радиационный.
По типу инфекционного возбудителя:
■ неспецифический, при котором причиной заболевания является собственная условно патогенная микрофлора;
■ специфический, когда выявляется определенный возбудитель (хламидии, микоплазмы, уреаплазмы, трихомонады, туберкулез, кандидоз).
По этому же фактору цистит можно разделить:
■ на бактериальный;
■ вирусный;
■ вызванный грибковой инфекцией.
По распространенности и локализации инфекционного процесса:
■ очаговый (шеечный, тригонит);
■ тотальный, или распространенный.
Симптоматика и клиническое течение. Острый цистит характеризуется внезапным, бурным началом, вызванным каким-либо провоцирующим фактором (переохлаждение, эндоскопическое вмешательство, травма), и быстрой регрессией в случае своевременно назначенной терапии. Тяжесть проявления симптомов нарастает в течение первых двух суток.
Больные жалуются на частое болезненное мочеиспускание, боли внизу живота и появление крови в конце мочеиспускания (терминальную гематурию, особенно характерную для шеечного цистита). Воспалительная реакция и отек стенки мочевого пузыря сопровождаются раздражением нервных окончаний. Даже незначительное скопление мочи вызывает сокращение мышечной стенки мочевого пузыря, и пациент ощущает очень сильный позыв к мочеиспусканию. Чем более выражен патологический процесс, тем меньше интервалы между мочеиспусканиями. В тяжелых случаях данный временной промежуток сокращается до 15- 20 мин, что чрезвычайно изнуряет больного. Характерным является ургентное недержание мочи, то есть императивный (повелительный) позыв к мочеиспусканию настолько силен, что больной теряет мочу, не успевая дойти до туалета.
Цистит сопровождается болевыми ощущениями в области мочевого пузыря и промежности разной степени интенсивности. Для болевого синдрома свойственно постоянство, что нарушает привычную жизнедеятельность человека и его отдых, поскольку не прекращается и в ночные часы.
Терминальная гематурия - также весьма характерный признак заболевания. Она появляется в конце мочеиспускания в виде отчетливо видимой примеси или даже капель крови. Моча при цистите теряет прозрачность из-за наличия большого количества микроорганизмов, форменных элементов крови, эпителиальных клеток и солей. Она становится мутной и приобретает неприятный запах.
Повышения температуры при цистите не наблюдается, что обусловлено пониженной способностью стенки мочевого пузыря к абсорбции веществ, в том числе и воспалительных токсинов. В норме данный механизм препятствует проникновению в кровь продуктов азотистого обмена из концентрированной мочи.
Крайне редко имеют место тяжелые формы острого цистита - флегмоноз-ный, гангренозный, геморрагический, язвенный. Для них характерны выраженная интоксикация, высокая температура тела, олигурия.
О рецидивирующем течении острого цистита говорят при появлении симптомов заболевания не реже двух раз за полгода либо трех раз в течение года. Причиной цистита в данном случае является реинфекция, то есть повторное инфицирование патогенной микрофлорой, источником которой служит как рядом расположенный очаг хронической инфекции, так и половой партнер. Также риск рецидивирования повышают прерванное лечение, бесконтрольный прием антибиотиков и несоблюдение правил личной гигиены.
Хронический цистит, как правило, является следствием предшествующего воспалительного или предрасполагающего заболевания и носит вторичный характер. Воспаление мочевого пузыря развивается и поддерживается в результате:
■ инфравезикальной обструкции (склеротические изменения шейки мочевого пузыря, доброкачественная гиперплазия, рак предстательной железы, сужения мочеиспускательного канала, фимоз);
■ МКБ (камни мочевого пузыря);
■ новообразований мочевого пузыря;
■ дивертикулов мочевого пузыря.
При отсутствии вышеуказанных патологических состояний и хроническом течении цистита, резистентном к проводимой терапии, необходимо исключить специфические заболевания, прежде всего мочеполовой туберкулез.
Клинические симптомы хронического цистита повторяют таковые при острой форме. Разница заключается лишь в степени их выраженности. Течение заболевания характеризуется периодическими обострениями, которые по клинике очень схожи с острым циститом и лечатся таким же образом. Возможен также вариант стабильного течения хронического цистита с минимальным набором жалоб и постоянными лабораторными признаками, как, например, лей-коцитурия и бактериурия.
Диагностика. Быстрое начало заболевания с характерной симптоматикой позволяют сразу заподозрить острый цистит. В клиническом и биохимическом анализах крови патологических изменений, как правило, не наблюдается.
Моча мутная, с запахом. При исследовании ее реакция чаще щелочная, всегда определяется большое количество лейкоцитов и бактерий, могут присутствовать эритроциты, эпителий, цилиндры, отмечается ложная протеинурия, то есть обусловленная распадом большого количества форменных элементов крови.
Бактериоскопия позволяет визуально (с помощью микроскопа) определить наличие инфекционного возбудителя. Более информативен посев мочи с определением бактериальной культуры и тестом на чувствительность к антибиотикам. Недостатком этого метода является длительность его выполнения, поэтому при клинически подтвержденном диагнозе цистита начинают антибактериальную терапию препаратами широкого спектра действия, не дожидаясь результатов посева.
Важно отметить, что при остром цистите противопоказаны инвазивные методы диагностики, прежде всего цистоскопия. Во-первых, данная процедура не несет существенной информации, во-вторых, при наличии острого воспаления она крайне болезненна и, в-третьих, может привести к реинфицированию и/или усугубить течение инфекционного процесса. Цистоскопия возможна и показана при хроническом цистите, с ее помощью могут быть выявлены участки гиперемии, выраженный сосудистый рисунок (рис. 19, см. цв. вклейку), фибринозные наложения, язвы, лейкоплакия, камни и др.
Дифференциальная диагностика. При остром цистите диагноз, как правило, не вызывает сомнений. Хронический цистит, особенно в случаях отсутствия характерной клинической симптоматики и неэффективности лечения, следует дифференцировать прежде всего с туберкулезом и новообразованиями мочевого пузыря.
Отличительными признаками туберкулезного цистита являются кислая реакция мочи и отсутствие микробного роста при посевах ее на обычные среды. Необходимы неоднократная микроскопия осадка мочи на микобактерии туберкулеза и посев ее на специальные среды. Наиболее характерный признак новообразований мочевого пузыря - тотальная безболевая макрогематурия. Установить диагноз позволяют сонография, КТ и цистоскопия с биопсией стенки мочевого пузыря.
Лечение. Лечебная тактика при остром цистите заключается в назначении антибактериальной терапии, рекомендуются покой, обильное питье, тепло на низ живота, из рациона исключаются острые и экстрактивные блюда.
В настоящее время существует ряд эффективных схем антибиотикотерапии в зависимости от длительности приема: однократная доза, трехдневный и семидневный курсы. Доказана клиническая эффективность кратковременных курсов лечения женщин репродуктивного возраста.
Наилучшим препаратом однократного применения является фосфомицин (монурал). Это антибиотик широкого спектра действия, эффективный в отношении кишечной палочки, стафилококка, протея, синегнойной палочки, клеб-сиеллы и др. Устойчивость микрофлоры к данному препарату незначительна. При лечении неосложненного цистита показан однократный прием 3 г фосфо-мицина, действие которого продолжается в течение 5 дней. Его применение обосновано при бактериурии беременных, а также в качестве профилактики перед инвазивными исследованиями (цистоскопия) и оперативными вмешательствами. Хороший эффект также оказывает однократный прием левофлок-сацина в дозе 250 мг, излеченность после него достигала 95 % пациентов.
Более длительный курс антибиотикотерапии показан при лечении цистита у пациентов с факторами риска рецидивирования и хронизации инфекции. К ним следует отнести:
■ острый цистит у мужчин;
■ цистит у женщин старше 65 лет;
■ сохранение клинической симптоматики более 7 дней;
■ беременность;
■ сахарный диабет и другие нарушения обмена веществ;
■ использование диафрагм и спермицидов.
Этим больным наиболее целесообразно назначение фторхинолонов, цефа-лоспоринов 3-го и 4-го поколений и защищенных пенициллинов.
С точки зрения сочетания таких качеств лекарственных средств, как эффективность, невысокая стоимость и низкая вероятность рецидивов, в настоящее время препаратами выбора являются фторхинолоны. Обладая широким спектром действия и достаточно длительно присутствуя на фармакологическом рынке, они по-прежнему характеризуются наименьшим уровнем резистентности микрофлоры. Из данной группы обычно назначают ципрофлоксацин, левофлоксацин, норфлоксацин и офлоксацин. Стандартный семидневный курс этих препаратов позволяет полностью снять симптоматику цистита и элиминировать возбудителя.
Дозировка фторхинолонов при трехдневном курсе: левофлоксацин - по 500 мг 1 раз в день; ципрофлоксацин - по 250 мг 2 раза в день или по 500 мг 1 раз в день; норфлоксацин - по 400 мг 2 раза в день; офлоксацин - по 200 мг 2 раза в день.
Цефалоспорины хорошо себя зарекомендовали в лечении инфекций мочевы-водящих путей. Они обладают высокой эффективностью в отношении практически всех грамотрицательных (протей, клебсиелла, энтеробактер) бактерий, в том числе устойчивых ко многим антибиотикам внутрибольничных штаммов, и многих грамположительных (стафилококки, стрептококки) микроорганизмов. Среди последних поколений цефалоспоринов перорального применения следует отметить цефиксим (400 мг 1 раз в сутки или по 200 мг 2 раза в сутки) и цефтибутен (400 мг 1 раз в сутки).
Полусинтетические пенициллины (аугментин, амоксиклав) содержат клаву-лановую кислоту, позволяющую нейтрализовать ферментативную защиту грам-положительных бактерий. Рекомендуемая доза составляет 625 мг 2 раза в день для трехдневного курса лечения и по 375 мг 1 раз в день для семидневного.
Кроме антибиотиков, следует отметить положительное влияние уроантисеп-тиков. Представителями данной группы являются нитрофурантоин (фурадо-нин) и фуразидин (фурагин). Эти препараты, всасываясь в желудочно-кишечном тракте, проходят через мочевыводящие пути в неизмененном виде, имеют низкий уровень резистентности к кишечной палочке (1 %), кроме того, они дешевы. Препаратами с малой эффективностью ввиду высокого уровня устойчивости микрофлоры являются ко-тримоксазол (бисептол), нитроксолин, нали-диксовая кислота. Резистентность бактерий для данных препаратов достигает порой 90 %, но, тем не менее, они все еще популярны.
Симптоматическая терапия. Болевые ощущения можно купировать назначением нестероидных противовоспалительных средств, которые обладают противовоспалительным и анальгезирующим действием (солпадеин, диклофенак, лорноксикам и др.). Из спазмолитиков применяются но-шпа, баралгин, цисте-нал, платифиллин и др.

Рис. 9.4. Сонограмма. Интерстициальный цистит: деформация и утолщение стенки мочевого пузыря (1), уменьшение его емкости (2), расширение мочеточника в результате рубцового поражения устья (3)
Критериями излеченности цистита являются полное отсутствие клиниче ской симптоматики, отсутствие лейкоцитурии и роста бактериальных колоний при посеве мочи после окончания антибактериальной терапии. Следует взять контрольный общий анализ и посев мочи на микрофлору как минимум через неделю после отмены антибиотиков.
Лечение хронического цистита более сложное и длительное. Терапия заключается в приеме антибиотиков
в течение 7-14 дней, а иногда и нескольких недель. Особенно важно устранить причину хронического инфекционно-воспалительного процесса, провести санацию очагов хронической инфекции и коррекцию иммунодефицитного состояния.
В профилактике цистита важную роль играют соблюдение правил личной гигиены, своевременное лечение воспалительных заболеваний и нарушений уродинамики, предупреждение переохлаждения, соблюдение асептики при эн-довезикальных исследованиях и катетеризации мочевого пузыря.
Прогноз при своевременном и правильном лечении острого цистита благоприятный. Цистит не является причиной летальных исходов, за исключением гангрены мочевого пузыря. Несвоевременное и нерациональное лечение острого цистита способствует его переходу в хроническую форму, при которой прогноз менее благоприятный.
Интерстициальный цистит является особой формой хронического неспецифического воспаления мочевого пузыря с рубцовым перерождением его стенки и развитием микроцистиса. Для него характерны стерильные посевы мочи и отсутствие эффекта от антибактериальной терапии.
Диагностика основана на УЗИ, при котором определяются малая емкость мочевого пузыря, деформация и утолщение его стенок, расширение дисталь-ных отделов мочеточников (рис. 9.4).
Существенное значение для диагностики имеют тест с калия хлоридом, комплексное уродинамическое исследование и цистоскопия с биопсией измененной стенки мочевого пузыря.
Лечение заключается в назначении антигистаминных препаратов, антидепрессантов, инстилляций гепарина, диметилсульфоксида и гиалуроновой кислоты. При микроцистисе показано хирургическое лечение, заключающееся в иссечении рубцово-сморщенного мочевого пузыря с замещением его детубуляризированным участком кишки, - аугментационная цисто-пластика .
Прогноз при интерстициальном цистите в плане сохранения мочевого пузыря неблагоприятный. Длительное течение интерстициального цистита приводит к микроцистису и требует оперативного лечения - замещение его участком подвздошной кишки на брыжейке.
9.6. УРЕТРИТ
Уретрит - воспаление мочеиспускательного канала. В силу анатомо-фи-зиологических особенностей он как самостоятельное заболевание у женщин практически не встречается, и мочеиспускательный канал вовлекается в патологический процесс при воспалении рядом расположенных органов (цистите, нагноении парауретральных желез и др.).
Заболевание встречается преимущественно у лиц репродуктивного возраста.
Этиология и патогенез. Подавляющее большинство уретритов передается половым путем. Инкубационный период может составлять от нескольких часов до нескольких месяцев. Значительную роль в патогенезе уретритов играет состояние макроорганизма. Способствующими местными факторами являются гипо- и эписпадия, сужения уретры.
Классификация. Различают неспецифические и специфические (гонококковые) уретриты. Гонококковый уретрит вызывается микроорганизмами Neisseria gon-orrhoeae (грамотрицательными внутриклеточными диплококками).
Уретрит может быть первичным и вторичным. При первичном уретрите воспалительный процесс начинается непосредственно со слизистой оболочки уретры. При вторичном инфекция попадает в уретру из воспалительного очага, имеющегося в другом органе (мочевом пузыре, простате, влагалище и т. д.).
В зависимости от этиологического фактора различают следующие виды уретритов.
Инфекционные уретриты:
■ бактериальные ;
■ трихомонадные (или вызванные другими простейшими);
■ вирусные ;
■ кандидозные (или вызванные другими грибами);
■ микоплазменные ;
■ хламидийные . Неинфекционные уретриты:
■ аллергические;
■ химические.
Симптоматика и клиническое течение. Различают три основные формы уретрита: острый, торпидный и хронический.
Острый гонорейный уретрит характеризуется обилием выделений из уретры. На головке полового члена они могут ссыхаться, образуя корки. Губки уретры красные, отечные, слизистая оболочка ее несколько выворачивается наружу. При пальпации уретра утолщенная и болезненная. Пораженные крупные уретральные железы обнаруживаются в виде мелких, похожих на песчинки образований. Больные жалуются на жжение и сильные боли при мочеиспускании, особенно в его начале (в результате растяжения уретры проходящей мочой). Симптоматика при поражении заднего отдела мочеиспускательного канала меняется: количество выделений несколько уменьшается, нарастает частота мочеиспусканий, в конце их возникает резкая боль, иногда отмечается выделение крови.
В зависимости от вирулентности возбудителя и иммунного статуса организма уретрит может принимать упорное течение и переходить в хроническую
форму. При присоединении воспаления семенного бугорка (колликулита) могут наблюдаться расстройства эякуляции и гемоспермия. Клиническая картина торпидного (подострого) и хронического уретрита сходны. Как правило, жалобы слабо выражены: характерны явления дискомфорта, парестезии, зуда в области уретры. Скудные выделения отмечаются в утренние часы до мочеиспускания, отмечается умеренная гиперемия и слипание губок уретры (уретрит с вышеуказанными симптомами в первые два месяца течения считается торпидным, а при дальнейшем существовании - хроническим).
Трихомонадные уретриты вызываются Trichomonas vaginalis. Длительность инкубационного периода трихомонадного уретрита составляет 10-12 дней. Заболевание характеризуется появлением зуда, жжения в области наружного отверстия уретры. В первой порции мочи при встряхивании обнаруживается много мелких пузырьков, что связано со слизеобразованием. Однако такая же картина может наблюдаться в начальной фазе аллергических уретритов. Затем появляются выделения, сначала слизистые, затем слизисто-гнойные. Они могут быть обильными, иметь желтоватый цвет и не отличаться от выделений при остром гонорейном уретрите. Без лечения через 3-4 недели острые явления стихают, и уретрит приобретает торпидное течение. Одним из осложнений может быть воспаление выводных протоков предстательной железы.
Микоплазматический и хламидийный уретриты передаются половым путем и могут быть причиной бесплодия. Возбудители отличаются от бактерий пластичностью наружной мембраны. Отсюда - полиморфизм и возможность прохождения через бактериальные фильтры. Эти уретриты характеризуются полным отсутствием какой-либо специфичности, поэтому поиски микоплазм и хламидий следует проводить при всех длительно протекающих торпидных и хронических уретритах. У больных хламидийными уретритами могут возникать экстрагенитальные проявления заболевания (конъюнктивиты, артриты, поражения внутренних органов и кожи) - так называемый синдром Рейтера.
Вирусный уретрит чаще вызывается вирусом герпеса. Длительность инкубационного периода варьирует в широких пределах. Начало герпетического уретрита сопровождается жжением, ощущением дискомфорта в области мочеиспускательного канала. На коже появляются группы напряженных полусферических мелких пузырьков, после их вскрытия остаются болезненные эрозии. Важной особенностью течения герпетического уретрита является его упорное рецидивирование. Заболевание может продолжаться десятки лет, обостряясь без явной периодичности.
Грибковый (микотический) уретрит развивается в результате поражения слизистой оболочки уретры дрожжевыми грибами и встречается сравнительно редко. Чаще всего является осложнением длительной антибактериальной терапии, реже - передается от половой партнерши, страдающей кандидамикотическим вульвовагинитом. Клинические проявления очень скудные.
Осложнениями уретрита являются простатит, орхоэпидидимит, цистит, а в отдаленном периоде - сужения мочеиспускательного канала.
Диагностика и дифференциальная диагностика. Этиология уретрита всегда требует уточнения, поэтому следует дифференцировать специфический уретрит от неспецифического и других патологических процессов в уретре (полипы, кондиломы,
новообразования и камни уретры). Помимо вышеуказанных жалоб диагноз устанавливают на основании наличия полового контакта в анамнезе, микроскопического исследования выделений из уретры (а при необходимости, из ротоглотки и прямой кишки) в нативном и окрашенном по Граму мазке. Помимо микробов и простейших, выявляются клеточные элементы (лейкоциты, эпителий), слизь, оценка которых позволяет уточнить этиологические и патогенетические факторы уретрита. Обязательно проведение бактериологических методов исследования, включающих посев материала на специальные питательные среды.
В настоящее время широкое распространение в диагностике уретритов нашли реакции иммунофлюоресценции и ПЦР-диагностика. Метод ПЦР основан на обнаружении определенного участка ДНК искомого микроорганизма. Он высокочувствителен (95 %) и высокоспецифичен (90-100 %).
Установлению диагноза способствуют многостаканные пробы и уретроскопия. Последняя противопоказана при остром уретрите, но при торпидном и хроническом течении оказывается очень информативной. Многостаканные пробы имеют большое значение для топической диагностики воспалительного процесса (уретрит, простатит, цистит).
Лечение. Во время лечения рекомендуется обильное питье, строгое соблюдение диеты с исключением приема алкоголя и острой пищи и половое воздержание.
Основным методом лечения уретрита является антибактериальная терапия, основанная на чувствительности выявленных возбудителей к используемым препаратам. В зависимости от формы и тяжести заболевания применяют антибиотики различных групп: полусинтетические пенициллины, тетрациклины, це-фалоспорины 2-го и 3-го поколения.
При бактериальных уретритах обнаруживаются различные варианты стрептококков, стафилококков, кишечной палочки, энтерококков и других микроорганизмов, которые могут существовать в мочеполовой системе здоровых мужчин и женщин. Рекомендуемые схемы лечения включают использование антибактериальных препаратов (доксициклин по 100 мг 2 раза в сутки 7 дней или азитромицин 1000 мг однократно). В качестве альтернативных средств назначают макролиды (эритромицин, кларитромицин, рокситромицин) или фторхинолоны (ципрофлоксацин, офлоксацин, левофлоксацин). Лечение гонорейного уретрита заключается в назначении цефексима однократно перо-рально в дозе 400 мг или цефтриаксона в дозе 250 мг однократно. Препаратами второй линии являются фторхинолоны. Они используются при резистентности возбудителя к цефалоспоринам.
В лечении трихомонадного уретрита используется метронидазол (внутрь 2 г однократно) либо тинидазол (внутрь 2 г однократно).
Терапия микоплазматического и хламидийного уретрита заключается в назначении азитромицина и доксициклина, а в качестве альтернативных препаратов - рокситромицина и кларитромицина.
При первичном клиническом эпизоде герпетического уретрита используются противовирусные препараты (ацикловир - 200 мг, фамцикловир - 500 мг). При частых (более 6 раз в год) рецидивах следует начинать супрессивную терапию.
Лечение грибкового уретрита заключается в отмене антибактериальных препаратов и назначении противогрибковых средств (кетоконазол, флуко-назол).
Местное лечение хронического уретрита включает инстилляции в уретру 0,25-0,5% раствора нитрата серебра, 1-3% раствора протаргола или 0,5% раствора диоксидина.
Прогноз. При своевременном лечении острого уретрита прогноз благоприятный. Хронический уретрит может осложниться сужением мочеиспускательного канала, орхоэпидидимитом и развитием бесплодия.
9.7. ПРОСТАТИТ
Простатит - воспаление предстательной железы. Это самое частое заболевание половых органов у мужчин репродуктивного возраста.
Этиология и патогенез. Основные причины заболевания - инфекционные и небактериальные воспалительные процессы, развивающиеся вследствие функциональных, микроциркуляторных и застойных нарушений. Инфекционными факторами могут быть патогенные бактерии, вирусы, грибы и др. Отсутствие в секрете предстательной железы патогенной флоры может быть связано с наличием трансформированных L-форм бактерий, мико-плазм, хламидий, вирусов. Изредка встречаются и представители анаэробной флоры.
Инфекция может попадать в простату восходящим каналикулярным путем при уретритах, циститах, после проведения эндоскопических манипуляций. Реже бактерии проникают в предстательную железу гематогенным путем из гнойных очагов в организме (фурункулы, карбункулы, синуситы и т. д.).
В развитии небактериального простатита огромное значение имеют предрасполагающие факторы - венозный стаз и застой секрета, так как сам секрет предстательной железы обладает бактерицидным действием. Провоцирующими факторами являются запоры, злоупотребление алкоголем, длительная малоподвижная работа.
Классификация. Предложено несколько классификаций простатита. Одни из самых популярных - клинико-анатомическая и Национального института здравоохранения (США, 1995 г.).
Клинико-анатомическая классификация:
■ острые простатиты (катаральный, фолликулярный, паренхиматозный);
■ абсцесс предстательной железы;
■ острая гиперемия предстательной железы (простатизм);
■ хронический простатит;
■ гранулематозный простатит;
■ застойный, или конгестивный, простатит;
■ атония предстательной железы;
■ склероз предстательной железы.
Классификация Национального института здравоохранения:
■ острый бактериальный простатит;
■ хронический бактериальный простатит;
■ хронический небактериальный простатит/синдром хронической тазовой боли:
воспалительный хронический тазовый болевой синдром (в секрете простаты, моче и эякуляте определяются лейкоциты);
невоспалительный хронический тазовый болевой синдром, признаки воспаления отсутствуют;
■ асимптоматический хронический простатит (при отсутствии клинических симптомов заболевания диагноз устанавливается по данным гистологического исследования простаты).
9.7.1. Острый и хронический простатит
Симптоматика и клиническое течение. Острый бактериальный простатит встречается редко и не превышает 2-3 % от всех воспалительных процессов в предстательной железе. Клиническая картина заболевания характеризуется бурным началом и складывается из сильных болей в промежности, внизу живота, крестце, недомогания, лихорадки, нередко с ознобом, учащенного болезненного и затрудненного мочеиспускания. Больной бледен, наблюдается тахикардия, может быть тошнота. При трансректальной пальпации предстательная железа увеличена, напряжена, резко болезненна, при наличии абсцесса определяется флюктуация. Иногда боли бывают настолько сильны, что пациенты не дают полноценно провести данное исследование.
Хронический простатит встречается значительно чаще и наблюдается у 1035 % мужчин репродуктивного возраста. Больные жалуются в основном на боли в нижней части живота, промежности. Иррадиация их возможна в задний проход, мошонку, крестец, паховые области. Иногда у пациентов возникает чувство жжения в промежности и уретре. Как правило, отмечается четкая взаимосвязь болей с половыми контактами: усиление их при половом воздержании и облегчение вплоть до исчезновения после коитуса. При дефекации могут возникать неприятные или болезненные ощущения в области малого таза, связанные с давлением каловых масс на воспаленную железу.
В ряде случаев отмечаются дизурические явления. Больные жалуются на учащенное, болезненное мочеиспускание, императивные позывы, чувство неполного опорожнения мочевого пузыря, реже - затруднение мочеиспускания, слабую струю мочи.
Изменение состояния эрогенных зон малого таза может привести к повышению их возбудимости или, наоборот, к угнетению чувствительности, что может сопровождаться расстройствами половой функции.
Течение хронического простатита может сопровождаться выделением из уретры по утрам небольшого количества мутноватой жидкости (простаторея). Иногда имеется четкая связь выделений с процессом дефекации. Простаторея обусловлена гиперпродукцией секрета предстательной железы и нарушением функции запирательных механизмов дистальных отделов канальцев и области семенного бугорка.
Большая часть пациентов при подробном сборе анамнеза отмечают повышение психической и физической утомляемости, депрессию, явления психастении.
Диагностика основана на изучении жалоб больного, тщательном сборе анамнеза, лабораторных и специальных методах исследования состояния предстательной железы.
Одним из наиболее достоверных и информативных методов диагностики является пальцевое ректальное исследование предстательной железы. При хроническом простатите она чаще нормальных размеров, асимметрична, мягко-эластической или тестоватой консистенции, неоднородная, с участками рубцовых втяжений, умеренно болезненная при пальпации. После проведенного массажа железа становится более мягкой, иногда даже дряблой, что говорит о нормальной эвакуации содержимого в просвет мочеиспускательного канала.
После осмотра необходимо получить секрет простаты для микроскопического и бактериологического исследования. Обнаружение в нем лейкоцитов, снижение количества лецитиновых зерен свидетельствуют о воспалительном процессе. Как правило, между количеством лейкоцитов и лецитиновых зерен существует обратная зависимость (на которую оказывает влияние степень активности воспалительного процесса). В секрете простаты могут также содержаться эпителиальные клетки. Призматический эпителий слущивается из ка-нальцевого аппарата предстательной железы, а секреторный - из ее ацинусов. Выявление в ходе бактериологического культурального исследования патогенных микроорганизмов свидетельствует о бактериальной (инфекционной) природе заболевания. Материал для исследования из предстательной железы можно также получить при проведении пробы Stamey-Mears.
УЗИ предстательной железы является третьим по значимости после пальцевого исследования и микроскопии полученного секрета. Оно проводится через переднюю брюшную стенку и ректальным датчиком. Наиболее высокоинформативным является трансректальное УЗИ. Сонография может выявить асимметрию, изменение размеров железы, наличие узлов, образований, включений, полостей, кальцинатов, диффузных изменений паренхимы.
Уретроскопия позволяет оценить состояние простатической части уретры и зоны семенного бугорка (рис. 2, см. цв. вклейку). Выявляются наличие воспалительных процессов, рубцовых изменений, анатомических дефектов, сужения просвета мочеиспускательного канала и некоторые другие изменения.
Рентгенологические методы исследования применяют только при наличии конкретных показаний (например, выявление камней предстательной железы).
Дифференциальная диагностика. Хронический простатит следует в первую очередь дифференцировать с опухолевыми заболеваниями и туберкулезом предстательной железы, а также с воспалением рядом расположенных органов (везикулит, цистит, парапроктит). В большинстве случаев лабораторные данные (онкомаркеры, бактериоскопическое и бактерилогическое исследование секрета предстательной железы на микобактерии туберкулеза), УЗИ, КТ и МРТ, сцинтиграфия скелета и биопсия простаты позволяют установить правильный диагноз.
Лечение. Этиотропная антибактериальная терапия включает антибиотики широкого спектра действия, позволяющие элиминировать весь спектр микроорганизмов, выявленных в секрете предстательной железы.
Острый простатит требует экстренной госпитализации с парентеральным введением антибактериальных препаратов, проведения противовоспалительной, дезинтоксикационной, общеукрепляющей терапии.
При хроническом простатите необходимо длительное многокурсовое комплексное лечение, как правило, в амбулаторных условиях.
Продолжительность антибактериальной терапии при остром простатите составляет 2-4 недели, а при хроническом - 4-6 недель. Препаратами выбора являются фторхинолоны (левофлоксацин, ципрофлоксацин - по 500 мг внутрь 1-2 раза в сутки, ломефлоксацин, моксифлоксацин, офлоксацин - по 400 мг внутрь 1-2 раза в сутки). Препаратами второго ряда считаются доксициклин и триметоприм, а резервными - цефотаксим, цефтриаксон и амикацин.
Нестероидные противовоспалительные препараты (диклофенак натрия - внутрь по 50 мг 2 раза в сутки после еды, в течение 20 дней) позволяют устранить болевой синдром. Биорегуляторные пептиды: простаты экстракт (ви-тапрост, простатилен) применяют в течение 30 дней в виде суппозиториев на ночь. Альфа-1-адреноблокаторы (тамсулозин, альфузозин, доксазозин) больным с хроническим простатитом назначают при выраженных расстройствах мочеиспускания. У 20-70 % больных с хроническим простатитом наблюдаются различные психические расстройства, требующие коррекции. В этих случаях пациентам прописывают транквилизаторы и антидепрессанты.
Пациентам с хроническим простатитом рекомендуется санаторно-курортное лечение в Железноводске, Кисловодске, Саки, Старой Руссе. Им назначают скипидарные, солевые и хвойные ванны, а также грязевые ректальные тампоны.
В ряде случаев для эвакуации застойного воспалительного отделяемого, образующегося в выводных протоках предстательной железы, может проводиться массаж предстательной железы. Восстановлению полноценной микроциркуляции в органах малого таза способствует назначение физиотерапии, лечебной физкультуры и местных процедур (теплые микроклизмы с ромашкой, шалфеем).
Пациентам показан активный образ жизни, занятия спортом для устранения застойных явлений в тазовых органах и повышения мышечного тонуса тазовой диафрагмы.
Диетотерапия заключается в полноценном здоровом питании с высоким содержанием витаминов группы В и аскорбиновой кислоты. Необходимо исключить острые блюда, алкоголь.
Регулярная половая жизнь способствует профилактике и устранению кон-гестивных явлений в предстательной железе.
Прогноз при своевременной диагностике и лечении заболевания благоприятный. Острый простатит при отсутствии адекватной терапии может перейти в хроническую форму или привести к развитию абсцесса предстательной железы.
9.7.2. Абсцесс предстательной железы
Этиология и патогенез. Возбудителями абсцесса предстательной железы преимущественно являются грамположительные микроорганизмы. Вирулентные штаммы могут проникать в предстательную железу при септикопиемии
из различных гнойных очагов (гидраденит, фурункул, остеомиелит, тонзиллит и др.). Факторами, предрасполагающими к развитию абсцесса предстательной железы, являются переохлаждение, интеркуррентные заболевания, иммунодефицитные состояния, конгестивные явления в простате. Последние связаны с нерегулярной половой жизнью, вредными привычками (алкоголь, табакокурение), заболеваниями тазовых органов, сопровождающимися запорами, а также длительной малоподвижной, сидячей работой. Абсцесс предстательной железы может явиться осложнением острого бактериального простатита.
Классификация. Различают первичный и вторичный абсцесс простаты. При первичном инфекция попадает в ткань предстательной железы гематогенно из удаленных гнойных очагов. Вторичный абсцесс простаты является следствием острого простатита.
Симптоматика и клиническое течение. Абсцесс предстательной железы характеризуется клиникой острого гнойного воспалительного процесса. Заболевание начинается с повышения температуры тела до 39-40 °С, больного беспокоят озноб, слабость, жажда, интенсивные боли внизу живота, промежности и крестце. Возникает затрудненное, болезненное мочеиспускание, связанное с отеком предстательной железы и сдавливанием простатического отдела уретры, вплоть до острой задержки мочи. Характерны интенсивные пульсирующие боли в промежности, затем в прямой кишке. Возможен прорыв абсцесса в мочеиспускательный канал, мочевой пузырь или прямую кишку, что проявляется резким помутнением мочи или гнойными выделениями при дефекации с одновременной нормализацией температуры тела.
Диагностика основана на данных анамнеза и жалобах больного. При пальцевом ректальном исследовании предстательной железы выявляется ее увеличение, пастоз-ность, болезненность и участок флюктуации, являющийся признаком абсцесса.
При трансректальном УЗИ простаты абсцесс выявляется как гипоэхогенное образование с нечеткими контурами (рис. 9.5).
КТ свидетельствует о наличии ограниченного жидкостного образования в ткани предстательной железы. Его трансректальная пункция позволяет точно установить диагноз и является начальным этапом лечения заболевания.
Дифференциальную диагностику абсцесса предстательной железы следует проводить прежде всего с острым парапроктитом и везикулитом. Правильно установить диагноз позволяют пальцевое ректальное исследование, сонография и компьютерная томография органов малого таза.
Лечение. Пациенту с абсцессом предстательной железы показана экстренная госпитализация в стационар. Параллельно с проведением антибактериальной, дезинток-сикационной, общеукрепляющей терапии под ультразвуковым контролем производят пункцию абсцесса, а затем его вскрытие и

Рис. 9.5. Трансректальная сонограмма. Абсцесс предстательной железы (стрелка)
дренирование промежностным или трансректальным доступом. Возможно трансуретральное вскрытие с помощью резектоскопа.
Применяют антибиотики широкого спектра действия (доксициклин - 200 мг/сут; ципрофлоксацин - 500 мг/сут; офлоксацин - 400 мг/сут; цефтриак-сон - 500 мг/сут). В послеоперационном периоде для ускорения рассасывания инфильтратов и предупреждения развития рубцово-склеротических изменений эффективны лидаза (64 ЕД подкожно), экстракт алоэ (2,0 подкожно), микроклизмы с антисептическими препаратами (10-15% раствор димексида, диокси-дина), ректальные свечи с противовоспалительным эффектом.
Прогноз благоприятный, при своевременном вскрытии и дренировании абсцесса наступает выздоровление. Позднее обращение больного за медицинской помощью и запоздалое лечение могут привести к жизненно опасному осложнению - сепсису.
9.7.3. Камни предстательной железы
Это редкое заболевание, при котором конкременты образуются в выводных протоках и ацинусах предстательной железы.
Этиология и патогенез. Причины образования камней связаны с длительным воспалительным процессом в предстательной железе и снижением концентрации цинка, который удерживает соли кальция в связанном состоянии. Одна из причин - рефлюкс мочи из уретры при наличии препятствия к мочеиспусканию. В подавляющем большинстве случаев камни предстательной железы можно рассматривать как осложнение хронического простатита.
Патологическая анатомия. Ядро камней состоит из амилоидных телец и слущенного эпителия, на которые наслаиваются фосфаты и соли кальция. Камни желтоватого цвета, различные по величине, могут быть одиночными и множественными. Обтурация камнями выводных протоков ацинусов простаты вызывает застой секрета предстательной железы и воспаление. Длительный воспалительный процесс может привести к образованию абсцессов, а при затруднении оттока из семенных пузырьков развивается везикулит. Предстательная железа постепенно атрофируется.
Симптоматика и клиническое течение. Больные жалуются на постоянные тупые боли в промежности, крестце, учащенное, болезненное, затрудненное мочеиспускание. Возможна терминальная гематурия, гемоспермия. При присоединении воспаления отмечается усиление болей во время полового акта. Половое влечение и потенция снижаются.
Диагностика камней предстательной железы основывается на пальцевом ректальном исследовании, при котором в плотной, болезненной, иногда дряблой предстательной железе ощущается крепитация.
На обзорной рентгенограмме определяются тени камней, обычно мелких и множественных, в проекции симфиза ниже контура мочевого пузыря (рис. 9.6). На цистограмме тени камней также отчетливо видны ниже контура мочевого пузыря. Диагноз подтверждается и при УЗИ.
Дифференциальная диагностика. Изменения в предстательной железе (увеличение, уплотнение, бугристость) могут напоминать подобные при туберкулезе и
Рис. 9.6. Обзорная рентгенограмма таза. Камни предстательной железы (стрелки)
раке простаты. Для туберкулеза характерно наличие специфического воспалительного процесса и в других органах, а для рака - повышение уровня простатического специфического антигена, общие симптомы злокачественного образования.
Лечение. Больные со случайно выявленными и неосложненными камнями предстательной железы в специальном лечении не нуждаются. Камни простаты в сочетании с хроническим простатитом требуют консервативного противовоспалительного лечения, исключается массаж органа. При абсцедировании проводится оперативное лечение, направленное на ликвидацию гнойного очага и камней (аденомэктомия, простатэк-томия, ТУР предстательной железы).
Прогноз благоприятный при проведении адекватного лечения.
9.8. ВЕЗИКУЛИТ
Везикулит (сперматоцистит) - воспаление семенных пузырьков.
Этиология и патогенез. Как самостоятельное заболевание везикулит встречается достаточно редко и может быть вызван как неспецифической, так и специфической микрофлорой. Путь проникновения инфекции в подавляющем числе случаев - каналикулярный, реже гематогенный.
Классификация. Различают острый и хронический везикулит.
Везикулит может быть первичным или вторичным, являясь осложнением уретрита, простатита, эпидидимита.
Симптоматика и клиническое течение. Острый везикулит сопровождается повышением температуры тела до 38-39 °С, недомоганием, ознобами, болями в прямой кишке, промежности, которые усиливаются при дефекации. Характерными симптомами являются боли при эякуляции и появление крови в эякуляте (гемоспермия).
Хронический везикулит чаще всего возникает вследствие недолеченного острого воспалительного процесса в семенных пузырьках. Больные предъявляют жалобы на боли в промежности, болезненные эрекции, гемо- и пио-спермию.
Диагностика. В случае острого везикулита при пальцевом ректальном исследовании пальпируются увеличенные, резко болезненные семенные пузырьки. После пальпации в выделениях из уретры (или в моче) обнаруживается большое количество лейкоцитов и эритроцитов. В трехстаканной пробе пиурия выявляется преимущественно в третьей порции.
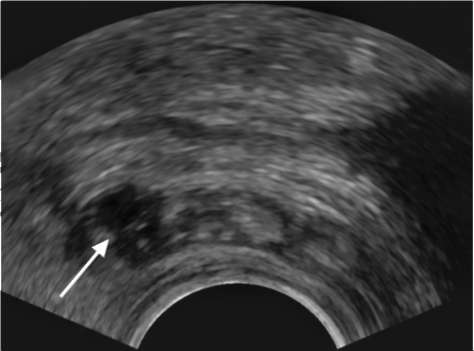
Рис. 9.7. Трансректальная сонограмма. Везикулит (стрелка)
При ультразвуковом обследовании семенные пузырьки легко определяются как гипоэхогенные образования.
В случае хронического везикулита при пальцевом ректальном исследовании над предстательной железой обнаруживаются плотные и болезненные семенные пузырьки. Важное значение для диагностики имеет обнаружение в семенной жидкости большого количества лейкоцитов и эритроцитов, мертвых сперматозоидов после массажа семенных пузырьков. Помогает уточнить диагноз УЗИ (рис. 9.7).
Дифференциальная диагностика острого везикулита в первую очередь проводится с острым простатитом, абсцессом предстательной железы и парапро-ктитом; хронического - с хроническим простатитом и туберкулезом простаты. Помогают установить правильный диагноз пальцевое ректальное исследование, сонография предстательной железы и компьютерная томография.
Лечение. Проводится антибактериальная терапия препаратами широкого спектра действия. Наиболее эффективны фторхинолоны (ципрофлоксацин, офлоксацин, левофлоксацин), защищенные пенициллины (амоксиклав) и це-фалоспорины 2-3-го поколения (цефуроксим, цефтриаксон, цефотаксим). Анальгетики и спазмолитики чаще применяют в виде суппозиториев. Для предотвращения запоров необходимо использовать слабительные средства. Хорошо зарекомендовали себя горячие микроклизмы (с 10-15 % раствором димек-сида, отварами ромашки, шалфея).
Если острый везикулит осложняется эмпиемой семенных пузырьков, то показано экстренное оперативное вмешательство - пункция и дренирование гнойника под ультразвуковым контролем.
При хроническом везикулите лечение заключается в антибактериальной терапии, проведении массажа семенных пузырьков, использовании грязевых аппликаций на промежность и грязевых ректальных тампонов, горячих микроклизм с противовоспалительными препаратами.
Прогноз при своевременном обращении и адекватной терапии благоприятный.
9.9. ЭПИДИДИМИТ
Эпидидимит - воспаление придатка яичка.
Этиология и патогенез. Эпидидимит развивается преимущественно вследствие проникновения инфекции в придаток или гематогенным путем из очагов гнойной инфекции (ангина, фурункул, гидраденит, пневмония и др.), или каналикулярно, по семявыносящему протоку, при наличии воспалительного процесса в уретре или предстательной железе. Возможно развитие эпидиди-
мита после инструментальных (катетеризация мочевого пузыря, бужирование уретры) и эндоскопических (уретроцистоскопия) вмешательств.
Гораздо реже причиной эпидидимита могут быть аномалии развития нижних мочевых путей (дивертикулы, клапаны задней уретры) и травмы органов мошонки.
Асептическое воспаление придатка яичка может развиться в результате избирательного накопления в нем амиодарона - препарата, используемого в кардиологической практике.
Патологическая анатомия. Придаток яичка уплотнен, резко увеличен за счет воспалительной инфильтрации и отека вследствие сдавливания кровеносных и лимфатических сосудов. Канальцы придатка расширены и заполнены слизис-то-гнойным содержимым. Семявыносящий проток утолщен, инфильтрирован, просвет его сужен. В воспалительный процесс вовлекаются и оболочки семенного канатика (диферентит и фуникулит). Часто эпидидимит сочетается с воспалением яичка - орхитом. В таких случаях говорят об эпидидимоорхите.
Классификация эпидидимитов и орхитов следующая.
По этиологии:
■ инфекционный:
специфический (туберкулезный, гонорейный, трихомонадный); неспецифический (бактериальный, вирусный, вызванный микоплазма-ми и хламидиями);
■ некротически-инфекционный (при перекруте и некротизации гидатид или яичка );
■ гранулематозный (вызванный семенной гранулемой);
■ посттравматический. По течению заболевания:
■ острый (серозный и гнойный);
■ хронический.
Симптоматика и клиническое течение. Острый эпидидимит начинается с быстро нарастающего увеличения придатка яичка, резких болей в нем, повышения температуры тела до 40 °С с ознобами. Воспаление и отек распространяются на оболочки яичка и мошонку, в результате чего кожа ее растягивается, теряет складчатость, становится гиперемированной. При вовлечении в патологический процесс яичка (эпидидимоорхит) граница между ними перестает определяться. Обычно развивается реактивное гидроцеле. Боли иррадиируют в паховую область, резко усиливаются при движении, в связи с чем больные вынуждены находиться в постели. Вследствие несвоевременно начатой или неадекватной терапии острого эпидидимита заболевание может абсцедировать или перейти в хроническую форму.
Хронический эпидидимит характеризуется латентным течением. Болевые ощущения незначительны. Наличие узла или ограниченного уплотнения в головке придатка указывает на его гематогенное происхождение. При процессе в хвосте придатка следует искать связь с заболеванием уретры или инструментальным исследованием.
Диагностика в большинстве случаев не вызывает затруднений. Диагноз устанавливается на основании данных осмотра и пальпации органов мошонки.
Определяется увеличенная и отечная соответствующая половина мошонки, кожа ее гиперемирована, складчатость сглажена. Придаток значительно увеличен, уплотнен, резко болезнен. При абсцедировании определяется флюктуация.
Появление симптоматической водянки подтверждают диафаноскопия и УЗИ. В анализах крови определяются лейкоцитоз со сдвигом формулы влево, повышение СОЭ.
Уточнить диагноз позволяет трехстаканная проба мочи и ее бактериоскопи-ческое и бактериологическое исследование.
Дифференциальная диагностика. Неспецифический эпидидимит по своей клинической картине иногда трудно отличить от туберкулеза придатка яичка. Решающее значение имеет тщательный сбор эпидемиологического анамнеза, выявление микобактерий туберкулеза в пунктате придатка, наличие двустороннего поражения с образованием гнойных свищей мошонки.
Острый эпидидимит следует отличать от перекрута гидатид или яичка, требующих экстренного хирургического лечения, и новообразований яичка. Перекрут яичка характеризуется внезапным появлением сильных болей в соответствующей половине мошонки, отсутствием температурной реакции, гиперемии кожи мошонки и значительного увеличения придатка яичка. Новообразования яичка нередко развиваются в молодом возрасте. Яичко значительно увеличено в размерах, отсутствуют признаки воспалительного процесса. Уточнить диагноз помогают УЗИ органов мошонки и определение онкомаркеров в сыворотке крови.
Лечение. Больному с острым эпидидимитом показан постельный режим. Для обеспечения покоя воспаленного органа применяют суспензорий (тугие плавки), в первые 2-3 суток - местно холод.
Назначают антибиотики широкого спектра действия (доксициклин - 200 мг/сут; ципрофлоксацин - 500 мг/сут; офлоксацин - 400 мг/сут; цефтриак-сон - 500 мг/сут). Местно применяют компрессы с 10-15% раствором димек-сида, электрофорез с йодистым калием, новокаином. Хорошо зарекомендовала себя магнитно-лазерная терапия.
После стихания воспалительного процесса назначают тепло на мошонку, диатермию, УВЧ.
При возникновении абсцесса придатка яичка показано оперативное лечение - вскрытие и дренирование абсцесса, при массивном поражении органа выполняют эпидидимэктомию.
Прогноз при неспецифическом эпидидимите благоприятный при адекватном и своевременном лечении. В случае двустороннего хронического воспаления заболевание может осложниться экскреторным бесплодием.
9.10. ОРХИТ
Орхит - воспаление яичка.
Этиология и патогенез. Причины и течение заболевания такие же, как при остром эпидидимите. Из-за тесной взаимосвязи и взаимного расположения яичка и его придатка в патологический процесс нередко вовлекаются оба органа - развивается эпидидимоорхит.
Этиология неспецифического эпидидимита может быть вирусной. Вирусные инфекции чаще поражают яичко, а не его придаток. Прежде всего это имеет место при эпидемическом паротите, приводящем к тяжелому поражению паренхимы яичка с развитием бесплодия.
Патологическая анатомия. Анатомические изменения определяются степенью деградации канальцевой системы яичка. Снижается тургор, и нарастает гипотрофия паренхимы (вплоть до атрофии клеток Сертоли). В основе механизма развития патологического процесса лежит первичное повреждающее воздействие на ткань, приводящее к отеку, гибели тканей, нарушению проницаемости гемотестикулярного барьера. В связи с началом выработки аутоантител со временем может произойти нарушение процесса сперматогенеза и в здоровом яичке. Даже после ликвидации воспалительного процесса выработка аутоантител организмом продолжается.
Симптоматика и клиническое течение. Заболевание начинается остро. Больные жалуются на внезапно возникающие боли в яичке, озноб, повышение температуры тела до 39-40 °С, увеличение яичка. Боли иррадиируют в паховую область, резко усиливаются при движении. Состояние больного ухудшается за счет интоксикации, температура тела остается высокой, появляются отечность и гиперемия кожи мошонки, исчезает ее сглаженность. При эпидемическом паротите орхит развивается на 3-10-й день заболевания или в первую неделю выздоровления. В 30 % случаев поражение носит двусторонний характер.
При вовлечении в патологический процесс придатка яичка (эпидидимоор-хит) граница между придатком и яичком перестает определяться. Развивается реактивная водянка оболочек яичка.
Диагностика. Данные анамнеза, подтверждающие травму или первичные заболевания, и клиническая картина способствуют правильной постановке диагноза. При изолированном поражении яичка придаток его не увеличен, семенной канатик утолщен, семявыносящий проток пальпируется отчетливо, без инфильтративных изменений.
УЗИ органов мошонки позволяет определить наличие реактивного гидроцеле, отечность паренхимы яичка, а при абсцедировании - гипоэхогенные участки.
Дифференциальная диагностика. Неспецифический орхит следует дифференцировать с перекрутом, туберкулезом, опухолями яичка и ущемленной па-хово-мошоночной грыжей. Основными методами дифференциальной диагностики, как и при эпидидимите, являются специфические туберкулезные пробы, определение онкомаркеров и УЗИ органов мошонки.
Лечение. Консервативная терапия такая же, как при остром эпидидимите. При возникновении абсцесса яичка показано оперативное лечение - вскрытие гнойника и дренирование мошонки. При гнойном орхите, особенно у пожилых людей после операции на предстательной железе, целесообразно выполнить орхэктомию. При орхите паротидного генеза к общей противовоспалительной терапии добавляют глюкокортикостероиды (преднизолон - 20 мг/сут) и ацетилсалициловую кислоту (1,5 г/сут).
Прогноз при неспецифическом орхите благоприятный. Двусторонний орхит, особенно как осложнение инфекционного паротита у детей, может привести к бесплодию.
9.11. БАЛАНОПОСТИТ
Баланит - это воспаление головки полового члена. Постит - воспаление крайней плоти. Баланит и постит, как правило, встречаются одновременно, поэтому практически всегда это единая форма заболевания - баланопостит.
Этиология и патогенез. Причинами баланопостита могут быть инфекционные и неинфекционные агенты. В первом случае вызывать баланопостит может неспецифическая (бактерии, вирусы, грибы) и специфическая (микобактерии туберкулеза, хламидии, микоплазмы, трихомонады) микрофлора. Вторую группу составляют неинфекционные баланопоститы: ксеротический облитерирующий баланопостит, плазменно-клеточный баланит Зоона, псориаз, аллергический контактный дерматит, химический баланопостит или баланопостит в результате введения различных маслянистых веществ под кожу крайней плоти.
Развитию заболевания способствуют местные факторы, прежде всего врожденный или приобретенный фимоз. В таких случаях невозможность обнажения головки приводит к застою содержимого препуциального мешка с разложением в нем сальной смазки и мочи.
Классификация. В зависимости от клинического течения баланопостит подразделяют на острый и хронический.
Факторы, способствующие развитию заболевания:
■ несоблюдение гигиенических мероприятий в отношении головки полового члена и крайней плоти;
■ фимоз;
■ хронический уретрит;
■ заболевания головки полового члена (остроконечные кондиломы, мягкий и твердый шанкр, опухоли);
■ сахарный диабет и другие иммуносупрессивные заболевания, особенно у пожилых мужчин;
■ травматизация головки полового члена и крайней плоти (при половом акте, нижним бельем, инородными телами).
Симптоматика и клиническое течение. Больного беспокоят зуд и боли в головке полового члена, рези при мочеиспускании. При осмотре крайняя плоть отечна, гиперемирована, отмечаются гнойные выделения из препуциального мешка. Степень выраженности воспалительного процесса может варьировать от минимальной (незначительная гиперемия и/или точечные участи покраснения на головке) до развития тяжелого гнойного баланопостита с эрозировани-ем и разрушением кожных покровов.
Если лечение не проводится, то заболевание осложняется лимфангитом, проявляющимся красными полосами на тыльной стороне полового члена. При прогрессировании процесса гиперемия становится сплошной, нарастает отек органа. Появляется паховый лимфаденит, возможна гангрена полового члена с выраженной интоксикацией, лихорадкой и развитием уросепсиса.
Диагностика. Жалобы и характерная клиническая картина позволяют в большинстве случаев сразу установить диагноз. Для идентификации возбудителя используют бактериоскопическое и бактериологическое исследование, а также ПЦР-диагностику.
Дифференциальная диагностика. Проводится с первичными заболеваниями головки полового члена, вызвавшими баланопостит, прежде всего с сифилисом, остроконечными кондиломами и новообразованиями. С этой целью следует устранить наличие кругового сужения крайней плоти, санировать и осмотреть препуциальный мешок, головку полового члена.
Лечение должно быть направлено на устранение первичного заболевания. Прежде всего следует обеспечить свободное открытие крайней плоти и головки полового члена. Обязательно проведение гигиенических мероприятий - санации головки полового члена и внутреннего листка крайней плоти слабыми растворами перманганата калия, фурацилина, хлоргексидина и другими антисептиками. Регулярно должна проводиться смена нижнего белья. Оперативное лечение (циркумцизия) применяется по медицинским показаниям при постоянно рецидивирующих хронических баланопоститах.
Прогноз благоприятный при своевременно начатом и адекватном лечении.
9.12. КАВЕРНИТ
Кавернит - воспаление пещеристых тел полового члена.
Этиология и патогенез. Инфицирование кавернозных тел происходит в результате гематогенного заноса вирулентной микрофлоры из существующих очагов хронической инфекции. Проникновению микроорганизмов способствует повреждение пещеристых тел в результате бытовой травмы, фаллопроте-зирования, интракавернозных введений различных веществ, в том числе лекарственных средств.
Симптоматика и клиническое течение. Заболевание начинается остро. Пациенты жалуются на боли в половом члене, которые могут сопровождаться эрекциями, повышением температуры тела. Половой член увеличивается в размерах, пальпируется плотный болезненный инфильтрат. При запоздалом лечении на месте воспалительного инфильтрата образуется абсцесс кавернозного тела, который может прорваться в просвет уретры. Вместе с гноем отторгаются некротические массы пещеристых тел. В ряде случаев развивается септическое состояние.
Диагностика и дифференциальная диагностика, как правило, затруднений не вызывают. Диагноз устанавливают на основании характерных жалоб, анамнеза и физикальных данных пациента. Дифференцировать острый кавернит следует прежде всего с приапизмом. Отличительными признаками острого кавернита являются повышение температуры тела, пальпируемый инфильтрат или участок флюктуации в кавернозной ткани полового члена и лейкоцитоз крови со сдвигом формулы влево.
Лечение. Больные с острым кавернитом должны быть экстренно госпитализированы. Назначается парентеральная антибактериальная дезинтоксика-ционная и общеукрепляющая терапия. При ее неэффективности и появлении признаков абсцедирования показано хирургическое лечение, заключающееся во вскрытии и дренировании гнойных очагов кавернозных тел. В последующем большое внимание уделяется физиотерапии с применением рассасывающих средств (йодид калия, экстракт алоэ, лидаза).
Прогноз благоприятный при своевременном консервативном лечении. При некрозе соединительнотканных перегородок кавернозных тел в результате абс-цедирования, потребовавшего хирургического лечения, прогноз в плане сохранения эректильной функции неблагоприятен.
9.13. НЕКРОТИЗИРУЮЩИЙ ФАСЦИИТ ПОЛОВЫХ ОРГАНОВ (ГАНГРЕНА ФУРНЬЕ)
Некротизирующий фасциит половых органов - внезапно начинающийся и бурно протекающий острый анаэробный воспалительный процесс в наружных половых органах с быстрым развитием некроза тканей. Заболевание впервые описано французским венерологом Furnie в 1883 году. До открытия антибиотиков летальность при нем составляла 40 %, а в настоящее время - 3-7 %.
Этиология и патогенез. В большинстве случаев гангрену мошонки вызывают анаэробные микроорганизмы, такие как Clostridium perfringes, Clostridium septi-cum, Clostridium oedematiens, Clostridium septicum и др. Факторами, предрасполагающими к ее развитию, являются: травматические повреждения мошонки , иммунодефицитные состояния, дисгормональные нарушения, патология свертывающей системы крови.
Патологическая анатомия. Локализации процесса в области наружных половых органов способствует особенность их анатомического строения. Кожа мошонки отличается значительной рыхлостью эпителиального покрова, слой эпидермиса намного тоньше, чем в коже других участков тела. Подкожная клетчатка рыхлая и развита слабо. Увлажнение кожи отделяемым сальных желез, множество волосяных фолликулов снижают резистентность и способствуют развитию воспаления. Множественный тромбоз мелких сосудов усугубляет течение заболевания. Гистологическое исследование при гангрене Фурнье выявляет множественные некротические участки, лейкоцитарную инфильтрацию и множественные микроабсцессы с участками септического тромбоза.
Симптоматика и клиническое течение. Гангрена Фурнье начинается с разлитого и быстро нарастающего отека мошонки. Мошонка значительно увеличивается в размерах, ярко гиперемирована, резко болезненна при пальпации, появляются участки подкожной крепитации. Уже в первый день заболевания на коже мошонки обнаруживаются пузыри с серозно-геморрагическим содержимым. Состояние больного при этом резко ухудшается, появляются признаки тяжелой интоксикации. На 2-3-и сутки пузыри вскрываются с образованием эрозий, с развитием некроза кожи и подлежащих тканей. Некроз с характерным почернением кожи может быстро распространяться на кожу полового члена, паховых областей, конечностей, спины.
К концу первой недели определяется демаркационная линия и начинается отторжение омертвевших участков кожи половых органов, сопровождающееся большим количеством гнойного отделяемого грязно-серого цвета с пузырьками газа и зловонным запахом. Отек полового члена и мошонки может вызвать затруднение мочеиспускания, вплоть до острой задержки мочи.
При несвоевременном лечении процесс расплавления и полного отторжения мошонки заканчивается к 10-12-му дню. Яички полностью лишаются кожи, имеют ярко-красный цвет и висят на семенных канатиках. Явления интоксикации снижаются. При несвоевременном лечении процесс приобретает генерализованную форму с некротическим поражением кожи на многих участках тела, развитием тяжелого анаэробного сепсиса, который в большинстве случаев приводит к летальному исходу.
Диагностика и дифференциальная диагностика. Диагноз гангрены Фурнье устанавливают на основании характерных жалоб, клинической картины и объективных данных. В начале развития заболевания до появления участков некроза кожи ее следует дифференцировать с эпидидимоорхитом и кавернитом.
Лечение. Больные с гангреной Фурнье подлежат экстренной госпитализации. Назначают парентеральное введение антибиотиков широкого спектра действия в повышенных дозах, дезинтоксикационную и общеукрепляющую терапию. Гнойно-некротические участки тканей широко иссекают и дренируют. Рану промывают растворами, выделяющими кислород (3 % перекись водорода, 0,5 % раствор перманганата калия), а затем накладывают повязки, обильно смоченные данными растворами. Внутривенно вводят поливалентную противогангренозную сыворотку - 15 000 ЕД. После получения данных бактериологического исследования отделяемого вводят соответствующую сыворотку и специфичный бактериофаг. При ограниченном участке поражения кожа мошонки в связи с ее исключительной регенераторной способностью восстанавливается и имеет нормальный вид. После иссечения большого кожного массива при тотальной гангрене в дальнейшем проводят пластические операции по замещению кожи мошонки и полового члена.
Прогноз неблагоприятный, примерно в 3-7 % случаев гангрена Фурнье заканчивается летальным исходом. Своевременное и адекватное лечение приводит к выздоровлению.
Контрольные вопросы
1. Какова этиология хронического пиелонефрита? Как он классифицируется?
2. Какова клиническая картина острого пиелонефрита?
3. Назовите основные причины перехода пиелонефрита в хроническую форму.
4. Как проводится диагностика хронического пиелонефрита и пионефроза?
5. Что является причинами развития паранефрита?
6. Приведите классификацию цистита.
7. Каково лечение острого воспаления мочевого пузыря?
8. Какие факторы способствуют развитию и поддержанию хронического ин-фекционно-воспалительного процесса в мочевом пузыре?
9. Что является возбудителями уретритов?
10. Чем характеризуется синдром Рейтера?
11. Что включает этиотропное лечение уретрита?
12. Как проходит клиническое течение острого и хронического эпидидимита?
13. С чем и как проводится дифференциальная диагностика хронического орхита?
14. В чем заключается лечение баланопостита?
Клиническая задача 1
Больной, 43 года, жалуется на общую слабость, недомогание, повышение температуры тела до 39 °С, озноб, боли в левой половине поясницы и живота. Болен в течение 6 дней. Три недели назад перенес острый тонзиллит. При осмотре: положение вынужденное - левое бедро приведено к животу, при его разгибании определяется резкая болезненность. Пальпация в левом костно-вертебральном углу также болезненна. Анализ мочи без патологии.
Установите предварительный диагноз. Каковы план обследования и тактика лечения больного?
Клиническая задача 2
Больная, 23 года. Заболела остро. Жалуется на частое болезненное мочеиспускание, боли в надлобковой области, помутнение мочи, выделение крови в конце акта мочеиспускания. Температура тела нормальная, объективно - болезненность в надлобковой области.
Установите диагноз и выберите тактику лечения.
Клиническая задача 3
Больной, 36 лет. Заболел два дня назад остро, когда стал отмечать увеличение и болезненность левой половины мошонки, лихорадку до 39,2 °С. При осмотре левая половина мошонки увеличена в размерах, кожа ее отечна, гиперемирова-на, складчатость сглажена. Пальпаторно определяется резко болезненное, увеличенное в размерах левое яичко с придатком плотной консистенции.
Установите диагноз. С какими заболеваниями необходимо провести дифференциальную диагностику? Обоснуйте план дополнительного обследования и лечебную тактику.