Пособие по клинической биохимии / Под ред. Л.В. Акуленко. - 2007. - 256 с.
|
|
|
|
ТЕМА 10 ЭНДОКРИНОЛОГИЯ И ИММУНОЛОГИЯ РЕПРОДУКЦИИ
Говоря об исследовании функционирования систем репродукции организма, мы, как правило, имеем в виду анализ эндокринных показателей, отражающих основные моменты регуляции образования мужских и женских гамет, возможности оплодотворения, имплантации оплодотворенной яйцеклетки, вынашивания эмбриона. Названные проблемы - область внимания гинекологов, эндокринологов, андрологов. Нас, специалистов лабораторной диагностики, прежде всего привлекают новые технологические возможности выявления причин, в том числе иммунологических, мужского и женского бесплодия, что, несомненно, играет решающую роль в выборе терапевтического воздействия или хирургической помощи пациентам.
Яичники и яички ответственны за выработку эффекторных гормонов репродуктивной системы, отвечающих за созревание гамет. Регуляция синтеза мужских и женских половых гормонов состоит из нескольких уровней. Самый первый уровень - нейроэндокринные структуры промежуточного мозга. Хотелось бы кратко охарактеризовать основные моменты нейроэндокринологии репродуктивной системы, так как перспективы успешного клинического решения проблемы бесплодия и нарушений функций половых органов сопряжены с пониманием процессов регуляции.
Область гипоталамуса выделяет рилизинг-факторы (ГРГ, ПРГ) и ингибирующие факторы (статины), являющиеся регуляторами синтеза и выброса тропных гормонов гипофиза. Гипофиз, в свою очередь, регулирует синтез эстрогенов, гестагенов и андрогенов в периферических железах, выделяя ЛГ, ФСГ, пролактин. Надпочечники тоже синтезируют небольшие количества половых гормонов. До недавнего времени оставался неясным вопрос о том, где и как осуществляется интеграция нервной и эндокринной систем в управлении репродуктивной функцией, и какие химические факторы действуют на гипоталамус, побуждая его к секреции либеринов и статинов. Главное достижение нейроэндокринологов последних лет - доказательство
причастности адренергических и холинергических медиаторов, дофамина серотонина, гистамина, ГАМК, ряда нейропептидов к регуляции секреции гонадотропинов:
• показано, что норадреналин оказывает стимулирующее действие на выброс ЛГ;
• эстрогены по принципу обратной связи действуют на скорость обмена норадреналина на уровне норадренергических нейронов, содержащих эстрогеновые рецепторы, а также через опиоидные или ГАМК-ергические нейроны, которые содержат рецепторы стероидных гормонов;
• серотонин участвует в регуляции секреции ЛГ, воздействуя на выработку ГРГ, но его участие зависит от гормонального фона на периферии (эстрогенов и гестагенов);
• порядка 30 нейропептидов участвуют в регуляции синтеза гонадотропинов; это соматостатин, натрийуретический фактор предсердия, нейротензин (из преоптической области мозга); нейропептиды Y и YY (из аркуатной области мозга), ТРГ, КРФ, холецистокинин, брадикинин, бомбезин, вазопрессин, окситоцин, опиоидные пептиды (из паравентрикулярных и супрахиазматических ядер).
Приведенная информация предполагает широкие перспективы выбора клиницистом между использованием только гормональных средств или сочетанным их применением с другими препаратами при лечении нарушений репродуктивной системы центрального генеза. Гонадотропные гормоны гипофиза ФСГ и ЛГ секретируются передней долей, а органами-мишенями служат гонады. Это гликопротеиды, состоящие из альфа- и бета-субъединиц, причем альфа-субъединица того и другого гормона идентичны, а бета-субъединицы определяют антигенную специфичность гормона. Следует заметить, что альфасубъединица гомологична таковой и в ТТГ, и в ХГЧ. Как в мужском, так и в женском организме эти гормоны универсальны, но действие их различно. У мужчин ЛГ прямо действует на клетки Ляйдига и стимулирует выработку тестостерона. ФСГ контролирует рост и функцию семенных канальцев, в особенности сперматогенез в клетках Сертоли. У женщин ЛГ и ФСГ оказывают синергичный эффект на синтез стероидов яичника. Мишени ЛГ - оболочки яичника и желтое тело. ЛГ вызывает овуляцию и лютеинизирует клетки гранулезы. ФСГ контролирует рост фолликулов до наступления их зрелости и готовности к овуляции, а, начиная с ранних стадий биосинтеза стероидов, синергическим взаимодействием ЛГ и ФСГ стимулируется биосинтез клетками гранулезы эстрадиола.
Пролактин - гормон специализированных лактогенных клеток передней доли гипофиза. Его синтез и освобождение также находится под контролем гипоталамуса. Кроме того, децидуальная оболочка и эндометрий, плацента также являются продуцентами пролактина. По химической природе пролактин не является гликопротеидом и состоит из одной полипептидной цепи. У мужчин биологическая специфическая роль его не установлена.
Периферические половые железы синтезируют гормоны, в основе которых лежит химическая структура циклопентанпергидрофенантрена, и синтезируются они из холестерина. В женском организме яичники циклично под контролем гипоталамуса и гипофиза синтезируют эстрогены и гестагены, а в мужском в яичках вырабатываются андрогены. Кора надпочечников тоже является продуцентом половых стероидов, но в последнее время показано, что в норме показатели андрогенов, синтезированных надпочечниками и яичками в состоянии покоя, не связаны между собой и подчиняются как минимум двум независимым системам контроля. При этом нарушение продукции андрогенов, обусловленное поражением яичек в условиях гипергонадотропного гипогонадизма, не сопровождается компенсаторной гиперпродукцией андрогенов надпочечниками. У женщин, очевидно, тоже существуют различные системы контроля синтеза половых стероидов яичниками и надпочечниками, доказательством этому является существование строгого овариального цикла. Для того чтобы понять, зачем надпочечникам синтезировать половые гормоны, нужно обратиться к схеме синтеза стероидов. Ключевым моментом в ней является прогестерон как исходный материал для дальнейшей модификации химической структуры в ходе образования различных групп гормонов (кортизол, альдостерон, эстрогены, андрогены). Пути синтеза сопряжены для гибкой регуляции активности ферментов. Стероиды гидрофобны, поэтому в водной среде плазмы крови 95% всех гормонов связаны с транспортными белками. Биологически активны только свободные молекулы, а пул их пополняется из связанных по мере необходимости. Связывающий половые гормоны глобулин переносит эстрадиол и андрогены с низкой емкостью и высокой аффинностью, в то время как кортикостероидсвязывающий глобулин связывает глюкокортикоиды и прогестерон.
В клетках органов мишеней стероидные гормоны связываются с внутриклеточными рецепторами, и образовавшийся молекулярный комплекс действует в ядре на уровне регуляции транскрипции. Необходимо отметить, что в ЦНС тоже есть рецепторы стероидных гормонов, что определяет психосексуальную направленность индивида.
ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ СПЕРМАТОГЕНЕЗА И ДИАГНОСТИКА ЭНДОКРИННОГО БЕСПЛОДИЯ У МУЖЧИН
Сперматогенез, осуществляемый в семенных канальцах, - гормональнозависимый процесс. Под действием гонадотропин-рилизинг фактора гипофиз выделяет лютеинизирующий гормон, регулирующий высвобождение тестостерона клетками Ляйдига. ФСГ, в свою очередь, связывается с рецепторами на клетках Сертоли, что является сигналом к синтезу циклического АМФ, а он запускает серию реакций, приводящих к образованию андрогенсвязывающего белка. Именно поэтому клетки Сертоли способны поддерживать высокую концентрацию андрогенов, которая необходима для сперматогенеза. Тестостерон оказывает свое действие на секрецию ЛГ двумя путями: 1) непосредственно воздействуя на переднюю долю гипофиза и 2) воздействуя на нее опосредованно через гипоталамус. В тканях яичек образуется полипептид ингибин, способный снижать секрецию ФСГ, опосредованно влияя на концентрацию тестостерона в семенных канальцах. Чувствительность клеток организма к тестостерону избирательна. Это, по-видимому, объясняется наличием в клетке-мишени фермента, превращающего тестостерон в 5-дигидротестостерон, который и несет биологический эффект.
ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ МЕНСТРУАЛЬНОГО ЦИКЛА
Первый стимул для роста фолликула в яичнике - ФСГ. Под его влиянием клетки гранулезы начинают вырабатывать эстрадиол, концентрация которого достигает максимума к середине цикла. ФСГ и эстрадиол, связываясь с рецепторами в передней доле гипофиза, стимулируют выработку ЛГ, который оказывает двоякое действие: во-первых, он вызывает дальнейший рост фолликула и его разрыв, во-вторых, вызывает образование желтого тела. Желтое тело растет и секретирует прогестерон и эстрадиол. Когда секреция эстрогенов достигает максимальных величин, они, действуя по механизму обратной связи на нейросекреторные клетки гипоталамуса, ингибируют выход рилизинг-гормона и далее ФСГ. Рост фолликула прекращается.
Прогестерон в отличие от эстрогена вырабатывается только в период существования желтого тела (10-12 дней). Главная его функция заключается в подготовке эндометрия к имплантации яйцеклетки. Если
беременность не наступила, желтое тело подвергается инволюции, синтез прогестерона прекращается. Видимо, в этом случае существование желтого тела предетерминировано. Концентрации прогестерона становится недостаточно, чтобы поддерживать утолщенный эндометрий, он слущивается. Низкие концентрации стероидов снимают блок с нейросекреторных элементов гипоталамуса и гипофиза. Если же беременность наступила, в крови появляется другой гормон - хорионический гонадотропин, который более эффективен, чем ЛГ в отношении поддержания и развития желтого тела. Как уже отмечено, химически ХГЧ и ЛГ устроены сходным образом, что, вероятно, обеспечивает сходные физиологические явления. ХГЧ синтезируется клетками трофобласта. Желтое тело беременности в 2,5 раза больше по размеру относительно обычного и претерпевает инволюцию лишь к концу 3-го месяца беременности. Однако к этому времени плацента берет на себя функцию синтеза прогестерона для поддержания беременности.
ХГЧ вырабатывается у женщин в таком количестве, что он выделяется с мочой. Исторически, самым первым таким тестом стало введение мочи беременной половозрелой девственной крольчихе. Это вызывает овуляцию с образованием геморрагических фолликулов, которые образуют желтые тела. Дальнейшую оценку осуществляли после гистологического исследования. В последние 20 лет с развитием иммунологической технологии разработаны тесты, более чувствительные и специфичные, чем описанный выше и требующие меньшей затраты времени и средств. Определяют бета-субъединицу гормона, которая и делает его собственно ХГЧ (альфа-субъединица гомологична у ЛГ, ФСГ, ТТГ) в крови или моче с помощью моноспецифичных антител. Комплекс антитела и бета-субъединицы (если таковая в крови или моче имеется) выявляют другими антителами, которые специфичны первым антителам и химически связаны с ферментом, дающим при добавлении субстрата цветной продукт. Реакцию оценивают по фотометрическому определению количества гормона. В норме ХГЧ в отсутствие беременности нет. Однако в патологических ситуациях (пузырный занос, хориоэпителиома) определение ХГЧ становится решающим диагностическим критерием и параметром контроля лечения.
Было давно замечено, что во время беременности овуляции не происходит, так как быстро устанавливаются такие уровни эстрогенов и прогестерона, которые подавляют образование ФСГ, а вследствие этого, и рост фолликулов. В этом отношении эстрогены эффективнее прогестерона. Следующим шагом было использование этих данных
для разработки средств предупреждения овуляции у небеременных женщин. Суть гормональной контрацепции состоит в поддержании в организме женщины гормонального фона беременности. Следует отметить, что подавление овуляции любым из используемых препаратов зависит от их действия за сутки. Это значительно превышает действие однократной дозы природного гормона, так как природные гормоны подвергаются в организме быстрому метаболизму. По этой причине в качестве пероральных контрацептивов применяют синтетические препараты, имеющие достаточно длительный гормональный эффект. В свете изложенного необходимо заметить, что все гормональные исследования по оценке собственной репродуктивной функции следует проводить не на фоне приема гормональных препаратов.
Охарактеризовав эндокринологические аспекты функции репродуктивной системы, хотелось бы остановиться на возможностях лабораторных технологий в ее оценке. Чисто технически она сводится к определению базальных уровней гонадотропинов, пролактина, гормонов периферических половых желез и оценке результатов функциональных проб.
Проявление нарушений эндокринной функции у женщин - патология менструального и овариального циклов. Ведущий симптом - олигоаменорея. В упрощенной форме аменорею подразделяют на первичную и вторичную. В большинстве случаев первичной аменореи причины носят генетический характер, а патология сочетается с нарушением роста и развития, инфантилизмом или интерсексуальностью. Рассмотренные в начале основные положения половой генетики позволяют понять механизмы данных нарушений. В случаях вторичной аменореи должна быть прежде всего исключена физиологическая причина аменореи: постменопауза или беременность. В медицинской практике первичная аменорея достаточно редка, тогда как вторичная имеет значительное распространение среди бесплодных пар.
В основе классификации лежит концентрация гонадотропных гормонов в крови. По этой причине лабораторное обследование пациентки начинают с определения гормонального статуса (тесты перечислены в плане обследования). При нормальной концентарции гормонов выделяют три основных варианта дефектов:
• анатомические причины (аплазия матки и влагалища при дисгенезии мюллеровых протоков у лиц с женским генотипом и гонадными признаками);
• тестикулярная феминизация - кариотип мужской, но в виду дефектов синтеза андрогенов на ранних этапах эмбрионального
развития или рецепции андрогенов не происходит развитие вольфовых протоков и формирования вторичных половых признаков по мужскому типу;
• гиперандрогения, включающая в себя адреногенитальный синдром (АГС) и синдром поликистозных яичников (СПЯ).
Основной признак АГС - накопление в крови 17-оксипрогестерона вследствие дефекта 21-гидроксилазы. При высоком уровне гонадотропинов в сочетании с низкими концентрациями эстрогенов выделяют также три основные группы причин аменореи:
• дис- и агенезия яичников вследствие дефектов развития гонад или дифференцировки половых желез;
• хромосомные аберрации, часто сочетающиеся с первичной яичниковой недостаточностью (синдром Тернера, встречающийся с частотой 1:3000 новорождённых);
• яичниковая недостаточность вследствие хирургических операций, химиотерапии и лучевой терапии.
При снижении количества гонадотропинов ведущими манифестирующими факторами у пациенток являются задержка полового развития, препубертатная нервная анорексия и опухоли ЦНС. В таких ситуациях лабораторное обследование помимо определения гормонального статуса расширено оценкой проб с гонадотропинрилизинг-гормоном, а при подозрении на опухоли ЦНС дополняется инструментальными методами диагностики.
Классификация вторичной аменореи, представленная здесь, основана на частоте встречаемости причин заболевания. Лабораторное обследование пациенток проводят после полного гинекологического осмотра и начинают с определения гормонального статуса. В план обследования включены дополнительные функциональные тесты для подтверждения или дифференцировки диагноза.
Гиперпролактинемическая аменорея или олигоаменорея в 30-60% случаев сопровождается лактореей. Причины развития гиперпролактинемии: нейротрансмиттерные расстройства на уровне гипоталамуса (подавление секреции дофамина, блокада дофаминовых рецепторов лактотропных клеток лекарственными препаратами); гиперплазия лактотропных клеток аденогипофиза, пролактинома; механическое сдавление гипофизарной ножки, прерывающее блокирующую активность дофамина; функциональное доминирование серотонинэргических нейронов, регулирующих выброс пролактолиберина в гипоталамусе. Подтверждение диагноза гиперпролактинемии - определение базального уровня пролактина в крови и функциональных
тестов стимуляции выхода пролактина. Необходимо обратить внимание на следующее:
• существует суточный ритм пролактина, и для оценки берут утреннюю порцию крови;
• высвобождение пролактина зависит от многих физиологических факторов, включая стресс;
• мануальное исследование молочных желез, предшествующее забору крови, может привести к подъему концентрации гормона.
В плане лабораторной диагностики указаны тесты с тиреорилизинг-гормоном и метоклопрамидом, что удобно в выявлении латентной гиперпролактинемии, когда клиническая манифестация может наступать при уровне пролактина в 5-10 раз выше нормы. Сниженная реакция пролактина на стимуляцию тиролиберином или ее отсутствие существенны для подозрения на пролактиному, но не имеют самостоятельного диагностического значения. Наличие четкой реакции на тиролиберин не исключает пролактиному, а усиленная реакция не означает исключительно гипоталамическое происхождение заболевания. Однако следует иметь в виду, что дополнительные инструментальные исследования не выявляют микроаденому гипофиза.
Здесь следует коротко упомянуть неактивные аденомы гипофиза, составляющие 25-33% всех гипофизарных аденом. Для них характерно отсутствие типичных симптомов. Такие аденомы часто происходят из общих клеток аденогипофиза и продуцируют аномальное количество общей альфа-субъединицы гонадотропинов и ТТГ. У женщин и мужчин с неактивными аденомами выявлено два варианта развития заболевания: а) у женщин заболевание начинается с нарушения менструального цикла по типу олигоменореи-галактореи, при котором выявляется СПЯ; у мужчин имеется умеренная гиперпролактинемия со снижением половых функций, сопровождающаяся высоким или нормальным уровнем гонадотропинов; б) у женщин и у мужчин выявляют признаки вторичного гипогонадизма.
В зависимости от состояния половых желез наблюдают два типа реакций на гонадолиберин: а) гиперергическая реакция с увеличением ЛГ у женщин с СПЯ и у мужчин с нормальным состоянием половых желез; б) гипоергическая реакция ЛГ с уменьшением его резервов при проявлениях вторичного гипогонадизма.
Лабораторное выявление гиперандрогенемии требует дальнейшей ее дифференцировки на надпочечниковую и яичниковую. СПЯ сопровождается повышением андрогенов, преимущественно тестостерона и андростендиона, а функциональная проба с гонадолиберином
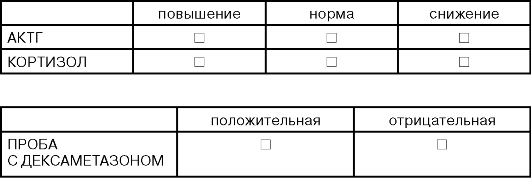
дает усиленную реакцию ЛГ. При надпочечниковых причинах ведущим признаком является повышение ДГЭА-S, 17-оксипрогестерона при АГС, а проба с дексаметазоном положительная.
Повышение уровня ФСГ >100 одновременно со снижением эстрадиола свидетельствует о преждевременной менопаузе.
Часто вторичной аменореей сопровождаются эндокриннометаболические расстройства - сахарный диабет, тиреоидная патология, избыточная масса тела. В случае гипотиреоза механизм отрицательной обратной связи вызывает увеличение секреции тиреолиберина, что ведет за собой развитие латентной легкой или среднетяжелой гиперпролактинемии. Диагностика базируется на параметрах щитовидной железы. Необходимо и проведение пробы с тиреолиберином. Инсулярная недостаточность или плохо скомпенсированный сахарный диабет ведет к снижению яичниковой функции в сочетании с гипосекрецией гонадотропинов. В случае избытка массы тела повышена активность коры надпочечников с избыточной продукцией андрогенов. Часть андрогенов ароматизируется в жировой ткани в эстрогены со смещением равновесия в пользу эстрона. При этом замедляется секреция ФСГ, стимулируя выход ЛГ. ЛГ вызывает дополнительный выход андрогенов и их попадание в клетки внутренней оболочки фолликула. Фолликул атрезируется.
Если концентрация пролактина, андрогенов и ФСГ в пределах нормы и не обнаружено эндокринно-метаболических нарушений или опухолей, то методом исключения диагностируют гипоталамическую аменорею, которую подтверждают пробами с гонадолиберином.
По статистике в России около 30% супружеских пар бесплодны. Примерно в 50% случаев проблема заключена в мужчине. Наряду с достигнутыми успехами в решении эндокринногинекологических задач по диагностике и коррекции бесплодия андрология остается одной из самых неизученных областей медицины. Прежде чем проводить инвазивные мероприятия в отношении женщины, целесообразно провести комплекс андрологической диагностики, куда входит обязательная лабораторная программа.
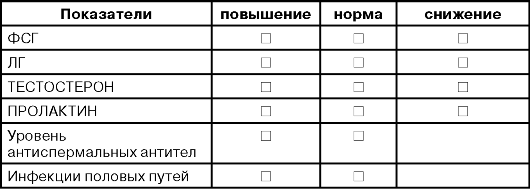
Отправное звено - анализ спермограммы. При получении патологических результатов и исключении инфекции мочеполовых путей проводят эндокринологические исследования. Цель этих исследований - дифференциальная диагностика между гипогонадотропным гипогонадизмом (гипоталамо-гипофизарная недостаточность) и гипергонадотропным гипогонадизмом (тубулярная недостаточность яичек). Основными тестами в гормональном статусе считают ФСГ, ЛГ,
тестостерон и пролактин, дополнительными - ДГЭА-S, 17-оксипро- гестерон, проведение дексаметазонового теста.
А) Уровень ФСГ часто в пределах нормы. Это уже дает основания рассчитывать на успех медикаментозного лечения. Достоверное повышение ФСГ позволяет судить о недостаточной тубулярной продукции ингибина. Исходно это является отрицательным прогностическим признаком. В случае синдрома Кляйнфельтера (трисомия 47XXY, частота 1:600) у пациентов выявляют значительное повышение базального уровня ФСГ и уменьшение размеров гонад. Снижение уровня ФСГ встречается редко. Пациенты поддаются эффективной заместительной терапии. Подтверждает диагноз проба с гонадолиберином. Пробу считают положительной при подъеме концентрации ФСГ в 1,5 раза. Если выявляют выраженное повышение ФСГ, то причина в гипоталамической недостаточности, если проба не вызывает достоверного повышения гормона, то причина в гипофизарной недостаточности. В таких случаях заместительную терапию проводят гонадотропинами.
Б) Измерение концентрации тестостерона проводят в утренние часы, так как имеется суточный ритм гормона. Если недостаточность тестостерона связана с недостатком гонадотропинов, то возможно проведение заместительной терапии. В случае недостатка тестостерона при нормальном содержании ФСГ заместительная терапия тестостероном не способна вызвать стимуляцию сперматогенеза, поскольку концентрация тестостерона в гонадах в 100 раз превышает таковую в крови.
Концентрацию ЛГ определяют одновременно с базальным уровнем ФСГ и тестостерона. Этот тест дает дополнительную информацию при нормальных значениях ФСГ и тестостерона. Повышение базального уровня ЛГ говорит о комбинированном тестикулярном поражении. Для подтверждения диагноза необходима проба с гонадолиберином. В случае нормальных значений ЛГ и значений ФСГ и тестостерона вблизи предельных, сочетанная тестикулярная патология менее вероятна и проведение пробы необязательно.
ИММУНОЛОГИЯ РЕПРОДУКЦИИ
Иммунология репродукции - относительно новая область на стыке науки и медицины. В течение более 40 лет в центре внимания исследователей, работающих в этой области, были следующие проблемы.
1. Изучение механизмов, позволяющих плоду избежать отторжения организмом беременной, и оценка возможности того, что спонтанный аборт является результатом нарушения этих механизмов.
2. Исследование механизмов, препятствующих продвижению сперматозоида в мужском и женском репродуктивных трактах, и вероятности того, что иммунный ответ на гаметы может быть причиной бесплодия.
3. Изучение механизмов, защищающих от заболеваний, передающихся половым путем на уровне слизистых оболочек половой системы, и возможности предотвращения инфекций путем иммунизации.
4. Исследование роли иммунологических механизмов в репродуктивной эндокринологиии, перинатологии и различных патологиях репродуктивной системы.
Развитие иммунологии репродукции в мире и результаты исследований убеждают в участии иммунологических механизмов в патогенезе нарушений репродуктивной функции. Это патология репродуктивной системы женщины (воспалительные заболевания половой системы, эндометриоз, миомы, поликистоз), бесплодие (мужское и женское), патология беременности (гестоз, привычный выкидыш и др.) и перинатальная патология плода (внутриутробная инфекция, неонатальная инфекция, гипотрофия и недоношенность).
Каждая пятая супружеская пара в нашей стране страдает бесплодием, причем у 20% бесплодных пар даже современный уровень диагностики не позволяет обнаружить патологические отклонения. Нарушения репродуктивной функции остаются необъяснимыми, несмотря на тщательное андрологическое и гинекологическое обследование. Благодаря успехам молекулярной и клеточной биологии количество таких пациентов удалось уменьшить за счет выделения группы с иммунологическим бесплодием: супружеские пары, в которых хотя бы у одного из партнеров выявляются антиспермальные антитела. Исследования последних лет доказали, что примерно 10-20% нарушений репродуктивной функции неясного генеза можно объяснить действием иммунных механизмов.
Относительное бесплодие может быть обусловлено нарушением функции центральной нервной системы и неполноценностью спермиев. Поскольку сперма и яйцеклетка обладают антигенами, иммунная реакция на них также может быть причиной бесплодия. Такое аутоиммунное бесплодие возникает у мужчин при нарушении гематотестикулярного барьера, приводящем к выработке антиспермальных антител. Антиспермальные антитела, связываясь с поверхностными антигенами
сперматозоидов, могут нарушать функциональную активность этих клеток: препятствовать проникновению сперматозоидов через цервикальный канал в полость матки, обездвиживать сперматозоиды и вызывать их гибель. Они же способны препятствовать взаимодействию сперматозоида и яйцеклетки, блокируя поверхностные рецепторы сперматозоидов или ингибируя процесс акросомальной реакции. Кроме того, они могут приводить к патологии эмбриона, выявляемой на стадии преимплантации, и влиять на активность клеток трофобласта, снижая их пролиферацию и продукцию ими хорионического гонадотропина.
Мужское бесплодие может быть вызвано следующими факторами.
1. Образование в организме антиспермальных антител при попадании в кровь сперматогоний в результате травмы яичка, операций на брюшной полости, тяжелых гнойных инфекций брюшной полости, при которых может произойти травма семенных канатиков.
2. Затруднение оплодотворения из-за нарушения подвижности сперматозоидов за счет перегревания и тесной одежды у мужчин.
3. Нарушение созревания полноценных сперматозоидов, связанное с неопущением яичка до 6 лет.
4. Инфекция мочевыводящих путей и репродуктивных органов (особенно герпетическая), приводящая к нарушению подвижности сперматозоидов.
5. Прием противозачаточных препаратов женщиной и мужчиной.
Механизмы уклонения сперматозоидов от иммунологического надзора в мужском организме:
• иммунологическая толерантность, обусловленная низким порогом просачивания спермальных антигенов;
• иммуномодуляторные механизмы внутри яичек, такие как стероиды, макрофаги, супрессорные клетки, которые могут предотвращать активацию иммунологического распознавания;
• периферическая иммуномодуляция яичек: Т-супрессорные клетки в эпидидимисе (придатке яичка) и иммуносупрессорная активность семенной жидкости (в сперме выделен компонент, названный «иммуноглобулин связывающий фактор», Immunoglobulin binding factor - IBF, который снижает активацию В-лимфоцитов и подавляет активность Т-хелперов, таким образом предотвращая продукцию антиспермальных антител в репродуктивном тракте).
Попадание в кровь сперматогоний в результате нарушения гематотестикулярного барьера приводит к формированию в организме мужчины антиспермальных антител:
1. Травмы яичка, мошонки, варикоцеле (расширение вен, окружающих семенной канатик).
2. Крипторхизм; инфекции (хламидии, микоплазмы, вирусы герпеса и папилломавирус), злокачественные новообразования.
3. Закупорка семявыносящих путей.
4. Операции на брюшной полости.
5. Тяжелые гнойные инфекции брюшной полости, при которых может произойти травма семенных канатиков.
6. Вибрация (велосипед, мотоцикл).
Нарушение гематотестикулярного барьера открывает доступ крови к тканям яичка и формированию иммунного ответа на сперматозоиды и ткани яичка. Деструкция в системе семявыносящих протоков ведет ко вторичным иммунным поражениям в пределах семенных канальцев, вовлекающим клеточно-специфические реакции на всех стадиях сперматогенеза и приводящим к появлению антиспермальных антител. Недостаточность механизма мимикрии приводит к контакту спермальных антигенов с иммунной системой и выработке антиспермальных антител как в мужском, так и женском организме. К снижению жизнеспособности сперматозоидов и нарушению механизма мимикрии приводят нарушения процессов сперматогенеза (в яичке) или функционального созревания (в эпидидимисе), вызванные различными причинами (воспалительные заболевания, варикоцеле, крипторхизм, эндокринная патология)
Ведущую роль в нарушениях репродуктивной функции у женщин, кроме гормонального статуса, играют уровни цитокинов в крови. Так, при дефиците гранулоцитарно-макрофагального колониестимулируещего фактора беременность может не наступить из-за отсутствия фертильности. Недостаток эпидермального ростового фактора, который вместе с IL-3 способствует имплантации бластоциты, приводит к нарушению развития бластоцитов и сосудов в матке. IL-1 угнетает развитие бластоциты и прикрепление трофобласта, гамма-интерферон угнетает бластоцитоз и способствует развитию трофобласта.
Развитию женского бесплодия способствует и появление в организме женщины антиспермальных антител, которые могут быть причиной нарушения акросомальной реакции. Акросома сперматозоида имеет 30 видов антигенов, на которые в организме женщины могут образовываться антитела, блокирующие их функцию. Чаще всего это
происходит при попадании спермы в прямую кишку (анальный половой контакт) и при контактах во время воспалительных процессов в половой сфере женщины. Антиспермальные антитела в организме женщины блокируют подвижность сперматозоидов и препятствуют имплантации оплодотворенной яйцеклетки. К появлению антител приводят следующие факторы.
1. Нарушение целостности слизистых оболочек (химические способы контрацепции, воспаление).
2. Повышенное количества лейкоцитов, в том числе лимфоцитов, в сперме.
3. Сперматозоиды, связанные с антиспермальными антителами.
4. Высокий процент аномальных и «старых» сперматозоидов (при редкой половой жизни).
5. Оральный и анальный секс (попадание спермы в желудочно-кишечный тракт).
6. Попадание большого количества сперматозоидов в брюшную полость (особенности морфологии половых путей, неправильное проведение методов внутриматочной инсеминации).
7. Попытки экстракорпорального оплодотворения в анамнезе (гормональный «удар» по гипоталамо-гипофизарно-яичниковой системе, травма при заборе яйцеклеток).
8. Коагуляция эрозии шейки матки в анамнезе.
9. Воспалительные процессы во влагалище.
В литературе описаны следующие механизмы повреждающего действия антител:
• вызывают снижение скорости движения и жизнеспособности сперматозоидов;
• нарушают функциональную целостность мембраны сперматозоидов;
• снижают оплодотворяющую способность эякулята;
• оказывают повреждающее действие на функцию предстательной железы;
• препятствуют продвижению сперматозоидов и их пенетрацию через цервикальную слизь;
• блокируют рецепторные участки на головке сперматозоида, ответственные за связывание с блестящей оболочкой яйцеклетки;
• нарушают процесс капацитации сперматозоидов;
• воздействуют на акросомальную реакцию, блокируя экзоцитоз кортикальных гранул.
Показания для определения в крови концентрации антиспермальных антител.
1. Измененные показатели спермограммы:
• агрегация и агглютинация сперматозоидов;
• низкая подвижность;
• феномен «движения на месте» сперматозоидов;
• низкая жизнеспособность спермы.
2. Отклонения в посткоитальном тесте:
• малое количество сперматозоидов в цервикальной слизи;
• низкая подвижность;
• явление дрожания сперматозоидов в посткоитальном тесте;
• отрицательный посткоитальный тест.
3. Отрицательный тест взаимодействия сперматозоидов и шеечной слизи in vitro.
4. Наличие определенных факторов риска (см. выше).
5. Неудачи или низкие показатели при экстракорпоральном оплодотворении.
6. Необъяснимое бесплодие у обследованных супружеских пар.
Уклонение сперматозоидов от иммунологического надзора организма женщины осуществляется благодаря наличию у него поверхностного оболочечного антигена скаферина (scaferin). Он не распознается иммунной системой женщины как «чужой», в результате чего полноценные, сильные сперматозоиды доходят до ампулярной части трубы и оплодотворяют яйцеклетку. Дойдя до яйцеклетки, сперматозоиды сбрасывают оболочечный антиген. Погибшие сперматозоиды выделяют в кровь факторы подавляющие иммунную систему матери в момент «раздевания» сперматозоида.
Антитела к чужеродным HLA-антигенам плода фиксируются на плаценте, что стимулирует в ней кровоснабжение и формирует полноценное ее развитие. Эти комплексы на плаценте являются блокирующими и защищают плод от проникновения иммунных факторов матери в организм плода. Если супруги идентичны по HLA-антигенам (гомозиготы), то иммунная система матери не распознает антигены плода и не формирует блокирующие факторы иммунного ответа. Отсутствие сенсибилизации организма матери к плоду может привести к неполноценному развитию плаценты, в результате чего может произойти ее отторжение и выкидыш. Иммунный конфликт при этом возникает из-за идентичности женщины и мужчины по двум и более антигенам гистосовместимости (HLA-антигенам). Развитию выкидыша способствуют инфекции репродуктивного тракта, анатомические аномалии
развития, тяжелые заболевания сердечно-сосудистой системы и печени, гормональные нарушения и иммуноконфликтная беременность, наличие перекрестнореагирующих антигенов сперматозоидов и эмбриона. В развитии выкидыша играют роль и антитела к фосфолипидам (ложноположительная реакция фон Вассермана, антифосфолипидный синдром). Высокие титры этих антител нарушают плацентарное кровоснабжение и могут вызвать гибель плода. Сохранение беременности осуществляют за счет антигенной незрелости плода, защитных (протективных) свойств матки, отсутствия общей сосудистой системы матери и плода и повышения продукции глюкокортикоидов для супрессии иммунного ответа матери.
Иммунологические конфликты во многих случаях служат основой патологии взаимоотношений мать-плод. Плод по существу является своеобразным аллотрансплантатом. Причины того, что в одних случаях беременность развивается нормально, а в других возникают иммунологически обусловленные осложнения, разнообразны. Многочисленные специфические и неспецифические факторы обеспечивают выживаемость плода, несмотря на его антигенную несовместимость. К ним относятся:
• особая организация пограничных между матерью и плодом тканей (трофобласт, децидуальная оболочка);
• защитное влияние антител, вырабатываемых против специфических антигенов плода;
• блокирующее действие иммунных комплексов антиген+антитело на плаценте;
• общее супрессивное влияние на иммунные клетки плацентарных белковых и стероидных гормонов, возникших при беременности;
• супрессивное действие лимфоцитов плода;
• блокирующие антитела у беременных против HLA-DR антигенов плода.
Нормальное течение беременности обеспечивается определенным состоянием иммунной системы, при котором плод развивается нормально под влиянием изоантител, Т-лимфоцитов и естественных киллеров, привлекаемых в плаценту и выделяющих цитокины, стимулирующие рост и дифференцировку тканей плода. В этом заключается целесообразность несовместимости между матерью и плодом. Сдвиги в этой иммунологической сети, индуцированные различными факторами, могут привести к развитию патологии беременности. Причиной этого могут быть генетическая предрасположенность, обусловливающая особые варианты несовместимости (резус-антигены),
и др. Некоторая степень иммунодепрессии при беременности, предохраняющая плод от гибели, обеспечивается гормональными и другими неспецифическими факторами. Целый ряд различных иммунологических показателей в течение беременности изменены (субпопуляции клеток, иммуноглобулины, реакция на антигены и аллергены). Еще более значительные изменения иммунореактивности выявлены при различной патологии беременности. При позднем токсикозе беременных обнаружена сенсибилизация лейкоцитов беременных к антигенам плода и плодных оболочек. Спонтанные первичные выкидыши и гибель плода могут обусловливаться наличием антифосфолипидных антител. Присутствие этих антител может сопровождаться тромбозами, тромбоцитопенией и другими признаками аутоиммунной реакции. Изучение уровня уиркулирующих иммунных комплексов при поздних токсикозах показало, что они могут явиться причиной иммунокомплексных поражений органов и тканей (почек - нефропатия, эклампсия, печени, сосудов, кожи).
Резус-конфликт, лежащий в основе гемолитической болезни ново- рождённых, является другим примером иммунопатологии беременности. Основа этого конфликта - наличие у плода Rh (D) антигена и отсутствие его у матери. Образующиеся при этом в организме матери неполные IgG-антитела могут проникать через плаценту и вызывать разрушение эритроцитов плода.
Таким образом, значимая роль иммунологических реакций в патологии репродукции свидетельствует о целесообразности изучения показателей иммунной системы и проведения таким пациентам иммуномодулирующей терапии.
10.1. Алгоритмы лабораторной диагностики при аменорее
Железы внутренней секреции, вырабатывающие гормоны, называются эндокринными («endon» - внутри, «krino» - отделять). Все органы репродуктивной системы гормонозависимы, поэтому нарушение работы эндокринных желез в той или иной степени оказывает влияние на репродукцию. Любое нарушение менструального цикла, подбор контрацептивных препаратов, назначение стимуляторов овуляции и сперматогенеза, лечение климактерических расстройств начинают с гормонального обследования. На детородную функцию влияют гормоны гипофиза, надпочечников, щитовидной железы, половые гормоны. При мужском бесплодии часто встречается нарушение сперматогенеза.
Лабораторная диагностика в акушерстве и гинекологии играет очень важную роль, поскольку в основе работы репродуктивной системы лежат циклические изменения продукции целого ряда гормонов, и диагностика нарушений в функционировании этой системы может быть обеспечена только лабораторными методами. Наиболее существенные показатели, отражающие функциональное состояние оси гипоталамус-гипофиз-яичники в течение менструального цикла:
• концентрация ФСГ, ЛГ и эстрадиола на 3-5-е сутки цикла;
• концентрация эстрадиола в предовуляторные дни (11-13-е сутки цикла);
• концентрация ФСГ, ЛГ и прогестерона на 7-е сутки после предполагаемой овуляции (22-23-и сутки цикла);
• пиковая концентрация ЛГ в дни овуляции.
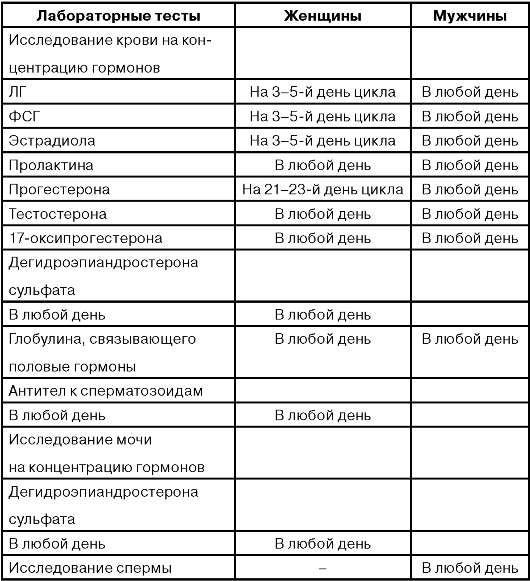
Исследование концентраций тестостерона, ДЭА-S, гормона, связывающего половые гормоны (ГСПГ), 17-оксипрогестерона следует выполнять только при наличии соответствующих клинических показаний (признаки гирсутизма, адреногенитальный синдром и др.) в любую фазу цикла. Мы рекомендуем выполнение этих исследований при первом визите пациента (на 5-7-е сутки цикла при его наличии).
Наиболее частая ошибка врачей-гинекологов - несоблюдение сроков исследования концентрации половых гормонов, что нивелирует эффективность гормональной диагностики.
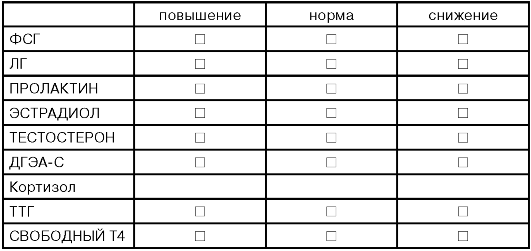
Значимы для диагностики нарушений репродуктивной функции следующие изменения уровня половых гормонов:
1. Высокие (в 2 и более раза выше нормы) концентрации ФСГ на пятые сутки в сочетании с низкими концентрациями эстрадиола свидетельствуют о низкой функциональной активности яичников и отсутствии доминирующего фолликула или его низкой гормональной активности.
2. Отсутствие нарастания концентрации эстрадиола в предовуляторные дни (недостаточность I фазы).
3. Низкая концентрациия прогестерона на 20-22-е сутки (недостаточность II фазы).
4. Отсутствие или низкая концентрация ЛГ в день овуляции.
При аменорее или дисменорее диагностический алгоритм должен быть иным. Мы рекомендуем следующую диагностическую последовательность.
1. Исключить беременность.
2. Определить наличие яичников.
3. Определить уровни ФСГ, ЛГ с интервалом в неделю. Высокие концентрации ЛГ и ФСГ свидетельствуют об отсутствии функции яичников. Низкие - о локализации нарушений на уровне гипоталамо-гипофизарной системы.
При нарушении генеративной функции необходимо определение гонадотропинов, пролактина, тестостерона и ГСПГ (глобулин, связывающий половые гормоны), 17-ОН-прогестерона. Вместо анализа мочи на 17-КС и 17-ОКС мы рекомендует определять в моче ДЭГА-S и кортизол. Этот набор тестов позволяет более точно судить о метаболизме стероидов в организме. ГСПГ оказывает огромное влияние на содержание в крови биологически активной «свободной» фракции стероидных половых гормонов. Изменения концентрации ГСПГ сопровождают целый ряд клинически значимых синдромов. Только по уровню ГСПГ может реально оценить активную фракцию тестостерона и эстрадиола.
Диагностическое значение определения ГСПГ. У женщин в крови концентрация глобулина обычно выше, чем у мужчин, особенно она повышается на поздних сроках беременности и после приема эстрогенов. Прием андрогенов приводит к снижению концентрации ГСПГ. У мужчин увеличение ГСПГ наблюдают при гипогонадизме, тестикулярной
недостаточности, гинекомастии, циррозе печени, у женщин - при приеме пероральных контрацептивов. Снижение концентрации обнаруживают при болезни Иценко-Кушинга, поликистозе яичников, гипотиреозе, синдроме гирсутизма у женщин. Уровень ГСПГ - высоко чувствительный тест для контроля эффективности лечения.
Каждой фазе менструального цикла соответствует определенное количество гормона в крови, поэтому для правильной интерпретации получаемых результатов необходимо знать референтные значения уровня гормонов для здоровых женщин по фазам цикла.
 ГИПЕРАНДРОГЕНИЯ
ГИПЕРАНДРОГЕНИЯ
Гиперандрогения - наиболее распространенное эндокринное нарушение у женщин фертильного возраста. Негативные метаболические нарушения ведут к риску развития гипертензии, сердечно-сосудистых заболеваний и инсулиннезависимого сахарного диабета.
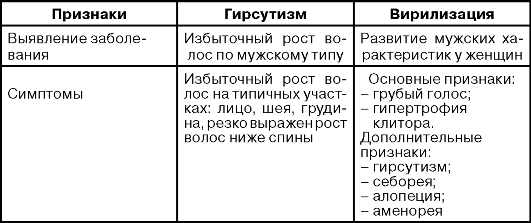
Диагностика основывается на обнаружении понижения или повышения уровней одного параметра однократно или определение в динамике. Наиболее часто определяемый параметр - определение концентрации тестостерона или индекса свободного тестостерона. У большинства пациентов обнаруживают повышение концентраций андростендиона и других предшественников (ДЭГА-S). Наиболее важное в диагностическом плане какое-либо повышение концентрации андрогенов, близкое к верхним или низшим референсным значениям.
ГИРСУТИЗМ
Гирсутизм - гормональная проблема, возникающая в результате избыточной продукции андрогенов из-за нарушений в надпочечниках и яичниках. Нарушения вызывают беспокойство в связи с избыточным ростом волос по мужскому типу. Обычно избыточный рост волос бывает на лице, шее, грудине, сильно выражен рост волос ниже спины. Симптомы - нерегулярные менструации, бесплодие, ожирение.
Причины увеличения продукции антрогенов и гирсутизма:
1. Причины, связанные с заболеваниями яичников:
- синдром поликистоза яичников;
- гипертекоз;
- андрогенпродуцирующая опухоль яичников;
- вирилизация беременных.
2. Причины, связанные с нарушениеями в надпочечниках:
- врожденная или приобретенная гиперплазия надпочечников;
- андрогенпродуцирующая опухоль надпочечников;
- синдром Кушинга.
3. Другие:
- идиопатический или наследственный гирсутизм;
- частичная тестикулярная феминизация;
- состояние в постменопаузе;
- ятрогенные (лекарственно-индуцируемые).
ПРИЗНАКИ ГИРСУТИЗМА И ВИРИЛИЗАЦИИ
 ЛАБОРАТОРНОЕ ОБСЛЕДОВАНИЕ, СВЯЗАННОЕ С ИЗБЫТКОМ АНДРОГЕНОВ У ЖЕНЩИН С ГИРСУТИЗМОМ
ЛАБОРАТОРНОЕ ОБСЛЕДОВАНИЕ, СВЯЗАННОЕ С ИЗБЫТКОМ АНДРОГЕНОВ У ЖЕНЩИН С ГИРСУТИЗМОМ
 Для интерпретации лабораторных результатов необходимо определить фазу цикла!
Для интерпретации лабораторных результатов необходимо определить фазу цикла!
ВИРИЛИЗАЦИЯ
Вирилизация - развитие мужских характеристик у женщин, таких как грубый голос, увеличение роста волос на теле и лице, уменьшение размера груди и облысение по мужскому типу.
Причины вирилизации:
• использование анаболических стероидов для наращивания мышечной массы;
• врожденная гиперплазия надпочечников, ряд врожденных заболеваний, характеризующихся дефектами энзимов, которые приводят к повышенной продукции андрогенов;
• синдром поликистоза яичников, киста, опухоль яичников.
Дополнительные причины:
• нарушение способности яичников продуцировать, формировать и выделять яйцеклетку;
• гипертрофия яичников;
• ранние менархе;
• нерегулярные менструации;
• ожирение;
• бесплодие.
АДРЕНОГЕНИТАЛЬНЫЙ СИНДРОМ
Адреногенитальный синдром - врожденная гиперплазия надпочечников, которая характеризуется семейными нарушениями гормональной продукции надпочечниками. Причина генетически детерминированных нарушений в метаболизме продукции стероидных гормонов - дефицит 21-гидролазы, которым страдают 95% больных. Лечение этих заболеваний включает гормонозаместительную терапию. Мониторирование показателей состава крови, подавление сверхбыстрого полового созревания и мониторирование скелетного формирования с помощью лабораторного обследования.
ПЛАН ЛАБОРАТОРНОГО ОБСЛЕДОВАНИЯ ПАЦИЕНТКИ
СО ВТОРИЧНОЙ АМЕНОРЕЕЙ
ТЕСТЫ ПЕРВОГО УРОВНЯ (ГОРМОНАЛЬНЫЙ СТАТУС)
 ДОПОЛНИТЕЛЬНЫЕ ТЕСТЫ /ДИАГНОСТИКА ГИПЕРПРОЛАКТИНЕМИИ/
ДОПОЛНИТЕЛЬНЫЕ ТЕСТЫ /ДИАГНОСТИКА ГИПЕРПРОЛАКТИНЕМИИ/
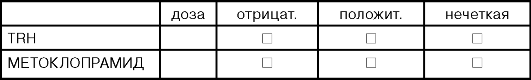 ДОПОЛНИТЕЛЬНЫЕ ТЕСТЫ /ПРИ ОСНОВНОМ ДИАГНОЗЕ САХАРНЫЙ ДИАБЕТ/
ДОПОЛНИТЕЛЬНЫЕ ТЕСТЫ /ПРИ ОСНОВНОМ ДИАГНОЗЕ САХАРНЫЙ ДИАБЕТ/
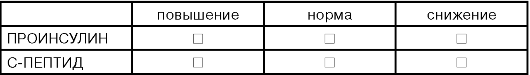 ДОПОЛНИТЕЛЬНЫЕ ТЕСТЫ /ИССЛЕДОВАНИЕ ЛГ И ФСГ В ПРОБЕ С ГОНАДОЛИБЕРИНОМ/
ДОПОЛНИТЕЛЬНЫЕ ТЕСТЫ /ИССЛЕДОВАНИЕ ЛГ И ФСГ В ПРОБЕ С ГОНАДОЛИБЕРИНОМ/
 ДОПОЛНИТЕЛЬНЫЕ ТЕСТЫ /ПРИ ГИПЕРАНДРОГЕНИИ/
ДОПОЛНИТЕЛЬНЫЕ ТЕСТЫ /ПРИ ГИПЕРАНДРОГЕНИИ/
 ДОПОЛНИТЕЛЬНЫЕ ТЕСТЫ /ПРИ ГИПЕРАНДРОГЕНИИ, АГС/
ДОПОЛНИТЕЛЬНЫЕ ТЕСТЫ /ПРИ ГИПЕРАНДРОГЕНИИ, АГС/
 ПЛАН ОБСЛЕДОВАНИЯ ПАЦИЕНТА С БЕСПЛОДИЕМ ГОРМОНАЛЬНЫЙ СТАТУС /БАЗАЛЬНЫЙ УРОВЕНЬ ГОРМОНОВ/
ПЛАН ОБСЛЕДОВАНИЯ ПАЦИЕНТА С БЕСПЛОДИЕМ ГОРМОНАЛЬНЫЙ СТАТУС /БАЗАЛЬНЫЙ УРОВЕНЬ ГОРМОНОВ/
 ДОПОЛНИТЕЛЬНЫЕ ГОРМОНАЛЬНЫЕ ТЕСТЫ
ДОПОЛНИТЕЛЬНЫЕ ГОРМОНАЛЬНЫЕ ТЕСТЫ
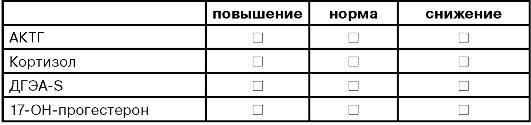 ДИАГНОСТИЧЕСКИЙ АЛГОРИТМ
ДИАГНОСТИЧЕСКИЙ АЛГОРИТМ
ЭНДОКРИННОГО БЕСПЛОДИЯ МУЖЧИН
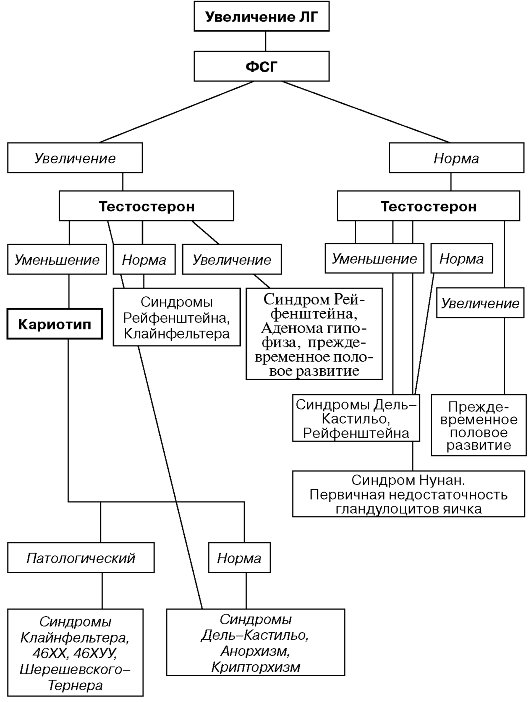 ДИАГНОСТИЧЕСКИЙ АЛГОРИТМ ЭНДОКРИННОГО
ДИАГНОСТИЧЕСКИЙ АЛГОРИТМ ЭНДОКРИННОГО
БЕСПЛОДИЯ МУЖЧИН
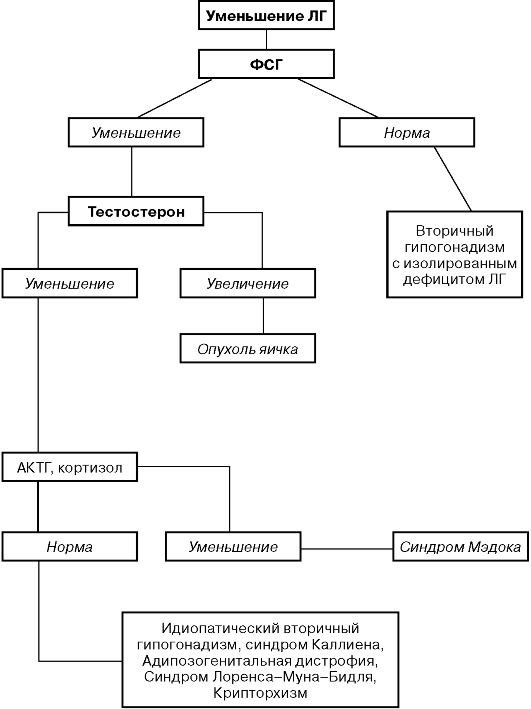 ДИАГНОСТИЧЕСКИЙ АЛГОРИТМ ЭНДОКРИННОГО
ДИАГНОСТИЧЕСКИЙ АЛГОРИТМ ЭНДОКРИННОГО
БЕСПЛОДИЯ МУЖЧИН