Внутренние болезни: учебник. - 6-е изд., перераб. и доп. / В. И. Маколкин, С. И. Овчаренко, В. А. Сулимов. - 2012. - 768 с. : ил.
|
|
|
|
Глава 7. ДИФФУЗНЫЕ ЗАБОЛЕВАНИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ
ДИФФУЗНЫЕ ЗАБОЛЕВАНИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Диффузные заболевания соединительной ткани (ДЗСТ) или коллагенозы (термин, имеющий историческое значение) - группа заболеваний, характеризующихся системным иммуновоспалительным поражением соединительной ткани и ее производных. Это групповое, но не нозологическое понятие, в связи с чем этим термином не следует обозначать отдельные нозологические формы.
ДЗСТ объединяют достаточно большое число заболеваний. Наиболее распространены СКВ, ССД и ДМ. К этой группе заболеваний также относят ОРЛ, традиционно описываемую в разделе заболеваний сердечно-сосудистой системы. В настоящее время доказано, что при ДЗСТ происходят глубокие нарушения иммунного гомеостаза, выражающиеся в развитии аутоиммунных процессов, т.е. реакций иммунной системы, сопровождающихся образованием антител или сенсибилизированных лимфоцитов, направленных против антигенов собственного организма.
В основе аутоиммунных нарушений лежит иммунорегуляторный дисбаланс, выражающийся в угнетении супрессорной и усилении хелперной активности Т-лимфоцитов с последующей активацией В-лимфоцитов и гиперпродукцией различных специфических аутоантител.
Существует ряд общих черт, объединяющих ДЗСТ:
• общность патогенеза - нарушение иммунного гомеостаза в виде неконтролируемой выработки аутоантител и образования иммунных комплексов «антиген-антитело», циркулирующих в крови и фиксирующихся в тканях с последующим развитием тяжелой воспалительной реакции (особенно в микроциркуляторном русле, почках, суставах и др.);
• сходство морфологических изменений (фибриноидное изменение основного вещества соединительной ткани, васкулиты, лимфоидные и плазмоклеточные инфильтраты и др.);
• хроническое течение с периодами обострений и ремиссий;
• обострение под влиянием неспецифических воздействий (инфекционные заболевания, инсоляция, вакцинация и др.);
• многосистемность поражения (кожа, суставы, серозные оболочки, почки, сердце, легкие);
• лечебный эффект иммуносупрессорных средств (глюкокортикоиды, цитостатические препараты).
Все заболевания, входящие в эту группу, отличаются клиническими и морфологическими признаками, поэтому в каждом конкретном случае следует стремиться к точному нозологическому диагнозу.
В этой главе представлен диагностический поиск при СКВ, ССД и ДМ.
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА
Системная красная волчанка (СКВ) - системное аутоиммунное заболевание, возникающее у лиц молодого возраста (преимущественно у женщин) и развивающееся на фоне генетически обусловленного несовершенства иммунорегуляторных процессов, что приводит к неконтролируемой продукции антител к собственным клеткам и их компонентам и развитию аутоиммунного и иммунокомплексного хронического поражения (В.А. Насонова, 1989). Сущность заболевания состоит в иммуновоспалительном поражении соединительной ткани, микроциркуляторного русла, кожи, суставов и внутренних органов, при этом ведущими считают висцеральные поражения, определяющие течение и прогноз болезни.
Заболеваемость СКВ составляет от 4 до 25 случаев на 100 тыс. населения. Заболевание чаще всего развивается у женщин детородного возраста. Во время беременности и в послеродовом периоде значительно возрастает риск обострения. Женщины страдают СКВ в 8-10 раз чаще мужчин. Пик заболеваемости приходится на возраст 15-25 лет. У детей соотношение заболевших девочек и мальчиков снижается и составляет 3:1. Смертность при СКВ в 3 раза выше, чем в популяции. У мужчин заболевание протекает столь же тяжело, как и у женщин.
СКВ принадлежит к генетически детерминированным заболеваниям: исследования, проведенные в популяции, показали, что предрасположенность к возникновению СКВ связана с определенными генами II класса гистосовместимости (HLA), генетически обусловленным дефицитом отдельных компонентов комплемента, а также с полиморфизмом генов некоторых рецепторов и фактором некроза опухоли α (ФНО-α).
Этиология
Конкретный этиологический фактор при СКВ не установлен, но ряд клинических симптомов (цитопенический синдром, эритема и энантема) и определенные закономерности развития болезни позволяют ассоциировать СКВ с заболеваниями вирусной этиологии. В настоящее время придают значение РНК-вирусам (медленные или латентные вирусы). Обнаружение семейных случаев заболевания, частое существование в семьях других ревматических или аллергических болезней и различных нарушений иммунитета позволяют думать о возможном значении семейно-генетической предрасположенности.
Манифестации СКВ способствует целый ряд неспецифических факторов - инсоляция, неспецифическая инфекция, введение сывороток, прием некоторых лекарственных средств (в частности, периферических вазодилататоров из группы гидралазинов), а также стресс. СКВ может начаться после родов или аборта. Все эти данные позволяют рассматривать СКВ как мультифакторное заболевание.
Патогенез
Вследствие воздействия на иммунную систему вируса, а возможно, и противовирусных антител, на фоне наследственной предрасположенности возникает дисрегуляция иммунного ответа, что приводит к гиперреактивности гуморального иммунитета. В организме больных происходит неконтролируемая продукция антител к различным его тканям, клеткам и белкам (в том числе к различным клеточным органеллам и ДНК). Установлено, что при СКВ вырабатываются аутоантитела примерно к сорока из более чем двухсот потенциальных антигенных клеточных компонентов. В дальнейшем происходят образование иммунных комплексов и их отложение в различных органах и тканях (преимущественно в микроциркуляторном русле). Характерны разнообразные дефекты иммунорегуляции, сопровождающиеся гиперпродукцией цитокинов (ИЛ-6, ИЛ-4 и ИЛ-10). Затем развиваются процессы, связанные с элиминацией фиксированных иммунных комплексов, что приводит к высвобождению лизосомальных ферментов, повреждению органов и тканей и развитию иммунного воспаления. В процессе воспаления и деструкции соединительной ткани высвобождаются новые антигены, вызывающие формирование антител и образование новых иммунных комплексов. Таким образом, возникает порочный круг, обеспечивающий хроническое течение заболевания.
Классификация
В настоящее время в нашей стране принята рабочая классификация клинических вариантов течения СКВ, учитывающая:
• характер течения;
• активность патологического процесса;
• клинико-морфологическую характеристику поражения органов и систем. Характер течения болезни
• Острое течение характеризуется быстрым развитием мультиорганных изменений (включая поражение почек и ЦНС) и высокой иммунологической активности.
• Подострое течение: в дебюте заболевания возникают основные симптомы, неспецифическое поражение кожи и суставов. Заболевание протекает волнообразно, с периодическими обострениями и развитием полиорганных нарушений в течение 2-3 лет с момента возникновения первых симптомов.
• Хроническое течение характеризуется длительным преобладанием одного или нескольких признаков: рецидивирующего полиартрита, синдрома дискоидной волчанки, синдрома Рейно, синдрома Верльгофа или синдрома Шегрена. Множественные органные поражения возникают к 5-10-му году болезни.
Фаза и степень активности процесса:
• активная (высокая активность - III, умеренная - II, минимальная -I);
• неактивная (ремиссия).
Клинико-морфологическая характеристика поражений:
• кожи (симптом «бабочки», капилляриты, экссудативная эритема, пурпура, дискоидная волчанка и др.);
• суставов (артралгии, острый, подострый и хронический полиартрит);
• серозных оболочек (полисерозит - плеврит, перикардит и переспленит);
• сердца (миокардит, эндокардит, недостаточность митрального клапана);
• легких (острый и хронический пневмонит, пневмосклероз);
• почек (люпус-нефрит нефротического или смешанного типа, мочевой синдром);
• нервной системы (менингоэнцефалополирадикулоневрит, полиневрит).
При хроническом течении болезни у 20-30% больных развивается так называемый антифосфолипидный синдром, представленный клинико-лабораторным симптомокомплексом, включающим венозные и (или) артериальные тромбозы, различные формы акушерской патологии, тромбоцитопению и разнообразные поражения органов. Характерный иммунологический признак - образование антител, реагирующих с фосфолипидами и фосфолипидсвязывающими белками (более детально о антифосфолипидном синдроме будет сказано далее).
Выделяют также три степени активности патологического процесса, характеризующей выраженность потенциально обратимого иммуновоспалительного повреждения и определяющей особенности лечения каждого конкретного больного. Активность следует отличать от тяжести заболевания, под которой понимаются совокупность необратимых изменений, потенциально опасных для больного.
Клиническая картина
Клиническая картина болезни чрезвычайно разнообразна, что связано с множественностью поражения органов и систем, характером течения, фазой и степенью активности воспалительного процесса.
На первом этапе диагностического поиска получают информацию, на основании которой можно составить представление:
• о варианте начала заболевания;
• характере течения болезни;
• степени вовлечения в патологический процесс тех или иных органов и систем;
• ранее проводимом лечении, его эффективности и возможных осложнениях.
Варианты начала болезни могут быть самыми разнообразными. Чаще всего оно представлено сочетанием различных синдромов. Моносимптомное начало, как правило, не характерно. В связи с этим предположение о заболевании СКВ возникает с момента обнаружения у больного такого сочетания. В этом случае повышается диагностическая ценность тех или иных синдромов.
В раннем периоде СКВ наиболее распространенными считают синдромы поражения суставов, кожи и серозных оболочек, а также лихорадку. Таким образом, наиболее подозрительными в отношении СКВ будут сочетания:
• лихорадки, полиартрита и трофических нарушений кожи (в частности, выпадение волос - алопеция);
• полиартрита, лихорадки и поражения плевры (плеврит);
• лихорадки, трофических нарушений кожи и поражения плевры.
Диагностическая значимость этих сочетаний в существенной мере повышается, если поражение кожи представлено эритемой, но в начальном периоде болезни ее регистрируют лишь в 25% случаев. Тем не менее это обстоятельство не снижает диагностического значения вышеперечисленных сочетаний.
Малосимптомное начало болезни не характерно, но отмечен дебют СКВ с возникновения массивных отеков вследствие развития с самого начала диффузного гломерулонефрита (люпус-нефрита) нефротического или смешанного типа.
Вовлечение в патологический процесс различных органов манифестирует симптомами их воспалительного поражения (артрит, миокардит, перикардит, пневмонит, гломерулонефрит, полиневрит и др.).
Сведения о ранее проводимом лечении позволяют судить:
• о его оптимльности;
• об остроте течения болезни и степени активности процесса (начальные дозы глюкокортикоидов, длительность их применения, поддерживающие дозы, включение в лечебный комплекс цитостатиков при выраженных иммунных расстройствах, высокой активности люпус-нефрита и т.д.);
• об осложнениях глюкокортикоидного и цитостатического лечения.
На первом этапе можно сделать определенные выводы относительно диагноза при длительном течении болезни, но в ее дебюте диагноз устанавливают на дальнейших этапах исследования.
На втором этапе диагностического поиска можно получить множество данных, свидетельствующих о поражении органов и степени их функциональной недостаточности.
Поражение опорно-двигательного аппарата манифестирует полиартритом, напоминающим РА симметричным поражением мелких суставов кисти (проксимальных межфаланговых, пястно-фаланговых, лучезапястных) и крупных суставов (реже). При развернутой клинической картине заболевания определяют дефигурацию суставов, обусловленную периартикулярным отеком. В течение болезни развиваются деформации мелких суставов. Суставные изменения могут сопровождаться поражением мышц в виде диффузных миалгий, и очень редко - истинным ПМ с отеком и слабостью мышц. Иногда поражение представлено лишь артралгиями.
Поражение кожного покрова отмечают так же часто, как и суставов. Наиболее типичны эритематозные высыпания на лице в области скуловых дуг и спинки носа («бабочка»). Воспалительные высыпания на носу и щеках, повторяющие очертания «бабочки», представлены различными вариантами:
• сосудистой (васкулитной) «бабочкой» - нестойким, пульсирующим, разлитым покраснением кожи с цианотичным оттенком в средней зоне лица,
усиливающимся под действием внешних факторов (инсоляция, ветер, холод) или волнения;
• «бабочкой» типа центробежной эритемы (изменения кожи локализуются только в области переносицы).
Кроме «бабочки» можно обнаружить дискоидные высыпания - эритематозные приподнимающиеся бляшки с кератическим нарушением и последующим развитием атрофии кожи лица, конечностей и туловища. Наконец, у части больных отмечают неспецифическую экссудативную эритему на коже конечностей и грудной клетки, а также признаки фотодерматоза на открытых частях тела.
К поражениям кожного покрова относят капиллярит - мелкоточечную геморрагическую сыпь на подушечках пальцев рук, ногтевых ложах и ладонях. Кожные поражения могут сочетаться с энантемой на твердом нёбе. На слизистой оболочке рта или носоглоточной области можно обнаружить безболезненные изъязвления.
Поражение серозных оболочек возникает у 90% больных (классическая диагностическая триада - дерматит, артрит, полисерозит). Особенно часто обнаруживают поражение плевры и перикарда, реже - брюшины. Симптомы плеврита и перикардита описаны в предыдущих разделах, поэтому далее будут перечислены лишь их особенности при СКВ:
• чаще возникает сухой плеврит и перикардит;
• при выпотных формах количество экссудата невелико;
• поражение серозных оболочек кратковременно, и обычно его диагностируют ретроспективно при обнаружении плевроперикардиальных спаек или утолщения костальной, междолевой и медиастинальной плевры при рентгенологическом исследовании;
• отмечают выраженную тенденцию к развитию слипчивых процессов (всевозможные сращения и облитерация серозных полостей).
Для СКВ весьма характерно поражение сердечно-сосудистой системы, возникающее на различных этапах течения болезни.
Чаще всего обнаруживают перикардиты, склонные к рецидивированию. Значительно чаще, чем считали ранее, отмечают поражение эндокарда в виде бородавчатого эндокардита (волчаночный эндокардит) на створках митрального, аортального или трехстворчатого клапана. При длительном течении процесса на втором этапе поиска можно обнаружить признаки недостаточности соответствующего клапана (признаки стенозирования отверстия, как правило, отсутствуют).
Очаговый миокардит практически никогда не регистрируют, но диффузное поражение, особенно при тяжелом течении, сопровождается определенными симптомами (см. «Миокардит»).
Поражение сосудов может манифестировать синдромом Рейно, для которого характерны приступообразно развивающиеся расстройства артериального кровоснабжения кистей и (или) стоп, возникающие под действием холода или волнения. Во время приступа отмечают парестезии; кожа пальцев становится бледной и (или) цианотичной, пальцы холодные. Преимущественно возникает поражение II-V пальцев кистей и стоп, реже - других дистальных участков тела (носа, ушей, подбородка и др.).
Поражения легких могут быть обусловлены основным заболеванием и вторичной инфекцией. Воспалительный процесс в легких (пневмонит) протекает остро либо продолжается месяцами и манифестирует признаками синдрома воспалительной инфильтрации легочной ткани, аналогичными таковым при пневмонии. Особенность процесса состоит в возникновении малопродуктивного кашля в сочетании с одышкой. Другой вариант поражения легких - хронические интерстициальные изменения (воспаление периваскулярной, перибронхиальной и междольковой соединительной ткани), выражающиеся в развитии медленно прогрессирующей одышки и изменений легких при рентгенологическом исследовании. Характерные физикальные данные практически отсутствуют, так что судить о подобном поражении легких на втором этапе диагностического поиска практически невозможно.
Поражение ЖКТ, как правило, представлено субъективными признаками, обнаруживаемыми на первом этапе. При физикальном обследовании иногда обнаруживают неопределенную болезненность в эпигастральной области и в месте проекции поджелудочной железы, а также признаки стоматита. В ряде случаев развивается гепатит: отмечают увеличение и болезненность печени.
Чаще всего при СКВ возникает поражение почек (волчаночный гломерулонефрит или люпус-нефрит), от эволюции которого зависит дальнейшая судьба больного. Поражение почек при СКВ может протекать в виде различных вариантов, поэтому данные непосредственного обследования больного могут широко варьировать. При изолированных изменениях мочевого осадка какихлибо нарушений во время физикального исследования не обнаруживают. При гломерулонефрите, протекающем с нефротическим синдромом, определяют массивные отеки и нередко - АГ. При формировании хронического нефрита с постоянной АГ обнаруживают увеличение левого желудочка и акцент II тона во втором межреберье справа от грудины.
Аутоиммунная тромбоцитопения (синдром Верльгофа) манифестирует типичными высыпаниями в виде геморрагических пятен различной величины на коже внутренней поверхности конечностей, коже груди и живота, а также на слизистых оболочках. После незначительных травм (например, после экстракции зуба) возникают кровотечения. Носовые кровотечения иногда приобретают профузный характер и приводят к анемии. Кожные кровоизлияния могут иметь различную окраску: сине-зеленоватую, бурую или желтую. Нередко СКВ длительно манифестирует лишь синдромом Верльгофа без других типичных клинических симптомов.
Поражение нервной системы выражено в различной степени, так как в патологический процесс вовлекаются практически все ее отделы. Больные предъявляют жалобы на головные боли мигренозного характера. Иногда возникают судорожные припадки. Возможны нарушения мозгового кровообращения вплоть до развития инсульта. При обследовании больного обнаруживают признаки полиневрита с нарушением чувствительности, болезненностью по ходу нервных стволов, снижением сухожильных рефлексов и парестезиями. Органический мозговой синдром характеризуется эмоциональной лабильностью, эпизодами депрессии, нарушением памяти и слабоумием.
Поражение ретикулоэндотелиальной системы представлено ранним симптомом генерализации процесса - полиаденопатией (увеличение всех групп лимфатических узлов, не достигающее значительной степени), а также, как правило, умеренным увеличением селезенки и печени.
Поражение органа зрения манифестирует сухим кератоконъюнктивитом, что обусловлено патологическими изменениями слезных желез и нарушением их функции. Сухость глаз приводит к развитию конъюнктивита, эрозий роговицы или кератита с нарушением зрения.
При антифосфолипидном синдроме можно обнаружить венозные (в глубоких венах нижних конечностей с повторными тромбоэмболиями легочной артерии) и артериальные (в артериях головного мозга, приводящие к инсультам и транзиторным ишемическим атакам) тромбозы. Регистрируют клапанные пороки сердца, внутрисердечные тромбы, имитирующие миксому сердца, и тромбозы коронарных артерий с развитием ИМ. Поражения кожи при антифосфолипидном синдроме разнообразны, но наиболее распространенное из них - сетчатое ливедо (livedo reticularis).
Таким образом, после второго этапа обследования обнаруживают полиорганность поражений, причем их степень весьма различна: от едва клинически заметных (субклинических) до выраженных, преобладающих над остальными, что создает предпосылки для диагностических ошибок - интерпретации этих изменений в качестве признаков самостоятельных заболеваний (например, гломерулонефрита, миокардита, артрита).
Третий этап диагностического поиска при СКВ имеет очень большое значение, так как:
• помогает поставить окончательный диагноз;
• демонстрирует выраженность иммунных нарушений и степень поражения внутренних органов;
• позволяет определить степень активности патологического (волчаночного) процесса.
На третьем этапе наибольшее значение приобретает лабораторное исследование крови. Выделяют две группы показателей.
• Показатели, имеющие прямое диагностическое значение (указывают на выраженные иммунологические нарушения):
- LE-клетки (клетки красной волчанки) - зрелые нейтрофилы, фагоцитирующие ядерные белки других клеток крови, распавшихся под действием АНФ.
- АНФ - гетерогенная популяция аутоантител, реагирующих с различными компонентами клеточного ядра и циркулирующих в крови (у 95% больных обнаруживают в титре 1:32 и выше). Отсутствие АНФ в подавляющем большинстве случаев свидетельствует против диагноза СКВ.
- АНА - антитела к нативной (т.е. к целой молекуле) ДНК. Повышение их концентрации коррелирует с активностью заболевания и развитием волчаночного нефрита. Их обнаруживают у 50-90% больных.
- Антитела к Sm-ядерному антигену (анти-Sm) высокоспецифичны для СКВ. Антитела к Ro/La рибонуклеопротеину считают специфичными для СКВ (методом иммунофлюоресценции их обнаруживают в 30% случаев, методом гемагглютинации - у 20% пациентов).
- Феномен «розетки» - свободно лежащие в тканях измененные ядра (гематоксилиновые тельца), окруженные лейкоцитами.
- Диагностика антифосфолипидного синдрома при СКВ основана на определении волчаночных антикоагулянтов - специфических антител к фосфолипидам, которые обнаруживают при определении свертываемости крови с помощью функциональных тестов (определение увеличенного тромбопластинового времени) и антител к кардиолипину с помощью иммуноферментного анализа. Термин «волчаночный антикоагулянт» не верен, так как основной клинический признак присутствия вышеуказанных антител - тромбоз, а не кровотечение. Указанные антитела обнаруживают и при так называемом первичном антифосфолипидном синдроме - самостоятельном заболевании, при котором возникают тромбозы, акушерская патология, тромбоцитопения, сетчатое ливедо и аутоиммунная гемолитическая анемия.
• Неспецифические острофазовые показатели, к которым относят:
- диспротеинемию с повышенным содержанием α2- и γ-глобулинов;
- обнаружение СРБ;
- увеличение концентрации фибриногена;
- повышение СОЭ.
При выраженных суставных поражениях в небольшом титре можно обнаружить РФ - антитело к Fc-фрагменту IgG.
При исследовании периферической крови можно обнаружить лейкопению (1-1,2х109/л) со сдвигом лейкоцитарной формулы до юных форм и миелоцитов в сочетании с лимфопенией (5-10% лимфоцитов). Возможна умеренная гипохромная анемия, в некоторых случаях - гемолитическая анемия, сопровождающаяся желтухой, ретикулоцитозом и положительной пробой Кумбса. Иногда регистрируют тромбоцитопению в сочетании с синдромом Верльгофа.
Для поражения почек характерны изменения в моче, которые можно классифицировать следующим образом (И.Е. Тареева, 1983):
• субклиническая протеинурия (содержание белка в моче 0,5 г/сут, часто - в сочетании с небольшой лейкоцитурией и эритроцитурией);
• более выраженная протеинурия, служащая выражением нефротического синдрома, сопровождающего подострый или активный волчаночный нефрит.
Очень высокая протеинурия (как, например, при амилоидозе) развивается редко. Отмечают умеренную гематурию. Лейкоцитурия может быть следствием как волчаночного воспалительного процесса в почках, так и результатом нередкого присоединения вторичного инфекционного поражения мочевыводящих путей.
При пункционной биопсии почек обнаруживают неспецифические мезангиомембранозные изменения, часто - с фибропластическим компонентом. Характерным считают:
• обнаружение в препаратах свободно лежащих в почечной ткани измененных ядер (гематоксилиновых телец);
• капиллярные мембраны клубочков в виде проволочных петель;
• отложение на базальной мембране клубочков фибрина и иммунных комплексов в виде электронно-плотных депозитов.
По классификации ВОЗ выделяют следующие морфологические типы волчаночного нефрита:
• класс I - отсутствие изменений.
• класс II - мезангиальный тип;
• класс III - очаговый пролиферативный тип;
• класс IV - диффузный пролиферативный тип;
• класс V - мембранозный тип;
• класс VI - хронический гломерулосклероз.
При рентгенологическом исследовании обнаруживают:
• изменения в суставах (при суставном синдроме - эпифизарный остеопороз в суставах кистей и лучезапястных суставах, при хроническом течении артрита и деформациях - сужение суставной щели с подвывихами);
• изменения в легких при развитии пневмонита (при длительном течении болезни - дисковидные ателектазы, усиление и деформацию легочного рисунка в сочетании с высоким стоянием диафрагмы);
• изменения со стороны сердца при развитии волчаночного порока или экссудативного перикардита.
ЭКГ позволяет обнаружить неспецифические изменения конечной части желудочкового комплекса (зубец Т и сегмент ST), аналогичные описанным ранее при миокардите и перикардите.
КТ и МРТ головного мозга обнаруживают патологические изменения с поражением ЦНС.
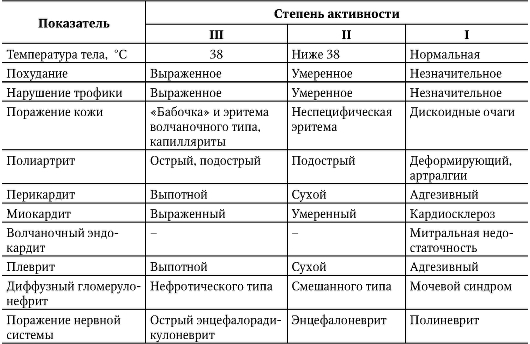
При проведении диагностического поиска необходимо также определить степень активности волчаночного процесса (табл. 7-1).
Таблица 7-1. Критерии активности патологического процесса при системной красной волчанке (Насонова В.А., 1989)
Оконгание табл. 7-1
Диагностика
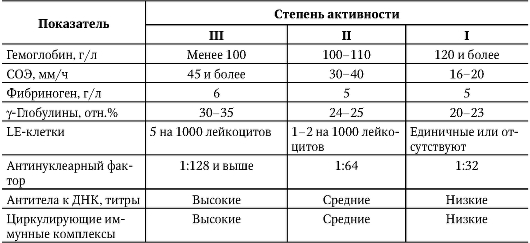
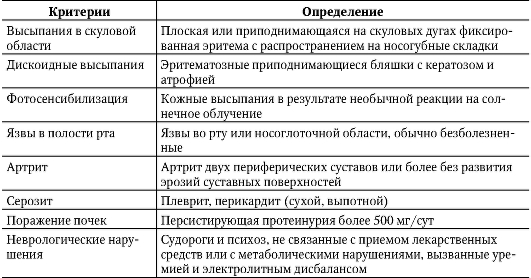
В случаях классического течения СКВ-диагностика проста и основана на обнаружении «бабочки», рецидивирующего полиартрита и полисерозита, составляющих клиническую диагностическую триаду, дополняемую присутствием LE-клеток или АНФ в диагностических титрах. Вспомогательное значение имеет молодой возраст больных, связь с родами, абортами, началом менструальной функции, инсоляцией и инфекционными заболеваниями. Значительно сложнее установить диагноз в других случаях, особенно если вышеперечисленные классические диагностические признаки отсутствуют. В этой ситуации помогают диагностические критерии, разработанные Американской ревматологической ассоциацией (АРА) в 1982 г. и пересмотренные в 1992 г. (табл. 7-2).
Таблица 7-2. Диагностические критерии системной красной волчанки (АРА)
Окончание табл. 7-2

Диагноз достоверен при обнаружении соответствия четырем критериям или более. Если присутствует менее четырех критериев, то диагноз СКВ сомнителен, и требуется динамическое наблюдение за больным. Такой подход имеет четкое обоснование: он предостерегает от назначения таким больным глюкокортикоидов, так как с такими же симптомами могут протекать и другие заболевания (в том числе паранеопластический синдром), при которых их применение противопоказано.
Дифференциальная диагностика
СКВ следует дифференцировать с целым рядом заболеваний. Насколько велик перечень органов и систем, вовлекаемых в патологический процесс при СКВ, настолько же обширен и список заболеваний, которые можно ошибочно диагностировать у больного. СКВ может в большей степени имитировать различные патологические состояния. Это особенно часто случается в дебюте заболевания, а также при доминирующем поражении одного-двух органов (систем). Например, обнаружение в начале болезни поражения плевры можно расценить как плеврит туберкулезной этиологии; миокардит можно трактовать как ревматический или неспецифический. Особенно много ошибок допускают, если СКВ дебютирует гломерулонефритом. В подобных случаях ставят диагноз только гломерулонефрита.
СКВ чаще всего приходится дифференцировать от ОРЛ (ревматизмом), ИЭ, хронического активного гепатита (ХАГ), геморрагических диатезов (тромбоцитопенической пурпуры) и других болезней из группы ДЗСТ.
Необходимость дифференциальной диагностики с ревматизмом возникает, как правило, у подростков и юношей в дебюте заболевания - при возникновении артрита и лихорадки. Ревматический артрит отличается от волчаночного большей остротой симптомов, преимущественным поражением крупных суставов и скоротечностью. Не следует придавать дифференциально-диагностического значения предшествующему инфекционному поражению (ангине), поскольку оно может послужить неспецифическим фактором, вызывающим развитие клинических признаков СКВ. Диагноз ревматизма становится достоверным с момента возникновения признаков поражения сердца (ревмокардит). Последующее динамическое наблюдение позволяет обнаружить формирующийся порок сердца, тогда как при СКВ, если и формируется недостаточность митрального клапана, то она выражена незначительно и не сопровождается отчетливыми
гемодинамическими нарушениями. Митральная регургитация выражена незначительно. В отличие от СКВ, в острой стадии ревматизма отмечают лейкоцитоз. АНФ не обнаруживают.
Дифференциальная диагностика между СКВ и РА затруднительна в начальной стадии болезни, что связано со сходством клинической картины: возникает симметричное поражение мелких суставов кисти, в процесс вовлекаются новые суставы, характерна утренняя скованность. Дифференциальная диагностика основана на преобладании при РА в пораженных суставах пролиферативного компонента, раннем развитии гипотрофии мышц, приводящих в движение пораженные суставы, и стойкости суставных поражений. Эрозии суставных поверхностей при СКВ отсутствуют, но служат характерным признаком РА. Высокий титр РФ характерен для РА. При СКВ его обнаруживают редко и в невысоком титре. Исключительно сложна дифференциальная диагностика СКВ и висцеральной формы РА. Уточненная диагностика в обоих случаях не влияет на характер лечения (назначение глюкокортикоидов).
При ХАГ могут возникать системные нарушения в виде лихорадки, артрита, плеврита, кожных высыпаний и гломерулонефрита. Можно обнаружить лейкопению, тромбоцитопению, LE-клетки и АНФ. При проведении дифференциальной диагностики следует учитывать:
• ХАГ чаще развивается в среднем возрасте;
• в анамнезе у больных ХАГ есть указания на перенесенный вирусный гепатит;
• при ХАГ обнаруживают выраженные изменения структуры и функции печени (цитолитический и холестатический синдром, признаки печеночной недостаточности, гиперспленизм, портальная гипертензия);
• при СКВ поражение печени возникает не всегда и протекает в виде гепатита легкого течения (с умеренными признаками цитолитического синдрома);
• при ХАГ обнаруживают различные маркеры вирусного поражения печени (противовирусные антитела и вирусный антиген).
При первичном ИЭ быстро возникает поражение сердца (недостаточность аортального или митрального клапана), а антибактериальная терапия дает отчетливый эффект. LE-клетки, антитела к ДНК, АНФ, как правило, отсутствуют. При своевременном проведении бактериологического исследования обнаруживают рост патогенной микрофлоры.
При тромбоцитопенической пурпуре (идиопатической или симптоматической) отсутствуют многие синдромы, наблюдаемые при СКВ, типичные лабораторные признаки (LE-клетки, АНФ, антитела к ДНК) и лихорадка.
Наиболее сложна дифференциальная диагностика с другими заболеваниями из группы ДЗСТ. Такие состояния, как ССД и ДМ, могут иметь множество общих черт с СКВ. Это обстоятельство усугубляет возможность обнаружения при этих заболеваниях АНФ и LE-клеток, хотя и в меньшем титре. Основные дифференциально-диагностические признаки - более частое и выраженное поражение внутренних органов (особенно почек) при СКВ, совершенно иной характер поражения кожи при ССД и четкий миопатический синдром при ДМ. В ряде случаев поставить правильный диагноз позволяет только длительное
динамическое наблюдение за больным. Иногда на это уходит много месяцев и даже лет (особенно при хроническом течении СКВ с минимальной степенью активности).
Формулировка развернутого клинического диагноза СКВ должна учитывать все рубрики, приведенные в рабочей классификации заболевания. Диагноз должен отражать:
• характер течения болезни (острое, подострое, хроническое), а при хроническом течении (обычно - моноили олигосиндромном) следует указать ведущий клинический синдром;
• активность процесса;
• клинико-морфологическую характеристику поражения органов и систем с указанием стадии функциональной недостаточности (например, при люпус-нефрите - стадия почечной недостаточности, при миокардите - существование или отсутствие сердечной недостаточности, при поражении легких - существование или отсутствие дыхательной недостаточности и др.);
• указание на проводимое лечение (например, глюкокортикоидами);
• осложнения лечения (если они есть).
Лечение
Учитывая патогенез заболевания, больным СКВ рекомендовано комплексное патогенетическое лечение. Его задачи:
• подавление иммунного воспаления и иммунокомплексных нарушений (неконтролируемого иммунного ответа);
• предупреждение осложнений иммуносупрессивной терапии;
• лечение осложнений, возникающих в процессе проведения иммуносупрессивной терапии;
• воздействие на отдельные, резко выраженные синдромы;
• удаление из организма ЦИК и антител.
Прежде всего, необходимо исключить психоэмоциональные стрессы, инсоляцию, активно лечить сопутствующие инфекционные заболевания, употреблять нежирную пищу с высоким содержанием полиненасыщенных жирных кислот, кальция и витамина Д. В период обострения болезни и на фоне лечения цитостатическими препаратами необходима активная контрацепция. Не следует принимать контрацептивы с высоким содержанием эстрогенов, поскольку они вызывают обострение заболевания.
Для подавления иммунного воспаления и иммунокомплексных нарушений при лечении СКВ применяют основные иммуносупрессоры: глюкокортикоиды короткого действия, цитостатические препараты и аминохинолиновые производные. Длительность лечения, выбор препарата, а также поддерживающие дозы определяются:
• степенью активности заболевания;
• характером течения (остротой);
• обширностью вовлечения в патологический процесс внутренних органов;
• переносимостью глюкокортикоидов или цитостатиков, а также существованием или отсутствием осложнений иммуносупрессивной терапии;
• существованием противопоказаний.
В начальных стадиях болезни при минимальной активности процесса и преобладании в клинической картине поражения суставов глюкокортикоиды следует назначать в небольших дозах (преднизолон в дозе менее 10 мг/сут). Больные должны находиться на диспансерном учете, чтобы при возникновении первых признаков обострения заболевания врач мог своевременно назначить лечение глюкокортикоидами в оптимальной дозе.
При хроническом течении болезни с преимущественным поражением кожи в течение многих месяцев можно применять хлорохин (в дозе 0,25 г/сут) или гидроксихлорохин.
При возникновении признаков высокой активности и генерализации процесса с вовлечением в него внутренних органов необходимо немедленно перейти на более эффективное иммуносупрессивное лечение глюкокортикоидами: назначают преднизолон в дозе 1 мг/сут и более. Длительность приема высоких доз колеблется от 4 до 12 нед. Снижение дозы следует проводить постепенно, под тщательным клинико-лабораторным контролем. Поддерживающие дозы (по 5-10 мг/сут) больные должны принимать в течение многих лет.
Таким образом, основной метод лечения СКВ - применение глюкокортикоидов. При их использовании следует придерживаться следующих принципов:
• начинать лечение только при подтверждении диагноза СКВ (при подозрении применять эти препараты не следует);
• доза глюкокортикоидов должна быть достаточной для подавления активности патологического процесса;
• лечение подавляющей дозой следует проводить до достижения выраженного клинического эффекта (улучшение общего состояния, нормализация температуры тела, улучшение лабораторных показателей, положительная динамика органных изменений);
• после достижения эффекта следует постепенно переходить на поддерживающие дозы;
• обязательна профилактика осложнений лечения глюкокортикоидами. Для предупреждения побочного действия глюкокортикоидов применяют:
• препараты калия (оротовая кислота, калия хлорид, калия и магния аспарагинат);
• анаболические средства (метандиенон в дозе 5-10 мг);
• мочегонные (салуретики);
• гипотензивные препараты (ингибиторы АПФ);
• антацидные средства.
При развитии тяжелых осложнений назначают:
• антибиотики (при вторичной инфекции);
• противотуберкулезные препараты (при развитии туберкулеза, чаще - легочной локализации);
• препараты инсулина, диетическое питание (при сахарном диабете);
• противогрибковые средства (при кандидозе);
• противоязвенное лечение (при образовании стероидной язвы).
Во время лечения глюкокортикоидами возникают ситуации, когда необходимо введение экстравысоких доз преднизолона (внутривенно капельно в дозе 1000 мг в течение 30 мин на протяжении трех дней):
• резкое увеличение (всплеск) активности процесса (III степень), несмотря на, казалось бы, оптимальное лечение;
• резистентность к дозам, с помощью которых ранее достигали положительного эффекта;
• выраженные органные изменения (нефротический синдром, пневмонит, генерализованный васкулит, цереброваскулит).
Подобная пульс-терапия приостанавливает образование иммунных комплексов вследствие торможения синтеза антител к ДНК. Снижение концентрации последних, вызванное глюкокортикоидами, приводит к образованию иммунных комплексов меньших размеров (в результате диссоциации более крупных).
Значительное подавление активности процесса после проведения пульстерапии позволяет в дальнейшем назначать небольшие поддерживающие дозы глюкокортикоидов. Пульс-терапия наиболее эффективна у больных молодого возраста с небольшой длительностью заболевания.
Лечение глюкокортикоидами не всегда оказывается успешным, что обусловлено:
• необходимостью снижения дозы при развитии осложнений, несмотря на то, что такая терапия эффективна у конкретного больного;
• непереносимостью глюкокортикоидов;
• резистентностью к лечению глюкокортикоидами (обычно обнаруживают достаточно рано).
В подобных случаях (особенно при развитии пролиферативного или мембранозного люпус-нефрита) назначают цитостатики: циклофосфамид (ежемесячное внутривенное болюсное введение в дозе 0,5-1 г/м2 в течение не менее 6 мес, а затем - каждые 3 мес в течение 2 лет) в сочетании с преднизолоном в дозе 10-30 мг/сут. В дальнейшем можно вернуться к лечению глюкокортикоидами, так как резистентность к ним обычно исчезает.
Для лечения менее тяжелых, но резистентных к глюкокортикоидам симптомов болезни назначают азатиоприн (по 1-4 мг/кг в сутки) или метотрексат (по 15 мг/нед) и циклоспорин (в дозе менее 5 мг/кг в сутки) в сочетании с невысокими дозами преднизолона (по 10-30 мг/сут).
Критерии оценки эффективности применения цитостатиков:
• уменьшение или исчезновение клинических признаков;
• исчезновение стероидорезистентности;
• стойкое снижение активности процесса;
• предотвращение прогрессирования люпус-нефрита. Осложнения цитостатической терапии:
• лейкопения;
• анемия и тромбоцитопения;
• диспептические явления;
• инфекционные осложнения.
При снижении числа лейкоцитов менее 3,0х109/л дозу препарата следует снизить до 1 мг/кг массы тела. При дальнейшем нарастании лейкопении препарат отменяют и на 50% увеличивают дозу преднизолона.
Широкое распространение получили экстракорпоральные методы лечения - плазмаферез и гемосорбция. Они позволяют удалять из организма ЦИК, повысить чувствительность клеточных рецепторов к глюкокортикоидам и уменьшить интоксикацию. Их применяют при генерализованном васкулите, тяжелом органном поражении (люпус-нефрит, пневмонит, цереброваскулит), а также при выраженных иммунных нарушениях, плохо поддающихся лечению глюкокортикоидами.
Обычно экстракорпоральные методы применяют в сочетании с пульстерапией или, при ее неэффективности, самостоятельно. Следует отметить, что при цитопеническом синдроме экстракорпоральные методы не применяют.
Больным с высоким титром антифосфолипидных антител в крови, но без клинических признаков антифосфолипидного синдрома, назначают небольшие дозы ацетилсалициловой кислоты (по 75 мг/сут). При подтвержденном антифосфолипидном синдроме, сопровождающемся клиническими признаками, применяют гепарин натрия и малые дозы ацетилсалициловой кислоты.
Для лечения мышечно-скелетных нарушений (артриты, артралгии, миалгии) и умеренно выраженного серозита можно применять обычные дозы НПВС.
Прогноз
В последние годы в связи с применением эффективных методов лечения прогноз улучшился: через 10 лет после установления диагноза выживаемость составляет 80%, а через 20 лет - 60%. У 10% больных, особенно при поражении почек (смерть наступает вследствие прогрессирования ХПН) или цереброваскулите, прогноз остается неблагоприятным.
Профилактика
Так как этиология СКВ неизвестна, первичную профилактику не проводят. Тем не менее выделяют группу риска, к которой относят, прежде всего, родственников больных, а также лиц, страдающих изолированным кожным поражением (дискоидная волчанка). Они должны избегать инсоляции, переохлаждения, не должны подвергаться прививкам, получать грязелечение и другие бальнеопроцедуры.
СИСТЕМНАЯ СКЛЕРОДЕРМИЯ
ССД - системное заболевание соединительной ткани и мелких сосудов, характеризующееся воспалением и распространенными фиброзно-склеротическими изменениями кожи и внутренних органов. Это определение болезни отражает существо ССД - фиброзную трансформацию соединительной ткани, служащей каркасом внутренних органов, составным элементом кожи и кровеносных сосудов. Безудержное развитие фиброза связано с избыточным коллагенообразованием вследствие нарушения функционирования фибробластов.
Распространенность ССД различна в разных географических зонах и этнических группах, в том числе и проживающих в одном регионе. Первичная заболеваемость колеблется от 3,7 до 19,0 случаев на 1 млн населения в год. ССД чаще регистрируют среди женщин (соотношение 5:7,1) в возрасте 30-60 лет.
Этиология
Причина развития болезни неизвестна. Придают значение вирусам, так как существуют косвенные свидетельства их роли в возникновении ССД: в пораженных тканях обнаружены вирусоподобные включения и повышенный титр антивирусных антител. Установлена семейно-генетическая предрасположенность к ССД, так как у родственников больных обнаруживают изменения белкового обмена в виде гипергаммаглобулинемии, синдрома Рейно, а иногда и ССД.
К неблагоприятным факторам, способствующим манифестации болезни и ее обострениям, следует отнести факторы внешней среды (длительный контакт с поливинилхлоридом, кремниевой пылью), применение лекарственных средств (блеомицин, триптофан), а также охлаждение, травмы, нарушение нейроэндокринных функций и воздействие профессиональных вредностей в виде вибрации.
Патогенез
В основе патогенеза лежит нарушение процесса взаимодействия различных клеток (эндотелиальных, гладкомышечных клеток сосудистой стенки, фибробластов, Т- и В-лимфоцитов, моноцитов, тучных клеток, эозинофилов) друг с другом и компонентами соединительнотканного матрикса. Результатом всего перечисленного служит селекция популяции фибробластов, устойчивых к апоптозу и функционирующих в автономном режиме максимальной синтетической активности, что активирует неофибриллогенез и способствует изменению гликопротеидов основного вещества соединительной ткани. В результате развиваются фиброзно-склеротические изменения соединительной ткани. Одновременно происходит дисрегуляция иммунного ответа организма на внедрение вируса, что выражается в гиперпродукции антител к собственным тканям (аутоантитела). Затем формируются иммунные комплексы, оседающие в микроциркуляторном русле и внутренних органах, что приводит к развитию иммунного воспаления. Выраженность иммунных и аутоиммунных нарушений при ССД не столь велика, как при СКВ.
Фиброзно-склеротические изменения соединительной ткани, поражение сосудов и внутренних органов в результате иммунного воспаления обусловливают многообразие клинических признаков заболевания (рис. 7-1).
Классификация
В нашей стране принята рабочая классификация ССД, учитывающая характер течения, стадию развития болезни и клинико-морфологическую характеристику поражения органов и систем.
• Характер течения:
- быстро прогрессирующее;
- хроническое.
• Стадия:
- начальная;
- генерализованная;
- терминальная.
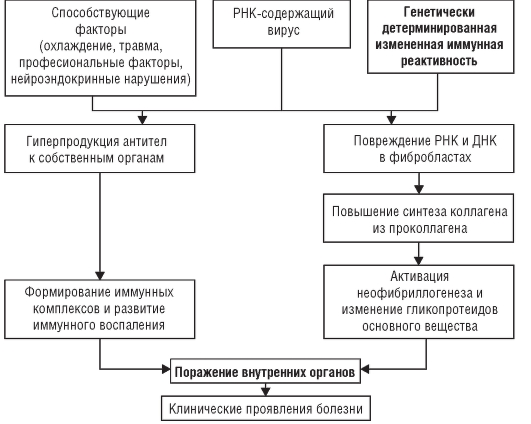
Рис. 7-1. Патогенез системной склеродермии
• Клинико-морфологическая характеристика поражения:
- кожи и периферических сосудов - плотный отек, индурация, гиперпигментация, телеангиэктазии, синдром Рейно;
- опорно-двигательного аппарата - артралгии, полиартрит, псевдоартрит, ПМ, кальциноз, остеолиз;
- сердца - миокардиодистрофия, кардиосклероз, порок сердца (чаще всего - недостаточность клапана);
- легких - интерстициальная пневмония, склероз, адгезивный плеврит;
- пищеварительной системы - эзофагит, дуоденит, спруподобный синдром;
- почек - истинная склеродермическая почка, хронический диффузный гломерулонефрит, очаговый гломерулонефрит;
- нервной системы - полиневрит, нейропсихические расстройства, вегетативные сдвиги.
• Выраженность уплотнения кожи оценивают пальпаторно по 4-балльной системе:
- 0 - уплотнения нет;
- 1 - незначительное уплотнение;
- 2 - умеренное уплотнение;
- 3 - выраженное уплотнение (невозможность собрать в складку).
В последние годы стали выделять пресклеродермию, диффузную кожную склеродермию, ограниченную (лимитированную) склеродермию, включающую синдром CREST (об этом синдроме будет сказано ниже), и склеродерму без склеродермии (этот вариант весьма редок и составляет не более 5 % всех больных с ССД).
Для хронического течения, наиболее свойственного ССД, характерны постепенно развивающиеся вазомоторные нарушения по типу синдрома Рейно и обусловленные ими трофические расстройства, что служит единственным признаком заболевания в течение многих лет. В дальнейшем присоединяется уплотнение кожи и периартикулярных тканей с развитием остеолиза и медленно прогрессирующих склеротических изменений внутренних органов (пищевода, сердца, легких).
Быстро прогрессирующее течение характеризуется возникновением тяжелых фиброзных периферических и висцеральных поражений уже в первый год болезни и нередким поражением почек по типу истинной склеродермической почки (наиболее частая причина смерти больных).
Учитывая прогрессирующий характер болезни, для оценки эволюции и степени нарастания патологического процесса выделяют три стадии течения:
• стадия I - начальных проявлений - преимущественно суставные изменения при подостром, и вазоспастические - при хроническом течении;
• стадия II - генерализации процесса - полисиндромность и полисистемность поражения многих органов и систем;
• стадия III - терминальная - преобладание тяжелых склеротических, дистрофических или сосудисто-некротических процессов (нередко - с отчетливыми нарушениями функций одного или нескольких органов).
Клиническая картина
Клиническая картина заболевания отличается полиморфностью и полисиндромностью, отражая его генерализованный характер. Практически нет органа или системы, которые не могли бы быть вовлечены в патологический процесс.
На первом этапе диагностического поиска получают информацию, на основании которой можно составить представление о диагнозе и варианте начала болезни, характере течения процесса, вовлечении в патологический процесс различных органов, ранее проводимом лечении и его эффективности, а также осложнениях.
Чаще болезнь начинается с поражения кожи, а затем постепенно присоединяется поражение органов (типичная форма). В других случаях (атипичная форма) в клинической картине с самого начала доминирует поражение внутренних органов при минимальных кожных изменениях, что затрудняет диагностику. По мере течения заболевания можно составить представление о характере его течения (острое, подострое и хроническое).
Жалобы больных при вовлечении в патологический процесс внутренних органов соответствуют субъективным симптомам при том или ином их поражении (плеврит, артрит, синдром Рейно, дуоденит и др.). Вместе с тем больные могут предъявлять жалобы, наиболее характерные именно для ССД: затруднение глотания и поперхивания при глотании в результате поражения верхней
части пищевода. Вазоспастические нарушения при синдроме Рейно не ограничиваются пальцами рук, а распространяются на кисти и стопы. Нередко пациенты испытывают чувство онемения в области губ, какой-либо части лица и кончика языка. Они предъявляют жалобы на сухость слизистой оболочки рта и конъюнктивы, а также на невозможность плакать (нет слез). Поражение кожи лица выражается в ощущении стянутости кожи и рта (трудно открыть рот). Как правило, температура тела не повышена. Похудание (иногда значительное) отмечают обычно при прогрессировании и генерализации заболевания.
После первого этапа (при длительном течении болезни) можно сделать определенное заключение о диагнозе. Выполнить это в самом начале бывает крайне трудно, так как симптомы ССД во многом напоминают другие состояния из группы ДЗСТ (СКВ, РА, ДМ), а при моноили олигосиндромности - другие заболевания, характеризующиеся поражением лишь одного органа (сердца, легких и др.).
Ha втором этапе диагностического поиска получают данные, свидетельствующие о поражении органов и систем и их функциональной недостаточности. При развернутой клинической картине болезни поражение кожи отмечают у подавляющего большинства больных. Оно выражается в последовательном развитии отека, индурации, а затем атрофии с преимущественной локализацией на лице и кистях. Возможны также трофические изменения кожи в виде депигментации, подчеркнутого сосудистого рисунка и телеангиэктазий. Поражение слизистых оболочек выражается в повышенной сухости. На коже могут возникать изъязвления и гнойничковая сыпь; волосы выпадают, ногти деформируются. В конечной стадии болезни кожа лица становится плотной, ее невозможно взять в складку. Лицо амимично, маскообразно. Характерна форма рта: губы тонкие, собраны в нерасправляющиеся складки, постепенно утрачивается способность к широкому открытию рта (симптом «кисета»).
Вазоспастические изменения при синдроме Рейно в виде побеления кожной поверхности обнаруживают в области лица, губ, кистей и стоп.
Поражение суставов выражается в их дефигурации за счет преимущественного поражения периартикулярных тканей, а также истинного склеродермического полиартрита с преобладанием экссудативно-пролиферативных или фиброзно-индуративных изменений. Характерно развитие склеродермической кисти: укорочение пальцев вследствие остеолиза ногтевых фаланг, истончение их кончиков, деформация ногтей и легкие сгибательные контрактуры. Такую кисть сравнивают с птичьей лапой (склеродактилия).
Поражение мышц, морфологически представляя собой фиброзный интерстициальный миозит или миозит с дистрофическими и некротическими изменениями, выражается в миастеническом синдроме, атрофии, уменьшении мышечной массы и нарушении движений. Возможно образование болезненных уплотнений (кальцинатов) в мышцах. Особенно часто отложения солей кальция обнаруживают в мягких тканях пальцев рук.
Поражение ЖКТ (эзофагит, дуоденит, синдром нарушенного всасывания или упорный запор) в основном обнаруживают на первом и третьем этапе диагностического поиска.
Поражение органов дыхания выражается в виде пневмонита, протекающего остро или хронически, вяло. Физические данные крайне скудны, в выраженных случаях выявляют только эмфизему легких. Значительно большую информацию дает рентгенологическое исследование, оказывающее существенную помощь и при выявлении двустороннего базального пневмосклероза, характерного для ССД.
При выраженном пневмосклерозе и его длительном существовании развивается легочная гипертензия, приводящая сначала к гипертрофии правого желудочка, а затем - к его недостаточности. Легочная гипертензия манифестирует цианозом, акцентом II тона во втором межреберье слева от грудины, одышкой, резким снижением толерантности к физической нагрузке и выраженным усилением пульсации в эпигастральной области, обусловленной гипертрофией правого желудочка.
Поражение сердца занимает основное место среди висцеральных симптомов ССД как по частоте, так и по влиянию на исход болезни. Для ССД характерен так называемый первичный кардиосклероз, не связанный с предшествующими некротическими или воспалительными изменениями миокарда. Отмечают увеличение сердца (иногда - значительное), а также нарушения сердечного ритма в виде экстрасистолии или МА. Поражение эндокарда приводит к развитию порока сердца, практически всегда - к митральной недостаточности. Сочетание последней с кардиосклерозом в ряде случаев может обусловить развитие сердечной недостаточности со всеми ее характерными признаками. Перикардит при ССД наблюдают редко и чаще он протекает как сухой.
Поражение мелких сосудов - склеродермическая ангиопатия - манифестирует вазомоторными нарушениями (синдром Рейно) и характеризуется пароксизмальным вазоспазмом с характерной последовательностью изменений окраски кожи пальцев (побеление, цианоз, покраснение), ощущением напряжения и болезненностью. В выраженных случаях синдром Рейно приводит к кровоизлияниям, некрозу тканей пальцев и телеангиэктазиям.
Поражение почек при ССД (у 80% больных) обусловлено патологическими изменениями сосудов, но не развитием фиброза. Наиболее тяжелый симптом - склеродермический почечный криз, обычно развивающийся в первые пять лет болезни у больных с диффузной формой ССД и манифестирующий злокачественной АГ (АД более 170/130 мм рт.ст.), быстро прогрессирующей почечной недостаточностью, гиперренинемией (в 90% случаев) и неспецифическими признаками. Последние представлены одышкой, головной болью и судорогами. При поражении почек в виде изолированных изменений мочевого осадка во время физикального обследования не обнаруживают никаких существенных патологических признаков.
В основе поражения нервной системы лежат сосудистые, дистрофические и фиброзные изменения, представленные симптомами полиневрита с нарушением рефлексов и чувствительности.
Таким образом, после второго этапа обнаруживают полиорганность поражения с преимущественным поражением кожи и ее дериватов. Степень изменений весьма различна - от субклинических до значительно выраженных. Возможность установления диагноза ССД при преимущественном поражении кожи
более высокая, чем при преобладании висцеральных нарушений. В последнем случае, если на первый план выступает поражение какого-нибудь одного органа (почки, сердце), существуют предпосылки для совершения диагностических ошибок.
На третьем этапе диагностического поиска можно:
• определить степень активности процесса;
• уточнить выраженность поражения внутренних органов;
• провести дифференциальную диагностику с другими заболеваниями из группы хронических ДЗСТ.
В определении степени активности заболевания наибольшее значение имеют неспецифические острофазовые показатели, к которым относят:
• диспротеинемию с повышением концентрации а2-и γ-глобулинов;
• повышение содержания СРБ;
• увеличение концентрации фибриногена;
• повышение СОЭ.
О существовании и выраженности иммунных нарушений можно судить по определению РФ (обнаруживают в 40-50% случаев), антинуклеарных антител (в 95%) и LE-клеток (у 2-7% пациентов). В отличие от СКВ все эти показатели при СКД обнаруживают в значительно меньшем титре и реже.
Наибольшее диагностическое значение придают так называемым склеродермическим антителам.
• Антитела Scl-70 чаще обнаруживают при диффузных формах ССД (40%). Их присутствие в сочетании с носительством HLA-DR3/DRw52 - прогностически неблагоприятный фактор у больных с синдромом Рейно, увеличивающий риск развития легочного фиброза при ССД в 17 раз.
• Антитела к центромере (элемент хромосомы) обнаруживают у 20-30% больных (большинство из них имеют признаки CREST-синдрома).
• Антитела к РНК-полимеразе I и III высокоспецифичны для ССД. Они присутствуют преимущественно у больных с диффузной формой и ассоциируются с поражением почек и неблагоприятным прогнозом.
При поражении почек отмечают выраженную в той или иной степени протеинурию в сочетании с минимальными изменениями мочевого осадка (микрогематурия, цилиндрурия). При истинной склеродермической почке (развитие некрозов почечной ткани вследствие поражения почечных сосудов) может развиться острая почечная недостаточность с увеличением содержания креатинина в крови.
При ССД отмечают диссоциацию между обнаруживаемыми при пункционной биопсии выраженными морфологическими изменениями почечной ткани и сосудов и сравнительно умеренными клиническими (в том числе лабораторными) признаками поражения почек. Если вследствие поражения почек развивается АГ, то отмечают изменения глазного дна (сужение артерий и расширение вен).
При поражении сердца на ЭКГ определяют неспецифические изменения конечной части желудочкового комплекса (снижение амплитуды и инверсия зубца Т), а иногда - нарушения внутрижелудочковой проводимости. Рентгенологически визуализируют увеличение сердца. Рентгенография помогает
обнаружить кальциноз мышц и мягких тканей пальцев кисти, а также дифференцировать изменения суставов при ССД с нарушениями при РА (при ССД отсутствуют эрозии суставных поверхностей). В 60-70% случаев на рентгенограмме отмечают поражение ЖКТ (особенно пищевода и кишечника). Изменения пищевода представлены его диффузным расширением в сочетании с сужением в нижней трети, ослаблением перистальтики и некоторой ригидностью стенок.
При биопсии кожи, синовиальной оболочки и мышц обнаруживают характерные для ССД фиброзные изменения, а также поражение сосудов. Данные морфологического исследования не оказывают решающего значения в установлении диагноза.
Диагностика
Диагностика болезни основана на обнаружении больших и малых диагностических критериев.
К большим критериям относят проксимальную склеродерму - симметричное утолщение, уплотнение и индурацию кожи пальцев и кожи, расположенной проксимальнее пястно-фаланговых и плюснефаланговых суставов. Изменения могут затрагивать лицо, шею и туловище (грудная клетка и живот).
Малые критерии:
• склеродактилия - вышеперечисленные кожные изменения, ограниченные вовлечением в патологический процесс пальцев;
• рубцы на кончиках пальцев или потеря вещества подушек пальцев;
• двусторонний базальный легочный фиброз.
У больного ССД должен присутствовать либо главный критерий (большой), либо, по крайней мере, два малых критерия. Чувствительность - 97%, специфичность - 98%.
Наиболее типично для ССД сочетание кальциноза, синдрома Рейно, эзофагита, склеродактилии и телеангиэктазий (синдром CREST - по первым буквам английских наименований перечисленных симптомов).
Диагностика ССД на ранних стадиях основана на обнаружении триады первоначальных признаков (возникающих наиболее рано): синдрома Рейно, суставного синдрома (чаще - полиартралгии) и плотного отека кожи. Существенно реже в ранней стадии обнаруживают одну из висцеральных локализаций процесса.
Значительные трудности в диагностике ССД связаны с отсутствием характерного кожного синдрома у больных с выраженными полисиндромными поражениями внутренних органов (так называемая ССД без склеродермии). В этих случаях существенную помощь оказывает рентгенологическое исследование, позволяющее обнаружить нарушение моторики пищевода и его расширение, а также дилатацию двенадцатиперстной и толстой кишки.
Дифференциальная диагностика
ССД следует дифференцировать от целого ряда заболеваний и, прежде всего, от других ДЗСТ, а также от болезней, клиническая картина которых весьма сходна с таковой поражения какого-либо органа при ССД (при условии его до-
минирования). Например, при склеродермическом поражении сердца проводят дифференциальную диагностику с атеросклеротическим кардиосклерозом, ревмокардитом и неспецифическим миокардитом; при легочном поражении - с хронической пневмонией, туберкулезом и профессиональными заболеваниями легких (пневмокониоз); при поражении пищевода следует исключить его рак.
Основой для дифференциальной диагностики служит обнаружение типичных для ССД признаков.
• Преобладание своеобразных кожных поражений в сочетании с синдромом Рейно и незначительно выраженными лабораторными данными при ССД в отличие от кожных изменений при СКВ, сочетающихся с более высокой активностью патологического процесса (по данным лабораторных исследований).
• В отличие от СКВ, при ССД поражение внутренних органов не сочетается с выраженными иммунными нарушениями (АНФ, РФ и антитела к ДНК обнаруживают в меньшем титре, частота определения и количество LE- клеток также невелики).
• Суставной синдром при ССД в отличие от РА сочетается с мышечными контрактурами, отложением кальция в мягких тканях и мышцах, фиброзными анкилозами и остеолизом концевых фаланг. Деструктивные изменения костной ткани при ССД отсутствуют, преобладает поражение периартикулярных тканей.
• В отличие от ИБС, поражение сердца при ССД не сопровождается ангинозными болями. На ЭКГ отсутствуют признаки перенесенного ИМ. В отличие от ревматического поражения сердца, при ССД никогда не развиваются стенозы (митральный, устья аорты); обычно существует умеренно выраженная изолированная митральная недостаточность.
• Доминирующее поражение какой-либо системы или органа при ССД всегда сочетается с кожными и мышечными изменениями и синдромом Рейно. Для клинической картины других заболеваний (хроническая пневмония, атеросклеротический кардиосклероз, заболевания кишечника, язвенная болезнь), от которых приходится дифференцировать ССД, характерна моносиндромность.
• При ССД доминируют кожные изменения и синдром Рейно, тогда как при ДМ на первый план выступает поражение мышц в сочетании со своеобразным параорбитальным отеком лилового цвета («симптом очков»).
• Глюкокортикоиды при ССД не дают такой разительный положительный эффект, как при СКВ.
• В ряде случаев, когда ССД манифестирует суставным, кожным и астеновегетативным синдромом, лишь длительное динамическое наблюдение позволяет поставить правильный диагноз.
Формулировка развернутого клинического диагноза должна учитывать рубрики, приведенные в рабочей классификации. Диагноз должен отражать:
• характер течения;
• стадию;
• клинико-морфологическую характеристику поражения органов и систем организма с указанием стадии функциональной недостаточности (напри-
мер, при пневмосклерозе - стадии легочной недостаточности, при поражении почек - стадии почечной недостаточности и др.).
Лечение
Лечение ССД должно быть комплексным и учитывать следующие аспекты:
• воздействие на сосудистые осложнения и в первую очередь - на синдром Рейно;
• воздействие на развитие фиброзных изменений;
• иммуносупрессию и противовоспалительное действие;
• воздействие на локальные симптомы заболевания.
Следует избегать влияния холода, курения, местного воздействия вибрации, стрессовых ситуаций и приема препаратов, вызывающих периферический сосудистый спазм (β-адреноблокаторы без вазодилатирующего действия).
Медикаментозное лечение синдрома Рейно предусматривает назначение блокаторов медленных кальциевых каналов - амлодипина (по 5-20 мг/сут), нифедипина пролонгированного действия (по 30-90 мг/сут), фелодипина (по 5-10 мг/сут), а также верапамила пролонгированного действия (по 240-480 мг/ сут) или дилтиазема (по 120-360 мг/сут).
Хороший эффект оказывает прием внутрь пентоксифиллина (по 400 мг 3 раза в сутки). Также назначают антиагреганты - дипиридамол (по 300- 400 мг/сут) или тиклопидин (по 500 мг/сут).
В критических ситуациях (легочная гипертензия, гангрена, почечный криз) на протяжении 6-24 ч в течение 2-5 сут внутривенно вводят синтетические простагландины: алпростадил (по 0,1-0,4 мкг/кг в минуту) или илопрост (по 0,5-2 нг/кг в минуту).
Препарат, разрушающий внутренние связи в молекуле коллагена и тормозящий избыточное коллагенообразование, - пеницилламин. Его назначают при подостром течении, быстро нарастающих индуративных изменениях кожи и симптомах прогрессирующего генерализованного фиброза натощак через день в дозе 250-500 мг/сут. Ранее рекомендованные высокие дозы (по 750-1000 мг/сут) не увеличивают эффективность лечения, но значительно возрастает частота возникновения побочного действия. При лечении пеницилламином необходимо следить за лабораторными показателями мочи, так как на 6-12-м мес с момента начала лечения может развиться протеинурия. При ее нарастании до 0,2 г/сут препарат отменяют. При выраженных кожных поражениях рекомендована ферментотерапия. Назначают подкожное введение гиалуронидазы вблизи пораженных участков или электрофорез с этим препаратом.
Противовоспалительные и цитотоксические препараты применяют на ранней (воспалительной) стадии ССД и при быстро прогрессирующем течении заболевания.
Назначение стандартных доз НПВС рекомендовано для лечения мышечносуставных нарушений при ССД и стойкой субфебрильной лихорадки.
Глюкокортикоиды в небольших дозах (по 15-20 мг/сут) применяют при прогрессирующем диффузном поражении кожи и явных клинических признаках воспалительной активности (миозит, альвеолит, серозит, рефрактерный
артрит и тендосиновит). Прием больших доз не рекомендован (риск развития склеродермического почечного криза).
При назначении в дозе 2 мг/кг в день в течение 12 мес циклофосфамид уменьшает кожный зуд только у больных диффузной формой ССД.
Метотрексат назначают при сочетании ССД с РА или ПМ.
При склеродермическом почечном кризе для устранения сосудистых спазмов и предотвращения развития склеродермической почки используют ингибиторы АПФ (каптоприл по 100-150 мг/сут, эналаприл по 10-40 мг/сут) под контролем АД.
При поражении пищевода с целью профилактики дисфагии рекомендованы частое дробное питание и исключение приема пищи позднее 18 ч. Лечение дисфагии предусматривает назначение прокинетиков (метоклопрамид в дозе 10 мг 3-4 раза в сутки). При рефлюкс-эзофагите назначают омепразол (внутрь по 20 мг/сут).
Воздействие на локальные симптомы болезни предусматривает аппликации 25-50% раствора диметилсульфоксида. В периоды отсутствия активности патологического процесса можно рекомендовать ЛФК и массаж.
Прогноз
При ССД прогноз определяется вариантом течения и стадией развития. Отмечено, что чем больше времени отделяет развернутую стадию от возникновения первых признаков болезни (в частности, синдрома Рейно), тем благоприятнее прогноз. Пятилетняя выживаемость колеблется от 34 до 73%, в среднем составляя 68%. Риск смерти при ССД в 4,7 раза выше, чем в популяции.
Предикторы неблагоприятного прогноза:
• диффузная форма болезни;
• возраст начала болезни старше 47 лет;
• мужской пол;
• фиброз легких, легочная гипертензия, аритмии, поражение почек в первые три года болезни;
• анемия, высокая СОЭ, протеинурия в начале болезни.
Профилактика
К группе риска относят лиц со склонностью к вазоспастическим реакциям, полиартралгиям, а также родственников больных, страдающих различными диффузными заболеваниями соединительной ткани. Они не должны подвергаться воздействию провоцирующих факторов (охлаждение, вибрация, травмы, воздействие химических веществ, инфекционные агенты и др.). Больных ССД ставят на диспансерный учет. Систематически проводимое лечение (в частности, правильно подобранная поддерживающая терапия) - лучшее средство профилактики обострений.
ДЕРМАТОМИОЗИТ (ПОЛИМИОЗИТ)
ДМ - системное воспалительное заболевание скелетной, гладкой мускулатуры и кожи. Реже отмечают вовлечение в патологический процесс внутренних органов. При отсутствии поражения кожи используют термин «полимиозит» ПМ.
Основной симптом заболевания - резкая мышечная слабость вследствие прогрессирующего тяжелого некротического миозита с преимущественным поражением мышц проксимальных отделов конечностей. По мере прогрессирования заболевания мышечная ткань атрофируется и замещается фиброзной. Аналогичные процессы происходят и в миокарде. В паренхиматозных органах развиваются дистрофические изменения. В патологический процесс также вовлекаются сосуды мышц, внутренних органов и кожи.
ДМ (ПМ) - редкое заболевание. Частота его возникновения в популяции колеблется от 2 до 10 случаев на 1 млн населения в год. Болезни подвержены люди зрелого возраста (40-60 лет), чаще - мужчины, чем женщины (соотношение 2:1).
Этиология
Выделяют две формы ДМ (ПМ) - идиопатический и вторичный (опухолевый). Этиология идиопатического ДМ неясна, но известны факторы, способствующие манфестации, а в дальнейшем и обострению этого заболевания:
• инсоляция;
• переохлаждение;
• инфекционное поражение (ОРЗ, грипп, ангина и др.);
• гормональная перестройка (климакс, беременность, роды);
• эмоциональный стресс;
• физическая травма, хирургическое вмешательство;
• сенсибилизация лекарственными препаратами (хлорпромазин, препараты инсулина, антибиотики, пеницилламин);
• вакцинация;
• контакт с эпоксидными смолами, фоторастворителями;
• физиотерапевтические процедуры.
Вероятно, имеет значение наследственно-генетическая предрасположенность: у больных обнаруживают антигены В-8/DR3, B14 и B40 системы HLA. Это тесно связано не с самим заболеванием, а с определенными иммунными нарушениями и в первую очередь с гиперпродукцией миозинспецифических аутоантител.
Опухолевый (вторичный) ДМ составляет 25% всех случаев заболевания и развивается у больных, страдающих злокачественными опухолями. Чаще всего ДМ возникает при раке легкого, кишечника, предстательной железы, яичника, а также при гемобластозах. Возникновение ДМ у лиц в возрасте старше 60 лет почти всегда указывает на его опухолевое происхождение.
Патогенез
Под влиянием вируса и генетической предрасположенности или опухолевых антигенов происходит нарушение (дисрегуляция) иммунного ответа, выражаю-
щееся в дисбалансе В- и Т-системы лимфоцитов: в организме вырабатываются антитела к скелетным мышцам и развивается сенсибилизация Т-лимфоцитов к ним. Реакция «антиген-антитело» и цитотоксический эффект сенсибилизированных к мышцам Т-лимфоцитов способствуют образованию и отложению в мышцах и микроциркуляторном русле различных органов иммунных комплексов. Их элиминация приводит к высвобождению лизосомных ферментов и развитию иммунного воспаления в мышцах и внутренних органах. При воспалении высвобождаются новые антигены, способствующие дальнейшему образованию иммунных комплексов, что ведет к хронизации заболевания и вовлечению в патологический процесс ранее здоровых мышц. Основные звенья патогенеза ДМ представлены на рис. 7-2.
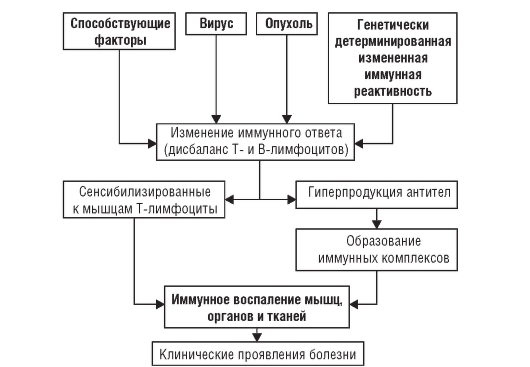
Рис. 7-2. Патогенез дерматомиозита
Клиническая картина
Клиническая картина заболевания отличается системностью и полисиндромностью .
Основные синдромы:
• мышечный (миозит, мышечная атрофия, кальциноз);
• кожный (эритема, отек кожи, дерматит, пигментация и депигментация, телеангиэктазии, гиперкератоз, крапивница);
• суставной (артралгии, поражение периартикулярных тканей, редко - истинные артриты);
• висцеральный (миокардит, кардиосклероз, пневмонит, аспирационные пневмонии, пневмофиброз, желудочно-кишечные кровотечения, миогло-
булинурическая почка с развитием острой почечной недостаточности, полинейропатия). Выделяют следующие периоды течения болезни:
• I период (начальный) - продолжается от нескольких дней до 1 мес и более, манифестирует только мышечными и (или) кожными изменениями;
• II период (манифестный) - развернутая картина болезни;
• III период (терминальный) - представлен дистрофическими изменениями внутренних органов и признаками их выраженной функциональной недостаточности (возможно развитие осложнений).
Различают три формы течения болезни:
• острую форму, когда быстро нарастает генерализованное поражение скелетной мускулатуры, приводящее к полной обездвиженности больного. Прогрессирует поражение мышц глоточного кольца и пищевода (дисфагия, дизартрия). Быстро развивается поражение внутренних органов (особенно сердца) с летальным исходом через 2-6 мес с начала болезни;
• подострую форму с более медленным, постепенным нарастанием симптомов. Тяжелое поражение мышц и висцериты возникают через 1-2 года;
• хроническую форму с длительным циклическим течением. Преобладают процессы атрофии и склероза. Возможно локальное поражение мышц.
На первом этапе диагностического поиска получают сведения о характере начала заболевания - остром (повышение температуры тела до 38-39 °С, кожная эритема и боли в мышцах) или постепенном (умеренная слабость, нерезкие миалгии и артралгии, усиливающиеся после физической нагрузки, инсоляции или других неблагоприятных воздействий).
Наиболее характерные жалобы обусловлены поражением мышц: больные отмечают слабость, не могут самостоятельно сесть или встать, им крайне трудно подниматься по лестнице, нередки боли в мышцах. Мышечная слабость и болезненность локализуются симметрично в проксимальных отделах конечностей, спине и шее.
При поражении глоточных мышц больные жалуются на поперхивание при глотании, жидкая пища выливается через нос. Носовой оттенок голоса и охриплость обусловлены поражением мышц гортани.
При поражении кожи больные отмечают стойкое изменение ее окраски в местах, подверженных действию солнца (зона декольте, лицо, кисти), а также на наружных поверхностях бедер и голеней. Характерно возникновение параорбитального отека лилового цвета («симптом очков»). При поражении слизистых оболочек больные жалуются на сухость, жжение в глазах и отсутствие слез («сухой» синдром).
Вовлечение в патологический процесс различных органов выражается симптомами, свойственными миокардиту, кардиосклерозу, пневмониту, гломерулонефриту, полиневриту, артриту и др.
Сведения о проводимом лечении позволяют судить о его правильном подборе, а косвенно - и о характере течения: использование аминохинолиновых препаратов свидетельствует о хроническом течении, применении преднизолона и цитостатиков - о более остром.
На втором этапе диагностического поиска при развернутой клинической картине болезни, прежде всего, отмечают симметричное поражение мышц: плотные, тестоватые на ощупь, они увеличены в объеме и болезненны при пальпации. При поражении мимической мускулатуры заметна некоторая маскообразность лица. В дальнейшем возникает атрофия мышц, особенно выраженная со стороны плечевого пояса. Также происходит поражение дыхательных мышц и диафрагмы. При пальпации мышц можно обнаружить локальные уплотнения - кальцинаты, которые располагаются и в подкожной жировой клетчатке. Кальциноз чаще развивается у молодых людей с распространенным поражением мышц при переходе острого течения в подострое или хроническое. Нередко отмечают снижение массы тела на 10-20 кг.
Поражение кожи - не обязательный признак ДМ, но при его существовании на открытых частях тела отмечают отек, эритему (над суставами - надсуставная эритема, в околоногтевых зонах в сочетании с микронекрозами в виде темных точек - синдром Готтрона), капилляриты, петехиальные высыпания и телеангиэктазии. Эритема отличается большой стойкостью, синюшным оттенком, сопровождается зудом и шелушением. Типичен «симптом очков» - эритема вокруг глаз. Нередко отмечают покраснение, шелушение и растрескивание кожи ладоней («рука механика или ремесленника»), ломкость ногтей и усиленное выпадение волос.
Довольно часто регистрируют выраженный синдром Рейно.
Признаки висцеральных поражений при ДМ, так же, как и при ССД, не слишком ярки, в отличие от СКВ. Можно отметить известную диссоциацию между выраженностью патоморфологических изменений органов и их клинической манифестацией. Поражение сердца (миокардит, кардиосклероз) представлено такими неспецифическими признаками, как увеличение его размеров, глухость тонов, тахикардия и нарушение ритма в виде экстрасистолии. Выраженные изменения миокарда могут привести к возникновению симптомов сердечной недостаточности.
Поражение легких в виде пневмонита сопровождается крайне скудными симптомами. Развивающийся фиброз обнаруживают по признакам эмфиземы легких и дыхательной недостаточности. Аспирационная пневмония характеризуется всеми типичными симптомами.
Для поражения ЖКТ характерна дисфагия: происходит срыгивание твердой и выливание через нос жидкой пищи. Патологические изменения сосудов желудка и кишечника могут привести к желудочно-кишечным кровотечениям. Иногда отмечают умеренное увеличение печени, реже - гепатолиенальный синдром с увеличением лимфатических узлов.
Неврологические нарушения представлены изменениями чувствительности: гиперестезией периферического или корешкового характера, гипералгезией, парестезией и арефлексией.
На третьем этапе диагностического поиска существенную помощь оказывают методы исследования, позволяющие оценить остроту воспалительного процесса и распространенность поражения мышц.
Об остроте процесса можно судить по неспецифическим острофазовым показателям (увеличение СОЭ, повышение содержания фибриногена и СРБ,
гипер-а2-глобулинемия) и признакам иммунных изменений (невысокий титр РФ, увеличение содержания γ-глобулинов, антител к нуклеопротеиду и растворимым ядерным антигенам, антитела к Mi2, Jol, SRP, а в случае идиопатического ДМ - увеличение концентрации IgG).
При хроническом, вялом течении болезни изменения острофазовых показателей могут отсутствовать (СОЭ нередко соответствует норме).
Распространенность поражения мышц характеризуется рядом биохимических изменений. Повышается индекс креатин/креатинин, что связано с присутствием в моче креатина при снижении креатининурии. При значительном поражении мышц может возникать миоглобинурия. Увеличение активности трансаминаз не типично для поражения скелетной мускулатуры. У некоторых больных с миопатическим синдромом это заставляет предположить гепатит.
При иммунологическом исследовании обнаруживают миозитспецифические антитела. К ним относят антитела к аминоацилсинтетазам транспортной РНК (антисинтетазные антитела) и в первую очередь антитела к гистидил-тРНКсинтетазе (Jo1). Антитела Jo1 обнаруживают у половины больных ДМ (ПМ), тогда как другие антисинтетазные антитела - крайне редко (5%). Продукция антисинтетазных антител ассоциируется с развитием так называемого антисинтетазного синдрома, характеризующегося острым началом, лихорадкой, симметричным артритом, интерстициальным поражением легких, синдромом Рейно и поражением кистей рук по типу «руки механика».
Для ДМ опухолевого происхождения у мужчин характерно обнаружение простатоспецифического антигена, у женщин - СА-125 (антиген опухоли яичника). Кроме того, при иной локализации опухоли можно обнаружить другие опухольспецифичные антигены.
Существенную помощь в диагностике поражения мышц оказывает электромиография, позволяющая обнаружить нормальную электрическую активность мышц в состоянии их произвольного расслабления и низкоамплитудную - при произвольных сокращениях.
При биопсии кожи и мышц отмечают картину тяжелого миозита с потерей поперечной исчерченности мышечных волокон, фрагментацией, зернистой и восковидной дегенерацией, а также очаги некроза, лимфоидно-плазмоклеточную инфильтрацию и явления фиброза. Мышечную биопсию проводят для подтверждения диагноза ДМ даже при существовании характерных клинических, лабораторных и инструментальных признаков заболевания. Наиболее информативна биопсия мышцы, вовлеченной в патологический процесс, но без выраженной атрофии.
Прочие методы исследования (ЭКГ, рентгенологические и эндоскопические) необходимы для:
• оценки состояния пораженных внутренних органов;
• поиска опухоли при подозрении на ДМ опухолевого происхождения.
Диагностика
Для диагностики ДМ (ПМ) следует использовать следующие диагностические критерии.
• Поражение кожи:
- гелиотропная сыпь (пурпурно-красные высыпания на веках);
- признак Готтрона (пурпурно-красная шелушащаяся атрофическая эритема или пятна на разгибательной поверхности кистей над суставами);
- эритема на разгибательной поверхности конечностей над локтевыми и коленными суставами.
• Проксимальная мышечная слабость (верхние и нижние конечности и туловище).
• Повышение активности КФК или альдолазы в крови.
• Боли в мышцах при пальпации или миалгии.
• Миогенные изменения при электромиографии (короткие полифазные потенциалы моторных единиц со спонтанными потенциалами фибрилляции).
• Обнаружение антител Jo1 (антитела к гистидил-тРНК-синтетазе).
• Недеструктивный артрит или артралгии.
• Признаки системного воспаления (повышение температуры тела более 37 °С, увеличение концентрации СРБ или СОЭ более 20 мм/ч).
• Морфологические изменения, соответствующие воспалительному миозиту (воспалительные инфильтраты в скелетных мышцах с дегенерацией или некрозом мышечных волокон, активный фагоцитоз или признаки активной регенерации).
При обнаружении, по крайней мере, одного типа поражения кожи и минимум четырех других признаков диагноз ДМ достоверен (чувствительность - 94,1%, специфичность - 90,3%).
Присутствие, по крайней мере, четырех признаков соответствует диагнозу ПМ (чувствительность - 98,9%, специфичность - 95,2%).
Дифференциальная диагностика
Несмотря на высокую чувствительность и специфичность критериев, диагностика ДМ (ПМ) представляет большие трудности, особенно в дебюте заболевания .
ДМ (ПМ) следует дифференцировать от инфекционных и неврологических заболеваний, ССД, СКВ и РА. В основе дифференциальной диагностики лежат следующие изменения:
• Упорство суставного синдрома при РА, обнаружение при рентгенологическом исследовании эрозий суставных поверхностей костей, отсутствие характерных для ДМ изменений кожи и мышц.
• В отличие от СКВ, при ДМ висцеральные нарушения не столь резко выражены и возникают значительно реже. В клинической картине ДМ преобладает поражение мышц, а лабораторные показатели (особенно иммунологические) изменены в значительно меньшей степени.
• В отличие от ССД, кожные изменения при ДМ имеют совершенно иной характер: нет типичных изменений кистей, а ведущим считают мышечный синдром (в том числе резкую мышечную слабость). Тем не менее дифференциальная диагностика ССД и ДМ наиболее трудна. В сложных случаях необходимо использовать электрофизиологические и морфологические методы исследования.
• При остром течении ДМ необходимо исключить инфекционное поражение (септическое состояние, рожистое воспаление и др.), что возможно при динамическом наблюдении за больным.
• При доминировании адинамии и нарушении рефлексов возникает необходимость в проведении дифференциальной диагностики с неврологическими заболеваниями, что осуществляют при совместном наблюдении больного терапевтом и невропатологом.
Формулировка развернутого клинического диагноза ДМ должна отражать:
• период течения;
• форму течения;
• клинико-морфологическую характеристику поражения систем и органов с указанием ведущих синдромов и существования или отсутствия функциональной недостаточности органов (систем).
Лечение
Основная задача - подавление активности иммунных реакций и воспалительного процесса, а также нормализация функции отдельных, наиболее пораженных органов и систем. Раннее начало лечения (в течение первых 3 мес с момента возникновения симптомов ) ассоциируется с более благоприятным прогнозом, чем позднее.
Лучший эффект оказывают глюкокортикоиды: при ДМ предпочтительнее всего назначать преднизолон (по 1-2 мг/кг в сутки). В течение первых недель суточную дозу следует делить на три приема, а затем принимать всю ее однократно утром, поскольку улучшение состояния больного развивается медленнее, чем при СКВ или ССД (в среднем - через 1-3 мес). При отсутствии положительной динамики в течение 4 нед следует увеличить дозу глюкокортикоидов. После достижения эффекта (нормализация мышечной силы и активности КФК) дозу преднизолона очень медленно снижают до поддерживающей, каждый месяц - на 1/4 суммарной. Снижение дозы необходимо проводить под строгим клиническим и лабораторным контролем.
Пульс-терапия редко бывает эффективной. Ее назначают при быстром прогрессировании дисфагии (риск аспирационной пневмонии) и развитии системных поражений (миокардит, альвеолит).
Если лечение преднизолоном не эффективно или его невозможно назначить вследствие непереносимости и развития осложнений, то следует применять цитостатические препараты.
В настоящее время рекомендовано раннее назначение метотрексата, позволяющее быстрее перевести больных на поддерживающие дозы преднизолона. Метотрексат назначают внутрь, подкожно или внутривенно в дозе 7,5-25 мг/ нед. Внутривенное введение препарата рекомендуют при недостаточной эффективности или плохой его переносимости при приеме внутрь. Следует помнить, что отсутствие эффекта от лечения преднизолоном указывает на возможность существования опухолевого АНФ, поэтому, прежде чем назначать цитостатические препараты, следует провести расширенный онкологический поиск для исключения злокачественной опухоли.
Больным с резистентными к преднизолону формами заболевания назначают прием внутрь циклоспорина по 2,5-5,0 мг/кг в сутки.
Азатиоприн уступает метотрексату по эффективности. Максимальный эффект развивается позже (в среднем - через 6-9 мес). Назначают прием препарата внутрь по 100-200 мг/сут.
Циклофосфамид - средство выбора при интерстициальном легочном фиброзе (по 2 мг/кг в сутки).
Аминохинолиновые препараты (хлорохин, гидроксихлорохин) применяют в следующих ситуациях:
• при хроническом течении болезни без признаков активности процесса (для контроля кожных поражений);
• при снижении дозы преднизолона или цитостатиков для уменьшения риска возможного обострения.
Плазмаферез следует назначать больным с тяжелым, резистентным к другим методам лечения ДМ (ПМ) в сочетании с глюкокортикоидами и метотрексатом или цитостатическими препаратами.
В последние годы для лечения все чаще применяют ингибиторы ФНО-α. Перспективное направление лечения связано с применением ритуксимаба. Максимальный эффект развивается через 12 нед после первой инъекции, что ассоциируют со снижением содержания CD20+ В-лимфоцитов в периферической крови.
Прогноз
В настоящее время в связи с применением преднизолона и цитостатиков при острых и подострых формах прогноз значительно улучшился: пятилетняя выживаемость составляет 90%. В случае приобретения заболеванием хронического течения трудоспособность больного может восстанавливаться.
Прогноз при вторичном (опухолевом) ДМ зависит от эффективности оперативного вмешательства: при успешно проведенной операции все признаки болезни могут исчезнуть. Факторы, ухудшающие прогноз болезни: пожилой возраст, поздний диагноз, неправильное лечение в начале болезни, тяжелое течение миозита (лихорадка, дисфагия, поражение легких, сердца и ЖКТ), антисинтетазный синдром. При опухолевом ДМ пятилетняя выживаемость составляет только 50%.
Профилактика
Предупреждения обострений (вторичная профилактика) достигают проведением поддерживающего лечения, санацией очагов инфекции и повышением сопротивляемости организма. У родственников больного возможно проведение первичной профилактики (исключение перегрузок, инсоляции, переохлаждений).