Внутренние болезни в 2-х томах: учебник / Под ред. Н.А. Мухина, В.С. Моисеева, А.И. Мартынова - 2010. - 1264 c.
|
|
|
|
ГЛАВА 53. НОРМАЛЬНЫЙ ГЕМОПОЭЗ
Кроветворение (гемопоэз) - тонко регулируемый процесс последовательных дифференцировок родоначальных клеток, проводящий к образованию зрелых клеток крови всех восьми линий (миелоидные: эритроциты, базофильные, эозинофильные и нейтрофильные гранулоциты, мегакариоциты, моноциты-макрофаги и лимфоидные: Т- и В-лимфоциты).
КРОВЕТВОРНЫЕ ОРГАНЫ
Кроветворные клетки образуются в органах кроветворения, разделяющихся на эмбриональные (желточный мешок, эмбриональная печень, селезёнка и костный мозг) и взрослые (костный мозг, селезёнка, тимус, лимфатические узлы и Пейеровы бляшки).
Кроветворение в костном мозге происходит в полости всех трубчатых и плоских костей в пространстве между синусами, в так называемом кроветворном (стромальном) микроокружении. К клеткам микроокружения относятся эндотелиальные клетки, адвентициальные клетки, ретикулярные клетки (фибробласты костного мозга), макрофаги, жировые клетки, остеокласты, остеоциты. Внеклеточный матрикс представлен набором нерастворимых белков (глюкозаминогликанов, протеогликанов, фибронектина, гликопротеинов), коллагеновыми и эластиновыми волокнами, в сети которых располагаются тяжи кроветворных клеток и основное вещество кости. Способность кроветворных клеток узнавать клетки стромы и распределяться в нём (хоуминг) обусловлена молекулами клеточной адгезии, интегринами и непосредственными клеточными контактами. Это свойство клеток проявляется при трансплантации костного мозга: 85% введёных внутривенно клеток попадает в костный мозг, масса которого составляет 6% от массы тела. Оставшиеся 15% распределяются между печенью, лёгкими, селезёнкой и другими органами.
Родоначальные кроветворные клетки локализуются в костном мозге. Предшественники Т- и В-лимфоцитов также образуются в костном мозге, однако их окончательная дифференцировка происходит в тимусе (Т-лимфоциты) и селезёнке, лимфатических узлах и Пейеровых бляшках (В-лимфоциты).
Селезёнка морфологически состоит из двух отделов - красной и белой пульпы. В красной пульпе происходит депонирование и разрушение эритроцитов. Большинство макрофагов красной пульпы фагоцитируют разрушенные эритороциты и пигменты железа. Белая пульпа, образованная артериями и окружающими их лимфоидными футлярами, в основном заселена Т-лимфоцитами. Кластеры В-лимфоцитов расположены по периферии периартериальных зон. После антигенной стимуляции первичные фолликулы развиваются во вторичные с зародышевыми центрами. В них развиваются В-лимфоциты и плазматические клетки.
Тимус - центральный и высокоспециализированный орган лимфопоэза, в котором происходит созревание и клональная селекция Т-лимфоцитов, а также удаление аутореактивных клонов. Предшественники Т-лимфоцитов попадают в корковое вещество тимуса из костного мозга. Для тимоцитов коркового вещества характерна высокая скорость пролиферации, однако большая часть из них гибнет, а часть популяции приобретает специфические маркёры Т-хелперов и Т-супрессоров и мигрирует через мозговое вещество тимуса во вторичные лимфоидные органы (селезёнку, лимфатические узлы).
С возрастом происходит инволюция тимуса, однако он никогда не замещается жировой тканью полностью и в нём продолжается выработка гуморальных факторов. Лифопоэтическую функцию принимают на себя клетки Лангерганса в коже и брыжеечные лимфоидные клеточные скопления.
Лимфатические узлы - основа формирования иммунологического ответа. В синусах лимфатических узлов макрофаги, захватив антиген, презентируют его В-лимфоцитам, непосредственно осуществляющим иммунный ответ. Субкапсулярная зона лимфоузлов заполнена преимущественно Т-лимфоцитами и дендритными клетками, несущими большое количество молекул гистосовместимости II класса, необходимых для активации Т-лимфоцитов. Медуллярная зона заполнена более зрелыми клетками, секретирующими антитела.
Строение и функция Пейеровых бляшек, расположенных по ходу тонкого кишечника, аналогична лимфоидным фолликулам селезёнки и лимфатических узлов.
СХЕМА КРОВЕТВОРЕНИЯ
Основные положения схемы кроветворения (отсутствие бессмертных "самоподдерживающихся" стволовых клеток, возможность сокращения числа митозов в процессе созревания, клональный характер кроветворения со сменой клонов, наличие ещё не выявленных, более ранних, чем стволовая клетка, предшественников и др.) были многократно подтверждены в течение многих лет. После утраты основного свойства стволовых и только стволовых клеток - способности к самоподдержанию - и невозможности определения самого понятия "стволовости", единственным критерием принадлежности клеток к стволовому отделу остается пролиферативный потенциал, достаточный для мультилинейного восстановления кроветворения после депрессии собственного кроветворения.
Время определения молекулярных основ биологии стволовых клеток ещё не пришло и составить более или менее ясную картину оркестровки генов в ходе кроветворных дифференцировок пока не удаётся.
В нижних этажах кроветворного дерева изменений очень немного. Помимо восьми ранее известных линий кроветворных дифференцировок выделены ещё новые: натуральные киллеры (клетки, участвующие в природном иммунитете, в том числе и против злокачественных клеток) и профессиональные антиген-презентирующие дендритные клетки. В настоящее время различают 11-12 линий дифференцировки кроветворных клеток.
Схему кроветворения (рис. 53-1) мы начинаем с единственного члена отдела тотипотентных предшественников, эмбриональной стволовой клетки (ЭС). Эта клетка способна к образованию клеток всех тканей организма. Эмбриональные стволовые клетки в нормальном развитии не существуют. Их выделяют из внутренней массы бластоциста на стадии примерно 100-120 клеток. В эмбриогенезе эти клетки быстро переходят на следующие стадии дифференцировки. Эмбриональные стволовые клетки образуются только в условиях остановки созревания клеток бластоциста вне организма, например при культивировании в определенных условиях. Дифференцировка клеток бластоциста блокируется и они способны пролиферировать практически бесконечно (больше 120 удвоений) без дифференцировки, без малигнизации, без изменений кариотипа и др. Снятие блока приводит к беспорядочной дифференцировке эмбриональной стволовой клетки. И хотя до разумного клинического применения эмбриональных стволовых клеток ещё далеко, уже сейчас целесообразно поместить этот предшественник в вершину кроветворной иерархии.
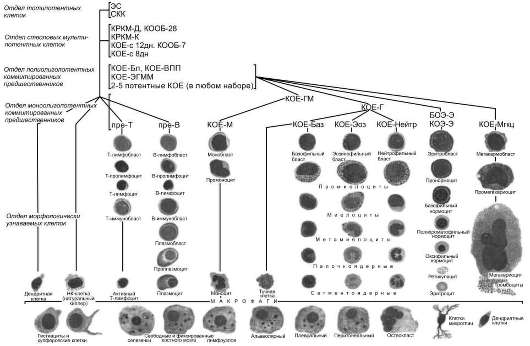
Собственно кроветворение начинается с клеток стволового отдела. Популяция стволовых кроветворных клеток (СКК) немногочисленнна и крайне гетерогенна. Клетки этого отдела находятся в состоянии дифференцировки и созревания, продвигаясь вниз по кроветворной иерархии. Никакого набора одинаковых клеток даже в суботделах стволовых кроветворных клеток не существует, нет дискретных отделов, разделенных чёткими границами.
Отдел стволовых клеток включает предшественники, способные к мультипотентным дифференцировкам по всем линиям кроветворных клеток и обладающих высоким пролиферативным потенциалом. Этот отдел пока включает три члена. Первый и наиболее ранний из них, про-СКК. Эта клетка, видимо, близка к промежуточным элементам, расположенным между тотипотентными эмбриональными клетками и ранними кроветворными предшественниками. Про-СКК находятся в состоянии глубокого покоя, они не пролиферируют в культуре в ответ на цитокины, не образуют колоний в селезёнке in vivo или в полутвердых средах in vitro, при трансплантации начинают образовывать миелоидные клетки только через 8 мес, а лимфоидные - только после 10 мес. Не ясно, участвуют ли вообще про-СКК в нормальном кроветворении или существуют в качестве резерва для особых ситуаций.
Второй член стволового отдела - клетка, способная длительно репопулировать облучённое животное (ДР-СКК). Главная её характеристика - высокий пролиферативный потенциал. Одна такая клетка может обеспечить поддержание мультилинейного кроветворения в течение всей жизни животного; она даже способна восстановить кроветворение при пассаже к вторичному облученному реципиенту. ДР-СКК активно функционирует при трансплантации кроветворных тканей. Именно она обеспечивает эффекты, определяемые термином "трансплантация костного мозга". Стволовые клетки кроветворения человека имеют фенотип Lin-c-Kit+CD34+CD38-.
Последний член отдела - клетка, способная кратковременно репопулировать облучённое животное (КР-СКК). Её отличие от ДР-СКК только количественное: она способна полностью мультилинейно репопулировать облучённый организм, однако эффект кратковременен и через 4-6 нед её кроветворные способности истощаются.
Очень близок к клеткам стволового отдела мультипотентный предшественник (МКП): эти клетки не способны сколько-нибудь длительно поддерживать кроветворение, хотя они мультипотентны и сохраняют весь набор кроветворных дифференцировок.
Клетки всей кроветворной иерархии представляют собой континуум клеток, пролиферативный потенциал которых постепенно снижается, а степень дифференцированности нарастает. В отделе стволовых клеток возможно движение не строго в одном направлении: КР-СКК и даже МКП могут вернуться к свойствам ДР-СКК или остановиться в этом движении, возвращаясь к состоянию глубокого покоя.
Следующий отдел - полипотентные коммитированные предшественники. Выделены две популяции предшественников. Один из них, общий лимфоидный предшественник (ОЛП), способен только к лимфоидным дифференцировкам без промежуточных стадий; другой, общий миелоидный предшественник (ОМП), дифференцируется только по миелоидным направлениям. Оба они не способны к сколько-нибудь длительному поддержанию кроветворения без подсева из стволового отдела.
Дифференцировка общего миелоидного предшественника включает ряд промежуточных стадий: общий предшественник гранулоцитов и макрофагов, гранулоцитарно-моноцитарная колониеобразующая единица (ГМ-КОЕ), из которого дифференцируются монопотентные предшественники моноцитарная колониеобразующая единица (КОЕ-М) и гранулоцитарная колониеобразующая единица (КОЕ-Г) и общий предшественник эритроцитов и мегакариоцитов (ЭМгкц), который даёт начало эритроидному и тромбоцитарному ростку в костном мозге.
В схему кроветворения всегда включали только паренхиму костного мозга, т.е. кроветворные клетки, производные стволовой клетки кроветворения. Между тем в костном мозге существует ещё одна стволовая клетка, мезенхимальная стволовая клетка (МСК), которая строит "дом" для кроветворных клеток, строму костного мозга. Целесообразно сопроводить схему иерархии кроветворных клеток, иерархическим деревом мезенхимальных стволовых клеток, обеспечивающих не только поддержание кроветворения, но и в значительной степени его регуляцию (рис. 53-2).
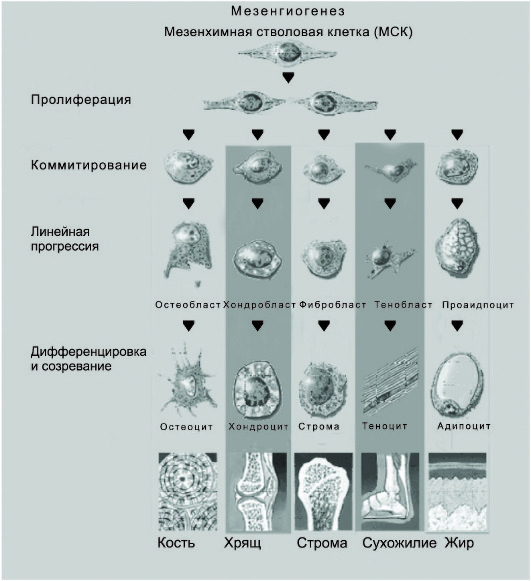
Мезенхимальные стволовые клетки охарактеризованы значительно хуже, чем стволовые кроветворные клетки. В костном мозге обнаружены клетки, способные при культивировании давать колонии прилипающих клеток разной морфологии, главным образом фибробластоподобных. По мере пассажей клетки приобретают более однообразную морфологию и могут расти бесконечно. Такие клетки названы мультипотентными взрослыми предшественниками (MAPC - Multipotent Adult Progenitor Cells).
Основные данные о существовании мезенхимальной стволовой клетки и её физиологическом значении были получены in vivo, при имплантации фрагментов костного мозга, например под капсулу почки. В этих условиях мезенхимальные стволовые строят кроветворное микроокружение заново: образуется кость, строма костного мозга, внеклеточный матрикс и все компоненты нормальной костномозговой стромы. На такую строму из крови мигрируют стволовые кроветворные клетки, начинающие кроветворную дифференцировку. Остеокласты ремодулируют кость, образуется костный футляр с губчатой костью внутри, возникает эктопический очаг кроветворения.
Одной из главных характеристик стволовой кроветворной клетки является её способность к миграции, с повторным заселением кроветворных территорий, инстинкт дома. Именно эта её способность позволила использовать внутривенную трансплантацию стволовых кроветворных клетки. И в этом отношении мезенхимальная стволовая клетка существенно отличается от стволовой кроветворной клетки: она не способна к миграции, не попадает в пригодные для заселения участки при внутривенном введении, и даже у полных радиационных химер не участвует в создании кроветворного микроокружения. Различные миграционные характеристики являются ещё одним веским доказательством независимости стволовой кроветворной и мезенхимальной стволовой клеток.
Мезенхимальная стволовая клетка обладает способностью к дифференцировке во все клетки кроветворного микроокружения, и характеризуется высоким "самоподдержанием". Открыты по меньшей мере два стромальных предшественника: мезенхимальная стволовая клетка, исходная мультипотентная клетка, способная к повторному переносу микроокружения, т.е. обладающая "самоподдержанием", и более зрелый мультипотентный элемент, индуцибильный предшественник стромы (ИПС), который отвечает на индукционные влияния и при наличии стимуляции (перенос в облучённый организм) строит очаг кроветворения, размер которого гораздо больше обычного (в нормальном реципиенте).
Существует внешнее сходство кроветворной и стромальной иерархий костного мозга. Однако по существу эти ткани принципиально отличаются. Основная задача кроветворной ткани - производство огромного количества клеток крови, имеющих относительно короткий жизненный цикл и потому нуждающихся в постоянном пополнении. Строма же кроветворной ткани представляет собой основу, "дом" для кроветворных клеток, кроветворное микроокружение, и обновление стромальных клеток происходит очень медленно, так как они имеют длительный жизненный цикл. Хотя строма постоянно перестраивается, интенсивность перестройки не идёт ни в какое сравнение с темпом кроветворения. Так, для замены скелета у человека требуется около 10 лет. Представленная картина только намечает линии стромальных дифференцировок. Неизвестно, существуют ли олиго-монопотентные стромальные предшественники и сколько клеточных элементов располагаются на пути от мезенхимальной стволовой клетки до терминально дифференцированных клеток ряда. Пока доказана дифференцировка мезенхимальной стволовой клетки в костную ткань, хрящ, строму костного мозга, сухожилия, жировую ткань. Весьма вероятно, что мезенхимальная стволовая клетка способна дифференцироваться в гладкие мышцы сосудов. Менее ясна дифференцировка в эндотелий, с последующим васкуло- и ангиогенезом.
В очень примитивном виде функции стромы можно ограничить двумя: механическая (образование скелета) и кроветворная (создание кроветворного микроокружения). Основная его роль заключается в осуществлении регулирующих влияний. В этом доме имеются привилегированные помещения, "ниши", в которых стволовые кроветворные клетки защищены как от внешних индуцирующих воздействий, так и от внутренних сигналов, что блокирует их дифференцировку и обеспечивает сохранение резерва стволовых кроветворных клеток. Другие участки стромы, включая клеточный матрикс, принимают участие в регуляции более зрелых клеток, разграничивая строму на участки преимущественно эритроидного или миелоидного кроветворения. Основы такой регуляции, видимо, связаны с градиентом концентрации цитокинов и ростовых факторов в зависимости либо от близости клеток, продуцирующих цитокины, либо от взаимодействия рецептор-лиганд на кроветворных и стромальных клетках.
В отличие от стволовой кроветворной клетки, использование в клинике мезенхимальной стволовой клетки только начато. Применение её обычно требует создания искусственных трёхмерных структур из биодеградированных материалов, или двумерных плёнок. Имеющиеся данные показывают перспективность этих исследований для ускорения заживления переломов, для создания синовиальных поверхностей и даже для ремоделирования суставов.
В предлагаемой схеме кроветворения впервые объединены обе категории стволовых клеток костного мозга, демонстрируется простой и очевидный факт: в физиологических условиях дифференцировки строго специфичны. Даже при общем происхождении (в данном случае мезенхимальном) и расположении в одной и той же ткани (костный мозг) линии дифференцировок стволовой кроветворной клетки и мезенхимальной стволовой клетки никогда не перекрываются.