Внутренние болезни в 2-х томах: учебник / Под ред. Н.А. Мухина, В.С. Моисеева, А.И. Мартынова - 2010. - 1264 c.
|
|
|
|
ГЛАВА 12. КАРДИОМИОПАТИИ И МИОКАРДИТЫ
Кардиомиопатия - первичное поражение миокарда, сопровождающееся нарушением его структуры и функций и не являющееся следствием других заболеваний, прежде всего венечных артерий, клапанного аппарата, перикарда, АГ. Это поражение обычно медленно прогрессирует.
Миокардиты могут развиваться на фоне клинической картины различных инфекций, и тогда их природа не вызывает особых сомнений, а течение характеризуется как правило выздоровлением под влиянием этиотропной терапии. Однако значительно чаще развитие миокардита отчетливо не связано с каким-либо внешним фактором, и наряду с быстрым обратным развитием симптомов воспаления миокарда возможно медленное (иногда после кажущегося выздоровления) развитие картины кардиомиопатии (обычно дилатационной). В связи с этим важно рассмотреть вопросы соотношения кардиомиопатий и миокардитов.
Если диагностика венечной патологии, включая инфаркт миокарда, в большой степени связана с появлением ЭКГ, то дифференцированный подход к поражениям миокарда обязан появлению, прежде всего, ЭхоКГ. Несомненно, оба типа поражения сердца стали наблюдать значительно чаще, начиная со второй половины ХХ века. Тем не менее доминирующими в диагностике остаются клинический подход и оценка патологии с выявлением основных кардиологических синдромов.
Хотя первые описания отдельных форм кардиомиопатий появились в литературе ещё в XIX веке, а к миокардитам и алкогольному поражению миокарда многие авторы неоднократно возвращались в течение ХХ века, проблема кардиомиопатий в её виде, близком современному, была сформулирована в конце 50-х годов ХХ века. Уже тогда были выделены три основных типа кардиомиопатий: гипертрофическая, дилатационная, рестриктивная.
Позднее были сформулированы представления о так называемых вторичных или специфических кардиомиопатиях, т.е. поражениях миокарда, развивающихся при известных, изученных ранее заболеваниях. При этом поражение миокарда часто доминировало в клинической картине, признаки патологии других органов иногда были выражены слабо, что вызывало трудности дифференциальной диагностики с первичными кардиомиопатиями.
В связи с развитием инвазивных методов диагностики в кардиологии, и в частности благодаря применению биопсии миокарда, в 1960-1970-х годах было накоплено много информации о морфологических признаках поражения сердца. Больше всего надежд возлагалось на адекватную морфологическую диагностику воспалительных изменений в сердце (миокардит) при клинических признаках его поражения. Однако оказалось, что воспалительный характер заболевания, подозреваемый клинически, не всегда подтверждался морфологически, а воспаление, подтверждённое морфологически, далеко не всегда поддавалось интенсивной противовоспалительной терапии. Сегодня биопсия миокарда чаще всего используется в трансплантологии для диагностики реакции отторжения и значительно реже - для уточнения характера морфологических изменений.
КЛАССИФИКАЦИЯ
В 1995 г. ВОЗ была предложена классификация кардиомиопатий, которая позднее была дополнена (Уинни Дж., Браунвальд Е., 2001).
• Первичные кардиомиопатии.
• Дилатационная кардиомиопатия - дилатация и нарушение сократимости желудочков, вызванные действием вирусных, иммунных, генетических, токсических (алкоголь) или других не выясненных пока факторов.
• Гипертрофическая кардиомиопатия - гипертрофия миокарда желудочков, часто асимметричная, связанная с мутацией генов белков саркоплазмы.
• Рестриктивная кардиомиопатия - ограничение наполнения и уменьшение диастолического размера желудочков при близкой к норме систолической функции.
• Аритмогенная кардиомиопатия правого желудочка - прогрессирующий фиброз и жировая дистрофия преимущественно правого желудочка, чаще у лиц из одной семьи. Проявляется желудочковой тахикардией, возникающей из правого желудочка.
• Неклассифициируемые кардиомиопатии - заболевания, которые не могут быть включены в описанные группы, включая систолическую дисфункцию с минимальной дилатацией, фиброэластоз.
• Вторичные (специфические) кардиомиопатии.
• Ишемическая кардиомиопатия (вследствие ИБС) характеризуется проявлениями дилатационной кардиомиопатии со снижением сократительной функции желудочков, не вполне соответствующей выраженности венечной обструкции и ишемии. Может протекать как со стенокардией и инфарктом миокарда, так и без них.
• Клапанная кардиомиопатия - дисфункция сердца, не соответствующая выраженности аномалии клапанов и перегрузки камер, связанной с недостаточностью клапана или стеноза отверстия.
• Гипертоническая кардиомиопатия - гипертрофия левого желудочка, иногда с явлениями недостаточности его функции систолического или диастолического происхождения.
• Воспалительная кардиомиопатия - дисфункция сердца вследствие миокардита.
• Метаболические кардиомиопатии (эндокринные, семейные болезни накопления, дефицит витаминов).
• Генерализованные системные заболевания (патология соединительной ткани, инфильтрации и гранулёмы).
• Мышечные дистрофии при миотонической дистрофии, дистрофиях мышц Дюшенна, Беккера.
• Нейромышечные нарушения при атаксии Фридрайха, лентигинозе.
• Аллергические и токсические реакции на алкоголь, цитотоксические средства, катехоламины, радиацию.
• Перипартальная кардиомиопатия во время беременности и после родов.
В клинической практике чаще используют функциональную классификацию кардиомиопатий, подразделяющую патологические изменения в сердце на три типа (дилатация, гипертрофия, рестрикция), что отчетливо выявляют, прежде всего, при первичных кардиомиопатиях.
• Дилатация характеризуется преобладанием расширения полостей над гипертрофией и превалированием систолической сердечной недостаточности.
• Гипертрофия характеризуется утолщением стенок сердца (как с обструкцией выносящего тракта левого желудочка, так и без неё) и возможностью развития диастолической сердечной недостаточности.
• Рестрикция проявляется неадекватным расслаблением миокарда левого желудочка, вызывающим ограничение диастолического наполнения левого желудочка.
При вторичных кардиомиопатиях чаще всего отмечают признаки дилатационной кардиомиопатии, реже - рестриктивной кардиомиопатии, и лишь в отдельных случаях возможны проявления вторичной гипертрофической кардиомиопатии (при АГ, амилоидозе).
12.1. ДИЛАТАЦИОННАЯ КАРДИОМИОПАТИЯ
Дилатационная кардиомиопатия - первичное поражение сердца, характеризующееся расширением его полостей и нарушением сократительной функции.
Заболеваемость в мире составляет 3-10 случаев на 100 000 населения. Мужчины заболевают чаще женщин. Хотя причина заболевания чаще всего остается невыясненной, синдром дилатационной кардиомиопатии описан при 75 болезнях, среди которых чаще фигурируют ИБС и скрываемое больным злоупотребление алкоголем.
ЭТИОЛОГИЯ
Возникновение дилатационной кардиомиопатии связывают с взаимодействием нескольких факторов: генетических нарушений, экзогенных воздействий (прежде всего вирусов, реже - цитотоксических ЛС), аутоиммунных механизмов.
• Семейную дилатационную кардиомиопатию, в развитии которой генетический фактор, видимо, играет решающую роль, наблюдают в 20-30% всех случаев этой болезни. Выделено несколько видов семейных форм дилатационных кардиомиопатий с различными генетическими нарушениями, пенетрантностью и клиническими проявлениями. Чаще у близких родственников больных находят бессимптомно протекающую дилатацию левого желудочка (по данным ЭхоКГ). Патология наследуется по аутосомно-доминантному типу. Одна из форм этой патологии - мутация гена белка дистрофина (компонента цитоскелета кардиомиоцитов). Известны также мутации митохондриальной дезоксирибонуклеиновой кислоты (ДНК). В перспективе разрабатывается программа по выявлению бессимптомных носителей мутировавшего гена и профилактике прогресссирования болезни.
• Обнаружена связь между перенесённым инфекционным миокардитом и развитием дилатационной кардиомиопатии. Установлено, что дилатационная кардиомиопатия может развиться после миокардита (в 15% случаев), вызванного рядом инфекционных агентов [энтеровирусами, вирусом гепатита C, вирусом иммунодефицита человека (ВИЧ) и др.]. С помощью метода молекулярной гибридизации обнаружена энтеровирусная рибонуклеиновая кислота (РНК) в ДНК клеток больных с миокардитом и дилатационной кардиомиопатией. После инфекции, обусловленной вирусом Коксаки, может развиться сердечная недостаточность (даже через несколько лет).
• Под воздействием экзогенных факторов белки сердечной ткани приобретают антигенные свойства, что стимулирует синтез АТ и провоцирует развитие дилатационной кардиомиопатии. При дилатационной кардиомиопатии обнаружено увеличение содержания в крови цитокинов и активированных T-лимфоцитов. Находят аномалии различных Т-лимфоцитов: цитотоксических, супрессорных, NK-клеток. Кроме того, обнаруживают АТ к ламинину, миозину тяжёлых цепей, тропомиозину, актину. Все эти данные указывают на связь развития дилатационной кардиомиопатии с предшествующим миокардитом.
Однако большую часть случаев развития синдрома дилатационной кардиомиопатии связывают с ИБС.
ПАТОГЕНЕЗ
Уменьшение количества полноценно функционирующих кардиомиоцитов приводит к расширению камер сердца и нарушению сократительной функции миокарда. Полости сердца расширяются, развиваются систолическая и диастолическая дисфункции обоих желудочков. Заболевания постепенно прогрессирует согласно ниже перечисленным механизмам, в итоге приводя к развитию ХСН.
• На начальных стадиях болезни компенсация происходит благодаря закону Франка-Старлинга (степень диастолического растяжения пропорциональна силе сокращения волокон миокарда). Сердечный выброс сохраняется также за счёт увеличения ЧСС и уменьшения периферического сопротивления при физической нагрузке.
• Постепенно компенсаторные механизмы нарушаются, увеличивается ригидность сердца, ухудшается систолическая функция, и закон Франка-Старлинга перестаёт действовать. Уменьшаются минутный и ударный объёмы сердца, увеличивается конечное диастолическое давление в левом желудочке и происходит дальнейшее расширение полостей сердца. Возникает относительная недостаточность митрального и трёхстворчатого клапанов из-за дилатации желудочков и расширения фиброзных колец. В ответ на это (а также для уменьшения дилатации полостей) возникает компенсаторная гипертрофия миокарда в результате увеличения миоцитов и объёма соединительной ткани (масса сердца может превышать 600 г). Уменьшение сердечного выброса и увеличение внутрижелудочкового диастолического давления могут привести к уменьшению венечной перфузии, вследствие чего возникает субэндокардиальная ишемия.
• Уменьшение сердечного выброса и снижение перфузии почек стимулируют симпатическую нервную и ренин-ангиотензиновую системы. Избыточное количество катехоламинов повреждает миокард, приводя к тахикардии, аритмиям и периферической вазоконстрикции. Ренин-ангиотензиновая система вызывает периферическую вазоконстрикцию, вторичный гиперальдостеронизм, приводя к задержке ионов натрия, жидкости и развитию отёков, увеличению ОЦК.
Характерно формирование в полостях сердца пристеночных тромбов. Они возникают (в порядке уменьшения частоты встречаемости): в ушках предсердий, правом желудочке, левом желудочке. Образованию пристеночных тромбов способствует замедление пристеночного кровотока из-за уменьшения сократимости миокарда, фибрилляции предсердий, увеличения активности свёртывающей системы крови и уменьшения фибринолитической активности. Повреждение клеток проводящей системы и кардиомиоцитов создает предпосылки для развития аритмий и нарушений проводимости.
ПАТОМОРФОЛОГИЯ
Отмечают дилатацию камер сердца, особенно левого желудочка (обычно с его небольшой гипертрофией). Нередко обнаруживают внутрисердечные тромбы. При микроскопическом исследовании находят поля фиброза, особенно периваскулярного и субэндокардиального, иногда видны небольшие участки некроза и клеточной инфильтрации, признаки гипертрофии кардиомиоцитов. При обычном исследовании невозможно уточнить этиологический фактор.
КЛИНИЧЕСКАЯ КАРТИНА
Проявления дилатационной кардиомиопатии включают застойную сердечную недостаточность, нарушения ритма и тромбоэмболии (возможно наличие как одного, так и всех трёх признаков). Заболевание развивается постепенно, но при отсутствии лечения (а часто даже и на фоне лечения) неуклонно прогрессирует. Клиническая картина определяется компенсацией болезни.
• Жалобы длительное время могут отсутствовать. При снижении сократительной способности миокарда постепенно возникают жалобы, характерные для ХСН: одышка, слабость, утомляемость, сердцебиение, периферические отёки (см. главу 11 "Сердечная недостаточность"). При расспросе больных нужно выяснить возможную этиологию болезни (семейный анамнез, вирусная инфекция, токсические воздействия, другие заболевания).
• При декомпенсации отмечают признаки застоя в малом (одышка, хрипы в лёгких, ортопноэ, приступы сердечной астмы) и большом (периферические отёки, асцит, гепатомегалия) круге кровообращения, сниженного сердечного выброса (снижение периферической перфузии в виде цианоза и холодной влажной кожи, низкое систолическое АД) и нейроэндокринной активации (тахикардия, периферическая вазоконстрикция).
Одним из ранних проявлений дилатационной кардиомиопатии может быть пароксизмальная мерцательная аритмия, которая, как правило, быстро переходит в постоянную форму. Однако даже при наличии тахисистолии больной часто долгое время не ощущает мерцательную аритмию.
При перкуссии сердца можно выявить расширение границ относительной сердечной тупости в обе стороны (кардиомегалия), а при аускультации - систолические шумы относительной недостаточности трёхстворчатого и митрального клапанов.
Характерно нарушение ритма в виде фибрилляции предсердий. Возможны тромбоэмболические осложнения по типу поражения мелких ветвей лёгочной артерии, окклюзии артерий большого круга кровообращения при наличии пристеночных тромбов. К частым осложнениям дилатационной кардиомиопатии относятся тромбоэмболии, возникающие более чем у 30% больных. Риск тромбоэмболических осложнений наиболее высок у больных с постоянной формой мерцательной аритмии и выраженной сердечной недостаточностью. Однако тромбоэмболии возникают и при стабильном состоянии больных, не внушающем каких-либо опасений. Тромбоэмболии в мозговые артерии и крупные ветви лёгочной артерии могут стать причиной внезапной смерти больных. Однако некоторые тромбоэмболии (например, в сосуды почек) протекают бессимптомно и иногда обнаруживаются лишь при аутопсии. Другие частые осложнения дилатационной кардиомиопатии - нарушения ритма и проводимости сердца (30% больных), внезапная сердечная смерть.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Используют следующие инструментальные методы исследования.
• На ЭКГ можно обнаружить признаки гипертрофии и перегрузки левого желудочка (депрессия сегмента ST и отрицательные зубцы T в I стандартном, aVL, V5, V6 отведениях), левого предсердия. У 20% больных дилатационной кардиомиопатией обнаруживают фибрилляцию предсердий. Возможны нарушения проводимости, в частности блокада левой ножки пучка Гиса (до 80% больных), наличие которой коррелирует с высоким риском внезапной сердечной смерти (появление блокады левой ножки пучка Гиса связывают с развитием фиброзного процесса в миокарде). Характерно удлинение интервала Q-T и его дисперсия (см. главу 13 "Аритмии и блокады сердца"). Реже возникает АВ-блокада.
• ЭхоКГ (рис. 12-1) позволяет выявить основной признак дилатационной кардиомиопатии - дилатацию полостей сердца с уменьшением фракции выброса левого желудочка, снижение сократимости миокарда, при этом возможны участки асинергии. В допплеровском режиме можно обнаружить относительную недостаточность митрального и трёхстворчатого клапанов (может быть и относительная недостаточность аортального клапана), нарушения диастолической функции левого желудочка. Кроме того, при ЭхоКГ можно провести дифференциальную диагностику, определить вероятную причину сердечной недостаточности (пороки сердца, постинфарктный кардиосклероз), оценить риск тромбоэмболии при наличии пристеночных тромбов.
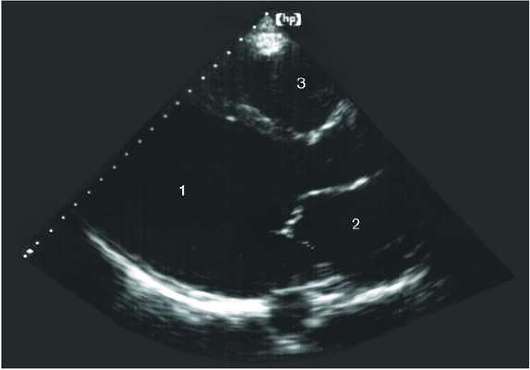
• Рентгенологическое исследование помогает обнаружить увеличение размеров сердца, признаки лёгочной гипертензии, гидроперикарда.
ДИАГНОСТИКА
Диагноз дилатационной кардиомиопатии ставят путём исключения других заболеваний сердца, проявляющихся синдромом хронической систолической сердечной недостаточности.
Основным методом диагностики дилатационной кардиомиопатии служит ЭхоКГ, позволяющая выявить дилатацию камер сердца и снижение сократимости левого желудочка, а также исключить поражение клапанов сердца и перикардиальный выпот. Обнаруживают увеличение конечного систолического и диастолического размеров левого желудочка, уменьшение его фракции выброса, иногда умеренную гипертрофию миокарда. Позднее развивается дилатация правого желудочка.
У дилатационной кардиомиопатии нет каких-либо патогномоничных клинических или морфологических маркёров, что затрудняет её дифференциальную диагностику с вторичными поражениями миокарда известной природы (при ИБС, АГ, системных заболеваниях и т.д.). Последние, при наличии дилатации камер сердца, как уже упоминалось, называют вторичными кардиомиопатиями. Особенно трудной иногда бывает дифференциальная диагностика дилатационной кардиомиопатии с тяжёлым ишемическим поражением миокарда у пожилых людей при отсутствии характерного болевого синдрома в виде стенокардии. При этом следует обращать внимание на наличие факторов риска атеросклероза, наличие атеросклеротического поражения аорты и других сосудов, но решающими могут быть данные коронарографии, позволяющие исключить стенозирующее поражение венечных артерий. При зондировании сердца отмечают увеличение конечного диастолического давления в левом желудочке, а также давления в левом предсердии и лёгочной артерии. При более тяжёлом поражении отмечают также увеличение и повышение давления в правых камерах сердца. Венечные артерии при идиопатической дилатационной кардиомиопатии остаются неизменёнными.
ЛЕЧЕНИЕ
Лечение дилатационной кардиомиопатии заключается в адекватной коррекции ХСН (см. главу 11 "Сердечная недостаточность").
• В первую очередь необходимо ограничить физическую нагрузку и количество потребляемой соли и жидкости.
• Всем больным при отсутствии противопоказаний необходимо назначать ингибиторы АПФ (каптоприл, эналаприл, рамиприл, периндоприл и др.), в том числе даже при отсутствии застойной сердечной недостаточности. Препараты этой группы не только дают симптоматический эффект, но и предупреждают развитие и прогрессирование сердечной недостаточности. При появлении задержки жидкости ингибиторы АПФ комбинируют с диуретиками, в основном с фуросемидом.
• При тяжёлой сердечной недостаточности показано применение спиронолактона в дозе 25-50 мг/сут.
• Кроме того, используют дигоксин, особенно при наличии мерцательной аритмии.
Лечение аритмии и сердечной недостаточности
Значительные трудности в лечении больных дилатационной кардиомиопатией возникают при наличии стойкой тахикардии и тяжёлых нарушений ритма сердца. Терапия дигоксином в дозах более 0,25-0,375 мг/сут у таких больных быстро приводит к развитию гликозидной интоксикации даже при нормальной концентрации калия в сыворотке крови. В таких случаях целесообразно использование β-адреноблокаторов (бисопролола, карведилола, метопролола). Применение β-адреноблокаторов особенно показано при постоянной форме мерцательной аритмии. О благоприятном действии β-адреноблокаторов при дилатационной кардиомиопатии свидетельствуют результаты ряда клинических испытаний, которые подтвердили увеличение выживаемости больных под влиянием препаратов этой группы (см. также главу 11 "Сердечная недостаточность"). При сердечной недостаточности лучше всего изучена эффективность кардиоселективных препаратов метопролола и бисопролола, а также карведилола, блокирующего не только β-адренорецепторы, но и α1-адренорецепторы. Блокада последних приводит к расширению сосудов.
Антиагреганты
В связи со склонностью к тромбообразованию целесообразно длительное применение антиагрегантов - ацетилсалициловой кислоты в дозе 0,25-0,3 г/сут.
Трансплантация сердца
Как первичная дилатационная кардиомиопатия, так иногда и вторичная при ИБС - одно из главных показаний к трансплантации сердца.
ТЕЧЕНИЕ И ПРОГНОЗ
Естественное течение дилатационной кардиомиопатии может быть разнообразным и остается не совсем прогнозируемым. Во-первых, есть больные, у которых дилатация левого желудочка и других камер сердца может быть весьма умеренной (хотя четко превышающей нормальные размеры), а у части из них жалобы могут отсутствовать, переносимость нагрузки может быть удовлетворительной. Некоторых из них впоследствии даже исключали из числа претендентов на пересадку сердца. Число таких больных остается не ясным. Поэтому, наряду с несомненной вероятностью прогрессирования болезни и неблагоприятного исхода, следует иметь в виду возможность более благоприятного течения и даже выздоровления. В таких случаях не следует забывать о возможности благоприятной динамики заболевания при сокращении употребления алкоголя.
Неблагоприятный прогноз имеют больные дилатационной кардиомиопатией при наличии следующих проявлений.
• IV функциональный класс ХСН по Нью-Йоркской классификации (см. главу 11 "Сердечная недостаточность").
• Выраженная дилатация левого или правого желудочка, выявленная при ЭхоКГ или рентгенологическом исследовании.
• Сферическая форма левого желудочка по данным ЭхоКГ.
• Низкая фракция выброса левого желудочка по данным ЭхоКГ.
• Низкое систолическое АД.
• Низкий сердечный индекс (менее 2,5 л/мин/м2).
• Высокое давление наполнения левого и правого желудочка.
• Признаки выраженной нейроэндокринной активации - низкая концентрация натрия в сыворотке крови, увеличенное содержание в крови норадреналина.
Неблагоприятный прогноз определяется наличием таких клинических признаков, как ритм галопа, частые желудочковые аритмии, пожилой возраст больных, выраженность сердечной недостаточности и фиброза миокарда по данным биопсии миокарда.
Выживаемость больных с дилатационной кардиомиопатией в течение 10 лет в среднем составляет 15-30%. При малосимптомном течении дилатационной кардиомиопатии 5-летняя выживаемость больных не превышает 80%. У больных, госпитализированных по поводу ХСН, 5-летняя выживаемость составляет 50%. При рефрактерной сердечной недостаточности (IV функциональный класс по Нью-Йоркской классификации) выживаемость в течение 1 года не превышает 50%.
АЛКОГОЛЬНАЯ КАРДИОМИОПАТИЯ
Полагают, что у 30% больных дилатационная кардиомиопатия вызвана избыточным потреблением алкоголя, т.е. поражение миокарда у них, по крайней мере до определённого времени, может быть обратимым. Клинические наблюдения показывают, что избыточное потребление алкоголя может приводить к сердечной недостаточности, АГ, цереброваскулярным нарушениям, аритмиям и внезапной смерти. При этом эпидемиологические исследования показывают, что алкоголь регулярно употребляет 60% взрослого населения, а 10% им злоупотребляют.
Токсическое воздействие алкоголя на миокард может привести к возникновению дилатационной кардиомиопатии различными путями.
• В экспериментальных исследованиях воздействие этанола или его метаболита уксусного ацетальдегида вызывает уменьшение синтеза сократительных белков, повреждение митохондрий, образование свободных радикалов и повреждение кардиомиоцитов (наблюдают увеличение содержания тропонина T в крови как признак поражения миокарда). Тем не менее тяжёлое поражение миокарда по типу дилатационной кардиомиопатии возникает лишь у 20% лиц, злоупотребляющих алкоголем.
• Хроническое воздействие этанола вызывает уменьшение синтеза белков, повреждение саркоплазматической сети и образование токсических эфиров жирных кислот и свободных радикалов. Кроме того, хроническое употребление алкоголя вызывает нарушения питания и всасывания, ведущие к дефициту тиамина, гипомагниемии, гипофосфатемии. Эти нарушения обусловливают изменение метаболизма клеток, механизма возбуждения-сокращения и усиливают дисфункцию миокарда. Изменения в миокарде могут возникнуть как остро, так и постепенно.
Следует иметь ввиду, что при употреблении алкоголя может развиться бери-бери, т.е гиповитаминоз B1.
ПАТОМОРФОЛОГИЯ
Патологические изменения в миокарде неспецифичны и проявляются интерстициальным фиброзом, цитолизом миоцитов, признаками гипертрофии части мышечных волокон. Электронная микроскопия обнаруживает увеличенные и дезорганизованные митохондрии с крупными гликогенсодержащими вакуолями. Имеются данные о развитии преимущественно жировой дистрофии кардиомиоцитов.
КЛИНИЧЕСКАЯ КАРТИНА
Болезнь чаще развивается у мужчин 40-55 лет. Многие из них остаются социально адаптированными лицами без признаков поражения печени и нервной системы. Обычно они хорошо переносят большие дозы алкоголя, не теряя при этом самоконтроля и сохраняя высокую работоспособность. Эти люди часто отрицают злоупотребление алкоголем (поскольку сохраняют самоконтроль даже при употреблении крепких алкогольных напитков до 1 л/сут). Поэтому следует обращать внимание на наличие признаков злоупотребления алкоголем: склонность к ожирению, паротит, контрактуру Дюпюитрена, признаки травм, татуировка, признаки другой висцеральной патологии (гастрит, панкреатит, энцефалопатия, увеличение печени). В крови часто находят макроцитоз, небольшое повышение активности ГГТП и трансаминаз.
На ранних стадиях болезни могут быть кардиалгии, снижение переносимости физической нагрузки, что при специальном обследовании может сопровождаться нарушением диастолической функции. Позднее у части пациентов развивается дилатация камер сердца с нарушением кровообращения по обоим кругам, причём иногда даже раньше по большому кругу. Часто фактором, провоцирующим развитие или усиление сердечной недостаточности, служит пароксизм мерцательной аритмии, которая поначалу может наступать эпизодически после алкогольных эксцессов.
Клинические признаки на поздней стадии не имеют отличия от признаков дилатационной кардиомиопатии. Возможны разнообразные изменения ЭКГ с нарушениями проводимости, наджелудочковыми и желудочковыми аритмиями, изменениями реполяризации.
ЛЕЧЕНИЕ
Необходима строгая абстиненция (поэтому особенно важен своевременный диагноз). При этом постепенно может наступить улучшение. Через 6-12 мес при абстиненции признаки сердечной недостаточности могут значительно уменьшиться, так же как потребность в лекарствах, прежде всего мочегонных. При проведении исследования с мечеными моноклональными АТ показано отчетливое уменьшение их связывания в миокарде при прекращении употребления алкоголя. Терапия синдрома дилатационной кардиомиопатии с сердечной недостаточностью, аритмиями, тромбоэмболиями проводится по общим правилам. В последние годы проявления алкогольной кардиомиопатии все чаще встречаются у более пожилых больных с признаками ИБС, в том числе перенесших инфаркт миокарда. Необходимость строгой абстиненции в таких случаях очевидна.
12.2. ГИПЕРТРОФИЧЕСКАЯ КАРДИОМИОПАТИЯ
Гипертрофическая кардиомиопатия - достаточно распространённое поражение сердца генетической природы, характеризующееся утолщением стенок левого желудочка. Гипертрофия стенки левого желудочка более 15 мм неясного генеза считается диагностическим критерием гипертрофической кардиомиопатии.
Различают обструктивную (сужающую выносящий тракт левого желудочка) и необструктивную гипертрофические кардиомиопатии. Гипертрофия может быть симметричной (увеличение с вовлечением всех стенок левого желудочка) и асимметричной (увеличение с вовлечением одной из стенок). Гипертрофия может охватывать изолированно лишь верхушку сердца (апикальная гипертрофическая кардиомиопатия). При гипертрофии верхней части межжелудочковой перегородки непосредственно под фиброзным кольцом аортального клапана говорят о мышечном субаортальном стенозе.
Важными общими особенностями гипертрофической кардиомиопатии (как с обструкцией, так и без неё) выступают высокая частота нарушений ритма сердца, прежде всего желудочковой экстрасистолии и пароксизмальной тахикардии. С аритмиями связывают внезапную смерть, наступающую у 50% больных гипертрофической кардиомиопатией.
Эпидемиология
Гипертрофическую кардиомиопатию наблюдают у 0,2% населения, чаще в виде необструктивных форм (70-80%), реже - обструктивных (20-30%, в виде идиопатического гипертрофического мышечного субаортального стеноза). Заболеваемость у детей составляет 0,3-0,5 случаев на 100 000 населения. Нередко болезнь развивается в зрелом и пожилом возрасте, хотя в последнем случае диагностика заболевания может вызвать трудности, поскольку возможна связь заболевания с атеросклеротическим поражением. Мужчины болеют чаще женщин. Возможно сочетание болезни с другой патологией генетической природы.
ЭТИОЛОГИЯ
Гипертрофическую кардиомиопатию считают наследственным заболеванием. Она наследуется аутосомно-доминантным путём в результате мутаций одного из следующих генов кодирующих белки саркомера:
• β-тяжёлая цепь миозина, ген локализован в хромосоме 14;
• тропонин T сердечной ткани, ген в хромосоме 1;
• тропомиозин, ген в хромосоме 15;
• миозин-связывающий белок C, ген в хромосоме 11;
• лёгкие цепи миозина (хромосомы 3 и 12);
• актин (хромосома 15), титин, тропонин C.
Семейный характер патологии отмечают более чем у половины больных. При этом в одной семье имеются признаки одной и той же мутации. Выявлены по крайней мере 10 генетических локусов, ответственных за возникновение заболевания. В этих генах обнаружено более 100 мутаций, вызывающих гипертрофическую кардиомиопатию. Выживаемость больных гипертрофической кардиомиопатией, возникшей в результате особо клинически злокачественной мутации гена β-тяжёлой цепи миозина, существенно ниже, чем при мутации гена сердечного тропонина T, причём в последнем случае клинические проявления возникают в более позднем возрасте. Генетические исследования показывают, что у близких родственников больных нередко имеются те же генетические мутации, однако без неблагоприятных фенотипических признаков (здоровые носители мутировавщего гена). У этих лиц гипертрофия миокарда может развиться спустя много лет.
ПАТОГЕНЕЗ
Большинство мутаций генов саркомеров приводят к замене одной аминокислоты в белке, имеющем важное функциональное значение. В результате мутации генов возникает гипертрофия левого желудочка и участки дезорганизации кардиомиоцитов.
Механизмы, приводящие к характерным изменениям, остаются неясными.
• Полагают, что гипертрофия развивается в результате снижения сократительной функции миокарда, хотя это предположение не получило достаточного подтверждения. Не исключают нарушения энергетических процессов с аномалией использования аденозинтрифосфорной кислоты (АТФ).
• В возникновении гипертрофической кардиомиопатии имеет значение и патологическая стимуляция симпатической нервной системы. Кроме того, аномально утолщённые интрамуральные артерии не обладают способностью к адекватной дилатации, что ведёт к ишемии, фиброзу миокарда и его патологической гипертрофии.
Вне зависимости от предполагаемых причин развития заболевания патогенез включает следующие изменения.
• Нарушение систолической функции, которое особенно характерно для асимметричной формы.
При асимметричной гипертрофии межжелудочковой перегородки возникает обструкция выносящего тракта левого желудочка - мышечный субаортальный стеноз. При такой локализации гипертрофии миокарда левый желудочек разделяется на две части: сравнительно небольшую субаортальную и большую верхушечную. В период изгнания между ними возникает перепад давления. Обструкция выносящего тракта и градиент давления в левом желудочке весьма вариабельны и могут спонтанно уменьшаться или увеличиваться, т.е. субаортальный стеноз носит динамический характер. Это объясняют тем, что причиной субаортального стеноза выступают не только гипертрофия межжелудочковой перегородки, но и парадоксальное смещение передней створки митрального клапана. Эта створка в систолу приближается к перегородке, а иногда даже полностью смыкается с ней на короткое время (0,08 с), что приводит к появлению или резкому нарастанию обструкции выносящего тракта левого желудочка. Патологическое движение передней створки митрального клапана вперёд во время систолы возникает в результате сокращения сосочковых мышц при аномальном расположении митрального клапана по отношению к выносящему тракту левого желудочка. Кроме того, выброс крови из выносящего тракта левого желудочка и снижение давления в нём притягивают переднюю створку к межжелудочковой перегородке (эффект насоса Вентури).
• Вследствие наличия препятствий для нормального тока крови нарастает градиент давления между левым желудочком и аортой, что приводит к повышению конечного систолического давления в левом желудочке. У большинства больных отмечают повышенные показатели систолической функции левого желудочка.
• Вне зависимости от градиента давления между левым желудочком и аортой у больных с гипертрофической кардиомиопатией имеется нарушение диастолической функции левого желудочка, приводящее к увеличению конечного диастолического давления, увеличению давления заклинивания лёгочных капилляров, дилатации левого предсердия. Развитие диастолической дисфункции связано с уменьшением растяжимости (вследствие увеличения мышечной массы, уменьшения полости левого желудочка и снижения растяжимости миокарда вследствие его фиброза) и нарушением расслабления левого желудочка.
• Гипертрофическая кардиомиопатия в ряде случаев сопровождается ишемией миокарда, что связано со следующими причинами.
• Снижение вазодилататорного резерва венечных артерий.
• Аномальное строение интрамуральных артерий сердца.
• Увеличение потребности миокарда в кислороде (увеличенная мышечная масса).
• Сдавление артерий, проходящих в толще миокарда во время систолы.
• Увеличения диастолического давления наполнения.
Помимо перечисленных причин, у 15-20% больных наблюдают сопутствующий атеросклероз венечных артерий.
ПАТОМОРФОЛОГИЯ
Основное морфологическое проявление гипертрофической кардиомиопатии - утолщение стенок левого желудочка более 13 мм (иногда до 60 мм) в сочетании с нормальными или уменьшенными размерами его полости. У большинства больных гипертрофию обнаруживают в возрасте более 20 лет. Наблюдают гипертрофию межжелудочковой перегородки и большей части боковой стенки левого желудочка, в то время как задняя стенка вовлекается в процесс редко. У других пациентов гипертрофируется только межжелудочковая перегородка. У 30% больных может быть локальная гипертрофия стенки левого желудочка небольших размеров: верхушки левого желудочка (апикальная), только задней или переднебоковой стенки. У части больных (около 30%) в гипертрофический процесс вовлекаются правый желудочек, сосочковые мышцы. Наряду с этим имеется дилатация левого предсердия (возникает из-за увеличенного конечного диастолического давления в левом желудочке).
При гистологическом исследовании участков гипертрофии обнаруживают беспорядочное расположение кардиомиоцитов, замещение мышечной ткани фиброзной, аномальные интрамуральные венечные артерии. Считается, что участки дезорганизации кардиомиоцитов могут предрасполагать к возникновению аритмий.
Наиболее важным гистологическим признаком считают наличие неупорядоченной гипертрофии, характеризующейся разнонаправленным расположением миофибрилл и необычными связями между соседними клетками миокарда. При микроскопии (в том числе с использованием электронного микроскопа) биоптатов обоих желудочков при гипертрофической кардиомиопатии выявляют также неспецифические дистрофические и пролиферативные изменения. Очаги фиброза представлены беспорядочно переплетающимися пучками грубых коллагеновых волокон.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
У большинства больных жалобы и клинические признаки заболевания могут длительно отсутствовать, и только тщательное обследование помогает установить диагноз.
Клинические проявления гипертрофической кардиомиопатии обусловлены обструкцией выносящего тракта левого желудочка, его диастолической дисфункцией, ишемией миокарда и нарушениями сердечного ритма. При гипертрофической кардиомиопатии возможна внезапная сердечная смерть. В большинстве случаев (80%) она возникает в результате фибрилляции желудочков. К факторам риска внезапной сердечной смерти при гипертрофической кардиомиопатии относят следующие.
• Остановка сердца в анамнезе.
• Стойкая желудочковая тахикардия.
• Резко выраженная гипертрофия левого желудочка.
• Особенности генотипа (характер мутации) или семейный анамнез внезапной сердечной смерти.
• Частые пароксизмы желудочковой тахикардии, выявляемые при суточном мониторировании ЭКГ.
• Раннее появление симптомов гипертрофической кардиомиопатии (в детском возрасте).
• Частые обмороки.
• Ненормальная реакция АД на физическую нагрузку (снижение).
Сердечная недостаточность с выраженными застойными явлениями может развиться у 15-20% больных. Возможно возникновение острой сердечной недостаточности, особенно при резком усилении митральной обструкции. При этом существенной дилатации сердца обычно не происходит, поскольку основной механизм в этом случае - нарушение диастолы и наполнения левого желудочка.
ЖАЛОБЫ
Заболевание длительное время может протекать бессимптомно, и его случайно выявляют при обследовании по другому поводу. Наиболее часто больных беспокоят одышка при физической нагрузке, боли за грудиной (различного, в том числе стенокардитического характера), сердцебиение, головокружения, обмороки.
• Одышка возникает в результате увеличения диастолического давления наполнения левого желудочка и пассивного ретроградного увеличения давления в лёгочных венах. Увеличение давления наполнения левого желудочка обусловлено ухудшением диастолического расслабления вследствие выраженной гипертрофии.
• Головокружение и обмороки возникают при физических нагрузках в результате ухудшения мозгового кровообращения вследствие усугубления обструкции выносящего тракта левого желудочка. Также эпизоды потери сознания могут быть обусловлены аритмиями.
• Боли за грудиной появляются вследствие увеличения потребности миокарда в кислороде в результате гипертрофии. Могут возникать типичные приступы стенокардии, причинами которых выступают несоответствие между венечным кровотоком и возросшей потребностью в кислороде гипертрофированного миокарда, сдавление интрамуральных ветвей венечных артерий субэндокардиальной ишемией в результате нарушения диастолического расслабления.
• Сердцебиение может быть проявлением наджелудочковой или желудочковой тахикардии, фибрилляции предсердий.
ОБЪЕКТИВНОЕ ОБСЛЕДОВАНИЕ
При осмотре внешних проявлений заболевания может не быть. При наличии выраженной сердечной недостаточности обнаруживают цианоз.
При пальпации можно выявить двойной верхушечный толчок (сокращение левого предсердия и левого желудочка) и систолическое дрожание у левого края грудины.
Тоны сердца обычно не изменены, хотя может быть парадоксальное расщепление II тона при значительном градиенте давления между левым желудочком и аортой (см. раздел "Стеноз устья аорты" в главе 8 "Приобретённые пороки сердца"). Основным аускультативным проявлением гипертрофической кардиомиопатии с обструкцией выносящего тракта левого желудочка считают систолический шум. Возникновение систолического шума связано с наличием внутрижелудочкового градиента давления между левым желудочком и аортой, а также митральной регургитацией (заброс крови в левое предсердие в результате пролабирования одной из створок митрального клапана вследствие избыточного давления в левом желудочке).
• Шум имеет характер нарастания и последующего убывания и его лучше выслушивать между верхушкой сердца и левым краем грудины. Он может иррадиировать в подмышечную область.
• Шум ослабевает (вследствие уменьшения обструкции выносящего тракта левого желудочка) при уменьшении сократимости миокарда (например, вследствие приёма β-адреноблокаторов), увеличении объёма левого желудочка или увеличении АД (например, в положении на корточках, приёме вазоконстрикторов).
• Шум усиливается (вследствие увеличения обструкции) в результате усиления сократимости (например, при физической нагрузке), уменьшения объёма левого желудочка, снижения АД (например, при пробе Вальсальвы, приёме антигипертензивных средств, нитратов).
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Используют следующие инструментальные исследования.
• Изменения на ЭКГ при гипертрофической кардиомиопатии обнаруживают у 90% больных. К основным признакам заболевания относят: гипертрофию левого желудочка, изменения сегмента ST и зубца T, наличие патологических зубцов Q (во II, III стандартных, aVF, грудных отведениях), фибрилляцию и трепетание предсердий, желудочковую экстрасистолию, укорочения интервала P-R(Q), неполную блокаду ножек пучка Гиса. Причины появления патологических зубцов Q неизвестны. Их связывают с ишемией миокарда, ненормальной активацией межжелудочковой перегородки. Реже на ЭКГ у больных фиксируют желудочковую тахикардию, фибрилляцию предсердий. При верхушечной кардиомиопатии часто возникают гигантские отрицательные зубцы T (глубиной более 10 мм) в грудных отведениях.
• При суточном мониторировании ЭКГ наджелудочковые аритмии выявляют у 25-50% больных гипертрофической кардиомиопатией, у 25% больных обнаруживают желудочковую тахикардию.
• ЭхоКГ - основной метод диагностики данного заболевания (рис. 12-2). Определяют локализацию гипертрофированных участков миокарда, степень выраженности гипертрофии, наличие обструкции выносящего тракта левого желудочка. В 60% выявляют асимметричную гипертрофию, в 30% - симметричную, в 10% - апикальную. В допплеровском режиме определяют выраженность митральной регургитации, степень градиента давления между левым желудочком и аортой (градиент давления более 50 мм рт.ст. считают выраженным). Кроме того, в допплеровском режиме также выявляют сопутствующую незначительную или умеренную аортальную регургитацию у 30% больных гипертрофической кардиомиопатией. У 80% больных можно выявить признаки диастолической дисфункции левого желудочка (см. главу 11 "Сердечная недостаточность" раздел 11.3 "Диастолическая сердечная недостаточность"). Фракция выброса левого желудочка может быть увеличена.
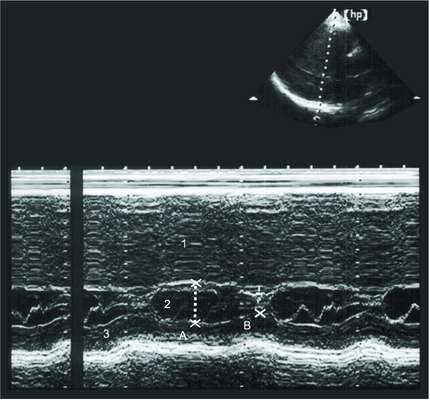
К признакам гипертрофической кардиомиопатии также относят: малый размер полости левого желудочка, дилатацию левого предсердия, сниженную амплитуду движения межжелудочковой перегородки при нормальном или увеличенном движении задней стенки левого желудочка, прикрытие створок аортального клапана в середине систолы (в результате эффекта Вентури).
Признаками обструктивной кардиомиопатии считают следующие.
• Асимметричная гипертрофия межжелудочковой перегородки (толщина межжелудочковой перегородки должна быть на 4-6 мм больше нормы для данной возрастной группы и в 1,3 и более раза толще задней стенки левого желудочка).
• Систолическое движение передней створки митрального клапана вперёд.
• При рентгенологическом исследовании контуры сердца могут быть нормальными. При значительном повышении давления в лёгочной артерии отмечают выбухание её ствола и расширение ветвей.
ТЕЧЕНИЕ
Течение гипертрофической кардиомиопатии вариабельно. У большинства больных заболевание протекает стабильно или даже имеет тенденцию к улучшению (у 5-10% в течение 5-20 лет). Женщины с гипертрофической кардиомиопатией обычно хорошо переносят беременность. При длительном течении болезни чаще наблюдают развитие сердечной недостаточности.
Имеется некоторая корреляция между генотипом, характером мутаций и фенотипическими признаками, в частности течением болезни. В семьях с мутацией гена тропонина T гипертрофия обычно слабо выражена, но высок риск внезапной смерти. Мутация протеина C, связанного с миозином, ассоциируется с поздним началом заболевания, умеренной выраженностью гипертрофии, редкостью внезапной смерти. Однако данные особенности проявляются не у всех больных. Поэтому весьма вероятно влияние на развитие болезни внешних факторов.
ДИАГНОСТИКА
Основным методом диагностики гипертрофической кардиомиопатии служит ЭхоКГ, позволяющая выявить утолщение миокарда и оценить наличие обструкции выносящего тракта левого желудочка. Необходимо исключить причины вторичной гипертрофии, в том числе приобретённые и врождённые пороки сердца, АГ, ИБС и т.д.
• Гипертрофическая кардиомиопатия может сочетаться с АГ, которую выявляют у больных при суточном мониторировании АД. При АГ гипертрофия обычно носит симметричный и более умеренный характер (толщина стенки редко превышает 15 мм).
• Также иногда трудно отличить гипертрофическую кардиомиопатию от физиологической гипертрофии миокарда у атлетов. В пользу гипертрофической кардиомиопатии свидетельствует наличие асимметричной гипертрофии левого желудочка. Некоторую помощь при дифференциальной диагностике может оказать тканевая ЭхоКГ в допплеровском режиме.
• В раннем возрасте гипертрофия левого желудочка может быть вызвана рядом метаболических нарушений, которые диагностируют только морфологически при биопсии миокарда: гликогеноз, болезнь Фабри, дефицит карнитина, ребенок матери, страдающей диабетом, митохондриальные цитопатии. В зрелом возрасте длительное изолированное прогрессирование гипертрофии миокарда может быть обусловлено амилоидозом, ожирением, феохромоцитомой.
ЛЕЧЕНИЕ
При гипертрофической кардиомиопатии (особенно при обструктивной форме) рекомендуют избегать значительных физических нагрузок, поскольку при этом может увеличиваться градиент давления между левым желудочком и аортой, возникать аритмии сердца и обморочные состояния.
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
Выбор ЛС определяет клиническая картина.
• При бессимптомном течении гипертрофической кардиомиопатии возможно назначение β-адреноблокаторов (от 40 до 240 мг/сут пропранолола, 100-200 мг/сут атенолола или метопролола) или блокаторов медленных кальциевых каналов (верапамила в дозе 120-360 мг/сут).
• При умеренно выраженных симптомах назначают либо β-адреноблокаторы (пропранолол в дозе от 40 до 240 мг/сут, атенолол или метопролол в дозе 100-200 мг/сут), либо блокаторы медленных кальциевых каналов (верапамил в дозе 120-360 мг/сут). Они уменьшают ЧСС и удлиняют диастолу, увеличивают пассивное наполнение левого желудочка и уменьшают давление наполнения. Подобная терапия также показана при возникновении фибрилляции предсердий. Кроме того, в связи с высоким риском развития тромбоэмболий при фибрилляции предсердий больным следует назначать антикоагулянты (см. главу 13 "Аритмии и блокады сердца").
• При значительно выраженных симптомах гипертрофической кардиомиопатии, помимо β-адреноблокаторов или верапамила, назначают диуретики (например, гидрохлоротиазид в дозе 25-50 мг/сут).
• При обструктивной гипертрофической кардиомиопатии следует избегать применения сердечных гликозидов, нитратов, адреномиметиков, необходимо проводить профилактику инфекционного эндокардита (см. главу 6 "Инфекционный эндокардит"), поскольку на передней створке митрального клапана могут появляться вегетации в результате её постоянной травматизации.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Оперативное лечение проводят при обструктивной форме гипертрофической кардиомиопатии с выраженными симптомами и рефрактерностью к лекарственной терапии. При этом осуществляется септальная миотомия или миоэктомия. В настоящее время всё чаще производят алкогольную аблацию межжелудочковой перегородки. При этом через введённый катетер в артерию, кровоснабжающую гипертрофированный участок миокарда (который вызывает обструкцию), вводят чистый алкоголь. Возникает некроз и затем отторжение этого участка миокарда с уменьшением обструкции. Однако эта процедура опасна в связи с нарушением электрических свойств миокарда и возможностью развития аритмий.
При наличии частых пароксизмов желудочковой тахикардии прибегают к имплантации кардиовертера-дефибриллятора, что также обеспечивает профилактику внезапной смерти. При наличии приступов мерцательной тахиаритмии возможно профилактическое применение амиодарона и непрямых антикоагулянтов.
Применяют также двухкамерную электрическую стимуляцию левого желудочка, которая приводит к значительному уменьшению обструкции.
ПРОГНОЗ
Без лечения смертность больных гипертрофической кардиомиопатией составляет 2-4% в год. К группе высокого риска относят пациентов, имеющих один фактор риска и более внезапной сердечной смерти. В 10% отмечен переход гипертрофической кардиомиопатии в дилатационную. У 5-10% больных развивается инфекционный эндокардит.
12.3. РЕСТРИКТИВНАЯ КАРДИОМИОПАТИЯ
Рестриктивная (от лат. restrictio - ограничение) кардиомиопатия - первичное или вторичное поражение сердца, характеризующееся нарушением диастолической функции желудочков.
Рестриктивная кардиомиопатия характеризуется преимущественным нарушением диастолической функции и повышением давления наполнения желудочков при нормальной или мало изменённой сократительной функции миокарда и отсутствии его значимой гипертрофии и дилатации. Рестриктивное поражение миокарда наблюдают при большой и неоднородной группе заболеваний, отличающихся по этиологии и патогенезу.
Заболевание наблюдают редко. В то же время всё чаще наблюдают больных ишемической или гипертонической кардиомиопатией, у которых на продолжительном отрезке времени определяют нарушение диастолической функции с признаками сердечной недостаточности, что может быть определено как рестриктивное поражение.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Основные причины рестриктивных кардиомиопатий представлены в табл. 12-1.
Неинфильтративные поражения миокарда | Идиопатическая кардиомиопатия Семейная кардиомиопатия Невыраженная гипертрофическая кардиомиопатия Склеродермия Диабетическая кардиомиопатия |
Инфильтративные поражения и болезни накопления | Гемохроматоз Амилоидоз Саркоидоз Жировая инфильтрация Болезнь Гоше Гликогеноз |
Эндомиокардиальные поражения | Эндомиокардиальный фиброз Эозинофильная эндомиокардиальная болезнь (болезнь Лёффлера) Карциноидная болезнь сердца Метастатические опухоли Радиационное поражение сердца Применение ЛС (антрациклиновая интоксикация, серотонин) |
Одной из распространённых причин рестриктивного поражения миокарда выступает гиперэозинофилия, (в 95% случаев). К эозинофильному поражению сердца близок эндомиокардиальный фиброз.
Основным в патогенезе рестриктивной кардиомиопатии считают нарушение наполнения левого желудочка из-за утолщения и повышение жёсткости (или снижение податливости) стенки желудочков, которые могут быть следствием фиброза эндокарда или миокарда различной этиологии (эндомиокардиальный фиброз, системная склеродермия) и инфильтративных заболеваний (амилоидоза, наследственного гемохроматоза, опухолей). Возникают значительное увеличение диастолического давления в левом и правом желудочках и лёгочная гипертензия. В последующем развивается диастолическая сердечная недостаточность (см. главу 11 "Сердечная недостаточность"). Систолическая функция левого желудочка длительное время остаётся нормальной.
Развитие сердечной недостаточности у таких больных не сопровождается увеличением объёма левого желудочка, а наоборот, он может уменьшиться. Сходные гемодинамические изменения наблюдают при констриктивном перикардите.
ПАТОМОРФОЛОГИЯ
При рестриктивной кардиомиопатии обычно поражены оба желудочка, но размеры их полостей остаются в нормальных пределах или уменьшаются (при эндомиокардиальном фиброзе). Обычно дилатированы предсердия. При эндомиокардиальном фиброзе поражаются эндокард и клапанный аппарат, что может приводить к возникновению порока (стеноза и/или недостаточности). Для амилоидоза характерно выраженное утолщение и уплотнение стенок сердца.
КЛИНИЧЕСКАЯ КАРТИНА
При рестриктивной кардиомиопатии больные обычно жалуются на одышку, боли в сердце при физической нагрузке, периферические отёки, боли в правом подреберье и увеличение живота. При осмотре выявляют набухшие шейные вены. При аускультации можно выслушать ритм галопа, систолический шум недостаточности трёхстворчатого и митрального клапанов. При лёгочной гипертензии определяют её характерные аускультативные признаки (см. главу 14 "Лёгочная гипертензия"). В лёгких при значительном застое крови выслушивают хрипы. Характерны увеличение печени и асцит.
ЛАБОРАТОРНО-ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
При лабораторных исследованиях находят изменения, присущие основному заболеванию (см. табл. 12-1).
Из инструментальных методов применяют следующие.
• При рестриктивной кардиомиопатии на ЭКГ можно обнаружить признаки блокады левой ножки пучка Гиса (редко - правой), сниженный вольтаж комплекса QRS (более характерный для амилоидоза сердца), неспецифические изменения сегмента ST и зубца T, различные аритмии, признаки перегрузки левого предсердия.
• При ЭхоКГ размеры полостей сердца не изменены. В ряде случаев можно выявить утолщение эндокарда. Характерным проявлением рестриктивной кардиомиопатии считают нарушения диастолической функции левого желудочка: укорочение времени изоволемического расслабления, увеличение пика раннего наполнения, уменьшение пика позднего предсердного наполнения желудочков и увеличение отношения раннего наполнения к позднему при ЭхоКГ в допплеровском режиме (см. главу 11 "Сердечная недостаточность").
• Особенностью рентгенологической картины лёгких при рестриктивной кардиомиопатии считают нормальные контуры сердца при наличии признаков венозного застоя в лёгких.
• Биопсию миокарда проводят при подозрении на гликогенозы. При болезни Лёффлера можно выявить эозинофильную инфильтрацию, миокардиальный фиброз. Отрицательный результат биопсии миокарда не исключает диагноза рестриктивной кардиомиопатии.
ДИАГНОСТИКА
Подозревать рестриктивное поражение миокарда необходимо у больных с застойной сердечной недостаточностью при отсутствии дилатации и резко выраженных нарушений сократительной функции левого желудочка по данным ЭхоКГ; при этом размеры левого предсердия и часто правого желудочка увеличены.
В диагностике рестриктивного поражения миокарда иногда помогают другие признаки основного заболевания.
• Фибропластический эндокардит Лёффлера сопровождается гиперэозинофилией с высоким лейкоцитозом, иногда с гепатолиенальным синдромом, поражением лёгких, мозга. При прогрессировании заболевания поражается миокард. Болезнь чаще находят у мужчин старше 30 лет. Гиперэозинофилией считают наличие в крови более 1500 эозинофилов в мм3 в течение не менее 6 месяцев или до развития летального исхода. Гиперэозинофилия с поражением сердца может быть при синдроме Черджа-Стросс, который характеризуется астмой, аллергическим ринитом и некротизирующим васкулитом. Причины гиперэозинофилии при эндокардите Лёффлера остаются неизвестными. Предполагают связь с паразитарными, аллергическими и неопластическими факторами, включая эозинофильный лейкоз. При морфологическом исследовании обнаруживают поражение обоих желудочков с утолщением пристеночного эндокарда, достигающего иногда 1 см. При гистологическом исследовании находят острый эозинофильный эндомиокардит, пристеночный тромбоз, фиброзные изменения.
Клиническая картина включает лихорадку, потерю веса, кашель, застойную сердечную недостаточность. Возможна кардиомегалия без выраженных застойных явлений и с шумом митральной недостаточности. Часто возникают тромбоэмболии. Прогрессирование болезни протекает с нарастанием сердечной недостаточности, поражением лёгких, почек. На ЭКГ находят разнообразные неспецифические изменения. При ЭхоКГ находят утолщение части стенки левого желудочка с ограничением подвижности задней створки митрального клапана. При катетеризации обнаруживают повышенное давление в конце диастолы, признаки митральной или трикуспидальной регургитации.
• Эндомиокардиальный фиброз наблюдают обычно в тропических странах Африки (Уганде, Нигерии). Возникает фиброз эндокарда желудочков, который часто распространяется на клапаны с формированием их недостаточности. В странах экваториальной Африки он может быть причиной смерти в 20% случаев. Поражение сердца носит тотальный характер, начинаясь с перикардита с последующим вовлечением всех камер сердца, их эндокарда и миокарда. При микроскопии находят увеличение содержания коллагена, фиброз, иногда грануляционную ткань, интерстициальный отек. Клиническая картина включает сердечную недостаточность с застоем по обоим кругам, аритмии.
• Амилоидоз - заболевание, проявляющееся нарушением обмена веществ и отложением в органах своеобразных фибрилл, образующихся из разных белков. Поражение миокарда более характерно для первичного амилоидоза с отложением частей лёгких цепей иммуноглобулинов, продуцируемых моноклональной популяцией плазматических клеток. Следует упомянуть также редкий семейный амилоидоз, наследуемый по аутосомно-доминантному типу с продуцированием тироксин-связывающего преальбумина - транстиретина. Известны три преимущественных варианта поражения: кардиальный, неврологический и нефрологический. Следует иметь в виду также сенильный амилоидоз у стариков с продукцией транстиретина или протеина, схожего с предсердным натрийуретическим пептидом.
При первичном амилоидозе заболевание может длительно протекать с преимущественным рестриктивным поражением миокарда (сердечная недостаточность может развиться при рестрикции), которое прогрессирует и приводит к дилатации камер сердца. На раннем или более позднем этапах могут присоединяться поражения почек, кишечника (синдром нарушенного всасывания), языка (макроглоссия) и другие признаки. Поражение внутренних органов развивается в зрелом возрасте (старше 35 лет). Нередко наблюдают ортостатическую гипотонию, нарушения проводимости.
Морфологическое исследование слизистой оболочки десны, прямой кишки или жировой ткани - важный метод диагностики амилоидоза: при специальной окраске находят амилоид. Иногда с целью уточнения типа амилоидоза необходимо иммуногистохимическое исследование.
С помощью ЭхоКГ при отложении амилоида в миокарде может быть обнаружена своеобразная грануляция, которая также позволяет предположить диагноз. На ЭКГ характерным является значительное снижение вольтажа зубцов, в то время как при ЭхоКГ находят утолщение стенки миокарда.
• При гемохроматозе, помимо поражения сердца, возможны поражение печени, сахарный диабет, потемнение кожи, напоминающее загар. Диагноз ставится после биопсии печени, при которой находят отложение железосодержащего пигмента.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику проводят со следующими заболеваниями.
• С выпотным и констриктивным перикардитом.
• При поражении левого желудочка следует исключить другие причины лёгочной гипертензии (митральный стеноз, "лёгочное сердце").
ЛЕЧЕНИЕ
Лечение, как правило, симптоматическое и направлено на уменьшение застоя в большом и малом круге кровообращения, снижение конечного диастолического давления в левом желудочке и уменьшение риска тромбоэмболий. Поэтому при рестриктивной кардиомиопатии используют диуретики (гидрохлоротиазид в дозе 50 мг/сут или фуросемид), вазодилататоры (например, изосорбида динитрат и изосорбида мононитрат в дозе 20-60 мг/сут), непрямые антикоагулянты. Диуретики и периферические вазодилататоры в больших дозах могут ухудшить состояние больных, поскольку снижают сердечный выброс (из-за уменьшения преднагрузки) и провоцируют артериальную гипотензию. Сердечные гликозиды обычно не назначают, так как систолическая функция сердца сохранена (их можно применять только при значительном нарушении систолической функции). Следует помнить, что при амилоидозе у больных имеется повышенная чувствительность к сердечным гликозидам в результате связывания дигоксина амилоидом. При выраженных застойных явлениях с увеличением печени, отёками целесообразно назначение спиронолактона - антагониста альдостерона.
При вторичной рестриктивной кардиомиопатии проводят лечение основного заболевания.
• В острой фазе болезни Лёффлера при наличии гиперэозинофилии и патологии внутренних органов применяют ГК и иммунодепрессанты, которые могут улучшить течение болезни. В случаях неудачи с некоторым успехом пытаются применять интерферон. При наличии выраженного фиброза эндокарда, существенно меняющего гемодинамику, производят хирургическое иссечение фиброзной ткани.
• При гемохроматозе могут быть эффективны повторные кровопускания, при которых выведение из организма избытка железа сопровождается его извлечением из депо в разных тканях, в том числе и из сердца.
• Хирургическое лечение при фибропластическом эндокардите состоит в иссечении утолщённого эндокарда и освобождении сухожильных хорд и ткани клапанов. При тяжёлой недостаточности клапанов проводят их протезирование.
• При амилоидозе пытаются применять пересадку зародышевых клеток, однако эффективность этого метода будет оценена в будущем. Эффективность трансплантации сердца при амилоидозе значительно ниже, чем при других видах патологии: только около 35% этих больных выживают 4 года и более. Это связано с продолжающимся прогрессированием болезни и отложением амилоида в сердце, почках и других органах.
ПРОГНОЗ И ОСЛОЖНЕНИЯ
Летальность в течение 2 лет достигает 35-50%. Рестриктивная кардиомиопатия может осложняться тромбоэмболией, аритмиями, прогрессированием сердечной недостаточности.
12.4. МИОКАРДИТЫ
Миокардит - воспаление сердечной мышцы, сопровождающееся её дисфункцией.
Распространённость миокардитов неизвестна, поскольку заболевание часто протекает в субклинической форме, заканчиваясь полным выздоровлением. У мужчин миокардит возникает в 1,5 раза чаще, чем у женщин.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Основные причины миокардитов перечислены ниже.
• Инфекционные заболевания.
• Вирусы (Коксаки, ECHO, аденовирусы, вирусы гриппа, герпеса, цитомегаловирусы, гепатита B и C, краснухи, арбовирусы).
• Бактерии (стрептококки, стафилококки, боррелии, коринебактерии дифтерии, сальмонеллы, микобактерии туберкулёза, хламидии, легионеллы, риккетсии).
• Простейшие (трипаносомы, токсоплазмы).
• Паразиты (эхинококки, трихинеллы).
• Грибы (кандиды, аспергиллы, кокцидиоидомицеты, гистоплазмы).
• Неинфекционные заболевания (коллагенозы, васкулиты).
• Токсические вещества (антрациклины, катехоламины, кокаин, ацетаминофен, литий).
• Радиоактивное излучение.
• Аллергия (в том числе лекарственная - на пенициллины, ампициллин, гидрохлоротиазид, метилдопу, сульфаниламиды).
Более чем в 50% случаев миокардиты обусловлены вирусами. Экспериментальные модели вирусных миокардитов (аналогичные миокардиту у человека) получены с использованием вирусов Коксаки B, аденовирусов, вируса гепатита C. С помощью молекулярной диагностической техники (ПЦР, молекулярная гибридизация) показано персистирование вирусной инфекции в миокарде у значительной части больных. Повреждение миокарда может происходить в результате непосредственного повреждения кардиомиоцитов самим агентом или его токсинами (например, при дифтерии) или быть результатом иммунного ответа организма. После воздействия повреждающего агента в миокарде чаще (но не обязательно) возникает воспалительный инфильтрат, который состоит преимущественно из лимфоцитов, но может содержать также нейтрофилы, эозинофилы и макрофаги.
Полагают, что при вирусном миокардите основное значении имеет не прямое цитопатическое действие вирусов, а иммунная реакция, опосредованная клеточными механизмами. Могут иметь значение также АТ против внутриклеточных компонентов кардиомиоцитов. У больных активным миокардитом миоциты экспрессируют межклеточные молекулы адгезии, которые играют важную роль в поддержании активности патологического процесса. Выделяемые клетками воспалительного инфильтрата цитокины обостряют миокардит, активируя цитотоксические T-лимфоциты и индуцируя экспрессию синтетазы оксида азота, сопровождающуюся повреждением миоцитов. При миокардите в крови повышено содержание ФНО, ИЛ-6, ИЛ-1, колониестимулирующего фактора гранулоцитов. При значительном поражении миокарда возможны нарушения систолической или диастолической функции сердца, нарушения ритма и проводимости.
Миокардит может приобретать хроническое течение, что обычно связано с развитием аутоиммунного процесса (АТ против миозина сердечной мышцы). Миокардит может приводить к возникновению дилатационной кардиомиопатии. При миокардите, подтверждённом морфологически, находят значительно более высокое содержание в миокарде норадреналина и адреналина по сравнению с дилатационной кардиомиопатией.
Миокард в той или иной степени поражается практически при любых инфекционных заболеваниях (вирусных, бактериальных, риккетсиозных, грибковых, паразитарных). В клинической картине инфекционного процесса симптомы поражения миокарда в большинстве случаев бывают второстепенными и чаще имеют невоспалительное происхождение. Однако у некоторых больных заболевание протекает тяжело и сопровождается сердечной недостаточностью, нарушениями ритма и проводимости. В таких случаях наблюдают выраженные воспалительные изменения в сердечной мышце - инфекционный миокардит. В воспалительный процесс вовлекаются интерстициальная ткань сердца, мелкие сосуды, миокардиоциты. Диагностика инфекционного агента осуществляется при выявлении других внесердечных проявлений, а также специальных лабораторных тестов, прежде всего серологических.
Наряду с поражениями миокарда при различных заболеваниях, когда они выступают частью клинических проявлений (например, дифтерии, СКВ и других системных заболеваний и васкулитов т.д.), известны также заболевания сердечной мышцы, протекающие изолированно. Развитие миокардита в таких случаях связывают с действием вирусов (прежде всего вируса Коксаки типа B) и иммунологических факторов. Вирусы могут размножаться непосредственно в кардиомиоцитах и оказывать цитопатическое действие, что подтверждают случаи выделения вирусов из клеток миокарда больных миокардитом. При этом другие клинические проявления вирусной инфекции, прежде всего в острый период болезни, чаще всего отсутствуют.
Среди заболеваний, проявляющихся только симптомами поражения миокарда, выделяют дистрофические и воспалительные поражения, связанные с аллергической или иммунопатологической реакцией, например в ответ на применение ЛС, а не с инфекцией.
ПАТОМОРФОЛОГИЯ
Морфологические критерии воспалительной реакции в миокарде (сходные с признаками реакции отторжения пересаженного сердца):
• инфильтрация лимфоцитами и гистиоцитами, но иногда нейтрофилами и эозинофилами;
• отложения иммуноглобулина и белков системы комплемента на сарколемме и в интерстиции с повреждением эндотелия капилляров;
• в более редких случаях преобладает дистрофия миокардиоцитов, сопровождающаяся незначительной клеточной реакцией и иногда завершающаяся некробиозом и миоцитолизом.
В зависимости от характера клеточного инфильтрата различают лимфоцитарный, эозинофильный, гигантоклеточный, гранулематозный (при саркоидозе и болезни Вегенера) миокардиты. Тяжёлый гигантоклеточный миокардит может сочетаться с язвенным колитом, тиреоидитом, ревматоидным артритом, пернициозной анемией, опухолями (раком лёгкого, вилочковой железы, лимфомы).
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина зависит от распространённости и локализации поражения. Даже небольшой очаг в проводящей системе может привести к выраженным клиническим симптомам, например нарушениям проводимости. Диффузный миокардит характеризуется дилатацией камер сердца и сердечной недостаточностью. Предшествующее повреждение миокарда любой природы повышает его чувствительность к инфекции.
При инфекционном миокардите в клинической картине обычно доминируют проявления основного инфекционного заболевания (лихорадка, иногда с общей интоксикацией и другими симптомами). Диагностика инфекционного процесса определяется как клинической картиной, так и данными специальных лабораторных методов. Характерно развитие признаков миокардита на высоте инфекционного заболевания. Клиническая картина миокардита в данных случаях варьирует от незначительных изменений на ЭКГ до острейшей сердечной недостаточности.
Симптомы изолированного острого миокардита обычно появляются в период выздоровления у больных, перенёсших острую вирусную инфекцию. В лёгких случаях (очаговый миокардит) это одышка, тахикардия, кардиалгии, изменения на ЭКГ. При более тяжёлых поражения (диффузный миокардит) развиваются дилатация камер сердца и застойная сердечная недостаточность. Прогноз при остром миокардите лёгкого течения благоприятный; его проявления нередко исчезают без лечения.
Клиническая картина определяется тяжестью заболевания.
• Миокардит может протекать или бессимптомно с последующим полным выздоровлением или малосимптомно. Характерны неспецифические симптомы: лихорадка, слабость, повышенная утомляемость. У 60% больных при сборе анамнеза выявляют предшествующее вирусное заболевание верхних дыхательных путей. Интервал между острой респираторной вирусной инфекцией и появлением миокардита обычно составляет около 2 нед.
• При средней тяжести течения наблюдают одышку, слабость, сердцебиение.
• Тяжёлое течение характеризуется дилатацией камер сердца, проявлениями сердечной недостаточности, возникающей в течение нескольких дней или недель и сопровождающейся соответствующими симптомами (одышкой, отёками ног).
• При тяжёлом миокардите полное выздоровление наблюдают реже; миокардит обычно принимает хроническое течение, а по клинической картине его сложно дифференцировать от дилатационной кардиомиопатии. В развитии хронического миокардита важную роль играют иммунные нарушения.
• Наиболее тяжёлой формой течения миокардита считают внезапную сердечную смерть в результате фатальных аритмий (в 10% случаев внезапной сердечной смерти на аутопсии обнаруживают миокардит).
Миокардит может быть очаговым или диффузным. Ниже представлены варианты течения миокардита, которые предлагают выделять в последнее время.
• Фульминантное течение (шок, тяжёлая левожелудочковая дисфункция с полным выздоровлением или смертью).
• Острое течение [сердечная недостаточность с дисфункцией левого желудочка с улучшением или переходом в дилатационную кардиомиопатию (иногда под влиянием иммунодепрессии)].
• Хроническое активное течение [сердечная недостаточность с дисфункцией левого желудочка и с развитием дилатационной кардиомиопатии (от иммунодепрессии эффекта нет)].
• Хроническое персистирующее течение (с нормальной функцией левого желудочка и морфологическим подтверждением).
Миокардит может симулировать острый инфаркт миокарда (боль, изменения на ЭКГ, биохимические изменения).
Тоны при миокардите могут быть не изменены. При значительном поражении миокарда отмечают уменьшение звучности I тона, выслушивают патологический III тон. Определяют систолический шум относительной недостаточности митрального клапана. При присоединении перикардита может выслушиваться шум трения перикарда. Иногда развивается плеврит, сопровождающийся возникновением шума трения перикарда.
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
В общем анализе крови у 60% больных острым миокардитом отмечают увеличение СОЭ. Лейкоцитоз возникает только у 25% больных. В биохимическом анализе крови у 10-12% больных острым миокардитом обнаруживают увеличение содержания MB-изоформы КФК. Характерно нарастание титра АТ, нейтрализующих вирусы.
Для постановки диагноза используют следующие инструментальные методы.
• На ЭКГ отмечают синусовую тахикардию, изменения сегмента ST и зубца T, нарушения проводимости (АВ-блокада разной степени, блокада ножек пучка Гиса), наджелудочковые и желудочковые аритмии. В ряде случаев имеются изменения на ЭКГ, характерные для инфаркта миокарда. Снижение вольтажа также может быть одним из проявлений миокардита. Для миокардита при лаймоборрелиозе характерна АВ-блокада.
• При ЭхоКГ можно выявить нарушения сократимости миокарда, дилатацию полостей сердца. У 15% больных при ЭхоКГ выявляют пристеночные внутрижелудочковые тромбы. Отсутствие изменений при ЭхоКГ не исключает диагноза миокардита.
• При рентгенологическом исследовании в случае значительного поражения миокарда могут наблюдаться увеличение размеров сердца, появление признаков застоя в лёгких.
• Окончательный диагноз миокардита устанавливают на основании биопсии миокарда. Гистологическими признаками миокардита считают воспалительную инфильтрацию миокарда с дегенеративными изменениями прилежащих кардиомиоцитов. Однако в настоящее время воспалительный процесс в миокарде всё чаще протекает без существенной клеточной воспалительной реакции. Кроме того, прижизненно даже при многократной (5-6 раз) биопсии миокарда не всегда удается попасть именно в участок с воспалительной инфильтрацией, что снижает значение этой небезопасной диагностической процедуры. Обнаружение инфекционного агента в биоптатах - весьма редкое явление.
Диагноз миокардита предполагают при возникновении сердечной недостаточности, развившейся через несколько недель после вирусной инфекции.
Заподозрить миокардит у больного с клинической картиной дилатационной кардиомиопатии позволяет наличие общих симптомов воспаления, например повышение температуры тела, стойкое увеличение СОЭ, которое нельзя объяснить сопутствующими заболеваниями (в том числе проявлениями тромбоэмболий), а также поражение других органов иммуновоспалительного происхождения - артралгии или артрит, миалгии, плеврит.
ЛЕЧЕНИЕ
Рекомендуют ограничить физическую активность. При выявлении причины проводят этиотропное лечение. При наличии снижения сократимости левого желудочка лечение аналогично таковому при дилатационной кардиомиопатии. Следует помнить, что больные миокардитом обладают повышенной чувствительностью к сердечным гликозидам (повышен риск гликозидной интоксикации). В ряде случаев может быть эффективной иммуносупрессивная терапия (азатиоприн, циклоспорин, преднизолон).
ПРОГНОЗ И ОСЛОЖНЕНИЯ
Миокардит может излечиваться самостоятельно (при лёгком течении) или заканчиваться развитием ХСН. У некоторых больных проявления миокардита могут длительно проявляться в виде сохраняющихся дисфункции миокарда и блокады левой ножки пучка Гиса, синусовой тахикардии, снижения толерантности к физической нагрузке.
Осложнения миокардита:
• дилатационная кардиомиопатия;
• внезапная сердечная смерть (вследствие возникновения полной АВ-блокады или желудочковой тахикардии).