Хаитов Р.М. Иммунология: учебник / Р.М. Хаитов. - 2-е изд., перераб. и доп. - 2013. - 528 с.: ил.
|
|
|
|
Глава 5. АНТИТЕЛА. B-ЛИМФОЦИТЫ
АНТИГЕН
Антиген - любая молекула (соединения разной химической природы: пептиды, углеводы, полифосфаты, стероиды), которая потенциально может быть распознана иммунной системой организма как чужеродная («не своя»). Таким образом, антиген - молекула, несущая признаки генетически чужеродной информации. В качестве синонима применяют также термин «иммуноген», подразумевая, что иммуноген (антиген) способен вызвать ответные реакции иммунной системы, в итоге приводящие к развитию приобретённого иммунитета. Способность вызывать такие ответные реакции (т.е. образование антител и сенсибилизацию - приобретение организмом чувствительности к антигену) присуща не всей молекуле антигена, а только особой её части, которую называют антигенной детерминантой, или эпитопом. У большинства белковых антигенов такую детерминанту образует последовательность из 4-8 аминокислотных остатков, а у полисахаридных антигенов - 3-6 гексозных остатков. Число детерминант у одного вещества может быть различным. Так, у яичного альбумина их не менее 5, у дифтерийного токсина - минимум 80, у тиреоглобулина - более 40. Различают экзогенные (поступающие в организм извне) и эндогенные антигены (аутоантигены - продукты собственных клеток организма), а также антигены, вызывающие аллергические реакции, - аллергены.
АНТИТЕЛА
Антитело - особый растворимый белок с определённой биохимической структурой - иммуноглобулин, который присутствует
в сыворотке крови и других биологических жидкостях и предназначен для связывания антигена. В энциклопедическом словаре медицинских терминов указано следующее определение: антитела (анти- + тела) - глобулины сыворотки крови человека и животных, образующиеся в ответ на попадание в организм различных антигенов (принадлежащих бактериям, вирусам, белковым токсинам и др.) и специфически взаимодействующие с этими антигенами.
• Антитела связывают антиген. Существенным и уникальным свойством антител, отличающим их даже от TCR, служит их способность связывать антиген непосредственно в том виде, в каком он проникает в организм (в нативной конформации). При этом времени на предварительную метаболическую обработку антигена не требуется, поэтому антитела - очень важный фактор безотлагательной защиты организма (например, от сильных ядов, при укусах змей, скорпионов, пчёл и др.).
• Конкретное антитело синтезируется исключительно B-лимфоцитами одного клона. При дифференцировке каждый B-лимфоцит и его дочерние клетки (клон В-лимфоцитов) приобретают способность синтезировать единственный вариант антител с уникальной структурой антигенсвязывающего центра молекулы - т.е. имеет место клональность биосинтеза иммуноглобулинов.
• Множество антител. В то же время вся совокупность В-лимфоцитов организма способна синтезировать огромное разнообразие антител - около 106-109, однако точно установить, сколько разных антигенов потенциально способно связать одно антитело, принципиально невозможно.
• Иммуноглобулины. Все антитела - белки, имеющие глобулярную вторичную структуру, поэтому молекулы этого типа и названы иммуноглобулинами. Антитела принадлежат к суперсемейству иммуноглобулинов (рис. 5-1), куда входят также белки MHC, некоторые молекулы адгезии [LFA-2 (CD2), ICAM-1 (CD54), VCAM-1 (CD106) и др. (см. табл. 4-1)], TCR, отдельные рецепторы цитокинов [для ИЛ-1 типов I и II, ИЛ-6, M-CSF, c-kit (CD117)], рецепторы для Fc-фрагментов иммуноглобулинов (FcαR, FcγRI, FcγRII), мембранные молекулы CD3, CD4, CD8, CD80 и др.
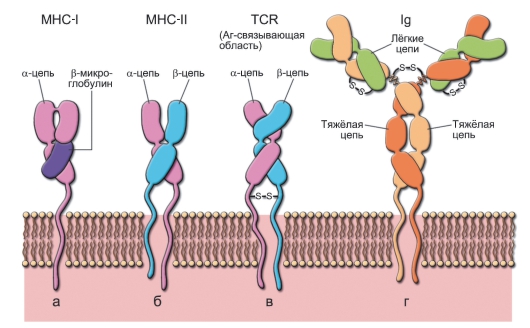
Рис. 5-1. Структура белков суперсемейства иммуноглобулинов: а - молекула MHC-I состоит из a-цепи, внемембранная её часть связана с короткой цепью Р2-микроглобулина; б - молекула MHC-II состоит из двух субъединиц: более длинной a-цепи и р-цепи. Часть каждой цепи выступает над поверхностью клеточной мембраны, цепь содержит трансмембранный участок и небольшой фрагмент в цитоплазме; в - антигенсвязывающая область молекулы TCR состоит из двух цепей: a и р. Каждая цепь представлена двумя внеклеточными иммуноглобулинподобными доменами (вариабельным на NH конце и константным), стабилизированными при помощи S-S связей, и цитоплазматическим стабильным COOH-концом. SH-группа, присутствующая в цитоплазматическом фрагменте a-цепи, может взаимодействовать с мембранными или цитоплазматическими белками; г - мономер молекулы IgM, встроенный в плазматическую мембрану B-лимфоцитов, это рецептор для антигена. Разнообразие специфичностей TCR и иммуноглобулинов обеспечивается возможностью сайтспецифической рекомбинации множества различных генных сегментов, кодирующих отдельные фрагменты молекулы
ИММУНОГЛОБУЛИНЫ
Иммуноглобулины [международная аббревиатура - Ig (Immunoglobulin)] - класс структурно связанных белков, содержащих 2 вида парных полипептидных цепей: лёгкие (L, от англ. Light - лёгкий), с низкой молекулярной массой, и тяжёлые (H, от англ. Heavy - тяжёлый), с высокой молекулярной массой. Все 4 цепи соединены вместе дисульфидными связями. Принципиальная схема строения молекулы иммуноглобулина (мономер) приведена на рис. 5-2.
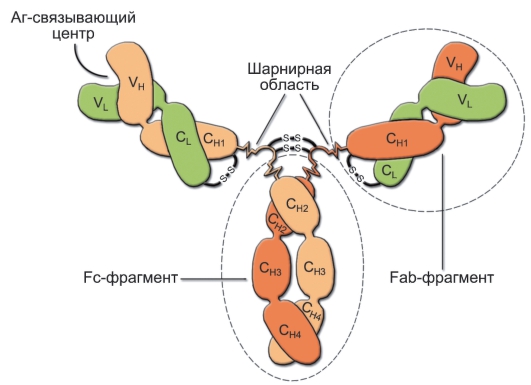
Рис. 5-2. Молекула иммуноглобулина: L - лёгкие цепи; H - тяжёлые цепи; V - вариабельная область; С - константная область; N-концевые области L- и Н-цепей (V-область) образуют 2 антигенсвязывающих центра - (Fab)2-фрагмент. Fc-фрагмент молекулы взаимодействует со своим рецептором на мембране различных типов клеток (макрофаги, нейтрофилы, тучные клетки)
Классы иммуноглобулинов
На основании структурных и антигенных признаков Н-цепей иммуноглобулины подразделяют (в порядке относительного содержания в сыворотке крови) на 5 классов: IgG (80%), IgA (15%), IgM (10%), IgD (менее 0,1%), IgE (менее 0,01%). Заглавная латинская буква справа от «Ig» обозначает класс иммуноглобулина - М, G, А, Е или D. Молекулы IgG, IgD и IgE мономеры, IgM - пентамер; молекулы IgA в сыворотке крови - мономеры, а в экскретируемых жидкостях (слёзная, слюна, секреты слизистых оболочек) - димеры (рис. 5-3).
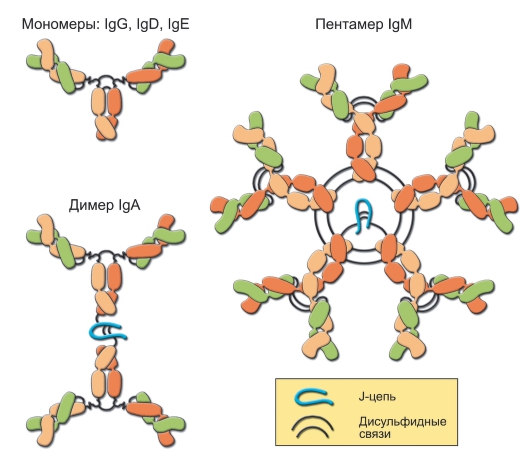
Рис. 5-3. Мономеры и полимеры иммуноглобулинов. J-цепь (от англ. Joining - связывающая) связывает остатки цистеина на C-концах тяжёлых цепей IgM и IgA
• Подклассы. У иммуноглобулинов классов G (IgG) и A (IgA) имеется несколько подклассов: IgG1, IgG2, IgG3, IgG4 и IgA1,
IgA2.
• Изотипы. Классы и подклассы иммуноглобулинов иначе называют изотипами, они одинаковы у всех особей данного вида.
• Аллотипы. Индивидуальные аллельные варианты иммуноглобулинов в пределах одного изотипа называются аллотипами.
• Идиотипы. По антигенной специфичности антитела относят к различным идиотипам.
Структура иммуноглобулинов
• Фрагменты молекулы иммуноглобулина (см. рис. 5-2). Путём протеолитического расщепления молекулы иммуноглобулина с последующей ионообменной хроматографией можно получить 3 фрагмента: 1 Fc-фрагмент и 2 Fab-фрагмента.
◊ Fab-фрагменты (Fragment, antigen binding - антигенсвязывающие фрагменты) - 2 одинаковых фрагмента, сохраняющих способность связывать антиген.
◊ Fc-фрагмент (Fragment, constantorcrystallizable - константный фрагмент) - непарный, легко кристаллизуется. Fc-фрагменты иммуноглобулинов в пределах одного изотипа строго идентичны (независимо от специфичности антител к антигенам). Они обеспечивают взаимодействие комплексов антиген-антитело с системой комплемента, фагоцитами, эозинофилами, базофилами, тучными клетками. При этом каждый класс иммуноглобулинов взаимодействует только с определёнными эффекторными клетками или молекулами.
• Тяжёлые цепи определяют различия между классами иммуноглобулинов, поэтому разные типы тяжёлых цепей обозначают греческими буквами соответственно латинской аббревиатуре класса: для IgM - μ, для IgG - γ, для IgA - α, для IgE - ε, для IgD - δ. Каждая из H-цепей молекул IgG, IgD и IgA состоит из 4 доменов (см. рис. 5-2): вариабельного - VH и константных (СН1, СН2, СН3). H-цепи молекул IgM и IgE содержат дополнительный домен - СН4.
• Лёгкие цепи примыкают к N-концу тяжёлых цепей. Каждая L-цепь состоит из двух доменов - VL и CL. Известно 2 типа лёгких цепей иммуноглобулинов - κ и λ. Функциональ-
ные различия между иммуноглобулинами с лёгкими κ- или λ-цепями не выявлены.
• Домены. Вторичная структура полипептидных цепей представлена доменами (см. рис. 5-1), каждый из которых включает около 110 аминокислотных остатков.
◊ V-домены обеих цепей имеют сильно варьирующий аминокислотный состав (отсюда и их обозначение - Variable), что позволяет им связывать разные антигены.
♦ Гипервариабельные участки. Внутри V-доменов выделяют несколько гипервариабельных участков: HVR1,
HVR2, HVR3 (HVR - от Hypervariable Region). Другое
обозначение - CDR (Complementarity Determining Region), т.е. области молекулы иммуноглобулина, определяющие её комплементарность антигену.
♦ Каркасные области. Промежутки между гипервариабельными участками обозначают как FR (Framework Regions), т.е. каркасные области: FR1, FR2, FR3 и FR4. Помимо чисто «скелетной», для них характерны и другие функции, не связанные с распознаванием антигенов: FRучастки V-области молекул иммуноглобулинов могут обладать ферментативной (протеазной и нуклеазной) активностью, связывать ионы металлов и суперантигены.
◊ C-домены. Остальные домены имеют строго инвариантный для каждого изотипа иммуноглобулинов аминокислотный состав и называются C-доменами (от Constant).
♦ В C-доменах и в FR-участках V-доменов содержатся одинаковые аминокислотные последовательности, что рассматривают как молекулярное свидетельство генетической общности.
♦ Гомологичные последовательности аминокислот присутствуют (помимо иммуноглобулинов) и в молекулах других белков, объединяемых с иммуноглобулинами в одно молекулярное суперсемейство иммуноглобулинов (см. выше и рис. 5-1).
Большое количество возможных комбинаций L- и H-цепей создаёт многообразие антител каждого индивидуума.
• Формы иммуноглобулинов. Молекулы иммуноглобулинов одной и той же специфичности присутствуют в организме в трёх формах: растворимой, трансмембранной и связанной.
◊ Растворимая. В крови и других биологических жидкостях (секретируемый клеткой иммуноглобулин).
◊ Трансмембранная. На мембране B-лимфоцита в составе антигенраспознающего рецептора B-лимфоцитов - BCR. Трансмембранные формы всех классов иммуноглобулинов (включая IgM и IgA) - мономеры.
◊ Связанная. Иммуноглобулины, за Fc-конец связанные с Fс-рецепторами клеток (макрофагами, нейтрофилами, эозинофилами). Все антитела, кроме IgE, могут фиксироваться FcR клеток только в комплексе с антигеном.
Связывание антигена
Гипервариабельные участки V-области антитела (как и TCR) непосредственно и комплементарно связывают антиген с помощью ионных, ван-дер-ваальсовых, водородных и гидрофобных взаимодействий (сил, связей).
• Эпитоп (антигенная детерминанта - см. выше) - участок молекулы антигена, непосредственно участвующий в образовании ионных, водородных, ван-дер-ваальсовых и гидрофобных связей с активным центром Fab-фрагмента.
• Сродство между антигеном и антителом количественно характеризуют понятиями «аффинность» и «авидность».
• Аффинность. Силу химической связи одного антигенного эпитопа с одним из активных центров молекулы иммуноглобулина называют аффинностью связи антитела с антигеном. Аффинность количественно принято оценивать по константе диссоциации (в моль-1) одного антигенного эпитопа с одним активным центром.
Так как у цельных молекул мономерных иммуноглобулинов присутствует по 2 потенциально равнозначных симметрично расположенных активных центра для связывания антигена, у димерного IgA - 4, а у пентамерного IgM - 10, скорость диссоциации целой молекулы иммуноглобулина со всеми связанными эпитопами меньше, чем скорость диссоциации одного из активных центров.
• Авидность. Силу связи целой молекулы антитела со всеми антигенными эпитопами, которые ей удалось связать, называют авидностью связи антитела с антигеном.
ГЕНЫ ИММУНОГЛОБУЛИНОВ
Зародышевые гены иммуноглобулинов. У здорового человека B-лимфоциты в течение жизни создают несколько миллионов вариантов антител, связывающих разные антигены (потенциально 1016 антигенов). Никакой геном физически не несёт столько различных структурных генов. Количество наследуемого от родителей генетического материала (ДНК), определяющего биосинтез антител, не так уж и велико - немногим более 120 структурных генов. Это наследуемое множество генов - зародышевые гены иммуноглобулинов (зародышевая конфигурация генов).
Гены вариабельных доменов
Во всех соматических клетках, включая СКК, гены иммуноглобулинов находятся именно в зародышевой конфигурации, где гены V-участков представлены в виде отдельных сегментов, расположенных друг относительно друга на значительном расстоянии и сгруппированных в несколько кластеров: собственно V (вариабельный), J (связующий), а у тяжёлых цепей также D (от англ. Diversity - разнообразие). Процесс формирования разнообразия структурных генов для миллионов вариантов V-участков молекул иммуноглобулинов продолжается в течение всей жизни в процессе дифференцировки B-лимфоцитов и является запрограммированнослучайным. В его основе лежат 3 механизма, свойственные только генам антигенсвязывающих молекул (иммуноглобулин, TCR): соматическая рекомбинация, неточность связей между V, D и J сегментами и гипермутагенез.
• Соматическая рекомбинация. На самом раннем этапе дифференцировки лимфоцитов начинается сложный генетический процесс объединения сегментов ДНК, предназначенных для кодирования разных частей антигенсвязывающих молекул - V- и C-доменов. В непрерывную последовательность ДНК соединяются по одному сегменту из V-, D- и J-областей, при этом в каждом отдельном B-лимфоците возникает уникальная комбинация VDJ для тяжёлой цепи и VJ - для лёгкой цепи. Вся остальная ДНК зародышевого гена выбрасывается из генома в виде кольцевых ДНК.
◊ Число возможных комбинаций можно подсчитать. Для к-цепи из 40 V-сегментов и 5 J-сегментов может получиться 40x5=200 вариантов V-области; для λ-цепи - 30x4=120 вариантов; всего для лёгких цепей 320 вариантов; для тяжёлой цепи 50V×30D×6J=9000 вариантов антигенсвязывающих областей. В целой молекуле иммуноглобулина разные лёгкие и тяжёлые цепи объединяются в тетрамер также случайным образом (по крайней мере теоретически). Число случайных сочетаний из 320 и 9000 - около 3x106.
◊ Рекомбиназы. Рекомбинацию ДНК генов иммуноглобулинов катализируют специальные ферменты - рекомбиназы (RAG1 и RAG2 - Recombination-Activating Gene). Они же катализируют рекомбинацию ДНК генов TCR в T-лимфоцитах, т.е. рекомбиназы - уникальные ферменты лимфоцитов. Однако в В-лимфоцитах эти ферменты не «трогают» гены TCR, а в T-лимфоцитах «обходят» гены иммуноглобулинов. Следовательно, до начала процесса перестройки ДНК в клетке уже существуют регуляторные белки, различные у T- и В-лимфоцитов.
• Неточность связи V-D-J. Под неточностью связей сегментов V, D и J понимают тот факт, что при их формировании происходит добавление лишних нуклеотидов. Выделяют 2 типа таких нуклеотидов: P- и N-нуклеотиды.
◊ Нуклеотиды P (от англ. Palindromic sequences - зеркальные последовательности) возникают на концах каждого из сегментов, вовлечённых в рекомбинацию, при вырезании одноцепочечных петель ДНК (шпилек) и «достройки хвостов» ферментами репарации ДНК.
◊ Нуклеотиды N (от англ. Nontemplate-encoded - нематрично кодируемые), характерные только для тяжёлых цепей, случайным образом пристраиваются к концам V-, D- и J-сегментов специальным ферментом - терминальной дезоксинуклеотидилтрансферазой.
◊ С учётом присоединения N- и P-нуклеотидов число вариантов антигенсвязывающих областей целых молекул иммуноглобулинов составляет порядка 1013. Если учесть аллельные варианты V-, D- и J-сегментов, то мыслимое разнообразие составит около 1016 (в действительности это
число меньше, поскольку в организме нет такого количества лимфоцитов). ◊ В 2/3 случаев «платой» за попытки увеличить разнообразие антигенсвязывающих областей антител служит непродуктивная рекомбинация генов, т.е. сдвиг рамки считывания или генерация стоп-кодонов, делающий невозможной трансляцию белка.
• Гипермутагенез - запланированное повышение частоты точечных мутаций - отличает гены иммуноглобулинов даже от генов TCR. Гипермутагенез имеет место только в В-лимфоцитах во время иммуногенеза (т.е. после состоявшегося распознавания антигена и начавшегося иммунного ответа) в зародышевых центрах лимфоидных фолликулов периферических лимфоидных органов и тканей (лимфатических узлов, селёзенки, диффузных скоплений). Частота точечных мутаций в V-генах иммуноглобулинов достигает 1 нуклеотида из 1000 на 1 митоз (т.е. каждый второй В-лимфоцит клона в зародышевом центре приобретает точечную мутацию в V гене иммуноглобулинов), тогда как для всей остальной ДНК она на 9 порядков ниже.
Гены константных доменов
Структурные гены константных доменов полипептидных цепей иммуноглобулинов расположены в тех же хромосомах, что и V-, D- и J-гены, к 3'-концу от J-сегментов.
• Лёгкая цепь (рис. 5-4). Для лёгких κ- и λ-цепей существует по одному C-гену - Сκ и Cλ «Стыковка» нуклеотидного кода для V- и C-доменов лёгких цепей происходит на уровне не ДНК, а РНК - по механизму сплайсинга первичного транскрипта РНК.
• Тяжёлая цепь (рис. 5-5) каждого изотипа иммуноглобулинов также кодируется отдельным C-геном. У человека такие гены расположены в следующем порядке, считая от J-сегмента к 3'-концу: Сμ, Сδ, Сγ3, Сγ1, ψСε (псевдоген е-цепи), Cα1, Cγ2, Cγ4, Сε, Сα2.
Завершившие лимфопоэз В-лимфоциты (независимо от специфичности их BCR) экспрессируют иммуноглобулины только классов IgM и IgD. При этом мРНК транскрибируется в виде непрерывного первичного транскрипта с перестроенных генов VDJ и
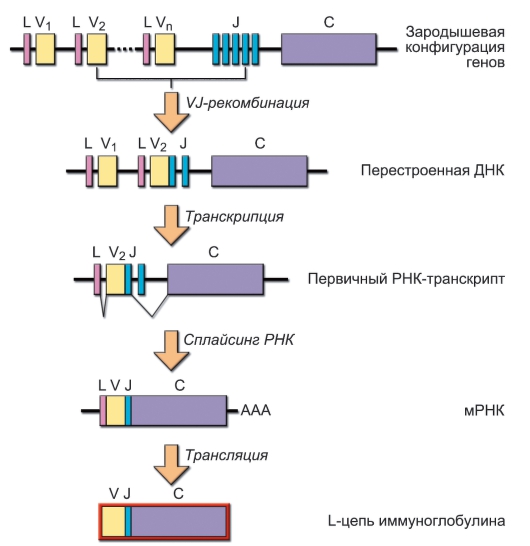
Рис. 5-4. Структура генов и синтез белка лёгкой (L) цепи иммуноглобулинов
Сμ/Cδ. При этом ДНК остальных C-генов других изотипов остаётся нетронутой. В результате альтернативного сплайсинга первичного транскрипта образуются мРНК отдельно для тяжёлых цепей IgM и IgD, которые и транслируются в белок. Этим процессом заканчивается полноценный лимфопоэз В-клеток.
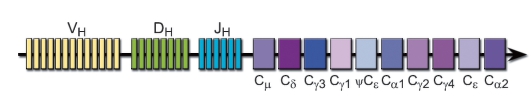
Рис. 5-5. Структура генов тяжёлой (Н) цепи иммуноглобулинов человека
Переключение изотипов иммуноглобулинов
В процессе развития иммунного ответа, т.е. после распознавания антигена и под действием определённых цитокинов и молекул клеточной мембраны T-лимфоцитов, может происходить переключение синтеза иммуноглобулинов на другие изотипы - IgG, IgE, IgA (рис. 5-6).
• Переключение изотипа тяжёлой цепи тоже идёт по механизму рекомбинации ДНК: к ранее перестроенной комбинации VDJ присоединяется один из C-генов тяжёлой цепи (Су1, Су2, Су3,
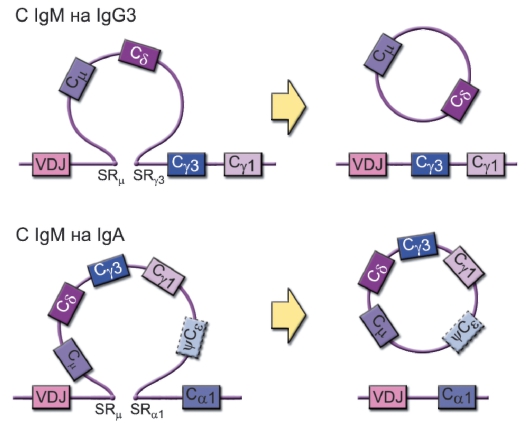
Рис. 5-6. Рекомбинация ДНК при переключении изотипов иммуноглобулинов В-лимфоцитов
Сγ4, Сε, Сα1 или Сα2). При этом происходит разрыв ДНК по областям переключения - SR (Switch Region), расположенным в интронах перед каждым C-геном (за исключением С5).
• ДНК C-генов, предшествующих задействованному, элиминируется в виде кольцевых структур, поэтому дальнейшее переключение изотипа возможно только по направлению к 3'-концу.
• Установлено, что гипермутагенез и переключение изотипов иммуноглобулинов катализируются ферментом AID (Activation Induced Cytidine Deaminase - цитидиндезаминаза, индуцируемая активацией). Этот фермент специфически атакует экспрессированные гены иммуноглобулинов и отщепляет аминогруппы от цитидиновых оснований, которыми богата ДНК этих генов. В результате этого цитозины преобразуются в урацилы, которые распознаются и вырезаются ферментами репарации ДНК. Последующая цепочка каталитических реакций с участием более чем десяти различных белков (эндонуклеаз, фосфатаз, полимераз, гистонов и т.п.) приводит к появлению мутаций (в случае гипермутагенеза) или двуцепочечных разрывов в ДНК по областям переключения изотипов.
B-ЛИМФОЦИТЫ
Рецептор BCR
Молекула иммуноглобулина способна связывать антиген как в растворе, так и в иммобилизованном на клетке состоянии, однако для формирования полноценного BCR необходимы ещё 2 полипептида, называемые (на наш взгляд, неудачно) (CD79a) и Igβ (CD79b). Все 6 полипептидных цепей BCR представлены на рис. 5-7.
Внеклеточный домен. Igα и Igβ имеют по одному внеклеточному домену, которым они прочно, но нековалентно связаны с тяжёлыми цепями иммуноглобулинового компонента BCR.
Цитоплазматические активирующие последовательности. В ци-
топлазматических участках Igα и Igβ присутствуют характерные последовательности аминокислотных остатков, называемые иммунорецепторными тирозинсодержащими активирующими после-
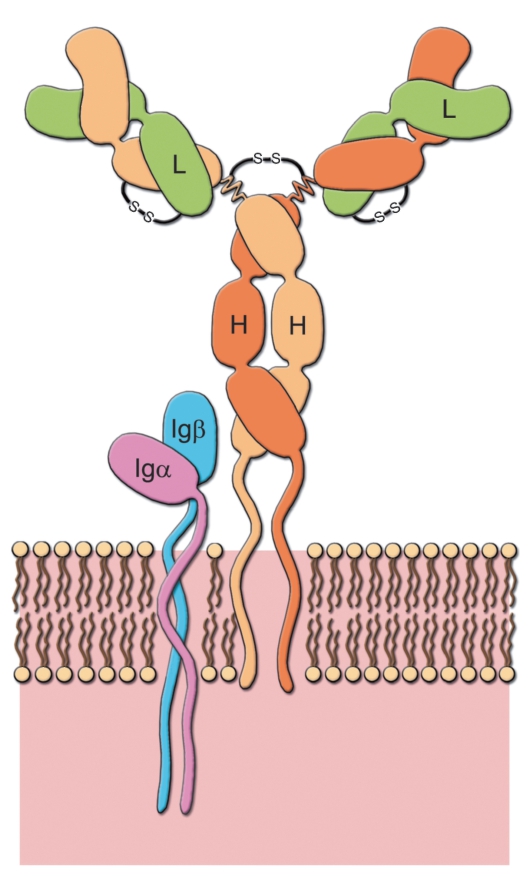
Рис. 5-7. Антигенраспознающий рецептор В-лимфоцита
довательностями (ITAM - Immunoreceptor Tyrosine-based Activation Motif); такие же последовательности присутствуют в проводящих сигнал компонентах антигенраспознающего рецептора T-клеток.
Активация B-лимфоцита. Для эффективной активации В-клетки через BCR необходима перекрёстная «сшивка» антигеном нескольких BCR. Для этого молекула антигена должна иметь повторяющиеся эпитопы на своей поверхности. Дальнейшие события активации B-лимфоцита показаны на рис. 5-8.
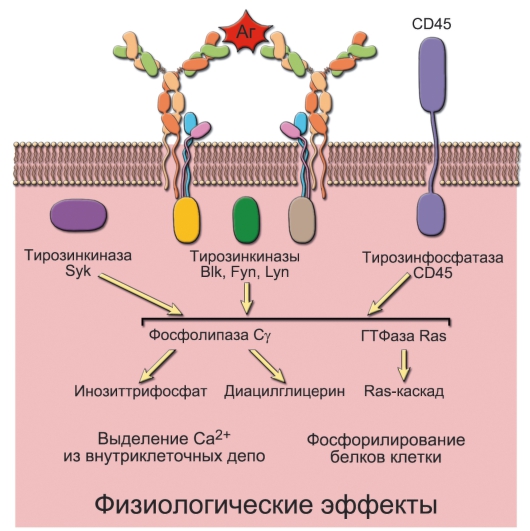
Рис. 5-8. Активация В-лимфоцита: внутриклеточная передача «сигнала»
Корецепторный комплекс
Повторяющиеся эпитопы есть не на каждом антигене; следовательно, не каждый антиген способен вызвать перекрёстную сшивку BCR, поэтому необходим дополнительный корецепторный комплекс мембранных молекул, связанных с внутриклеточными системами проведения сигналов. В этот комплекс входят по крайней мере 3 мембранные молекулы: CD19, CR2 (CD21) и TAPA-1 (CD81).
• CR2 - рецептор для компонентов комплемента. Связывание CR2 с продуктами деградации компонентов комплемента (C3b, C3dg и C3bi) вызывает фосфорилирование молекулы CD19 ассоциированными с BCR киназами.
• CD19. Фосфорилированная молекула CD19 активирует фосфатидилинозит-3-киназу и молекулу Vav (многофункциональная молекула проведения внутриклеточных сигналов), которые усиливают активационные реакции, инициированные BCR (рис. 5-8).
• TAPA-1 (Target of AntiProliferative Antibody - мишень для антипролиферативных антител) в мембране физически примыкает к CD19 и CR2, но роль этой молекулы неизвестна.
Дифференцировка B-лимфоцитов
Дифференцировка B-лимфоцитов из общей лимфоидной клетки-предшественника (потомка СКК) включает несколько этапов и процессов: перестройку генов иммуноглобулинов и интеграцию их продуктов в клеточный метаболизм; экспрессию генов молекул, обеспечивающих проведение сигнала с BCR внутрь клетки; экспрессию генов мембранных молекул, необходимых для взаимодействия с другими клетками (в первую очередь с T-лимфоцитами и ФДК); экспрессию на мембране корецепторных комплексов.
В2-лимфоциты
Этапы В2-лимфопоэза. В лимфопоэзе B2-лимфоцитов выделяют 6 этапов: общая лимфоидная клетка-предшественник → ранняя про-B-клетка → поздняя про-B-клетка → большая пре-B-клетка → малая пре-B-клетка → незрелая B-клетка → зрелая наивная B-клетка (выходит из костного мозга в периферическую лимфоидную ткань).
• Общая лимфоидная клетка-предшественник. Экспрессирует несколько молекул адгезии, обеспечивающих оседлость в течение необходимого периода времени в костном мозге, среди них VLA-4 (Very Late Activation Antigen-4 - очень поздний активационный антиген 4), лигандом которого на клетках стромы служит VCAM-1 (Vascular Cell Adhesion Molecule-1 - молекула-1 адгезии к стенке сосуда).
• Ранняя про-B-клетка. Происходит D-J-рекомбинация в генах тяжёлых цепей, на обеих гомологичных хромосомах. В этой стадии (помимо молекул адгезии) экспрессируется рецептор c-kit (CD117) для первого фактора роста - мембранной молекулы клеток стромы SCF - фактора стволовых клеток. Это взаимодействие обеспечивает прохождение предшественниками B-лимфоцитов, ещё не поделёнными на клоны по антигенраспознающим рецепторам, необходимого числа митозов.
• Поздняя про-B-клетка. Происходит V-DJ-рекомбинация генов иммуноглобулинов сначала на одной из гомологичных хромосом. Если она окажется непродуктивной, то та же попытка повторяется на второй гомологичной хромосоме. Если перестройка на первой хромосоме продуктивна, вторая хромосома использована не будет. При этом образуется так называемое аллельное исключение (allelic exclusion), когда белок иммуноглобулина будет кодироваться только одной хромосомой, а вторая будет «молчащей». В результате индивидуальный лимфоцит сможет продуцировать антитела только одной специфичности. Этот процесс закладывает основу клональности антител.
◊ Как только в клетке происходит трансляция полипептида тяжёлой цепи, он экспрессируется на мембране в составе так называемого пре-B-рецептора. Этот рецептор содержит суррогатную лёгкую цепь (идентичную для всех клеток на этой стадии созревания), μ-цепь, Igα, Igβ. Экспрессия этого рецептора транзиторна, но абсолютно необходима для правильной дифференцировки B-лимфоцитов.
◊ Поздняя про-B-клетка также экспрессирует рецепторы для цитокинов ИЛ-7 и SDF-1, секретируемых клетками стромы и вызывающих пролиферацию и накопление «полуклонов» B-лимфоцитов (про-B- и больших пре-B-клеток) с уже известной специфичностью по тяжёлой цепи, но ещё неизвестной - по лёгкой. Это тоже увеличивает разнообразие молекул иммуноглобулинов: с одной и той же тяжёлой цепью будет сочетаться больше разных вариантов лёгких цепей.
• Пре-B-клетка. Происходит V-J-перестройка генов иммуноглобулинов лёгких цепей (сначала одной из цепей - к или λ) на одной из гомологичных хромосом. Если продуктивная
перестройка не получится с первой попытки, предпринимаются следующие. Клетки, в которых не произошло ни одной продуктивной перестройки в генах тяжёлых и лёгких цепей, погибают по механизму апоптоза - явления, весьма распространённого среди лимфоцитов.
• Незрелый B-лимфоцит. Уже экспрессируется дефинитивный BCR, содержащий L-цепь, μ-цепь, + Igα + Igβ.
Развитие толерантности. На стадии незрелых B-лимфоцитов начинается также развитие толерантности к собственным тканям организма. Для этого предусмотрено 3 механизма: делеция аутореактивных клонов, ареактивность (анергия) и «редактирование» рецептора по антигенной специфичности. Первые два механизма продолжают действовать и по выходе лимфоцита из костного мозга, т.е. при контакте со значительными количествами аутоантигенов.
• Негативная селекция и делеция клонов. Связывание мембранного антигена незрелой B-клеткой (экспрессирует IgM-BCR, но ещё отсутствует IgD-BCR) служит сигналом для её апоптоза. Таким образом, удаляются B-лимфоциты, несущие антигенраспознающие рецепторы, способные связывать белки собственных тканей.
• Ареактивность. Связывание незрелым B-лимфоцитом растворимого антигена не приводит к апоптозу, но лимфоцит приходит в состояние анергии, т.е. проведение сигнала от BCR блокируется и лимфоцит не активируется.
• «Редактирование» рецепторов происходит в небольшой части незрелых B-клеток, в которых ещё активны рекомбиназы. В этих клетках связывание IgM (в составе BCR на поверхности незрелого B-лимфоцита) с антигеном служит сигналом для запуска повторного процесса рекомбинации VDJ/VJ: образующаяся при этом новая комбинация может не быть аутореактивной.
Маркёр завершения B-лимфопоэза (образования зрелого наивного B-лимфоцита, готового к выходу из костного мозга в периферическую лимфоидную ткань) - одновременная экспрессия (коэкспрессия) на мембране двух типов BCR - с IgM и IgD (причём IgD больше, чем IgM).
Иммуногенез. После распознавания антигена и вступления в иммунный ответ B-лимфоцит проходит в фолликулах перифери-
ческих лимфоидных органов и тканей ещё 2 стадии додифференцировки, которые называют иммуногенезом.
• Пролиферация центробластов. В фолликулах В-лимфоциты, называемые на этой стадии центробластами, интенсивно пролиферируют, удерживаясь связями со специальными клетками стромы - ФДК.
• На ФДК экспрессированы необычные рецепторы для иммуноглобулинов (FcR), способные продолжительное время (дни, месяцы, возможно, годы) удерживать комплекс антиген-антитело на мембране клетки.
• В центробластах происходит возрастание аффинности антител в отношении специфического антигена по механизму гипермутагенеза, так как на этом этапе дифференцировки выживают те из вновь мутировавших В-лимфоцитов, у которых аффинность BCR к антигенам на поверхности ФДК выше. Этот процесс также называют положительной селекцией.
• Выбор дальнейшего пути. На второй стадии иммуногенеза происходит выбор: В-лимфоцит становится либо В-лимфоцитом памяти (дифференцированный резерв на случай повторной встречи с тем же антигеном), либо плазмоцитом (плазматической клеткой) - продуцентом больших количеств секретируемых антител заданной специфичности (рис. 5-9).
Описанный путь дифференцировки характерен для В2-лимфоцитов, которые давно известны и хорошо изучены. Однако существует и другая субпопуляция В-лимфоцитов - В1-клетки.
В1-лимфоциты
• В свою очередь, В1-лимфоциты подразделяют на 2 субпопуляции: В1а (CD5+) и В1b (CD5-).
• Предшественники В1а-лимфоцитов ещё в эмбриональном периоде мигрируют из эмбриональных кроветворных тканей (фетальной печени, оментума) в брюшную и плевральную полости, где существуют как самоподдерживающаяся популяция. В1b-лимфоциты тоже происходят из фетальных предшественников, однако их пул у взрослых может частично пополняться за счёт костного мозга.
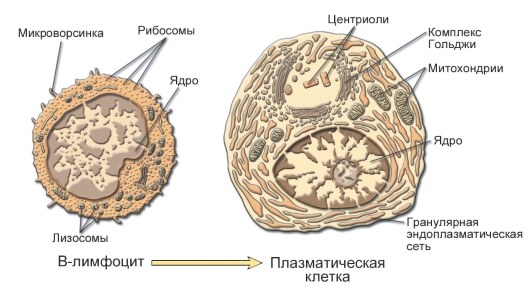
Рис. 5-9. B-лимфоцит и плазматическая клетка. Активированные B-лимфоциты, т.е. распознавшие антигенную детерминанту и получившие сигнал к пролиферации, пролиферируют и заканчивают дифференцировку. Совокупность окончательно дифференцированных потомков B-лимфоцита составляет клон плазматических клеток, синтезирующих антитела (иммуноглобулины) именно к этой и только к этой антигенной детерминанте. Обратите внимание, что в цитоплазме плазматической клетки присутствует большое количество синтезирующего белок аппарата - гранулярной эндоплазматической сети. На мембране плазмоцита уже нет ни иммуноглобулинов, ни MHC-II. В этих клетках прекращается переключение классов иммуноглобулинов и гипермутагенез, а образование антител уже не зависит от контакта с антигеном и взаимодействий с T-лимфоцитами
• Предназначение B1-лимфоцитов - быстрый ответ на проникающие в организм широко распространённые патогены (преимущественно бактерии). Многие В1-клетки продуцируют антитела, специфичные к аутоантигенам.
• Разнообразие антител, продуцируемых B1-лимфоцитами, невелико; как правило, они полиспецифичны. Почти все антитела В1-клеток принадлежат к IgM-изотипу и распознают наиболее распространённые соединения клеточных стенок бактерий.
• Преобладающая часть нормального IgM сыворотки крови здорового человека синтезируется именно B1-лимфоцитами.
• Предполагают, что основная функция B1a-лимфоцитов - секреция естественных антител, а B1b-лимфоцитьI участвуют в продукции антител к Т-независимым антигенам.
Естественные (конститутивные) иммуноглобулины
Ещё до встречи с каким бы то ни было внешним антигеном в крови и биологических жидкостях организма уже присутствуют так называемые естественные (конститутивные) иммуноглобулины. У взрослых большинство из них относится к IgG, но есть также IgA и IgM. Эти антитела способны связывать множество антигенов (как эндо-, так и экзогенных). Мишенями для нормальных иммуноглобулинов могут быть другие иммуноглобулины; TCR; молекулы CD4, CD5 и HLA-I; FcγR; лиганды для молекул межклеточной адгезии и др.
Функции естественных антител. Есть основания полагать, что естественные антитела выполняют ряд весьма важных для здоровья организма функций: «первая линия обороны» против патогенов; удаление из организма погибших клеток и продуктов катаболизма; презентация антигенов T-лимфоцитам; поддержание гомеостаза аутоиммунной реактивности; противовоспалительное действие (нейтрализация суперантигенов; индукция синтеза противовоспалительных цитокинов; аттенуация комплементзависимого повреждения тканей и др.).