Хаитов Р.М. Иммунология: учебник / Р.М. Хаитов. - 2-е изд., перераб. и доп. - 2013. - 528 с.: ил.
|
|
|
|
Глава 6. Т-ЛИМФОЦИТЫ
Основная роль T-лимфоцитов - распознавание изменённых поверхностных структур собственных клеток организма. Если на поверхности своих клеток будут представлены чужеродные или изменённые свои молекулы, T-лимфоцит организует уничтожение повреждённой клетки.
• В отличие от B-лимфоцитов, T-лимфоциты не продуцируют растворимых форм антигенраспознающих молекул. Более того, большинство T-лимфоцитов не способно распознавать и связывать растворимые антигены.
• Для того чтобы T-лимфоцит «обратил своё внимание на антиген», другие клетки должны каким-то образом «пропустить» антиген через себя и выставить его на своей мембране в комплексе с MHC-I или MHC-II. Это и есть феномен презентации антигена T-лимфоциту. Распознавание такого комплекса T-лимфоцитом - двойное распознавание, или MHC-рестрикция T-лимфоцитов.
АНТИГЕНРАСПОЗНАЮЩИЙ РЕЦЕПТОР T-ЛИМФОЦИТОВ
Антигенраспознающие рецепторы T-клеток (TCR) состоят из цепей, принадлежащих к суперсемейству иммуноглобулинов (см. рис. 5-1). Выступающий над поверхностью клетки антигенраспознающий участок TCR - гетеродимер (т.е. состоит из двух разных полипептидных цепей). Известны два варианта TCR, обозначаемые как αβTCR и γδTCR. Эти варианты различаются составом полипептидных цепей антигенраспознающего участка. Каждый T-лимфоцит экспрессирует только 1 вариант рецепто-
ра. apT-клетки были открыты раньше и изучены подробнее, чем у5Т-клетки; поэтому строение антигенраспознающего рецептора Т-лимфоцитов (TCR) удобнее описывать на примере apTCR. Полностью трансмембранно расположенный TCR состоит из 8 или 10 полипептидных цепей (одна или две пары α/β и комплекс из двух ε, двух ζ и по одной δ и γ цепей; рис. 6-1).
• Трансмембранные цепи α и β TCR. Это 2 примерно одинаковые по размеру полипептидные цепи - α (молекулярная масса 40-60 кДа, кислый гликопротеин) и β (молекулярная масса 40-50 кДа, нейтральный или основный гликопротеин). Каждая из этих цепей содержит по 2 гликозилированных домена во внеклеточной части рецептора, гидрофобную (положительно заряженную за счёт остатков лизина и аргинина) трансмембранную часть и короткий (из 5-12 остатков аминокислот) цитоплазматический участок. Внеклеточные части обеих цепей соединены одной дисульфидной связью.
◊ V-область. Наружные внеклеточные (дистальные) домены обеих цепей имеют вариабельный аминокислотный состав. Они гомологичны V-области молекул иммуноглобулинов и составляют V-область TCR. Именно V-области а- и р-цепей вступают в связь с комплексом MHC-пептид.
◊ C-область. Проксимальные домены обеих цепей гомологичны константным областям иммуноглобулинов; это C-области TCR.
◊ Короткий цитоплазматический участок (как α-, так и β-цепи) не может самостоятельно обеспечить проведение сигнала внутрь клетки. Для этого служат 6 дополнительных полипептидных цепей: γ, δ, 2 ε и 2 ζ
• Комплекс CD3. Цепи у, 5, е (вместе их называют комплексом CD3) необходимы для экспрессии а- и р-цепей, их стабилизации и проведения сигнала внутрь клетки. Комплекс CD3 состоит из внеклеточной, трансмембранной (отрицательно заряженной и потому электростатически связанной с трансмембранными участками а- и р-цепей) и цитоплазматической частей.
• ζ-Цепи соединены между собой дисульфидным мостиком и, будучи по большей части расположенными в цитоплазме, осуществляют проведение сигнала внутрь клетки.
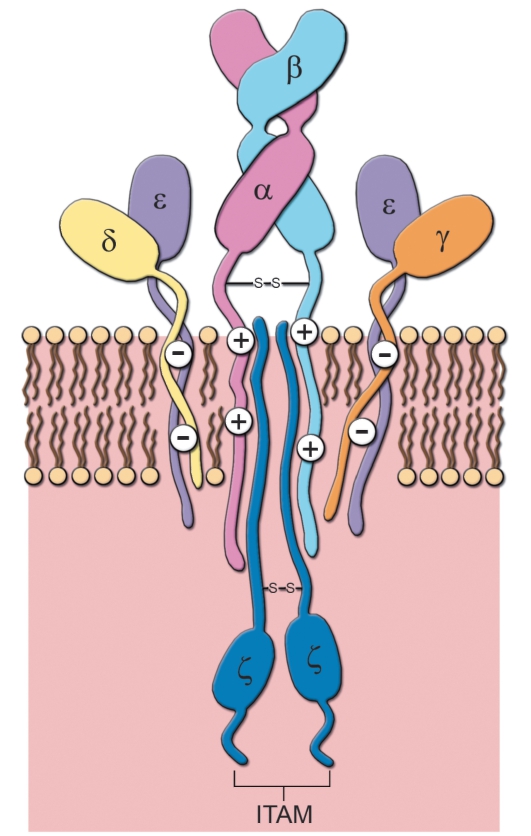
Рис. 6-1. αβT-клеточный рецептор. Антигенсвязывающая область рецептора формируется α- и β-цепями; цепи γ, δ, ε (вместе их называют комплексом CD3) необходимы для экспрессии α- и β-цепей, их стабилизации и проведения сигнала внутрь клетки; передачу сигнала обеспечивает ζ-цепь - самая «внутриклеточная». ITAM (Immunoreceptor-Tyrosin-based Activation Motif) - тирозинсодержащие активационные последовательности аминокислот в иммунорецепторах
• ITAM-последовательности. Цитоплазматические участки полипептидных цепей γ, δ, ε и ζ содержат последовательности ITAM (1 последовательность в γ- и δ-цепях, 2 - в ε-цепях и 3 - в каждой ζ-цепи), взаимодействующие с тирозинкиназа-
ми цитозоля (активация этих ферментов и составляет начало биохимических реакций по проведению сигнала). В связывании антигена участвуют ионные, водородные, ван-дер-ваальсовы и гидрофобные силы, конформация рецептора при этом существенно изменяется. Каждый TCR потенциально способен связывать порядка 105 разных антигенов, причём не только родственные по строению (перекрёстно реагирующие), но и негомологичные по структуре.
Гены T-клеточного рецептора
Гены α-, β-, γ- и δ-цепей (рис. 6-2) гомологичны генам иммуноглобулинов и претерпевают при дифференцировке T-лимфоцитов соматическую рекомбинацию ДНК, что теоретически обеспечивает генерацию порядка 1016-1018 вариантов антигенсвязывающих рецепторов (реально это разнообразие ограничено числом лимфоцитов в организме до 109).
• Гены a-цепи имеют 70-80 V-сегментов, 61 J-и один C-сегмент.
• Гены р-цепи содержат 52 V-сегмента, 2 D-сегмента, 13 J-сегментов и 2 C-сегмента.
• Гены 5-цепи. Между V- и J-сегментами a-цепи расположены гены D-, J- и C-сегментов 5-цепи y5TCR. V-сегменты 5-цепи «вкраплены» среди V-сегментов a-цепи.
• Гены у-цепи y5TCR имеют 2 C-сегмента, 3 J-сегмента перед первым C-сегментом и 2 J-сегмента перед вторым C-сегментом, 12 V-сегментов.
Перестройка генов
• Рекомбинация ДНК происходит при объединении V-, D- и J-сегментов и катализируется тем же комплексом рекомбиназ, что и при дифференцировке B-лимфоцитов.
• После перестройки VJ в генах a-цепи и VDJ в генах р-цепи, а также присоединения некодируемых N- и Р-нуклеотидов с ДНК транскрибируется РНК. Объединение с C-сегментом и удаление лишних (неиспользуемых) J-сегментов происходит при сплайсинге первичного транскрипта.
• Гены a-цепи могут перестраиваться неоднократно при уже правильно перестроенных и экспрессированных генах р-цепи.
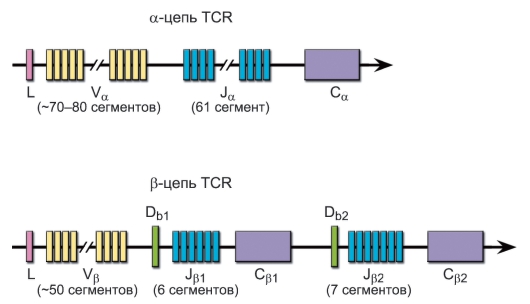
Рис. 6-2. Гены а- и р-цепей антигенраспознающего рецептора T-лимфоцитов
Именно поэтому есть некоторая вероятность того, что одна клетка может нести более одного варианта TCR.
• Соматическому гипермутагенезу гены TCR не подвергаются.
Корецепторные молекулы CD4 и CD8
Помимо самого TCR, каждый зрелый T-лимфоцит экспрессирует одну из так называемых корецепторных молекул - CD4 или CD8, которые также взаимодействуют с молекулами MHC на АПК или клетках-мишенях. Каждая из них имеет цитоплазматический участок, связанный с тирозинкиназой Lck, и, вероятно, вносит свой вклад в проведение сигнала внутрь клетки при распознавании антигена.
• CD4 связывается с инвариантной частью (р2-доменом) молекулы MHC-II (принадлежит к суперсемейству иммуноглобулинов, см. рис. 5-1, б). CD4 имеет молекулярную массу 55 кДа и 4 домена во внеклеточной части. При активации T-лимфоцита одну молекулу TCR «обслуживают» 2 молекулы CD4 (вероятно, происходит димеризация молекул CD4).
• CD8 связывается с инвариантной частью (а3-доменом) молекулы MHC-I (принадлежит к суперсемейству иммуноглобулинов, см. рис. 5-1, а). CD8 - гетеродимер цепей а и р, соединённых дисульфидной связью. В некоторых случаях обнаруживают гомодимер из двух а-цепей, который также может взаимодействовать с MHC-I. Во внеклеточной части каждая из цепей имеет по одному иммуноглобулиноподобному домену.
ПРОВЕДЕНИЕ СИГНАЛА С АНТИГЕНРАСПОЗНАЮЩИХ РЕЦЕПТОРОВ ЛИМФОЦИТОВ
TCR и BCR имеют ряд общих закономерностей регистрации и проведения в клетку активационных сигналов (см. рис. 5-8).
• Кластеризация рецепторов. Для активации лимфоцита необходима кластеризация антигенраспознающих рецепторов и корецепторов, т.е. «сшивка» нескольких рецепторов одним антигеном.
• Тирозинкиназы. В проведении сигнала значительную роль играют процессы фосфорилирования/дефосфорилирования белков по остатку тирозина под действием тирозинкиназ и тирозинфосфатаз, ведущие к активации или инактивации этих белков. Эти процессы легко обратимы и «удобны» для быстрых и гибких реакций клетки на внешние сигналы.
• Киназы Src. Богатые тирозином ITAM-последовательности цитоплазматических участков иммунорецепторов подвергаются фосфорилированию под действием нерецепторных (цитоплазматических) тирозинкиназ семейства Src (Fyn, Blk, Lyn в В-лимфоцитах, Lck и Fyn - в T-лимфоцитах).
◊ Активность киназ Src зависит от состояния C-концевого участка молекулы: его фосфорилирование под действием киназы Csk инактивирует, а дефосфорилирование трансмембранной тирозинфосфатазой CD45 - активирует фермент.
◊ Другой механизм регуляции активности киназ Src - их ковалентное связывание с убиквитином через адапторный
белок Cb1. Связывание с убиквитином «направляет» белки на деградацию в протеосомах.
• Другие киназы. Киназы ZAP-70 (в T-лимфоцитах) и Syk (в B-лимфоцитах), связываясь с фосфорилированными ITAM-последовательностями, активируются и начинают фосфорилировать адапторные белки: LAT (Linker for Activation of T cells) (киназой ZAP-70), SLP-76 (киназой Syk) и SLP-65 (киназой Syk).
• Фосфолипаза Cy (см. рис. 4-3). Киназы семейства Tec (Btk в B-лимфоцитах, Itk - в T-лимфоцитах) связывают адапторные белки и активируют фосфолипазу Cy (PLCy).
◊ PLCy расщепляет фосфатидилинозитдифосфат (PIP2) клеточной мембраны на фосфатидилинозиттрифосфат (PIP3) и диацилглицерин (DAG).
◊ DAG остаётся в мембране и активирует протеинкиназу С (PKC) - серин/треониновую киназу, которая активирует эволюционно «древний» фактор транскрипции NF-kB.
◊ PIP3 связывается со своим рецептором в эндоплазматическом ретикулуме и высвобождает ионы кальция из депо в цитозоль.
◊ Свободный кальций активирует кальцийсвязывающие белки - кальмодулин, регулирующий активность ряда других белков, и кальциневрин, дефосфорилирующий и тем самым активирующий ядерный фактор активированных T-лимфоцитов NFAT (Nuclear Factor of Activated T cells).
• Ras и другие малые G-белки в неактивном состоянии связаны с ГДФ, но адапторные белки заменяют последний на ГТФ, чем переводят Ras в активное состояние.
◊ Ras обладает собственной ГТФазной активностью и быстро отщепляет третий фосфат, чем возвращает себя в неактивное состояние (самоинактивируется).
◊ В состоянии кратковременной активации Ras успевает активировать очередной каскад киназ, называемых MAPK (Mitogen-Activated Protein Kinase), которые в итоге активируют фактор транскрипции AP-1 в ядре клетки.
ДИФФЕРЕНЦИРОВКА T-ЛИМФОЦИТОВ
Процессы дифференцировки, происходящие в тимусе, изучены достаточно подробно.
• Тимоциты дифференцируются из общей клетки-предшественника, которая ещё вне тимуса экспрессирует такие мембранные маркёры, как CD7, CD2, CD34 и цитоплазматическую форму CD3.
• Коммутированные к дифференцировке в T-лимфоциты клетки-предшественники мигрируют из костного мозга в субкапсулярную зону коры тимуса, где примерно в течение 1 нед медленно пролиферируют. На тимоцитах появляются новые мембранные молекулы CD44 и CD25.
• Затем клетки перемещаются вглубь коры тимуса, молекулы CD44 и CD25 исчезают с их мембраны. В этой стадии начинается перестройка генов р-, y- и 5-цепей TCR. Если гены y- и 5-цепей успевают продуктивно (т.е. без сдвига рамки считывания) перестроиться раньше, чем гены р-цепи, то лимфоцит дифференцируется далее как y5T. В противном случае происходит экспрессия р-цепи на мембране в комплексе с pTα (инвариантной суррогатной цепью, заменяющей на этом этапе настоящую α-цепь) и CD3. Это служит сигналом к прекращению перестройки генов γ- и δ-цепей. Клетки начинают пролиферировать и экспрессировать одновременно CD4 и CD8 (дважды позитивные тимоциты). При этом накапливается масса клеток с уже готовой р-цепью, но с ещё не перестроенными генами а-цепи, что вносит свой вклад в разнообразие ар-гетеродимеров.
• На следующем этапе клетки перестают делиться и начинают перестраивать Vα-гены, причём несколько раз в течение 3-4 сут. Перестройка генов а-цепи приводит к необратимой делеции 5-локуса, расположенного между сегментами генов а-цепи.
• Происходят экспрессия TCR с каждым новым вариантом α-цепи и отбор (селекция) тимоцитов по силе связывания с комплексом MHC-пептид на мембранах эпителиальных клеток тимуса.
◊ Позитивная селекция: погибают тимоциты, не связавшие ни одного из доступных комплексов MHC-пептид. В результате позитивной селекции в тимусе погибает около 90% тимоцитов.
◊ Негативная селекция уничтожает клоны тимоцитов, связывающих комплексы MHC-пептид со слишком высокой аффинностью. Негативная селекция элиминирует от 10 до 70% клеток, прошедших позитивную селекцию.
◊ Тимоциты, связавшие какой-либо из комплексов MHC- пептид с правильной (т.е. средней по силе) аффинностью, получают сигнал к выживанию и продолжают дифференцировку.
• На короткое время с мембраны тимоцитов исчезают обе корецепторные молекулы, а затем экспрессируется одна из них: тимоциты, распознавшие пептид в комплексе с MHC-I, экспрессируют корецептор CD8, а с MHC-II - корецептор CD4. Соответственно на периферию выходят (в соотношении около 2:1) T-лимфоциты двух типов: CD8+ и CD4+, функции которых в предстоящих иммунных ответах различны.
◊ CD8+ T-клетки играют роль цитотоксических T-лимфоцитов (ЦТЛ) - они распознают и непосредственно убивают клетки, модифицированные вирусом, опухолевые и другие «изменённые» клетки (рис. 6-3).
◊ CD4+ T-клетки. Функциональная специализация CD4+ T-лимфоцитов более разнообразна. Значительная часть CD4+ T-лимфоцитов в процессе развития иммунного ответа становится T-хелперами (помощниками), взаимодействующими с В-лимфоцитами, Т-лимфоцитами и другими клетками при прямом контакте или через растворимые факторы (цитокины). В определённых случаях из них могут развиться CD4+ ЦТЛ (в частности, такие T-лимфоциты обнаружены в значительных количествах в коже больных с синдромом Лайелла).
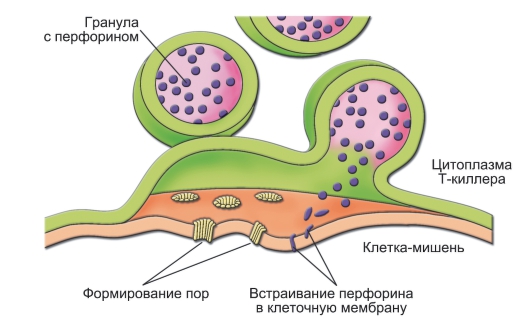
Рис. 6-3. Механизм воздействия цитотоксического T-лимфоцита на клетку-мишень. В киллере гранулы с перфорином в ответ на увеличение концентрации Са2+ сливаются с клеточной мембраной. Освободившийся перфорин встраивается в мембрану клетки-мишени с последующим образованием пор, проницаемых для гранзимов, воды и ионов. В результате клетка-мишень лизируется
Субпопуляции Т-хелперов
С конца 80-х гг. XX в. было принято выделять 2 субпопуляции T-хелперов (в зависимости от того, какой набор цитокинов они продуцируют) - Th1 и Th2. В последние годы спектр субпопуляций CD4 Т-клеток продолжает расширяться. Так, обнаружены субпопуляции Th17, T-регуляторы, Tr1, Th3, Tfh и др.
Основные субпопуляции CD4 Т-клеток.
• Th0 - CD4+ Т-лимфоциты на ранних стадиях развития иммунного ответа, они продуцируют только ИЛ-2 (митоген для всех лимфоцитов).
• Th1 - дифференцированная субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на продукции ИФНγ, ФНОβ и ИЛ-2. Эта субпопуляция осуществляет регуляцию многих реакций клеточного иммунитета, включая гиперчувствительность замедленного типа (ГЗТ) и активацию ЦТЛ. Кроме того, Th1 стимулируют продукцию В-лимфоцитами опсонизирующих антител класса IgG, запускающих каскад активации ком-
племента. Развитие избыточного воспаления с последующим повреждением тканей напрямую связано с активностью Th1 субпопуляции.
• Th2 - дифференцированная субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на продукции ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10 и ИЛ-13. Эта субпопуляция участвует в активации В-лимфоцитов и способствует секреции ими больших количеств антител разных классов, особенно IgE. Кроме того, Th2 субпопуляция участвует в активации эозинофилов и развитии аллергических реакций.
• Th17 - субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на продукции ИЛ-17. Эти клетки играют ключевую роль при аутоиммунных заболеваниях.
• Т-регуляторы - CD4+ Т-лимфоциты, подавляющие активность других клеток иммунной системы посредством секреции иммуносупрессорных цитокинов - ИЛ-10 (ингибитора активности макрофагов и Th1) и ТФРβ - ингибитора пролиферации лимфоцитов. Ингибиторный эффект может также достигаться при непосредственном межклеточном взаимодействии, поскольку на мембране некоторых Т-регуляторов экспрессированы индукторы апоптоза активированных и «отработавших» лимфоцитов - FasL (Fas-лиганд). Существует несколько популяций CD4+ регуляторных Т-лимфоцитов: естественные (Treg), созревающие в тимусе (CD4+ CD25+, экспрессируют фактор транскрипции Foxp3), и индуцированные - CD4+ Т-лимфоциты, локализованные преимущественно в слизистых оболочках пищеварительного тракта и переключившиеся на продукцию ТФРβ (Th3) или ИЛ-10 (Tr1). Нормальное функционирование Т-регуляторов необходимо для поддержания гомеостаза иммунной системы и предотвращения аутоиммунных заболеваний.
• Дополнительные хелперные популяции. В последнее время появляется описание всё новых популяций CD4+ Т-лимфоцитов, классифицированных по типу преимущественно продуцируемого ими цитокина. Так, как оказалось, одной из важнейших популяций являются Tfh (от англ. follicular helper - фолликулярный хелпер). Эта популяция CD4+ Т-лимфоцитов преимущественно расположена в лимфоидных фолликулах и осуществляет хелперную функцию для В-лимфоцитов посредством
продукции ИЛ-21, вызывая их созревание и терминальную дифференцировку в плазматические клетки. Кроме ИЛ-21, Tfh могут также продуцировать ИЛ-6 и ИЛ-10, необходимые для дифференцировки В-лимфоцитов. Нарушение функций этой популяции приводит к развитию аутоиммунных заболеваний или иммунодефицитов. Другой «новоявленной» популяцией являются Th9 - продуценты ИЛ-9. По-видимому, это Th2, переключившиеся на секрецию ИЛ-9, который способен вызывать пролиферацию Т-хелперных клеток при отсутствии антигенной стимуляции, а также усиливать секрецию В-лимфоцитами IgM, IgG и IgE. Основные субпопуляции Т-хелперов представлены на рис. 6-4.
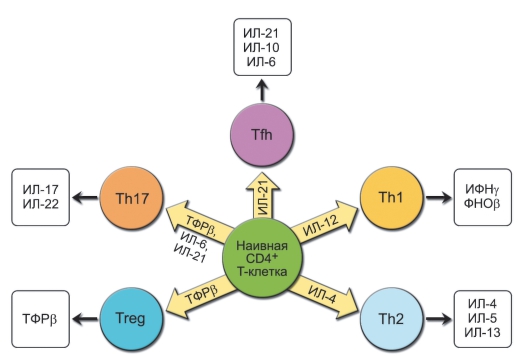
Рис. 6-4. Основные субпопуляции хелперных Т-лимфоцитов. Дифференцировка наивных Т-лимфоцитов в специализированные популяции происходит при их активации в результате контакта с антигенпрезентирующими клетками и под действием секретируемых ими цитокинов. Направление дифференцировки также зависит от типа антигена, запускающего иммунный ответ. Так, вирусные антигены усиливают продукцию ИФНу, приводящего к преимущественному накоплению Th1 лимфоцитов. В свою очередь, бактериальные токсины и гельминты стимулируют образование Th2 лимфоцитов. При отсутствии ассоциации антигенов с инфекционными агентами дендритные клетки могут направлять дифференцировку Т-хелперов в Treg
γδT-лимфоциты
Подавляющее большинство (99%) T-лимфоцитов, проходящих лимфопоэз в тимусе, составляют αβT-клетки; менее 1% - γδT-клетки. Последние в большинстве дифференцируются вне тимуса, в первую очередь в слизистых оболочках пищеварительного тракта. В коже, лёгких, пищеварительном и репродуктивном трактах они являются доминирующей субпопуляцией внутриэпителиальных лимфоцитов. Среди всех T-лимфоцитов организма γδT-клетки составляют от 10 до 50%. В эмбриогенезе γδT-клетки появляются раньше, чем αβT-лимфоциты.
• γδT-клетки не экспрессируют CD4. Молекула CD8 экспрессирована на части γδT-клеток, но не в виде αβ-гетеродимера, как на Tαβ CD8+ клетках, а в виде гомодимера из двух a-цепей.
• Антигенраспознающие свойства: y5TCR в большей степени напоминают иммуноглобулины, чем αβTCR, т.е. способны связывать нативные антигены независимо от классических молекул MHC - для γδT-клеток не обязателен или вовсе не нужен предварительный процессинг антигена АПК.
• Разнообразие y5TCR меньше, чем αβTCR или иммуноглобулинов, хотя в целом αβT-клетки способны распознавать широкий спектр антигенов (в основном это фосфолипидные антигены микобактерий, углеводы, белки теплового шока).
• Функции γδT-клеток ещё до конца не изучены, хотя становится преобладающим мнение, что они служат одним из связующих компонентов между врождённым и приобретённым иммунитетом. γδT-клетки - один из первых барьеров на пути патогенов. Кроме того, эти клетки, секретируя цитокины, играют важную иммунорегуляторную роль и способны дифференцироваться в ЦТЛ.
Тимуснезависимые антигены. Некоторые антигены способны вызывать иммунный ответ с участием В-лимфоцитов, но без помощи T-лимфоцитов. Этот тип иммуного ответа характеризуется рядом особенностей: вырабатываются антитела только IgM изотипа (обычно переключения изотипов нет, однако у мыши выявляют IgG3, специфичные к таким антигенам), иммунологической памяти обычно нет, а также не происходит «созревания» аффинности. Но у подобного ответа есть и преимущество: он развивается уже в первые двое суток после проникновения антигена и начинает
защищать организм в ранние сроки инфекции, пока тимусзависимый ответ ещё не сформировался.
Антигены такого типа называют тимуснезависимыми и подразделяют на 2 класса.
◊ Тимуснезависимые антигены 1-го класса (ТН-1) в достаточно высоких концентрациях способны индуцировать поликлональную активацию В-лимфоцитов и продукцию поликлональных иммуноглобулинов. Эти вещества ещё называют В-клеточными митогенами. Бактериальный ЛПС - классический пример ТН-1.
◊ Тимуснезависимые антигены 2-го класса (ТН-2) представлены достаточно длинными молекулами с повторяющимися структурами (полисахариды бактериальных стенок, фиколл). Эти антигены мультивалентны и могут вызывать перекрёстную сшивку иммуноглобулиновых рецепторов. ТН-2 (в отличие от ТН-1) способны активировать только зрелые В-лимфоциты (преимущественно В1-лимфоциты). В незрелых В-лимфоцитах повторяющиеся антигенные эпитопы индуцируют анергию или апоптоз.