Хаитов Р.М. Иммунология: учебник / Р.М. Хаитов. - 2-е изд., перераб. и доп. - 2013. - 528 с.: ил.
|
|
|
|
Глава 12. ВТОРИЧНАЯ ИММУННАЯ НЕДОСТАТОЧНОСТЬ И СИНДРОМ ПРИОБРЕТЁННОГО ИММУНОДЕФИЦИТА
Вторичный иммунодефицит, или вторичная иммунная недостаточность (ВИН) - заболевание иммунной системы, развивающееся в любом возрасте, и которое, как принято считать, не является результатом генетического дефекта. Клинически ВИН проявляется часто рецидивирующими бактериальными, грибковыми, вирусными инфекциями, плохо поддающимися традиционным методам лечения.
Основные факторы этиологии ВИН представлены в табл. 12.1
Таблица 12-1. Основные факторы этиологии вторичной иммунной недостаточности
Выделяют 3 формы ВИН: индуцированную, спонтанную и приобретённую.
ИНДУЦИРОВАННАЯ И СПОНТАННАЯ ФОРМЫ ВТОРИЧНОЙ ИММУННОЙ НЕДОСТАТОЧНОСТИ
Индуцированная форма ВИН возникает в результате воздействия конкретных причинных факторов: рентгеновского излучения, цитостатической терапии, применения глюкокортикоидов, травмы и хирургических вмешательств. К этой же группе ВИН относят нарушения иммунитета, развивающиеся вторично по отношению к основному заболеванию (при диабете, заболеваниях печени, почек, злокачественных новообразованиях).
Спонтанная форма ВИН характеризуется отсутствием видимой причины, вызвавшей нарушение иммунной реактивности. Клинически она проявляется в виде хронических, часто рецидивирующих инфекционно-воспалительных процессов органов дыхания, придаточных пазух носа, урогенитального тракта, глаз, кожи, мягких тканей, вызванных оппортунистическими и условно-патогенными микроорганизмами.
Наиболее трудны для диагностики и часто остаются нераспознанными проявления спонтанной формы ВИН, особенно в случае затяжных, часто рецидивирующих, тяжёлых форм без явных изменений показателей иммунного статуса.
В группу риска по возникновению ВИН с ведущим инфекционным синдромом следует включать больных с хроническими, рецидивирующими или непрерывно текущими, плохо поддающимися традиционной терапии очагами инфекции различной этиологии и локализации.
Клинические признаки, позволяющие предполагать наличие ВИН:
• хронические, часто повторяющиеся бронхиты с пневмониями в анамнезе, сочетающиеся с заболеваниями ЛОР-органов (гнойными синуситами, отитами, лимфаденитами);
• часто повторяющиеся пневмонии, бронхоплевропневмонии;
• бронхоэктатическая болезнь;
• бактериальные поражения кожи и подкожной клетчатки (пиодермия, фурункулёз, абсцессы, флегмоны, септические гранулёмы, рецидивирующий парапроктит у взрослых);
• грибковые поражения кожи и слизистых оболочек, кандидоз, паразитарные заболевания;
• афтозные стоматиты в сочетании с повышенной заболеваемостью острыми респираторными вирусными инфекциями;
• рецидивирующая герпесвирусная инфекция различной локализации;
• гастроэнтеропатия с хронической диареей неясной этиологии, дисбактериозом;
• лимфаденопатия, повторные лимфадениты;
• длительный субфебрилитет, лихорадка неясной этиологии;
• генерализованные инфекции (сепсис, гнойные менингиты).
ИНФЕКЦИЯ ВИРУСОМ ИММУНОДЕФИЦИТА ЧЕЛОВЕКА И СИНДРОМ ПРИОБРЕТЁННОГО
ИММУНОДЕФИЦИТА
Наиболее яркий пример приобретённой формы ВИН - СПИД, развивающийся в результате инфицирования ВИЧ, поражающего в первую очередь клетки иммунной системы.
В июне 1981 г. в Центр по контролю и профилактике заболеваний (CDC - Centers for Disease Control & Prevention) в Атланте (США) поступили сообщения от 2 врачей из разных городов о 5 случаях неизвестного заболевания, отличающегося клинической картиной от всех известных болезней. Заболевшие были мужчинами-гомосексуалистами, имевшими половые контакты, что навело на мысль об инфекционном генезе заболевания. Они умерли от пневмонии, вызванной грибком Pneumocystis carinii. В иммунограмме у них было выявлено практически полное отсутствие CD4+ T-лимфоцитов, но при этом ничто в анамнезе не указывало на врождённый иммунодефицит. На основании этих 5 случаев CDC объявил национальную готовность в отношении нового инфекционного заболевания, названного СПИД. К августу 1981 г. в CDC поступила информация ещё о 111 подобных больных. Стало ясно, что началась эпидемия СПИДа, к 1990 г. ситуация была оценена как пандемия. В 100% случаев заболевание заканчивалось летально; здорового вирусоносительства выявлено не было. В связи с этим по решению Всемирной организации здравоохранения нозология СПИД была переименована в ВИЧ-инфекцию. Термин СПИД означает терминальную стадию ВИЧ-инфекции.
Вирус, возбудитель инфекции, активно размножающийся в лимфатических узлах человека, был выделен в 1983 г. во Франции в Институте Пастера коллективом исследователей под руко-
водством Люка Монтанье (в 2008 г. он и его сотрудница Франсуаза Барр-Синусси получили Нобелевскую премию за открытие вируса, инфицирующего лимфоциты). Для ускорения исследований ряд образцов был направлен в Национальный институт рака (США) Роберту Галло, который вырастил вирус в культуре, исследовал его и показал связь этого вируса со СПИДом. Этот вирус был назван ВИЧ-1. Впоследствии был обнаружен ВИЧ-2, который не так широко распространён, как ВИЧ-1. ВИЧ-2 встречается в основном в регионах Западной Африки, и заражение им вызывает более мягкое течение заболевания.
Строение вируса иммунодефицита человека и его жизненный цикл. Инфицирование
• ВИЧ относится к семейству ретровирусов, его геном состоит из двух идентичных копий одноцепочечной РНК (рис. 12-1). Вирус имеет специальный фермент - обратную транскриптазу (RT - Reverse Transcriptase), также именуемую ревертазой. Это многофункциональный фермент, состоящий из двух субъединиц с несколькими доменами и обладающий активностью как РНК-, так и ДНК-зависимой ДНК-полимеразы, а также РНКазы Н. Ревертаза после проникновения вируса в клетку-мишень синтезирует цепь ДНК на матрице вирусной РНК, т.е. этот фермент действует как РНК-зависимая ДНК-полимераза. Затем РНКаза Н разрушает матричную РНК в гибриде РНК-ДНК. После чего обратная транскриптаза синтезирует комплементарную цепь ДНК, в конечном результате формируя двухцепочечную ДНК.
• Другой вирусный фермент - интеграза - катализирует ковалентную интеграцию вирусной ДНК в ДНК генома человека, причём сразу в несколько разных участков. Интегрированная ДНК вируса называется провирусом. С этой ДНК происходят транскрипция мРНК для трансляции белков вируса и синтез геномной РНК вируса.
• Фосфолипидная оболочка ВИЧ - это часть мембраны клетки человека, захваченная при отпочковывании вирусной частицы от неё. В оболочку ВИЧ встроены гликопротеины (gp - glycoprotein) gp120 (поверхностный) и gp41 (трансмембранный). Каждый из них состоит из трёх субъединиц.
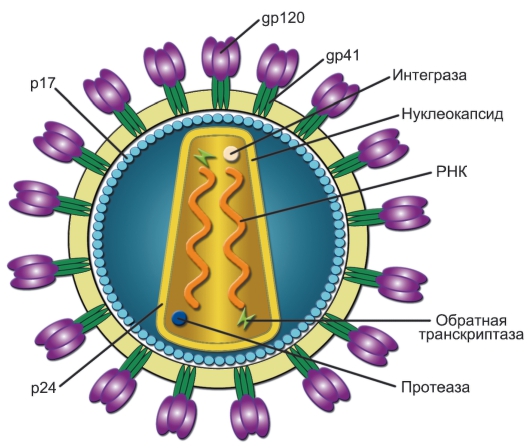
Рис. 12-1. Строение вируса иммунодефицита человека. Оболочка вируса - фосфолипидная мембрана, в которую встроены гликопротеины gp120 (поверхностный) и gp41 (трансмембранный). В нуклеокапсиде заключён геном вируса - две одноцепочечные нити РНК. В матриксе представлен белок p17, в оболочке нуклеокапсида - белок p24. Ферменты вируса иммунодефицита человека: обратная транскриптаза, интеграза и протеаза
Геном ВИЧ состоит приблизительно из 10 000 нуклеотидов, частота точечных мутаций составляет около 10-4, т.е. каждый дочерний вирион несёт хотя бы одну мутацию. Столь высокая генетическая изменчивость характерна для РНК-содержащих вирусов и объясняется высокой частотой ошибок при «работе» обратной транскриптазы. Ретровирусы по совокупности своих патогенных свойств превосходят другие вирусы. Подсчитано, что в организме инфицированного больного на бессимптомной стадии развития болезни содержится до 106 генетических вариантов вируса (квази-
видов), на стадии клинических проявлений - около 108 вариантов. Цикл репликации вируса продолжается 10 ч. Вирус цитопатогенен, т.е. после выхода вирионов из клетки последняя разрушается.
Оба конца генома ВИЧ (3' и 5') представлены длинными концевыми повторами LTR (Long Terminal Repeats), синтезируемыми в процессе интеграции ДНК провируса в геном клетки. LTR управляют образованием новых вирусов и могут активироваться и белками вируса, и белками инфицированной клетки.
В геноме ВИЧ 9 генов, расположенных «внахлёст», т.е. перекрывающихся друг с другом. Эти 9 генов кодируют по меньшей мере 15 белков. Гены gag, pol и env кодируют структурные белки вируса. Ген pol (polymerase) кодирует ферменты: обратную транскриптазу, интегразу и протеазу. Ген gag (group specific antigens) кодирует полипротеин, расщепляемый протеазой до p6, p7, p17, p24. Ген env (envelope) кодирует белок gp160, расщепляемый протеазой на gp41 и gp120. Другие 6 генов - tat (transactivator of transcription), rev (regulator of virus), nef (negative factor), vif (viral infectivity factor), vpr (virus protein R), vpu (virus protein U, только в ВИЧ-1), vpx (virus protein X, только в ВИЧ-2) - кодируют регуляторные белки (их чаще всего обозначают по названию гена теми же 3 буквами, только первая буква заглавная), отвечающие за способность ВИЧ инфицировать клетки и производить новые копии вируса.
• Белки ВИЧ. Основные белки ВИЧ-1 (лат. буква «p» означает «protein», а цифры после «p» - молекулярный вес в кДа):
◊ gp120 - поверхностный белок, обеспечивает связывание с клетками-мишенями; лиганды: молекула CD4, рецептор для хемокинов семейств CC и CXC;
◊ gp41 - обеспечивает слияние мембран клетки и вириона и интернализацию вириона в клетку;
◊ p24 - формирует оболочку нуклеокапсида (ядра вируса);
◊ p17 - белок матрикса вируса, связан с фосфолипидной мембраной, взаимодействует с gp41 и gp120; участвует в транспорте содержимого нуклеокапсида;
◊ p7 - белок нуклеокапсида, связан с геномной РНК;
◊ p6 - связывается с белком Vpr;
◊ p66/51 - обратная транскриптаза (RT, ревертаза, РНК-зависимая ДНК-полимераза), синтезирует ДНК на матрице
РНК;
◊ p15 - домен обратной транскриптазы с активностью РНКазы H, удаляет РНК из гибрида РНК-ДНК;
◊ p31 - интеграза, встраивает ДНК вируса в клеточный геном;
◊ p10-15 - протеаза; расщепляет большие белковые трансляты на отдельные функционально активные белки вируса;
◊ Tat (p14-16) - активирует транскрипцию с вирусных генов, стабилизирует вирусную мРНК, усиливает трансляцию с вирусной мРНК;
◊ Rev (p19) - нужен для экспрессии белков оболочки; а также обеспечивает транспорт компонентов вируса из ядра;
◊ Nef (p25-27) - способствует усилению инфицирующей способности вирионов, уменьшает количество рецептора CD4 на поверхности инфицированных клеток и приводит к эндоцитозу молекул MHC-I;
◊ Vif (p23) - необходим для выхода реплицировавших вирусов из клетки-мишени (вероятно, участвует в фолдинге белков оболочки);
◊ Vpr (p10-15) - способствует репликации ВИЧ в неделящихся и дифференцированных клетках, например макрофагах, нейронах, ДК;
◊ Vpu (p15) - стимулирует отпочковывание вируса; этот белок необязателен для жизненного цикла ВИЧ.
• Заражение клетки. ВИЧ преимущественно инфицирует CD4+ T-лимфоциты, а также ДК (главный резервуар латентной инфекции), моноциты/макрофаги и клетки микроглии мозга. Для внедрения в клетку человека ВИЧ использует её мембранные рецепторы CD4, а также рецепторы для хемокинов семейств CC (RANTES, MIP-1a, MIP-1p) и CXC (SDF-1) - CCR5 (моноциты/макрофаги) и CXCR4 (CD4+ T-лимфоциты). У инфицированного человека вирус присутствует во всех тканях и секретах организма, включая сперму, слизистые секреты, а также в небольших количествах в слюне, поте, ушной сере, моче, экскрементах (этих незначительных концентраций недостаточно для передачи инфекции).
• Пути трансмиссии ВИЧ: половой, через слизистые оболочки, повреждённую кожу, трансфузионно (переливание крови и введение препаратов из заражённой крови), через общие шприцы наркоманов, трансплацентарно, через грудное молоко.
• Антропогенные факторы пандемии: наркомания, широкое применение гемотрансфузий и продуктов из человеческой крови; медицинский инструментарий для манипуляций на слизистых оболочках (эндоскопы, стоматологическое оборудование и др.); массовый трансконтинентальный транспорт; высокая концентрация населения в больших городах; полигамные сексуальные контакты.
Жизненный цикл ВИЧ состоит из нескольких событий.
• Свободный вирус приближается к клетке человека (Т-лимфоциту, ДК, моноциту/макрофагу и др.).
• Белок вирусной оболочки gp120 взаимодействует с мембранными рецепторами CD4 и CXCR4 (если вместо лимфоцита моноцит/макрофаг, то gp120 связывается с CD4 и CCR5).
• Вирусный трансмембранный гликопротеин gp41 заякоривается в мембране клетки-мишени и обеспечивает её слияние с оболочкой вируса. Содержимое вируса впрыскивается в клетку.
• Обратная транскрипция. Одноцепочечная вирусная РНК служит матрицей, на которой вирусная ревертаза синтезирует ДНК. Получается гибрид РНК-ДНК, потом РНК удаляется из гибрида вирусной РНКазой Н, после чего достраивается комплементарная цепь ДНК и образуется двойная спираль.
• Интеграция в геном клетки. Вирусная ДНК встраивается в человеческую ДНК с помощью вирусной интегразы. Когда инфицированная клетка делится, то копия встроенной вирусной ДНК (провирус) передаётся дочерней клетке, т.е. провирус размножается одновременно с клеткой.
• Транскрипция. На ДНК провируса синтезируется РНК, которая одновременно служит и структурной основой для постройки генома вирусных частиц, и матрицей для синтеза белков вируса.
• Трансляция. На вирусной матричной РНК синтезируются вирусные белки.
• Сборка. Вирусные РНК и белки собираются в незрелую вирусную частицу.
• Отпочковывание. Незрелые вирусные частицы отпочковываются от клетки, забирая себе часть клеточной фосфолипидной мембраны. Вирусная протеаза начинает расщеплять вирусные трансляты.
• Созревание. Вирусная протеаза расщепляет вирусные трансляты на функционально активные вирусные белки, и образуется вирус, полностью готовый к заражению новой клетки. Активное размножение ВИЧ происходит в CD4+ Т-хелперах. В других заражённых клетках ВИЧ сохраняется, воспроизводится с клеткой и нарушает её функции (см. раздел «Проявления иммунодепрессии»).
Жизненный цикл ВИЧ представлен на рис. 12-2.
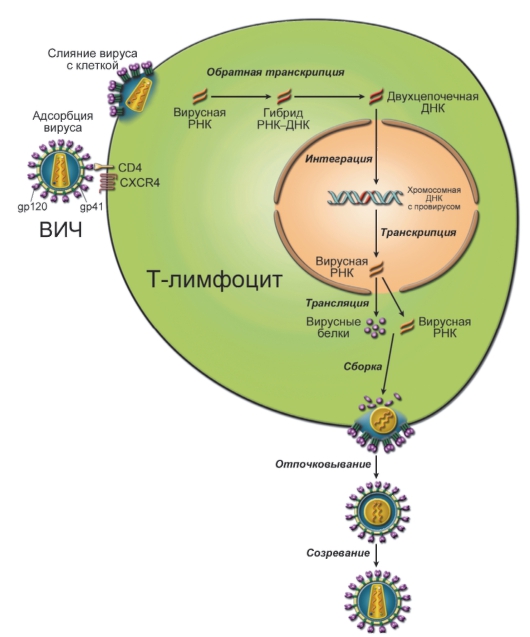
Рис. 12-2. Жизненный цикл вируса иммунодефицита человека. Взаимодействие вируса с CD4+ Т-лимфоцитом, встраивание вирусного генома в геном человека и размножение вируса. Подробности см. в тексте
Клиническая картина
Между моментом заражения и временем появления клинических симптомов ВИЧ-инфекции существует скрытый, бессимптомный период развития болезни.
• Клинически латентный период сильно различается по продолжительности у разных людей, что зависит от дозы полученного при заражении вируса, генотипа человека (HLA), его исходного состояния здоровья, наличия других вирусных и бактериальных инфекционных заболеваний, образа жизни. Выделяют несколько групп пациентов по продолжительности клинически латентного периода ВИЧ-инфекции:
◊ у 10% заболевание развивается до стадии СПИД в первые 2-3 года от момента заражения;
◊ у 80-85% людей заболевание развивается до стадии СПИД в течение 10 лет;
◊ у 5-10% инфицированных людей клинические симптомы отсутствуют в течение 7-10 лет, при этом сохраняется стабильный уровень CD4+ T-лимфоцитов в крови.
• Клинически заболевание подразделяют на 3 стадии (по реестру CDC) по манифестации индикаторных болезней и по числу CD4+ T-лимфоцитов в периферической крови.
• Клиническим стадиям присвоены латинские литеры A (бессимптомная стадия, может проявляться генерализованная лимфоаденопатия), B (симптоматическая, но степень выраженности симптомов меньше, чем в стадии С) и C - развитие полной клинической симптоматики СПИДа. К литере клинической стадии (в зависимости от концентрации CD4+ T-лимфоцитов в 1 мкл крови) добавляют арабские цифры 1 (>500), 2 (200-500) и 3 (<200). Всего различают 9 ранжированных клинических стадий: A1, A2, A3, B1, B2, B3, C1, C2, C3. Динамика содержания в крови CD4+ T-лимфоцитов представлена на рис. 12-3.
Индикаторные заболевания
• Стадия А. Бессимптомная; либо персистирующая более 3 мес генерализованная лимфоаденопатия без видимых признаков других инфекционных заболеваний.
• Стадия В. Бациллярный ангиоматоз; ротоглоточный кандидоз; кандидоз вульвовагинальный, персистирующий, торпидный к традиционной терапии; цервикальная дисплазия или цервикальная карцинома; лихорадка (38,5 °С) и/или диарея
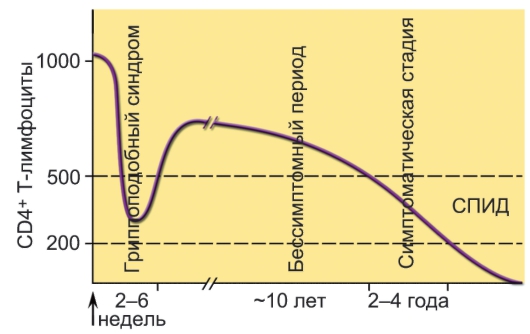
Рис. 12-3. Динамика содержания CD4+ T-лимфоцитов в крови пациентов, инфицированных вирусом иммунодефицита человека. По оси ординат - содержание CD4+ T-лимфоцитов (количество в 1 мкл). Ранняя фаза - гриппоподобный синдром (длится 2-6 нед при заражении большой дозой вируса); клинически бессимптомный период (продолжается в среднем 10 лет); симптоматическая стадия развития заболевания (продолжается 2-4 года); синдром приобретённого иммунодефицита - терминальная стадия развития заболевания (продолжается 0,5-1 год)
длительностью более 1 мес; лейкоплакия слизистой полости рта; опоясывающий герпес (более двух эпизодов в год); тромбоцитопения; листериоз; пельвиоцеллюлит (часто сопутствуют тубоовариальные абсцессы). • Стадия С. Кандидоз бронхов, трахеи, лёгких; кандидоз пищевода; цервикальный рак; кокцидиомикоз, диссеминированный или экстрапульмонарный; экстрапульмонарный криптококкоз; системная цитомегаловирусная инфекция; цитомегаловирусный ретинит с потерей зрения; ВИЧ-энцефалопатия; простой герпес: изъязвления длятся дольше 1 мес, с локализацией в бронхах, лёгких или пищеводе; гистоплазмоз, диссеминированный или экстрапульмонарный; хронический кишечный изоспориоз (более 1 мес); саркома Капоши; лимфома Беркитта; лимфома иммунобластная; лимфома мозга первичная; туберкулёз любой локализации; инфицирование микобактериями любых других видов; пневмония, вызванная Pneumocystis
carinii; пневмония рекуррентная (больше двух эпизодов в год); прогрессивная мультифокальная лейкоэнцефалопатия; токсоплазмоз мозга; синдром истощения (wasting-syndrome). Проявления иммунодепрессии начинаются задолго до клинической манифестации индикаторных болезней. Механизмы иммунодепрессии.
• CD4+ T-лимфоциты.
◊ Прямое цитотоксическое действие ВИЧ на CD4+ T-лимфоциты (T-хелперы).
◊ Гибель вследствие образования синцитиев. На заражённой клетке экспонирован вирусный белок gp120, обладающий высоким сродством к CD4. В результате заражённые клетки сливаются с незаражёнными и образуется синцитий, который уже не функционирует и погибает. Т.е. уничтожается заражённая клетка и вместе с ней множество нормальных CD4+ T-лимфоцов. Образование синцития - один из механизмов гибели клеток при ВИЧ-инфекции. Этот эффект проявляется после того, как одна клетка поражается вирусом и начинает сама производить вирусные белки, в том числе и белок gp120, молекулы которого располагаются на поверхности поражённой клетки.
◊ Растворимый gp120, связываясь с неинфицированными Т-лимфоцитами, превращает их в мишень для ЦТЛ и антителозависимой клеточной цитотоксичности.
◊ Суперантигены ВИЧ индуцируют поликлональную активацию и апоптоз T-лимфоцитов.
◊ Характерный признак ВИЧ-инфекции - массовая гибель CD4+ Т-лимфоцитов в пищеварительном тракте. Сопровождающая заболевание энтеропатия и повышение проницаемости стенок кишечника приводят к проникновению в кровоток патогенных микроорганизмов и ЛПС, что также приводит к активации лимфоцитов.
• Макрофаги. Происходит угнетение хемотаксиса; ослабление антигенпрезентирующих функций (белок вируса Tat, активирующий транскрипцию вирусных генов, значительно подавляет транскрипцию и биосинтез молекул MHC-I, а следовательно, и противовирусные иммунные реакции); ухудшение фагоцитоза, опосредованного Fc-рецепторами; нарушение всех макрофагальных бактерицидных механизмов.
• CD8+ T-лимфоциты. Выявляют лимфоцитоз, но постепенное снижение функции ЦТЛ. С сохранением функции специфических CD8+ Т-клеток связывают более медленный переход заболевания в быстро прогрессирующую стадию.
• NK-клетки. Происходит снижение функциональной активности.
• B-лимфоциты. Характерна поликлональная активация самим ВИЧ, а также вирусом Эпштейна-Барр, цитомегаловирусом и другими вирусами. Соответственно развивается гипериммуноглобулинемия (особенно за счёт изотипов IgG1, IgG3, IgA, IgE), но происходит снижение антительных функций сыворотки и способности к индукции антигенспецифического гуморального ответа. Кроме этого противовирусные антитела, связывая вирусы в комплекс, помогают им инфицировать все клетки, имеющие Fc-рецепторы (феномен усиления вирусной инфекции антителами).
• Клетки-предшественники. ВИЧ инфицирует как СКК, так и тимоциты и предшественники миелопоэза, чем угнетает кроветворение.
• Цитокины, стимулирующие развитие иммунного ответа, в ещё большей степени стимулируют репликацию ВИЧ: самый сильный стимулятор ВИЧ - ФНОа.
Лабораторная диагностика
Специфическая лабораторная диагностика ВИЧ - определение в крови или биоптате лимфоидных тканей человека (или в любом другом биоматериале) специфических маркёров:
• РНК и ДНК вируса (методом ПЦР);
• противовирусных антител (методами иммуноферментного анализа, иммунохроматографии и иммуноблоттинга);
• белка p24 (с помощью «ловушечного» иммуноферментного анализа);
• живого реплицирующегося вируса (высев в культуру клеток in vitro).
При выборе лабораторного метода для выявления ВИЧ-инфекции следует учитывать время возможного заражения, предполагаемые генетические субтипы вируса в зависимости от источника заражения (африканские, североамериканские, азиатские)
и их соответствие имеющимся в наличии диагностическим тестсистемам.
• При массовом скрининге и проверке донорской крови на ВИЧ используют иммуноферментный анализ для одновременного определения антител к ВИЧ и антигена - белка p24. Считают, что антитела можно выявить примерно через 1,5 мес после заражения, а антиген - примерно после 3-й недели. Впоследствии антиген (p24) выявить не удаётся, поскольку он находится в составе иммунных комплексов.
• Для подтверждения результатов иммуноферментного анализа используют иммуноблоттинг, позволяющий определить к каким именно белкам вырабатываются антитела.
• Определение генома ВИЧ используют для назначения лечения. Для этого выявляют:
◊ геном ВИЧ в форме РНК с помощью обратной транскрипции и последующей ПЦР;
◊ геном провируса в форме ДНК с помощью ПЦР.
• Оценка результатов. Если какой-либо анализ показал наличие инфекции, то результат необходимо подтвердить с помощью других тест-систем и более чем одним независимым методом. Ложноположительные результаты возможны, но вероятность ошибки уменьшается с увеличением числа применяемых методов анализа. Только по совокупности лабораторных данных можно сделать определённое заключение о наличии или отсутствии ВИЧ-инфекции. Однако сколько бы анализов ни было сделано конкретному человеку, категорически утверждать, что в его организме отсутствует ВИЧ, нельзя.
Накопленный эпидемиологический опыт показал, что вероятность передачи ВИЧ с препаратами крови и органных трансплантатов составляет 100%; трансплацентарно от матери к плоду - 15-20%; при грудном вскармливании от матери к ребёнку - 30-40%; при гомосексуальных контактах от мужчины к мужчине - 1%; при гетеросексуальных контактах от мужчины к женщине - 0,1%, от женщины к мужчине - ниже. При наличии воспалительных заболеваний и повреждений слизистых оболочек вероятность сексуальной трансмиссии ВИЧ существенно возрастает.
Лечение
Химиотерапия
Разработки медикаментозного лечения ВИЧ-инфекции требуют огромных финансовых затрат. Ежегодно проходят лабораторное тестирование тысячи химиопрепаратов. В среднем один препарат в год доводят до стадии клинических испытаний. При лечении ВИЧ-инфекции и СПИДа применяют нуклеозидные и ненуклеозидные ингибиторы обратной транскриптазы, ингибиторы вирусной протеазы и лекарственные средства, подавляющие пролиферацию клеток.
• Нуклеозидные и нуклеотидные ингибиторы обратной транскриптазы. Являются конкурентными ингибиторами субстрата обратной транскриптазы. Модифицированные аналоги дезоксинуклеозидов встраиваются в цепь ДНК, делая невозможным дальнейшее её наращивание. Используют следующие препараты и их сочетания: абакавир; абакавир + ламивудин + зидовудин; диданозин; залцитабин; зидовудин; ламивудин; ламивудин + зидовудин; ставудин; фосфазид.
• Ненуклеозидные ингибиторы обратной транскриптазы. Этот тип ингибиторов непосредственно связывается с ферментом и подавляет его ДНК-синтезирующую активность. Невирапин; эфавиренз; делавирдин.
• Ингибиторы вирусной протеазы: ампренавир; индинавир; нелфинавир; ритонавир; саквинавир; атазанавир.
• Ингибиторы слияния вириона с клеткой-мишенью: энфувиртид связывается с gp41, а маравирок (торговое название - селзентри) служит антагонистом хемокинового рецептора CCR5.
• Ингибиторы интегразы: ралтегравир.
• Ингибиторы созревания. Блокируют образование нуклеокапсида. В настоящее время проходят клинические испытания препараты вивекон и бевиримат.
• Препараты, подавляющие синтез ДНК: гидроксикарбамид (гидроксимочевина) сам по себе не является противоретровирусным препаратом и в основном применяется при лечении гематологических онкозаболеваний. Гидроксикарбамид подавляет синтез эндогенных дезоксинуклеозидов и, таким образом, способен усиливать действие нуклеозидных ингибиторов обратной транскриптазы. Используется в комбинации с диданозином и ставудином.
Побочные эффекты химиотерапии. Химиопрепараты имеют весьма существенные побочные эффекты.
• Ингибиторы вирусной протеазы имеют наиболее тяжёлые побочные эффекты: липодистрофия в виде существенного повышения содержания в крови холестерина и абдоминального ожирения, сахарный диабет.
• Нуклеозидные ингибиторы обратной транскриптазы. Типичные побочные эффекты - тошнота, рвота, диарея, головные и абдоминальные боли, сыпь, аллергические реакции.
• Ненуклеозидные ингибиторы обратной транскриптазы. Побочные эффекты те же, что у нуклеозидных ингибиторов; кроме того, велика гепатотоксичность (вплоть до клинического гепатита), вероятны нарушения со стороны ЦНС (головокружение, сонливость, гипнотический транс, галлюцинации, бессонница, сны наяву, ночные кошмары, эйфория или депрессия, мании).
Высокоактивная антиретровирусная медикаментозная терапия
В настоящее время с помощью определённой комбинированной противовирусной химиотерапии можно достичь быстрого снижения репликации ВИЧ в организме и соответственно уменьшения вплоть до неопределимых анализами количеств вирусных РНК в крови на период до года. Такая химиотерапия получила название высокоактивной антиретровирусной медикаментозной терапии - HAART (Highly Active AntiRetroviral Therapy). HAART включает 1 или более ингибитор вирусной протеазы и 2 или более ненуклеозидных ингибитора обратной транскриптазы вируса. Используют и нуклеозидные ингибиторы обратной транскриптазы. HAART назначается пожизненно, так как эта терапия не может удалить провирус, и при её отмене происходит вспышка размножения ВИЧ. И поскольку ВИЧ мутирует и легко образуются резистентные формы (квазивиды ВИЧ), приходится менять комбинацию препаратов. Если человек поддаётся HAART, если ВИЧ подавляется, то появляется надежда, что потом подберут новые препараты, к которым будут чувствительны квазивиды ВИЧ, ставшие резистентными к предыдущей комбинации.
Важно также оценить побочные эффекты HAART. Они ставят врача и пациента перед выбором между прогрессией вирусной инфекции и осложнениями, вызванными побочными эффекта-
ми противовирусных препаратов. Часто организм гораздо легче переносит не столь интенсивный химиотерапевтический удар по вирусу - моноили дитерапию противовирусными лекарственными средствами. Клиническое состояние пациентов в целом при такой противовирусной терапии всё же лучше, чем совсем без лечения. Например, монотерапия зидовудином существенно уменьшает проявления ВИЧ-индуцированной деменции, а у ВИЧ-инфицированных беременных с последующим родоразрешением кесаревым сечением снижает частоту заражения плода и новорождённого до 8% по сравнению с 15-30% при отсутствии лечения. Монотерапия оказывает клинический эффект в течение не более 6-18 мес.
Лечение индикаторных заболеваний
• Пневмония, вызванная одноклеточным грибком Pneumocystis carinii (пневмоцистная пневмония; PCP - Pneumocystis pneumonia). Р. carinii присутствует у 95% населения в возрасте старше 5 лет. Это заболевание развивается у 0,5% ВИЧ-инфицированных в течение 6 мес после снижения у них числа CD4+ T-лимфоцитов в крови до 200-350/мкл. В 8% случаев PCP развивается при снижении этого показателя ниже 200 лимфоцитов на 1 мкл крови. У ВИЧ-инфицированных пневмоцистная пневмония имеет тенденцию манифестировать первой из оппортунистических инфекций. P. carinii не удаётся культивировать in vitro. Диагноз подтверждают микроскопическим обнаружением пневмоцисты в мокроте при окраске метенамином серебра. Поскольку клиническая картина этой пневмонии характеризуется сухим кашлем, мокроту для анализа получают после ингаляции 3% солевого раствора. Лечение. Манифестировавшую пневмонию лечат ко-тримоксазолом, при непереносимости применяют дапсон.
• Токсоплазмоз. Toxoplasma gondii - простейшее, облигатный внутриклеточный паразит. Заболевание манифестирует как фокальный энцефалит. Диагноз ставят по клиническим данным, подтверждают посмертно. Прижизненную биопсию мозга в диагностических целях применяют крайне редко. Летальность не меньше 15%. Лечение: пириметамин, сульфадиазин, клиндамицин. Вторичная профилактика пожизненная.
• Цитомегаловирусная инфекция. У ВИЧ-инфицированных цитомегаловирус поражает разные органы; заболевание манифестирует в виде цитомегаловирусного ретинита, поражения пищеварительного тракта (эзофагит, гастрит, дуоденит, холангит, колит), энцефалита, радикуломиелопатии. Лечение: ацикловир, фоскарнет натрия, фамцикловир.
• Герпесвирусные инфекции - вирус простого герпеса. У ВИЧ-инфицированных часто встречаются герпетические инфекции. Инфекция вирусом простого герпеса манифестирует перорально или генитально, иногда поражает пищевод или вызывает энцефалит. Лечение: ацикловир, фоскарнет натрия, фамцикловир.
• Туберкулёз по летальности занимает второе место в мире среди инфекционных заболеваний. Соответственно он особо опасен для ВИЧ-инфицированных. Диагноз подтверждают микроскопической идентификацией Mycobacterium tuberculosis в мазках из поражённых процессом тканей при окраске по Цилю-Нильсену или высевом возбудителя. Лечение: изониазид, рифампицин, пиразинамид, стрептомицин, этамбутол, тиоацетазон, а также комбинации названных лекарственных средств. Для современных штаммов M. tuberculosis характерна резистентность к антибиотикотерапии. В настоящее время проводят разработки новых препаратов и программ лечения.
• Другие микобактериальные инфекции, как правило, манифестируют у ВИЧ-инфицированных с числом CD4+ T-лимфоцитов в крови меньше 50/мкл. Патогенез инфекционного процесса не изучен. Микобактерии можно высеять из респираторного и пищеварительного трактов. Клинические симптомы: нарастающая лихорадка, ночные поты, потеря массы тела, панцитопения. Без лечения смерть наступает через 3-4 мес. Лечение: кларитромицин, азитромицин.
• Криптококкоз. Дрожжеподобный грибок Cryptococcus neoformans поражает около 10% ВИЧ-инфицированных с числом CD4+ Т-лимфоцитов в крови меньше 200/мкл. Наиболее характерные места локализации поражения - мозговые оболочки и лёгкие. Лабораторно подтвердить диагноз можно при негативном контрастировании криптококков в спинномозговой жидкости. Лечение: флуконазол, амфотерицин В.
• Кандидоз. Орофарингеальные и вагинальные инфекции дрожжевым грибком Candida albicans выявляют у ВИЧ-ин-
фицированных уже при небольшой выраженности синдрома иммунодефицита. Диагноз ставят по данным физикального обследования. Манифестация кандидоза при ВИЧ-инфекции плохой прогностический признак. Лечение: топические и системные противогрибковые антибиотики: амфотерицин В, нистатин, кетоконазол, флуконазол. При тяжёлых или торпидных формах применяют амфотерицин В внутривенно.
• Гистоплазмоз. Заражение диморфным дрожжевым грибком Histoplasma capsulatum у ВИЧ-инфицированных манифестирует в острой или подострой форме с симптомами лихорадки, пневмонии и изъязвления верхних дыхательных путей, спленомегалии, цитопении. Диагноз ставят при обнаружении гистоплазмы в биопсийном материале, мокроте или костном мозге, а также по данным высева гистоплазмы in vitro. Лечение: амфотерицин В, итраконазол.
• Криптоспоридиоз. Cryptosporidium parvum - простейшее. Эта протозойная инфекция поражает эпителий кишки. У ВИЧ-инфицированных обычно манифестирует уже в поздние сроки развития заболевания. Симптомы: боли в животе, частая водянистая диарея, потеря массы тела. Лекарственная терапия не подобрана (симптоматическое лечение).
• Другие инфекционные заболевания органов пищеварения. Для ВИЧ-инфицированных характерны множественные суперинфекции: микроспоридиозы (Enterocytozoon bieneus и Encephalitozoon intestinalis), а также вызываемые микроорганизмами: Salmonella, Shigella, Campylobacter jejuni, Giardia lamblia, Clostridium difficile.
• Бактериальные респираторные инфекционные заболевания. Если бактериальные респираторные заболевания, обусловленные Streptococcus pneumoniae и Haemophilus influenzae, вызывают у человека пневмонию 2 раза в год и более, то это должно насторожить врача в отношении наличия у пациента ВИЧ-инфекции.
• Саркома Капоши. Выявляют полифокальные очаги пролиферации клеток эндотелиального происхождения, локализованные в коже, слизистых оболочках (орофарингеальной области, кишечника), лёгких, печени, лимфатических узлах. Возбудителем считают 8-й тип вируса герпеса. Саркома Капоши в последние годы встречается только у 15% ВИЧ-инфицированных, что
существенно меньше, чем в предыдущие годы. Это объясняют тем, что вирус герпеса типа 8 распространяется преимущественно через гомосексуальные контакты, а доля гомосексуалов среди всех ВИЧ-инфицированных в первые годы пандемии составляла до 90%; в настоящее время она снизилась в связи с распространением эпидемии в других категориях населения. Рост клеток саркомы Капоши зависит от их стимуляции ВИЧ-белком Tat, а также цитокинами ИЛ-1, ИЛ-6 и ФНОа, онкостатином и, возможно, другими факторами. Диагноз кожной формы саркомы Капоши ставят по данным физикального осмотра. Иногда её можно спутать с бациллярным ангиоматозом. Висцеральную форму саркомы Капоши диагностировать труднее. Лечение. Локализованные формы саркомы Капоши хорошо отвечают на радиотерапию и локальную химиотерапию. При генерализованных и висцеральных формах назначают системную химиотерапию блеомицином, винкристином, винбластином, доксорубицином. Эффективен ИФНа в больших дозах (9-36 млн ед. в сутки), но только у пациентов с числом СD4+ T-лимфоцитов в крови, превышающим 200/мкл.
• Неходжкинские лимфомы развиваются, как правило, у пациентов, получающих своевременную и надлежащую антиретровирусную химиотерапию и эффективное лечение оппортунистических инфекций. Продолжительность жизни таких пациентов достаточна для развития лимфом. Практически все лимфомы у ВИЧ-инфицированных B-клеточного происхождения, иммунобластные. Часто это первичная лимфома мозга. При церебральной локализации в клетках лимфомы обнаруживают вирус Эпштейна-Барр в 100% случаев; при периферической локализации (выявляют реже церебральной) - в 50% случаев. Лечение: радио- и химиотерапия (циклофосфамид, винкристин, эпирубицин, преднизолон).
• Чешуйчатая карцинома. Для ВИЧ-инфекции характерна чешуйчатая карцинома шейки матки или прямой кишки, ассоциированная с вирусами папилломы человека. У ВИЧ-инфицированных женщин и мужчин рекомендуют каждые 6 мес проводить исследование (ПЦР-диагностику) на наличие вирусов папилломы человека, в основном 16-го и 18-го онкогенных типов.
• СПИД-ассоциированная деменция. Симптомы этого заболевания имеют преимущественно субкортикальный характер. Их подразделяют на 3 группы:
◊ когнитивные симптомы (снижение способности концентрировать внимание, ухудшение краткосрочной памяти, замедление мыслительных способностей);
◊ моторные симптомы (нарушение координации, ухудшение почерка, нестабильность походки);
◊ изменение поведения (социальная апатия и самоотстранение от общественной жизни).
СПИД-ассоциированная деменция может развиться уже через несколько недель или месяцев после инфицирования. На поздних стадиях заболевание прогрессирует до развития полной деменции с потерей ориентировки, мутизмом, парапарезами, недержанием мочи и кала. Диагноз ставят по физикальным данным. При патологоанатомическом исследовании выявляют атрофию мозга, диффузное и субкортикальное повреждение белого вещества мозга, атрофию серого вещества, реже церебральные васкулиты. Лечение. СПИД-ассоциированная деменция неплохо поддаётся лечению зидовудином в максимально переносимых дозах. Признаки клинического улучшения обычно наступают через 2 мес от начала лечения. Улучшение наступает и в тех случаях, когда доминирующие изоляты ВИЧ у больного резистентны к зидовудину. Зидовудин используют также для первичной профилактики СПИД-ассоциированной деменции.
• Прогрессивная мультифокальная лейкоэнцефалопатия (прионная болезнь) встречается у 4% ВИЧ-инфицированных, преимущественно на поздних стадиях заболевания. Лечение не подобрано.
• Периферическая нейропатия. ВИЧ-ассоциированная периферическая нейропатия - наиболее частая неврологическая патология у ВИЧ-инфицированных (выявляют как минимум у 50%). Проявляется в парестезиях и онемениях сначала стоп, затем кистей. Лечение: капсаицин♠ (мазь), вальпроевая кислота, клоназепам, малые дозы амитриптилина.
• Разные проявления со стороны нервной системы. Возможны невриты и воспалительные демиелинизирующие полинейропатии и нейропатии автономных нервных узлов с соответству-
ющей висцеральной симптоматикой (аритмии, гипотензия, диарея и т.д.), а также асептический менингит во время остро развившегося гриппоподобного синдрома первичной инфекции. Лечение: малые дозы амитриптилина, антиконвульсанты (фенитоин, карбамазепин, клоназепам). У 20% ВИЧ-инфицированных при патологоанатомическом исследовании находят инфаркты в базальных ганглиях мозга.
Лекарственная профилактика
Лекарственная профилактика наиболее часто выявляемых заболеваний при ВИЧ-инфекции представлена в табл. 12-2.
Таблица 12-2. Профилактика оппортунистических инфекций и СПИД-ассоциированной деменции
Иммунотерапия
Под иммунотерапией понимают воздействия, направленные на восстановление функций лимфоцитов, или введение в организм медиаторов иммунного ответа.
• При развившейся ВИЧ-инфекции иммунотерапия не показана. Дело в том, что именно гиперстимуляция иммунной системы самой вирусной инфекцией и приводит к повреждению иммунной системы задолго до того, как скажется прямое цитотоксическое действие вируса на инфицированные лимфоциты. Кроме того, многие факторы иммунитета способствуют усилению репликации вируса (ФНОа, ИЛ-1, ИЛ-6 и др.).
• Вопрос о поддержке регенерации иммунной системы встаёт только в случаях, когда с помощью HAART удалось подавить репликацию ВИЧ до диагностически неопределяемых количеств. Впрочем, у взрослых ВИЧ-инфицированных возможности регенерации иммунной системы после успешной HAART ограничены. Предложена схема стимуляции пролиферации лимфоцитов ИЛ-2 (внутривенные инфузии курсом в течение 5 сут каждые 8 нед), приводящей к заметному повышению числа CD4+ Т-лимфоцитов в периферической крови. Но при этом репертуар TCR остаётся таким, каким он был на момент начала противовирусной терапии, т.е. возможности развития иммунных ответов de novo остаются ограниченными.
• Есть предварительные данные, что иммунное отклонение в пользу Th1 повышает возможности иммунной системы ВИЧ-инфицированных (только после HAART) развивать иммунный ответ на неоантигены.