Хаитов Р.М. Иммунология: учебник / Р.М. Хаитов. - 2-е изд., перераб. и доп. - 2013. - 528 с.: ил.
|
|
|
|
Глава 8. ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ ИММУНИТЕТА
Эффекторные механизмы иммунитета состоят в том, что TCR на поверхности T-лимфоцита и/или иммуноглобулины в растворе физически доставляют связанный антиген к таким клеткам или ферментам, специально предназначенным для расщепления антигена до мелких метаболитов, от которых организм может избавиться через свои системы выделения (почки, пищеварительный тракт).
В соответствии с двумя типами антигенсвязывающих рецепторов выделяют 2 типа эффекторных механизмов.
• Антителозависимый, или гуморальный иммунитет. Осуществляется за счет гуморальных (растворимых) факторов - антител, связывающих антиген и удаляющих его через ряд механизмов: преципитацию, агглютинацию, нейтрализацию, лизис, блокаду и опсонизацию.
• Опосредованный клетками (антителонезависимый), или клеточный иммунитет. Клеточный иммунитет реализуется за счёт клеток иммунной системы, в первую очередь Т-лимфоцитов, а также активированных макрофагов и NK-клеток, непосредственно разрушающих генетически чужеродные клетки, инфицированные вирусами и другими внутриклеточными патогенами клетки, и опухолевые клетки.
АНТИТЕЛОЗАВИСИМЫЕ МЕХАНИЗМЫ ЗАЩИТЫ
Опсонизация и запуск системы комплемента
Само по себе связывание антител с антигеном является защитным, по крайней мере, в двух случаях:
• если антиген - сильный яд, то антитело при связывании нейтрализует его токсичность;
• если антиген представлен на поверхности патогена (вирус, прион, бактерия), то антитело, связав его, препятствует распространению патогена в организме.
Однако и в этих случаях защитная реакция не заканчивается образованием макромолекулярных комплексов антиген-антитело. Эти комплексы необходимо расщепить до мелких метаболитов. Для этого антитела фиксируют и активируют компоненты комплемента (IgM > IgG3 > IgG1). Комплексы антиген-антитело-компоненты комплемента транспортируются эритроцитами, имеющими рецепторы для компонентов комплемента, в синусоиды селезёнки и печени, где их фагоцитируют и расщепят макрофаги.
Fc-рецепторы
FcR - мембранные молекулы, специфически связывающие Fc-фрагменты иммуноглобулинов. Их (наряду с TCR и BCR) можно отнести к иммунорецепторам, так как клетка-носитель FcR способна связать антиген (пусть и посредством антител) и отвечать на него. FcR присутствуют не толко на лимфоцитах, но и на всех известных лейкоцитах.
Типы и разновидности FcR. По изотипу связываемых тяжёлых цепей иммуноглобулинов выделяют 4 разновидности FcR: γ, ε, α, μ; а по аффинности связи с лигандом - 3 типа FcR: I, II и III. FcR типа I способны связывать свободные молекулы антител (это особенно характерно для IgE), FcR типов II и III - только комплексы антиген-антитело.
Антителозависимая клеточная цитотоксичность
Феномен антителозависимой клеточной цитотоксичности (АЗКЦТ) имеет место, когда антитело связывает антиген на по-
верхности какой-либо клетки-мишени и через Fc-фрагмент привлекает для её разрушения эффекторные клетки (NK-клетки, макрофаги, эозинофилы и др.).
• Естественные киллеры. NK-клетки имеют рецептор (FcγRIII) для Fc-фрагментов IgG. Механизм собственно киллерного действия NK на клетку-мишень такой же, как и киллерный механизм ЦТЛ - перфорин-гранзимовый (см. рис. 1-4 и рис. 6-4).
• Эозинофилы. Механизм санации от гельминтов - это тоже антителозависимая клеточная цитотоксичность (АЗКЦТ), где в качестве эффекторных клеток выступают эозинофилы, имеющие низкоаффинные рецепторы для IgE - FcεRII и для IgA - FcaRII. Связывание этих рецепторов с лигандами в сочетании с сигналом от цитокина ИЛ-5 стимулирует синтез и секрецию эозинофилом высокотоксичных белков, направленных на уничтожение гельминтов. Другими словами, активированный эозинофил секретирует ряд биологически активных веществ, свойства которых объясняют симптоматику так называемых эозинофильных воспалительных процессов (табл. 8.1).
Таблица 8-1. Биологически активные продукты эозинофилов
Гиперчувствительность немедленного типа
Сосудистые и миоконстрикторные реакции, опосредованные медиаторами тучных клеток и базофилов, приводят к развитию гиперчувствительности немедленного типа (ГНТ).
Базофильные лейкоциты и тучные клетки. В этих реакциях антитела вовлекают в ответ базофилы и тучные клетки. Существенные функциональные признаки этих клеток схожи: наличие на мембране высокоаффинного рецептора для IgE (FcεRI) и одинаковый набор биологически активных медиаторов.
• Тучные клетки локализованы в соединительной ткани собственного слоя слизистых оболочек, в подкожной соединительной ткани и соединительной ткани, расположенной по ходу всех кровеносных сосудов. Выделяют, по крайней мере, 2 тканевые разновидности тучных клеток.
- Тучные клетки слизистой оболочки из сериновых протеаз экспрессируют триптазу и химазу, секретируют минимум гистамина; из протеогликанов в них преобладает хондроитинсульфат; из метаболитов арахидоновой кислоты - лейкотриен C4 (LTC4). По-видимому, дифференцировка этих клеток зависит от T-лимфоцитов, а именно от местной стимуляции клеток-предшественников цитокином ИЛ-3.
- Тучные клетки соединительной ткани локализованы в серозных оболочках полостей тела и в лёгких. Из сериновых протеаз экспрессируют преимущественно триптазу, из протеогликанов - гепарин, секретируют много гистамина, из метаболитов арахидоновой кислоты в них преобладает простагландин D2. Дифференцировку этих тучных клеток стимулируют фибробласты.
• Базофилы циркулируют в крови и мигрируют в ткани только в очаг воспаления (как нейтрофилы). На базофилах экспрессированы молекулы адгезии, важные для хоминга в очаг: LFA-1 (CD11a/CD18), Mac-1 (CD11b/CD18), CD44.
Активация. Сигналы, активирующие и тучные клетки, и базофилы.
• Гомотипная агрегация FcεRI (активируются комплексом IgE с антигеном или антителами к рецептору); FcεRI способен связывать свободные IgE-антитела (до того как они свяжут свой антиген). Клетки с комплексом IgE-FcεRI на мембране находятся в состоянии готовности в считанные секунды и минуты осуществить дегрануляцию в ответ на распознавание поступившего антигена (рис. 8-1).
• Анафилатоксины - активированные компоненты комплемента (C5a > C4a > C3a).
• Медиаторы из активированных нейтрофилов.
• Нейромедиаторы (норадреналин, вещество Р).
Медиаторы тучных клеток и базофилов различны по биохимическим свойствам, предназначению и срокам выброса из активированной тучной клетки. Медиаторы, депонируемые в гранулах, первыми выбрасываются из клетки в ответ на активирующий сигнал. Другие медиаторы синтезируются de novo и вступают в процесс позже.
• Гистамин. На разных клетках есть различные рецепторы для гистамина - Н1, Н2 и Н3. Гистамин проявляет различные вазоактивные эффекты: эндотелиальные клетки претерпевают
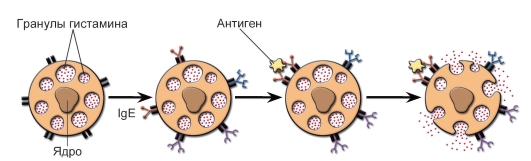
Рис. 8-1. Дегрануляция тучных клеток. На поверхности тучных клеток молекулы IgE связаны Fc-рецепторами. Антиген взаимодействует с Fab-фрагментами IgE. Активированная этим сигналом тучная клетка подвергается дегрануляции
констрикцию, и сыворотка выходит из сосуда в ткани; гистамин стимулирует синтез в клетках эндотелия простациклина и радикала оксида азота (NO), вызывающих расслабление гладких мышц сосудистой стенки и, следовательно, вазодилатацию.
- Если процесс происходит в коже, то клинически он проявляется в виде волдырей и покраснения (крапивница). В случае аллергической патологии снять симптомы помогают лекарственные средства - блокаторы Н1-рецепторов гистамина.
- Если гистамина выделяется достаточно много, то он вызывает клинически значимые сокращения гладких мышц кишки (перистальтику) и бронхов (бронхоспазм), однако этот эффект непродолжителен, поскольку гистамин быстро распадается во внеклеточной среде.
• Липидные медиаторы. При стимуляции тучных клеток в них активируются ферменты метаболизма липидов, а именно фосфолипаза А2. Этот фермент использует в качестве субстратов фосфолипиды клеточных мембран и липиды (в первую очередь арахидоновую кислоту). В результате образуются биологически активные медиаторы.
- Простагландин D2 - действует как вазодилататор и бронхоконстриктор. В биосинтезе простагландина D2 из арахидоновой кислоты участвует циклооксигеназа. Фармакологическими ингибиторами этого фермента служат ацетилсалициловая кислота и другие НПВС.
- Лейкотриены (LTC4, LTD4, LTE4) - альтернативные продукты метаболизма арахидоновой кислоты, образуемые под воздействием 5-липооксигеназы. Комплекс лейкотриенов - медленно реагирующий компонент анафилаксии. Именно этот комплекс медиаторов в наибольшей мере ответственен за бронхоконстрикцию при бронхиальной астме. Это объясняет усугубление астматических приступов ацетилсалициловой кислотой: блокируя синтез простагландина D2, ацетилсалициловая кислота высвобождает метаболический шунт арахидоновой кислоты в пользу лейкотриенов.
- Фактор активации тромбоцитов (ФАТ) вызывает бронхоконстрикцию, а также релаксацию гладких мышц сосудов и ретракцию эндотелия. ФАТ продуцируют не только (а может
быть и не столько) тучные клетки, сколько клетки эндотелия, стимулированные гистамином и лейкотриенами.
- Ферменты тучных клеток и базофилов [сериновые протеазы (триптаза и химаза), катепсин G, карбоксипептидаза] способствуют перестройке матрикса соединительной ткани.
- Цитокины тучных клеток и базофилов. К ним относят интерлейкины, GM-CSF и др.
Гиперчувствительность немедленного типа (ГНТ). Цитокины тучных клеток и базофилов поддерживают иммунное отклонение в дифференцировке субпопуляций CD4+ T-лимфоцитов в пользу Th2 (ИЛ-4, ИЛ-13), а также поддерживают дифференцировку и активацию эозинофилов (ИЛ-5, ИЛ-3, GM-CSF). В случае патологии именно эти клетки (Th2, тучные клетки, базофилы, эозинофилы) и IgE составляют самоподдерживающийся ансамбль, ответственный за реакции ГНТ. Мишени для цитокинов - клетки гладкой мускулатуры и эндотелия (следовательно, сосуды, бронхи, органы пищеварения). Системная реакция ГНТ - анафилактический шок (АШ).
Реликтовые свойства антител
Помимо связывания антигенов, компонентов комплемента и FcR, молекулы иммуноглобулинов имеют ещё несколько свойств (видимо, унаследованных от каких-то предковых белков).
• Каталитическая (пептидазная) активность - в некоторых случаях антитела сами расщепляют специфичный антиген, функционируя как протеазы.
• Способность связывать нуклеотиды выявлена у доменов VL и VH: пуриновое кольцо связывается с остатками триптофана и тирозина. При этом связи с нуклеотидами могут не мешать связыванию антигена в антигенсвязывающем центре. Некоторые антитела, связывающие нуклеиновые кислоты, обладают способностью расщеплять полинуклеотиды (ДНКазная активность).
• Способность связывать металлы (например, ртуть, цинк, свинец). Это свойство антител может иметь отношение к патогенезу заболеваний: антитела, связывая жизненно необходимые ионы металлов-микроэлементов, вызывают дефицит этих металлов во внутренней среде. Подобные предположения воз-
никли в отношении склеродермии и антител, связывающих свинец.
• Способность связывать суперантигены. Свойства суперантигенов для иммуноглобулинов описаны для трёх веществ: белка А стафилококка (SpA), gp120 ВИЧ-1 и кишечного сиалопротеина. Один такой суперантиген может связать более 80% всех иммуноглобулинов крови, при этом иммуноглобулин теряет способность связывать свой специфический антиген. Считают, что таков один из компонентов патогенеза иммунодефицита при ВИЧ-инфекции.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ, ОПОСРЕДОВАННЫЕ КЛЕТКАМИ
Антителонезависимые эффекторные механизмы иммунитета в первую очередь реализуют ЦТЛ. К ним в основном относят CD8+ Tαβ-лимфоциты и NKT-клетки (лимфоциты, одновременно экспрессирующие рецепторы NK- и Т-клеток). Есть T-киллеры и среди Tγδ-лимфоцитов.
Главное назначение ЦТЛ - санация организма от внутриклеточных патогенов, опухолевых и других изменённых клеток, реализуемая киллерной функцией ЦТЛ и цитокинами.
• Киллерная функция. ЦТЛ осуществляют киллерную функцию (см. рис. 1-4 и рис. 6-4) с помощью особых белков - цитотоксинов, к которым относят перфорин, гранзимы и недостаточно изученный цитолизин.
- Синтез цитотоксинов происходит de novo после вовлечения ЦТЛ в иммунный ответ и распознавания ими специфического антигена.
- Накопление цитотоксинов. В виде функционально неактивных молекул-предшественников цитотоксины накапливаются в гранулах, которые сконцентрированы вблизи TCR.
- Дегрануляция ЦТЛ происходит в области межклеточного контакта, образующегося при связывании TCR с антигеном на поверхности клетки-мишени. Этот процесс облигатно зависит от Ca2+.
- Перфорин накапливается в гранулах в виде растворимого предшественника. При высвобождении из гранул и в при-
сутствии Ca2+ перфорин быстро полимеризуется в мембране клетки-мишени, образуя цилиндрическую структуру. При этом липофильные участки молекул перфорина ориентируются в сторону клеточной мембраны, а гидрофильные - в сторону канала внутрь клетки. В результате образуется пора диаметром около 16 нм.
- Гранзимы и апоптоз. Через пору, образованную перфорином, внутрь клетки-мишени попадают выделенные ЦТЛ гранзимы. Охарактеризовано 3 гранзима ЦТЛ - А, В и С. Это специализированные сериновые протеазы, субстратами которых служат ферменты, инициирующие в клеткемишени программу апоптоза. При этом происходит разрушение ДНК и белков не только клетки, но и инфицировавшего её вируса.
- Лизис мишени. Если в механизмах апоптоза клетки-мишени есть какие-либо дефекты, ЦТЛ всё равно разрушает клетку - путём осмотического лизиса через сформированные перфорином поры. Однако в этом случае неповреждённые вирусные частицы и нуклеиновые кислоты могут инфицировать другие клетки, что и происходит в случае некоторых инфекций.
• Цитокины. CD8+ ЦТЛ продуцируют цитокины - ИФНγ, ФНОα и ФНОβ (лимфотоксин). В частности, ИФНγ проявляет следующие эффекты:
- непосредственно подавляет репликацию вирусов;
- индуцирует в клетках-мишенях повышенную экспрессию молекул MHC-I и MHC-II, способствуя более эффективной презентации вирусных антигенов T-лимфоцитам (и для распознавания, и для киллинга);
- активирует макрофаги и NK-клетки;
- наконец, ИФНγ - кофактор индукции дифференцировки наивных CD4+ T-лимфоцитов в Th1-клетки, а последнее означает, что CD8+ ЦТЛ вносят вклад в развитие других эффекторных механизмов иммунного ответа (с участием Th1-лимфоцитов).
ГИПЕРЧУВСТВИТЕЛЬНОСТЬ
ЗАМЕДЛЕННОГО ТИПА
Гиперчувствительность замедленного типа (ГЗТ) - воспаление тканей, «организуемое» CD4+ T-лимфоцитами субпопуляции Th1 - продуцентами ИФНу. Клетками-исполнителями служат активированные макрофаги. Если макрофаг в очаге инфекции активирован при взаимодействии с CD4+ Th1-лимфоцитом, то микробицидные возможности макрофага существенно увеличиваются и активированный макрофаг с большей вероятностью разрушит патогены (к сожалению, в макрофаге погибают не все патогены, особенно жизнеспособны вирусы, например, ВИЧ, а также микобактерии).
Активация макрофага. Для активации макрофага необходимы 2 типа воздействия со стороны лимфоцитов:
• контактное - молекула CD40L на Th1-лимфоците вступает в связь с молекулой CD40 на макрофаге;
• цитокиновое - ИФНγ, продуцируемый Th1-клеткой, CD8+ ЦТЛ или NK-клеткой, связывает рецептор на макрофаге;
• инфицированный макрофаг имеет больше шансов вступить во взаимодействие с Th1-клеткой, обусловленное распознаванием Т-клеткой антигена на поверхности макрофага. В результате именно этот макрофаг получит активирующие сигналы от Т-клетки через интерферон и CD40L.
Ингибитор активации макрофагов - ИЛ-10.
Характеристики активированного макрофага. Макрофаг, активированный взаимодействием с Th1-клеткой, приобретает следующие признаки и функциональные способности.
• Увеличивается число рецепторов FcγR,припомощикоторых макрофаг связывает комплексы антиген-антитело и фагоцитирует их.
• ИФНу в макрофагах индуцирует биосинтез ферментов, генерирующих радикалы активных форм кислорода, которые окисляют фагоцитированный антиген.
• В макрофагах под воздействием ИФНγ,ФНОα и,возможно, ИЛ-1 индуцируется экспрессия NO-синтазы, продуцирующей радикал NO*, который также окисляет фагоцитированный материал.
• В макрофагах индуцируется синтез липидных медиаторов воспаления - ФАТ, простагландинов и лейкотриенов (LTE4).
• Макрофаг синтезирует тканевой фактор коагуляции. В начавшемся процессе коагуляции активируется сывороточный тромбин - протеаза, стимулирующая клетки эндотелия сосудов, а также нейтрофилы к синтезу ФАТ, что ещё больше способствует прогрессированию воспалительного процесса.
• ИФНγ служит самым сильным из известных индукторов синтеза и экспрессии молекул MHC-II. Кроме того, на активированных макрофагах (в отличие от неактивированных) индуцируется экспрессия костимуляторной молекулы B7, что делает активированные макрофаги более эффективными АПК. Кроме того, на активированных макрофагах возрастает экспрессия молекул адгезии ICAM-1 и LFA-3.
• Активированные макрофаги продуцируют ИЛ-12, способствующий дифференцировке Th1-лимфоцитов.
Очаг воспаления. Цитокины активированных макрофагов - ФНОα, ИЛ-1 и хемокины - создают очаг воспаления в виде плотных на ощупь узелков разного размера (симптом индурации). Плотность очага обусловлена выпотом из сосудов фибриногена и полимеризацией его в фибрин. Среди клеток, присутствующих в очаге, в первые 6-8 ч преобладают нейтрофилы, затем макрофаги и Th1-лимфоциты. Плотность клеток в свежем очаге ГЗТ невелика.
Сроки развития реакции. ГЗТ названа так, поскольку между моментом проникновения антигена в ткань и развитием характерного очага плотного воспаления проходит не менее 24-48 ч. После связывания антигена Th1-клетке требуется примерно 1 ч для индукции биосинтеза цитокинов, а также синтеза и экспрессии на мембране молекулы CD40L.
Эффекты факторов роста. Среди цитокинов, продуцируемых активированными макрофагами, присутствуют факторы роста, что может значительно изменить состояние прилегающих к очагу тканей. Стандартная защитная реакция - развитие очага воспаления по типу ГЗТ, но в патологических случаях цитокины, выделяемые активированными макрофагами, вызывают фиброзное перерождение тканей: тромбоцитарный фактор роста PDGF (PlateletDerived Growth Factor) стимулирует пролиферацию фибробластов, а вырабатываемый CD4+ T-лимфоцитами и макрофагами ТФР-β стимулирует синтез коллагена. Кроме того, факторы роста, вырабатываемые макрофагами, вызывают образование дополнительных кровеносных сосудов - ангиогенез.