Хаитов Р.М. Иммунология: учебник / Р.М. Хаитов. - 2-е изд., перераб. и доп. - 2013. - 528 с.: ил.
|
|
|
|
Глава 4. ИММУННЫЙ ОТВЕТ
Не всегда врождённые механизмы иммунитета достаточны для защиты организма. В таких случаях начинается развитие приобретённого (адаптивного) иммунного ответа.
Приобретённый иммунный ответ - многоэтапный ответ с обязательным участием лимфоцитов и других клеток иммунной системы.
Основные задачи иммунного ответа:
• распознавание лимфоцитами антигена (например, патогена) или клеток, модифицированных антигеном (например, вирусами);
• деструкция патогена и повреждённых клеток;
• элиминация (выведение) продуктов деструкции из организма.
ПРИЗНАКИ АДАПТИВНОГО
ИММУННОГО ОТВЕТА
• Клоны лимфоцитов. Лимфоциты - единственный тип клеток в организме, при дифференцировке которых происходит обязательная соматическая рекомбинация ДНК в генах, кодирующих антигенраспознающие рецепторы. Таким образом, в организме непрерывно генерируется беспрецедентное разнообразие клонов лимфоцитов по антигенраспознающим рецепторам - 1018 вариантов у T-лимфоцитов и 1016 вариантов у B-лимфоцитов.
• Связывание антигенраспознающего рецептора лимфоцита с лигандом необходимо, но ещё недостаточно для инициации иммунного ответа.
• Корецепторы. Помимо антигенраспознающего рецептора, на мембране лимфоцитов есть инвариантные, но строго необходимые для развития иммунного ответа корецепторы.
• Для инициации иммунного ответа лимфоциту необходимо получить сигналы по «двум каналам» - от рецепторов для антигена и от корецепторов.
• Дополнительные активирующие сигналы через корецепторы поступают в лимфоциты от АПК (ДК, макрофагов, покровного эпителия и др.) и их биологически активных продуктов.
• Клетки воспаления не имеют большого разнообразия рецепторов. Их рецепторы инвариантны, консервативны, кодируются зародышевыми генами, но именно эти рецепторы первыми избирательно связывают продукты микроорганизмов, не характерные для макроорганизмов. Следовательно, именно рецепторы клеток воспаления - «носители эволюционной памяти», именно они первыми отличают «чужое» от «своего» и информируют лимфоциты о факте проникновения «чужого» во внутреннюю среду.
• Лимфоцит при инициации иммунного ответа распознаёт антиген и связывает лиганд в лимфоидных органах, под влиянием стимулирующих и костимулирующих сигналов активируется и обязательно пролиферирует. В-лимфоцит додифференцируется в лимфоидных органах в плазматические клетки, которые вырабатывают антитела, специфичные к антигену, местно либо мигрируют в костный мозг, где происходят те же самые процессы. Сенсибилизированные Т-лимфоциты (как и В-лимфоциты) мигрируют в очаг поражения в ткани (выходят из крови), где разрушают инфицированные клетки, либо выделяют цитокины, вовлекающие в эту деструкцию макрофаги, эозинофилы, NK-клетки и другие лейкоциты.
ЭТАПЫ РАЗВИТИЯ ИММУННОГО ОТВЕТА
• Началом процесса служит проникновение антигена во внутреннюю среду организма. В природе это происходит при повреждении покровных тканей. При этом в них выделяются определённые вещества (стресс-протеины, белки теплового шока, цитокины кератиноцитов и клеток соединительной ткани) - медиаторы воспаления, которые и «подготавливают
почву» для развития адаптивного иммунного ответа (если это потребуется). Попадание антигена без значимого нарушения целостности покровов сразу во внутреннюю среду - событие редкое. Чаще это происходит при искусственных вмешательствах: парентеральном введении веществ или трансплантации тканей и органов. • Врождённые защитные реакции в отношении антигенов направлены на то, чтобы не пропустить антигены глубже покровных тканей. В первую очередь это сосудистые реакции: расширение сосудов микроциркуляторного русла, повышенный выпот из сосудов в ткани плазмы или сыворотки (соответственно всех сывороточных неспецифических противоинфекционных факторов) и экстравазация лейкоцитов (прежде всего, фагоцитов-нейтрофилов). Локальный отёк препятствует всасыванию антигенов в системную циркуляцию.
◊ Проникший в покровы патоген поглощают эндоцитозом или фагоцитозом ДК и/или макрофаги. И те, и другие - профессиональные АПК, но только ДК обладают особыми свойствами и мигрируют из покровов (вместе с антигенами) в региональные лимфоидные органы. ДК процессируют антигены, проходят этапы созревания, экспрессируют на мембране комплексы пептидов с молекулами MHC-II и необходимые корецепторные молекулы, с помощью которых они могут эффективно взаимодействовать с T-лимфоцитами в T-зависимых зонах периферических лимфоидных органов.
◊ Кроме АПК, в покровных тканях с антигенами контактируют внутриэпителиальные лимфоциты, среди которых много γδT-клеток, распознающих непептидные антигены без предварительной презентации АПК. Под покровными тканями в плевральной и брюшной полостях присутствуют В1-лимфоциты, продуцирующие антитела с широкой перекрёстной реактивностью, специфичные в основном к распространённым бактериальным антигенам и аутоантигенам.
◊ Не «перехваченный» в барьерных тканях антиген может поступить непосредственно в системную циркуляцию. Тем не менее иммунный ответ на него ещё может развиться, поскольку АПК (ДК и макрофаги) присутствуют и в си-
нусоидах селезёнки, через которую проходит весь объём крови.
• В T-зависимых зонах лимфатических узлов ДК презентируют антигены (в комплексе с MHC-II) интенсивно мигрирующим T-лимфоцитам. Среди T-лимфоцитов рано или поздно найдётся клетка с рецептором, специфичным к данному антигену. Если при этом состоятся все необходимые и достаточные корецепторные взаимодействия с АПК, то T-лимфоцит получит активационный сигнал, и с этого момента начнётся собственно антигенспецифичный иммунный ответ.
◊ Двойное распознавание - процесс распознавания фрагментов пептидного антигена, в комплексе с молекулами МНС-I (CD8+ ЦТЛ) или МНС-II (CD4+ Т-хелпером). При этом Т-лимфоциты инициируют иммунный ответ против распознанного антигена, презентированного АПК в комплексе со «своими» молекулами MHC-II или против клеток собственного организма, несущих вирусные или изменённые свои пептиды в комплексе с MHC-I.
• Распознавший антиген T-лимфоцит начинает пролиферировать и дифференцироваться. В результате образуется клон дифференцированных антигенспецифичных T-лимфоцитов. Такие T-клетки называют лимфоцитами-эффекторами. В процессе дифференцировки T-лимфоциты экспрессируют в надлежащем количестве мембранные молекулы и секретируют цитокины, необходимые для взаимодействия с B-лимфоцитами, лейкоцитами или для атаки клеток-мишеней.
• В T-зависимых зонах периферических лимфоидных органов происходит взаимодействие активированных антигеном T-лимфоцитов с активированными антигеном B-лимфоцитами.
• Провзаимодействовавшие с антигеном и с T-клетками B-лимфоциты мигрируют в зону лимфоидного фолликула, где пролиферируют и дифференцируются в антителопродуценты - плазматические клетки.
◊ Первые плазматические клетки остаются в лимфатическом узле. Секретируемые ими антитела в значительном количестве связываются рецепторами для Fc-фрагмента антител (FcR) ФДК и в таком виде способны в течение продолжи-
тельного времени удерживать антиген в лимфоидном фолликуле.
◊ Остальные плазматические клетки уходят из фолликулов лимфоидных органов и мигрируют преимущественно в костный мозг или слизистые оболочки, где и осуществляют массовое образование антител, секретируя их в кровь или во внешнюю среду.
• Активированные Т-лимфоциты (ЦТЛ, Th1, Th2) выходят из региональных лимфатических узлов через эфферентные лимфатические сосуды, попадают в системную циркуляцию, а оттуда - в очаг воспаления в месте проникновения или диссеминации патогена.
• Если T-лимфоцит в очаге воспаления находит и связывает свой антиген, то он начинает усиленно синтезировать и секретировать эффекторные молекулы - цитотоксины, непосредственно вызывающие гибель клеток-мишеней, или цитокины, вовлекающие в деструкцию антигена те или иные лейкоциты (макрофаги, эозинофилы, тучные клетки, базофилы, нейтрофилы).
• В эффекторной фазе иммунного ответа связанный антиген подвергается фагоцитозу и разрушению гидролитическими ферментами, кислородными радикалами и радикалами оксида азота до мелких метаболитов, выводимых из организма через почки и пищеварительный тракт.
• Если организм санирован от патогена/антигена - первый результат достигнут. После этого в норме происходит остановка продуктивного иммунного ответа - так называемая супрессия.
• Второй результат адаптивной иммунной реакции - иммунологическая память. По современным представлениям лимфоцитами иммунологической памяти становится незначительная часть покоящихся лимфоцитов (вероятно, порядка единиц процентов), экспрессирующих особые, ингибирующие активацию молекулярные структуры.
МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ КЛЕТОК В ХОДЕ ИММУННОГО ОТВЕТА
При развитии иммунного ответа разные клетки взаимодействуют друг с другом. Известны как минимум 2 механизма такого взаимодействия:
• адгезия клеток: мембранные молекулы одной клетки комплементарно связываются с мембранными молекулами другой клетки, что приводит к межклеточному контакту;
• взаимодействие при помощи медиаторов: клетка секретирует особые растворимые молекулы (медиаторы), рецепторы к которым присутствуют на мембранах других клеток. При связывании рецептора с лигандом реализуется тот или иной биологический эффект. Медиаторы, участвующие в развитии иммунного ответа, называют цитокинами и хемокинами.
Молекулы межклеточной адгезии
К молекулам межклеточной адгезии относят селектины, адрессины, интегрины, молекулы суперсемейства иммуноглобулинов и ряд других.
• Селектины - трансмембранные белки на поверхности лимфоцитов, лейкоцитов, тромбоцитов и эндотелиоцитов. Общим для них является наличие во внеклеточной части лектиноподобного домена, способного комплементарно связывать сахара.
• Адрессины - муциноподобные молекулы на мембране эндотелиоцитов - лиганды для селектинов. Селектины и адрессины обеспечивают селективную адгезию клеток к стенке сосуда, необходимую для их экстравазации и дальнейшего проникновения в очаг поражения.
• Интегрины - гетеродимерные белки, состоящие из крупной а-цепи и меньшей по размеру р-цепи.
◊ LFA-1 (Lymphocyte Function-Associated antigen - антиген, ассоциированный с функцией лимфоцитов) - наиболее важный интегрин для активации любого T-лимфоцита, так как антитела к LFA-1 способны блокировать активацию как наивных, так и покоящихся T-клеток. Однако анализ врождённых генетических дефектов молекул адгезии пока-
зывает, что другие интегрины (например, CD2) способны компенсировать отсутствие LFA-1.
◊ VIA (Very Late Activation antigens - очень поздние антигены активации). Эти интегрины экспрессируются T-лимфоцитами на 2-4-е сутки после активации и имеют наибольшее функциональное значение для проникновения уже стимулированной T-клетки в очаг воспаления, где ей надлежит организовать элиминацию антигена.
• ICAM (InterCellular Adhesion Molecules - молекулы межклеточной адгезии) относят к суперсемейству иммуноглобулинов.
◊ Взаимодействие молекул адгезии LFA-3 и ICAM-1 на клетках эпителия тимуса с комплементарными им молекулами CD2 и LFA-1 на тимоцитах необходимо для удержания последних в тимусе в процессе их дифференцировки.
◊ Наивные T-лимфоциты в T-зависимых зонах периферических лимфоидных органов взаимодействуют с АПК при помощи LFA-1, CD2 и ICAM-3 на T-клетках и ICAM-1, ICAM-2, LFA-1 и LFA-3 на АПК. Этого взаимодействия достаточно для запуска пролиферации распознавших антиген T-лимфоцитов и дифференцировки их в лимфоцитыэффекторы.
Данные по отдельным молекулам адгезии приведены в табл. 4-1. Таблица 4-1. Молекулы адгезии клеток
Цитокины
Взаимодействия, опосредованные цитокинами, более динамичны и оперативны, чем адгезивные. Для цитокинов характерны общие свойства.
• Разные типы клеток могут продуцировать одноимённые цитокины и экспрессировать рецепторы для них.
• Действие цитокинов избыточно, «многословно», «чрезмерно». С одной стороны, разные цитокины могут вызывать внешне одинаковые реакции клеток, с другой - каждый цитокин индуцирует в разных клетках различные биологические эффекты.
• Цитокины в подавляющем большинстве случаев - близкодействующие медиаторы, обусловливающие локальные взаимодействия клеток в очагах развития процессов в тканях.
◊ В зависимости от клетки-мишени выделяют аутокринные эффекты (действуют на саму клетку, секретировавшую цитокин) и паракринные эффекты (действуют на другие рядом расположенные клетки) цитокинов.
◊ Эндокринные (дистантные, или системные) эффекты проявляются, когда цитокин достигает клетки-мишени, циркулируя с кровью. У здоровых людей в крови обычно удаётся обнаружить множество различных цитокинов, включая интерфероны, но в концентрациях, не превышающих несколько пикограмм (10-12 г) в миллилитре. Системное действие выявлено в основном для четырёх цитокинов: ФНОα, ИЛ-1, ИЛ-6 и M-CSF при тяжёлой патологии типа септического шока и опосредовано через гипоталамус и печень.
• Большинство цитокинов не депонируется в клетках, а синтезируется импульсно («по запросу»), начиная с транскрипции мРНК цитокина с соответствующего гена. Хотя небольшие количества ФНОα или других цитокинов могут депонироваться в гранулах нейтрофилов, тромбоцитов и тучных клеток.
• Матричная РНК цитокинов - короткоживущая, что объясняет транзиторный характер их продукции клеткой: они вырабатываются вскоре после получения «запроса» на их продукцию, но непродолжительное время.
• Каскадность действия цитокинов выражается в том, что под влиянием одного цитокина клетка может начать вырабаты-
вать другие (или тот же самый). Это приводит к усилению биологических эффектов.
• Каскад цитокинов саморегулируется - клетка, начавшая продуцировать активационные цитокины, через несколько часов или суток переключается на синтез супрессорных цитокинов и/или экспрессирует ингибиторные рецепторы либо рецепторы для сигналов к апоптозу.
По функциональному назначению выделяют 5 основных групп цитокинов.
• Гемопоэтические цитокины регулируют пролиферацию и дифференцировку всех клеток кроветворной системы. К ним относят колониестимулирующие факторы - CSF (Colony Stimulating Factors) для гранулоцитарно/моноцитарной клеткипредшественника (GM-CSF), для предшественника моноцитов (M-CSF), для предшественника гранулоцитов (G-CSF); эритропоэтин, тромбопоэтин, ИЛ-3 (мульти-CSF), ИЛ-5 (CSF для эозинофилов), ИЛ-7 (CSF для лимфоцитов), фактор стволовых клеток - SCF (Stem Cell Factor, его второе название «c-kit-лиганд»). К гемопоэтинам относят и ИЛ-1а (второе название - гемопоэтин-1), так как он поддерживает рост самых ранних клеток-предшественников кроветворения. Негативные регуляторы гемопоэза - ФНОа и трансформирующий фактор роста β (ТФРβ). Хемокин MIPα ингибирует ранние клетки-предшественницы гемопоэза.
• Первичные провоспалительные цитокины (цитокины врождённого иммунитета) - ИЛ-1α, ИЛ-1β, ФНОα и ИЛ-6. Они чрезвычайно плейотропны и действуют на клетки близлежащих тканей. Их продуцируют главным образом макрофаги и ДК покровных структур в очаге внедрения патогена. ИЛ-1 и ФНОа действуют преимущественно локально (если нет септического заражения крови), а ИЛ-6 индуцирует биосинтез белков острой фазы в печени.
• Иммунорегуляторные цитокины - регулируют пролиферацию и дифференцировку T- и B-лимфоцитов и NK-клеток в периферических лимфоидных органах и тканях. В первую очередь их продуцируют активированные профессиональные АПК (макрофаги и ДК) и сами лимфоциты. К этой группе относят ИЛ-2 (митоген для лимфоцитов), ИЛ-4, ИЛ-12, ИЛ-15, ИФНγ.
• Цитокины - медиаторы воспаления, являются продуктами активированных T-лимфоцитов и вызывают активацию лейкоцитов общевоспалительного назначения: ИФНγ (активатор макрофагов и NK-клеток), ИЛ-5 (стимулирует пролиферацию В-лимфоцитов, а также индуцирует и активирует эозинофилы); лимфотоксины (активаторы нейтрофилов), в частности лимфотоксин-α (ФНОР), обеспечивающий образование воспалительных гранулём in vivo.
• Противовоспалительные (иммуносупрессорные) цитокины. К ним относят ИЛ-10 (продуцируемый макрофагами и ингибирующий макрофаги) и ТФРβ (продуцируемьгй активированными CD4+ T-лимфоцитами и ингибирующий дальнейшую пролиферацию лимфоцитов). Кроме того, ИЛ-4 и ИЛ-13 - цитокины, ингибирующие макрофаги, а также в некоторых процессах выступающие в качестве противовоспалительных.
В табл. 4-2 приведена краткая характеристика некоторых цитокинов.
Таблица 4-2. Функции цитокинов
AICD (Activation-Induced Cell Death) - индуцированная активацией смерть клеток. LIF (Leukemia Inhibitory Factor) - фактор подавления лейкоза.
MIF (Macrophage migration Inhibitory Factor) - фактор подавления миграции макрофагов.
Хемокины
Среди цитокинов особое значение для иммуногенеза и модуляции воспаления имеют так называемые хемокины - небольшие (66-76 аминокислотных остатков) секреторные белки, регулирующие миграцию лейкоцитов. Кроме того, большинство хемокинов поддерживает ангиогенез и продукцию коллагенов клетками соединительной ткани (регенерацию). В настоящее время известно не менее 50 хемокинов, в том числе многие факторы хемотаксиса моноцитов и ИЛ-8. Считают, что при соответствующих условиях любая клетка организма продуцирует те или иные хемокины. Хемокины способны связываться не только со своими лигандами на мембране клетки-мишени, но и с молекулами межклеточного матрикса, создавая в нём градиент концентрации по мере приближения к клетке-продуценту хемокина.
Эти хемоаттрактанты имеют структурное сходство, в том числе в расположении остатков цистеина, образующих дисульфидные мостики. На основании расположения первых двух цистеиновых остатков хемокины подразделяют на 4 семейства: CC, CXC, C и CX3C.
В табл. 4-3 приведена краткая характеристика некоторых известных на сегодняшний день хемокинов.
Таблица 4-3. Некоторые хемокины
BLC (В Lymphocyte Chemoattractant) - хемоаттрактант В-лимфоцитов.
СТАСК (Cutaneous Т-cell-Attracting ChemoKine) - хемокин, привлекающий Т-лимфоциты кожи. DC-CK1 (Dendritic Cell-specific ChemoKine) - хемокин, специфичный для ДК.
ELR - триплет глутамат-лейцин-аргинин, который присутствует (+) или отсутствует (-) перед первым инвариантным остатком цистеина.
ENA-78 (Epithelial-cell-derived Neutrophil Attractant) - аттрактант нейтрофилов, получаемый из эпителиальных клеток. GCP-2 (Granulocyte Chemotactic Protein) - белок хемотаксиса гранулоцитов. GRO (α, β, γ) (Growth-Related Oncogene) - онкоген, относящийся к росту. НСС (Haemofiltrate СС chemokine) - СС хемокин из гемофильтрата. IP-10 (Interferon-y inducible Protein) - ИФНγ-индуцируемый белок.
I-TAC (interferon-Inducible T-cell Alpha Chemoattractanf) - индуцируемый интерфероном Т-клеточный α-хемоаттрактант.
МСР (Monocyte Chemoattractant Protein) - хемоаттрактантный белок для моноцитов.
MDC (Macrophage-Derived Chemokine) - хемокин, получаемый из макрофагов.
MEC (Mammary-Enriched Chemokine) - хемокин, обогащенный в молочной железе.
MIG (Monokine induced by Interferon у) - монокин, индуцированный интерфероном у (ИФНу).
MIP (lα; 1β; Зα; Зβ) (Macrophage Inflammatory Protein) - макрофагальный воспалительный белок.
MPIF (Myeloid Progenitor Inhibitory Factor) - фактор, ингибирующий миелоидные предшественники.
NAP-2 (Neutrophil-Activating Peptide) - нейтрофилактивирующий пептид.
PF4 (Platelet Factor) - тромбоцитарный фактор.
RANTES (Regulated upon Activation Normal T-cell Expressed and Secreted) - экспрессируемый и секретируемый нормальными Т-клетками и регулируемый процессами активации.
SDF (α, β) (Stromal cell-Derived Factor) - фактор, получаемый из клеток стромы.
TARC (Thymus and Activation Regulated Chemokine) - хемокин, регулируемый тимусом и активацией.
ТЕСК (Thymus-Expressed ChemoKine) - хемокин, экспрессированный в тимусе.
Рецепторы для цитокинов и хемокинов
Выделяют несколько семейств рецепторов для цитокинов.
• Семейство рецепторов гемопоэтических цитокинов представлено гетеродимерными молекулами и включает рецепторы для ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-9 и ИЛ-15; рецептор для GM-CSF; рецептор для эритропоэтина; рецептор для гормона роста. Рецептор для ИЛ-2 существует в трёх формах, различающихся по составу субъединиц, а также по аффинности к ИЛ-2. Тример ИЛ-2Rαβγ обладает наибольшей аффинностью, димер ИЛ-2Rβγ - промежуточной и мономер ИЛ-2Rα - наименьшей.
• Семейство рецепторов интерферонов - гомодимерные трансмембранные молекулы. Помимо собственно рецепторов для интерферонов, в семейство входит рецептор для ИЛ-10.
• Семейство рецепторов фактора некроза опухоли (TNFR -
Tumor Necrosis Factor Receptor) включает молекулы, состоящие из одной трансмембранной полипептидной цепи, - TNFR-I и TNFR-II, CD40, Fas (CD95), CD30, CD27, рецептор для фактора роста нервов (NGFR). Путь проведения сигналов от рецепторов цитокинов (рис. 4-1) - самый короткий из известных, что соответствует физиологическим особенностям эффектов цитокинов (очень быстрые, но непродолжительные).
• Цитоплазматические участки рецепторов для цитокинов ассоциированы с киназами семейства Janus, способными фосфорилировать эти участки по остатку тирозина после связывания рецептора с цитокином. Известно 4 члена этого семейства: Jak1, Jak2, Jak3, Tyk-2. Их молекулярная масса от 110 000 до 140 000 Да.
• К фосфорилированным участкам рецептора могут присоединяться молекулы из семейства STAT (Signal Transducers and Activators of Transcription) - проводники сигналов и активаторы транскрипции. Описано 7 молекул STAT: STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b, STAT6. Их молекулярная масса составляет от 84 000 до 113 000 Да.
◊ Те же киназы Janus фосфорилируют молекулы STAT по остатку тирозина в N-концевом домене и димеризуют их.
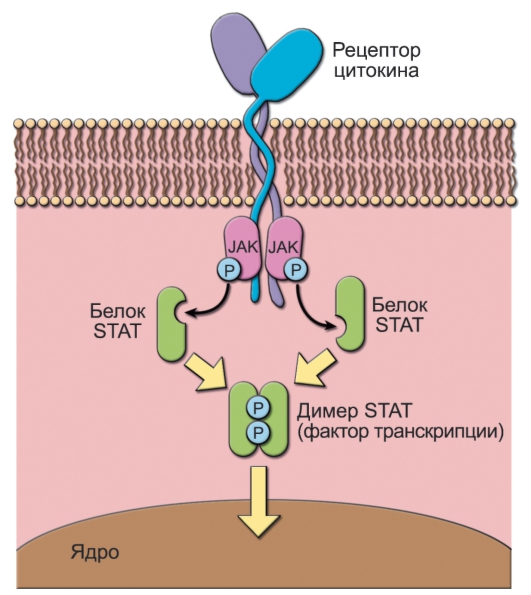
Рис. 4-1. Проведение сигналов от рецепторов для цитокинов (схема). Пояснения в тексте
◊ Фосфорилированные STAT отделяются от внутриклеточных цепей рецептора, образуя гомоили гетеродимеры и мигрируют в ядро, где связываются с ДНК и активируют транскрипцию.
Рецепторы для хемокинов принадлежат к семейству семичленных трансмембранных «гармошек»; в это семейство входят также рецепторы для анафилатоксинов комплемента (C5a, C3a, C4a), фоторецепторы (родопсин и бактериородопсин) и множество других. Рецепторы этого семейства передают сигнал внутрь клетки через G-белки (ГТФ/ГДФ-связывающие белки).
• Каждый G-белок состоит из трёх пептидных цепей - Gα, Gβ и Gγ. В покое Gα-цепь образует комплекс с ГДФ. При связывании рецептора с лигандом ГДФ замещается на ГТФ и Gα-цепь диссоциирует от димера Gβ/Gγ (рис. 4-2).
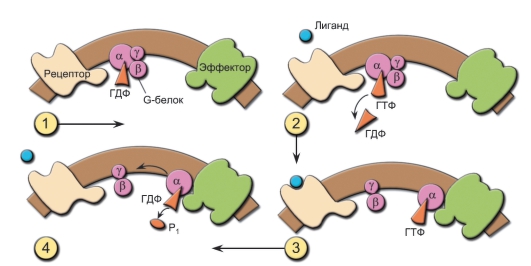
Рис. 4-2. Белок G: 1 - выключенное состояние: а-субъединица связана с гуанозиндифосфатом (ГДФ) и не контактирует с эффектором; 2 - при взаимодействии лиганда с рецептором ГДФ заменяется на ГТФ, G-белок активируется; 3 - G-белок диссоциирует, несущая ГТФ а-субъединица перемещается в мембране, связывается с эффектором и активирует его; 4 - а-субъединица превращает ГТФ в ГДФ, инактивируется и объединяется с другими субъединицами G-белка
• Gα-цепи различных G-белков имеют разные функции: одни активируют фосфолипазу Cy, другие - аденилатциклазу, катализирующую образование циклического аденозинмонофосфата (цАМФ). Это приводит к разнообразным физиологическим эффектам, реализуемым посредством изменения режима функционирования ионных каналов, активации или блокирования разных биохимических реакций (рис. 4-3).
• Кроме того, Gα-цепь обладает ГТФазной активностью, что позволяет ей вновь объединиться с другими субъединицами G-белка и прекратить проведение сигнала.
ИММУНОЛОГИЧЕСКАЯ ПАМЯТЬ
Феномен иммунологической памяти проявляется в том, что в случае успешного иммунного ответа на патоген при его повторных попаданиях санация осуществляется существенно быстрее и эффективнее, а патоген не успевает вызвать патологический ин-
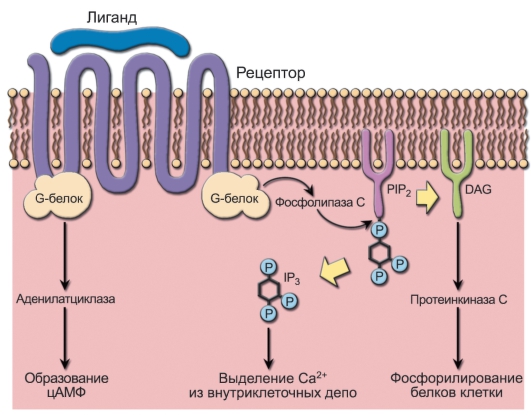
Рис. 4-3. Проведение сигналов с рецепторов семейства тетраспанинов. Роль инозиттрифосфата и диацилглицерина в реализации действия лигандов на клетку-мишень. Образование комплекса лиганда-рецептор стимулирует G-белок, активирующий фосфолипазу С. Фосфолипаза С катализирует расщепление фосфатидил инозит-4,5-бифосфата (PIP2) на инозит-1,4,5-трифосфат (IP,) и диацилглицерин (DAG). Инозиттрифосфат (IP3) вызывает высвобождение Ca2+ из внутриклеточных депо. Ca2+-зависимая протеинкиназа С, активированная диацилглицерином (DAG), фосфорилирует белки клетки
фекционный процесс. Это состояние известно как протективный иммунитет, т.е. иммунитет, защищающий от заболевания.
В основе феномена иммунологической памяти лежит следующий факт: часть лимфоцитов (единицы процентов) антигенспецифичного клона, вовлечённого в первый иммунный ответ, «замораживается» и персистирует в организме в течение неопределённого времени (для различных антигенов время очень различается - вплоть до пожизненного).
В настоящее время неизвестно, какие именно молекулы и взаимодействия и на каком точно этапе иммуногенеза определяют формирование популяции лимфоцитов памяти. В то же время установлены отличия разных лимфоцитов памяти от других субпопуляций тех же лимфоцитов.
• B-лимфоциты. B-лимфоциты памяти отличаются от плазматических клеток (терминальной стадии дифференцировки B-лимфоцитов) по ряду признаков.
◊ Покоящиеся B-лимфоциты памяти несут поверхностные иммуноглобулины, экспрессируют молекулы MHC-II; способны к пролиферации, переключению между изотипами иммуноглобулинов, гипермутациям гипервариабельных участков молекулы иммуноглобулина - CDR (расположены в V-домене; см. главу 5), но не способны к интенсивному образованию иммуноглобулинов.
◊ Плазматические клетки, напротив, способны к интенсивному синтезу/секреции иммуноглобулинов, но не несут поверхностные иммуноглобулины, не экспрессируют молекулы MHC-II; не способны к пролиферации, переключению между изотипами иммуноглобулинов, гипермутациям CDR V-доменов иммуноглобулинов.
• T-лимфоциты памяти отличаются от зрелых T-клеток и по частоте встречаемости антигенспецифичных клонов в лимфоидной ткани, и по экспрессии ряда мембранных молекул [LFA-3 (CD58); CD2; LFA-1 (CD11a/CD18); CD44; CD45RO] более чем в 10-100 раз. В отличие от наивных лимфоцитов, они испытывают существенно меньшую потребность в медиаторах воспаления и в костимулирующих сигналах для запуска иммунного ответа на специфический антиген и могут отвечать при минимальных симптомах воспаления или вне его. В то же время наивные T-клетки (в отличие от T-лимфоцитов памяти) экспрессируют на поверхности CD45RA и большие количества молекул L-селектина, обеспечивающие хоминг Т-лимфоцитов в лимфатические узлы.