Хаитов Р.М. Иммунология: учебник / Р.М. Хаитов. - 2-е изд., перераб. и доп. - 2013. - 528 с.: ил.
|
|
|
|
Глава 3. МЕХАНИЗМЫ ВРОЖДЁННОГО ИММУНИТЕТА
Врождённый иммунитет - наиболее ранний защитный механизм как в эволюционном плане (он существует практически у всех многоклеточных, от растений до человека), так и по времени ответа, развивающегося в первые часы и дни после проникновения чужеродного материала во внутреннюю среду, т.е. задолго до развития адаптивной иммунной реакции. Значительную часть патогенов инактивируют именно врождённые механизмы иммунитета, не доводя процесс до развития иммунного ответа с участием лимфоцитов. И только те патогены или их дозы, с которыми не справляются механизмы врождённого иммунитета, «достаются» лимфоцитам. При этом адаптивный иммунный ответ невозможен без участия процессов врождённого иммунитета. В механизмах врождённой защиты организма важнейшую роль играют первичные рецепторы для патогенов, система комплемента, фагоцитоз, эндогенные пептиды-антибиотики и факторы защиты от вирусов - интерфероны.
РЕЦЕПТОРЫ РАСПОЗНАВАНИЯ «ЧУЖОГО»
На поверхности микроорганизмов присутствуют повторяющиеся молекулярные углеводные и липидные структуры, которых в подавляющем большинстве случаев нет на клетках организма хозяина. Особые рецепторы, распознающие этот «узор» на поверхности патогена, - PRR (Pattern Recognition Receptors - паттернраспознающие рецепторы) - позволяют клеткам врождённого иммунитета обнаруживать микробные клетки. В зависимости от локализации выделяют растворимые и мембранные формы PRR.
• Растворимые рецепторы для патогенов - белки сыворотки крови, синтезируемые печенью: липополисахаридсвязываю-
щий белок (LBP - Lipopolysaccharide Binding Protein), компонент системы комплемента C1q и белки острой фазы МСЛ и СРБ. Они непосредственно связывают микробные продукты в жидких средах организма и обеспечивают возможность их поглощения фагоцитами, т.е. являются опсонинами (от греч. opsonein - делающий вкусным). Кроме того, некоторые из них активируют систему комплемента.
◊ СРБ, связывая фосфорилхолин клеточных стенок ряда бактерий и одноклеточных грибов, опсонизирует их и активирует систему комплемента по классическому пути.
◊ МСЛ принадлежит к семейству коллектинов. Имея сродство к остаткам маннозы, экспонированным на поверхности многих микробных клеток, МСЛ запускает лектиновый путь активации комплемента.
◊ Белки сурфактанта лёгких - SP-A и SP-D принадлежат к тому же молекулярному семейству коллектинов, что и МСЛ. Они, вероятно, имеют значение в опсонизации (связывании антител с клеточной стенкой микроорганизма) лёгочного патогена - одноклеточного грибка Pneumocystis carinii.
• Мембранные рецепторы. У млекопитающих эти рецепторы получили название Toll-подобных - TLR (Toll-Like Receptor), т.е. сходны с Toll-рецептором дрозофилы. Одни из них непосредственно связывают продукты патогенов (рецепторы для маннозы макрофагов, TLR-дендритных и других клеток), другие работают совместно с иными рецепторами [например, CD14 молекула на макрофагах связывает комплексы бактериального липополисахарида (ЛПС) с LBP, а TLR-4 вступает во взаимодействие с CD14 и передаёт соответствующий сигнал внутрь клетки]. Всего у млекопитающих описано 13 различных вариантов TLR (у человека пока только 10).
ПРОВЕДЕНИЕ СИГНАЛОВ С TOLL-ПОДОБНЫХ РЕЦЕПТОРОВ
Цитоплазматические участки молекул TLR (так же как рецептора для ИЛ-1) содержат характерные последовательности остатков аминокислот, названные TIR-доменом (Toll/Interleukin-1 Receptor). При взаимодействии рецептора с лигандом (рис. 3-1) этот домен
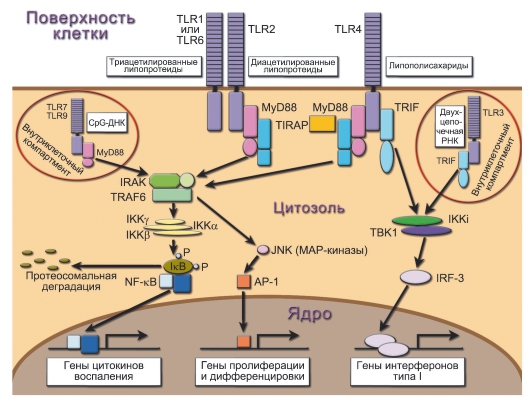
Рис. 3-1. Пути передачи сигналов с Toll-подобных рецепторов (TLR). После стимуляции все TLR, за исключением TLR3, вовлекают в действие MyD88, IRAK и TRAF6, индуцирующие активацию пути посредством Ubc13/TAK1. TAK1-комплекс активирует IKK-комплекс, состоящий из IKKα, IKKβ и IKKγ, катализирующий фосфорилирование белка IkB. Фосфорилированный IkB деградирует по протеосомозависимому пути, позволяя NF-kB транслоцироваться в ядро. TAK1 также фосфорилирует киназы MAP, в частности JNK, и, таким образом, индуцирует активацию фактора транскрипции AP-1 (активирующий протеин-1). Состав AP-1 варьирует и зависит от типа активирующего сигнала. Основные его формы - гомодимеры c-Jun или гетеродимеры c-Jun и c-Fos. В клеточном ядре NF-kB активирует транскрипцию провоспалительных цитокинов. В свою очередь, AP-1 инициирует транскрипцию генов, ответственных за пролиферацию, дифференцировку и регуляцию апоптоза. TIRAP связывается с TLR4, TLR1/2 или TLR2/6, также активируя MyD88-зависимый путь передачи сигнала. В MyD88-независимом пути задействован TRIF, который связывается с TLR3 и TLR4 и взаимодействует с TBK1 и IKKi, которые опосредуют фосфорилирование IRF3. Фосфорилированный IRF3 димеризуется, транслоцируется в ядро и индуцирует экспрессию генов интерферонов типа I
связывает особый адапторный белок - MyD88 (Myeloid Differentiation factor 88), взаимодействующий с серин/треониновыми киназами IRAK1 и 4 (Interleukin-1 Receptor-Associated Kinases - киназы рецептора ИЛ-1). Цепочка последующих взаимодействий приводит к активации IKK киназы, состоящей из IKKα, IKKβ и IKKγ субъединиц. В результате фактор транскрипции NF-кВ (Nuclear Factor of к-chain B-lymphocytes) освобождается от ингибирующего его белка IkB и транслоцируется в клеточное ядро.
NF-кВ запускает транскрипцию генов провоспалительных цитокинов (ФНОа, ИЛ-1, ИЛ-6, ИЛ-12), хемокинов (ИЛ-8) и костимуляторных молекул В7.1 (CD80) и В7.2 (CD86), необходимых для презентации антигена T-лимфоцитам, и обеспечивает миграцию этих клеток из очага проникновения патогена в региональные лимфатические узлы, создавая необходимые условия для начала адаптивного иммунного ответа.
Одновременно NF-кВ инициирует транскрипцию гена своего белка-ингибитора IkB, что обеспечивает спонтанное затухание сигнала с TLR.
Сравнительная характеристика врождённых и адаптивных механизмов резистентности приведена в табл. 3-1.
Таблица 3-1. Сравнение биологических свойств рецепторов врождённого и адаптивного иммунитета
Существуют субпопуляции лимфоцитов со свойствами, «промежуточными» между таковыми неклонотипных механизмов врождённого иммунитета и клонотипных лимфоцитов с большим разнообразием рецепторов для антигенов. Они не пролиферируют после связывания антигена (т.е. экспансии клонов не происходит), но в них сразу индуцируется продукция эффекторных молекул. Ответ не слишком специфичен и наступает быстрее, чем «истинно лимфоцитарный», иммунологической памяти не формируется. К таким лимфоцитам можно отнести:
• внутриэпителиальные лимфоциты типа γδT-клеток с перестроенными генами TCR ограниченного разнообразия (связывают лиганды типа белков теплового шока, нетипичные нуклеотиды, фосфолипиды, MHC-IB);
• B1-лимфоциты брюшной и плевральной полостей имеют перестроенные гены BCR ограниченного разнообразия, обладающие широкой перекрёстной реактивностью с бактериальными антигенами. К категории лимфоцитов с «промежуточными» свойствами относят также NK-лимфоциты, или естественные киллеры.
ЕСТЕСТВЕННЫЕ КИЛЛЕРЫ
Особая субпопуляция лимфоцитов - естественные киллеры (NK-клетки) - дифференцируются из общей лимфоидной клеткипредшественника и in vitro способны спонтанно (т.е. без предварительной иммунизации) убивать некоторые опухолевые, а также инфицированные вирусами клетки. В циркулирующей крови нормальные киллеры составляют около 15% всех мононуклеарных клеток, а в тканях локализованы в печени (большинство), красной пульпе селезёнки, слизистых оболочках (особенно репродуктивных органов).
• По эффекторным функциям NK-клетки близки к T-лимфоцитам: они проявляют цитотоксическую активность в отношении клеток-мишеней (по тому же перфорин-гранзимовому механизму, что и ЦТЛ, см. рис. 1-4 и рис. 6-4) и продуцируют цитокины (ИФНу, ФНО, GM-CSF, ИЛ-5, ИЛ-8).
• Отличие NK-клеток от T-лимфоцитов состоит в том, что у них отсутствует TCR и они распознают комплекс антигенMHC иным (не вполне ясным) способом. NK не формируют клеток иммунологической памяти.
• На NK-клетках есть рецепторы, способные связывать молекулы MHC-I собственных клеток, относящиеся к семейству KIR (Killer-cell Immunoglobulin-like Receptors). Но эти рецепторы не активируют, а ингибируют киллерную функцию нормальных киллеров. Кроме того, на NK-клетках есть такие иммунорецепторы, как FcyR, и экспрессирована молекула CD8, имеющая сродство к MHC-I.
• На уровне ДНК гены KIR не перестраиваются, но на уровне первичного транскрипта происходит альтернативный сплайсинг, что обеспечивает определённое разнообразие вариантов этих рецепторов у каждой отдельной NK-клетки. На каждом нормальном киллере экспрессировано более одного варианта
KIR.
• Поскольку субнормальная экспрессия MHC-I возникает в клетках при патологических процессах (например, при вирусной инфекции, опухолевом перерождении), NK-клетки способны убивать инфицированные вирусами или перерождённые клетки собственного организма (в экспериментах in vitro).
СИСТЕМА КОМПЛЕМЕНТА
Комплемент - система сывороточных белков и нескольких белков клеточных мембран, выполняющая 3 важных функции: опсонизацию микроорганизмов для дальнейшего их фагоцитоза, инициацию сосудистых реакций воспаления и перфорацию мембран бактериальных и других клеток. Компоненты комплемента (табл. 3-2, 3-3) обозначают буквами латинского алфавита C, B и D с добавлением арабской цифры (номер компонента) и дополнительных строчных букв. Компоненты классического пути обозначают латинской буквой С и арабскими цифрами (C1, C2 ... C9), для субкомпонентов комплемента и продуктов расщепления к соответствующему обозначению добавляют строчные латинские буквы (С1q, C3b и т.д.). Активированные компоненты выделяют чертой над литерой, инактивированные компоненты - буквой «i» (например, iC3b).
• Активация комплемента (рис. 3-2). В норме, когда внутренняя среда организма «стерильна» и патологического распада собственных тканей не происходит, уровень активности си-
Таблица 3-2. Компоненты системы комплемента
Таблица 3-3. Основные эффекты белков системы комплемента и фрагментов их расщепления
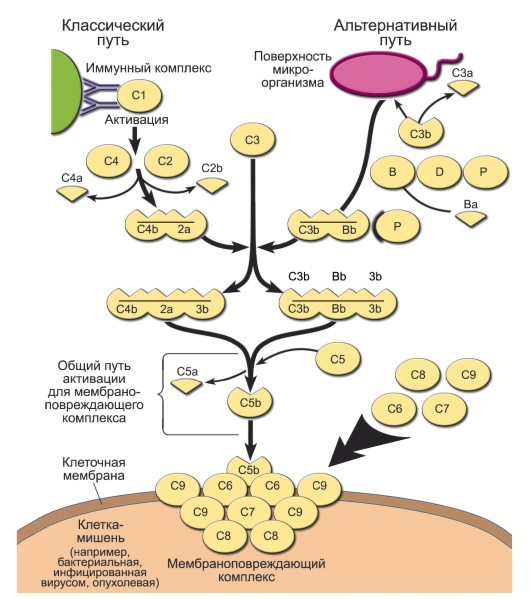
Рис. 3-2. Активация системы комплемента и образование мембраноатакующего комплекса. Пояснения в тексте, а также в табл. 3-2, 3-3. Активированные компоненты, согласно международному соглашению, надчёркнуты
стемы комплемента невысок. При появлении во внутренней среде микробных продуктов происходит активация системы комплемента. Она может происходить по трём путям: альтернативному, классическому и лектиновому. ◊ Альтернативный путь активации. Его инициируют непосредственно поверхностные молекулы клеток микроорганизмов [факторы альтернативного пути имеют буквенное обозначение: P (пропердин), В и D (ферменты системы комплемента)].
♦ Из всех белков системы комплемента в сыворотке крови больше всего C3 - его концентрация в норме составляет 1,2 мг/мл. При этом всегда имеется небольшой, но значимый уровень спонтанного расщепления C3 с образованием C3a и C3b. Компонент C3b - опсонин, т.е. он способен ковалентно связываться как с поверхностными молекулами микроорганизмов, так и с рецепторами на фагоцитах. Кроме того, «осев» на поверхности клеток, C3b связывает фактор В. Тот, в свою очередь, становится субстратом для сывороточной сериновой протеазы - фактора D, который расщепляет его на фрагменты Ва и Bb. C3b и Bb образуют на поверхности микроорганизма активный комплекс, стабилизируемый пропердином (фактор Р).
♦ Комплекс C3b/Bb служит C3-конвертазой и значительно повышает уровень расщепления C3 по сравнению со спонтанным. Кроме того, после связывания с C3 он расщепляет C5 до фрагментов C5a и C5b. Малые фрагменты C5a (наиболее сильный) и C3a - анафилатоксины комплемента, т.е. медиаторы воспалительной реакции. Они создают условия для миграции фагоцитов в очаг воспаления, вызывают дегрануляцию тучных клеток, сокращение гладких мышц. C5a также вызывает повышение экспрессии на фагоцитах CR1 и CR3.
♦ С C5b начинается формирование «мембраноатакующего комплекса», вызывающего перфорацию мембраны клеток микроорганизмов и их лизис. Сначала образуется комплекс C5b/C6/C7, встраивающийся в мембрану клетки. Одна из субъединиц компонента C8 - C8b - присоединяется к комплексу и катализирует полимери-
зацию 10-16 молекул C9. Этот полимер и формирует неспадающуюся пору в мембране диаметром около 10 нм. В результате клетки становятся неспособными поддерживать осмотический баланс и лизируются. ◊ Классический и лектиновый пути сходны друг с другом и отличаются от альтернативного способом активации C3. Главной C3-конвертазой классического и лектинового пути служит комплекс C4b/C2a, в котором протеазной активностью обладает C2a, а C4b ковалентно связывается с поверхностью клеток микроорганизмов. Примечательно, что белок C2 гомологичен фактору В, даже их гены расположены рядом в локусе MHC-III.
♦ При активации по лектиновому пути один из белков острой фазы - МСЛ - взаимодействует с маннозой на поверхности клеток микроорганизмов, а МСЛассоциированная сериновая протеаза катализирует активационное расщепление C4 и C2.
♦ Сериновой протеазой классического пути служит C1s, одна из субъединиц комплекса C1qr2s2. Она активируется, когда, по крайней мере, 2 субъединицы C1q связываются с комплексом антиген-антитело. Таким образом, классический путь активации комплемента связывает врождённый и адаптивный иммунитет.
• Рецепторы компонентов комплемента. Известно 5 типов рецепторов для компонентов комплемента (CR - Complement Receptor) на различных клетках организма. ◊ CR1 экспрессирован на макрофагах, нейтрофилах и эритроцитах. Он связывает C3b и C4b и при наличии других стимулов к фагоцитозу (связывания комплексов антиген- антитело через FcyR или при воздействии ИФНу - продукта активированных T-лимфоцитов) оказывает пермиссивное действие на фагоциты. CR1 эритроцитов через C4b и C3b связывает растворимые иммунные комплексы и доставляет их к макрофагам селезёнки и печени, обеспечивая тем самым клиренс крови от иммунных комплексов. При нарушении этого механизма иммунные комплексы выпадают в осадок - прежде всего в базальных мембранах сосудов клубочков почек (CR1 есть и на подоцитах клубочков почек), приводя к развитию гломерулонефрита.
◊ CR2 B-лимфоцитов связывает продукты деградации C3 - C3d и iC3b. Это в 10-100 тыс. раз увеличивает восприимчивость B-лимфоцита к своему антигену. К сожалению, эту же мембранную молекулу - CR2 - использует в качестве своего рецептора вирус Эпштейна-Барр - возбудитель инфекционного мононуклеоза.
◊ CR3 и CR4 также связывают iC3b, который, как и активная форма C3b, служит опсонином. Однако связывания iC3b с CR3 само по себе достаточно для стимуляции фагоцитоза.
◊ C5aR состоит из 7 доменов, пенетрирующих мембрану клетки. Такая структура характерна для рецепторов, связанных с G-белками (белки, способные связывать гуаниновые нуклеотиды - GTP).
• Защита собственных клеток. Собственные клетки организма защищены от деструктивных воздействий активного комплемента благодаря так называемым регуляторным белкам системы комплемента.
◊ С1-ингибитор (С1inh) разрушает связь C1q с C1r2s2, тем самым ограничивая время, в течение которого C1s катализирует активационное расщепление C4 и C2. Кроме того, С1inh ограничивает спонтанную активацию C1 в плазме крови. При генетическом дефекте С1inh возникает наследственный ангионевротический отёк (АО). Его патогенез состоит в хронически повышенной спонтанной активации системы комплемента и избыточном накоплении анафилактинов (C3a и С5а), вызывающих отёки. Заболевание лечат заместительной терапией препаратом dinh.
◊ C4-связывающий белок - C4BP (C4-Binding Protein) связывает C4b, предотвращая взаимодействие C4b и С2a.
◊ DAF (Decay-Accelerating Factor - фактор, ускоряющий деградацию, CD55) ингибирует конвертазы классического и альтернативного путей активации комплемента, блокируя формирование мембраноатакующего комплекса.
◊ Фактор H (растворимый) вытесняет фактор В из комплекса с C3b.
◊ Фактор I (сывороточная протеаза) расщепляет C3b на C3dg и iC3b, а C4b - на C4c и C4d.
◊ Мембранный белок MCP связывает C3b и делает его доступным для фактора I.
◊ CD59 и DAF (CD55). Активность белков комплекса атаки на мембрану сдерживается мембранными белками CD59 и DAF. Они защищают собственные клетки организма от лизиса комплементом. При наследственном дефекте их связи с клеточной мембраной развивается пароксизмальная ночная гемоглобинурия. У таких больных эпизодически возникают приступы внутрисосудистого лизиса собственных эритроцитов активированным комплементом и происходит экскреция гемоглобина почками.
ФАГОЦИТОЗ
Фагоцитоз - особый процесс поглощения клеткой крупных макромолекулярных комплексов или корпускулярных структур. «Профессиональные» фагоциты у млекопитающих - два типа дифференцированных клеток - нейтрофилы и макрофаги, которые созревают в костном мозге из СКК и имеют общую промежуточную клетку-предшественник.
Нейтрофилы составляют значительную часть лейкоцитов периферической крови - 60-70%, или 2,5-7,5×109 клеток в 1 л крови. В норме нейтрофилы не выходят из сосудов в периферические ткани, но они первыми мигрируют (т.е. подвергаются экстравазации) в очаг воспаления за счёт быстрой экспрессии молекул адгезии - VLA-4 (лиганд на эндотелии - VCAM-1) и интегрина CD11b/CD18 (лиганд на эндотелии - ICAM-1). На их наружной мембране выявлены эксклюзивные маркёры - CD66а и CD66d (раково-эмбриональные антигены).
Моноциты и макрофаги. Моноциты являются «промежуточной формой», в крови их 5-10% от общего числа лейкоцитов. Их назначение - стать оседлыми макрофагами в тканях. Макрофаги печени называют купферовскими клетками, мозга - микроглией, лёгких - альвеолярными и интерстициальными, почек - мезангиальными.
Рецепторы мембраны макрофагов
• CD115 (CSF-1R) - рецептор для колониестимулирующего фактора моноцитов (M-CSF). Присутствует также на мембране полипотентной клетки-предшественника гранулоцитов и моноцитов и унипотентного предшественника моноцитов.
• Рецепторы клеточной мембраны макрофагов, участвующие в процессе фагоцитоза.
◊ CD14 - рецептор для комплексов бактериальных ЛПС с белками сыворотки крови, связывающими ЛПС (LBP), а также комплексов ЛПС с другими продуктами микроорганизмов (например, с эндотоксинами).
◊ Рецепторы для фрагментов фосфолипидных мембран и других компонентов собственных повреждённых и умирающих клеток (рецепторы-«мусорщики», scavenger receptors). Таков, например, CD163 - рецептор для «старых» эритроцитов.
◊ Рецептор, связывающий маннозу. Присутствует только на мембране тканевых макрофагов.
◊ Рецептор для комплемента - CR3 (интегрин CD11b/CD18) и CR4 (интегрин CD11c/CD18). Помимо комплемента, они связывают и ряд бактериальных продуктов: ЛПС, липофосфогликан Leishmania, гемагглютинин из филаментов Bordetella, поверхностные структуры дрожжевых клеток Candida и грибков Histoplasma.
◊ CD64 - рецептор для Fc-фрагментов IgG - FcγRI (Fcγ-рецептор первого типа), обеспечивающий фагоцитоз макрофагами иммунных комплексов. FcγRI считают мембранным маркёром моноцитов/макрофагов, поскольку он экспрессируется только на этих клетках. Сила связывания FcγRI с иммуноглобулинами различных изотипов убывает в ряду: IgG3 > IgG1 > IgG4 > IgG2.
• Рецепторы, осуществляющие взаимодействие с лимфоцитами. Наряду с уже упомянутым CD64 к ним относят:
◊ Рецепторы для цитокинов, вырабатываемых активированными лимфоцитами. Связывание с ИФНγ и фактором некроза опухоли (ФНО) приводит к активации макрофага. Через рецептор для ИЛ-10 макрофаг, напротив, инактивируется.
◊ CD40, B7, MHC-I, MHC-II - мембранные молекулы для контактов с комплементарными мембранными молекулами лимфоцитов, т.е. для непосредственных межклеточных взаимодействий. У нейтрофилов таких рецепторов нет.
Последствия фагоцитоза. После того как фагоцит охватывает своей мембраной поглощаемый объект и заключает его в мембран-
ную везикулу, называемую фагосомой, происходят следующие события.
• Расщепление фагоцитированного материала. Этот процесс идёт по одинаковым биохимическим механизмам во всех фагоцитах.
◊ Лизосомы - специальные внутриклеточные органеллы, содержащие набор гидролитических ферментов (кислых протеаз и гидролаз) с оптимумом pH порядка 4,0. В клетке лизосомы сливаются с фагосомами в фаголизосому, где и происходят реакции расщепления поглощённого материала.
◊ Ферментные системы. НАДФ-Н-оксидазы, супероксиддисмутаза, NO-синтазы, генерируют активные формы неорганических окислителей: пероксид водорода (Н2О2), супероксид анион (О2-), синглетный кислород (1O2), радикал гидроксила (OH-), гипохлорид (OCl-), оксид азота (NO). Эти радикалы также участвуют в деструкции фагоцитированного объекта.
• Секреция литических ферментов и окислительных радикалов в межклеточное пространство, где они также оказывают бактерицидное действие (но при этом поражают и собственные ткани). Нейтрофилы, помимо уже названных веществ, продуцируют и секретируют коллагеназу, катепсин G, желатиназу, эластазу и фосфолипазу A2.
• Продукция и секреция цитокинов. Макрофаги и нейтрофилы, активированные продуктами микроорганизмов, начинают продуцировать цитокины и другие биологически активные медиаторы, инициирующие воспалительные реакции в очаге проникновения чужеродных агентов, подготавливая возможность развития адаптивного иммунного ответа.
◊ Макрофаги продуцируют интерлейкины (ИЛ-1, ИЛ-6, ИЛ12); хемокин ИЛ-8; фактор некроза опухоли a (ФНОа); простагландины; лейкотриен В4 (LTB4); фактор, активирующий тромбоциты (ФАТ).
◊ Нейтрофилы продуцируют ФНОa, ИЛ-12, хемокин ИЛ-8,
LTB4 и ФАТ.
• Процессинг и презентация антигена - образование внутри клеток комплексов из продуктов расщепления фагоцитированного материала с собственными молекулами MHC-II и экспрессия этого комплекса на поверхности клетки для презентации антигенов T-лимфоцитам. Этот процесс осуществляется АПК: ДК, макрофагами и др.
ЭНДОГЕННЫЕ ПРОТИВОБАКТЕРИАЛЬНЫЕ ПЕПТИДЫ - ПРИРОДНЫЕ АНТИБИОТИКИ
Пептиды, обладающие активностью антибиотиков, обнаружены в клетках многих эукариот - от растений до человека. Они образуются путём процессинга более крупных белков-предшественников и содержат 13-80 аминокислотных остатков. В настоящее время это одно из самых новых направлений исследований. В базе данных о пептидах-антибиотиках содержится свыше 750 наименований.
Выделяют несколько групп пептидов-антибиотиков, из которых для человека важны так называемые дефензины - пептиды, содержащие несколько цистеинов, между которыми сформированы 3 дисульфидные связи. а-Дефензины содержатся в гранулах нейтрофилов. Синтез р-дефензинов происходит в клетках покровных тканей - эпителия дыхательных путей и пищеварительного тракта.
Генетические дефекты пептидов-антибиотиков или необходимых для их функционирования кофакторов (например, ионных каналов, так как активность пептидов-антибиотиков «высокочувствительна» к ионной силе), вероятно, коррелируют с развитием прогредиентно текущей хронической патологии с инфекционными факторами в этиологии. Например, на сегодняшний день доказана связь развития муковисцидоза с мутацией гена-регулятора мембранной проводимости CFTR, которая, возможно, определяет снижение активности β-дефензина в эпителии дыхательных путей.
ИНТЕРФЕРОНЫ ТИПА I
Существуют и факторы врождённой защиты от вирусов - интерфероны типа I, а именно ИФНα, ИФНβ и др. Считают, что основной источник интерферонов типа I в организме - плазмацитоидные ДК. Интерфероны - небольшие белки, синтезируемые в инфицированных вирусом клетках. Индуктором синтеза интерферонов служат молекулы двуспиральной РНК. Двуспиральная РНК может быть геномной РНК вирусов или промежуточным продуктом транскрипции у ДНК-содержащих вирусов. В клетках млекопитающих собственных двуспиральных РНК нет.
Ферменты, индуцируемые интерферонами и нарушающие репликативный цикл вирусов.
• Олигоаденилатсинтетаза, полимеризующая АТФ в 2',5'-олигомеры (в норме нуклеотиды в нуклеиновых кислотах связаны по 3',5'). Аномальные 2',5'-олигомеры активируют эндорибонуклеазу, которая расщепляет их и заодно вирусные нуклеиновые кислоты.
• Серинтреониновая киназа Р1 фосфорилирует фактор инициации синтеза белка эукариот eIF-2, что приводит к подавлению трансляции, в том числе и вирусных белков.
• Белок MX - клеточный белок, о котором известно, что он необходим для проявления резистентности клетки к размножению в ней вируса гриппа (по данным генетического нокаута гена mx).
ФАКТОРЫ ВРОЖДЁННОГО ИММУНИТЕТА
В табл. 3-4 перечислены различные факторы (молекулы) врождённой резистентности, относящиеся к разным функциональным классам (лектины, ЛПС-реактивные белки, активаторы комплемента, цитокины, липидные медиаторы, реактанты острой фазы, пентраксины).
Таблица 3-4. Факторы врождённого иммунитета