Хаитов Р.М. Иммунология: учебник / Р.М. Хаитов. - 2-е изд., перераб. и доп. - 2013. - 528 с.: ил.
|
|
|
|
Глава 13. АЛЛЕРГИЧЕСКИЕ ЗАБОЛЕВАНИЯ
ОПРЕДЕЛЕНИЕ ТЕРМИНОВ
Термин «аллергия» в 1906 г. ввёл австрийский педиатр К. Пирке для обозначения состояний необычно повышенной реактивности у детей, которые он иногда наблюдал при инфекционных заболеваниях или при сывороточной болезни (от греч. allos - другой, иной, не такой, как все). Аллергические реакции - реакции гиперчувствительности иммунной системы, не имеющие защитного значения для организма и развивающиеся в ответ на воздействие антигенов, называемых аллергенами.
Остро развивающееся и часто угрожающее жизни состояние гиперчувствительности - анафилаксия (anaphylaxis как противоположность prophylaxis). Если «профилактический» - защитный, то «анафилактический» - противоположный защитному, т.е. разрушающий. Аллергические реакции лежат в основе патогенеза аллергических заболеваний. Организм, ткани и клетки, способные отвечать реакциями гиперчувствительности, принято называть сенсибилизированными, т.е. имеющими «подготовленную» чувствительность к данному агенту.
Поскольку в основе аллергической реакции лежит иммунологический механизм, то она является высокоспецифичной. Такой сенсибилизированный организм отвечает аллергической реакцией исключительно на антигенные структуры (детерминанты), использованные для иммунизации (сенсибилизации), или же на родственные им молекулы.
В классической аллергологии истинной аллергией (или атопией) принято называть антигензависимую дегрануляцию тучных клеток и базофилов и её патофизиологические последствия. При истинной аллергии [IgE-oпoсредованной, или ГНТ (рис. 13-1)] происходит пе-
рекрёстная сшивка FcεRI комплексами IgE-антиген, т.е. атопия - IgE-опосредованная аллергия, относящаяся по этой классификации к I типу иммунологических реакций. Большинство аллергических заболеваний относят именно к атопии. Антигеннезависимую дегрануляцию с теми же патофизиологическими последствиями, что и при истинной аллергии (атопии), называют псевдоаллергией. При псевдоаллергических реакциях (IgE-независимая реакция гиперчувствительности) происходит перекрёстная сшивка FceRI аутоантителами к этому рецептору или перекрёстная сшивка FcyRIII агрегированными IgG. Эти IgE-независимые реакции гиперчувствительности могут развиваться под влиянием вещества P, продуктов деградации коллагена, хемокинов (ИЛ-8, MCP-1, MIP-1a, RANTES), цитокинов (ИЛ-3, GM-CSF), продуктов активированного комплемента - анафилатоксинов (C5a, C3a), лекарственных средств (опиатов, ацетилсалициловой кислоты и других НПВС, цитостатиков, рентгеноконтрастных веществ и др.), пищевых продуктов (гистаминолибераторов: рыбы, копчёностей, специй, некоторых овощей, фруктов и др.), физических факторов (физических нагрузок, переохлаждения, перегревания, инсоляции и т.д.).
АЛЛЕРГЕНЫ
Аллергены - вещества белковой и полисахаридной природы с определённой молекулярной массой: 10-70 кДа. Хотя в некоторых контекстах термины «аллерген» и «антиген» употребляют как синонимы, следует иметь в виду, что не всякий антиген может вызвать аллергическую реакцию. Аллергены отличаются некоторыми физическими и химическими свойствами, а также особенностями проникновения в организм. Ниже перечислены некоторые свойства аллергенов.
• Относительно невысокая молекулярная масса.
• Способность сорбироваться или агрегироваться в мелкие частицы и в таком виде проникать (диффундировать) в секреты слизистых оболочек и покровные ткани, без видимого травмирования покровных тканей.
• Высокая растворимость и способность легко элюировать в жидкие среды организма.
• Химическая стабильность in vivo (аллергены не метаболизируются, по крайней мере, быстро).
• Среди белков аллергенами чаще всего становятся ферменты протеазы. Небелковые вещества сами по себе не являются аллергенами, однако они способны образовывать химические соединения с собственными белками организма, приобретая тем самым свойства полноценных аллергенов.
• Аллергены проявляют своё действие в крайне малых дозах. Например, клинически значимая суммарная доза аллергенов пыльцы амброзии может составлять всего 1 мкг за год.
Классификация
Существует несколько классификаций аллергенов.
Классификация, основанная на способе попадания аллергена в организм.
• Ингаляционные аллергены (бытовая и производственная пыль, клещи домашней пыли, пыльца растений, частицы эпидермиса и шерсть животных, эпидермис и волосы человека, продукты химического производства, частицы тел насекомых, споры непатогенных микроскопических грибов).
• Пищевые аллергены (белок куриного яйца и коровьего молока, пищевые злаки, рыба и т.д.), некоторые пищевые добавки - консерванты, красители, эмульгаторы.
• Парентеральные (лекарственные средства, сыворотки, вакцины, яд перепончатокрылых насекомых, слюна кровососущих насекомых - комаров, клопов, мошек и др.).
Классификация, основанная на происхождении экзогенных аллергенов.
• Аллергены неинфекционного происхождения (бытовые, эпидермальные, пыльцевые, инсектные, пищевые, промышленные).
• Аллергены инфекционного происхождения:
◊ Бактериальные (непатогенные и патогенные бактерии, а также продукты их жизнедеятельности).
◊ Грибковые (непатогенные и патогенные грибы, а также продукты их жизнедеятельности).
◊ Вирусные (различные виды риновирусов и продукты их взаимодействия с тканями).
◊ Паразитарные (экзогенные и эндогенные антигены гельминтов).
Классификация по химическим группам.
• Белки
◊ Компоненты пищи (яйца, молоко, орехи, ракообразные, моллюски, бобовые и т.д.).
◊ Яд пчёл, ос, шершней и других перепончатокрылых.
◊ Компоненты вакцин (против кори, гриппа; столбнячный анатоксин и др.).
◊ Гормоны (инсулин, адренокортикотропный гормон, тиреотропный гормон и др.).
◊ Компоненты сывороток и препаратов крови.
◊ Ферментные препараты (стрептокиназа и др.).
◊ Латекс (хирургические перчатки, эндотрахеальные трубки, презервативы и др.).
◊ Белковые компоненты клещей домашней пыли, тараканов, пыльцы растений, выделений животных и др.
• Гаптены
◊ Антибиотики (пенициллины, цефалоспорины и др.).
◊ Миорелаксанты.
◊ Витамины (тиамин и др.).
◊ Цитостатики (цисплатин, циклофосфамид, цитарабин и
др.).
◊ Опиаты и т.д.
• Полисахариды
◊ Декстраны.
◊ Декстран-железо.
Номенклатура аллергенов. Подкомитет по номенклатуре аллергенов Международного союза иммунологических обществ [IUIS - International Union of Immunological Societies (Allergen Nomenclature Sub-Committee)] постоянно пополняет официальный список аллергенов и изоаллергенов (http://www.allergen.org). Таблица аллергенов и изоаллергенов полностью воспроизведена на диске, приложенном к учебнику. Первые 3 буквы в названии аллергена обозначают род, следующая за ними буква - вид, арабские цифры указывают порядок открытия, последующие цифры - код изоаллергена. Так, Amb a 8.0101 кодирует изоаллерген 0101 восьмого из очищенных аллергенов, полученных из Ambrosia artemisifolia.
Бытовые аллергены. Главную роль среди них играет домашняя пыль. Это сложный по своему составу аллерген, в который входят пылевые частицы (одежды, постельного белья, мебели, книг), плесневые и дрожжевые грибы, частицы домашних насекомых (отрядов таракановых, чешуекрылых, прямокрылых, перепончатокрылых, ручейников), бактерии (непатогенные стафилококки и др.). Основной аллергенный компонент домашней пыли - кле-
щи (живые, мёртвые, их линные шкурки и экскременты), среди которых большинство составляют клещи вида Dermatophagoides: D. pteronissinus, D. farinae, D. microceras. Они обитают в постелях, подушках, где питаются чешуйками рогового слоя эпидермиса человека. Бытовые аллергены вызывают чаще всего аллергические заболевания органов дыхания - аллергический ринит (АР) и бронхиальную астму (БА), а также АтД.
Эпидермальные аллергены: перхоть, шерсть, эпидермис животных, перья птиц, чешуя рыб. Так же как и бытовые аллергены, они могут быть причиной развития АР и БА. Профессиональная сенсибилизация описана у ветеринаров, парикмахеров, работников вивариев, птицеферм, овцеводов, коневодов и др.
Пыльцевые аллергены. Аллергенными свойствами чаще обладает пыльца ветроопыляемых растений, она должна быть летучей и присутствовать в воздухе в значительных количествах. Аллергены пыльцы растений - гликопротеины молекулярной массой 10-50 кДа. Диаметр пыльцевых зёрен аллергенных растений составляет 20-60 мкм. Пыльца большего диаметра (60-100 мкм и более) задерживается при вдыхании на слизистой оболочке полости носа, пыльца диаметром 20-30 мкм достигает уровня средних и мелких бронхов, а менее 3 мкм - альвеол. Пыльца растений имеет специфические для разных видов морфологические особенности, однако в пределах рода есть общие перекрёстные антигены. В каждой климатогеографической зоне есть свои виды растений, пыльца которых чаще всего вызывает развитие сезонной аллергии - поллиноза. Для каждого региона характерен свой «график» пыления.
Для средней полосы России характерны 3 основных пика пыления растений, ответственных за развитие аллергических реакций:
• весенний период (апрель - май), когда происходит пыление деревьев (среди них наиболее выраженной аллергенной активностью обладает пыльца берёзы, ольхи, орешника, дуба, ясеня);
• ранний летний период (июнь - середина июля), когда пылят злаковые травы (тимофеевка, ежа, овсяница, райграс, мятлик, костёр, рожь, кукуруза и др.);
• поздний летний и осенний (середина июля - середина сентября), когда пылят сорные травы (полынь, амброзия, лебеда, одуванчик, подсолнечник и др.).
Пищевые аллергены. Наибольшими аллергенными свойствами обладают продукты, содержащие животные и растительные белки: молоко, мясо различных животных и птиц, яйца, рыба и морепродукты, пищевые злаки, бобовые, орехи, овощи и фрукты и др. В качестве аллергенов могут выступать и добавленные к пищевым продуктам химические вещества (антиокислители, красители, ароматические и другие вещества).
Инсектные аллергены. К ним относят аллергены яда жалящих и слюны кусающих насекомых, пыль из частиц насекомых. Они вызывают как местные, так и общие аллергические реакции.
Лекарственные аллергены. Любое лекарственное средство (за исключением некоторых составных частей биологических жидкостей - натрия хлорида, глюкозы и др.) может привести к развитию ЛА. Лекарственные средства или их метаболиты служат, как правило, гаптенами. В молекуле лекарственного средства роль антигенной детерминанты может выполнять не вся молекула, а только определённая её часть. Эти участки могут быть одинаковыми у различных препаратов - общие, перекрёстно-реагирующие детерминанты (табл. 13-1). При возникновении аллергической реакции на один препарат необходимо исключать применение всех средств, имеющих общую с ним детерминанту.
Промышленные аллергены. Промышленные аллергены, как правило, гаптены, которые соединяются с белками через свою реакционноспособную группу. Чем выше способность гаптена образовывать химическую связь с белком, тем выше его аллергенная активность. Наиболее часто встречающиеся промышленные аллергены - скипидар, масла, никель, хром, мышьяк, дёготь, смолы, дубильные вещества, азонафтоловые и другие красители, танин, пирогаллол, лаки, шеллак, инсектофунгициды, фенопласты и аминопласты; вещества, содержащие бакелит, формалин, мочевину, эпоксидные смолы (аралдит), гексаметилентетрамин, гунидины, тиазолы и другие детергенты, аминобензолы, производные хинолина, гидрохинона, хлорбензола, соединения нафталина и др. В быту аллергенами могут быть компоненты моющих, чистящих, косметических средств, парфюмерные вещества, краски для волос, бровей и др. Чаще всего промышленные аллергены вызывают аллергические реакции, в основе которых лежит ГЗТ (IV тип), например, контактный дерматит.
Таблица 13-1. Общие антигенные детерминанты лекарственных средств разных групп
Аллергены инфекционного происхождения. Самые различные возбудители инфекционных заболеваний (бактериальных, грибковых, вирусных) и продукты их жизнедеятельности могут вызывать развитие аллергических процессов. Аллергические заболевания, в патогенезе которых инфекционное поражение играет ведущую роль, получили название инфекционно-аллергических. Сенсибилизация антигенами условно-патогенной и сапрофитной флоры из очагов хронического воспаления (придаточные пазухи носа, среднее ухо, кариозные зубы, миндалины, желчный пузырь и др.) может приводить к развитию некоторых форм БА, АО (отёка Квинке), крапивницы и других заболеваний. Особую роль в развитии аллергии играют грибы и их споры. Среди них есть патогенные для человека виды, вызывающие инфекционные заболевания, при которых аллергия становится частью патогенеза (аспергиллёз, актиномикоз и др.), и непатогенные, которые, попадая в организм человека
в виде спор, вызывают сенсибилизацию и развитие различных аллергических заболеваний (АР, бронхиальная астма). Такие грибымикроорганизмы (Alternaria spp., Cladosporium spp., Penicillium spp., Candida spp. и др.) содержатся в атмосферном воздухе, жилищах, домашней пыли, заплесневелых продуктах. Их концентрация зависит от времени года, влажности, температуры и других условий.
ТИПЫ РЕАКЦИЙ ГИПЕРЧУВСТВИТЕЛЬНОСТИ
Наиболее широко используется в настоящее время классификация реакций гиперчувствительности по П. Джеллу (P. Gell) и Р. Кумбсу (R. Coombs) (1969 г.), предусматривающая 4 типа таких реакций. Позже был выделен 5-й тип. В основе механизма I, II, III и V типов гиперчувствительности лежит взаимодействие антигена с антителом. Тип IV гиперчувствительности зависит от наличия сенсибилизированных лимфоцитов, несущих на своей поверхности рецепторы, специфически распознающие антиген. Этот тип реакции относят к замедленной гиперчувствительности. Ниже приведена краткая характеристика разных типов реакций гиперчувствительности по упомянутой классификации (рис. 13-1). • Тип I (анафилактический, IgE-зависимый). Обусловлен образованием особого типа антител, имеющих высокое сродство к определённым клеткам (например, тучным клеткам, базофилам). Эти антитела называют гомоцитотропными [к ним относят реагины (IgE и IgG4) человека], поскольку у них выражена тропность к клеткам (тканям) того же вида животного, от которого они получены. Попадая в организм, аллерген фрагментируется в АПК до пептидов, презентируемых затем этими клетками Th2-лимфоцитам. Тh2-клетки, в свою очередь, активизируясь, продуцируют ряд лимфокинов, в частности ИЛ-4 (и/или альтернативную молекулу - ИЛ-13), ИЛ-5, ИЛ-6, ИЛ-10, а также экспрессируют на своей поверхности лиганд для CD40 (CD40L или CD154), что обеспечивает необходимый сигнал для В-клеток к индукции синтеза IgE. Образовавшийся аллергенспецифический IgE взаимодействует с имеющими к ним очень высокое сродство специализированными рецепторами FcεRI (расположены на тучных клетках слизистых оболочек и соединительной ткани, базофилах), а также низкоаффинных FcεRII (CD23; экспрессированы на
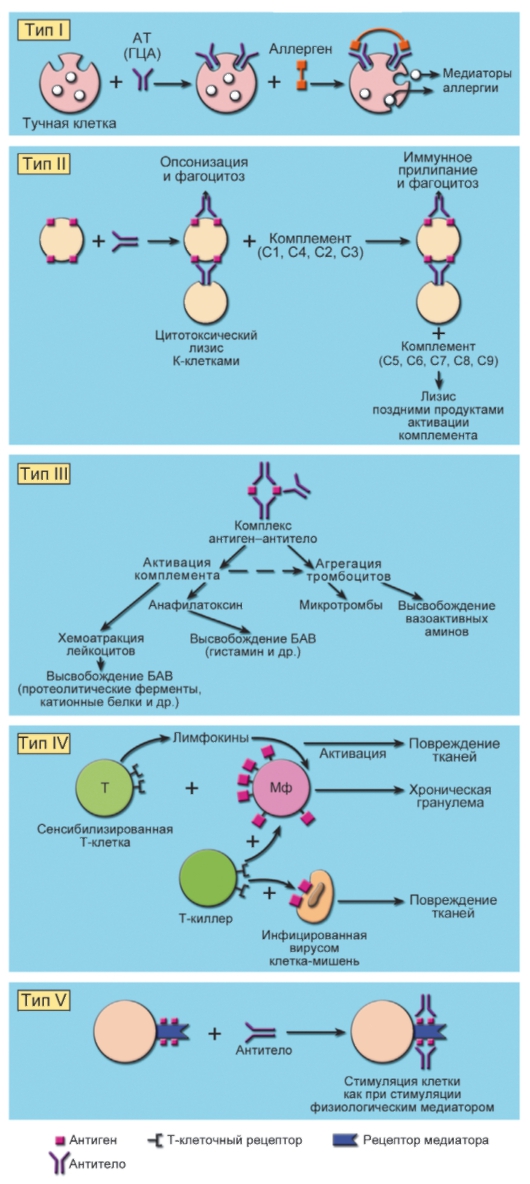
Рис. 13-1. Типы реакций гиперчувствительности: ГЦА - гомоцитотропные антитела; Мф - макрофаг; БАВ - биологически активные вещества
поверхности В-лимфоцитов, моноцитов, эозинофилов и, возможно, Т-лимфоцитов). CD23 может отделяться с клеточных мембран и попадать в циркуляцию, стимулируя продукцию IgE В-лимфоцитами. При повторном поступлении аллерген связывается IgE-антителами, что вызывает цепь биохимических превращений мембранных липидов (патохимическую фазу), следствием которых является секреция медиаторов, таких как гистамин, метаболиты арахидоновой кислоты (простагландин D2, сульфидопептидные лейкотриены: C4, D4, E4), ФАТ и происходит активация плазменных кининов. Медиаторы, взаимодействуя с рецепторами органов-мишеней, индуцируют патофизиологическую фазу атопической реакции: повышение сосудистой проницаемости и отёк ткани, сокращение гладкой мускулатуры, гиперсекрецию слизистых желёз, раздражение периферических нервных окончаний. Эти изменения составляют основу быстрой (ранней) фазы аллергической реакции, развивающейся в течение первых минут после контакта с аллергеном. Подготовка миграции клеток из сосудов в ткань обеспечивается изменением кровотока в микрососудах и экспрессией молекул клеточной адгезии на эндотелии и лейкоцитах. Последовательное вовлечение в процесс молекул адгезии и хемокинов приводит к инфильтрации тканей базофилами, эозинофилами, Т-лимфоцитами, тучными клетками, клетками Лангерганса. После активации они тоже секретируют проаллергические (провоспалительные) медиаторы, что формирует позднюю (или отсроченную) фазу аллергической реакции. Типичные примеры этого вида реакций - атопическая БА, АР, аллергический конъюнктивит (АК), аллергическая крапивница, АШ и др. • Тип II (цитотоксический, или цитолитический) - антителозависимая цитотоксическая гиперчувствительность. При этом виде реакции антитела взаимодействуют с естественными антигенами клеточных поверхностей или же с антигенами, вторично сорбированными на клеточной поверхности. Повреждение и лизис клеток происходят вследствие активации образующимся комплексом антиген-антитело системы комплемента по классическому пути. Пример такого типа цитотоксической реакции - гемотрансфузионные реакции, возникающие вследствие несовместимости групп крови. В этом случае в качестве
антигенов, с которыми взаимодействуют антитела, выступают естественные клеточные структуры. Антигены, служащие мишенью для антител, могут быть представлены внеклеточными структурами. Такая ситуация возникает при нефротоксическом нефрите, когда антитела взаимодействуют с антигенами базальной мембраны почечных клубочков. В других случаях (например, при лекарственной тромбоцитопенической пурпуре) антитела взаимодействуют с антигенами (лекарственное средство или продукт его метаболизма), включёнными в состав клеточной поверхности.
◊ К этому же типу гиперчувствительности могут быть отнесены реакции, при которых в результате взаимодействия антигенов с антителами происходит опсонизация клеточной поверхности (Fc-фрагментом антител, ориентированным наружу) или иммунная адгезия (за счёт фиксации С3-компонента комплемента), что подготавливает фагоцитоз.
◊ Наконец, к типу II гиперчувствительности может быть отнесена и антителозависимая опосредованная клетками цитотоксичность (АЗКЦ). В этом случае лизис клеток наступает в результате действия на них клеток-киллеров (К-клеток, например ЦТЛ, NK-клеток), вовлекаемых в реакцию молекулами антител, соединёнными антигенсвязывающим участком с поверхностью клетки-мишени, а Fc-фрагментом - с соответствующим FcR клетки-киллера. В этом случае лизис осуществляется без участия комплемента.
• Тип III гиперчувствительности - опосредованная образованием иммунных комплексов. При этом типе реакции растворимые антигены взаимодействуют с антителами (преципитирующие антитела) не на клеточных поверхностях, а в растворимой форме. В результате образуются иммунные комплексы, что приводит к активации комплемента и агрегации тромбоцитов со всеми последующими событиями, приводящими к повреждению тканей. Примеры таких реакций - сывороточная болезнь и феномен Артюса.
• Тип IV - ГЗТ (опосредованная клетками или антителонезависимая). В основе этого типа гиперчувствительности лежит взаимодействие T-лимфоцитов, несущих на своей поверхности специфические рецепторы (сенсибилизированные
T-лимфоциты), с презентированным на макрофаге антигеном, что стимулирует T-клетку и вызывает высвобождение ею цитокинов, опосредующих внешние проявления замедленной гиперчувствительности. Классические примеры таких реакций - туберкулиновая реакция, контактная аллергия. Если действие лимфоцитов направлено против вирусов, инфицирующих клетки, или против трансплантационных антигенов, стимулированные лимфоциты трансформируются в бластные клетки, обладающие свойствами клеток-киллеров по отношению к клеткам-мишеням, несущим данный антиген. К этим реакциям относят аллергию, формирующуюся при некоторых инфекционных заболеваниях, реакцию отторжения трансплантата, некоторые виды аутоиммунных поражений. Невозможность элиминации антигена приводит к накоплению в ткани макрофагов и образованию характерных гранулём. • Тип V гиперчувствительности (этот тип выделяют не во всех классификациях). В отличие от типа II в реакциях типа V участвуют антитела, не обладающие комплементсвязывающей активностью и направленные против рецепторов на клеточной поверхности. Связывание этих антител вызывает либо блокаду, либо активацию рецепторов, приводящую к нарушению физиологических путей передачи сигнала от них. Если задействованы рецепторы, участвующие в физиологической активации клетки, то можно ожидать, что будет происходить стимуляция данного типа клеток со всеми вытекающими последствиями. Такие реакции развиваются при действии на клетку антител, направленных против рецепторов физиологических медиаторов. Примером могут быть антитела, взаимодействующие с антигенными структурами, расположенными вблизи или в самом рецепторе тиреотропного гормона. Воздействие таких антител на тиреоидные клетки приводит к реакции, аналогичной действию самого гормона: к активации аденилатциклазы клеточной мембраны и затем - к стимуляции цАМФ в тиреоидных клетках. В этом случае развивается тиреотоксикоз, сопровождающий аутоиммунное заболевание - болезнь Грейвса (см. главу 14). Блокада передачи сигнала с рецепторов также приводит к развитию патологических процессов. Пример такого рода - аутоиммунное заболевание myasthenia gravis. В этом случае антитела наруша-
ют передачу с ацетилхолиновых рецепторов, что приводит к прогрессирующей мышечной слабости (см. главу 14).
В формирование клинических проявлений аллергии и развитие отдельных нозологических форм вовлечены, как правило, не один, а несколько типов гиперчувствительности. Например, в анафилактических реакциях (помимо основного, ведущего - типа I) может участвовать и тип II, а при ЛА удаётся выявить признаки всех 4 типов гиперчувствительности.
Все реакции гиперчувствительности можно разделить на 3 типа в зависимости от временного интервала между моментом контакта сенсибилизированного организма с антигеном и возникновением внешних (клинических) проявлений аллергической реакции. Это реакции немедленные, поздние (отсроченные) и замедленные.
• Немедленные реакции возникают через несколько минут (или быстрее) после контакта с антигеном. К немедленным реакциям относят гладкомышечные и сосудистые реакции, обусловленные выбросом в ограниченный участок тканей (при местном процессе) или в кровь (при системном процессе) биологически активных медиаторов тучных клеток и базофилов при их активации и дегрануляции.
• Поздние реакции (отсроченные реакции) развиваются через несколько часов.
• Замедленные реакции развиваются через 2-3 сут. Замедленные реакции гиперчувствительности проявляются воспалением с участием лимфоцитов: ГЗТ (Th1-клетки, макрофаги), ЦТЛ, антителозависимой клеточной цитотоксичности и др. (типы II, III и IV по классификации Джелла и Кумбса).
◊ В развитие реакций немедленного и позднего типа вовлечены различные виды антител, присутствующие в сыворотке крови, и соответственно которые могут быть перенесены от одного (сенсибилизированного) организма другому (несенсибилизированному) с сывороткой.
◊ Реакции замедленного типа связаны с присутствием сенсибилизированных клеток, и потому их возможно перенести реципиенту не с сывороткой крови, а только с клетками.
В развитии аллергических реакций разных типов выделяют 3 стадии.
• Иммунологическая стадия, во время которой происходит ответ на внедрение аллергена (образование антител и/или) сенси-
билизированных лимфоцитов и соединение их с повторно поступившим или персистирующим в организме аллергеном).
• Патохимическая стадия, состоящая в образовании и высвобождении теми или иными активированными клетками медиаторов аллергических реакций.
• Патофизиологическая стадия заключается в действии этих медиаторов на различные периферические ткани и клетки, а также в развитии внешних (клинических) проявлений гиперчувствительности.
ИММУНОГЛОБУЛИН Е. РЕГУЛЯЦИЯ СИНТЕЗА И СЕКРЕЦИИ
IgE - гликопротеин с молекулярной массой 190 кДа и коэффициентом седиментации 8S. Аналогично другим иммуноглобулинам молекула IgE состоит из 4 цепей - 2 лёгких и 2 тяжёлых. Тяжёлые цепи е-типа, определяющие изотипическую принадлежность этого белка, содержат 5 доменов (1 вариабельный и 4 константных). При расщеплении папаином образуются Fc-фрагмент, содержащий 2 е-антигенные детерминанты, и 2 Fab-фрагмента, в которые входят связывающие антиген участки. Третичная структура Fc-фрагмента обеспечивает способность молекулы фиксироваться на высокоаффинном FcεRI-рецепторе мембраны тучных клеток и базофилов.
Высокоаффинный рецептор FcεRI для IgE состоит из α-, βи двух γ-цепей, из которых только α-цепь связывает IgE, α β- и γ-цепи участвуют в передаче сигнала при связывании IgE с аллергеном, что приводит в конечном итоге к высвобождению медиаторов из клетки. Низкоаффинный FcεRII-рецептор (CD23) экспрессирован на поверхности В-лимфоцитов, моноцитов/макрофагов, тромбоцитов и эозинофилов. Экспрессию рецептора усиливает ИЛ-4. Рецептор FceRII расщепляется с образованием растворимой формы (sCD23), сохраняющей способность связывать IgE и играющей регуляторную роль в образовании IgE. Естественные лиганды sCD23 - CD21, рецептор для вируса Эпштейна-Барр, известный также как рецептор для комплемента CR2, представленный на В-клетках, ДК и Т-лимфоцитах (см. табл. 3-2).
В результате всесторонних исследований регуляции образования IgE получены данные, позволившие раскрыть иммунологиче-
ские механизмы атопического фенотипа. Основную роль в переключении синтеза тяжёлых цепей иммуноглобулинов (см. главу 5) на тип e играет растворимый медиатор ИЛ-4. Кроме того, наряду с ИЛ-4 также необходим второй сигнал, обеспечиваемый прямым контактом с CD4+ Т-хелпером, а именно взаимодействие CD40 на активированных Т-клетках с рецептором для CD40 на В-клетках. Функциональный антагонист ИЛ-4 - ИФНу. Действуя на те же самые механизмы, он угнетает выработку IgE. Подавляют синтез IgE также ИФНα, ТФРβ, ИЛ-8, ИЛ-12 (рис. 13-2).
Известны 2 типа Т-хелперных клеток (Th1 и Th2), различающиеся по спектру вырабатываемых цитокинов: Th1-клетки вырабатывают ИЛ-2, ФНОа и ИФНу, тогда как Th2-клетки продуцируют ИЛ-4, ИЛ-5, ИЛ-6 и ИЛ-10. Th2-клеткам отводят ведущую роль в поддержании хронического воспаления. Именно с преобладанием у атопических индивидуумов Th2-клеток и образованием ИЛ-4 ассоциирована способность к гиперпродукции IgE, а с выработкой ИЛ-5 - пролиферация и активация эозинофилов. Образуемые активированными Th2-клетками ИЛ-4 и ИЛ-10 наряду со стимуляцией IgE-ответа оказывают угнетающее действие на Th1-хелперы. При этом отменяется контроль Th1-клеток за активностью
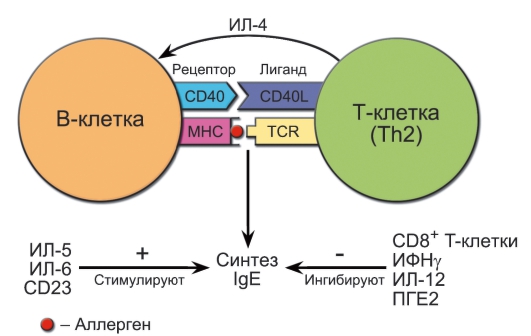
Рис. 13-2. Регуляция образования IgE у человека
Th2-лимфоцитов, осуществляемый посредством реципрокного действия ИФНγ. Вместе с выработкой ИЛ-4 это приводит к персистирующей гиперпродукции IgE при продолжающемся воздействии аллергена, что замыкает порочный круг заболевания.
В норме IgE-антитела играют важную роль в противогельминтной защите человека. В качестве эффекторных клеток в этом процессе участвуют эозинофилы, макрофаги и тромбоциты. Они связывают IgE и IgE-содержащие иммунные комплексы посредством FceRII-рецепторов и выделяют при этом активные метаболиты кислорода, лизосомальные ферменты, лейкотриены (LT) и ФАТ, атакующие возбудитель.
Уровень общего IgE в сыворотке может быть значительно повышен при АтД, коррелируя с тяжестью заболевания, при аллергическом бронхолёгочном аспергиллёзе (АБЛА), глистных инвазиях, микозах, некоторых лимфопролиферативных заболеваниях и др. У больных АР, БА или поллинозом содержание IgE может не превышать нормальных значений, в связи с чем уровень общего IgE в сыворотке не может служить специфическим чувствительным диагностическим тестом на наличие этих заболеваний.
МЕДИАТОРЫ ГИПЕРЧУВСТВИТЕЛЬНОСТИ НЕМЕДЛЕННОГО ТИПА
Высвобождаемые из активированных тучных клеток и базофилов медиаторы условно можно разделить на две группы. Первую группу составляют вещества, предсуществующие в клетке до её активации и находящиеся в связанном с гранулярным матриксом состоянии. В ходе активации клетки происходит вытеснение этих медиаторов с гранулярного матрикса и высвобождение их во внеклеточную среду. По видам функциональных свойств медиаторы могут быть веществами, обладающими вазоактивным действием, способностью вызывать сокращение гладкой мускулатуры и стимулировать периферические нервные окончания, ферментативной активностью, хемотаксическим и иммунотропным действием и др. Один и тот же медиатор может проявлять несколько видов активности.
Основные предсуществующие, быстро высвобождаемые при активации клеток медиаторы и их действие:
• гистамин: повышение сосудистой проницаемости; гиперсекреция слизи; сокращение гладкой мускулатуры; зуд (H1); об-
разование простагландинов; повышение уровня цАМФ (Н2), или цГМФ (H1), или торможение (Н2) хемотаксиса нейтрофилов и эозинофилов, [ингибиторами/инактиваторами служат блокаторы H1- и Н2-рецепторов гистамина; гистаминаза (диаминоксидаза); гистамин-метилтрансфераза];
• эозинофильный хемотаксический фактор анафилаксии (ЭХФА): хемоаттракция и инактивация эозинофилов и нейтрофилов (ингибиторами/инактиваторами служат аминопептидаза; карбоксипептидаза А);
• ЭХФА-олигопептиды: хемоаттракция эозинофилов и мононуклеарных лейкоцитов; инактивация эозинофилов;
• нейтрофильный хемотаксический фактор: хемоаттракция и инактивация нейтрофилов;
• арилсульфатаза А: гидролиз ароматических сульфатных эфиров (ионы РО4, SO4).
Предсуществующие, прочно связанные с гранулами медиаторы:
• гепарин: антикоагуляция; торможение активации комплемента; высвобождение липопротеинлипазы и фосфолипазы (протамин, гепариназа);
• химаза: гидролиз протеогликанов; повышение сосудистой проницаемости;
• триптаза: генерация C3a анафилатоксина; протеолиз; деградация кининогена;
• пероксидаза: инактивация лейкотриенов;
• супероксиддисмутаза: дисмутация О2 в пероксид водорода [диэтилдитиокарбамат (имутиол)].
Помимо предсуществующих медиаторов, из активированных клеток высвобождаются продукты, образуемые (преимущественно из липидных предшественников) в ходе активации клеток. Кроме того, тучные клетки и базофилы являются источниками образования и секреции цитокинов, в частности ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-13. Базофилы также синтезируют, содержат и секретируют ИЛ-4 (но не ИЛ-3, ИЛ-5, ИЛ-10, GM-CSF), ИЛ-13, макрофагальный белок воспаления MIP-1α.
Образуемые в ходе активации клетки и высвобождаемые из неё медиаторы составляют вторую обширную группу посредников аллергической реакции:
• лейкотриены C4, D4, E4: сокращение гладкой мускулатуры, повышение проницаемости стенок сосудов; синергизм с ги-
стамином; генерация простагландинов; сокращение сосудов (С4); расширение сосудов (D4, E4) (арилсульфатаза А и В, пероксидаза, пероксиды);
• простагландин D2: сокращение гладкой мускулатуры; повышение артериального давления; повышение уровня цАМФ (блокада синтеза НПВС, специфическая дегидрогеназа);
• тромбоксан А2: сокращение гладкой мускулатуры; стимуляция агрегации тромбоцитов;
• эндопероксиды (G2, H2): сокращение гладкой мускулатуры;
• фактор, активации тромбоцитов (ФАТ): агрегация тромбоцитов, высвобождение из них аминов; повышение проницаемости стенок сосудов;
• простагландингенерирующий фактор: индукция образования простагландинов, тромбоксана В2;
• базофильный калликреин анафилаксии (в базофилах): бронхоспазм; расширение сосудов; повышение сосудистой проницаемости; боль (ингибиторами/инактиваторами служат карбоксипептидаза, химотрипсин).
ПРИНЦИПЫ ДИАГНОСТИКИ АЛЛЕРГИЧЕСКИХ ЗАБОЛЕВАНИЙ
Диагностика направлена на выявление причин и факторов, способствующих формированию и манифестации аллергических заболеваний. Для этого применяют специфические и неспецифические методы обследования.
Начинают диагностику всегда с выяснения жалоб и сбора аллергологического анамнеза, особенности которых нередко позволяют предположить предварительный диагноз, изучения истории жизни и болезни, которые осуществляет врач во время осмотра пациента.
Клинические методы обследования включают врачебный осмотр, клинико-лабораторные, рентгенологические, инструментальные, функциональные и другие методы исследования (по показаниям).
Основной принцип специфической диагностики аллергических заболеваний - выявление причинно-значимого аллергена, для чего определяют аллергические антитела (специфические IgE) или
сенсибилизированные лимфоциты и продукты специфического взаимодействия антигенов и антител.
Специфическое аллергологическое обследование включает:
• сбор аллергологического анамнеза;
• проведение кожных тестов;
• проведение провокационных тестов;
• лабораторную диагностику.
Сбор аллергологического анамнеза
При опросе больного особое внимание обращают на особенности развития первых симптомов заболевания, их интенсивность, динамику развития, длительность и чувствительность к назначаемым фармакотерапевтическим средствам.
Выясняют семейный анамнез аллергии, поскольку известно, что у 30-70% больных с аллергическими заболеваниями близкие родственники страдают аллергией.
При сборе анамнеза отмечают наличие или отсутствие сезонности заболевания, его связь с простудой, изменением климатических, жилищных или рабочих условий. Например, указание на ежегодное развитие респираторных проявлений (ринорея, заложенность носа, приступы удушья и др.) и/или зуда век, слезотечения в одни и те же периоды времени (весенние или летние месяцы, в сезон цветения определённых растений) характерно для поллиноза, и в план обследования таких больных включают методы тестирования с пыльцевыми аллергенами. Для больных с инфекционно-аллергической формой БА характерно обострение аллергического заболевания на фоне острых респираторных вирусных или бактериальных инфекционных заболеваний, особенно в холодное время года.
Необходимо выяснить жилищно-бытовые условия больного, наличие в квартире мягкой мебели, ковров, книг, домашних животных, рыб, птиц, а также вызывает ли контакт больного с домашней пылью, животными и другими аллергенами обострение заболевания.
Отдельно собирают пищевой анамнез (связь симптомов с употреблением каких-либо пищевых продуктов) и фармакологический анамнез (связь развития реакции с приёмом препаратов, её длительность, объём лечения и его эффективность).
Анализ пищевого дневника. Для диагностики пищевой аллергии больного просят вести пищевой дневник, в котором указывается
дата, время приёма пищи, название продукта с учётом объёма и способа приготовления, характер симптомов с указанием времени их появления и динамикой состояния в течение дня, характер стула, а также применяемые медикаменты и их эффективность.
Правильно собранный анамнез позволяет не только выяснить характер заболевания, но и предположить его этиологию, т.е. виновный аллерген или группу аллергенов.
Эти предположения должны быть подтверждены специфическими методами обследования - кожными, провокационными и другими тестами.
Кожные тесты
Существуют разные методы кожного тестирования с аллергенами in vivo: prick-тесты (тесты уколом), скарификационные тесты, аппликационные тесты, внутрикожные тесты. Кожное тестирование с ингаляционными и пищевыми аллергенами проводят для диагностики только IgE-зависимых аллергических заболеваний.
Для кожного тестирования используют стандартные серийные, содержащие 10 тыс. единиц белкового азота (PNU - Protein Nitrogen Unit) в 1 мл, водно-солевые экстракты аллергенов. Эти экстракты приготавливают из пыльцы растений, домашней пыли, клещей домашней пыли, шерсти, пуха, эпидермиса животных и птиц, пищевых и других продуктов.
Противопоказания для проведения кожных тестов.
• Обострение основного заболевания.
• Острые интеркуррентные инфекционные заболевания.
• Туберкулёз и ревматизм в период обострения.
• Нервные и психические заболевания в период обострения.
• Болезни сердца, печени, почек и системы крови в стадии декомпенсации.
• АШ в анамнезе.
• Беременность и период лактации.
Не рекомендуется проведение аллергологического обследования в полном объёме детям до 3-летнего возраста, больным в период лечения глюкокортикоидами и блокаторами Н1-рецепторов гистамина (снижают кожную чувствительность), а также после острой аллергической реакции, поскольку в этот период пробы могут оказаться отрицательными из-за истощения в коже сенсибилизирующих антител.
Наиболее часто применяют prick-тесты или скарификационные тесты, которые ставят на внутренней поверхности предплечий на расстоянии 3-5 см друг от друга. Обязательны тесты на отрицательный (с тест-контрольной жидкостью) и положительный контроль (с гистамином). Оценку проб проводят через 20 мин, учитывая при этом наличие/отсутствие гиперемии и размер волдыря.
Внутрикожные пробы более чувствительны, но отличаются меньшей специфичностью, их используют главным образом для выявления сенсибилизации к аллергенам бактериального и грибкового происхождения.
Аппликационные пробы (patch-тесты) проводят с помощью стандартных наборов химических аллергенов для тестирования для диагностики аллергического контактного дерматита (определение ГЗТ - IV тип реакций).
Провокационные тесты
Провокационные тесты используют при расхождении данных анамнеза и результатов кожного тестирования. Противопоказания для проведения провокационных тестов те же, что и для кожного тестирования.
В зависимости от вида аллергена и способа его введения в организм выделяют провокационные тесты: конъюнктивальный, назальный, ингаляционный, подъязычный и пероральный. Для диагностики ЛА применяют тест торможения естественной эмиграции лейкоцитов
in vivo (ТТЕЭЛ), разработанный А.Д. Адо.
Методы лабораторной диагностики
Основные показания для назначения лабораторных методов специфической аллергодиагностики, проводимых in vitro:
• ранний детский возраст;
• высокая степень сенсибилизации пациента;
• наличие противопоказаний к проведению кожного тестирования;
• непрерывно рецидивирующее течение заболевания без периодов ремиссии;
• невозможность отмены антигистаминных и других препаратов, влияющих на кожную чувствительность;
• поливалентная сенсибилизация, когда невозможно провести тестирование in vivo сразу со всеми предполагаемыми аллергенами в ограниченные сроки обследования;
• резко изменённая реактивность кожи;
• ложноположительный или ложноотрицательный результат при кожном тестировании;
• уртикарный дермографизм.
В клинической практике наиболее широко применяют следующие методы специфической диагностики аллергии, проводимые in vitro:
• иммуноферментные методы анализа для выявления специфических IgE с колориметрическим, флюориметрическим и хемилюминесцентным способом регистрации результатов;
• радиоаллергосорбентный тест (PACT) для выявления специфических IgE;
• непрямой базофильный тест (тест Шелли);
• прямой базофильный тест (тест Шелли);
• реакция специфического высвобождения гистамина из базофилов периферической крови пациента.
Данные методы лабораторной диагностики позволяют выявить только состояние сенсибилизации (наличие или отсутствие специфических IgE-антител к аллергенам без учёта клинических проявлений). Методы лабораторной диагностики рассматривают в качестве дополнительных мер, позволяющих уточнить сомнительные результаты тестирования in vivo.
При постановке диагноза нужно опираться главным образом на жалобы пациента, данные аллергоанамнеза, осмотра больного, кожного тестирования, а также на результаты общеклинического обследования пациента.
ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКИХ ЗАБОЛЕВАНИЙ
Лечение пациентов с аллергическими заболеваниями подразумевает проведение мероприятий, направленных на элиминацию причинно-значимого аллергена, фармакотерапию и аллергенспецифическую иммунотерапию.
Элиминация аллергенов
Элиминацию (удаление) причинно-значимых аллергенов относят к патогенетическим методам лечения при всех аллергических заболеваниях.
В лечении пищевой аллергии элиминация заключается в назначении диеты, не содержащей пищевого аллергена.
Пациентам, страдающим ЛА, рекомендуют избегать приёма лекарственных средств, к которым имеется сенсибилизация, содержащих их комбинированных препаратов, а также лекарственных средств, имеющих аналогичную химическую структуру (см. табл. 13-1).
В случае ингаляционной аллергии полное исключение контакта с аллергеном невозможно. Однако даже частичное выполнение мер, направленных на элиминацию аллергена, облегчает течение заболевания, уменьшает потребность в противоаллергических препаратах. Особенно важно проводить эти мероприятия при наличии серьёзных ограничений для медикаментозного лечения (беременность, лактация, ранний детский возраст, тяжёлые сопутствующие заболевания).
Комплекс мероприятий, направленных на элиминацию домашней пыли, позволяет уменьшить аллергенную нагрузку на пациента с бытовой сенсибилизацией. В частности, следует содержать квартиру в чистоте, рекомендуется убрать мягкую мебель, шерстяные ковры, старые шерстяные вещи и драпировки, подушки и одеяла заменить на синтетические. Рекомендуется использование акарицидных средств, уничтожающих клещей.
Не рекомендуется держать в квартире животных и разводить цветы. Следует проводить 1-2 раза в неделю влажную уборку квартиры. Обязательное условие - запрет на курение в квартире и использование различных дезодорантов, лаков и других косметических средств, вызывающих раздражение слизистой оболочки дыхательных путей.
Больным с грибковой сенсибилизацией следует избегать пребывания в сырых помещениях, из рациона необходимо исключить все пищевые продукты, подвергаемые в процессе приготовления ферментации (например, сыры, пиво, вино, квас, газированные напитки).
При повышенной чувствительности к пыльцевым аллергенам следует рекомендовать пациентам выезжать в другую климатическую зону, не употреблять в пищу продукты, которые могут вызы-
вать перекрёстные реакции; не использовать лекарственные и косметические средства растительного происхождения (табл. 13-2).
Таблица 13-2. Возможные перекрёстные аллергические реакции на пищевые продукты, лекарственные средства и лекарственное растительное сырьё при пыльцевой и грибковой сенсибилизации
Всем пациентам, страдающим аллергией, особенно лекарственной или инсектной, нужно выдавать паспорт больного аллергическим заболеванием, который служит не только памяткой для
больного и врача, но и руководством, которым можно воспользоваться в неотложных ситуациях. В паспорте фиксируют фамилию, имя, отчество пациента, его возраст, диагноз, спектр аллергенов, к которым он сенсибилизирован, а также перечень мероприятий по устранению контакта с причинными аллергенами. В паспорте больного, перенёсшего АШ на ужаление перепончатокрылыми насекомыми, должны быть указания на необходимость иметь при себе аптечку с перечнем лекарственных средств, шприца-укладки и мероприятий по оказанию неотложной помощи в сезон вылета насекомых. В паспорте указывают адрес и телефон аллергологического кабинета (стационара), где наблюдается больной, и подпись врача, выдавшего паспорт.
Фармакотерапия аллергических заболеваний
Основные группы лекарственных средств, используемых в фармакотерапии аллергических заболеваний:
• антигистаминные лекарственные средства - блокаторы Н1-рецепторов гистамина, или обратные агонисты Н1-гистаминовых рецепторов (системного действия и топические), и препараты, повышающие способность сыворотки крови связывать гистамин;
• стабилизаторы мембран тучных клеток (кромоны и кетоти-
фен);
• глюкокортикоиды (системного действия и топические);
• бронхорасширяющие лекарственные средства;
• адреностимуляторы;
• комбинированные препараты;
• антагонисты лейкотриеновых рецепторов;
• анти-IgЕ-антитела.
Антигистаминные средства
Блокаторы Н1-рецепторов гистамина. В настоящее время известно более 150 препаратов - блокаторов Н1-рецепторов гистамина. Можно выделить 2 группы этих препаратов: блокаторы Н1-рецепторов гистамина 1-го поколения (гидроксизин, дифенгидрамин, хифенадин, клемастин, мебгидролин, прометазин, хлоропирамин, ципрогептадин), характеризующиеся низкой селективностью и продолжительностью действия в течение 4-12 ч, и блокаторы Н1-рецепторов гистамина 2-го поколения (акривастин, лоратадин, мизоластин, це-
тиризин, эбастин), обладающие высокой селективностью и продолжительностью действия в течение 18-24 ч. К последним также относят конечные метаболиты, обладающие высокой селективностью действия и продолжительностью эффекта в течение 24 ч: дезлоратадин - метаболит лоратадина, левоцетиризин - левовращающий метаболит гидроксизина и фексофенадин - метаболит терфенадина. Блокаторы Н1-рецепторов снижают реакцию организма на гистамин, снимают обусловленный этим медиатором спазм гладкой мускулатуры, уменьшают проницаемость капилляров и отёк тканей, снимают гипотензивный эффект, вызванный гистамином, и устраняют другие его эффекты.
Антигистаминные препараты 1-го поколения - конкурентные блокаторы Н1-рецепторов, т.е. связывание их с рецепторами быстро обратимо. Именно поэтому для получения клинического эффекта необходимо использовать эти препараты в высоких дозах 3-4 раза в сутки. При таком режиме дозирования чаще проявляются и нежелательные эффекты классических блокаторов Н1-рецепторов. Антигистаминные препараты 1-го поколения легко проникают через гематоэнцефалический барьер благодаря своей липофильности и электростатическому заряду. Кроме блокады Н1-рецепторов, эти препараты блокируют мускариновые холинорецепторы, серотониновые и а-адренергические рецепторы, что может вызывать сонливость и другие нежелательные проявления со стороны ЦНС (головокружение, нарушение координации и др.), сухость слизистых оболочек, нарушение зрения, дисфункцию пищеварительного тракта, нарушение мочеиспускания. Также для этой группы препаратов характерен эффект тахифилаксии (снижения терапевтической эффективности) при длительном их применении (более 10 сут).
Многолетний опыт эффективного использования блокаторов Н1-рецепторов гистамина 1-го поколения (более 50 лет) определил их место в клинической практике. Некоторые нежелательные эффекты препаратов этой группы в определённых клинических ситуациях могут оказаться даже полезными. Например, седативный эффект при интенсивном кожном зуде и связанном с этим нарушением сна у больных аллергодерматозами, местноанестезирующий эффект и др. Наличие инъекционных лекарственных форм блокаторов Н1-рецепторов гистамина 1-го поколения делает их незаменимыми в острых и неотложных ситуациях.
Антигистаминные препараты 2-го поколения связываются с Н1-рецепторами неконкурентно. Такие взаимодействия разрушить сложно, а образовавшийся комплекс лиганд-рецептор диссоциирует сравнительно медленно, чем и объясняется более продолжительное действие таких препаратов (24 ч) и возможность однократного приёма в сутки. Для этой группы препаратов характерны непроходимость через гематоэнцефалический барьер и отсутствие седативного эффекта; отсутствие тахифилаксии. Для некоторых лекарственных средств 2-го поколения, помимо антигистаминного и антиаллергического действия, описан и противовоспалительный эффект, заключающийся в ингибировании медиаторов воспаления (провоспалительных цитокинов, хемокинов, молекул адгезии).
Препараты, повышающие способность сыворотки крови связывать гистамин [гистаглобулин♠ (гистамин + иммуноглобулин человека нормальный), гистаглобин♠] - комбинированные препараты, состоящие из нормального человеческого иммуноглобулина и гистамина гидрохлорида, при введении которого повышается способность сыворотки инактивировать свободный гистамин. Также происходит подавление высвобождения гистамина из тучных клеток за счёт угнетения IgE-опосредованной реактивности базофилов.
Стабилизаторы мембран тучных клеток: кромоглициевая кислота (кромоны - препараты кромоглициевой кислоты), лодоксамид, недокромил.
Механизм действия стабилизаторов мембран тучных клеток обусловлен торможением высвобождения из клеток-мишеней (особенно из тучных клеток) медиаторов аллергии - гистамина и других биологически активных веществ. Противоаллергический эффект кромонов многокомпонентный: он связан с торможением трансмембранного транспорта ионов кальция внутрь клетки (и соответственно зависимых от ионов кальция активационных процессов) и с торможением активности фосфодиэстеразы (и соответственно с приростом содержания внутриклеточного цАМФ, что объясняет угнетение IgE-зависимой секреции медиаторов). Действие этих препаратов распространяется на многие клетки, участвующие в аллергическом ответе (тучные клетки, эозинофилы, базофилы, макрофаги, тромбоциты), они тормозят все фазы аллергической реакции.
Натрия кромогликат♠ (кромоглициевая кислота) длительно присутствует на слизистой оболочке, медленно абсорбируется,
обеспечивая тем самым длительность действия. Высокая степень ионизации молекулы натрия кромогликата♠ объясняет его экскрецию в неизменном виде (этот препарат не проникает в клетки, не метаболизируется). Тем же свойством объясняется чрезвычайно низкая частота побочных эффектов и хороший профиль безопасности препарата. Существуют формы для эндобронхиального, интраназального применения, глазные капли, а также форма для приёма внутрь (при пищевой аллергии). Лодоксамид выпускается в форме глазных капель. Недокромил натрия сходен по химической структуре и механизму действия с натрия кромогликатом, однако эффективнее его в 4-10 раз при предупреждения развития бронхиальной обструкции и аллергических реакций. Недокромил натрия выпускается в форме для эндобронхиального применения.
Для достижения лечебного эффекта необходимо регулярное продолжительное, а при лечении поллиноза - заблаговременное введение рекомендуемых терапевтических доз препаратов этой группы.
Специальную группу препаратов составляют блокаторы Н1-рецепторов гистамина, обладающие стабилизирующим действием на эффекторные клетки-мишени (тучные клетки) - азеластин, кетотифен, оксатомид. Обычно наблюдаемые побочные эффекты от применения этих препаратов оказываются характерными для антагонистов Н1-рецепторов.
В определённых клинических ситуациях оправдано применение блокаторов Н1-рецепторов местного действия (например, азеластина). Разовые дозы Н1-антагонистов этой группы несравненно ниже требуемых для системного использования. Однако местное применение не снимает системных проявлений аллергии.
Глюкокортикоиды
Глюкокортикоиды обладают противоаллергическим, противовоспалительным и иммуносупрессивным действием.
Глюкокортикоиды путём пассивной диффузии проникают через клеточную мембрану в цитоплазму клетки, где связываются рецепторами глюкокортикоида. Образовавшийся комплекс гормон-рецептор перемещается в клеточное ядро, где связывается с коактивирующими молекулами и чувствительным элементом генов, обусловливая геномный эффект глюкокортикоидов. В результате в клетке активируются процессы транскрипции (трансактивации)
генов и образование белков, обладающих противовоспалительным эффектом:
• липокортина-1, тормозящего фосфолипазу А2 и образование арахидоновой кислоты в некоторых клетках;
• секреторного ингибитора протеаз лейкоцитов в эндотелиальных клетках лёгких;
• ингибитора ядерного фактора (NF-κB),активирующего экспрессию «воспалительных» генов в клетках и играющего ключевую роль в развитии воспаления дыхательных путей;
• ИЛ-10, уменьшающего транскрипцию провоспалительных цитокинов и хемокинов;
• антагониста рецептора ИЛ-1;
• нейтральной эндопептидазы, разрушающей брадикинин и тахикинины;
• β2-адренорецепторов клеток лёгких (глюкокортикоиды увеличивают их количество и чувствительность к агонистам).
Комплексы гормон-рецептор взаимодействуют с факторами транскрипции [AP-1 (активирующий протеин-1), NF-kB и др.], которые активируются под влиянием медиаторов воспаления, оксидантов и вирусов, обусловливая внегеномный эффект глюкокортикоидов. Результат этого - торможение транскрипции провоспалительных генов (трансрепрессия), что, в свою очередь, уменьшает образование в клетках провоспалительных факторов [цитокинов (ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, ИЛ-11, ИЛ-13, ИЛ-16, ИЛ-17, ИЛ-18, ФНОα, GM-CSF, RANTES и др.); индуцибельной синтетазы оксида азота; индуцибельной циклооксигеназы 2; фосфолипазы А2; эндотелина-1; молекул адгезии лейкоцитов (ICAM-1, VCAM-1, Е-селектина) и др]. Один из молекулярных механизмов торможения глюкокортикоидами экспрессии «воспалительных генов» - активация гистоновой деацетилазы (HDAC), что приводит к деацетилированию гистонов хромосом, приводящему к уплотнению структуры хроматина и ограничению доступа к ДНК факторов транскрипции. Помимо этого глюкокортикоиды могут снижать стабильность мРНК и оказывать действие на образование воспалительных белков в рибосомах.
Глюкокортикоиды усиливают образование эндонуклеаз в клетках. Активация эндонуклеаз - центральное событие поздних этапов апоптоза (физиологической запрограммированной гибели клеток). В соответствии с этим прямое следствие действия глюко-
кортикоидов - гибель большого количества клеток (лимфоцитов, моноцитов, базофилов, эозинофилов и тучных клеток). Действие глюкокортикоидов на нейтрофилы имеет противоположный характер, однако эти гормоны вызывают резкое снижение их функциональной активности и уменьшение миграции нейтрофилов в очаги воспаления.
Противоаллергическое действие глюкокортикоидов заключается в одновременном воздействии на большинство клеток, вовлекаемых в аллергический процесс, что в конечном счёте выражается в угнетении инфильтрации слизистой оболочки и кожи и в уменьшении содержания в зоне аллергического воспаления эффекторных клеток (тучных клеток, базофилов и эозинофилов). Глюкокортикоиды угнетают также повышенную проницаемость сосудов и секрецию слизи (табл. 13-3).
Таблица 13-3. Основные эффекты глюкокортикоидов на клетки-мишени аллергического ответа
Противовоспалительный эффект глюкокортикоидов неспецифичен и развивается в ответ на любые повреждающие стимулы (физические, химические, бактериальные или патологические им-
мунные, такие как гиперчувствительность или аутоиммунные реакции), что делает эти препараты пригодными для воздействия на многочисленные патологические процессы.
За счёт непосредственного взаимодействия с ДНК глюкокортикоиды индуцируют или ингибируют синтез ферментов, участвующих в регуляции обмена веществ. Основные нежелательные метаболические эффекты глюкокортикоидов:
• стимулирующее действие на глюконеогенез (в результате - гипергликемия и глюкозурия);
• снижение синтеза белка и повышение его распада, что проявляется отрицательным азотистым балансом (похудание, мышечная слабость, атрофия кожи и мышц, стрии, кровоизлияния, замедление роста у детей);
• перераспределение жира, повышение синтеза жирных кислот и триглицеридов (гиперхолестеринемия);
• минералкортикоидная активность (приводит к увеличению объёма циркулирующей крови и повышению артериального давления);
• отрицательный баланс кальция (остеопороз);
• угнетение гипоталамо-гипофизарной системы, в результате чего уменьшается образование адренокортикотропного гормона (надпочечниковая недостаточность).
Системные глюкокортикоиды (бетаметазон, гидрокортизон, дексаметазон, метилпреднизолон, преднизолон, триамцинолон). В зависимости от длительности лечения различают кратковременную и длительную глюкокортикоидную терапию. Кратковременную терапию глюкокортикоидами (в течение 1-10 сут) применяют в экстренных случаях (шоковые состояния, тяжёлые аллергические реакции, обострение БА, астматический статус, АО и т.п.). Риск развития побочных эффектов при кратковременном применении глюкокортикоидов ниже, возможна быстрая их отмена. При необходимости длительного приёма внутрь препаратами выбора являются преднизолон или метилпреднизолон, так как они имеют короткий период полувыведения (что позволяет моделировать физиологический суточный ритм секреции глюкокортикоидов), наиболее близки по химической структуре к кортизолу и оказывают наименьшее (после гидрокортизона) угнетающее действие на функцию надпочечников.
В определённых ситуациях нужно введение пролонгированных форм глюкокортикоидов [триамцинолона ацетонид* (триамцино-
лон), метилпреднизолона ацепонат и комбинация быстродействующего бетаметазон натрий фосфата с бетаметазона дипропионатом♠ (бетаметазон)].
Топические глюкокортикоиды (местного действия). Возможность местного использования глюкокортикоидов коренным образом изменила тактику ведения больных аллергическими заболеваниями. Ингаляционный, интраназальный, конъюнктивальный, чрескожный пути введения обеспечивают доставку глюкокортикоидов непосредственно к месту их действия, а именно к слизистым оболочкам бронхов, носовой полости, конъюнктивы глаза и коже. Преимущества топических глюкокортикоидов - высокое сродство к рецепторам, выраженная местная противовоспалительная активность, более низкие (примерно в 100 раз) терапевтические дозы, низкая биодоступность.
Время наступления эффекта при интраназальном применении флутиказона пропионата и мометазона фуроата* (мометазон) - конец первых суток от начала лечения; при применении беклометазона дипропионата* (беклометазон) - третьи сутки. Однако максимальное лечебное действие топических глюкокортикоидов наступает через несколько суток от начала регулярного применения препарата.
Наиболее широко используемые в аллергологии топические глюкокортикоиды:
• ингаляционные: беклометазона дипропионат♠, будесонид, флутиказона пропионат;
• интраназальные: беклометазона дипропионат♠, будесонид, мометазона фуроат♠, флутиказона пропионат;
• при лечении АК: гидрокортизон, десонид, дексаметазон, преднизолон в виде глазных суспензий или мази;
• наружные формы глюкокортикоидов:
◊ фторированные (бетаметазон, клобетазол, триамцинолон, флуоцинолона ацетонид, флуметазон, флутиказон) вызывают ряд побочных эффектов: атрофию кожи, стрии, телеангиэктазии, гипертрихоз, стероидные акне, розацеа, периоральный дерматит, нарушение пигментации, склонность к вторичной инфекции;
◊ нефторированные (алклометазон, гидрокортизон, метилпреднизолона ацепонат, мометазона фуроат*, преднизолон), обладающие наименьшими побочными эффектами
и наибольшей клинической эффективностью, их можно применять на области лица, складок, гениталий (даже у детей), использовать отдельно или в составе комбинированных лекарственных средств (в сочетании с антибиотиками, противогрибковыми препаратами и др.).
Бронхорасширяющие лекарственные средства
К бронхорасширяющим лекарственным средствам относят 3 основные группы препаратов:
• селективные β2-адреностимуляторы;
• М-холинолитики;
• диметилксантины.
β2-Адреностимуляторы (β2-агонисты). Результат стимуляции β2-адренорецепторов в лёгочной ткани - расслабление гладкой мускулатуры и соответственно расширение бронхов. Вместе с тем через β2-адренорецепторы опосредуются следующие эффекты: повышение мукоцилиарного клиренса, секреторной активности слизистых желёз, образование сурфактанта, влияние на холинэргическую передачу возбуждения. При чрезмерной стимуляции чувствительность β2-адренорецепторов уменьшается из-за процесса «десенситизации» рецептора, обусловленной его разобщением с G-белком и аденилатциклазой. Происходит уменьшение числа рецепторов на поверхности клетки - интернализация, или даун-регуляция (десенситизация) - и частичная их деградация. Десенситизация β2-адренорецепторов приводит к снижению эффективности β2-адреномиметиков и заставляет больных увеличивать дозу и частоту их применения, что служит причиной возникновения побочных эффектов и снижения эффективности лечения. Центральная проблема безопасности β2-адреностимуляторов - их нежелательное действие на кровеносную систему (тахикардия, аритмия, повышение артериального давления вследствие увеличения сердечного выброса), которое зависит от селективности, дозы и способа введения. Тропность к β2-адренорецепторам сердечной ткани выше у фенотерола и формотерола, чем у сальбутамола и салметерола.
Противопоказания к назначению β2-адреномиметиков - гиперчувствительность к этим препаратам, ишемическая болезнь сердца, тахиаритмии, артериальная гипертензия, гипертиреоз. Контроль за безопасностью лечения должен включать электрокардиографию и определение калия в крови, особенно у больных с риском сердечно-сосудистых заболеваний.
Для купирования приступов удушья можно применять селективные β2-адреностимуляторы короткого действия (гексопреналин, изопреналин, кленбутерол, сальбутамол, фенотерол) или длительного действия (салметерол, формотерол). Используют различные способы введения этих лекарственных средств: наибольшее применение получили дозированные аэрозоли, спейсер, небулайзер. Применяют также комбинированные препараты, например, ипратропия бромид + фенотерол. Ингаляционные β2-адреностимуляторы длительного действия (салметерол, формотерол) следует назначать пациентам с БА до повышения доз ингаляционных глюкокортикоидов, если стандартные дозы ингаляционных глюкокортикоидов не позволяют достичь ремиссии заболевания.
Назначение больным БА комбинированных препаратов, содержащих глюкокортикоиды и β2-адреностимулятор длительного действия (салметерол + флутиказон и формотерола фуроат/будесонид), позволяет значительно улучшить функцию лёгких, уменьшить число ночных приступов, снизить потребность в в2-агонистах короткого действия и число обострений. Препараты из этой группы высоко эффективны при лечении средней и тяжёлой форм БА.
М-холинолитики или антихолинергические средства (ипратропия бромид, тиотропия бромид, тровентол) ослабляют, предотвращают или прекращают взаимодействие ацетилхолина с мускариновыми рецепторами. Оказывают бронхорасширяющее действие при бронхоспазме и уменьшают секрецию бронхиальных желёз. У больных БА с сопутствующей сердечно-сосудистой патологией М-холинолитики могут быть альтернативой β2-адреномиметикам.
Диметилксантины (аминофиллин, теофиллин). Механизм бронходилатирующего действия теофиллина частично обусловлен ингибированием фосфодиэстеразы, имеющей несколько изоформ, неодинаково распределённых в тканях, из которых наиболее значимы для астмы - 3-е и 4-е семейство. Ингибиторы 4-го типа фосфодиэстеразы отвечают за гидролиз цАМФ, тормозят высвобождение медиаторов аллергии из базофилов, подавляют образование реактивных форм кислорода эозинофилами, уменьшают биосинтез тромбоксана, секрецию эозинофильного катионного белка, дегрануляцию эозинофилов и др. Препарат обладает бронхолитическим действием; повышает сократительную способность и устойчивость дыхательной мускулатуры к нагрузке, уменьша-
ет остаточный объём воздуха в лёгких, является слабым стимулятором дыхания, стимулирует функцию реснитчатого эпителия. В терапевтических дозах теофиллин влияет на клеточные системы, участвующие в запуске, формировании и поддержании аллергического воспаления. Эуфиллин♠ (аминофиллин; сочетание теофиллина с 1,2-этилендиамином) в основном используют для купирования острых приступов бронхоспазма или планово - как средство базисной терапии. Существуют пролонгированные формы теофиллина для приёма внутрь с двукратным или однократным режимом дозирования в сутки.
Адреностимуляторы, или симпатомиметики - большая группа лекарственных средств, имитирующих эффекты стимуляции α-, β-адренорецепторов и допаминовых рецепторов симпатической нервной системы. Выделяют лекарственные средства смешанного действия (эпинефрин, норэпинефрин, эфедрин, псевдоэфедрин и допамин), стимулирующие α- и β-адренорецепторы. Эти препараты оказывают выраженное вазопрессорное и кардиотоническое действие и, за исключением псевдоэфедрина, применяются для лечения тяжёлых состояний, связанных с гипотонией и ослаблением сердечно-сосудистой деятельности. Преимущественно α-стимулирующим эффектом обладают фенилэфрин, нафазолин, карбиноксамин и другие лекарственные средства, оказывающие сосудосуживающий эффект и применяемые в основном местно в качестве деконгестантов. При АР эти препараты вызывают сужение сосудов в слизистой оболочке носа, уменьшение её отёка, тем самым ослабляя ощущение заложенности носа. Курс лечения не рекомендуют продолжать более 7-10 сут, учитывая риск развития медикаментозного ринита с отчётливым усилением заложенности носа (феномен «рикошета»). Лекарственные средства, стимулирующие в-адренорецепторы, подразделяют на неселективные и селективные (селективные в2-адреностимуляторы, применяемые для лечения БА, описаны выше).
Антагонисты лейкотриеновых рецепторов (зафирлукаст, монтелукаст) блокируют цистеиниловые рецепторы лейкотриена 1 и устраняют или предотвращают вызываемые лейкотриенами спазм гладкой мускулатуры бронхов, повышенную проницаемость сосудов, гиперсекрецию слизи, замедление мукоцилиарного транспорта, хемотаксис эозинофилов и эозинофильную инфильтрацию, гиперреактивность бронхов и гиперплазию их гладкомышечных
клеток. Применение антагонистов лейкотриеновых рецепторов при БА позволяет уменьшить силу проявлений заболевания, улучшить функциональные показатели дыхания и сократить потребность в других противоастматических препаратах.
Aнти-IgE-антитела (омализумаб). Омализумаб - рекомбинантное гуманизированное моноклональное антитело, содержащее структурные домены IgG1 человека и мышиную идиотипическую часть, распознающую CH3 домен IgE, ответственный за связывание с Fc-рецепторами. Анти-IgE-антитела избирательно распознают и конкурентно связывают IgE, образуя небольшие комплексы (менее 1000 кДа), не способные связывать комплемент, которые элиминируются с помощью ретикулоэндотелиальной системы, не вызывая побочных эффектов. Таким образом, снижая уровень циркулирующего свободного IgE, омализумаб препятствует связыванию IgE с высокоаффинным FcεRI и низкоаффинным FcεRII, предотвращая высвобождение медиаторов из клеток-мишеней аллергии (тучных клеток, базофилов) при стимуляции их специфическим аллергеном. Анти-IgE-антитела не соединяются с IgE, уже прикреплёнными к FcεR1 и, следовательно, не способны инициировать активацию тучных клеток или базофилов. Назначение омализумаба больным с тяжёлыми формами резистентной БА позволяет уменьшить потребность в глюкокортикоидах и β2-адреностимуляторах, улучшить функциональные показатели дыхания.
Аллергенспецифическая иммунотерапия
Аллергенспецифическая иммунотерапия (АСИТ), предложенная Нуном (Noon) и впервые использованная Фрименом (Freeman) в 1911 г. для лечения поллиноза, заключается во введении в организм пациента возрастающих доз экстракта аллергена, к которому у больного выявлена повышенная чувствительность. Цель лечения - специфическая гипосенсибилизация (снижение чувствительности пациента к естественной экспозиции данного аллергена). Этот метод является единственным, действующим на все патогенетические звенья аллергического процесса. Проведение АСИТ позволяет уменьшить потребность пациента в противоаллергических препаратах; предупредить трансформацию АР в бронхиальную астму; предупредить расширение спектра аллергенов, к которым у пациента формируется повышенная чувствительность.
АСИТ - один из наиболее научно-оправданных и широко используемых эффективных методов лечения больных аллергическими заболеваниями с IgE-опосредованным механизмом развития (сезонным и круглогодичным АР, АК, атопической БА, страдающих анафилактическими реакциями в ответ на ужаление перепончатокрылыми насекомыми).
Терапевтическое действие АСИТ распространяется на все этапы аллергического ответа, что не характерно ни для одного из известных фармакологических препаратов. Действие АСИТ охватывает собственно иммунологическую фазу и приводит к переключению иммунного ответа с Тh2-типа на Тh1-тип (что влечёт за собой переключение иммунного ответа с IgE- на IgG-тип или даже к Т-лимфоцитарной толерантности), тормозит как раннюю, так и позднюю фазы IgE-опосредованной аллергической реакции, угнетает клеточную картину аллергического воспаления и неспецифическую тканевую гиперреактивность. Именно в силу этих важных обстоятельств в отечественной аллергологии давно сложилось мнение о необходимости как можно более раннего начала проведения АСИТ.
Клиническая эффективность АСИТ, по данным разных авторов, достигает 70-90% и выражается в торможении внешних проявлений заболевания и уменьшении потребности в лекарственных препаратах. Специфическая гипосенсибилизация, а также наблюдаемые при этом снижение неспецифической тканевой гиперреактивности и противовоспалительное действие удерживаются на протяжении длительного периода после завершения АСИТ.
Многолетний опыт применения специфической иммунотерапии в разных странах позволяет говорить не только об эффективности, но и о безопасности этого метода лечения как у детей, так и у взрослых.
Обязательные условия для назначения АСИТ.
• Доказанная IgE-зависимая природа заболевания с установленными клинически-значимыми причинно-значимыми аллергенами.
• Проведение элиминационных мероприятий до начала лечения.
• Интеркуррентные заболевания должны быть диагностированы и пролечены.
Противопоказания для проведения АСИТ.
• Инфекционные заболевания.
• Декомпенсированные заболевания различных органов и систем.
• Тяжёлые иммунопатологические состояния и иммунодефициты.
• Онкологические заболевания, туберкулёз.
• Тяжёлые психические расстройства.
• Лечение р-адреноблокаторами, включая топические формы.
• Приём ингибиторов моноамиооксидазы в комбинации с симпатомиметиками.
• Невозможность соблюдения пациентом схемы назначенного лечения.
• Тяжёлая форма БА, неконтролируемая фармакотерапией (ОФВ1 менее 70% после проведения адекватной фармакотерапии).
• Сердечно-сосудистые заболевания, при которых возможны осложнения при использовании эпинефрина.
• Возраст меньше 5 лет.
Существуют различные методы АСИТ: парентеральный (подкожное введение аллергена), пероральный, сублингвальный, интраназальный и эндобронхиальный. Наибольшее распространение получили парентеральный и сублингвальный (широко применяемый в педиатрической практике) методы. АСИТ проводят по специально разработанным схемам в зависимости от вида и способа введения аллергена и индивидуальной чувствительности пациента.
Для достижения лучшего эффекта необходимо проведение нескольких (3-5) последовательных курсов АСИТ.
В ходе АСИТ в ответ на введение аллергена могут возникнуть нежелательные побочные эффекты в виде местных или системных реакций (от лёгких проявлений ринита и БА до выраженного бронхоспазма, АО и АШ). По данным разных авторов, частота развития анафилактических реакций колеблется от 0,0007 до 0,01%. Тяжёлые реакции больше характерны для АСИТ ядами перепончатокрылых насекомых, при высокой степени сенсибилизации пациента и для ускоренных вариантов АСИТ.
АСИТ должны проводить только врачи-аллергологи, имеющие опыт такого лечения, в условиях аллергологического кабинета или стационара. Проведение АСИТ не противоречит назначению медикаментозного лечения, характер которого ориентирован на степень тяжести и течение аллергического заболевания.
АЛЛЕРГИЧЕСКИЙ РИНИТ
Аллергический ринит (АР) - заболевание слизистой оболочки носа, в основе которого лежит аллергическое воспаление, вызываемое причинно-значимым аллергеном.
Эпидемиология
Распространённость АР в разных странах мира составляет 4-32%, в России - 10-24%. Чаще всего заболевание дебютирует в первой половине жизни.
Классификация
Согласно классификации 2000 г. (Международный консенсус по аллергическому риниту) выделяют сезонный, круглогодичный и профессиональный АР.
В соответствии с документом ARIA 2001 (Allergic Rhinitis and its Impact on Asthma - Аллергический ринит и его влияние на астму) выделяют:
• интермиттирующий АР - симптомы беспокоят менее 4 сут в неделю или менее 4 нед в году;
• персистирующий АР - симптомы беспокоят более 4 сут в неделю и более 4 нед в году.
По степени тяжести:
• лёгкая степень тяжести - у пациента имеются слабовыраженные симптомы ринита, не нарушающие дневную активность и сон;
• средняя степень тяжести - симптомы ринита препятствуют работе, учёбе, занятиям спортом, нарушают сон пациента;
• тяжёлая степень - симптомы значительно ухудшают качество жизни пациента, который при отсутствии лечения не может нормально работать, учиться, заниматься спортом, значительно нарушается ночной сон.
По стадии заболевания:
• обострение;
• ремиссия.
Формулировка диагноза включает указание спектра аллергенов, к которым выявлена повышенная чувствительность.
Этиология
У больных круглогодичным АР основные причинно-значимые аллергены - бытовые, эпидермальные, аллергены тараканов и
споры плесневых грибов, обитающих внутри помещений. Сезонный АР обусловлен аллергией к пыльце растений и спорам плесневых грибов, присутствующих в воздухе в весенне-летне-осенний период.
У больных круглогодичным АР часто выявляют сопутствующие аллергические заболевания и осложнения ринита: АК, синуситы, полипы околоносовых пазух, острый и хронический средний отит, евстахеит, ослабление слуха. АР - фактор риска развития БА. Для больных сезонным АР характерно сочетание с АК, БА, АтД, крапивницей, перекрёстной пищевой непереносимостью.
Патогенез
АР по механизму развития относят к аллергическим реакциям немедленного типа (IgE-опосредованная; см. соответствующий раздел).
Клиническая картина
Основные симптомы АР: зуд в полости носа, ринорея (обильные водянистые выделения из носа), многократное чихание, заложенность носа. Наличие всех 4 симптомов необязательно. У больных круглогодичным АР ведущие симптомы - заложенность носа, выраженное затруднение носового дыхания, выделения из носа слизистого характера. У больных сезонным АР наиболее частые симптомы - приступообразное чихание, зуд в носу и ринорея. Помимо классических симптомов АР, нередко выявляют общее недомогание, головную боль, боль в ухе, снижение слуха, нарушение обоняния, носовые кровотечения, першение в горле, кашель.
Осложнения АР: синуситы, полипы околоносовых пазух, острый и хронический средний отит, евстахеит, ослабление слуха. АР является фактором риска развития БА.
Диагностика
• Физикальное обследование. Характерные внешние признаки ринита: отсутствие носового дыхания, отёчность лица, у больных приоткрыт рот, наличие дерматита над верхней губой и в области крыльев носа, тёмные круги под глазами; пациенты могут потирать ладонью кончик носа - «аллергический салют», в случае присоединения вторичной инфекции назальный секрет может носить слизисто-гнойный характер.
• Аллергологическое обследование (см. соответствующий раздел).
• Лабораторные и инструментальные исследования:
◊ клинический анализ крови (в период обострения возможно наличие эозинофилии);
◊ цитологическое исследование назального секрета (наличие эозинофилии);
◊ передняя риноскопия (отёк носовых раковин, цианотичный или серый цвет слизистой оболочки, пятнистость слизистой оболочки (симптом Воячека), могут выявлять полипы.
• Дополнительные исследования:
◊ передняя риноманометрия;
◊ эндоскопия;
◊ рентгенография или компьютерная томография придаточных пазух носа (диагностика осложнённых форм АР, в первую очередь при полипозном риносинусите);
- посев отделяемого из носа на флору. Дифференциальная диагностика
Дифференциальную диагностику АР проводят с инфекционным ринитом, вазомоторным ринитом; ринитом, обусловленным аномалиями анатомического строения носа; неаллергическим эозинофильным ринитом, медикаментозным ринитом [вследствие применения деконгестантов, резерпина, ингибиторов ангиотензинпревращающего фермента (АПФ), оральных контрацептивов]; ринитом у больных с непереносимостью ацетилсалициловой кислоты и других НПВС; аденоидами (у детей); гормональным ринитом (при половом созревании, беременности, гипотиреозе); неаллергическим профессиональным ринитом.
Всех больных АР необходимо обследовать на наличие БА.
Лечение
Терапия АР включает:
• профилактику;
• фармакотерапию;
• патогенетическую терапию (АСИТ);
• лечение осложнений АР;
• обучение пациентов.
Профилактика включает элиминацию аллергена (см. соответствующий раздел); соблюдение гипоаллергенной диеты с исключением продуктов и лекарственных средств, обладающих перекрёстной реактивностью с причинным аллергеном (см. табл. 13-2);
для больных сезонным АР в сезон пыления причинно-значимых растений запрещено проведение профилактической вакцинации, плановых оперативных вмешательств и инвазивных методов исследования; при необходимости проведения инвазивных методов обследования и лечения, включающей парентеральное введение глюкокортикоидов и антигистаминных средств, премедикация обязательна.
Фармакотерапия аллергического ринита
• Блокаторы H1-рецепторов гистамина принимают внутрь (предпочтительно 2-го поколения: акривастин, дезлоратадин, левоцетиризин, лоратадин, фексофенадин, цетиризин, эбастин) или используют препараты местного действия (азеластин, левокабастин). Больным с тяжёлым течением АР, особенно при обострении сопутствующих атопических заболеваний, возможно парентеральное введение блокаторов Н1-рецепторов с последующим переводом пациента на приём препаратов этой группы внутрь.
• Топические глюкокортикоиды [беклометазона дипропионат♠ (беклометазон), будесонид, флутиказона пропионат, мометазона фуроат♠ (мометазон), триамцинолона ацетонид* (триамцинолон)] превосходят блокаторы Н1-рецепторов гистамина и кромоны по эффективности купирования симптомов АР; наиболее эффективные лекарственные средства для больных с затруднением носового дыхания и нарушением обоняния. Больным с особенно тяжёлым течением АР при недостаточном эффекте лечения можно назначить системные глюкокортикоиды коротким курсом (меньше 5 сут).
• Стабилизаторы мембран тучных клеток (кромоны интраназально). Менее эффективны по сравнению с блокаторами Н1-рецепторов гистамина и топическими глюкокортикоидами; благодаря высокой степени безопасности получили наибольшее применение в педиатрии.
• Деконгестанты (агонисты α2-адренорецепторов: нафазолин, инданазолин, ксилометазолин, оксиметазолин, тетризолин; агонист α1-адренорецепторов фенилэфрин и адреностимуляторы смешанного действия: эфедрин и псевдоэфедрин). Длительность применения топических деконгестантов ограничена (3-10 сут). Системные деконгестанты менее эффективны; их использование ограничено в связи с наличием системного симпатомиметического действия.
В случае присоединения инфекционного отита, гайморита и других инфекционных заболеваний показано применение антибактериальных лекарственных средств в сочетании с противовоспалительной, санационной терапией и другими видами лечения. При наличии полипоза носа проводят курсовое (1-2 мес) лечение топическими глюкокортикоидами (беклометазон, будесонид, мометазон или флутиказон).
Хирургическое лечение проводят: при необратимых (фиброзной и сосочковой) формах гипертрофии носовых раковин; наличии аномалий внутриносовой полости; при патологии околоносовых пазух, которую невозможно устранить другим путём. При сезонном АР осложнения, требующие хирургического вмешательства, возникают редко.
АСИТ. Показана пациентам с АР при точном выявлении причинных аллергенов в периоды ремиссии (вне сезона пыления) (см. соответствующий раздел).
Обучение пациента подразумевает проведение беседы о природе заболевания, мерах профилактики обострения АР, методах лечения в период обострения и ремиссии.
АЛЛЕРГИЧЕСКИЙ КОНЪЮНКТИВИТ
Аллергический конъюнктивит (АК) - заболевание, характеризующееся наличием воспаления конъюнктивы и глаза, вызванного причинно-значимым аллергеном, и клинически проявляющееся слёзотечением, ощущением «инородного тела в глазах», гиперемией конъюнктивы и зудом век.
Эпидемиология
Как правило, АК сочетается с другими аллергическими заболеваниями (часто АР, так называемый риноконъюнктивальный синдром, БА, АтД; может быть проявлением пищевой аллергии, в связи с чем трудно получить объективные данные о его распространённости).
Классификация
Выделяют:
• сезонный АК;
• круглогодичный АК.
По степени тяжести:
• лёгкое течение;
• среднетяжёлое течение;
• тяжёлое течение.
По стадии заболевания:
• обострение;
• ремиссия.
Формулировка диагноза включает указание спектра аллергенов, выявленных у больного.
Этиология
Сезонный АК обусловлен аллергией к пыльце растений и спорам плесневых грибов. У больных круглогодичным АК основные причинно-значимые аллергены - бытовые, эпидермальные, аллергены тараканов и споры плесневых грибов. Симптомы АК могут наблюдать при длительном применении глазных капель, косметических средств, при контакте с различными химическими веществами.
Патогенез
АК по механизму развития относится к аллергическим реакциям немедленного типа (IgE-опосредованная; см. соответствующий раздел).
Клиническая картина
Характерны: слёзотечение, ощущение «инородного тела в глазах», гиперемия конъюнктивы, зуд век, отёк век (иногда).
Осложнения АК: инфекционный конъюнктивит, кератоконъюнктивит, блефароконъюнктивит и др.
Диагностика
• Физикальное обследование. Характерны внешние признаки конъюнктивита: отёчность и гиперемия конъюнктив, слёзотечение, инъекция сосудов склер, отёк век, при тяжёлом течении - отёк лица, тёмные круги под глазами.
• Аллергологическое обследование (см. соответствующий раздел).
• Лабораторные и инструментальные исследования:
- клинический анализ крови (в период обострения возможно наличие эозинофилии);
- офтальмоскопия (при исследовании передней камеры глаза выявляют гиперсекрецию водянистой влаги, не содержащей патологических примесей - крови, гноя и пр.);
- цитологическое исследование отделяемого из глаз (наличие эозинофилии).
• Дополнительные исследования: бактериологическое и вирусологическое исследование отделяемого из глаз.
Дифференциальная диагностика. Дифференциальную диагностику АК проводят с инфекционным конъюнктивитом (вирусным, бактериальным, в том числе хламидийным, грибковым, паразитарным), инфекционным блефароконъюнктивитом, весенним конъюнктивитом (весенний катар), сухим кератоконъюнктивитом, гигантским сосочковым кератоконъюнктивитом (может быть обусловлен ношением линз), конъюнктивитом при системных заболеваниях.
Лечение
Лечение АК включает:
• профилактику;
• фармакотерапию;
• патогенетическую терапию (АСИТ);
• лечение осложнений АР;
• обучение пациентов.
Профилактика та же, что и при АР (см. соответствующий раздел). Фармакотерапия аллергического конъюнктивита
• Блокаторы H1-рецепторов гистамина (предпочтительно последнего поколения).
• Стабилизаторы мембран тучных клеток (препараты кромоглициевой кислоты, кетотифен, лодоксамид - конъюнктивально).
• Топические глюкокортикоиды в виде глазных суспензий или мази.
• Деконгестанты (агонисты α2-адренорецепторов); применяют не дольше 4 сут.
При наличии показаний проводят системную антибактериальную терапию и другие методы лечения. При наличии осложнений рекомендовано наблюдение офтальмологом.
Аллергенспецифическая иммунотерапия (АСИТ). Пациентам с АК при точном выявлении причинных аллергенов в периоды ремиссии показано проведение АСИТ (см. соответствующий раздел).
Обучение пациента подразумевает проведение беседы о природе заболевания, мерах профилактики обострения АК, методах лечения в период обострения и ремиссии.
БРОНХИАЛЬНАЯ АСТМА
Бронхиальная астма (БА) - хроническое воспалительное заболевание дыхательных путей, основной патогенетический механизм которого - гиперреактивность бронхов, а основное клиническое проявление - частично или полностью обратимая (спонтанно или вследствие лечения) бронхиальная обструкция вследствие бронхоспазма, гиперсекреции и отёка слизистой оболочки бронхов.
Эпидемиология
Распространённость БА в мире варьирует от 1 до 18%. В России заболеваемость БА составляет 5,6-7,3%; среди детей - 5,6-12,1%. До 14-летнего возраста распространённость БА почти в 2 раза выше среди мальчиков, чем среди девочек. С возрастом эта разница уменьшается, и среди взрослых БА чаще выявляют у женщин, чем у мужчин. Существенное влияние на заболеваемость БА оказывают климатогеографические факторы, загрязнение воздуха и т.д. Летальность от БА увеличивается с возрастом: у детей она составляет 1%, у взрослых 2-4%.
Классификация
По международной номенклатуре выделяют аллергическую и неаллергическую БА.
• Аллергическая БА подразумевает атопическую (обусловленную развитием IgE-опосредованной реакции гиперчувствительности I типа) и неатопическую форму БА (подразумевает не IgE-зависимые типы реакции).
• Неаллергическая БА характеризуется отсутствием аллергической реакции в патогенезе. Один из вариантов неаллергической БА - аспириновая БА.
• Смешанная БА подразумевает участие нескольких механизмов в патогенезе БА.
В России используют классификацию БА по клиникопатогенетическим критериям, в соответствии с которой выделяют атопическую, инфекционно-аллергическую формы и так называемую аспириновую астму.
• Атопическая форма обусловлена сенсибилизацией к ингаляционным, редко - к пищевым аллергенам.
• Инфекционно-аллергическая форма обусловлена наличием сенсибилизации к инфекционным аллергенам - бактериям, грибам и др.
• Аспириновая форма. Происхождение аспиринового варианта БА связывают с нарушением метаболизма арахидоновой кислоты и повышением выработки лейкотриенов. В этом случае у 4,2% больных БА формируется так называемая аспириновая триада, включающая БА, полипоз носа (околоносовых пазух), непереносимость ацетилсалициловой кислоты и других НПВС.
Возможно сочетание нескольких патогенетических механизмов. Существует классификация, подразделяющая БА на эндогенную и экзогенную. Данные формы не включают всё клиническое многообразие проявлений БА, поэтому отдельно выделяют астму физического усилия, вирусиндуцированную и др.
В 2006 г. в основных рекомендациях Глобальной инициативы по борьбе с БА (GINA - the Global Initiative For Asthma) была предложена классификация астмы, основанная на оценке степени её контроля: контролируемая, частично контролируемая, неконтролируемая. Указанная классификация предполагает отражение индивидуальной восприимчивости пациента к противоастматической терапии. Такая восприимчивость может варьировать в течение всего года. Помимо этого выделено понятие «астма, трудно поддающаяся лечению». На данный момент указанная классификация широкого распространения не получила.
По степени тяжести и характеру течения различают:
• интермиттирующую БА: симптомы заболевания проявляются реже 1 раза в неделю, короткие обострения, ночные симптомы не чаще 2 раз в месяц, объём форсированного выдоха за первую секунду (ОФВ1) или пиковая скорость выдоха (ПСВ) составляет ≥80% от должных значений, вариабельность показателей ПСВ или ОФВ1 <20%;
• лёгкую персистирующую БА: симптомы от 1 раза в течение недели возникают до 1 раза в сутки, обострения могут влиять на физическую активность и сон, ночные симптомы проявляются чаще 2 раз в месяц. ПСВ или ОФВ1 составляют 80% от должных величин или более, вариабельность показателей ОФВ1 или ПСВ равна 20-30%;
• персистирующую БА средней тяжести: симптомы возникают ежедневно, обострения могут влиять на физическую активность и сон, ночные приступы чаще 1 раза в неделю, потребность в ежедневном применении агонистов β2-адренорецепторов короткого действия, физическая активность и другие неспецифические факторы могут провоцировать приступы БА. ПСВ или ОФВ1 составляют 60-80% должных величин, вариабельность показателей ОФВ1 или ПСВ >30%;
• тяжёлую персистирующую БА: симптомы возникают ежедневно, частые обострения, частые ночные приступы. Ограничение физической активности, ПСВ или ОФВ1 составляют ≤60% должных величин, вариабельность показателей ОФВ1 или
ПСВ >30%.
• астматический статус (status asthmaticus) - тяжёлое и опасное для жизни состояние - затянувшийся приступ экспираторного удушья, не купирующийся обычными противоастматическими лекарственными средствами в течение нескольких часов. Различают анафилактическую (стремительное развитие) и метаболическую (постепенное развитие) формы астматического статуса. Для астматического статуса характерны значительная степень обструктивных нарушений, вплоть до полного отсутствия бронхиальной проводимости, непродуктивный кашель, выраженные проявления гипоксии, нарастающая резистентность к бронхорасширяющим лекарственным средствам; в ряде случаев возникают признаки передозировки агонистов β2-адренорецепторов и метилксантинов.
Выделяют несколько фаз течения БА: обострение, стихающее обострение, ремиссия.
Этиология
При атопической БА непосредственной причиной, вызывающей приступ удушья, является причинно-значимый аллерген. При других формах БА в этом могут принимать участие инфекционные агенты (бактериальные, грибковые, вирусные, паразитарные), лекарственные средства (например, ацетилсалициловая кислота и другие НПВС, препараты пенициллинового ряда), физическое усилие и др.
Патогенез
В основе формирования аллергического воспаления бронхов при БА лежат реакции гиперчувствительности I, III и IV типов
по классификации Джелла и Кумбса. Чаще других ведущую роль играет IgE-обусловленная гиперчувствительность I типа, а также неиммунные механизмы.
Клиническая картина
Основной симптом БА любой этиологии - приступ удушья, преимущественно в ночные и утренние часы, с затруднённым выдохом, часто сопровождающийся дистанционными хрипами. При атопической БА приступ удушья обычно чётко связан с причиннозначимым аллергеном.
Основные жалобы и характерные признаки: приступы удушья, затруднённое дыхание, приступообразный кашель (может быть основным и единственным симптомом, расценивается как эквивалент приступа удушья); шумное, свистящее дыхание; одышка, сердцебиение; отхождение вязкой мокроты при кашле на завершающей стадии удушья; сочетание с другими аллергическими заболеваниям (АР, АК); частое сочетание БА с патологией верхних дыхательных путей; при аспириновой БА выявляют полипоз носа; приём ацетилсалициловой кислоты и других НПВС провоцирует выраженный бронхоспазм, асфиксию, крапивницу, АО.
Осложнения
• Лёгочные: хронический бронхит, гиповентиляционная пневмония, эмфизема лёгких, пневмосклероз, дыхательная недостаточность, бронхоэктазы, ателектазы, пневмоторакс.
• Внелёгочные: лёгочное сердце, сердечная недостаточность, дистрофия миокарда, аритмия, у пациентов с гормонозависимым вариантом БА возможно появление осложнений, связанных с длительным применением системных глюкокортикоидов.
Диагностика
• Физикальное обследование. Выраженность изменений, выявляемых при физикальном обследовании, зависит от степени тяжести БА и фазы заболевания.
В период ремиссии и при отсутствии осложнений БА никаких отклонений от нормы не выявляют.
При некомпенсированном течении могут возникать учащение частоты дыхания и частоты сердечных сокращений; повышение артериального давления; участие в акте дыхания вспомогательных мышц грудной клетки; уменьшение подвижности нижнего края
лёгких; при перкуссии может возникать коробочный перкуторный звук; при аускультации выслушиваются: жёсткое дыхание, разнотональные сухие свистящие хрипы, преимущественно на выдохе; могут выслушиваться разнокалиберные влажные хрипы; бронхиальный секрет носит слизистый или слизисто-гнойный характер, может быть обильным водянистым или вязким, вплоть до образования слепков.
При астматическом статусе: положение пациента - ортопноэ; выявляют кашель с отделением скудного вязкого секрета; потливость; цианоз; при аускультации - резкое ослабление дыхания (преимущественно в нижних отделах лёгких), хрипы; в более тяжёлых случаях - полное отсутствие бронхиальной проводимости и хрипов («немое лёгкое»); может возникать резкое повышение артериального давления, частоты сердечных сокращений и парадоксальный пульс.
• Аллергологическое обследование (см. соответствующий раздел).
• Лабораторные и инструментальные исследования.
◊ Обязательные лабораторные исследования: клинический анализ крови (возможно наличие эозинофилии в период обострения); общий анализ мокроты (возможно наличие эозинофилии, спиралей Куршмана, кристаллов Шарко- Лейдена); бактериологическое исследование мокроты на флору и чувствительность к антибиотикам.
◊ Дополнительные лабораторные исследования: определение газового состава артериальной крови, рН крови; определение в сыворотке крови белковых фракций, уровня IgA, IgM и IgG; у больных, получающих глюкокортикоиды системного действия, проводят анализ крови на кортизол, адренокортикотропный гормон, а также анализ мочи на
17-ОКС.
◊ Обязательные инструментальные исследования: исследование функции внешнего дыхания: определяют ОФВ1, форсированная жизненная ёмкость лёгких (FVC - Forced Vital Capacity), индекс Тиффно, ПСВ и другие показатели; рентгенография органов грудной клетки; рентгенография придаточных пазух носа; электрокардиография.
◊ Дополнительные инструментальные исследования: диагностическая бронхоскопия; бронхомоторные тесты (тест с бронхолитиками на обратимость бронхиальной обструк-
ции; тест с бронхоконстрикторами; тест с дозированной физической нагрузкой).
Дифференциальная диагностика
Дифференциальную диагностику БА (независимо от её формы) проводят со следующими заболеваниями: хронической обструктивной болезнью лёгких, сердечной недостаточностью, респираторными вирусными инфекциями, бронхиолитом, АБЛА и другими заболеваниями, протекающими с лёгочной эозинофилией; а также с опухолями, наличием в дыхательных путях инородных тел, рекуррентными эмболиями мелких сосудов лёгких, гипервентиляционным синдромом, экзогенным аллергическим альвеолитом (ЭАА).
Дифференциальная диагностика различных форм БА.
• Атопическая БА. Дебют заболевания - как правило, до 20- 30 лет. Отмечают связь симптомов заболевания с воздействием ингаляционных аллергенов (домашней пыли, пыльцы и т.д.). Характерен чёткий эффект элиминации - уменьшение выраженности симптомов при уменьшении аллергенной нагрузки. Тесты с ингаляционными аллергенами положительны. Повышение уровня общего и специфических IgE. Эозинофилия в периферической крови и мокроте. Сопутствующие аллергические заболевания (АР, АК, АтД). Аллергические заболевания в семейном анамнезе.
• Инфекционно-аллергическая БА. Дебют заболевания - в 30- 40 лет. Положительные кожные и лабораторные тесты с инфекционными аллергенами и отрицательные - с ингаляционными, хотя нередко встречается смешанная БА (атопическая и неаллергическая). Отягощённый семейный анамнез аллергии выявляют реже, чем при атопической БА. Течение средней степени тяжести или тяжёлое. Формирование эмфиземы и пневмосклероза возникает чаще, чем при атопической БА. Наличие эффекта элиминации нехарактерно. Патологию придаточных пазух носа выявляют чаще, чем при атопической БА.
• Аспириновая БА. Дебют заболевания - после 30-40 лет. Характерно наличие «аспириновой триады»: БА, непереносимость ацетилсалициловой кислоты и других НПВС, рецидивирующий полипоз носа (гайморовых пазух; может отсутствовать). Развитие приступов удушья на фоне приёма ацетилсалициловой кислоты и других НПВС. Может выявляться сенсибилизация к атопическим и инфекционным аллергенам. Течение, как правило, средней тяжести или тяжёлое.
Лечение
Лечение БА включает:
• профилактические мероприятия;
• фармакотерапию: купирование приступов и обострений БА; базисную терапию, которую больной получает постоянно с целью контроля БА;
• патогенетическую терапию (АСИТ);
• лечение осложнений БА;
• обучение пациентов.
Профилактика включает своевременную диагностику и адекватную базисную терапию БА и сопутствующей аллергической и соматической патологии, прекращение контакта с причиннозначимым аллергеном и неспецифическими раздражителями внешней среды, при аспириновой БА - отказ от приёма ацетилсалициловой кислоты и других НПВС, отказ от приёма адреноблокаторов (независимо от формы БА), исключение профессиональной вредности, профилактику респираторных вирусных инфекционных заболеваний, проведение вакцинации от гриппа, проведение премедикации перед инвазивными методами обследования и лечения, включающей парентеральное введение глюкокортикоидов и метилксантинов.
Для купирования приступов БА применяют:
• ингаляционные β2-агонисты короткого действия или комбинированные лекарственные средства, включающие холинолитики и β2-агонисты;
• метилксантины короткого действия;
• топические глюкокортикоиды и β2-агонисты через небулайзер;
• системные глюкокортикоиды.
Купирование обострения БА. При назначении лечения, направленного на купирование обострения БА, следует учитывать исходную степень тяжести обострения и наличие осложнений БА. При лёгком обострении БА с незначительными обструктивными изменениями в лёгких рекомендовано использование ингаляционных лекарственных средств - агонистов β2-адренорецепторов короткого действия или комбинированных лекарственных средств (β2-агониста и холинолитика), ингаляционных глюкокортикоидов. Для облегчения ингаляций и повышения эффективности лекарственных средств предпочтительнее использовать небулайзер. При наличии среднетяжёлого и тяжёлого обострения БА показано допол-
нительное применение системных лекарственных средств. Для этого предпочтительнее использовать инфузионные формы, поскольку они дают возможность достижения более быстрого эффекта и коррекции дозы в соответствии с объективным состоянием пациента, позволяют исключить непосредственное негативное воздействие на органы пищеварения. Доза и длительность инфузионного введения лекарственных средств (системные глюкокортикоиды, аминофиллин) зависят от скорости объективной стабилизации состояния пациента. Отмена системных лекарственных средств должна быть постепенной. Дозу лекарственных средств снижают ежедневно на 25-30% от предыдущей. При отсутствии выраженной бронхиальной обструкции с уменьшением дозы и частоты введения инфузионных препаратов нужно их замещать ингаляционными и/или таблетированными лекарственными средствами.
С целью улучшения отхождения мокроты назначают муколитики и стимуляторы моторной функции дыхательных путей (перорально или ингаляционно - ацетилцистеин, бромгексин, амброксол). Применение блокаторов Н1-рецепторов гистамина в острый период нежелательно, поскольку они затрудняют дренаж бронхиального секрета. При наличии осложнений (пневмонии, бронхита, гайморита и др.) показано применение антибактериальных лекарственных средств в сочетании с противогрибковой терапией.
В очень тяжёлых случаях при неэффективности лечения и нарастании дыхательной недостаточности используют интубацию трахеи, искусственную вентиляцию лёгких, проводят аспирацию мокроты и ингаляции отхаркивающих средств.
Базисная терапия. Ступенчатый подход к медикаментозному лечению, который коррелирует с классификацией БА по степени тяжести, позволяет получать эффект от лечения с применением наименьшего количества лекарственных средств (табл. 13-4). Впоследствии интенсивность лечения меняют в зависимости от изменения тяжести состояния. Схему лечения необходимо пересматривать каждые 3-6 мес. Базисная терапия подразумевает ежедневное длительное применение противоастматических лекарственных средств, позволяющих сохранять контроль над персистирующей БА. Для всех ступеней помимо ежедневного приёма лекарственных средств для базисной терапии следует применять ингаляционный в2-агонист быстрого действия по потребности, однако не чаще 3-4 раз в сутки.
Таблица 13-4. Лекарственные средства для базисной терапии бронхиальной астмы
АСИТ. Пациентам с атопической БА лёгкой и средней степени тяжести в периоды ремиссии показано проведение АСИТ (при показателях ОФВ1 >70% должных величин после адекватной фармакотерапии).
Обучение пациента подразумевает проведение беседы о природе заболевания, мерах профилактики обострения БА, методах лечения в период обострения и ремиссии, необходимости регулярного и правильного применения противоастматических средств базисной терапии, обучение «самоконтролю» по показателям пикфлоуметрии.
АЛЛЕРГИЧЕСКИЙ БРОНХОЛЁГОЧНЫЙ АСПЕРГИЛЛЁЗ
Аллергический бронхолёгочный аспергиллёз (АБЛА) - хроническое инфекционно-аллергическое заболевание бронхов и лёгких, вызванное грибками Aspergillus fumigatus.
Эпидемиология
В 90% случаев АБЛА возникает у больных атопической БА. Распространённость аспергиллёза среди больных БА не превышает 1-2%.
Классификация
Выделяют 5 стадий АБЛА:
• Стадия I. Острая: уровень IgE в крови более 1500 МЕ/мл; количество эозинофилов в крови - 1000/мкл; на рентгенограммах лёгких выявляют «летучие» инфильтраты.
• Стадия II. Ремиссия: уровень IgE в крови незначительно выше нормы (160-300 МЕ/мл); количество эозинофилов в крови в норме.
• Стадия III. Обострение: уровень IgE в крови более 1500 МЕ/мл; количество эозинофилов в крови - 1000/мкл; на рентгенограммах лёгких «летучие» инфильтраты выявить не удаётся.
• Стадия IV. Кортикостероидозависимая БА: уровень IgE в крови около 1000 МЕ/мл; умеренное увеличение количества эозинофилов в крови (редко); на рентгенограммах лёгких выявляют «летучие» инфильтраты.
• Стадия V. Фиброз лёгочной ткани: картина прогрессирующей дыхательной недостаточности.
Этиология
Возбудитель заболевания - сапрофитный гриб Aspergillus fumigatus - широко распространён в природе. Споры грибов, попадая с вдыхаемым воздухом в бронхи, находят в вязком секрете подходящие условия для роста. Малый размер спор позволяет им успешно достигать респираторных бронхиол.
Патогенез
В развитии деструктивных лёгочных процессов предполагается участие реакций гиперчувствительности I, II и IV типов (по классификации Джелла и Кумбса). Взаимодействие антигена с иммунной системой организма приводит к образованию IgE-, IgA- и IgG-антител, активации клеток-мишеней аллергической реакции, высвобождению медиаторов аллергии и аллергическому воспалению стенок бронхов с инфильтрацией нейтрофилами и эозинофилами. Грибы выделяют токсин - афлатоксин - и секретируют протеолитические ферменты, вызывающие повреждения респираторного тракта.
Клиническая картина
Заболевание обычно начинается остро, чаще в холодное время года с повышением температуры от субфебрильных цифр до высоких фебрильных значений. Появляется или усиливается кашель с выделением слизисто-гнойной мокроты, иногда с примесью крови и коричневатыми образованиями в виде слепков бронхов. Больные жалуются на боли в грудной клетке, напоминающие плевральные, а также выраженную общую слабость, недомогание. Симптомы БА усиливаются: приступы удушья могут носить эпизодический характер, у некоторых больных могут развиваться тяжёлые приступы удушья и астматический статус.
Для АБЛА характерна клинико-рентгенологическая триада симптомов:
• атопическая БА;
• рецидивирующие инфильтраты лёгких;
• высокая эозинофилия периферической крови (около 1000 клеток в 1 мкл).
Осложнения: диссеминированный аспергиллёз у больных, получавших массивную терапию глюкокортикоидами.
Диагностика
• Физикальное обследование: характерна бледность кожных покровов, одышка, признаки интоксикации; при перкуссии
в верхних отделах лёгких выявляются участки притупления перкуторного звука, над которыми аускультативно прослушиваются влажные мелкопузырчатые хрипы.
• Аллергологическое обследование (см. соответствующий раздел).
• Лабораторные и инструментальные исследования:
◊ клинический анализ крови (эозинофилия более 20%, умеренный лейкоцитоз и повышение СОЭ);
◊ цитологический анализ мокроты (большинство клеток составляют эозинофилы);
◊ микроскопический анализ мокроты (выявляют элементы мицелия гриба);
◊ бактериологическое исследование мокроты (на кровяном или мальтозном агаре удаётся выделить культуру Aspergillus fumigatus);
◊ кожные тесты с экстрактом из Aspergillus fumigatus дают типичную реакцию по немедленному типу (однако эта реакция может свидетельствовать о наличии IgE-обусловленной сенсибилизации без наличия аспергиллёза), которая не является специфической у больных АБЛА;
◊ определение уровня общего IgE в сыворотке крови;
◊ определение уровня специфических IgE и IgG к Aspergillus fumigatus в сыворотке крови;
◊ рентгенологическое обследование (выявляют единичные или множественные инфильтраты, иногда занимающие почти половину верхней доли лёгкого);
◊ компьютерная томография (центральные бронхоэктазы в бронхах крупного и среднего калибра - типичные признаки АБЛА).
Дифференциальная диагностика
Дифференциальную диагностику АБЛА проводят у пациентов с эозинофильными лёгочными инфильтратами иного происхождения, лёгочным туберкулёзом и хроническим обструктивным бронхитом.
Лечение
Основной принцип лечения - терапия, направленная на снижение активности Aspergillus fumigatus и уменьшение степени сенсибилизации организма:
• применение системных глюкокортикоидов более 6 мес;
• противогрибковая терапия (амфотерицин В или итраконазол) проводится только в стадии ремиссии.
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТ
Экзогенный аллергический альвеолит (ЭАА) - диффузное, обычно двустороннее воспаление лёгочной ткани аллергической, аутоиммунной или токсической природы без поражения бронхиального дерева, сопровождающееся развитием дыхательной недостаточности.
Эпидемиология
Частоту распространения ЭАА определяют климатогеографические особенности, профессиональные и бытовые условия. Так, в Великобритании среди форм ЭАА преобладает «лёгкое любителя волнистых попугайчиков» и развивается у 2-5% владельцев домашних птиц. В США - «лёгкое пользующихся кондиционерами и увлажнителями воздуха» (15-70% всех вариантов ЭАА), в Японии - летний тип ЭАА, связанный с ростом грибов Trichosporon cutaneum (75% всех вариантов). В крупных промышленных городах (в том числе и в Москве) в настоящее время ведущие причины - аллергены птиц и грибковые аллергены.
Классификация
По типу течения выделяют острый, подострый и хронический
ЭАА.
Этиология
В индукции заболевания участвуют различные аллергены:
• Бактериальные аллергены (термофильные актиномицеты, Bacillus subtilis, Micropolispora faeni и др.).
• Грибковые аллергены (Aspergillus fumigatus, Alternaria spp, Penicillium notatum, Penicillium glaucum, Coniosporum corticale, Cryptostroma corticale и др.).
• Белковые антигены животного происхождения (сывороточные белки и экскременты кур, голубей, попугаев, крупного рогатого скота, свиней, пыль рыбной муки, пшеничной муки и др.).
• Антигены растительного происхождения (опилки дуба, кедра, коры клёна, красного дерева, экстракты кофейных зёрен и др.).
• Медикаментозные антигены (противомикробные, противовоспалительные, противопаразитарные, ферментные и другие лекарственные средства белкового происхождения).
В связи с тем что постоянная ингаляция тех или иных веществ связана с определённой профессией, отдельные виды ЭАА по-
лучили название по профессии или роду занятий больных (альвеолит мукомолов, болезнь сыроваров, лёгкое фермера, кашель ткачей и др.)
Патогенез
В развитии ЭАА ведущая роль принадлежит реакциям гиперчувствительности III и IV типов (по классификации Джелла и Кумбса). Образование и локальное отложение иммунных комплексов на ранних этапах развития воспалительного ответа (через 4-8 ч после контакта с аллергеном) вызывают острое повреждение интерстиция сосудов и альвеол, активирует систему комплемента (C3a, C5a) и альвеолярных макрофагов, стимулируя хемотаксис нейтрофилов и макрофагов. Последние вырабатывают провоспалительные и токсические продукты арахидоновой кислоты, кислородные радикалы, ИЛ-1, ФНО и другие факторы, усиливая острый воспалительный ответ и поддерживая в дальнейшем реакцию ГЗТ и CD8+ T-клеточную цитотоксичность. Реакции ГЗТ развиваются через 24-48 ч после экспозиции антигену. Стимуляция антигеном приводит к формированию гранулём и активации фибробластов и в результате - к избыточному синтезу коллагена и интерстициальному фиброзу.
Клиническая картина
Острый ЭАА обычно развивается после массивной экспозиции причинного аллергена в условиях окружающей среды (например, после контакта с заплесневелым сеном). Симптомы появляются через 4-12 ч. Характерны лихорадка, озноб, слабость, тяжесть в области грудной клетки, кашель, одышка, боли в мышцах и суставах. Мокрота, как правило, скудная, слизистая. Частым симптомом также являются головные боли, особенно в области лба. При осмотре пациента выявляют цианоз, при аускультации лёгких - крепитацию, более выраженную в базальных отделах; иногда могут выслушиваться и свистящие хрипы. Перечисленные симптомы обычно разрешаются в течение 24-72 ч, однако часто появляются вновь после нового контакта с причинным аллергеном.
Подострая форма ЭАА развивается при менее интенсивной хронической экспозиции причинных аллергенов, что чаще происходит в домашних условиях (например, при длительном контакте с домашними птицами). Основные симптомы: одышка при физической нагрузке, быстрая утомляемость, кашель со слизистой мо-
кротой, иногда лихорадка в дебюте заболевания. В лёгких (обычно в базальных отделах) выявляют мягкую крепитацию.
Хронический ЭАА развивается при длительной экспозиции антигену в невысокой дозе. Характерно незаметное начало, прогрессирующая одышка при физическом напряжении, тахипноэ, периодически анорексия и выраженное снижение массы тела; аускультативно выявляют крепитацию. Впоследствии у пациентов развиваются интерстициальный фиброз, лёгочное сердце, дыхательная и сердечная недостаточность.
Диагностика
• Физикальное обследование (см. выше).
• Аллергологическое обследование (см. соответствующий раздел).
• Лабораторные и инструментальные исследования:
◊ рентгенологическое обследование (усиление лёгочного рисунка и мелкоузелковые тени, спонтанно исчезающие после элиминации аллергена);
◊ компьютерная томография, выполняемая в момент вдоха (по показаниям; центролобулярные узелки, окружённые участками лёгочной ткани неправильной формы и повышенной прозрачности, которая свидетельствует об обструкции мелких дыхательных путей);
◊ функция внешнего дыхания: при остром течении ЭАА через 4-6 ч после экспозиции антигену выявляют рестриктивный тип нарушения вентиляции. Изменения функции внешнего дыхания иногда протекают двухфазно: в первой фазе - изменения по обструктивному типу (около 1 ч), во второй фазе (через 4-8 ч) - по рестриктивному типу;
◊ клинический анализ крови (лейкоцитоз до 25х109 клеток на литр, сдвиг лейкоцитарной формулы влево, СОЭ - нормальные значения или повышение до 40 мм/ч; эозинофилия нехарактерна, в отдельных случаях достигает 10%);
◊ выявление преципитирующих антител к специфическому антигену в сыворотке крови (иммуноэлектрофорез или иммунофлуоресцентный метод);
◊ определение уровня иммуноглобулинов (повышение IgM и общего IgА).
• Консультации специалистов: пульмонолога и фтизиатра.
Дифференциальная диагностика
Дифференциальную диагностику ЭАА проводят с атипичной и микоплазменной пневмонией, туберкулёзом, саркоидозом и другими интерстициальными заболеваниями лёгких.
Лечение
• Прекращение контакта с аллергеном (поскольку заболевание часто имеет профессиональный характер, обязательное соблюдение гигиенических мер на рабочем месте или смена профессии).
• Применение глюкокортикоидов; при неэффективности - иммуносупрессивная терапия.
• Физические методы лечения (массаж грудной клетки и лечебная физкультура).
УЗЕЛКОВЫЙ ПОЛИАРТЕРИИТ
Узелковый полиартериит (синонимы: узелковый периартериит, узелковый панартериит) - системное заболевание соединительной ткани, характеризующееся воспалением артерий среднего и малого калибра с последующей ишемией снабжаемых ими органов и систем, а также тяжёлыми сосудистыми осложнениями, определяющими прогноз заболевания.
В 1951 г. Дж. Чёрдж (J. Churg) и Л. Стросс (L. Strauss) включили в группу узелкового полиартериита больных с сочетанием БА, эозинофилии и системного васкулита - синдром Чёрджа-Стросс. Позднее синдром Чёрджа-Стросс был выделен в отдельную нозологическую форму.
Синдром Чёрджа-Стросс (ранее - астматический вариант узелкового полиартериита) - эозинофильное гранулёматозное воспаление органов дыхания и некротизирующий васкулит с сегментарным поражением артерий мелкого и среднего калибра в сочетании с БА и эозинофилией периферической крови.
Эпидемиология
Распространённость узелкового полиартериита невелика и составляет 4 случая на 1 млн населения. Болеют в основном мужчины в возрасте 40-50 лет. Поражение сосудов лёгких выявляют менее чем у 10% больных.
Класификация
Классификационные критерии клинических манифестаций синдрома Чёрджа-Стросс включают 6 основных проявлений: БА, эозинофилию периферической крови более 10%, моноили полинейропатию, летучие лёгочные инфильтраты, синуситы, экстраваскулярную тканевую эозинофилию.
Этиология
Причина развития узелкового полиартериита точно не установлена. Обсуждают вопрос о роли вирусных (респираторные вирусы, вирусы гепатитов В и С и др.) и бактериальных агентов, лекарственной непереносимости, введения вакцин и лечебных сывороток.
Патогенез
В патогенезе узелкового полиартериита имеет значение III тип реакций гиперчувствительности по классификации Джелла и Кумбса. Отмечают повышенное образование антинейтрофильных цитоплазматических аутоантител, направленных против различных цитоплазматических антигенов, что приводит к повышению проницаемости мембран нейтрофилов. При узелковом полиартериите происходит поражение мышечного типа артерий в области их разветвления, эндотелия сосудов, внутренней эластичной мембраны и периваскулярной ткани, что в конечном итоге может приводить к ишемии и некрозу тканей различных органов.
Клиническая картина
Узелковый полиартериит начинается с общих симптомов: лихорадки, утомляемости, мышечной слабости, миалгии, похудения. При поражении лёгких наиболее частые клинические проявления: внезапная одышка, свистящее дыхание, кашель разнообразного характера, кровянистая мокрота, рецидивирующее кровохарканье, боли в грудной клетке, плевральные боли; при вовлечении в патологический процесс почек - протеинурия, гематурия, хроническая почечная недостаточность, артериальная гипертензия; в пищеварительном тракте выявляют боли в животе, кровотечения, инфаркт кишечника. Часто возникают: атрофия мышц, поражение ЦНС, множественная нейропатия и артрит.
Диагностика
• Физикальное обследование и оценка жалоб больного.
• Аллергологическое обследование (см. соответствующий раздел)
• Лабораторные и инструментальные исследования:
◊ клинический анализ крови (возможен лейкоцитоз, тромбоцитоз, снижение гемоглобина, повышение СОЭ, для синдрома Чёрджа-Стросс характерна эозинофилия более 10%);
◊ биохимический анализ крови (выявляют повышение содержания СРБ, увеличение активности щелочной фосфатазы, ферментов печени);
◊ общий анализ мочи;
◊ бактериологическое исследование (исключение инфекционного заболевания);
◊ серологические тесты на сифилис;
◊ определение уровня общего IgE в сыворотке крови (характерно повышение);
◊ исследование компонентов комплемента (выявляют снижение концентрации);
◊ определение антинуклеарного и ревматоидного факторов (для исключения системного ревматического заболевания);
◊ определение антинейтрофильных цитоплазматических аутоантител (для подтверждения диагноза синдрома Чёрджа- Стросс);
◊ выявление маркёров вирусов гепатита В и С, а также ВИЧ;
◊ рентгенография органов грудной клетки (характерны симметричный или асимметричный отёк лёгких, усиление лёгочного рисунка, узелковые тени у корней, расширение корней, плевральный выпот);
◊ компьютерная и магнитно-резонансная томография (для определения локализации процесса);
◊ ангиография (выявляют аневризмы сосудов среднего калибра).
Дифференциальная диагностика
Дифференциальную диагностику узелкового полиартериита проводят с другими вариантами БА, системными и инфекционными заболеваниями, тяжёлым атеросклеротическим поражением сосудов, опухолями (предсердной миксомой, лимфопролиферативными опухолями).
Лечение
• Иммуносупрессивная терапия [глюкокортикоиды (преднизолон 1-2 мг/кг в сутки с постепенным снижением дозы), сочетание глюкокортикоидов и иммунодепрессантов].
• При неэффективности стандартного лечения и тяжёлом активном течении заболевания проводят плазмаферез.
• При наличии маркёров репликации вируса гепатита В в сочетании с глюкокортикоидами и плазмаферезом показано дополнительное назначение препаратов интерферона и ламивудина.
СИНДРОМ ЛЕФФЛЕРА
Различают 2 варианта синдрома Леффлера (другое написание: Лёффлера; врач W. Loffler) - эозинофильный летучий инфильтрат и рестриктивную кардиомиопатию. Синдром Леффлера-1 (синонимы: простая эозинофильная пневмония, летучие эозинофильные инфильтраты, простая лёгочная эозинофилия) - заболевание, характеризующееся наличием транзиторных эозинофильных лёгочных инфильтратов с высокой эозинофилией крови.
Эпидемиология
Заболевание распространено повсеместно, чаще встречается в тропиках. Преобладающий возраст заболевших - 16-40 лет.
Этиология
Синдром Леффлера может быть вызван практически любой паразитарной инвазией тканей (аскаридами, анкилостомами, трихинеллами, плоскими червями, печёночным сосальщиком, шистосомами, стронгилоидами, кошачьим сосальщиком, токсокарой, острицами, филяриями). Известна также роль ингаляционных аллергенов - пыльцы растений, спор грибов, некоторых производственных аллергенов (в частности никелевой пыли), лекарственных средств (сульфаниламидов, пенициллина, соединений золота). Однако во многих случаях выяснить этиологический фактор не представляется возможным, и тогда речь идёт об эозинофильной пневмопатии.
Патогенез
В формировании синдрома Леффлера принимает участие аллергическая реакция немедленного типа, о чём свидетельствуют «летучий» характер инфильтратов и полная их регрессия без формирования вторичных патологических очагов, а также повышение уровня IgE в сыворотке крови у этих больных. В ряде случаев
синдром Леффлера развивается по типу феномена Артюса за счёт образования преципитирующих антител к антигенам. Иногда в эозинофильных инфильтратах выявляют лимфоциты, что свидетельствует об участии в патогенезе клеточно-опосредованных аллергических реакций.
Клиническая картина
В большинстве случаев больные жалоб не предъявляют. Реже выявляют сухой, непродуктивный кашель, субфебрильную температуру, иногда - проявления бронхоспазма. Мокрота вязкая, в небольшом количестве, редко - с примесью крови. При аускультации выслушиваются сухие хрипы, преимущественно в верхних отделах лёгких.
Диагностика
• Физикальное обследование.
• Аллергологическое обследование (см. соответствующий раздел).
• Лабораторные и инструментальные исследования:
◊ клинический анализ крови (выявляют лейкоцитоз, высокий уровень эозинофилии - до 20-70%, однако при хронизации процесса количество эозинофилов может не превышать нормальных значений);
◊ цитологический анализ мокроты (выявляют эозинофилы, кристаллы Шарко-Лейдена);
◊ паразитологическое обследование (копроовоцистоскопия, выявление антител к антигенам токсокары, эхинококка, описторхиса, трихинеллы) по показаниям;
◊ определение уровня общего IgE в сыворотке крови (повышение иногда до 1000 МЕ/мл);
◊ определение уровня специфических IgE в сыворотке крови;
◊ рентгенологическое обследование (выявляют единичные или множественные инфильтраты округлой формы, локализованные чаще в верхних отделах обоих лёгких, субплеврально (типичен «летучий» характер инфильтратов - могут исчезать самостоятельно через несколько дней, не оставляя рубцов в лёгочной ткани).
Дифференциальная диагностика
Дифференциальную диагностику проводят у пациентов с лёгочным туберкулёзом, бактериальными и вирусными пневмониями, саркоидозом, лимфогранулёматозом, гранулёматозом Вегенера, при длительном течении - с АБЛА и синдромом Чёрджа-Стросс.
Лечение
• Противопаразитарные лекарственные средства [карбендацим, альбендазол* (албендазол), мебендазол, пирантел].
• Десенсибилизирующая терапия (блокаторы Н1-рецепоров гистамина, системные глюкокортикоиды).
Возможно спонтанное выздоровление.
ТРОПИЧЕСКАЯ ЭОЗИНОФИЛИЯ
Тропическая эозинофилия - заболевание, вызываемое микрофиляриями и характеризующееся персистирующей эозинофилией, поражением лёгких и плевры.
Эпидемиология
Заболевание распространено в странах тропического пояса. Болеют обычно лица в возрасте 20-40 лет, мужчины в 4 раза чаще, чем женщины.
Этиология и патогенез
Возбудителей филяриозов относят к отряду Spirurida, семейству Filarioidea. Для филярий человек - окончательный хозяин. Источник инвазии - больной человек или позвоночное животное. Промежуточный хозяин - кровососущие насекомые (комары, слепни). При укусе комара инвазионные формы микрофилярий попадают в кожу, активно внедряются в кровеносное русло и с током крови заносятся в ткани. Спустя 3-18 мес происходит их превращение в половозрелые формы. В результате жизнедеятельности паразитов и при их распаде образуются вещества, вызывающие сенсибилизацию организма хозяина с местными и общими токсико-аллергическими реакциями. Микрофилярии, находящиеся в сосудистом русле, вызывают застой лимфы, что приводит к развитию вторичной инфекции.
Клиническая картина
После заражения постепенно развиваются сухой кашель, одышка, свистящее дыхание, особенно выраженные по ночам, а также недомогание, потеря аппетита и похудение. При обострении в лёгких выслушивают сухие и влажные хрипы. У детей, в отличие от взрослых, часто увеличиваются лимфоузлы и печень. Осложнения: пневмосклероз.
Диагностика
Диагностику основывают на эпидемиологических данных и клинической картине.
• Физикальное обследование.
• Лабораторные и инструментальные исследования:
◊ клинический анализ крови (характерна выраженная эозинофилия - более 3000 клеток в 1 мкл у 20-50% больных);
◊ определение уровня общего IgE в сыворотке крови (более 1000 МЕ/мл);
◊ в сыворотке крови и бронхоальвеолярном лаваже выявляют антитела к филяриям;
◊ рентгенологическое обследование (ограниченные, множественные и относительно стойкие инфильтраты размером 1-2 мм на фоне усиленного лёгочного рисунка);
◊ определение функции внешнего дыхания (рестриктивные нарушения и снижение диффузионной способности лёгких, а у 30% больных - обструктивные нарушения).
Дифференциальная диагностика
Дифференциальную диагностику тропической эозинофилии проводят у пациентов с эозинофильной пневмонией, туберкулёзом, саркоидозом, АБЛА.
Лечение
Применяют противопаразитарные лекарственные средства [диэтилкарбамазин, альбендазол♠ (албендазол)], десенсибилизирующую терапию (блокаторы Н1-рецепоров гистамина, системные глюкокортикоиды).
АНАФИЛАКТИЧЕСКИЙ ШОК
Анафилактический шок (АШ) - угрожающее жизни состояние, остро развивающееся в ответ на воздействие аллергена, сопровождающееся нарушением гемодинамики, что приводит к недостаточности кровообращения и гипоксии во всех жизненно важных органах.
Эпидемиология
Среди всех анафилактических реакций частота АШ составляет 4,4%. У лиц, страдающих атопией, частота развития АШ выше. Наиболее частая причина развития АШ - введение различных
лекарственных средств (20,8% всех случаев АШ), ужаление перепончатокрылыми насекомыми (в общей популяции - 0,8-3,3%; у пчеловодов - 15-43%); пищевые, пыльцевые и некоторые бактериальные аллергены; латекс (0,3% в общей популяции) и др. Смертность от АШ составляет 3-4,3%.
Классификация
Тяжесть АШ определяют по выраженности гемодинамических нарушений. Выделяют 4 степени тяжести АШ (см. раздел «Клиническая картина»).
В зависимости от характера тех или иных проявлений анафилаксии и сопутствующих гемодинамических нарушений выделяют 5 форм АШ: гемодинамическую, асфиксическую, абдоминальную, церебральную, АШ с преимущественным поражением кожных покровов и слизистых оболочек.
В зависимости от характера течения АШ выделяют острое злокачественное, доброкачественное, затяжное, рецидивирующее, абортивное течение.
Этиология
АШ - клиническое проявление анафилаксии, обусловленной сенсибилизацией к различным аллергенам: лекарственным средствам (чаще всего антибиотикам и НПВС), ядам перепончатокрылых (пчёл, ос и др.), пищевым аллергенам (у детей до 3 лет - белкам куриного яйца, молока, сои; у лиц более старшего возраста - к белкам арахиса, ракообразных, рыбы), пыльцевым аллергенам, некоторым бактериальным аллергенам, гетерологичным сывороткам и вакцинам, латексу. Истинный АШ развивается при повторном попадании аллергена в организм, при этом первичный контакт с этим аллергеном может происходить относительно незаметно. АШ может стать следствием ошибок при проведении АСИТ или аллергологического тестирования in vivo с использованием диагностических аллергенов.
Развитие анафилактоидной (неиммунной) реакции (клинически схожей с анафилактической) возможно уже при первом введении таких лекарственных средств, как декстраны, рентгеноконтрастные вещества, протамина сульфат, протеазы, перфторкарбоны, стрептаза♠ (стрептокиназа), алтеплаза, альбумин♠ (альбумин человека), маннитол, морфин, полимиксин В и других лекарств, оказывающих прямое гистаминвысвобождающее действие на тучные клетки.
На некоторые лекарственные средства могут развиваться как анафилактические, так и анафилактоидные реакции (местные анестетики, наркотические лекарственные средства, миорелаксанты, препараты крови, НПВС).
Патогенез
АШ по механизму развития относят к аллергическим реакциям немедленного типа (I тип, IgE-, реже IgG4-опосредованные). В патогенезе АШ отсутствует иммунопатологическая стадия.
Клиническая картина
Время развития АШ - от нескольких секунд до нескольких часов. Основные симптомы АШ обусловлены нарушением гемодинамики. При АШ может возникать несколько волн гемодинамических расстройств. Помимо этого выявляют нарушения со стороны других органов и их систем: дыхательной (бронхоспазм, отёк в различных отделах респираторного тракта, гиперсекреция слизи и др.), центральной и периферической нервной системы (нарушение мозгового кровообращения, демиелинизирующий процесс); органов пищеварения (спазм гладких мышц кишечника и печёночных вен, расширение капилляров и артерий брюшной полости с депонированием в них крови, усиление образования пепсина и соляной кислоты в желудке); органов мочеполовой системы (спазм гладкой мускулатуры матки и мочевого пузыря), а также гематологические нарушения (снижение свёртываемости крови и активация протеинсвёртывающей системы, приводящие к геморрагическим осложнениям, тромбозам и развитию синдрома диссеминированного внутрисосудистого свёртывания крови). Повышение сосудистой проницаемости и другие изменения в покровных тканях приводят к возникновению кожных проявлений анафилаксии (кожного зуда, крапивницы, отёка Квинке). После выхода из шокового состояния у больных могут сохраняться нарушения функций различных органов и систем в течение 3-4 нед. Возможны поздние аллергические реакции, демиелинизирующие процессы в ЦНС, аллергический миокардит, гепатит, гломерулонефрит, неврит, васкулит и др. Такие больные требуют более длительного врачебного наблюдения.
От выраженности гемодинамических нарушений зависит степень тяжести шока.
• АШ I степени тяжести: артериальное давление снижено на 30- 40 мм рт.ст. от нормальных величин; могут выявляться пред-
вестники (зуд кожи, высыпания, першение в горле, кашель и др.); пациент в сознании (может возникать возбуждение или вялость, депрессия, беспокойство, страх смерти); характерна гиперемия кожных покровов, возможны крапивница, АО, симптомы АР, АК, кашель. Легко поддаётся лечению симпатомиметиками и глюкокортикоидами.
• АШ II степени тяжести: артериальное давление 90-60/40 мм рт. ст.; потеря сознания наступает не сразу или не происходит совсем; может быть продромальный период, для которого характерны беспокойство, страх смерти, слабость, зуд кожи, крапивница, АО, осиплость голоса (вплоть до афонии), затруднение глотания, головокружение, головная боль, шум в ушах, парестезии, симптомы АР и АК, боли в животе, пояснице и в области сердца. Объективно выявляются бледность кожных покровов, иногда с синюшным оттенком, одышка, стридорозное дыхание, хрипы в лёгких, тахикардия, тахиаритмия. Может возникать рвота, непроизвольная дефекация и мочеиспускание.
• АШ III степени тяжести: потеря сознания происходит быстро, артериальное давление 60-40/0 мм рт. ст.; нередко выявляют тонические и клонические судороги, холодный липкий пот, цианоз губ, расширение зрачков. Тоны сердца глухие, сердечный ритм неправильный, пульс нитевидный. Лечение малоэффективно.
• АШ IV степени тяжести: стремительное развитие с немедленной потерей сознания, артериальное давление определить не удаётся, тоны сердца и дыхание не выслушиваются. Ответ на введение симпатомиметиков и глюкокортикоидов практически отсутствует.
Диагностика
Порядок проведения обследования при АШ отличен от такового при других аллергических заболеваниях. В остром периоде сбор аллергологического анамнеза у пациента часто невозможен, диагноз АШ устанавливают на основании клинической картины и обстоятельств, при которых развилась реакция (введение лекарственных средств, ужаление насекомыми и т.д.), а также данных лабораторного и инструментального обследования.
• Аллергологический, фармакологический и пищевой анамнез (см. соответствующий раздел) собирают подробно после стабилизации состояния пациента.
• Физикальное, лабораторное и инструментальное обследование
проводят в острый период для оценки клинической картины шока, тяжести состояния, выявления осложнений АШ, а также динамического контроля за состоянием пациента. Мониторинг состояния пациента проводят в течение всего периода наблюдения для оценки адекватности лечения и продолжают в течение 7-10 сут после купирования острого состояния, поскольку существуют вероятность рецидива симптоматики и развития поздних аллергических реакций. В течение 3-4 нед у пациента могут сохраняться нарушения функций различных органов и систем.
◊ Лабораторное общеклиническое обследование включает клинический анализ крови; определение рН, РаСО2, РаО2 (оценка выраженности респираторного и метаболического ацидоза), водно-электролитного баланса; исследование системы свёртывания крови и другие тесты (по показаниям).
◊ Лабораторное аллергологическое обследование можно проводить на фоне лечения, направленного на купирование острой реакции при необходимости уточнения диагноза (определение уровня гистамина, триптазы, ИЛ-5 в крови, уровня общего и специфического IgE). После стабилизации состояния пациенту можно провести более подробное обследование, направленное на уточнение причиннозначимого аллергена: кожное тестирование, лабораторную диагностику (предпочтительно использование лабораторных методов исследования).
Дифференциальная диагностика
Дифференциальную диагностику АШ проводят со всеми видами шока и другими острыми состояниями, сопровождающимися артериальной гипотензией, нарушением дыхания и нарушением сознания (септическим и кардиогенным шоком, острой сердечной недостаточностью, инфарктом миокарда, обмороками, тромбоэмболией лёгочной артерии, эпилепсией, солнечными и тепловыми ударами, гипогликемией, гиповолемией, передозировкой лекарственных средств и др.). АШ необходимо дифференцировать с системной анафилактоидной реакцией, в основе которой лежит дозозависимый неиммунный механизм.
Лечение
Лечение АШ включает комплекс неотложных мероприятий, направленных на устранение основных нарушений, вызванных ал-
лергической реакцией. Объём предпринимаемых мер определяется тяжестью состояния и клиническими проявлениями:
• прекращение контакта с аллергеном;
• инфузионная терапия (введение коллоидных и кристаллоидных растворов);
• лечение адреномиметиками;
• лечение системными глюкокортикоидами;
• симптоматическое лечение;
• сердечно-лёгочная реанимация (при остановке дыхания и кровообращения).
Прекращение контакта с аллергеном. В зависимости от причины АШ следует прекратить введение лекарственных средств, удалить жало насекомого и т.д. Выше места инъекции или ужаления (по возможности) наложить венозный жгут; место инъекции или ужаления обколоть 0,1% раствором эпинефрина в дозе 0,1-0,3 мл внутрикожно и приложить лёд.
Контроль и обеспечение проходимости дыхательных путей. При нарушении проходимости дыхательных путей корнем языка вследствие нарушения сознания необходимо выполнить тройной приём Сафара (в положении пациента лёжа на спине переразгибают голову в шейно-затылочном сочленении, выводят вперёд и вверх нижнюю челюсть, приоткрывают рот), при возможности - вводят воздуховод или интубационную трубку. У больных с нарушением проходимости дыхательных путей вследствие отёка глотки и гортани необходимо как можно быстрее интубировать трахею. При затруднении интубации или невозможности её проведения необходимо выполнить конихотомию (экстренное рассечение мембраны между щитовидным и перстневидным хрящами). После восстановления проходимости дыхательных путей необходимо обеспечить дыхание чистым кислородом.
Лечение симпатомиметиками: эпинефрин 0,1% раствор вводят подкожно по 0,3-0,5 мл; при неэффективности возможно повторное подкожное введение с интервалами 5-10 мин (максимально 2,0 мл) и переход на внутривенное капельное введение (эпинефрин или норэпинефрин) до стабилизации состояния. При тяжёлом течении АШ необходимо сразу начинать с внутривенного введения эпинефрина. Одновременно с симпатомиметиками показано введение допамина (особенно важно при необходимости длительной прессорной терапии при низком ответе на применение сим-
патомиметиков, при высоком риске развития осложнений, связанных с нарушением кровообращения жизненно важных органов) по 4-10 мкг/кг/мин, в тяжёлых случаях до 50 мкг/кг/мин и больше. Подбор препарата, скорость и длительность его введения осуществляют в каждой конкретной ситуации индивидуально.
Лечение глюкокортикоидами: вводят внутривенно капельно, струйно или внутримышечно; длительность и доза зависят от степени тяжести и причин, приведших к развитию АШ (преднизолон - 90-120 мг, или дексаметазон - 8-32 мг, или гидрокортизон - 250 мг, или бетаметазон - 8-32 мг).
Инфузионную терапию проводят для восполнения объёма циркулирующей крови, устранения гемоконцентрации и эффективного восстановления артериального давления на перфузионном уровне. Применяют сочетание коллоидных и кристаллоидных растворов (декстраны, изотонический раствор натрия хлорида, раствор Рингера* и др.)
Симптоматическая терапия: при необходимости проводят дополнительное симптоматическое лечение (в том числе блокаторами Н1-рецепторов гистамина, диуретиками, бронхолитическими лекарственными средствами). Лечение блокаторами Н1-рецепторов гистамина и диуретиками проводят только при наличии строгих показаний и на фоне полной стабилизации артериального давления и отмены вазопрессорной терапии. При сохраняющемся, несмотря на введение эпинефрина, бронхообструктивном синдроме возможно внутривенное введение аминофиллина [2,4% раствор по 5-6 мг/кг в течение 20 мин с последующей инфузией (при необходимости) 0,2-0,9 мг/кг в час]. При развитии АШ в ответ на введение пенициллина показано однократное внутримышечное введение пенициллиназы* - 1 млн ЕД в 2,0 мл изотонического раствора натрия хлорида (при развитии АШ в ответ на введение пролонгированных форм пенициллинов - применяют в течение 3 сут).
Профилактика. Необходим правильно собранный анамнез жизни и заболеваний больного, фармакологический анамнез (аллергические заболевания у больного и в семье; наличие у больного соматических заболеваний, способных привести к предполагаемой сенсибилизации; наличие профессиональных вредностей; были ли раньше осложнения при введении сывороток и вакцин, осложнения при использовании медикаментов и др.). Следует регистрировать в амбулаторной и стационарной карте все лекарственные
средства (или группы), к которым установлена непереносимость. Необходимо избегать полипрагмазии, назначать препараты только по показаниям. Всем больным, перенёсшим острые анафилактические и анафилактоидные реакции, должно быть проведено аллергологическое обследование для установления причинно-значимого аллергена и должен быть выдан паспорт больного аллергическим заболеванием. Следует провести обучение пациента профилактике обострений. Нужно информировать (самому больному или родственникам) врачей других специальностей об имеющейся аллергии. Пациентам с инсектной аллергией показаны проведение АСИТ и соблюдение профилактических мероприятий в сезон вылета перепончатокрылых насекомых, включая ношение индивидуальной аптечки (см. соответствующий раздел).
АТОПИЧЕСКИЙ ДЕРМАТИТ
Атопический дерматит (АтД) [синонимы: синдром атопической экземы/дерматита (САЭД), атопическая экзема, детская экзема, конституциональная экзема, нейродермит, пруриго Бенье] - аллергическое заболевание кожи, возникающее, как правило, в раннем детском возрасте у лиц с наследственной предрасположенностью к атопическим заболеваниям, имеющее хроническое рецидивирующее течение, возрастные особенности локализации и морфологии очагов воспаления, характеризующееся кожным зудом и обусловленное гиперчувствительностью как к аллергенам, так и к неспецифическим раздражителям.
Эпидемиология
Распространённость АтД среди детей и подростков в развитых странах составляет 10-37%, среди взрослого населения - 0,2-2%. В России этот показатель по приблизительным оценкам составляет 5,9%. Чаще заболевание развивается в течение первых 5 лет жизни, причём у половины - в возрасте до года, у остальных - от года до 5 лет.
Классификация
В настоящее время не существует единой классификации АтД. Иногда выделяют:
• экзогенный (аллергический) АтД, ассоциированный с респираторной аллергией и сенсибилизацией к аэроаллергенам;
• эндогенный (неаллергический) АтД, неассоциированный с респираторной аллергией и сенсибилизацией к каким-либо аллергенам.
В рабочей классификации АтД, предложенной отечественными авторами, выделяют возрастные периоды, стадии заболевания, степень тяжести и распространённости кожного процесса.
Рабочая классификация АтД
• Возрастные периоды заболевания:
◊ I - младенческий (до 2 лет);
◊ II - детский (от 2 до 13 лет);
◊ III - подростковый и взрослый (старше 13 лет).
• Стадии заболевания:
◊ стадия обострения:
♦ фаза выраженных клинических проявлений;
♦ фаза умеренных клинических проявлений;
◊ стадия ремиссии:
♦ неполная ремиссия;
♦ полная ремиссия.
• Распространённость процесса:
◊ ограниченно-локализованный;
◊ распространённый;
◊ диффузный.
• Степень тяжести процесса:
◊ лёгкое течение;
◊ средней тяжести;
◊ тяжёлое течение.
Этиология
У большинства больных АтД - самое раннее клиническое проявление атопии: у 80-90% пациентов он начинается в первые 5 лет жизни. Генетическую предрасположенность к атопии выявляют у 60-80% больных. Более чем у 80% больных АтД ассоциирован с АР или АК (или и с тем, и с другим), у 30-40% - с аллергической БА. Важную роль в формировании АтД играют пищевые (белки коровьего молока, куриного яйца, рыбы, злаков) и ингаляционные (бытовые, эпидермальные, пыльцевые, грибковые) аллергены. Частым обострениям АтД и его хроническому течению способствуют провоцирующие факторы (механические, физические, химические раздражители, повышенное потоотделение,
табачный дым, стресс, гормональные нарушения, инфекционные поражения, поллютанты).
Патогенез
Патогенез АтД многокомпонентный, хотя главную роль в развитии заболевания играют иммунные нарушения. В основе АтД лежит хроническое аллергическое воспаление кожи. Пусковой механизм иммунного ответа при АтД - взаимодействие аллергенов с IgE-антителами на поверхности тучных клеток и базофилов. Помимо пищевых и аэроаллергенов, среди которых наибольшее значение имеют клещи домашней пыли - Dermatophagoides pteronissinus и Dermatophagoides farinae, IgE-ответ могут инициировать суперантигены Staphylococcus aureus, а также грибы Malassezia spp., Candida spp. и аутоантигены. Ведущий иммунопатологический механизм развития АтД состоит в двухфазном изменении соотношения Тh1/Тh2-лимфоцитов. В острую фазу происходит активация Тh2-клеток, приводящая к образованию большого количества IgE-антител. Хроническая фаза заболевания характеризуется преобладанием Тh1-ответа.
Важную роль в развитии АтД отводят дефекту врождённого иммунного ответа, в частности нарушению функции эпидермального барьера, образованию противомикробных пептидов, а также миграции нейтрофилов. Эти нарушения лежат в основе повышенной колонизации кожи больных АтД патогенами S. aureus, Malassezia spp., Candida spp. и подверженности вирусной инфекции (Herpes simplex virus, Molluscum contagiosum virus, Vaccinia virus). В развитии хронического воспаления при АтД принимает участие IgE-аутореактивность, т.е. IgE-ответ против белков собственных экто-, мезо- и эндодермальных тканей. При АтД имеются нарушения нейровегетативной регуляции, чем объясняется хроническое течение заболевания даже при отсутствии экспозиции этиологически значимых аллергенов. У таких больных снижается порог чувствительности к стрессовым влияниям (страх, перенапряжение, перевозбуждение и др.).
Клиническая картина
Основные клинические признаки АтД - кожный зуд и поражение кожи (папулёзные, везикулёзные высыпания, сухость кожи, шелушение, гиперемия, инфильтрация, расчёсы, лихенизация, мокнутие).
Зуд является постоянным симптомом во всех возрастных периодах и может быть изнуряющим, так называемым биопсирующим. Поражение кожи в разных возрастных периодах проявляется неодинаково.
• Младенческий период: преобладание экссудативной формы АтД, воспаление носит острый или подострый характер, присутствует гиперемия, отёчность, мокнутие, корки. Локализация: лицо, наружная поверхность голеней, сгибательные и разгибательные поверхности конечностей. К концу этого периода очаги локализуются преимущественно в области локтевых сгибов и подколенных ямок, а также в области запястий и шеи.
• Детский период: процесс носит характер хронического воспаления: эритема, папулы, шелушение, утолщение кожи (инфильтрация), усиление кожного рисунка (лихенизация), множественные экскориации (расчёсы), трещины. На местах разрешения высыпаний - участки гипоили гиперпигментации. У некоторых детей в этом периоде формируется дополнительная складка нижнего века [симптом Денни-Моргана (Dennie-Morgan)]. Локализация: локтевые и подколенные складки, задняя поверхность шеи, сгибательные поверхности голеностопных и лучезапястных суставов, заушные области.
• Подростковый и взрослый период: преобладают явления инфильтрации с лихенизацией, эритема имеет синюшный оттенок. Папулы сливаются в очаги сплошной папулёзной инфильтрации. Локализация: верхняя половина туловища, лицо, шея, верхние конечности.
Распространённость процесса оценивают по площади поражения кожи в процентах от общей площади кожных покровов:
• ограниченно-локализованный (менее 10%): локтевые и/или подколенные складки, кожа кистей рук, кожа шеи и/или лица;
• распространённый (10-50%): частично поражена кожа груди, спины, помимо локтевых и подколенных складок, вовлекаются в процесс другие участки кожи конечностей (плечи, предплечья, голени, бёдра);
• диффузный (более 50%): кожа всего тела, волосистая часть головы.
При оценке степени тяжести заболевания учитывают длительность и частоту обострений, длительность ремиссий, распростра-
нённость кожного процесса и его морфологические особенности, интенсивность кожного зуда, нарушение сна, эффективность проводимого лечения.
• Лёгкое течение: ограниченно-локализованное поражение кожи; редкие обострения (1-2 раза в год), преимущественно в холодное время года продолжительностью до 1 мес; продолжительность ремиссии 6-8 мес; хороший эффект от проводимого лечения.
• Среднетяжёлое течение: распространённое поражение кожи; обострения возникают чаще (до 3-4 раз в год) и длятся дольше - до нескольких месяцев; продолжительность ремиссии менее 4 мес; упорное течение с невыраженным эффектом от проводимого лечения.
• Тяжёлое течение: распространённое или диффузное поражение кожи; частые (более 6 раз в год) и длительные (несколько месяцев или постоянные) обострения; редкие и непродолжительные (менее 2 мес) ремиссии; лечение приносит кратковременное и незначительное улучшение.
АтД часто сочетается с респираторными проявлениями атопии (АР, АК, БА), а также может осложняться вторичными инфекционными заболеваниями (бактериальными, грибковыми или вирусными). Для больных АтД характерно наличие сопутствующих заболеваний внутренних органов и систем, выявляемых в среднем у 80% детей и у 90% взрослых. На первом месте стоит патология органов пищеварительного тракта.
Диагностика
• Физикальное обследование: следует обратить внимание на характер высыпаний, которые могут соответствовать определённому возрастному периоду АтД; наличие или отсутствие расчёсов, свидетельствующих об интенсивности кожного зуда, а также на симптомы АР, АК и БА.
• Аллергологическое обследование (см. соответствующий раздел).
• Лабораторные и инструментальные исследования:
◊ клинический анализ крови (возможно наличие эозинофилии);
◊ общий анализ мочи;
◊ биохимический анализ крови (СРБ, общий белок, билирубин, аланин аминотрансфераза, аспартат аминотрансфераза, глюкоза);
◊ бактериологическое исследование фекалий и посевы со слизистых оболочек ротоглотки и других возможных очагов инфекции (по показаниям);
◊ паразитологическое обследование (копроовоцистоскопия, выявление антител к антигенам токсокары, эхинококка, описторхиса, трихинеллы) по показаниям;
◊ ультразвуковое исследование органов брюшной полости, щитовидной железы, почек (по показаниям);
◊ гастроскопия (по показаниям);
◊ дуоденальное зондирование с посевом жёлчи (по показаниям);
◊ рентгенография органов грудной клетки и придаточных пазух носа (по показаниям).
Цель общеклинического обследования - выявление сопутствующих заболеваний и очагов хронической инфекции.
Дифференциальная диагностика
Дифференциальную диагностику АтД проводят со следующими заболеваниями: себорейным дерматитом, пелёночным дерматитом, аллергическим контактным дерматитом, чесоткой; строфулюсом; ихтиозом обыкновенным; псориазом обыкновенным; ограниченным нейродермитом (лишай Видаля); микробной экземой; розовым лишаем Жибера; дерматофитией; лимфомой кожи в ранней стадии; герпетиформным дерматитом Дюринга; фенилкетонурией; синдромом гипериммуноглобулинемии E; синдромом Вискотта- Олдрича; десквамативной эритродермией Лейнера-Муссу.
Лечение
Лечение АтД включает:
• наружное лечение и уход за кожей;
• системную фармакотерапию;
• патогенетическое лечение (АСИТ);
• физиотерапевтические методы лечения;
• обучение пациента;
• реабилитацию и профилактику, включая элиминацию причинно-значимого аллергена.
Наружная терапия
• Лекарственные средства, не содержащие глюкокортикоиды.
• Наружные глюкокортикоиды - нефторированные (предпочтительнее) и фторированные. Для наибольшей эффективности и избежания побочных эффектов следует:
◊ использовать наружные глюкокортикоиды непродолжительно;
◊ чередовать участки воздействия; не использовать препараты этой группы под повязки;
◊ снижать частоту аппликаций после улучшения;
◊ использовать топические глюкокортикоиды, обладающие высокой эффективностью, низкой системной абсорбцией и низким атрофогенным потенциалом.
• Топические иммунодепрессанты - ингибиторы кальциневрина (пимекролимус, такролимус). Эти препараты эффективно контролируют лёгкие и среднетяжёлые формы АтД.
В зависимости от клинической картины АтД и локализации очагов поражения средства для наружной терапии применяют в различных лекарственных формах: в виде водных растворов, эмульсий, лосьонов, аэрозолей, паст, кремов, мазей и др.
При осложнённом микробной инфекцией АтД целесообразно применять комбинированные наружные лекарственные средства, содержащие, помимо глюкокортикоидов, антибиотик, эффективный в отношении стафилококка, и противогрибковый компонент. Также высокой эффективностью, особенно при осложнённых формах АтД, обладают препараты цинка, такие как цинка пиритионат.
Специальный уход за кожей включает использование наружных лечебно-косметических средств, а также мероприятий по устранению триггерных факторов. Его нужно проводить как в периоды обострения заболевания, так и во время ремиссии.
Системная фармакотерапия АтД
• Блокаторы H1-рецепторов гистамина. Больным с тяжёлым течением АтД, особенно при обострении сопутствующих атопических заболеваний, возможно парентеральное введение блокаторов Н1-рецепторов гистамина с последующим переводом пациента на приём препаратов этой группы внутрь.
• Системные глюкокортикоиды (дексаметазон, преднизолон) вводят парентерально для купирования обострения распространённых форм или тяжёлого диффузного АтД при неэффективности наружной терапии.
• Системные иммунодепрессанты (циклоспорин А) применяют при упорном течении АтД и неэффективности других видов терапии.
При наличии показаний проводят системную антибактериальную (предпочтительно макролиды) и противогрибковую (кетоконазол, тербинафин, флуконазол и др.) терапию.
Аллергенспецифическая иммунотерапия (АСИТ). Пациентам с АтД при точном выявлении причинных аллергенов в периоды ремиссии показано проведение АСИТ (см. соответствующий раздел).
Физиотерапевтические методы лечения, а также искусственные и природные курортные факторы применяют в комплексе с наружной и фармакотерапией больных АтД. Основное место занимает ультрафиолетовое облучение, оказывающее хороший терапевтический эффект при различных стадиях АтД. При тяжёлом и упорном течении АтД применяют метод фотохимиотерапии или ПУВА-терапии, в основе которого лежит сочетанное использование фотосенсибилизаторов фурокумаринового ряда и длинноволнового ультрафиолетового излучения в диапазоне волн 320-400 нм.
Обучение пациента подразумевает проведение беседы о природе заболевания, мерах профилактики обострения АтД, основных правилах личной гигиены и ухода за кожей при АтД; методах лечения в период обострения и ремиссии.
Профилактика включает следующие основные мероприятия: элиминацию аллергена (см. соответствующий раздел), соблюдение индивидуальных элиминационных диет; проведение премедикации перед инвазивными методами обследования и лечения, включающей парентеральное введение глюкокортикоидов и блокаторов Н1-рецепторов гистамина; назначение гипоаллергенных диет женщинам из групп риска во время лактации значительно снижает частоту возникновения АтД у детей; на протяжении первых 4 мес жизни ребёнка, входящего в группы риска, рекомендуется исключительно грудное вскармливание, при необходимости для докармливания ребёнка разрешают профилактические или лечебно-профилактические гипоаллергенные смеси (на основе гидролизатов молочного белка); введение прикормов оправдано только продуктами с низкой сенсибилизирующей активностью после 4 мес жизни; контроль над факторами внешней среды (исключение воздействия табачного дыма, уменьшение экспозиции аллергенов в первые годы жизни, поддержание низкой влажности и адекватной вентиляции, уменьшение воздействия поллютантов); исключение применения различных раздражающих веществ, стиральных порошков, сильных моющих средств, растворителей
и др.; избегание интенсивной физической нагрузки как фактора, усиливающего потоотделение и зуд; исключение воздействия крайних значений температур и влажности; избегание стрессовых ситуаций.
КОНТАКТНЫЙ ДЕРМАТИТ
Контактный дерматит - воспаление кожи, возникающее при воздействии на неё экзогенных факторов (механических, физических, химических).
Аллергический контактный дерматит (АКД) относят к группе аллергодерматозов. Он характеризуется развитием воспаления кожи в ответ на воздействие веществ, способных вызывать специфическую аллергическую реакцию.
Эпидемиология
По данным разных авторов, контактным дерматитом страдает от 5 до 10% населения.
Классификация
По этиологии:
• простой контактный дерматит;
• аллергический контактный дерматит. По течению:
• острый контактный дерматит;
• хронический контактный дерматит.
Этиология
Простой (воспалительный) контактный дерматит возникает вследствие воздействия раздражающих химических веществ или других факторов (трения, термического ожога, травмы и др.), носит неаллергический характер. Аллергический контактный дерматит возникает после повторного контакта кожи с каким-либо аллергеном.
Известно более 3000 веществ, обладающих аллергенными свойствами, и с каждым годом их список расширяется. Большинство аллергенов, вызывающих аллергический контактный дерматит, - низкомолекулярные химические соединения, ионы металлов, способные легко проникать через кожу. В табл. 13-5 представлены основные вещества, способные вызвать аллергический контактный дерматит, а также группы риска по развитию аллергического контактного дерматита.
Таблица 13-5. Вещества, способные вызывать аллергический контактный дерматит
Некоторые вещества (антибиотики, сульфаниламиды, ретиноиды, некоторые психотропные средства, а также некоторые наружные лекарственные средства) могут вызвать повышение чувствительности кожи к воздействию солнечных лучей - фотосенсибилизацию. При этом возникает фотодерматит, являющийся разновидностью аллергического контактного дерматита. В этом случае высыпания появляются на открытых участках кожи, не защищённых одеждой от солнца.
Патогенез
Аллергический контактный дерматит относят к реакциям ГЗТ (IV тип по классификации Джелла и Кумбса). Он развивается через 10-14 сут после первичного контакта (период сенсибилизации) и через 12-48 ч после повторного контакта с виновным аллергеном.
Клиническая картина
Клинические проявления простого контактного дерматита и аллергического контактного дерматита сходны: покраснение, отёчность кожи; появление мелких пузырьков и крупных пузырей, наполненных жидкостью, локализованных в местах непосредственного контакта с повреждающим веществом. Иногда такие пузыри сливаются, лопаются, образуя обширные мокнущие очаги, которые могут нагнаиваться вследствие присоединения вторичной инфекции. В особенно тяжёлых случаях воспаление кожи может носить распространённый характер.
Диагностика
• Физикальное обследование (см. выше).
• Аллергологическое обследование: сбор аллергологического анамнеза (см. соответствующий раздел), постановка аппликационных тестов (patch-тесты) с использованием стандартных наборов аллергенов для тестирования (не ранее чем через месяц после появления острого контактного дерматита, когда наступает стадия регресса или ремиссия).
Дифференциальная диагностика
Дифференциальную диагностику аллергического контактного дерматита проводят у пациентов с АтД, нумулярной экземой, псориазом, себорейным дерматитом, аллергическими реакциями на медикаменты, герпетическим поражением кожи, дерматомикозами.
Лечение
Общие принципы лечения аллергического контактного дерматита.
• Элиминация подозреваемого вещества.
• Наружная терапия: традиционные средства; топические глюкокортикоиды, в том числе комбинированные при признаках инфицирования; увлажняющие средства. В острый период назначают компрессы с холодной водой, дубящими отварами,
жидкостью Бурова через каждые 3-4 ч продолжительностью 15 мин с целью уменьшения мокнутия. Наружные глюкокортикоиды способны быстро облегчить состояние больных и купировать воспалительные проявления на коже. Топические глюкокортикоиды назначают при аллергическом контактном дерматите средней степени тяжести или в стадию регресса при тяжёлом аллергическом контактном дерматите 3-4 раза в сутки. Есть сведения об эффективности топических иммунодепрессантов: пимекролимуса и такролимуса при нераспространённых формах аллергического контактного дерматита.
• Фармакотерапия: при тяжёлом распространённом остром аллергическом контактном дерматите, сопровождающемся зудом и экссудацией, возможно применение парентеральных блокаторов Н1-рецепторов гистамина 1-го поколения в сочетании с системными глюкокортикоидами; при ограниченном - применение блокаторов Н1-рецепторов гистамина 1-го поколения внутрь.
• Неэффективность местной терапии, а также распространение бактериальной инфекции на обширную поверхность тела - показание к назначению антибиотиков системного действия (предпочтение следует отдавать макролидам).
• Профилактика: прекращение контакта с аллергеном; исключение профессиональной вредности; при использовании косметики следует соблюдать осторожность; перед использованием нового косметического средства нужно проверять чувствительность кожи к нему; необходимо ограничить применение продуктов, содержащих спирт и другие обезжиривающие вещества.
КРАПИВНИЦА
Крапивница - этиологически гетерогенное заболевание или синдром, основным проявлением которого является волдырь (лат. urtica). Волдырь - первичный элемент кожной сыпи - местный отёк сосочкового слоя дермы, возникающий вследствие повышения проницаемости сосудов, вазодилатации, ускорения тока крови. Для волдыря характерны: в большинстве случаев кожный зуд, иногда - жжение; ограниченный отёк кожи, варьирующий по размеру и форме; гиперемия; полное разрешение в период до 24 ч (от
нескольких минут до нескольких часов); возникновение на любом участке кожи. У 50% больных крапивница может сопровождаться АО (отёком Квинке - отёком глубоких слоёв дермы, подкожной клетчатки и подслизистого слоя (пищеварительного, урогенитального трактов, верхних дыхательных путей). Эпидемиология
Острая крапивница возникает хотя бы 1 раз в течение жизни у 10-20% (иногда до 25%) популяции, максимальную частоту (15,7%) выявляют в возрасте до 40 лет. Частота встречаемости АО составляет 1 случай на 10 000-150 000 населения и не зависит от расы и пола. Хроническую крапивницу чаще выявляют у женщин среднего возраста (около 30%). В общей популяции распространённость крапивницы составляет 0,05-0,50%; среди детей и подростков - 2,1-6,7%. Наиболее часто крапивница возникает у женщин. Заболевание встречается в любом возрасте, но преимущественно - от 23 до 40 лет. Установлено, что у 49% больных выявляют сочетание крапивницы и АО, у 40% - только крапивницу, у 11% - изолированный АО.
Классификация
Единой признанной во всём мире классификации крапивницы не существует. Предлагают рассматривать крапивницу по продолжительности течения [острая (проявления длятся меньше 6 нед) и хроническая (проявления длятся дольше 6 нед)], по механизмам развития (иммунная и неиммунная), по причине её возникновения (идиопатическая, инфекционная, физическая, эндокринная, психогенная, паранеопластическая и т.д.). Ниже приведена классификация крапивницы, рекомендованная в Российском национальном согласительном документе по крапивнице и АО, учитывающая клинические формы, этиологию и патогенез.
• Иммунологическая крапивница
◊ Аллергическая (IgE-зависимые реакции гиперчувствительности).
◊ Аутоиммунная (аутоантитела к FcεRI или IgE).
◊ Уртикарный васкулит (иммунные комплексы).
◊ Комплементзависимая (дефицит С1-ингибитора).
• Физическая крапивница (возникает под действием физических стимулов)
◊ Механическая:
♦ дермографическая (кратковременное механическое воздействие);
♦ замедленная крапивница от давления (длительное местное воздействие давления);
♦ вибрационная (воздействие вибрации).
◊ Температурная:
♦ тепловая контактная (воздействие тепла);
♦ холодовая контактная (воздействие холода).
◊ Возникающая под действием других факторов:
♦ солнечная (ультрафиолетовое облучение);
♦ анафилаксия/крапивница, вызванная физическим усилием (физическое напряжение).
• Особые формы крапивницы:
◊ аквагенная (контакт с водой);
◊ контактная (контакт с ирритантами и т.д.);
◊ холинергическая (физические упражнения, стресс, перегревание и т.д.);
◊ адренергическая (физическая нагрузка, стресс и т.д.);
◊ крапивница, вызванная не IgE-опосредованной дегрануляцией тучных клеток (прямое активирующее действие агентов на тучные клетки, например, опиатов, пищевых добавок);
◊ медикаментозная крапивница с отличными от описанных выше механизмами развития (приём НПВС, ингибиторов АПФ и др.).
• Идиопатическая крапивница (причинный фактор не установлен).
По степени тяжести выделяют: лёгкую, средней степени тяжести и тяжёлую формы. У одного пациента может быть 2 типа крапивницы и более. Она может быть самостоятельным заболеванием (первичной) или симптомом различных заболеваний (вторичной). Некоторые клинические ситуации характеризуются изолированными АО без крапивницы, например АО с дефицитом С1-ингибитора (см. раздел «Ангиоотёки»).
Этиология
Крапивница - полиэтиологическое заболевание. Она может быть вызвана воздействием лекарственных средств, пищевыми продуктами, ядом насекомых, контактным путём (латекс); IgG-аутоантителами к FcεRI или IgE (при аутоиммунной крапивнице); С3а и С5а иммунными комплексами (при ревматоидном артрите, СКВ, синдроме Шегрена, уртикарном васкулите, сыво-
роточной болезни и др.). Нередкая причина развития и триггер обострений крапивницы - инфекционные агенты: вирусы (особенно гепатитов А, B и C, вирус Эпштейна-Барр и др.), бактерии (стрептококки, стафилококки, Helicobacter pylori, кишечная палочка, нейсерии, микоплазмы и др.), грибы, паразиты (лямблии, гельминты и др.). В развитии некоторых форм крапивницы участвуют генетические факторы [синдром Макла-Уэлса (Muckle- Wells) имеет аутосомно-доминантный тип наследования (1q44) и характеризуется наличием холодовой крапивницы в сочетании с прогрессирующей нейросенсорной тугоухостью, амилоидозом, артралгиями и миалгиями]. Генетические факторы, вероятно, определяют образование аутоантител у больных с аутоимунной крапивницей.
Патогенез
Возникновение гиперемированного волдыря с зудом связано с повышением проницаемости мелких сосудов сосочкового слоя кожи; расширением сосудов; периваскулярной инфильтрацией (эозинофилами, базофилами, нейтрофилами, CD4+ Т-лимфоцитами), вызванной каскадом реакций вследствие дегрануляции тучных клеток при их активации за счёт иммунных, неиммунных или неизвестных механизмов. Аллергическая крапивница обусловлена I, реже II и III типами реакций гиперчувствительности. Как правило, её выявляют при остром течении заболевания. В основе крапивницы, возникающей при гемотрансфузиях, лежит цитотоксический тип реакций гиперчувствительности; при сывороточной болезни - иммунокомплексный. В развитии хронической идиопатической крапивницы участвует аутоиммунный механизм - у 40-50% пациентов в крови выявляют аутоантитела (IgG1, IgG3, в меньшей степени IgG4) к а-цепи FcεRI и реже - к IgE, фиксированным на клетках. Их взаимодействие приводит к дегрануляции тучных клеток и базофилов, чему способствует активация системы комплемента с образованием анафилатоксина С5а. Неаллергическая крапивница и АО могут быть обусловлены следующими механизмами: повышением концентрации гистамина при снижении скорости его инактивации; избыточным выделением ацетилхолина; нарушением метаболизма арахидоновой кислоты (торможение циклооксигеназного пути с уменьшением продукции простагландина Е2 и активация липооксигеназного пути её превращения с образованием избыточного количества лейкотриенов С4, D4, E4); накоплением брадикинина, повышающего сосудистую проницаемость
(этим эффектом обладают ингибиторы АПФ); активацией системы комплемента классическим (дефицит С1-ингибитора) или альтернативным путём (рентгеноконтрастные средства, декстраны, инфекция).
Клиническая картина
Многообразные формы крапивницы имеют сходные клинические проявления, за исключением некоторых видов физических крапивниц, особых форм крапивниц и уртикарного васкулита. Начальный симптом, как правило, зуд, вслед за которым появляются высыпания - волдыри характерного вида, напоминающие следы от крапивы или комариных укусов. Волдыри либо увеличиваются в размерах, либо остаются небольшими (1-5 мм). Крупные волдыри имеют тенденцию превращаться в кольцевидные элементы с просветлением в центре. Диаметр таких колец эритемы и отёка может достигать 20 см. Обычно высыпания то появляются, то исчезают; они могут сохраняться в течение нескольких часов в одном месте, а затем исчезают и вновь появляются в другом. Цвет элементов, как правило, бледно-розовый; форма может быть овальной, кольцевидной, дугообразной, полициклической, причудливой. АО проявляется более диффузным набуханием рыхлой подкожной соединительной ткани в области тыльной поверхности кистей и стоп, век, губ, гениталий, слизистых оболочек. Отёк верхних дыхательных путей может вызвать нарушение дыхания, которое нередко ошибочно принимают за приступ бронхиальной астмы. Отёк чаще асимметричен, сопровождается незначительным зудом. Хроническая крапивница характеризуется длительным течением, высыпания обильнее в вечернее и ночное время (связано с суточными ритмами секреции гистамина). Развитие АО с локализацией в области гортани - жизнеугрожающее состояние в связи с возможностью асфиксии.
Диагностика
• Физикальное обследование.
• Аллергологическое обследование (см. соответствующий раздел).
• Лабораторные и инструментальные исследования.
◊ Клинический анализ крови: эозинофилия характерна для атопии или паразитарного заболевания; лейкоцитоз, сдвиг лейкоцитарной формулы влево и повышение СОЭ - при-
знаки воспаления; резкое ускорение СОЭ в сочетании с повышением уровня СРБ характерны для уртикарного васкулита; патологическая формула с изменением числа и морфологии лимфоцитов может указывать на лимфопролиферативные заболевания.
◊ Общий анализ мочи: протеинурия и изменение плотности мочи - признак поражения почек при аутоиммунных заболеваниях.
◊ Биопсия кожи (проводят при подозрении на уртикарный васкулит).
◊ Биохимический анализ крови (определяют СРБ, общий белок, билирубин, глюкозу, активность аланинаминотрансферазы и аспартатаминотрансферазы).
◊ Ревматологические пробы (антинуклеарные антитела, СРБ, криопреципитины) по показаниям.
◊ Гормональное исследование крови [тироксин свободный (Т4), тиреотропный гормон, антитиреоидные антитела].
◊ Бактериологическое исследование фекалий и посевы со слизистых оболочек ротоглотки и других возможных очагов инфекции (по показаниям).
◊ Паразитологическое обследование (копроовоцистоскопия, выявление антител к антигенам токсокары, эхинококка, описторхиса, трихинеллы, лямблий) по показаниям.
◊ Определение маркёров вирусных гепатитов.
◊ Ультразвуковое исследование органов брюшной полости, щитовидной железы, почек (по показаниям).
◊ Кожный тест с аутологичной сывороткой крови при подозрении на аутоиммунную крапивницу.
◊ Гастроскопия с верификацией Helicobacter pylori (по показаниям).
◊ Дуоденальное зондирование с посевом жёлчи (по показаниям).
◊ Рентгенография органов грудной клетки и придаточных пазух носа (по показаниям).
При подозрении на физическую крапивницу проводят тесты, представленные в табл. 13-6 (за 48 ч до проведения тестов необходимо отменить блокаторы Н1-рецепторов гистамина).
Таблица 13-6. Диагностические тесты при физической крапивнице
Дифференциальная диагностика
Крапивницу необходимо дифференцировать с заболеваниями и состояниями, которые сопровождаются уртикарными высыпаниями.
Уртикарный васкулит, или ангиит - кожный васкулит с преимущественным поражением венул, проявляющийся рецидивирующими уртикарными высыпаниями с гистопатологическими признаками лейкоцитокластического васкулита. Во многих случаях является идиопатическим, иногда может развиваться на фоне аутоиммунных, инфекционных, онкологических заболеваний и лекарственных реакций. Кожные элементы при уртикарном васкулите -
эритематозные, отёчные, ограниченные волдыри. Отличительные черты волдыря при уртикарном васкулите - петехии, уплотнения, резидуальное гемосидериновое окрашивание и транзиторная гиперпигментация, а также длительное сохранение элементов (более 24 ч). Больные чаще жалуются на жжение и болезненность, чем на зуд. В ряде случаев уртикарный васкулит сопровождается такими признаками, как livedo reticularis, АО, узелки и макулярная эритема. Иногда поражение кожи при уртикарном васкулите ничем не отличается от поражения кожи при обычной крапивнице. Уртикарный васкулит часто сопровождается системными проявлениями (артралгией, абдоминальными симптомами и др.).
Пигментная крапивница (мастоцитоз) - ограниченное или системное заболевание, обусловленное пролиферацией тучных клеток в коже и других органах. Проявляется обычно множественными высыпаниями на коже в виде мелких пятен округлой формы красно-бурого цвета (мелкопятнистая форма) или несколько возвышающимися папулами (папулёзная форма). Патогномоничный симптом для пигментной крапивницы - феномен трения Унны- Дарье - набухание и покраснение пятен через несколько минут после потирания их пальцем или шпателем. Одновременно появляется зуд. Может осложнять другие формы атопии (например, аллергию на яд перепончатокрылых), вызывая тяжёлые реакции с сосудистым коллапсом. Встречается при системном мастоцитозе (генерализованная форма заболевания с инфильтрацией тучными клетками костей, печени, лимфатических узлов и селезёнки). Дефицит С1-эстеразы (см. раздел «Ангиоотёки») Также дифференциальную диагностику крапивницы проводят у пациентов с многоформной экссудативной эритемой, строфулюсом, герпетиформным дерматитом Дюринга, небуллёзным пемфигоидом, буллёзным пемфигоидом, чесоткой, полиморфными высыпаниями у беременных и др.
Лечение
Лечение крапивницы включает:
• этиологическое лечение;
• патогенетическое (системное медикаментозное) лечение:
◊ купирование обострений;
◊ подбор адекватной базисной терапии, применение которой приведёт к минимизации или полному исчезновению симптомов заболевания;
• лечение сопутствующей патологии;
• мониторинг.
Этиологическое лечение включает элиминационные мероприятия при выявлении этиологически значимых аллергенов у больных аллергической крапивницей (см. соответствующий раздел); соблюдение общей гипоаллергенной или индивидуальной элиминационной диеты; исключение подозреваемых лекарственных препаратов; не рекомендуется применение НПВС в период обострения крапивницы, а также ингибиторов АПФ и блокаторов ангиотензина-II при наличии АО; эрадикация инфекционных и хронических воспалительных процессов; больным с физической крапивницей следует избегать воздействия провоцирующих факторов; нужно проводить информирование больных о характере заболевания.
Патогенетическое (системное медикаментозное) лечение:
• Блокаторы H1-рецепторов гистамина. Принимают внутрь (предпочтительно последнего поколения: дезлоратадин, левоцетиризин, лоратадин, фексофенадин, цетиризин, эбастин). Возможно применение блокаторов Н1-рецепторов гистамина со стабилизирующим действием на мембраны тучных клеток (кетотифен) до 6 мес. Больным с тяжёлым течением крапивницы, особенно при развитии АО, показано парентеральное введение блокаторов Н1-рецепторов гистамина (1-го поколения). В некоторых случаях используют сочетание Н1- и Н2-блокаторов.
• Системные глюкокортикоиды (преднизолон, дексаметазон) применяют парентерально коротким курсом для купирования обострения. В случае упорного течения и отсутствия эффекта от лечения НПВС принимают в низких дозах (преднизолон или метилпреднизолон) внутрь ежедневно или через день с постепенным снижением дозы до минимальной или до полной отмены. В некоторых тяжёлых случаях используют пролонгированные формы глюкокортикоидов.
• При тяжёлом течении по показаниям проводят дезинтоксикационную терапию (гемодез и др.).
• Пищеварительные ферменты, сорбенты - по показаниям.
• При эффективности антигистаминных препаратов возможно проведение курса гистаглобулина.
• При крапивнице с тяжёлым течением, торпидной к традиционному лечению, ассоциированной с аутоиммунными заболе-
ваниями, могут оказаться эффективными иммунодепрессанты, гидроксихлорохин, сульфасалазин.
• Назначение трициклических антидепрессантов обосновано наличием депрессивных расстройств у больных хронической крапивницей, а также их антигистаминным и антихолинергическим действием.
Симптоматическое лечение проводят по показаниям в соответствии с выявленной сопутствующей патологией (лечение: антибактериальное, противогрибковое, направленное на коррекцию дисбактериоза, противоязвенное, тиреоидными гормонами и др.).
АНГИООТЁКИ
АО является результатом локального повышения проницаемости подслизистых и подкожных капилляров и венул. Почти 50% больных крапивницей предъявляют жалобы на АО. В этих случаях и крапивница, и АО являются симптомами одного заболевания.
Эпидемиология
Наследственный АО выявляют редко. Он составляет не более 2% всех случаев АО. Предполагают, что это заболевание встречается с частотой 1:10 000-1:50 000.
Классификация
Приведена подробная классификация АО с учётом разнообразия клинических форм и этиологических факторов заболевания. По клинической характеристике
• По течению:
◊ острый (до 6 нед);
◊ хронический (более 6 нед).
• По сочетанию с крапивницей:
◊ изолированный;
◊ сочетанный.
По возможному механизму развития
• С преимущественным вовлечением системы комплемента:
◊ наследственный АО:
♦ I тип - абсолютный дефицит С1-ингибитора (изолированный АО);
♦ II тип - относительный дефицит С1-ингибитора (изолированный АО);
♦ III тип (эстрогензависимые отёки) - без дефицита С1-ингибитора (изолированный АО).
◊ Приобретённый АО: приобретённый дефицит С1-ингибитора (при лимфопролиферативных, аутоиммунных, инфекционных заболеваниях):
♦ I тип - абсолютный (изолированный АО);
♦ II тип - относительный c образованием аутоантител к С1-ингибитору (изолированный АО).
• С участием других механизмов:
◊ вызываемый ингибиторами АПФ (изолированный АО);
◊ обусловленный гиперчувствительностью к лекарственным препаратам, пищевым продуктам, укусам и ужалениям насекомыми (в большинстве случаев сочетается с крапивницей);
◊ возникающий на фоне очаговой инфекции (может быть сочетанным);
◊ ассоциированный с аутоиммунными заболеваниями (может быть сочетанным).
• Идиопатический (может быть сочетанным).
Этиология
I и II типы наследственного АО обусловлены генетически детерминированным абсолютным или относительным дефицитом С1-ингибитора, при III типе его концентрация и функция не изменены. С1-ингибитор относится к семейству ингибиторов сериновых протеаз и регулирует активность нескольких систем: комплемента (C1), калликреин-кининовой, свёртывания крови (факторы XII и XI) и фибринолиза (плазмин). Ген, кодирующий его синтез, локализован на длинном плече хромосомы 11 (11q12-q13.1). Известно более 150 мутаций, приводящих к нарушению структуры и функции С1-ингибитора. При I типе выявляют снижение (как правило, на 50% и более) концентрации и функциональной активности, при II типе - уменьшение активности (не менее чем в 2 раза) при нормальном или повышенном уровне С1-ингибитора. Заболевание наследуется по аутосомно-доминантному типу. При приобретённой форме АО причиной дефицита служит избыточное потребление С1-ингибитора (I тип) или образование к нему аутоантител (II тип). Заболевание возникает при опухолях (лимфопролиферативных заболеваниях и др.), аутоиммунных и инфекционных заболеваниях. Эстрогензависимые отёки встречаются у женщин. Механизм их развития не ясен; предполагают, что забо-
левание связано с усилением образования брадикинина и замедлением его разрушения за счёт снижения активности АПФ (кининазы) под влиянием эстрогенов. Этиология АО, сопровождающих крапивницу, описана в разделе «Крапивница».
Патогенез
При наследственном АО повреждение гена приводит к значительному уменьшению количества С1-ингибитора либо ген кодирует синтез достаточного количества дисфункционального С1-ингибитора. Во время приступа наследственного АО активация комплемента по классическому пути приводит к появлению анафилатоксинов С3а, С4а и С5а, которые вызывают повышение проницаемости капилляров и возникновение отёка. Неконтролируемая активация калликреина приводит к повышению плазменных кининогенов, высвобождению разных кининов (брадикинина, калликреина), повышающих сосудистую проницаемость, вазодилатацию, сокращение гладких мышц кишечника. При АО, не связанных с патологией системы комплемента (при приёме ингибиторов АПФ), может быть нарушен основной механизм деградации брадикинина и снижен уровень ангиотензина II.
Клиническая картина
Наследственный или приобретённый АО можно заподозрить у пациентов с рецидивирующими глубокими отёками кожи (незудящие, бледные) любой локализации, периодическими интенсивными болями в животе, служащими поводом для неоднократных госпитализаций в хирургические стационары. Обострения связаны с травмой, стоматологическим вмешательством, стрессом, острым респираторным заболеванием. В ряде случаев есть схожий семейный анамнез. Традиционная противоаллергическая терапия неэффективна. Смертность при наследственном АО достигает 30-40% и вызвана в основном обструкцией верхних дыхательных путей.
АО, не связанные с патологией системы комплемента, характеризуются интенсивным глубоким отёком кожи и подкожных тканей (отёк, как правило, горячий, гиперемированный, может сопровождаться зудом и крапивницей).
Диагностика
При лабораторной диагностике наследственного АО определяют концентрацию и функциональную активность С1-ингибитора и
компонентов системы комплемента (C1q, С2, С4). Диагностика АО, не связанных с патологией системы комплемента, описана в разделе «Крапивница». Дифференциальную диагностику наследственного и приобретённого АО проводят с другими видами АО, отёками при гипотиреозе, узелковом васкулите, синдроме сдавления верхней полой вены, заболеваниях печени, почек и др.
Лечение
Общие принципы лечения: купирование острого отёка; базисная терапия; профилактика вероятного отёка. Купирование острого АО:
• немедикаментозное лечение: проведение экстренной интубации или трахеостомии при необходимости; гемодинамический контроль;
• лечение препаратами крови: свежая или свежезамороженная нативная плазма в дозе 250-300 мл (использование ограничено из-за возможного инфицирования больного); за рубежом отдают предпочтение концентрату С1-ингибитора (в России не зарегистрирован);
• лечение андрогенами (даназол, станазол или метилтестостерон) до клинической ремиссии с последующим снижением дозы;
• лечение антифибринолитическими лекарственными средствами (е-аминокапроновая кислота или транексамовая кислота);
• при отёках в области лица и шеи дополнительно вводят системные глюкокортикоиды (преднизолон, дексаметазон) или фуросемид.
Базисную терапию наследственного АО проводят в период ремиссии: лечение андрогенами или антифибринолитическими лекарственными средствами.
Профилактика включает следующие основные мероприятия: обучение больного профилактике обострений; информирование (больным) врачей других специальностей об имеющемся заболевании; по возможности избегать оперативных вмешательств, травм, стрессовых ситуаций, простудных заболеваний; санация очагов хронической инфекции (зубы, миндалины и др.), а также эрадикация H. pylori; проведение премедикации перед инвазивными методами обследования, стоматологическими и оперативными вмешательствами, включающей приём антифибринолитических лекарственных средств, андрогенов (начинать приём за несколько
дней до вмешательства и продолжать в течение нескольких дней после); перед оперативным вмешательством также показано внутривенное введение плазмы и аминокапроновой кислоты; оказание самопомощи при жизнеугрожающих состояниях; не рекомендуется приём ингибиторов АПФ, эстрогенсодержащих препаратов (контрацептивов, проведение гормональной заместительной терапии), активаторов плазминогена (стрептокиназы, алтепазы и др.).
Лечение приобретённого АО, связанного с патологией системы комплемента, предполагает в первую очередь лечение заболеваний, вызвавших эту патологию, и применение вышеперечисленных лекарственных средств.
ИНСЕКТНАЯ АЛЛЕРГИЯ
Инсектная аллергия - совокупность аллергических реакций, возникающих при контактах с насекомыми и их метаболитами: при укусах, ужалениях насекомыми, соприкосновении с ними, вдыхании частиц тел насекомых или продуктов их жизнедеятельности.
Инсектные аллергены попадают в организм различными путями:
• с ядом при ужалении перепончатокрылыми насекомыми;
• со слюной при укусах кровососущими насекомыми;
• ингаляционным путём при попадании чешуек тел, частиц хитинового покрова и метаболитов инсектного происхождения в состав домашней пыли, а также при профессиональном контакте;
• контактным путём при непосредственном контакте с насекомыми и/или продуктами их жизнедеятельности.
Эпидемиология
Аллергию к яду жалящих насекомых выявляют у 0,4-8% населения. Группу риска составляют пчеловоды (15-43%), а также лица, живущие вблизи пасек. Летальность при анафилактических реакциях на яд перепончатокрылых составляет от 64 до 84%. Множественные ужаления, вызывающие токсические реакции, выявляют у 7% больных, летальность при этом составляет 2-36%. Наличие пигментной крапивницы (мастоцитоза) - фактор риска серьёзных или даже фатальных реакций на ужаления. Распространённость инсектной аллергии на укусы кровососущих насекомых составляет 7-20%. Описаны случаи АШ после укусов комаров и клопов.
Классификация
Гиперергические реакции, возникающие при ужалении/укусе насекомыми, классифицируют по типам:
• аллергические реакции ГНТ;
• аллергические реакции ГЗТ;
• токсические реакции;
• ложноаллергические (псевдоаллергические) реакции. Этиология
Наиболее значимыми, способными вызывать острые аллергические состояния, являются ужаления насекомых отряда перепончатокрылых, который включает представителей семейства Vespidae (настоящие осы, лосинные осы, шершни, бумажные осы), семейства Apidae (пчёлы и шмели), а также Formicidae (семейство муравьев). Яд перепончатокрылых содержит низкомолекулярные соединения (биогенные амины, аминокислоты, фосфолипиды), основные пептиды (мелиттин - один из основных аллергенов яда пчелы, апамин, MCD-пептид и др.) и высокомолекулярные белки-ферменты (фосфолипаза А2, гиалуронидаза, щелочная и кислая фосфатазы, эстеразы, ариламидазы и др.). Биогенные амины вызывают расширение и повышение проницаемости сосудов и боль; пептиды и фосфолипаза - токсические эффекты; ферменты и высокомолекулярные пептиды - аллергические реакции.
Нежалящих насекомых, вызывающих инсектную аллергию, условно можно разделить на кровососущих (комары, мошки, слепни, клопы, вши, блохи и др.), кусающих (жуки, тараканы и др.) и некусающих (хирономидии, бабочки и др.). Слюна кровососущих насекомых содержит токсические, анестезирующие, противосвёртывающие вещества.
Патогенез
В большинстве случаев развитие аллергической реакции на ужаление/укус или контакт с метаболитами насекомых обусловлено I типом (IgE-опосредованные) реакций (по классификации Джелла и Кумбса), реже - III типом (иммунокомплексные). В зависимости от преобладания в составе иммунного комплекса антигена или антител выделяют 2 клинические формы заболевания (при избытке антигена развивается местная реакция с инфильтра-
цией ткани нейтрофилами по типу феномена Артюса; при избытке антител возникают изменения по типу сывороточной болезни). При ужалениях/укусах большим числом (десятки, сотни) насекомых чаще развиваются токсические реакции. В основе развития псевдоаллергических реакций лежит первичное неспецифическое действие некоторых компонентов яда или слюны, приводящее к высвобождению гистамина.
Клиническая картина
Аллергические реакции при инсектной аллергии могут быть местными, системными или органными, с преимущественным поражением отдельных органов и тканей. Местные аллергические реакции характеризуются гиперемией и отёком в месте ужаления/укуса диаметром не меньше 10 см и сохраняющимися не меньше 24 ч. Выражен сильный кожный зуд. При развитии системных поражений различают лёгкую, средней тяжести и тяжёлую степень проявления, а также АШ (табл. 13-7). АШ развивается через несколько секунд или минут после ужаления/укуса.
Таблица 13-7. Классификация системных реакций при ужалении или укусе насекомыми
Отсроченные реакции могут возникать при иммунокомплексном типе реакции гиперчувствительности. В месте ужаления/укуса через 8-12 ч появляются кровоподтёк, волдырь, плотные инфильтраты, не исчезающие в течение 2-3 сут. Отсроченные системные реакции развиваются в срок от 2 ч до 3 нед после ужаления или укуса и могут проявляться лихорадкой, артралгией, увеличением лимфоузлов, крапивницей, отёком Квинке, геморрагической сыпью. После ужаления/укуса возможны местные и системные поражения нервной системы (преходящие анестезия и парез ужаленной конечности; генерализованные судороги, тетраили парапарез, спутанность сознания, афазия, психоорганический синдром, депрессия, сильная головная боль, головокружение, потеря слуха, боль и шум в ушах, невриты периферических или черепно-мозговых нервов и другие поражения, чаще обратимого характера); поражение кровеносной (васкулиты) и мочевыделительной систем (нефропатии). При ужалениях/укусах большим числом (десятки, сотни) насекомых чаще развиваются токсические реакции. При этом больные предъявляют жалобы на головную боль, тошноту, рвоту.
Диагностика
• Физикальное обследование.
• Аллергологический анамнез (см. соответствующий раздел).
• Лабораторные и инструментальные исследования: клинический анализ крови, общий анализ мочи, биохимический анализ крови и другие исследования; определение функции внешнего дыхания; электрокардиография; ультразвуковое исследование внутренних органов проводят по показаниям при наличии патологических воспалительных реакций со стороны дыхательной, кровеносной и других систем для уточнения степени тяжести и осложнений аллергического заболевания.
Дифференциальную диагностику проводят с токсическими и псевдоаллергическими реакциями.
Лечение
Общие принципы лечения:
• элиминация аллергена, мероприятия для уменьшения всасывания яда (наложение жгута на 20 мин выше места ужаления; холод на место ужаления; удаление жала пчелы; обеспечение
покоя и возвышенного положения конечности, в которую произошло ужаление);
• симптоматическое лечение, направленное на устранение развившейся реакции;
• АСИТ;
• профилактика.
Для купирования симптомов инсектной аллергии применяют лекарственные средства нескольких групп.
• Блокаторы Н1-рецепторов гистамина 1-го или 2-го поколения.
• Системные глюкокортикоиды.
• Симптоматические средства [прессорные амины (эпинефрин), эуфиллин* (аминофиллин), в2-агонисты]. Подбор препарата проводят индивидуально с учётом тяжести заболевания, переносимости лекарственного средства и возраста пациента.
Лечение АШ - см. соответствующий раздел.
АСИТ (см. соответствующий раздел) проводят в специализированном аллергологическом стационаре при наличии в нём отделения интенсивной терапии, поскольку существует угроза системных и анафилактических реакций на введение инсектных аллергенов, в осенне-зимний период (вне сезона вылета насекомых). Для проведения АСИТ аллергенами жалящих насекомых в клиниках Европы и США используют коммерческие лекарственные средства, приготовленные на основе ядов ос и пчёл.
Профилактика: необходимо соблюдать меры предупреждения ужаления перепончатокрылыми насекомыми (находиться вдали от пасек и других мест скопления насекомых; в сезон вылета пчёл не пользоваться пахнущими веществами, не принимать и не готовить пищу на улице; на окна в доме поставить москитные сетки; при работе в саду или огороде оставлять минимум открытых частей тела, надевать обувь на плотной подошве и головной убор), иметь при себе паспорт больного аллергическим заболеванием (см. соответствующий раздел) и противошоковый комплект, при наличии профессионального заболевания, связанного с инсектной аллергией, следует решить вопрос о смене места работы больного.
ЛЕКАРСТВЕННАЯ АЛЛЕРГИЯ
Лекарственная аллергия (ЛА) - осложнения лекарственной терапии, опосредованные иммунными механизмами. В отличие от
осложнений медикаментозного лечения неаллергического характера, ЛА имеет следующие особенности:
• нет дозозависимости, т.е. ЛА возникает при попадании даже минимального количества лекарственного средства (аллергена);
• ЛА возникает не раньше чем через 5-7 сут после первого применения препарата (период, необходимый для фазы сенсибилизации);
• ЛА клинически проявляется в виде классических симптомов аллергических заболеваний;
• симптомы ЛА повторяются, их тяжесть усугубляется при последующих введениях лекарственного средства;
• ЛА может возникать на лекарственные средства одной группы или разных групп, имеющие сходную химическую структуру и обладающие перекрёстными аллергенными свойствами.
Эпидемиология
Распространённость ЛА, по результатам разных исследователей, колеблется в широких пределах - от 1 до 30%. Среди препаратов, служащих причиной развития аллергических реакций, на первом месте находятся пенициллины (как природные, так и синтетические и полусинтетические) - 0,7-55% (в 0,002% случаев возникает АШ) и большинство р-лактамных антибиотиков, затем НПВС - до 25%, антибиотики других групп - 0,8-18%, сульфаниламиды - 0,5-10%, препараты, влияющие преимущественно на тканевые процессы, - до 8%, местные анестетики - до 6%, йод- и бромсодержащие препараты - до 4%, вакцины и сыворотки - до 1,5%, другие группы лекарственных средств - до 18%. Доля ЛА в структуре аллергопатологии колеблется в пределах 4,5-7%.
Классификация
Классификация истинной ЛА по механизмам развития:
• анафилактический тип (может развиваться на чужеродные сыворотки, пенициллины, сульфаниламиды, анальгетики, витамины, препараты теофиллинового ряда);
• цитотоксический тип (в ответ на метилдопу, метициллин, фенитоин);
• иммунокомплексный тип (в ответ на пенициллины и другие антибиотики, сыворотки, вакцины, сульфаниламиды, пира-
золоновые производные, анестетики, парааминосалициловую кислоту);
• клеточно-опосредованный тип (ГЗТ) [сульфаниламиды:, алкалоиды, соединения металлов (золото, ртуть), стрептомицин, пенициллин, местные анестетики, антисептики];
• реакции с неуточнёнными механизмами;
• комбинированная сенсибилизация (на одно лекарственное средство возникают аллергические реакции разных типов).
Помимо истинной ЛА выделяют псевдоаллергические реакции на лекарственные средства.
Этиология
ЛА может развиться на введение практически любого препарата. Лекарственные средства могут быть полноценными антигенами (белкового происхождения - препараты плазмы и крови, гормоны и другие лекарства, высокомолекулярные соединения). Большинство же лекарственных средств - неполноценные антигены - гаптены: неизменённые лекарственные средства, примеси и продукты их распада, продукты биотрансформации или распада in vivo. В формировании ЛА играет роль реактогенность гаптена и способность белков организма к конъюгации. Различные белки обладают этими свойствами в неодинаковой степени (вероятно, оно присуще в большей мере белкам-экссудатам при воспалительных процессах). Специфичность иммунного ответа связана с химической структурой лекарственных средств, конфигурацией его молекулы или молекулы его метаболита; кроме того, иммунный ответ направлен против белковой части конъюгата и поэтому характеризуется аутоагрессивными свойствами.
Патогенез
Истинные аллергические реакции на лекарственные средства могут быть опосредованы одним из четырёх типов реакций гиперчувствительности (по классификации Джелла и Кумбса) или их комбинацией (см. соответствующий раздел).
Псевдоаллергические реакции опосредованы теми же медиаторами, что и при истинной аллергии, но иммунные механизмы в этом не участвуют (табл. 13-8). Как правило, тяжесть возникшей псевдоаллергической реакции во многом зависит от скорости введения препарата и его концентрации.
Таблица 13-8. Механизмы неаллергических (псевдоаллергических) реакций на лекарственные средства
Клиническая картина и патогенез
Клинические симптомы при ЛА, независимо от механизма их формирования, носят полиорганный характер, проявляясь нарушением функции органов и систем. Аллергические реакции на медикаменты могут быть системными или с преимущественным поражением отдельных органов и тканей.
Лекарственные сыпи. Кожные высыпания - самый частый симптом ЛА, но по клиническим и морфологическим характеристикам они не отличаются от высыпаний другой этиологии, что создаёт определённые трудности для диагностики.
К наиболее типичным аллергическим поражениям кожи при ЛА относят крапивницу и АО, контактный дерматит (см. соответствующие разделы), полиморфные кожные высыпания: чаще экзантемы (до 75%), буллёзные высыпания, геморрагии, петехии и другие виды сыпи. Механизмы развития - как аллергические, так и псевдоаллергические.
Фиксированная эритема проявляется одиночными, реже множественными бляшками, пузырями или эрозиями на одном и том же месте. Наиболее частая причина - приём сульфаниламидов, НПВС, барбитуратов, антибиотиков группы тетрациклина.
Фототоксические реакции: реакции кожи на воздействие света ультрафиолетового или видимого диапазонов на фоне действия лекарственных средств (как местных, так и для системного применения). Причинные лекарственные средства - НПВС, хинолоны, тетрациклины, фенотиазины, амиодарон, лекарственные средства местного действия, хлорпромазин, препараты серы и др.
Многоформная экссудативная эритема - синдром, характеризующийся поражением кожи чаще конечностей (кистей и стоп) и слизистых оболочек, в основе которого лежит повреждение сосудов дермы. Высыпания представлены пятнами, папулами, напоминающими мишень, а также везикулами и пузырями. Сопровождается недомоганием, артралгиями, повышением температуры. Многоформная экссудативная эритема может быть вызвана любым лекарственным средством, чаще - пенициллином, сульфаниламидами, барбитуратами, вакциной против полиомиелита, БЦЖ. В последнее время многоформную экссудативную эритему связывают с вирусной или бактериальной инфекцией. Нередко носит рецидивирующий характер. Многие авторы расценивают многоформную экссудативную эритему, синдром Стивенса-Джонсона и синдром Лайелла как стадии одного заболевания.
Феномен Артюса-Сахарова характеризуется гиперемией, инфильтратами, абсцессами, фистулами в месте введения препарата; в абсцессах выявляют стерильный гной. Появляется на 7-9-е сут после применения лекарственного средства; инфильтрат держится долго, иногда до нескольких месяцев, может быть первым и единственным симптомом ЛА.
Лекарственная лихорадка. В большинстве случаев возникает в период от нескольких дней до 3 нед после начала приёма лекарственных средств, а иногда через несколько часов после повторного
введения лекарственных средств сенсибилизированному пациенту. В 3-5% случаев - единственный симптом ЛА. Нередко сопровождается различными кожными высыпаниями и поражением внутренних органов. Интенсивность лихорадки может варьировать. Прекращение приёма причинного лекарственного средства приводит к нормализации температуры в течение 3-4 сут. Лихорадка может быть симптомом сывороточной болезни, лекарственного аллергического васкулита, острого интерстициального нефрита, лекарственно-индуцированного волчаночного синдрома.
Системные аллергические реакции на лекарственные средства: АШ, синдром Стивенса-Джонсона, синдром Лайелла, сывороточная болезнь, лекарственный волчаночный синдром, системный васкулит. Такие реакции чаще всего вызывают препараты пенициллина и другие антибиотики, сыворотки, местные анестетики [особенно новокаин* (прокаин), прокаин, лидокаин], метамизол натрия, витамины (особенно В1), сульфаниламиды (особенно пролонгированные формы) и др.
Лекарственный АШ отличается тяжестью клинических проявлений и серьёзностью прогноза (см. соответствующий раздел).
Синдром Стивенса-Джонсона - вариант многоформной экссудативной эритемы, при котором наряду с поражением кожи возникает поражение слизистых оболочек как минимум двух органов. Клинические признаки: острое начало, высокая лихорадка, артралгии; иногда продромальный гриппоподобный синдром в течение нескольких дней; на коже распространённые элементы округлой формы с признаками эрозирования в центре, поражение слизистой полости рта в виде образования пузырей, эрозий с белёсоватым налётом или покрытых геморрагическими корками; поражение глаз в виде катарального или гнойного кератоконъюнктивита с эрозивным или язвенным поражением конъюнктивы и/или роговицы; в 50% случаев происходит эрозивное поражение слизистых оболочек мочеполовой системы, редко развиваются бронхиолиты, колиты, проктиты.
Синдром Лайелла (эпидермальный некролиз) - острая, наиболее тяжёлая, угрожающая жизни аллергическая реакция, характеризующаяся буллёзным поражением кожи и слизистых оболочек, эпидермальным некролизом (симптом Никольского положительный) и эксфолиацией кожи, в сочетании с тяжёлой интоксикацией и нарушением функций всех органов и систем (кровеносной
системы, органов дыхания и пищеварения, мочеполовой системы, всех слизистых оболочек и др.).
Как синдром Лайелла, так и синдром Стивенса-Джонсона могут возникнуть на фоне вирусных, реже бактериальных инфекционных заболеваний. Клинические признаки: головная боль, тошнота, фебрильная лихорадка вплоть до злокачественной гипертермии (до 38-41°С); внешний вид кожи напоминает ожог III степени; эпидермальный некролиз составляет более 10% кожного покрова; в 90% случаев выявляют эрозивно-язвенные поражения слизистых оболочек (глаз, полости рта, пищеварительного тракта, мочеполовой системы); характерны спутанность сознания; нарушение водно-электролитного и белкового баланса; развитие болевого и токсико-аллергического шока; в более поздние сроки происходит присоединение инфекционных осложнений.
Сывороточная болезнь. Реакции в виде сывороточной болезни и сывороточноподобного синдрома чаще возникают после введения препаратов на основе гетерологичных сывороток (чаще лошадиной): противостолбнячной, а также антирабической, противодифтерийной, противозмеиной, а также сывороток, применяемых при укусах ядовитых насекомых, ботулизме, газовой гангрене и других заболеваниях; введения вакцин, йод- и бромсодержащих препаратов, депо-пенициллина (бензилпенициллин), сульфаниламидов, некоторых НПВС, цитостатиков. Клинические признаки: начало заболевания через 1-3 нед после введения лекарственного средства; фебрильная лихорадка (до 39°С и выше); кожные полиморфные высыпания (чаще крапивница и АО); артралгии с преимущественным поражением крупных суставов, миалгии, лимфоаденопатия. Длительность заболевания колеблется (в зависимости от степени тяжести) от 7-10 сут до нескольких недель; редко возможно развитие системного васкулита, гломерулонефрита, острой воспалительной демиелинизирующей полирадикулонейропатии. При клинико-лабораторном обследовании выявляют: в периферической крови - лейкопению, нейтропению, повышение количества плазматических клеток, увеличение СОЭ; в сыворотке крови - снижение концентрации компонентов комплемента, особенно С3, C4; в моче - протеинурию, микрогематурию, гиалиновые цилиндры.
Лекарственно-индуцированный волчаночный синдром. Характеризуется лихорадкой, миалгией, артралгиями, артритами, серозитами, кожными проявлениями (эритематозная сыпь, возможно
развитие васкулита); поражением почек (гломерулонефрит). Возможны гематологические нарушения, снижение уровня комплемента и наличие анти-ДНК-антител; спонтанное разрешение заболевания в течение 1-7 мес после прекращения приёма причинного лекарственного средства. Наиболее частые причины - применение прокаинамида, гидралазина, пеницилламина, изониазида, интерферона-альфа, метилдопы, хлорпромазина, прокталола.
Системный лекарственный васкулит. Сопровождается лихорадкой, кожными проявлениями (петехиальной сыпью, крапивницей), артралгиями, лимфоаденопатией. Развивается через 2-14 сут (чаще 7-10 сут) после приёма причинного лекарственного средства. Редко могут развиться гломерулонефрит, интерстициальный нефрит, гепатоцеллюлярные повреждения и другие патологии; в анализах крови могут выявлять повышение СОЭ. Наиболее частые причины - применение сульфаниламидов, тиазидных диуретиков, пенициллинов, цефалоспоринов, аллопуринола, препаратов йода.
ЛА может протекать с поражением других органов и систем.
Диагностика
• Физикальное, лабораторное и инструментальное обследование
проводят в острый период для оценки симптомов аллергической реакции, тяжести состояния, выявления осложнений, а также динамического контроля за состоянием пациента. Нарушения функции различных органов и систем могут сохраняться в течение длительного времени (в зависимости от клинических проявлений и их тяжести).
• Аллергологическое обследование: собирают аллергологический, фармакологический и пищевой анамнез (см. соответствующий раздел).
• Лабораторные тесты - определение уровня гистамина, триптазы, ИЛ-5 в крови; определение уровня специфических IgE, а также IgG и IgM; базофильный тест; реакция бласттрансформации лимфоцитов и др. Абсолютно достоверных лабораторных тестов для диагностики ЛА не существует.
Кожные диагностические тесты широкого распространения не получили ввиду их неспецифичности и опасности развития осложнений. Провокационные тесты (подъязычный) проводит в крайних случаях только врач-аллерголог в условиях аллергологического стационара с учётом возможных противопоказаний. Тест торможения естественной эмиграции лейкоцитов in vivo с лекарственны-
ми средствами - в настоящее время единственный тест, результаты которого в большинстве случаев достоверны. Тест доступен для любого медицинского учреждения, не требует дорогостоящего оборудования, может быть проведён врачом-аллергологом не только в стационаре, но и в амбулаторных условиях.
Дифференциальная диагностика
Дифференциальную диагностику ЛА проводят у пациентов с нежелательными побочными реакциями другого генеза (побочное действие лекарственных средств; токсическое, местнораздражающее действие) и псевдоаллергическими реакциями.
Лечение
Основные принципы лечения:
• прекращение воздействия лекарственного средства, мероприятия для уменьшения его всасывания (промывание желудка, очистительные клизмы, энтеросорбенты);
• симптоматическое лечение, направленное на устранение развившейся реакции;
• десенситизация (проводит врач-аллерголог в стационаре), при невозможности отказа от приёма причинного лекарственного средства ввиду жизненной необходимости его использования;
• профилактика.
Лечение кожных проявлений ЛА, не сопровождающихся поражением других органов и их систем. Наружное лечение: проводят с учётом возраста пациента, локализации и распространённости патологического процесса, стадии и степени тяжести высыпаний на коже и слизистых оболочках, переносимости лекарственных средств (топические блокаторы Н1-рецепторов гистамина, глюкокортикоиды и комбинированные препараты, антисептики). В зависимости от стадии высыпаний используют лекарственные средства в разных формах (растворы, лосьоны, гели, кремы, мази, пасты). Системное лечение: блокаторы Н1-рецепторов гистамина 1-го и 2-го поколения, при тяжёлом течении применяют короткие курсы системных глюкокортикоидов.
Терапия системных аллергических реакций на лекарственные средства
• Неотложная помощь при АШ (см. соответствующий раздел).
• Лечение синдрома Стивенса-Джонсона и синдрома Лайелла.
Лечение проводят в реанимационном отделении. Системные глюкокортикоиды вводят только внутривенно (дексаметазон
или бетаметазон по 4-32 мг в сутки струйно или капельно), с постепенным снижением дозы при стабилизации состояния до полной отмены. Проводят трансфузионную терапию с целью дезинтоксикации, обеспечения потребности организма в белке, восполнения энергетических затрат, нормализации водно-электролитного баланса, борьбы с синдромом диссеминированного внутрисосудистого свёртывания крови, а также профилактики и лечения анемии. Назначают заместительную терапию (альбумин, нативная плазма, иммуноглобулин человека нормальный, по жизненным показаниям при развитии лейкопении и агранулоцитоза - переливание свежей донорской крови). Антибактериальную терапию проводят при признаках вторичной инфекции (категорически противопоказаны пенициллины и их производные). Гемосорбция показана больным ЛА III и IV степени тяжести. В некоторых случаях показаны плазмаферез и гемодиализ. Парентерально вводят блокаторы Н1-рецепторов гистамина 1-го поколения. Назначают симптоматическую терапию (по показаниям: вазопрессорные амины, сердечные гликозиды, антикоагулянты, диуретики, ингибиторы протеаз, анальгетики, дезагреганты, седативные лекарственные средства и др.). Искусственную вентиляцию лёгких и лечебные бронхоскопии проводят по показаниям. Следует осуществлять уход за поражёнными слизистыми оболочками и кожей.
• Лечение сывороточной болезни. Проводят симптоматическое лечение в зависимости от клинической картины, нередко прибегают к применению системных глюкокортикоидов.
• При лечении васкулитов, поражений печени, почек и лёгких назначают системные глюкокортикоиды, при тяжёлом течении васкулита - иммунодепрессанты.
Профилактика: тщательный сбор фармакологического анамнеза; регистрация в амбулаторной и стационарной карте всех лекарственных средств, к которым установлена непереносимость; необходимо избегать полипрагмазии, назначать препараты только по показаниям; всем больным, перенёсшим тяжёлые реакции на лекарственные средства, должно быть проведено аллергологическое обследование для установления причинного лекарственного средства и должен быть выдан паспорт больного аллергическим заболеванием; исключение препарата, ранее вызывавшего истин-
ную аллергическую реакцию, а также лекарственных средств, обладающих сходной химической структурой и перекрёстными аллергенными свойствами (см. табл. 13-2); информирование (больным) врачей других специальностей об имеющейся аллергии; отказ от назначения фитотерапии больным с пыльцевой сенсибилизацией (см. табл. 13-3); доза вводимых препаратов должна соответствовать возрасту и весу больного; для профилактики истинных аллергических и псевдоаллергических реакций на лекарственные средства при необходимости экстренного проведения оперативного вмешательства, экстракции зубов, введения рентгеноконтрастных веществ лицам с отягощённым аллергологическим и фармакологическим анамнезом следует проводить премедикацию системными глюкокортикоидами и блокаторами Н1-рецепторов гистамина.
АЛЛЕРГИЯ НА ЛАТЕКС
Эпидемиология
Распространённость латексной аллергии в общей популяции составляет приблизительно 1%, среди медицинских работников колеблется от 5 до 22%, среди пациентов со спина бифида (spina bifida) и урогенитальной патологией, которые часто подвергаются оперативным вмешательствам, - в 12,5-60% случаев, среди пациентов с менингомиелоцеле (meningomyelocele) - у 12-67%. Также к группе риска относят пациентов с другими атопическими заболеваниями, частыми хирургическими вмешательствами, работников резиновой и пищевой промышленности. Определяющий фактор в развитии сенсибилизации к латексу - частота и длительность контакта с аллергеном независимо от пола и возраста.
Классификация
По механизмам развития:
• опосредованная ГНТ (преимущественно у атопических больных);
• опосредованная ГЗТ (преимущественно у больных, не страдающих атопией);
• опосредованная комбинированной гиперчувствительностью;
• опосредованная неиммунными реакциями (местнораздражающий эффект).
Этиология
Латекс - млечный сок каучуконосных растений, в частности бразильской гевеи (Hevea brasiliensis), относящейся к семейству Euphorbiaceae. К настоящему времени известно 11 латексных аллергенов. У некоторых из них выявлены перекрёстные аллергенные свойства с другими растительными аллергенами, что опосредует реакции немедленной гиперчувствительности к некоторым орехам, фруктам и овощам (особенно бананам, авокадо, каштанам, киви, персикам, папайе, дыне, картофелю, помидорам), а также креветкам (фруктово-латексный синдром).
Патогенез
Существуют разные пути сенсибилизации при латексной аллергии:
• аэрогенный - при вдыхании латексных частиц, диспергированных в воздухе (индуцирует IgE-опосредованные реакции);
• контактный - при контакте кожи и слизистых оболочек с изделиями из латекса (перчатки, презервативы и др.; индуцирует клеточно-опосредованные реакции IV типа);
• алиментарный - через пищеварительный тракт (при пользовании детскими сосками, надувании ртом резиновых шаров и др.);
• парентеральный (при катетеризации сосудов, контакте с тканями раневой поверхности во время операции).
В развитии реакций на латекс могут участвовать неиммунные механизмы. Это происходит, например, в тех случаях, когда перчатки создают окклюзию, в результате чего увеличивается трансэпидермальная потеря жидкости, что приводит к последующему раздражению кожи. К провоцирующим факторам развития таких реакций относят частое мытьё рук и работу с химическими реактивами.
Клиническая картина
Аллергические реакции на латекс могут быть системными или с преимущественным поражением отдельных органов и тканей.
Кожные реакции: различного рода сыпи (крапивница, мелкоточечная сыпь в местах непосредственного контакта с латексом), АО, кожный зуд; повышенная сухость, шелушение и гиперемия кожи; трещины и мокнутие кожи. Выделяют 3 основных типа кожных реакций на латекс, различающихся по механизмам развития:
• простой контактный дерматит (неиммунного генеза; выявляют в 40% случаев), характеризуется хроническим воспалением,
сухостью и появлением трещин в месте контакта с изделиями из латекса;
• аллергический контактный дерматит (IV тип реакций; выявляют в 30% случаев), развивается через 24-72 ч после контакта с изделиями из латекса;
• контактная крапивница (I тип реакций; выявляют в 20% случаев), может быть локальной, генерализованной, сопровождаться развитием АО.
Клинические проявления со стороны дыхательной системы (реагиновый тип реакций) возникают немедленно после контакта с латексом (в течение 1 ч): ринорея, заложенность носа, чихание, кашель, першение в горле, приступы удушья, одышка; могут сопровождаться конъюнктивитом.
АШ - наиболее тяжёлая реакция на латекс (чаще выявляют у пациентов с атопией). Клинические симптомы АШ развиваются в течение нескольких минут до 2 ч после контакта (чаще при хирургических операциях).
Диагностика
• Аллергологическое обследование.
V Сбор аллергологического, фармакологического, пищевого анамнеза (см. соответствующий раздел). Необходимо выяснить наличие у пациента следующих симптомов: зуда и отёка во рту после стоматологического вмешательства, надувания воздушных шаров, употребления в пищу перекрёстнореагирующих с латексом продуктов (см. выше); зуда и отёка после вагинального или ректального обследования и использования презервативов или других изделий из латекса; зуда и отёка кистей после работы в резиновых перчатках; хронического контактного дерматита; симптомов поражения дыхательных путей при контакте с изделиями из латекса; анафилактических реакций на латекс в прошлом; хирургических вмешательств в грудном возрасте.
◊ Кожные prick-тесты с латексным аллергеном.
◊ Аппликационный (patch-тест) с фрагментом латексной перчатки.
◊ Провокационные тесты: назальный, бронхиальный (применяют крайне редко в связи с высоким риском развития тяжёлых реакций).
◊ Тест высвобождения гистамина из базофилов цельной крови.
◊ Определение уровня специфичного к латексу IgE. ◊ Иммуноблоттинг для выявления сенсибилизации к отдельным аллергенам латекса.
◊ Тест пролиферации лимфоцитов для диагностики клеточноопосредованных реакций (при контактных дерматитах).
• Физикальное обследование.
• Лабораторные и инструментальные исследования:
◊ общеклинические методы (клинический анализ крови, общий анализ мочи, биохимический анализ крови, цитологическое исследование мазков и др.);
• определение функции внешнего дыхания;
• электрокардиография;
• другие исследования проводят по показаниям для выявления сопутствующих заболеваний, а также для уточнения степени тяжести и осложнений аллергического заболевания.
Дифференциальную диагностику латексной аллергии проводят с другими аллергическими заболеваниями со сходной клинической картиной, а также с неаллергической экземой и крапивницей.
Лечение
Общие принципы лечения:
• элиминационно-профилактические мероприятия;
• гипоаллергенная диета;
• фармакотерапия (зависит от особенностей клинических проявлений, степени тяжести, наличия сопутствующей патологии), включает блокаторы Н1-рецепторов гистамина, системные глюкокортикоиды по показаниям. При острых состояниях используют симптоматическое лечение, направленное на устранение клинических проявлений заболевания;
• наружная терапия при проявлениях контактного дерматита (топические глюкокортикоиды, увлажняющие средства, комбинированные препараты при признаках инфекционных заболеваний).
Профилактика: нужно прекратить контакт с латексными изделиями; для уменьшения попадания аллергена ингаляционным путём в помещениях, где регулярно применяют перчатки или другие изделия из латекса, следует использовать воздухоочистительные приборы; при развитии реакций на латекс у лиц, профессионально контактирующих с ним, нужно решить вопрос об изменении
условий труда или смене профессии; запрещается использование латекс-содержащих материалов при оказании неотложной помощи, проведении оперативного лечения и инвазивных исследований больным, страдающим аллергией к латексу; лицам, страдающим атопией и планирующим работать в пищевой, текстильной, резиновой промышленности и медицинских учреждениях, рекомендовано проведение аллергологического обследования для выявления латентной сенсибилизации к латексу; нужно соблюдать элиминационную диету с исключением перекрёстно-реагирующих продуктов (см. выше); пациентам с простым контактным дерматитом следует надевать хлопчатобумажные перчатки под латексные, проводить регулярный уход за кожей.
ПИЩЕВАЯ АЛЛЕРГИЯ
Пищевая аллергия - состояние повышенной чувствительности организма к пищевым продуктам, характеризующееся развитием клинических симптомов непереносимости, обусловленное участием иммунных или псевдоаллергических механизмов.
Эпидемиология
Распространённость пищевой аллергии составляет от 1,4 до 20%. Мужчины болеют в 2 раза чаще, чем женщины. Истинная пищевая аллергия чаще возникает в детстве; взрослые, страдающие пищевой аллергией, как правило, болеют с детства. Часто пищевую аллергию выявляют у пациентов с атопическими заболеваниями (у больных поллинозом в 60% случаев, у больных АтД - в 30-40% среди детей и около 20% среди взрослых, у больных БА - 8%). Аллергию к коровьему молоку чаще выявляют у детей, особенно до 2 лет (у 0,5% детей грудного возраста). В некоторых случаях «под маской» пищевой аллергии протекают заболевания пищеварительного тракта или приобретённые энзимопатии, глистные инвазии, психические заболевания и др.
Классификация
Нередко диагноз «пищевая аллергия» ставят при любых нежелательных реакциях, возникающих после употребления пищевого продукта. Согласно международной классификации все реакции на пищу можно разделить на:
• токсические реакции;
• нетоксические реакции:
◊ иммунологические (пищевая аллергия);
◊ неиммунологические (пищевая непереносимость);
◊ реакции с неизвестным механизмом развития. Выделяют:
• истинные аллергические реакции на пищу:
◊ IgE-зависимые;
◊ IgE-независимые:
♦ IgG/IgM-обусловленные;
♦ клеточно-опосредованные (замедленные);
• псевдоаллергические реакции (ложная пищевая аллергия), не связанные с иммунными механизмами, но клинически проявляющиеся симптомами аллергических реакций.
Этиология
Пищевая аллергия может развиваться после приёма практически любого продукта, однако существуют продукты, обладающие выраженными аллергенными свойствами, и продукты, имеющие слабую сенсибилизирующую активность. Более выраженные сенсибилизирующие свойства характерны для продуктов белкового происхождения, содержащих животные и растительные белки, хотя прямая зависимость между содержанием белка и аллергенностью продуктов отсутствует.
Пищевые аллергены - это гликопротеины с молекулярной массой 10-60 кДа. Наиболее распространённые пищевые аллергены: молоко (а-лактальбумин, р-лактоглобулин, бычий сывороточный альбумин, казеин), рыба, ракообразные, яйца птиц (овальбумин, овомукоид, кональбумин, лизоцим), мясо различных животных и птиц, пищевые злаки (глютен, делящийся на альбумин, глиадин и глобулин), бобовые (особенно соя), орехи, овощи и фрукты и др. Для больных поллинозом характерны реакции перекрёстной пищевой аллергии, обусловленной идентичностью структуры аллергена (см. табл. 13-3).
В формировании аллергических реакций на пищу могут участвовать и гаптены, содержащиеся в пищевых продуктах или пищевых добавках (например, азокрасители), которые, соединяясь с сывороточными белками, образуют полный антиген.
При нормальной функции пищеварительного тракта и гепатобилиарной системы сенсибилизация к продуктам, употребляемым в пищу, развивается реже.
Патогенез
Истинная пищевая аллергия может протекать по механизмам ГНТ (IgE- и IgG4-опосредованная, особенно при аллергии к молоку, яйцам, рыбе) и ГЗТ (при употреблении продуктов, содержащих азокрасители, хинин и другие добавки). Формированию истинной пищевой аллергии способствуют следующие факторы: генетически детерминированная предрасположенность к аллергии; чрезмерное антигенное воздействие на кишечник; кишечные паразиты; желудочно-кишечный кандидоз; заболевания органов пищеварения, приводящие к нарушению секреторной функции, повышению проницаемости слизистой оболочки кишечника, нарушению всасывания высокомолекулярных соединений, энзимопатиям; употребление алкоголя; нерациональное питание.
В основе развития псевдоаллергических реакций лежит неспецифическое высвобождение тех же медиаторов, что и при истинной аллергии (в основном гистамина). Причиной ложных реакций может быть не только сам продукт, но и различные пищевые добавки (красители, ароматизаторы, антиоксиданты, эмульгаторы, ферменты, загустители, бактериостатические вещества, консерванты и др.). Развитию псевдоаллергических реакций на пищевые продукты способствует ряд факторов: избыточное поступление в организм гистамина и тирамина при злоупотреблении пищевыми продуктами, богатыми гистамином, тирамином, гистаминолибераторами; нарушение инактивации гистамина и эндогенного тирамина; избыточный синтез тирамина кишечной флорой; повышенное всасывание гистамина при функциональной недостаточности слизистой оболочки пищеварительного тракта; нарушение синтеза простагландинов, лейкотриенов и др.
У одного и того же пациента могут развиваться реакции на пищевой продукт, обусловленные участием как специфических, так и неспецифических механизмов.
Клиническая картина
Клинические проявления пищевой аллергии могут быть системными или с преимущественным поражением отдельных органов и тканей; степень тяжести - от лёгкой до крайне тяжёлой (при АШ; табл. 13-9).
Таблица 13-9. Классические проявления пищевой аллергии
Редкие и маловероятные клинические проявления пищевой аллергии: аритмия, миокардит, аллергическая гранулоцитопения, аллергическая тромбоцитопения, болезнь Меньера, депрессия, поведенческие нарушения и гиперреактивность у детей, нефротический синдром, энурез.
Диагностика
• Физикальное обследование.
• Аллергологическое обследование (см. соответствующий раздел), в том числе:
◊ кожные тесты с пищевыми аллергенами; ◊ провокационные тесты (оральный тест);
◊ определение уровня общего, группового и специфического IgE и IgG4 к пищевым аллергенам.
• Лабораторные и инструментальные исследования:
◊ оценка функции кишечного барьера (биопсия, оценка кишечной проницаемости), особенно необходима для дифференциальной диагностики пищевой аллергии с целиакией;
◊ общеклинические методы (клинический анализ крови, общий анализ мочи, биохимический анализ крови, цитологическое исследование мазков и др.); определение функции внешнего дыхания; электрокардиография; бактериологическое исследование фекалий; паразитологическое обследо-
вание (копроовоцистоскопия, выявление антител к антигенам токсокары, эхинококка, описторхиса, трихинеллы); ультразвуковое исследование внутренних органов; гастроскопия (проводят по показаниям) с целью выявления сопутствующих заболеваний, имеющих значение для формирования истинной и ложной пищевой аллергии, а также для уточнения степени тяжести и осложнений аллергического заболевания. Дифференциальную диагностику пищевой аллергии проводят с другими видами нежелательных реакций на пищу (рвотой, диареей, болями в животе, метеоризмом, недостаточной прибавкой в весе и похудением и др.). Такие реакции обусловлены заболеваниями и аномалиями органов пищеварения и гепатобилиарной системы; метаболическими нарушениями; эндокринными, психическими заболеваниями; паразитарными инвазиями; кишечными инфекциями; муковисцидозом; целиакией; интоксикациями; пищевыми отравлениями.
Лечение
Общие принципы лечения:
• элиминация аллергенного пищевого продукта при истинной аллергии (элиминационная диета) или гипоаллергенная диета - при псевдоаллергических реакциях на пищу;
• устранение симптомов аллергии с помощью фармакотерапии;
• лечение сопутствующих заболеваний, участвующих в формировании истинной или ложной аллергии на пищу;
• профилактика.
Элиминация (исключение из рациона аллергенного продукта и всех блюд, содержащих этот продукт) - основа лечения истинной пищевой аллергии. При этом необходимо следить, чтобы питание больного было сбалансировано по основным ингредиентам, объёму и соответствовало возрасту и массе больного.
Неспецифическая гипоаллергенная диета по А.Д. Адо предполагает исключение из рациона цитрусовых; орехов; рыбы, морепродуктов; птицы и изделий из неё; шоколада и шоколадных изделий; кофе; копчёных продуктов; уксуса, горчицы, майонеза; хрена, редьки, редиса; томатов, баклажанов; грибов; яиц; молока пресного; клубники, земляники, дыни, ананаса; изделий из сдоб-
ного теста; мёда; категорически запрещается употреблять все алкогольные напитки. Больному разрешается есть нежирную отварную говядину; супы (крупяные, овощные, на вторичном говяжьем бульоне, вегетарианские); масло (сливочное, оливковое, подсолнечное); картофель отварной; каши (гречневую, рисовую, геркулесовую); огурцы свежие, петрушку, укроп; яблоки печёные; чай; сахар; компоты из яблок, слив, смородины, вишни, сухофруктов; белый несдобный хлеб.
Для купирования симптомов пищевой аллергии применяют лекарственные средства нескольких групп.
• Блокаторы Н1-рецепторов гистамина 1-го или 2-го поколения.
• Стабилизаторы мембран тучных клеток.
• Глюкокортикоиды (топические и/или системные).
• Симптоматические средства.
Первичная профилактика: адекватное и сбалансированное кормление беременной и кормящей грудью женщины; продолжительное (не менее 6 мес) грудное вскармливание; введение прикорма строго по возрасту в соответствии с основными правилами; у детей, находящихся на искусственном вскармливании, подбор молочных смесей (гипоаллергенные смеси на основе гидролизатов молочного белка) в соответствии с возрастными рекомендациями; контроль над факторами внешней среды (исключение воздействия табачного дыма, уменьшение экспозиции аллергенов в первые годы жизни, поддержание низкой влажности и адекватной вентиляции, уменьшение воздействия поллютантов); для детей старшего возраста необходимо соблюдение возрастной диеты и правильного режима питания; своевременное выявление и лечение заболеваний органов пищеварения и гепатобилиарной системы.
Вторичная профилактика: соблюдение индивидуальных элиминационных диет; изучение состава продуктов (указанного на упаковке) для предотвращения употребления аллергенных.