Хаитов Р.М. Иммунология: учебник / Р.М. Хаитов. - 2-е изд., перераб. и доп. - 2013. - 528 с.: ил.
|
|
|
|
Глава 7. АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ
Лейкоцитарные антигены человека (HLA - Human Leukocyte Antigens) - гликопротеины, кодируемые генами главного комплекса гистосовместимости - MHC (Major Histocompatibility Complex), определяют биологическую индивидуальность каждого человека. В иммунной системе эти гликопротеины выполняют важнейшую функцию: они участвуют в презентации АПК пептидных антигенов Т-лимфоцитам.
ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ
HLA-молекулы, кодируемые генами MHC, подразделяют на гликопротеины MHC класса I (HLA-A, HLA-B и HLA-C), которые представлены на поверхности всех соматических клеток, за исключением клеток ворсинчатого трофобласта и эритроцитов, и MHC класса II (HLA-DP, HLA-DQ и HLA-DR), экспрессированных преимущественно на мембране АПК (ДК, активированных макрофагов и В-лимфоцитов), а также на некоторых T-хелперах.
Соматические клетки в нормальных условиях не экспрессируют молекулы MHC-II. T-лимфоциты с помощью антигенраспознающих рецепторов способны распознавать антигены только в комплексе с молекулами MHC-I или MHC-II на поверхности клеток своего организма (феномен двойного распознавания). Таким образом, природная функция белков MHC - презентация пептидных антигенов T-лимфоцитам.
Гены главного комплекса гистосовместимости
Комплекс MHC весьма значителен по размеру, включает около 2000 аллельных вариантов генов. Расположение в геноме локусов комплекса MHC человека схематически показано на рис. 7-1.
• MHC-I. Гены групп HLA-A, HLA-B, HLA-C и другие кодируют молекулы MHC класса I.
• MHC-II. Гены групп HLA-DP, HLA-DQ и HLA-DR кодируют молекулы MHC класса II.
• MHC-III. Термин «MHC-III» обозначает область между MHC-I и MHC-II, где картированы гены, кодирующие некоторые компоненты системы комплемента (C4a и C4b, C2, фактор В), цитокины (ФНОα и лимфотоксин), 21-гидроксилазу (фермент, участвующий в биосинтезе стероидных гормонов) и др.
• Неклассические гены не принадлежат ни к одному из классов MHC. Описано 6 таких генов в области расположения генов MHC-I (Е, F, G, Н, J, X) и 6 - в области MHC-II (DM, DO, CLIP, TAP, LMP, LNA).
Трансмембранные молекулы главного комплекса гистосовместимости
• Молекула MHC-I (см. рис. 5-1, а) состоит из двух полипептидных цепей - α-цепи и β2-микроглобулина.
◊ α-Цепь состоит примерно из 325 аминокислотных остатков, имеет молекулярную массу около 45 кДа и содержит 3 внеклеточных домена (α1, α2, α3), трансмембранный участок и цитоплазматический участок из 55 аминокислотных остатков. Домены α1 и α2 формируют углубление в виде жёлоба или «корзины» размером 0,25x0,1x0,11 нм для связывания антигенных пептидов длиной 9-11 аминокислот, предназначенных для распознавания T-лимфоцитами.
◊ С внеклеточными а-доменами нековалентно ассоциирована лёгкая полипептидная цепь с молекулярной массой 11,5 кДа, называемая β2-микроглобулином (кодируется геном, расположенным вне комплекса MHC, на хромосоме 15).
• Молекулы MHC-II (см. рис. 5-1, б) - гетеродимеры из двух трансмембранных гликопротеинов: α-цепи (молекулярная
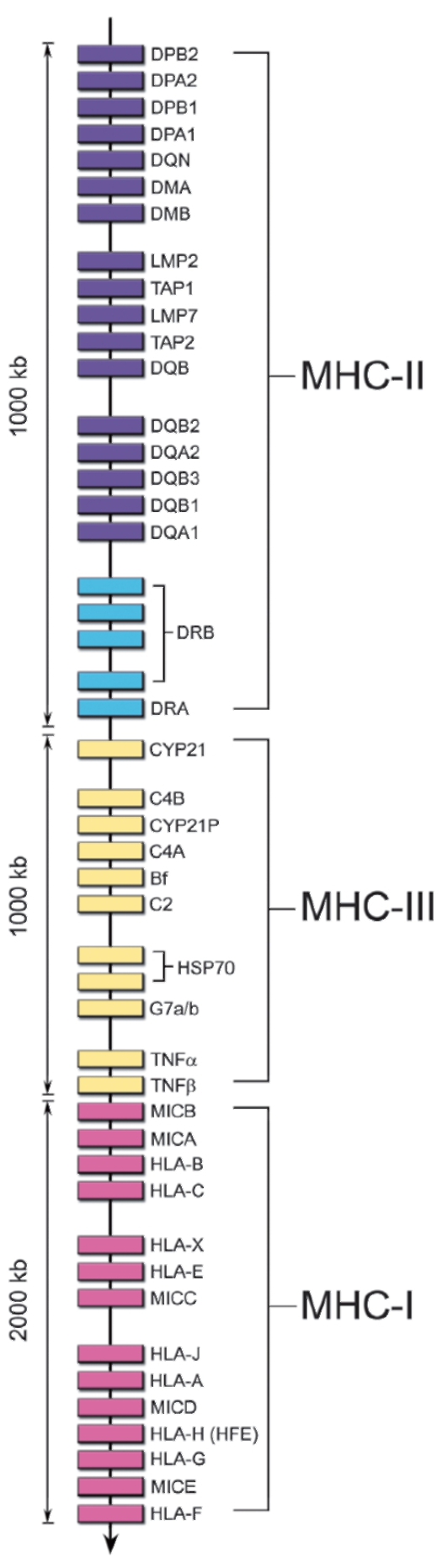
Рис. 7-1. Расположение генов MHC в хромосоме 6 человека
масса 34 кДа) и β-цепи (молекулярная масса 29 кДа). Внеклеточная часть каждой цепи имеет 2 домена. Пептидсвязывающую бороздку формируют совместно α1- и β1-домены. В отличие от аналогичного углубления в составе гликопротеинов MHC-I, щель MHC-II открыта с обеих сторон, что позволяет связывать более длинные пептиды (15-30 аминокислот).
Генетический полиморфизм
Гены комплекса MHC (в отличие от генов TCR и иммуноглобулинов) не подвергаются рекомбинации. Механизм их приспособления к неограниченному множеству потенциальных антигенов заключается в их генетическом полиморфизме (кодоминантность, множественность аллелей, естественный отбор).
• Кодоминантность. Гены MHC кодоминантны, т.е. одновременно экспрессируются гены материнской и отцовской хромосом. Генов MHC-I по 3 (А, В, С) в каждой из гомологичных хромосом, генов MHC-II - также по 3 (DP, DQ, DR). Следовательно, если у матери и отца нет одинаковых аллелей, то каждый человек имеет как минимум 12 различных основных аллелей генов MHC.
• Множественность аллелей. Полиморфизм классических генов MHC (классов I и II) означает наличие в популяции множества аллелей - вариантов одноимённого гена у разных особей. Для отдельных локусов MHC известно более сотни аллельных вариантов. Каждый аллельный вариант молекулы MHC преимущественно связывает пептиды с определёнными «якорными» аминокислотными остатками.
• Эволюционный отбор. Каждая особь потенциально способна развить защитный иммунный ответ только на те пептиды, которые способны связать гликопротеины MHC этой особи. Конкретные варианты MHC закрепляются в эволюции естественным отбором, и каждая отдельная особь оказывается приспособленной к региональным видам и штаммам инфекционных микроорганизмов, на защиту от которых шёл отбор MHC у предков.
• Неклассические гены MHC, видимо, не полиморфны или не столь полиморфны, как гены MHC классов I и II.
Комплексы антигенный пептид-MHC
Формирование комплексов антигенных пептидов с молекулами MHC разных классов происходит в различных клеточных компартментах.
• MHC-I «обслуживают» зону цитозоля, сообщающегося через ядерные поры с содержимым ядра. Здесь происходит фолдинг (принятие правильной конформации) синтезированных белковых молекул. При возникновении ошибок (в том числе и при синтезе вирусных белков) белковые продукты расщепляются в мультипротеазных комплексах (протеосомы). Образующиеся при этом пептиды связываются с молекулами MHC-I. В результате молекулы MHC-I презентируют T-лимфоцитам внутриклеточно образующиеся пептидные антигены. Именно поэтому CD8+ T-лимфоциты, распознающие комплексы антигенов с MHC-I, участвуют в первую очередь в защите от вирусных, а также внутриклеточных бактериальных инфекционных заболеваний.
• MHC-II. Зона «обслуживания» MHC-II связана с внеклеточной средой, а также с клеточными органеллами (аппарат Гольджи, эндоплазматический ретикулум, лизосомы, эндосомы и фагосомы). Пептиды, образующиеся в данной зоне, имеют внеклеточное происхождение - это продукты протеолиза белков, захваченных клеткой посредством эндоцитоза или фагоцитоза. Вновь синтезированные молекулы a- и р-цепей MHC-II с помощью инвариантной полипептидной цепи Ii и кальнексина экспонируются внутрь везикул (эндосом или фаголизосом) и только здесь, связавшись с пептидным антигеном, принимают необходимую конформацию для дальнейшей экспрессии на мембране клетки. Таким образом, молекулы MHC-II осуществляют презентацию антигена при развитии иммунного ответа на внеклеточные патогены. Главную роль в этом ответе играют CD4+ T-лимфоциты, распознающие антиген в комплексе с MHC-II.
Суперантигены
В ходе эволюции инфекционные микроорганизмы «научились» синтезировать так называемые суперантигены, которые способны присоединяться к молекулам MHC-II без процессинга
в АПК и связываться с V-областью β-цепи TCR. Такое связывание вызывает поликлональную активацию 2-20% периферических CD4+ T-лимфоцитов, что приводит, с одной стороны, к общей интоксикации организма, а с другой - к быстрой гибели активированных T-лимфоцитов путём апоптоза и, следовательно, к иммунодефициту. Например, клиническая картина пищевых отравлений обусловлена главным образом действием энтеротоксинов стафилококков на T-лимфоциты. Иммунодефицит при ВИЧ-инфекции также в значительной мере объясняется лимфотоксическим действием суперантигенов ВИЧ.
Антигенпрезентирующие молекулы CD1
За пределами MHC имеются гены, кодирующие антигенпрезентирующие молекулы (например, гены кластера CD1, кодирующие CD1a, CD1b, CD1c, CD1d, CD1e). Продуктах этих генов - гетеродимеры (состоят из a-цепи и в2-микроглобулина), они способны связывать и презентировать T-лимфоцитам небелковые антигены (например, миколевую кислоту и липоарабиноманнан оболочки микобактерий). Эти молекулы-гетеродимеры конститутивно экспрессированы на ДК и B-лимфоцитах, а также на тимоцитах и энтероцитах. Антиген в комплексе с CD1 распознаёт γδT-лимфоциты и NKT-клетки. NKT-лимфоциты - это αβT-клетки, TCR которых кодируется сегментом Va24, кроме того, они экспрессируют маркёры NK-клеток. Фенотип NKT-клеток: либо CD4/CD8-, либо CD8+.
АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ
Молекулы MHC контролируют иммунный ответ. Так, MHC-II участвуют в презентации антигенов T-клеткам (рис. 7-2, 7-3) и во взаимодействии T- и B-лимфоцитов. Антигены MHC-I и MHC-II связываются поверхностными маркёрами Т-клеток: MHC-I с CD8, а MHC-II - с CD4.
• Профессиональные АПК. Молекулы MHC-II экспрессированы только на определённых клетках, которые называют профессиональными АПК. Таких клеток у человека 3 типа: ДК костномозгового происхождения, B-лимфоциты и макрофаги. На их мембранах, помимо молекул MHC-I и MHC-II, при-
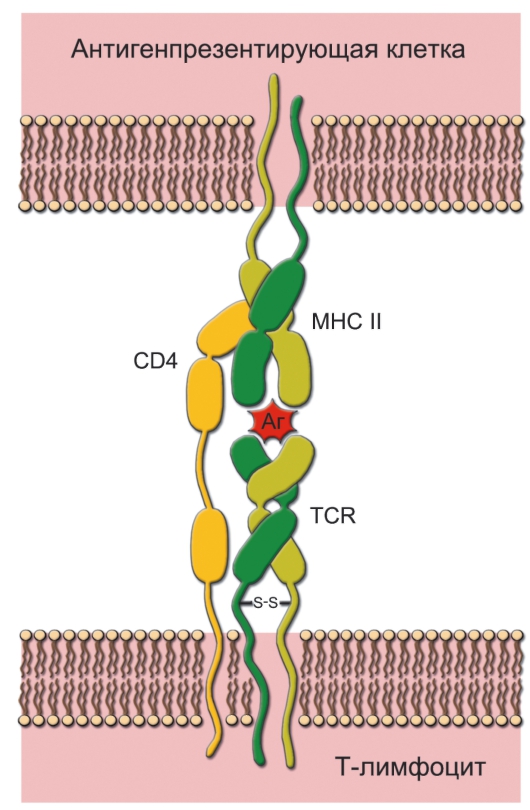
Рис. 7-2. Распознавание антигена рецептором T-лимфоцита. Каждая молекула MHC-II состоит из двух цепей - α и β. При помощи TCR T-клетка распознаёт антиген, но только находящийся в комплексе с молекулой MHC. В случае T-хелпера в процессе также участвует CD4, который свободным концом связывается с молекулой MHC. Распознаваемый T-клеткой антиген имеет два участка: один взаимодействует с молекулой MHC, другой (эпитоп) связывается с рецептором T-лимфоцита. Подобный же тип взаимодействия, но с участием CD8, характерен для процесса распознавания цитотоксическим T-лимфоцитом антигена, связанного с молекулой MHC-I. Аг - антиген
сутствуют все корецепторные молекулы. Они продуцируют цитокины, необходимые для активации T-лимфоцитов к иммунному ответу.
• Эндотелий тоже может выполнять функции АПК, но особого назначения. Вероятно, экспрессия комплексов «пептид- MHC» на клетках эндотелия служит специфическим сигналом, привлекающим эффекторные лимфоциты из циркулирующей крови в очаг поражения (обеспечивает антигенспецифичный хоминг).
Характеристика разных АПК представлена в табл. 7-1. Таблица 7-1. Свойства профессиональных антигенпрезентирующих клеток
Дендритные клетки
Из всех клеток, имеющих определение «дендритные» (что означает «клетки с отростками»), к профессиональным АПК относят только клетки костномозгового происхождения. Такие клетки широко представлены в организме. Их много в покровных тканях
(клетки Лангерганса в коже), носоглотке, лёгких, кишечнике и желудке, в крови (незрелые формы) и в лимфоидных органах (зрелые, активированные). Если у B-лимфоцитов и макрофагов есть и иные (причём главные для них) функции - продукция иммуноглобулинов у B-лимфоцитов, фагоцитоз и «переваривание» у макрофагов, - то у ДК нет других функций, кроме презентации антигенов и передачи костимулирующих сигналов лимфоцитам.
• Разновидности ДК. Выявлены 2 разновидности ДК.
◊ Миелоидные ДК происходят из моноцитов и экпрессируют CD11 маркёр. Их, вероятно, можно рассматривать как разновидность макрофагов, специализирующихся на презентации антигенов T-лимфоцитам.
◊ Плазмоцитоидные ДК происходят от общей лимфоидной клетки-предшественницы, из которой развиваются также T- и B-лимфоциты, NK-клетки. Маркёры предшественников плазмоцитоидных ДК: ИЛ-3Rα (вариант рецептора для ИЛ-3, или CD123), иммуноглобулиноподобных рецепторов - ILT3+ (CD85k) и ILT7+ (CD85g), а также BDCA-2 (CD303), BDCA-3 (CD141) и BDCA-4 (СD304).
• Эндоцитоз. ДК активно и непрерывно поглощают вещества из окружающей среды. При отсутствии патогена ДК поглощают вещества собственных тканей и презентируют этот материал T-лимфоцитам без корецепторного стимула. В результате иммунный ответ в отношении собственных тканей не развивается и поддерживается состояние толерантности к «своему». ДК до активации представлены незрелыми формами, с низкой способностью презентировать антигены Т-лимфоцитам.
• Активация. ДК активируются при проникновении патогена в организм и превращаются в зрелые ДК. В распознавании патогена при этом участвует TLR.
◊ На миелоидных ДК (как и на макрофагах) присутствуют рецепторы для маннозы, ЛПС, а также TLR2 и TLR4, распознающие продукты грамотрицательных и грамположительных бактерий соответственно.
◊ На плазмоцитоидных ДК присутствуют TLR7 и TLR9 (распознают вирусную и бактериальную ДНК), а также особый лектиновый рецептор (связывает, например, вирус гриппа).
• Иммунологический синапс. Активированные патогеном ДК (зрелые) мигрируют из покровных тканей в региональные
лимфоидные органы (в частности, в паракортикальные зоны лимфатических узлов), где и презентируют T-лимфоцитам антигены и активируют их через корецепторные молекулы B7.1, B7.2 и CD40. Формирование такого межклеточного - иммунологического - синапса (рис. 7.3) обязательное условие начала развития иммунного ответа.
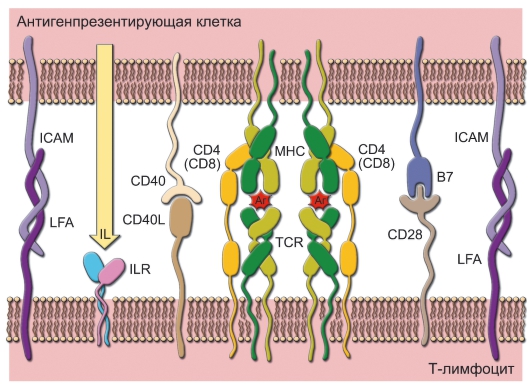
Рис. 7-3. Иммунологический синапс между T-лимфоцитом и антигенпрезентирующей клеткой. Минимальный набор взаимодействий, необходимых для начала развития иммунного ответа: связь агрегированных TCR с комплексами пептид-MHC; связь корецептора CD4 (или CD8) с MHC; связь CD40 с CD40L; связь B7 с CD28; связи молекул адгезии (ICAM, LFA); взаимодействия цитокинов (IL) с рецепторами для цитоки-
нов (ILR)
Взаимодействие Т- и В-лимфоцитов
При первичном иммунном ответе единственные эффективные АПК для T-лимфоцитов - ДК. Но при активации T-лимфоцита антигеном, презентированным ДК, в иммунный ответ будут вовлекаться и рядом расположенные В-лимфоциты, для которых в сложившемся микроокружении тоже найдутся объекты для распознавания. При этом возможны 2 варианта взаимодействия T- и В-лимфоцитов.
• В-лимфоциты через BCR связывают растворимый антиген, поглощают его эндоцитозом, подвергают процессингу и экспонируют на поверхности фрагменты антигена в составе комплексов с молекулами MHC-II. TCR связывает антиген на поверхности В-лимфоцита в комплексе с молекулой МНС-II. Кроме того, устанавливаются все необходимые и достаточные корецепторные взаимосвязи между T- и В-лимфоцитами (табл. 7-2). Такое взаимодействие происходит в T-зависимых зонах периферической лимфоидной ткани в начале развития иммунного ответа.
• В-лимфоцит распознаёт специфический антиген, однако недалеко оказывается активированный T-лимфоцит, распознавший антиген на другой АПК. В таком случае взаимодействие Ти В-лимфоцитов может ограничиться восприятием В-клеткой цитокиновых сигналов от В-лимфоцита. Взаимодействие же с участием мембранных молекул может наступать или не наступать (по крайней мере, в первичном иммунном ответе). При вторичном иммунном ответе в процесс вовлекаются Т-клетки памяти и обязательно происходит взаимодействие мембранной молекулы В-лимфоцита CD40 с мембранной молекулой T-клетки CD40L (кроме T-лимфоцитов, CD40L экспрессируется на тучных клетках, тромбоцитах, макрофагах, NK-клетках, а также на клетках гладких мышц, эндотелиальных и эпителиальных клетках). Без этого взаимодействия, как показывает опыт, не происходит переключение с IgM на другие изотипы. Вторичный же ответ В2-лимфоцитов характеризуется обязательным переключением изотипа иммуноглобулинов с IgM на IgG, IgA или IgE. Эти взаимодействия Т- и В-клеток происходят уже в В-клеточных зонах - в фолликулах лимфоидных органов.
Таблица 7-2. Взаимодействие Т- и В-клеток (при условии, что B-лимфоцит выполняет роль антигенпрезентирующей клетки)
ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ РАЗВИТИЕ РАЗЛИЧНЫХ ТИПОВ ИММУННОГО ОТВЕТА
ДК в качестве АПК не только обеспечивают саму возможность развития иммунного ответа или возникновение иммунологической толерантности, но и определяют направление дифференцировки хелперных субпопуляций T-лимфоцитов, а значит, и тип иммунного ответа (табл. 7-3).
Таблица 7-3. Типы иммунного ответа
Характер активации АПК зависит от биохимических характеристик и дозы патогена, его биологических свойств и путей попадания в организм. В результате развивается последовательность событий, представленная на рис. 7-4.
Th1-опосредованный, или клеточный иммунный ответ
Доминирует секреция ИФНγ, приводящая к активации макрофагов и стимуляции секреции В-лимфоцитами антител с опсонирующими свойствами. Важную роль в TM-ответе играют ЦТЛ и
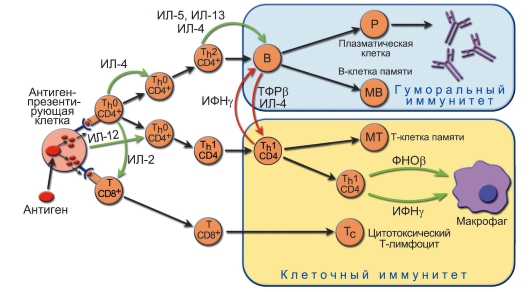
Рис. 7-4. Роль антигенпрезентирующих клеток и Т-хелперов в формировании оптимального варианта иммунного ответа. Этапы: 1 - различные патогены по-разному связываются с разными антигенпрезентирующими клетками, по-разному процессируются и по-разному их активируют; 2 - активированные разными способами антигенпрезентирующие клетки продуцируют разные цитокины, воздействующие на T-лимфоциты. Кроме того, концентрации антигена на антигенпрезентирующих клетках могут значительно различаться; 3 - таким образом, направление дифференцировки эффекторного T-лимфоцита определяют и антиген, и цитокиновый сигнал от антигенпрезентирующих клеток; 4 - дифференцированные эффекторные T-лимфоциты начинают продуцировать определённый набор цитокинов, который определяет различные типы иммунного ответа. Перекрёстная регуляция: ИФНу, образуемый Th1-клетками, подавляет пролиферацию Th2. В свою очередь, ИЛ-10, продуцируемый Th2-клетками, подавляет образование Th1-цитокинов. Зелёные стрелки - активационные сигналы, красные - ингибиторные
NK-клетки, что важно не только для противоинфекционного, но и для противоопухолевого и трансплантационного иммунитета.
Биологические эффекты ИФНу направлены на уничтожение клеток, инфицированных вирусами или бактериями:
• индукция противовирусного эффекта на уровне ферментов, расщепляющих нуклеиновые кислоты (2',5'-олигоаденилатсинтетазы и др.);
• сильная стимуляция макрофагов, соответственно повышенный синтез этими клетками токсичных продуктов;
• стимуляция NK-клеток;
• поддержание переключения синтеза иммуноглобулинов в В-лимфоцитах на IgG, что активирует фагоциты (нейтрофилы и макрофаги), т.е. T-лимфоциты как продуценты интерферона обеспечивают макрофагальный и цитотоксический характер иммунного ответа.
Условия развития иммунного ответа типа Th1
При инфекциях внутриклеточными патогенами (вирусы, ряд бактерий) свойства патогена (в том числе его проникающая способность) обусловливают формирование на АПК (ДК) высокой концентрации патогенного материала. Связывание CD40L на мембране T-лимфоцита с CD40 на ДК служит для последней сигналом к продукции некоторых интерлейкинов и интерферонов.
Интерлейкин-12
• Миелоидные ДК продуцируют ИЛ-12 (быстро, в большом количестве, но непродолжительное время - до 1 сут) и ФНОа, стимулируя T-лимфоциты к продукции ИФНу.
• Плазмоцитоидные ДК продуцируют ИЛ-12 в меньших количествах (в 100-1000 раз) по сравнению с миелоидными ДК, зато более продолжительное время (несколько суток).
• Макрофаги. ИЛ-12 продуцируют также макрофаги и нейтрофилы.
• T-лимфоциты. На T-лимфоците, TCR которого связал антиген с высокой авидностью, устойчиво экспрессируется рецептор для ИЛ-12, содержащий р2-субъединицу (экспрессия этой субъединицы специфична именно для Th1).
Интерфероны
• Плазмоцитоидные ДК сразу после распознавания патогена (ещё до попадания в лимфатический узел) начинают активно продуцировать интерфероны типа I (ИФНа и ИФНр), которые, с одной стороны, аутокринно стимулируют созревание ДК, с другой - индуцируют образование T-лимфоцитами ИФНу и ИЛ-10 (а не одного только ИФНу, как ИЛ-12 миелоидных ДК).
• ИФНγ и ИФНα- кофакторы для дифференцировки Th1-лимфоцитов, индуцируемой ИЛ-12. Его источником, помимо Th1-клеток, служат активированные CD8+ T-клетки, т.е. CD8+ Т-лимфоциты вносят свой вклад в дифференцировку CD4+ T-клеток по пути Th1.
• ИЛ-10 подавляет дифференцировку и активность Th1-клеток (возможно, не прямо, а через угнетение активности макрофагов и возникающего при этом недостатка ИЛ-12).
Таким образом, большая доза антигена и достаточные количества ИЛ-12 - необходимые и, возможно, достаточные условия для индукции дифференцировки T-лимфоцитов в продуценты ИФНу, т.е. CD4+ Th1-лимфоциты.
Тh2-опосредованный, или гуморальный иммунный ответ
• Иммунный ответ Th2-типа контролируется другими цитокинами, чем Th1 (в основном ИЛ-4). Продуценты ИЛ-4 - CD4+ Th2-клетки, дважды негативные CD4-CD8- T-лимфоциты, тучные клетки. Этот тип ответа направлен на стимуляцию В-лимфоцитов к образованию антител, нейтрализующих бактерии, токсины, паразитов и реализующих другие эффекты гуморального иммунитета.
• Th2-лимфоциты поддерживают переключение синтеза изотипов иммуноглобулинов в B-лимфоцитах на IgE, IgG4 и IgА. Клетки-партнёры для этих изотипов - тучные клетки, базофилы и эозинофилы. При их активации развиваются воспалительные процессы с выраженным вазоактивным компонентом и экссудацией или характерное эозинофильное воспаление.
• За исключением патологических случаев IgE-зависимых аллергических реакций, иммунный ответ Th2-типа принято (достаточно условно) рассматривать как противовоспалительный.
Условия развития иммунного ответа типа Th2
Этот вариант иммунного ответа направлен на «перехват» растворимых компонентов патогенов (токсинов, аллергенов, химиопрепаратов), а также на элиминацию крупных инвазивных патогенов - гельминтов, которые не могут быть фагоцитированы
макрофагами из-за своих размеров. Растворимые патогены в низких концентрациях могут быть связаны только растворимыми же антителами, поэтому в качестве АПК выступают B-лимфоциты и плазмоцитоидные ДК. При этом внутри АПК патогены не размножаются и экспрессируются на мембрану в комплексах с MHC в малых количествах. Интерлейкин-4
• СD4+ Т-лимфоциты, не получившие стимула от ИЛ-12, экспрессируют молекулу OX40. Лигандом для неё служит OX40L на мембране активированных ДК и B-лимфоцитов.
• Взаимодействие OX40-OX40L индуцирует образование T-лимфоцитами ИЛ-4 и экспрессию на В-клетках CXCR5 (рецептор для хемокина CXCL13), обеспечивающий миграцию этих В-лимфоцитов в лимфоидные фолликулы лимфатического узла (т.е. в B-клеточную зону, где анатомически локализованы дальнейшие Т/B-взаимодействия).
• ИЛ-4 и ИЛ-13 аутокринно стимулируют дифференцировку наивных CD4+ T-лимфоцитов в Th2-клетки.
Интерлейкин-5
• При физиологическом иммунном ответе на антигены, в частности, связанные с гельминтами, TШ-лимфоцитьI и тучные клетки продуцируют ИЛ-5.
• ИЛ-5 поддерживает эозинофилопоэз и активирует зрелые эозинофилы. Это единственный известный эффекторный механизм, убивающий гельминтов, проникших в ткани внутренней среды организма.
Кишечных гельминтов организм «изгоняет» также с участием IgE, индуцирующего дегрануляцию тучных клеток в слизистой оболочке кишки. Выбрасываемый в ткани гистамин инициирует сокращение гладких мышц стенки кишки, т.е. активную перистальтику и выброс гельминтов. Кроме того, цитокины, ассоциированные с Th2-ответом (ИЛ-4, ИЛ-9, ИЛ-13, ИЛ-25 и ИЛ-33), вызывают активацию эпителиальных клеток кишечника и усиление выработки слизи.
Апоптоз. Для Th2-лимфоцитов характерна экспрессия ещё одной мембранной молекулы - CD30. Взаимодействие её с лигандом CD30L, экспрессированным на B-лимфоцитах, эозинофилах, эпителии мозговой зоны тимуса и клетках-предшественницах миело-
поэза в костном мозге, сначала повышает активность T-лимфоцита, а затем индуцирует его апоптоз.
Иммунное отклонение
Направление терминальной дифференцировки наивных CD4+ T-лимфоцитов в сторону преобладания той или иной субпопуляции (Th1 или Th2) в процессе развития иммунного ответа называют иммунным отклонением. Нарушение баланса активности Th1- и Th2-субпопуляций играет определяющую роль в развитии многих заболеваний.
Патологические процессы с превалированием иммунного ответа типа Th1 или Th2 перечислены ниже.
• Th1 (макрофагальное воспаление - ГЗТ, гранулёмы): тиреоидит Хасимото, офтальмопатия, сахарный диабет I типа, рассеянный склероз, ревматоидный артрит, гастрит (возбудитель Helicobacter pylori), боррелиоз Лайма, хронический гепатит С, острое отторжение аллотрансплантата, острая болезнь «трансплантат против хозяина», саркоидоз, апластическая анемия, привычные аборты.
• Th2 (Th2-зависящее воспаление - экссудативное, эозинофильное и др.): корь, синдром Оменна, атонические заболевания; хроническая болезнь «трансплантат против хозяина»; аллергический кератоконъюнктивит.