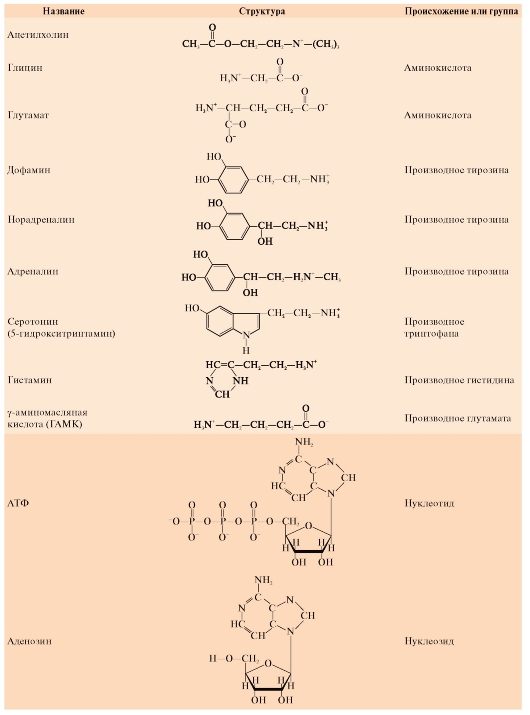
Атлас по физиологии. В двух томах. Том 1: учеб. пособие / А. Г. Камкин, И. С. Киселева - 2010. - 408 с. : ил.
|
|
|
|
Глава 3. Синапсы
Электрическое взаимодействие клеток: электрический синапс
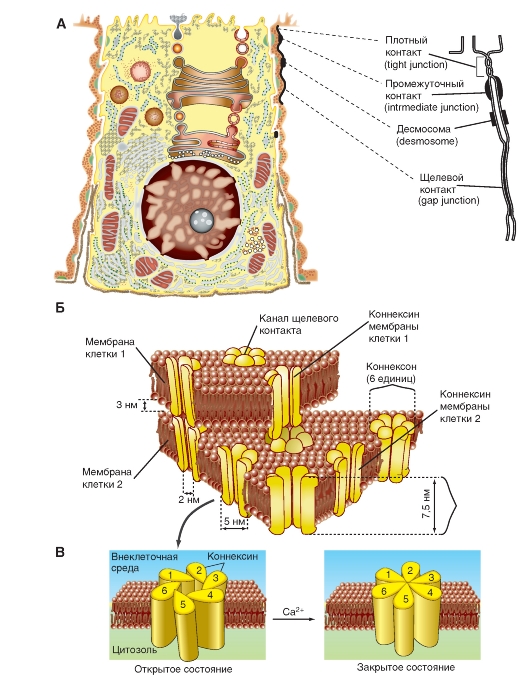
Впервые ультраструктура межклеточных контактов была подробно изучена в 1963 г. М.Г. Фаркухаром (Farquhar M.G.) и Г.Е. Палейдом (Palade G.E.) на тонких срезах различных эпителиальных клеток. В апикальной области этих клеток были выделены три специализированные структуры. На рисунке 3-1 A схематично представлена клетка с основными известными типами контактных структур.
1. В непосредственной близости к протоку располагается зона замыкания, или плотный контакт (tight junction). Эта зона характеризуется слиянием внешних листков мембран соседних клеток с образованием одиночной электронно-плотной полосы вдоль контакта и представляет собой сеть ветвящихся тонких гребней.
2. Непосредственно к плотному контакту примыкает зона слипания, или промежуточный контакт (intermediate junction). Эта зона характеризуется наличием межклеточной щели шириной 150-200 А, заполненной гомогенным материалом низкой электронной плотности. Кроме того, для этой зоны характерен строгий параллелизм соседних клеточных мембран. В прилегающей к ней цитоплазме перпендикулярно контакту локализованы полосы плотного материала.
3. Десмосома (desmosome) - локальное дискообразное электронно-плотное образование, располагающееся параллельно внутреннему листку каждой клеточной мембраны. Межклеточная щель составляет около 240 А. От каждой десмосомы внутрь цитоплазмы расходятся пучки фибрилл.
4. Введение в практику электронной микроскопии методов обработки материала солями тяжелых металлов позволило идентифицировать еще один тип контактов - щелевой контакт (gap junction), имеющий в области тесного сближения мембран двух соседних клеток межклеточную щель шириной 20-40 А. Именно этот тип контактов клеток представляет значительный интерес для физиологии с позиций межклеточного взаимодействия и будет детально обсуждаться ниже.
5. Позднее в некоторых тканях беспозвоночных был обнаружен еще один тип клеточного контакта, септированный контакт (septate junction), в котором межклеточное пространство шириной в 150-170 А пересекается перегородками (септами) толщиной 40-50 А, связывающими внешние поверхности соседних клеток. Для межклеточного электрического взаимодействия основное значение имеет щелевой контакт.
Щелевой контакт, или gap junction, - наиболее распространенный тип контактов между клетками практически всех тканей животных, присутствующий между клетками как электровозбудимых, так и электроневозбудимых тканей. В бислое мембран обеих клеток, образующих щелевой контакт, белковая часть представлена цилиндрическими структурами, распространяющимися по всей ширине щели и пронизывающими насквозь оба бислоя. Эти структуры представляют собой заполненные водой каналы и служат основой для осуществления физиологических функций щелевого контакта.
Модель части мембран двух клеток, имеющих щелевой контакт, представлена на рис. 3-1 Б. Щелевой контакт состоит из ряда гексагональных субъединиц - коннексонов - с расстоянием между ними 80-100 А. Каждый коннексон состоит из шести коннексинов полипептидной природы, построенных так, что они создают канал, как бы окружая его. Проходя через бислои мембран каждой из двух соседних клеток, коннексоны выходят в межклеточную щель, где соединяются друг с другом и образуют контактную структуру в виде водного канала между цитоплазмой двух соседних клеток. В результате того, что одиночные коннексины каждого коннексона могут изгибаться относительно друг друга, центральный канал коннексона открывается или закрывается. На рис. 3-1 В представлена модель открытого (слева) и закрытого (справа) канала щелевого контакта. Видно, что такой механизм регуляции просвета канала напоминает работу диафрагмы. Радиальное смещение (около 6 А) каждого коннексина соответствует изменению наклона субъединицы по отношению к продольной оси коннексона только на 5°.
Рис. 3-1. Межклеточные контакты и структура щелевого контакта.
А - типы межклеточных контактов. Б - модель структуры щелевого контакта, включающая липидный бислой двух соседних клеток, содержащий коннексоны, каждый из которых построен из шести коннексинов. В - в увеличенном виде представлено открытое и закрытое состояние канала коннексона
Структура коннексонов
Коннексоны позволяют осуществлять обмен ионами и водорастворимыми молекулами с молекулярной массой до 1200-1500 Да между клетками. Это свидетельствует о возможности метаболической кооперации между клетками, когда одна клетка способна передавать другой вещества, которые последняя не синтезирует. Например, АМФ, АДФ или АТФ могут проходить через щелевой контакт. Кроме того через него может осуществляться переход из клетки в клетку цАМФ, внутриклеточного вторичного мессенджера. Эти каналы служат основой и для электротонического взаимодействия между клетками. Центральный канал коннексона может закрываться в результате увеличения концентрации внутриклеточного Са2+ или Н+ в одной из клеток, а также в ответ на деполяризацию одной или обеих клеток.
В целом, щелевые контакты обладают следующими свойствами и функциями:
• это структуры, ответственные за эффективную диффузионную связь между клетками;
• через них могут проникать гидрофильные соединения, не способные проходить через другие участки поверхностных мембран;
• диффузионные каналы между двумя клетками изолированы от остальной межклеточной среды;
• проницаемость контактирующих мембран в области щелевых контактов резко падает при увеличении концентрации свободного внутриклеточного кальция, закисления или деполяризации любой из клеток;
• диффузионные каналы из клетки в клетку способны формироваться в течение десятков секунд или минут при тесном сближении мембран двух соседних клеток.
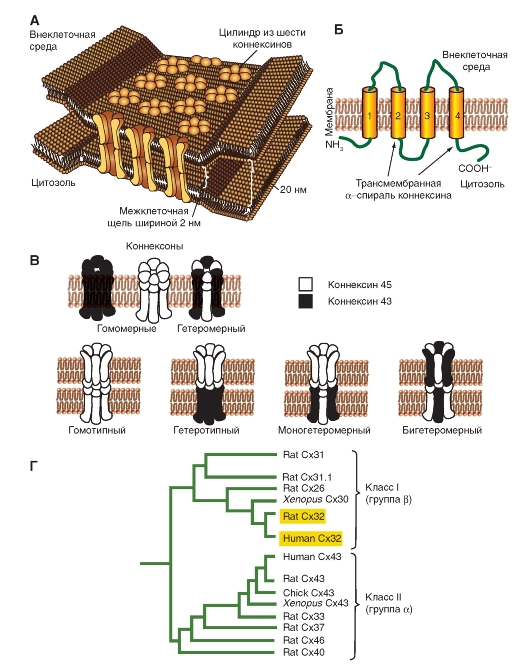
Пространственная модель щелевого контакта и молекулярная организация коннексина представлены на рис. 3-2 А, Б.
На рисунке 3-2 В показаны различные комбинации коннексинов, формирующих коннексоны, хемиканалы и реальные каналы. Эти данные приведены на основе коннексина (Сх) Сх45 и Сх43.
Наконец, на рис. 3-2 Г представлены две ветви филогенетического древа семейства коннексинов. Примечательно, что разница между двумя выделенными коннексинами из двух разных классов заключается только в четырех аминокислотах.
Рис. 3-2. Коннексоны и их молекулярная организация
Принцип межклеточного электротонического взаимодействия
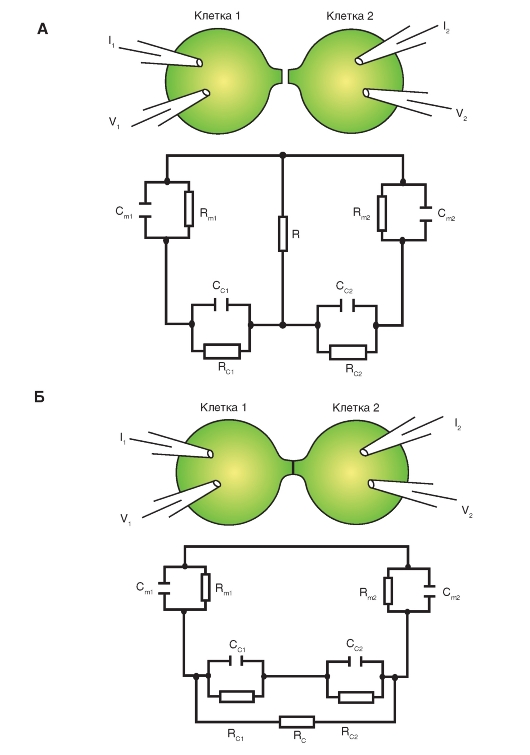
Для анализа факторов, определяющих условия передачи возбуждения от клетки к клетке, необходимо рассмотреть эквивалентную электрическую схему области контакта, учитывающую все его основные элементы, влияющие на передачу электрического сигнала через эту область. Использование эквивалентных электрических схем позволяет на основании экспериментальных данных количественно оценивать значение того или иного элемента схемы. Контактам разной морфологической структуры соответствуют разные эквивалентные электрические схемы.
Для сравнения рассмотрим два типа клеточных контактов - плотный контакт, клеточный контакт с узкой межклеточной щелью без коннексонов, эквивалентная электрическая схема которого представлена на рис. 3-3 А, и щелевой контакт, эквивалентная электрическая схема которого представлена на рис. 3-3 Б. Последнюю модель рассматривают при условии, что сопротивление утечки стремится к бесконечности. Кроме того, считается, что весь ток проходит из одной клетки в другую по каналам коннексонов, хорошо изолированных от окружающей среды. Эквивалентная электрическая схема в этом случае не содержит емкости. Сопротивление цитоплазмы и наружной среды принимается крайне малым. Такой подход, безусловно, представляется слишком упрощенным, но он приемлем для ряда объектов.
Если в каждую из клеток введены стимулирующие и регистрирующие микроэлектроды, то возможно определить входное сопротивление каждой клетки, обусловленное только свободными неконтактными мембранами, и сопротивление контактной
мембраны. Для этого необходимо через оба стимулирующих микроэлектрода пропускать токи такой силы, чтобы потенциалы обеих клеток стали равны. При этом ток через контакт не идет, и входные сопротивления клеток легко определить:
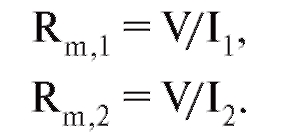
Было введено понятие «коэффициент электрической связи», т.е. отношения
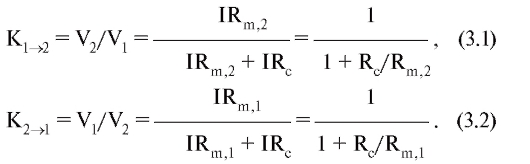
Эти коэффициенты, вообще говоря, не равны друг другу и зависят от входных сопротивлений клеток. Действительно, если сопротивление контактной мембраны в этой модели стремится к нулю, то коэффициент передачи стремится к единице.
Из этих уравнений следует, что K зависит от величины входного сопротивления клетки. Например, изменения потенциала в большой клетке могут сильно сдвинуть потенциал в соседней маленькой клетке с высоким входным сопротивлением. Наоборот, эти же изменения потенциала в маленькой клетке незначительно сдвинут потенциал в большой. Такая зависимость эффектов от клеточных размеров получила название «геометрическое выпрямление». Входное сопротивление клеток зависит не только от их величины, но и от удельного сопротивления их мембраны, поэтому всякое изменение сопротивления одной из клеток меняет электрическую связь между ними, и притом несимметрично.
Рис. 3-3. Эквивалентные электрические схемы клеточных контактов.
А - эквивалентная электрическая схема клеточного контакта с узкой межклеточной щелью (100-200 Å) без коннексонов.
Обозначения: Rm1 и Rm2 - сопротивления поверхностной мембраны клеток 1 и 2, соответственно; Cm1 и Cm2 - емкости поверхностной мембраны клеток 1 и 2, соответственно; R - сопротивление утечки через межклеточную щель, Rc1 и Rc2, Cc1 и Cc2 - общее сопротивление и емкость двух контактных мембран.
Б - эквивалентная электрическая схема клеточного контакта с коннексонами.
Обозначения: Rm1 и Rm2 - сопротивления поверхностной мембраны клеток 1 и 2, соответственно; Cm1 и Cm2 - емкости поверхностной мембраны клеток 1 и 2, соответственно; R - сопротивление утечки через межклеточную щель равно бесконечности; Rc1 и Rc2, Cc1 и Cc2 - общее сопротивление и емкость двух контактных мембран, RJ - суммарное сопротивление всех коннексонов в щелевом контакте
Принципы обнаружения щелевого контакта
Существует несколько принципов, лежащих в основе обнаружения щелевого контакта.
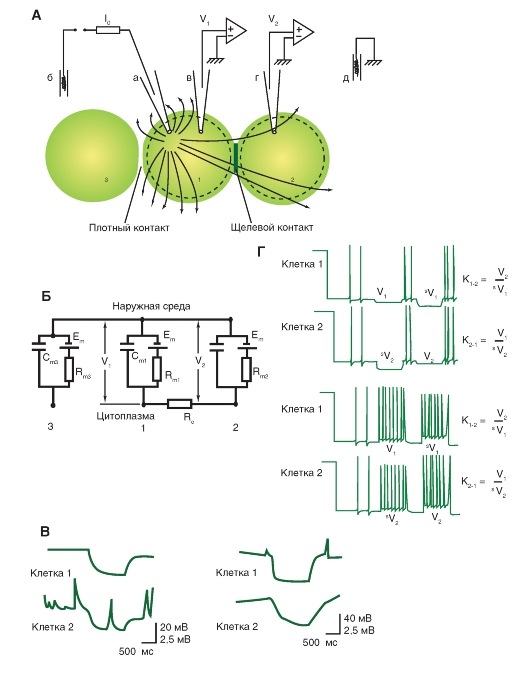
1. Электрофизиологический способ выявления щелевого контакта при помощи пары стандартных микроэлектродов, когда сравнивают электротонические потенциалы в клетке, через которую вводится ток, и в соседней клетке, куда он распространяется, что определяет коэффициент электрической связи (рис. 3-4 А).
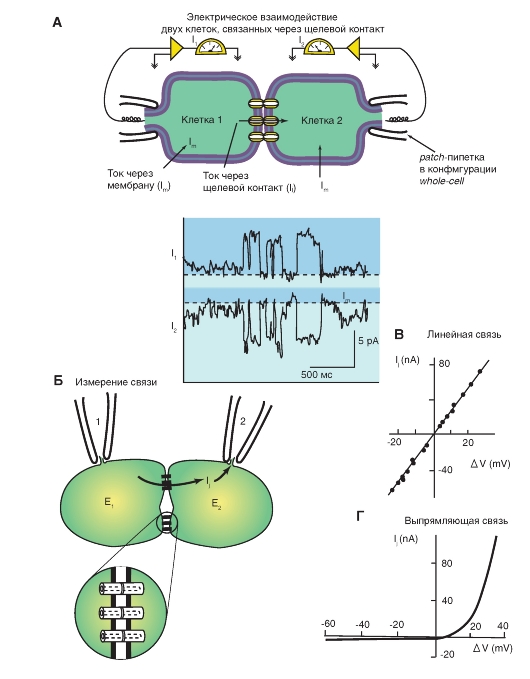
2. Электрофизиологический способ определения наличия щелевого контакта с помощью метода двойного patch-clamp и измерения I-V характеристик (рис. 3-5).
3. Метод проведения через щелевой контакт метки, когда внутриклеточно вводят меченое вещество (в большинстве случаев - флуоресцирующий краситель), для которого наружная мембрана непроницаема, и определяют возможность его перетекания в соседние клетки.
3. В последние годы для обнаружения щелевого контакта широко применяют конфокальную микроскопию с использованием меченых антител к коннексинам.
Роль щелевого контакта в проведении возбуждения в ткани
Мембрана электровозбудимых клеток потенциалуправляема, т.е. работа ионных каналов управляется потенциалом, а изменение потенциала зависит от тока, поступающего, например, через щелевой контакт от соседних клеток. При
достижении потенциала порога электровозбудимые клетки генерируют потенциалы действия, распространяющиеся, например у нейронов, по отросткам к другим нервным клеткам или эффекторным органам, у мышечных клеток запускают сокращение, а у возбудимых клеток желез управляют секрецией. Таким образом, функционирование возбудимых тканей связано с распределением потенциала и распространением тока в них. Временные и пространственные характеристики распределения потенциала и тока в тканях зависят от двух факторов: свойств электровозбудимых мембран клеток, образующих данную ткань, и геометрии ткани (как формы клеток, так и типа связей между клетками). Особенности распространения тока в цилиндрической клетке отличаются от особенностей распространения в сферической клетке. Ткань, в которой каждая клетка связана через щелевой контакт всего с одной соседней, будет отличаться от ткани, клетка которой связана с несколькими соседними. Анализ эквивалентной электрической схемы демонстрирует отличия, которые могут проявляться в электрических свойствах и функциональных особенностях ткани.
При небольших сдвигах мембранного потенциала от потенциала покоя проницаемость клеточной мембраны не меняется или меняется очень незначительно, так что ее сопротивление можно считать постоянным. Как обсуждалось ранее, обнаруженные при этом электрические свойства называют пассивными. Эти свойства имеют большое функциональное значение, так как именно они в значительной степени определяют условия возникновения возбуждения в клетке или ткани.
Рис. 3-4. Определение электрической передачи между клетками.
А - электрофизиологический способ определения наличия щелевого контакта и измерения коэффициента электротонической связи. Стрелки показывают направление электрического тока при пропускании через электроды «а» и «б». Б - эквивалентная электрическая схема клетки, имеющей коннексоны с одной соседней клеткой и не имеющей коннексоны с другой соседней.
Обозначения: 1, 2, 3 - соседние клетки. V1 и V2 - падение напряжения на клетках 1 и 2.
В - искусственная внутриклеточная гиперполяризация мембраны клетки вызывает смещение мембранного потенциала в соседней клетке, связанной щелевым контактом, и наоборот. Г - двустороннее электрическое взаимодействие нейронов. Деполяризация первой клетки вызывает смещение мембранного потенциала второй клетки, и наоборот. Аналогично гиперполяризация первой клетки вызывает смещение мембранного потенциала во второй клетке, и наоборот
Методы изучения щелевых контактов
Рассмотрим пассивные электрические свойства сферической клетки и цилиндрического волокна, имеющие одинаковые свойства поверхностной мембраны. Уже такое сравнение достаточно четко показывает роль геометрических факторов.
В клетках, форма которых близка к сферической, сопротивление цитоплазмы крайне мало по сравнению с сопротивлением мембраны самой клетки, а эквивалентная электрическая схема совпадает с эквивалентной схемой мембраны, т.е. представляет собой параллельно соединенные сопротивление и емкость. Мы рассмотрим здесь две пассивные электрические характеристики сферической клетки: входное сопротивление (Rin) и постоянную времени (τ). Входное сопротивление - отношение разности потенциалов на мембране, возникающей при пропускании через клетку постоянного тока, к величине этого тока. Для сферической клетки эта величина совпадает с сопротивлением всей ее поверхностной мембраны. При подаче прямоугольного импульса электрического тока между внутренней частью клетки и наружной средой потенциал на ее мембране лишь постепенно достигает установившегося значения, изменяясь по закону:
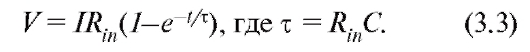
Этот вопрос детально проанализирован при обсуждении механизма пассивного электротонического потенциала.
Обсудим функциональное значение Rin. Если на клетку действует синаптический сигнал, а время его действия велико, так что можно пренебречь емкостью мембраны, то синаптический ток будет равен:
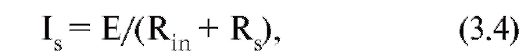
где Е - разность потенциала покоя и равновесного потенциала данного синапса; Rs - сопротивление синапса.
При влиянии одного или нескольких синапсов Rs много больше Rin и, следовательно, синаптический ток равен:

Сдвиг потенциала на мембране клетки, создаваемый этим током, равен:
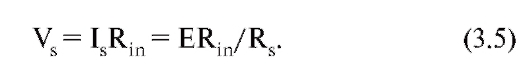
Следовательно, Vs прямо пропорционально Rin. Таким образом, если клетка имеет большие размеры и соответственно маленькое R n, то такой же синапс незначительно изменяет ее потенциал, в то время, как маленькую клетку он может возбудить. Следовательно, Rin влияет на эффективность действия синапса на клетку, определяя возможность возникновения возбуждения.
Рассмотрим теперь функциональное значение постоянной времени клетки. Обсудим только один из аспектов. Обычно для возбуждения даже маленькой клетки недостаточно активации всего одного синапса. Однако после прекращения работы синапса созданный им на мембране потенциал не спадает мгновенно. Его спад идет экспоненциально с постоянной времени τ. Другими словами, емкость клеточной мембраны постепенно разряжается через ее сопротивление. Если теперь тот же синапс будет активирован вторично, то создаваемый им сдвиг потенциала станет суммироваться с остаточным сдвигом, сохранившимся от первой активации синапса. Такой процесс называют временной суммацией. Ясно, что процесс временной суммации проходит тем эффективнее, чем больше постоянная времени мембраны. Таким образом, величина τ, в частности, определяет способность клетки к временной суммации.
Рис. 3-5. Изучение электрической передачи между клетками методом двойного patch-clamp и измерения I-V характеристик.
А - метод двойного patch-clamp. Показаны одиночные коннексоны. Поскольку потенциал клетки 1 фиксирован на -40 мВ, а потенциал клетки 2 фиксирован на -80 мВ, электрический ток течет через щелевой контакт от клетки 1 к клетке 2. Б - проведение электрического тока через коннексоны при исследованиях методом двойного patch-clamp. Коннексоны увеличены. В - линейная вольт-амперная характеристика септального электрического синапса речного рака. Г - вольт-амперная характеристика аномального выпрямления, т.е. асимметрия в проведении через гигантский электрический синапс речного рака. Примечание: для понимания разницы в вольт-амперных кривых на панелях В и Г вернитесь к описательной части рис. 3-3
Транспорт веществ через щелевой контакт
Одно из важнейших свойств щелевого контакта как транспортной системы состоит в том, что при его наличии между соседними клетками может осуществляться интенсивный диффузионный обмен гидрофильными соединениями с молекулярной массой до 1500 Да, минуя наружную среду. Через коннексоны щелевого контакта проходят неорганические ионы (Na+, K+, Cl-, I-, SO42-), сахара (мальтоза, мальтотриоза, мальтотетроза, сахароза), аминокислоты (аспарагиновая, глутаминовая, гексоглицин), нуклеотиды (гипоксантин, аденин, уридин, тиогуанин). Заметим, что многие из перечисленных веществ не способны диффундировать через наружную мембрану клеток.
Электрический синапс
Принцип работы электрического синапса показан на рис. 3-6 А. Механизм передачи сигнала через электрический синапс аналогичен механизму распространения потенциала действия по нервному волокну. В нервном волокне потенциал действия возникает за счет разности потенциалов между возбужденной и невозбужденной областями. Это вызывает открытие Na+-каналов и генерацию импульса заново на каждом последующем участке волокна. В электрическом синапсе в результате разности потенциалов между возбужденным и невозбужденным участками возникают локальные токи, и потенциал из возбужденной терминали аксона распространяется в постсинаптическую клетку, пройдя через ее мембрану и замыкаясь снаружи. Это приводит к открытию Na+-каналов в мембране постсинаптической клетки и возникновению там потенциала действия. Такой механизм работы требует низкого сопротивления пре- и постсинаптической мембран, что обеспечивается наличием коннексонов.
Основные функции электрических синапсов сводятся к следующим.
1. Быстродействие, что позволяет обеспечивать быстрые реакции организма. Например, гигантские нейроны нервных ганглиев пиявок обеспечивают быстрые сокращения продольной мускулатуры через нейронные цепи, связанные посредством электрических синапсов.
2. Синхронизация работы нейронов. В этом случае электрическая связь клеток обеспечивает их
синхронную работу. Наиболее известные системы таких пар нейронов обеспечивают одновременную работу органов двух сторон тела, например синхронное сокращение продольных мышечных волокон у пиявки.
3. Возникновение импульсных разрядов в группе электрически связанных клеток. Например, у тритона 30 нейронов, связанных электрическими синапсами, запускают реакцию избегания. При возбуждении любого из этих нейронов сразу же включаются все, что обеспечивает полноценность реакции животного.
4. Выпрямление сигнала, что обеспечивает его передачу только в одном направлении. Это хорошо продемонстрировано в мотонейронах пиявок. Односторонняя передача сигнала необходима, чтобы этот сигнал не попал в другую систему с электрической передачей.
Роль щелевого контакта в сердце
В сердечной ткани передача сигнала от клетки к клетке осуществляется только электротонически (рис. 3-6 Б) через щелевые контакты, названные применительно к ткани сердца нексусами. Это достаточно старый термин, не отражающий существа передачи электрического сигнала, мы вводим его для снятия естественных вопросов в случае чтения литературы, посвященной миокардиальной ткани.
В сердце электрическая связь показана для клеток всех его отделов, в том числе между клетками с разной дифференцировкой, например между волокнами Пуркинье и клетками рабочего миокарда. Поскольку щелевые контакты между клетками обладают низким сопротивлением относительно мембраны контактирующих клеток, возбужденная клетка может передавать сигнал невозбужденной, в результате чего эта последняя возбуждается.
Нарушение щелевых контактов между клетками ухудшает условия для распространения возбуждения, что может привести к возникновению частичных или полных блоков проведения на отдельных участках ткани и возникновению различных патологических режимов работы сердца. Однако при повреждении или гибели миокардиальных клеток происходит блокирование проводимости коннексонов между нормальной и поврежденной клетками. Это способствует резкой локализации повреждения и увеличивает жизнеспособность сердца.
Лиганд-рецепторное взаимодействие (основные определения)
Лиганд - это молекула, которая может взаимодействовать с участком связывания (местами связывания) так называемого молекулярного рецептора - специфическим участком молекулы, в основном белковой природы, встроенной, например, в мембрану клетки или находящейся в цитоплазме. Механизм связывания - либо электрическое притяжение между противоположно заряженными ионными или полярными группами лиганда и участка связывания белка, либо слабое притяжение, обусловленное вандер-ваальсовыми силами между неполярными областями двух молекул. В этом взаимодействии не участвуют ковалентные связи. Белок - молекулярный рецептор может содержать несколько участков связывания, каждый из которых специфичен в отношении определенного лиганда.
Существует два понятия, заложенные исторически в термин «рецептор». В одном случае под термином «рецептор» подразумевают нервные окончания чувствительного нейрона или специализированные нервные клетки, но в другом случае под понятием «рецептор» чаще понимают белковую структуру, рассматриваемую на клеточном уровне, которая имеет участки связывания для сигнальных молекул, например гормонов, трансмиттеров и т.д. Эту белковую структуру часто называют молекулярным рецептором.
Взаимодействие лиганда и участка связывания молекулярного рецептора лежит в основе реализации множества функций как самих белков, так и клеток в целом. Для реализации подобного механизма связывания необходимо, чтобы лиганд находился практически рядом с участком связывания белка, поскольку в противном случае сила электрического притяжения между противоположно заряженными областями на участке связывания молекулярного рецептора и лиганде будет мала. Кроме того, эта сила значительно уменьшается по мере увеличения расстояния между молекулярным рецептором и лигандом. Например, слабые ван-дер-ваальсовы силы действуют только между неполярными группами, расположенными очень близко друг к другу. Эта близость достигается тем, что форма лиганда комплементарна форме участка связывания. Образно можно сказать, что лиганд подходит к участку связывания молекулярного рецептора, как ключ к замку.
Взаимодействие лиганда с участком связывания молекулярного рецептора может быть строго специфичным, и, следовательно, участок связывания
может связывать только один тип лиганда. Эта способность участка связывания молекулярного рецептора взаимодействовать только со строго специфическим лигандом называется химической специфичностью, поскольку участок связывания определяет(ся) тип(ом) химической связи.
Хотя некоторые участки связывания имеют химическую специфичность, которая позволяет им связывать только один тип лиганда, другие участки менее специфичны и, таким образом, способны связывать ряд родственных лигандов, поскольку фрагмент каждого такого лиганда может быть комплементарен форме участка связывания. По этому принципу можно выделить участки связывания с высоким сродством к лиганду, с промежуточным сродством и низким сродством.
Молекулярные рецепторы имеют различные аминокислотные последовательности и, соответственно, имеют, различную конфигурацию. Следовательно, они имеют участки связывания различной формы, каждый из которых имеет свою собственную химическую специфичность.
Сила связывания лиганда с участком связывания белка известна как его аффинность или сродство. В зависимости от того, с какой стороны описывают афинность (с позиций лиганда или с позиций участка связывания), говорят либо об аффинности лиганда по отношению участку связывания рецептора, либо об аффинности участка связывания по отношению к лиганду. В общем случае говорят об аффинности лиганд-рецепторного взаимодействия.
Аффинность лиганда по отношению к участку связывания определяет, насколько вероятно то, что связанный лиганд покинет поверхность белка и вернется в несвязанное состояние.
Другим фактором, определяющим процент насыщения участков связывания, является аффинность участка связывания к лиганду (в отличие от афинности лиганда к участку связывания).
Участок связывания, который прочно связывает лиганд, называют участком связывания с высоким сродством (высокоаффинным участком связывания - high-affinity binding site), а тот участок, с которым лиганд связывается слабо, называют участком связывания с низким сродством (низкоаффинным участком связывания - low-affinity binding site). Кроме того, известны участки связывания с промежуточной аффинностью (intermediate-affinity binding site).
Обычные столкновения между молекулами, находящимися в растворе, и рецептором, содержащим связанный лиганд, могут привести к вытеснению непрочно связанного лиганда. Мерой
сродства участка связывания к лиганду служит концентрация лиганда, необходимая для обеспечения 50% насыщения; чем более низкая концентрация лиганда необходима для связывания его с половиной центров связывания, тем больше афинность участка связывания к лиганду.
Аффинность и химическая специфичность представляют собой два основных свойства участков связывания. Химическая специфичность зависит только от формы участка связывания, а аффинность зависит от силы притяжения между рецептором и лигандом.
Между лигандами, находящимися в растворе, и соответствующими участками связывания белка быстро достигается равновесие, так что в любой момент некоторые свободные лиганды становятся связанными со свободными участками связывания, а некоторые связанные лиганды освобождаются от участков связывания. Для описания этой ситуации применяют понятие насыщение (сатурация), определяющее совокупность участков связывания, содержащих связанный лиганд в данный момент времени. Когда заполнены все участки связывания, говорят о 100% насыщении. Когда лиганд связан с половиной имеющихся участков связывания, система насыщена на 50% и т.д. Единичный участок связывания также будет насыщен на 50%, если он содержит связанный лиганд в течение 50% времени.
Процент насыщения участков связывания зависит и от концентрации свободного лиганда в растворе, и от аффинности участка связывания к лиганду. И, как и степень выраженности биологического эффекта, он будет увеличиваться с увеличением количества занятых лигандом участков связывания до тех пор, пока все они не будут заполнены. Дальнейшее увеличение концентрации лиганда не приведет ни к какому результату, поскольку все участки связывания уже заняты.
В ряде случаев с определенными участками связывания наблюдаеться конкуренция между лигандами за один и тот же участок связывания.
Например, если в растворе присутствуют два конкурирующих лиганда «А» и «Б», то увеличение концентрации лиганда «А» приведет к увеличению количества связанного лиганда «А», уменьшая, таким образом, количество участков, доступных для лиганда «Б», и снижая количество связанного лиганда «Б». Многие лекарства обеспечивают свое действие путем конкуренции за участки связывания с эндогенными лигандами организма. Занимая связывающий участок, лекарство уменьшает количество природного лиганда, который может быть связан с этим центром.
Лиганды могут быть агонистами или антагонистами.
Агонист - это лиганд, который взаимодействует с участком связывания и изменяет состояние молекулярного рецептора, заканчивающееся биологическим ответом. Например, в химическом синапсе агонистами называют вещества, действующие подобно трансмиттеру.
Обычные (классические) агонисты (conventional agonists) усиливают активность рецептора, тогда как обратные агонисты (inverse agonists) уменьшают эту активность.
Основной, или ортостерический участок связывания
Экзогенные агонисты могут действовать посредством связывания с тем же самым участком связывания, как эндогенные агонисты (primary - основной, или orthosteric - ортостерический участок связывания) или реже с другой частью макромолекулы рецептора (аллостерический, или аллотопический участок связывания). Агонисты этой второй категории иногда называют аллостерическими (аллотопическими) активаторами, или аллостерическими (аллотопическими) агонистами.
Некоторые агонисты (например, глутамат) могут быть эффективны только в присутствии другого лиганда (например, глицина в случае глутамата), который взаимодействует с другим участком связывания на макромолекуле рецептора. В этих условиях глутамат представляет собой первичный агонист, а глицин выступает как ко-агонист.
Наряду с агонистами существуют химические соединения, которые хотя и взаимодействуют с участком связывания на макромолекуле рецептора, но не могут открыть ионный канал. Занимая участок связывания, они препятствуют рецепции естественного трансмиттера и возникновению его эффекта, поскольку действуют на ту же самую макромолекулу рецептора, что и агонист. Такие вещества называют антагонистами.
Антагонизм может быть химическим или функциональным.
Химический антагонизм - это результат наличия в среде антагониста и способности участка связывания белка взаимодействовать с ним. Функциональный антагонизм происходит на участках клетки, не имеющих отношения к рецептору, опосредующему ответ агониста.
Функциональный антагонизм может осуществляться с помощью разных механизмов в виде непрямого и физиологического антагонизма. Непрямой антагонизм представляет собой конкуренцию антагониста и агониста за место
связывания с лигандом в промежуточной макромолекуле, которая участвует в осуществлении агонистом его биологической реакции. Связывание этого участка на промежуточной молекуле с антагонистом не дает возможности осуществиться этой реакции. При физиологическом антагонизме действие одного агониста обычно через другой рецептор оказывает противоположный эффект по отношению к эффекту, свойственному оригинальному агонисту.
Поскольку белки вовлечены практически во все процессы, происходящие в клетке, механизмы, контролирующие эти функции, сконцентрированы на регуляции активности белков. Известно два способа регуляции активности белков: (1) посредством изменения конформации молекулы белка, что влияет на связывание лиганда, и (2) через регуляцию синтеза и деградации белков, что определяет типы белков и их количество в клетке. В контексте настоящего материала представляется важным коротко обсудить первый тип регуляции - контроль за конформацией молекулы белка.
Поскольку конформация белков зависит от электрического притяжения между заряженными или поляризованными группами в различных областях белка, изменение в распределении заряда вдоль полипептидной цепи или полярности молекул, непосредственно окружающих его, изменяет конформацию белка. Известны два механизма, используемых клетками для селективного изменения конформации определенных белков. Это аллостерическая и ковалентная модуляция.
Прежде всего, обсудим аллостерическую модуляцию. При связывании лиганда с белком силы, притягивающие лиганд к белку, изменяют его конформацию. Например, когда лиганд приближается к участку связывания, эти силы могут вызвать изменение формы поверхности участка связывания и придавать форму, наиболее соответствующую форме поверхности лиганда. Более того, изменение формы участка связывания приводит к изменению формы других областей белка. Таким образом, если белок содержит два участка связывания, нековалентное связывание лиганда с одним из участков может изменить форму второго участка связывания и характеристики связывания этого второго участка. Такое явление названо аллостерической модуляцией, а такие белки - аллостерическими.
Один участок связывания аллостерического белка, названный активным центром (функциональным центром), взаимодействует со своим лигандом и обеспечивает физиологическую активность белка. Однако для этого необходимо, чтобы
предварительно другой участок связывания, названный регуляторным центром, соединился со своим лигандом и изменил форму активного центра. Лиганд, который связывается с регуляторным участком, называют модуляторной молекулой.
Таким образом, модуляторная молекула (иначе аллостерический или атопический модулятор) представляет собой лиганд, увеличивающий или уменьшающий действие (основного, или ортостерического) агониста или антагониста, соединяясь с другим (аллостерическим, или аллотопическим) местом на рецепторной макромолекуле, т.е. с регуляторным центром.
Среди аллостерических (аллотопических) модуляторов выделяют несколько видов.
1. Аллостерические (аллотопические) усилители (allosteric enhancers) - это модуляторы, которые усиливают аффинность ортостерических лигандов и/или эффективность агониста, не создавая никакого собственного эффекта.
2. Аллостерические (аллотопические) антагонисты - это модуляторы, которые уменьшают аффинность ортостерических лигандов и/или эффективность агонистов.
3. Аллостерические (аллотопические) агонисты, или аллостерические (аллотопические) активаторы - это лиганды, которые способны опосредовать активацию рецептора их собственным путем, связываясь с центром распознавания на макромолекуле рецептора, отличающийся от основного (ортостерического) участка связывания.
4. Нейтральные аллостерические (аллотопические) лиганды взаимодействуют с аллостерическим участком связывания без влияния на связывание или функции ортостерических лигандов, но могут все еще блокировать действие других аллостерических модуляторов, которые действуют через тот же самый аллостерический участок связывания.
В некоторых аллостерических белках связывание молекулы модулятора с регуляторным центром обеспечивает включение, а в других - выключение активного центра. Кроме того, связывание модуляторной молекулы может уменьшать или увеличивать сродство активного центра к лиганду. Взаимодействие между регуляторными и активными центрами белка - это один из способов регуляции. Существует и другой способ, когда активные центры определенных белков могут влиять друг на друга. Обычно эти белки состоят более чем из одной полипептидной цепи, соединенной вместе благодаря электрическому притяжению между отдельными цепями. При этом на каждой цепи может быть только один связывающий участок,
служащий активным центром. Однако связывание лиганда с активным центром одной из цепей может приводить к изменению активных центров, расположенных на других цепях. Явление взаимодействия между активными центрами в мультимерном белке (т.е. в белке, содержащем более чем одну полипептидную цепь) называют кооперативностью. Кооперативность может обеспечивать прогрессивное увеличение аффинности для связываемого лиганда по мере того, как все большее количество участков белка связывают лиганд.
Синтопическое взаимодействие (syntopic interaction) - это взаимодействие между лигандами, которые связываются с тем же самым центром распознавания или с местами распознавания, которые перекрываются, на рецепторной макромолекуле. Этот термин чаще всего применяют при описании конкурентоспособных взаимодействий между лигандами, которые связываются с основным (ортостерическим) участком связывания на рецепторе. Но синтопическое взаимодействие может также происходить между различными лигандами, совместно использующими одинаковый центр распознавания (например, общий аллостерический центр) где-нибудь на макромолекуле рецептора.
Аллостерическое (аллотопическое) взаимодействие - это взаимодействие между лигандами, которые связываются с отличающимися неперекрывающимися местами распознавания на макромолекуле рецептора. Термины «синтопический» и «аллотопический» рекомендованы для того, чтобы различать взаимодействия, происходящие в общем (том же самом) месте, по сравнению с взаимодействием между различными местами соответственно. Термин «аллотопический» может быть использован равноценно с термином «аллостерический» при описании перекрестного взаимодействия между различными участками на макромолекуле рецептора. Термин «синтопический» должен быть ограничен, определяя взаимодействия в общем (том же самом) месте, и не должен использоваться заменяемо с термином «ортостерический». Последний термин относится только к основному месту распознавания на рецепторе (месту связывания эндогенного агониста).
Аллостерический переход (allosteric transition) - это изомеризация макромолекулы рецептора с большим числом конформационных состояний. Различные авторы использовали термин «аллостерический» в различных ситуациях. Первое
общее применение термина должно описать любой механизм, включающий изомеризацию рецептора с двумя или более конформационными состояниями, каждое из которых может иметь различную аффинность к данному лиганду. Второе общее использование термина должно описывать взаимодействие между двумя топографически отличающимися местами распознавания на макромолекуле рецептора в данном конформационном состоянии. Чтобы применять оба варианта использования терминов, рекомендуют, чтобы термин «аллостерический переход» применяли при описании механизмов изомеризации рецептора. Термин «аллостерическое (или аллотопическое) взаимодействие» необходимо использовать при описании перекрестного взаимодействия между лигандами, связывающимися с неперекрывающимися местами распознавания на макромолекуле рецептора.
Ковалентная модуляция - это второй способ изменить форму и, таким образом, активность белка. Ковалентная модуляция заключается в ковалентном присоединении заряженных химических групп к некоторым боковым остаткам аминокислот полипептидной цепи. В русскоязычной литературе это явление обычно называется «ковалентной модификацией».
В большинстве случаев к белку с помощью реакции фосфорилирования ковалентно прикрепляется фосфатная группа, несущая отрицательный заряд. В этом случае фосфатная группа переносится с одной молекулы на другую. Фосфорилирование одного из боковых остатков определенной аминокислоты в белке приводит к появлению в этой области отрицательного заряда, который обеспечивает изменение его конформации. Если изменение конформации влияет на участок связывания, это приводит к изменению свойств участка связывания. Хотя такой механизм значительно отличается от описанного выше, эффекты, производимые ковалентной модуляцией, подобны эффектам аллостерической модуляции. То есть при ковалентной модуляции функциональный участок связывания может быть включен или выключен либо может быть изменена его аффинность для лиганда. Напомним, что в отличие от аллостерической модуляции, которая обеспечивается нековалентным связыванием модуляторной молекулы, ковалентная модуляция требует химической реакции, в которой образуется ковалентная связь.
Химический синапс
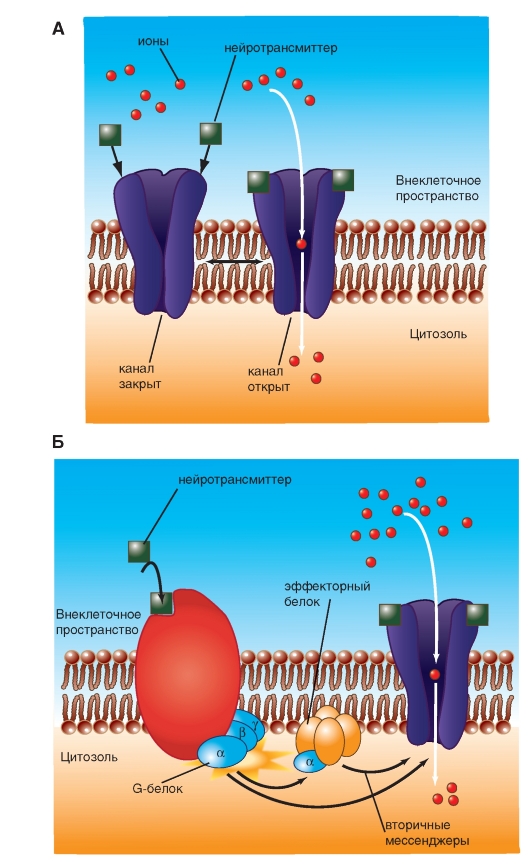
Химический синапс выполняет задачу передачи электрического сигнала от пресинаптического нейрона на постсинаптическую клетку. Для этого существует комплекс механизмов, которые в ответ на изменение потенциала мембраны в пресинаптической клетке приводят к изменению потенциала мембраны постсинаптической клетки. Итак, электрический сигнал пришел на пресинаптическую мембрану и вызвал ее деполяризацию. В результате этого произошло освобождение из везикул пресинаптической зоны специфических переносчиков, называемых нейротрансмиттерами, или медиаторами. Эти химические соединения диффундируют к постсинаптической области и открывают на постсинаптической мембране ионные каналы. Так как потенциал покоя мембраны каждой клетки определяется равновесием между различными ионными токами, оно может нарушаться, если определенный вид ионов вдруг начнет усиленно диффундировать через клеточную мембрану по электрохимическому градиенту. Если, например, мембрана клетки станет проницаемой для ионов Na+, то эти ионы по электрохимическому градиенту начнут входить в клетку. В результате происходит деполяризация мембраны клетки. Именно это и происходит на постсинаптической мембране, в чем заключается важный принцип: изменение возможности проводимости определенных ионов через постсинаптическую мембрану служит основой функции химических синапсов. Ионные токи изменяют потенциал мембраны постсинаптической клетки, поэтому такие изменения потенциала называют постсинаптическими потенциалами. Так как в формировании потенциала покоя мембраны участвует большое число ионов, равновесие может нарушаться посредством изменений проводимости различных ионов. Так, например, при дополнительном выходящем токе ионов K+ или при входящем токе ионов Cl- может происходить гиперполяризация, которая является противоположностью возбуждения. Т.е. определенные химические процессы на постсинаптической мембране могут посредством гиперполяризации вызывать и торможение нейрона. В этой возможности можно видеть существенное эволюционное преимущество химических синапсов.
Совершенно очевидно, что представленные химические процессы могут быть модифицированы посредством других химических веществ. Это происходит при помощи независимых соединений - нейромодуляторов.
С другой стороны, химические процессы в синапсе открывают широкие возможности для фармакологической регуляции и оказываются предметом многочисленных исследований с целью поиска эндогенных соединений, способных модифицировать в заданных направлениях синаптическую передачу. И действительно, многие медикаменты реализуют свое фармакологическое действие путем влияния на синаптическое проведение. Это относится не только к психотропным и наркотическим веществам. Многие другие, например, (гипотензивные) средства понижающие артериальное давление, также действуют опосредованно через синапсы. Кроме того, многие яды растительного и животного происхождения направленно действуют на химический синапс.
Необходимо подчеркнуть, что нейротрансмиттеры, наряду с их прямыми задачами, имеют также большое значение в передаче информации: во время нейроонтогенеза (зародышевого и раннего развития до года) они играют важнейшую роль при образовании связей в церебральных структурах. Так как большинство соединений с наркотическим действием влияет на функцию нейротрансмиттеров, то их потребление в том или ином виде матерью во время беременности или грудного вскармливания имеет негативные последствия для нейроонтогенеза ребенка.
Почти все синаптические терминали освобождают не один трансмиттер, но одновременно с ним целый ряд биологически активных соединений. Примерами таких сопутствующих соединений служат АТФ, ГТФ, окситоцин, вещество Р, энкефалин и др. Их называют котрансмиттеры. Многие трансмиттеры, например, глицин и ГАМК или глицин и глутамат могут присутствовать в везикулах одновременно. Котрансмиттеры могут модулировать синаптические процессы. Накапливаясь в везикулах, они обладают собственной кинетикой освобождения, например освобождение только при значительной величине пресинаптического потенциала.
Рис. 3-6. Химический синапс и принцип его работы
Аксональный транспорт
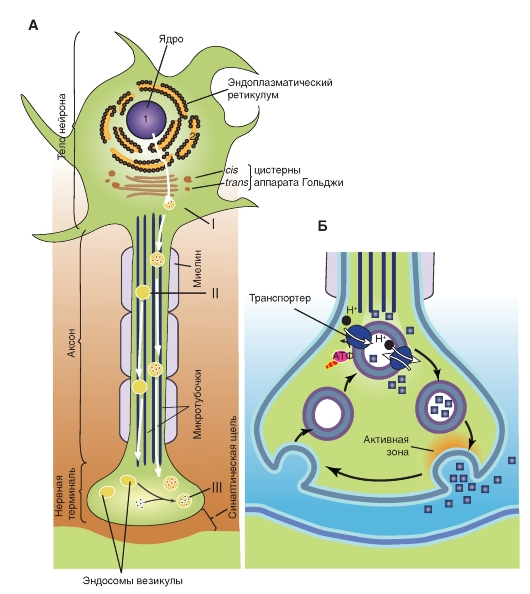
Мембранные и цитоплазматические компоненты, которые образуются в биосинтезирующем аппарате сомы и проксимальной части дендритов, должны распределяться по аксону (особенно важно их поступление в пресинаптические структуры синапсов), чтобы восполнить потерю элементов, подвергшихся высвобождению или инактивации. Однако многие аксоны слишком длинны, чтобы материалы могли эффективно перемещаться из сомы к синаптическим окончаниям путем простой диффузии. Эту задачу выполняет особый механизм - аксональный транспорт.
Существуют несколько типов аксонального транспорта. Окруженные мембранами органоиды и митохондрии транспортируются с относительно большой скоростью посредством быстрого аксонального транспорта. Вещества, растворенные в цитоплазме (например, белки), перемещаются с помощью медленного аксонального транспорта. У млекопитающих быстрый аксональный транспорт имеет скорость 400 мм/сутки, а медленный аксональный транспорт - около 1 мм/сутки. Синаптические пузырьки могут передвигаться с помощью быстрого транспорта из сомы мотонейрона спинного мозга человека к нервно-мышечному соединению стопы примерно за 2,5 суток. Сравним: доставка на такое же расстояние многих растворимых белков происходит примерно за 3 года.
Для аксонального транспорта требуется затрата метаболической энергии и присутствие внутриклеточного Са2+. Элементы цитоскелета (точнее, микротрубочки) создают систему направляющих тяжей, вдоль которых передвигаются окруженные мембранами органоиды (рис. 3.7). Эти органоиды прикрепляются к микротрубочкам аналогично тому, как это происходит между толстыми и тонкими филаментами волокон скелетных мышц; движение органоидов вдоль микротрубочек запускается ионами Са2+.
Аксональный транспорт осуществляется в двух направлениях. Транспорт от сомы к аксональным терминалям, называемый антероградным аксональным транспортом, восполняет в пресинаптических окончаниях запас синаптических пузырьков и ферментов, ответственных за синтез нейромедиатора. Транспорт в противоположном направлении - ретроградный аксональный транспорт, возвращает опустошенные синаптические
пузырьки в сому, где эти мембранные структуры деградируются лизосомами.
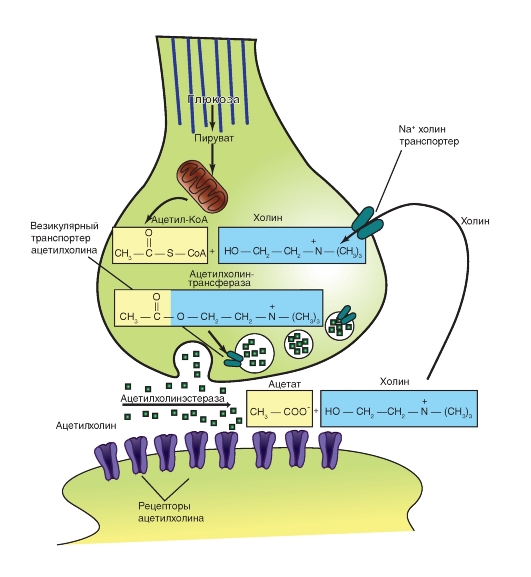
Высокая, в ряде случаев, потребность в молекулах трансмиттера вызывает, как правило, синтез трансмиттера на месте, то есть непосредственно в пресинаптическом окончании. Разумеется, необходимые для синтеза ферменты синтетизируются в теле и при поморщи аксонального транспорта доставляются в синаптические окончания. Поскольку пути синтеза трансмиттера зависят от вида, рассмотрим их на примере обсуждаемого выше холинэргического синапса. Другие трансмиттерные вещества имеют, разумеется, свои собственные пути синтеза.
АЦХ образуется с помощью холин-ацетилтрансферазы путем ацетилирования холина, причем остаток уксусной кислоты образуется из ацетилкоэнзима-А. Холин широко распространен в организме и включается в нервное окончание при помощи двух различных механизмов транспорта, из которых один обладает очень высоким сродством (так называемый высокоаффинный захват). Этот путь блокируется при помощи гемихолина. Если нервное окончание деполяризовано (активировано), то захват холина ускоряется. АЦХ, синтетизированный в цитоплазме, активно транспортируется и накапливается в синаптических везикулах. Это приводит к очень высокой концентрации АЦХ от 0.2 М до 0.6 М, что соответствует нескольким тысячам молекул на везикулу. В целом можно сказать, что низкомолекулярные трансмиттеры накапливаются в маленьких (40-50 нм) электронно-оптически прозрачных везикулах, тогда как большие (>70 нм) электронно-оптически плотные везикулы содержат белки и пептиды. Эти соединения образуются не в пресинаптическом окончании, а в теле клетки и попадают при помощи аксонального транспорта в пресинаптическое окончание.
Теперь необходимо отметить, что хотя синапсы называются на основании названия их главного трансмиттера (например, холинэргический), почти все синаптические терминали освобождают не только один единственный трансмиттер, но одновременно с ним целый ряд биологически активных соединений - ко-трансмиттеров. Примерами таких сопутствующих соединений являются АТФ, ГТФ, окситоцин, вещество Р, энкефалин, и другие. Ко-трансмиттеры могут модулировать синаптический процесс.
Рис. 3-7. Синтез и рецикл синаптических везикул и их содержимого.
А - Биосинтез нейротрансмиттеров.
I. Везикулы, предшественники пептидных трансмиттеров и ферменты синтезируются в теле нейрона и высвобождаются из аппарата Гольджи.
II. Везикулы перемещаются по аксону с помощью быстрого аксонального транспорта. Пептидные трансмиттеры уже заключены в некоторые везикулы.
III. Непептидные нейротрансмиттеры синтезируются и транспортируются в везикулы непосредственно в нервных окончаниях
Б - Экзоцитоз (высвобождение визикул с медиатором)
Механизм высвобождения трансмиттера
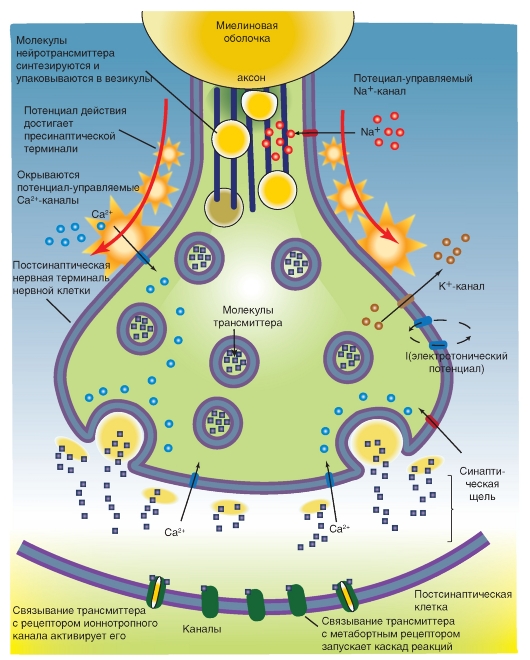
Серия потенциалов действия «пробегает» вдоль аксона, достигает нервного окончания и деполяризует пресинаптическую зону. Во время этой деполяризации в нервном окончании возникает не только входящий ток Na+, как это происходит в мембране по всей длине аксона. Мембрана окончания аксона имеет и потенциал-управляемые Ca2+- каналы, через которые во время деполяризации, вызванной пришедшим потенциалом действия, ионы Ca2+ проникают в синаптическое окончание. В состоянии покоя очень низкая концентрация Ca2+ (приблизительно 10-7 М) повышается на несколько порядков. Одновременно ионы Ca2+ дополнительно выходят из эндоплазматического ретикулума. В каждом случае требуется некоторое время (приблизительно 0,2 мс), прежде чем цитоплазматический уровень свободного кальция (кальциевое зеркало) достигнет необходимых действенных концентраций. В синаптическом окончании в зоне пресинаптической мембраны расположено большое число синаптических пузырьков (везикул). Их мембраны, подобно клеточной мембране, состоят из фосфолипидного бислоя и белков. Эти везикулы заполнены жидкостью, в составе которой содержится химическое вещество - трансмиттер, благодаря которому осуществляется синаптическая передача. Трансмиттер «переносит» возбуждение от пресинаптической мембраны на постсинаптическую мембрану, откуда и берется его название.
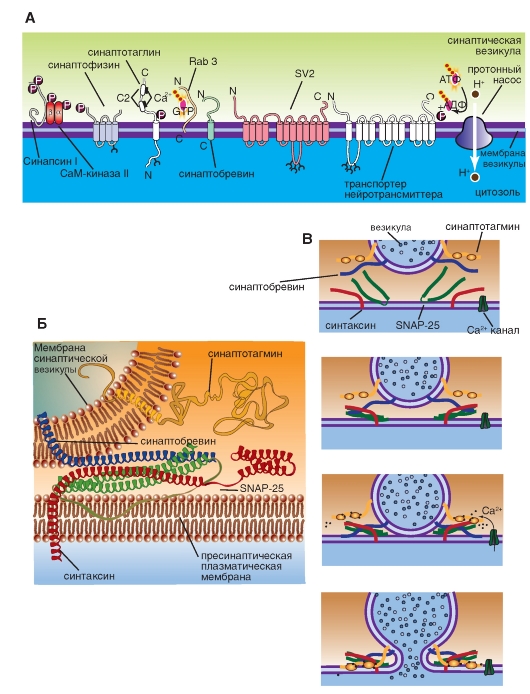
Синаптические везикулы фиксируются большей частью к цитоскелету посредством протеина синапсина (synapsin), локализованного на цитоплазматической поверхности каждой везикулы, к протеину спектрину (spectrin), расположенному на волокнах F-актина цитоскелета, образуя тем самым трансмиттерный резервуар. Меньшая часть везикул также связана с внутренней стороной пресинаптической мембраны с помощью
специфических протеинов. Это взаимодействие осуществляется посредством белка мембраны везикулы - синаптобревина (synaptobrevin) и белка пресинаптической мембраны синтаксина (syntaxin). Именно эти везикулы непосредственно поставляют трансмиттер для очередного выброса.
Если потенциал действия достиг пресинаптической области, и в пресинаптическом окончании концентрация Ca2+ поднялась до необходимого уровня, то происходят два процесса. Во-первых, на уже связанных с пресинаптической мембраной везикулах, по существу, лежащих на ней, Ca2+ связывается с протеином, входящим в мембрану везикулы - синаптотагмином (synaptotagmin). Это приводит к тому, что мембрана везикулы раскрывается. Одновременно комплекс полипептида, называемого синаптофизином (synaptophysin), сливается с неидентифицированными протеинами пресинаптической мембраны. При этом возникает пора, через которую осуществляется регулируемый экзоцитоз, т.е. секреция трансмиттера в синаптическую щель, причем этот процесс регулирует еще один протеин везикулы - rab3А. В одной везикуле сосредоточено примерно 6000-8000 молекул трансмиттера, и это именно то наименьшее количество трансмиттера, освобожденного в синаптическую щель, которое называется 1 квант трансмиттера. В совокупности локальная концентрация трансмиттера в синаптической щели после его освобождения относительно высока и лежит в миллимолярном диапазоне.
Во-вторых, повышенный уровень ионов Ca2+ в пресинаптическом окончании активирует Ca2+-кальмодулин-зависимую протеинкиназу II (СаМ-киназа II). В пресинаптическом окончании этот фермент фосфорилирует синапсин. После этого нагруженные трансмиттером везикулы освобождаются от цитоскелета и перемещаются на пресинаптическую мембрану для осуществления дальнейшего цикла.
Рис. 3-8. Высвобождение трансмиттеров.
А - белки, встроенные в мембрану везикулы. Б - взаимодействие везикулярных белков и белков пресинаптической мембраны. В - механизм высвобождения трансмиттера из везикулы.
Б - экзоцитоз (высвобождение везикул с медиатором)
Преобразование трансмиттера
Трансмиттер может быть либо быстро химически расщеплен на неактивные компоненты, либо удален из синаптической щели путем высокоселективного обратного захвата в пресинаптическое окончание. В центральной нервной системе клетки глии могут также захватывать трансмиттер. Кроме того, на возбуждающих глутаматергических синапсах синаптическая область плотно покрыта отростками астроцитов. Какой из инактивирующих механизмов играет в синапсе большую роль - зависит от типа синапса.
Так, АЦХ, исключительно быстро гидролизуется АЦХ-эстеразой. Возникают ацетат (остаток ацетила) и холин. Последний, благодаря высокоспецифичному механизму транспорта, опять захватывается пресинаптическим окончанием и вновь используется для образования АЦХ. На этом уровне возможна фармакологическая регуляция холинергических синапсов. АЦХ-эстеразу можно ингибировать рядом соединений, например эзерином ( physostigmin). Продолжительность постсинаптического действия выброшенного АЦХ при этом удлиняется. Терапевтически это используется в тех случаях, когда для устранения мышечной релаксации после наркоза конкурентные блокаторы типа кураре хотят вытеснить с помощью высокой концентрации АЦХ. Таким способом можно очень быстро восстановить мышечный тонус.
Пресинаптические окончания благодаря описанному механизму обратного захвата (реаптейка)
захватывают и возвращают либо фрагменты трансмиттера (например, холин), либо всю молекулу трансмиттера (например, серотонин). Для этого в пресинаптической мембране находятся специфические протеины - транспортеры. Данный механизм обратного захвата фрагментов или всей молекулы трансмиттера, в свою очередь, может находиться опять под влиянием многих синапсов. Ряд психофармакологических веществ используют этот синаптический механизм в качестве мишени. Так, например, антидепрессант имипрамин блокирует обратный захват катехоламинов адренергическими синапсами. Тем самым повышается эффективность действия трансмиттера. Группа таких веществ называется ингибиторами обратного захвата, их часто применяют в психофармакологии.
Мембрана везикулы после освобождения трансмиттера также рециклируется. Она эндоцитотически поступает в пресинаптическое окончание и используется для вновь образуемого связывания везикул.
Во многих синапсах рецепторы для трансмиттера есть не только в постсинаптической мембране, но также и в пресинаптической. Это так называемые ауторецепторы. В зависимости от типа синапса, при взаимодействии с ними трансмиттера его высвосвобождение либо усиливается, либо прекращается (позитивное или негативная обратная связь). На ауторецепторы может оказывать влияние также входящий ток Ca2+ в пресинаптическом окончании.
Рис. 3-9. Расщепление, удаление и обратный захват трансмиттера на примере ацетилхолина
Типы химических синапсов
У части синапсов ионный канал, который при действии лиганда, т.е. благодаря связыванию с молекулой трансмиттера, открывается (каналы, управляемые лигандами), называется ионотропным рецептором (рис. 3-10 А).
Рецепторы, в которых открытие ионного канала связано с подключением других химических процессов, называют метаботропными рецепторами. На метаботропных рецепторах лиганд открывает ионный канал не прямо, а опосредованно, через вторичные мессенджеры (рис. 3-10 Б). У большинства синапсов рецепторный белок не представляет собой ионный канал, но при связывании с ним молекул трансмиттера возникает каскад химических реакций, в результате которых соседствующие ионные каналы открываются при помощи вторичных мессенджеров. Речь идет о метаботропных рецепторах.
Хорошим примером и ионотропного, и метаботропного синапса служит холинергический синапс, у которого трансмиттером служит АЦХ. У холинергических синапсов два типа рецепторов: АЦХ-рецепторы, чувствительные дополнительно
к никотину (никотиновый АЦХ-рецептор), и АЦХ-рецепторы, чувствительные дополнительно к мускарину (мускариновый АЦХ-рецептор). Первый является ионотропным, второй - метаботропным.
У мускариновых синапсов и место связывания с трансмиттером, и ионный канал локализованы не в самом трансмембранном белке. Эти рецепторы связаны непосредственно с G-белком. Такая структура дает дополнительные возможности для влияния на функцию синапсов. С одной стороны, для таких рецепторов также существуют конкурентные блокаторы. У мускариновых синапсов это, например, атропин, - алкалоид, содержащийся в растениях семейства пасленовых. Очевидно, что синаптическая передача, в которой используются такие механизмы, очень медленная. До изменения проводимости мембраны должны произойти многие химические реакции. Время передачи лежит в диапазоне от 100 мс. К мускариновым синапсам относятся постганглионарные, парасимпатические и ауторецепторы центральной нервной системы. Мускариновые рецепторы, образованные от аксонов маутнеровских клеток nucleus basalis (Meynert cells), управляют особыми процессами обучения.
Таблица 3-1. Перечень соединений, влияющие на никотиновые, мускариновые и холинергические синапсы
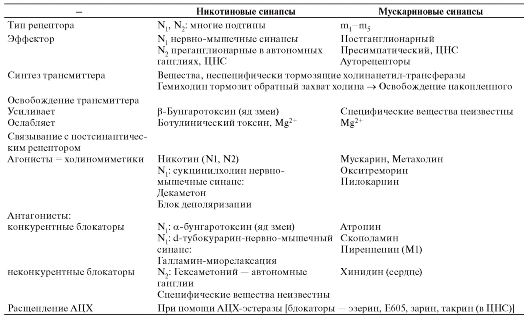
Рис. 3-10. Ионотропные и метаботропные синапсы
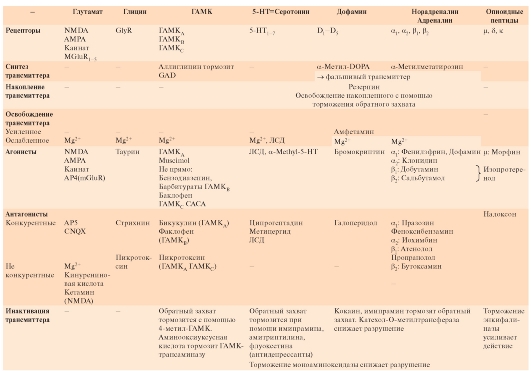
Типы трансмиттеров и механизмы их действия
Ацетилхолин. Является медиатором для всех двигательных нейронов, многих интернейронов ЦНС, а также нейронов парасимпатической нервной системы. Существует 2 типа рецепторов ацетилхолина: АЦХ-рецепторы, чувствительные дополнительно к никотину: никотиновый АЦХрецептор и, соответственно, никотиновый АЦХ (нАЦХ) синапс, и АЦХ-рецепторы, чувствительные дополнительно к мускарину - мускариновый АЦХ-рецептор и, соответственно, мускариновый (мАЦХ) АЦХ синапс. АЦХ синапс с никотиновым рецептором являются ионотропными, а АЦХ синапсы с мускариновым рецептором являются метаботропными.
Глутамат в синапсах выполняет функцию трансмиттера и ко-трансмиттерами (может присутствовать одновременно с другими трансмиттерами, например с глицином). Глутамат в мозге является важнейшим трансмиттером для возбуждающих синапсов. Синапсы, использующие в качестве трансмиттера глутамат, находятся приблизительно на 50% нейронов центральной нервной системы. Такие синапсы образуют важнейшие возбуждающие входы систем мозга к коре большого мозга. Они принимают участие в процессах обучения. Глутамат прямо открывает неспецифический ионный канал для катионов.
Глицин служит трансмиттером тормозных синапсов и действует как нейромодулятор. Глицин предназначен для выполнения специфических ингибиторных задач. Большинство клеток Реншоу, через которые тормозятся α-мотонейроны спинного мозга, выбрасывают глицин. Глициновые рецепторы открывают каналы для ионов Cl-, что способствует возникновению так называемых тормозных постсинаптических потенциалов (тормозных потенциалов синаптической пластинки - ТПСП). Синаптическое действие заканчивается с помощью механизма обратного захвата глицина.
В центральной нервной системе глицин играет также и роль нейромодулятора, например, в гиппокампе NMDA-рецепторы, описанные в предыдущем разделе, испытывают модулирующее влияние со стороны глицина.
γ-Аминомасляную кислоту выбрасывают в качестве трансмиттера многие тормозные интернейроны, имеющиеся практически во всех отделах центральной нервной системы, и аксоны клеток Пуркинье мозжечка. ГАМК оказывает тормозное действие на постсинаптические структуры. Существует по меньшей мере два
различных постсинаптических механизма, которые запускаются благодаря различным рецепторам (ГАМКА и ГАМКС с одной стороны; ГАМКВ с другой стороны).
Серотонин (5-hydroxytryptamin) - биогенный амин, широко распространенный в ЦНС. В мозге его особенно много в области тектума. Оттуда наблюдается много проекций в лимбическую систему, к таламусу и гипоталамусу, в передний мозг, в мозжечок и в спинной мозг. По этим путям, очевидно, осуществляется контроль многих нейрональных функций.
На постсинаптической мембране были обнаружены различные серотониновые рецепторы, которые большей частью, благодаря вторичным мессенджерам, открывают каналы для ионов К+ и Са2+. Действие трансмиттера заканчивается включением механизма обратного захвата пресинаптической областью.
Гистамин - моноамин, выступающий в качестве трансмиттера. Особенно важную роль он играет как модулятор в мозге грудных детей. Гистаминергические нейроны у взрослых находятся в заднем гипоталамусе и связаны со многими участками мозга, где они оказывают влияние на состояние бодрствования, мышечную активность, прием пищи, сексуальные отношения и обменные процессы в мозге. Из-за участия этих нейронов в регуляции процессов сна и бодрствования многие антигистаминные препараты вызывают состояние сонливости.
Дофамин - биогенный амин, наиболее представленный в базальных ганглиях, где нейроны черной субстанции образуют дофаминергический путь к стриатуму, выполняя функцию контроля моторики.
Дофаминергические пути, которые исходят от area ventalis tegmentalis и проецируются к nucleus accumbeus, играют большую роль в патогенезе эпилепсии.
Существуют различные дофаминовые рецепторы, действующие через вторичные мессенджеры. Их постсинаптическое действие может быть тормозным или возбуждающим. Дофамин очень быстро захватывается обратно из синаптической щели в пресинаптическое окончание. Там он претерпевает превращения благодаря моноаминоксидазе. Вне нейрона, он подвергается воздействию катехол-О-метилтрансферазы.
Норадреналин катехоламин, выполняющий функцию трансмиттера в ЦНС и синтезирующийся прежде всего нейронами locus coeruleus. Это ядро состоит не более чем из 1000 клеток, аксоны которых так многократно разветвляются, что можно найти адренергические окончания во
многих областях ЦНС. Они оказывают модулирующее влияние, например, на процессы созревания, обучения, переработку информации в мозгу, регуляцию сна и на эндогенное торможение боли. В периферической нервной системе норадреналин служит важным трансмиттером симпатических постганглионарных окончаний, например, на сердце и на гладких мышцах сосудов. В некоторых центральных синапсах как трансмиттер рассматривают адреналин.
Для катохоламинов существует четыре главных типа рецепторов: α1, α2, β1 и β2. Они отличаются по реакции на различные агонисты или антагонисты, а также по постсинаптическим эффектам. Рецепторы α1 управляют Са2+-каналами при помощи вторичного мессенджера IP3 и при активации повышают внутриклеточную концентрацию ионов Са2+. Активация рецепторов ведет к уменьшению концентрации вторичного мессенджера цАМФ, вызывая различные эффекты. Активация рецепторов β, например, на клетках Пуркинье мозжечка, повышает при помощи вторичного мессенджера цАМФ проводимость
мембраны для ионов К+ и, таким образом, образует ТПСП. Обратный захват и разрушение похожи на таковые для дофамина
Олигопептиды, которые действуют как трансмиттеры или нейромодуляторы - это приемущественно короткие полипептиды, состоящие из 2-30 аминокислотных остатков. Они функционируют как трансмиттеры или ко-трансмиттеры либо модулируют синаптические процессы. Так энкефалин, эндорфин и динорфин служат трансмиттерами в тех синапсах, в которых опиоидные вещества также оказывают действие. Опиоиды (например, морфин) являются сильными анальгетиками. Вышеназванные опиоидные пептиды тормозят распространение боли в спинном мозге. Кроме того, они играют большую роль в лимбической, автономной и моторной системах.
Другие нейропептиды: вещество Р, ангиотензин II, соматостатин, вазоактивный интестинальный полипептид (VIP), нейропептид Y и многие другие. Большинство названных веществ были открыты в качестве гормонов прежде, чем была определена их роль в синаптическом переносе.
Таблица 3-2. Примеры механизмов действия трансмиттеров на различные типы рецепторов

Типы ацетилхолиновных синапсов
Среди синапсов с химическим механизмом передачи электрического сигнала особое место занимает так называемый холинергический синапс, у которого медиатором служит АЦХ. Особенность этих синапсов заключается в том, что в организме присутствуют две их группы, подразделяющиеся по тому типу АЦХ-рецептора, который присутствует на постсинаптической мембране. Это АЦХ-рецепторы, чувствительные дополнительно к никотину (нАЦХ-рецептор и, соответственно, нАЦХ синапс), и АЦХ-рецепторы, чувствительные дополнительно к мускарину (мАЦХ-рецептор и, соответственно, мАЦХ синапс). АЦХ синапсы с никотиновым АЦХ-рецептором являются ионотропными, а АЦХ синапсы с мускариновым АЦХ-рецептором - метаботропными.
На примере ионотропного АЦХ синапса и метаботропного АЦХ синапса рассмотрим механизм проведения электрического сигнала.
В противоположность синапсу с ионотропнам рецептором (рис. 3-11 А), в котором трансмиттер непосредственно открывает ионный канал, у метаботропных рецепторов есть другие рецепторные белки, которые не являются ионными каналами
(рис. 3-11 Б).
В ионотропном никотиновом АЦХ синапсе две молекулы свободного АЦХ связываются с рецепторным белком, представляющим собой одну из структур ионного канала, что вызывает сдвиг заряда внутри макромолекулы рецептора и как следствие аллостерическое изменение его формы и формы самого канала. Центральный канал расширяется, его внутренний диаметр становится приблизительно равным 0,65 нм. Благодаря этому центральный канал становится проницаемым для ионов натрия. Однако для анионов канал не проходим из-за имеющихся на внутренних стенках зарядов. Коротко: активация нАЦХ-канала
вызывает проводимость постсинаптической мембраны для катионов, деполяризацию постсинаптической мембраны, формирование потенциала и, в итоге, сокращение мышцы.
В метаботропном мускариновом АЦХ синапсе АЦХрецептором служит белок, который не является ионным каналом. Он интересен в эволюционном аспекте, поскольку обладает большим химическим сходством со светочувствительным пигментом родопсином, α- и β- адренергическими и другими рецепторами. Ионные каналы, необходимые для возникновения потенциала на постсинаптической мембране, открываются там только благодаря процессам, определяемым вторичными посредниками. Как только трансмиттер связывается с рецептором, G-белок, имеющий три субъединицы, образует с рецептором комплекс. ГДФ, связанный с G-белком, заменяется на ГТФ. При этом образуется активированный G-белок, состоящий из ГТФ и α-субъединицы, который открывает калиевый ионный канал. Этот пример демонстрирует, что агонист гиперполяризовал бы постсинаптическую клетку, и, значит, затормозил бы ее активность.
У вторичных мессенджеров есть много возможностей для осуществления влияния на ионные каналы. С помощью различных вторичных мессенджеров определенные ионные каналы могут открываться или закрываться. Наряду с описанным механизмом открытия канала с помощью активированной α-субъединицы G-белка у многих синапсов при помощи ГТФ может также активироваться β- и γ-субъединицы, например, в сердце. В других метаботропных синапсах могут играть роль другие вторичные мессенджеры. Так, ионные каналы могут открываться с помощью цАМФ/IР3 или с помощью фосфорилирования протеинкиназы С. Этот процесс также запускается G-белком, который активирует фосфолипазу С, что ведет к образованию IP3. Дополнительно увеличивается образование DAG и протеинкиназы.
Рис. 3-11. Механизмы работы ионотропного синапса (А) и метаботропного синапса (Б)
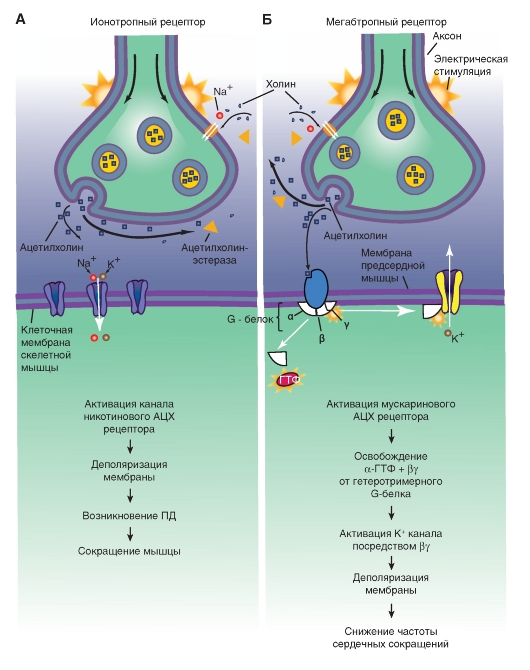
Ионотропный никотиновый холинергический синапс
На примере ионотропного никотинового холинергического синапса рассмотрим ацетилхолиновую передачу с участием ионотропного нАЦХ-рецептора. Итак, в этом синапсе в качестве трансмиттера из везикул выбрасывается АЦХ, и такой синапс называется холинергическим никотиновым синапсом. Примером холинергического синапса является нервно-мышечный синапс.
В постсинаптической мембране выделяют так называемую субсинаптическую мембранную зону непосредственного контакта пресинаптической мембраны с мембраной постсинаптической клетки, которую иначе называют активной зоной синапсов, где находятся протеины, связывающиеся с молекулами трансмиттера и поэтому называющиеся рецепторами. Обратите внимание, что существует два понятия, заложенные в термин «рецептор». В одном случае под термином «рецептор» подразумеваются нервные окончания чувствительного нейрона, или специализированные нервные клетки, но в другом случае это белковые структуры, встроенные в мембрану, которые имеют места связи для сигнальных молекул, например гормоны, трансмиттеры и т.д.
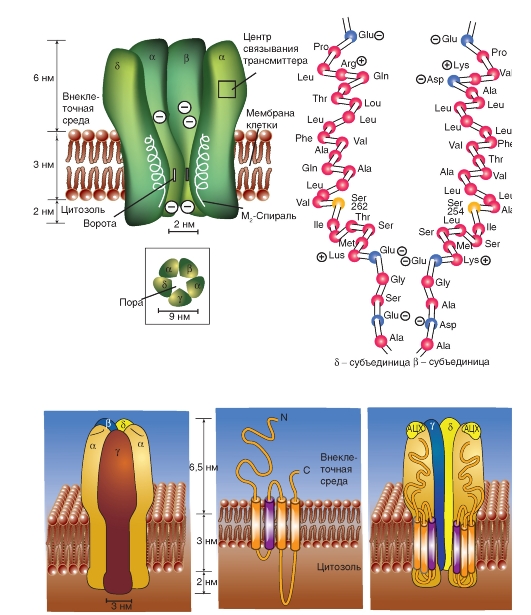
Рецепторный белок для нАЦХ-рецептора состоит из 5 субъединиц, вместе образующих пору - ионный канал, пронизывающий клеточную мембрану. Каждый из таких каналов может находиться в двух состояниях - открытом или закрытом. В открытом состоянии каналы имеют строго определенную проницаемость для ионов. Большей частью этот канал закрыт. Но если две молекулы АЦХ связываются с рецептором, то возникает сдвиг заряда внутри макромолекулы и как следствие аллостерическое изменение его формы. Центральный канал расширяется, и его внутренний диаметр становится приблизительно равным 0,65 нм. Благодаря этому центральный канал становится проходимым для катионов натрия и калия. Однако для анионов канал непроходим изза имеющихся на внутренних стенках зарядов.
В нормальном состоянии рецепторы для трансмиттеров находятся только в области субсинаптической мембраны. Это относится также и к нервно-мышечному синапсу. Однако, хотя АЦХ-рецепторы находятся преимущественно в субсинаптической мембране, крайне небольшое их количество встречается и на поверхности мышечной клетки. Но если двигательный нерв, например, из-за ранения разорван или сильно поврежден, то АЦХ-рецепторы образуются на всей поверхности мышечной клетки; мышца становится гиперчувствительна к АЦХ.
Рис. 3-12. Структура n-холинорецептора
Глутаматный синапс
Многие соединения используются в синапсах как трансмиттеры. Например, глутамат в мозге служит важнейшим трансмиттером для возбуждающих синапсов. Синапсы, которые используют в качестве трансмиттера глутамат, находятся приблизительно на 50% нейронов ЦНС. Они наиболее распространены в переднем мозге (telencephalon) и гиппокампе. Глутаматные синапсы образуют важнейшие возбуждающие входы систем мозга к коре большого мозга. Таким образом, глутамат представляет собой важнейший трансмиттер ЦНС. Именно поэтому, например, в качестве средства для наркоза применяют фармакологический препарат кетамин, представляющий собой антагонист глутамата.
Освобождение глутамата происходит в зависимости от концентрации ионов Ca2+ в пресинаптической области. Однако завершение синаптического переноса осуществляется не посредством его ферментативного разрушения в синаптической щели, а по механизму обратного захвата трансмиттера пресинаптическим нервным окончанием. Кроме того, в этом процессе участвует астроглия.
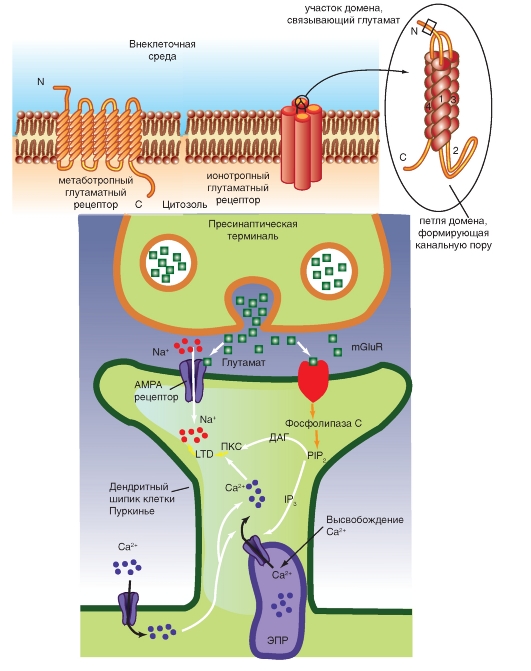
Глутамат прямо открывает неспецифический ионный канал для катионов. Существует, по крайней мере, три основных типа постсинаптических рецепторов, у каждого из которых много подтипов. Они различаются по своей способности связываться с экзогенными агонистами. К этим рецепторам относятся ионотропные рецепторы - лиганд-управляемые катионные каналы - NMDA (N-метил-D-аспартат), AMPA (α-ами- но-3-гидрокси-5-метил-4-изоксазол-пропионовая кислота) и метаботропный mGluR1-5, действие которого осуществляется через IP3/DAG.
На рисунке 3-13 показано, что освобожденный из пресинаптической области глутамат параллельно активирует два рецептора постсинаптической мембраны - ионотропный лиганд-управляемый рецептор, служащий катионным каналом AMPA, и метаботропный рецептор mGluR1-5. Рецептор mGluR1-5 активирует фосфолипазу С, которая расщепляет фосфатидилинозитол-4,5-дифосфат на DAG
и IP3. IP3 вызывает высвосвобождение Са2+ из эндоплазматического ретикулума. Кроме того, Са2+ поступает через потенциал-управляемые каналы мембраны клетки, что приводит не только к увеличению его уровня, но и активации высвобождения из эндоплазматического ретикулума. Повышение уровня Са2+ и появление DAG совместно активируют протеинкиназу С, которая меняет свойства AMPA, приводя к возникновению эффекта долговременной депрессии (Long-Term depression - LTD).
Процесс каждого синаптического переноса должен быстро заканчиваться, в противном случае ответ не возникал бы под влиянием вновь поступающих сигналов и наблюдался бы блок деполяризации. Организм обладает многими способами прекращения синаптического тока. В качестве первого можно назвать десенситизацию, т.е. уменьшение чувствительности рецептора к большим концентрациям трансмиттера, например в результате длительной синаптической активности. В этом случае, несмотря на непрерывное связывание трансмиттера с рецептором, конформация каналообразующего белка меняется так, что канал становится непроницаемым для ионов. При этом синаптический ток прекращается, и процесс переноса заканчивается. Десенситизация наиболее часто осуществляет быстрые механизмы уменьшения чувствительности рецептора. У большинства синапсов десенситизация рецептора может, однако, длиться минуты, до тех пор, пока канал реконфигурируется и станет вновь возбудимым.
Чтобы избежать длительной десенситизации есть другие возможности прекращения действия трансмиттера. Трансмиттер может быть либо быстро химически расщеплен на неактивные компоненты, либо удален из синаптической щели путем высокоселективного обратного захвата в пресинаптическое окончание. В ЦНС клетки глии могут также захватывать трансмиттер. Кроме того, на возбуждающих глутаматергических синапсах синаптическая область плотно покрыта отростками астроцитов. Какой из инактивирующих механизмов играет в синапсе большую роль, зависит от типа синапса.
Рис. 3-13. Один из механизмов работы глутаматного синапса
Фосфорилирование и дефосфорилирование в глутаматном синапсе
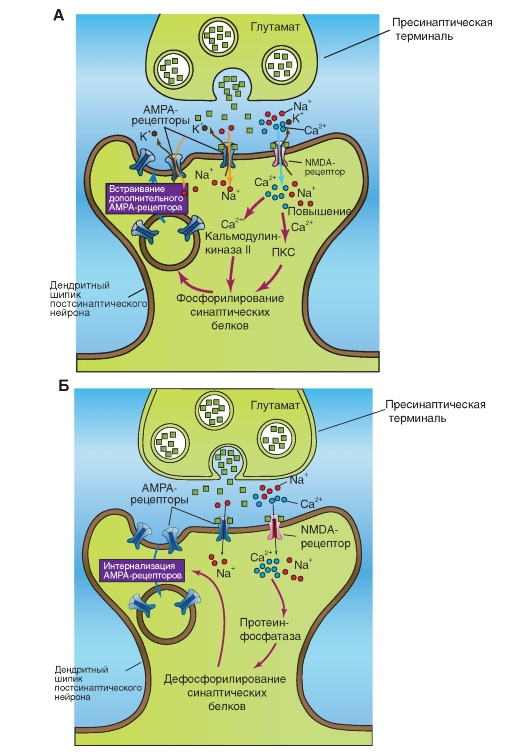
Глутаматный синапс содержит на постсинаптической мембране два типа ионотропных рецепторов. К ним относятся лиганд-управляемые катионные каналы - NMDA и AMPA. Первый тип рецептора назван NMDA-рецептором, поскольку с ним связывается NMDA. К другому типу относится АМРА-рецептор, связывающийся с AMPA.
На рисунке 3-14 А показано, что освобожденный из пресинаптической области глутамат параллельно активирует два ионотропных рецептора - лиганд-управляемых канала постсинаптической мембраны, являющихся катионными каналами AMPA и NMDA. Через катионный канал AMPA в постсинаптическую область входят ионы Na+, которые деполяризуют постсинаптическую мембрану. В отличие от AMPA, NMDA- канал открывается, если постсинаптическая мембрана достаточно деполяризована. Через этот канал в постсинаптическую область поступают и ионы Na+ и Са2+. Вход Са2+ в клетку приводит к активации протеинкиназы С. Параллельно Са2+ связывается в комплекс с кальмодулином и активирует Са2+/кальмодулин киназу II. Оба этих процесса направлены на фосфорилирование синаптических белков. В итоге запускается процесс введения дополнительных AMPA- рецепторов в постсинаптическую мембрану, как это показано на рисунке, который способствует длительному потенцированию - долговременному синаптическому потенцированию (Long-Term potentiation - LTP).
Но чрезмерное возбуждение многих NMDA синапсов может также необратимо повредить постсинаптические клетки (так называемая эксайтотоксичность - цитотоксичность, свойственная возбуждающим нейротрансмиттерам, например,
глутамату и аспартату), что, по-видимому, осуществляется при действии значительного входящего тока ионов Ca2+. Очевидно, десенситизация наступает на рецепторах этого типа очень медленно. Эксайтотоксичность усиливает многие неврологические заболевания, такие, как нарушение слуха, течение болезни Альцгеймера или наследственные повреждения, вызванные первичной гипоксией.
На рисунке 3-14 Б, как и на предыдущем, показано, что глутаматный синапс содержит на постсинаптической мембране два типа ионотропных рецепторов. К ним относятся лигандуправляемые катионные каналы - NMDA и AMPA. Но на этом рисунке продемонстрирован противоположный эффект - не вставка дополнительных AMPA-рецепторов в постсинаптическую мембрану, а наоборот, интернализация AMPA-рецепторов из постсинаптической мембраны. Низкоамплитудный подъем концентрации Са2+ в клетке активирует протеинфосфатазу, находящуюся в постсинаптической зоне. Это ведет к дефосфорилированию синаптических белков и тем самым к интернализации AMPA-рецепто- ров из постсинаптической мембраны, уменьшая возможность связывания с AMPA-рецепторами освободившегося глутамата. Благодаря этому механизму возможно уменьшение синаптической активности долговременная синаптическая депрессия (Long-Term depression - LTD).
На многих описанных синапсах вместо глутамата находится аспартат. Часто на NMDA-рецепто- рах глицин является котрансмиттером. Кетамин, применяемый для наркоза, представляет собой неконкурентный блокатор NMDA-рецепторов. Из синаптической щели глутамат удаляется либо посредством обратного захвата в пресинаптическую область, либо в клетки глии. Наряду с ионотропными рецепторами к глутамату существует еще ряд метаботропных глутаматных рецепторов.
Рис. 3-14. Глутамат и механизм работы синапса с этим трансмиттером через ионотропные рецепторы (лигандуправляемые катионные каналы) NMDA и AMPA, направленный на фосфорилирование (А) или дефосфорилирование (Б) синаптических белков и вставку дополнительных AMPA-рецепторов в постсинаптическую мембрану
Механизм долговременной потенциации и долговременной синаптической депрессии
На рисунке 3-15 показаны пути, приводящие к повышению уровня цАМФ и активации цАМФзависимой ПКА. Активация ферментативной активности цАМФ-зависимой протеинкиназы должна вовлекать отделение регуляторных субъединиц от комплекса. Эта активация происходит в присутствии микромолярных концентраций цАМФ. Каждая регуляторная субъединица связывает две его молекулы. Связывание цАМФ индуцирует конформационные изменения в регуляторных субъединицах и снижает афинность их связывания с каталитическими субъединицами. В результате этого регуляторные субъединицы отделяются от каталитических субъединиц, и каталитические субъединицы становятся активированными. Каталитические единицы ПКА попадают в ядро клетки и запускают процесс транскрипции.
На рисунке показано, что освобожденный из пресинаптической области глутамат активирует ионотропный рецептор - лиганд-управляемый канал постсинаптической мембраны, являющийся катионным каналом NMDA. Вход Са2+ в клетку приводит к связыванию Са2+ с кальмодулином, и этот комплекс активирует протеинкиназы. Аденилатциклаза переводит АТФ в цАМФ, что приводит к активации ПКА. Активация ПКА вследствие связывания четырех молекул цАМФ вызывает конформационные изменения в регуляторных субъединицах и снижает аффинность их связывания с каталитическими субъединицами, а также приводит к отделению регуляторных субъединиц от каталитических. Далее каталитические единицы проникают в ядро.
Долговременная потенциация (Long-Term potentiation - LTP) осуществляется через протеинкиназу А, активирующую регулятор транскрипции CREB - cAMP response element binding protein.
Рис. 3-15. Механизмы, определяющие кратковременные и долговременные изменения в синаптической передаче
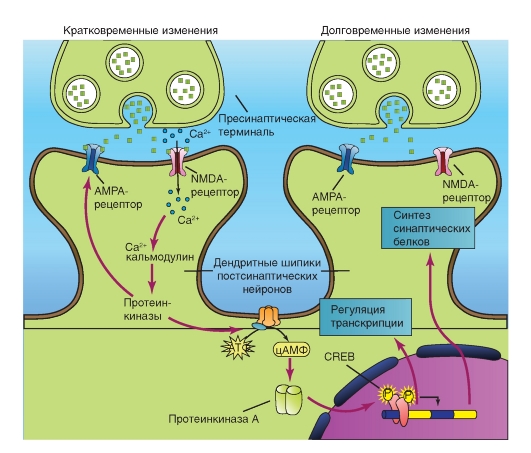
Рецепторы NMDA и AMPA определяют работу глутаматного синапса
Некоторые из глутаматных синапсов, снабженные ионотропными рецепторами - лигандуправляемыми катионными каналами - NMDA и AMPA - обладают, по сравнению с обычными синапсами, дополнительным любопытным механизмом. Ионы Mg2+, которые находятся во внеклеточной жидкости, оказывают на них влияние в качестве неконкурентного блокатора,
выключая сопряженный с этим рецептором ионный канал. Таким образом, освобождение трансмиттера и связывание его с NMDA-каналом не приводит к эффекту. Если потенциал мембраны постсинаптической клетки благодаря возбуждающим синапсам, имеющим AMPA-канал, совсем немного деполяризуется, то связывание Mg2+ уменьшается. После этого Mg2+ освобождает ионный канал, и ионы натрия могут проникать в клетку, вызывая, таким образом, сильную деполяризацию.
Рис. 3-16. Потенциалы, возникающие на постсинаптической мембране глутаматного синапса, которые определяются работой ионотропных рецепторов - лигандуправляемых катионных каналов - NMDA и AMPA.
А - потенциалы, генерируемые АМРА в условиях блокады ионами Mg2+ NMDA и суммарный потенциал. Ионы Mg2+ неконкурентно блокируют ионный канал NMDA. Так что даже после связывания глутамата ионный ток не может течь. Б - если перед этим возбуждающий глутаматный синапс на клетке слегка кратковременно преддеполяризовать (сместить потенциал мембраны в более положительную область), то ионы Mg2+ не смогут больше быть связанными с NMDA-каналами. Блок Mg2+ снимается, и ионы Na+ и Са2+ могут устремиться в клетку. Ионы Са2+ могут использоваться в качестве внутриклеточного вторичного мессенджера и регулировать дальнейшие процессы
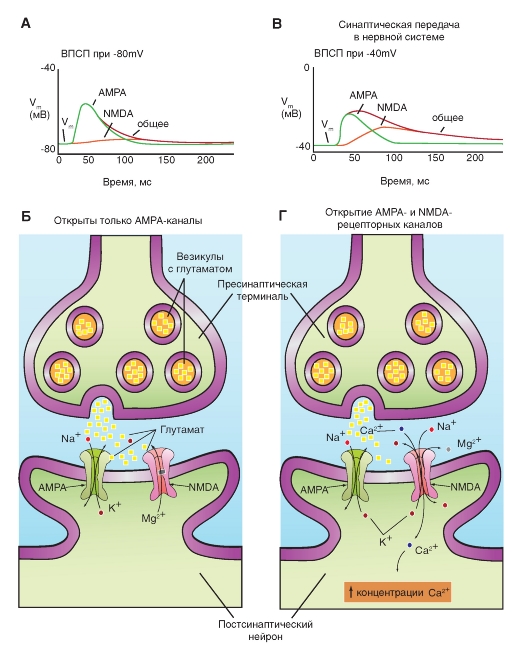
ГАМК как трансмиттер
Многие тормозные интернейроны, присутствующие практически во всех отделах ЦНС, и аксоны клеток Пуркинье мозжечка выбрасывают в качестве трансмиттера γ-аминомасляную кислоту (ГАМК, GABA: γ-Aminobutyric acid). ГАМК оказывает тормозное действие на постсинаптические структуры. Существует по меньшей мере два различных постсинаптических механизма, запускающихся благодаря различным рецепторам (ГАМКА, ГАМКС с одной стороны; ГАМКВ с другой стороны).
ГАМКА-и ГАМКС-рецепторы непосредственно открывают каналы для ионов Cl-, что приводит к появлению входящего Cl-тока и тем самым к гиперполяризации в виде ТПСП. Барбитураты (препараты, применяемые для наркоза), стероидные анестетики и транквилизаторы (успокаивающие средства) из класса бензодиазепинов (например, диазепам) усиливают ингибиторное действие ГАМКА-рецепторов. Механизм их действия заключается в связывании с белком ионного канала, который уже взаимодействует с ГАМК, и таким образом в усилении действия ГАМК.
Канал построен из нескольких субъединиц. Одна из этих субъединиц связывает ГАМК, другая может дополнительно связать бензодиазепин, третья - связать барбитурат и еще одна - связать стероид. В настоящее время неясно, какие природные вещества (например, нейромодуляторы) оказывают действие на так называемые бензодиазепиновые или барбитуратные рецепторы. Названные субъединицы могут обладать различными химическими свойствами, определяемыми их химической структурой, что обусловливает различные фармакологические эффекты. Бикукуллин представляет собой конкурентный блокатор для ГАМКА-, но не для ГАМКС-рецептора. Яд пикротоксин, вызывающий судороги, является неконкурентным блокатором, закрывающим канал для ионов Cl-.
ГАМКВ открывают каналы для ионов К+ посредством G-белка. Агонистом служит баклофен. Пресинаптические ГАМКВ-рецепторы закрывают каналы Са2+ и тормозят освобождение трансмиттера. Действие ГАМК прекращается путем обратного захвата ГАМК пресинаптическим окончанием и клетками глии.
Рис. 3-17. γ-Аминомасляная кислота как трансмиттер в синапсе: расщепление, удаление и обратный захват
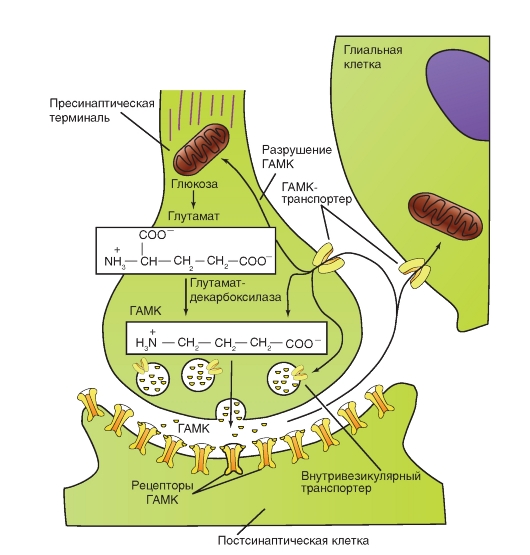
Глицин как трансмиттер
Аминокислота глицин выполняет функцию трансмиттера в тормозных синапсах и действует как нейромодулятор. Глицин выполняет специфические ингибиторные задачи. Большинство клеток Реншоу, через которые осуществляется торможение α-мотонейронов спинного мозга, высвобождают глицин. Стрихнин является конкурентным антагонистом, и его применение приводит к судорогам из-за отсутствия торможения
α-мотонейронов. Рецепторы глицина открывают С1--каналы, что способствует возникновению ТПСП. Синаптическое действие заканчивается с помощью механизма обратного захвата глицина.
В ЦНС глицин играет также и роль нейромодулятора, например в гиппокампе NMDA-рецепторы, описанные ранее, испытывают модулирующее влияние со стороны глицина.
Важно заметить, что хотя синапсы называются по наименованию их главного трансмиттера (например, холинергический).
Рис. 3-18. Глицин: расщепление, удаление и обратный захват трансмиттера
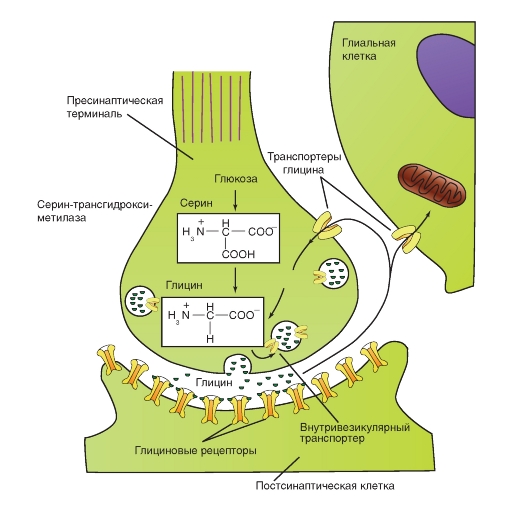
NO как трансмиттер
Оксид азота (NO) - это паракринный медиатор, выделяемый эндотелиальными клетками и некоторыми нейронами. Вследствие того, что NO быстро окисляется, его биологическая жизнь длится всего несколько секунд. По этой причине NO влияет только на клетки, находящиеся вблизи от места своего выделения. NO стимулирует растворимую гуанилатциклазу в клетках-мишенях и тем самым повышает в клетке мишени внутриклеточную концентрацию цГМФ. Это, в свою очередь, стимулирует цГМФ-зависимую протеинкиназу.
Оксид азота легко распространяется путем диффузии и может принимать на себя функции трансмиттера. При этом, например, пресинаптические процессы могут регулироваться с помощью обратной связи. Возможно, этот вид переноса информации играет большую роль в ЦНС. Механизмы прекращения действия подобных трансмиттеров
не позволяют включить их в классическую синаптическую схему.
Образование NO катализируется NO-синтазой NOS - Са2+-кальмодулин-зависимым ферментом, ускоряющим превращение аргинина в цитруллин и NO. Повышение цитозольного уровня Ca2+ приводит к увеличению образования и выделения NO. NO освобождается нервными окончаниями гранулярных клеток мозжечка и действует на постсинаптические клетки Пуркинье мозжечка. NO выделяется эндотелиальными клетками под влиянием агонистов типа ацетилхолина, присоединение которого к мускариновым рецепторам повышает внутриклеточный уровень Са2+. Освобождение NO эндотелиальными клетками вызывает вазодилатацию в близлежащих клетках гладких мышц сосудов. Кроме того, NO служит одним из нейротрансмиттеров, освобождаемых нейронами и иннервирующих кишечник. Действуя на гладкомышечные клетки желудочно-кишечного тракта, NO подавляет их сократительную активность.
Рис. 3-19. Оксид азота (NO) в качестве трансмиттера, освобождаемого нейронами
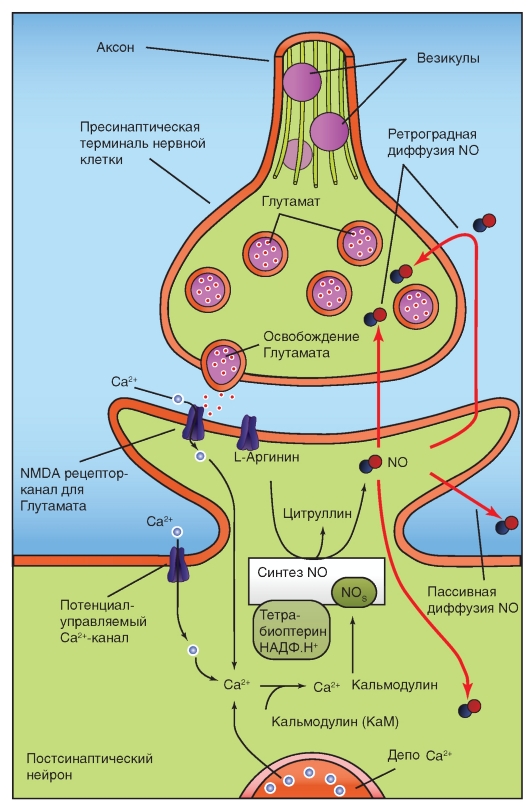
Возбуждающий постсинаптический потенциал (ВПСП)
Рассмотрим этот вопрос на примере АЦХ. Взаимодействуя с рецептором, молекулы АЦХ открывают неспецифические ионные каналы в постсинаптической мембране клетки так, что повышается их способность к проводимости для одновалентных катионов. Существует сильная движущая сила для натрия, и ионы Na+ устремляются внутрь клетки и деполяризуют ее мембрану. С другой стороны, канал проходим и для ионов K+, для которых сохраняется незначительный электрохимический градиент, направленный из внутриклеточной области к внеклеточной среде. Через постсинаптическую мембрану одновременно проходят и ионы K+, тем самым слегка противодействуя деполяризации, обусловленной входящим током ионов Na+. Работа описанных каналов ведет к базовому входящему току положительных ионов и, следовательно, к деполяризации постсинаптической мембраны, которая называется применительно к синапсам ВПСП. На концевой пластинке нервно-мышечного синапса ВПСП называют также потенциалом концевой пластинки. Так как участвующие ионные токи зависят от разности их потенциала равновесия и потенциала мембраны, то при уменьшенном потенциале покоя мембраны ток ионов Na+ становится всегда меньше, а ток ионов К+ - больше. Именно поэтому амплитуда ВПСП уменьшается.
В механизме генерации ВПСП участвуют и другие ионные каналы с другими свойствами (лигандуправляемые, а не потенциал-управляемые), и проводимость трансмиттер-управляемых каналов (лиганд-управляемых) зависит только от количества молекул трансмиттера, связавшихся с молекулами рецептора. Амплитуда ВПСП лежит в диапазоне от 100 μВ до (в некоторых случаях) 10 мВ. В зависимости от вида синапса, общая продолжительность ВПСП лежит в диапазоне от 5 до 100 мс.
Прежде всего, в зоне синапса образовавшийся локально ВПСП распространяется пассивно электротонически по всей постсинаптической мембране клетки. Этот процесс не подчиняется закону «все или ничего». Если большое число возбуждающих
синапсов активируются одновременно или почти одновременно, то возникает явление так называемой суммации, которое реализуется в виде возникновения ВПСП существенно большей амплитуды, что может деполяризовать мембрану всей постсинаптической клетки. Если величина этой деполяризации достигает в области постсинаптической мембраны порогового значения (10 мВ или больше), то на аксонном холмике нервной клетки молниеносно открываются потенциал-управляемые Na+-каналы, и клетка генерирует потенциал действия, который проводится вдоль аксона. В случае моторной концевой пластинки это приводит к мышечному сокращению. От начала ВПСП до образования потенциала действия проходит еще около 0,3 мс, так что при обильном освобождении трансмиттера постсинаптический потенциал может появиться уже через 0,5-0,6 мс после пришедшего в пресинаптическую область потенциала действия. В общих чертах, время «синаптической задержки», подразумевающее необходимое время между возникновением пре- и постсинаптического потенциала действия, всегда зависит от типа синапса.
Тормозной постсинаптический потенциал (ТПСП)
Решающими для ионного тока в мембране оказываются величина ее потенциала и количество открытых ионных каналов. Определяющим оказывается тип белка канала, на который действует трансмиттер. Так на одних синапсах находятся каналы для K+, тогда как на других есть каналы для Cl-. Последние распространены много чаще. Рассмотрим в виде примера рецептор метаботропного синапса, повышающий при связывании с трансмиттером проводимость для ионов К+. При нормальной величине потенциала мембраны это приводит к дальнейшему выходящему току ионов К+ и гиперполяризации потенциала мембраны. Возникает так называемый ТПСП. Принципиально похожая ситуация складывается, если гиперполяризующий мембрану ток связан с ионами Cl-. Cl- течет в клетку и гиперполяризует ее. Подобная картина характерна для очень многих клеток.
Рис. 3-20. Потенциалы и токи, возникающие на постсинаптической мембране.
А - процессы освобождения трансмиттера и формирование возбуждающего постсинаптического потенциала (ВПСП) после электрического возбуждения (стрелка), поступившего на пресинаптическое окончание, связаны с возникновением возбуждающего постсинаптического тока (ВПСТ) и генерацией вследствие этого ВПСП. Если ВПСП переходит порог, то возникает потенциал действия (ПД), который во время фазы нарастания благодаря потенциалуправляемым Na+каналам деполяризует мембрану в направлении ENa, т.е. к потенциалу равновесия для Na+. Б - процессы освобождения трансмиттера и формирование ТПСП связаны с ингибиторным постсинаптическим током (ТПСТ) и соответствующим ему ТПСП. При этом ток вызывает движение через мембрану ионов К+. Ионы Cl- могут играть роль, если потенциал мембраны позитивнее, чем потенциал равновесия для Cl-, который лежит от -75 до -70 мВ. В - токи мембраны при активации возбуждающих (ВПСТ) и ингибиторных синапсов (ТПСТ) и возникающие в этом случае результирующие постсинаптические потенциалы (ВПСП, ТПСП). При одновременной активации возбуждающих и тормозных синапсов возникающие мембранные токи суммируются, поэтому результирующий постсинаптический потенциал (красный) становится очень маленьким
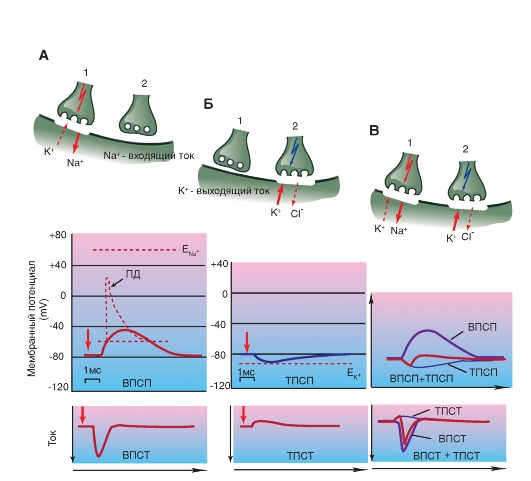
Синаптические ионные токи
в условиях фиксации потенциала
На панели (А) представлена схема регистрации токов концевой пластинки нервно-мышечного препарата в условиях фиксации потенциала. На панели (Б) представлены синаптические токи, зарегистрированные при смещении мембранного потенциала тестовыми ступеньками в диапазоне от -120 до +38 мВ при поддерживаемом потенциале. При отрицательных значениях мембранного
потенциала синаптические токи имеют входящее направление. Если мембранный потенциал не фиксировать, то входящий ток приведет к деполяризации мышечного волокна. При положительных значениях мембранного потенциала синаптические токи направлены из клетки наружу. На панели (В) представлена зависимость амплитуды синаптического тока от мембранного потенциала. Эта зависимость близка к линейной, и потенциал реверсии синаптических токов находится около нуля.
Рис. 3-21. Синаптические ионные токи и потенциал реверсии, измененный в условиях фиксации потенциала
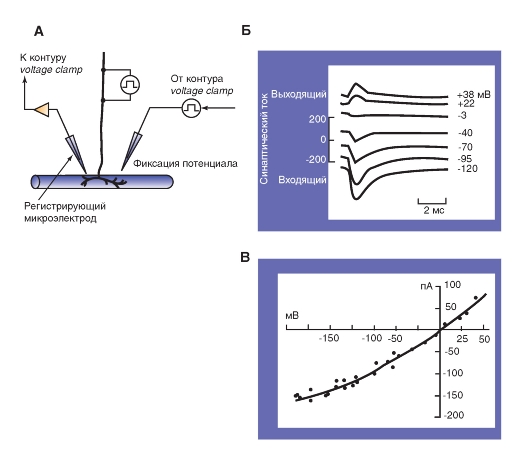
Взаимное влияние ВПСП и ТПСП
Если на мембране клетки активируются одновременно возбуждающие и тормозные синапсы, то ионный ток уменьшается. В этом случае организм обладает возможностью эффективно подавлять возбуждающие или тормозящие влияния на нервной клетке.
Нервная клетка усыпана тысячами синаптических окончаний, часть из которых возбуждающие, а часть - тормозные. Если соседствующие возбуждающие и тормозные синапсы (одновременно) активируются, то возникающие токи накладываются друг на друга. Результирующий постсинаптический потенциал (по абсолютной величине) меньше, чем только один ВПСП или только один ТПСП. При одновременной активации возбуждающего и тормозного синапсов результирующий ВПСП может вызывать незначительную деполяризацию мембраны клетки. Тогда клетка возбуждается менее сильно, т.е. тормозится. При этом является существенным не ТПСП, а гиперполяризация мембраны вследствие повышения ее проводимости для ионов К+ или Cl-. Тем самым потенциал мембраны поддерживается вблизи потенциала равновесия для ионов калия (или хлора) на уровне достаточно больших отрицательных значений, и деполяризующий эффект входящего тока натрия уменьшается. Входящий ток натрия компенсируется выходящим током калия или входящим током хлора.
Таким образом, ВПСП возникает благодаря повышению проводимости для натрия и
тем самым благодаря входящему току натрия, а ТПСП - благодаря выходящему току калия или входящему току хлора.
Исходя из этого можно было бы предположить, что понижение проводимости для калия должно деполяризовать мембрану клетки, между тем как уменьшение проводимости для натрия должно было бы привести к гиперполяризации. Это действительно так. Природа также использует этот механизм, а именно - закрытие ионных каналов в результате связывания трансмиттера с рецептором. Синапсы, у которых деполяризация вызывается уменьшением проводимости калия, находятся в ганглиях автономной нервной системы. Там, главным образом, присутствуют синапсы, у которых АЦХ, активируя входящий ток натрия, вызывает ВПСП. Но есть также и те синапсы, у которых АЦХ уменьшает существующую проводимость калия и тем самым вызывает (длительные) ВПСП. Уменьшение существующей проводимости натрия, приводящее к гиперполяризации мембраны клетки, можно наблюдать в палочках и колбочках сетчатки.
Еще необходимо отметить, что механизм возникновения постсинаптических потенциалов соответствует механизму образования так называемых рецепторных потенциалов в клетках органов чувств (рецепторных клетках), где ионные каналы открываются или закрываются с помощью определенного химического или физического раздражения. Сходство не удивляет. Синапс - это высоко специализированная структура, которая реагирует высокоспецифично на определенные химические вещества.
Рис. 3-22. ВПСП и ТПСП на мембране клетки взаимно влияют друг на друга
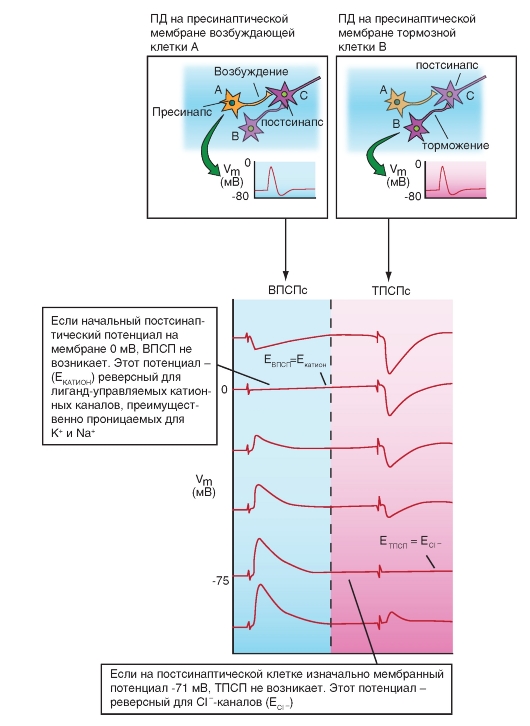
Лиганд-управляемые ионные каналы. Их токи
На примере двух различных типов лигандуправляемых ионных каналов (одиночного ионного канала, связанного с АЦХ-рецептором, и одиночного К+-канала, активируемого АЦХ) мы продемонстрируем условия, приводящие к их открытию, и токи, текущие через них.
Для описания первого типа лиганд-управляемых ионных каналов в качестве примера приведем никотиновый ацетилхолиновый рецептор, который сам служит ионным каналом. На рисунке 3-23 А1 показана регистрация тока в конфигурации outside-out, протекающего через одиночный ионный канал бычьего нАЦХ-рецептора, экспрессированного в ооцит ксенопуса. Этот лиганд-управляемый канал состоит из нескольких субъединиц. В первом случае (вверху) канал имеет конфигурацию α2βγδ, во втором случае (снизу) - конфигурацию α2βεδ. В обоих случаях
одиночный ток возникает при стимуляции канала АЦХ в концентрации 500 нМ. На рисунке 3-23 А2 показана реакция нАЦХ-рецептора эмбриональной и взрослой мышц на АЦХ. В обоих случаях реакции возникают только на аппликацию АЦХ.
В качестве второго типа лиганд-управляемого ионного канала рассмотрим К+-ионный канал, активируемый АЦХ. На рисунке 3-23 Б показана регистрация входящего К+-тока, активируемого АЦХ (К(ACh)-канал). Контрольная регистрация демонстрирует определенную активность канала. На фоне введенного в перфузионный раствор АЦХ в концентрации 100 нМ вероятность открытия канала не меняется, поскольку он находится под patch-пипеткой, и АЦХ не может проникнуть в эту область. Нижняя кривая демонстрирует регистрацию на фоне введенного в patch-пипетку АЦХ в концентрации 10 нМ. В этом случае наблюдается выраженная активация канала, поскольку соединение контактирует с его рецептором.
Рис. 3-23. Примеры токов АЦХ-управляемые ионные каналы.
А - ток через одиночный ионный канал бычьего n-холинорецептора, экспрессированного в ооцит ксенопуса (1) и мембрану эмбриональных и зрелых мышечных клеток (2).
Б - входящий К+-ток через К+-канал, активируемый АЦХ (регистрация в конфигурации cell-attached)
Patch-clamp для изучения канальных токов синапса
При применении метода patch-clamp в конфигурации outside-out, продемонстрированной на рис. 3-24 А, можно провести измерение тока, текущего через ионотропный одиночный ионный канал, расположенный во фрагменте мембраны под пипеткой, «вырезанной» из постсинаптической мембраны мышечной клетки. Когда АЦХ апплицирован на внешнюю поверхность мембраны, потенциал которой фиксирован на негативном уровне, можно увидеть повторяющиеся короткие открытия одиночного канала (рис. 3-24 Б), которые проявляются в виде резких падений тока в отрицательную область, соответствующих входящему ионному току (т.е. катионы входят в клетку). На рисунке 3-24 В представлено синхронное открытие многих ионотропных одиночных ионных каналов, активированных с помощью АЦХ, у синапса,
потенциал которого фиксирован на негативном уровне. Рисунок 3-24 В1 представляет собой запись эксперимента, в котором на фоне релиза АЦХ из пресинаптической терминали регистрировали одиночный канал. В этом случае канал открывается временно. На рисунке 3-24 В2 представлена запись эксперимента, в котором некоторое число каналов регистрировали одновременно. На фоне релиза АЦХ из пресинаптической терминали наблюдали открытие каналов почти синхронно. На рисунке 3-24 В3 представлена запись эксперимента, в котором регистрировали одновременно большое число каналов, находящихся на постсинаптической мембране. Эти каналы продуцировали так называемый макроскопический ток. На рисунке 3-24 Г показан типичный ВПСП, регистрируемый в режиме фиксации тока, а не фиксации потенциала. ВПСП - это деполяризация мембраны, которая может приводить к генерации потенциала действия.
Рис. 3-24. Активация ацетилхолинового рецептора - ионотропного одиночного ионного канала в нервномышечном синапсе
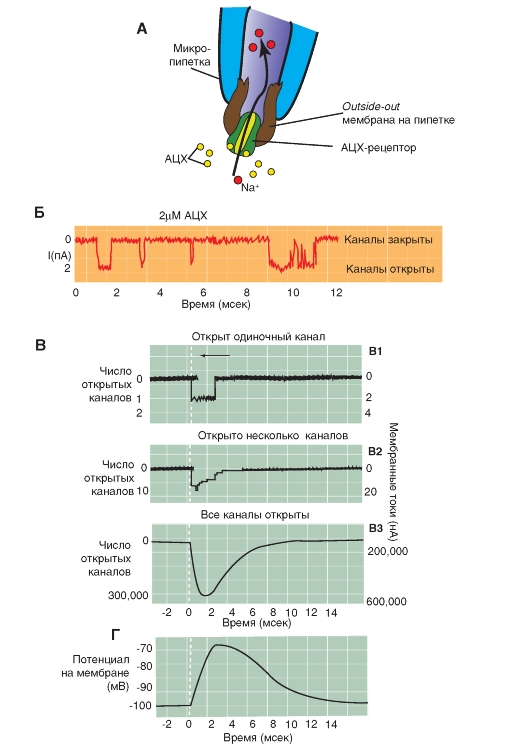
Соединения с синаптическим влиянием
Наряду с трансмиттером, другие соединения тоже могут влиять на рецепторный белок. Если их связывание с рецептором приводит к одинаковому с трансмиттером эффекту, то их называют агонистами, если же они путем связывания, напротив, препятствуют действию трансмиттера, их называют антагонистами.
Мы видели, что специфическая молекула трансмиттера связывается с белком, образующим канал, открывая его для ионов. Для этого на белке есть связывающий участок. Данный участок не является абсолютно специфическим. Для большинства синапсов установлен целый ряд эндогенных и экзогенных соединений, способных к взаимодействию со связывающим участком, многие из них представляют собой лекарства. Возьмем опять пример никотинового синапса. Его естественным трансмиттером служит АЦХ. Однако с рецептором, предназначенным для АЦХ, могут связываться сходные по структуре химические соединения, например - сукцинилхолин, который имитирует действие АЦХ, что приводит к возникновению ВПСП. Некоторые значительно отличающиеся по химическому строению молекулы, например никотин, также могут соединяться со связывающим участком рецепторного белка. Вещества, действующие подобно трансмиттеру, называют агонистами. Часто такие соединения используют для идентификации рецептора. Так, например, произошло с никотином, что породило название «никотиновый синапс».
Наряду с агонистами, существуют химические соединения, которые хотя и связываются с молекулой рецептора, но не могут открывать ионный канал. Занимая связывающий участок, они препятствуют рецепции естественного трансмиттера и возникновению его эффекта. В результате эти соединения блокируют ионный канал, препятствуя его открытию. Такие вещества называют антагонистами. Например, содержащийся
в яде кураре, которым индейцы смазывали наконечники стрел, d-тубокурарин, представляет собой конукрентный блокатор для никотиновых рецепторов. Он конкурирует с природным трансмиттером, связываясь с АЦХ-рецептором нервно-мышечного синапса, и препятствует произвольным сокращениям мышц, что приводит к смерти через остановку дыхания. Курареподобные вещества применяют в настоящее время на фоне анестезии при хирургических операциях для мышечной релаксации. Другим соединением, которое высоко специфично и конкурентно связывается с никотиновыми АЦХ-рецепторами, является змеиный яд α-бунгаротоксин. Он действует уже в наномолярной концентрации и может применяться в экспериментах для того, чтобы маркировать АЦХ-рецепторы на поверхности клетки.
Препараты типа кураре действуют на мускариновые синапсы, для которых классическим конкурентным блокатором служит атропин. Выше уже были представлены данные о возможности фармакологического влияния на холинергические синапсы. Таблица дает нам информацию о наличии некоторых типов синапсов. Обратите внимание на то, что наблюдаются существенные различия между никотиновыми и мускариновыми рецепторами, и что даже внутри одного типа рецептора есть подтипы, которые нередко существенно отличаются по своим свойствам. Кроме того, большая часть фармакологических препаратов не действует на синапсы ЦНС только потому, что они не могут проникнуть через гематоэнцефалический барьер и достигнуть возможных мест действия.
Блок деполяризации при действии сукцинилхолина и подобных веществ осуществляется благодаря незначительной стойкой деполяризации, возникающей под действием этих соединений. Она ведет к инактивации потенциал-управляемых Na+-каналов вблизи концевых пластинок, что препятствует возникновению потенциалов действия мышечного волокна. Наступает и десенситизация АЦХ-рецепторов.
Рис. 3-25. Свойства основных нейротрансмиттеров (см. таблицу)