Фармакология : учебник. - 10-е изд., испр., перераб. и доп. - Харкевич Д. А. 2010. - 752 с.
|
|
|
|
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, РЕГУЛИРУЮЩИЕ ФУНКЦИИ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ (ГЛАВЫ 5-12)
Известно значительное число веществ, с помощью которых можно управлять многими функциями ЦНС. К ним относятся разнообразные химические соединения, влияющие на психическое состояние и эмоции, уменьшающие восприятие болевых ощущений, способствующие развитию сна, вызывающие наркоз и др.
Основой действия большинства нейротропных средств на ЦНС является их способность изменять процесс межнейронной (синаптической) передачи возбуждения. В зависимости от направленности возникающих при этом эффектов различают вещества угнетающего и стимулирующего типа. В свою очередь каждую из этих групп можно подразделить на вещества общего и избирательного действия (табл.).
Отличительным свойством веществ общего действия является отсутствие у них избирательного влияния на определенные центры или функции. Они вмешиваются в деятельность ЦНС практически на всех ее уровнях. Типичным примером подобных веществ являются средства для наркоза. Они оказывают выраженное угнетающее влияние на передачу возбуждения в центральных звеньях рефлексов,
Таблица. Вещества, влияющие на центральную нервную систему
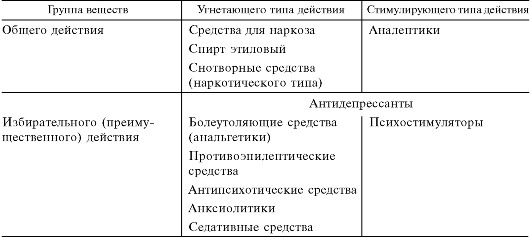
замыкающихся в головном, спинном и продолговатом мозге. Это приводит к выключению сознания, подавлению чувствительности и большинства рефлексов.
Вещества с так называемым избирательным действием влияют преимущественно на определенные центры или на функциональные системы, не нарушая деятельность ЦНС в целом. К таким препаратам относятся болеутоляющие (например, опиоиды), противопаркинсонические средства, анксиолитики и др. Указанные группы веществ отличаются разной степенью избирательности действия на определенные центры и функции ЦНС.
Нейротропные средства могут влиять на различные этапы синаптической передачи (в возбуждающих и тормозных синапсах), в частности на:
1) синтез медиатора;
2) депонирование медиатора;
3) процесс высвобождения медиатора из нервных окончаний;
4) взаимодействие медиатора с рецепторами постсинаптической и пресинаптической мембран;
5) нейрональный захват медиатора или его метаболитов;
6) экстранейрональный захват медиатора;
7) энзиматические превращения медиатора.
Основой избирательности действия большинства нейротропных веществ является их специфическое взаимодействие с определенными системами медиаторов/ модуляторов. Чаще всего они выступают в роли агонистов или антагонистов тех или иных типов рецепторов. Кроме того, ряд препаратов действуют опосредованно, через эндогенные лиганды, влияя на их метаболизм, высвобождение и захват.
Важное место занимают нейротропные вещества, которые воздействуют на адренергическую систему. В ЦНС большое скопление норадренергических нейронов находится в голубом пятне (locus coeruleus) серого вещества моста. Отсюда аксоны нейронов проецируются в кору головного мозга, гиппокамп, гипоталамус, мозжечок, продолговатый и спинной мозг. Как известно, с адренергической системой связаны преимущественно стимулирующие влияния на функции ЦНС. На эту систему влияют некоторые психостимуляторы (сиднокарб), анорексигенные средства (фепранон), препараты, применяемые при артериальной гипертензии (клофелин). Трициклические антидепрессанты (имизин и др.) угнета- ют обратный нейрональный захват норадреналина. Опосредуются эффекты указанных групп веществ в основном через α- и β-адренорецепторы.
Многие группы фармакологических веществ действуют на дофаминергическую систему, которая включает нигростриатные, мезолимбические и тубероинфундибулярные пути. От состояния дофаминергической системы зависят центральная регуляция двигательной активности, поведенческие и психические функции, продукция ряда гипофизарных гормонов (секреция пролактина, гормона роста), функция центра рвоты. Регуляция дофаминергической системы осуществляется через разные типы дофаминовых (D) пост- и пресинаптических рецепторов. Стимуляция пресинаптических дофаминовых рецепторов уменьшает синтез и высвобождение из нервных окончаний дофамина.
Выделяют 2 группы дофаминовых рецепторов: группа D1-рецепторов (подгруппы D1 и D5) в основном вызывает постсинаптическое торможение. Они связаны с 08-белками. Стимулируют аденилатциклазу, повышая содержание цАМФ. Группа D2-рецепторов (подгруппы D2, D3 и D4) вызывает пре- и постсинаптическое торможение. Эти рецепторы связаны с Gi/o-белками. Ингибируют аденилатциклазу. Кроме того, они активируют К+-каналы и оказывают угнетающее действие на Са2+-каналы. Из применяемых лекарственных средств известны как блокато-

ВАСИЛИЙ ВАСИЛЬЕВИЧ ЗАКУСОВ (1903-1986).
Известный советский фармаколог. Один из авторов теории синаптического действия веществ на центральную нервную систему.
ры дофаминовых рецепторов (например, антипсихотические и некоторые противорвотные средства), так и вещества, активирующие дофаминергическую систему (ряд противопаркинсонических средств; дофаминомиметик бромокриптин, угнетающий при акромегалии1 продукцию гормона роста и пролактина).
Важное место в ряду медиаторов/моду- ляторов ЦНС принадлежит серотонину (5-гидрокситриптамин; 5-НТ). В верхней части продолговатого мозга и в мосте находится обширное скопление серотонин- ергических нейронов. Эти образования называются ядрами шва (nucleus raphes). Их нейроны проецируются как краниально (кора, гиппокамп, лимбическая сис- тема, гипоталамус), так и каудально (продолговатый и спинной мозг). Наиболее высоко содержание серотониновых рецепторов в гиппокампе, стриатуме и фрон- тальной коре. Возбуждение пресинаптических рецепторов уменьшает высво- бождение серотонина и некоторых других медиаторов из нервных окончаний. Что касается постсинаптических рецепторов,
то их стимуляция может сопровождаться как возбуждением, так и торможением.
Выделен ряд подтипов серотониновых рецепторов с дополнительными подразделениями для отдельных подтипов (5-НТ1А-D), 5-НТ2А-С и т.д.).
5-НТ1-рецепторы локализуются пре- и постсинаптически. Так, стимуляция 5-НТ1А-рецепторов вызывает постсинаптическое торможение. С функцией 5-НТт-рецепторов связывают пресинаптическое торможение. Передача постсинаптического возбуждения связана с рецепторами 5-НТ1С, 5-НТ2, 5-НТ3 и 5-НТ4.
Функция серотонинергической системы довольно разнообразна. Это регуляция циклов сна и бодрствования, психических функций, настроения, памяти, аппетита, возбудимости мотонейронов, регуляция проведения сенсорных стимулов (в том числе болевых), центральная терморегуляция, влияние на продукцию ряда гипоталамических факторов и гипофизарных гормонов.
Известны препараты, которые влияют на серотонинергическую систему. Так, агонист 5-НТ1А-рецепторов буспирон используется в качестве анксиолитического средства. Антагонист 5-НТ3-рецепторов ондансетрон является активным противорвотным средством. Антидепрессант флуоксетин избирательно блокирует обратный нейрональный захват серотонина, увеличивая его концентрацию в синаптической щели.
Важным медиатором, участвующим в межнейронной передаче возбуждения, является ацетилхолин. Он взаимодействует с м- и н-холинорецепторами, расположенными в различных отделах головного мозга и ствола мозга. Локализуются
1 В норме бромокриптин (как и дофамин) повышает продукцию гормона роста.
холинорецепторы как пост-, так и пресинаптически. Обычно ацетилхолин выполняет функцию возбуждающего медиатора. В отдельных случаях возникает тормозной эффект. Возбуждение пресинаптических м-холинорецепторов снижает высвобождение ацетилхолина. Функция холинорецепторов в ЦНС недостаточно ясна (особенно н-холинорецепторов). Известно, что холинергические процессы участвуют в контроле психических и моторных функций, в реакции пробуждения, в обучении. В медицинской практике центральные холиноблокаторы используют при паркинсонизме (циклодол). В последние годы пристальное внимание привлекли вещества, активирующие центральные холинергические процессы (например, антихолинэстеразные препараты, легко проникающие через гематоэнцефалический барьер, в том числе физостигмин). Это обусловлено тем, что в ряде случаев они оказывают благоприятное действие при болезни Альцгеймера (пресенильная деменция), при которой снижено содержание в головном мозге холинергических нейронов. М- и н-холинорецепторы, локализованные в ЦНС, имеют также значение в регуляции проведения ноцицептивных (болевых) стимулов.
Все большее внимание привлекает возможность фармакологической регуляции синаптических процессов, осуществляемых при участии аминокислот. К медиаторам относят ГАМК, глицин, глутамат. Кроме того, предполагают, что и ряд других аминокислот могут быть нейромедиаторами или нейромодуляторами (L-аспартат, β-аланин и др.). Более детально изучена физиологическая роль ГАМК. Известно, что она является тормозным медиатором, который взаимодействует со следующими типами рецепторов: ГАМКА, ГАМКВ и ГАМКС. Действие ГАМК и других агонистов на ГАМКА-рецепторы (пре- и постсинаптические) устраняется их антагонистом бикукуллином. В отношении ГАМКВ-рецепторов бикукуллин неэффективен.
С постсинаптическим ГАМКА-рецептором в единый макрорецепторный комплекс связаны бензодиазепиновый рецептор, а также участки, с которыми взаимодействуют барбитураты и пикротоксин. ГАМКА-рецептор регулирует проницаемость ионофоров для ионов хлора. При действии ГАМК на постсинаптические рецепторы происходит повышение хлорной проницаемости, возникают гиперполяризация и соответственно тормозной эффект. Возбуждение соответствующими агонистами аллостерических бензодиазепиновых или барбитуратных рецепторов повышает тормозной эффект ГАМК (повышается аффинитет последней к ГАМКА-рецепторам). По такому принципу действуют анксиолитики бензодиазепинового ряда и снотворные средства, являющиеся производными барбитуровой кислоты.
Через систему ГАМК опосредованы эффекты и некоторых противоэпилептических средств (фенобарбитал, натрия вальпроат). Один из агонистов ГАМКА-рецепторов (THIP) вызывает анальгетический эффект.
С помощью фармакологических веществ можно также влиять на синтез и биотрансформацию, нейрональный и глиальный захват ГАМК, изменяя ее содержание в ЦНС.
ГАМКВ-рецепторы изучены менее детально. Расположены они на пост- и пресинаптической мембранах. Имеются данные о том, что посредством G-белка ГАМКВ-рецепторы связаны с аденилатциклазой. Стимуляция этого подтипа рецепторов приводит к повышению содержания цАМФ, что уменьшает проницаемость ионных каналов для Ca2+. Воздействие ГАМК на пост- и пресинаптические ГАМКВ- рецепторы сопровождается тормозным эффектом, но механизм его не выяснен.
Из агонистов ГАМКВ-рецепторов нашел применение препарат баклофен. Он используется для снижения повышенного тонуса скелетных мышц и обладает некоторой болеутоляющей активностью. Синтезированы антагонисты ГАМКВ-рецепторов (факлофен, 2-оксисаклофен), которые используются только в экспериментальной медицине.
К числу тормозных медиаторов относится также глицин, который в наибольшем количестве содержится в сером веществе спинного мозга. Аналогично ГАМК он увеличивает проницаемость ионофоров для ионов хлора, вызывает гиперполяризацию, что сопровождается тормозным эффектом. Глициновые рецепторы блокируются стрихнином, чем, собственно, и объясняется механизм его судорожного действия. Высвобождение глицина из нервных окончаний блокируется столбнячным токсином. Подобно глицину действует и β-аланин, но его эффект не устраняется стрихнином.
Возбуждающие эндогенные аминокислоты L-глутамат и, возможно, L-ас- партат также рассматриваются в числе нейромедиаторов или нейромодуляторов. Аналогичное действие оказывает синтетическое соединение N-метил-D-аспар- тат (NMDA).
Глутамат, взаимодействуя с глутаматными рецепторами, увеличивает проницаемость мембраны для ионов натрия, вызывает деполяризацию и возбуждающий эффект. Медиаторная функция глутамата показана для гиппокампа, обонятельного тракта, кортикостриарных путей. Рецепторы возбуждающих аминокислот гетерогенны. Выделяют 3 подтипа ионотропных рецепторов: NMDA, каинатные1 и АМРА-рецепторы. Имеются также метаботропные глутаматные рецепторы.
В последние годы большое внимание привлекли NMDA-рецепторы. Это связано с тем, что их блокирование (например, дизоцилпином, ранее известным как вещество МК-801) предупреждает в эксперименте дегенерацию нейронов головного мозга при ишемии, что в перспективе может иметь важное практическое приложение (при ишемии мозга, инсультах). Кроме того, установлено, что так называемый диссоциативный анестетик кетамин является антагонистом NMDA- рецепторов. Противопаркинсонический препарат мидантан также блокирует эти рецепторы. Дальнейшее исследование возможностей фармакологической регуляции медиаторного действия возбуждающих аминокислот представляет несом- ненный интерес для изыскания противоэпилептических средств, психотропных препаратов, веществ, улучшающих память.
Важной группой медиаторов/модуляторов являются пептиды. К настоящему времени из тканей организма выделено несколько десятков пептидов, функции которых широко изучаются. Образуются биологически активные нейропептиды из предшественников, которые находятся в телах нейронов, где происходит их протеолиз. Активные метаболиты путем аксонального транспорта поступают к окончаниям нейронов, где и функционируют в качестве нейромедиаторов, комедиаторов или нейромодуляторов.
Каждый из пептидов взаимодействует со специфическими рецепторами, которые могут иметь довольно широкую локализацию (в центральной и периферической нервной системе, в тканях периферических органов). Ряд пептидов одновременно выполняет роль и гормонов, и нейромедиаторов (например, окситоцин). Наиболее детально изучена группа опиоидных пептидов - лейэнкефалин, метэнкефалин, β-эндорфин, динорфины, эндоморфины. Показано, что они специфи-
1 Агонистом каинатных рецепторов является каиновая кислота (аминокислота, выделенная из морских водорослей). В больших концентрациях обладает нейротоксическим эффектом, разрушая тела нейронов, имеющих глутаматные рецепторы.
чески взаимодействуют с разными подтипами опиоидных рецепторов (μ-, δ-, κ-рецепторами). Взаимодействие агонистов с каждым подтипом опиоидных рецепторов сопровождается определенными эффектами (см. главу 8; 8.1). Известно, что к числу опиоидов экзогенного происхождения относятся опиоидные анальгетики. Синтезированы и антагонисты опиоидных рецепторов (например, налоксон).
Предполагается, что роль нейромодуляторов выполняют также пурины - пуриновые нуклеотиды (АДФ, АМФ) и аденозин. Как уже отмечалось, имеются специальные пуриновые рецепторы (пост- и пресинаптические), которые подразделяют на Р1-рецепторы (более чувствительны к аденозину, чем к АТФ) и Р2- рецепторы (более чувствительны к АТФ). Р1-рецепторы подразделяют на аденозиновые А1- и А2-рецепторы. Пурины оказывают на нейроны ЦНС в основном угнетающее действие. Антагонисты Р1-рецепторов - метилксантины (кофеин, теофиллин и др.) - стимулируют ЦНС.
Обсуждается вопрос об участии гистамина в межнейронной передаче возбуждения. В ЦНС обнаружены гистаминовые Н1-, Н2- и Н3-рецепторы. Гистамин при ионофоретическом подведении к нейронам мозга может вызывать как возбуждающий, так и тормозной эффекты. О гистаминовых Н1- и Н2-рецепторах см. в главах 15.3 и 25.1.
Н3-рецепторы первоначально были обнаружены на гистаминергических нейронах ЦНС в виде пресинаптических рецепторов. Последние регулируют образование и высвобождение гистамина. Гистаминсодержащие нейроны в основном локализуются в заднем гипоталамусе (в туберомамиллярном ядре) и проецируются к разным областям ЦНС (коре больших полушарий, стриатуму, гиппокампу и др.). Помимо угнетающего влияния на высвобождение гистамина (роль ауторецепторов), пресинаптические Н3-рецепторы участвуют в регуляции продукции и ряда других медиаторов/модуляторов (ацетилхолина, ГАМК, дофамина, глутамата, серотонина, норадреналина), т.е. функционируют и как пресинаптические гетерорецепторы. Распределение гистаминсодержащих нейронов и гистаминовых рецепторов в ЦНС свидетельствует об участии гистамина в регуляции многих функций ЦНС. Так, гистамин, несомненно, является одним из компонентов регуляции цикла сон-бодрствование. В частности, в этом процессе принимают участие Н1-рецепторы. Известно, что блокаторы этого подтипа рецепторов, проникающие в ЦНС, оказывают седативное действие (димедрол, дипразин). Показано, что в эксперименте некоторые агонисты Н3-рецепторов удлиняют «медленный» сон.
Отмечено также, что гистаминергическая система принимает участие в регуляции таких процессов, как обучение, запоминание. Показано, например, что антагонисты Н3-рецепторов могут улучшать мыслительные функции.
Следует также отметить важную роль гистамина в развитии эпилептических судорог. При определенных экспериментальных моделях судорог некоторые антагонисты Н1-рецепторов и агонисты Н3-рецепторов оказывали противосудорожное действие. Кроме того, противогистаминные средства могут оказаться полезными при лечении ожирения1.
1Помимо ЦНС, гистаминовые Н3-рецепторы находятся также в желудочно-кишечном тракте (их стимуляция на пресинаптических окончаниях уменьшает высвобождение гистамина, что понижает секрецию хлористоводородной кислоты желудка; они участвуют также в гастропротекторном действии), в сердечно-сосудистой системе (активация пресинаптических гистаминовых Н3-рецепторов подавляет адренергические влияния), в верхних дыхательных путях (противовоспалительный эффект).
Возможности фармакотерапевтического использования агонистов и антагонистов Н3-рецепторов периферической локализации пока неясны.
Созданы агонисты [иммепип, иметит, (R)-α-метилгистамин] и антагонисты (ципроксифан, клобенпропит, тиоперамид, клозапин) Н3-рецепторов и начаты их клинические исследования.
Большое внимание привлекает также окись азота (NO). В нейронах гиппокампа и других отделах мозга обнаружена NO-синтетаза, которая участвует в биосинтезе NO. Очевидно, и в ЦНС окись азота выполняет роль медиатора. Однако ее функциональная значимость и возможности воздействия на эту систему с помощью фармакологических веществ изучены недостаточно.
В регуляции ряда функций ЦНС принимают участие и простагландины (например, в теплорегуляции, ноцицепции), что следует учитывать при создании лекарственных средств и изучении механизма их действия. Так, болеутоляющий и жаропонижающий эффекты неопиоидного анальгетика парацетамола объясняются его способностью ингибировать биосинтез простагланди-
нов в ЦНС.
В ЦНС и в периферических тканях имеются и так называемые каннабиноидные рецепторы. Каннабиноидами обозначают соединения, содержащиеся в конопле (Cannabis), а также их метаболиты и синтетические аналоги. Издавна конопля используется для получения гашиша и марихуаны, обладающих психозомиметическим действием. Основным действующим началом конопли является Δ9 -тет- рагидроканнабинол. К настоящему времени идентифицировано 2 типа каннабиноидных рецепторов - СВ1 и СВ2. Выделены также их эндогенные лиганды, в том числе - анандамид и 2-арахидонилглицерин.
Агонисты и антагонисты каннабиноидных рецепторов представляют определенный практический интерес. Так, антагонисты СВ1-рецепторов могут быть эффективны в качестве анорексигенных средств, возможно - при лечении ряда нейродегенеративных заболеваний ЦНС, шизофрении и другой патологии.
Отдельные агонисты СВ1-рецепторов уже применяются как противорвотные средства и для стимуляции аппетита. Возможно их использование при дискинезиях различного генеза, а также в качестве анальгетиков.
СВ2-рецепторы находятся в основном на иммунокомпетентных клетках, участвуя, по-видимому, в процессе модуляции высвобождения цитокинов. Действительно, у агонистов СВ2-рецепторов обнаружено противовоспалительное и иммунодепрессивное действие.
Однако, терапевтический потенциал каннабиноидов и их антагонистов пока изучен недостаточно и требует дальнейших исследований.
Выявлен еще один тип рецепторов - ваниллоидные (капсаициновые) рецепторы (VR1). Первоначально их обнаружили на мембранах первичных афферентов. Известно, что их агонистом является капсаицин1 - действующее начало красного стручкового перца (Capsicum spp.). Местное нанесение капсаицина вызывает жжение, боль, которые сменяются локальным снижением болевой чувствительности. Считают, что капсаицин приводит к истощению депо вещества Р в афферентных С-волокнах и таким путем нарушает передачу болевых импульсов в ЦНС. К числу активных экзогенных агонистов ваниллоидных рецепторов относятся также пиперин, действующее начало черного перца (Piper nigrum), и растительный токсин резинифератоксин. Одним из выделенных эндогенных агонистов VR1 является анандамид2. Получены и антагонисты VR1, например, капсазепин.
1 (Е)-8-метил-N-ваниллил- 6-нонэнамид.
2 Ваниллоидные рецепторы активируются также высокой температурой (>43?С) и при низком рН (за счет действия протонов).
Ваниллоидные рецепторы обнаружены также во многих образованиях ЦНС.
Из приведенных данных очевидно, что в центральной регуляции принимает участие множество нейромедиаторов и нейромодуляторов, взаимодействие которых и определяет функциональное состояние ЦНС. Эти нейромедиаторные системы являются важнейшей «мишенью» для воздействия фармакологических веществ.
Вместе с тем, некоторые вещества действуют непосредственно на ионные каналы, без участия рецепторов (ряд противоэпилептических средств, блокаторы кальциевых каналов).
Некоторые нейротропные средства оказывают нормализующее влияние на энергетический обмен нейронов (например, ноотропные препараты).
Для более полного представления о механизмах возникновения тех или иных эффектов необходимо располагать многими данными. Так, требуется определить центры или ассоциации нейронов, наиболее чувствительные к данному препарату, т.е. основную локализацию его действия. Следует также установить этапы синаптической передачи, которые изменяются наиболее существенно, и определить биологический субстрат, являющийся «мишенью» для фармакологического средства. Наконец, важно выяснить, каковы механизмы взаимодействия препарата с рецепторами, с эндогенными физиологически активными веществами и т.д.
Разрешение всех этих вопросов лимитируется ограниченностью сведений о физиологии и патологии ЦНС. Недостаточно изучено взаимоотношение различных отделов ЦНС. Нет исчерпывающих данных о медиаторах и модуляторах, участвующих в межнейронной передаче в ЦНС, их взаимодействии и о структуре рецепторов, с которыми они реагируют. Отсутствуют адекватные экспериментальные модели для большинства патологических состояний ЦНС. Тем не менее значительный объем фармакологических исследований в ряде случаев позволя- ет, хотя и в общих чертах, представить механизмы возникновения тех конечных эффектов, которые отражают фармакодинамику нейротропных средств и позволяют более целенаправленно использовать нейротропные препараты в медицинской практике.