Инсулин - в норме и при патологии: учебное пособие. - Мкртумян А.М. 2008. - 64 с. : илл.
|
|
|
|
СИНТЕЗ ИНСУЛИНА
Синтез инсулина в β-клетках происходит поэтапно: на первом этапе происходит образование препроинсулина, который представляет собой последовательность пре-В-цепь - соединительный пептид - А-цепь. Пре-про-последовательность, состоящая из 104 аминокислотных остатков, необходима для адресного направления молекулы в просвет эндоплазматического ретикулума. Пре-последовательность довольно быстро отщепляется, после чего проинсулин накапливается в незрелых гранулах. По мере созревания гранул происходит расщепление инсулина и соединительного пептида (С-пептида) в гранулах внутри β-клеток, после чего оба соединения накапливаются в зрелых гранулах. Гранулы, в которых присутствуют проинсулин, его интермедиаты, инсулин, С-пептид, ионы цинка и амилин, постепенно созревают, в ходе этого процесса содержание в них проинсулина снижается, а концентрация кристаллов цинка и инсулина постепенно увеличивается. Выделяются инсулин и С-пептид в аликвотных количествах во внеклеточное пространство по механизму экзоцитоза (рис. 1, см. вклейку).
Инсулин был открыт Фредериком Бантингом и Чарльзом Бестом, работавшими в лаборатории Дж. Маклеода в Торонто в 1921 г. Исследователи выделили инсулин из поджелудочной железы собаки и ввели его панкреатэктомированному животному с клиническими
проявлениями СД, что привело к нормализации уровня сахара и купировало симптомы диабета. Нобелевская премия 1923 г. по медицине была присуждена Бантингу и Маклеоду.
Инсулин - гормон, представляющий собой молекулу, состоящую из двух аминокислотных цепей: А (21 аминокислотный остаток) и В (30 аминокислотных остатков), соединенных между собой двумя дисульфидными мостиками (рис. 2). Дополнительный дисульфидный мостик соединяет два остатка цистеина в положениях 6 и 11 А- цепи. Впервые аминокислотная последовательность инсулина была расшифрована Ф. Сангером в 1955 г., за что ученый был удостоен Нобелевской премии по химии в 1958 г. Он же провел межвидовое сравнение аминокислотных последовательностей инулина и пришел к выводу, что, являясь древним соединением, инсулин, синтезируемый β-клетками, у различных животных сходен по химической структуре. Инсулин может существовать в виде мономера, димера и гексамера - 3 димера.
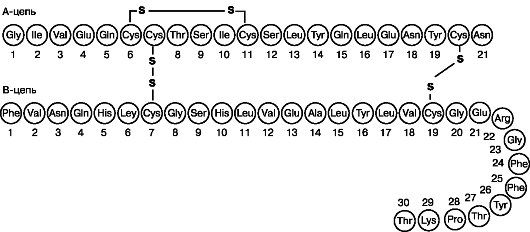 Рис. 2. Аминокислотная последовательность инсулина человека
Рис. 2. Аминокислотная последовательность инсулина человека
Необходимо отметить, что молекулы всех инсулинов обладают общим высококонсервативным участком, включающим область связывания с рецептором. Анализ межвидовых различий инсулина позволил установить наиболее консервативные аминокислоты: А1, А19, А20, А21, В23, В24, В25, составляющие рецепторный фрагмент молекулы. Все эти остатки группируются на одной стороне молеку-
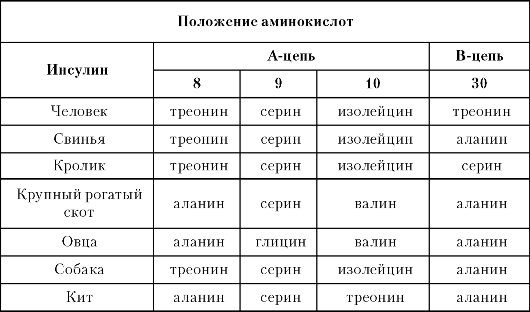
лы. Именно эта область взаимодействует с рецепторами инсулина, что позволяет понять реакцию клеток животных разных видов на инсулины различного происхождения. Мостик, соединяющий остатки цистеина в положениях 6 и 11, не участвует во взаимодействии инсулина с рецептором, но играет важную роль в формировании и поддержании трехмерной структуры гормона. В 1969 г. Ходжкин, используя рентгеноструктурный анализ, описал трехмерную структуру кристаллов свиного инсулина. Инсулины различных животных различаются вторичной структурой (формой А-цепи), а также третичной, которая собственно и определяет биологическую активность - способность взаимодействовать со специфическим рецептором, а также антигенные свойства гормона (табл. 1). Необходимо сказать, что, несмотря на различия в аминокислотных последовательностях инсулина у различных представителей высших позвоночных, именно консервативность рецепторного фрагмента позволяет инсулину одного вида позвоночных восприниматься рецепторами другого вида.
У человека ген, кодирующий структуру инсулина, локализуется на коротком плече 11 хромосомы, а ген рецептора инсулина локализован на 19 хромосоме.
Таблица 1. Различия аминокислотных последовательностей у некоторых млекопитающих
 Этапы
развития производства и получения инсулина позволяют проследить
становление генной инженерии и применения высоких технологий в медицине.
После открытия Бантинга и Беста Е. Джослин в 1922 г. с успехом начал
применять препараты инсулина в клинической практике и по праву считается
родоначальником клинической инсулинотерапии, а вместе со Штольте он
считается основателем интенсивной инсулинотерапии.
Этапы
развития производства и получения инсулина позволяют проследить
становление генной инженерии и применения высоких технологий в медицине.
После открытия Бантинга и Беста Е. Джослин в 1922 г. с успехом начал
применять препараты инсулина в клинической практике и по праву считается
родоначальником клинической инсулинотерапии, а вместе со Штольте он
считается основателем интенсивной инсулинотерапии.
В 40-х годах прошлого века начато производство НПХ-инсулина (нейтрального протамина Хагедорна), а в 1964 г. Катсояни начал химический синтез инсулина.