Лучевая диагностика: учебник: Т. 1 / под ред. проф. Г.Е. Труфанова. - 2011. - 416 с.: ил.
|
|
|
|
Глава 6. Основы и клиническое применение радионуклидного метода диагностики
ФИЗИЧЕСКИЕ ОСНОВЫ РАДИОНУКЛИДНОЙ ДИАГНОСТИКИ
В основе радионуклидного метода диагностики лежит явление естественной радиоактивности, открытое в конце XIX века французским физиком Анри Беккерелем. Этот ученый впервые показал, что некоторые химические элементы способны испускать «невидимые лучи», которые засвечивают рентгеновскую пластину так же, как и рентгеновские лучи. За это открытие Анри Беккерель в 1903 г. был удостоен Нобелевской премии.
Открытие рентгеновского излучения и естественной радиоактивности стало фундаментом, на котором построены современная ядерная физика и медицинская радиология.
Излучение, обнаруженное Беккерелем, стали называть сначала бекке-релевыми лучами - по аналогии с рентгеновскими. Однако оказалось, что новое излучение не однородное, а складывается из трех составляющих, которые стали именовать по первым буквам греческого алфавита - α-, β-и γ-излучение.
Альфа-излучение (4α2) представляет собой поток атомов гелия, лишенных электронов. Альфа-частица имеет двойной положительный заряд (два протона и два нейтрона) и массу, равную 4 атомным единицам. Пробег α-частиц в теле человека составляет несколько десятков микрон.
Бета-излучение - это поток β-частиц, т. е. электронов (e-1) или позитронов (β+). Каждая частица обладает одним элементарным положительным или отрицательным электрическим зарядом. Масса электрона составляет всего около 1/1840 массы атома водорода. Электроны, образовавшиеся при распаде радионуклидов, проникают на несколько миллиметров в ткани человека.
Гамма-излучение - электромагнитное излучение, испускаемое при радиоактивном распаде. В отличие от тормозного излучения спектр γ-излу-чения дискретный, так как переход ядра атома из одного энергетического состояния в другое осуществляется скачкообразно. Свойства γ-излучения определяются длиной волны (λ) и энергией кванта (E). Энергия γ-кван-тов находится в пределах от десятков килоэлектрон-вольт до мегаэлектронвольт, поэтому они имеют высокую проникающую способность и оказывают выраженное биологическое действие.
Современная радионуклидная диагностика основана на регистрации γ-кван-тов, либо испускаемых непосредственно радиоактивными нуклидами при
их распаде (сцинтиграфия, однофотонная эмиссионная компьютерная томография), либо образующихся при взаимодействии позитронов, испускаемых нуклидом, с электронами окружающих атомов.
Регистрация γ-квантов производится несколькими способами - подсчетом ионизаций в ионизационных камерах, газоразрядных счетчиках и фиксацией пробега γ-квантов в некоторых веществах при попадании в них ионизирующих излучений (так называемых сцинтилляторах). Число ионизаций, или сцинтилляций, соответствует числу радиоактивных распадов и, соответственно, количеству радиоактивного нуклида.
Единицей активности радионуклида в системе СИ является беккерель (Бк). 1 Бк равен 1 ядерному превращению за 1 с. На практике еще используют внесистемную единицу кюри (Ки): 1 Ки = 3,7 х 1010 ядерных превращений за 1 с; 1 Бк равен 0,027 нКи.
В общем виде схема превращений атомов испусканием γ-квантов или позитронов выглядит для гамма-излучающих нуклидов:
атом радиоактивного нуклида - стабильный атом + γ-квант; для позитрон-излучающих нуклидов:
протон - позитрон (+) + нейтрино (0) + нейтрон (0); далее в организме происходит взаимодействие позитрона с электроном электронной оболочки атомов:
позитрон (+) + электрон (-) - γ-квант + γ-квант.
В связи с различиями в физических свойствах γ-квантов, образующихся при распаде γ-излучающих и позитрон-излучающих нуклидов, в современной ядерной медицине методики с использованием тех и других выделились в самостоятельные методы, которые будут рассмотрены отдельно.
РАДИНУКЛИДНЫЕ ИССЛЕДОВАНИЯ
НА ОСНОВЕ ГАММА-ИЗЛУЧАЮЩИХ НУКЛИДОВ
Радиофармацевтическим препаратом (РФП) называется разрешенное для введения человеку с диагностической или лечебной целью химическое соединение, содержащее в своей молекуле определенный радиоактивный нуклид.
Большинство РФП, меченных γ-излучающими нуклидами, искусственно синтезированы эти химические соединения тем или иным образом отображают функцию органов и тканей или имитируют естественные метаболиты организма. В последние годы разработаны РФП на основе естественных химических соединений или их аналогов, которые более точно отражают течение биологических процессов при различных заболеваниях.
Основные требования, предъявляемые к РФП:
- низкая радиотоксичность, от которой зависит лучевая нагрузка на пациента и персонал;
- относительно короткий период полураспада;
- удобный для регистрации γ-излучения энергетический спектр;
- соответствующие биологические свойства, определяющие участие в метаболизме и позволяющие решать конкретные диагностические задачи;
- соответствующая фармакодинамика, при которой РФП быстро выводится из организма.
Радионуклиды с физическим периодом полураспада в несколько недель принято считать долгоживущими, в несколько дней - среднеживущими, в несколько часов - короткоживущими, в несколько минут - ультракоротко-живущими.
Время пребывания радионуклида в организме характеризуется периодом физического полураспада нуклида (Т1/2) и временем биологического полувыведения РФП из организма (Тб). Эти величины комбинируются в интегральную величину скорости убывания активности (Тэфф): Тэфф=Т1/2х Тб / (Т1/2+ Тб).
Для ядерной медицины в плане радиационной безопасности оптимальны короткоживущие гамма-излучающие нуклиды (99mTc, 111In, 113In, 199T1, 201T1, 123I) и ультракороткоживущие нуклиды (18F, 11C, 13N, 15O, 68Ga, 82Rb).
Следует отметить, что РФП с быстрым выведением из организма не всегда нужны для радионуклидных исследований, поскольку в исследуемом органе должно оставаться достаточное количество радиоактивного индикатора для получения качественного изображения.
РФП можно подразделить на органотропные, туморотропные, или специфические, и соединения без выраженной селективности.
По способности проникать или не проникать через гематотканевые и мембранные барьеры - на диффундирующие и недиффундирующие.
Органотропность РФП бывает направленной, если препарат создан специально для исследования определенного органа, в котором происходит его избирательное накопление, и косвенной, под которой понимают временную концентрацию РФП по пути его выведения из организма. Кроме того, существует понятие вторичной селективности, когда препарат претерпевает химические превращения, и возникают новые соединения, способные к накоплению в органах и тканях.
ОСНОВНЫЕ ТИПЫ АППАРАТОВ И ПРИНЦИПЫ РЕГИСТРАЦИИ γ-КВАНТОВ
В зависимости от способа и типа регистрации излучений все радиометрические приборы разделяются на следующие типы:
- лабораторные радиометры для измерения радиоактивности отдельных образцов или проб различных биологических сред;
- дозкалибраторы для измерения величины абсолютной радиоактивности образцов или растворов радионуклидов;
- медицинские радиометры для измерения радиоактивности всего тела или отдельного органа;
- радиографы для регистрации динамики перемещения РФП в органах с представлением информации в виде кривых;
- профильные сканеры для регистрации распределения РФП в теле больного либо в исследуемом органе с представлением данных в виде изображений (сканеры) или в виде кривых распределения.
- сцинтилляционная гамма-камера - для регистрации динамики перемещения РФП, а также для изучения его распределения в теле больного и исследуемом органе.
В настоящее время все функции радиографов и сканеров совмещают в себе современные сцинтилляционные гамма-камеры.
РЕГИСТРАЦИЯ γ-КВАНТОВ
γ-Кванты, испускаемые радионуклидами, в теле пациента распространяются прямолинейно во всех направлениях. Они улавливаются специальными детекторами, расположенными вблизи тела пациента. Поскольку детектор имеет плоскую поверхность и находится во время исследования в одной плоскости по отношению к телу, улавливаются только γ-кванты, распространяющиеся в этой плоскости.
В общем виде устройство любого радиодиагностического прибора включает в себя следующие части:
- сцинтилляционно-детектирующее устройство, осуществляющее преобразование γ- или β-излучения в энергию квантов света, а затем - в электрические сигналы;
- усилитель электрических импульсов, поступающих со сцинтилляци-онно-детектирующего устройства;
- амплитудный анализатор импульсов - устройство, дифференцирующее поступающие с усилителя сигналы;
- устройство регистрации и представления информации - преобразователь сигналов дифференциального дискриминатора в цифровую, графическую или визуальную информацию;
- специализированный или универсальный компьютер для управления процессом сбора и обработки данных.
Сцинтилляционно-детектирующее устройство состоит, как правило, из сцинтиллятора и фотоэлектронного умножителя (ФЭУ). Чаще всего в современных γ-камерах используются твердые сцинтилляторы на основе оптически прозрачных монокристаллов йодида натрия или калия, активированных таллием или теллуром. γ-Кванты, попадая в кристалл, передают ему свою энергию, в результате чего возникает свечение (флюоресценция), называемое сцинтилляцией. Это очень слабое свечение регистрируется с помощью высокочувствительного устройства - фотоэлектронного умножителя, преобразующего световые импульсы в электрические сигналы. Эти сигналы усиливаются встроенным усилителем и поступают на вход амплитудного анализатора (дифференциального дискриминатора). Число импульсов в единицу времени, или частота их следования, зависит от интенсивности излучения и, таким образом, от количества нуклида, находящегося в поле зрения детектора.
Совершенствование γ-камер и разработка нового программного обеспечения привели к созданию γ-камер с функцией томографии. Методика исследования получила название однофотонной эмиссионной компьютерной томографии (ОФЭКТ). Основными преимуществами этих комплексов
являются возможность получения срезов изучаемых органов и активное использование компьютера для управления процессом сканирования.
ОФЭКТ позволяет получить объемное представление о распределении РФП внутри исследуемого органа или области исследования. ОФЭКТ-изоб-ражения получают путем записи серии плоскостных сцинтиграмм при вращении детекторов γ-камеры вокруг тела пациента. Затем с помощью мощных компьютеров производится построение срезов в различных плоскостях. Многие современные аппараты совмещают полученные томографические срезы с компьютерно-томографическими или магнитно-резонансными изображениями и таким образом соединяют анатомическую информацию с функциональной.
ВИДЫ РАДИОНУКЛИДНЫХ ИССЛЕДОВАНИЙ
Все радионуклидные исследования разделяют на динамические и статические. Динамические исследования проводятся с целью изучения динамики распределения РФП в том или ином органе. Они состоят из записи серии кадров (плоскостных сцинтиграмм) в течение определенного времени после внутривенной инъекции РФП. Затем с помощью компьютерных программ производят обработку данных и построение кривых распределения РФП. Наиболее часто динамические исследования используются при изучении функции почек, печени и желчных путей, щитовидной железы.
Статические исследования применяют для оценки пространственного распределения РФП в теле больного или в каком-либо органе. Рассчитывают накопление РФП в тканях, сравнивают накопление в различных участках органов, оценивают равномерность накопления внутри органа. Статические исследования проводятся путем записи одной плоскостной сцинтиграммы над определенной областью тела в течение времени, необходимого для накопления достаточного объема информации.
ОФЭКТ можно отнести к разновидности статических исследований, но в последнее время разработаны программы динамической однофотон-ной эмиссионной КТ.
Все радионуклидные методы также разделяют на методы радиографической визуализации и невизуализационные методы. При радиографической визуализации распределение РФП оценивается непосредственно по сцинти-граммам или томограммам. Невизуализационные методы включают в себя методы измерения количества радионуклида в биологических средах организма и образцах тканей.
ОБЛАСТИ ПРИМЕНЕНИЯ РАДИОНУКЛИДНОЙ ДИАГНОСТИКИ
Онкология
РФП, избирательно накапливающиеся в опухолях, называют туморотроп-ными и разделяют на следующие группы:
- РФП, способные накапливаться в тканях, окружающих опухоль.
- РФП, тропные к мембранам опухолевых клеток.
- РФП, проникающие в опухолевые клетки.
Задачами радионуклидного исследования в онкологии являются:
- выявление злокачественных новообразований различных органов и тканей;
- дифференциальная диагностика злокачественных и доброкачественных процессов;
- определение эффективности проводимого оперативного или консервативного лечения;
- выявление продолженного роста опухолей.
В диагностике опухолей используют статическую сцинтиграфию и одно-фотонную эмиссионную КТ (рис. 6.1).
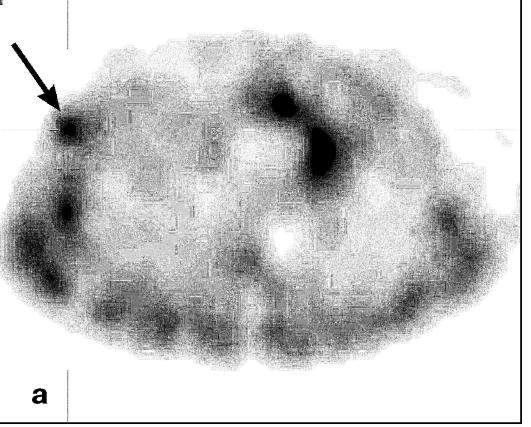
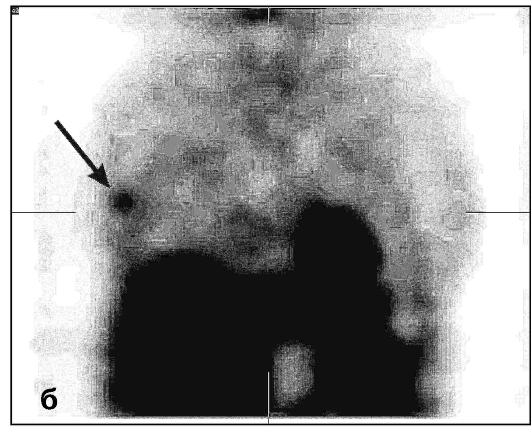
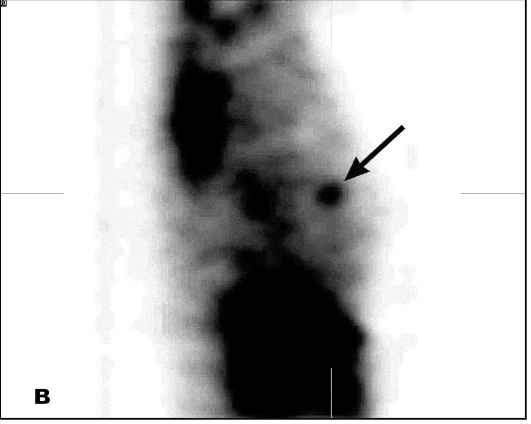
Рис. 6.1. Однофотонные эмиссионные компьютерные томограммы молочных желез. Рак левой молочной железы. На томосцин-тиграммах в аксиальной (а), фронтальной (б) и сагиттальной (в) плоскостях определяется очаг патологического накопления тумо-ротропного радиофармпрепарата (стрелка)
Кардиология
Основные задачи радионуклидной диагностики сердечно-сосудистых заболеваний:
- выявление ишемии миокарда;
- определение повреждений (некроза) сердечной мышцы;
- определение метаболизма и жизнеспособности миокарда;
- выявление воспалительных заболеваний сердечно-сосудистой системы;
- оценка центральной гемодинамики и сократительной способности
сердца.
Основной методикой радионуклидного исследования в кардиологии является однофотонная эмиссионная КТ (см. рис. 9.42).
Выявление ишемии миокарда проводится с помощью перфузионной сцинти-графии. Она позволяет:
- определить различные типы дефектов перфузии миокарда (стабильные дефекты, преходящие дефекты, полустабильные дефекты, феномен парадоксального перераспределения);
- выявить участки гибернированного миокарда - области хронически ишемизированной сердечной мышцы с обратимо нарушенной инотропной функцией, которая восстанавливается после успешной реваскуляризации;
- определить бассейн кровоснабжения коронарных артерий;
- провести дифференциальную диагностику ишемии и острого инфаркта миокарда;
- прогнозировать острые кардиальные осложнения у пациентов с коронарной недостаточностью.
Метаболизм и жизнеспособность миокарда
Основными энергетическими субстратами миокарда являются жирные кислоты и глюкоза. В норме их метаболизм сбалансирован. В условиях недостатка кислорода происходит переключение энергообразования с пути бета-окисления жирных кислот на путь анаэробного гликолиза, при котором истощаются запасы АТФ, увеличивается выработка лактата, развивается внутриклеточный ацидоз. Все это приводит к снижению сократимости миокарда.
Наиболее доступным методом оценки биоэнергетики миокарда является ОФЭКТ с 123I-жирными кислотами. Методика позволяет:
- оценить жизнеспособность миокарда;
- оценить кинетику метаболизма жирных кислот в кардиомиоцитах с помощью повторной ОФЭКТ.
В настоящее время синтезировано множество радиоактивных маркеров эндогенного метаболизма миокарда. Для оценки этих процессов одинаково часто используют ОФЭКТ и ПЭТ.
Центральная гемодинамика и сократительная функция сердца
Основной методикой является радионуклидная равновесная вентрику-лография, которая позволяет определить локальную сократимость желудочков и скорость изменений объема крови в полостях сердца.
Пульмонология
Основными методиками радионуклидных исследований легких являются перфузионная и вентиляционная сцинтиграфия легких. Используется
также ОФЭКТ.
Перфузионная сцинтиграфия легких основана на временной эмболизации капиллярного русла после внутривенного введения микроагрегатов или микросфер альбумина человеческой сыворотки, меченных радионуклидом (рис. 6.2). Отсутствие накопления РФП в какой-либо области легких свидетельствует о нарушении в ней кровотока.
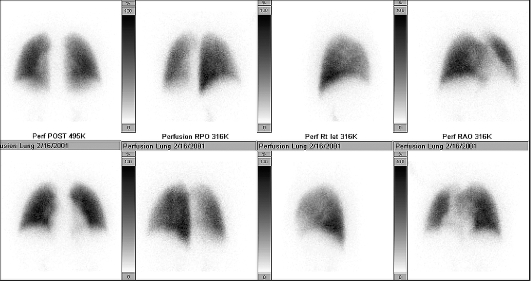
Рис. 6.2. Перфузионные сцинтиграммы легких. Норма
Достоинствами сцинтиграфии являются возможность выявления нарушений кровотока до развития клинических проявлений и рентгенологических признаков инфильтративных изменений легочной ткани и инфаркт-пневмонии. Вентиляционная сцинтиграфия легких проводится с целью определения локализации, характера и распространенности обструкционных поражений бронхиального дерева.
Урология и нефрология
Радионуклидное исследование почек позволяет оценить клубочковую фильтрацию, канальцевую секрецию, уродинамику, а также состояние паренхимы, кровоснабжение и топографию органа в одном исследовании. При этом функциональные изменения выявляются на ранних стадиях патологического процесса. Введение небольших доз РФП позволяет выполнять неоднократные исследования.
Радионуклидные методы исследования почек включают:
- ренографию;
- динамическую сцинтиграфию почек;
- статическую сцинтиграфию почек;
- ангиореносцинтиграфию (см. рис. 12.25, 12.28).
Гастроэнтерология
Печень, желчные пути и желудочно-кишечный тракт
Сцинтиграфия слюнных желез проводится для диагностики воспалительных, дистрофических и опухолевых заболеваний слюнных желез; оценки их функционального состояния при различных заболеваниях: сиалоадени-тов (в частности паротита), слюнно-каменной болезни, синдрома Шегрена (хроническое воспаление экзокринных желез с признаками секреторной недостаточности).
Сцинтиграфическая диагностика используется для выявления моторно-эвакуаторных расстройств желудка, тонкой кишки, определения тактики хирургического лечения и оценки результатов операции.
Сцинтиграфические исследования в диагностике заболеваний печени
В печени существуют 3 тканевые системы, визуализация которых требует различных РФП. Гепатобилиарная система включает в себя гепатоци-ты и желчные пути. Ретикулоэндотелиальная система (РЭС) состоит из печеночных макрофагов (клеток Купфера). Кровеносная система в состоянии покоя содержит 1/5 объема циркулирующей крови, 25% которой поступает через печеночную артерию и 75% - через портальную вену.
Основными методиками радионуклидных исследований печени и желчных путей являются динамическая сцинтиграфия печени и статическая сцинтиграфия ретикулоэндотелиальной системы (РЭС).
Динамическая сцинтиграфия гепатобилиарной системы представляет собой комплексное исследование, включающее оценку функционального состояния печени, концентрационной и двигательной функции желчного пузыря, проходимости желчных путей и определение дисфункции сфинктера Одди.
Статическая сцинтиграфия ретикулоэндотелиальной системы (РЭС) проводится с целью определения формы, размеров и нарушений анатомо-мор-фологической структуры печени и селезенки при опухолях, гепатитах, циррозах и других заболеваниях (см. рис. 6.3 на цв. вклейке).
Как при острых, так и при хронических диффузных поражениях печени (вирусные, алкогольные гепатиты, интоксикация при химиотерапии, отравления тяжелыми металлами, цирроз), ее размеры могут быть нормальными, увеличенными или уменьшенными в зависимости от тяжести процесса. Распределение РФП неравномерное. Накопление РФП в селезенке и костном мозге усиленное.
Травматология и ортопедия
Основной методикой радионуклидного исследования скелета является статическая сцинтиграфия. Иногда она дополняется однофотонной эмиссионной КТ.
В норме на сцинтиграммах визуализируются кости с симметричной аккумуляцией индикатора. Несколько большее накопление отмечается в области суставов. В мягких тканях накопление РФП минимальное (рис. 6.4).
Накопление РФП, зависит от:
- метаболической активности кости; усиление аккумуляции индикатора наблюдается в областях повышенной остеобластической активности (травмы, опухоли, воспаления);
- кровотока в костной ткани;
- симпатической иннервации.
Щитовидная железа
Сцинтиграфия щитовидной железы выполняется с целью определения функционального состояния ее ткани. Исследование проводят с помощью
радиоактивного йода (1231), чтобы оценить йодпоглотительную функцию железы, а также с помощью 99тТе-пертехнетата, который не включается в метаболизм щитовидной железы, но накапливается в ее ткани аналогично йоду. Эта методика позволяет оценить наличие, локализацию ткани щитовидной железы и ее анатомо-топографические особенности (см. рис. 6.5, 6.6, 6.7 на цв. вклейке).
Неврология и нейрохирургия
ОФЭКТ головного мозга является одним из информативных методов в неврологии.
Перфузионная томосцинтиграфия головного мозга используется для определения регионар -ного мозгового кровотока у пациентов с це-реброваскулярной патологией (инсульты, транзиторные ишемические атаки, субарах-ноидальные кровоизлияния и другие нарушения мозговой гемодинамики) (ем. рис. 6.8 на цв. вклейке).
Перфузионная ОФЭКТ играет важную роль в диагностике ранних стадий инсульта (в первые часы), когда структурные изменения еще не наступили, а нарушения регионарного кровотока уже имеются (см. рис. 6.9 на цв. вклейке).
Перфузионная ОФЭКТ может служить адекватным способом оценки перфузии после выполнения реконструктивных операций на сонных артериях, а также для выявления хирургических осложнений.
Перфузионная ОФЭКТ помогает выявить лиц с высоким риском развития инсульта в 1-ю неделю после транзиторных ишемичес-ких атак.
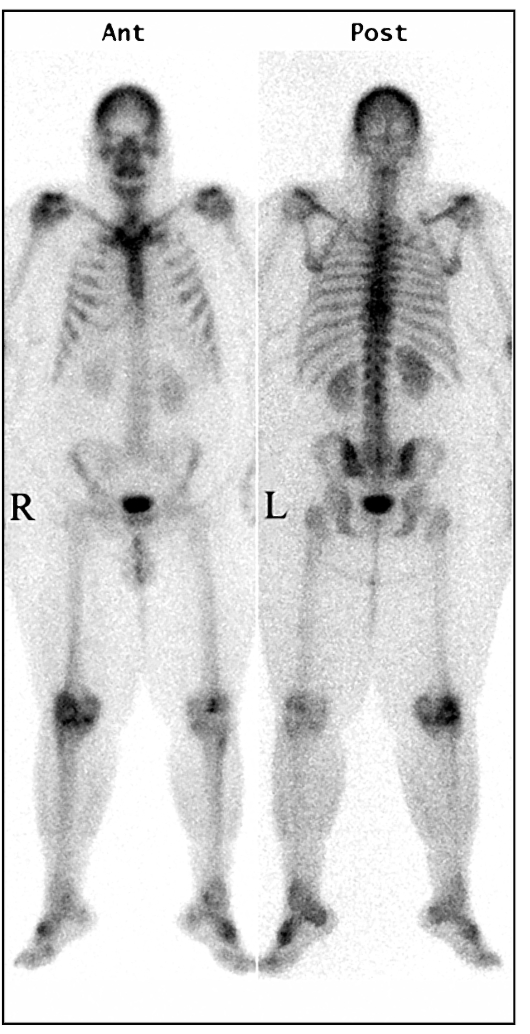
Рис. 6.4. Статические сцинти-граммы костей скелета в прямых передней и задней проекциях
Новообразования головного мозга
Сцинтиграфия позволяет:
- уточнить характер патологического очага;
- получить информацию об активности опухоли;
- визуализировать области патологического накопления относительно тех или иных анатомических образований головного мозга;
- выявить продолженный рост опухоли;
- контролировать эффективность проводимой химиотерапии или лучевой терапии;
- оценить радикальность выполненного оперативного вмешательства.
Для радионуклидной диагностики новообразований головного мозга используются РФП, не проникающие через гематоэнцефалический барьер (см. рис. 6.10 на цв. вклейке).
Воспалительные процессы
Основным преимуществом сцинтиграфической диагностики воспаления является возможность исследования всего тела. При этом используют лейкоциты больного, меченные радионуклидом (см. рис. 6.11).
Направления радионуклидной диагностики при воспалительных процессах:
- воспалительные заболевания костей и суставов.
- воспалительные заболевания органов полости живота. Радионук-лидная диагностика воспалительных заболеваний кишечника оказывается методом выбора, если возникающие в качестве осложнения воспалительного процесса стриктуры затрудняют продвижение бария или эндоскопа;
- воспалительные заболевания в кардиологии (септический эндокардит, осложнения оперативных вмешательств и миокардит);
- легочная инфекция. Сцинти-графия наиболее эффективна в фазу формирования легочного абсцесса. Кроме этого, данный метод исследования можно применять в сложных клинических ситуациях для дифференциальной диагностики абсцесса и кисты;
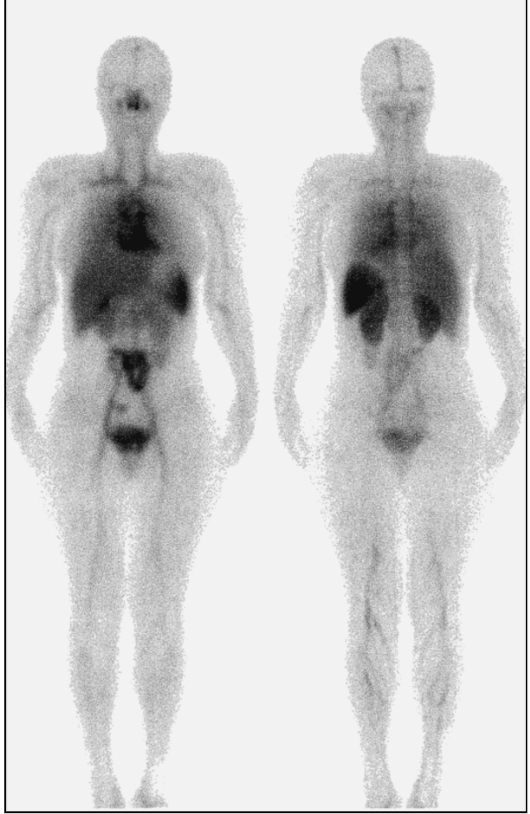
Рис. 6.11. Статические сцинтиграммы тела с мечеными лейкоцитами в норме
- воспалительные процессы в урологии и нефрологии. Необходимость в сцинтиграфической индикации очага воспаления возникает у пациентов с подозрением на инфицирование солитарных кист почек, когда денситомет-рическая оценка плотности тканей при КТ не дает информации о содержимом кист. Использование сцинтиграфии эффективно также в выявлении очага воспаления после оперативных вмешательств на органах забрюшинного пространства и при подозрениях на отторжение почечного трансплантата;
- лихорадка неясного генеза.
ПОКАЗАНИЯ К ПРОВЕДЕНИЮ РАДИОНУКЛИДНЫХ ИССЛЕДОВАНИЙ
Голова
1. Опухоли головного мозга.
2. Острые и хронические нарушения мозгового кровообращения.
3. Сосудистая и другие виды деменций; болезнь Альцгеймера, болезнь Пар-кинсона, эпилепсия и др.
4. Заболевания слюнных желез:
- воспалительные заболевания (острый и хронический сиалоденит, паротит);
- слюннокаменная болезнь;
- опухоли слюнных желез.
Шея
1. Заболевания щитовидной железы:
- дифференциальная диагностика доброкачественных и злокачественных узловых образований щитовидной железы;
- определение йодпоглотительной функции при гипо- и гипертиреозе.
2. Исследование лимфатических узлов шеи:
- дифференциальная диагностика лимфаденопатий.
Грудь
Исследование сердца.
1. Диагностика ИБС.
2. Определение степени тяжести ИБС:
- выявление скрытой ишемии;
- оценка площади поражения миокарда;
- оценка жизнеспособности миокарда;
- оценка эффективности лечения.
3. Миокардиты, инфекционный эндокардит.
4. Кардиомиопатии.
5. Оценка сократительной функции миокарда при различных заболеваниях.
Исследование легких.
1. Тромбоэмболия ветвей легочной артерии.
2. Диагностика и дифференциальная диагностика опухолей легких.
3. Определение уровня и характера обструкционных поражений бронхиального дерева.
4. Гнойно-деструктивные заболевания легких. Исследование органов средостения.
- опухолевые и опухолеподобные заболевания. Исследование молочной железы.
- диагностика и стадирование рака молочной железы. Живот
1. Органы желудочно-кишечного тракта:
- выявление нарушения моторно-эвакуаторной функции пищевода и желудка;
- определение кишечной непроходимости.
2. Паренхиматозные органы пищеварительной системы:
- воспалительные заболевания печени и желчного пузыря (острый и хронический гепатит и холецистит);
- цирроз печени;
- нарушения моторной функции желчных путей;
- желчнокаменная болезнь;
- оценка функции пересаженной печени.
3. Мочевые органы:
- оценка функции почек (травмы, воспалительные заболевания, опухоли, планирование оперативных вмешательств);
- выявление врожденных аномалий;
- оценка кровоснабжения почек;
- выявление пузырно-мочеточникового рефлюкса.
4. Надпочечники:
- дифференциальная диагностика опухолевых и неопухолевых заболеваний.
Таз
1. Мочевой пузырь:
- оценка функции мочевого пузыря.
2. Простата:
- диагностика опухолевых и неопухолевых заболеваний простаты.
Конечности и позвоночник
1. Инфекционные заболевания костей и суставов.
2. Опухоли и метастатическое поражение костей.
3. Определение степени минерализации костей.
4. Определение активности зон роста костей у детей.
Все тело
1. Выявление злокачественных новообразований различных органов и тканей.
2. Поиск метастазов первичной опухоли.
3. Поиск очагов инфекции при лихорадках неясного генеза.
4. Определение уровня нарушения оттока лимфы при различных заболеваниях и травмах.
РАДИОНУКЛИДНЫЕ ИССЛЕДОВАНИЯ
НА ОСНОВЕ ПОЗИТРОН-ИЗЛУЧАЮЩИХ НУКЛИДОВ
Позитронно-эмиссионная томография (ПЭТ) - метод радионуклидной диагностики, основанный на применении РФП, меченных нуклидами - позитронными излучателями.
Физические основы, принципы регистрации излучения и построение изображения при ПЭТ
Эмиссия позитрона из ядра атома. Ядро любого нуклида, способного к по-зитронному распаду, нестабильно из-за большего числа протонов, чем ней-
ронов. Для перехода к стабильному состоянию ему необходимо избавиться от одного протона. Это происходит в виде реакции:
протон > позитрон (+) + нейтрино (0) + нейтрон (0).
В результате получается стабильный атом, где число протононуклонов равно числу электронов. Позитрон является продуктом этой реакции.
Позитрон, который образовался в результате этой реакции, представляет собой положительно заряженную частицу с массой, равной массе электрона. После эмиссии из ядра атома позитрон проходит в окружающих тканях расстояние 1-3 мм и вступает во взаимодействие с электроном. В момент остановки в электронной оболочке атома позитрон соединяется с электроном, и масса обеих частиц превращается в два высокоэнергетических γ-кванта, разлетающихся в строго противоположные стороны (аннигиляция). Энергия каждого из этих квантов равна 511 кэВ (см. рис. 6.12).
Регистрация γ-квантов и формирование изображения. В позитронно-эмис-сионном томографе происходит регистрация γ-квантов с помощью нескольких колец детекторов. Если два γ-кванта регистрируются одновременно двумя противоположно расположенными детекторами (в течение короткого времени), то предполагается, что они возникли от аннигиляции вдоль линии, соединяющей эти детекторы. Этой принцип назван детекцией совпадения. В дальнейшем обработка полученной информации не отличается от таковой при других методах радионуклидной визуализации: γ-квант, попадая на кристалл детектора, вызывает вспышку (сцинтилляцию), фотоэлектронные умножители (ФЭУ) переводят суммарную величину таких вспышек в цифровой вид, который уже и выводится на экран дисплея.
Детекторы расположены в виде кольца вокруг исследуемого объекта, что позволяет зарегистрировать все аннигиляции с использованием схемы совпадений.
Реконструкция изображения. ПЭТ-система суммирует все линии ответа от пар детекторов, зарегистрированные за время записи, и реконструирует изображение по алгоритму аналогично КТ, МРТ и ОФЭКТ. Таким образом, получаются послойные изображения накопления РФП в исследуемой области или во всем теле сразу, и главной задачей становится определить точную локализацию этих изменений с учетом данных, ранее полученных другими методами исследований.
Методики проведения исследований в ПЭТ
Существуют две основные методики проведения сканирования при ПЭТ - динамическая и статическая.
Динамическое сканирование основано на сборе информации с одной и той же области тела через определенные промежутки времени с целью мониторирования динамики накопления РФП, например для определения скорости накопления, времени нахождения и скорости выведения РФП в патологическом образовании. В дальнейшем при полноценной статистической обработке эти параметры могут четко характеризовать патологию, позволяя сформулировать правильный диагноз.
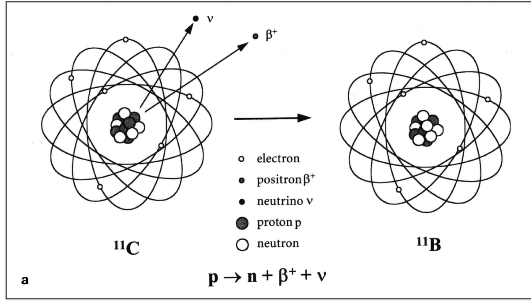
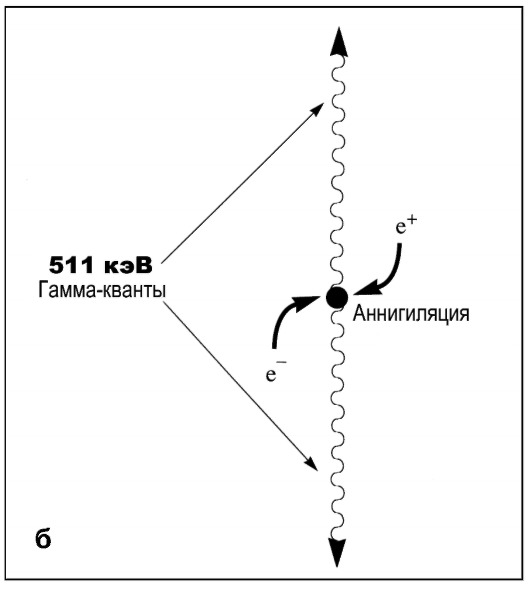
Рис. 6.12. Схема эмиссии позитрона из ядра атома и взаимодействия его с электроном: а - процесс стабилизации ядра атома с превращением протона в нейтрон и испусканием позитрона; б - взаимодействие положительно заряженного позитрона и отрицательно заряженного электрона (аннигиляция) с образованием двух гамма-квантов
Статическое сканирование - методика, основанная на однократном сборе информации с той или иной области или со всего тела через некоторое время после введения РФП. Используя этот тип сканирования, нужно знать уровни накопления введенного РФП в норме и уметь отличить их от накопления при патологических состояниях. Часто методика дополняется отсроченным сканированием, чтобы определиться с динамикой выведения РФП из образования. Например, для дифференциальной диагностики воспалительных изменений и злокачественного процесса более быстрое выведение глюкозы из патологической зоны будет свидетельствовать о воспалительных изменениях. Полученную картину накопления РФП сравнивают с результатами других (морфологических) лучевых методов исследования - КТ или МРТ.
Современные совмещенные ПЭТ-КТ-сканеры позволяют проводить одновременно два исследования (ПЭТ и КТ) и точно совмещать данные ПЭТ с результатами КТ, чтобы оценить морфологические изменения с точки зрения изменения метаболизма клеток.
Радиофармпрепараты для ПЭТ
При ПЭТ используются РФП - естественные метаболиты, меченные радиоактивным кислородом, углеродом, азотом, фтором. Эти препараты включаются в обмен веществ. В результате можно оценить процессы, протекающие на клеточном уровне.
Для ПЭТ, используются только ультракороткоживущие нуклиды. Данные об используемых нуклидах представлены в табл. 6.1.
Таблица 6.1. Нуклиды, используемые для проведения ПЭТ
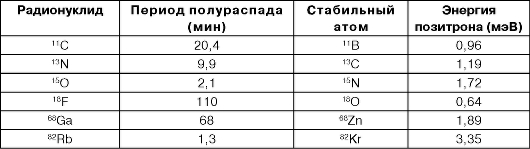
Период полураспада исчисляется несколькими минутами и даже секундами. Для производства РФП в циклотронах синтезируют ультракоротко-живущие радионуклиды. Следующим этапом является присоединение полученного нуклида к естественному метаболиту (углевод, аминокислота или жирная кислота), например: 18F + глюкоза = 18F-дезоксиглюкоза (18F-ФДГ). Это происходит в радиохимической лаборатории.
ПЭТ с 18F-ФДГ является высокоинформативной методикой, ее используют в диагностике злокачественных опухолей.
Глюкоза, попадая в кровяное русло при посредничестве переносчиков (гексокиназы), поступает внутрь клетки в виде глюкозо-6-фосфата и в дальнейшем претерпевает изменения по двум основным биохимическим путям в виде глюконеогенеза и гликолиза. В таком случае РФП был бы разрушен и потерял бы свое предназначение. 18F-ФДГ доходит только до промежуточной метаболической формы - 18F-ФДГ-6-фосфата- и далее изменений не претерпевает, оставаясь внутри клетки. Это и позволяет пронаблюдать накопление глюкозы в тканях при ПЭТ (рис. 6.13).
Через 1 ч после введения высокий захват ФДГ отмечается в головном мозге, миокарде и в почках. Увеличенный захват ФДГ также возможен в участках репарации ткани (например, после биопсии) и при инфекционных процессах. В норме захват ФДГ высокий в желудочно-кишечном тракте, щитовидной железе, слюнных железах, скелетной мускулатуре, костном мозге и в мочевых органах.
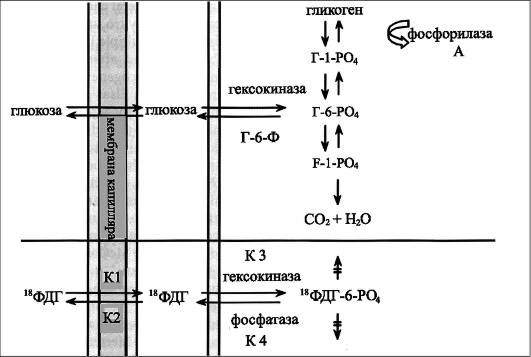
Рис. 6.13. Схема метаболизма глюкозы и 18-фтордезоксиглюкозы (ФДГ). 18-фторде-зоксиглюкоза в отличие от обычной глюкозы не подвергается метаболизму далее стадии глюкозо-6-фосфата и остается внутриклеточно. Таким образом появляется возможность регистрировать концентрацию накопления РФП
Аминокислоты. В последнее время все большее значение приобретают исследования с использованием аминокислот или их аналогов, меченных по-зитрон-излучающими нуклидами.
Транспорт аминокислот усиливается при опухолевой трансформации клетки. Рост опухоли требует повышенного поступления питательных веществ, необходимых для энергетического обмена, синтеза белка, поэтому увеличение транспорта аминокислот может быть связано со специфическими изменениями на поверхности опухолевой клетки. Эти данные послужили основой для использования меченых аминокислот в качестве РФП для визуализации опухоли, так как замена атома углерода на нуклид углерода 11С химически не изменяет молекулу.
Заметное преимущество РФП на основе аминокислот заключается в большем контрасте между опухолевой и нормальной тканью мозга в сравнении с 18F-ФДГ. Из аминокислот наиболее часто применяют 11С-метионин, главным образом из-за простого и эффективного радиохимического синтеза. С помощью 18F-ФДГ оценивается энергетический метаболизм, а 11С-метионина - транспорт и метаболизм аминокислоты. Разные физиологические механизмы накопления обусловливают различную роль этих двух РФП в ПЭТ.
Другие РФП. Существуют РФП на основе таких биологически активных веществ, как холин, ацетат, искусственно синтезированные аминокислоты: [11C] - холин для диагностики и стадирования рака предстательной железы, [11C] - ацетат для диагностики рака предстательной железы и первичного
рака печени, [15O] - вода в диагностике перфузионных расстройств головного мозга, [13N] - аммоний в диагностике метаболических нарушений миокарда, [11С] - бутират натрия в диагностике образований головного мозга.
Однако до настоящего времени нет единого суждения в выборе наиболее диагностически значимого РФП для ПЭТ. Все РФП имеют свои преимущества и недостатки.
Основы клинического применения ПЭТ
В настоящее время ПЭТ применяется для диагностики главным образом в онкологии, кардиологии и неврологии.
Онкология
ПЭТ необходима для дифференциальной диагностики опухолевых и неопухолевых изменений, выявленных при МРТ или КТ, либо для уточнения морфологической структуры опухоли, диагностированной методами лучевой диагностики (см. рис. 6.14 на цв. вклейке).
ПЭТ позволяет диагностировать и стадирования злокачественные опухоли, определить степень их злокачественности (см. рис. 6.15 на цв. вклейке).
ПЭТ также является ценной методикой при диагностике региональных и отдаленных метастазов. Становится возможным более точно установить стадию онкологического процесса для выбора оптимальной тактики лечения (см. рис. 6.16 - 6.19 на цв. вклейке).
ПЭТ отражает метаболизм клеток и поэтому позволяет оценить реакцию опухоли на химиолучевое лечение, что при соответствующем изменении тактики также улучшает прогноз и исход заболевания (рис. 6.20, рис. 6.21, 6.22 на цв. вклейке).
Кардиология
Появляется возможность прогнозировать результаты реваскуляризации миокарда.
Изображения ПЭТ демонстрируют участки снижения миокардиального кровотока. Поскольку нуклиды для ПЭТ имеют очень короткий период полураспада, возможно последовательное проведение исследования: покой- нагрузка.
Неврология и психиатрия
Применение ПЭТ с 18F-ФДГ позволяет оценить увеличение или уменьшение потребления глюкозы и локализовать эпилептогенные фокусы (см. рис. 6.23 на цв. вклейке).
ПЭТ используется в диагностике различных видов деменций, включая и болезнь Альцгеймера (см. рис. 6.24 на цв. вклейке).
Болезнь Паркинсона, болезнь Геттингтона, синдром Туретта не всегда можно точно диагностировать при КТ и МРТ. При ПЭТ определяются изменение накопления препарата в допаминовых рецепторах в проекции хвостатого ядра и скорлупы (см. рис. 6.25 на цв. вклейке).
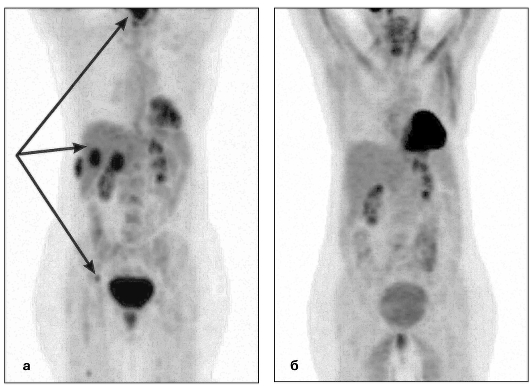
Рис. 6.20. Лимфома Ходжкина: а - на ПЭТ-томограмме до лечения отмечается множественное поражение печени и лимфатических узлов (стрелки); б - на ПЭТ-томограмме через 6 мес после химиотерапии отмечается полная ремиссия
ПОКАЗАНИЯ К ПРОВЕДЕНИЮ ПЭТ
Голова
1. Диагностика и дифференциальная диагностика злокачественных новообразований.
2. Оценка эффективности проводимого лечения.
3. Выбор наиболее активного участка опухоли для проведения биопсии.
4. Ранняя диагностика метаболических нарушений головного мозга при болезни Паркинсона, болезни Геттингтона, синдроме Туретта, деменции и болезни Альцгеймера.
Грудь, живот, малый таз, опорно-двигательная система
1. Диагностика и стадирование злокачественных новообразований.
2. Оценка эффективности лечения злокачественных опухолей.
3. Выбор наиболее активного участка опухоли для проведения биопсии.
4. Оценка жизнеспособности миокарда при ИБС.
5. Выявление ишемии миокарда при ИБС.