Общее обезболивание и седация в детской стоматологии: Руководство/ В.И. Стош, С.А. Рабинович и др. 2007 - 184 с.
|
|
|
|
ГЛАВА 3 ОСНОВНЫЕ ОСОБЕННОСТИ ОРГАНИЗМА РЕБЕНКА, ВЛИЯЮЩИЕ НА АНЕСТЕЗИОЛОГИЧЕСКОЕ ПОСОБИЕ
Для осуществления адекватного и, в первую очередь, безопасного анестезиологического пособия у детей необходимо знать и учитывать взаимодействие комплекса факторов. К ним относятся анатомические и психофизиологические особенности организма ребенка, имеющие тем большие отличия от взрослого пациента, чем меньше возраст ребенка; влияние стоматологического и возможных сопутствующих заболеваний на организм ребенка; применяемый метод анестезии и средств обезболивания; особенности воздействия стоматологического вмешательства.
Детский организм имеет ряд анатомических и психофизиологических особенностей, непосредственно связанных с его ростом и развитием. Последние протекают неравномерно и не являются простым увеличением его основных биологических параметров. Наибольшие отличия от взрослого наблюдаются с момента рождения ребенка до 6 лет. В этом возрастном периоде ребенок по всем параметрам столь значительно отличается от взрослого, что лечебные методы, навыки и средства, применяемые у взрослых, без учета этих особенностей не только не эффективны, но и опасны. Анестезиологическое пособие пациентам детского возраста требует от анестезиолога специальных знаний в области педиатрии.
Под воздействием анестезиологического пособия функции организма меняются в зависимости не только от характера операции, но и основной и сопутствующей патологии. Функциональные сдвиги в организме вызываются и непосредственно влиянием медикаментов, и совокупностью и последовательностью применения всех методов, компонентов и режимов, входящих в современное анестезиологическое пособие. Необходимо учитывать вклад, который вносят в функциональные изменения анестезия, аналгезия и атараксия, уровень миорелаксации, параметры вентиляции легких, изменения АД, температуры тела, методы, применяемые проводящими вмешательство врачами и др. Рассматривая только эффекты препаратов, применяемых для анестезии, необходимо помнить, что с учетом премедикации, индукции, ос-
новной анестезии, местных блокад и возможной инфузии растворов для лекарственной коррекции функций организма, пациент в совокупности получает сочетание множества препаратов. Учесть их взаимодействие, а иногда и противодействие, в изменении функций организма не всегда легко, но стремиться к этому необходимо.
Попытаемся суммарно отобразить особенности организма ребенка, влияющие на анестезиологическое пособие, и влияние самой анестезии и стоматологического вмешательства на его основные функции.
3.1. ВОЗРАСТНАЯ ПЕРИОДИЗАЦИЯ
Принятая в педиатрии возрастная периодизация создана на основе учета неравномерности роста и развития организма ребенка. В нашей стране наиболее распространена проверенная временем и практикой модифицированная классификация возрастных периодов Н.П. Гундобина [19, 38]. В данной классификации во внеутробном этапе развития условно выделяют следующие возрастные периоды: новорожденность - от рождения до 28 дней; грудной - от 29 дней до 1 года; преддошкольный (ранний) - от 1 года до 3 лет (первый рост в ширину); дошкольный (средний) - от 4 лет до 6 лет (первый рост в длину); школьный (старший) от 7 до 15 лет, подразделяющийся на два подпериода: второй рост в ширину (от 7 до 10 лет) и второй рост в длину (от 11 до 15 лет). Периодизация является условной - у одних детей период может начинаться раньше, а у других позже [5], но в целом она определяет выбор и особенности проведения обезболивания и всего лечебного процесса.
В периоде новорожденности наиболее характерно становление функции самостоятельного дыхания и перестройка иммунной и гормональной систем. В ходе становления самостоятельного дыхания у детей развивается метаболический ацидоз, компенсированный активной гипервентиляцией [39]. Данное положение делает необходимым при проведении анестезии обеспечивать такой же уровень легочной вентиляции. При легочной вентиляции в режиме нормоили гиповентиляции развивается декомпенсированный метаболический ацидоз, приводящий к центральному угнетению внешнего дыхания. На 3-5-й день развития отмечается ослабление пассивного иммунитета и уменьшение количества гормонов, полученных новорожденным от матери; продукция собственных гормонов, собственный иммунитет еще недостаточны
[22, 6, 62]. При нарушении поступления их с молоком матери, что, как правило, бывает у детей, нуждающихся в лечении, риск обезболивания и операции резко увеличивается.
В грудном возрасте характерны дальнейшее снижение пассивного и недостаточность активного иммунитета; функциональная незавершенность ЦНС; повышенная проницаемость гематоэнцефалического барьера; склонность к диффузным реакциям на повреждающие воздействия [7, 67, 23]. Данные особенности увеличивают возможность таких осложнений, как судорожный синдром, сепсис, гнойно-некротический трахеобронхит, полиочаговая пневмония.
Детям раннего возраста свойственен психический негативизм (первый возраст упрямства), в котором особенно тяжело переносятся разлука с родителями, госпитализация, медицинские манипуляции [29]. В возрасте 11-12 лет начинается период полового созревания, что необходимо учитывать в лечебном процессе.
3.2. ФИЗИЧЕСКОЕ РАЗВИТИЕ
Основные биологические процессы, протекающие в детском, незрелом, организме, - рост и развитие. Рост - это в основном количественный процесс, приводящий к увеличению длины и массы тела. Развитие - процесс качественный, приводящий к специализации и дифференциации клеток, тканей и органов. Между ростом и развитием существует тесная взаимосвязь, но при некоторых болезненных состояниях она может нарушаться. Под термином «физическое развитие» в клинической педиатрии подразумевают как динамический процесс (увеличение длины и массы тела, развитие отдельных частей тела и др.), так и биологическое созревание ребенка в том или ином периоде детства [53]. При этом учитывают некоторые физиометрические показатели, а у детей раннего возраста (особенно 1-го года жизни) - формирование статических и моторных функций, что в целом определяет работоспособность или запас физических сил [1, 28].
Физическое развитие - совокупность морфологических и функциональных признаков, позволяющих определить запас физических сил, выносливость и работоспособность организма.
Размеры тела как конечный результат процесса роста тесно связаны со всем комплексом функциональных свойств: основным обменом и от-
дельными видами метаболизма, гормональными и нейротрофическими факторами регуляции и др. Вследствие этого морфологический тип имеет основное значение в характеристике физического развития человека, а физиологические тесты характеризуют отдельные свойства организма. При высокой и положительной связи структурных и функциональных показателей организма морфологическая характеристика позволяет дать непосредственную оценку запаса физических сил.
Физическое развитие определяется множеством наследственных и социальных факторов. Для экспресс-оценки физического развития ребенка в первую очередь используются показатели его роста и массы тела [35, 54]. Доношенный новорожденный ребенок весит 2500-5000 г (в среднем мальчики 3500 г, девочки 3300 г). Согласно конвенциональному определению ВОЗ (1948 г.), каждый ребенок, масса тела которого при рождении меньше 2500 г, считается недоношенным. Поскольку практически 20-30% детей с массой тела меньше 2500 г рождены в срок, а около 8% недоношенных детей имеют массу тела при рождении более 2500 г, эксперты ВОЗ предложили понятие «недоношенность» заменить понятием - «малая масса при рождении». При массе тела на 25% меньше нормальной речь идет о новорожденном с внутриутробной дистрофией.
После рождения в первые 3-4 дня отмечается «физиологическая» потеря массы тела. Обычно через 2 нед она достигает исходного значения, а затем увеличивается. Определение «должной-нормальной» массы тела грудного ребенка производят по формуле:
масса тела равна массе при рождении + (произведение числа месяцев жизни на а),
где а в первом полугодии 600 г, во втором - 500 г.
В дальнейшем изменение массы тела идет неравномерно; минимальное прибавление (1,5 кг в год) происходит в 5-6 лет, максимальное (5- 6 кг в год) в пубертатном периоде. Аналогичные изменения претерпевает рост, увеличение которого особенно значительно в первые месяцы жизни.
Показатели массы тела и роста весьма вариабельны. Наибольшее значение имеет не каждый в отдельности, а их соотношение, определяющее пропорциональность развития ребенка соответственно возрасту [31].
Более емкое понятие, позволяющее оценить физическое развитие ребенка, - конституциональный тип. У правильно вскормленных, воспитанных, ухоженных детей определяется 4 основных типа конституции
[56, 70, 39]:
• нормосомия - ребенок развит и развивается гармонично, масса и рост соответствуют возрастной норме;
• гипосомия - ребенок развит гармонично, но масса и рост меньше возрастной нормы;
• гиперсомия - масса и рост заметно превышают норму;
• лептосомия - масса отстает от роста; ребенок кажется вытянутым в длину. Эти дети часто имеют астенический тип и узкую грудную клетку, удлиненное (капельное) сердце.
Дети астенического сложения отличаются симпатикотонией. У них наблюдается повышенная раздражительность, учащенный нитевидный пульс, иногда резко негативная реакция на все манипуляции. При гиперсомной конституции, если масса тела ребенка значительно превышает возрастную норму, может наблюдаться пикнический тип, характеризующийся парасимпатикотонией с тенденцией к бронхиальной астме, брадикардии. Для этих детей характерна боязливость и плаксивость, но вместе с тем легкая внушаемость.
Если наряду с ожирением у детей в подкожной клетчатке имеется повышенное содержание воды, определяется так называемый «пастозный хабитус». Заболевания у таких детей часто сопровождаются резкой гипертермией и молниеносным течением; возможно быстрое развитие подсвязочного отека с резкой дыхательной недостаточностью [39].
Обозначенные особенности физического развития ребенка имеют тем большую значимость для анестезиолога, чем сильнее отдельные конкретные параметры отличаются от нормальных возрастных величин. Уменьшение массы тела говорит о необходимости специальных мероприятий в периоде предоперационной подготовки, устранении дефицита белка, незаменимых аминокислот в пищевом рационе, коррекции водно-энергетических потерь и др.
На основе оценки физического развития ребенка проводят выбор вида и метода обезболивания, планируют объем необходимого вмешательства, рассчитывают ряд важнейших показателей, без которых лечебный процесс невозможен. Наиболее широко используют критерий массы тела при назначении лекарственных средств (на 1 кг массы тела). Однако в отдельности критерии массы или возраста не всегда надежны, особенно при патологических состояниях. Эти параметры, дополненные показателем роста, позволяют рассчитать показатель, позволяющий выяснить более точно необходимую индивидуальную дозировку лекарственных веществ для ре-
бенка - площадь поверхности тела (используют номограммы). Изменения этого показателя с возрастом соответствуют изменениям основного обмена; можно использовать и упрощенный расчет: известно, что поверхность тела у новорожденного в среднем равна 0,25 м2, у ребенка 2 лет - 0,5 м2, 9 лет - 1 м2, у взрослого - 1,75 м2.
3.3. НЕРВНАЯ СИСТЕМА
В момент рождения ребенка не завершено не только физиологическое, но и анатомическое развитие нервной системы. В связи с этим:
• извилины коры большого мозга только намечены; количество клеток коры и число межнейронных связей мало; клетки недифференцированны;
• чувствительные волокна спинномозговых нервов миелинизированы, двигательные - еще лишены миелиновой оболочки;
• таламо-паллидарная система управляется корой большого мозга в неполном объеме. Движения носят импульсивный, рефлекторностереотипный и атетозоподобный характер, в особенности в ответ на ноцицептивные раздражения. Все рефлексы, осуществляемые через подкорковые отделы - кожно-мышечные, сухожильные, лабиринтные, - чрезвычайно повышены, что вызывает склонность детей к судорожным реакциям. Развитию судорожных реакций у детей также способствуют более высокий уровень обмена и большое содержание воды в тканях мозга;
• вегетативная нервная система (ВНС) у новорожденных развита в большей степени, чем ЦНС. Регулирующая роль ВНС по отношению к внутренним органам не одинакова: лучше контролируется сердечно-сосудистая система, хуже - дыхательная. Симпатическая нервная система более развита к моменту рождения, чем парасимпатическая.
Развитие нервной системы определяет главные (для анестезиолога) особенности болевого реагирования ребенка психоэмоциональные и сенсорные. Особенно ярко проявляется развитие воли на 2-3-м году жизни. Отсутствие «опыта» ведет к тому, что ребенок неохотно подчиняется любым мерам, ограничивающим его желание (первый возраст упрямства). Это ведет к негативизму и требует особо внимательного подхода при подготовке к анестезии и различным манипуляциям. Второй воз-
раст упрямства (у девочек - 12, у мальчиков - 14 лет) совпадает с пубертатным периодом [29, 34, 8].
Неприятные моменты, сопровождающие лечебные манипуляции, могут длительно сохраняться в памяти ребенка, формируя отрицательное отношение к лечебному процессу на всю жизнь. Из табл. 3 становится ясно, что следовые реакции могут сохраняться достаточно длительное время, начиная с 2-летнего возраста.
Таблица 3.
Развитие памяти
Возраст | Способность узнавания |
3 мес | Остается в течение нескольких минут |
1 год | Сохраняется около 2 нед |
2 года | Сохраняется несколько месяцев |
4 года | Сохраняется в течение года |
Старше 4 лет | Сохраняется длительно, если не случается какого-либо события, вытесняющего эту способность |
В некоторых случаях память на отрицательные воздействия может сохраняться дольше и возникать в более раннем возрасте, чем мы предполагаем [42]. Отмечено, что психические эмоции возникают раньше, чем ребенок может выразить их словами [15]. Очень важен учет особенностей реакции ребенка на болевые раздражители. В связи с тем, что четкое «осмысление» боли связано с корой большого мозга, можно сделать ложное заключение о том, что новорожденный невосприимчив к боли. Исследования ряда авторов показали, что, уже начиная с 1-недель- ного возраста, ребенок реагирует на болевые воздействия, а в некоторых работах [63, 71] отмечена двигательная реакция на боль уже в первые часы после рождения.
Основными особенностями реакции новорожденного на боль являются быстрое истощение реакции, диффузный характер. Это приводит к тому, что менее развитые нервные регуляторные процессы, прежде всего дыхание, нарушаются раньше, чем механизмы более развитые, например регулирующие сердечно-сосудистую систему. Вследствие этого у новорожденных не наблюдается классической картины шока с выраженной сосудистой недостаточностью, а его эквивалентом является дыхательная недостаточность, приводящая (при отсутствии соответствующих лечебных мер) к гибели ребенка.
Развитие коры приводит к возможности дифференциации чувства боли - соматической, висцеральной, отраженной, но длительное время (до 10-12 лет) преобладает психогенная боль [2]. Это затрудняет диагностику и требует при лечении болевого синдрома применения не только анальгетических препаратов, но и воздействия на психику ребенка: использование психотерапии, гипноза, седативных и анксиолитических средств.
3.3.1. ВЛИЯНИЕ АНЕСТЕЗИИ НА ЦНС
Несмотря на длительный опыт применения общей анестезии в клинической практике и интенсивным научным исследованиям механизм развития общей анестезии остается до конца невыясненным.
Главная цель общей анестезии - получение обратимых специфических изменений состояния ЦНС с помощью анестезиологических средств (анестетиков). Оценивая воздействие анестетиков на ЦНС, учитывают не только их основные эффекты (атараксия, нейролепсия, аналгезия и др.), но и побочные влияния в виде изменения симпатического или парасимпатического тонуса, ганглионарной блокады, энергетического и температурного баланса и др. Эти влияния выражаются в изменении функций других систем - дыхания, кровообращения и др., причем данные изменения в свою очередь отражаются на состоянии ЦНС. Механизм развития общей анестезии, вызываемый действием общих анестетиков разных типов, неодинаков, так как связан с преимущественным изменением деятельности функционально различных структур ЦНС.
Общим для всех анестетиков воздействием на ЦНС являются изменение величины основного обмена мозга, мозгового кровотока и внутричерепного давления.
Практически все ингаляционные анестетики расширяют сосуды мозга, увеличивают мозговой кровоток и снижают потребление О2 (например, фторотан на 20%). Закись азота не влияет на мозговой кровоток, но снижает поглощение О2 на 15%.
Воздействие внутривенных анестетиков на головной мозг различается. Барбитураты почти вдвое снижают мозговой кровоток и поглощение О2; кетамин увеличивает и мозговой кровоток, и поглощение О2 мозгом. Действие фентанила и дроперидола на кровоток и поглощение О2 в мозге зависит от их доз, исходного состояния больного, величины внутри-
черепного давления и др. Чаще всего они (а также их смеси - таламонал) уменьшают мозговой кровоток.
Исходя из этих эффектов анестетиков, при высоком внутричерепном давлении, когда требуется уменьшить мозговой кровоток, нейролептаналгезия предпочтительнее ингаляционной анестезии [16, 30]. Следует учитывать, что газовый гомеостаз влияет на мозговой кровоток не меньше, чем сами анестетики [11].
3.4. ДЫХАТЕЛЬНАЯ СИСТЕМА
У детей дыхательная система служит примером незаконченности развития с недостаточностью компенсаторных механизмов [16, 64]. Новорожденные всегда дышат носом. Сравнительно слабые мышцы ротоглотки, узкие носовые ходы приводят к тому, что значительная часть работы дыхания приходится на преодоление сопротивления дыхательных путей. Специфика развития дыхательных путей способствует формированию нарушений свободной проходимости, особенно в области хоан, голосовой щели и трахеи. Существуют обильная секреция слизи, узость хоан, у детей нередко наблюдаются аденоиды и гипертрофированные миндалины. Большой язык занимает значительно большую часть полости рта по сравнению с взрослыми, что в сочетании с высоко стоящим надгортанником создает дополнительные трудности обеспечения свободной проходимости дыхательных путей при масочном способе наркоза [39].
Площадь между голосовыми связками (вход в трахею) у новорожденных составляет 14 мм2. Развитие отека объемом всего в 1 мм вследствие травмы или гипергидратации, к которому рыхлая слизистая особенно предрасположена, уменьшает просвет входа в трахею на 65%. Трахея в области перстневидного хряща - еще более узкое место: у новорожденных диаметр в данном месте всего 4 мм. В 4-летнем возрасте он равен только половине диаметра взрослого - 20 мм. Соответственно отек объемом 1 мм суживает просвет данного пространства у 4-летних детей на 75%, а у взрослых - только на 20%. Эта анатомическая особенность является одной из основных причин быстрого возникновения дыхательной недостаточности при подсвязочном отеке у детей [39].
Отношение объема легких и массы тела - дыхательная поверхность легких у детей по сравнению с взрослыми значительно меньше. Объем
грудной клетки и, соответственно, легких небольшой, особенно в сравнении с объемом брюшной полости. Расположение ребер горизонтально, грудина мягкая, что в сочетании с высоким стоянием диафрагмы ограничивает возможность увеличения объема грудной клетки при дыхании. Большую часть вентиляции обеспечивает диафрагма и любое ограничение ее подвижности, например, увеличение живота ведет к развитию респираторного дистресс-синдрома [36].
В детском возрасте основные межреберные и вспомогательные дыхательные мышцы недостаточно развиты. Это приводит к тому, что в условиях спокойного дыхания они обеспечивают относительно высокий газообмен, но при возникновении патологических состояний быстро развивается недостаточность компенсаторных возможностей (табл. 4).
Таблица 4.
Сравнение некоторых морфологических и функциональных показателей грудных детей с теми же показателями у взрослых
Показатель | Грудной ребенок | Взрослый |
Поверхность тела, м2 | 0,21 | 1,7 |
Масса тела, кг | 3 | 70 |
VO2 мл/мин (объем поглощенного О2) | 18 | 250 |
Поверхность легких, м2 | 4 | 80 |
Число альвеол 106 | 24 | 300 |
Большая потребность организма ребенка в О2 создает особенности физиологии дыхания ребенка [32, 36]. Потребление О2 у детей вдвое больше, чем у взрослых, и превышает 6 мл на 1 кг массы тела в 1 минуту. Повышение температуры тела ребенка еще более увеличивает потребность в О2. При повышении температуры тела на 1 °С основной обмен увеличивается в среднем на 13%; его увеличение более значительно, если гипертермия обусловлена ожогом, травмой или сепсисом. Основные параметры, характеризующие дыхание, определение которых не вызывает затруднений на амбулаторном приеме, приведены в табл. 5.
Кроме дыхательных (газообменных), легкие выполняют ряд иных функций. Одна из них - фильтрация, очищение крови от патологических примесей - клеточных агрегатов, сгустков фибрина и др. Присутствие ферментных систем позволяет не только задерживать эти примеси в легких, но и метаболизировать их.
Таблица 5.
Показатели дыхательного объема и частоты дыхания у детей
Показатель | Возраст детей | Взрослые (21 год) | |||||||
Новорожденные | 1 год | 3 года | 5 лет | 8 лет | 12 лет | 14 лет | муж | жен | |
Дыхательный объем, мл | 21 | 79 | 97 | 120 | 150 | 220 | 270 | 500 | 420 |
Частота дыхания, мин | 56 | 34 | 29 | 27 | 24 | 22 | 18 | 12 | 12 |
В легких вырабатывается гепарин и тромбопластин, участвующие в свертывающей и противосвертывающей системах крови. Тучные клетки альвеол продуцируют также и другие биохимически активные вещества, главным образом гистамин, которые принимают участие в регуляции перфузии легких и других органов [43, 26].
Легкие участвуют в дезактивации вазоактивных кининов, количество которых в крови резко увеличивается при шоковых и септических состояниях. Адреналин проходит через легочный фильтр, а норадреналин задерживается и разрушается им. В состоянии гипотермии и глубокого наркоза способность легких инактивировать норадреналин уменьшается, что вызывает спазм периферических сосудов и нарушение микроциркуляции. Легкие, обладая свойствами эластичного резервуара, также способствуют регуляции объема циркулирующей крови (ОЦК) и поддержания непрерывности кровотока [13].
3.4.1. ВЛИЯНИЕ АНЕСТЕЗИИ НА ДЫХАНИЕ
Анестезия оказывает на функцию дыхания многоплановое влияние, зависящее как от свойств применяемых анестетиков, так и методов проведения обезболивания и стоматологического вмешательства. Главные побочные эффекты всех анестетиков связаны с дыханием. Степень миорелаксации, положение тела пациента в ходе вмешательства, применяемый режим вентиляции легких (СВЛ, ВВЛ, ИВЛ) обладают большим влиянием на данную функцию.
Реализуются действия анестезии в первую очередь через ЦНС. Именно этим путем вызываются изменения ритма дыхания, его глуби-
ны, соотношения фаз вдоха и выдоха, режимов работы дыхательных мышц и мышц, обеспечивающих проходимость верхних дыхательных путей. Так от тонуса и степени рефлекторной активности подбородочно-язычной мышцы зависит возможность удерживания языка при вдохе на определенном расстоянии от задней стенки глотки. Мышцы, поднимающие и напрягающие небную занавеску, небно-глоточная и небно-язычная мышцы определяют положение мягкого неба, особенно в положении пациента лежа на спине: западает мягкое небо или нет. Экскурсии грудной клетки обеспечиваются сокращением диафрагмы и вспомогательных дыхательных мышц. За счет сокращения диафрагмы создается 75% изменения объема грудной полости. Вдох осуществляется активно за счет сокращения диафрагмы и наружных межреберных мышц. Выдох - процесс пассивный. При изменении условий дыхания, увеличении дыхательных усилий подключаются грудиноключично-сосцевидные, лестничные и грудные мышцы. Первые способствуют поднятию грудной клетки; лестничные мышцы препятствуют смещению верхних ребер внутрь на вдохе. Грудные мышцы при упоре рук на неподвижную опору способствуют увеличению объема грудной клетки (вдоху). Выдох, как мы уже отметили, процесс пассивный, но при увеличении дыхательных усилий и изменении положения тела пациента в его осуществление могут вовлекаться внутренние межреберные мышцы и некоторые мышцы живота, т.е. мышцы способствующие движению ребер вниз. В положении лежа на спине выдох, как правило, пассивен, а в положении стоя становится активным. Большинство стоматологических амбулаторных вмешательств под общей анестезией производят в положении пациента сидя, что может вызвать необходимость работы вспомогательных мышц.
Показатели характера дыхания, глубины и частоты используют как одни из важных клинических признаков глубины анестезии. Все внутривенные, ингаляционные анестетики и наркотические аналгетики вызывают дозозависимое угнетение дыхания и уменьшают чувствительность к СО2 Результат их воздействия неодинаков (табл. 6, 7).
По данным А.П.Зильбера [25, 26, 27, 11], в ходе анестезии уменьшается чувствительность дыхательного центра к изменениям рН, PCO2 и PO2 т.е. изменяются все звенья центральной регуляции дыхания: и хеморецепторной зоны дна IV желудочка, и синокаротидной зоны, и др.
Изменение грудных и брюшных компонентов вентиляции сопровождается уменьшением функциональной остаточной емкости (ФОЕ) лег-
Таблица 6.
Влияние ингаляционных анестетиков на дыхание
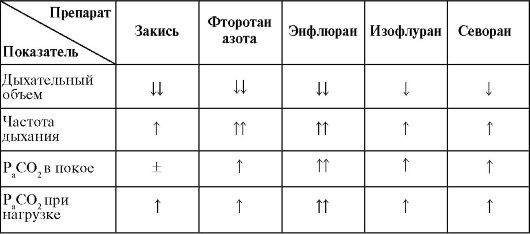 Примечание: J, - уменьшение; 4- увеличение; ± - нет изменений.
Примечание: J, - уменьшение; 4- увеличение; ± - нет изменений.
Таблица 7.
Влияние препаратов, используемых для анестезии на дыхание (сводные данные)
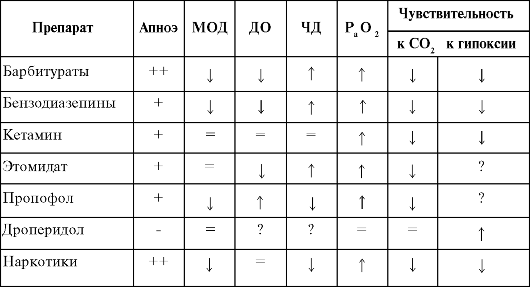 Примечание. (-)
- практически не вызывает апноэ, (+) - может возникнуть преходящее
апноэ, (++) - часто наблюдается апноэ, может потребоваться ИВЛ, (?) -
нет данных, 4 - уменьшение, 4- увеличение, (=) незначительное
влияние в стандартных дозах. МОД - минутный объем дыхания; ДО -
дыхательный объем; ИД - частота дыхания.
Примечание. (-)
- практически не вызывает апноэ, (+) - может возникнуть преходящее
апноэ, (++) - часто наблюдается апноэ, может потребоваться ИВЛ, (?) -
нет данных, 4 - уменьшение, 4- увеличение, (=) незначительное
влияние в стандартных дозах. МОД - минутный объем дыхания; ДО -
дыхательный объем; ИД - частота дыхания.
ких и резервного объема выдоха (РО). В связи с этим снижается эффективный альвеолярный объем, а альвеолярный шунт и альвеолярное мертвое пространство увеличиваются, т.е. в легких возникает иное вентиляционно-перфузионное соотношение. Из-за снижения РОвыд сокращается резерв ФОЕ, в связи с чем раньше происходит экспираторное закрытие дыхательных путей.
Данные изменения связаны не только с новым режимом центральной регуляции дыхания, изменившим соотношение грудного и диафрагмального компонентов, но и с влиянием анестетика на бронхиальный и сосудистый тонус легких. Уменьшение эффективного альвеолярного объема тем более выражено, чем продолжительнее вмешательство и анестезия.
Анестезия влияет на недыхательные функции легких, в частности на их способность контролировать уровень различных биологически активных веществ, изменяющих тонус сосудов, бронхов и вентиляционноперфузионное соотношение в легких. Нарушается выработка сурфактанта, меняется уровень серотонина, ангиотензина II, катехоламинов, циклических нуклеотидов и других биологически активных веществ [14].
Анестезия и параметры вентиляции легких (ВВЛ, ИВЛ) меняют регионарное распределение вентиляции и кровотока в легких, причем кровоток меняется в большей степени, чем вентиляция, поэтому нарушается и распределение этих соотношений. Имеются определенные различия в регионарном распределении вентиляционно-перфузионных соотношений в легких при разных методах анестезии и ИВЛ [25]. Эти регионарные различия надо учитывать при выборе метода анестезиологического пособия в связи с сопутствующей патологией органов дыхания, поскольку от вентиляционно-перфузионного соотношения в легких главным образом и зависит эффективность легочного газообмена [64].
Анестезия снижает дренирование мокроты из легких, сокращая мукоцилиарный клиренс и угнетая кашлевой рефлекс. Нормализация дренирования легких в связи с анестезиологическим пособием - обязательная задача анестезиолога, как во время операции, так и в ближайшем послеоперационном периоде.
Особое влияние на систему дыхания при анестезиологическом пособии оказывает ИВЛ. Она всегда нарушает дренаж мокроты, хотя первоначально, усиливая коллатеральную вентиляцию через поры Кона, облегчает отделение сгустка мокроты от стенки альвеолы благодаря
 Испаритель Джеймса Янга Симпсона - 1848-1850 гг. Реплика 1936 года
Испаритель Джеймса Янга Симпсона - 1848-1850 гг. Реплика 1936 года
 Межзубная распорка 1875 год, применялась во время наркоза
Межзубная распорка 1875 год, применялась во время наркоза
появлению пристеночного пузырька воздуха. Однако в дальнейшем высыхание слизистой оболочки и отсутствие кашля при ИВЛ требуют от анестезиолога специальных мер по освобождению легких от мокроты.
3.5. СИСТЕМА КРОВООБРАЩЕНИЯ
Кровообращение в организме ребенка обладает относительно большими компенсаторными возможностями [66, 39]. В связи с этим даже сравнительно тяжелые изменения в работе сердечно-сосудистой системы, появляющиеся вследствие гипоксии, кровопотери, травмы, как правило, быстро купируются по устранении действия вызвавшего их фактора.
Высокий уровень метаболизма поддерживается у детей большим сердечным выбросом (минутный объем, МО), составляющим у новорожденного около 200 мл/кг/мин, что в 2-3 раза больше, чем у взрослого [16, 36]. Отношение массы сердца к массе тела у новорожденного больше, чем у взрослого. На 1 кг массы тела у новорожденного в среднем приходится 5,5 г сердечной мышцы, к 13-16 годам - 4,5 г, а у взрослого - только 4 г. У детей достаточно велик объем несокращающейся сердечной мышцы - до 60% (у взрослых - 30%). Желудочки сердца развиты у новорожденного одинаково; небольшие желудочки определяют относительно плохую желудочковую растяжимость; отмечается правый тип электрокардиограммы. По мере взросления функционально левый желудочек начинает преобладать; окончательное формирование соотношений между желудочками наступает в постпубертатном периоде [52,68]. Изменяются и топографические взаимоотношения передней поверхности сердца с грудиной. По мере взросления сердце смещается в грудной полости вниз, что следует учитывать при проведении непрямого массажа сердца. У детей компрессию следует производить в области середины грудины, а не в нижней трети ее, как у взрослых. Сравнительно небольшая толщина грудной клетки делает хорошо слышными сердечные тоны, ослабление которых свидетельствует об ослаблении силы сердечных сокращений. Постоянное выслушивание тонов сердца - обязательный метод наблюдения во время анестезии у детей.
Крупные сосуды у детей в сравнении с артериолами и капиллярами развиты лучше, что приводит к некоторой функциональной «централи-
зации» кровообращения. Капилляры создают многочисленные анастомозы, что обеспечивает эффективный газообмен тканей в нормальных условиях.
Суммарная величина просвета артериального русла обратно пропорциональна возрасту. У маленьких детей суммарный просвет венозной части сосудистого русла практически равен этому показателю артериального русла (у взрослых он в 2 раза больше).
Формирование нервной регуляции сердца и сосудов у ребенка не закончено, но эта незавершенность меньше, чем в системе дыхания [69]. Существующее преобладание влияния симпатической нервной системы определяет склонность к значительному учащению сокращений сердца в ответ на патологические воздействия и развитию спазма сосудов даже при незначительном раздражении их стенки. Введение небольших доз местных анестетиков (новокаин, лидокаин) позволяет в этих случаях устранить спазм сосудов.
Детям свойственна характерная синусовая дыхательная аритмия, которая маскируется частым ритмом сердечных сокращений у детей до 2 лет; у детей старшего возраста - тахикардией, возникающей при напряжении, волнении, плаче, крике.
Зависимость частоты сердечных сокращений (ЧСС) и показателей АД от возраста представлена в табл. 8.
Таблица 8.
Зависимость показателей кровообращения и дыхания от возраста
Возраст | Артериальное давление, мм рт. ст. | ЧСС, уд/мин | ЧД, в 1 мин | |
Систолическое | Диастолическое | |||
Новорожденные | 70-80 | 40-60 | 140 | 50 |
3 недели | 85 | 60 | 130 | 50 |
1 год | 100 | 65 | 120 | 40 |
2 года | 100 | 65 | 110 | 30 |
4 года | 100 | 65 | 100 | 30 |
6 лет | 100 | 65 | 100 | 27 |
8 лет | 105 | 65 | 90 | 22 |
10 лет | 110 | 70 | 85 | 20 |
14 лет | 115 | 75 | 80 | 20 |
Особенности сердечно-сосудистой системы у детей обусловлены высоким уровнем обмена и повышенной потребностью в кислороде. Это обеспечивается рядом особенностей гемодинамики и состава крови.
Скорость кровотока у детей примерно в 2 раза больше, чем у взрослых. Одновременно у детей больше относительный объем крови. Он составляет у новорожденного 84 мл/кг, в то время как у взрослого только 60-65 мл/кг. Ударный и минутный объем (сердечный выброс) увеличивается с возрастом (табл. 9), однако относительно массы и поверхности тела эти показатели обратно пропорциональны возрасту.
Возможность более быстрого кровотока при относительно большем объеме обеспечивается у детей большей емкостью и меньшим периферическим сопротивлением артериального русла. Решающее значение имеет радиус сосуда. При увеличении его с 1 до 2 мм поток увеличивается в 16 раз.
Количество эритроцитов и гематокрит, а, соответственно, и содержание гемоглобина у новорожденного высокие, поэтому кислородная емкость крови больше, чем у взрослого.
Повышенная гемоконцентрация вызывает необходимость предупреждения тромбообразования - количество тромбоцитов и протромбина у детей низкое.
Наиболее важным отличием является сдвиг кривой диссоциации гемоглобина влево, что обеспечивает большее насыщение крови O2 даже при его низком парциальном давлении.
Таблица 9.
Ударный и минутный объем сердца у детей
Показатели | Возраст | |||||
1 год | 2 года | 4 года | 6 лет | 10 лет | 14 лет | |
Ударный объем, мл | 11 | 14 | 19 | 25 | 34 | 43 |
Минутный объем, мл | 1370 | 1620 | 2120 | 2500 | 3120 | 3700 |
Средний объем крови при рождении составляет 90 мл/кг. У младенцев и маленьких детей он снижается до 80 мл/кг и достигает взрослого уровня 75 мл/кг к 6-8-летнему возрасту. Кровопотери более 10% должны восполняться, если ожидаются дальнейшие потери. Большинство детей с нормальной концентрацией гемоглобина могут переносить кровопотерю до 20% от ОЦК. Восполнение объема плазменными белками
может избавить от ненужного переливания крови. Гематокрит 25% вполне приемлем и позволяет избежать трансфузии с сопутствующим риском передачи инфекции и образования антител, что позднее может вызвать проблемы в жизни, особенно у девочек.
3.5.1. ВЛИЯНИЕ АНЕСТЕЗИИ НА КРОВООБРАЩЕНИЕ
На кровообращение влияют практически все компоненты анестезиологического пособия - степень миорелаксации, методы и параметры вентиляции легких, величина АД, инфузионная терапия, а также используемые общие и местные анестетики.
Как отмечает А.П. Зильбер [11], воздействие анестетиков складывается из непосредственного, как правило, в разной степени угнетающего действия на миокард и опосредованного - через другие органы и системы. Анестетики могут модифицировать работу центральных и периферических адренергических и холинергических систем, вызывать изменения КОС и других компонентов метаболизма, газового состава крови, что инициирует изменения в системе кровообращения.
Современная анестезия многокомпонентна. Применение комбинаций различных анестетиков и других медикаментов могут давать суммарный эффект, существенно отличающийся от того, который развивается при раздельном применении этих препаратов. Эти суммарные эффекты необходимо строго учитывать в работе и это обстоятельство должно ограничивать количество одновременно применяемых препаратов, так как взаимодействие пяти и более практически не возможно прогнозировать. При анестезиологическом пособии нелегко выделить четкое влияние конкретного препарата на сердечный выброс, общее периферическое сопротивление (ОПС), ЧСС и др.
Попытаемся оценить влияние анестетиков хотя бы на основные показатели: сократимость миокарда и сердечный выброс, ОПС и ритм сердечных сокращений. Оценка этих параметров приобретает существенное значение в первую очередь при выборе метода анестезии у больных с сопутствующей патологией кровообращения.
• Влияние на миокард и сердечный выброс. Все общие анестетики, используемые в современной анестезиологии, угнетают миокард, но у многих из них это прямое действие сопровождается стимуляцией симпатико-адреналовой системы, что компенсирует депрессию миокарда. Эфир
в небольших концентрациях не снижает сердечный выброс, однако углубление анестезии, устраняющее адренергическую стимуляцию, ведет к его уменьшению. Все галоидсодержащие анестетики (фторотан, метоксифлуран, энфлуран) оказывают прямое кардиодепрессивное действие. Раньше полагали, что главным действием фторотана на кровообращение является ганглиоблокирующий эффект. Это угнетение легко обратимо и исчезает обычно в первые полчаса после прекращения анестезии. Закись азота в концентрациях, используемых при анестезиологическом пособии, видимо, не оказывает прямого действия ни на миокард, ни на сосудистую стенку. При этом она стимулирует адренергические системы, вследствие чего при анестезии кардиодепрессивное действие фторотана и других анестетиков может уменьшаться.
При нейролептаналгезии дроперидол и фентанил действуют на систему кровообращения различно. Дроперидол - слабый α-адренолитик, который несколько сокращает сердечный выброс и ударный объем, изменяя венозный возврат. Фентанил урежает сердечный ритм вследствие центрального депрессивного и холинергического эффектов, а действие его на сократимость миокарда слабо выражено. В целом нейролептаналгезия несколько ухудшает сократимость миокарда, умеренно уменьшает сердечный выброс. Пропофол значительно уменьшает сократимость миокарда.
Диазепам на миокард не действует, но кратковременно уменьшает периферическое сосудистое сопротивление, вследствие чего АД и сердечный выброс несколько уменьшаются.
Раньше полагали, что кетамин стимулирует миокард, хотя в действительности он его угнетает, а стимуляция кровообращения связана с α- и β-адреностимуляцией сосудов, блокировать которую весьма не просто.
Тиопентал-натрий снижает сердечный выброс в связи с подавлением симпатико-адреналовой активности и прямым действием на сократимость миокарда. Имеет значение и связанное с действием препарата нарушение венозного возврата крови к сердцу.
Общие анестетики изменяют тонус периферических сосудов. Вызываемые изменения в большей степени зависят от уровня анестезии, а не от свойств анестетика. Так, при использовании фторотана в концентрациях 1,5-2 об.% сосудистый тонус несколько уменьшается. Применение энфлурана, дроперидола, диазепама и тиопентал-натрия, пропофола также приводит к уменьшению сопротивления сосудов. Кетамин, наоборот, увеличивает периферическое сопротивление сосудистой системы.
Влияние общих анестетиков на сердечный ритм зависит от многих обстоятельств. Аритмии, возникающие во время анестезии, чаще связаны не с прямым действием анестетика, а со стимуляцией симпатико-адреналовой системы, а также с респираторным и метаболическим ацидозом.
Особо опасными моментами анестезии, при которых чаще возникают аритмии, являются интубация трахеи, туалет дыхательных путей, стимулирующие блуждающий нерв, а также мышечная фибрилляция при введении первых доз деполяризующих миорелаксантов. В этот момент может внезапно измениться уровень электролитов плазмы. Кроме того, дитилин может действовать прямо на холинергические синапсы.
Поскольку практически любое оперативное вмешательство вызывает в организме состояние стресса, при котором всегда нарушается микроциркуляция, имеет значение воздействие анестезии на микроциркуляцию как средства, снижающего данные нарушения.
Поверхностная анестезия эфиром, фторотаном и энфлураном увеличивает вазомоцию, т.е. поочередное заполнение и опустошение капиллярных зон, что связано с большей активностью терминальных артериол. При углублении анестезии вазомоция уменьшается, поскольку артериолы расширяются и уменьшается их реакция на катехоламины. Венулы под влиянием общей анестезии, как правило, расширяются. Барбитураты нарушают микроциркуляцию, диазепам и натрия оксибутират практически на нее не влияют.
Грубые нарушения микроциркуляции могут наблюдаться при любом анестезиологическом пособии в результате действия операции и основной патологии, ради которой она предпринята.
Влияние местных анестетиков на систему кровообращения зависит не только от характера анестетика, но и от способа его применения (инфильтрационная, проводниковая, эпидуральная спинномозговая анестезия, внутривенное введение местного анестетика).
Все местноанестезирующие препараты увеличивают рефрактерный период сердца, угнетают возбудимость, сократимость и проводимость миокарда. Учитывая этот эффект, новокаин и ксикаин (лидокаин) используют для лечения тахиаритмий. Прямое угнетающее действие местных анестетиков на миокард может проявиться при введении новокаина, лидокаина и новокаинамида в больших дозах.
Все местные анестетики, за исключением ксикаина и кокаина, оказывают и прямое действие на артериолы - вызывают вазодилатацию и
снижают сосудистое сопротивление. Сочетание прямого действия местных анестетиков на миокард, артериолы и ганглии, может привести к значительному снижению АД.
Таким образом, все имеющиеся сегодня общие и местные анестетики угнетают кровообращение, но одновременно воздействуют на системы компенсации, благодаря чему суммарный угнетающий эффект оказывается достаточно безопасным. При наличии сопутствующей патологии системы кровообращения, некорригированных волемических и метаболических расстройствах влияние анестезии на кровообращение может достичь опасных уровней, что должно быть учтено анестезиологом.
Надлежит отметить, что проблема воздействия анестетиков на кровообращение далека пока от разрешения. В первую очередь это связано с одновременным использованием нескольких анестетиков, вспомогательных медикаментов, когда трудно оценить действие каждого из них, а также и с различным исходным состоянием анестезируемых пациентов.
Под действием анестезии и оперативного вмешательства развиваются изменения КОС и газового состава крови, влияющие на кровообращение. Часто действие анестетиков на кровообращение маскируется гипоксией. Влияние гипоксии на систему кровообращения имеет двухфазный характер. В первой фазе возникает генерализованный спазм артериол и венул (кроме мозгового и коронарного бассейна микроциркуляции), возрастают АД и ЧСС. Вторая фаза наблюдается при увеличении гипоксии: если она своевременно не устранена и развиваются реологические расстройства кровотока с секвестрацией крови и снижением ОЦК. Развиваются метаболический ацидоз, электролитные расстройства, интерстициальный отек из-за увеличения проницаемости мембран. Возникает миокардиальная недостаточность. Гипероксия, встречающаяся при анестезиологическом пособии, может сопровождаться брадикардией, снижением АД вследствие химической денервации каротидного узла.
Респираторный ацидоз стимулирует симпатико-адреналовую систему и, следовательно, выброс катехоламинов. Благодаря этому компенсируется прямое угнетающее действие гиперкапнии на миокард. Гиперкапния влияет на пороговую концентрацию различных анестетиков, при которой возникает аритмия (аритмический порог). При выраженном респираторном ацидозе возможен повышенный транспорт К+ из клеток в межклеточную жидкость, меняющий сократимость миокарда.
Воздействие гиперкапнии, если ей не сопутствует гипоксия, на кровообращение имеет компенсированный характер. Увеличение PaCO2 до известных пределов увеличивает и сердечный выброс. Поскольку гиперкапния стимулирует симпатико-адреналовую систему, ее быстрое устранение может привести к тяжелому коллапсу («постгиперкапническая гипотензия»), который может наблюдаться после окончания общей анестезии по закрытому контуру, если поглощение CO2 было неполным, или при гиповентиляции.
Респираторный алкалоз приводит к спазму резистивных сосудов и брадикардии. Во время анестезии гипокапния может быть связана с режимом ИВЛ, а также со снижением продукции CO2, вызванным угнетением метаболизма под влиянием анестезии, миорелаксации и низкой температуры тела. Гипокапния может уменьшать сердечный выброс.
Кроме описанных выше воздействий, анестезия, в особенности, если она сопровождается гиповолемией, может вызывать постуральные реакции кровообращения, выражающиеся в изменении сосудистого тонуса. Основной механизм постуральных реакций - снижение или увеличение венозного возврата при изменении положения тела. Растяжение опасных рефлексогенных зон при неудачной операционной позиции, грубых воздействиях, недостаточной глубине анестезии также представляет значительную опасность.
Рефлекторная импульсация из операционной раны может привести к аритмии, фибрилляции сердца или асистолии, сосудистой дистонии. Наиболее опасными рефлексогенными зонами являются гортань и глотка, желчные пути, средостение, легкие, промежность, брыжейка, глазные яблоки, надкостница.
Также возможно опосредованное воздействие на работу системы кровообращения анестезии через систему крови, изменения которой во время вмешательства и анестезии оценивают чаще всего как изменения объема и распределения крови в сосудистом русле. Оценка свойств крови в связи с анестезиологическим пособием почти не проводилась, за исключением исследований свертывающей и связанных с нею систем крови - фибринолитической и антикоагулянтной.
Свертывающая система крови изменяется под влиянием анестезии. Происходящие изменения связаны не только со свойствами анестетика, но и с подавлением симпатико-адреналовой активности, метаболическими расстройствами, нарушением кислородного и углекислотного гомеостаза. Применение лекарственных средств при использовании вспо-
могательных методов также влияет на реологические свойства и свертываемость крови.
Большое значение приобретает исходное состояние свертывающей системы крови в связи с наличием ее собственной патологии или патологии систем, от которых она зависит: кровообращения, дыхания, печени, почек, селезенки, костного мозга. Естественно, что на изменение свертывающей системы крови при анестезиологическом пособии влияет антикоагулянтная и фибринолитическая терапия, проведенная до операции.
Различные средства, применяемые во время и после операции, влияют на систему свертывания крови. Адреналин и другие катехоламины, эфедрин, атропин, никотиновая кислота, морфин, пахикарпин, прогестерон предрасполагают к гиперкоагуляции, в то время как ацетилсалициловая кислота и другие салицилаты, курантил, индометацин, кавинтон, трентал, инсулин, пенициллин, антикоагулянты замедляют процесс свертывания. Мочегонные с различным механизмом действия могут увеличить вязкость крови, и тогда возникает гиперкоагуляция. Декстраны и другие дезагреганты изменяют заряд форменных элементов крови, препятствуют их склеиванию и, следовательно, предрасполагают к гипокоагуляции, поэтому дозу вводимых декстранов надо регулировать под контролем результатов исследования свертывающей активности крови.
Оценка действия самих анестетиков показала, что во время анестезии на свертывающую систему крови влияют не столько свойства анестетика, сколько степень угнетения или возбуждения симпатико-адреналовой активности, так как катехоламины усиливают свертывание крови [26]. Следовательно, поверхностная анестезия любым анестетиком, гипоксия, гиперкапния способствуют гиперкоагуляции из-за возникающей гиперкатехоламинемии, тогда как глубокая анестезия ведет к гипокоагуляции, если не сопровождается гиповентиляцией, гипоксией и гиперкапнией. Влияние режима анестезии на микроциркуляцию и, следовательно, на реологические свойства крови также активнее изменяет свертывающую систему крови, чем сами свойства анестетика.
Активность факторов свертывающей системы варьирует при наличии патологии внутренних органов: гиперспленизм с тромбоцитопенией или гемолизом, патология печени (гипопротеинемия, гипофибриногенемия и недостаток некоторых факторов), авитаминозы, капилляропатии при болезни Шенлейна-Геноха, синдроме Элерса-Данлоса (врожденная патология сосудистой стенки), васкулитных коллагенозах, анафилактичес-
кой реакции типа феномена Санарелли-Шварцмана и др. В подобных ситуациях анестезиолог должен своевременно установить и по возможности ликвидировать дефицит того или иного фактора.
3.6. ПИЩЕВАРИТЕЛЬНАЯ СИСТЕМА
У детей пищеварительная система имеет ряд особеностей. Отсутствие зубов и большой язык, занимающий больший, чем у взрослого, объем полости рта, затрудняют обеспечение свободной проходимости верхних дыхательных путей при проведении наркоза масочным способом. Введение ротового воздуховода и разгибание головы не всегда позволяют решить эту проблему. Молочные зубы, как правило, прорезываются в течение 1-го года жизни и выпадают, начиная с 6 лет и до конца подросткового периода. Наличие подвижных, шатающихся зубов при неосторожных манипуляциях в полости рта может приводить к их аспирации; такие зубы необходимо выявить при предоперационном осмотре. Иногда для предотвращения аспирации шатающиеся зубы приходится удалять.
Слизистая оболочка полости рта у новорожденного отличается нежностью эпителиального покрова, относительной сухостью и обилием кровеносных сосудов. Она легко ранима и при ее травме высока вероятность кровотечения. Продукция слюны при рождении мала, что способствует легкому инфицированию слизистой оболочки. В 4-5-месячном возрасте отмечается период усиленного физиологического слюноотделения: возникает опасность нарушения проходимости дыхательных путей слюной во время наркоза и операции.
Пищевой рефлекс в раннем возрасте является доминирующим, в связи с чем даже раздражающие вещества при случайном попадании в полость рта ребенка будут проглочены вследствие высокого автоматизма акта глотания. Это положение и то, что объем одного глотка у детей относительно больше, чем у взрослых, увеличивают вероятность возникновения более тяжелых отравлений при приеме ядовитых веществ.
Прежде считалось [39], что опорожнение желудка у грудных детей происходит значительно медленнее, чем в любом другом возрасте: у 30% детей желудок опорожняется в течение 5 ч; у 43% детей опорожнение затягивается и продолжается свыше 8 ч. Недавние исследования [81, 83, 116, 118] показали большую скорость опорожнения желудка у де-
тей - 99% содержимого выводится в течение 2 ч, однако этот показатель определяется несколькими факторами. Они включают в себя объем желудочного содержимого и его состав, различные патологические состояния и лечебные назначения. У маленьких детей нередко наблюдается аэрофагия.
В раннем детском возрасте отмечают слабость кардиального сфинктера желудка с одновременным мощным развитием мышечного слоя привратника. Все это создает опасность регургитации в ходе наркоза и после операции. Регургитация - пассивное (вследствие этого поздно замечаемое) вытекание содержимого желудка, как правило, приводящее к его аспирации с тяжелыми последствиями - аспирационной пневмонией, а иногда и летальным исходом. Повышенная активность блуждающих нервов стимулирует гастроспазм, а чревных нервов - спазм привратника, что способствует частому возникновению рвоты у детей. Приведенные данные определяют большую важность проблемы «пустого желудка» и применения так называемого «режима ничего через рот» (НЧР) перед анестезией и операцией, что позволяет свести к минимуму риск регургитации и аспирационной пневмонии. Каков же интервал, в течение которого следует соблюдать режим НЧР? По этому поводу существуют разные мнения. Канадское анестезиологическое общество [86] рекомендует перед плановой операцией соблюдать этот режим у детей в течение как минимум 5 ч. Мы считаем, что следует отказаться от приема молока, смесей и твердой пищи в течение указанного времени в табл. 10.
Таблица 10.
Продолжительность режима НЧР перед операцией
 Примечание: * - чистые жидкости - вода, сок без мякоти, раствор глюкозы.
Примечание: * - чистые жидкости - вода, сок без мякоти, раствор глюкозы.
Исследования показали, что прием чистых жидкостей ближе ко времени операции уменьшает возможность гипогликемии и способствует более гладкой индукции и стабильному течению анестезии. Мы рекомендуем детям последний прием жидкости не позднее 2 ч до планируемых анестезии и вмешательства.
Относительные размеры печени у новорожденного и грудного ребенка велики - 4% от массы тела (у взрослого - 2%). При этом она частично функционально недоразвита, но быстро становится центром продукции протеинов и детоксикации лекарств. У новорожденных отмечается количественное и качественное различие плазменных протеинов при снижении плазменного альбумина. Это означает, что связывание протеинами у них меньше, что позволяет большему количеству препарата оставаться активным. У грудных детей особенно незрелы в функциональном состоянии ферментативные системы печени, участвующие в конъюгации веществ. Некоторые лекарства (например, диазепам и витамин К) могут конкурировать с билирубином за протеины и повышать вероятность развития желтухи у новорожденных. Желтуха, наблюдаемая у новорожденных, может быть физиологической или патологической. Гипербилирубинемия и вытеснение билирубина, связанного с альбуминами, лекарственными препаратами могут приводить к развитию билирубиновой энцефалопатии, которая у недоношенных детей развивается при более низких уровнях билирубина, чем у детей, рожденных в срок.
Недоразвитие печеночных микросомальных ферментов может быть ответственно за чрезвычайно редкое печеночное повреждение, связанное с фторотаном, у пациентов моложе 10 лет.
Незрелость ферментативных систем, участвующих в инактивации токсичных продуктов в печени, сопровождается у младших детей недостаточной дифференциацией паренхимы печени и ее полнокровием. Этим объясняется возможность быстрого повреждения печени под влиянием инфекции и интоксикации.
Действие анестезии, вызывающее уменьшение кровотока в печени или гипоксемию может резко усугублять функциональную недостаточность, поэтому неправильное применение анестетиков и методов анестезии, ухудшающих кровоток, у детей чаще, чем у взрослых, приводит к острой печеночной недостаточности.
3.6.1. АНЕСТЕЗИЯ И ФУНКЦИЯ ПЕЧЕНИ
В ходе анестезии оперативного вмешательства на функциональное состояние печени влияет множество факторов:
• операционные факторы (кровотечение, патологические рефлексы, гиперкатехоламинемия, истощающая гликогенные депо печени и др.);
• гемотрансфузионная терапия;
• режим вентиляции и зависящий от него кислородный и углекислотный гомеостаз;
• действие анестетиков и других медикаментов, используемых при операции и анестезии.
Все они главным образом изменяют печеночной кровоток и метаболические процессы в печени [11, 26]. Печеночный кровоток нарушают все виды гиповолемии; гиповолемию с нарушением печеночного кровотока может вызвать и общая анестезия избыточной глубины.
Снижение печеночного кровотока иногда наблюдается и при использовании некоторых анестетиков в умеренных дозах. Например, фторотан несколько снижает печеночный кровоток без повышения сосудистого сопротивления органов брюшной полости; эфир и тиопентал-натрия на печеночный кровоток не влияют.
Трансфузия крови и белковых препаратов представляет несомненную опасность для печени в связи с тем, что аллергия является одним из ведущих факторов повреждения печени. Гепатотоксический эффект анестетиков среди прочих факторов оперативного вмешательства, вероятно, наименее опасен для здоровой печени. Тем не менее гепатотоксичность различных анестетиков заслуживает обсуждения.
Прежде чем относить возникновение гепатита или печеночной недостаточности за счет прямого или опосредованного действия анестетика на печень, следует исключить ряд других, более частых и более важных факторов. Надо убедиться в том, что больной не страдал скрытой печеночной недостаточностью, что ему не вводили гепатотоксические антибиотики или иные лекарственные средства. Необходимо исключить влияние гиповолемии любой этиологии, гипоксии, гемолиза и других повреждающих печень факторов, не относящихся к действию анестезии.
Почти все лекарственные средства, так или иначе, детоксицируются печенью. Ни один из применяемых в настоящее время анестетиков, кроме хлороформа и фторотана, не дает особого гепатотоксического эффекта, большего, чем любое другое лекарство. Относительно гепатотоксичности фторотана до сих пор высказывают различные мнения. Нарушения функции печени после повторной фторотановой анестезии были зарегистрированы у детей, однако их частота чрезвычайно мала по сравнению с таковой у взрослых. Тем не менее, хотя не следует опасаться применять фторотан у больных со здоровой печенью, лучше отказаться от него при печеночной патологии.
Тиопентал-натрий не является гепатотоксичным анестетиком и разрушается в печени не более, чем любой анестетик, однако при его введении происходит связывание молекул тиопентал-натрия с молекулами альбуминов. Образовавшиеся комплексы не обладают ни наркотическими, ни токсическими свойствами: так обезвреживается основная часть введенного препарата. Небольшие его количества связываются мышцами, жировой тканью, часть разрушается в печени. Следовательно, тиопентал-натрия не опасен для функций печени, но недостаток альбуминов, который, как правило, наблюдается при печеночной недостаточности, может иметь опасные последствия [26]. Тиопентал-натрий, не соединившийся с альбуминами плазмы, циркулирует в организме в виде активного анестетика, вызывая гораздо более глубокую анестезию, чем требуется. Возникают передозировка и, как немедленное следствие, угнетение дыхания и кровообращения, которое в свою очередь ведет к опасным для печени гипоксии, респираторному ацидозу и сокращению кровотока. Более того, связывание тиопентал-натрия с альбуминами происходит только при нормальной или слабоосновной реакции плазмы. При возникновении респираторного и метаболического ацидоза оно резко нарушается, свободного тиопентал-натрия остается еще больше, анестезия углубляется без введения дополнительного количества анестетика, действие патологических механизмов усугубляется.
Очевидно, прежде чем установить дозу вводимого при патологии печени тиопентал-натрия, следует определить уровень альбуминов плазмы. При гипоальбуминемии анестезия необходимой глубины может быть достигнута значительно меньшими количествами препарата.
Закись азота сама по себе не оказывает вредного влияния на печень. Эфир может вызывать гиперкатехоламинемию, которая уменьшает гликогенное депо печени, только в этом и проявляется его неблагоприятное влияние на печень.
Местные анестетики не дают заметного гепатотоксического эффекта, но выраженной гепатотоксичностью обладает гиперкатехоламинемия, связанная с болевым и психоэмоциональным фактором. Она способствует сокращению депо гликогена, нарушает микроциркуляцию в печени, ведет к гиповолемии, поэтому для функционального состояния печени недостаточная местная анестезия гораздо опаснее, чем общая анестезия.
3.7. МОЧЕВЫДЕЛИТЕЛЬНАЯ СИСТЕМА
В момент рождения развитие почек не закончено. Мочевые канальцы и корковый слой слабо развиты. Скорость клубочковой фильтрации составляет 15-30% нормальной величины для взрослого и достигает его уровня к концу 1-го года жизни. Новорожденный в первые дни жизни выделяет очень насыщенную мочу в небольшом количестве. С 4-5-го дня количество отделяемой мочи увеличивается, а ее относительная плотность уменьшается. В этот период почечный клиренс лекарственных средств и их метаболитов снижен.
Недостаточность функции почек особенно ярко проявляется по отношению к натрию и хлору, поэтому введение физиологического раствора у новорожденных и грудных детей не оправдано. Необходимо учитывать и то, что у детей обмен воды происходит значительно быстрее, чем у взрослых. При низкой концентрационной способности почек это представляет повышенные требования к их выделительной функции. Почки у маленьких детей работают как бы на пределе своих возможностей - всегда велика вероятность развития водной интоксикации и межтканевого отека. Анестезия и оперативное вмешательство могут ухудшать функцию почек.
3.7.1. АНЕСТЕЗИЯ И ФУНКЦИЯ ПОЧЕК
Во время оперативного вмешательства на функциональное состояние почек, как и печени, анестезиологическое пособие влияет положительно, защищая от многих факторов операционной агрессии - травмы, гипоксии, гиперкатехоламинемии и др.
Анестезиологические средства, как правило, не угнетают функцию почек. Наоборот, снятие страха и эмоционального напряжения с помощью средств, применяемых для премедикации и индукции, предупреждает гиперкатехоламинемию и уменьшает вредное влияние оперативного вмешательства на почки. Хорошую защиту от операционного стресса обеспечивает нейролептаналгезия (НЛА), хотя при ней несколько повышено содержание антидиуретического гормона (АДГ), сокращающего диурез.
Нефротоксический эффект анестетиков по сравнению с факторами, сопутствующими оперативному вмешательству, главным образом
гиповолемией и гипоксией, не имеет клинического значения. Исключение составляет лишь метоксифлюран, о нефротоксичности которого сообщают довольно часто. Его не следует использовать при анестезиологическом пособии больным с функционально неполноценными почками.
Все другие общие анестетики, применяемые в современной анестезиологии, в клинических дозах не оказывают повреждающего действия на функцию почек, хотя изменения, главным образом фильтрации с мало меняющейся реабсорбцией, наблюдаются при общей анестезии большинством известных анестетиков. Это сопровождается снижением минутного диуреза (иногда до 50% нормальной величины), но в течение нескольких часов после операции функции почек нормализуются. Если же этого не происходит, то вероятнее всего является следствием многообразных патологических влияний на почки во время операции и в ближайшем периоде после нее, которые анестезиолог не сумел устранить.
Миорелаксанты не оказывают негативного действия на почки, но могут задерживаться при их патологии и циркулировать, вызывая продленное апноэ.
Какова бы ни была природа гиповолемии и артериальной гипотензии, применение вазопрессоров, в частности норадреналина, ухудшает, а не улучшает состояние почек, поскольку централизация кровотока под их воздействием происходит за счет сокращения кровоснабжения почек и других органов.
Помимо гиповолемии, гипоксии и ацидоза во время операции почки могут быть повреждены свободным гемоглобином и миоглобином. Гемолиз во время операции - это чаще всего результат гемотрансфузии, а миолиз - следствие мышечной ишемии, а иногда злокачественной гипертермии. Почки фильтруют свободный гемоглобин, если его уровень в плазме превышает 0,5-1,4 г/л, а миоглобин - свыше 0,15 г/л [90]. Если во время операции установлен гемолиз или миолиз, то стимуляция диуреза и введение натрия гидрокарбоната обязательны.
До тех пор, пока диурез во время операции и анестезии находится в пределах 0,5-1 мл/мин, анестезиолог может не беспокоиться за функцию почек, но сокращение его ниже этого предела - сигнал к немедленным диагностическим и лечебным действиям.
В соответствии с вышеизложенным особое опасение относительно функции почек при проведении анестезии вызывают дети моложе 1 года.
3.8. ЭНДОКРИННАЯ СИСТЕМА
Поджелудочная железа. У новорожденных, особенно недоношенных, низки запасы гликогена, в связи с чем у них чаще развивается гипогликемия. Дети, рожденные матерью, страдающей сахарным диабетом, также склонны к гипогликемии. У них наблюдается гиперинсулинемия, возникающая во внутриутробной жизни в ответ на повышенное содержание глюкозы в материнской крови.
Щитовидная железа имеет относительно небольшие размеры, но интенсивность обмена тироксина у детей раннего возраста значительно выше, чем у взрослых. Гипотиреоз у детей - наиболее часто встречающееся эндокринное заболевание. Наиболее вероятно, что большинство случаев развития «необъяснимого» подсвязочного отека связано с ухудшением функции щитовидной железы, вызванным анестезией и операцией у ребенка, исходно имевшего гипотиреоз.
Надпочечники у новорожденных имеют относительно больший, чем у взрослых, размер. При этом отмечается их функциональная незрелость. В строении надпочечников преобладает «эмбриональная» кора. В крови циркулируют глюкокортикоидные гормоны, полученные от матери. В момент становления мочевыделительной функции (конец 1-й недели) количество глюкокортикоидных гормонов в крови уменьшается, а достаточное количество собственных гормонов ребенок вырабатывает только в возрасте 1 мес и старше. Мозговое вещество надпочечников в этот период продуцирует почти исключительно норадреналин; продукция адреналина минимальна. Норадреналин исполняет роль медиатора симпатической нервной системы, хорошо развитой у ребенка к моменту рождения. Адреналин же является как бы «аварийным» гормоном, действие которого полностью проявляется во время стресса. Этим подтверждается представление о меньшей защищенности новорожденного в период от 1-й недели до 1-го месяца его постнатальной жизни.
Вилочковая железа (тимус) относительно наиболее выражена при рождении, хотя ее абсолютная наибольшая масса отмечена в пубертатном периоде. Раннему детскому возрасту свойственно физиологическое увеличение размеров вилочковой железы, но существуют и патологические состояния, встречающиеся крайне редко, вызывающие затруднения дыхания, такие как тимогенный стридор. Гиперплазия вилочковой железы может приводить к развитию тимико-лимфатического статуса. Этим термином обозначают синдром, который состоит в увеличении вилочко-
вой железы и лимфатических органов в склонности к пастозному телосложению (при нормальной массе тела), гипоплазии сосудистой системы (главным образом узкой аорты), тенденции к патологической реактивности системы кровообращения и внезапной смерти. У детей с данным статусом отмечаются бледность, пастозность, гипотоничность, нередко обнаруживают признаки лимфатического диатеза - следует полагать, что это состояние является вторичным. Оно обусловлено гипофункцией коры надпочечников и вызываемой стрессорными воздействиями ее недостаточностью, поэтому и лечение направлено на искусственное возмещение недостатка глюкокортикоидных гормонов.
3.8.1. ЭНДОКРИННАЯ СИСТЕМА И АНЕСТЕЗИЯ
Анестезиологическое пособие в сравнении с оперативным вмешательством и имеющимся заболеванием оказывает значительно меньшее влияние на эндокринную систему.
При изучении функции гипофиза выявлено, что уровень адренокортикотропного гормона (АКТГ) при вводной анестезии увеличивается, и его увеличение сохраняется в течение всего оперативного вмешательства. Данное действие анестезии наблюдается при общем обезболивании эфиром, фторотаном, натрия оксибутиратом, НЛА и в послеоперационном периоде. При местной анестезии ни во время операции, ни в послеоперационном периоде уровень АКТГ плазмы не повышается. Премедикация фенотиазиновыми препаратами, морфином и барбитуратами уменьшает секрецию АКТГ и, соответственно, выброс кортикоидных гормонов и катехоламинов надпочечниками.
Травма, боль, страх, операция и гиповолемия повышают уровень АДГ. Ранее полагали, что при фторотановой, эфирной и метоксифлурановой анестезии его содержание в крови значительно возрастает, однако исследования, проведенные более совершенным радиоиммунным методом, показали, что фторотан, энфлуран, морфин, фентанил вызывают незначительное увеличение АДГ плазмы в начале анестезии, а в период пробуждения уровень АДГ снижается до исходного [123]. В значительно большей степени стимулятором выброса гормона является кровопотеря. Эту реакцию надо считать приспособительной, поскольку благодаря ей в организме задерживается вода и увеличивается ОЦК. Чем травматичнее операция, тем выше уровень АДГ.
Метоксифлуран, эфир, натрия оксибутират и НЛА значительно увеличивают уровень соматотропного гормона, тогда как фторотан, тиопентал-натрий, энфлуран и регионарная местная анестезия почти не влияют на плазменную концентрацию этого гормона. Этот момент необходимо учитывать в связи с его влиянием на углеводный и жировой обмен. Оперативное вмешательство само по себе увеличивает его концентрацию в крови в 15-20 раз в первый час от начала операции, а затем уровень соматотропного гормона постепенно снижается.
Уровень тиреотропного гормона гипофиза под влиянием общей анестезии эфиром, фторотаном, метоксифлураном, натрия-оксибутиратом, тиопентал-натрием, местной регионарной анестезии и самой операции не меняется. В раннем послеоперационном периоде уровень тиреотропного гормона уменьшается.
Исследование влияния анестезиологического пособия на функцию надпочечников показало, что премедикация уменьшает активность коркового и мозгового вещества надпочечника, а степень этого подавления может служить критерием эффективности премедикации.
Анестезия эфиром и фторотаном увеличивает адренокортикоиднуюактивность, но при продолжительной анестезии фторотаном без операции содержание гидрокортизона не увеличивается, а искусственно повышенный уровень кортикостероидов уменьшается. Не отмечено увеличение концентрации кортикостероидов плазмы при применении метоксифлурана, энфлурана, закиси азота, миорелаксантов, пропанидида. Кетамин и натрия-оксибутират усиливают адренокортикоидную активность. НЛА, предион на уровень кортикостероидов не влияют.
При местной анестезии адренокортикоидная активность остается прежней, но реакция коры надпочечников активируется в послеоперационном периоде сразу после прекращения анестезии.
Искусственная вентиляция легких (ИВЛ) сама по себе не изменяет активность коры надпочечников, но ее неадекватные режимы с нарушением газообмена и метаболизма могут стимулировать и мозговое, и корковое вещество надпочечников.
При анестезии эфиром, метоксифлураном, тиопентал-натрием с закисью азота в 2 раза увеличивается уровень альдостерона и сохраняется таким в течение 1 часа после начала операции.
Анестезия изменяет содержание катехоламинов. Премедикация морфином и фентанилом увеличивает уровень адреналина плазмы, но при этом уменьшается количество норадреналина. Эфир увеличивает содер-
жание катехоламинов в плазме главным образом за счет норадреналина. Фторотан при нормальном или сниженном РаО2 вне операции не увеличивает концентрацию катехоламинов плазмы, но во время операции наблюдается незначительное ее повышение. Метоксифлуран и тиопентал-натрий не действуют на уровень катехоламинов. Данные исследований влияния НЛА на катехоламины плазмы различны.
В послеоперационном периоде уровень катехоламинов всегда повышается, причем преобладание эмоционального стресса способствует увеличению главным образом количества адреналина, а физического - норадреналина.
Изучение изменений ренин-ангиотензиновой системы под влиянием анестезии показало, что премедикация не влияет на уровень ренина, как и кратковременная анестезия фторотаном, эфиром и местная региональная анестезия. Операция стимулирует выброс ренина, его уровень особенно возрастает при нарастающей гиповолемии.
Концентрация ангиотензина-II во время операции повышается, но в первые послеоперационные сутки снижается до исходного.
Функция щитовидной железы изменяется в ходе анестезии. Вне зависимости от того, что уровень тиреотропного гормона гипофиза не изменяется, содержание тироксина и трийодтиронина колеблется. Значительно повышается плазменный уровень тироксина в связи с фторотановой, эфирной и энфлурановой анестезией. При использовании метоксифлурана, натрия-оксибутирата, тиопентал-натрия и регионарной местной анестезии изменений уровень тироксина не изменяется. Необходимо отметить, что операционная травма может повышать уровень тироксина, премедикация диазепамом на содержание в крови тироксина и трийодтиронина не влияет.
Суммируя данные о влиянии анестезии и операции на эндокринную систему, необходимо отметить, что ее реакции связаны со многими обстоятельствами и зависят от возраста, исходного эмоционального и физического состояния, наличия болезней эндокринной системы. Травматичность, локализация и продолжительность оперативного вмешательства - главные факторы, влияющие на эндокринные реакции. Режим анестезии также имеет значение. Например, медленное введение анестетиков, спокойная индукция обусловливают менее выраженную реакцию эндокринной системы, чем введение в анестезию, сопровождающееся возбуждением. Важным средством, устраняющим патологическую реакцию эндокринной системы на операцию и анестезию, яв-
ляется нормализация гомеостаза (устранение гиповолемии, нарушений газообмена, метаболизма, гипотермии или гипертермии).
3.9. СИСТЕМА ИММУНИТЕТА
У новорожденного большое значение имеет пассивный иммунитет, обусловленный переданными от матери разнообразными антитоксинами, противовирусными и антибактериальными антителами, принадлежащими к IgG. Характерным для периода новорожденности является дефицит антител к грамотрицательным микроорганизмам, что предрасполагает к частым инфекционным заболеваниям. Уровень IgG в сыворотке пуповинной крови коррелирует с его содержанием в сыворотке крови матери, но часто бывает выше в связи со способностью плода в последние месяцы пренатальной жизни концентрировать IgG путем активной плацентарной передачи. Содержание IgG у недоношенных тем ниже, чем больше срок недоношенности. Вскоре после рождения начинается катаболизм пассивно полученных IgG, уровень которых максимально понижается к 6-9-му месяцу грудного возраста.
Становление иммунной системы представляет сложный и продолжительный процесс, заканчивающийся лишь в пубертатно-юношеском возрасте, когда организм уже способен адекватно реагировать на различные инфекционные возбудители и чужеродные агенты. Щитовидная железа регулирует генетически детерминированное иммунологическое созревание. Иммунологическая компетентность отдельных клонов лимфоцитарных клеток появляется в различные периоды онтогенетического развития, причем иммунная реактивность достигает своего высшего предела в пубертатно-юношеском возрасте [65].
3.9.1. ИММУНИТЕТ И АНЕСТЕЗИЯ
Иммунная реактивность организма может изменяться, что выражается в ослаблении иммунитета (инфекционные поражения, нарушение заживления ран, злокачественный рост) и его искаженной реакции (анафилактический шок, аллергические болезни).
Общая и местная анестезия существенно влияет на иммунную систему, угнетая ее [100, 110, 125]. В результате ряда исследований выявлено влияние анестезии, в ходе которой применялись тиопентал, сукцинил-
холин, изофлюкан, дроперидол, фентанил, кетамин, на угнетение системы комплемента, подавление фагоцитоза и антителзависимой цитотоксичности при антибактериальной защите [91]. Важно отметить, что восстановление происходит лишь к 10-м суткам. Доказано угнетающее влияние анестезии на концентрацию иммуноглобулинов [85]. Отмечалось также уменьшение содержания NK-клеток - естественных киллеров, осуществляющих противоопухолевую и противовирусную защиту [75]. Неоднократно описано снижение содержания Т- и В-лимфоцитов [17, 18, 37, 107, 109].
В то же время отмечено, что в результате воздействия ряда анестетиков в крови больных увеличивается скорость синтеза ФНО-α, ИФН-α и ИФН-β при стимуляции in vitro лимфоцитов с ФГА в реакции бласт-трансформации (РБТЛ), то есть лимфоциты находятся в гиперактивированном состоянии [76]. Вследствие этого следует учитывать эту способность средств для наркоза усиливать синтез как провоспалительных, так и противовоспалительных цитокинов [100]. При разработке и апробации новых средств для наркоза необходимо отбирать такие, которые оказывают наименьшее воздействие на иммунную систему. В связи этим, невозможно не обратить внимания на появление в отечественной клинической практике нового ингаляционного препарата Ксенона, который, не имеет аллергизирующих и канцерогенных свойств и оказывает, в отличие от большинства традиционных анестетиков, иммуностимулирующее действие [12].
3.10. АНЕСТЕЗИОЛОГИЧЕСКИЕ СРЕДСТВА, АНАФИЛАКСИЯ, АЛЛЕРГИЯ
Следует сказать, что в арсенале анестезиолога нет препаратов, не способных вызывать аллергические реакции. Такие реакции на местно-анестезирующие препараты отмечаются чаще, чем на общие анестетики, так как общая анестезия не только подавляет, но и маскирует все реакции иммунитета.
Профилактика аллергических реакций состоит в сокращении арсенала медикаментов до самого необходимого уровня и выявлении пациентов «опасных» в плане аллергии [26]. Риск развития аллергической реакции значительно увеличивается у пациентов с наследственной предрасположенностью. Должны настораживать имеющиеся в прошлом необъяснимые коллапсы, наличие аллергии к другим лекарственным препаратам;
веществам нелекарственной природы и прочим факторам. При аллергии к какому-нибудь препарату возможность аллергической реакции на другие лекарственные средства увеличивается в десятки раз, и протекают такие реакции тяжелее. Поэтому нужно крайне осторожно использовать в анестезиологической практике лекарства с сомнительной терапевтической ценностью, применяемые рутинно, без необходимости.
3.11. ТЕРМОРЕГУЛЯЦИЯ
У детей, в особенности новорожденных, отмечается большее (в 3 раза), чем у взрослых, отношение площади поверхности тела к его массе. Это приводит к большим потерям тепла в связи со значительной поверхностью теплоотдачи, особенно в области головы. Детскому организму свойственна высокая скорость метаболических процессов, но у него недостаточно жира для термоизоляции от внешней среды, и поэтому тепло быстро теряется. До 3-х месяцев остается не сформированным механизм холодовой дрожи, обеспечивающий быстрое увеличение теплопродукции, но у детей имеются другие пути продукции тепла. Только у детей тепло вырабатывается так называемым бурым жиром; этот жир располагается вокруг лопаток, в средостении и вокруг надпочечников и почек [39]. Младенцы реагируют на переохлаждение повышением выработки норадреналина, стимулирующего липолиз и термогенез в бурой жировой ткани. Кроме повышения теплопродукции, норадреналин также вызывает сужение сосудов большого и малого круга кровообращения. Выраженная вазоконстрикция приводит к шунтированию крови справа налево, гипоксемии и метаболическому ацидозу [36]. У ослабленных и недоношенных младенцев запасы бурого жира ограничены, поэтому они более чувствительны к холоду.
Особенности терморегуляции у детей приводят к необходимости поддержания в операционной достаточно теплой температуры воздуха с целью уменьшения потерь тепла. Иногда в жаркой операционной дети могут перегреваться, особенно если у них была высокая температура до операции; перегревание может быть связано с введением атропина и ингаляцией фторотана. Температуру воздуха в операционной следует постоянно контролировать. В связи с перечисленным выше, необходим особо тщательный подход к выбору и дозировке анестезиологических препаратов.