Гинекология : учебник / Б. И. Баисова и др. ; под ред. Г. М. Савельевой, В. Г. Бреусенко. - 4-е изд., перераб. и доп. - 2011. - 432 с. : ил.
|
|
|
|
Глава 15. ЗАБОЛЕВАНИЯ МАТКИ
15.1. Внутриматочная патология
Внутриматочная патология включает гиперпластические процессы эндометрия; подслизистую миому матки; аденомиоз (внутренний эндометриоз); перегородки в матке; синехии; инородные тела. В структуре гинекологических заболеваний внутриматочная патология занимает значительное место.
Гиперпластические процессы эндометрия. Под гиперпластическими процессами эндометрия понимают патологическую диффузную или очаговую пролиферацию железистого и стромального компонентов слизистой оболочки матки с преимущественным поражением железистых структур.
Согласно принятой в 1994 г. классификации ВОЗ, выделяют эндоме-триальные полипы, эндометриальную гиперплазию - простую и сложную (комплексную), гиперплазию с клеточной атипией - простую и сложную.
В нашей стране термины "атипическая гиперплазия" и "аденоматоз" используются как синонимы, при этом атипическая гиперплазия подразделяется по степеням: легкая, среднетяжелая и тяжелая.
Гиперпластические процессы эндометрия возможны в любом возрасте, но их частота значительно возрастает в периоде перименопаузы.
Патогенез. Ведущее место в патогенезе гиперпластических процессов эндометрия отводится гормональным нарушениям в виде относительной или абсолютной гиперэстрогении при отсутствии антиэстрогенного влияния прогестерона или недостаточном его влиянии. Причины гиперэстроге-нии: ановуляция, обусловленная персистенцией или атрезией фолликулов; гормонопродуцирующие структуры яичников (стромальная гиперплазия, текоматоз, гранулезоклеточная опухоль, текаклеточные опухоли); нарушение гонадотропной функции гипофиза; гиперплазия коры надпочечников; неправильное использование гормональных препаратов (эстрогены, антиэстрогены). Известно, что у больных раком молочной железы прием та-моксифена увеличивает частоту гиперпластических процессов и рака эндометрия.
В патогенезе гиперпластических процессов эндометрия большое место занимают обменно-эндокринные нарушения: изменения жирового обмена, метаболизма половых гормонов при патологии гепатобилиарной системы и желудочно-кишечного тракта, иммунитета, функции щитовидной железы. В связи с этим у пациенток с гиперпластическими процессами эндометрия нередко отмечаются ожирение, гиперлипидемия, сахарный диабет, АГ, метаболический синдром.
Однако гиперпластические процессы эндометрия могут развиваться и при ненарушенных гормональных соотношениях. Немалую роль в развитии гиперпластических процессов эндометрия играют нарушения тканевой рецепции, инфекционно-воспалительные изменения в эндометрии, иммунные нарушения. Развитие железисто-фиброзных полипов эндометрия в 75% наблюдений происходит при ненарушенных гормональных соотношениях, при этом у 95,3% больных эндометрий инфицирован либо имеются признаки его хронического воспаления.
Развитие в последние годы молекулярной биологии, медицинской генетики, клинической иммунологии позволило выявить сложную систему факторов, участвующих в клеточной регуляции. Расширились представления о межклеточном взаимодействии и внутриклеточных процессах в гормонально зависимых тканях. Так, установлено, что в регуляции пролифера-тивной активности клеток эндометрия наряду с эстрогенами участвует ряд биологически активных соединений - таких, как факторы роста, цитоки-ны, метаболиты арахидоновой кислоты, а также система клеточного и гуморального иммунитета. Доказано, что в тканевом гомеостазе и патогенезе пролиферативных заболеваний важная роль принадлежит дисбалансу между процессами клеточной пролиферации и запрограммированной гибели клеток (апоптоз). Резистентность клеток эндометрия к апоптозу приводит к накоплению измененных и избыточно пролиферирующих клеток, что является характерной чертой неопластических изменений эндометрия.
Таким образом, патологическая трансформация эндометрия - сложный биологический процесс, затрагивающий все звенья нейрогуморальной системы организма женщины.
Гиперплазия эндометрия. Понятие "гиперплазия эндометрия" гистологическое; оно включает избыточный рост и структурные изменения желез эндометрия, отсутствие разделения на компактный и спонгиозный слои, нарушение правильного распределения желез в строме. Как правило, гиперпластическим изменениям подвергается функциональный слой слизистой оболочки тела матки, значительно реже - базальный слой.
Основные гистологические признаки железистой гиперплазии эндометрия сводятся к увеличению числа желез и изменению их формы (железы расширены), увеличению соотношения стромального и железистого компонентов при отсутствии цитологической атипии (рис. 15.1).
Простая гиперплазия эндометрия без атипии переходит в рак в 1% случаев, сложная без атипии - в 3 раза чаще.
Полипы эндометрия - наиболее распространенный вид гиперпластического процесса эндометрия; встречаются с частотой до 25%; малигнизиру-ются в 2-3% наблюдений. Наиболее часто полипы эндометрия выявляются в пре- и постменопаузе.
Полип эндометрия представляет собой доброкачественное образование, исходящее из базального слоя эндометрия. Патогномоничный анатомический признак полипа эндометрия - его основание (ножка) (рис. 15.2).
В зависимости от гистологического строения различают железистые (функционального или базального типа), железисто-фиброзные, фиброз-
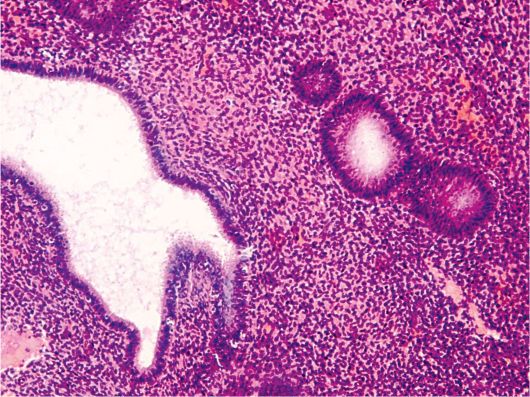
Рис. 15.1. Простая железистая (железисто-кистозная) гиперплазия эндометрия. Окраска гематоксилином и эозином, × 200. Фото О.В. Зайратьянца
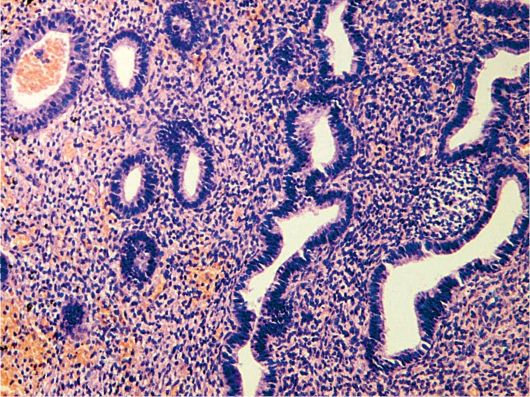
Рис. 15.2. Железисто-фиброзный полип эндометрия. Окраска гематоксилином и эозином, × 200. Фото О.В. Зайратьянца
ные и аденоматозные полипы эндометрия. Для аденоматозных полипов характерны интенсивная пролиферация желез и их эпителия с относительно высокой митотической активностью, атипия железистых клеток. Аденома-тозные полипы относят к предраковым состояниям слизистой оболочки матки.
Железистые полипы наиболее типичны для репродуктивного периода, железисто-фиброзные - для пре- и перименопаузы, фиброзно-железистые и фиброзные - для постменопаузы.
В репродуктивном и пременопаузальном периодах жизни женщины полипы эндометрия в качестве гистологически самостоятельной формы могут определяться как на фоне гиперплазии эндометрия, так и при нормальной слизистой оболочке различных фаз менструального цикла.
Полипы эндометрия в постменопаузе, как правило, бывают одиночными и могут возникать на фоне атрофичной слизистой оболочки. Иногда в этот период они достигают больших размеров и, выходя за пределы шейки матки, имитируют полип цервикального канала.
Особого внимания заслуживает рецидивирующая форма полипов эндометрия. Понятие "рецидив" неприемлемо, если ранее при удалении полипа эндометрия не использовался гистероскопический контроль, так как при выскабливании слизистой оболочки матки без гистероскопии возможно оставление патологически измененной ткани.
Предрак эндометрия. С морфологических позиций к предраку эндометрия относят гиперплазию с атипией (атипическая гиперплазия) и адено-матозные полипы.
К морфологическим признакам атипии эндометрия относят (рис. 15.3):
• увеличение числа желез, близко расположенных друг к другу, иногда с пальцеобразными выростами в направлении стромы;
• железистый цилиндрический эпителий в 2-4 ряда с формированием папиллярных выростов в направлении маточных желез, при выраженной атипии наблюдается потеря полярности;
• гиперхромные ядра с равномерным или (при большой атипии) с неравномерным распределением хроматина и глыбками его по периферии; высокую митотическую активность с увеличением спектра патологических митозов;
• базофильную цитоплазму при меньшей степени атипии, оксифиль-ную - при выраженной;
• наличие отечной стромы, с фибробластами и лимфоцитами;
• неравномерное распределение кровеносных сосудов с явлениями стаза и тромбоза.
Простая атипическая гиперплазия без лечения прогрессирует в рак у 8% больных, сложная атипическая гиперплазия - у 29%. Однако риск малиг-низации гиперпластических процессов эндометрия зависит не только от морфологической формы заболевания, но и от сопутствующей гинекологической и экстрагенитальной патологии (синдром поликистозных яичников, феминизирующие опухоли яичников, миома матки, ожирение, сахарный диабет или нарушение толерантности к глюкозе, гиперлипидемия, расстройства функции гепатобилиарной системы).
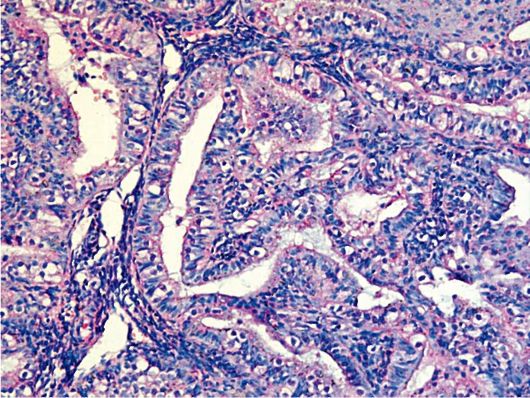
Рис. 15.3. Атипическая комплексная железистая гиперплазия эндометрия (аденома-тозная гиперплазия). Окраска гематоксилином и эозином, χ 400. Фото О.В. Зайратьянца
Клиническая симптоматика. Основные клинические проявления гиперпластических процессов эндометрия - маточные кровотечения, чаще ациклические в виде метроррагий, реже меноррагии. При больших полипах эндометрия могут наблюдаются схваткообразные боли внизу живота. Иногда полипы эндометрия остаются бессимптомными, особенно в постменопаузе.
Поскольку патогенетическую основу гиперпластических процессов эндометрия у больных репродуктивного возраста составляет ановуляция, одним из симптомов является бесплодие, чаще первичное.
Бессимптомное течение гиперпластических процессов эндометрия может наблюдаться у 10% менструирующих больных и у 40% в постменопаузе.
Диагностика гиперпластических процессов эндометрия. Скрининговыми методами диагностики гиперпластических процессов эндометрия являются трансвагинальное УЗИ, при неоднозначной эхографической картине возможно выполнение ГСГ, реже исследование аспирата из полости матки. Методами углубленного обследования являются гистероскопия и раздельное диагностическое выскабливание слизистой оболочки матки. Окончательно верифицировать диагноз можно только после гистологического исследования эндометрия.
Трансвагинальное УЗ-сканирование является высокоинформативным, не-инвазивным, безопасным методом диагностики гиперпластических процессов эндометрия. Информативность метода зависит от вида патологии эндометрия и возраста женщины; она повышается при сочетании с ГСГ. Диагностика гиперплазии эндометрия при УЗИ основывается на выявлении увеличенного в переднезаднем размере срединного маточного эха (М-эха) с неоднородной акустической плотностью. У менструирующих женщин толщину М-эха следует оценивать в соответствии с фазой менструального цикла. Лучше всего проводить исследование сразу после менструации, когда тонкое М-эхо соответствует полному отторжению функционального слоя эндометрия, а увеличение переднезаднего размера М-эха на всем протяжении либо локально должно расцениваться как патология. В большинстве
наблюдений отличить железистую гиперплазию эндометрия от атипической при УЗИ не удается.
Если период постменопаузы не превышает 5 лет, толщина М-эха до 5 мм может считаться нормальной, при постменопаузе более 5 лет она не должна превышать 4 мм (при однородной структуре).
Точность диагностики гиперплазии эндометрия при УЗИ составляет 6070%. ГСГ не позволяет значительно улучшить результаты диагностики.
Ультразвуковая картина полипов эндометрия показывает овоидные, реже округлые включения в полости матки повышенной эхоплотности (рис. 15.4). Диагностические затруднения возникают при железистых полипах эндометрия, которые повторяют конфигурацию полости матки, имеют листовидную, уплощенную форму и не приводят к утолщению М-эха. По звукопроводимости они близки к окружающему эндометрию. Регистрация цветовых эхо-сигналов при допплеровском исследовании в структуре включения дает возможность дифференцировать полипы с внутриматочными синехиями, а у менструирующих пациенток - со сгустками крови, но кровоток при ЦДК в полипах определяется лишь в 40% наблюдений. Информативность транс-
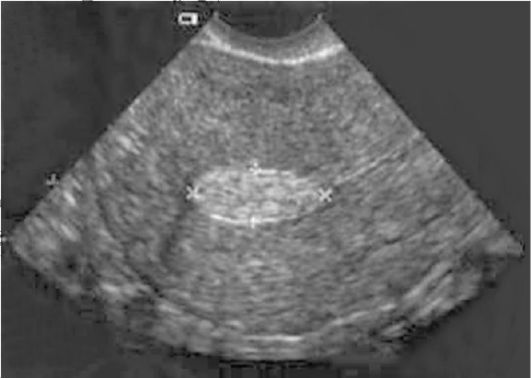
Рис. 15.4. Полип эндометрия. УЗИ
вагинального УЗИ при полипах эндометрия составляет 80-98%. Контрастирование полости матки при ГСГ позволяет повысить диагностические возможности УЗИ (рис. 15.5).
Цитологическое либо гистологическое исследование аспирата из полости матки может использоваться в качестве скрининга патологии эндометрия. Аспирационная биопсия эндометрия может использоваться как метод контроля эффективности гормональной терапии при гиперпластических процессах эндометрия. При раке эндометрия она позволяет поставить диагноз и избежать гистероскопии и диагностического выскабливания, которые не отвечают принципам абластики.
Гистероскопия. Информативность гистероскопии в диагностике гиперпластических процессов эндометрия составляет 63-97%. Гистероскопия необходима и перед выскабливанием слизистой оболочки матки - для уточнения характера патологии и его локализации, и после него - с целью контроля тщательности удаления ткани.
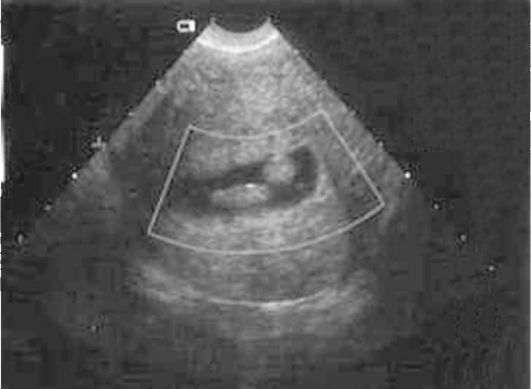
Рис. 15.5. Полипы эндометрия. ГСГ
При гиперплазии эндометрия и отсутствии кровяных выделений эндометрий, как правило, утолщен в виде складок различной высоты, бледно-розового цвета, отечный, в нем просматривается большое количество протоков желез (прозрачные точки; рис. 15.6). При изменении скорости потока жидкости в полость матки отмечается волнообразное движение эндометрия. Если гистероскопию проводят у пациентки с длительными кровяными выделениями, в дне матки и в области устьев маточных труб чаще определяются бахромчатые обрывки эндометрия бледно-розового цвета (на остальном протяжении эндометрий тонкий, бледный - рис. 15.7). Такую гистероскопическую картину трудно отличить от картины эндометрия в фазе ранней пролиферации. Окончательный диагноз возможен только при гистологическом исследовании соскоба слизистой оболочки матки.
При полиповидной форме гиперплазии эндометрия визуально полость матки на всем протяжении выполнена полиповидными разрастаниями эндометрия бледно-розового цвета, иногда с пузырьками по поверхности, множественными эндометриальными синехиями (рис. 15.8). Поверхность эндометрия при этом виде гиперплазии выглядит неровной, с ямками, кистами, бороздками различной величины. Как правило, в дне и по задней
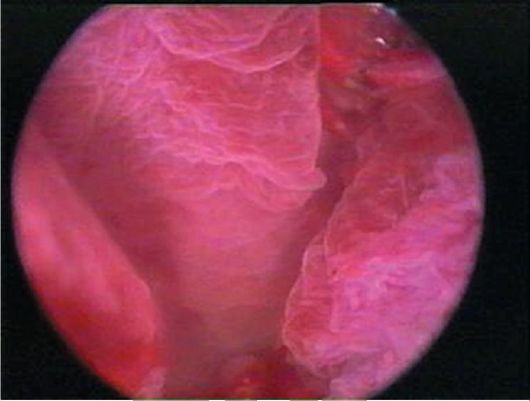
Рис. 15.6. Гистероскопическая картина гиперплазии эндометрия (утолщенный эндометрий в виде складок)
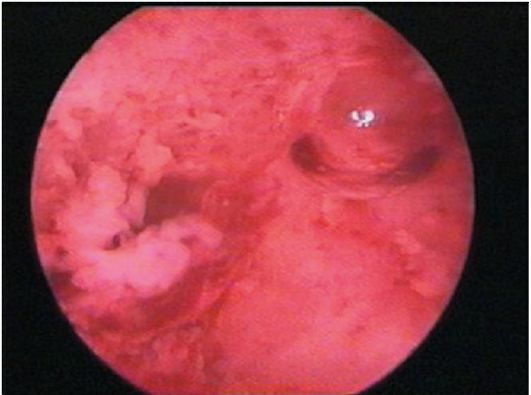
Рис. 15.7. Эндометрий в виде обрывков в стадии отторжения. Гистероскопия
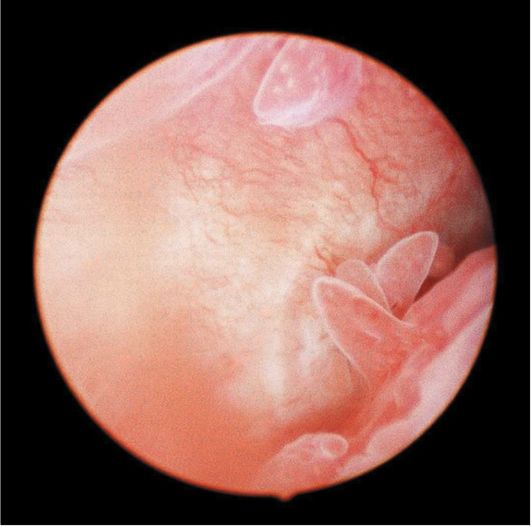
Рис. 15.8. Полиповидная гиперплазия эндометрия. Гистероскопия
стенке матки изменения более выражены. Полиповидную гиперплазию эндометрия, особенно при проведении гистероскопии накануне менструации, трудно отличить от эндометрия в фазе поздней секреции. В подобных случаях для установления диагноза необходимо сопоставить гистероскопическую картину с клинической картиной заболевания и днем менструального цикла.
Атипическая гиперплазия эндометрия не имеет характерных эндоскопических критериев, гистероскопическая картина напоминает обычную железисто-кистозную гиперплазию. При тяжелой форме атипической гиперплазии могут определяться железистые полиповидные разрастания тусклого желтоватого или сероватого цвета (рис. 15.9). Чаще они пестрые,
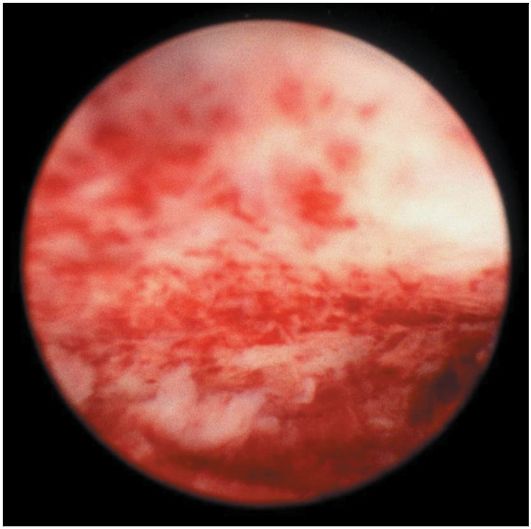
Рис. 15.9. Гистероскопическая картина атипической гиперплазии эндометрия
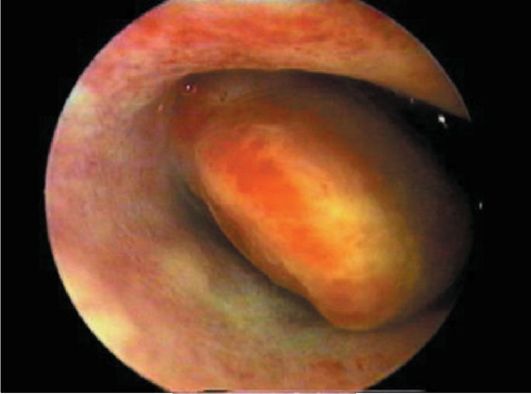
Рис. 15.10. Фиброзный полип эндометрия. Гистероскопия
желтовато-сероватые с белесым налетом. Как правило, окончательный диагноз устанавливают после гистологического исследования.
Фиброзные полипы эндометрия при гистероскопии определяются в виде единичных бледных образований округлой или овальной формы, чаще небольшого размера (от 0,5x1 до 0,5x1,5 см), обычно на ножке, плотной структуры, с гладкой поверхностью, маловаскуляризирован-ных (рис. 15.10). Иногда фиброзные полипы эндометрия достигают большого размера. При гистероскопии
может быть допущена диагностическая ошибка, когда одна из поверхностей полипа, который плотно прилегает к стенке матки, воспринимается как атрофичная слизистая оболочка и полип не диагностируется. При обнаружении полипа необходимо обследовать его со всех сторон, оценить величину, локализацию, место прикрепления, величину ножки. Фиброзные полипы напоминают подслизистые миоматозные узлы; при их дифферен-цировке часто возникают трудности.
Железисто-кистозные полипы эндометрия в отличие от фиброзных чаще бывают большого размера (до 5-6 см), определяются в виде единичных образований, хотя может быть одновременно несколько полипов. Форма полипов продолговатая, конусовидная, неправильная (с перемычками), поверхность гладкая, ровная, в некоторых случаях над ней выступают кистоз-ные образования с тонкой стенкой и прозрачным содержимым (рис. 15.11). Цвет полипов бледно-розовый, бледно-желтый, серовато-розовый. Нередко верхушка полипа бывает темно-багрового или синюшно-багрового цвета. На поверхности полипа видны сосуды в виде капиллярной сети (рис. 15.12).
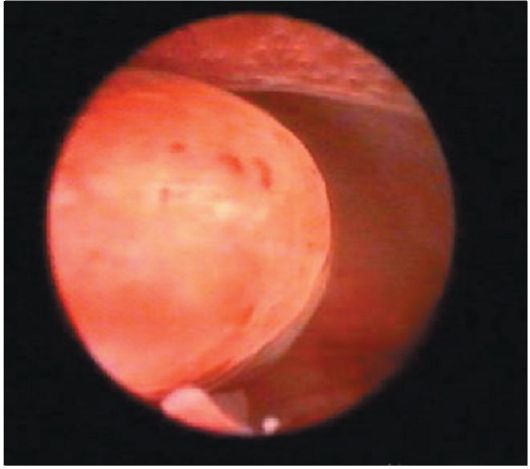
Рис. 15.11. Желизисто-кистозный полип эндометрия. Гистероскопия
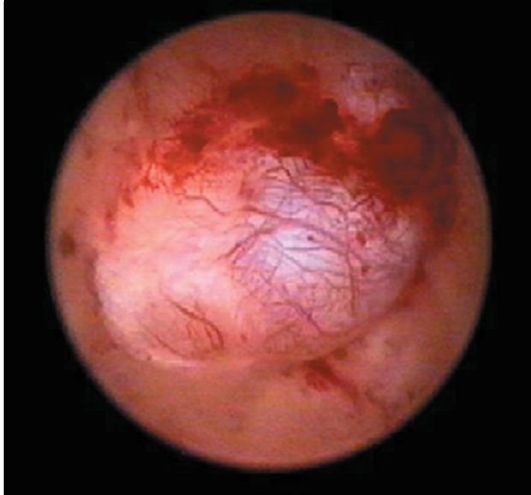
Рис. 15.12. Железисто-фиброзный полип эндометрия с сосудистым рисунком. Гистероскопия
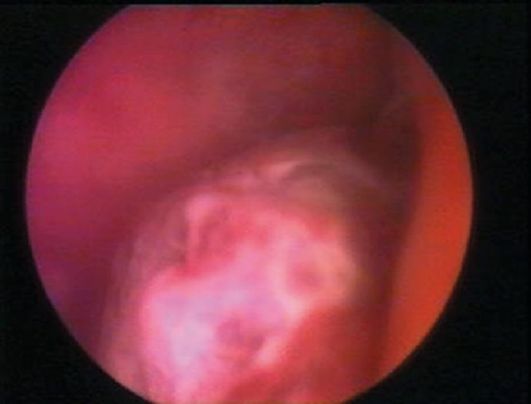
Рис. 15.13. Аденоматозный полип эндометрия. Гистероскопия
Аденоматозные полипы эндометрия чаще локализуются ближе к устьям маточных труб и, как правило, бывают небольшого размера (0,5x1; 0,5x1,5 см), выглядят более тусклыми, серыми, рыхлыми (рис. 15.13), но могут визуально не отличаться от железисто-кистозных полипов; в этом случае характер полипа при эндоскопическом исследовании определить не удается.
Полипы эндометрия изменяют форму при изменении скорости подачи жидкости или газа в полость матки - они сплющиваются, увеличиваются в диаметре, при уменьшении давления вытягиваются в длину и совершают колебательные движения.
Гистологическое исследование соскобов слизистой оболочки матки - окончательный метод диагностики гиперпластических процессов эндометрия.
Лечение гиперпластических процессов эндометрия. Терапия у женщин разного возраста складывается из остановки кровотечения, восстановления менструальной функции в репродуктивном периоде или достижения атрофии и субатрофии эндометрия в более старшем возрасте, а также профилактики рецидива гиперпластического процесса.
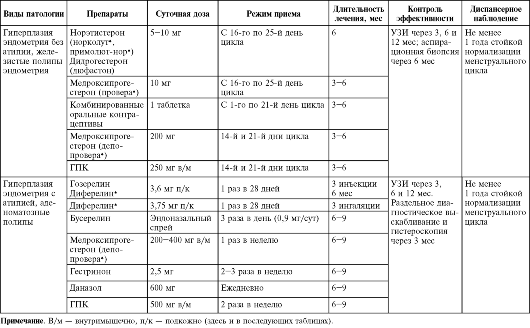
Ведение пациенток репродуктивного возраста с гиперпластическими процессами эндометрия. Традиционным методом лечения гиперпластических процессов эндометрия является гормональная терапия, которую назначают после гистероскопии, раздельного диагностического выскабливания и гистологического исследования. Схемы гормонального лечения представлены в табл. 15.1.
Рецидив гиперпластического процесса эндометрия может свидетельствовать о гормонально-активных процессах в яичниках, что требует уточнения их состояния, включая визуальные методы диагностики (УЗИ, лапароскопия, биопсия яичников). Отсутствие морфологических изменений в яичниках позволяет продолжить гормональную терапию более высокими дозами препаратов либо использовать гестагенсодержащие ВМК. Необходимо учитывать инфекционный фактор как возможную причину заболевания и неэффективности гормонотерапии.
При неэффективности гормонотерапии, рецидиве гиперплазии эндометрия без атипии у женщин, выполнивших репродуктивную функцию и не заинтересованных в ее сохранении, целесообразна абляция (резекция) эндометрия, которая выполняется при нежелании женщины в дальнейшем беременеть, возрасте старше 35 лет, желании сохранить матку, величина которой не превышает 10 нед беременности. Миома матки и аденомиоз не являются абсолютными противопоказаниями для абляции при гиперплазии эндометрия, но они ухудшают результаты лечения.
Таблица 15.1. Гормональное лечение гиперпластических процессов эндометрия в репродуктивном возрасте
При неэффективности гормонотерапии и рецидиве атипической гиперплазии эндометрия или аденоматозных полипов целесообразно оперативное лечение, объем которого определяется индивидуально, возможно выполнение гистерэктомии, клиновидной резекции яичников (у больных с СПКЯ), аднексэктомии (при наличии гормонпродуцирующей опухоли яичника).
Лечение гиперпластических процессов эндометрия у пациенток в перимено-паузе. Первый этап лечения включает гистероскопию с раздельным диагностическим выскабливанием слизистой оболочки матки. Выбор дальнейшей терапии зависит от морфологической структуры эндометрия, сопутствующей гинекологической и экстрагенитальной патологии. Выбор гормонального препарата, схема и длительность лечения определяются также желанием женщины сохранить менструации.
Схемы гормональной терапии гиперпластических процессов эндометрия в пре- и перименопаузе представлены в табл. 15.2.
При рецидивирующей гиперплазии эндометрия без атипии, невозможности проведения гормонотерапии из-за сопутствующей экстрагенитальной патологии показана гистероскопическая операция - абляция эндометрия. Рецидив гиперпластических процессов эндометрия, а также сочетание этой патологии с миомой матки и (или) внутренним эндометриозом у больных в пре- и перименопаузе требуют расширения показаний к радикальному оперативному вмешательству (гистерэктомии).
Ведение пациенток с гиперплазией эндометрия в постменопаузе. Раздельное диагностическое выскабливание с гистероскопией показано пациенткам, у которых при скрининг-обследовании заподозрена патология эндометрия, либо имелись кровянистые выделения. При впервые выявленной гиперплазии эндометрия у женщин в постменопаузе целесообразно назначение гормональной терапии, при клинико-ультразвуковых признаках гормон-продуцирующей опухоли яичника показана гистерэктомия с придатками. Рецидив гиперплазии эндометрия в постменопаузе служит показанием к хирургическому вмешательству - экстирпации матки с придатками, что является методом выбора у данной категории больных. У пациенток с абсолютными противопоказаниями к абдоминальной гистерэктомии допустима гормонотерапия гестагенами до 12 мес, либо абляция эндометрия. Обязательным является динамическое наблюдение с эхографией, аспирационной биопсией эндометрия, при необходимости - с гистероскопией, раздельным диагностическим выскабливанием.
При атипической гиперплазии эндометрия в постменопаузе необходимо сразу решать вопрос о радикальной операции - пангистерэктомии. При выраженной экстрагенитальной патологии и повышенном риске оперативного лечения (пангистерэктомии) необходимо длительное лечение гестаге-нами.
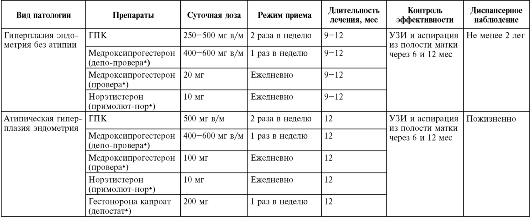
Схемы гормональной терапии гиперплазии эндометрия у пациенток периода постменопаузы представлены в табл. 15.3.
С целью снижения риска осложнений гормонотерапии, назначаемой в любом возрасте по поводу гиперпластических процессов эндометрия, параллельно рекомендуют гепатопротекторы, антикоагулянты, антиагреганты.
Таблица 15.2. Гормональная терапия гиперпластических процессов эндометрия в период пре- и перименопаузы
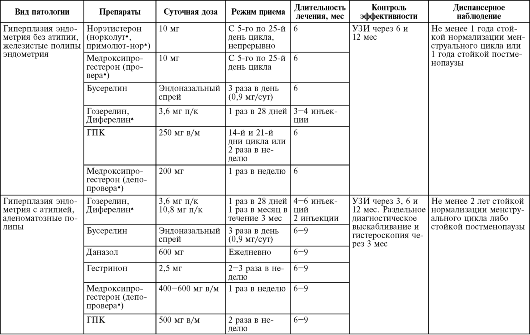
Таблица 15.3. Гормональная терапия при гиперплазии эндометрия в постменопаузе
Лечение пациенток с полипами эндометрия. Основной метод лечения больных с полипом эндометрия - прицельная полипэктомия. Радикальное удаление полипа эндометрия (с базальным слоем эндометрия в месте локализации ножки полипа) возможно только под контролем гистероскопии с применением как механических эндоскопических инструментов, так и электрохирургических, а также лазерной технологии. Электрохирургическое иссечение полипа при гистероскопии рекомендуется при фиброзных и пристеночных полипах эндометрия, а также при рецидивирующих полипах эндометрия. У пациенток в период перименопаузы гистероскопическую полипэктомию целесообразно сочетать с абляцией эндометрия.
После удаления железистых и железисто-фиброзных полипов эндометрия назначают гормональную терапию, вид и длительность которой зависят от возраста пациентки, морфологического строения полипа, сопутствующей патологии. Схемы гормональной терапии пациенток с полипами эндометрия в постменопаузе представлены в табл. 15.4.
Схемы гормональной терапии при железистых полипах эндометрия в репродуктивном и перименопаузальном периодах соответствуют таковым при гиперплазии эндометрия без атипии.
Таблица 15.4. Гормональная терапия при полипах эндометрия в постменопаузе

Внутриматочные синехии. Внутриматочные синехии (сращения), подразумевают частичное или полное заращение полости матки (синдром Ашер-мана).
Патогенез. Существует несколько теорий возникновения внутриматоч-ных синехий: инфекционная, травматическая, нейровисцеральная. Основным фактором считается механическая травма базального слоя эндометрия после родов, аборта (раневая фаза) или грубого выскабливания; инфекция служит вторичным фактором. Возникновение внутриматочных сине-хий наиболее вероятно у пациенток с замершей беременностью, поскольку остатки плацентарной ткани могут вызывать активацию фибробластов и образование коллагена до регенерации эндометрия.
Внутриматочные синехии могут также возникнуть после оперативных вмешательств на матке: миомэктомии, метропластики или диагностического выскабливания слизистой оболочки, абляции эндометрия, а также после эндометрита. Данную патологию может также провоцировать ВМК.
Классификация. Наиболее удобна и часто используется классификация внутриматочных синехий по распространенности и степени облитерации полости матки:
I степень - вовлечено менее 1/4 объема полости матки, тонкие спайки, дно и устья труб свободны;
II степень - вовлечено от 1/4 до 3/4 объема полости матки, слипания стенок нет, есть только спайки, дно и устья труб частично закрыты;
III степень - вовлечено более 3/4 объема полости матки.
Клиническая симптоматика. В зависимости от степени заращения полости матки внутриматочные синехии проявляются гипоменструальным синдромом или аменореей. Следствием синехий становятся бесплодие или невынашивание беременности. В случае заращения нижней части полости матки с нормально функционирующим эндометрием в верхней части может развиться гематометра. Значительное заращение полости матки и недостаток нормально функционирующего эндометрия приводят к затруднению имплантации плодного яйца. Даже слабо выраженные внутриматочные си-нехии становятся одной из причин неэффективности ЭКО.
Диагностика. Для диагностики внутриматочных синехий применяют гистеросальпингографию, УЗИ, гистероскопию, наиболее информативна ГСГ.
Гистеросальпингография. Рентгенологическая картина при внутриматоч-ных синехиях зависит от характера последних и их распространенности. Обычно синехии проявляются в виде одиночных или множественных дефектов наполнения неправильной формы и различных размеров. Плотные множественные синехии могут разделять полость матки на большое количество камер различного размера, соединенных между собой мелкими протоками. Такую конфигурацию матки не удается определить при гистероскопии; она может дать информацию только о первых нескольких сантиметрах нижнего сегмента полости матки. При гистерографии текучее контрастное вещество может находить пути через сложные лабиринты и необлитериро-ванные пространства. При гистеросальпингографии часто получают ложно-положительные результаты из-за обрывков эндометрия, слизи, искривления полости матки.
УЗИ. Возможности эхографии в диагностике внутриматочных синехий ограничены. В некоторых случаях визуализируются неровные контуры эндометрия, прерывистое М-эхо, при гематометре определяется анэхогенное содержимое в полости матки. ГСГ позволяет выявить единичные внутри-маточные сращения, если нет полной обструкции в нижней части полости матки (рис. 15.14).
Гистероскопия. При гистероскопии синехии определяются как белесоватые бессосудистые тяжи - сращения между стенками матки различной, плотности и протяженности, нередко уменьшающие объем полости матки, а иногда полностью ее облитерирующие. Синехии могут располагаться также в цервикальном канале, вызывая его заращение и препятствуя доступу в полость матки и оттоку содержимого из нее. Нежные синехии выглядят как тяжи бледно-розового цвета в виде паутины, иногда видны проходящие
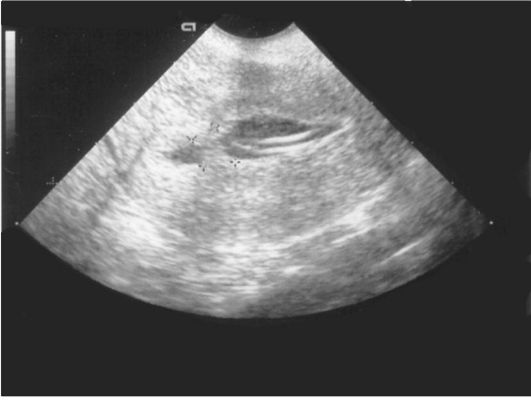
Рис. 15.14. Гидросонография (вну-триматочные синехии в виде дефекта наполнения)
в них сосуды. Более плотные синехии определяются как плотные белесоватые тяжи, располагающиеся, как правило, по боковым стенкам, реже - по центру полости матки (рис. 15.15, 15.16). Множественные поперечные синехии обусловливают частичное заращение полости матки с множеством полостей различной величины в виде углублений (отверстий). Иногда эти отверстия ошибочно принимают за устья маточных труб.
Лечение. В настоящее время единственным методом лечения внутрима-точных синехий является их рассечение под прямым визуальным гистероскопическим контролем, чтобы не травмировать оставшийся эндометрий - для восстановления нормального менструального цикла и фертильности. Характер операции, ее эффективность и отдаленные результаты зависят от вида внутриматочных синехий и степени окклюзии полости матки.
Расположенные центрально синехии можно разделить тупым путем с помощью корпуса гистероскопа. Используют также эндоскопические ножницы и щипцы, неодимовый ИАГ-лазер (на иттрий-алюминиевом гранате). Из электрохирургических инструментов наиболее удобен при разделении синехий электрод в виде иглы.
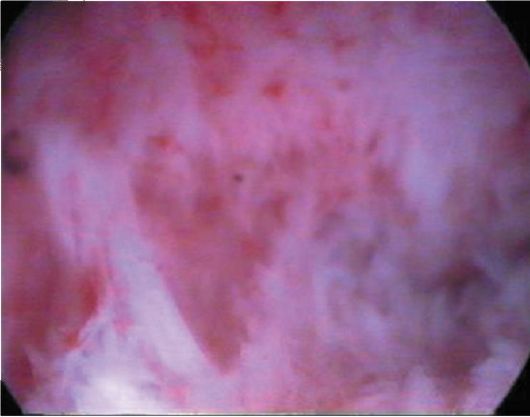
Рис. 15.15. Гистероскопическая картина плотных внутриматочных синехий (синдром Ашермана)
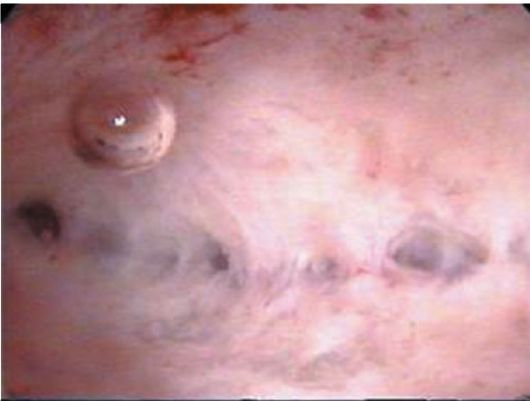
Рис. 15.16. Гистероскопическая картина плотных внутриматочных синехий
Для предотвращения возможной перфорации матки операцию проводят под контролем УЗИ, при значительном заращении полости матки - под лапароскопическим контролем.
Несмотря на высокую эффективность гистероскопического адгезиолизи-са внутриматочных синехий, рецидив заболевания не исключен, особенно при распространенных, плотных синехиях и у пациенток с туберкулезным поражением матки. Для предотвращения рецидива внутриматочных сращений практически все хирурги предлагают вводить в полость матки катетер Фолея (на 1 сут), ВМК типа петли Липпса не менее чем на 1 мес, специальный противоспаечный гель. В последующем назначают гормональную терапию (эстроген-гестагены в высоких дозах) с целью восстановления эндометрия в течение 3-6 мес.
Прогноз. Эффективность трансцервикального рассечения внутриматоч-ных синехий под контролем гистероскопа зависит от функционального состояния сохраненного эндометрия, распространенности и протяженности внутриматочных сращений: чем больше заращена полость матки, тем менее результативна операция. В плане восстановления менструальной и репродуктивной функций, а также возможности рецидива заболевания хуже всего прогноз при внутриматочных синехиях туберкулезной этиологии.
Беременные после рассечения распространенных внутриматочных сине-хий представляют группу риска по возникновению осложнений беременности, родов и послеродового периода. У 1/3 женщин с внутриматочными синехиями происходят самопроизвольные выкидыши, у 1/3 - преждевременные роды и у 1/3 отмечается патология плаценты (плотное прикрепление, предлежание).
Профилактика. Необходимо помнить о возможности возникновения внутриматочных синехий у пациенток с осложненным течением раннего послеродового и послеабортного периода. При возникновении нарушений менструального цикла у этих женщин необходимо как можно раньше проводить гистероскопию с целью ранней диагностики синехий и их разрушения. У больных с подозрением на остатки плодного яйца или плаценты в матке целесообразно выполнять не просто выскабливание слизистой оболочки матки, а осуществлять гистероскопию для уточнения расположения патологического очага и его прицельного удаления без травмирования неизменного эндометрия.
Внутриматочная перегородка - порок развития, при котором полость матки разделена на две половины (гемиполости) перегородкой различной длины. Пациентки с внутриматочной перегородкой составляют 48-55% всех женщин с пороками развития половых органов. В общей популяции перегородка в матке встречается приблизительно у 2-3% женщин.
Клиническая картина. У женщин с перегородкой в матке в основном отмечается невынашивание беременности, реже - бесплодие. В I триместре беременности риск самопроизвольного выкидыша у пациенток с перегородкой в матке составляет 28-60%, во II триместре - приблизительно 5%. Для пациенток с внутриматочной перегородкой характерны преждевременные роды, нарушения сократительной способности матки в родах, отмечается
неправильное положение плода. Причины отрицательного влияния перегородки на течение беременности:
• недостаточный объем полости матки - перегородка мешает росту плода;
• истмико-цервикальная недостаточность, которая нередко сочетается с перегородкой матки;
• имплантация на бессосудистой перегородке, которая не способна поддерживать адекватное развитие эмбриона.
Чаще эти нарушения возникают при полной перегородке в матке.
У пациенток с перегородкой в матке часто встречаются дисменорея и патологические маточные кровотечения.
Примерно 50% женщин с внутриматочной перегородкой способны к зачатию и вынашиванию беременности, порок развития матки у них выявляется случайно, при обследовании по поводу другого заболевания.
Диагностика. Как правило, перегородка в матке диагностируется при обследовании пациентки с невынашиванием беременности (УЗИ, метро-сальпингография) либо при гистероскопии и выскабливании слизистой оболочки матки, при котором может возникнуть подозрение на аномалию развития. В клинической практике для диагностики внутриматочной перегородки используют различные методы исследования.
Гистеросальпингография позволяет определять только внутренние контуры полости матки; наружные контуры не видны, возможна ошибка в определении вида порока. При гистеросальпингографии сложно различить перегородку в матке и двурогую матку. Диагностическая точность гисте-росальпингографии в диагностике вида порока развития матки составляет
50%.
Эхография. Перегородка в матке выявляется не всегда и определяется на эхограмме как тонкостенная структура, идущая в переднезаднем направлении. Создается впечатление, что матка состоит из двух частей (рис. 15.17). По данным УЗИ отличить двурогую матку от полной или неполной перегородки в матке удается не всегда. УЗ-аппараты с трехмерным изображением позволяют с высокой точностью (91-95%) диагностировать внутриматоч-ную перегородку. Наибольшей информативностью обладает ГСГ: на фоне
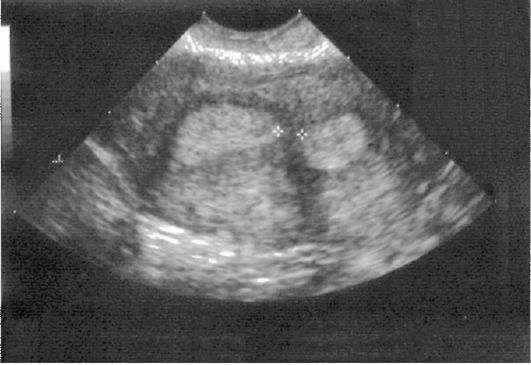
Рис. 15.17. УЗИ внутриматоч-ной перегородки
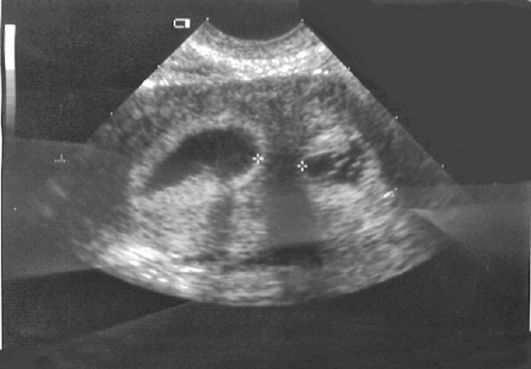
Рис. 15.18. ГСГ внутриматочной перегородки
расширенной полости матки легко идентифицируется перегородка, можно определить ее толщину и протяженность (рис. 15.18).
При выполнении УЗИ матки у пациенток с подозрением на внутрима-точную перегородку необходимо обследование почек для исключения аномалий развития.
Эндоскопические методы исследования. Наиболее полную информацию о характере порока развития матки можно получить при сочетании гистероскопии, ГСГ и лапароскопии.
Параллельное обследование с применением двух эндоскопических методов необходимо в связи с тем, что гистероскопическая картина при двурогой матке и внутриматочной перегородке идентична. Лапароскопия позволяет не только уточнить вид порока развития матки (внешние контуры матки), оценить состояние придатков матки, тазовой брюшины, но и произвести коррекцию выявленных патологических процессов в брюшной полости. Кроме того, лапароскопия может быть методом контроля хода гистероскопической операции при рассечении внутриматочной перегородки.
У больных с внутриматочной перегородкой лапароскопическая картина может показать расширение матки в поперечнике или белесоватую полоску, проходящую в сагиттальном направлении, и небольшое втяжение в этой области; одна половина матки может быть больше другой, но иногда матка сохраняет обычные размеры и форму. Гистероскопия используется как для уточнения формы порока, так и для его хирургической коррекции.
При гистероскопии внутриматочная перегородка определяется в виде полоски ткани треугольной формы, различной толщины и длины, разделяющей полость матки на две гемиполости (рис. 15.19), причем в каждой из них определяется только одно устье маточной трубы. Перегородка может быть полной, доходящей до цервикального канала, и неполной (рис. 15.20). Чаще перегородка бывает продольной, длиной от 1 до 5-6 см, но могут встречаться и поперечные перегородки. Продольная перегородка может определяться в виде треугольника, основание которого утолщено и находится в дне матки. Редко встречаются перегородки в цервикальном канале. Уточнить вид порока развития матки, особенно при толстой и полной перегородке, можно при сочетании гистероскопии с ГСГ.
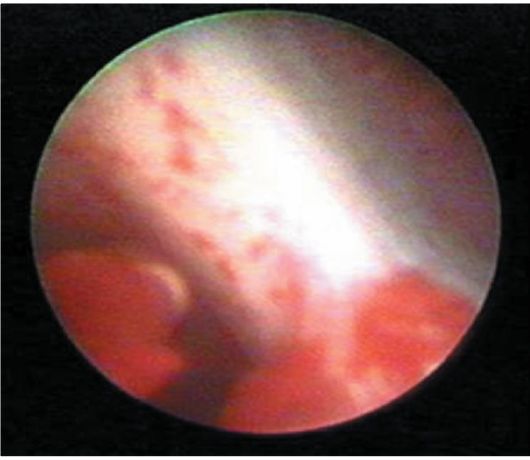
Рис. 15.19. Гистероскопическая картина внутриматочной перегородки, разделяющей полость матки на две гемиполости
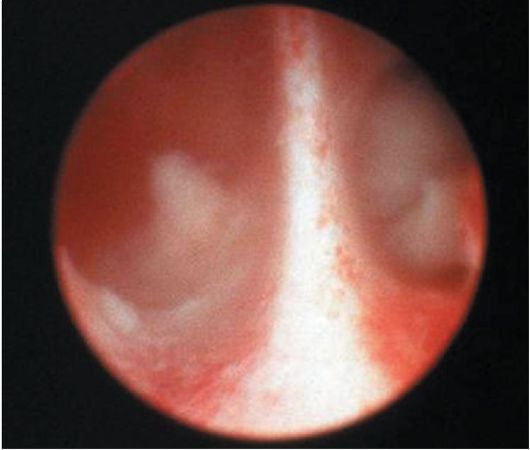
Рис. 15.20. Неполная внутриматочная перегородка. Гистероскопия
Дополнительные методы исследования. Высокой информативностью в диагностике пороков развития матки обладают МРТ и спиральная КТ. Их применение целесообразно для уточнения диагноза в сложных случаях на этапе обследования; это позволяет избежать применения инвазивных методов диагностики. Однако вследствие дороговизны указанные методики не являются рутинными.
Лечение. Хирургическое лечение внутриматочной перегородки, по мнению многих авторов, должно проводиться только при выраженном нарушении репродуктивной функции. По мнению других, сразу же после выявления внутриматочной перегородки пациентке необходимо предложить метропластику, не дожидаясь возможных осложнений.
В настоящее время методом выбора при внутриматочной перегородке является ее рассечение под визуальным контролем трансцервикальным путем при гистероскопии. В зависимости от толщины перегородку можно рассекать с помощью эндоскопических ножниц (если она тонкая) либо ги-стерорезектоскопа (при толстой, широкой, васкуляризированной перегородке). Возможно применение лазера.
При полной перегородке матки, переходящей в цервикальный канал, рекомендуют сохранять цервикальную часть перегородки для предотвращения вторичной истмико-цервикальной недостаточности.
После рассечения широкой внутриматочной перегородки с целью уменьшения вероятности формирования синехий в месте рассечения перегородки и быстрой эпителизации большинство авторов назначают эстрогены (эстра-диол - по 2 мг ежедневно в 1-ю фазу) на 2-3 мес.
Прогноз. Гистероскопическое рассечение внутриматочной перегородки - щадящая и малотравматичная операция (в отличие от применявшейся ранее абдоминальной метропластики). Вследствие отсутствия рубца на матке после такой операции роды могут проводиться через естественные родовые пути. Частота нормальных родов, по данным разных авторов, после
гистероскопического рассечения внутриматочной перегородки составляет 70-85%. Однако в литературе есть упоминания о разрывах матки во время беременности после гистероскопической метропластики - как осложненной (перфорация матки), так и неосложненной метропластики.
Инородные тела в матке. К инородным телам в матке относятся внутри-маточные контрацептивы (ВМК) и их фрагменты, костные остатки, различные лигатуры.
Клиническая картина инородных тел в полости матки чаще проявляется различными нарушениями менструальной функции (меноррагии, меноме-троррагии, ациклические кровяные выделения). При длительном нахождении инородного тела в матке клиническая симптоматика может проявляться вторичным бесплодием, явлениями хронического эндометрита или пиометрой. Возможны бессимптомные инородные тела в полости матки (фрагменты ВМК).
Болевой синдром возникает при перфорации матки ВМК и дальнейшей миграции его к соседним органам с возможной их перфорацией. Не исключена миграция ВМК в сальник, ректосигмоидный угол толстой кишки, забрюшинное пространство, мочевой пузырь, в слепую кишку, к области червеобразного отростка, в тонкую кишку, к придаткам матки.
Костные фрагменты обычно становятся случайной находкой у пациенток с нарушениями менструального цикла, длительным эндометритом или выявляются при обследовании у женщин с вторичным бесплодием. В анамнезе можно выявить случаи прерывания беременности при большом сроке (13-14 нед и более), осложнявшиеся, как правило, длительным кровотечением, иногда с повторными выскабливаниями.
Лигатуры, как правило, шелковые или лавсановые, выявляются у больных хроническим эндометритом и пиометрой, с указанием на кесарево сечение или консервативную миомэктомию в анамнезе. Также пациентки жалуются на постоянные гнойные выделения из половых путей, не поддающиеся массивной антибактериальной терапии, и вторичное бесплодие.
Диагностика. Основной метод диагностики инородных тел в матке - гистероскопия, дополнительные методы (УЗИ, при необходимости гидросо-нография - ГсГ и лапароскопия).
УЗИ. Ультразвуковая картина при ВМК зависит от формы и типа контрацептива. Каждый тип ВМК дает характерное четкое эхогенное изображение, способное меняться в зависимости от локализации контрацептива в матке. Оптимально для контрацепции такое расположение ВМК, когда его дистальная часть локализуется в дне, а проксимальная - не достигает уровня внутреннего зева.
При смещении ВМК его проксимальная часть визуализируется в верхней трети цервикального канала. Наиболее серьезное осложнение ВМК - перфорация матки, которая может быть неполной (ВМК проникает в мио-метрий) или полной (ВМК частично или полностью выходит за пределы матки).
Фрагменты ВМК могут определяться как в полости матки, так и в толще миометрия в виде линейных включений повышенной эхогенности, различных размеров, дающих акустическую тень (рис. 15.21).
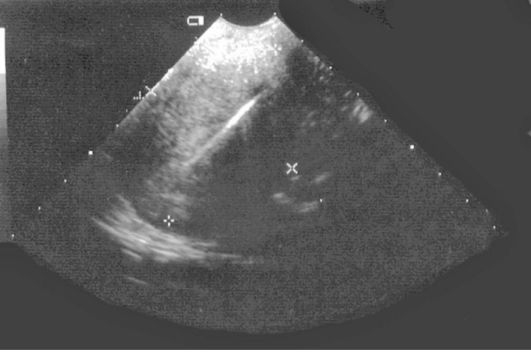
Рис. 15.21. УЗИ (фрагментарные остатки ВМК в миометрии и полости матки)
Точная ультразвуковая диагностика костных фрагментов затруднена. При УЗИ они могут определяться в виде разрозненных эхонасыщенных структур неправильной формы.
При лигатурах в полости матки УЗИ малоинформативно.
Гистероскопия. Эндоскопическая картина ВМК зависит от вида контрацептива и времени проведения исследования. Длительно находящийся в матке ВМК частично прикрывается синехиями и лоскутами эндометрия, кристаллами солей. При подозрении на фрагменты ВМК гистероскопию необходимо проводить в раннюю фазу пролиферации, тщательно осматривая все стенки матки. Фрагменты ВМК могут быть представлены раздробленной пластиковой частью, металлическими обломками, "усами" (рис. 15.22, 15.23); свободно находиться в полости матки или частично внедряться в ее стенку. При обнаружении перфорации матки ВМК гистероскопию проводят совместно с лапароскопией.

Рис. 15.22. Гистероскопическая картина ВМК, покрытого кристаллами солей
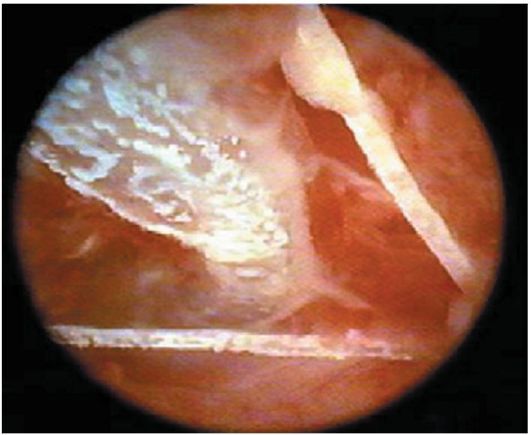
Рис. 15.23. Гистероскопическая картина ВМК с "усами"
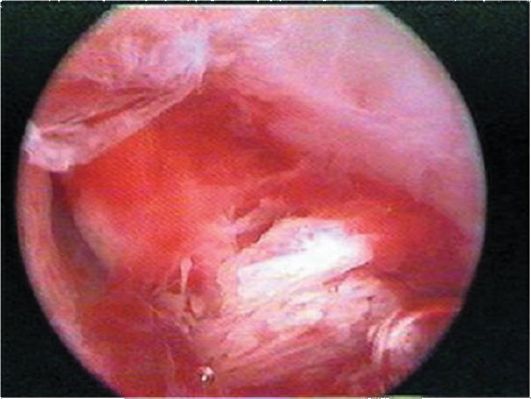
Рис. 15.24. Гистероскопическая картина костных фрагментов
Гистероскопия показана, когда в полости матки остаются фрагменты ВМК вследствие неудачного его удаления и есть подозрение на перфорацию матки. При длительном пребывании контрацептива в полости матки иногда происходит его плотное прикрепление и даже врастание в толщу миометрия. Гистероскопия позволяет определить локализацию самого ВМК или его фрагментов и прицельно удалить эти инородные тела.
Гистероскопическая картина костных фрагментов зависит от длительности их
пребывания в матке. Если срок относительно небольшой, видны пластинчатые плотные белесоватые образования с острыми краями, внедрившиеся в стенку матки (рис. 15.24). Если костные фрагменты долго находились в полости матки (более 5 лет), они имеют характерное кристаллическое строение (коралловидную форму) и при попытке удаления щипцами рассыпаются, "как песок". Чаще всего костные фрагменты располагаются в области устьев маточных труб и в дне матки.
Лигатуры при гистероскопии определяются как белесоватые нити на фоне общей гиперемии слизистой оболочки матки в нижней ее трети по передней стенке (после кесарева сечения) или в различных участках стенок матки (после консервативной миомэктомии; рис. 15.25, 15.26).
Лечение. Инородные тела удаляют из матки при гистероскопии с помощью специальных эндоскопических инструментов. Не рекомендуется пытаться удалять ВМК без видимых "усов" вслепую, различными приспособлениями. Такие попытки обычно приводят к деформации ВМК, его фрагментации, а иногда - к перфорации матки. При подозрении на перфорацию матки ВМК проводят сочетанное исследование: гистероскопию и лапароскопию.
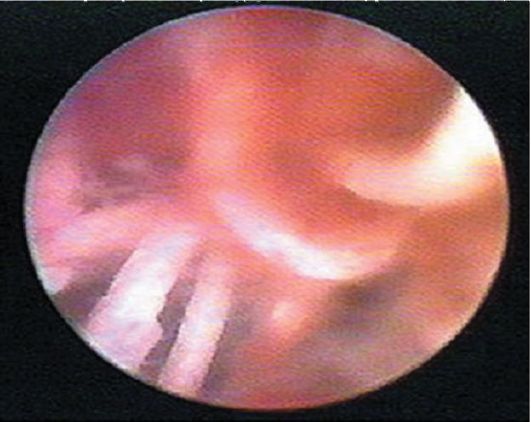
Рис. 15.25. Лигатуры в полости матки после кесарева сечения. Гистероскопия
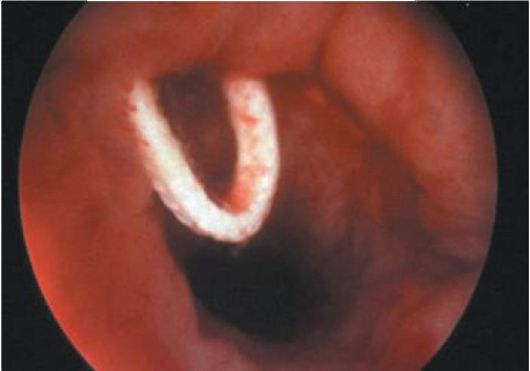
Рис. 15.26. Лигатуры в полости матки после консервативной миомэктомии. Гистероскопия
Если по данным УЗИ в толще миометрия определяются фрагменты ВМК, а при гистероскопии и лапароскопии их определить не удается, не следует пытаться извлекать эти фрагменты из толщи стенки. Необходимо наблюдение за пациенткой.
В послеоперационном периоде после удаления инородного тела из матки рекомендуется антибактериальная терапия с учетом чувствительности микрофлоры к препарату.
Контрольные вопросы
1. Перечислите виды внутриматочной патологии.
2. Назовите современные методы диагностики видов внутриматочной патологии.
3. Приведите классификацию гиперпластических процессов эндометрия (ВОЗ, 1994).
4. Какова лечебная тактика у больных с полипами эндометрия, эндо-метриальной и атипической гиперплазией эндометрия в различные периоды жизни женщины?
5. Укажите типы субмукозной миомы матки (в зависимости от выраженности интрамурального компонента узла).
6. Назовите методы диагностики и лечения у больных с субмукозной миомой.
15.2. Рак эндометрия
В последние десятилетия заболеваемость раком тела матки неуклонно возрастает, что, по-видимому, связано с увеличением продолжительности жизни женщин и их пребывания в периоде постменопаузы. Рак тела матки возникает в основном в постменопаузе, средний возраст пациенток составляет 60-62 года. В течение жизни раком эндометрия заболевает 2-3% женщин.
Существуют два патогенетических варианта рака тела матки - гормонально-зависимый и автономный.
Гормонально-зависимый рак матки встречается примерно в 70% наблюдений, в патогенезе этого варианта рака играет роль длительная гиперэ-строгения. Последняя может быть как абсолютной, так и относительной и возникать в результате ановуляции, феминизирующих опухолей яичника, избыточной периферической конверсии андрогенов в эстрогены (при ожирении, сахарном диабете), эстрогенных влияний (при заместительной гормональной терапии эстрогенами, лечении рака молочной железы тамок-сифеном с образованием метаболитов с эстрогенной активностью) и т.д. Гормонально-зависимому раку тела матки предшествует последовательное возникновение гиперпластических и предраковых процессов эндометрия. Как правило, это высокодифференцированная аденокарцинома, чувствительная к гормональной терапии. К факторам риска гормонально-зависимого рака тела матки относят бесплодие, отсутствие родов в анамнезе, позднюю менопаузу, ожирение, сахарный диабет, АГ, наследственную отягощенность
по раку с эндокринно-метаболическим патогенезом (рак молочной железы, эндометрия, яичников, толстой кишки), гормонпродуцирующие опухоли яичника, заместительную монотерапию эстрогенами в постменопаузе, применение тамоксифена при лечении рака молочной железы.
В ретроспективных исследованиях получены сведения о зависимости риска развития рака матки и выраженности гиперпластического процесса эндометрия. Рак матки возникает у 1% больных с железистой гиперплазией, у 3% - с железисто-кистозной, у 8% - с простой атипической гиперплазией и у 29% - со сложной атипической гиперплазией. Однако в постменопаузе этот риск выше, чем в другом возрасте.
Автономный патогенетический вариант рака эндометрия встречается менее чем в 30% наблюдений, возникает на фоне атрофии эндометрия при отсутствии гиперэстрогении у пациенток без обменно-эндокринных нарушений. Считается, что в развитии автономного варианта рака эндометрия играет роль выраженная депрессия Т-системы иммунитета на фоне нарушений адаптационного гомеостаза и гиперкортицизма. Изменения иммунитета состоят в значительном снижении абсолютного и относительного количества Т-лимфоцитов, угнетении всех субпопуляций Т-лимфоцитов и их теофиллинчувствительных форм, большом количестве лимфоцитов с блокированными рецепторами.
Автономный рак тела матки развивается в более старшем возрасте. Для данного варианта не установлены факторы риска. Как правило, он появляется у худых пожилых женщин без предшествующих гиперпластических процессов. В анамнезе может отмечаться кровотечение в постменопаузе на фоне атрофии эндометрия. Опухоль имеет низкую дифференцировку, низкую чувствительность к гормонотерапии, происходят ранняя инвазия в миометрий и метастазирование.
Классификация рака тела матки в зависимости от его распространенности основывается на клинических либо на клинико-гистологических данных.
Клиническая классификация (FIGO, 1971) используется до операции или у неоперабельных больных:
Стадия 0 - рак in situ.
Стадия I - опухоль ограничена телом матки.
Стадия II - опухоль распространяется на шейку матки, не выходя за пределы матки.
Стадия III - опухоль распространяется в пределах малого таза. Стадия IV - опухоль прорастает соседние органы или распространяется за пределы малого таза.
IVA - опухоль врастает в мочевой пузырь или прямую кишку. IVB - отдаленные метастазы.
Интраоперационные данные и гистологическое исследование позволяют выделить морфологические стадии рака тела матки (FIGO, 1988): Стадия IA - опухоль в пределах эндометрия.
Стадия IB - инвазия в миометрий не более чем на 1/2 его толщины. Стадия IС - инвазия в миометрий более чем на 1/2 его толщины. Стадия IIA - распространение на железы шейки матки.
Стадия IIВ - распространение на строму шейки матки.
Стадия IIIA - прорастание опухолью серозной оболочки матки, метастазы в маточные трубы или яичники, опухолевые клетки в смывах из брюшной полости.
Стадия IIIВ - распространение на влагалище.
Стадия ШС - метастазы в тазовые или поясничные лимфатические узлы.
Стадия IVA - прорастание слизистой оболочки мочевого пузыря или прямой кишки.
Стадия IVB - отдаленные метастазы в паховые лимфатические узлы.
Опираясь на данную классификацию и результаты гистологического исследования, у больных после операции планируют последующие этапы лечения.
Гистологически рак эндометрия чаще всего представлен:
• аденокарциномой (папиллярной, секреторной, с плоскоклеточной метаплазией);
• муцинозным раком;
• папиллярным серозным раком;
• светлоклеточным раком;
• плоскоклеточным раком;
• недифференцированным раком.
В 80% наблюдений рак эндометрия представлен аденокарциномой (рис. 15.27). В зависимости от выраженности тканевого и клеточного ати-пизма выделяют три степени дифференцировки рака тела матки (FIGO,
1989):
• высокодифференцированный рак (G1);
• умеренно дифференцированный рак (G2);
• низкодифференцированный рак (G3).
Клиническая картина рака тела матки в некоторой степени зависит от менструальной функции. У менструирующих женщин рак эндометрия может проявляться обильными длительными менструациями, часто нерегу-
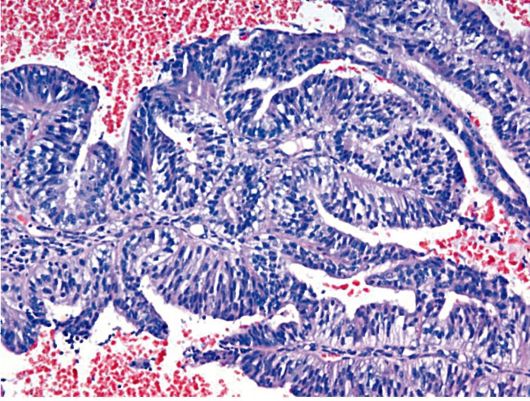
Рис. 15.27. Аденокарцинома (умеренно дифференцированная) эндометрия. Окраска гематоксилином и эозином, x 400. Фото О.В. Зайратьянца
лярными, ациклическими кровотечениями. Однако в 75% случаев рак эндометрия развивается у женщин в постменопаузе и обусловливает появление кровяных выделений из половых путей, которые называют кровотечением в постменопаузе. Кровяные выделения могут быть скудными, мажущими или обильными. Они возникают в постменопаузе у 90% больных раком эндометрия; в 8% случаев при диагностированном раке его клинические проявления отсутствуют. Помимо кровяных выделений, у больных могут наблюдаться гнойные выделения, а при стенозе цервикального канала может формироваться пиометра. Боли, если они не обусловлены пиометрой, появляются поздно, при распространенном раковом процессе с инфильтратами в малом тазу. При сдавлении мочеточника инфильтратом с возникновением блока почки боли локализуются в области поясницы. В отдельных наблюдениях могут формироваться асцит или объемные образования в малом тазу (при метастазах в яичники, большой сальник).
Диагностика рака тела матки. Женщинам в постменопаузе в качестве скрининга показано влагалищное УЗИ органов малого таза 1 раз в год, а в группе риска по раку эндометрия - 1 раз в полгода. Включения в структуре М-эха и его утолщение более 4 мм (при ранней постменопаузе - более 5 мм) подозрительны на патологию эндометрия и требуют гистероскопии, выскабливания слизистой матки. При явных эхографических признаках злокачественной трансформации эндометрия показана аспирационная биопсия эндометрия, а при ее неинформативности гистероскопия и выскабливание слизистой оболочки матки.
При нарушении менструального цикла и УЗ-признаках патологии эндометрия, а также при кровотечении в постменопаузе показаны гистеро-цервикоскопия и раздельное диагностическое выскабливание слизистой оболочки матки. Информативность гистероскопии при раке эндометрия в постменопаузе составляет 98%, гистологическое исследование соскобов позволяет установить окончательный диагноз.
После установления диагноза проводят тщательное обследование больной с целью определения клинической стадии процесса и выбора тактики ведения. Наряду с физикальным, гинекологическим и лабораторным исследованиями выполняют эхографию органов брюшной полости, колоноско-пию, цистоскопию, рентгенографию грудной клетки, при необходимости - экскреторную урографию, КТ и т.д.
Лечение больных раком эндометрия зависит от стадии процесса и состояния больной. Неоперабельны пациентки с диссеминацией опухоли - массивным переходом опухоли на шейку матки и большими инфильтратами в параметрии, прорастанием мочевого пузыря и прямой кишки, отдаленными метастазами. Среди больных, нуждающихся в операции, у 13% имеются противопоказания к оперативному лечению, обусловленные сопутствующими заболеваниями.
При оперативном лечении по поводу рака тела матки выполняют экстирпацию матки с придатками, а при риске поражения лимфатических узлов - еще и селективную забрюшинную лимфаденэктомию (1-й этап). Расширенную экстирпацию матки выполняют крайне редко, поскольку она не улучшает прогноз и увеличивает частоту интра- и послеоперационных
осложнений. Гистерэктомию осуществляют абдоминальным доступом; при начальных стадиях рака возможна лапароскопическая операция с извлечением матки через влагалище (без нарушения ее целостности). Необходимость лимфаденэктомии диктуется тем, что метастазы в лимфатические узлы гормононечувствительны. Лимфаденэктомию целесообразно производить при наличии одного или нескольких из следующих факторов риска:
- инвазия в миометрий, превышающая половину его толщины;
- переход опухоли на перешеек или шейку матки;
- распространение опухоли за пределы матки;
- диаметр опухоли более 2 см;
- низкая дифференцировка опухоли, светлоклеточный, папиллярный, серозный или плоскоклеточный рак.
Наиболее значимы для лимфогенной диссеминации и, соответственно, для прогноза степень дифференцировки опухоли и глубина инвазии.
При поражении тазовых лимфатических узлов метастазы в поясничные лимфатические узлы наблюдаются у 50-70% больных. Нормальные размеры лимфатических узлов при интраоперационной пальпации не могут служить основанием для отказа от лимфаденэктомии, поскольку в 90% случаев пораженные лимфатические узлы не увеличены. Удаляют общие подвздошные и поясничные лимфатические узлы, тазовая лимфаденэктомия прогностически наименее важна, поскольку тазовые лимфатические узлы в последующем попадают в зону облучения.
После получения результатов морфологического исследования планируют второй этап лечения.
При подтвержденном высокодифференцированном раке IA стадии лучевую терапию не проводят, в остальных случаях осуществляют внутрипо-лостную или дистанционную лучевую терапию или их комбинацию. При высокодифференцированной аденокарциноме помимо этого назначают гормонотерапию, что улучшает результаты лечения.
При лечении больных во II стадии возможна расширенная экстирпация матки с последующей лучевой терапией и гормональным лечением гестаге-нами или, наоборот, назначают лучевую терапию, а затем проводят операцию. Результаты лечения при двух указанных подходах одинаковы, но первый из них более предпочтителен, поскольку позволяет точнее определить морфологическую стадию процесса.
Лечение больных в III-IV стадии заболевания планируют индивидуально. Целесообразно начинать лечение с операции, в ходе которой нужно стремиться к радикальности или максимальной редукции опухоли, что значительно улучшает прогноз. После операции обычно проводят комплексную лучевую и гормональную терапию.
Прогноз при раке тела матки в основном зависит от морфологической стадии и в меньшей степени - от возраста больной, гистологического типа опухоли, ее размера, степени дифференцировки, перехода на шейку матки, глубины инвазии миометрия, опухолевых эмболов в лимфатических щелях, метастазов в яичники и лимфатические узлы, диссеминации по брюшине, содержания рецепторов эстрогенов и прогестерона в опухоли, плоидности опухолевых клеток.
С увеличением возраста прогноз ухудшается: 5-летняя выживаемость при раке тела матки у больных до 50 лет составляет 91%, после 70 лет - 61%. Редкие гистологические типы рака (плоскоклеточный, папиллярный серозный, светлоклеточный, недифференцированный) склонны к прогрес-сированию, что определяет плохой прогноз; 5-летняя выживаемость больных составляет лишь 33%, тогда как при аденокарциноме - 92%. С потерей дифференцировки опухоли ухудшается прогноз: 5-летняя безрецидивная выживаемость при высокодифференцированном раке составляет 92%, при умеренно дифференцированном - 86%, при низкодифференцированном - 64%. Увеличение глубины инвазии миометрия обусловливает метастазиро-вание и поэтому утяжеляет прогноз, при поверхностной инвазии 5-летняя выживаемость составляет 80-90%, при глубокой - только 60%. Метастазы в лимфатические узлы повышают риск прогрессирования рака тела матки в 6 раз. 5-летняя безрецидивная выживаемость при метастатическом поражении лимфатических узлов составляет 54%, а при отсутствии метастазов - 90%. Прогноз значительно лучше при гормонозависимом патогенетическом варианте рака эндометрия, чем при автономном: 5-летняя выживаемость составляет соответственно 90 и 60%.
Методы первичной профилактики рака тела матки призваны устранить перечисленные факторы риска развития рака эндометрия и, по сути, направлены на устранение гиперэстрогении: снижение массы тела, компенсацию сахарного диабета, восстановление репродуктивной функции, нормализацию менструальной функции, устранение причин ановуляции, своевременное оперативное лечение при феминизирующих опухолях и т.д.
Однако наиболее действенны меры вторичной профилактики, направленные на своевременную диагностику и лечение фоновых и предраковых пролиферативных процессов эндометрия: адекватные обследование и лечение, скрининговое обследование женщин 1 раз в год с использованием трансвагинальной эхографии, формирование групп риска по раку эндометрия (на основе известных факторов риска) с регулярным наблюдением (трансвагинальная эхография и аспирационная биопсия 1 раз в 6 мес).
Контрольные вопросы
1. Каковы клиническая симптоматика рака эндометрия в различные возрастные периоды жизни женщины, методы диагностики и лечения?
2. Перечислите факторы риска развития гормонально-зависимого варианта рака эндометрия.
15.3. Рак маточной трубы
Рак маточной трубы - наиболее редкая злокачественная опухоль женских половых органов, частота которой составляет 0,11-1,18%. Рак маточной трубы чаще выявляется в возрасте 50-52 лет. Как правило, опухоль поражает одну маточную трубу. В анамнезе у больных нередко бывают бесплодие и отсутствие родов.
Рак в маточной трубе может возникнуть первично (первичный рак), но значительно чаще развивается вторично, вследствие распространения раковой опухоли из тела матки, яичника (вторичный рак). Встречаются метастазы рака молочной железы и опухолей желудочно-кишечного тракта (метастатический рак).
По морфологическому строению первичный рак маточной трубы может быть папиллярным, папиллярно-железистым, железисто-солидным.
Первичный рак маточной трубы распространяется, как и рак яичников, лимфогенным, гематогенным и имплантационным путем, с метастазами в паховые и парааортальные лимфатические узлы.
Выделяют 4 стадии первичного рака маточной трубы:
I стадия - рак ограничен маточной трубой;
II стадия - рак ограничен одной или двумя трубами и распространяется в пределах малого таза (матка, яичники, клетчатка);
III стадия - опухоль поражает одну или две маточные трубы, органы малого таза (матка, яичники), есть метастазы в парааортальные и паховые лимфатические узлы;
IV стадия - опухоль поражает одну или две маточные трубы, органы малого таза, есть метастазы в парааортальные и паховые лимфатические узлы, отдаленные метастазы.
Стадию рака определяют в процессе лапаротомии.
Клиническая симптоматика и диагностика рака маточной трубы. В отличие от опухолей яичников, в том числе злокачественных, рак маточной трубы имеет клинические проявления на ранних стадиях. Поскольку маточная труба анатомически сообщается с полостью матки через маточное отверстие трубы, кровь и продукты распада опухоли попадают в полость матки и затем через цервикальный канал - во влагалище, проявляясь в виде патологических выделений. Основным клиническим проявлением рака маточной трубы становятся патологические выделения из половых путей: серозные, серозно-гнойные, чаще серозно-кровянистые, реже цвета мясных помоев. Количество выделений может быть различным, от мажущих до профузных. Длительность выделений до установления диагноза составляет в среднем 6-12 мес.
Вторым по частоте симптомом при раке маточной трубы являются боли в нижних отделах живота, особенно на стороне пораженной опухолью трубы.
Наиболее часто при раке маточной трубы в малом тазу слева или справа от матки пальпируется объемное образование диаметром 3 см и больше. При раке маточной трубы иногда выявляется асцит. В ряде случаев заболевание протекает бессимптомно.
Правильный диагноз при первичном раке маточных труб до операции устанавливают редко (в 1-13% случаев). Дифференциальную диагностику проводят с опухолью яичника, раком тела матки, миомой матки, воспалительным процессом в малом тазу.
О раке маточной трубы следует подумать, когда у женщин старше 40 лет, особенно в период постменопаузы, начинают быстро увеличиваться придатки матки при отсутствии указаний на острый воспалительный процесс
внутренних половых органов. Диагноз становится более вероятным, если увеличению придатков матки сопутствуют уменьшение количества лейкоцитов, повышение СОЭ при нормальной температуре тела.
При вторичном раке маточной трубы клиническая картина определяется основным заболеванием (рак матки, яичников).
С целью диагностики рака маточной трубы рекомендуется цитологическое исследование аспирата из полости матки, цервикального канала. Для повышения точности цитологического исследования отделяемое собирают с помощью специальных колпачков или тампонов, которые вводят во влагалище на несколько часов.
Для диагностики рака маточной трубы используют УЗИ с ЦДК. Ультразвуковой метод позволяет выявить опухоль трубы даже у пациенток с ожирением. Патологический кровоток в опухолевом образовании свидетельствует о злокачественном процессе. Ценность методики значительно повышается при сопоставлении результатов с цитологическим исследованием аспиратов из матки и отделяемого из влагалища.
Диагноз рака маточной трубы даже во время операции (лапароскопия, лапаротомия) удается поставить только у каждой второй больной.
На ранних стадиях заболевания труба выглядит интактной и опухоль можно пропустить, если не нарушена целостность маточной трубы. На более поздних стадиях маточная труба приобретает вид мешотчатой опухоли колбасовидной, грушевидной или ретортообразной формы, напоминающей по внешнему виду пиосальпинкс. Чаще опухоль локализуется в ампулярном отделе маточной трубы. На разрезе пораженная труба представляет собой полость, заполненную массами, имеющими вид цветной капусты.
Лечение рака маточной трубы оперативное. Показаны экстирпация матки с придатками и удаление большого сальника с последующей рентгенотерапией. Во всех случаях, кроме ранних стадий заболевания, после операции необходимо также проведение курсов химиотерапии препаратами платины. Включение лучевой терапии в комплекс лечения больных первичным раком маточной трубы (наряду с операцией и химиотерапией) позволяет повысить 5-летнюю выживаемость, а также увеличить длительность безрецидивного периода.
Лечение вторичного рака маточной трубы определяется состоянием первичного очага поражения (рак тела матки, рак яичников).
Прогноз. Общая 5-летняя выживаемость при раке маточной трубы составляет около 35%; 5-летняя выживаемость при I стадии равна приблизительно 70%, при II-III стадии - 25-30%. Выживаемость больных повышается при проведении комбинированного лечения (оперативное вмешательство, химиотерапия, лучевая терапия).
15.4. Миома матки
Миома матки - доброкачественная гормонально-зависимая опухоль миометрия, возникает у женщин репродуктивного возраста (пик заболеваемости приходится на 40 лет). Миома матки составляет до 30% гинекологических заболеваний.
Этиология и патогенез. Современные представления о развитии миомы матки основаны на гормональной теории. Нарушения экскреции и метаболического превращения эстрогенов, а также соотношения фракций эстрогенов (преобладание эстрона и эстрадиола в фолликулиновую, а эстриола - в лютеиновую фазу) приводят к морфологическим изменениям в миоме-трии. Масса миометрия может увеличиваться в результате как гиперплазии гладкомышечных клеток, которая инициируется эстрогенами, так и гипертрофии этих клеток. Наряду с эстрогенами рост миомы стимулирует прогестерон.
Гипертрофия гладкомышечньгх клеток при миоме матки аналогична таковой во время беременности и может возникать только при сочетанном воздействии сравнительно высоких концентраций эстрадиола и прогестерона. В лютеиновую фазу прогестерон повышает митотическую активность миомы, кроме того, он воздействует на рост миомы путем индуцирования факторов роста. В ткани миомы рецепторов эстрадиола и прогестерона больше, чем в неизмененном миометрии. Нарушение обмена половых стероидов в миоматозных узлах вызывает аутокринную стимуляцию клеток при участии так называемых факторов роста. Медиаторами действия эстрогенов в ткани миомы матки являются инсулиноподобные факторы роста I
и II.
Наряду с гормональными аспектами патогенеза миомы матки немаловажную роль играют изменения иммунной реактивности организма, особенно при наличии хронических очагов инфекции, выраженные изменения гемодинамики малого таза, а также наследственная предрасположенность. Зоны роста миомы формируются вокруг воспалительных инфильтратов и эндометриоидных очагов в миометрии. В увеличении миомы значительную роль играют фенотипическая трансформация гладких мышечных клеток и дегенеративные изменения в условиях нарушенной микроциркуляции. Зачатки миоматозных узлов могут образовываться на эмбриональном этапе. Рост клеток-предшественниц продолжается много лет на фоне выраженной активности яичников под действием эстрогенов и прогестерона. Миомы неоднородны по структуре. В зависимости от соотношения мышечной и соединительной ткани узлы подразделяют на миомы, фибромы и фибромиомы.
По морфогенетическим признакам выделяют простые миомы, развивающиеся по типу доброкачественной мышечной гиперплазии, и пролифери-рующие миомы с морфогенетическими критериями истинной доброкачественной опухоли. У каждой 4-й больной миома матки пролиферирующая, с быстрым ростом миоматозных узлов. Количество патологических митозов в пролиферирующих миомах не превышает 25%.
Подозрение на саркому матки появляется при обнаружении в процессе гистологического исследования более 70% патологических митозов, а также при определении миогенных элементов с явлениями атипии и неоднородностью ядер клеток. Малигнизация миомы в саркому происходит менее чем в 1% клинических наблюдений. При субмукозном ее расположении риск малигнизации выше.
В зависимости от локализации и роста выделяют субмукозные (подсли-зистые) миоматозные узлы, растущие в полость матки и деформирующие ее, и субсерозные (подбрюшинные) узлы, растущие в сторону брюшной полости. Если по мере роста миоматозный узел расслаивает листки широкой маточной связки, его называют интралигаментарным. Интерстициальные (межмышечные) миоматозные узлы растут из среднего слоя миометрия и располагаются в толще миометрия.
Субмукозные миоматозные узлы могут характеризоваться различным топографическим расположением. В зависимости от локализации, ширины основания миоматозного узла и величины интрамурального компонента выделяют следующие типы субмукозных миом:
0 тип - субмукозные узлы на ножке, без интрамурального компонента;
I тип - субмукозные узлы на широком основании с интрамуральным компонентом менее 50%;
II тип - миоматозные узлы с интрамуральным компонентом 50% и более. Для субсерозной миомы существует аналогичная классификация:
0 тип - субсерозный узел на ножке, без интрамурального компонента;
I тип - интрамуральный компонент составляет менее 50% от объема узла, большая его часть является субсерозной;
II тип - интрамуральный компонент представляет более 50% объема миоматозного узла, субсерозный компонент выражен мало.
Клиническая симптоматика и диагностика. Для субмукозной миомы характерны длительные, обильные менструации со сгустками (меноррагии), которые могут продолжаться в межменструальный период (метроррагии). Маточные кровотечения приводят к развитию анемии. Наряду с маточными кровотечениями бывают тянущие и схваткообразные боли внизу живота. В результате сокращений матки при 0 типе субмукозной миомы может произойти самопроизвольная экспульсия миоматозного узла. При рождающемся миоматозном узле боли бывают интенсивными и схваткообразными. Субмукозная миома матки нередко сопровождается бесплодием и невынашиванием беременности.
Отдельные субсерозные миоматозные узлы малых размеров могут долго клинически ничем не проявляться, но по мере их увеличения возникают признаки нарушения питания опухоли, увеличивается вероятность пере-крута ножки миоматозного узла. Пациентки могут жаловаться на дискомфорт внизу живота, периодически возникающие тянущие или острые боли. Боли могут иррадиировать в поясничную область, ногу, промежность. При совершившемся перекруте ножки миоматозного узла или возникновении обширной зоны некроза боли становятся интенсивными, появляются симптомы раздражения брюшины и общеклинические признаки "острого живота".
Интерстициально-субсерозные миоматозные узлы менее подвержены деструктивным процессам вследствие нарушения питания, клинически долго не проявляются и могут достигать диаметра 10-25 см и более. Больных беспокоят ощущение тяжести и дискомфорта внизу живота, его увеличение. Болевой синдром связан с растяжением висцеральной брюшины матки, давлением миоматозных узлов на нервные сплетения малого таза. При на-
рушении кровообращения в больших миоматозных узлах боли острые. В зависимости от локализации субсерозных узлов возможно нарушение функции соседних органов. Рост миоматозного узла кпереди способствует развитию дизурических явлений: больные жалуются на учащенное мочеиспускание, неполное опорожнение мочевого пузыря, императивные позывы к мочеиспусканию, острую задержку мочи. Перешеечное расположение миоматоз-ного узла на задней стенке матки приводит к давлению на прямую кишку и нарушает дефекацию. Субсерозные узлы, располагающиеся на боковой стенке матки в нижней и средней трети, при достижении большого размера изменяют топографию мочеточника, могут приводить к нарушению пассажа мочи на пораженной стороне, возникновению гидроуретера и формированию гидронефроза. Субсерозные миоматозные узлы редко вызывают нарушение менструальной функции. Однако при множественных субсерозных миоматозных узлах возможно нарушение сократительной способности миометрия и появление менометроррагий.
Интерстициальные миоматозные узлы приводят к увеличению матки и могут заметно влиять на сократительную способность миометрия. У пациенток возникают жалобы на обильные длительные менструации, реже - на межменструальные кровяные выделения из половых путей. Однако прямой зависимости между размерами матки и появлением маточных кровотечений нет. Анемия у больных миомой матки может быть следствием хронических кровопотерь и острых маточных кровотечений. Без нарушений менструального цикла анемия может быть обусловлена депонированием крови в увеличенной миоматозными узлами матке. У пациенток с большой миомой матки (более 20 нед беременности) может возникнуть синдром, обусловленный сдавлением нижней полой вены, который проявляется сердцебиением и одышкой в положении лежа. Пациентки могут жаловаться на боли, увеличение живота, возможны острая задержка мочи, гидронефроз. При сочетании интерстициальных, субмукозных и субсерозных узлов клиническая картина многообразнее, чем при изолированных миоматозных узлах.
Диагностика. При двуручном гинекологическом исследовании пациенток с субмукозным расположением миомы тело матки может быть увеличено незначительно. У больных с рождающимся субмукозным узлом определяется сглаженность шейки матки, в цервикальном канале пальпируется округлой или овоидной формы миоматозный узел плотной консистенции. Диагноз можно уточнить во время осмотра с помощью зеркал: миоматозный узел пролабирует из цервикального канала во влагалище, как правило, он белесоватого цвета, с выраженным сосудистым рисунком или петехиальны-ми кровоизлияниями. Отдельные субсерозные миоматозные узлы пальпируются отдельно от матки как округлые плотные подвижные образования. Субсерозные узлы приводят к увеличению матки и изменению ее формы. Матка может достигать значительных размеров, ее поверхность становится бугристой, миоматозные узлы при пальпации плотные, а при нарушении кровообращения - болезненные. Интралигаментарные миоматозные узлы определяются сбоку от матки и выполняют параметрий. Нижний полюс узла достижим при пальпации через боковой свод влагалища, он плотной
консистенции, ограниченно подвижный при попытке смещения. У больных с интерстициальной миомой пальпируется плотная увеличенная матка с гладкой или бугристой поверхностью, как правило, безболезненная. В прошлом основным методом диагностики подслизистых миоматозных узлов у пациенток с жалобами на обильные менструации, схваткообразные боли во время менструации и маточные кровотечения в постменопаузе была метрография. Рентгенологические признаки миомы матки: расширение или искривление ее тени, субмукозные миоматозные узлы определяются в виде дефектов наполнения с четкими контурами, чаще на широком основании.
В настоящее время одним из наиболее информативных методов диагностики миомы матки является эхография (рис. 15.28). Информативность УЗИ в диагностике миомы матки, по данным разных авторов, достигает 92,8-95,7%. Подслизистые узлы миомы внутри расширенной полости матки имеют вид округлых или овальных образований средней эхогенности с ровными контурами. Звукопроводимость подслизистых узлов миомы выше, чем полипов эндометрия. Информативность УЗ-диагностики суб-мукозной миомы матки значительно возрастет с внедрением в практику внутриматочной эхографии с помощью специальных датчиков.
Субсерозные миоматозные узлы при УЗИ визуализируются в виде округлых или овальных образований, выходящих за наружный контур матки. Миоматозные узлы зачастую имеют слоистую структуру и так называемую псевдокапсулу, которая образуется в результате уплотнения и гипертрофии миометрия, прилежащего к миоматозному узлу. Эхогенность и звуковая проводимость зависят от гистологического строения миоматозного узла. В однородных гиперэхогенных миоматозных узлах преобладает фиброзная ткань. Появление интранодулярных гипоэхогенных включений указывает на некроз или кистозные полости. Гиперэхогенные включения с акустическим эффектом поглощения бывают при кальцинированных дегенеративных изменениях. Ультразвуковое сканирование позволяет обнаружить интерстициальные миоматозные узлы диаметром не более 8-10 мм.
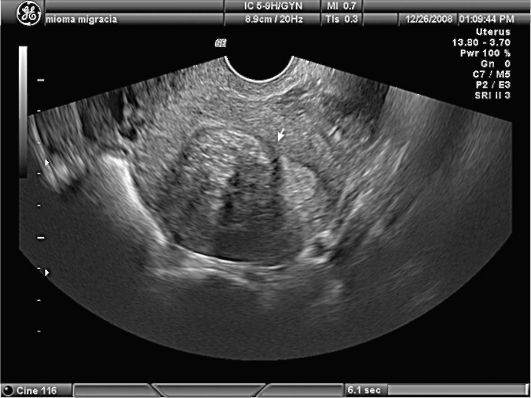
Рис. 15.28. Миома матки. Суб-мукозный узел. УЗИ
По данным УЗИ в зависимости от направления роста интерстициаль-ных миоматозных узлов можно прогнозировать появление субмукозных и субсерозных миоматозных узлов. Центрипетальное расположение миомы указывает на рост интерстициального миоматозного узла в полость матки, при увеличении такого узла более 10 мм появляется отчетливая деформация полости матки. Центрифугальный рост узлов происходит по направлению к брюшной полости. Центральный рост бывает при истинной межмышечной локализации миоматозных узлов и приводит к диффузному увеличению матки. Ультразвуковое сканирование дополняется исследованием пери-и интранодулярного кровотока для уточнения морфотипа опухоли. УЗИ, дополненное допплерографией, позволяет оценить особенности кровообращения в миоматозных узлах (рис. 15.29). При простой миоме регистрируется единичный периферический кровоток, при пролиферирующей - интенсивный центральный и периферический внутриопухолевый кровоток. Для оценки морфологической структуры опухоли важно определение количественных показателей кровотока. Так, для фибромиомы характерен кровоток с индексом резистентности выше 0,60, для пролиферирующей лейо-миомы - 0,50-0,55, для простой миомы - 0,55-0,60. В миоматозных узлах с некрозом и гиалинозом нарушено кровообращение, и при допплеро-графии определяется низкая скорость кровотока, ИР <0,44. Для саркомы матки характерны изменение ангиоархитектоники и появление атипической васкуляризации с формированием артериовенозных шунтов и анастомозов; при допплерографии определяется высокая скорость кровотока;
ИР <0,40.
Для уточнения топографического расположения миоматозных узлов можно использовать ультразвуковые томографы, дающие трехмерное ультразвуковое изображение. Трехмерная реконструкция наиболее информативна для субмукозной локализации узлов, она позволяет также оценить сопутствующий гиперпластический процесс в эндометрии (рис. 15.30, 15.31).
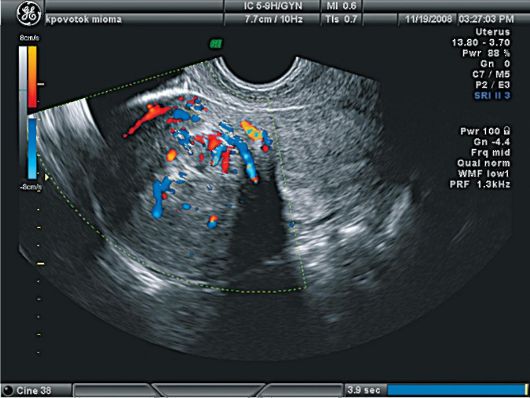
Рис. 15.29. Периферический и центральный кровоток в миоме. УЗИ и ЦДК
Рис. 15.30. Миома матки. Субмукозный узел. Трехмерное УЗИ
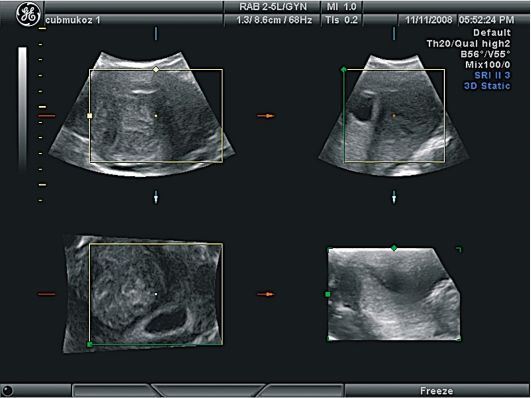
Рис. 15.31. Миома матки. Интерстициальный узел. Трехмерное УЗИ
Гидросонография (ГСГ) - метод ультразвуковой диагностики, который используется для уточнения типа субмукозной миомы матки (рис. 15.32). ГСГ позволяет дифференцировать узел и полип эндометрия, более четко определить размер и локализацию подслизистого узла относительно перешейка и устьев маточных труб, а также оценить степень деформации полости матки (рис. 15.33). Важными моментами диагностики субмукозных
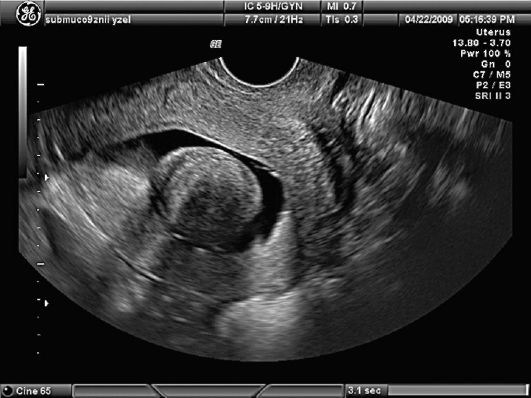
Рис. 15.32. Миома матки. I тип субмукозного узла. Гидросонография
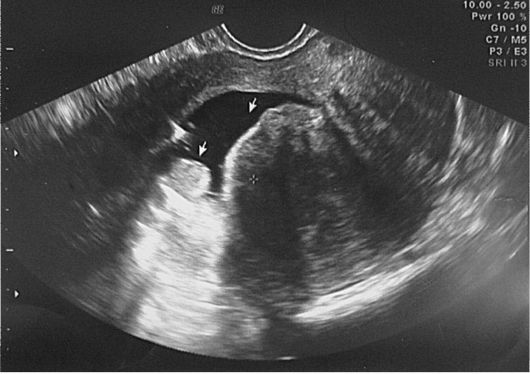
Рис. 15.33. Миома матки. II тип субмукозного узла. Полип эндометрия. Гидросо-нография
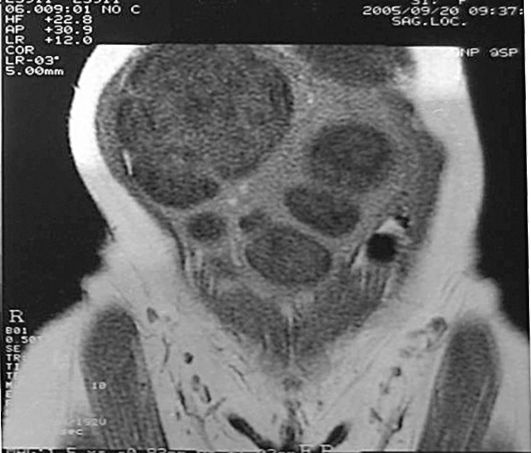
Рис. 15.34. Миома матки гигантских размеров. МРТ
узлов являются расположение интерстициальной части узла и близость латерального полюса к серозной оболочке матки. Все эти данные важны для выполнения миомэктомии субмукозных узлов с использованием транс-цервикального доступа. Для дифференциальной диагностики субсерозных узлов и опухолей забрюшинного пространства, увеличенных лимфатических узлов, опухолей малого таза и брюшной полости наряду с УЗИ применяют КТ и МРТ (рис. 15.34).
Гистероскопия позволяет с большой точностью диагностировать даже небольшие субмукозные узлы. Дефект наполнения в полости матки обычно выявляется при УЗИ или метрографии, но гистероскопия необходима для определения природы этого дефекта. Субмукозные узлы имеют сферическую форму, четкие контуры, белесоватый цвет, деформируют полость матки. На поверхности узла могут быть мелкоточечные или обширные кровоизлияния, иногда просматривается сеть растянутых и расширенных кровеносных сосудов, покрытых истонченным эндометрием. При изменении скорости подачи жидкости в полость матки подслизистые миоматозные узлы не меняют форму и размеры, что позволяет отличить их от полипа эндометрия. При обнаружении подслизистого узла определяют его величину, локализацию, ширину основания, величину интрамурального компонента
(рис. 15.35-15.37).
Интерстициальные узлы с центрипетальным направлением роста при гистероскопии определяются в виде выбухания одной из стенок матки. Гистероскопия показана при появлении нарушений менструального цикла у пациенток с маткой, увеличенной не более чем до 12-13 нед беременности. При большем увеличении матки информативность гистероскопии снижается.
Для исключения патологии эндометрия и слизистой оболочки церви-кального канала у пациенток с метроррагиями и контактными кровяными выделениями независимо от величины миомы матки проводится раздельное
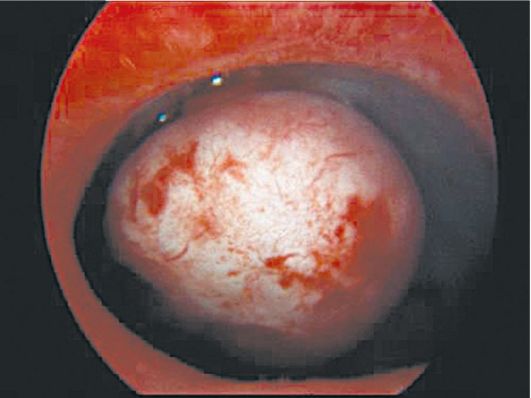
Рис. 15.35. Субмукозный узел 0 типа. Гистероскопия
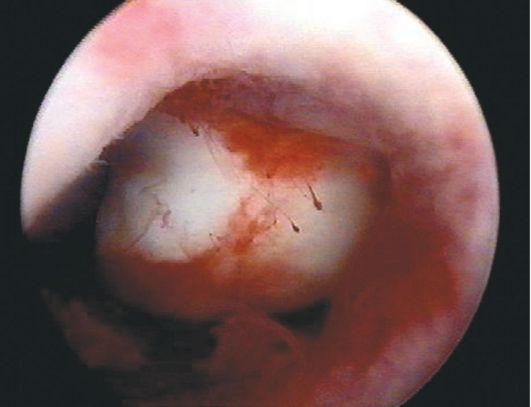
Рис. 15.36. Субмукозный узел I типа. Гистероскопия
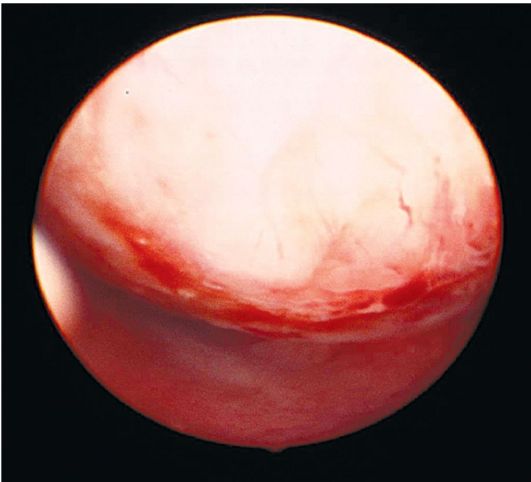
Рис. 5.37. Субмукозный узел II типа. Гистероскопия
диагностическое выскабливание слизистой оболочки матки с последующим гистологическим исследованием соскоба.
Диагностическая лапароскопия показана при невозможности дифференциальной диагностики субсерозной миомы матки, опухолей брюшной полости и забрюшинного пространства неинвазивными методами (рис. 15.38).
Лечение. Вопрос о целесообразности лечения при небольшой миоме матки без клинических проявлений окончательно не решен. Тем не менее, таким пациенткам показано динамическое наблюдение у гинеколога с обязательным ультразвуковым контролем 1 раз в год. Больным дают рекомендации, направленные на профилактику дальнейшего роста миомы и регуляцию гипоталамо-гипофизарно-яичниковых взаимоотношений. Пациенткам рекомендуют избегать тепловых процедур, им нельзя загорать на солнце и в солярии. Миома может увеличиться вследствие массажа и физиотерапии по поводу соматических заболеваний. С целью регуляции менструальной функции рекомендуется витаминотерапия по фазам менструального цикла (фолиевая кислота и витамины группы В в 1-ю фазу и витамин Е, аскорбиновая кислота - во 2-ю фазу) или использование гормональных контрацептивов. Предпочтительны монофазные эстроген-гестагенные препараты и низкодозированные гестагены.
Консервативная терапия миомы матки проводится с целью торможения роста или для обратного развития опухоли, лечения менометрорра-гий и анемии. С этой целью назначают прогестагены: норэтистерон, ли-нэстренол, медроксипрогестерон. Под действием этих препаратов миома и соответственно матка уменьшаются в среднем на 1-2 нед беременности;
Рис. 15.38. Субсерозный миоматозный узел I типа. Лапароскопия.
уменьшается кровопотеря при менструации и нормализуется уровень гемоглобина. В репродуктивном возрасте прогестагены назначают циклически с 16-го по 25-й день менструального цикла или с 5-го по 25-й день в течение 6-24 мес. Как правило, клинический эффект удается получить при миоме, не превышающей 8 нед беременности. У пациенток перименопаузального возраста целесообразно использовать прогестагены в непрерывном режиме в течение 6 мес, тем самым способствуя медикаментозной атрофии эндометрия и наступлению менопаузы. Для создания медикаментозной менопаузы применяют также антигестагены - гестринон. Для лечения миомы матки в настоящее время апробирован антигестаген мифепристон (Ru486), однако еще не отработаны дозы препарата и сроки лечения.
На рост миоматозных узлов влияют а-ГнРГ (гозерелин, трипторелин, бусерелин и др.). Под действием а-ГнРГ возможно уменьшение объема миоматозных узлов до 55%. Однако после прекращения приема препарата и восстановления менструальной функции у ряда больных начинается экспансивный рост миомы с признаками нарушения ее питания. Использование а-ГнРГ целесообразно у пациенток перименопаузального периода, поскольку обусловливает стойкую редукцию стероидогенеза, наступление менопаузы и, как следствие, купирование патологических симптомов миомы матки.
Агонисты ГнРГ используют для предоперационной подготовки к миомэктомии. Под воздействием а-ГнРГ структура миоматозного узла становится более плотной, снижается интра- и перинодулярный кровоток. Снижение внутриопухолевого кровотока, а также уменьшение миомы и плотности миометрия вокруг миоматозных узлов максимально выражены после 2-3 инъекций препарата. При более длительном курсе гормональной подготовки (ввиду прогрессирующей редукции артериального кровотока) возможны деструктивные и некробиотические процессы в миоматозных узлах, затрудняющие миомэктомию. Агонисты ГнРГ могут изменить топографию интерстициально-субмукозных узлов. Последние мигрируют в сторону полости матки, а интерстициально-субсерозные узлы вследствие уменьшения интерстициального компонента становятся более доступными для миомэк-томии.
Использование а-ГнРГ позволяет облегчить проведение миомэктомии и гистерэктомии у 76% больных из-за уменьшения матки и объема миома-тозных узлов. При миомэктомиях после гормональной подготовки крово-потеря уменьшается на 35-40%.
С целью предотвращения менометроррагий и роста миомы применяют внутриматочную гормональную систему "Мирена"♠, содержащую капсулу с левоноргестрелом (прогестаген). "Мирену"♠ вводят на 5 лет, она обеспечивает регулярное поступление левоноргестрела в полость матки и местное действие на эндометрий и миометрий с минимальными системными эффектами. Менструации становятся скудными, в ряде случаев наступает медикаментозная аменорея. Однако данный метод лечения может быть предложен пациенткам с размерами матки, не превышающими 6-8 нед беременности. Использование "Мирены"♠ противопоказано при субмукозной миоме, хронических воспалительных заболеваниях репродуктивной системы, фоновых
процессах на шейке матки, а также у пациенток с абсолютными показаниями к оперативному лечению.
Хирургическое лечение миомы матки остается ведущим, несмотря на достаточно высокую результативность консервативных методов. Частота радикальных операций доходит до 80%. Оперативные вмешательства по поводу миомы матки составляют 45% абдоминальных вмешательств в гинекологии. Хирургическое лечение миомы матки может быть радикальным или органо-сохраняющим. Радикальное хирургическое лечение в объеме гистерэктомии показано при:
• большом размере миомы (13-14 нед беременности);
• быстром росте миомы (более 4 нед за год);
• нарушении питания, некрозе миоматозного узла;
• шеечной миоме;
• миоме матки и менометроррагии, анемизирующей больную;
• росте миомы в постменопаузе;
• нарушении функции соседних органов.
В настоящее время имеется тенденция к снижению числа радикальных оперативных вмешательств при миоме матки и расширению показаний к органосохраняющим операциям. Органосохраняющая хирургия матки, помимо сохранения менструальной и репродуктивной функций, позволяет предотвратить нарушение деятельности тазовых органов и способствует профилактике их опущения. Объем оперативного вмешательства зависит от различных факторов. Хирургическое лечение миомы матки считается радикальным при выполнении гистерэктомии и включает в себя экстирпацию матки или надвлагалищную ее ампутацию без придатков. Шейка матки играет важную роль в формировании тазового дна и кровоснабжении мочеполовой системы. Объем оперативного вмешательства расширяется до экстирпации матки у женщин репродуктивного возраста при рецидивирующих фоновых процессах шейки матки, лейкоплакии с дисплазией многослойного плоского эпителия, при шеечном и перешеечном расположении миоматозного узла, а также при росте миомы матки у пациенток в постменопаузе.
Гистерэктомию можно провести абдоминальным, лапароскопическим и вагинальным доступами. Выбор хирургического доступа зависит от величины матки, размеров и локализации миоматозных узлов, а также от опыта и квалификации хирурга.
Органосохраняющие операции. Существуют методы оперативного вмешательства, позволяющие сохранить адекватное кровоснабжение яичников путем выделения восходящих ветвей маточных артерий и сохранить менструальную функцию при высокой надвлагалищной ампутации, а также де-фундации матки.
Менструальную и репродуктивную функции при миоме матки может сохранить миомэктомия, которая заключается в удалении миоматозных узлов и сохранении тела матки. Она может осуществляться лапаротомическим, лапароскопическим и гистероскопическим доступами. Выбор хирургического доступа зависит от:
- величины матки;
- локализации миоматозных узлов;
- числа и величины миоматозных узлов;
- предоперационной гормональной подготовки;
- оснащенности эндоскопическим оборудованием;
- опыта хирурга в выполнении эндоскопических операций. Лапаротомический доступ предпочтителен при множественных интер-
стициальных миоматозных узлах размером более 7-10 см, при низкой шеечно-перешеечной локализации узлов, особенно по задней и боковой стенкам матки. Лапаротомический доступ позволяет адекватно сопоставить края ложа удаленного большого узла с наложением двухрядных викриловых швов. От полноценности рубца на матке зависят течение планируемой беременности и ведение родов (рис. 15.39, 15.40).
Лапароскопический доступ показан при субсерозных миоматозных узлах на ножке (0 тип) или при субсерозных узлах I типа. Отдельные субсерозные миоматозные узлы не представляют трудностей для эндоскопического удаления. Узел после фиксации зубчатыми щипцами отделяют от матки, коагулируя ножку, после чего пересекают ее ножницами или коагулятором. Современные морцелляторы позволяют извлекать из брюшной полости узлы различных размеров и массы, мелкие миоматозные узлы можно извлекать через мини-лапаротомное и кольпотомное отверстия. Субсерозные узлы I типа удаляют путем декапсуляции и энуклеации с поэтапной коагуляцией кровоточащих сосудов ложа (рис. 15.41). При значительном размере ложа после миомэктомии накладывают эндоскопические двухрядные швы (рис. 15.42). Ушивание ложа узла позволяет осуществить дополнительный гемостаз, способствует профилактике спаечного процесса в малом тазу и формирует полноценный рубец. Вопрос о выполнении миомэктомии лапароскопическим доступом при интерстициальных миоматозных, а также субсерозных узлах II типа пересмотрен - данная локализация миомы является противопоказанием для использования лапароскопического доступа
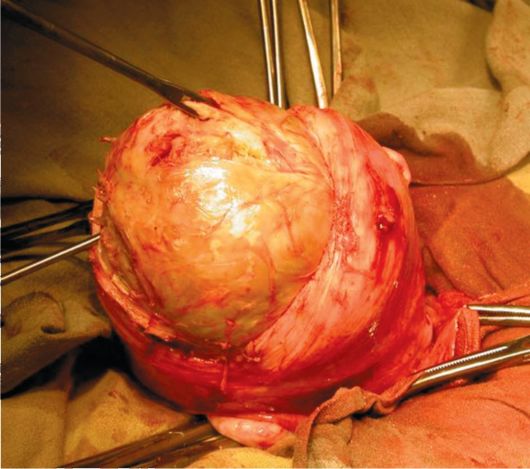
Рис. 15.39. Миомэктомия. Ла-паротомия
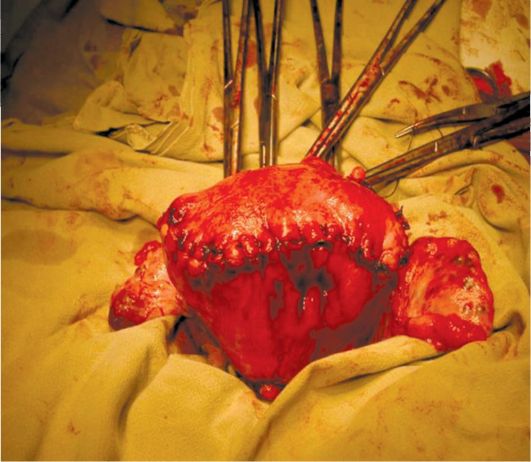
Рис. 15.40. Шов после миомэктомии. Лапаротомия
вследствие возможных разрывов матки по рубцу во время беременности и в родах.
При субмукозных миоматозных узлах выполняется трансцервикальная миомэктомия под контролем гистероскопии. Гистероскопическая миомэкто-мия (механическая, электрохирургическая и с помощью лазера) стала оптимальным методом удаления субмукозных миоматозных узлов.
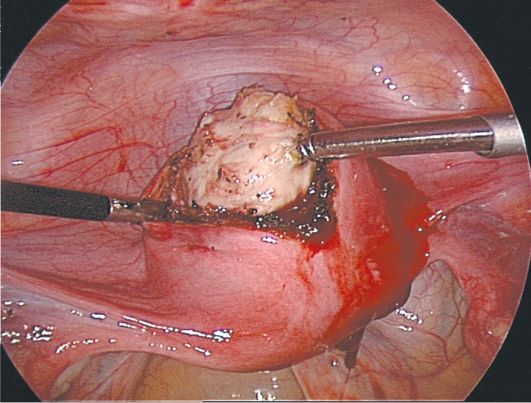
Рис. 15.41. Миомэктомия. Лапароскопия
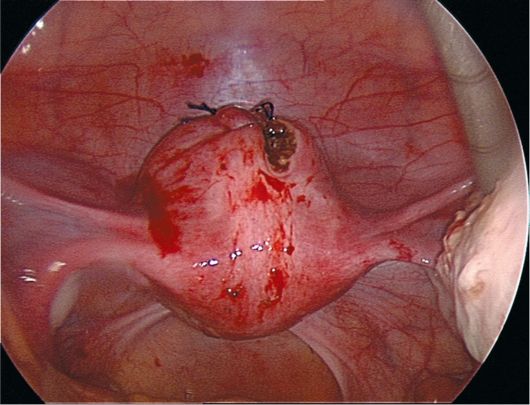
Рис. 15.42. Шов после миомэктомии. Лапароскопия
Выбор метода трансцервикальной миомэктомии зависит от:
- типа субмукозного узла, его локализации и величины;
- оснащенности эндоскопическим оборудованием;
- оперативных навыков хирурга в эндоскопии.
Механическая миомэктомия возможна при субмукозных узлах 0 и I типов с незначительным интерстициальным компонентом. При этом можно удалить даже большие подслизистые узлы. Возможность удаления механическим путем зависит также от локализации узла; легче всего удалять узлы, расположенные в дне матки. При удалении субмукозного узла необходимо дополнительно расширить цервикальный канал, прицельно фиксировать узел абортцангом и произвести его откручивание и удаление с последующим гистероскопическим контролем.
Электрохирургическая миомэктомия (гистерорезекция) показана при суб-мукозных узлах I и II типов. В зависимости от размера и типа субмукозного узла операцию можно выполнять одномоментно или в два этапа. Двухэтап-ная операция рекомендуется при узлах, у которых большая часть располагается в стенке матки (II тип по гистероскопической классификации - см. выше).
К факторам, ограничивающим трансцервикальную резекцию субмукоз-ных узлов, относятся:
- миоматозный узел диаметром более 5 см в диаметре;
- рубцы на матке после кесарева сечения и миомэктомии;
- сопутствующая патология эндометрия, труб и яичников.
К альтернативным методам лечения миомы матки относятся лапароскопический миолиз (вапоризация миоматозного узла с помощью лазера), ЭМА, перевязка или клеммирование маточных артерий и абляция миомы матки с помощью фокусированного ультразвукового луча (ФУЗ-абляция).
ЭМА может быть предложена пациенткам репродуктивного и премено-паузального возраста как альтернатива гистерэктомии у пациенток, желающих сохранить менструальную и репродуктивную функцию.
ЭМА не проводится в постменопаузе и противопоказана при:
• остром воспалительном процессе органов гениталий;
• раке эндометрия и шейки матки;
• подозрении на саркому матки.
Эмболизация маточной артерии проводится в рентгенооперационной под контролем ангиографа: после пункции и катетеризации бедренной артерии катетер устанавливают в устье маточной артерии, после чего вводят эмбо-лизирующие препараты: частицы поливенилалкоголя (ПВА), трисакрило-вые, желатиновые эмбосферы, гидрогель и др. (рис. 15.43). Прекращается кровоснабжение миоматозных узлов, снижается приток крови по маточным артериям. В миоматозных узлах возникают дистрофические процессы, которые приводят к их гиалинозу и фиброзу, а в ряде случаев к миолизису (рис. 15.44). Миоматозные узлы уменьшаются в размерах в 2-3 раза, общий размер матки - в 1,7-2,5 раза.
ЭМА является методом выбора у больных с сопутствующими соматическими заболеваниями, имеющих высокий риск венозного тромбоза (ожирение, сахарный диабет, железодефицитная анемия тяжелой степени, тромбофлебит и др.), а также у пациенток, перенесших неоднократные хирургические вмешательства на органах брюшной полости (в связи с высоким риском хирургических осложнений, связанных со спаечной болезнью). ЭМА отличается низкой частотой интра- и послеоперационных осложнений
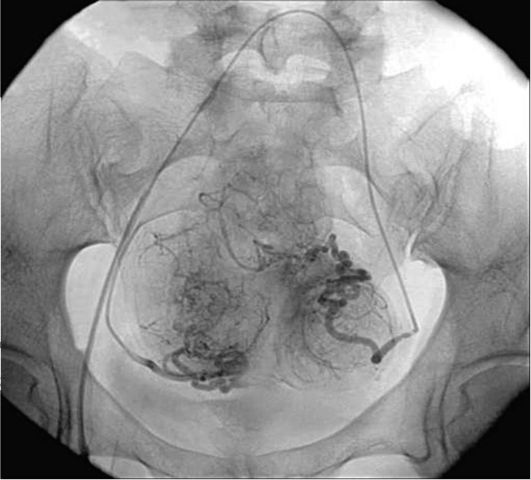
Рис. 15.43. Проведение катетера в маточную артерию. Ан-гиограмма
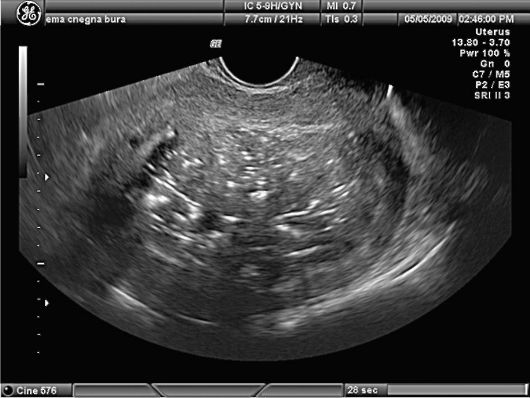
Рис. 15.44. Миома матки. Эм-болы в узле после эмболиза-ции маточных артерий. УЗИ
и высокой результативностью: эффективность ЭМА в отношении купирования клинических проявлений миомы матки (менометроррагии, анемии, болей, нарушения функции соседних органов и диспареунии) составляет 94%.
ЭМА используется в качестве предоперационной подготовки перед проведением миомэктомии лапаротомическим, лапароскопическим и транс-цервикальным доступом. При субмукозных миоматозных узлах, а также при интерстициальных миомах с центрипетальным направлением роста ЭМА приводит к уменьшению объема миоматозных узлов на 50-70%. Уменьшение мышечного ложа потенцирует сократительную способность мио-метрия и, как следствие, миграцию миоматозных узлов в полость матки. В зависимости от начальных размеров узлов, а также от их типа возможны различные исходы: самопроизвольная экспульсия, выделение узлов в виде детрита, миолизис. После уменьшения размеров узлов становится возможным выполнение трансцервикальной миомэктомии: методом откручивания при полном выделении узлов в полость матки или их резекции при формировании узлов I или II типа. Как этап перед выполнением лапаро-томической миомэктомии ЭМА проводится при большом размере матки (свыше 16 нед беременности) или при большом размере интерстициальных и интерстициально-субсерозных узлов (диаметром более 15 см). Лапароскопическая миомэктомия после ЭМА целесообразна при наличии субсерозного узла на ножке. Снижению интраоперационной кровопотери при выполнении миомэктомий после ЭМА способствуют уменьшение кровообращения в бассейне маточных артерий и полное его отсутствие в миоме.
Клеммирование, или перевязка маточных артерий, может выполняться как самостоятельный метод лечения или как этап перед миомэктомией с целью снижения интраоперационной кровопотери. Временное клеммирование или перевязка выполняется из трансвагинального доступа; после выполнения миомэктомии клеммы или лигатуры снимаются. При лапароскопическом доступе, как правило, используются пересечение восходящего ствола ма-
точной артерии или постоянное лигирование. Помимо снижения интраопе-рационной кровопотери наложение лигатур на восходящий ствол маточной артерии вызывает резкое сокращение миометрия и происходит выделение миоматозных узлов в брюшную полость. Клеммирование маточных артерий замедляет рост миомы, однако исключить рецидив роста или возможность образования новых зон нельзя - эффективность данного метода лечения для купирования клинических проявлений миомы составляет 65%.
ФУЗ-абляция миомы относится к неинвазивному методу лечения, при котором фокусированный ультразвук дистанционно коагулирует отграниченные участки миомы под контролем МРТ. Показанием к использованию данного метода лечения является миома матки с клиническими проявлениями. Использование ФУЗ-абляции противопоказано при миоме диаметром менее 2 см и более 10 см, множественном характере миомы матки, наличии узлов по задней стенке (из-за возможности непреднамеренного поражения нервных окончаний и развития плекситов), шеечных и перешеечных узлов (затруднение прохождения ФУЗ через лонную кость), фибром из-за скудной васкуляризации, наличии рубцов на передней брюшной стенке (риск ожога), металлических имплантатов и ожирения. Метод можно считать эффективным, если произведена деструкция более 60% от общего объема узла. Успешная ФУЗ-абляция миомы не предотвращает рост узлов другой локализации в отдаленном периоде. Преимуществами метода являются его малая инвазивность, отсутствие наркоза, возможность амбулаторного применения. Ограничивают использование метода необходимость высокоспецифичного оснащения операционной и большой спектр противопоказаний.
Прогноз. Миома матки относится к доброкачественным опухолям с редкой малигнизацией, поэтому прогноз для жизни благоприятный. Однако при росте миомы может потребоваться хирургическое лечение с исключением менструальной и репродуктивной функций у молодых женщин. Даже небольшие миоматозные узлы могут обусловить первичное и вторичное бесплодие.
Профилактика миомы матки заключается в своевременном выявлении заболевания на ранних стадиях и проведении патогенетически обоснованной терапии.
15.5. Саркома матки
Саркома матки - злокачественная опухоль, которая встречается редко и составляет от 3 до 5% всех злокачественных образований матки. Лейо-миосаркома развивается в среднем в возрасте 43-53 лет, эндометриальная стромальная саркома, карциносаркома и другие виды опухоли чаще возникают в постменопаузе.
Морфологическая классификация сарком матки:
• лейомиосаркома;
• эндометриальная стромальная саркома;
• смешанная гомологическая мюллеровская саркома (карциносаркома);
• смешанная гетерологическая мюллеровская саркома (смешанная мезо-дермальная саркома);
• другие саркомы матки.
Клиническая картина. Клинические проявления связаны с местом расположения и скоростью опухолевого роста. Матка быстро увеличивается в размерах, по мере ее роста присоединяются нарушения менструального цикла, боли в малом тазу, обильные водянистые бели, иногда с неприятным запахом. При возникновении саркомы матки в миоматозных узлах клинические проявления могут не отличаться от таковых при миоме матки (субмукозной, субсерозной, интерстициальной).
При инфицировании опухоли и образовании обширных зон некроза появляется лихорадка, развивается анемия и быстро наступает кахексия. От появления первых симптомов до обращения к врачу обычно проходит несколько месяцев.
Важным диагностическим признаком является рост миомы в постменопаузе.
Клинико-анатомическая классификация сарком тела матки: I стадия - опухоль ограничена телом матки; IIа стадия - опухоль ограничена эндометрием или миометрием; IIб стадия - опухоль поражает тело и шейку матки, не выходя за пределы матки;
III стадия - опухоль распространяется за пределы матки, но не выходит за пределы малого таза;
IIIа стадия - опухоль прорастает параметрий, происходит метастатическое поражение придатков матки;
IIIб стадия - опухоль поражает параметральную клетчатку, возможно метастазирование в лимфатические узлы или во влагалище;
IV стадия - опухоль прорастает в соседние органы, распространяется за пределы малого таза или дает отдаленные метастазы.
Диагностика основывается на данных анамнеза (быстрый рост миомы, а также ее рост в постменопаузе, характерные жалобы больных).
По данным УЗИ можно заподозрить саркому матки на основании неоднородной эхогенности и узловой трансформации матки, участков с нарушением питания и некрозом в узлах. Появляется патологический кровоток со снижением при допплерографии ИР <0,40.
Аспирационная биопсия при лейомиосаркоме малоинформативна, но позволяет заподозрить карциносаркому и эндометриальную саркому в 30% случаев. Диагностическая информативность гистероскопии и раздельного диагностического выскабливания составляет 80-100%. Подтвердить саркому межмышечной локализации можно интраоперационно с морфологическим исследованием биоптата.
Лечение в основном хирургическое: расширенная экстирпация матки с придатками. Дополнительно проводят радиационную терапию с облучением области малого таза в суммарной дозе 45-50 Гр.
Химиотерапия получила широкое распространение при лечении больных в послеоперационном периоде при распространенном опухолевом процессе. С этой целью используют доксорубицин, часто в комбинации с винкристи-
ном, дактиномицином или циклофосфамидом. При III стадии заболевания проводят комплексную терапию, при IV стадии - полихимиотерапию.
Прогноз при саркомах матки пессимистичный. Даже при I стадии заболевания у каждой 2-й пациентки отмечается рецидив, а при II и III стадиях он возникает у 90% больных. Выживаемость низкая даже на ранних стадиях саркомы матки, так как быстро появляются отдаленные метастазы.
Прогноз более благоприятный при развитии саркомы в миоматозном узле.
Контрольные вопросы
К разделам "Миома матки", "Саркома матки"
1. Дайте определение заболеваний: миома матки, саркома матки.
2. Этиология, патогенез миомы матки.
3. Приведите классификацию миомы матки: морфологическую и топографическую.
4. Каковы симптомы миомы матки, саркомы?
5. Назовите основные методы диагностики миомы матки, саркомы матки.
6. Укажите варианты хирургического лечения миомы матки, перечислите показания к гистерэктомии, миомэктомии.
7. Расскажите об альтернативных методах лечения: ЭМА, ФУЗ-абляция миомы матки.
8. Каким должно быть медикаментозное лечение миомы матки?
15.6. Заболевания шейки матки
Патологические изменения шейки матки отражены в клинико-морфологической классификации, наиболее широко применяемой на практике:
• неопухолевые процессы: истинная эрозия, эктопия шейки матки, эк-тропион, лейкоплакия (простая), полипы шейки матки;
• предраковые изменения (дисплазия) - цервикальная интраэпители-альная неоплазия (Cervical Intraepithelial Neoplasia - CIN);
• рак.
Частота неопухолевых (фоновых) и предраковых процессов шейки матки весьма высока и не имеет тенденции к снижению. Этим заболеваниям подвержен большой контингент молодых женщин, что нередко отражается на их репродуктивном здоровье.
Патогенез заболеваний шейки матки в немалой мере определяется ее морфофункциональными особенностями. На шейке матки имеются два вида эпителия: влагалищная порция покрыта многослойным плоским, а цервикальный канал выстлан однорядным цилиндрическим эпителием. Клетки эпителия отделяет от стромы базальная мембрана, содержащая ретикулиновые, аргирофильные волокна, коллаген, нейтральные мукополи-сахариды. Строма представлена переплетающимися пучками эластических, коллагеновых волокон, содержит кровеносные и лимфатические сосуды.
Многослойный плоский эпителий состоит из клеток, различающихся по величине, ядерно-цитоплазматическому соотношению, функциональным и митотическим способностям (рис. 15.45). Выделяют базальный, параба-зальный, промежуточный и поверхностный слои.
• Базальный слой состоит из одного ряда незрелых клеток с высокой митотической активностью (крупные клетки с крупным ядром), здесь же расположены резервные клетки, обладающие бипотентными свойствами (при регенерации формируют как многослойный плоский эпителий, так и цилиндрический эпителий).
• Парабазальные незрелые клетки располагаются в 2-4 ряда, также обладают достаточно крупными размерами, ядром и митотической активностью.
• Промежуточные клетки имеют полигональную форму, включения гликогена в цитоплазме и расположены в 6-12 слоев. Количество слоев промежуточных клеток и активность накопления гликогена эстроген-зависимы; наибольшие они в репродуктивном возрасте, минимальные - при гипоэстрогении в нейтральном периоде у девочек, а также в постменопаузе.
• Поверхностные клетки имеют уплощенную ладьевидную форму, ка-риопикнотическое ядро, их цитоплазма богата гликогеном, количество рядов поверхностных клеток варьирует в зависимости от фазы менструального цикла и может достигать 12-18.
В постменопаузе многослойный плоский эпителий влагалища и шейки матки в норме представлен только базальными и парабазальными клетками.
Цилиндрический эпителий представлен одним рядом цилиндрических, или бокаловидных, клеток с базально расположенными округлыми ядрами. Клетки цилиндрического эпителия обладают невысокой (по сравнению
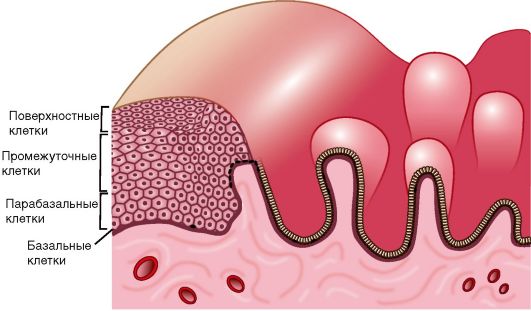
Рис. 15.45. Два вида эпителия, покрывающих шейку матки
с базальными клетками многослойного плоского эпителия) митотической активностью, они способны вырабатывать мукополисахариды, в результате чего происходит формирование слизистой пробки в шеечном канале.
Граница цилиндрического и плоского эпителия всегда привлекала внимание клиницистов, поскольку в 90% случаев заболевания шейки матки возникают именно в этой зоне ("зона бурь"). Наличие стыка двух видов эпителия на влагалищной порции шейки матки расценивается как физиологический процесс у девочек и подростков, у женщин в период беременности. В репродуктивном возрасте граница цилиндрического и плоского эпителия находится в области наружного зева, в постменопаузе - на различном уровне в цервикальном канале. Месторасположение границы цилиндрического и многослойного плоского эпителия необходимо учитывать при обследовании и лечении пациенток.
Фоновые заболевания шейки матки
Истинная эрозия представляет собой дефект многослойного плоского эпителия на влагалищной порции шейки матки. Считается, что истинная эрозия возникает в результате воспалительных процессов, приводящих к некробиозу многослойного плоского эпителия в кислой среде влагалища, который в результате механической травмы слущивается с подлежащей мембраны. При этом хотя бы частично сохраняется базальный слой клеток и тем самым - потенция к заживлению. Истинная эрозия эпителизируется в течение 3-7 дней. Она не имеет специфической клинической картины, и очень часто пациентка не обращается к врачу. Бели или другие патологические выделения, зуд, как правило, обусловлены преходящими воспалительными изменениями, экзоцервицитом, кольпитом. При кольпоскопии эрозия выглядит как участок эктоцервикса ярко-красного цвета, неправильной формы, не покрытый эпителием (рис. 15.46). Лечение направлено на устранение контаминации (местная антибактериальная терапия) и нормализацию микрофлоры влагалища (применение эубиотиков - лакто-бактерин♠ и др.), стимуляцию регенерации (солкосерил♠). При гормональных нарушениях и отсутствии должного лечения возможна эпителизация эрозии с формированием не многослойного плоского, а цилиндрического эпителия (эктопия) шейки матки.
Эктопия шейки матки подразумевает смещение цилиндрического эпителия на влагалищную порцию шейки матки. Выделяют врожденную и приобретенную эктопию (псевдоэрозию).
Если в пубертатном периоде не происходит закономерного смещения стыка 2 видов эпителия шейки матки к наружному зеву, то в репродуктивном периоде имеется врожденная эктопия - при кольпоскопии вокруг наружного зева определяется венчик цилиндрического эпителия округлой формы, красного цвета, с бархатистой поверхностью. С точки зрения гистогенеза врожденную эктопию можно рассматривать как вариант физиологической нормы, поэтому пациентки с неосложненной врожденной эктопией подлежат наблюдению.
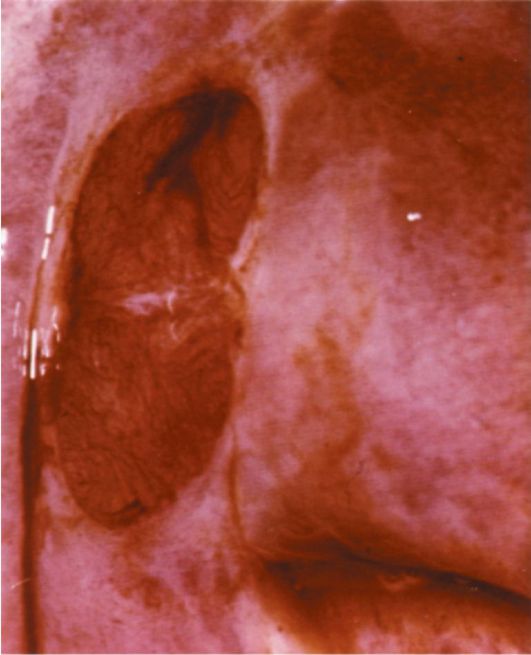
Рис. 15.46. Истинная эрозия. Кольпо-скопия. (Из: Бауэр Х.-К. Цветной атлас по кольпоскопии. - М., 2002. - С. 111)
Приобретенная эктопия может возникать в результате эпителизации истинной эрозии с формированием цилиндрического эпителия, источником которого могут быть резервные клетки. Предрасполагающими факторами являются урогенитальные инфекции, включая вирусные, гормональные нарушения. У пациенток с эктопией, как правило, жалоб нет, иногда наблюдаются бели, контактные кровяные выделения, что обычно бывает при сопутствующем экзо- и эндоцервиците. При гинекологическом осмотре эктопия выглядит как участок неправильной формы ярко-красного цвета, часто располагающийся асимметрично на передней или задней губе шейки матки на фоне бледной слизистой оболочки эктоцервикса. При кольпоско-пии эктопия представляет собой участки, покрытые множеством округлых или продолговатых красных сосочков (вид бархатистой поверхности).
Ярко-красный цвет обусловлен сосудами подлежащей стромы, просвечивающими через один ряд цилиндрических клеток (рис. 15.47). Иногда кольпоскопическую картину может дополнять "зона трансформации", которая отражает процессы замещения цилиндрического эпителия эктопии многослойным плоским - визуализируются метаплазированный и незрелый многослойный плоский эпителий, открытые и закрытые протоки желез, формирующиеся при перекрытии крипт в зоне эктопии многослойным плоским эпителием.
Тактика ведения пациенток с эктопией определяется по результатам кольпоскопии, цитологии, обследования на вирус папилломы человека (ВПЧ), при необходимости биопсии. При неосложненной эктопии у нерожавших женщин показано наблюдение, при персистирующем воспалительном процессе, ВПЧ после противовоспалительного и противовирусного лечения применяют криодеструкцию, лазерокоагуляцию, радиохирургиче-
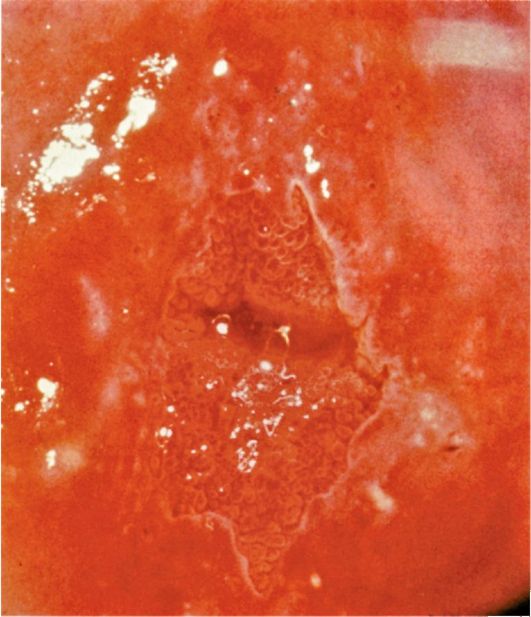
Рис. 15.47. Эктопия. Кольпоскопия. (Из: Бауэр Х.-К. Цветной атлас по коль-поскопии. - М., 2002. - С. 60)
ское воздействие (сургитрон). У пациенток, выполнивших репродуктивную функцию, показаны деструкция зоны эктопии или конизация шейки матки тем или иным методом.
Эктропионом называют сочетание эктопии и деформации шейки матки. Во время беременности в результате гормональных изменений и воздействия прогестерона увеличивается цервикальная эктопия, в родах (реже - при абортах) происходит выворот слизистой оболочки цервикального канала в результате разрывов циркулярных мышечных волокон шейки. Па-тогномоничных жалоб у пациенток нет. При осмотре на деформированной шейке матки с зияющим или щелевидным наружным зевом видны красные участки цилиндрического эпителия, нередко с зоной трансформации. Метод лечения выбирают в зависимости от степени деформации шейки матки, с учетом возраста и востребованности репродуктивной функции больной: криодеструкция, лазерокоагуляция, радиохирургическое воздействие - ди-атермоэлектроконизация.
Лейкоплакия шейки матки (в переводе с греч. - "белое пятно") представляет собой локальные процессы ороговения многослойного плоского эпителия разной выраженности - паракератоз, гиперкератоз, акантоз с формированием лимфогистиоцитарных инфильтратов вокруг сосудов подлежащей стромы. Согласно современным представлениям лейкоплакия относится к дискератозам. Выделяют простую лейкоплакию (фоновый процесс) и про-лиферирующую с атипией клеток, при которой отмечаются повышенная митотическая активность, атипические клетки в базальных и парабазаль-ных слоях многослойного плоского эпителия. Лейкоплакию с атипией клеток относят к предраку шейки матки и классифицируют в зависимости от степени атипии. В возникновении лейкоплакии играют роль вирусные, в меньшей степени эндокринные, иммунные, инфекционные (хламидии) факторы.
Лейкоплакия не сопровождается какой-либо симптоматикой. При обследовании больных лейкоплакией с клинически выраженными формами можно невооруженным глазом увидеть возвышающиеся белые бляшки на эктоцервиксе или они выявляются только кольпоскопически. Кольпоско-пическая картина лейкоплакии может выглядеть как йоднегативная зона в виде белесоватой блестящей пленки с гладкой или бугристой поверхностью в результате развития рогового слоя эпителия (рис. 15.48). Множественные красные точки в основе лейкоплакии (пунктация) и линии, образующие многоугольники в полях лейкоплакии (мозаика), обусловлены кровеносными сосудами в соединительнотканных сосочках и выростах, вдающихся в эпителиальные пласты при указанном заболевании. В участках лейкоплакии отсутствуют промежуточные клетки, накапливающие гликоген, что обусловливает отрицательную пробу Шиллера. Цитологическое исследование не позволяет надежно дифференцировать простую лейкоплакию и лейкоплакию с атипией, поскольку клетки, взятые с поверхности эпителия, не отражают процессов, происходящих в базальных слоях; необходима биопсия шейки матки с гистологическим исследованием.
Лечение проводится индивидуально, в зависимости от вида лейкоплакии, ее размеров, а также возраста и репродуктивной функции пациентки. При незаинтересованности в деторождении предпочтительны методы с гистологическим контролем удаляемой части шейки матки - радиохирургическая конизация, диатермоэлектроконизация. У молодых женщин при простой лейкоплакии во избежание рубцовых изменений шейки матки применяют криодеструкцию, лазерную вапоризацию, радиохирургическое лечение.
Полипы слизистой оболочки цервикального канала представляют собой соединительнотканные выросты, покрытые эпителием.
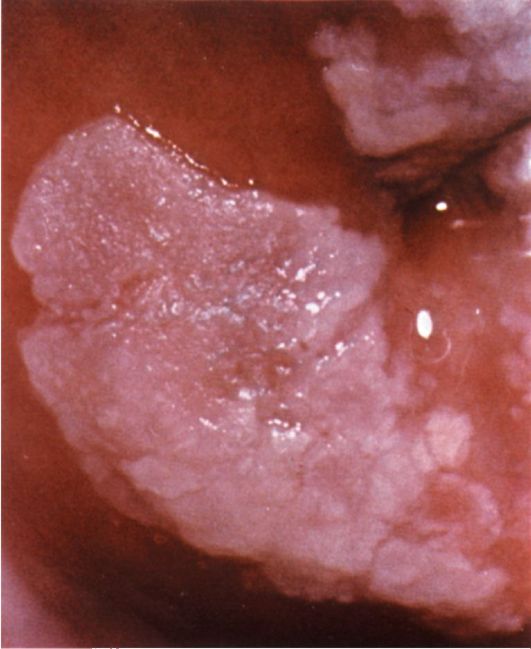
Рис. 15.48. Лейкоплакия. Кольпоско-пия. (Из: Бауэр Х.-К. Цветной атлас по кольпоскопии. - М., 2002. - С. 201)
Различают железистые (покрыты однорядным цилиндрическим эпителием) и эпидермизированные (покрыты метапластическим многослойным эпителием) полипы. Они выглядят как ярко-розовые образования продолговатой или листовидной формы, свисающие из наружного зева шейки матки; подобная картина не исключает полипов эндометрия (рис. 15.49). Современная ультразвуковая аппаратура с высокой разрешающей способностью позволяет диагностировать полипы шейки матки небольших размеров, не выходящие за пределы наружного зева. Они выглядят как включения повышенной или средней эхогенности в цервикальном канале.
Если ножка полипа визуализируется в нижней трети цервикального канала невооруженным глазом, возможно удаление полипа с коагуляцией его основания. В остальных наблюдениях необходима дифференциальная диагностика с полипами эндометрия больших размеров или с полипами, исходящими из нижней трети полости матки, поэтому полипэктомию осуществляют под контролем гистероцервикоскопии. При ультразвуковых и эндоскопических признаках патологии эндометрия полипэктомию целесообразно сочетать с раздельным диагностическим выскабливанием слизистой оболочки полости матки и цервикального канала.
Предраковые заболевания шейки матки
Предрак и рак шейки матки имеют общие этиологию и патогенез. В настоящее время доказана этиологическая роль ВПЧ в возникновении данной патологии. Вирус и его генетический материал обнаруживаются в 98% наблюдений в эпителиальных клетках при умеренной, тяжелой дисплазии и раке шейки матки. Среди ВПЧ, способных поражать половые органы, вы-
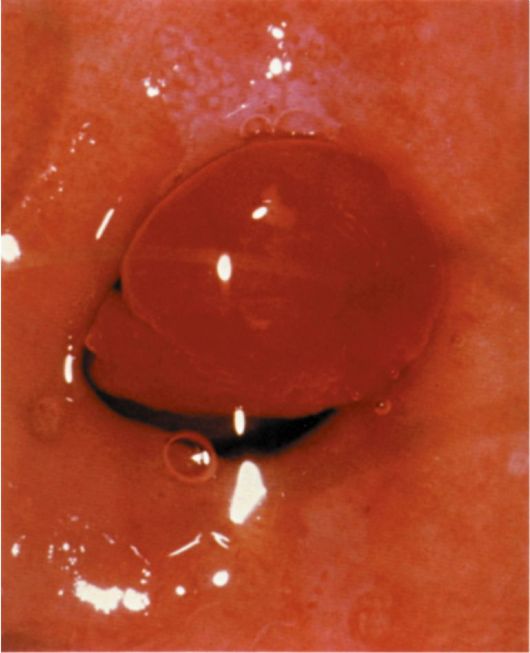
Рис. 15.49. Полипы слизистой оболочки цервикального канала. Кольпоскопия. (Из: Бауэр Х.-К. Цветной атлас по коль-поскопии. - М., 2002. - С. 83)
деляют серотипы, ассоциированные с низким (3,6,11,13,32,42, 43,44,72,73) и с высоким (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58) онкологическим риском. Серотипы 16 и 18 в странах Европы и в России обусловливают около 80% рака шейки матки и тяжелой дисплазии, остальные серотипы ответственны примерно за 20% предраковых и раковых процессов шейки матки.
Вирус имеет тропизм к эпителиальным клеткам и оказывает продуктивное (папилломы, кондилломы) и трансформирующее воздействие (CIN, рак). Папилломавирусная инфекция (ПВИ) может быть латентной (носи-тельство), субклинической (при обследовании выявляют койлоцитоз, дис-плазию, йоднегативную зону) и клинически выраженной (эндофитные, экзофитные кондиломы, рак). В большинстве случаев заражение ВПЧ остается незамеченным, в течение жизни ПВИ переносит 80% сексуально активного населения. ВПЧ-инфекция бессимптомна, ее диагностируют по данным ПЦР либо при микроскопическом обнаружении койлоцитоза, реже - методом гибридизации в растворе (Digene-test). Серодиагностика ПВИ не проводится, поскольку антитела формируются менее чем у 30% инфицированных ВПЧ.
Особенности течения ПВИ таковы, что у 95% инфицированных происходит спонтанная элиминация вируса на протяжении 9-15 мес. Примерно у 5% больных с ВПЧ элиминации не происходит; связывают это с восприимчивостью эпителия, наследственно обусловленными дефектами противовирусной и противоопухолевой защиты. У таких больных вирусная инфекция персистирует, возрастает степень дисплазии, в последующем, через 2-15 лет, может формироваться рак шейки матки.
ВПЧ является ДНК-содержащим вирусом, его ДНК содержит 9 генов, 2 из которых кодируют структурные белки L1 и L2, остальные - функциональные белки, в том числе ответственные за опухолевую трансформацию эпителиоцитов гены Е6 и Е7. ВПЧ-инфекция имеет эписомальную стадию, когда в клетке происходит сборка вирусных частиц, и интегративную, на которой часть вирусной ДНК встраивается в геном эпителиоцита, после чего начинается опухолевая трансформация клетки-хозяина.
Под дисплазией, или цервикальной интраэпителиальной неоплазией (CIN), подразумевают процессы структурной и клеточной атипии (нарушение дифференцировки клеток) с изменением слоистости эпителия без вовлечения базальной мембраны (рис. 15.50). Согласно классификации ВОЗ (1995), выделяют легкую, умеренную и тяжелую дисплазию (CIN). Если нарушение структуры эпителия, полиморфизм клеток, увеличение митозов, дискариоз ядер наблюдаются в нижней трети эпителиального пласта, то говорят о легкой дисплазии, при наличии изменений в нижней и средней третях - о средней ее степени, если указанные выше изменения захватывают весь пласт - о тяжелой дисплазии.
Дисплазия бессимптомна, чаще она существует при фоновых процессах (90%), реже - при визуально неизмененной шейке матки (10%). Практически во всех странах приняты скрининговые программы для выявления предрака и рака шейки матки, согласно которым цитологическое исследование мазков с шейки матки, кольпоскопия должны выполняться всем
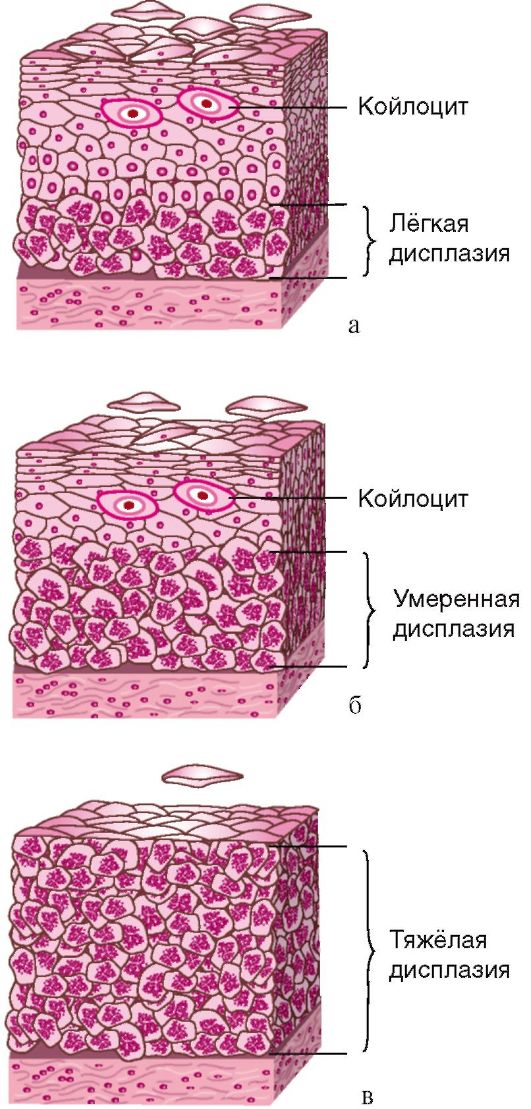
Рис. 15.50. Дисплазия разной степени выраженности: а - легкая; изменения ограничиваются нижней 1/3 эпителиального пласта (CIN1); б - поражены нижние 2/3 эпителиального пласта (CIN2); в - поражен весь эпителиальный пласт (CIN3, т.е. CIS или рак in situ)
женщинам с периодичностью 1 раз в каждые 1-5 лет (в России - 1 раз в 3 года), в том числе и тем, у кого нет никаких жалоб. В настоящее время изучается целесообразность включения в скрининговые программы определения ВПЧ методом ПЦР.
Цитологическое исследование не позволяет поставить точный диагноз, его чувствительность колеблется в пределах 60-90%, информативность метода повышается с увеличением степени дисплазии. Необходимо помнить,
что воспалительные процессы на шейке матки могут обусловить цитологическую картину, свойственную дисплазии; после соответствующего лечения картина нормализуется.
Кольпоскопическая картина дисплазии может включать в себя патологические сосуды (расширенные, неправильно ветвящиеся) в зоне превращения, пунктации, мозаики, беловатую окраску эпителия. Дисплазия обусловливает локальное побеление эпителия при ацетоуксусном тесте и йоднегативные зоны при пробе Шиллера (рис. 15.51).
Однако ни кольпоскопия, ни цитология не позволяют определить степень дисплазии и исключить преинвазивный и микроинвазивный рак. Окончательный диагноз устанавливают на основании гистологического исследования, получить материал для которого позволяет прицельная ножевая биопсия шейки матки с выскабливанием цервикального канала. Не рекомендуется производить биопсию конхотомом (специальные щипцы), поскольку эта методика не позволяет оценить подлежащую строму. Не следует осуществлять и электропетлевую биопсию, так как коагуляционные повреждения тканей затушевывают патологические изменения. Необходимо избегать неоправданной биопсии шейки матки и стремиться к полному удалению патологического очага с последующим гистологическим исследованием, поскольку при биопсии нарушается целостность базальной мембраны эпителия, и рак может перейти в следующую стадию.
Современные данные о течении ПВИ и дисплазии свидетельствуют о том, что CIN I спонтанно регрессирует в 75% наблюдений без какого-либо лечения, CIN II - в 40%, CIN III - в 5% случаев, причем элиминация вируса и излечение чаще происходят у более молодого контингента боль-
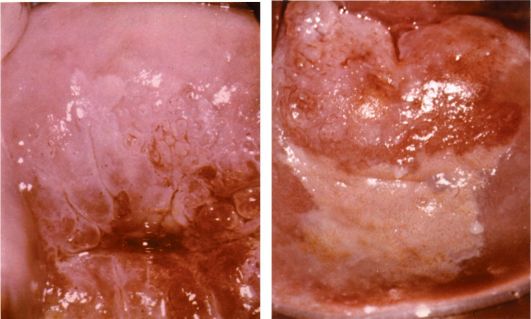
Рис. 15.51. Дисплазия шейки матки. Ацетоуксусный тест. Кольпоскопия. (Из: Бауэр Х.-К. Цветной атлас по кольпоскопии. - М., 2002. - С. 216-217)
ных. Поэтому при определении тактики ведения учитывают степень дисплазии, возраст больной и репродуктивную функцию. Известно, что хирургическое лечение дисплазии шейки матки увеличивает риск в последующем преждевременных родов в 4 раза.
У молодых женщин при легкой дисплазии показано динамическое наблюдение в течение года, при отсутствии регрессии или ухудшении производят конизацию шейки матки. При умеренной и тяжелой дисплазии показаны выскабливание цервикального канала и конизация шейки матки (радиохирургическая, лазерная, электроконизация) с последующим гистологическим исследованием удаленных тканей.
У пациенток в постменопаузе при дисплазии легкой и средней степени допустима конизация с выскабливанием цервикального канала, однако показания для экстирпации матки должны быть расширены.
15.7. Рак шейки матки
Рак шейки матки, происходя из покровного эпителия двух видов, имеет два основных гистологических варианта - плоскоклеточный (ороговеваю-щий и неороговевающий) рак и аденокарциному из цилиндрического эпителия. Эпидемиологические исследования показывают, что существует два возрастных пика заболеваемости раком шейки матки - в 34-36 лет, когда преобладает плоскоклеточный рак, и в 60-62 года, когда увеличивается доля аденокарциномы шейки матки. Рак шейки матки занимает третье по частоте место среди злокачественных новообразований половых органов; тенденцией последних лет является ежегодный прирост частоты рака шейки матки у молодых женщин на 2%. Ежегодно в мире выявляется около 500 тыс. новых заболеваний раком шейки матки. В России ежегодно регистрируется 12,3 тыс новых случаев рака шейки матки, 6 тыс женщин умирают от него.
Этиология и патогенез рака шейки матки связаны с ПВИ и сходны с таковыми при предраковых процессах (рассматривались в разделе, посвященном предраку шейки матки).
Плоскоклеточный рак встречается в 85-95% всех раковых поражений шейки матки, аденокарцинома - в 5-15%. Рак шейки матки может иметь экзофитный рост, более характерный для локализации опухоли на экзоцер-виксе, и эндофитный рост, характерный для локализации злокачественного процесса в эндоцервиксе. При эндофитных формах заболевания прогноз хуже.
Для плоскоклеточного рака шейки матки гистологически характерно наличие тяжей анаплазированного эпителия ниже базальной мембраны, клетки опухоли овальной или полигональной формы, с эозинофильной цитоплазмой, характерны полиморфизм ядер, множественные и атипичные фигуры митоза (рис. 15.52).
Аденокарцинома цервикального канала под микроскопом характеризуется наличием желез, выстланных несколькими слоями атипичных клеток с высокой митотической активностью (рис. 15.53), клетки - с бледной зернистой цитоплазмой, содержащей слизь, базально расположенные увеличенные гиперхромные ядра с грубым хроматином.
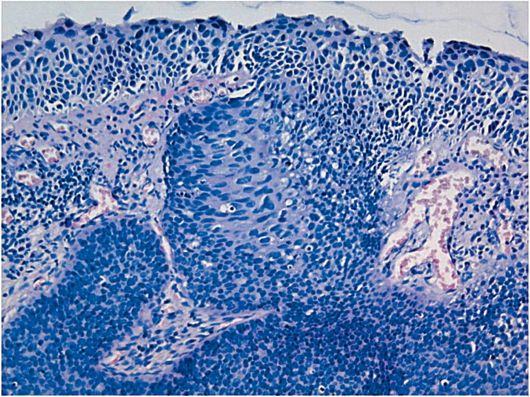
Рис. 15.52. Плоскоклеточный неороговевающий рак шейки матки. Окраска гематоксилином и эозином, χ 200. Фото О.В. Зайратьянца
В зависимости от распространенности рак шейки матки подразделяют на клинические стадии. Стадия 0 - рак in situ.
Стадия I - опухоль ограничена шейкой матки:
Iа1 - микроинвазивный рак с инвазией не более 3 мм и распространенностью по протяжению не более 7 мм (частота метастазов составляет
0,3%);
Iа2 - микроинвазивный рак с глубиной инвазии от 3 до 5 мм при диаметре опухоли 7-10 мм (частота метастазов в регионарных лимфатических узлах достигает 13%);
Iб - инвазивный рак шейки матки (глубина инвазии более 5 мм).
Стадия II - опухоль распространяется за пределы шейки матки:
IIа - инфильтрация верхней и средней третей влагалища или тела матки;
IIб - инфильтрация параметриев, не доходящая до стенок таза. Стадия III - опухоль за пределами шейки матки: IIIа - инфильтрация нижней трети влагалища;
IIIб - распространение инфильтрата на стенку таза, инфильтрат с гидронефрозом или вторично-сморщенной почкой.
Стадия IV - опухоль прорастает в соседние органы либо распространяется за пределы малого таза:
IVa - прорастание мочевого пузыря или прямой кишки;
IV6 - отдаленные метастазы.
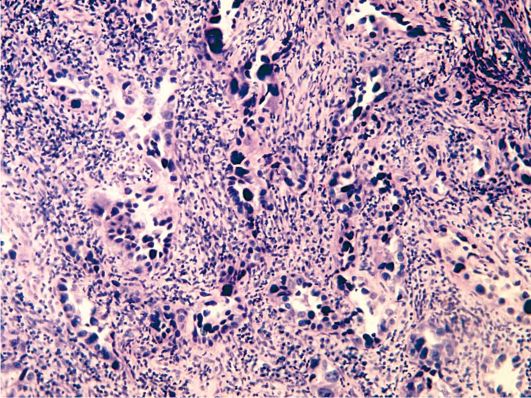
Рис. 15.53. Аденокарцинома шейки матки (светлоклеточная аденокарцинома). Окраска гематоксилином и эозином, χ 200. Фото О.В. Зайратьянца
Клинические проявления начальных форм рака шейки матки (рак in situ, микроинвазивный рак) отсутствуют. Патогномоничными для инвазивного рака шейки матки являются контактные кровяные выделения, реже бывают ациклические кровотечения. У пациенток могут быть жалобы на гноевидные, зловонные выделения, боли (в том числе в области поясницы, почек), лихорадку, похудение, нарушения функции соседних органов. Как правило, подобная симптоматика соответствует неоперабельным и запущенным формам рака.
Гинекологическое исследование при преинвазивном и микроинвазив-ном раке шейки матки неинформативно. При экзофитном росте опухоли на шейке матки возможна визуализация разрастаний по типу цветной капусты красного, серо-розового или белесоватого цвета, легко разрушающихся и кровоточащих при прикосновении. При распаде опухоли на поверхности шейки матки видны серые наложения фибрина. При эндофитном росте шейка матки увеличена, бочкообразной формы, с неровной бугристой поверхностью, неравномерной розово-мраморной окраской. Ректовагинальное исследование позволяет определить инфильтраты в параметрии, малом тазу.
Кольпоскопическая картина, вызывающая подозрение на плоскоклеточный рак шейки матки, включает в себя патологические сосуды, изменение окраски очага, неровность поверхности, ацетобелый эпителий, йоднегатив-ную окраску патологического эпителия (рис. 15.54). При распространенном раке шейки матки имеются бугристая поверхность, разрастания по типу цветной капусты, множество патологических сосудов, кровоизлияния, участ-
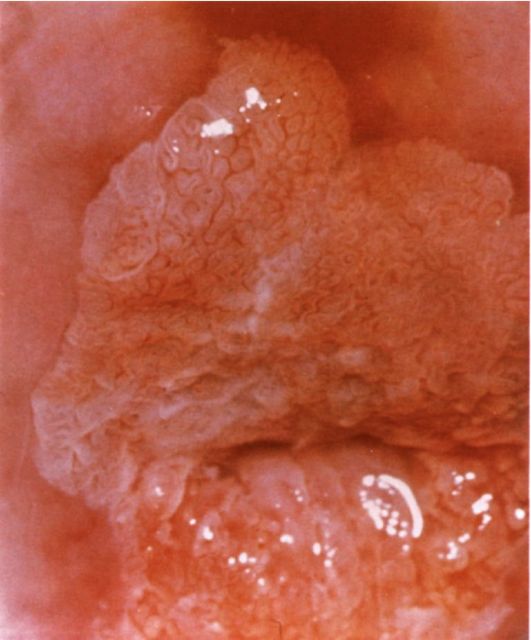
Рис. 15.54. Подозрение на рак шейки матки (Из: Бауэр Х.-К. Цветной атлас по кольпоскопии. - М., 2002. - С. 219).
ки некроза. Диагноз уточняется при биопсии шейки матки.
При раке цервикального канала клиническая картина более скудная, а диагностика затруднена на начальных стадиях, поскольку цер-викальный канал недоступен коль-поскопии. При распространенном раке цервикального канала шейка матки приобретает бочкообразную форму и плотную консистенцию. Изменения цитологической картины в цервикальном канале или эхографические признаки его патологии требуют проведения более углубленного обследования: гисте-роцервикоскопии, выскабливания цервикального канала с гистологическим исследованием соскоба, конусовидной биопсии шейки матки. При распадающемся раке диагноз возможно установить цитологически.
Для определения стадии процесса используют ректороманоскопию, цистоскопию, КТ, МРТ, ангио- и лимфографию, инструментальное исследование других органов и систем.
Лечение рака шейки матки включает воздействие на первичную опухоль (хирургическое, лучевое, сочетанное лучевое и химиотерапевтическое) и зоны регионарного метастазирования. Хирургическое лечение с удалением первичной опухоли возможно только при I и II стадиях; оно проводится в сочетании с лучевой терапией (комбинированная терапия). Глубиной инвазии определяется вероятность метастазов в регионарные лимфатические узлы и рецидива рака шейки матки, что учитывают при планировании лучевой терапии. На прогноз заболевания, помимо местного распространения процесса, в значительной мере влияет наличие лимфогенных и гематогенных метастазов. Данные исследований свидетельствуют о том, что при инвазии менее 1 мм метастазы и рецидивы отсутствуют, при глубине инвазии до 3 мм (Ia1 стадия) частота метастазов в регионарные лимфатические узлы составляет 0,3%, при глубине инвазии от 3 до 5 мм (Ia2 стадия) - у 13%. При стадии IB частота лимфогенных метастазов составляет 15-18%, а органных - 2,5%; при II стадии - соответственно 25-30 и 10,8%; при III стадии лимфоузлы метастатически поражены в 50-60%.
При раке in situ у женщины репродуктивного возраста выполняют конусовидную конизацию шейки матки с послойным интраоперационным гистологическим исследованием, что позволяет точно определить стадию процесса и максимально сохранить здоровую часть шейки матки.
В постменопаузе при раке in situ, расположенном в переходной зоне в цервикальном канале, методом выбора является экстирпация матки.
При стадии Ia1 у молодых женщин, заинтересованных в сохранении репродуктивной функции, выполняется высокая ножевая ампутация шейки матки, у пациенток старше 50 лет - экстирпация матки с придатками.
При стадии Iа2 производят пангистерэктомию, на втором этапе - лучевую терапию. У молодых женщин, в планы которых входит деторождение, в последнее время в отдельных онкологических стационарах выполняют трахелотомию (экстирпация шейки матки, лимфатических узлов и клетчатки таза с подшиванием стенок влагалища к внутреннему зеву сохраненной матки). При последующей беременности риск репродуктивных потерь очень высок, однако рождение жизнеспособных детей возможно.
У молодых женщин при стадии Iа2 возможно также выполнение экстирпации матки с трубами, при этом яичники фиксируют в области нижнего полюса почек с сохраненной сосудистой ножкой для выведения их из зоны последующего облучения. Данный подход позволяет сохранить гормональную функцию яичников и возможность суррогатного материнства для женщины. В настоящее время у женщин с раком шейки матки, заинтересованных в рождении ребенка, возможна криоконсервация яйцеклеток перед гистерэктомией.
При стадиях I6 и IIа и иногда при стадии IIб производят операцию Верт-гейма (пангистерэктомию, удаление лимфатических узлов, клетчатки таза, верхней трети влагалища) и сочетанную (внутриполостную и дистанционную) лучевую либо химиолучевую терапию. Индивидуально определяется этапность лечения, применяют как предоперационную лучевую терапию с последующей операцией, так и действия в обратной последовательности. В настоящее время при операбельном раке шейки матки в ведущих клиниках стали выполнять операции лапароскопическим доступом.
При стадиях IIб, IIIа, IIIб проводится сочетанная лучевая либо химио-лучевая терапия. При стадии IV осуществляется паллиативная терапия, но при отдаленных метастазах возможна химиотерапия цисплатином.
Прогноз при раке шейки матки определяется стадией заболевания, при I стадии 5-летняя выживаемость составляет 90-98%; при II стадии - 55- 60%, при III стадии - 30-40%, при IV - менее 10%. Значительно ухудшается прогноз при сочетании рака шейки матки и беременности. Так, 5-летняя выживаемость при I стадии на фоне беременности снижается до 25-30%. Однако у излеченных больных, перенесших начальные формы рака и ор-ганосохраняющие операции, наступление беременности в последующем не противопоказано.
Рак шейки матки является злокачественной опухолью, которую можно предупредить, поскольку ему предшествует длительный предраковый процесс. Прогрессирование дисплазии в рак шейки матки происходит в течение нескольких лет, своевременное лечение дисплазии (CIN) - действенная мера профилактики злокачественной опухоли данной локализации.
В настоящее время доказана вирусная теория происхождения рака шейки матки, вакцинация против ПВИ открывает новые перспективы в профи-
лактике рака шейки матки. Создана рекомбинантная вакцина против самых распространенных онкогенных серотипов ВПЧ - 16 и 18.
Впервые рекомбинантные частицы для вакцины на основе структурных белков L1 создал Я. Фрейзер, и поскольку функциональные белки Е1-Е7 в вакцине отсутствуют, она не оказывает мутагенного и канцерогенного действия, т.е. является высокобезопасной. В масштабе страны целесообразно иммунизировать подростков и лиц, не начавших половую жизнь, однако индивидуально возможна вакцинация и лиц других возрастных категорий, хотя ожидаемый защитный эффект ниже, чем при вакцинации подростков.
Имеющаяся вакцина против 16 и 18 серотипов ВПЧ не обеспечивает защиты против других онкогенных серотипов. Именно поэтому вакцинированные лица не должны пренебрегать другими правилами профилактики рака шейки матки. Известны следующие факторы риска дисплазии и рака шейки матки:
- раннее начало половой жизни;
- ранняя первая беременность;
- большое число половых партнеров;
- венерические заболевания в анамнезе;
- низкий социально-бытовой и культурный уровень пациентки и ее партнера;
- длительный прием оральных контрацептивов;
- курение;
- воздействие диэтилстильбестрола.
Ознакомление женщин и подростков с методами контрацепции для профилактики нежелательной и ранней беременности, разъяснение преимуществ барьерной контрацепции, пропаганда моногамных отношений, гигиенических норм, антиреклама курения и тому подобное направлены на формирование здорового образа жизни и ослабление действия вредных факторов, способствующих развитию рака шейки матки.
Контрольные вопросы
1. Каковы морфофункциональные особенности эпителия шейки матки в различные возрастные периоды жизни женщины?
2. Приведите клинико-морфологическую классификацию патологических эпителиальных изменений шейки матки.
3. Перечислите скрининговые методы обследования шейки матки, методы углубленного обследования при патологии шейки матки.
4. Перечислите неопухолевые изменения шейки матки, методы лечения больных.
5. Расскажите о роли папилломавирусной инфекции в возникновении цервикальной интраэпителиальной неоплазии и рака шейки матки.
6. Дайте понятие предрака шейки матки, расскажите о предраковых процессах шейки матки и принципах лечения.
7. Рак шейки матки, лечение больных в соответствии со стадией процесса, возрастом, реализованностью репродуктивной функции.