Гинекология : учебник / Б. И. Баисова и др. ; под ред. Г. М. Савельевой, В. Г. Бреусенко. - 4-е изд., перераб. и доп. - 2011. - 432 с. : ил.
|
|
|
|
ОБЩАЯ ГИНЕКОЛОГИЯ. Глава 9. НАРУШЕНИЯ МЕНСТРУАЛЬНОГО ЦИКЛА
Нарушения менструального цикла могут быть одним из частых проявлений гинекологических заболеваний или их причиной. Несмотря на большие адаптационные возможности женского организма, в последнее десятилетие отмечается неуклонный рост нарушений репродуктивной функции.
Многообразие нозологических форм нарушений менструального цикла обусловлено его многоступенчатой регуляцией. Нейрогуморальная координация менструальной функции осуществляется вследствие согласованной работы коры больших полушарий, специфических отделов гипоталамуса, гипофиза, а также их взаимодействия с периферическими эндокринными органами, рядом экстрагипоталамических структур. Как правило, нарушения менструального цикла связаны с изменениями в системе регуляции репродуктивной функции либо в органах-мишенях.
Наряду с симптомами, характеризующими тот или иной вариант нарушения менструального цикла (аменорея, дисфункциональные маточные кровотечения, альгодисменорея), выделяют наиболее часто встречающиеся в практике нейроэндокринные синдромы - такие, как синдром Иценко- Кушинга, Шиена, Шерешевского-Тернера, поликистозных яичников, а также предменструальный, постгистерэктомический синдромы и синдром после тотальной овариэктомии (посткастрационный).
9.1. Аменорея
Аменорея - отсутствие менструации в течение 6 мес и более, является симптомом многих гинекологических заболеваний и синдромов. Помимо аменореи, могут быть и другие изменения менструальной функции, такие, как гипоменорея, опсоменорея и олигоменорея - соответственно скудные, короткие и редкие менструации.
Различают физиологическую, патологическую, ложную и ятрогенную аменорею.
Физиологическая аменорея - отсутствие менструации до периода полового созревания, во время беременности, лактации и в постменопаузе.
Патологическая аменорея - симптом гинекологических или экстраге-нитальных заболеваний; может быть первичной и вторичной. Первичная аменорея - отсутствие первой менструации после 16 лет, вторичная - отсутствие менструации в течение 6 мес у ранее менструировавших женщин.
Ложная аменорея - отсутствие кровяных выделений из половых путей вследствие нарушения их оттока в связи с атрезией цервикального канала или пороком развития гениталий; при этом циклическая активность яичников не нарушена.
Ятрогенная аменорея наступает после гистерэктомии и тотальной овари-эктомии. Она также может быть связана с приемом лекарственных средств (агонисты гонадотропинов, антиэстрогенные препараты). Как правило, после прекращения лечения менструации восстанавливаются.
Известно, что нейрогуморальная регуляция менструального цикла происходит с участием коры головного мозга, подкорковых структур, гипофиза, яичников, матки и представляет собой единое целое. Нарушение в каком-либо звене неизбежно отражается на других звеньях цепи. Аменорея любой этиологии (любого уровня поражения, кроме маточной формы) в конечном итоге приводит к гипоэстрогении и отсутствию овуляции. Ги-поэстрогения, в свою очередь, сопряжена с гиперандрогенией, выраженность которой зависит от уровня поражения. Подобный дисбаланс половых гормонов определяет омужествление (вирилизм): характерное строение скелета, избыточное оволосение (гипертрихоз) , оволосение по мужскому типу (гирсутизм) , огрубение голоса, гипертрофию клитора, недоразвитие вторичных половых признаков.
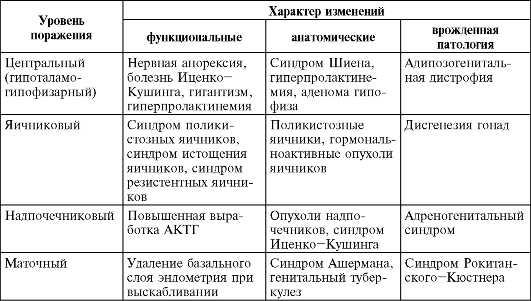
В зависимости от преимущественного уровня поражения того или иного звена нейроэндокринной системы выделяют аменорею центрального генеза (гипоталамо-гипофизарную), яичниковую, маточную ее формы, аменорею, обусловленную патологией надпочечников и щитовидной железы. Это условное разделение имеет большое значение для выбора тактики лечения. Поражение на каждом из уровней регуляции менструального цикла и матки может быть функционального или органического генеза либо результатом врожденной патологии (табл. 9.1).
Таблица 9.1. Причины аменореи и уровень поражения репродуктивной системы
9.2. Аменорея центрального генеза
К аменорее центрального генеза относятся нарушения функции как коры головного мозга, так и подкорковых структур (гипоталамо-гипофизарная аменорея). Нарушения гипоталамо-гипофизарной системы могут быть функциональными, органическими и следствием врожденной патологии.
Аменорея центрального генеза чаще бывает функциональной и, как правило, возникает в результате воздействия неблагоприятных факторов внешней среды. Механизмы нарушения реализуются через нейросекреторные структуры головного мозга, регулирующие тоническую и циклическую секрецию гонадотропинов. Под влиянием стресса происходят избыточное выделение эндогенных опиоидов, снижающих образование дофамина, а также уменьшение образования и выделения гонадолиберинов, что может приводить к аменорее. При незначительных нарушениях увеличивается число ановуляторных циклов, появляется недостаточность лютеиновой фазы.
Наиболее часто возникновению центральных форм аменореи предшествуют психическая травма, нейроинфекции, интоксикации, стресс, осложненные беременность и роды. Аменорея наблюдается у каждой 3-й больной шизофренией и маниакально-депрессивным психозом, особенно в период обострения. Имеют значение психологический стресс и перенесенные в детстве инфекционные заболевания. Физические перегрузки, связанные со значительным эмоционально-волевым напряжением, могут вызвать аменорею с психическими, астеноневротическими, астенодепрессивными или астеноипохондрическими нарушениями. Менструация прекращается внезапно. Наряду с аменореей наблюдаются раздражительность, плаксивость, головная боль, нарушения памяти, работоспособности, расстройство сна. Во время войны вследствие вынужденного голодания женщины резко худели, что приводило к нарушению в гипоталамо-гипофизарной области и к так называемой аменорее военного времени. Этому способствовали и психоэмоциональные нагрузки.
Функциональные нарушения гипоталамо-гипофизарной системы приводят к развитию нервной анорексии, болезни Иценко-Кушинга, гигантизма, функциональной гиперпролактинемии. Причины функциональных нарушений гипоталамо-гипофизарной системы:
• хронический психогенный стресс;
• хронические инфекции (частые ангины) и особенно нейроинфекции;
• эндокринные заболевания;
• прием препаратов, истощающих запасы дофамина в ЦНС (резерпин, опиоиды, ингибиторы моноаминоксидазы) и влияющих на секрецию и обмен дофамина (галоперидол, метоклопрамид).
Анатомические нарушения гипоталамо-гипофизарных структур, приводящие к синдрому Шиена и гиперпролактинемии, заключаются в следующем:
• гормонально-активные опухоли гипофиза: пролактинома, смешанные пролактин- и АКТГ-секретирующие аденомы гипофиза;
• повреждения ножки гипофиза в результате травмы или хирургического вмешательства, воздействия радиации;
• некроз ткани гипофиза, тромбоз сосудов гипофиза.
Врожденная патология гипоталамо-гипофизарной системы может привести к адипозогенитальной дистрофии.
Вне зависимости от причин поражения гипоталамо-гипофизарной области происходит нарушение выработки гипоталамического ГнРГ, что приводит к изменению секреции ФСГ, ЛГ, АКТГ, СТГ, ТТГ и пролактина. При этом может нарушаться цикличность их секреции. При изменении гормонообра-зовательной функции гипофиза возникают разнообразные синдромы. Снижение секреции ФСГ и ЛГ приводит к нарушению развития фолликулов и, следовательно, недостаточной выработке яичниками эстрогенов. Вторичная гипоэстрогения, как правило, сопровождается гиперандрогенией, которая, в свою очередь, способствует возникновению вирильного синдрома, умеренно выраженного при гипоталамо-гипофизарных нарушениях.
Поскольку гипофиз ответствен и за обменные процессы, при поражении гипоталамо-гипофизарной области больных отличает характерный внешний вид: ожирение, лунообразное лицо, жировой фартук, стрии на животе и на бедрах, однако возможна и чрезмерная худоба со слабо выраженными вторичными половыми признаками. Ожирение и сильное похудение в результате нарушений гипоталамо-гипофизарной области усугубляют проявления гормональной дисфункции.
К аменорее при нервной анорексии приводит резкое снижение секреции гонадотропинов. Это нередко наблюдается при настойчивом желании похудеть и быстром снижении массы тела на 15% и более. Такая патология распространена среди девушек-подростков, изнуряющих себя диетой и физическими нагрузками, и может быть началом психического заболевания. Отсутствие менструации - один из первых признаков начала заболевания, который приводит девушек к гинекологу. При осмотре отмечается резкое уменьшение подкожной жировой клетчатки при женском типе телосложения. Вторичные половые признаки развиты нормально. При гинекологическом исследовании обнаруживают умеренную гипоплазию наружных и внутренних половых органов. Продолжающаяся потеря массы тела может приводить к брадикардии, гипотонии, гипотермии. В дальнейшем появляются раздражительность, агрессивность, кахексия с полной потерей аппетита и отвращением к еде. Гипоэстрогенное состояние наряду с недостатком питания обусловливает предрасположенность больных к остеопорозу.
Синдром (болезнь) Иценко-Кушинга характеризуется повышением образования гипоталамусом кортиколиберина. Это вызывает активацию адрено-кортикотропной функции передней доли гипофиза вследствие гиперплазии базофильных клеток и в результате - гипертрофию и гиперфункцию надпочечников, избыточное образование глюкокортикостероидов и андрогенов. Следствием подобных гормональных нарушений становится гиперкорти-цизм, который приводит к гипокалиемическому ацидозу, усилению процессов гликонеогенеза, увеличению содержания сахара в крови и в итоге к стероидному диабету. Заболевание наблюдается в любом возрасте. У детей болезнь Иценко-Кушинга сопровождается вирилизацией различной выраженности, у взрослых в начале заболевания наблюдается аменорея, позже появляются признаки вирилизации. Характерно непропорциональное ожирение с отложением подкожной жировой клетчатки на лице, шее, верхней половине туловища. У больных лицо округлое, цианотично-красное.
Кожа сухая, атрофичная, с мраморным рисунком и участками пигментации и акне. На груди, животе, бедрах багрово-красные полосы растяжения.
Гигантизм также становится следствием гиперплазии эозинофильных клеток гипофиза с повышенной выработкой соматотропного и лактогенно-го гормонов. При гиперпродукции СТГ рост чрезмерно высокий, относительно пропорциональный или непропорциональный. Чрезмерное увеличение роста обычно замечают в препубертатном и пубертатном периодах, на протяжении ряда лет. Со временем может развиться акромегалоидное укрупнение черт лица. С самого начала заболевания отмечаются гипогона-дизм, первичная аменорея или раннее прекращение менструаций.
К синдрому Шиена приводят структурные изменения гипофиза вследствие массивных послеродовых или послеабортных кровотечений. При этом обнаруживаются некротические изменения и внутрисосудистый тромбоз в гипофизе. Ишемии гипофиза способствует также физиологическое снижение выделения АКТГ в послеродовом периоде. Внутрисосудистый тромбоз приводит и к изменениям печени, почек, структур мозга. Выраженность клинических проявлений синдрома Шиена зависит от величины и локализации поражения гипофиза и, соответственно, недостаточности его го-надотропной, тиреотропной, адренокортикотропной функций. Заболевание часто сопровождается клинической картиной гипофункции щитовидной железы или вегетососудистой дистонии по гипотоническому типу (головная боль, повышенная утомляемость, зябкость). Снижение гормональной функции яичников проявляется олигоменореей, ановуляторным бесплодием. Симптоматика тотальной гипофункции гипофиза обусловлена выраженной недостаточностью гонадотропной, тиреотропной и адренокортикотропной функций: стойкая аменорея, гипотрофия половых органов и молочных желез, облысение, снижение памяти, слабость, адинамия, похудение.
При сборе анамнеза выясняется связь начала заболевания с осложненными родами или абортом. Уточнить диагноз можно по снижению в крови уровня гонадотропинов, ТТГ, АКТГ, а также эстрадиола, кортизола, Т3 и Т4.
Гиперпролактинемия. Возникновение аменореи гипоталамо-гипофизарного генеза нередко сопровождается избыточной секрецией пролактина - гиперпролактинемией. Пролактин - единственный гормон передней доли гипофиза, секреция которого постоянно подавляется гипоталамусом и резко возрастает после освобождения гипофиза от гипоталами-ческого контроля. Физиологическая гиперпролактинемия наблюдается во время беременности и в период лактации, у практически здоровых женщин во время сна, после физических нагрузок, а также при стрессе. Гиперпро-лактинемия возможна вследствие повреждения внутриматочных рецепторов при частых выскабливаниях слизистой оболочки тела матки, ручном обследовании стенок матки после родов.
Этиология и патогенез. Причиной гиперпролактинемии могут быть как анатомические, так и функциональные нарушения в системе гипоталамус- гипофиз. Помимо этого на выработку пролактина влияют:
• эстрогены, эстрогенсодержащие оральные контрацептивы;
• препараты, влияющие на секрецию и обмен дофамина (галоперидол, метоклопрамид, сульпирид);
• препараты, истощающие запасы дофамина в ЦНС (резерпин, опиои-ды, ингибиторы моноаминоксидазы);
• стимуляторы серотонинергической системы (галлюциногены, амфетамины);
• гипофункция щитовидной железы.
Патогенез гиперпролактинемии заключается в нарушении тонического дофаминергического ингибирующего контроля секреции пролактина, вызванном дисфункцией гипоталамуса. Из эндогенных пролактинингибиру-ющих субстанций наиболее важен дофамин. Уменьшение его содержания в гипоталамусе приводит к снижению уровня пролактинингибирующего фактора и увеличению количества циркулирующего пролактина. Непрерывная стимуляция секреции пролактина приводит к гиперплазии пролакто-трофов, а затем могут сформироваться микро- и макроаденома гипофиза.
У 30-40% женщин с гиперпролактинемией повышен уровень надпочеч-никовых андрогенов - ДГЭА и ДГЭА-С. Гиперандрогения при гиперпролактинемии объясняется общностью гипоталамической регуляции пролак-тин- и АКТГ-секретирующей функции гипофиза. Кроме того, в сетчатой зоне коры надпочечников обнаружены рецепторы к пролактину.
Механизм нарушения репродуктивной функции на фоне гиперпролак-тинемии заключается в следующем. В гипоталамусе под влиянием пролак-тина уменьшаются синтез и выделение ГнРГ и соответственно ЛГ и ФСГ. В яичниках пролактин тормозит гонадотропинзависимый синтез стероидов, снижает чувствительность яичников к экзогенным гонадотропинам.
Клиническая симптоматика. Гиперпролактинемия проявляется нарушениями менструального цикла по типу гипо-, олиго-, опсо- и аменореи, а также бесплодием.
У женщин с гиперпролактинемией нередко наблюдается галакторея, причем она не всегда коррелирует с уровнем пролактина. Так, галакторея возможна и при нормальном его уровне, что связано с гиперчувствительностью рецепторов пролактина в молочной железе.
Выделяют так называемую бессимптомную гиперпролактинемию, при которой повышен уровень биологически активного пролактина. Около 50% женщин с гиперпролактинемией отмечают головную боль и головокружение, транзиторное повышение АД.
Диагностика гиперпролактинемии включает изучение общего и гинекологического анамнеза, детальное общетерапевтическое обследование. Особого внимания заслуживает состояние эндокринной системы, главным образом щитовидной железы и коры надпочечников.
Повышение уровня пролактина в плазме периферической крови является одним из подтверждений гиперпролактинемии. Имеет значение также соотношение содержания гонадотропных и половых гормонов. Для дифференциальной диагностики гиперпролактинемии, и в частности ее транзиторной формы, необходимо неоднократное определение пролактина в динамике. Наиболее информативны функциональные пробы с агонистом дофамина - бромокриптином (Парлодел♠) и антагонистом дофамина - метоклопрами-дом (Церукал♠). Функциональная гиперпролактинемия не сопровождается
изменениями турецкого седла на рентгенограмме, при КТ и МРТ в случае повышения уровня пролактина до 2000 мМЕ/л.
Для исключения анатомических изменений в гипофизе проводят рентгенологическое исследование черепа с целью выявления изменений в области турецкого седла. При макроаденоме гипофиза размеры турецкого седла увеличены, его дно 2-3-контурное, есть признаки склерозирования турецкого седла. Уровень пролактина при макроаденоме превышает 5000 мМЕ/л. При макроаденоме гипофиза отмечаются аменорея и галакторея. Диагностика микроаденомы гипофиза возможна при применении КТ или МРТ. Уровень пролактина при микроаденоме колеблется от 2500 до 10 000 мМЕ/л.
Лечение гиперпролактинемии проводят с учетом ее формы. Для лечения функциональной гиперпролактинемии широко применяются агонисты дофамина. Лечение начинают с назначения 1/2 таблетки бромокриптина в день во время еды, затем дозу увеличивают каждые два дня на 1/2 таблетки, доводя до 3-4 таблеток в день под контролем уровня пролактина крови и базальной температуры. При восстановлении овуляторных менструальных циклов дозу уменьшают до 1 таблетки в день; такое лечение проводят в течение 6-8 мес. Фертильность восстанавливается в 75-90% случаев. При недостаточности 2-й фазы цикла можно дополнительно с 5-го по 9-й день менструального цикла назначить кломифен, который стимулирует овуляцию. К препаратам последнего поколения в лечении гиперпролакти-немии относятся хинаголид (норпролак♠) и каберголин (достинекс♠) (1 мг в неделю в течение 3-4 нед). Это препараты пролонгированного действия с минимальными побочными проявлениями.
При микроаденоме гипофиза терапия также проводится бромокрипти-ном или его аналогами. При длительном лечении развиваются дистрофические изменения в опухоли; происходит ее уменьшение вплоть до полного исчезновения. Беременность на фоне лечения у больных с микроаденомой гипофиза протекает благополучно. В период беременности обязательно наблюдение невролога и офтальмолога.
Макроаденома гипофиза является показанием для оперативного лечения, которое проводит нейрохирург, либо для лучевой терапии.
Адипозогенитальная дистрофия является следствием врожденной патологии гипоталамо-гипофизарной области. Заболевание сопровождается прогрессирующим ожирением в результате нарушения центральной регуляции чувства насыщения из-за повреждения паравентрикулярных ядер гипоталамуса. Снижение гонадотропной функции гипофиза обусловливает недоразвитие половой системы (гипогонадизм). Инфекционные процессы гипофи-зарной области и аденома гипофиза с гиперплазией эозинофильных клеток гипофиза могут привести к гиперпродукции СТГ и чрезмерно высокому росту (относительно пропорциональный или непропорциональный гигантизм).
9.3. Яичниковая аменорея
Яичниковые формы аменореи обусловлены функциональными, органическими изменениями и врожденной патологией яичников. Наиболее частой причиной функциональных и морфологических нарушений на
яичниковом уровне регуляции менструального цикла является синдром по-ликистозных яичников (СПКЯ). Снижение или истощение гормональной функции яичников отмечается при синдроме резистентных яичников (СРЯ) и синдроме истощения яичников (СИЯ). Органические изменения яичников, сопровождающиеся нарушением менструальной функции, обусловлены гормонально-активными опухолями яичников (см. "Опухоли яичников").
СПКЯ - патология структуры и функции яичников с весьма разнообразной клинической картиной, наиболее постоянным компонентом которой является ановуляция. СПКЯ заключается в существенных морфологических изменениях яичников. Это гладкая и плотная белочная оболочка, разрастания соединительной ткани, увеличение количества кистозно-измененных фолликулов при отсутствии доминантного фолликула. Поликистозные яичники увеличены в объеме (>9 см3) в результате разрастания соединительной ткани, белочная оболочка жемчужно-белого цвета. На разрезе корковый слой напоминает соты, поскольку фолликулы разного диаметра.
СПКЯ сопровождается хронической ановуляцией, бесплодием, нередко нарушением обменных процессов, снижением толерантности к глюкозе, а также гиперандрогенией и, следовательно, вирилизацией. Чрезмерно высокой выработке андрогенов способствует разрастание межуточной ткани
при СПКЯ.
По результатам многочисленных гормональных и клинических исследований различают первичные (синдром Штейна-Левенталя, описан в 1935 г.) и вторичные поликистозные яичники, причем последние развиваются при надпочечниковой гиперандрогении, гиперпролактинемии, нейрообменно-эндокринных синдромах.
Наиболее удобна для использования в клинической практике предложенная М.Л. Крымской классификация, включающая три формы:
• типичная форма, сопровождающаяся преимущественно яичниковой гиперандрогенией, - первичные поликистозные яичники;
• сочетанная или смешанная форма как с яичниковой, так и с надпо-чечниковой гиперандрогенией;
• центральная форма с гиперандрогенией и выраженной дисфункцией центральных отделов репродуктивной системы с преобладанием вторичных поликистозных яичников.
Этиология и патогенез. Этиология и патогенез зависят от формы СПКЯ. В 60-х годах ХХ века патогенез типичной формы СПКЯ (синдром Штейна- Левенталя) связывали с генетически обусловленным дефицитом ферментов яичников, блокирующим превращение андрогенов в эстрогены. Однако в последующем было показано, что активность клеток гранулезы зависит от ФСГ. Нарушение процесса ароматизации андрогенов в эстрогены приводит к накоплению тестостерона (активного андрогена) и снижению уровня эстрогенов в яичниках. Вследствие этого по механизму обратной связи нарушается циклическая секреция гонадотропинов, что, в свою очередь, приводит к гиперплазии стромы и текаклеток яичников, чрезмерной или повышенной продукции андрогенов. Андрогены частично превращаются в эстрон, а часть эстрона - в эстрадиол. Однако этого недостаточно для
возникновения предовуляторного и лютеинового пика. Менструальный цикл приобретает монофазный характер.
В патогенезе смешанной (формы СПКЯ пусковым механизмом могут быть первичные нарушения функции коры надпочечников или транзиторный избыток надпочечниковых андрогенов в период адренархе. В периферических тканях андрогены частично превращаются в эстрогены. При достижении критической массы тела увеличивается периферическая конверсия андрогенов в жировой ткани. Это сопровождается возрастанием синтеза ЛГ в гипофизе и нарушением соотношения ЛГ/ФСГ, что приводит к гиперплазии текаклеток и стромы яичников. Перечисленные структуры синтезируют андрогены в избыточном количестве. Гиперандрогения препятствует созреванию фолликулов, приводит к ановуляции и еще больше подавляет секрецию ФСГ. Так замыкается порочный круг.
Участие структур головного мозга в развитии центральной формы СПКЯ подтверждается хронологической связью между началом заболевания и стрессовым состоянием (начало половой жизни, психические травмы, роды, аборты). Нарушение функции ЦНС может быть следствием острой или хронической инфекции либо интоксикации. При этом повышаются синтез и выделение эндогенных опиоидов, что нарушает дофаминергиче-скую регуляцию секреции ГнРГ, приводит к повышению базального уровня секреции ЛГ, относительному уменьшению продукции ФСГ и нарушению фолликулогенеза. Увеличение выделения ЛГ при СПКЯ обусловлено как первичным нарушением синтеза ГнРГ, так и хронической ановуляцией; эти эффекты взаимно потенцируются.
Современное представление о патогенезе СПКЯ, помимо нарушений гипоталамо-гипофизарного комплекса, яичников и надпочечников, включает метаболические нарушения и аутопаракринные факторы регуляции стероидогенеза в яичниках. Метаболические нарушения связаны с системой инсулин-глюкоза, так как инсулин участвует в продукции яичниковых андрогенов. Ожирение не играет решающей роли в патогенезе СПКЯ, однако в результате гиперинсулинемии и инсулинорезистентности усугубляются имеющиеся эндокринные нарушения. У больных с ожирением и инсулинорезистентностью хроническая гиперинсулинемия стимулирует образование инсулиноподобного фактора роста-1 (ИПФР-1). Последний через специфические рецепторы повышает образование андрогенов в те-каклетках и интерстициальной ткани яичников. Кроме того, инсулин способен тормозить образование в печени глобулинов, связывающих половые гормоны, в результате чего в крови возрастает свободная биологически активная фракция тестостерона.
Согласно имеющейся гипотезе, стимулирующее действие инсулина на синтез андрогенов в яичнике обусловлено генетической предрасположенностью.
СПКЯ развивается у женщин и с нормальной массой тела. В крови у них повышен уровень СТГ, обусловливающего образование ИПФР-1 в клетках гранулезы и усиливающего образование яичниковых андрогенов. Изучение биосинтеза гормонов в клетках гранулезы поликистозных яичников пока-
зало, что лютеинизированные клетки теряют способность к синтезу прогестерона. Это - один из возможных механизмов ановуляции у пациенток
с СПКЯ.
Клиническая симптоматика. Клинические проявления СПКЯ весьма различны, но основные из них при всех формах СПКЯ - гипо-, опсо-, олиго-и аменорея. Нарушения фолликулогенеза приводят к развитию ановулятор-ного первичного и вторичного бесплодия.
При типичной форме СПКЯ нарушения менструального цикла начинаются с менархе. При смешанной форме СПКЯ позднее менархе сочетается с нарушением менструального цикла в дальнейшем по типу вторичной аменореи. В репродуктивном возрасте наблюдаются хроническая ановуля-ция и бесплодие, чаще первичное. При центральной форме СПКЯ менархе нормальное, но менструальный цикл неустойчивый. В последующем это приводит к гипо-, опсо-, олигоили аменорее. Нарушения репродуктивной функции заключаются в невынашивании беременности на малых сроках и вторичном бесплодии. Кроме нарушений менструальной функции, отмечается дисфункция гипоталамо-гипофизарной системы. Начало заболевания может быть связано со стрессом, аденовирусной инфекцией, травмой головного мозга.
Главной причиной обращения к врачу пациенток юного возраста становится избыточное оволосение, частота которого при СПКЯ составляет, по данным разных авторов, от 50 до 100%. Гирсутизм при типичной форме СПКЯ развивается постепенно с периода менархе. Отмечается избыточный рост волос на верхней губе, подбородке, по белой линии живота. Резко выраженный гирсутизм и гипертрихоз для этой формы СПКЯ не типичны, но при смешанной форме гирсутизм наблюдается у всех пациенток. Зоны избыточного оволосения - внутренняя и наружная поверхность бедер, белая линия живота, верхняя губа, голени. Рост волос начинается с менархе или раньше. При центральной форме СПКЯ гирсутизм выявляется у 90% больных, возникает через 3-5 лет после нарушения менструальной функции, уже на фоне ожирения, и более выражен в репродуктивном возрасте. У этих пациенток можно заметить дистрофические изменения: полосы растяжения на груди, животе, бедрах, ломкость ногтей и волос.
Клиническая картина СПКЯ во многом определяется общими обменными нарушениями - такими, как дислипидемия, нарушения углеводного обмена, повышенный риск развития гиперпластических процессов гениталий. Эти нарушения могут обусловить раннее развитие атеросклеротиче-ских изменений сосудов, гипертонической болезни, ишемической болезни сердца. У 50% больных с типичной формой СПКЯ с подросткового возраста наблюдается повышенная масса тела с равномерным распределением подкожной жировой клетчатки. При смешанной форме СПКЯ ожирение наблюдается редко. При центральной форме ведущей является жалоба на избыточную массу тела. Ожирение достигает II-III степени; жировая ткань локализуется в основном на плечевом поясе, нижней половине живота и бедрах.
Диагностику СПКЯ необходимо начинать с тщательного изучения анамнеза и физикальных данных. Формирование СПКЯ начинается с пубертат-
ного периода и сопровождается нарушением становления менструальной функции. Первичные поликистозные яичники обусловливают нерегулярные менструации с периода пубертата, что отличает их от вторичных по-ликистозных яичников.
Клиническим критерием диагностики СПКЯ является гирсутизм (у 69% больных), появляющийся одновременно с началом пубертатного периода. Выраженность других клинических проявлений гиперандрогении различна. При прогрессировании симптомов вирилизации (гипертрофии клитора, дефеминизации фигуры, снижения тембра голоса) необходимо исключить гормонально-активные опухоли яичников и надпочечников; обычно это нетипично для СПКЯ.
К основным методам диагностики СПКЯ относятся эхография органов малого таза, исследование гормонов плазмы крови, лапароскопия с биопсией и гистологическим исследованием ткани яичника.
Патогномонично для СПКЯ двустороннее увеличение яичников, нередко при гипопластичной матке, что четко определяется при эхографии. Эхоскопическая картина яичников при трансвагинальном УЗИ (рис. 9.1) показывает увеличение объема яичников более 9 см3 (в среднем 16-20 см3), гиперплазированную строму, более 10 атретичных фолликулов, расположенных по периферии под утолщенной капсулой.
К гормональным критериям диагностики СПКЯ относят соотношение ЛГ/ФСГ более 2,5-3. Однако в последние годы показано, что нормальный уровень гонадотропных гормонов не исключает диагноза СПКЯ. Так, уровень ДГЭА и ДГЭА-С нормальный при типичной форме и повышен при наличии надпочечникового компонента (смешанная форма СПКЯ). При центральной форме СПКЯ соотношение ЛГ/ФСГ такое же, как при типичной, но соответствующий анамнез и клинические симптомы позволяют верифицировать диагноз.
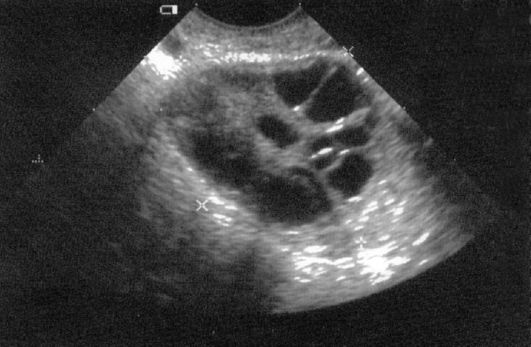
Рис. 9.1. Синдром поликистозных яичников. УЗИ
Обязательный этап в обследовании больных с СПКЯ - диагностика метаболических нарушений: гиперинсулинемии и инсулинорезистентности. ИМТ более 25 кг/м2 и дислипидемия свидетельствуют о гиперинсулинемии и инсулинорезистентности.
Типичная лапароскопическая картина яичников при СПКЯ: увеличенные размеры (до 5-6 см в длину и 4 см в ширину), сглаженная, утолщенная, жемчужно-белесоватая капсула. Отсутствие просвечивающих мелких фолликулярных кист и стигм овуляции свидетельствует о выраженной толщине капсулы яичников, что иногда затрудняет биопсию (рис. 9.2).
Лечение. Последовательность лечебных мероприятий у больных с СПКЯ зависит от жалоб, клинических проявлений и возраста пациентки. Поскольку основной причиной обращения к врачу больных репродуктивного возраста является бесплодие, целью лечения становятся восстановление менструальной и одновременно репродуктивной функции, профилактика гиперпластических процессов в органах-мишенях и коррекция преобладающего симптомокомплекса. С этой целью применяют консервативные и оперативные методы лечения.
При ожирении первый этап лечения (независимо от формы заболевания) - нормализация массы тела. Однако лечебное голодание противопоказано; наибольший лечебный эффект дает сочетание диетотерапии с физиотерапевтическими мероприятиями - массажем, лечебной физкультурой, иглорефлексотерапией. Снижение массы тела приводит к нормализации эндокринного профиля крови, снижению уровня инсулина и андрогенов, восстановлению регулярных менструаций. При СПКЯ центрального генеза патогенетически обосновано применение препаратов, корригирующих ней-ромедиаторный обмен (фенитоин - дифенин*), бекламид - хлоракон*). Возможно назначение орлистата, избирательно угнетающего липидный обмен, или субитрамина, блокирующего центр насыщения.
Следующим этапом лечения является стимуляция овуляции. Стимуляция начинается с применения кломифена, который дает антиэстрогенный эффект, блокируя рецепторы к эстрадиолу. После отмены препарата гона-дотропная функция нормализуется. Кломифен не стимулирует непосред-
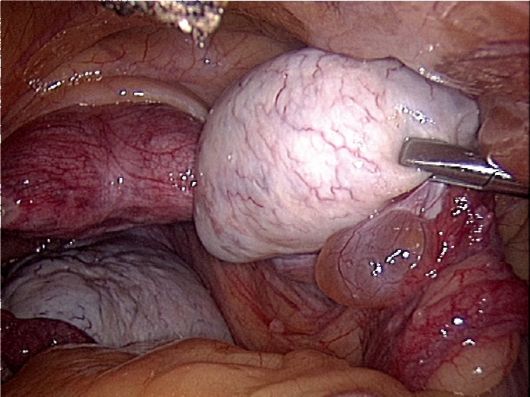
Рис. 9.2. Биопсия яичника. Лапароскопия
ственно яичники, а вызывает овуляцию вследствие кратковременной нормализации гипоталамо-гипофизарно-яичниковой системы. Препарат назначают по 100 мг с 5-го по 10-й день менструального цикла. Лечение кломифе-ном восстанавливает овуляцию у 48-80% больных, беременность наступает у 20-46%. При резистентности к кломифену стимуляцию овуляции можно проводить гонадотропными препаратами (пергонал♠, хумегон♠) по индивидуальным схемам. Однако стимуляция овуляции, особенно при повышенном уровне инсулина и при ожирении, увеличивает риск развития синдрома гиперстимуляции или может привести к ареактивности яичников.
Лечение женщин, не планирующих беременность, направлено на восстановление менструального цикла, лечение гирсутизма и профилактику отдаленных последствий СПКЯ, ухудшающих качество жизни. С этой целью применяют комбинированные оральные контрацептивы (КОК), снижающие уровень андрогенов, нормализующие менструальный цикл и способствующие профилактике гиперпластических процессов эндометрия. У пациенток с СПКЯ и нарушением жирового обмена КОК целесообразно сочетать с медикаментозной терапией инсулинорезистентности. Сочетание КОК с антиандрогенами потенцирует снижение секреции андрогенов. Ан-тиандрогены блокируют рецепторы андрогенов в ткани-мишени и подавляют гонадотропную секрецию. Применение препаратов с антиандрогенными свойствами (диане-35*) значительно расширило терапевтические возможности при СПКЯ. Антиандрогенный эффект Диане-35♠ можно усилить дополнительным назначением ципротерона (андрокур♠) по 25-50 мг с 5-го по 15-й день менструального цикла. Длительность лечения - от 6 мес до 2 лет и более.
Антиандрогенное действие оказывает спиронолактон (верошпирон♠), блокирующий периферические рецепторы и синтез андрогенов в надпочечниках и яичниках. Его длительный прием в дозе 100 мг/сут уменьшает гирсутизм. Однако медикаментозное лечение гирсутизма не всегда эффективно.
Хирургические методы лечения СПКЯ чаще проводят с использованием эндоскопического доступа. Хирургическое лечение нормализует гона-дотропную секрецию путем уменьшения объема андрогенсекретирующих тканей поликистозных яичников. В результате снижается уровень экстрагонадных эстрогенов, повышающих чувствительность гипофиза к ГнРГ. К хирургическим методам коррекции СПКЯ относятся клиновидная резекция, термокаутеризация (рис. 9.3), термовапоризация и декапсуляция по-ликистозных яичников. Хирургическое лечение наиболее эффективно при типичной форме СПКЯ.
Неэффективность клиновидной резекции яичников у части больных свидетельствует о сочетанной надпочечниково-яичниковой гиперандрогении.
Частота развития гиперпластических процессов эндометрия и риск возникновения рака эндометрия у больных с СПКЯ, особенно при типичной и центральной формах, определяют активную тактику ведения (проведение гистероскопии с раздельным диагностическим выскабливанием) даже при отсутствии жалоб. Своевременная диагностика и лечение таких больных являются мерами профилактики рака эндометрия.
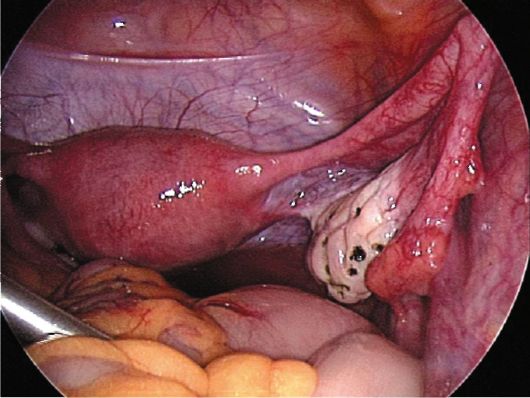
Рис. 9.3. Яичник после каутери-зации. Лапароскопия
Синдром резистентных яичников. В редких случаях недостаточность яичников может быть обусловлена синдромом резистентных яичников (СРЯ; синдром Сэвиджа). У женщин моложе 35 лет отмечаются аменорея, бесплодие, микро- и макроскопически неизмененные яичники при высоком уровне гонадотропинов. Вторичные половые признаки развиты нормально. Причины возникновения СРЯ не изучены; предполагается аутоиммунная природа данной патологии. Известно, что гипергонадотропная аменорея может сочетаться с аутоиммунными заболеваниями: болезнью Хашимото, миастенией, алопецией, тромбоцитопенической пурпурой, аутоиммунной гемолитической анемией. Резистентность яичников к высокому уровню гонадотропинов, возможно, связана с аномальностью молекулы ФСГ или отсутствием у гормона биологической активности. Большая роль отводится внутрияичниковым факторам, участвующим в регуляции функции яичников. Есть данные о влиянии ятрогенных факторов - радиорентгенотерапии, ци-тотоксичных препаратов, иммунодепрессантов, оперативных вмешательств на яичниках. Развитию резистентных яичников может способствовать поражение ткани яичника при туберкулезе, паротите, саркоидозе.
Клиническая симптоматика и диагностика. Начало заболевания большинство больных связывают со стрессом, тяжелыми вирусными инфекциями. Первая менструация, как правило, наступает своевременно, а через 5- 10 лет развивается аменорея, но у 84% больных в последующем эпизодически бывают менструации. Беременности и роды отмечаются у 5% больных. Больные с СРЯ правильного телосложения, удовлетворительного питания, с хорошо развитыми вторичными половыми признаками. Периодически они ощущают приливы жара к голове. При обследовании по тестам функциональной диагностики у них выявляются признаки гипофункции яичников: истончение слизистых оболочек вульвы и влагалища, слабоположительный феномен "зрачка", низкие показатели КПИ (от 0 до 25%).
При гинекологическом исследовании, эхографии, лапароскопии матка и яичники несколько уменьшены. Большинство авторов считают, что диагноз СРЯ можно поставить только после лапароскопии и биопсии яичников с последующим гистологическим исследованием, при котором обнаружи-
ваются примордиальные и преантральные фолликулы. При лапароскопии в яичниках видны просвечивающие фолликулы.
Гормональные исследования свидетельствуют о высоком уровне ФСГ и ЛГ в плазме крови. Уровень пролактина соответствует норме.
Большую диагностическую ценность имеют гормональные пробы. Снижение уровня ФСГ при введении эстрогенов и повышение уровня ФСГ и ЛГ в ответ на введение люлиберина свидетельствуют о сохранности механизма обратной связи между гипоталамо-гипофизарной системой и половыми стероидами.
Лечение. Терапия СРЯ представляет большие трудности. При лечении гонадотропинами получены противоречивые данные. Одни авторы отмечали увеличение фолликулов и менструальноподобные выделения на фоне введения ФСГ и ЛГ, другие - лишь рост фолликулов (пустые фолликулы) без повышения уровня эстрогенов крови.
Назначение эстрогенов основано на блокаде эндогенных гонадотропи-нов и последующем ребаунд-эффекте (эффект отражения). Кроме того, эстрогены увеличивают количество гонадотропных рецепторов в яичниках и, возможно, таким образом усиливают реакцию фолликулов на эндогенные гонадотропины. Восстановление генеративной функции возможно лишь с помощью вспомогательных репродуктивных технологий (ЭКО донорской яйцеклетки).
Синдром истощения яичников (СИЯ) - патологический симптомоком-плекс, включающий вторичную аменорею, бесплодие, вегетососудистые нарушения у женщин моложе 38 лет с нормальной в прошлом менструальной и репродуктивной функцией.
Этиология и патогенез. Ведущей причиной считают хромосомные аномалии и аутоиммунные расстройства, выражающиеся в малых врожденных яичниках с дефицитом фолликулярного аппарата, пре- и постпубертатной деструкции зародышевых клеток, первичном поражении ЦНС и гипотала-мической области. СИЯ - генерализованный аутоиммунный диатез.
В возникновении СИЯ играет роль множество факторов, в антеи постнатальном периоде приводящих к повреждению и замещению гонад соединительной тканью. Видимо, на фоне неполноценного генома любые экзогенные воздействия (радиация, различные лекарственные препараты, голодание, гипо- и авитаминоз, вирус гриппа и краснухи) могут способствовать развитию СИЯ. У большинства больных неблагоприятные факторы действовали в период внутриутробного развития (гестоз, экстрагени-тальная патология у матери). Начало заболевания часто связано с тяжелыми стрессовыми ситуациями, инфекционными заболеваниями.
СИЯ может иметь наследственный характер: у 46% больных родственницы отмечали нарушение менструальной функции - олигоменорею, ранний климакс.
Клиническая симптоматика. Началом заболевания считается аменорея или гипо-, опсо-, олигоменорея с последующей стойкой аменореей, которая сопровождается типичными для постменопаузы вегетативно-сосудистыми проявлениями - приливами, потливостью, слабостью, головной болью с нарушением трудоспособности. На фоне аменореи развиваются прогрес-
сирующие атрофические процессы в молочных железах и половых органах. Больные с СИЯ правильного телосложения, удовлетворительного питания. Ожирение не характерно.
Диагностика основывается на данных анамнеза и клинической картине. Менархе своевременное, менструальная и репродуктивная функции не нарушаются в течение 10-20 лет.
Пониженная функция яичников обусловливает выраженную стойкую гипоэстрогению: отрицательный симптом "зрачка", монофазную базальную температуру, низкие показатели КПИ (0-10%). Гормональные исследования также свидетельствуют о резком снижении функции яичников: уровень эстрадиола практически соответствует таковому у молодых женщин после овариэктомии. Уровень гонадотропных гормонов (ФСГ и ЛГ) резко повышен: ФСГ в 3 раза превышает овуляторный пик и в 15 раз - базальный уровень у здоровых женщин того же возраста; содержание ЛГ приближается к овуляторному пику и в 4 раза превышает базальный уровень у здоровых женщин. Активность пролактина в 2 раза ниже, чем у здоровых женщин.
Гинекологическое и дополнительные методы исследования обнаруживают уменьшение матки и яичников. При УЗИ, помимо уменьшения матки, отмечается резкое истончение ее слизистой оболочки матки при измерении М-эха. При лапароскопии также обнаруживаются маленькие, "морщинистые" яичники желтоватого цвета; желтое тело отсутствует, фолликулы не просвечивают. Ценный диагностический признак - отсутствие фолликулярного аппарата, подтвержденное гистологическим исследованием био-птатов яичников.
Для углубленного изучения функционального состояния яичников используют гормональные пробы. Проба с циклическим назначением эстрогенов (I фаза) и гестагенов (II фаза) сопровождается менструальноподобной реакцией через 3-5 дней после завершения пробы и значительным улучшением общего состояния.
Признаков органического поражения ЦНС нет.
Лечение больных с СИЯ направлено на профилактику и терапию эстро-гендефицитных состояний.
При бесплодии возможно только применение вспомогательной репродуктивной технологии - ЭКО с донорской яйцеклеткой. Стимуляция истощенного фолликулярного аппарата яичников нецелесообразна и небезразлична для здоровья женщины.
Больным с СИЯ показана заместительная гормонотерапия до возраста естественной менопаузы.
9.4. Надпочечниковая аменорея
Нарушения функции надпочечников, приводящие к изменениям менструальной функции, могут быть функциональными, анатомическими и врожденными. Больные с опухолью надпочечников лечатся у эндокринологов.
Синдром Иценко-Кушинга характеризуется избыточной выработкой гормонов надпочечниками - кортизола, андрогенов, что обусловлива-
ет характерную клиническую картину, напоминающую болезнь Иценко-Кушинга, и приводит к нарушению менструального цикла. Синдром может быть следствием функциональных, органических изменений коры надпочечников, избыточной продукции АКТГ гипофизом, реже он обусловлен гормонально-активными злокачественными новообразованиями других органов, способных секретировать АКТГ-подобное вещество. В основе синдрома лежит избыточная продукция глюкокортикостероидов, что приводит к нарушению углеводного обмена и усилению метаболизма белков, особенно в мышечной и костной ткани.
Основные клинические проявления и их выраженность зависят от вида и гормональной активности опухоли надпочечника. Наиболее выражены ранние симптомы вирилизации и аменорея при глюкоандростероме. Обращает на себя внимание внешний вид больной: "лунообразное" лицо багрово-красного цвета, отложения жира в подкожной клетчатке в области шеи и плечевого пояса наряду с атрофией мускулатуры конечностей и мышц передней брюшной стенки. Кожа сухая, со склонностью к гиперкератозу, на коже живота, груди и бедер стрии багрово-цианотичного цвета, гиперпигментация кожи локтей и кожных складок. Резко выражена АГ, отмечается диффузный или системный остеопороз. Если заболевание развивается в пре- и пубертатном периоде, рост замедляется.
Адреногенитальный синдром. К аменорее приводит АГС - врожденная гиперплазия коры надпочечников. Это генетически обусловленное заболевание, связанное с аутосомно-рецессивным геном.
Основным патогенетическим механизмом АГС является врожденный дефицит фермента С21-гидроксилазы, образование которой обеспечивает ген, локализованный в коротком плече одной пары хромосомы 6. Данный фермент участвует в синтезе андрогенов в коре надпочечников. Патология может не проявляться при наследовании одного патологического гена и манифестирует при наличии дефектных генов в обеих аутосомах 6-й пары хромосом. Недостаточность фермента обусловливает снижение выработки кортизола, что по механизму обратной связи увеличивает секрецию АКТГ, приводит к двусторонней гиперплазии коры надпочечников, усиливая синтез андрогенов.
Гиперсекреция андрогенов оказывает вирилизирующее действие на плод еще во внутриутробном периоде. Это приводит к развитию классической (врожденной) формы АГС (см. раздел "Детская гинекология"). Следствием ферментной недостаточности является и поздняя (стертая) форма АГС. До определенного возраста нерезко выраженный дефицит С21-гидроксилазы в надпочечниках компенсируется. При усилении функции надпочечников (эмоциональный стресс, начало половой жизни, беременность) увеличивается синтез андрогенов, что, в свою очередь, тормозит выделение гонадо-тропинов и нарушает циклические изменения в яичниках.
Клиническая симптоматика. Классическая форма АГС сопровождается чрезвычайно выраженной вирилизацией: большой клитор и большие половые губы напоминают мошонку (ложный женский гермафродитизм). При рождении иногда неправильно определяют пол (см. раздел "Детская гинекология").
Поздние формы АГС, проявляющиеся в постпубертатном периоде, характеризуются "стертой" вирилизацией. У большинства больных симптомы появляются после менархе в связи с активацией системы гипоталамус- гипофиз-яичники и надпочечников. Первая менструация - в 15-16 лет, в дальнейшем менструации нерегулярные, с тенденцией к олигоменорее. В этом периоде более выражен гирсутизм: рост волос по белой линии живота, на верхней губе, внутренней поверхности бедер, но маскулинизация выражена меньше, чем при классической форме АГС. Кожа жирная, пористая, с множественными акне, обширными пятнами гиперпигментации. Влияние андрогенов сказывается и на телосложении: нерезко выраженные мужские пропорции тела с широкими плечами и узким тазом, укорочение конечностей. После появления гирсутизма развивается гипоплазия молочных желез.
У пациенток с постпубертатной формой АГС нарушены менструальная и репродуктивная функции. Постпубертатная форма АГС сопряжена с прерыванием беременности на ранних сроках. Гирсутизм выражен незначительно: скудное оволосение белой линии живота и на верхней губе с сохранением женского типа телосложения.
Диагностика. При поздних формах АГС пытаются установить в семейном анамнезе случаи нарушения менструального цикла у сестер и родственниц по материнской и отцовской линиям.
Поздние формы АГС вызывают раннее и быстрое развитие оволосения по мужскому типу, позднее менархе и нерегулярные менструации в дальнейшем. Патогномоничны для АГС "спортивный" тип телосложения, гипертрихоз, угревая сыпь, умеренная гипоплазия молочных желез. АГС не сопровождается повышением массы тела, в отличие от других эндокринных нарушений с гипертрихозом.
Основная роль в диагностике АГС принадлежит гормональным исследованиям. Для уточнения происхождения андрогенов проводят гормональные исследования до и после дексаметазоновой пробы. Снижение уровня ДГЭА и ДГЭА-С в крови после приема препаратов, тормозящих выделение АКТГ, указывает на надпочечниковое происхождение андрогенов.
Данные УЗИ яичников свидетельствуют об ановуляции: наличие фолликулов различной степени зрелости, не достигающих преовуляторных размеров. По тестам функциональной диагностики: базальная температура с растянутой 1-й фазой и укороченной 2-й фазой, свидетельствующей о недостаточности желтого тела; андрогенный тип влагалищных мазков.
Лечение. Выбор лечебных препаратов у больных с поздними формами АГС определяется целью терапии: нормализацией менструального цикла, стимуляцией овуляции, подавлением гипертрихоза.
С целью коррекции нарушений гормональной функции коры надпочечников используют глюкокортикостероидные препараты (дексаметазон). Доза дексаметазона зависит от содержания ДГЭА в крови (на фоне приема дексаметазона уровень этого гормона не должен превышать верхнюю границу нормы). Кроме гормональных исследований, эффективность лечения контролируют измерением базальной температуры и учитывают изменения менструального цикла. При неполноценной 2-й фазе менструального цик-
ла необходима стимуляция овуляции с 5-го по 9-й день менструального цикла, в результате чего часто наступает беременность. После наступления беременности во избежание самопроизвольного выкидыша терапию глю-кокортикостероидами следует продолжить, длительность такого лечения определяют индивидуально.
Если женщина не заинтересована в беременности, а основными являются жалобы на гипертрихоз и гнойничковые высыпания на коже, рекомендуется гормонотерапия препаратами, содержащими эстрогены и анти-андрогены. Выраженный эффект в отношении гипертрихоза дает диане-35*. Препарат применяют с 5-го по 25-й день менструального цикла в течение 4-6 мес. Особенно эффективно сочетание диане-35* с ципротероном (ан-дрокур*), назначаемых в первые 10-12 дней цикла.
Антиандрогенное действие оказывает спиронолактон, подавляющий образование дигидротестостерона из тестостерона в коже, волосяных фолликулах и сальных железах. Спиронолактон назначают по 25 мг 2 раза в день. Применение препарата в течение 4-6 мес снижает уровень тестостерона на 80%, при этом снижения уровня кортикотропного и гонадотропных гормонов не отмечено. Синтетические прогестины также уменьшают гипертрихоз, но использование этих препаратов у женщин с АГС не должно быть длительным, так как подавление гонадотропинов нежелательно при угнетенной функции яичников.
9.5. Аменорея, обусловленная патологией щитовидной железы
Аменорея тиреоидного генеза чаще обусловлена первичным или вторичным гипотиреозом. В условиях дефицита тиреоидных гормонов усиливается рост тиреотрофов, продуцирующих повышенное количество ТТГ, подавляется функция клеток гипофиза, вырабатывающих ЛГ, увеличивается соотношение ФСГ/ЛГ. Дальнейшее снижение уровня тиреоидных гормонов ведет к угнетению деятельности яичников, нарастанию дегенеративных изменений в них. При субклинических и легких формах гипотиреоза наблюдается недостаточность лютеиновой фазы, при среднетяжелом и тяжелом гипотиреозе - аменорея. При гипотиреозе у детей возможны как преждевременное половое развитие, так и его задержка.
Гипертиреоз может приводить к возрастанию базального уровня ЛГ, подавлению овуляторного пика гормонов, повышению реактивности гонад в ответ на действие ЛГ и ФСГ. Все эти факторы способствуют ановуляции и аменорее. В органах-мишенях при длительном гипертиреозе под влиянием избытка тиреоидных гормонов происходят изменения (фиброзная мастопатия, уменьшение матки, дегенеративные изменения гранулезного слоя в яичниках).
Симптомы легких форм гипо- и гипертиреоза неспецифичны. Больные могут долго и безуспешно лечиться у разных специалистов по поводу веге-тососудистой дистонии, нейрообменно-эндокринного синдрома, аменореи неясного генеза.
9.6. Маточная форма аменореи
Маточная форма аменореи наблюдается при воздействии повреждающих факторов на матку либо при врожденных пороках внутренних половых органов.
Функциональные причины, приводящие к аменорее, связаны с травматическими повреждениями базального слоя эндометрия при частых и грубых выскабливаниях слизистой оболочки матки.
В результате удаления базального слоя эндометрия возможно возникновение внутриматочных спаек (синдром Ашермана). Одной из причин внутри-маточных спаек является генитальный туберкулез (см. главу 12 "Воспалительные заболевания женских половых органов"). Спайки могут привести к частичному или полному заращению полости матки. При полном зара-щении полости матки наступает вторичная аменорея. Заращение полости матки в нижней трети или в области цервикального канала при нормальном функционировании эндометрия в верхних отделах приводит к развитию гематометры. Обширные и плотные сращения становятся причиной вторичной аменореи и вторичного бесплодия в результате окклюзии устьев маточных труб, препятствующей процессу оплодотворения. Присоединение инфекции при травмировании слизистой оболочки матки во время выскабливания также способствует образованию внутриматочных синехий. Спаечный процесс в полости матки может возникнуть после миомэктомии, метропластики, диагностических выскабливаний, электроконизации шейки матки, эндометрита, введения ВМК. Образование внутриматочных синехий в постменопаузе - физиологический процесс.
Трофические нарушения травмированного эндометрия и вторичное выключение гипоталамической регуляции менструального цикла могут привести к раннему климаксу.
Врожденные аномалии развития матки и влагалища - синдром Рокитанского-Кюстнера (матка и влагалище в виде тонких соединительнотканных тяжей), агенезия, аплазия, атрезия влагалища - описаны в главе 4 "Пороки развития половых органов".
Эти пороки сопровождаются ложной аменореей и выраженным болевым синдромом. Ложная аменорея наблюдается и при атрезии цервикального канала в связи с его травматическим повреждением при внутриматочных манипуляциях или вследствие воспалительных процессов.
9.7. Определение уровня и характера поражения системы регуляции менструальной функции при аменорее. Общие принципы терапии
Обследование больной с аменореей предусматривает поэтапное определение уровня поражения. Направление диагностического поиска можно установить на основании жалоб, анамнеза и клинических проявлений. Иногда правильно собранный анамнез позволяет выявить причину аменореи до клинического обследования и дополнительных исследований (аменорея после стресса или быстрого похудения).
При общем осмотре удается составить представление о возможной патологии, поскольку для каждого уровня поражения характерны определенные клинические проявления: тип телосложения, ожирение и распределение жировой ткани, наличие или отсутствие соматических аномалий, симптомы вирилизации и маскулинизации.
Внешний вид, развитие и распределение подкожной жировой клетчатки у больных с гипоталамо-гипофизарными нарушениями имеют свои особенности: ожирение с отложением жировой ткани на животе в виде фартука, на плечевом поясе или снижение массы тела на 15-25% возрастной нормы, "лунообразное" лицо багрово-красного цвета, гиперпигментация кожи локтей и кожных складок, стрии, сухая кожа с мраморным рисунком, гипоплазия молочных желез.
При яичниковых нарушениях ожирение развивается у больных с центральной формой СПКЯ, распределение жировой ткани равномерное. Для врожденных и органических нарушений яичникового генеза ожирение не типично. Характерный внешний вид у больных с врожденной патологией яичников - дисгенезией гонад (см. раздел "Детская гинекология").
Больным с надпочечниковой аменореей ожирение также несвойственно. Выраженные клинические проявления отмечены у больных с врожденной дисфункцией коры надпочечников (классическая форма АГС), они приводят к патологии наружных половых органов и неправильному определению пола при рождении.
При маточной форме аменореи типичных изменений в телосложении и метаболизме нет. У больных нормальный женский тип телосложения. При врожденной патологии матка может отсутствовать, влагалище представляет собой слепой мешок. Развитие женских вторичных половых признаков правильное и своевременное. Генитальный инфантилизм и аномалию развития наружных половых органов можно выявить при гинекологическом исследовании.
Выраженность вирилизации также зависит от уровня поражения. Наиболее заметны андрогенные нарушения у больных с надпочечниковой аменореей (постпубертатные формы АГС, опухоли надпочечников): гирсутизм, андрогенный тип телосложения, алопеция, андрогенная дерматопатия, уменьшение молочных желез и матки. У больных с СПКЯ гирсутизм чаще наблюдается при смешанной форме заболевания, при центральной форме вирилизация появляется на фоне ожирения. Структурные изменения яичников и надпочечников (гормонально-активные опухоли) сопровождаются прогрессированием симптомов вирилизации (гипертрофия клитора, дефе-минизация фигуры, снижение тембра голоса).
Большая частота генетических аномалий и наследственных заболеваний, особенно при первичной аменорее, требует проведения генетических исследований, включающих определение полового хроматина и кариотипа.
Результаты клинико-анамнестического этапа обследования определяют спектр дополнительных инструментальных и лабораторных методов. Дальнейшее обследование предполагает выявление или исключение органических причин аменореи на всех уровнях регуляции менструального цикла. С этой целью обязательно применяют рентгенографию турецкого седла
и черепа, эхографию органов малого таза и щитовидной железы, гистероскопию с гистологическим исследованием соскобов, гистеросальпингогра-фию, лапароскопию. МРТ головного мозга назначают по показаниям.
При необходимости к обследованию больных привлекают смежных специалистов: офтальмолога (исследование глазного дна, периферических, цветовых полей зрения), терапевта, эндокринолога, невролога, психиатра, психолога.
После исключения опухолей и врожденной патологии органов репродуктивной системы для оценки ее функционального состояния проводят гормональные исследования и функциональные пробы. Важно определение уровня ФСГ, ЛГ, пролактина, ТТГ, Т3, Т4, эстрадиола, прогестерона, ДГЭА и ДГЭА-С, тестостерона, кортизола. Функциональные пробы способствуют дифференциальной диагностике и рассчитаны на стимуляцию или подавление деятельности эндокринных желез (см. главу 2 "Нейроэндокринная регуляция менструального цикла").
Лечение больных с аменореей комплексное и зависит от формы аменореи. Анатомические изменения органов, участвующих в регуляции менструального цикла, служат показанием для оперативного или лучевого лечения. В некоторых случаях хирургическое лечение сочетается с гормонотерапией.
Функциональные нарушения менструального цикла предусматривают воздействие на ведущее звено патогенеза гормональными и негормональными средствами. При этом необходима нормализация психоэмоциональной сферы, показано снижение массы тела при ожирении. Подобная терапия способствует коррекции нарушений в надпочечниках, щитовидной железе, яичниках.
При центральных нарушениях лечение начинают с коррекции метаболических изменений, прежде всего со снижения массы тела. Рекомендуется соблюдение гипокалорийной диеты, лечебная физкультура, циклическая витаминотерапия: с 1-го по 15-й день менструального цикла - прием фоли-евой кислоты, пиридоксина, с 16-го по 25-й день - аскорбиновой кислоты и витамина Е. При аменорее центрального генеза со снижением массы тела показано восстановление должной массы тела. Для нормализации функции гипоталамических структур и повышения эффективности диетотерапии применяют препараты, регулирующие нейромедиаторный обмен (фенито-ин, бекламид, бромокриптин). Фенитоин и бекламид показаны женщинам с преобладанием в клинической картине явлений гиперкортицизма. Нормализация массы тела у половины больных приводит к восстановлению регулярного менструального цикла и фертильности. При отсутствии эффекта можно рекомендовать циклическую терапию натуральными эстрогенами и гестагенами (дивитрен♠, дивина♠, фемостон♠ и др.) в течение 3-6 мес, что оказывает стимулирующее влияние на гипоталамические структуры. Примерная схема циклической гормонотерапии: с 5-го по 15-й день - эстра-диол (эстрофем♠, прогинова♠), этинилэстрадиол (микрофоллин♠); с 16-го по 26-й день - прогестерон, дидрогестерон, норэтистерон (норколут*). После нормализации массы тела можно проводить стимуляцию овуляции кло-мифеном с 5-го по 9-й день цикла в течение 2-3 мес.
Гипоталамо-гипофизарную систему у пациенток с сохраненными гормональными связями можно активизировать назначением комбинированных эстроген-гестагенных препаратов, прогестагенов, аналогов ГнРГ. Эти препараты сначала приводят к торможению регулирующих систем, а затем наблюдается ребаунд-эффект (эффект отражения), т.е. после их отмены наступает нормализация менструальной функции.
Для лечения гипоталамических нарушений используют гонадолиберин (пергонал*, профази*) в импульсном режиме. С этой же целью применяют кломифен, усиливающий синтез и секрецию гонадотропинов. При нарушении связи между гипоталамусом и гипофизом показано введение гонадо-тропинов (менотропин).
Устранение функциональных нарушений при яичниковой аменорее обеспечивает циклическая гормонотерапия в сочетании с циклической витаминотерапией.
Для коррекции гормональной функции коры надпочечников используют глюкокортикостероидные препараты.
При маточной форме аменореи вследствие травматических повреждений слизистой оболочки на 1-м этапе проводят рассечение внутриматочных си-нехий во время гистероскопии, а затем назначают циклическую гормонотерапию в течение 3-4 менструальных циклов.
Таким образом, функциональные нарушения на всех уровнях поражения требуют гормонотерапии. Ведение больных с аменореей предполагает обязательное диспансерное наблюдение. Неэффективность лечения следует рассматривать как показание для повторного обследования с целью выявления нераспознанной органической причины аменореи.
9.8. Дисфункциональные маточные кровотечения
Дисфункциональные маточные кровотечения (ДМК) - одна из форм нарушений менструальной функции, обусловленная нарушением циклической продукции гормонов яичников. ДМК могут проявляться в виде мено-, метроили менометроррагий. Функциональные изменения, приводящие к маточным кровотечениям, могут быть на любом уровне регуляции менструальной функции: в коре головного мозга, гипоталамусе, гипофизе, надпочечниках, щитовидной железе, яичниках. ДМК рецидивируют и нередко приводят к нарушению репродуктивной функции, а гормональные нарушения при ДМК - к развитию гиперпластических процессов вплоть до пред-рака и рака эндометрия.
В зависимости от периода жизни женщины выделяют:
• ДМК ювенильного периода - 12-17 лет (см. раздел "Детская гинекология");
• ДМК репродуктивного периода - 18-45 лет;
• ДМК пременопаузального периода - 46-55 лет.
9.9. Дисфункциональные маточные кровотечения репродуктивного периода
ДМК составляют около 4-5% гинекологических заболеваний репродуктивного периода и остаются наиболее частой патологией репродуктивной системы женщины.
Этиология и патогенез. Этиологическими факторами могут быть стрессовые ситуации, перемена климата, умственное и физическое переутомление, профессиональные вредности, неблагоприятные материально-бытовые условия, гиповитаминозы, интоксикации и инфекции, нарушения гормонального гомеостаза, аборты, прием некоторых лекарственных препаратов. Наряду с большим значением первичных нарушений в системе кора- гипоталамус-гипофиз не меньшую роль играют первичные нарушения на уровне яичников. Причиной расстройства овуляции могут быть воспалительные и инфекционные заболевания, под влиянием которых возможны утолщение белочной оболочки яичника, изменение кровоснабжения и снижение чувствительности ткани яичника к гонадотропным гормонам.
В зависимости от патогенетических механизмов и клинико-морфологических особенностей ДМК репродуктивного периода разделяют на ановуляторные и овуляторные.
В репродуктивном периоде конечным результатом гипоталамо-гипофизарных расстройств является ановуляция, в основе которой может быть как персистенция, так и атрезия фолликула. При ДМК в репродуктивном возрасте в яичниках чаще происходит персистенция фолликула с избыточной продукцией эстрогенов. Поскольку овуляция не происходит и желтое тело не образуется, создается прогестерондефицитное состояние и возникает абсолютная гиперэстрогения. Персистенция фолликула представляет собой как бы остановку нормального менструального цикла в срок, близкий к овуляции: фолликул, достигнув зрелости, не претерпевает дальнейших физиологических превращений, продолжая выделять эстрогены. Ановуляторные кровотечения могут быть на фоне атрезии фолликула в результате относительной гиперэстрогении. В яичнике один или несколько фолликулов останавливаются на любой стадии развития, не подвергаясь дальнейшим циклическим превращениям, но и не прекращая функционировать до определенного времени. В последующем атрезирующиеся фолликулы подвергаются обратному развитию или превращаются в мелкие кисты. При атрезии фолликулов эстрогенов мало, но в связи с ановуляцией отсутствуют желтое тело и выделение прогестерона - развивается состояние относительной гиперэстрогении.
Длительное воздействие повышенного уровня эстрогенов на матку вызывает избыточный рост эндометрия. Увеличение продолжительности и интенсивности пролиферативных процессов в эндометрии приводит к гиперплазии с риском развития атипической гиперплазии и аденокарциномы эндометрия. В связи с отсутствием овуляции и желтого тела нет достаточного количества прогестерона, необходимого для секреторной трансформации и нормального отторжения пролиферативного эндометрия. Механизм кровотечения связан с сосудистыми изменениями: застойное полнокровие
с резким расширением капилляров в эндометрии, нарушение кровообращения, тканевая гипоксия сопровождаются дистрофическими изменениями слизистой оболочки матки и появлением некротических процессов на фоне стаза крови и тромбозов. Все сказанное выше приводит к длительному и неравномерному отторжению эндометрия. Морфологическая структура слизистой оболочки пестрая: наряду с участками распада и отторжения имеются очаги регенерации.
Овуляторные ДМК обычно обусловлены персистенцией желтого тела, которая чаще наблюдается в возрасте старше 30 лет. Нарушение функции желтого тела заключается в его длительной функциональной активности. В результате персистенции желтого тела уровень гестагенов падает недостаточно быстро или долго остается на одном уровне. Неравномерное отторжение функционального слоя обусловливает длительную менометроррагию. Снижение тонуса матки под влиянием повышенного содержания прогестерона в крови также способствует кровотечению. Желтое тело при этом не имеет признаков обратного развития либо в нем наряду с лютеиновы-ми клетками, находящимися в состоянии обратного развития, есть участки с выраженными признаками функциональной активности. О персистенции желтого тела свидетельствуют высокий уровень прогестерона в крови и эхо-графическая картина яичников.
Во время кровотечения в эндометрии понижено содержание простаглан-дина F2, усиливающего сокращение сосудов, и повышено содержание про-стагландина Е2, препятствующего агрегации тромбоцитов.
Овуляторные кровотечения могут быть и в середине менструального цикла, после овуляции. В норме в середине менструального цикла бывает некоторое снижение уровня эстрогенов, но оно не ведет к кровотечению, так как общий гормональный уровень поддерживается начинающим функционировать желтым телом. При значительном и резком спаде уровня гормонов после овуляторного пика наблюдаются кровяные выделения из половых путей в течение 2-3 дней.
Клинические проявления дисфункционального маточного кровотечения, как правило, определяются изменениями в яичниках. Основной у больных с ДМК является жалоба на нарушение ритма менструаций: кровотечение чаще возникает после задержки менструации либо отмечаются менометрор-рагии. Если персистенция фолликула кратковременная, то маточное кровотечение по интенсивности и длительности не отличается от нормальной менструации. Чаще задержка бывает достаточно длительной (до 6-8 нед), после чего возникает кровотечение. Нередко оно начинается как умеренное, периодически уменьшается, снова усиливается и продолжается очень долго, приводя к анемии и ослаблению организма.
ДМК вследствие персистенции желтого тела - менструация, наступающая в срок или после небольшой задержки. С каждым новым циклом она становится все продолжительнее и обильнее, превращаясь в менометрорра-гию, длящуюся до 1-1,5 мес.
Нарушение функции яичников у больных с ДМК может привести к снижению фертильности.
При диагностике необходимо исключить другие причины кровотечения, которыми в репродуктивном возрасте могут быть: доброкачественные и злокачественные заболевания половых органов, эндометриоз, миома матки, травмы половых органов, воспалительные процессы матки и придатков, прервавшаяся маточная и внематочная беременность, остатки плодного яйца после артифициального аборта или самопроизвольного выкидыша, плацентарный полип после родов или аборта. Маточные кровотечения возникают при экстрагенитальных заболеваниях: болезнях крови, печени, сердечнососудистой системы, эндокринной патологии. Обследование должно быть направлено на исключение морфологической патологии и определение функциональных нарушений в системе гипоталамус-гипофиз-яичники- матка с использованием общедоступных, а при необходимости и дополнительных методов обследования. На 1-м этапе после клинических методов (изучение анамнеза, объективный общий и гинекологический осмотр) проводится гистероскопия с раздельным диагностическим выскабливанием и морфологическим исследованием соскобов. В последующем, после остановки кровотечения, показаны:
• лабораторное исследование (клинический анализ крови, коагулограм-ма) для оценки анемии и состояния свертывающей системы крови;
• обследование по тестам функциональной диагностики (измерение ба-зальной температуры, симптом "зрачка", симптом натяжения церви-кальной слизи, подсчет КПИ);
• рентгенография черепа (турецкого седла), ЭЭГ и ЭхоЭГ, РЭГ;
• определение содержания гормонов в плазме крови (гормоны гипофиза, яичников, щитовидной железы и надпочечников);
• УЗИ, ГСГ, гистеросальпингография;
• по показаниям обследование терапевтом, офтальмологом, эндокринологом, неврологом, гематологом, психиатром.
Тщательный анализ анамнестических данных способствует выяснению причин кровотечения и позволяет провести дифференциальную диагностику с заболеваниями, имеющими сходные клинические проявления. Как правило, возникновению ДМК предшествуют позднее менархе, ювениль-ные ДМК, что свидетельствует о неустойчивости репродуктивной системы. Указания на циклические болезненные кровотечения - меноррагии или менометроррагии - могут свидетельствовать об органической патологии (миома матки с субмукозным узлом, патология эндометрия, аденомиоз).
При общем осмотре обращают внимание на состояние и цвет кожных покровов, распределение подкожной жировой клетчатки при повышенной массе тела, выраженность и распространенность оволосения, полосы растяжения, состояние щитовидной железы, молочных желез.
В период отсутствия кровяных выделений из половых путей при специальном гинекологическом исследовании можно обнаружить признаки гиперили гипоэстрогении. При абсолютной гиперэстрогении слизистая оболочка влагалища и шейки матки сочные, матка несколько увеличена, резко положительные симптомы "зрачка" и натяжения цервикальной слизи. При относительной гипоэстрогении слизистые оболочки влагалища и шейки матки бледные, симптомы "зрачка" и натяжения цервикальной
слизи слабоположительные. При двуручном исследовании определяют состояние шейки матки, величину и консистенцию тела и придатков матки.
Следующий этап обследования - оценка функционального состояния различных звеньев репродуктивной системы. Гормональный статус изучают с помощью тестов функциональной диагностики на протяжении 3-4 менструальных циклов. Базальная температура при ДМК почти всегда монофазная. При персистенции фолликула наблюдают резко выраженный феномен "зрачка" в течение всего периода задержки менструации. При атрезии фолликула феномен "зрачка" выражен слабо, но сохраняется долго. При персистенции фолликула отмечается значительное преобладание орого-вевающих клеток (КПИ 70-80%), натяжение цервикальной слизи более 10 см, при атрезии - небольшие колебания КПИ от 20 до 30%, натяжение цервикальной слизи не более 4 см.
Для оценки гормонального статуса больной целесообразно определить в плазме крови уровень ФСГ, ЛГ, Прл, эстрогенов, прогестерона, Т3, Т4, ТТГ, ДГЭА и ДГЭА-С. Уровень прегнандиола в моче и прогестерона в крови свидетельствует о недостаточности лютеиновой фазы у больных с анову-ляторными ДМК.
Диагностика патологии щитовидной железы основывается на результатах комплексного клинико-лабораторного обследования. К возникновению маточных кровотечений приводит, как правило, повышение функции щитовидной железы - гипертиреоз. Повышение секреции Т3 или Т4 и снижение уровня ТТГ позволяют верифицировать диагноз.
Для выявления органических заболеваний гипоталамо-гипофизарной области применяют рентгенографию черепа и турецкого седла, МРТ. УЗИ как неинвазивный метод исследования можно применять в динамике для оценки состояния яичников, толщины и структуры М-эха у больных с ДМК, а также для дифференциальной диагностики миомы матки, эндометриоза, патологии эндометрия, беременности.
Важнейшим этапом диагностики является гистологическое исследование соскобов, полученных при раздельном выскабливании слизистой оболочки матки и цервикального канала; выскабливание с диагностической и одновременно гемостатической целью чаще приходится осуществлять на высоте кровотечения. Раздельное диагностическое выскабливание проводят под контролем гистероскопии. Результаты исследования соскоба при дисфункциональных маточных кровотечениях свидетельствуют о гиперплазии эндометрия и отсутствии стадии секреции.
Лечение больных с ДМК репродуктивного периода зависит от клинических проявлений. При обращении больной с кровотечением с лечебно-диагностической целью необходимо провести гистероскопию и раздельное диагностическое выскабливание. Эта операция обеспечивает остановку кровотечения, а последующее гистологическое исследование соскобов позволяет определить вид терапии, направленной на нормализацию менструального цикла.
При рецидивах кровотечения проводится гемостатическая терапия, в виде исключения возможен гормональный гемостаз. Однако консервативную терапию назначают лишь в случаях, когда информация о состоя-
нии эндометрия была получена в пределах 2-3 мес и по данным УЗИ нет признаков гиперплазии эндометрия. Симптоматическая терапия включает средства, сокращающие матку (окситоцин), кровоостанавливающие препараты (этамзилат, Викасол*, Аскорутин*). Существует несколько методик гормонального гемостаза с применением гестагенов, синтетических проге-стинов. Гемостаз гестагенами основан на их способности вызывать десква-мацию и полное отторжение эндометрия, но гестагенный гемостаз не дает быстрого эффекта.
Следующим этапом лечения является гормонотерапия с учетом состояния эндометрия, характера нарушений функции яичников и уровня эстрогенов крови. Цели гормонотерапии:
• нормализация менструальной функции;
• реабилитация нарушенной репродуктивной функции, восстановление фертильности при бесплодии;
• профилактика повторного кровотечения.
При гиперэстрогении (персистенции фолликула) лечение проводят во 2-ю фазу менструального цикла гестагенами (прогестерон, норэтистерон, дидрогестерон, утрожестан♠) в течение 3-4 циклов или эстроген-гестагенами с высоким содержанием гестагенов (ригевидон♠, микрогинон♠, силест♠) в течение 4-6 циклов. При гипоэстрогении (атрезии фолликулов) показана циклическая терапия эстрогенами и гестагенами в течение 3-4 циклов, гормонотерапию можно сочетать с витаминотерапией (в 1-ю фазу - фолиевая кислота, во 2-ю - аскорбиновая кислота) на фоне противовоспалительной терапии по схеме.
Профилактическую терапию назначают прерывистыми курсами (3 мес лечения + 3 мес перерыв). Повторные курсы гормонотерапии применяют по показаниям в зависимости от эффективности предшествующего курса. Отсутствие адекватной реакции на гормонотерапию на любом этапе следует рассматривать как показание для детального обследования больной.
С целью реабилитации нарушенной репродуктивной функции проводится стимуляция овуляции кломифеном с 5-го по 9-й день менструально-подобной реакции. Контролем овуляторного цикла являются двухфазная базальная температура, наличие доминантного фолликула и толщина эндометрия при УЗИ.
Общая неспецифическая терапия направлена на снятие отрицательных эмоций, физического и умственного переутомления, ликвидацию инфекций и интоксикаций. Целесообразно воздействовать на ЦНС, назначая психотерапию, аутогенную тренировку, гипноз, седативные, снотворные средства, транквилизаторы, витамины. В случае анемии необходима антианемическая терапия.
ДМК в репродуктивном периоде при неадекватной терапии склонны к рецидивам. Рецидивы кровотечения возможны вследствие неэффективной гормонотерапии или недиагностированной причины кровотечения.
9.10. Дисфункциональные маточные кровотечения пременопаузального периода
ДМК в возрасте от 45 до 55 лет называются климактерическими кровотечениями.
Этиология и патогенез. В основе климактерических кровотечений лежат нарушение строгой цикличности выделения гонадотропинов, взаимоотношения ФСГ и ЛГ и, как следствие, процессов созревания фолликулов, что приводит к ановуляторной дисфункции яичников. В яичниках чаще наблюдается персистенция фолликула и очень редко - атрезия. Ановуляции способствует уменьшение активности рецепторов гонадотропинов в яичниках. В результате устанавливается гиперэстрогения на фоне гипопрогестероне-мии. Чрезмерная пролиферация и отсутствие секреторной трансформации слизистой оболочки матки приводят к гиперплазии эндометрия различной выраженности. Маточное кровотечение обусловлено неполной и затянувшейся отслойкой гиперплазированного эндометрия.
Гиперэстрогенные маточные кровотечения наблюдаются также при гормонально-активных опухолях яичников (тека-, реже - гранулезоклеточ-ные). Эти опухоли нередко возникают в перименопаузальном возрасте (см. главу 16 "Заболевания яичников").
Клиническая симптоматика. Как правило, больные жалуются на обильное кровотечение из половых путей после задержки менструации от 8-10 дней до 4-6 нед. Ухудшение состояния, слабость, раздражительность, головная боль отмечаются только во время кровотечения.
Примерно у 30% больных с климактерическими кровотечениями наблюдается и климактерический синдром.
Диагностика. Основным условием эффективной терапии ДМК периме-нопаузального периода, как и репродуктивного, является точная диагностика причины кровотечения, т.е. исключение органических заболеваний.
ДМК пременопаузального периода часто рецидивируют и сопровождаются нейроэндокринными нарушениями. Общий осмотр дает представление о состоянии внутренних органов, возможных эндокринных нарушениях, изменениях обмена веществ.
При гинекологическом исследовании следует обратить внимание на соответствие возраста женщины и изменений половых органов, исключить органическую патологию половых органов.
Среди надежных и высокоинформативных методов выявления внутри-маточной патологии - УЗИ, гистероскопия и раздельное диагностическое выскабливание слизистой оболочки матки с последующим гистологическим исследованием соскоба. При отсутствии гистероскопа и подозрении на подслизистый узел или внутренний эндометриоз следует рекомендовать гистерографию или ГСГ.
Для уточнения состояния ЦНС проводят ЭхоЭГ и ЭЭГ, РЭГ, делают обзорный снимок черепа и турецкого седла, исследуют цветовые поля зрения. По показаниям назначают консультацию невролога. Целесообразно провести УЗИ щитовидной железы, гормональные исследования, определить уровень тромбоцитов.
Лечение начинают с раздельного диагностического выскабливания слизистой оболочки матки под контролем гистероскопии, что позволяет остановить кровотечение и получить данные о гистологическом строении эндометрия.
Лечение климактерических кровотечений должно быть комплексным.
С целью восстановления нормального функционирования ЦНС необходимо устранить отрицательные эмоции, физическое и умственное переутомление. Психотерапия, физиотерапия, транквилизаторы, гомеопатические препараты (климактоплан*, климадинон*, ременс*) позволяют нормализовать деятельность ЦНС.
Поскольку ДМК ведут к анемизации больных, при острой и хронической анемии необходимы применение препаратов железа (тотема*, венофер*), а также витаминотерапия (препаратами витаминов группы В, витамина К - для регуляции белкового обмена, аскорбиновой кислоты и витамина Р - для укрепления капилляров эндометрия, витамина Е - для улучшения функции гипоталамо-гипофизарной области).
Гормонотерапия направлена на профилактику кровотечений. С этой целью чаще всего применяют синтетические гестагены (дидрогестерон, норэ-тистерон). Гестагены последовательно приводят к торможению пролифера-тивной активности, секреторной трансформации эндометрия и вызывают атрофические изменения эпителия. Доза и последовательность применения гестагенов зависят от возраста пациентки и характера патологических изменений в эндометрии. Пациенткам моложе 47 лет можно назначать терапию по схеме с сохранением регулярных менструальных циклов: гестагены во 2-ю фазу цикла - с 16-го по 25-й день цикла или с 5-го по 25-й день цикла. Лечение пациенток старше 48 лет направлено на подавление функции яичников.
Комплексная терапия включает коррекцию обменно-эндокринных нарушений, прежде всего ожирения, путем строгого соблюдения соответствующей диеты и лечения АГ.
Рецидивы климактерических кровотечений после гормонотерапии чаще становятся следствием недиагностированной органической патологии или неправильно подобранных препарата либо его дозы, а также индивидуальной реакции на него. При рецидивирующих маточных кровотечениях, противопоказаниях к гормонотерапии и отсутствии данных, подтверждающих злокачественную патологию, возможна абляция эндометрия (лазерная, термическая или электрохирургическая). Данные методы лечения направлены на предотвращение восстановления эндометрия путем разрушения его базального слоя и желез.
9.11. Альгодисменорея
Альгодисменорея (дисменорея) - циклически повторяющийся болевой синдром, обусловленный функциональными, анатомическими изменениями матки (нарушения сократительной активности миометрия, гиперантеф-лексия, гиперретрофлексия, аденомиоз, миома), сопровождающими менструальное отторжение эндометрия. Частота альгодисменореи колеблется
от 8 до 80%. Альгодисменорея может сопровождаться комплексом нейрове-гетативных, поведенческих, обменных нарушений с потерей трудоспособности и изменением психосоматического статуса.
Патогенез. Различают первичную, или функциональную, не связанную с анатомическими изменениями внутренних половых органов, и вторичную альгодисменорею, обусловленную патологическими процессами в органах малого таза.
Первичная альгодисменорея появляется в подростковом возрасте, через 1-1,5 года после менархе, с началом овуляции, обычно у девочек астенического телосложения, повышенно возбудимых, эмоционально лабильных. Предпосылки первичной альгодисменореи:
- недостаточный уровень эндогенных опиатов (эндорфины, энкефа-лины);
- недостаточность лютеиновой фазы;
- функциональная несостоятельность тканевых протеолитических ферментов эндометрия и нарушения фрагментации отторгаемой слизистой оболочки матки;
- избыточное содержание простагландинов.
Возникновение первичной альгодисменореи большинство исследователей связывают с высоким уровнем простагландинов Е2 и F2a, являющихся мощным стимулятором сократительной активности миометрия, приводящей к болевым ощущениям. Спазм сосудов и локальная ишемия способствуют гипоксии клеток, накоплению аллогенных веществ, раздражению нервных окончаний и возникновению боли. Боль усиливается также в результате накопления в тканях солей кальция, так как высвобождение активного кальция повышает внутриматочное давление, амплитуду и частоту маточных сокращений.
Существенную роль в реакции женщины на усиленные спастические сокращения матки во время менструации играет болевая чувствительность. Болевой порог в значительной степени определяется синтезом эндогенных опиатов. Сильная мотивация и волевое усилие, переключение внимания на какую-либо интеллектуальную деятельность могут ослабить боль или даже полностью подавить ее.
Клиническая симптоматика. Схваткообразные боли в дни менструации или за несколько дней до нее локализуются внизу живота, иррадиируют в поясничную область, реже - в область наружных половых органов, паха и бедер. Боли приступообразные и довольно интенсивные, сопровождаются общей слабостью, тошнотой, рвотой, спастической головной болью, головокружением, повышением температуры тела до 37-38 °C, сухостью во рту, вздутием живота, обмороками и другими вегетативными расстройствами. Иногда ведущим становится какой-либо один симптом, который беспокоит больше, чем боль. Сильные боли истощают нервную систему, способствуют развитию астенического состояния, снижают работоспособность.
Диагностика первичной альгодисменореи основывается на:
- характерных конституциональных особенностях (астеническое телосложение), молодом возрасте больных, появлении альгодисмено-реи через 1,5-2 года после менархе;
- сопутствующих альгодисменорее вегетососудистых симптомах;
- отсутствии анатомических изменений при гинекологическом исследовании.
Лечение первичной альгодисменореи должно быть комплексным и включать медикаментозные и немедикаментозные средства:
• ингибиторы синтеза простагландинов - для снижения болевых ощущений. Необходимо учитывать раздражающее влияние препаратов на слизистую оболочку желудка и повышение агрегации тромбоцитов. В связи с этим лучше назначать НПВП в свечах. Наиболее часто применяют обладающие аналгезирующими свойствами индометацин, ди-клофенак, ибупрофен, ацетилсалициловую кислоту в таблетках;
• спазмолитики, анальгетики;
• комбинированные эстроген-гестагенные препараты с большим содержанием гестагенов или более активными гестагенами с 5-го по 25-й день менструального цикла - по 1 таблетке в течение не менее 3 мес;
• седативные средства в соответствии с выраженностью нейровегетатив-ных нарушений - от растительных препаратов до транквилизаторов (валериана♠, диазепам - реланиум♠);
• гомеопатические средства (ременс♠, мастодинон♠ и др.);
• немедикаментозное лечение - физио- и иглорефлексотерапию (ультразвук, диадинамические токи);
• витаминотерапию - витамин Е по 300 мг в день в первые 3 дня болезненных менструаций;
• правильный режим труда и отдыха: занятия спортом, способствующим гармоничному физическому развитию (плавание, коньки, лыжи).
Вторичная альгодисменорея обусловлена органическими изменениями в органах малого таза и чаще развивается у женщин старше 30 лет, у которых в анамнезе - роды, аборты, воспалительные гинекологические заболевания.
Одна из наиболее частых причин вторичной альгодисменореи - эндо-метриоз. Однако боли при этой патологии возможны на протяжении всего менструального цикла и усиливаются за 2-3 дня до менструации. Они чаще не схваткообразные, а ноющие, иррадиируют в область прямой кишки. Боли не сопровождаются расстройством функции желудочно-кишечного тракта. При гинекологическом исследовании в зависимости от локализации и распространения эндометриоидных гетеротопий определяют утолщение и болезненность крестцово-маточных связок, болезненность при смещении матки, увеличение придатков матки, изменение матки перед менструацией и ее уменьшение после окончания менструации (см. главу 13 "Эндометриоз").
Альгодисменорея может развиться у женщин, использующих ВМК. В таких случаях концентрация простагландинов в эндометрии значительно повышена и четко коррелирует с содержанием макрофагов в эндометрии при применении ВМК. При использовании ВМК, содержащих гестагены (например, левоноргестрел - мирена*), альгодисменореи не наблюдается, что объясняется уменьшением контрактильной активности матки под влиянием гормона желтого тела.
Менструации сопровождаются резкими схваткообразными болями при субмукозной миоме матки - при так называемых рождающихся миоматоз-
ных узлах, когда узел достигает внутреннего зева и сокращениями матки выталкивается через цервикальный канал.
Причиной болей во время менструации может быть варикозное расширение тазовых вен. Варикозное расширение вен малого таза может быть следствием воспалительных и спаечных процессов, а также результатом системной венозной патологии (расширение геморроидальных вен и вен нижних конечностей).
Вторичная альгодисменорея наблюдается у женщин с пороками развития половых органов, затрудняющими отток менструальной крови (см. главу 4 "Пороки развития половых органов").
Диагностика. Причины болезненных менструаций устанавливают при тщательном сборе анамнеза и обследовании пациентки.
При дифференциальной диагностике первичной и вторичной альгодис-менореи большое значение имеет УЗИ, позволяющее диагностировать различную внутриматочную патологию. Диагностике последней помогает использование контрастного вещества при трансвагинальном УЗИ (ГСГ).
Гистероскопия и лапароскопия используются не только с диагностической, но и с лечебной целью. Лапароскопия нередко становится единственным методом диагностики малых форм наружного эндометриоза, варикозного расширения вен малого таза, спаечного процесса, дефекта листков широких связок.
Лечение вторичной альгодисменореи заключается в устранении органической патологии. Нередко она требует оперативного лечения.
При неуточненном характере заболевания противопоказано длительное применение анальгетиков и транквилизаторов.
Контрольные вопросы
1. Что такое физиологическая, патологическая, ложная, ятрогенная аменорея?
2. Изложите принципы диагностики и терапии аменореи.
3. Каковы особенности аменореи разного генеза: центрального, яичникового, надпочечникового, маточного?
4. Укажите причины, способствующие развитию альгодисменореи.
5. Изложите лечение альгодисменореи.
6. Дайте объяснение понятию о дисфункциональных маточных кровотечениях.
7. Каков алгоритм обследования больных с ДМК?
8. Изложите принципы лечения больных с ДМК в зависимости от этиологии и возраста.