Неврология и нейрохирургия / под ред. А.Н. Коновалова, А.В. Козлова ; Е.И. Гусев, А.Н. Коновалов, В.И. Скворцова : учебник : - т. 1. - 2009. - 624 с.
|
|
|
|
ГЛАВА 12. Демиелинизирующие заболевания
12.1. Рассеянный склероз
Рассеянный склероз (син.: множественный склероз, sclerosis disseminata) - хроническое демиелинизирующее заболевание, развивающееся вследствие воздействия внешнего патологического фактора (наиболее вероятно, инфекционного) на генетически предрасположенный организм, при этом заболевании наблюдается многоочаговое поражение белого вещества ЦНС, в редких случаях с вовлечением и ПНС. На фоне хронического воспалительного процесса, в основе которого лежат аутоиммунные механизмы, наблюдается повреждение миелиновых оболочек нервных волокон (демиелинизация). Одновременно развиваются очаговые и диффузные нейродегенеративные изменения. В большинстве случаев рассеянный склероз имеет неуклонно прогрессирующее, чаще волнообразное течение, которое в последующем, по мере нарастания нейродегенеративных изменений, может сменяться постепенным прогрессированием, при этом заболевании пациенты молодого и среднего возраста сначала утрачивают работоспособность, а в более поздних стадиях - способность к передвижению и самообслуживанию. Временная нетрудоспособность, связанная в ранних стадиях с обострениями заболевания (при ремиттирующем течении), у большинства больных в последующем сопровождается нарастанием необратимых нарушений и развитием стойкой инвалидности. У 15% больных заболевание с самого начала неуклонно прогрессирует с быстрым формированием инвалидности (первично прогрессирующее течение).
Эпидемиология. Рассеянный склероз начинается практически в 60% случаев в возрасте от 20 до 40 лет, средний возраст клинического начала колеблется в разных популяциях от 29 до 33 лет. В настоящее время все чаще сообщается о раннем начале рассеянного склероза в детском возрасте (10-12 лет), что составляет 2-8% общего числа больных рассеянным склерозом, и у людей старше 50 лет.
Распространенность (болезненность) и заболеваемость рассеянным склерозом выше в географических зонах, максимально удаленных от экватора. В последние годы эта зависимость выражена меньше и заболевание стало часто встречаться и во многих южных регионах. Прямая связь
распространенности рассеянного склероза с широтой, вероятнее всего, обусловлена не только географическим положением, но и суммой генетических, этнических и медико-социальных факторов. Существенное влияние на риск развития заболевания оказывают особенности питания, социально-экономические и экологические характеристики.
Основные эпидемиологические характеристики рассеянного склероза:
• болеют преимущественно лица европейской расы, есть этнические группы (майори, эскимосы и народности Крайнего Севера, коренные индейцы и коренные жители Центральной Африки), где рассеянный склероз встречается очень редко;
• наличие семейного РС, т.е. нескольких случаев заболевания у кровных родственников (от 3 до 10% от всех случаев РС);
• во всех популяциях среди больных РС преобладают женщины, но у мужчин выше вероятность развития неблагоприятного первично прогрессирующего течения РС;
• изменение частоты РС среди перемещенного населения выявило изменение риска РС при смене зон проживания (миграции) в зависимости от возраста переезда (до и после 15 лет);
• существуют «кластеры РС» - зоны резко повышенной частоты РС и «микроэпидемии РС» - резкое увеличение заболеваемости РС на ограниченной территории в определенный временной промежуток;
• в ряде регионов отмечено, что в соседних странах, даже в пределах одной страны, показатели распространенности и заболеваемости РС могут значительно варьировать, что определяется суммой наследственных, внешних и социальных факторов.
Выделяют зону высокого риска с частотой заболевания более 50 на 100 000 населения (Северная и Центральная Европа, юг Канады и север США, юг Австралии и Новая Зеландия). Зона среднего риска имеет частоту заболевания 10-50 на 100 000 населения и объединяет центр и юг США, Гавайские острова, Северную Скандинавию, Южную Европу, Израиль, белое население Южной Африки, север и запад Украины, европейскую часть России, Дальний Восток. Зона низкого риска с частотой 10 и менее на 100 000 населения включает Азию, север Южной Америки, Аляску, Гренландию, острова Карибского моря, Мексику, большую часть Африки, Ближний и Средний Восток. Основной тенденцией в эпидемиологии рассеянного склероза последних десятилетий является увеличение распространенности и заболеваемости в ряде
регионов. В России, помимо исторически сложившихся зон высокого риска по рассеянному склерозу на севере и северо-западе страны, в 90-е годы описаны области высокого риска на юге европейской части, в центральных областях, Поволжье и на Дальнем Востоке. В качестве основных причин увеличения частоты заболевания предлагаются как истинное увеличение заболеваемости, т.е. числа новых случаев, так и влияние медико-социальных факторов (увеличение средней длительности жизни больных из-за раннего установления правильного диагноза, улучшения лечения).
Этиология. В настоящее время рассеянный склероз определяют как мультифакториальное заболевание. Под этим понимается участие как внешних, так и наследственных факторов.
Особое внимание исследователей привлекают следующие факторы:
• вирусы (ретровирусы, группы herpes VI, JC и др., вероятно, в сочетании с эндогенными ретровирусами), бактериальная инфекция (стрептококк, стафилококк и др.);
• хронические интоксикации (органические растворители, бензин, металлы, другие химикаты); большое значение имеет пребывание в экологически неблагоприятных условиях проживания, особенно в детском возрасте;
• особенности питания (в частности, преобладание животных жиров и белков), особенно в возрасте до 15 лет;
• хронический психоэмоциональный стресс; активно изучаются нейроиммунологические и психоиммунологические механизмы в формировании предрасположенности и особенностей клинического течения рассеянного склероза.
Внешние факторы, воздействуя на генетически предрасположенных людей, могут стимулировать развитие воспалительно-аутоиммунного процесса в ЦНС, разрушение миелина и повреждение нервных волокон. Наибольшее значение имеют инфекционные агенты, особенно вирусные инфекции. Многочисленные исследования показали, что, вероятнее всего, нет одного вируса как первопричины рассеянного склероза. Повышенный титр антител в ткани мозга и цереброспинальной жидкости к различным вирусам может быть следствием нарушения иммунорегуляции (поликлональная активация гуморального иммунитета), а не указывать на этиологическое значение того или иного возбудителя.
Вирусы кори, краснухи, инфекционного мононуклеоза (вирус Эпс- тайна-Барра), герпеса, ретровирусы, а также различные бактерии могут выступать в качестве триггерного фактора, участвуя в индукции и под-
держании воспалительного и аутоиммунного процессов, стимулируя нейродегенеративные изменения. Большое внимание уделяется участию латентной, персистирующей вирусной инфекции, в том числе и условно-патогенных для человека вирусов, в стимуляции иммунной системы и реактивации патологического процесса. В качестве триггеров обострения заболевания могут выступать и различные экзо- и эндогенные факторы, влияющие на проницаемость гематоэнцефалического барьера, отделяющего антигены мозга от иммунной системы крови. Среди этих факторов особое значение могут иметь инфекции и стрессовые ситуации, в меньшей степени травмы, физическое и психическое перенапряжение, хирургические операции, загрязнение окружающей среды.
Убедительно доказано существование генетических факторов предрасположенности к рассеянному склерозу, что наиболее отчетливо проявляется при семейных случаях заболевания. У монозиготных близнецов рассеянный склероз встречается в 4 раза чаще, чем у дизиготных. Имеется связь между риском развития рассеянного склероза и определенными локусами главной системы гистосовместимости на хромосоме 6 (HLA-системы), обусловливающими своеобразие иммунного ответа у данного индивидуума. Первоначальные исследования косвенными методами выявили связь с локусами A3 и В7 из первого класса. Более сильная ассоциация отмечена с набором аллелей по локусу HLA второго класса, который наследуется сцепленно. Этот набор получил название «гаплотип DR2» (или Dw2). Исследования с использованием методов прямого генотипирования позволили уточнить его аллельный состав, который в настоящее время описан как DRBl'1501, DQAl'0102, DQB1*0602. Помимо ассоциаций с генами HLA-системы, исследуются возможные связи риска развития рассеянного склероза с генами цитокинов, белков миелина, неспецифических ферментов, Т-клеточных рецепторов, иммуноглобулинов и др.
Вероятнее всего, рассеянный склероз - мультигенное заболевание, для развития которого необходима комбинация определенных аллелей по нескольким генам. Под воздействием внешних факторов эта наследственная предрасположенность реализуется как хронический демиелинизирующий процесс, активность и своеобразие клинических проявлений которого также зависят от индивидуального набора внешних и генетических факторов. Эта гипотеза была подтверждена при проведении геномного скрининга в нескольких странах, которые не показали ни на одной из хромосом присутствия главной области, сцепленной с заболеванием в разных популяциях. Более того, полный геномный по-
иск в различных этнических группах не дал совпадающих результатов, что может указывать на возможность генетической гетерогенности заболевания в разных популяциях. Ряд генетических маркеров связан не столько с риском развития рассеянного склероза, сколько с особенностями его патогенеза и клинического течения, восприимчивости к определенному виду лечения.
Патогенез. Большое значение в патогенезе рассеянного склероза имеет состояние иммунной системы. Об этом свидетельствуют инфильтраты, состоящие из иммунокомпетентных клеток, в свежей бляшке; связь с генетическими факторами, контролирующими иммунную систему; разнообразные изменения показателей иммунологических реакций крови и цереброспинальной жидкости; способность иммуносупрессоров подавлять обострение заболевания и, наконец, антитела и клоны клеток, специфичные к антигенам мозга, среди которых наиболее энцефалитогенным является основной белок миелина. Локально активируется небольшая группа клеток, которые вырабатывают хемокины и цитокины, вызывают повышение адгезии и проницаемости гематоэнцефалического барьера, что приводит к проникновению в ткань мозга большого количества клеток крови и развитию воспалительной реакции.
Активированные лимфоциты могут проникать через гематоэнцефалический барьер, что является важной составной частью пускового механизма аутоиммунных реакций в ЦНС. Трансмиграция клеток иммунной системы через гематоэнцефалический барьер - сложный процесс, в который вовлечено множество поверхностных молекул сосудистого эпителия и лимфоцитов, а также многие секретируемые белки.
В последующем происходит срыв толерантности к антигенам миелина, и в патологический процесс включаются различные клеточные и в меньшей степени гуморальные аутоиммунные реакции. Аутоиммунные реакции на основной белок миелина и другие антигены нарастают лавинообразно. Ведущее значение в запуске и поддержании иммунопатологического процесса имеют антигенпредставляющие клетки: микроглия, астроциты и эндотелий сосудов мозга, дендритные клетки, - способные привлекать циркулирующие лимфоциты в ткань и активировать их. Многие клетки глии, как и клетки крови, способны вырабатывать активационные цитокины, стимулирующие воспалительные и аутоиммунные реакции. Среди активационных цитокинов основное значение имеют гамма-интерферон, фактор некроза опухолей альфа, интерлейкины 1, 2 и 6 (ИЛ-1, ИЛ-2, ИЛ-6), способные усиливать экспрессию молекул
адгезии и стимулировать представление антигена лимфоцитам. Повышение продукции цитокинов может происходить под воздействием различных внешних и внутренних факторов, что реактивирует патологический процесс. Непосредственно разрушение миелина может происходить различными способами: активированными клетками, цитокинами, антителами. Возможны переключение иммунных реакций с внешних антигенов на антигены мозга (механизмы молекулярной мимикрии), развитие реакции на суперантигены и поликлональная стимуляция иммунитета при недостаточности механизмов контроля за аутоиммунными реакциями.
Не исключена возможность прямого цитопатического влияния вирусов, цитокинов, продуктов распада миелина и других токсичных веществ на олигодендроциты (миелинсинтезирующие клетки). Большое значение в патогенезе рассеянного склероза имеют особенности обмена в ткани мозга, изменения реологических свойств крови, нарушения обмена микроэлементов, жирных кислот, аминокислот и другие факторы. Нервные волокна подвергаются необратимым дегенеративным изменениям. Цитокины, продукты перекисного окисления и другие вещества могут повреждать нервные волокна уже в ранних стадиях заболевания. Недавние исследования показали, что воспалительные и нейродегенеративные изменения можно выявить не только в периваскулярных очагах, но и в неизмененной на первый взгляд ткани мозга. В связи с этим стали использовать термин «кажущееся нормальным белое вещество».
Длительный аутоиммунный процесс приводит к истощению иммунной системы с развитием вторичного иммунодефицита и снижению гормональной активности коры надпочечников.
Патоморфология. Морфологически патологический процесс при рассеянном склерозе проявляется многочисленными очаговыми изменениями в головном и спинном мозге (рис. 12.1). Наиболее частая локализация очагов (или бляшек) - перивентрикулярное белое вещество, боковые и задние канатики шейной и грудной части спинного мозга, мозжечок и ствол мозга. Свежая бляшка сопровождается периваскулярной инфильтрацией ткани мозга лимфоидными элементами крови, большинство которых составляют Т-клетки, а также выраженным локальным отеком, приводящим в ранних стадиях к преходящему блоку проведения нервного импульса по пораженному волокну. Кроме того, в бляшках в разных количествах выявлены иммуноглобулины, компоненты системы комплемента (включая мембраноатакующий комп-
лекс), провоспалительные цитокины, хемокины и другие иммунорегуляторные протеины.
Разрушение миелина и последующая дегенерация аксона становятся причинами стойкого блока проведения нервного импульса. В старой, неактивной бляшке рассеянного склероза отмечаются прежде всего реактивная пролиферация астроцитов (астроглиоз) и уменьшение содержания олигодендроцитов. В некоторых случаях по краям старой бляшки могут наблюдаться новые зоны отека и периваскулярной инфильтрации, что указывает на возможность роста старых очагов.
Электронно-микроскопическое и гистохимическое исследование очагов демиелинизации и «кажущегося нормальным» белого вещества у больных рассеянным склерозом позволило выделить различные типы очагового поражения мозга, которые определяются участием клеточных и гуморальных (антителозависимых) механизмов в разрушении ткани, выраженностью воспалительных реакций, активностью демиелинизации и ремиелинизации, степенью и первичностью повреждения олигодендроцитов и аксонов, т.е. выраженностью нейродегенеративных изменений. Гетерогенность демиелинизирующего процесса может быть обусловлена в первую очередь генетическими
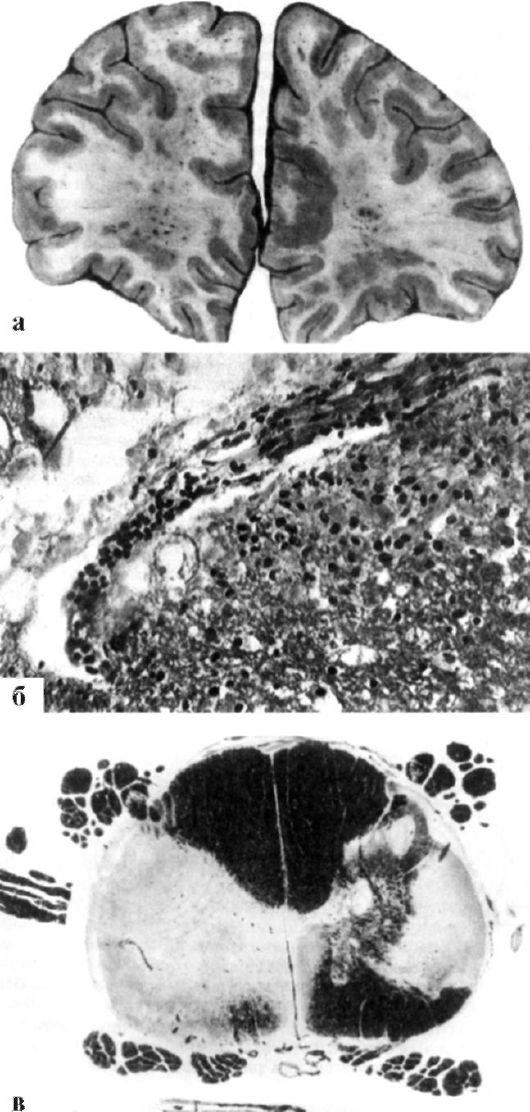 Рис. 12.1. Головной и спинной мозг при рассеянном склерозе. а - макропрепарат: лобные доли содержат бляшки в семиовальном центре и расширенные кровеносные сосуды; б - микропрепарат: клеточная инфильтрация демиелинизированной области; кровонаполнение сосуда с муфтой лимфоцитов и эозинофилов; в - очаги демиелинизации в спинном мозге
Рис. 12.1. Головной и спинной мозг при рассеянном склерозе. а - макропрепарат: лобные доли содержат бляшки в семиовальном центре и расширенные кровеносные сосуды; б - микропрепарат: клеточная инфильтрация демиелинизированной области; кровонаполнение сосуда с муфтой лимфоцитов и эозинофилов; в - очаги демиелинизации в спинном мозге
факторами, особенностями иммунорегуляции, многообразием энцефалитогенных пептидов, инициирующих иммунопатологические реакции при рассеянном склерозе, а также индивидуальными особенностями метаболизма.
Клинические проявления. В типичных случаях первые клинические симптомы рассеянного склероза появляются у лиц молодого возраста (от 18 до 45 лет), хотя в последнее время все чаще описывают дебют заболевания как у детей, так и у лиц старше 50 лет. Первыми симптомами заболевания часто бывают ретробульбарные невриты (рис. 12.2), проявляющиеся снижением остроты зрения, скотомы, ощущением нечеткости изображения, пелены перед глазами, преходящей слепотой на один или оба глаза (при двустороннем процессе).
Заболевание может начинаться с глазодвигательных расстройств (диплопия, косоглазие, межъядерная офтальмоплегия, вертикальный нистагм), неврита лицевого нерва, головокружения, пирамидных симптомов (центральный моно-, гемиили парапарез с высокими сухожильными и периостальными рефлексами, клонусами стоп, патологическими пирамидными рефлексами, исчезновением брюшных кожных рефлексов), мозжечковых нарушений (пошатывание при ходьбе, статическая и динамическая атаксия, интенционное дрожание, горизонтальный нистагм), расстройств поверхностной (гип-, диз- и парестезии) или глубокой чувствительности (сенситивная атаксия, сенситивный парез, гипотония). Наиболее ранними симптомами поражения проводящих путей могут быть повышенная истощаемость и исчезновение брюшных
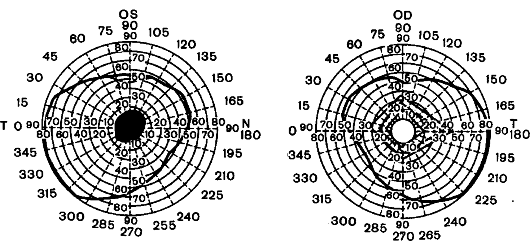 Рис. 12.2. Поля зрения при левостороннем ретробульбарном неврите. Центральная абсолютная скотома в поле зрения левого глаза
Рис. 12.2. Поля зрения при левостороннем ретробульбарном неврите. Центральная абсолютная скотома в поле зрения левого глаза
рефлексов, снижение вибрационной чувствительности, асимметрия сухожильных рефлексов. Значительно реже первыми признаками болезни становятся невротические расстройства, нарушения функций тазовых органов (задержка мочеиспускания, императивные позывы).
В аналитических ретроспективных исследованиях установлено, что дебют рассеянного склероза с ретробульбарного неврита и чувствительных расстройств и длительная первая ремиссия указывают на более благоприятное течение заболевания, а появление признаков поражения пирамидного тракта или путей мозжечка и короткая первая ремиссия (первично-прогредиентное течение, т.е. отсутствие ремиссий в целом) прогностически неблагоприятны.
Прогрессирование рассеянного склероза сопровождается поражением других отделов ЦНС и возникновением новых симптомов. Уже в начальных стадиях отмечается повышенная утомляемость (синдром «хронической усталости»). В более поздних стадиях наблюдаются эмоциональная неустойчивость, эйфория или депрессия, раздражительность, вялость, апатия, нарушения памяти и снижение интеллекта различной степени вплоть до деменции. Когнитивные нарушения выявляются уже в ранних стадиях заболевания и нарастают по мере прогрессирования патологического процесса. Эпилептические припадки встречаются редко, у некоторых больных могут быть пароксизмальные изменения тонуса, невралгические боли и другие пароксизмальные нарушения чувствительности. Наиболее ярким проявлением сенсорных пароксизмов при рассеянном склерозе служат простреливающие боли по типу синдрома Лермитта, который заключается в приступах интенсивной боли, ощущении покалывания, напряжении, «прохождении тока» по ходу позвоночника, чаще при разгибании шеи. Предполагаемая причина - очаг демиелинизации в шейном отделе спинного мозга с выраженным отеком и раздражением проходящих через него чувствительных волокон.
В большинстве случаев у больных имеются симптомы поражения и головного, и спинного мозга (цереброспинальная форма). В некоторых случаях в клинической картине преобладают симптомы поражения спинного мозга (спинальная форма) или мозжечка (мозжечковая или гиперкинетическая форма). В последнем случае интенционное дрожание может быть настолько выраженным, что достигает степени гиперкинеза и делает невозможным любое целенаправленное движение. Возникают дисметрия, адиадохокинез, скандированная речь, выраженная атаксия. У некоторых больных рассеянным склерозом, чаще у длительно болеющих, выявляются симптомы поражения ПНС, как правило, по типу полинейропатии.
Ряд симптомокомплексов отражает особенности клинического проявления демиелинизирующего поражения при рассеянном склерозе. Наиболее распространены синдромы «клинической диссоциации или расщепления», «непостоянства клинических симптомов» и «горячей ванны». Синдром «клинического расщепления» заключается в несоответствии между симптомами поражения различных структур, что отражает сочетание у одного больного признаков поражения разных проводящих путей или разных уровней поражения.
Например, признаки центрального пареза - высокие сухожильные рефлексы, патологические стопные знаки, наряду с выраженной мышечной гипотонией вследствие мозжечковой дисфункции, наблюдаются при одновременном поражении пирамидного пути и проводников мозжечка. Одним из наиболее известных и хорошо изученных синдромов при рассеянном склерозе является синдром «горячей ванны»: при повышении температуры окружающей среды состояние больных ухудшается (нарастают парез, атаксия). Усугубление симптомов, как правило, преходящее, что является более специфичным для рассеянного склероза признаком, чем само ухудшение состояния. Этот синдром неспецифичен и отражает повышенную восприимчивость нервного волокна, лишенного миелиновой оболочки («изоляции»), к внешним воздействиям. Существует клинический феномен колебания выраженности симптомов рассеянного склероза не только на протяжении нескольких месяцев или лет, но и в течение одних суток, что связано с высокой чувствительностью демиелинизированного волокна к изменениям гомеостаза.
В целом клинические проявления рассеянного склероза можно разделить на 7 основных групп:
• поражение пирамидной системы с геми-, пара- и тетрапарезами с соответствующим повышением сухожильных рефлексов и патологическими пирамидными симптомами;
• поражение мозжечка и его связей с развитием статической и динамической атаксии, мышечной гипотонии;
• нарушения чувствительности по проводниковому типу, сначала глубокой, с развитием сенситивной атаксии и сенситивных парезов, а затем болевой и температурной;
• поражение ствола мозга с нарушениями черепной иннервации, чаще всего с развитием глазодвигательных симптомов, поражением лицевого нерва (периферический парез мышц лица);
• невриты зрительного нерва (в том числе ретробульбарные невриты) со снижением остроты зрения и появлением скотом;
• нарушения функции тазовых органов, чаще по типу императивных позывов, задержек мочеиспускания, в последующем - недержания мочи, иногда сочетание задержек и эпизодов недержания мочи;
• нейропсихологические изменения: снижение памяти, скорости сенсомоторных реакций, способности концентрировать внимание, эйфория или депрессия, синдром хронической усталости.
Течение рассеянного склероза очень индивидуально, трудно предсказать длительность ремиссий и частоту обострений, степень восстановления функций и скорость прогрессирования необратимых нарушений. Помимо классического ремиттирующего заболевания, в большинстве случаев переходящего во вторичное прогрессирование (с обострениями или без них), у 10-15% больных наблюдается первично-прогрессирующий рассеянный склероз. В 10% случаев заболевание может иметь очень мягкое течение с минимальным остаточным неврологическим дефицитом после многих лет заболевания и, наоборот, быстро прогрессирующий злокачественный тип течения (стволовая форма рассеянного склероза, или болезнь Марбурга). При обострении (экзацербации или атаке) заболевания появляются новые неврологические нарушения или резко усиливаются уже имеющиеся. Это не связано с возможным параллельным инфекционным заболеванием, лихорадкой и другими причинами, которые могут вызвать декомпенсацию имевшихся нарушений. Длительность обострения может варьировать от нескольких дней до нескольких недель, но не менее 24 ч. Клиническая манифестация («дебют») рассеянного склероза является, по сути, его первым обострением. Истинные обострения опытный невролог должен отличать от псевдообострений, связанных с кратковременной и нетяжелой декомпенсацией уже имеющихся нарушений, например на фоне депрессии или повышения температуры тела. Возможны субклинические обострения, когда новые очаги образуются в клинически немых зонах и выявляются только при МРТ.
Различные изменения гомеостаза могут быть триггерами, провоцирующими обострение заболевания. Часто в этой роли выступают инфекции и психогенные стрессы, реже - травмы, переохлаждения и физическое перенапряжение, операции (особенно под наркозом). Многолетние динамические наблюдения показали, что беременность и роды не влияют на кратковременный и долгосрочный прогноз при рассеянном склерозе, могут индуцировать развитие стойкой длительной ремиссии. Искусственное прерывание беременности, особенно в поздних сроках, довольно часто является причиной тяжелых обострений рассеянного склероза. Ведение этих женщин в послеродовом периоде требует повы-
шенного внимания с целью предупреждения (минимизации) стрессового фактора и бактериальной инфекции, которые могут способствовать развитию обострения рассеянного склероза.
Диагностика и дифференциальная диагностика. Клинический полиморфизм рассеянного склероза, обусловленный индивидуальным набором внешних и генетических факторов патогенеза, обусловливает трудности ранней диагностики. Основой диагностики является специфическая клиническая картина заболевания, подтвержденная данными параклинических методов обследования. Специфическим клиническим проявлением рассеянного склероза служат признаки хронического, сначала, как правило, волнообразного, патологического процесса с накапливающимися симптомами поражения нескольких проводящих систем ЦНС, т.е. «диссеминация в месте и времени», при этом обязательно исключение всех других причин, т.е. сосудистых, инфекционных, неопластических и других заболеваний ЦНС, которые могут вызывать сходное хроническое многоочаговое поражение белого вещества головного мозга. Затруднения в диагностике рассеянного склероза могут возникнуть в ранних стадиях развития заболевания, когда нет клинических подтверждений диссеминации процесса в месте или во времени. В данном случае основную дополнительную информацию предоставляют данные МРТ и результаты исследования вызванных потенциалов головного мозга (чаще зрительных, реже соматосенсорных и слуховых), позволяющие выявить субклинические очаги поражения. Более сложна диагностика при атипичном, особенно злокачественном, течении заболевания или при первично-прогрессирующем течении с одновременным поражением других органов и систем, когда на первый план выходят вопросы комплексной клинико-инструментальной дифференциальной диагностики.
В крови часто обнаруживаются неспецифическая лейкопения, нейтропения, а в стадии обострения - лимфоцитоз. Наблюдаются увеличение агрегации тромбоцитов, тенденция к повышению содержания фибриногена и одновременно - активация фибринолиза. При обострении и прогрессирующем течении заболевания выявлено нарушение функции коры надпочечников, проявляющееся резким снижением экскреции с мочой С21-кортикостероидов (особенно глюкокортикоидной фракции), а также снижением уровня кортизола в плазме крови. Во время ремиссии содержание стероидных гормонов в моче и кортизола в плазме часто возвращается к норме.
При клинических проявлениях только одного очага с характерным волнообразным течением процесса важна инструментальная верифика-
ция нескольких очагов. В 90% случаев многоочаговое поражение подтверждается при МРТ головного мозга (рис. 12.3), когда регистрируется очаговое повышение интенсивности сигнала на Т2-взвешенных изображениях. Иногда при тяжелых длительных процессах очаги могут сливаться в зоны гиперинтенсивности, выявляется вторичная атрофия вещества головного мозга.
Высокоинформативна МРТ с использованием контрастных веществ, как правило, на основе гадолиния (Gd-DTPA). Парамагнитный контраст усиливает сигнал от зоны воспаления и отека (на T1-взвешенных изображениях). Этот метод позволяет выявлять свежие очаги с повышением проницаемости гематоэнцефалического барьера, т.е. делает возможным мониторинг активности патологического процесса. Сравнения с данными патоморфологических исследований позволили сде-
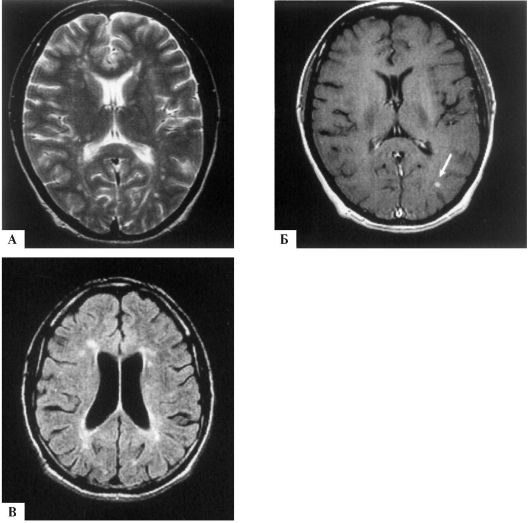 Рис. 12.3. МР-томограммы головного мозга при РС: А - типичные очаги овальной формы на Т2-взвешенном изображении; Б - один из очагов накапливает парамагнитный контраст на T1-взвешенном изображении (стрелка); В - сочетание перивентикулярных очагов с нейродегенеративными изменениями в виде расширения желудочков мозга
Рис. 12.3. МР-томограммы головного мозга при РС: А - типичные очаги овальной формы на Т2-взвешенном изображении; Б - один из очагов накапливает парамагнитный контраст на T1-взвешенном изображении (стрелка); В - сочетание перивентикулярных очагов с нейродегенеративными изменениями в виде расширения желудочков мозга
лать заключение, что накопление контраста происходит исключительно в свежих очагах демиелинизации с выраженными воспалительными изменениями в виде отека и клеточной инфильтрации.
Подтверждению диагноза на ранних стадиях развития патологического процесса или в сомнительных случаях служат критерии постановки диагноза РС. Основная задача этих критериев - обосновать диссеминацию в месте и во времени. Критерий разделения в локализации и во времени образования очагов («диссеминация в месте и времени») является основным при установлении клинически достоверного диагноза PC. Во многих случаях клинически не удается полностью выявить эти критерии: имеются симптомы, связанные только с одним очагом, и ремиттирующее течение заболевания или клинические признаки поражения двух одновременно возникших очагов в белом веществе и т.д. Для учета таких случаев введено понятие вероятного рассеянного склероза, когда диагноз может быть подтвержден или опровергнут после дополнительного обследования.
Выявление многоочагового поражения белого вещества мозга на МРТ не является основанием для диагностики рассеянного склероза: такие изменения могут наблюдаться при различных неврологических заболеваниях. Этот метод можно использовать как дополнительный, т.е. для подтверждения клинического предположения о диагнозе. Определенное диагностическое значение имеет выявление повышенного содержания IgG в цереброспинальной жидкости вследствие стимуляции гуморального иммунитета, что указывает на определенные нарушения иммунорегуляции в мозге. При изоэлектрическом фокусировании эти IgG формируют олигоклональные группы, поэтому они получили название «олигоклональные иммуноглобулины».
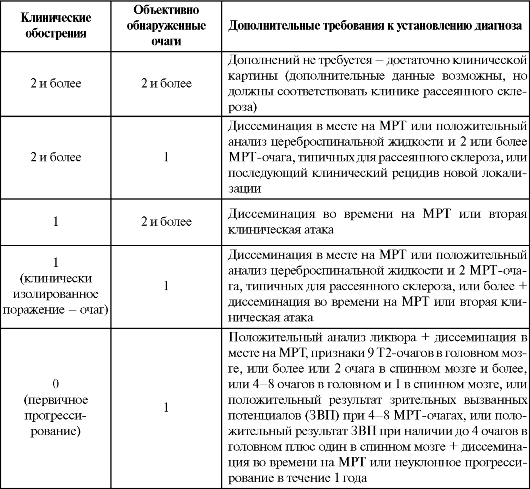
С 2001 г. для установления диагноза рассеянного склероза используют диагностические критерии МакДональда (табл. 12.1) с учетом результатов МРТ головного и спинного мозга как доказательства диссеминации патологического процесса в месте и во времени, которых достаточно для достоверной диагностики рассеянного склероза.
Косвенное значение имеют изменения показателей иммунных реакций периферической крови, свидетельствующие о дисбалансе в иммунной системе: уменьшение содержания Т-клеток, особенно супрессорного фенотипа, снижение функциональной активности специфических и неспецифических супрессоров, относительное увеличение содержания В-клеток и признаки их поликлональной активации in vivo, повышенные уровни продукции активационных цитокинов и антител к
Таблица 12.1. Диагностические критерии рассеянного склероза (МакДональд, 2001)
 ОБМ.
Эти изменения позволяют определить активность патологического процесса,
но не имеют самостоятельной диагностической ценности, так как
значительно варьируют у каждого больного.
ОБМ.
Эти изменения позволяют определить активность патологического процесса,
но не имеют самостоятельной диагностической ценности, так как
значительно варьируют у каждого больного.
Дифференцировать рассеянный склероз в начальных стадиях следует от невротических расстройств, вегетативно-сосудистой дисфункции, лабиринтитом или синдрома Меньера, оптического неврита различной этиологии, от поражений нервной системы при системных метаболических нарушениях, от васкулитов различной этиологии, в том числе при системных заболеваниях соединительной ткани, опухолей головного и спинного мозга, энцефалитов различной этиологии, острого рассеянного энцефаломиелита, нейродегенеративных заболеваний.
При преимущественно спинальных поражениях с прогрессирующим нижним парапарезом необходимо исключить опухоль спинного мозга или процессы, приводящие к его компрессии. В диагностически сложных случаях используют люмбальную пункцию (выявление блока субарахноидального пространства и резкое повышение содержания белка при опухолях спинного мозга), контрастные методы исследования (миелография) и МРТ. Сложна дифференциальная диагностика рассеянного склероза и дегенеративных заболеваний нервной системы. Так, гиперкинетическая форма рассеянного склероза может быть клинически сходной с дрожательной формой гепатоцеребральной дистрофии, мозжечковыми атаксиями. При выраженном спастическом нижнем парапарезе следует исключать болезнь Штрюмпеля, для которой не характерны признаки поражения других отделов нервной системы. Окончательное суждение о диагнозе во многих случаях можно сделать только на основе динамического наблюдения за больными.
Лечение. В связи с тем, что этиология заболевания неясна, этиотропного лечения рассеянного склероза в настоящее время нет. Принципы лечения больных основываются на индивидуальном подходе с учетом особенностей течения и активности иммунопатологического процесса, выраженности отдельных неврологических симптомов. Препарат назначают строго индивидуально на основе и под контролем иммунного статуса и с учетом всех показаний и противопоказаний. В последние годы появилась группа новых препаратов, способных при длительном использовании уменьшать частоту обострении и замедлять прогрессирование заболевания, т.е. оказывающих профилактическое действие. Большое значение имеют адекватно подобранное симптоматическое лечение, медико-социальная реабилитация больных. Симптоматическая терапия направлена на поддержание и коррекцию функций поврежденной системы, компенсацию нарушений, повышение качества жизни больных. Определенное значение имеет группа метаболических препаратов, способствующих регенерации поврежденной ткани и усилению собственных механизмов контроля за патологическим процессом. Все большее внимание сейчас уделяется методам немедикаментозного лечения и реабилитации больных, предупреждению осложнений.
Патогенетическая терапия состоит из лечения обострений и периодов резкого нарастания активности заболевания и предупреждения обострений и прогрессирования инвалидности. При обострении заболевания препаратами выбора остаются кортикостероиды и в меньшей степени препараты адренокортикотропного гормона (АКТГ), оказыва-
ющие противовоспалительное и иммуносупрессивное действие. Назначение этих препаратов призвано стабилизировать состояние гематоэнцефалического барьера, ограничить воспалительные и аутоиммунные процессы и разрушение миелина, т.е. уменьшить тяжесть и длительность обострения и предупредить развитие стойких неврологических последствий. Кортикостероиды практически не влияют на течение патологического процесса в дальнейшем. Следует подчеркнуть, что длительный прием кортикостероидов внутрь дает множество побочных эффектов, среди которых подавление кроветворения, трофические, эндокринные и гастроинтестинальные осложнения, инфекции и др.
Наибольшее распространение в настоящее время получили короткие курсы растворимых кортикостероидов в больших дозах, которые вводят внутривенно во время острой стадии активации патологического процесса. При такой схеме введения существенно меньше побочных эффектов, чем при длительных курсах приема преднизолона внутрь.
Чаще всего используют метилпреднизолон (метипред, солюмедрол, урбазон); метильная группа улучшает связывание с соответствующими рецепторами и обеспечивает более быстрое и активное воздействие на клетки-мишени. Метилпреднизолон снижает проницаемость сосудистой стенки, нормализует функцию гематоэнцефалического барьера, уменьшает отек, оказывает небольшое десенсибилизирующее и иммуносупрессивное действие. Препарат способен проникать через гематоэнцефалический барьер, поэтому оказывает как общее, так и местное противовоспалительное и противоотечное действие. Назначается по 1000 мг в день (на 400-500 мл изотонического раствора хлорида натрия) в течение 3-7 дней в зависимости от тяжести обострения и выраженности иммунологических признаков активации заболевания. Впоследствии возможно проведение короткого поддерживающего курса преднизолона в таблетках, начиная с 10-20 мг через день и снижая дозу по 5 мг. Ввиду возможности анафилактических реакций на внутривенное введение метилпреднизолона пульс-терапию проводят в условиях стационара, под наблюдением врача или медсестры. Развитие стероидзависимых остеопороза, синдрома Иценко-Кушинга, язвенной болезни желудка, реактивации герпетической и туберкулезной инфекции, колебаний уровня глюкозы крови и других осложнений при таком режиме введения встречается крайне редко, но все равно их следует мониторировать. Возможны периферические отеки, лимфопения, моноцитопения, активизация грибковых заболеваний, диспепсия, боли в животе, расстройства сна. Противопоказаниями к применению являются яз-
венная болезнь желудка и двенадцатиперстной кишки, сепсис и побочное действие метилпреднизолона в анамнезе.
Вместо метилпреднизолона можно использовать дексаметазон, дающий сходные клинические, иммунологические и побочные эффекты. Его назначают по 8 мг 2 раза в сутки, снижая дозу на 2 мг каждые 2 дня. Основные проблемы при использовании дексаметазона связаны с более выраженным, чем у метилпреднизолона, угнетением собственной продукции кортикостероидов.
При злокачественном течении заболевания возможно комбинированное использование кортикостероидов с плазмаферезом или с цитостатиками, но последнее используется редко, так как повышается риск суммирования побочных эффектов.
Стимуляторы продукции эндогенных кортикостероидов, а именно АКТГ и его синтетические аналоги (синактен-депо), изредка используют при нетяжелых обострениях ремиттирующей формы рассеянного склероза и нарастании активности заболевания при прогредиентных формах. Основными преимуществами АКТГ являются небольшое количество побочных эффектов, поддержание эндогенной продукции стероидов. В то же время у некоторых больных могут наблюдаться выраженные периферические отеки, изменения АД, гипертрихоз.
В патогенезе обострения при рассеянном склерозе существенное значение имеют неспецифические реакции, свойственные любому воспалительному процессу. В этой стадии оправдано использование ангиопротекторов и антиагрегантов, препаратов, снижающих проницаемость гематоэнцефалического барьера, антиоксидантов. Рекомендуются курсы введения пентоксифиллина (трентала, агапурина, вазонита), циннаризина, дицинона по 250 мг 3 раза в день, винпоцетина (кавинтона) по 5-10 мг 2-3 раза в день или комбинированных препаратов (фезам по 1 таблетке 3 раза в день в течение 30-60 дней). Для потенцирования антиагрегантного и ангиопротекторного эффекта возможно использование антиоксидантов (альфа-токоферол, препараты альфа-липоевой кислоты). Метаболические препараты (актовегин, церебролизин, карнитина хлорид, кортексин, глицин и другие), аминокислоты (глутаминовая, метионин), витамины группы В, Е, производные альфа-липоевой кислоты (тиоктацид, эспалипон, берлитион) способствуют более ранней компенсации нарушенных неврологических функций.
Можно не только вводить иммуноактивные препараты, но и выводить патологические агенты из крови с помощью плазмафереза. При рассеянном склерозе модулирующее действие плазмафереза может
быть связано с выведением продуктов распада миелина, антигенов, антител, иммуноактивных веществ. Ввиду возможности аллергической реакции на введение плазмы, приводящей к обострению рассеянного склероза, чаще используют замороженную плазму или белковые кровезаменители. Следует учитывать, что некоторые компоненты плазмы могут выполнять компенсаторную функцию и их удаление нежелательно, поэтому плазмаферез рекомендуется использовать только при выраженном обострении или прогрессировании заболевания. В последнем случае возможно одновременное введение кортикостероидов. Плазмаферез проводят 1 раз в неделю с заменой плазмы в количестве 5% массы тела, всего 3-5 сеансов. Вследствие выведения из крови иммуноглобулинов иногда дополняют процедуры внутримышечным введением сывороточного иммуноглобулина.
При нетяжелом обострении в ранних стадиях рассеянного склероза можно использовать только неспецифические метаболические и вазоактивные препараты, симптоматическое лечение. В таких случаях при обострении для выведения патогенных веществ возможно внутривенное капельное введение гемодеза (по 200-400 мл в день в течение 3- 5 дней). В данном случае иногда наблюдается быстрый благоприятный клинический эффект, что предполагает и возможное антивоспалительное влияние. В то же время для более быстрого выхода из обострения с минимальными остаточными нарушениями надо реагировать своевременно и адекватно. При признаках поражения ствола мозга, мозолистого тела, выраженных двигательных или координаторных нарушениях пульс-дозы кортикостероидов абсолютно обязательны.
При медленно прогрессирующем течении заболевания, например при вторично прогрессирующем, назначение сильных иммуносупрессоров нецелесообразно. В этих случаях более обосновано использование метаболических препаратов, комплексного симптоматического и реабилитационного лечения. При активном вторично прогрессирующем течении в России, всех странах Европы и Северной Америки разрешено использование цитостика митоксантрона по 5 мг/м2 площади тела (как правило, от 10 до 20 мг) внутривенно 1 раз в 3 мес. Потенциальная возможность развития кардиотоксического эффекта ограничивает использование этого препарата 12 курсами (4 раза в год в течение 3 лет). При злокачественных, неуклонно прогрессирующих вариантах течения рассеянного склероза применяют сильные иммуносупрессоры. Среди препаратов цитостатического и антипролиферативного действия наиболее активно изучались азатиоприн, циклофосфамид,
циклоспорин А, кладрибин, метотрексат, а также общее облучение лимфоцитов. Как правило, эти препараты назначают при неуклонно прогрессирующем течении рассеянного склероза и неэффективности повторных курсов кортикостероидов. Методом выбора при злокачественном течении заболевания остается пересадка аутологичных клеток костного мозга, которая осуществляется при совместном ведении пациента неврологами и гематологами по специальном протоколу. При этом после тотальной иммуносупрессии сохраненная клетка костного мозга способствует пролиферации нового пула иммунокомпетентных клеток, не сенсибилизированных к антигенам мозга. При проведении этого метода лечения необходимо жестко соблюдать все условия аутотрансплантации, учитывать все показания и противопоказания, возможные побочные эффекты вплоть до летальных случаев из-за тотальной иммуносупрессии.
При вторичном иммунодефиците в подострой стадии выхода из обострения могут быть эффективны иммуномодуляторы преимущественно хелперного действия. Из них наиболее известны препараты тимуса (Т-активин, тималин, тимопентин и др.). Т-активин назначают по 1 мл подкожно 1 раз в день 5 дней подряд, затем после 7-дневного перерыва подряд 2 инъекции подкожно по 1 мл в день.
Последнее десятилетие ознаменовалось резким повышением возможностей неврологов в области патогенетического лечения рассеянного склероза, что впервые позволило в определенной степени контролировать активность патологического процесса. Основным методом предупреждения обострений и увеличения длительности ремиссии сейчас является длительное использование иммуномодуляторов и иммуносупрессоров, снижающих активность воспалительного и аутоиммунного процесса. Результаты нескольких хорошо организованных больших рандомизированных клинических испытаний с использованием двойного слепого метода и плацебо, т.е. с выполнением всех современных требований доказательной медицины, показали, что регулярное проведение такого «профилактического» лечения безопасно, позволяет достоверно уменьшить частоту и тяжесть обострений (в среднем на 25-33% по сравнению с плацебо), а также достоверно замедлить прогрессирование инвалидности, хотя пока невозможно полностью остановить накопление необратимых неврологических нарушений. Позитивный эффект стабилен на протяжении по крайней мере 5-8 лет наблюдения. Клиническое улучшение подтверждается позитивными изменениями на МРТ в виде уменьшения объема очагового поражения мозга, умень-
шения количества активных и новых очагов. Также отмечена позитивная динамика клинических и МРТ показателей у больных со вторичнопрогрессирующим рассеянным склерозом с обострениями.
Данный метод длительной терапии получил общее название «препараты, изменяющие течение рассеянного склероза» (ПИТРС, или Disease modifying treatment - DMT). В настоящее время известно уже 4 препарата иммуномодулирующего действия - бетаферон (β-ИФН-1b, по 8 ММЕ или 250 мкг через день подкожно), ребиф (β-ИФН-1a, по 22 или 44 мкг 3 раза в неделю подкожно), авонекс (β-ИФН-1a, по 30 мкг 1 раз в неделю внутримышечно), копаксон (глатирамера ацетат, по 20 мг каждый день подкожно). Проводятся активные исследования других препаратов.
Введение цитокина гамма-интерферона в чистом виде и в составе неочищенных препаратов интерферона, а также использование неспецифических индукторов интерферона приводят к активизации рассеянного склероза, чаще в виде обострения. Это происходит из-за усиления антигенпредставляющей активности макрофагов, общей активации иммунитета. β-ИФН по иммуномодулирующим свойствам являются антагонистами гамма-интерферона и других провоспалительных цитокинов, снижают продукцию активационных цитокинов и активность антигенпредставляющих клеток, стабилизируют состояние гематоэнцефалического барьера. При длительном использовании β-ИФН отмечаются незначительные побочные эффекты в виде местных реакций на внутрикожное введение, лихорадки, депрессии. Выраженность системных побочных эффектов уменьшается при одновременном применении нестероидных противовоспалительных препаратов (например, парацетамола по 600-1000 мг в день). Назначение бетаферона и ребифа следует начинать с 20-25% рекомендуемой дозы с постепенным переходом через 14-28 дней на полную дозу. При использовании некоторых из таких препаратов нужно мониторировать биохимические показатели функции печени.
Копаксон (глатирамера ацетат) - синтетический полимер из четырех аминокислот: L-аланина, L-глутамина, L-лизина и L-тирозина. При регулярном введении препарата индуцируется рост клона специфичных клеток, способных подавлять аутоиммунную реакцию через продукцию противовоспалительных цитокинов. Предполагается, что пептиды, входящие в состав копаксона, вызывают индукцию толерантности, снижение продукции активационных цитокинов. Позитивные клинические эффекты копаксона подтверждены данными МРТ и сох-
раняются длительное время - 5-10 лет. В последнее время большое внимание привлекает потенциальное нейропротективное влияние ПИТРС.
Следует подчеркнуть, что курсы ПИТРС имеют преимущественно профилактическое значение, т.е. не восстанавливают функции, нарушенные в результате предшествующих обострений заболевания. Наиболее эффективно их применение в ранних стадиях рассеянного склероза, при нетяжелом поражении ЦНС. На фоне курса ПИТРС возможны обострения заболевания, при которых также назначаются кортикостероиды в пульс-дозах. В нескольких исследованиях отмечен дозозависимый эффект при использовании препаратов β-ИФН. Возможно, это связано и с частотой введения препарата.
Рассеянный склероз представляет собой не только медицинскую, но и социальную проблему, так как очень велики и прямая стоимость комплексной терапии с реабилитацией, и непрямые потери из-за длительной невозможности участия молодых людей в общественно полезном труде. В связи с этим в большинстве стран мира назначение ПИТРС, несмотря на их высокую стоимость, для определенной группы больных рассеянным склерозом обязательно. Оптимизация подходов к выявлению таких больных, тактике их ведения, корректировке плана лечения - основная задача ближайшего времени. ПИТРС назначают при установлении достоверного диагноза ремиттирующего рассеянного склероза в соответствии с критериями МакДональда, при активном ремиттирующем течении рассеянного склероза (β-ИФН также при вторичном прогрессировании с обострениями или в малых дозах после первого эпизода неврологических нарушений - дебюта рассеянного склероза). При позитивном клиническом эффекте в виде уменьшения частоты обострений и отсутствия резкого усиления тяжести состояния больного (инвалидности) лечение рекомендуется проводить так долго, как его может переносить больной. Исключениями являются беременность, роды и период кормления у женщин, когда ПИТРС противопоказаны, так как не изучено его влияние на плод и ребенка. Хотя в литературе имеются единичные сообщения о наблюдениях поздней отмены ПИТСР при беременности и об отсутствии влияния ПИТСР на плод, систематический анализ не проводился, поэтому препараты в таких случаях назначать нельзя. При развитии непереносимых побочных эффектов препарат следует отменять (для β-ИФН сначала рекомендуется снизить дозу, а при исчезновении побочных реакций вернуться к полной дозе препарата). При отрицательном клиническом результате, т.е. когда частота обострений не уменьшилась, имеется существенное нараста-
ние инвалидизации или переход к быстро прогрессирующему течению рассеянного склероза без обострений, лечение рекомендуется признать неэффективным и используемый препарат отменить.
В настоящее время проводятся клинические испытания метода индукции толерантности к различным антигенам миелина путем приема иммуносупрессоров, модулированию продукции цитокинов, введение больших доз иммуноглобулина внутривенно, методы контроля повышенной адгезии и хемотаксиса клеток. Особую группу составляют препараты пептидной природы с отчетливым регуляторным влиянием как на иммунную, так и на нервную систему, т.е. влияющие на «нейроиммунную сеть». Важная задача - разработка методов нейропротекции, позволяющих предупреждать очаговые и диффузные нейродегенеративные изменения.
Симптоматическая терапия проводится в тесной связи с медико-социальной реабилитацией больных и во многих случаях оказывает большое влияние на состояние больного рассеянным склерозом и на течение заболевания. Важным аспектом симптоматической терапии является снижение патологического мышечного тонуса. Для этого назначают миорелаксанты (тизанидин, баклофен, толперизон), препараты бензодиазепинового ряда (дантролен), иглорефлексотерапию, точечный массаж, применяют методы физической релаксации. При медикаментозной коррекции доза миорелаксантов подбирается индивидуально, постепенно увеличивается с малой до оптимальной, при которой спастичность снижается, но слабость в конечностях не нарастает. Используется локальное введение ботулин-токсина, блокирующего передачу в нервно-мышечных синапсах. Введение препарата в определенную мышцу требует хорошего знания анатомии и правил введения этого препарата. После расслабления мышцы большое значение имеют правильная установка конечности, проведение ЛФК для предупреждения повышения тонуса в других мышечных группах. Эффект одной инъекции длится 3-4 мес, часто необходимы повторные инъекции.
Проводят специальные упражнения по «вытягиванию» или «растягиванию» пораженных конечностей, они не дают побочных эффектов и могут существенно снизить тонус. Для получения клинического результата необходимо держать напряженную мышцу в растянутом состоянии не менее 2-4 мин. После того как мышца растянута, ее надо несколько минут держать в такой позиции для индукции медленного расслабления. Растягивание мышц можно производить с помощью механических и/или пневматических приспособлений. Начинают, как
правило, с мышц бедра в положении больного лежа на спине. Этот метод позволяет предупредить развитие контрактур и используется при лечении артрозов.
При умеренном повышении мышечного тонуса, особенно при спинальных формах рассеянного склероза, эффективны сеансы гипербарической оксигенации (ГБО). В ряде случаев курсы ГБО способствуют уменьшению выраженности нарушений функций тазовых органов. Нарушения функций тазовых органов, включая нарушения половой функции, можно также корректировать с помощью магнитостимуляции. При гиперрефлексии детрузора используют антихолинергические препараты, трициклические антидепрессанты. Большую проблему для больных с нижним парапарезом представляют частые императивные позывы и недержание мочи в дневное и ночное время. В этих случаях препаратом выбора является десмопрессин (аналог вазопрессина), в дозе 20 мкг эффективно снижающий продукцию мочи.
Для лечения гиперактивного мочевого пузыря наиболее часто применяют антихолинергические препараты, например оксибутинин (до 5 мг/сут внутрь или непосредственно в мочевой пузырь) или детрузитол (толтеро- дин-L-тартарат). К негативной стороне действия холинолитических препаратов относится риск развития задержек мочи, что требует проведения УЗИ мочевого пузыря с определением остаточной мочи в процессе лечения. Возможно использование α1-адреноблокаторов (омник) по 0,4 мг в день в течение 2 мес. Важным моментом в лечении расстройств функций тазовых органов является профилактика уроинфекций. В некоторых случаях для полного освобождения пузыря необходима периодическая катетеризация, так как любые нарушения пассажа мочи стимулируют развитие инфекционных заболеваний. Назначают уросептики: 5-НОК или производные нитрофурана (фуразолидон, фуразолин, фурадонин).
Для коррекции дисфункции вегетативной нервной системы применяют вегетотропные средства, при системном головокружении - бетагистин (бетасерк), циннаризин (стугерон), по показаниям - психотропные препараты. У тяжелобольных с гипотрофиями возможно проведение курсов лечения анаболическими стероидами, например ретаболилом.
Важное направление реабилитационного лечения - компенсация двигательных нарушений. Наряду с широким применением лекарственных препаратов, разрабатываются методы коррекции этих нарушений с помощью электро- и магнитостимуляции. Большое значение имеет подбор комплекса ЛФК. Клинический опыт показывает, что максимальное сохранение физической активности и проведение адекватной ЛФК по-
вышают силу паретичных мышц у больных рассеянным склерозом, способствуют выработке нового двигательного стереотипа и компенсации необратимых нарушений. Регулярные физические упражнения (занятия на велоэргометре для ног и рук по индивидуально подобранному графику не менее 30 мин в день) способствуют более быстрому и выраженному восстановлению силы мышц независимо от тяжести клинического состояния больных. В двигательной реабилитации больных активно используют методы, основанные на принципе биологической обратной связи. В создании комплексных индивидульных программ двигательной реабилитации больных рассеянным склерозом хорошо зарекомендовал себя тренировочный комплекс биомеханики движений.
Серьезной проблемой является коррекция нарушений координации и интенционного тремора. Выраженность этих нарушений можно уменьшить, назначая курсы витамина В6, бета-адреноблокаторов, трициклических антидепрессантов. Для купирования выраженного тремора, достигающего степени гиперкинезов, можно использовать карбамазепин (финлепсин, тегретол) с постепенным увеличением дозы с 0,1 до 1,2 г В случаях при умеренных проявлениях атаксии эффективны аминокислоты, в частности глицин. Важно адекватное лечение депрессии и тревожных состояний, для чего используют антидепрессанты и малые дозы нейролептиков. При синдроме хронической усталости, снижении памяти и астенических проявлениях могут быть полезны семакс, сальбутиамин (энерион) и другие препараты, оказывающие тонизирующее действие. Адекватное лечение нейропсихологических и когнитивных нарушений позволяет существенно повысить качество жизни больных.
Профилактика и прогноз. Больные рассеянным склерозом должны избегать инфекций, интоксикаций, переутомления. При появлении признаков общей инфекции необходимо соблюдать постельный режим, принимать десенсибилизирующие средства. Целесообразно ограничение тепловых процедур, противопоказана гиперинсоляция. При рассеянном склерозе рекомендуется сохранять максимальную активность во всех областях жизнедеятельности, если эта активность соответствует возможностям больного и исключает частые переутомления. Социальная изоляция неблагоприятно влияет ни течение заболевания, особенно на частоту его осложнений. Такие особенности методов ведения больных, нейрореабилитация в сочетании с современными методами патогенетического и симптоматического лечения изменили клиническую картину заболевания, и у многих больных отмечается благоприятное течение заболевания с длительными ремиссиями.
12.2. Острый рассеянный энцефаломиелит
Острый рассеянный энцефаломиелит (ОРЭМ) - воспалительное заболевание ЦНС с остро развивающимся диссеминированным демиелинизирующим поражением головного и спинного мозга.
Этиология. Как и при рассеянном склерозе, в основе ОРЭМ лежат аутоиммунные реакции на различные антигены миелина. Эти реакции развиваются у предрасположенных лиц, но в отличие от рассеянного склероза ограничиваются одним обострением, т.е. не имеют хронического течения («диссеминации во времени»). Триггером аутоиммунных реакций, по-видимому, является какой-либо известный вирус или вирус с пока еще неизвестными свойствами. Нельзя исключить и сосудисто-воспалительные, токсические факторы, под воздействием которых может развиваться вторичная демиелинизация. В целом ОРЭМ нельзя ни патоморфологически, ни клинически отличить от дебюта рассеянного склероза. Некоторые случаи ОРЭМ очень близки к поствакцинальным и постинфекционным энцефалитам.
Патоморфология. Основу патологического процесса при ОРЭМ составляют множественные периваскулярные очаги демиелинизации, очаговая сосудисто-воспалительная реакция с участием микроглии. Строение очагов такое же, как и при рассеянном склерозе, но воспалительные изменения и отек выражены больше, чем реактивная пролиферация астроглии. В меньшей степени поражаются олигодендроциты. Локализация процесса разнообразна - белое вещество больших полушарий, мозгового ствола, спинного мозга. Могут выявляться изменения в корешках и периферических нервах по типу периаксиального демиелинизирующего процесса.
Клинические проявления. Заболевание начинается остро, часто имитируя острую респираторную инфекцию. В некоторых случаях наблюдается подострое развитие в течение нескольких недель. Появляются головная боль, недомогание, повышение температуры (иногда значительное), озноб, психомоторное возбуждение, парестезии. Могут быть выражены общемозговые симптомы. Обычно имеются умеренные менингеальные знаки. На этом фоне через 2-3 дня появляются разнообразные очаговые симптомы. На МРТ выявляются множественные, обширные, часто сливные очаговые изменения без смещения срединных структур мозга (рис. 12.4).
В некоторых случаях доминируют симптомы поражения того или иного отдела ЦНС. Спинальная симптоматика проявляется пара- и тетрапарезами, обычно центральными, но иногда наблюдаются явления периферического пареза. Часто развивается гемипарез, возникают рас-
стройства чувствительности по проводниковому типу и нарушения функций тазовых органов. Возможен синдром Броун-Секара. Преимущественно стволовая локализация проявляется поражением черепных нервов (IX, X, XII пары), нередко отводящего и лицевого нервов. В процесс вовлекаются и зрительные нервы, появляются симптомы ретробульбарного неврита. Возникают мозжечковые расстройства в виде нистагма, статической и динамической атаксии.
В цереброспинальной жидкости при ОРЭМ обнаруживаются небольшое увеличение содержания белка, лимфоцитарный плеоцитоз (20-100 клеток в 1 мкл). В остром периоде заболевания в крови отмечаются умеренный лейкоцитоз, повышение СОЭ.
Лечение. Препаратами выбора остаются пульс-дозы кортикостероидов, которые вводят внутривенно. Назначают антиагреганты, ангиопротекторы, в некоторых случаях эффективны сеансы плазмафереза. Для восстановления нарушенных функций проводится активная метаболическая терапия (ноотропы, актовегин, церебролизин, аминокислоты, витамины), симптоматическая терапия. В подостром периоде показана активная нейрореабилитация с привлечением методов коррекции биомеханики движений, ЛФК и нейропсихологической коррекции.
Прогноз, как правило, благоп-
риятный. При тяжелом поражении ткани мозга иногда остаются парезы, расстройства чувствительности, снижение зрения, нейропсихологические изменения. Возможно и тяжелое течение ОРЭМ с быстрым нарушением сознания, бульбарными расстройствами и летальным исходом.
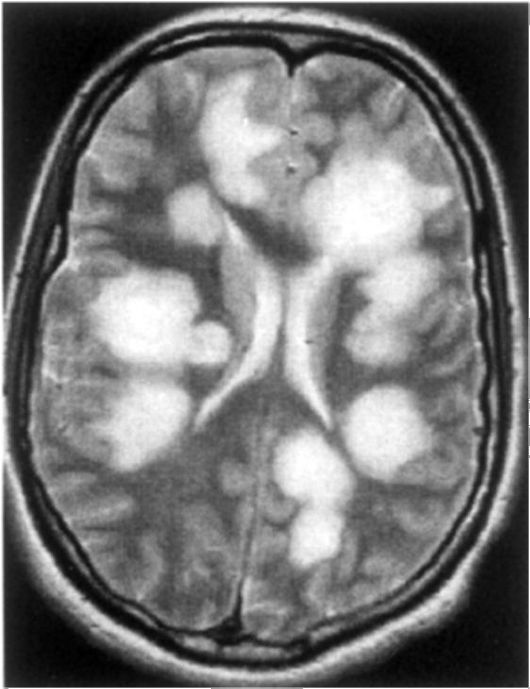 Рис. 12.4. МР-томограммы головного мозга при ОРЭМ. На Т2-взвешенном изображении видны типичные крупные очаги
Рис. 12.4. МР-томограммы головного мозга при ОРЭМ. На Т2-взвешенном изображении видны типичные крупные очаги