Неврология и нейрохирургия / под ред. А.Н. Коновалова, А.В. Козлова ; Е.И. Гусев, А.Н. Коновалов, В.И. Скворцова : учебник : - т. 1. - 2009. - 624 с.
|
|
|
|
ГЛАВА 1. МОРФОФУНКЦИОНАЛЬНЫЕ ОСНОВЫ НЕРВНОЙ СИСТЕМЫ
1.1. Нервная система: общая структура
Нервная система - это система организма, объединяющая и регулирующая различные физиологические процессы в соответствии с меняющимися условиями внешней и внутренней среды. Нервная система состоит из сенсорных компонентов, реагирующих на раздражители, исходящие из окружающей среды, интегративных - перерабатывающих и хранящих сенсорные и другие данные, и двигательных, управляющих движениями и секреторной деятельностью желез.
Нервная система воспринимает сенсорные стимулы, перерабатывает информацию и формирует поведение. Особые виды переработки информации - научение и память, благодаря которым при изменениях окружающей среды поведение адаптируется с учетом предшествующего опыта. В этих функциях участвуют и другие системы, такие как эндокринная и иммунная, но нервная система специализирована для выполнения указанных функций. Под переработкой информации подразумевают передачу информации в нейронных сетях, трансформацию сигналов путем их объединения с другими сигналами (нервная интеграция), хранение информации в памяти и извлечение информации из памяти, использование сенсорной информации для восприятия, мышление, обучение, планирование (подготовка) и выполнение двигательных команд, формирование эмоций. Взаимодействия между нейронами осуществляются посредством как электрических, так и химических процессов.
Поведение - это комплекс реакций организма на меняющиеся условия внешней и внутренней среды. Поведение может быть сугубо внутренним, скрытым процессом (познание) или доступным для внешнего наблюдения (двигательные или вегетативные реакции). У человека особенно важен набор тех поведенческих актов, которые связаны с речью. Каждую реакцию, простую или комплексную, обеспечивают нервные клетки, организованные в нейронные сети (нервные ансамбли и пути).
Нервную систему подразделяют на центральную и периферическую (рис. 1.1). Центральная нервная система (ЦНС) состоит из головного и спинного мозга. В периферическую нервную систему входят корешки, сплетения и нервы.
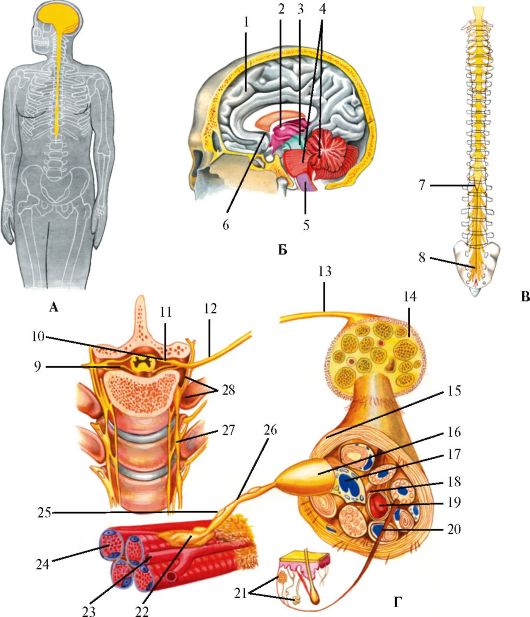 Рис. 1.1. Общее строение нервной системы.
Рис. 1.1. Общее строение нервной системы.
А - Центральная нервная система. Б - Ствол мозга: 1 - конечный мозг; 2 - промежуточный мозг; 3 - средний мозг; 4 - мост и мозжечок, 5 - продолговатый мозг, 6 - конечный мозг срединные структуры. В - Спинной мозг: 7 - спинномозговой конус; 8 - терминальные нити. Г - Периферическая нервная система: 9 - вентральный корешок; 10- дорзальный корешок; 11 - спинальный ганглий; 12 - спинномозговой нерв; 13 - смешанный периферический нерв; 14 - эпиневрий; 15 - периневрий; 16 - миелиновый нерв; 17 - фиброцит; 18 - эндоневрий; 19 - капилляр; 20 - безмиелиновый нерв; 21 - кожные рецепторы; 22 - окончание мотонейрона; 23 - капилляр; 24 - мышечные волокна; 25 - ядро шванновской клетки; 26 - перехват Ранвье; 27 - симпатический ствол; 28 - соединительная ветвь
Центральная нервная система
ЦНС собирает и перерабатывает поступающую от рецепторов информацию об окружающей среде, формирует рефлексы и другие поведенческие реакции, планирует и осуществляет произвольные движения. Кроме того, ЦНС обеспечивает так называемые высшие познавательные (когнитивные) функции. В ЦНС происходят процессы, связанные с памятью, обучением и мышлением.
Головной мозг в процессе онтогенеза формируется из мозговых пузырей, возникающих в результате неравномерного роста передних отделов медуллярной трубки (рис. 1.2). Из этих пузырей формируются передний мозг (prosencephalon), средний мозг (mesencephalon) и ромбовидный мозг (rhombencephalon). В дальнейшем из переднего мозга образуются конечный (telencephalon) и промежуточный (diencephalon) мозг, а ромбовидный мозг разделяется на задний (metencephalon) и продолговатый (myelencephalon, или medulla oblongata) мозг. Из конечного мозга, соответственно, формируются полушария большого мозга, базальные ганглии, из промежуточного мозга - таламус, эпиталамус, гипоталамус, метаталамус, зрительные тракты и нервы, сетчатка. Зрительные нервы и сетчатка - отделы ЦНС, как бы вынесенные за пределы головного мозга. Из среднего мозга образуются пластинка четверохолмия и ножки мозга. Из заднего мозга формируются мост и мозжечок. Мост мозга граничит внизу с продолговатым мозгом.
Задняя часть медуллярной трубки формирует спинной мозг, а ее полость превращается в центральный канал спинного мозга. Спинной мозг состоит из шейного, грудного, поясничного, крестцового и копчикового отделов, каждый из которых в свою очередь складывается из сегментов.
В ЦНС различают серое и белое вещество. Серое вещество представляет собой скопление тел нейронов, белое вещество - отростки нейронов, покрытые миелиновой оболочкой. В головном мозге серое вещество находится в коре больших полушарий, в подкорковых ганглиях, ядрах ствола мозга, коре мозжечка и его ядрах. В спинном мозге серое вещество концентрируется в его середине, белое - на периферии.
Периферическая нервная система
Периферическая нервная система (ПНС) отвечает за сопряжение между окружающей средой (или возбудимыми клетками) и ЦНС. В состав ПНС входят сенсорные (рецепторы и первичные афферентные нейроны) и двигательные (соматические и вегетативные мотонейроны) компоненты.
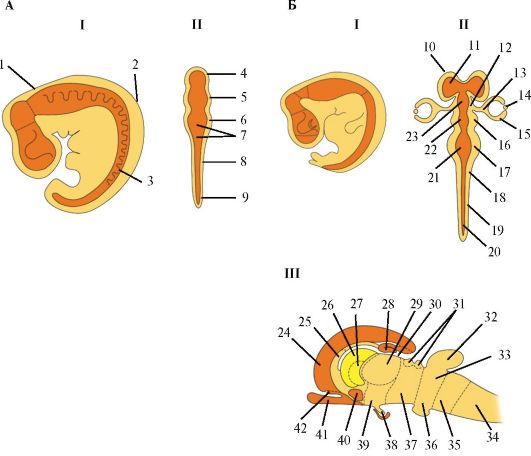 Рис. 1.2. Эмбриональное развитие нервной системы млекопитающего. Схема развития нервной рубки на стадии трех (А) и пяти (Б) мозговых пузырей. А. I - Общий вид сбоку: 1 - краниальный изгиб; 2 - шейный изгиб; 3 - спинномозговой узел. II -
Вид сверху: 4 - передний мозг; 5 - средний мозг; 6 - ромбовидный мозг; 7
- невроцель; 8 - стенка нервной трубки; 9 - зачаточный спинной мозг.
Рис. 1.2. Эмбриональное развитие нервной системы млекопитающего. Схема развития нервной рубки на стадии трех (А) и пяти (Б) мозговых пузырей. А. I - Общий вид сбоку: 1 - краниальный изгиб; 2 - шейный изгиб; 3 - спинномозговой узел. II -
Вид сверху: 4 - передний мозг; 5 - средний мозг; 6 - ромбовидный мозг; 7
- невроцель; 8 - стенка нервной трубки; 9 - зачаточный спинной мозг.
Б. I - Общий вид сбоку. Б. II - Вид сверху: 10 - конечный мозг; 11 - боковой желудочек; 12 - промежуточный мозг; 13 - глазной стебелек; 14 - хрусталик; 15 - зрительный нерв; 16 - средний мозг; 17 - задний мозг; 18 - продолговатый мозг; 19 - спинной мозг; 20 - центральный канал; 21 - четвертый желудочек; 22 - водопровод мозга; 23 - третий желудочек. III - Вид сбоку: 24 - новая кора; 25 - межжелудочковая перегородка; 26 - полосатое тело; 27 - бледный шар; 28 - гиппокамп; 29 - таламус; 30 - шишковидное тело; 31 - верхние и нижние холмики; 32 - мозжечок; 33 - задний мозг; 34 - спинной мозг; 35 - продолговатый мозг; 36 - мост; 37 - средний мозг; 38 - нейрогипофиз; 39 - гипоталамус; 40 - миндалевидное тело; 41 - обонятельный тракт; 42 - обонятельная кора
Сенсорная часть ПНС. Сенсорное восприятие - это преобразование энергии внешнего стимула в нервный сигнал. Оно осуществляется специализированными структурами - рецепторами, воспринимающими воздействие на организм разнообразных видов внешней энергии, включая механическую, свет, звук, химические стимулы, изменения температуры. Рецепторы расположены на периферических окончаниях первичных афферентных нейронов, передающих получаемую информацию в ЦНС по чувствительным волокнам нервов, сплетений, спинальных нервов и, наконец, по задним корешкам спинного мозга (либо по черепным нервам). Тела клеток задних корешков и черепных нервов находятся в спинномозговых (спинальных) ганглиях либо в ганглиях черепных нервов.
Двигательная часть ПНС. К двигательному компоненту ПНС относятся соматические и вегетативные (автономные) мотонейроны. Соматические мотонейроны иннервируют поперечнополосатую мускулатуру. Тела клеток находятся в передних рогах спинного мозга или в стволе мозга, у них длинные дендриты, получающие много синаптических «входов». Мотонейроны каждой мышцы составляют определенное двигательное ядро - группу нейронов ЦНС, имеющих сходные функции. Например, от ядра лицевого нерва иннервируются мышцы лица. Аксоны соматических мотонейронов покидают ЦНС через передний корешок либо через черепной нерв.
Вегетативные (автономные) мотонейроны посылают нервы к волокнам гладкой мускулатуры и к железам - преганглионарные и постганглионарные нейроны симпатической и парасимпатической нервной системы. Преганглионарные нейроны расположены в ЦНС - в спинном мозге либо в стволе мозга. В отличие от соматических мотонейронов, вегетативные преганглионарные нейроны образуют синапсы не на эффекторных клетках (гладкой мускулатуре или железах), а на постганглионарных нейронах, которые в свою очередь синаптически контактируют непосредственно с эффекторами.
1.2. Микроскопическое строение нервной системы
Основу нервной системы составляют нервные клетки, или нейроны, специализирующиеся на получении входящих сигналов и на передаче сигналов к другим нейронам или эффекторным клеткам. Кроме нервных клеток, в нервной системе имеются глиальные клетки и элементы соединительной ткани. Клетки нейроглии (от греч. «глия» - клей) вы-
полняют в нервной системе опорные, трофические, регуляторные функции, участвуя практически во всех видах активности нейронов. Количественно они преобладают над нейронами и занимают весь объем между сосудами и нервными клетками.
Нервная клетка
Основной структурно-функциональной единицей нервной системы является нейрон (рис. 1.3). В нейроне различают тело (сому) и отростки: дендриты и аксон. Сома и дендриты представляют воспринимающую поверхность клетки. Аксон нервной клетки образует синаптические связи с другими нейронами или с эффекторными клетками. Нервный импульс распространяется всегда в одном направлении: по дендритам к телу клетки, по аксону - от тела клетки (закон динамической поляризации нервной клетки Рамон-иКахаля). Как правило, нейрон имеет множество «входов», осуществляемых дендритами, и только один «выход» (аксон) (см. рис. 1.3).
Нейроны сообщаются друг с другом с помощью потенциалов действия, которые распространяются по аксонам. Потенциалы действия поступают от одного нейрона к следующему в результате синаптической передачи. Достигший пресинаптического окончания потенциал действия обычно запускает высвобождение нейромедиатора, который либо возбуждает постсинаптическую клетку, так что в ней возникает разряд из одного или нескольких потенциалов действия, либо тормозит ее активность. Аксоны не только передают информацию в нервных
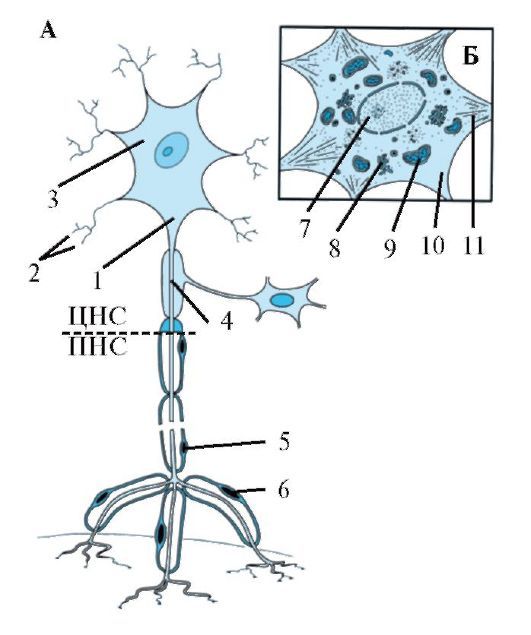 Рис. 1.3. Строение нейрона. А -
Типичный нейрон, состоящий из собственно тела, дендритов и аксона: 1 -
начало аксона; 2 - дендриты; 3 - тело нейрона; 4 - аксон; 5 -
шванновская клетка; 6 - разветвление аксона. Б - Увеличенное тело
нейрона. Аксональный холмик не содержит субстанции Ниссля: 7 - ядро; 8 -
аппарат Гольджи; 9 - митохондрии; 10 - аксональный холмик; 11 -
субстанция Ниссля
Рис. 1.3. Строение нейрона. А -
Типичный нейрон, состоящий из собственно тела, дендритов и аксона: 1 -
начало аксона; 2 - дендриты; 3 - тело нейрона; 4 - аксон; 5 -
шванновская клетка; 6 - разветвление аксона. Б - Увеличенное тело
нейрона. Аксональный холмик не содержит субстанции Ниссля: 7 - ядро; 8 -
аппарат Гольджи; 9 - митохондрии; 10 - аксональный холмик; 11 -
субстанция Ниссля
цепях, но и доставляют путем аксонного транспорта химические вещества к синаптическим окончаниям.
Существуют многочисленные классификации нейронов в соответствии с формой их тела, протяженностью и формой дендритов и другими признаками (рис. 1.4). По функциональному значению нервные клетки подразделяются на афферентные (чувствительные, сенсорные), доставляющие импульсы к центру, эфферентные (двигательные, моторные), несущие информацию от центра к периферии, и вставочные (интернейроны), в которых происходит переработка импульсов и организуются коллатеральные связи.
Нервная клетка осуществляет две основные функции: специфическую переработку поступающей информации и передачу нервного импульса и биосинтетическую, направленную на поддержание своей жизнедеятельности. Это находит выражение и в ультраструктуре нервной клетки. Передача информации от одной нервной клетки к другой, объединение нервных клеток в системы и комплексы различной сложности осуществляются структурами нейрона: аксонами, дендритами и синапсами. Органеллы, связанные с обеспечением энергетического обмена, белоксинтезирующей функцией клетки, встречаются в большинстве клеток; в нервных клетках они выполняют функции энергообеспечения клетки, переработки и передачи информации (см. рис. 1.3).
Структура нейрона. Сома. Тело нервной клетки имеет округлую или овальную форму, в центре (или слегка эксцентрично) располагается ядро. Оно содержит ядрышко и окружено наружной и внутренней ядерными мембранами толщиной около 70 Ǻ каждая, разделенных пери-
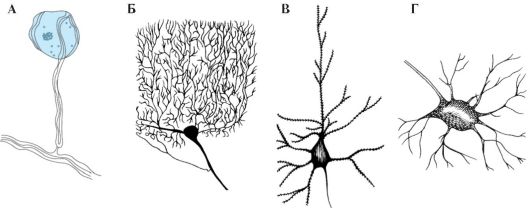 Рис. 1.4. Варианты нейронов разной формы.
Рис. 1.4. Варианты нейронов разной формы.
А - Псевдоуниполярный нейрон. Б - клетка Пуркинье (дендриты, аксон). В - пирамидная клетка (аксон). Г - мотонейрон переднего рога (аксон)
нуклеарным пространством, размеры которого вариабельны. В кариоплазме распределены глыбки хроматина, локализованные преимущественно у внутренней ядерной мембраны. В цитоплазме нервных клеток располагаются элементы зернистой и незернистой цитоплазматичсской сети, полисомы, рибосомы, митохондрии, лизосомы, многопузырчатые тельца и другие органеллы (рис. 1.5).
К аппарату биосинтеза в нейронах относятся тельца Ниссля - плотно прилегающие друг к другу сплюснутые цистерны гранулярного эндоплазматического ретикулума, а также хорошо выраженный аппарат Гольджи. Кроме того, сома содержит многочисленные митохондрии, определяющие ее энергетический обмен, и элементы цитоскелета, в том числе нейрофиламенты и микротрубочки. Лизосомы и фагосомы являются основными органеллами «внутриклеточного пищеварительного тракта».
Дендриты. Дендриты и их разветвления определяют рецептивное поле той или иной клетки (см. рис. 1.5). При электронно-микроскопическом исследовании обнаруживается, что тело нейрона постепенно переходит в дендрит. Резкой границы и выраженных различий в ультраструктуре сомы и начального отдела крупного дендрита не наблюдается. Дендриты очень вариабельны по форме, величине, разветвленности и ультраструктуре. Обычно от тела клетки отходит несколько дендритов. Длина дендрита может превышать 1 мм, на их долю приходится более 90% площади поверхности нейрона.
Основными компонентами цитоплазмы дендритов являются микротрубочки и нейрофиламенты; в проксимальных частях дендритов (ближе к клеточному телу) содержатся тельца Ниссля и участки аппарата Гольджи. Ранее считалось, что дендриты электрически невозбудимы, в настоящее время доказано, что дендриты многих
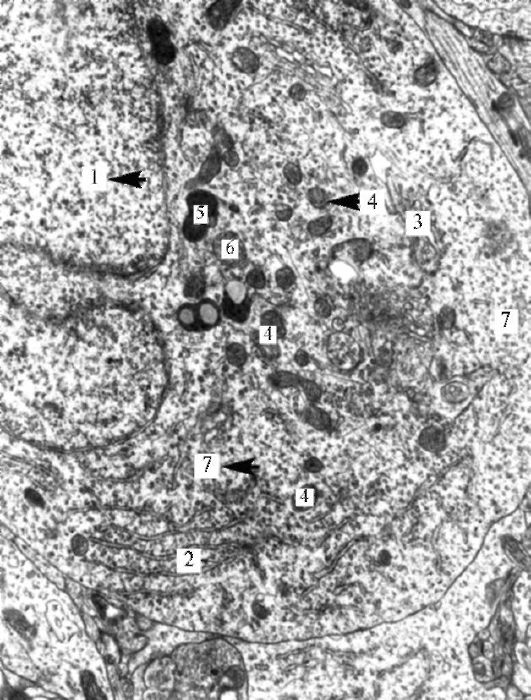 Рис. 1.5. Ультраструктура нервной клетки.
Рис. 1.5. Ультраструктура нервной клетки.
1 - ядро; 2 - гранулярная эндоплазматическая сеть; 3 - пластинчатый комплекс (Гольджи); 4 - митохондрии; 5 - лизосомы; 6 - мультивезикулярное тело; 7 - полисомы
нейронов обладают потенциалзависимой проводимостью, что обусловлено присутствием на их мембранах кальциевых каналов, при активации которых генерируются потенциалы действия.
Аксон. Аксон берет начало у аксонного холмика - специализированного участка клетки (чаще сомы, но иногда - дендрита) (см. рис. 1.3). Аксон и аксонный холмик отличаются от сомы и проксимальных участков дендритов отсутствием гранулярного эндоплазматического ретикулума, свободных рибосом и аппарата Гольджи. В аксоне присутствуют гладкий эндоплазматический ретикулум и выраженный цитоскелет.
Аксоны покрываются миелиновой оболочкой, образуя миелиновые волокна. Пучки волокон (в которых могут быть отдельные немиелинизированные волокна) составляют белое вещество мозга, черепные и периферические нервы. При переходе аксона в пресинаптическое окончание, наполненное синаптическими пузырьками, аксон образует колбовидное расширение.
Переплетения аксонов, дендритов и отростков глиальных клеток создают сложные, не повторяющиеся картины нейропиля. Распределение аксонов и дендритов, их взаиморасположение, афферентно-эфферентные взаимоотношения, закономерности синаптоархитектоники определяют механизмы интегративной функции мозга.
Типы нейронов. Полиморфизм строения нейронов определяется их различной ролью в системной деятельности мозга в целом. Так, нейроны ганглиев задних корешков спинного мозга (спинальных ганглиев) получают информацию не путем синаптической передачи, а от сенсорных нервных окончаний в рецепторных органах. В соответствии с этим клеточные тела этих нейронов лишены дендритов и не получают синаптических окончаний (биполярные клетки; рис. 1.6). Выйдя из клеточного тела, аксон такого нейрона разделяется на две ветви, одна из которых (периферический отросток) направляется в составе периферического нерва к рецептору, а другая ветвь (центральный отросток) входит в спинной мозг (в составе заднего корешка) либо в ствол мозга (в составе черепного нерва). Нейроны другого типа, такие, как пирамидные клетки коры больших полушарий и клетки Пуркинье коры мозжечка, заняты переработкой информации. Их дендриты покрыты дендритными шипиками и имеют обширную поверхность; к ним поступает огромное количество синаптических входов (мультиполярные клетки; см. рис. 1.4, 1.6). Можно классифицировать нейроны по длине их аксонов. У нейронов 1-го типа по Гольджи аксоны короткие, оканчивающиеся, так же как дендриты, близко к соме. Нейроны 2-го типа имеют длинные аксоны, иногда длиннее 1 м.
Нейроглия
Другая группа клеточных элементов нервной системы - нейроглия (рис. 1.7). В ЦНС человека число нейроглиальных клеток на порядок больше, чем число нейронов: 1013 и 1012 соответственно. Тесная морфологическая взаимосвязь является основой для физиологических и патологических взаимодействий глии и нейронов. Их взаимоотношения описываются концепцией динамических нейронально-глиальных сигнальных процессов. Возможность передачи сигналов от нейронов к глии и, таким образом, к другим нейронам открывает много вариантов для межклеточных «перекрестных разговоров».
Существует несколько типов нейроглии, в ЦНС нейроглия представлена астроцитами и олигодендроцитами, а в ПНС - шванновскими клетками и клетками-сателлитами. Кроме того, центральными глиальными клетками считаются клетки микроглии и клетки эпендимы.
Астроциты (получившие название благодаря своей звездчатой форме) регулируют состояние микросреды вокруг нейронов ЦНС. Их отростками окружены группы синаптических окончаний, которые в результате изолированы от соседних синапсов. Особые отростки - «ножки» астроцитов образуют контакты с капиллярами и соединительной тканью на поверхности головного и спинного мозга (мягкой мозговой оболочкой) (рис. 1.8). Ножки ограничивают свободную диффузию веществ в ЦНС. Астроциты могут активно поглощать К+ и нейромедиаторы, затем метаболизируя их. Благодаря избирательно повышенной проницаемости для ионов К+ астроглия регулирует активацию ферментов, необходимых для поддержания метаболизма нейронов, а также для удаления медиаторов и других агентов, выделяющихся в процессе нейро-
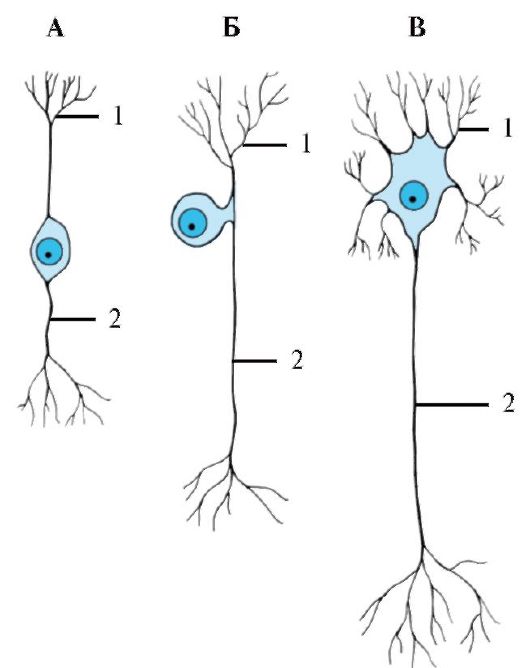 Рис. 1.6. Классификация нейронов по количеству отростков, отходящих от тела клетки.
Рис. 1.6. Классификация нейронов по количеству отростков, отходящих от тела клетки.
А - биполярный. Б - псевдоуниполярный. В - мультиполярный. 1 - дендриты; 2 - аксон
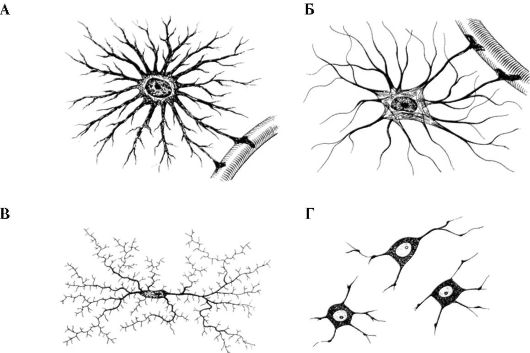 Рис. 1.7. Основные типы глиальных клеток.
Рис. 1.7. Основные типы глиальных клеток.
А - Протоплазматический астроцит. Б - микроглиальная клетка. В - олигодердроцит. Г - фиброзный астроцит
нальной активности. Астроглия участвует в синтезе иммунных медиаторов: цитокинов, других сигнальных молекул (циклический гуанозинмонофосфат - сОМР, оксид азота - NO), передаваемых затем нейронам, - в синтезе глиальных ростовых факторов (GDNF), участвующих в трофике и репарации нейронов. Астроциты способны реагировать на увеличение синаптической концентрации нейротрансмиттеров и изменение электрической активности нейронов изменениями внутриклеточной концентрации Са2+. Это создает «волну» миграции Са2+ между астроцитами, способную модулировать состояние многих нейронов.
Таким образом, астроглия, не являясь лишь трофическим компонентом нервной системы, участвует в специфическом функционировании нервной ткани. В цитоплазме астроцитов находятся глиальные филаменты, выполняющие в ткани ЦНС механическую опорную функцию. В случае повреждения отростки астроцитов, содержащие глиальные филаменты, подвергаются гипертрофии и формируют глиальный рубец.
Основной функцией олигодендроцитов является обеспечение электрической изоляции аксонов путем формирования миелиновой оболочки (рис. 1.9). Это многослойная обертка, спирально намотанная поверх плазматической мембраны аксонов. В ПНС миелиновая оболочка образована мембранами шванновских клеток (см. рис. 1.18). Миелин представляет
собой упаковку листов специфических плазматических мембран, богатых фосфолипидами, а также содержит протеины нескольких типов, различных в ЦНС и ПНС. Белковые структуры позволяют плазматическим мембранам плотно упаковываться вместе. При росте мембраны глиальной клетки происходит ее вращение вокруг аксона нейрона с образованием слоистой спирали с двойной плазматической мембраной вокруг аксона. Толщина миелиновой оболочки может составлять 50-100 мембран, играющих роль электрического изолятора аксона, предотвращающего ионообмен между цитозолем аксона и внеклеточной средой.
Кроме того, в состав нейроглии входят клетки-сателлиты, которые инкапсулируют нейроны ганглиев спинальных и черепных нервов, регулируя микросреду вокруг этих нейронов наподобие того, как это делают астроциты (рис. 1.10).
Еще один вид клеток - микроглия, или латентные фагоциты. Микроглия является единственным в ЦНС представительством иммунокомпетентных клеток. Она широко представлена во всей ткани мозга человека и составляет 9-12% общей глиальной популяции в сером веществе и 7,5-9% - в белом веществе. В отличие от астроцитов, микроглиальные клетки происходят из стволовых клеток и в нормальных условиях имеют вет-
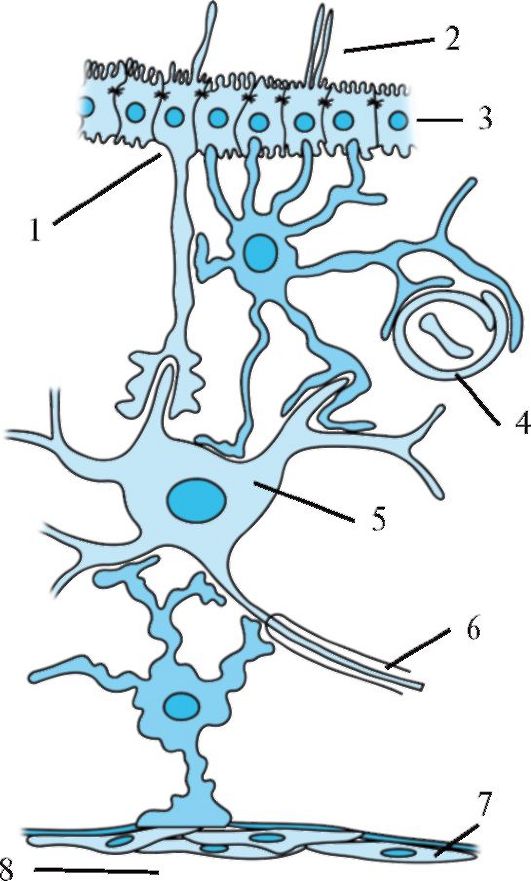 Рис. 1.8. Взаимодействие астроцитов с окружающими клеточными элементами.
Рис. 1.8. Взаимодействие астроцитов с окружающими клеточными элементами.
1 - таницит; 2 - полость желудочка; 3 - эпендимальные клетки; 4 - капилляр; 5 - нейрон; 6 - миелинизированный аксон; 7 - мягкая мозговая оболочка; 8 - субарахноидальное пространство.
На рисунке изображены два астроцита и их взаимосвязь с эпендимальными клетками, выстилающими желудочек, перикарионом, дендритами нейрона, капилляром, а также плоским эпителием мягкой мозговой оболочки. Следует отметить, что данный рисунок схематичен и связь нейрона одновременно с желудочком и субарахноидальным пространством маловероятна
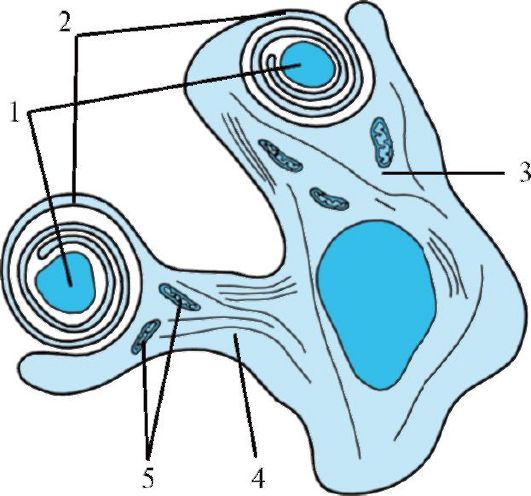 Рис. 1.9. Олигодендроцит:
формирование миелиновой оболочки аксона. 1 - аксон; 2 - миелин; 3 -
гладкий эндоплазматический ретикулум; 4 - нейрофиламенты; 5 -
митохондрии
Рис. 1.9. Олигодендроцит:
формирование миелиновой оболочки аксона. 1 - аксон; 2 - миелин; 3 -
гладкий эндоплазматический ретикулум; 4 - нейрофиламенты; 5 -
митохондрии
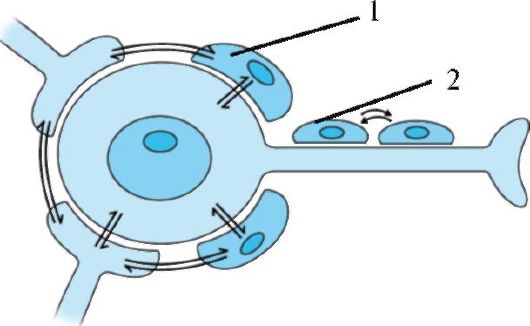 Рис. 1.10. Взаимодействие
глиальных клеток и нейронов. Схематично изображено стрелками. 1 -
сателлитная глиальная клетка; 2 - глиальная клетка, синтезирующая миелин
Рис. 1.10. Взаимодействие
глиальных клеток и нейронов. Схематично изображено стрелками. 1 -
сателлитная глиальная клетка; 2 - глиальная клетка, синтезирующая миелин
вистую форму со множеством отростков. Активация микроглии, в частности в условиях гипоксииишемии, сопровождается продукцией провоспалительных медиаторов с токсичными свойствами. Поддерживаемая ими хроническая воспалительная реакция в ткани головного мозга ведет к отсроченным нейрональным потерям, микроциркуляторным нарушениям, изменениям функции гематоэнцефалического барьера.
В патологических условиях микроглиальные клетки втягивают отростки и принимают амебоидную форму, чему соответствует их выраженная функциональная активация вплоть до состояния фагоцитоза. При повреждении мозговой ткани микроглия наряду с проникающими в ЦНС из кровотока фагоцитами способствует удалению продуктов клеточного распада.
Ткань ЦНС отделена от цереброспинальной жидкости (ЦСЖ), заполняющей желудочки мозга, эпителием, который сформирован эпендимальными клетками. Эпендима обеспечивает диффузию многих веществ между внеклеточным пространством мозга и ЦСЖ. ЦСЖ секретируют специализированные эпендимальные клетки сосудистых сплетений в системе желудочков.
Поступление к клеткам мозга питательных веществ и удаление продуктов жизнедеятельности клеток происходят через сосудистую
систему. Хотя нервная ткань изобилует капиллярами и другими кровеносными сосудами, гематоэнцефалический барьер (ГЭБ) ограничивает диффузию многих веществ между кровью и тканью ЦНС.
1.3. Электрическая передача информации между нейронами
Нормальная деятельность нервной системы зависит от возбудимости ее нейронов. Возбудимость - это способность клеточных мембран отвечать на действие адекватных раздражителей специфическими изменениями ионной проводимости и мембранного потенциала. Возбуждение - электрохимический процесс, идущий исключительно на цитоплазматической мембране клетки и характеризующийся изменениями ее электрического состояния, что запускает специфическую для каждой ткани функцию. Так, возбуждение мембраны мышцы вызывает ее сокращение, а возбуждение мембраны нейрона - проведение электрического сигнала по аксонам. Нейроны имеют не только потенциалуправляемые, т.е. регулируемые действием электрического возбудителя ионные каналы, но и хемоуправляемые и механоуправляемые.
Существуют различия во взаимоотношениях между мембранным потенциалом/проницаемостью мембраны и типом раздражителя. При воздействии электрического раздражителя цепь событий следующая: раздражитель (электрический ток) => сдвиг мембранного потенциала (до критического потенциала) => активация потенциалуправляемых ионных каналов => изменение ионной проницаемости мембраны => изменение ионных токов через мембрану => дальнейший сдвиг мембранного потенциала (формирование потенциала действия).
При воздействии химического раздражителя происходит принципиально другая цепь событий: раздражитель (химическое вещество) => химическое связывание раздражителя и рецептора хемоуправляемого ионного канала => изменение конформации лигандрецепторного комплекса и открытие рецепторуправляемых (хемоуправляемых) ионных каналов => изменение ионной проницаемости мембраны => изменение ионных токов через мембрану => сдвиг мембранного потенциала (формирование, например, локального потенциала).
Цепь событий под воздействием механического раздражителя похожа на предыдущую, так как в этом случае также активируются рецепто-
руправляемые ионные каналы: раздражитель (механический стресс) => изменение натяжения мембраны => открытие рецепторуправляемых (механоуправляемых) ионных каналов => изменение ионной проницаемости мембраны => изменение ионных токов через мембрану => сдвиг мембранного потенциала (формирование механоиндуцированного потенциала).
Пассивные электрические свойства клетки связаны с электрическими свойствами ее мембраны, цитоплазмы и внешней среды. Электрические свойства клеточной мембраны определяются ее емкостными и резистивными характеристиками, так как липидный бислой впрямую можно уподобить и конденсатору, и резистору. Емкостные характеристики липидного бислоя и реальной мембраны сходны, а резистивные различаются вследствие присутствия прежде всего белков, образующих ионные каналы. У большинства клеток входное сопротивление ведет себя нелинейно: для тока, текущего в одном направлении, оно больше, чем для противоположно направленного. Это свойство асимметрии отражает активную реакцию и называется выпрямлением. Ток, протекающий через мембрану, определяется емкостным и резистивным компонентами. Резистивный компонент описывает собственно ионный ток, поскольку в клетке электричество переносится ионами. Движению ионов в клетку или из клетки препятствует плазматическая мембрана. Поскольку мембрана представляет липидный бислой, непроницаемый для ионов, она обладает сопротивлением. Наоборот, мембрана имеет некоторую проводимость для ионов, которые проходят через ионные каналы. Из-за препятствия свободному перемещению ионов снаружи и внутри клетки находятся одинаковые ионы, но в разных концентрациях.
Существует два принципиальных механизма перемещения веществ через мембрану - посредством простой диффузии (рис. 1.11) и при по-
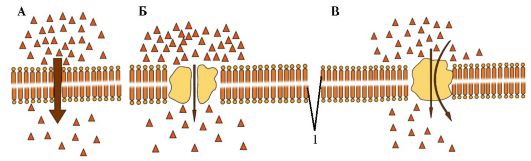 Рис. 1.11. Транспорт веществ через клеточную мембрану.
Рис. 1.11. Транспорт веществ через клеточную мембрану.
А - простая диффузия. Б - облегченная диффузия. В - активный транспорт: 1- мембрана
мощи специфических переносчиков, встроенных в мембрану и представляющих трансмембранные интегральные белки. К последнему механизму относятся облегченная диффузия и активный ионный транспорт, который может быть первично-активным и вторично-активным.
Посредством простой диффузии (без помощи переносчика) может осуществляться транспорт водонерастворимых органических соединений и газов (кислорода и углекислого газа) через липидный бислой путем их растворения в липидах клеточной мембраны; ионов Na+, Ca2+, К+, Cl- через ионные каналы клеточной мембраны, соединяющие цитоплазму клеток с внешней средой (пассивный ионный транспорт, который определяется электрохимическим градиентом и направлен от большего электрохимического потенциала к меньшему: внутрь клетки для ионов Na+, Ca2+, Cl-, наружу - для ионов К+); молекул воды через мембрану (осмос).
При помощи специфических переносчиков осуществляется энергетически независимая облегченная диффузия ряда соединений (см. рис. 1.11). Ярким примером облегченной диффузии является транспорт глюкозы через мембрану нейрона. Без специализированного астроцитарного переносчика поступление глюкозы в нейроны было бы практически невозможным, так как она является относительно большой полярной молекулой. Вследствие ее быстрого превращения в глюкозу-6- фосфат внутриклеточный уровень глюкозы более низкий, чем внеклеточный уровень, и, таким образом, сохраняется градиент, обеспечивающий непрерывный поток глюкозы в нейроны.
Энергетически зависимый первично-активный транспорт ионов Na+, Ca2+, К+, и Н+ - это энергозависимый перенос веществ против их электрохимических градиентов (см. рис. 1.11). Благодаря ему клетки могут накапливать ионы в концентрациях, более высоких по сравнению с окружающей средой. Движение от более низкой к более высокой концентрации и поддержание установившегося градиента возможны лишь при непрерывном энергетическом обеспечении транспортного процесса. При первичном активном транспорте происходит прямое потребление АТФ. АТФ-энергетические насосы (АТФазы) транспортируют ионы против их концентрационного градиента. На основании особенностей молекулярной организации различают 3 класса - Р, V и F (рис. 1.12). Все три класса АТФаз имеют одно или несколько мест связывания с АТФ на цитозольной поверхности мембраны. К классу Р относятся Са2+-АТФаза и Na+/К+-АТФаза. Переносчики активного ионного транспорта специфичны для транспортируемого вещества и насыщаемы, т.е. их поток максимален, когда все специфические места связывания с переносимым веществом заняты.
Многие градиенты электрохимического потенциала клетки, являющиеся необходимым условием для пассивного переноса ионов, появляются в результате их активного транспорта. Так, градиенты К+ и Na+ возникают в результате их активного переноса Na+/К+ - насосом (рис. 1.13). Вследствие активности Na+/К+-насоса внутри клетки ионы К+ присутствуют в большей концентрации, но они стремятся посредством диффузии перейти во внеклеточную среду по градиенту концентрации. Для сохранения равенства положительных и отрицательных зарядов внутри клетки выход во внешнюю среду ионов К+ должен быть компенсирован входом внутрь клетки ионов Na+. Поскольку мембрана в покое значительно меньше проницаема для ионов Na+, чем для ионов К+, калий должен выходить из клетки по градиенту концентраций. В результате на внешней стороне мембраны накапливается положительный заряд, а на внутренней - отрицательный. Так поддерживается потенциал покоя мембраны.
Вторично-активный транспорт ряда ионов и молекул тоже использует энергию, накопленную в результате потребления АТФ и затраченную на создание градиента концентрации. Градиент концентрации ионов относительно мембраны используется как источник энергии, созданный первичным активным транспортом (рис. 1.14). Таким образом, вторично-активный транспорт включает котранспорт и противотранспорт: поток ионов от более высокой (более высокое энергетическое состояние) к более низкой (более низкое энергетическое состояние) концентрации обеспечивает энергию для перемещения активно транспортируемого вещества из области его низкой концентрации в область высокой.
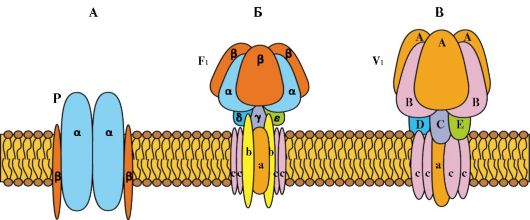 Рис. 1.12. Три класса АТФ-зависимых ионных насосов. А - P-класс. Б - F1-класс В - V1-класс
Рис. 1.12. Три класса АТФ-зависимых ионных насосов. А - P-класс. Б - F1-класс В - V1-класс
Потенциалы клетки, определяемые пассивным ионным транспортом
В ответ на подпороговый, близкий к порогу и пороговые импульсы электрического тока возникают соответственно пассивный электротонический потенциал, локальный ответ и потенциал действия (рис. 1.15). Все эти потенциалы определяются пассивным ионным транспортом через мембрану. Для их возникновения требуется поляризация мембраны клетки, которая может осуществляться внеклеточно (обычно наблюдается на нервных волокнах) и внутриклеточно (обычно отмечается на теле клетки).
Пассивный электротонический потенциал возникает в ответ на подпороговый импульс, который не приводит к открытию ионных каналов и определяется только емкостными и резистивными свойствами мембраны клетки. Пассивный электротонический потенциал характеризуется постоянной времени, которая отражает пассивные свойства мембраны временной ход изменений мембранного потенциала, т.е. скорость, с которой он меняется при переходе от одного значения к другому. Пас-
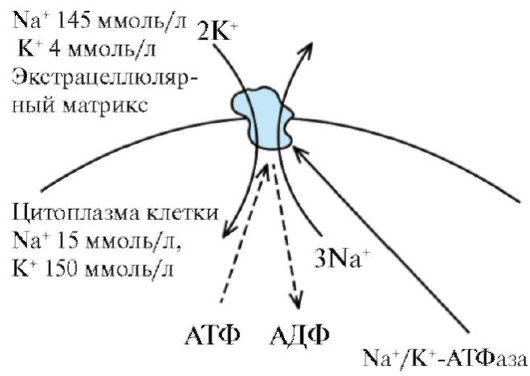 Рис. 1.13. Механизм работы Na+/K+ насоса
Рис. 1.13. Механизм работы Na+/K+ насоса
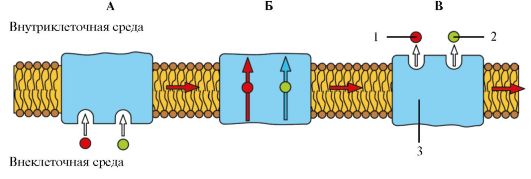 Рис. 1.14. Механизм работы вторично-активного транспорта. А - Этап 1. Б - Этап 2. В -
Этап 3: 1 - Na+; 2 - молекула вещества, которая должна быть перенесена
против градиента концентрации; 3 - транспортер. При связывании Na+ с
переносчиком возникают аллостерические изменения в связывающем центре
белка-переносчика для молекулы переносимого вещества, что вызывает
конформационные изменения белка-переносчика, позволяющие ионам Na+ и
связанному веществу выйти на другой стороне мембраны
Рис. 1.14. Механизм работы вторично-активного транспорта. А - Этап 1. Б - Этап 2. В -
Этап 3: 1 - Na+; 2 - молекула вещества, которая должна быть перенесена
против градиента концентрации; 3 - транспортер. При связывании Na+ с
переносчиком возникают аллостерические изменения в связывающем центре
белка-переносчика для молекулы переносимого вещества, что вызывает
конформационные изменения белка-переносчика, позволяющие ионам Na+ и
связанному веществу выйти на другой стороне мембраны
сивному электротоническому потенциалу присуще равенство скоростей нарастания и спада экспоненты. Существует линейная зависимость между амплитудами электрического стимула и пассивного электротонического потенциала, причем увеличение длительности импульса не меняет этой закономерности. Пассивный электротонический потенциал распространяется по аксону с затуханием, которое определяется постоянной длины мембраны.
При приближении силы электрического импульса к пороговой величине возникает локальный ответ мембраны, который проявляется изменением формы пассивного электротонического потенциала и развитием самостоятельного пика небольшой амплитуды, по форме напоминающего S-образную кривую (см. рис. 1.15). Первые признаки локального ответа регистрируются при действии стимулов, составляющих примерно 75% пороговой величины. При усилении раздражающего тока амплитуда локального ответа увеличивается нелинейно и может не только достигать критического потенциала, но и превышать его, не перерастая, однако, в потенциал действия. Самостоятельное развитие локального ответа связано с повышением натриевой проницаемости мембраны через натриевые каналы, обеспечивающие входящий ток, который при пороговом раздражителе вызывает фазу деполяризации потенциала действия. Однако при подпороговом стимуле это повышение проницаемости недостаточно для запуска процесса регенеративной деполяризации мембраны, поскольку открывается лишь небольшая часть натриевых каналов. Начавшаяся де-
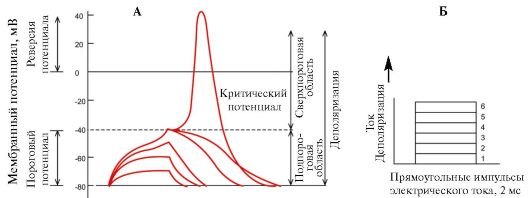 Рис. 1.15. Потенциалы мембраны клетки.
Рис. 1.15. Потенциалы мембраны клетки.
А - Динамика изменения мембранного потенциала в зависимости от силы деполяризующего импульса электрического тока. Б - Дискретное нарастание силы деполяризующего импульса
поляризация приостанавливается. В результате выхода из клетки ионов К+ потенциал возвращается на уровень потенциала покоя. В отличие от потенциала действия локальный ответ не имеет четкого порога возникновения и не подчиняется закону «все или ничего»: с увеличением силы электрического импульса амплитуда локального ответа растет. В организме локальный ответ является электрофизиологическим выражением местного возбуждения и, как правило, предшествует потенциалу действия. Иногда локальный ответ может существовать самостоятельно в виде возбуждающего постсинаптического потенциала. Примерами самостоятельного значения локального потенциала являются проведение возбуждения от амакриновых клеток сетчатки - нейронов ЦНС, лишенных аксонов, к синаптическим окончаниям, а также ответ постсинаптической мембраны химического синапса и коммуникативная передача информации между нервными клетками, генерирующими синаптические потенциалы.
При пороговой величине раздражающего электрического импульса возникает потенциал действия, состоящий из фаз деполяризации и реполяризации (рис. 1.16). Потенциал действия начинается в результате смещения под действием прямоугольного импульса электрического тока потенциала покоя (например, от -90 мВ) до уровня критического потенциала (разного для клеток различных типов). В основе фазы деполяризации лежит активация всех потенциалуправляемых натриевых каналов, вслед-
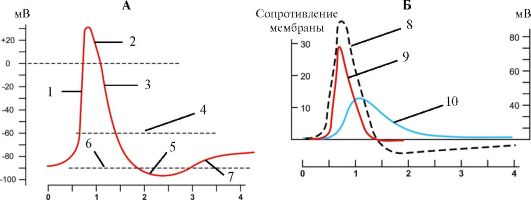 Рис. 1.16. Изменения мембранного потенциала нейрона (А) и проводимости ионов через плазмолемму (Б) при
возникновении потенциала действия. 1 - быстрая деполяризация; 2 -
овершут; 3 - реполяризация; 4 - пороговый потенциал; 5 -
гиперполяризация; 6 - потенциал покоя; 7 - медленная деполяризация; 8 -
потенциал действия; 9 - проницаемость для ионов натрия; 10 -
проницаемость для ионов калия.
Рис. 1.16. Изменения мембранного потенциала нейрона (А) и проводимости ионов через плазмолемму (Б) при
возникновении потенциала действия. 1 - быстрая деполяризация; 2 -
овершут; 3 - реполяризация; 4 - пороговый потенциал; 5 -
гиперполяризация; 6 - потенциал покоя; 7 - медленная деполяризация; 8 -
потенциал действия; 9 - проницаемость для ионов натрия; 10 -
проницаемость для ионов калия.
Кривые проводимости ионов взаимосвязаны с кривой потенциала действия
ствие чего нарастает пассивный транспорт ионов Na+ внутрь клетки и возникает смещение мембранного потенциала до 35 мВ (этот пиковый уровень различен для клеток разных типов). Превышение потенциала действия над нулевой линией называется овершутом. По достижении пика величина потенциала падает в отрицательную область, достигая потенциала покоя (фаза реполяризации). В основе реполяризации лежат инактивация потенциалуправляемых натриевых каналов и активация потенциалуправляемых калиевых каналов. Ионы К+ пассивным транспортом выходят из клетки и возникающий при этом ток ведет к смещению мембранного потенциала в отрицательную область. Фаза реполяризации завершается следовой гиперполяризацией или следовой деполяризацией - альтернативными ионными механизмами возвращения мембранного потенциала на уровень потенциала покоя (см. рис. 1.16). При первом механизме реполяризация достигает величины покоя и продолжается дальше в более отрицательную область, после чего возвращается к уровню потенциала покоя (следовая гиперполяризация); при втором - реполяризация происходит медленно и плавно переходит в потенциал покоя (следовая деполяризация). Развитие потенциала действия сопровождается фазными изменениями возбудимости клетки - от повышенной возбудимости к абсолютной и относительной рефрактерности.
Биоэлектрическая активность нейронов
Первый тип биоэлектрической активности клеток присущ молчащим нейронам, не способным самостоятельно генерировать потенциалы действия. Потенциал покоя этих клеток не меняется (рис. 1.17).
Нейроны второго типа способны самостоятельно генерировать потенциалы действия. Среди них выделяют клетки, генерирующие регулярную и нерегулярную ритмическую или пачечную (пачку составляет несколько потенциалов действия, после чего наблюдается короткий период покоя) активность.
К третьему типу биоэлектрической активности относятся нейроны, способные самостоятельно генерировать флюктуации потенциала покоя синусоидальной или пилообразной формы, не достигающие критического потенциала. Только редкие осцилляции могут достигнуть порога и вызвать генерацию одиночных потенциалов действия. Эти нейроны получили название пейсмекерных (рис. 1.17).
«Поведение» отдельных нейронов и межнейрональные взаимодействия находятся под влиянием длительной поляризации (деполяризации или гиперполяризации) постсинаптических мембран клеток.
Стимуляция нейронов постоянным деполяризующим электрическим током вызывает ответы ритмическими разрядами потенциалов действия. После прекращения длительной деполяризации мембраны наступает постактивационное торможение, при котором клетка не способна генерировать потенциалы действия. Длительность стадии постактивационного торможения прямо коррелирует с амплитудой стимулирующего тока. Затем клетка постепенно восстанавливает привычный ритм генерации потенциалов.
Напротив, постоянный гиперполяризующий ток тормозит развитие потенциала действия, что имеет особое значение по отношению к нейронам, обладающим спонтанной активностью. Нарастание гиперполяризации мембраны клетки приводит к уменьшению частоты спайковой активности и увеличению амплитуды каждого потенциала действия; следующей стадией является полное прекращение генерации потенциалов. После прекращения длительной гиперполяризации мембраны наступает фаза посттормозной активации, когда клетка начинает самопроизвольно генерировать с более высокой частотой, чем обычно, потенциалы действия. Длительность стадии постактивационной активации прямо коррелирует с амплитудой гиперполяризующего тока, после чего клетка постепенно восстанавливает привычный ритм генерации потенциалов.
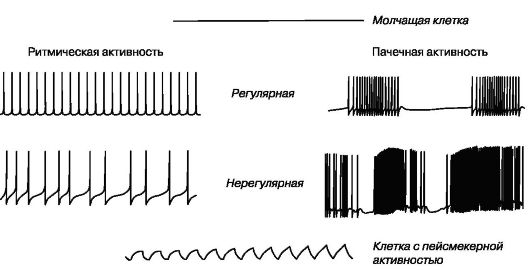 Рис. 1.17. Типы биоэлектрической активности нервных клеток
Рис. 1.17. Типы биоэлектрической активности нервных клеток
1.4. Проведение возбуждения по нервному волокну
Закономерности проведения возбуждения по нервным волокнам определяются как электрическими, так и морфологическими особенностями аксонов. Нервные стволы состоят из миелинизированных и немиелинизированных волокон. Мембрана немиелинизированного нервного волокна прямо контактирует с внешней средой, т.е. обмен ионами между внутриклеточной и внеклеточной средой может происходить в любой точке немиелинизированного волокна. Миелинизированное нервное волокно на большем протяжении покрыто жировой (миелиновой) оболочкой, выполняющей функции изолятора (см. рис. 1.18).
Миелин от одной глиальной клетки формирует регион миелинизированного нервного волокна, отделенный от следующего региона, образованного другой глиальной клеткой, немиелинизированным участком - перехватом Ранвье (рис. 1.19). Длина перехвата Ранвье составляет всего 2 мкм, а длина миелинизированного участка волокна между соседними перехватами Ранвье достигает 2000 мкм. Перехваты Ранвье полностью свободны от миелина и могут контактировать с внеклеточной жидкостью, т.е. электрическая активность миелинизированного нервного волокна ограничена мембраной перехватов Ранвье, через которую способны проникать ионы. В этих участках мембраны отмечается наибольшая плотность потенциалуправляемых натриевых каналов.
Пассивный электротонический потенциал распространяется по нервному волокну на небольшие расстояния (рис. 1.20), при этом его ампли-
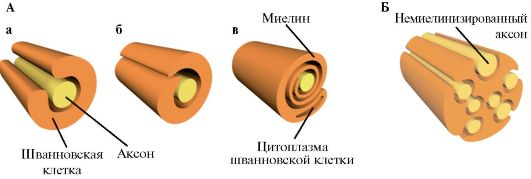 Рис. 1.18. Схема миелинизации периферического нервного волокна. А -
Этапы миелинизации. а - аксон обхватывается отростком шванновской
клетки; б - отросток шванновской клетки накручивается вокруг аксона; в -
шванновская клетка теряет большую часть цитоплазмы, превращаясь в
пластинчатую оболочку вокруг аксона. Б - Немиелинизированные аксоны, окруженные отростком шванновской клетки
Рис. 1.18. Схема миелинизации периферического нервного волокна. А -
Этапы миелинизации. а - аксон обхватывается отростком шванновской
клетки; б - отросток шванновской клетки накручивается вокруг аксона; в -
шванновская клетка теряет большую часть цитоплазмы, превращаясь в
пластинчатую оболочку вокруг аксона. Б - Немиелинизированные аксоны, окруженные отростком шванновской клетки
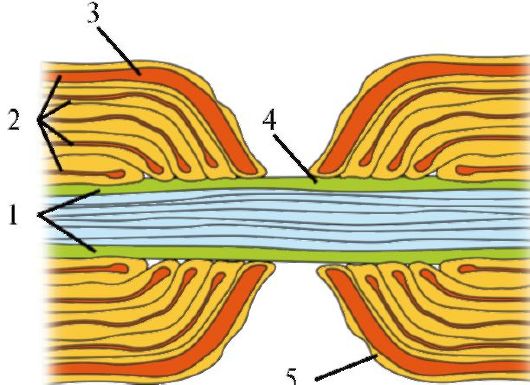 Рис. 1.19. Структура перехвата Ранвье.
Рис. 1.19. Структура перехвата Ранвье.
1 - плазматическая мембрана аксона;
2 - миелиновые мембраны; 3 - цитозоль шванновской клетки; 4 - зона перехвата Ранвье; 5 - плазматическая мембрана шванновской клетки
туда, скорость нарастания и падения с расстоянием уменьшаются (феномен затухания возбуждения). Распространение возбуждения в форме потенциала действия не сопровождается изменением формы или амплитуды потенциала, так как при пороговой деполяризации активизируются потенциалуправляемые ионные каналы, чего не происходит при распространении пассивного электротонического потенциала. Процесс распространения потенциала действия зависит от пассивных (емкость, сопротивление) и активных (активация потенциалуправляемых каналов) свойств мембраны нервного волокна.
И внутренняя, и внешняя среда аксона является хорошим проводником. Мембрана аксона, несмотря на изолирующие свойства, также может проводить ток из-за наличия каналов «утечки» ионов. При раздражении немиелинизированного волокна в месте раздражения открываются потенциалуправляемые натриевые каналы, что вызывает возникновение входящего тока и генерацию фазы деполяризации потенциала действия на этом участке аксона. Входящий ток Na+ индуцирует локальные круги тока между деполяризованной и недеполяризованной областями мембраны. Благодаря описанному механизму в немиелинизированном волокне потенциал действия распространяется в обе стороны от места возбуждения.
В миелинизированном нервном волокне потенциалы действия генерируются только в перехватах Ранвье. Электрическое сопротивление участков, покрытых миелиновой оболочкой, высокое и не допускает развития локальных круговых токов, которые необходимы для генерации потенциала действия. При распространении возбуждения по миелинизированному волокну нервный импульс перескакивает с одного перехвата Ранвье на другой (сальтаторное проведение) (см. рис. 1.20). При этом потенциал действия может распространяться в обе стороны от места раздражения, как и в немиелинизированном волокне. Сальтаторное проведе-
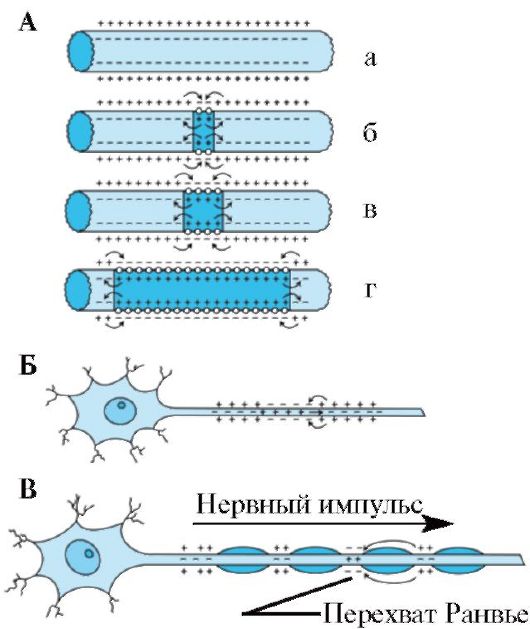 Рис. 1.20. Схема распространения электрического потенциала по нервному волокну.
Рис. 1.20. Схема распространения электрического потенциала по нервному волокну.
A - Распространение потенциала действия по немиелинизированному аксону: а - аксон в покое; б - инициация потенциала действия и возникновение локальных токов; в - распространение локальных токов; г - распространение потенциала действия по аксону. Б - Распространение потенциала действия от тела нейрона к терминальному окончанию. B - Сальтаторное проведение импульса по миелинизированному волокну. Перехваты Ранвье разделяют сегменты миелиновой оболочки аксона
ние импульса обеспечивает в 5-50 раз более высокую скорость проведения возбуждения по сравнению с немиелинизированным волокном. Кроме того, оно более экономично, так как локальная деполяризация мембраны аксона только в месте перехвата Ранвье приводит к потере в 100 раз меньшего количества ионов, чем при формировании локальных токов в немиелинизированном волокне. Кроме того, при сальтаторном проведении минимально задействованы потенциалуправляемые калиевые каналы, вследствие чего у потенциалов действия миелинизированных волокон часто нет фазы следовой гиперполяризации.
Законы проведения возбуждения по нервному волокну Первый закон: при раздражении нервного волокна возбуждение по нерву распространяется в обе стороны.
Второй закон: распространение возбуждения в обе стороны происходит с одинаковой скоростью.
Третий закон: возбуждение по нерву распространяется без феномена затухания, или без декремента. Четвертый закон: проведение возбуждения по нервному волокну возможно лишь при его анатомической и физиологической целостности. Любая травма поверхностной мембраны нервного волокна (перерезка, сдавление вследствие воспаления и отека окружающих тканей) нарушает проведение раздражения. Проведение нарушается и при изменении физиологического состояния волокна: блокаде ионных каналов, охлаждении и т.д.
Пятый закон: возбуждение распространения по нервным волокнам изолировано, т.е. не переходит с одного волокна на другое, а возбуждает лишь те клетки, с которыми контактируют окончания данного нервного волокна. В связи с тем, что в состав периферического нерва обычно входит множество разных волокон (двигательных, чувствительных, вегетативных), иннервирующих разные органы и ткани и выполняющих разные функции, изолированное проведение по каждому волокну имеет особое значение.
Шестой закон: нервное волокно не утомляется; потенциал действия волокна имеет одинаковую амплитуду очень длительное время.
Седьмой закон: скорость проведения возбуждения различна в разных нервных волокнах и определяется электрическим сопротивлением внутри- и внеклеточной среды, мембраны аксона, а также диаметром нервного волокна. С увеличением диаметра волокна скорость проведения раздражения возрастает.
Классификация нервных волокон
На основании скорости проведения возбуждения по нервным волокнам, длительности фаз потенциала действия и особенностей строения выделяют три основных типа нервных волокон: А, В и С.
Все волокна типа А миелинизированные; их разделяют на 4 подгруппы: α, β, γ и δ. Наибольший диаметр у αА-волокон (12-22 мкм), что определяет высокую скорость проведения возбуждения по ним (70- 170 м/с). Волокна типа αА у человека проводят возбуждение от двигательных нейронов передних рогов спинного мозга к скелетным мышцам, а также от проприоцептивных рецепторов мышц к чувствительным центрам ЦНС.
Другие волокна типа А (β, γ и δ) имеют меньший диаметр, меньшую скорость проведения возбуждения и более длительный потенциал действия. К этим группам волокон относятся преимущественно чувствительные волокна, проводящие импульсы от различных рецепторов в ЦНС; исключение составляют волокна γА, которые проводят возбуждение от γ-нейронов передних рогов спинного мозга к интрафузальным мышечным волокнам.
Волокна типа В также миелинизированные, относящиеся преимущественно к преганглионарным волокнам вегетативной нервной системы. Скорость проведения по ним составляет 3-18 м/с, длительность потенциала действия почти в 3 раза превышает аналогичный показатель волокон типа А. Для этих волокон не характерна фаза следовой деполяризации.
Волокна типа С немиелинизированные, имеют малый диаметр (около 1 мкм) и низкую скорость проведения возбуждения (до 3 м/с). Большинство волокон типа С являются постганглионарными волокнами симпатической нервной системы, некоторые волокна типа С участвуют в проведении возбуждения от болевых, температурных и других рецепторов.
1.5. Кодирование
Информация, передаваемая по аксону тем или иным способом, кодируется. Совокупность нейронов, обеспечивающих определенную функцию (например, конкретную сенсорную модальность), формирует проекционный путь (первый способ кодирования). Так, зрительный путь включает в себя нейроны сетчатки, латеральное коленчатое тело таламуса и зрительные области коры больших полушарий. Аксоны, проводящие зрительные сигналы, входят в состав зрительного нерва, зрительного тракта, зрительной лучистости. Физиологическим стимулом для активации зрительной системы служит свет, попадающий на сетчатку. Нейроны сетчатки преобразуют эту информацию и передают сигнал далее по зрительному пути. Однако при механическом или электрическом раздражении нейронов зрительного пути тоже возникает зрительное ощущение, хотя, как правило, искаженное. Итак, нейроны зрительной системы составляют проекционный путь, при активации которого возникает зрительное ощущение. Двигательные пути также представляют проекционные структуры. Например, при активации определенных нейронов коры больших полушарий генерируются разряды в мотонейронах мышц кисти, и эти мышцы сокращаются.
Второй способ кодирования обусловлен принципом упорядоченной пространственной (соматотопической) организации ЦНС. Соматотопические карты составлены определенными группами нейронов сенсорной и двигательной систем. Эти группы нейронов, во-первых, получают информацию от соответствующим образом локализованных областей поверхности тела и, во-вторых, посылают двигательные команды к определенным частям тела. В зрительной системе участки сетчатки представлены в коре мозга группами нейронов, образующими ретинотопические карты. В слуховой системе частотные характеристики звуков отражены в тонотопичсских картах.
Третий способ кодирования информации основан на варьировании характеристик последовательностей (серий) нервных импульсов, направ-
ляемых в результате синаптической передачи к следующей группе нейронов, при этом кодирующий механизм - временная организация разряда нервных импульсов. Возможны разные виды такого кодирования. Часто кодом служит средняя частота разряда: во многих сенсорных системах увеличение интенсивности стимула сопровождается повышением частоты разряда сенсорных нейронов. Кроме того, кодом могут служить длительность разряда, разнообразное группирование импульсов в разряде, продолжительность высокочастотных залпов импульсов и т.д.
1.6. Проведение возбуждения между клетками.
Синапсы
Взаимосвязи между нервными клетками осуществляются межнейрональными контактами, или синапсами. Информация в виде серии потенциалов действия поступает от первого (пресинаптического) нейрона на второй (постсинаптический) либо путем формирования локального тока между соседними клетками (электрические синапсы), либо опосредованно химическими веществами - медиаторами, нейротрансмиттерами (химические синапсы), либо с помощью обоих механизмов (смешанные синапсы). Быстрая передача сигналов осуществляется электрическими синапсами, более медленная - химическими.
Типичные синапсы - это образования, сформированные терминалями аксона одного нейрона и дендритами другого (аксодендритические синапсы). Кроме того, существуют аксосоматические, аксо-аксональные и дендродендритические синапсы (рис. 1.21). Некоторые ассоциативные нейроны имеют разнообразные синаптические связи (рис. 1.22). Синапс между аксоном мотонейрона и волокном скелетной мышцы называется двигательной концевой пластинкой, или нервномышечным соединением.
У электрического синапса (рис. 1.23) клеточные мембраны соседних нейронов тесно прилегают друг к другу, щель между ними составляет около 2 нм. Участки мембран соседних клеток, образующие щелевой контакт, содержат специфические белковые комплексы, состоящие из 6 субъединиц (коннексонов), располагающихся в таком порядке, что в центре контакта образуют заполненную водой пору. Коннексоны мембран соседних клеток, выстраиваясь друг против друга, образуют открытую связь - «каналы», расстояние между которыми составляет около 8 нм.
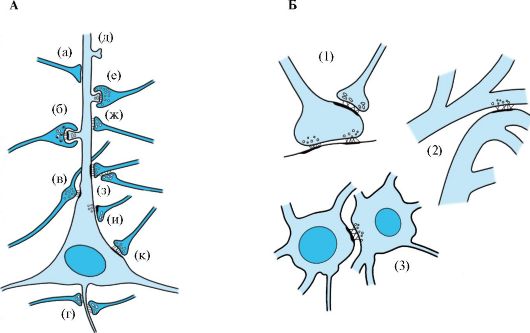 Рис. 1.21. Основные виды синапсов.
Рис. 1.21. Основные виды синапсов.
А - а - электрический синапс; б - шипиковый синапс, содержащий электронно-плотные везикулы; в - «en passant»-синапс, или синаптическая «почка»; г - тормозной синапс, расположенный на начальной части аксона (содержит эллипсоидные везикулы); д - дендритный шипик; е - шипиковый синапс; ж - тормозный синапс; з - аксо-аксональный синапс; и - реципрокный синапс; к - возбуждающий синапс. Б - Нетипичные синапсы: 1 - аксо-аксональный синапс. Окончание одного аксона может регулировать активность другого; 2 - дендродендрический синапс; 3 - сомасоматический синапс
Электрические синапсы наиболее часто образуются в эмбриональной стадии развития, у взрослого их количество уменьшается. Однако и во взрослом организме значимость электрических синапсов сохраняется для клеток глии и амакринных клеток сетчатки глаза; электрические синапсы можно обнаружить в стволе головного мозга, особенно в нижних оливах, в сетчатке глаза, вестибулярных корешках.
Деполяризация пресинаптической мембраны приводит к образованию разности потенциалов с недеполяризованной постсинаптической мембраной. В результате через каналы, образованные коннексонами, начинается движение положительных ионов по градиенту разности потенциалов в постсинаптическую клетку или движение анионов в обратном направлении. При достижении на постсинаптической мембране
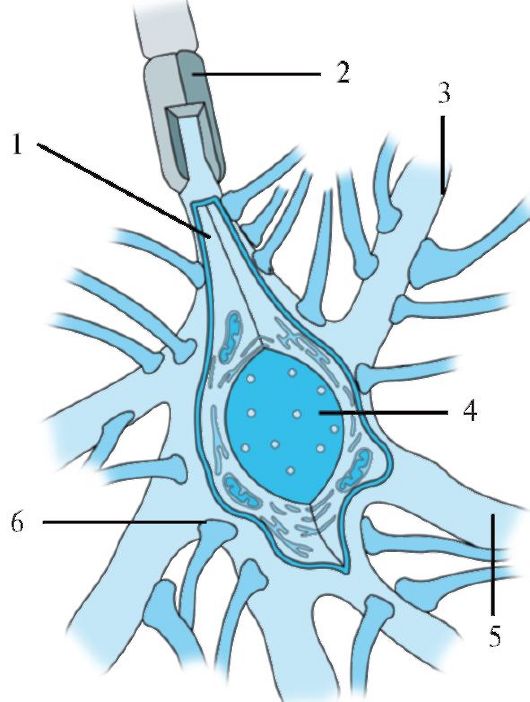 Рис. 1.22. Ассоциативный нейрон со множественными синаптическими связями.
Рис. 1.22. Ассоциативный нейрон со множественными синаптическими связями.
1 - аксонный холмик, переходящий в аксон; 2 - миелиновая оболочка; 3 - аксодендритический синапс; 4 - ядро; 5 - дендрит; 6 - аксосоматический синапс
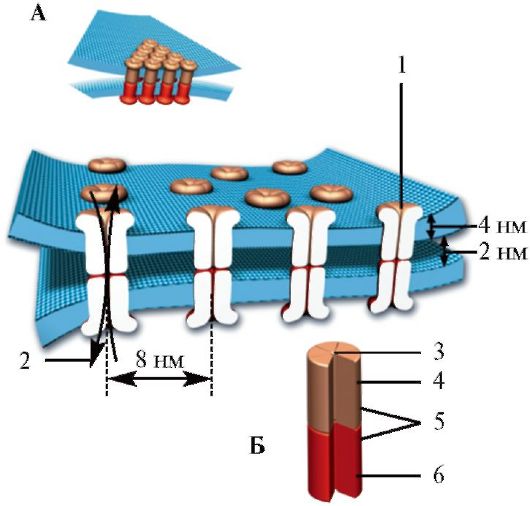 Рис. 1.23. Строение электрического синапса.
Рис. 1.23. Строение электрического синапса.
А - Щелевой контакт между участками мембран соседних клеток. Б - Коннексоны мембран соседних клеток образуют межнейрональный «канал». 1 - протеиновый комплекс; 2 - ионный канал. 3 - канал; 4 - коннексон клетки 1; 5 - каждые шесть субъединиц; 6 - коннексон клетки 2
суммарной деполяризации пороговой величины возникает потенциал действия. Важно отметить, что в электрическом синапсе ионные токи возникают с минимальной временной задержкой, составляющей 10-5 с, что объясняет высокую синхронизацию ответа даже очень большого числа клеток, соединенных щелевым контактом. Проведение тока через электрический синапс также возможно в обоих направлениях (в противоположность химическому синапсу).
Функциональное состояние электрических синапсов регулируется ионами Са2+ и уровнем мембранного потенциала клеток, что создает условия для влияния на распространение возбуждения вплоть до его прекращения. К особенностям деятельности электрических синапсов следует отнести невозможность прямого переноса возбуждения на отдаленные клетки, так как с возбужденной клеткой непосредственно связаны лишь немногие другие; уровень возбуждения в пресинаптической и постсинаптической клетках одинаков; затормозить распространение
возбуждения невозможно, в связи с этим головной мозг новорожденных и детей раннего возраста, содержащий значительно больше электрических синапсов, чем мозг взрослого, оказывается значительно более возбудимым для электрических процессов: быстро распространяющееся электрическое возбуждение не подвергается тормозной коррекции и почти мгновенно становится генерализованным, что объясняет его особую уязвимость и подверженность развитию пароксизмальной активности.
Следует отметить, что при некоторых формах демиелинизирующих полиневропатий аксоны, входящие в состав одного нервного ствола, начинают тесно соприкасаться друг с другом, формируя патологические зоны (эфапсы), внутри которых становится возможным «перепрыгивание» потенциала действия с одного аксона на другой. В результате возможно появление симптоматики, отражающей поступление «псевдоинформации» в головной мозг, - ощущение боли без раздражения периферических болевых рецепторов и т.д.
Химический синапс также передает электрический сигнал от пресинаптической к постсинаптической клетке, но в нем ионные каналы на постсинаптической мембране открываются или закрываются при помощи химических веществ-переносчиков (медиаторов, нейротрансмиттеров), высвобождающихся из пресинаптической мембраны (рис. 1.24). Изменение возможности проведения определенных ионов через постсинаптическую мембрану является основой функционирования химических синапсов. Ионные токи изменяют потенциал постсинаптической мембраны, т.е. вызывают развитие постсинаптического потенциала. В зависимости от того, проводимость каких ионов изменяется при действии нейротрансмиттера, его эффект может быть тормозящим (гиперполяризация постсинаптической мембраны вследствие дополнительного выходящего тока ионов К+ или входящего тока ионов С1-) или возбуждающим (деполяризация постсинаптической мембраны при дополнительном входящем токе ионов Ca2+ или Na+).
В синапсе (рис. 1.25) выделяют пресинаптический отросток, содержащий пресинаптические пузырьки (везикулы), и постсинаптическую часть (дендрит, тело клетки или аксон). В пресинаптическом нервном окончании в везикулах аккумулируются нейротрансмиттеры. Синаптические везикулы фиксируются в основном на цитоскелете посредством белков синапсина, локализованного на цитоплазматической поверхности каждой везикулы, и спектрина, расположенного на волокнах F- актина цитоскелета (рис. 1.26). Меньшая часть везикул связана с преси-
наптической мембраной посредством белка везикулы синаптобревина и белка пресинаптической мембраны синтаксина.
Одна везикула содержит 6000-8000 молекул трансмиттера, что составляет 1 квант трансмиттера, т.е. минимальное количество, освобождающееся в синаптическую щель. Когда серия потенциалов действия достигает нервного окончания (пресинаптической мембраны), ионы Са2+ устремляются внутрь клетки. На связанных с пресинаптической мембраной везикулах ионы Са2+ связываются с белком везикул синаптотагми-
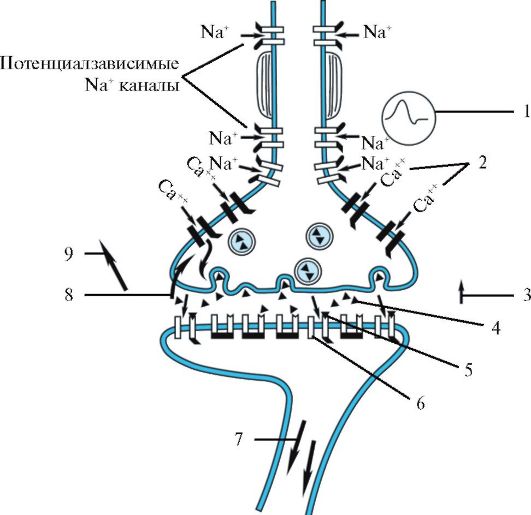 Рис. 1.24. Основные
этапы передачи через химический синапс: 1 - потенциал действия
достигает пресинаптического окончания; 2 - деполяризация
пресинаптической мембраны приводит к открытию потенциалзависимых Са2+-каналов; 3 - ионы Са2+
опосредуют слияние везикул с пресинаптической мембраной; 4 - молекулы
медиатора высвобождаются в синаптическую щель путем экзоцитоза; 5 -
молекулы медиатора связываются с постсинаптическими рецепторами,
активируя ионные каналы; 6 - происходит изменение проводимости мембраны
для ионов и в зависимости от свойств медиатора возникает возбуждающий
(деполяризация) или тормозной (гиперполяизация) потенциал
постсинаптической мембраны; 7 - ток ионов распространяется по
постсинаптической мембране; 8 - медиаторные молекулы возвращаются в
пресинаптическое окончание путем обратного захвата или 9 - диффундируют
во внеклеточную жидкость
Рис. 1.24. Основные
этапы передачи через химический синапс: 1 - потенциал действия
достигает пресинаптического окончания; 2 - деполяризация
пресинаптической мембраны приводит к открытию потенциалзависимых Са2+-каналов; 3 - ионы Са2+
опосредуют слияние везикул с пресинаптической мембраной; 4 - молекулы
медиатора высвобождаются в синаптическую щель путем экзоцитоза; 5 -
молекулы медиатора связываются с постсинаптическими рецепторами,
активируя ионные каналы; 6 - происходит изменение проводимости мембраны
для ионов и в зависимости от свойств медиатора возникает возбуждающий
(деполяризация) или тормозной (гиперполяизация) потенциал
постсинаптической мембраны; 7 - ток ионов распространяется по
постсинаптической мембране; 8 - медиаторные молекулы возвращаются в
пресинаптическое окончание путем обратного захвата или 9 - диффундируют
во внеклеточную жидкость
ном, что вызывает раскрытие мембраны везикул (см. рис. 1.26). Параллельно с этим комплекс полипептида синаптофизина сливается с неидентифицированными белками пресинаптической мембраны, что приводит к формированию поры, через которую осуществляется регулируемый экзоцитоз, т.е. секреция нейротрансмиттера в синаптическую щель. Специальные протеины везикул (rab3A) регулируют этот процесс.
Ионы Са2+ в пресинаптическом окончании активируют Са2+-кальмодулинзависимую протеинкиназу II - фермент, фосфорилирующий синапсин на пресинаптической мембране. Вследствие этого нагруженные трансмиттером везикулы могут освободиться от цитоскелета и переместиться на пресинаптическую мембрану для осуществления дальнейшего цикла.
Ширина синаптической щели составляет около 20-50 нм. В нее выбрасываются молекулы нейротрансмиттера, локальная концентрация которых сразу после выброса достаточно высока и находится в миллимолярном диапазоне. Молекулы нейротрансмиттера диффундируют к постсинаптической мембране примерно за 0,1 мс.
В постсинаптической мембране выделяют субсинаптическую зону - область непосредственного контакта пресинаптической и постсинаптической мембран, называемую также активной зоной синапса. В нее встроены протеины, образующие ионные каналы. В состоянии покоя эти каналы открываются редко. При попадании молекул нейротрансмиттера на постсинаптическую мембрану они взаимодействуют с белками ионных каналов (синаптическими рецепторами), изменяя их конформацию и приводя к значительно более частому открытию ионных каналов. Те рецепторы, ионные каналы которых открываются при непосредственном контакте с лигандом (нейротрансмиттером), называются ионотропными. Рецепторы, в которых откры-
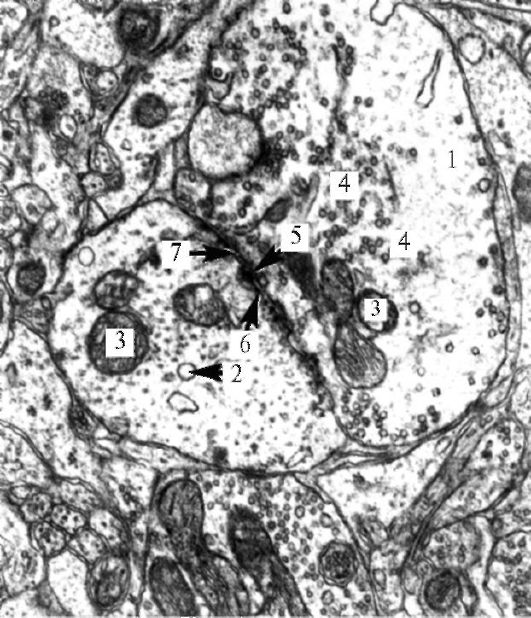 Рис. 1.25. Ультраструктура
аксодендритического синапса. 1 - аксон; 2 - дендрит; 3 - митохондрии; 4
- синаптические пузырьки; 5 - пресинаптическая мембрана; 6 -
постсинаптическая мембрана; 7 - синаптическая щель
Рис. 1.25. Ультраструктура
аксодендритического синапса. 1 - аксон; 2 - дендрит; 3 - митохондрии; 4
- синаптические пузырьки; 5 - пресинаптическая мембрана; 6 -
постсинаптическая мембрана; 7 - синаптическая щель
тие ионных каналов связано с подключением других химических процессов, называются метаботропными (рис. 1.27).
Во многих синапсах рецепторы для нейротрансмиттера находятся не только на постсинаптической, но и на пресинаптической мембране (ауторецепторы). При взаимодействии нейротрансмиттера с ауторецепторами пресинаптической мембраны его высвобождение усиливается или ослабляется (положительная или отрицательная обратная связь) в зависимости от типа синапса. На функциональное состояние ауторецепторов также влияет концентрация ионов Са2+.
Взаимодействуя с постсинаптическим рецептором, нейротрансмиттер открывает неспецифические ионные каналы в постсинаптической
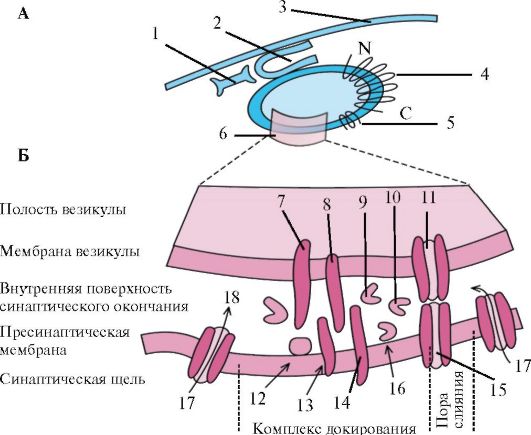 Рис. 1.26. Докирование везикулы у пресинаптической мембраны. А -
Синаптическая везикула присоединяется к элементу цитоскелета с помощью
молекулы синапсина. Комплекс докирования выделен четырехугольником: 1 -
самкиназа 2; 2 - синапсис 1; 3 - фодрин; 4 - переносчик медиатора; 5 -
синаптофизин; 6 - комплекс докирования
Рис. 1.26. Докирование везикулы у пресинаптической мембраны. А -
Синаптическая везикула присоединяется к элементу цитоскелета с помощью
молекулы синапсина. Комплекс докирования выделен четырехугольником: 1 -
самкиназа 2; 2 - синапсис 1; 3 - фодрин; 4 - переносчик медиатора; 5 -
синаптофизин; 6 - комплекс докирования
Б - Увеличенная схема комплекса докирования: 7 - синаптобревин; 8 - синаптотагмин; 9 - rab3A; 10 - NSF; 11 - синаптофизин; 12 - SNAP; 13 - синтаксин; 14 - нейрексин; 15 - физофиллин; 16 - α-SNAP; 17 - Са2+; 18 - n-sec1. СаМ- киназа-2 - кальмодулинзависимая протеинкиназа 2; n-secl - секреторный белок; NSF - N-этилмалеимид-чувствительный белок слияния; гаb3ЗА - ГТФаза из семейства ras; SNAP - белок пресинаптической мембраны
мембране. Возбуждающий постсинаптический потенциал возникает вследствие повышения способности ионных каналов проводить одновалентные катионы в зависимости от их электрохимических градиентов. Так, потенциал постсинаптической мембраны находится в диапазоне между -60 и -80 мВ. Равновесный потенциал для ионов Na+ составляет +55 мВ, что объясняет сильную движущую силу для ионов Na+ внутрь клетки. Равновесный потенциал для ионов К+ составляет примерно -90 мВ, т.е. сохраняется незначительный ток ионов К+, направленный из внутриклеточной среды во внеклеточную. Работа ионных каналов ведет к деполяризации постсинаптической мембраны, которая называется возбуждающим постсинаптическим потенциалом. Так как ионные токи зависят от разности равновесного потенциала и потенциала мембраны, то при сниженном потенциале покоя мембраны ток ионов Na+ ослабевает, а ток ионов К+ нарастает, что ведет к уменьшению амплитуды возбуждающего постсинаптического потенциала. Токи Na+ и К+, участвующие в возникновении возбуждающего постсинаптичес-
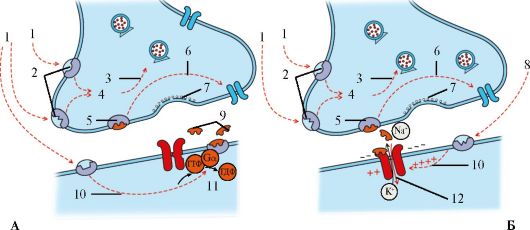 Рис. 1.27. Схема строения рецептора.
Рис. 1.27. Схема строения рецептора.
А - Метаботропного. Б - Ионотропного: 1 - нейромодуляторы или медикаменты; 2 - рецепторы с различными участками связывания (гетероцептор); 3 - нейромодуляция; 4 - вторичный мессенджер; 5 - ауторецептор; 6 - обратная связь; 7 - встраивание мембраны везикулы; 8 - нейромодуляторы; 9 - трансмиттер; 10 - нейромодуляция; 11- трансмиттер катализирует реакции G-белков; 12 - трансмиттер открывает ионный канал
кого потенциала, ведут себя иначе, чем при генерации потенциала действия, так как в механизме постсинаптической деполяризации принимают участие другие ионные каналы с иными свойствами. Если при генерации потенциала действия активируются потенциалуправляемые ионные каналы, а при нарастании деполяризации открываются и другие каналы, в результате чего процесс деполяризации усиливает сам себя, то проводимость трансмиттеруправляемых (лигандуправляемых) каналов зависит только от количества молекул трансмиттера, связавшихся с рецепторами, т.е. от количества открытых ионных каналов. Амплитуда возбуждающего постсинаптического потенциала составляет от 100 мкВ до 10 мВ, длительность потенциала находится в диапазоне от 4 до 100 мс в зависимости от вида синапса.
Локально образовавшийся в зоне синапса возбуждающий постсинаптический потенциал пассивно распространяется по всей постсинаптической мембране клетки. При одновременном возбуждении большого числа синапсов возникает явление суммации постсинаптического потенциала, проявляющееся резким повышением его амплитуды, вследствие чего может деполяризовываться мембрана всей постсинаптической клетки. Если величина деполяризации достигает порогового значения (более 10 мВ), то начинается генерация потенциала действия, который проводится по аксону постсинаптического нейрона. От начала возбуждающего постсинаптического потенциала до образования потенциала действия проходит около 0,3 мс, т.е. при массивном высвобождении нейротрансмиттера постсинаптический потенциал может появиться уже через 0,5-0,6 мс с момента прихода в пресинаптическую область потенциала действия (так называемая синаптическая задержка).
К постсинаптическому рецепторному белку могут иметь высокое сродство другие соединения. В зависимости от того, к какому (по отношению к нейротрансмиттеру) эффекту приводит их связывание с рецептором, выделяют агонисты (однонаправленное действие с нейротрансмиттером) и антагонисты (действие которых препятствует эффектам нейротрансмиттера).
Существуют рецепторные белки, не являющиеся ионными каналами. При связывании с ними молекул нейротрансмиттера возникает каскад химических реакций, в результате которых соседние ионные каналы открываются при помощи вторичных мессенджеров - метаботропные рецепторы. Важную роль в их функционировании играет G-белок. Синаптическая передача, в которой используется метаботропная рецепция, очень медленная, время передачи импульса составляет около 100 мс. К синапсам
этого типа относятся постганглионарные рецепторы, рецепторы парасимпатической нервной системы, ауторецепторы. Примером является холинергический синапс мускаринового типа, в котором зона связывания нейротрансмиттера и ионный канал локализуются не в самом трансмембранном белке, метаботропные рецепторы связаны непосредственно с G-белком. При связывании трансмиттера с рецептором G-белок, имеющий три субъединицы, образует с рецептором комплекс. ГДФ, связанный с G-белком, заменяется на ГТФ, при этом G-белок активизируется и приобретает способность открывать калиевый ионный канал, т.е. гиперполяризировать постсинаптическую мембрану (см. рис. 1.27).
Вторичные мессенджеры могут открывать или закрывать ионные каналы. Так, ионные каналы могут открываться при помощи цАМФ/IР3 или фосфорилирования протеинкиназы С. Этот процесс также проходит с помощью G-белка, который активирует фосфолипазу С, что ведет к образованию инозитолтрифосфата (IP3). Дополнительно увеличивается образование диацилглицерола (ДАГ) и протеинкиназы С (ПКС) (рис. 1.28).
Каждая нервная клетка имеет на своей поверхности множество синаптических окончаний, одни из которых возбуждающие, другие - тор-
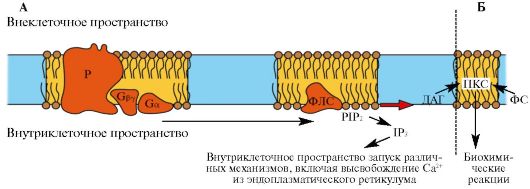 Рис. 1.28. Роль вторичных мессенджеров инозитолтрифосфата (IP3) (А) и диацилглицерола (ДАГ) (Б) в
работе метаботропного рецептора. При связывании медиатора с рецептором
(Р) происходит изменение конформации G-белка с последующей активацией
фосфолипазы С (ФЛС). Активированная ФЛС расщепляет
фосфатидилинозитолтрифосфат (PIP2) на ДАГ и IP3. ДАГ остается во внутреннем слое клеточной мембраны, a IP3
диффундирует в цитозоль в качестве вторичного посредника. ДАГ встроен
во внутренний слой мембраны, где он взаимодействует с протеинкиназой С
(ПКС) в присутствии фосфатидилсерина (ФС)
Рис. 1.28. Роль вторичных мессенджеров инозитолтрифосфата (IP3) (А) и диацилглицерола (ДАГ) (Б) в
работе метаботропного рецептора. При связывании медиатора с рецептором
(Р) происходит изменение конформации G-белка с последующей активацией
фосфолипазы С (ФЛС). Активированная ФЛС расщепляет
фосфатидилинозитолтрифосфат (PIP2) на ДАГ и IP3. ДАГ остается во внутреннем слое клеточной мембраны, a IP3
диффундирует в цитозоль в качестве вторичного посредника. ДАГ встроен
во внутренний слой мембраны, где он взаимодействует с протеинкиназой С
(ПКС) в присутствии фосфатидилсерина (ФС)
мозные. Если параллельно активируются соседние возбуждающие и тормозные синапсы, возникающие токи накладываются друг на друга, в результате возникает постсинаптический потенциал с амплитудой меньшей, чем раздельно его возбуждающая и тормозная составляющие. При этом существенна гиперполяризация мембраны вследствие повышения ее проводимости для ионов К+ и С1-.
Таким образом, возбуждающий постсинаптический потенциал генерируется благодаря повышению проницаемости для ионов Na+ и входящему току ионов Na+, a тормозной постсинаптический потенциал генерируется вследствие выходящего тока ионов К+ или входящего тока ионов С1-. Понижение проводимости для ионов К+ должно деполяризовать мембрану клетки. Синапсы, в работе которых деполяризация вызывается уменьшением проводимости для ионов К+, локализуются в ганглиях вегетативной (автономной) нервной системы
Синаптический перенос должен быть быстро завершен, чтобы синапс был готов для нового переноса, иначе ответ не возникал бы под влиянием вновь поступающих сигналов, наблюдался бы блок деполяризации. Важным механизмом регуляции является быстрое снижение чувствительности постсинаптического рецептора (десенситизация), которое наступает при еще сохраняющихся молекулах нейротрансмиттера. Несмотря на непрерывное связывание нейротрансмиттера с рецептором, конформация каналообразующего белка меняется, ионный канал становится непроницаемым для ионов и синаптический ток прекращается. У многих синапсов десенситизация рецептора может быть длительной (до нескольких минут), пока не произойдут реконфигурация и реактивация канала.
Другими путями прекращения действия трансмиттера, позволяющими избежать длительной десенситизации рецептора, являются быстрое химическое расщепление трансмиттера на неактивные компоненты или его удаление из синаптической щели путем высокоселективного обратного захвата пресинаптическим окончанием. Характер инактивирующего механизма зависит от типа синапса. Так, ацетилхолин очень быстро гидролизуется ацетилхолинэстеразой на ацетат и холин. В ЦНС возбуждающие глутаматергические синапсы плотно покрыты отростками астроцитов, которые активно захватывают нейротрансмиттер из синаптической щели и метаболизируют его.
1.7. Нейротрансмиттеры и нейромодуляторы
Нейротрансмиттеры передают сигнал в синапсах между нейронами или между нейронами и исполнительными органами (мышечные, железистые клетки). Нейромодуляторы пресинаптически влияют на количество высвобождаемого нейротрансмиттера или его обратный захват нейроном. Помимо этого, нейромодуляторы постсинаптически регулируют чувствительность рецепторов. Таким образом, нейромодуляторы способны регулировать уровень возбудимости в синапсах и изменять эффект нейротрансмиттеров. Нейротрансмиттеры и нейромодуляторы вместе образуют группу нейроактивных субстанций.
Многие нейроны являются объектом воздействия нескольких нейроактивных субстанций, но при стимуляции высвобождают только один трансмиттер. Один и тот же нейротрансмиттер в зависимости от типа постсинаптического рецептора может давать возбуждающий или тормозящий эффект. Некоторые нейротрансмиттеры (например, дофамин) могут функционировать и как нейромодуляторы. В нейрофункциональную систему обычно вовлекается несколько нейроактивных субстанций, при этом одна нейроактивная субстанция способна влиять на несколько нейрофункциональных систем.
Катехоламинергические нейроны
Катехоламинергические нейроны содержат в перикарии и отростках такие нейротрансмиттеры, как дофамин, норадреналин или адреналин, которые синтезируются из аминокислоты тирозина. В мозге взрослого человека дофаминергические, норадренергические и адренергические нейроны по локализации соответствуют меланинсодержащим нейронам. Норадренергические и дофаминергические клетки обозначаются номерами от А1 до А15, а адренергические - от С1 до С3, порядковые номера присвоены в возрастающем порядке, соответственно расположению в стволе мозга от нижних отделов к верхним.
Дофаминергические нейроны Дофаминсинтезирующие клетки (А8-А15) располагаются в среднем, промежуточном и конечном мозге (рис. 1.29). Наибольшая группа дофаминергических клеток - компактная часть черной субстанции (А9). Их аксоны формируют восходящий путь, проходящий через латеральную часть гипоталамуса и внутреннюю капсулу, нигростриарные пучки воло-
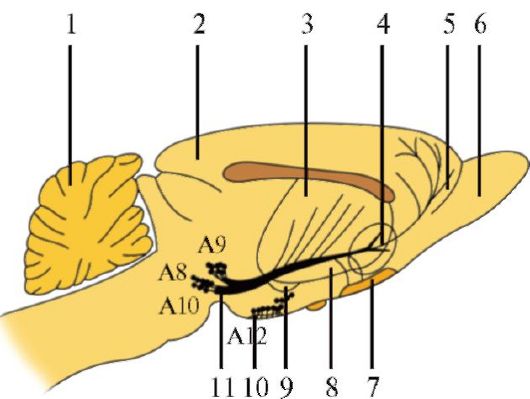 Рис. 1.29. Локализация дофаминергических нейронов и их путей в головном мозге крыс.
Рис. 1.29. Локализация дофаминергических нейронов и их путей в головном мозге крыс.
1 - мозжечок; 2 - кора головного мозга; 3 - полосатое тело; 4 - прилежащее ядро; 5 - лобная кора; 6 - обонятельная луковица; 7 - обонятельный бугор; 8 - хвостатое ядро; 9 - миндалевидное ядро; 10 - срединное возвышение; 11 - нигростриарный пучок. Основной путь (нигростриарный пучок) начинается в черном веществе (А8, А9) и проходит вперед к полосатому телу
кон достигают хвостатого ядра и скорлупы. Совместно с дофаминергическими нейронами ретикулярной субстанции (А8) они формируют нигростриарную систему.
Основной путь (нигростриарный пучок) начинается в черном веществе (А8, А9) и проходит вперед к полосатому телу.
Мезолимбическая группа дофаминергических нейронов (А10) простирается от мезэнцефалических отделов до лимбической системы. Группа А10 формирует вентральную вершину у межножковых ядер в покрышке среднего мозга. Аксоны направляются к внутренним ядрам конечной борозды, перегородки, обонятельным бугоркам, прилежащему ядру (n. accumbens), поясной извилине.
Третья дофаминергическая система (А12), называемая тубероинфундибулярной, находится в промежуточном мозге, располагается в сером бугре и простирается до воронки. Эта система связана с нейроэндокринными функциями. Другие диэнцефальные группы клеток (А11, А13 и А14) и их клетки-мишени также располагаются в гипоталамусе. Маленькая группа А15 рассредоточена в обонятельной луковице и является единственной дофаминергической группой нейронов в конечном мозге.
Все дофаминовые рецепторы действуют через систему вторичных мессенджеров. Их постсинаптическое действие может быть возбуждающим или тормозным. Дофамин быстро захватывается обратно в пресинаптическое окончание, где метаболизируется моноаминоксидазой (МАО) и катехол-О-метилтрансферазой (КОМТ).
Норадренергические нейроны Норадренергические нервные клетки находятся только в узкой переднелатеральной зоне покрышки продолговатого мозга и моста (рис. 1.30). Во-
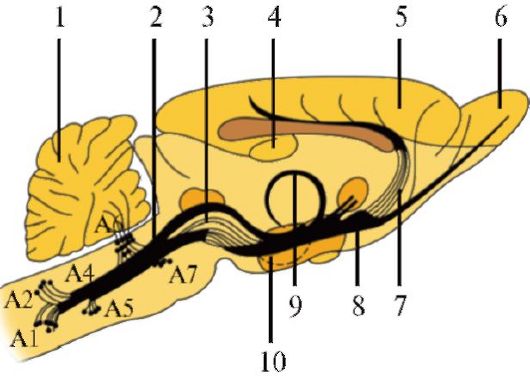 Рис. 1.30. Локализация норадренергических нейронов и их путей в головном мозге крыс (парасагиттальный срез).
Рис. 1.30. Локализация норадренергических нейронов и их путей в головном мозге крыс (парасагиттальный срез).
1 - мозжечок; 2 - дорсальный пучок; 3 - вентральный пучок; 4 - гиппокамп; 5 - кора головного мозга; 6 - обонятельная луковица; 7 - перегородка; 8 - медиальный переднемозговой пучок; 9 - концевая полоска; 10 - гипоталамус.
Основной путь начинается в голубом пятне (А6) и проходит вперед несколькими пучками, давая ответвления к различным отделам головного мозга. Также норадренергические ядра расположены в вентральной части ствола мозга (A1, A2, А5 и А7). Большинство их волокон идет вместе с волокнами нейронов голубого пятна, однако часть проецируется в дорсальном направлении
локна, идущие от этих нейронов, поднимаются к среднему мозгу или нисходят к спинному мозгу. Кроме того, норадренергические клетки имеют связи с мозжечком. Норадренергические волокна разветвляются обширнее, чем дофаминергические. Считается, что они играют роль в регуляции мозгового кровотока.
Самая большая группа норадренергических клеток (А6) расположена в составе голубого пятна (locus cereleus) и включает почти половину всех норадренергических клеток (рис. 1.31). Ядро расположено в верхней части моста у дна IV желудочка и простирается вверх вплоть до нижних холмиков четверохолмия. Аксоны клеток голубого пятна многократно ветвятся, их адренергические окончания можно найти во многих отделах ЦНС. Они оказывают модулирующее влияние на процессы созревания и обучения, переработку информации в мозге, регуляцию сна и эндогенное торможение боли.
Задний норадренергический пучок берет свое начало от группы А6 и соединяется в среднем мозге с ядрами заднего шва, верхними и нижними бугорками четверохолмия; в промежуточном мозге - с передними ядрами таламуса, медиальным и латеральным коленчатыми телами; в конечном мозге - с миндалевидным телом, гиппокампом, неокортексом, поясной извилиной.
Дополнительные волокна от клеток группы А6 идут к мозжечку через его верхнюю ножку (см. рис. 1.31). Нисходящие волокна от голубого пятна совместно с волокнами соседней группы клеток А7 идут к заднему ядру блуждающего нерва, нижней оливе и спинному мозгу. Переднебоко-
 Рис. 1.31. Схема проводящих норадренергических путей от голубого ядра (пятна), расположенного в сером веществе моста.
Рис. 1.31. Схема проводящих норадренергических путей от голубого ядра (пятна), расположенного в сером веществе моста.
1 - волокна проводящего пути; 2 - гиппокамп; 3 - таламус; 4 - гипоталамус и миндалевидное ядро; 5 - мозжечок; 6 - спинной мозг; 7 - голубое пятно
вой нисходящий пучок от голубого пятна отдает волокна к передним и задним рогам спинного мозга.
Нейроны групп А1 и А2 располагаются в продолговатом мозге. Совместно с группами клеток моста (А5 и А7) они формируют передние восходящие норадренергические пути. В среднем мозге они проецируются на серое околоводопроводное ядро и ретикулярную формацию, в промежуточном мозге - на весь гипоталамус, в конечном мозге - на обонятельную луковицу. Кроме того, от этих групп клеток (А1, А2, А5, А7) бульбоспинальные волокна идут также к спинному мозгу.
В ПНС норадреналин (и в меньшей степени адреналин) является важным нейротрансмиттером симпатических постганглионарных окончаний вегетативной нервной системы.
Адренергические нейроны
Адреналинсинтезирующие нейроны находятся только в продолговатом мозге, в узкой переднелатеральной области. Наибольшая группа клеток С1 лежит позади заднего оливного ядра, средняя группа клеток С2 - рядом с ядром одиночного пути, группа клеток С3 - непосредственно под околоводопроводным серым веществом. Эфферентные пути от С1-С3 идут к заднему ядру блуждающего нерва, ядру одиночного пути, голубому пятну, околоводопроводному серому веществу моста и среднего мозга, гипоталамусу.
Существует 4 основных типа катехоламинергических рецепторов, различающихся по реакции на действие агонистов или антагонистов и по постсинаптическим эффектам. Рецепторы α1 управляют кальциевыми каналами при помощи вторичного мессенджера инозитолфосфата-3 и при активации повышают внутриклеточную концентрацию ионов
Са2+. Стимуляция β2-рецепторов ведет к уменьшению концентрации вторичного мессенджера цАМФ, что сопровождается различными эффектами. Рецепторы в посредством вторичного мессенджера цАМФ повышают проводимость мембран для ионов К+ генерируя тормозной постсинаптический потенциал.
Серотонинергические нейроны
Серотонин (5-гидрокситриптамин) образуется из аминокислоты триптофана. Большинство серотонинергических нейронов локализуются в медиальных отделах ствола мозга, образуя так называемые ядра шва (рис. 1.32). Группы В1 и В2 располагаются в продолговатом мозге, В3 - в пограничной зоне между продолговатым мозгом и мостом, В5 - в мосту, В7 - в среднем мозге. Нейроны шва В6 и В8 находятся в покрышке моста и среднем мозге. В ядрах шва также находятся нервные клетки, содержащие и другие нейротрансмиттеры, такие как дофамин, норадреналин, ГАМК, энкефалин и субстанция Р. По этой причине ядра шва называются также многотрансмиттерными центрами.
Проекции серотонинергических нейронов соответствуют ходу норадреналинергических волокон. Основная масса волокон направляется к структурам лимбической системы, ретикулярной формации и спинному мозгу. Существует связь с голубым пятном - основным сосредоточением норадреналинергических нейронов.
Большой передний восходящий тракт поднимается от клеток группы В6, В7 и В8. Он идет кпереди сквозь покрышку среднего мозга и латерально сквозь гипоталамус, затем отдает ветви по направлению к своду и поясной извилине. Посредством этого пути группы В6, В7 и В8 связаны в среднем мозге с межножковыми ядрами и черной субстанцией, в промежуточном мозге - с ядрами поводка, таламуса и гипоталамусом, в конечном мозге - с ядрами перегородки и обонятельной луковицей.
Существуют многочисленные проекции серотонинергических нейронов на гипоталамус, поясную извилину и обонятельную кору, а также связи со стриатумом и лобной корой. Более короткий задний восходящий тракт соединяет клетки групп В3, В5 и В7 посредством заднего продольного пучка с околоводопроводным серым веществом и задней гипоталамической областью. Помимо этого, существуют серотонинергические проекции на мозжечок (от В6 и В7) и спинной мозг (от В1 до В3), а также многочисленные волокна, соединяющиеся с ретикулярной формацией.
Высвобождение серотонина происходит обычным способом. На постсинаптической мембране располагаются рецепторы, которые с помощью вторичных мессенджеров открывают каналы для ионов К+ и Са2+. Выделяют 7 классов рецепторов к серотонину: 5-НТ1 - 5-НТ7, поразному отвечающих на действие агонистов и антагонистов. Рецепторы 5-HT1, 5-HT2 и 5-НТ4 расположены в головном мозге, рецепторы 5- НТ3 - в ПНС. Действие серотонина заканчивается с помощью механизма обратного захвата нейротрансмиттера пресинаптическим окончанием. Серотонин, не поступивший в везикулы, дезаминируется с помощью МАО. Существует ингибиторное влияние нисходящих серотонинергических волокон на первые симпатические нейроны спинного мозга. Предполагается, что таким образом нейроны шва продолговатого мозга контролируют проведение болевых импульсов в антеролатеральной системе. Дефицит серотонина связан с возникновением депрессии.
 Рис. 1.32. Локализация серотонинергических нейронов и их путей в головном мозге крыс (парасагиттальный срез).
Рис. 1.32. Локализация серотонинергических нейронов и их путей в головном мозге крыс (парасагиттальный срез).
1 - обонятельная луковица; 2 - пояс; 3 - мозолистое тело; 4 - кора головного мозга; 5 - медиальный продольный пучок; 6 - мозжечок; 7 - медиальный переднемозговой пучок; 8 - мозговая полоска; 9 - концевая полоска; 10 - свод; 11 - хвостатое ядро; 12 - наружная капсула. Серотонинергические нейроны сгруппированы в девяти ядрах, расположенных в стволе мозга. Ядра В6-В9 проецируются кпереди в промежуточный и конечный мозг, тогда как каудальные ядра проецируются в продолговатый и спинной мозг
Гистаминергические нейроны
Гистаминергические нервные клетки располагаются в нижней части гипоталамуса близко к воронке. Гистамин метаболизируется ферментом гистидиновой декарбоксилазой из аминокислоты гистидина. Длинные и короткие пучки волокон гистаминергических нервных клеток в нижней части гипоталамуса идут к стволу мозга в составе задней и перивентрикулярной зоны. Гистаминергические волокна достигают околоводопроводного серого вещества, заднего ядра шва, медиального вестибулярного ядра, ядра одиночного пути, заднего ядра блуждающего нерва, ядра
лицевого нерва, переднего и заднего кохлеарных ядер, латеральной петли и нижнего бугорка четверохолмия. Кроме того, волокна направляются к промежуточному мозгу - задним, латеральным и передним отделам гипоталамуса, сосцевидным телам, зрительному бугру, перивентрикулярным ядрам, латеральным коленчатым телам и к конечному мозгу - диагональной извилине Брока, n. accumbens, миндалевидному телу и коре большого мозга.
Холинергические нейроны
Альфа (α)- и гамма (γ)-мотонейроны глазодвигательного, блоковидного, тройничного, отводящего, лицевого, языкоглогочного, блуждающего, добавочного и подъязычного нервов и спинномозговых нервов - холинергические (рис. 1.33). Ацетилхолин влияет на сокращение скелетной мускулатуры. Преганглионарные нейроны вегетативной нервной системы холинергические, они стимулируют постганглионарные нейроны вегетативной нервной системы. Прочие холинергические нервные клетки получили буквенно-цифровое обозначение в направлении сверху вниз (в обратном порядке по сравнению с катехоламинергическими и серотонинергическими нейронами). Холинергические нейроны Ch1 формируют около 10% клеток срединных ядер перегородки, нейроны Ch2 составляют 70% клеток вертикального лимба диагональной борозды Брока, нейроны Ch3 составляют 1% клеток горизонтального лимба диагональной борозды Брока. Все три группы нейронов проецируются вниз на медиальные ядра поводка и межножковые ядра. Нейроны Ch1 соединяются восходящими волокнами через свод с гиппокампом. Группа клеток Ch3 синаптически связана с нервными клетками обонятельной луковицы.
В мозге человека группа клеток Ch4 относительно обширна и соответствует базальному ядру Мейнерта, в котором 90% всех клеток - холинергические. Эти ядра получают афферентные импульсы от субкортикальных диэнцефально-телэнцефалических отделов и формируют лимбико-паралимбическую кору мозга. Передние клетки базального ядра проецируются на фронтальный и париетальный неокортекс, а задние клетки - на окципитальный и височный неокортекс. Таким образом, базальное ядро является передающим звеном между лимбико-паралимбическими отделами и неокортексом. Две небольшие группы холинергических клеток (Ch5 и Ch6) располагаются в мосту и рассматриваются как часть восходящей ретикулярной системы.
Небольшая группа клеток периоливарного ядра, частично состоящая из холинергических клеток, расположена у края трапециевидного тела в нижних отделах моста. Ее эфферентные волокна идут к рецепторным клеткам слуховой системы. Эта холинергическая система влияет на передачу звуковых сигналов.
Аминацидергические нейроны
Нейротрансмиттерные свойства доказаны для четырех аминокислот: возбуждающие для глутаминовой (глутамат), аспарагиновой (аспартат) кислот, тормозные - для g-аминомаслянной кислоты и глицина. Предполагаются нейротрансмиттерные свойства цистеина (возбуждающие); таурина, серина и р-аланина (тормозные).
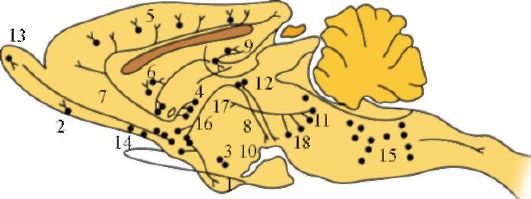 Рис. 1.33. Локализация
холинергических нейронов и их путей в головном мозге у крыс
(парасагиттальный срез). 1 - миндалевидное ядро; 2 - переднее
обонятельное ядро; 3 - дугообразное ядро; 4 - базальное ядро Мейнерта; 5
- кора головного мозга; 6 - скорлупа хвостатого ядра; 7 - диагональный
пучок Брока; 8 - отогнутый пучок (пучок Мейнерта); 9 - гиппокамп; 10 -
межножковое ядро; 11 - латерально-дорсальное ядро покрышки; 12 -
медиальное ядро поводка; 13 - обонятельная луковица; 14 - обонятельный
бугор; 15 - ретикулярная формация; 16 - мозговая полоска; 17 - таламус;
18 - ретикулярная формация покрышки
Рис. 1.33. Локализация
холинергических нейронов и их путей в головном мозге у крыс
(парасагиттальный срез). 1 - миндалевидное ядро; 2 - переднее
обонятельное ядро; 3 - дугообразное ядро; 4 - базальное ядро Мейнерта; 5
- кора головного мозга; 6 - скорлупа хвостатого ядра; 7 - диагональный
пучок Брока; 8 - отогнутый пучок (пучок Мейнерта); 9 - гиппокамп; 10 -
межножковое ядро; 11 - латерально-дорсальное ядро покрышки; 12 -
медиальное ядро поводка; 13 - обонятельная луковица; 14 - обонятельный
бугор; 15 - ретикулярная формация; 16 - мозговая полоска; 17 - таламус;
18 - ретикулярная формация покрышки
Глутаматергические и аспартатергические нейроны Структурно сходные аминокислоты глутамат и аспартат (рис. 1.34) электрофизиологически классифицируются как возбуждающие нейротрансмиттеры. Нервные клетки, содержащие глутамат и/или аспартат в качестве нейротрансмиттеров, имеются в слуховой системе (нейроны первого порядка), в обонятельной системе (объединяют обонятельную луковицу с корой большого мозга), в лимбической системе, в неокортексе (пирамидные клетки). Глутамат обнаруживается также в нейронах проводящих путей, идущих от пирамидных клеток: кортикостриарном, кортикоталамическом, кортикотектальном, кортикомостовом и кортикоспинальном трактах.
Важную роль в функционировании глутаматной системы играют астроциты, не являющиеся пассивными элементами нервной системы, а участвующие в обеспечении нейронов энергетическими субстратами в ответ на увеличение синаптической активности. Астроцитарные отрост-
 Рис. 1.34. Синтез глутаминовой и аспарагиновой кислот.
Рис. 1.34. Синтез глутаминовой и аспарагиновой кислот.
Путем гликолиза происходит превращение глюкозы в пируват, который в присутствии ацетил-КоА вступает в цикл Кребса. Далее путем трансаминирования оксалоацетат и α-кетоглутарат превращаются в аспартат и глутамат соответственно (реакции представлены в нижней части рисунка)
ки расположены вокруг синаптических контактов, что позволяет им улавливать увеличение синаптической концентрации нейротрансмиттеров (рис. 1.35). Перенос глутамата из синаптической щели опосредуется специфическими транспортными системами, две из которых глиальноспецифичны (GLT- 1 и GLAST- переносчики). Третья транспортная система (ЕААС-1), находящаяся исключительно в нейронах, не вовлекается в перенос высвободившегося из синапсов глутамата. Переход глутамата в астроциты происходит по электрохимическому градиенту ионов Na+.
В нормальных условиях поддерживается относительное постоянство внеклеточных концентраций глутамата и аспартата. Их повышение включает компенсаторные механизмы: захват нейронами и астроцитами избытков из межклеточного пространства, пресинаптическое торможение выброса нейротрансмиттеров, метаболическую утилизацию и
 Рис. 1.35. Строение глутаматергического синапса.
Рис. 1.35. Строение глутаматергического синапса.
Глутамат высвобождается из синаптических везикул в синаптическую щель. На рисунке изображены два механизма обратного захвата: 1 - обратно в пресинаптическое окончание; 2 - в соседнюю глиальную клетку; 3 - глиальная клетка; 4 - аксон; 5 - глутамин; 6 - глутамин-синтетаза; 7 - АТФ+NH4+; 8 - глутаминаза; 9 - глутамат + NH4+; 10 - глутамат; 11 - постсинаптическая мембрана. В глиальных клетках глутаминсинтаза превращает глутамат в глутамин, который далее переходит в пресинаптическое окончание. В пресинаптическом окончании глутамин превращается обратно в глутамат ферментом глутаминазой. Свободный глутамат также синтезируется в реакциях цикла Кребса в митохондриях. Свободный глутамат собирается в синаптических везикулах до возникновения следующего потенциала действия. В правой части рисунка представлены реакции превращения глутамата и глутамина, опосредованные глутаминсинтетазой и глутаминазой
др. При нарушении их элиминации из синаптической щели абсолютная концентрация и время пребывания глутамата и аспартата в синаптической щели превышают допустимые пределы, и процесс деполяризации мембран нейронов становится необратимым.
В ЦНС млекопитающих существуют семейства ионотропных и метаботропных глутаматных рецепторов. Ионотропные рецепторы регулируют проницаемость ионных каналов и классифицируются в зависимости от чувствительности к действию N-метил-D-аспартата (NMDA), α-амино-3-гидрокси-5-метил-4-изоксазол-пропионовой кислоты (АМРА), каиновой кислоты (К) и L-2-амино-4-фосфономасляной кислоты (L-AP4) - наиболее селективных лигандов данного типа рецепторов. Названия этих соединений и были присвоены соответствующим типам рецепторов: NMDA, АМРА, Ки L-AP4.
Наиболее изучены рецепторы NMDA-типа (рис. 1.36). Постсинаптический рецептор NMDA представляет собой сложное надмолекулярное образование, включающее несколько сайтов (участков) регуляции: сайт специфического связывания медиатора (L-глутаминовой кислоты), сайт специфического связывания коагониста (глицина) и аллостерические модуляторные сайты, расположенные как на мембране (полиаминовый), так и в ионном канале, сопряженном с рецептором (сайты связывания двухвалентных катионов и «фенциклидиновый» сайт - участок связывания неконкурентных антагонистов).
Ионотропные рецепторы играют ключевую роль в осуществлении возбуждающей нейропередачи в ЦНС, реализации нейропластичности, образовании новых синапсов (синаптогенез), в повышении эффективности функционирования уже имеющихся синапсов. С указанными процессами во многом связаны механизмы памяти, обучения (приобретение новых навыков), компенсации функций, нарушенных вследствие органического поражения мозга.
Возбуждающим аминоацидергическим нейротрансмиттерам (глутамату и аспартату) при определенных условиях свойственна цитотоксичность. При их взаимодействии с перевозбужденными постсинаптическими рецепторами развиваются дендросоматические поражения без изменений проводящей части нервной клетки. Условия, создающие такое перевозбуждение, характеризуются повышенным выделением и/или уменьшенным повторным захватом переносчика. Перевозбуждение глутаматом именно рецепторов NMDA приводит к открытию аго-
нист-зависимых кальциевых каналов и мощному притоку Ca2+ в нейроны с внезапным увеличением его концентрации до пороговой. Вызываемая избыточным действием аминоацидергических нейротрансмиттеров «эксайтотоксическая смерть нейронов» является универсальным механизмом повреждения нервной ткани. Она лежит в основе некротической смерти нейронов при различных заболеваниях головного мозга, как острых (ишемический инсульт), так и хронических (ней-
 Рис. 1.36. Глутаматный NMDA-ре- цептор
Рис. 1.36. Глутаматный NMDA-ре- цептор
родегенерации). На экстрацеллюлярные уровни аспартата и глутамата, а следовательно, и на выраженность эксайтотоксичности влияют температура и рН головного мозга, внеклеточные концентрации одновалентных ионов С1- и Na+. Метаболический ацидоз угнетает транспортные системы глутамата из синаптической щели.
Имеются данные о нейротоксических свойствах глутамата, связанных с активацией АМРА- и К-рецепторов, приводящей к изменению проницаемости постсинаптической мембраны для одновалентных катионов К+ и Na+, усилению входящего тока ионов Na+ и кратковременной деполяризации постсинаптической мембраны, что, в свою очередь, вызывает усиление притока Са2+ в клетку через агонист-зависимые (рецепторы NMDA) и потенциалзависимые каналы. Поток ионов Na+ сопровождается входом в клетки воды, что обусловливает набухание апикальных дендритов и лизис нейронов (осмолитическое повреждение нейронов).
Метаботропные глутаматные рецепторы, связанные с G-белком, играют важную роль в регуляции внутриклеточного кальциевого тока, вызванного активацией NMDA-рецепторов, и выполняют модуляторные функции, вызывая тем самым изменения в деятельности клетки. Эти рецепторы не влияют на функционирование ионных каналов, но стимулируют образование внутриклеточных посредников диацилглицерола и нозитолтрифосфата, принимающих участие в дальнейших процессах ишемического каскада.
ГАМКергические нейроны
Некоторые нейроны в качестве нейротрансмиттера содержат г-аминомасляную кислоту (ГАМК), которая образуется из глутаминовой кислоты под действием глутаматдекарбоксилазы (рис. 1.37). В коре большого мозга ГАМКергические нейроны находятся в ольфакторной и лимбической областях (корзинчатые нейроны гиппокампа). ГАМК также содержат нейроны эфферентных экстрапирамидных стриатонигральных, паллидонигральных и субталамопаллидарных путей, клетки Пуркинье мозжечка, нейроны коры мозжечка (Гольджи, звездчатые и корзинчатые), вставочные тормозные нейроны спинного мозга.
ГАМК является наиболее важным тормозным нейротрансмиттером ЦНС. Основная физиологическая роль ГАМК - создание устойчивого равновесия между возбуждающими и тормозными системами, модуляция и регуляция активности главного возбуждающего нейротрансмиттера глутамата. ГАМК ограничивает распространение возбуждающего стимула как пресинаптически - через ГАМК-В-рецепторы, функциональ-
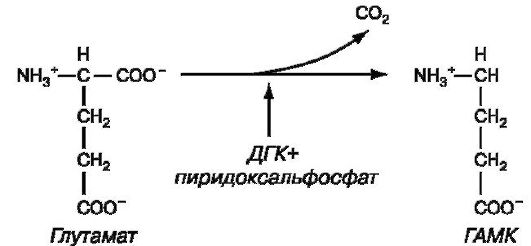 Рис. 1.37. Реакция превращения глутамата в ГАМК.
Рис. 1.37. Реакция превращения глутамата в ГАМК.
Для активности декарбоксилазы глутаминовой кислоты (ДГК) необходим кофермент пиридоксальфосфат
 Рис. 1.38. ГАМК-рецептор.
Рис. 1.38. ГАМК-рецептор.
1 - бензодиазепин-связывающий сайт;
2 - ГАМК-связывающий сайт; 3 - ионный канал для CL-; 4 - барбитурат-связывающий сайт
но связанные с потенциалзависимыми кальциевыми каналами пресинап- тических мембран, так и постсинаптически - через ГАМКА-рецепторы (ГАМК-барбитуратбензодиазепин-рецепторный комплекс), функционально связанные с потенциалзависимыми хлорными каналами. Активация постсинаптических ГАМК-А-рецепторов приводит к гиперполяризации клеточных мембран и торможению возбуждающего импульса, вызванного деполяризацией.
Плотность ГАМК-А-рецепторов максимальна в височной и лобной коре, гиппокампе, миндалевидных и гипоталамических ядрах, черной субстанции, околоводопроводном сером веществе, ядрах мозжечка. Несколько в меньшей степени рецепторы представлены в хвостатом ядре, скорлупе, таламусе, затылочной коре, эпифизе. Все три субъединицы ГАМК-А-рецептора (α, β и γ) связывают ГАМК, хотя наиболее высока аффинность связывания с б-субъединицей (рис. 1.38). Барбитураты взаимодействуют с а- и Р-субъединицами; бензодиазепины - только с 7-субъеди- ницей. Аффинность связывания каждого из лигандов повышается, если параллельно с рецептором взаимодействуют другие лиганды.
Глицинергические нейроны Глицин является тормозным нейротрансмиттером практически во всех отделах ЦНС. Наибольшая плотность глициновых рецепторов обнаружена в структурах ствола, коре больших полушарий, стриатуме, ядрах гипоталамуса, проводниках от лобной коры к гипоталамусу, моз-
жечке, спинном мозге. Глицин проявляет ингибирующие свойства посредством взаимодействия не только с собственными стрихнинчувствительными глициновыми рецепторами, но и с рецепторами ГАМК.
В малых концентрациях глицин необходим для нормального функционирования глутаматных рецепторов NMDA. Глицин является ко-агонистом рецепторов NMDA, так как их активация возможна лишь при условии связывания глицина со специфическими (нечувствительными к стрихнину) глициновыми сайтами. Потенцирующее действие глицина на рецепторы NMDA проявляется в концентрациях ниже 0,1 мкмоль, а в концентрации от 10 до 100 мкмоль глициновый сайт насыщается полностью. Высокие концентрации глицина (10-100 ммоль) не активируют NMDA-индуцированную деполяризацию in vivo и, следовательно, не увеличивают эксайтотоксичность.
Пептидергические нейроны
Нейротрансмиттерная и/или нейромодуляторная функция многих пептидов еще изучается. Пептидергические нейроны включают:
• гипоталамонейрогипофизарные нервные клетки с пептидами ок-
• ситоцином и вазопрессином в качестве нейротрансмиттеров; гипофизтрофические клетки с пептидами соматостатином, корти-
колиберином, тиролиберином, люлиберином;
• нейроны с пептидами вегетативной нервной системы желудочнокишечного тракта, такими, как субстанция Р, вазоактивный интестинальный полипептид (ВИН) и холецистокинин;
• нейроны, пептиды которых образуются из про-опиомеланокортина (кортикотропин и β-эндорфин),
• энкефалинергические нервные клетки.
Субстанция-Р - содержащие нейроны Субстанция Р - пептид из 11 аминокислот, оказывающий медленно начинающееся и длительно продолжающееся возбуждающее действие. Субстанцию Р содержат:
• около 1/5 клеток спинальных ганглиев и тригеминального (Гассерова) ганглия, аксоны которых имеют тонкую миелиновую оболочку или не миелинизированы;
• клетки обонятельных луковиц;
• нейроны околоводопроводного серого вещества;
• нейроны пути, идущего от среднего мозга к межножковым ядрам;
• нейроны эфферентных нигростриарных путей;
• небольшие нервные клетки, расположенные в коре большого мозга, преимущественно в V и VI слоях.
ВИП-содержащие нейроны Вазоактивный интестинальный полипептид (ВИП) состоит из 28 аминокислот. В нервной системе ВИП является возбуждающим нейротрансмиттером и/или нейромодулятором. Наибольшая концентрация ВИП обнаруживается в неокортексе, преимущественно в биполярных клетках. В стволе мозга ВИП-содержащие нервные клетки располагаются в ядре одиночного пути и связаны с лимбической системой. В супрахиазмальном ядре находятся ВИП-содержащие нейроны, связанные с ядрами гипоталамуса. В желудочно-кишечном тракте оказывает вазодилатирующее действие и стимулирует переход гликогена в глюкозу.
β-Эндорфинсодержащие нейроны β -Эндорфин - пептид из 31 аминокислоты, функционирующий как тормозной нейромодулятор мозга. Эндорфинергические клетки находятся в медиобазальном гипоталамусе и в нижних отделах ядра одиночного пути. Восходящие эндорфинергические пути от гипоталамуса направляются к преоптическому полю, ядрам перегородки и миндалевиднму телу, а нисходящие пути идут к околоводопроводному серому веществу, голубому ядру и ретикулярной формации. Эндорфинергические нейроны участвуют в центральной регуляции аналгезии, они стимулируют высвобождение гормона роста, пролактина и вазопрессина.
Энкефалинергические нейроны
Энкефалин - пептид из 5 аминокислот, функционирующий как эндогенный лиганд опиатных рецепторов. Энкефалинергические нейроны располагаются в поверхностном слое заднего рога спинного мозга и ядре спинального тракта тройничного нерва, периовальном ядре (слуховая система), обонятельных луковицах, в ядрах шва, в сером околоводопроводном веществе. Энкефалинсодержащие нейроны находятся также в неокортексе и аллокортексе.
Энкефалинергические нейроны пресинаптически ингибируют высвобождение субстанции Р из синаптических окончаний афферентов, проводящих болевые импульсы (рис. 1.39). Аналгезии можно достигнуть путем электростимуляции или микроинъекций опиатов в эту область. Энкефалинергические нейроны влияют на гипоталамо-гипофизарную регуляцию синтеза и выделения окситоцина, вазопрессина, некоторых либеринов и статинов.
Оксид азота
Оксид азота (NO) является полифункциональным физиологическим регулятором со свойствами нейротрансмиттера, который в отличие от традиционных нейротрансмиттеров не резервируется в синаптических везикулах нервных окончаний и высвобождается в синаптичсскую щель путем свободной диффузии, а не по механизму экзоцитоза. Молекула NO синтезируется в ответ на физиологическую потребность ферментом WA-синтазой (WAS) из аминокислоты L-аргинина. Способность NO давать биологический эффект определяется в основном малыми размерами его молекулы, ее высокой реактивностью и способностью к диффузии в тканях, в том числе нервной. Это послужило основанием назвать NO ретроградным мессенджером.
Выделяют три формы WAV. Две из них конститутивные: нейрональная (ncNOS) и эндотелиальная (ecWAS), третья - индуцибельная (WAV), обнаруженная в клетках глии.
Кальций-кальмодулинзависимость нейрональной изоформы WAV обусловливает усиление синтеза NO при нарастании уровня внутриклеточного кальция. В связи с этим любые процессы, ведущие к накоплению кальция в клетке (энергетический дефицит, изменения активного ионного транспорта,
 Рис. 1.39. Механизм энкефалинергической регуляции болевой чувствительности на уровне студенистого вещества.
Рис. 1.39. Механизм энкефалинергической регуляции болевой чувствительности на уровне студенистого вещества.
1 - интернейрон; 2 - энкефалин; 3 - рецепторы энкефалина; 4 - нейрон заднего рога спинного мозга; 5 - рецепторы субстанции Р; 6 - субстанция Р; 7 - чувствительный нейрон спинномозгового ганглия. В синапсе между периферическим чувствительным нейроном и нейроном спинноталамического ганглия основным медиатором является субстанция P. Энкефалинергический интернейрон реагирует на болевую чувствительность, оказывая пресинаптическое ингибирующее влияние на высвобождение субстанции Р
глутаматная эксайтотоксичность, оксидантный стресс, воспаление), сопровождаются повышением уровня NO.
Показано, что NO оказывает модулирующее влияние на синаптическую передачу, на функциональное состояние глутаматных рецепторов NMDA. Активируя растворимую гемсодержащую гуанилатциклазу, NO участвует в регуляции внутриклеточной концентрации ионов Са2+, рН внутри нервных клеток.
1.8. Аксональный транспорт
Важную роль в межнейрональных связях играет аксональный транспорт. Мембранные и цитоплазматичсские компоненты, которые образуются в биосинтезирующем аппарате сомы и проксимальной части дендритов, должны распределяться по аксону (особенно важно их поступление в пресинаптические структуры синапсов), чтобы восполнить потерю элементов, подвергшихся высвобождению или инактивации.
Однако многие аксоны слишком длинны, чтобы материалы могли эффективно перемещаться из сомы к синаптическим окончаниям путем простой диффузии. Эту задачу выполняет особый механизм - аксональный транспорт. Существует несколько его типов. Окруженные мембранами органеллы и митохондрии транспортируются с относительно большой скоростью посредством быстрого аксонального транспорта. Вещества, растворенные в цитоплазме (например, белки), перемещаются с помощью медленного аксонального транспорта. У млекопитающих быстрый аксональный транспорт имеет скорость 400 мм/сут, а медленный - около 1 мм/сут. Синаптические пузырьки могут поступать с помощью быстрого аксонального транспорта из сомы мотонейрона спинного мозга человека к мышцам стопы через 2,5 сут. Сравним: доставка на такое же расстояние многих растворимых белков занимает примерно 3 года.
Для аксонального транспорта требуются затрата метаболической энергии и присутствие внутриклеточного кальция. Элементы цитоскелета (точнее, микротрубочки) создают систему направляющих тяжей, вдоль которых передвигаются окруженные мембранами органеллы. Эти органеллы прикрепляются к микротрубочкам аналогично тому, как это происходит между толстыми и тонкими филаментами волокон скелетных мышц; движение органелл вдоль микротрубочек запускается ионами Са2+.
Аксональный транспорт осуществляется в двух направлениях. Транспорт от сомы к аксональным терминалям, называемый антероградным аксонным транспортом, восполняет в пресинаптических окончаниях запас синаптических пузырьков и ферментов, ответственных за синтез нейромедиатора. Транспорт в противоположном направлении - ретроградный аксонный транспорт, возвращает опустошенные синаптические пузырьки в сому, где эти мембранные структуры деградируются лизосомами. Поступающие от синапсов вещества необходимы для поддержания нормального метаболизма тел нервных клеток и, кроме того, несут информацию о состоянии их концевых аппаратов. Нарушение ретроградного аксонального транспорта приводит к изменениям нормальной работы нервных клеток, а в тяжелых случаях - к ретроградной дегенерации нейронов.
Система аксонального транспорта является тем основным механизмом, который определяет возобновление и запас медиаторов и модуляторов в пресинаптических окончаниях, а также лежит в основе формирования новых отростков, аксонов и дендритов. Согласно представлениям о пластичности мозга в целом, даже в мозге взрослого человека постоянно происходят два взаимосвязанных процесса: формирование новых отростков и синапсов, а также деструкция и исчезновение некоторой части существовавших ранее межнейрональных контактов. Механизмы аксонального транспорта, связанные с ними процессы синаптогенеза и роста тончайших разветвлений аксонов лежат в основе обучения, адаптации, компенсации нарушенных функций. Расстройство аксонального транспорта приводит к деструкции синаптических окончаний и изменению функционирования определенных систем мозга.
Лекарственными и биологически активными веществами можно влиять на метаболизм нейронов, определяющий их аксональный транспорт, стимулируя его и повышая тем самым возможность компенсаторно-восстановительных процессов. Усиление аксонального транспорта, рост тончайших ответвлений аксонов и синаптогенез играют положительную роль в нормальной работе мозга. При патологии эти явления лежат в основе репаративных, компенсаторно-восстановительных процессов.
Посредством аксонального транспорта по периферическим нервам распространяются некоторые вирусы и токсины. Так, вирус ветряной оспы (Varicella zoster virus) проникает в клетки спинномозговых (спинальных) ганглиев. Там вирус пребывает в неактивной форме иногда в течение многих лет, пока не изменится иммунный статус человека. Тогда вирус может транспортироваться по сенсорным аксонам к коже, и в дерматомах соотве-
тствующих спинальных нервов возникают болезненные высыпания опоясывающего лишая (Herpes zoster). Путем аксо-нального транспорта переносится и столбнячный токсин. Бактерии Clostridium tetani из загрязненной раны путем ретроградного транспорта попадают в мотонейроны. Если токсин выйдет во внеклеточное пространство передних рогов спинного мозга, он блокирует активность синаптических рецепторов тормозных нейромедиаторных аминокислот и станет причиной тетанических судорог.
1.9. Реакции нервной ткани на повреждение
Повреждение нервной ткани сопровождается реакциями нейронов и нейроглии. В случае тяжелого повреждения клетки погибают. Поскольку нейроны являются постмитотическими клетками, они не восполняются.
Механизмы смерти нейронов и клеток глии
В сильно поврежденных тканях преобладают процессы некроза, затрагивающие целые клеточные поля с пассивной дегенерацией клеток, набуханием и фрагментацией органелл, разрушением мембран, лизисом клеток, выходом внутриклеточного содержимого в окружающую ткань и развитием воспалительного ответа. Некроз всегда обусловлен грубой патологией, его механизмы не требуют затрат энергии и предотвратить его можно только с помощью удаления причины повреждения.
Апоптоз - вид программированной клеточной смерти. Апоптозные клетки, в противоположность некротическим, располагаются поодиночке или небольшими группами, разбросаны по всей ткани. Они имеют меньший размер, неизмененные мембраны, сморщенную цитоплазму с сохранением органелл, появлением множественных цитоплазматических мембрансвязанных выпячиваний. Не наблюдается и воспалительной реакции ткани, что в настоящее время служит одним из важных отличительных морфологических признаков апоптоза от некроза. И сморщенные клетки, и апоптозные тельца содержат нетронутые клеточные органеллы и массы конденсированного хроматина. Результатом последовательной деструкции ДНК в апоптозпых клетках становится невозможность их репликации (воспроизведения) и участия в межклеточных взаимодействиях, так как эти процессы требуют синтеза новых протеинов. Умирающие клетки эффективно удаляются из ткани путем фагоцитоза. Основные различия процессов некроза и апоптоза суммированы в табл. 1.1.
Таблица 1.1. Признаки различия процессов некроза и апоптоза
 Апоптоз
является неотъемлемой частью процессов развития и гомеостаза зрелой
ткани. В норме организм использует этот генетически запрограммированный
механизм в эмбриогенезе для уничтожения «избытка» клеточного материала в
ранней стадии развития тканей, в частности в нейронах, не установивших
контакты с клетками-мишенями и лишенных, таким образом, трофической
поддержки из этих клеток. В зрелом возрасте интенсивность апоптоза в ЦНС
млекопитающих существенно снижается, хотя остается высокой в других
тканях. Устранение пораженных вирусами клеток, развитие иммунного ответа
также сопровождаются апоптозной реакцией. Наряду с апоптозом выделяют и
другие варианты программированной клеточной смерти.
Апоптоз
является неотъемлемой частью процессов развития и гомеостаза зрелой
ткани. В норме организм использует этот генетически запрограммированный
механизм в эмбриогенезе для уничтожения «избытка» клеточного материала в
ранней стадии развития тканей, в частности в нейронах, не установивших
контакты с клетками-мишенями и лишенных, таким образом, трофической
поддержки из этих клеток. В зрелом возрасте интенсивность апоптоза в ЦНС
млекопитающих существенно снижается, хотя остается высокой в других
тканях. Устранение пораженных вирусами клеток, развитие иммунного ответа
также сопровождаются апоптозной реакцией. Наряду с апоптозом выделяют и
другие варианты программированной клеточной смерти.
Морфологическими маркерами апоптоза являются апоптозные тельца и сморщенные нейроны с целостной мембраной. Биохимическим маркером, который стал практически идентичен понятию «апоптоз», считают ДНК-фрагментацию. Этот процесс активируется ионами Ca2+ и Mg2+, а ингибируется ионами Zn2+. Расщепление ДНК происходит в результате действия кальций-магнийзависимой эндонуклеазы. Установлено, что эндонуклеазы расщепляют ДНК между белками гистонами, высвобождая фрагменты регулярной длины. ДНК первоначально делится на большие фрагменты из 50 и 300 000 оснований, которые затем расщепляются на части из 180 пар оснований, образующие «лестницу» при сепарации гелевым электрофорезом. ДНК-фрагментация не всегда коррелирует с характерной для апоптоза морфологией и является условным маркером, неэквивалентным морфологическим критериям. Наиболее совершенным для подтверждения апоптоза является биологически-гистохимический метод, позволяющий зафиксировать не только ДНК-фрагментацию, но и важный морфологический признак - апоптозные тельца.
Программа апоптоза состоит из трех последовательных этапов: принятия решения о смерти или выживании; осуществления механизма уничтожения; элиминации погибших клеток (деградация клеточных компонентов и их фагоцитоз).
Выживание или смерть клеток в значительной степени определяется продуктами экспрессии генов cW-семейства. Белковые продукты двух из этих генов, ced-3 и ced-4 («генов-убийц»), необходимы для протекания апоптоза. Белковый продукт гена ced-9 защищает клетки, препятствуя апоптозу посредством предотвращения возбуждения генов ced-3 и ced-4. Остальные гены семейства ced кодируют протеины, вовлеченные в упаковку и фагоцитоз умирающих клеток, деградацию ДНК умершей клетки.
У млекопитающих гомологами гена-убийцы ced-3 (и его белковых продуктов) являются гены, кодирующие интерлейкинпревращающие ферменты - каспазы (цистеиновые аспартил-протеазы), которые обладают различной субстратной и ингибирующей специфичностью. Неактивные предшественники каспаз - прокаспазы присутствуют во всех клетках. Активация прокаспаз у млекопитающих осуществляется аналогом ced-4-гена - возбуждающим фактором апоптозной протеа- зы-1 (Apaf-a), имеющим место связывания для АТФ, что подчеркивает значимость уровня энергетического обеспечения для выбора механизма смерти. При возбуждении каспазы модифицируют активность клеточных белков (полимераз, эндонуклеаз, компонентов ядерной мембраны), ответственных за фрагментацию ДНК в апоптозных клетках. Активированные ферменты начинают расщепление ДНК с появлением в местах разрывов трифосфонуклеотидов, вызывают разрушение цитоплазменных белков. Клетка теряет воду и уменьшается, рН цитоплазмы снижается. Клеточная мембрана теряет свои свойства, клетка сморщивается, образуются апоптозные тельца. В основе процесса перестройки клеточных мембран лежит активация сирингомиелазы, которая расщепляет сирингомиелин клетки с высвобождением керамида, активирующего фосфолипазу А2. Происходит накопление продуктов арахидоновой кислоты. Экспрессированные в ходе апоптоза белки фосфатидилсерин и витронектин выводят на наружную поверхность клетки и сигнализируют макрофагам, осуществляющим фагоцитоз апоптозных телец.
Гомологами гена нематоды ced-9, определяющего выживаемость клеток, у млекопитающих является семейство протоонкогенов bcl-2. И bcl-2, и родственный ему протеин bcl-x-l представлены в мозге млекопитающих, где защищают нейроны от апоптоза при ишемическом воздействии, удалении факторов роста, влиянии нейротоксинов in vivo и in vitro. Анализ продуктов экспрессии bcl-2-генов выявил целое семейство bcl-2-родственных белков, включающее как антиапоптозные (Bcl-2 и Bcl-x-l), так и проапоптозные (Bcl-x-s, Bax, Bad, Bag) протеины. Протеины Ьах и bad обладают гомологичной последовательностью и формируют гетеродимеры с bcl-2 и bcl-x-l in vitro. Для активности, подавляющей смерть, bcl-2 и bcl-x-l должны сформировать димеры с протеином Ьах, а димеры с протеином bad усиливают смерть. Это позволило сделать вывод о том, что bcl-2 и родственные молекулы являются ключевыми детерминантами клеточного выживания или клеточной смерти в ЦНС. Молекулярно-генетические исследования установили, что так
называемое генное семейство bcl-2, состоящее из 16 генов с противоположными функциями, у человека картируется на хромосоме 18. Антиапоптотические эффекты дают шесть генов семейства, подобно прародителю группы bcl-2; другие 10 генов поддерживают апоптоз.
Про- и антиапоптотические эффекты активированных продуктов экспрессии генов bcl-2 реализуются через модуляцию активности митохондрии. Митохондрия является ключевой фигурой апоптоза. Она содержат цитохром С, АТФ, ионы Са2+ и апоптозиндуцирующий фактор (АИФ) - компоненты, необходимые для индукции апоптоза. Выход этих факторов из митохондрии происходит при взаимодействии ее мембраны с активированными белками семейства bcl-2, которые прикрепляются к наружной мембране митохондрии в местах сближения наружной и внутренней мембран - в области так называемой пермеабилизационной поры, являющейся мегаканалом диаметром до 2 нм. При прикреплении белков bcl-2 к наружной мембране митохондрии мегаканалы поры расширяются до 2,4-3 нм. По этим каналам в цитозоль клетки из митохондрии поступают цитохром С, АТФ и АИФ. Антиапоптозные белки семьи bcl-2, напротив, закрывают мегаканалы, прерывая продвижение апоптотического сигнала и защищая клетку от апоптоза. В процессе апоптоза митохондрия не теряет своей целостности и не подвергается разрушению. Вышедший из митохондрии цитохром С образует комплекс с фактором, ативирующим апоптотическую протеазу (APAF-l), каспазой-9 и АТФ. Данный комплекс представляет собой апоптосому, в которой происходит активация каспазы-9, а затем основной «киллерной» каспазы-3, что приводит к смерти клетки. Митохондриальный сигнальный механизм является основным путем индукции апоптоза.
Другим механизмом индукции апоптоза служит передача проапоптотического сигнала при связи лиганда с рецепторами региона клеточной смерти, которая происходит с помощью адапторных белков FADD/MORT1, TRADD. Рецепторный путь клеточной смерти значительно короче, чем митохондриальный: по средствам адапторных молекул происходит активация каспазы-8, которая, в свою очередь, напрямую активирует «киллерные» каспазы.
Определенные протеины, такие как р53, р21 (WAF1), могут способствовать развитию апоптоза. Показано, что природный р53 вызывает апоптоз в опухолевых клеточных линиях и in vivo. Трансформация р53 из природного типа в мутантную форму приводит к развитию рака во многих органах в результате подавления процессов апоптоза.
Дегенерация аксона
После перерезки аксона в соме нервной клетки развивается так называемая аксонная реакция, направленная на восстановление аксона путем синтеза новых структурных белков. В соме неповрежденных нейронов тельца Ниссля интенсивно окрашиваются основным анилиновым красителем, который связывается с рибонуклеиновыми кислотами рибосом. Однако во время аксонной реакции цистерны шероховатого эндоплазматического ретикулума увеличиваются в объеме, заполняясь продуктами синтеза белка. Происходит хроматолиз - дезорганизация рибосом, вследствие которой окрашивание телец Ниссля основным анилиновым красителем становится гораздо слабее. Тело клетки набухает и округляется, а ядро смещается к одной стороне (эксцентрическое положение ядра). Все эти морфологические изменения - отражение цитологических процессов, сопровождающих усиленный синтез белка.
Участок аксона дистальнее места перерезки отмирает. В течение нескольких дней этот участок и все синаптические окончания аксона подвергаются разрушению. Миелиновая оболочка аксона тоже дегенерирует, ее фрагменты захватываются фагоцитами. Однако клетки нейроглии, образующие миелин, не погибают. Эта последовательность явлений получила название уоллеровской дегенерации.
Если поврежденный аксон обеспечивал единственный или основной синаптический вход к нервной или к эффекторной клетке, то постсинаптическая клетка может подвергнуться дегенерации и погибнуть. Хорошо известный пример - атрофия волокон скелетной мышцы после нарушения их иннервации мотонейронами.
Регенерация аксона
После дегенерации поврежденного аксона у многих нейронов может отрастать новый аксон. На конце проксимального отрезка аксон начинает ветвиться [спрутинг (sprouting) - разрастание]. В ПНС новообразованные ветви растут вдоль исходного пути погибшего нерва, если, конечно, этот путь доступен. В период уоллеровской дегенерации шванновские клетки дистальной части нерва не только выживают, но и пролиферируют, выстраиваясь рядами там, где проходил погибший нерв. «Конусы роста» регенерирующего аксона прокладывают свои пути между рядами шванновских клеток и в конечном итоге могут достигать своих мишеней, реиннервируя их. Затем аксоны ремиелинизируются шванновскими клетками. Скорость регенерации ограни-
чивается скоростью медленного аксонного транспорта, т.е. примерно 1 мм/сут.
Регенерация аксонов в ЦНС имеет некоторые отличия: клетки олигодендроглии не могут наметить путь для роста ветвей аксона, поскольку в ЦПС каждый олигодендроцит миелинизирует множество аксонов (в отличие от шванновских клеток в ПНС, каждая из которых снабжает миелином только один аксон).
Важно отметить, что химические сигналы по-разному действуют на регенерационные процессы в ЦНС и ПНС. Дополнительное препятствие регенерации аксонов в ЦНС - глиальные рубцы, формируемые астроцитами.
Синаптический спрутинг, обеспечивающий «реусиление» существующих нейрональных токов и образование новых полисинаптических связей, обусловливает пластичность нейрональной ткани и формирует механизмы, участвующие в восстановлении нарушенных неврологических функций.
Трофические факторы
Важную роль в развитии ишемического повреждения ткани мозга играет уровень его трофического обеспечения.
Нейротрофические свойства присущи многим протеинам, в том числе и структурным белкам (например, S1OOβ). В то же время максимально их реализуют факторы роста, которые представляют разнородную группу трофических факторов, состоящую по меньшей мере из 7 семейств, - нейротрофины, цитокины, фибробластные факторы роста, инсулинзависимые факторы роста, семейство трансформирующего фактора роста 31 (TGF-J3I), эпидермальные факторы роста и другие, в том числе ростовой протеин 6 (GAP-6)4, тромбоцитзависимый фактор роста, гепаринсвязанный нейротрофический фактор, эритропоэтин, макрофагальный колониестимулирующий фактор и др. (табл. 1.2).
Наиболее сильное трофическое влияние на все основные процессы жизнедеятельности нейронов оказывают нейротрофины - регуляторные белки нервной ткани, которые синтезируются в ее клетках (нейронах и глии). Они действуют локально - в месте высвобождения и особенно интенсивно индуцируют ветвление дендритов и рост аксонов в направлении клеток-мишеней.
К настоящему времени наиболее изучены три нейротрофина, близких друг другу по структуре: фактор роста нервов (NGF), фактор роста, выделенный из головного мозга (BDNF), и нейротрофин-3 (NT-3).
Таблица 1.2. Современная классификация нейротрофических факторов
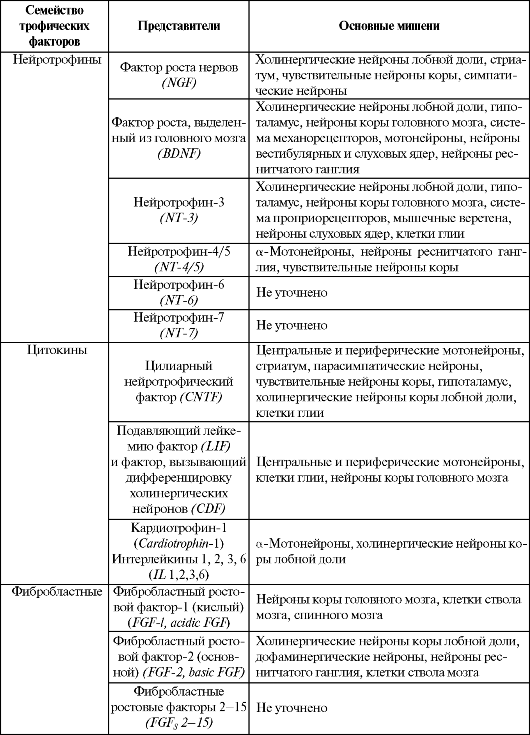
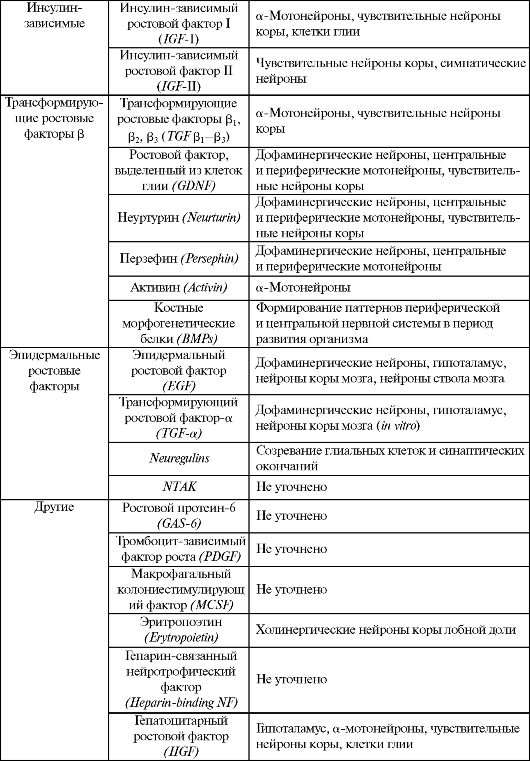 В
развивающемся организме они синтезируются клеткой-мишенью (например,
мышечным веретеном), диффундируют по направлению к нейрону, связываются с
молекулами рецепторов на его поверхности.
В
развивающемся организме они синтезируются клеткой-мишенью (например,
мышечным веретеном), диффундируют по направлению к нейрону, связываются с
молекулами рецепторов на его поверхности.
Связанные с рецепторами факторы роста захватываются нейронами (т.е. подвергаются эндоцитозу) и транспортируются ретроградно в сому. Там они могут воздействовать непосредственно на ядро, изменяя образование ферментов, ответственных за синтез нейромедиаторов и рост аксонов. Различают две формы рецепторов к факторам роста - низкоаффинные рецепторы и высокоаффинные рецепторы тирозинкиназы, с которыми связывается большинство трофических факторов.
В результате аксон достигает клетки-мишени, устанавливая с ней синаптический контакт. Факторы роста поддерживают жизнь нейронов, которые в их отсутствие не могут существовать.
Трофическая дизрегуляция является одной из универсальных составляющих патогенеза повреждения нервной системы. При лишении трофической поддержки зрелых клеток развивается биохимическая и функциональная дедифференциация нейронов с изменением свойств иннервируемых тканей. Трофическая дизрегуляция сказывается на состоянии макромолекул, принимающих участие в мембранном электрогенезе, активном ионном транспорте, синаптической передаче (ферменты синтеза медиаторов, постсинаптические рецепторы) и эффекторной функции (мышечный миозин). Ансамбли дедифференцированных центральных нейронов создают очаги патологически усиленного возбуждения, запускающего патобиохимичсские каскады, которые ведут к гибели нейронов по механизмам некроза и апоптоза. Напротив, при достаточном уровне трофического обеспечения регресс неврологического дефицита после ишемического повреждения мозга часто наблюдается даже при оставшемся морфологическом дефекте, изначально его вызвавшем, что свидетельствует о высокой приспособляемости мозговой функции.
Установлено, что в развитии недостаточности трофического обеспечения принимают участие изменения калиевого и кальциевого гомеостаза, избыточный синтез оксида азота, который блокирует фермент тирозинкиназу, входящий в активный центр трофических факторов, дисбаланс цитокинов. Одним из предполагаемых механизмов является аутоиммунная агрессия против собственных нейротрофинов и структурных нейроспецифических белков, обладающих трофическими свойствами, которая становится возможной в результате нарушения защитной функции гематоэнцефалического барьера.